Кандидоз слизистой. Выделение чистой культуры и определение чувствительности к антимикотическим препаратам
Микробиологическое исследование, в ходе которого определяют наличие и видовую принадлежность дрожжеподобных грибов рода Candida, используемое для диагностики и контроля лечения кандидоза слизистых оболочек.
Синонимы английские
Кандидоз полости рта, генитальный кандидоз. Посев на среду с определением вида гриба и его резистентности к противогрибковым препаратам.
Метод исследования
Микробиологический метод.
Какой биоматериал можно использовать для исследования?
Мазок из десневого кармана.
Как правильно подготовиться к исследованию?
- Не проводить туалет полости рта в день взятия биоматериала на исследование.
Общая информация об исследовании
Кандидоз слизистой – это инфекционно-воспалительный процесс, вызываемый дрожжеподобными грибами рода Candida, на слизистых оболочках. Наибольшее клиническое значение имеет кандидоз полости рта и генитальный кандидоз.
Наибольшее клиническое значение имеет кандидоз полости рта и генитальный кандидоз.
Дрожжеподобные грибы рода Candida (Candida spp.) считаются представителями нормальной микробиоты слизистых организма человека. Действительно, дрожжевые грибы могут быть выявлены примерно у 60 % взрослых здоровых людей в полости рта и у 12 % женщин во влагалище. В норме дрожжевые грибы находятся в равновесии с бактериальными комменсалами слизистых оболочек и не вызывают никаких воспалительных изменений («здоровое носительство»). В некоторых ситуациях, однако, рост дрожжевых грибов усиливается, что сопровождается возникновением локального инфекционно-воспалительного процесса – кандидоза, который также известен под названием «молочница». Чаще всего причиной кандидоза слизистых является C. albicans, однако все большее значение приобретает кандидоз, вызванный другими видами этого рода – C. glabrata, C. dubliniensis, C. krusei и др.
Кандидоз слизистых встречается очень часто. Факторами риска кандидоза полости рта являются младенческий и пожилой возраст, наличие тяжелых заболеваний с иммунодефицитом (особенно лейкоз, лимфомы, карциноматоз и ВИЧ), недостаточная гигиена полости рта, синдром Шегрена, сахарный диабет и другие эндокринологические заболевания, ношение зубных протезов, применение ингаляционных и системных глюкокортикоидов. Факторы риска генитального кандидоза (вульвовагинита) менее ясны, однако предполагается значение нарушения баланса эстрогенов и применения антибиотиков.
Факторы риска генитального кандидоза (вульвовагинита) менее ясны, однако предполагается значение нарушения баланса эстрогенов и применения антибиотиков.
Клиническая картина кандидоза слизистых достаточна характерна (наличие крошковатых налетов белого цвета на фоне гиперемии при псевдомембранозной форме кандидоза), однако она может напоминать другие заболевания, в первую очередь лейкоплакию и красный плоский лишай. Для дифференциальной диагностики этих заболеваний проводят лабораторные тесты.
Существует несколько способов идентификации дрожжеподобных грибов: микроскопия окрашенного по Граму или с помощью метиленового синего мазка/соскоба, микроскопия мазка/соскоба после обработки раствором гидроксида калия KOH, микроскопия нативного мазка (для вульвовагинита) и посев на среду (микробиологический метод).
Посев на среду – это самый точный метод диагностики. С помощью этого метода удается не только выявить дрожжеподобные грибы, но и определить конкретный вид гриба и его количество, а также его чувствительность к противогрибковым препаратам.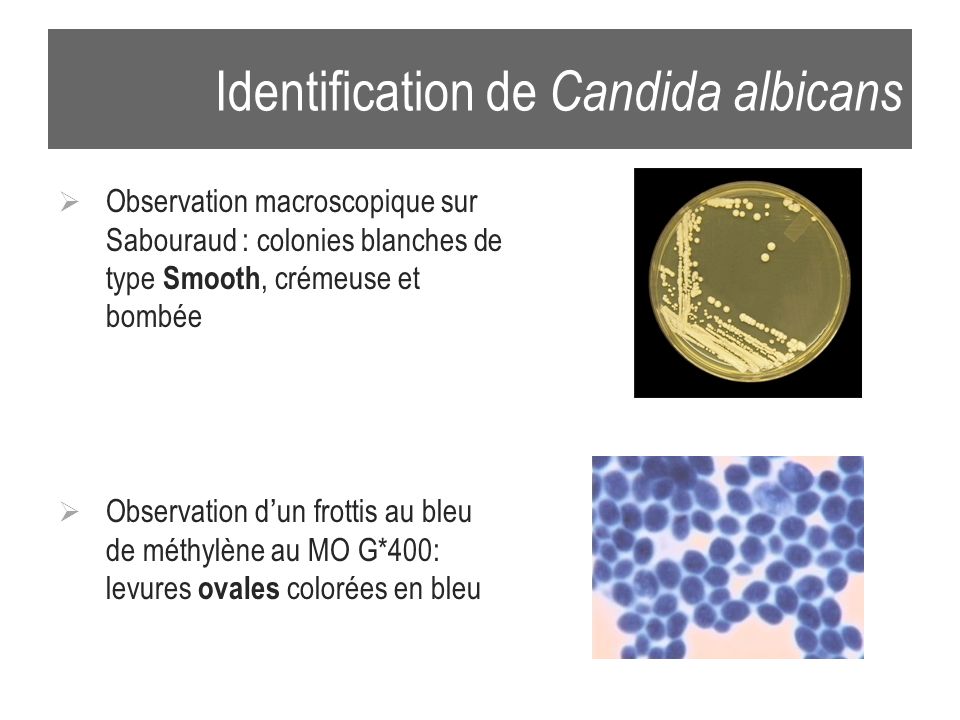 Определение видовой принадлежности культуры микроорганизмов, в том числе грибов, называется выделением «чистой культуры». Выделение чистой культуры и определение чувствительности к противогрибковым препаратам имеет особое значение при наличии у пациента резистентного к стандартной (эмпирической) антимикотической терапии кандидоза или при рецидивирующем течении заболевания. Исследование может применяться как для первичной диагностики, так и для оценки эффективности лечения заболевания.
Определение видовой принадлежности культуры микроорганизмов, в том числе грибов, называется выделением «чистой культуры». Выделение чистой культуры и определение чувствительности к противогрибковым препаратам имеет особое значение при наличии у пациента резистентного к стандартной (эмпирической) антимикотической терапии кандидоза или при рецидивирующем течении заболевания. Исследование может применяться как для первичной диагностики, так и для оценки эффективности лечения заболевания.
С учетом большой распространенности «здорового носительства» грибов рода Candida, у многих людей при микробиологическом исследовании может быть определен незначительный рост дрожжеподобных грибов. При отсутствии каких-либо клинических признаков кандидоза такой рост не имеет никакого клинического значения. С другой стороны, обилие колоний дрожжевых грибов (более 104 КОЕ/мл) у пациента с минимальными признаками кандидоза или вовсе без них, но с факторами риска этого заболевания должно насторожить врача и, возможно, потребует назначение антимикотических препаратов. В этом случае дополнительным диагностическим исследованием, которое может существенно помочь при интерпретации результатов, является микроскопия — определение в мазке множества делящихся дрожжеподобных грибов свидетельствует в пользу кандидоза.
В этом случае дополнительным диагностическим исследованием, которое может существенно помочь при интерпретации результатов, является микроскопия — определение в мазке множества делящихся дрожжеподобных грибов свидетельствует в пользу кандидоза.
С учетом того, что иногда кандидоз слизистой (в первую очередь, полости рта) является симптомом более серьезного заболевания, в некоторых случаях могут быть рекомендованы дополнительные лабораторные тесты, в том числе анализ глюкозы крови, определение гормонов щитовидной, паращитовидной, половых желез и надпочечников, анализ на ВИЧ и иммунологические исследования. Более широкое лабораторное обследование также показано при наличии хронического кандидоза кожи и слизистых. Следует отметить, что генитальный кандидоз не относится к числу инфекций, передающихся половым путем (ИППП), поэтому при выявлении этого заболевания у пациента обследование его половых партнеров не показано.
Для чего используется исследование?
- Для диагностики и контроля лечения кандидоза слизистых оболочек.

Когда назначается исследование?
- При наличии признаков кандидоза слизистых оболочек: жжения, болезненности, зуда, наличия крошковатых налетов белого цвета на фоне гиперемии;
- при наличии факторов риска кандидоза полости рта: младенческий и пожилой возраст, наличие тяжелых заболеваний с иммунодефицитом (лейкоз, лимфомы, карциноматоз и ВИЧ), недостаточная гигиена полости рта, синдром Шегрена, сахарный диабет и другие эндокринологические заболевания, ношение зубных протезов, применение ингаляционных и системных глюкокортикоидов.
Что означают результаты?
Выдается результат по грибам рода Candida — обнаружены/не обнаружены + результат по микроскопии (наличие нормальной микрофлоры/ клетки эпителия, лейкоциты, палочки, кокки и т.д.).
Положительный результат:
- кандидоз слизистых;
- «здоровое носительство».
Отрицательный результат:
- норма;
- эффективное лечение противогрибковыми препаратами.

Что может влиять на результат?
- Применение противогрибковых препаратов (флуконазол, итраконазол) может приводить к ложноотрицательному результату.
Скачать пример результата
Важные замечания
- При отсутствии каких-либо клинических признаков кандидоза незначительный рост колоний гриба (менее 104 КОЕ/мл) не имеет клинического значения;
- иногда кандидоз слизистой (в первую очередь, полости рта) является симптомом более серьезного заболевания, поэтому могут быть рекомендованы дополнительные лабораторные тесты.
Также рекомендуется
[02-014] Общий анализ крови (без лейкоцитарной формулы и СОЭ)
[06-015] Глюкоза в плазме
[08-118] Тиреотропный гормон (ТТГ)
[08-033] Паратиреоидный гормон, интактный
[07-032] HIV 1,2 Ag/Ab Combo (определение антител к ВИЧ типов 1 и 2 и антигена p24)
Кто назначает исследование?
Терапевт, дерматовенеролог, врач общей практики.
Литература
- Gonsalves WC, Chi AC, Neville BW. Common oral lesions: Part I. Superficial mucosal lesions. Am Fam Physician. 2007 Feb 15;75(4):501-7.
- Burns T., Breathnach S., Cox N., Griffiths C. Rook’s Texbook of Dermatology / T. Burns, S. Breathnach , N. Cox, C. Griffiths; 8th ed. – Wiley-Blackwell, 2010.
Роль различных видов грибов рода Candida в этиологии кандидоза полости рта у пациентов с псориазом и экземой
Кандидоз — заболевание, часто диагностируемое врачами разных специальностей: стоматологами, терапевтами, хирургами, дерматологами [4]. Кандидоз полости рта может возникнуть как при приеме системных препаратов (антибиотиков, иммуносупрессоров), так и вследствие снижения иммунитета (у ВИЧ-инфицированных пациентов, у лиц с хроническими соматическими заболеваниями) [2, 3]. Среди факторов, способствующих поражению полости рта кандидозной инфекцией, большое значение имеют хронические заболевания кожи: экзема и псориаз тяжелого, длительного течения. Возможность возникновения кандидоза полости рта при них объясняется как применением иммуносупрессивной терапии (антибиотики, глюкокортикостероиды), так и иммунодефицитными состояниями, возникающими на фоне этих заболеваний [9].
Возможность возникновения кандидоза полости рта при них объясняется как применением иммуносупрессивной терапии (антибиотики, глюкокортикостероиды), так и иммунодефицитными состояниями, возникающими на фоне этих заболеваний [9].
Самый частый возбудитель кандидоза полости рта — грибы Candida albicans, вызывающие заболевание в 62—93% случаев [8]. По данным некоторых авторов, 2-е место среди дрожжеподобных грибов, вызывающих оральный кандидоз, занимает вид C. glabrata [7].
Определение вида грибов рода Candida, вызвавших кандидоз ротовой полости, не является широко распространенным методом исследования, однако оно особенно необходимо в случаях выявления резистентности возбудителя к проводимому лечению.
Частота выявления кандидоза полости рта у пациентов с псориазом, экземой, а также видовая характеристика грибов рода Candida и их роль в этиологии кандидоза полости рта у лиц с хроническими кожными заболеваниями, на наш взгляд, изучены недостаточно, а результаты исследований освещены лишь в небольшом количестве источников литературы [2—4].
Цели нашего исследования — оценка распространенности кандидоза полости рта у пациентов с псориазом и экземой в сравнении с контрольной группой и видовая идентификация возбудителя.
Материал и методы
На базе Витебского областного клинического кожно-венерологического диспансера и на кафедре терапевтической стоматологии Витебского государственного медицинского университета были обследованы лица 3 групп: с псориазом, с хронической экземой и без кожных заболеваний в анамнезе (контроль) (табл. 1).
Все пациенты были обследованы для выявления кандидоза полости рта и бессимптомного кандидоносительства. С этой целью проводились сбор жалоб, анамнеза, осмотр полости рта с занесением данных в карту обследования. Затем на базе бактериологической лаборатории Витебского областного центра гигиены и эпидемиологии были проведены выявление культур грибов рода Candida и их последующая видовая идентификация.
Материал для лабораторных исследований (белые пленки и налеты на слизистой оболочке полости рта) забирали стерильным ватным тампоном, увлажненным физиологическим раствором, в день обращения пациента за стоматологической помощью (до назначения антимикотической терапии) [1]. Ватный тампон с материалом переносили в стерильной пробирке с последующим пересевом на среду Сабуро. Далее проводилась инкубация культур в термостате в течение 48 ч при t=25—28 °С. Из подозрительных колоний грибов делались мазки, окрашивались по Граму и просматривались под микроскопом.
Для накопления чистой культуры производился отсев колоний на скошенный агар Сабуро или его сектора. В дальнейшем видовую идентификацию полученной культуры осуществляли по характеру роста колоний на твердых средах и с использованием методов биохимического типирования (тест на уреазу, тесты ферментации углеводов) [1, 5, 6]. Окончательно количество выросших колоний оценивали через 5 сут полуколичественным методом.
С целью выявления возможного увеличения степени обсемененности слизистой оболочки полости рта грибами рода Сandida при бессимптомном кандидоносительстве через 4 дня осуществлялись повторные бактериологические исследования.
Для видовой идентификации грибов вида C. albicans (выявление фрагментов ДНК в клиническом материале) также был применен метод молекулярной биологии (полимеразная цепная реакция — ПЦР). Исследование осуществляли на базе ЦНИЛ Витебского государственного медицинского университета с помощью набора реагентов «АмплиСенс Candida albicans» с детекцией в агар-геле (Россия).
Диагноз кандидоза полости рта ставили пациентам с жалобами на жжение, дискомфорт в полости рта, болезненные ощущения при приеме кислой пищи, запах изо рта, при наличии клинических проявлений, характерных для различных форм данного заболевания.
Диагноз подтверждался данными бактериологического (количество колоний грибов рода Candida ≥103 КОЕ/мл), цитологического исследования, ПЦР.
Кандидоносительство устанавливалось при отсутствии жалоб, клинических проявлений и количестве колоний грибов рода Candida ≤103 КОЕ/мл на фоне отсутствия увеличения количества культур при проведении повторного бактериологического исследования.
Статистическую обработку результатов проводили с помощью программ MS Excel и «Статистика 6.0».
Результаты и обсуждение
При осмотре полости рта характерные для кандидоза жалобы и клинические проявления разной степени тяжести обнаружены у 8 (8,6%) человек контрольной группы, у 53 (23,9%) пациентов с псориазом (р<0,05) и у 33 (30%) — с хронической экземой (р<0,05). Таким образом, клиническая картина кандидоза полости рта достоверно чаще определялась у лиц с псориазом и экземой, чем в контрольной группе.
При применении бактериологического метода грибы рода Candida выявлены у 72 (32,4%) из 222 пациентов с псориазом. У 59 (81,9%) из 72 количество колоний составляло ≥103 КОЕ/мл. В группе пациентов с хронической экземой при посеве грибы рода Candida выявлены у 38 (34,5%) и у 33 (86,8%) из них количество колоний было ≥103 КОЕ/мл.
У 59 (81,9%) из 72 количество колоний составляло ≥103 КОЕ/мл. В группе пациентов с хронической экземой при посеве грибы рода Candida выявлены у 38 (34,5%) и у 33 (86,8%) из них количество колоний было ≥103 КОЕ/мл.
В контрольной группе при посеве грибы рода Candida выявлены у 18 (19,3%) человек, при этом у 9 (50%) из них количество колоний составило ≥103 КОЕ/мл.
Данные о частоте выявления колоний грибов рода Candida у пациентов с псориазом, распространенным инфекционным дерматитом и у лиц контрольной группы представлены в табл. 2.
Из пациентов с псориазом грибы рода Candida, отличные от C. albicans, были выявлены у 7 (9,7% от лиц с выявленными грибами данного рода), в том числе C. tropicalis — у 1, C. parapsilosis — у 1, C. krusei — у 4. У 1 пациента вид Candida определить не удалось.
Из пациентов с распространенным инфекционным дерматитом грибы рода Candida, отличные от C. albicans, выявлены у 9 (23,7%), в том числе C. tropicalis — у 1 пациента, C. parapsilosis — у 2, C. krusei — у 4 человек. У 2 пациентов вид грибов рода Сandida определить не удалось.
albicans, выявлены у 9 (23,7%), в том числе C. tropicalis — у 1 пациента, C. parapsilosis — у 2, C. krusei — у 4 человек. У 2 пациентов вид грибов рода Сandida определить не удалось.
В контрольной группе виды Candida, отличные от C. albicans, выявлены у 3 (16,7%) пациентов, в том числе C. parapsilosis — у 2 и C. krusei — у 1.
ПЦР проведена у 39 пациентов с псориазом, у 12 — с распространенным инфекционным дерматитом и у 41 человека из контрольной группы.
Из пациентов с псориазом грибы вида C. albicans выявлены у 4 (10,2%), из лиц с распространенным инфекционным дерматитом — у 4 (33,3%) и в контрольной группе — у 9 (22,0%).
Среди этих лиц клиническая картина кандидоза и число колоний >1000/мл были зафиксированы у 1 пациента с псориазом, у 3 — с распространенным инфекционным дерматитом и у 2 лиц контрольной группы. Среди пациентов с псориазом выявлено 53 (23,9%) человека, страдающих кандидозом ротовой полости, среди лиц с распространенным инфекционным дерматитом — 33 (30%) и в контрольной группе — 8 (8,6%).
Таким образом, у лиц с кожными заболеваниями (псориаз, экзема) частота встречаемости кандидоза ротовой полости достоверно выше, чем в контрольной группе (р<0,05). Достоверных различий в частоте выявления представителей данного рода, отличных от C. albicans, нами не обнаружено. Наиболее частыми возбудителями кандидоза во всех исследуемых группах после C. albicans явились C. krusei и C. parapsilosis.
Анализы в KDL. Посев на грибы рода кандида с идентификацией
Выберите требуемый вид биоматериала
В течение суток перед исследованием не применять местные антисептики и антибиотики, в течение 2 часов исключить любые местные процедуры (полоскания, спреи, капли). Материал для исследования из зева берется утром до чистки зубов, или в течение дня не ранее чем через 2 часа после последнего приема пищи. Исследование проводится до начала антибактериальной терапии. Контроль излеченности — не ранее чем через 2 недели после окончания лечения.
Контроль излеченности — не ранее чем через 2 недели после окончания лечения.
Взятие материала на исследование возможно только врачом соответствующей квалификации.
Используется средняя порция утренней мочи. Перед сбором мочи проводится тщательный туалет наружных половых органов без использования антибактериального мыла и антисептиков. Исследование проводится до начала антибактериальной терапии. Контроль излеченности — не ранее чем через 2 недели после окончания лечения.
В течение суток перед исследованием не применять местные антисептики и антибиотики, в течение 2 часов исключить любые местные процедуры (полоскания, спреи, капли). Материал для исследования из зева берется утром до чистки зубов, или в течение дня не ранее чем через 2 часа после последнего приема пищи. Исследование проводится до начала антибактериальной терапии. Контроль излеченности — не ранее чем через 2 недели после окончания лечения.
Кал собирается в стерильный пластиковый контейнер в небольшом объеме (не более 1/3 контейнера) из различных мест фекальной массы. Стул должен быть самостоятельным и собран с невпитывающих материалов.
Стул должен быть самостоятельным и собран с невпитывающих материалов.
Накануне исследования не применять местные лекарственные препараты и процедуры, исключить половой акт. При взятии соскоба из уретры не мочиться в течение 1,5-2 часов до процедуры. Если исследование назначается для контроля излеченности, то взятие материала на исследование методом ПЦР возможно не ранее, чем через 28 дней после окончания приема антибиотиков, на микробиологические исследования не ранее,чем через 14 дней.
Соскобы из урогенитального тракта не берутся в течение суток после местной терапии (свечи, мази, спринцевания), после полового контакта и во время менструации у женщин. После кольпоскопии, интравагинального УЗИ должно пройти 48 часов. В случае наличия признаков острого воспаления необходимость взятия мазка определяется лечащим врачом. Если исследование назначается для контроля излеченности, то взятие материала на микробиологические исследования не ранее,чем через 14 дней после окончания лечения.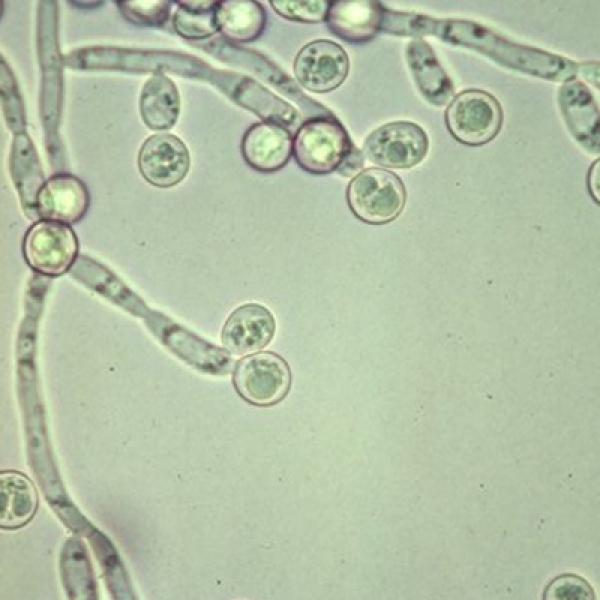
Соскобы из урогенитального тракта не берутся в течение суток после местной терапии (свечи, мази, спринцевания), после полового контакта и во время менструации у женщин. После кольпоскопии, интравагинального УЗИ должно пройти 48 часов. В случае наличия признаков острого воспаления необходимость взятия мазка определяется лечащим врачом. Если исследование назначается для контроля излеченности, то взятие материала на исследование методом ПЦР возможно не ранее, чем через 28 дней после окончания приема антибиотиков, на микробиологические исследования не ранее,чем через 14 дней.
Соскобы из урогенитального тракта не берутся в течение суток после местной терапии (свечи, мази, спринцевания), после полового контакта и во время менструации у женщин. После кольпоскопии, интравагинального УЗИ должно пройти 48 часов. В случае наличия признаков острого воспаления необходимость взятия мазка определяется лечащим врачом. Если исследование назначается для контроля излеченности, то взятие материала на исследование методом ПЦР возможно не ранее, чем через 28 дней после окончания приема антибиотиков, на микробиологические исследования не ранее,чем через 14 дней.
Мокроту можно собрать только при наличии кашля! Перед сбором мокроты рекомендуется почистить зубы (не использовать зубную пасту с антибактериальными компонентами) и прополоскать рот кипяченой водой. Избегать попадания в мокроту слюны и носовой слизи. Мокрота по мере откашливания собирается в стерильный контейнер. Кашель можно вызвать с помощью нескольких глубоких вдохов.
статьи медцентра Оксфорд Медикал Днепр
Женское влагалище содержит уникальную микрофлору и обладает кислой реакцией среды. Влагалище женщины населяет множество разнообразных микроорганизмов, в числе которых и грибы рода «кандида» (Candida).
Стоит лишь немного нарушить биологическое равновесие влагалища, как грибы превращаются из одного из обитателей в заболевание.
ГРИБЫ РОДА CANDIDA. ЧТО ЭТО?
Это вопрос волнует всех женщин. Кандидоз, попросту – молочница – является одной из самых неприятных женских болезней.
Характерные признаки молочницы, вызывающие основной дискомфорт, это — творожистые выделения, обладающие неприятным кислым запахом. Обнаружение гриба в результате лабораторного анализа еще не свидетельствует о болезни, так как пребывание этого гриба в микрофлоре влагалища абсолютно естественно. О заболевании кандидозом говорят симптомы.
Обнаружение гриба в результате лабораторного анализа еще не свидетельствует о болезни, так как пребывание этого гриба в микрофлоре влагалища абсолютно естественно. О заболевании кандидозом говорят симптомы.
Неслучайно, что кандида «выбрала» именно влагалище в качестве совей среды обитания. Грибам кандида, как и другим живым организмам, свойственно стремление клеток к определенным факторам-раздражителям (тропизм). Растения, например, активнее всего растут на свету. А кандиды выбирают среду содержащую гликоген.
Гликоген — полисахарид, являющийся главной формой сохранения глюкозы в клетках органического происхождения. Гликоген является энерго-резервом ткани, своеобразным ресурсом, быстро воспользоваться которым организм может при острой необходимости. В слизистой оболочке влагалища женщины содержатся большие запасы гликогена, именно поэтому кандида чувствительна к изменениям диеты. Резкое уменьшение сладкого и углеводом в рационе женщины значительно угнетает рост этого гриба.
ЛЕЧЕНИЕ КАНДИДОЗА
Существует два типа микрофлоры слизистой оболочки человека: резидентная и транзиторная.
Резидентная микрофлора – микроорганизмы, живущие на слизистой всегда, не вызывающие заболевание своим присутствием. Такими микроорганизмами являются, к примеру, ацидофильные лактобактерии. Они препятствуют возникновению заболеваний и следят за «чистотой» влагалища. Еще одной важной ролью кислой среды влагалища – препятствие проникновению сперматозоидов, в результате чего достичь яйцеклетки может лишь самый здоровый и сильный сперматозоид. Именно так должно быть, когда женщина следит за гигиеной и придерживается здорового образа жизни.
Транзиторная микрофлора – бактерии, попадающие на слизистую из внешней среды, во время контакта с заражённым человеком или предметом. Такие бактерии могут провоцировать развитие инфекционных заболеваний, если с ними не бороться.
Также как и гарднерелла, микоплазма и уреаплазма, грибок рода кандида – характерный представитель транзиторного типа флоры. Кандида может появиться у женщины как вследствии дисбактериоза желудочно-кишечного тракта, так и при незащищенном контакте с зараженным мужчиной.
В норме грибы кандида могут составлять лишь очень малую часть микрофлоры влагалища. Лечение грибов рода кандида основано на повышение общего и местного иммунитета, и направлено на восстановление нормальной микрофлоры влагалища.
Опубликовано: 20.01.2015
Обновлено: 06.03.2019
( Рейтинг: 4.54, голосов: 37 )
Экофуцин® – первый препарат для эрадикации грибов рода Candida с эффектом стимуляции роста лактобацилл у беременных женщин
Цель исследования: оценить эффективность и безопасность препарата Экофуцин® (международное непатентованное наименование [МНН]: натамицин, вспомогательное вещество — лактулоза), суппозитории для интравагинального введения, в сравнении с монокомпонентным лекарственным препаратом с МНН натамицин, на основании оценки сроков наступления клинической и микробиологической ремиссии острого кандидозного вагинита/вульвовагинита у беременных женщин.
Материал и методы: в исследовании участвовали беременные (срок беременности от 18 до 31 нед.) женщины от 18 до 45 лет включительно с симптомами острого кандидозного вагинита/вульвовагинита. Пациентки применяли исследуемый препарат Экофуцин® или препарат сравнения — монокомпонентный натамицин. Оба препарата применяли в дозе 1 суппозиторий интравагинально 1 р./сут в течение 6 сут. Первичным показателем эффективности явилось время до достижения клинической ремиссии, вторичным показателем — количество пациенток, у которых была достигнута ремиссия заболевания без рецидивов. Также до и после лечения проводили лабораторные исследования отделяемого из влагалища. Для оценки безопасности исследуемого препарата и препарата сравнения регистрировали нежелательные явления.
Результаты исследования: в основной группе клиническая и микробиологическая ремиссия наступила у большего количества пациенток и в среднем за более короткий промежуток времени, чем в группе сравнения. Также в основной группе часть клинических проявлений (зуд, жжение) купировались быстрее и рецидивов заболевания за время наблюдения было меньше благодаря увеличению количества лактобактерий во влагалище (до 100 раз по сравнению с исходным). По окончании терапии у пациенток, получавших препарат Экофуцин®, содержание лактобактерий в отделяемом из цервикального канала увеличилось в среднем в 50 раз (до 100 раз максимально) по сравнению с исходным, в то время как у пациенток из группы сравнения на фоне лечения данный показатель увеличился в 2,5 раза (p<0,001). При использовании исследуемого препарата и препарата сравнения не выявили развития нежелательных явлений.
Выводы: результаты проведенного сравнительного исследования достоверно демонстрируют более надежную эрадикацию грибов рода Candida и быстрое купирование клинических проявлений кандидозного вагинита/вульвовагинита у большего количества пациенток в основной группе, которые использовали препарат Экофуцин®. У женщин, получавших Экофуцин®, отмечали увеличение содержания лактобактерий во влагалище до 100 раз, что способствовало уменьшению частоты рецидивов заболевания.
Ключевые слова: Экофуцин, натамицин, лактулоза, вульвовагинальный кандидоз, Candida, лактобактерии , кандидозный вагинит/ вульвовагинит.
Для цитирования: Кузьмин В.Н., Богданова М.Н. Экофуцин® — первый препарат для эрадикации грибов рода Candida с эффектом стимуляции роста лактобацилл у беременных женщин. РМЖ. 2020;1(*):1–7.
Современный взгляд на использование грибов в женском здоровье и болезнях
РЕЗЮМЕ
Большая часть того, что известно о грибах во влагалище человека, получена в результате культуральных исследований и фенотипической характеристики отдельных организмов. Несмотря на свою ценность, эти подходы замаскировали сложность грибковых сообществ во влагалище. Влагалищный микобиом стал новой областью исследований, поскольку инструменты геномики все чаще используются, и мы начинаем осознавать роль, которую эти грибковые сообщества играют в здоровье и болезнях человека.Хотя количество грибов значительно превосходит их бактериальные аналоги, они являются важными составляющими экосистемы влагалища у многих здоровых женщин. Candida albicans , условно-патогенный грибковый патоген, колонизирует 20% женщин, не вызывая каких-либо явных симптомов, однако он является одной из основных причин инфекционного вагинита. Понимание механизмов комменсализма и патогенеза имеет важное значение для разработки более эффективных методов лечения. Описание взаимодействия между Candida , бактериями (такими как Lactobacillus spp.) и других грибков во влагалище является фундаментальным для нашей характеристики микобиома влагалища.
КЛЮЧЕВЫЕ СЛОВА: Candida albicans , грибковое сообщество, грибы, инфекционные заболевания, микробная экология, микробиом, микробиота, микобиота, влагалище, кандидозный вульвовагинальный
Введение
Сообщество грибковых организмов, обитающих в нижних отделах женского репродуктивного тракта называется вагинальной микобиотой. Среди них — одна из основных причин вагинальной инфекции Candida albicans , хорошо изученный грибковый патоген.Поскольку вульвовагинальный кандидоз (ВВК) является второй наиболее часто встречающейся формой инфекционного вагинита, большие усилия были вложены в изучение механизмов патогенеза C. albicans . Однако совокупность грибковых организмов, присутствующих во влагалище, сильно недооценивается. Хотя мы обладаем обширными знаниями о типах бактерий, присутствующих во влагалище, об их грибковых аналогах известно очень мало. Недавние исследования, изучающие состав грибов во влагалище, указали на захватывающий новый рубеж исследований.Изучение типов, функциональной и композиционной динамики видов грибов в контексте среды влагалища является важной задачей, имеющей потенциальные последствия для лечения и профилактики ВВК, улучшения акушерских исходов и репродуктивного здоровья в целом. Недавние достижения в области инструментов секвенирования следующего поколения позволили проводить высокопроизводительную идентификацию грибов и дать новые знания об их экологии.
Микология влагалища
Сумма геномов и генов грибов, существующих в определенной экологической или биологической нише, называется «микобиомом».” 1 У человека микобиом плохо изучен по сравнению с микробиомом, который был подробно описан в рамках Human Microbiome Project — крупнейшего и наиболее полного исследования бактериальных таксонов у здоровых взрослых. 2-5 В разгар новой взрывной эры геномики, быстро развивающихся технологий секвенирования и передовых инструментов биоинформатики микобиом превратился в свою собственную «подспециализацию» в области микробной геномики, но отстает сильно отстает от своего бактериального аналога. 6
В самых ранних исследованиях вагинальной микробиологии недооценивалась сложность этой экосистемы, отчасти из-за ограничений используемых культурально-зависимых методов. 7,8 В то время как давно известно, что бактерии доминируют во влагалищной среде, что привело к ряду исследований бактериального сообщества, первые исследователи вагинальной микологии попытались привлечь внимание к важности грибковых членов этого сообщества. 9
Используя классические культурально-зависимые методы, исследователи измерили точечную распространенность вагинальных грибков у здоровых добровольцев и диабетиков, а также у подростков и беременных женщин. 10-12 Грибы были выделены культивированием в 20–60% проб. Без исключения преобладающий член грибного сообщества определяется как C. albicans (часто> 70%), хотя ранговая распространенность среди не albicans — видов (включая C. krusei, C. parapsilosis, C. tropicalis). , C. glabrata, C. guilliermondii, C. pseudotropicalis, C. stellatoidea и др.) Варьируется в зависимости от изучаемой популяции, географии и методов выращивания. Более поздние эпидемиологические исследования носительства Candida сообщают о еще большей представленности C.albicans , что составляет 85–95% выделенных изолятов. 13-15
В исследовании, сравнивающем изолятов Candida из США и Соединенного Королевства, сделан вывод о том, что физиологическое биотипирование не позволяет достоверно различить исследованные изоляты. 16 По мнению авторов, данные не подтверждают тропизм штаммов — выбор между «вагинотропными» и «вагинопатическими» штаммами, поскольку штаммы, выделенные во время инфекции, статистически идентичны штаммам, собранным при бессимптомной колонизации. 16,17 Использование тех же методов биотипирования Odds et al. 17,18 сообщили о согласованности изолятов из разных участков (и типов тканей) у одного и того же пациента и изолятов, собранных с разницей в несколько месяцев. Используя разные методы, отдельная группа также сообщила, что не существует значительных различий между штаммами Candida , выделенными из разных участков тела; но добавил, что один хозяин может быть колонизирован несколькими видами и даже несколькими генотипами одного и того же вида. 19
Используя независимую от культивирования библиотеку клонов гена 18S рРНК, Guo et al 20 идентифицировали 3 типа грибов во влагалищных образцах: Ascomycota (22/28), из которых Candida были преобладающими родами. , Basidiomycota (5/28) и Oomycota (1/28). Они сообщили о большей доле C. albicans и более низкой доле S. cerevisiae и некультивируемых (неидентифицированных) грибов у женщин с аллергическим ринитом и рецидивирующим вагинальным кандидозом по сравнению со здоровыми людьми из контрольной группы.Разнообразие грибов также увеличилось в этих популяциях пациентов по сравнению с контрольной группой. Авторы предположили, что грибковый дисбиоз может быть коррелирован с патофизиологией рецидивирующего вагинального кандидоза, подчеркивая роль грибкового сообщества в заболевании.
Хотя технология секвенирования следующего поколения значительно расширила наши представления о бактериальной микробиоте во влагалище человека 21 , эти сложные методы применялись для изучения микобиоты влагалища в гораздо меньшей степени.Фактически, самое первое исследование грибковых сообществ во влагалище на основе секвенирования нового поколения было опубликовано в 2013 году группой, целью которой было описать бактериальные и грибковые сообщества женщин в Эстонии. 22 В этом поперечном исследовании секвенировали внутренний транскрибируемый спейсер 1 (ITS1) в 251 вагинальном образце от 294 здоровых женщин, чтобы охарактеризовать таксономический состав грибов. Пятьдесят восемь процентов последовательностей принадлежали к отделу Ascomycota , хотя Basidiomycota также была представлена в небольшом количестве последовательностей (3%).В пределах Ascomycota наблюдались попадания в Saccharomycetales (доминирует род Candida ), Capnodiales, Eurotiales, Pleosporales и Helotiales . Полученное среднее таксономическое богатство для каждого образца составило около 8 функциональных таксономических единиц грибов (OTU). Candida OTU могут быть обнаружены в 70% образцов. Не удивительно, что в группе последовательностей, картирующих Candida, преобладала C. albicans (68%).Поразительно, что из этого набора данных было получено 161 уникальное совпадение на уровне вида, но 38% OTU не были указаны — не было доступно таксономическое присвоение ниже царства. Эти результаты говорят об очень серьезной проблеме в молекулярной таксономии грибов. Качество и относительно низкая представленность видов грибов в справочных базах данных напрямую влияет на качество и точность возвращаемых таксономических присвоений. В современных базах данных не только отсутствует богатый объем последовательностей, которые существуют для бактериального гена 16S рРНК, но также широко распространены таксономические синонимы и неправильная классификация. 23-25 Для защиты целостности этих исследований абсолютно необходимы тщательное аннотирование последовательностей и курирование базы данных. Результаты, опубликованные Drell et al. , 22 , тем не менее, показывают недооцененное разнообразие грибковых членов в вагинальной экосистеме и требуют последующих действий по этим результатам. В свете нашего ограниченного понимания вагинальной микологии, большая часть того, что мы знаем, получена в результате исследований, посвященных ключевому игроку C. albicans .
Комменсализм грибков во влагалище
Witkin и Ledger 26 описали характеристики и качества среды влагалища человека, которые делают ее уникальной и сложной. В отличие от часто используемых моделей на животных, влагалище женщин репродуктивного возраста имеет отчетливо кислую среду (pH 4,5 или ниже) из-за присутствия бактерий, продуцирующих молочную кислоту, которые процветают в этой анаэробной нише 27 , иначе не описанной в Класс Mammalia. 28 Дальнейшие сложности влагалищной среды у людей включают циклы роста, выработку гликогена и продуктов его распада человеческими α-амилазами 29 и отрыв эпителия в ответ на репродуктивные гормоны, в первую очередь врожденные (в отличие от адаптивная) иммунная защита слизистых оболочек. 30-32 Эти физиологические особенности, безусловно, являются ключевыми детерминантами микробной колонизации слизистой оболочки влагалища. 7,33
В 1976 году Гоплеруд и др. выделили Lactobacillus spp и C. albicans с постоянно увеличивающейся частотой в течение всех 3 триместров у здоровых беременных женщин. 34 Эти ранние наблюдения предоставили предварительные доказательства положительной корреляции между уровнем эстрогена и вагинальной колонизацией микробов.Данные были дополнительно подтверждены Ларсеном и Галаском 35 , которые продемонстрировали облигатную эстрогенизацию для достижения колонизации дрожжей на модели вагинального кандидоза на крысах. В настоящее время все модели вагинального кандидоза на лабораторных животных требуют лечения эстрогенами для установления колонизации и последующей инфекции. 36, 37 Некоторые виды Candida обладают цитозольным рецептором эстрогена, который может опосредовать прямые транскрипционные ответы на гормоны хозяина. 38 Кроме того, было показано, что эстроген нарушает хемотаксис нейтрофилов к эпителию влагалища 39 и ингибирует дифференцировку клеток Th27, 40 , что приводит к повышенной уязвимости хозяина для патогенов, таких как Candida . Клинические и анекдотические сообщения часто связывают симптоматический вагинит Candida с лютеиновой фазой непосредственно перед менструацией, которая характеризуется как высоким уровнем эстрогена, так и повышенным влагалищным pH. 7 Исследователи задокументировали повышенный уровень C.albicans присоединяется к вагинальным эпителиальным клеткам посредством передачи сигналов эстрогена. 41 Кроме того, хотя Candida известен своей переносимостью в широком диапазоне pH, прилипание к вагинальным эпителиальным клеткам значительно усиливается при pH 6 по сравнению с pH 3–4. 7
Гормонозависимое производство и накопление гликогена (и продуктов его распада 29 ) эпителиальными клетками влагалища человека не следует недооценивать с точки зрения его вклада в колонизацию грибков, 42 однако Candida может использовать другие питательные вещества (включая лактат), благодаря чему Candida легко адаптируется к изменениям питательной микросреды во влагалище. 7 Источник питания, используемый Candida в определенной нише, не является тривиальной деталью, поскольку исследования четко показали влияние факторов окружающей среды, таких как доступность питательных веществ, на архитектуру клеточной стенки 43-45 , которая влияет на взаимодействия между Candida и иммунные клетки. Недавняя работа in vitro показала, что в присутствии молочной кислоты (в качестве единственного источника углерода) C. albicans поглощается макрофагами менее эффективно и может изменять профили цитокинов иммунных клеток, в частности, за счет увеличения ИЛ-10 и уменьшения Ил-17 производства. 46, 47 Интересно, что клетки, выращенные в смешанной лактатно-глюкозной среде, ведут себя больше как клетки, выращенные на лактате. Это имеет особое значение во влагалище из-за обилия как гликогена (и продуктов его расщепления), так и молочной кислоты, которые могут эффективно способствовать противовоспалительному ответу на Candida. Другие исследования подтвердили эти выводы и предполагают, что Candida , возможно, эволюционировала для сдерживания иммунных реакций, чтобы способствовать своей собственной стойкости и комменсализму. 48 Также было показано, что Lactobacillus индоламин-2,3-диоксигеназа 1 (IDO1) в кишечнике приводит к продукции катаболитов триптофана, которые действуют на регуляторные Т-клетки, что приводит к повышенной локальной экспрессии IL-22 49 и иммунозащита к ВВЦ. 50 Это говорит о том, что бактериальный микробиом может опосредовать толерантность к C. albicans на слизистой оболочке.
Прикрепление к эпителию слизистой оболочки опосредуется связыванием со специфическими рецепторами хозяина, из которых семейство адгезии ALS (агглютинин-подобная последовательность) изучено лучше всего. 51-53 Образование гиф также является важным фактором прикрепления. 54,55 В ответ на механизмы определения кворума росту дрожжей способствует высокая плотность клеток (> 10 7 клеток на мл -1 ), тогда как образование гиф стимулируется более низкой плотностью клеток (<10 7 клеток на мл). -1 ). 53 C. albicans прикрепляется к эпителиальным клеткам влагалища и полости рта на более высоком уровне, чем у других видов 56 — важное, но, скорее всего, частичное объяснение преобладания C.albicans -ассоциированные инфекции. Интересно, что Sobel et al. 57 сообщили о заметной индивидуальной вариабельности прилипания Candida к расслоенным вагинальным эпителиальным клеткам, но об увеличении прикрепления C. albicans к эпителиальным клеткам женщин с рецидивирующим VVC. 58
Патогенез
Candida и вульвовагинального кандидоза
Несмотря на то, что он является второй по распространенности вагинальной инфекцией среди женщин репродуктивного возраста в США, 13,59 эпидемиологические данные о заболеваемости ВВК остаются неполными — в первую очередь потому, что в соответствии со стандартами органов общественного здравоохранения это инфекция не подлежит регистрации. 60 И хотя это исключительно распространено — 3 из 4 женщин будут поражены хотя бы один раз в течение жизни 61 — частота бессимптомного носительства C. albicans у здоровых женщин оценивается примерно в 20%. 12,62 Механизмы иммунопротекции все еще обсуждаются, а факторы, запускающие переход от комменсальных к патогенным дрожжам, остаются неясными. Однако общепринято, что предрасположенность к росту / инвазии Candida специфична для ниши 63,64 , хотя часто встречаются иммунные дефекты, нарушения целостности эпителия и микробный дисбактериоз. 55 Хотя между слизистой оболочкой рта и влагалища существует много общего, иммунология вагинита Candida , несомненно, отличается. 65,66 Об иммунологии ВВК написаны отличные обзоры, поэтому здесь мы не будем их обсуждать. 67-69
Статистически значимое увеличение было отмечено в количестве колоний C. albicans , культивированных из мазков женщин с ВВК, что представляет увеличение концентрации грибков по сравнению с контролем (здоровые, без ВВК), хотя нет Разница была измерена с видами Candida , отличными от albicans. 70 Peeters et al 70 отметили положительную корреляцию между количеством выросших колоний C. albicans и количеством / тяжестью выделений из влагалища, а также зарегистрированным зудом (зудом). Эти результаты подтверждают теорию порога грибковой нагрузки, выше которого рекрутируются воспалительные клетки, что приводит к часто регистрируемым вагинальным симптомам, включая зуд, раздражение, жжение и выделения. 68
Candida — полиморфные грибы, морфогенные переходы которых являются важными механизмами патогенеза в организме человека-хозяина. 71,72 Дрожжевая форма (бластоконидия) обычно связана с бессимптомной колонизацией, передачей или распространением (особенно в кровотоке) 60,73 , в то время как гифальная (мицелиальная) форма в основном способствует прикреплению и инвазии слизистой оболочки, что характерно для симптоматическое заболевание. 57,60,74,75 Peters et al 76 недавно отметили, что гены, которые контролируют морфогенез C. albicans , необходимы для иммунопатологии, связанной с VVC.Различные стимулы окружающей среды влияют на морфологию клетки, включая доступность питательных веществ, pH и температуру. 72 Используя сложные механизмы восприятия кворума, C. albicans регулирует морфогенез в ответ на эти внешние сигналы. 77
In vitro протеолитическая активность изолятов C. albicans от женщин с симптоматической ВВК была выше, чем у изолятов от бессимптомных носителей. 78 Протеолитические ферменты, а именно семейство секретируемых аспартилпротеаз (SAP), являются хорошо изученными факторами вирулентности, используемыми C.albicans , в частности, для проникновения в слой слизистой оболочки во время ВВК и индукции иммунопатологии. 79-83 В 1940 году было высказано предположение, что иммунопатология ВВК вызывается токсином Candida . 84 Спустя десятилетия исследователи опровергли эту гипотезу, предположив, что гликопротеинов клеточной стенки Candida похожи на бактериальные эндотоксины по своему структурному расположению, пирогенности и иммуногенности, хотя и гораздо менее эффективны. 85 Однако ранее в этом году Moyes et al 86 идентифицировали секретируемый цитолитический пептидный токсин, продуцируемый C.albicans , который важен для патогенеза слизистой оболочки на мышиной модели ротоглоточного кандидоза. C. albicans гена удлинения клетки 1 (ECE1), который кодирует токсин, названный ими кандидализин, 86 также является одним из наиболее высоко экспрессируемых генов во время мышиного VVC. 87
Как и многие патогенные бактерии, видов Candida в целом и C. albicans в частности эффективны при образовании биопленок в организме человека-хозяина. 88,89 C. albicans биопленок было обнаружено на зубных протезах, катетерах, а также на эпителии слизистых оболочек. 90 Контактное зондирование (контакт с абиотическими субстратами или субстратами-хозяевами) было описано как важный пусковой механизм для образования биопленок C. albicans . 91 Кроме того, дрожжевые клетки стимулируются к образованию гиф при контакте с поверхностью, 91 , что в некоторых случаях может способствовать активному проникновению в ткани хозяина 92,93 , а в других может приводить к образованию зрелой биопленки. 94 Транскрипционная регуляция образования биопленок в основном приписывается Bcr1, Tec1 и Efg1, 90 однако недавние исследования выявили новые факторы транскрипции, связанные с этим процессом: Ndt80, Rob1, Brg1. 95 Harriott et al. 96 были первыми, кто продемонстрировал на моделях in vivo, и ex vivo вагинита мышей Candida , что C. albicans действительно образует Bcr1- и Efg1-зависимые биопленки. Подобно другим участкам тела, биопленки во влагалище вызывают серьезную озабоченность, поскольку они вовлечены в иммунопатологию ВВК, неудачи противогрибкового лечения и рецидивирующие инфекции. 97,98 Геномные микровариации у C. albicans , которые включают перестройки, потерю гетерозиготности, полиморфизмы и вариации числа копий, также были связаны с устойчивостью грибов в организме хозяина и устойчивостью к противогрибковым препаратам. 99,100
Candida — Взаимодействие бактерий во влагалище
Еще в 1930 году палочка Додерлейна, 101 , которая сейчас широко известна как Lactobacillus , положительно относилась к защите слизистой оболочки влагалища и «здоровой» »Микросреда. 102 Из-за отсутствия Lactobacillus spp. микробиота влагалища связана с восприимчивостью к урогенитальным инфекциям, таким как бактериальный вагиноз, 103,104 ВИЧ, 105 и инфекция мочевыводящих путей, 106 , вполне естественно, что Lactobacillus spp аналогичным образом может защитить женщин от кандидозный вульвовагинит (ВВК). Среди прочего, Odds предложил в 1979 году модель, в которой устанавливается симбиоз между некоторыми грибами и бактериями, 107,108 , хотя эти отношения не были четко выяснены во влагалище.Ранние эксперименты по совместному культивированию бактерий и дрожжей привели к гипотезе о том, что роль вагинальных бактерий вряд ли предотвратит колонизацию Candida , а скорее предотвратит их неограниченное размножение. 35 В поддержку этой гипотезы короткоцепочечные жирные кислоты и лактат, продуцируемые Lactobacillus spp. и другие бактерии, продуцирующие молочную кислоту, ингибируют переключение дрожжей на гифы у C. albicans . 109 Кроме того, исследователи сообщили о более низком количестве Lactobacillus spp во влагалищных культурах от женщин с симптоматическим ВВК. 70,102 Подтверждающие доказательства этой гипотезы включают повышенную восприимчивость к вагиниту Candida после антибактериальной терапии, хорошо документированному фактору риска ВВК. 110-112 Но не все исследования подтвердили связь между ВВК и использованием антибиотиков, 113 и даже отдельные сообщения противоречивы. Это согласуется с различными типами вагинальной микробиоты, на которые антибиотики могут по-разному влиять. 114,115 Не у всех женщин, принимающих антибиотики, развивается ВВК, и у большинства женщин, сообщающих о ВВК, в последнее время не принимали антибактериальную терапию.Колонизация Candida , по-видимому, является необходимым фактором риска развития ВВК после антибактериальной терапии. 116 Однако недавно одна группа ученых пришла к выводу, что их результаты более согласуются с тем, что Lactobacillus связано с повышенным риском вульвовагинального кандидоза. 117 Объясняя механизм, с помощью которого молочная кислота подавляет иммунные ответы на C. albicans , Эне и др. 46 предоставили доказательства этого утверждения.
Candida — взаимодействия бактерий во влагалище, вероятно, происходят в контексте полимикробной биопленки на поверхности эпителия. 118119 Модель in vitro различных бактериальных биопленок C. albicans пришла к выводу, что бактерии отрицательно влияют на образование биопленок C. albicans , подавляя рост грибов и подавляя гены, ответственные за образование гиф. 120 Пелег и др. 121 описали 5 типов бактериально-грибковых взаимодействий, и многие предполагают, что они также имеют место во влагалище: физические взаимодействия, 122,123 химические обмены, 124 использование побочных продуктов метаболизма, 109,118 изменения окружающей среды, 124 и изменение иммунного ответа хозяина. 125 Необходимы дальнейшие исследования, чтобы лучше понять эту важную взаимосвязь между вагинальными бактериями, Candida spp. и другие грибы при здоровье и болезнях.
Значение микобиома грибов
Становится все более очевидным, что сообщества грибов играют более значительную роль в здоровье и болезнях человека, чем предполагалось ранее. 126,127 Необходимы согласованные усилия, такие как усилия по изучению бактериального состава и численности, чтобы вывести эту область на трансляционную и клиническую арену.Характеристика микобиома человека может привести к широкому клиническому прогрессу в диагностике, лечении и профилактике грибковых инфекций 23,128 и вульвовагинального кандидоза, в частности, но также потенциально бактериальных и вирусных инфекций. Новые разработки в области влияния грибков на здоровье и болезни человека, ставшие возможными благодаря технологиям секвенирования нового поколения, не зависящим от культур, оказались очень многообещающими. Хотя грибки гораздо менее многочисленны, чем бактерии в окружающей среде, но в первую очередь Candida albicans , они оказывают выраженное влияние на здоровье влагалища и, следовательно, требуют более глубоких исследований взаимодействия между микобиомом и микробиомом.В то время как патогенные механизмы, приписываемые отдельным видам грибов, поглощают большую часть микологии, считается, что исследования микобиома установят корреляцию между составом и функцией всего грибкового сообщества, а также взаимодействиями разных царств с процессами болезни. Примечательно, что в патогенный процесс вовлечены грибковые взаимодействия; C. glabrata связывается с гифами C. albicans для выявления ротоглоточного кандидоза, 129 , таким образом подтверждая необходимость исследований микобиома, которые учитывают полный контекст, в котором происходит инфекция.Выделение и характеристика патогенов на основе культур остается большой необходимостью, однако разработка новых моделей полимикробных сообществ in vitro (и даже in vivo ) была бы идеальной для проверки гипотез о роли микобиома влагалища для здоровья и здоровья. болезнь. И хотя мы инвестируем научный капитал в понимание патогенных механизмов, мы не должны игнорировать механизмы комменсализма, поскольку это, вероятно, приведет к превентивным стратегиям, запрещающим переход от комменсала к патогену. 130
Взаимодействие между Candida и микробиотой на границе слизистой оболочки оказывает глубокое влияние на экосистему влагалища. 109,120-125 Метаболиты и небольшие молекулы, вырабатываемые микробиотой, влияют на метаболизм и морфологию видов Candida . Изменения относительной численности микробиоты также влияют на численность Candida и ее способность проникать на поверхность слизистой оболочки, где происходит инвазия. В здоровом состоянии, когда вырабатывается молочная кислота, полученная из микробиоты, Candida может изменять выработку цитокинов хозяином и способствовать передаче противовоспалительных сигналов.Вклад бактериально-грибковых взаимодействий в экологию микробиоты влагалища еще предстоит описать.
Candida Albicans и дрожжевые инфекции
Этот обычный тип дрожжей может вызывать болезненные и раздражающие дрожжевые инфекции.
Candida albicans — это разновидность дрожжей — одноклеточный гриб — это нормальная часть микробов, обитающих в желудочно-кишечном тракте.
Небольшие количества дрожжей также обитают в различных теплых и влажных областях по всему телу, включая рот, прямую кишку, влагалище и части вашей кожи.
Его количество естественным образом контролируется бактериями и другими микроорганизмами, составляющими ваш микробиом, сообществом микроорганизмов, населяющих ваше тело.
Однако различные факторы могут нарушить ваш микробный баланс, склоняя чашу весов в пользу C. albicans и позволяя грибку выйти из-под контроля и вызвать дрожжевую инфекцию, называемую кандидозом.
Эти факторы включают:
- Антибиотики, убивающие как патогенные (вызывающие заболевания), так и полезные бактерии
- Беременность
- Диабет
- ВИЧ и другие состояния, нарушающие иммунную систему, включая стероиды и химиотерапию
Вагинальные дрожжи Инфекция
Хотя она вызывает около 90 процентов дрожжевых инфекций, Candida albicans — не единственный вид из рода Candida , который обитает в организме.
Другие распространенные виды включают C. glabrata , C. parapsilosis , C. tropicalis и C. krusei .
По оценкам некоторых исследований, около 20 процентов бессимптомных здоровых женщин имеют Candida , живущих во влагалище (хотя по некоторым оценкам это число намного выше, на 80 процентов), согласно отчету журнала The Lancet за июнь 2007 года. .
Но C. albicans включает от 85 до 95 процентов штаммов дрожжей Candida , выделенных из влагалища, отмечается в отчете.
Эти грибки проникают во влагалище через задний проход.
Избыточный рост C. albicans (или других видов Candida ) во влагалище вызывает дрожжевую инфекцию, также известную как кандидозный вагинит или вульвовагинальный кандидоз.
Общие симптомы включают:
- Зуд во влагалище и ощущение жжения в области влагалища, включая половые губы и вульву
- Белые выделения из влагалища, которые иногда описывают как похожие по консистенции на творог
- Боль во время мочеиспускания или секса
- Покраснение и отек вульвы
Вагинальные дрожжевые инфекции обычно лечат с помощью противогрибковых кремов или суппозиториев, приобретаемых без рецепта (OTC) или по рецепту.
Большинство дрожжевых инфекций проходят в течение нескольких дней после начала лечения.
Молочница и инвазивный кандидоз
Candida albicans — очень распространенный грибок, который встречается во рту у людей всех возрастов.
Например, согласно отчету Postgraduate Medical Journal , грибок обитает во рту у 30–45 процентов здоровых взрослых людей.
Несмотря на такую распространенность, оральная инфекция, вызываемая C. albicans , которая называется молочницей или кандидозом полости рта, не очень распространена среди населения в целом, по данным Центров по контролю и профилактике заболеваний (CDC).
Молочница поражает в основном очень молодых, пожилых людей и людей с ослабленной иммунной системой (включая людей, принимающих стероиды).
Симптомы молочницы включают язвы кремового цвета во рту, в том числе на языке, внутренней поверхности щек и десен, а также боль при глотании.
Если после приема антибиотиков развивается легкая инфекция молочницы, может потребоваться употребление пробиотиков или йогурта с активными культурами или безрецептурных таблеток Lactobacillus acidophilus (полезные бактерии), поскольку эти методы лечения помогают восстановить нормальный баланс микробов во рту.
Для более серьезных инфекций требуются противогрибковые препараты, в том числе специальные жидкости для полоскания рта и леденцы.
видов Candida — Doctor Fungus
Беркхоут, 1923 ном. минусы
(описан Беннетом в 1844 г.)
Таксономическая классификация
Царство: Грибки
Тип: Ascomycota
Подтип: Ascomycotina
Класс: Ascomycetes
Порядок: Saccharomycetales
Семейство: Candidae
Описание и естественная среда обитания
Кандида — дрожжи и наиболее частая причина условно-патогенных микозов во всем мире.Он также является частым колонизатором кожи и слизистых оболочек человека. Кандида является представителем нормальной флоры кожи, рта, влагалища и стула. Помимо того, что он является патогеном и колонизатором, он обнаружен в окружающей среде, особенно на листьях, цветах, воде и почве. В то время как большинство из Candida spp. являются митоспорическими, некоторые имеют известное телеоморфное состояние и производят половые споры. См. Страницу, посвященную отдельным видам, для получения более подробной информации о телеоморфных родах.
Виды
Род Candida включает около 154 видов.Из них шесть наиболее часто выделяются при инфекциях человека. В то время как Candida albicans является наиболее распространенным и значимым видом, Candida tropicalis , Candida glabrata , Candida parapsilosis , Candida krusei и Candida lusitaniae также изолированы как возбудители инфекции Candida 649. Важно отметить, что в последнее время наблюдается рост числа инфекций, вызванных non-albicans Candida spp., например, Candida glabrata и Candida krusei [4, 29, 117]. Пациенты, получающие профилактику флуконазолом, особенно подвержены риску развития инфекций из-за устойчивых к флуконазолу штаммов Candida krusei и Candida glabrata [186]. Тем не менее, разнообразие Candida spp. которые встречаются при инфекциях, увеличивается, и теперь вероятно появление других видов, которые редко встречались в прошлом [158, 259, 288, 294].
| Виды, обычно вызывающие инвазивный кандидоз | |
| Виды | Частота |
|---|---|
| Candida albicans Candida tropicalis Candida glabrata Candida parapsilosis Candida krusei Candida lusitaniae | 50 {64e6c1a1710838655cc965f0e1ea13052e867597ac43370498029d1bc5831201} {15-30} 64e6c1a1710838655cc965f0e1ea13052e867597ac43370498029d1bc5831201 15-30 {64e6c1a1710838655cc965f0e1ea13052e867597ac43370498029d1bc5831201} {15-30} 64e6c1a1710838655cc965f0e1ea13052e867597ac43370498029d1bc5831201 ~ 1 {64e6c1a1710838655cc965f0e1ea13052e867597ac43370498029d1bc5831201} {~ 1} 64e6c1a1710838655cc965f0e1ea13052e867597ac43370498029d1bc5831201 |
Синонимы
См. Сводку синонимов и отношений телеоморф-анаморф для Candida spp.
Патогенность и клиническое значение
Инфекции, вызванные Candida spp. обычно называют кандидозом. Клинический спектр кандидоза чрезвычайно разнообразен. Может быть поражен практически любой орган или система в организме. Кандидоз может быть поверхностным и локальным или глубоко укоренившимся и диссеминированным. Распространенные инфекции возникают в результате гематогенного распространения из первично инфицированного локуса. Candida albicans — наиболее патогенный и наиболее часто встречающийся вид среди всех.Его способность прилипать к тканям хозяина, продуцировать секреторные аспартил-протеазы и ферменты фосфолипазы и переходить из дрожжевой в гифальную фазу являются основными детерминантами его патогенности. Несколько факторов хозяина предрасполагают к кандидозу [242, 266, 270]:
| КОЭФФИЦИЕНТ ПЕРСПОЗНАВАНИЯ | ПРИМЕРЫ |
|---|---|
| Физиологический | Беременность, возраст (пожилые и младенческие) |
| Травма | Мацерация, инфекция, ожоговая рана |
| Гематологический | Нейтропения, клеточный иммунодефицит (лейкемия, лимфома, СПИД, апластическая анемия) |
| Эндокринологический | Сахарный диабет, гипопаратиреоз, болезнь Аддисона |
| Ятрогенный | Химиотерапевтические препараты, кортикостероиды, оральные контрацептивы, антибиотики, катетеры, хирургия |
| Другое | Внутривенная наркомания, недоедание, мальабсорбция, тимома |
Кандидоз — это в основном эндогенная инфекция, возникающая в результате чрезмерного роста грибка, обитающего в нормальной флоре.Однако иногда он может быть получен из экзогенных источников (таких как катетеры или протезы) [167] или путем передачи от человека к человеку (например, кандидоз полости рта у новорожденных от матерей с вагинальным кандидозом или эндофтальмитом после трансплантации роговицы от инфицированного донора. ) [210].
Макроскопические и микроскопические особенности
Колонии Candida spp. от кремового до желтоватого цвета, быстро растут и созревают за 3 дня. Текстура колонии может быть пастообразной, гладкой, блестящей или сухой, морщинистой и тусклой, в зависимости от вида [1295].
Микроскопические особенности Candida spp. также показывают вариации, связанные с видами. Все виды производят бластоконидии по отдельности или небольшими группами. Бластоконидии могут быть круглыми или удлиненными. Большинство видов производят псевдогифы, которые могут быть длинными, разветвленными или изогнутыми. Настоящие гифы и хламидоспоры продуцируются штаммами примерно Candida spp.
Несмотря на то, что они принадлежат к одному роду, различные виды обладают некоторой степенью уникального поведения в отношении текстуры их колоний, микроскопической морфологии на агаре кукурузной муки твин 80 при 25 ° C (метод Далмау) и профилей ферментации или ассимиляции в биохимических исследованиях. тесты [1295].
Для подробностей выберите вид:
Гистопатологические особенности
См. Нашу страницу гистопатологии.
Сравнить с
Candida spp. следует дифференцировать от других клинически встречающихся дрожжей, таких как Blastoschizomyces , Cryptococcus , Geotrichum , Malassezia , Rhodotorula , Saccharomyces и Trichosporon. Морфология на агаре кукурузной муки твин 80, образование капсул, уреазная активность, способность расти в присутствии циклогексимида, характер роста в бульоне Сабуро и профили ферментационной ассимиляции помогают дифференцировать Candida от других дрожжей.Хорошо развитые псевдогифы и одноклеточные бластоконидии характеризуют обычный вид Candida . Candida отличается от Cryptococcus наличием хорошо развитых псевдогифов. Отсутствие артроконидий является основным микроскопическим признаком, который отличает Candida от Trichosporon и Geotrichum , двух родов, которые продуцируют многочисленные артроконидии [1295].
Меры предосторожности в лабораторных условиях
Никаких особых мер предосторожности, кроме общих лабораторных, не требуется.
Восприимчивость
См. Наше расширенное обсуждение обычных паттернов восприимчивости Candida spp.
Что такое дрожжи? | Candida дрожжи
Дрожжи — это микроскопические одноклеточные организмы, принадлежащие к царству грибов — таксономической группе, которая также включает грибы и плесень.
Согласно «Биоразнообразию и экофизиологии дрожжей» (Springer, 2006), ученые идентифицировали около 1500 видов дрожжей, организмов, которые составляют около 1 процента всех видов грибов.
Дрожжи встречаются в природе, населяют почву, растительность и водные экосистемы. Они также часто встречаются на телах людей и других животных.
Дрожжи из рода Candida являются патогенными, то есть вызывают заболевания. Candida дрожжевые инфекции, известные как кандидоз, могут поражать многие участки тела, включая кожу, гениталии, горло, рот и кровь.
Candida albicans — это дрожжевой вид, который чаще всего вызывает кандидоз.Этот вид дрожжевых грибков обычно присутствует в организме в небольших концентрациях, но различные факторы — использование антибиотиков, гормональный дисбаланс, стресс или ослабленная иммунная система — могут вызвать его быстрый рост, что приводит к инфекции.
Если дрожжи Candida попадают в кровоток, они могут распространиться по всему телу и вызвать жар, озноб и даже смерть. Эта инфекция называется инвазивным кандидозом или кандидемией и является четвертой по распространенности инфекцией кровотока в Соединенных Штатах, по данным Центров по контролю и профилактике заболеваний.
Некоторые распространенные дрожжи также полезны и важны для пищевой промышленности.
Пекари используют дрожжи Saccharomyces cerevisiae в качестве разрыхлителя для осветления и смягчения выпечки. В процессе, называемом ферментацией, эти грибы превращают сахар, присутствующий в тесте, в углекислый газ, который образует в тесте карманы, вызывая его расширение. В результате этого процесса также образуется небольшое количество спирта, но выпечка его сжигает (и убивает дрожжи).
С.cerevisiae и различные другие дрожжи также важны для производства алкогольных напитков. Например, в процессе ферментации микробы превращают фруктовые соки в вино и превращают сусло (сладкую жидкость, полученную при измельчении зерен) в пиво.
Дрожжи также находят промышленное применение в производстве биотоплива и биоремедиации (метод управления отходами, основанный на использовании микроорганизмов).
Следите за Джозеф Кастро на Twitter . Следуйте за нами @livescience , Facebook и Google+ .
Candida auris (C. auris) — Канал лучшего здоровья
Что такое
Candida auris ?
Кандида — это вид грибов (дрожжей), обитающих на коже и внутри человеческого тела. Candida auris (также называемый C. auris ) — необычный грибок, который может вызывать серьезные инфекции.
Большинство людей, являющихся носителями грибка на своем теле, не заболевают им, но иногда это может привести к серьезным инфекциям кровотока, ранам и ушам.Люди, являющиеся носителями грибка (известные как колонизация), считаются колонизированными на всю жизнь.
Инфекции, вызываемые C. auris , вызывают беспокойство, потому что их сложнее лечить, чем другие кандидозные инфекции, поскольку они часто устойчивы к лекарствам.
Candida auris также легче передается от человека к человеку, чем другие типы Candida. По этой причине C. auris может вызывать проблемы в больницах и домах престарелых, поскольку он может передаваться от одного пациента к другому или через общие объекты.
Как получить
Candida auris ?
На сегодняшний день в Австралии было выявлено очень мало случаев C. auris . Все случаи, выявленные до сих пор в Австралии, были у людей, которые находились в зарубежных больницах, где чаще встречается C. auris .
В большинстве случаев люди переносят грибок где-нибудь на своем теле, не вызывая никаких симптомов или инфекции. Это называется колонизацией. Люди, которые колонизированы C. auris , не имеют никаких симптомов и могут не знать, что у них это есть, и могут передать грибок другому человеку.
Candida auris также может передаваться через оборудование, которое используется совместно пациентами, или через загрязнение окружающей среды. Он не распространяется по воздуху при кашле или чихании.
Вызовет ли мне
Candida auris недомогание?
У здоровых людей колонизация C. auris обычно не вызывает плохого состояния здоровья. Люди могут переносить C. auris на коже без каких-либо симптомов. Однако эти люди рискуют получить C.auris , если они госпитализированы по другой причине или принимают антибиотики.
У некоторых людей, например, у тех, чья иммунная система слаба или ослаблена, или которые уже плохо себя чувствуют из-за других заболеваний, C. auris может стать серьезной проблемой, поскольку может вызвать серьезные инфекции кровотока, раны или уха.
C. auris , скорее всего, повлияет на пациентов, которые:
- находятся в больнице в районе с зарегистрированным или подозреваемым C.auris передача
- длительное пребывание в больнице
- постоянное медицинское устройство, такое как центральный венозный катетер, мочевой катетер, желчный катетер или дренаж раны
- ослабленная иммунная система
- многократное или недавнее воздействие антибиотиков широкого спектра действия
- диабет mellitus
- недавно перенесла операцию.
Как диагностируется
Candida auris ?
Люди, не контактировавшие с известным случаем C.auris при поступлении в медицинское учреждение проходить тестирование не нужно.
Если вы контактировали с C. auris во время пребывания в медицинском учреждении, вы можете пройти обследование в медицинском учреждении на предмет наличия у вас грибка. Это позволяет поставщикам медицинских услуг узнать, кто является переносчиком грибка, и принять меры для предотвращения его распространения среди других людей. Медсестра или врач протрите или протрите ватным тампоном кожу около ваших подмышек и область, где ваша нога соединяется с вашим телом (пах).Тест безболезненный.
Тампон будет отправлен в лабораторию со специальной технологией, способной идентифицировать C. auris (одна сложность C. auris состоит в том, что его может быть трудно идентифицировать без правильной технологии). Ваш врач получит результаты. Если тест покажет, что вы являетесь носителем грибка, медсестра или врач обсудят с вами результаты и дальнейшие действия.
Инфекции, вызванные C. auris , такие как инфекции кровотока, ран или ушей, диагностируются так же, как и другие инфекции.В зависимости от локализации инфекции образец крови, мазок из раны или уха или другой образец будет отправлен в лабораторию для культивирования. Затем лаборатория определит, что инфекция вызвана C. auris , и сообщит об этом лечащему врачу.
Как лечится
Candida auris ?
Большинство инфекций C. auris поддаются лечению противогрибковыми препаратами, называемыми эхинокандинами. Однако некоторые инфекции C. auris устойчивы к основным типам противогрибковых препаратов, что затрудняет их лечение.В этой ситуации для лечения инфекции может потребоваться несколько противогрибковых препаратов в высоких дозах. Ваш врач предоставит более конкретную информацию о любом лечении, которое вам может потребоваться.
Поскольку в настоящее время нет доказательств того, что колонизацию можно вылечить с помощью противогрибковых препаратов, лечение не требуется и не рекомендуется для людей, у которых установлено, что носитель C. auris без каких-либо симптомов или признаков инфекции.
Назначение противогрибковых препаратов людям, которые колонизированы, но не инфицированы, может быть опасным и увеличивать вероятность развития инфекции.
Что такое скрининг на
Candida auris ?
Скрининг на C. auris будет проводиться только в том случае, если вы контактировали с известным случаем C. auris и были идентифицированы медицинским учреждением. Вам нужно будет сдать мазок, как описано выше в разделе «Как диагностируется C. auris ?», За исключением этого случая, который называется «скрининговым тестом».
Если будет установлено, что у вас грибок, ваша медсестра или врач расскажут вам о результатах анализа и о том, что вы можете сделать, чтобы предотвратить распространение грибка среди других людей.
В ожидании результатов анализов, если вы находитесь в больнице, вас могут поместить в одноместную палату. Персонал, входящий в палату, будет носить халаты и перчатки, чтобы предотвратить передачу инфекции другим пациентам.
Что будет, если у меня
Candida auris ?
Если вы находитесь в больнице и у вас есть C. auris, , ваша медицинская бригада примет следующие дополнительные меры предосторожности, чтобы предотвратить распространение C. auris среди других пациентов.
- Вас переведут в отдельную комнату, а на вашей двери будет висеть табличка, напоминающая медицинским работникам, входящим в вашу комнату, об особых мерах предосторожности, которые им необходимо предпринять, например надевать халат и перчатки.
- Всем, включая ваших посетителей и вас, необходимо вымыть руки или протереть руки спиртосодержащим средством для рук перед входом в вашу комнату или выходом из нее.
- В вашу больничную карту будет внесено предупреждение, чтобы предупредить персонал, если вы будете госпитализированы в другой раз, о том, что требуются дополнительные меры предосторожности.
Ваша семья и друзья могут навещать вас. Однако, чтобы предотвратить распространение C. auris среди других пациентов или в окружающую среду, важно, чтобы все ваши посетители:
- вымыли руки или использовали спиртосодержащий крем для рук перед входом и выходом из вашей комнаты
- сделать не есть и не пить в своей комнате
- не пользоваться туалетом в больнице
- не посещать других пациентов больницы сразу после посещения.
После того, как вам поставили диагноз C. auris , вы будете считаться колонизированными на неопределенный срок. Таким образом, хотя вы можете быть достаточно здоровы, чтобы вас выписали из больницы, считается, что у вас C. auris , и вам нужно будет принимать дополнительные меры предосторожности каждый раз, когда вас госпитализируют в медицинское учреждение в будущем.
Следовательно, если вы пойдете в другое медицинское учреждение, к поставщику медицинских услуг (например, к врачу или физиотерапевту) или будете получать услуги по уходу на дому в будущем, вам нужно будет сообщить им, что у вас C.auris . Возьмите с собой отчет о выписке из больницы.
Что я могу сделать, чтобы предотвратить распространение
Candida auris ?
Если вам поставили диагноз C. auris , по возможности:
- не прикасайтесь к каким-либо участкам сломанной кожи или повязкам на рану
- обязательно вымойте руки или используйте спиртосодержащие средства для рук, особенно
- после пользоваться туалетом
- перед едой
- всякий раз, когда вы выходите из больничной палаты.
Посетители также должны продолжать соблюдать правила гигиены рук и следить за тем, чтобы они мыли руки или использовали спиртосодержащие средства для растирания рук до и после прикосновения к пациентам или любым предметам у постели больного.
Если у меня
Candida auris , нужно ли мне делать что-нибудь по-другому, когда я пойду домой?
Нет необходимости принимать особые меры предосторожности дома после выписки из больницы, но важно, чтобы вы и ваша семья не забывали соблюдать следующие общие правила гигиены:
- Всегда мойте руки водой с мылом
- после посещения туалета
- перед приготовлением и приемом пищи
- до и после прикосновения к ранам или медицинским устройствам, которые могут у вас быть.
- Используйте свои собственные полотенца и салфетки для лица. Не делитесь этими предметами с другими людьми.
- По возможности закройте раны повязкой.
В вашем доме не требуется специальной уборки, и вашу одежду можно стирать обычным образом вместе с остальной домашней стиркой. Все столовые приборы и посуду можно мыть обычным способом.
Не забудьте сообщить медицинским учреждениям или другим поставщикам медицинских услуг о том, что у вас обнаружено C.auris . Нет необходимости информировать другие общественные учреждения или предприятия, не связанные со здравоохранением (например, общественный бассейн). Важно отметить, что наличие C. auris никоим образом не влияет на ваш доступ к лечению и уходу.
Куда обратиться за помощью
- Ваш врач общей практики
- Группа профилактики и контроля инфекций в вашем лечебном учреждении, если вы были в больнице и обеспокоены
Кандида — симптомы, причины, лечение
Кандида — это научное название рода грибов.Кандидозные инфекции, также называемые кандидозом, часто называют дрожжевыми или грибковыми инфекциями. Когда они возникают во рту и горле, кандидозные инфекции называются молочницей. Наиболее частые очаги инфекции — это рот и горло, гениталии и влажные кожные складки. Кандида также может вызывать системную инфекцию или инфекцию всего организма, но это очень редко и встречается менее чем в 0,1% случаев ежегодно в Соединенных Штатах (Источник:
CDC).
Кандида может вызывать воспаление в инфицированных тканях.Кожные или кожные инфекции Candida имеют тенденцию проявляться в виде красных, мокнущих и шелушащихся участков. Кандидозные инфекции также могут вызывать появление гнойных шишек. Во рту и горле инфекция часто образует толстые белые пятна. Генитальные инфекции Candida часто вызывают густые белые выделения из влагалища.
Кандида естественным образом встречается в окружающей среде, а также может присутствовать на поверхности кожи, во рту и пищеварительном тракте, а также во влагалище, не вызывая проблем. Однако инфекции могут возникать у здоровых в остальном людей людей, когда они принимают антибиотики или имеют участки кожи, которые постоянно влажные.Люди с ослабленной иммунной системой подвергаются более высокому риску развития инфекций Candida, включая системные инфекции.
При надлежащем лечении инфекции Candida часто проходят, хотя могут повторяться.
Candida инфекции редко бывают серьезными или опасными для жизни, если они не являются системными инфекциями.
Немедленно обратитесь за медицинской помощью (позвоните 911) в случае серьезных симптомов, таких как лихорадка и озноб, которые не проходят, спутанность сознания, летаргия, потеря или изменение уровня сознания, судороги, снижение диуреза, учащенное сердцебиение, боль в груди, сильная боль в животе и необычная раздражительность или плохое питание у ребенка.
Немедленно обратитесь за медицинской помощью , если у вас никогда не было
Candida инфекция раньше, и вы полагаете, что она у вас есть, если вы лечитесь от
Candida , но симптомы повторяются или сохраняются, или если у вас есть другие проблемы. Также незамедлительно обратитесь за медицинской помощью, если у вас жар и озноб, которые не поддаются лечению или у вас проблемы с глотанием.
EurekAlert! Новости науки
изображение: Изображение флуоресцентной микроскопии, иллюстрирующее морфологию C.аурис .
посмотреть еще
Кредит: Жоао Нубрега Алмейда Жуниор / UNIFESP
Полностью занятые отделения интенсивной терапии (ОИТ). Физически и морально истощенные медицинские работники. Хаотично переполненные больницы. Эти и аналогичные проблемы, вызванные пандемией COVID-19 в Бразилии, создали идеальные условия для появления Candida auris , микроорганизма, который некоторые называют «супергрибком» из-за скорости, с которой у него развивается лекарственная устойчивость.
Первые два случая были подтверждены в декабре 2020 года в больнице в Сальвадоре (штат Баия, северо-восточная Бразилия) и описаны в журнале Journal of Fungi группой исследователей во главе с Арнальдо Коломбо, главой Специальной микологической лаборатории. в Федеральном университете Сан-Паулу (UNIFESP). Исследование было поддержано Исследовательским фондом Сан-Паулу — FAPESP.
«Девять других пациентов с C. auris с тех пор были диагностированы в той же больнице, некоторые колонизировали [грибком в их организме, но не причиняли вреда], а другие инфицированы», — сказал Коломбо.«О других случаях заболевания в Бразилии не сообщалось, но есть основания для беспокойства. Мы отслеживаем эволюционные характеристики изолятов C. auris от пациентов в больнице в Сальвадоре, и мы уже нашли образцы с пониженной чувствительностью к флуконазол и эхинокандины. Последние относятся к основному классу препаратов, используемых для лечения инвазивного кандидоза ».
За исключением C. auris , грибы рода Candida являются частью микробиоты кишечника человека и вызывают проблемы только при наличии дисбаланса в организме, объяснил Коломбо.К ним относятся инфекции, такие как вагинальная дрожжевая инфекция и молочница (кандидоз полости рта), часто вызываемые C. albicans.
Однако в некоторых случаях грибок попадает в кровоток и вызывает системную инфекцию, известную как кандидемия, наиболее распространенная форма инвазивного кандидоза, подобного бактериальному сепсису. Вторжение в кровоток и усиленный ответ иммунной системы на патоген могут вызвать повреждение нескольких органов и даже привести к смерти. Согласно научным данным, смертность среди больных кандидемией, инфицированных C.auris может достигать 60%.
«Этот вид быстро становится устойчивым ко многим лекарствам и не очень чувствителен к дезинфицирующим средствам, используемым в больницах и клиниках», — сказал Коломбо. «В результате он может сохраняться в больницах, где он колонизирует медицинских работников и в конечном итоге заражает пациентов с тяжелой формой COVID-19 и других пациентов, находящихся в критическом состоянии в течение длительного периода».
Несколько факторов делают пациентов, инфицированных SARS-CoV-2, идеальными мишенями для C. auris , включая длительное пребывание в больнице, мочевые и центральные венозные катетеры (позволяющие вторжение в кровоток), а также стероиды и антибиотики (которые нарушают микробиоту кишечника) .
«Вирус может повредить слизистую оболочку кишечника тяжелых пациентов с COVID-19 [способствуя вторжению в кровоток патогенов], так что пациент становится уязвимым для кандидемии», — сказал Коломбо.
Несколько стран сообщили о появлении C. auris во время пандемии COVID-19, добавил он, что делает необходимость усиления контроля над внутрибольничными инфекциями во всей Бразилии еще более насущной. Не менее важно рациональное использование противомикробных препаратов в отделениях интенсивной терапии.С начала пандемии азитромицин и другие антибиотики стали назначаться более широко, в основном без подлинного обоснования.
Мониторинг
C. auris был впервые изолирован в Японии в 2009 году, но научное сообщество не уделяло ему особого внимания, пока несколько лет спустя не произошли вспышки кандидемии, вызванной супергрибком, в Азии и Европе. В 2016 году в статье группы UNIFESP в журнале Journal of Infection сообщалось о прибытии этого вида в Америку через Венесуэлу.Вскоре его обнаружили в Колумбии, Панаме и Чили.
«В 2017 году мы участвовали в рабочей группе, созванной Министерством здравоохранения и ANVISA [бразильским органом по надзору за здоровьем], и написали технический стандарт [Уведомление о рисках 01/2017], предупреждающий службы здравоохранения о том, что следует принять меры предосторожности для отслеживания возможного прибытия C. auris в Бразилии, что было подтверждено только в конце прошлого года », — сказал Коломбо.
С тех пор команда UNIFESP отслеживает появление новых грибковых патогенов при инфекциях кровотока, задокументированных медицинскими центрами по всей Бразилии, не обнаруживая C.auris до сих пор.
К настоящему времени в мире описано пять клад или линий C. auris . По словам Коломбо, клады, изолированные в Сальвадоре, больше напоминают азиатский оригинал, чем вариант, обнаруженный в Венесуэле и других странах Южной Америки, что предполагает второе независимое прибытие супергрибка на континент.
«Альтернативно, это может быть местный источник окружающей среды, поскольку ни один из бразильских пациентов, инфицированных грибком, не выезжал за границу и не заразил родственников», — сказал Коломбо.
Каждый месяц, начиная с декабря, исследователи получали образцы клады, выделенной в больнице в Сальвадоре, для тестирования ее чувствительности к противогрибковым препаратам в их лаборатории.
«В этих тестах мы подвергаем культивированный микроорганизм воздействию прогрессирующих концентраций противогрибковых средств, чтобы определить самую низкую дозу, которая может его инактивировать. В случае C. auris , присутствующего в образцах, недавно выделенных в Сальвадоре, например, доза должна быть в четыре-пять раз больше, чем доза, использованная для инактивации изолята, культивированного в декабре 2020 года », — сказал Коломбо.
В сотрудничестве с голландскими коллегами группа UNIFESP проводит исследование генетического секвенирования, чтобы выяснить, не мутировал ли ген, придающий лекарственной устойчивости C. auris , за этот период.
«Механизм, который позволяет видам развивать устойчивость к лекарствам, не является ферментативной деградацией, как у многих бактерий, устойчивых к антибиотикам», — сказал Коломбо. «Гриб развивает структурные модификации белков, с которыми связывается лекарство, чтобы ингибировать синтез клеточной стенки [глюкансинтазы в случае эхинокандинов], что является ключом к его выживанию.Мы видим, как это явление происходит здесь, в Бразилии ».
В дополнение к удвоенной гигиене, необходимо активизировать усилия по надзору для выявления подозреваемых патогенов, добавил он. Подтверждение наличия C. auris в образце — нетривиальная задача, требующая специального оборудования. Наиболее широко используемый метод — это масс-спектрометрия с матричной лазерной десорбцией / ионизацией по времени пролета (MALDI-TOF), довольно распространенная в микробиологических лабораториях, но не всегда доступная в больницах Бразилии.
«Если анализ проводится с использованием обычных автоматизированных методов, C. auris можно спутать с другими видами, такими как C. haemulonii или C. lusitaniae . В идеале, любой штамм Candida , проявляющий лекарственную устойчивость должны быть отправлены на анализ в референс-лабораторию », — сказал Коломбо.
###
О Фонде исследований Сан-Паулу (FAPESP)
Исследовательский фонд Сан-Паулу (FAPESP) — это государственное учреждение, миссией которого является поддержка научных исследований во всех областях знаний путем присуждения стипендий, стипендий и грантов исследователям, связанным с высшими учебными заведениями и исследовательскими учреждениями в штате Сан-Паулу, Бразилия.FAPESP осознает, что самые лучшие исследования могут быть выполнены только при сотрудничестве с лучшими исследователями со всего мира. Поэтому он установил партнерские отношения с финансирующими агентствами, высшими учебными заведениями, частными компаниями и исследовательскими организациями в других странах, известных высоким качеством своих исследований, и поощряет ученых, финансируемых за счет его грантов, к дальнейшему развитию международного сотрудничества.


