Лекарства для небулайзера / bwell-swiss.ru
Какие лекарства можно использовать в небулайзерах?
Можно ли использовать минеральную воду?
Лекарственные препараты, используемые для ингаляций с помощью небулайзеров
Применяемые лекарства и их дозировки должны быть согласованы с лечащим врачом. Используйте только те растворы, которые Вам рекомендовал врач
1.Лекарственные средства, расширяющие бронхи (бронхолитики)
Дозировка и кратность применения устанавливается индивидуально по назначению врача. Лечение обычно начинают с наименьших рекомендованных доз.
-
- а) Бета2-агонисты
-
- Сальбутамол. «Золотой стандарт» бронхолитической терапии при лечении обострений бронхиальной астмы любой степени тяжести:
-
-
- Вентолин небулы
- Сальгим
- Стеринеб Саламол
- Асталин
-
-
- б) Комбинированные лекарственные препараты
-
- в) М-холинолитики
-
-
- Ипратропиум бромид: Атровент
-
2. Лекарства, разжижающие мокроту
Лекарства, разжижающие мокроту
-
-
- Лазолван
- АмброГЕКСАЛ
- Физиологический 0,9% раствор хлорида натрия
- Гипертонический раствор NaCI(3 или 4%).
- Флуимуцил
- Пульмозим
- Слабощелочную минеральную воду типа «Боржоми» или «Ессентуки» использовать не рекомендуется по причине нестабильного солевого состава. Ни один из производителей минеральных вод не производит растворы для ингаляций.
-
3. Антибактериальные лекарства
Возможно применение некоторых антибиотиков, антисептиков (диоксидин 0,5% раствор), противотуберкулезных и противогрибковых препаратов по назначению врача
-
-
- Флуимуцил-антибиотик
-
4. Противовоспалительные лекарственные препараты
-
-
- Глюкокортикостероиды — Пульмикорт (будесонид) суспензия для небулайзера
- Кромоны — Кромогексал
-
5. Противокашлевые лекарства
Противокашлевые лекарства
При приготовлении растворов нужно соблюдать ряд правил:
-
- В качестве растворителя используют стерильный физиологический раствор (0,9% хлорида натрия). Не следует пользоваться водопроводной (даже кипяченой) и дистиллированной водой. Температура раствора к моменту ингаляции должна быть не ниже 20°С. При одновременном назначении нескольких первой проводится ингаляция бронхолитика, через 10-15 минут – муколитика, затем, после отхождения мокроты, противовоспалительного препарата.
Не рекомендуются для небулайзеров:
-
- Все растворы, содержащие масла. Растворы, содержащие взвешенные частицы, в т. ч. отвары и настои трав. Эуфиллин, папаверин, платифиллин, димедрол и им подобные средства, как не имеющие субстрата воздействия на слизистой оболочке. Ингаляция системных гормонов (гидрокортизон, дексазон,преднизолон) через небулайзер технически возможна, но при этом достигается системное, а не местное действие препаратов.
 Поэтому небулайзерная терапия системными гормонами не имеет преимуществ и не рекомендуется.
Поэтому небулайзерная терапия системными гормонами не имеет преимуществ и не рекомендуется.
Поделитесь статьёй с друзьями
Лекарства для ингаляции — поиск лекарств и наличие в аптеках
Ингаляция — эффективный и безопасный метод лечения бронхитов, бронхиальной астмы и других патологий дыхательной системы. Лечебный эффект достигается благодаря транспортировке лекарственных препаратов в форме аэрозоля непосредственно в очаг воспалительного процесса. Каким лекарством делают ингаляции при лечении заболеваний верхних и нижних дыхательных путей?
Меры предосторожности
Применение небулайзера требует соблюдения некоторых правил:
для ингаляций нельзя использовать эфирные масла, суспензии, сиропы и отвары трав,
в качестве растворителя нельзя брать воду, только физраствор,
готовую основу для ингаляций нужно использовать на протяжении 2 часов,
перед применением раствор нужно подогреть до комнатной температуры.

Муколитические препараты
Муколитики – препараты, способствующие разжижению и выведению вязкой мокроты из дыхательных путей. Эффективные лекарства-муколитики для ингаляции:
Амброксол, Лазолван (действующее вещество — амброксол) – препараты, уменьшающие вязкость мокроты,
АЦЦ, Флуимуцил (действующее вещество — ацетилцистеин) оказывают противовоспалительный эффект, способствуют разжижению и выведению мокроты из органов дыхания,
физраствор или минеральная вода увлажняют слизистую оболочку дыхательных путей, помогают вывести мокроту и не вызывают побочных эффектов. Могут использоваться для лечения детей раннего возраста,
гипертонический раствор NaCl и разведенные в физрастворе Геделикс или Мукалтин, Пектусин, Синупрет.
Бронхолитики
Бронхолитические лекарства для ингаляции используются для лечения обструктивных бронхитов, снимают бронхоспазм, помогают купировать приступы бронхиальной астмы, они эффективны при терапии любых болезней, при которых существует риск развития бронхоспазма. Примером бронхолитического препарата, используемого для ингаляций, является Беродуал, который применяется вместе с физраствором. Также для этих целей используют:
Примером бронхолитического препарата, используемого для ингаляций, является Беродуал, который применяется вместе с физраствором. Также для этих целей используют:
Атровент,
Беротек (Фенотерол) назначают при астме, обструктивном бронхите, спазмах бронхов,
Сальбутамол.
Средства от кашля
Эффективные лекарства для ингаляции при сухом кашле – Лидокаин. Препарат подавляет кашлевый рефлекс, снижая чувствительность кашлевых рецепторов. Если используется несколько препаратов, следует соблюдать очередность: сначала применяются бронхорасширяющие препараты, через 15 минут – отхаркивающие, последние – противовоспалительные или дезинфицирующие.
Антибактериальные препараты
Антибактериальные препараты также используются для проведения ингаляций, но такое лечение можно осуществлять только по назначению врача и под его контролем. Антибиотики, применяемые для ингаляций:
Антибиотики, применяемые для ингаляций:
Флуимуцил – эффективное средство для лечения заболеваний дыхательных путей (бронхиты, тонзиллиты, фарингиты, пневмонии),
Диоксидин применяют при лечении гнойных воспалительных процессов носоглотки,
Гентамицин 4% (ампулы для инъекций) — эффективный препарат для лечения обострения хронических гнойных бронхитов,
Цефтриаксон разводится с водой для инъекций,
Фурацилин целесообразно использовать для лечения больных ОРВИ с целью профилактики и предупреждения проникновения инфекции в нижние дыхательные пути.
Антисептические лекарственные средства
Мирамистин – антисептический препарат широкого спектра действия. Его используют для ингаляций при лечении заболеваний верхних дыхательных путей. Препарат широко используется для лечения гайморита, кашля, ринитов. Средство не нужно растворять, оно используется в чистом виде. Мирамистин – безопасное лекарство для ингаляции, его можно применять для лечения детей и беременных.
Средство не нужно растворять, оно используется в чистом виде. Мирамистин – безопасное лекарство для ингаляции, его можно применять для лечения детей и беременных.
Иммуномодуляторы
Препараты этой группы используются для лечения и профилактики вирусных заболеваний дыхательной системы:
Деринат,
Интерферон.
Противовоспалительные гормональные средства
Пример лекарства из этой группы — Пульмикорт (глюкокортикостероид), который используется при лечении бронхиальной астмы и обструктивных заболеваний легких. Препарат эффективен при купировании приступов ложного крупа у детей в возрасте до 3 лет. Раствор для ингаляций с Пульмикортом готовится вместе с физраствором.
Противовоспалительные средства растительного
Какие лекарства используют для небулайзера (ингалятора)
Какие лекарства используют для небулайзера
При лечении с помощью небулайзера нужно придерживаться некоторых правил, чтобы получить максимальную пользу для здоровья. Существуют специальные растворы лекарственных препаратов, пригодные для небулайзерной терапии, а также вещества, которые не желательно использовать.
Существуют специальные растворы лекарственных препаратов, пригодные для небулайзерной терапии, а также вещества, которые не желательно использовать.
Не рекомендуется использовать для небулайзера
В небулайзерной терапии используют растворы в ампулах или специальных контейнерах (небулах).
Для небулайзера рекомендуется такие виды препаратов
1. Бронхолитики — препараты, расширяющие бронхи (беродуал, атровента, боротек, саламол, сальгим, вентолин не были)
2. Муколитики и мукорегуляторы — препараты для разжижения мокроты и облегчения отхаркивания (флуимицил, АЦЦ, лазолван, амбробене, амброгексал, синупрет, минеральная вода «Боржоми», «Нарзан», физраствор)
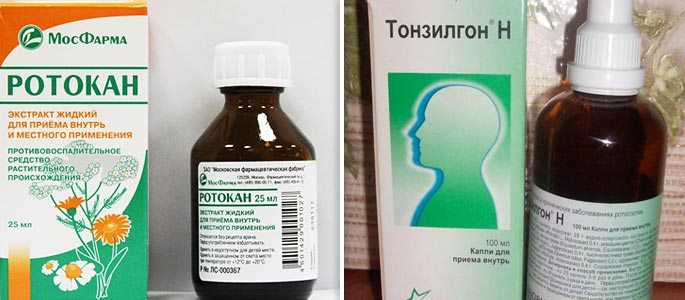
3. Противовоспалительные лекарственные препараты (тонзилгон Н, ротокан, спиртовой настой экстракта календулы, эвкалипта)
4. Глюкокортикостероиди — гормональные препараты, которые имеют в первую очередь противовоспалительное и противоотечное действие (дексаметазон, пульмикорт), и антигестаминни препараты — имеют противоаллергическое действие (кромогексал)
Глюкокортикостероиди — гормональные препараты, которые имеют в первую очередь противовоспалительное и противоотечное действие (дексаметазон, пульмикорт), и антигестаминни препараты — имеют противоаллергическое действие (кромогексал)
5. Антибиотики и антисептики (флуимицил-антибиотик, мирамистин, фурацилин, диоксидин, гентамицин, хлорофиллипт)
6. Иммуномодуляторы — (интерферон, дерината)
7. Противокашлевые средства — (туссамаг)
8. Сосудосуживающие препараты (адреналин, нафтизин)
Можно делать ингаляции, используя только физраствор или минеральную воду. Они увлажняют слизистую оболочку дыхательных путей и облегчают отхождение мокроты.
Перед использованием лекарственных препаратов советуем обратиться за консультацией врача.
Некоторые рекомендации при использовании небулайзера
При заболевании верхних дыхательных путей — вдох и выдох делаем через нос, используя маску.
При заболевании средних дыхательных путей — вдох и выдох делаем через рот, используя маску.
При заболевании трахеи, бронхов, легких — вдох и выдох делаем через рот, используя мундштук.
Помните, что при одновременном назначении нескольких ингаляций, сначала нужно проводить ингаляцию с помощью бронхолитических препаратов, минут за 10-15 — муколитических препаратов, а уже в последнюю очередь использовать противовоспалительные средства или антибиотики.
После проведения ингаляции не желательно выходить на улицу в течение 1 часа, если прохладно.
Противопоказаниями в использовании небулайзера является высокая температура, аллергия на определенные препараты, гипертония.
Не забывайте, что после каждого использования небулайзер нужно разбирать и промывать. Перед составлением небулайзера все части должны быть сухими. Периодически нужно проводить дезинфекцию (термическую или дезинфицирующими растворами).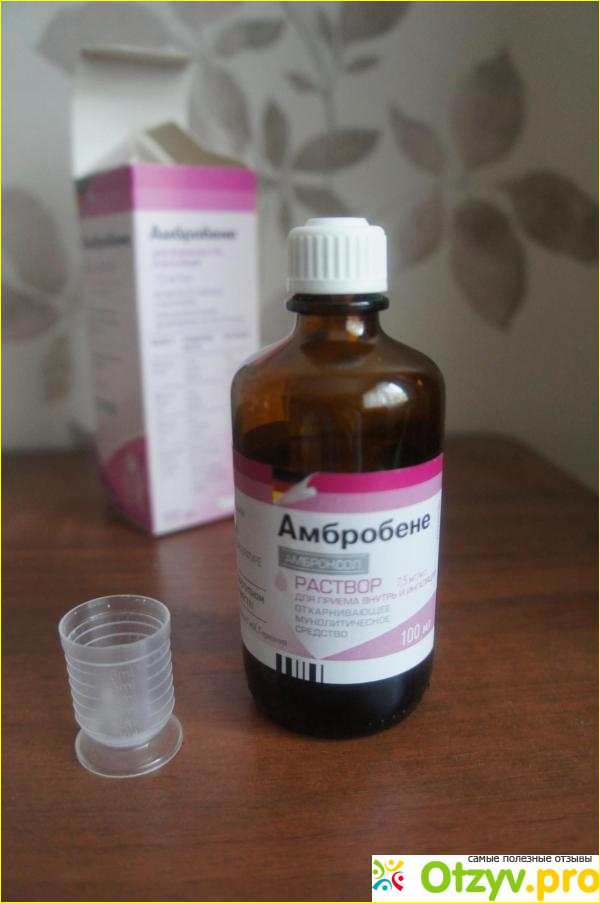
Курс лечения с помощью небулайзера Индивидуальный в зависимости от сложности заболевания и препарата, который используют, обычно длится 5-10 дней.
В прокате Baby Service Ровно вы сможете подобрать необходимую модель небулайзера и взять в аренду на необходимое время.
Небулайзер — это оптимальный вариант лечения в сезон простудных заболеваний, он может стать настоящим семейным спасителем, поскольку подходит как для взрослых, так и для детей.
Лекарства для ингалятора — Медсправочник Лекарства для ингалятора
Фармацевтическая промышленность предлагает огромный спектр различных препаратов, которые представлены как в виде таблеток, сиропов и эмульсий, так и в виде растворов для инъекций. Несмотря на столь широкий ассортимент, существует ряд заболеваний, требующих особого подхода. К ним относятся патологии дыхательной системы, связанные с воспалительными процессами, протекающими в легких, бронхах или трахее.
При лечении подобных заболеваний широкое распространение получили лекарства для ингалятора. Такие препараты можно использовать в домашних условиях. Они способны проникать в отдаленные уголки дыхательной системы, доставляя действующее вещество к очагу воспаления. Однако не стоит сбрасывать со счетов индивидуальную восприимчивость к тому или иному препарату, и не нужно отказываться от антибиотиков в пользу ингаляций. Ведь эти лекарственные средства не могут быть взаимозаменяемыми.
Следует помнить о необходимости тщательной очистки ингалятора после применения, чтобы не занести ту же инфекцию при проведении процедуры. Большинство препаратов специалисты рекомендуют разводить стерильным физраствором.
Какие лекарства для ингалятора пользуются заслуженной популярностью у врачей и пациентов? Их условно можно разделить на несколько категорий:
- Антисептики. Среди наиболее известных можно назвать Фурацилин и Диоксидин, Мирамистин
- Антибиотики. Гентамицин, Тобрамицин.

- Анестетики. К числу наиболее популярных относится Лидокаин.
- Гормональные средства. Кромогексал, Будесонит или Пульмикорт, Дексаметазон.
- Иммуномодуляторы. Одни из наиболее известных и эффективных препаратов носят название Интерферон и Деринат.
- Муколитики. Флуимуцил, Лазолван, Амброксол, Амброгексал, Пульмозим, Ацетилцистеин.
- Препараты комбинированного действия. Яркими представителями данной группы являются Беродуал и Фенотерол.
- Фитотерапия. Ротокан, Туссамаг, Хлорофиллипт.
- Сосудосуживающие средства, применяемые против отека. Адреналин, Нафтизин.
Вышеперечисленные препараты представляют собой далеко не полный список лекарств для ингалятора. Стоит отметить, что дозировку и необходимость применения того или иного лекарственного средства должен определять специалист, по результатам обследования. Самостоятельное назначение препарата, длительности курса и дозировки может иметь необратимые последствия для организма.
Противовоспалительный эффект экстрамелкодисперсного комбинированного препарата Фостер на модели хронической обструктивной болезни легких | Титова
1. Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease. 2019 Report. Available at: https://goldcopd.org/wp-content/uploads/2018/11/GOLD-2019-v1.7-FINAL-14Nov2018-WMS.pdf
2. Айсанов З.Р., Авдеев С.Н., Архипов В.В. и др. Национальные клинические рекомендации по диагностике и лечению ХОБЛ: алгоритм принятия клинических решений. Пульмонология. 2017; 27 (1): 13–20 DOI: 10.18093/0869-0189-2017-27-1-13-20.
3. Aisanov Z., Avdeev S., Arkhipov V. et al. Russian guidelines for the management of COPD: algorithm of pharmacologic treatment. Int. J. Chron. Obstruct. Pulmon. Dis. 2018; 13: 183–187. DOI: 10.2147/COPD.S153770.
4. Barnes P.J. Inflammatory mechanisms in patients with chronic obstructive pulmonary disease. J. Allergy Clin. Immunol. 2016; 138 (1): 16–27. DOI: 10.1016/j.jaci.2016.05.011.
5. Barnes P.J. Glucocorticosteroids. Handb. Exp. Pharmacol. 2017; 237: 93–115. DOI: 10.1007/164_2016_62.
6. Adcock I.M., Mumby S. Glucocorticoids. Handb. Exp. Pharmacol. 2017; 237: 171–196. DOI: 10.1007/164_2016_98.
7. Овчаренко С.И. Ингаляционные глюкокортикостероиды в терапии больных хронической обструктивной болезнью легких: быть или не быть?! Практическая пульмонология. 2016; (1): 16–23.
8. Емельянов А.В. Ингаляционные глюкокортикоиды при хронической обструктивной болезни легких: каково их место в лечении этого заболевания? Русский медицинский журнал. 2017; 25 (3): 227–231.
9. Izquierdo Alonso J.L., Rodrı´guez Glez-Moro J.M. [The excessive use of inhaled corticosteroids in chronic obstructive pulmonary disease.] Arch. Bronconeumol. 2012; 48 (6): 207–212. DOI: 10.1016/j.arbres.2012.01.002 (in Spanish).
10. Cataldo D., Derom E., Liistro G. et al. Overuse of inhaled corticosteroids in COPD: five questions for withdrawal in daily practice. Int. J. Chron. Obstruct. Pulmon. Dis. 2018; 13: 2089–2099. DOI: 10.2147/COPD.S164259.
11. Yawn B.P., Suissa S., Rossi A. Appropriate use of inhaled corticosteroids in COPD: the candidates for safe withdrawal. NPJ Prim. Care Respir. Med. 2016; 26: 16068. DOI: 10.1038/npjpcrm.2016.68.
12. Kunz L.I.Z., Postma D.S., Klooster K. et al. Relapse in FEV1 decline after steroid withdrawal in COPD. Chest. 2015; 148 (2): 389–396. DOI: 10.1378/chest.14-3091.
13. Arpinelli F., Caramori G., Magnoni M.S. [Risk of pneumonia during long term regular treatment of stable COPD with inhaled glucocorticoids: a systematic review.] Recenti Prog. Med. 2017; 108 (4): 175–182. DOI: 10.1701/2681.27453 [in Italian].
14. Thomas B.J., Porritt R.A., Hertzog P.J. et al. Glucocorticosteroids enhance replication of respiratory viruses: effect of adjuvant interferon. Sci. Rep. 2014; 4: 7176. DOI: 10.1038/srep07176.
15. Лещенко И.В., Куделя Л.М., Игнатова Г.Л. и др. Резолюция совета экспертов «Место противовоспалительной терапии при ХОБЛ в реальной клинической практике» от 8 апреля 2017 г., Новосибирск. Русский медицинский журнал. 2017; 25 (18): 1322–1324.
16. Лебедева Е.С., Кузубова Н.А., Данилов Л.Н. и др. Воспроизведение в эксперименте хронической обструктивной болезни легких. Бюллетень экспериментальной биологии и медицины. 2011; 152 (11): 596–600.
17. Lamort A.S., Gravier R., Laffitte A. et al. New insights into the substrate specificity of macrophage elastase MMP-12. Biol. Chem. 2016; 397 (5): 469–484. DOI: 10.1515/hsz-2015-0254.
18. Demedts I.K., Morel-Montero A., Lebecque S. et al. Elevated MMP-12 protein levels in induced sputum from patients with COPD. Thorax. 2006; 61 (3): 196–201. DOI: 10.1136/thx.2005.042432.
19. Levänen B., Glader P., Dahlén B. et al. Impact of tobacco smoking on cytokine signaling via interleukin-17A in the peripheral airways. Int. J. Chron. Obstruct. Pulmon. Dis. 2016; 11: 2109–2116. DOI: 10.2147/COPD.S99900.
20. Yadava K., Bollyky P., Lawson M.A. The formation and function of tertiary lymphoid follicles in chronic pulmonary inflammation. Immunology. 2016; 149 (3): 262–269. DOI: 10.1111/imm.12649.
21. Двораковская И.В., Кузубова Н.А., Фионик А.М. и др. Патологическая анатомия бронхов и респираторной ткани крыс при воздействии диоксида азота. Пульмонология. 2009; (1): 78–82.
22. Eustace A., Smyth L.J.С., Mitchell L. et al. Identification of cells expressing IL-17A and IL-17F in the lungs of patients with COPD. Chest. 2011; 139 (5): 1089–1100. DOI: 10.1378/chest.10-0779.
23. Duan M.C., Zhang J.Q., Liang Y. et al. Infiltration of IL-17-producing T cells and Treg cells in a mouse model of smoke-induced emphysema. Inflammation. 2016; 39 (4): 1334–1344. DOI: 10.1007/s10753-016-0365-8.
24. Zhou D.J., Chen Y., Zhang X.J. et al. Effects of oleic acid on SP-B expression and release in A549 cells. Eur. Rev. Med. Pharmacol. Sci. 2015; 19 (18): 3438–3443.
25. Hemming J.M., Hughes B.R., Rennie A.R. et al. Environmental pollutant ozone causes damage to lung surfactant protein B (SP-B). Biochemistry. 2015; 54 (33): 5185–5197. DOI: 10.1021/acs.biochem.5b00308.
26. Лямина С.В., Малышев И.Ю. Сурфактантный белок D в норме и при заболеваниях легких. Русский медицинский журнал. 2012; (1): 50–55.
27. Sin D.D., Pahlavan P.S., Man S.F. Surfactant protein D: A lung specific biomarker in COPD? Ther. Adv. Respir. Dis. 2008; 2 (2): 65–74. DOI: 10.1177/1753465808088903.
28. Polosukhin V.V., Lawson W.E., Milstone A.P. et al. Association of progressive structural changes in the bronchial epithelium with subepithelial fibrous remodeling: A potential role for hypoxia. Virchows Arch. 2007; 451: 793–803. DOI: 10.1007/s00428-007-0469-5.
29. Richmond B.W., Brucker R.M., Han W. et al. Airway bacteria drive a progressive COPD-like phenotype in mice with polymeric immunoglobulin receptor deficiency. Nat. Commun. 2016; 7: 11240. DOI: 10.1038/ncomms11240.
Ингаляции ребенку при простуде небулайзером – можно ли использовать?
К сожалению, наши дети болеют. И каждая заботливая мама готова сделать все возможное, чтобы больничные листы ей приходилось подписывать как можно реже. А раз так, то «ингаляция» и «небулайзер» стоит добавить в список постоянно используемых в доме слов.
Небулайзер для детей – прибор для ингаляций, который особенно эффективно показал себя в лечении болезней дыхательных путей. Проводить ингаляции можно ребенку любого возраста. К тому же, дышать паром ребенок согласится быстрее, чем захочет проглотить горькую пилюлю.
Ингаляторы бывают разных типов. Компрессорные меш-небулайзеры сейчас самые популярные. Они распыляют лекарство потоком воздуха. В небулайзер можно добавить точную дозу лекарства, которое непрерывно будет поступать в камеру. Важно, что при использовании прибора необязательно глубоко дышать.
Можно ли делать ингаляции небулайзером ребенку при простуде.
Прибор идеально подходит маленьким пациентам: работает бесшумно, снабжен детской маской и управляется одной кнопкой. Понравится крохе и яркая расцветка корпуса. Компактные размеры и незначительный вес ингалятора позволяют брать его в поездки. А чтобы по дороге с ним ничего не случилось, уложите его в футляр, который идет в комплекте.
Купить небулайзер остро необходимо, если у малыша астма или острая аллергия. Им можно делать ингаляции при температуре детям, заболевшим ОРВИ. Поможет он и при бронхите, фарингите, ларингите, рините в острой или хронической формах.
Для каких лекарств можно купить ингалятор.
Препараты для небулайзера назначает только врач! Для ингаляций выпускают препараты, разжижающие мокроту, расширяющие бронхи, противовоспалительные и противоаллергические лекарства, антибиотики, солевые растворы.
При этом в устройстве данного типа нельзя распылять травяные отвары, суспензии, масляные растворы. Папаверин, димедрол, эуфиллин в данном случае также бесполезны, поскольку в капельном виде они не оказывают нужного эффекта.
Постоянная заложенность носа у ребенка: что дать от насморка, если заложен нос
Соавтор, редактор и медицинский эксперт – Максимов Александр Алексеевич.
Дата последнего обновления: 30.06.2021 г.
Количество просмотров: 223 644.
Среднее время прочтения: 5 минут.
Содержание:
Причины заболевания
Как снять заложенность носа у ребенка
Родители нередко сталкиваются с проблемой затруднения носового дыхания у малышей, что связано с отеком слизистой оболочки. Заложенность носа у ребенка может возникнуть и без признаков насморка. Такое состояние не только приводит к ухудшению самочувствия и плохому настроению, но и вызывает различные последствия. Когда не дышит нос, у ребенка нарушаются сон и аппетит, появляется угроза воспаления глотки и бронхов из-за вдыхания ртом холодного воздуха. У младенцев могут развиться опасные для жизни нарушения дыхания во сне. Поэтому снять заложенность носа у ребенка необходимо в том числе из соображений безопасности.
Наверх к содержанию
Причины заболевания
В настоящее время самыми частыми причинами насморка с заложенностью носа у ребенка считаются острые респираторные инфекционные заболевания и аллергические реакции. Увеличение аденоидов и аномалии строения носа тоже могут мешать ребенку нормально дышать.1
Предрасполагающими факторами к появлению заложенности носа являются:2
- наследственная отягощенность по аллергии;
- наличие любого типа аллергии у самого ребенка;
- неблагоприятные экологические условия: проживание около промышленной зоны или автотрасс, пассивное курение (когда ребенок вдыхает табачный дым при курении взрослыми), чрезмерная сухость воздуха в комнате;
- частая нерациональная антибиотикотерапия, что нарушает состав микрофлоры на слизистой оболочке и ослабляет иммунную систему;
- искусственное вскармливание;
- повторяющиеся вирусные инфекции, перенесенные ребенком в первые 3 года жизни;
- частое необоснованное применение различных препаратов и минерально-витаминных комплексов, которые нередко используются без назначения врача;
- инородные тела, из-за которых сужается просвет носовых ходов и может отекать слизистая оболочка.
Наверх к содержанию
Как снять заложенность носа у ребенка
Даже если заложенность носа возникла не в первый раз, перед началом лечения необходимо проконсультироваться с врачом для выяснения причины заболевания. Аллергический насморк и вирусная инфекция требуют разных схем терапии, и только специалист сможет быстро распознать характер имеющихся нарушений.
Промывание носа. Можно использовать при любом виде насморка. Эта несложная и доступная процедура помогает очистить слизистую оболочку от скопившегося воспалительного секрета и микроорганизмов, уменьшить ее отечность.3 Для промывания используют солевые растворы, стерильную морскую воду, антисептические и противовоспалительные средства.
Ингаляции. Для лечения заложенности носа у ребенка разрешено применять теплые ингаляции. Можно дышать над горячими отварами лечебных растений или использовать добавленные в воду эфирные масла. Даже обычный пар нередко помогает справиться с заложенностью носа при насморке у ребенка. Во время ингаляций мягко прогреваются воспаленные ткани, разжижается слизь, уменьшается отек, уничтожается часть возбудителей. После такого лечения нужно освободить нос, воспользовавшись аспиратором или попросив малыша высморкаться.
Согревающие мази. В дополнение к другим средствам можно использовать согревающие мази с эфирными маслами. Их намазывают на ступни, виски, переносицу и крылья носа.
Точечный массаж. Этот метод основан на акупунктурном воздействии на определенные точки на теле человека. Его применяют для снижения заложенности носа у детей и взрослых. Для усиления эффекта при точечном массаже используют эфирные масла.
Капли и спреи в нос. При вирусных респираторных заболеваниях и аллергическом рините схема лечения включает применение антигистаминных средств последнего поколения в виде назальных капель и спреев. Они оказывают местное действие и имеют небольшое количество противопоказаний. Специальные средства для детей линейки ТИЗИН® помогают справиться с заложенностью, облегчая носовое дыхание и улучшая самочувствие. ТИЗИН® Алерджи содержит антигистаминные средства и используется при терапии поллиноза и аллергических ринитов. Гиалуроновая кислота, входящая в состав ТИЗИН® Эксперт для детей, дополнительно увлажняет слизистую носа и способствует ее скорейшему восстановлению.
Информация в данной статье носит справочный характер и не заменяет профессиональной консультации врача. Для постановки диагноза и назначения лечения обратитесь к квалифицированному специалисту.
Список литературы:
- Ryan Belcher, Frank Virgin. The role of the adenoids in pediatric chronic rhinosinusitis
Med Sci (Basel). 2019 Feb; 7 (2):35. Райан Белчер, Фрэнк Вирджин. Роль аденоидов в развитии хронического риносинусита у детей. - Данилова Е.И., Трусова О.Ю., Суменко В.В. Эффективность применения комбинированной терапии острого риносинусита у детей. ФГБОУ ВО «Оренбургский государственный медицинский университет» Минздрава России. Медицинский совет. 2018; 17: 118-123.
- Старостина Л.С. Санация полости носа у детей раннего возраста.
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М.Сеченова» Минздрава России. Pediatrics. Consilium Medicum. 2019; 1:33-36.
Читайте также:
Детский насморк
Препараты от насморка для детей
Астма: лечение воспалений
Какое отношение воспаление имеет к астме?
Если у вас астма, вы знаете, что воспаление вызывает набухание внутренней оболочки дыхательных путей и выделение слизи. Это воспаление делает дыхательные пути более чувствительными к определенным триггерам астмы, которые вызывают приступы астмы. Из-за этого противовоспалительные препараты являются одним из наиболее важных вариантов лечения людей с астмой — они помогают остановить процесс, приводящий к приступам астмы.
Прямые противовоспалительные препараты включают кортикостероиды, которые вдыхаются непосредственно в легкие или являются системными (вводятся таким образом, что лекарство влияет на все тело, например, таблетки / пилюли). Стабилизаторы тучных клеток и модификаторы лейкотриенов — это лекарства, которые действуют по-разному и помогают улучшить противовоспалительное действие кортикостероидов. Моноклональные антитела (биологическая терапия), которые предлагают новые способы лечения, нацеленные на клетки эозинофилов, ответственные за воспаление в дыхательных путях, которые способствуют развитию астмы.
Какие противовоспалительные препараты при астме?
Кортикостероиды ингаляционные
Ингаляционные кортикостероиды — наиболее эффективные лекарства, которые вы можете принимать для уменьшения отека дыхательных путей и образования слизи. Преимущества использования этих лекарств включают:
- Меньше симптомов и обострений астмы.
- Снижение использования ингаляторов бета-агонистов короткого действия (облегчение или спасение).
- Улучшение функции легких.
- Меньше обращений в отделение неотложной помощи и госпитализаций.
- Лучше контролировать астму.
Важно помнить, что ингаляционные стероиды предотвращают симптомы, но не облегчают их. Их нужно принимать каждый день, и их нельзя прекращать или уменьшать, если вы не обсудили это со своим лечащим врачом.
Ингаляционные кортикостероиды включают:
- Дипропионат беклометазона (Qvar RediHaler®).
- Будесонид (Pulmicort®; Symbicort®). Симбикорт сочетает в себе будесонид и формотерол.
- Циклизонид (Alvesco® HFA).
- Флутиказон (Flovent® HFA; Advair® HFA и дискус, Wixela® Inhub, AirDuo®). Эти продукты сочетают в себе флутиказон и салметерол.
- Флутиказона фуроат (Arnuity® Ellipta; Breo® Ellipta; Trelegy®Ellipta). Breo сочетает флутиказона фуроат с вилантеролом, бета-агонистом длительного действия. Trelegy сочетает в себе флутиказон, вилантерол и умеклидиний.
- Флутиказона пропионат (ArmonAir® RespiClick).
- Мометазон (Asmanex®, Dulera®).Дулера сочетает в себе мометазон и формотерол.
Ингаляционные кортикостероиды бывают трех видов: ингалятор с отмеренной дозой (MDI), ингалятор для сухого порошка (DPI) и растворы для небулайзеров. Форма MDI лучше всего работает при использовании камеры выдержки с клапаном или «проставки». Камера помогает доставить больше лекарства в дыхательные пути и оставляет меньше лекарства во рту и горле.
Ингаляционные кортикостероиды безопасны для взрослых и детей. У них очень мало побочных эффектов, особенно в более низких дозах.
Это редко, но если вы принимаете более высокие дозы, могут возникнуть молочница (грибковая инфекция во рту) и охриплость голоса. Вы можете предотвратить это, полоская рот, полощая горло и сплевывая после каждого использования, а также используя спейсер с ДИ. Если вы заболели молочницей, вы можете легко вылечить ее с помощью противогрибкового средства для полоскания рта, которое прописал врач.
Ваш врач назначит минимальную возможную дозу для контроля астмы. Многие люди обеспокоены приемом «стероидов».«Эти стероиды НЕ то же самое, что анаболические стероиды, которые принимают некоторые спортсмены для наращивания мышечной массы. Стероиды в лекарствах от астмы являются противовоспалительными препаратами, и их ежедневное употребление поможет контролировать астму.
Системные кортикостероиды (пероральные или внутривенные)
Системные кортикостероиды используются для лечения тяжелых приступов астмы. Это лекарства в виде таблеток или жидкости, которые принимаются внутрь (перорально), или жидкости, которые вводятся через вену (внутривенно). Эти лекарства используются с другими лекарствами для контроля внезапных и тяжелых приступов астмы или для лечения длительной, трудно поддающейся контролю астмы.
Системный прием стероидов может занять до трех часов, чтобы начать работать, и лучше всего через шесть-12 часов. Иногда кортикостероиды принимают в высоких дозах в течение нескольких дней (всплеск стероидов) или в уменьшающихся дозах с течением времени (постепенное снижение дозы стероидов). Их также можно вводить в низких дозах ежедневно или через день для долгосрочного контроля.
Системные стероиды, доступные также в виде дженериков, включают:
- Ацетат кортизона.
- Дексаметазон.
- Гидрокортизон (Кортеф®).
- Метилпреднизолон (Medrol®, Solu-Medrol®, Depo-medrol®).
- Преднизон (Deltasone®).
- Преднизолон (Prelone®, Pediapred®, Orapred®).
Побочные эффекты системных стероидов, как правило, возникают после длительного использования и включают ряд проблем:
- Угри.
- Увеличение веса.
- Изменения настроения или поведения.
- Расстройство желудка.
- Потеря кости.
- Глазные изменения, такие как глаукома или катаракта.
- Замедление роста.
Эти побочные эффекты редко возникают при кратковременном применении. Вы будете использовать их только на краткосрочной основе при приступе острой астмы. Если вы длительное время принимаете стероиды из-за трудноизлечимой астмы, вы должны находиться под наблюдением пульмонолога или аллерголога. Эти поставщики рассмотрят возможность более продвинутого лечения и возможного направления к другим специальностям.
Модификаторы лейкотриенов
Лейкотриены — это химические вещества, которые естественным образом встречаются в нашем организме.Они вызывают сокращение мышц дыхательных путей и выделение слизи. Лекарства-модификаторы лейкотриенов действуют, блокируя действие лейкотриенов в организме. Исследования показывают, что эти препараты улучшают циркуляцию воздуха и уменьшают симптомы астмы. Они выпускаются в форме таблеток, которые принимают один или два раза в день, и могут снизить потребность в других лекарствах от астмы.
Модификаторы лейкотриенов включают:
- Монтелукаст (Singulair®).
- Зафирлукаст (Accolate®).
- Зилеутон (Zyflo®).
Наиболее частыми побочными эффектами модификаторов лейкотриенов являются головная боль и тошнота.Модификаторы лейкотриенов могут мешать правильному действию некоторых других лекарств (например, теофиллина и варфарина, разжижающего кровь). Обязательно сообщите своему врачу обо всех лекарствах, которые вы принимаете.
Моноклональные антитела
Моноклональные антитела (биологическая терапия) при тяжелой астме помогают блокировать реакцию на триггеры дыхательных путей, вызывающие воспаление. Они нацелены на клетки, которые являются частью иммунной системы организма. Эти продукты включают в себя широкий спектр лекарств, которые вводятся либо путем инъекции в кабинете врача, либо внутривенной инфузией в клинике или больнице, либо самостоятельно дома.Люди, принимающие биопрепараты, получают лечение каждые 2-8 недель в зависимости от конкретного биопрепарата. Вы должны находиться под наблюдением пульмонолога или аллерголога.
Стабилизаторы тучных клеток
Стабилизаторы тучных клеток — это лекарства, которые предотвращают высвобождение гистамина и других воспалительных веществ из клеток, называемых тучными клетками. Они используются редко.
Записка из клиники Кливленда
Важно помнить, что астма — это хроническое (то есть присутствующее постоянно) воспаление дыхательных путей в легких.Ежедневное лечение лекарствами, которые прописал вам врач, приведет к лучшему контролю над астмой и, в долгосрочной перспективе, к более здоровым легким.
Легочные и назальные противовоспалительные и противоаллергические ингаляционные системы доставки аэрозолей
Название: Легочные и назальные противовоспалительные и противоаллергические ингаляционные системы доставки аэрозолей
ОБЪЕМ: 10 ВЫПУСК: 3
Автор (ы): Xiao Wu, Oreoluwa O.Адедойн и Хайди М. Мансур
Место работы: Университет Кентукки, Фармацевтический колледж, Департамент фармацевтических наук — Отдел разработки лекарств, 789 South Limestone Street, Lexington, KY 40536-0596, США
Ключевые слова: Легочная доставка лекарств, аэрозоль, назальный спрей, противовоспалительные, противоаллергические, кортикостероиды, антигистаминные препараты, деконгестанты, ринит, антихолинергические средства, стабилизаторы тучных клеток, бета-агонисты, короткого действия, длительного действия
Реферат: Большинство респираторных инфекций, заболеваний и аллергических реакций имеют разную степень воспаления.Воспаление — это естественная иммунная защитная реакция на присутствие аллергенов или инородных частиц, которые вступают в контакт или влияют на клетки и ткани в дыхательных путях. Три основных класса терапевтических препаратов, доступных для противовоспалительного и противоаллергического действия, — это кортикостероиды, антигистаминные препараты и деконгестанты. Кортикостероидные препараты для легочной ингаляции и / или назальной доставки включают беклометазона дипропионат, будесонид, циклесонид, флутиказона фуроат, флутиказона пропионат, мометазона фуроат и триамцинолона ацетонид.Антигистаминные препараты для назального введения включают азеластин и олопатадин. Доступны два распространенных противоотечных средства — оксиметазолин и фенилэфрин. Другой терапевтический класс, антихолинергические агенты, такие как ипратропия бромид и тиотропия бромид, используются при доставке в легкие при лечении воспалительных заболеваний, таких как астма и хроническая обструктивная болезнь легких. Стабилизатор тучных клеток терапевтического класса, кромолин натрия, может использоваться для предотвращения и облегчения назальных аллергических симптомов.Кроме того, кромолин натрия был первым сухим порошковым ингалятором для легочной доставки лекарств несколько десятилетий назад и в настоящее время представлен на рынке как ингалятор с отмеренной дозой под давлением для легочной ингаляционной доставки. В зависимости от устройств, используемых для доставки лекарств в легкие, этот способ можно разделить на три категории; а именно небулайзеры, дозирующие ингаляторы под давлением и ингаляторы сухого порошка. Назальная доставка противовоспалительных и противоаллергических лекарственных средств обычно коммерчески доступна в форме водного спрея.В этой статье всесторонне рассматриваются и обсуждаются различные виды лекарств, используемых для противовоспалительного и противоаллергического действия посредством легочного и назального пути доставки, а также их механизмы действия, продаваемые продукты, признаки болезненного состояния, при этом подчеркивается доставка лекарств и терапевтические аспекты.
Аэрозольные поверхностно-активные вещества, противовоспалительные препараты и анальгетики
Введение
Ингаляционный путь введения лекарственного средства может быть идеальным при заболеваниях, при которых легкие являются основным органом-мишенью или при которых требуется быстрое начало действия лекарственного средства и внутривенный доступ недоступен.Ингаляционные кортикостероиды при воспалительных заболеваниях легких, таких как астма и ХОБЛ, например, достигают местного контроля с меньшим количеством побочных эффектов, наблюдаемых при применении системных стероидов. Точно так же при остром повреждении легких аэрозолизация сурфактанта вместо инстилляции позволяет избежать преходящей обструкции дыхательных путей и, как следствие, гипоксии и гипотензии, которые могут наблюдаться при инстилляции, и может способствовать более однородному распределению лекарственного средства. Вдыхание также может быть целесообразным способом лечения наркотиков. Учитывая огромную адсорбционную площадь легких, действие вдыхаемых наркотиков может начаться почти так же быстро, как и при внутривенном введении лекарств, и при этом отпадает необходимость во внутривенном доступе.
Однако ингаляционное введение лекарственного средства не так просто, как может показаться, и следует помнить о нескольких важных предостережениях. Эффективность некоторых лекарств может измениться при аэрозолизации, и, следовательно, может потребоваться корректировка дозы. Система доставки лекарства может повлиять на дозу, поскольку разбавление различными количествами вдыхаемого газа может изменить процент, фактически доставленный в легкие. Размер частиц должен быть адаптирован к конкретной цели в легких. 1 Более крупные частицы (3–5 мкм) имеют тенденцию попадать в верхние или главные бронхиальные дыхательные пути 2 и могут быть идеальными для таких лекарств, как бронходилататоры, которые в первую очередь воздействуют на гладкие мышцы, тогда как более мелкие частицы (1–3 мкм) допускают отложение в более мелких дыхательных путях и альвеолах, которые являются мишенями для таких лекарств, как аэрозольные поверхностно-активные вещества. 3 Ингаляционные анальгетики также требуют частиц небольшого размера специально для быстрого начала действия, которое возможно при альвеолярной абсорбции. С другой стороны, частицы размером менее 1 мкм могут не оседать в легких, оставаясь взвешенными в потоке газа при выдохе и, следовательно, неэффективны. Наконец, потери могут быть еще одной серьезной проблемой, особенно для дорогих лекарств, потому что количество распыляемого лекарства может значительно отличаться от количества фактически доставленного лекарства.
Дозировка, размер частиц и конкретная мишень лекарственного средства являются важными факторами при выборе пути доставки аэрозоля. В этой статье рассматриваются 3 конкретных класса лекарств, для которых аэрозольный путь может иметь определенные преимущества.
Поверхностно-активные вещества в аэрозольной форме
Замена поверхностно-активного вещества может быть полезной при многих типах травм легких у детей и взрослых. Без сурфактанта альвеолы имеют тенденцию разрушаться во время нормального приливного дыхания, что приводит к снижению эластичности легких, несоответствию вентиляции / перфузии и часто дыхательной недостаточности.Введение экзогенного сурфактанта продемонстрировало эффективность как для профилактики, так и для лечения детского респираторного дистресс-синдрома (RDS), при котором дефицит сурфактанта из-за незрелости легких является первичным. 4 Дисфункция сурфактанта играет сопоставимую роль при ОРДС, хотя дисфункция не является в первую очередь дефицитом, а скорее побочным повреждением в любом процессе, приведшем к начальному повреждению легких (рис. 1). 5 Ценность замены сурфактанта при ОРДС, однако, менее ясна и является предметом текущих клинических исследований.
Рис. 1.
Роль сурфактанта в неонатальном остром повреждении легких. Повышенная проницаемость эндотелия легких, повреждение эпителия и апоптоз приводят к притоку богатой белком жидкости, которая инактивирует сурфактант. Точно так же цитокины, нейтрофилы, активные формы кислорода (АФК), тромбин и механическое растяжение способствуют интенсивному воспалительному ответу легких с накоплением как провоспалительных, так и противовоспалительных медиаторов, которые могут инактивировать сурфактант и снизить синтез сурфактанта.Снижение продукции и оборота сурфактанта приводит к снижению эластичности легких, объема легких в состоянии покоя и функциональной остаточной емкости. NETS = внеклеточные ловушки нейтрофилов; TNF-альфа = фактор некроза опухоли альфа. С любезного разрешения д-р Анил Сапру.
В настоящее время единственным одобренным методом введения сурфактанта является инстилляция. К сожалению, для инстилляции требуется установка искусственного дыхательного пути и, по крайней мере, временная вентиляция с положительным давлением, что может иметь неблагоприятные последствия для нестабильного или хрупкого пациента.Интубация сопряжена с риском седации или анестезии, возможностью неправильного положения эндотрахеальной трубки и возможным прямым повреждением дыхательных путей. Положительное давление может привести к травмам, связанным с повреждающими эффектами высокого давления (баротравма), чрезмерным растяжением легких (волютравма) или повторяющимися циклами альвеолярного коллапса и повторного расширения (ателектравма), что в совокупности называется повреждением легких, вызванным вентилятором. 6 У недоношенных детей повреждение легких, вызванное вентилятором, может происходить довольно быстро, и основное преимущество экзогенного сурфактанта может заключаться в уменьшении воздействия вентиляции с положительным давлением. 7 Например, животные, находящиеся на искусственной вентиляции легких, имеют значительно более высокие уровни провоспалительных цитокинов в ткани легких по сравнению с животными, получавшими только СРАР. 8 Сама по себе закапывание также может иметь неблагоприятные последствия. Закапывание большого объема жидкости через эндотрахеальную трубку приводит к преходящей обструкции дыхательных путей, которая может вызвать гипоксию и гиперкарбию, а повышение внутригрудного давления уменьшает венозный возврат к сердцу и может привести к гипотонии и гемодинамической нестабильности.Эти эффекты обычно преходящи, но требуют тщательного наблюдения и могут помешать этой терапии у нестабильных людей. Несмотря на эти риски, многочисленные исследования продемонстрировали, что сурфактант, вводимый путем инстилляции, эффективен как для профилактики, так и для лечения RDS 4 ; Эффективность сурфактанта при остром повреждении легких неонатального возраста менее очевидна.
Первые попытки использовать экзогенное поверхностно-активное вещество как при RDS, так и при ARDS были через аэрозоль и не увенчались успехом. Робиллард и др. 9 в 1964 г. и Чу и др. 10 в 1967 г. аэрозольный дипальмитоилфосфатидилхолин, первичный поверхностно-активный фосфолипид, для лечения младенцев с РДС.Хотя клинические симптомы (оценка ретракции) улучшились, это не повлияло на заболеваемость или смертность. Аналогичная попытка введения распыленного Exosurf, синтетического поверхностно-активного вещества, лишенного поверхностно-активных апопротеинов, взрослым с ОРДС была столь же безуспешной 30 лет спустя. 11 Не было немедленного улучшения оксигенации или каких-либо изменений в отдаленных результатах. Действительно, ранние неудачи применения сурфактанта в аэрозольной форме у недоношенных новорожденных препятствовали последующим попыткам использовать экзогенное сурфактант в качестве терапии.Только после того, как Enhörning et al 12 в 1973 году показали, что закапанный сурфактант из цельного легкого оказывает терапевтическое действие на недоношенных детенышей кроликов, было достигнуто общее согласие о том, что RDS является вторичным по отношению к дефициту сурфактанта. Прошло почти десять лет (1981 г.), прежде чем было сообщено об успешном применении сурфактанта у недоношенных людей с РДС. 13,14 Последующие исследования продемонстрировали ценность инстилляции экзогенного сурфактанта как для профилактики, так и для лечения РДС, но было мало попыток доставить лекарство в виде аэрозоля.Аналогичная картина наблюдалась с сурфактантом при неонатальном повреждении легких. Ранняя неудача сурфактанта в виде аэрозоля препятствовала дальнейшим экспериментам, и ограниченный успех сурфактанта при неонатальном повреждении легких до сих пор был связан исключительно с инстилляциями.
Аэрозолизация как средство введения сурфактанта имеет несколько теоретических преимуществ перед закапыванием. (1) Аэрозолизация позволяет избежать вышеупомянутой гипоксии и гипотензии, вызванных закапыванием большого объема жидкости по эндотрахеальной трубке.(2) Аэрозолизация может привести к более однородному распределению сурфактанта в легких. 15 (3) Может потребоваться меньшее количество препарата (всего 2–3 мг / кг по сравнению с обычной инстиллированной дозой 100 мг / кг). 16 (4) Аэрозолизация может позволить вводить сурфактант без необходимости искусственного дыхания. Однако существуют ограничения, связанные с аэрозолизацией поверхностно-активного вещества. Как было отмечено ранее, аэрозоль должен иметь подходящий размер капель или частиц.Частицы размером более 5 мкм имеют тенденцию попадать в глотку или проксимальные дыхательные пути; слишком мелкие (<1 мкм) капли не оседают в альвеолах и выдыхаются. Размер Златовласки представляет собой средний аэродинамический диаметр ∼1–2 мкм. К счастью, этого можно достичь с помощью ряда доступных в настоящее время небулайзеров. Доставка адекватной дозы также является проблемой. Хотя может потребоваться меньше поверхностно-активного вещества, если большая часть достигает альвеол, более крупный размер частиц (> 5 мкм) может привести к тому, что большая часть аэрозоля попадет в трубки, ротоглотку или проксимальные дыхательные пути.В результате может оказаться, что только часть аэрозольного препарата достигает альвеол. Генераторы аэрозолей также ограничены по объему жидкости, которая может быть распылена за определенный период времени. Сухие аэрозоли могут предложить привлекательную альтернативу, хотя здесь также оптимальный размер частиц, состояние гидратации частиц и характер дыхания могут влиять на альвеолярную адсорбцию. Различные аэрозольные устройства, их преимущества и недостатки описаны в таблице 1.
Таблица 1.
Преимущества и недостатки аэрозольных устройств
Было проведено несколько исследований, сравнивающих введение аэрозольного сурфактанта с инстилляцией, и большинство исследований проводилось на животных моделях с иногда противоречивые результаты.Наиболее полными исследованиями являются исследования Lewis et al. 18,19 Их первоначальные исследования на недоношенных ягнятах показали сопоставимое улучшение показателей эффективности аппарата ИВЛ, динамической податливости и кривых давление-объем с введенными цельными легкими (Альвеофакт) и распыленными (Альвеофакт и Сурванта) поверхностно-активными веществами. 18 Распыление привело к большему отложению в правой верхней доле и трахее по сравнению с закапанным лекарством, но физиологические эффекты были сопоставимы. Однако более поздние эксперименты на овцах с моделью повреждения легкого лаважа продемонстрировали значительные различия между сурфактантами и способами введения. 19 Это исследование показало, что закапывание сурфактанта из всего легкого (сурфактант из экстракта легких крупного рогатого скота [BLES]) был наиболее эффективным в улучшении оксигенации и эластичности легких (рис. 2). Распыленная Сурванта была на втором месте и была значительно лучше, чем инстиллированная Сурванта. Интересно, что распыленный BLES почти не оказывал никакого эффекта. При анализе in vitro оказалось, что BLES инактивирован распылением, о чем свидетельствует увеличенное соотношение мелких агрегатов к большим агрегатам (поверхностно-активное вещество с мелкими агрегатами относительно лишено поверхностной активности, а крупный агрегат считается активным поверхностно-активным веществом).Такое снижение содержания поверхностно-активного вещества с крупными агрегатами после распыления не наблюдалось при использовании Survanta, что, вероятно, объясняет, почему распыленный Survanta был эффективным, а распыленный BLES — нет.
Рис. 2.
P aO 2 и альвеолярно-артериальная разница кислорода (P (A-a) O 2 ) до лечения и в течение 180 мин после лечения. Значения представляют собой средние значения ± SE. Животные, получавшие сурфактант из коровьего легкого (BLES; n = 5), аэрозольный Survanta (Surf; n = 5) и закапанный Surf ( n = 5), имели значительные улучшения по обеим параметрам после лечения по сравнению с их соответствующие значения перед обработкой ( P <.01). Животные, получавшие BLES в виде аэрозоля ( n = 5), не имели значительных изменений ни в одной из переменных с течением времени. Из ссылки 19, с разрешения.
Другие исследования аэрозольного сурфактанта на животных также дали разные результаты в зависимости от аэрозольного устройства, способа доставки аэрозоля в легкие, модели повреждения легких и конкретного использованного сурфактанта. Сравнение введения Exosurf и Survanta с помощью струйного и ультразвукового небулайзера кроликам после повреждения легких лаважем продемонстрировало значительные различия в количестве доставляемого лекарственного средства, определяемое как типом небулайзера (ультразвуковой> струйный), так и конкретным поверхностно-активным веществом (Exosurf> Survanta). 20 Однако, независимо от способа доставки, ни один из препаратов не оказал значительного воздействия на оксигенацию. Новый тип небулайзера, названный генератором капиллярного аэрозоля, показал эквивалентное улучшение оксигенации на модели повреждения легких поросят, когда сурфактант KL4 вводился путем закапывания по сравнению с аэрозолизацией. 21 Выживаемость, гистология легких и уровни интерлейкина-8 были лучше с аэрозольным и инстиллированным сурфактантом KL4 по сравнению с контрольной популяцией, поддерживаемой только CPAP.Ruppert et al., , 22, , использовали порошковый аэрозоль с Venticute, искусственным поверхностно-активным веществом с рекомбинантным поверхностно-активным протеином C, в моделях лаважа легких и блеомицина у кроликов и продемонстрировали быструю нормализацию оксигенации до уровней, существовавших до травмы. Кроме того, Venticute в форме аэрозоля восстановил нормальную эластичность легких у спонтанно дышащих мышей, поврежденных блеомицином. Дейк и др. 23 сравнивали распыленный и инстиллированный Альвеофакт (сурфактант всего легкого крупного рогатого скота) на модели повреждения лаважа легких кролика.Обе группы испытали улучшение оксигенации, хотя реакция на закапанное сурфактант была почти мгновенной, тогда как улучшение с распыленным сурфактантом произошло в течение 2-часового периода времени. Однако важно, что распыление позволило избежать быстрого изменения среднего кровяного давления и церебрального кровотока, связанного с изменениями внутригрудного давления, связанными с инстилляцией (рис. 3). Изолированная перфузируемая модель повреждения легкого кролика, вызванная лаважем, продемонстрировала уменьшенную фракцию шунта как с распыленным, так и с инстиллированным Alveofact, но кровоток в плохо вентилируемые области был увеличен с инстиллированным по сравнению с распыленным сурфактантом. 24 Аэрозольный и инстиллированный Curosurf недоношенным ягнятам продемонстрировал сопоставимое улучшение газообмена и комплаентности, но церебральные гемодинамические изменения во время введения были менее серьезными при использовании аэрозольного пути. 25 Wagner et al. 26 сравнили распыленный и инстиллированный Curosurf (200 мг / кг) на аналогичной модели повреждения легкого кролика. Их небулайзер доставил туман с размером капель 120 ± 4 мкм через интратрахеальный катетер. Оба метода доставки привели к быстрому восстановлению оксигенации до травмы.Распределение сурфактанта было несколько лучше с распыленным лекарством, хотя распределение было оценено как относительно однородное при обоих подходах. Исследователи пришли к выводу, что распыление сурфактанта в трахею было эффективным, даже когда размер капель был относительно большим. Они предположили, что этот подход может избежать побочных эффектов болюсной инстилляции.
Рис. 3.
Непрерывные измерения среднего артериального давления (MABP) и церебрального кровотока (CBF) в левой сонной артерии кроликов с тяжелой дыхательной недостаточностью, получавших инстилляцию или распыление сурфактанта.Все значения выражены в виде среднего ± SEM процентного изменения значений до обработки ( n = 6). * P <0,05 по сравнению со значениями до обработки; # P <0,05 между группами. Из ссылки 23, с разрешения.
Опыт применения сурфактанта в аэрозольной форме у людей был ограничен, и большинство из них приходилось на недоношенных новорожденных. В неконтролируемом исследовании распыляемого препарата Альвеофакт у 20 недоношенных новорожденных (средний гестационный возраст 31 неделя, масса тела при рождении 1680 г) сообщалось о немедленном улучшении оксигенации (альвеолярно-артериальное различие), P aCO 2 и одышки, хотя улучшение в частота дыхания не достигла статистической значимости. 27 Исследователи использовали струйный небулайзер Intersurgical RO252 / ME с расходом 8 л / мин и доставляли аэрозоль непосредственно через носоглоточную трубку. Четырнадцати из 20 младенцев интубация не требовалась, и единственным побочным эффектом, связанным с распыленным сурфактантом, было увеличение вязких выделений, требующих частого отсасывания. В аналогичном исследовании Exosurf применяли через небулайзер для недоношенных детей и не сообщали об его влиянии на оксигенацию. 28 Восемь из 22 пациентов потребовали интубации и искусственной вентиляции легких в течение 2 часов после приема распыляемой жидкости Exosurf.Berggren et al., , 29, , сравнили CPAP с CPAP плюс распыленный Curosurf у 24 недоношенных новорожденных и не продемонстрировали различий в немедленной функции легких или других результатах. Наконец, в неконтролируемом исследовании фазы 2 17 недоношенных новорожденных лечили небулайзером Aerosurf (сурфактант KL4), доставляемым через небулайзер с вибрирующей сеткой (Aeroneb Pro) во время CPAP. 30 Исследователи отметили несколько побочных эффектов и улучшение оксигенации, хотя в отсутствие группы сравнения их выводы были ограниченными.Пятерым из 17 младенцев потребовалась интубация и последующая закапывание сурфактанта, но все выжили. Исследователи сочли, что доставка лекарства с помощью небулайзера была непостоянной, и это было ограничением исследования.
Опыт применения сурфактанта в аэрозольной форме при неонатальных заболеваниях легких более ограничен. Уже упоминалось об отрицательном исследовании Exosurf у взрослых с ОРДС. 11 В исследовании сравнивали распыленный Exosurf и распыленный полунормальный раствор, носитель для Exosurf, у 725 взрослых с ОРДС, вторичным по отношению к сепсису.Не было изменений оксигенации или функции легких, а также снижения смертности. Авторы утверждали, что доза сурфактанта могла быть недостаточной, потому что, по оценкам, 95% распыленного лекарства было извлечено из трубки вентилятора, и что распыленный полунормальный физиологический раствор в контрольной группе, возможно, действительно был вредным. Также было высказано предположение, что Exosurf не является очень эффективным поверхностно-активным веществом, потому что он лишен поверхностно-активных апопротеинов. Поверхностно-активные белки B и C, по-видимому, жизненно важны для снижения поверхностного натяжения in vivo. 31 Напротив, Anzueto et al. 32 сообщили об улучшении транспорта мокроты и общей легочной функции при использовании распыляемого Exosurf по сравнению с плацебо у субъектов с хроническим бронхитом. В другом исследовании сравнивали меченный технецием калфактант в аэрозольной форме и физиологический раствор у 8 субъектов с муковисцидозом и продемонстрировали аналогичное распределение, но с более быстрым клиренсом технеция с калфактантом, предполагая, что вдыхание калфактанта увеличивает клиренс слизи. 33 В интервенционном исследовании с участием 5 молодых людей с муковисцидозом распыленный сурфактант из цельного легкого (Альвеофакт) вводился ежедневно в течение 5 дней и не показал какого-либо улучшения ОФВ 1 или ФЖЕЛ. 34 В отличие от этого, отчет об одном случае распыления Exosurf у пациента с предполагаемым реперфузионным повреждением после трансплантации легкого показал быстрое улучшение комплаентности и оксигенации. 35 Два небольших контролируемых исследования у взрослых с астмой показали, что распыленное сурфактант снижает чувствительность дыхательных путей 36 и улучшает легочную функцию 37 во время обострения астмы, но более раннее исследование распыленного сурфактанта у детей с астмой было безуспешным. 38 Хотя введение сурфактанта теоретически может улучшить проходимость дыхательных путей в проводящих дыхательных путях 39 при астме, клинические данные для людей ограничены.
В настоящее время использование поверхностно-активного вещества в виде аэрозоля ограничено экспериментальными протоколами. Из исследований на животных можно сделать несколько выводов. (1) Размер капель или частиц должен находиться в пригодном для вдыхания диапазоне (1-2 мкм), хотя возможно, что оптимальный диапазон может варьироваться для разных сурфактантов и пациентов разного размера (или возраста).(2) Эффективная доза оказывается на порядок ниже при доставке аэрозолем, чем при закапывании. К сожалению, для этого может потребоваться сравнимое количество использования лекарства, поскольку количество лекарства, фактически доставленное в легкие, может иметь мало отношения к количеству лекарства в аэрозольной форме. (3) Как и в случае с закапанным поверхностно-активным веществом, вероятно, что более полные поверхностно-активные вещества (то есть с поверхностно-активными апопротеинами или миметиками апопротеинов) будут более эффективными, чем поверхностно-активные вещества без поверхностно-активных апопротеинов.(4) Поскольку большая часть пользы экзогенного сурфактанта может заключаться в предотвращении повреждения легких, вызванного вентилятором, раннее введение, вероятно, будет более эффективным, чем позднее. Таким образом, эффективная доставка аэрозоля без необходимости интубации или вентиляции с положительным давлением была бы идеальной. (5) Некоторые небулайзеры могут инактивировать некоторые поверхностно-активные вещества (например, BLES с ультразвуковым небулайзером), поэтому демонстрация поверхностной активности после распыления является обязательной. (6) Распределение поверхностно-активного вещества важно, поскольку неоднородное распределение поверхностно-активного вещества может фактически ухудшить соответствие вентиляции / перфузии в легких.Большинство исследований на животных предполагают, что распределение более однородно при аэрозолизации по сравнению с инстилляцией, но большинство исследований проводилось на моделях гомогенного повреждения легких (повреждение лаважем или недоношенность). Ясно, что необходимы дополнительные исследования.
Аэрозолизация — многообещающий подход к введению сурфактанта, особенно потому, что сурфактант можно вводить до интубации и проведения вентиляции с положительным давлением (таблица 2). Это позволяет избежать побочных эффектов, связанных с попаданием большого объема жидкости в дыхательные пути, и потенциального повреждения легких в результате вентиляции с положительным давлением.Немногочисленные данные также позволяют предположить, что распределение поверхностно-активного вещества может быть более однородным, когда лекарство находится в аэрозольной форме. Гетерогенное распределение постулируется как одна из причин неэффективности экзогенного сурфактанта в самом последнем рандомизированном контролируемом исследовании (РКИ). 40 Очевидно, однако, что сурфактант в аэрозольной форме остается в значительной степени непроверенным при повреждении легких у человека. Как и в случае с любой терапией, дьявол может быть в деталях: в частности, в типе аэрозольного устройства, типе сурфактанта, дозировке, времени, лежащем в основе травме легких и, вероятно, других факторах, которые мы еще не понимаем.Аэрозолизация поверхностно-активного вещества, по-видимому, имеет мало побочных эффектов, поэтому в ближайшем будущем ожидаются дальнейшие исследования фазы 2 и 3 на людях.
Таблица 2.
Возможные преимущества и недостатки аэрозолизации поверхностно-активных веществ
Противовоспалительные агенты в аэрозольной форме
Многие типы заболеваний легких или повреждения легких связаны с воспалением. Хотя воспалительная реакция сложна и редко локализуется только в легком, интуитивно понятно, что аэрозолизация позволит достичь наивысшей концентрации противовоспалительного агента в легком при минимальном неблагоприятном воздействии на другие системы органов.В настоящее время доступно большое количество противовоспалительных препаратов, хотя только некоторые из них разработаны для ингаляций. Далее описываются вдыхаемые (или подходящие для аэрозолизации) противовоспалительные лекарственные средства и их применение при различных заболеваниях.
Ингаляционные кортикостероиды
Ингаляционные кортикостероиды, возможно, являются лучшим примером преимуществ аэрозольных препаратов по сравнению с системными противовоспалительными средствами. Ингаляционные кортикостероиды вытеснили все другие препараты для контроля воспаления дыхательных путей и используются при астме, бронхолегочной дисплазии, аллергическом бронхолегочном аспергиллезе, ХОБЛ и некоторых типах интерстициальных заболеваний легких.Кортикостероиды — сильнодействующие противовоспалительные препараты с множеством эффектов. Как указано де Бенедиктисом и Бушем, стероиды 41 подавляют воспаление с помощью нескольких механизмов: (1) прямое геномное воздействие на экспрессию ядерных генов путем воздействия на транскрипцию; (2) блокирование ядерного фактора каппа B, тем самым снижая транскрипцию цитокинов, хемокинов, молекул клеточной адгезии и рецепторов для этих молекул; (3) активация рецепторов глюкокортикоидов, которые имеют следующий эффект ингибирования фосфолипазы A 2 и циклооксигеназы-2, что приводит к снижению простагландинов, тромбоксанов и лейкотриенов; (4) ускорение апоптоза эозинофилов; и (5) усиление экспрессии рецепторов β 2 в дыхательных путях и снижение реактивности бронхов на прямые и косвенные раздражители.
Системно применяемые кортикостероиды связаны с большим количеством значительных побочных эффектов; к наиболее серьезным относятся подавление иммунитета и надпочечников, гипертония, гипергликемия, увеличение веса, подавление роста, желудочно-кишечное кровотечение и образование катаракты. К сожалению, системные кортикостероиды также являются наиболее эффективной терапией многих типов воспалительных заболеваний легких. При острой астме системные стероиды являются основой терапии, и многие утверждают, что бронходилататоры действуют только до тех пор, пока стероиды не окажут свое действие.Однако побочные эффекты системных стероидов препятствуют их постоянному применению у всех, кроме наиболее тяжелых пациентов с астмой. При хроническом заболевании легких у недоношенных (бронхолегочная дисплазия) системные стероиды позволяют быстрее отлучить от ИВЛ и провести более раннюю экстубацию, но были связаны со значительным замедлением развития спустя годы. 42,43 Следовательно, они обычно не используются у недоношенных детей. При муковисцидозе системные стероиды замедляют ухудшение функции легких, но за счет нарушения роста. 44 Точно так же краткосрочные системные стероиды могут быть полезны при ХОБЛ, но были связаны с повышенным риском осложнений, включая атрофию мышц и пневмонию. 45,46
Ингаляционные кортикостероиды обладают многими преимуществами системных стероидов, смягчая их побочные эффекты. Для долгосрочного контроля астмы ингаляционные кортикостероиды являются наиболее мощными и неизменно эффективными лекарствами для достижения общих целей лечения. 47–49 По сравнению с плацебо, ингаляционные кортикостероиды уменьшают симптомы астмы и уменьшают частоту и тяжесть обострений. 48 Низкие дозы ингаляционных кортикостероидов считаются безопасными, при этом наиболее частые побочные эффекты ограничиваются кандидозом полости рта и дисфонией, которые можно свести к минимуму путем полоскания полости рта после приема. Однако у детей проспективное рандомизированное контролируемое исследование показало умеренную задержку роста при применении ингаляционных кортикостероидов по сравнению с плацебо. 50
Обычно применяется ежедневное введение ингаляционных кортикостероидов, но исследование на взрослых показало, что прерывистые короткие курсы ингаляционных кортикостероидов в начале обострения астмы могут быть столь же эффективными, как и постоянное ежедневное применение. 51 Метаанализ 4 педиатрических и 2 взрослых исследований показал, однако, что ежедневное по сравнению с прерывистым использованием приводит к лучшему контролю астмы и меньшей потребности в экстренном введении агонистов β 2 . 52 Кокрановский обзор 55 исследований показал, что ингаляционные кортикостероиды не снижали последовательно скорость снижения ОФВ 1 у пациентов с ХОБЛ, но снижали количество обострений и улучшали качество жизни. 53 Ингаляционные кортикостероиды не эффективны при хронических заболеваниях легких у недоношенных. 54
Доступно большое количество ингаляционных препаратов кортикостероидов (таблица 3). С момента подписания Монреальского протокола в 1987 году хлорфторуглероды были заменены гидрофторалканами в качестве пропеллентов в дозированных ингаляторах кортикостероидов. Изменения состава позволили разработать новый продукт и разработать ингаляционные кортикостероиды с меньшим размером частиц. Хотя стероидные рецепторы присутствуют во всех дыхательных путях, размер частиц 55 , по-видимому, имеет значение.В РКИ, посвященных астме, так называемых ультрамелких гидрофторалканов, беклометазон показал такую же эффективность при половине дозы более крупных частиц хлорфторуглерода беклометазона (рис. 4). 57,58 Подобные результаты были продемонстрированы с флунизолидом. 59 По сравнению с ингаляционными кортикостероидами с крупными частицами, ингаляционные кортикостероиды с мелкими частицами приводят к перераспределению дозы в дыхательных путях с меньшим осаждением в ротоглотке и большим отложением в легких и на периферии легких.Это может быть особенно важно для детей, у которых различия в анатомии дыхательных путей и уровне координации и взаимодействия в значительной степени способствуют меньшему размеру частиц. 60 Меньший размер частиц увеличивает время пребывания в аэрозоле и способствует большему проникновению в легкие и увеличению отложения лекарства в нижних дыхательных путях. Дополнительным преимуществом может быть более низкая частота кандидоза полости рта и дисфонии, частые побочные эффекты ингаляционных кортикостероидов, поскольку сверхмелкозернистый размер частиц приводит к меньшему отложению препарата в верхних дыхательных путях. 57–60
Таблица 3.
Сравнение отложений в легких и размера частиц стероидных ингаляторов
Рис. 4. Расчет сравнения доз
показывает, что для этого потребуется 2,6-кратная доза ингаляционного стероида с крупными частицами (хлорфторуглерода [CFC] дипропионат беклометазона) для достижения такого же улучшения ОФВ 1 по сравнению с ингаляционным стероидом с ультратонкими частицами (пропеллент гидрофторалкан [HFA] беклометазон). Из справки 56, с разрешения.
Обеспокоенность возможными побочными эффектами более высоких доз ингаляционных кортикостероидов для лечения астмы побудила к разработке препаратов, сочетающих ингаляционные кортикостероиды с агонистами β 2 длительного действия.В некоторых исследованиях было показано, что они снижают необходимую дозу ингаляционных кортикостероидов, улучшая контроль астмы. 61 Национальные рекомендации, однако, предлагают добавлять агонисты β 2 длительного действия только в том случае, если контроль не может быть достигнут с помощью монотерапии (таблица 4). 62 Они несут предупреждение FDA «черный ящик» о том, что они могут увеличивать риск внезапной смерти, что, как считается, связано с понижающей регуляцией рецепторов β 2 , хотя об этом не сообщалось в сочетании с ингаляционными кортикостероидами.Комбинированные препараты значительно дороже одних ингаляционных кортикостероидов, хотя общая стоимость любого лекарства должна учитывать эффективность и стоимость лекарственного отказа; Одно посещение отделения неотложной помощи или одна госпитализация может стоить столько же, сколько годовой запас ингаляционных кортикостероидов / комбинированных препаратов β 2 -агониста длительного действия.
И последнее примечание по поводу ингаляционных кортикостероидов: ни один препарат не является эффективным при неэффективном введении! Дети, особенно маленькие дети, представляют собой серьезные проблемы с доставкой лекарств в виде аэрозолей.Использование маски — это норма, потому что сотрудничество зачастую неоптимально. К сожалению, младенческий нос является эффективным аэродинамическим фильтром, а младенцы и маленькие дети, как правило, дышат через нос. Младенцы и дети также обычно не поддерживают задержку дыхания, которая позволяет аэрозолю оседать в дистальных отделах легких, а плач значительно снижает отложение в легких. Одно из преимуществ ультратонких ингаляционных кортикостероидных препаратов состоит в том, что для их введения может потребоваться меньшая координация.Многочисленные исследования с участием детей демонстрируют, что чем меньше, тем лучше и что на самом деле может быть меньше побочных эффектов, поскольку может быть достаточно более низких доз ингаляционных кортикостероидов. 60
Антимускариновые агенты длительного действия
Холинергические парасимпатические нервы способствуют повышению тонуса гладких мышц при ХОБЛ и астме, а антимускариновые агенты в первую очередь являются бронходилататорами. Однако ацетилхолин также может высвобождаться из ненейрональных клеток, чтобы воздействовать на гладкие мышцы дыхательных путей и другие клетки, участвующие в воспалительной реакции, 63 , и антимускариновые агенты могут, следовательно, уменьшать воспаление.Эти агенты стали основой терапии ХОБЛ, и их использование получает все большее признание при лечении астмы. Насколько это улучшение возможно связано с противовоспалительным эффектом по сравнению с бронхолитическим действием, неясно. Имеются обширные доказательства того, что антимускариновые агенты длительного действия улучшают контроль симптомов и качество жизни у пациентов с ХОБЛ, 64 , и их эффективность при астме также изучается. 65 Исследование, сравнивающее тиотропий с салметеролом (агонист β 2 длительного действия) и ингаляционными кортикостероидами при хронической плохо контролируемой астме, продемонстрировало равную эффективность; оба превзошли удвоение дозы ингаляционных кортикостероидов (рис.5). 64 Как и в случае ингаляционных кортикостероидов и агонистов β 2 длительного действия, ингаляция этих агентов обеспечивает более эффективную доставку лекарств с меньшими побочными эффектами по сравнению с системным введением.
Рис. 5.
Средние различия между субъектами, получавшими тиотропий, теми, кто получал двойной глюкокортикоид, и теми, кто получал салметерол, в отношении утреннего пика выдоха (PEF) (A), вечернего PEF (B), пре-бронходилататора FEV 1 (C), и доля дней борьбы с астмой за 14-дневный период (D).Усы указывают на 95% доверительный интервал. Из ссылки 64, с разрешения.
Четыре антимускариновых агента длительного действия коммерчески доступны в Соединенных Штатах, хотя несколько других проходят фазу 3 испытаний. Тиотропия бромид, продаваемый как Spiriva, обладает специфичностью в отношении мускаринового рецептора M3, что снижает вероятность возникновения тахикардии. Aclidinium (Almirall) имеет аналогичную селективность и продолжительность действия, но в клинических испытаниях он проявляется быстрее. 66 Оба имеют приблизительную продолжительность эффекта 24 часа.Ипратропиум (Атровент) представляет собой антимускариновое средство короткого действия, и его применение ограничено обострениями астмы и, возможно, ХОБЛ. Интересно, что способ доставки этих агентов может привести к значительным различиям в результатах. Водный раствор тиотропия, доставляемый через ингалятор (Респимат), был связан с повышенной смертностью по сравнению с плацебо в нескольких исследованиях ХОБЛ, а также по сравнению с зарегистрированными показателями в исследованиях с использованием порошкового ингалятора (HandiHaler). 67 Однако последующее крупное рандомизированное контролируемое исследование не выявило разницы в смертности, и в настоящее время оба препарата доступны для клинического применения в США. 68
Установлено использование антимускариновых агентов длительного действия при ХОБЛ, и, как и в случае с последовательными поколениями агонистов β 2 , вероятно, что будет разработано больше рецептор-селективных агентов (в частности, мускариновый рецептор M3). Их использование при астме также вероятно возрастет, учитывая их продемонстрированное превосходство над более высокими дозами ингаляционных кортикостероидов при астме у взрослых. 67 β 2 Комбинация агонистов / антимускариновых агентов длительного действия может иметь синергетический эффект, и в настоящее время они проходят испытания при ХОБЛ. 69 β 2 агонисты могут усиливать расслабление гладких мышц бронхов, непосредственно индуцированное мускариновым антагонистом, путем уменьшения высвобождения ацетилхолина посредством модуляции холинергической нейротрансмиссии. В свою очередь, мускариновые антагонисты могут снижать бронхоконстрикторные эффекты ацетилхолина. Еще неизвестно, найдут ли эти комбинированные агенты место в лечении хронической астмы. Как указывалось ранее, их противовоспалительные эффекты спорны, и, следовательно, их потенциальное использование при других воспалительных заболеваниях легких неясно.
Магний
Магний не является классическим противовоспалительным средством, но оказывает антиоксидантное действие на нейтрофилы в дополнение к ослаблению бронхоспазма за счет прямого расслабления гладких мышц. 70 Исследования с внутривенным введением магния обычно не показали положительного эффекта при астме у взрослых 71,72 , но показали минимальное, но значительное влияние на функцию легких (обычно ОФВ 1 или пиковую скорость выдоха) при детской астме. 73,74 В многоцентровом педиатрическом исследовании MAGNETIC вдыхание магния по сравнению с физиологическим раствором (добавленным к альбутеролу и ипратропию) привело к статистически значимому улучшению оценки тяжести астмы через 60 минут.Однако это не привело к разнице в долгосрочных результатах (пребывание в больнице, интубация или госпитализация в педиатрическое отделение интенсивной терапии). 73 Исследователи отметили, что улучшение было наиболее значительным у пациентов с тяжелой астмой и у тех, у кого симптомы были относительно острыми. При вдыхании магния побочных эффектов не сообщалось. Сравнимое исследование у взрослых, исследование 3Mg, в котором сравнивали внутривенный или ингаляционный магний с плацебо, показало отсутствие эффекта ингаляционного магния и минимальный, но значительный эффект внутривенного магния. 72 Как при вдыхании, так и при внутривенном введении магния детям, страдающим астмой, оказывается, больше пользы, чем взрослым с астмой.
Магний имеет значительное преимущество в том, что он дешев и относительно лишен побочных эффектов, кроме ощущения тепла из-за расширения сосудов при внутривенном болюсном введении. Однако существует мало свидетельств пролонгированного расширения бронхов или какого-либо улучшения конечных результатов при острой астме. Учитывая предположение, что он может быть эффективным в более тяжелых случаях астмы, часто добавляют 74 ингаляционный или внутривенный магний, когда стандартные распыленные агонисты β 2 плюс ипратропий не полностью устраняют клинические симптомы.
Хроматы
Кромогликат натрия (кромолин) и недокромил являются противовоспалительными препаратами, доставляемыми исключительно путем ингаляции. Эти препараты резко подавляют дегрануляцию тучных клеток в дыхательных путях. Также было показано, что более длительное лечение снижает количество эозинофилов, тучных клеток и лимфоцитов и снижает экспрессию молекулы внутриклеточной адгезии-1 и молекулы адгезии эндотелиальных лейкоцитов-1 при биопсии бронхов через 12 недель. 75 Несколько десятилетий назад хроматы были агентами первой линии для лечения астмы легкой и средней степени тяжести и бронхоспазма, вызванного физической нагрузкой, но их применение затмило ингаляционные кортикостероиды.Лекарства были проблематичны, так как требовали введения 3–4 раза в день, но имели главное преимущество в том, что они практически не имели побочных эффектов, кроме редкой анафилаксии или аллергических реакций. Мета-анализ (Кокрановский обзор) 1026 субъектов в 23 исследованиях, проведенных между 1970 и 1997 годами, показал, что кромолин не лучше плацебо при сравнении дней без симптомов, хотя использование бронходилататоров было меньше у субъектов, принимавших кромолин. 76 Кромолин затем стал отнесен ко второму уровню астмы, по крайней мере, у детей, и его использование почти прекратилось.
Интересный обзор Келлера и Ширхольца 77 предполагает, что хроматы не подвергались адекватному исследованию. Они утверждают, что предыдущие исследования кромолина и его сестринского препарата, недокромила, были неадекватными, потому что доставка лекарства через дозирующий ингалятор или ингалятор с сухим порошком приводила к частицам> 5 мкм, которые не попадают в вдыхаемый диапазон. Из-за чрезвычайно гигроскопической природы лекарственного средства размер частиц имел тенденцию к быстрому увеличению в течение срока службы дозированного ингалятора или ингалятора сухого порошка из-за попадания воды в канистру, что делало доставляемые частицы неэффективными.Авторы предполагают, что более новые небулайзеры (например, PARI LC Sprint и eFlow 30S) доставляют частицы в пригодном для вдыхания диапазоне (3–3,5 мкм), что приводит к более эффективной и стабильной доставке лекарств без проблемы несоответствия в размере частиц или дозе. Авторы утверждают, что необходимость приема 3–4 раза в день могла больше отражать несоответствия в доставке дозы, чем фактический период полувыведения лекарства. Несмотря на предполагаемые недостатки ранних исследований и разработку более эффективных небулайзеров, кромолин по-прежнему отнесен к статусу второго уровня в рекомендациях по лечению астмы как в Европе, так и в США.
Лидокаин
Подобно кортикостероидам, лидокаин сокращает выживаемость эозинофилов и подавляет кашель в ответ на различные раздражители. 78,79 Несколько неконтролируемых исследований показывают эффективность при астме легкой и средней степени тяжести. Контролируемое слепое исследование, проведенное Hunt et al 80 с участием 50 взрослых с астмой, которым вводили 100 мг лидокаина в виде аэрозоля по сравнению с физиологическим раствором 4 раза в день, показало улучшение FEV 1 , меньшее ночное пробуждение, снижение использования бронходилататоров и снижение количества эозинофилов в крови.Однако последующее исследование 81 не показало улучшения по сравнению с контролем плацебо, хотя доза была значительно меньше (40 мг дважды в день) по сравнению с исследованием Hunt 80 (100 мг 4 раза в день). Хотя якобы оба исследования были слепыми, онемение, связанное с ингаляцией лидокаина, делало ослепление несколько сомнительным. Лидокаин продемонстрировал эффективность при трудноизлечимом кашле, но не доказал свою эффективность при лечении острой астмы. Действительно, у значительного процента субъектов в исследовании Hunt 80 наблюдалось измеримое немедленное снижение ОФВ 1 , связанное с ингаляционным лидокаином.В настоящее время маловероятно, что вдыхаемый лидокаин найдет применение в качестве противовоспалительного средства при лечении астмы или других воспалительных заболеваний легких.
Циклоспорин
Циклоспорин — это ингибитор кальциневрина, обычно используемый для предотвращения или лечения отторжения при различных трансплантатах твердых органов путем блокирования активации Т-лимфоцитов. Системное введение лекарств требует тщательного контроля из-за низкого терапевтического индекса, особенно почечной токсичности. Аэрозолизация особенно привлекательна при трансплантации легких, потому что легкие являются мишенью, и может быть возможно достичь более высокой концентрации в легких при минимизации токсичности.Трансплантация легких имеет самый высокий уровень смертности среди всех трансплантатов твердых органов, причем как острое, так и хроническое отторжение являются основными причинами отказа трансплантата и смерти. Исследования трансплантации легких на животных демонстрируют, что ингаляционный циклоспорин может достигать высоких концентраций трансплантата с минимальной токсичностью, 82,83 , и эти результаты были подтверждены открытыми испытаниями на людях после трансплантации. 84,85 РКИ ингаляционного циклоспорина по сравнению с плацебо у 58 субъектов после трансплантации легких продемонстрировало, что, хотя не было улучшения показателей острого отторжения, выживаемость и выживаемость без хронического отторжения были значительно выше при использовании ингаляционного циклоспорина по сравнению с плацебо. 86 Распыленный циклоспорин также был оценен на безопасность и фармакокинетику у здоровых людей и пациентов с астмой. 87 Уровни сыворотки были намного ниже, чем при сопоставимых пероральных дозах, и повторные ингаляционные дозы хорошо переносились без какого-либо видимого системного подавления иммунитета. Мощные иммунодепрессанты в аэрозольной форме, такие как циклоспорин и такролимус, вероятно, будут все шире использоваться в будущем, но в настоящее время остаются в основном экспериментальными.
Гепарин
Гепарин в аэрозольной форме продемонстрировал способность предотвращать вызванную физической нагрузкой бронхоспазм 88,89 и использовался для лечения пластического бронхита, 90 , но, по-видимому, он особенно эффективен при остром повреждении легких из-за вдыхания дыма.Неясно, проявляется ли первичный эффект как противовоспалительный агент или просто как местно активный антикоагулянт. Повреждение от вдыхания дыма происходит в первую очередь из-за химических токсинов в дыме, а не из-за термического поражения. Первоначальное повреждение ограничивается трахеей и главными бронхиальными дыхательными путями с отслаиванием слизистой оболочки дыхательных путей, повышенной проницаемостью микрососудов, повышенной секрецией слизи и выраженной воспалительной реакцией. Фибриноцеллюлярные псевдомембраны образуются в течение нескольких часов после травмы, и предполагается, что раннее вдыхание гепарина может уменьшить образование фибрина и избежать возникшей в результате обструкции дыхательных путей. 91 Несколько ретроспективных клинических исследований на людях показали переменное улучшение показателей смертности на 92,93 и повреждений легких 92–94 баллов по сравнению с историческими контрольными данными. Важно отметить, что ни одно из исследований не выявило увеличения частоты кровотечений. Исследование было NCT01454869, но было отозвано.
Прочие противовоспалительные агенты
Ряд других агентов был испытан в качестве аэрозольной противовоспалительной терапии при астме и других заболеваниях легких.К ним относятся дапсон, 95 фуросемид, 96 кетопрофен, 97 антигистаминные препараты (азеластин), 98 интерферон, 99 и пентоксифиллин, 100 , но они либо все еще экспериментальны, либо неэффективны. Как указывалось ранее, аэрозольная доставка противовоспалительных агентов особенно привлекательна из-за возможности максимизировать уровни лекарственного средства и предположительно терапевтического эффекта при минимизации побочных эффектов. Вероятно, что в будущем будут апробированы аэрозольные препараты многих противовоспалительных средств.
Аэрозольные анальгетики
Опиоиды
Как свидетельствуют трагические случаи гибели российских военных при попытке вывести из строя чеченских повстанцев на театре военных действий в Москве, 101 опиоидные анальгетики могут быть довольно эффективно доставлены с помощью аэрозолей. Это может быть особенно привлекательным путем за пределами больницы, где внутривенный доступ может быть проблематичным с точки зрения как доступности, так и необходимого набора навыков для стерильного и безопасного введения внутривенных лекарств.По сравнению с пероральными препаратами, ингаляционные опиоиды дают более быстрое начало резкой боли, а также позволяют избежать трудностей с пероральными препаратами, которые возникают у пациентов, проходящих химиотерапию из-за тошноты или рвоты.
Наркотики можно эффективно вводить с помощью аэрозоля, но на фармакокинетику и фармакодинамику влияет ряд факторов. Биодоступность или фактическая доставляемая доза может варьироваться в зависимости от аэрозольного устройства, а также от того, является ли оно непрерывным или активируемым дыханием.Более крупные частицы могут конденсироваться в носу, ротоглотке и оборудовании, что затрудняет определение доставленной дозы. Устройства непрерывного действия аэрозоля по сравнению с устройствами, активируемыми дыханием, могут привести к тому, что большая часть дозы будет потеряна в окружающей среде. Действительно, многие исследования, сравнивающие вдыхание и внутривенное введение наркотиков, противоречат этим эффектам. 102–107 Новые устройства, активируемые дыханием, такие как система AERx PMS (рис. 6), 102,103 более надежны, их биодоступность приближается к 60–75% по сравнению с внутривенным введением.Стаккато фентанил для портативных ингаляторов дает разовую дозированную дозу высокоочищенного фентанила, которая дает пиковые уровни в сыворотке и площадь под кривой концентраций, очень сопоставимые с таковыми, полученными при внутривенном введении фентанила. 104 Размер капель может также влиять на метаболизм и доставку лекарств. Krajnik et al 103 сравнили 2 разных небулайзера, доставляющих капли размером 0,5–2 и 2–5 мкм, соответственно, и продемонстрировали значительные различия в соотношении морфин-3-глюкуронида и морфин-6-глюкуронида.Они предположили, что морфин может в некоторой степени метаболизироваться в легких, и, следовательно, размер капель может иметь значительное влияние на эффективность и побочные эффекты. В интересном исследовании на собаках, находящихся на ИВЛ, распыленный морфин показал более длительную продолжительность действия с более низкими пиковыми концентрациями в сыворотке по сравнению с внутривенным введением. 106 Авторы предполагают, что это может привести к более безопасному (более низкий пиковый уровень) и более эффективному (более длительный) способ введения морфина.Следует отметить, что ингаляционная доза (1,32 мг / кг) была вдвое больше, чем внутривенная доза (0,66 мг / кг), хотя авторы постулировали, что дозы были сопоставимы, поскольку почти половина вдыхаемой дозы оставалась в небулайзере.
Рис. 6.
Система доставки лекарств AERx PMS. Предоставлено Aradigm.
Контролируемые исследования на людях ограничены. В клинических испытаниях распыленный фентанил при острой боли в педиатрическом отделении неотложной помощи был сопоставим с внутривенным введением, хотя требуемая ингаляционная доза была вдвое больше, чем внутривенная. 108 Fulda et al. 109 сравнивали распыленный и контролируемый пациентом морфин в слепом рандомизированном контролируемом исследовании у пациентов с травмами с острой грудной болью. Субъектам, получавшим распыленный морфин, требовались более высокие дозы, но они имели эквивалентное обезболивание с меньшим седативным действием. В другом исследовании 2 субъекта с серповидно-клеточной анемией и острым грудным синдромом сообщили об уменьшении боли на 90% и 40% соответственно с помощью распыленного морфина. 110 Авторы предполагают, что распыленный морфин может действовать непосредственно на рецепторы мю легких и, следовательно, иметь меньше системных эффектов.Напротив, введение 0,2 мг / кг морфина с помощью распыления 22 пациентам отделения неотложной помощи с острой сильной болью не продемонстрировало значительного облегчения боли при оценке через 1, 3, 5 и 10 мин. 111 Исследование биодоступности распыленного морфина по сравнению с пероральным и внутривенным введением показало, что биодоступность распыленного морфина составляет лишь одну двадцатую от биодоступности морфина для внутривенного введения и одну пятую от морфина при пероральном введении. 105 Авторы пришли к выводу, что распыленный морфин может иметь более быстрое начало, но является очень неэффективным средством доставки морфина.
Одним из предполагаемых преимуществ распыленных наркотиков является их влияние на одышку. Одышка — тревожный симптом у многих тяжелобольных и неизлечимых пациентов. Наркотики, вводимые различными путями, эффективны для облегчения одышки, но за счет потенциального угнетения дыхания или других нежелательных эффектов. Постулируется, что вдыхаемые наркотики оказывают прямое воздействие на внутрилегочные опиоидные рецепторы 112 и, таким образом, требуют более низких доз или имеют меньше системных побочных эффектов при лечении одышки.К сожалению, это не было подтверждено контролируемыми исследованиями. Обзор 18 рандомизированных исследований, сравнивающих наркотики в виде аэрозолей и внутривенных наркотиков, продемонстрировал сопоставимую эффективность, ни один из них не был лучше. 113 Это контрастирует с рандомизированным перекрестным исследованием, проведенным Нозедой и др. 114 , показывающим, что ни 10, ни 20 мг распыленного морфина ничем не отличались от солевого раствора плацебо, судя по шкалам одышки пациентов. Аналогичное исследование с использованием 20 и 40 мг морфина в небулайзере не дало улучшения ощущаемой одышки или теста с 6-минутной ходьбой по сравнению с плацебо. 115 Распыляемый конкретный наркотик также может влиять на эффективность. Семнадцать субъектов с одышкой, связанной с неизлечимой болью при раке, получавших небулайзерный гидроморфон, сообщили об облегчении симптомов в течение 15 минут без значительных побочных эффектов. 116 Однако в этом исследовании не было группы сравнения.
Основная трудность в интерпретации всех исследований наркотиков в аэрозольной форме — это неопределенность в отношении доставленной дозы. Как отмечалось ранее, даже при использовании небулайзера, активируемого дыханием, по оценкам, фактически доставляется только 60% дозы, и сколько дождей выходит в ротоглотку и т. Д., Неясно (и абсорбция с поверхностей слизистых оболочек также может отличаться. ).Таким образом, трудно оценить доказательства эквивалентности или превосходства распыления над внутривенным. Наркотики в аэрозольной форме могут быть эффективными, но их кинетика менее предсказуема по сравнению с другими способами доставки. Некоторые из более новых систем доставки (AERx PMS, Staccato fentanyl) дают более предсказуемую фармакокинетику и могут быть идеальными для быстрого введения, когда внутривенный доступ недоступен, и желательно немедленное облегчение боли. Несмотря на наличие опиоидных рецепторов в легких, не было выявлено явных различий в специфических для легких эффектов (например, при одышке), которые можно было бы рекомендовать при вдыхании вместо внутривенного или энтерального введения наркотика.
Местные анестетики
Распыленные анестетики местного действия также заслуживают краткого обсуждения. Распыленный лидокаин уже упоминался как потенциальное аэрозольное противовоспалительное средство при астме 78–80 и является очень эффективным местным анестетиком. Сообщается, что распыленный лидокаин облегчает боль при установке назогастрального зонда, бронхоскопии 117 , 118,119 и эндотрахеальной интубации, 120 , хотя не все исследования показывают эффективность. 121,122 Тетракаин использовался для аналогичной цели, но имеет потенциальный недостаток, связанный с возникновением метгемоглобинемии при передозировке. 123 Добавление фентанила к распыляемому лидокаину может дать дополнительные преимущества. В исследовании 45 детей, подвергшихся бронхоскопии, Мустафа 124 сравнил распыленный лидокаин, лидокаин плюс фентанил и физиологический раствор и продемонстрировал, что комбинация лидокаина и фентанила приводит к большей гемодинамической стабильности, меньшему количеству эпизодов кашля и меньшей десатурации кислорода.Единственным побочным эффектом было немного более длительное время восстановления.
Ограничение дозы местного анестетика имеет очевидное значение. Токсичные уровни лидокаина могут спровоцировать судороги, угнетение миокарда и аритмии. Передозировка тетракаином (и его обычно используемым продуктом (цетакаином) в сочетании с бензокаином и аминобензоатом) может привести к фатальной метгемоглобинемии. 123 Обычная доза, рекомендуемая для ингаляционного лидокаина, составляет максимум 4 мг / кг, но сообщалось о дозах до 6 мг / кг без побочных эффектов.О систематических сравнительных исследованиях различных концентраций лидокаина не сообщалось, равно как и не уделялось внимания специфике аэрозольного устройства или размера частиц. Поскольку ингаляционные местные анестетики используются в первую очередь для местной анальгезии носоглотки и / или ротоглотки, для этой цели представляется целесообразным использовать частицы большего размера.
Выводы
Можно распылять множество различных лекарств с преимуществами и недостатками, описанными ранее.Немаркированное использование аэрозольных лекарств увеличивается, часто без предварительного исследования, 125 , и важно понимать, что аэрозолизация может изменить не только начало и действие лекарства, но и дозу. Некоторые препараты могут терять активность при распылении, особенно с некоторыми небулайзерами, и фактическая доставленная доза может не соответствовать запланированной. Эффективная доза может быть связана с размером частиц, взаимодействием пациента с аэрозольным устройством (например, спейсерами) и координацией или усилиями пациента.Следовательно, дозировка должна быть адаптирована к биодоступности лекарственного средства при введении его аэрозольным путем. Начало действия лекарства также может быть связано с размером частиц, и это может быть важным фактором при использовании некоторых лекарств, таких как наркотики. Также необходимо учитывать потери и токсичность для тех, кто находится в непосредственной близости. Например, при использовании распыленного фентанила потери не вызывают особого беспокойства, поскольку лекарство относительно дешево, но воздействие других веществ в непосредственном окружении пациента может быть важным фактором.
Аэрозолизация наиболее целесообразна для лекарств, у которых легкие являются основным органом-мишенью. Поверхностно-активные вещества, ингаляционные кортикостероиды и все чаще антибиотики (не упомянутые в этом обзоре) являются одними из наиболее убедительных примеров. Однако лекарственные препараты необходимо исследовать, чтобы определить их биодоступность, фармакокинетику, фармакодинамику и эффективность после распыления. Кроме того, тип аэрозольного устройства может повлиять на все вышеперечисленное. Крайне важно, чтобы врачи осознавали, что аэрозолизация лекарства может резко изменить его свойства, и исследование должно предшествовать принятию аэрозольного пути доставки лекарства.
Лечение пероральными препаратами, отличными от стероидов, для уменьшения воспаления легких и ухудшения функции легких у людей с муковисцидозом
Обзор вопроса
Мы рассмотрели данные, чтобы увидеть, могут ли препараты, не являющиеся стероидами, уменьшить воспаление в легких и остановить его. ухудшение функции легких у людей с муковисцидозом.
Общие сведения
Воспаление легких увеличивает наносимый им ущерб и является наиболее частой причиной ранней смерти людей с муковисцидозом.В высоких дозах нестероидные противовоспалительные препараты, особенно ибупрофен, могут работать против воспаления, но в низких дозах есть некоторые свидетельства того, что они могут вызывать воспаление. Использование высоких доз также вызывает опасения по поводу потенциальных нежелательных эффектов, что ограничивает использование этих препаратов при муковисцидозе.
Дата поиска
Доказательства актуальны на 21 ноября 2018 г.
Характеристики исследования
Мы искали испытания, сравнивающие пероральные нестероидные противовоспалительные препараты с плацебо (таблетка, не содержащая активного лекарства ).Мы искали любой уровень дозы. но испытание должно было длиться не менее двух месяцев на людях с муковисцидозом. Мы нашли 17 испытаний и включили четыре из них с участием 287 человек в возрасте от 5 до 39 лет; еще одно исследование еще не опубликовано полностью, а два еще продолжаются; мы оценим их, когда у нас будет больше информации. В трех из четырех включенных испытаний сравнивали ибупрофен с плацебо; два из этих испытаний проводились в одном центре и с участием одних и тех же людей. В одном испытании сравнивали препарат под названием пироксикам с плацебо.Самый продолжительный судебный процесс длился четыре года.
Мы стремились сообщить о функции легких, состоянии питания, рентгеновских снимках легких, о том, как часто нужно было внутривенное введение антибиотиков, подробностях о госпитализации, выживаемости и побочных эффектах.
Ключевые результаты
Мы объединили результаты двух крупнейших исследований ибупрофена и показали, что у тех, кто принимал ибупрофен, ежегодная скорость снижения функции легких была ниже, что согласуется с тремя измерениями функции легких. Затем мы проанализировали эти результаты, разделенные по возрасту (хотя изначально мы не планировали этого делать), и обнаружили, что два измерения показали более медленные темпы ежегодного снижения функции легких у детей младшего возраста.Результаты четырех испытаний показали, что меньшее количество участников в группе ибупрофена было госпитализировано по крайней мере один раз по сравнению с плацебо, хотя не было ясно, было ли разница случайной или нет. В одном испытании люди, длительно принимавшие высокую дозу ибупрофена, с меньшей вероятностью нуждались в внутривенных антибиотиках, имели лучший пищевой статус и более здоровые легкие по данным рентгена. В испытаниях не сообщалось о серьезных побочных эффектах, но они не были предназначены для демонстрации различий в частоте побочных эффектов.
Подводя итог, мы обнаружили доказательства того, что высокая доза нестероидного противовоспалительного препарата, в первую очередь ибупрофена, может замедлить прогрессирование поражения легких у людей с муковисцидозом, особенно у молодых людей. Долгосрочные результаты по безопасности ограничены, но мы считаем, что есть достаточно доказательств, чтобы предположить, что нестероидные противовоспалительные препараты должны быть временно отменены, когда люди с муковисцидозом получают внутривенные аминогликозиды или другие препараты, которые могут серьезно повредить почки.
Испытание препарата пироксикам не дало многих результатов в форме, которую мы могли бы проанализировать в обзоре. У нас не было никаких результатов для нашего основного результата — функции легких. Единственные результаты, о которых мы сообщили, об отсутствии разницы между группой пироксикама и группой плацебо по количеству госпитализаций.
Качество доказательств
Мы оценили качество доказательств как в целом умеренное. Мы думали, что три испытания ибупрофена имели хороший или адекватный уровень методологического качества с небольшим риском предвзятости результатов, но использовали ряд различных исходов и итоговых показателей.У нас не было никаких опасений относительно рисков систематической ошибки при сравнении пироксикама с плацебо.
Новые методы лечения травм от вдыхания дыма: обзор | Journal of Translational Medicine
Мы провели всесторонний поиск литературы с помощью PubMed, чтобы определить новые методы лечения травм от вдыхания дыма с сопутствующими ожогами или без них. Мы искали препараты, которые все еще исследуются и еще не одобрены Управлением по контролю за продуктами и лекарствами США (FDA).Мы использовали английский язык и искали статьи по ключевым словам ингаляция, дыхательные пути, дым, легкие, и легочный, отдельно или в сочетании с лечение, терапия, ожог, дым, выход, и термический. Мы признаем, что предвзятость исследователя могла повлиять на наш подход к расследованию. Чтобы ограничить эту предвзятость и обеспечить всесторонний обзор, мы отметили все дополнительные источники, на которые были ссылки в публикациях во время нашего первоначального поиска, и, если применимо, включили их в наш обзор.
Новые методы лечения были разделены на категории в зависимости от их терапевтической стратегии: терапия стволовыми клетками, антикоагулянтная терапия, ингибирование селектина, модуляция воспалительного пути, разложение супероксида и пероксинитрита, селективное ингибирование NOS, сероводород, ингибирование HMG-CoA редуктазы, ингибирование протонной помпы, и таргетные нанотерапии (Таблица 1). Модели включают либо вдыхание дыма, либо ожог плюс травму от вдыхания дыма. Индивидуальные методы лечения оценивались на основе их метода введения, профиля безопасности, системных эффектов, влияния на патофизиологию легких, а также общей эффективности и смертности (если сообщалось).
Таблица 1 Новые методы лечения травм от вдыхания дыма
Терапия стволовыми клетками
Мезенхимальные стволовые клетки — это мультипотентные клетки-предшественники, которые обладают способностью дифференцироваться в несколько клеточных линий. Эта уникальная характеристика сделала терапию стволовыми клетками популярным потенциальным терапевтическим методом благодаря способности стволовых клеток регенерировать и восстанавливать различные типы тканей после травм [7]. Исследования подтвердили регенеративный потенциал мезенхимальных стволовых клеток костного мозга (BMSC) в моделях острого повреждения легких [8,9,10,11].Zhu et al. перевел этот экспериментальный план на модель травмы от вдыхания дыма на крысах, где BMSC вводили через инъекцию в хвостовую вену после воздействия дыма. Результаты были значимыми для ослабления травм у крыс, которым вводили BMSC после воздействия дыма, при этом авторы также отметили значительное улучшение легочной гистопатологии, отека легких, снижение баллов повреждения легких, стимулирование ангиогенеза за счет паракринной активности, усиление регуляции фактора роста эндотелия сосудов ( VEGF) и участие сигнального пути Notch2 [12].Zhu et al. также исследовали BMSC на более крупной модели животных и использовали кроликов для изучения специфического взаимодействия между BMSC и VEGF. Они нанесли травму от вдыхания дыма с последующей внутривенной инъекцией BMSC, а затем собрали легочную ткань в течение 6 часов после травмы. Они отметили значительное увеличение VEGF в поврежденной ткани легкого с уменьшением количества периферического VEGF у этих травмированных животных, а также значительное улучшение отека легких в группах лечения по сравнению с контролем [7].
Лю и др. использовали модель травмы от вдыхания дыма на крысах с последующей инъекцией BMSC в хвостовую вену и изучили эффекты, наблюдаемые через 24 часа после травмы. Эти авторы отметили улучшение отека легких, а также снижение провоспалительного цитокина IL-8 с увеличением противовоспалительного цитокина IL-10 в группах лечения по сравнению с контролем [13]. И Zhu et al. и Chen et al. наблюдали аналогичные изменения в про- и противовоспалительных цитокинах в сыворотке на кроличьей модели травмы от вдыхания дыма, когда животных лечили BMSC сразу после травмы, вызванной дымом.Эти животные были оценены в течение 6 часов после травмы, и все повышения воспалительных цитокинов (например, TNF-альфа, IL-1-бета и IL-6) были значительно снижены в группах лечения по сравнению с животными, которые получили травму от вдыхания дыма без кости. терапия стволовыми клетками костного мозга [14, 15]. Кроме того, Zhu et al. наблюдали значительное улучшение отека легких, измеренное по соотношению влажного и сухого, у животных, получавших BMSC после травмы от вдыхания дыма, по сравнению с контрольной группой [15].
В попытке локализовать мезенхимальные стволовые клетки, полученные из костного мозга человека (hBMSC), в месте повреждения легких Song et al.использовали люциферазу (LUC) и меченый зеленой флуоресцентной меткой (GFP) hBMSC на мышиной модели травмы от вдыхания дыма [16]. Клетки LUC-GFP-hBMSC вводили через хвостовую вену через 24 часа после травмы от вдыхания дыма и контролировали с помощью биолюминесцентной визуализации (BLI). Сигналы BLI первоначально были отмечены как в модели повреждения, так и в контрольной модели, но сигнал BLI стал намного сильнее в легочной ткани группы травмы через 24 часа после травмы, в то время как в контрольной группе сигналы BLI мигрировали в брюшную полость в тот же момент времени [16 ].Авторы также проанализировали повреждение паренхимы легких и отек легких, используя соотношение влажного и сухого, и обнаружили, что у мышей, которым вводили hMSC, было значительно более низкое соотношение влажного и сухого по сравнению с необработанными мышами [16]. Кроме того, у мышей, получавших hMSC, также наблюдалось гистопатологическое улучшение, повышенный фактор роста кератиноцитов [17] и снижение TNF-альфа в жидкости бронхиального альвеолярного лаважа (BALF) [16].
Cui et al. оценивали легочный эффект мезенхимальных стволовых клеток амниона, вводимых после травмы от вдыхания дыма.Мезенхимальные стволовые клетки амниона человека (hAMSC) вводили крысам через хвостовую вену после воздействия белого дыма [18]. Степень ингаляционного повреждения впоследствии анализировали с помощью компьютерной томографии, соотношения влажных и сухих веществ, гистопатологии и оценки газов крови. Вестерн-блот был использован для анализа уровней сурфактантного белка, а иммуноферментный анализ (ELISA) был использован для обнаружения воспалительных цитокинов в BALF, оба из которых играют роль в воспалении и легочном иммунном ответе. Результаты продемонстрировали общее легочное улучшение у крыс, получавших hAMSC [18].Меченые hAMSC наблюдались в основном в легочной ткани после травмы от вдыхания дыма, и в группе лечения наблюдалось значительное улучшение патологии КТ и гистопатологического балла через 28 дней после ингаляционной травмы, а также снижение отношения влажного к сухому, что указывает на улучшение отека легких [ 18]. Также наблюдалось общее улучшение легких, обработанных hAMSC, на основании оценки снижения легочного фиброза, улучшения соотношения PaO 2 / FiO 2 , увеличения экспрессии сурфактантного белка, снижения соотношения влажных и сухих веществ и снижения воспалительных цитокинов в ЖБАЛ у крыс. которые лечились с помощью hAMSC после травмы от вдыхания дыма [18].
Ихара и др. исследовали влияние мезенхимальных стволовых клеток, полученных из жировой ткани, на легочные микрососудистые изменения, используя модель травмы от вдыхания дыма у овцы [19]. Овец подвергали воздействию хлопкового дыма, а затем разделили на группы, которые получали стволовые клетки, полученные из жировой ткани, или контрольный носитель. Было отмечено, что в группах лечения улучшилась функция легких, продемонстрированная улучшенным соотношением PaO 2 / FiO 2 , индексом оксигенации и улучшенным пиковым давлением в дыхательных путях.Кроме того, у этих животных также наблюдалось улучшение проницаемости легочных микрососудов, наблюдаемое после травмы от вдыхания дыма, что проявлялось в уменьшении легочного лимфотока и повышении уровня белка в плазме по сравнению с контрольными животными, которые не получали терапию стволовыми клетками [19].
Хотя эти результаты показывают, что лечение стволовыми клетками может уменьшить воспаление и повреждение паренхимы после травмы от вдыхания дыма, дальнейшие исследования для определения точного механизма действия, а также снижения смертности и дополнительного терапевтического потенциала могут быть полезными.Потенциальное использование стволовых клеток также может быть ограничено из-за отсутствия легкодоступных источников и потенциальной потребности в расширении, что в будущем станет проблемой для трансляционных исследований и клинической применимости.
Таргетная антикоагулянтная терапия
Ряд соединений появился в качестве потенциальных методов лечения ингаляционных травм, которые сосредоточены на различных аспектах процесса заболевания, включая воспаление и обструкцию дыхательных путей. Комбинация фибрина, клеточного дебриса и муцина формирует обструктивные цилиндры после травмы от вдыхания дыма, что позволяет распространять уже гипоксическое состояние из-за снижения вентиляции и увеличения перфузии или несоответствия вентиляции / перфузии [20].Кроме того, обструкция приводит к гиперинфляции альвеол, которые высвобождают воспалительный цитокин и нейтрофильный хемотактант IL-8, вызывая дальнейшее воспаление, потерю легочной гипоксической вазоконстрикции и повреждение [21, 22]. Введение антитромбина III (ATIII), гепарина, тканевого активатора плазминогена (tPA) и комбинации вышеперечисленного изучалось на ограниченном количестве моделей животных с ингаляционными и ожоговыми повреждениями [21]. Энхбаатар и др. использовали модель ожога и вдыхания дыма на овце для дальнейшего изучения этих терапевтических возможностей.Первоначально они вводили активатор плазминогена в форме аэрозоля (tPA) овцам после ожога кожи и травмы от вдыхания дыма и обнаружили улучшение оксигенации легких, утечки сосудов, отека легких и обструкции дыхательных путей с высокой дозой (2 мг против 1 мг) tPA [ 23]. Энхбаатар и др. также вводили овцу в виде аэрозоля ATIII и гепарин после аналогичной модели сочетания кожного ожога и травмы от вдыхания дыма и снова обнаружили значительное уменьшение цилиндров и обструкции дыхательных путей, а также легочного лимфотока (показатель трансваскулярной жидкости из-за повышенной проницаемости сосудов и косвенный индикатор тяжести повреждения легких) по сравнению с неповрежденной контрольной группой [24].Кроме того, авторы наблюдали снижение пикового давления в дыхательных путях, улучшение pH артериальной крови, более высокие отношения PaO 2 / FiO 2 и уменьшение отека легких в группах лечения ATIII / гепарин по сравнению с животными, которые не подвергались ожогам или травмам от дыма. [24]. Аналогичным образом, когда способ введения ATIII из распыленной формы был изменен на внутривенную форму (при сохранении введения распыленного гепарина), аналогичные результаты наблюдались со значительным улучшением легочного газообмена, обструкции дыхательных путей и содержания воды в легких у обожженных животных. подвергались травме от вдыхания дыма и подвергались лечению по сравнению с необработанной контрольной группой [25].Miller et al. выполнили систематический обзор и обобщили продолжающиеся исследования с использованием этой модели ожога и ингаляции у овец, в которой вводили комбинацию антикоагулянтных терапевтических средств посредством ингаляции, инъекции или их комбинации [21]. Примечательно, что большинство комбинированных схем привело к улучшению оксигенации, другие также обнаружили улучшение отека легких и лимфотока в легких у обработанных животных по сравнению с контрольной группой [21].
Miller et al. исследовали аналогичный терапевтический подход в ретроспективном исследовании с историческим контролем и проанализировали преимущество выживания у пациентов, получавших небулайзерный гепарин, N-ацетилцистеин и альбутерол, по сравнению с пациентами, получавшими только альбутерол после травмы от вдыхания дыма.Они обнаружили значительно улучшенную оценку тяжести повреждения легких в группе лечения после 2-го дня госпитализации со значительным улучшением общей легочной функции и улучшением выживаемости [22]. Лечение распылением гепарина продемонстрировало положительные эффекты, специфичные для симптомов, у пациентов с ингаляционным повреждением; однако не существует установленных клинических руководств относительно дозировки или стратегии лечения или рассмотрения возможности развития коагулопатии или гепарин-индуцированной тромбоцитопении у этой конкретной популяции пациентов.
Ингибирование селектина
Также появились терапевтические варианты, направленные на воспалительную реакцию, которая возникает в легких после ингаляционного повреждения, с одним механизмом действия, специально ориентированным на нейтрализацию селектинов антителами. Эти селектины состоят из белков, расположенных либо на эндотелиальных клетках (E-селектин и P-селектин), либо экспрессируемых на лейкоцитах (L-селектины) [26]. Лекарства, нацеленные на белки, используемые для адгезии лейкоцитов и передачи сигналов, такие как L-селектин, были использованы в попытке уменьшить негативные воспалительные эффекты, связанные с повышенной проницаемостью сосудов и отеком после травмы от вдыхания дыма [27].Одна группа исследовала эффекты блокады L-селектина с использованием антител к молекуле адгезии лейкоцитов 1-3 (LAM 1-3), которую они вводили как до [28], так и после ожога и ингаляционного повреждения у овец [27]. Первоначально они вводили ЛАМ за 2 часа до ожога и вдыхания дыма и обнаружили улучшение отсроченной проницаемости микрососудов без значительного улучшения оксигенации [28]. В надежде использовать это в качестве более терапевтического подхода Katahira et al. вводили LCAM после ожога и травмы от вдыхания дыма на аналогичной модели овцы.Это введение антител сопровождалось мониторингом легочной трансваскулярной жидкости, газообмена, кардио- и легочной гемодинамики, гистологических изменений, соотношения влажных и сухих веществ и изменений общего числа лейкоцитов. Они обнаружили значительно меньше легочной жидкости, легочного лимфотока и общего количества нейтрофилов у обработанных животных, но не обнаружили статистически значимых изменений в гистологическом исследовании, соотношении PaO 2 / FiO 2 или соотношении влажных и сухих веществ у обработанных животных. группы по сравнению с контролем [27].Это исследование подтвердило, что основной терапевтический эффект связан с трансваскулярным потоком жидкости и образованием отеков [27]. Chandra et al. сосредоточили внимание на блокаде P-селектина на аналогичной модели ожога и ингаляции у овец и не обнаружили разницы в соотношении PaO 2 / FiO 2 или легочном потоке лимфы в группах лечения по сравнению с контрольными животными [26]. Хемокины и интерлейкины играют важную роль как в повреждении легких, так и в выздоровлении, и остаются предметом постоянных исследований после ожогового ингаляционного повреждения [29].Однако результаты этих исследований продолжают различаться из-за изменений времени введения антител, дозировки или конкретного благоприятного воздействия на легкие и требуют дополнительных исследований для оценки этих ограничений, а также общего преимущества в отношении смертности в исследуемой популяции. Кроме того, введение этих экспериментальных терапевтических средств обеспечивало системные эффекты, которые потенциально могли ограничивать клиническое использование и предполагать сохраняющуюся потребность в легочно-специфических терапевтических средствах для нацеливания и лечения травм от вдыхания дыма.
Модуляция воспалительного пути
Патологический ответ на ингаляционное повреждение включает многие аспекты воспалительного каскада. В предыдущей работе одной из наших лабораторий Dunn et al. разработали мышиную модель ингаляционного повреждения, которая успешно воспроизвела человеческое повреждение, и при этом отметила повышение специфических цитокинов и связанных с повреждением молекулярных паттернов (DAMP) [30]. В частности, этот проект был направлен на повышение уровня хемотактанта нейтрофилов CXCL1. Авторы идентифицировали ослабленный ответ на инфильтрацию легочных нейтрофилов после травмы от вдыхания дыма путем введения нейтрализующего антитела к CXCL1, а также обнаружили значительно сниженное количество воспалительных цитокинов (IL-6, IL-1 бета, IL-16) в группе лечения. по сравнению с необработанным контролем [30].Также было отмечено, что гистопатология легких и общий бактериальный клиренс улучшились в группе, получавшей нейтрализующее антитело CXCL1 [30]. Они предположили, что блокирование этого раннего хемотактанта ослабляет раннее рекрутирование нейтрофилов, что в конечном итоге предотвращает раннее повреждение легких и обеспечивает улучшенный клиренс бактерий после повреждения от вдыхания дыма [30].
Zhang et al. также исследовали воспаление легких после травмы от вдыхания дыма, используя модель крысы, подвергнутой воздействию дыма.В этом исследовании крысам внутрибрюшинно после травмы от вдыхания дыма вводили пуерарин, китайское лекарство с иммуномодулирующими свойствами, и обнаружили снижение нейтрофилов, проницаемости сосудов, отека легких и клеточного инфильтрата в группах лечения после травмы по сравнению с контрольной группой. Они также отметили повышенные уровни противовоспалительных Т-клеток (Th2) и снижение уровней Th3, которые, как считается, усугубляют острое повреждение легких за счет провоспалительной передачи сигналов [31]. Ding et al.выполнили рандомизированное контрольное испытание, которое также было сосредоточено на цитокинах и воспалительных клетках после травмы от вдыхания дыма; однако в этом исследовании использовались люди. Терапевтическое исследование в этом исследовании было сосредоточено на введении перфторгексана в трахею [32]. Перфторгексан принадлежит к семейству перфторуглеродов химических соединений, которые представляют собой жидкости с низким поверхностным натяжением и высокой способностью растворять и переносить кислород. Он использовался в качестве формы жидкостной вентиляции для улучшения газообмена в легких в различных моделях легочного повреждения [33], но было отмечено, что он имеет значительные системные эффекты при внутривенном введении [34, 35].В конечном итоге авторы обнаружили снижение количества нейтрофилов, IL-6 и IL-8 в жидкости бронхоальвеолярного лаважа после 3 дней лечения в группе травмы от вдыхания дыма, но не отметили каких-либо значительных изменений в системном воспалении в той же группе [32]. ]. Они также отметили улучшение эластичности легких после терапии перфторгексаном, но не смогли обнаружить значительных различий в соотношении PaO 2 / FiO 2 у пациентов контрольной группы и пациентов с травмой от вдыхания дыма [32]. Хотя было отмечено, что введение парообразного интратрахеального перфторгексана уменьшает местное воспаление, долгосрочные системные эффекты остаются неизвестными.Отмечено, что внутривенное введение перфторуглеродов вызывает пневмоторакс, лактоацидоз и гиперкапнию, что обеспечит значительные клинические ограничения, если аналогичные результаты будут отмечены при интратрахеальном введении, а также создаст проблемы, связанные с производством и хранением соединения, что ограничит клинические проявления выгода и переводимость [34, 35].
Zhang et al. исследовали эффект подавления передачи сигналов цитокинов 1 (SOCS-1) на легочное воспаление и апоптоз на мышиной модели травмы от вдыхания дыма [36, 37].SOCS-1 подавляет провоспалительные цитокины и стимулирует передачу сигналов цитокинов, активируя убиквитин-протеасомный путь [36,37,38]. Он также играет роль в активации макрофагов и высвобождении цитокинов, что приводит к не подавляемому и смертельному воспалению у животных с нокаутом [39]. SOCS-1 ранее исследовался на других моделях острого повреждения легких и оказался эффективным в регулировании воспалительной реакции и ограничении легочного повреждения в этих моделях [40, 41]. Zhang et al. использовали мышиную модель травмы от вдыхания дыма для дальнейшего исследования этих защитных эффектов.Они вводили интратрахеальный SOCS-1 до травмы от вдыхания дыма, а затем наблюдали за мышами в течение 8 дней. Группы лечения продемонстрировали повышение смертности, более здоровые легкие при макроскопическом исследовании, улучшенную гистопатологию, снижение инфильтрации моноцитов и нейтрофилов, а также более низкие уровни провоспалительного ИЛ-1 бета и снижение расщепления каспазы 1 по сравнению с контрольной группой [37].
Глютамин утилизируется тяжелобранными тканями и известен как условно незаменимая аминокислота.Предыдущие исследования, посвященные изучению роли глутамина на животных моделях сепсиса и острого повреждения легких, отметили многообещающую пользу легочной ткани после травмы [42, 43]. Ли и др. вводили глутамин через инъекцию в хвостовую вену крысам после травмы от вдыхания дыма. Они обнаружили, что группы лечения улучшили гистопатологию, уменьшили отек, улучшили оксигенацию, снизили уровни провоспалительных цитокинов и уменьшили фиброз. Интересно, что они также отметили повышенный уровень защитных белков теплового шока у крыс, получавших глутамин после воздействия дыма [44].
Введение терапии, направленной на иммуномодуляцию, продолжает оставаться предметом исследований в развивающейся области с использованием исследований травм от вдыхания дыма как на животных, так и на людях, но продолжение экспериментов по выявлению системных побочных эффектов, прямой легочной терапевтической пользы и общей смертности может дать ценная информация в этом классе лекарств.
Роль оксида азота
Роль оксида азота (NO) в ожогах и травмах от вдыхания дыма изучалась в многочисленных исследованиях за последнее десятилетие с использованием модели овец как кожного ожога, так и травмы от вдыхания дыма.Считается, что повышенная продукция NO участвует в механизме и обострении легочного повреждения после ожогового повреждения как за счет снижения легочной гипоксической вазоконстрикции, так и за счет увеличения образования свободных радикалов за счет взаимодействия с супероксидом и образованием пероксинитрита. В травмированных условиях легочная ткань испытывает гипоксическое сужение сосудов для сохранения соответствующей вентиляции (V) и перфузии (Q) для лучшей оптимизации газообмена. Потеря этой вазоконстрикции за счет увеличения продукции NO приводит к тому, что кровь течет мимо невентилируемых альвеол, что приводит к несоответствию V / Q, легочному шунту и гипоксии тканей [2, 45].Кроме того, повышенные уровни NO реагируют с супероксидом с образованием пероксинитрита, который, в свою очередь, вызывает повреждение ДНК, что в конечном итоге приводит к чрезмерной активации ферментов репарации ДНК (поли (АДФ-рибоза) полимераза 1 или PARP) и индукции клеточного стресса с вероятна активация NF-каппа B и накопление воспалительных цитокинов [45,46,47,48,49].
Синтаза оксида азота (NOS), источник оксида азота, экспрессируется в нескольких изоформах в легких, включая эндотелиальную (eNOS), нейрональную (nNOS) и индуцибельную NOS (iNOS).Эти изоформы экспрессируются в здоровой легочной ткани, но, как полагают, имеют повышенную экспрессию после ожогов и травм от вдыхания дыма. Cox et al. далее исследовали распределение изоформ NOS после ожога и вдыхания дыма с использованием иммуногистохимического анализа легочной ткани на модели крупного рогатого скота. Они обнаружили, что все три изоформы экспрессируются в неповрежденной легочной и бронхиальной ткани, но наблюдали значительное увеличение уровней iNOS на моделях повреждений [46].
Распад супероксида и пероксинитрита
Помимо активации нейтрофилов, повышенной проницаемости сосудов, отека легких и повышенной передачи сигналов и активации цитокинов, свободные радикалы кислорода вносят свой вклад в патологический инсульт легких в результате травмы от вдыхания дыма [50].Супероксиддисмутаза (SOD), которая катализирует диссоциацию супероксида на пероксид и кислород, была исследована на предмет ее потенциальной терапевтической пользы после введения при травмах от вдыхания дыма с использованием моделей овец, но с ограниченным успехом [51]. Bone et al. вводили внутривенно SOD овцам в трех различных возрастающих дозах через 1 час после травмы от вдыхания дыма. Они не обнаружили различий в гемодинамике, соотношении PaO 2 / FiO 2 , доставке кислорода или потоке лимфы в легких в группах лечения по сравнению с другими.в контрольной популяции, с единственным значительным изменением, связанным с увеличением потребления кислорода в группе лечения средней дозой через 24 часа после травмы от вдыхания дыма [51]. Дополнительные исследования изучали пользу введения СОД после ингаляционного повреждения; однако они использовали небулайзерную СОД для прямой внутритрахеальной доставки. Maybauer et al. вводили небулайзерную СОД овцам через 1 час и 12 часов после ингаляционного повреждения, но снова не обнаружили статистически значимой разницы в потоке лимфы в легких, соотношении PaO 2 / FiO 2 или отеке легких в группах лечения по сравнению с контролем [52].Хотя распыленная SOD не улучшила оксигенацию легких, газообмен или отек, группы лечения действительно имели значительно более низкие уровни маркеров перекисного окисления липидов и повреждения тканей (конъюгированных диенов) по сравнению с контролем, что свидетельствует об улучшении общего повреждения паренхимы у животных, получавших с СОД, а также с более низкими уровнями утечки из сосудов и потери белка [52]. Эти результаты отличались от более ранних исследований, в которых СОД вводили до ингаляционного ожога [53]; однако в недавних исследованиях использовались более клинически релевантные модели на животных.Считается, что отсутствие терапевтического эффекта является вторичным по отношению к образованию супероксидных радикалов перед введением СОД, что приводит к необратимому повреждению свободными радикалами перед потенциальными полезными эффектами СОД [51, 52].
Понимая, что супероксид реагирует с NO с образованием пероксинитрита, Hamahata et al. вводили W-85, катализатор разложения пероксинитрита, на аналогичную овечью модель ожога и травмы от вдыхания дыма посредством прямой катетеризации бронхиальной артерии. Они обнаружили значительное улучшение оксигенации легких, шунтирования и проницаемости сосудов легких в группах лечения по сравнению с контрольной группой без травм, что является дополнительным подтверждением роли NO в повреждении легких после ожога и травмы от вдыхания дыма и преимуществ терапевтической стратегии, направленной на пероксинитрит. [54].Аналогичным образом Lange et al. вводили INO-4885, катализатор разложения пероксинитрита, овцам после ожогов и травм от вдыхания дыма в течение 24 часов, первоначально в виде болюсной дозы с последующей непрерывной инфузией [55]. Исследование отметило значительное улучшение соотношения PaO 2 / FiO 2 , легочного лимфотока, отека легких и давления в дыхательных путях со значительным снижением провоспалительного цитокина IL-8 [55]. Они также отметили значительное снижение VEGF и PARP, что может означать более низкие уровни клеточного повреждения и окислительного стресса, но не отметили каких-либо преимуществ для выживаемости и не провели специального исследования зависимости от дозы [55].
Ito et al. разработали комбинированную модель травмы с использованием модели овцы отравления от вдыхания дыма и инфекции Pseudomonas aeruginosa , чтобы сосредоточить внимание на эффекте разложения супероксида и ингибирования пероксинитрита на повреждение легких [56]. Они ввели внутривенный болюс с последующей непрерывной инфузией R-100, молекулы, которая доставляет NO, одновременно способствуя каталитическому разложению супероксида и перекиси водорода, в течение 24 часов после ингаляционного повреждения.Группы лечения имели значительно более высокое соотношение PaO 2 / FiO 2 с более низкими потребностями в кислороде, пиковым давлением в дыхательных путях и общим жидкостным балансом при сохранении аналогичной сердечно-легочной гемодинамики по сравнению с контрольной группой [56]. При сравнении этих групп не было значительных различий в гистопатологическом внешнем виде легочной ткани или соотношении влажной и сухой ткани, но в группе лечения наблюдалась тенденция к легочному улучшению [56]. В этом исследовании не было обнаружено никаких данных относительно смертности, уровней нитратов или нитритов или окислительного стресса [56].Энхбаатар и др. описали введение неселективного ингибитора NOS, метилового эфира L-NG-нитроаргинина, который ослаблял негативное влияние на газообмен в легких, но также приводил к повышению среднего артериального и легочного артериального давления, а также к снижению сердечного выброса. [57]. Это открытие направило последующие исследования, в которых основное внимание было уделено специфическому ингибированию синтазы оксида азота для улучшения травмы легких после вдыхания дыма с ожогом или без него.
Селективное ингибирование NOS
В специализированных исследованиях изучались эффекты ингибирования iNOS на модели ожога и ингаляции у овцы.Энхбаатар и др. вводили BBS-2, ингибитор димеризации iNOS, в течение 24 или 48 часов после ожога и ингаляционного повреждения овцам внутривенно [48, 57]. Сначала они провели эту терапию в течение 48 часов и отметили задержку снижения отношения PaO 2 / FiO 2 в группах лечения по сравнению с контрольной группой, что подразумевает задержку легочного повреждения и, как следствие, наблюдаемое ингибирование газообмена. после травмы от вдыхания дыма [57]. Кроме того, в группах лечения наблюдалось значительное улучшение лимфотока в легких, отека легких (измеряемого соотношением влажного и сухого) и давления в дыхательных путях с гистологическим улучшением образования слепков в дыхательных путях [57].В попытке лучше охарактеризовать механизм действия ингибирования iNOS на уменьшение повреждения легких, Энхбаатар позже повторил этот эксперимент, но назначил терапию BBS-2 только в течение 24 часов по сравнению с первоначальными 48 часами. Опять же, они отметили аналогичные улучшения у животных, получавших лечение, а также значительное снижение уровней MPO, PARP и провоспалительного цитокина IL-8 в группах лечения по сравнению с контрольными [48]. Аналогичным образом Pandareesh et al. отметили снижение уровней iNOS после перорального приема Bacopa monniera (BME), природного антиоксиданта и поглотителя свободных радикалов, на крысах с травмами от вдыхания дыма [58, 59].В этом исследовании изучались множественные пути воспалительного поражения, включая активные формы кислорода, перекисное окисление липидов, активность нитрита, активность ацетилхолинэстеразы, активность ГАМК и активность белка теплового шока. В частности, они обнаружили значительное снижение уровней iNOS, которое реагировало на пероральное введение BME дозозависимым образом, что, возможно, способствовало улучшению гистопатологии легких в группах лечения по сравнению с фиктивными и контрольными животными [58]. Подавление iNOS BBS-2 и BME, по-видимому, оказало положительное влияние на повреждение легких после травмы от вдыхания дыма без заметных негативных системных или сердечно-легочных последствий в течение периода исследования [57, 58].Необходимы дальнейшие исследования, чтобы подтвердить эффективность и смертность от этой терапевтической стратегии.
Saunders et al. сосредоточены на терапевтических эффектах селективного ингибирования nNOS на аналогичной модели легочного повреждения у овец. В этом исследовании 7-нитроиндизол (7-NI), специфический ингибитор nNOS, вводили овцам после ожогов и отравлений от вдыхания дыма путем непрерывной внутривенной инфузии в течение 23 часов после травмы. Было отмечено, что общая активность NOS была выше у травмированных животных по сравнению с контрольной группой, а уровни NOS в группах лечения почти вернулись к значениям, аналогичным показателям фиктивных животных [60].Кроме того, другие маркеры повреждения, такие как малоновый диальдегид легочной ткани, IL-8, оценка гистопатологии, давление в дыхательных путях и активность миелопероксидазы (MPO), были значительно ниже в группах лечения, что свидетельствует об улучшении легочного повреждения, которое произошло после ожога и травмы от вдыхания дыма [ 60].
Lange et al. объединили обе эти стратегии лечения в животной модели травмы от вдыхания дыма и сепсиса. Это исследование вызвало травму овец от вдыхания дыма с последующей интратрахеальной установкой P.aeruginosa , затем вводили 7-НИ в течение 1–12 часов после травмы и BBS-2 в течение 12–24 часов после травмы. Этот терапевтический подход был направлен на ингибирование как nNOS (через 7-NI), так и iNOS (через BBS-2). Терапевтические группы показали улучшение соотношения PaO 2 / FiO 2 , давления в дыхательных путях и гистопатологических показателей, но не показали никакого улучшения активности MPO (т. Е. Накопления нейтрофилов в легких), кровотока в трахее или отека легких по сравнению с контрольной группой. [61]. Эта терапевтическая комбинация не оказалась более эффективной, чем введение каждого лечения по отдельности [61].Затем та же группа провела дополнительные исследования с идентичной комбинацией лекарств с использованием модели ожога и вдыхания дыма на овце с последующей постоянной и одновременной инфузией 7-NI и BBS-2 в течение 48 часов после травмы в меньшей дозе по сравнению с к предыдущим экспериментам. В этом сценарии они отметили улучшение соотношения PaO 2 / FiO 2 , легочного шунтирования и давления вентилятора, а также лимфотока в легких и полную профилактику отека легких в группах лечения по сравнению с контролем [62].Заметные ограничения включают различное время инфузии между исследованиями, оптимальную дозировку для большей популяции пациентов и раннее завершение исследования через 24 или 48 часов. Этот короткий терапевтический курс не позволяет оценить долгосрочные системные эффекты и не дает информации об общем улучшении смертности. Этот одновременный терапевтический подход оказался более эффективным, чем отмечалось ранее, но необходимы дальнейшие исследования, чтобы подтвердить пользу различных уровней ингибирования NOS в комбинации или по отдельности.
Сероводород
Введение сероводорода (H 2 S) было исследовано в качестве еще одного потенциального терапевтического средства при травмах от вдыхания дыма из-за его противовоспалительных эффектов. Ранее эти эффекты были продемонстрированы на моделях острого повреждения легких с заметным снижением провоспалительных цитокинов (IL-6, IL-8) и увеличением противовоспалительного цитокина IL-10 в группах лечения [63]. Кроме того, было отмечено, что введение H 2 S ингибирует церебральный пероксинитрит [64] и препятствует инфильтрации лейкоцитов и остром воспалению in vivo [65], а также ингибирует каппа B и последующую экспрессию iNOS in vitro [66].Недавно Han et al. исследовали влияние аэрозольного вдыхаемого H 2 S на iNOS in vivo на крысиной модели травмы от вдыхания дыма и аналогичным образом отметили значительное снижение оксида азота, iNOS и NF-каппа B в группах лечения H 2 S при сравнении курить травмированных крыс, не получавших H 2 S [67].
Esechie et al. исследовали эффекты введения сероводорода на животных моделях сочетанного ожога и травмы от дыма. Первоначально они применили эту терапевтическую стратегию к модели ожога и отравления от вдыхания дыма на мышах, после чего им подкожно вводили сульфид натрия, донор сероводорода.В группах лечения наблюдалось значительное снижение провоспалительного ИЛ-1 бета, повышение уровня противовоспалительного ИЛ-10, ослабление гистопатологического повреждения легочной ткани, а также значительное снижение общей смертности [68]. Затем эту терапевтическую стратегию протестировали на модели овцы с ожогом и вдыханием дыма, после чего сульфид натрия вводили внутривенно болюсной дозой с последующей непрерывной инфузией в течение 24 часов после травмы. Точные уровни H 2 S напрямую не измерялись.Опять же, Esechie et al. отметили улучшение общей смертности в группах лечения, а также значительно увеличенное соотношение PaO 2 / FiO 2 , легочное шунтирование и давление в дыхательных путях по сравнению с контрольной группой, без значительного улучшения инфильтрации нейтрофилов или отека легких [69]. Они также сообщили о значительном снижении экспрессии iNOS, образования пероксинитрита и уровней PARP в группах лечения по сравнению с контролем [69]. Хотя эти данные предполагают ослабление результирующего снижения легочной функции после травмы от вдыхания дыма введением H 2 S, дальнейшие исследования, сфокусированные на дозировке, микрососудистой или системной вазодилатации и долгосрочных эффектах, могут оказаться полезными.Хотя H 2 S был изучен на других моделях воспаления и повреждения легких, точный механизм действия после травмы от вдыхания дыма остается неизвестным и потребует дальнейшего изучения, прежде чем переводить его в клиническую модель.
Ингибирование HMG-CoA редуктазы
Ингибиторы 3-гидрокси-3-метилглутарил-кофермента A (HMG-CoA) редуктазы описывают механизм действия в классе лекарств, известных как статины. Статины наиболее известны своим гиполипидемическим действием и обычно используются у пациентов с кардиогенными заболеваниями.Сообщалось также, что прием этих препаратов приводит к иммуномодулирующим и противовоспалительным эффектам, включая снижение провоспалительных факторов транскрипции и ферментов, молекул адгезии и хемоаттрактантных белков [70, 71]. Основываясь на этих знаниях, Belli et al. вводили пероральные статины крысам после ожогов и отравлений от вдыхания дыма для выявления любого возможного защитного эффекта при поражении легких [72]. Они обнаружили значительное улучшение гистопатологических показателей, инфильтрации лейкоцитов и апоптоза пневмоцитов в группах лечения по сравнению с контрольными группами, но не отметили значительной разницы в уровнях МПО между группами [72].Уровни iNOS были значительно ниже в группах лечения по сравнению с контрольными животными, но не по сравнению с фиктивными животными, а уровни перекисного окисления липидов (измеренные с помощью MDA легких) были значительно ниже в группах лечения по сравнению с контрольными и фиктивными животными [72]. Кроме того, они обнаружили значительно более высокие уровни концентрации глутатиона в группах лечения по сравнению как с фиктивным, так и с контрольным повреждением, что подразумевает защиту от перекисного окисления липидов, окислительного стресса и апоптоза у травмированных мышей, получавших статины [72].Применение этого терапевтического средства может быть ограничено системным действием препарата. Пероральное введение ограничивает легочные специфические преимущества, и дальнейшие исследования по изучению гиполипидемических и системных антиоксидантных эффектов у пациентов с травмами от вдыхания дыма улучшат клиническую переносимость.
Ингибирование протонной помпы
Ингибиторы протонной помпы (ИПП) использовались в желудочно-кишечном тракте для лечения гиперпродукции желудочной кислоты и связанных с ней состояний, но недавно появились исследования, изучающие экстра-желудочно-кишечные эффекты этого класса лекарств из-за ранее отмечалось противовоспалительное и антифиброзное действие, а также угнетение экспрессии iNOS [73, 74].Нельсон и др. исследовали действие эзомепразола PPI на мышей после травмы от вдыхания дыма. Они вводили эзомепразол перорально либо через 2 дня после ингаляционного повреждения (профилактическая группа), либо через 10 дней после травмы (лечебная группа) либо в высокой дозе (300 мг / кг), либо в низкой дозе (30 мг / кг). Интересно, что они обнаружили снижение уровней NO и iNOS у животных, получавших низкие дозы ИПП, а также снижение уровней воспалительного цитокина TNF-альфа в плазме и улучшение гистопатологии и фиброза [73].Хотя это многообещающе, эффекты этого терапевтического средства ограничены пероральным приемом. Дальнейшие исследования могут также рассмотреть возможность изучения потенциальных побочных эффектов и токсичности для органов этого потенциально дозозависимого терапевтического препарата до его клинического применения у пациентов с травмой от вдыхания дыма.
Целевые нанотерапии
Новые методы лечения травм от вдыхания дыма оказались предметом текущих и предстоящих исследований на различных моделях животных. В большинстве рассмотренных выше исследований использовалось системное введение лекарств с одновременным мониторингом их воздействия на легочные повреждения.Терапевтические успехи также были достигнуты в отношении различных легочных патологий, при этом самые последние исследования были сосредоточены на адресной доставке лекарств с помощью наночастиц. Наночастицы могут доставляться пероральным, трансдермальным, аэрозольным или внутрисосудистым путем и нацелены на поражение легких, избегая при этом возможной системной токсичности [75]. В частности, ингаляционная нанотерапия использует аэрозольные наночастицы для доставки терапевтического средства непосредственно к месту повреждения, чтобы максимизировать абсорбцию и простоту введения, избегая системных эффектов или потери лекарства из-за универсального метаболизма [76, 77].Прямая доставка в легкие также обеспечивает большую площадь поверхности для абсорбции лекарства через альвеолярные эпителиальные клетки, а вариации размера конкретных наночастиц могут способствовать их задержке в легочных альвеолах, если это показано [75]. Хотя многообещающие, остающиеся опасения включают потенциальную токсичность для легких, снижение абсорбции поврежденными легкими, возможное удаление с помощью защитных механизмов легких или переменную стабильность лекарственного средства в аэрозольной форме [77]. Исследования изучали эффект ингаляционной нанотерапии при воспалительных заболеваниях [78], легочной гипертензии [79, 80,] инфекции легких [81] и раке легких [82,83,84,85], и потенциальная польза от применения нанотерапевтических препаратов может быть трансформирована к модели травмы от вдыхания дыма для улучшения терапевтической специфичности.Недавно Carvalho et al. вводили карвакрол, природное соединение, восстанавливающее кислород, в легкие после травмы от вдыхания дыма у крыс с использованием твердых липидных наночастиц (SLN) [86]. Они отметили улучшение гистопатологии у животных, получавших карвакрол, по сравнению с контролем. Кроме того, они отметили значительное снижение уровня малонового диальдегида (и, следовательно, снижение уровней окислительного стресса), но наблюдали это изменение как у животных, получавших кислород, так и у животных, получавших карвакрол, по сравнению с животными, подвергшимися только травме от вдыхания дыма.Не было значительных различий в воспалительных клетках в группах лечения по сравнению с контролем [86]. Многочисленные исследования также изучали потенциал доставки лекарственного средства наночастицам, направленным на легкие после внутрисосудистой инъекции, и обнаружили накопление наночастиц в легких, печени и селезенке, хотя уровни оставались относительно низкими по сравнению с другими органами ретикулоэндотелиальной системы [75]. В настоящее время инъекционные наночастицы не тестировались на модели травмы от вдыхания дыма.Конкретная система адресной доставки лекарств, использующая введение наночастиц в сочетании с этими появляющимися терапевтическими средствами, может расширить терапевтический потенциал пациентов с травмой от вдыхания дыма и должна служить в качестве будущего объекта исследования в этом клиническом сценарии.
Лечение астмы и лекарства — GAAPP
Лечение астмы и лекарства
Если у вас астма, ваши дыхательные пути всегда воспаляются. Выстилка дыхательных путей — дыхательные трубки, ведущие в легкие, — опухает, воспаляется и забивается слизью и жидкостью.Мышцы вокруг дыхательных путей могут напрягаться, когда что-то вызывает ваши симптомы. Вдыхаемые аллергены или раздражители, такие как пассивное курение и загрязнение воздуха, действуют как наждачная бумага на необработанные поверхности. Вы начинаете кашлять и хрипеть, пытаясь дышать. Это называется бронхоспазмом. Специальное лечение астмы неизбежно.
Хотя мы не можем вылечить астму, мы можем ее контролировать. Каждый случай астмы индивидуален, поэтому вы и ваш врач должны составить план лечения астмы специально для вас.Это ваша астма; вы должны сказать своему врачу, чего вы хотите достичь. В этом плане будет информация о ваших триггерах астмы и инструкции по приему лекарств.
Что нужно знать о лекарствах от астмы?
Ингаляционные препараты попадают прямо в дыхательные пути с использованием одного из трех типов устройств доставки:
- дозирующий ингалятор (MDI): используйте баллон с аэрозолем под давлением, вставленный в пластиковый мундштук для подачи мелкодисперсного аэрозоля для вдыхания.
- ингалятор сухого порошка (DPI): доставлять лекарство в виде сухого порошка с помощью специального ингалятора; для большинства DPI требуется сильное вдыхание
- : превращает жидкое лекарство в туман, который можно медленно вдыхать; младенцы и дети ясельного возраста всегда должны использовать маску со своим небулайзером
Небулайзер
Лекарства для перорального приема , проглатываемые в виде пилюль, таблеток или жидкостей, попадают в дыхательные пути, циркулируя через кровоток.
Выбор правильных лекарств зависит от многих факторов — вашего возраста, симптомов, триггеров астмы и того, что лучше всего подходит для контроля астмы.
Лекарства от астмы
Существует четыре основных типа лекарств от астмы:
- Бронходилататоры расслабляют и открывают дыхательные пути для облегчения хрипов, кашля, удушья и затрудненного дыхания
- Противовоспалительные средства уменьшают и предотвращают воспаление легких — воспаление присутствует всегда. Тихая часть астмы, которую вы не видите и не слышите
- Комбинированные бронхолитические и противовоспалительные препараты в одном приборе
- Модификаторы лейкотриенов блокируют действие лейкотриенов, медиаторов, участвующих в ответах иммунной системы
- Моноклональные антитела против IgE (Омализумаб) блокируют антитела IgE, вызывающие симптомы аллергии.
Бронходилататоры
- Бронходилататоры быстрого действия (короткого действия) (бета2-агонисты) расслабляют и открывают дыхательные пути и облегчают дыхание в течение нескольких минут. Вы также можете использовать бронходилататоры короткого действия, чтобы предотвратить бронхоспазм, вызванный физической нагрузкой. Для облегчения дыхания при первых признаках симптомов следует использовать быстродействующие бронходилататоры — чем раньше вы примете лекарство, тем меньше вам понадобится.
Доступен широкий спектр бронходилататоров, таких как дозированные ингаляторы (MDI) и ингаляторы сухого порошка (DPI).
- Антихолинергические средства (также называемые антагонистами мускарана) облегчают кашель, выделение мокроты, хрипы и стеснение в груди, связанные с хроническими заболеваниями легких.
Если вам нужно использовать быстродействующие бронходилататоры все чаще и чаще в течение недели, это признак продолжающегося воспаления; необходимы противовоспалительные препараты.
- Бронходилататоры длительного действия (12 часов) расслабляют и открывают дыхательные пути на срок до 12 часов. Эти лекарства рекомендуются только в качестве дополнительной терапии для тех, кто уже принимает противовоспалительные препараты для лечения астмы.Не используйте чаще одного раза в 12 часов.
- Теофиллин выпускается в форме таблеток, капсул, раствора и сиропа. Это лекарство помогает открыть дыхательные пути, расслабляя гладкие мышцы.
Противовоспалительные средства
Противовоспалительные средства лечат воспаление. Противовоспалительные препараты также защищают от повреждающего воздействия воспаления дыхательных путей. После приема противовоспалительного препарата вы не увидите и не почувствуете никаких немедленных изменений. Это связано с тем, что требуется время, чтобы отек дыхательных путей спал, а слизь и лишняя жидкость вышли из дыхательных путей.Эти лекарства обычно необходимо принимать каждый день, чтобы предотвратить возникновение симптомов и приступов.
- Ингаляционные кортикостероиды — наиболее эффективная долгосрочная терапия астмы. Они уменьшают и предотвращают образование жидкости и избытка слизи, а также отека в дыхательных путях. При вдыхании лекарство попадает непосредственно в воспаленные дыхательные пути. Кортикостероиды по-прежнему являются золотым стандартом в терапии астмы. Возможно, вам придется принимать эти лекарства в течение нескольких дней или недель, прежде чем они принесут максимальную пользу.В отличие от оральных кортикостероидов, эти кортикостероидные препараты имеют относительно низкий риск побочных эффектов и, как правило, безопасны для длительного использования. Эти препараты для длительного контроля астмы, обычно принимаемые ежедневно, являются краеугольным камнем лечения астмы.
Пациенты часто прекращают прием ингаляционных кортикостероидов или других лекарств, когда у них отсутствуют симптомы и они чувствуют себя хорошо. Чтобы предотвратить появление симптомов и приступов, ваш ингалятор с кортикостероидами следует принимать регулярно каждый день.
- Пероральные кортикостероиды будут использоваться для лечения обострений астмы или тяжелой астмы. Обычно их назначают только на короткие периоды времени (5-14 дней), чтобы предотвратить нежелательные побочные эффекты.
- Нестероидные противовоспалительные препараты , такие как хромоны, стабилизаторы тучных клеток, помогают уменьшить воспаление и уменьшить реакции аллергических клеток.
- Модификаторы лейкотриенов . Эти пероральные противовоспалительные препараты помогают облегчить симптомы астмы на срок до 24 часов.Он предотвращает отек дыхательных путей при контакте с возбудителем астмы.
Комбинированные ингаляторы: Эти лекарства содержат бета-агонист длительного действия вместе с кортикостероидами и обычно назначаются в качестве ежедневных лекарств. Лекарства длительного действия (кортикостероиды) уменьшают воспаление дыхательных путей, которое приводит к появлению симптомов. Ингаляторы быстрого действия (бронходилататоры) быстро открывают опухшие дыхательные пути, ограничивающие дыхание. Если вам нужны оба этих лекарства, это удобный способ принимать их вместе.
Если у вас обострение астмы, ингалятор быстрого действия может сразу облегчить симптомы. Но если ваша основная ежедневная терапия работает должным образом, вам не нужно слишком часто использовать быстродействующий ингалятор. Записывайте, сколько затяжек вы делаете каждую неделю. Если вам нужно использовать быстродействующий ингалятор чаще, чем рекомендует врач, обратитесь к врачу. Вероятно, вам нужно изменить прием противовоспалительных препаратов.
Лекарства от аллергии
может помочь, если ваша астма спровоцирована или усугублена аллергией.
- Иммунотерапия / Уколы от аллергии . Иммунотерапия постепенно снижает реакцию иммунной системы на определенные аллергены.
- Анти-IgE: Омализумаб (Xolair) . Это лекарство, вводимое в виде инъекций каждые две-четыре недели, специально предназначено для людей, страдающих аллергией и тяжелой астмой. Он предотвращает реакцию на аллергические триггеры. Это достигается путем блокирования антител, вызывающих аллергию.
Прочие
Бронхиальная термопластика
Это очень специфическое лечение может использоваться при тяжелой астме, которая не улучшается при приеме кортикостероидов или других долгосрочных лекарств от астмы.Бронхиальная термопластика нагревает внутренние части дыхательных путей в легких с помощью электрода, сокращая гладкую мускулатуру внутри дыхательных путей. Это ограничивает способность дыхательных путей сжиматься, облегчая дыхание и, возможно, уменьшая приступы астмы.
Лечение по степени серьезности для лучшего контроля: поэтапный подход
Ваше лечение должно быть гибким и основываться на изменениях ваших симптомов, которые следует тщательно оценивать каждый раз, когда вы обращаетесь к врачу. Затем ваш врач может соответствующим образом скорректировать ваше лечение.
Если ваша астма хорошо контролируется, ваш врач может прописать меньше лекарств. Если астма плохо контролируется или ухудшается, врач может увеличить дозу лекарств и порекомендовать более частые посещения.
Уровни контроля астмы
| Хорошо контролируемый ЗЕЛЕНАЯ ЗОНА | Плохо контролируемый ЖЕЛТАЯ ЗОНА | Очень плохо контролируется КРАСНАЯ ЗОНА | |
| Такие симптомы, как кашель, хрипы или одышка | Два дня в неделю или меньше | Более двух дней в неделю | Ежедневно и в течение ночи |
| Ночное пробуждение | Два раза в месяц или реже | Один-три раза в неделю | Четыре раза в неделю или чаще |
| Влияние на повседневную деятельность | Нет | Некоторые ограничения | Чрезвычайно ограниченный |
| Использование быстродействующего ингалятора для контроля симптомов | Два дня в неделю или меньше | Более двух дней в неделю | Несколько раз в день |
| Показания теста легких | Более 80% вашего личного лучшего прогноза | От 60 до 80% вашего личного лучшего прогноза | Менее 60% вашего личного лучшего прогноза |
План действий при астме или план лечения астмы
Попросите своего врача составить вместе с вами план действий при астме, в котором в письменной форме будет указано, когда следует принимать определенные лекарства или когда следует увеличивать или уменьшать дозу лекарств в зависимости от ваших симптомов.Также включите список ваших триггеров и шаги, которые необходимо предпринять, чтобы их избежать.
См. Также всю информацию о чрезмерной зависимости от ингаляторов Blue Reliever.
Влияние ингаляции эвкалиптового масла на боль и воспалительные реакции после полной замены коленного сустава: рандомизированное клиническое испытание
Сообщается, что эвкалиптовое масло эффективно уменьшает боль, отек и воспаление. Это исследование было направлено на изучение влияния вдыхания эвкалиптового масла на боль и воспалительные реакции после операции по замене коленного сустава (TKR).Участники были рандомизированы 1: 1 в группу вмешательства (группа ингаляции эвкалипта) или контрольную группу (группа ингаляции миндального масла). Пациенты вдыхали эвкалиптовое или миндальное масло в течение 30 минут непрерывного пассивного движения (CPM) в течение 3 дней подряд. Боль по визуальной аналоговой шкале (ВАШ), артериальное давление, частота сердечных сокращений, концентрация C-реактивного белка (CRP) и количество лейкоцитов (WBC) измерялись до и после ингаляции. Боль по ВАШ во все три дня () и систолическое () и диастолическое () артериальное давление на второй день были значительно ниже в группе, вдыхавшей эвкалипт, чем в группе, вдыхавшей миндальное масло.Однако частота сердечных сокращений, СРБ и лейкоциты существенно не различались в двух группах. В заключение, вдыхание эвкалиптового масла было эффективным для уменьшения боли и артериального давления у пациента после TKR, предполагая, что вдыхание эвкалиптового масла может быть вмешательством медсестры для облегчения боли после TKR.
1. Введение
Остеоартрит, наиболее распространенное заболевание опорно-двигательного аппарата во всем мире, является распространенным хроническим заболеванием, которое вызывает боль, ограничивает активность и снижает качество жизни [1].Остеоартрит может возникать во всех суставах, но колено является наиболее частой локализацией [2]. Наиболее частые клинические признаки остеоартрита включают боль, скованность, отек и воспаление. Хирургическое вмешательство может быть рассмотрено у пациентов, у которых не наблюдается улучшения симптомов при нехирургическом лечении, особенно когда сильная боль мешает повседневной жизни [3]. Полная замена коленного сустава (TKR) — это хирургическая процедура, при которой деформированный хрящ коленного сустава резецируется и заменяется металлической структурой, заполненной полиэтиленом, что приводит к новой структуре сустава.Было показано, что TKR улучшает качество жизни пациентов с тяжелым артритом, уменьшая боль в коленях и улучшая их функцию [4]. Воспаление, вызванное инфекцией после ТКР, отрицательно сказывается на прогнозе пациента, при глубоком инфицировании требуется повторная операция [5]. Таким образом, контроль воспаления, а также обезболивание необходимы для быстрого восстановления и функциональности. Масло эвкалипта ( Eucalyptus globulus ) широко используется в народной медицине для лечения инфекций верхних дыхательных путей, гастрита и диабета [6].
Эвкалиптовое масло содержит α -пинен и 1,8-цинеол и действует как антиоксидант с сильной активностью улавливания радикалов [7]. На модели вызывающего боль отека стоп на мышах пероральное введение 1,8-цинеола, который составляет 70–90% (мас. / Мас.) Содержимого эвкалиптового масла, подавляло образование отека и уменьшало воспаление и боль [ 8]. Этот эффект 1,8-цинеола обусловлен его ингибированием секреции цитокинов Т-лимфоцитами [9]. Электромиография показала, что применение масла эвкалипта к здоровому человеку оказывает миорелаксирующее действие, а также способствует повышению эмоциональной устойчивости [10].Более того, на крысиной модели восприимчивости к боли от горячей плиты эвкалиптовое масло было не только обезболивающим, но и уменьшало образование отеков и оказывало противовоспалительное действие [11].
Хотя было обнаружено, что эвкалиптовое масло уменьшает боль и подавляет отек и воспаление на животных моделях, его влияние на боль у пациентов, перенесших TKR, не было определено. Поэтому мы оценили, может ли вдыхание эвкалиптового масла эффективно уменьшить боль и воспалительные реакции у пациентов, перенесших TKR.
2. Материалы и методы
2.1. Дизайн исследования и размер выборки
Пациенты были случайным образом распределены с использованием таблицы случайных чисел для вдыхания масла эвкалипта или миндального масла (используемого в качестве растворителя, контроля) во время непрерывного пассивного движения (CPM) после TKR, при этом как исследователи, так и субъекты были не осведомлены о назначении лечения . Основываясь на величине эффекта 0,80, статистической мощности 0,80 и уровне значимости 0,05, минимальное количество пациентов, необходимое для сравнения различий между экспериментальной и контрольной группами, было оценено в 26 пациентов на группу.Изначально в каждую группу были отнесены 28 субъектов, 52 из которых завершили исследование, 25 — в экспериментальной и 27 — в контрольной.
2.2. Участники
К участию были приглашены пациенты, которым был поставлен диагноз остеоартрит одним и тем же врачом и которые перенесли TKR. Всем субъектам (1) были прописаны обезболивающие, включая гидрохлорид оксикодона, фентанил, нестероидные противовоспалительные препараты (NASID) и таблетки с антибиотиками, (2) не было никаких осложнений или других воспалительных заболеваний после операции, (3) не лечились при лечении антидепрессантами, гормонами или ароматерапией (4) не курили, (5) находились в сознании и ориентировались, и (6) имели оценку боли по визуальной аналоговой шкале (ВАШ)> 4 перед вдыханием аромата.Дизайн и протокол исследования были одобрены Комитетом по этике Медицинского центра Корейского университета (код: ED11285), и все участники предоставили письменное информированное согласие.
2.3. Газовая хроматография-масс-спектрометрический анализ
Газовая хроматография-масс-спектрометрия (ГХ-МС) была проведена для анализа составов эвкалиптового масла. ГХ-МС анализ выполняли на газовом хроматографе Agilent 7890 с инертным масс-спектрометром 5975 (США), аналитическую капиллярную колонку проводили на HP-Innowax (60 м × 0.25 мм внутренний диаметр, 0,5 мкм толщина пленки мкм, Agilent, США). Газ-носитель — гелий, скорость потока — 1,0 мл / мин. Температура инжектора была увеличена до 280 ° C. И образцы (1,0 мк л) вводили с соотношением долей 50: 1. Температура колонки первоначально поддерживалась на уровне 50 ° C (выдержка в течение 3 мин), линейное изменение до 240 ° C со скоростью 3 ° C / мин и окончательно выдержал 10 мин. Температура источника ионов и линии передачи была установлена на 230 и 250 ° C. Масс-спектрометр работал в режиме ионизации электронным ударом (70 эВ).
2.4. Intervention
Масло эвкалипта и миндальное масло были поставлены компанией Aromarant Co. Ltd. (Роттинген, Германия). Эвкалиптовое масло растворяли в миндальном масле до концентрации 3% (об. / Об.). В экспериментальной группе масло эвкалипта (растворенное в миндальном масле) помещали на дюймовую марлевую подушечку, которую помещали между носом и желобком на 30 минут CPM в течение 3 дней подряд, начиная с третьего дня после операции. Контрольная группа получала то же лечение, что и экспериментальная группа, за исключением эвкалипта.Масло эвкалипта и миндальное масло имеют схожий цвет и были упакованы в бутылки одинаковой формы. Все эксперименты проводились отдельно. Составитель смеси был единственным, кто знал, какой участник принадлежал к какой группе согласно присвоенному номеру на бутылке. Пациенты и исследователь не были проинформированы о типах и эффектах ароматического масла.
2,5. Оценка результата
Боль измерялась с помощью шкалы боли по ВАШ. Он также используется в большинстве исследований тревожности, состоит из горизонтальной шкалы, варьирующейся от 0 (отсутствие боли) слева и 10 (сильная боль) справа [12].Пациентов просили указывать количество баллов по ВАШ боли при каждом определении. Артериальное давление и частота сердечных сокращений измерялись каждый день масляной ингаляции, до и после CPM, как индикаторы реакции вегетативной нервной системы на боль. Артериальное давление измеряли в плечевой артерии с помощью сфигмоманометра Deluxe Aneroid (Mac-check, Япония) после 10-минутного отдыха в положении лежа. Пульс измеряли на лучевой артерии в течение 1 минуты.
В этом исследовании CRP измеряли с помощью иммуноанализа латекса с LX-2200 (Eiken Inc., Япония), а количество лейкоцитов измеряли полупроводниковой проточной цитометрией с помощью XE-5000 (Sysmex, Inc., Япония).
2.6. Сбор данных
Образцы крови собирали перед завтраком в первый день ингаляции аромата и в дни 4 и 7 для измерения концентраций C-реактивного белка (CRP) и количества лейкоцитов (WBC). Боль ВАШ, артериальное давление и частота сердечных сокращений измерялись до и после каждого 30-минутного сеанса ингаляции.
2.7. Статистический анализ
Все статистические анализы были выполнены с использованием статистического пакета для социальных наук, SPSS 20.0. Демографические и клинические характеристики двух групп сравнивались с использованием тестов t , точных тестов Фишера и критериев хи-квадрат, в зависимости от ситуации. Все данные представлены как частота, проценты и стандартная ошибка среднего (SEM) или стандартное отклонение (SD). Различия в оценках боли по ВАШ до и после ингаляции аромата в каждой группе сравнивались с использованием критерия суммы рангов Уилкоксона и парного теста t , а различия между группами анализировались с использованием тестов Манна-Уитни U и непарных t. -тест.
3. Результаты
3.1. Составы масла эвкалипта
Всего было идентифицировано 31 соединение (Таблица 1). Основными летучими ароматическими соединениями эвкалиптового масла были 1,8-циенол (61,46%), лимонен (13,68%), ρ -цимен (8,55%), γ -терпинен (5,87%) и α — пинен (4,95%).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RT: время удерживания. b КИ: Индексы Коваца. c Рассчитано с площадью пика, полученной с помощью ГХ / МС. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Характеристики участников и тест на гомогенность
Пятьдесят два человека были рандомизированы, 25 из которых принимали эвкалиптовое масло и 27 — миндальное масло (контрольная). Демографические и связанные с заболеванием характеристики были схожими в двух группах, включая тип хирургического вмешательства, продолжительность остеоартрита и лечение пероральными гипотензивными и противодиабетическими средствами (таблица 2).Средний возраст 52 участников составлял 68,2 года (диапазон от 43 до 85 лет), и большинство из них составляли женщины. Их средний индекс массы тела (ИМТ) был равен, и все 52 человека имели избыточный вес / ожирение (ИМТ ≥ 25 кг / м 2 ). Тридцать семь пациентов (71,2%) перенесли одностороннюю TKR и 15 (28,9%) — одновременную двустороннюю TKR. Средняя продолжительность остеоартрита в группах, принимавших эвкалиптовое и миндальное масло, составляла годы и годы соответственно. Перед ингаляцией аромата показатели боли по ВАШ, систолическое артериальное давление, диастолическое артериальное давление, частота сердечных сокращений, количество СРБ и лейкоцитов были одинаковыми в двух группах (таблица 3).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Данные представлены как среднее (стандартное отклонение) или (%). Сокращения: SD: стандартное отклонение, BMI: индекс массы тела. т -тест. Точный тест Фишера. Тест хи-квадрат. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Сокращения: VAS: визуальная аналоговая шкала; sBP: систолическое артериальное давление; дБП: диастолическое артериальное давление; ЧСС: частота сердечных сокращений; CRP: C-реактивный белок; WBC: лейкоциты. Тест суммы рангов Вилкоксона. Данные представлены как медиана ± межквартильный размах. т -тест. Данные представлены как среднее ± стандартное отклонение. | |||||||||||||||||||||||||||||
3.3. Влияние масла эвкалипта на оценку боли по ВАШ
Оценка боли по ВАШ после ароматерапии в дни 1-3 снизилась, и 1 балл, соответственно, по сравнению с баллами до ингаляции (рис. 1 (а)). В контрольной группе, однако, оценка боли по ВАШ в дни 1–3 увеличилась, и, соответственно, по сравнению с оценкой до ингаляции.В целом, оценка боли по ВАШ была значительно ниже в группе, получавшей эвкалиптовое масло, чем в контрольной группе (рис. 1 (а)).
3.4. Влияние эвкалиптового масла на частоту сердечных сокращений и артериальное давление
По сравнению с частотой сердечных сокращений перед лечением частота сердечных сокращений в группе с эвкалиптовым маслом увеличивалась в уд / мин в 1-й день CPM и снижалась в уд / мин и / мин в дни 2 и 3, соответственно (Рисунок 1 (б)). Однако частота сердечных сокращений в контрольной группе увеличивалась после CPM на, и уд / мин в дни 1-3 CPM, соответственно.Межгрупповые различия в частоте сердечных сокращений достоверно не различались.
Систолическое артериальное давление в дни 1–3 снизилось, и, соответственно, в группе, принимавшей эвкалиптовое масло, и увеличилось, и, соответственно, в контрольной группе (рис. 1 (c)). На 2-й день SPB в эвкалиптовом масле был значительно ниже, чем в контрольной группе (рис. 1 (c)). Аналогичным образом, диастолическое артериальное давление в группе, получавшей эвкалиптовое масло, снизилось, и, соответственно, в дни 1-3, и увеличилось, и, соответственно, в контрольной группе в те же дни.Диастолическое артериальное давление на 2-й день было значительно ниже в группе, получавшей эвкалиптовое масло, чем в контрольной группе (рис. 1 (d)).
3.5. Влияние эвкалиптового масла на воспалительные реакции
Концентрации CRP в сыворотке перед ингаляцией и на 4 и 7 дни были, и, соответственно, в группе эвкалиптового масла, и,, и, соответственно, в контрольной группе (Рисунок 2 (a) ). Хотя концентрации CRP в обеих группах имели тенденцию постепенно увеличиваться после операции, а затем уменьшаться, значимых различий между группами не наблюдалось.
Количество лейкоцитов перед ингаляцией и на 4-й и 7-й дни было, и, соответственно, в группе, получавшей эвкалиптовое масло, и,, и, соответственно, в контрольной группе (рис. 2 (b)). Ни одно из этих различий не достигло статистической значимости. 9. Обсуждение. у больных остеоартрозом.
Боль — это эмоция, по сути своей субъективная и личная [13, 14]. Чтобы оценить субъективную боль пациента, мы использовали инструменты измерения ВАШ. Мы обнаружили, что вдыхание масла эвкалипта значительно снизило оценку боли по ВАШ по сравнению с нашей контрольной группой. Основным компонентом эвкалиптового масла является 1,8-цинеол, который оказывает морфиноподобное действие, снимая боль у мышей [8]. Другое исследование также показало, что 1,8-цинеол проявляет антиноцицептивные свойства у крыс и мышей [15]. Эти данные, вместе с нашими результатами, предполагают, что субъективное обезболивающее действие эвкалиптового масла, по крайней мере частично, связано с 1,8-цинеолом.
Считается, что серотонин играет важную роль в контроле боли [16]. Было показано, что активация серотонинового рецептора, присутствующего на С-волокнах, опосредует индуцированные серотонином проноцицептивные эффекты [17]. Недавние исследования показали, что эфирные масла действуют путем модуляции центральной системы нейромедиаторов. Hypericum perforatum считается ингибитором синаптосомного захвата серотонина [15]. Кроме того, лимонное масло обладает антиксиолитическим действием за счет подавления моноаминов дофамина и усиления серотонинергических нейронов [18].Поэтому обезболивающие эффекты эвкалиптового масла в настоящих результатах следует рассматривать как участие серотонинергической системы. Считается, что боль и стресс после TKR и во время CPM действуют на центральную и симпатическую нервную систему, повышая кровяное давление и пульс. В настоящем исследовании группа, получавшая ингаляции с эвкалиптовым маслом, показала статистически значимое снижение артериального давления, предполагая, что эвкалиптовое масло может способствовать расслаблению за счет снижения симпатической активности при одновременном усилении парасимпатической во время CPM после TKR.Возможный путь для этого объяснения может включать обонятельную систему. На вегетативную нервную систему влияют одоранты, поэтому вдыхание эфирного масла оказывает прямое воздействие на вегетативную нервную систему через обонятельную систему [19, 20]. Недавнее исследование показало, что обонятельная стимуляция эфирным маслом лаванды и его активным компонентом, линалоолом, снижает активность симпатических нервов у крыс [21]. Следовательно, масло эвкалипта также может модулировать вегетативные реакции, такие как артериальное давление, через центральную нервную систему и вегетативную нервную систему.Сердечно-сосудистые эффекты 1,8-цинеола также изучались в нескольких исследованиях. 1,8-цинеол снижает артериальное давление в норме и вызывает эндотелий-зависимую вазорелаксацию в аорте [22, 23]. В других сообщениях показано, что введение 1,8-цинеола снижает сократительную активность у крыс [24]. Таким образом, существует вероятность того, что 1,8-цинеол способствует гипотензивному действию эфирного масла эвкалипта.
Эвкалиптовое масло используется для лечения инфекции гриппа из-за его противовоспалительного и антибактериального действия [25].Более того, было обнаружено, что 1,8-цинеол снижает количество цитокинов, вызывающих воспаление у морских свинок [20], и значительно снижает отек и уровень СРБ в очагах воспаления по всему телу [26]. Эти исследования побудили нас предположить, что эвкалиптовое масло уменьшит боль после TKR за счет уменьшения воспалительных реакций. Однако маркеры воспалительных реакций, такие как концентрация CRP и количество лейкоцитов, существенно не различались между нашей группой эвкалиптового масла и контрольной группой, хотя сравнения до и после ингаляции показали, что количество лейкоцитов в эвкалипте, как правило, было ниже, чем в контрольной группе. , что могло быть связано со временем осмотра, концентрацией вдыхаемого эвкалиптового масла и / или частотой его применения.
Таким образом, это исследование, в котором изучалось влияние ингаляций эвкалиптового масла на пациентов, перенесших TKR, показало, что ингаляции эвкалиптового масла были эффективны в снижении субъективной боли пациента и артериального давления после операции. Эти данные свидетельствуют о том, что вдыхание эвкалиптового масла может быть ценным медсестринским вмешательством для облегчения боли после TKR.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Первые два автора (Ян Сук Джун и Пурум Канг) внесли равный вклад в эту работу.

 Поэтому небулайзерная терапия системными гормонами не имеет преимуществ и не рекомендуется.
Поэтому небулайзерная терапия системными гормонами не имеет преимуществ и не рекомендуется.