Клебсиелла пневмония 10 7 — Педиатрия
Здравствуйте! А на каком вы вскармливании? При ГВ ведь стул может быть и с примесью зелени, и слизи ( примеси слизи особено характерны для детей с аллергической настроенностью). Пенистый стул может быть, если ребёнок просто не досасывается до жирного «заднего» молока, а ограничивается только богатым углеводами передним… Впрочем, масса и рост у вас вполне приемлимые для вашего возраста (хотя с учётом данных при рождении прибавки могли бы быть и больше) — так что скорее всего Ваш сынуля высасывает всё молоко ( если, конечно, вы на ГВ).
Я согласна с вашей оценкой антибактериального лечения в вашей ситуации. Но назначать ( или отменять) терапию заочно неверно, неправильно; я же не вижу ребёнка и чего-то могу недооценивать. Может, вам показать малыша хорошему врачу-инфекционисту? Я же без осмотра малыша могу помочь вам только информацией…
В отношении дисбактериоза я высказывала свою позицию неоднократно. Слово «дисбактериоз» означает нарушение нормальной флоры кишечника. Нарушиться ни с того, ни с сего она не может: нужно или заболеть выраженной кишечной инфекцией, или «выбить» всю нормальную флору назначенным по какому-то поводу сильным лекарством вроде антибиотика. Вместе с тем в первые месяцы жизни незрелый ЖКТ ребенка приспосабливается к питанию, совершенствуется и развивается. Это сопровождается закономерными изменениями стула. К дисбактериозу это отношения не имеет.
Нарушиться ни с того, ни с сего она не может: нужно или заболеть выраженной кишечной инфекцией, или «выбить» всю нормальную флору назначенным по какому-то поводу сильным лекарством вроде антибиотика. Вместе с тем в первые месяцы жизни незрелый ЖКТ ребенка приспосабливается к питанию, совершенствуется и развивается. Это сопровождается закономерными изменениями стула. К дисбактериозу это отношения не имеет.
Дисбиоз — это всегда вторичное состояние; у детей оно развивается или после кишечной инфекции, или после лечения антибиотиками или гормонами. Клиническими проявлениями дисбиоза являются запоры или поносы, боли в животе, его вздутие и пр. прелести.Нередко расстройство кишечной флоры сочетается с аллергическими проявлениями — но последние вполне могут существовать и сами по себе.
То, что микробный состав кала немного отличается от общепринятых норм, ещё ни о чём не говорит. Для определения истинной микробной картины такой анализ, как сделали Вы, нужно проводить как минимум 3 раза — и только при однотипных изменениях можно говорить о реальности такой флоры. Микробы, высеянные из какашек в просвете кишечника, быстро меняются. Правильнее было бы исследовать пристеночную флору — но это трудоемкое и неприятное для малышей обследование.
Микробы, высеянные из какашек в просвете кишечника, быстро меняются. Правильнее было бы исследовать пристеночную флору — но это трудоемкое и неприятное для малышей обследование.
Клебсиеллы относятся к условно-патогенной флоре. (можно посмотреть http://www.gastroscan.ru/handbook/118/3171). Сами по себе они не опасны. Правда, у вас их чуть больше, чем положено по нормативу — но это повышение, на мой взгляд, некритично ( правда, оговорюсь — я не инфекционист). Я бы советовала вам попробовать такой сбор.
СБОР ДЛЯ ЛЕЧЕНИЯ ДИСБАКТЕРИОЗА
(Авторы – Косов В.А., Ермолин С.И. и др., Центральный клинический военный санаторий «Архангельское»;
был опубликован в «Военно-медицинском журнале» №9, 1996 г., стр. 53-56)
Валериана лекарственная, корень – 2 части
Ромашка аптечная, цветы – 2 части
Мята перечная, лист – 1 часть
Малина обыкновенная, плоды – 2 части
Все компоненты смешать в указанных пропорциях. Авторы рекомендовали дозировать сбор КАПЛЯМИ, но он настолько приятен и полезен, что дети охотно пьют его в больших дозах. 1 столовую ложку смеси заварить 1 стаканом кипятка в термосе, настаивать 2-6 часов ( или ночь). Курс лечения – 1 месяц.
1 столовую ложку смеси заварить 1 стаканом кипятка в термосе, настаивать 2-6 часов ( или ночь). Курс лечения – 1 месяц.
Всегда немного опасаюсь назначать малину малышам — у них часты аллергические реакции на краситель, придающий фруктам и ягодам красный цвет. Для аллергиков даже советую этот компонент сбора исключить; и без него сбор прекрасно «работает». Назначала его не раз. Попробуйте — может, и вам поможет. Удачи!
Чем опасна клебсиелла для грудничка: симптомы и лечение инфекции
23 ноября 2018 14:00
Антонина Галич, педиатр, семейный врач
Клебсиелла относится к условно-патогенным бактериям и именно ее зачастую считают «виновницей» развития дисбактериоза у малышей. Она действительно очень устойчива к окружающей среде, может сохраняться долгое время, как на предметах, так и на теле человека и погибает лишь спустя 30 минут при температуре 65 градусов. Что делать, чтобы помочь малышу справиться с инфекцией?
Что делать, чтобы помочь малышу справиться с инфекцией?
Читайте такжеГрудничковый массаж: основные принципы и правила
В наши дни все чаще у грудничков встречаются инфекционные заболевания, вызываемые патогенными микроорганизмами. Одними из них являются палочки Фридлендера, провоцирующие появление клебсиеллы. Несмотря на то, что эти палочки считаются достаточно безобидными и могут находиться повсюду, стремительное увеличение их количества имеет самые неожиданные последствия. В чем же причины их размножения клебсиеллы, какие симптомы можно наблюдать при данном заболевании и есть ли необходимость в его лечении, рассмотрим подробнее в данной статье.
Практически каждый родитель боится в результатах анализов на дисбактериоз увидеть это страшное слово – «клебсиелла». Однако данную бактерию можно встретить практически у всех, так как она является одной из множества бактерий, живущих в организме человека, никак себя не проявляя. Но такое «затишье» длится лишь до тех пор, пока в организме сохраняется оптимальная микрофлора. Если же количество «хороших» бактерий по каким-то причинам резко уменьшается, то патогенные бактерии, к которым относится клебсиелла, становится опасными.
Если же количество «хороших» бактерий по каким-то причинам резко уменьшается, то патогенные бактерии, к которым относится клебсиелла, становится опасными.
Активизироваться клебсиелла начинает не спонтанно. На это ее могут спровоцировать несколько причин:
- Ослабление иммунитета
- Несоблюдение гигиенических условий
- Неочищенная вода и продукты питания
- Контакт с носителем инфекции
Важно помнить, что в основном патогенные микроорганизмы проникают в ткани новорожденного через мать в процессе родов или после них. Но так же существуют и другие штаммы, проникающие в организм крохи через пыль, еду, воду и шерсть животных.
Интересно, что по данным исследований ВОЗ, клебсиелла является потенциальным кандидатом на роль супербактерий, то есть бактерий, устойчивых к антибиотикам. А это значит, что они представляют собой угрозу для существования людей как вида в целом.
Для формирования супербактерий достаточно двух причин
Не до конца вылеченные инфекции. Зачастую после начала приема антибиотиков, пациенту становится значительно легче и он преждевременно прекращает прием назначенных медикаментов или же врач просчитывается с назначаемым курсом лечения, что так же может повлиять на развитие супербактерий.
Зачастую после начала приема антибиотиков, пациенту становится значительно легче и он преждевременно прекращает прием назначенных медикаментов или же врач просчитывается с назначаемым курсом лечения, что так же может повлиять на развитие супербактерий.
Читайте такжеНасморк у грудного ребенка: причины появления и правильное лечение
Использование антибиотиков в большом количестве. Организм человека со многими инфекциями, включая и кишечные сбои, способен справиться самостоятельно. А злоупотребление антибиотиками крайне негативно сказывается на организме человека, так как применение таких сильных медикаментов приводит к тому, что бактерии адаптируются к ним, а значит, перестают на них реагировать.
Так как клебсиелла считается одной из самых распространенных больничных инфекций, она автоматически становится очень опасной, так как в больницах систематически применяются антибиотики. Это чревато тем, что в любой больнице может сформироваться очень устойчивый штамм, а пациенты этой клиники автоматически станут носителями данной супербактерии.
Чаще всего клебсиелла поражает кишечник новорожденного и больше этому подвержены ослабленные и недоношенные малыши. У грудничков клебсиеллез практически всегда протекает достаточно в тяжелой форме. Опасность данного заболевания состоит в том, что ее симптоматику очень легко перепутать с другими воспалительными процессами желудочно-кишечного тракта, такими как:
- повышение температуры тела до 37-39 градусов
- частое срыгивание или рвота, иногда это достигает 6-8 раз в сутки
- очень частый и обильный жидкий стул до 20 раз в сутки
- может присутствовать примесь крови в кале новорожденного
- присутствует сероватый оттенок кожных покровов младенца
- болезненность в области живота, вследствие чего малыш становится капризным
- присутствует вялость и заторможенность
- отсутствует аппетит
Инфекции, вызванные клебсиеллой, длятся дольше остальных кишечных инфекций, чем и отличаются от других подобных заболеваний. В связи с сильным обезвоживанием организма грудничка возникает угроза его жизни! Именно поэтому не стоит заниматься самолечением и при любой кишечной инфекции необходимо своевременно проконсультироваться с лечащим врачом.
В связи с сильным обезвоживанием организма грудничка возникает угроза его жизни! Именно поэтому не стоит заниматься самолечением и при любой кишечной инфекции необходимо своевременно проконсультироваться с лечащим врачом.
Читайте такжеВиды аллергических реакций: как защитить ребенка от аллергии
Клебсиеллу возможно обнаружить лишь с помощью лабораторных исследований. Для этого у пациента берут часть каловых или рвотных масс, мазки из носа, анализ крови, в котором могут произойти некоторые изменения.
Анализ кала на дисбактериоз может быть непоказательным, поэтому в странах с хорошо развитой медициной данный анализ считается бесполезным и не применяется в таких случаях.
Причины, при которых необходимо лечить клебсиеллез:
- превышенное количество бактерии в кале
- угнетенное самочувствие ребенка
Если же у ребенка наблюдается хороший аппетит, и он не теряет вес, а набирает его по норме, то лечить клебсиеллез нет необходимости.
В чем заключается лечение клебсиеллеза?
Применение лечения с помощью антибиотиков при таком заболевании как клебсиеллез применяется крайне редко, только лишь в тяжелых случаях. Основная методика лечения при более легкой форме заболевания заключается в гидратации, то есть в восполнении жидкости в организме. Зачастую родители не могут справиться с данной проблемой, поэтому им предлагается госпитализация в клинику.
Существует несколько рекомендаций для профилактики клебсиеллеза:
- кормить ребенка необходимо только тогда, когда он голоден, так как печень играет немаловажную роль в поддержании иммунной системы человека, а значит, она не должна быть перегружена
- в рацион маленького ребенка или его мамы (при грудном вскармливании) обязательно должно входить большое количество овощей, фруктов, зелени и круп
- использовать антибиотики в самых крайних случаях, только тогда, когда без них действительно невозможно обойтись.

симптомы и лечение klebsiella pneumoniae в кишечнике
Нередким явлением для маленького малыша является появление коликов в животе, кишечное расстройство. У новорожденного сразу же нарушается сон, он становится беспокойным. Иногда причиной этого недуга бывает клебсиелла, в кале у ребенка ее легко обнаружить при проведении анализа.
Попадая к ребенку, бактерия вызывает дисбактериоз, кишечные расстройства, вздутие, также может вызывать пневмонию. Если во взрослом организме здорового человека эта палочка может не вызывать развития воспалений, то у маленького малыша может вызвать необратимые последствия, особенно при запоздалом лечении.
Диагностика этой болезни затрудняется, по причине схожести симптомов с другими патологиями желудочно-кишечного тракта.
Содержание статьи
Клебсиелла: чем она опасна для детского здоровья
Это заболевание относится к группе патогенных микроорганизмов, которые при нормальном состоянии могут обитать в кишечнике человека, а при ослаблении организма развиваться.
Всего существует 7 разновидностей заболевания, но чаще всего встречается 2 типа:
У грудничков возбудителем заболевания чаще всего выступает klebsiella pneumoniae, в кале у ребенка обнаруживает при обследовании.
Представляется опасность потому, что помимо кишечника бактерии могут проникнуть в мозговую оболочку, кости, мочевыделительную систему, кровь, что создаст угрозу для жизни малыша. Таким образом, может развиться сепсис.
При здоровом организме малыша также могут обнаружить эти бактерии, при этом состояние его не будет ухудшаться.
Проникновение из окружающей среды, происходит следующими путями:
- загрязненные руки;
- через питье неочищенной воды;
- от зараженного молока;
- при неправильной обработке сосков перед кормлением;
- воздушным путем;
- из почвы, пыли;
- через невымытые овощи и фрукты.
У детей нередко бывают ослаблены иммунные функции организма, что способствует развитию воспалительных процессов, после чего клебсиелла в кишечнике у ребенка начинает активизироваться.
На первые месяцы жизни появление патологий связывают со следующими причинами:
- Слабо развитая иммунная система;
- Отсутствие необходимого количества микрофлоры на коже, в кишечнике, дыхательных путях.
Для развития бактерий, наиболее благоприятны такие условия:
- аллергические реакции;
- патологии ЖКТ;
- ослабленный организм, при недостатке витаминов;
- долгое и бесконтрольное лечение антибиотиками.
Если приходилось часто проводить лечение с помощью антибиотиков, это лишь затруднит лечение заболевание. Все потому, что чувствительность бактерий ко многим видам лекарственных средств значительно снижается.
Как развивается заболевание в кишечнике
Клебсиелла имеет вид палочки, довольно внушительного размера. Она не подвижна, снаружи защищена специальной капсулой, с мощью которой имеет высокую устойчивость к высоким и низким температурам.
Бактерия не погибает даже при охлаждении и не все антибиотики способны ее разрушать.
Как показали исследования, при кипячении бактерия теряет свою жизнеспособность.
Попадая в кишечник малыша, может не проявлять какого-либо развития, но в самый неблагоприятный момент, при снижении защитных функций организма будет происходить стремительное развитие.
Найденная клебсиелла пневмония в кале у ребенка это повод для беспокойства и дальнейшего обследования всех органов ЖКТ. При попадании в толстый кишечник может представлять серьезную угрозу для здоровья малыша, особенно на первые месяцы после рождения.
Симптоматика у ребенка
Многие родители путают это заболевание с дисбактериозом, которому подвержены практически все дети в первые недели после рождения.
Когда присутствует клебсиелла в кишечнике, симптомы у детей на первых месяцах жизни проявляются следующим образом:
- вздутие живота и газообразование;
- срыгивания после еды;
- колики;
- понос с примесями слизи, а иногда и кровяными сгустками;
- повышение температуры тела;
- лихорадочные приступы;
- болевые ощущения в животе.

Определить дисбактериоз это или клебсиелла можно только после проведения анализа. Чаще всего, когда обнаруживается клебсиелла в кале у ребенка, симптомы будут означать, что происходит развитие болезни.
При тяжелом течении недуга у ребенка может наступить обезвоживание, рвота повторяется несколько раз за день. Наблюдают следующие симптомы:
- сниженный аппетит;
- упадок жизненных сил.
Клебсиелла пневмония вызывает у ребенка резкое повышение температуры тела, иногда даже выше 39°С.
У больного появляется кашель с выделением мокроты, которая имеют неприятный запах и может содержать кровяные сгустки. Определяется клебсиелла пневмония в кале у ребенка, после проведения анализа.
Рентгеновский снимок позволяет более точно поставить диагноз. Таким образом, врач определяет все очаги поражения. Болезнь чаще всего сопровождается и другими респираторными заболеваниями.
Иногда кишечная инфекция протекает совместно с пневмонией. Тогда у ребенка могут возникнуть такие симптомы:
Тогда у ребенка могут возникнуть такие симптомы:
- частые судороги;
- энтероколит;
- ацидоз.
При своевременной помощи можно излечить этот недуг. Однако часто родители прибегают к медицинской помощи, когда заболевание переходит в затяжную форму.
У ребенка могут наблюдаться следующие осложнения:
- инфекции в кишечнике;
- менингит;
- гайморит;
- конъюнктивит.
У новорожденных малышей заболевание начинает развиваться на кожных покровах головы, особенно при наличии родовых травм от щипцов.
Могут возникать поражения конечностей и суставов, обычно это проявляется припухлостью на месте поражения. Ребенок при пеленании начинает беспокойно себя вести, при этом температура тела не всегда превышает норму.
Лечение для детей
Если заболевание протекает легко, грудничкам назначают лекарственные препараты бактериологического типа. К ним относятся:
- Бактериофаги;
- Пребиотики.

Таким образом, восстанавливается микрофлора кишечника у малыша. Однако при затяжном течении болезни, этим методом не обойтись, тогда назначают антибиотики.
Однако весь период лечения малыш находится под тщательным надзором специалистов.
Кроме того, пациенту назначают курс витаминов для повышения иммунных функций. Именно поэтому когда проявляется клебсиелла в кале у ребенка, лечение должно быть проведено быстро.
Заключение
Чтобы избежать развития этого заболевания необходимо тщательно следить за личной гигиеной малыша. При грудном вскармливании предварительно обрабатывать соски.
Если была обнаружена клебсиелла в кишечнике у ребенка, лечение не должно затягиваться. Тогда можно справиться с недугом без каких-либо последствий для малыша.
Вконтакте
Google+
Одноклассники
Нашей девочке 4,5 месяца.
 Мы полностью на ГВ. За все это время стул ребенка нестабилен: в основном жидкий с непереваренными комочками, иногда просто водой, очень часто сплошная слизистая тягучая масса зеленого цвета. Кроме того, что всегда после кормления долго остается надутая, как шарик, и мучается пуками, но без капризов- нас ничего не беспокоит. Решили сдать анализ на дисбактериоз. У мамы в молоке в одной груди обнаружили Стафилококк epidermikus c не очень мне понятной припиской «немассивная обсемененная». Кал ребенка, картина такая: Патогенной флоры — не обнаружено. E.coli с нормальной ферментной активностью – 15*10 в 10 E.coli со сниженной ферментной активностью – 0 E.coli гемолитические- 0 Золотистый стафилококк- 4* 10 во 2 Бифидо
Мы полностью на ГВ. За все это время стул ребенка нестабилен: в основном жидкий с непереваренными комочками, иногда просто водой, очень часто сплошная слизистая тягучая масса зеленого цвета. Кроме того, что всегда после кормления долго остается надутая, как шарик, и мучается пуками, но без капризов- нас ничего не беспокоит. Решили сдать анализ на дисбактериоз. У мамы в молоке в одной груди обнаружили Стафилококк epidermikus c не очень мне понятной припиской «немассивная обсемененная». Кал ребенка, картина такая: Патогенной флоры — не обнаружено. E.coli с нормальной ферментной активностью – 15*10 в 10 E.coli со сниженной ферментной активностью – 0 E.coli гемолитические- 0 Золотистый стафилококк- 4* 10 во 2 Бифидо
13 Дек Нашей девочке 4,5 месяца. Мы полностью на ГВ. За все это время стул ребенка нестабилен: в основном жидкий с непереваренными комочками, иногда просто водой, очень часто сплошная слизистая тягучая масса зеленого цвета. Кроме того, что всегда после кормления долго остается надутая, как шарик, и мучается пуками, но без капризов- нас ничего не беспокоит.
 Решили сдать анализ на дисбактериоз. У мамы в молоке в одной груди обнаружили Стафилококк epidermikus c не очень мне понятной припиской «немассивная обсемененная». Кал ребенка, картина такая: Патогенной флоры – не обнаружено. E.coli с нормальной ферментной активностью – 15*10 в 10 E.coli со сниженной ферментной активностью – 0 E.coli гемолитические- 0 Золотистый стафилококк- 4* 10 во 2 Бифидо- 10в 9 Лакто – 10 в 8 Клебсиелла – 3* 10 в7. Нужно ли лечиться маме и как лечить ребенка, не прибегая к антибиотикам, по более щадящей , но надежной схеме. Нужно ли вообще лечить ребенка с такими анализами и беспокойным стулом? Будем очень благодарны за консультацию
Решили сдать анализ на дисбактериоз. У мамы в молоке в одной груди обнаружили Стафилококк epidermikus c не очень мне понятной припиской «немассивная обсемененная». Кал ребенка, картина такая: Патогенной флоры – не обнаружено. E.coli с нормальной ферментной активностью – 15*10 в 10 E.coli со сниженной ферментной активностью – 0 E.coli гемолитические- 0 Золотистый стафилококк- 4* 10 во 2 Бифидо- 10в 9 Лакто – 10 в 8 Клебсиелла – 3* 10 в7. Нужно ли лечиться маме и как лечить ребенка, не прибегая к антибиотикам, по более щадящей , но надежной схеме. Нужно ли вообще лечить ребенка с такими анализами и беспокойным стулом? Будем очень благодарны за консультацию
Posted at 14:24h
in вопрос-ответ
by admin
У Вашего ребёнка дисбиоз кишечника, аэробно-анаэробный, декомпенсированный. Лечение требуют два микроба:
– Стафилококк золотистый ( Staphylococcus aureus) — факультативный и наиболее частый возбудитель стафилококкоза, частый представитель микрофлоры носа и кожи
Стафилококк золотистый способен вызывать целую вереницу болезней, от минорных заболеваний кожи, таких как прыщи, папулы, пиодермия, фурункулы, целлюлит, гиподермит, жировая гранулема, карбункулы и т. д.Под его влияние попадают многие органы: кожа, мягкие ткани, кости, суставы; вызывает инфекции в ранах. Как и прежде относится к числу пяти наиболее частых причин нозокомиальных (больничных) инфекций, часто является причиной постоперационных ран (нагноений).
д.Под его влияние попадают многие органы: кожа, мягкие ткани, кости, суставы; вызывает инфекции в ранах. Как и прежде относится к числу пяти наиболее частых причин нозокомиальных (больничных) инфекций, часто является причиной постоперационных ран (нагноений).
– Клебсиелла ( Klebsiella) — условно-патогенная бактерия.
Представители рода встречаются в фекалиях человека, на коже и слизистых дыхательных путей, в почве, воде, фруктах и овощах. Благодаря капсуле устойчивы в окружающей среде. Бактерии этого рода Вызывают пневмонию, урогенитальные инфекции, в том числе у новорожденных, у ослабленных и пожилых лиц, конъюнктивиты, менингиты, сепсис, острые кишечные инфекции. Klebsiella pneumoniae subsp. ozaenae и Klebsiella pneumoniae subsp. rhinoscleromatis вызывают соответственно озену и риносклерому (гранулематозное поражение слизистой оболочки верхних дыхательных путей).
Для лечения дисбиоза кишечника Вам необходимо обратиться к педиатру по месту жительства или вызвать врача из «Доброго Доктора» по телефону 8029-333-88-77 ежедневно с 9. 00 до 19.00.
00 до 19.00.
Эпидермальный стафилококк, который был обнаружен у мамы, в лечении не нуждается.
Пробиотики Нормофлорины – лечение дисбактериоза
Назад к списку
29.03.2012
Загрузка…
В современном мире наблюдается рост инфекционных заболеваний, вызванных различными условно-патогенными микроорганизмами, в частности, бактериями рода Клебсиелла (лат. Klebsiella). Это палочковидный микроорганизм семейства энтеробактерий. В роде клебсиелл выделяют четыре вида. Чаще всего встречается палочка Фридлендера, вызывающая воспаление легких и Klebsiella oxytoca – поражающая желудочно-кишечный тракт – толстый кишечник.
Клебсиелла живет в организме совершенно здоровых людей, являясь одним из элементов нормальной флоры кишечника. В норме klebsiella может присутствовать на коже, на слизистой оболочке дыхательных путей человека и животных. Бактерия может существовать в почве, воде, пище, пыли. Она является одной из самых распространённых внутрибольничных инфекций. Клебсиелла попадает в желудочно-кишечный тракт с плохо вымытых рук, овощей и фруктов, с водой, с почвой. Когда клебсиелла находится в организме, она имеет палочкообразную форму, но, попав в окружающую среду, начинает видоизменяться – она округляется и покрывается специальной оболочкой – капсулой! Благодаря этому приспособлению, Клебсиеллы весьма устойчивы к действию факторов окружающей среды и высоким температурам.
В норме klebsiella может присутствовать на коже, на слизистой оболочке дыхательных путей человека и животных. Бактерия может существовать в почве, воде, пище, пыли. Она является одной из самых распространённых внутрибольничных инфекций. Клебсиелла попадает в желудочно-кишечный тракт с плохо вымытых рук, овощей и фруктов, с водой, с почвой. Когда клебсиелла находится в организме, она имеет палочкообразную форму, но, попав в окружающую среду, начинает видоизменяться – она округляется и покрывается специальной оболочкой – капсулой! Благодаря этому приспособлению, Клебсиеллы весьма устойчивы к действию факторов окружающей среды и высоким температурам.
В случаях ослабления собственных факторов защиты – иммунитета, клебсиелла активно размножается в тканях и вызывает эндотоксемию, воспалительный процесс в органах. Особенно часто встречаются заболевания, вызванные клебсиеллой, у грудничков. Это связано с особенностью иммунитета малышей и недостаточностью при рождении нормальных микроорганизмов в кишечнике, дыхательных путях, на коже. Симптомы клебсиеллы у грудничка схожи с симптомами дисбактериоза. Поэтому, при любом расстройстве стула, нужно обязательно сдать кал ребёнка на анализ, чтобы точно выявить, какие именно бактерии вызвали изменение состояния ребёнка. У грудничка Клебсиелла может вызывать симптомы инфекционного заболевания, протекающего в лёгкой форме, а может, в зависимости от силы иммунитета, приводить к тяжёлому течению: с повышением температуры, ознобом, лихорадкой, болями в животе, диареей и сильным обезвоживанием организма. При появлении таких симптомов необходимо обратиться к врачу, а также сдать кал малыша на исследования. Если в анализе была выявлена клебсиелла, но заболевание малыша протекает в лёгкой форме, то лечение проводят пробиотиками, синбиотиками – Нормофлоринами. Большую роль в восстановлении иммунитета и нормальной микрофлоры у малыша играет грудное вскармливание. При высокой обсеменённости клебсиеллой и тяжёлой форме заболевания назначают сложную терапию с применением антибиотиков.
Симптомы клебсиеллы у грудничка схожи с симптомами дисбактериоза. Поэтому, при любом расстройстве стула, нужно обязательно сдать кал ребёнка на анализ, чтобы точно выявить, какие именно бактерии вызвали изменение состояния ребёнка. У грудничка Клебсиелла может вызывать симптомы инфекционного заболевания, протекающего в лёгкой форме, а может, в зависимости от силы иммунитета, приводить к тяжёлому течению: с повышением температуры, ознобом, лихорадкой, болями в животе, диареей и сильным обезвоживанием организма. При появлении таких симптомов необходимо обратиться к врачу, а также сдать кал малыша на исследования. Если в анализе была выявлена клебсиелла, но заболевание малыша протекает в лёгкой форме, то лечение проводят пробиотиками, синбиотиками – Нормофлоринами. Большую роль в восстановлении иммунитета и нормальной микрофлоры у малыша играет грудное вскармливание. При высокой обсеменённости клебсиеллой и тяжёлой форме заболевания назначают сложную терапию с применением антибиотиков.![]() В ряде случаев у грудничка обнаруживается повышенное содержание клебсиеллы в кале, но при этом он чувствует себя нормально. Тогда препараты с лакто- и бифидобактериями – биокомплексы Нормофлорины назначают для вытеснения излишнего количества клебсиеллы, повышения иммунитета и улучшения собственной полезной микрофлоры.
В ряде случаев у грудничка обнаруживается повышенное содержание клебсиеллы в кале, но при этом он чувствует себя нормально. Тогда препараты с лакто- и бифидобактериями – биокомплексы Нормофлорины назначают для вытеснения излишнего количества клебсиеллы, повышения иммунитета и улучшения собственной полезной микрофлоры.
Кроме того, под действием клебсиеллы могут развиваться такие тяжелые заболевания, как пневмония, воспалительные заболевания мочевыводящих путей, менингит, конъюнктивит, или более редкие болезни – озена (зловонный насморк), риносклерома. Симптомы и признаки инфекций, вызываемых клебсиеллами, в частности инфекций мочеполовой системы, желчных путей и и других органов ЖКТ, сходны с симптоматикой инфекций, обусловленных кишечной палочкой. Кишечные заболевания, ассоциированные с клебсиеллой, часто вызываются смешанной флорой. Клебсиеллы являются родственниками бактерий рода Serratia и рода Enterobacter и их трудно, но можно дифференцировать только с помощью специальных проб. А делать это необходимо, потому что, Klebsiella, Serratia и Enterobacter обладают различной чувствительностью к противомикробным препаратам. Комплексное лечение заболеваний, вызванных клебсиеллой, зависит от локализации и выраженности патологического процесса. Антибиотики назначают в тяжелых случаях по чувствительности, при легком течении или обнаружении в анализах не применяют. Обязательно в лечении используют препараты, восстанавливающие кишечную микрофлору, ведь только в организме с нормальной здоровой микрофлорой не сможет активизироваться и развиться патогенная флора!
А делать это необходимо, потому что, Klebsiella, Serratia и Enterobacter обладают различной чувствительностью к противомикробным препаратам. Комплексное лечение заболеваний, вызванных клебсиеллой, зависит от локализации и выраженности патологического процесса. Антибиотики назначают в тяжелых случаях по чувствительности, при легком течении или обнаружении в анализах не применяют. Обязательно в лечении используют препараты, восстанавливающие кишечную микрофлору, ведь только в организме с нормальной здоровой микрофлорой не сможет активизироваться и развиться патогенная флора!
Как правило, антимикробную терапию рекомендуют начинать еще до получения результатов посева и определения лекарственной чувствительности к антибиотикам. В этом случае незаменимы пробиотики – биокомплексы Нормофлорины, содержащие продукты жизнедеятельности живых лакто- и бифидобактерий с активным антисептическим, противовоспалительным действием, оказывает лечебный эффект при клебсиеллёзах, что доказано многолетней практикой и научными исследованиями, которые показали максимальную эффективность Нормофлоринов (Л и Б) в сравнении с другими бифидо- и лактосодержащими препаратами.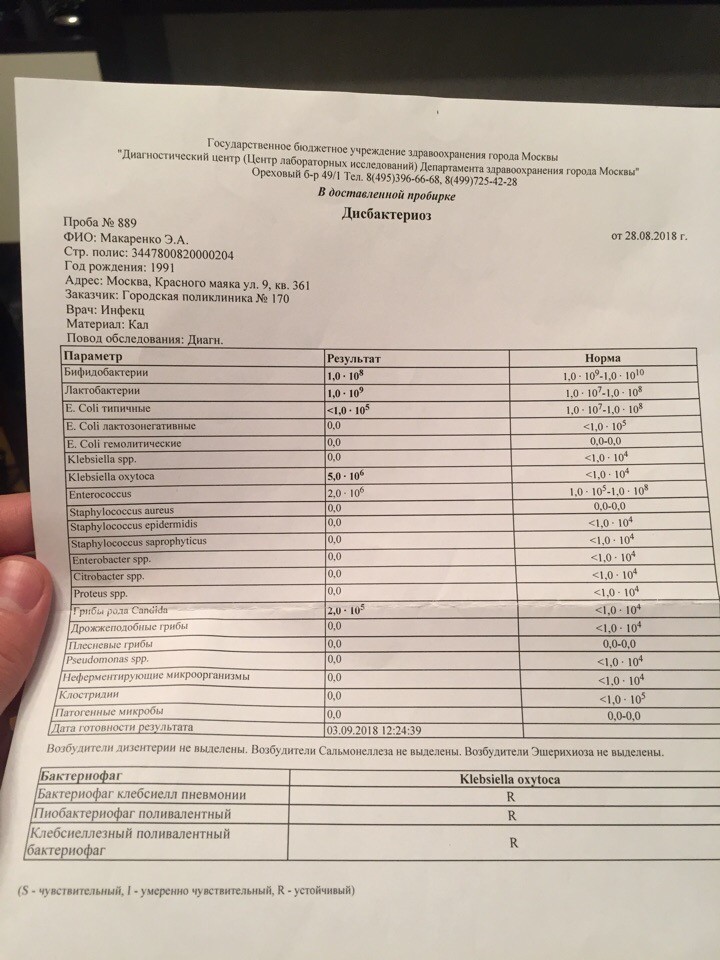
Читайте также:
Симптомы клебсиеллёза
Назад к списку
Клебсиелла пневмония в кале у грудничка и моче: что это такое, лечение и рекомендации Комаровского для ребенка
При подозрении на пневмонию, кишечную инфекцию или дисбактериоз родители иногда слышат от врачей загадочное слово клебсиеллы.
Их называют виновниками многих серьезных проблем грудничков и одним из основных врагов недоношенных малышей на первом этапе выхаживания.
Что же это за противник и как с ним бороться, мы разберем в сегодняшней статье.
Что такое клебсиелла?
Клебсиеллами называется группа специфических грамотрицательных энтеробактерий, названных по имени первооткрывателя Клебса. Представляют собой неподвижные палочки с одиночным, парным или цепочкообразным расположением. Устойчивы к окружающей среде и большинству существующих антибиотиков.
Устойчивы к окружающей среде и большинству существующих антибиотиков.
Место обитания – кожа, слизистые, кал, моча грудничка, вода, почва, плодоовощная продукция.
Различают следующие часто встречающиеся разновидности:
- Klebsiella pneumoniae или палочка Фридлендера (самый частый виновник госпитальных пневмоний),
- Klebsiella oxytoca (поражает кишечник человека),
- Klebsiella rhinoscleromatis (провоцирует воспаление носоглотки, одна из причин риносклеромы),
- Klebsiella ozaenae (провоцирует хроническую форму воспаления слизистой оболочки носоглотки и ее атрофию),
- Klebsiella terrigena,
- Klebsiella granulomatis (причина паховой гранулемы – донованоза),
- Klebsiella planticola.
Палочки клебсиеллы вызывают самые различные поражения органов человека. У детей инфицирование клебсиеллами чаще всего вызывает:
- поражения легких (пневмонии, в том числе госпитальные),
- инфекции мозга (менингиты),
- воспалительные процессы ЛОР-органов (затяжные риниты, гаймориты),
- острые и затяжные кишечные инфекции,
- конъюнктивиты.

Подробнее о палочке Фридлендера
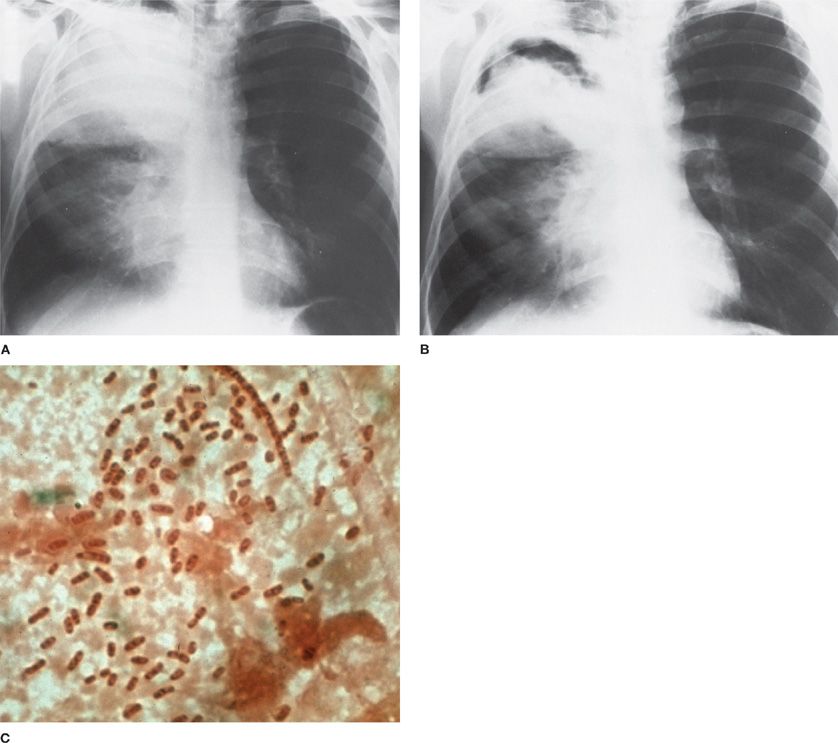
Клебсиелла пневмония (или палочка Фридлендера) – это группа бактерий, устойчивых как к высоким температурам, так и ко многим антибактериальным препаратам.
Причина этой устойчивости – образование толстой и прочной защитной капсулы, позволяющей бактерии выживать в экстремальных для нее условиях. Основной виновник госпитальных пневмоний у новорожденных и грудничков. Способна атаковать не только дыхательные органы, но и другие системы органов (кишечник, мочевыделительную систему).
Клебсиеллезная пневмония вызывается несколькими подвидами палочки Фридлендера. Носителями этой клебсиеллы могут быть многие здоровые люди, но в случае ослабления иммунитета начинает развиваться заболевание. Активизация палочки сопровождается продуцированием большого количества токсинов.
Пневмония Фридлендера начинается остро, с температурой 39°С и выше, симптомами интоксикации, кровянистыми примесями в мокроте, стремительным (в большинстве случаев) развитием осложнений. Симптоматика у грудных детей часто схожа с кишечными заболеваниями, что осложняет правильную постановку диагноза.
Симптоматика у грудных детей часто схожа с кишечными заболеваниями, что осложняет правильную постановку диагноза.
Развивается такая пневмония стремительно, формируя все новые очаги поражения в легких, имеется склонность к образованию абсцессов.
Причины и факторы риска
Попаданию клебсиеллы в организм и ее активной болезнетворной деятельности способствуют следующие факторы:
- проблемы с иммунитетом (ослабление или иммунодефицит),
- нарушения санитарии и гигиены,
- частые и длительные респираторные инфекции,
- аутоиммунные проблемы и диабет,
- дисбактериоз на фоне долгого приема антибиотиков.
Иммунитет на первом году жизни ребенка находится только в процессе формирования, дать адекватный отпор агрессивной микрофлоре малыш пока не в состоянии.
Исходя из этого, очень важно строгое соблюдение санитарного режима дома, исключение контактов с животными в первые месяцы после рождения, стерильность в отношении личных вещей и предметов соприкосновения с малышом (одежда, подгузники и другое).
К особым факторам риска относятся:
- недоношенность,
- применение искусственной вентиляции легких и зондирования,
- врожденные и приобретенные иммунодефициты,
- гипотрофия,
- ослабление организма на фоне других заболеваний,
- антисанитария.
Будьте внимательны! Больше всего инфекционным атакам клебсиелл подвержены груднички первого года жизни, ввиду несформированной иммунной системы, особенно недоношенные новорожденные на различных этапах выхаживания.
Симптомы
Проникая в организм, клебсиелла присутствует во всех биологических жидкостях и продуктах обмена веществ организма: в крови, мокроте, кале, моче, желчи, выделениях очагов воспаления, рвотных массах, спинномозговой жидкости.
На заражение клебсиеллой у грудничков указывают следующие симптомы и признаки:
- повышение температуры,
- расстройства работы кишечника (колики, вздутие, жидкий стул с примесями слизи или крови),
- судороги,
- признаки ацидоза,
- рвота, срыгивания,
- вялость,
- нарушения кровообращения.

Характерными отличиями присутствия клебсиеллеза от других патологий являются:
- резкий запах (необычный) мочи и кала,
- неприятный запах мокроты и носовых выделений.
Присутствует высокая вероятность развития осложнений – менингитов, гепатитов, миокардитов и геморрагических реакций.
Диагностика
Для выявления клебсиеллы как возбудителя инфекции проводят следующие исследования:
- бактериологический посев (бакпосев),
- бактериоскопия,
- серологическая идентификация микроорганизмов,
- реакция агглютинации.
В качестве материала для исследования (в зависимости от формы инфекции) используется кровь, мокрота, моча, кал, выделения из носовых пазух или зева, гной или образцы соединительной ткани, образовавшейся в процессе заживления ранок.
Бактериологический посев (бакпосев)
Для проведения бакпосева у грудничков берут один из перечисленных выше материалов. Срок исследования – 24 часа.
Первоначально проводится посев предоставленного материала на специальную среду К-2. При этом используется мочевина, рафиноза и кислотно-основный индикатор (бромтимоловый синий). Полученный раствор должен простоять при температуре 37˚С в течение суток. За это время в посевной среде при наличии клебсиелл возникают колониальные скопления слизистого вещества желтого или зелено-желтого оттенка.
Затем осуществляется пересев в среду Пешкова и изучение ферментативных свойств, образовавшихся в выращенной чистой культуре микробов. На этом этапе появляется необходимость отнесения бактерий к определенному подвиду. Для этого изучается строение образовавшихся колоний путем их помещения в мясо-пептонный агар.
Колониальные образования, сформировавшиеся в виде петель, свидетельствуют о наличии палочки клебсиеллы пневмонии, а круговые колонии определяют наличие бактерии риносклеромы. Клебсиелла озена выдает себя круговым или рассеянным расположением колоний.
После выделения образцов чистой культуры, происходит проверка их на реакцию взаимодействия с антибактериальными препаратами.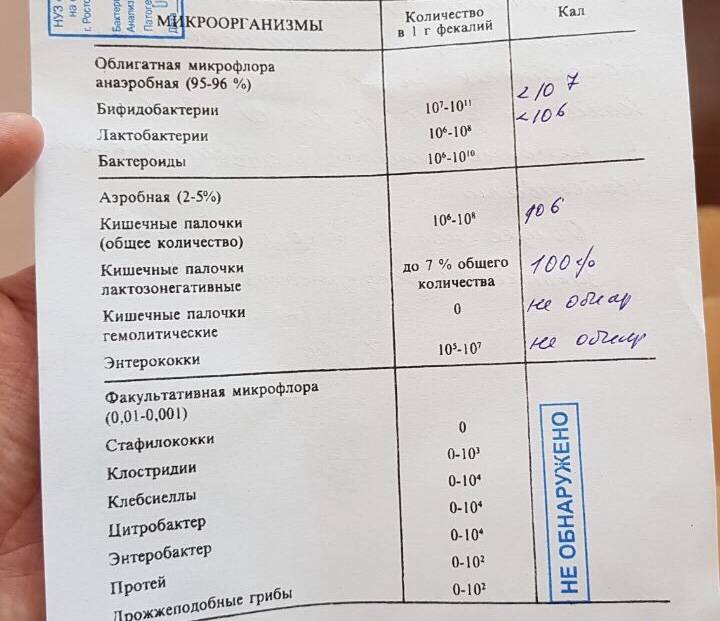
Полезно знать! Самый распространенный диагностический метод выявления заболевания – бактериологический посев.
Бактериоскопия
Бактериоскопия основывается на обнаружении бактерий с помощью микроскопов. Метод проводится путем окрашивания обследуемого материала специальным составом. Выявленные микробы окрашиваются в отличительный от добавленного состава цвет.
Серологическая диагностика
Относится к достаточно сложным и затратным исследованиям, поэтому ее очень редко применяют. Серологические исследования это способы изучения конкретных антител или антигенов в сыворотке крови больных, базирующиеся на реакциях иммунитета. Также их используют для определения антигенов бактерий или вирусов.
Серология основана на сопоставлении реакции агглютинации и реакции связывания комплимента. Для реакции агглютинации применяют стандартный О-клебсиеллезный антиген или аутоштамп. Если титры антител превышают к бактериям в 4-кратном размере, то это свидетельствует о болезнетворности бактерий.
Другие анализы
По показаниям проводят и другие анализы (копрограмма, анализы крови) для выявления масштабов поражения организма. Присутствие клебсиеллы в крови говорит о генерализации заражения и риске развития сепсиса.
Нормы показателей у детей
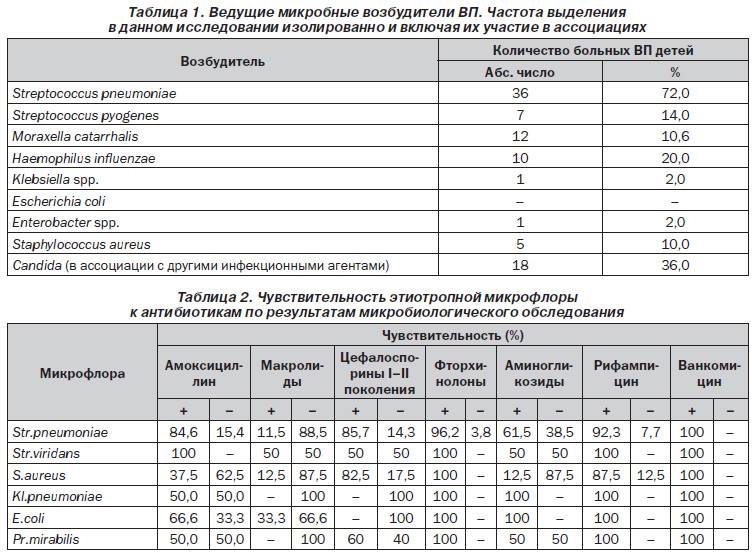
В кале
Для здоровой микрофлоры кишечника бактерии клебсиеллы являются условно-патогенными. При обнаружении незначительного их количества на коже или слизистой человека опасность для его здоровья исключается.
Важно! Существует предельно допустимое количественное содержание этих бактерий в человеческом организме. Один грамм сданного для анализа материала должен содержать не более 10 в 5 степени клеток клебсиеллы.
Например, содержание в кале здорового грудного ребенка клебсиеллы с показателем менее 10 в 4 или 10 в 5 степени (согласно данным различных лабораторий) считается нормой.
Бактериальный уровень в размере 10 в 6 степени свидетельствует об отклонении показателей от допустимой нормы. В данном случае пациенту предписывают прохождение необходимых терапевтических мероприятий.
В данном случае пациенту предписывают прохождение необходимых терапевтических мероприятий.
Лечение бактериофагами рекомендована грудничку в случае диагностирования клебсиеллы в кале 10 в 7 или 10 в 8 степени. Тот же показатель в размере 10 в 10 степени требует проведения лечебной процедуры посредством антибиотиков.
О наличии клебсиеллы в качестве возбудителя говорит повышенное содержание болезнетворных микроорганизмов в мокроте.
При взятии на диагностику кала, норма выявленной клебсиеллы пневмонии составляет менее 10 в 5 степени. Превышение содержания бактерий с наибольшей степенью вероятности говорит о спровоцированном клебсиеллой гастроэнтерите или энтероколите.
В моче
В норме в моче клебсиеллы могут обнаруживаться только при их случайном туда попадании (во время взятия анализа, например), поэтому в данном биологическом материале их обнаруживают очень редко.
Если на фоне повышенного уровня клебсиеллы в моче у грудного ребенка продолжительное время держится высокая температура тела, то ему необходимо проходить обследование почек и мочеполовой системы, чтобы исключить прогрессирующий пиелонефрит.
Методы лечения
Данный тип бактерий устойчив к большинству антибиотиков, что делает затруднительным подбор лечения. В нетяжелых случаях используются бактериофаги (специфические или поливалентные) и пробиотики с пребиотиками для компенсации микрофлоры.
В случае среднетяжелых и тяжелых форм заболевания лечение детей назначается по следующему протоколу:
- антибактериальные препараты (пенициллиновая группа, цефалоспорины, тетрациклины, в редких случаях фторхинолоновые препараты),
- препараты общего действия (жаропонижающие, дезинтоксикационные, регидратационные),
- симптоматическое лечение (отхаркивающие, противорвотные, сосудосуживающие, обезболивающие и др.
 ).
).
Рекомендации доктора Комаровского
По мнению известного педиатра Евгения Комаровского, при обнаружении родителями признаков клебсиеллеза у грудничка необходимо срочно обратиться к врачу и сдать анализы для своевременного выявления возбудителя. Это позволит, не теряя драгоценного времени, начать адекватное лечение ребенка и предотвратить развитие осложнений.
Раннее распознавание клебсиеллы даст возможность обойтись без использования антибиотиков и сохранить хрупкий иммунитет грудничка.
Важно! При появлении признаков заболевания необходимо пристально контролировать питьевой режим и не допускать обезвоживания! Обезвоживание приводит к 30% летальных исходов!
Особое внимание Комаровский рекомендует уделить соблюдению гигиены, использованию пробиотиков и корректировке режима малыша.
Заключение: профилактика
Клебсиеллы – наши постоянные соседи. Они живут в водопроводной воде, на руках и садово-огородной продукции, в шерсти домашних животных и под ободком унитаза.
Иммунитет грудных малышей не готов дать достойный отпор из-за своей незрелости. Избежать клебсиеллеза можно, соблюдая несложные рекомендации:
- своевременное и правильное лечение ОРВИ,
- соблюдение гигиены и санитарии дома,
- выполнение требований противоэпидемического режима и регламента стерилизаций в стационарах и родильных отделениях,
- полноценное (грудное или адаптированное) питание малыша согласно возраста,
- ограничение контакта с животными в первые месяцы жизни ребенка,
- контроль состояния здоровья беременной и роженицы, своевременные анализы и обследования.
Здоровый организм в состоянии противостоять клебсиелле, поэтому правильное формирование развивающегося иммунитета малыша позволит избежать заболевания.
Загрузка…
Клебсиелла в кале у грудничка: норма показателей, лечение
С появлением антимикробных лекарств, способных изменять микрофлору кишечника, особое значение приобрело наличие бактерии Клебсиелла в кале у грудничка. Большую роль в распространении этой патологии играют слабое здоровье населения, снижение иммуннитета и способность болезнетворных микробов развивать устойчивость к антибиотикам.
Большую роль в распространении этой патологии играют слабое здоровье населения, снижение иммуннитета и способность болезнетворных микробов развивать устойчивость к антибиотикам.
СодержаниеПоказать
Клебсиелла – что это такое?
Наиболее часто у новорожденных и грудных детей кишечные инфекции вызываются условно-патогенными микроорганизмами из семейства enterobacteriaceae, в которое входит и клебсиелла – грамотрицательная палочка без жгутиков и других приспособлений для передвижения.
Клебсиеллы на редкость живучи. Каждую бактерию окружает плотная полисахаридная капсула, благодаря которой она может выжить даже после обработки антибактериальным мылом.
Размер клебсиелл составляет 0.3-6 мкм. Под микроскопом видно, что они располагаются поодиночке, маленькими группами или виде коротких цепочек. В чашках Петри клебсиеллы размножаются при температуре около 36 градусов, образуя блестящие скопления выпуклой формы.
Клебсиеллы широко распространены у людей всех возрастов. В минимальных количествах эти микроорганизмы безвредны, но иногда они способны быстро размножиться и стать причиной болезни.
В минимальных количествах эти микроорганизмы безвредны, но иногда они способны быстро размножиться и стать причиной болезни.
Клебсиеллы, поселившееся в ЖКТ, приводят к клебсиеллезу – острой кишечной инфекции, протекающей с поражением желудка и кишечника, а иногда легких и других органов. У новорожденных под действием бактерий иногда развивается сепсис.
Для человека опасны три вида клебсиелл:
- K. Pneumoniae;
- K. Oxytoca;
- K. Ozaenae.
Особенно вредоносна бактерия Клебсиелла пневмония. Некоторые ее культуры вырабатывают сильный яд, вызывающий тяжелые изменения в строении стенок кишок и внутрисосудистое свертывание крови.
Автор:
Миронова Елена
Не разобрался в материале статьи или нужна помощь? Задай вопрос сейчас и получи на него ответ.
Задать вопрос автору
Бактерия представляет особенную опасность для новорожденных и младенцев с врожденными пороками миокарда, недоношенностью и сбоями в работе иммунной системы.
Бактерия Окситока – второй по распространённости вид клебсиелл. Окситока становится причиной воспалений легких, суставов, слизистой рта.
Окситока становится причиной воспалений легких, суставов, слизистой рта.
Клебсиеллезы широко распространены у новорожденных и детишек до года. Особенно подвержены клебсиеллезу дети первого полугодия, находящиеся на искусственном вскармливании.
У детей до года заболевание протекает по типу гастроэнтероколита. У детишек старше 12 месяцев клебсиеллез идет по типу пищевой токсикоинфекции.
Примечание. Энтероколит – одновременное воспаление тонкого и толстого кишечника. Токсикоинфекция – отравление организма токсинами, вырабатываемыми бактериями.
Причины клебсиеллезов у детей
Агентом заражения может стать больной человек любого возраста или носитель бактерий. Клебсиеллы передаются орально-фекальным способом, но возможен контактный и воздушно-капельный путь передачи.
Вместе с выделениями людей бактерии попадают во внешнюю среду, где долго остаются живыми. Клебсиеллы хорошо переносят холод, дезрастворы и многие современные антибиотики, поэтому часто становятся источником внутрибольничных вспышек клебсиеллеза.
Клебсиеллезы появляются независимо от времени года. Инфекция может поразить одного человека или целую группу.
Анализ кала на клебсиеллу у грудничка – норма и патология
Присутствие клебсиелл в кале грудника не означает, что малыш болен. Это могут оказаться не болезнетворные разновидности, а один из вариантов нормальной кишечной микрофлоры. В кишечнике живет множество разнообразных микроорганизмов, взаимно сдерживающих размножение друг друга. В обычных условиях патологически быстрому размножению клебсиелл мешает нормальная флора кишечника. Нет причин вмешиваться в этот естественный процесс.
Говорить о клебсиеллезе можно, если количество бактерий в одном грамме фекалий превышает 105 микробных тел.
Правила сдачи анализа кала на бактериологическое исследование:
- Фекалии помещают в стерильную посуду стерильным инструментом.
- Биоматериал доставляется в лабораторию не позже 2 часов с момента взятия.
- Допустимо хранить биоматериал в холодильнике не более 6 часов.

Как долго ждать результатов исследования? Предварительный результат лаборатория выдаст через 48 часов, а окончательный – через 72.
Серологический анализ крови играет вспомогательную роль в диагностике клебсиллиоза. Титр у заболевшего малыша изменяется от 1:20 до 1:80 или от 1:8 до 1:64.
Другие симптомы заражения
У малышей с ослабленным или нарушенным иммунитетом клебсиеллы могут размножиться сильнее нормальных показателей, что приведет к развитию кишечной инфекции в легкой или тяжелой форме.
Клебсиеллез в тяжелой форме сопровождается высокой температурой, лихорадкой, абдоминальная резью, поносом, сильным обезвоживанием.
При появлении первых симптомов кишечной инфекции необходимо немедленно вызвать врача и сдать кал ребенка на исследование.
Как правило, клебсиеллез у грудничков начинается остро и быстро развивается. Малыш отказывается брать грудь, становятся вялым, обильно срыгивает. Испражнения становятся жидкими, водянистыми, неестественного желто-зеленого цвета с добавкой мутноватого слизистого налета.
Рвота и понос – защитные механизмы, с помощью которых организм пытаться избавиться от инфекции.
Новорожденные с тяжелым клебсиллиозом быстро приходят в тяжелое состояние. Из-за обезвоживания и токсикоза они теряют в массе до 500 г. Анализ крови показывает слабо выраженную анемию. Быстро развившийся энтероколит может закончится некрозом кишечной стенки. В таких случаях в стуле появляется кровь и возникает угроза перфорации кишки.
Возможные осложнения клебсиеллеза за у новорожденных:
- гепатит;
- миокардит;
- менингит;
- подкожные кровоизлияния;
- воспаление мозга.
Лечение инфекции у грудного ребенка
Малыши до года с острым клебсиеллеозом нуждаются в немедленной госпитализации в инфекционный стационар, где им будет проводиться адекватная терапия, направленная на подавление инфекции и восстановление объема жидкости в организме.
Для терапии клебсиеллезов всех форм разработана особая методика. Назначая лечение, доктор обязан ее придерживаться. Согласно лечебному протоколу, антибиотики, способные убивать клебсиеллу, у детей до года используются в исключительных случаях, так как эти препараты несут массу побочных эффектов и высокотоксичны для малыша.
Согласно лечебному протоколу, антибиотики, способные убивать клебсиеллу, у детей до года используются в исключительных случаях, так как эти препараты несут массу побочных эффектов и высокотоксичны для малыша.
Если заболевание протекает по легкому типу, для лечения грудничка достаточно пробиотиков и бактериофагов.
Бактериофаги – современные антимикробные лекарства избирательного действия, уничтожающие болезнетворные бактерии. Это безопасная альтернатива антибиотикам. В биологическом смысле бактериофаги представляют собой особые вирусы, способные размножаться только в организмах болезнетворных бактерий.
Антиклебсиельные бактериофаги:
- Бактериофаг klebsiella pneumoniae жидкий, очищенный;
- Бактериофаг поливалентный клебсиеллезный, жидкий, очищенный;
- Пиобактериофаг комплексный, жидкий.
Перечисленные препараты представляют собой раствор для приема внутрь орально или для постановки клизм. Лекарство дают детям трижды в день за 30-60 минут до кормления.
Лекарство дают детям трижды в день за 30-60 минут до кормления.
Таблица разовой дозировки бактериофагов при кишечной инфекции, вызванной клебсиеллой:
Возраст | Орально | В виде клизмы |
Дети 0-6 мес | 5 мл | 10 мл |
| Дети 6-12 мес | 10 мл | 20 мл |
Бактериофаги не имеют противопоказаний, но они менее активны чем антибиотики. Препараты обладают широким спектром действия и одновременно уничтожают стафилококков, стрептококков, энтерококков, протей, клебсиелл, синегнойную и кишечную палочку.
Подробнее о лечении клебсиеллеза можно прочесть здесь.
Видео-материал о бактериофагах и принципах их действия на бактерии:
Профилактика заражения
Для профилактики клебсиллиозов в роддомах, детских стационарах, отделениях для недоношенных должен строго соблюдаться противоэпидемический режим.
У малышей до года главным условием хорошей работы кишечника является грудное кормление. В материнском молоке содержатся иммуноглобулины и другие факторы иммунитета.
Грудное молоко – это не просто еда, а еще и замена естественного иммунитета, который у ребенка до года еще не сформировался.
Чтобы малыш не заразился дома, нужно понимать, что клебсиеллез – типичная кишечная инфекция, поэтому для ее профилактики нужно соблюдать меры санитарно-гигиенического характера:
- мыть руки и грудь перед кормлением;
- обрабатывать погремушки и другие предметы, которые могут попасть ребенку в рот;
- соблюдать правила личной гигиены.
Прикорм нужно вводить своевременно и правильно. Детскую еду необходимо готовить, хранить и транспортировать в условиях, не позволяющих размножаться бактериям.
Видео от доктора Комаровского о кишечных инфекциях у детей:
Победить паразитов можно!
Антипаразитарный комплекс® — Надежное и безопасное избавление от паразитов за 21 день!
- В состав входят только природные компоненты;
- Не вызывает побочных эффектов;
- Абсолютно безопасен;
- Защищает от паразитов печень, сердце, легкие, желудок, кожу;
- Выводит из организма продукты жизнедеятельности паразитов.

- Эффективно уничтожает большую часть видов гельминтов за 21 день.
Сейчас действует акция на бесплатную упаковку. Читать мнение экспертов.
Клинико-патологические находки у детей, умерших в результате инфекции кровотока Klebsiella pneumoniae
Основные моменты
- •
Инфекции кровотока, вызванные Klebsiella pneumoniae , являются основной клинической проблемой у госпитализированных детей
- •
Есть исследования в области результатов аутопсии
- •
Наша статья привносит другое измерение в понимание Enterobacteriaceae инфекций у детей
- •
Раннее обнаружение образования биопленок в образцах тканей может указывать на неоптимальные ответы к антибиотикам
- •
Необходимы дополнительные исследования для понимания молекулярных механизмов образования биопленок, связанных с Klebsiella pneumoniae
Реферат
Предпосылки
Klebsiella pneumoniae b Инфекция лудстрима (KPBSI) тесно связана с госпитализацией и может привести к значительной заболеваемости и смертности. Данных, описывающих результаты вскрытия KPBSI у детей, мало.
Данных, описывающих результаты вскрытия KPBSI у детей, мало.
Методы
Мы провели ретроспективный обзор клинико-патологических данных у детей, умерших во время курса KPBSI в детской больнице в Кейптауне, Южная Африка.
Результаты
Пятнадцать госпитализированных детей, умерших и перенесших вскрытие, были включены в этот анализ. Их средний возраст (межквартильный диапазон, IQR) составлял 4 (1-22) месяца, 2 (20%) были ВИЧ-инфицированными и 10 (67%) имели умеренно или сильно пониженный вес.Среднее время до смерти от момента положительного посева крови составляло 1 (IQR 0–5) день. Заметными результатами аутопсии во многих случаях были полиорганная недостаточность, вызванная сепсисом, включая инволюцию тимуса, эрозии пищевода, кровоизлияние в надпочечники, острый некроз канальцев и разрушение паренхимы легких. Другие гистологические находки включали диссеминированную внутрисосудистую коагулопатию, некротизирующее воспаление во многих органах; и у четырех из пяти детей образование биопленок.
Заключение
KPBSI может вызвать обширную некротическую ткань.
Ключевые слова
Klebsiella pneumoniae Инфекция кровотока
Дети
Африка
Вскрытие / вскрытие
Рекомендуемые статьиЦитирующие статьи (0)
© 2019 Авторы. Опубликовано Elsevier Ltd от имени Британской ассоциации инфекций.
Рекомендуемые статьи
Ссылки на статьи
Клебсиелла — обзор | Темы ScienceDirect
Клинические проявления
Klebsiella spp . являются важными условно-патогенными микроорганизмами у детей, вызывающими широкий спектр инфекций, включая ИБС, связанные со здоровьем и населением; инфекции центральной нервной системы (ЦНС), дыхательные пути, мочевые пути, опорно-двигательный аппарат, и брюшная полость; глубокие абсцессы и инфекции послеоперационных, травматических и ожоговых ран. Примерно 75% BSI связаны со здравоохранением. 16–24 Вспышки в неонатальных отделениях вызывают серьезную озабоченность. 25 Неонатальные инфекции включают BSI, менингит, абсцесс мозга, конъюнктивит, абсцесс печени, эндокардит, пневмонию, некротический фасциит, артрит, остеомиелит, инфекцию мочевыводящих путей (UTI) и некротический энтероколит (NEC). 26–32 Клинические проявления инфекции не отличаются от таковых у других грамотрицательных бацилл. Хотя Escherichia coli является наиболее частой причиной ИМП, Klebsiella и Proteus spp . также являются распространенными микроорганизмами Enterobacteriaceae, связанными с ИМП. 33
25 Неонатальные инфекции включают BSI, менингит, абсцесс мозга, конъюнктивит, абсцесс печени, эндокардит, пневмонию, некротический фасциит, артрит, остеомиелит, инфекцию мочевыводящих путей (UTI) и некротический энтероколит (NEC). 26–32 Клинические проявления инфекции не отличаются от таковых у других грамотрицательных бацилл. Хотя Escherichia coli является наиболее частой причиной ИМП, Klebsiella и Proteus spp . также являются распространенными микроорганизмами Enterobacteriaceae, связанными с ИМП. 33
Грамотрицательные микроорганизмы составляют более 50% ИМТ у детей. Во время 6-летнего проспективного исследования грамотрицательных BSI в педиатрическом медицинском центре третичного уровня в Израиле, K.pneumoniae был наиболее часто идентифицируемым патогеном и составлял 26% (109 из 419) изолятов. 19 В обзоре 57 случаев ИМТ у детей, вызванного K. pneumoniae , 67% были моложе 12 месяцев, и большинство из них имели по крайней мере одно основное заболевание, включая аномалии желудочно-кишечного тракта в 56%, центральный венозный катетер. у 35%, нейтропения у 25% и патология мочевыводящих путей у 16%. 34
у 35%, нейтропения у 25% и патология мочевыводящих путей у 16%. 34
Проект по надзору и контролю за патогенами эпидемиологической важности, основанный в Университете Содружества Вирджинии в Ричмонде, предоставил важные данные для определения преобладающих патогенов, ответственных за связанные со здравоохранением ИБТ у детей. 35 Хотя грамположительные организмы, особенно коагулазонегативные Staphylococcus spp., Составляли более 50% изолятов, Candida spp . На приходилось 9,3%, а на Klebsiella spp — . На , Enterobacter spp. И Escherichia coli приходилось 5,8%, 5% и 5% изолятов соответственно.
Другие состояния, связанные с Klebsiella spp. BSI в детстве включает недоношенность, предшествующее воздействие антибиотиков, предшествующий ротавирусный гастроэнтерит, процедуру Касаи при атрезии желчных путей, злокачественные новообразования, послеоперационный статус, ожоги, множественные травмы, синдром приобретенного иммунодефицита, гранулоцитарные нарушения, гомозиготную серповидно-клеточную анемию, трансплантацию твердых органов, послеоперационный период после спленэктомии, системной красной волчанки и дефицита β1 цепи рецептора интерлейкина-12.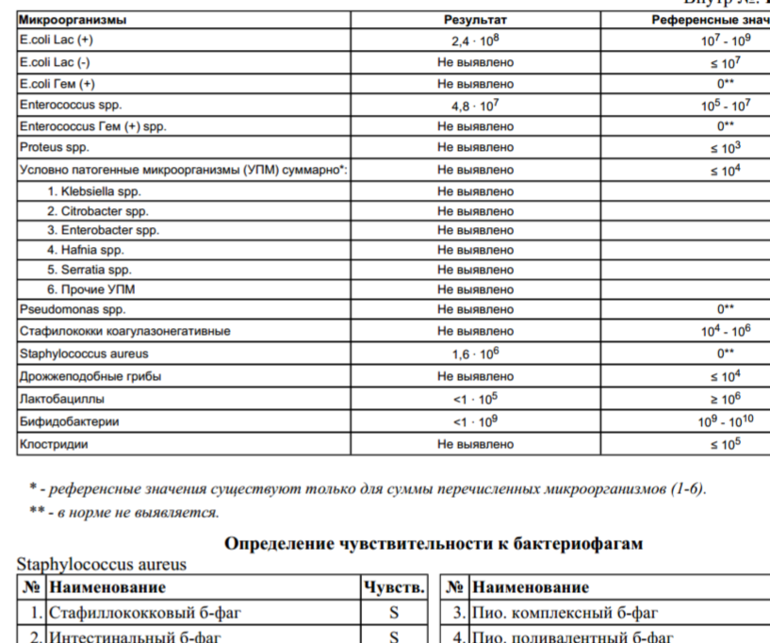 19,35–41 Загрязненные растворы для внутривенного введения также были идентифицированы как источник Klebsiella spp. BSI. 42
19,35–41 Загрязненные растворы для внутривенного введения также были идентифицированы как источник Klebsiella spp. BSI. 42
Общий коэффициент смертности Klebsiella spp. BSI составляет около 11%, а уровень смертности от BSI, связанного со здравоохранением, составляет 14,5%. 19,35 Повышенный уровень смертности в значительной степени связан с острым лейкозом, нейтропенией, инфекциями, связанными со здоровьем (HAI), и предшествующей терапией кортикостероидами.
Цитотоксин-продуцирующие штаммы K.oxytoca были причастны к антибиотико-ассоциированному геморрагическому колиту. 14,43,44 Клиническим проявлениям боли в животе и кровавой диареи обычно предшествует лечение антибиотиками с β-лактамным агентом. Колит обычно сегментарный и локализуется преимущественно в правой толстой кишке. Прекращение приема противомикробного агента и поддерживающая терапия обычно приводят к клиническому разрешению. Энтеротоксигенные и энтероагрегантные штаммы K. pneumoniae также были вовлечены в качестве причин детского гастроэнтерита. 45
pneumoniae также были вовлечены в качестве причин детского гастроэнтерита. 45
Raoultella spp. непостоянно сообщалось как колонизирующие бактерии желудочно-кишечного тракта госпитализированных новорожденных и как возбудители ИБС и пневмонии у взрослых. 46,47 R. planticola был выделен из мочи взрослых особей; раны, включая внутрибрюшной абсцесс, связанный с панкреатитом; и загрязненные детские смеси. 48–50 R. ornithinolytica был выделен из крови новорожденного с висцеральной гетеротаксией, функциональной аспленией и сложным врожденным пороком сердца, у которого была НЭК; от одного взрослого с гигантской кистой почек; а от другого — с синдромом кишечной лихорадки. 51–53
R. ornithinolytica и R. planticola , по всей видимости, вызывают отравление скомброидных (гистаминовых) рыб. 8 Это состояние возникает после приема внутрь неправильно хранимой (> 20 ° C) скумброидной рыбы (например, тунца, махи-махи, скумбрии, скумбрии, сардины) и возникает в результате расщепления высоких концентраций гистидина на гистамин под действием бактериальных гистидиндекарбоксилаза. 51,53 Инкубационный период может составлять от 1 минуты до 3 часов. Клинические проявления могут включать заметное покраснение кожи (особенно лица, верхней части туловища и рук), головную боль, головокружение, спазмы в животе, рвоту, диарею, жжение во рту, крапивницу, генерализованный зуд и (редко) гипотензию и бронхоспазм.
51,53 Инкубационный период может составлять от 1 минуты до 3 часов. Клинические проявления могут включать заметное покраснение кожи (особенно лица, верхней части туловища и рук), головную боль, головокружение, спазмы в животе, рвоту, диарею, жжение во рту, крапивницу, генерализованный зуд и (редко) гипотензию и бронхоспазм.
Колонизация микробов координирует патогенез изолята младенцев Klebsiella pneumoniae
Dominguez-Bello, M. G. et al. . Способ доставки определяет приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci USA 107 , 11971–11975 (2010).
ADS
Статья
Google ученый
Мартин Р. и др. .События в раннем возрасте, включая способ доставки и тип кормления, братьев и сестер и пол, формируют развивающуюся микробиоту кишечника.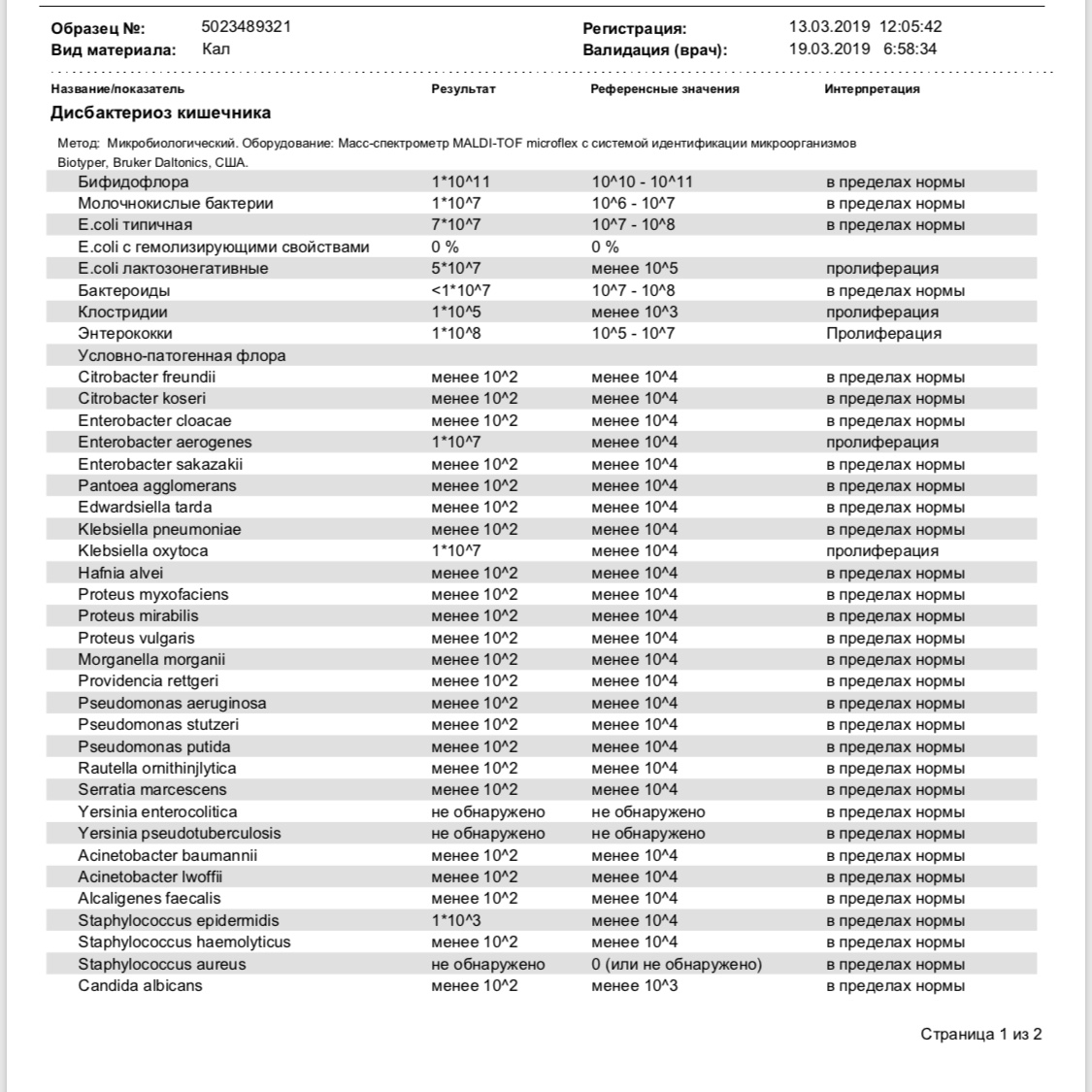 PLoS ONE 11 , e0158498 (2016).
PLoS ONE 11 , e0158498 (2016).
Артикул
PubMed Central
Google ученый
Корпела К., и др. . Развитие кишечной микробиоты и гестационный возраст у недоношенных новорожденных. Sci Rep 8 , 2453 (2018).
ADS
Статья
PubMed Central
Google ученый
Догра, С. и др. . На динамику микробиоты кишечника младенца влияют способ родоразрешения и продолжительность беременности, и она связана с последующим ожирением. MBio 6 (2015).
Harmsen, H.J. et al. . Анализ развития кишечной флоры у детей, находящихся на грудном вскармливании и на искусственном вскармливании, с использованием методов молекулярной идентификации и обнаружения. J Pediatr Gastroenterol Nutr 30 , 61–67 (2000).
J Pediatr Gastroenterol Nutr 30 , 61–67 (2000).
CAS
Статья
PubMed Central
Google ученый
Правин, П., Джордан, Ф., Приами, К. и Морин, М. Дж. Роль грудного вскармливания в иммунной системе младенца: системный взгляд на микробиом кишечника. Микробиом 3 , 41 (2015).
Артикул
PubMed Central
Google ученый
Томкович С. и Джобин С. Микробиота и иммунные реакции хозяина: отношения любви и ненависти. Иммунология 147 , 1–10 (2016).
CAS
Статья
PubMed Central
Google ученый
Дутта, С., Ганеш, М., Рэй, П. и Наранг, А. Колонизация кишечника у младенцев с очень низкой массой тела при рождении в первую неделю жизни. Индийский педиатр 51 , 807–809 (2014).
Артикул
PubMed Central
Google ученый
Гибсон М. К. и др. . Динамика развития микробиоты кишечника недоношенных новорожденных и антибиотикорезистома. Нат. Microbiol. 1 , 16024 (2016).
CAS
Статья
PubMed Central
Google ученый
Чу, Д. М. и др. . Созревание структуры и функции сообщества микробиома младенца во многих участках тела и в зависимости от способа доставки. Nat Med 23 , 314–326 (2017).
CAS
Статья
PubMed Central
Google ученый
Новрузян, Ф.L., Wold, A. E. и Adlerberth, I. Штаммы Escherichia coli, принадлежащие к филогенетической группе B2, обладают превосходной способностью сохраняться в микрофлоре кишечника младенцев. J Infect Dis 191 , 1078–1083 (2005).
CAS
Статья
PubMed Central
Google ученый
Putze, J. et al. . Генетическая структура и распределение геномного острова колибактина среди членов семейства Enterobacteriaceae. Инфекция иммунной 77 , 4696–4703 (2009).
CAS
Статья
PubMed Central
Google ученый
Nowrouzian, F. L. & Oswald, E. Штаммы Escherichia coli, способные к длительной персистенции в микробиоте кишечника, несут потенциально генотоксичный островок pks. Microb Pathog 53 , 180–182 (2012).
Microb Pathog 53 , 180–182 (2012).
CAS
Статья
PubMed Central
Google ученый
Артур, Дж. С. и др. . Воспаление кишечника нацелено на вызывающую рак активность микробиоты. Наука 338 , 120–123 (2012).
ADS
CAS
Статья
PubMed Central
Google ученый
Dejea, C. M. и др. . Пациенты с семейным аденоматозным полипозом содержат биопленки толстой кишки, содержащие онкогенные бактерии. Наука 359 , 592–597 (2018).
ADS
CAS
Статья
PubMed Central
Google ученый

Куэвас-Рамос, Г. и др. . Escherichia coli вызывает повреждение ДНК in vivo и запускает геномную нестабильность в клетках млекопитающих. Proc Natl Acad Sci USA 107 , 11537–11542 (2010).
ADS
CAS
Статья
PubMed Central
Google ученый
Чен, Ю.-Т. и др. . Распространенность и характеристики клинических изолятов Klebsiella pneumoniae, положительных по кластеру генов генотоксина pks, на Тайване. Sci Rep 7 , 43120 (2017).
ADS
CAS
Статья
PubMed Central
Google ученый
Струве К. и др. . Картирование эволюции гипервирулентной Klebsiella pneumoniae. MBio 6 , e00630 (2015).
CAS
Статья
PubMed Central
Google ученый
Lai, Y.-C. и др. . Генотоксическая Klebsiella pneumoniae на Тайване. PLoS ONE 9 , e96292 (2014).
ADS
Статья
PubMed Central
Google ученый
Пачоса, М. К. и Мечас, Дж. Клебсиелла пневмония: переход в наступление с сильной защитой. Microbiol Mol Biol Rev 80 , 629–661 (2016).
CAS
Статья
PubMed Central
Google ученый
Регейро, В., Кампос, М. А., Понс, Дж., Альберти, С. и Бенгоэча, Дж. А. Поглощение полисахаридного полисахарида капсулы Klebsiella pneumoniae вызывает воспалительную реакцию эпителиальных клеток дыхательных путей человека. Microbiology (Reading, Engl) 152 , 555–566 (2006).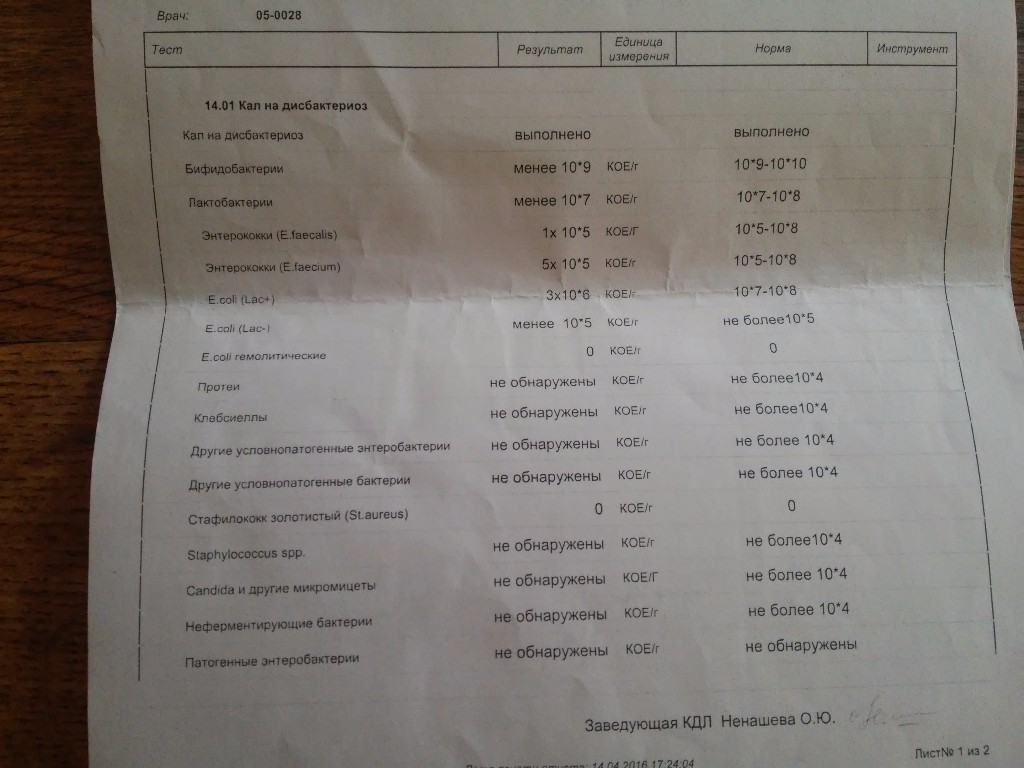
CAS
Статья
Google ученый
Холден, В. И., Брин, П., Хоул, С., Дозуа, К. М. и Бахман, М. А. Сидерофоры Klebsiella pneumoniae вызывают воспаление, распространение бактерий и стабилизацию HIF-1α во время пневмонии. MBio 7 (2016).
Chen, W., Liu, F., Ling, Z., Tong, X. & Xiang, C. Микробиота, связанная с просветом кишечника человека и слизистой оболочкой, у пациентов с колоректальным раком. PLoS ONE 7 , e39743 (2012).
ADS
CAS
Статья
PubMed Central
Google ученый
Kaakoush, N.O. и др. . Микробный дисбактериоз у педиатрических больных с болезнью Крона. J Clin Microbiol 50 , 3258–3266 (2012).
J Clin Microbiol 50 , 3258–3266 (2012).
Артикул
PubMed Central
Google ученый
Garrett, W. S. и др. . Enterobacteriaceae действуют совместно с микробиотой кишечника, вызывая спонтанный и передаваемый от матери колит. Cell Host Microbe 8 , 292–300 (2010).
CAS
Статья
PubMed Central
Google ученый
Lau, H. Y., Huffnagle, G. B. & Moore, T. A. Факторы хозяина и микробиоты, которые контролируют колонизацию слизистой оболочки Klebsiella pneumoniae у мышей. Микробы заражают 10 , 1283–1290 (2008).
CAS
Статья
PubMed Central
Google ученый
Zhang, C. et al. .Удаление клеток Панета в присутствии Klebsiella pneumoniae вызывает некротизирующий энтероколит (NEC) -подобное повреждение в тонкой кишке незрелых мышей. Dis Model Mech 5 , 522–532 (2012).
CAS
Статья
PubMed Central
Google ученый
Dubois, D. et al. . ClbP является прототипом подгруппы пептидаз, участвующей в биосинтезе нерибосомных пептидов. J Biol Chem 286 , 35562–35570 (2011).
CAS
Статья
PubMed Central
Google ученый
Brotherton, C.A. & Balskus, E.P. Механизм устойчивости к пролекарству участвует в биосинтезе колибактина и цитотоксичности. J Am Chem Soc 135 , 3359–3362 (2013).
CAS
Статья
PubMed Central
Google ученый
Томкович С. и др. .Локорегиональные эффекты микробиоты в доклинической модели канцерогенеза толстой кишки. Cancer Res 77 , 2620–2632 (2017).
CAS
Статья
PubMed Central
Google ученый
Dobbler, P. T. et al. . Низкое микробное разнообразие и аномальная микробная сукцессия связаны с некротическим энтероколитом у недоношенных детей. Front Microbiol 8 , 2243 (2017).
Артикул
PubMed Central
Google ученый
Denning, N. -L. И Принс, Дж. М. Дисбактериоз кишечника новорожденных при некротическом энтероколите. Мол Мед 24 , 4 (2018).
-L. И Принс, Дж. М. Дисбактериоз кишечника новорожденных при некротическом энтероколите. Мол Мед 24 , 4 (2018).
Артикул
PubMed Central
Google ученый
Янг Ю. и Джобин К. Профессор Арлетт Дарфей-Мишо: открытие адгезивно-инвазивной Escherichia coli. J Crohns Colitis 9 , 373–375 (2015).
ADS
Статья
PubMed Central
Google ученый
Glocker, E.-O. и др. . Воспалительное заболевание кишечника и мутации, влияющие на рецептор интерлейкина-10. N Engl J Med 361 , 2033–2045 (2009).
CAS
Статья
PubMed Central
Google ученый
Моран, К. Дж. и др. . Полиморфизм IL-10R связан с очень ранним язвенным колитом. Воспаление кишечника 19 , 115–123 (2013).
Артикул
PubMed Central
Google ученый
Муруган Д. и др. . Воспалительное заболевание кишечника с очень ранним началом, связанное с аберрантным переносом IL-10R1 и излечение с помощью гаплоидентичной трансплантации костного мозга с использованием Т-клеток. J Clin Immunol 34 , 331–339 (2014).
CAS
Статья
Google ученый
Ли, И.-А. И Ким, Д.-Х. Klebsiella pneumoniae увеличивает риск воспаления и колита на мышиной модели кишечного заболевания кишечника. Scand J Gastroenterol 46 , 684–693 (2011).
CAS
Статья
Google ученый
Маккафферти, Дж. и др. . Стохастические изменения с течением времени, а не эффекты основателя, управляют эффектами клетки в сборке микробного сообщества в модели мыши. ISME J 7 , 2116–2125 (2013).
CAS
Статья
PubMed Central
Google ученый
Atarashi, K. et al. . Внематочная колонизация ротовыми бактериями в кишечнике вызывает индукцию клеток Th2 и воспаление. Наука 358 , 359–365 (2017).
ADS
CAS
Статья
PubMed Central
Google ученый
Mirpuri, J. et al. . IgA, специфичный для протеобактерий, регулирует созревание кишечной микробиоты. Кишечные микробы 5 , 28–39 (2014).
Артикул
PubMed Central
Google ученый
Dalmasso, G., Cougnoux, A., Delmas, J., Darfeuille-Michaud, A.И Боннет Р. Бактериальный генотоксин колибактин способствует росту опухоли толстой кишки, изменяя микроокружение опухоли. Кишечные микробы 5 , 675–680 (2014).
Артикул
PubMed Central
Google ученый
Bossuet-Greif, N. et al . Escherichia coli ClbS — это белок устойчивости к колибактину. Mol Microbiol 99 , 897–908 (2016).
CAS
Статья
PubMed Central
Google ученый
Tripathi, P. et al . Clbs — это циклопропангидролаза, которая придает устойчивость к колибактину. J Am Chem Soc 139 , 17719–17722 (2017).
CAS
Статья
PubMed Central
Google ученый
Mousa, J. J. et al. . MATE транспорт генотоксина колибактина, производного от E. coli. Нат. Microbiol. 1 , 15009 (2016).
CAS
Статья
PubMed Central
Google ученый
Муса, Дж. Дж., Ньюсом, Р. К., Янг, Ю., Джобин, С. и Брунер, С. Д. ClbM — это универсальный катион-беспорядочный переносчик MATE, обнаруженный в кластере генов биосинтеза колибактина. Biochem Biophys Res Commun 482 , 1233–1239 (2017).
CAS
Статья
PubMed Central
Google ученый
Мартин, П. и др. . Взаимодействие между сидерофорами и путями биосинтеза генотоксина колибактина у Escherichia coli. PLoS Pathog 9 , e1003437 (2013).
CAS
Статья
PubMed Central
Google ученый
Lu, M.-C. и др. . Колибактин способствует гипервирулентности pks + K1 CC23 Klebsiella pneumoniae при инфекциях менингита мышей. Front Cell Infect Microbiol 7 , 103 (2017).
PubMed
PubMed Central
Google ученый
Розен, Д. А. и др. . Klebsiella pneumoniae FimK способствует вирулентности при пневмонии у мышей. J Infect Dis 213 , 649–658 (2016).
А. и др. . Klebsiella pneumoniae FimK способствует вирулентности при пневмонии у мышей. J Infect Dis 213 , 649–658 (2016).
CAS
Статья
PubMed Central
Google ученый
Паласиос, М., Броберг, К. А., Уокер, К. А., Миллер, В. Л. Случайная мутация выявляет серьезный дефект вирулентности мутанта aKlebsiella pneumoniae fepB. мСфера 2 (2017).
Клиффорд Р. Дж. и др. . Обнаружение бактериальной 16S рРНК и идентификация четырех клинически важных бактерий с помощью ПЦР в реальном времени. PLoS ONE 7 , e48558 (2012).
ADS
CAS
Статья
PubMed Central
Google ученый
Liu, Y. et al. . ПЦР-определение Klebsiella pneumoniae в детской смеси на основе внутреннего транскрибируемого спейсера 16S – 23S. Int J Food Microbiol 125 , 230–235 (2008).
CAS
Статья
PubMed Central
Google ученый
Diancourt, L., Passet, V., Verhoef, J., Grimont, P. A. D. & Brisse, S. Мультилокусное типирование последовательностей нозокомиальных изолятов Klebsiella pneumoniae. J Clin Microbiol 43 , 4178–4182 (2005).
CAS
Статья
PubMed Central
Google ученый
Джолли, К. А., Брей, Дж. Э. и Мейден, М. С. Дж. Геномика бактериальной популяции с открытым доступом: программное обеспечение BIGSdb, веб-сайт PubMLST. org и их приложения. [версия 1; судей: 2 утверждено]. Wellcome Open Res. 3 , 124 (2018).
org и их приложения. [версия 1; судей: 2 утверждено]. Wellcome Open Res. 3 , 124 (2018).
Артикул
PubMed Central
Google ученый
Стаден Р., Бил К. Ф. и Бонфилд Дж. К. Пакет Стадена, 1998. Методы Мол Биол 132 , 115–130 (2000).
CAS
PubMed
PubMed Central
Google ученый
Бертани, Г. Исследования по лизогенезу. I. Способ высвобождения фага лизогенными Escherichia coli. J Bacteriol 62 , 293–300 (1951).
CAS
PubMed
PubMed Central
Google ученый
Wang, S. et al. . Векторы вакцины против сальмонелл, демонстрирующие замедленный синтез антигена in vivo , для повышения иммуногенности. Инфекция иммунной 78 , 3969–3980 (2010).
et al. . Векторы вакцины против сальмонелл, демонстрирующие замедленный синтез антигена in vivo , для повышения иммуногенности. Инфекция иммунной 78 , 3969–3980 (2010).
CAS
Статья
PubMed Central
Google ученый
Sun, W., Sanapala, S., Rahav, H. & Curtiss, R. Пероральное введение рекомбинантного аттенуированного штамма Yersinia pseudotuberculosis вызывает защитный иммунитет против чумы. Вакцина 33 , 6727–6735 (2015).
CAS
Статья
PubMed Central
Google ученый
Sun, X., Threadgill, D. и Jobin, C. Campylobacter jejuni индуцирует колит посредством активации у млекопитающих-мишеней передачи сигналов рапамицина. Гастроэнтерология 142 , 86–95. e5 (2012).
e5 (2012).
CAS
Статья
PubMed Central
Google ученый
Karrasch, T., Kim, J.-S., Muhlbauer, M., Magness, ST & Jobin, C. Gnotobiotic IL-10 — / -; NF-kappa B (EGFP) мыши обнаруживают критическая роль передачи сигналов TLR / NF-каппа B в колите, индуцированном комменсальными бактериями. J Immunol 178 , 6522–6532 (2007).
CAS
Статья
PubMed Central
Google ученый
Новый механизм бактериальной вирулентности?
648 Краткие отчеты CID 1998; 27 (сентябрь)
9. Brown S, Becher J, Brady W. Лечение эктопаразитарных инфекций: обзор 15. Shelley WB, Shelley ED, Burmeister V. Колонизация Staphylococcus aureus-
ция норы в норвежской эритродермической чесотке.Тематическое исследование
англоязычной литературы, 1982–1992 гг. Clin Infect Dis 1995;
Clin Infect Dis 1995;
Ятрогенная инфекция. J Am Acad Dermatol 1988; 19: 673–8.
20 (приложение 1): S104–9.
16. Гловер Р., Янг Л., Гольц Р. В.. Норвежская чесотка в приобретенном иммуноде —
10. Мейнкинг Т.Л., Таплин Д. Безопасность перметрина по сравнению с линданом при лечении.
Синдром эффективности: отчет о случае, приведшем к смерти от
ассоциированной чесотки. Arch Dermatol 1996; 132: 959 — 62.
сепсис [письмо]. J Am Acad Dermatol 1987; 16: 396–9.
11. Franz TJ, Lehman PA, Franz SF, Guin JD. Сравнительный чрескожный
17. Meinking TL, Taplin D, Hermida JL, Pardo R, Kerdel FA. Обработка
абсорбция линдана и перметрина. Arch Dermatol 1996; 132:
чесотки с ивермектином. N Engl J Med 1995; 333: 26–30.
901–5.
18. Del Giudice P, Carles M, Couppie
´
P, et al. Успешное лечение корок
12.Первис RS, Тайринг СК. Вспышка линдан-устойчивой чесотки позволила успешно лечить
(норвежская) чесотка ивермектином у двух пациентов с человеческим иммунодефицитом
с применением 5% крема с перметрином. J Am Acad Dermatol 1991;
J Am Acad Dermatol 1991;
Инфекция, вызванная вирусом муно-дефицита [письмо]. BJ Dermatol 1996; 135:
25: 1015–6.
494–5.
13. Соломон Б.А., Верхний С.Р., Карр Е.М., Шалита А.Р. Нейротоксическая реакция на
19. Рейнтьес Р., Хук К. Смерти, связанные с ивермектином от чесотки [письмо].
линдан у ВИЧ-положительного пациента. Новая проблема старого лекарства
Lancet 1997; 350: 215–6.
лем. J Fam Pract 1995; 40: 291 — 6.
20. Диасгранадос, JA, Costa JL. Смертность после лечения ивермектином [письмо].
14. Funkhouser ME, Omohundro C, Ross A, Berger TG. Управление
Lancet 1997; 349: 1698.
чесотка у пациентов с болезнью, вызванной вирусом иммунодефицита человека [письмо].
21. Оркин М. Чесотка: что нового? Curr Probl Dermatol 1995; 22: 105–11.
Arch Dermatol 1993; 129: 911 — 3.
22. Фишман Х.С. Дерматит от крысиного клеща. Кутис 1988; 42: 414–6.
Начали терапию цефтриаксоном в / в 2 г / сут в течение 2 дней.
Кровавая диарея, вызванная Klebsiella pneumoniae: состояние пациента
быстро улучшилось, и лабораторная оценка
Новый механизм бактериальной вирулентности?
— гематологические показатели исправлены. В это время повторный посев стула
был отрицательным на K.пневмония.
Klebsiella pneumoniae и Klebsiella oxytoca, оба com-
K. pneumoniae и K. oxytoca, оба комменсалы человека
, передаваемые через желудочно-кишечный тракт человека, были зарегистрированы
желудочно-кишечного тракта, иногда вызывают диарею у людей [1] ].
может быть случайной причиной диареи у людей [1]. Мы описываем
Некоторые из этих диареегенных штаммов кодируют термостабильные или термо-
пациента с кровавой диареей, вызванной К.пневмония.
молабильный токсин [1], или уникальный цитотоксин, который вызывает округление
66-летняя женщина поступила для оценки лихорадки
клеток культуры ткани [2]. Однако роль этих токсинов в
(температура 38,57 ° С), слабость и кровавый понос. Один
Один
патогенез диареи, ассоциированной с клебсиеллой, не был прояснен за неделю до госпитализации, в последний день ее визита в Египет,
ed. В этом изоляте не было обнаружено последовательностей
, которые она получила неизвестный антибиотик для лечения резкого
, гомологичного генам энтеропатогенных E.coli, которые кодируют
начало диареи и лихорадки. Применение антибиотика было прекращено на
из-за термолабильных и термостабильных токсинов, которые производятся на
на следующий день из-за генерализованного зуда и крапивницы.
некоторые штаммы K. pneumoniae.
При медицинском осмотре выявлены боли в животе и тошнота.
Один из способов связи кишечных патогенов с кишечником.
Лабораторная оценка показала следующие значения: лейкоциты,
клетки — это перестройка цитоскелета.Изолят K. pneumoniae
3,5 1 10
9
/ л; тромбоциты, 101 1 10
9
/ л; и гемоглобин,
проявлял свойства связывания с клетками HeLa (фигура 1A), а cy-
13,0 г / дл. У нее не было ослабленного иммунитета, и у нее был ВИЧ
У нее не было ослабленного иммунитета, и у нее был ВИЧ
, скелетные белки, такие как актин, накапливались в точке отрицательного результата
. Культуры крови были отрицательными на бактерии. Microbio-
логическая оценка стула была отрицательной на сальмонеллу, контакт шибактерии с хозяином (рисунок 1B).Было обнаружено, что изолят представляет собой
gella и виды Yersinia; энтеропатогенная кишечная палочка;
отрицательный при тестировании на наличие последовательностей ДНК
видов Campylobacter; и Clostridium difficile. Культура кала —
кодирует факторы вирулентности, которые ранее приписывались
культурам K. pneumoniae, которые были выделены в виде чистой культуры на
патогенных штаммах E. coli, которые вызывают кровавую диарею.
Среда Дригальского (лактозно-пурпурный кристалл). ; Diagnostic Pasteur,
или дизентерийные синдромы (гены, кодирующие SLT-I и SLT-II, ipaH
Marnes la Coquette, Франция) и были устойчивы к гену хлорамфени-
).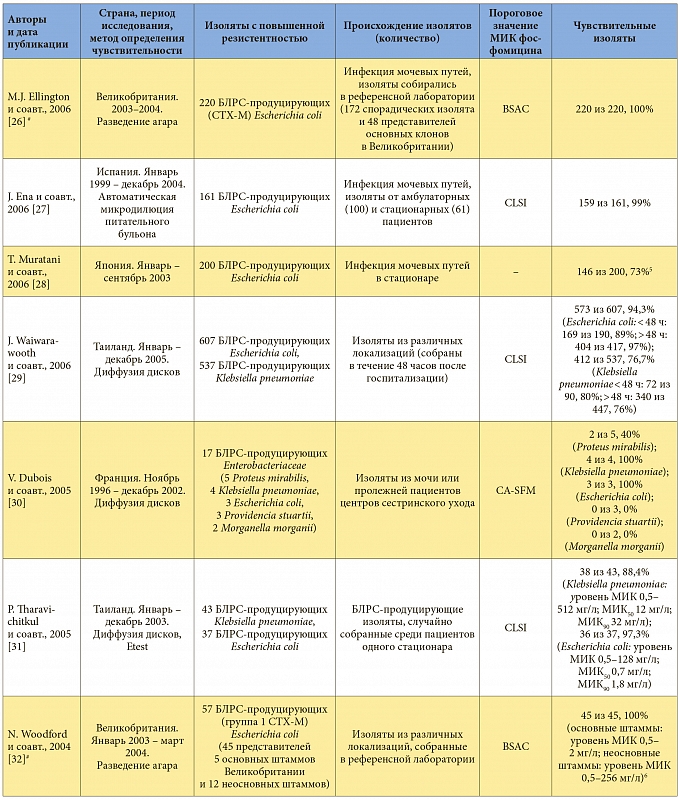
col, сульфамиды и фторхинолоны. Оценка паразитов
Способность связываться с культивируемыми эпителиальными клетками и способствовать развитию
(Giardia lamblia, Entamoeba histolytica, Schistosoma man-
, модификация цитоскелета описана в энтеропато-
soni) была отрицательной. Ни ротавирусов, ни аденовирусов не было обнаружено генной E. coli
(EPEC). Штаммы EPEC прикрепляются к кишечнику
tected.
слизистой оболочки и образуют резкое «прикрепление и стирание» (A–
E) поражение [3, 4].Важные перестройки цитоскелета
(цитоскелетные белки) наблюдаются под прикрепленными бактериями
терии, включая актин [5]. Эти перестройки коррелируют с
Перепечатки или переписка: Д-р FW Goldstein, Service de Microbiologie
наличие хромосомного локуса LEE (локус для энтероцита
Me
´
dicale, Fondation Ho
ˆ
pital Joseph, 185 rue Raymond Losserand, 75014
effacement) и с геном eaeA, кодирующим интимин. Есть
Есть
Париж, Франция.
не было обнаружено последовательностью в нашем изоляте, который был гомологичен
Clinical Infectious Diseases 1998; 27: 648–9
к гену EPEC eaeA или к гену, кодирующему адгезию
q 1998, по данным Американского общества инфекционистов. Все права защищены.
1058–4838 / 98 / 2703–0037 $ 03.00
EPEC штаммы клетки HeLa (ген bfpA). Одно объяснение для
/ 9c55 $$ se16 08-24-98 05:26:17 cidas UC: CID
гостем 29 декабря 2011 г. http://cid.oxfordjournals.org/ Загружено с
Предпосылки, Патофизиология, Эпидемиология клебсиелл
Манделл. Enterobacteriaceae. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета . 7-е изд. Черчилль Ливингстон, отпечаток Эльзевьера; 2009.
Nordmann P, Cuzon G, Naas T. Реальная угроза бактерий, продуцирующих карбапенемазу Klebsiella pneumoniae. Ланцет Infect Dis . 2009 Апрель 9 (4): 228-36.[Медлайн].
Ланцет Infect Dis . 2009 Апрель 9 (4): 228-36.[Медлайн].
Чжоу И., Ван Х, Шен Дж, Лу З., Лю Ю. Эндогенный эндофтальмит, вызванный устойчивой к карбапенемам гипервирулентной клебсиеллой пневмонией: отчет о болезни и обзор литературы. Окул Иммунол Инфламм . 2018 19 сен. 1-6. [Медлайн].
Лю З., Гу И, Ли Х, Лю И, Йе И, Гуань С. и др. Идентификация и характеристика гипервирулентного (гипермуковязкого), продуцирующего NDM-1 Klebsiella pneumoniae в Китае. Энн Лаб Мед .2019 марта 39 (2): 167-175. [Медлайн].
Сузуки К., Ямагути Т., Янаи М. Одновременное возникновение гипермуковязкости Klebsiella pneumoniae эмфизематозный абсцесс простаты, эмфизематозный цистит и почечный абсцесс. Документы, удостоверяющие личность . 2018. 14: e00464. [Медлайн].
Вон С.Ю., Муньос-Прайс Л.С., Лоланс К., Хота Б., Вайнштейн Р.А., Хайден М.К. Возникновение и быстрое региональное распространение энтеробактерий Klebsiella pneumoniae, продуцирующих карбапенемазу. Клин Инфект Дис . 2011 Сентябрь 53 (6): 532-540. [Медлайн].
Ливермор DM. Четырнадцать лет сопротивления. Int J Антимикробные агенты . 2012 Апрель 39 (4): 283-94. [Медлайн].
Мифтод Э, Дорняну О., Лека Д., Теодор А., Михалаче Д., Филип О. и др. [Профиль устойчивости к противомикробным препаратам E. coli и Klebsiella spp. из мочи в Инфекционной больнице Яссы]. Rev Med Chir Soc Med Nat Iasi . 2008 апр-июн. 113 (2): 478-82. [Медлайн].
coli и Klebsiella spp. из мочи в Инфекционной больнице Яссы]. Rev Med Chir Soc Med Nat Iasi . 2008 апр-июн. 113 (2): 478-82. [Медлайн].
Tu YC, Lu MC, Chiang MK, Huang SP, Peng HL, Chang HY и др. Генетические требования для абсцесса печени, вызванного Klebsiella pneumoniae, на модели оральной инфекции. Заражение иммунной . 2009 г. 11 мая [Medline].
Муньос-Прайс Л.С., Пуарель Л., Бономо Р.А., Швабер М.Дж., Дайкос Г.Л., Кормикан М. и др. Клиническая эпидемиология глобального распространения карбапенемаз Klebsiella pneumoniae. Ланцет Infect Dis . 2013 Сентябрь 13 (9): 785-96. [Медлайн].
Fevre C, Passet V, Deletoile A, Barbe V, Frangeul L, Almeida AS и др. Идентификация Klebsiella pneumoniae subsp. На основе ПЦР. rhinoscleromatis, возбудитель риносклеромы. PLoS Негл Троп Дис . 2011 Май. 5 (5): e1052. [Медлайн]. [Полный текст].
2011 Май. 5 (5): e1052. [Медлайн]. [Полный текст].
Гупта Н., Лимбаго Б.М., Патель Дж. Б., Каллен А. Дж.. Карбапенем-устойчивые Enterobacteriaceae: эпидемиология и профилактика. Клин Инфект Дис . 2011 г. 1. 53 (1): 60-7. [Медлайн].
ван Дуин Д., Бономо, РА. Цефтазидим / авибактам и цефтолозан / тазобактам: комбинации ингибиторов β-лактама / β-лактамазы второго поколения. Клин Инфект Дис . 2016 15 июля.63 (2): 234-41. [Медлайн]. [Полный текст].
Loutit JS и др. Меропенем-ваборбактам (MV) в сравнении с пиперациллин-тазобактамом (PT) при лечении взрослых с осложненными инфекциями мочевыводящих путей (cUTI), включая острый пиелонефрит (AP), в рандомизированном, двойном слепом двойном испытании фазы 3 (TANGO) 1). Открытый форум по инфекционным болезням . 2016. Т. 3. No. suppl_1: Представлено Американским обществом инфекционных болезней IDWeek. Сан-Диего, Калифорния. 4-8 октября 2017 г.[Полный текст].
Сан-Диего, Калифорния. 4-8 октября 2017 г.[Полный текст].
Дойл Д., Пейрано Дж., Ласколс С., Ллойд Т., Черч Д.Л., Питаут Дж. Д.. Лабораторное обнаружение энтеробактерий, продуцирующих карбапенемазы. Дж. Клин Микробиол . 2012 декабрь 50 (12): 3877-80. [Медлайн]. [Полный текст].
Weisenberg SA, Morgan DJ, Espinal-Witter R, Larone DH. Клинические результаты у пациентов с Klebsiella pneumoniae, продуцирующей карбапенемазу K. pneumoniae, после лечения имипенемом или меропенемом. Диагностика микробиологических инфекций .2009 г., 1 апреля [Medline].
Чан Ю. Р., Лю Дж. С., Почаск Д. А., Чжэн М., Мицнер Т. А., Бергер Т. и др. Липокалин 2 необходим для защиты легочного организма от инфекции клебсиелл. Дж Иммунол . 2009 15 апреля. 182 (8): 4947-56. [Медлайн].
Аль-Рабеа А.А., Бурвен Д.Р., Элдин М.А. и др. Инфекции кровотока Klebsiella pneumoniae у новорожденных в больнице Королевства Саудовская Аравия. Инфекционный контроль Hosp Epidemiol . 1998 сентября 19 (9): 674-9. [Медлайн].
Андерсон MJ, Janoff EN. Клебсиеллезный эндокардит: отчет о двух случаях и обзор. Клин Инфект Дис . 1998 26 февраля (2): 468-74. [Медлайн].
Blaser J, Konig C, Simmen HP, Thurnheer U.Мониторинг сывороточных концентраций для схем дозирования нетилмицина один раз в сутки. J Антимикробный Chemother . 1994 Февраль 33 (2): 341-8. [Медлайн].
[Медлайн].
Bodey GP, Elting LS, Rodriquez S, Hernandez M. Klebsiella bacteremia. 10-летний обзор в онкологическом учреждении. Рак . 1989 декабрь 1. 64 (11): 2368-76. [Медлайн].
Branger J, Florquin S, Knapp S. Мыши с дефицитом LPS-связывающего белка имеют нарушенную защиту против грамотрицательной, но не грамположительной пневмонии. Инт Иммунол . 2004 16 ноября (11): 1605-11. [Медлайн].
Эйнштейн Б.И. Enterobacteriaceae. В: Mandell GL, Bennett JE, Dolin E, eds. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета. Том 2. 5 изд. Нью-Йорк, Нью-Йорк: Черчилль Ливингстон; 2000: . 2294-310.
Фермер JJ. Enterobacteriaceae: введение и идентификация. В: Murray PR, Baron, EJ, Pfaller MA, eds. Руководство по клинической микробиологии. 7 изд. Вашингтон, округ Колумбия: Американское общество микробиологии; 1999: . 438-47.
7 изд. Вашингтон, округ Колумбия: Американское общество микробиологии; 1999: . 438-47.
Fisman DN, Kaye KM. Дозировка аминогликозидных антибиотиков один раз в день. Инфекция Dis Clin North Am . 14 июня 2000 г. (2): 475-87. [Медлайн].
Gamea AM, Эль-Татави, FA. Влияние рифампицина на риносклерому: электронно-микроскопическое исследование. Дж Ларингол Отол . 1990 Октябрь 104 (10): 772-7. [Медлайн].
Hirche TO, Gaut JP, Heinecke JW.Миелопероксидаза играет решающую роль в уничтожении Klebsiella pneumoniae и инактивации эластазы нейтрофилов: влияет на защиту организма. Дж Иммунол . 2005 г., 1. 174 (3): 1557-65. [Медлайн].
Kaye KS, Fraimow HS, Abrutyn E. Патогены, устойчивые к антимикробным агентам. Эпидемиология, молекулярные механизмы и клиническое ведение. Инфекция Dis Clin North Am . 2000 июня, 14 (2): 293-319. [Медлайн].
Инфекция Dis Clin North Am . 2000 июня, 14 (2): 293-319. [Медлайн].
Химджи ПЛ, Майлз А.А.Микробные хелаторы железа и их действие на клебсиеллёзные инфекции кожи морских свинок. Br J Exp Pathol . 1978, апр. 59 (2): 137-47. [Медлайн].
Кобаши Ю., Фудзита К., Карино Т. и др. [Клинический анализ внебольничной пневмонии, требующей госпитализации в общественную больницу — сравнение пожилых и не пожилых пациентов]. Кансенсогаку Дзасси . 2000, январь, 74 (1): 43-50. [Медлайн].
Кобаши Й, Охба Х, Йонеяма Х и др.[Клинический анализ пациентов с внебольничной пневмонией, требующих госпитализации, по возрастным группам]. Кансенсогаку Дзасси . 2001 Март 75 (3): 193-200. [Медлайн].
Корвик Дж. А., Брайан С. С., Фарбер Б. и др. Проспективное обсервационное исследование бактериемии Klebsiella у 230 пациентов: исход для комбинации антибиотиков по сравнению с монотерапией. Противомикробные агенты Chemother . 1992 Декабрь 36 (12): 2639-44. [Медлайн].
и др. Проспективное обсервационное исследование бактериемии Klebsiella у 230 пациентов: исход для комбинации антибиотиков по сравнению с монотерапией. Противомикробные агенты Chemother . 1992 Декабрь 36 (12): 2639-44. [Медлайн].
Лиам К.К., Лим К.Х., Вонг СМ.Внебольничная пневмония у пациентов, нуждающихся в госпитализации. Респирология . 2001 Сентябрь 6 (3): 259-64. [Медлайн].
Lucente FE. Ринит и заложенность носа. Otolaryngol Clin North Am . 1989, 22 апреля (2): 307-18. [Медлайн].
Mentec H, Vallois JM, Bure A и др. Пиперациллин, тазобактам и гентамицин по отдельности или в комбинации в модели эндокардита инфекции штаммом Klebsiella pneumoniae, продуцирующим ТЕМ-3, или его чувствительным вариантом. Противомикробные агенты Chemother . 1992 сентября, 36 (9): 1883-9. [Медлайн].
[Медлайн].
Merino S, Camprubi S, Alberti S и др. Механизмы устойчивости Klebsiella pneumoniae к уничтожению, опосредованному комплементом. Заражение иммунной . 1992 июн. 60 (6): 2529-35. [Медлайн].
Николау Д.П., Фриман С.Д., Белливо П.П. и др. Опыт применения программы приема аминогликозидов один раз в день у 2184 взрослых пациентов. Противомикробные агенты Chemother .1995 г., 39 (3): 650-5. [Медлайн].
Патерсон DL. Рекомендации по лечению тяжелых инфекций, вызванных энтеробактериями, продуцирующими бета-лактамазы расширенного спектра (БЛРС). Clin Microbiol Infect . 2000 Сентябрь 6 (9): 460-3. [Медлайн].
Патерсон DL, Тренхольм GM. Виды клебсиелл. В: Yu VL, Merigan TC, Barriere SL, eds. Антимикробная терапия и вакцины.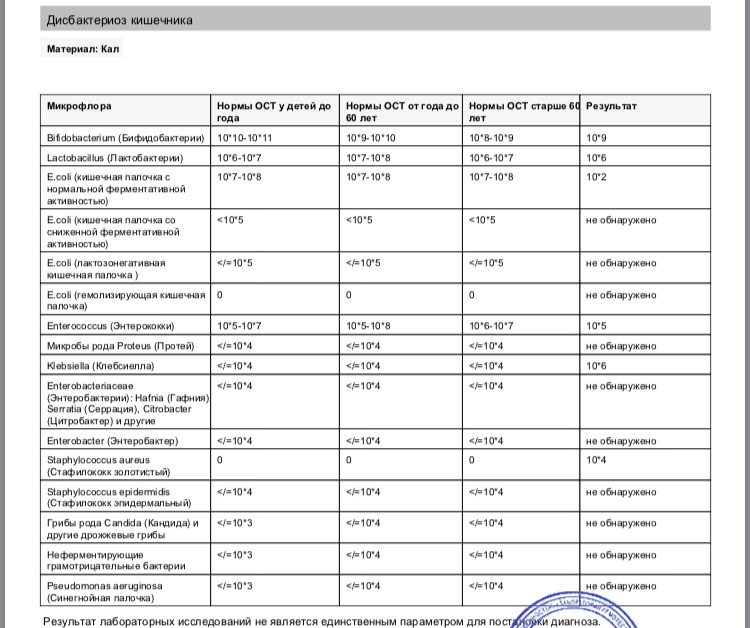 Балтимор, Мэриленд: Уильямс и Уилкинс; 1999: .239-48.
Балтимор, Мэриленд: Уильямс и Уилкинс; 1999: .239-48.
Podschun R, Ullmann U. Klebsiella spp. как внутрибольничные патогены: эпидемиология, систематика, методы типирования, факторы патогенности. Clin Microbiol Ред. . 1998, 11 октября (4): 589-603. [Медлайн].
Прабакер К., Лин М.Ю., МакНалли М., Черабудди К., Ахмед С., Норрис А. Перевод из учреждений длительного ухода за больными связан с носительством энтеробактерий, продуцирующих карбапенемазу Klebsiella pneumoniae: многобольничное исследование. Инфекционный контроль Hosp Epidemiol . 2012 декабрь 33 (12): 1193-9. [Медлайн].
Prince SE, Dominger KA, Cunha BA, Klein NC. Klebsiella pneumoniae pneumonia. Сердце легкое . 1997 сентябрь-октябрь. 26 (5): 413-7. [Медлайн].
Rice L. Эволюция и клиническое значение бета-лактамаз расширенного спектра действия. Сундук . 2001 фев. 119 (2 доп.): 391S-396S. [Медлайн].
Riser E, Noone P, Howard FM. Эпидемиологическое исследование инфекции клебсиелл в отделении особого ухода за младенцами лондонской больницы. Дж. Клин Патол . 1980, апрель, 33 (4): 400-7. [Медлайн].
Sahly H, Podschun R. Клинические, бактериологические и серологические аспекты инфекций, вызываемых клебсиеллами, и их спондилоартропатических последствий. Clin Diagn Lab Immunol .1997 июл.4 (4): 393-9. [Медлайн].
Сахли Х., Подщун Р., Ульманн У. Инфекции клебсиелл у хозяина с ослабленным иммунитетом.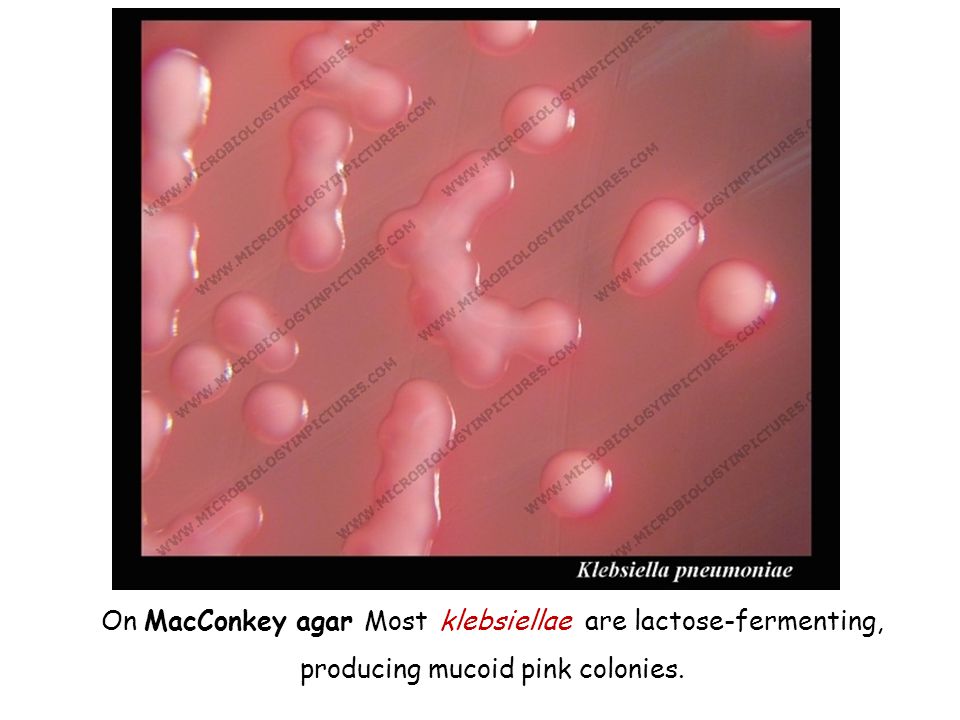 Adv Exp Med Biol . 2000. 479: 237-49. [Медлайн].
Adv Exp Med Biol . 2000. 479: 237-49. [Медлайн].
Sedor J, Mulholland SG. Внутрибольничные инфекции мочевыводящих путей, связанные с постоянным катетером. Урол Клин Норт Ам . 1999 26 ноября (4): 821-8. [Медлайн].
Сегал-Маурер С., Мариано Н., Кави А. и др.Успешное лечение цефтазидим-резистентного вентрикулита Klebsiella pneumoniae с помощью внутривенного меропенема и внутрижелудочкового полимиксина B: отчет о клиническом случае и обзор. Клин Инфект Дис . 1999 Май. 28 (5): 1134-8. [Медлайн].
Сиджабат Х., Ниммо Г.Р., Уолш Т.Р., Бинотто Э., Хтин А, Хаяши Й. и др. Устойчивость к карбапенемам у Klebsiella pneumoniae за счет металло-ß-лактамазы Нью-Дели. Клин Инфект Дис . 2011 Февраль 52 (4): 481-4. [Медлайн].
Тойванен П. , Хансен Д.С., Местре Ф.Соматические серогруппы, капсульные типы и виды фекальных клебсиелл у пациентов с анкилозирующим спондилитом. Дж. Клин Микробиол . 1999 сентябрь 37 (9): 2808-12. [Медлайн].
, Хансен Д.С., Местре Ф.Соматические серогруппы, капсульные типы и виды фекальных клебсиелл у пациентов с анкилозирующим спондилитом. Дж. Клин Микробиол . 1999 сентябрь 37 (9): 2808-12. [Медлайн].
Tomas JM, Benedi VJ, Ciurana B, Jofre J. Роль капсулы и O-антигена в устойчивости Klebsiella pneumoniae к бактерицидной активности сыворотки. Заражение иммунной . 1986 г., 54 (1): 85-9. [Медлайн].
Urban AW, Craig WA. Суточная дозировка аминогликозидов. Curr Clin Top Infect Dis . 1997. 17: 236-55. [Медлайн].
Уоррен Дж. У. Катетер-ассоциированные инфекции мочевыводящих путей. Int J Антимикробные агенты . 2001 г., 17 (4): 299-303. [Медлайн].
Зохар Ю., Талми Ю.П., Штраус М. и др. Снова посетила Озена. Дж Отоларингол .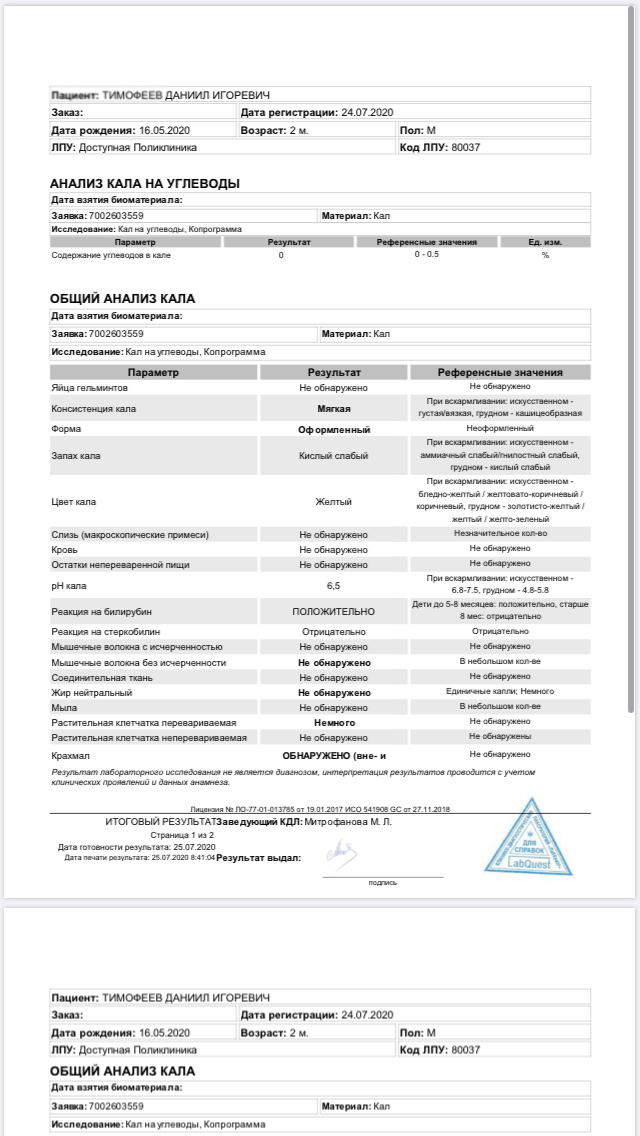 1990 октября 19 (5): 345-9. [Медлайн].
1990 октября 19 (5): 345-9. [Медлайн].
Мур П.П., Макгоуэн Г.Ф., Сандху С.С., Аллен П.Дж.. Klebsiella pneumoniae абсцесс печени, осложненный эндогенным эндофтальмитом: важность ранней диагностики и вмешательства. Med J Aust . 2015 Октябрь 5. 203 (7): 300-1. [Медлайн].
Модель на животных для изучения кишечной колонизации Klebsiella pneumoniae и передачи от хозяина к хозяину
Abstract
Важным, но малоизученным аспектом жизненного цикла успешного патогена является передача от хозяина к хозяину. Внутрибольничные инфекции (HAI), возникающие в результате передачи устойчивых к лекарствам патогенов, поражают сотни миллионов пациентов во всем мире. Klebsiella pneumoniae ( Kpn ), грамотрицательная бактерия, печально известна тем, что вызывает HAI, при этом многие из этих инфекций трудно поддаются лечению, поскольку Kpn приобрела множественную лекарственную устойчивость.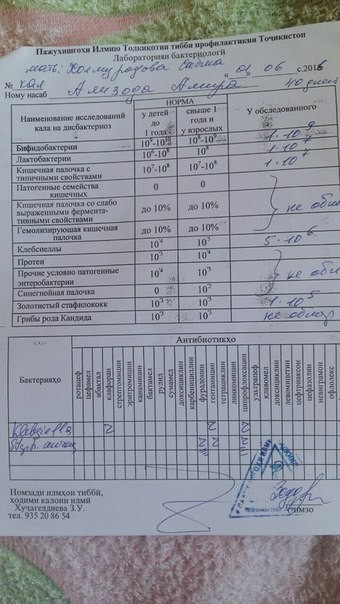 Эпидемиологические исследования показывают, что передача Kpn от хозяина к хозяину требует тесного контакта и обычно происходит фекально-оральным путем. Здесь мы описываем мышиную модель, которую можно использовать для изучения колонизации слизистой оболочки (ротоглотки и желудочно-кишечного тракта [GI]), выделения с фекалиями и передачи Kpn фекально-оральным путем. Используя пероральный путь инокуляции и выделение фекалий в качестве маркера колонизации GI, мы показали, что Kpn может бессимптомно колонизировать желудочно-кишечный тракт иммунокомпетентных мышей и изменяет микробиоту GI хозяина.Плотность колонизации в желудочно-кишечном тракте и уровни выделения с фекалиями различались среди протестированных клинических изолятов. Гипервирулентный изолят Kpn был способен перемещаться из желудочно-кишечного тракта и вызывать инфекцию печени, имитирующую путь заражения человека. Экспрессия капсулы требовалась для колонизации и, в свою очередь, для устойчивого отторжения.
Эпидемиологические исследования показывают, что передача Kpn от хозяина к хозяину требует тесного контакта и обычно происходит фекально-оральным путем. Здесь мы описываем мышиную модель, которую можно использовать для изучения колонизации слизистой оболочки (ротоглотки и желудочно-кишечного тракта [GI]), выделения с фекалиями и передачи Kpn фекально-оральным путем. Используя пероральный путь инокуляции и выделение фекалий в качестве маркера колонизации GI, мы показали, что Kpn может бессимптомно колонизировать желудочно-кишечный тракт иммунокомпетентных мышей и изменяет микробиоту GI хозяина.Плотность колонизации в желудочно-кишечном тракте и уровни выделения с фекалиями различались среди протестированных клинических изолятов. Гипервирулентный изолят Kpn был способен перемещаться из желудочно-кишечного тракта и вызывать инфекцию печени, имитирующую путь заражения человека. Экспрессия капсулы требовалась для колонизации и, в свою очередь, для устойчивого отторжения. Кроме того, мышей-носителей Kpn были способны передавать инфекции неинфицированным совместно проживающим мышам. Наконец, лечение антибиотиками привело к изменениям в микробиоте хозяина и развитию временного фенотипа суперседдера, что повысило эффективность передачи.Таким образом, эту модель можно использовать для определения вклада факторов хозяина и бактерий в распространение Kpn .
Кроме того, мышей-носителей Kpn были способны передавать инфекции неинфицированным совместно проживающим мышам. Наконец, лечение антибиотиками привело к изменениям в микробиоте хозяина и развитию временного фенотипа суперседдера, что повысило эффективность передачи.Таким образом, эту модель можно использовать для определения вклада факторов хозяина и бактерий в распространение Kpn .
Введение
Передача патогенов от хозяина к хозяину является основным источником внутрибольничных инфекций, которые считаются серьезной угрозой для здоровья пациента, а также значительным бременем для системы здравоохранения (1, 2). Только в США на внутрибольничные инфекции (HAI) приходится около 100 000 смертей (3). Основной причиной этих внутрибольничных инфекций и множественных вспышек в больницах по всему миру является Klebsiella pneumoniae ( K.pneumoniae ; Kpn ), член семейства Enterobacteriaceae , который часто вызывает пневмонию, бактериемию, гнойные абсцессы печени и инфекции мочевыводящих путей (4), причем большинство этих инфекций обычно возникает у пациентов с ослабленным иммунитетом. С повсеместным использованием антибиотиков изоляты Kpn приобрели широкую лекарственную устойчивость, а некоторые из них теперь даже считаются устойчивыми к лекарственным средствам, что делает вызываемые ими инфекции чрезвычайно трудными для лечения (5-7).По этой причине ВОЗ перечисляет Klebsiella pneumoniae как критический патоген, для которого срочно требуются новые антибиотики и другие методы лечения для решения этой растущей проблемы здравоохранения (8, 9). Дальнейшее обострение лечения инфекций Kpn — это недавняя идентификация изолятов, названных «гипервирулентными K. pneumoniae » ( hvKP ), которые могут вызывать заболевания, такие как внебольничные гнойные абсцессы печени у здоровых людей (10–12). Пациенты, выздоравливающие после инфекций hvKP , часто страдают от постинфекционных осложнений, которые могут привести к потере конечности или зрения (13-15).Эти штаммы, первоначально изолированные в Азиатско-Тихоокеанском регионе, с тех пор распространились по всему миру (10).
С повсеместным использованием антибиотиков изоляты Kpn приобрели широкую лекарственную устойчивость, а некоторые из них теперь даже считаются устойчивыми к лекарственным средствам, что делает вызываемые ими инфекции чрезвычайно трудными для лечения (5-7).По этой причине ВОЗ перечисляет Klebsiella pneumoniae как критический патоген, для которого срочно требуются новые антибиотики и другие методы лечения для решения этой растущей проблемы здравоохранения (8, 9). Дальнейшее обострение лечения инфекций Kpn — это недавняя идентификация изолятов, названных «гипервирулентными K. pneumoniae » ( hvKP ), которые могут вызывать заболевания, такие как внебольничные гнойные абсцессы печени у здоровых людей (10–12). Пациенты, выздоравливающие после инфекций hvKP , часто страдают от постинфекционных осложнений, которые могут привести к потере конечности или зрения (13-15).Эти штаммы, первоначально изолированные в Азиатско-Тихоокеанском регионе, с тех пор распространились по всему миру (10).
В естественной среде первыми местами колонизации слизистой оболочки обычно являются ротоглотка и желудочно-кишечный тракт (16, 17). Эти события колонизации обычно протекают бессимптомно (18). Однако при определенных обстоятельствах Kpn может получить доступ к другим стерильным участкам хозяина и вызвать заболевание. Эпидемиологические данные показывают, что многие пациенты в больницах являются носителями Kpn в желудочно-кишечном тракте, с корреляцией между носительством Kpn и последующим заболеванием от того же изолята (19-21).Помимо пациентов, персонал больницы также может быть бессимптомным носителем Kpn , и эти тихие носители действуют как резервуар, из которого Kpn может проявлять болезнь у одного и того же хозяина или действовать как источник передачи новому хозяину (18, 22 -24).
Устойчивость к колонизации, обеспечиваемая микробиотой хозяина, играет решающую роль в блокировании колонизации патогенами. Однако использование антибиотиков снижает микробное разнообразие в желудочно-кишечном тракте, что потенциально позволяет Kpn легко колонизировать хозяина. Исследования также показывают, что лечение мышей антибиотиками предрасполагает их к состоянию «супершеддера», когда они выделяют резидентные патогены кишечника в большем количестве, что усиливает передачу от хозяина к хозяину (25, 26). Однако неясно, способствует ли лечение антибиотиками в условиях больницы увеличению передачи лекарственно-устойчивого Kpn .
Исследования также показывают, что лечение мышей антибиотиками предрасполагает их к состоянию «супершеддера», когда они выделяют резидентные патогены кишечника в большем количестве, что усиливает передачу от хозяина к хозяину (25, 26). Однако неясно, способствует ли лечение антибиотиками в условиях больницы увеличению передачи лекарственно-устойчивого Kpn .
Наше понимание болезненного состояния, связанного с Klebsiella pneumoniae , получено в основном на животных моделях, изучающих инфекции легких и мочевыводящих путей.В то время как эти исследования выявили бактериальные факторы и факторы хозяина, которые вносят вклад в вирулентность Kpn , существует очень мало понимания механизмов колонизации желудочно-кишечного тракта и передачи от хозяина к хозяину. Считается, что тесный контакт, особенно в условиях больницы, способствует распространению Kpn от инфицированного хозяина к наивному хозяину. Считается, что передача происходит фекально-оральным путем, либо в результате плохой гигиены, либо при контакте с загрязненными поверхностями (фомитами) (20, 22-24).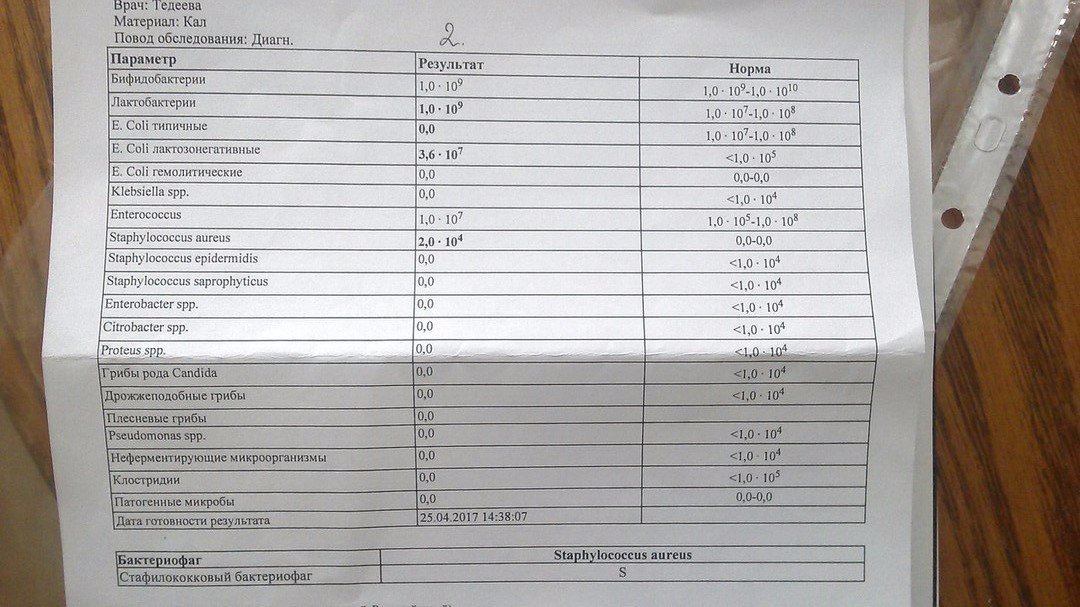
Здесь мы описываем новую мышиную модель, позволяющую изучать колонизацию Kpn GI, шеддинг и передачу от хозяина к хозяину. Используя пероральный способ инокуляции Kpn в популяции инбредных мышей, мы исследовали колонизацию и передачу K. pneumoniae в желудке. Мы демонстрируем, что Kpn может стабильно колонизировать желудочно-кишечный тракт без лечения антибиотиками, и эти мыши остаются постоянно колонизированными и могут передавать Kpn своим товарищам по клетке.Кроме того, лечение мышей-носителей антибиотиками вызывает дисбактериоз кишечника и запускает временный фенотип супершеддера.
Материалы и методы
Заявление об этике
Это исследование было проведено в соответствии с руководящими принципами, изложенными в требованиях к благополучию животных Национального научного фонда и Политике службы общественного здравоохранения в отношении гуманного ухода и использования лабораторных животных (27). Баптистский медицинский центр Wake Forest IACUC следит за благополучием, благополучием, надлежащим уходом и использованием всех позвоночных животных. Номер утвержденного протокола для этого проекта — A18-160.
Номер утвержденного протокола для этого проекта — A18-160.
Условия роста бактерий и конструкция штамма
Штаммы, использованные в исследовании, перечислены в таблице 1. Изоляты K. pneumoniae выращивали в бульоне Luria-Bertani (LB) Lennox при постоянном перемешивании при 37 ° C. Для всех инфекций мышей ночную культуру Kpn центрифугировали при ∼27000 x g в течение 15 минут, и полученный осадок ресуспендировали в аналогичном объеме 1X фосфатно-солевого буфера (PBS).Для получения желаемой плотности для инфекций мышей (10 6 КОЕ / 100 мкл) бактериальную суспензию в PBS разводили 2% раствором сахарозы-PBS. Десятикратные серийные разведения высевали на селективную среду (LB-Agar с антибиотиком) и инкубировали при 30 ° C в течение ночи для количественного культивирования. Планшеты LB, содержащие антибиотики, представляли собой стрептомицин (str, 500 мкг / мл), хлорамфеникол (50 мкг / мл), ампициллин (25 мкг / мл), апрамицин (50 мкг / мл), спектиномицин (30 мкг / мл) и рифампицин (30 мкг). / мл).
/ мл).
Ген wzi кодирует консервативный белок внешней мембраны, участвующий в прикреплении капсульного полисахарида к внешней мембране.Полиморфизм последовательностей в гене wzi был использован для идентификации и характеристики различных изолятов. Kpn AZ10 ( wzi 372), чувствительный к антибиотику изолят был сделан устойчивым к str, как описано, впоследствии был пассирован GI мыши и назван AZ99 (28, 29). Для конструирования мутанта fimH на соответствующем генетическом фоне была проведена ПЦР с использованием полимеразы Q5 (NEB) с геномной ДНК AZ101 в качестве матрицы и праймеров fimH перед (GGCGGTGATTAACGTCACCT) и fimH вниз по течению T (GATAGAGCAGCACGTT), которые дают гомология по крайней мере 500 пар оснований на любом конце кассеты транспозона.Продукт ПЦР очищали с использованием набора Qiagen MinElute. Мутагенез с лямбда-красным проводили, как описано ранее (30), и клетки выделяли в среде Super Optimal Broth с репрессией катаболита (SOC) при 30 ° C и встряхивании в течение ночи. Выделенные бактерии высевали на селективный агар LB, содержащий хлорамфеникол (50 мкг / мл). Отдельные колонии очищали, и мутацию подтверждали с помощью ПЦР.
Выделенные бактерии высевали на селективный агар LB, содержащий хлорамфеникол (50 мкг / мл). Отдельные колонии очищали, и мутацию подтверждали с помощью ПЦР.
Для определения ориентации промотора fim была проведена ПЦР с использованием образцов in vitro из бульона LB, отдельных колоний из чашек LB или образцов in vivo (фекальные гранулы) от мышей, инфицированных Kpn .Бульонную культуру центрифугировали, как описано выше, ресуспендировали в равном объеме dH 2 O и кипятили в течение 5 минут. Также одну колонию ресуспендировали в 10 мкл dH 2 O и кипятили в течение 5 минут. ДНК выделяли из фекальных осадков (100 мг) с использованием Quick-DNA ™ Fecal / Soil Microbe Microprep (Zymo Research). 5 мкл образца использовали в ПЦР с полимеразой OneTaq (NEB) с праймерами Cas168 GGGACAGATACGCGTTTGAT и Cas169 GCCTAACTGAACGGTTTGA, как описано ранее (31). Очищенный продукт ПЦР расщепляли рестриктазой HinFI (NEB) в течение 1 часа и разделяли на 1.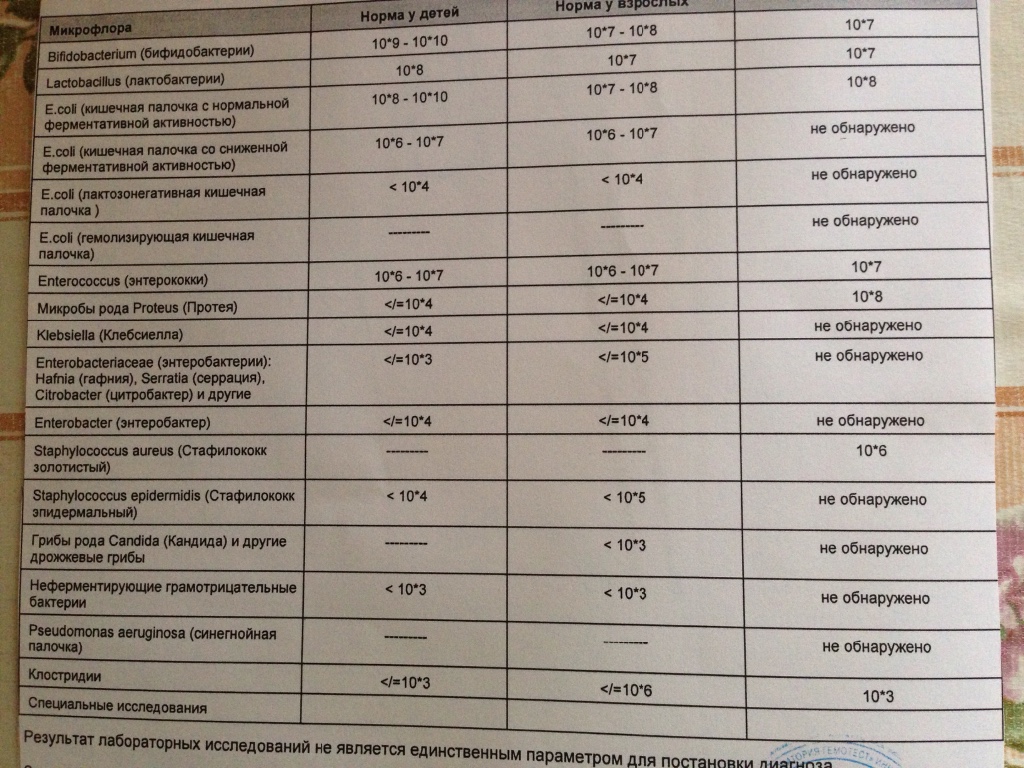 2% агарозный гель. Как установлено ранее, «выключенная ориентация» промотора fim приводит к полосам продукта размером 496 п.о. и 321 п.н., тогда как «включенная ориентация» дает полосы размером 605 п.о. и 212 п.н. (31).
2% агарозный гель. Как установлено ранее, «выключенная ориентация» промотора fim приводит к полосам продукта размером 496 п.о. и 321 п.н., тогда как «включенная ориентация» дает полосы размером 605 п.о. и 212 п.н. (31).
Инфекции мышей для колонизации и выделения
Колонии мышей C57BL / 6J (SPF), полученные из лаборатории Джексона (Бар-Харбор, штат Мэн), разводили и содержали в стандартном помещении для животных в Biotech Place, Wake Forest Baptist Medical Center. Все работы с животными выполнялись в соответствии с руководящими принципами Американской ассоциации лабораторных исследований животных (AALAS) {Worlein, 2011 # 87} и с одобрения Институционального комитета по уходу и использованию животных (IACUC) Медицинского центра баптистов Уэйк Форест.Мышей в возрасте 5-7 недель инфицировали и наблюдали за ними в ходе экспериментов. Пища была удалена от мышей за 6 часов до инокуляции. Мышей кормили примерно 10 6 КОЕ / 100 мкл K. pneumonia в двух дозах по 50 мкл 2% сахарозы-PBS с интервалом в час, из наконечника пипетки. Сразу после этого мышам возвращали пищу.
Сразу после этого мышам возвращали пищу.
Для количественной оценки ежедневного выделения бактерий мышей извлекали из их жилья и помещали в контейнеры для изоляции. Фекальные гранулы (~ 0,02 г, примерно 2 гранулы) собирали и помещали в пробирку с завинчивающейся крышкой на 2 мл (Fisherbrand, 02-682-558) вместе с по меньшей мере 2 стеклянными шариками (BioSpec, 11079127).Образцы разбавляли 1:10 в PBS (вес: объем). Для гомогенизации фекальных гранул использовали бисерную мельницу 24 (Fisherbrand) (2,1 настройки мощности, 1 мин). После этого пробирки вращали в мини-центрифуге (Thermo Scientific, MySpin 6) для осаждения более крупных частиц. Десятикратные серийные разведения высевали из супернатанта на соответствующие планшеты с антибиотиками и инкубировали в течение ночи при 30 ° C. Выделение бактерий рассчитывали в КОЕ на грамм фекалий. Предел обнаружения составил 100 КОЕ / г. Каждая мышь была уникально помечена, чтобы можно было отслеживать выделение фекалий каждой отдельной мыши на протяжении всего эксперимента.
Для запуска антибиотикозависимого фенотипа супершеддер Kpn мышей инфицировали перорально str-устойчивым Kpn , как описано выше. Через четыре-пять дней после инокуляции (p.i) мышам вводили зонд стрептомицином (5 мг / 200 мкл) либо один раз, либо в течение трех последовательных дней, и ежедневное выделение контролировали после лечения антибиотиками. Чтобы определить эффект лечения неомицином до инфицирования Kpn , мышам вводили однократную дозу (5 мг / 200 мкл) через желудочный зонд за 24 часа до инокуляции MKP103, производного изолята KPNIh2 с делецией гена, кодирующего карбапенемазу KPC-3. (32).Подсчет бактерий подсчитывали по фекальным осадкам, как описано выше. Чтобы определить роль непрерывного лечения антибиотиками в фенотипе супершеддера, питьевую воду заменяли водой, содержащей 1 г / л ампициллина, за 24 часа до заражения; мышей содержали на ампициллин-воде в течение 10 дней p.i. после чего их помещали в обычную воду до конца эксперимента. Фекальное выделение Kpn оценивали до 20 дней после заражения и количественно оценивали, как описано выше.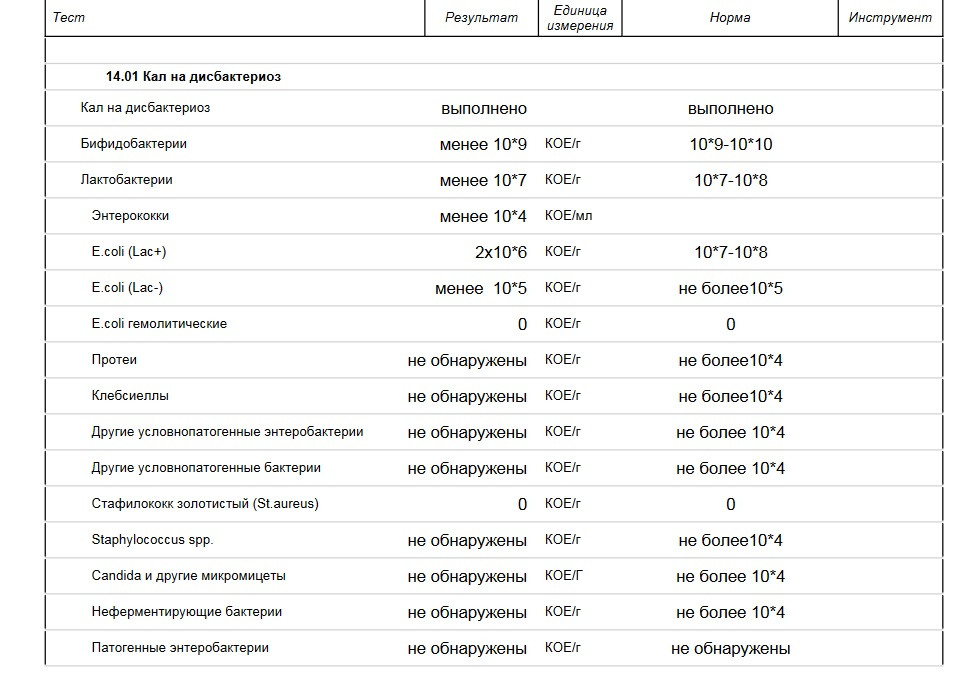
Для конкурентных экспериментов мышей инфицировали смесью AZ94 в соотношении 1: 1 и интересующего мутанта.Фекальное выделение обоих штаммов оценивали, как описано выше. Гомогенаты фекалий высевали на агар LB с апрамицином (50 мкг / мл) и str (500 мкг / мл). Индекс конкурентоспособности (CI) рассчитывался, как описано ранее (33), с использованием следующего уравнения:
Значение 0 предполагает, что ни один из штаммов не имеет преимущества. Значение> 1 указывает на то, что мутант имеет конкурентное преимущество, тогда как значение <1 указывает на преимущество WT.
Для определения плотности колонизации в желудочно-кишечном тракте подвздошную кишку, слепую кишку и толстую кишку удаляли в стерильных условиях сразу после CO 2 (2 л / мин, 5 мин) эвтаназии животных и последующей сердечной пункции.Слепая кишка, проксимальный отдел толстой кишки и участок конечного отдела подвздошной кишки, равный длине ободочной кишки, удаляли у каждого животного. Органы взвешивали и помещали в отдельные пробирки с завинчивающейся крышкой на 2 мл (Fisherbrand, 02-682-558), по меньшей мере, с 2 стеклянными шариками (BioSpec Products, 11079127). Образцы разбавляли 1:10 в PBS (масса: объем), гомогенизировали и высевали, как описано выше. Предел обнаружения составил 100 КОЕ / г.
Образцы разбавляли 1:10 в PBS (масса: объем), гомогенизировали и высевали, как описано выше. Предел обнаружения составил 100 КОЕ / г.
Для определения плотности колонизации в почках, печени и селезенке органы удаляли в стерильных условиях сразу после эвтаназии, как описано выше.Органы взвешивали и помещали в конические пробирки объемом 15 мл. Для почек и печени добавляли вес PBS, равный объему, и образцы гомогенизировали с использованием PowerGen 700 (настройка мощности 2 в течение 30 секунд), тогда как для селезенки к массе органа добавляли объем 1X PBS, в десять раз превышающий объем PBS, и гомогенизировали как над. Образцы наносили на чашки, как описано. Предел обнаружения почек и печени составил 33 КОЕ / мл, а для селезенки — 100 КОЕ / мл.
Промывание ротоглотки проводили 200 мкл стерильного PBS из желудочного зонда, введенного в пищевод.Пищевод был обнажен и разрезан в поперечном направлении. Затем в разрез пищевода вставляли иглу для желудочного зонда, присоединенную к предварительно заполненному инсулиновому шприцу (BD) 1X PBS, и собирали PBS изо рта. Собранный лаваж серийно разводили и высевали на соответствующие чашки с антибиотиками и инкубировали в течение ночи при 30 ° C. Предел обнаружения при промывании полости рта составил 33 КОЕ / мл.
Собранный лаваж серийно разводили и высевали на соответствующие чашки с антибиотиками и инкубировали в течение ночи при 30 ° C. Предел обнаружения при промывании полости рта составил 33 КОЕ / мл.
Исследования передачи
Для экспериментов по передаче 4: 1 и 1: 4 Мыши с индексом C57BL / 6J (n = 1 или n = 4) в возрасте 5-7 недель инфицированы Kpn , как описано выше, и происходит линька. собирают ежедневно для определения плотности колонизации желудочно-кишечного тракта.На 4 день p.i. контактных мышей (n = 4 или n = 1) помещали в клетки с индексными мышами. Фекальное выделение индексных и контактных мышей собирали и количественно оценивали в течение по меньшей мере 6 дней после сожительства, всего 10 дней для индексных мышей и 6 дней для контактных мышей. На 10 день мышей умерщвляли, как описано выше, и лаваж подвздошной кишки, слепой кишки, толстой кишки и полости рта всех мышей обрабатывали, как описано выше, для определения плотности колонизации Kpn .
В экспериментах по передаче 1: 4, в которых оценивалось введение однократной дозы антибиотика, индексные мыши были инфицированы str-устойчивым Kpn , и выделение фекалий Kpn было определено количественно в течение 4 дней p.я. На 5 день p.i индексных мышей обрабатывали стрептомицином (5 мг / 200 мкл) через желудочный зонд, а затем помещали вместе с контактными мышами. Фекалии мышей собирали ежедневно у индексных и контактных мышей. В непрерывном исследовании передачи контрольного заражения мышь-индекс помещалась в воду, содержащую ампициллин (1 г / л), за 24 часа до заражения. Контактных мышей помещали в воду, содержащую ампициллин (1 г / л), за 24 часа до введения указательной мыши. После совместного размещения у мышей-индексов и контактных мышей собирали данные о ежедневном выделении, чтобы определить, произошли ли какие-либо события передачи.
Чтобы подтвердить, что события передачи от хозяина к хозяину происходят фекально оральным путем, была использована метаболическая клетка (Tecniplast Cat. № 3700M022). Kpn заражений проводили, как описано выше. Через 4 дня после инфицирования контактную мышь помещали в метаболическую клетку и собирали фекальные выделения как у индексных, так и у контактных мышей, чтобы определить частоту передачи.
№ 3700M022). Kpn заражений проводили, как описано выше. Через 4 дня после инфицирования контактную мышь помещали в метаболическую клетку и собирали фекальные выделения как у индексных, так и у контактных мышей, чтобы определить частоту передачи.
Гистология
Мышей инфицировали либо PBS (контроль, содержащий только носитель), либо изолятом KPPR1S.Подгруппе мышей, инфицированных Kpn , через зонд вводили стрептомицин (однократная обработка; 5 мг / 200 мкл), чтобы вызвать состояние суперседдера через 5 дней p.i. В качестве положительного контроля мышей помещали в питьевую воду ad libitum в течение 7 дней, добавляя 3% (вес / объем) декстрансульфата натрия (DSS) с молекулярной массой 50 000 в питьевую воду. Все мыши были умерщвлены на 7-й день после первоначального лечения или заражения. Собирали 2,5 см толстой кишки, непосредственно дистальнее слепой кишки, промывали 1x PBS и получали методом швейцарских рулонов.После этого образец консервировали в формалине 1:10 (Fisherbrand, 305-510) и через 24 часа переносили в 70% этанол. Образцы залили парафином перед тем, как сделать срезы, закрепить и окрасить гематоксилином и эозином (H & E). Полученные слайды были оценены отделением патологии медицинского центра Баптист Уэйк Форест.
Образцы залили парафином перед тем, как сделать срезы, закрепить и окрасить гематоксилином и эозином (H & E). Полученные слайды были оценены отделением патологии медицинского центра Баптист Уэйк Форест.
Печень собирали в стерильных условиях либо у ложно инфицированных мышей, либо у перорально инфицированных мышей hvKP1, и в крайнем случае. Образцы печени были разрезаны примерно на 6 частей.5 мм и помещают в 10% формалин (10 частей формалина на 1 часть ткани). Через 24-48 часов образцы переносили в 70% этанол и хранили при 4 ° C до дальнейшей обработки для окрашивания H & E и по Граму с подсчетом баллов, как описано выше.
Анализ фекального микробиома
Фекальный микробиом исследовали согласно ранее описанным методам (34-36). Вкратце, геномную ДНК из 200 мг фекалий экстрагировали с использованием набора MoBio Powerfecal DNA (Qiagen, Валенсия, Калифорния) в соответствии с инструкциями производителя.Ампликонная ПЦР гипервариабельной области V4 гена 16S рДНК была выполнена с использованием универсальных праймеров 515F (штрих-код) и 806R в соответствии с протоколом Earth Microbiome Project (PMID: 22402401). Ампликоны очищали с использованием магнитных шариков AMPure ® (Agencourt) и количественно определяли продукты с помощью флуориметра Qubit-3 (InVitrogen). Конечная библиотека ампликонов была создана, как описано ранее (37). Эквимолярную объединенную библиотеку секвенировали на платформе Illumina MiSeq с использованием набора реагентов 2 × 300 п.н. (набор реагентов Miseq v3; Illumina Inc.) для парного секвенирования. Контроль качества секвенирования проводился с помощью встроенного программного обеспечения Miseq Control и Miseq Reporter (Illumina Inc.), а полученные последовательности были демультиплексированы, отфильтрованы по качеству, кластеризованы и проанализированы с использованием программного пакета QIIME (34, 35, 38, 39) . Таксономическая классификация проводилась в QIIME на основе 97% сходства последовательностей с базой данных Greengenes (38). Альфа-разнообразие и пропорции бактерий сравнивали с использованием теста Краскела-Уоллиса с последующим попарным тестом Манна-Уитни.
Ампликоны очищали с использованием магнитных шариков AMPure ® (Agencourt) и количественно определяли продукты с помощью флуориметра Qubit-3 (InVitrogen). Конечная библиотека ампликонов была создана, как описано ранее (37). Эквимолярную объединенную библиотеку секвенировали на платформе Illumina MiSeq с использованием набора реагентов 2 × 300 п.н. (набор реагентов Miseq v3; Illumina Inc.) для парного секвенирования. Контроль качества секвенирования проводился с помощью встроенного программного обеспечения Miseq Control и Miseq Reporter (Illumina Inc.), а полученные последовательности были демультиплексированы, отфильтрованы по качеству, кластеризованы и проанализированы с использованием программного пакета QIIME (34, 35, 38, 39) . Таксономическая классификация проводилась в QIIME на основе 97% сходства последовательностей с базой данных Greengenes (38). Альфа-разнообразие и пропорции бактерий сравнивали с использованием теста Краскела-Уоллиса с последующим попарным тестом Манна-Уитни. Линейный дискриминационный анализ (LDA) размер эффекта (LEfSe) был применен для выявления отличительных признаков (уникальных бактериальных таксонов), которые определяют различия в разные моменты времени или в разных группах (40). Иерархическая кластеризация и тепловые карты, отображающие закономерности численности, были построены в статистическом программном пакете «R» (версия 3.6.0; https://www.r-project.org/) с использованием «тепловой карты.2» и «ggplots» пакеты.
Линейный дискриминационный анализ (LDA) размер эффекта (LEfSe) был применен для выявления отличительных признаков (уникальных бактериальных таксонов), которые определяют различия в разные моменты времени или в разных группах (40). Иерархическая кластеризация и тепловые карты, отображающие закономерности численности, были построены в статистическом программном пакете «R» (версия 3.6.0; https://www.r-project.org/) с использованием «тепловой карты.2» и «ggplots» пакеты.
Статистический анализ
Все статистические анализы были выполнены с использованием GraphPad Prism 8.0 (GraphPad Software, Inc., Сан-Диего, Калифорния). Если не указано иное, различия определяли с использованием теста Манна-Уитни U (сравнение двух групп) или теста Краскела-Уоллиса с последующим анализом Данна (сравнение нескольких групп).
Результаты
Установление колонизации
Klebsiella pneumoniae в кишечном тракте мыши
Мы стремились создать GI-модель колонизации Klebsiella pneumoniae , которая имитировала бы естественную колонизацию в хозяине. Из-за сложности установления колонизации Kpn GI через желудочный зонд, в предыдущих исследованиях использовалась предварительная обработка антибиотиками, чтобы разрушить микробиоту хозяина и позволить колонизацию Kpn через желудочный зонд (41-43). Сначала мы проверили способность Kpn колонизировать желудочно-кишечный тракт, дав взрослым мышам дозы в диапазоне от 10 5 -10 9 КОЕ / 100 мкл без лечения антибиотиками, чтобы не нарушить микробиоту хозяина ( Рис. 1A ).Однако вместо лечения через желудочный зонд мышей инфицировали перорально из пипетки, чтобы имитировать естественный путь заражения (44). Мы использовали клинический изолят Kpn KPPR1S, который широко применялся для моделирования у мышей болезненного состояния, связанного с Kpn . Устойчивость к стрептомицину и рифампину KPPR1S позволила нам подсчитать бактерии в фекальных гранулах на селективных чашках. Как показано в , фиг. 1B-C , Kpn колонизировало желудочно-кишечный тракт и активно выделялось с фекалиями мышей с дозами выше 10 5 КОЕ.
Из-за сложности установления колонизации Kpn GI через желудочный зонд, в предыдущих исследованиях использовалась предварительная обработка антибиотиками, чтобы разрушить микробиоту хозяина и позволить колонизацию Kpn через желудочный зонд (41-43). Сначала мы проверили способность Kpn колонизировать желудочно-кишечный тракт, дав взрослым мышам дозы в диапазоне от 10 5 -10 9 КОЕ / 100 мкл без лечения антибиотиками, чтобы не нарушить микробиоту хозяина ( Рис. 1A ).Однако вместо лечения через желудочный зонд мышей инфицировали перорально из пипетки, чтобы имитировать естественный путь заражения (44). Мы использовали клинический изолят Kpn KPPR1S, который широко применялся для моделирования у мышей болезненного состояния, связанного с Kpn . Устойчивость к стрептомицину и рифампину KPPR1S позволила нам подсчитать бактерии в фекальных гранулах на селективных чашках. Как показано в , фиг. 1B-C , Kpn колонизировало желудочно-кишечный тракт и активно выделялось с фекалиями мышей с дозами выше 10 5 КОЕ. Доза <10 5 КОЕ не привела к установлению колонизации (порог обнаружения 100 КОЕ), что позволяет предположить, что требуется минимальная доза 10 5 (данные не показаны). Основываясь на этих результатах, мы выбрали 10 6 КОЕ в качестве минимальной дозы, необходимой для установления колонизации Kpn . Основываясь на наших предварительных исследованиях, которые показывают, что плохое выделение фекалий Kpn коррелирует со снижением колонизации ЖКТ, мы использовали ежедневное выделение фекалий в качестве замены плотности колонизации в ЖКТ.Затем мы определили, как долго Kpn колонизирует желудочно-кишечный тракт мыши. Мы проследили выделение Kpn с фекалиями инфицированных мышей в течение 15 или 30 дней p.i и наблюдали, что Kpn выделялось на аналогичных уровнях на протяжении всего исследования (рис. 1D-E) . Кроме того, наши результаты показали, что Kpn колонизирует поверхность слизистой оболочки ротоглотки ( Fig.
Доза <10 5 КОЕ не привела к установлению колонизации (порог обнаружения 100 КОЕ), что позволяет предположить, что требуется минимальная доза 10 5 (данные не показаны). Основываясь на этих результатах, мы выбрали 10 6 КОЕ в качестве минимальной дозы, необходимой для установления колонизации Kpn . Основываясь на наших предварительных исследованиях, которые показывают, что плохое выделение фекалий Kpn коррелирует со снижением колонизации ЖКТ, мы использовали ежедневное выделение фекалий в качестве замены плотности колонизации в ЖКТ.Затем мы определили, как долго Kpn колонизирует желудочно-кишечный тракт мыши. Мы проследили выделение Kpn с фекалиями инфицированных мышей в течение 15 или 30 дней p.i и наблюдали, что Kpn выделялось на аналогичных уровнях на протяжении всего исследования (рис. 1D-E) . Кроме того, наши результаты показали, что Kpn колонизирует поверхность слизистой оболочки ротоглотки ( Fig.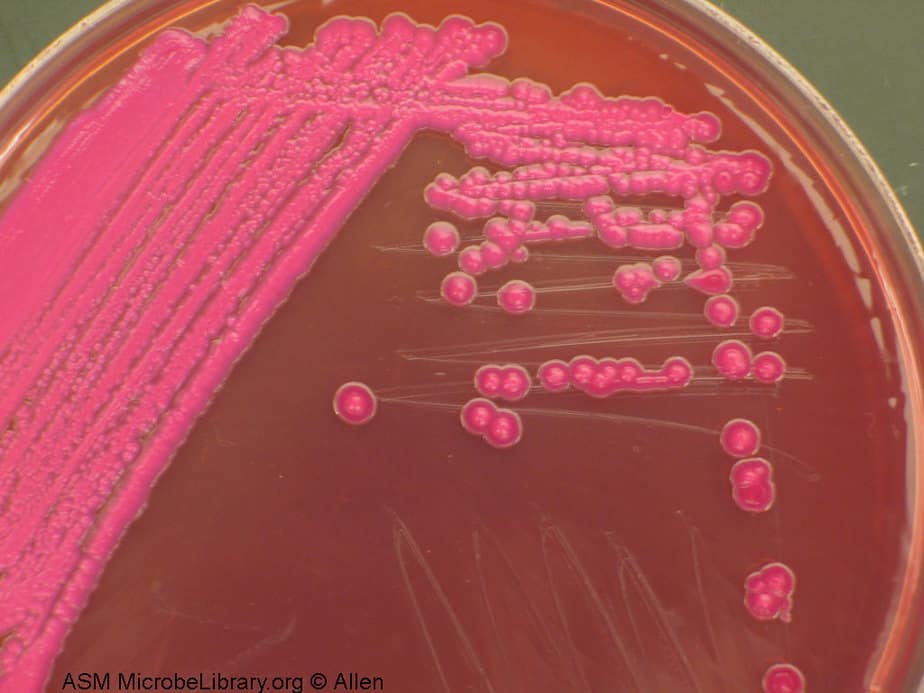 1F ). Взятые вместе, наши данные показывают, что при пероральном введении Kpn колонизирует слизистую оболочку ротоглотки, может закрепиться и сохраниться в желудочно-кишечном тракте и сильно выделяется с фекалиями.
1F ). Взятые вместе, наши данные показывают, что при пероральном введении Kpn колонизирует слизистую оболочку ротоглотки, может закрепиться и сохраниться в желудочно-кишечном тракте и сильно выделяется с фекалиями.
Рисунок 1.
K. pneumoniae колонизирует желудочно-кишечный тракт мышей. (A) Схематическое изображение мышей C57BL / 6J, орально инфицированных изолятом K. pneumoniae KPPR1S (10 5 , 10 6 , 10 8 и 10 9 КОЕ). (B-C) показывает количественные результаты ежедневного выделения и плотность колонизации в кишечном тракте (подвздошной кишке, слепой кишке и толстой кишке) на 7 день после инокуляции от мышей, получавших различные дозы Kpn . (D-E) Данные по выделению фекалий, собранные у мышей, которым вводили 10 6 КОЕ KPPR1S, и отслеживались в течение 15 или 30 дней после заражения. (F) (i, ii) Плотность колонизации изолята KPPR1S в ротоглотке и нижнем отделе желудочно-кишечного тракта мышей через 15 дней после инокуляции. Полоски указывают средние значения. L.O.D, предел обнаружения.
Полоски указывают средние значения. L.O.D, предел обнаружения.
Отличительной чертой изолятов K. pneumoniae является их генетическая гетерогенность, которая влияет на их способность вызывать заболевание (45).Таким образом, мы определили, вносит ли генетическая пластичность Kpn также вклад в колонизацию ЖКТ. Мы проверили способность набора генетически разнообразных клинических изолятов Kpn колонизировать желудочно-кишечный тракт мышей. Для анализа мы выбрали MKP103, производное KPNIh2, которое стало причиной вспышки в Клиническом центре NIH, hvKP1, гипервирулентный изолят человека, и AZ99, фекальный изолят человека. Все три штамма показали различную плотность колонизации желудочно-кишечного тракта мышей, при этом уровень выделения hvKP1 был аналогичен KPPR1S ( рис.2А ). Удивительно, но изолят MKP103 колонизировал плохо, и мыши обычно выводили его из своего желудочно-кишечного тракта к 5 дню p.i. Как видно по выделению фекалий, изолят фекалий человека AZ99 постоянно колонизировал желудочно-кишечный тракт, хотя и с меньшей плотностью по сравнению с KPPR1S. Более того, мыши, колонизированные hvKP1, имели высокий уровень смертности ( фиг. 2C ). Известно, что гипервирулентные изоляты вызывают гнойные абсцессы печени (PLA) (11). Как показано на фиг. (фиг. 2D), мыши , погибшие после пероральной инокуляции изолятом hvKP1, были колонизированы с высокой плотностью в печени, почках и селезенке тем же изолятом.Более того, у этих мышей, по-видимому, развились абсцессы печени (фиг. 3A) , которые, как подтвердило окрашивание H&E и по Граму, содержали некротическую ткань, воспалительные клетки и грамотрицательные бактерии (фиг. 3B-D) . Таким образом, наша модель имитирует динамику заболевания человека, где гипервирулентный изолят (hvKP1) способен перемещаться из желудочно-кишечного тракта в другие стерильные участки и вызывать развитие болезненного состояния.
Более того, мыши, колонизированные hvKP1, имели высокий уровень смертности ( фиг. 2C ). Известно, что гипервирулентные изоляты вызывают гнойные абсцессы печени (PLA) (11). Как показано на фиг. (фиг. 2D), мыши , погибшие после пероральной инокуляции изолятом hvKP1, были колонизированы с высокой плотностью в печени, почках и селезенке тем же изолятом.Более того, у этих мышей, по-видимому, развились абсцессы печени (фиг. 3A) , которые, как подтвердило окрашивание H&E и по Граму, содержали некротическую ткань, воспалительные клетки и грамотрицательные бактерии (фиг. 3B-D) . Таким образом, наша модель имитирует динамику заболевания человека, где гипервирулентный изолят (hvKP1) способен перемещаться из желудочно-кишечного тракта в другие стерильные участки и вызывать развитие болезненного состояния.
Рисунок 2.
Различия между клинических изолятов K. pneumoniae по уровням выделения фекалий и вирулентности. (A.) Мышей инфицировали указанным изолятом K. pneumoniae с указанными ежедневными значениями выделения. (B.) Сравнение мышей, инфицированных штаммом MKP103 K. pneumoniae , с предварительной обработкой антибиотиком неомицином (5 мг / 200 мкл) или без нее. Символы представляют значения потери, полученные от одной мыши в данный день. Полоса представляет собой медианное значение. Пунктирная линия представляет предел обнаружения (L.O.D). (C.) Выживаемость мышей, инфицированных желудочно-кишечным трактом K.pneumoniae изолят KPPR1S (n = 10) или hvKP1 (n = 10) в течение 15 дней. Состояние экстремизма или смерть оценивались как невыживание. Лог-ранговый тест (Мантел-Кокса), выполняемый для определения статистических различий. **, P < 0,01 для KPPR1S по сравнению с hvKP1. (D.) Столбиковая диаграмма, показывающая среднюю плотность колонизации гипервирулентного изолята hvKP1 в почках, печени и селезенке от мышей, которые были первоначально инфицированы перорально столбцами S.
(A.) Мышей инфицировали указанным изолятом K. pneumoniae с указанными ежедневными значениями выделения. (B.) Сравнение мышей, инфицированных штаммом MKP103 K. pneumoniae , с предварительной обработкой антибиотиком неомицином (5 мг / 200 мкл) или без нее. Символы представляют значения потери, полученные от одной мыши в данный день. Полоса представляет собой медианное значение. Пунктирная линия представляет предел обнаружения (L.O.D). (C.) Выживаемость мышей, инфицированных желудочно-кишечным трактом K.pneumoniae изолят KPPR1S (n = 10) или hvKP1 (n = 10) в течение 15 дней. Состояние экстремизма или смерть оценивались как невыживание. Лог-ранговый тест (Мантел-Кокса), выполняемый для определения статистических различий. **, P < 0,01 для KPPR1S по сравнению с hvKP1. (D.) Столбиковая диаграмма, показывающая среднюю плотность колонизации гипервирулентного изолята hvKP1 в почках, печени и селезенке от мышей, которые были первоначально инфицированы перорально столбцами S. E.M. Каждая точка данных представляет собой плотность колонизации в определенном органе конкретной мыши.Органы были получены от мышей, находившихся в крайнем состоянии. Предел обнаружения печени и почек составил 33 КОЕ / мл и 100 КОЕ / мл для селезенки.
E.M. Каждая точка данных представляет собой плотность колонизации в определенном органе конкретной мыши.Органы были получены от мышей, находившихся в крайнем состоянии. Предел обнаружения печени и почек составил 33 КОЕ / мл и 100 КОЕ / мл для селезенки.
Рисунок 3.
Представитель K. pneumoniae абсцессов печени (красные стрелки) от мышей, которые умерли от инфекции изолятом hvKP1, который первоначально колонизировал их желудочно-кишечный тракт (A.) . Образцы ткани печени, окрашенные гематоксилином и окрашенные эозином. Здесь показан образец ткани печени с разрешением 20X от неинфицированных мышей (B.) , показывающий нормальные гептаоциты или инфицированных мышей (C.) , который содержит большую область коагуляционного и литического некроза с гепатоцеллюлярной диссоциацией, включая центральные инфильтраты нейтрофилов (*) с несколькими рассеянными мононуклеарными воспалительными клетками. Периферический аспект поражения содержит многочисленные лимфоциты, макрофаги и новые рассеянные нейтрофилы (стрелки). (D) 100-кратное изображение масляной иммерсии обведенной рамкой области от C, показывающее грамотрицательные бактерии, присутствующие в некротизированной ткани печени.
(D) 100-кратное изображение масляной иммерсии обведенной рамкой области от C, показывающее грамотрицательные бактерии, присутствующие в некротизированной ткани печени.
Лечение антибиотиками приводит к развитию фенотипа супершеддера
Kpn
Учитывая, что фекально-оральный путь передачи в больничных условиях считается важной причиной внутрибольничных инфекций (46, 47), было удивительно, что изолят MKP103 не удалось колонизировать желудочно-кишечный тракт мышей (, фиг. 2A, ). Однако, поскольку многие пациенты, которые приобрели MKP103 в желудочно-кишечном тракте, получали антибиотики (20), мы рассмотрели, повлияет ли использование антибиотиков на способность этого изолята колонизировать желудочно-кишечный тракт.Более того, частое использование антибиотиков в медицинских учреждениях коррелирует с инфекциями Klebsiella pneumoniae (20). Поэтому мышам вводили через зонд неомицин для снижения устойчивости к колонизации микробиотой желудочно-кишечного тракта хозяина, а затем инфицировали MKP103, чтобы определить, влияет ли лечение антибиотиками положительно на их способность колонизировать. Как показано на фиг. , предварительная обработка мышей антибиотиком позволила MKP103 колонизировать и сохраняться в инфицированном желудочно-кишечном тракте хозяина до 15 дней после инфицирования.
Как показано на фиг. , предварительная обработка мышей антибиотиком позволила MKP103 колонизировать и сохраняться в инфицированном желудочно-кишечном тракте хозяина до 15 дней после инфицирования.
Наши результаты показывают, что лечение антибиотиками позволяет изоляту Kpn (MKP103), который плохо колонизирует, закрепиться в желудочно-кишечном тракте. Однако остается неизвестным, влияет ли лечение антибиотиками на плотность колонизации изолятов, которые активно колонизируют, не требуя лечения антибиотиками. Мы определили, приведет ли лечение антибиотиками к развитию фенотипа супершеддер, при котором инфицированный хозяин выделяет патоген в гораздо большем количестве, чем другой инфицированный хозяин.Это явление наблюдалось в естественных условиях и считается основным источником передачи вируса от хозяина к хозяину (48). Для характеристики этого фенотипа использовались мышиные модели, где> 10 8 КОЕ / г (пороговое значение супершеддер [SS]) указанного патогена в фекалиях обычно считается пороговым значением для фенотипа супершеддер (фенотип SS) (25, 26). Используя изолят KPPR1S, поскольку он постоянно колонизировал мышей с высокой плотностью без лечения антибиотиками, мы оценили выделение из фекалий Kpn в течение 10-12 дней.я. либо после однократного лечения стрептомицином, либо после трех дней лечения стрептомицином. Мы обнаружили, что лечение антибиотиками запускало временный фенотип супершеддера ( фиг. 4A-B ), в то время как такой фенотип не наблюдался с контролем только носителем (PBS) ( фиг. S1A ). Вторая обработка антибиотиками после того, как мыши вернулись к исходным уровням Kpn , выделившимся после первого лечения антибиотиками, вызвала развитие другого временного фенотипа супершеддера (рис.S1B) .
Используя изолят KPPR1S, поскольку он постоянно колонизировал мышей с высокой плотностью без лечения антибиотиками, мы оценили выделение из фекалий Kpn в течение 10-12 дней.я. либо после однократного лечения стрептомицином, либо после трех дней лечения стрептомицином. Мы обнаружили, что лечение антибиотиками запускало временный фенотип супершеддера ( фиг. 4A-B ), в то время как такой фенотип не наблюдался с контролем только носителем (PBS) ( фиг. S1A ). Вторая обработка антибиотиками после того, как мыши вернулись к исходным уровням Kpn , выделившимся после первого лечения антибиотиками, вызвала развитие другого временного фенотипа супершеддера (рис.S1B) .
Рисунок 4. Обработка
антибиотиками инфицированных K. pneumoniae мышей запускает фенотип супершеддер. Выделение фекалий от отдельных мышей (n = 9), инфицированных K. pneumoniae KPPR1S при однократной дозе сульфата стрептомицина (5 мг / 200 мкл) (A.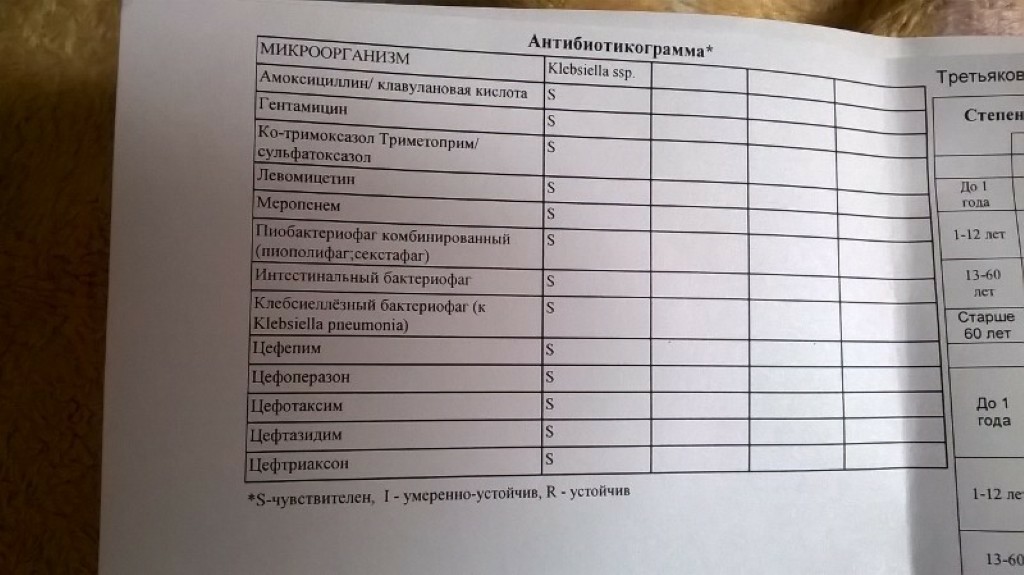 ) или (n = 4) при трех курсах лечения стрептомицином на последовательные дни (B.) , привели к быстрому развитию сильного выделения (> 10 8 КОЕ / грамм кала [порог супершеддера (SS)], продолжающегося в течение 3 дней после лечения антибиотиками. (C.) Высокое фекальное выделение изолята MKP103 K. pneumoniae от мышей (n = 6), получавших ампициллин (1 г / л) в питьевой воде. Снятие давления антибиотиков в конечном итоге приводит к уменьшению выделения фекалий (<10 8 КОЕ / грамм кала).
) или (n = 4) при трех курсах лечения стрептомицином на последовательные дни (B.) , привели к быстрому развитию сильного выделения (> 10 8 КОЕ / грамм кала [порог супершеддера (SS)], продолжающегося в течение 3 дней после лечения антибиотиками. (C.) Высокое фекальное выделение изолята MKP103 K. pneumoniae от мышей (n = 6), получавших ампициллин (1 г / л) в питьевой воде. Снятие давления антибиотиков в конечном итоге приводит к уменьшению выделения фекалий (<10 8 КОЕ / грамм кала).
В клинических условиях пациенты с ослабленным иммунитетом, как правило, постоянно получают лечение антибиотиками; Таким образом, мы определили эффект ежедневного лечения антибиотиками на выделение Kpn . Мы добавили в питьевую воду мышей ампициллин за 24 часа до инокуляции Kpn и продолжали в течение 10 дней p.я. Поскольку Kpn по своей природе устойчивы к ампициллину, мыши, инфицированные изолятом MKP103, проявляли фенотип Kpn superhedder (рис..gif) 4C) . После снятия давления антибиотика у мышей в течение нескольких дней проявлялся фенотип с высоким уровнем выделения. Взятые вместе, наши данные предполагают, что в результате лечения антибиотиками у Kpn может развиться фенотип суперседдера, и продолжительность этого фенотипа зависит от продолжительности лечения антибиотиками.
4C) . После снятия давления антибиотика у мышей в течение нескольких дней проявлялся фенотип с высоким уровнем выделения. Взятые вместе, наши данные предполагают, что в результате лечения антибиотиками у Kpn может развиться фенотип суперседдера, и продолжительность этого фенотипа зависит от продолжительности лечения антибиотиками.
Лечение антибиотиками приводит к нарушению микробиоты хозяина, что коррелирует с фенотипом супершеддер. Чтобы получить представление о состоянии носителя
Kpn и фенотипе супершеддера, мы провели анализ 16S для определения изменений кишечной микробиоты хозяина, которые произошли во время инфекции и как следствие лечения антибиотиками ( рис.5А ). Для подробного анализа 16S мы выделили ДНК из образцов фекалий, собранных в шести различных временных точках у инфицированных мышей Kpn (n = 4). Фекальные гранулы собирали перед инокуляцией для определения исходного уровня микробиоты желудочно-кишечного тракта хозяина. Образцы собирали на 7, 9 и 11 дни после лечения антибиотиками для определения изменений в микробиоте хозяина. На 3-й и 5-й дни p.i мы не смогли обнаружить последовательности гена Kpn 16S рРНК , даже несмотря на то, что они выделялись на уровне 10 6 КОЕ / грамм фекального образца.Этот результат предполагает, что Kpn включает только второстепенный компонент кишечной микробиоты хозяина. Основным компонентом разнообразного микробного сообщества кишечника хозяина являются Bacteroidetes ( Bacteroidales [ S24 -7]) и Firmicutes (Clostridales) (рис. 5C; Таблица S1) , которые считаются быть типичным профилем стабильной микробиоты кишечника млекопитающих.
Образцы собирали на 7, 9 и 11 дни после лечения антибиотиками для определения изменений в микробиоте хозяина. На 3-й и 5-й дни p.i мы не смогли обнаружить последовательности гена Kpn 16S рРНК , даже несмотря на то, что они выделялись на уровне 10 6 КОЕ / грамм фекального образца.Этот результат предполагает, что Kpn включает только второстепенный компонент кишечной микробиоты хозяина. Основным компонентом разнообразного микробного сообщества кишечника хозяина являются Bacteroidetes ( Bacteroidales [ S24 -7]) и Firmicutes (Clostridales) (рис. 5C; Таблица S1) , которые считаются быть типичным профилем стабильной микробиоты кишечника млекопитающих.
Рисунок 5.
Фенотип суперэдера, вызванный антибиотиками, коррелирует с уменьшением разнообразия кишечных микробов. (A.) Среднее выделение из фекалий изолята K. pneumoniae KPPR1S мышами-носителями (n = 4) до лечения антибиотиками и после лечения однократной дозой стрептомицина (5 мг / 200 мкл), которое индуцирует преходящий фенотип супершеддер. Планки погрешностей представляют S.E.M. Пунктирная линия представляет порог супершеддера (SS). (B.) Изменения кишечной микробиоты у мышей-носителей из образцов, полученных в день 0 до заражения, на 3 и 5 дни после инокуляции и на 7, 9 и 11 дни после лечения антибиотиками.ДНК выделяли из образцов фекалий, полученных от инфицированных мышей, и проводили анализ 16s рРНК. Данные представлены в виде индекса разнообразия Шеннона со средним значением и Stdev значениями. Статистические различия рассчитаны по критерию Краскела-Уоллиса. (C.) Изменение микробного разнообразия, определенное по образцам фекалий в указанные выше дни и показанное в виде гистограммы с относительной численностью в процентах основных родов. Стрелка показывает идентификацию ДНК Klebsiella pneumoniae на 7 день после инфицирования.*, p значение <0,05, **, p < 0 . 01
Планки погрешностей представляют S.E.M. Пунктирная линия представляет порог супершеддера (SS). (B.) Изменения кишечной микробиоты у мышей-носителей из образцов, полученных в день 0 до заражения, на 3 и 5 дни после инокуляции и на 7, 9 и 11 дни после лечения антибиотиками.ДНК выделяли из образцов фекалий, полученных от инфицированных мышей, и проводили анализ 16s рРНК. Данные представлены в виде индекса разнообразия Шеннона со средним значением и Stdev значениями. Статистические различия рассчитаны по критерию Краскела-Уоллиса. (C.) Изменение микробного разнообразия, определенное по образцам фекалий в указанные выше дни и показанное в виде гистограммы с относительной численностью в процентах основных родов. Стрелка показывает идентификацию ДНК Klebsiella pneumoniae на 7 день после инфицирования.*, p значение <0,05, **, p < 0 . 01
Однократное введение str привело к резким изменениям микробиоты кишечника. Как подробно описано в рис. 5B , произошло статистически значимое снижение общего видового богатства, особенно для S24-7 , с одновременным увеличением для Erwinia и Bacteroides . Как проиллюстрировано на фиг. , фиг. 5C , мы наблюдали только Kpn -специфичных последовательностей гена 16s рРНК во время индуцированного антибиотиком фенотипа супершеддер.Снижение уровней выделения Kpn коррелировало с увеличением S24-7 и других основных компонентов микробиоты хозяина, а также с потерей обнаружения Kpn специфичных последовательностей 16s рРНК. Таким образом, лечение антибиотиками приводит к нарушению микробиоты хозяина, что коррелирует с развитием временного фенотипа супершеддера. Более того, нарушение микробиоты хозяина антибиотиками связано со снижением микробного богатства, которое восстанавливается через три дня после воздействия антибиотиков.
Как подробно описано в рис. 5B , произошло статистически значимое снижение общего видового богатства, особенно для S24-7 , с одновременным увеличением для Erwinia и Bacteroides . Как проиллюстрировано на фиг. , фиг. 5C , мы наблюдали только Kpn -специфичных последовательностей гена 16s рРНК во время индуцированного антибиотиком фенотипа супершеддер.Снижение уровней выделения Kpn коррелировало с увеличением S24-7 и других основных компонентов микробиоты хозяина, а также с потерей обнаружения Kpn специфичных последовательностей 16s рРНК. Таким образом, лечение антибиотиками приводит к нарушению микробиоты хозяина, что коррелирует с развитием временного фенотипа супершеддера. Более того, нарушение микробиоты хозяина антибиотиками связано со снижением микробного богатства, которое восстанавливается через три дня после воздействия антибиотиков.
Факторы Klebsiella pneumoniae , способствующие выделению и колонизации
Чтобы изучить вклад известных детерминант вирулентности Kpn , мы протестировали выделение и колонизацию ранее описанного мутанта с недостаточностью капсулы (cps) (Δ manC ) штамм КППР1С.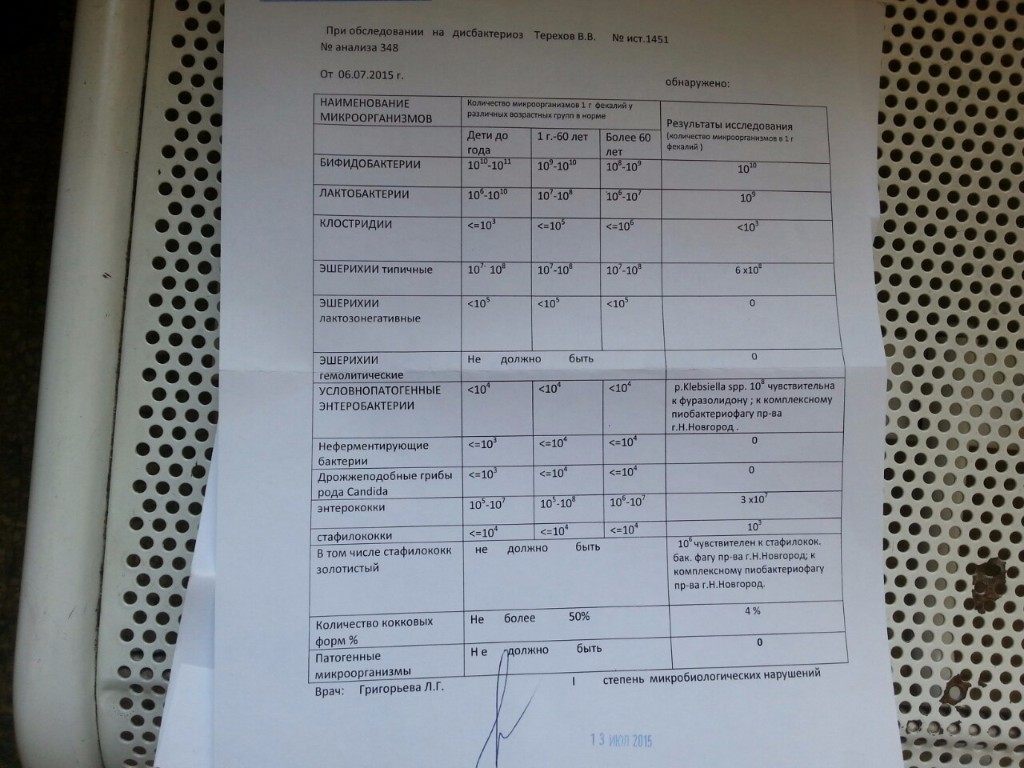 Как видно из , фиг. 6A , в течение 15 дней инфицирования мутант ΔmanC терял, а также плохо колонизировал (фиг. S2) по сравнению с родительским штаммом дикого типа (WT).
Как видно из , фиг. 6A , в течение 15 дней инфицирования мутант ΔmanC терял, а также плохо колонизировал (фиг. S2) по сравнению с родительским штаммом дикого типа (WT).
Рисунок 6.
Влияние факторов вирулентности K. pneumoniae на выделение фекалий и колонизацию ротоглотки. (A.) Мышей инфицировали перорально KPPR1S (WT) или мутантом с дефицитом капсулы ( ΔmanC ) и собирали фекальные выделения в указанные дни. Каждый символ представляет КОЕ, полученный от одной мыши в данный день, а сплошная линия представляет средние значения. (B.) Мышей инфицировали перорально смесью WT 1: 1 или мутантом с дефицитом капсулы ( ΔmanC ) с выделением фекалий, собранным в указанные дни.CI определяли, как описано в материалах и методах. Каждый символ представляет значение Log 10 CI для отдельной мыши в заданный день. Сплошная линия представляет собой медианное значение. Пунктирная линия указывает конкурентный индекс, равный 1, или отношение мутанта к WT 1: 1. (C.) Мышей инфицировали орально WT или изогенным мутантом ( fimH :: cam; FimH-) и собирали фекальные выделения в указанные дни. (D.) Мышей инфицировали перорально смесью WT 1: 1 или мутантом (FimH-) с выделением фекалий, собранным в указанные дни.CI определяли, как указано в разделе «Материалы и методы». (E.) Плотность колонизации в ротоглотке для изолята WT и изогенных мутантов определяли через 15 дней после инфицирования с показанными средними значениями. Для статистических различий CI определяется знаковый ранговый критерий Уилкоксона. Тест Манна-Уитни используется для определения различий в выделении фекалий. Различия в колонизации ротоглотки определяли с помощью теста Краскела-Уоллиса. *, с < 0 . 05 , **, p < 0 . 01 , ***, п < 0 . 001 .
Бактерии могут образовывать биопленочные структуры в желудочно-кишечном тракте (49). Мы предположили, что при коинфекции WT Kpn и штамма Δ manC образуется смешанная популяционная (внутривидовая) биопленка в желудочно-кишечном тракте, помогая компенсировать дефицит капсулы штамма Δ manC . Тем не менее, коинфицированные мыши по-прежнему слабо выделяли штамм Δ manC по сравнению с родительским штаммом ( рис.6Б ). Эти наблюдения предполагают, что капсульный полисахарид Kpn необходим для устойчивой колонизации ЖКТ и возможного фекального выделения.
Далее, поскольку фимбрии типа 1 Kpn считаются важными для колонизации мочевыводящих путей хозяина, мы определили их роль в колонизации ЖКТ (31). Промотор локуса KPPR1S fim находится под контролем фазовой переменной, который, как наблюдали, находился в выключенном положении как для in vitro (бульонная культура), так и для in vivo (фекальные гранулы) (данные не показаны).Чтобы определить потребность фимбрий типа 1 для KPPR1S в колонизации ЖКТ, был сконструирован делеционный мутант fimH , который кодирует кончик адгезина фимбрий 1 типа, необходимый для правильного взаимодействия с эпителиальным слоем хозяина (50). Как видно из фиг. 6C-D , даже несмотря на то, что у мышей, инфицированных мутантом fimH , медиана выделения была снижена, она не была значительно ниже, чем у линии WT. Наконец, мы определили, вносят ли эти мутанты также вклад в колонизацию поверхности слизистой оболочки ротоглотки. На рис. 6E показано, что капсула необходима для колонизации ротоглоточного пространства, тогда как фимбрии 1 типа не требуются. В целом наши данные показывают, что капсульный полисахарид Kpn играет критическую роль в колонизации ЖКТ. Напротив, фимбрии Kpn type1, по-видимому, несущественны для колонизации кишечника.
Klebsiella pneumoniae Передается фекально-оральным путем
Передача кишечных патогенов обычно происходит фекально-оральным путем, и передача от хозяина к хозяину в условиях больницы является основным источником инфекции (20, 46 ).Таким образом, мы определили, могут ли события передачи Kpn от хозяина к хозяину наблюдаться в нашей модели на животных. Первоначально мы разместили одну неинфицированную мышь (контакт) с четырьмя инфицированными мышами (индекс). Фекальные гранулы собирали для подсчета плотности колонизации и того, произошла ли передача от основной к контактировавшей мыши. Мы наблюдали 100% эффективность передачи при соотношении 4: 1, причем передача происходила в течение 24 часов после совместного проживания животных ( рис. 7A и C ). Поскольку эффективность передачи высока при соотношении 4: 1, мы решили определить динамику передачи Kpn с одной индексной мышью, размещенной вместе с четырьмя контактными мышами.При соотношении 1: 4 наблюдалась пониженная эффективность передачи (~ 35%), предполагая, что произошло недостаточно событий выделения Kpn для того, чтобы все неинфицированные мыши стали колонизированными ( фиг. 7B-C ).
Рисунок 7.
K. pneumoniae Передача между хозяевами с лечением антибиотиками и без него. (A.) Представляет соотношение индексной и контактной передачи 4: 1. Четыре наивные мыши были инфицированы перорально KPPR1S и помещены с одной не инфицированной мышью.Фекальное выделение контролировали ежедневно как индексной, так и контактной мышью. (B.) Представляет соотношение индексной и контактной передачи 1: 4. Одна наивная мышь была инфицирована перорально KPPR1S и содержалась с четырьмя неинфицированными мышами, а выделение фекалий контролировали ежедневно (C.) Наблюдаемая эффективность передачи K. pneumoniae с различным соотношением инфицированных и неинфицированных, действием антибиотиков и динамикой передачи в метаболическая клетка. Статистические различия рассчитываются с использованием двустороннего точного критерия Фишера.
Затем, чтобы имитировать условия, преобладающие в больнице, где пациенты обычно принимают антибиотики, мы исследовали влияние лечения антибиотиками на динамику передачи Kpn . Однократное лечение антибиотиком индексной мыши, объединенной с четырьмя контактными мышами, привело к передаче> 90%, что свидетельствует о том, что высокий уровень выделения Kpn в фекальных гранулах может преодолеть устойчивость к колонизации контактных мышей ( фиг. 7C ). Наконец, мы проверили действие антибиотиков как на индексных, так и на контактных мышах, добавив антибиотики в их питьевую воду.Индексную мышь инфицировали MKP103 и содержали отдельно в течение нескольких дней, а затем вводили четырем контактным мышам, уже принимающим антибиотики. Мы наблюдали 100% эффективность передачи, когда и индексная, и контактная мыши получали антибиотики ежедневно. Более того, поскольку все мыши в клетке принимали антибиотики, у всех развился фенотип супершеддера ( Fig. S3A ). Наши результаты дают представление о высокой трансмиссивности Kpn в больницах, где широко используются антибиотики.
Мы предполагаем, что передача Kpn происходит фекально-оральным путем, на основе моделей передачи других кишечных патогенов и копрофагической природы мышей. Однако, поскольку Kpn колонизирует как ротовую полость, так и желудочно-кишечный тракт, мы определили, происходит ли передача от хозяина к хозяину Kpn из-за копрофагического действия мышей или путем контакта с инфицированными ротовыми выделениями. Мышей содержали в метаболической клетке, где у них нет доступа к фекальным гранулам.При соотношении индекса и контактных мышей 4: 1 не было обнаружено событий передачи между инфицированными и неинфицированными мышами в течение 10-дневного эксперимента, что позволяет предположить, что в нашей модели на животных передача от хозяина к хозяину требует контакта с фекалиями. материи ( рис. 7C ). Наконец, инфицированные мыши в метаболической клетке теряли Kpn , что убедительно свидетельствует о постоянной колонизации, которая не требовала повторного посева за счет потребления инфицированных фекальных гранул ( фиг. S3B ).
Обсуждение
Генетическая гетерогенность Klebsiella pneumoniae позволяет этому патогену колонизировать различные поверхности слизистой оболочки хозяина, что может существенно повлиять на клинический результат. Klebsiella pneumoniae Проявления болезни дыхательных и мочевыводящих путей были тщательно смоделированы на животных (4). Однако поверхность слизистой оболочки желудочно-кишечного тракта, также легко колонизируемая Kpn , не была предметом многих научных исследований (51, 52).В этом отчете мы описываем мышиную модель оральной инфекции K. pneumoniae для изучения колонизации ЖКТ и передачи от хозяина к хозяину. Мы впервые демонстрируем, что Kpn может стабильно колонизировать желудочно-кишечный тракт иммунокомпетентных мышей, не нарушая микробиоту хозяина — ключевой момент нашей модели. Во-вторых, хозяин, постоянно колонизируемый патогеном, считается значительным резервуаром для новых инфекций, и наша животная модель колонизации GI Kpn воспроизводит этот фенотип, указывая на то, что это полезный инструмент для изучения событий внутри хозяина и между хозяином. коробка передач.В-третьих, мы наблюдали вариабельность способности колонизировать желудочно-кишечный тракт и вызывать инвазивные заболевания между различными изолятами Kpn , предполагая, что генетическая пластичность Kpn может быть вовлечена в наблюдаемую вариабельность. Наконец, поскольку многие пациенты в больницах, как правило, принимают антибиотики, мы впервые смогли экспериментально показать, что лечение антибиотиками запускает развитие фенотипа супершеддера у мышей-носителей, что способствует передаче от хозяина к хозяину.
В предыдущих исследованиях использовалось лечение антибиотиками для снижения устойчивости к колонизации хозяина путем разрушения резидентной микробиоты для установления колонизации Kpn (31, 41, 53). Однако лечение антибиотиками снижает способность распознавать роль бактериальных факторов, которые позволяют Kpn преодолеть устойчивость к колонизации. Наша модель не требует использования антибиотиков для установления стабильной и стойкой колонизации Kpn и, следовательно, позволяет идентифицировать бактериальные факторы и факторы хозяина, которые способствуют колонизации и передаче Kpn .В наших первоначальных исследованиях мы установили, что путь заражения имеет решающее значение для стабильной колонизации Kpn в желудочно-кишечном тракте. Пероральный желудочный зонд, стандартный способ инфицирования для моделирования кишечных инфекций на мышиных моделях, приводил только к временной колонизации Kpn в желудочно-кишечном тракте (данные не показаны). Однако при пероральном введении подобная доза позволила Kpn колонизировать желудочно-кишечный тракт и сохраняться, не нарушая микробиоту хозяина. Недавнее исследование Atarashi et al .показали, что Kpn , колонизирующая ротовую полость пациентов, может засеять желудочно-кишечный тракт (44). В нашей модели инфекции мы также наблюдали Kpn , колонизирующее ротовую полость мышей.
Отличительной чертой многих патогенов ЖКТ является их способность вызывать острый воспалительный ответ хозяина. Многочисленные отчеты также предполагают, что Kpn может способствовать дисбактериозу кишечника и играть активную роль в индукции реакции хозяина (44, 54). Однако эпидемиологические данные также предполагают, что Kpn может незаметно колонизировать здоровых людей (18).В нашей мышиной модели мы не смогли обнаружить никаких острых признаков воспаления после инфицирования Kpn . Кроме того, в отличие от фенотипа супершеддерного серовара Salmonella Typhimurium , индуцированный антибиотиком фенотип супершеддера Kpn не был связан с колитом ( рис. S4 ). Наши данные предполагают, что Kpn в желудочно-кишечном тракте ведет себя таким образом, чтобы не вызывать острого воспалительного ответа, и носительство считается бессимптомным явлением.
Роль основных факторов вирулентности Kpn , включая его капсульный полисахарид (CPS), фимбрии 1 типа и другие, была тщательно изучена как в условиях in vitro , так и в условиях in vivo (4). Однако данные о потребности в Kpn CPS при колонизации ЖКТ противоречивы (41, 42). Поскольку эти исследования проводились на мышах, получавших антибиотики, вполне возможно, что точная роль бактериальных факторов, вероятно, замаскирована.Здесь, используя нашу модель, мы окончательно показываем, что CPS Kpn является важным компонентом, необходимым для эффективной колонизации как верхнего (ротоглотка), так и нижнего (кишечника) тракта GI. Роль капсулы, возможно, относится к защите от опосредованного хозяином клиренса и взаимодействия со слизью (42, 55, 56).
Мы также проверили требования к фимбриям Kpn типа 1 при колонизации GI. Несмотря на то, что фимбрии 1 типа имеют решающее значение для колонизации мочевыводящих путей, они, по-видимому, не нужны для колонизации ЖКТ (31).Однако для некоторых патогенных изолятов E. coli для колонизации необходимы фимбрии 1 типа (57, 58). Кроме того, недавняя работа Юнга и др. . с использованием мышей, получавших антибиотики, наблюдали дефект колонизации ЖКТ мутантом Kpn fimD , в котором отсутствует компонент-носитель, который облегчает сборку и возможную транслокацию пилуса через внешнюю мембрану (53). Однако в нашей модели мы наблюдали только небольшое снижение медианного выделения у мышей, инфицированных изогенным мутантом fimH , по сравнению со штаммом WT, предполагая, что экспрессия фимбрий типа 1 изолята KPPR1S необязательна для колонизации ЖКТ.Этот результат о том, что фимбрии типа 1 изолята KPPR1S не вносят вклад в колонизацию ЖКТ, не был неожиданным, поскольку мы не наблюдали его экспрессию в тестируемых условиях (данные не показаны). Однако фимбрии типа 1 могут играть роль в колонизации GI для изолятов, которые действительно экспрессируют эту структуру.
Наша модель также позволяет нам впервые понять динамику передачи Klebsiella pneumoniae . Мы наблюдали события передачи между Kpn -инфицированными и контактными мышами, предполагая, что выделение Kpn в этой модели достаточно велико для передачи, хотя и с более низкой частотой.Мы также наблюдали, что контактные мыши колонизировали с меньшей плотностью по сравнению с индексными мышами, возможно, из-за уменьшения дозы Kpn в фекальных гранулах. Таким образом, наши данные основаны на эпидемиологических исследованиях, которые предполагают 5-25% переносимости в естественной среде (19, 59). Однако лечение инфицированных или контактировавших мышей антибиотиками привело к высокой частоте передачи вируса от хозяина к хозяину. Однократная доза лечения антибиотиками выявила фенотип суппершеддера у основного хозяина, который мог передаваться> 90% неинфицированных мышей.Предполагается, что 80% инфекций происходят из-за передачи 20% инфицированных людей неинфицированным хозяевам (известное как правило 80/20) (60). Такие люди называются супершеддерами или суперпредседателями. Однако мы не смогли наблюдать фенотип супершеддера Kpn без нарушения микробиоты хозяина, предполагая, что в нашей модели на животных динамика передачи Kpn не соответствует правилу 80 // 20. Многочисленные исследования кишечных патогенов показывают, что лечение антибиотиками вызывает дисбактериоз желудочно-кишечного тракта, снижает устойчивость к колонизации устойчивой резидентной микробиотой и способствует распространению патогенов (25, 26).Наш анализ 16S показывает, что фенотип супершеддера на основе антибиотиков коррелирует со снижением микробного разнообразия. В отличие от фенотипов супершеддер Salmonella серовара Typhimurium и Clostridium difficile (25, 26), фенотип супершеддера Kpn длится более короткое время после однократного лечения антибиотиками. Однако мышей, инфицированных Kpn , которые постоянно получали антибиотики, выделялись на уровне супершеддера, что, как мы полагаем, является обычным явлением в больничных условиях.Наши данные показывают, что развитие фенотипа супершеддер является основным фактором передачи инфекции от хозяина к хозяину в больнице. Частота передачи K. pneumoniae не была установлена в условиях больницы и может быть выше или ниже, чем частота, определенная в нашей мышиной модели. Мы полагаем, что обстановка с высоким уровнем использования антибиотиков увеличивает вероятность вспышек Kpn . Поэтому за пациентами, принимающими антибиотики, следует тщательно наблюдать, чтобы определить, колонизированы ли они К.пневмония .
В заключение мы описали модель, которая будет полезна для понимания сложных взаимодействий между K. pneumoniae и иммунной системой хозяина и кишечной микробиотой. Доступность библиотеки отмеченных мутантов Kpn (32) и нескольких аннотированных геномов Kpn должна позволить провести исследования по выявлению бактериальных факторов, которые способствуют колонизации и передаче Kpn . Поскольку большинство внутрибольничных инфекций Kpn возникают в результате колонизации желудочно-кишечного тракта и фекально-орального пути передачи (20, 29), понимание биологии желудочно-кишечной колонизации и фекально-оральной передачи Kpn было бы полезным, поскольку оно могло бы служить в качестве идеальная точка вмешательства.
Дополнительные рисунки
Рисунок S1.
(A.) Обработка мышей, инфицированных K. pneumoniae , одним PBS (200 мкл) не вызывает фенотипа суперседдера. (B.) Обработка стрептомицина сульфатом (5 мг / 200 мкл) запускает фенотип супершеддера (> 10 8 КОЕ / грамм фекалий) у мышей, инфицированных Klebsiella pneumoniae . Вторая обработка сульфатом стрептомицина (5 мг / 200 мкл) после того, как мыши вернулись к уменьшенному выделению Kpn , вызывает второй фенотип супершеддера, который также является временным.
Рисунок S2.
Плотность колонизации в желудочно-кишечном тракте (подвздошная кишка, слепая кишка и толстая кишка) для изолята WT и мутанта с дефицитом изогенной капсулы ( ΔmanC ) определяли через 15 дней после инфицирования с показанными средними значениями. Предел обнаружения составил 10 2 КОЕ / грамм ткани. Различия в колонизации ЖКТ определяли с помощью теста Краскела-Уоллиса. ***, р < 0 . 001 .
Рисунок S3.
(A.) Лечение антибиотиками приводит к развитию фенотипа супершеддер у индексных (инфицированных) мышей и высокой скорости передачи.Индексным мышам давали ампициллин (1 г / литр) в питьевой воде за день до пероральной инокуляции изолятом MKP103 Kpn . За день до того, как указательную мышь поместили в клетку для контактных мышей (n = 4), им также давали ампициллин (1 г / литр) с питьевой водой. Контактные мыши быстро колонизировались изолятом MKP103, и как индексные, так и контактные мыши демонстрировали фенотип супершеддер (> 10 8 КОЕ / грамм фекалий). Здесь показаны два независимых исследования передачи. (B.) Данные по выделению фекалий, собранные у мышей, которым вводили 10 6 КОЕ KPPR1S, помещенных в метаболическую клетку для уменьшения копрофагии, и наблюдались в течение 13 дней после заражения. Показаны медианные значения, где каждая точка представляет одну мышь в данный день. Предел обнаружения (L.O.D) составил 10 2 КОЕ / грамм кала.
Рисунок S4.
Колонизация Klebsiella pneumoniae показывает нормальную слизистую толстой кишки. Здесь представлены швейцарские рулоны слизистой оболочки толстой кишки, окрашенные гематоксилином и окрашенные эозином. (A.) Мышам вводили только PBS и готовили ткань через 7 дней после обработки. (B.) Ткань толстой кишки мышей, полученная через 7 дней после ежедневной обработки 3% DSS. Здесь подробно показано изъязвление (длинные стрелки) слизистой оболочки с воспалением, расширяющим подслизистую оболочку (*), а также потерю и фрагментацию отдельных мышечных клеток (короткие стрелки). (C.) Мышей, инфицированных KPPR1S, и ткань подготовили через 7 дней после инфицирования. (D.) Мышей, инфицированных KPPR1S, давали однократную дозу стрептомицина (5 мг / 200 мкл) для запуска фенотипа супершеддера и готовили ткань через два дня после лечения антибиотиками.Эпителий толстой кишки кажется нормальным у мышей, инфицированных KPPR1S и его фенотипом супершеддер, и сходен по морфологии с контролем PBS.
Таблица S1.
Список видов бактерий, идентифицированных в фекальных осадках мышей с помощью анализа 16s рРНК Штаммы, использованные в этом исследовании
Благодарности
Мы хотели бы поблагодарить доктора наук. Майкл Бахман (Мичиганский университет), Алан Хаузер (Северо-Западный университет), Вирджиния Миллер (UNC Chapel Hill), Томас Руссо (Университет Буффало-SUNY) и Джеффри Н.Weiser (Медицинская школа Нью-Йоркского университета) за штаммы, использованные в этом исследовании. Мы также хотели бы поблагодарить докторов наук. Филиппу Эрнандесу (Бостонский университет), Вирджинии Миллер, Кимберли Уокер (UNC Chapel Hill), Джеффри Н. Вейзеру и Тони Зангари (Медицинский факультет Нью-Йоркского университета) за плодотворные обсуждения относительно создания модели и рукописи.
Это исследование финансировалось стартапом, предоставленным Баптистским медицинским центром Уэйк Форест компании M.A.Z.
Инфекция E-Coli: не только из продуктов питания
E coli и другие грамотрицательные бациллы, такие как штаммы Klebsiella, Enterobacter, Proteus, и Pseudomonas, также могут вызывать заболевания, не связанные с пищевыми продуктами , включая инфекции крови (сепсис), воспаление покровов головного и спинного мозга (менингит) у новорожденных детей и инфекции мочевыводящих путей у детей и взрослых всех возрастов.
При большинстве инфекций новорожденных E. coli или другие грамотрицательные бактерии обычно передаются из половых путей матери новорожденному во время родов. Иногда они также могут передаваться через личный контакт с опекунами или другими детьми.
Признаки и симптомы
Ребенок, у которого развивается сепсис, часто демонстрирует такие признаки и симптомы, как
- Лихорадка, включая повышенную и понижающуюся температуру
- Дыхание с хрюканьем
- Вялость
- Раздражительность
- Отсутствие аппетита
- Рвота
- Желтуха (пожелтение кожи и глаз)
- Вздутие живота
- Диарея
Менингит у новорожденных с E coli или другой грамотрицательной инфекцией может не вызывать всех признаков, обычно связанных с инфекцией центральной нервной системы.Признаки менингита могут включать жар или аномально низкую температуру, вялость или кому, рвоту, вздутие мягкого пятна (технический термин для мягкого места на голове — родничок) и судороги.
Признаки инфекции мочевыводящих путей (ИМП) включают боль при мочеиспускании, учащенное мочеиспускание и мокнутие в постели или одежде у ранее сухого ребенка.
Когда звонить педиатру
Немедленно обратитесь к педиатру, если у вашего ребенка появятся симптомы, подобные описанным здесь.
Как ставится диагноз?
Для диагностики этих инфекций ваш педиатр назначит анализы крови, спинномозговой жидкости и мочи вашего ребенка.
Лечение
Если у вашего новорожденного сепсис или менингит, врач сначала пропишет вам ампициллин и аминогликозиды. (Иногда вместо аминогликозидов используются препараты цефалоспорина.) Лабораторные тесты могут определить точный организм, вызывающий инфекцию. Лечение длится от 10 до 14 дней в большинстве случаев сепсиса и не менее 21 дня при менингите.


 Как показали исследования, при кипячении бактерия теряет свою жизнеспособность.
Как показали исследования, при кипячении бактерия теряет свою жизнеспособность.

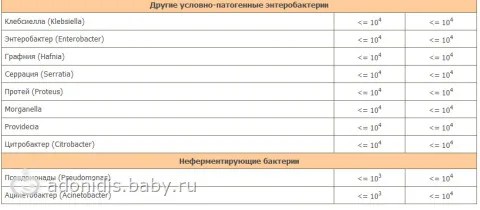
 ).
).