Желчегонные лекарственные средства и препараты желчи — Справочник лекарств
Желчегонные препараты – это группа лекарственных средств, которые стимулируют образование и/или отток желчи в двенадцатиперстную кишку, препятствуя развитию застойных явлений в желчном пузыре и печени, а также образованию камней (холелитиазу).
Желчегонные препараты делят на средства, преимущественно стимулирующие образование желчи в печени (холеретики), и средства, стимулирующие выведение желчи (холекинетики).
Показания к применению
Желчегонные препараты применяют при заболеваниях, которые сопровождаются снижением образования желчи или ее застоем: хронических гепатитах, холециститах (воспалениях желчного пузыря), холангитах (воспалениях желчевыводящих путей), дискинезии желчевыводящих путей, холангиогепатитах.
Также желчегонные препараты используют в случае длительных хирургических дренированиях желчных протоков, при свищах желчного пузыря.
Фармакологическое действие
Желчегонные препараты повышают образование желчи за счет стимуляции желчесекреторной функции печени – так работают холеретики. Желчегонные препараты подкласса холекинетиков увеличивают ток желчи по желчевыводящим путям за счет раздражения рецепторов двенадцатиперстной кишки и рефлекторному увеличению сокращений желчного пузыря, а также расслаблению желчевыводящих путей.
Все желчегонные препараты растительного происхождения дополнительно оказывают противовоспалительное, гепатопротекторное и умеренное противомикробное действие за счет наличия в их составе флавоноидов, эфирных масел и смол.
Отдельные желчегонные препараты выраженно расслабляют желчевыводящие протоки, оказывая тем самым холеспазмолитическое действие.
Классификация желчегонных препаратов
Желчегонные препараты классифицируют на:
- средства, стимулирующие желчеобразование в печени (холеретики): цветки бессмертника песчаного, столбики с рыльцами кукурузы, корень куркумы, кора крушины, корни одуванчика, трава тысячелистника, плоды тмина, корень цикория, трава чистотела, цветки пижмы, трава петрушки, плоды шиповника, листья мяты, экстракт чеснока, листья крапивы;
- средства, стимулирующие желчевыведение (холекинетики): магния сульфат, сорбитол, ксилит.

Холеретическое действие оказывают также минеральные воды – они увеличивают количество желчи за счет водного компонента, нормализуют реологические свойства (повышают текучесть) желчи.
Холекинетическое действие присуще также растительным маслам – оливковому, подсолнечному, облепиховому, маслу виноградных косточек.
Основы лечения желчегонными препаратами
Выраженное фармакологическое действие растительных желчегонных препаратов-холеретиков развивается через 5-7 дней от начала приема, достигая максимума через 2-3 недели лечения. Поэтому препараты холеретиков следует использовать курсами в 1-2 месяца, курс лечения можно повторять 2-4 раза в год. Применяют препараты холеретиков за полчаса до еды 3-4 раза в день.
Желчегонный эффект препаратов холекинетиков развивается при первом же приеме. Холекинетики обычно применяют короткими курсами в 10-14 дней (редко – до 1 месяца).
Особенности лечения желчегонными препаратами
Все желчегонные препараты категорически противопоказаны при нарушениях проходимости желчевыводящих путей, например, камнем – при желчнокаменной болезни, или при сдавлении желчного потока опухолью или рубцом.
Кроме того, желчегонные препараты не рекомендуют использовать в острой фазе болезней печени и желчного пузыря – острых гепатитах и острых холециститах, поскольку в таком случае они могут ухудшить состояние пациента.
Желчегонные препараты усиливают антибактериальный эффект антибиотиков группы пенициллинов, тетрациклинов, макролидов, а также антипротозойных средств (метронидазола). Поэтому холеретики целесообразно включать в состав комплексного лечения инфекционных заболеваний желчного пузыря и желчных протоков.
Магния сульфат как желчегонное средство следует использовать внутрь (перорально). При введении внутримышечно или внутривенно желчегонный эффект магния сульфата не проявляется, уступая место противосудорожному, успокаивающему, гипотензивному действию.
Помимо холекинетического действия магния сульфат оказывает также выраженный слабительный эффект, поэтому дополнительно его можно использовать при нарушениях желчевыделения, которые сопровождаются запорами.
Основные направления лечения детей с билиарными дисфункциями, ассоциированными с дисплазией соединительной ткани | #09/19
Билиарные дисфункции (БД) относятся к наиболее частой патологии пищеварительной системы у детей. Традиционно лечебная программа при БД включает следующие направления:
- коррекция моторно-тонических нарушений в билиарной системе;
- улучшение текучих свойств желчи;
- нормализация деятельности центральной нервной системы.
Не менее важно учитывать тот фон, на котором сформировалась БД у конкретного ребенка, поскольку в подавляющем большинстве случаев она является вторичной и ее течение нередко зависит от основного заболевания (хронический гастродуоденит, язвенная болезнь, ожирение и т. д.) [1–3]. Одним из факторов, способствующих развитию БД, является дисплазия соединительной ткани (ДСТ) [4–6]. БД, протекающие у детей-диспластиков, нередко характеризуются длительным и упорным течением с частыми рецидивами, ранним формированием билиарного сладжа с исходом в желчнокаменную болезнь и вовлечением сопряженных органов в патологический процесс. Причиной такого негативного влияния соединительнотканной дисплазии на течение БД являются нарушение вегетативной регуляции, дисэлементоз, незрелость соединительнотканных структур стенки пузыря, аномалии развития желчного пузыря, характерные для ДСТ. Своевременное начало лечебных мероприятий при БД, ассоциированных с ДСТ, призвано предупредить возможность трансформации моторных нарушений в билиарной системе в более тяжелую патологию.
Основой рационального лечения детей с БД на фоне ДСТ является лечебное питание. Диетотерапия проводится на основе принципов лечебного питания при холепатиях с учетом характера моторных нарушений в билиарной системе, но с обязательным включением достаточного количества витаминов, макро- и микроэлементов и непредельных жирных кислот, необходимых для поддержания адекватного метаболизма соединительной ткани. Рекомендуется достаточное содержание растительных жиров, овощей, нежирных сортов рыб («средиземноморский» вариант диеты).
Рекомендуется достаточное содержание растительных жиров, овощей, нежирных сортов рыб («средиземноморский» вариант диеты).
При всех вариантах моторных нарушений рекомендуется дробное питание (в 5–6 приемов с перерывами между ними в 3–4 часа), которое обеспечивает периодичность выделения желчи и панкреатического секрета. Ограничивают продукты, вызывающие раздражение слизистой оболочки пищевого канала и сильное сокращение желчного пузыря: жирные сорта мяса, рыбы и птицы, бульоны, изделия из сдобного теста, пряности, грибы, лук и чеснок, щавель и редька, маринады, копчености, газированные напитки. Исключают продукты, повышающие газообразование в кишечнике: ржаной хлеб, горох, бобы. Не рекомендуются слишком горячие и любые холодные блюда. В рацион включают продукты, обладающие липотропным действием (творог, кисломолочные продукты, блюда из гречневой и овсяной круп, нежирные сорта говядины и рыбы). Для предотвращения запоров, а значит, и для нормализации внутрибрюшного давления и улучшения пассажа желчи в двенадцатиперстную кишку используют растительные продукты, способствующие опорожнению кишечника (морковь, тыква, кабачок, зелень, арбуз, дыня, чернослив, курага, груша). Разрешаются сладости — пастила, мармелад, джемы и мед.
При гипермоторной дисфункции желчного пузыря и спазме сфинктеров для уменьшения тонуса гладкой мускулатуры показано применение магнийсодержащих продуктов (гречневая крупа, пшеничные отруби, пшено, все виды капусты). Овощи можно использовать в сыром, вареном, печеном виде. Ограничивают продукты, усиливающие процессы брожения и гниения в кишечнике (цельное свежее молоко, сдобное тесто, консервы и др.).
При гипомоторике желчного пузыря показаны некрепкие мясные бульоны, сливки, сметана, яйца всмятку и растительные масла. Последние имеют особую ценность, поскольку легко эмульгируются и всасываются в кишечнике, содержат значительное количество полиненасыщенных жирных кислот, богатых фосфатидами, витаминами А, Е, К. Желательно добавлять масла в готовые блюда, а не в процессе кулинарной обработки. Рацион должен содержать овощи и фрукты, богатые пищевыми волокнами (курага, клубника, малина, сушеный шиповник и др.). Разрешаются пищевые добавки в виде пшеничных отрубей, которые сокращают время пассажа пищи по кишечнику и улучшают метаболизм желчных кислот.
Рацион должен содержать овощи и фрукты, богатые пищевыми волокнами (курага, клубника, малина, сушеный шиповник и др.). Разрешаются пищевые добавки в виде пшеничных отрубей, которые сокращают время пассажа пищи по кишечнику и улучшают метаболизм желчных кислот.
Необходимым компонентом немедикаментозного воздействия при БД, ассоциированных с ДСТ, является оптимальный двигательный режим. Следует организовать режим дня с чередованием труда и отдыха. Очень важно избегать гиподинамии. Показаны ежедневная гимнастика с упражнениями аэробного типа и лечебная физкультура с упражнениями, сочетающими направленность на улучшение моторной функции желчевыводящих путей и улучшающими состояние определенной группы мышц для достижения правильной осанки. Необходимо достичь оптимального двигательного режима, избегая гиподинамии, с одной стороны, и перегрузок — с другой. Предпочтительны умеренные динамические нагрузки, а именно — плавание, ходьба, прогулочные лыжи, велосипед, бадминтон. Противопоказаны занятия, требующие тяжелой физической нагрузки и групповые виды спорта с повышенной вероятностью травматизации.
Целью медикаментозной терапии больных с БД, ассоциированной с ДСТ, являются:
- коррекция реологических (текучих) свойств желчи;
- нормализация моторики желчного пузыря, тонуса сфинктерного аппарата, а также давления в двенадцатиперстной кишке, что в конечном итоге должно обеспечить нормальный отток желчи и панкреатического секрета;
- улучшение процессов пищеварения и всасывания в тонкой кишке.
Коррекция нарушений коллоидной стабильности желчи — важнейшая составляющая базисного лечения пациентов со всеми формами БД. С этой целью применяются препараты урсодезоксихолевой кислоты (УДХК) (Урсофальк, Урсосан), которые снижают синтез холестерина в печени и его всасывание в кишечнике. УДХК образует с молекулами холестерина жидкие кристаллы, способствующие растворению холестериновых камней, улучшающие физико-химические свойства желчи и предупреждающие образование новых кристаллов. Помимо этого препарат индуцирует образование желчи, богатой бикарбонатами, что увеличивает ее пассаж, стимулирует выведение токсичных желчных кислот через кишечник, а улучшая моторную функцию желчного пузыря, положительно влияет на микробиоценоз кишечника. Препарат назначают в дозе 10–15 мг/кг в сутки на ночь в течение 3–4 нед. Но длительность приема может увеличиваться в зависимости от клинической ситуации, достигая 3–24 мес.
Помимо этого препарат индуцирует образование желчи, богатой бикарбонатами, что увеличивает ее пассаж, стимулирует выведение токсичных желчных кислот через кишечник, а улучшая моторную функцию желчного пузыря, положительно влияет на микробиоценоз кишечника. Препарат назначают в дозе 10–15 мг/кг в сутки на ночь в течение 3–4 нед. Но длительность приема может увеличиваться в зависимости от клинической ситуации, достигая 3–24 мес.
Одним из желчегонных средств, применяемых у детей, является сухой водный экстракт листьев артишока полевого (Хофитол), основными частями которого являются кофеоловая и хининовая кислоты, флавоноиды, витамины, микроэлементы. Хофитол оказывает желчегонное, антисептическое, антитоксическое, противовоспалительное, антиоксидантное и иммуностимулирующее действие, снижает уровень холестерина за счет холеретического действия и уменьшения его внутрипеченочного синтеза. Важно, что, стимулируя желчеотделение, препарат ослабляет литогенные свойства желчи, что снижает риск развития холелитиаза. Экстракт листьев артишока защищает печеночные клетки, укрепляет мембрану гепатоцита за счет антиоксидантного действия, стимулирует антитоксическую функцию печени, улучшает жировой и углеводный обмен, аппетит. Препарат назначают по 1–2 таблетки (в зависимости от возраста) 3 раза в сутки за 15–20 мин до еды. В виде раствора для приема внутрь назначают взрослым по 2,5–3 мл 3 раза в сутки, а детям 1/4–1/2 дозы взрослых.
К желчегонным средствам, используемым у детей при БД, относят препарат, содержащий расторопшу (Галстена). Препарат обладает противовоспалительным, холеретическим, спазмолитическим и гепатопротективным действием, которое проявляется уменьшением выраженности цитолиза и внутрипеченочного холестаза. Поскольку препарат выпускается во флаконах с капельницей, то он легко дозируется детям разных возрастов. Младенцам рекомендуется по 1 капле, детям от 1 года до 12 лет — по 5 капель, старше 12 лет — по 10 капель 3 раза в сутки. Курс лечения при БД составляет, как правило, не более 3 нед.
Из растительных желчегонных средств следует упомянуть сухой экстракт бессмертника песчаного, который содержит флавоноиды, гликозиды, стерины и эфирные масла. Такой состав наряду с желчегонным эффектом позволяет уменьшить литогенность желчи. Кроме того, препарат обладает спазмолитическим свойством и антибактериальной активностью в отношении гнилостной и газообразующей флоры. Препарат выпускают в виде гранул для приготовления суспензии и в таблетках. Детям 1–3 лет показано по 2 пакетика в сутки, 4–5 лет — по 3 пакетика, старше 5 лет — по 4 пакетика в сутки. Детям старше 14 лет можно назначать в таблетках — по 1 таблетке 3 раза в сутки. Курс лечения составляет 10–14 дней.
Желчегонный эффект гепатопротекторов растительного происхождения является прямым показанием для их назначения детям с гипомоторной дисфункцией желчного пузыря. Терапию проводят прерывистыми курсами по 2 нед в месяц в течение 3–6 мес. При необходимости курсы лечения можно повторять.
Важной задачей лечения любой формы БД является купирование болевого синдрома, который служит основой развития невротических и депрессивных состояний, ухудшающих переносимость боли и усиливающих ее, вследствие повышения висцеральной чувствительности. Для ликвидации болей, обусловленных спазмом сфинктеров, гипермоторикой желчного пузыря или его перерастяжением вследствие гипомоторики, используется регулятор моторики желчевыводящих путей тримебутин (Тримедат). Являясь агонистом периферических μ-, κ- и δ-опиатных рецепторов, тримебутин обладает одновременно спазмолитическим и прокинетическим эффектами в зависимости от исходного уровня тонуса мышечных волокон. Важным его свойством является способность снижать висцеральную гиперчувствительность, что разрывает «порочный» круг патогенеза болей при БД. Препарат разрешен детям с 3-летнего возраста. Детям 3–5 лет назначается по 25 мг 3 раза в сутки, 5–12 лет — по 50 мг 3 раза в сутки, а детям старше 12 лет — по 100–200 мг в сутки.
Для купирования спазмов сфинктеров используют селективный М-холинолитик гиосцина бутилбромид (Бускопан), который не влияет на ЦНС, поскольку не проникает через гематоэнцефалический барьер. Периферическое антихолинергическое действие обусловлено блокадой внутриорганных парасимпатических ганглиев и мускариновых рецепторов. Селективность гиосцина бутилбромида обусловлена его расслабляющим воздействием только лишь в месте возникновения спазмов органов желудочно-кишечного, билиарного трактов и мочеполовой системы. Назначают детям старше 6 лет по 10–20 мг 3 раза в сутки, запивая небольшим количеством воды. Отменять препарат следует постепенно, поскольку при быстрой отмене могут наблюдаться тошнота, потливость, головокружение. Его не рекомендуют назначать в жаркое время года, а во время лечения не следует принимать горячие ванны или перегреваться при выполнении физических упражнений.
Периферическое антихолинергическое действие обусловлено блокадой внутриорганных парасимпатических ганглиев и мускариновых рецепторов. Селективность гиосцина бутилбромида обусловлена его расслабляющим воздействием только лишь в месте возникновения спазмов органов желудочно-кишечного, билиарного трактов и мочеполовой системы. Назначают детям старше 6 лет по 10–20 мг 3 раза в сутки, запивая небольшим количеством воды. Отменять препарат следует постепенно, поскольку при быстрой отмене могут наблюдаться тошнота, потливость, головокружение. Его не рекомендуют назначать в жаркое время года, а во время лечения не следует принимать горячие ванны или перегреваться при выполнении физических упражнений.
Механизм действия миотропных спазмолитиков заключается в накоплении в клетке цАМФ и уменьшении концентрации ионов кальция, что тормозит соединение актина с миозином. Этот эффект достигается либо ингибированием фосфодиэстеразы, либо блокадой аденозиновых рецепторов, либо их комбинацией. Наиболее широко из неселективных спазмолитиков используется дротаверина гидрохлорид, блокирующий фосфодиэстеразу IV типа, что позволяет достичь выраженного расслабления миоцитов ЖКТ. По своему спазмолитическому действию он превосходит эффективность другого представителя этой группы — папаверина гидрохлорида.
Однако при использовании неселективных спазмолитиков следует учитывать их системное действие, а именно воздействие на всю гладкую мускулатуру, включая мочевыделительную систему, кровеносные сосуды и т. д. При длительном их применении возможно развитие гипомоторной дисфункции желчного пузыря и гипотонии сфинктеров, поэтому назначают препараты этой группы на непродолжительное время (не более 2–3 нед). Дротаверина гидрохлорид назначают в следующих дозах: детям до 6 лет по 10–20 мг 1–2 раза в сутки, 6–12 лет — по 20 мг 1–2 раза в сутки. Папаверина гидрохлорид детям от 6 мес до 2 лет назначают по 0,005 г; 3–4 лет — по 0,005–0,01 г; 5–6 лет — по 0,01 г; 7–9 лет — по 0,01–0,015 г; 10–14 лет — 0,015–0,02 г 3–4 раза в сутки.
Учитывая возможность нежелательных эффектов при использовании неселективных спазмолитиков, оптимальным для купирования болевого синдрома при гипермоторных дисфункциях желчного пузыря и спазме сфинктера Одди является назначение препаратов, избирательно расслабляющих гладкую мускулатуру органов ЖКТ. Из миотропных спазмолитиков к ним относится гимекромон (Одестон), обеспечивающий отток желчи в двенадцатиперстную кишку и снижающий давление в билиарной системе. Гимекромон облегчает приток желчи в кишечник и тем самым усиливает энтерогепатическую циркуляцию желчных кислот, участвующих в первой фазе образования желчи. Обладая желчегонным и спазмолитическим эффектами, препарат обеспечивает физиологический дренаж желчевыводящих путей, а увеличивая поступление желчи в кишечник, он способствует ликвидации запоров. Применяться гимекромон у детей может с 7 лет в дозе по 200 мг (1 таблетка) 3 раза в сутки за 30 мин до еды в течение 1–3 нед.
Эффективное желчегонное действие оказывают тюбажи с минеральной водой. Утром натощак больной выпивает 100–150 мл теплой минеральной воды без газа, затем укладывается на правый бок, под который подкладывают теплую грелку, и лежит 40–120 мин. В минеральную воду могут добавляться ксилит (0,5 г/кг на 100–200 мл воды), магния сульфат (0,2–0,4 г/кг развести в 100 мл теплой воды). Вместо минеральной воды могут использоваться соли, обладающие желчегонным эффектом, или мед. Конкретный стимулирующий состав подбирает врач, исходя из особенностей больного. Курс лечения обычно состоит из 10 процедур, которые проводят один раз в три дня.
Учитывая, что БД сопровождаются нарушениями пищеварения в результате расстройства эмульгирования жиров, то в лечебный комплекс по показаниям включают ферментные препараты (панкреатин), среди которых у детей наиболее широко применяется Креон 10000. Препарат обладает высокой активностью липазы, устойчивостью к желудочному соку, возможностью растворения оболочек микросфер и высвобождением активных ферментов в тонкой кишке. При этом воспроизводятся физиологические процессы пищеварения, когда панкреатический сок выделяется порциями в ответ на периодическое поступление пищи из желудка. Кроме того, необходимо помнить, что основным патогенетическим механизмом развития дуоденальной гипертензии при БД может быть избыточный бактериальный рост в тонкой кишке и повышенное содержание жидкости и газа в просвете двенадцатиперстной кишки в результате бродильно-гнилостных процессов, обусловленных микробной контаминацией. Именно поэтому при клинико-лабораторных проявлениях нарушения микробиоценоза кишечника, наряду с препаратами, восстанавливающими микробиоценоз (селективная деконтаминация, про- и пребиотки), предпочтительнее назначать микросферические ферменты. Таким образом, важным фактором, определяющим терапевтическую эффективность, является галеническая форма препарата в кислотоустойчивой оболочке. Доза подбирается индивидуально и зависит от выраженности экзокринной недостаточности поджелудочной железы. Креон 10000 назначается в суточной дозе 1000–2000 ЕД активности липазы на килограмм массы тела в 3–4 приема. Микросферы можно высыпать из капсулы, а необходимое их количество давать детям раннего возраста. Рекомендуют проводить 2–3 курса ферментотерапии по 2 нед с двухнедельным перерывом.
При этом воспроизводятся физиологические процессы пищеварения, когда панкреатический сок выделяется порциями в ответ на периодическое поступление пищи из желудка. Кроме того, необходимо помнить, что основным патогенетическим механизмом развития дуоденальной гипертензии при БД может быть избыточный бактериальный рост в тонкой кишке и повышенное содержание жидкости и газа в просвете двенадцатиперстной кишки в результате бродильно-гнилостных процессов, обусловленных микробной контаминацией. Именно поэтому при клинико-лабораторных проявлениях нарушения микробиоценоза кишечника, наряду с препаратами, восстанавливающими микробиоценоз (селективная деконтаминация, про- и пребиотки), предпочтительнее назначать микросферические ферменты. Таким образом, важным фактором, определяющим терапевтическую эффективность, является галеническая форма препарата в кислотоустойчивой оболочке. Доза подбирается индивидуально и зависит от выраженности экзокринной недостаточности поджелудочной железы. Креон 10000 назначается в суточной дозе 1000–2000 ЕД активности липазы на килограмм массы тела в 3–4 приема. Микросферы можно высыпать из капсулы, а необходимое их количество давать детям раннего возраста. Рекомендуют проводить 2–3 курса ферментотерапии по 2 нед с двухнедельным перерывом.
У детей старшего возраста можно использовать панкреатин, выпускаемый в таблетированной форме, покрытой оболочкой (Мезим форте). Дозируется индивидуально в зависимости от выраженности диспепсических расстройств из расчета 500–100 ЕД липазы/кг массы на каждый прием пищи.
При наличии запоров показаны препараты лактулозы (Дюфалак, Нормазе) в возрастной дозе в течение 1 месяца, после чего продолжают курс лечения в пребиотической дозе (1/2 от лечебной дозы) еще 1 месяц. Следует учитывать, что препараты лактулозы способствуют улучшению энтерогепатической циркуляции желчных кислот, что уменьшает риск формирования билиарного сладжа.
Физиотерапия при гипермоторных дискинезиях может включать электрофорез с новокаином, парафиновые или озокеритовые аппликации, индуктотермию на область правого подреберья, общие радоновые или хвойные ванны, а при гипокинетических дискинезиях — электрофорез с магния сульфатом, фарадизацию, гальванизацию, диадинамические токи Бернара, ультразвук низкой интенсивности.
Лечение БД проводится прерывистыми курсами (по 2 нед в месяц), чередуя желчегонные препараты, общей продолжительностью 3 мес при отсутствии аномалий желчного пузыря и не менее 6 мес при выявлении аномалий. Затем, при купировании клинических проявлений заболевания, целесообразно проводить один двухнедельный курс лечения в квартал в течение 2–3 лет. При наличии билиарного сладжа длительность первого непрерывного курса лечения желчегонными препаратами должна составлять не менее 4 нед с последующим переходом к прерывистым курсам желчегонной терапии. При этом целесообразно проводить ультразвуковое исследование желчного пузыря 2 раза в год в течение 2–3 лет.
Лечебно-профилактический эффект может значительно усилиться после пребывания ребенка в местном санатории или на одном из южных курортов (Железноводск, Кавказские Минеральные Воды, Геленджик, Анапа и др.), где широко используются немедикаментозные методы: дието- и фитотерапия, массаж, ЛФК, физиотерапевтические процедуры. Особое значение на этом этапе приобретает бальнеотерапия. При гипермоторной дискинезии показаны слабоминерализованные (2–5 г/л) минеральные воды гидрокарбонатно-хлоридно-натриевые, с низким содержанием газа, в теплом виде до 5–6 раз в день небольшими порциями в подогретом до 35–45 °C виде за 15–30 мин до еды. Детям с гипомоторной дискинезией рекомендуются минеральные воды средней минерализации (5–15 г/л) сульфатно-натриевые и сульфатно-магниевые комнатной температуры или слегка подогретые (17–30 °C), за 30–60 мин до еды 3 раза в день.
Эффективность восстановительного лечения детей с БД во многом зависит от четко организованного диспансерного наблюдения за больным, которое проводится не менее 2 лет и включает осмотры педиатром или гастроэнтерологом (1 раз в 6 мес), ультразвуковое исследование (УЗИ) печени, желчного пузыря, поджелудочной железы по показаниям, противорецидивные мероприятия или своевременную коррекцию выявленных нарушений [7]. Противорецидивное лечение в случае ассоциации БД и ДСТ следует проводить в виде двухнедельных курсов 1 раз в квартал в течение не менее 3 лет. При наличии билиарного сладжа показан непрерывный курс желчегонных препаратов в течение 4 недель с последующим переходом к прерывистым курсам. При этом целесообразно проводить УЗИ желчного пузыря, печени, поджелудочной железы 2 раза в год в течение 3 лет [6].
При наличии билиарного сладжа показан непрерывный курс желчегонных препаратов в течение 4 недель с последующим переходом к прерывистым курсам. При этом целесообразно проводить УЗИ желчного пузыря, печени, поджелудочной железы 2 раза в год в течение 3 лет [6].
Детям с БД, ассоциированной с ДСТ, помимо противорецидивного лечения препаратами, нормализующими моторную функцию желчевыводящих путей, необходимы курсы метаболической медикаментозной терапии, включающей препараты, стимулирующие коллагенообразование (препараты магния, L-карнитина, витамины группы В) и улучшающие биоэнергетическое состояние организма (Рибоксин, Лимонтар, Кудесан) [8, 9]. Длительность подобной терапии должна составлять не менее 1–2 месяцев, число курсов — 2–3 в год в зависимости от выраженности ДСТ.
Литература
- Волынец Г. В., Хавкин А. И. Дисфункции билиарного тракта у детей // Медицинский оппонент. 2018. 1 (3). С. 59–64.
- Урсова Н. И. Функциональные заболевания билиарного тракта у детей как мультидисциплинарная проблема // Альманах клинической медицины. 2014. № 33. С. 47–56.
- Харитонова Л. А., Запруднов А. М. Заболевания билиарного тракта у детей — современный взгляд на проблему // Педиатрия. 2016. № 6. С. 130–139.
- Шлыкова О. П., Краснова Е. Е., Чемоданов В. В. Диспластические соединительнотканные нарушения у детей с билиарной дисфункцией // Вопросы практической педиатрии. 2010. Т. 5, № 6. С. 13–18.
- Арсентьев В. Г., Баранов В. С., Шабалов Н. П. Наследственные заболевания соединительной ткани как конституциональная причина полиорганных нарушений у детей. СПб: СпецЛит, 2015. 231 с.
- Аббакумова Л. Н. и др. Полиорганные нарушения при дисплазиях соединительной ткани у детей. Алгоритмы диагностики. Тактика ведения. Российские рекомендации // Педиатр. 2016. Т. 7, № 4. С. 5–36.
- Кильдиярова Р. Р., Бельмер С. В., Хавкин А. И. и др. Реабилитация детей с патологией органов пищеварения // Материалы ХХIV Международного Конгресса детских гастроэнтерологов России и стран СНГ «Актуальные проблемы абдоминальной патологии у детей».
 Москва, 14–16 марта 2017 г. / Под общей ред. проф. С. В. Бельмера и проф. Л. И. Ильенко. М.: ИД «Медпрактика-М», 2017. С. 208–257.
Москва, 14–16 марта 2017 г. / Под общей ред. проф. С. В. Бельмера и проф. Л. И. Ильенко. М.: ИД «Медпрактика-М», 2017. С. 208–257. - Аббакумова Л. Н. и др. Наследственные и многофакторные нарушения соединительной ткани у детей. Алгоритмы диагностики. Тактика ведения. Российские рекомендации // Педиатр. 2016. Т. 7, № 2. С. 5–39.
- Чемоданов В. В., Краснова Е. Е. Принципы медицинского сопровождения детей с дисплазией соединительной ткани // Лечащий Врач. 2018. № 11. С. 66–69.
Е. Е. Краснова*, 1, доктор медицинских наук, профессор
В. В. Чемоданов*, доктор медицинских наук, профессор
О. П. Шлыкова**, кандидат медицинских наук
* ФГБОУ ВО ИвГМА Минздрава России, Иваново
** ДГ КДЦ, Иваново
1 Контактная информация: [email protected]
DOI: 10.26295/OS.2019.32.72.008
Основные направления лечения детей с билиарными дисфункциями, ассоциированными с дисплазией соединительной ткани/ Е. Е. Краснова, В. В. Чемоданов, О. П. Шлыкова
Для цитирования: Лечащий врач № 9/2019; Номера страниц в выпуске: 40-43
Теги: дисфункции билиарного тракта, дисплазия соединительной ткани, дети, немедикаментозные воздействия, медикаментозное лечение.
Желчегонный препарат — Медицина и здоровье
11 час назад, ясмин сказал:
привести в норму питание. ничего жареного и гриля. только отварное и припущенное. жидкие каши. и дюспалалин и антибиотик рекомендовали для снятия воспаления.
Это же какой идиот антибиотик рекомендовал?
Я лекциями о здоровом питании и лечебном голодании могу большие деньги зарабатывать
13 часа назад, coin-pro сказал:
Из своего опыта человека, круто попавшего на все желчекаменные дела, могу сказать, что прием желчегонных при камнях облегчения не даст: усиление оттока желчи вызовет усиление движения камней.
Для обезболивания-дюспаталин (накрайняк ношпа). А дальше, извиняюсь за банальность, аппаратная диагностика, консультация и лечение.
Спазм вызывающий острые болевые ощущения снимается Бускапином, здесь ничего фантазировать не надо, я же спрашиваю про желчегонные, продающиеся в Испании, не более того.
Да, для стимуляции желчного пузыря и выхода из него застоявшейся желчи с камнями или без, не суть.
12 часа назад, Kipling сказал:
Урсосан, урсофальк . Если ЖКБ — лапароскопическое удаление пузыря
Удаление пузыря — это крайняя мера и уж точно не у испанских коновалов)))
Антибиотики без побочек. Как правильно принимать эти лекарства?
Продукты, которые есть нельзя!
Чтобы антибиотики не принесли вреда здоровью, на время лечения придётся отказаться от некоторых продуктов, в первую очередь от алкоголя. Ведь алкоголь, по сути, – это яд для наших клеток. Да, в небольшом количестве он образуется и у нас в организме, в кишечнике при расщеплении бактериями растительной пищи. И с малыми дозами этого вещества здоровый человек справиться может. Но на фоне заболевания, когда на организм воздействуют не только вирусы и бактерии, но и антибиотики, приём алкоголя – удар по системе детоксикации. Такого она попросту может не выдержать, и тогда проблем с печенью не избежать.
Ещё один напиток, с которым придётся на время попрощаться, – молоко. Кальций, содержащийся в молочных продуктах, вступает в реакцию с компонентами антибактериальных препаратов, тем самым дезактивируя их. В результате лекарства попросту не будут работать. К тому же молоко снижает количество полезных бактерий, а на фоне дисбиоза (нарушения баланса между полезной и условно-патогенной микрофлорой) ухудшается способность переваривать лактозу – молочный сахар. Поэтому в сочетании с молоком антибиотики могут привести к брожению в кишечнике и вздутию живота.
Поэтому в сочетании с молоком антибиотики могут привести к брожению в кишечнике и вздутию живота.
Также на фоне приёма лекарств стоит максимально уменьшить количество углеводистой пищи, особенно простых углеводов. Как мы уже говорили, они могут спровоцировать рост условно-патогенной микрофлоры.
Откажитесь от острого, жареного, перчёного – такая пища раздражает слизистую желудка, которая из-за антибиотиков и так не в лучшем состоянии. Жиров тоже должно быть по минимуму – жирная пища перегружает печень.
Питание на фоне приёма антибиотиков должно включать продукты, которые защищают слизистую желудочно-кишечного тракта, а также поддерживают дружественную нам микрофлору. Это прежде всего овощи, в которых много клетчатки (именно пищевые волокна служат пищей для полезной микрофлоры). Это могут быть сельдерей, кабачки, баклажаны, зелень. Можно включить в меню немного фруктов – слишком большое их количество не рекомендуется из-за довольно высокого содержания сахара. Но и овощи, и фрукты нужно термически обрабатывать (отваривать, тушить, запекать) – ферментированная клетчатка быстрее и легче усвоится бактериями.
Не забывайте и про крепкие мясные бульоны – они помогают защитить и восстановить слизистую кишечника. Неслучайно они так часто используются в лечебном питании.
Артишок
Описание
Многолетнее лекарственное растение. Отнесено к семейству сложноцветных. Стебель артишока посевного — до 1,5 м высотой, ветвистый, прямостоячий, серо-зеленый. Листья растения — перисторассеченные, крупные, беловатые опушенные снизу и серовато-зеленые сверху. Его цветки собраны в большие корзинки синего цвета. Растение артишок посевной цветет в июне – июле и имеет плод-семянку.
Состав
В листьях артишока содержатся хлорогеновая и кофейная кислота, цинарин, минеральные соли, полисахариды, в частности инулин, а также витамины А, В1, В2, С, танин, пектин, калий, органические кислоты. Благодаря наличию полифенольных производных цинарина, хлорогеновой и кофейной кислот, экстракт артишока обладает гепатопротекторным и желчегонным свойствами. Аскорбиновая кислота, каротин, витамины В1 и В2, а также инулин нормализуют обмен веществ в организме человека.
Благодаря наличию полифенольных производных цинарина, хлорогеновой и кофейной кислот, экстракт артишока обладает гепатопротекторным и желчегонным свойствами. Аскорбиновая кислота, каротин, витамины В1 и В2, а также инулин нормализуют обмен веществ в организме человека.
Цветоложе содержит белковые вещества, углеводы, каротин, инулин, в большом количестве витамины — тиамин, рибофлавин, аскорбиновую кислоту, В1, В2, каротин и ароматические вещества.
Свойства
Благодаря влиянию цинарина, листья посевного артишока проявляют желчегонное действие и могут восстанавливать клетки печени. Листья лекарственного растения снижают уровень жирных кислот и холестерина в крови, оказывают мочегонное воздействие на организм человека.
Применение
Препараты артишока представляют собой, с точки зрения фармацевтики, горькое средство с благотворным воздействием на работу печени, одновременно стимулирующее образование и отток желчи. Выводит из организма токсины, соли тяжелых металлов, радионуклиды.
Препараты артишока хорошо помогают при тошноте, ощущении тяжести, метеоризме и болях, вызываемых плохой функцией печени.
Пациенты с камнями в желчном пузыре считают, что им лучше всего помогают препараты артишока: колики становятся реже. Кроме того, артишок снижает содержание жира и холестерина в крови.
Артишок активизирует деятельность кишечника и полезен при лечении запора. Воздействуя на печень, он стимулирует вывод продуктов жизнедеятельности организма из ее тканей, а также оказывает мочегонное действие и ускоряет вывод из организма избыточной жидкости. Кроме того, артишок содействует удалению жира из жировых клеток и по этой причине является важным компонентом любой диеты.
Во время сильной интоксикации организма необходимо принимать артишок, чтобы не произошли патологические изменения, ферменты сыворотки крови остались в норме, так как силимарин артишока полностью разрушает токсины. Артишок незаменим при похмельном синдроме, улучшает пищеварение и легко снимает неприятные ощущения при переедании.
Артишок незаменим при похмельном синдроме, улучшает пищеварение и легко снимает неприятные ощущения при переедании.
Входит в состав следующих препаратов:
Подготовка к дуоденальному зондированию | Медицинский центр Медлайн
За 5-8 дней до процедуры
Для получения точных результатов, запрещено делать слепое зондирование (тюбаж). Необходимо прекращение употребления каких-либо препаратов, действие которых способно влиять на функции печени и кишечника:
Зонд
1. Желчегонные, в том числе лечебные травы, влияющие на систему желчевыделения.
2. Спазмолитики.
3. Сосудорасширяющие.
4. Пищеварительные ферменты.
5. Слабительные.
6. Иные лекарства, провоцирующие увеличение вырабатываемого количества желчи.
Меню питания пациента остается привычным, однако все продукты, стимулирующие желчегонную систему, из рациона исключаются. К таковым относятся:
1. Наваристые рыбные и мясные отвары.
2. Жирные и жареные продукты.
3. Яйца и все блюда с ними.
4. Кофе, насыщенный чай.
5. Сладости.
6. Алкоголь.
За 2-3 дня до процедуры
Из рациона пациента дополнительно исключаются продукты, содержащие:
1. Животные жиры (сливочное масло).
2. Молочные продукты.
3. Копчености.
4. Жареные блюда.
5. Фрукты.
6. Овощи.
Необходимо выпивать по стакану сладкого чая перед отходом ко сну (это не относится к диабетикам), а также прикладывать грелку на правое подреберье (область печени). Однако в случае подозрения на лямблиоз, грелка противопоказана.
Билирубинат кальция в желчи
Накануне процедуры
Перед днем выполнения процедуры ужин должен быть ранним (не позднее 18-19 часов вечера), содержащий легкие блюда. Запрещено принимать такие продукты:
1. Молоко.
2. Картофель.
3. Черный хлеб.
4. Другие продукты, повышающие газообразование в кишечнике.
В день процедуры
Запрещено принимать какую-либо еду, жидкости, а также следует воздержаться от курения. Допустимо выпить малое количество воды, но не позже, чем за 2 часа до запланированной процедуры.
Допустимо выпить малое количество воды, но не позже, чем за 2 часа до запланированной процедуры.
Продолжительность выполнения дуоденального зондирования варьируется от 40 мин. до 3 часов.
После завершения процедуры
Можно выпить сладкого теплого чая, а через 20-60 мин. после завершения процедуры можно принимать пищу. Еда должна быть легкой, а пища на протяжении всего дня не должна содержать острых, жирных и жареных блюд. Меню питания после дуоденального зондирования первые 3 дня должно состоят из правильно подобранных блюд, которые не будут создавать ЖКТ дополнительную нагрузку, ведь перед проведением процедуры, пациент некоторое время придерживался диеты, которая помогала желудку подготовиться к предстоящему испытанию.
Куркума — полезные свойства и противопоказания
Куркума – одна из самых известных и наиболее используемых специй с древних времен.
Это пряность также известна под названием «шафран Индии» из-за их сходства по цвету и применению. В Индии куркума известна более 5000 лет, и уже древние тексты указывали на ее диетические качества и целебное влияние на организм.
В западных странах куркума стала широко применяться не очень давно, в составе приправы карри, основным компонентом которого она является.
В терапевтических и пищевых целях используют корневище растения, которое находится под землей и представляет собой не корень, а подземный видоизмененный стебель.
Разновидностей куркумы насчитывается не менее 40. В кулинарных и лечебных целях используют всего 4-5 видов. Они отличаются друг от друга по форме, цвету корневищ, остроте.
Самый распространенный вид – ярко-оранжевые корневища, турмерик.
Аромат куркумы, теплый и острый, чем-то напоминает аромат имбиря (который является ее «родственником»), что играет основную роль в выборе специи для приготовления еды.
В состав куркумы входят многие витамины и микроэлементы, но учитывая сравнительно небольшую порцию этой специи (до 1ч. л. в день) – вклад ее в потребление этих компонентов достаточно скромен.
л. в день) – вклад ее в потребление этих компонентов достаточно скромен.
Куркума — это хорошая и полезная специя.
Зато наличие полифенольного соединения куркумина (семейство куркуминоидов, около 3% в сухом порошке измельченного высушенного корневища) определяет большинство его полезных качеств, придает куркуме пряный, слегка горький, отчетливо землистый вкус и ярко-желтый цвет.
Из-за красящей способности куркумин используется в качестве натурального пищевого красителя (E100) в производстве соусов, сыров, майонеза. Раньше куркума применялась для окрашивания тканей и кожи.
За тысячи лет использования куркумы были замечены многие ее лечебные свойства.
Противовоспалительные, антибактериальные качества этой желтой специи использовались для лечения внутренних и кожных заболеваний.
В жарких и влажных странах, таких как Индия, страна происхождения куркумы, это отличное лекарство для лечения ран без применения повязок, которые могут только усугублять воспаление.
За последние 30-40 лет проведено много исследований на тканевых культурах, лабораторных животных и несколько не очень больших клинических исследований на людях по изучению куркумина, его влиянию на различные процессы, особенностей всасывания, усвоения.
Получены данные, что он обладает антиоксидантным действием, способен уменьшать количество свободных радикалов, вызывающих повреждения на клеточном уровне.
Эти нарушения лежат в основе многих хронических состояний – от сахарного диабета и атеросклероза, до онкологических заболеваний и старения.
В ходе исследований на предмет противораковых свойств выяснилось, что куркума может использоваться в качестве профилактики рака кожи, простаты, ротовой полости, почек, молочной железы, печени, толстой кишки и поджелудочной железы. Конечно, лекарством от рака куркума не является, но свой вклад как в предупреждение этих заболеваний, так и лучшую переносимость химиотерапии может внести.
Куркума может использоваться в качестве профилактики рака кожи, простаты, ротовой полости, почек, молочной железы, печени, толстой кишки и поджелудочной железы.
Еще одним исключительным свойством куркумы является ее заживляющая способность — отличное средство первой помощи при солнечных ожогах, дерматитах, укусах насекомых и ранах. Находит применение в лечении псориаза, угревой сыпи в составе мазей.
В косметологии куркума тоже активно применяется для укрепления волос, в качестве питательных и очищающих масок. С этой целью применяют не только «золотую» куркуму, но и ее белую разновидность – циадорею. Она острее привычной, но в косметических целях показала себя очень хорошо, особенно при отбеливании кожи, борьбе с пигментными пятнами.
Также, благодаря противовоспалительному и обезболивающему действию, она широко используется как средство от гриппа, болей в горле и простуды. Полоскания, горячие напитки с куркумой – натуральные и эффективные средства, доступные каждому.
В виде мазей на основе куркумы с добавлением чеснока, растительного масла и меда она может помочь при болезнях суставов, принося облегчение при течении артрита, подагры. Рассчитывать на быстрый эффект уменьшения боли и воспаления в суставе от приема внутрь не стоит, при местном использовании – эффект может быть более выраженный.
Используют «пасту» и полоскание с куркумой для отбеливания зубов, лечения кариеса и периодонтита. Было исследование корейских ученых, подтвердившее положительное действие куркумы для состояния зубов и десен через 30 дней ежедневного применения пасты с ее добавлением.
Но особенно заметный эффект куркумы – это желчегонное свойство, способность улучшить выработку и отток желчи. В результате работа пищеварительного тракта становится более активной и эффективной, увеличивается секреция желудочного сока, уменьшается вздутие живота, за счет антисептических качеств восстанавливается баланс микрофлоры. А за счет улучшения обмена жиров (желчь играет важную роль в их переваривании и всасывании) в исследованиях было отмечено снижение уровня холестерина крови, что положительно сказывается на сердечно-сосудистой заболеваемости.
Несмотря на то что куркума – натуральная и часто используемая специя, есть ряд противопоказаний и осторожностей при ее применении:
- Не стоит злоупотреблять куркумой во время беременности (небольшие количества при привычном употреблении повредить не могут), так как она повышает тонус матки. Но это свойство может быть полезно в послеродовом периоде.
- Маленьким детям не стоит добавлять ее до 6 лет. Продолжающее формироваться пищеварение может быть более чувствительным к действию специи, жидкий стул, изжога, метеоризм, боли в животе – частые явления при добавлении взрослых порций куркумы в тарелку ребенка, особенно, непривычного в ней
- Людям с желчно-каменной болезнью и заболеваниями желудка в стадии обострения также стоит избегать употребления куркумы в значительных дозах (больше 1/2ч.л в день). Увеличивая выработку желудочного сока и отток желчи (особенно вместе с горьким перцем) может раздражать воспаленную слизистую желудка и кишечника, усиливая боли. Если есть камни в желчном пузыре, они могут стать причиной колики из-за желчегонного действия куркумы. Это частая причина срочного хирургического вмешательства – удаления желчного пузыря.
Камни в желчном пузыре могут стать причиной колики из-за желчегонного действия куркумы.
Куркума достаточно доступный продукт, который можно найти повсеместно. Ее можно приобрести в виде порошка в качестве специи и пищевой добавки в обычных и специализированных магазинах. При выборе куркумы-порошка нужно обращать внимание на цвет – желто-золотой, запах (пряный, немного горчичный) и, при возможности попробовать, на вкус – горьковатый, немного ореховый.
Рекомендуемая доза составляет 1 чайная ложка в день. Специи обычно кладут в конце приготовления пищи, чтобы сохранить аромат и свойства растения. Ее можно добавлять в супы, кремы, соусы, варенье и йогурт, а также в продукты растительного происхождения, такие как тофу и растительное молоко. Часто с куркумой готовят рис или мясо, которые приобретаю характерный аромат и приятный желтый оттенок.
В виде горячего напитка с добавлением только куркумы или в сочетании с имбирем, корицей, лимоном является отличным согревающим и тонизирующим средством. Большой популярностью пользуется молочный напиток с добавлением куркумы — «Куркума-латте» или «Золотое молоко». Для его приготовления понадобится любое молоко по вкусу (растительное или коровье), доведенное до кипения вместе с порошком куркумы (1/2 чайной ложки на стакан молока), свежим или высушенным имбирем, корицей и щепоткой чёрного перца.
Было также замечено, что регулярное употребление куркумы улучшает мыслительные процессы, память, внимание. Помогает бороться с синдромом перенапряжения и хронической усталости.
Стоит помнить, что куркума очень плохо усваивается, больше 90% ее проходит «насквозь», оказывая при этом сокогонное, желчегонное, местное противовоспалительное действие на пищеварительную систему, но не всасываясь в кровь. Добавление же одновременно небольшого количества черного перца (за счет пиперина) значительно повышает усвоение куркумина и оказание уже общего действия на организм. Другим правилом использования золотой специи является добавление хотя бы небольшого количества жира, что также повышает ее усвоение. Поэтому вместе с мясом, молоком, орехами, растительных или животным маслом куркума более доступна.
Куркуму лучше употреблять вместе с мясом, молоком, орехами, растительных или животным маслом.
Если ставить целью получить терапевтическую пользу от куркумы (а не только гастрономическое удовольствие), нужно употребить достаточно большую ее порцию, больше обычной рекомендуемой. Или использовать ее практически ежедневно, как принято в традиционной кухне народов Юго-восточной Азии.
Кто не готов поглощать острые азиатские блюда каждый день, может принимать пищевые добавки с куркумином. Они могут быть в виде таблеток, капсул. Как правило, в состав включен и пиперин (не больше 5%), повышающий биодоступность основного вещества. Иногда его «упаковывают» вместе c магнием, Омега-3 полиненасыщенными жирными кислотами, витамином С – создавая мощный антиоксидантный комплекс.
Доза куркумина в БАД может быть от 40 мг до 1000мг. Созданы также так называемые «мицеллярные» формы, способствующие лучшему ее усвоению. В качестве лечебной добавки может быть использован и «сок куркумы» — вытяжка из корневищ этого замечательного растения.
Куркума – специя, обладающая множеством полезных свойств, но все же имеющая ряд противопоказаний. Важно помнить меру и осторожность в ее использовании, перед применением обязательно посоветоваться со своим врачом.
Какие лекарственные препараты из класса желчегонных средств используются при лечении холестаза?
Автор
Хишам Назер, MBBCh, FRCP, DTM & H Профессор педиатрии, консультант по детской гастроэнтерологии, гепатологии и клиническому питанию, Медицинский факультет Университета Иордании, Иордания
Хишам Назер, MBBCh, FRCP, DTM & H является членом следующих медицинских общества: Американская ассоциация врачей-лидеров, Королевский колледж педиатрии и детского здоровья, Королевский колледж хирургов в Ирландии, Королевское общество тропической медицины и гигиены, Королевский колледж врачей и хирургов Соединенного Королевства
Раскрытие информации: не раскрывать.
Специальная редакционная коллегия
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Главный редактор
Кармен Каффари, доктор медицины Доцент кафедры педиатрии, отделение гастроэнтерологии / питания, Медицинская школа университета Джона Хопкинса
Кармен Каффари, доктор медицины, является членом следующих медицинских обществ: Американского колледжа гастроэнтерологии, Американской гастроэнтерологической ассоциации, Североамериканское общество детской гастроэнтерологии, гепатологии и питания, Королевский колледж врачей и хирургов Канады
Раскрытие информации: Получены гонорары от лабораторий Прометея за выступления и обучение; Получал гонорары от Abbott Nutritionals за выступления и преподавание. для: Abbott Nutritional, Abbvie, спикеры.
для: Abbott Nutritional, Abbvie, спикеры.
Дополнительные участники
Джаянт Деодхар, доктор медицины Доцент педиатрии, Медицинский колледж Би Джей, Индия; Почетный консультант отделения педиатрии и неонатологии, Мемориальная больница короля Эдуарда, Индия
Раскрытие информации: нечего раскрывать.
Желчегонный — обзор | ScienceDirect Topics
ЛЕЧЕНИЕ И РЕЗУЛЬТАТЫ
Несколько желчегонных, иммунодепрессивных и антифибротических средств использовались для лечения первичного СК у взрослых, но не было показано, что лекарство может изменить его естественное течение.Урсодезоксихолевая кислота (УДХК) представляет собой гидрофильную желчную кислоту, которая стабилизирует мембраны клеток печени, подверженных токсическим концентрациям природной хенодезоксихолевой кислоты. Проспективное рандомизированное двойное слепое плацебо-контролируемое исследование у взрослых пациентов с первичной СК показало улучшение лабораторных тестов у пациентов, получавших 13-15 мг / кг / день УДХК, но это не сопровождалось долгосрочными положительными изменениями (Lindor, 1997 ). Было высказано предположение (Mitchell et al., 2001a), и были представлены некоторые доказательства (Harnois et al., 2001), более высокие дозы УДХК (25–30 мг / кг / день) могут принести пользу.
Несмотря на неофициальные сообщения об улучшении с помощью глюкокортикоидов и азатиоприна у взрослых пациентов с первичной СК (Myers et al., 1970; Javett, 1971), их использование вызывает споры. Другие препараты, эффективность которых не доказана, включают пеницилламин, метотрексат, колхицин, циклоспорин, холестирамин, никотин и пентоксифиллин. Сообщалось, что такролимус улучшает функциональные тесты печени в небольшом пилотном исследовании, которое, однако, было неконтролируемым, непродолжительным и не имело гистологических и холангиографических данных (Van Thiel et al., 1995).
При ювенильной форме СК, которая имеет сильные аутоиммунные особенности, лечение стероидами и азатиоприном, аналогичным тем, которые используются при АИГ, как сообщается, является полезным в ослаблении паренхиматозного воспалительного поражения, но менее эффективно в борьбе с желчью. заболевание протоков (Gregorio et al., 2001). Положительный ответ на иммуносупрессию, наблюдаемый у этих молодых пациентов, контрастирует с неутешительными результатами, полученными при первичной СК у взрослых, возможно, потому, что у последних наблюдается гораздо более запущенное заболевание.
заболевание протоков (Gregorio et al., 2001). Положительный ответ на иммуносупрессию, наблюдаемый у этих молодых пациентов, контрастирует с неутешительными результатами, полученными при первичной СК у взрослых, возможно, потому, что у последних наблюдается гораздо более запущенное заболевание.
Средняя зарегистрированная выживаемость взрослых пациентов с первичной СК составляет 10–12 лет с момента постановки диагноза (Wiesner et al., 1989; Farrant et al., 1991). Заболевание прогрессирует, и у большинства бессимптомных пациентов в конечном итоге развиваются симптомы хронического холестаза и билиарного цирроза (Porayko et al., 1990). Пожилой возраст, высокий уровень билирубина и АСТ в сыворотке, низкий уровень альбумина, гепатоспленомегалия, кровотечение из варикозно расширенных вен, наличие ВЗК и продвинутая гистологическая стадия являются независимыми предикторами плохого прогноза (Angulo and Lindor, 1999).
Для пациентов с поздней стадией СК трансплантация печени — единственный эффективный терапевтический вариант, и для достижения оптимальных результатов ее следует предлагать, когда болезнь еще не запущена. Текущая 3-летняя выживаемость составляет 85–90%. Интересно, что пациенты, которым трансплантировали СК, имеют значительно более высокий уровень развития неанастомотических стриктур желчных путей после операции (Sheng et al., 1993; Feller et al., 1996). Это, наряду с частым обнаружением гистологических признаков, согласующихся с SC, в биоптатах после трансплантации (Harrison et al., 1994; Наруми и др., 1995) предположили, что болезнь может рецидивировать в трансплантате, хотя диагностика рецидива затруднена из-за других посттрансплантационных осложнений, которые могут повлиять на желчные протоки. Определение рецидива SC было предложено клиникой Mayo (Graziadei et al., 1999) и включает: 1) диагностику SC до трансплантации; 2) холангиографические признаки SC менее чем через 90 дней после операции или гистологии, показывающие фиброзный холангит и / или фибро-облитерирующие поражения с дуктопенией, билиарным фиброзом или билиарным циррозом или без них; 3) исключение тромбоза печеночной артерии, хронического протокового отторжения, стриктуры анастомоза, неанастомотической стриктуры менее чем через 90 дней после операции, несовместимости донор / реципиент по системе ABO. Используя это определение, рецидив SC был зарегистрирован у 20% пациентов с трансплантацией (Graziadei et al., 1999). В целом, рецидивирующий СК не оказывает серьезного негативного влияния на среднесрочную выживаемость пациента или трансплантата. Активность ВЗК после трансплантации непостоянна, но, как сообщается, она более серьезна, особенно в отделениях, где стероидная иммуносупрессия отменяется на ранней стадии (Papatheodoridis et al., 1998; Gow and Chapman et al., 2000). Колоректальный рак поражает 5–7% пациентов с первичным СК после трансплантации печени, в особенности тех, у кого в анамнезе долгая история язвенного колита и панколита (Loftus et al., 1998; MacLean et al., 2003; Вера и др., 2003). Для предотвращения этого опасного для жизни осложнения рекомендуется ежегодное наблюдение и колэктомия у отдельных пациентов из группы высокого риска с длительным тяжелым колитом (Loftus et al., 1998; Gow PJ, Chapman, 2000; Vera et al., 2003).
Используя это определение, рецидив SC был зарегистрирован у 20% пациентов с трансплантацией (Graziadei et al., 1999). В целом, рецидивирующий СК не оказывает серьезного негативного влияния на среднесрочную выживаемость пациента или трансплантата. Активность ВЗК после трансплантации непостоянна, но, как сообщается, она более серьезна, особенно в отделениях, где стероидная иммуносупрессия отменяется на ранней стадии (Papatheodoridis et al., 1998; Gow and Chapman et al., 2000). Колоректальный рак поражает 5–7% пациентов с первичным СК после трансплантации печени, в особенности тех, у кого в анамнезе долгая история язвенного колита и панколита (Loftus et al., 1998; MacLean et al., 2003; Вера и др., 2003). Для предотвращения этого опасного для жизни осложнения рекомендуется ежегодное наблюдение и колэктомия у отдельных пациентов из группы высокого риска с длительным тяжелым колитом (Loftus et al., 1998; Gow PJ, Chapman, 2000; Vera et al., 2003).
Терапия желчегонными и иммунодепрессивными агентами
[9] Маркус Б.Х., Диксон Э.Р., Грамбш П.М. и др. Эффективность трансплантации печени у
больных первичным билиарным циррозом. N Engl J Med 1989; 320 (26): 1709–13.
[10] Линдор К. Урсодезоксихолевая кислота для лечения первичного билиарного цирроза. N Engl
J Med 2007; 357 (15): 1524–9.
[11] Линдор К.Д., Диксон Э.Р., Балдус В.П. и др. Урсодезоксихолевая кислота в лечении первичного билиарного цирроза
. Гастроэнтерология 1994; 106 (5): 1284–90.
[12] Линдор К.Д., Терно Т.М., Йоргенсен Р.А. и др. Влияние урсодезоксихолевой кислоты на выживаемость
у пациентов с первичным билиарным циррозом. Гастроэнтерология 1996; 110 (5): 1515–8.
[13] Poupon RE, Lindor KD, Cauch-Dudek K, et al. Комбинированный анализ рандомизированных
контролируемых исследований
урсодезоксихолевой кислоты при первичном билиарном циррозе. Гастроэнтерология
1997; 113 (3): 884–90.
[14] Ангуло П., Линдор К.Д., Терно Т. М. и др. Использование шкалы риска Майо у пациентов
М. и др. Использование шкалы риска Майо у пациентов
с первичным билиарным циррозом, получающих урсодезоксихолевую кислоту. Печень 1999; 19 (2): 115–21.
[15] Corpechot C, Carrat F, Bahr A, et al. Влияние терапии урсодезоксихолевой кислотой на естественное течение
первичного билиарного цирроза.Гастроэнтерология 2005; 128 (2): 297–303.
[16] ter Borg PC, Schalm SW, Hansen BE, et al. Прогноз при лечении урсодезоксихолевой кислотой
пациентов с первичным билиарным циррозом. Результаты 10-летнего когортного исследования с участием 297 человек —
человека. Am J Gastroenterol 2006; 101 (9): 2044–50.
[17] Heathcote EJ. Лечение первичного билиарного цирроза. Практические рекомендации Американской ассоциации по исследованию заболеваний печени
. Гепатология 2000; 31 (4): 1005–13.
[18] Leuschner U, Leuschner M, Sieratzki J, et al.Растворение желчных камней с помощью урсодезоксихолевой кислоты
у пациентов с хроническим активным гепатитом и двухлетнее наблюдение. Пилотное исследование. Dig
Dis Sci 1985; 30 (7): 642–9.
[19] Poupon R, Chretien Y, Poupon RE, et al. Является ли урсодезоксихолевая кислота эффективным средством лечения первичного билиарного цирроза
? Ланцет 1987; 1 (8537): 834–6.
[20] Лазаридис К.Н., Горс Г.Дж., Линдор К.Д. Механизмы действия урсодезоксихолевой кислоты и
клиническое применение при гепатобилиарных расстройствах.J Hepatol 2001; 35 (1): 134–46.
[21] Паумгартнер Г., Бойерс У. Урсодезоксихолевая кислота при холестатической болезни печени: пересмотр механизмов действия
и терапевтического использования. Гепатология 2002; 36 (3): 525–31.
[22] Bachrach WH, Hofmann AF. Урсодезоксихолевая кислота в лечении холестерина, холестерина, литиаза
. Часть II. Dig Dis Sci 1982; 27 (9): 833–56.
[23] Podda M, Ghezzi C, Battezzati PM, et al. Влияние разных доз урсодезоксихолевой кислоты
на хроническое заболевание печени. Dig Dis Sci 1989; 34 (12 Suppl): 59S – 65S.
Dig Dis Sci 1989; 34 (12 Suppl): 59S – 65S.
[24] Йоргенсен Р.А., Диксон Э.Р., Хофманн А.Ф. и др. Характеристика пациентов с полным биохимическим ответом на урсодезоксихолевую кислоту. Gut 1995; 36 (6): 935–8.
[25] van de Meeberg PC, Wolfhagen FH, Van Berge-Henegouwen GP, et al. Однократная или многократная доза урсодезоксихолевой кислоты
при холестатической болезни печени: обогащение желчных путей и биохимический ответ
. J Hepatol 1996; 25 (6): 887–94.
[26] Angulo P, Dickson ER, Therneau TM, et al.Сравнение трех доз кислоты урсодезоксихолевой
при лечении первичного билиарного цирроза: рандомизированное исследование. J Hepatol 1999; 30 (5):
830–5.
[27] Poupon RE, Balkau B, Eschwege E, et al. Многоцентровое контролируемое исследование урсодиола для лечения первичного билиарного цирроза
. Исследовательская группа UDCA-PBC. N Engl J Med 1991;
324 (22): 1548–54.
[28] Heathcote EJ, Cauch-Dudek K, Walker V, et al. Канадское многоцентровое двойное слепое исследование
Рандомизированное контролируемое исследование урсодезоксихолевой кислоты при первичном билиарном циррозе.Hepa-
тология 1994; 19 (5): 1149–56.
[29] Combes B, Carithers RL Jr, Maddrey WC, et al. Рандомизированное двойное слепое контролируемое плацебо-
исследование урсодезоксихолевой кислоты при первичном билиарном циррозе. Гепатология 1995;
22 (3): 759–66.
[30] Йоргенсен Р., Ангуло П., Диксон Э. Р. и др. Результаты длительного лечения урсодиолом
больных первичным билиарным циррозом. Am J Gastroenterol 2002; 97 (10): 2647–50.
439
ЛЕЧЕНИЕ ПЕРВИЧНОГО БИЛИАРНОГО ЦИРРОЗА
Активное энтерогепатическое циклирование не требуется для холеретического действия 24-норурсодезоксихолевой кислоты у мышей
Abstract
Превосходная способность нороксихолевой кислоты (нор-) урсол 9016A индуцировать богатый бикарбонатом гиперхолерезис объясняется его способностью подвергаться холегепатическому шунтированию, а и УДХК в настоящее время оцениваются в качестве терапевтического средства для лечения различных форм заболеваний печени. Целью этого исследования было использование моделей мышей для изучения вклада переносчиков желчных кислот в желчегонное действие и УДХК. Здесь мы показываем, что апикальный натрий-зависимый переносчик желчных кислот (ASBT) и органический переносчик растворенных веществ-альфа (OSTα) не нужны ни для , ни для УДХК-стимуляции оттока желчи и секреции бикарбоната желчи у мышей. Анализ транскриптома печени показал, что и UDCA индуцировали печеночную экспрессию ограниченного числа генов-транспортеров, в частности полипептида 1a4, транспортирующего органический анион (Oatp1a4).Однако ни , ни УДХК мощно стимулировали богатый бикарбонатом гиперхолерезис у мышей с дефицитом Oatp1a / 1b. Блокирование реабсорбции желчных кислот в кишечнике путем совместного введения ингибитора ASBT или секвестранта желчных кислот не влияло на способность и УДХК индуцировать отток желчи у мышей дикого типа. Результаты подтверждают концепцию, что эти основные переносчики желчных кислот не принимают непосредственного участия в абсорбции, желчепеченочном шунтировании или желчегонном действии и УДХК.Кроме того, полученные данные подтверждают дальнейшее исследование терапевтического синергизма между и УДХК и ингибиторами ASBT или секвестрантами желчных кислот при холестатической болезни печени.
Целью этого исследования было использование моделей мышей для изучения вклада переносчиков желчных кислот в желчегонное действие и УДХК. Здесь мы показываем, что апикальный натрий-зависимый переносчик желчных кислот (ASBT) и органический переносчик растворенных веществ-альфа (OSTα) не нужны ни для , ни для УДХК-стимуляции оттока желчи и секреции бикарбоната желчи у мышей. Анализ транскриптома печени показал, что и UDCA индуцировали печеночную экспрессию ограниченного числа генов-транспортеров, в частности полипептида 1a4, транспортирующего органический анион (Oatp1a4).Однако ни , ни УДХК мощно стимулировали богатый бикарбонатом гиперхолерезис у мышей с дефицитом Oatp1a / 1b. Блокирование реабсорбции желчных кислот в кишечнике путем совместного введения ингибитора ASBT или секвестранта желчных кислот не влияло на способность и УДХК индуцировать отток желчи у мышей дикого типа. Результаты подтверждают концепцию, что эти основные переносчики желчных кислот не принимают непосредственного участия в абсорбции, желчепеченочном шунтировании или желчегонном действии и УДХК.Кроме того, полученные данные подтверждают дальнейшее исследование терапевтического синергизма между и УДХК и ингибиторами ASBT или секвестрантами желчных кислот при холестатической болезни печени.
Введение
или Урсодезоксихолевая кислота ( или УДХК) представляет собой синтетический аналог с укороченной боковой цепью C-23 гидрофильной нативной урсодезоксихолевой кислоты желчной кислоты (УДХК) и устойчив к конъюгации боковой цепи с глицином или таурином. (1). Фармакологические свойства и физиологическое действие и УДХК делают его терапевтическим кандидатом при различных холестатических заболеваниях печени (1).В доклинических исследованиях пероральное введение или УДХК уменьшало повреждение печени и фиброз желчных протоков у мышей с перевязкой желчных протоков и у мышей Abcb4 / Mdr2 — / — , тогда как введение УДХК усугубляло повреждение печени и желчных протоков (2, 3 ). В этих моделях или УДХК вызывали детоксикацию и выведение желчных кислот почками и проявляли антипролиферативные, антифиброзные и противовоспалительные свойства (2–6). В фазе 2 клинических испытаний введение или УДХК в течение 12 недель снижало уровень щелочной фосфатазы (ЩФ) в сыворотке крови и других маркеров холестаза ферментов печени у пациентов с первичным склерозирующим холангитом (ПСХ) (7) и снижало уровень аланинаминотрансферазы (АЛТ) в сыворотке. у пациентов с неалкогольной жировой болезнью печени (8).
В этих моделях или УДХК вызывали детоксикацию и выведение желчных кислот почками и проявляли антипролиферативные, антифиброзные и противовоспалительные свойства (2–6). В фазе 2 клинических испытаний введение или УДХК в течение 12 недель снижало уровень щелочной фосфатазы (ЩФ) в сыворотке крови и других маркеров холестаза ферментов печени у пациентов с первичным склерозирующим холангитом (ПСХ) (7) и снижало уровень аланинаминотрансферазы (АЛТ) в сыворотке. у пациентов с неалкогольной жировой болезнью печени (8).
Введение дигидроксибильных кислот с укороченными боковыми цепями, таких как или УДХК, вызывает поток желчи, богатый бикарбонатом, сверх того, что можно объяснить их осмотическим действием (1). Превосходная способность и УДХК по сравнению с УДХК вызывать гиперхолерезис объясняется способностью и УДХК уклоняться от конъюгации (амидирования) боковой цепи с глицином или таурином и подвергаться холегепатическому шунтированию. По пути, предложенному Hofmann (1, 9), неконъюгированная или УДХК секретируются гепатоцитами в желчь и абсорбируются в протонированной форме холангиоцитами, выстилающими желчевыводящие пути, тем самым генерируя ион бикарбоната из билиарного CO 2 .Затем и УДХК проникают через билиарный эпителий и попадают в перидуктулярное капиллярное сплетение, которое оттекает в воротную вену (или непосредственно в синусоиды печени), доставляя или УДХК для поглощения гепатоцитами и последующей ресекреции в желчь. Немодифицированная УДХК и , которая не всасывается в желчных путях, перемещается вместе с другими компонентами желчных путей в тонкий кишечник, где она реабсорбируется и переносится энтерогепатическим кровотоком обратно в печень для поглощения и повторной секреции в желчь.Таким образом, или УДХК участвует в нескольких раундах холегепатического шунтирования или в комбинации энтерогепатического и холегепатического циклов, прежде чем превращаться в более полярный метаболит в результате метаболизма фазы 1 или фазы 2 в печени (в основном, глюкуронизации фазы 2) и выводиться из организма. в моче или кале (1, 9–11). Физико-химические свойства и проницаемость и УДХК (дополнительная таблица 1) в целом согласуются с ролью пассивной диффузии в абсорбции и УДХК (12).Однако опосредованные носителями механизмы клеточного поглощения и экспорта также играют важную роль в поглощении и утилизации многих лекарств и эндобиотиков (13-15), а также в вкладе переносчиков желчных кислот и органических анионов в абсорбцию и холегепатическое шунтирование и . УДХК до конца не изучен (16). В этом исследовании мы применили генетический подход, чтобы определить, необходимы ли основные переносчики желчных кислот ASBT и OSTα-OSTβ и активная энтерогепатическая циркуляция для гиперхолеретического действия или УДХК.
в моче или кале (1, 9–11). Физико-химические свойства и проницаемость и УДХК (дополнительная таблица 1) в целом согласуются с ролью пассивной диффузии в абсорбции и УДХК (12).Однако опосредованные носителями механизмы клеточного поглощения и экспорта также играют важную роль в поглощении и утилизации многих лекарств и эндобиотиков (13-15), а также в вкладе переносчиков желчных кислот и органических анионов в абсорбцию и холегепатическое шунтирование и . УДХК до конца не изучен (16). В этом исследовании мы применили генетический подход, чтобы определить, необходимы ли основные переносчики желчных кислот ASBT и OSTα-OSTβ и активная энтерогепатическая циркуляция для гиперхолеретического действия или УДХК.
Результаты
Чтобы определить, требуются ли основной транспортер желчных кислот Asbt и активная энтерогепатическая циркуляция желчных кислот для богатого бикарбонатом холереза, индуцированного или УДХК, мы исследовали поток желчи и выход бикарбоната желчи в фоновом штамме. WT и Asbt — / — мышей кормили кормом или кормом плюс 0,5% или УДХК в течение 7 дней. Схема эксперимента и морфологический ответ на введение и УДХК показаны на дополнительном рисунке 2.Введение или UDCA мышам WT и Asbt — / — в течение 7 дней имело тенденцию к снижению массы тела (дополнительный рисунок 2B, C), но не влияло на длину или вес тонкого кишечника, длину или вес толстой кишки или вес почки (данные не показаны). Вес печени и отношение веса печени к массе тела были увеличены в обоих генотипах при лечении или УДХК (дополнительный рисунок 2D, E). Однако анализ срезов печени, окрашенных H и E, не выявил явных гистологических различий между генотипами или группами лечения (дополнительный рисунок 2F), а химический состав плазмы существенно не отличался между группами корма и или UDCA для обоих генотипов (дополнительная таблица 2).
Влияние введения или УДХК на поток желчи и выход растворенных веществ желчи показано на рисунке 1 и обобщено в таблице 1. На диете грызунов поток желчи, концентрация бикарбонатов, выход бикарбоната желчи и pH желчи были одинаковыми. у мышей WT и Asbt — / — . В соответствии с блоком активной реабсорбции желчных кислот в подвздошной кишке, концентрация и выход желчных кислот в желчные пути были снижены более чем на 50% у мышей Asbt — / — , получавших корм, по сравнению с мышами WT (рис. 1D, E).По сравнению с мышами, получавшими пищу, введение или УДХК увеличивало скорость потока желчи в 5-6 раз, концентрацию бикарбоната желчи в 2 раза и выход бикарбоната более чем в 10 раз как у WT, так и у Asbt — / — мышей (Фигуры 1А, Б, В; Таблица 1). Кормление и УДХК также увеличивало выработку желчной кислоты примерно в 4 и 8 раз у мышей WT и Asbt — / — соответственно (Фигуры 1D, E). Поскольку способность или УДХК стимулировать холерезис, богатый бикарбонатом, считается вторичной по отношению к его потенциалу в отношении шунтирования холегепатии и обогащения желчи, состав желчных желчных кислот был определен для корма и , ни , ни , обработанные УДХК, и Asbt. — / — мышей.Показаны выход и относительная доля каждого вида желчных кислот (Рисунки 1E, 1F). По сравнению с мышами дикого типа, которых кормили пищей, мыши Asbt — / — имели более гидрофобный состав желчных кислот с пониженным относительным количеством 6-гидроксилированных форм желчных кислот, таких как тауро-β-мурихолевая кислота (TβMCA), и повышенное количество таурохолевой кислоты (TCA) и производного от нее продукта кишечной микробиоты тауродезоксихолевой кислоты (TDCA). После введения или УДХК состав желчных желчных кислот стал более гидрофильным у мышей Asbt — / — и очень похож на мышей WT, при этом на или УДХК приходится примерно 60% от общего количества желчных желчных кислот в организме. оба генотипа.Также наблюдалось значительное снижение доли TCA и TDCA у мышей Asbt — / — после лечения или UDCA. Изменения гидрофобности желчных кислот отражаются в рассчитанном индексе гидрофобности, который снизился с +0,166 до -0,483 у мышей Asbt — / — при кормлении или UDCA, но практически не изменился у мышей WT (рассчитанное значение индекса гидрофобности -0,453 против -0,489 у мышей и , ни мышей, получавших УДХК, соответственно).Для сравнения показаны количества различных видов желчных кислот, выделяемых с калом (дополнительный рисунок 3). В условиях кормления кормом содержание желчных кислот в фекалиях было примерно в 5 раз больше у мышей Asbt — / — по сравнению с мышами WT и включало более высокую долю холевой кислоты и дезоксихолевой кислоты. Введение в рацион и УДХК увеличивало содержание желчных кислот в кале как у мышей WT, так и у мышей Asbt — / — и сдвигало состав эндогенных желчных кислот в сторону 6-гидроксилированных видов мрихолатов.Повышение уровня желчных кислот в кале было вызвано, главным образом, экзогенной УДХК и , однако количество эндогенной желчной кислоты в кале также увеличивалось как у мышей WT, так и у мышей Asbt — / — после введения или . УДХК.
оба генотипа.Также наблюдалось значительное снижение доли TCA и TDCA у мышей Asbt — / — после лечения или UDCA. Изменения гидрофобности желчных кислот отражаются в рассчитанном индексе гидрофобности, который снизился с +0,166 до -0,483 у мышей Asbt — / — при кормлении или UDCA, но практически не изменился у мышей WT (рассчитанное значение индекса гидрофобности -0,453 против -0,489 у мышей и , ни мышей, получавших УДХК, соответственно).Для сравнения показаны количества различных видов желчных кислот, выделяемых с калом (дополнительный рисунок 3). В условиях кормления кормом содержание желчных кислот в фекалиях было примерно в 5 раз больше у мышей Asbt — / — по сравнению с мышами WT и включало более высокую долю холевой кислоты и дезоксихолевой кислоты. Введение в рацион и УДХК увеличивало содержание желчных кислот в кале как у мышей WT, так и у мышей Asbt — / — и сдвигало состав эндогенных желчных кислот в сторону 6-гидроксилированных видов мрихолатов.Повышение уровня желчных кислот в кале было вызвано, главным образом, экзогенной УДХК и , однако количество эндогенной желчной кислоты в кале также увеличивалось как у мышей WT, так и у мышей Asbt — / — после введения или . УДХК.
Таблица 1. Поток и состав желчи у WT и Asbt — / — Мышей, получавших Chow или или UDCA Diet
Значения выражены как среднее ± стандартное отклонение. Указывается количество мышей в группе (n).Значения с разными надстрочными буквами значительно различаются ( P <0,05) в соответствии с обычным двухфакторным дисперсионным анализом и тестом множественных сравнений Сидака. BLD, ниже уровня обнаружения; LW, вес печени.
Рис. 1. Обработка или УДХК увеличивает поток желчи и выход бикарбоната желчи и растворенных веществ у мышей WT и Asbt — / — .
( A ) Отток желчи. ( B ) Концентрация бикарбоната желчных путей. ( C ) Выход бикарбоната.( D ) Вывод желчных желчных кислот. ( E ) Выход видов желчных желчных кислот (среднее + SEM). ( F ) Состав желчных желчных кислот в виде круговых диаграмм. Если не указано иное, показаны среднее + SD; n = 6-7 мышей на группу. Четкие строчные буквы указывают на значительные различия между группами ( P <0,05).
Влияние кормления или UDCA на выход других растворенных веществ желчных путей у мышей WT и Asbt — / — показано в таблице 1.Общая концентрация и выход глутатиона имели тенденцию быть выше у мышей Asbt — / — , получавших корм, по сравнению с мышами WT. Это может быть механизмом увеличения потока желчи, не зависящего от желчных кислот, чтобы компенсировать прерывание энтерогепатической циркуляции желчных кислот и снижение потока желчи, зависимого от желчных кислот. Введение или UDCA мышам WT и Asbt — / — не изменяло концентрацию билиарного глутатиона, но увеличивало выход глутатиона в 3-4 раза для обоих генотипов.Уровни билиарного холестерина были немного снижены у мышей WT и Asbt — / — , получавших диету или UDCA, но общий выход холестерина был увеличен по сравнению с мышами, получавшими пищу, из-за увеличения потока желчи. В отличие от билиарного холестерина, введение или УДХК резко снижало секрецию билиарного фосфолипида как у мышей WT, так и у мышей Asbt — / — , что согласуется с предыдущими исследованиями (1–3), и было приписано снижению поверхностной активности и способность норУДХК извлекать фосфолипид из канальцевой мембраны (10).В целом, эти данные предполагают, что Asbt не требуется для абсорбции или UDCA или его способности стимулировать богатый бикарбонатом гиперхолерезис у мышей.
OSTα-OSTβ является гетеромерным двунаправленным транспортером-фасилитатором и отвечает за экспорт желчных кислот через базолатеральную мембрану различного эпителия. Подобно ASBT, OSTα-OSTβ экспрессируется энтероцитами подвздошной кишки и холангиоцитами. Однако OSTα-OSTβ также экспрессируется на более низких уровнях в проксимальном отделе тонкой кишки и в толстой кишке, где он может участвовать в экспорте желчных кислот, которые были поглощены через апикальную мембрану путем пассивной диффузии (17, 18).Из-за их более высокого pKa часть неконъюгированных и конъюгированных с глицином желчных кислот протонируется и попадает в эпителий за счет неионной диффузии (19). Однако, оказавшись внутри цитоплазматического компартмента, слабые кислоты ионизируются при этом нейтральном pH, потенциально препятствуя их выходу из клетки за счет пассивной диффузии и вызывая потребность в переносчике оттока, таком как OSTα-OSTβ. Чтобы определить, может ли OSTα-OSTβ вносить вклад в абсорбцию и богатый бикарбонатом холерез, индуцированный или УДХК, мы исследовали поток желчи и выход бикарбоната желчи в фоновом штамме WT и Ostα — / — Asbt — / — мышей, которых кормили кормом или кормом плюс 0.5% или УДХК в течение 7 дней. Ostα — / — Asbt — / — мышей были отобраны для этих исследований вместо Ostα — / — мышей, поскольку инактивация Asbt защищает Ostα — / — мышей от повреждения подвздошной кишки и ослабляет связанные с этим адаптивные изменения, такие как удлинение тонкой кишки и гистологические изменения подвздошной кишки, такие как притупление ворсинок, увеличение количества продуцирующих муцин клеток и усиление пролиферации клеток (20).Эти изменения, как предполагалось, усложнят интерпретацию результатов в отношении роли транспортной активности Ostα-Ostβ в кишечной абсорбции и желчегонных действиях и УДХК. Схема эксперимента и морфологический ответ на введение и УДХК показаны на дополнительном рисунке 4. Как и в случае мышей WT и Asbt — / — , отношение веса печени к массе тела было увеличено у Ostα — / — Asbt — / — и соответствующие мыши WT, получавшие лечение или УДХК (дополнительная фигура 4E).По сравнению с мышами, которых кормили пищей, введение или УДХК увеличивало скорость потока желчи в 5-6 раз, концентрацию бикарбоната желчи в 2 раза, выход бикарбоната более чем в 10 раз и выход глутатиона в 5-6 раз. у мышей WT и мышей с сопоставимой по фоновой линии линии без Asbt и Ostα (рис. 2).
Как и в случае мышей WT и Asbt — / — , отношение веса печени к массе тела было увеличено у Ostα — / — Asbt — / — и соответствующие мыши WT, получавшие лечение или УДХК (дополнительная фигура 4E).По сравнению с мышами, которых кормили пищей, введение или УДХК увеличивало скорость потока желчи в 5-6 раз, концентрацию бикарбоната желчи в 2 раза, выход бикарбоната более чем в 10 раз и выход глутатиона в 5-6 раз. у мышей WT и мышей с сопоставимой по фоновой линии линии без Asbt и Ostα (рис. 2).
Рис. 2. Обработка или УДХК увеличивает поток желчи и выход бикарбоната желчи и растворенных веществ у мышей WT и Ostα — / — Asbt — / — мышей.
( A ) Отток желчи.( B ) Концентрация бикарбоната желчных путей. ( C ) Выход бикарбоната. ( D ) Концентрация глутатиона. ( E ) Выход глутатиона. Среднее + SD, n = 5-7 мышей на группу. Четкие строчные буквы указывают на значительные различия между группами ( P <0,05).
Отрицательные результаты для Asbt и Ostα-Asbt нулевых мышей не исключают потенциального участия других мембранных транспортеров. Мы предположили, что и УДХК могут действовать с прямой связью, чтобы индуцировать экспрессию гепатоцитов или холангиоцитов транспортеров, участвующих в расположении или УДХК, холегепатическом шунтировании или механизме действия.Чтобы идентифицировать потенциальных кандидатов, был проведен анализ RNA-Seq с использованием печени мышей WT, получавших корм или рационы, содержащие или UDCA. Используя log2 (кратное изменение)> 1 и множественное тестирование (FDR 5%), у мышей WT, получавших или UDCA, было идентифицировано 1232 гена с пониженной регуляцией и 1087 гена с повышенной регуляцией. Сужение нашего внимания к экспрессии гена мембранного транспортера выявило 80 членов семейства Solute Carrier ( SLC ), 16 членов семейства АТФ-связывающих кассет ( ABC ) и 15 членов семейства транспортирующих АТФаз P-типа ( ATP ) (Рисунок 3A , 3B; дополнительная фигура 5A), которые по-разному экспрессируются у или UDCA по сравнению с контрольными мышами WT, получавшими пищу. Из этих печеночных генов значительно индуцировалась экспрессия 30 SLC , 10 ABC и 3 АТФ транспортеров. Среди наиболее высокоиндуцированных генов-транспортеров у мышей, получавших и UDCA, был Slco1a4 (Oatp1a4; первоначально назывался Oatp2). Oatp1a4 является натрий-независимым носителем, способствующим захвату, с широкой субстратной специфичностью, который включает желчные кислоты и, как сообщается, экспрессируется на синусоидальной мембране гепатоцитов (21).
Из этих печеночных генов значительно индуцировалась экспрессия 30 SLC , 10 ABC и 3 АТФ транспортеров. Среди наиболее высокоиндуцированных генов-транспортеров у мышей, получавших и UDCA, был Slco1a4 (Oatp1a4; первоначально назывался Oatp2). Oatp1a4 является натрий-независимым носителем, способствующим захвату, с широкой субстратной специфичностью, который включает желчные кислоты и, как сообщается, экспрессируется на синусоидальной мембране гепатоцитов (21).
Рисунок 3.Обработка или УДХК изменяет экспрессию ограниченного числа генов печеночного транспортера. Анализ РНК-Seq печени мышей WT, получавших корм или рацион или с УДХК.
( A ) Дифференциально экспрессируемые генов мембранных транспортеров SLC , экспрессия которых была значительно индуцирована ( P <0,05; n = 6 на группу) у мышей и , обработанных UDCA, по сравнению с мышами, получавшими корма. ( B ) Дифференциально экспрессируемые гены транспортера ABC и ATP P-типа АТФазы ( P <0.05; n = 6 на группу) у мышей, получавших и УДХК, по сравнению с мышами, получавшими корм. ( C ) Экспрессия в печени указанных транспортеров и связанный с желчной кислотой биосинтез или метаболизирующие ферменты у мышей WT и Asbt — / — , получавших корм или рацион, содержащий или УДХК, в течение 7 дней. РНК выделяли из печени отдельных мышей и использовали для ПЦР-анализа в реальном времени. Экспрессию мРНК нормализовали с использованием циклофилина, и результаты для каждого гена выражали относительно мышей WT, получавших пищу (установлено на 100%).Среднее + SD, n = 6-7 мышей на группу. Четкие строчные буквы указывают на значительные различия между группами ( P <0,05).
Для дальнейшего изучения результатов RNA-Seq была использована ПЦР в реальном времени для измерения экспрессии мРНК выбранных транспортеров и генов, критических для гомеостаза желчных кислот (рис. 3C). Введение или УДХК индуцировало экспрессию мРНК Oatp1a4 более чем в 6 раз у мышей WT и Asbt — / — , тогда как другие гены семейства печеночных OATP, Oatp1a1, Oatp1b2 и Oatp2b1, в значительной степени не пострадали.Что касается других переносчиков, участвующих в метаболизме желчной кислоты или холестерина, печеночная экспрессия Asbt была снижена, тогда как Ntcp, Bsep, Mrp2, Abcg5 / 8 были умеренно увеличены, а уровни РНК Mrp3 увеличились в 3-4 раза (Рисунок 3C). В подвздошной кишке введение или УДХК имело тенденцию к снижению экспрессии мРНК связанных с желчной кислотой генов Asbt, Fgf15 и Ostα-Ostβ, но мало влияло на экспрессию Ibabp (дополнительная фигура 5B). Примечательно, что введение норУДКА индуцировало экспрессию ряда генов-мишеней PXR, включая Slco1a4 (Oatp1a4), Abcc3 (Mrp3) и Cyp3a11 .Эти результаты согласуются с анализом данных RNA-Seq, который выявил опосредованную прегнаном X-рецептором (PXR) прямую регуляцию ферментов, метаболизирующих ксенобиотики, как один из наиболее регулируемых путей (дополнительный рисунок 6A). Чтобы напрямую проверить гипотезу о том, что или УДХК могут действовать напрямую через PXR или другие ядерные рецепторы, активируемые желчной кислотой, способность и UDCA активировать PXR мыши, фарнезоидный X-рецептор человека (FXR) и рецептор витамина D человека. (VDR) исследовали на трансфицированных клетках Huh7 человека.В диапазоне концентраций до 100 мкМ ни , ни УДХК не повышали активность репортерных плазмид PXR, FXR или VDR (дополнительная фигура 6B).
3C). Введение или УДХК индуцировало экспрессию мРНК Oatp1a4 более чем в 6 раз у мышей WT и Asbt — / — , тогда как другие гены семейства печеночных OATP, Oatp1a1, Oatp1b2 и Oatp2b1, в значительной степени не пострадали.Что касается других переносчиков, участвующих в метаболизме желчной кислоты или холестерина, печеночная экспрессия Asbt была снижена, тогда как Ntcp, Bsep, Mrp2, Abcg5 / 8 были умеренно увеличены, а уровни РНК Mrp3 увеличились в 3-4 раза (Рисунок 3C). В подвздошной кишке введение или УДХК имело тенденцию к снижению экспрессии мРНК связанных с желчной кислотой генов Asbt, Fgf15 и Ostα-Ostβ, но мало влияло на экспрессию Ibabp (дополнительная фигура 5B). Примечательно, что введение норУДКА индуцировало экспрессию ряда генов-мишеней PXR, включая Slco1a4 (Oatp1a4), Abcc3 (Mrp3) и Cyp3a11 .Эти результаты согласуются с анализом данных RNA-Seq, который выявил опосредованную прегнаном X-рецептором (PXR) прямую регуляцию ферментов, метаболизирующих ксенобиотики, как один из наиболее регулируемых путей (дополнительный рисунок 6A). Чтобы напрямую проверить гипотезу о том, что или УДХК могут действовать напрямую через PXR или другие ядерные рецепторы, активируемые желчной кислотой, способность и UDCA активировать PXR мыши, фарнезоидный X-рецептор человека (FXR) и рецептор витамина D человека. (VDR) исследовали на трансфицированных клетках Huh7 человека.В диапазоне концентраций до 100 мкМ ни , ни УДХК не повышали активность репортерных плазмид PXR, FXR или VDR (дополнительная фигура 6B).
Значительное увеличение, наблюдаемое для экспрессии Oatp1a4 в печени, повысило вероятность того, что этот транспортер может быть индуцирован с прямой связью для облегчения печеночного клиренса и холегепатического шунтирования или UDCA. Чтобы напрямую проверить гипотезу, способность или УДХК индуцировать секрецию желчи и выход бикарбоната желчи была исследована на мышах WT и Oatp1a / 1b — / — , у которых Slco1a1 . , Slco1a4 , Slco1a5 , Slco1a6 и Slco1b2 были вырезаны посредством cre-опосредованной делеции кластера генов Slco1a / 1b (22).Для этих исследований была выбрана хорошо охарактеризованная модель мыши Oatp1a / 1b — / — , поскольку различные переносчики Oatp1a и Oatp1b демонстрируют значительное перекрытие в их тканевой экспрессии и субстратной специфичности, а другие члены подсемейства Oatp1a / 1b мыши могут частично компенсировать потерю только Oatp1a4. Схема эксперимента и морфологический ответ на кормление или УДХК у мышей Oatp1a / 1b — / — показаны на дополнительном рисунке 7.Введение или УДХК мышам WT на фоне FVB и Oatp1a / 1b — / — в течение 7 дней снижало массу тела для обоих генотипов и увеличивало массу печени и отношение массы печени к массе тела у мышей WT. Поток желчи и выход растворенных веществ желчи показаны на рисунке 4. Поток желчи и концентрация бикарбоната желчи, выход бикарбоната и pH были одинаковыми у мышей WT, получавших пищу, и мышей Oatp1a / 1b — / — . Подобно мышам WT C57BL / 6J, введение или UDCA мышам WT FVB значительно увеличивало отток желчи на 4.В 7 раз, концентрация бикарбоната желчных путей в 1,6 раза и выход бикарбоната в 7,5 раз по сравнению с мышами, получавшими пищу. У мышей Oatp1a / 1b — / — введение или УДХК вызывало 5-кратное увеличение скорости потока желчи, 2-кратное увеличение концентрации бикарбоната желчных путей и 11-кратное увеличение выхода бикарбоната.
, Slco1a4 , Slco1a5 , Slco1a6 и Slco1b2 были вырезаны посредством cre-опосредованной делеции кластера генов Slco1a / 1b (22).Для этих исследований была выбрана хорошо охарактеризованная модель мыши Oatp1a / 1b — / — , поскольку различные переносчики Oatp1a и Oatp1b демонстрируют значительное перекрытие в их тканевой экспрессии и субстратной специфичности, а другие члены подсемейства Oatp1a / 1b мыши могут частично компенсировать потерю только Oatp1a4. Схема эксперимента и морфологический ответ на кормление или УДХК у мышей Oatp1a / 1b — / — показаны на дополнительном рисунке 7.Введение или УДХК мышам WT на фоне FVB и Oatp1a / 1b — / — в течение 7 дней снижало массу тела для обоих генотипов и увеличивало массу печени и отношение массы печени к массе тела у мышей WT. Поток желчи и выход растворенных веществ желчи показаны на рисунке 4. Поток желчи и концентрация бикарбоната желчи, выход бикарбоната и pH были одинаковыми у мышей WT, получавших пищу, и мышей Oatp1a / 1b — / — . Подобно мышам WT C57BL / 6J, введение или UDCA мышам WT FVB значительно увеличивало отток желчи на 4.В 7 раз, концентрация бикарбоната желчных путей в 1,6 раза и выход бикарбоната в 7,5 раз по сравнению с мышами, получавшими пищу. У мышей Oatp1a / 1b — / — введение или УДХК вызывало 5-кратное увеличение скорости потока желчи, 2-кратное увеличение концентрации бикарбоната желчных путей и 11-кратное увеличение выхода бикарбоната.
Рис. 4. Обработка или УДХК увеличивает поток желчи и выход бикарбоната желчи и растворенных веществ у мышей WT и Oatp1a / 1b — / — .
( A ) Отток желчи. ( B ) Концентрация бикарбоната желчных путей. ( C ) Выход бикарбоната. ( D ) pH желчных путей. Среднее + SD, n = 5 мышей на группу. Четкие строчные буквы указывают на значительные различия между группами ( P <0,05).
Четкие строчные буквы указывают на значительные различия между группами ( P <0,05).
Введение или УДХК (2), ингибиторов ASBT (23, 24) и секвестрантов желчных кислот (25) ранее показало пользу на модели холестаза Abcb4 / Mdr2 — / — и, по-видимому, включают как перекрывающиеся, так и дополнительные терапевтические механизмы действия.Следуя нашим наблюдениям за мышами Asbt — / — , получавшими или УДХК, мы затем исследовали влияние фармакологического прерывания энтерогепатической циркуляции желчных кислот на желчегонное действие и УДХК путем совместного введения ASBTi или секвестрант желчных кислот (колесевелам). Колесевелам представляет собой секвестрант желчных кислот и неабсорбируемый полимер, который связывает желчные кислоты за счет комбинации гидрофобных и ионных взаимодействий и с более высоким сродством, чем секвестранты первого поколения, такие как холестирамин (26).Самцов мышей WT кормили кормом, кормом с добавлением 0,006% (мас. / Мас.) ASBTi, кормом с добавлением 2% (мас. / Мас.) Колесевеламом или этими диетами плюс 0,5% (мас. / Мас.) или УДХК в течение 7 дней. Схема эксперимента и морфологический ответ на кормление или UDCA показаны на дополнительном рисунке 8. Введение или UDCA мышам в течение 7 дней имело тенденцию к снижению массы тела, особенно при совместном введении с ASBTi (подтверждающий рис. 8B, C) и увеличить отношение веса печени к массе тела (дополнительная фигура 8E).Однако анализ срезов печени, окрашенных H и E, не выявил явных гистологических различий между группами лечения (дополнительная фигура 8F), а химический состав плазмы существенно не отличался между группами (дополнительная таблица 3). Уровни желчных кислот, выделяемых с калом для каждой из экспериментальных групп, показаны на дополнительном рисунке 8G. Введение ASBTi по сравнению с колесевеламом привело к большему увеличению содержания желчных кислот в кале, однако оба лечения вызвали аналогичные изменения в составе желчных кислот в кале по сравнению с контрольными мышами с кормом (дополнительная фигура 8H). Введение или УДХК с пищей увеличивало содержание желчных кислот в кале во всех группах лечения из-за увеличения экскреции экзогенной или УДХК, а также увеличения эндогенных желчных кислот.
Введение или УДХК с пищей увеличивало содержание желчных кислот в кале во всех группах лечения из-за увеличения экскреции экзогенной или УДХК, а также увеличения эндогенных желчных кислот.
Аналогично результатам для мышей Asbt — / — , или УДХК значительно увеличили поток желчи в 3-4 раза, концентрацию бикарбоната в ~ 2 раза и выход бикарбоната в ~ 8 раз в WT. мышей при совместном введении с ASBTi (рис. 5A, 5B, 5C).Примечательно, что и УДХК также стимулировали аналогичный богатый бикарбонатом холерез при совместном введении с колесевеламом. В соответствии с блокировкой всасывания желчных кислот в кишечнике, концентрации желчных кислот были снижены у мышей, получавших ASBTi и колесевелам, по сравнению с контрольными мышами, употребляющими пищу, однако введение и УДХК значительно увеличивало выход желчных кислот во всех группах лечения (рис. 5F). Наблюдение за тем, что совместное введение колесевелама не ослабляет гиперхолерезис, вызванный или УДХК, побудило исследовать способность колесевелама связывать или УДХК по сравнению с эндогенными желчными кислотами в моделированной жидкости тонкого кишечника.В соответствии с предыдущими данными колесевелам эффективно связывал GCDCA и TDCA in vitro (27). Однако в тех же условиях было минимальное связывание или УДХК с колесевеламом (дополнительная фигура 9), что дает возможное объяснение неэффективности совместно вводимого колесевелама в отношении противодействия действиям и УДХК. Таким образом, фармакологическое ингибирование всасывания желчных кислот в кишечнике не препятствует способности и УДХК вызывать у мышей богатый бикарбонатом гиперхолерезис.
Рисунок 5. Фармакологическое ингибирование всасывания желчных кислот в кишечнике не изменяет или УДХК-индукцию богатого бикарбонатом гиперхолерезиса у мышей.
( A ) Отток желчи. ( B ) Концентрация бикарбоната желчных путей. ( C ) Выход бикарбоната. ( D ) pH желчных путей. ( E ) Концентрация желчных желчных кислот. ( F ) Вывод желчных желчных кислот. ( G ) Фекальные желчные кислоты (средние значения). ( H ) Состав фекальных желчных кислот в виде круговых диаграмм.Если не указано иное, показаны среднее + SD; n = 5 мышей на группу. Четкие строчные буквы указывают на значительные различия между группами ( P <0,05).
( C ) Выход бикарбоната. ( D ) pH желчных путей. ( E ) Концентрация желчных желчных кислот. ( F ) Вывод желчных желчных кислот. ( G ) Фекальные желчные кислоты (средние значения). ( H ) Состав фекальных желчных кислот в виде круговых диаграмм.Если не указано иное, показаны среднее + SD; n = 5 мышей на группу. Четкие строчные буквы указывают на значительные различия между группами ( P <0,05).
Обсуждение
Главный вывод этого исследования состоит в том, что основные переносчики желчных кислот ASBT и OSTα-OSTβ не требуются для перорального введения или УДХК для стимуляции гиперхолерезиса, богатого бикарбонатами. Физиологические свойства и метаболизм C-23 или -мобильных кислот с укороченной боковой цепью, таких как или UDCA, были предметом значительных исследований (1, 10, 11).Из-за более высокой критической концентрации мицелл (ККМ) (17 мМ), чем у многих природных желчных кислот, или УДХК, скорее всего, присутствует в желчи в мономерной, а не мицеллярной форме (28). Основываясь на своих выводах, Хофманн с соавторами предположили, что C-23 и -дигидроксижелные кислоты достаточно гидрофобны, чтобы абсорбироваться путем пассивной диффузии (9). Однако мембранные переносчики участвуют в печеночном клиренсе различных гидрофобных препаратов и эндобиотиков, включая неконъюгированные желчные кислоты C-24 (22, 29), а также в исследовании вклада отдельных переносчиков желчных кислот и органических анионов в транспорт и УДХК. был ограничен моделями на основе трансфицированных клеток (16).ASBT и OSTα-OSTβ играют центральную роль в кишечной реабсорбции желчных кислот и экспрессируются желчным эпителием (31–33). Таким образом, было возможно, что эти основные переносчики желчных кислот могут играть прямую или косвенную роль в абсорбции, желчепеченочном шунтировании и действиях и УДХК.
В соответствии с предыдущими исследованиями, введение или УДХК значительно увеличивало выделение желчи и концентрацию бикарбоната у мышей WT, и аналогичные результаты наблюдались для Asbt — / — и Ostα — / — Asbt — / — мышей.Выход желчной кислоты, обычно более низкий у мышей Asbt — / — по сравнению с мышами WT, был значительно увеличен при введении или УДХК. Это было вызвано, в первую очередь, увеличением оттока желчи, поскольку концентрация общей желчной кислоты в желчных путях существенно не изменилась. Однако введение и УДХК значительно изменило состав желчных кислот, при этом и УДХК составляют более половины видов желчных кислот и сопутствующее снижение эндогенных форм желчных кислот.У мышей Asbt — / — , получавших ингибиторы ASBT, композиция желчных желчных кислот становится более гидрофобной и обогащается TCA и TDCA. Это, скорее всего, связано с повышенным синтезом TCA в печени и повышенным потоком TCA в толстую кишку, где она метаболизируется до дезоксихолевой кислоты (DCA), пассивно реабсорбируется и переносится обратно в печень для поглощения, реконъюгации и 7α-регидроксилирования часть TDCA в TCA (24, 30). После введения или УДХК состав желчных эндогенных желчных кислот у мышей WT и Asbt — / — становится очень похожим.Потенциальным механизмом снижения TDCA является подавление или UDCA микробного 7α-дегидроксилирования холевой кислоты кишечника, поскольку введение или UDCA также уменьшало долю DCA в фекалиях от Asbt — / — мышей и мышей WT. лечится ингибитором ASBT или секвестрантом желчной кислоты. Интересно, что наблюдалось увеличение эндогенных желчных кислот в кале у мышей WT, получавших или УДХК, что может быть вторичным по отношению к снижению экспрессии Asbt в подвздошной кишке или слабому ингибированию активности Asbt в подвздошной кишке. Используя модели на основе клеток, гидрофобные неконъюгированные желчные кислоты, такие как CDCA, DCA, UDCA, LCA, демонстрировали незначительное очевидное поглощение, опосредованное ASBT, по сравнению с фоном, но все же способны конкурировать за поглощение конъюгированных желчных кислот (31).
Используя модели на основе клеток, гидрофобные неконъюгированные желчные кислоты, такие как CDCA, DCA, UDCA, LCA, демонстрировали незначительное очевидное поглощение, опосредованное ASBT, по сравнению с фоном, но все же способны конкурировать за поглощение конъюгированных желчных кислот (31).
Мы предположили, что и УДХК могут индуцировать экспрессию в печени своего собственного транспортера (ов) с прямой связью, чтобы облегчить холегепатическое шунтирование. Анализ RNA-Seq показал, что и UDCA индуцировали экспрессию только небольшого подмножества генов печеночных транспортеров, включая несколько транспортеров, участвующих в гомеостазе желчных кислот, Oatp1a4, Mrp3, Mrp4 и Mdr1a.Интересно, что многие из генов, индуцированных или UDCA, являются генами-мишенями PXR, что повышает вероятность того, что или UDCA могут действовать прямо или косвенно через PXR. Однако при опросе ни , ни УДХК не показали, что они непосредственно активируют мышиную PXR или ядерные рецепторы, чувствительные к желчным кислотам, FXR или VDR, как измерено с помощью анализов репортерного репортера ядерный рецептор-люцифераза в трансфицированных клетках гепатомы человека Huh7. Мы сосредоточили наше внимание на Oatp1a4, поскольку его экспрессия в печени была наиболее сильно индуцирована у мышей WT, получавших и UDCA.Oatp1a4 (первоначально названный Oatp2) экспрессируется на синусоидальной мембране гепатоцитов, транспортирует различные органические анионы и вносит вклад в печеночный клиренс стероидных сульфатов, желчных кислот и лекарств (32–34). Однако три наиболее распространенные изоформы печеночного Oatp у грызунов, Oatp1a1, Oatp1b2 и Oatp1a4, демонстрируют перекрывающуюся субстратную специфичность (35), что побудило нас использовать мышиную модель Oatp1a / 1b — / — , в которой отсутствуют все 3 транспортера для наших исследований. (22). Подобно мышам Asbt — / — и Ostα — / — Asbt — / — , потеря транспортеров Oatp1a / 1b не нарушала способность norUDCA стимулировать богатый бикарбонатом гиперхолерезис. Это согласуется с данными, полученными с использованием клеток, стабильно экспрессирующих OATP печени человека, которые не смогли обнаружить заметный транспорт или UDCA с помощью OATP1B1, OATP1B3 или OATP2B1 человека (16).
Это согласуется с данными, полученными с использованием клеток, стабильно экспрессирующих OATP печени человека, которые не смогли обнаружить заметный транспорт или UDCA с помощью OATP1B1, OATP1B3 или OATP2B1 человека (16).
Обнаружение того, что концентрация бикарбоната желчных путей и поток желчи увеличиваются в WT, получавшем или UDCA, и различных моделях нокаута транспортера, полностью согласуется с механизмом холегепатического шунтирования или UDCA, предложенным Hofmann (1), однако исследование имел ряд ограничений.Это включало использование высоких фармакологических доз или УДХК, вводимых с пищей. Хотя более высокая доза широко использовалась в предыдущих исследованиях на мышах (2–4), она может скрыть вклад механизмов, опосредованных насыщаемыми носителями, в абсорбцию, расположение и действие и УДХК. Еще одним ограничением исследования является то, что количественно определялись только немодифицированные и УДХК, а метаболиты норУДХК, такие как глюкурониды и УДХК, не измерялись (2, 10).
Одним из наиболее интересных результатов этого исследования является способность или УДХК увеличивать отток желчи и бикарбонат желчных путей при совместном введении с ASBTi или секвестрантом желчных кислот. Основываясь на наших выводах на мышах Asbt — / — , неудивительно, что на желчегонное действие или UDCA не влиял ASBTi. Однако совместное введение или УДХК с секвестрантом желчных кислот ранее не исследовалось.Это контрастирует с УДХК, взаимодействие которой с секвестрантами желчных кислот было изучено in vitro, , на животных моделях и на людях (36–38). В этих исследованиях холестирамин и колестимид эффективно связывали и снижали всасывание в кишечнике совместно вводимой УДХК. Таким образом, было удивительно, что совместное введение колесевелама не ослабляло желчегонное действие ни , ни УДХК. При использовании анализов in vitro колесевелам плохо связывает и УДХК по сравнению с конъюгированными желчными кислотами, однако потребуются дополнительные исследования, чтобы определить, является ли это общим свойством всех секвестрантов желчных кислот. Хотя как ингибирование ASBT, так и введение секвестрантов желчных кислот нарушают энтерогепатическую циркуляцию желчных кислот, существуют важные различия в механизме действия, с помощью которого они потенциально улучшают признаки холестаза (23-25, 39). В настоящем исследовании ингибирование ASBT снижает общую концентрацию желчных кислот в желчных путях, однако в присутствии и урсодезоксихолевой кислоты по-прежнему индуцируется отток желчи. Эти результаты показывают, что фармакологическое подавление АСВТ в подвздошной кишке не только не ухудшает положительное влияние норУДХК на отток желчи, но и в определенных условиях может иметь положительный синергетический эффект в холестатических моделях.Это включает пониженную концентрацию желчных желчных кислот, более гидрофильный состав желчных желчных кислот и повышенную концентрацию бикарбоната желчных путей, наблюдаемую при ингибировании или УДХК плюс ASBT по сравнению с ингибированием только ASBT.
Хотя как ингибирование ASBT, так и введение секвестрантов желчных кислот нарушают энтерогепатическую циркуляцию желчных кислот, существуют важные различия в механизме действия, с помощью которого они потенциально улучшают признаки холестаза (23-25, 39). В настоящем исследовании ингибирование ASBT снижает общую концентрацию желчных кислот в желчных путях, однако в присутствии и урсодезоксихолевой кислоты по-прежнему индуцируется отток желчи. Эти результаты показывают, что фармакологическое подавление АСВТ в подвздошной кишке не только не ухудшает положительное влияние норУДХК на отток желчи, но и в определенных условиях может иметь положительный синергетический эффект в холестатических моделях.Это включает пониженную концентрацию желчных желчных кислот, более гидрофильный состав желчных желчных кислот и повышенную концентрацию бикарбоната желчных путей, наблюдаемую при ингибировании или УДХК плюс ASBT по сравнению с ингибированием только ASBT.
В совокупности наши результаты показывают, что или УДХК не требуют основных переносчиков желчных кислот, ASBT, OSTα-OSTβ или членов семейства OATP1a / 1b для абсорбции, холегепатического шунтирования или для индукции богатого бикарбонатом гиперхолерезиса.Важно отметить, что эти результаты также поддерживают дальнейшие исследования терапевтического потенциала комбинации или УДХК и блокаторов энтерогепатической циркуляции желчных кислот при холестатической болезни печени.
Методы
Материалы
или УДХК (24-нор-5β-холан-23-овая кислота) была получена в качестве исследовательского подарка от доктора Фальк Фарма доктору Майклу Траунеру. SC-435; (4R, 5R) -5- [4- [4- (1-аза-4-азониабицикло [2.2.2] октан-4-ил) бутокси] фенил] -3,3-дибутил-7,8-диметокси- 1,1-диоксо-4,5-дигидро-2H-1λ6C; 6-бензотиепин-4-ол) был получен в качестве исследовательского подарка от Shire Pharmaceuticals.Колесевелам был предоставлен доктором Аланом Хофманном (Калифорнийский университет в Сан-Диего).
Животные
Asbt — / — мыши ( C57BL / 6NJ-Slc10a2 tm1a (KOMP) Mbp ; Asbt-нокаут-первый, вставка с репортерной меткой и условным потенциалом; Targeting Project CSD7 //www.komp.org/ProductSheet.php?cloneID=617849) были получены из репозитория медицинского колледжа Бейлора в рамках проекта Knockout Mouse Project (KOMP), и колонии Asbt — / — и соответствующие мыши WT содержатся в Медицинский факультет Университета Эмори.Характеристика экспрессии мРНК Asbt в подвздошной и печеночной тканях, экскреции желчных кислот в фекалиях, размера и состава пула желчных кислот у самцов и самок мышей WT и Asbt, сначала нокаутных, показаны на дополнительном рисунке 1. Соответствующий фоновый штамм WT и Ostα — / — Asbt — / — мышей были получены, как описано ранее (20). Самцов мышей с нокаутом кластера генов Oatp1a / 1b ( Oatp1a / 1b — / — ) (FVB.129P2-Del (Slco1b2-Slco1a5) 1Ahs) и мышей FVB WT с сопоставимым фоном были приобретены у Taconic Biosciences.Для исследований ASBTi и колесевелама мышей-самцов WT (C57BL / 6J) получали из Jackson Labs.
Обработка животных и измерение потока желчи
Все эксперименты проводились с использованием мышей-самцов в возрасте 3 месяцев (масса тела 25-30 г). Указанные генотипы скармливали кормом для грызунов (Envigo; Teklad custom Diet No. TD.160819; общий 18% белковый рацион для грызунов) в течение 7 дней. В течение следующих 7 дней мышей кормили кормом для грызунов TD.160819 или кормом для грызунов TD.160819, содержащим указанные комбинации 0.5% (вес / вес) или UDCA, 0,006% ASBTi (SC-435; доза ~ 11 мг / кг / день) или 2% (вес / вес) колесевелам. Количество вводимых или УДХК, ASBTi и колесевелама было выбрано на основании опубликованных исследований, демонстрирующих достаточные дозы для индукции оттока желчи ( или УДХК) или нарушения энтерогепатической циркуляции желчных кислот (ASBTi, колесевелам) (4, 25, с. 40). Исходя из расчета 3 г диеты, потребляемой в день на 25 г массы тела, доза или УДХК составляла приблизительно 600 мг / кг / день.Поток желчи у мышей измеряли, как описано ранее (2). В конце периода сбора желчи кровь брали путем пункции сердца для измерения химического состава плазмы. Части печени были взяты для гистологии и измерения экспрессии генов.
40). Исходя из расчета 3 г диеты, потребляемой в день на 25 г массы тела, доза или УДХК составляла приблизительно 600 мг / кг / день.Поток желчи у мышей измеряли, как описано ранее (2). В конце периода сбора желчи кровь брали путем пункции сердца для измерения химического состава плазмы. Части печени были взяты для гистологии и измерения экспрессии генов.
Биохимия плазмы и измерения растворенных веществ желчных путей
Химия плазмы измерялась в Лаборатории обеспечения качества и диагностики животных ресурсов Университета Эмори. Образцы желчи использовали сразу после выделения для измерения HCO 3 -, pH, общего CO 2 , Na, K, Cl и глюкозы с помощью анализатора газов крови (i-STAT; Abbott Point of Care Inc) в Лаборатория клинической патологии Национального исследовательского центра приматов Университета Эмори и Йеркса.Концентрации билиарного глутатиона измеряли в основном центре педиатрических биомаркеров Университета Эмори. Концентрации желчных желчных кислот, холестерина и фосфолипидов измеряли ферментативно, как описано ранее (41, 42).
Гистологический анализ
Сегменты печени фиксировали в 10% нейтральном формалине (Sigma-Aldrich), заливали парафином и обрабатывали Детским здравоохранением Службы патологии Атланты. Гистологические срезы (5 мкм) вырезали и окрашивали H&E.Гистология печени оценивалась слепым методом сертифицированным ветеринарным патологом (S.G.).
Измерение желчной кислоты
Для характеристики мышей Asbt — / — , фекалии были собраны у взрослых самцов и самок мышей в течение 72 часов. Общее содержание желчных кислот в кале определяли с помощью ферментативного анализа (41, 43). Размер пула определяли как содержание желчных кислот в тонком кишечнике, печени и желчном пузыре, удаленных у мышей, не голодавших (44, 45).Количественный анализ желчных кислот от корма или мышей, получавших и УДХК, проводили в лаборатории клинической масс-спектрометрии Медицинского центра детской больницы Цинциннати, как описано (46). Для исследований кормления или UDCA образцы фекалий собирали из клеток, содержащихся в группах мышей со стандартной подстилкой, в конце 7-дневного периода кормления или периода кормления или UDCA. Состав желчных кислот в фекалиях определяли с помощью газовой хроматографии / масс-спектрометра Hewlett-Packard Agilent в центре педиатрических биомаркеров в Университете Эмори, как описано (47).
Для исследований кормления или UDCA образцы фекалий собирали из клеток, содержащихся в группах мышей со стандартной подстилкой, в конце 7-дневного периода кормления или периода кормления или UDCA. Состав желчных кислот в фекалиях определяли с помощью газовой хроматографии / масс-спектрометра Hewlett-Packard Agilent в центре педиатрических биомаркеров в Университете Эмори, как описано (47).
Анализ RNA-Seq
Общую РНК экстрагировали из замороженной ткани печени с использованием реагента TRIzol (Invitrogen, Carlsbad, CA). Библиотеки РНК-Seq были приготовлены Novogen Co., Ltd и секвенированы в системе Illumina HiSeq1000. Анализ дифференциальной экспрессии проводили с использованием пакета DESeq2 R компании Bioconductor (48). Полученные значения P были скорректированы с использованием процедуры Бенджамини-Хохберга для контроля частоты ложных открытий (49). Дифференциально экспрессируемые гены с кратностью изменения> 1.0 и скорректированный P <0,05 были выбраны для функциональной аннотации (инвентарный номер серии GEO: GSE145020). Анализ пути данных РНК-Seq выполняли с использованием MetaCore (GeneGo Inc, Сент-Джозеф, Мичиган).
Люциферазные анализы
Клетки печени человека (Huh7) трансфицировали плазмидами экспрессии химерного ядерного рецептора, кодирующего лиганд-связывающий домен мышиного PXR, слитого с ДНК-связывающим доменом GAL4 вместе с 5-кратной последовательностью активации (UAS) -люциферазы репортерные или экспрессионные плазмиды для человеческого FXR или VDR вместе с FXR или VDR-чувствительными репортерными плазмидами люциферазы.Добавления лигандов и измерения активности люциферазы выполняли, как описано (40).
Анализ связывания желчных кислот с колесевеламом in vitro
Связывание желчных кислот с колесевеламом проводили, как описано (27).
Статистический анализ
Показаны средние значения ± стандартное отклонение, если не указано иное. Данные были оценены на предмет статистически значимых различий с использованием теста Манна-Уитни, двустороннего критерия t Стьюдента, ANOVA и теста Тьюки-Крамера на предмет достоверной значимой разницы post-hoc или теста множественных сравнений Сидака (GraphPad Prism; Маунтин-Вью, Калифорния). Различия считались статистически значимыми при P <0,05.
Различия считались статистически значимыми при P <0,05.
Доступность данных
Набор данных печени RNA-Seq доступен в репозитории GEO под следующим номером доступа: GSE145020.
Одобрение исследования
Все эксперименты на животных были одобрены институциональными комитетами по уходу за животными и их использованию в Университете Эмори.
Вклад авторов
J.L., J.K.T., S.J.K, C.D.F., M.T. и P.A.D разработали исследование и разработали эксперименты.J.L, J.K.T., K.P., A.R., S.G и P.A.D. проводили эксперименты, собирали результаты и анализировали данные. J.L., J.K.T. и P.A.D. справился с исследованием. J.K.T., J.L., S.J.K., M.T. и P.A.D написали статью. J.L. и J.K.T. внес равный вклад в эту работу. J.L. инициировал проект до того, как J.K.T. присоединился к лаборатории. Поступив в лабораторию, J.K.T. работал с J.L. для проведения экспериментов, сбора результатов и анализа данных. JKT продолжил проект после того, как J.L. покинул лабораторию и занял другую должность.
Благодарности
Мы благодарим Shire Pharmaceutical за исследовательский дар SC-435, доктора Алана Хофманна (Калифорнийский университет, Сан-Диего) за исследовательский дар колесевелама, доктора. Kenneth Setchell и Wujuan Zhang (Детская клиническая масс-спектрометрическая лаборатория Цинциннати) за анализ образцов желчных кислот мышей, доктор Стив Кливер (Юго-западный медицинский центр Техасского университета) за экспрессию PXR и репортерные плазмиды и доктор Джеймс Флит (Purdue University) для плазмид экспрессии VDR.Мы также благодарим Эшли Беннет за помощь со сбором желчи и доктора Иво П. ван де Пеппеля за помощь в анализе ядерных рецепторов. Мы благодарим Центр биомаркеров Emory Pediatrics за помощь с измерениями желчной кислоты и глутатиона, Детское здравоохранение Атланты, патологическую службу, за помощь в обработке тканей, и Центр молекулярной патологии приматов Йеркса за помощь в гистологическом анализе. Части этой работы были представлены на Ежегодном собрании Американской ассоциации по изучению заболеваний печени в Сан-Франциско, Калифорния, 8-13 ноября 2018 г. и опубликованы в абстрактной форме, Hepatology 2018; 68: 46A.Это исследование было поддержано Национальным институтом здравоохранения, Национальным институтом диабета, болезней органов пищеварения и почек грантами DK047987 (PAD) и DK056239 (SJK), Фондом Мередит Браун в Эмори (SJK) и Детским здравоохранением Атланты и педиатрическим университетом Эмори. Биомаркеры Core. JKT поддерживался T32 GM008367. MT был поддержан Австрийским научным фондом (FWF) в рамках проектов F3517, F7310 и I2755.
и опубликованы в абстрактной форме, Hepatology 2018; 68: 46A.Это исследование было поддержано Национальным институтом здравоохранения, Национальным институтом диабета, болезней органов пищеварения и почек грантами DK047987 (PAD) и DK056239 (SJK), Фондом Мередит Браун в Эмори (SJK) и Детским здравоохранением Атланты и педиатрическим университетом Эмори. Биомаркеры Core. JKT поддерживался T32 GM008367. MT был поддержан Австрийским научным фондом (FWF) в рамках проектов F3517, F7310 и I2755.
Сноски
Конфликт интересов: P.Доусон и А. Рао получили исследовательские гранты от Albireo Pharma; С. Карпен консультировал компании Albireo Pharma, Mirum, Intercept и LifeMaxBio; MT получила гранты на исследования от Albireo, Cymabay, Falk, Gilead, Intercept, MSD и Takeda, а также гранты на поездки от Abbvie, Falk, Gilead и Intercept. Он консультировал Albireo Pharma, BiomX, Boehringer Ingelheim, Falk Pharma GmbH, Genfit, Gilead, Intercept, Jannsen, MSD, Novartis, Phenex, Regulus and Shire и выступал в качестве спикера в Falk Foundation, Gilead, Intercept и MSD.Он также является соавтором патентов на медицинское использование и UDCA, поданных Медицинскими университетами Граца и Вены.
Трихепат — Лабиес
Трихепат — Лабиес
REV02 | 102017. © 2021
Все права защищены.
Положения и условия • Политика конфиденциальности
Описание:
Трихепат, защитник и регенератор печеночных клеток, с желчегонным и желчегонным действием.Реактивизирует и усиливает гепатобилиарные функции. 100% натуральное происхождение. Никаких противопоказаний и побочных эффектов. Состоит из силимарина, антиоксиданта расторопши пятнистой (Silybium marianum), холина и метионина.
Его состав характеризуется:
- На уровне печени: защищает мембрану гепатоцитов, предотвращая застой, дегенерацию и лизис. Он действует на фагоциты ретикулоэндотелиальной системы (SER), улучшая его детоксифицирующее действие.
 Восстанавливает паренхиму печени, предотвращая ожирение печени и цирроз.
Восстанавливает паренхиму печени, предотвращая ожирение печени и цирроз. - На уровне желчевыводящей системы: способствует образованию и выведению желчи (желчегонное и желчегонное действие).
Формула:
| Силимарин | 0,6 г |
| DL-метионин | 8,0 г |
| Битартрат холина | 8,0 г |
| Вспомогательные вещества q.с. | 100 мл |
Показания:
- Острые и хронические заболевания печени различного происхождения для поддержки специфических методов лечения.
- В качестве профилактики при лечении различными лекарствами (противоэпилептические, антимикотические, антибиотики, кортикостероиды и т. Д.) Или различных патологий (гипотиреоз, синдром Кушинга, канцерогенез и т. Д.), Которые приводят к жировой дегенерации с последующим циррозом паренхимы печени.
- Случайное отравление.
- Жировая печень неустановленной этиологии.
- Инфекционные состояния и желудочно-кишечные расстройства различного происхождения. Синдром циклической рвоты.
- При наличии желчного осадка и / или холецистита.
- При биохимических изменениях гепатограммы.
Дозировка и способы введения:
Устный. Лечебная доза: 4 мл на каждые 15 кг веса 3 раза в день.Лечение продолжают до тех пор, пока сохраняется агрессия гепатоцитов или пока функция не восстановится. Снижение печеночных ферментов можно использовать в качестве параметра.
При отсутствии клинических симптомов может быть назначена профилактическая доза: 4 мл на каждые 15 кг 1 раз в сутки.
- Данная презентация соответствует Глобальному портфолио, она может варьироваться в зависимости от страны вашего проживания.
Артишок | PeaceHealth
1.Марка N. Cynara scolymus L. — артишок. Zeitschrift Phytother 1990; 11: 169-75.
Zeitschrift Phytother 1990; 11: 169-75.
2. Марка N. Cynara scolymus L. — артишок. Zeitschrift Phytother 1990; 11: 169-75.
3. Леунг А.Ю., Фостер С. Энциклопедия общих натуральных ингредиентов, используемых в пищевых продуктах, лекарствах и косметике, 2-е изд. Нью-Йорк: John Wiley & Sons, 1996, 42-3.
4. Кирхгоф Р., Беккерс С., Кирхгоф Г.М. и др.Повышение холерезиса с помощью экстракта артишока. Фитомедицина 1994; 1: 107-15.
5. Финтельманн В. Антидиспептическое и гиполипидемическое действие экстракта листьев артишока. Zeitschrift fur Allgemeinmed 1996; 72 (Приложение 2): 3-19.
6. Финтельманн В. Антидиспептическое и гиполипидемическое действие экстракта листьев артишока. Zeitschrift fur Allgemeinmed 1996; 72 (Приложение 2): 3-19.
7. Englisch W, Beckers C, Unkauf M, et al.Эффективность сухого экстракта артишока у пациентов с гиперлипопротеинемией. Arzneimittelforschung 2000; 50: 260-5.
8. Heckers H, Dittmar K, Schmahl FW, Huth K. Неэффективность цинарина в качестве терапевтического режима при семейной гиперлипопротеинемии II типа. Атеросклероз 1977; 26: 249-53.
9. Гебхардт Р. Новые экспериментальные результаты действия экстракта листьев артишока. Zeitschrift fur Allgemeinmed 1996; 72: 20-3.
10.Браун Дж. Э., Райс-Эванс, Калифорния. Богатый лютеолином экстракт артишока защищает липопротеины низкой плотности от окисления in vitro. Исследования свободных радикалов 1998; 29: 247-55.
11. Финтельманн В. Антидиспептическое и гиполипидемическое действие экстракта листьев артишока. Zeitschrift fur Allgemeinmed 1996; 72: 1-19.
12. Ньюолл, Калифорния, Андерсон Л.А., Филипсон Дж. Д. Лекарства на травах: Руководство для специалистов в области здравоохранения . Лондон: Фармацевтическая пресса, 1996, стр. 36.
Лондон: Фармацевтическая пресса, 1996, стр. 36.
13. Блюменталь М., Буссе В.Р., Голдберг А. и др. (ред.). Полные монографии Немецкой комиссии E: терапевтическое руководство по лекарственным растениям . Остин: Американский ботанический совет и Бостон: Связь интегративной медицины, 1998, 84-5.
Cholestyramine Resin Артикул
[1]
Scaldaferri F, Pizzoferrato M, Ponziani FR, Gasbarrini G, Gasbarrini A, Использование и показания холестирамина и секвестрантов желчных кислот.Внутренняя и неотложная медицина. 2013 г., апрель [PubMed PMID: 21739227]
[2]
Garden JM, Ostrow JD, Roenigk HH Jr, Зуд при холестазе печени. Патогенез и терапия. Архив дерматологии. 1985 ноя. [PubMed PMID: 39]
[3]
Handelsman Y, Роль секвестрантов желчных кислот в лечении диабета 2 типа.Уход за диабетом. 2011 г., май [PubMed PMID: 21525463]
[4]
Гарг А., Гранди С.М., Лечение холестирамином дислипидемии при инсулиннезависимом сахарном диабете. Краткосрочное двойное слепое перекрестное испытание. Анналы внутренней медицины. 1994, 15 сентября [PubMed PMID: 8053615]
[5]
Ян И, Хван С., Ким М., Лим И, Ким М. Х., Ли С., Лим Дж., Кан М. И., Ча Бай, рефрактерная болезнь Грейвса, успешно вылеченная дополнительным холестирамином и последующей тотальной тиреоидэктомией.Эндокринология и метаболизм (Сеул, Корея). 2015 декабрь [PubMed PMID: 26394731]
[6]
Ха Дж, Джо К. , Кан Б., Ким М.Х., Лим Д.Д., Использование холестирамина для быстрого возврата к эутиреоидным состояниям у пациентов с тиреотоксикозом. Эндокринология и метаболизм (Сеул, Корея). 2016 сен [PubMed PMID: 27469067]
, Кан Б., Ким М.Х., Лим Д.Д., Использование холестирамина для быстрого возврата к эутиреоидным состояниям у пациентов с тиреотоксикозом. Эндокринология и метаболизм (Сеул, Корея). 2016 сен [PubMed PMID: 27469067]
[7]
Камар Ф. Б., Маккуиллан Р. Ф., Гиперхлоремический метаболический ацидоз, вызванный холестирамином: отчет о болезни и обзор литературы.Отчеты о клинических случаях в нефрологии. 2015 [PubMed PMID: 26425378]
[8]
Якобсон Т.А., Армани А., Маккенни Дж. М., Гайтон Дж. Р., Вопросы безопасности с желудочно-кишечными активными гиполипидемическими препаратами. Американский кардиологический журнал. 2007 марта 19 [PubMed PMID: 17368279]
[9]
Зорек Дж. А., Маклафлин Э. Дж., Фике Д. С., Маклафлин А. А., Самиуддин М., Молодой Р. Б., Измерение изменений в восприятии с помощью инструмента «Восприятие студентами межпрофессионального клинического образования врача-фармацевта» (SPICE).BMC медицинское образование. 2014 г., 20 мая [PubMed PMID: 24884800]
[10]
Talwalkar JA, Souto E, Jorgensen RA, Lindor KD, Естественная история зуда при первичном билиарном циррозе. Клиническая гастроэнтерология и гепатология: официальный журнал клинической практики Американской гастроэнтерологической ассоциации. Июль 2003 г. [PubMed PMID: 15017671]
.


 Москва, 14–16 марта 2017 г. / Под общей ред. проф. С. В. Бельмера и проф. Л. И. Ильенко. М.: ИД «Медпрактика-М», 2017. С. 208–257.
Москва, 14–16 марта 2017 г. / Под общей ред. проф. С. В. Бельмера и проф. Л. И. Ильенко. М.: ИД «Медпрактика-М», 2017. С. 208–257. Для обезболивания-дюспаталин (накрайняк ношпа). А дальше, извиняюсь за банальность, аппаратная диагностика, консультация и лечение.
Для обезболивания-дюспаталин (накрайняк ношпа). А дальше, извиняюсь за банальность, аппаратная диагностика, консультация и лечение.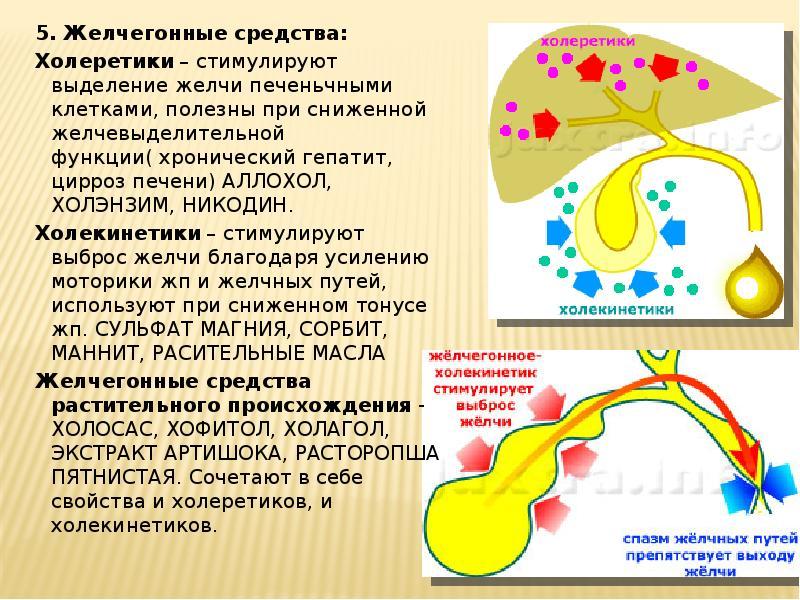 Восстанавливает паренхиму печени, предотвращая ожирение печени и цирроз.
Восстанавливает паренхиму печени, предотвращая ожирение печени и цирроз.