Врач рассказал, как помочь организму восстановиться после коронавируса
ФОТО: архив пресс-службы
Казахстанцев, которые перенесли коронавирусную инфекцию, становится с каждым днем все больше. Вирус этот новый, и, конечно, еще много вопросов по лечению и реаблитации после него пока остаются открытыми. Но уже известно, что болезнь оказывает значительное влияние на легочную ткань.
К сожалению, пока не созданы специальные медикаменты или технологии, позволяющие полностью восстановить легкие. Легочная ткань должна восстановиться сама, а наша задача – помочь ей в этом. Поэтому очень важна реабилитация после лечения.
Внимание! В этой публикации будут даны советы для ознакомления. Это не инструкции к действию и не алгоритмы лечения. Вся информация в этой статье касается периода восстановления после болезни, а не во время нее. Пожалуйста, по медицинским показаниям проконсультируйтесь с лечащим врачом.
Прежде всего, после перенесенной болезни важна дыхательная гимнастика, которая позволяет укрепить дыхательные мышцы, увеличить подвижность легких и грудной клетки.
— В домашних условиях, если нет пневмонии, но был коронавирус, лучше делать дыхательную гимнастику по Стрельниковой – это быстрые, громкие вдохи. При пневмонии основным является глубокий вдох, задержка дыхания от трех секунд и выше, потом выдох не менее четырех секунд – медленный, длительный выдох. Такое дыхание хорошо сопровождать несложным упражнением – поднимание и опускание рук во время вдоха и выхода, двигаться корпусом, — рассказал Мурат Аманбаев, врач-реаниматолог ММЦ 1 Центр фтизиопульмонологии.
Также важна дозированная физическая нагрузка. Например, в первый месяц после перенесенного заболевания хорошо помогут восстановиться прогулки на свежем воздухе. Не стоит забывать про здоровый сон и полноценное питание, в котором должно присутствовать достаточное количество белков, жиров и углеводов.
И последнее – ингаляции на минеральной воде. Они полезны для увлажнения дыхательных путей и нормализации работы легких после перенесенного заболевания.
— Обращаю внимание, что ингаляции во время болезни при пневмонии недопустимы, так как в этом случае скапливается жидкость, которая усугубляет положение. Ингаляцию лучше делать после полного выздоровления, — отметил Мурат Аманбаев.
При проведении ингаляций в домашних условиях нужно правильно подобрать активное вещество, которое должно оказать лечебный эффект. Если ваш лечащий врач не назначил определенное лекарственное средство, то выбором может стать использование минеральной воды. Подбирая минеральную воду для проведения ингаляций, нужно учитывать, какие активные элементы присутствуют в минеральной воде и какие они оказывают эффекты. В частности, для бронхолегочной системы важными являются соединения магния, особенно сульфат магния, кальций и хлор. Магний принимает участие в регулировке функции внешнего дыхания. Соединения магния оказывают бронхолитическое действие и локализуют приступы удушья, увеличивают силу сокращения дыхательных мышц. Ингаляции сульфата магния оказывают благотворное действие на функцию бронхолегочного дерева. Кальций играет важную роль в регуляции бронхиальной проводимости и оказывает отхаркивающее действие, которое будет особенно выраженным, если в минеральной воде содержится соединения кальция и хлора.
Ингаляции сульфата магния оказывают благотворное действие на функцию бронхолегочного дерева. Кальций играет важную роль в регуляции бронхиальной проводимости и оказывает отхаркивающее действие, которое будет особенно выраженным, если в минеральной воде содержится соединения кальция и хлора.
В случае после перенесенной пневмонии, в том числе и вызванной вирусом Covid-19, хорошо подходит минеральная лечебно-столовая вода QULAGER-BURABAY, в составе которой содержатся все необходимые для восстановления легких минеральные вещества. К тому же это казахстанская вода, добываемая на севере Казахстана из месторождения «Кулагер-Арасан» и более доступная по цене.
ВАЖНО! При проведении ингаляций с минеральной водой в домашних условиях нужно придерживаться несложных правил.
- Вода для ингаляций должна быть теплой, ее нужно нагреть на водяной бане до температуры 30-45ºС. Нельзя делать горячие ингаляции, так как можно получить ожог дыхательных путей.
- Воду нужно открыть заранее и, встряхивая бутылку, удалить из нее газы.
 Еще лучше оставить бутылку открытой на несколько часов или на ночь.
Еще лучше оставить бутылку открытой на несколько часов или на ночь. - Проводить ингаляции нужно в спокойном состоянии, не отвлекаясь разговорами или чтением, одежда должна быть свободной.
- Проводят ингаляции через 1-1,5 часа после еды или физической нагрузки.
- За 2 часа до и после ингаляции нельзя принимать лекарственные препараты.
- После ингаляции должен быть отдых в течение 15-30 минут. В течение 1 часа после ингаляции рекомендуется исключить разговоры и прием пищи.
Будьте здоровы! И не забудьте проконсультироваться с врачом.
Ошибки при использовании ингалятора, небулайзера, как правильно делать ингаляции
Ингаляция – эффективная процедура при заболеваниях дыхательных путей. Но иногда ингаляции усложняют ситуацию, и причина этому − неправильное применение прибора.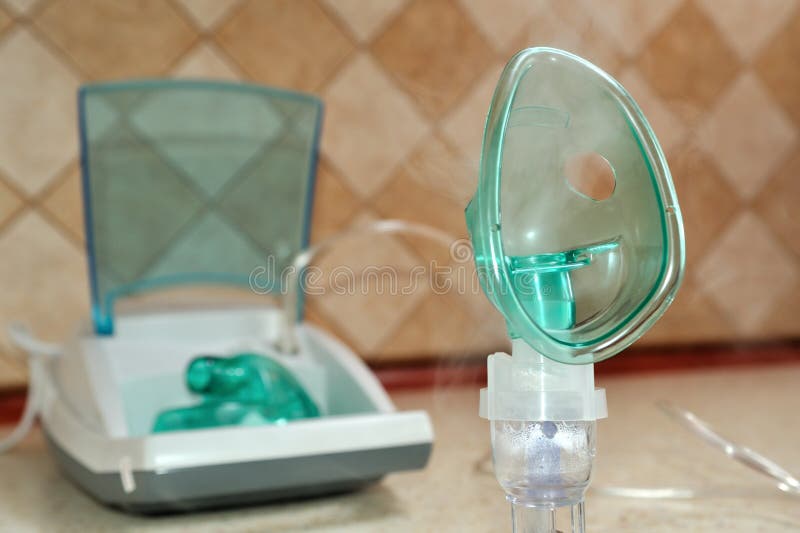 Расскажем, какие ошибки при использовании небулайзеров нельзя допускать.
Расскажем, какие ошибки при использовании небулайзеров нельзя допускать.
Семь ошибок при использовании небулайзера
Выбор лекарственного препарата, длительности и кратности проведения процедур зависит от вида и тяжести заболевания. А диагностика и назначение лечения – это прерогатива врача.
- Использование масляных растворов
Капельки масла оседают на бронхах, нарушают газообмен и могут привести к опасным последствиям. Устройство же приходит в негодность и не подлежит ремонту.
Для проведения ингаляций можно использовать только специальные лекарства, предназначенные для небулайзерной терапии.
- Использование небулайзера сразу после другого члена семьи
Съемные элементы небулайзера следует обрабатывать после каждой процедуры в соответствии с инструкцией к прибору. Это исключает перекрестные инфекции, если небулайзером пользуются несколько людей.
- Несоблюдение времени и кратности выполнения ингаляций
Частота и время проведения процедур подбираются врачом в зависимости от вида и сложности заболевания.
- Отмена процедуры при повышенной температуре тела
Если состояние пациента удовлетворительное и иное не предписано врачом, ингаляции с помощью небулайзера можно делать и при повышенной температуре тела.
Гипертермия является противопоказанием для паровых ингаляций, но небулайзеры работают по другому принципу.
- Проведение ингаляций для лечения заболеваний, при которых небулайзерная терапия неэффективна
В небулайзере лекарственный раствор рассеивается до мелкого тумана с размером частиц 1−5 мкм. Аэрозоль оседает в средних и нижних отделах дыхательных путей. Процедуры помогают при трахеите, бронхите, бронхиальной астме и пневмонии. При фарингите и рините ингаляции будут неэффективны.
- Применение формированного дыхания
Дыхание во время ингаляции должно быть обычным, нефорсированным. Частое глубокое дыхание приводит к гипервентиляции легких и может вызвать головокружение.
Ингаляция травами в Челябинске, Екатеринбурге, цены на процедуру
Проведение ингаляций – это один из наиболее доступных и эффективных методов лечения инфекционных заболеваний верхних дыхательных путей. Они также рекомендованы в комплексном лечении пневмонии, в том числе вызванной вирусами. Ингаляционные процедуры эффективны при легкой и средней форме коронавируса, когда у пациента отмечают затрудненное дыхание, сухой кашель, боль и чувство жжения в области грудной клетки.
Они также рекомендованы в комплексном лечении пневмонии, в том числе вызванной вирусами. Ингаляционные процедуры эффективны при легкой и средней форме коронавируса, когда у пациента отмечают затрудненное дыхание, сухой кашель, боль и чувство жжения в области грудной клетки.
В медицине применяют много трав, которые обладают целебными свойствами. Фитотерапия признана одним из действенных методик лечения. Травы также применяют в качестве активного компонента при проведении паровых процедур.
Цель проведения ингаляций при воспалении легких – увлажнение слизистых оболочек, разжижение и выведение из организма слизи, снятие воспаления и боли, облегчение дыхания.
Эффект от лечения ингаляциями на травах
Под воздействием пара ускоряется циркуляция крови, тем самым стимулируя очищение слизистых. Ингаляции травами способствуют:
- увлажнению слизистых;
- снятию отечности, воспаления и спазмов;
- обеззараживанию воспаленных участков;
- разжижению мокроты и выведению ее из организма;
- устранению боли и чувства першения в горле;
- ускорению отхаркивания мокроты;
- стимулированию работы иммунной системы;
- стабилизации общего состояния верхних дыхательных путей.

Ингаляции травами – это популярная процедура, поскольку ее можно проводить в домашних условиях. Испарения лекарственных трав равномерно распределяются по дыхательным путям, проникая в наиболее отдаленные пораженные участки. Однако, при их проведении нужно следовать рекомендациям врача.
Ингаляции рекомендуем проводить при помощи небулайзера (холодного пара), так как мелкие частицы пара глубже проникают в легкие.
Для ингаляций могут применяться такие травы как душица, календула, мать-и-мачеха, тимьян, зверобой, а также цветы ромашки и календулы, листья эвкалипта.
Комплексное лечение и реабилитация в санатории «Урал»
Как уже упоминалось, ингаляции травами популярны благодаря их доступности. Но лучше проводить такое лечение в специализированных кабинетах под наблюдением врачей. Паровые процедуры являются частью комплексных лечебных программ, которые предлагаются в нашем санатории.
Пандемия коронавируса поставила перед сотрудниками санатория новые задачи: обеспечить успешную реабилитацию пациентов и восстановление нормальной деятельности их иммунной системы. COVID-19 как новое инфекционное заболевание, опасно не только острой фазой, но и негативными последствиями в будущем. Вирусы разрушительно действуют на сердечно-сосудистую систему, органы дыхания и нервную систему.
COVID-19 как новое инфекционное заболевание, опасно не только острой фазой, но и негативными последствиями в будущем. Вирусы разрушительно действуют на сердечно-сосудистую систему, органы дыхания и нервную систему.
Задача реабилитационных программ нашего санатория – это восстановление иммунитета, приведение в норму работы всех систем организма, восстановление психо-эмоционального фона пациента. С этой целью мы предлагаем:
- эффективные бальнеологические процедуры на основе целебных минеральных вод «Уралочка»;
- водолечение и грязевые процедуры с использованием рапы (озерной воды) и сапропелевых грязей озера Подборное;
- баротерапию как эффективный метод ликвидации дефицита кислорода в клетках и тканях;
- ингаляции и фитотерапию;
- спелеотерапию;
- курс лечебной дыхательной гимнастики для нормализации деятельности органов дыхания.
Целебный эффект оказывают прогулки по территории санатория, который расположен в уединенном месте среди величественных лесов, недалеко от озера Подборное.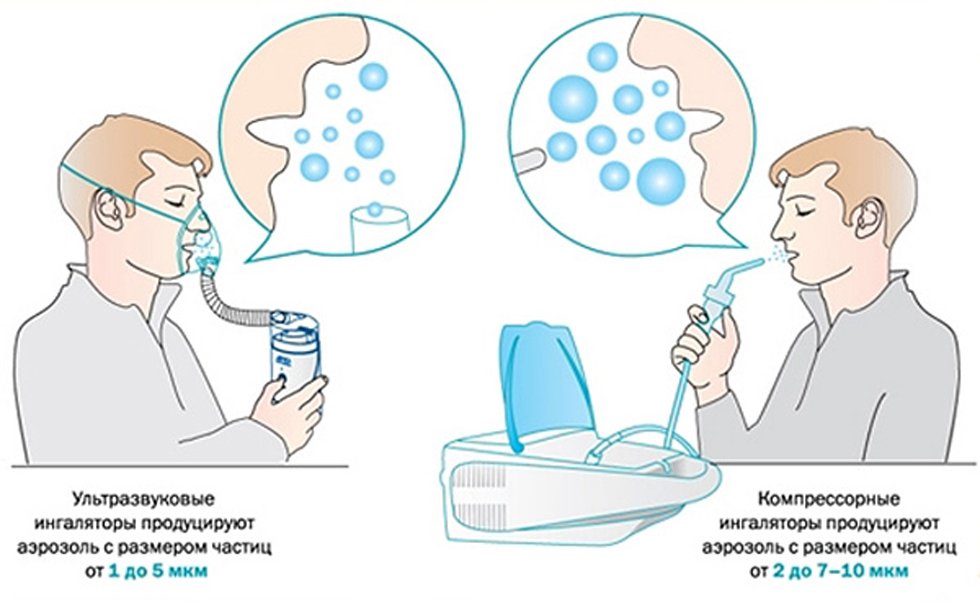
Преимущества лечения и реабилитации в санатории «Урал»
- диагностику и лечение проводят опытные врачи высшей категории, кандидаты и доктора наук;
- используем современные методики лечения и профилактики заболеваний;
- обеспечиваем эпидемиологическую безопасность, соблюдение социальной дистанции;
- предлагаем комфортные условия лечения и проживания;
- предоставляем все возможности для интересного и познавательного досуга;
- предлагаем индивидуальные программы лечения с учетом состояния здоровья пациента.
В отличие от многих клиник, у нас не бывает большого скопления пациентов на врачебных осмотрах и процедурах, поэтому при соблюдении мер предосторожности, риск заражения на территории санатория равен нулю.
Использование в лечении собственных природных источников позволяет достигать отличных результатов в лечении, реабилитации и профилактике заболеваний, в том числе инфекционного характера.
Как восстановиться после коронавирусной пневмонии
Даже те, кто избежал попадания в стационар, заболев новой коронавирусной инфекцией, нуждаются в реабилитации.
Многие жалуются на одышку, хрипы во время дыхания, слабость. Рассмотрим, как быстрее восстановиться после коронавируса и пневмонии, чтобы избежать фиброза лёгких и других осложнений.
Почему появляется одышка и другие симптомы после коронавируса?
Фиброз – это соединительная ткань, которая формируется вместо нормальной. В лёгком появляются рубцы, что приводит к уменьшению дыхательной поверхности. Если повреждённые участки небольшие, человек их вероятно не заметит. Обширная поражённая область приводит к одышке, возможна дыхательная недостаточность.
SARS-CoV-2 поражает альвеолы, это легочные структуры, отвечающие за газообменный процесс. Они поглощают кислород и очищают его от углекислого газа. Коронавирусная инфекция воздействует альвеолы, что приводит к образованию воспалительного экссудата. Определяется фиброз рентгеновским снимком, на котором отчётливо проявляются белые пятна.
Фиброзом также страдают курильщики со стажем и люди, переболевшие тяжёлой вирусной инфекцией. Недостаток кислорода негативно сказывается на работе всех органов, поэтому важно заняться восстановлением легких после коронавируса как можно быстрее.
Недостаток кислорода негативно сказывается на работе всех органов, поэтому важно заняться восстановлением легких после коронавируса как можно быстрее.
Когда можно начать заниматься реабилитацией?
Программа реабилитации нацелена на устранение чрезмерной утомляемости, одышки, головокружений. Начинать восстановление нужно сразу после нормализации температуры тела, снятия воспалительного процесса и получения разрешения от доктора.
Чем раньше пройти курс реабилитация после ковидной пневмонии, тем более эффективным он будет. На получение разрешения от врача можно рассчитывать через ~20 дней после старта лечения.
Что входит в программу реабилитации
При восстановлении после коронавирусной пневмонии врачами рекомендуется прохождение следующих процедур:
В период реабилитации важно избегать стрессов, соблюдать строгий питьевой режим (2 литра в день), обеспечить здоровый сон. Если на улице холодно и сыро, по возможности оставаться дома.
Дыхательная гимнастика
Гимнастика предполагает выполнение упражнений, направленных на увеличение эластичности легких, стимулирование кровообращения и лёгочной мускулатуры. Занятия следует проводить ежедневно, начинать можно с 10 минут и далее увеличивать продолжительность до 20 минут.
Ингаляции
Ингаляции назначаются лечащим врачом, так как подбор препарата зависит от состояния дыхательной системы пациента. Наиболее популярны следующие лекарства:
- Беродуал.
- Пульмикорт.
- Лазолван.
- АЦЦ.
- Вентолин.
Периодически рекомендуется делать ингаляции с минеральной водой. Проводится процедура в спокойной обстановке после приёма пища (через 1.5-2 часа). После ингаляции не рекомендуется выходить из дома в течение часа.
Лечебный массаж
Массаж ускоряет обменные процессы в организме, что положительно сказывается на восстановительном процессе. Сеансы также помогают снять мышечное напряжение, улучшить настроение, побороть бессонницу. Всё это важно для пациентов, перенесших ковид-19.
Всё это важно для пациентов, перенесших ковид-19.
ЛФК
Это тонизирующая лечебная гимнастика, оказывающая успокоительный эффект на нервную систему. Комплекс упражнений составляется исходя из состояния пациента, поэтому перед началом занятий следует получить рекомендации у врача. Продолжительность тренировки составляет 30-40 минут, впоследствии можно заняться плаванием.
Диета
Чтобы организм быстрее пришёл в форму, необходимо обеспечить его витаминами, минералами и питательными веществами. В дневном рационе должны содержаться следующие компоненты:
- Аминокислоты – рыба, натуральные масла, орехи.
- Белок (легкоусвояемый) – яйца, мясо, творог.
- Пробиотики – квашеная капуста, молочные продукты.
- Железо – гречка, печень (говяжья и куриная).
- Витамины – овощи, фрукты.
Физиотерапия
Самая важная часть восстановления легких после коронавируса в домашних условиях – это физиотерапия. Пациентам может быть назначена индуктометрия, магнитотерапия, ультразвуковая терапия, СМТ-терапия.
Данные процедуры позволяют снять обструкцию бронхов, уничтожить патогенную микрофлору, улучшить микроциркуляцию. Физиотерапия также оказывает противоотёчное, противовоспалительное, болеутоляющее действие, снимает спазмы.
Для прохождения полного комплекса физиотерапии рекомендуется использовать оборудование от компании «Солнышко». Эффективно борются с заболеваниями органов дыхания приборы ДМВ-терапии.
Также стоит обратить внимание на магнитотерапевтический аппарат «Магнитон» АМнп-02, действие которого направлено на регенерацию повреждённых тканей, восстановление нервной системы.
Ультрафиолетовые облучатели от компании «Солнышко» эффективно борются с ларинготрахеитом, хроническим и острым бронхитом, другими заболеваниями органов дыхания.
Что нельзя делать при реабилитации
Зачастую пациенты часто пренебрегают требованиями докторов после выписки из стационара, что вызывает осложнения. Прописанный курс приёма препараторов, программа прохождения физиотерапии должны быть пройдены полностью./GettyImages-649745556-59b57f4f845b3400100a8135.jpg) Некоторые пациенты прекращают лечение, как только проходят симптомы.
Некоторые пациенты прекращают лечение, как только проходят симптомы.
Переболевшему коронавирусом рекомендуется избегать переохлаждений. Иммунитет после COVID-19 ещё долгое время остаётся в ослабленном состоянии, что может привести к рецидиву, спровоцировать ОРВИ или простуду. При переохлаждении даже есть шанс развития изменений в сосудах и головном мозге. Это может вызвать проблемы с сердцем и другими внутренними органами.
Во время реабилитации нельзя нарушать рабочий режим, не рекомендуется курить, посещать места с большим количеством людей. Нужно следить и за уровнем влажности в квартире, она не должна превышать 40 %. Нельзя нарушать водный баланс в организме, это приводит к изменениям в циркуляции в крови.
Кратко о главном
Появление симптомов фиброза, воспаление лёгких – не приговор. Чтобы вернуть организм в здоровое состояние и избежать долгосрочных последствий, необходимо строго соблюдать рекомендации врачей. Физиотерапия аппаратами «Солнышко», зарядка, диета и другие элементы реабилитационной программы помогут пациенту полностью восстановить работу легких.
Как восстановить организм после перенесённого коронавируса
Людей, которые перенесли коронавирусную инфекцию, становится с каждым днём всё больше. Вирус новый и, конечно, ещё много вопросов остаются пока открытыми. Но уже известно, что он оказывает значительное влияние на лёгочную ткань.
К сожалению, пока не созданы специальные медикаменты или технологии, позволяющие на 100% восстановить лёгкие. Лёгочная ткань должна восстановиться сама, а наша задача – помочь ей в этом. Поэтому очень важна реабилитация после лечения.
Прежде всего это дыхательная гимнастика, которая позволяет укрепить дыхательные мышцы, увеличить подвижность лёгких и грудной клетки.
«В домашних условиях, если нет пневмонии, но был коронавирус, лучше делать дыхательную гимнастику по Стрельникову – это быстрые, громкие вдохи. При пневмонии основным является глубокий вдох, задержка дыхания от трёх секунд и выше, потом выдох не менее четырёх секунд – медленный, длительный выдох. Такое дыхание хорошо сопровождать несложным упражнением – поднимание и опускание рук во время вдоха и выхода, двигаться корпусом. Это упражнение можно делать и во время болезни, и после», — рассказал Мурат Аманбаев, врач-реаниматолог ММЦ 1, Центра фтизиопульмонологии.
Также важна дозированная физическая нагрузка. Например, в первый месяц после перенесённого заболевания хорошо помогут восстановиться прогулки на свежем воздухе. Не стоит забывать про здоровый сон и полноценное питание, в котором должно присутствовать достаточное количество белка – это нужно для нормального восстановления тканей организма.
И последнее – ингаляции на минеральной воде. Они полезны для увлажнения дыхательных путей и нормализации работы лёгких после перенесенного заболевания.
«Обращаю внимание, что ингаляции во время болезни (при пневмонии) неэффективны, так как в этом случае скапливается жидкость, которая усугубляет положение. Ингаляцию лучше делать после полного выздоровления или в случае, если нет пневмонии», — отметил Мурат Аманбаев.
При проведении ингаляций в домашних условиях нужно правильно подобрать активное вещество, которое должно оказать лечебный эффект. Если ваш лечащий врач не назначил определённое лекарственное средство, то методом выбора может быть использование минеральной воды. Подбирая минеральную воду для проведения ингаляций, нужно учитывать, какие активные элементы присутствуют в минеральной воде и какие они оказывают эффекты. В частности, для бронхолёгочной системы важными являются соединения магния, особенно сульфат магния, кальций и хлор. Магний принимает участие в регулировке функции внешнего дыхания. Соединения магния оказывают бронхолитическое действие и локализуют приступы удушья, увеличивают силу сокращения дыхательных мышц. Ингаляции сульфата магния оказывают благотворное действие на функцию бронхолёгочного дерева. Кальций играет важную роль в регуляции бронхиальной проводимости и оказывает отхаркивающее действие, которое будет особенно выраженным, если в минеральной воде содержится соединения кальция и хлора.
Магний принимает участие в регулировке функции внешнего дыхания. Соединения магния оказывают бронхолитическое действие и локализуют приступы удушья, увеличивают силу сокращения дыхательных мышц. Ингаляции сульфата магния оказывают благотворное действие на функцию бронхолёгочного дерева. Кальций играет важную роль в регуляции бронхиальной проводимости и оказывает отхаркивающее действие, которое будет особенно выраженным, если в минеральной воде содержится соединения кальция и хлора.
В случае после перенесённой пневмонии, в том числе и вызванной вирусом Covid-19, хорошо подходит минеральная лечебно-столовая вода Qulager-Burabay, в составе которой содержатся все необходимые для восстановления лёгких минеральные вещества. К тому же это казахстанская вода, добываемая на Севере Казахстана из месторождения «Кулагер-Арасан» и более доступная по цене.
Важно! При проведении ингаляций с минеральной водой в домашних условиях нужно придерживаться несложных правил:
- Вода для ингаляций должна быть тёплой, её нужно нагреть на водяной бане до температуры 30-45 0С.
 Не рекомендуются горячие ингаляции, так как можно получить ожог дыхательных путей.
Не рекомендуются горячие ингаляции, так как можно получить ожог дыхательных путей. - Воду нужно открыть заранее и встряхивая бутылку удалить из неё газы.
- Проводить ингаляции нужно в спокойном состоянии, не отвлекаясь разговорами или чтением, одежда должна быть свободной.
- Проводят ингаляции через 1-1,5 часа после еды или физической нагрузки.
- За 2 часа до и после ингаляции нельзя принимать лекарственные препараты.
- После ингаляции должен быть отдых в течение 15-30 минут.
- В течении 1 часа после ингаляции рекомендуется исключить разговоры и приём пищи.
Будьте здоровы!
Повышают ли ингаляционные стероиды риск развития пневмонии у людей с хронической обструктивной болезнью легких (ХОБЛ)?
Почему этот вопрос важен?
Ингаляционные кортикостероиды (ИКС) являются лекарствами, которые могут уменьшить число обострений ХОБЛ и улучшить качество жизни. При ХОБЛ, ИКС, как правило, используют вместе с бета2-агонистами длительного действия (ДДБА; LABA). Наиболее распространенными ингаляционными формами комбинаций ИКС и ДДБА являются флутиказон и салметерол, и будесонид и формотерол, но также используют флутиказона фуроат один раз в день вместе с новым ДДБА под названием вилантерол. Большое число исследований показали пользу ИКС, но они [ИКС] могут увеличить риск развития пневмонии. В дополнение к этому, могут быть трудности в диагностике пневмонии, и тяжесть пневмонии может быть плохо отражена в клинических испытаниях. Поэтому, несмотря на то, что у нас есть обзоры по ингаляционным стероидам при ХОБЛ, мы хотели выполнить обзор исключительно в отношении пневмонии, чтобы мы могли рассмотреть существующие доказательства.
Наиболее распространенными ингаляционными формами комбинаций ИКС и ДДБА являются флутиказон и салметерол, и будесонид и формотерол, но также используют флутиказона фуроат один раз в день вместе с новым ДДБА под названием вилантерол. Большое число исследований показали пользу ИКС, но они [ИКС] могут увеличить риск развития пневмонии. В дополнение к этому, могут быть трудности в диагностике пневмонии, и тяжесть пневмонии может быть плохо отражена в клинических испытаниях. Поэтому, несмотря на то, что у нас есть обзоры по ингаляционным стероидам при ХОБЛ, мы хотели выполнить обзор исключительно в отношении пневмонии, чтобы мы могли рассмотреть существующие доказательства.
Общая цель этого обзора заключается в оценке риска развития пневмонии у людей с ХОБЛ, принимающих флутиказон или будесонид.
Как мы ответили на этот вопрос?
Мы искали все исследования, сравнивающие будесонид или флутиказон против имитации ингаляции (плацебо), и все исследования, сравнивающие их использование в комбинации с ДДБА (т. е.будесонид/формотерол, флутиказона пропионат/ салметерол, флутиказона фуроат/вилантерол) против только ДДБА в тех же дозах. Это позволило нам оценить риск ИКС как при их отдельном использовании, так и в комбинации с ДДБА.
е.будесонид/формотерол, флутиказона пропионат/ салметерол, флутиказона фуроат/вилантерол) против только ДДБА в тех же дозах. Это позволило нам оценить риск ИКС как при их отдельном использовании, так и в комбинации с ДДБА.
Что мы нашли?
Мы нашли 43 исследования с включением более 30 000 людей с ХОБЛ. Исследований, в которых использовали флутиказон, было больше (26 исследований; 21 247 человек), чем исследований с будесонидом (17 исследований; 10 150 человек). Мужчины в этих исследованиях составили большую долю (около 70%), а течение ХОБЛ у них обычно классифицируют как тяжелое. Последний поиск исследований для включения в этот обзор был проведен в сентябре 2013 года.
Мы сравнили каждое лекарство против контроля и оценили отдельно результаты исследований, в которых сравнивали ИКС против плацебо, и комбинацию ИКС/ДДБА против только ДДБА. Мы также провели непрямое сравнение будесонида и флутиказона на основе их эффектов против плацебо, чтобы изучить, было ли одно лекарство безопаснее, чем другое.
Флутиказон увеличил число «серьезных» пневмоний (требующих госпитализации). За 18 месяцев, на 18 человек больше на каждую 1000, пролеченных флутиказоном, были госпитализированы с пневмонией.
Будесонид также увеличил число пневмоний, классифицированных как «серьезные». За девять месяцев было зарегистрировано на 6 случаев госпитализаций больше на каждые 1000 лиц, пролеченных будесонидом. Более низкая доза будесонида (320 мкг) была связана с меньшим числом серьезных пневмоний, чем более высокая доза (640 мкг).
В целом, число cмертей в группах с применением ИКС было не больше, по сравнению с контролем, и смерти, связанные с пневмонией, были слишком редкими, так или иначе.
Когда мы сравнили флутиказон и будесонид против друг друга, разница между ними была недостаточно отчетливой, чтобы сказать, был ли один из них безопаснее (в отношении пневмонии, требующей госпитализации и в целом, неблагоприятных событий и смертей). Риск любого случая пневмонии (т. е. менее серьезных случаев, которые могли бы быть пролечены без госпитализации) был выше при использовании флутиказона, чем будесонида.
е. менее серьезных случаев, которые могли бы быть пролечены без госпитализации) был выше при использовании флутиказона, чем будесонида.
Доказательства для большинства исходов были оценены как имеющие высокое или умеренное качество. В отношении исходов, имеющих доказательства высокого качества, маловероятно, что дальнейшие исследования изменят нашу уверенность в оценке эффекта, но средние рейтинги [доказательства умеренного качества] отражают некоторую неопределенность в результатах. Результаты исследований будесонида были, в целом, менее отчетливыми, т.к. эти исследования включали меньшее число людей, и их продолжительность была короче.
Вывод
Будесонид и флутиказон, при применении их отдельно или в комбинации с ДДБА, могут увеличить риск развития серьезных пневмоний, требующих госпитализации. Не было показано влияния на шансы умереть при сравнении с отсутствием применения ИКС. Сравнение двух лекарств не выявило никакой разницы в отношении серьезных пневмоний или риска смерти. Флутиказон был связан с более высоким риском любой пневмонии (т.е. случаев пневмонии, которые можно лечить амбулаторно), чем будесонид, но потенциальные различия в определении, используемом соответствующими фармацевтическими производителями, снизили нашу уверенность в этих результатах. Эти опасения должны быть сбалансированы с известной пользой ИКС (например, уменьшение числа обострений, улучшение функции легких и качества жизни).
Флутиказон был связан с более высоким риском любой пневмонии (т.е. случаев пневмонии, которые можно лечить амбулаторно), чем будесонид, но потенциальные различия в определении, используемом соответствующими фармацевтическими производителями, снизили нашу уверенность в этих результатах. Эти опасения должны быть сбалансированы с известной пользой ИКС (например, уменьшение числа обострений, улучшение функции легких и качества жизни).
Исследователям следует помнить о рисках, связанных с ИКС и убедиться, что пневмония диагностирована соответствующим образом в исследованиях.
Ингаляционная терапия пневмонии. Лечение воспаления легких в Москве
При пневмонии воспалительный процесс развивается в легочной ткани. В бронхах образуется секрет, который нарушает проходимость бронхиального дерева. Нарушаются местные механизмы защиты. Врачи назначают лекарственные препараты, которые вводят в организм разными путями: через рот, внутримышечно, внутривенно. Ингаляции при воспалении лёгких являются элементом физиотерапевтического лечения. Пульмонологи Юсуповской больницы ингаляционным путём вводят антибиотики, бронхолитики, муколитики. Процедуры выполняют с помощью ультразвуковых ингаляторов, небулайзеров.
Пульмонологи Юсуповской больницы ингаляционным путём вводят антибиотики, бронхолитики, муколитики. Процедуры выполняют с помощью ультразвуковых ингаляторов, небулайзеров.
Виды ингаляций
Основная цель ингаляционной терапии – достижение максимального местного терапевтического эффекта в дыхательных путях при незначительных проявлениях системного действия. Ингаляции при пневмонии оказывают следующее действие:
- улучшают дренажную функцию дыхательных путей;
- уменьшают отёк и стимулируют регенерацию;
- снижают активность воспалительного процесса;
- прерывают бронхоспазм;
- воздействуют на местные иммунные реакции респираторного тракта;
- улучшают микроциркуляцию слизистой оболочки дыхательных путей.
При пневмонии можно делать ингаляции, учитывая состояние пациента, показания и противопоказания.
Наиболее распространёнными видами ингаляций являются:
- паровые;
- тепловлажные;
- влажные;
- масляные;
- воздушные;
- ультразвуковые.

Наиболее доступными физиотерапевтическими процедурами являются паровые ингаляции. Их проводят с помощью паровых ингаляторов. Процедуры показаны пациентам с острыми и хроническими заболеваниями носовой полости, среднего уха, горла, острыми и хроническими заболеваниями трахеи и бронхов. Их делают при острых респираторных заболеваниях и гриппе, профессиональных заболеваниях органов дыхания. Противопоказаниями к паровым ингаляциям являются тяжёлые формы туберкулёза, пневмония, плеврит, кровохарканье, артериальная гипертензии, ишемическая болезнь сердца, гипертрофия и полипоз слизистых оболочек дыхательных путей.
При выполнении влажных ингаляций лекарственное вещество с помощью портативного ингалятора распыляется и вводится в дыхательные пути без предварительного подогрева. Их делают с целью предупреждения высыхания слизистой оболочки трахеобронхиального дерева в условиях длительной искусственной вентиляции, для купирования отёка дыхательных путей, предупреждения бронхоспастической реакции, связанной с физической нагрузкой, гигиены дыхательных путей при наличии трахеостомы. Паровые ингаляции применяют в качестве симптоматической терапии заболеваний верхних дыхательных путей.
Паровые ингаляции применяют в качестве симптоматической терапии заболеваний верхних дыхательных путей.
Тепловлажные ингаляции вызывают покраснение слизистой оболочки дыхательных путей, подавляют упорный кашель, разжижают мокроту, ускоряют эвакуацию слизи, улучшают дренирующую функцию бронхов. Процедуры делают пациентам, страдающим подострыми и хроническими заболеваниями носа, горла и среднего уха, острыми и хроническими заболеваниями бронхов и трахеи. Они показаны при абсцессе лёгкого, бронхиальной астме, пневмосклерозе, профессиональных заболеваниях органов дыхания, гриппе и острых респираторных заболеваниях.
Масляные ингаляции основаны на распылении подогретых различных масел, которые обладают трофическим, восстановительным и бронхопротективным действием. Их применяют для лечения и профилактики острого воспаления слизистых дыхательных путей, при набухании и утолщении слизистых оболочек, неприятных ощущениях сухости гортани или в носу. Противопоказаниям являются нарушение дренажной функции бронхов и работа на производствах с большим количеством мелкой пыли.
Воздушные ингаляции проводятся путём распыления находящихся в баллончике лекарственных веществ легко испаряющимся газом или сжатым воздухом. Показаниями являются:
- подострые и хронические заболевания трахеи и бронхов;
- выраженный отёк;
- пневмония в стадии выздоровления;
- бронхиальная астма;
- профессиональные заболевания бронхов и лёгких
- состояния после операции на лёгких, сопровождающиеся гнойными осложнениями.
Во время ультразвуковых ингаляций жидкость разбивается на мелкие частицы при помощи ультразвука или механических колебаний ультравысокой частоты. Ультразвуковые ингаляции являются эффективным средством лечения абсцесса лёгкого, пневмосклероза, пневмонии в фазе выздоровления, профессиональных заболеваний лёгких.
Проведение ингаляций при пневмонии небулайзером
В Юсуповской больнице ингаляции при пневмонии проводят небулайзером. Они помогают остановить воспалительный процесс, улучшают работу бронхов и лёгких, восстанавливают их вентиляционную и дренажную функцию. Суть небулайзера состоит в том, что во время процедуры создаётся аэрозольный пар с частичками лекарственного средства, которое достигает слизистых оболочек бронхов и лёгких. Ингаляции небулайзером способствуют проникновению лекарственных средств в область без воспаления, что позволяет снижать дозу препарата, принимаемого внутрь.
Суть небулайзера состоит в том, что во время процедуры создаётся аэрозольный пар с частичками лекарственного средства, которое достигает слизистых оболочек бронхов и лёгких. Ингаляции небулайзером способствуют проникновению лекарственных средств в область без воспаления, что позволяет снижать дозу препарата, принимаемого внутрь.
Существуют компрессорные и ультразвуковые небулайзеры. Компрессорные небулайзеры преобразуют лекарственные препараты в аэрозольный пар с помощью создания давления в жидкости, а ультразвуковые – ультразвуком. Процедуры не выполняют при наличии следующих противопоказаний:
- индивидуальная непереносимость лекарственных препаратов, используемых для ингаляции;
- высокая температура;
- легочные и носовые кровотечения;
- легочные и сосудов носоглотки;
- артериальная гипертензия;
- инфаркты и инсульты;
- церебральный атеросклероз.
Препараты, применяемые для ингаляций
При вирусной пневмонии с помощью небулайзера распыляют в дыхательные пути следующие противовирусные препараты: человеческий лейкоцитарный интерферон, полудан (индуктор интерферона), аминокапроновая кислота, натрия тиосульфат. Ингаляционным путём в организм вводят иммуномодуляторы: лейкинферон, деринат. Щелочные растворы (натрия гидрокарбонат), натрия хлорид, аквамарис способствуют разжижжению мокроты.
Ингаляционным путём в организм вводят иммуномодуляторы: лейкинферон, деринат. Щелочные растворы (натрия гидрокарбонат), натрия хлорид, аквамарис способствуют разжижжению мокроты.
Муколитические препараты (АЦЦ, амброксол, флуимуцил, ринофлуимуцил, лазолван) применяют при нарушении бронхиальной проходимости у пациентов с пневмонией. Уменьшают воспалительный процесс препараты для местной антибактериальной терапии. К ним относится изофра (рифамицетин), полидекса, флуимуцил-антибиотик ИТ, амикацин.
Снимают спазм бронхов при пневмонии с помощью β2 агонистов короткого действия: вентолина, беротека. Их вводят с помощью небулайзера. Спазмолитическим эффектом обладают антихолинергические препараты: атровент, беродуал. После ингаляций этих лекарственных средств улучшается бронхиальная проходимость.
Ингаляции способствуют быстрому выздоровлению. Позвоните по телефону Юсуповской больницы, где врачи проводят комплексную терапию пневмоний, используют все пути введения лекарственных препаратов.
Ингаляционные препараты для профилактики и лечения пневмонии
Expert Opin Drug Saf. Авторская рукопись; доступно в PMC 2015 7 августа.
Опубликован в окончательной редакции как:
PMCID: PMC4527977
NIHMSID: NIHMS710030
Онкологический центр Андерсона, Хьюстон, Техас, США
† Автор для переписки медицины, Техасский университет, Отдел инфекционных заболеваний, Онкологический центр доктора медицины Андерсона, Инфекционный контроль и здоровье сотрудников, 402, 1515 Holcombe Boulevard, Texas 77030, Хьюстон, США, тел .: +1 713 792 0825; Факс: +1713745 6839; Gro.nosrednadm @ radfasa См. другие статьи в PMC, в которых цитируется опубликованная статья.
Abstract
Легкие являются наиболее распространенным местом серьезных инфекций из-за их большой площади поверхности, подверженной воздействию внешней среды, и минимальной барьерной защиты. Однако такая архитектура делает легкие доступными для местной терапии. Терапевтические аэрозоли включают аэрозоли, направленные на улучшение мукоцилиарного клиренса патогенов, стимуляцию врожденной устойчивости к микробной инфекции, цитокиновую стимуляцию иммунной функции и доставку антибиотиков.По нашему мнению, ингаляционные противомикробные препараты используются недостаточно, особенно у пациентов с трудноизлечимыми легочными инфекциями. Использование ингаляционной антимикробной терапии стало важной частью лечения инфекции дыхательных путей, вызываемой Pseudomonas aeruginosa при муковисцидозе, и профилактики инвазивной грибковой инфекции у пациентов, перенесших трансплантацию сердца и легких. Цитокиновая ингаляционная терапия также изучалась при лечении неопластических и инфекционных заболеваний. Выбор легочных систем доставки лекарств остается критическим, поскольку воздушно-струйный и ультразвуковой небулайзер могут обеспечить субоптимальную концентрацию лекарственного средства при неправильном использовании.В будущем развитии этой области мы рекомендуем сделать акцент на изучении использования аэрозольного гипертонического солевого раствора для снижения патогенной нагрузки в дыхательных путях субъектов, инфицированных микробами с низкой вирулентностью, стимуляции врожденной резистентности для предотвращения пневмонии у субъектов с ослабленным иммунитетом с использованием цитокинов.
Терапевтические аэрозоли включают аэрозоли, направленные на улучшение мукоцилиарного клиренса патогенов, стимуляцию врожденной устойчивости к микробной инфекции, цитокиновую стимуляцию иммунной функции и доставку антибиотиков.По нашему мнению, ингаляционные противомикробные препараты используются недостаточно, особенно у пациентов с трудноизлечимыми легочными инфекциями. Использование ингаляционной антимикробной терапии стало важной частью лечения инфекции дыхательных путей, вызываемой Pseudomonas aeruginosa при муковисцидозе, и профилактики инвазивной грибковой инфекции у пациентов, перенесших трансплантацию сердца и легких. Цитокиновая ингаляционная терапия также изучалась при лечении неопластических и инфекционных заболеваний. Выбор легочных систем доставки лекарств остается критическим, поскольку воздушно-струйный и ультразвуковой небулайзер могут обеспечить субоптимальную концентрацию лекарственного средства при неправильном использовании.В будущем развитии этой области мы рекомендуем сделать акцент на изучении использования аэрозольного гипертонического солевого раствора для снижения патогенной нагрузки в дыхательных путях субъектов, инфицированных микробами с низкой вирулентностью, стимуляции врожденной резистентности для предотвращения пневмонии у субъектов с ослабленным иммунитетом с использованием цитокинов. или синтетические аналоги молекулярной структуры, ассоциированные с патогенами, и больше возможностей для использования ингаляционных противомикробных препаратов. Эти терапевтические средства все еще находятся в зачаточном состоянии, но имеют большие перспективы.
или синтетические аналоги молекулярной структуры, ассоциированные с патогенами, и больше возможностей для использования ингаляционных противомикробных препаратов. Эти терапевтические средства все еще находятся в зачаточном состоянии, но имеют большие перспективы.
Ключевые слова: амикацин, противогрибковый, противовирусный, аспергиллез, рак, колистин, цитокин, ингаляционный тобрамицин, врожденный иммунитет, пневмония, псевдомонады, трансплантация, ванкомицин, вентилятор-ассоциированная пневмония, зигомикоз
62 1. Среди обоих: оба. и людей с ослабленным иммунитетом пневмония остается ведущей причиной преждевременной смерти в мире [1–3]. Восприимчивость легких к инфекции возникает из-за архитектурных требований газообмена и частого вдыхания инфекционных агентов.Для обеспечения вентиляции люди постоянно подвергают воздействию внешней среды 100 м 2 площади поверхности легких. Поскольку каждую минуту вентилируется 5-10 л окружающего воздуха, частицы, капли и болезнетворные микроорганизмы также уносятся. Кроме того, в то время как даже здоровые нормальные добровольцы демонстрируют ночную микроабсорбцию орогастрального содержимого, пациенты с неврологическими, анатомическими или ятрогенными препятствиями для защиты дыхательных путей (например, эндотрахеальные или назогастральные трубки) особенно восприимчивы к аспирации инфицированного материала в обширную поверхность раздела нижних отделов. дыхательные пути.
Кроме того, в то время как даже здоровые нормальные добровольцы демонстрируют ночную микроабсорбцию орогастрального содержимого, пациенты с неврологическими, анатомическими или ятрогенными препятствиями для защиты дыхательных путей (например, эндотрахеальные или назогастральные трубки) особенно восприимчивы к аспирации инфицированного материала в обширную поверхность раздела нижних отделов. дыхательные пути.
В отличие от кожных поверхностей, обернутых непроницаемой кожей, желудка с его кислым просветом или нижних отделов желудочно-кишечного тракта с толстым слоем прилипшей слизи, обширный интерфейс легких с окружающей средой защищен только минимальной защитой барьера. Легочный барьер ограничен необходимостью беспрепятственной газовой диффузии, поэтому эта нежная ткань тонка капилляров. Тем не менее, несмотря на эту структурную уязвимость, легкие успешно защищаются от большинства инфекционных проблем с помощью различных механизмов [4–9].Большинство вдыхаемых или аспирированных патогенов не достигают периферических дыхательных путей из-за захвата в подвижном слое слизистого геля, выстилающего проксимальные проводящие дыхательные пути, с последующим изгнанием через мукоцилиарную эскалаторную систему [4]. Постоянное присутствие антимикробных пептидов и антител в жидкости, выстилающей дыхательные пути, ограничивает рост патогенов, которые успешно проникают в небольшие дыхательные пути. Альвеолярные макрофаги поглощают организмы, которые достигают самых отдаленных воздушных пространств [6,7]. Когда базовые защитные механизмы превышены, эпителий легких реагирует увеличением своих прямых противомикробных свойств (см. Раздел 3) и сигнализирует о привлечении лейкоцитов из кровообращения.
Постоянное присутствие антимикробных пептидов и антител в жидкости, выстилающей дыхательные пути, ограничивает рост патогенов, которые успешно проникают в небольшие дыхательные пути. Альвеолярные макрофаги поглощают организмы, которые достигают самых отдаленных воздушных пространств [6,7]. Когда базовые защитные механизмы превышены, эпителий легких реагирует увеличением своих прямых противомикробных свойств (см. Раздел 3) и сигнализирует о привлечении лейкоцитов из кровообращения.
Хотя доступность и большая поверхность легких способствуют их восприимчивости к инфекции, эти особенности также предоставляют уникальную возможность для местной терапии в виде респираторных аэрозолей, как показано ниже. Во-первых, недавно были разработаны стратегии увеличения мукоцилиарного клиренса с использованием аэрозолей гипертонического солевого раствора, которые могут снизить нагрузку патогенов в легких. Во-вторых, недавний прогресс в понимании врожденного иммунитета показал, что резистентность респираторного эпителия к патогенам может быть значительно стимулирована, и применение методов лечения, основанных на этом понимании, может снизить восприимчивость к инфекции у уязвимых групп пациентов.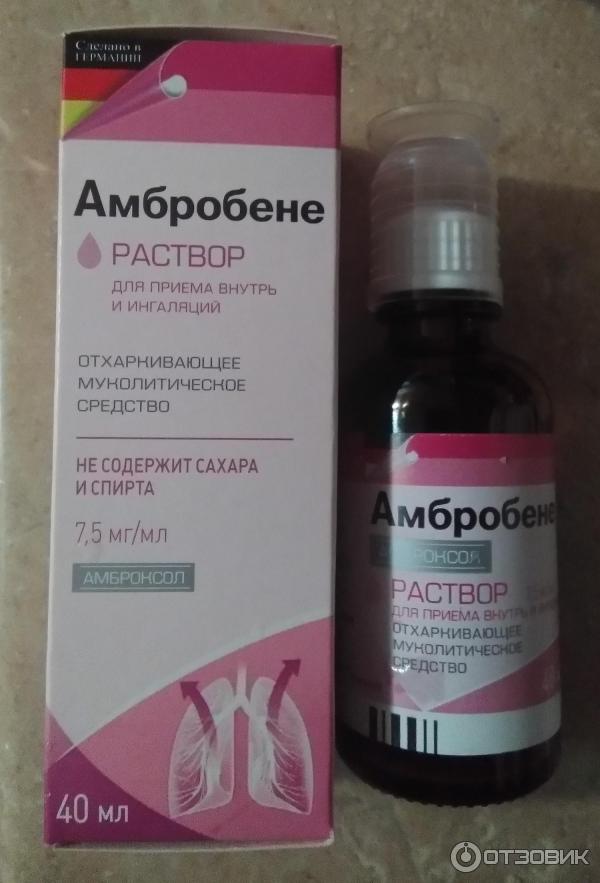 В-третьих, перенаправление отклоненного адаптивного иммунитета на повышение устойчивости к специфическим патогенам за счет аэрозольной доставки цитокинов было подтверждено небольшими исследованиями на людях. В-четвертых, антибиотики могут доставляться респираторным путем, максимизируя концентрацию лекарств в области инфекции, где необходимо уничтожение микробов, и сводя к минимуму системные концентрации лекарств, которые могут приводить к нежелательным побочным эффектам. Теоретическая основа и практический статус каждого из этих методов ингаляционной терапии рассматриваются в следующих разделах.
В-третьих, перенаправление отклоненного адаптивного иммунитета на повышение устойчивости к специфическим патогенам за счет аэрозольной доставки цитокинов было подтверждено небольшими исследованиями на людях. В-четвертых, антибиотики могут доставляться респираторным путем, максимизируя концентрацию лекарств в области инфекции, где необходимо уничтожение микробов, и сводя к минимуму системные концентрации лекарств, которые могут приводить к нежелательным побочным эффектам. Теоретическая основа и практический статус каждого из этих методов ингаляционной терапии рассматриваются в следующих разделах.
2. Аэрозольный гипертонический солевой раствор для увеличения мукоцилиарного клиренса легких
Основным стимулом к увеличению выведения слизи из легких стало лечение муковисцидоза (МВ). Традиционно постуральный дренаж, перкуссия и другие физические методы сочетаются с очищением от кашля для мобилизации слизи и мусора из дыхательных путей. Совсем недавно для увеличения мукоцилиарного клиренса были введены эффективные аэрозольные методы лечения. Первичный дефект при МВ — отсутствие апикального эпителиального хлоридного канала, что приводит к уменьшению объема жидкости на поверхности дыхательных путей [10,11].Это предотвращает эффективное движение ресничек и вызывает обезвоживание слизи, что в совокупности ухудшает мукоцилиарный клиренс и повреждает дыхательные пути. Кроме того, эти изменения приводят к заселению обычно стерильных дыхательных путей бактериями и грибками, вызывая дальнейшее воспаление и повреждение дыхательных путей. По мере углубления понимания этих основных механизмов были введены методы лечения для увеличения объема жидкости на поверхности дыхательных путей (). К ним относятся нуклеотиды, амилорид и гипертонический солевой раствор (HSS), но среди них самые убедительные доказательства поддерживают аэрозольный HSS.
Первичный дефект при МВ — отсутствие апикального эпителиального хлоридного канала, что приводит к уменьшению объема жидкости на поверхности дыхательных путей [10,11].Это предотвращает эффективное движение ресничек и вызывает обезвоживание слизи, что в совокупности ухудшает мукоцилиарный клиренс и повреждает дыхательные пути. Кроме того, эти изменения приводят к заселению обычно стерильных дыхательных путей бактериями и грибками, вызывая дальнейшее воспаление и повреждение дыхательных путей. По мере углубления понимания этих основных механизмов были введены методы лечения для увеличения объема жидкости на поверхности дыхательных путей (). К ним относятся нуклеотиды, амилорид и гипертонический солевой раствор (HSS), но среди них самые убедительные доказательства поддерживают аэрозольный HSS.
Эпителий дыхательных путей с жидкостью на поверхности
Проводящие дыхательные пути выстланы примерно равным количеством мерцательных и секреторных эпителиальных клеток. Секреторные клетки содержат гранулы, которые включают пептиды и муцины (зеленые), хотя внутриклеточные муцины могут быть обнаружены только в небольших дистальных отделах дыхательных путей с помощью чувствительных иммуногистохимических методов или во время воспалительной метаплазии, когда их продукция увеличивается [15,19]. Жидкость на поверхности дыхательных путей состоит из перицилиарного слоя глубиной 7 мкм (синий) и покрывающего его слоя слизистого геля (зеленый), толщина которого варьируется от <1 мкм в дистальных дыхательных путях до> 50 мкм в проксимальных дыхательных путях человека.Реснички бьют направленно, чтобы продвинуть слой слизистого геля к головке гортани. Гликопротеины муцина MUC5AC и MUC5B являются основными компонентами слоя слизистого геля и высвобождаются экзоцитарно как из подлежащего поверхностного эпителия (показано), так и из подслизистых желез (не показано). Хотя слой слизистого геля важен для очистки от вдыхаемых патогенов (красный), чрезмерное производство муцина или истощение жидкости на поверхности дыхательных путей может привести к закупорке слизью просвета дыхательных путей, обеспечивая убежище для микробной инфекции.
Жидкость на поверхности дыхательных путей состоит из перицилиарного слоя глубиной 7 мкм (синий) и покрывающего его слоя слизистого геля (зеленый), толщина которого варьируется от <1 мкм в дистальных дыхательных путях до> 50 мкм в проксимальных дыхательных путях человека.Реснички бьют направленно, чтобы продвинуть слой слизистого геля к головке гортани. Гликопротеины муцина MUC5AC и MUC5B являются основными компонентами слоя слизистого геля и высвобождаются экзоцитарно как из подлежащего поверхностного эпителия (показано), так и из подслизистых желез (не показано). Хотя слой слизистого геля важен для очистки от вдыхаемых патогенов (красный), чрезмерное производство муцина или истощение жидкости на поверхности дыхательных путей может привести к закупорке слизью просвета дыхательных путей, обеспечивая убежище для микробной инфекции.
Ранние исследования 1990-х годов показали, что увеличение концентрации аэрозольных растворов хлорида натрия (физиологического раствора) приводит к увеличению скорости мукоцилиарного клиренса [12–14]. На основании этих результатов, аэрозоли HSS были протестированы при краткосрочном лечении пациентов с CF и показали, что они улучшают функцию легких [12,15]. В 2006 году два крупных исследования с использованием 4 мл 7% физиологического раствора в форме аэрозоля два раза в день продемонстрировали улучшение функции легких и снижение частоты обострений [16,17], и теперь это лечение стало основой лечения МВ.
На основании этих результатов, аэрозоли HSS были протестированы при краткосрочном лечении пациентов с CF и показали, что они улучшают функцию легких [12,15]. В 2006 году два крупных исследования с использованием 4 мл 7% физиологического раствора в форме аэрозоля два раза в день продемонстрировали улучшение функции легких и снижение частоты обострений [16,17], и теперь это лечение стало основой лечения МВ.
Есть несколько причин полагать, что лечение аэрозолями HSS принесет пользу не только больным МВ, но и пациентам. Во-первых, скорость мукоцилиарного клиренса увеличивается за счет увеличения гидратации даже у тех, у кого не наблюдается истощения жидкости на поверхности дыхательных путей. Это наблюдалось у пациентов с гиперальдостероном, у которых врожденно снижено всасывание натрия, и у здоровых людей при использовании аэрозолей HSS [18]. Во-вторых, закупорка мелких дыхательных путей слизью из просвета возникает при заболеваниях легких, помимо МВ, таких как астма, хроническая обструктивная болезнь легких (ХОБЛ) и инфекции дыхательных путей, вызванные вирусными, грибковыми и микобактериальными патогенами [19,20]. В-третьих, истощение жидкости на поверхности дыхательных путей происходит при некоторых нарушениях воспаления и инфекции дыхательных путей в результате протеолитической активации апикального эпителиального натриевого канала (ENaC) [21]. Исходя из этого, мы начали использовать аэрозольные 7% HSS у пациентов с закупоркой слизи в дыхательных путях и / или стойкой инфекцией дыхательных путей следующим образом. Для вызванной вирусом гиперсекреции слизи с кашлем у пациентов с астмой, ХОБЛ или посттрансплантационным констриктивным бронхиолитом мы используем HSS вместе с обычным режимом лечения обострения пациента, чтобы облегчить кашель и обеспечить доставку ингаляционных лекарств в дыхательные пути, которые в противном случае были бы забит слизью.У пациентов с аллергическим бронхолегочным аспергиллезом (ABPA) мы используем HSS вместе с некоторыми комбинациями ингаляционных стероидов, системных стероидов, системной противогрибковой и системной анти-IgE-терапией. При атипичной микобактериальной инфекции мы используем HSS либо в качестве монотерапии, либо вместе с ингаляционными и / или пероральными антибиотиками.
В-третьих, истощение жидкости на поверхности дыхательных путей происходит при некоторых нарушениях воспаления и инфекции дыхательных путей в результате протеолитической активации апикального эпителиального натриевого канала (ENaC) [21]. Исходя из этого, мы начали использовать аэрозольные 7% HSS у пациентов с закупоркой слизи в дыхательных путях и / или стойкой инфекцией дыхательных путей следующим образом. Для вызванной вирусом гиперсекреции слизи с кашлем у пациентов с астмой, ХОБЛ или посттрансплантационным констриктивным бронхиолитом мы используем HSS вместе с обычным режимом лечения обострения пациента, чтобы облегчить кашель и обеспечить доставку ингаляционных лекарств в дыхательные пути, которые в противном случае были бы забит слизью.У пациентов с аллергическим бронхолегочным аспергиллезом (ABPA) мы используем HSS вместе с некоторыми комбинациями ингаляционных стероидов, системных стероидов, системной противогрибковой и системной анти-IgE-терапией. При атипичной микобактериальной инфекции мы используем HSS либо в качестве монотерапии, либо вместе с ингаляционными и / или пероральными антибиотиками. У пациентов с эндобронхиальным стентом мы используем HSS для предотвращения скопления слизи дистальнее стента, что может привести к ателектазу или пневмонии. Иногда мы лечили пациентов с HSS, у которых были рентгенологические помутнения периферического легочного дерева в почке, для которых нам не удалось идентифицировать патоген.У нас есть неофициальные данные о симптоматических и рентгенологических улучшениях в поддержку всех этих применений, но нам неизвестны данные контролируемых испытаний. Когда используется несколько видов аэрозольной терапии, например, HSS вместе с ингаляционными стероидами, мы сначала применяем HSS, хотя объективных доказательств, подтверждающих эту практику, нет. Были бы полезны исследования, предназначенные для измерения применимости и оптимальных методов аэрозольного HSS при других заболеваниях, кроме МВ.
У пациентов с эндобронхиальным стентом мы используем HSS для предотвращения скопления слизи дистальнее стента, что может привести к ателектазу или пневмонии. Иногда мы лечили пациентов с HSS, у которых были рентгенологические помутнения периферического легочного дерева в почке, для которых нам не удалось идентифицировать патоген.У нас есть неофициальные данные о симптоматических и рентгенологических улучшениях в поддержку всех этих применений, но нам неизвестны данные контролируемых испытаний. Когда используется несколько видов аэрозольной терапии, например, HSS вместе с ингаляционными стероидами, мы сначала применяем HSS, хотя объективных доказательств, подтверждающих эту практику, нет. Были бы полезны исследования, предназначенные для измерения применимости и оптимальных методов аэрозольного HSS при других заболеваниях, кроме МВ.
3. Аэрозольная стимуляция врожденного иммунитета легких
Хотя дыхательные пути и альвеолярный эпителий часто рассматриваются как пассивные барьеры, они дополняют базовую защиту легких, претерпевая значительные местные структурные и функциональные изменения при обнаружении патогенных раздражителей. Например, в ответ на вирусное, грибковое или аллергическое воспаление эпителиальные клетки дыхательных путей быстро приобретают гиперсекреторный фенотип в результате процесса, называемого слизистой метаплазией [22,23]. Предполагается, что адаптивная ценность структурной и молекулярной пластичности респираторного эпителия заключается в усилении защиты от микробных патогенов, и это подтверждается наблюдением улучшенного бактериального клиренса после индукции антимикробных белков, включая дефенсины, кателицидины, лизоцим и генераторы реактивных микроорганизмов. формы кислорода [24–28].В присутствии патогенов дыхательные пути и альвеолярный эпителий также вырабатывают воспалительные цитокины и вовлекают лейкоциты в защиту легких [29]. Подавление адаптивного иммунитета и гематопоэза, которое происходит при гематологических злокачественных новообразованиях и / или цитотоксической химиотерапии, не устраняет врожденный иммунный ответ легких на инфекцию. Скорее, пациенты с глубокой иммуносупрессией вырабатывают замечательные цитокиновые и хемокиновые ответы на легочные инфекции [30].
Например, в ответ на вирусное, грибковое или аллергическое воспаление эпителиальные клетки дыхательных путей быстро приобретают гиперсекреторный фенотип в результате процесса, называемого слизистой метаплазией [22,23]. Предполагается, что адаптивная ценность структурной и молекулярной пластичности респираторного эпителия заключается в усилении защиты от микробных патогенов, и это подтверждается наблюдением улучшенного бактериального клиренса после индукции антимикробных белков, включая дефенсины, кателицидины, лизоцим и генераторы реактивных микроорганизмов. формы кислорода [24–28].В присутствии патогенов дыхательные пути и альвеолярный эпителий также вырабатывают воспалительные цитокины и вовлекают лейкоциты в защиту легких [29]. Подавление адаптивного иммунитета и гематопоэза, которое происходит при гематологических злокачественных новообразованиях и / или цитотоксической химиотерапии, не устраняет врожденный иммунный ответ легких на инфекцию. Скорее, пациенты с глубокой иммуносупрессией вырабатывают замечательные цитокиновые и хемокиновые ответы на легочные инфекции [30].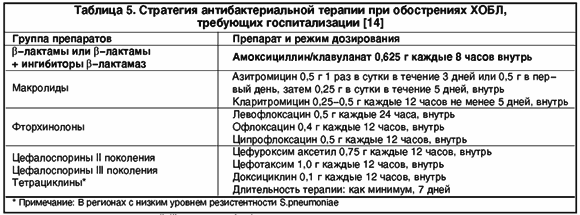
При врожденном иммунитете лейкоциты и паренхимные клетки идентифицируют присутствие патогенов посредством распознавания патоген-ассоциированных молекулярных паттернов (PAMPs), общих для многих видов патогенов, рецепторами распознавания паттернов, кодируемых зародышевой линией (PRR) [31–35].Распознавание PAMP посредством PRR активирует внутриклеточные сигнальные каскады, приводя к экспрессии продуктов, участвующих в микробной защите, воспалении и модуляции адаптивного иммунитета [36]. До сих пор попытки вызвать врожденный иммунитет легких были направлены на стимуляцию PRR с использованием природных или синтетических лигандов [37]. Наиболее распространенными мишенями были Toll-подобные рецепторы (TLR), хотя NOD-подобные рецепторы использовались в качестве адъювантов вакцины в течение многих лет [37], а другие молекулы, такие как RIG-подобные рецепторы и дектин, считались потенциальными терапевтическими мишенями. [37–42].
Чтобы проверить, можно ли эффективно использовать функциональную пластичность легких для защиты от пневмонии in vivo , наша лаборатория сильно стимулировала врожденный иммунитет перед заражением вдыхаемыми респираторными патогенами. Чтобы достичь этого, мышей подвергали воздействию лизата в виде аэрозоля, изготовленного из нетипируемого Haemophilus influenzae , одновременно стимулируя несколько антимикробных путей [42]. Однократное распыление привело к приобретению высокого уровня устойчивости к заражению вирулентными неконфекционными патогенами в течение 2 часов после лечения ().Мы назвали этот феномен стимулированным врожденным сопротивлением (StIR), чтобы отразить несколько аспектов защиты. Он считается «стимулированным», поскольку резистентность значительно возрастает после терапевтического применения лизата. Защита отражает действие «врожденных» защит, что демонстрируется несколькими ключевыми характеристиками: i) защита достигается за часы, а не дни или недели, как требуется для адаптивного иммунитета; ii) защита достигается у наивных мышей после лечения, полученного от микроба, не являющегося родственным тому, который использовался в контрольном заражении; iii) эффект сохраняется, несмотря на химическое или генетическое истощение адаптивных лейкоцитов; и iv) защита распространяется на каждый микробный патоген, против которого он был протестирован, что указывает на широкий, неизбирательный ответ.
Чтобы достичь этого, мышей подвергали воздействию лизата в виде аэрозоля, изготовленного из нетипируемого Haemophilus influenzae , одновременно стимулируя несколько антимикробных путей [42]. Однократное распыление привело к приобретению высокого уровня устойчивости к заражению вирулентными неконфекционными патогенами в течение 2 часов после лечения ().Мы назвали этот феномен стимулированным врожденным сопротивлением (StIR), чтобы отразить несколько аспектов защиты. Он считается «стимулированным», поскольку резистентность значительно возрастает после терапевтического применения лизата. Защита отражает действие «врожденных» защит, что демонстрируется несколькими ключевыми характеристиками: i) защита достигается за часы, а не дни или недели, как требуется для адаптивного иммунитета; ii) защита достигается у наивных мышей после лечения, полученного от микроба, не являющегося родственным тому, который использовался в контрольном заражении; iii) эффект сохраняется, несмотря на химическое или генетическое истощение адаптивных лейкоцитов; и iv) защита распространяется на каждый микробный патоген, против которого он был протестирован, что указывает на широкий, неизбирательный ответ.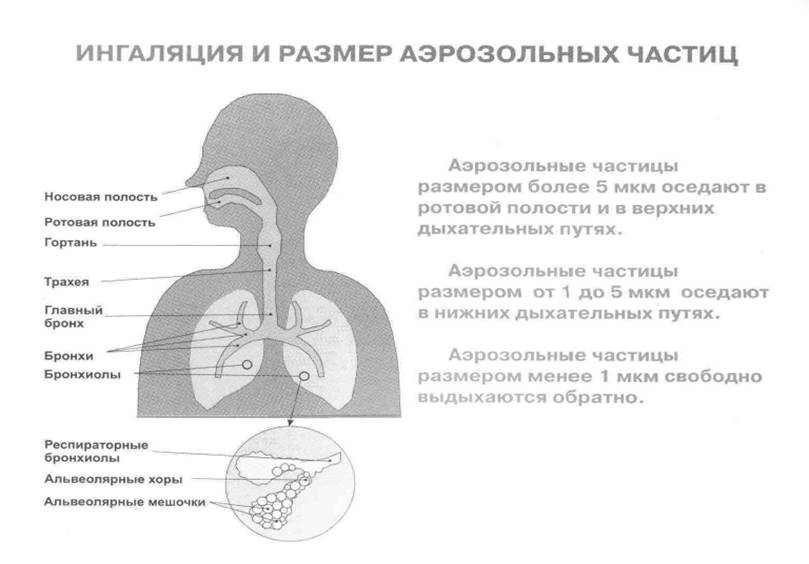 Защита связана с «сопротивлением» следующим образом. Столкнувшись с микробной проблемой, выживание зависит от двух стратегий хозяина: толерантности (способность ограничивать ущерб, причиняемый патогеном) и устойчивости (способности ограничивать бремя патогенов) [43,44]. Мы обнаружили, что обработка лизатом ограничивает количество патогенов, связанных с различными классами организмов. Следовательно, мы определили устойчивость как основное средство защиты лизата.
Защита связана с «сопротивлением» следующим образом. Столкнувшись с микробной проблемой, выживание зависит от двух стратегий хозяина: толерантности (способность ограничивать ущерб, причиняемый патогеном) и устойчивости (способности ограничивать бремя патогенов) [43,44]. Мы обнаружили, что обработка лизатом ограничивает количество патогенов, связанных с различными классами организмов. Следовательно, мы определили устойчивость как основное средство защиты лизата.
Выживаемость после заражения Streptococcus pneumoniae (Spn) после лечения аэрозольным лизатом нетипируемого Haemophilus influenze (NTHi)
Мышей предварительно обрабатывали в группах по шесть человек аэрозольным лизатом NTHi для стимуляции врожденного иммунитета, затем заражали как одну группу с высокой дозой Spn (6.1 × 10 10 КОЕ / мл). Выживаемость через 7 дней показана как функция интервала между лечением и контрольным заражением (* p = 0,015, ‡ p = 0,002, лечение по сравнению с необработанным) [50].
Сначала мы протестировали защитное действие StIR против наиболее распространенной причины бактериальной пневмонии во всем мире, Streptococcus pneumoniae , и обнаружили, что, хотя все нелеченные мыши умерли после ингаляционного заражения, все мыши, обработанные лизатом, выжили. Механистические исследования показали, что защита тесно коррелировала с индукцией антимикробной среды в легких, что продемонстрировано быстрым снижением количества патогенов по сравнению с нелеченными мышами [42].Защитный эффект сохранялся, даже если у мышей не было резидентных лейкоцитов в легких (альвеолярных макрофагов и тучных клеток) или у мышей не было рекрутированных нейтрофилов. Последующие исследования также показали, что лимфоциты не нужны при StIR, а исследований in vitro и показали, что респираторный эпителий был достаточен как для определения лечения, так и для воздействия на противомикробный ответ [45].
Стимулированная врожденная резистентность широко распространяется на другие важные бактериальные респираторные патогены. Среди распространенных причин внутрибольничной пневмонии ингаляционное лечение бактериальным лизатом сильно защищает от Pseudomonas aeruginosa , Klebsiella pneumoniae и лейкоцидин-продуцирующих лейкоцидин Panton-Valentine устойчивых к метициллину Staphylococcus aureus [45]. Дыхательный путь — наиболее вероятный портал входа для агентов биотеррора и единственный способ, с помощью которого такие патогены были успешно доставлены в современную эпоху (например, ингаляционная сибирская язва) [46–49].Мы исследовали, может ли StIR защищать от агентов биотеррора, и обнаружили, что однократная обработка лизатом в виде аэрозоля значительно увеличивает среднюю выживаемость мышей, зараженных Bacillus anthracis , Yersinia pestis или Francisella tularensis [45]. Для всех исследованных бактериальных патогенов защита от летального исхода была связана со значительным и немедленным сокращением количества патогенов.
Среди распространенных причин внутрибольничной пневмонии ингаляционное лечение бактериальным лизатом сильно защищает от Pseudomonas aeruginosa , Klebsiella pneumoniae и лейкоцидин-продуцирующих лейкоцидин Panton-Valentine устойчивых к метициллину Staphylococcus aureus [45]. Дыхательный путь — наиболее вероятный портал входа для агентов биотеррора и единственный способ, с помощью которого такие патогены были успешно доставлены в современную эпоху (например, ингаляционная сибирская язва) [46–49].Мы исследовали, может ли StIR защищать от агентов биотеррора, и обнаружили, что однократная обработка лизатом в виде аэрозоля значительно увеличивает среднюю выживаемость мышей, зараженных Bacillus anthracis , Yersinia pestis или Francisella tularensis [45]. Для всех исследованных бактериальных патогенов защита от летального исхода была связана со значительным и немедленным сокращением количества патогенов.
Учитывая широту защиты от разнородных видов бактерий и предположение о еще более широком антимикробном действии путем анализа экспрессии гена легких после лечения, также была протестирована защита мышей от грибкового патогена. Поскольку ни мыши, ни люди обычно не восприимчивы к пневмонии Aspergillus в отсутствие иммунодефицита, мышей лечили циклофосфамидом и кортизолом перед контрольным заражением A. fumigatus . Из инфицированных мышей> 70% умерли, если они не прошли предварительную обработку лизатом. Практически все, кто проходил лечение, выжили (93%). Как и в случае с бактериальными патогенами, StIR привел к значительному снижению внутрилегочной грибковой нагрузки [45].
Поскольку ни мыши, ни люди обычно не восприимчивы к пневмонии Aspergillus в отсутствие иммунодефицита, мышей лечили циклофосфамидом и кортизолом перед контрольным заражением A. fumigatus . Из инфицированных мышей> 70% умерли, если они не прошли предварительную обработку лизатом. Практически все, кто проходил лечение, выжили (93%). Как и в случае с бактериальными патогенами, StIR привел к значительному снижению внутрилегочной грибковой нагрузки [45].
Вирус гриппа является основной причиной смертности от легочных инфекций во всем мире, и эффективный легочный StIR может обеспечить защиту во время пандемий.Мы обнаружили, что в то время как 100% контрольных мышей умерли от геморрагической пневмонии,> 90% выжили после одной предварительной обработки бактериальным лизатом [50]. Мы также обнаружили значительное улучшение показателей выживаемости, если лизат в форме аэрозоля вводили через 1 день после заражения, что указывает на то, что стимуляция врожденного иммунитета может быть полезной для лечения, а также для профилактики пневмонии.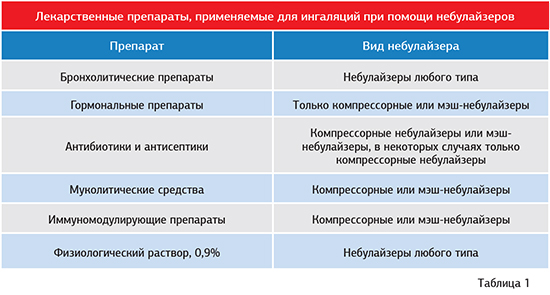 Кроме того, мы обнаружили, что добавление рибавирина к лечению лизатом привело к синергетическому улучшению выживаемости (т. Е., лучше, чем аддитивный эффект одного из видов лечения) при введении после инфекции [50]. Как и в случае со всеми другими исследованными патогенами, защита от гриппа, вызванная лизатом, коррелировала со снижением титров вируса в легких.
Кроме того, мы обнаружили, что добавление рибавирина к лечению лизатом привело к синергетическому улучшению выживаемости (т. Е., лучше, чем аддитивный эффект одного из видов лечения) при введении после инфекции [50]. Как и в случае со всеми другими исследованными патогенами, защита от гриппа, вызванная лизатом, коррелировала со снижением титров вируса в легких.
В то время как лечение нетипируемым лизатом Haemophilus influenza (NTHi) приводит к быстрой активации врожденного иммунитета слизистой оболочки легких, защитный эффект ослабевает через 4-5 дней [50,51]. Следовательно, для предотвращения пневмонии у групп пациентов, подвергавшихся риску по истечении этого периода, вероятно, потребуется повторное лечение.Мы обнаружили, что повторяющееся дозирование является эффективным и безопасным для мышей. При повторной обработке лизатом мыши показали стойкую устойчивость к заражению S. pneumoniae , P. aeruginosa и вирусом гриппа A [45,50]. Мыши, подвергавшиеся обработке лизатом еженедельно в течение 50 недель, не показали явных патологий, таких как преждевременная смерть, потеря веса или изменения поведения [36]. После 8 еженедельных воздействий инфильтрация мононуклеарных клеток окружала дыхательные пути, хотя наблюдалось очень мало альвеолярных воспалительных клеток.После 25 еженедельных воздействий был очевиден легкий фиброз стенки дыхательных путей, который далее прогрессировал после 50 еженедельных воздействий [52]. Увеличенная временная шкала фиброза стенки дыхательных путей и прогрессирующего накопления лимфоцитов предполагает, что фиброз возникает из-за адаптивного иммунного ответа после хронического воздействия бактериального лизата, а не в ответ на саму стимуляцию врожденного иммунитета. Замена макромолекулярных стимуляторов врожденного иммунитета низкомолекулярными аналогами, которые не вызывают адаптивного иммунного ответа, и снижение интенсивности стимуляции, таким образом, позволяет избежать этого долгосрочного осложнения.Действительно, толстая кишка мышей постоянно стимулируется присутствием просветных бактерий, что приводит к конститутивной активации StIR, что может быть обнаружено как индуцибельно сниженная способность убивать бактерии эпителием толстой кишки после лечения антибиотиками [53], но толстая кишка этого не делает.
После 8 еженедельных воздействий инфильтрация мононуклеарных клеток окружала дыхательные пути, хотя наблюдалось очень мало альвеолярных воспалительных клеток.После 25 еженедельных воздействий был очевиден легкий фиброз стенки дыхательных путей, который далее прогрессировал после 50 еженедельных воздействий [52]. Увеличенная временная шкала фиброза стенки дыхательных путей и прогрессирующего накопления лимфоцитов предполагает, что фиброз возникает из-за адаптивного иммунного ответа после хронического воздействия бактериального лизата, а не в ответ на саму стимуляцию врожденного иммунитета. Замена макромолекулярных стимуляторов врожденного иммунитета низкомолекулярными аналогами, которые не вызывают адаптивного иммунного ответа, и снижение интенсивности стимуляции, таким образом, позволяет избежать этого долгосрочного осложнения.Действительно, толстая кишка мышей постоянно стимулируется присутствием просветных бактерий, что приводит к конститутивной активации StIR, что может быть обнаружено как индуцибельно сниженная способность убивать бактерии эпителием толстой кишки после лечения антибиотиками [53], но толстая кишка этого не делает. развивается фиброз.
развивается фиброз.
Данные на мышах показывают, что лечение, индуцирующее врожденную резистентность в легких, должно хорошо переноситься пациентами-людьми. Мы считаем, что причина того, что мыши могут переносить самые высокие применяемые дозы (в 12 раз превышающие терапевтическую дозу) без явных побочных эффектов [51], заключается в том, что ответная реакция содержится в просвете легких.Несмотря на то, что количество воспалительных цитокинов в жидкости бронхоальвеолярного лаважа увеличивается в несколько тысяч раз по сравнению с исходным уровнем, уровень системных цитокинов почти не увеличивается [50]. Это согласуется с недавней работой Hoogerwerf и его коллег, которые вызвали значительные воспалительные реакции легких в дыхательных путях у людей, подвергшихся внутрилегочному применению липотехоиновой кислоты (лиганд TLR2) и липополисахарида (LPS, лиганд TLR4) TLR, но не были связаны с любые идентифицируемые клинические признаки или симптомы [54].
Не только наша лаборатория исследует стимуляцию TLR, которая может способствовать увеличению выживаемости хозяина при инфекциях. Несколько групп наблюдали иммуномодулирующие эффекты ЛПС и пытались изменить течение респираторных инфекций, доставляя производные ЛПС [40,41,55] или изменяя структуру ЛПС [39] у патогенов, используемых при экспериментальной пневмонии. У всех была обнаружена некоторая степень защиты за счет применения одного агониста TLR4, как и у нас [51]. Испытания отдельных агонистов TLR также были успешными при инфекционных заболеваниях человека.Например, подкожное введение синтетического агониста TLR9 вызвало системные воспалительные реакции и снизило вирусную нагрузку гепатита C [42], а местный имиквимод (TLR7) оказался многообещающим при лечении кожного лейшманиоза [38]. Однако вполне вероятно, что для достижения полной эффективности и широты действия, продемонстрированных с бактериальным лизатом, потребуются синергетические взаимодействия множественной стимуляции PRR [56-59].
Несколько групп наблюдали иммуномодулирующие эффекты ЛПС и пытались изменить течение респираторных инфекций, доставляя производные ЛПС [40,41,55] или изменяя структуру ЛПС [39] у патогенов, используемых при экспериментальной пневмонии. У всех была обнаружена некоторая степень защиты за счет применения одного агониста TLR4, как и у нас [51]. Испытания отдельных агонистов TLR также были успешными при инфекционных заболеваниях человека.Например, подкожное введение синтетического агониста TLR9 вызвало системные воспалительные реакции и снизило вирусную нагрузку гепатита C [42], а местный имиквимод (TLR7) оказался многообещающим при лечении кожного лейшманиоза [38]. Однако вполне вероятно, что для достижения полной эффективности и широты действия, продемонстрированных с бактериальным лизатом, потребуются синергетические взаимодействия множественной стимуляции PRR [56-59].
Лизат, используемый для индукции StIR, не обладает антибиотическим действием [45].Скорее, он вызывает собственные защитные продукты хозяина. Индукция выработки антимикробного пептида согласуется как со временем, так и с широтой защиты и демонстрируется с помощью микроматрицы экспрессии генов [45] и протеомного анализа [51]. В будущем, возможно, удастся обойти стадию индукции хозяина и напрямую доставить полезные антимикробные пептиды или миметики малых молекул [43].
Индукция выработки антимикробного пептида согласуется как со временем, так и с широтой защиты и демонстрируется с помощью микроматрицы экспрессии генов [45] и протеомного анализа [51]. В будущем, возможно, удастся обойти стадию индукции хозяина и напрямую доставить полезные антимикробные пептиды или миметики малых молекул [43].
В ближайшем будущем стимуляция естественной реакции хозяина на микробные продукты для профилактики и лечения пневмонии может стать основой для разработки новой клинической терапевтической стратегии [44,45].
4. Аэрозольная доставка цитокинов для направленного иммунного отклонения
IFNα-2a, IFNγ-1b и GM-CSF вводились легочным путем пациентам с резистентной легочной инфекцией Mycobacterium tuberculosis и нетуберкулезным микобактериозом (NTM) включая Mycobacterium avium комплексное заболевание легких с переменным успехом. Эти иммунологически разнообразные белки также использовались для лечения неинфекционных заболеваний легких, таких как первичный рак легких, метастатический рак в легкие и альвеолярный протеиноз, заболевание, недавно связанное с антителами против нативного GM-CSF [60–62]. Ниже приводится краткое описание клинического опыта использования терапии ингаляционными цитокинами при легочной инфекции.
Ниже приводится краткое описание клинического опыта использования терапии ингаляционными цитокинами при легочной инфекции.
Ингаляционный IFNα переносится в более низких дозах (1-20 MIU) без системных побочных эффектов, тогда как лихорадка, недомогание и головная боль возникали при использовании доз в диапазоне от 60 до 120 MIU и совпадали с обнаруживаемым цитокином в периферическом кровообращении [63, 64]. Бронхоспазм препятствует использованию этого цитокина у пациентов с хроническим бронхитом [65].Спасательная терапия с использованием ингаляционного IFNα для лечения неоперабельного рака легких не обнадеживает [66]. Добавление IFNα 3 MIU 3 раза в неделю к противотуберкулезной терапии было связано с ранним исчезновением лихорадки и быстрым снижением количества кислотоустойчивых бацилл в отхаркиваемой мокроте по сравнению с одной антимикробной терапией [67]. Кроме того, у пациентов с резистентной к лечению туберкулезной инфекцией добавление ингаляционного IFNα показало обнадеживающие результаты, хотя необходимы дальнейшие крупные рандомизированные исследования для подтверждения безопасности, стоимости и эффективности [68].
Низкие дозы ингаляционного IFNγ хорошо переносятся, в том числе пациентами с бронхореактивными состояниями, такими как астма, и после воздействия этого плейотропного провоспалительного цитокина была продемонстрирована измеримая активация альвеолярных макрофагов [69,70]. Имеется значительный клинический опыт использования ингаляционного IFNγ для лечения легочных микобактериальных инфекций. В сочетании с антимикробной терапией терапия IFNγ в виде аэрозоля привела к благоприятным ответам как на лекарственно-чувствительный, так и на лекарственно-устойчивый туберкулез легких, с уничтожением микроорганизмов и улучшением радиографических показателей заболевания [71–73].Однако этого преимущества не наблюдалось у пациентов с тяжелым основным заболеванием легких, у которых был туберкулез легких [74]. Точно так же не было отмечено терапевтического эффекта у пациентов с МВ, получавших высокие дозы (500 или 1000 мкг) ингаляционного IFNγ для снижения риска инфекции, тем не менее, пациенты страдали от серьезной лекарственной токсичности, включая одышку, кровохарканье и госпитализацию [75]. IFNγ также был исследован для предотвращения вентилятор-ассоциированной пневмонии (ВАП) у пациентов с тяжелыми травмами [76].Количество ВАП было уменьшено, хотя не наблюдалось улучшения общей смертности у этих пациентов с травмой, которые получали 100 мкг рекомбинантного IFNγ в аэрозольной форме 3 раза в день [76]. Эта неэффективность частично может быть связана с низкой доставкой цитокинов через стандартный распылитель [77]. Рекомбинантный GM-CSF в аэрозольной форме хорошо переносится пациентами с легочными метастазами в дозах 250 мкг дважды в день без серьезных побочных эффектов [78]. О применении аэрозольных GM-CSF для лечения инфекций у людей не сообщалось.Однако эксперименты на животных подтверждают абсорбцию в легких аэрозольного или интратрахеально введенного GM-CSF, и GM-CSF в аэрозольной форме оказался эффективным в искоренении инвазивного легочного аспергиллеза у мышей в модели с ослабленным иммунитетом [79,80].
IFNγ также был исследован для предотвращения вентилятор-ассоциированной пневмонии (ВАП) у пациентов с тяжелыми травмами [76].Количество ВАП было уменьшено, хотя не наблюдалось улучшения общей смертности у этих пациентов с травмой, которые получали 100 мкг рекомбинантного IFNγ в аэрозольной форме 3 раза в день [76]. Эта неэффективность частично может быть связана с низкой доставкой цитокинов через стандартный распылитель [77]. Рекомбинантный GM-CSF в аэрозольной форме хорошо переносится пациентами с легочными метастазами в дозах 250 мкг дважды в день без серьезных побочных эффектов [78]. О применении аэрозольных GM-CSF для лечения инфекций у людей не сообщалось.Однако эксперименты на животных подтверждают абсорбцию в легких аэрозольного или интратрахеально введенного GM-CSF, и GM-CSF в аэрозольной форме оказался эффективным в искоренении инвазивного легочного аспергиллеза у мышей в модели с ослабленным иммунитетом [79,80].
Другие цитокины, используемые аэрозольным путем, включают IFNβ при лечении рака легких, IL-2 при почечно-клеточной карциноме и другом метастатическом раке легких, растворимый рецептор IL-4 для пациентов с астмой и эритропоэтин для лечения анемии..gif) Ни один из них не использовался для лечения легочной инфекции.
Ни один из них не использовался для лечения легочной инфекции.
5. Доставка синтетических антибиотиков в аэрозольной форме
В первом подразделе мы обсудим использование аминогликозидов в лечении и профилактике серьезных легочных инфекций у пациентов из группы высокого риска, а затем кратко ознакомимся с ограниченным клиническим опытом применения других противомикробных препаратов. препараты, которые использовались для спасительной терапии трудноизлечимой пневмонии. Учитывая, что были проведены обширные обзоры ингаляционного пентамидина при ВИЧ-ассоциированной инфекции Pneumocystis jiroveci , эта тема здесь не рассматривается.
5.1 Аэрозольная терапия аминогликозидами
Теоретически аминогликозиды имеют несколько характеристик, которые, по-видимому, способствуют ингаляционному введению. Во-первых, аминогликозиды обладают эффектом уничтожения, зависящим от концентрации, что означает, что высокие уровни, достижимые в дыхательных путях с помощью ингаляционных препаратов, могут привести к повышению клинической эффективности. Более того, аминогликозиды обладают значительной ограничивающей дозу токсичностью для людей, так что дозы, которые можно вводить при системном введении, приводят к относительно низким уровням в паренхиме легких.Наконец, поскольку аминогликозиды использовались относительно редко в течение последних нескольких десятилетий, многие организмы с множественной лекарственной устойчивостью, вызывающие нозокомиальную респираторную инфекцию, остаются восприимчивыми по крайней мере к одному, если не ко многим, обычно используемым аминогликозидам. Действительно, из всех классов антибиотиков данные о доставке противомикробных препаратов путем ингаляции наиболее обширны для аминогликозидов. В этом разделе мы рассмотрим фармакокинетическую, клиническую информацию и информацию о безопасности, касающуюся ингаляционной терапии аминогликозидами.
Более того, аминогликозиды обладают значительной ограничивающей дозу токсичностью для людей, так что дозы, которые можно вводить при системном введении, приводят к относительно низким уровням в паренхиме легких.Наконец, поскольку аминогликозиды использовались относительно редко в течение последних нескольких десятилетий, многие организмы с множественной лекарственной устойчивостью, вызывающие нозокомиальную респираторную инфекцию, остаются восприимчивыми по крайней мере к одному, если не ко многим, обычно используемым аминогликозидам. Действительно, из всех классов антибиотиков данные о доставке противомикробных препаратов путем ингаляции наиболее обширны для аминогликозидов. В этом разделе мы рассмотрим фармакокинетическую, клиническую информацию и информацию о безопасности, касающуюся ингаляционной терапии аминогликозидами.
Разработка аминогликозидов широкого спектра действия, таких как гентамицин, в конце 1960-х — начале 1970-х годов открыла большие перспективы для лечения ранее резистентных респираторных инфекций из-за устойчивых к антимикробным препаратам грамотрицательных палочек, таких как P. aeuroginosa [81]. . Однако вскоре исследователи сообщили, что системное введение гентамицина часто не помогало лечить легочные инфекции из-за P. aeuroginosa и других грамотрицательных палочек, несмотря на чувствительность in vitro к [82].Низкие уровни гентамицина в респираторных секретах заставили исследователей предположить, что беспорядочное проникновение аминогликозидов в очаг инфекции может быть причиной терапевтических неудач, и предположить, что введение гентамицина непосредственно в легкие может улучшить клинический ответ [83,84]. Предварительные исследования 1970-х годов показали, что концентрация гентамицина в мокроте часто была на порядок выше после эндотрахеального введения по сравнению с системным лечением [83,85].
aeuroginosa [81]. . Однако вскоре исследователи сообщили, что системное введение гентамицина часто не помогало лечить легочные инфекции из-за P. aeuroginosa и других грамотрицательных палочек, несмотря на чувствительность in vitro к [82].Низкие уровни гентамицина в респираторных секретах заставили исследователей предположить, что беспорядочное проникновение аминогликозидов в очаг инфекции может быть причиной терапевтических неудач, и предположить, что введение гентамицина непосредственно в легкие может улучшить клинический ответ [83,84]. Предварительные исследования 1970-х годов показали, что концентрация гентамицина в мокроте часто была на порядок выше после эндотрахеального введения по сравнению с системным лечением [83,85].
Данные, накопленные в последующие 30 лет, подтвердили предположение этих ранних сообщений о том, что проникновение аминогликозидов в легочную паренхиму является субоптимальным после системного введения [86–93]. Фармакокинетика доставки аминогликозидного лекарственного средства имеет особое значение, поскольку эти агенты обладают зависящим от концентрации эффектом уничтожения, а это означает, что более высокие уровни лекарственного средства связаны с усилением антимикробного действия [94]. Например, оптимальный клинический ответ на терапию аминогликозидами происходит, когда максимальная концентрация лекарственного средства (C max ) до минимальной ингибирующей концентрации (МИК) составляет> 8: 1 [95–98].Терапия аминогликозидами при пневмонии обычно рассматривается для относительно устойчивых неферментативных грамотрицательных палочек, таких как P. aeruginosa , Acinetobacter baumanii и Stenotrophomonas maltophila [99]. Несмотря на то, что они сильно варьируются в зависимости от популяции пациентов и рассматриваемых аминогликозидов, даже для восприимчивых организмов, МПК для этих организмов обычно находятся в диапазоне 1-8 мкг / мл [100]. Таким образом, чтобы максимизировать возможность клинического ответа, необходимы концентрации легочных аминогликозидов ≥ 10-40 мкг / мл.Важно отметить, что ни один из доступных в настоящее время аминогликозидов не достигает таких уровней при системном введении даже в условиях воспалительного процесса, который, как ожидается, приведет к увеличению попадания в легкие из кровотока [85,86,91,92,101] .
Например, оптимальный клинический ответ на терапию аминогликозидами происходит, когда максимальная концентрация лекарственного средства (C max ) до минимальной ингибирующей концентрации (МИК) составляет> 8: 1 [95–98].Терапия аминогликозидами при пневмонии обычно рассматривается для относительно устойчивых неферментативных грамотрицательных палочек, таких как P. aeruginosa , Acinetobacter baumanii и Stenotrophomonas maltophila [99]. Несмотря на то, что они сильно варьируются в зависимости от популяции пациентов и рассматриваемых аминогликозидов, даже для восприимчивых организмов, МПК для этих организмов обычно находятся в диапазоне 1-8 мкг / мл [100]. Таким образом, чтобы максимизировать возможность клинического ответа, необходимы концентрации легочных аминогликозидов ≥ 10-40 мкг / мл.Важно отметить, что ни один из доступных в настоящее время аминогликозидов не достигает таких уровней при системном введении даже в условиях воспалительного процесса, который, как ожидается, приведет к увеличению попадания в легкие из кровотока [85,86,91,92,101] .
В отличие от трудностей достижения удовлетворительных уровней в легких с помощью системного введения аминогликозидов, местная доставка аминогликозидов приводит к концентрациям, которые могут быть эффективными даже против относительно резистентных организмов [85,86,93,102-104].Измерения уровней аминогликозидов в легких после местного введения сильно зависят от механизма, используемого для доставки лекарственного средства, дозы и места отбора пробы. Однако, несмотря на эти различия, исследователи неизменно демонстрируют уровни аминогликозидов> 200 мкг / мл в респираторных образцах после местного применения [85–87,89,101–107]. Данные, касающиеся концентраций аминогликозидов, аналогичны в исследованиях на животных и людях, у больных и здоровых пациентов, а также при использовании инвазивных и неинвазивных методов тестирования [85–87,89,101–107].Таким образом, фармакокинетические данные убедительно свидетельствуют о том, что местное введение аминогликозидов с большей вероятностью приведет к эффективным уровням лекарственного средства по сравнению с системной доставкой.
5.2 Клинические исследования ингаляционных аминогликозидов: муковисцидоз
Контроль над бронхолегочной инфекцией заметно повысил качество и продолжительность жизни пациентов с МВ [108]. Уникальная эндобронхиальная среда пациентов с МВ означает, что легкие таких пациентов колонизируются такими организмами, как S.aureus и H. influenza вскоре после рождения. Однако со временем P. aeuroginosa обычно становится преобладающим легочным патогеном у пациентов с МВ, колонизируя> 80% людей к 18 годам [109]. Взаимодействие «хозяин-патоген» между пациентами с МВ и P. aeuroginosa относительно уникально с точки зрения бактериальных процессов, так как однажды установленная эндобронхиальная инфекция, вызванная P. aeuroginosa , редко полностью искореняется [110]. Большая часть терапевтических достижений, достигнутых за последние десятилетия в лечении пациентов с МВ, была достигнута за счет снижения бремени P.aeuroginosa в легких пациентов с МВ, что впоследствии уменьшает воспалительный ответ, ответственный за прогрессирование бронхоэктазов.
В то время как внутривенные антибиотики долгое время были золотым стандартом для лечения инфекции P. aeuroginosa у пациентов с МВ, за последние 20 лет серия все более тщательных клинических исследований четко установила роль ингаляционных аминогликозидов в подавлении P. y инфекция aeuroginosa у пациентов с МВ.Первоначально использовался гентамицин, но исследователи перешли к тобрамицину в свете его повышенной активности против Pseudomonas [111–113]. Для удобства в ранних исследованиях использовались небулайзерные флаконы с аминогликозидами, изначально предназначенные для внутривенного введения, которые потенциально могли вызвать раздражение легких из-за присутствия консервантов и антиоксидантов. Важный прогресс произошел, когда Smith et al . разработали препарат тобрамицина без консервантов для распыления, который в дозе 600 мг обеспечивает гораздо более высокую дозу, чем типичный флакон для внутривенного введения на 80 мг [114].Это была доза тобрамицина 600 мг, которая использовалась в критическом исследовании перекрестного дизайна для 71 человека, в котором пациенты получали t.i.d. дозирование. После 1 месяца приема распыленного тобрамицина ключевые параметры функции легких и плотность мокроты P. aeuroginosa значительно улучшились в группе лечения [107]. Эффективный, но громоздкий характер лечения привел к разработке следующего поколения распыленного тобрамицина, который впоследствии был использован в крупнейшем рандомизированном плацебо-контролируемом исследовании распыленных аминогликозидов.В общей сложности 520 пациентов с CF, которые были колонизированы P. aeuroginosa , были рандомизированы для получения распыленного тобрамицина 300 мг два раза в день. или плацебо, вводимое в 4-недельных блоках включения-выключения в течение 24 недель [115]. Пациенты, получавшие активное лечение, показали улучшение показателей легочной функции, меньшую потребность в госпитализации и значительное снижение плотности P. aeuroginosa в мокроте. Важно отметить, что положительный эффект ингаляционного тобрамицина сохранялся в течение 2 лет после начала лечения [116].Результаты этого исследования привели к одобрению FDA США раствора тобрамицина для ингаляции (TSI) (TOBI ™ , Novartis Corp., Восточный Ганновер, Нью-Джерси), который до сих пор является единственным одобренным антибиотическим препаратом для ингаляции дыхательных путей в США. .
Эффективность TOBI в хроническом подавлении P. aeuroginosa у пациентов с МВ привела к исследованиям ингаляционных аминогликозидов при обострениях МВ, но результаты не были столь впечатляющими. Несколько исследований показали, что добавление ингаляционных аминогликозидов, таких как тобрамицин или амикацин, к системной антипсевдомональной терапии увеличивает долю пациентов, у которых излечивается P.aeuroginosa из мокроты, но не улучшает клинические исходы, такие как тесты функции легких [117,118]. Недавно завершенное международное исследование, проведенное в 17 центрах, не выявило статистической разницы в клинических исходах при добавлении ингаляционного тобрамицина к системно вводимому ципрофлоксацину у пациентов с МВ, инфицированных P. aeuroginosa, у пациентов с МВ с острым обострением [119]. Пациенты, получавшие ингаляционный тобрамицин, имели более низкую плотность мокроты P. aeuroginosa , но повышенную частоту хрипов при ингаляционной терапии, что могло свести на нет пользу от усиленного противомикробного эффекта.Таким образом, в настоящее время ингаляционная терапия не считается частью стандарта лечения пациентов с МВ с обострениями.
5.3 Лечение пациентов с бронхоэктазами без кистозного фиброза ингаляционными аминогликозидами
Хотя МВ является преобладающей причиной бронхоэктазов в развитых странах, существует несколько других заболеваний, которые могут привести к бронхоэктазу [120]. Обнадеживающие результаты лечения бронхоэктазов, связанных с МВ, увеличили давний интерес к лечению пациентов с бронхоэктазами, не связанными с МВ, с помощью ингаляционных аминогликозидов [121].К сожалению, как и в случае острых обострений при МВ, накопленные к настоящему времени данные об эффективности ингаляционных аминогликозидов при бронхоэктазах, не связанных с МВ, не так сильны, как данные для поддерживающей терапии при МВ. К настоящему времени четыре опубликованных клинических исследования изучали использование ингаляционных аминогликозидов у пациентов без МВ с бронхоэктазами и хронической инфекцией P. aeuroginosa , во всех из которых использовался ингаляционный тобрамицин в дозе 300 мг два раза в день. дозирование [119,122–124]. Подобно основным исследованиям МВ, эти испытания неизменно показывают, что ингаляционный тобрамицин значительно снижает респираторную нагрузку у P.aeuroginosa . Однако, в отличие от ситуации с бронхоэктазами, связанными с МВ, снижение уровня P. aeuroginosa у пациентов с бронхоэктазами, не связанными с МВ, не привело к последовательному улучшению объективных клинических показателей, таких как тесты функции легких. Одно исследование обнаружило улучшение «общего состояния здоровья» у пациентов, получавших тобрамицин [123]. Обнаружение того, что у пациентов, получавших тобрамицин, развился более выраженный бронхоспазм по сравнению с пациентами, получавшими плацебо, значительно ограничило применение аэрозольных антибиотиков при бронхоэктазах без МВ [121].Таким образом, широкое использование ингаляционных аминогликозидов у пациентов с бронхоэктазами без МВ требует разработки препарата, который вызывает меньшее раздражение дыхательных путей при сохранении антипсевдомональной эффективности.
5.4 Профилактика и лечение вентилятор-ассоциированной пневмонии с помощью ингаляционных аминогликозидов
Хотя ИВЛ имеет жизненно важное значение для ведения тяжелобольных пациентов, она часто осложняется развитием респираторных инфекций, которые вызывают значительную заболеваемость и смертность [125].Учитывая простоту доступа, обеспечиваемую интубацией трахеи, существует долгая история введения противомикробных препаратов непосредственно в дыхательные пути для лечения и профилактики респираторных инфекций, связанных с аппаратом искусственной вентиляции легких [83]. Наиболее систематически исследуемой областью в этом отношении было использование местных антибиотиков для предотвращения искусственной вентиляции легких (ВАП) [126]. Хотя самые крупные исследования были проведены с антибиотиками, не являющимися аминогликозидами, и тобрамицин, и гентамицин показали некоторую эффективность в предотвращении ВАП [127, 128].Недавний метаанализ показал, что местное применение антимикробных препаратов значительно снижает частоту ВАП у пациентов с искусственной вентиляцией легких [126]. Эти данные противоречат рекомендациям Центров по контролю и профилактике заболеваний против использования распыленных антибиотиков для предотвращения ВАП из-за опасений по поводу развития устойчивости к противомикробным препаратам и побочных эффектов введения [129].
По сравнению с профилактикой ВАП, существует меньше системных данных об использовании ингаляционных аминогликозидов для терапии ВАП [130].Однако, учитывая рост показателей ВАП из-за множественной лекарственной или даже панрезистентности грамотрицательных патогенов, использование ингаляционных аминогликозидов или других противомикробных препаратов может стать все более распространенным явлением в попытке повысить локальные концентрации лекарств для борьбы с относительно устойчивыми патогенами. Следует отметить, что недавнее ретроспективное исследование онкологических пациентов с грамотрицательной палочкой ВАП показало, что те пациенты, которые получали ингаляционные аминогликозиды, в основном тобрамицин или ингаляционный колистин, имели значительно лучшие клинические результаты по сравнению с пациентами, получавшими терапию системными аминогликозидами или колистином [131].Наконец, Палмер и др. . недавно сообщили о результатах исследования, в котором пациенты с вентилятор-ассоциированным трахеобронхитом (VAT) были рандомизированы для приема ингаляционных противомикробных препаратов, тобрамицина и / или ванкомцина или плацебо [132]. Пациенты, получавшие ингаляционные противомикробные препараты, имели заметное улучшение объективных респираторных показателей и имели значительно меньшую вероятность прогрессирования до ВАП по сравнению с пациентами, получавшими плацебо. В совокупности сочетание повышения лекарственной устойчивости и накопления данных об эффективности ингаляционной терапии указывает на то, что местная терапия аминогликозидами может играть многогранную роль в профилактике и лечении респираторной инфекции у пациентов с механической вентиляцией легких, хотя необходимы многоцентровые проспективные исследования.
5.5 Безопасность ингаляционных аминогликозидов
Двумя основными проблемами, вызывающими обеспокоенность в отношении местной терапии аминогликозидами, являются развитие лекарственной устойчивости и побочные эффекты лекарств или системы доставки лекарств. Учитывая, что местное применение приводит к градиенту концентрации противомикробного препарата от центральных к периферическим дыхательным путям, существует серьезное беспокойство по поводу индукции устойчивости к противомикробным препаратам [121]. Более того, местная терапия часто назначается в течение продолжительных периодов времени, даже лет, тем самым максимально увеличивая возможность развития лекарственной устойчивости.В то время как отчеты о случаях и серии случаев подтверждают, что резистентные организмы могут возникать во время терапии, тщательное обследование в ходе рандомизированных клинических испытаний не показало, что появление резистентных к лекарствам организмов у пролеченных пациентов является особенно важной проблемой [100, 110, 126]. В свете чрезвычайно высоких уровней аминогликозидов, достижимых с помощью небулайзерной терапии, некоторые страны предложили разработать специфические для ингаляции контрольные точки МИК, при которых очень немногие организмы действительно будут устойчивы к аминогликозидам [133].Приведет ли загрязнение окружающей среды при нозокомиальной небулайзерной терапии к повышению устойчивости к аминогликозидам в медицинских учреждениях, остается теоретическим, но не доказанным вопросом. Выявление бронхоспазма при местной терапии — еще одна важная проблема безопасности, особенно когда распыленные антибиотики используются для облегчения симптомов, например, при бронхоэктазах [121]. Хотя обычно они легко поддаются лечению бронходилататорами, раздражение дыхательных путей распыляемыми аминогликозидами ограничено для многих пациентов, и продолжение исследований по разработке более переносимых методов лечения имеет решающее значение для более широкого использования.
5.6 Другие виды антибактериальной терапии в виде аэрозолей
Клинический опыт аэрозолизации антибактериальных средств, отличных от аминогликозидов, ограничен, но продолжает расти. Заметное увеличение числа грамотрицательных патогенов с множественной лекарственной устойчивостью привело к увеличению использования полимиксинов, противомикробных препаратов, которые были разработаны в 1950-х годах, но их использование быстро сократилось в 1970-х и 1980-х годах из-за опасений по поводу нефротоксичности [134]. Использование колистина (полимиксина E) в последнее время заметно увеличилось в виде штаммов P.aeruginosa и A. bauamnnii , устойчивые ко всем другим классам коммерчески доступных антимикробных препаратов, остались чувствительными к колистину [134]. Подобно аминогликозидам, ингаляция является потенциально привлекательным способом введения колистина, учитывая токсичность, наблюдаемую при системном введении. Ретроспективные и нерандомизированные исследования показали обнадеживающие результаты при использовании ингаляционного колистина, хотя исследования осложняются неоднородностью пациентов и назначением дополнительных противомикробных препаратов в сочетании с ингаляционным колистином [130, 131, 134–138].До сих пор сообщалось о минимальной токсичности ингаляционного колистина, хотя систематические данные отсутствуют. Ингаляционный азтреонам представляется безопасной и эффективной альтернативой ингаляционному тобрамицину при муковисцидозе [139]. Наконец, недавнее исследование показало, что ингаляционный ванкомицин эффективен в предотвращении прогрессирования трахеобронхита, связанного с ИВЛ, до пневмонии, связанной с ИВЛ [132]. Неуклонный рост лекарственной устойчивости среди респираторных патогенов придает дополнительную актуальность продолжению исследований, направленных на более точное определение роли вдыхаемых противомикробных препаратов при легочных инфекциях.
5.7 Противогрибковая аэрозольная терапия
Несмотря на недавние достижения в области противогрибковой лекарственной терапии, инвазивные грибковые инфекции (ИФИ) остаются серьезной угрозой для больных раком с ослабленным иммунитетом и реципиентов трансплантации органов или кроветворения [140, 141]. Ответ на терапию системными цитокинами, повышающими иммунитет, такую как рекомбинантный GM-CSF, IFNγ и переливание донорских гранулоцитов, чреват отсутствием исследований по оценке стоимости и полезности и усугубляется неопределенными данными клинической эффективности [142].Инвазивный аспергиллез представляет собой опасную для жизни инфекцию, часто наблюдаемую в течение первых 3 лет после трансплантации сердце-легкие [143], тогда как у реципиентов аллогенной трансплантации стволовых клеток эта инфекция возникает в период нейтропении перед приживлением, во время острой трансплантации вместо трансплантата. болезнь хозяина (GVHD) и в период позднего риска, который включает лечение хронической GVHD [144]. У больных раком пациенты с острым миелогенным лейкозом особенно восприимчивы к ИФИ, а период риска может быть увеличен у пациентов с рефрактерным или рецидивирующим раком [145].Ингаляционный амфотерицин B был исследован для предотвращения ИФИ у восприимчивых пациентов в периоды высокого риска и для терапии спасения у пациентов с трудно поддающимся лечению инвазивным грибковым заболеванием легких.
У реципиентов трансплантата легкие инфекции Aspergillus разновидностей приводят к колонизации, которая часто предшествует инвазивному заболеванию, проявляющемуся как трахеобронхит или инфекции анастомоза, и / или инвазивное заболевание легких; диссеминация грибков у этих пациентов без нейтропении и без рака встречается редко.Большинство этих грибковых инфекций возникает у реципиентов трансплантатов солидных органов без нейтропении в период раннего отторжения трансплантата и иммуносупрессивной терапии отторжения [143]. Интересно отметить, что колонизация видами Aspergillus через 3 месяца после трансплантации чаще встречается у пациентов с человеческим лейкоцитарным антигеном (HLA) A1; однако у этих пациентов, склонных к поздней грибковой колонизации, риск инвазивного грибкового заболевания существенно не увеличивался [143]. Напротив, недавно сообщалось о нескольких грибковых инфекциях у реципиентов трансплантата сердца с рефрактерным отторжением, получавших сиролимус в сочетании с такролимусом, и пациентов с васкулопатией сердечного аллотрансплантата [146].
Ингаляционный амфотерицин B был первым лекарством, используемым для лечения системного микоза, и более ранние эксперименты на животных с использованием аэрозольного амфотерицина B показали благоприятную эффективность при лечении легочного аспергиллеза [147]. Липидные препараты амфотерицина B, такие как липидный комплекс амфотерицина B (ABLC), также эффективно доставлялись аэрозольным путем. Прединфекционная обработка ABLC в дозе 0,4–1,6 мг / кг за 2 дня до инфекции обеспечила увеличение выживаемости на 63–100% в экспериментах на животных [148].Пиковая концентрация амфотерицина B в бронхоальвеолярном лаваже после однократного приема достигается через 30 минут после ингаляции, и он медленно выводится из легких в течение следующих 24 часов [149].
Устройство доставки лекарственного средства остается критически важным для прогнозирования концентрации лекарственного средства, распыляемого в виде аэрозоля. В исследованиях клинической кинетики распределения 10% вдыхаемого ABLC откладывалось в легких при введении через специализированные системы доставки, такие как распылитель AeroEclipse, управляемый сжатым воздухом 7-8 л / мин, и это отложение в легких было в два раза выше по сравнению с достигнутыми уровнями. использование стандартных систем доставки аэрозолей для бронхолитической терапии [150].Состав также важен, поскольку в экспериментах на животных концентрация лекарственного средства в аэрозольной форме ABLC в шесть раз выше по сравнению с дезоксихолатом амфотерицина B [148]. Кроме того, ингаляционный ABLC хорошо переносился при исследовании реципиентов трансплантата легкого, тогда как обычный дезоксихолат амофотерицина B приводил к вдвое большему количеству побочных эффектов, связанных с лечением [151].
Сообщалось о значительном сокращении случаев инвазивного легочного аспергиллеза у пациентов, получавших ингаляционный амфотерицин B во время и после операции по трансплантации сердца и сердце – легкие [152].Аналогичным образом, препарат амфотерицина B (ABLC) на основе липидов также успешно использовался для профилактики трахеобронхита Aspergillus, анастомозов и инвазивных заболеваний легких у реципиентов сердца и легких [143, 153].
Скудность клинических данных по лечению амфотерицином B в аэрозольной форме у пациентов с установленной грибковой инфекцией легких затрудняет рекомендацию этого вмешательства даже в рефрактерных случаях. Вот два примера таких случаев: пациент без иммуносупрессии с поствирусным трахеобронхитом, вызванным Aspergillus, который не ответил на длительную липосомальную терапию амфотерицином B, имел благоприятный ответ на длительное лечение ингаляционным дезоксихолатом амфотерицина B плюс GM-CSF и IFNγ-иммунитет. усиление [154].Во-вторых, у пациента с тяжелой иммуносупрессией и инфекцией легкого Rhizomucor, которая в результате эволюции превратилась в Pseudalescheria boydii , инфекция полностью исчезла с помощью ингаляционного ABLC, которая продолжалась в течение 5 месяцев, и при долгосрочном наблюдении рецидива инфекции не наблюдалось [155]. Эти случаи подчеркивают потенциальную роль ингаляционного амфотерицина B в лечении установленного заболевания; однако на основании текущей клинической информации нельзя дать никаких рекомендаций.
5.8 Противовирусная аэрозольная терапия
Вирусные инфекции дыхательных путей обычно протекают в легкой форме и часто поддаются поддерживающей терапии. Однако у пациентов с ослабленным иммунитетом, больных раком или трансплантацией, эти инфекции могут быть связаны с тяжелыми осложнениями, требующими ранней диагностики и своевременной терапии [137]. Обеспокоенность вызывают парамиксовирусы, такие как респираторно-синцитиальный вирус (RSV) и вирус парагриппа (PIV), вирусы гриппа A и B, аденовирус и недавно признанный метапневмовирус человека (hMPV).Рибавирин, аналог пуринового нуклеозида, использовался для лечения хронической инфекции вируса гепатита С пероральным введением, а также для лечения геморрагической лихорадки и диссеминированного hMPV путем внутривенного введения. Рибавирин в аэрозольной форме был одобрен FDA для лечения инфекций RSV у госпитализированных детей. Обычное непрерывное лечение 60 мг рибавирина / мл в течение 18 часов эффективно с внутривенным иммуноглобулином или без него; однако пациенты чувствуют себя сильно изолированными, что может помешать уходу за ними [138].Периодически вводимый в виде аэрозоля рибавирин в дозе 20 мг / мл в течение 2 ч 3 раза в день также был эффективен у взрослых пациентов с раком и трансплантацией стволовых клеток с инфекцией RSV [140]. У детей с ослабленным иммунитетом и инфекцией RSV периодические высокие дозы (60 мг) рибавирина / мл в течение 2 часов, вводимые 3 раза в день, хорошо переносились, ассоциировались с клиническим ответом, сравнимым со стандартной непрерывной терапией, и ассоциировались со значительно меньшим загрязнением окружающей среды и воздействием на здоровье: медицинским работникам и с большей доступностью для пациентов [141, 142].
Парагрипп ассоциируется с потенциально серьезными осложнениями у реципиентов трансплантата сердце-легкие, с возможной ролью в остром отторжении аллотрансплантата и облитерирующем поствирусном бронхиолите [143]. Ингаляционный рибавирин в этой популяции ассоциировался с клиническим улучшением, хотя клинический опыт ограничен [144]. У реципиентов трансплантата гемопоэтических стволовых клеток парагриппозная вирусная инфекция является серьезной в присутствии других копатогенов и у пациентов с дыхательной недостаточностью, и лечение рибавирином в форме аэрозоля не было связано с уменьшением продолжительности выделения вируса или смертностью, связанной с пневмонией [145].
Вирус гриппа A является основной причиной заболеваемости и смертности, и инфекции часто бывают тяжелыми у пациентов с дефектным адаптивным Т-клеточным ответом. Лекарственная устойчивость к ингибиторам нейраминидазы представляет собой серьезную проблему лечения в условиях плохого ответа на обычные вакцины в популяции высокого риска рака и трансплантата [146]. Аэрозольный рибавирин 60 мг / мл для трех дневных доз продолжительностью 15 мин был эффективен против гриппа A и B у мышей [147]. Недавно было показано, что мегадоза рибавирина (100 мг / мл) эффективна у мышей, инфицированных летальным вирусом гриппа A h4N2.Эта мегадозовая терапия в течение всего 4 дней привела к выживаемости> 90% при назначении в течение 24–48 часов после инфицирования [148]. Необходимы дальнейшие клинические исследования для оценки соответствующей дозы и эффективности рибавирина для лечения лекарственно-устойчивой или лекарственно-резистентной вирулентной инфекции, вызванной вирусом гриппа.
Метапневмовирус человека возник как распространенный вирусный патоген дыхательных путей, связанный с субклиническим или легким заболеванием. Иногда было показано, что у пациентов с Т-клеточными иммунными дефектами hMPV вызывает диссеминированное смертельное заболевание [149].У пациентов, перенесших трансплантацию стволовых клеток или солидных органов, эти инфекции, даже при ограниченном легочном заболевании, представляют опасность для жизни и повышают риск поствирусной инвазивной грибковой пневмонии [150]. Внутривенный рибавирин считается лучшим доступным лечением этих серьезных диссеминированных или легочных инфекций hMPV, что отражает противовирусный эффект препарата и возможные лекарственные иммуномодулирующие свойства, которые могут еще больше повысить клиренс вируса и помочь в разрешении инфекции, особенно при ослабленном иммунитете. хост [151].
У пациентов с непереносимостью внутривенного рибавирина из-за гемолитической анемии и других серьезных осложнений с некоторым успехом применялось аэрозольное лечение легочного hMPV [152]. Точно так же при лечении пневмотропного аденовируса человека аэрозольный рибавирин предпочтительнее внутривенного из-за высокой концентрации лекарства, достигаемой в альвеолах, по сравнению с внутривенной терапией рибавирином, которая может не приводить к цитотоксическим концентрациям в легочной ткани [153]. Однако это может быть не единственным определяющим фактором клинической эффективности терапии рибавирином, поскольку лекарственное усиление активности Т-хелперных Т-клеток Th2 требует дальнейшей оценки в клинических испытаниях [151].
6. Системы небулайзера
Критическим фактором для всех ингаляционных терапевтических средств являются характеристики системы доставки. Для всех методов лечения, обсуждаемых в данном документе, использовались жидкие аэрозоли, чаще всего создаваемые воздушно-струйными небулайзерами, хотя все чаще используются дополнительные технологии [156]. Воздухоструйный и ультразвуковой распылители генерируют аэрозоль под высоким давлением и вибрацией пьезоэлектрического кристалла соответственно. Эти обычно используемые системы доставки обеспечивают адекватное отложение антимикробных препаратов в легких у амбулаторных пациентов, тогда как доставка лекарств ниже у пациентов в критическом состоянии, получающих вспомогательную вентиляцию легких [157,158].В новых электрических генераторах аэрозолей используется вибрирующая сетка или пластина с множеством отверстий, которые увеличивают отложение лекарства в легких в 2–3 раза и значительно повышают выход лекарства по сравнению с аэрозольными небулайзерами. Это следует учитывать для аэрозольной доставки лекарств у пациентов с пневмонией на ИВЛ [159].
Точно так же ингаляционная терапия цитокинами кажется привлекательной для различных трудно поддающихся лечению микобактериальных инфекций, поражающих легкие, хотя доставка этих агентов к месту инфекции представляет собой сложную задачу.В стандартных небулайзерных системах, таких как Respirgard или Misty-neb, только 5–7% общей введенной дозы достигает легочной ткани [74, 160]. Эту трудность можно уменьшить, используя высокоэффективные воздушно-струйные или ультразвуковые небулайзеры или специализированные системы доставки с использованием генераторов электрического аэрозоля нового поколения для достижения терапевтических концентраций иммуномодулирующих цитокинов в месте легочной инфекции. Для получения дополнительной информации отсылаем читателя к недавним обзорным статьям [161].
7. Резюме
Легкие являются наиболее частым очагом серьезной инфекции из-за их большой площади поверхности, подверженной воздействию внешней среды, и минимальной барьерной защиты. Однако такая архитектура делает легкие доступными для местной терапии. Терапевтические аэрозоли включают аэрозоли, направленные на улучшение мукоцилиарного клиренса патогенов, стимуляцию врожденной устойчивости к микробной инфекции, цитокиновую стимуляцию иммунной функции и доставку антибиотиков. Эти терапевтические средства все еще находятся в зачаточном состоянии, но имеют большие перспективы.
8. Экспертное заключение
По нашему мнению, ингаляционные противомикробные препараты используются недостаточно, особенно у пациентов с трудноизлечимыми легочными инфекциями низкой остроты.
Использование ингаляционной противомикробной терапии стало важной частью лечения инфекции дыхательных путей, вызываемой P. aeruginosa при муковисцидозе, и профилактики инвазивной грибковой инфекции у пациентов, перенесших трансплантацию сердца и легких.
В будущем развитии этой области мы рекомендуем сделать акцент на изучении использования аэрозольного гипертонического солевого раствора для уменьшения вызываемых патогенами нарушений дыхательных путей у субъектов, инфицированных микробами с низкой вирулентностью, стимуляции врожденной резистентности для предотвращения пневмония у субъектов с ослабленным иммунитетом, использующих цитокины или синтетические аналоги PAMP, и больше возможностей для использования ингаляционных противомикробных препаратов.
Сноски
Заявление о заинтересованности
Это исследование было частично поддержано грантом CA16672 для поддержки онкологических центров Национальных институтов здравоохранения.
Библиография
1. Доклад о состоянии здравоохранения в мире, 2004 г. — История изменений. Женева: Всемирная организация здравоохранения; 2004. [Google Scholar] 3. Джоос Л., Тамм М. Нарушение защиты легочного хозяина у хозяина с ослабленным иммунитетом: химиотерапия рака. Proc Am Thorac Soc. 2005. 2 (5): 445–8. [PubMed] [Google Scholar] 4. Ноулз М.Р., Буше Р.С. Очистка от слизи как основной врожденный защитный механизм дыхательных путей млекопитающих. J Clin Invest. 2002. 109 (5): 571–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Трэвис С.М., Сингх П.К., Валлийский М.Дж.Противомикробные пептиды и белки во врожденной защите поверхности дыхательных путей. Curr Opin Immunol. 2001. 13 (1): 89–95. [PubMed] [Google Scholar] 8. Flanders SACH, Saint S. Нозокомиальная пневмония: состояние науки. Am J Infect Control. 2006; (34): 84–93. [PubMed] [Google Scholar] 9. Ноулз М.Р., Буше Р.С. Очистка от слизи как основной врожденный защитный механизм дыхательных путей млекопитающих. J Clin Invest. 2002. 109 (5): 571–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Ратьен Ф. Восстановление жидкости на поверхности дыхательных путей при муковисцидозе.N Engl J Med. 2006. 354 (3): 291–3. [PubMed] [Google Scholar] 11. Тарран Р., Дональдсон С., Буше Р. Обоснование применения гипертонической солевой терапии при муковисцидозе легких. Semin Respir Crit Care Med. 2007. 28 (3): 295–302. [PubMed] [Google Scholar] 12. Eng PA, Morton J, Douglass JA, et al. Краткосрочная эффективность распыляемого ультразвуком гипертонического раствора при муковисцидозе. Педиатр Пульмонол. 1996. 21 (2): 77–83. [PubMed] [Google Scholar] 13. Робинсон М., Регнис Дж. А., Бейли Д. Л. и др. Влияние гипертонического раствора, амилорида и кашля на мукоцилиарный клиренс у пациентов с муковисцидозом.Am J Respir Crit Care Med. 1996. 153 (5): 1503–1509. [PubMed] [Google Scholar] 14. Суд Н., Беннетт В.Д., Земан К. и др. Повышение концентрации вдыхаемого физиологического раствора с амилоридом или без него: влияние на мукоцилиарный клиренс у нормальных субъектов. Am J Respir Crit Care Med. 2003. 167 (2): 158–63. [PubMed] [Google Scholar] 15. Wark PA, McDonald V. Распыленный гипертонический раствор для лечения муковисцидоза. Кокрановская база данных Syst Rev.2003; (1): CD001506. [PubMed] [Google Scholar] 16. Дональдсон С.Х., Беннетт В.Д., Земан К.Л. и др. Очистка слизи и функция легких при муковисцидозе с гипертоническим раствором.N Engl J Med. 2006. 354 (3): 241–50. [PubMed] [Google Scholar] 17. Элкинс М.Р., Робинсон М., Роуз Б.Р. и др. Контролируемое испытание длительного применения ингаляционного гипертонического раствора у пациентов с муковисцидозом. N Engl J Med. 2006. 354 (3): 229–40. [PubMed] [Google Scholar] 18. Керем Э., Бистрицер Т., Ханукоглу А. и др. Дисфункция легочного эпителия натриевых каналов и избыток жидкости в дыхательных путях при псевдогипоальдостеронизме. N Engl J Med. 1999. 341 (3): 156–62. [PubMed] [Google Scholar] 19. Уильямс О.В., Шарафхане А., Ким В. и др.Слизь в дыхательных путях: от производства до секрета. Am J Respir Cell Mol Biol. 2006. 34 (5): 527–36. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Буше RC. Обезвоживание поверхности дыхательных путей при муковисцидозе: патогенез и терапия. Annu Rev Med. 2007. 58: 157–70. [PubMed] [Google Scholar] 22. Эванс С.М., Уильямс О.В., Тувим М.Дж. и др. Муцин продуцируется clara-клетками проксимальных дыхательных путей мышей, зараженных антигеном. Am J Respir Cell Mol Biol. 2004. 31 (4): 382–94. [PubMed] [Google Scholar] 23. Уильямс О.В., Шарафхане А., Ким В. и др.Слизь в дыхательных путях: от производства до секрета. Am J Respir Cell Mol Biol. 2006. 34 (5): 527–36. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Акинби Х.Т., Эпод Р., Бхатт Х. и др. Уничтожение бактерий усиливается экспрессией лизоцима в легких трансгенных мышей. J Immunol. 2000. 165 (10): 5760–6. [PubMed] [Google Scholar] 25. Bals R, Weiner DJ, Moscioni AD, et al. Усиление врожденной защиты хозяина за счет экспрессии антимикробного пептида кателицидина. Infect Immun. 1999. 67 (11): 6084–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26.Коул А.М., Ляо Х.И., Стучлик О. и др. Катионные полипептиды необходимы для антибактериальной активности жидкости дыхательных путей человека. J Immunol. 2002. 169 (12): 6985–91. [PubMed] [Google Scholar] 27. Коул AM, Thapa DR, Gabayan V и др. Снижение клиренса Pseudomonas aeruginosa из дыхательных путей мышей с дефицитом лизоцима M. J Leukoc Biol. 2005. 78 (5): 1081–5. [PubMed] [Google Scholar] 28. Moser C, Weiner DJ, Lysenko E, et al. бета-дефенсин 1 способствует развитию врожденного иммунитета легких у мышей. Infect Immun. 2002. 70 (6): 3068–72.[Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Эванс С.Е., Хан П.Й., Макканн Ф. и др. Бета-глюканы клеточной стенки Pneumocystis стимулируют генерацию хемокинов альвеолярными эпителиальными клетками через механизмы, зависящие от ядерного фактора, каппа-B. Am J Respir Cell Mol Biol. 2005. 32 (6): 490–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Агусти С., Рано А., Ровира М. и др. Воспалительный ответ, связанный с легочными осложнениями у пациентов с ослабленным иммунитетом, не связанных с ВИЧ. Грудная клетка. 2004. 59 (12): 1081–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31.Бартон Г.М., Меджитов Р. Сигнальные пути толл-подобных рецепторов. Наука. 2003. 300 (5625): 1524–15. [PubMed] [Google Scholar] 32. Болдрик Дж. К., Ализаде А. А., Дин М. и др. Стереотипные и специфические программы экспрессии генов в врожденных иммунных реакциях человека на бактерии. Proc Natl Acad Sci USA. 2002. 99 (2): 972–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Капетанович Р., Кавайон Дж. М.. Ранние события врожденного иммунитета при распознавании микробных патогенов. Экспертное мнение Biol Ther. 2007. 7 (6): 907–18. [PubMed] [Google Scholar] 34.Каваи Т., Акира С. Сигнализация TLR. Смерть клетки отличается. 2006. 13 (5): 816–25. [PubMed] [Google Scholar] 35. Копп Э., Меджитов Р. Распознавание микробной инфекции по Toll-подобным рецепторам. Curr Opin Immunol. 2003. 15 (4): 396–401. [PubMed] [Google Scholar] 36. Чжан Г., Гош С. Активация NF-kappaB, опосредованная Toll-подобным рецептором: филогенетически консервативная парадигма врожденного иммунитета. J Clin Invest. 2001; 107 (1): 13–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Улевич Р.Ю. Терапия, направленная на врожденную иммунную систему.Nat Rev Immunol. 2004. 4 (7): 512–20. [PubMed] [Google Scholar] 38. Аревало И., Туллиано Дж., Киспе А. и др. Роль имиквимода и парентерального антимониата меглумина в начальном лечении кожного лейшманиоза. Clin Infect Dis. 2007. 44 (12): 1549–54. [PubMed] [Google Scholar] 39. Канистанон Д., Хаджар А.М., Пеллетье М.Р. и др. Мутант Francisella по углеводной модификации липида А вызывает защитный иммунитет. PLoS Pathog. 2008; 4 (2): e24. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Лембо А., Пеллетье М., Айер Р. и др.Введение синтетического агониста TLR4 защищает мышей от легочной туляремии. J Immunol. 2008. 180 (11): 7574–81. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Лурманн А., Дейтерс Ю., Скокова Дж. И др. Эффекты in vivo синтетического 2-килодальтонного активирующего макрофаги липопептида Mycoplasma fermentans после легочного применения. Infect Immun. 2002. 70 (7): 3785–92. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. МакХатчисон Дж. Г., Бэкон Б. Р., Гордон С. К. и др. Фаза 1B, рандомизированное двойное слепое исследование с увеличением дозы CPG 10101 у пациентов с хроническим вирусом гепатита С.Гепатология. 2007. 46 (5): 1341–9. [PubMed] [Google Scholar] 43. Raberg L, Sim D, Read AF. Распутывание генетической изменчивости для устойчивости и толерантности к инфекционным заболеваниям у животных. Наука. 2007. 318 (5851): 812–4. [PubMed] [Google Scholar] 44. Уильямс Т.Н., Мванги Т.В., Вамбуа С. и др. Отрицательный эпистаз между защитным действием от малярии альфа + -талассемии и серповидно-клеточной характеристикой. Нат Жене. 2005. 37 (11): 1253–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Эванс С.Е., Скотт Б.Л., Клемент К.Г. и др.Стимулированная врожденная резистентность эпителия легких защищает мышей от бактерий и грибков. Am J Respir Cell Mol Biol. 2009 27 марта; [Epub перед печатью] [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Деннис Д.Т., Инглсби Т.В., Хендерсон Д.А. и др. Туляремия как биологическое оружие: управление медициной и общественным здравоохранением. ДЖАМА. 2001. 285 (21): 2763–73. [PubMed] [Google Scholar] 47. Хиллеман MR. Обзор: причины и профилактика в биологической войне и биотерроризме. Вакцина. 2002. 20 (25–26): 3055–67. [PubMed] [Google Scholar] 48.Уэйн Конлан Дж., Шен Х., Куоли Р. и др. Аэрозольная, но не внутрикожная иммунизация живым вакцинным штаммом Francisella tularensis защищает мышей от последующего аэрозольного заражения высоковирулентным штаммом патогена типа А посредством механизма, зависимого от Т-лимфоцитов и гамма-интерферона. Вакцина. 2005. 23 (19): 2477–85. [PubMed] [Google Scholar] 50. Тувим М.Дж., Эванс С.Е., Клемент К.Г. и др. Усиленное воспаление легких защищает от пневмонии гриппа А. PLoS ONE. 2009; 4 (1): e4176.[Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Клемент К.Г., Эванс С.Е., Эванс С.М. и др. Стимуляция врожденного иммунитета легких защищает мышей от летальной пневмококковой пневмонии. Am J Respir Crit Care Med. 2008. 177 (12): 1322–30. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Могхаддам С.Дж., Клемент К.Г., Де ла Гарза М.М. и др. Лизат Haemophilus influenzae индуцирует аспекты фенотипа хронической обструктивной болезни легких. Am J Respir Cell Mol Biol. 2008. 38 (6): 629–38. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53.Brandl K, Plitas G, Mihu CN и др. Устойчивые к ванкомицину энтерококки используют вызванный антибиотиками врожденный иммунный дефицит. Природа. 2008. 455 (7214): 804–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Hoogerwerf JJ, de Vos AF, Bresser P, et al. Воспаление легких, вызванное липотейхоевой кислотой или липополисахаридом у человека. Am J Respir Crit Care Med. 2008. 178 (1): 34–41. [PubMed] [Google Scholar] 55. Реппе К., Черниг Т., Лурманн А. и др. Иммуностимуляция липопептидом-2, активирующим макрофаги, увеличивала выживаемость при пневмонии мышей.Am J Respir Cell Mol Biol. 2009. 40 (4): 474–81. [PubMed] [Google Scholar] 56. Багчи А., Херруп Э.А., Уоррен Х.С. и др. MyD88-зависимый и MyD88-независимый пути синергизма, прайминга и толерантности между агонистами TLR. J Immunol. 2007. 178 (2): 1164–71. [PubMed] [Google Scholar] 57. Trinchieri G, Sher A. Сотрудничество сигналов Toll-подобных рецепторов во врожденной иммунной защите. Nat Rev Immunol. 2007. 7 (3): 179–90. [PubMed] [Google Scholar] 58. Меджитов Р. Распознавание микроорганизмов и активация иммунного ответа.Природа. 2007. 449 (7164): 819–26. [PubMed] [Google Scholar] 59. Foster SL, Hargreaves DC, Medzhitov R. Ген-специфический контроль воспаления с помощью TLR-индуцированных модификаций хроматина. Природа. 2007. 447 (7147): 972–8. [PubMed] [Google Scholar] 60. Тадзава Р., Хамано Э., Араи Т. и др. Гранулоцитарно-макрофагальный колониестимулирующий фактор и легочный иммунитет при легочном альвеолярном протеинозе. Am J Respir Crit Care Med. 2005. 171 (10): 1142–9. [PubMed] [Google Scholar] 61. Андерсон П.М., Маркович С.Н., Слоан Дж. А. и др. Аэрозольный гранулоцитарный макрофаг-колониестимулирующий фактор: низкая токсичность, легочная биологическая терапия у пациентов с метастазами в легких.Clin Cancer Res. 1999. 5 (9): 2316–23. [PubMed] [Google Scholar] 62. Trapnell BC, Whitsett JA, Nakata K. Легочный альвеолярный протеиноз. N Engl J Med. 2003. 349 (26): 2527–39. [PubMed] [Google Scholar] 63. Киннула В., Маттсон К., Кантелл К. Фармакокинетика и токсичность вдыхаемого человеческого интерферона-альфа у пациентов с раком легких. J Interferon Res. 1989. 9 (4): 419–23. [PubMed] [Google Scholar] 64. Маасилта П., Халме М., Маттсон К. и др. Фармакокинетика ингаляционного рекомбинантного и природного альфа-интерферона. Ланцет.1991; 337 (8737): 371. [PubMed] [Google Scholar] 65. Киннула В., Кантелл К., Маттсон К. Эффект вдыхаемого природного интерферона-альфа на диффузную бронхоальвеолярную карциному. Eur J Cancer. 1990; 26 (6): 740–1. [PubMed] [Google Scholar] 66. Маасилта П., Холсти Л. Р., Халме М. и др. Природный альфа-интерферон в сочетании с гиперфракционированной лучевой терапией при лечении немелкоклеточного рака легкого. Int J Radiat Oncol Biol Phys. 1992. 23 (4): 863–8. [PubMed] [Google Scholar] 67. Giosue S, Casarini M, Alemanno L и др.Эффекты аэрозольного интерферона-альфа у больных туберкулезом легких. Am J Respir Crit Care Med. 1998. 158 (4): 1156–62. [PubMed] [Google Scholar] 68. Giosue S, Casarini M, Ameglio F и др. Аэрозольное лечение интерфероном-альфа у пациентов с туберкулезом легких с множественной лекарственной устойчивостью. Eur Cytokine Netw. 2000. 11 (1): 99–104. [PubMed] [Google Scholar] 69. Мартин Р. Дж., Богуневич М., Хенсон Дж. Э. и др. Воздействие вдыхаемого гамма-интерферона на нормальные дыхательные пути человека. Am Rev Respir Dis. 1993; 148 (6 Pt 1): 1677–82.[PubMed] [Google Scholar] 70. Богуневич М., Мартин Р.Дж., Мартин Д. и др. Эффекты распыленного рекомбинантного гамма-интерферона на астматические дыхательные пути. J Allergy Clin Immunol. 1995. 95 (1 Pt 1): 133–5. [PubMed] [Google Scholar] 71. Кондо Р., Раджу Б., Канова А. и др. Рекомбинантный гамма-интерферон стимулирует передачу сигнала и экспрессию генов в альвеолярных макрофагах in vitro и у больных туберкулезом. Infect Immun. 2003. 71 (4): 2058–64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Раджу Б., Хосино Ю., Кувабара К. и др.Аэрозольный гамма-интерферон (IFN-гамма) индуцирует экспрессию генов, кодирующих IFN-гамма-индуцибельный белок 10 килодальтон, но не индуцируемую синтазу оксида азота в легких во время туберкулеза. Infect Immun. 2004. 72 (3): 1275–83. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Кондо R, Rom WN, Schluger NW. Лечение туберкулеза легких с множественной лекарственной устойчивостью с помощью аэрозольного гамма-интерферона. Ланцет. 1997. 349 (9064): 1513–5. [PubMed] [Google Scholar] 74. Condos R, Hull FP, Schluger NW и др.Региональное отложение аэрозольного гамма-интерферона при туберкулезе легких. Грудь. 2004. 125 (6): 2146–55. [PubMed] [Google Scholar] 75. Moss RB, Mayer-Hamblett N, Wagener J, et al. Рандомизированное двойное слепое плацебо-контролируемое исследование с увеличением дозы аэрозольного интерферона гамма-1b у пациентов с кистозным фиброзом легких легкой и средней степени тяжести. Педиатр Пульмонол. 2005. 39 (3): 209–18. [PubMed] [Google Scholar] 76. Накос Г., Маламу-Мици В.Д., Лачана А. и др. Иммунопаралич у больных с тяжелой травмой и действие ингаляционного гамма-интерферона.Crit Care Med. 2002. 30 (7): 1488–94. [PubMed] [Google Scholar] 77. Вирголини I, Куртаран А., Леймер М. и др. Ингаляционная сцинтиграфия с меченным йодом-123 интерфероном гамма-1b: исследование легочного отложения и повышения дозы у здоровых добровольцев. J Nucl Med. 1997. 38 (9): 1475–81. [PubMed] [Google Scholar] 78. Рао Р.Д., Андерсон П.М., Арндт К.А. и др. Терапия аэрозольным гранулоцитарным макрофагальным колониестимулирующим фактором (GM-CSF) при метастатическом раке. Am J Clin Oncol. 2003. 26 (5): 493–8. [PubMed] [Google Scholar] 79.Нивен Р.В., Уиткомб К.Л., Шанер Л. и др. Легочная абсорбция аэрозольного и интратрахеально инстиллированного rhG-CSF и моноПЕГилированного rhG-CSF. Pharm Res. 1995; 12 (9): 1343–9. [PubMed] [Google Scholar] 80. Мачида М., Хаяши М., Авазу С. Абсорбция в легких рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора (rhG-CSF) после интратрахеального введения крысам. Биол Фарм Булл. 1996. 19 (2): 259–62. [PubMed] [Google Scholar] 81. Gatmaitan BG, Carruthers MM, Lerner AM. Гентамицин в лечении первичных грамотрицательных пневмоний.Am J Med Sci. 1970; 260 (2): 90–4. [PubMed] [Google Scholar] 83. Klastersky J, Geuning C, Mouawad E, et al. Эндотрахеальный гентамицин при бронхиальных инфекциях у пациентов с трахеостомией. Грудь. 1972: 61 (2): 117–20. [PubMed] [Google Scholar] 85. Odio W, Van Laer E, Klastersky J. Концентрации гентамицина в бронхиальном секрете после внутримышечного и эндотрахеального введения. J Clin Pharmacol. 1975. 15 (7): 518–24. [PubMed] [Google Scholar] 86. Панидис Д., Маркантонис С.Л., Бутзука Э. и др. Проникновение гентамицина в жидкость выстилки альвеол у пациентов в критическом состоянии с вентилятор-ассоциированной пневмонией.Грудь. 2005. 128 (2): 545–52. [PubMed] [Google Scholar] 87. Каркас А.Дж., Гарсия-Сатуе Д.Л., Сапатер П. и др. Проникновение тобрамицина в эпителиальную выстилочную жидкость пациентов с пневмонией. Clin Pharmacol Ther. 1999. 65 (3): 245–50. [PubMed] [Google Scholar] 88. Valcke YJ, Vogelaers DP, Colardyn FA и др. Проникновение нетилмицина в нижние дыхательные пути после приема один раз в сутки. Грудь. 1992. 101 (4): 1028–32. [PubMed] [Google Scholar] 89. Брауде А.С., Хорнштейн А., Кляйн М. и др. Распределение тобрамицина в легких.Am Rev Respir Dis. 1983; 127 (5): 563–5. [PubMed] [Google Scholar] 90. Kuhn RJ. Фармацевтические соображения при аэрозольной доставке лекарств. Фармакотерапия. 2002; 22 (3 Pt 2): 80S – 5S. [PubMed] [Google Scholar] 91. Goldstein I, Wallet F, Nicolas-Robin A и др. Отложение в легких и эффективность распыленного амикацина при пневмонии, вызванной Escherichia coli, у вентилируемых поросят. Am J Respir Crit Care Med. 2002. 166 (10): 1375–81. [PubMed] [Google Scholar] 92. Гольдштейн I, Кошелек F, Роберт Дж. И др. Концентрация распыленного амикацина в легочной ткани во время искусственной вентиляции легких у поросят со здоровыми легкими.Am J Respir Crit Care Med. 2002. 165 (2): 171–5. [PubMed] [Google Scholar] 93. Klastersky J, Carpentier-Meunier F, Kahan-Coppens L, et al. Антибиотики при грамотрицательной бронхопневмонии назначаются эндотрахеально. Грудь. 1979; 75 (5): 586–91. [PubMed] [Google Scholar] 94. Флюм П, Клепсер МЭ. Обоснование использования антибиотиков в аэрозольной форме. Фармакотерапия. 2002; 22 (3 Pt 2): 71S – 9S. [PubMed] [Google Scholar] 95. Мур Р.Д., Литман П.С., Смит С.Р. Клинический ответ на терапию аминогликозидами: важность отношения максимальной концентрации к минимальной ингибирующей концентрации.J Infect Dis. 1987. 155 (1): 93–9. [PubMed] [Google Scholar] 96. Мур RD, Смит CR, Литман PS. Связь уровней аминогликозидов в плазме со смертностью у пациентов с грамотрицательной бактериемией. J Infect Dis. 1984. 149 (3): 443–8. [PubMed] [Google Scholar] 97. Schentag JJ. Корреляция фармакокинетических параметров с эффективностью антибиотиков: взаимосвязь между концентрациями в сыворотке, значениями МИК и бактериальной эрадикацией у пациентов с грамотрицательной пневмонией. Scand J Infect Dis Suppl. 1990; 74: 218–34.[PubMed] [Google Scholar] 98. Дезил-Эванс Л.М., Мерфи Дж. Э., Джоб М.Л. Корреляция фармакокинетических показателей с терапевтическим исходом у пациентов, получающих аминогликозиды. Clin Pharm. 1986. 5 (4): 319–24. [PubMed] [Google Scholar] 99. Коллинз Т., Гердинг Д.Н. Аминогликозиды в сравнении с бета-лактамами при грамотрицательной пневмонии. Semin Respir Infect. 1991. 6 (3): 136–46. [PubMed] [Google Scholar] 100. Бернс Дж. Л., Ван Дальфсен Дж. М., Шавар Р. М. и др. Влияние хронического периодического введения ингаляционного тобрамицина на респираторную микробную флору у пациентов с муковисцидозом.J Infect Dis. 1999. 179 (5): 1190–6. [PubMed] [Google Scholar] 101. Valcke Y, Pauwels R, Van der Straeten M. Проникновение аминогликозидов в жидкость выстилки альвеол крыс. Эффект воспаления дыхательных путей. Am Rev Respir Dis. 1990. 142 (5): 1099–103. [PubMed] [Google Scholar] 102. Меерс П., Невилл М., Малинин В. и др. Проникновение биопленки, запускаемое высвобождение и активность ингаляционного липосомального амикацина in vivo при хронических инфекциях легких, вызванных Pseudomonas aeruginosa. J Antimicrob Chemother. 2008. 61 (4): 859–68.[PubMed] [Google Scholar] 103. Дэвис К.К., Као П.Н., Якобс С.С. и др. Аэрозольный амикацин для лечения легочных инфекций Mycobacterium avium: серия наблюдательных случаев. BMC Pulm Med. 2007; 7: 2. [Бесплатная статья PMC] [PubMed] [Google Scholar] 104. Макколл С.Ю., Спруилл В.Дж., Уэйд В.Е. Применение тобрамицина в аэрозольной форме при лечении резистентного псевдомонадного пневмонита. Ther Drug Monit. 1989. 11 (6): 692–5. [PubMed] [Google Scholar] 105. Допфер Р., Брэнд П, Маллингер Б. и др. Ингаляция тобрамицина у больных муковисцидозом: сравнение двух методов.J. Physiol Pharmacol. 2007; 58 (Дополнение 5) (Pt 1): 141–54. [PubMed] [Google Scholar] 106. Ленуар Г., Антипкин Ю.Г., Миано А. и др. Эффективность, безопасность и местная фармакокинетика высококонцентрированного распыленного тобрамицина у пациентов с муковисцидозом, колонизированными синегнойной палочкой. Педиатрические препараты. 2007; 9 (Дополнение 1): 11–20. [PubMed] [Google Scholar] 107. Рэмси Б.В., Доркин Х.Л., Айзенберг Д.Д. и др. Эффективность аэрозольного тобрамицина у пациентов с муковисцидозом. N Engl J Med. 1993. 328 (24): 1740–6. [PubMed] [Google Scholar] 109.Кантон Р., Кобос Н., де Грасиа Дж. И др. Антимикробная терапия легочной патогенной колонизации и инфекции Pseudomonas aeruginosa у пациентов с муковисцидозом. Clin Microbiol Infect. 2005. 11 (9): 690–703. [PubMed] [Google Scholar] 110. Sexauer WP, Fiel SB. Антибиотики в аэрозольной форме при муковисцидозе. Semin Respir Crit Care Med. 2003. 24 (6): 717–26. [PubMed] [Google Scholar] 111. Кун П., Ландау Л.И., Фелан П.Д. Распыленный гентамицин у детей и подростков с муковисцидозом. Aust Paediatr J.1984. 20 (1): 43–5. [PubMed] [Google Scholar] 112. Уолл М.А., Терри А.Б., Айзенберг Дж. И др. Ингаляционные антибиотики при муковисцидозе. Ланцет. 1983; 1 (8337): 1325. [PubMed] [Google Scholar] 113. Стейнкамп Г., Туммлер Б., Гаппа М. и др. Длительная аэрозольная терапия тобрамицином при муковисцидозе. Педиатр Пульмонол. 1989. 6 (2): 91–8. [PubMed] [Google Scholar] 114. Смит А.Л., Рэмси Б.В., Хеджес Д.Л. и др. Безопасность применения аэрозольного тобрамицина в течение 3 месяцев пациентам с муковисцидозом. Педиатр Пульмонол. 1989. 7 (4): 265–71.[PubMed] [Google Scholar] 115. Рэмси Б.В., Пепе М.С., Куан Дж. М. и др. Периодическое введение ингаляционного тобрамицина пациентам с муковисцидозом. Группа по изучению муковисцидоза, вдыхаемого тобрамицином. N Engl J Med. 1999. 340 (1): 23–30. [PubMed] [Google Scholar] 116. Мох РБ. Долгосрочные преимущества ингаляционного тобрамицина у подростков с муковисцидозом. Грудь. 2002. 121 (1): 55–63. [PubMed] [Google Scholar] 117. Стивенс Д., Гэри Н., Айлз А. и др. Эффективность ингаляционного тобрамицина при лечении обострений легких у детей с муковисцидозом.Pediatr Infect Dis. 1983; 2 (3): 209–11. [PubMed] [Google Scholar] 118. Schaad UB, Wedgwood-Krucko J, Suter S и др. Эффективность ингаляционного амикацина в качестве дополнения к внутривенной комбинированной терапии (цефтазидим и амикацин) при муковисцидозе. J Pediatr. 1987. 111 (4): 599–605. [PubMed] [Google Scholar] 119. Билтон Д., Хениг Н., Моррисси Б. и др. Добавление ингаляционного тобрамицина к ципрофлоксацину при обострении инфекции Pseudomonas aeruginosa при бронхоэктазах у взрослых. Грудь. 2006. 130 (5): 1503–10. [PubMed] [Google Scholar] 121.Рубин Б.К. Аэрозольные антибиотики для лечения бронхоэктазов без кистозного фиброза. J Aerosol Med Pulm Drug Deliv. 2008. 21 (1): 71–6. [PubMed] [Google Scholar] 122. Drobnic ME, Sune P, Montoro JB и др. Ингаляционный тобрамицин пациентам с неуковным фиброзом, бронхоэктазами и хронической бронхиальной инфекцией, вызванной синегнойной палочкой. Энн Фармакотер. 2005. 39 (1): 39–44. [PubMed] [Google Scholar] 123. Баркер А.Ф., Коуч Л., Фил С.Б. и др. Раствор тобрамицина для ингаляций снижает плотность мокроты синегнойной палочки при бронхоэктазах.Am J Respir Crit Care Med. 2000. 162 (2 Pt 1): 481–5. [PubMed] [Google Scholar] 124. Шейнберг П., Шор Э. Пилотное исследование безопасности и эффективности раствора тобрамицина для ингаляции у пациентов с тяжелыми бронхоэктазами. Грудь. 2005. 127 (4): 1420–146. [PubMed] [Google Scholar] 125. Додек П., Кинан С., Кук Д. и др. Основанное на фактических данных клиническое руководство по профилактике вентилятор-ассоциированной пневмонии. Ann Intern Med. 2004. 141 (4): 305–13. [PubMed] [Google Scholar] 126. Falagas ME, Siempos II, Bliziotis IA, et al.Введение антибиотиков через дыхательные пути для профилактики пневмонии, приобретенной в ОИТ: метаанализ сравнительных исследований. Crit Care. 2006; 10 (4): R123. [Бесплатная статья PMC] [PubMed] [Google Scholar] 127. Ратгебер Дж., Зильманн С., Панцер С. и др. Профилактика пневмонии путем эндотрахеальной микронебулизации тобрамицина. Анастезиол Интенсивмед Нефалмед Шмерцтер. 1993. 28 (1): 23–9. [PubMed] [Google Scholar] 128. Klastersky J, Huysmans E, Weerts D, et al. Эндотрахеально вводимый гентамицин для профилактики инфекций дыхательных путей у пациентов с трахеостомией: двойное слепое исследование.Грудь. 1974. 65 (6): 650–4. [PubMed] [Google Scholar] 129. Таблан О.К., Андерсон Л.Дж., Бессер Р. и др. Руководство по профилактике пневмонии, связанной с оказанием медицинской помощи, 2003 г .: рекомендации CDC и Консультативного комитета по практике инфекционного контроля в здравоохранении. MMWR Recomm Rep. 2004; 53 (RR-3): 1–36. [PubMed] [Google Scholar] 130. Falagas ME, Agrafiotis M, Athanassa Z и др. Введение антибиотиков через дыхательные пути в качестве монотерапии пневмонии. Эксперт Rev Anti Infect Ther. 2008. 6 (4): 447–52. [PubMed] [Google Scholar] 131.Ghannam DE, Rodriguez GH, Raad II и др. Ингаляционные аминогликозиды у онкологических больных с грамотрицательной бактериальной пневмонией, связанной с вентилятором: безопасность и осуществимость в эпоху роста лекарственной устойчивости. Eur J Clin Microbiol Infect Dis. 2009. 28 (3): 253–9. [PubMed] [Google Scholar] 132. Палмер Л. Б., Смолдон Г. К., Чен Дж. Дж. И др. Аэрозольные антибиотики и трахеобронхит, связанный с вентилятором, в отделении интенсивной терапии. Crit Care Med. 2008; 36 (7): 2008–13. [PubMed] [Google Scholar] 133. Морозини М.И., Гарсия-Кастильо М., Лоза Э. и др.Контрольные точки для прогнозирования чувствительности Pseudomonas aeruginosa к вдыхаемому тобрамицину у пациентов с муковисцидозом: использование тест-полосок Etest с высоким диапазоном значений. J Clin Microbiol. 2005. 43 (9): 4480–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 134. Линден П.К., Патерсон Д.Л. Парентеральный и ингаляционный колистин для лечения вентилятор-ассоциированной пневмонии. Clin Infect Dis. 2006; 43 (Дополнение 2): S89 – S4. [PubMed] [Google Scholar] 135. Михалопулос А., Фотакис Д., Вирцили С. и др. Колистин в аэрозольной форме в качестве дополнительного лечения респираторно-ассоциированной пневмонии, вызванной грамотрицательными бактериями с множественной лекарственной устойчивостью: проспективное исследование.Respir Med. 2008. 102 (3): 407–12. [PubMed] [Google Scholar] 136. Kwa AL, Loh C, Low JG и др. Распыленный колистин в лечении пневмонии, вызванной множественной лекарственной устойчивостью Acinetobacter baumannii и Pseudomonas aeruginosa. Clin Infect Dis. 2005. 41 (5): 754–7. [PubMed] [Google Scholar] 137. Берлана Д., Ллоп Дж. М., Форт Е. и др. Использование колистина для лечения грамотрицательных инфекций с множественной лекарственной устойчивостью. Am J Health Syst Pharm. 2005. 62 (1): 39–47. [PubMed] [Google Scholar] 138. Hamer DH. Лечение внутрибольничной пневмонии и трахеобронхита, вызванных синегнойной палочкой с множественной лекарственной устойчивостью, колистином в аэрозольной форме.Am J Respir Crit Care Med. 2000. 162 (1): 328–30. [PubMed] [Google Scholar] 139. Маккой К.С., Квиттнер А.Л., Оерманн С.М. и др. Азтреонам лизин вдыхается при хронической болезни дыхательных путей Pseudomonas aeruginosa при муковисцидозе. Am J Respir Crit Care Med. 2008. 178 (9): 921–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 140. Сафдар А. Стратегии усиления иммунной функции у реципиентов гемопоэтической трансплантации, у которых есть грибковые инфекции. Пересадка костного мозга. 2006. 38 (5): 327–37. [PubMed] [Google Scholar] 141. Сафдар А.Трудности с грибковыми инфекциями у пациентов с острым миелогенным лейкозом: стратегии повышения иммунитета. Онколог. 2007; 12 (Дополнение 2): 2–6. [PubMed] [Google Scholar] 142. Safdar ARG, Lichtiger B, Dickey BF и др. Повышение иммунитета рекомбинантным интерфероном гамма 1b у 20 пациентов с гематологическими злокачественными новообразованиями и системными оппортунистическими инфекциями, получавших переливания донорских гранулоцитов. Рак. 2006. 106 (12): 2664–71. [PubMed] [Google Scholar] 143. Монтойя Дж. Г., Чапарро С. В., Селис Д. и др. Инвазивный аспергиллез на фоне трансплантации сердца.Clin Infect Dis. 2003; 37 (Приложение 3): S281–92. [PubMed] [Google Scholar] 144. Гарсия-Видаль CUA, Кирби К.А., Марр К.А. Эпидемиология инвазивных инфекций плесени у реципиентов аллогенных стволовых клеток: биологические факторы риска инфекции в зависимости от времени после трансплантации. Clin Infect Dis. 2008. 47 (8): 1041–50. [Бесплатная статья PMC] [PubMed] [Google Scholar] 145. Маттиуцци Г.Н., Кантарджиан Х., Фадерл С. и др. Липидный комплекс амфотерицина B как профилактика инвазивных грибковых инфекций у пациентов с острым миелогенным лейкозом и миелодиспластическим синдромом, проходящих индукционную химиотерапию.Рак. 2004. 100 (3): 581–9. [PubMed] [Google Scholar] 146. Сингх Н., Лимай А.П., Форрест Г. и др. Поздний инвазивный аспергиллез у реципиентов трансплантата в современную эпоху. Med Mycol. 2006. 44 (5): 445–9. [PubMed] [Google Scholar] 147. Schmitt HJ, Bernard EM, Hauser M, et al. Аэрозольный амфотерицин B эффективен для профилактики и лечения крысиной модели легочного аспергиллеза. Антимикробные агенты Chemother. 1988. 32 (11): 1676–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 148. Cicogna CE, White MH, Bernard EM и др.Эффективность профилактического аэрозольного липидного комплекса амфотерицина B на модели легочного аспергиллеза на крысах. Антимикробные агенты Chemother. 1997. 41 (2): 259–61. [Бесплатная статья PMC] [PubMed] [Google Scholar] 149. Коидзуми Т., Кубо К., Канеки Т. и др. Фармакокинетическая оценка амфотерицина B в легочной ткани: распределение легочной лимфы после внутривенной инъекции и распределение воздушного пространства после аэрозолизации и ингаляции амфотерицина B. Противомикробные агенты Chemother. 1998. 42 (7): 1597–600. [Бесплатная статья PMC] [PubMed] [Google Scholar] 150.Коркоран Т.Е., Венкатараманан Р., Михельц К.М. и др. Аэрозольное отложение липидного комплекса амфотерицин-B (Abelcet) у реципиентов трансплантата легких. Am J Transplant. 2006. 6 (11): 2765–73. [PubMed] [Google Scholar] 151. Дрю Р.Х., Доддс Эшли Э., Бенджамин Д.К., мл. И др. Сравнительная безопасность липидного комплекса амфотерицина B и дезоксихолата амфотерицина B в качестве противогрибковой профилактики в аэрозольной форме у реципиентов трансплантата легких. Трансплантация. 2004. 77 (2): 232–7. [PubMed] [Google Scholar] 152. Монтойя Дж. Г., Хиральдо Л. Ф., Эфрон Б. и др.Инфекционные осложнения у 620 последовательных пациентов после трансплантации сердца в медицинском центре Стэнфордского университета. Clin Infect Dis. 2001. 33 (5): 629–40. [PubMed] [Google Scholar] 153. Палмер С.М., Дрю Р.Х., Уайтхаус Дж. Д. и др. Безопасность аэрозольного липидного комплекса амфотерицина B у реципиентов трансплантата легких. Трансплантация. 2001. 72 (3): 545–8. [PubMed] [Google Scholar] 154. Ботинки RJ, Патерсон Д.Л., Олворт А.М. и др. Успешное лечение постгриппозного псевдомембранозного некротизирующего аспергиллеза бронхов липосомальным амфотерицином, ингаляционным амфотерицином B, гамма-интерфероном и GM-CSF.Грудная клетка. 1999. 54 (11): 1047–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 155. Сафдар А., О’Брайен С., Кури И.Ф. Эффективность и возможность применения липидной комплексной терапии амфотерицина В в аэрозольной форме при легочном зигомикозе с прорывом каспофунгина. Пересадка костного мозга. 2004. 34 (5): 467–8. [PubMed] [Google Scholar] 156. Дханд Р., Гунтур В.П. Как лучше всего доставлять аэрозольные препараты пациентам, находящимся на ИВЛ. Clin Chest Med. 2008. 29 (2): 277–96. vi. [PubMed] [Google Scholar] 157. Макинтайр Н.Р., Сильвер Р.М., Миллер К.В. и др.Доставка аэрозоля интубированным пациентам на ИВЛ. Crit Care Med. 1985. 13 (2): 81–4. [PubMed] [Google Scholar] 158. Заявление о консенсусе по аэрозолям-1991. Американская ассоциация респираторной помощи. Respir Care. 1991. 36 (9): 916–21. [PubMed] [Google Scholar] 159. Дханд Р., Сохал Х. Система доставки легочных лекарств для ингаляционной терапии у пациентов с механической вентиляцией легких. Эксперт Rev Med Devices. 2008. 5 (1): 9–18. [PubMed] [Google Scholar] 160. Blanchard JDCD и др. Отложение в легких интерферона гамма-1b после ингаляции через систему AERx vs.Небулайзер Respirgard II ™ . Am J Respir Crit Care Med. 2003; 167: A373. [Аннотация встречи] [Google Scholar] 161. Уоттс А.Б., МакКонвилл Дж. Т., Уильямс РО. Современные методы лечения и технологические достижения в области доставки лекарственных средств в виде водных аэрозолей. Препарат Дев Инд Фарм. 2008. 34 (9): 913–22. [PubMed] [Google Scholar]
Ингаляционные терапевтические средства для профилактики и лечения пневмонии
Expert Opin Drug Saf. Авторская рукопись; доступно в PMC 2015 7 августа.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC4527977
NIHMSID: NIHMS710030
M.Онкологический центр Д. Андерсона, Хьюстон, Техас, США
† Автор для переписки: адъюнкт-профессор медицины Техасского университета, департамент инфекционных заболеваний, Онкологический центр доктора медицины Андерсона, инфекционный контроль и здоровье сотрудников, 402, 1515 Holcombe Boulevard , Техас 77030, Хьюстон, США, тел .: +1 713 792 0825; Факс: +1713745 6839; gro.nosrednadm@radfasa См. другие статьи в PMC, в которых цитируется опубликованная статья.
Abstract
Легкие являются наиболее распространенным местом серьезных инфекций из-за их большой площади поверхности, подверженной воздействию внешней среды, и минимальной барьерной защиты.Однако такая архитектура делает легкие доступными для местной терапии. Терапевтические аэрозоли включают аэрозоли, направленные на улучшение мукоцилиарного клиренса патогенов, стимуляцию врожденной устойчивости к микробной инфекции, цитокиновую стимуляцию иммунной функции и доставку антибиотиков. По нашему мнению, ингаляционные противомикробные препараты используются недостаточно, особенно у пациентов с трудноизлечимыми легочными инфекциями. Использование ингаляционной антимикробной терапии стало важной частью лечения инфекции дыхательных путей, вызываемой Pseudomonas aeruginosa при муковисцидозе, и профилактики инвазивной грибковой инфекции у пациентов, перенесших трансплантацию сердца и легких.Цитокиновая ингаляционная терапия также изучалась при лечении неопластических и инфекционных заболеваний. Выбор легочных систем доставки лекарств остается критическим, поскольку воздушно-струйный и ультразвуковой небулайзер могут обеспечить субоптимальную концентрацию лекарственного средства при неправильном использовании. В будущем развитии этой области мы рекомендуем сделать акцент на изучении использования аэрозольного гипертонического солевого раствора для снижения патогенной нагрузки в дыхательных путях субъектов, инфицированных микробами с низкой вирулентностью, стимуляции врожденной резистентности для предотвращения пневмонии у субъектов с ослабленным иммунитетом с использованием цитокинов. или синтетические аналоги молекулярной структуры, ассоциированные с патогенами, и больше возможностей для использования ингаляционных противомикробных препаратов.Эти терапевтические средства все еще находятся в зачаточном состоянии, но имеют большие перспективы.
Ключевые слова: амикацин, противогрибковый, противовирусный, аспергиллез, рак, колистин, цитокин, ингаляционный тобрамицин, врожденный иммунитет, пневмония, псевдомонады, трансплантация, ванкомицин, вентилятор-ассоциированная пневмония, зигомикоз
62 1. Среди обоих: оба. и людей с ослабленным иммунитетом пневмония остается ведущей причиной преждевременной смерти в мире [1–3]. Восприимчивость легких к инфекции возникает из-за архитектурных требований газообмена и частого вдыхания инфекционных агентов.Для обеспечения вентиляции люди постоянно подвергают воздействию внешней среды 100 м 2 площади поверхности легких. Поскольку каждую минуту вентилируется 5-10 л окружающего воздуха, частицы, капли и болезнетворные микроорганизмы также уносятся. Кроме того, в то время как даже здоровые нормальные добровольцы демонстрируют ночную микроабсорбцию орогастрального содержимого, пациенты с неврологическими, анатомическими или ятрогенными препятствиями для защиты дыхательных путей (например, эндотрахеальные или назогастральные трубки) особенно восприимчивы к аспирации инфицированного материала в обширную поверхность раздела нижних отделов. дыхательные пути.
В отличие от кожных поверхностей, обернутых непроницаемой кожей, желудка с его кислым просветом или нижних отделов желудочно-кишечного тракта с толстым слоем прилипшей слизи, обширный интерфейс легких с окружающей средой защищен только минимальной защитой барьера. Легочный барьер ограничен необходимостью беспрепятственной газовой диффузии, поэтому эта нежная ткань тонка капилляров. Тем не менее, несмотря на эту структурную уязвимость, легкие успешно защищаются от большинства инфекционных проблем с помощью различных механизмов [4–9].Большинство вдыхаемых или аспирированных патогенов не достигают периферических дыхательных путей из-за захвата в подвижном слое слизистого геля, выстилающего проксимальные проводящие дыхательные пути, с последующим изгнанием через мукоцилиарную эскалаторную систему [4]. Постоянное присутствие антимикробных пептидов и антител в жидкости, выстилающей дыхательные пути, ограничивает рост патогенов, которые успешно проникают в небольшие дыхательные пути. Альвеолярные макрофаги поглощают организмы, которые достигают самых отдаленных воздушных пространств [6,7]. Когда базовые защитные механизмы превышены, эпителий легких реагирует увеличением своих прямых противомикробных свойств (см. Раздел 3) и сигнализирует о привлечении лейкоцитов из кровообращения.
Хотя доступность и большая поверхность легких способствуют их восприимчивости к инфекции, эти особенности также предоставляют уникальную возможность для местной терапии в виде респираторных аэрозолей, как показано ниже. Во-первых, недавно были разработаны стратегии увеличения мукоцилиарного клиренса с использованием аэрозолей гипертонического солевого раствора, которые могут снизить нагрузку патогенов в легких. Во-вторых, недавний прогресс в понимании врожденного иммунитета показал, что резистентность респираторного эпителия к патогенам может быть значительно стимулирована, и применение методов лечения, основанных на этом понимании, может снизить восприимчивость к инфекции у уязвимых групп пациентов.В-третьих, перенаправление отклоненного адаптивного иммунитета на повышение устойчивости к специфическим патогенам за счет аэрозольной доставки цитокинов было подтверждено небольшими исследованиями на людях. В-четвертых, антибиотики могут доставляться респираторным путем, максимизируя концентрацию лекарств в области инфекции, где необходимо уничтожение микробов, и сводя к минимуму системные концентрации лекарств, которые могут приводить к нежелательным побочным эффектам. Теоретическая основа и практический статус каждого из этих методов ингаляционной терапии рассматриваются в следующих разделах.
2. Аэрозольный гипертонический солевой раствор для увеличения мукоцилиарного клиренса легких
Основным стимулом к увеличению выведения слизи из легких стало лечение муковисцидоза (МВ). Традиционно постуральный дренаж, перкуссия и другие физические методы сочетаются с очищением от кашля для мобилизации слизи и мусора из дыхательных путей. Совсем недавно для увеличения мукоцилиарного клиренса были введены эффективные аэрозольные методы лечения. Первичный дефект при МВ — отсутствие апикального эпителиального хлоридного канала, что приводит к уменьшению объема жидкости на поверхности дыхательных путей [10,11].Это предотвращает эффективное движение ресничек и вызывает обезвоживание слизи, что в совокупности ухудшает мукоцилиарный клиренс и повреждает дыхательные пути. Кроме того, эти изменения приводят к заселению обычно стерильных дыхательных путей бактериями и грибками, вызывая дальнейшее воспаление и повреждение дыхательных путей. По мере углубления понимания этих основных механизмов были введены методы лечения для увеличения объема жидкости на поверхности дыхательных путей (). К ним относятся нуклеотиды, амилорид и гипертонический солевой раствор (HSS), но среди них самые убедительные доказательства поддерживают аэрозольный HSS.
Эпителий дыхательных путей с жидкостью на поверхности
Проводящие дыхательные пути выстланы примерно равным количеством мерцательных и секреторных эпителиальных клеток. Секреторные клетки содержат гранулы, которые включают пептиды и муцины (зеленые), хотя внутриклеточные муцины могут быть обнаружены только в небольших дистальных отделах дыхательных путей с помощью чувствительных иммуногистохимических методов или во время воспалительной метаплазии, когда их продукция увеличивается [15,19]. Жидкость на поверхности дыхательных путей состоит из перицилиарного слоя глубиной 7 мкм (синий) и покрывающего его слоя слизистого геля (зеленый), толщина которого варьируется от <1 мкм в дистальных дыхательных путях до> 50 мкм в проксимальных дыхательных путях человека.Реснички бьют направленно, чтобы продвинуть слой слизистого геля к головке гортани. Гликопротеины муцина MUC5AC и MUC5B являются основными компонентами слоя слизистого геля и высвобождаются экзоцитарно как из подлежащего поверхностного эпителия (показано), так и из подслизистых желез (не показано). Хотя слой слизистого геля важен для очистки от вдыхаемых патогенов (красный), чрезмерное производство муцина или истощение жидкости на поверхности дыхательных путей может привести к закупорке слизью просвета дыхательных путей, обеспечивая убежище для микробной инфекции.
Ранние исследования 1990-х годов показали, что увеличение концентрации аэрозольных растворов хлорида натрия (физиологического раствора) приводит к увеличению скорости мукоцилиарного клиренса [12–14]. На основании этих результатов, аэрозоли HSS были протестированы при краткосрочном лечении пациентов с CF и показали, что они улучшают функцию легких [12,15]. В 2006 году два крупных исследования с использованием 4 мл 7% физиологического раствора в форме аэрозоля два раза в день продемонстрировали улучшение функции легких и снижение частоты обострений [16,17], и теперь это лечение стало основой лечения МВ.
Есть несколько причин полагать, что лечение аэрозолями HSS принесет пользу не только больным МВ, но и пациентам. Во-первых, скорость мукоцилиарного клиренса увеличивается за счет увеличения гидратации даже у тех, у кого не наблюдается истощения жидкости на поверхности дыхательных путей. Это наблюдалось у пациентов с гиперальдостероном, у которых врожденно снижено всасывание натрия, и у здоровых людей при использовании аэрозолей HSS [18]. Во-вторых, закупорка мелких дыхательных путей слизью из просвета возникает при заболеваниях легких, помимо МВ, таких как астма, хроническая обструктивная болезнь легких (ХОБЛ) и инфекции дыхательных путей, вызванные вирусными, грибковыми и микобактериальными патогенами [19,20].В-третьих, истощение жидкости на поверхности дыхательных путей происходит при некоторых нарушениях воспаления и инфекции дыхательных путей в результате протеолитической активации апикального эпителиального натриевого канала (ENaC) [21]. Исходя из этого, мы начали использовать аэрозольные 7% HSS у пациентов с закупоркой слизи в дыхательных путях и / или стойкой инфекцией дыхательных путей следующим образом. Для вызванной вирусом гиперсекреции слизи с кашлем у пациентов с астмой, ХОБЛ или посттрансплантационным констриктивным бронхиолитом мы используем HSS вместе с обычным режимом лечения обострения пациента, чтобы облегчить кашель и обеспечить доставку ингаляционных лекарств в дыхательные пути, которые в противном случае были бы забит слизью.У пациентов с аллергическим бронхолегочным аспергиллезом (ABPA) мы используем HSS вместе с некоторыми комбинациями ингаляционных стероидов, системных стероидов, системной противогрибковой и системной анти-IgE-терапией. При атипичной микобактериальной инфекции мы используем HSS либо в качестве монотерапии, либо вместе с ингаляционными и / или пероральными антибиотиками. У пациентов с эндобронхиальным стентом мы используем HSS для предотвращения скопления слизи дистальнее стента, что может привести к ателектазу или пневмонии. Иногда мы лечили пациентов с HSS, у которых были рентгенологические помутнения периферического легочного дерева в почке, для которых нам не удалось идентифицировать патоген.У нас есть неофициальные данные о симптоматических и рентгенологических улучшениях в поддержку всех этих применений, но нам неизвестны данные контролируемых испытаний. Когда используется несколько видов аэрозольной терапии, например, HSS вместе с ингаляционными стероидами, мы сначала применяем HSS, хотя объективных доказательств, подтверждающих эту практику, нет. Были бы полезны исследования, предназначенные для измерения применимости и оптимальных методов аэрозольного HSS при других заболеваниях, кроме МВ.
3. Аэрозольная стимуляция врожденного иммунитета легких
Хотя дыхательные пути и альвеолярный эпителий часто рассматриваются как пассивные барьеры, они дополняют базовую защиту легких, претерпевая значительные местные структурные и функциональные изменения при обнаружении патогенных раздражителей.Например, в ответ на вирусное, грибковое или аллергическое воспаление эпителиальные клетки дыхательных путей быстро приобретают гиперсекреторный фенотип в результате процесса, называемого слизистой метаплазией [22,23]. Предполагается, что адаптивная ценность структурной и молекулярной пластичности респираторного эпителия заключается в усилении защиты от микробных патогенов, и это подтверждается наблюдением улучшенного бактериального клиренса после индукции антимикробных белков, включая дефенсины, кателицидины, лизоцим и генераторы реактивных микроорганизмов. формы кислорода [24–28].В присутствии патогенов дыхательные пути и альвеолярный эпителий также вырабатывают воспалительные цитокины и вовлекают лейкоциты в защиту легких [29]. Подавление адаптивного иммунитета и гематопоэза, которое происходит при гематологических злокачественных новообразованиях и / или цитотоксической химиотерапии, не устраняет врожденный иммунный ответ легких на инфекцию. Скорее, пациенты с глубокой иммуносупрессией вырабатывают замечательные цитокиновые и хемокиновые ответы на легочные инфекции [30].
При врожденном иммунитете лейкоциты и паренхимные клетки идентифицируют присутствие патогенов посредством распознавания патоген-ассоциированных молекулярных паттернов (PAMPs), общих для многих видов патогенов, рецепторами распознавания паттернов, кодируемых зародышевой линией (PRR) [31–35].Распознавание PAMP посредством PRR активирует внутриклеточные сигнальные каскады, приводя к экспрессии продуктов, участвующих в микробной защите, воспалении и модуляции адаптивного иммунитета [36]. До сих пор попытки вызвать врожденный иммунитет легких были направлены на стимуляцию PRR с использованием природных или синтетических лигандов [37]. Наиболее распространенными мишенями были Toll-подобные рецепторы (TLR), хотя NOD-подобные рецепторы использовались в качестве адъювантов вакцины в течение многих лет [37], а другие молекулы, такие как RIG-подобные рецепторы и дектин, считались потенциальными терапевтическими мишенями. [37–42].
Чтобы проверить, можно ли эффективно использовать функциональную пластичность легких для защиты от пневмонии in vivo , наша лаборатория сильно стимулировала врожденный иммунитет перед заражением вдыхаемыми респираторными патогенами. Чтобы достичь этого, мышей подвергали воздействию лизата в виде аэрозоля, изготовленного из нетипируемого Haemophilus influenzae , одновременно стимулируя несколько антимикробных путей [42]. Однократное распыление привело к приобретению высокого уровня устойчивости к заражению вирулентными неконфекционными патогенами в течение 2 часов после лечения ().Мы назвали этот феномен стимулированным врожденным сопротивлением (StIR), чтобы отразить несколько аспектов защиты. Он считается «стимулированным», поскольку резистентность значительно возрастает после терапевтического применения лизата. Защита отражает действие «врожденных» защит, что демонстрируется несколькими ключевыми характеристиками: i) защита достигается за часы, а не дни или недели, как требуется для адаптивного иммунитета; ii) защита достигается у наивных мышей после лечения, полученного от микроба, не являющегося родственным тому, который использовался в контрольном заражении; iii) эффект сохраняется, несмотря на химическое или генетическое истощение адаптивных лейкоцитов; и iv) защита распространяется на каждый микробный патоген, против которого он был протестирован, что указывает на широкий, неизбирательный ответ.Защита связана с «сопротивлением» следующим образом. Столкнувшись с микробной проблемой, выживание зависит от двух стратегий хозяина: толерантности (способность ограничивать ущерб, причиняемый патогеном) и устойчивости (способности ограничивать бремя патогенов) [43,44]. Мы обнаружили, что обработка лизатом ограничивает количество патогенов, связанных с различными классами организмов. Следовательно, мы определили устойчивость как основное средство защиты лизата.
Выживаемость после заражения Streptococcus pneumoniae (Spn) после лечения аэрозольным лизатом нетипируемого Haemophilus influenze (NTHi)
Мышей предварительно обрабатывали в группах по шесть человек аэрозольным лизатом NTHi для стимуляции врожденного иммунитета, затем заражали как одну группу с высокой дозой Spn (6.1 × 10 10 КОЕ / мл). Выживаемость через 7 дней показана как функция интервала между лечением и контрольным заражением (* p = 0,015, ‡ p = 0,002, лечение по сравнению с необработанным) [50].
Сначала мы протестировали защитное действие StIR против наиболее распространенной причины бактериальной пневмонии во всем мире, Streptococcus pneumoniae , и обнаружили, что, хотя все нелеченные мыши умерли после ингаляционного заражения, все мыши, обработанные лизатом, выжили. Механистические исследования показали, что защита тесно коррелировала с индукцией антимикробной среды в легких, что продемонстрировано быстрым снижением количества патогенов по сравнению с нелеченными мышами [42].Защитный эффект сохранялся, даже если у мышей не было резидентных лейкоцитов в легких (альвеолярных макрофагов и тучных клеток) или у мышей не было рекрутированных нейтрофилов. Последующие исследования также показали, что лимфоциты не нужны при StIR, а исследований in vitro и показали, что респираторный эпителий был достаточен как для определения лечения, так и для воздействия на противомикробный ответ [45].
Стимулированная врожденная резистентность широко распространяется на другие важные бактериальные респираторные патогены.Среди распространенных причин внутрибольничной пневмонии ингаляционное лечение бактериальным лизатом сильно защищает от Pseudomonas aeruginosa , Klebsiella pneumoniae и лейкоцидин-продуцирующих лейкоцидин Panton-Valentine устойчивых к метициллину Staphylococcus aureus [45]. Дыхательный путь — наиболее вероятный портал входа для агентов биотеррора и единственный способ, с помощью которого такие патогены были успешно доставлены в современную эпоху (например, ингаляционная сибирская язва) [46–49].Мы исследовали, может ли StIR защищать от агентов биотеррора, и обнаружили, что однократная обработка лизатом в виде аэрозоля значительно увеличивает среднюю выживаемость мышей, зараженных Bacillus anthracis , Yersinia pestis или Francisella tularensis [45]. Для всех исследованных бактериальных патогенов защита от летального исхода была связана со значительным и немедленным сокращением количества патогенов.
Учитывая широту защиты от разнородных видов бактерий и предположение о еще более широком антимикробном действии путем анализа экспрессии гена легких после лечения, также была протестирована защита мышей от грибкового патогена.Поскольку ни мыши, ни люди обычно не восприимчивы к пневмонии Aspergillus в отсутствие иммунодефицита, мышей лечили циклофосфамидом и кортизолом перед контрольным заражением A. fumigatus . Из инфицированных мышей> 70% умерли, если они не прошли предварительную обработку лизатом. Практически все, кто проходил лечение, выжили (93%). Как и в случае с бактериальными патогенами, StIR привел к значительному снижению внутрилегочной грибковой нагрузки [45].
Вирус гриппа является основной причиной смертности от легочных инфекций во всем мире, и эффективный легочный StIR может обеспечить защиту во время пандемий.Мы обнаружили, что в то время как 100% контрольных мышей умерли от геморрагической пневмонии,> 90% выжили после одной предварительной обработки бактериальным лизатом [50]. Мы также обнаружили значительное улучшение показателей выживаемости, если лизат в форме аэрозоля вводили через 1 день после заражения, что указывает на то, что стимуляция врожденного иммунитета может быть полезной для лечения, а также для профилактики пневмонии. Кроме того, мы обнаружили, что добавление рибавирина к лечению лизатом привело к синергетическому улучшению выживаемости (т. Е., лучше, чем аддитивный эффект одного из видов лечения) при введении после инфекции [50]. Как и в случае со всеми другими исследованными патогенами, защита от гриппа, вызванная лизатом, коррелировала со снижением титров вируса в легких.
В то время как лечение нетипируемым лизатом Haemophilus influenza (NTHi) приводит к быстрой активации врожденного иммунитета слизистой оболочки легких, защитный эффект ослабевает через 4-5 дней [50,51]. Следовательно, для предотвращения пневмонии у групп пациентов, подвергавшихся риску по истечении этого периода, вероятно, потребуется повторное лечение.Мы обнаружили, что повторяющееся дозирование является эффективным и безопасным для мышей. При повторной обработке лизатом мыши показали стойкую устойчивость к заражению S. pneumoniae , P. aeruginosa и вирусом гриппа A [45,50]. Мыши, подвергавшиеся обработке лизатом еженедельно в течение 50 недель, не показали явных патологий, таких как преждевременная смерть, потеря веса или изменения поведения [36]. После 8 еженедельных воздействий инфильтрация мононуклеарных клеток окружала дыхательные пути, хотя наблюдалось очень мало альвеолярных воспалительных клеток.После 25 еженедельных воздействий был очевиден легкий фиброз стенки дыхательных путей, который далее прогрессировал после 50 еженедельных воздействий [52]. Увеличенная временная шкала фиброза стенки дыхательных путей и прогрессирующего накопления лимфоцитов предполагает, что фиброз возникает из-за адаптивного иммунного ответа после хронического воздействия бактериального лизата, а не в ответ на саму стимуляцию врожденного иммунитета. Замена макромолекулярных стимуляторов врожденного иммунитета низкомолекулярными аналогами, которые не вызывают адаптивного иммунного ответа, и снижение интенсивности стимуляции, таким образом, позволяет избежать этого долгосрочного осложнения.Действительно, толстая кишка мышей постоянно стимулируется присутствием просветных бактерий, что приводит к конститутивной активации StIR, что может быть обнаружено как индуцибельно сниженная способность убивать бактерии эпителием толстой кишки после лечения антибиотиками [53], но толстая кишка этого не делает. развивается фиброз.
Данные на мышах показывают, что лечение, индуцирующее врожденную резистентность в легких, должно хорошо переноситься пациентами-людьми. Мы считаем, что причина того, что мыши могут переносить самые высокие применяемые дозы (в 12 раз превышающие терапевтическую дозу) без явных побочных эффектов [51], заключается в том, что ответная реакция содержится в просвете легких.Несмотря на то, что количество воспалительных цитокинов в жидкости бронхоальвеолярного лаважа увеличивается в несколько тысяч раз по сравнению с исходным уровнем, уровень системных цитокинов почти не увеличивается [50]. Это согласуется с недавней работой Hoogerwerf и его коллег, которые вызвали значительные воспалительные реакции легких в дыхательных путях у людей, подвергшихся внутрилегочному применению липотехоиновой кислоты (лиганд TLR2) и липополисахарида (LPS, лиганд TLR4) TLR, но не были связаны с любые идентифицируемые клинические признаки или симптомы [54].
Не только наша лаборатория исследует стимуляцию TLR, которая может способствовать увеличению выживаемости хозяина при инфекциях. Несколько групп наблюдали иммуномодулирующие эффекты ЛПС и пытались изменить течение респираторных инфекций, доставляя производные ЛПС [40,41,55] или изменяя структуру ЛПС [39] у патогенов, используемых при экспериментальной пневмонии. У всех была обнаружена некоторая степень защиты за счет применения одного агониста TLR4, как и у нас [51]. Испытания отдельных агонистов TLR также были успешными при инфекционных заболеваниях человека.Например, подкожное введение синтетического агониста TLR9 вызвало системные воспалительные реакции и снизило вирусную нагрузку гепатита C [42], а местный имиквимод (TLR7) оказался многообещающим при лечении кожного лейшманиоза [38]. Однако вполне вероятно, что для достижения полной эффективности и широты действия, продемонстрированных с бактериальным лизатом, потребуются синергетические взаимодействия множественной стимуляции PRR [56-59].
Лизат, используемый для индукции StIR, не обладает антибиотическим действием [45].Скорее, он вызывает собственные защитные продукты хозяина. Индукция выработки антимикробного пептида согласуется как со временем, так и с широтой защиты и демонстрируется с помощью микроматрицы экспрессии генов [45] и протеомного анализа [51]. В будущем, возможно, удастся обойти стадию индукции хозяина и напрямую доставить полезные антимикробные пептиды или миметики малых молекул [43].
В ближайшем будущем стимуляция естественной реакции хозяина на микробные продукты для профилактики и лечения пневмонии может стать основой для разработки новой клинической терапевтической стратегии [44,45].
4. Аэрозольная доставка цитокинов для направленного иммунного отклонения
IFNα-2a, IFNγ-1b и GM-CSF вводились легочным путем пациентам с резистентной легочной инфекцией Mycobacterium tuberculosis и нетуберкулезным микобактериозом (NTM) включая Mycobacterium avium комплексное заболевание легких с переменным успехом. Эти иммунологически разнообразные белки также использовались для лечения неинфекционных заболеваний легких, таких как первичный рак легких, метастатический рак в легкие и альвеолярный протеиноз, заболевание, недавно связанное с антителами против нативного GM-CSF [60–62].Ниже приводится краткое описание клинического опыта использования терапии ингаляционными цитокинами при легочной инфекции.
Ингаляционный IFNα переносится в более низких дозах (1-20 MIU) без системных побочных эффектов, тогда как лихорадка, недомогание и головная боль возникали при использовании доз в диапазоне от 60 до 120 MIU и совпадали с обнаруживаемым цитокином в периферическом кровообращении [63, 64]. Бронхоспазм препятствует использованию этого цитокина у пациентов с хроническим бронхитом [65].Спасательная терапия с использованием ингаляционного IFNα для лечения неоперабельного рака легких не обнадеживает [66]. Добавление IFNα 3 MIU 3 раза в неделю к противотуберкулезной терапии было связано с ранним исчезновением лихорадки и быстрым снижением количества кислотоустойчивых бацилл в отхаркиваемой мокроте по сравнению с одной антимикробной терапией [67]. Кроме того, у пациентов с резистентной к лечению туберкулезной инфекцией добавление ингаляционного IFNα показало обнадеживающие результаты, хотя необходимы дальнейшие крупные рандомизированные исследования для подтверждения безопасности, стоимости и эффективности [68].
Низкие дозы ингаляционного IFNγ хорошо переносятся, в том числе пациентами с бронхореактивными состояниями, такими как астма, и после воздействия этого плейотропного провоспалительного цитокина была продемонстрирована измеримая активация альвеолярных макрофагов [69,70]. Имеется значительный клинический опыт использования ингаляционного IFNγ для лечения легочных микобактериальных инфекций. В сочетании с антимикробной терапией терапия IFNγ в виде аэрозоля привела к благоприятным ответам как на лекарственно-чувствительный, так и на лекарственно-устойчивый туберкулез легких, с уничтожением микроорганизмов и улучшением радиографических показателей заболевания [71–73].Однако этого преимущества не наблюдалось у пациентов с тяжелым основным заболеванием легких, у которых был туберкулез легких [74]. Точно так же не было отмечено терапевтического эффекта у пациентов с МВ, получавших высокие дозы (500 или 1000 мкг) ингаляционного IFNγ для снижения риска инфекции, тем не менее, пациенты страдали от серьезной лекарственной токсичности, включая одышку, кровохарканье и госпитализацию [75]. IFNγ также был исследован для предотвращения вентилятор-ассоциированной пневмонии (ВАП) у пациентов с тяжелыми травмами [76].Количество ВАП было уменьшено, хотя не наблюдалось улучшения общей смертности у этих пациентов с травмой, которые получали 100 мкг рекомбинантного IFNγ в аэрозольной форме 3 раза в день [76]. Эта неэффективность частично может быть связана с низкой доставкой цитокинов через стандартный распылитель [77]. Рекомбинантный GM-CSF в аэрозольной форме хорошо переносится пациентами с легочными метастазами в дозах 250 мкг дважды в день без серьезных побочных эффектов [78]. О применении аэрозольных GM-CSF для лечения инфекций у людей не сообщалось.Однако эксперименты на животных подтверждают абсорбцию в легких аэрозольного или интратрахеально введенного GM-CSF, и GM-CSF в аэрозольной форме оказался эффективным в искоренении инвазивного легочного аспергиллеза у мышей в модели с ослабленным иммунитетом [79,80].
Другие цитокины, используемые аэрозольным путем, включают IFNβ при лечении рака легких, IL-2 при почечно-клеточной карциноме и другом метастатическом раке легких, растворимый рецептор IL-4 для пациентов с астмой и эритропоэтин для лечения анемии.Ни один из них не использовался для лечения легочной инфекции.
5. Доставка синтетических антибиотиков в аэрозольной форме
В первом подразделе мы обсудим использование аминогликозидов в лечении и профилактике серьезных легочных инфекций у пациентов из группы высокого риска, а затем кратко ознакомимся с ограниченным клиническим опытом применения других противомикробных препаратов. препараты, которые использовались для спасительной терапии трудноизлечимой пневмонии. Учитывая, что были проведены обширные обзоры ингаляционного пентамидина при ВИЧ-ассоциированной инфекции Pneumocystis jiroveci , эта тема здесь не рассматривается.
5.1 Аэрозольная терапия аминогликозидами
Теоретически аминогликозиды имеют несколько характеристик, которые, по-видимому, способствуют ингаляционному введению. Во-первых, аминогликозиды обладают эффектом уничтожения, зависящим от концентрации, что означает, что высокие уровни, достижимые в дыхательных путях с помощью ингаляционных препаратов, могут привести к повышению клинической эффективности. Более того, аминогликозиды обладают значительной ограничивающей дозу токсичностью для людей, так что дозы, которые можно вводить при системном введении, приводят к относительно низким уровням в паренхиме легких.Наконец, поскольку аминогликозиды использовались относительно редко в течение последних нескольких десятилетий, многие организмы с множественной лекарственной устойчивостью, вызывающие нозокомиальную респираторную инфекцию, остаются восприимчивыми по крайней мере к одному, если не ко многим, обычно используемым аминогликозидам. Действительно, из всех классов антибиотиков данные о доставке противомикробных препаратов путем ингаляции наиболее обширны для аминогликозидов. В этом разделе мы рассмотрим фармакокинетическую, клиническую информацию и информацию о безопасности, касающуюся ингаляционной терапии аминогликозидами.
Разработка аминогликозидов широкого спектра действия, таких как гентамицин, в конце 1960-х — начале 1970-х годов открыла большие перспективы для лечения ранее резистентных респираторных инфекций из-за устойчивых к антимикробным препаратам грамотрицательных палочек, таких как P. aeuroginosa [81]. . Однако вскоре исследователи сообщили, что системное введение гентамицина часто не помогало лечить легочные инфекции из-за P. aeuroginosa и других грамотрицательных палочек, несмотря на чувствительность in vitro к [82].Низкие уровни гентамицина в респираторных секретах заставили исследователей предположить, что беспорядочное проникновение аминогликозидов в очаг инфекции может быть причиной терапевтических неудач, и предположить, что введение гентамицина непосредственно в легкие может улучшить клинический ответ [83,84]. Предварительные исследования 1970-х годов показали, что концентрация гентамицина в мокроте часто была на порядок выше после эндотрахеального введения по сравнению с системным лечением [83,85].
Данные, накопленные в последующие 30 лет, подтвердили предположение этих ранних сообщений о том, что проникновение аминогликозидов в легочную паренхиму является субоптимальным после системного введения [86–93]. Фармакокинетика доставки аминогликозидного лекарственного средства имеет особое значение, поскольку эти агенты обладают зависящим от концентрации эффектом уничтожения, а это означает, что более высокие уровни лекарственного средства связаны с усилением антимикробного действия [94]. Например, оптимальный клинический ответ на терапию аминогликозидами происходит, когда максимальная концентрация лекарственного средства (C max ) до минимальной ингибирующей концентрации (МИК) составляет> 8: 1 [95–98].Терапия аминогликозидами при пневмонии обычно рассматривается для относительно устойчивых неферментативных грамотрицательных палочек, таких как P. aeruginosa , Acinetobacter baumanii и Stenotrophomonas maltophila [99]. Несмотря на то, что они сильно варьируются в зависимости от популяции пациентов и рассматриваемых аминогликозидов, даже для восприимчивых организмов, МПК для этих организмов обычно находятся в диапазоне 1-8 мкг / мл [100]. Таким образом, чтобы максимизировать возможность клинического ответа, необходимы концентрации легочных аминогликозидов ≥ 10-40 мкг / мл.Важно отметить, что ни один из доступных в настоящее время аминогликозидов не достигает таких уровней при системном введении даже в условиях воспалительного процесса, который, как ожидается, приведет к увеличению попадания в легкие из кровотока [85,86,91,92,101] .
В отличие от трудностей достижения удовлетворительных уровней в легких с помощью системного введения аминогликозидов, местная доставка аминогликозидов приводит к концентрациям, которые могут быть эффективными даже против относительно резистентных организмов [85,86,93,102-104].Измерения уровней аминогликозидов в легких после местного введения сильно зависят от механизма, используемого для доставки лекарственного средства, дозы и места отбора пробы. Однако, несмотря на эти различия, исследователи неизменно демонстрируют уровни аминогликозидов> 200 мкг / мл в респираторных образцах после местного применения [85–87,89,101–107]. Данные, касающиеся концентраций аминогликозидов, аналогичны в исследованиях на животных и людях, у больных и здоровых пациентов, а также при использовании инвазивных и неинвазивных методов тестирования [85–87,89,101–107].Таким образом, фармакокинетические данные убедительно свидетельствуют о том, что местное введение аминогликозидов с большей вероятностью приведет к эффективным уровням лекарственного средства по сравнению с системной доставкой.
5.2 Клинические исследования ингаляционных аминогликозидов: муковисцидоз
Контроль над бронхолегочной инфекцией заметно повысил качество и продолжительность жизни пациентов с МВ [108]. Уникальная эндобронхиальная среда пациентов с МВ означает, что легкие таких пациентов колонизируются такими организмами, как S.aureus и H. influenza вскоре после рождения. Однако со временем P. aeuroginosa обычно становится преобладающим легочным патогеном у пациентов с МВ, колонизируя> 80% людей к 18 годам [109]. Взаимодействие «хозяин-патоген» между пациентами с МВ и P. aeuroginosa относительно уникально с точки зрения бактериальных процессов, так как однажды установленная эндобронхиальная инфекция, вызванная P. aeuroginosa , редко полностью искореняется [110]. Большая часть терапевтических достижений, достигнутых за последние десятилетия в лечении пациентов с МВ, была достигнута за счет снижения бремени P.aeuroginosa в легких пациентов с МВ, что впоследствии уменьшает воспалительный ответ, ответственный за прогрессирование бронхоэктазов.
В то время как внутривенные антибиотики долгое время были золотым стандартом для лечения инфекции P. aeuroginosa у пациентов с МВ, за последние 20 лет серия все более тщательных клинических исследований четко установила роль ингаляционных аминогликозидов в подавлении P. y инфекция aeuroginosa у пациентов с МВ.Первоначально использовался гентамицин, но исследователи перешли к тобрамицину в свете его повышенной активности против Pseudomonas [111–113]. Для удобства в ранних исследованиях использовались небулайзерные флаконы с аминогликозидами, изначально предназначенные для внутривенного введения, которые потенциально могли вызвать раздражение легких из-за присутствия консервантов и антиоксидантов. Важный прогресс произошел, когда Smith et al . разработали препарат тобрамицина без консервантов для распыления, который в дозе 600 мг обеспечивает гораздо более высокую дозу, чем типичный флакон для внутривенного введения на 80 мг [114].Это была доза тобрамицина 600 мг, которая использовалась в критическом исследовании перекрестного дизайна для 71 человека, в котором пациенты получали t.i.d. дозирование. После 1 месяца приема распыленного тобрамицина ключевые параметры функции легких и плотность мокроты P. aeuroginosa значительно улучшились в группе лечения [107]. Эффективный, но громоздкий характер лечения привел к разработке следующего поколения распыленного тобрамицина, который впоследствии был использован в крупнейшем рандомизированном плацебо-контролируемом исследовании распыленных аминогликозидов.В общей сложности 520 пациентов с CF, которые были колонизированы P. aeuroginosa , были рандомизированы для получения распыленного тобрамицина 300 мг два раза в день. или плацебо, вводимое в 4-недельных блоках включения-выключения в течение 24 недель [115]. Пациенты, получавшие активное лечение, показали улучшение показателей легочной функции, меньшую потребность в госпитализации и значительное снижение плотности P. aeuroginosa в мокроте. Важно отметить, что положительный эффект ингаляционного тобрамицина сохранялся в течение 2 лет после начала лечения [116].Результаты этого исследования привели к одобрению FDA США раствора тобрамицина для ингаляции (TSI) (TOBI ™ , Novartis Corp., Восточный Ганновер, Нью-Джерси), который до сих пор является единственным одобренным антибиотическим препаратом для ингаляции дыхательных путей в США. .
Эффективность TOBI в хроническом подавлении P. aeuroginosa у пациентов с МВ привела к исследованиям ингаляционных аминогликозидов при обострениях МВ, но результаты не были столь впечатляющими. Несколько исследований показали, что добавление ингаляционных аминогликозидов, таких как тобрамицин или амикацин, к системной антипсевдомональной терапии увеличивает долю пациентов, у которых излечивается P.aeuroginosa из мокроты, но не улучшает клинические исходы, такие как тесты функции легких [117,118]. Недавно завершенное международное исследование, проведенное в 17 центрах, не выявило статистической разницы в клинических исходах при добавлении ингаляционного тобрамицина к системно вводимому ципрофлоксацину у пациентов с МВ, инфицированных P. aeuroginosa, у пациентов с МВ с острым обострением [119]. Пациенты, получавшие ингаляционный тобрамицин, имели более низкую плотность мокроты P. aeuroginosa , но повышенную частоту хрипов при ингаляционной терапии, что могло свести на нет пользу от усиленного противомикробного эффекта.Таким образом, в настоящее время ингаляционная терапия не считается частью стандарта лечения пациентов с МВ с обострениями.
5.3 Лечение пациентов с бронхоэктазами без кистозного фиброза ингаляционными аминогликозидами
Хотя МВ является преобладающей причиной бронхоэктазов в развитых странах, существует несколько других заболеваний, которые могут привести к бронхоэктазу [120]. Обнадеживающие результаты лечения бронхоэктазов, связанных с МВ, увеличили давний интерес к лечению пациентов с бронхоэктазами, не связанными с МВ, с помощью ингаляционных аминогликозидов [121].К сожалению, как и в случае острых обострений при МВ, накопленные к настоящему времени данные об эффективности ингаляционных аминогликозидов при бронхоэктазах, не связанных с МВ, не так сильны, как данные для поддерживающей терапии при МВ. К настоящему времени четыре опубликованных клинических исследования изучали использование ингаляционных аминогликозидов у пациентов без МВ с бронхоэктазами и хронической инфекцией P. aeuroginosa , во всех из которых использовался ингаляционный тобрамицин в дозе 300 мг два раза в день. дозирование [119,122–124]. Подобно основным исследованиям МВ, эти испытания неизменно показывают, что ингаляционный тобрамицин значительно снижает респираторную нагрузку у P.aeuroginosa . Однако, в отличие от ситуации с бронхоэктазами, связанными с МВ, снижение уровня P. aeuroginosa у пациентов с бронхоэктазами, не связанными с МВ, не привело к последовательному улучшению объективных клинических показателей, таких как тесты функции легких. Одно исследование обнаружило улучшение «общего состояния здоровья» у пациентов, получавших тобрамицин [123]. Обнаружение того, что у пациентов, получавших тобрамицин, развился более выраженный бронхоспазм по сравнению с пациентами, получавшими плацебо, значительно ограничило применение аэрозольных антибиотиков при бронхоэктазах без МВ [121].Таким образом, широкое использование ингаляционных аминогликозидов у пациентов с бронхоэктазами без МВ требует разработки препарата, который вызывает меньшее раздражение дыхательных путей при сохранении антипсевдомональной эффективности.
5.4 Профилактика и лечение вентилятор-ассоциированной пневмонии с помощью ингаляционных аминогликозидов
Хотя ИВЛ имеет жизненно важное значение для ведения тяжелобольных пациентов, она часто осложняется развитием респираторных инфекций, которые вызывают значительную заболеваемость и смертность [125].Учитывая простоту доступа, обеспечиваемую интубацией трахеи, существует долгая история введения противомикробных препаратов непосредственно в дыхательные пути для лечения и профилактики респираторных инфекций, связанных с аппаратом искусственной вентиляции легких [83]. Наиболее систематически исследуемой областью в этом отношении было использование местных антибиотиков для предотвращения искусственной вентиляции легких (ВАП) [126]. Хотя самые крупные исследования были проведены с антибиотиками, не являющимися аминогликозидами, и тобрамицин, и гентамицин показали некоторую эффективность в предотвращении ВАП [127, 128].Недавний метаанализ показал, что местное применение антимикробных препаратов значительно снижает частоту ВАП у пациентов с искусственной вентиляцией легких [126]. Эти данные противоречат рекомендациям Центров по контролю и профилактике заболеваний против использования распыленных антибиотиков для предотвращения ВАП из-за опасений по поводу развития устойчивости к противомикробным препаратам и побочных эффектов введения [129].
По сравнению с профилактикой ВАП, существует меньше системных данных об использовании ингаляционных аминогликозидов для терапии ВАП [130].Однако, учитывая рост показателей ВАП из-за множественной лекарственной или даже панрезистентности грамотрицательных патогенов, использование ингаляционных аминогликозидов или других противомикробных препаратов может стать все более распространенным явлением в попытке повысить локальные концентрации лекарств для борьбы с относительно устойчивыми патогенами. Следует отметить, что недавнее ретроспективное исследование онкологических пациентов с грамотрицательной палочкой ВАП показало, что те пациенты, которые получали ингаляционные аминогликозиды, в основном тобрамицин или ингаляционный колистин, имели значительно лучшие клинические результаты по сравнению с пациентами, получавшими терапию системными аминогликозидами или колистином [131].Наконец, Палмер и др. . недавно сообщили о результатах исследования, в котором пациенты с вентилятор-ассоциированным трахеобронхитом (VAT) были рандомизированы для приема ингаляционных противомикробных препаратов, тобрамицина и / или ванкомцина или плацебо [132]. Пациенты, получавшие ингаляционные противомикробные препараты, имели заметное улучшение объективных респираторных показателей и имели значительно меньшую вероятность прогрессирования до ВАП по сравнению с пациентами, получавшими плацебо. В совокупности сочетание повышения лекарственной устойчивости и накопления данных об эффективности ингаляционной терапии указывает на то, что местная терапия аминогликозидами может играть многогранную роль в профилактике и лечении респираторной инфекции у пациентов с механической вентиляцией легких, хотя необходимы многоцентровые проспективные исследования.
5.5 Безопасность ингаляционных аминогликозидов
Двумя основными проблемами, вызывающими обеспокоенность в отношении местной терапии аминогликозидами, являются развитие лекарственной устойчивости и побочные эффекты лекарств или системы доставки лекарств. Учитывая, что местное применение приводит к градиенту концентрации противомикробного препарата от центральных к периферическим дыхательным путям, существует серьезное беспокойство по поводу индукции устойчивости к противомикробным препаратам [121]. Более того, местная терапия часто назначается в течение продолжительных периодов времени, даже лет, тем самым максимально увеличивая возможность развития лекарственной устойчивости.В то время как отчеты о случаях и серии случаев подтверждают, что резистентные организмы могут возникать во время терапии, тщательное обследование в ходе рандомизированных клинических испытаний не показало, что появление резистентных к лекарствам организмов у пролеченных пациентов является особенно важной проблемой [100, 110, 126]. В свете чрезвычайно высоких уровней аминогликозидов, достижимых с помощью небулайзерной терапии, некоторые страны предложили разработать специфические для ингаляции контрольные точки МИК, при которых очень немногие организмы действительно будут устойчивы к аминогликозидам [133].Приведет ли загрязнение окружающей среды при нозокомиальной небулайзерной терапии к повышению устойчивости к аминогликозидам в медицинских учреждениях, остается теоретическим, но не доказанным вопросом. Выявление бронхоспазма при местной терапии — еще одна важная проблема безопасности, особенно когда распыленные антибиотики используются для облегчения симптомов, например, при бронхоэктазах [121]. Хотя обычно они легко поддаются лечению бронходилататорами, раздражение дыхательных путей распыляемыми аминогликозидами ограничено для многих пациентов, и продолжение исследований по разработке более переносимых методов лечения имеет решающее значение для более широкого использования.
5.6 Другие виды антибактериальной терапии в виде аэрозолей
Клинический опыт аэрозолизации антибактериальных средств, отличных от аминогликозидов, ограничен, но продолжает расти. Заметное увеличение числа грамотрицательных патогенов с множественной лекарственной устойчивостью привело к увеличению использования полимиксинов, противомикробных препаратов, которые были разработаны в 1950-х годах, но их использование быстро сократилось в 1970-х и 1980-х годах из-за опасений по поводу нефротоксичности [134]. Использование колистина (полимиксина E) в последнее время заметно увеличилось в виде штаммов P.aeruginosa и A. bauamnnii , устойчивые ко всем другим классам коммерчески доступных антимикробных препаратов, остались чувствительными к колистину [134]. Подобно аминогликозидам, ингаляция является потенциально привлекательным способом введения колистина, учитывая токсичность, наблюдаемую при системном введении. Ретроспективные и нерандомизированные исследования показали обнадеживающие результаты при использовании ингаляционного колистина, хотя исследования осложняются неоднородностью пациентов и назначением дополнительных противомикробных препаратов в сочетании с ингаляционным колистином [130, 131, 134–138].До сих пор сообщалось о минимальной токсичности ингаляционного колистина, хотя систематические данные отсутствуют. Ингаляционный азтреонам представляется безопасной и эффективной альтернативой ингаляционному тобрамицину при муковисцидозе [139]. Наконец, недавнее исследование показало, что ингаляционный ванкомицин эффективен в предотвращении прогрессирования трахеобронхита, связанного с ИВЛ, до пневмонии, связанной с ИВЛ [132]. Неуклонный рост лекарственной устойчивости среди респираторных патогенов придает дополнительную актуальность продолжению исследований, направленных на более точное определение роли вдыхаемых противомикробных препаратов при легочных инфекциях.
5.7 Противогрибковая аэрозольная терапия
Несмотря на недавние достижения в области противогрибковой лекарственной терапии, инвазивные грибковые инфекции (ИФИ) остаются серьезной угрозой для больных раком с ослабленным иммунитетом и реципиентов трансплантации органов или кроветворения [140, 141]. Ответ на терапию системными цитокинами, повышающими иммунитет, такую как рекомбинантный GM-CSF, IFNγ и переливание донорских гранулоцитов, чреват отсутствием исследований по оценке стоимости и полезности и усугубляется неопределенными данными клинической эффективности [142].Инвазивный аспергиллез представляет собой опасную для жизни инфекцию, часто наблюдаемую в течение первых 3 лет после трансплантации сердце-легкие [143], тогда как у реципиентов аллогенной трансплантации стволовых клеток эта инфекция возникает в период нейтропении перед приживлением, во время острой трансплантации вместо трансплантата. болезнь хозяина (GVHD) и в период позднего риска, который включает лечение хронической GVHD [144]. У больных раком пациенты с острым миелогенным лейкозом особенно восприимчивы к ИФИ, а период риска может быть увеличен у пациентов с рефрактерным или рецидивирующим раком [145].Ингаляционный амфотерицин B был исследован для предотвращения ИФИ у восприимчивых пациентов в периоды высокого риска и для терапии спасения у пациентов с трудно поддающимся лечению инвазивным грибковым заболеванием легких.
У реципиентов трансплантата легкие инфекции Aspergillus разновидностей приводят к колонизации, которая часто предшествует инвазивному заболеванию, проявляющемуся как трахеобронхит или инфекции анастомоза, и / или инвазивное заболевание легких; диссеминация грибков у этих пациентов без нейтропении и без рака встречается редко.Большинство этих грибковых инфекций возникает у реципиентов трансплантатов солидных органов без нейтропении в период раннего отторжения трансплантата и иммуносупрессивной терапии отторжения [143]. Интересно отметить, что колонизация видами Aspergillus через 3 месяца после трансплантации чаще встречается у пациентов с человеческим лейкоцитарным антигеном (HLA) A1; однако у этих пациентов, склонных к поздней грибковой колонизации, риск инвазивного грибкового заболевания существенно не увеличивался [143]. Напротив, недавно сообщалось о нескольких грибковых инфекциях у реципиентов трансплантата сердца с рефрактерным отторжением, получавших сиролимус в сочетании с такролимусом, и пациентов с васкулопатией сердечного аллотрансплантата [146].
Ингаляционный амфотерицин B был первым лекарством, используемым для лечения системного микоза, и более ранние эксперименты на животных с использованием аэрозольного амфотерицина B показали благоприятную эффективность при лечении легочного аспергиллеза [147]. Липидные препараты амфотерицина B, такие как липидный комплекс амфотерицина B (ABLC), также эффективно доставлялись аэрозольным путем. Прединфекционная обработка ABLC в дозе 0,4–1,6 мг / кг за 2 дня до инфекции обеспечила увеличение выживаемости на 63–100% в экспериментах на животных [148].Пиковая концентрация амфотерицина B в бронхоальвеолярном лаваже после однократного приема достигается через 30 минут после ингаляции, и он медленно выводится из легких в течение следующих 24 часов [149].
Устройство доставки лекарственного средства остается критически важным для прогнозирования концентрации лекарственного средства, распыляемого в виде аэрозоля. В исследованиях клинической кинетики распределения 10% вдыхаемого ABLC откладывалось в легких при введении через специализированные системы доставки, такие как распылитель AeroEclipse, управляемый сжатым воздухом 7-8 л / мин, и это отложение в легких было в два раза выше по сравнению с достигнутыми уровнями. использование стандартных систем доставки аэрозолей для бронхолитической терапии [150].Состав также важен, поскольку в экспериментах на животных концентрация лекарственного средства в аэрозольной форме ABLC в шесть раз выше по сравнению с дезоксихолатом амфотерицина B [148]. Кроме того, ингаляционный ABLC хорошо переносился при исследовании реципиентов трансплантата легкого, тогда как обычный дезоксихолат амофотерицина B приводил к вдвое большему количеству побочных эффектов, связанных с лечением [151].
Сообщалось о значительном сокращении случаев инвазивного легочного аспергиллеза у пациентов, получавших ингаляционный амфотерицин B во время и после операции по трансплантации сердца и сердце – легкие [152].Аналогичным образом, препарат амфотерицина B (ABLC) на основе липидов также успешно использовался для профилактики трахеобронхита Aspergillus, анастомозов и инвазивных заболеваний легких у реципиентов сердца и легких [143, 153].
Скудность клинических данных по лечению амфотерицином B в аэрозольной форме у пациентов с установленной грибковой инфекцией легких затрудняет рекомендацию этого вмешательства даже в рефрактерных случаях. Вот два примера таких случаев: пациент без иммуносупрессии с поствирусным трахеобронхитом, вызванным Aspergillus, который не ответил на длительную липосомальную терапию амфотерицином B, имел благоприятный ответ на длительное лечение ингаляционным дезоксихолатом амфотерицина B плюс GM-CSF и IFNγ-иммунитет. усиление [154].Во-вторых, у пациента с тяжелой иммуносупрессией и инфекцией легкого Rhizomucor, которая в результате эволюции превратилась в Pseudalescheria boydii , инфекция полностью исчезла с помощью ингаляционного ABLC, которая продолжалась в течение 5 месяцев, и при долгосрочном наблюдении рецидива инфекции не наблюдалось [155]. Эти случаи подчеркивают потенциальную роль ингаляционного амфотерицина B в лечении установленного заболевания; однако на основании текущей клинической информации нельзя дать никаких рекомендаций.
5.8 Противовирусная аэрозольная терапия
Вирусные инфекции дыхательных путей обычно протекают в легкой форме и часто поддаются поддерживающей терапии. Однако у пациентов с ослабленным иммунитетом, больных раком или трансплантацией, эти инфекции могут быть связаны с тяжелыми осложнениями, требующими ранней диагностики и своевременной терапии [137]. Обеспокоенность вызывают парамиксовирусы, такие как респираторно-синцитиальный вирус (RSV) и вирус парагриппа (PIV), вирусы гриппа A и B, аденовирус и недавно признанный метапневмовирус человека (hMPV).Рибавирин, аналог пуринового нуклеозида, использовался для лечения хронической инфекции вируса гепатита С пероральным введением, а также для лечения геморрагической лихорадки и диссеминированного hMPV путем внутривенного введения. Рибавирин в аэрозольной форме был одобрен FDA для лечения инфекций RSV у госпитализированных детей. Обычное непрерывное лечение 60 мг рибавирина / мл в течение 18 часов эффективно с внутривенным иммуноглобулином или без него; однако пациенты чувствуют себя сильно изолированными, что может помешать уходу за ними [138].Периодически вводимый в виде аэрозоля рибавирин в дозе 20 мг / мл в течение 2 ч 3 раза в день также был эффективен у взрослых пациентов с раком и трансплантацией стволовых клеток с инфекцией RSV [140]. У детей с ослабленным иммунитетом и инфекцией RSV периодические высокие дозы (60 мг) рибавирина / мл в течение 2 часов, вводимые 3 раза в день, хорошо переносились, ассоциировались с клиническим ответом, сравнимым со стандартной непрерывной терапией, и ассоциировались со значительно меньшим загрязнением окружающей среды и воздействием на здоровье: медицинским работникам и с большей доступностью для пациентов [141, 142].
Парагрипп ассоциируется с потенциально серьезными осложнениями у реципиентов трансплантата сердце-легкие, с возможной ролью в остром отторжении аллотрансплантата и облитерирующем поствирусном бронхиолите [143]. Ингаляционный рибавирин в этой популяции ассоциировался с клиническим улучшением, хотя клинический опыт ограничен [144]. У реципиентов трансплантата гемопоэтических стволовых клеток парагриппозная вирусная инфекция является серьезной в присутствии других копатогенов и у пациентов с дыхательной недостаточностью, и лечение рибавирином в форме аэрозоля не было связано с уменьшением продолжительности выделения вируса или смертностью, связанной с пневмонией [145].
Вирус гриппа A является основной причиной заболеваемости и смертности, и инфекции часто бывают тяжелыми у пациентов с дефектным адаптивным Т-клеточным ответом. Лекарственная устойчивость к ингибиторам нейраминидазы представляет собой серьезную проблему лечения в условиях плохого ответа на обычные вакцины в популяции высокого риска рака и трансплантата [146]. Аэрозольный рибавирин 60 мг / мл для трех дневных доз продолжительностью 15 мин был эффективен против гриппа A и B у мышей [147]. Недавно было показано, что мегадоза рибавирина (100 мг / мл) эффективна у мышей, инфицированных летальным вирусом гриппа A h4N2.Эта мегадозовая терапия в течение всего 4 дней привела к выживаемости> 90% при назначении в течение 24–48 часов после инфицирования [148]. Необходимы дальнейшие клинические исследования для оценки соответствующей дозы и эффективности рибавирина для лечения лекарственно-устойчивой или лекарственно-резистентной вирулентной инфекции, вызванной вирусом гриппа.
Метапневмовирус человека возник как распространенный вирусный патоген дыхательных путей, связанный с субклиническим или легким заболеванием. Иногда было показано, что у пациентов с Т-клеточными иммунными дефектами hMPV вызывает диссеминированное смертельное заболевание [149].У пациентов, перенесших трансплантацию стволовых клеток или солидных органов, эти инфекции, даже при ограниченном легочном заболевании, представляют опасность для жизни и повышают риск поствирусной инвазивной грибковой пневмонии [150]. Внутривенный рибавирин считается лучшим доступным лечением этих серьезных диссеминированных или легочных инфекций hMPV, что отражает противовирусный эффект препарата и возможные лекарственные иммуномодулирующие свойства, которые могут еще больше повысить клиренс вируса и помочь в разрешении инфекции, особенно при ослабленном иммунитете. хост [151].
У пациентов с непереносимостью внутривенного рибавирина из-за гемолитической анемии и других серьезных осложнений с некоторым успехом применялось аэрозольное лечение легочного hMPV [152]. Точно так же при лечении пневмотропного аденовируса человека аэрозольный рибавирин предпочтительнее внутривенного из-за высокой концентрации лекарства, достигаемой в альвеолах, по сравнению с внутривенной терапией рибавирином, которая может не приводить к цитотоксическим концентрациям в легочной ткани [153]. Однако это может быть не единственным определяющим фактором клинической эффективности терапии рибавирином, поскольку лекарственное усиление активности Т-хелперных Т-клеток Th2 требует дальнейшей оценки в клинических испытаниях [151].
6. Системы небулайзера
Критическим фактором для всех ингаляционных терапевтических средств являются характеристики системы доставки. Для всех методов лечения, обсуждаемых в данном документе, использовались жидкие аэрозоли, чаще всего создаваемые воздушно-струйными небулайзерами, хотя все чаще используются дополнительные технологии [156]. Воздухоструйный и ультразвуковой распылители генерируют аэрозоль под высоким давлением и вибрацией пьезоэлектрического кристалла соответственно. Эти обычно используемые системы доставки обеспечивают адекватное отложение антимикробных препаратов в легких у амбулаторных пациентов, тогда как доставка лекарств ниже у пациентов в критическом состоянии, получающих вспомогательную вентиляцию легких [157,158].В новых электрических генераторах аэрозолей используется вибрирующая сетка или пластина с множеством отверстий, которые увеличивают отложение лекарства в легких в 2–3 раза и значительно повышают выход лекарства по сравнению с аэрозольными небулайзерами. Это следует учитывать для аэрозольной доставки лекарств у пациентов с пневмонией на ИВЛ [159].
Точно так же ингаляционная терапия цитокинами кажется привлекательной для различных трудно поддающихся лечению микобактериальных инфекций, поражающих легкие, хотя доставка этих агентов к месту инфекции представляет собой сложную задачу.В стандартных небулайзерных системах, таких как Respirgard или Misty-neb, только 5–7% общей введенной дозы достигает легочной ткани [74, 160]. Эту трудность можно уменьшить, используя высокоэффективные воздушно-струйные или ультразвуковые небулайзеры или специализированные системы доставки с использованием генераторов электрического аэрозоля нового поколения для достижения терапевтических концентраций иммуномодулирующих цитокинов в месте легочной инфекции. Для получения дополнительной информации отсылаем читателя к недавним обзорным статьям [161].
7. Резюме
Легкие являются наиболее частым очагом серьезной инфекции из-за их большой площади поверхности, подверженной воздействию внешней среды, и минимальной барьерной защиты. Однако такая архитектура делает легкие доступными для местной терапии. Терапевтические аэрозоли включают аэрозоли, направленные на улучшение мукоцилиарного клиренса патогенов, стимуляцию врожденной устойчивости к микробной инфекции, цитокиновую стимуляцию иммунной функции и доставку антибиотиков. Эти терапевтические средства все еще находятся в зачаточном состоянии, но имеют большие перспективы.
8. Экспертное заключение
По нашему мнению, ингаляционные противомикробные препараты используются недостаточно, особенно у пациентов с трудноизлечимыми легочными инфекциями низкой остроты.
Использование ингаляционной противомикробной терапии стало важной частью лечения инфекции дыхательных путей, вызываемой P. aeruginosa при муковисцидозе, и профилактики инвазивной грибковой инфекции у пациентов, перенесших трансплантацию сердца и легких.
В будущем развитии этой области мы рекомендуем сделать акцент на изучении использования аэрозольного гипертонического солевого раствора для уменьшения вызываемых патогенами нарушений дыхательных путей у субъектов, инфицированных микробами с низкой вирулентностью, стимуляции врожденной резистентности для предотвращения пневмония у субъектов с ослабленным иммунитетом, использующих цитокины или синтетические аналоги PAMP, и больше возможностей для использования ингаляционных противомикробных препаратов.
Сноски
Заявление о заинтересованности
Это исследование было частично поддержано грантом CA16672 для поддержки онкологических центров Национальных институтов здравоохранения.
Библиография
1. Доклад о состоянии здравоохранения в мире, 2004 г. — История изменений. Женева: Всемирная организация здравоохранения; 2004. [Google Scholar] 3. Джоос Л., Тамм М. Нарушение защиты легочного хозяина у хозяина с ослабленным иммунитетом: химиотерапия рака. Proc Am Thorac Soc. 2005. 2 (5): 445–8. [PubMed] [Google Scholar] 4. Ноулз М.Р., Буше Р.С. Очистка от слизи как основной врожденный защитный механизм дыхательных путей млекопитающих. J Clin Invest. 2002. 109 (5): 571–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Трэвис С.М., Сингх П.К., Валлийский М.Дж.Противомикробные пептиды и белки во врожденной защите поверхности дыхательных путей. Curr Opin Immunol. 2001. 13 (1): 89–95. [PubMed] [Google Scholar] 8. Flanders SACH, Saint S. Нозокомиальная пневмония: состояние науки. Am J Infect Control. 2006; (34): 84–93. [PubMed] [Google Scholar] 9. Ноулз М.Р., Буше Р.С. Очистка от слизи как основной врожденный защитный механизм дыхательных путей млекопитающих. J Clin Invest. 2002. 109 (5): 571–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Ратьен Ф. Восстановление жидкости на поверхности дыхательных путей при муковисцидозе.N Engl J Med. 2006. 354 (3): 291–3. [PubMed] [Google Scholar] 11. Тарран Р., Дональдсон С., Буше Р. Обоснование применения гипертонической солевой терапии при муковисцидозе легких. Semin Respir Crit Care Med. 2007. 28 (3): 295–302. [PubMed] [Google Scholar] 12. Eng PA, Morton J, Douglass JA, et al. Краткосрочная эффективность распыляемого ультразвуком гипертонического раствора при муковисцидозе. Педиатр Пульмонол. 1996. 21 (2): 77–83. [PubMed] [Google Scholar] 13. Робинсон М., Регнис Дж. А., Бейли Д. Л. и др. Влияние гипертонического раствора, амилорида и кашля на мукоцилиарный клиренс у пациентов с муковисцидозом.Am J Respir Crit Care Med. 1996. 153 (5): 1503–1509. [PubMed] [Google Scholar] 14. Суд Н., Беннетт В.Д., Земан К. и др. Повышение концентрации вдыхаемого физиологического раствора с амилоридом или без него: влияние на мукоцилиарный клиренс у нормальных субъектов. Am J Respir Crit Care Med. 2003. 167 (2): 158–63. [PubMed] [Google Scholar] 15. Wark PA, McDonald V. Распыленный гипертонический раствор для лечения муковисцидоза. Кокрановская база данных Syst Rev.2003; (1): CD001506. [PubMed] [Google Scholar] 16. Дональдсон С.Х., Беннетт В.Д., Земан К.Л. и др. Очистка слизи и функция легких при муковисцидозе с гипертоническим раствором.N Engl J Med. 2006. 354 (3): 241–50. [PubMed] [Google Scholar] 17. Элкинс М.Р., Робинсон М., Роуз Б.Р. и др. Контролируемое испытание длительного применения ингаляционного гипертонического раствора у пациентов с муковисцидозом. N Engl J Med. 2006. 354 (3): 229–40. [PubMed] [Google Scholar] 18. Керем Э., Бистрицер Т., Ханукоглу А. и др. Дисфункция легочного эпителия натриевых каналов и избыток жидкости в дыхательных путях при псевдогипоальдостеронизме. N Engl J Med. 1999. 341 (3): 156–62. [PubMed] [Google Scholar] 19. Уильямс О.В., Шарафхане А., Ким В. и др.Слизь в дыхательных путях: от производства до секрета. Am J Respir Cell Mol Biol. 2006. 34 (5): 527–36. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Буше RC. Обезвоживание поверхности дыхательных путей при муковисцидозе: патогенез и терапия. Annu Rev Med. 2007. 58: 157–70. [PubMed] [Google Scholar] 22. Эванс С.М., Уильямс О.В., Тувим М.Дж. и др. Муцин продуцируется clara-клетками проксимальных дыхательных путей мышей, зараженных антигеном. Am J Respir Cell Mol Biol. 2004. 31 (4): 382–94. [PubMed] [Google Scholar] 23. Уильямс О.В., Шарафхане А., Ким В. и др.Слизь в дыхательных путях: от производства до секрета. Am J Respir Cell Mol Biol. 2006. 34 (5): 527–36. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Акинби Х.Т., Эпод Р., Бхатт Х. и др. Уничтожение бактерий усиливается экспрессией лизоцима в легких трансгенных мышей. J Immunol. 2000. 165 (10): 5760–6. [PubMed] [Google Scholar] 25. Bals R, Weiner DJ, Moscioni AD, et al. Усиление врожденной защиты хозяина за счет экспрессии антимикробного пептида кателицидина. Infect Immun. 1999. 67 (11): 6084–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26.Коул А.М., Ляо Х.И., Стучлик О. и др. Катионные полипептиды необходимы для антибактериальной активности жидкости дыхательных путей человека. J Immunol. 2002. 169 (12): 6985–91. [PubMed] [Google Scholar] 27. Коул AM, Thapa DR, Gabayan V и др. Снижение клиренса Pseudomonas aeruginosa из дыхательных путей мышей с дефицитом лизоцима M. J Leukoc Biol. 2005. 78 (5): 1081–5. [PubMed] [Google Scholar] 28. Moser C, Weiner DJ, Lysenko E, et al. бета-дефенсин 1 способствует развитию врожденного иммунитета легких у мышей. Infect Immun. 2002. 70 (6): 3068–72.[Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Эванс С.Е., Хан П.Й., Макканн Ф. и др. Бета-глюканы клеточной стенки Pneumocystis стимулируют генерацию хемокинов альвеолярными эпителиальными клетками через механизмы, зависящие от ядерного фактора, каппа-B. Am J Respir Cell Mol Biol. 2005. 32 (6): 490–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Агусти С., Рано А., Ровира М. и др. Воспалительный ответ, связанный с легочными осложнениями у пациентов с ослабленным иммунитетом, не связанных с ВИЧ. Грудная клетка. 2004. 59 (12): 1081–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31.Бартон Г.М., Меджитов Р. Сигнальные пути толл-подобных рецепторов. Наука. 2003. 300 (5625): 1524–15. [PubMed] [Google Scholar] 32. Болдрик Дж. К., Ализаде А. А., Дин М. и др. Стереотипные и специфические программы экспрессии генов в врожденных иммунных реакциях человека на бактерии. Proc Natl Acad Sci USA. 2002. 99 (2): 972–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Капетанович Р., Кавайон Дж. М.. Ранние события врожденного иммунитета при распознавании микробных патогенов. Экспертное мнение Biol Ther. 2007. 7 (6): 907–18. [PubMed] [Google Scholar] 34.Каваи Т., Акира С. Сигнализация TLR. Смерть клетки отличается. 2006. 13 (5): 816–25. [PubMed] [Google Scholar] 35. Копп Э., Меджитов Р. Распознавание микробной инфекции по Toll-подобным рецепторам. Curr Opin Immunol. 2003. 15 (4): 396–401. [PubMed] [Google Scholar] 36. Чжан Г., Гош С. Активация NF-kappaB, опосредованная Toll-подобным рецептором: филогенетически консервативная парадигма врожденного иммунитета. J Clin Invest. 2001; 107 (1): 13–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Улевич Р.Ю. Терапия, направленная на врожденную иммунную систему.Nat Rev Immunol. 2004. 4 (7): 512–20. [PubMed] [Google Scholar] 38. Аревало И., Туллиано Дж., Киспе А. и др. Роль имиквимода и парентерального антимониата меглумина в начальном лечении кожного лейшманиоза. Clin Infect Dis. 2007. 44 (12): 1549–54. [PubMed] [Google Scholar] 39. Канистанон Д., Хаджар А.М., Пеллетье М.Р. и др. Мутант Francisella по углеводной модификации липида А вызывает защитный иммунитет. PLoS Pathog. 2008; 4 (2): e24. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Лембо А., Пеллетье М., Айер Р. и др.Введение синтетического агониста TLR4 защищает мышей от легочной туляремии. J Immunol. 2008. 180 (11): 7574–81. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Лурманн А., Дейтерс Ю., Скокова Дж. И др. Эффекты in vivo синтетического 2-килодальтонного активирующего макрофаги липопептида Mycoplasma fermentans после легочного применения. Infect Immun. 2002. 70 (7): 3785–92. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. МакХатчисон Дж. Г., Бэкон Б. Р., Гордон С. К. и др. Фаза 1B, рандомизированное двойное слепое исследование с увеличением дозы CPG 10101 у пациентов с хроническим вирусом гепатита С.Гепатология. 2007. 46 (5): 1341–9. [PubMed] [Google Scholar] 43. Raberg L, Sim D, Read AF. Распутывание генетической изменчивости для устойчивости и толерантности к инфекционным заболеваниям у животных. Наука. 2007. 318 (5851): 812–4. [PubMed] [Google Scholar] 44. Уильямс Т.Н., Мванги Т.В., Вамбуа С. и др. Отрицательный эпистаз между защитным действием от малярии альфа + -талассемии и серповидно-клеточной характеристикой. Нат Жене. 2005. 37 (11): 1253–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Эванс С.Е., Скотт Б.Л., Клемент К.Г. и др.Стимулированная врожденная резистентность эпителия легких защищает мышей от бактерий и грибков. Am J Respir Cell Mol Biol. 2009 27 марта; [Epub перед печатью] [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Деннис Д.Т., Инглсби Т.В., Хендерсон Д.А. и др. Туляремия как биологическое оружие: управление медициной и общественным здравоохранением. ДЖАМА. 2001. 285 (21): 2763–73. [PubMed] [Google Scholar] 47. Хиллеман MR. Обзор: причины и профилактика в биологической войне и биотерроризме. Вакцина. 2002. 20 (25–26): 3055–67. [PubMed] [Google Scholar] 48.Уэйн Конлан Дж., Шен Х., Куоли Р. и др. Аэрозольная, но не внутрикожная иммунизация живым вакцинным штаммом Francisella tularensis защищает мышей от последующего аэрозольного заражения высоковирулентным штаммом патогена типа А посредством механизма, зависимого от Т-лимфоцитов и гамма-интерферона. Вакцина. 2005. 23 (19): 2477–85. [PubMed] [Google Scholar] 50. Тувим М.Дж., Эванс С.Е., Клемент К.Г. и др. Усиленное воспаление легких защищает от пневмонии гриппа А. PLoS ONE. 2009; 4 (1): e4176.[Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Клемент К.Г., Эванс С.Е., Эванс С.М. и др. Стимуляция врожденного иммунитета легких защищает мышей от летальной пневмококковой пневмонии. Am J Respir Crit Care Med. 2008. 177 (12): 1322–30. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Могхаддам С.Дж., Клемент К.Г., Де ла Гарза М.М. и др. Лизат Haemophilus influenzae индуцирует аспекты фенотипа хронической обструктивной болезни легких. Am J Respir Cell Mol Biol. 2008. 38 (6): 629–38. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53.Brandl K, Plitas G, Mihu CN и др. Устойчивые к ванкомицину энтерококки используют вызванный антибиотиками врожденный иммунный дефицит. Природа. 2008. 455 (7214): 804–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Hoogerwerf JJ, de Vos AF, Bresser P, et al. Воспаление легких, вызванное липотейхоевой кислотой или липополисахаридом у человека. Am J Respir Crit Care Med. 2008. 178 (1): 34–41. [PubMed] [Google Scholar] 55. Реппе К., Черниг Т., Лурманн А. и др. Иммуностимуляция липопептидом-2, активирующим макрофаги, увеличивала выживаемость при пневмонии мышей.Am J Respir Cell Mol Biol. 2009. 40 (4): 474–81. [PubMed] [Google Scholar] 56. Багчи А., Херруп Э.А., Уоррен Х.С. и др. MyD88-зависимый и MyD88-независимый пути синергизма, прайминга и толерантности между агонистами TLR. J Immunol. 2007. 178 (2): 1164–71. [PubMed] [Google Scholar] 57. Trinchieri G, Sher A. Сотрудничество сигналов Toll-подобных рецепторов во врожденной иммунной защите. Nat Rev Immunol. 2007. 7 (3): 179–90. [PubMed] [Google Scholar] 58. Меджитов Р. Распознавание микроорганизмов и активация иммунного ответа.Природа. 2007. 449 (7164): 819–26. [PubMed] [Google Scholar] 59. Foster SL, Hargreaves DC, Medzhitov R. Ген-специфический контроль воспаления с помощью TLR-индуцированных модификаций хроматина. Природа. 2007. 447 (7147): 972–8. [PubMed] [Google Scholar] 60. Тадзава Р., Хамано Э., Араи Т. и др. Гранулоцитарно-макрофагальный колониестимулирующий фактор и легочный иммунитет при легочном альвеолярном протеинозе. Am J Respir Crit Care Med. 2005. 171 (10): 1142–9. [PubMed] [Google Scholar] 61. Андерсон П.М., Маркович С.Н., Слоан Дж. А. и др. Аэрозольный гранулоцитарный макрофаг-колониестимулирующий фактор: низкая токсичность, легочная биологическая терапия у пациентов с метастазами в легких.Clin Cancer Res. 1999. 5 (9): 2316–23. [PubMed] [Google Scholar] 62. Trapnell BC, Whitsett JA, Nakata K. Легочный альвеолярный протеиноз. N Engl J Med. 2003. 349 (26): 2527–39. [PubMed] [Google Scholar] 63. Киннула В., Маттсон К., Кантелл К. Фармакокинетика и токсичность вдыхаемого человеческого интерферона-альфа у пациентов с раком легких. J Interferon Res. 1989. 9 (4): 419–23. [PubMed] [Google Scholar] 64. Маасилта П., Халме М., Маттсон К. и др. Фармакокинетика ингаляционного рекомбинантного и природного альфа-интерферона. Ланцет.1991; 337 (8737): 371. [PubMed] [Google Scholar] 65. Киннула В., Кантелл К., Маттсон К. Эффект вдыхаемого природного интерферона-альфа на диффузную бронхоальвеолярную карциному. Eur J Cancer. 1990; 26 (6): 740–1. [PubMed] [Google Scholar] 66. Маасилта П., Холсти Л. Р., Халме М. и др. Природный альфа-интерферон в сочетании с гиперфракционированной лучевой терапией при лечении немелкоклеточного рака легкого. Int J Radiat Oncol Biol Phys. 1992. 23 (4): 863–8. [PubMed] [Google Scholar] 67. Giosue S, Casarini M, Alemanno L и др.Эффекты аэрозольного интерферона-альфа у больных туберкулезом легких. Am J Respir Crit Care Med. 1998. 158 (4): 1156–62. [PubMed] [Google Scholar] 68. Giosue S, Casarini M, Ameglio F и др. Аэрозольное лечение интерфероном-альфа у пациентов с туберкулезом легких с множественной лекарственной устойчивостью. Eur Cytokine Netw. 2000. 11 (1): 99–104. [PubMed] [Google Scholar] 69. Мартин Р. Дж., Богуневич М., Хенсон Дж. Э. и др. Воздействие вдыхаемого гамма-интерферона на нормальные дыхательные пути человека. Am Rev Respir Dis. 1993; 148 (6 Pt 1): 1677–82.[PubMed] [Google Scholar] 70. Богуневич М., Мартин Р.Дж., Мартин Д. и др. Эффекты распыленного рекомбинантного гамма-интерферона на астматические дыхательные пути. J Allergy Clin Immunol. 1995. 95 (1 Pt 1): 133–5. [PubMed] [Google Scholar] 71. Кондо Р., Раджу Б., Канова А. и др. Рекомбинантный гамма-интерферон стимулирует передачу сигнала и экспрессию генов в альвеолярных макрофагах in vitro и у больных туберкулезом. Infect Immun. 2003. 71 (4): 2058–64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Раджу Б., Хосино Ю., Кувабара К. и др.Аэрозольный гамма-интерферон (IFN-гамма) индуцирует экспрессию генов, кодирующих IFN-гамма-индуцибельный белок 10 килодальтон, но не индуцируемую синтазу оксида азота в легких во время туберкулеза. Infect Immun. 2004. 72 (3): 1275–83. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Кондо R, Rom WN, Schluger NW. Лечение туберкулеза легких с множественной лекарственной устойчивостью с помощью аэрозольного гамма-интерферона. Ланцет. 1997. 349 (9064): 1513–5. [PubMed] [Google Scholar] 74. Condos R, Hull FP, Schluger NW и др.Региональное отложение аэрозольного гамма-интерферона при туберкулезе легких. Грудь. 2004. 125 (6): 2146–55. [PubMed] [Google Scholar] 75. Moss RB, Mayer-Hamblett N, Wagener J, et al. Рандомизированное двойное слепое плацебо-контролируемое исследование с увеличением дозы аэрозольного интерферона гамма-1b у пациентов с кистозным фиброзом легких легкой и средней степени тяжести. Педиатр Пульмонол. 2005. 39 (3): 209–18. [PubMed] [Google Scholar] 76. Накос Г., Маламу-Мици В.Д., Лачана А. и др. Иммунопаралич у больных с тяжелой травмой и действие ингаляционного гамма-интерферона.Crit Care Med. 2002. 30 (7): 1488–94. [PubMed] [Google Scholar] 77. Вирголини I, Куртаран А., Леймер М. и др. Ингаляционная сцинтиграфия с меченным йодом-123 интерфероном гамма-1b: исследование легочного отложения и повышения дозы у здоровых добровольцев. J Nucl Med. 1997. 38 (9): 1475–81. [PubMed] [Google Scholar] 78. Рао Р.Д., Андерсон П.М., Арндт К.А. и др. Терапия аэрозольным гранулоцитарным макрофагальным колониестимулирующим фактором (GM-CSF) при метастатическом раке. Am J Clin Oncol. 2003. 26 (5): 493–8. [PubMed] [Google Scholar] 79.Нивен Р.В., Уиткомб К.Л., Шанер Л. и др. Легочная абсорбция аэрозольного и интратрахеально инстиллированного rhG-CSF и моноПЕГилированного rhG-CSF. Pharm Res. 1995; 12 (9): 1343–9. [PubMed] [Google Scholar] 80. Мачида М., Хаяши М., Авазу С. Абсорбция в легких рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора (rhG-CSF) после интратрахеального введения крысам. Биол Фарм Булл. 1996. 19 (2): 259–62. [PubMed] [Google Scholar] 81. Gatmaitan BG, Carruthers MM, Lerner AM. Гентамицин в лечении первичных грамотрицательных пневмоний.Am J Med Sci. 1970; 260 (2): 90–4. [PubMed] [Google Scholar] 83. Klastersky J, Geuning C, Mouawad E, et al. Эндотрахеальный гентамицин при бронхиальных инфекциях у пациентов с трахеостомией. Грудь. 1972: 61 (2): 117–20. [PubMed] [Google Scholar] 85. Odio W, Van Laer E, Klastersky J. Концентрации гентамицина в бронхиальном секрете после внутримышечного и эндотрахеального введения. J Clin Pharmacol. 1975. 15 (7): 518–24. [PubMed] [Google Scholar] 86. Панидис Д., Маркантонис С.Л., Бутзука Э. и др. Проникновение гентамицина в жидкость выстилки альвеол у пациентов в критическом состоянии с вентилятор-ассоциированной пневмонией.Грудь. 2005. 128 (2): 545–52. [PubMed] [Google Scholar] 87. Каркас А.Дж., Гарсия-Сатуе Д.Л., Сапатер П. и др. Проникновение тобрамицина в эпителиальную выстилочную жидкость пациентов с пневмонией. Clin Pharmacol Ther. 1999. 65 (3): 245–50. [PubMed] [Google Scholar] 88. Valcke YJ, Vogelaers DP, Colardyn FA и др. Проникновение нетилмицина в нижние дыхательные пути после приема один раз в сутки. Грудь. 1992. 101 (4): 1028–32. [PubMed] [Google Scholar] 89. Брауде А.С., Хорнштейн А., Кляйн М. и др. Распределение тобрамицина в легких.Am Rev Respir Dis. 1983; 127 (5): 563–5. [PubMed] [Google Scholar] 90. Kuhn RJ. Фармацевтические соображения при аэрозольной доставке лекарств. Фармакотерапия. 2002; 22 (3 Pt 2): 80S – 5S. [PubMed] [Google Scholar] 91. Goldstein I, Wallet F, Nicolas-Robin A и др. Отложение в легких и эффективность распыленного амикацина при пневмонии, вызванной Escherichia coli, у вентилируемых поросят. Am J Respir Crit Care Med. 2002. 166 (10): 1375–81. [PubMed] [Google Scholar] 92. Гольдштейн I, Кошелек F, Роберт Дж. И др. Концентрация распыленного амикацина в легочной ткани во время искусственной вентиляции легких у поросят со здоровыми легкими.Am J Respir Crit Care Med. 2002. 165 (2): 171–5. [PubMed] [Google Scholar] 93. Klastersky J, Carpentier-Meunier F, Kahan-Coppens L, et al. Антибиотики при грамотрицательной бронхопневмонии назначаются эндотрахеально. Грудь. 1979; 75 (5): 586–91. [PubMed] [Google Scholar] 94. Флюм П, Клепсер МЭ. Обоснование использования антибиотиков в аэрозольной форме. Фармакотерапия. 2002; 22 (3 Pt 2): 71S – 9S. [PubMed] [Google Scholar] 95. Мур Р.Д., Литман П.С., Смит С.Р. Клинический ответ на терапию аминогликозидами: важность отношения максимальной концентрации к минимальной ингибирующей концентрации.J Infect Dis. 1987. 155 (1): 93–9. [PubMed] [Google Scholar] 96. Мур RD, Смит CR, Литман PS. Связь уровней аминогликозидов в плазме со смертностью у пациентов с грамотрицательной бактериемией. J Infect Dis. 1984. 149 (3): 443–8. [PubMed] [Google Scholar] 97. Schentag JJ. Корреляция фармакокинетических параметров с эффективностью антибиотиков: взаимосвязь между концентрациями в сыворотке, значениями МИК и бактериальной эрадикацией у пациентов с грамотрицательной пневмонией. Scand J Infect Dis Suppl. 1990; 74: 218–34.[PubMed] [Google Scholar] 98. Дезил-Эванс Л.М., Мерфи Дж. Э., Джоб М.Л. Корреляция фармакокинетических показателей с терапевтическим исходом у пациентов, получающих аминогликозиды. Clin Pharm. 1986. 5 (4): 319–24. [PubMed] [Google Scholar] 99. Коллинз Т., Гердинг Д.Н. Аминогликозиды в сравнении с бета-лактамами при грамотрицательной пневмонии. Semin Respir Infect. 1991. 6 (3): 136–46. [PubMed] [Google Scholar] 100. Бернс Дж. Л., Ван Дальфсен Дж. М., Шавар Р. М. и др. Влияние хронического периодического введения ингаляционного тобрамицина на респираторную микробную флору у пациентов с муковисцидозом.J Infect Dis. 1999. 179 (5): 1190–6. [PubMed] [Google Scholar] 101. Valcke Y, Pauwels R, Van der Straeten M. Проникновение аминогликозидов в жидкость выстилки альвеол крыс. Эффект воспаления дыхательных путей. Am Rev Respir Dis. 1990. 142 (5): 1099–103. [PubMed] [Google Scholar] 102. Меерс П., Невилл М., Малинин В. и др. Проникновение биопленки, запускаемое высвобождение и активность ингаляционного липосомального амикацина in vivo при хронических инфекциях легких, вызванных Pseudomonas aeruginosa. J Antimicrob Chemother. 2008. 61 (4): 859–68.[PubMed] [Google Scholar] 103. Дэвис К.К., Као П.Н., Якобс С.С. и др. Аэрозольный амикацин для лечения легочных инфекций Mycobacterium avium: серия наблюдательных случаев. BMC Pulm Med. 2007; 7: 2. [Бесплатная статья PMC] [PubMed] [Google Scholar] 104. Макколл С.Ю., Спруилл В.Дж., Уэйд В.Е. Применение тобрамицина в аэрозольной форме при лечении резистентного псевдомонадного пневмонита. Ther Drug Monit. 1989. 11 (6): 692–5. [PubMed] [Google Scholar] 105. Допфер Р., Брэнд П, Маллингер Б. и др. Ингаляция тобрамицина у больных муковисцидозом: сравнение двух методов.J. Physiol Pharmacol. 2007; 58 (Дополнение 5) (Pt 1): 141–54. [PubMed] [Google Scholar] 106. Ленуар Г., Антипкин Ю.Г., Миано А. и др. Эффективность, безопасность и местная фармакокинетика высококонцентрированного распыленного тобрамицина у пациентов с муковисцидозом, колонизированными синегнойной палочкой. Педиатрические препараты. 2007; 9 (Дополнение 1): 11–20. [PubMed] [Google Scholar] 107. Рэмси Б.В., Доркин Х.Л., Айзенберг Д.Д. и др. Эффективность аэрозольного тобрамицина у пациентов с муковисцидозом. N Engl J Med. 1993. 328 (24): 1740–6. [PubMed] [Google Scholar] 109.Кантон Р., Кобос Н., де Грасиа Дж. И др. Антимикробная терапия легочной патогенной колонизации и инфекции Pseudomonas aeruginosa у пациентов с муковисцидозом. Clin Microbiol Infect. 2005. 11 (9): 690–703. [PubMed] [Google Scholar] 110. Sexauer WP, Fiel SB. Антибиотики в аэрозольной форме при муковисцидозе. Semin Respir Crit Care Med. 2003. 24 (6): 717–26. [PubMed] [Google Scholar] 111. Кун П., Ландау Л.И., Фелан П.Д. Распыленный гентамицин у детей и подростков с муковисцидозом. Aust Paediatr J.1984. 20 (1): 43–5. [PubMed] [Google Scholar] 112. Уолл М.А., Терри А.Б., Айзенберг Дж. И др. Ингаляционные антибиотики при муковисцидозе. Ланцет. 1983; 1 (8337): 1325. [PubMed] [Google Scholar] 113. Стейнкамп Г., Туммлер Б., Гаппа М. и др. Длительная аэрозольная терапия тобрамицином при муковисцидозе. Педиатр Пульмонол. 1989. 6 (2): 91–8. [PubMed] [Google Scholar] 114. Смит А.Л., Рэмси Б.В., Хеджес Д.Л. и др. Безопасность применения аэрозольного тобрамицина в течение 3 месяцев пациентам с муковисцидозом. Педиатр Пульмонол. 1989. 7 (4): 265–71.[PubMed] [Google Scholar] 115. Рэмси Б.В., Пепе М.С., Куан Дж. М. и др. Периодическое введение ингаляционного тобрамицина пациентам с муковисцидозом. Группа по изучению муковисцидоза, вдыхаемого тобрамицином. N Engl J Med. 1999. 340 (1): 23–30. [PubMed] [Google Scholar] 116. Мох РБ. Долгосрочные преимущества ингаляционного тобрамицина у подростков с муковисцидозом. Грудь. 2002. 121 (1): 55–63. [PubMed] [Google Scholar] 117. Стивенс Д., Гэри Н., Айлз А. и др. Эффективность ингаляционного тобрамицина при лечении обострений легких у детей с муковисцидозом.Pediatr Infect Dis. 1983; 2 (3): 209–11. [PubMed] [Google Scholar] 118. Schaad UB, Wedgwood-Krucko J, Suter S и др. Эффективность ингаляционного амикацина в качестве дополнения к внутривенной комбинированной терапии (цефтазидим и амикацин) при муковисцидозе. J Pediatr. 1987. 111 (4): 599–605. [PubMed] [Google Scholar] 119. Билтон Д., Хениг Н., Моррисси Б. и др. Добавление ингаляционного тобрамицина к ципрофлоксацину при обострении инфекции Pseudomonas aeruginosa при бронхоэктазах у взрослых. Грудь. 2006. 130 (5): 1503–10. [PubMed] [Google Scholar] 121.Рубин Б.К. Аэрозольные антибиотики для лечения бронхоэктазов без кистозного фиброза. J Aerosol Med Pulm Drug Deliv. 2008. 21 (1): 71–6. [PubMed] [Google Scholar] 122. Drobnic ME, Sune P, Montoro JB и др. Ингаляционный тобрамицин пациентам с неуковным фиброзом, бронхоэктазами и хронической бронхиальной инфекцией, вызванной синегнойной палочкой. Энн Фармакотер. 2005. 39 (1): 39–44. [PubMed] [Google Scholar] 123. Баркер А.Ф., Коуч Л., Фил С.Б. и др. Раствор тобрамицина для ингаляций снижает плотность мокроты синегнойной палочки при бронхоэктазах.Am J Respir Crit Care Med. 2000. 162 (2 Pt 1): 481–5. [PubMed] [Google Scholar] 124. Шейнберг П., Шор Э. Пилотное исследование безопасности и эффективности раствора тобрамицина для ингаляции у пациентов с тяжелыми бронхоэктазами. Грудь. 2005. 127 (4): 1420–146. [PubMed] [Google Scholar] 125. Додек П., Кинан С., Кук Д. и др. Основанное на фактических данных клиническое руководство по профилактике вентилятор-ассоциированной пневмонии. Ann Intern Med. 2004. 141 (4): 305–13. [PubMed] [Google Scholar] 126. Falagas ME, Siempos II, Bliziotis IA, et al.Введение антибиотиков через дыхательные пути для профилактики пневмонии, приобретенной в ОИТ: метаанализ сравнительных исследований. Crit Care. 2006; 10 (4): R123. [Бесплатная статья PMC] [PubMed] [Google Scholar] 127. Ратгебер Дж., Зильманн С., Панцер С. и др. Профилактика пневмонии путем эндотрахеальной микронебулизации тобрамицина. Анастезиол Интенсивмед Нефалмед Шмерцтер. 1993. 28 (1): 23–9. [PubMed] [Google Scholar] 128. Klastersky J, Huysmans E, Weerts D, et al. Эндотрахеально вводимый гентамицин для профилактики инфекций дыхательных путей у пациентов с трахеостомией: двойное слепое исследование.Грудь. 1974. 65 (6): 650–4. [PubMed] [Google Scholar] 129. Таблан О.К., Андерсон Л.Дж., Бессер Р. и др. Руководство по профилактике пневмонии, связанной с оказанием медицинской помощи, 2003 г .: рекомендации CDC и Консультативного комитета по практике инфекционного контроля в здравоохранении. MMWR Recomm Rep. 2004; 53 (RR-3): 1–36. [PubMed] [Google Scholar] 130. Falagas ME, Agrafiotis M, Athanassa Z и др. Введение антибиотиков через дыхательные пути в качестве монотерапии пневмонии. Эксперт Rev Anti Infect Ther. 2008. 6 (4): 447–52. [PubMed] [Google Scholar] 131.Ghannam DE, Rodriguez GH, Raad II и др. Ингаляционные аминогликозиды у онкологических больных с грамотрицательной бактериальной пневмонией, связанной с вентилятором: безопасность и осуществимость в эпоху роста лекарственной устойчивости. Eur J Clin Microbiol Infect Dis. 2009. 28 (3): 253–9. [PubMed] [Google Scholar] 132. Палмер Л. Б., Смолдон Г. К., Чен Дж. Дж. И др. Аэрозольные антибиотики и трахеобронхит, связанный с вентилятором, в отделении интенсивной терапии. Crit Care Med. 2008; 36 (7): 2008–13. [PubMed] [Google Scholar] 133. Морозини М.И., Гарсия-Кастильо М., Лоза Э. и др.Контрольные точки для прогнозирования чувствительности Pseudomonas aeruginosa к вдыхаемому тобрамицину у пациентов с муковисцидозом: использование тест-полосок Etest с высоким диапазоном значений. J Clin Microbiol. 2005. 43 (9): 4480–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 134. Линден П.К., Патерсон Д.Л. Парентеральный и ингаляционный колистин для лечения вентилятор-ассоциированной пневмонии. Clin Infect Dis. 2006; 43 (Дополнение 2): S89 – S4. [PubMed] [Google Scholar] 135. Михалопулос А., Фотакис Д., Вирцили С. и др. Колистин в аэрозольной форме в качестве дополнительного лечения респираторно-ассоциированной пневмонии, вызванной грамотрицательными бактериями с множественной лекарственной устойчивостью: проспективное исследование.Respir Med. 2008. 102 (3): 407–12. [PubMed] [Google Scholar] 136. Kwa AL, Loh C, Low JG и др. Распыленный колистин в лечении пневмонии, вызванной множественной лекарственной устойчивостью Acinetobacter baumannii и Pseudomonas aeruginosa. Clin Infect Dis. 2005. 41 (5): 754–7. [PubMed] [Google Scholar] 137. Берлана Д., Ллоп Дж. М., Форт Е. и др. Использование колистина для лечения грамотрицательных инфекций с множественной лекарственной устойчивостью. Am J Health Syst Pharm. 2005. 62 (1): 39–47. [PubMed] [Google Scholar] 138. Hamer DH. Лечение внутрибольничной пневмонии и трахеобронхита, вызванных синегнойной палочкой с множественной лекарственной устойчивостью, колистином в аэрозольной форме.Am J Respir Crit Care Med. 2000. 162 (1): 328–30. [PubMed] [Google Scholar] 139. Маккой К.С., Квиттнер А.Л., Оерманн С.М. и др. Азтреонам лизин вдыхается при хронической болезни дыхательных путей Pseudomonas aeruginosa при муковисцидозе. Am J Respir Crit Care Med. 2008. 178 (9): 921–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 140. Сафдар А. Стратегии усиления иммунной функции у реципиентов гемопоэтической трансплантации, у которых есть грибковые инфекции. Пересадка костного мозга. 2006. 38 (5): 327–37. [PubMed] [Google Scholar] 141. Сафдар А.Трудности с грибковыми инфекциями у пациентов с острым миелогенным лейкозом: стратегии повышения иммунитета. Онколог. 2007; 12 (Дополнение 2): 2–6. [PubMed] [Google Scholar] 142. Safdar ARG, Lichtiger B, Dickey BF и др. Повышение иммунитета рекомбинантным интерфероном гамма 1b у 20 пациентов с гематологическими злокачественными новообразованиями и системными оппортунистическими инфекциями, получавших переливания донорских гранулоцитов. Рак. 2006. 106 (12): 2664–71. [PubMed] [Google Scholar] 143. Монтойя Дж. Г., Чапарро С. В., Селис Д. и др. Инвазивный аспергиллез на фоне трансплантации сердца.Clin Infect Dis. 2003; 37 (Приложение 3): S281–92. [PubMed] [Google Scholar] 144. Гарсия-Видаль CUA, Кирби К.А., Марр К.А. Эпидемиология инвазивных инфекций плесени у реципиентов аллогенных стволовых клеток: биологические факторы риска инфекции в зависимости от времени после трансплантации. Clin Infect Dis. 2008. 47 (8): 1041–50. [Бесплатная статья PMC] [PubMed] [Google Scholar] 145. Маттиуцци Г.Н., Кантарджиан Х., Фадерл С. и др. Липидный комплекс амфотерицина B как профилактика инвазивных грибковых инфекций у пациентов с острым миелогенным лейкозом и миелодиспластическим синдромом, проходящих индукционную химиотерапию.Рак. 2004. 100 (3): 581–9. [PubMed] [Google Scholar] 146. Сингх Н., Лимай А.П., Форрест Г. и др. Поздний инвазивный аспергиллез у реципиентов трансплантата в современную эпоху. Med Mycol. 2006. 44 (5): 445–9. [PubMed] [Google Scholar] 147. Schmitt HJ, Bernard EM, Hauser M, et al. Аэрозольный амфотерицин B эффективен для профилактики и лечения крысиной модели легочного аспергиллеза. Антимикробные агенты Chemother. 1988. 32 (11): 1676–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 148. Cicogna CE, White MH, Bernard EM и др.Эффективность профилактического аэрозольного липидного комплекса амфотерицина B на модели легочного аспергиллеза на крысах. Антимикробные агенты Chemother. 1997. 41 (2): 259–61. [Бесплатная статья PMC] [PubMed] [Google Scholar] 149. Коидзуми Т., Кубо К., Канеки Т. и др. Фармакокинетическая оценка амфотерицина B в легочной ткани: распределение легочной лимфы после внутривенной инъекции и распределение воздушного пространства после аэрозолизации и ингаляции амфотерицина B. Противомикробные агенты Chemother. 1998. 42 (7): 1597–600. [Бесплатная статья PMC] [PubMed] [Google Scholar] 150.Коркоран Т.Е., Венкатараманан Р., Михельц К.М. и др. Аэрозольное отложение липидного комплекса амфотерицин-B (Abelcet) у реципиентов трансплантата легких. Am J Transplant. 2006. 6 (11): 2765–73. [PubMed] [Google Scholar] 151. Дрю Р.Х., Доддс Эшли Э., Бенджамин Д.К., мл. И др. Сравнительная безопасность липидного комплекса амфотерицина B и дезоксихолата амфотерицина B в качестве противогрибковой профилактики в аэрозольной форме у реципиентов трансплантата легких. Трансплантация. 2004. 77 (2): 232–7. [PubMed] [Google Scholar] 152. Монтойя Дж. Г., Хиральдо Л. Ф., Эфрон Б. и др.Инфекционные осложнения у 620 последовательных пациентов после трансплантации сердца в медицинском центре Стэнфордского университета. Clin Infect Dis. 2001. 33 (5): 629–40. [PubMed] [Google Scholar] 153. Палмер С.М., Дрю Р.Х., Уайтхаус Дж. Д. и др. Безопасность аэрозольного липидного комплекса амфотерицина B у реципиентов трансплантата легких. Трансплантация. 2001. 72 (3): 545–8. [PubMed] [Google Scholar] 154. Ботинки RJ, Патерсон Д.Л., Олворт А.М. и др. Успешное лечение постгриппозного псевдомембранозного некротизирующего аспергиллеза бронхов липосомальным амфотерицином, ингаляционным амфотерицином B, гамма-интерфероном и GM-CSF.Грудная клетка. 1999. 54 (11): 1047–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 155. Сафдар А., О’Брайен С., Кури И.Ф. Эффективность и возможность применения липидной комплексной терапии амфотерицина В в аэрозольной форме при легочном зигомикозе с прорывом каспофунгина. Пересадка костного мозга. 2004. 34 (5): 467–8. [PubMed] [Google Scholar] 156. Дханд Р., Гунтур В.П. Как лучше всего доставлять аэрозольные препараты пациентам, находящимся на ИВЛ. Clin Chest Med. 2008. 29 (2): 277–96. vi. [PubMed] [Google Scholar] 157. Макинтайр Н.Р., Сильвер Р.М., Миллер К.В. и др.Доставка аэрозоля интубированным пациентам на ИВЛ. Crit Care Med. 1985. 13 (2): 81–4. [PubMed] [Google Scholar] 158. Заявление о консенсусе по аэрозолям-1991. Американская ассоциация респираторной помощи. Respir Care. 1991. 36 (9): 916–21. [PubMed] [Google Scholar] 159. Дханд Р., Сохал Х. Система доставки легочных лекарств для ингаляционной терапии у пациентов с механической вентиляцией легких. Эксперт Rev Med Devices. 2008. 5 (1): 9–18. [PubMed] [Google Scholar] 160. Blanchard JDCD и др. Отложение в легких интерферона гамма-1b после ингаляции через систему AERx vs.Небулайзер Respirgard II ™ . Am J Respir Crit Care Med. 2003; 167: A373. [Аннотация встречи] [Google Scholar] 161. Уоттс А.Б., МакКонвилл Дж. Т., Уильямс РО. Современные методы лечения и технологические достижения в области доставки лекарственных средств в виде водных аэрозолей. Препарат Дев Инд Фарм. 2008. 34 (9): 913–22. [PubMed] [Google Scholar]
вариантов лечения пневмонии
TommL / E + / Getty Images
Лечение пневмонии зависит от вашего типа и степени тяжести. В большинстве случаев с пневмонией можно справиться с помощью домашних средств, но могут потребоваться и другие методы лечения, включая лекарства, отпускаемые без рецепта, антибиотики, противовирусные, противогрибковые и дыхательные препараты.В некоторых случаях может потребоваться госпитализация.
Если вы лечитесь от пневмонии, но чувствуете, что ваши симптомы не улучшаются или они начинают улучшаться, но затем ухудшаются, снова обратитесь к врачу. Это могут быть признаки того, что ваше состояние не поддается лечению или что у вас возникла другая инфекция.
Домашние средства и образ жизни
Большинство случаев пневмонии можно вылечить дома с помощью следующих мер:
- Отдыхайте как можно больше. Если у вас пневмония, вам нужен отдых, чтобы ваше тело могло бороться с инфекцией и выздоравливать. Не пытайтесь делать все, что вы обычно делаете, и отдыхать, когда чувствуете усталость. Чем больше вы сможете отдыхать, тем быстрее вам станет лучше.
- Пейте много жидкости. Вы слышите это часто, независимо от того, какое у вас заболевание, но это действительно важно.Питье большего количества воды поможет разжижить слизь в вашем теле, облегчая ее изгнание при кашле, что является важной частью выздоровления от пневмонии.Пейте бульон, суп, чай или даже горячую воду, чтобы избавиться от озноба и получить дополнительное увлажнение.
- Выпейте чашку кофе или чая с кофеином. Известно, что кофеин является мягким бронходилататором и химически похож на теофиллин, лекарство, которое используется для лечения астмы. Исследования показали, что кофеин может улучшить дыхание, открывая дыхательные пути на срок до четырех часов.
- Принимайте лекарства в соответствии с указаниями. Ваш врач может назначить вам антибиотик, противовирусное или противогрибковое средство в зависимости от того, какой у вас тип пневмонии.Убедитесь, что вы приняли его в соответствии с инструкциями и выполнили весь рецепт, даже если вы почувствуете себя лучше.
- Запустите увлажнитель. Как и в случае с питьевой водой, увлажнитель будет поддерживать влажность дыхательных путей, особенно когда воздух в вашем доме сухой.
- Полощите горло соленой водой. Полоскание горла несколько раз в день может помочь смыть часть слизи из горла и облегчить боль в горле. Если вы ненавидите соленую воду, полоскание простой водой тоже подойдет.
- Поговорите со своим врачом о лекарствах от кашля. Поскольку вам необходимо кашлять, чтобы избавиться от инфекции, поговорите со своим врачом, прежде чем принимать какие-либо средства от кашля, даже если из-за кашля вам трудно заснуть. Возможно, вы сможете принять небольшую дозу лекарства от кашля, или у вашего врача могут быть другие варианты.
- Бросьте курить и держитесь подальше от дыма. Дым усугубляет симптомы и может продлить время восстановления.
Рецепты
Ваш врач может выписать вам множество рецептов, опять же, в зависимости от типа пневмонии и ваших симптомов.
Антибиотики: Если у вас бактериальная или аспирационная пневмония, ваш врач пропишет вам антибиотик. Выбор лучшего антибиотика зависит от способности выяснить, каким типом бактерий вы были инфицированы, поэтому могут потребоваться некоторые испытания и ошибка до того, как ваши симптомы начнут улучшаться.
Если у вас легкая пневмония и вы в целом здоровы, врач, вероятно, пропишет вам Зитромакс (азитромицин), Биаксин (кларитромицин) или эритроцин (эритромицин).Вам могут потребоваться более сильные антибиотики, если у вас есть определенные заболевания, такие как сердечные заболевания, хроническая обструктивная болезнь легких (ХОБЛ), диабет или заболевание почек.
Дыхательные процедуры: Ваш врач может также назначить ингалятор или распылитель, чтобы помочь разжижить слизь в легких и улучшить дыхание. Наиболее распространенными лекарствами от этого являются вентолин, ProAir или Proventil (альбутерол).
Противовирусные препараты: Если у вас вирусная пневмония, ваш врач может назначить противовирусное средство, особенно если ваша пневмония была вызвана гриппом или герпесом и заболевание было выявлено на ранней стадии.Противовирусные препараты, которые могут быть назначены, включают Тамифлю (осельтамивир), Реленза (занамивир), Рапиваб (перамивир), Зовиракс (ацикловир), Цитовен (ганцикловир), Фоскавир (фоскарнет), Вистид (цидофовир), Низирал (кетоконзол) (кетоконзол). (рибавирин).
Противогрибковые препараты: Если у вас грибковая пневмония и ваша иммунная система подавлена или у вас есть другие серьезные заболевания, ваш врач может назначить вам противогрибковое лечение. Эти лекарства включают амфотерицин B, дифлюкан (флуконазол), онмель или споранокс (итраконазол). ), Вифенд (вориконазол), Ноксафил (позаконазол) или Креземба (изавуконазол).
Лекарства, отпускаемые без рецепта
Безрецептурные средства, которые обычно используются для лечения симптомов пневмонии, включают:
- Жаропонижающие / обезболивающие: Тайленол (парацетамол), мотрин или адвил (ибупрофен), алеве (напроксен) или аспирин помогут снизить температуру и уменьшить любую боль, которая может у вас возникнуть. Никогда не давайте аспирин детям, потому что это увеличивает риск развития синдрома Рея — редкого, но потенциально опасного для жизни заболевания.
- Отхаркивающие средства: Эти лекарства помогают разжижать и выводить слизь из легких. Ваш врач, вероятно, не захочет, чтобы вы принимали средства от кашля, или, по крайней мере, попросит вас принять небольшую дозу, потому что вам нужно чтобы иметь возможность кашлять, чтобы вывести инфекцию.
Госпитализация
Если у вас тяжелые симптомы или у вас есть сопутствующие заболевания, которые повышают вероятность осложнений от пневмонии, вам может потребоваться госпитализация.Вы можете получать внутривенные (IV) лекарства и / или дыхательные процедуры, чтобы улучшить вашу способность легко дышать, уменьшить кашель и раздражение и улучшить оксигенацию. При любом типе пневмонии вам также может потребоваться дополнительный кислород или, в редких случаях, даже вентилятор, чтобы помочь вам дышать.
Причины госпитализации
Госпитализация более вероятна, если к вам относится одна из следующих ситуаций или факторов:
- Вы старше 65 лет
- Вы сбиты с толку или дезориентированы
- У вас другая серьезная проблема со здоровьем, например диабет, ХОБЛ или болезнь сердца
- Ухудшилась функция почек
- Вы не можете позаботиться о себе дома
- Антибиотик, который вы принимаете, не помогает
- Ты быстро дышишь
- Ваша температура ниже нормы
- У вас медленный или быстрый пульс
У детей госпитализация более вероятна, если верны следующие факторы:
- Ребенку до 2 месяцев
- У него проблемы с дыханием
- Ребенок вялый или более сонный, чем обычно
- Низкий уровень кислорода в крови
- Признаки обезвоживания присутствуют
Дополнительная медицина (CAM)
Поскольку пневмония может быть опасным для жизни заболеванием, вам никогда не следует заменять обычное лечение альтернативной терапией.Однако дополнительная альтернативная медицина (CAM) может дополнять традиционные методы лечения, когда они используются вместе.
Теплые травяные чаи успокаивают боль в горле и согревают, если вас мучает озноб. Мята перечная и эвкалипт особенно полезны, потому что они, кажется, расщепляют слизь и уменьшают воспаление горла.
Пажитник убирает заложенность и очищает горло. Чаепитие из семян пажитника может помочь разрушить слизь и уменьшить постоянный кашель.
Обязательно поговорите со своим врачом, если решите использовать CAM.
Для конкретного типа
Различные типы пневмонии требуют своего собственного лечения.
Бактериальная пневмония: Бактериальная пневмония обычно лечится антибиотиками, респираторными препаратами, лекарствами, отпускаемыми без рецепта, и средствами обеспечения комфорта. Однако, если ваш случай станет тяжелым, вам может потребоваться госпитализация для внутривенного введения антибиотика.
Ваши симптомы должны улучшиться через один-три дня после приема антибиотиков, но пройдет не менее недели или дольше, прежде чем вы почувствуете себя полностью лучше, в зависимости от того, насколько вы были здоровы вначале.
Вирусная пневмония: Если у вас диагностирована вирусная пневмония, антибиотики не помогут. Самое главное, вам нужно отдыхать и заботиться о себе. Если вы попытаетесь придерживаться своего обычного распорядка, вам, скорее всего, потребуется больше времени, чтобы восстановиться, поэтому сделайте все возможное, чтобы замедлиться и больше отдыхать.
Ваш лечащий врач может порекомендовать лекарства, отпускаемые без рецепта, или лекарства, отпускаемые по рецепту, чтобы помочь справиться с вашими симптомами и облегчить вам дискомфорт, который они вызывают, но эти меры не вылечат болезнь.Иногда могут быть прописаны противовирусные препараты.
В большинстве случаев вирусная пневмония проходит сама по себе в течение одной-трех недель.
Микоплазменная пневмония: Микоплазменная пневмония обычно не такая серьезная, как бактериальная или вирусная пневмония, поэтому курс лечения может немного отличаться. Это часто называют «ходячей пневмонией», что означает, что вы не чувствуете себя настолько больным, что вам нужно оставаться в постели весь день.
Технически микоплазменная пневмония вызывается бактериями и в некоторых случаях лечится антибиотиками, хотя часто она проходит сама по себе без лечения.Хотя вам может не понадобиться оставаться в постели при микоплазменной пневмонии, дополнительный отдых, поддержание водного баланса и прием безрецептурных лекарств для облегчения симптомов, которые вы испытываете, должны помочь вам быстрее выздороветь.
Аспирационная пневмония: Аспирационная пневмония лечится путем удаления постороннего предмета, если это возможно, и прекращения аспирации большего количества пищи или жидкости. Это может означать, что вам не разрешают есть, и вам будут вводить калории и жидкости через капельницу или через зонд для кормления.
Антибиотики также являются важной частью лечения, помогая свести к минимуму скопление бактерий в легких и предотвратить обострение инфекции. Этот тип пневмонии сложно лечить и может потребоваться длительный курс лечения антибиотиками.
Часто задаваемые вопросы
Как ваш врач определяет лечение пневмонии?
Ваше лечение зависит от типа пневмонии. Ваш врач может поставить диагноз с помощью физического осмотра, лабораторных анализов и визуализации, например рентгеновских лучей.
Как обычно лечат ходячую пневмонию?
Ваш врач может назначить антибиотики, если вероятной причиной являются бактерии. Отдых и питье большого количества жидкости также могут помочь вам быстрее восстановиться. Чтобы облегчить симптомы, ваш врач может порекомендовать безрецептурные лекарства, в том числе антигистимины от заложенности носа и средства для снижения температуры, такие как тайленол (парацетамол) и адвил (ибупрофен).
Аспирационная пневмония и химический пневмонит — заболевания легких и дыхательных путей
Крошечные частицы изо рта часто капают или попадают в дыхательные пути при вдыхании (аспирации).Обычно они устраняются нормальными защитными механизмами (такими как кашель), прежде чем они попадут в легкие и вызовут воспаление или инфекцию. Если такие частицы не удаляются (из-за нарушения защитных механизмов и / или из-за большого объема аспирированного материала), может развиться аспирационная пневмония.
Материал, отсасываемый изо рта и горла, с большей вероятностью может содержать бактерии, которые могут вызвать инфекционную пневмонию. Материал, отсасываемый из желудка, обычно очень кислый и может серьезно повредить легкие еще до развития инфекции.
Люди, которые особенно подвержены риску аспирационной пневмонии, включают людей, которые
Проблемы с глотанием (может случиться из-за инсульта)
Находятся в состоянии алкогольного или наркотического опьянения
Находятся без сознания из-за анестезии, седативных препаратов или заболевания
Проходили стоматологические, респираторные или пищеварительные процедуры
Симптомы аспирационной пневмонии не проявляются как минимум день или два.Самый частый симптом —
.
При кашле выделяется мокрота (густая или обесцвеченная слизь). Вскоре мокрота пахнет отвратительно.
Другие симптомы аспирационной пневмонии включают
Одышка (одышка)
Врачи обычно ставят диагноз аспирационной пневмонии на основании обнаружения признаков или симптомов у людей, которые имеют какой-либо из факторов риска, описанных выше.
Рентген грудной клетки подтверждает диагноз пневмонии. Если рентгеновский снимок показывает аномалию в определенных частях легких, таких как дно легких (обычное место для аспирированного материала), скорее всего, причиной является аспирация.
Для лечения аспирационной пневмонии необходимы антибиотики. Можно использовать многие антибиотики, включая клиндамицин, амоксициллин / клавуланат, ампициллин / сульбактам и имипенем.
Людям с заболеваниями, повышающими риск аспирации, врачи могут отменить или уменьшить дозировку препаратов, вызывающих седативный эффект.Слегка приподнимите изголовье кровати, чтобы пища, жидкость или кислота из желудка не попали вверх в горло, а затем в легкие, а употребление продуктов определенной текстуры или загустевших жидкостей также помогает снизить риск аспирации. Логопед может научить человека особым приемам глотания (например, глотанию с подтягиванием подбородка к груди), чтобы еще больше снизить риск аспирации.
Как лечится пневмония при ходьбе?
Пневмония — это респираторное заболевание, которое влияет на способность пациента легко дышать.Когда инфекция поражает, воздушные мешки в легких заполняются жидкостью или гноем. Это может привести к появлению таких симптомов, как лихорадка, медленно ухудшающийся кашель, насморк или выделение носа, а также сильное чувство усталости. Существует более тридцати различных причин пневмонии, приводящих к разной степени тяжести заболевания.
Кредит изображения: Создание рабочих мест 51 / Shutterstock
Осложнения, вызванные пневмонией, могут привести к летальному исходу. Возможные осложнения могут включать:
- Респираторная недостаточность (невозможность дышать, приводящая к использованию аппарата ИВЛ)
- Синдром острого респираторного заболевания (тяжелая версия дыхательной недостаточности)
- Сепсис (заражение крови, которое может вызвать органную недостаточность)
- Легочные сосуды (жидкость внутри воздушных карманов легких, которую необходимо дренировать во время операции)
Если вовремя поймать болезнь, можно успешно вылечить ее с помощью лекарств.
Что такое ходячая пневмония?
Форма типичной пневмонии, вызываемой бактериями M ycoplasma pneumoniae , называется активной пневмонией. Это более легкая форма заболевания, которая не проявляет очень серьезных симптомов. Пациент часто принимает симптомы за простуду или грипп.
Инфекция не приводит к настолько плохому самочувствию пациента, что требуется постельный режим. Пациент продолжает ходить и соблюдать распорядок дня, отсюда и название.Только один из трех случаев активной пневмонии переходит в полноценную пневмонию. Часто его не лечат, потому что он никогда не был диагностирован.
Как лечится пневмония при ходьбе?
Пневмония при ходьбе часто не диагностируется с медицинской точки зрения. Он просто проходит курс, и в течение недели-трех недель выздоравливает. Однако при правильном диагнозе страдания пациента могут значительно облегчиться, а время выздоровления сокращается с помощью антибиотиков.
Если симптомы, похожие на простуду или грипп, сохраняются от недели до десяти дней, пациенту следует обратиться к врачу.Большинство людей не подозревают о возможности развития бодрящей пневмонии и, следовательно, не принимают надлежащих мер предосторожности при заражении ею.
Лечение на дому
Простые меры могут облегчить борьбу с бодрящей пневмонией в домашних условиях. Большинству пациентов не нужно госпитализировать для лечения.
- Отдохните побольше. Даже когда кажется, что с организмом все в порядке, пока вы справляетесь с симптомами, отдых позволяет ему быстрее восстанавливаться.
- Пейте больше жидкости.Чем больше жидкости проходит через тело, тем быстрее выводятся токсины из системы.
- Используйте грелки. Мышечные боли, сопровождающие болезнь, можно облегчить, применив теплые компрессы на пораженный участок.
- Паровые ингаляции. Размещение увлажнителя в комнате поможет, но настоящая паровая ингаляция с эфирными маслами, такими как лаванда или чайное дерево, может облегчить дискомфорт в горле.
- Используйте лекарства для контроля температуры.Температура обычно невысока, но может истощить организм. Держите это под контролем, используя нестероидные противовоспалительные препараты (НПВП).
Лечение в больнице
В случае ухудшения состояния пациента рекомендуется поместить его в больницу. Вот какое лечение им могут назначить.
- Антибиотики. Если пациент может их проглотить, ему могут назначить пероральные антибиотики, но если симптомы тяжелые, ему можно сделать внутривенное вливание.
- Кислородная терапия. Если уровень кислорода в крови будет низким, пациенту может быть назначена кислородная терапия для повышения уровня.
- Обезболивающее. Облегчение боли в теле может быть усилено обезболивающими. Для облегчения грудного кашля можно также назначить противозастойное средство.
Меры по профилактике пневмонии при ходьбе
Поскольку блуждающая пневмония — это заразное заболевание, которое распространяется внутри сообщества, принятие простых профилактических мер может снизить его способность наносить ущерб сообществу.В случае вспышки пневмонии несколько профилактических мер могут иметь большое значение.
- Инфицированные люди должны использовать салфетку при чихании. Это предотвратит попадание бактерий, присутствующих в каплях, на другие поверхности.
- Использованные салфетки следует хранить в корзине для мусора. После утилизации салфеток корзину для мусора следует обеззаразить дезинфицирующими средствами.
- Руки пациентов следует часто мыть теплой водой с мылом.Это предотвращает перенос бактерий при прикосновении к различным предметам, с которыми в дальнейшем могут обращаться другие люди.
- Салфетки на спиртовой основе следует использовать для протирания таких поверхностей, как дверные ручки, столешницы и стационарные телефоны, с которыми могут регулярно обращаться инфицированные люди и другие лица.
- Инфицированные люди должны прикрывать рот и нос маской, когда они смешиваются с толпой, чтобы помочь сдержать инфекцию.
Список литературы
- Клиника Кливленда, Ходячая пневмония, https: // my.clevelandclinic.org/health/articles/atypical-pneumonia-walking-pneumonia
- Johns Hopkins Medicine, пневмония http://www.hopkinsmedicine.org/healthlibrary/conditions/respiratory_disorders/pneumonia_85,P01321/
- CDC, Лечение антибиотиками и устойчивость, https://www.cdc.gov/pneumonia/atypical/mycoplasma/hcp/antibiotic-treatment-resistance.html
- Kids Health, Пневмония при ходьбе, http://kidshealth.org/en/parents/walking-pneumonia.html
- https: // medlineplus.gov / ency / article / 000079.htm
Дополнительная литература
Признаки, симптомы и лечение пневмонии
Погода холодная, начались насморки и кашель. Когда я работал в педиатрии первичного звена, я лечил многих детей, у которых были насморк, кашель, заложенность носа и лихорадка. В большинстве случаев это дети, у которых были вирусные заболевания верхних дыхательных путей, и они быстро поправлялись при поддерживающей терапии. А как насчет инфекции нижних дыхательных путей? Это называется пневмонией, когда жидкость и гной заполняют легкие.Состояние может быть более серьезным, чем обычная простуда.
Что такое пневмония?
Пневмония — это инфекция одного или обоих легких. Чаще всего это может быть вызвано вирусами или бактериями, но также может быть вызвано грибами или паразитами. Обычно это диагностируется при сочетании физического осмотра и рентгена грудной клетки. Пневмония часто вызывает «потрескивание» и другие аномальные звуки в груди, когда вы слушаете легкие с помощью стетоскопа. Педиатр вашего ребенка также может назначить посев мокроты (слизистой) или анализы крови.
Возможно, вы слышали термин «ходячая пневмония»? Это особый тип пневмонии, обычно вызываемой бактериями «микоплазма». Эта форма пневмонии является менее тяжелой, и дети, как правило, чувствуют себя достаточно хорошо, чтобы ходить в школу или играть, несмотря на легочную инфекцию. Если вы считаете, что у вашего ребенка «ходячая пневмония», ему все же следует пройти обследование у врача и не ходить в школу.
Один из симптомов пневмонии субфебрильная или высокая температура.
Признаки и симптомы пневмонии
Пневмония обычно начинается с инфекции верхних дыхательных путей (носа и горла), а через несколько дней переходит в инфекцию нижних дыхательных путей в легких. Симптомы зависят от возраста ребенка и возбудителя пневмонии (вирус или бактерия). Бактериальная пневмония имеет быстрое начало с высокой температурой, а вирусная пневмония развивается более постепенно и обычно выглядит менее серьезным.Симптомы пневмонии обычно включают комбинацию следующих факторов:
- Боль в животе или рвота
- Боль в груди
- Застой с большим количеством слизистой
- Кашель
- Затрудненное дыхание
- Головная боль
- Потеря аппетита
- Низкая или высокая температура (возможно, с ознобом или болями в теле)
- Учащенное дыхание
- Насморк
- Свистящее дыхание или другое «смешное» дыхание
Лечение пневмонии
Если ваш ребенок заболеет бактериальной пневмонией, ему будут прописаны антибиотики в течение одной-двух недель.Если у вашего ребенка вирусная пневмония, антибиотики не будут назначаться, потому что они не действуют на вирусы, а противовирусные препараты у детей используются нечасто. В большинстве случаев вирусным инфекциям необходимо «идти своим чередом» или проходить самостоятельно с помощью только поддерживающих методов лечения (контроль температуры или боли, введение жидкости, обеспечение комфорта ребенка). Иногда бывает сложно определить вирусную инфекцию от бактериальной пневмонии, поэтому врачи могут предпочесть лечение антибиотиками. Педиатр вашего ребенка может порекомендовать другие методы лечения, например,
- Ацетаминофен или ибупрофен
- Средства для лечения дыхания, такие как небулайзерное дыхание, пероральные стероиды или ингаляторы
Некоторым детям требуется госпитализация с более тяжелыми формами пневмонии.Госпитализированным детям с пневмонией может потребоваться дополнительный кислород, внутривенные антибиотики и лекарства, а также частые дыхательные процедуры.
Во время сезона гриппа важно определить, есть ли у вашего ребенка пневмония или другое заболевание, например грипп. Это сообщение в блоге поможет. Я призываю вас поделиться этим с другими родителями и опекунами. Моя следующая запись в блоге RN Remedies будет посвящена профилактике пневмонии и уходу за ребенком с пневмонией. Следите за этим!
Аспирационная пневмония — что вам нужно знать
- CareNotes
- Аспирационная пневмония
Этот материал нельзя использовать в коммерческих целях, в больницах или медицинских учреждениях.Несоблюдение может повлечь судебный иск.
ЧТО НУЖНО ЗНАТЬ:
Что такое аспирационная пневмония?
Аспирационная пневмония — это легочная инфекция, которая развивается после того, как вы всасываете (вдыхаете) пищу, жидкость или рвоту в легкие. Вы также можете аспирировать пищу или жидкость из желудка, которые попадают в пищевод. Если вы не можете откашлять аспирированный материал, в ваших легких могут размножиться бактерии и вызвать инфекцию.
Что увеличивает мой риск аспирационной пневмонии?
Ваш риск наиболее высок, если вы старше 75 лет или живете в доме престарелых или центре длительного ухода.С возрастом вы можете стать менее активным или прикованным к постели. Возможно, вы не сможете хорошо глотать или кашлять. Также повышают риск аспирационной пневмонии:
- Мышцы, которые помогают глотать, ослаблены инсультом, болезнью Альцгеймера или другими заболеваниями
- Ослабленная иммунная система, вызванная диабетом, ХОБЛ, сердечной недостаточностью или другими проблемами со здоровьем
- Курение сигарет
- Использование зонда для кормления или вентилятора, позволяющего бактериям попадать в легкие
- Операция или лучевая терапия для лечения рака головы или шеи
- Плохая гигиена полости рта, отсутствие зубов или зубных протезов
- Алкоголизм или внутривенное употребление наркотиков
Каковы признаки и симптомы аспирационной пневмонии?
- Лихорадка
- Кашель с выделением или отсутствием слизи
- Мокрота розовая или пенистая
- Синеватая кожа вокруг рта и кончиков пальцев
- Проблемы с глотанием
- Одышка, учащенное или шумное дыхание
- Боль в груди или учащенное сердцебиение
- Замешательство, утомляемость или изменение бдительности
- Изменения голоса, например бульканье и охриплость
- Потеря аппетита или потеря веса
Как диагностируется аспирационная пневмония?
Часто делают аспирацию, но не подозревают об этом.Ваш лечащий врач может диагностировать аспирационную пневмонию, если у вас есть симптомы и проблемы с глотанием в анамнезе. Он или она спросит о ваших симптомах и о том, когда они начались. Он или она заглянет вам внутрь рта и в горло и прислушается к вашему сердцу и легким. Ваш лечащий врач попросит вас говорить и кашлять, пока он или она слушает. Расскажите ему или ей о любых проблемах со здоровьем и о любых лекарствах, которые вы принимаете. Вам может понадобиться любой из следующих тестов:
- Анализы крови используются для определения высокого уровня лейкоцитов.Это может быть признаком заражения.
- Бариевая ласточка может показать, если у вас есть долгосрочные проблемы с глотанием. Ваш лечащий врач будет следить за тем, как вы глотаете различные продукты и жидкости. Вас могут попросить выпить густую жидкость под названием барий, пока медицинские работники делают рентгеновские снимки вашего горла, пищевода и легких.
- Посев мокроты может быть проверен на наличие бактерий, которые могут вызвать пневмонию. Ваш лечащий врач может попросить вас откашлять слизь в чашку, или он или она может отсосать слизь из вашего горла.
- Рентген или снимки CT могут показать повреждение легких или инфекцию, например отек и жидкость в легких. Вам могут дать контрастную жидкость перед компьютерной томографией, чтобы ваш лечащий врач мог лучше рассмотреть изображения. Сообщите своему врачу, если у вас когда-либо была аллергическая реакция на контрастную жидкость.
Как лечится аспирационная пневмония?
Вам может понадобиться любое из следующего:
- Антибиотики назначаются для лечения пневмонии, вызванной бактериями.Вам могут назначить антибиотики в виде таблеток или внутривенно.
- Стероиды используются для уменьшения отека легких.
- Вам может потребоваться дополнительный кислород , если уровень кислорода в крови ниже допустимого. Вы можете получить кислород через маску, надетую на нос и рот, или через маленькие трубки, вставленные в ноздри. Перед тем, как снимать маску или кислородную трубку, проконсультируйтесь с лечащим врачом.
Что я могу сделать для предотвращения или лечения аспирационной пневмонии?
- Обратитесь к логопеду в соответствии с указаниями. Логопед научит вас упражнениям для укрепления мышц, которые вы используете для глотания.
- Сядьте, пока ешь. Если вы прикованы к постели, держите изголовье кровати слегка приподнятым (под углом примерно от 30 ° до 45 °) во время еды. Ешьте небольшими кусочками, ешьте медленно и глотайте, опустив подбородок.
- Ешьте мягкую пищу и пейте загустевшие жидкости. Диетолог научит вас делать жидкости более густыми, чтобы у вас было меньше проблем с глотанием. Пейте жидкости через трубочку или пейте их ложкой.Спросите у диетолога, какие продукты вам следует есть. Он или она может посоветовать мягкую пищу, такую как вареные хлопья, макароны, хорошо приготовленные фрукты и овощи и яичницу-болтунью. Ваш диетолог может также посоветовать влажное нежное мясо, нарезанное небольшими кусочками.
- Уход за зубами и полостью рта. Средства для ухода за полостью рта могут помочь убить вредные бактерии во рту, чтобы вы не аспирировали их. Сидя, чистите зубы в течение 2 минут в день после завтрака и снова после ужина.Также почистите язык. Если у вас нет зубов, аккуратно почистите десны мягкой зубной щеткой. Протезы следует снимать и чистить электрической зубной щеткой и водой после завтрака и ужина. Замочите протезы на ночь в чистящем растворе. Регулярно посещайте стоматолога для чистки зубов и десен.
- Ограничьте или избегайте приема седативных средств. Эти лекарства увеличивают риск аспирации, потому что они сушат рот и вызывают сонливость. По возможности избегайте приема антигистаминных препаратов, потому что они также вызывают сухость во рту.
- Не курите. Никотин и другие химические вещества в сигаретах и сигарах могут вызывать повреждение легких. Обратитесь к своему врачу за информацией, курите ли вы в настоящее время и нуждаетесь в помощи, чтобы бросить курить. Электронные сигареты или бездымный табак по-прежнему содержат никотин. Перед использованием этих продуктов проконсультируйтесь со своим врачом.
Когда мне следует немедленно обратиться за помощью?
- У вас боль в груди.
- Вы сбиты с толку или не можете ясно мыслить.
- У вас проблемы с дыханием, или ваше дыхание кажется учащенным, чем обычно.
Когда мне следует связаться с поставщиком медицинских услуг?
- У вас жар.
- Ваши симптомы не улучшаются после 2 или 3 дней лечения.
- У вас есть вопросы или опасения по поводу вашего состояния или ухода.
Соглашение об уходе
У вас есть право помочь спланировать свое лечение. Узнайте о своем состоянии здоровья и о том, как его можно лечить. Обсудите варианты лечения со своими поставщиками медицинских услуг, чтобы решить, какое лечение вы хотите получать.Вы всегда имеете право отказаться от лечения. Вышеуказанная информация носит исключительно учебный характер. Он не предназначен для использования в качестве медицинского совета по поводу индивидуальных состояний или лечения. Поговорите со своим врачом, медсестрой или фармацевтом, прежде чем следовать какой-либо лечебной схеме, чтобы узнать, безопасно ли она для вас и эффективна.
© Copyright IBM Corporation 2021 Информация предназначена только для использования Конечным пользователем и не может быть продана, распространена или иным образом использована в коммерческих целях. Все иллюстрации и изображения, включенные в CareNotes®, являются собственностью A.D.A.M., Inc. или IBM Watson Health
Подробнее об аспирационной пневмонии
Сопутствующие препараты
IBM Watson Micromedex
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности за медицинское обслуживание
.

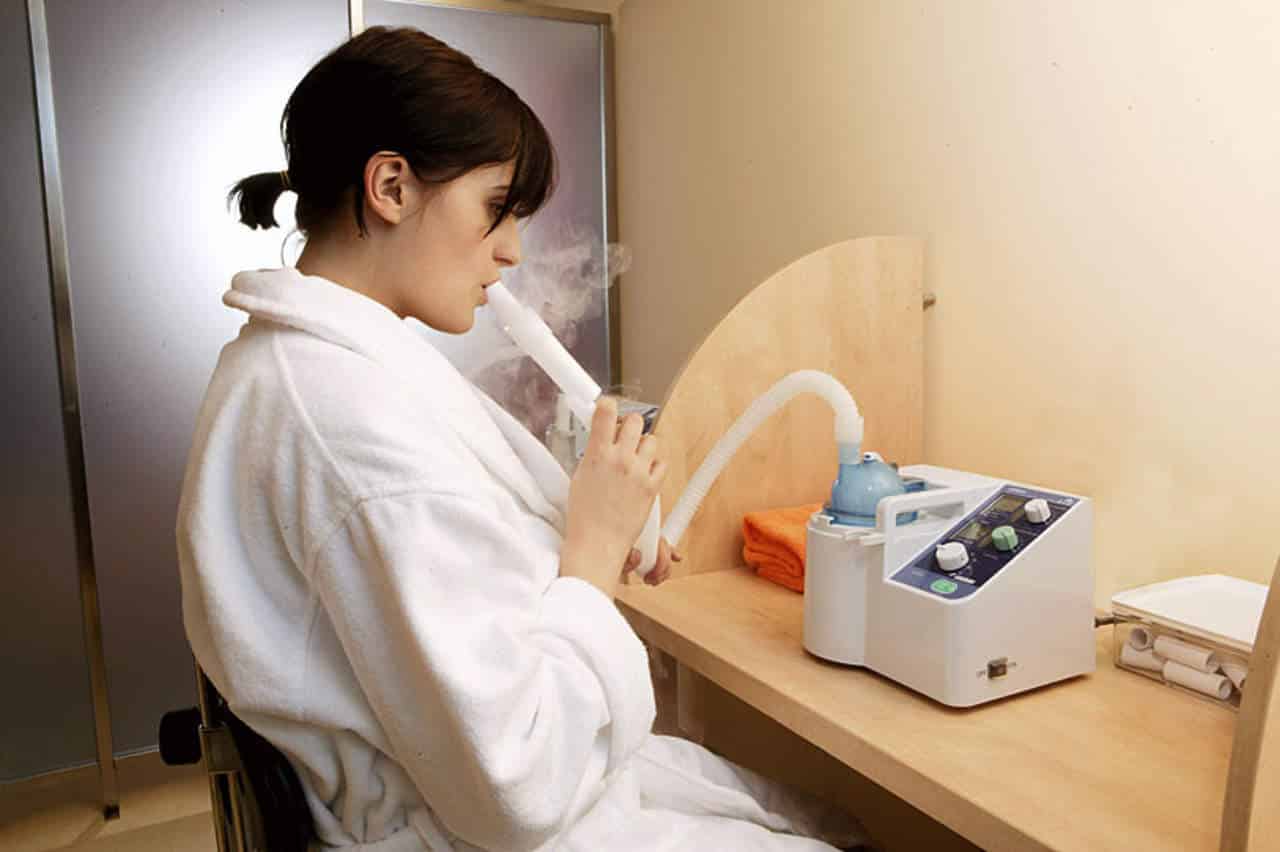 Еще лучше оставить бутылку открытой на несколько часов или на ночь.
Еще лучше оставить бутылку открытой на несколько часов или на ночь.
 Не рекомендуются горячие ингаляции, так как можно получить ожог дыхательных путей.
Не рекомендуются горячие ингаляции, так как можно получить ожог дыхательных путей.