Внебольничные пневмонии тяжелого течения: особенности терапии | Ноников В.Е., Фоминых В.П., Латков О.Е., Колерова О.В.
Диагностика и своевременная оптимальная терапия пневмоний (П) не теряют своей актуальности. Надежды на успешное решение всех проблем лечения П с помощью антибиотиков не оправдались. Несмотря на огромный арсенал антибактериальных средств летальность при этом заболевании остается высокой. Весьма впечатляет, что многие годы структура летальности США, в порядке убывающей значимости, была следующей: все сердечно–сосудистые заболевания; все злокачественные новообразования; убийства, самоубийства, несчастные случаи; пневмония. Как видно, первые три позиции занимали группы различных причин смерти, а четвертая позиция представлена единственной нозологический формой – пневмонией. Опубликованные данные [1,2] свидетельствуют, что общая летальность при П составляет 11,8%, но варьирует в широком диапазоне в зависимости от возбудителей. Наибольшая летальность отмечена при П, вызванных синегнойной палочкой (61,1%), клебсиеллой (35,7%), золотистым стафилококком (31,8%), ассоциациями бактерий (23,6%). Ниже летальность при П, вызванных легионеллой (14,7%), пневмококками (12,3%), хламидиями (9,8%), гемофильными палочками (7,4%), микоплазмой (1,4%).
Ниже летальность при П, вызванных легионеллой (14,7%), пневмококками (12,3%), хламидиями (9,8%), гемофильными палочками (7,4%), микоплазмой (1,4%).
Этиологический принцип деления пневмоний (П), положенный в основу Международной статистической классификации, принципиально самый правильный, но следует признать, что и на рубеже XXI века этиологическая расшифровка пневмоний при первом контакте с пациентом невозможна. Поэтому повсеместное распространение получило сугубо прагматичное деление пневмоний на внебольничные (Community–acquired pneumonia) и внутрибольничные (Nosocomial pneumonia). Столь условное деление П, тем не менее, является оправданным для единственной практической цели – эмпирического выбора антибиотика первого ряда, потому что различаются их этиологические агенты. Суждение о месте развития П врач может вынести незамедлительно после сбора анамнеза, а следовательно, и более обоснованно подойти к выбору антибактериального средства.
Самыми частыми возбудителями внебольничных пневмоний являются [1–4] пневмококки, стрептококки, гемофильные палочки и внутриклеточные агенты: микоплазма, хламидия, легионелла, вирусы. Пневмонии, вызванные клебсиеллой нередко развиваются у алкоголиков (аспирация рвотных масс).
Пневмонии, вызванные клебсиеллой нередко развиваются у алкоголиков (аспирация рвотных масс).
Внутрибольничные пневмонии чаще вызываются стафилококками и энтеробактериями, особенно тяжело протекают пневмонии, вызванные полирезистентной синегнойной палочкой.
В работах, посвященных лечению пневмоний [1–4], основное внимание уделяется антибактериальной терапии. Это крайне важно, потому что именно оптимальная антибактериальная терапия определяет исход заболевания. С другой стороны, единственная цель и возможности антибактериальной терапии – это подавление инфекции и эрадикация возбудителя. Полноценное лечение П должно быть не только этиотропным, но и патогенетическим, потому что при этом заболевании инфекционное начало сопряжено с проблемами иммунитета, собственно воспаления и нарушенных функций. У лиц пожилого и старческого возраста развитие П нередко влечет за собой обострение сопутствующих заболеваний, что тоже должно учитываться при проводимой терапии.
Поэтому представляется рациональной программная терапия пневмоний тяжелого течения, которая различается в острый период болезни и в период выздоровления. Схематично программа, используемая нами в многопрофильной больнице на протяжении 20 лет, заключается в следующем:
Схематично программа, используемая нами в многопрофильной больнице на протяжении 20 лет, заключается в следующем:
Острый период болезни:
• Подавление инфекции (антибактериальная терапия)
• Лечение дыхательной недостаточности
• Стабилизация гемодинамики
• Дезинтоксикационая терапия
• Коррекция нарушений гемостаза
• Заместительная иммунотерапия
• Лечение сопутствующих заболеваний
• Симптоматическая терапия
Период выздоровления:
• Противовоспалительная терапия
• Улучшение вентиляции
• Улучшение микроциркуляции
• Лечение сопутствующих заболеваний
• Проведение реабилитационных программ
Всего по этим программам мы ежегодно лечили в отделении пульмонологии многопрофильной больницы 300–400 больных П, из которых 10% переносили П тяжелого течения, а 5% нуждались в терапии в условиях реанимационного отделения. Следует отметить, что за многолетний период в этой программе претерпела значительные изменения тактика антибактериальной терапии: появились новые антибиотики, изменились эпидемиологическая ситуация и резистентность микроорганизмов к антибиотикам, появились новые схемы антибактериальной терапии, стали использоваться неизвестные ранее сочетания антибиотиков.
В остром периоде болезни лечение П начинается с антибактериальной терапии, которая должна применяться в кратчайшие сроки после установления диагноза. Этиология заболевания в этот момент неизвестна и врач ориентируется на клиническую картину, рентгенологические данные, собственный опыт, аллергологический анамнез и знание спектра действия антибактериальных средств. Фактически выбор антибиотика осуществляется эмпирически. На этапе выбора антибиотика врачу может помочь анализ клинической ситуации. Именно в это время существенно оценить эпидемиологическую ситуацию, фоновые заболевания (хронический бронхит, диабет, аспирационный синдром и т.д.), вредные привычки.
В качестве определенной помощи врачу представляет клинический интерес сопоставление [1,2] рентгеноморфологических данных с этиологическими агентами пневмоний. Долевые и многодолевые паренхиматозные инфильтрации характерны для бактерий (в том числе пневмококк и легионелла). Очагово–сливные двусторонние инфильтрации могут быть гриппозной, пневмококковой, стафилококковой и легионеллезной природы. Гомогенные очаговые инфильтрации характерны для пневмококковой и легионеллезной инфекции, в то время как негомогенные очаговые инфильтрации более типичны для вирусной, стафилококковой и микоплазменной природы. Сочетание инфильтративных и интерстициальных изменений типично для поражений вирусами, микоплазмой, пневмоцистами. Пневмонии, проявляющиеся милиарными интерстициальными изменениями, характерны для сальмонелл, МБТ, грибов. Вирусы, микоплазма, хламидии, грибы нередко вызывают пневмонии рентгенологически проявляющиеся сетчатыми интерстициальными изменениями. Пневмония проявляющаяся инфильтративными или интерстициальными изменениями в сочетании с увеличением лимфатических узлов средостения чаще вызываются МБТ, микоплазмой, хламидиями, грибами. Деструктивные пневмонии с развитием множественных перибронхиальных абсцессов обычны при стафилококковой инфекции, в то время как единичные крупные абсцессы более типичны для пневмоний, вызванных клебсиеллой.
Гомогенные очаговые инфильтрации характерны для пневмококковой и легионеллезной инфекции, в то время как негомогенные очаговые инфильтрации более типичны для вирусной, стафилококковой и микоплазменной природы. Сочетание инфильтративных и интерстициальных изменений типично для поражений вирусами, микоплазмой, пневмоцистами. Пневмонии, проявляющиеся милиарными интерстициальными изменениями, характерны для сальмонелл, МБТ, грибов. Вирусы, микоплазма, хламидии, грибы нередко вызывают пневмонии рентгенологически проявляющиеся сетчатыми интерстициальными изменениями. Пневмония проявляющаяся инфильтративными или интерстициальными изменениями в сочетании с увеличением лимфатических узлов средостения чаще вызываются МБТ, микоплазмой, хламидиями, грибами. Деструктивные пневмонии с развитием множественных перибронхиальных абсцессов обычны при стафилококковой инфекции, в то время как единичные крупные абсцессы более типичны для пневмоний, вызванных клебсиеллой.
Больные пневмониями тяжелого течения подлежат госпитализации в терапевтические (пульмонологические) отделения или, при опасных для жизни проявлениях болезни – в блоки интенсивной терапии/реанимации.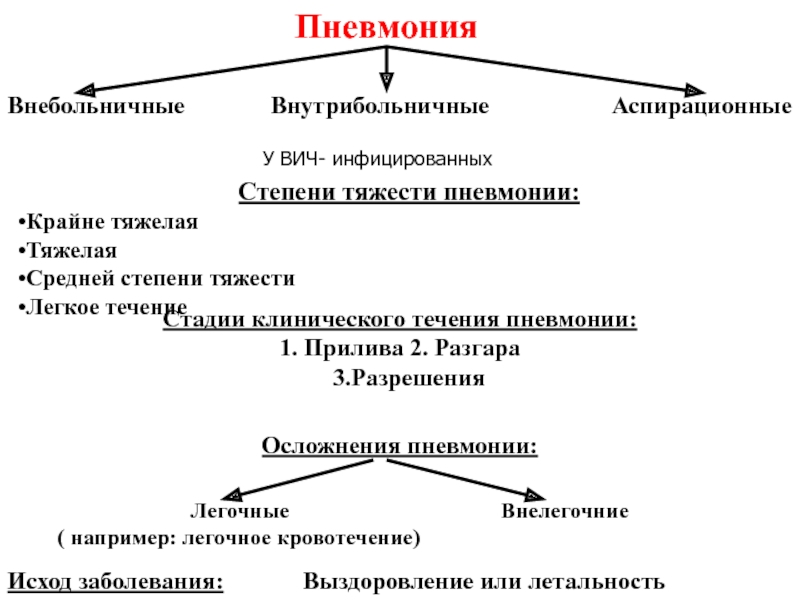 При установлении диагноза П тяжелого течения антибактериальная терапия должна начинаться незамедлительно с внутривенного применения препаратов. Экстренное применение антибиотиков применительно к тяжелым П в последние годы считается обязательным и подразумевает сроки, соответствующие срокам применения фибринолитической терапии при инфаркте миокарда. В начальный (самый ответственный) период лечения стала широко использоваться так называемая деэскалационная терапия, когда при П тяжелого течения, в период до уточнения возбудителя назначаются сочетания антибиотиков, с наибольшей вероятностью подавляющих возможный спектр этиологических агентов.
При установлении диагноза П тяжелого течения антибактериальная терапия должна начинаться незамедлительно с внутривенного применения препаратов. Экстренное применение антибиотиков применительно к тяжелым П в последние годы считается обязательным и подразумевает сроки, соответствующие срокам применения фибринолитической терапии при инфаркте миокарда. В начальный (самый ответственный) период лечения стала широко использоваться так называемая деэскалационная терапия, когда при П тяжелого течения, в период до уточнения возбудителя назначаются сочетания антибиотиков, с наибольшей вероятностью подавляющих возможный спектр этиологических агентов.
В стационаре может использоваться схема при которой внебольничные П лечатся b–лактамными антибиотиками (амоксициллин, амоксициллин/клавуланат, цефотаксим, цефтриаксон, цефепим, меропенем) или их сочетанием с макролидами (азитромицин, кларитромицин, эритромицин) при подозрении на возможность инфицирования внутриклеточными агентами, или при тяжелом течении заболевания. Возможно применение респираторных фторхинолонов (левофлоксацин, моксифлоксацин). Сочетания b–лактамных антибиотиков с аминогликозидами и/или фторхинолонами используются при абсцедировании. При подозрении на аспирацию назначаются b–лактамные препараты, активные в отношении грамотрицательной флоры в сочетании с аминогликозидами (амикацин) и/или фторхинолонами (офлоксацин, ципрофлоксацин) и/или метронидазолом.
Возможно применение респираторных фторхинолонов (левофлоксацин, моксифлоксацин). Сочетания b–лактамных антибиотиков с аминогликозидами и/или фторхинолонами используются при абсцедировании. При подозрении на аспирацию назначаются b–лактамные препараты, активные в отношении грамотрицательной флоры в сочетании с аминогликозидами (амикацин) и/или фторхинолонами (офлоксацин, ципрофлоксацин) и/или метронидазолом.
Важное значение имеют лечение дыхательной недостаточности, стабилизация гемодинамики, дезинтоксикационная терапия, коррекция нарушений гемостаза. У лиц пожилого и старческого возраста важно проводить лечение сопутствующих заболеваний, которые обычно обостряются при развитии пневмонии.
В период выздоровления необходимости в антибактериальной терапии не имеется. В этот период важно проводить противовоспалительную терапию и обеспечивать восстановление нарушенных функций легочной вентиляции и капиллярного кровотока. Проведение реабилитационных программ и лечение сопутствующих заболеваний существенно способствуют полному выздоровлению.
На протяжении многих лет описанная программа комплексной терапии пневмоний показала высокую эффективность.
Итак, для клинической практики, важно разделять пневмонии по тяжести течения и в этом плане лучше всего сформулировано понятие пневмонии тяжелого течения, в то время как дефиниция легкого и средней тяжести течения субъективна (если не использовать шкалу бальной оценки риска [3], приведенную в таблицах 1 и 2. В зависимости от классов риска уровень возможной летальности варьирует от 0,1–0,4% (1 класс) до 30% (5 класс), то–есть может различаться в 60 (!) раз. В соответствии со шкалой A. Fein тяжесть течения П увеличивается с возрастом и во многом обусловлена серьезными сопутствующими заболеваниями и осложнениями самой П.
Наблюдение 1. Пациент Н., 22 лет, экстренно госпитализирован в отделение реанимации в первый день заболевания. Дебют острый – озноб, фебрильная лихорадка до 39°С, плевральная боль справа, одышка. Дома развилась артериальная гипотензия до 60/40 мм рт. ст. Отягощающих сопутствующих и перенесенных заболеваний нет. В анамнезе аллергическая реакция на пенициллин. При осмотре состояние тяжелое. Температура тела 37,0°С. Кожные покровы бледные. Сознание ясное. Артериальная гипотензия 75/40 мм рт ст. Синусовая тахикардия с ЧСС до 110 в 1 мин. Умеренная одышка с ЧД до 22–24 в покое. Аускультативно в нижней доле правого легкого дыхание незначительно ослаблено. Хрипы не выслушиваются, шум а трения плевры нет. При экстренном обследовании рентгенологически выявлена массивная пневмоническая инфильтрация нижней доли правого легкого. По данным эхокардиографии – признаки легочной гипертензии. Ультразвуковое исследование обнаружило гепато– и спленомегалию. Анализ крови: нейтрофильный лейкоцитоз 37,3 тыс./мкл (палочкоядерных нейтрофилов – 33%), в капиллярной крови рН – 7,39; рО2 – 62,3; рСО2 – 33,8; sO2 – 91,3%. Биохимический скрининг – без отклонений от нормы.
ст. Отягощающих сопутствующих и перенесенных заболеваний нет. В анамнезе аллергическая реакция на пенициллин. При осмотре состояние тяжелое. Температура тела 37,0°С. Кожные покровы бледные. Сознание ясное. Артериальная гипотензия 75/40 мм рт ст. Синусовая тахикардия с ЧСС до 110 в 1 мин. Умеренная одышка с ЧД до 22–24 в покое. Аускультативно в нижней доле правого легкого дыхание незначительно ослаблено. Хрипы не выслушиваются, шум а трения плевры нет. При экстренном обследовании рентгенологически выявлена массивная пневмоническая инфильтрация нижней доли правого легкого. По данным эхокардиографии – признаки легочной гипертензии. Ультразвуковое исследование обнаружило гепато– и спленомегалию. Анализ крови: нейтрофильный лейкоцитоз 37,3 тыс./мкл (палочкоядерных нейтрофилов – 33%), в капиллярной крови рН – 7,39; рО2 – 62,3; рСО2 – 33,8; sO2 – 91,3%. Биохимический скрининг – без отклонений от нормы.
Диагностирована долевая пневмония тяжелого течения. После посева крови на стерильность начата внутривенная терапия меропенемом (3,0 г/сут) в сочетании с азитромицином перорально (0,5 г/сут). Ликвидировать артериальную гипотензию не удавалось несмотря на массивное внутривенное применение коллоидов, кристаллоидов, оксигенотерапию. Клиническая ситуация расценена как септический шок. Стабилизация гемодинамики достигнута только путем многочасового вазопрессорного лечения допамином. На основании антибиотикограммы выделенной гемокультуры зеленящего стрептококка азитромицин отменен, продолжена монотерапия меропенемом. После стабилизации и убедительного улучшения состояния пациента внутривенное лечение меропенемом прекращено и, в режиме ступенчатой терапии, антибактериальная терапия продолжена пероральным применением моксифлоксацина (400 мг/сут). Диагноз сформулирован как долевая стрептококковая пневмония тяжелого септического течения, осложненная септическим шоком. Проведено в отделении реанимации 10 суток, в отделении пульмонологии – 4 койко/дня. На 14 сутки лечения достигнуто клинико–рентгенологическое разрешение пневмонии. Констатировано выздоровление.
Ликвидировать артериальную гипотензию не удавалось несмотря на массивное внутривенное применение коллоидов, кристаллоидов, оксигенотерапию. Клиническая ситуация расценена как септический шок. Стабилизация гемодинамики достигнута только путем многочасового вазопрессорного лечения допамином. На основании антибиотикограммы выделенной гемокультуры зеленящего стрептококка азитромицин отменен, продолжена монотерапия меропенемом. После стабилизации и убедительного улучшения состояния пациента внутривенное лечение меропенемом прекращено и, в режиме ступенчатой терапии, антибактериальная терапия продолжена пероральным применением моксифлоксацина (400 мг/сут). Диагноз сформулирован как долевая стрептококковая пневмония тяжелого септического течения, осложненная септическим шоком. Проведено в отделении реанимации 10 суток, в отделении пульмонологии – 4 койко/дня. На 14 сутки лечения достигнуто клинико–рентгенологическое разрешение пневмонии. Констатировано выздоровление.
В приведенном наблюдении важно отметить, что у молодого и исходно здорового человека пневмония манифестировала доказанной бактериемией, причем уже в дебюте заболевания развился тяжелый септический шок. В то же время при оценке по шкале A. Fein пневмония соответствовала только 2–му классу риска, при котором летальность невелика и больные могут лечиться амбулаторно. Поэтому можно отметить, что прогностическая оценка по классам риска не всегда верна, особенно применительно к лицам молодого возраста и тогда тяжесть течения заболевания следует оценивать не по прогностической шкале, а исходя из реальной клинической ситуации.
В то же время при оценке по шкале A. Fein пневмония соответствовала только 2–му классу риска, при котором летальность невелика и больные могут лечиться амбулаторно. Поэтому можно отметить, что прогностическая оценка по классам риска не всегда верна, особенно применительно к лицам молодого возраста и тогда тяжесть течения заболевания следует оценивать не по прогностической шкале, а исходя из реальной клинической ситуации.
Доказательные признаки П тяжелого течения [4,6] наиболее полно были сформулированы Американским торакальным обществом (ATS) и, с небольшой коррекцией, используются в Европейских странах. Тяжесть течения пневмонии определяется по клиническим признакам и данным обследования.
Это:
• Дыхательная недостаточность (число дыханий > 30 в 1 мин)
• Сосудистая недостаточность (АД систолическое
• Лихорадка > 38,3°С
• Сонливость, сопор, дезориентация
• Внелегочные очаги инфекции: менингит, септический артрит и т.п.
• Лейкопения 30.0 тыс/мкл
• Ра О2
• Гематокрит
• Почечная недостаточность
• Многодолевое поражение, удвоение зоны инфильтрации за 48 часов, абсцедирование, плевральный выпот
Наблюдение 2. Пациент М.И.В., 47 лет, госпитализирован в реанимационное отделение в связи с интенсивной болью в верхних отделах живота и артериальной гипотонией до 70/60 мм рт.ст. Направительный диагноз – «прободная язва желудка». Дебют острый – за 2 суток до госпитализации возникла лихорадка до 39°С, познабливание, сухой кашель, боль в животе, слабость, миалгия. Эпидемиологический анамнез – контакт с птицей (домашний попугай, птичий корм покупался на рынке). Отягощающие заболевания – хронический бронхит на фоне табакокурения, хронический парадонтит.
Пациент М.И.В., 47 лет, госпитализирован в реанимационное отделение в связи с интенсивной болью в верхних отделах живота и артериальной гипотонией до 70/60 мм рт.ст. Направительный диагноз – «прободная язва желудка». Дебют острый – за 2 суток до госпитализации возникла лихорадка до 39°С, познабливание, сухой кашель, боль в животе, слабость, миалгия. Эпидемиологический анамнез – контакт с птицей (домашний попугай, птичий корм покупался на рынке). Отягощающие заболевания – хронический бронхит на фоне табакокурения, хронический парадонтит.
При осмотре состояние тяжелое. Кожные покровы бледные, акроцианоз. Сознание сохранено. Выраженная артериальная гипотензия до 40/0 мм рт.ст. Олигурия. Синусовая тахикардия (ЧСС 120 в 1 мин). Одышка в покое с ЧД до 30 в 1 мин. Аускультативно над левым легким выслушивается бронхиальное дыхание. Хрипов и шума трения плевры нет. Живот не вздут, участвует в акте дыхания, при пальпации мягкий, болезненный в верхних отделах. Симптом Щеткина сомнительный. При перкуссии живота печеночная тупость сохранена. Печень и селезенка не увеличены.
Печень и селезенка не увеличены.
При экстренном эндоскопическом, рентгенологическом и ультразвуковом исследованиях признаков острого хирургического заболевания не выявлено.
На рентгенографии легких (рис. 1) выявлена двусторонняя верхнедолевая пневмония. В анализах крови – нейтрофильный лейкоцитоз 10,3 тыс./мкл со значительным изменением лейкоцитарной формулы (палочкоядерные нейтрофилы 58,5%, миелоциты 3,5%, метамиелоциты 4,0%), тромбоцитопения (148 тыс/мкл), повышение уровня креатинина (178 мкмоль/л) и мочевины (11,4 ммоль/л), в капиллярной крови – гипоксемия (pO2 – 42 мм Hg, sO2 – 79,5%), ацидоз (pH – 7,33).
Диагностирована тяжелая двусторонняя пневмония, осложнившаяся плевритом, септическим шоком и полиорганной недостаточностью. Клинико–лабораторные данные (очаг инфекции, системный воспалительный ответ, дыхательная, сосудистая, почечная недостаточность, потребление тромбоцитов) были основанием для диагностики сепсиса. Этиологический агент был неизвестен, а эпидемиологические данные допускали предположение об орнитозной (хламидийной) инфекции или ассоциации возбудителей с участием внутриклеточных агентов. Начато антибактериальное лечение: цефепим 3,0 г/сут внутривенно в сочетании с азитромицином 1,0 г/сут перорально. На фоне массивной внутривенной инфузии коллоидов и кристаллоидов, введения свежезамороженной плазмы, гепарина, анальгетиков, оксигенотерапии удалось устранить явления септического шока и уменьшить степень дыхательной недостаточности.
Начато антибактериальное лечение: цефепим 3,0 г/сут внутривенно в сочетании с азитромицином 1,0 г/сут перорально. На фоне массивной внутривенной инфузии коллоидов и кристаллоидов, введения свежезамороженной плазмы, гепарина, анальгетиков, оксигенотерапии удалось устранить явления септического шока и уменьшить степень дыхательной недостаточности.
При контрольной рентгенографии легких через 48 часов (рис. 2) и при компьютерной томографии – через 72 часа (рис. 3) выявлено значительное прогрессирование пневмонии. Аускультативно в легких с обеих сторон на фоне большого количества влажных хрипов стала выслушиваться инспираторная крепитация. Проведена иммунозаместительная внутривенная терапия поливалентным человеческим иммуноглобулином. Коротким курсом использованы небольшие дозы глюкокортикостероидов. Проведена коррекция антибактериальной терапии: сочетанное внутривенное применение меропенема 3,0 г/сут и левофлоксацина 0,5 г/сут, а также противогрибковое лечение флуконазолом внутривенно 0,2 г/сут. Из правой плевральной полости эвакуирован нейтрофильный экссудат.
Из правой плевральной полости эвакуирован нейтрофильный экссудат.
При повторных посевах крови и плевральной жидкости роста микрофлоры не получено. Диагностически значимых концентраций бактерий в посевах мокроты не выявлено. Первоначальные предположения о возможной этиологической роли орнитоза (хламидиоза) подтвердились последующим диагностическим увеличением титра антител к антигену орнитоза в парных сыворотках.
Общая продолжительность антибактериального лечения составила 11 суток. На 17 сутки лечения на фоне убедительного клинического улучшения состояния пациента при контрольной компьютерной томографии легких выявлена выраженная положительная динамика: пневмоническая инфильтрация и двусторонний плеврит полностью разрешились. На 21 сутки пациент в удовлетворительном состоянии выписан домой.
Особенностью этого наблюдения был выраженный плевральный болевой синдром, следствием которого была диагностическая ошибка на догоспитальном этапе. Тяжелое течение П определялось полиорганными нарушениями, и драматическим течением болезни, характерным для тяжелого сепсиса. Серологически верифицированный возбудитель возможно являлся не единственным этиологическим агентом, но принципиально важно, что анализ эпидемиологической ситуации клиницистами, не исключал вариант хламидиоза (орнитоза). Антибактериальная терапия исходно была ориентирована на подавление широкого спектра возможных патогенов.
Серологически верифицированный возбудитель возможно являлся не единственным этиологическим агентом, но принципиально важно, что анализ эпидемиологической ситуации клиницистами, не исключал вариант хламидиоза (орнитоза). Антибактериальная терапия исходно была ориентирована на подавление широкого спектра возможных патогенов.
Собственный многолетний опыт диагностики и лечения больных пневмонией реанимационного уровня позволил сформулировать и критерии пневмоний крайней тяжести (табл. 3). К подобным пневмониям можно отнести по наличию одного из таких клинических признаков как:
• Необходимость проведения ИВЛ
• Септический шок
• Применение прессорных аминов для стабилизации гемодинамики более 4 часов
• Кома
• Дистресс–синдром
• Полиорганная недостаточность.
Фактически речь идет о больных П септического течения или с развернутой картиной сепсиса, нуждающихся в реанимационных мероприятиях. У больных П крайне тяжелого течения драматическая клиническая симптоматика обычно дополняется результатами обследования при котором выявляют палочкоядерный сдвиг (до 50% и более) в лейкоцитарной формуле, развитие ДВС–синдрома, признаки почечной и/или печеночной недостаточности, выделение гемокультуры (особый риск при выделении грамотрицательной флоры или ассоциации возбудителей). Рентгенологически обычно фиксируется удвоение зоны инфильтрации за 48 часов или сочетание массивной инфильтрации с признаками дистресс–синдрома. Эта программа не противоречит последним публикациям [5] придающим особое значение старческому возрасту, септическому шоку, необходимости проведения ИВЛ.
Рентгенологически обычно фиксируется удвоение зоны инфильтрации за 48 часов или сочетание массивной инфильтрации с признаками дистресс–синдрома. Эта программа не противоречит последним публикациям [5] придающим особое значение старческому возрасту, септическому шоку, необходимости проведения ИВЛ.
Наблюдение 3. Пациент Г.Д.М., 75 лет, госпитализирован в реанимационное отделение. Заболел остро – за 5 часов до госпитализации возникли одышка, кашель, повышение температура тела до 37,5°С. Страдает атеросклерозом сосудов головного мозга, кистами головного мозга различных сроков давности вследствие повторных инсультов, болезнью Паркинсона, нарушением глотания; постинфарктным и диффузным кардиосклерозом; хронической обструктивной болезнью легких; сахарным диабетом 2 типа; наличием пролежней вследствие длительной гипокинезии. Обращают на себя внимание частые предшествующие госпитализации с повторными курсами антибактериального лечения.
При осмотре состояние тяжелое. Температура тела 36,0°С. Тургор кожных покровов снижен, акроцианоз, множественные пролежни. Сознание нарушено – сопор. Нарушение глотания. Одышка с ЧДД 26 в 1 мин. Синусовая тахикардия с ЧСС 130 в 1 мин. Артериальная гипотензия: АД 60/40 мм рт.ст. Аускультативно в легких на фоне ослабленного везикулярного дыхания выслушиваются рассеянные мелкопузырчатые хрипы. Живот мягкий, на пальпацию пациент не реагирует. Стул обычного цвета и консистенции.
Тургор кожных покровов снижен, акроцианоз, множественные пролежни. Сознание нарушено – сопор. Нарушение глотания. Одышка с ЧДД 26 в 1 мин. Синусовая тахикардия с ЧСС 130 в 1 мин. Артериальная гипотензия: АД 60/40 мм рт.ст. Аускультативно в легких на фоне ослабленного везикулярного дыхания выслушиваются рассеянные мелкопузырчатые хрипы. Живот мягкий, на пальпацию пациент не реагирует. Стул обычного цвета и консистенции.
При обследовании рентгенологически выявлена двусторонняя полисегментарная инфильтрация легочной паренхимы, в анализах крови – высокий нейтрофильный лейкоцитоз (29,2 тыс/мкл) с выраженными изменениями лейкоцитарной формулы (палочкоядерные нейтрофилы 64%, миелоциты 4%, метамиелоциты 0,5%), гипергликемия (12,1 ммоль/л), повышенный уровень мочевины (11 ммоль/л), в капиллярной крови – выраженная гипоксемия (pO2 – 46,7 мм рт.ст., sO2 – 79,8%). Показатели эритроцитов и гемоглобина крови нормальные.
Диагностирована двусторонняя аспирационная пневмония тяжелого течения на фоне нарушения глотания, паркинсонизма и длительной гипокинезии у пациента с тяжелым сосудистым поражением мозга и рядом отягощающих сопутствующих заболеваний. Экстренно начато антибактериальное лечение – цефепим внутривенно 3,0 г/сутки в сочетании с метронидазолом внутривенно 1,5 г/сутки; массивная инфузионная терапия; ингаляция кислорода.
Экстренно начато антибактериальное лечение – цефепим внутривенно 3,0 г/сутки в сочетании с метронидазолом внутривенно 1,5 г/сутки; массивная инфузионная терапия; ингаляция кислорода.
В результате интенсивного лечения стабилизировалась гемодинамика (без применения вазопрессоров), пациент пришел в сознание, уменьшились одышка, тахикардия и гипоксемия, нормализовалась гликемия.
На 3 сутки лечения на фоне повторно наступившего нарушения сознания и прогрессирования легочно–сердечной недостаточности констатирована смерть пациента. Реанимационные мероприятия были безуспешны.
При аутопсии подтверждено наличие двусторонней очагово–сливной пневмонии с образованием острых и подострых абсцессов в верхней доле левого легкого у пациента с постинсультными кистами головного мозга, постинфарктным крупноочаговым кардиосклерозом. Кроме того, выявлен язвенный гастродуоденит с пенетрацией одной из язв двенадцатиперстной кишки в головку поджелудочной железы и состоявшимся желудочно–кишечным кровотечением. Согласно патологоанатомическому заключению, смерть пациента, страдавшего цереброваскулярным заболеванием с наличием постинфарктных кист в головном мозге и развитием очагово–сливной двусторонней абсцедирующей пневмонии, язвенного гастродуоденита, желудочно–кишечного кровотечения, наступила от нарастающей интоксикации и легочно–сердечной недостаточности.
Согласно патологоанатомическому заключению, смерть пациента, страдавшего цереброваскулярным заболеванием с наличием постинфарктных кист в головном мозге и развитием очагово–сливной двусторонней абсцедирующей пневмонии, язвенного гастродуоденита, желудочно–кишечного кровотечения, наступила от нарастающей интоксикации и легочно–сердечной недостаточности.
Таким образом, у 75–летнего пациента, перенесшего ранее инфаркт миокарда и повторные инсульты, развилась П тяжелого течения на фоне периферических сосудистых расстройств, сахарного диабета и ХОБЛ. Терапия была неэффективна вследствие тяжелой двусторонней П с множественным абсцедированием и развитием тяжелой внелегочной патологии.
Наблюдение 4. Пациент С.Б.М., 66 лет, госпитализирован в реанимационное отделение на 6 сутки заболевания. Дебют острый – общее недомогание, кашель, лихорадка до 39°С. Отягощающие заболевания: сахарный диабет 2 типа легкого течения, гипертоническая болезнь, хронический средний отит.
При осмотре состояние крайне тяжелое. Температура тела 39,4°С. Кожные покровы бледные, профузный пот, акроцианоз. Сознание сохранено, эйфория. Интенсивная одышка с ЧДД до 50 в 1 мин. Клинические признаки консолидации верхней доли левого легкого. Рассеянные влажные и сухие хрипы. ЧСС 90 в 1 мин. АД 150/90 мм рт.ст. Пастозность голеней.
Температура тела 39,4°С. Кожные покровы бледные, профузный пот, акроцианоз. Сознание сохранено, эйфория. Интенсивная одышка с ЧДД до 50 в 1 мин. Клинические признаки консолидации верхней доли левого легкого. Рассеянные влажные и сухие хрипы. ЧСС 90 в 1 мин. АД 150/90 мм рт.ст. Пастозность голеней.
При экстренном обследовании рентгенологически выявлена двусторонняя пневмония (рис. 1). В анализах крови – нейтрофильный лейкоцитоз 14 тыс/мкл со значительными изменениями лейкоцитарной формулы (палочкоядерные нейтрофилы 35,5%, миелоциты 2,0%), повышенный уровень мочевины (8,4 ммоль/л) и креатинина (140 мкмоль/л), пониженный уровень натрия (130 ммоль/л). На электрокардиограмме – перегрузка правого предсердия и правого желудочка. Гипоксемии и гиперкапнии в капиллярной крови не выявлено.
Диагностирована тяжелая пневмония. Заболевание приняло крайне осложненное течение. Прогрессирование острой дыхательной недостаточности до степени острого респираторного дистресс–синдрома потребовало наложения трахеостомы и проведения длительной ИВЛ с максимальной концентрацией кислорода, а развитие септического шока – многочасового вазопрессорного лечения допамином. При контрольной рентгенографии легких через 72 часа отмечено выраженное прогрессирование пневмонии (рис. 2). Кроме того, развились: острая печеночно–почечная недостаточность, энцефалопатия, метаболический ацидоз, кровотечение из стрессовых язв желудка, анемия, гиперкоагуляционный синдром, декомпенсация сахарного диабета, обострение мочевой инфекции и хронического среднего отита. Диагностирован тяжелый сепсис с полиорганной дисфункцией.
При контрольной рентгенографии легких через 72 часа отмечено выраженное прогрессирование пневмонии (рис. 2). Кроме того, развились: острая печеночно–почечная недостаточность, энцефалопатия, метаболический ацидоз, кровотечение из стрессовых язв желудка, анемия, гиперкоагуляционный синдром, декомпенсация сахарного диабета, обострение мочевой инфекции и хронического среднего отита. Диагностирован тяжелый сепсис с полиорганной дисфункцией.
Проведено интенсивное антибактериальное лечение: первоначальная эмпирическая терапия – внутривенно цефепим 4,0 г/сут в сочетании с азитромицином 0,5 г/сут перорально. Дальнейшее антибактериальное лечение корректировалось на основании результатов многократных бактериологических исследований различных биосред (бронхиальных смывов, мочи, гнойного отделяемого из уха). Получена полимикробная кокковая флора: золотистый и эпидермальный стафилококк, пневмококк, энтерококк, грибы рода кандида. При многократных исследованиях крови гемокультура не выделена.
В связи с рецидивирующей лихорадкой и резистентностью выделяемой флоры к антибиотикам на протяжении 59 дней (!) последовательно применены меропенем, ципрофлоксацин, амоксициллин/клавуланат, имипенем/циластатин, ванкомицин. Для профилактики грибковой суперинфекции вследствие массивной и длительной антибактериальной терапии внутривенно использовался (41 день!) флуконазол. В комплексном лечении применялись бронхоскопические санации, инсулин, антикоагулянты (70 суток), антиагреганты, кортикостероиды, гастропротекторы, бронхолитики, альбумин, электролиты, коллоиды, кристаллоиды, нейротропные и кардиотропные препараты, анаболические стероиды, эритропоэтин, препараты железа, зондовое и парентеральное питание.
Для профилактики грибковой суперинфекции вследствие массивной и длительной антибактериальной терапии внутривенно использовался (41 день!) флуконазол. В комплексном лечении применялись бронхоскопические санации, инсулин, антикоагулянты (70 суток), антиагреганты, кортикостероиды, гастропротекторы, бронхолитики, альбумин, электролиты, коллоиды, кристаллоиды, нейротропные и кардиотропные препараты, анаболические стероиды, эритропоэтин, препараты железа, зондовое и парентеральное питание.
Пациент провел в реанимационном отделении 59 суток. Из них 51 сутки (!) применялась аппаратная искусственная вентиляция легких. При этом общий срок госпитализации составил 77 койко/дней. Результатом описанной драматической терапии явилось полное рентгенологическое разрешение пневмонической инфильтрации (рис. 3) и выздоровление пациента. Примечательно, что, несмотря на перенесенный острый респираторный дистресс–синдром и длительную ИВЛ с высокой концентрацией кислорода, на контрольной бодиплетизмографии рестриктивных изменений выявлено не было.
После выписки из стационара для проведения восстановительного лечения направлен в Загородный центр реабилитации, где находился в течение трех недель.
Последнее наблюдение необычно не только крайней тяжестью течение (сепсис), но и поистине драматической терапией, которая включала механическую ИВЛ в течение 51 дня и агрессивную многодневную (59 дней) антибактериальную терапию. Этапная терапия (реанимация – отделение пульмонологии – Центр реабилитации) привела к выздоровлению по клиническим, рентгенологическим и функциональным данным.
Приведенные программы лечения П тяжелого течения, используемые нами в клинической практике на протяжении многих лет, позволили обеспечить эффективную терапию и получить благоприятные исходы у большинства наблюдавшихся пациентов.
Литература
1. Albert R., Spiro S., Jett J. // Comprehensive Respiratory Medicine.– 1999.– Mosby.– 788 p.
2. Bartlett G. Management of Respiratory Tract Infections // 2001.– Lippincott Williams & Wilkins.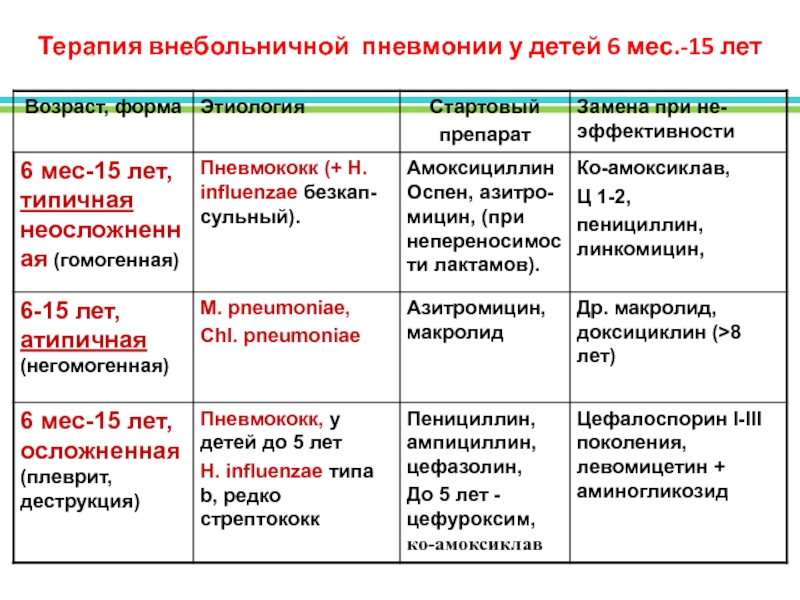 – 277 p.
– 277 p.
3. Fein A., Grossman R., Ost D. et al. // Diagnosis and Management of Pneumonia and Other Respiratory Infections.– 1999.– Professional Communications Inc..– 288 p.
4. Niederman M., Mandel L., Anzueto A. et al. American Thoracic Society guidlines for the management of adults with community–acquired pneumoniae: diagnosis, assessment of severity, antimicrobial therapy and prevention // Am. J. Resp. Crit. Care Med..– 2001.– 163.– p. 1730–1754
5. Paganin F., Lilienthal F., Bourdin A. et al. Severe community–acquired pneumonia: assessment of microbial aetiology as mortality factor // Eur. Respir. J..– 2004.–24.– p. 779–785
6. Яковлев С.В. Тяжелая внебольничная пневмония // в кн. Пневмония (А.Г.Чучалин, А.И.Синопальников, Н.Е.Чернеховская).– Москва.– «Экономика и информатика».– 2002.– с. 266–279
.
Искусственный интеллект помогает прогнозировать риски тяжёлого течения пневмоний
Изображение отсутствует
Ежедневный видеоконсилиум с заведующими пульмонологических отделений Красноярска и районных медучреждений края
Красноярская краевая клиническая больница, Лаборатория по искусственному интеллекту Сбербанка и СберМедИИ реализуют проект, который позволяет оценивать риск тяжелого течения вирусной пневмонии у пациентов с помощью системы, основанной на искусственном интеллекте.
Технология разработана специалистами Лаборатории по искусственному интеллекту. Цель проекта – своевременно выявлять пациентов с высоким риском тяжелого течения пневмонии, что позволяет корректировать тактику лечения и сокращать количество смертельных случаев.
Проект был инициирован в декабре 2019 года. Для обучения системы ИИ использовалась анонимизированная база данных пациентов с пневмонией, находящихся на лечении в ККБ. Полученная модель использовала информацию из электронной медицинской карты, а также результаты лабораторных и инструментальных методов исследований, полученных за первые сутки госпитализации пациента.
С началом пандемии COVID-19 в марте 2020 года исследователи попробовали использовать модель на пациентах с COVID-19, но первые попытки не дали ожидаемую точность для таких пациентов. Тогда команда проекта доработала систему с учетом информации о «ковидных» пациентах инфекционных госпиталей Красноярска.
Кроме того, специалисты отдела автоматизированных систем управления Красноярской краевой клинической больницы и СберМедИИ интегрировали сервис искусственного интеллекта с медицинской информационной системой, что позволило врачам получать оперативные отчёты о степени риска в режиме онлайн. На основе данных за первые сутки госпитализации система ИИ оценивает и присваивает одну их 4х степеней риска, (в диапазоне от 29% до 100%)
Главный внештатный специалист Министерства здравоохранения Красноярского края, пульмонолог, доктор медицинских наук Ирина Демко с самого начала участвует в данном проекте и считает использование системы ИИ в медицинских учреждениях края перспективным направлением:
— Врачи и специалисты Красноярской краевой клинической больницы приняли самое деятельное участие в тестировании системы и положительно оценили результаты и полученный опыт. Модель ИИ показала свою эффективность на практике, но важно учитывать, что не всегда тяжесть состояния пациента обусловлена только пневмонией, но и многими сопутствующими состояниями, которые на момент госпитализации переносит человек.
Сейчас ведётся опытная эксплуатация сервиса. На ежедневных видеоконференциях главных внештатных специалистов Министерства здравоохранения края с пульмонологическими отделениями ККБ проводится детальный разбор и корректировка тактики ведения пациентов с риском неблагоприятного течения пневмонии.
За первый месяц использования системы, в сравнении с предыдущими периодами, в группе высокого риска количество пациентов, попавших в реанимацию, удалось сократить на 14,3%, количество летальных исходов – на 44,3%.
Первый заместитель Председателя Правления Сбербанка Александр Ведяхин высоко оценил совместную работу с красноярскими медиками:
— За прошедшие полтора года команда Лаборатории по искусственному интеллекту Сбера и Красноярской краевой клинической больницы прошли большой путь от идеи до отладки и внедрения модели ИИ. В результате врачи получили инструмент, который хорошо выявляет риск тяжелого течения болезни, а значит, позволяет вовремя начать профилактику и в конечном счёте – спасать жизни
Данный эксперимент – первый в России, и красноярские медики дали положительное заключение о тиражировании системы на другие инфекционные госпитали Красноярского края. Проектом уже заинтересовались пульмонологи и исследователи ИИ из других регионов, и, если он покажет высокую эффективность на достаточно длительном временном горизонте, опыт будет применён в других областях медицины, где важно своевременное выявление рисков осложнения и смерти пациентов.
Пациент 80 лет с COVID-19 тяжелого течения, с тяжелой сердечно-сосудистой патологией и поражением почек снят с аппарата ИВЛ в отделении анестезиологии и реанимации «НМИЦ кардиологии» Минздрава России
Пациент Ш., 80 лет. Диагноз: U07.1 Коронавирусная инфекция, вызванная COVID-19 (подтвержденная), тяжелая форма. Внебольничная двусторонняя пневмония. Дыхательная недостаточность 2 ст. ИБС. Постинфарктный кардиосклероз (инфаркт миокарда от 2012 года). Нарушение ритма сердца: пароксизмальная фибрилляция предсердий, тахисистолический вариант. Гипертоническая болезнь 3 стадии. Артериальная гипертензия 3 ст. Риск ССО 4 очень высокий. Хроническая болезнь почек 4 ст. Язвенная болезнь желудка, эпизод желудочно-кишечного кровотечения от 24.04.2020, рецидив от 27.04.2020.
Анамнез заболевания
16.03.2020 у пациента появился выраженный сухой непродуктивный кашель и одышка. Принимал антибиотики без эффекта. С 28.03 по 10.04.2020 находился на стационарном лечении в ГКБ № 15 ДЗМ по поводу внебольничной правосторонней нижнедолевой пневмонии (бактериальной). Два мазка ПЦР на COVID-19 были отрицательными. Получал терапию: ампициллин + сульбактам 1,5 г х 3р/сут, азитромицин 500 мг/сут. Был выписан с улучшением и рекомендацией продолжить прием левофлоксацина в дозе 500 мг/сут, который пациент не принимал.
После выписки сохранялись одышка и общая слабость. Через несколько дней возобновился сухой кашель, появилась лихорадка, усилилась слабость, в связи с чем 17.04.2020 бригадой СМП пациент доставлен в НМИЦ кардиологии Минздрава России для дальнейшего обследования и лечения.
При поступлении на компьютерной томографии органов грудной клетки объем поражения легких 15% (КТ-1). При ПЦР-исследовании на SARS-COV19 получен положительный результат.
Назначена специфическая противовирусная и антибактериальная терапия (гидроксихлорохин, азитромицин, цефоперазон/сульбактам), антикоагулянтны (эноксапарин по 40 мг х 2 р/сут). Состояние больного оставалось стабильным, SpO2 в пределах 95-96% на атмосферном воздухе.
20.04.2020 появилась рвота кофейной гущей. На эзофагогастродуоденоскопии выявлены эрозии желудка. Добавлена терапия ингибиторами протонной помпы и антацидами. Антикоагулянтная терапия временно отменена. 23.04.2020 на компьютерной томографии органов грудной клетки отмечена незначительная отрицательная динамика, объем поражения легких увеличился до 20% (КТ-2). Плаквенил заменен на калетру. 27.04.2020 на ЭХО-КГ ФВ 50%, среднее давление в легочной артерии 60-65 мм рт. ст., убедительных данных за наличие свежих зон нарушений локальной сократимости миокарда нет.
Ночью 28.04.2020 отмечено ухудшение состояния, нарастание одышки, SpO2 93% на инсуффляции кислорода 6 мл/мин.
Пациент переведен в реанимацию. Сознание – умеренно заторможен. По шкале NEWS – 12 баллов, частота дыхания 30/мин. В реанимации увеличена скорость инсуффляции кислорода до 10 л/мин, SpO2 – 98%. Течение заболевания осложнилось пароксизмом мерцания предсердий с частотой сокращений – 120-140/мин, гипотонией, десатурацией, потерей сознания.
Больной переведен на ИВЛ. Восстановлен синусовый ритм с помощью электрической кардиоверсии. Состояние стабилизировано. Проводилась терапия: цефоперазон + сульбактат 2 гр. х 2р/сут в/в капельно, омез 180 мг х 50,0 NaCl-0,9% в/в через перфузор со скоростью 2,1 мл/ч, метопролол 50 мг х 2р сут, калетра 400 мг внутрь 2р/сут, инфибета 1 фл. п/к 1 раз через день. Тяжесть состояния пациента усугубилась повторным кровотечением из желудочно-кишечного тракта, по поводу чего выполнен эндоскопический гемостаз, проведена консервативная гемостатическая терапия (инфузия свежезамороженной плазмы, антифибринолитики в/в). Выполнена компьютерная томография: площадь поражения легких увеличилась до 30%.
На 4 сутки пребывания в реанимации пациент переведен на вспомогательную вентиляцию легких в режиме CИПАП. Проведенная терапия: специфическая противовирусная (инфибета, калетра), антибактериальная (сульцеф, левофлоксацин), гепатопротекторная (гептрал), непрерывная инфузия блокаторов протонной помпы (омез), инфузия альбумина и свежезамороженной плазмы, антифибринолитическая терапия (транексамовая кислота), эндоскопический гемостаз, бета-блокаторы, коррекция электролитов и кислотно-щелочного равновесия, электрическая кардиоверсия, энтеральное питание.
Состояние пациента улучшилось. На 5 сутки пациент экстубирован и переведен на инсуффляцию кислорода со скоростью 6 л/мин через назальные канюли, SpO2 – 100%. На 7 сутки пребывания в реанимации пациент переведен в палатное отделение.
В настоящее время пациент находится в палатном отделении, продолжается комплексная терапия.
ФГБУ «НМИЦ Кардиологии» Минздрава России — Чазовский кардиоцентр — начал борьбу с COVID-19 c 14.04.2020.
Пульс-Терапия стероидными гормонами больных с Коронавирусной пневмонией (COVID-19), системным воспалением и риском венозных тромбозов и тромбоэмболий (исследование ПУТНИК) | Мареев
Новая коронавирусная инфекция, вызванная вирусом SARS-CoV-2 и получившая название COVID-19, 11 марта 2020 года была объявлена Всемирной организацией здравоохранения (ВОЗ) пандемией. Тяжелые формы течения этого заболевания сопровождаются развитием вирусной пневмонии с тотальным поражением мелких сосудов легких, бронхиол и альвеол. В патогенезе COVID-19 существенную роль играет прогрессирующее системное воспаление, сопровождающееся лимфопенией и нейтрофилезом. Патологическая гиперреактивность иммунной системы, выражающаяся в неконтролируемой активации цитокинами иммунных клеток в очаге воспаления и высвобождении последними новой порции цитокинов и хемокинов, получила название «цитокиновый шторм». У пациентов с COVID-19 отмечаются высокие уровни интерлейкинов (ИЛ) (ИЛ-1‑β, ИЛ-1RA, ИЛ-6, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-17), макрофагального воспалительного белка, фактора роста эндотелия сосудов, фактора некроза опухоли α (ФНО-α) и других провоспалительных хемокинов, цитокинов и сигнальных белков. «Цитокиновый шторм» увеличивает риск развития острого респираторного дистресс-синдрома и может приводить к полиорганной недостаточности [1].
Глюкокортикостероиды (ГКС) являются одними из самых популярных противовоспалительных агентов, с длительной историей использования. В настоящее время ВОЗ не рекомендует рутинное использование кортикостероидов у пациентов для лечения вирусной пневмонии или острого респираторного дистресс-синдрома, если только пациенты не имеют других заболеваний, таких как астма, обострение хронической обструктивной болезни легких или септический шок [2]. Во временных рекомендациях Министерства здравоохранения Российской Федерации (МЗ РФ) есть упоминание о возможности применения ГКС в малых дозах (метилпреднизолон 1 мг / кг / сут., внутривенно) в качестве упреждающей противовоспалительной терапии. При этом пульс-терапия ГКС не входит в список рекомендованных Министерством здравоохранения подходов к лечению COVID-19. (Временные методические рекомендации профилактика, диагностика и лечение новой коронавирусной инфекции (COVID 19) 7 версия) [3].
Тем не менее именно эти лекарства часто применяются при лечении воспаления и «цитокинового шторма», вызванного вирусом SARS-CoV-2, в том числе и по причине наибольшей доступности. В систематическом обзоре 41 исследования по лечению COVID-19 чаще всего (в 25 протоколах) использовалась глюкокортикоидная терапия по разным схемам и в разных дозах [4]. К сожалению, ГКС обладают довольно большим количеством побочных эффектов. Среди основных средне- и долгосрочных нежелательных эффектов этой группы препаратов – увеличение резистентности к инсулину [5–7], увеличение сердечно-сосудистого риска и риска бактериальных инфекций [8]. Нарушения обмена глюкозы и увеличение риска суперинфекций может быть корригировано в условиях стационарного лечения пациентов с коронавирусной пневмонией. Наиболее опасным выглядит повышение риска тромботических и тромбоэмболических осложнений, которые и так характерны для COVID-19 и могут приводить к полиорганным поражениям, и ухудшать прогноз. В целом ряде исследований было показано, что COVID-19 может сопровождаться гиперкоагуляцией, с торможением фибринолиза, что приводит к микротромбозам в сосудах легких, почек, сердца и повышенному риску венозных тромбоэмболий (ВТЭ), включая тромбоэмболию легочной артерии (ТЭЛА) и артериальных, вплоть до развития инсульта [9, 10]. Кроме того, независимым фактором, определяющим плохой прогноз больных с COVID-19, является повышенный уровень D-димера, продукта распада фибрина, используемого в качестве маркера повышенного риска тромбообразования [10, 11]. По мере накопления знаний и лучшего понимания патогенеза болезни все большее распространение получает антикоагулянтная терапия [11]. Нельзя исключить, что терапия ГКС может снизить эффективность профилактической терапии низкомолекулярными гепаринами (НМГ) из‑за повышения риска тромбообразования.
Изучение эффективности (возможное подавление воспаления и «цитокинового шторма») и безопасности (возможное прогрессирование сердечно-сосудистых осложнений и тромбозов) глюкокортикоидной терапии у пациентов с COVID-19 представляет научный интерес и обладает практическим значением.
Мы провели ретроспективное когортное сравнительное исследование 34 пациентов с тяжелым течением коронавирусной пневмонии, требовавших противовоспалительного лечения. Целью работы была оценка клинической эффективности и безопасности пульс-терапии высокими дозами ГКС в течение трехдневного курса с продлением поддерживающими дозами до одной недели больных с COVID-19.
Материалы и методы
В исследование было включено 34 пациента, находящихся на стационарном лечении в Московском Научно-Образовательном центре МГУ имени М. В. Ломоносова (МНОЦ МГУ) с доказанным диагнозом коронавирусной пневмонии. Диагноз во всех случаях был подтвержден определением наличия РНК вируса SARS-CoV-2 по полимеразной цепной реакции и типичными изменениями в легких по данным компьютерной томографии (КТ). Исходно была назначена стандартная терапия гидроксихлорохином с азитромицином, позже с добавлением бромгексина и спиронолактона. Кроме этого, с первого дня госпитализации всем пациентам проводилась антикоагулянтная терапия НМГ (согласно массе тела), причем при повышении величины D-димера ≥5 мкг / мл, пациенты переводились на лечебные дозы НМГ. При необходимости корригировалась антибактериальная терапия, и больные обеих групп принимали в среднем 1,4 антибиотика. Никаких различий во вспомогательной терапии, как и в назначении препаратов для лечения сопутствующей патологии, между группами не было.
У пациентов, которые затем вошли в активную группу, (17 пациентов) течение болезни с высокой лихорадкой, снижением сатурации кислорода в крови, увеличением С-реактивного белка (СРБ) и отсутствием положительной динамики по данным КТ потребовало экстренного проведения противовоспалительной терапии. При отсутствии антиинтерлейкиновых препаратов лечащими врачами было принято решение о проведении пациентам пульс-терапии высокими дозами ГКС: метилпреднизолоном по 1000 мг внутривенно в течение 3 дней с переводом на дексаметазона по 4 мг дважды в день в течение 3–7 дней. Одному пациенту дополнительно вводился тоцилизумаб 400 мг. Пятеро больных после окончания гормонотерапии получали колхицин в дозе 0,5 мг / сут. В качестве контрольной группы были отобраны 17 больных, сходных по основным характеристикам, проходивших в это же время лечение в клинике МНОЦ МГУ, по тем же протоколам, но не получавших пульс-терапии ГКС. Одному пациенту вводился тоцилизумаб 400 мг. Лишь шестеро из них находились на терапии колхицином 1 мг первый день, затем 0,5 мг / сут. Другой специфической противовоспалительной терапии в обеих группах не проводилось. Длительность наблюдения в обеих группах составила 10 дней. В группе терапии ГКС – 10 дней с момента начала терапии, в группе контроля – 10 дней с момента включения в наблюдение.
Анализ данных в группах терапии ГКС и контроля проводился с дважды заслепленными конечными точками: на этапе выборки данных и на этапе статистической обработки, что полностью исключает субъективный фактор влияния на результаты.
Исходная характеристика обследованных пациентов представлена в таблице 1.
В группе пульс-терапии ГКС медиана возраста составила 59 лет, 15 из 17 (88,2 %) пациентов были мужчины с медианой индекса массы тела 29,9 кг / м2. В группе контроля медиана возраста была выше – 68 лет, также в большинстве случаев эту группу составили мужчины (58,5 %) с индексом массы тела 27,8 кг / м2, но все эти различия были статистически не значимы. Группы не различались по количеству и частоте сопутствующих заболеваний (сердечно-сосудистых, с преобладанием артериальной гипертонии, сахарного диабета, хронической обструктивной болезни легких и онкологических).
Больные в группе пульс-терапии ГКС по сравнению с группой контроля имели статистически значимо более сильную лихорадку (разница по медиане + 0,9⁰ С), более выраженную, но статистически не значимо, одышку (медиана частоты дыхательных движений (ЧДД) 24 против 19 в минуту), связанную с более низкой сатурацией кислорода (медианы 85 % против 94 % на воздухе и 92 % против 96 % при вентиляции кислородом). В активной группе все пациенты находились на кислородной поддержке против 53 % в группе контроля (р=0,002) и они чаще были в отделении реанимации и интенсивной терапии (ОРИТ) и на искусственной вентиляции легких (ИВЛ), хотя по двум последним показателям значимых различий между группами не было. По исходному уровню систолического артериального давления (САД) группы статистически значимо не различались, а тахикардия имела место в более тяжелой группе пациентов, получивших пульстерапию ГКС.
По биохимическим исследованиям обе группы имели показатели, характерные для тяжелой коронавирусной пневмонии, и по большинству показателей не различались. Суммарный показатель выраженности воспаления (С-реактивный белок, СРБ) был повышен в 19 раз в группе контроля и в 27 раз в группе активной терапии (р=0,048). Троекратно был повышен уровень D-димера, что, вкупе с увеличением фибриногена, отражало повышенную наклонность к тромбообразованию на фоне воспалительного процесса (р=0,125). В обеих группах отмечались лимфопения и увеличение количества нейтрофилов, выходящее за пределы нормальных значений лишь в активной группе. Соотношение числа нейтрофилов к лимфоцитам (индекс Н / Л) составило 4,06 в контрольной группе и 6,05 в группе активного лечения (р=0,125). Количество тромбоцитов, уровни глюкозы, креатинина и расчетной скорости клубочковой фильтрации (СКФ) были в пределах нормальных величин и не различались по группам.
По данным КТ все 34 пациента имели признаки двусторонней вирусной пневмонии, характерные для COVID-19. Медиана поражения по стадиям, рекомендованным МЗ РФ и Департаментом здравоохранения Москвы [3], составила 2,0 для группы контроля и 3,0 для группы активной терапии, причем 58,8 % пациентов активной группы имели 3–4 стадии поражения легких, в то время как в группе контроля таких пациентов не было. По данным компьютерного анализа (MultiVox, ФФМ МГУ) суммарный объем поражения легких («матовые стекла», «булыжная мостовая» и участки консолидации и фиброза) составил 25,6 % в группе контроля и 53,2 % в активной группе (р<0,001).
Компьютерная томография легких и органов грудной клетки выполнялась на 32‑рядном компьютерном томографе Somatom Scope (Siemens, Германия). Исследования выполнялись с толщиной среза 1 мм.
При первом исследовании использовался стандартный протокол КТ с напряжением тока на трубке 120 кВ и автоматическим модулированием силы тока на трубке в диапазоне 200–400 мА, при повторных КТ применяли протокол низкодозной КТ с уменьшенными параметрами напряжения тока на трубке (100 или 110 кВ) и автоматической модуляцией тока на трубке в диапазоне 40–120 мА. При стандартном протоколе средняя лучевая нагрузка составляла 3,9±0,4 мЗв, при низкодозном – 0,9±0,2 мЗв. Исследования КТ выполнялись при поступлении и выписке пациента, в период госпитализации их повторяли по мере клинической необходимости, но не реже, чем один раз в 5 дней.
Все полученные изображения в формате DICOM хранились в радиологической информационной сети (PACS / RIS) МНОЦ МГУ. Для обработки и анализа КТ использовались рабочие станции Syngo.via (Siemens).
При обработке и описании данных КТ использовалась полуколичественная шкала оценки объема зон инфильтрации и консолидации легких, рекомендованная Временными методическими рекомендациями МЗ РФ «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19) версий 6 и 7 (КТ – КТ4).
Для точного количественного анализа динамики объема вызванных COVID-19 изменений паренхимы легких во всех случаях использовался отечественный программный комплекс «Гамма Мультивокс» со специальным приложением для анализа поражения легких при COVID-19, созданным лабораторией медицинских компьютерных систем НИИЯФ им. Д. В. Скобельцына МГУ имени М. В. Ломоносова и факультетом фундаментальной медицины (ФФМ) МГУ им. М. В. Ломоносова (https://multivox.ru). С помощью данной программы для всех серий КТ у каждого пациента, включенного в исследование, выполнялись автоматическая цветная кодировка и подсчет объемов зон «матового стекла» и консолидации на КТ изображениях, оценивался их объем в кубических сантиметрах и процент по отношению к объему легкого. Учитывалась сумма любых матовых стекол и зон консолидации. Программа генерировала таблицы с измеренными значениями, при выполнении исследований в динамике происходило добавление новых данных в таблицу. Исследование уровня биохимических показателей крови (СРБ, креатинин, мочевина, глюкоза) было выполнено на автоматическом биохимическом анализаторе AU480 Beckman Coulter, Германия; общий анализ крови (5 diff) на гематологическом анализаторе XN 2000 Sysmex Corporation, Япония; исследование уровня показателей гемостаза (фибриноген, D-димер) на автоматическом анализаторе гемостаза STA-Compact Diagnostica Stago SAS, Франция.
Для объективизации тяжести клинического состояния и адекватной оценки эффектов проводимой терапии мы использовали две шкалы. Во-первых, шкалу NEWS-2 (Reproduced from: Royal College of Physicians. National Early Warning Score (NEWS) 2: Standardizing the assessment of cute-illness severity in the NHS. Updated report of a working party. London: RCP, 2017), модернизированную для пациентов с COVID-19 [12]. Кроме того, нашу оригинальную шкалу оценки клинического состояния больных с коронавирусной инфекцией (ШОКС-COVID).
Шкала NEWS-2 была создана для оценки тяжести больных с острыми респираторными синдромами, создавалась и много лет широко использовалась для оценки риска клинического ухудшения, своевременного и компетентного принятия решения о месте лечения, необходимости интенсификации лечения. Шкала валидирована на многих популяциях пациентов. И в отношении COVID-19 шкала выполняла задачу быстрой оценки риска клинического ухудшения и сортировки больных. За основу взяты классические клинические проявления – ЧДД, сатурация кислорода, необходимость вентиляции, состояние сознания, температура тела, а также частота сердечных сокращений (ЧСС) и САД. Поэтому она недостаточно учитывает особенности пациентов с COVID-19. Китайские исследовали дополнили эту шкалу параметром возраста, добавив максимальное количество баллов (3) за возраст старше 65 лет [12]. Это отражало ранние представления о течении COVID-19 во время вспышки эпидемии в г. Ухань. Сегодня понятно, что далеко не только возраст, а и сопутствующие заболевания утяжеляют прогноз пациентов, и максимальный риск проявляется в подгруппе лиц старше 80 лет, где он в 6 раз выше, чем в 65 лет [13].
По модифицированной шкале NEWS-2 низкому риску плохого прогноза соответствует 0 баллов, среднему – 1–4 балла, высокому – 5–6 баллов и очень высокому – 7 баллов и больше. В нашем исследовании пациенты группы контроля имели медиану по шкале NEWS-2 5 баллов, что соответствует высокому риску, а в группе активной терапии 11 баллов, что соответствует очень высокому риску.
Учитывая, что оценка состояния пациентов с COVID-19 зависит от нескольких ключевых показателей и не только степени одышки, сатурации крови кислородом и необходимости вентиляции. Эти показатели в большей степени характеризуют тяжесть поражения легких и дыхательную недостаточность. Состояние сознания напрямую коррелирует с попаданием пациента в ОРИТ и особенно, от нахождения на ИВЛ. Одним из ключевых показателей можно считать степень реального поражения легочной ткани по данным КТ, что далеко не всегда коррелирует с клиническими проявлениями нехватки воздуха, а также степень выраженности воспалительного процесса, главными маркерами которого являются выраженность лихорадки и величина СРБ. Кроме того, одним из основных прогностических маркеров неблагоприятного течения болезни может служить риск тромботических и тромбоэмболических осложнений, дополняющих поражение легочной ткани, определяемый величиной D-димера. Исходя из удачного опыта создания подобной интегральной шкалы Шкалы оценки клинического состояния (ШОКС) для пациентов с хронической сердечной недостаточностью (Беленков Ю. Н. и Мареев В. Ю., 2000), мы попытались создать собственную оригинальную шкалу определения клинического состояния пациентов с COVID-19, учитывающую основные маркеры тяжести болезни – ШОКС COVID, представленную в таблице 2.
Больные, имеющие от 0 до 3 баллов, относятся к низкому риску, 4–6 – среднему риску, 7–10 – серьезному риску, т. е. выше среднего, 11–14 – баллов к высокому риску и, наконец, пациенты с 15 баллами и выше имеют крайне высокий риск неблагоприятного течения болезни, быстрого прогрессирования поражения легких, полиорганной недостаточности и крайне трудно поддаются терапии. Шкала создавалась на основании теоретических предположений, а не на данных анализа какой‑либо когорты, так же, как и определение категорий риска, и пока не валидирована.
Медиана баллов по шкале ШОКС-COVID составила 7,0 для пациентов контрольной группы, что соответствует риску выше среднего и 12,0 для больных, которым проводилась пульс-терапия ГКС, что определяет высокий риск. Как видно, по шкале NEWS-2 больные обеих групп оцениваются как гораздо более тяжелые, чем по ШОКС-COVID, хотя разделение на высокий и очень высокий риск всегда вопрос во многом философский.
Выявленные различия в клинической тяжести течения болезни в основном и определили решение к проведению более активной противовоспалительной терапии ГКС в активной группе.
В качестве первичной точки исследования использовалось изменение баллов по шкале ШОКС-COVID.
В качестве вторичных конечных точек были использованы: динамика клинического показателя баллов по шкале [NEWS-2 и сатурация крови кислородом (SpO2), изменение уровней СРБ и D-димера в крови, оценка процента поражения легких на КТ по Мультивокс.
Статистическая обработка результатов
Описание количественных данных представлено в виде медианы и интерквантильного размаха (медиана и 25 %;75 %). Качественные данные представлены в виде абсолютных и относительных величин. Значимость различий между группами по качественным признакам оценивалась на основании критерия χ2, а также двустороннего точного теста Фишера. Сравнение количественных признаков между группами было проведено с использованием критерия Манна–Уитни.
Для сравнения динамики параметров внутри каждой из групп использовался критерий Уилкоксона для связных выборок для количественных признаков и критерий Мак–Немара для качественных данных.
Для оценки корреляции в связи с непараметрическим распределением исследуемых показателей проводилось логарифмическое преобразование данных и последующий расчет коэффициента корреляции Пирсона.
Критический уровень значимости при проверке статистических гипотез принимался ˃0,05.
Статистический анализ проведен в программе R студия с использованием языка программирования R.
Результаты исследования
Динамика баллов по ШОКС-COVID, в качестве первичной точки исследования, представлена на рисунке 1.
В группе контроля медиана баллов по ШОКС-COVID статистически незначимо возросла с 7,00 [6,00; 9,00] до 9,00 [5,50; 10,0] баллов (p=0,148), оставаясь при этом в той же категории риска – выше среднего, в то время как в группе пульс-терапии ГКС снизилась с 13,0 [11,0; 15,0] до 10,0 [7,0; 13,0] баллов (р=0,01). Дельты в процессе лечения также статистически значимо различались + 1,00 [–2,25; 3,00] балл в группе контроля и –4,00 [–5,00; –2,00] балла в группе пульс-терапии ГКС (р=0,011).
На рисунке 2 показана динамика клинического состояния больных в процессе лечения по шкале NEWS-2.
В группе контроля количество баллов незначительно снизилось с 5,00 [4,00; 5,50] до 3,00 [3,00; 6,50] (р=0,97), в то время как в группе активной терапии снижение было статистически значимым с 11,0 [6,00; 12,0] до 6,00 [3,75; 9,25] баллов (р=0,026). Две группы статистически значимо различались и по степени снижения баллов по клинической шкале NEWS-2 от –1,00 [–2,00; 2,50] балла в контрольной группе до –3,50 [–4,50; –0,75] в группе пульс-терапии ГКС (р=0,043).
Максимальная разница в изменении самочувствия пациентов была отмечена за счет изменения сатурации крови кислородом и снижения одышки (рис. 3).
В контрольной группе этот показатель не изменился и составил 94,0 [93,5; 96,0] % исходно, и 94,0 [89,5; 97,0] % после лечения (р=0,51). В группе пульс-терапии сатурация кислорода статистически значимо возрастала с 85,0 [80,0; 89,0] % до 93,0 [91,5; 95,0] % (р=0,025). Динамика этого показателя, естественно, была более значимой при терапии ГКС: +8,00 [2,25; 13,0] % против +1,00 [–6,00; 4,00] % в контрольной группе (р=0,008).
Остальные изменения клинических показателей представлены в таблице 3.
Как видно из таблицы, у больных в группе пульс-терапии ГКС отмечалось статистически значимое снижение температуры тела до нормальных величин, снижение ЧДД на 5 в 1 минуту и ЧСС на 13 уд. / мин. Количество больных в ОРИТ снизилось с 12 до 8, при этом один пациент был переведен с ИВЛ на неинвазивную вентиляцию легких, увеличилось и число пациентов, находящихся в ясном сознании с 8 до 11. В группе контроля никаких существенных изменений не произошло, что лишний раз характеризует коронавирусную пневмонию как очень упорное заболевание, плохо поддающееся лечению на стадии развившегося обширного воспалительного процесса в легких на фоне острого воспаления.
На рисунке 4 представлены данные компьютерной обработки КТ легких с определением общего процента поражения легких на момент включения и на 10 день наблюдения. Учитывалась сумма любых матовых стекол и зон консолидации.
Как видно, в группе контроля, несмотря на проводимое лечение, общий объем поражения легких не только не уменьшился, но и статистически значимо возрастал с 25,6 [12,6; 34,7] % до 44,9 [23,3; 52,2] % (р=0,0026). Принимая во внимание отсутствие изменений в сатурации кислорода и одышки, не исключено, что при большем проценте поражения не вентилируемые участки легких (зоны консолидации) могли переходить в частично вентилируемые («матовые стекла»). Анализ по стадиям, используемым по рекомендациям МЗ РФ показал отсутствие серьезной динамики в цифрах: медиана 2,00 [1,00; 2,00] исходно и 2,00 [2,00; 3,00] в конце наблюдения, хотя статистически есть разница в пользу увеличения (р=0.0147).
В группе терапии ГКС процент поражения легких по данным компьютерного анализа не изменился: исходно – 53,2 [37,3; 65,1] %, после гормонотерапии – 53,9 [41,3; 68,4] % (р=0,67). Не изменилась и стадия поражения легких – медиана 3,00 [2,00; 3,00] до и после пульс-терапии ГКС (р=0,82). Здесь мы тоже можем предположить, что значимое снижение одышки, нарастание сатурации крови кислородом, снижение уровня кислородной поддержки было связано с качественными, а не количественными характеристиками поражения легочной ткани. В любом случае в группе пульс-терапии ГКС медиана изменений процента поражения легких на КТ составила лишь +0,75 [–10,95; 13,9] %, в то время как в контроле +17,6 [0,10; 23,6] % и различия немного не достигали статистической значимости (р=0,062).
В качестве иллюстрации приводим клиническое наблюдение (рис. 5).
На рисунке 5.01 представлены данные больного И., 44 лет, поступившего в МНОЦ МГУ 22.04.2020 (второй день работы клиники c COVID-19), с умеренным поражением легких – 38,4 %, из них минимальная выраженность в виде «матовых стекол» (светло-желтая окраска) – 17,1 %, серьезная – в виде плотных «матовых стекол» (коричневая окраска – 21,3 %) и консолидации (красная окраска – 1,5 %). Субфебрильная лихорадка в течение трех дней 37,6°С, отсутствие выраженной одышки ЧДД 18 в мин, сатурация кислорода при дыхании 94 %, уровень СРБ 38,6 мг / дл и D – димера 0,89 мкг / мл на фоне терапии имидазолилэтанамидом пентандиовой кислоты, гидроксихлорохином и азитромицином, назначенных амбулаторно до поступления больного в стационар. Состояние было расценено как относительно удовлетворительное. Лечение азитромицином было продолжено. Вместо гидроксихлорохина были назначены бромгексин 8 мг х 4 раза в день, спиронолактон 50 мг х 2 раз в день и эноксапарин натрия 40 мг х 2 раза в день. Терапия, подобная той, что проводилась в группе контроля.
До 28.04.2020 состояние больного постепенно ухудшалось, были сменены антибиотики и увеличена доза эноксапарина натрия до 80 мг х 2 раза. Но 29.04 состояние критически ухудшилось.
На рисунке 5.02 представлены данные КТ от 29.04.20. Как видно, поражение легких увеличилось до 68,6 % из них только 6,6 % – «матовые стекла», 21,1 % – плотные «матовые стекла» и консолидация – 40,9 % (серьезная выраженность поражения – 62 %). У больного лихорадка 38,5ᵒС, ЧДД 26 в 1 мин, ЧСС 120 уд / мин, сатурация кислорода 78 %, СРБ 425 мг / дл, D-димер 1,33 мкг / мл. Уровень нейтрофилов был повышен до 7,55х109 / л, и отмечалась выраженная лимфопения 0,47х109 / л, индекс Н / Л составлял 16,06. Пациент был переведен в ОРИТ и на ИВЛ. Учитывая выраженность процесса, острое воспаление и отсутствие препаратов, влияющих на интерлейкины, было принято решение о проведении пульс-терапии метилпреднизолоном по 1000 мг в течение 3 дней с переводом на дексаметазон по 8 мг дважды в день в течение еще 5 дней. Затем пациент был переведен на колхицин по 1 мг первый день и 0,5 мг последующие дни до выписки.
В результате уровень СРБ снизился в 4 раза, фибриноген с 11,07 до 7,2 г / л, насыщение крови кислородом возросло с 78 % до 94 %, ЧДД снизилась до 20, а ЧСС до 92 уд. / мин. D-димер незначительно возрос до 1,63 мг / мл. Увеличился нейтрофилез до 17,2х109 / л, и число лимфоцитов до 1,39х109 / л. Индекс Н / Л уменьшился до 12,4. На фоне отчетливого противовоспалительного действия к 10 дню после начала пульс-терапии ГКС объем поражения легких значительно уменьшился (рисунок 5.03). Умеренное поражение в виде «матовых стекол» составило лишь 12,3 % и такой же объем составляла зона консолидации. Общий объем непораженной легочной ткани возрос до 75,4 %. Больной был экстубирован на 6 день после пульс-терапии ГКС, переведен из ОРИТ на 10 день и на 14 день был выписан из стационара с рекомендациями приема колхицина 0,5 мг в сутки и ривароксабана 10 мг / сут. Запланирован контроль на 45‑й день.
В таблице 4 представлены изменения лабораторных показателей в группах гормонотерапии и контроля.
Наибольший интерес представляла динамика динамика СРБ, как наиболее популярного маркера выраженности воспалительного процесса. Он снизился статистически значимо в группе терапии ГКС (р=0,009) и незначимо в группе контроля. Медиана снижения была вдвое больше в активной группе – 85,57 [–155,3; –2,36] мг / дл против 41,03 [–65,0; 24,3] мг / дл в группе контроля, но различия оказались статистически не значимыми (р=0,109). Тем не менее исходно уровень СРБ был на 39 мг / дл выше в группе терапии ГКС, а после лечения, наоборот, на 15 мг / дл выше в группе контроля. СРБ существенно (более чем на 10 %) снизился у 13 (76,5 %) пациентов в группе терапии ГКС и у 6 (35,3 %) в группе контроля.
При оценке динамики D-димера отмечено его статистически значимое повышение в группе терапии ГКС (р=0,044) и отсутствие изменений в группе контроля (р=0,31). Медиана повышения в активной группе составила 0,66 [–0,11; 9,16] мкг / мл (на 47 % от исходного), в то время как в группе контроля – 0,01 [–0,64; 0,47] мкг / мл (р=0,040). Увеличение уровня D-димера более чем на 10 % отмечено у 12 (70,6 %) пациентов в группе терапии ГКС. У двух произошла ТЭЛА и еще у двух развился венозный тромбоз конечностей (всего 4 / 17 = 23,5 %). В этих случаях уровень D-димера повышался до 12,8 и 20,0 мкг / мл при ТЭЛА до 13,5 и 12,5 мкг / мл при венозных тромбозах. В группе контроля значимых повышений уровня D-димера и тромботических осложнений выявлено не было.
Изменения фибриногена в обеих группах были минимальными.
Лимфопения имела место исходно в обеих группах, больше среди больных, которым проводилось лечение ГКС, и значимо не изменилась к концу наблюдения ни в одной из групп. Количество нейтрофилов не менялось и даже имело тенденцию к снижению в группе контроля. В активной группе существенно увеличился нейтрофилез на 73 % (р<0,0001), что характерно для лечения ГКС.
Важный показатель индекс Н / Л, отражающий выраженность хронического воспаления, в группе активного лечения увеличился на 153 % (р=0,006) и незначимо снизился в контрольной группе. Медиана изменений в группе терапии ГКС составила +6,12 [0,336; –16,5], против –0,315 [ –1,73; 5,17] в группе контроля (р=0,038).
Из остальных показателей заслуживает внимания значимое увеличение числа тромбоцитов в обеих группах больных, что позитивно на фоне агрессивной терапии антикоагулянтами.
Изменения уровня глюкозы носили разнонаправленный характер – незначимое повышение в группе терапии ГКС (р=0,222) и значимое снижение в группе контроля (р=0,032). Медиана изменений составила –1,02 [–1,63; –0,55] ммоль / л в группе контроля и +0,02 [–1,13; +3,15] ммоль / л в группе лечения ГКС, но различия не достигли статистической значимости (p=0,06). Однако в группе терапии ГКС у 7 / 17 (41,2 %) больных было повышение уровня глюкозы больше 9 ммоль / л, что потребовало назначения / усиления сахароснижающей терапии, при том, что в контрольной группе таких пациентов не было.
Статистически значимого изменения функции почек, уровня креатинина и СКФ по медианам не выявлено ни в одной из групп.
Среднее время, проведенное пациентами на лечении в стационаре, составило 18,0 [16,0; 20,5] дней в группе контроля и 26,0 [22,0; 31,5] дней в группе терапии ГКС (р=0,001).
В качестве клинического примера приводим данные больного А., 62 лет. с COVID-19 и 68,2 % поражения легких по данным КТ (рис. 6).
У пациента длительно наблюдалась, уровень СРБ достигал 122 мг / дл, D-димер 1,33 мкг / мл, сатурация кислорода 89 % без кислородной поддержки. Обращала на себя внимание выраженная лимфопения 0,34х109 / л, нейтрофилез 6,26х109 / л и крайне высокий индекс Н / Л – 18,4, как маркер выраженного воспаления и риска ВТЭ. Больной был переведен в ОРИТ на неинвазивную ИВЛ. Было принято решение о проведении пульс-терапии высокими дозами ГКС. Через 5 дней состояние улучшилось, температура тела нормализовалась, СРБ снизился до 46 мг / дл, сатурация кислорода возросла до 95 %, процент поражения легочной ткани уменьшился до 38,2 %, и пациент был переведен в отделение. Хотя оставалась лимфопения 0,37х109 / л, индекс Н / Л увеличился до 20,6 и D-димер возрос до 2,74 мкг / мл. На следующий день состояние резко ухудшилось, крайне усилилась одышка, появились боли в грудной клетке, D-димер увеличился до 13,52 мкг / мл. На КТ-ангиограммах – ТЭЛА, несмотря на постоянную терапию НМГ в лечебной дозе. Доза НМГ была еще увеличена и добавлен дипиридамол. Впоследствии все осложнения удалось купировать, и больной был выписан в удовлетворительном состоянии на 27 день.
Обсуждение
COVID-19 проходит различные стадии, каждая из которых требует своих лечебных подходов. На стадии развившейся вирусной пневмонии, протекающей с поражением альвеол, проблема усугубляется прогрессированием системного воспаления и вовлечением в процесс не только легочной паренхимы, но и бронхиол, мелких сосудов и повышенным тромбообразованием. В этих случаях гиперреактивность иммунной системы сопровождается чрезмерной активацией цитокинов, дальнейшей активацией макрофагов и эпителиальных клеток и постоянным увеличением выброса цитокинов и хемокинов, что получило название «цитокинового шторма» [14, 15]. Именно лечению такого рода пациентов с COVID-19 посвящено настоящее исследование. Рекомендации ВОЗ и МЗ РФ предполагают использование в таких случаях «упреждающей противовоспалительной терапии» для купирования «цитокинового шторма» и преодоления критического воспаления [2, 3]. Учитывая лидирующую роль провоспалительных ИЛ, в качестве противовоспалительных препаратов рекомендуются ингибитор ИЛ-6 тоцилизумаб [16], ингибитор ИЛ-1β канакинумаб [17] ингибитор ИЛ-17 секукинумаб [18], ингибитор янус киназ JAK-1 и JAK-2 руксолитиниб [19].
Даже при возможной высокой эффективности этих препаратов, кстати, требующих проверки в клинических исследованиях, их доступность и стоимость оставляют желать лучшего.
Применение самых популярных на протяжении последних 50 лет противовоспалительных препаратов – ГКС при COVID-19 не рекомендовано ВОЗ, и лишь в версии 7 рекомендаций МЗ РФ указано возможное использование ГКС в малых дозах до 1 мг / кг / день. Мета – анализ исследований по применению стероидов при коронавирусных пневмониях, включая COVID-19, продемонстрировал отсутствие положительного влияния на прогноз и замедление элиминации вируса [20, 21]. Однако пульс-терапия высокими дозами ГКС при раннем начале терапии атипичной пневмонии показывала замедление прогрессирования болезни, лучшее разрешение изменения в легких при невысоком риске побочных эффектов [22, 23]. Ограничениями к применению ГКС является их способность усиливать протромботическе факторы, особенно при иммунном воспалении, что имеет место при COVID-19 с «цитокиновым штромом» [24]. Существуют исследования, связывающие риск развития ВТЭ при терапии стероидными гормонами с дозами препаратов, причем максимальное повышение риска отмечено при дозах от 1000 до 2000 мг / сут. [25]. И главная опасность в том, что риск тромбозов и тромбоэмболий при терапии ГКС может проявляться непосредственно после начала лечения [26].
Исходя из неясностей и недостаточной изученности этого вопроса, целью нашего исследования стало изучение баланса эффективности и безопасности пульс-терапии ГКС (1000 мг метилпреднизолона в течение 3 дней внутривенно с переводом на дексаметазон мг в течение 3–5 дней) в лечении пациентов с тяжелой коронавирусной пневмонией в сравнении с группой пациентов, не получающих противовоспалительной терапии. Анализ обследованных пациентов продемонстрировал признаки системного воспаления с экстремальным повышением СРБ в 19 раз в контрольной и в 27 раз в группе терапии ГКС (маркер «цитокинового шторма»). Одновременно в активной группе регистрировались лихорадка, лимфопения (0,66х109 / л), нейтрофилез (5,02х109 / л) и повышение индекса Н / Л до 6,05), троекратное повышение D-димера, одышка (ЧДД 26 в 1 мин) при низкой сатурации кислорода (85 %), тахикардия (ЧСС 97 уд. / мин). Суммарный балл клинического состояния NEWS-2, включающий, кроме клинических проявлений болезни, нахождение пациентов в ОРИТ (70,6 %) и на ИВЛ (35,3 %), и спутанность сознания, составил 11, притом, что показатель больше 7 баллов соответствует очень высокому риску. Процент поражения легких был более 50 %, что соответствовало 3 стадии по рекомендациям МЗ РФ. По суммарной шкале ШОКС-COVID, включающей, кроме клинических показателей, уровни СРБ и D-димера и процент поражения легких, то есть анализирующей факторы, определяющие прогноз, пациенты в группе пульс-терапии ГКС набрали 13 баллов, что соответствует высокому риску неблагоприятного прогноза. Пациенты в группе контроля имели менее тяжелое течение болезни по большинству изученных параметров. Это, с одной стороны, затрудняло сравнение результатов в группах, но, с другой, позволяло надеяться на более благоприятное течение болезни.
Проведенное исследование подтвердило возможную эффективность пульс-терапии ГКС в лечении COVID-19 пневмонии с «цитокиновым штормом». Статистически значимо и более существенно, чем в группе контроля, снизился балл ШОКС-COVID (первичная конечная точка исследования). Было достигнуто значительное улучшение клинического состояния ( – 8 баллов по шкале NEWS-2, +9 % сатурации кислорода, нормализация температуры тела, достоверное уменьшение потребности в кислородной поддержке). Подобное улучшение происходило на фоне троекратного снижения уровня СРБ, что характеризовало быстрый противовоспалительный эффект высоких доз ГКС. В итоге процент поражения легких не изменялся в сравнении с группой контроля, где происходило прогрессирование пневмонии и значимое увеличение процента поражения легких. На клиническом примере можно видеть прогрессирование поражения легких при отсутствии противовоспалительной терапии в первом периоде лечения (рис. 5.01, 5.02) и разрешение процесса после пульс-терапии ГКС во втором периоде наблюдения (рис. 5.02, 5.03). В известной степени это яркая иллюстрация сравнительного влияния контроля (без противовоспалительной терапии, первый период) и пульс-терапии ГКС (второй период) на примере одного и того же пациента. Это был один из первых тяжелых больных с COVID-19 в нашей клинике, и этот пример научил нас правилу: течение COVID-19 пневмонии крайне упорное, и при повышении маркеров воспаления пневмония не может быть успешно излечена без противовоспалительных препаратов. Полученные результаты показали, что пульс-терапия ГКС может прерывать «цитокиновый шторм». Однако результаты исследований с COVID-19 не подтвердили улучшения прогноза, скорее наоборот [27, 28]. Это и привело к рекомендациям использования антицитокиновых препаратов, а не ГКС, которые, к тому же могут замедлять элиминацию вируса при лечении COVID-19 [29, 30].
Второй задачей исследования была оценка безопасности пульс-терапии высокими дозами ГКС больных с COVID-19. В целом мы не выявили негативного влияния на кардиологические показатели, включая повышение АД. Повышения уровня глюкозы в среднем по группе терапии ГКС также не зарегистрировано, хотя в группе контроля этот показатель статистически значимо снизился. При индивидуальном анализе у 6 / 17 (35,3 %) больных обнаружено повышение уровня глюкозы больше 9 ммоль / л, что потребовало назначения / усиления сахароснижающей терапии. Наиболее проблемной представлялась динамика D-димера. В группе контроля этот показатель не менялся, а при терапии ГКС статистически значимо увеличивался (медиана до 1,98 мкг / мл). В предыдущих исследованиях было продемонстрировано, что при увеличении D-димера выше 2,0 мкг / мл риск ВТЭ у больных с COVID-19 повышается в 51 раз [31]. Были исследования, где даже повышение D-димера выше 1,0 мкг / мл достоверно в 18 раз увеличивало риск тромбозов [32]. В нашем исследовании у 4 больных были зафиксированы венозные тромбозы (2 ТЭЛА), совпадавшие с повышением D-димера выше 10 мкг / мл. Учитывая, что тромботические осложнения при COVID-19 связывают с аутоиммунным воспалением, мы проанализировали возможные взаимосвязи. Как хорошо известно, ГКС могут вызывать лейкоцитоз и нейтрофилез [33]. В нашем исследовании количество нейтрофилов при лечении ГКС увеличилось на 73 % (р<0,0001), при отсутствии изменений в группе контроля. При сохраняющейся лимфопении индекс Н / Л статистически значимо увеличился в 2,5 раза, при отсутствии изменений в группе контроля. Величина индекса Н / Л отражает активацию хронического воспаления [34, 35], аутоиммунного воспаления эндотелия [36] и характеризует неблагоприятное течение COVID-19 [37, 38]. Поэтому мы провели анализ корреляционной связи между изменениями индекса Н / Л и D-димера в процессе лечения (рис. 7).
Как видно из рисунка 7, была выявлена прямая статистически значимая ассоциация между повышением индекса D-димера и индекса Н / Л по группе в целом (r=0,47, p=0,005) и в группе лечения ГКС (r=0,49, p=0,04), и она отсутствовала в группе контроля. Это особенно важно, так как индекс Н / Л является не только маркером воспаления, но и предиктором ВТЭ и ТЭЛА [39, 40]. Исследование 180 больных с COVID-19 продемонстрировало тесную статистически значимую связь между величиной индекса Н / Л и степенью поражения легких по данным КТ [41]. Таким образом, применение ГКС, несмотря на быстрое снижение СРБ и острого воспаления, и улучшение клинического состояния больных с COVID-19, провоцирует рост нейтрофилеза, индекса Н / Л, что приводит к статистически значимому повышению риска тромбозов и ТЭ, показателем чего является достоверный рост D-димера. Использование индекса Н / Л может предсказывать как тяжесть течения COVID-19 [42], так и неблагоприятный прогноз [43]. При максимальном повышения индекса Н / Л (4,85–88,09) риск смерти больных с коронавирусной пневмонией увеличивается в 15 раз [44], а эффективность ГКС при высоком уровне Н / Л снижается [45]. Поэтому при выборе пульс-терапии высокими дозами ГКС в качестве противовоспалительного ответа на «цитокиновый шторм» у больных с COVID-19 необходимо учитывать уровни индекса Н / Л и D-димера и обязательно рассмотреть усиление антикоагулянтной терапии.
Кроме того, при повышении индекса Н / Л и хронического воспаления, восстановление воздушности легких может затягиваться [41, 46], что может удлинять сроки лечения. Пациенты активной группы провели в стационаре на 8 дней дольше (хотя частично это может объясняться и более тяжелым течением болезни). Для ускорения процесса выздоровления в нашей клинике принята тактика назначения после терапии ГКС курса ингибитора инфламмасом противовоспалительного средства колхицина (что иллюстрируется и нашим клиническим наблюдением), клиническая эффективность которого в настоящее время исследуется (https://clinicaltrials.gov/ct2/show/NCT04403243).
Ограничения исследования
Небольшое количество больных. Отсутствие рандомизации и несбалансированность групп по исходной тяжести, ретроспективный характер исследования.
1. Sun X, Wang T, Cai D, Hu Z, Chen J, Liao H et al. Cytokine storm intervention in the early stages of COVID-19 pneumonia. Cytokine & Growth Factor Reviews. 2020;53:38–42. DOI: 10.1016/j.cytogfr.2020.04.002
2. World Health Organization. Clinical management of COVID-19. WHO Reference Number: WHO/2019-nCoV/clinical/2020.5. 2020. [Internet] 2020. Available at: https://www.who.int/publications-detail-redirect/clinical-management-of-covid-19
3. Министерство здравоохранения РФ. Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Версия 7 (03.06.2020). Москва. Доступно на: https://static-0.rosminzdrav.ru/system/attachments/attaches/000/050/584/original/03062020_%D0%9CR_COVID-19_v7.pdf
4. Tobaiqy M, Qashqary M, Al-Dahery S, Mujallad A, Hershan AA, Kamal MA et al. Therapeutic management of patients with COVID-19: a systematic review. Infection Prevention in Practice. 2020;100061. [Epub ahead of print]. DOI: 10.1016/j.infpip.2020.100061
5. Darmon P, Dadoun F, Boullu-Ciocca S, Grino M, Alessi M-C, Dutour A. Insulin resistance induced by hydrocortisone is increased in patients with abdominal obesity. American Journal of Physiology-Endocrinology and Metabolism. 2006;291(5):E995–1002. DOI: 10.1152/ajpendo.00654.2005
6. Zarković M, Beleslin B, Ćirić J, Penezić Z, Stojković M, Trbojević B et al. Glucocorticoid effect on insulin sensitivity: A time frame. Journal of Endocrinological Investigation. 2008;31(3):238–42. DOI: 10.1007/BF03345596
7. Clore J, Thurby-Hay L. Glucocorticoid-Induced Hyperglycemia. Endocrine Practice. 2009;15(5):469–74. DOI: 10.4158/EP08331.RAR
8. Shono A, Mori S, Nakamura K, Yatomi A, Takada H, Tanaka H et al. Glucocorticoid-sensitive Paroxysmal Atrial Fibrillation, Sick Sinus Syndrome, and Mitral Regurgitation in a Patient with Malignant Rheumatoid Vasculitis. Internal Medicine (Tokyo, Japan). 2019;58(21):3093–8. DOI: 10.2169/internalmedicine.3090-19
9. Wright FL, Vogler TO, Moore EE, Moore HB, Wohlauer MV, Urban S et al. Fibrinolysis Shutdown Correlates to Thromboembolic Events in Severe COVID-19 Infection. Journal of the American College of Surgeons. 2020;S1072-7515(20)30400-2. [Epub ahead of print]. DOI: 10.1016/j.jamcollsurg.2020.05.007
10. Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. Journal of Thrombosis and Haemostasis. 2020;18(4):844–7. DOI: 10.1111/jth.14768
11. Thachil J, Tang N, Gando S, Falanga A, Cattaneo M, Levi M et al. ISTH interim guidance on recognition and management of coagulopathy in COVID‐19. Journal of Thrombosis and Haemostasis. 2020;18(5):1023–6. DOI: 10.1111/jth.14810
12. Liao X, Wang B, Kang Y. Novel coronavirus infection during the 2019–2020 epidemic: preparing intensive care units – the experience in Sichuan Province, China. Intensive Care Medicine. 2020;46(2):357–60. DOI: 10.1007/s00134-020-05954-2
13. The OpenSAFELY Collaborative, Williamson E, Walker AJ, Bhaskaran KJ, Bacon S, Bates C et al. OpenSAFELY: factors associated with COVID-19-related hospital death in the linked electronic health records of 17 million adult NHS patients. Epidemiology. Av. at: http://medrxiv.org/lookup/doi/10.1101/2020.05.06.20092999. DOI: 10.1101/2020.05.06.20092999. 2020.
14. Schett G, Sticherling M, Neurath MF. COVID-19: risk for cytokine targeting in chronic inflammatory diseases? Nature Reviews Immunology. 2020;20(5):271–2. DOI: 10.1038/s41577-020-0312-7
15. Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ. COVID-19: consider cytokine storm syndromes and immunosuppression. The Lancet. 2020;395(10229):1033–4. DOI: 10.1016/S0140-6736(20)30628-0
16. Xu X, Han M, Li T, Sun W, Wang D, Fu B et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proceedings of the National Academy of Sciences. 2020;117(20):10970–5. DOI: 10.1073/pnas.2005615117
17. Ucciferri C, Auricchio A, Di Nicola M, Potere N, Abbate A, Cipollone F et al. Canakinumab in a subgroup of patients with COVID-19. The Lancet Rheumatology. 2020; [Av. at: https://www.researchgate.net/publication/341920485_Canakinumab_in_a_subgroup_of_patients_with_COVID-19]. DOI: 10.1016/S2665-9913(20)30167-3
18. Wan MT, Shin DB, Winthrop KL, Gelfand JM. The risk of respiratory tract infections and symptoms in psoriasis patients treated with IL-17-pathway inhibiting biologics: A meta-estimate of pivotal trials relevant to decision-making during the COVID-19 pandemic. Journal of the American Academy of Dermatology. 2020;S0190962220308665. [Epub ahead of print]. DOI: 10.1016/j.jaad.2020.05.035
19. Cao Y, Wei J, Zou L, Jiang T, Wang G, Chen L et al. Ruxolitinib in treatment of severe coronavirus disease 2019 (COVID-19): A multicenter, single-blind, randomized controlled trial. Journal of Allergy and Clinical Immunology. 2020;S0091674920307387. [Epub ahead of print]. DOI: 10.1016/j.jaci.2020.05.019
20. Li H, Chen C, Hu F, Wang J, Zhao Q, Gale RP et al. Impact of corticosteroid therapy on outcomes of persons with SARS-CoV-2, SARSCoV, or MERS-CoV infection: a systematic review and meta-analysis. Leukemia. 2020;34(6):1503– 11. DOI: 10.1038/s41375-020-0848-3
21. Zha L, Li S, Pan L, Tefsen B, Li Y, French N et al. Corticosteroid treatment of patients with coronavirus disease 2019 (COVID‐19). Medical Journal of Australia. 2020;212(9):416–20. DOI: 10.5694/mja2.50577
22. Zhao Z. Description and clinical treatment of an early outbreak of severe acute respiratory syndrome (SARS) in Guangzhou, PR China. Journal of Medical Microbiology. 2003;52(8):715–20. DOI: 10.1099/jmm.0.05320-0
23. Ho JC, Ooi GC, Mok TY, Chan JW, Hung I, Lam B et al. High–Dose Pulse Versus Nonpulse Corticosteroid Regimens in Severe Acute Respiratory Syndrome. American Journal of Respiratory and Critical Care Medicine. 2003;168(12):1449–56. DOI: 10.1164/rccm.200306-766OC
24. Majoor CJ, Sneeboer MMS, de Kievit A, Meijers JCM, van der Poll T, Lutter R et al. The influence of corticosteroids on hemostasis in healthy subjects. Journal of Thrombosis and Haemostasis. 2016;14(4):716–23. DOI: 10.1111/jth.13265
25. Johannesdottir SA, Horváth-Puhó E, Dekkers OM, Cannegieter SC, Jørgensen JOL, Ehrenstein V et al. Use of Glucocorticoids and Risk of Venous Thromboembolism: A Nationwide Population-Based CaseControl Study. JAMA Internal Medicine. 2013;173(9):743. DOI: 10.1001/jamainternmed.2013.122
26. Stuijver DJF, Majoor CJ, van Zaane B, Souverein PC, de Boer A, Dekkers OM et al. Use of Oral Glucocorticoids and the Risk of Pulmonary Embolism. Chest. 2013;143(5):1337–42. DOI: 10.1378/chest.12-1446
27. Ye Z, Wang Y, Colunga-Lozano LE, Prasad M, Tangamornsuksan W, Rochwerg B et al. Efficacy and safety of corticosteroids in COVID-19 based on evidence for COVID-19, other coronavirus infections, influenza, community-acquired pneumonia and acute respiratory distress syndrome: a systematic review and meta-analysis. Canadian Medical Association Journal. 2020;cmaj.200645. [Epub ahead of print]. DOI: 10.1503/cmaj.200645
28. Yang Z, Liu J, Zhou Y, Zhao X, Zhao Q, Liu J. The effect of corticosteroid treatment on patients with coronavirus infection: a systematic review and meta-analysis. Journal of Infection. 2020;81(1):e13–20. DOI: 10.1016/j.jinf.2020.03.062
29. Siddiqi HK, Mehra MR. COVID-19 illness in native and immunosuppressed states: A clinical–therapeutic staging proposal. The Journal of Heart and Lung Transplantation. 2020;39(5):405–7. DOI: 10.1016/j.healun.2020.03.012
30. Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. The Lancet. 2020;395(10223):473–5. DOI: 10.1016/S0140-6736(20)30317-2
31. Zhang L, Yan X, Fan Q, Liu H, Liu X, Liu Z et al. D‐dimer levels on admission to predict in‐hospital mortality in patients with Covid‐19. Journal of Thrombosis and Haemostasis. 2020;18(6):1324–9. DOI: 10.1111/jth.14859
32. Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. The Lancet. 2020;395(10229):1054–62. DOI: 10.1016/S0140-6736(20)30566-3
33. Ronchetti S, Ricci E, Migliorati G, Gentili M, Riccardi C. How Glucocorticoids Affect the Neutrophil Life. International Journal of Molecular Sciences. 2018;19(12):4090. DOI: 10.3390/ijms19124090
34. Imtiaz F, Shafique K, Mirza S, Ayoob Z, Vart P, Rao S. Neutrophil lymphocyte ratio as a measure of systemic inflammation in prevalent chronic diseases in Asian population. International Archives of Medicine. 2012;5(1):2. DOI: 10.1186/1755-7682-5-2
35. Lorente D, Mateo J, Templeton AJ, Zafeiriou Z, Bianchini D, Ferraldeschi R et al. Baseline neutrophil–lymphocyte ratio (NLR) is associated with survival and response to treatment with second-line chemotherapy for advanced prostate cancer independent of baseline steroid use. Annals of Oncology. 2015;26(4):750–5. DOI: 10.1093/annonc/mdu587
36. Djaballah-Ider F, Touil-Boukoffa C. Effect of combined colchicinecorticosteroid treatment on neutrophil/lymphocyte ratio: a predictive marker in Behçet disease activity. Inflammopharmacology. 2020; [Epub ahead of print]. DOI: 10.1007/s10787-020-00701-x
37. Liu J, Liu Y, Xiang P, Pu L, Xiong H, Li C et al. Neutrophil-to-lymphocyte ratio predicts critical illness patients with 2019 coronavirus disease in the early stage. Journal of Translational Medicine. 2020;18(1):206. DOI: 10.1186/s12967-020-02374-0
38. Yang A-P, Liu J, Tao W, Li H. The diagnostic and predictive role of NLR, d-NLR and PLR in COVID-19 patients. International Immunopharmacology. 2020;84:106504. DOI: 10.1016/j.intimp.2020.106504
39. Karataş MB, İpek G, Onuk T, Güngör B, Durmuş G, Çanga Y et al. Assessment of Prognostic Value of Neutrophil to Lymphocyte Ratio and Platelet to Lymphocyte Ratio in Patients with Pulmonary Embolism. Acta Cardiologica Sinica. 2016;32(3):313–20. DOI: 10.6515/acs20151013a
40. Kayrak M, Erdoğan Hİ, Solak Y, Akıllı H, Gül EE, Yıldırım O et al. Prognostic Value of Neutrophil to Lymphocyte Ratio in Patients with Acute Pulmonary Embolism: A Restrospective Study. Heart, Lung and Circulation. 2014;23(1):56–62. DOI: 10.1016/j.hlc.2013.06.004
41. Zhang Y, Wu W, Du M, Luo W, Hou W, Shi Y et al. Neutrophil-toLymphocyte Ratio may Replace Chest Computed Tomography to Reflect the Degree of Lung Injury in Patients with Corona Virus Disease 2019 (COVID-19). Av. at: https://www.researchsquare.com/article/rs-23201/v1. DOI: 10.21203/rs.3.rs-23201/v1. 2020.
42. Zhu Z, Cai T, Fan L, Lou K, Hua X, Huang Z et al. Clinical value of immune-inflammatory parameters to assess the severity of coronavirus disease 2019. International Journal of Infectious Diseases. 2020;95:332–9. DOI: 10.1016/j.ijid.2020.04.041
43. Lagunas-Rangel FA. Neutrophil-to-lymphocyte ratio and lymphocyte-to-C- reactive protein ratio in patients with severe coronavirus disease 2019 (COVID-19): A meta-analysis. Journal of Medical Virology. 2020; [Epub ahead of print]. DOI: 10.1002/jmv.25819
44. Liu Y, Du X, Chen J, Jin Y, Peng L, Wang HHX et al. Neutrophil- tolymphocyte ratio as an independent risk factor for mortality in hospitalized patients with COVID-19. Journal of Infection. 2020;81(1):e6–12. DOI: 10.1016/j.jinf.2020.04.002
45. Mehra N, Sharp A, Lorente D, Dolling D, Sumanasuriya S, Johnson B et al. Neutrophil to Lymphocyte Ratio in Castration-Resistant Prostate Cancer Patients Treated with Daily Oral Corticosteroids. Clinical Genitourinary Cancer. 2017;15(6):678-684.e1. DOI: 10.1016/j.clgc.2017.05.012
46. Cataudella E, Giraffa CM, Di Marca S, Pulvirenti A, Alaimo S, Pisano M et al. Neutrophil-To-Lymphocyte Ratio: An Emerging Marker Predicting Prognosis in Elderly Adults with Community-Acquired Pneumonia. Journal of the American Geriatrics Society. 2017;65(8):1796–801. DOI: 10.1111/jgs.14894
Программа диагностики осложнений внебольничной пневмонии тяжелого течения Текст научной статьи по специальности «Клиническая медицина»
МЕЖДУНАРОДНЫЙ НАУЧНЫЙ ЖУРНАЛ «СИМВОЛ НАУКИ» №4/2016 ISSN 2410-700Х
Таким образом, издержки в организации учебной деятельности студентов отрицательно сказываются на их образе жизни, что приводит к ухудшению состояния здоровья и обуславливают высокую заболеваемость среди студенческой молодежи. Поэтому необходимо разрабатывать организационные меры и специальные программы, направленные на сохранение и укрепление здоровья студенческой молодежи.
Список использованной литературы:
1. Есауленко И.Э. Концептуальные основы охраны здоровья и повышения качества жизни учащейся молодежи региона/ И.Э. Есауленко, В.И. Попов, А.А. Зуйкова, Т.Н. Петрова. — Воронеж: Издательско-полиграфический центр «Научная книга», 2013 -797 с.
2. Мелихова Е.П., Либина И.И., Губина О.И., Натарова А.А. Особенности оценки здоровья студентов при обучении в медицинском вузе. Системный анализ и управление в биомедицинских системах. 2010. Т.9 № 4. — С. 809-812.
3. Мелихова Е.П. Гигиеническая оптимизация процесса обучения студентов медицинского вуза: автореферат дисс. канд. биологических наук / Федеральный научный центр гигиены им. Ф.Ф. Эрисмана. Москва, 2010.
4. Мелихова Е.П., Губина О.И. Сравнительная оценка состояния здоровья студентов медицинского вуза / Фундаментальные и прикладные научные исследования: сборник статей Международной научно-практической конференции. 2016. С.193-195
5. Мелихова Е.П., Натарова А.А., Васильева М.В. Гигиеническая оценка фактического питания студентов медицинского вуза / Символ науки. 2016. № 3-2. С. 178-180.
6. Попов В.И., Колесникова Е.Н., Петрова Т.Н. Здоровье учащейся молодежи: подходы к оценке и совершенствованию/ Научно-медицинский вестник Центрального Черноземья. 2014. № 58. — С. 60-63.
7. Толоконникова Е.П., Попов В.И. Оценка влияния микроклимата помещений на состояние работоспособности студентов/Системный анализ и управление в биомедицинских системах. 2009. Т. 8. № 4. С. 951-954.
8. Толоконникова Е.П., Попов В.И. Оценка ситуативной тревожности у студентов при обучении в медицинском вузе / Медико-биологические и социально-психологические проблемы безопасности в чрезвычайных ситуациях. 2009. № 5. С. 61-64.
© Натарова А.А., Васильева М.В., 2016
УДК 616.24-002
Николаевский Евгений Николаевич
Доктор медицинских наук, профессор, ФГОУ ВПО «Самарский ГУПС», г. Самара, РФ E-mail: [email protected]
ПРОГРАММА ДИАГНОСТИКИ ОСЛОЖНЕНИЙ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ ТЯЖЕЛОГО ТЕЧЕНИЯ
Аннотация
В статье представлена разработанная программа диагностики осложнений внебольничной пневмонии тяжелого течения в многопрофильном стационаре.
Ключевые слова
Диагностика, осложнения, внебольничная пневмония тяжелого течения.
_МЕЖДУНАРОДНЫЙ НАУЧНЫЙ ЖУРНАЛ «СИМВОЛ НАУКИ» №4/2016 ISSN 2410-700Х_
Тяжелая внебольничная пневмония характеризуется высокими показателями летальности, поэтому своевременная диагностика осложнений играет важную роль для повышения эффективности комплексного лечения [1, 2]. На основании результатов лечения 40 молодых больных осложненной внебольничной пневмонией (ОВП) тяжелого течения в СамВМедИ (г. Самара) нами разработана программа рациональной диагностики в многопрофильном стационаре [3, 4, 5, 6].
Учитывая тяжесть состояния больных и характер осложнений диагностику, лечение проводили в отделении реанимации и интенсивной (ОРИТ) [7, 8]. В ходе обследования в ОРИТ проводили ежедневное физикальное обследование с оценкой динамических изменений аускультативной картины легких, степени выраженности легочных и внелегочных осложнений, тяжести респираторных расстройств, органной (полиорганной) дисфункции (недостаточности). Осуществляли постоянный динамический контроль показателей температуры тела, АД, ЧСС, ЧДД, массы тела, диуреза.
Определяли парциальное давление кислорода, углекислого газа, рН артериальной и смешанной крови, электролиты, показатели свёртывающей системы, белкового состава крови, выделительной функции почек, острофазовые биохимические показатели (таблица 1).
Таблица 1
Программа диагностики ОВП в многопрофильном стационаре [7, 8]
Этап ы Мероприятия
I Клиническое обследование Ежедневное физикальное обследование, оценка динамики аускультативной картины легких, признаков легочных и внелегочных осложнений, тяжести ОДН, органной дисфункции. Контроль показателей температуры тела, систолического и диастолического артериального давления, ЧСС, ЧДД, массы тела, диуреза.
II Рентгенологическое исследование Рентгенография, малодозовая цифровая флюорография органов грудной клетки с учётом изменения клинико-лабораторной картины заболевания
III Лабораторные исследования
Микроскопия мазка мокроты, окрашенной по Граму Посев мокроты, определение чувствительности бактерий к антибиотикам Трёхкратное бактериологическое исследование венозной крови Посев мокроты на БК Динамический контроль концентрации фибриногена, С-реактивного белка, АСТ, АЛТ, креатинина, белка и его фракций в крови, электролитов плазмы и кислотно-основного состояния крови Оценка иммунной, свертывающей системы крови, гематокрита Мониторинг парциального давления газов крови Проведение клинических анализов крови, мочи в динамике
IV Инструментальные исследования Аппаратный мониторинг оксигенации крови Электрокардиография в динамике УЗИ плевральной полости в динамике (по показаниям) УЗИ селезёнки, печени, почек с оценкой в динамике структуры и размеров (по показаниям) Эхокардиография с оценкой в динамике размеров камер сердца, показателей сократительной способности (по показаниям) Санационная, диагностическая бронхоскопия (при развитии выраженного бронхообструктивного синдрома, затяжного течения пневмонии)
Рентгенологическое исследование проводилось в двух проекциях, с учётом изменения клинической картины ОВП на фоне проводимого лечения с интервалом в 2-3 дня. Из лабораторных исследований наиболее информативны для определения тактики антибактериальной терапии были данные микроскопии мокроты (окрашенной по Граму), посева мокроты и чувствительности бактерий к антибиотикам, бактериологическое исследование крови, определение лейкоцитарного индекса интоксикации.
_МЕЖДУНАРОДНЫЙ НАУЧНЫЙ ЖУРНАЛ «СИМВОЛ НАУКИ» №4/2016 ISSN 2410-700Х_
При проведении комплексной интенсивной терапии определяли в динамике электролиты плазмы крови, парциальное давление газов в крови, состояние кислотно-основного состояния. Из биохимических показателей важное значение для оценки органной дисфункции имели С-реактивный белок, общий фибриноген, АСТ, АЛТ, щелочная фосфатаза, креатинин, белок крови и его фракции. Состояние свертывающей системы крови оценивали по показателям протромбинового индекса, концентрации общего фибриногена, количеству тромбоцитов в крови.
Дополнительные инструментальные исследования у больных тяжелой и крайне тяжелой ОВП включали трансторакальную полипозиционную ЭхоКГ, УЗИ плевральной полости при формировании плеврального выпота (с интервалом 3-4 дня). У больных с экссудативным плевритом УЗИ проводили для более точной оценки объема выпота и уточнения показаний для пункции. УЗИ органов брюшной полости выполнялась для выявления признаков инфекционно-токсического поражения печени, почек, селезенки с интервалом в 4-6 дней. Санационно-диагностическая бронхоскопия осуществлялась при развитии выраженного бронхообструктивного синдрома, затяжного течения болезни [7, 8].
Обследование с применением комплекса клинических, лабораторно-инструментальных методов исследований позволило верифицировать легочные и внелегочные осложнения тяжелой ОВП на ранних стадиях развития у 90% больных, что позволило повысить эффективность комплексного лечения [8].
Таким образом, в диагностике и оценке динамики развития легочных осложнений у больных ОВП наиболее эффективна малодозовая цифровая рентгенография органов грудной клетки (с интервалом в 2-3 дня), УЗИ плевральных полостей (с интервалом 3-4 дня). Для выявления внелегочных осложнений у данной категории пациентов показано ультразвуковое исследование сердца, печени, почек, селезенки с интервалом в 4-6 дней.
Список использованной литературы:
1. О.В. Фесенко, А.И. Синопальников Современные системы оценки внебольничной пневмонии тяжелого течения: перспективы и ограничения // Клиническая микробиология и антимикробная химиотерапия. — 2011. — Том 13, № 3. — С. 204-213.
2. Исмагилов Н.М., Николаевский Е.Н., Кульпин Д.И. Осложненная внебольничная пневмония в 21 веке // Пульмонология. — 2005. — Т. 2, Прил. 1. -С. 234.
3. Кульпин Д.И., Николаевский Е.Н., Исмагилов Н.М. Осложнения внебольничной пневмонии у военнослужащих // Вестник Рос. военно-медицинской академии. — 2005. — Прил. 1 (14). — С. 100-101.
4. Хутинаев М.А., Николаевский Е.Н., Исмагилов Н.М. Современная лечебно-диагностическая тактика при осложненной внебольничной пневмонии // Пульмонология. — 2005. — Т. 2, Прил. 1. — С. 127.
5. Исмагилов Н.М., Николаевский Е.Н., Хутинаев М.А. Современное течение осложненной внебольничной пневмонии у военнослужащих по призыву // Вестник Рос. военно-медицинской академии. — 2005.- Прил. 1 (14). — С. 102.
6. Николаевский Е.Н. Современные аспекты диагностики и лечения тяжелой внебольничной пневмонии у лиц молодого возраста // Вестник Рос. военно-медицинской академии. — 2007. — Т. 6, № 8. — С. 82.
7. Кульпин Д.И., Николаевский Е.Н., Исмагилов Н.М. Эффективность лечения осложненной внебольничной пневмонии в отделении интенсивной терапии и реанимации многопрофильного лечебного учреждения // Вестник Рос. военно-медицинской академии. — 2005. — Прил. 1 (14). — С. 124-125.
8. Николаевский Е.Н. Некоторые аспекты диагностики и лечения осложненной внебольничной пневмонии // Вестник Рос. военно-медицинской академии. — 2005. — Прил. 1 (12). — С. 122.
9. Бовтунов В.П., Николаевский Е.Н., Исмагилов Н.М. Изменения сердечно-сосудистой системы у больных тяжелой внебольничной пневмонией // Вестник Рос. военно-медицинской академии. — 2007. — № 2 (18). — С. 90-92.
© Николаевский Е.Н., 2016
Ретроспективный анализ лабораторного тестирования 54 пациентов с пневмонией тяжелого и крайне тяжелого течения, вызванной COVID-19
Оригинал: Laboratory Investigation
Автор: Yanlei Li et al
Опубликовано: Nature 27.04.2020 (https://www.nature.com)
Перевод: Наталия Шахгильдян, Фонд профилактики рака
Краткое содержание
Своевременное выявление изменений лабораторных показателей, характерных для пневмонии, вызванной коронавирусом нового типа (COVID-19), может способствовать постановке диагноза и определению прогноза заболевания. В этом исследовании собраны клинические данные 54 взрослых с COVID-19, которые с 28 января по 11 февраля 2020 года находились на лечении в университетском госпитале Тунцзи Хуачжунского университета науки и технологии (район Zhongfa, Китай). Средний возраст пациентов – 61,8 ± 14,5 лет, большая часть – 50-79 лет. Сопутствующие заболевания чаще наблюдались у тех, кто был в крайне тяжелом состоянии, чем у пациентов в тяжелом состоянии. Уровень лимфоцитов был значительно снижен у всех групп, но у пациентов в крайне тяжелом состоянии количество лимфоцитов было ниже, чем у пациентов в тяжелом состоянии. У всех пациентов было зарегистрировано удлинение протромбинового времени (ПТВ) и увеличение уровня продуктов деградации фибриногена (ПДФ) и д-димера, однако эти показатели сильнее изменились у пациентов в крайне тяжелом состоянии. Уровень ферритина – чувствительный показатель заражения коронавирусом тяжелого острого респираторного синдрома‑2 (SARS-CoV-2), однако он не мог быть использован для оценки тяжести заболевания. Кроме того, у всех пациентов зафиксировано значительное повышение уровня двух провоспалительных факторов: растворимого рецептора интерлейкина-2 (sIL-2R) и интерлейкина-6 (IL-6). У пациентов с крайне тяжелым течением пневмонии эти факторы повышены сильнее, чем у пациентов с тяжелым течением. По частоте поражения почки заняли второе место, затем следуют сердце и печень. У пациентов в крайне тяжелом состоянии почки и сердце были поражены сильнее, чем у пациентов с тяжелом состоянии. Все пациенты в тяжелом состоянии (31) выздоровели. Из пациентов в крайне тяжелом состоянии умерло 6 человек, выздоровело выздоровело 17. Крайне тяжелые пациенты провели в стационаре значительно больше времени, чем тяжелые пациенты.
Если суммировать, тяжесть заболевания связана с пониженным уровнем лимфоцитов, удлинением ПТВ, вторичным повышением фибринолитической активности и активности sIL-2R и IL-6 .
АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ ТЯЖЕЛОЙ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ У ВЗРОСЛЫХ: ОБЗОР РЕКОМЕНДАЦИЙ И КЛИНИЧЕСКИЕ ПРИМЕРЫ | Рачина
1. Заболеваемость населения России в 2012 году. Статистические материалы. Москва, 2013.
2. Синопальников А.И. Внебольничная пневмония. В кн.: Внебольничные инфекции дыхательных путей. Руководство для врачей. Под ред. А.И. Синопальникова, Р.С. Козлова. — М: Премьер МТ, Наш Город, 2007. C. 295–333.
3. Sligl W.I., Marrie T.J. Severe Community-Acquired Pneumonia. Crit Care Clin 2013; 29: 563–601.
4. Angus D.C., Marrie T.J., Obrosky D.S., et al. Severe communityacquired pneumonia: use of intensive care services and evaluation of American and British Thoracic Society diagnostic criteria. Am J Respir Crit Care Med 2002;166: 717–23.
5. Mortensen E.M., Coley C.M., Singer D.E., et al. Causes of death for patients with community-acquired pneumonia: results from the Pneumonia Patient Outcomes Research Team cohort study. Arch Intern Med 2002;162: 1059–64.
6. Tejerina E., Frutos V., Restrepo M.I., et al. Prognosis factors and outcome of community-acquired pneumonia needing mechanical ventilation. J Crit Care 2005;20: 56–65.
7. Marrie T.J., Carriere K.C., Jin Y., et al. Factors associated with death among adults <55 years of age hospitalized for community-acquired pneumonia. Clin Infect Dis 2003;36(4):413–21.
8. Ewig S., Woodhead M., Torres A. Towards a sensible comprehension of severe community-acquired pneumonia. Intensive Care Med 2011; 37: 214–223.
9. Torres A., Blasi F., Peetermans W.E., et al. The aetiology and antibiotic management of community-acquired pneumonia in adults in Europe: a literature review. Eur J Clin Microbiol Infect Dis. doi 10.1007/s10096- 014-2067-1.
10. Welte T., Torres A., Nathwani D. Clinical and economic burden of community-acquired pneumonia among adults in Europe. Thorax 2010; doi:10.1136/thx.2009.129502.’
11. Рачина С.А., Козлов Р.С., Шаль Е.П., и соавт. Структура бактериальных возбудителей внебольничной пневмонии в многопрофильных стационарах г. Смоленска. Пульмонология 2011; 1: 5–18.
12. Иванчик Н.В., Козлов С.Н., Рачина С.А., и соавт. Этиология фатальных внебольничных пневмоний у взрослых. Пульмонология 2008; 6: 53–58.
13. Рачина С.А., Козлов Р.С. Современные подходы к микробиологической диагностике при внебольничной пневмонии. Пульмонология 2010; № 5: 5–14.
14. Pavia A.T. What is the Role of Respiratory Viruses in Community-Acquired Pneumonia? What is the Best Therapy for Influenza and Other Viral Causes of Community-Acquired Pneumonia? Infect Dis Clin N Am 2013; 27: 157–175.
15. Пневмококки: уроки прошлого — взгляд в будущее. Козлов Р.С. Смоленск, 2010.
16. Козлов Р.С., Сухорукова М.В., Сидоренко С.В., и соавт. Чувствительность к цефтаролину основных возбудителей бактериальных инфекций в Российской Федерации. Клин микробиол антимикроб химиотер 2015; 17(1) — принята к публикации.
17. Сивая О.В., Козлов Р.С., Кречикова О.И., и соавт. Антибиотикорезистентность Haemophilus influenzae в России: результаты многоцентрового проспективного исследования ПеГАС. Клин микробиол антимикроб химиотер 2014; 16: 57–69.
18. Woodhead M., Blasi F., Ewig S. and the ERS/ESCMID Task Force. Guidelines for the management of adult lower respiratory tract infections. Clin Microbiol Infect 2011; 17 (Suppl. 6): 1–59.
19. Lim W.S., Baudouin S.V., George R.C., et al. British Thoracic Society guidelines for the management of community-acquired pneumonia in adults — update 2009. Thorax 2009; 64 (Suppl III): iii1–55.
20. Mandell L.M., Wunderink R.G, Anzueto A., et al. Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on the Management of Community-Acquired Pneumonia in Adults. Clin Infect Dis 2007; 44 (Suppl 2): S27–72.
21. Чучалин А.Г., Синопальников А.И., Козлов Р.С., и соавт. Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых. Пульмонология 2014; 4: 13–48.
22. Sibila O., Restrepo M.I., Anzueto A. What is the Best Antimicrobial Treatment for Severe Community-Acquired Pneumonia (Including the Role of Steroids and Statins and Other Immunomodulatory Agents). Infect Dis Clin N Am 2013; 27: 133–147.
23. Torres A., Garau J., Arvis P., et al. Moxifloxacin monotherapy is effective in hospitalized patients with community-acquired pneumonia: the MOTIV study — a randomized clinical trial. Clin Infect Dis 2008; 46(10): 1499–509
Тяжелая пневмония, требующая госпитализации в ОИТ: пересмотрено
Резюме
Цели
Описать этиологию, исходы и подходы к ведению пациентов с внебольничной пневмонией (ВП) и внутрибольничной пневмонией (ВП), которые потребовали госпитализации в ОИТ, и определить предикторы смертности.
Методы
Проспективное обсервационное исследование 119 последовательных пациентов, поступивших в ОИТ с диагнозом ВП (n = 89) или HAP (n = 30) с мая 2011 по декабрь 2012.
Результаты
Общий уровень смертности в отделениях интенсивной терапии и стационарах от ВП и ВП составил 24,4% и 30,3% соответственно. Не было значительных различий между пациентами с ВП и ВП с точки зрения смертности в ОИТ или средней продолжительности пребывания в больнице. Наиболее часто выделяемыми возбудителями были h2N1 (23%) и Streptococcus pneumonia (17%) у пациентов с ВП и Acinetobacter baumannii (37%) у пациентов с ГАП. Организмы с множественной лекарственной устойчивостью (МЛУ) были обнаружены у 32 (38.6%) изолятов. Среднее время приема антибиотиков составляло 2 часа. Большинство пациентов (82%) получали антибиотики дважды. Множественный регрессионный анализ выявил септический шок (бета = 0,43, p <0,001), острый респираторный дистресс-синдром [ARDS] (бета = 0,34, p = 0,003) и индекс тяжести пневмонии [PSI] (бета = -0,36 , p <0,024) в качестве значимых предикторов смертности.
Заключение
Исходы пациентов с тяжелой пневмонией, поступивших в отделение интенсивной терапии, были лучше, чем в предыдущих отчетах.Раннее применение комбинированных антибиотиков практиковалось с осторожностью. Микроорганизмы с множественной лекарственной устойчивостью и респираторные вирусы были обычно изолированными патогенами. Наличие септического шока, ОРДС и высокого ИСД были независимыми прогностическими факторами смертности.
Ключевые слова
ARDS
ICU
Результат
Пневмония
Оценка степени тяжести
Рекомендуемые статьиЦитирующие статьи (0)
Copyright © 2015 Авторы. Производство и хостинг Elsevier Ltd.
Рекомендуемые статьи
Ссылки на статьи
Из-за тяжелой пневмонии 4,2 миллиона детей в год отчаянно нуждаются в кислороде
ЛОНДОН / НЬЮ-ЙОРК, 11 ноября 2020 г. — и страны со средним уровнем дохода с критически низким уровнем кислорода каждый год, как показал новый анализ ЮНИСЕФ, Инициативы Клинтона по доступу к здравоохранению (CHAI), Спасите детей и Детского исследовательского института Мердока (MCRI).[i]
Агентства заявляют, что сбои в работе служб здравоохранения, связанные с пандемией COVID-19, угрожают стать еще одним ударом в борьбе с крупнейшим в мире инфекционным убийцей детей, который уже уносит жизни более 800000 детей в возрасте до пяти лет каждый год. Пневмония вызывается бактериями, вирусами или грибками, и дети борются за дыхание, поскольку их легкие наполняются гноем и жидкостью. Тяжелая пневмония ежегодно поражает более 22 миллионов детей младшего возраста в странах с низким и средним уровнем доходов и убивает больше, чем малярия, корь и диарея вместе взятые.
«COVID-19 заразил миллионы людей и еще больше ухудшил тяжелые условия жизни детей», — сказала Генриетта Фор, исполнительный директор ЮНИСЕФ. «Пока мир борется с пандемией и серьезными последствиями, которые она несет для наиболее уязвимых, мы не должны упускать из виду тот факт, что пневмония продолжает уносить более 2000 молодых жизней каждый день. Медицинский кислород может помочь некоторым из этих жизней ».
Медицинский кислород может спасти жизнь многим детям с тяжелой пневмонией в сочетании с антибиотиками.Но во многих местах кислород для лечения ребенка с тяжелой пневмонией в течение 3-4 дней может стоить не менее 30-45 фунтов стерлингов [ii]. Для беднейших семей этот законопроект представляет собой огромное препятствие для лечения — если ребенок может попасть в медицинское учреждение с работающим кислородом и вообще обученными медицинскими работниками, которых часто не хватает в более бедных странах.
Более бедные страны столкнулись с огромной нехваткой кислородных систем и материалов еще до начала COVID-19. Но растущие потребности из-за пандемии сделали этот дефицит заметным.Хорошая новость в том, что кислород можно производить на месте по доступной цене.
Генеральный директор
Save the Children UK Кевин Уоткинс сказал: « Пандемия выявила острую нехватку кислорода в беднейших странах. Ежегодно миллионы детей обращаются в медицинские учреждения в развивающихся странах, нуждаясь в кислородной поддержке. В большей части Африки менее одного из пяти получают необходимое лечение. Многие умирают от истощения — их хрупкие тела испытывают нехватку кислорода, необходимого для восстановления.
«Так не должно быть.В то время как мир стремится увеличить снабжение кислородом, чтобы спасти жизни как от COVID-19, так и от пневмонии, он должен стать самым труднодоступным, бесплатным для всех и устойчивым. Если мы сосредоточимся только на краткосрочных решениях, мы рискуем упустить важную возможность спасти миллионы жизней для будущих поколений ».
Д-р Иэн Бартон, генеральный директор CHAI, сказал: «Помощь странам в создании устойчивых систем для надежного и эффективного обеспечения кислородом спасет жизни во время этой пандемии и обеспечит устойчивое лечение пациентов в будущем.”
Моделирование Джона Хопкинса показало, что нарушение ухода за новорожденными, доступ к антибиотикам и поставка вакцин против пневмонии означают, что сочетание пневмонии и неонатального сепсиса может уносить более 25 000 жизней детей каждый месяц. [Iii] Во многих странах во многих странах. Анализ данных из рутинных информационных систем здравоохранения, отдельно проведенный «Спасем детей» и ЮНИСЕФ, показывает, что количество детей, получающих иммунизацию, диагностику и лечение, сократилось.
После начала пандемии обострение нехватки кислорода и рост цен на кислород были зарегистрированы в странах с одними из самых высоких показателей детской смертности от пневмонии, таких как Индия [iv], Бангладеш [v] и Нигерия [vi]. По данным Всемирной организации здравоохранения, в беднейших странах в настоящее время может быть от 5 до 20% необходимого им медицинского кислорода [vii].
Но пандемия COVID-19 вызвала глобальные усилия по улучшению систем подачи кислорода. Одним из свидетельств масштабных усилий по увеличению поставок является то, что ВОЗ и партнеры раздали 30 000 кислородных концентраторов странам по всему миру.Только ЮНИСЕФ поставил более 15 000 концентраторов в более чем 90 стран [viii]
.
В комментарии, опубликованном в журнале Lancet ко Всемирному дню пневмонии 12 ноября, глобальные агентства здравоохранения, включая Save the Children и ЮНИСЕФ, призывают правительства и доноров наращивать инвестиции и усилия, предпринимаемые в ответ на COVID-19, для укрепления систем здравоохранения, которые могут бороться с детской пневмонией [ix].
Спасите детей, CHAI и ЮНИСЕФ призывают доноров и правительства:
- Инвестируйте в кислородные системы в странах с низким и средним уровнем доходов, в том числе в Африке и Южной Азии, чтобы обеспечить стабильное снабжение кислородом детей, которые в нем нуждаются.
- Поддерживать и укреплять основные стандартные медицинские услуги, имеющие решающее значение для выживания детей во время вспышки COVID-19 и в последующий период, с бесплатным пакетом основных медицинских услуг, который включает кислородную терапию, в том числе для детей.
- Получение более точных данных для мониторинга пандемии и ее воздействия на систему здравоохранения, включая охват пульсоксиметрии для диагностики, кислорода и рекомендуемых антибиотиков первой линии при детской пневмонии — амоксициллина в форме диспергируемых таблеток и инъекционных антибиотиков при тяжелой пневмонии.
Во всем мире «Спасите детей», ЮНИСЕФ и CHAI расширяют масштабы программ на местах и объединяют усилия с партнерами для предоставления жизненно важных диагнозов и лечения детям. Например:
- В Нигерии организация «Спасите детей» стала партнером GSK, чтобы обеспечить надежное снабжение кислородом каждой койки педиатрического отделения в больнице общего профиля Дутсе в Нигерии.
- В Гане и Сенегале ЮНИСЕФ закупил запасы кислорода для реагирования на COVID-19, продолжая и расширяя усилия по поддержке правительства в улучшении доступа к основному лечению для детей с пневмонией.В Сьерра-Леоне ЮНИСЕФ поддержал установку трех кислородных установок с адсорбцией при переменном давлении (PSA) по всей стране, а в Бангладеш ЮНИСЕФ открыл завод по производству жидкого медицинского кислорода для отделения специального ухода за новорожденными в районной больнице Кокс-Базар-Садар для обслуживания беженцев рохинджа. .
- В Эфиопии, Кении, Нигерии, Индии и Уганде — пяти странах, на которые приходится треть всех смертей в мире из-за низкого содержания кислорода в крови — CHAI с 2016 года работает над расширением доступа к диагностике и лечению.Как финалисты конкурса Фонда Макартура «100 и изменение», CHAI и MCRI ежегодно стремятся спасти десятки тысяч жизней, постоянно расширяя кислородную терапию и диагностику в этих пяти странах с тяжелым бременем болезни. CHAI также работает в партнерстве с PATH и Коалицией «Каждое дыхание на счету» (EBC) над проектом Координация реагирования на респираторную помощь COVID-19 , чтобы поддержать страны в разработке и выполнении плана респираторной помощи для удовлетворения требований COVID-19.
[i] Оценка подготовлена организацией «Спасите детей», ЮНИСЕФ и CHAI совместно с группой экспертов на основе опубликованных данных о доле госпитализированных детей с пневмонией, у которых диагностирована гипоксемия, которая, по нашим оценкам, составляет в среднем 25% во всем мире со значительными вариациями по регионам.
[ii] https://blogs.worldbank.org/health/oxygen-all-during-covid-19-coronavirus-and-beyond
[iii] https://www.thelancet.com/action/showPdf?pii=S2214-109X%2820%2930229-1 — Сценарий 2: 12 920 дополнительных детских смертей в результате перебоев в связи с ведением случаев неонатального сепсиса и пневмонии; 11 760 детских смертей в результате отказа от пероральных антибиотиков от пневмонии; 690 детских смертей в результате отказа от пневмококковой конъюгированной вакцины.
[iv] https://www.bbc.com/news/world-asia-india-54139112
[v] https://apnews.com/article/df97326ec00fb7cc4abf5b3821ace984
[vi] https://qz.com/africa/18/why-africa-has-medical-oxygen-shortages-across-the-continent/
[vii] https://www.who.int/publications/m/item/covid-19-virtual-press-conference-transcript—23-october-2020
[viii] https://www.who.int/publications/m/item/covid-19-virtual-press-conference-transcript—23-october-2020
[ix] Комментарии написаны экспертами в данной области и представляют их собственные взгляды, а не обязательно взгляды The Lancet или какого-либо специального журнала Lancet.В отличие от статей, содержащих оригинальные исследования, этот комментарий не рецензировался внешними экспертами. Комментарий Lancet закрыт до 23.30 GMT / 18.30 EST среды, 11 ноября, и тогда он выйдет в эфир.
Успешное лечение тяжелой пневмонии, пиопневмоторакса с тяжелым острым респираторным дистресс-синдромом и септического шока: история болезни | European Journal of Medical Research
Мужчина 65 лет был госпитализирован 15 декабря 2018 г. в отделение интенсивной терапии дыхательных путей (RICU) после того, как в течение 10 дней испытывал симптомы лихорадки, кашля, боли в груди слева и одышку в течение 1 дня. день.Он много лет страдал гипертонией, сахарным диабетом и диабетической нефропатией и контролировал эти состояния с помощью лекарств. При поступлении пациент показал высокие баллы 21, 4 и 6 соответственно по шкалам Acute Physiology и Chronic Health Evaluation II (APACHE II), SOFA и Женевской шкале. Его прикроватный снимок грудной клетки показал серьезный левый плевральный выпот с воспалением правого легкого (рис. 1а) и рост воспалительных маркеров (лейкоциты (WBC) 27,55 * 10 9 / л, прокальцитонин (ПКТ) 2.8900 нг / мл и C-реактивный белок (CRP)> 200 мг / л) с некоторыми другими плохими лабораторными результатами (D-димер 0,5 мг / л, молочная кислота 10,40 моль / л, альбумин 23,4 г / л, креатинин 171,7 мкмоль / л , Предшественник натрийуретического пептида B-типа 1437,00 пг / мл). Пациент лечился карбапенемами и гликопептидами (рис. 2), антибактериальный спектр которых включал грамположительные бактерии, грамотрицательные бактерии, Pseudomonas, и анаэробы. В то же время пациентка также получала неинвазивную вентиляцию (режим ST, FiO 2 90%, F 18 ударов в минуту, IPAP 13 см вод. Ст. 2 O, EPAP 5 см вод.Через несколько часов у пациента появилась раздражительность, холодные и влажные конечности и шок. Из левой грудной клетки извлекли 780 мл гнойной смеси жидкости и газа, а в левую часть грудной клетки поместили торакальную дренажную трубку для непрерывного дренажа. Исследование плеврального выпота показало, что общее количество клеток составляло 681 889 * 10 6 / л, а количество ядерных клеток составляло 245 589 * 10 6 / л. После этих мер у пациента немного уменьшилась одышка.
Фиг.1
Серия прикроватных снимков грудной клетки: a Большое количество левых плевральных выпотов с воспалением правого легкого; b Левый плевральный выпот был частично абсорбирован при добавлении инкапсулированного газа, и тень от массы нижнего правого легкого стала больше и толще; c Пневматоз произошел в средостении, и обширное скопление газа было обнаружено с обеих сторон шеи и под кожей грудной стенки; d Воспаление обоих легких уменьшилось, и подкожный газ в основном абсорбировался
Рис.2
Изменения температуры тела и режима приема антиинфекций во время госпитализации
Состояние пациента ухудшилось со второго дня госпитализации. У него появилась гипотензия с респираторной недостаточностью. Его НО упал до 67 мм рт. Лабораторные тесты показали худшие показатели — лейкоциты 38,63 * 10 9 / л, ПКТ 19,0700 нг / м, СРБ> 200 мг / л, BNP 4711,00 пг / м и расчетная скорость клубочковой фильтрации (рСКФ) снизилась до 26 мл / мин. . Прикроватный снимок грудной клетки показал инкапсулированный пневмоторакс в левой грудной полости (рис.1б). Были выполнены интубация трахеи и инвазивная механическая вентиляция (режим P-A / C, FiO2 100%, F 18 / мин, Pi 16 см вод. Ст. 2 O, PEEP 4 см вод. Ст. 2 O). При этом применялись седативные, болеутоляющие и миорелаксанты. Также использовались норэпинефрин, низкомолекулярный гепарин, энтеральное питание и парентеральное питание. Бронхоальвеолярный лаваж проводился для выявления обширной эрозии и отека слизистой оболочки бронхов и серьезной закупорки дыхательных путей обильными гнойными выделениями.В течение следующих 11 дней до экстубации проводили ежедневный бронхоальвеолярный лаваж.
Прикроватная ПЗПТ выполнялась в течение 8–12 часов в день в течение 3 дней подряд, начиная с третьего дня госпитализации, а объем ультрафильтрации составлял 150 мл, 100 мл и 1116 мл соответственно. После ПЗПТ у пациента сохранялись стабильные показатели жизнедеятельности без использования норадреналина и миорелаксантов. С 5-го дня приема гамма-глобулин вводили по 20 г в день в течение 3 дней подряд, после чего ОИ пациента постепенно увеличивался (рис.3). Во время лечения посев мокроты предполагал рост дрожжевых грибков, в то время как несколько культур крови не показали каких-либо положительных результатов. Stenotrophomonas maltophilia , тест на чувствительность которого показал, что он чувствителен к миноциклину, был обнаружен в левом плевральном гное. Aspergillus обнаружен в мокроте эндотрахеальной трубки. Aspergillus fumigatus присутствовал в жидкости бронхоальвеолярного лаважа. Поэтому к лечению были добавлены противогрибковые препараты и миноциклин.
Рис. 3
Изменения индекса оксигенации и воспалительных факторов
На 10-е сутки у этого пациента развилась подкожная эмфизема с одышкой (рис. 1в). Учитывая, что сжатие и закупорка дренажной трубки могут препятствовать улучшению этого синдрома, закрытая торакальная дренажная трубка была заменена. На 12-й день маркеры воспаления продолжили снижаться, а СКФ увеличилась до 53,6 мл / мин. Эксперименты со спонтанным дыханием (SBT) проводились в течение 2 часов, а индекс быстрого поверхностного дыхания (RSBI) составлял 80.Затем эндотрахеальная трубка была удалена, и пациент был переведен на неинвазивную механическую вентиляцию легких. Торакальная дренажная трубка была удалена на 14-й день, и в то время использовались противоинфекционные схемы сульбактама, цефоперазона, ванкомицина, миноциклина и каспофунгина. На 17-й день прикроватная рентгенограмма грудной клетки пациента показала уменьшение воспаления и в основном абсорбцию подкожного газа (рис. 1d). Носовые катетеры заменили неинвазивную механическую вентиляцию легких, а биапенем использовался отдельно для защиты от инфекции на 21-й день.Пациент выписался из стационара через 35 дней поступления и остался доволен методом и эффектом лечения. Наблюдался в поликлинике той же больницы. В настоящее время он ведет нормальный образ жизни, его рСКФ остается на уровне 60 мл / мин (по состоянию на октябрь 2020 года).
Ведение тяжелой внебольничной пневмонии у детей в развивающихся и развитых странах
Введение
Внебольничная пневмония (ВП) распространена среди детей во всем мире, но ее заболеваемость и смертность значительно выше в развивающихся странах, чем в промышленно развитом мире.1–3 Было подсчитано, что у детей третьего мира в возрасте до 5 лет возникает около 151 миллиона новых эпизодов в год, что приводит к заболеваемости 0,29 эпизода на ребенка в год и уровню смертности 1,3–2,6%, 1 2 или > 2 миллиона в год. В промышленно развитых странах общее количество новых эпизодов в той же возрастной группе составляет около 4 миллионов (частота 0,05 эпизодов на ребенка в год), а риск смерти чрезвычайно низок у здоровых в остальном детей детей и относительно важен только для субъектов с тяжелыми формами заболевания. хронические основные заболевания.3 4
Эти различия обусловлены рядом факторов. Во-первых, частота таких факторов риска, как недоедание, скученность, низкая масса тела при рождении, ВИЧ и отсутствие иммунизации против кори и пневмококка, намного выше среди детей в развивающихся странах.1–4 Во-вторых, они с большей вероятностью будут подвержены влиянию других вероятных или возможные факторы риска, такие как дефицит цинка и витамина А, плохое образование матерей и проживание в загрязненных районах.1–4 Наконец, между развивающимися и развитыми странами существуют глубокие различия в организации и эффективности их систем здравоохранения.5
Целью этого обзора является рассмотрение имеющихся данных, касающихся диагностики и лечения тяжелых случаев ВП у детей. Данные, использованные в этом обзоре, были определены путем поиска в PubMed, Medline, Current Contents и списках литературы соответствующих статей. Поисковые запросы были «внебольничная пневмония», «тяжелая пневмония» и «осложненная пневмония». Учитывались только статьи, написанные на английском языке и относящиеся к педиатрической популяции (в возрасте 0–18 лет). Учитывая большое количество опубликованных статей, мы ограничились цитированием самых последних работ (2003–2009 гг.), Если они не были полезны для справочных целей.Поскольку условно-патогенные агенты могут вызывать большинство эпизодов у хозяина с ослабленным иммунитетом, мы не будем рассматривать пневмонию у детей с нарушенной защитой хозяина.
Оценка тяжелой ВП
Расчетная частота госпитализации детей из-за ВП составляет 8,7% всех случаев ВП в развивающихся странах4 и 0,3% в развитых странах6. Используемые для определения ВП и ее тяжести, а также распространенность факторов риска развития тяжелой ВП сильно различаются (см. таблицу 1).
Таблица 1
Критерии, используемые в развивающихся и развитых странах для определения степени тяжести внебольничной пневмонии (ВП)
Учитывая ограниченную доступность радиологического оборудования в развивающихся странах, ВП обычно диагностируется только на основании клинических признаков и симптомов .8 Это часто приводит к завышению общего числа случаев, поскольку его часто путают с другими респираторными заболеваниями, в основном с бронхиолитом. Однако это также может быть недооценено, поскольку плохая организация служб здравоохранения во многих развивающихся странах означает, что многие дети с тяжелой формой ВП не попадают в больницу, а умирают дома.
Тот факт, что тяжесть ВП определяется на основе клинических признаков и симптомов, также может привести к ошибочным оценкам, поскольку было показано, что втягивание грудной клетки и учащение дыхания имеют положительную и отрицательную прогностическую ценность как индикаторы консолидации легких только 45% и 83%, 9 и эти проценты могут быть значительно ниже у детей в возрасте> 36 месяцев.10 Как показано в таблице 1, развивающиеся страны используют классификацию ВОЗ для определения степени тяжести ВП, а тяжелая ВП диагностируется, когда помимо всех признаки и симптомы, используемые для диагностики поражения нижних дыхательных путей, у ребенка наблюдается втяжение нижней части грудной клетки, расширение носа и (если молодой) хрюканье.11 Для очень тяжелой ВП требуется по крайней мере еще один признак или симптом поражения дыхательной системы, центральной нервной системы или желудочно-кишечного тракта. Было подсчитано, что на основе этих критериев более 75% детей, госпитализированных по поводу ВП, имеют тяжелое или очень тяжелое заболевание. 12–15
Вероятно, более надежные данные о частоте тяжелых и очень тяжелых ВП. собираются в развитом мире, где большинство случаев ВП подтверждается рентгенографией грудной клетки.7 Кроме того, хотя нет оценки в детстве, аналогичной той, которая используется у взрослых с ВП, 16-17 эксперты согласны с тем, что оксигенация крови является важным фактором для оценки тяжести ВП и лучший показатель потребности в госпитализации, 7 и рекомендации Британского торакального общества (BTS) по ведению детей с ВБП утверждают, что сатурация кислорода <92% указывает на тяжелую ВП.7 Используя эти критерии, недавнее многоцентровое исследование, проведенное в 13 больницах на северо-востоке Англии Кларком и соавторами , показало, что 59% детей с радиологически подтвержденной ВП в возрасте 0–15 лет имели тяжелое заболевание и, когда анализ был только у младенцев, частота тяжелой ВП увеличилась до 71% .18 Эти данные подтверждают предыдущие выводы Tan et al 19 и Michelow et al .20
Некоторые авторы пытались использовать рентгенографию грудной клетки для улучшения определения тяжелой ВП, но, хотя некоторые исследования показывают, что консолидация легких связана с большим клиническим поражением, это не подтверждается глобальной оценкой всех доступных данных.21–24
Этиология и тяжесть ВП
Давно известно (в основном на основании исследований пункции легких, проведенных в развивающихся странах), что легкая и умеренная ВП в основном вызывается вирусами, особенно в первые годы жизни, в то время как большинство случаев тяжелой ВП вызывается бактериями.1–4
Однако также было показано (в развивающихся и развитых странах), что вирусы гриппа и респираторно-синцитиальный вирус играют важную роль в возникновении тяжелой и / или сложной ВП.25–27 Недавнее распространение нового вируса гриппа A / h2N1 ясно показало, что вирусная инфекция может вызывать ВП с отрицательным исходом во всех возрастных группах. 28–30
Streptococcus pneumoniae , Haemophilus influenzae (включая не- типизируемые штаммы) и Staphylococcus aureus являются наиболее часто культивируемыми бактериями в тяжелых случаях педиатрии 31–35, хотя некоторые исследования также показали, что широко распространены Streptococcus pyogenes и грамотрицательные кишечные бактерии.36 37 Значение «атипичных» бактерий ( Mycoplasma pneumoniae и Chlamydophila pneumoniae ) в тяжелой и / или осложненной ВП не было полностью определено во всем мире, в основном из-за трудностей в их идентификации.21 Однако недавно опубликованные данные показывают, что у значительного числа детей ВП, вызванная атипичными бактериями, имеет осложненное течение, в основном из-за наличия плеврального выпота.38
Роль различных патогенов значительно изменилась за последние годы, особенно в развитых странах.Тем не менее, профилактика ВП — серьезная задача, которую предпринимают различные организации, такие как ВОЗ, также в развивающихся странах. Широкое использование вакцины H influenzae типа b и, совсем недавно, гептавалентной пневмококковой конъюгированной вакцины (PCV-7) почти устранило ВП из-за первого39 40 и значительно снизило количество случаев, вызванных вторым патогеном. 41– 43 Учитывая эффективность этих двух вакцин, их следует настоятельно рекомендовать во всем мире.41–43 Однако S pneumoniae по-прежнему является наиболее важным этиологическим агентом тяжелой и / или осложненной ВП во всем мире: 44–46 серотипы пневмококков 1 и 3 значительно чаще ассоциировались с осложненной, чем с неосложненной ВП, 42 43 47–49 и пневмококковые серотипы 5, 7F, 14 и 19A часто были связаны с тяжелой и / или сложной ВБП 50 51
Лечение
В большинстве случаев невозможно определить этиологию ВП в клинических условиях. упражняться.1–3 7 18 22 34 Более того, сочетанные инфекции бактерий и вирусов распространены во всем мире, и их нельзя отличить от инфекции, вызванной одним патогеном. 1–3 7 18 22 34 Это означает, что антибактериальная терапия назначается всем детям с строго подозреваемый или подтвержденный диагноз ВП, особенно если клинические признаки и симптомы тяжелые; однако существуют различия в терапевтических режимах, обычно используемых в развивающихся и развитых странах.1–3 7 11 16 22 34 В этом отношении следует также помнить, что в развивающихся странах распространены некоторые этиологии (например, туберкулез и малярия). ) и его также следует рассматривать для лечения в сложных случаях2 4 5; это объясняет, почему антибиотики почти всегда назначают пациентам с ВП.
Лечение антибиотиками в развивающихся странах
В развивающихся странах основной целью лечения является снижение риска смерти как можно дешевле.11 52 53 В таблице 2 показано лечение антибиотиками, предложенное ВОЗ для тяжелых и очень тяжелых случаев ВП у детей. диагностирован в странах третьего мира.11 В тяжелых случаях рекомендуются бензилпенициллин, амоксициллин и хлорамфеникол, а в случае очень тяжелой ВП рекомендуются ампициллин или амоксициллин плюс гентамицин.11 Выбор альтернативной схемы лечения, продолжительность терапии и госпитализации, а также возможность продолжения приема антибиотиков перорально в домашних условиях — все это обусловлено развитием заболевания, развитием осложнений и наличием факторов риска. 11 54
Таблица 2
Лечение антибиотиками детей с тяжелой и очень тяжелой внебольничной пневмонией (ВП) в соответствии с руководящими принципами ВОЗ, рекомендованными для развивающихся стран
Очевидно, что этот подход вызывает ряд проблем из-за риска внутрибольничных заболеваний и более тщательного медицинского обслуживания затрат, поэтому различные исследования изучали, можно ли лечить тяжелую ВП перорально в домашних условиях без значительного увеличения количества неудач лечения или риска осложнений и смерти.53 55–59 К сожалению, лишь некоторые из них являются достаточно методологически адекватными, чтобы сделать четкие выводы.55–59 Тем не менее, несмотря на их различия в отношении используемых антибиотиков и критериев эффективности, все они указывают на отсутствие значительной разницы между пероральными и пероральными препаратами. парентеральная терапия по показателям неэффективности лечения или клинического успеха в конце терапии и в конце периода наблюдения (таблица 3). Однако в этих исследованиях не принимается во внимание относительная польза и вред пероральных антибиотиков у детей с ВП, связанный с бактериальным подтверждением, рентгенографической консолидацией долей или прогрессированием эмпиемы, что означает, что пероральная антибиотикотерапия не может назначаться систематически во всех случаях тяжелой ВП. .Следовательно, терапевтический подход, предложенный ВОЗ, остается лучшим компромиссом между минимальным риском неудачи и максимальной простотой терапии.
Таблица 3
Сравнение пероральных и парентеральных антибиотиков при тяжелой внебольничной пневмонии (ВП) у детей
Одно возможное дальнейшее упрощение, ведущее к значительному сокращению продолжительности госпитализации, теоретически может быть основано на данных, касающихся предикторов ответа на лечение. В связи с этим доля детей с пневмонией, которые не могут адекватно реагировать на обычные антибиотики и поддерживающую терапию, колеблется от 9% до 21%, независимо от используемого антибиотика 60, и было продемонстрировано, что данные получены из истории болезни пациента и первых обследование — например, более молодой возраст, предыдущий прием антибиотиков, кормление грудью, проживание в переполненном доме, более высокая частота дыхания и статус иммунизации — являются независимыми предикторами возможной неудачи лечения.57 61
Если возможно, насыщение крови кислородом дает существенные преимущества для выявления возможных неудач лечения. Исследования, проведенные в Индонезии, Кении, Замбии и Гамбии, показали, что риск смерти у детей с гипоксией на исходном уровне в 1,4–4,6 раза выше, чем у детей без него53. 61–67 Рентгенография грудной клетки, которая позволяет выявить характеристики, которые больше коррелируют с бактерия или другие бактерии с вирусной этиологией, часто недоступны в развивающихся странах.2 4 5 С другой стороны, пульсоксиметр значительно проще в использовании, чем рентгенографическое оборудование грудной клетки, дешевле, легче калибровать и проще обслуживать и ремонтировать .53 Следовательно, его использование (вместе с рассмотрением клинических данных) могло бы показаться лучшим способом решения после короткого периода наблюдения, рискует ли ребенок неэффективностью перорального лечения антибиотиками или его можно безопасно лечить дома. В отличие от развитых стран, жар и лабораторные исследования обычно не используются в развивающихся странах для оценки ВП2 4 5
Лечение антибиотиками в развитых странах
В промышленно развитых странах начальное лечение тяжелой ВП включает госпитализацию и внутривенное введение антибиотиков.7 16 22 68–70 Выбор антибиотика в основном зависит от возраста пациента, и давно предлагалось использовать один препарат, активный против наиболее вероятного возбудителя инфекции. 7 16 22 68–70 Однако недавняя демонстрация того, что атипичные бактерии могут играть роль роль в возникновении тяжелой ВП привела к тому, что некоторые эксперты предложили использовать комбинацию бета-лактама и макролидного антибиотика у всех детей в возрасте> 3 месяцев.16 22 Таблица 4 суммирует текущий терапевтический подход к тяжелой ВП в развитых странах, рекомендованный большой группой экспертов.Очевидно, что возраст является наиболее важным фактором для определения этиологии. Хотя вирусная этиология играет важную роль у детей в возрасте до 2 лет, в то время как у детей более старшего возраста бактерии (особенно атипичные) встречаются чаще, большое совпадение клинических, лабораторных и рентгенологических данных между различными этиологиями поддерживает систематическое использование антибиотиков при тяжелой ВП. .22
Таблица 4
Предлагаемые лекарственные препараты для лечения тяжелой внебольничной пневмонии (ВП) в развитых странах
Глобальная пандемия антибиотикорезистентности отдельных патогенов, обычно обнаруживаемых у детей с респираторными заболеваниями, оказала незначительное влияние на лечение противомикробными препаратами. тяжелая и осложненная ВП у детей.22 Это связано с тем, что, хотя штаммы S pneumoniae постепенно развили множественные механизмы устойчивости за последние 20–30 лет, а устойчивые штаммы (в том числе некоторые с множественной лекарственной устойчивостью) распространились в нескольких регионах мира, 71 72 было обнаружено, что риск неудачи после лечения пенициллинами и цефалоспоринами существенно не отличается от того, который обычно наблюдается у взрослых и детей с ВП из-за чувствительных к антибиотикам штаммов S pneumoniae .73–78 Более того, в большинстве случаев неудач было трудно определить, был ли отрицательный результат истинным бактериологическим поражением из-за устойчивости инфекционного организма или клиническим отказом из-за других сопутствующих факторов.73–78 Успех Лечение бета-лактамными антибиотиками, даже в присутствии устойчивых штаммов, может быть легко объяснено на основе фармакокинетических и фармакодинамических принципов, предсказывающих вероятный клинический успех.79 80
Вопрос об устойчивости S pneumoniae к макролидам более важен22, потому что риск неэффективности монотерапии макролидами в случаях бактериемической ВБП был четко задокументирован.81 82 Это объясняет, почему монотерапия макролидами не рекомендуется для начального лечения тяжелой детской ВП, а при назначении макролидов всегда используется в сочетании с бета-лактамами, чтобы покрыть атипичные бактерии (которые лишь в редких случаях проявляют устойчивость к macrolides) .22 68
Наконец, в каждом классе антибиотиков выбор должен быть ограничен препаратом, который наиболее активен против возможных инфекционных агентов и имеет лучший профиль переносимости и безопасности, самый узкий спектр действия и самую низкую стоимость.1–3 7 22 34 После того, как будет продемонстрировано клиническое улучшение, пациентов, которые могут переносить пероральные препараты и не страдают диареей, следует переключить на пероральную терапию, чтобы уменьшить дискомфорт пациента, способствовать выписке из больницы и ограничить расходы на здравоохранение. Общая продолжительность лечения обычно составляет 10–14 дней. В случае осложнений рекомендуются антибиотики более широкого спектра действия (например, пиперациллин плюс ингибитор бета-лактама или карбапенем в сочетании с ванкомицином) в течение более длительного периода (3–6 недель).
Лечение осложнений
Парапневмонический выпот
Частота парапневмонического выпота в США и Европе в последние годы увеличивалась, и в настоящее время он встречается примерно у 40% всех пациентов с бактериальной пневмонией19. 83–85. предположили, что использование PCV-7 может быть связано с так называемым «феноменом замещения» 19 41–43 83–85, то есть за счет уменьшения циркуляции штаммов, включенных в вакцину, PCV-7 благоприятствует заболевания, вызванные невакцинными серотипами, включая серотипы 1, 3, 5, 7F и 19A, которые часто связаны с эмпиемой.Однако эта гипотеза требует подтверждения, поскольку влияние замены серотипа на частоту инвазивных заболеваний у детей до сих пор было незначительным, 86 87, и было показано, что рост числа инфекций, вызванных такими серотипами, как 19A, не зависит от использования ПКВ. -7,88 В большинстве случаев эмпиемы объем жидкости минимален, а жидкость не загрязнена и содержит лишь незначительное количество фибрина и клеток.19 Однако в присутствии бактерий (примерно в 20–30% случаев) объем жидкости имеет тенденцию к уменьшению. увеличивается и изменяется его состав с переходом к фибрино-гнойной и организационной фазе.11 В случае ВП жидкость вызвана изменениями местных факторов и представлена экссудатом (то есть отличается от транссудата, потому что характеризуется одним из следующих факторов: отношение белка плевральной жидкости к белку сыворотки> 0,5; соотношение Лактатдегидрогеназа плевральной жидкости (ЛДГ) до уровня ЛДГ в сыворотке> 0,6; ЛДГ в плевральной жидкости> 0,7 раза выше нормального верхнего предела для сыворотки).
Целью лечения парапневмонического выпота является стерилизация плевральной жидкости и восстановление нормальной функции легких.Опять же, выбор антибиотиков разный в развивающихся и развитых странах. ВОЗ рекомендует вводить хлорамфемикол 25 мг / кг внутримышечно или внутривенно каждые 8 ч до улучшения состояния ребенка, а затем тот же препарат перорально в общей сложности в течение 4 недель.11 В случае документально подтвержденной инфекции, вызванной S aureus , ВОЗ предлагает клоксациллин 50 мг / кг внутримышечно или внутривенно каждые 6 часов вместе с гентамицином 7,5 мг / кг внутримышечно или внутривенно один раз в день до улучшения состояния ребенка, а затем оксациллин перорально четыре раза в день в течение 3 недель.11
В развитых странах, поскольку S pneumoniae является наиболее частой причиной эмпиемы, 19 83 84 86 первичная терапия основана на высоких внутривенных дозах антибиотика, способных обеспечить хорошее покрытие пневмококков. корреляция между развитием эмпиемы и наличием устойчивости S pneumoniae к антибиотикам, 89 рекомендуемый антибиотик такой же, как и для тяжелых случаев. В случае некротизирующей пневмонии, прогрессирующего заболевания или основного иммунодефицита детям младшего возраста показаны препараты широкого спектра действия в сочетании с антистафилококковыми антибиотиками.Продолжительность введения не кодифицирована, но большинство авторов предлагают внутривенную терапию в течение 1 недели после исчезновения лихорадки с последующей пероральной терапией в течение следующих 1–4 недель. 90
Независимо от возраста, дренирование плевральной жидкости не показано. если его объем, обнаруженный при УЗИ, не превышает 1 см. 86 90 Если объем больше, дренаж полезен для подтверждения диагноза путем исключения других причин плеврального выпота, определения качества жидкости, выявления инфекционного организма и уменьшения респираторных симптомов, таким образом ускорение разрешения болезни.Теоретически жидкость можно дренировать четырьмя способами: торакоцентез с помощью дренажной трубки (с фибринолизом или без него) или хирургическая обработка раны. 90–93 Можно использовать один кран, когда УЗИ показывает, что объем жидкости незначительно превышает 1 см и боковая рентгенография пролежня показывает, что он свободно течет в плевральную полость, 90–93, но когда объем увеличивается или жидкость становится локализованной, необходимо использовать повторные отводы или вставлять дренаж.90–93 Хотя нерандомизированные исследования показали, что Показано, что эти две процедуры сопоставимы, многие авторы предпочитают введение дренажа, поскольку повторные проколы более травматичны.90–93
Фибринолитические препараты рекомендуются, когда плевральная жидкость становится органной. 86 90 93 94 Однако эффективность фибринолитических средств обсуждается, и самые последние данные, кажется, предполагают, что они не значительно сокращают продолжительность лихорадки, дренажный зонд. дренаж или госпитализация, и эта операция может потребоваться независимо от стадии заболевания.95
Данные об эффективности видеоассистированной торакоскопической хирургии (VATS) также противоречивы.Avansino и др. обнаружили, что пациенты, перенесшие первичную операцию, имели меньшую смертность и нуждались в более коротких периодах госпитализации, зондовой торакостомии и антибактериальной терапии.96 С другой стороны, Sonnappa и др. обнаружили, что VATS и зондовая торакостомия с интраплевральной урокиназой были в значительной степени эквивалентны с точки зрения частоты неудач и медианы госпитализации после вмешательства.97
На основании этих данных кажется, что пошаговый алгоритм эмпиемы плевры, предложенный Proesmans и De Boeck, можно считать приемлемым.90 Это относится только к антибиотикам, если объем плевральной жидкости <1 см; если это не так, следует использовать дренаж через межреберную трубку с добавлением фибринолитиков, когда жидкость кажется организованной. VATS считается спасательной процедурой только в тех случаях, когда предыдущие методы лечения не помогли.
Наконец, у детей с парапневмоническим выпотом следует внимательно наблюдать за признаками и симптомами ухудшения гемодинамики из-за перикардиального выпота. 90 98 99 Хотя количество перикардиальной жидкости обычно очень мало и не вызывает симптомов, иногда требуется перикардиоцентез.
Некротическая пневмония и пневмоцеле
Во время бактериальной ВП развиваются некротизирующая пневмония и пневматоцеле в результате локализованного бронхиолярного и альвеолярного некроза.100 Хотя такие бактерии, как S pneumoniae , H influenzae , Klebsiella pneumoniae Klebsiella pneumoniae Может быть вовлечена Escherichia coli , основная причина — S aureus , 100, что означает, что после постановки диагноза следует немедленно ввести внутривенное антистафилококковое средство.Выбор препарата зависит от частоты возникновения метициллинрезистентности S aureus в районе, где возник этот случай: если она превышает 20%, следует использовать ванкомицин.
Продолжительность внутривенного введения антибиотиков не кодифицирована, но разумно предположить, что его следует продолжать до тех пор, пока у ребенка не появятся признаки улучшения, а затем следует пероральное введение в течение общего курса антибиотиков продолжительностью не менее 3 недель.
Большинство пневматоцеле спонтанно исчезают, а рентгенологические изменения исчезают в течение первых 2 месяцев, хотя это может занять до 6 месяцев.Следует продолжать наблюдение в сложных случаях, включая случаи с поражением гемиторакса более чем на 50% и тяжелым ателектазом, а также развитием бронкоплевральных свищей с натяжением100. хирургическое иссечение — единственное решение. 100 101
Абсцессы легкого
Абсцессы легкого возникают в результате острого разрушения паренхимы легкого, обычно из-за бактерий, попадающих из ротоглотки, 102 103, хотя реже они вызваны лежащий в основе бронхиальный процесс, развитие ВП или септического эмбола.
Анаэробные бактерии ( Prevotella , Fusobacterium , Peptostreptococcus и Bacteroides ) являются наиболее частыми возбудителями абсцессов легких и составляют 70–90% всех изолятов104 105 S aureus наиболее часто встречается обнаруживается при сопутствующей эмпиеме, 106 107 и факультативные патогены включают α-гемолитические стрептококки, Enterobacteriaceae , S pyogenes и S pneumoniae .108 109
Эволюция абсцесса легкого часто коварна.Примерно у половины таких пациентов наблюдается кашель и жар, выделяется мокрота, также могут возникать боли в груди и кровохарканье. Тем не менее, гнилостное дыхание иногда является единственным или преобладающим проявлением.102, 103 Диагноз основывается на рентгенографическом обнаружении уровня воздух-жидкость, указывающего на полость размером не менее 2 см с определенной стенкой.110 Однако рентгенограммы грудной клетки первоначально проводятся. недиагностика примерно в одной пятой случаев.110 КТ-сканирование является полезным средством определения степени заболевания, любых лежащих в основе аномалий и наличия инородного тела.Ультрасонография также может быть полезной для целей последующего наблюдения.110
Основой лечения является длительная антибактериальная терапия.111 112 Большинство экспертов рекомендуют двух-трехнедельный курс парентерального приема антибиотиков с последующим курсом пероральных антибиотиков для завершения в общей сложности 4–6 недель. Выбранные антибиотики должны обеспечивать аэробное и анаэробное покрытие (т.е. пенициллиназа-резистентный агент, активный против S aureus и клиндамицина или пиперациллина, плюс ингибитор бета-лактама или меропенем).111 112 Если есть подозрение на наличие или выделение грамотрицательных бактерий, следует добавить аминогликозиды. 111 112
От 80% до 90% всех абсцессов легких рассасываются при использовании только антибактериальной терапии. У большинства детей симптомы отсутствуют в течение 7–10 дней, хотя лихорадка может сохраняться до 3 недель111. 112 В случае тяжелых пациентов или тех, у кого не наблюдается улучшения после 7–10 дней соответствующей противомикробной терапии, необходимо хирургическое вмешательство. быть на рассмотрении. Все чаще используются малоинвазивные методы чрескожной аспирации под контролем КТ, но дренирование также может потребоваться, если абсцесс имеет диаметр> 4 см и вызывает смещение средостения или приводит к зависимости от аппарата ИВЛ.113 В редких сложных случаях может потребоваться торакотомия с лобэктомией и / или декортикацией. 113
Поддерживающая терапия
Кислород
Введение кислорода считается важным при лечении тяжелой ВП как в развивающихся, так и в развитых странах, хотя есть и незначительные различия в целевых уровнях насыщения кислородом (Sao 2 ). ВОЗ рекомендует давать кислород детям с тяжелой ВП и крайне низким втягиванием грудной клетки или с частотой дыхания ≥70 вдохов / мин, а также всем детям с очень тяжелой ВП.11 Введение кислорода рекомендуется до исчезновения признаков гипоксии или, если доступна пульсоксиметрия, до тех пор, пока Sao 2 не останется стабильным на уровне> 90%. Рекомендации BTS указывают на введение кислорода во всех случаях тяжелой ВП и предлагают поддерживать уровни Sao 2 > 92% .7
Существуют большие различия в методах, используемых для доставки кислорода, потому что ВОЗ рекомендует назальные канюли или назальный или носоглоточный катетера и подчеркивает тот факт, что маска для лица или головы не показана, 11 в то время как рекомендации BTS предлагают использовать носовые канюли, головной ящик и лицевую маску, подчеркивая при этом тот факт, что нет убедительных доказательств, указывающих на то, что любой из этих методов более эффективен. эффективнее других.7 С другой стороны, кормление легче с помощью назальных канюль, хотя они не позволяют подавать кислород со скоростью потока> 2 л / мин.
Гидравлическая терапия
Поскольку дети с тяжелой формой ВП обычно не могут поддерживать потребление жидкости из-за одышки или усталости, 114–116 назогастральная или внутривенная инфузионная терапия является обязательной. Питание через назогастральный зонд может ухудшить респираторные заболевания у новорожденных и детей младшего возраста с узкими носовыми ходами, 114 поэтому им и пациентам, страдающим рвотой, предпочтительно по возможности вводить внутривенное вливание жидкости.Потребление жидкости следует рассчитывать с учетом возможного обезвоживания и больших потерь жидкости из-за учащенного дыхания и лихорадки. Тем не менее, баланс жидкости и концентрацию электролитов в сыворотке следует контролировать ежедневно, потому что у тяжелобольных детей относительно часто наблюдается несоответствующая секреция антидиуретического гормона, и в таких случаях следует тщательно контролировать объем и тип инфузии жидкости. Физиотерапия широко используется в педиатрической практике (особенно в промышленно развитых странах), поскольку считается, что она полезна для эвакуации воспалительного экссудата и трахеобронхиального секрета, устранения обструкции дыхательных путей, снижения сопротивления дыхательных путей, усиления газообмена и уменьшения работы дыхания.117 118 Однако его реальная полезность спорна, поскольку нет научных доказательств того, что он изменяет течение ВП, даже в тяжелых случаях или при наличии осложнений. 119–122 физиотерапия, эффективность которой может быть разной (например, перкуссия грудной клетки и вибрация, использование осциллирующих устройств и использование положительного давления на выдохе), эти результаты дополнительно подтверждают рекомендации BTS о том, что физиотерапию грудной клетки не следует рекомендовать детям с ВП.7
Выводы
Хотя тяжелая ВП и осложнения бактериальной ВП стали менее частыми с появлением широкого применения эффективных антибиотиков на ранних этапах развития инфекции и возможности предотвращения ВП с помощью вакцин, они продолжают вносить свой вклад. детской заболеваемости, требуют инвазивного обследования и лечения, а также продлевают госпитализацию. Ограниченное количество существующих руководств по ведению педиатрической ВП лишь незначительно учитывает тяжелые и / или сложные случаи7, 68, 69, и дальнейшие международные руководства срочно необходимы как в развивающихся, так и в развитых странах.Однако для разработки рекомендаций, основанных на фактических данных, необходимы дополнительные исследования в различных областях, таких как этиология тяжелых случаев и причины осложнений, более точное определение антибиотикотерапии первого и второго ряда (включая дозы и продолжительность лечения). парентерального и перорального лечения антибиотиками), а также когда операция действительно полезна, разъяснение роли различных типов физиотерапии грудной клетки в зависимости от состояния пациента и определение того, как вести наблюдение за пациентами с различными типами осложнений.Наконец, необходимо приложить дополнительные усилия для предотвращения ВП, чтобы охват вакцинацией против H influenzae типа b и S pneumoniae во всем мире мог быть достигнут во всем мире, а влияние использования этих вакцин можно было контролировать с помощью активных наблюдение.
Острая эозинофильная пневмония — NORD (Национальная организация редких заболеваний)
УЧЕБНИКИ
Cottin V, Cordier JF. Эозинофильные пневмонии, В: Cottin V, Cordier JF, Richeldi L. Орфанные болезни легких: клиническое руководство по редким заболеваниям легких.2015, Springer-Verlag (Лондон).
Кордье Дж. Ф., Коттин В. Эозинофильные пневмонии. В: Интерстициальная болезнь легких, 5-е изд. Schwarz MI, King Jr. TE, ред. 2011, Народное медицинское издательство, Шелтон, Коннектикут. С. 833-893.
Коттин В. Идиопатические эозинофильные пневмонии. В: Европейская респираторная монография: Клинические справочники для специалистов в области респираторных заболеваний. Сиротские болезни легких. Кордье JF, изд. 2011 г., Европейское респираторное общество, Великобритания. Стр. 118-139.
СТАТЬИ ИЗ ЖУРНАЛА
Rhee CK, Min KH, Yim NY, Lee JE, Lee NR, Chung MP, Jeon K.Клиническая характеристика и лечение острой эозинофильной пневмонии кортикостероидами. Eur Respir J 2013; 41: 402-9. http://www.ncbi.nlm.nih.gov/pubmed/22599359
Tsigkaropoulou E, Hatzilia D, Rizos E, et al. Острая эозинофильная пневмония, вызванная венлафаксином. Gen Hosp Psychiatry. 2011; 33: e7-9. http://www.ncbi.nlm.nih.gov/pubmed/21762842
Миллер Б.А., Грей А., Леблан Т.В. и др. Острая эозинофильная пневмония, вызванная даптомицином: сообщение о трех случаях. Clin Infect Dis. 2010; 50: 63-68.http://www.ncbi.nlm.nih.gov/pubmed/20420515
Jeong YJ, Kim KL, Seo IJ, et al. Эозинофильные заболевания легких: клинический, радиологический и патологический обзор. Рентгенография. 2007; 27: 617-637. http://www.ncbi.nlm.nih.gov/pubmed/17495282
Shorr AF, Scoville SL, Cersovsky SB, et al. Острая эозинофильная пневмония среди военнослужащих США, дислоцированных в Ираке или рядом с ним. ДЖАМА. 2004; 292: 2997-3005. http://jama.ama-assn.org/content/292/24/2997.long
Allen JN, Magro CM, King MA.Эозинофильные пневмонии. Semin Respir Crit Care Med. 2002; 23: 127-134. http://www.ncbi.nlm.nih.gov/pubmed/16088605
Poletti V, Costabel U, Casoni GL, et al. Редкие инфильтративные заболевания легких: проблема для клиницистов. Дыхание. 2004; 71: 431-443. http://www.ncbi.nlm.nih.gov/pubmed/15467318
Philit F, Etienne-Mastroianni B, Parrot A и др. Идиопатическая острая эозинофильная пневмония. Обследовано 22 пациента. Am J Respir Crit Car Med. 2002; 166: 1235-1239. http: //www.ncbi.nlm.nih.gov/pubmed/12403693
ИНТЕРНЕТ
Saukkonen JJ. Легочная эозинофилия.Medscape, Обновлено: 31 декабря 2015 г. Доступно по адресу: http://emedicine.medscape.com/article/301070-overview По состоянию на 6 декабря 2018 г.
Признаки самоподдерживающихся воспалительных цепей при тяжелой пневмонии COVID
Наиболее опасным для жизни осложнением COVID-19 является тяжелая пневмония с сильным поражением воздушных мешков легких. Воспаление играет центральную роль в этом процессе.Хотя воспаление является важной частью нашей иммунной защиты для борьбы с инфекцией, оно, тем не менее, может вызывать побочные повреждения тканей. Из-за высокой смертности и продолжительности заболевания, наблюдаемого при пневмонии COVID-19, было высказано предположение, что воспаление, возникающее в результате заражения SARS-CoV-2 (коронавирусом, вызывающим COVID-19), каким-то образом отличается от типа воспаления, вызванного другими респираторными инфекциями. Однако исчерпывающих данных, подтверждающих это утверждение, не было.В статье Nature , Grant et al. 1 восполняют этот пробел в знаниях, напрямую сравнивая иммунные клетки, выделенные из легких людей с пневмонией COVID-19, с иммунными клетками, полученными от людей, перенесших пневмонию, возникшую по другим причинам.
Как и большинство вирусов, поражающих дыхательную систему, SARS-CoV-2 может проникать в организм через нос или рот и инфицировать эпителиальные клетки, выстилающие поверхность дыхательных путей в горле и легких.Инфицированные клетки испускают молекулярные сигналы, которые предупреждают иммунные клетки в крови о миграции в легкие для усиления противовирусного ответа 2 . Хотя важную информацию можно получить, изучая такие иммунные клетки, обнаруженные в кровотоке, истинное понимание воспаления легких требует исследования, которое включает изоляцию этих клеток из воздушных мешков (альвеол) легких.
Золотым стандартом получения иммунных клеток из легких является метод, называемый бронхоальвеолярным лаважем, при котором физиологический раствор вводится в небольшие дыхательные пути и воздушные мешочки, а затем осторожно удаляется с помощью отсасывания для извлечения интересующих клеток.Используя этот метод, Грант и его коллеги получили иммунные клетки (рис. 1) у 88 человек с пневмонией COVID-19 и у 211 человек с пневмонией, возникшей в результате других инфекций. Все образцы были взяты от людей в отделениях интенсивной терапии, которым для дыхания требовался аппарат искусственной вентиляции легких. В большинстве случаев образцы собирались через повторяющиеся промежутки времени во время болезни, что обеспечивало всесторонний анализ во времени (продольный анализ) воспалительной реакции в легких людей с тяжелой пневмонией COVID-19.
Рисунок 1 | Цикл воспаления, который может привлекать иммунные клетки в легкие во время пневмонии COVID-19. Грант и др. . 1 проанализировали иммунные клетки из легких людей, перенесших пневмонию, вызванную COVID-19 или другими заболеваниями. У людей с COVID-19 была большая доля Т-клеток и моноцитов в популяции иммунных клеток, чем у людей с другими типами пневмонии. a . Авторы подтвердили сообщения 4 , 5 о том, что в легких иммунные клетки, называемые макрофагами, инфицированы вирусом SARS-CoV-2, вызывающим COVID-19.Грант и др. . обнаружили, что эти инфицированные клетки экспрессируют гены, кодирующие типы молекул хемоаттрактанта, которые могут привлекать Т-клетки и моноциты в легкие из крови. b , Т-клетки, попавшие в легкие, экспрессировали ген, кодирующий воспалительную молекулу интерферона-γ (IFN-γ). IFN-γ может стимулировать моноциты и макрофаги к увеличению выработки хемоаттрактантов и других воспалительных молекул (не показано). c , Моноциты могут созреть в макрофаги и перезапустить цикл, если они инфицированы SARS-CoV-2.Предлагаемая петля воспаления и привлечения иммунных клеток может объяснить длительное воспаление, которое характерно для пневмонии COVID-19.
На первом этапе своего исследования авторы проанализировали различные классы воспалительных клеток, выделенных из воздушных мешочков. Интересно то, что авторы обнаружили, что иммунные клетки людей с COVID-19 содержат большую долю Т-клеток и моноцитов по сравнению с популяцией иммунных клеток людей, пневмония которых возникла по другой причине.Т-клетки и моноциты относительно редко встречаются в здоровых легких 3 , поэтому предполагается, что эти иммунные клетки были рекрутированы в воздушные мешочки с помощью локально продуцируемых хемоаттрактантных белков. Важно отметить, что эти различия в типах воспалительных клеток у людей с COVID-19 нельзя объяснить другими клиническими факторами, такими как фаза их заболевания или коинфекция другими болезнетворными агентами.
Чтобы исследовать механизмы, лежащие в основе рекрутирования Т-клеток и моноцитов в легкие, Grant et al .проверили, инфицированы ли иммунные клетки SARS-CoV-2. Они подтвердили предыдущие сообщения 4 , 5 о том, что РНК этого вируса обнаружена в макрофагальных клетках — типе иммунных клеток, которые, как известно, поглощают мертвые клетки и мусор — в легких. Интересно, что авторы обнаружили вирусную РНК, соответствующую как «положительной» цепи вируса, кодирующей вирусные белки, так и зеркальной копии этой цепи («отрицательной» цепи). Наличие отрицательной цепи особенно указывает на активную репликацию вируса в макрофагах.Эти макрофаги также имели высокий уровень экспрессии генов, кодирующих хемоаттрактантные белки, такие как CCL4 и CXCL10, которые могут рекрутировать Т-клетки и моноциты. Поэтому авторы пришли к выводу, что инфицирование макрофагов SARS-CoV-2 запускает инфицированные клетки для высвобождения этих хемоаттрактантов.
Чтобы определить возможные роли Т-клеток, которые рекрутируются в легкие, авторы оценили экспрессию генов на уровне отдельных клеток. Грант и его коллеги обнаружили, что Т-клетки экспрессируют РНК, кодирующую белок интерферон-γ (IFN-γ), который, как известно, стимулирует макрофаги и моноциты для производства воспалительных молекул 6 .Действительно, авторы обнаружили, что макрофаги от людей с COVID-19 экспрессировали интерферон-чувствительные гены на более высоком уровне, чем макрофаги от людей, которые не болели COVID-19.
Одной из уникальных характеристик тяжелой пневмонии COVID-19 является ее особенно большая продолжительность по сравнению с типичной продолжительностью пневмонии, связанной с другими вирусными инфекциями. Тяжелое воспаление легких и длительная дыхательная недостаточность сохраняются при COVID-19 даже после того, как вирусная инфекция перестает выявляться 7 .Однако механизмы, которые управляют этой устойчивой воспалительной реакцией, полностью не определены. Одна из возможностей — это петля положительной обратной связи, предложенная Грантом и его коллегами, в которой инфицирование макрофагами SARS-CoV-2 приводит к выработке хемоаттрактантов, которые привлекают моноциты и Т-клетки в легкие (рис. 1). Вновь набранные моноциты могут созревать с образованием макрофагов, и если Т-клетки продуцируют IFN-γ, который стимулирует макрофаги производить больше хемоаттрактантов, это увековечивает цикл воспаления.
Хотя данные, подтверждающие модель авторов, основаны почти исключительно на профилировании экспрессии генов иммунных клеток, эта схема предлагает объединяющую и правдоподобную основу для объяснения. Чтобы доказать, что эта модель верна, каждый предложенный шаг должен быть подтвержден в функциональных исследованиях, а причинно-следственная связь каждого предложенного звена в этом пути должна быть проверена. Кроме того, следует внимательно рассмотреть вопрос о том, как функция этих представляющих интерес иммунных клеток может интегрироваться с функциями других типов клеток легких, таких как эпителиальные клетки, которые являются основным типом клеток, инфицированных SARS-CoV-2.Ранее предполагалось, что эпителиальные клетки 4 являются основным фактором воспаления при COVID-19.
Примечательно, что типы клеток и молекул, которые составляют эту предложенную самоподдерживающуюся воспалительную цепь при COVID-19, также в некоторой степени присутствуют в клетках, выделенных от людей с пневмонией, возникшей в результате других типов бактериальной или вирусной инфекции. . Это вызывает вопрос о том, является ли воспалительный путь, открытый авторами, специфичным для COVID-19, или он также действует при других формах тяжелой пневмонии.Подтверждение любой возможности явилось бы большим достижением. Это связано с тем, что такое открытие может привести к терапевтическому нацеливанию на инфицированные макрофаги, воспалительные Т-клетки или специфические воспалительные молекулы в качестве способа блокирования самоподдерживающихся воспалительных цепей и, таким образом, предложить способ предотвращения стойкого повреждения легких.
Почему пневмония такая распространенная и тяжелая?
Дыхание подвергает наши легкие воздействию микробов. На протяжении всей жизни мы делаем вдох каждые несколько секунд.С каждым вдохом мы приносим в легкие около половины литра внешнего мира. Воздух содержит множество загрязнителей, включая бактерии, вирусы и грибки. Кроме того, вдыхаемый воздух проходит через наш рот и нос, попадая в легкие. Эти верхние дыхательные пути заселены бактериями даже у здоровых людей и являются источником воздействия многих патогенов.
Микробы и микробные продукты, такие как токсины, влияют на клетки легких, поэтому они должны быть устранены, когда попадают в легкие.Легкие обладают множеством защитных механизмов, способных уничтожать небольшое количество безобидных микробов, которые попадают туда. Однако, когда попадает большее количество микробов или особенно вирулентных микробов, возникает необходимость в воспалительных реакциях. Воспаление помогает убить микробы, но затрудняет дыхание и делает его менее эффективным.
У врачей есть хорошие инструменты для борьбы с легочными инфекциями. Вакцины предотвращают появление инфекций легких у некоторых микробов, а антибиотики лечат пациентов от многих типов пневмонии.Несмотря на эти полезные инструменты, легочные инфекции остаются серьезной проблемой для общественного здравоохранения. Вакцины против многих микробов, поражающих легкие, отсутствуют. Людей с ослабленными иммунными функциями сложно или невозможно эффективно вакцинировать, даже если вакцины доступны. У микробов развивается устойчивость к ранее эффективным антибиотикам. Некоторые микробы не восприимчивы к каким-либо известным лекарствам. Даже в случае успеха уничтожения микробов иногда недостаточно, чтобы спасти пациентов, страдающих от воспалительного поражения, такого как острый респираторный дистресс-синдром.
Необходимо разработать новые инструменты, что требует новых знаний. Нам нужно лучше понять, как легкие подвергаются воздействию микробов, чтобы мы могли уменьшить такое воздействие.
