Плоскоклеточный рак легкого: низкодифференцированный плоскоклеточный рак легкого, лечение плоскоклеточного рака легких
Плоскоклеточная форма рака легкого является самой распространенной. На ее долю приходится около 60% от всех злокачественных новообразований данного органа. Опухоль развивается в результате метаплазии (замещения) клеток мерцательного эпителия клетками плоского эпителия. Последние могут иметь различное строение, в зависимости от которого выделяют несколько разновидностей плоскоклеточного рака легкого.
Причины и группы риска
Основной причиной возникновения рака легкого является воздействие канцерогенных факторов на клетки плоского эпителия. Этими факторами могут выступать токсические химические вещества, которые содержатся в воздухе, ионизирующее излучение и др. Абсолютное большинство пациентов, у которых подтвердился диагноз плоскоклеточного рака, страдают от никотиновой зависимости. Вредные и канцерогенные вещества, содержащиеся в табачном дыме, оказывают выраженное негативное влияние на клетки бронхов и существенно увеличивают вероятность трансформации клеток.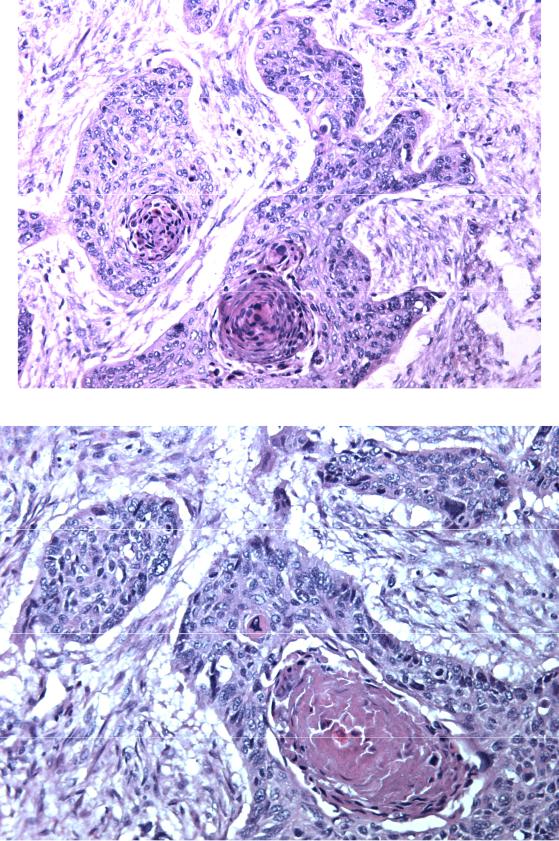
Специалисты отмечают определенные группы людей, у которых риск обнаружить плоскоклеточный рак легкого будет выше. К ним относятся:
- Мужчины, чей возраст превышает 50 лет.
- Курильщики с большим стажем.
- Пациенты, у которых имеются хронические заболевания легкого.
- Лица с наследственной предрасположенностью.
- Работники, которые трудятся во вредных условиях.
Данные категории людей должны уделять максимум внимания своему здоровью и регулярно проходить профосмотр, который поможет выявить плоскоклеточный рак легкого на начальной стадии.
Классификация плоскоклеточного рака легких
В зависимости от клеточного строения, выделяют следующие виды заболевания:
- Железисто-плоскоклеточный рак. Является разновидностью плоскоклеточного рака, который имеет гистологические признаки аденокарциномы. Данная форма характеризуется быстрым течением, активным метастазированием и образованием больших опухолевых очагов.
- Ороговевающая форма рака легкого относится к высокодифференцированным опухолям.
 Для этого вида свойственно раннее метастазирование и образование первичного очага в корне легкого.
Для этого вида свойственно раннее метастазирование и образование первичного очага в корне легкого. - Неороговевающий рак легкого является умеренно дифференцированным. Он проявляется общими симптомами, часто сочетается со злокачественным поражением пищевода.
- Низкодифференцированный рак. По сравнению с другими видами плоскоклеточного рака, эту форму сложнее всего диагностировать и лечить. Кроме того, у пациентов часто выявляются метастазы в других органах — мозг, печень, почки даже при небольших размерах первичного очага.
С анатомической точки зрения выделяют центральную и периферическую формы плоскоклеточного рака. Возможно выявление атипичных вариантов, которые встречаются достаточно редко.
Стадии заболевания
В течении плоскоклеточного рака легкого выделяют 4 стадии, которые последовательно сменяют друг друга.
- Первая стадия характеризуется небольшими размерами опухоли (до 3 см), отсутствием метастазов.
- На второй стадии рака легкого опухоль может достигать больших размеров (до 6 см) и давать метастазы в рядом расположенные лимфоузлы.

- На третьей стадии первичный очаг рака легкого достигает размеров до 8 см, отмечаются метастазы в отдаленные группы лимфоузлов.
- Четвертая стадия характеризуется активным распространением плоскоклеточного рака по всему организму, нарушаются функции многих органов и систем, состояние пациента становится крайне тяжелым.
Стадии заболевания сказываются не только на методах лечения, но и на прогнозе выживаемости. Чем раньше выявлена болезнь, тем больше шансов достигнуть длительной ремиссии.
Клинические проявления плоскоклеточного рака легкого
Гистологическое строение опухоли практически никак не влияет на проявления рака. Решающее значение имеет размер первичного очага, его локализация и стадия. При этом специфических симптомов, которые помогли бы отличить плоскоклеточный от других форм рака легкого не отмечается.
Начальные стадии заболевания часто протекают бессимптомно, поэтому выявить рак легкого удается случайно во время профилактической флюорографии. По мере роста опухоли, могут проявляться следующие симптомы:
По мере роста опухоли, могут проявляться следующие симптомы:
- Длительный беспричинный кашель.
- Кровохарканье.
- Одышка.
- Боль в области груди.
При прогрессировании плоскоклеточного рака клиническая картина дополняется вторичными симптомами, которые зависят от локализации новообразования, наличия метастазов, реакции организма на опухоль. Частыми вторичными симптомами являются осиплость голоса, боли в шее, дисфагия, аритмия, снижение массы тела и др. Данные проявления позволяют врачу заподозрить рак легкого, но для того, чтобы поставить точный диагноз, потребуется пройти обследование и получить гистологическую верификацию.
Диагностика плоскоклеточного рака
Первичное обследование пациентов, у которых есть подозрение на плоскоклеточный рак легкого включает в себя сбор анамнеза, анализ симптомов и жалоб, общий осмотр пациента и рентгенологические методы диагностики. На снимках часто удается обнаружить первичный очаг рака легкого, определить его примерный размер и локализацию, оценить состояние регионарных лимфоузлов. Для получения более точных данных, а также с целью выявления метастазов плоскоклеточного рака в другие органы могут быть назначены:
Для получения более точных данных, а также с целью выявления метастазов плоскоклеточного рака в другие органы могут быть назначены:
- Компьютерная томография.
- Магнитно-резонансная томография.
- Позитронно-эмиссионная томография.
Кроме того, в план комплексного обследования включаются лабораторные анализы (общий и биохимический анализ крови, онкомаркеры и др.), бронхоскопия, УЗИ внутренних органов, при наличии показаний, и другие методы.
Важное значение в выявлении рака имеет биопсия с последующим гистологическим исследованием. Образец ткани, которая содержит клетки рака легкого получают при помощи бронхоскопии, трансторакальной пункции или торакоскопии. Дополнительно врач может отбирать образцы мокроты или промывные воды бронхов для цитологического исследования. Гистологическое исследование позволяет определить точный вид рака, что определяет чувствительность опухоли к лечению.
Методы диагностики применяются не только для выявления точного диагноза. Комплексное обследование может проводиться с целью отслеживания динамики, определения эффективности лечения и выявления осложнений.
Комплексное обследование может проводиться с целью отслеживания динамики, определения эффективности лечения и выявления осложнений.
Как лечат плоскоклеточный рак легкого
В настоящее время существует несколько видов лечения плоскоклеточного рака.
- Химиотерапия. Данный метод лечения рака является наиболее универсальным и распространенным. Его можно применять в комбинации с другими методиками — хирургическим лечением, лучевой терапией и т.д. В качестве самостоятельного метода лечения рака химиотерапия применяется редко. Выбор препарата и продолжительность курса зависят от стадии, чувствительности рака легкого к лечению и других факторов. Хорошо себя зарекомендовала полихимиотерапия, в ходе которой применяются комбинации из нескольких препаратов.
- Иммунотерапия. Данный метод лечения является одним из самых современных и продолжает активно развиваться. При иммунотерапии плоскоклеточного рака назначаются специфические препараты из группы моноклональных антител, ингибиторов контрольных точек и специальных вакцин.
 Они обладают разным механизмом действия, но приводят к одному и тому же результату —иммунная система начинает активно атаковать клетки рака легкого.
Они обладают разным механизмом действия, но приводят к одному и тому же результату —иммунная система начинает активно атаковать клетки рака легкого. - Радиотерапия (лучевая терапия). В основе метода лежит воздействие ионизирующего излучения на клетки рака легкого. Облучение опухоли может выполняться перед операцией, непосредственно во время или после ее завершения. В зависимости от локализации очага может назначаться фракционирование, эндобронхиальная и конформная лучевая терапия.
- Хирургическое лечение. Удаление новообразования оперативным путем является ведущим методом лечения при выявлении опухоли на ранней стадии. Объем операции может варьировать от лобэктомии (удаление одной доли легкого) до пневмонэктомии (удаление всего легкого целиком). Неплохих результатов лечения плоскоклеточного рака иногда удается достичь, если комбинировать хирургический метод с химиотерапией, лучевой терапией или иммунотерапией.
Вместе со специальными методами лечения назначается симптоматическая терапия. Она направлена на восстановление основных показателей организма и улучшение состояния пациента. С этой целью могут назначаться антибактериальные, противовоспалительные, обезболивающие и другие препараты, которые устраняют симптомы болезни.
Она направлена на восстановление основных показателей организма и улучшение состояния пациента. С этой целью могут назначаться антибактериальные, противовоспалительные, обезболивающие и другие препараты, которые устраняют симптомы болезни.
Прогноз и продолжительность жизни при плоскоклеточном раке легкого
Как и при любых других видах рака, решающее значение на продолжительность жизни оказывает стадия опухолевого процесса и чувствительность к лечению. Наиболее неблагоприятным в этих отношениях являются низкодифференцированные опухоли. Они плохо отвечают на лечение и склонны к быстрому прогрессированию. Средняя продолжительность жизни в таких случаях ограничивается 8 месяцами. Если опухоль была обнаружена на первой стадии и пациент хорошо ответил на лечение, то показатели пятилетней выживаемости могут достигать 80%. Если мелкоклеточный рак легких был диагностирован на второй стадии, то этот показатель уменьшается вдвое — до 40%. Пятилетняя выживаемость на 3 и 4 стадиях составляет около 20% и 8% соответственно.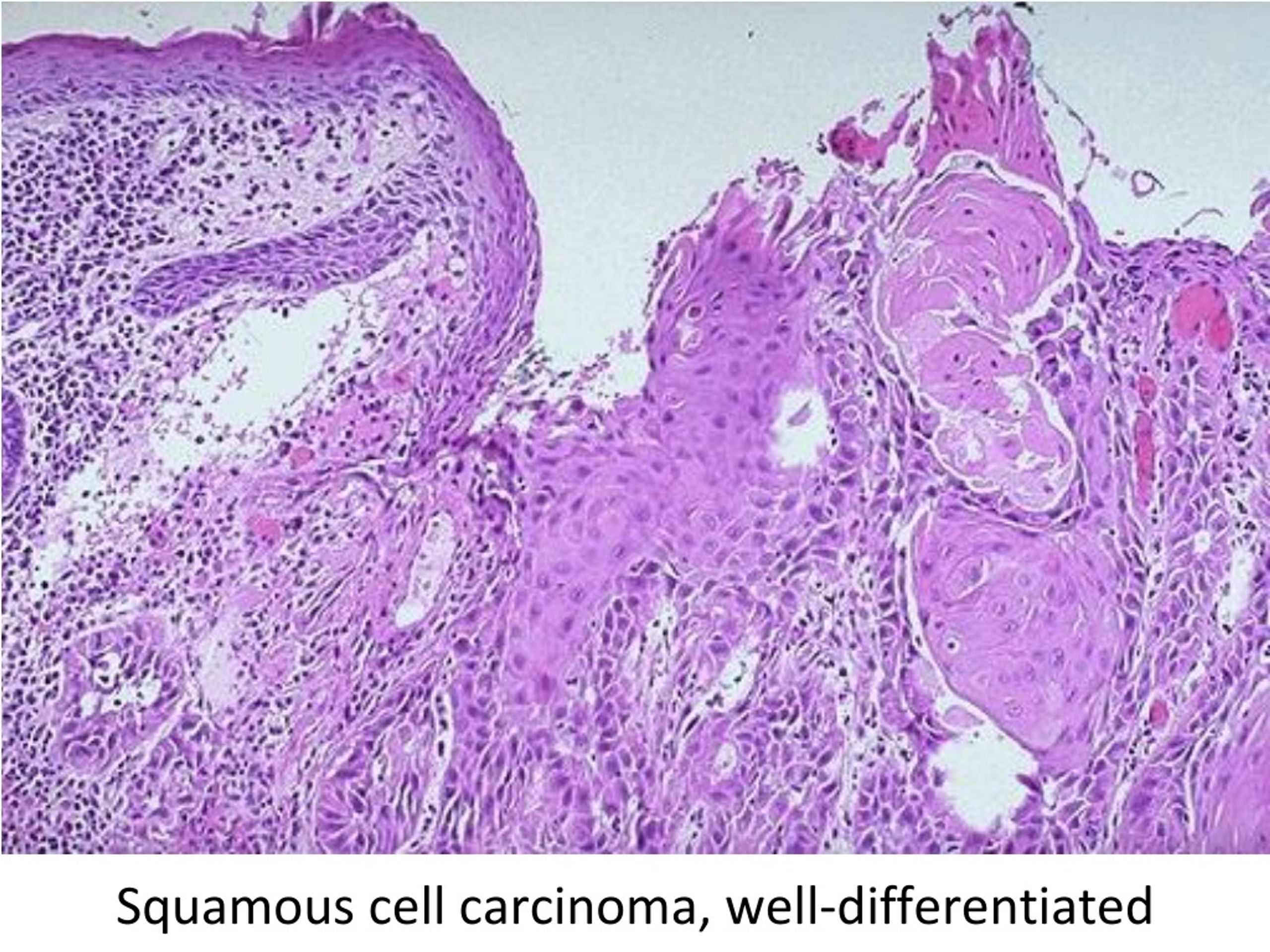
Рак легкого | Клиническая больница №122 имени Л.Г.Соколова Федерального Медико-Биологического Агентства
Рак легкого — заболевания при котором происходит бесконтрольное деление клеток ткани легкого.
Ткань легкого состоит из нескольких видов клеток. В зависимости от варианта клеток из которых произошла опухоль выделяют две группы патологии:
- Мелкоклеточный рак
- Немелкоклеточный рак
Немелкоклеточный рак легкого
Немелкоклеточный рак может иметь несколько вариантов:
Наиболее распространены:
- Плоскоклеточный (ороговевающий или неороговевающий)
- Аденокарцинома
Более редкие:
- Крупноклеточная карцинома (светлоклеточая карцинома, крупноклеточный нейроэндокринный рак, базалойдный рак и т.д.)
- Плеоморфная (саркоматойдная) карцинома (гигантоклеточная, веретеноклеточная и т.д.)
- Атипичный карциноид
- Не классифицируемые карциномы
Диагностика немелкоклеточного рака легкого
В обязательный диагностический набор входят:
- Компьютерная томография органов грудной клетки и брюшной полости
- Фибробронхоскопия с гистологическим подтверждением диагноза
- Клинический и биохимический анализ крови
Кроме того, часто требуются дополнительные исследования:
- Компьютерная томография и\или магнитно-резонансная томография головного мозга
- Диагностическая торакоскопия
- Определение онкомаркеров
- Сцинтиграфия костей
- Позитронно-эмиссионная томография (ПЭТ)
Стадирование немелкоклеточного рака легкого
Важным звеном при выборе тактики лечения является определение стадии процесса.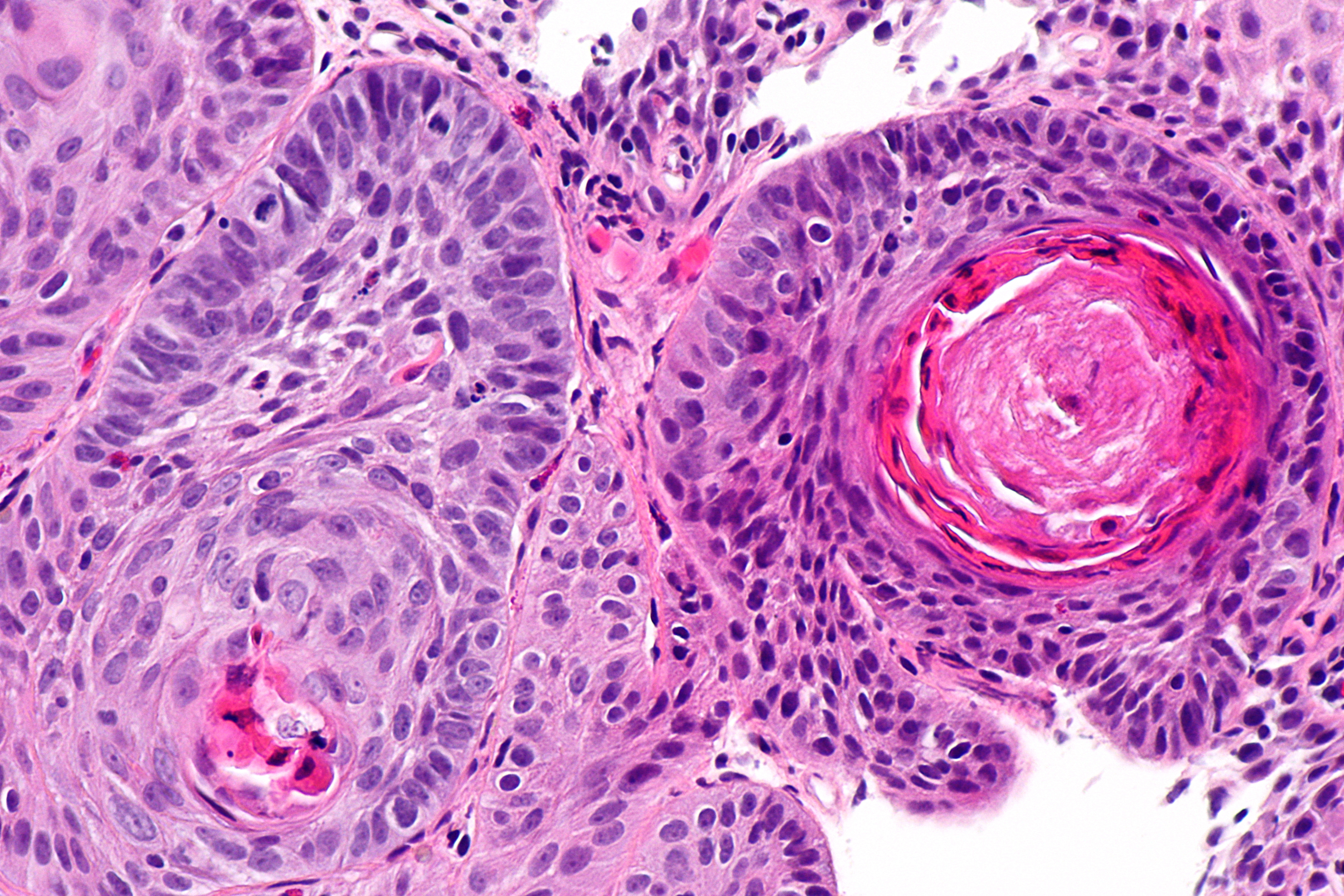 Стадию устанавливают в соответствии с критериями международной классификации TNM, Всемирной организацией здравоохранения (ВОЗ). «Т» — обозначает размер опухоли, «N» — наличие пораженных лимфатических узлов, «М» — наличие метастазов.
Стадию устанавливают в соответствии с критериями международной классификации TNM, Всемирной организацией здравоохранения (ВОЗ). «Т» — обозначает размер опухоли, «N» — наличие пораженных лимфатических узлов, «М» — наличие метастазов.
Tх — опухоль не выявлена
Tis — опухоль не распространяющаяся в соседние ткани
T1 — опухоль не более 3 см, не распространяющаяся в главный бронх
T2 — опухоль более 3 см, но не более 7 см, не захватывающая все легкое и располагающаяся более 2 см от области разветвления трахеи
T3 — опухоль > 7 см или переходящая на грудную стенку, диафрагму, плевру, перикард (оболочку сердца) или опухоль, не доходящая до области разветвления трахеи менее 2 см, или с ателектазом всего легкого или пневмонией всего легкого
T4 — опухоль, непосредственно переходящая на средостение, сердце, крупные сосуды, трахею, пищевод, тела позвонков, область разветвления трахеи или 2 опухоли в разных долях одного легкого
Лечение немелкоклеточного рака легкого
Выбор тактики лечения зависит от стадии заболевания, состояния пациента, сопутствующей патологии. Часто используются комбинации нескольких методов лечения (хирургический, лекарственный, лучевой).
Часто используются комбинации нескольких методов лечения (хирургический, лекарственный, лучевой).
При ограниченных стадиях опухолевого процесса используют комбинацию хирургического лечения с последующим химиотерапевтическим или химио-лучевым (адъювантным) лечением.
В случае если опухоль слишком большая и выполнение оперативного лечения опасно или невозможно — проводят неоадъюватную терапию для уменьшения размеров опухоли с последующим хирургическим лечением.
При распространенном опухолевом процессе проводят лекарственную терапию (химиотерапия, биотерапия).
Среди наиболее часто используемых химиопрепаратов — цисплатин, доцетаксел, паклитаксел, этопозид, гемцитабин и др.
Наиболее распространенными биопрепаратами (таргетными препаратами) — цетуксимаб (эрбитукс), бевацезумаб (авастин), эрлотиниб (тарцева) и т.д.
Перед принятием решения о дальнейшем лечении, важным моментом является обсуждение выбранной тактики с пациентом и, по его желанию, с родственниками пациента.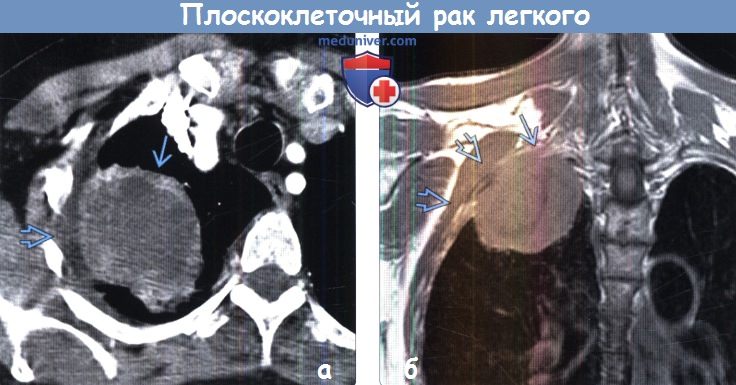
Мелкоклеточный рак легкого
Мелкоклеточный рак также может называться нейроэндокинной опухолью легкого.
Диагностика мелкоклеточного рака легкого
В обязательный диагностический набор входят:
- Компьютерная томография органов грудной клетки и брюшной полости
- Фибробронхоскопия с гистологическим подтверждением диагноза
- Клинический и биохимический анализ крови
Кроме того, часто требуются дополнительные исследования:
- Компьютерная томография и\или магнитно-резонансная томография головного мозга
- Диагностическая торакоскопия
- Определение онкомаркеров
- Сцинтиграфия костей
- Позитронно-эмиссионная томография (ПЭТ)
Стадирование мелкоклеточного рака легкого
Общепринятой классификацией мелкоклеточного рака легкого является двухстадийная система:
- Ограниченная стадия (локализованная) — заболевание ограничено одной половиной грудной клетки (гемитораксом)
- Распространенная стадия — заболевание вышло за пределы одной половины грудной клетки
Лечение мелкоклеточного рака легкого
Выбор тактики лечения зависит от стадии заболевания, состояния пациента, сопутствующей патологии.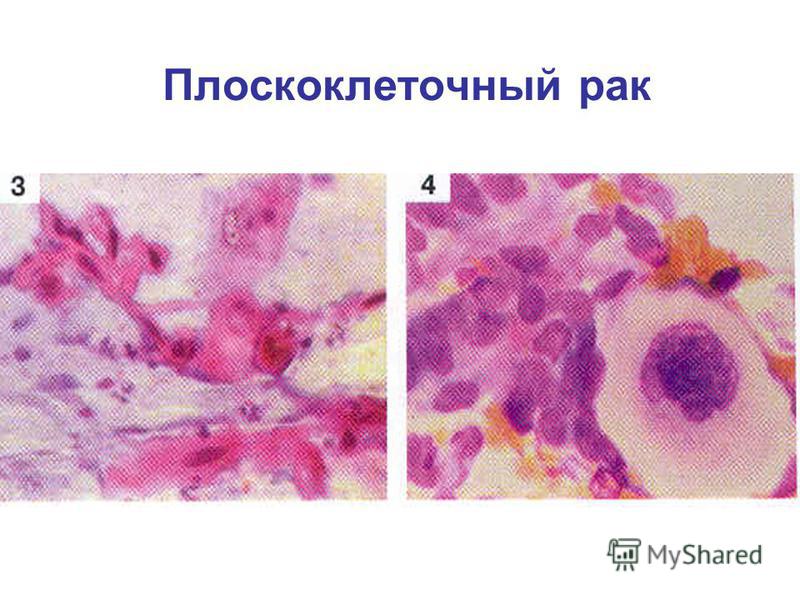 Часто используются комбинации нескольких методов лечения (лекарственный, лучевой). Хирургический метод лечения используется редко, т.к. имеет невысокую эффективность при данном виде опухоли.
Часто используются комбинации нескольких методов лечения (лекарственный, лучевой). Хирургический метод лечения используется редко, т.к. имеет невысокую эффективность при данном виде опухоли.
При ограниченных стадиях опухолевого процесса используют комбинацию химиолучевого лечения или химиотерапию.
При распространенном опухолевом процессе проводят лекарственную терапию — химиотерапию.
Среди наиболее часто используемых химиопрепаратов — цисплатин, карбоплатин, доцетаксел, иринотекан, паклитаксел, этопозид, гемцитабин и др.
Чаще всего используют комбинации препаратов платины (цисплатин, карбоплатин) с этопозидом, гемцитабином (Гемзар) или иринотеканом.
Перед принятием решения о дальнейшем лечении, важным моментом является обсуждение выбранной тактики с пациентом и, по его желанию, с родственниками пациента.
Вы можете записаться к нам на прием, позвонив нам по телефонам:
Телефон\факс: (812) 559-94-41
Телефон: 8-911-117-82-28
Отделение онкологии
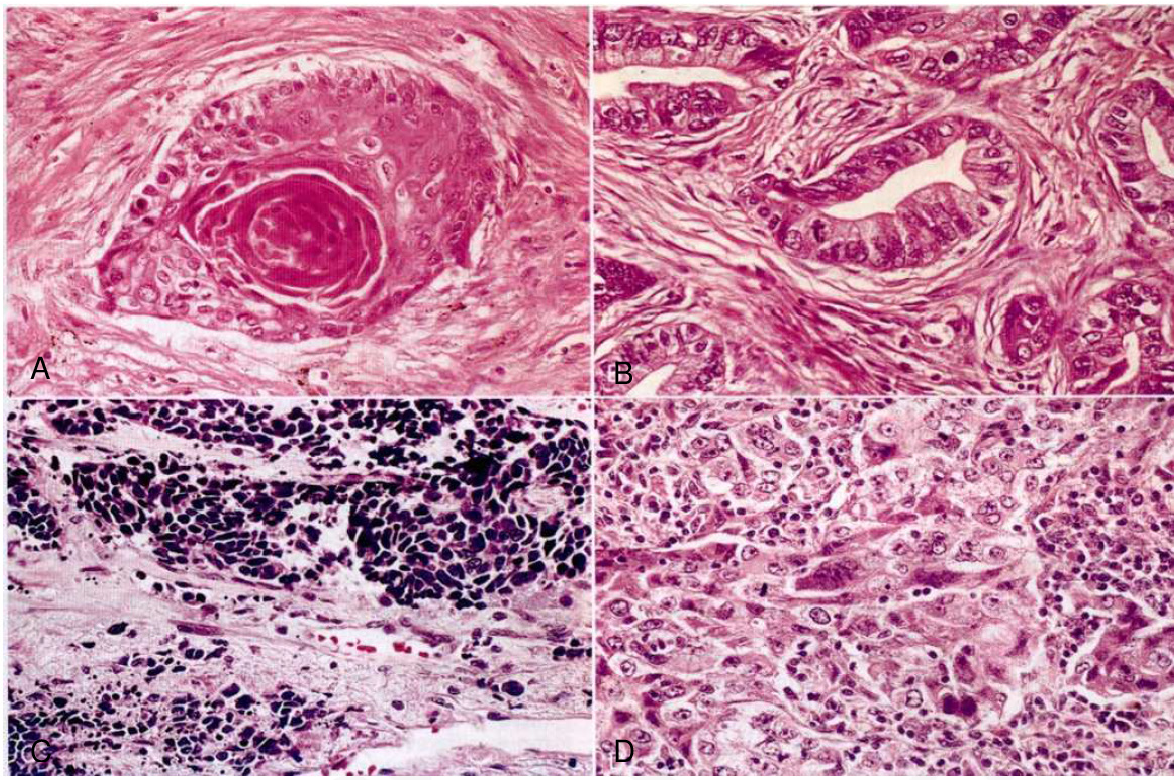
ЯДРЫШКОВЫЕ ОРГАНИЗАТОРЫ В KI-67 ПОЗИТИВНЫХ КЛЕТКАХ ПЛОСКОКЛЕТОЧНОГО РАКА ЛЕГКОГО: КЛИНИКО-МОРФОЛОГИЧЕСКИЕ ПАРАЛЛЕЛИ И ВЫЖИВАЕМОСТЬ | Кобяков
1. Гервас П.А., Литвяков Н.В., Попова Н.О., Добродеев А.Ю., Тарасова А.С., Юмов Е.Л., Иванова Ф.Г., Черемисина О.В., Афанасьев С.Г., Гольдберг В.Е., Чердынцева Н.В. Проблемы и перспективы совершенствования молекулярно-генетиче ской диагностики для назначения таргетных препаратов в онкологии // Сибирский онкологический журнал. 2014. № 2. С. 46–55.
Гервас П.А., Литвяков Н.В., Попова Н.О., Добродеев А.Ю., Тарасова А.С., Юмов Е.Л., Иванова Ф.Г., Черемисина О.В., Афанасьев С.Г., Гольдберг В.Е., Чердынцева Н.В. Проблемы и перспективы совершенствования молекулярно-генетиче ской диагностики для назначения таргетных препаратов в онкологии // Сибирский онкологический журнал. 2014. № 2. С. 46–55.
2. Кобяков Д.С., Климачев В.В., Авдалян А.М., Бобров И.П., Бычкова Е.Ю., Круглова Н.М., Лазарев А.Ф., Лушникова Е.Л., Непомнящих Л.М. Аргирофильные белки ядрышковых организаторов и пролиферативная активность клеток при плоскоклеточном раке легкого // Клеточные технологии в биологии и медицине. 2014. № 2. С. 97–102.
3. Abe S., Sukoh N., Ogura S., Kunikane H., Watanabe N., Nakajima I., Takekawa H., Kawakami Y. Nucleolar organiser regions as a marker of growth rate in squamous cell carcinoma of the lung // Thorax. 1992. Vol. 47 (10). Р. 778–780.
1992. Vol. 47 (10). Р. 778–780.
4. Biesterfeld S., Farokhzad F., Kluppel D., Schneider S., Hufnagl P. Improvement of breast cancer prognostication using cell kinetic-based silver-stainable nucleolar organizer region quantification of the MIB-1 positive tumor cell compartment // Virchows Arch. 2001. Vol. 438 (5). Р. 478–484.
5. Bigras G., Marcelpoil R., Brambilla E., Brugal G. Interest of targeting AgNORs measurement in cycling cells: in vivo cell kinetic evaluation of non-small cell lung cancer // Anal. Cell. Pathol. 1996. Vol. 11 (3). Р. 183–198.
6. Canet V., Montmasson M.P., Usson Y., Giroud F., Brugal G. Correlation between silver-stained nucleolar organizer region area and cell cycle time // Cytometry. 2001. Vol. 43 (2). Р. 110–116.
7. Kidogawa H., Nanashima A., Yano H., Matsumoto M., Yasutake T., Nagayasu T. Clinical significance of double staining of MIB-1 and AgNORs in primary breast carcinoma // Anticancer Res. 2005. Vol. 25 (6B). Р. 3957–3962.
Kidogawa H., Nanashima A., Yano H., Matsumoto M., Yasutake T., Nagayasu T. Clinical significance of double staining of MIB-1 and AgNORs in primary breast carcinoma // Anticancer Res. 2005. Vol. 25 (6B). Р. 3957–3962.
8. Lorenzato M., Abboud P., Lechki C., Browarnyj F., O’Donohue M.F., Ploton D., Adnet J.J. Proliferation assessment in breast cancer: a doublestaining technique for AgNOR quantification in MIB-1 positive cells especially adapted for image cytometry // Micron. 2000. Vol. 31 (2). Р. 151–159.
9. Munakata S., Hendricks J.B. A multilabeling technique for simultaneous demonstration and quantitation of Ki-67 and nucleolar organizer regions (AgNORs) in paraffin-embedded tissue // J. Histochem. Cytochem. 1994. Vol. 42 (6). Р. 789–793.
10. Pich A.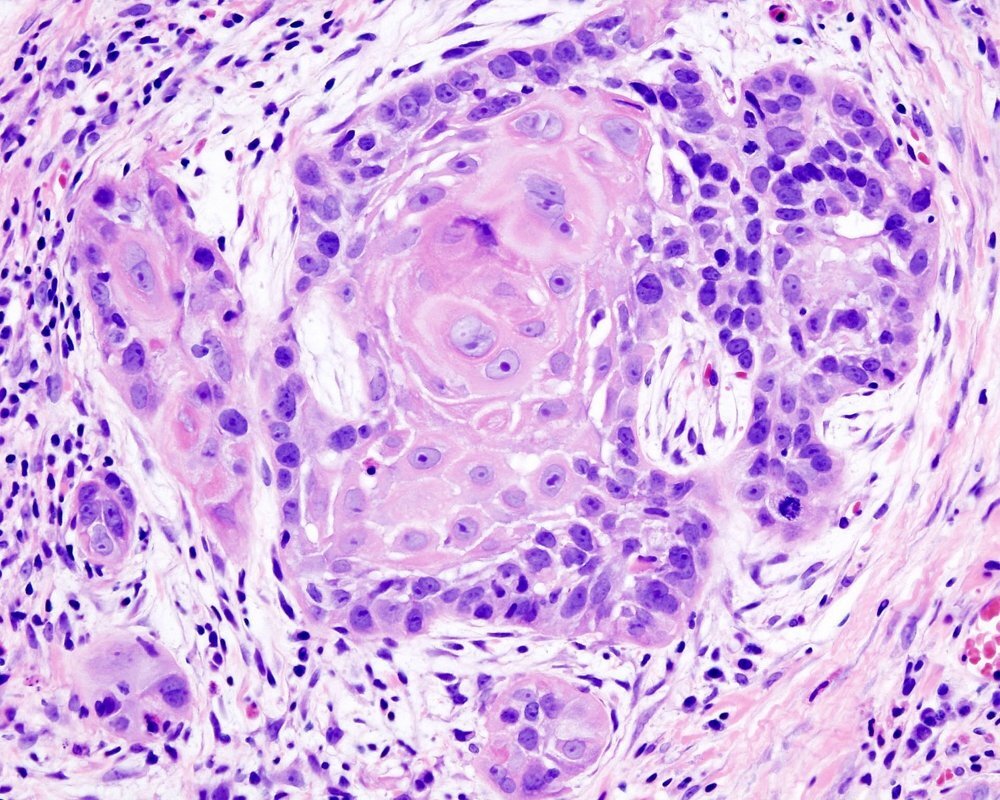 , Chiusa L., Margaria E. Prognostic relevance of AgNORs in tumor pathology // Micron. 2000. Vol. 31 (2). Р. 133–141.
, Chiusa L., Margaria E. Prognostic relevance of AgNORs in tumor pathology // Micron. 2000. Vol. 31 (2). Р. 133–141.
11. Scholzen T., Gerdes J. The Ki-67 protein: from the known and the unknown // J. Cell Physiol. 2000. Vol. 182 (3). Р. 311–322.
12. Sirri V., Roussel P., Hernandez-Verdun D. The AgNOR proteins: qualitative and quantitative changes during the cell cycle // Micron. 2000. Vol. 31 (2). Р. 121–126.
13. Sobin L., Gospodarowicz M., Wittekind C. TNM classification of malignant tumours. 7th ed. Oxford, Wiley-Blackwell, 2009. Р. 138–146.
14. Tomobe M., Shimazui T., Uchida K., Hinotsu S., Akaza H. Argyrophilic nucleolar organizer region in proliferating cell has a predictive value for local recurrence in superficial bladder tumor // J. Urol. 1999. Vol. 162 (1). Р. 63–68.
Urol. 1999. Vol. 162 (1). Р. 63–68.
15. Trere D. AgNOR staining and quantification // Micron. 2000. Vol. 31 (2). Р. 127–131.
16. Yamaguchi S. Relationship between the responses to simultaneous double staining for Ki-67 and AgNOR and the clinicopathological features of non-small cell pulmonary carcinoma // Acta Med. Nagasaki. 1994. Vol. 39 (4). Р. 147–152.
Лечение рака лёгких в Германии
От каких факторов зависит прогноз при лечении рака легких
Рак легких: особенности патологии
Сразу следует отметить, что рак легких – это не отдельная патология, а собирательное понятие, включающее различные по своему гистологическому строению, локализации и клиническому течению злокачественные новообразования, которые нередко требуют противоположной тактики лечения.
Тем не менее, для всех опухолей, объединенных под названием рак легкого, характерно многообразие клинических проявлений (как типичных для поражения органов дыхания (кашель, субфебрильная лихорадка, дыхательная недостаточность), так и нетипичных (полиартриты, невриты, гормональные нарушения)), а также неуклонное прогрессирование, склонность к рецидивам, быстрое и раннее метастазирование. Поэтому прогноз при раке легкого всегда серьезный.
Прогноз при раке легкого в зависимости от стадии заболевания
Стадия развития заболевания – это основной фактор, который предопределяет результаты лечения. На первой стадии, когда опухоль имеет небольшие размеры и метастазы не обнаруживаются, можно говорить о высокой вероятности не только клинического (достижение стойкой ремиссии), но и биологического исцеления от смертельно опасной болезни.
На второй стадии опухоль может достигать значительных размеров, не прорастая при этом в окружающие органы и ткани. Ко второй стадии рака легких также относятся опухоли незначительных размеров при обнаружении метастазов в лимфатических узлах. В таких случаях прогноз относительно биологического исцеления весьма сомнительный, но адекватное лечение позволяет достичь стойкой ремиссии у преимущественного большинства пациентов.
Ко второй стадии рака легких также относятся опухоли незначительных размеров при обнаружении метастазов в лимфатических узлах. В таких случаях прогноз относительно биологического исцеления весьма сомнительный, но адекватное лечение позволяет достичь стойкой ремиссии у преимущественного большинства пациентов.
Третья стадия развития рака легких характеризуется поражением отдаленных лимфатических узлов (средостенных, надключичных и т.п.) и/или прорастанием опухоли в окружающие органы и ткани (средостение, перикард, трахею, пищевод, тела позвонков и т.п.). В таких случаях, прогноз пятилетней выживаемости значительно ниже.
На четвертой стадии развития говорят о распространенном процессе, когда имеются многочисленные отсевы опухоли в отдаленные органы и ткани. В преимущественном большинстве случаев метастазирующего рака легких прогноз неблагоприятный, поскольку возможна лишь консервативная противоопухолевая терапия и симптоматическое лечение, направленное на улучшение качества жизни пациента.
Прогноз при раке легкого в зависимости от разновидности злокачественной опухоли
Прогноз при раке легких также зависит от происхождения клеток, так прогноз при плоскоклеточных злокачественных опухолях, произрастающих из эпителиальной выстилки бронхов лучше, чем при новообразованиях, происходящих из клеток бронхиальных желез.
Низкодифференцированный рак растет быстрее и рано начинает метастазировать, поэтому прогноз в таких случаях значительно хуже. Вместе с тем, при высокой чувствительности опухолевых клеток к химиотерапии прогноз улучшается. Поэтому, к примеру, прогноз при мелкоклеточном раке намного лучше, чем при других низкодифференцированных злокачественных опухолях легких.
Кроме происхождения клеток, степени их дифференциации и чувствительности к консервативным методам противоопухолевой терапии на прогноз при раке легкого влияют и другие факторы, в том числе локализация первичной опухоли и общее состояние организма на момент начала заболевания.
Новости | Unim — лаборатория гистологии и иммуногистохимии
Рак легкого является самым распространенным онкологическим заболеванием среди мужчин в России, а также первым по смертности среди мужчин и женщин в России и в мире. Примерно каждый четвертый больной среди общего числа вновь зарегистрированных онкологических больных и каждый третий, умирающий от этих болезней, — это больные раком легкого. От рака легкого ежегодно умирает больше больных, чем от рака простаты, молочной железы и толстой кишки вместе взятых.
По морфологической классификации ВОЗ рак легкого делится на 4 основные:
— плоскоклеточный рак (40 % больных)
— аденокарцинома (40–50 %)
— мелкоклеточный рак (МРЛ) (15–20 %),
— крупноклеточный рак (5–10 %)
В последние годы были установлены молекулярные нарушения при раке легкого, что позволило идентифицировать различные мишени и использовать эти знания для развития молекулярно-направленной таргетной терапии.
Немелкоклеточный рак легкого
Возможность обнаружения мутаций при НМРЛ, которые чувствительны к молекулярной таргетной терапии, является основным ведущим фактором для выработки тактики лечения больных НМРЛ. Мутации EGFR определяются примерно у 15 % среди всех больных НМРЛ у 30–35 % — с аденокарциномой легкого в европейской популяции, а в азиатской популяции до 50–70 %. Практически все они расположены в четырех экзонах, кодирующих тирозинкиназный домен (в 18, 19, 20, 21-м экзонах). Однако, 89 % всех мутаций EGFR — это делеция в 19-м экзоне (49 %) и мутация L858R в 21-м экзоне. При резистентности к ингибиторам тирозинкиназ в 50 % возникает мутация Т790М в 20-м экзоне. Наличие мутаций при НМРЛ указывает на более благоприятный прогноз и четко предсказывают чувствительность к тирозинкиназным ингибиторам, таким как гефитиниб (иресса), эрлотиниб (тарцева) и афатиниб.
Также важной частью диагностики является определение гиперэкспрессии сосудистых факторов роста. Ангиогенез является важным фактором роста опухоли и ее метастазирования. При формировании новых кровеносных сосудов увеличивается скорость пролиферации опухолевых клеток и роста опухоли. Поэтому выявление различных ангиогенных факторов стало задачей онкологов-исследователей. Одним из этих факторов является сосудистый эндотелиальный фактор роста (VEGF), который отвечает за стимуляцию формирования новых кровеносных сосудов. Усиление экспрессии VEGF отмечается при многих злокачественных опухолях и в том числе при раке легкого. Увеличение концентрации VEGF коррелирует с неблагопрятным прогнозом, с уменьшением выживаемости без прогрессирования и общей выживаемости.
Ангиогенез является важным фактором роста опухоли и ее метастазирования. При формировании новых кровеносных сосудов увеличивается скорость пролиферации опухолевых клеток и роста опухоли. Поэтому выявление различных ангиогенных факторов стало задачей онкологов-исследователей. Одним из этих факторов является сосудистый эндотелиальный фактор роста (VEGF), который отвечает за стимуляцию формирования новых кровеносных сосудов. Усиление экспрессии VEGF отмечается при многих злокачественных опухолях и в том числе при раке легкого. Увеличение концентрации VEGF коррелирует с неблагопрятным прогнозом, с уменьшением выживаемости без прогрессирования и общей выживаемости.
Новые практические достижения в лекарственной терапии НМРЛ связаны с идентификацией нового белка ЕМL4-ALK. Это эхинодермальный микротрубочково- ассоциированный протеин в 3-й позиции гена анапластической лимфомной киназы, который явился результатом незначительной инверсии в коротком рукаве хромосомы. EML4-ALK присутствует в 3–7 % НМРЛ и взаимно исключает мутации KRAS и EGFR. Препарат кризотиниб — ALK-киназный ингибитор, ингибирует фосфорилирование ALK и c-Met, блокируя активацию гена. Кризотиниб является малой молекулой, ингибирует тирозинкиназы ALK, c-Met (HGFR) и их онкогенные варианты. При наличии мутаций ALK эффективность кризотиниба составляет > 50–60 %. В августе 2011 г. кризотиниб получил разрешение FDA США для лечения местнораспространенного и метастатического НМРЛ при наличии мутации ALK. Одновременно был разрешен и FISH-тест для определения данного вида мутации. Разрешение было обосновано результатами двух исследований у больных, ранее получавших химиотерапию. В одном из них эффективность составила 50 %, в другом — 61 %. III фаза клинического исследования кризотиниба (ксалкори) при ЕМL4-АLК-мутированном (транслокация) НМРЛ в рандомизированном сравнительном исследовании с пеметрекседом по 500 мг/м2 или с доцетакселом по 75 мг/м2 21-дневного цикла продемонстрировала преимущество кризотиниба как в отношении ВБП, так и в отношении ОВ. Таким образом, молекулярная диагностика является основой для выбора лечебной тактики при НМРЛ.
Препарат кризотиниб — ALK-киназный ингибитор, ингибирует фосфорилирование ALK и c-Met, блокируя активацию гена. Кризотиниб является малой молекулой, ингибирует тирозинкиназы ALK, c-Met (HGFR) и их онкогенные варианты. При наличии мутаций ALK эффективность кризотиниба составляет > 50–60 %. В августе 2011 г. кризотиниб получил разрешение FDA США для лечения местнораспространенного и метастатического НМРЛ при наличии мутации ALK. Одновременно был разрешен и FISH-тест для определения данного вида мутации. Разрешение было обосновано результатами двух исследований у больных, ранее получавших химиотерапию. В одном из них эффективность составила 50 %, в другом — 61 %. III фаза клинического исследования кризотиниба (ксалкори) при ЕМL4-АLК-мутированном (транслокация) НМРЛ в рандомизированном сравнительном исследовании с пеметрекседом по 500 мг/м2 или с доцетакселом по 75 мг/м2 21-дневного цикла продемонстрировала преимущество кризотиниба как в отношении ВБП, так и в отношении ОВ. Таким образом, молекулярная диагностика является основой для выбора лечебной тактики при НМРЛ. Существующие и предполагаемые молекулярные маркеры должны быть предусмотрены при выборе стратегического направления в лечении конкретного больного (индивидуализируемая терапия).
Существующие и предполагаемые молекулярные маркеры должны быть предусмотрены при выборе стратегического направления в лечении конкретного больного (индивидуализируемая терапия).
Мелкоклеточный рак легкого
Мелкоклеточный рак легкого (МРЛ) — особая форма рака легкого, который в начале 70-х годов прошлого столетия был выделен в отдельную группу благодаря необычному клиническому течению, быстрому росту первичной опухоли, раннему метастазированию, высокой чувствительности к химиотерапии и лучевой терапии. МРЛ встречается почти исключительно у пациентов с воздействием табака в анамнезе. Он прочно ассоциируется с активным курением (2–3 пачки сигарет в день).
При диагностике МРЛ особое значение имеет оценка распространенности процесса, определяющая выбор терапевтической тактики. После морфологического подтверждения диагноза (бронхоскопия с биопсией, трансторакальная пункция, биопсия метастатических узлов) проводится компьютерная томография (КТ) грудной клетки и брюшной полости, а также КТ или магнитно-резонансная томография (МРТ) головного мозга (с контрастированием) и сканирование костей. В последнее время появились сообщения о том, что позитронно-эмиссионная томография (ПЭТ) позволяет дополнительно уточнить стадию процесса.
В последнее время появились сообщения о том, что позитронно-эмиссионная томография (ПЭТ) позволяет дополнительно уточнить стадию процесса.
Источник: Клинические рекомендации Ассоциации Онкологов России
Плоскоклеточный рак легкого (значение клинико-морфологических и молекулярно-генетических характеристик опухоли в прогнозировании результатов хирургического лечения)
1. Аксель Е.М., Давыдов М.И. Статистика заболеваемости и смертности от злокачественных новообразований в 2000 году.// Сб. «Злокачественные новообразования в России и странах СНГ в 2000», Москва, РОЩ им. Н.Н. Блохина РАМН, 2002, с.85-106.
2. Барышников А.Ю., Степанова Е.В., Давыдов М.И. Молекулярные биомаркеры рака легкого.// Вестник ОНЦ им. Н.Н. Блохина, №1,2000, с. 51-59.
3. Берзиньш Ю.А., Брамберга В.М., Фрейволдс Т.В., Зитаре И.Я., Плечере Д.А. Цитофотометрическая характеристика ядер клеток рака легких. В сб.: Автоматизация цитологических исследований. Киев: Наукова думка, 1990, с. 23-24.
23-24.
4. Богатырев В.Н. Значение количественных методов исследования (морфометрии, проточной цитофлуорометрии, сканирующей микро’фотометрии) в клинической онкоцитологии.// Автореф. дисс. доктора мед. наук, Москва, 1991,42 с.
5. Богатырев В.Н. Метод лазерной протоковой цитометрии.-Москва, 1998, стр. 74-99.
6. Бойко А.В. Лучевая терапия немелкоклеточного рака легкого.// Журн. Практическая онкология, №3, 2000, с.24-29.
7. Вагнер Р.И. Эволюция хирургического лечения больных раком легкого.// Материалы третьей ежегодной Российской онкологической конференции 1999, Санкт-Петербург.
8. Войке С. Цитологическая диагностика рака легких.— Варшава:Пол.гос.мед.изд-во, 1970, 116с.
9. Ю.Гаспарян А.В./ Полиморфизм онкогеов и микросателлитных последовательностей генома у пациентов с немелкоклеточным раком легкого и первичномножественными злокачественными новообразованиями.// Дис. кан. биол. наук, М. 1997.
10. Давыдов М.И. Полоцкий Б.Е. Хирургическое лечение немелкоклеточного рака легкого. Современные принципиальные позиции. Анналы Московского онкологического общества, №2, 1997, стр.16-17.
Современные принципиальные позиции. Анналы Московского онкологического общества, №2, 1997, стр.16-17.
11. Давыдов М. И., Полоцкий Б. Е. Сосременные принципы выбора лечебной тактики и возможность хирургического лечения немелкоклеточного рака легкого.// Сб. «Новое в терапии рака легкого» под редакцией Н.И. Переводчиковой, М. 2003, с.41-53
12. Давыдов М.И., Аксель Е.М. Злокачественные новообразования в России и странах СНГ в 2001.// М., Медицинское информационное агенство, 2003,296с.
13. Захарычев В.Д. Прогноз и выживаемость больных с операбельным немелкоклеточным периферическим раком легкого.// Киевская медицинская академия последипломного образования им. П.Л. Шупика МЗ Украины, Киев, 2002.
14. Зборовская И. Б., Чижиков В.В. Детекция молекулярных нарушений, характерных для рака легкого. Возможности использования в клинической практике.// Сб. Новое в терапии рака легкого, 2003.
15. Зборовская И.Б., Татосян А.Г. Молекулярно-генетические маркеры при раке легкого: онкогены и гены су-прессоры.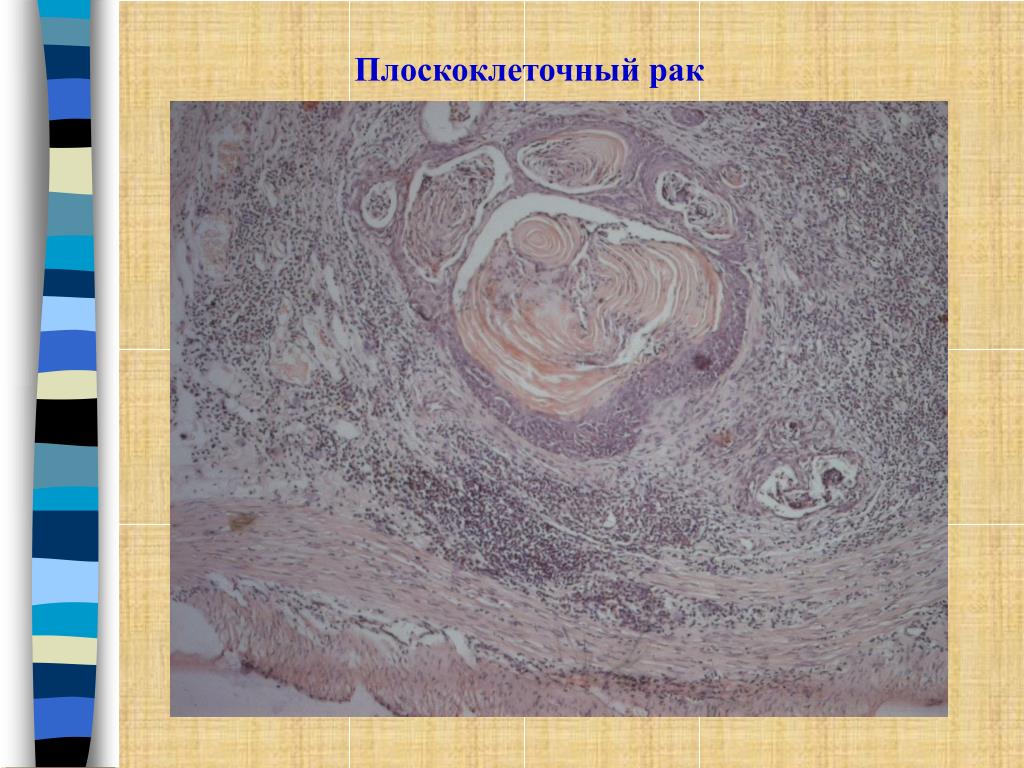 // Новое в терапии рака легкого. Bristol-Myers Squibb 1997, 5-17.
// Новое в терапии рака легкого. Bristol-Myers Squibb 1997, 5-17.
16. Кац В.А. Морфометрический анализ ультраструктуры опухолевых клеток с различной спецификой белкового синтеза. Вопр. онкол. 1979, №6, стр.40-43.
17. Князев П.Г., Федоров А.И./ Активация онкогенов в опухолях человека.// Итоги науки и техники. Москва. Серия вирусология 15, 1988, 113-156.
18. Коган Е.А., Мазуренко Н.Н., Юшков П.В. и др./ Имму-ногистохимия клеточных онкогенов при предраке и раке легкого.// Арх. пат. 8, 1990, 3-12.
19. Копнин Б.П. Мишени действия онкогенов и опухолевых супрессоров: ключ к пониманию базовых механизмов канцерогенеза.// Биохимия, 2000, Т.65, с.5-34.
20. Корман Д.Б. Характеристика темпа роста мелкок- ле-точного рака легкого.-Вопр.онкол.,1989, №2, стр. 158-162.
21. Лактионов К.П. Эпидермоидный рак легкого, (клиника, диагностика,прогноз).// Дисс.докт.мед.наук, М., 1988г.
22. Мерабишвили В.М., Дятченко О.Т. Статистика рака легкого (заболеваемость, смертность, выживаемость). // Журн. Практическая онкология, №3,2000, с.3-7.
// Журн. Практическая онкология, №3,2000, с.3-7.
23. Мещерякова И.А. Внутриполостная лучевая терапия в лечении злокачественных опухолей трахеи и бронхов: Авто-реф. канд. дис. М., 2000. — 25 с.
24. Михина 3. П. Лучевая терапия при раке легкого.// сборник Новое в терапии рака легкого Москва, 2003.27. МИФИ 2001.
25. Никуличев Л.А.// Дисс. д.м.н.
26. Панков А.К., Чирвина Е.Д. Пневмонэктомия с медиастинальной лимфаденэктомией по поводу рака легкого // Грудная хир. -1990.-№ 5.-С. 47-49.
27. Переводчикова Н.И. Химиотерапия немелкоклеточного рака легкого состояние проблемы в 2000г.// Журн. Практическая онкология, №3,2000, с.29-37.31. Подвязников С.О., 1997.
28. Поддубная И.В., Аксель Е.М., Киприянова Н.С .Анализ состояния онкологической помощи в Республике Саха (Якутия) за 1991-2001 гг.// Современная онкология, т.5, №3, 2003.
29. Полоцкий Б.Е. Хирургическое лечение немелкоклеточного рака легкрго.// Диссертация доктора медицинских наук, Москва 1995г.34. Сельчук В. Ю., 1994.35. Сусулёва Н.А., 2002.
Ю., 1994.35. Сусулёва Н.А., 2002.
30. Татосян А.Г. Онкогены.// «Канцерогенез» под ред. Д.Г. Заридзе. М.: Научный мир, 2000. С.57-74.
31. Трапезников Н.Н., Аксель Е.М. Заболеваемость злокачественными новообразованиями населения стран СНГ.// М., 1996
32. Трапезников Н.Н., Аксель Е.М. Заболеваемость злокачественными новообразованиями и смертность от них населения стран СНГ.// М., 2000.
33. Трахтенберг А.Х. Рак легкого.// Б-ка практического врача. Злокачественные новообразования. М., Медицина, 1987, 304с.
34. Трахтенберг А.Х., Чиссов В.И. Клиническая онкопуль-монология.// М., изд-во «Геотар», 2000, 599с.
35. Турусов B.C. Прогрессия опухолей: этиологические, морфологические и молекулярно-биологические аспекты.// Арх. пат. Т.54, Вып.7, 5-14.
36. Чумаков П.М. р53: выбор между жизнью и смертью // Биохимия, 2000, 65, 34-48.43. Шишков Р.В.,2001.
37. Ahrendt S, Chow J, Xu L et al. Molecular detection of tumor cells in bronchoalveolar lavage fluid from patients with early stage lung cancer//J Natl Cancer Inst, 1999, 17, 332-339.
38. Albain K.S., Crowley J.J., Le Blanc M. et al. Survival determinants in extensive stage non-small cell lung cancer. The Southwest Oncology Group experience. J. Clin. Oncol. 1991; 9: 1618-26.
39. Amundson S, Myer T, Fornance A Roles for p53 in growth arrest and apoptosis: putting on the brakes after genotoxic stress.// Oncogene, 1998,17, 3287-3299.
40. Apolinario R. M., van der Valk P., de Jong J. S. et al. // J. clin. Oncol. 1997. -Vol. 15. — P. 2456-2466.
41. Asamura H., Hakajima Т., Mukai K., Noguchi M.,Scimosa- to Y. DNA cytofluorometric and nuclear morphometric analyses of lung adenocarcinoma.// Cancer, 1989, v.64, №8, p. 1657-1664.
42. Asamura H.,Nakajima Т., Mukai K., Shimosato Y. Nuclear DNA content by cytofluorometry of stage I adenocarcinoma of the lung in relation to postoperative recurrence.// Chest, 1989, v.96, №2, p.312-318.
43. Aszalos A., Ross D. //Anticancer Res. 1998 — Vol. 18. — P. 2937-2944.
44. Atkin N.B.,Kay K. Prognostic significance of modal DNA value and other factors in malignant tumor based on 1465 cases.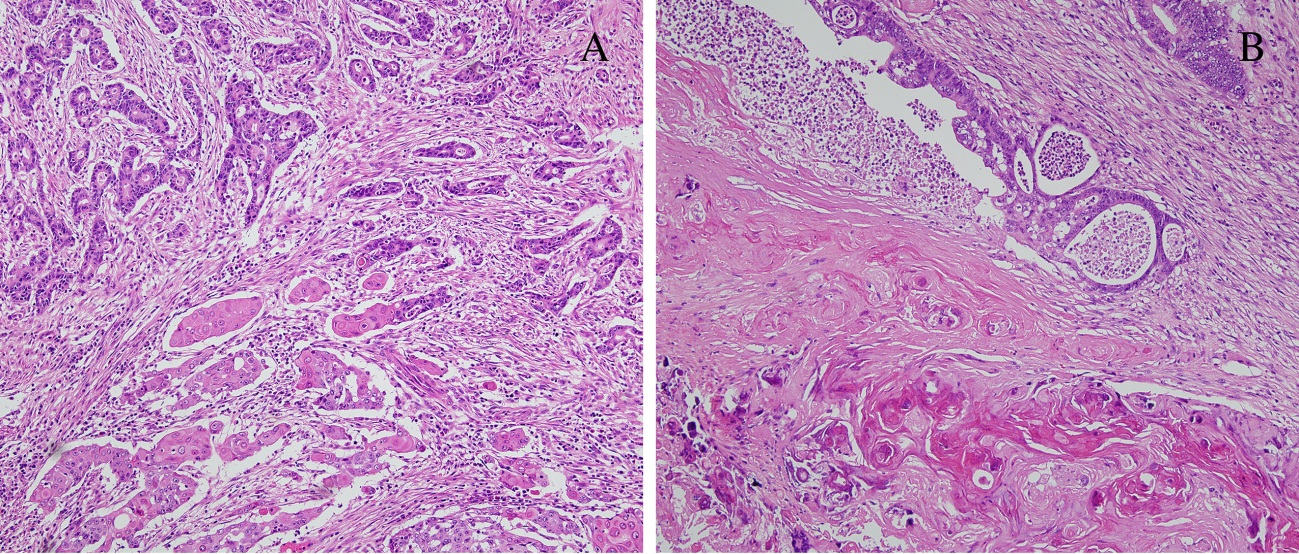 -Br. J.Cancer, 1979, v.40, p.210-221.
-Br. J.Cancer, 1979, v.40, p.210-221.
45. Balko J.A., Tao Liang-Che An expert system for teaching cytopathologic diagnosis of lung cancer.// Analyt Quant Cytol His-tol.,1994, v.16, N5., p. 321-331.
46. Barbacid M. H-ras oncogenes: their role in neoplasia.// Eur. J. Clin. Invest, 20, 1990, 225-235.
47. Barlogie В., Drewinko В., Schumann J., Goehde W., Dosik G., Latreille J., Johnston D.A., Freireich E.J. Cellular DNA content as a marker of neoplasia in man.// Amer. J. Med., 1980, v.69, p. 195-203.
48. Barlogie В., Jchuson T.S., Drewinko В., Schwartzendruber D.E., Goehde W., Andreeff M., Freireich E.J. Flow-cytometry in clinical cancer research.-Cancer Res.,1983,v.43, p.3982-3997.
49. Beltrami V. Terapia Chirurgica e integrata nel cancrobron-chogeno: risultati di una seria personale HQ. Chir. 1997. -Vol.18 -N10 -P. 474-476.
50. Bocking A.,Klose K., Kyll H., Hauptmann S. Cytologic versus histologic evaluation of needle biopsy of the lung, hilum and mediastinum: sensitivity, specificity and typing accuracy.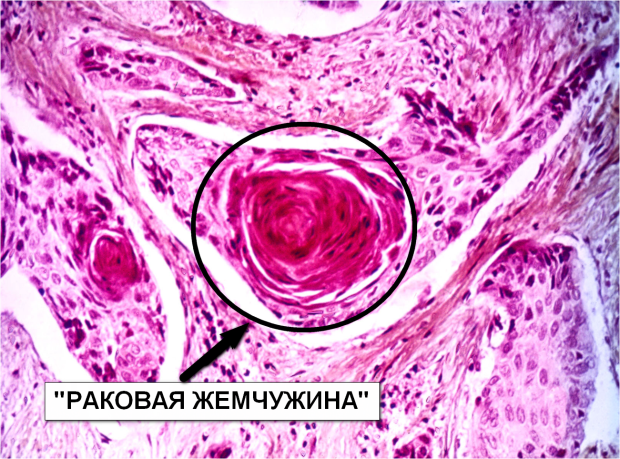 — Acta Cytologica,1995, v.39, N3., p. 463-471.
— Acta Cytologica,1995, v.39, N3., p. 463-471.
51. Brechot J.-M., Chevret S., Charpentier M.-C. et al. Blood vessel and lymphatic vessel invasion in resected nonsmall cell lung carcinoma //Cancer. -1996. -Vol.78 -N10 -P. 2111-2118.
52. Brock R.C. Bronchial carcinoma // Brit. Med. J., 1948, Vol. 2, P. 737.
53. Capon D, Chen E, Levinson D. et al./ Complete nucleotide sequences of the T24 human bludder carcinoma oncogene and its normal homologue.//Nature 302, 1983, 33.
54. Carney D.N. Biology of Small-Cell Lung Cancer.- Lancet, 1992, v.339, p.843-846.
55. Carney DN. The biology of lung cancer. Curr Opin Pulm Med 1995 Jul;l (4):271-7.
56. Caspersson T.,Auer G.,Fallenius A.,Kudynowski J. Cyto-chemical changes in the nucleus during tumor development.// J. Histochem, 1983, v.15, p.337-362.
57. Casson A.G., McCuaig S., Craig I., Ayed A., Inculet R., Kerkvii-et N., O’Malley F.: Prognostic value and clinicopathologic correlation of p53 mutations and nuclear DNA content in human lung cancer: A prospective study. // J Surg Oncol 1994; 56:13-20
// J Surg Oncol 1994; 56:13-20
58. Charloux A., Quoix E., Wolkove N., Small D., Pauli G., Kreisman H. The increasing incidence of lung adenocarcinoma: reality or artefact? A review of the epidemiology of lung adeno-carcinoma.Int J Epidemiol 1997 Feb;26 (l):14-23
59. Chiba I., Takahashi Т., Nau M. Mutation of p53 gene a frequently in primary, resected non-small cell lung cancer human lung, 5,1603-1610.
60. Chowdary D, Dermody J, Jha K, Ozer H. Accumulation ofp53 in a mutant cell line defective in the ubiquitin pathway//Mol Cell Biol, 1994,14, 1997-2003.
61. Cooper J. Oncogenes and anti-oncogenes.// Current Opin. Cell Biol. 2,1990, 285-295.
62. Cox G., Walker R., Muller S. et al. Does immunoin- tensity account for the differences in prognostic signifi cance of Bcl-2 expression in non-small cell lung cancer? // Pathol Oncol Res, 2000, 6, 87-92
63. Craft P. S., Harris A. L. //Ann. Oncol. 1994.- №5, P. 305311.
64. Curan W.J. Issues in the nonoperative management of patients with locally advanced non-small cell lung cancer// Proc.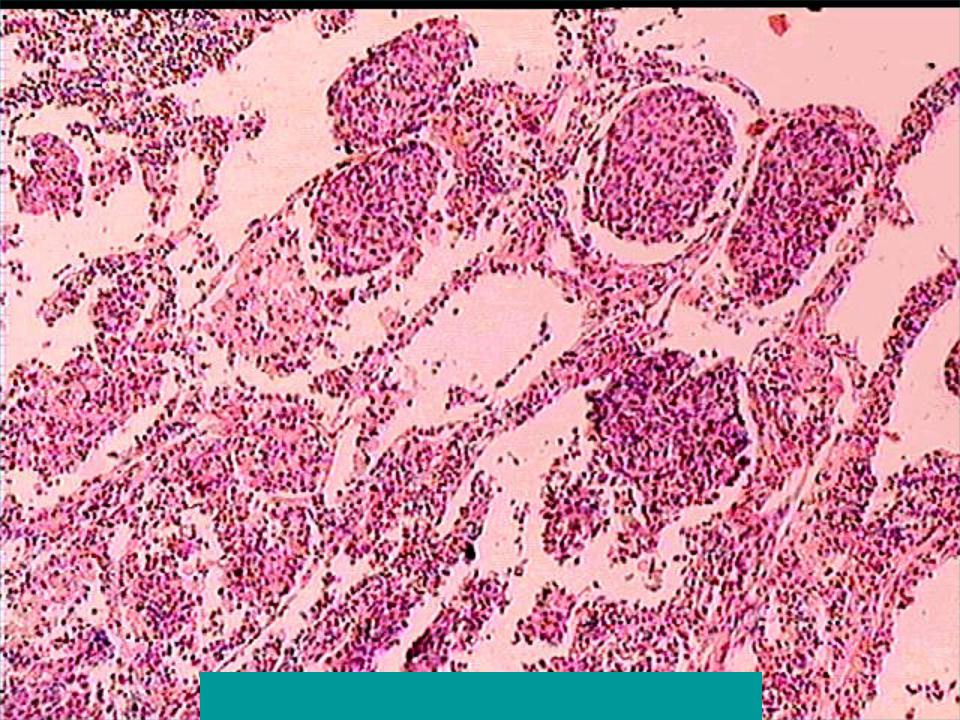 ASCO, 1999, Educational book /Ed. M.C. Perry; ASCO, 1999, P.370-373.
ASCO, 1999, Educational book /Ed. M.C. Perry; ASCO, 1999, P.370-373.
65. Dameron K, Volpert O, Tainsky M, Bouck N. Control of angio-genesis in fibroblasts by p53 regulation of thrombospondin-1.// Scienc,e 1994, 9, 1582-1584.
66. DeMay R. Lung. In book: The art and science of cytopathol-ogy.// ASCP Press, Chicago, 1998, p.947-998.
67. Desnan L., Scott C., Pizzolito S. et al. Non-small celllung cancer: morphology and DNA flow cytometry //Anal. And Quant.Cytol. and Histol. -1996. -Vol.18 -N6 -P. 438-452.
68. Dillman R.O., Herndon J., Seagren S.L. et al. Improved survival in stage III non-small cell lung cancer: Seven-year follow-up of Cancer and Leukemia Group В (CALGB) 8433 trial// J. Nat. Cancer Inst. -1996. -Vol.88. -P.1210-1215.
69. Ebina M, Steinberg S, Mulshine J, Linnoila R Relationship of p53 overexpression and up-regulation of proliferating cell nuclear antigen with the clinical course of non-small cell lung cancer.// Cancer Res, 1994, 54, 2496-2503.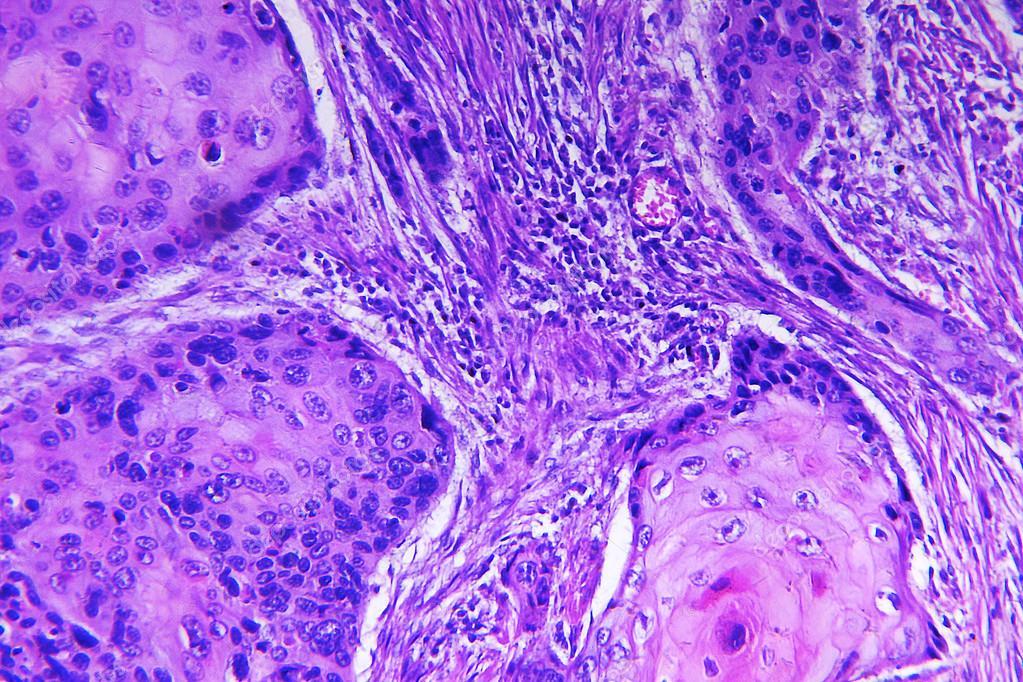
70. Eerola A.K., Tormanen U., Rainio P. et al. Apoptosis in operated small cell lung carcinoma is inversely related to tumour necrosis and p53 immunoreactivity.//J. Pathol. 1997. -Vol.181 -N2 -P. 172-177.
71. Esteller M., Sanchez-Cespedes M., Resell R. et al. Detection of aberrant promoter hypermethylation of tumor suppressor genes in serum DNA from non-small cell lung cancer patients.// Cancer Res, 1999, 59, 67-70.
72. Fiorentino E., Maiorana A.M., Gambino M. et al. So-pravivenza postoperatoria a lung termine. Oltre 15 anni, in 128pazienti con cancro del polmone //Acta Chir.Mediterr. . -1995. -Vol.11 -N6 -P. 245-249.
73. Fontanini G., Begini D., Vignati S. et al. Microvessel count predicts metastatic disease and survival in non-small cell lung cancer.// J.Pathol., 1995, Vol.177, №1, P. 57-63.
74. Fontanini G., Vignati S., Bigini D. et al. Bcl-2 pro tein: a prognostic factor inversely correlated in non- small-cell lung cancer.// Br J Cancer, 1997, 71, 1003-1007
75. Fontanini G., Vignati S., Lucchi M. et al.//Ibid. 1997, Vol. 75.-P. 1295-1301.
Fontanini G., Vignati S., Lucchi M. et al.//Ibid. 1997, Vol. 75.-P. 1295-1301.
76. Fontanini G., Vignati S., Vigini D. et al. // Br. J. Cancer. 1995, Vol.71, P. 1003-1007.
77. Fraire A.E., Johnson E.H., Yesner R. et al. Prognostic sig-nificans of histopatologic subtype and stage in small cell lung cancer. Hum Pathol 1992; 21:520 528.
78. Gallick G, Kurzrock R, Kloetzer W. et al./ Expression of p21(ra.y) in fresh primari and metastatic human colorectal tumors.// Proc. Natl. Acad. Sci USA 82, 1985, 1795-1799.
79. Geerling J. Non-small Cell Lung Cancer Collaborative Group. Chemotherapy in non-small cell lung cancer: a mete-analysis using updated data on individual patients from 52 randomised clinical trials.
80. Giaccone G, Splinter Т., Postmus P. et al. Paclitaxel-cisplatin versus teniposide-cisplatin in advanced non-small cell lung cancer// Proc.ASCO. -1996, Vol.15, 373p.
81. Giaccone G., van Arc-Otte J., Rubio G. J. et al. // Int. J. Cancer, 1996, Vol. 66, P. 760-767.
82. Giatromanolaki A., Kuokuorakis M., O’Byrne К etal.//J. Pathol. 1995. -Vol. 179. — P. 80-88.
83. Ginsberg R.J. Surgery and small cell lung cancer an overview.// Lung Cancer 1989; 5:232-236.
84. Graeber A, Osmanian C, Lowe S, Graccia A Hipoxia-mediated selection of cells with diminished apoptotic potential in solid tumors // Nature, 1996, 379, 88-91.
85. Gralla RJ. Docetaxel trials in non-small cell lung carcinoma. Taxanes in lung cancer/ Ed. D. Johnson, J. Klastersly NY: Marcel Dekker, 1998. -P.105-115.
86. Granone P, Margaritora S, Cesario A, Bonatti P, Galetta D, Picciocchi A. Concurrent radio-chemotherapy in N2 non small cell lung cancer: interim analysis.Eur J Cardiothorac Surg 1997 Sep; 12 (3):366-71.
87. Grant C., Valdimarsson G., Hipfner D. et al. // Cancer Res. -1994. -Vol. 54. -P. 357-361.
88. Graziano S.// Lung Cancer, 1997, vol. 17, h. 37-58.
89. Greenblatt M, Bennett W, Hollstein M, Harris C. plutations in the p53 tumor suppressor gene: clues to can-leer etiology and molecular pathogenesis.// Cancer Res, 1994, 15,4855-4878.
90. Gupta K.B., Raj В., Kummar R. et al. Evaluation of diagnostic accuracy of flexible fiberoptic bronchoscopy in suspected cases of malignancy lung //Indian J.Chest Diseases and Allied Sci.,1996, Vol.38, №4,266p.
91. Harpole D, Herndon J, Wolfe W, et al. A prognostic model of recurrence and death in stage I non-small cell lung cancer utilizing presentation, histopathology, and oncoprotein expression // Cancer Res, 1995, 55, 51- 56.
92. Heighway J, Thatcher N, Cerny T. and Hasleton P./ Genetic predisposition to human lung cancer.// Brit. J. Cancer, 53, 1986, 453-457.
93. Heigl A., von Bulzingsloven, Siemon G. Untersuchungen zur Qualitatskontrolle in der Onkologie am Beispiel der Bron-chialkarzinome //Atemwegs und Lungenkrankh. -1996. Vol.22 -N12 -P. 634-644.
94. Hermeking H, Lengauer C, Polyak К et al. 14-3-3 sigma is a p53-regulated inhibitor of G2/M progression // Mol Cell, 1997, 1, 3-11.
95. Higashiyama M., Doi O., Kodama K. etal. //J. Surg. Oncol. 1997.-Vol. 64.-P. 48-54.
96. Higashiyama M., Kodama K., Yokouchi H. et al. //J. surg. Oncol. 1998. — Vol. 68. — P. 19-24.
97. Hillerdal G., Henderson D.W., Path M.R.C. Asbestos, asbes-tosis, pleural plaques and lung cancer //Scand.J.Work, Environ, and Health. -1997. -Vol.23 -N2 -P. 93-104.
98. Horio Y, Takahashi T, Kuroishi T et al. Prognostic significance of p53 mutations and 3p deletions in primary resected non-small cell lung cancer // Cancer Res, 1993, 53, 1-4.
99. Houston S.J., Plunkett T.A., Barnes D.M., Smith P., Rubens R.D., Miles D.W. Overexpression of c-erbB2 is an independent marker of resistance to endocrine therapy in advanced breast cancer. Br J Cancer 1999; №3:168-71.
100. Ichihara A, Tanaka К Roles of proteasomes in cell growth // Mol Biol Rep, 1995,21, 49-52.
101. Jiang S., Kameya Т., Sato Y. et al. Bcl-2 protein expression in lung cancer and close correlation with neu- roendocrine differentiation//Am J Pathol, 1996, 148, 837-846.
102. Jiang S., Sato Y, Kuwao Т., Kameya T. Expression of Bcl-2 oncogene protein is prevalent in small cell lung carcinomas.// J Pathol, 1995,77,135-138
103. Kaiser U., Schilli M., Haag U. et al. // Lung Cancer. 1996 -Vol. 15-P. 31-40.
104. Kakizawa K., Yamaguchi Y., Shirosawa H., Shimizu B. p53 mutation in non-small cell lung cancers //Lung Cancer. 1997. -Vol.37-N1 -P. 5-11.
105. Kawai Т., Suzuci M., Kono S. et al. // Cancer. 1994, Vol. 74, p. 2468-2475.
106. Kawasaki M., Nakanishi Y., Kuwano K. et al. // Eur. J. Cancer. 1998. -№9, P. 1352-1357.
107. Kawasaki M., Nakanishi Y., Yatsunami J. et al. // Cancer J. Sci. Am.-1996, №4, P. 217.
108. Kern J. A:, Slebos R. J. C., Top B. et al. // J. clin. Invest. -1994-Vol. 33-P. 516-520.
109. Kitagawa Y., Wong F., Lo P. et al. // Am. J. Respir. Cell. Mol. Biol. 1996. — Vol. 15. — P. 45-54.
110. Kobayashi K., Ishihara Ts. Postoperative adjuvant chemotherapy with CDDP+VDS for non-small cell lung cancer: a randomized, controlled trial.// Lung Cancer. -1996. -Vol. 36 №7 -P. 899-907.
111. Kohek P.H., Pakish В., Glanzer H. Intraluminal irradiadia-tion in the treatment of malignant airway obstruction// Europ. J. Oncol. 1994. -Vol. 20(6). -P. 674-680.
112. Krontiris T, Dimartino N, Colb M, Mitchison H. and Parcin-son D./ Human restriction fragment lenght polymorphism and cancer risk assessment.// J. cell. Biochem. 30, 1986, 319-329.
113. Krontiris TG, Devlin B, Karp DD, Robert NJ and Risch N./ 1993. An association between the risk of cancer and mutations in the Hrasle minisatellite locus. //N.E.J, of Medicine, 329, 517-523.
114. Kubota Y., Petres R. E., Easley K. A. et al. // Cancer., 1992, Vol.70, P. 2602-2609.
115. Kunze E., Reckels M., Elardt В./ Der hamatogene metasta-sierungsmobus des bronchial karzinoms in abhandidkeit von der tumorgrobe und van metastatischen lymphknotenbefall. Eine autopsiestudie //Pathologe. 1985, V6, p.71-79.
116. Laerum O.D., Farsund T. Clinical application of flow cytometry : A review.-Cytometry, 1981 ,v.2,p. 1-13.
117. Le Chevalier Т., Arriagada R., Quoix E. et al. Radiotherapy alone versus combined chemotherapy and radiotherapy in nonre-sectable non-small cell lung cancer: First analysis of a randomized trial in 353 patients// Ibid. -1991. -Vol. 83. -P. 417-423.
118. Linke S, Clarkin K, DiLeonardo A et al. A reversible, p53 -dependent GO/G1 cell cycle arrest induced by ribonucleotidt depletion in the absence of detectable DNA damage.// Genes Dev, 1996, 10, 934-947.
119. Lorenz J., Jakob H., Ferlicir R. Das Bronchialcarcinomeine zunehmende Herausforderung in Klinik und Praktik. Therapie-woche.- 1989, 39, N19, 1368-1369.
120. Lynch Т. Advanced NSCLC. Traditional chemotherapy meets novel biologic agents. Medscape Conference Coverage, based on sele sessions at the ASCO 2001.
121. Macchiarmi P., Fontanini G., Hardin M. J. et al. // Lancer. 1992.-Vol.340.-P. 145-146.
122. Marchetti A., Buttitta F., Pellegrini S. et al. Alterations of PI6 (MTS1) in node-positive non-small cell lung carcinomas //J.Pathol. 1997. -Vol.181 -№2 -P. 178-182.
123. Mariuzzi G., Mariuzzi L., MOmbello A., Santinelli A. Grading and prognosis of tumors.- In book : Compendium on the computerized cytology and histology laboratory. Ed.: Wied G., Bartels P., Rosenthal D., Schenck U. TOC, Chicago, 1994, p.68- 88.
124. Marrogi A, Travis W, Welsh J et al., Nitric oxide synthase, cyclooxygenase 2 and vascular endothelial growth factor in the angiogenesis of non-small cell lung carcinoma // Clin Cancer Res, 2000,6,4739-4744
125. Martin J., Ginsberg R. J., Venkatraman E. S. et al. Long-Term Results of Combined-Modality Therapy in Resectable Non-Small-Cell Lung Cancer J. Clin. Oncol. 2002, 20: 1989-1995.
126. Mattern J, Koomagi M, Volm M. Association of vascular endothelian growth factor expression with intratumoral vessel density and tumor cell proliferation in human epidermoid lung carcinoma.// Br J Cancer, 1996, 73,931-934
127. Mattern J., Koomagi R., Volm M. //Anticancer 1997, Vol. 17, P. 2249-2252
128. Matthews D.E. and Farewell M.T. Using and understanding medical statistics. KARGER, 1988.
129. Mayebeya Sh., Naito Y. Five years of a cancer registry in Wakayama Prefecture //Lung Cancer. -1997. -Vol.37 -№6 P. 817-824.
130. McLaren R, Kuzu I, Dunnill M et al. The relation ship of p53 immunostaining to survival in carcinoma of the lung // Br J Cancer, 1992, 66, 735-738.
131. Michel Fb., Pujol J.L. Cancer Bronchique: De l’epidemiolo-gie aux traitements //Sem. Hop. Paris. -1997. -Vol.73 -№27-28 -P. 879-889.
132. Mitsudomi T, Lyama T, Kusano T et al. Mutations of the p53 gene as a predictor of poor prognosis in patients with non-small cell lung cancer // Proc Am Assoc Cancer Res, 1993, 34, 516.
133. Miyashita Т., Harigai M., Hanada M., Reed J. Identification of a p53-dependent negative response ele ment in the bcl-2 gene.// Cancer Res, 1994, 54, 3131 -3135.
134. Motoyama A., Kasumoto M., Kono M. Diagnostic criteria for peripheral pulmonary nodules detected by secondary screening for lung cancer by helical CT //Lung Cancer. 1997. -Vol.37 -№4 -P. 491-500.
135. Mountain C. F. A new international staging system for lung cancer. Chest, 1986, 89 (supj. 4), 2255.
136. Muller K.:M., Wiethege Th., Tolnay E., Junker K. Biologie der Lungentumoren. Prognosefactoren durch den Pathologen? //Atemweegs- und Lungenkrankh. -1997. Vol.23 -№6 -P. 302307.
137. Mountain C. F. A new international staging system for lung cancer. Chest, 1986, 89 (supp. 4), 2255.
138. Nakamura N., Oshika Y., Abe Y. et al. Gene expression of granulocyte colony stimulating factor in non-small cell lung can-cer.//Anticancer Res. -1997. -Vol.17 -№18 -P. 573-576.
139. Nakayama Y., Hayakawa K., Mitsuhashi N., Saito Y., Nibe H. Long term survivors of non-small cell lung cancer after radiation therapy: The significance of histological type //Anticancer Res. -1997. -Vol.17 -N4A -P. 2769-2774.
140. Naruke Tsuguo. Lymph node metastasis of lung cancer an-dassociated surgery .//Asian Med J., 1990, 33, №12, pp 668.
141. Nash G., Hutter R.V.P., Henson D.E. Practice protocol for the examination of speciments from patients with lung cancer //Cancer. -1996. -Vol.77 -№10 -P. 2167-2174
142. Nishimori H, Shiratsuchi T, Urano T et al. A novel brain-specific p53-target gene, BAH, containing throm- bospondin type 1 repeats inhibits experimental angio genesis // Oncogene, 1997, 15,2145-2150.
143. Non Small Cell Lung Cancer Collaborative Group. Chemotherapy in non small cell lung cancer. A metaanalysis using updated data on individual patients from 52 randomized clinical trials. British Medical J. 1995; 311(7010): 899-909.
144. Ohta Y, Watanabe S, Murakami Set al. Vascular endothelial growth factor and lymph node metastasis in primary lung cancer // Br J Cancer, 1997,76,1041-1045
145. OshikaY.,’Nakamura M., TokunagaT. etal.// Mod. Pathol. -1998.-№11 -P. 1059-1063.
146. Palmisano W, Divine K, Saccomanno G. et al. Predicting lung cancer by detecting aberrant promoter methylation in sputum.// Cancer Res, 2000, 60, 5954- 5958.
147. Pezzella F., Turley H., Kuzu I. et al. Bcl-2 protein in non-small cell lung carcinoma.//New Engl. J. Med., 1993. -Vol. 329. -P. 690-694.
148. Pfeiffer P., Clausen P. P., Andersen K.,Rose C. L// Br. J. Cancer.-1996. Vol. 74 — P. 86-91.
149. Polyzos A., Tsavaris N., Vslemes M. et al. Chemotherapy of non small cell lung cancer. A prospectively randomized study of cisplatin-etoposide versus cisplatin-mitomycin-vinblastine //J.Chemother. -1997. -Vol.9 -N2 -P. 102-105.
150. Qu Jiaqi, Hou W., Shi N. Experience of surgical treatment of patients with N2 lung cancer.//Chinese J.Oncol. -1996. -Vol.18 -N5 -P. 376-378.
151. Quinlan D, Davidson A, Summers С et al. Accumulation of p53 protein correlates with a poor prognosis in human lung cancer // Cancer Res, 1992, 52,4828- 4831
152. Ravi R, Mookerjee B, van Hensbergen Y et al. p53-mediated repression of nuclear factor-kappaB RelA via the transcriptional integrator p300.// Cancer Res, 1998,58,4531-4536.
153. Sakao Y.,Hata E., Miyamoto H. et al. Prognosis and prognostic factor after extended lymphadenectomy for the lung cancer //J.Jap. Assoc. Thorac. Surg. -1997. -Vol.45 -N5 -P. 711-717.
154. Saksela K, Berght J, Lehto V. et al.// Cancer Res. 46, 1985, 1823-1827.
155. Sandler A., Nemunaitis J., Dehnam С et al. Phase III study of cisplatin (C) with or without gemcitabine (G) in patients with advanced Non-small cell lung cancer// Proc. ASCO. -1998. -Vol.17. -P. 454a (Abstr. 1747).
156. Satoh H., Ishikawa H., Yamashita Y.T. et al. Outcome of patients with lung cancer detected by mass screening versus presentation with symptoms //Anticancer Res. -1997. -Vol. 17 -№3C -P. 2293-2296.
157. Saunders M., Dische S. Continuous, hyperfractionated, accelerated radiothetapy (CHART) in nonSsmall cell carcinoma of the bronchus// Int. J. Radiat. Oncol. Biol. Phys. 1990. -Vol. 19. -P. 1211-1215.
158. Scagliotti G. V., De Marinis F., Rinaldi M., et al. Phase III Randomized Trial Comparing Three PlatinumBased Doublets in Advanced NonSmall Cell Lung Cancer. Proc. ASCO 2001, 20, 1227.
159. Schnieder P.M., Hung M.-C., Chinoza S.M. // Cancer Res., 1989, Vol.49, P. 4968-4971.
160. Schwarting R. // Lab. Invest. 1993. — Vol. 68. — P. 597-599.
161. Sculier J.P., Berghmans Т., Vermylen P., Ninane V. Actu-alites en cancerologie pulmonaire //Rev. Med. Bruxelles.-1997. -Vol.18-№4-P. 204-208.
162. Shahidi-H; Kvale-PA Long-term survival following surgical treatment of solitary brain metastasis in non-small cell lung cancer. Chest. 1996 Jan; 109(1): 271-6
163. Shankey T.V., Rabinovitch P.S., Bagwell В., Bauer K.D. et al., Guidelines for implementation of clinical DNA cytometry.-Cytometry,1993, v.14, N2., p. 472- 477.
164. Shepherd F.A., Dancey J., Ramlau R. A prospective randomised trial of docetaxel versus best supportive care in patients with non-small cell lung cancer previously treated with platinum-based chemotherapy// J. Clin. Oncol. -2000. -Vol.18. -P. 20952103.
165. Shirakusa T, Kawahara K, Iwasaki A, Okabayashi K, Shirai-shi T, Yoneda S, Yoshinaga Y, Matsuzoe D, Watanabe K. Extended operation for T4 lung carcinoma.Ann Thorac Cardiovasc Surg 1998 Jun;4 (3): 110-8
166. Simony J., Pujol J. L., Radal M. et al. // Cancer Res. 1996, Vol. 50, P. 4382-4387.
167. Smith M, Chen I, Zhan Q et al. Interaction of the p53-regulated protein Gadd45 with proliferating cell nuclear antigen.// Science 1994, 266, 1376-1380.
168. Sozy G., Moizzo M., Donghi R. Deletions of 17p andp53 mutations in preneoplastic lesions of the lung // Cancer Re, s 1992, 52, 6079-6082.
169. Spandidos D, Pintzas A, Kakkanas A. et al.// Anticancer Res. 7, 1987, 1299-1304.
170. Sugio K, Ishida T, Yokoyama H, et al. Ras gene mutations as a prognostic’ marker in adenocarcinoma of the human lung without lymph node metastasis.// Cancer Res, 1992, 52, 29032906.
171. Takagi Y, Koo L, Osada H et al. Distinct muta- tional spectrum of the p53 gene in lung cancers from Chinese women in Hong Kong // Cancer Res, 1995, 55, 5354-5357.
172. Takanami I., Imamura Т., Hashizume T. // Jap. J. elm. Oncol 1997, Vol. 26, P. 293-297.
173. Tateishi M., Ishida Т., Mitsudoma Т. et al.// Eur. J. Cancer, 1991, vol. 27, p.1372-1375.
174. Tendori L.,Trindelli-Danesi D.,Mauro F.et al., Non-small cell carcinoma: Tumor characterization on the basis of flow cy-tometrically determined cellular heterogeneity.// Cytometry, 1983, v.4, p. 174-183.
175. Tockman M.S. Clinical detection of lung cancer progression markers.// J.Cell. Biochem., 1996, Supp.l, №25, P. 177-184.
176. Tomirotti M., Galassi В., Dambrosio M et al Cis/carboplatin+vinorelbine +/- radiotherapy in stage III and IV non-small lung carcinoma //J.Chemother. -1997. -Vol.9 -№1 -P. 62-65.
177. Top B, Mooi W, Klaver S et al. Comparative analysis ofp53 gene mutations and protein accumulation in human non-small-cell lung cancer // Int. J Cancer, 1995, 64, 83-91.
178. Tsai C.-M., Chang K.-T., Wu L.-H. et al. // Ibid. 1996. -Vol.56.- P. 206-209.
179. Tugekar M. F., Gatter R. E., Dunnill M. S., Mason D. Y.// Histopathology. -1991. Vol. 19. — P. 545-550.
180. Urschel JD, Antkowiak JG, Takita H. Is there a role for surgery in small-cell lung cancer? J R Soc Med 1997 Jul;90 (7):387-90.
181. Usuda K., Saito Y., Sakurada A. et al. Prognostic analyses of resected primary lung cancer.// Lung Cancer. 1994. -Vol.34 -N2 -P. 191-198.
182. Utrera R, Collavin L, Lazarevic D et al. A novel p53-inducible gene coding for a microtubule-localized protein with G2-phase-specific expression // EMBO J , 1998,17,5015-5025.
183. Van Meir E, Polverini P, Chazin V et al. Release of an inhibitor of angiogenesis upon induction of wild type p53 expression in glioblastoma cells.//Nat Genet, 1994, 8,171-176.
184. Vindelov L.L.,Christensen I.J.,Nissen N.I. Standartization of high-resolution flow cytometric DNA analysis by the simultaneous use of chicken and trout red blood cells as internal reference stan-dards.-Cytometry, 1983,v.3,N5,p.321-331.
185. Vogt-Moykopf I. New aspects in the staging of lung cancer. Prospective validation of the International Union Against Cancer TNM classification. Cancer 1992; 70: 1102-1110.
186. Vollmer R.T. The effect of cell size on the pathologic diagnosis of small and large cell carcinomas of the lung.-Cancer, 1982, v.50, №7, p.1380-1383.
187. Volm M, Koomagi J, Mattern J. Prognostic value of vascular endothelial growth factor and its receptor Fit- 1 in squamous cell lung cancer.// Int J Cancer, 1997, 74, 64-68.
188. Volm M, Mattern J, Koomagi R Angiostatin expression in non-small cell lung cancer.// Clin Cancer Res, 2000, 6, 3236-3240.
189. Volm M., Koomagi R., Mattern J., Stammler G. // Eur. J Cancer., 1997, Vol 33, P. 691-693.
190. Watkin Simon W., Gren John A. Small cell carcinoma of the bronchus: historical perspektive of a treatable disease. J. Roy. Soc. Med.-1990, 83, №2, 108-110.
191. Weibel E.R. Stereological principles for morphometry in electron microscopy.-Int.Rev.Cytol, 1969, v.26, p.235-303.
192. Weidner N. //Am. J. Pathol. 1995, Vol. 147, P. 9-19.
193. Weidner N.// Semin. Diagn. Pathol. 1993, №10, P. 302-313.
194. Weiel J, Adams D. and Hamilton T.// Cell. Immunol. 88, 1984, 343.
195. Weiner D.B. et al.// Cancer Res., 1990, vol. 50, p. 412-425.
196. Wright S. R., Boag A., Vaidimarsson G. et al. // Clin. Cancer Res 1998. — №9. — P. 2279-2289.
197. Wu G, Burns T, McDonald E et al. KILLER/DR5 is a DNA damage-inducible p53 -regulated death receptor gene // Nat Genet, 1997,17,141-143
198. Wozniak A.J., Crawley J.J., Balcerzak S.P. et al. Randomized trial comparing cisplatin with cisplatin plus vinorelbin in the treatment of advanced non small cell lung cancer: A Southwest Oncology Group study// Ibid., -1998. -Vol.16, №7. -P.2459 -2465.
199. Xu H, Quinlan D, Davidson A et al. Altered retinoblastoma protein expression and prognosis in early-stage non-small-cell lung carcinoma.// J Natl Cancer Inst, 1994, 86, 695-699.
200. Yamaziki K., Abe S., Takekawa H. et al. // Cancer 1994, Vol. 74. P. 2245-2250.
201. Yu D., Wang S.-S., Dulski К. M. et al. // Cancer Res. 1994. — Vol. 54. — P. 3260-3266.
202. Yuan A., Yu C., Chen W. et al. Correlation of total VEGF mRNA and protein expression with histologic type, tumor angio-genesis, patient survival and timing of relapse in non-small-cell lung cancer // Int. J. Cancer, 2000, 89,475-483.
203. Yuan A., Yu C.J., Luh K.T. et al. Aberrant p53 Expression Correlates With Expression of Vascular Endothelial Growth Factor m RNA and Interleukin-8 mRNA and Neoangiogenesis in non-Small-Cell Lung Cancer.
204. Zochbauer-Muller S, Gazdar A., Minna J. Molecular pathogenesis of lung cancer. Ann Rev Phisiol, 2002, 64, 681-708.
Мелкоклеточный рак легкого
ГУ РОНЦ им. Н.Н.Блохина РАМН, Москва
М.Б. Бычков, Э.Н. Дгебуадзе, С.А. Большакова
В настоящее время ведутся исследования новых методов терапии при МРЛ. С одной стороны, разрабатываются новые схемы и комбинации с меньшим уровнем токсичности и большей эффективностью, с другой стороны, изучаются новые препараты. Основной целью проводимых исследований является увеличение выживаемости пациентов и уменьшение частоты рецидивов. Необходимо продолжить изучение эффективности новых препаратов с новым механизмом действия.
Рак легкого является одним из наиболее распространенных онкологических заболеваний в мире. Немелкоклеточная (НМРЛ) и мелкоклеточная (МРЛ) формы рака легкого встречаются в 80-85% и 10-15% случаев, соответственно [41]. Как правило, мелкоклеточная его форма чаще всего встречается у курящих и очень редко у некурящих больных.
МРЛ относится к наиболее злокачественно текущим опухолям и характеризуется коротким анамнезом, быстрым течением, имеет тенденцию к раннему метастазированию. Мелкоклеточный рак легкого является опухолью, высокочувствительной к химиотерапии, при этом у большинства пациентов можно получить объективный эффект. При достижении полной регрессии опухоли проводится профилактическое облучение головного мозга, что позволяет уменьшить риск отдаленного метастазирования и увеличить уровень общей выживаемости [4].
При диагностике МРЛ особое значение имеет оценка распространенности процесса, определяющая выбор терапевтической тактики. После морфологического подтверждения диагноза (бронхоскопия с биопсией, трансторакальная пункция, биопсия метастатических узлов) проводится компьютерная томография (КТ) грудной клетки и брюшной полости, а также КТ или магнитно-резонансная томография (МРТ) головного мозга (с контрастированием) и сканирование костей.
В последнее время появились сообщения о том, что позитронно-эмиссионная томография позволяет дополнительно уточнить стадию процесса.
При МРЛ, как и при других формах рака легкого, используется стадирование по международной системе TNM, однако большинство больных МРЛ уже имеют на момент установления диагноза III-IV стадию заболевания, в связи с этим до настоящего времени не потеряла свое значение классификация, согласно которой различают локализованную и распространенную формы заболевания.
При локализованной стадии МРЛ опухолевое поражение ограничено одним гемитораксом с вовлечением в процесс регионарных ипсилатеральных лимфатических узлов корня и средостения, а также и ипсилатеральных надключичных лимфатических узлов, когда технически можно выполнить облучение с использованием одного поля.
Распространенной стадией заболевания считается процесс, когда опухолевое поражение не ограничено одним гемитораксом, с наличием контралатеральных лимфогенных метастазов или опухолевого плеврита.
Стадия процесса, определяющая терапевтические возможности, является основным прогностическим фактором при МРЛ [1].
Прогностические факторы:
1. Степень распространенности процесса: у больных с локализованным процессом (не выходящим за пределы грудной клетки) достигаются лучшие результаты при химиолучевой терапии.
2. Достижение полной регрессии первичной опухоли и метастазов: отмечается существенное увеличение длительности жизни и имеется возможность полного выздоровления.
3. Общее состояние больного: пациенты, начинающие лечение в хорошем состоянии, имеют более высокую эффективность лечения, большую выживаемость, чем пациенты в тяжелом состоянии, истощенные, с выраженными симптомами болезни, гематологическими и биохимическими изменениями.
Принципы терапии мелкоклеточного рака легкого
Оперативное лечение показано только при ранних стадиях МРЛ (T1-2N0—1). Оно должно дополняться послеоперационной полихимиотерапией (4 курса). У данной группы больных 5-летняя выживаемость составляет 39% [33].
Лучевая терапия приводит к регрессии опухоли у 6080% пациентов, однако в самостоятельном виде она не увеличивает продолжительность жизни из-за появления отдаленных метастазов [9].
Химиотерапия является краеугольным камнем лечения МРЛ. Среди активных препаратов следует отметить: цик- лофосфан, доксорубицин, винкристин, этопозид, топотекан, иринотекан, паклитаксел, доцетаксел, гемцитабин, винорельбин. Их эффективность в монотерапии колеблется от 25 до 50% [23, 35]. В табл. 1 представлены схемы современной комбинированной химиотерапии МРЛ.
Лечение больных с локализованной формой МРЛ
Эффективность современной терапии данной формы МРЛ колеблется от 65% до 90%, с полной регрессией опухоли у 45-75% больных и медианой выживаемости 1824 мес [15, 38]. Больные, начавшие лечение в хорошем общем состоянии (PS 0-1) и ответившие на индукционную терапию, имеют шансы на 5-летнюю безрецидивную выживаемость.
При локализованной форме МРЛ проводится химиотерапия (ХТ) по одной из вышеуказанных схем (2-4 курса) в сочетании с лучевой терапией (ЛТ) на область первичного очага, корня легкого и средостения с подведением суммарной очаговой дозы 30-45 Гр (50-60 Гр по изоэффекту) [6, 7, 37]. Начало лучевой терапии должно быть максимально приближено к началу химиотерапии, т.е. лучше всего ЛТ начинать либо на фоне проведения 1-2 курсов химиотерапии, либо после проведения оценки эффективности лечения двух курсов ХТ.
Больным, у которых достигнута полная ремиссия, рекомендуется проведение профилактического облучения головного мозга в суммарной дозе 30 Гр в связи с высоким риском (до 70%) метастазирования в головной мозг [4].
Медиана выживаемости больных с локализованной формой МРЛ при использовании комбинированного лечения составляет 16-24 мес, при этом 2-летняя выживаемость равна 40-50%, 5-летняя — 10%. У группы больных, начавших лечение в хорошем общем состоянии, возможности достижения 5-летней выживаемости составляют 25% [15, 38].
Лечение больных с распространенной формой МРЛ
У таких больных основным методом лечения является комбинированная химиотерапия в тех же режимах, а облучение проводится только по специальным показаниям. Общая эффективность химиотерапии составляет 70%, но полная регрессия достигается только у 20% больных [15]. В то же время, выживаемость пациентов при достижении полной регрессии опухоли достоверно выше, чем при получении частичной регрессии, и приближается к выживаемости больных с локализованной формой МРЛ.
Таблица №1.
Схемы современной комбинированной химиотерапии МРЛ
| Препараты | Схема химиотерапии | Интервал между курсами |
| ЕР
Цисплатин Этопозид | 80 мг/м2 внутривенно в 1-й день 120 мг/м2 внутривенно в 1,2,3-й дни | 1 раз в 3 нед |
| CDE
Циклофосфамид Доксорубицин Этопозид | 1000 мг/м2 внутривенно в 1-й день 45 мг/м2 внутривенно в 1-й день 100 мг/м2 внутривенно в 1,2,3-й дни или 1,3,5-й дни | 1 раз в 3 нед |
| CAV
Циклофосфамид Доксорубицин Винкристин | 1000 мг/м2 внутривенно в 1-й день 50 мг/м2 внутривенно в 1-й день 1,4 мг/м2 внутривенно в 1-й день | 1 раз в 3 нед |
| AVP
Нимустин (CCNU) Этопозид Цисплатин | 2-3 мг/кг внутривенно в 1-й день 100 мг/м2 внутривенно в 4,5,6-й дни 40 мг/м2 внутривенно в 1,2,3-й дни | 1 раз в 4-6 нед |
| CODE
Цисплатин Винкристин Доксорубицин Этопозид | 25 мг/м2 внутривенно в 1-й день 1 мг/м2 внутривенно в 1-й день 40 мг/м2 внутривенно в 1-й день 80 мг/м2 внутривенно в 1,2,3-й дни | 1 раз в неделю в течение 8 нед |
| TC
Паклитаксел Карбоплатин | 135 мг/м2 внутривенно в 1-й день AUC 5 мг/м2 внутривенно в 1-й день | 1 раз в 3-4 нед |
| TP
Доцетаксел Цисплатин | 75 мг/м2 внутривенно в 1-й день 75 мг/м2 внутривенно в 1-й день | 1 раз в 3 нед |
| IP
Иринотекан Цисплатин | 60 мг/м2 внутривенно в 1,8,15-й дни 60 мг/м2 внутривенно в 1-й день | 1 раз в 3 нед |
| GP
Гемцитабин Цисплатин | 1000 мг/м2 внутривенно в 1,8-й дни 70 мг/м2 внутривенно в 1-й день | 1 раз в 3 нед |
При метастатическом поражении костного мозга, отдаленных лимфатических узлов, при метастатическом плеврите основным методом лечения является химиотерапия. При метастатическом поражении лимфатических узлов средостения с синдромом сдавления верхней полой вены целесообразно применять комбинированное лечение (химиотерапию в сочетании с лучевой). При метастатическом поражении костей, головного мозга, надпочечников методом выбора является лучевая терапия. При метастазах в головной мозг лучевая терапия в суммарной очаговой дозе (СОД) 30 Гр позволяет получить клинический эффект у 70% больных, причем, у половины из них регистрируется полная регрессия опухоли по данным КТ [4]. В последнее время появились сообщения о возможности использования системной химиотерапии при метастазах в головной мозг. В табл. 2 представлена современная тактика лечения различных форм МРЛ.
Терапевтическая тактика при рецидиве МРЛ
Несмотря на высокую чувствительность к химиотерапии и лучевой терапии МРЛ, это заболевание имеет высокий уровень рецидивов, в таком случае выбор препаратов для химиотерапии второй линии зависит от уровня ответа на первую линию лечения, длительности безрецидивного промежутка и от локализации метастатических очагов.
Принято различать больных с чувствительным рецидивом МРЛ, т.е. имевших в анамнезе полный или частичный эффект от первой линии химиотерапии и наличием прогрессирования не менее чем через 3 мес после окончания индукционной химиотерапии. В этом случае, возможно, повторно использовать схему лечения, на фоне которой выявлен эффект. Существуют пациенты с рефрактерным рецидивом, т.е. когда отмечается прогрессирование заболевания в процессе первой линии химиотерапии или менее чем через 3 мес после ее окончания. Прогноз заболевания у больных МРЛ особенно неблагоприятен для пациентов с рефрактерным рецидивом — в этом случае медиана выживаемости после диагностики рецидива не превышает 3-4 мес. При наличии рефрактерного рецидива целесообразно применение ранее не использовавшихся цитостатиков и/или их комбинаций.
В последнее время изучаются и уже используются новые препараты в терапии МРЛ, к ним относятся гемцитабин, топотекан, винорельбин, иринотекан, таксаны, а также таргетные препараты.
Гемцитабин. Гемцитабин является аналогом деокситидина и относится к пиримидиновым антиметаболитам. По данным исследования Y. Cornier и соавт., его эффективность в монотерапии составила 27%, по результатам датского исследования уровень общей эффективности составляет 13% [8]. Поэтому стали изучать комбинированные режимы химиотерапии с включением гемцитабина. В итальянском исследовании проводилось лечение по схеме PEG (гемцитабин, цисплатин, этопо- зид), при этом уровень объективной эффективности составил 72%, однако отмечена высокая токсичность [10]. London Lung Group опубликовали данные рандомизированного исследования III фазы по прямому сравнению двух схем лечения GC (гемцитабин + цисплатин) и РЕ. Различий в медианах выживаемости не было получено, здесь также отмечен высокий уровень токсичности схемы GC [20].
Топотекан. Топотекан — это водорастворимый препарат, являющийся полусинтетическим аналогом камптотецина, он не обладает перекрестной токсичностью с другими цитостатиками, использующимися при лечении МРЛ. Результаты некоторых исследований отмечают его эффективность и при наличии резистентных форм заболевания [3, 11, 13, 39, 40]. Также в этих работах выявлена хорошая переносимость топотекана, характеризующаяся управляемой некумулятивной миелосупрессией, низким уровнем негематологической токсичности и значительным уменьшением клинических проявлений заболевания [2, 12, 29, 30]. Использование топотекана во второй линии терапии МРЛ одобрено приблизительно в 40 странах мира, включая США и Швейцарию.
Винорельбин. Винорельбин является полусинтетическим винкаалкалоидом, который участвует в предотвращении процессов деполимеризации тубулина. По данным некоторых исследований, уровень ответа при монотерапии винорельбином составляет 17% [16, 21]. Было также выявлено, что комбинация винорельбина и гемцитабина является достаточно эффективной и обладает невысоким уровнем токсичности. В работе J.D. Hainsworth и соавт. уровень частичной регрессии составил 28% [19]. Несколько исследовательских групп оценивали эффективность и токсический профиль комбинации карбоплатина и винорельбина [18, 24]. Полученные данные указывают на то, что эта схема активно работает при мелкоклеточном раке легкого, однако, токсичность ее довольно высока, в связи с чем, необходимо определить оптимальные дозы для вышеуказанной комбинации.
Таблица №2.
Современная тактика лечения МРЛ
| Локализованный процесс | Распространенный процесс |
|
1. Химиотерапия
Схема ЕР: этопозид + цисплатин Схема CAV: циклофосфамид+ доксорубицин+ винкристин
2. Лучевая терапия
Ранняя одновременно с 1-м или 2-м курсом ХТ Поздняя — с 3-м курсом ХТ Суммарная доза ЛТ — 45 Гр
3. При наличии полной регрессии
Проводится профилактическое облучение головного мозга — СОД 30 Гр
|
1. Химиотерапия
Схемы EP, CAV или CDE (4-6 курсов)
2. Лучевая терапия
Проводится на отдельные очаги поражения
|
Иринотекан. Основываясь на результатах исследования II фазы Japan Clinical Oncology Group начали рандомизированное исследование III фазы JCOG-9511 по прямому сравнению двух схем химиотерапии цисплатин + иринотекан (PI) и цисплатин + этопозид (РЕ) у ранее нелеченных пациентов с МРЛ [27]. В первой комбинации доза иринотекана составила 60 мг/м2 в 1, 8-й и 15-й дни, цисплатина — 60 мг/м2 в 1-й день каждые 4 нед, во второй комбинации цисплатин вводили в дозе 80 мг/м2, этопозид — 100 мг/м2 в 1-3-й дни, каждые 3 нед. Всего в первой и второй группе было проведено по 4 курса химиотерапии. В работу планировалось включить 230 больных, однако, набор был остановлен после проведения предварительного анализа полученных результатов (n=154), так как выявлено достоверное увеличение выживаемости в группе, получающей лечение по схеме PI (медиана выживаемости равна 12,8 против 9,4 месяцев, соответственно). Однако следует отметить, что только 29% больных, рандомизированных в группу PI, смогли получить необходимую дозу препаратов. По данным этого исследования, схема PI была признана в Японии стандартом лечения локализованной формы МРЛ. В связи с небольшим количеством пациентов данные этой работы необходимо было подтвердить.
Поэтому в Северной Америке было начато исследование III фазы [32]. С учетом уже имеющихся результатов дозы препаратов были редуцированы. В схеме PI доза цисплатина составила 30 мг/м2 в 1-й день, иринотекана — 65 мг/м2 в 1-й и 8-й дни 3-недельного цикла. Что касается токсичности, то диарея IV степени не была зарегистрирована, предварительные данные по эффективности ожидаются.
Таксаны. В работе J.E. Smyth и соавт. проводилось изучение эффективности доцетаксела 100 мг/м2 в монотерапии у ранее леченных больных (n=28), объективная эффективность составила 25% [32].
В исследование ECOG включено 36 ранее нелеченных пациентов с МРЛ, которые получали паклитаксел 250 мг/м2в виде 24-часовой инфузии каждые 3 нед [14]. При этом уровень частичной регрессии составил 30%, в 56% случаев была зарегистрирована лейкопения IV степени. Однако интерес к этому цитостатику не ослабевал, в связи с чем, в США было начато Intergroup Study, где изучалась комбинация паклитаксела с этопозидом и цисплатином (ТЕР) или карбоплатином — (ТЕС) [26]. В первой группе химиотерапия проводилась по схеме ТЕР (паклитаксел 175 мг/м2 в 1-й день, этопозид 80 мг/м2 в 1-3-й дни и цисплатин 80 мг/м2 в 1-й день, при этом обязательным условием было введение колониестимулирующих факторов с 4-го по 14-й дни), в схеме РЕ дозы препаратов были идентичными. Более высокий уровень токсичности наблюдался в группе ТЕР, к сожалению, различий в медиане выживаемости не было получено (10,4 против 9,9 месяцев).
M. Reck и соавт. представили данные рандомизированного исследования III фазы, в котором в одной группе изучалась комбинация ТЕС (паклитаксел 175 мг/м2 в 4-й день, этопозид в 1-3-й дни в дозе 125 мг/м2 и 102,2 мг/м2пациентам с I-IIffi и IV стадией заболевания, соответственно, и карбоплатин AUC 5 в 4-й день), в другой группе — CEV (винкристин 2 мг в 1-й и 8-й дни, этопозид с 1го по 3-й день в дозе 159 мг/м2 и 125 мг/м2 больным с I- ШВ и IV стадией и карбоплатин AUC 5 в 1-й день) [28]. Медиана общей выживаемости составила 12,7 против 10,9 месяцев, соответственно, однако, полученные различия недостоверны (р=0,24). Уровень токсических реакций был приблизительно одинаков в обеих группах. По данным других исследований, аналогичных результатов не получилось, так что на сегодняшний день препараты таксанового ряда редко применяются при лечении мелкоклеточного рака легкого.
В терапии МРЛ исследуются новые направления лекарственного лечения, имеющие тенденцию к переходу от неспецифических лекарственных средств к так называемой таргетной терапии, направленной на определенные гены, рецепторы, ферменты. В ближайшие годы именно характер молекулярно-генетических нарушений будет определять выбор лекарственных схем лечения у больных МРЛ.
Таргетная терапия
Таргетная терапия aHmu-CD56. Известно, что клетки мелкоклеточного рака легкого экспрессируют CD56 [25]. Он экспрессируется периферическими нервными окончаниями, нейроэндокринными тканями, миокардом. Для подавления экспрессии CD56 были получены конъюгированные моноклональные антитела N901-bR. В I фазе исследования приняли участие пациенты (n=21) с рецидивом МРЛ, им в течение 7 дней проводилась инфузия препарата [31]. В одном случае была зарегистрирована частичная регрессия опухоли, длительность которой составила 3 мес. В работе British Biotech (I фаза) изучали моноклональные антитела mAb, которые конъюгируются в токсин DM1. DM1 ингибирует полимеризацию тубулина и микротрубочек, что приводит к смерти клетки. Исследования в этой области продолжаются.
Талидомид. Имеется мнение о том, что рост солидных опухолей зависит от процессов неоангиогенеза. С учетом роли неоангиогенеза в росте и развитии опухолей разрабатываются препараты, направленные на прекращение процессов ангиогенеза.
Например, талидомид был известен как лекарственное средство против бессонницы, который впоследствии перестал применяться в связи с наличием у него тератогенных свойств. К сожалению, механизм его антиангиогенного действия не известен, однако, талидомид блокирует процессы васкуляризации, индуцированные фактором роста фибробластов и эндотелиальным фактором роста [5]. Во II фазе исследования 26 больным с ранее нелеченным МРЛ было проведено 6 курсов стандартной химиотерапии по схеме РЕ, а затем в течение 2 лет они получали лечение талидомидом (100 мг в день) с минимальным уровнем токсичности [22]. У 2 пациентов зарегистрирована ПР, у 13 — ЧР, медиана выживаемости составила 10 мес, 1-летняя выживаемость — 42%. С учетом полученных многообещающих результатов решено начать исследования III фазы по изучению талидомида.
Ингибиторы матриксной металлопротеиназы. Металлопротеиназы являются важными ферментами, участвующими в неоангиогенезе, основной их ролью является участие в процессах ремоделирования ткани и продолженного роста опухоли. Как выяснилось, инвазия опухоли, а также ее метастазирование зависят от синтеза и высвобождения этих ферментов опухолевыми клетками. Некоторые ингибиторы металлопротеиназ уже синтезированы и опробованы при мелкоклеточном раке легкого, как, например, маримастат (British Biothech) и BAY12-9566 (Bayer).
В большом исследовании по изучению маримастата участвовало более 500 больных с локализованной и диссеминированной формами мелкоклеточного рака легкого, после проведения химиотерапии или химиолучевого лечения одной группе пациентов назначали маримастат (10 мг 2 раза в день), другой — плацебо [34]. Увеличения выживаемости получить не удалось. В работе по изучению BAY12-9566 в группе изучаемого препарата было отмечено уменьшение выживаемости, поэтому исследования ингибиторов металлопротеиназы при МРЛ были прекращены.
Также при МРЛ проводили изучение препаратов, ингибирующих рецепторы тирозинкиназы (гефитиниб, иматиниб) [17]. Только при исследовании иматиниба (гливек) были получены обещающие результаты, в связи с чем, продолжаются работы в этом направлении.
Таким образом, в заключение следует еще раз подчеркнуть, что в настоящее время ведутся исследования новых методов терапии при МРЛ. С одной стороны, разрабатываются новые схемы и комбинации с меньшим уровнем токсичности и большей эффективностью, с другой стороны, изучаются новые препараты. Основной целью проводимых исследований является увеличение выживаемости пациентов и уменьшение частоты рецидивов. Необходимо продолжить изучение эффективности новых препаратов с новым механизмом действия. В этом обзоре представлены результаты некоторых исследований, в которых отражены данные химиотерапии и таргетной терапии. Таргетные препараты обладают новым механизмом действия, что дает основание надеяться на возможность более успешного лечения такого заболевания, как мелкоклеточный рак легкого.
Литература
1. Бычков М.Б. Мелкоклеточный рак легкого. Руководство по химиотерапии опухолевых заболеваний / Под ред. Н.И. Переводчиковой. — М., 2005. — P. 203-208.
2. Anzai H., Frost P., Abbuzzese J.L. Synergistic cytotoxicity with combined inhibition of topoisomerase (Topo) I and II // Proc. Amer. Assoc. Cancer. Res. — 1992. — Vol. 33. — P. 431.
3. Ardizzoni A., Hansen H, Dombernowsky P. et al. Topotecan, a new active drug in the second-line treatment of small-cell lung cancer: a phase II study in patients with refractory and sensitive disease. The European Organization of Research and Treatment of Cancer Early Clinical Studies Group and New Drug Development Office, and the Lung Cancer Cooperative Group // J. Clin. Oncol. — 1997. — Vol. 15. — P. 2090-2096.
4. Auperin A., Arriagada R., PignonJP. et al. Prophylactic cranial irradiation for patients with non-small cell lung cancer in complete remission. Profilactic Cranial Irradiation Collaborative Group // New Engl. J. Med. — 1999. — Vol. 341. — P. 476-484.
5. Bauer KS, Dixon S.C., Figg W.D. et al. Inhibition of angiogenesis by thalidomide requires metabolic activation, which is species0dependent // Biochem. Pharmacol. — 1998. — Vol. 55. — P. 1827-1834.
6. Bleehen NM, Girling DJ, Machin D. et al. A randomized trial of three or six courses of etoposide cyclophosphamide methotrexate and vincristine or six courses of etoposide and ifosfamide in small cell lung cancer (SCLC). I: survival and prognostic factors. Medical Research Council Lung Cancer Working Party // Brit. J. Cancer. — 1993. — Vol. 68. — P. 1150-1156.
7. Bleehen N.M., Girling D.J., Machin D. et al. A randomized trial of three or six courses of etoposide cyclophosphamide methotrexate and vincristine or six courses of etoposide and ifosfamide in small cell lung cancer (SCLC). II: quality of life. Medical research Council Lung Cancer Working Party // Brit. J. Cancer. — 1993. — Vol. 68. — P. 1157-1166.
8. Cormier Y., EisenhauerE, MuldalA et al. Gemcitabine is an active new agent in previously untreated extensive small cell lung cancer (SCLC). A study of National Cancer Institute of Canada Clinical Trials Group // Ann. Oncol. — 1994. — Vol. 5. — P. 283-285.
9. Cullen M, Morgan D, Gregory W. et al. Maintenance chemotherapy for anaplastic small cell carcinoma of the bronchus: a randomized, controlled trial // Cancer Chemother. Pharmacol. — 1986. — Vol. 17. — P. 157-160.
10. De Marinis F, Migliorino MR, Paoluzzi L. et al. Phase I/II trial of gemcitabine plus cisplatin and etoposide in patients with small-cell lung cancer // Lung Cancer. — 2003. — Vol. 39. — P- 331-338.
11. Depierrie A., von PawelJ., Hans K et al. Evaluation of topotecan (Hycamtin TM) in relapsed small cell lung cancer (SCLC). A multicentre phase Ii study // Lung Cancer. — 1997. — Vol. 18 (Suppl. 1). — P. 35.
12. Dowlati A, Levitan N., Gordon NH. et al. Phase II and pharmacokinetic/pharmacodynamic trial of sequential topoi- somerase I and II inhibition with topotecan and etoposide in advanced non-small-cell lung cancer // Cancer Chemother. Pharmacol. — 2001. — Vol. 47. — P. 141-148.
13. Eckardt J, Gralla R., Pallmer M.C. et al. Topotecan (T) as second-line therapy in patients with small cell lung cancer (SCLC): a phase II study // Ann. Oncol. — 1996. — Vol. 7 (Suppl. 5). — P. 107.
14. Ettinger DS, Finkelstein DM, Sarma RP. et al. Phase Ii study of paclitaxel in patients with extensive-disease small-cell lung cancer: an Eastern Cooperative Oncology Group study // J. Clin. Oncol. — 1995. — Vol. 13. — P. 1430-1435.
15. Evans W.K., Shepherd Fa, Feld R et al. VP-16 and cisplatin as first-line therapy for small-cell lung cancer // J. Clin. Oncol. — 1985. — Vol. 3. — P. 1471-1477.
16. Furuse K., Kubota K., Kawahara M. et al. Phase II study of vinorelbine in heavily previously treated small cell lung cancer. Japan Lung Cancer Vinorelbine Group // Oncology. — 1996. — Vol. 53. — P. 169-172.
17. Gamou S., Hunts J, Harigai H. et al. Molecular evidence for lack of epidermal growth factor receptor gene expression in small cell lung carcinoma cells // Cancer Res. — 1987. — Vol. 47. — P. 2668-2673.
18. Gridelli C., Rossi A., Barletta E. et al. Carboplatin plus vinorelbine plus G-CSF in elderly patients with extensive-stage small¬cell lung cancer: a poorly tolerated regimen. Results of a multicenter phase II study // Lung Cancer. — 2002. — Vol. 36. — P. 327-332.
19. Hainsworth JD, Burris III HA, ErlandJB. et al. Combination chemotherapy with gemcitabine and vinorelbine in the treatment of patients with relapsed or refractory small cell lung cancer: a phase II trial of the Minnie Pearl Cancer Research Network // Cancer. Invest. — 2003. — Vol. 21. — P. 193-199.
20. James L.E., Rudd R., Gower N. et al. A phase III randomized comparison of gemcitabine/carboplatin (GC) with cisplatin/ etoposide (PE) in patients with poor prognosis small cell lung cancer (SCLC) // Proc. Amer. Clin. Oncol. — 2002. — Vol. 21. — Abstr. 1170.
21. Jassem J., Karnicka-Mlodkowska H., van Pottelsberghe C. et al. Phase II study of vinorelbine (Navelbine) in previously treated small cell lung cancer patients. EORTC Lung Cancer Cooperative Group // Europ. J. Cancer. — 1993. — Vol. 29A. — P. 1720-1722.
22. Lee SM.,JamesLE,Mohmmaed-Ali V. et al. A phase II study of carboplatin/etoposide with thalidomide in small cell lung cancer (SCLC) // Proc. Amer. Soc. Clin. Oncol. — 2002. — Vol. 21. — Abstr. 1251.
23. Lowebraun S., BartolucciA., Smalley RV. et al. The superiority of combination chemotherapy over single agent chemo¬therapy in small cell lung cancinoma // Cancer. — 1979. — Vol. 44. — P. 406-413.
24. Mackay HJ, O’Brien M, Hill S. et al. A phase II study of carboplatin and vinorelbine in patients with poor prognosis small cell lung cancer // Clin. Oncol. — (R. Coll. Radiol.). — 2003. — Vol. 15. — P. 181-185.
25. Moolenaar CE, Muller EJ., Schol DJ. et al. Expression of neural cell adhesion molecule-related sialoglycoprotein in small cell lung cancer and neuroblastoma cell lines H69 and CHP-212 // Cancer. Res. — 1990. — Vol. 50. — P. 1102-1106.
26. Niell H.B., Herndon J.E., Miller AA et al. Final report of a randomized phase III Intergroup trial of etoposide (VP-16) and cisplatin (DDP) with or without paclitaxel (TAX) and G-CSP in patients with extensive stage small cell lung cancer (ED-SCLC) // Lung Cancer. — 2003. — Vol. 41 (Suppl. 2). — S. 81.
27. Noda K., Nishiwaki Y., KawaharaM. et al. Irinitecan plus cisplatin compared with etiposide plus cisplatin for extensive small-cell lung cancer // New Engl. J. Med. — 2003. — Vol. 346. — P. 85-91.
28. Reck M, von Pawel J., Macha HN. et al. Randomized phase III trial of paclitaxel etoposide, and carboplatin versus carboplatin, and vincristine in patients with small-cell lung cancer // J. Natl. Cancer. Inst. — 2003. — Vol. 95. — P. 1118-1127.
29. Rinaldi D., Lorman N., BrierreJ. et al. A phase I-II trial of topotecan and gemcitabine in patients with previously treated, advanced non-small cell lung cancer (LOA-3) // Cancer. Invest. — 2001. — Vol. 19. — P 467-474.
30. Rinaldi D., Lorman N., Brierre J. et al. A phase II trial of topotecan and gemcitabine in patients with previously treated, advanced nonsmall cell lung carcinoma // Cancer. — 2002. — Vol. 95. — P. 1274-1278.
31. Roy D.C., Ouellet S., Le Houillier et al. Elimination of neuroblastoma and small-cell lung cancer cells with an antineural cell adhesion molecule immunotoxin // J. Natl. Cancer. Inst. — 1996. — Vol. 88. — P. 1136-1145.
32. Sandler A, Langer C., BunnJrPA. et al. Interim safety analysis of irinotecan and cisplatin combination chemotherapy for previously untreated extensive small cell lung cancer // Proc. Amer. Soc. Clin. Oncol. — 2003. — Vol. 22. — Abstr. 2537.
33. Seifter EJ, Ihde D.C. Therapy of small cell lung cancer: a prospective on two decades of clinical research // Semin. Oncol. — 1988. — Vol. 15. — P. 278-299.
34. Shepherd FA, Giaccone G, Seymour L. et al. Prospective, randomized, double-blind, placebo-controlled trial of marim- astat after response to first-line chemotherapy in patients with small-cell lung cancer: a trial of national Cancer. Institute of Canada — Clinical Trials Group and European Organization for Research and Treatment of Cancer // J. Clin. Oncol. — 2002. — Vol. 20. — P. 4434-4439.
35. Smith I.E, Evans BD. Carboplatin (JM8) as a single agent in combination in the treatment of small cell lung cancer // Cancer. Treat. Rev. — 1985. — Vol. 12 (Suppl. A). — P. 73-75.
36. Smyth JF, Smith IE, Sessa C. et al. Activity of docetaxel (Taxotere) in small cell lung cancer. The Early Clinical Trials Group of EORTC // Europ. J. Cancer. — 1994. — Vol. 30A. — P. 1058-1060.
37. Spiro S.G., Souhami RL, Geddes D.M. et al. Duration of chemotherapy in small cell lung cancer: a Cancer Research Campaign trial // Brit. J. Cancer. — 1989. — Vol. 59. — P. 578-583.
38. Sundstrom S., Bremenes RM, Kaasa S. et al. Cisplatin and etoposide regimen is superior to cyclophosphamide. Epirubi- cin, and vincristine regimen in small-cell lung cancer: results from randomized phase III trial with 5 year’follow-up // J. Clin. Oncol. — 2002. — Vol. 20. — P. 4665-4672.
39. von PawelJ., DepierreA., Hans K. et al. Topotecan (Hycamtin TM) in small cell lung cancer (SCLC) after failure of first line therapy: multicentre phase II study // Europ. J. Cancer. — 1997. — Vol. 33. (Suppl. 8). — P. S229.
40. von Pawel J, Schiller J.H., Shepherd FA et al. Topotecan versus cyclophosphamide, doxorubicin, and vincristine for the treatment of recurrent small-cell lung cancer // J. Clin. Oncol. — 1999. — Vol. 17. — P. 658-667.
41. Wu AH, Henderson B.E., Thomas D.C. et al. Secular trends in histologic types of lung cancer // J. Natl. Cancer. Inst. — 1986. — Vol. 77. — P. 53-56.
Поступила в редакцию 16.11.2005 г.
Плоскоклеточный рак легкого — StatPearls
Непрерывное обучение
Плоскоклеточный рак легкого, также известный как плоскоклеточный рак легкого, является разновидностью немелкоклеточного рака легкого (НМРЛ). Плоскоклеточные опухоли легких часто возникают в центральной части легкого или в основных дыхательных путях, таких как левый или правый бронх. Основным возбудителем клеточной трансформации является табачный дым. В этом упражнении рассматривается оценка и лечение плоскоклеточного рака легкого и подчеркивается роль межпрофессиональной группы в ведении пациентов с этим заболеванием.
Целей:
Определите этиологию плоскоклеточного рака легкого.
Изучите соответствующий анамнез, физикальное состояние и оценку плоскоклеточного рака легкого.
Опишите доступные варианты лечения плоскоклеточного рака легкого.
Обобщите стратегии межпрофессиональной группы для улучшения координации помощи и коммуникации для улучшения ухода за пациентами с плоскоклеточным раком легкого и улучшения результатов.
Получите бесплатный доступ к вопросам с несколькими вариантами ответов по этой теме.
Введение
Плоскоклеточный рак легкого, также известный как плоскоклеточный рак легкого, представляет собой тип немелкоклеточного рака легкого (НМРЛ). Среди НМРЛ наиболее распространена аденокарцинома, за которой следует плоскоклеточный рак легкого, особенно у женщин. Это объясняется изменением характера курения сигарет, но окончательных доказательств нет.
Этиология
Примерно 80% случаев рака легких у мужчин и 90% случаев у женщин связаны с курением.[1] [2] SCC более тесно связан с курением, чем любой другой тип NSCLC. К другим факторам риска SCC относятся возраст, семейный анамнез, воздействие вторичного табачного дыма, минеральных и металлических частиц или асбеста.
Эпидемиология
Рак легкого — наиболее распространенный вид рака и причина смертности от рака во всем мире. [3] Заболеваемость раком легких в 2018 году оценивалась в 2 093 876 случаев во всем мире, что составляет 11,6% глобального бремени рака. По оценкам, смертность от рака легких в 2018 году во всем мире составила 1761 007 смертей, что составляет около 18.4% глобальной смертности от рака. [4]
Глобальное распределение заболеваемости раком легких в 2018 г. было следующим: Азия (58,5%), Европа (22,4%), Северная Америка (12,1%), ЛАК (4,3%), Африка (1,9%) и Океания (0,81%). . [4]
Примерно 85% всех случаев рака легких являются НМРЛ. Аденокарцинома и плоскоклеточный рак являются наиболее распространенными подтипами, на которые приходится 50% и 30% случаев НМРЛ соответственно. [3]
Патофизиология
SCC заболевание легких возникает в результате трансформации плоскоклеточных клеток, выстилающих дыхательные пути.Плоские клетки — это тонкие плоские клетки, выстилающие многие органы человеческого тела. Плоскоклеточные опухоли легких часто возникают в центральной части легкого или в основных дыхательных путях, таких как левый или правый бронх. Основным возбудителем клеточной трансформации является табачный дым, который содержит более 300 вредных агентов и 40 потенциальных канцерогенов. Трансформированные плоские клетки характеризуются ороговением и / или межклеточными мостами и часто демонстрируют высокую частоту мутаций.[4]
Гистопатология
Правильный гистологический диагноз становится все более важным, потому что он может предсказать ответ и токсичность лечения. [5] Диагноз SCC может быть подтвержден, если минимум 10% опухолевой массы резецированных образцов демонстрируют особенности трансформации, такие как кератинизация или внутриклеточные мостики. Если дифференцированный плоский элемент опухоли минимален, ставится диагноз малодифференцированного ПКР. Панель иммуногистохимии (ИГХ) вместе с окраской муцина может помочь идентифицировать подтипы НМРЛ.SCC также демонстрирует сильную экспрессию плоских биомаркеров, включая белки p63 и p40.
В 2015 году Всемирная организация здравоохранения пересмотрела классификацию, чтобы выделить три варианта SCC на основе гистологического исследования: [6]
Анамнез и физические данные
Симптомы NSCLC могут включать кашель, боль в груди, одышку, кровь в мокроте, свистящее дыхание, охриплость голоса, повторяющиеся инфекции грудной клетки (включая бронхит и пневмонию), потеря веса, потеря аппетита и усталость.Однако пациенты с НМРЛ часто не проявляют никаких симптомов на ранних стадиях заболевания. Метастазы могут возникать при запущенном заболевании, а симптомы могут включать боль в костях, ущемление спинного мозга и неврологические симптомы (головная боль, слабость или онемение конечностей, головокружение, судороги).
Оценка
После физического обследования для оценки ПКР можно использовать общий анализ крови (CBC), рентген грудной клетки или компьютерную томографию (CT) при условии, что опухоль имеет достаточный размер. Наличие полости, заполненной газом или жидкостью в опухолевой массе, является классическим признаком SCC.[1] Другие признаки могут включать легочные узелки, новообразование или инфильтрат, расширение средостения, ателектаз, увеличение корней и плевральный выпот. Дополнительные исследования, включая КТ брюшной полости с контрастированием, магнитно-резонансную томографию головного мозга (МРТ) с контрастированием и функциональные тесты легких (PFT), также могут быть выполнены после постановки первоначального диагноза. Также проводится оценка PD-L1, EGFR, онкогена слияния ALK и других мутаций.
Лечение / менеджмент
Лечение зависит от стадии рака.Хирургическая резекция — это первая линия лечения I и II стадий. Для 1А химиотерапия не играет никакой роли. Для 1B в некоторых случаях рассматривается хирургическая резекция с адъювантной химиотерапией, если размер опухоли превышает 4 см. Стадия II лечится хирургическим вмешательством с последующей химиотерапией, обычно предпочтительна лобэктомия, но при плохих кандидатах на операцию можно рассмотреть возможность субдолевой резекции. На стадии I и II лучевая терапия рассматривается, если есть положительные границы после операции, а также при плохих кандидатах на хирургическое вмешательство.
Большинство опухолей III стадии неоперабельны. На стадии IIIA, которая определенно назначается во время операции резекции, можно рассмотреть возможность последующей адъювантной химиотерапии, но химиотерапия с лучевой терапией является обычным выбором. Для стадии IIIB используется комбинированная химиотерапия и лучевая терапия. На IV стадии используется химиотерапия с паллиативным облучением. Множественные рандомизированные контролируемые исследования и масштабные метаанализы подтверждают превосходство комбинированных схем химиотерапии при распространенном НМРЛ.[2] Также, в зависимости от статуса мутации, используется таргетная терапия. При запущенном НМРЛ терапия должна основываться на молекулярных особенностях опухоли.
При НМРЛ с соматической мутацией показана терапия специфическими ингибиторами [7]. Для мутации рецептора роста эпидермиса используются ингибиторы тирозинкиназы, такие как эрлотиниб, гефитиниб, афатиниб. Кризотиниб — первая линия мутации ALK. Рассматривается НМРЛ, у которого отсутствует эта мутация в зависимости от экспрессии лиганда 1 запрограммированной гибели (PD-L1), только иммунотерапия или иммунотерапия с комбинированной химиотерапией.Химиотерапия для неоадъювантной и адъювантной терапии включает цисплатин с винорелбином или этопозидом, винбластин, гемцитабин, доцетаксел или пеметрексед. Пациентам, которые не переносят цисплатин, рекомендуется применение паклитаксела с карбоплатином. Системная терапия первой линии на поздних стадиях включает бевацизумаб, карбоплатин и паклитаксел. Другими вариантами являются цетуксимаб с цисплатином и винорелбином или эрлотиниб с химиотерапией на основе платины.
Дифференциальная диагностика
SSC легкого необходимо дифференцировать от других видов рака легких, включая мелкоклеточный рак легкого (SCLC) и другие NSCLC, такие как аденокарцинома и крупноклеточная карцинома.
Хирургическая онкология
Хирургическое лечение является предпочтительным методом лечения I и II стадии. На стадии IIIA хирургическое вмешательство рассматривается только в отдельных случаях.
Лучевая онкология
Лучевая терапия рассматривается для стадий I и II с положительными границами после операции или у плохих кандидатов на хирургическое вмешательство, у которых полная лобэктомия невозможна. Для стадии III лучевая терапия, наряду с химиотерапией, является лечением выбора. На стадии IV лучевая терапия применяется только в качестве паллиативной меры.
Соответствующие исследования и текущие испытания
Иммунотерапевтический атезолизумаб (анти-PDL1, RG7446, моноклональное антитело MPDL3280A против PD-L1 (лиганд запрограммированной смерти 1) оценивается в клинических испытаниях фазы III в качестве потенциального средства лечения первой линии. Пациенты с неплоскоклеточным или плоскоклеточным немелкоклеточным раком легкого, опухоли которых экспрессируют PDL1. Также продолжается испытание фазы I по оценке атезолизумаба в комбинации с эрлотинибом или алектинибом у пациентов с немелкоклеточным раком легкого.IPA-3 или OTSSP167 и ауранофин имели высокий синергетический эффект в клеточных линиях плоскоклеточной карциномы мутантных EGFR или KRAS и снижали объем опухоли в моделях на мышах [8].
Управление токсичностью и побочными эффектами
Химиотерапия на основе платины, наряду со вторыми активными цитотоксическими агентами, обычно рассматривается у пациентов, которым требуется химиотерапия. Вероятность токсичности увеличивается после четырех-шести циклов терапии и не рекомендуется после этого. У пациентов без оптимального ответа поддерживающую терапию можно продолжить одним или несколькими компонентами, но обычно терапию на основе платины прекращают из-за ее серьезной токсичности.[9] Пациенты должны находиться под наблюдением на нефротоксичность, ототоксичность, цитопении и выраженную невропатию. Обычно считается, что фолиевая кислота, витамин b12 и иногда дексаметазон помогают избежать некоторых побочных эффектов химиотерапии.
Стадия
Стадия рака легкого основана на изображениях компьютерной томографии в соответствии с системой стадирования опухолевых узлов и метастазов (TNM). Это краткое изложение 8-го издания TNM по раку легких, выпущенного IASLC (Международной ассоциацией по изучению рака легких) и заменяющего 7-е издание TNM.[10]
Предлагаемые дескрипторы T, N и M для восьмого издания классификации TNM для рака легких
Примечание. Изменения в седьмом издании выделены жирным шрифтом.
а. Необычная поверхностная распространяющаяся опухоль любого размера с инвазивным компонентом, ограниченным стенкой бронха, которая может простираться проксимальнее главного бронха, также классифицируется как T1a.
б. Одиночная аденокарцинома, ≤ 3 см с преимущественно лепидным рисунком, и ≤ 5 мм инвазии в любом одном очаге.
с. Опухоли T2 с этими особенностями классифицируются как T2a, если ≤4 см в наибольшем измерении или если размер не может быть определен, и T2b, если> 4 см, но ≤5 см в наибольшем измерении.
г. Большинство плевральных (перикардиальных) выпотов при раке легких возникают из-за опухолей. Однако у некоторых пациентов множественные микроскопические исследования плевральной (перикардиальной) жидкости отрицательны на опухоль, и жидкость не содержит крови и не является экссудатом. Когда эти элементы и клиническая оценка указывают на то, что выпот не связан с опухолью, выпот следует исключить как дескриптор стадии.
e. Это включает поражение одного удаленного (нерегионального) лимфатического узла.
Предлагаемые группы стадий для восьмого издания классификации TNM для рака легких
Прогноз
Плоскоклеточный рак легкого может распространяться на несколько участков, включая мозг, позвоночник и другие кости, надпочечники и печень. Из-за отсутствия таргетной терапии SCC и поздней стадии обнаружения прогноз для этих пациентов часто неблагоприятный.
Осложнения
Осложнения SCC легкого могут включать:
Одышку, если опухоль блокирует основные дыхательные пути или вызывает накопление жидкости вокруг легких (плевральный выпот)
Кровотечение в дыхательных путях, в результате при кровохарканье
Метастазы, приводящие к боли и неврологическим осложнениям
Послеоперационная и реабилитационная помощь
Предоперационная гимнастика и программа реабилитации показали значительные послеоперационные результаты и снижение послеоперационных легочных осложнений.[11]. Однако послеоперационная легочная реабилитация без предоперационных упражнений показала лишь незначительное или умеренное влияние на послеоперационную способность к физической нагрузке в краткосрочном периоде наблюдения, но долгосрочное влияние на функциональную способность неизвестно. [12]
Консультации
Пульмонология
Кардиоторакальная хирургия
Медицинская онкология
Хирургическая онкология
Паллиативная помощь
Психиатрическое отделение или смягчение факторов риска, таких как табачные изделия и причины профессиональных заболеваний (например, использование средств индивидуальной защиты), может снизить развитие SCC.Информирование о раннем скрининге рака с помощью компьютерной томографии грудной клетки с низкой дозой очень важно для раннего выявления и лечения, чтобы предотвратить опухолевую нагрузку. Консультирование пациентов о стадиях рака и шансах на полное излечение в случае раннего выявления и консультирование по паллиативной помощи на поздних стадиях очень важно для снижения стресса как для пациентов, так и для близких.
Улучшение результатов команды здравоохранения
Учитывая сложность ухода, требуемого при лечении этого состояния, необходима межпрофессиональная медицинская бригада, включая врачей первичного звена, кардиоторакальных хирургов, медицинских онкологов, онкологов-радиологов, хирургических онкологов и паллиативную помощь.Сильное сотрудничество и общение внутри межпрофессиональной команды жизненно важны для улучшения результатов.
Рисунок
Плоскоклеточный рак легкого. Медицинский журнал Новой Англии. Образы в клинической медицине. ID PUB MED: 30207918. Доктор Бхану Саббула
Ссылки
- 1.
- Чаудхури MR. Первичные кавитирующие карциномы легких. Грудная клетка. 1973 Май; 28 (3): 354-66. [Бесплатная статья PMC: PMC470041] [PubMed: 4353362]
- 2.
- Gridelli C, Ardizzoni A, Douillard JY, Hanna N, Manegold C, Perrone F, Pirker R, Rosell R, Shepherd FA, De Petris L, Di Майо М., де Маринис Ф.Последние проблемы лечения первой линии распространенного немелкоклеточного рака легкого: результаты заседания международной группы экспертов Итальянской ассоциации торакальной онкологии. Рак легких. 2010 июн; 68 (3): 319-31. [PubMed: 20036027]
- 3.
- Перес-Морено П., Брамбилла Е., Томас Р., Сория Дж. Плоскоклеточный рак легкого: молекулярные подтипы и терапевтические возможности. Clin Cancer Res. 2012 01 мая; 18 (9): 2443-51. [PubMed: 22407829]
- 4.
- Сеть исследований атласа генома рака.Комплексная геномная характеристика плоскоклеточного рака легких. Природа. 2012, 27 сентября; 489 (7417): 519-25. [Бесплатная статья PMC: PMC3466113] [PubMed: 22960745]
- 5.
- Dietel M, Bubendorf L, Dingemans AM, Dooms C, Elmberger G, García RC, Kerr KM, Lim E, López-Ríos F, Thunnissen E, Van Schil PE, von Laffert M. Диагностические процедуры немелкоклеточного рака легкого (НМРЛ): рекомендации Европейской экспертной группы. Грудная клетка. 2016 Февраль; 71 (2): 177-84. [Бесплатная статья PMC: PMC4752623] [PubMed: 26530085]
- 6.
- Трэвис В.Д., Брамбилла Э., Николсон А.Г., Ятабэ Y, Остин Дж. Х.М., Бизли М.Б., Кириак Л.Р., Дачич С., Дуиг Э., Флидер ДБ, Гейзингер К., Хирш Ф.Р., Исикава Ю., Керр К.М., Ногучи М., Пелоси Дж., Пауэлл Калифорния, Цао М.С., Вистуба И., Группа экспертов ВОЗ. Классификация опухолей легких Всемирной организации здравоохранения 2015 г .: влияние генетических, клинических и радиологических достижений со времени классификации 2004 г. J Thorac Oncol. 2015 сентябрь; 10 (9): 1243-1260. [PubMed: 262
- 7.
- Lindeman NI, Cagle PT, Beasley MB, Chitale DA, Dacic S, Giaccone G, Jenkins RB, Kwiatkowski DJ, Saldivar JS, Squire J, Thunnissen E, Ladanyi M.Руководство по молекулярному тестированию для отбора пациентов с раком легких на ингибиторы тирозинкиназы EGFR и ALK: руководство Коллегии американских патологов, Международной ассоциации по изучению рака легких и Ассоциации молекулярной патологии. J Thorac Oncol. 2013 июл; 8 (7): 823-59. [Бесплатная статья PMC: PMC4159960] [PubMed: 23552377]
- 8.
- Ito M, Codony-Servat C, Codony-Servat J, Lligé D, Chaib I, Sun X, Miao J, Sun R, Cai X, Verlicchi A, Окада М., Молина-Вила М.А., Карачалиу Н., Цао П, Розелл Р.Нацеленность на пути передачи сигналов PKCι-PAK1 в аденокарциноме мутантного EGFR и KRAS и плоскоклеточной карциноме легкого. Сигнал сотовой связи. 2019 28 октября; 17 (1): 137. [Бесплатная статья PMC: PMC6819333] [PubMed: 31660987]
- 9.
- Azzoli CG, Baker S, Temin S, Pao W, Aliff T, Brahmer J, Johnson DH, Laskin JL, Masters G, Milton D, Nordquist L , Pfister DG, Piantadosi S, Schiller JH, Smith R, Smith TJ, Strawn JR, Trent D, Giaccone G., Американское общество клинической онкологии. Американское общество клинической онкологии, обновленное руководство по химиотерапии немелкоклеточного рака легкого IV стадии.J Clin Oncol. 2009 20 декабря; 27 (36): 6251-66. [Бесплатная статья PMC: PMC2793036] [PubMed: 19917871]
- 10.
- Goldstraw P, Chansky K, Crowley J, Rami-Porta R, Asamura H, Eberhardt WE, Nicholson AG, Groome P, Mitchell A, Bolejack V. , Международная ассоциация по изучению стадии рака легких и комитет по прогнозным факторам, консультативные советы и участвующие учреждения. Консультативные советы и учреждения-участники Международной ассоциации по изучению стадийности рака легких и прогностических факторов.Проект IASLC по стадированию рака легкого: предложения по пересмотру групп стадий TNM в предстоящем (восьмом) издании классификации TNM для рака легкого. J Thorac Oncol. 2016 Янв; 11 (1): 39-51. [PubMed: 26762738]
- 11.
- Себио Гарсиа Р., Яньес Браге М.И., Хименес Мулхейзен Э., Грейнджер К.Л., Денехи Л. Функциональные и послеоперационные результаты после предоперационных тренировок у пациентов с раком легких: систематический обзор и метаанализ . Взаимодействовать Cardiovasc Thorac Surg.2016 сентябрь; 23 (3): 486-97. [PubMed: 27226400]
- 12.
- Sommer MS, Staerkind MEB, Christensen J, Vibe-Petersen J, Larsen KR, Holst Pedersen J, Langberg H. Влияние программ послеоперационной реабилитации у пациентов, оперированных по поводу рака легких: систематический обзор и метаанализ. J Rehabil Med. 2018 28 февраля; 50 (3): 236-245. [PubMed: 29392334]
Определите этиологию плоскоклеточного рака легкого.
Изучите соответствующий анамнез, физикальное состояние и оценку плоскоклеточного рака легкого.
Опишите доступные варианты лечения плоскоклеточного рака легкого.
Обобщите стратегии межпрофессиональной группы для улучшения координации помощи и коммуникации для улучшения ухода за пациентами с плоскоклеточным раком легкого и улучшения результатов.
а. Необычная поверхностная распространяющаяся опухоль любого размера с инвазивным компонентом, ограниченным стенкой бронха, которая может простираться проксимальнее главного бронха, также классифицируется как T1a.
б. Одиночная аденокарцинома, ≤ 3 см с преимущественно лепидным рисунком, и ≤ 5 мм инвазии в любом одном очаге.
с. Опухоли T2 с этими особенностями классифицируются как T2a, если ≤4 см в наибольшем измерении или если размер не может быть определен, и T2b, если> 4 см, но ≤5 см в наибольшем измерении.
г. Большинство плевральных (перикардиальных) выпотов при раке легких возникают из-за опухолей. Однако у некоторых пациентов множественные микроскопические исследования плевральной (перикардиальной) жидкости отрицательны на опухоль, и жидкость не содержит крови и не является экссудатом. Когда эти элементы и клиническая оценка указывают на то, что выпот не связан с опухолью, выпот следует исключить как дескриптор стадии.
e. Это включает поражение одного удаленного (нерегионального) лимфатического узла.
Одышку, если опухоль блокирует основные дыхательные пути или вызывает накопление жидкости вокруг легких (плевральный выпот)
Кровотечение в дыхательных путях, в результате при кровохарканье
Метастазы, приводящие к боли и неврологическим осложнениям
Пульмонология
Кардиоторакальная хирургия
Медицинская онкология
Хирургическая онкология
Паллиативная помощь
Психиатрическое отделение или смягчение факторов риска, таких как табачные изделия и причины профессиональных заболеваний (например, использование средств индивидуальной защиты), может снизить развитие SCC.Информирование о раннем скрининге рака с помощью компьютерной томографии грудной клетки с низкой дозой очень важно для раннего выявления и лечения, чтобы предотвратить опухолевую нагрузку. Консультирование пациентов о стадиях рака и шансах на полное излечение в случае раннего выявления и консультирование по паллиативной помощи на поздних стадиях очень важно для снижения стресса как для пациентов, так и для близких.
Улучшение результатов команды здравоохранения
Учитывая сложность ухода, требуемого при лечении этого состояния, необходима межпрофессиональная медицинская бригада, включая врачей первичного звена, кардиоторакальных хирургов, медицинских онкологов, онкологов-радиологов, хирургических онкологов и паллиативную помощь.Сильное сотрудничество и общение внутри межпрофессиональной команды жизненно важны для улучшения результатов.
Рисунок
Плоскоклеточный рак легкого. Медицинский журнал Новой Англии. Образы в клинической медицине. ID PUB MED: 30207918. Доктор Бхану Саббула
Ссылки
- 1.
- Чаудхури MR. Первичные кавитирующие карциномы легких. Грудная клетка. 1973 Май; 28 (3): 354-66. [Бесплатная статья PMC: PMC470041] [PubMed: 4353362]
- 2.
- Gridelli C, Ardizzoni A, Douillard JY, Hanna N, Manegold C, Perrone F, Pirker R, Rosell R, Shepherd FA, De Petris L, Di Майо М., де Маринис Ф.Последние проблемы лечения первой линии распространенного немелкоклеточного рака легкого: результаты заседания международной группы экспертов Итальянской ассоциации торакальной онкологии. Рак легких. 2010 июн; 68 (3): 319-31. [PubMed: 20036027]
- 3.
- Перес-Морено П., Брамбилла Е., Томас Р., Сория Дж. Плоскоклеточный рак легкого: молекулярные подтипы и терапевтические возможности. Clin Cancer Res. 2012 01 мая; 18 (9): 2443-51. [PubMed: 22407829]
- 4.
- Сеть исследований атласа генома рака.Комплексная геномная характеристика плоскоклеточного рака легких. Природа. 2012, 27 сентября; 489 (7417): 519-25. [Бесплатная статья PMC: PMC3466113] [PubMed: 22960745]
- 5.
- Dietel M, Bubendorf L, Dingemans AM, Dooms C, Elmberger G, García RC, Kerr KM, Lim E, López-Ríos F, Thunnissen E, Van Schil PE, von Laffert M. Диагностические процедуры немелкоклеточного рака легкого (НМРЛ): рекомендации Европейской экспертной группы. Грудная клетка. 2016 Февраль; 71 (2): 177-84. [Бесплатная статья PMC: PMC4752623] [PubMed: 26530085]
- 6.
- Трэвис В.Д., Брамбилла Э., Николсон А.Г., Ятабэ Y, Остин Дж. Х.М., Бизли М.Б., Кириак Л.Р., Дачич С., Дуиг Э., Флидер ДБ, Гейзингер К., Хирш Ф.Р., Исикава Ю., Керр К.М., Ногучи М., Пелоси Дж., Пауэлл Калифорния, Цао М.С., Вистуба И., Группа экспертов ВОЗ. Классификация опухолей легких Всемирной организации здравоохранения 2015 г .: влияние генетических, клинических и радиологических достижений со времени классификации 2004 г. J Thorac Oncol. 2015 сентябрь; 10 (9): 1243-1260. [PubMed: 262
- 7.
- Lindeman NI, Cagle PT, Beasley MB, Chitale DA, Dacic S, Giaccone G, Jenkins RB, Kwiatkowski DJ, Saldivar JS, Squire J, Thunnissen E, Ladanyi M.Руководство по молекулярному тестированию для отбора пациентов с раком легких на ингибиторы тирозинкиназы EGFR и ALK: руководство Коллегии американских патологов, Международной ассоциации по изучению рака легких и Ассоциации молекулярной патологии. J Thorac Oncol. 2013 июл; 8 (7): 823-59. [Бесплатная статья PMC: PMC4159960] [PubMed: 23552377]
- 8.
- Ito M, Codony-Servat C, Codony-Servat J, Lligé D, Chaib I, Sun X, Miao J, Sun R, Cai X, Verlicchi A, Окада М., Молина-Вила М.А., Карачалиу Н., Цао П, Розелл Р.Нацеленность на пути передачи сигналов PKCι-PAK1 в аденокарциноме мутантного EGFR и KRAS и плоскоклеточной карциноме легкого. Сигнал сотовой связи. 2019 28 октября; 17 (1): 137. [Бесплатная статья PMC: PMC6819333] [PubMed: 31660987]
- 9.
- Azzoli CG, Baker S, Temin S, Pao W, Aliff T, Brahmer J, Johnson DH, Laskin JL, Masters G, Milton D, Nordquist L , Pfister DG, Piantadosi S, Schiller JH, Smith R, Smith TJ, Strawn JR, Trent D, Giaccone G., Американское общество клинической онкологии. Американское общество клинической онкологии, обновленное руководство по химиотерапии немелкоклеточного рака легкого IV стадии.J Clin Oncol. 2009 20 декабря; 27 (36): 6251-66. [Бесплатная статья PMC: PMC2793036] [PubMed: 19917871]
- 10.
- Goldstraw P, Chansky K, Crowley J, Rami-Porta R, Asamura H, Eberhardt WE, Nicholson AG, Groome P, Mitchell A, Bolejack V. , Международная ассоциация по изучению стадии рака легких и комитет по прогнозным факторам, консультативные советы и участвующие учреждения. Консультативные советы и учреждения-участники Международной ассоциации по изучению стадийности рака легких и прогностических факторов.Проект IASLC по стадированию рака легкого: предложения по пересмотру групп стадий TNM в предстоящем (восьмом) издании классификации TNM для рака легкого. J Thorac Oncol. 2016 Янв; 11 (1): 39-51. [PubMed: 26762738]
- 11.
- Себио Гарсиа Р., Яньес Браге М.И., Хименес Мулхейзен Э., Грейнджер К.Л., Денехи Л. Функциональные и послеоперационные результаты после предоперационных тренировок у пациентов с раком легких: систематический обзор и метаанализ . Взаимодействовать Cardiovasc Thorac Surg.2016 сентябрь; 23 (3): 486-97. [PubMed: 27226400]
- 12.
- Sommer MS, Staerkind MEB, Christensen J, Vibe-Petersen J, Larsen KR, Holst Pedersen J, Langberg H. Влияние программ послеоперационной реабилитации у пациентов, оперированных по поводу рака легких: систематический обзор и метаанализ. J Rehabil Med. 2018 28 февраля; 50 (3): 236-245. [PubMed: 29392334]
Определите этиологию плоскоклеточного рака легкого.
Изучите соответствующий анамнез, физикальное состояние и оценку плоскоклеточного рака легкого.
Опишите доступные варианты лечения плоскоклеточного рака легкого.
Обобщите стратегии межпрофессиональной группы для улучшения координации помощи и коммуникации для улучшения ухода за пациентами с плоскоклеточным раком легкого и улучшения результатов.
а. Необычная поверхностная распространяющаяся опухоль любого размера с инвазивным компонентом, ограниченным стенкой бронха, которая может простираться проксимальнее главного бронха, также классифицируется как T1a.
б. Одиночная аденокарцинома, ≤ 3 см с преимущественно лепидным рисунком, и ≤ 5 мм инвазии в любом одном очаге.
с. Опухоли T2 с этими особенностями классифицируются как T2a, если ≤4 см в наибольшем измерении или если размер не может быть определен, и T2b, если> 4 см, но ≤5 см в наибольшем измерении.
г. Большинство плевральных (перикардиальных) выпотов при раке легких возникают из-за опухолей. Однако у некоторых пациентов множественные микроскопические исследования плевральной (перикардиальной) жидкости отрицательны на опухоль, и жидкость не содержит крови и не является экссудатом. Когда эти элементы и клиническая оценка указывают на то, что выпот не связан с опухолью, выпот следует исключить как дескриптор стадии.
e. Это включает поражение одного удаленного (нерегионального) лимфатического узла.
Одышку, если опухоль блокирует основные дыхательные пути или вызывает накопление жидкости вокруг легких (плевральный выпот)
Кровотечение в дыхательных путях, в результате при кровохарканье
Метастазы, приводящие к боли и неврологическим осложнениям
Пульмонология
Кардиоторакальная хирургия
Медицинская онкология
Хирургическая онкология
Паллиативная помощь
Психиатрическое отделение или смягчение факторов риска, таких как табачные изделия и причины профессиональных заболеваний (например, использование средств индивидуальной защиты), может снизить развитие SCC.Информирование о раннем скрининге рака с помощью компьютерной томографии грудной клетки с низкой дозой очень важно для раннего выявления и лечения, чтобы предотвратить опухолевую нагрузку. Консультирование пациентов о стадиях рака и шансах на полное излечение в случае раннего выявления и консультирование по паллиативной помощи на поздних стадиях очень важно для снижения стресса как для пациентов, так и для близких.
Улучшение результатов команды здравоохранения
Учитывая сложность ухода, требуемого при лечении этого состояния, необходима межпрофессиональная медицинская бригада, включая врачей первичного звена, кардиоторакальных хирургов, медицинских онкологов, онкологов-радиологов, хирургических онкологов и паллиативную помощь.Сильное сотрудничество и общение внутри межпрофессиональной команды жизненно важны для улучшения результатов.
Рисунок
Плоскоклеточный рак легкого. Медицинский журнал Новой Англии. Образы в клинической медицине. ID PUB MED: 30207918. Доктор Бхану Саббула
Ссылки
- 1.
- Чаудхури MR. Первичные кавитирующие карциномы легких. Грудная клетка. 1973 Май; 28 (3): 354-66. [Бесплатная статья PMC: PMC470041] [PubMed: 4353362]
- 2.
- Gridelli C, Ardizzoni A, Douillard JY, Hanna N, Manegold C, Perrone F, Pirker R, Rosell R, Shepherd FA, De Petris L, Di Майо М., де Маринис Ф.Последние проблемы лечения первой линии распространенного немелкоклеточного рака легкого: результаты заседания международной группы экспертов Итальянской ассоциации торакальной онкологии. Рак легких. 2010 июн; 68 (3): 319-31. [PubMed: 20036027]
- 3.
- Перес-Морено П., Брамбилла Е., Томас Р., Сория Дж. Плоскоклеточный рак легкого: молекулярные подтипы и терапевтические возможности. Clin Cancer Res. 2012 01 мая; 18 (9): 2443-51. [PubMed: 22407829]
- 4.
- Сеть исследований атласа генома рака.Комплексная геномная характеристика плоскоклеточного рака легких. Природа. 2012, 27 сентября; 489 (7417): 519-25. [Бесплатная статья PMC: PMC3466113] [PubMed: 22960745]
- 5.
- Dietel M, Bubendorf L, Dingemans AM, Dooms C, Elmberger G, García RC, Kerr KM, Lim E, López-Ríos F, Thunnissen E, Van Schil PE, von Laffert M. Диагностические процедуры немелкоклеточного рака легкого (НМРЛ): рекомендации Европейской экспертной группы. Грудная клетка. 2016 Февраль; 71 (2): 177-84. [Бесплатная статья PMC: PMC4752623] [PubMed: 26530085]
- 6.
- Трэвис В.Д., Брамбилла Э., Николсон А.Г., Ятабэ Y, Остин Дж. Х.М., Бизли М.Б., Кириак Л.Р., Дачич С., Дуиг Э., Флидер ДБ, Гейзингер К., Хирш Ф.Р., Исикава Ю., Керр К.М., Ногучи М., Пелоси Дж., Пауэлл Калифорния, Цао М.С., Вистуба И., Группа экспертов ВОЗ. Классификация опухолей легких Всемирной организации здравоохранения 2015 г .: влияние генетических, клинических и радиологических достижений со времени классификации 2004 г. J Thorac Oncol. 2015 сентябрь; 10 (9): 1243-1260. [PubMed: 262
- 7.
- Lindeman NI, Cagle PT, Beasley MB, Chitale DA, Dacic S, Giaccone G, Jenkins RB, Kwiatkowski DJ, Saldivar JS, Squire J, Thunnissen E, Ladanyi M.Руководство по молекулярному тестированию для отбора пациентов с раком легких на ингибиторы тирозинкиназы EGFR и ALK: руководство Коллегии американских патологов, Международной ассоциации по изучению рака легких и Ассоциации молекулярной патологии. J Thorac Oncol. 2013 июл; 8 (7): 823-59. [Бесплатная статья PMC: PMC4159960] [PubMed: 23552377]
- 8.
- Ito M, Codony-Servat C, Codony-Servat J, Lligé D, Chaib I, Sun X, Miao J, Sun R, Cai X, Verlicchi A, Окада М., Молина-Вила М.А., Карачалиу Н., Цао П, Розелл Р.Нацеленность на пути передачи сигналов PKCι-PAK1 в аденокарциноме мутантного EGFR и KRAS и плоскоклеточной карциноме легкого. Сигнал сотовой связи. 2019 28 октября; 17 (1): 137. [Бесплатная статья PMC: PMC6819333] [PubMed: 31660987]
- 9.
- Azzoli CG, Baker S, Temin S, Pao W, Aliff T, Brahmer J, Johnson DH, Laskin JL, Masters G, Milton D, Nordquist L , Pfister DG, Piantadosi S, Schiller JH, Smith R, Smith TJ, Strawn JR, Trent D, Giaccone G., Американское общество клинической онкологии. Американское общество клинической онкологии, обновленное руководство по химиотерапии немелкоклеточного рака легкого IV стадии.J Clin Oncol. 2009 20 декабря; 27 (36): 6251-66. [Бесплатная статья PMC: PMC2793036] [PubMed: 19917871]
- 10.
- Goldstraw P, Chansky K, Crowley J, Rami-Porta R, Asamura H, Eberhardt WE, Nicholson AG, Groome P, Mitchell A, Bolejack V. , Международная ассоциация по изучению стадии рака легких и комитет по прогнозным факторам, консультативные советы и участвующие учреждения. Консультативные советы и учреждения-участники Международной ассоциации по изучению стадийности рака легких и прогностических факторов.Проект IASLC по стадированию рака легкого: предложения по пересмотру групп стадий TNM в предстоящем (восьмом) издании классификации TNM для рака легкого. J Thorac Oncol. 2016 Янв; 11 (1): 39-51. [PubMed: 26762738]
- 11.
- Себио Гарсиа Р., Яньес Браге М.И., Хименес Мулхейзен Э., Грейнджер К.Л., Денехи Л. Функциональные и послеоперационные результаты после предоперационных тренировок у пациентов с раком легких: систематический обзор и метаанализ . Взаимодействовать Cardiovasc Thorac Surg.2016 сентябрь; 23 (3): 486-97. [PubMed: 27226400]
- 12.
- Sommer MS, Staerkind MEB, Christensen J, Vibe-Petersen J, Larsen KR, Holst Pedersen J, Langberg H. Влияние программ послеоперационной реабилитации у пациентов, оперированных по поводу рака легких: систематический обзор и метаанализ. J Rehabil Med. 2018 28 февраля; 50 (3): 236-245. [PubMed: 29392334]
Определите этиологию плоскоклеточного рака легкого.
Изучите соответствующий анамнез, физикальное состояние и оценку плоскоклеточного рака легкого.
Опишите доступные варианты лечения плоскоклеточного рака легкого.
Обобщите стратегии межпрофессиональной группы для улучшения координации помощи и коммуникации для улучшения ухода за пациентами с плоскоклеточным раком легкого и улучшения результатов.
а. Необычная поверхностная распространяющаяся опухоль любого размера с инвазивным компонентом, ограниченным стенкой бронха, которая может простираться проксимальнее главного бронха, также классифицируется как T1a.
б. Одиночная аденокарцинома, ≤ 3 см с преимущественно лепидным рисунком, и ≤ 5 мм инвазии в любом одном очаге.
с. Опухоли T2 с этими особенностями классифицируются как T2a, если ≤4 см в наибольшем измерении или если размер не может быть определен, и T2b, если> 4 см, но ≤5 см в наибольшем измерении.
г. Большинство плевральных (перикардиальных) выпотов при раке легких возникают из-за опухолей. Однако у некоторых пациентов множественные микроскопические исследования плевральной (перикардиальной) жидкости отрицательны на опухоль, и жидкость не содержит крови и не является экссудатом. Когда эти элементы и клиническая оценка указывают на то, что выпот не связан с опухолью, выпот следует исключить как дескриптор стадии.
e. Это включает поражение одного удаленного (нерегионального) лимфатического узла.
Одышку, если опухоль блокирует основные дыхательные пути или вызывает накопление жидкости вокруг легких (плевральный выпот)
Кровотечение в дыхательных путях, в результате при кровохарканье
Метастазы, приводящие к боли и неврологическим осложнениям
Пульмонология
Кардиоторакальная хирургия
Медицинская онкология
Хирургическая онкология
Паллиативная помощь
Психиатрическое отделение или смягчение факторов риска, таких как табачные изделия и причины профессиональных заболеваний (например, использование средств индивидуальной защиты), может снизить развитие SCC.Информирование о раннем скрининге рака с помощью компьютерной томографии грудной клетки с низкой дозой очень важно для раннего выявления и лечения, чтобы предотвратить опухолевую нагрузку. Консультирование пациентов о стадиях рака и шансах на полное излечение в случае раннего выявления и консультирование по паллиативной помощи на поздних стадиях очень важно для снижения стресса как для пациентов, так и для близких.
Улучшение результатов команды здравоохранения
Учитывая сложность ухода, требуемого при лечении этого состояния, необходима межпрофессиональная медицинская бригада, включая врачей первичного звена, кардиоторакальных хирургов, медицинских онкологов, онкологов-радиологов, хирургических онкологов и паллиативную помощь.Сильное сотрудничество и общение внутри межпрофессиональной команды жизненно важны для улучшения результатов.
Рисунок
Плоскоклеточный рак легкого. Медицинский журнал Новой Англии. Образы в клинической медицине. ID PUB MED: 30207918. Доктор Бхану Саббула
Ссылки
- 1.
- Чаудхури MR. Первичные кавитирующие карциномы легких. Грудная клетка. 1973 Май; 28 (3): 354-66. [Бесплатная статья PMC: PMC470041] [PubMed: 4353362]
- 2.
- Gridelli C, Ardizzoni A, Douillard JY, Hanna N, Manegold C, Perrone F, Pirker R, Rosell R, Shepherd FA, De Petris L, Di Майо М., де Маринис Ф.Последние проблемы лечения первой линии распространенного немелкоклеточного рака легкого: результаты заседания международной группы экспертов Итальянской ассоциации торакальной онкологии. Рак легких. 2010 июн; 68 (3): 319-31. [PubMed: 20036027]
- 3.
- Перес-Морено П., Брамбилла Е., Томас Р., Сория Дж. Плоскоклеточный рак легкого: молекулярные подтипы и терапевтические возможности. Clin Cancer Res. 2012 01 мая; 18 (9): 2443-51. [PubMed: 22407829]
- 4.
- Сеть исследований атласа генома рака.Комплексная геномная характеристика плоскоклеточного рака легких. Природа. 2012, 27 сентября; 489 (7417): 519-25. [Бесплатная статья PMC: PMC3466113] [PubMed: 22960745]
- 5.
- Dietel M, Bubendorf L, Dingemans AM, Dooms C, Elmberger G, García RC, Kerr KM, Lim E, López-Ríos F, Thunnissen E, Van Schil PE, von Laffert M. Диагностические процедуры немелкоклеточного рака легкого (НМРЛ): рекомендации Европейской экспертной группы. Грудная клетка. 2016 Февраль; 71 (2): 177-84. [Бесплатная статья PMC: PMC4752623] [PubMed: 26530085]
- 6.
- Трэвис В.Д., Брамбилла Э., Николсон А.Г., Ятабэ Y, Остин Дж. Х.М., Бизли М.Б., Кириак Л.Р., Дачич С., Дуиг Э., Флидер ДБ, Гейзингер К., Хирш Ф.Р., Исикава Ю., Керр К.М., Ногучи М., Пелоси Дж., Пауэлл Калифорния, Цао М.С., Вистуба И., Группа экспертов ВОЗ. Классификация опухолей легких Всемирной организации здравоохранения 2015 г .: влияние генетических, клинических и радиологических достижений со времени классификации 2004 г. J Thorac Oncol. 2015 сентябрь; 10 (9): 1243-1260. [PubMed: 262
- 7.
- Lindeman NI, Cagle PT, Beasley MB, Chitale DA, Dacic S, Giaccone G, Jenkins RB, Kwiatkowski DJ, Saldivar JS, Squire J, Thunnissen E, Ladanyi M.Руководство по молекулярному тестированию для отбора пациентов с раком легких на ингибиторы тирозинкиназы EGFR и ALK: руководство Коллегии американских патологов, Международной ассоциации по изучению рака легких и Ассоциации молекулярной патологии. J Thorac Oncol. 2013 июл; 8 (7): 823-59. [Бесплатная статья PMC: PMC4159960] [PubMed: 23552377]
- 8.
- Ito M, Codony-Servat C, Codony-Servat J, Lligé D, Chaib I, Sun X, Miao J, Sun R, Cai X, Verlicchi A, Окада М., Молина-Вила М.А., Карачалиу Н., Цао П, Розелл Р.Нацеленность на пути передачи сигналов PKCι-PAK1 в аденокарциноме мутантного EGFR и KRAS и плоскоклеточной карциноме легкого. Сигнал сотовой связи. 2019 28 октября; 17 (1): 137. [Бесплатная статья PMC: PMC6819333] [PubMed: 31660987]
- 9.
- Azzoli CG, Baker S, Temin S, Pao W, Aliff T, Brahmer J, Johnson DH, Laskin JL, Masters G, Milton D, Nordquist L , Pfister DG, Piantadosi S, Schiller JH, Smith R, Smith TJ, Strawn JR, Trent D, Giaccone G., Американское общество клинической онкологии. Американское общество клинической онкологии, обновленное руководство по химиотерапии немелкоклеточного рака легкого IV стадии.J Clin Oncol. 2009 20 декабря; 27 (36): 6251-66. [Бесплатная статья PMC: PMC2793036] [PubMed: 19917871]
- 10.
- Goldstraw P, Chansky K, Crowley J, Rami-Porta R, Asamura H, Eberhardt WE, Nicholson AG, Groome P, Mitchell A, Bolejack V. , Международная ассоциация по изучению стадии рака легких и комитет по прогнозным факторам, консультативные советы и участвующие учреждения. Консультативные советы и учреждения-участники Международной ассоциации по изучению стадийности рака легких и прогностических факторов.Проект IASLC по стадированию рака легкого: предложения по пересмотру групп стадий TNM в предстоящем (восьмом) издании классификации TNM для рака легкого. J Thorac Oncol. 2016 Янв; 11 (1): 39-51. [PubMed: 26762738]
- 11.
- Себио Гарсиа Р., Яньес Браге М.И., Хименес Мулхейзен Э., Грейнджер К.Л., Денехи Л. Функциональные и послеоперационные результаты после предоперационных тренировок у пациентов с раком легких: систематический обзор и метаанализ . Взаимодействовать Cardiovasc Thorac Surg.2016 сентябрь; 23 (3): 486-97. [PubMed: 27226400]
- 12.
- Sommer MS, Staerkind MEB, Christensen J, Vibe-Petersen J, Larsen KR, Holst Pedersen J, Langberg H. Влияние программ послеоперационной реабилитации у пациентов, оперированных по поводу рака легких: систематический обзор и метаанализ. J Rehabil Med. 2018 28 февраля; 50 (3): 236-245. [PubMed: 29392334]
- Папиллярный
- Мелкоклеточный
- Светлоклеточный
- Базалоид
- Аденокарцинома начинается вдоль внешних краев легких и под слизистой оболочкой бронхов в секреторных (железистых) клетках. Это самый распространенный тип рака легких у людей, которые никогда не курили.
- Мелкоклеточный рак легкого быстро растет и быстро распространяется на другие органы.
- Воздействие вторичного табачного дыма
- Курение марихуаны
- Повторяющееся воспаление легких в результате таких состояний, как пневмония или туберкулез
- Воздействие определенных химических веществ, таких как асбест, тальк, бензин или мышьяк
- Радон (газ природного происхождения, который нельзя увидеть, попробовать или обонять)
- Загрязнение воздуха
- Не проходящая боль в груди
- Одышка и хрипы
- Рецидивирующие легочные инфекции, такие как пневмония или бронхит
- Кровавая или ржавчина мокрота (откашливаемая слизь)
- Охриплость горла
- Отек шеи и лица
- Боль и слабость в плече, руке или кисти
- Необъяснимая лихорадка
- Усталость (сильная усталость)
- Отсутствие чувства голода
- Потеря веса
- Головная боль
- Боль во всем теле
- Сломанные или сломанные кости
- Рентген легких, который может показать опухоль
- КТ-сканирование, которое может показать поражения, которые не могут быть обнаружены на рентгеновском снимке
- Цитологическое исследование мокроты, которое проверяет слизь от кашля до узнать, есть ли раковые клетки
- Бронхоскопия, при которой ваш врач исследует ваши легкие с помощью трубки с подсветкой, которая проходит по горлу и в легкие
- Медиастиноскопия, при которой ваш врач может сделать разрез на шее и провести операцию и взять ткань образцы из лимфатических узлов
- Игольная биопсия, при которой ваш врач вводит иглу через грудную стенку в легкие для взятия образцов клеток
- Биопсия (образец ткани) лимфатических узлов или других областей, где мог распространиться рак
- КТ
- МРТ
- Позитронно-эмиссионная томография (ПЭТ), которая представляет собой визуализационный тест, который показывает, как ваши органы и ткани функционируют с использованием радиоактивного препарата
- Кость сканы
- Сегментэктомия или клиновидная резекция, при которой ваш врач удаляет небольшую часть легкого
- Лобэктомия, при которой ваш врач удаляет одну или две доли легкого
- Пневмонэктомию, при которой ваш врач удаляет все легкое
- Фотодинамическая терапия (ФДТ), также известная как лазерная терапия, которая представляет собой тип лечения рака, нацеленного на раковые клетки
- Целевые методы лечения, такие как лекарства, которые блокируют кровеносные сосуды в новых опухолях, чтобы остановить их рост
- 1.
Hirsch FR, Scagliotti GV, Mulshine JL, Kwon R, Curran WJ Jr, Wu YL, Paz-Ares L. Рак легких: современные методы лечения и новые целевые методы лечения. Ланцет. 2017; 389: 299–311.
CAS
СтатьяGoogle ученый
- 2.
Брей Ф., Ферли Дж., Сурджоматарам И., Сигель Р.Л., Торре Л.А., Джемаль А. Глобальная статистика рака 2018: оценки GLOBOCAN заболеваемости и смертности от 36 раковых заболеваний в 185 странах во всем мире. CA Cancer J Clin. 2018; 68: 394–424.
Артикул
Google ученый
- 3.
Reck M, Rabe KF. Точная диагностика и лечение распространенного немелкоклеточного рака легкого. N Engl J Med. 2017; 377: 849–61.
CAS
СтатьяGoogle ученый
- 4.
Saintigny P, Burger JA. Последние достижения в биологии немелкоклеточного рака легкого и его клиническом лечении. Discov Med. 2012; 13: 287–97.
PubMed
Google ученый
- 5.
Пиперди Б., Мерла А., Перес-Солер Р. Ориентация на ангиогенез при плоскоклеточном немелкоклеточном раке легкого. Наркотики. 2014; 74: 403–13.
CAS
СтатьяGoogle ученый
- 6.
Socinski MA, Obasaju C, Gandara D, Hirsch FR, Bonomi P, Bunn P, Kim ES, Langer CJ, Natale RB, Novello S, et al. Клинико-патологические особенности распространенного плоскоклеточного НМРЛ. J Thorac Oncol. 2016; 11: 1411–22.
Артикул
Google ученый
- 7.
Hirsch FR, Spreafico A, Novello S, Wood MD, Simms L, Papotti M. Прогностическая и прогностическая роль гистологии при распространенном немелкоклеточном раке легкого: обзор литературы. J Thorac Oncol. 2008; 3: 1468–81.
Артикул
Google ученый
- 8.
Терлицци М., Коларуссо С., Пинто А., Соррентино Р. Лекарственная устойчивость при немелкоклеточном раке легкого (НМРЛ): влияние генетических и негенетических изменений на терапевтический режим и реакцию.Pharmacol Ther. 2019; 202: 140–8.
CAS
СтатьяGoogle ученый
- 9.
Youlden DR, Cramb SM, Baade PD. Международная эпидемиология рака легких: географическое распространение и светские тенденции. J Thorac Oncol. 2008; 3: 819–31.
Артикул
Google ученый
- 10.
Сакураи Х., Асамура Х., Гойя Т., Эгути К., Наканиси Й., Савабата Н., Окумура М., Мияока Е., Фуджи Ю.Различия в выживаемости по полу для резецированного немелкоклеточного рака легкого: ретроспективный анализ 12 509 случаев в исследовании Японского реестра рака легких. J Thorac Oncol. 2010; 5: 1594–601.
Артикул
Google ученый
- 11.
Cetin K, Ettinger DS, Hei YJ, O’Malley CD. Выживаемость по гистологическому подтипу при немелкоклеточном раке легкого IV стадии на основе данных Программы эпиднадзора, эпидемиологии и конечных результатов. Clin Epidemiol.2011; 3: 139–48.
Артикул
Google ученый
- 12.
Лим В., Ридж, Калифорния, Николсон А.Г., Мирсадраи С. 8 (th) рак легкого по классификации TNM и система клинической стадии: обзор изменений и клинических последствий. Quant Imaging Med Surg. 2018; 8: 709–18.
Артикул
Google ученый
- 13.
Коллинз Г.С., Рейцма Дж.Б., Альтман Д.Г., Мунс К.Г. Прозрачный отчет многомерной модели прогнозирования для индивидуального прогноза или диагноза (TRIPOD): заявление TRIPOD.BMJ. 2015; 350: g7594.
Артикул
Google ученый
- 14.
Lei Z, Li J, Wu D, Xia Y, Wang Q, Si A, Wang K, Wan X, Lau WY, Wu M, et al. Номограмма для предоперационной оценки риска микрососудистой инвазии при гепатоцеллюлярной карциноме, связанной с вирусом гепатита B, в рамках миланских критериев. JAMA Surg. 2016; 151: 356–63.
Артикул
Google ученый
- 15.
Хэнли Дж. А., Макнил Б. Дж..Значение и использование площади под кривой рабочей характеристики приемника (ROC). Радиология. 1982; 143: 29–36.
CAS
СтатьяGoogle ученый
- 16.
Wolbers M, Koller MT, Witteman JC, Steyerberg EW. Прогностические модели с конкурирующими рисками: методы и применение для прогнозирования коронарного риска. Эпидемиология. 2009. 20: 555–61.
Артикул
Google ученый
- 17.
Лю А., Хоу Ф, Цинь И, Сун Дж, Се Б., Сюй Дж, Цзяо В. Прогностическая ценность прогностической модели, основанной на патологических особенностях инвазивной аденокарциномы легких. Рак легких. 2019; 131: 14–22.
Артикул
Google ученый
- 18.
Pencina MJ, D’Agostino RB, Vasan RS. Оценка дополнительной прогностической способности нового маркера: от области под кривой ROC до реклассификации и далее. Stat Med. 2008. 27: 157–72.
Артикул
Google ученый
- 19.
Du Q, Yan C, Wu SG, Zhang W, Huang C, Yao Y, Wang L, Zhang Q, Liu Q, Guan J и др. Разработка и проверка новой модели диагностической номограммы, основанной на онкомаркерах, для оценки риска рака легких при поражении легких: многоцентровое исследование среди населения Китая. Cancer Lett. 2018; 420: 236–41.
CAS
СтатьяGoogle ученый
- 20.
Фицджеральд М., Сэвилл Б.Р., Льюис Р.Дж. Анализ кривой принятия решений. ДЖАМА. 2015; 313: 409–10.
CAS
СтатьяGoogle ученый
- 21.
Викерс А.Дж., Элькин Е.Б. Анализ кривой принятия решения: новый метод оценки моделей прогнозирования. Принятие решений в медицине. 2006; 26: 565–74.
Артикул
Google ученый
- 22.
Гу К., Ли Х.Й., Ли К., Чой Дж.Й., Ву С.И., Сон И., Ким Х.К., Чой Ю.С., Ким Дж., Зо Джи и др. Комплексная оценка клинических, патологических и радиологических прогностических факторов плоскоклеточного рака легкого.PLoS ONE. 2019; 14: e0223298.
CAS
СтатьяGoogle ученый
- 23.
Лу С. Разработка вариантов лечения китайских пациентов с запущенным плоскоклеточным раком легкого: акцент на афатиниб. Onco Targets Ther. 2019; 12: 1521–38.
CAS
СтатьяGoogle ученый
- 24.
Масуда Р., Кидзима Х., Нито М., Вада А., Мацудзаки Т., Икома Ю., Наказато К., Масуда Д., Танака М., Кобаяши Х. и др.Лимфатическая инвазия является важным показателем плохого прогноза для пациентов с плоскоклеточным раком легких. Мол Мед Реп. 2017; 15: 2067–73.
CAS
СтатьяGoogle ученый
- 25.
Мао К., Ся В., Донг Г., Чен С., Ван А., Цзинь Г., Цзян Ф., Сюй Л. Номограмма для прогнозирования выживаемости немелкоклеточного рака легкого стадии IIIA-N2 после операции. J Thorac Cardiovasc Surg. 2018; 155 (1784–92): e3.
Google ученый
- 26.
Wang Y, Pang Z, Chen X, Bie F, Wang Y, Wang G, Liu Q, Du J. Номограмма выживания для пациентов с первоначально диагностированным метастатическим немелкоклеточным раком легкого: исследование на основе SEER. Будущее Онкол. 2019; 15: 3395–409.
CAS
СтатьяGoogle ученый
- 27.
Дэн Дж, Рен З, Вен Дж, Ван Б., Хоу Х, Сюэ З, Чу Х. Построение номограммы, прогнозирующей общую выживаемость пациентов с отдаленно метастатическим немелкоклеточным раком легкого.Cancer Manag Res. 2018; 10: 6143–56.
CAS
СтатьяGoogle ученый
- 28.
Yang M, Xu W, Liu T, Yang X, Wang P, Wu S, Wei H, Zhao J, Yang C, Xiao J. Разработка и проверка новой модели прогнозирования выживаемости у пациентов с метастазами в позвоночник от немелкоклеточного рака легкого. Spine Phila Pa 1976. 2019; 44: 246–57.
Артикул
Google ученый
- 29.
Ван С. Разработка модели прогнозирования затрудненного гемостаза после эндобронхиальной биопсии у пациентов с раком легкого. Biomed Res Int. 2019; 2019: 1656890.
PubMed
PubMed CentralGoogle ученый
- 30.
Guo M, Li B, Yu Y, Wang S, Xu Y, Sun X, Wang L, Yu J. Определение схемы лечения пожилых местно-распространенных НМРЛ и прогнозирование результатов с помощью проверенной модели: SEER на основе анализа. Cancer Med. 2019; 12: e22.
Артикул
Google ученый
- 31.
Ли Г, Хуанг С., Лянь Л., Сонг Х, Сун В., Мяо Дж., Ли Б., Юань И, Ву С., Лю Х и др. Вывод и внешняя проверка модели для прогнозирования 2-летнего риска смерти пациентов с запущенным шистосомозом после выписки. EBioMedicine. 2019; 47: 309–18.
Артикул
Google ученый
- 32.
Барбур С.Дж., Коппо Р., Чжан Х., Лю Ч.Х., Сузуки Ю., Мацузаки К., Катафучи Р., Эр Л., Эспино-Эрнандес Г., Ким С.Дж. и др.Оценка нового международного инструмента прогнозирования риска при IgA-нефропатии. JAMA Intern Med. 2019; 179: 942–52.
Артикул
Google ученый
- 33.
Тан X, Ли Y, Тянь X, Чжоу X, Ван И, Хуанг М., Рен Л., Чжоу Л., Сюэ Дж., Дин З. и др. Прогнозирование тяжелого острого лучевого пневмонита у пациентов с немелкоклеточным раком легкого, получающих послеоперационную лучевую терапию: разработка и внутренняя проверка номограммы на основе клинических параметров и параметров гистограммы объема дозы.Радиотренажер Oncol. 2019; 132: 197–203.
Артикул
Google ученый
- 34.
Li J, Liu Y, Yan Z, Wan X, Xia Y, Wang K, Liu J, Lau WY, Wu M, Shen F. Номограмма, прогнозирующая легочные метастазы гепатоцеллюлярной карциномы после частичной гепатэктомии. Br J Рак. 2014; 110: 1110–7.
CAS
СтатьяGoogle ученый
- 35.
Majumdar A, Campos S, Gurusamy K, Pinzani M, Tsochatzis EA.Определение минимально приемлемой диагностической точности неинвазивного тестирования фиброза при циррозе: исследование аналитического моделирования решений. Гепатология. 2019; 7: 89.
Google ученый
- Сигель Р.Л., Миллер К.Д., Джемал А: Статистика рака, 2015. CA Cancer J Clin. 2015; 65: 5 — 29.
- Джемал А., Тун М.Дж., Райс Л.А. и др.: Ежегодный отчет для страны о статусе рака, 1975–2005 гг., С указанием тенденций в отношении рака легких, употребления табака и др. борьба против табака. J Natl Cancer Inst. 2008; 100: 1672–94.
- Путила Дж., Гуо Н.Л .: Объединение ХОБЛ с клинической, патологической и демографической информацией уточняет прогноз и предсказание реакции на лечение немелкоклеточного рака легкого. PLoS One. 2014; 9: e100994.
- Согаард М., Томсен Р.В., Боссен К.С. и др.: Влияние коморбидности на выживаемость при раке: обзор. Clin Epidemiol. 2013; 5: 3–29.
- Пао В., Миллер В., Заковски М. и др. Мутации гена рецептора EGF часто встречаются при раке легких у «никогда не курильщиков»; и связаны с чувствительностью опухолей к гефитинибу и эрлотинибу. Proc Natl Acad Sci US A. 2004; 101: 13306-133011.
- Lynch TJ, Bell DW, Sordella R, et al: Активирующие мутации в рецепторе эпидермального фактора роста, лежащие в основе реакции немелкоклеточного легкого рак на гефитиниб. N Engl J Med. 2004; 350: 2129-39.
- Mok TS, Wu YL, Thongprasert S, et al: Гефитиниб или карбоплатин-паклитаксел при аденокарциноме легких. N Engl J Med. 2009; 361: 947—957.
- Morgensztern D, Waqar S, Subramanian J, et al: Повышение выживаемости при немелкоклеточном раке легкого стадии IV: наблюдение, эпидемиология и исследование конечных результатов с 1990 по 2005 гг. J Thorac Oncol. 2009; 4: 1524-1529.
- Комплексная геномная характеристика плоскоклеточного рака легких. Природа. 2012; 489: 519–525.
- Шиллер Дж. Х., Харрингтон Д., Белани С. П. и др.: Сравнение четырех схем химиотерапии для запущенного немелкоклеточного рака легкого. N Engl J Med. 2002; 346: 92-98.
- Scagliotti GV, Parikh P, von Pawel J, et al: Исследование фазы III, сравнивающее цисплатин плюс гемцитабин с цисплатином плюс пеметрексед у не получавших химиотерапию пациентов с далеко зашедшей стадией немелкоклеточного рака легкого. J Clin Oncol. 2008; 26: 3543-3551.
- Scagliotti G, Hanna N, Fossella F, et al: Дифференциальная эффективность пеметрекседа в соответствии с гистологией NSCLC: обзор двух исследований фазы III. Онколог. 2009; 14: 253-263.
- Соцински М.А., Бондаренко И.Н., Карасева Н.А.: Результаты выживаемости рандомизированного исследования III фазы наб-паклитаксела и карбоплатина по сравнению с паклитакселом на основе кремофора и карбоплатином в качестве терапии первой линии при распространенном немелкоклеточном раке легкого. J Clin Oncol. 2011; 29: 2011 (доп .; абстр. 7551).
- Соцински М.А., Лангер С.Дж., Окамото I и др.: Безопасность и эффективность еженедельного приема nab (R) -паклитаксела в комбинации с карбоплатином в качестве терапии первой линии у пожилых пациентов с распространенным немелкоклеточным раком легкого. Ann Oncol. 2013; 24: 314-321.
- Thatcher N, Hirsch FR, Luft AV, et al: Нецитумумаб плюс гемцитабин и цисплатин по сравнению с гемцитабином и цисплатином в качестве терапии первой линии у пациентов с плоскоклеточным немелкоклеточным раком легкого IV стадии (SQUIRE): открытое маркированное рандомизированное контролируемое исследование III фазы. Ланцет Онкол. 2015; 16: 763-774.
- Rizvi NA, Mazieres J, Planchard D, et al: Активность и безопасность ниволумаба, ингибитора иммунных контрольных точек против PD-1, для пациентов с запущенным, рефрактерным плоскоклеточным немелкоклеточным раком легкого (CheckMate 063) : фаза 2, исследование одной рукой. Ланцет Онкол. 2015; 16: 257–265.
- Brahmer J, Reckamp KL, Baas P, et al: Nivolumab против доцетаксела при запущенном плоскоклеточном немелкоклеточном раке легкого. N Engl J Med. 2015; 373: 123-135.
- Гарон Э.Б., Ризви Н.А., Хуэй Р. и др.: Пембролизумаб для лечения немелкоклеточного рака легкого. N Engl J Med. 2015; 372: 2018-2028.
- Herbst RS, Baas P, Kim DW, et al: Пембролизумаб по сравнению с доцетакселом для ранее леченного, PD-L1-положительного, распространенного немелкоклеточного рака легкого (KEYNOTE-010): рандомизированное контролируемое исследование. Ланцет. 2016; 387: 1540-1550.
- Garon EB, Ciuleanu TE, Arrieta O, et al: Рамуцирумаб плюс доцетаксел по сравнению с плацебо плюс доцетаксел для лечения второй линии немелкоклеточного рака легкого стадии IV после прогрессирования болезни на терапии на основе платины (REVEL): многоцентровое двойное слепое рандомизированное исследование 3 фазы. Ланцет. 2014; 384: 665-673.
- Тао Д., Хань Х, Чжан Н. и др.: Профилирование генетических изменений пациентов с резектированными плоскоклеточными карциномами легких. Oncotarget , 2016.
- Shayesteh L, Lu Y, Kuo WL, et al: PIK3CA участвует в качестве онкогена в раке яичников. Nat Genet. 1999; 21: 99-102.
- Wu G, Xing M, Mambo E, et al: Соматическая мутация и увеличение числа копий PIK3CA при раке груди человека. Breast Cancer Res. 2005; 7: R609-616.
- DeMichele A, Clark AS, Tan KS, et al: Палбоциклиб (PD0332991), ингибитор CDK 4/6 (PD0332991) при распространенном раке молочной железы Rb +: активность фазы II, безопасность и прогностическая оценка биомаркеров. Clin Cancer Res. 2015; 21: 995-1001.
- Kenji T, Mukai H, Naito Y, et al: Исследование фазы 1 пальбоциклиба, циклинзависимого ингибитора киназы 4/6, у японских пациентов. Cancer Sci. 2016; 107: 755-763.
- Niesvizky R, Badros AZ, Costa LJ, et al: Фаза 1/2 исследования ингибитора циклин-зависимой киназы (CDK) 4/6 палбоциклиба (PD-0332991) с бортезомибом и дексаметазоном при рецидивирующей / рефрактерной множественной миеломе. Leuk Лимфома. 2015; 56: 3320–3328.
- Вон Д. Д., Хван В. Т., Лал П. и др.: Фаза 2 испытания ингибитора циклин-зависимой киназы 4/6 палбоциклиба у пациентов с опухолями зародышевых клеток, экспрессирующими ретинобластому. Рак. 2015; 121: 1463–1468.
- Weiss J, Sos ML, Seidel D, et al: Частая и очаговая амплификация FGFR1 ассоциируется с терапевтически поддающейся лечению зависимостью от FGFR1 при плоскоклеточном раке легкого. Sci Transl Med. 2010; 2: 62ra93.
- Gavine PR, Mooney L, Kilgour E, et al: AZD4547: пероральный биодоступный, мощный и селективный ингибитор семейства тирозинкиназ рецептора фактора роста фибробластов.
]
Плоскоклеточный рак легкого — StatPearls
Непрерывное обучение
Плоскоклеточный рак легкого, также известный как плоскоклеточный рак легкого, представляет собой тип немелкоклеточного рака легкого ( НМРЛ).Плоскоклеточные опухоли легких часто возникают в центральной части легкого или в основных дыхательных путях, таких как левый или правый бронх. Основным возбудителем клеточной трансформации является табачный дым. В этом упражнении рассматривается оценка и лечение плоскоклеточного рака легкого и подчеркивается роль межпрофессиональной группы в ведении пациентов с этим заболеванием.
Целей:
Получите бесплатный доступ к вопросам с несколькими вариантами ответов по этой теме.
Введение
Плоскоклеточный рак легкого, также известный как плоскоклеточный рак легкого, представляет собой тип немелкоклеточного рака легкого (НМРЛ).Среди НМРЛ наиболее распространена аденокарцинома, за которой следует плоскоклеточный рак легкого, особенно у женщин. Это объясняется изменением характера курения сигарет, но окончательных доказательств нет.
Этиология
Примерно 80% случаев рака легких у мужчин и 90% случаев у женщин связаны с курением. [1] [2] SCC более тесно связан с курением, чем любой другой тип NSCLC. К другим факторам риска SCC относятся возраст, семейный анамнез, воздействие вторичного табачного дыма, минеральных и металлических частиц или асбеста.
Эпидемиология
Рак легкого — наиболее распространенный вид рака и причина смертности от рака во всем мире. [3] Заболеваемость раком легких в 2018 году оценивалась в 2 093 876 случаев во всем мире, что составляет 11,6% глобального бремени рака. Расчетная смертность от рака легких в 2018 г. составила 1 761 007 смертей во всем мире, что составляет около 18,4% глобальной смертности от рака. [4]
Глобальное распределение заболеваемости раком легких в 2018 году было следующим: Азия (58,5%), Европа (22,4%), Северная Америка (12.1%), LAC (4,3%), Африка (1,9%) и Океания (0,81%) [4].
Примерно 85% всех случаев рака легких являются НМРЛ. Аденокарцинома и плоскоклеточный рак являются наиболее распространенными подтипами, на которые приходится 50% и 30% случаев НМРЛ соответственно. [3]
Патофизиология
SCC заболевание легких возникает в результате трансформации плоскоклеточных клеток, выстилающих дыхательные пути. Плоские клетки — это тонкие плоские клетки, выстилающие многие органы человеческого тела. Плоскоклеточные опухоли легких часто возникают в центральной части легкого или в основных дыхательных путях, таких как левый или правый бронх.Основным возбудителем клеточной трансформации является табачный дым, который содержит более 300 вредных агентов и 40 потенциальных канцерогенов. Трансформированные плоские клетки характеризуются ороговением и / или межклеточными мостами и часто демонстрируют высокую частоту мутаций [4].
Гистопатология
Правильный гистологический диагноз становится все более важным, поскольку он может предсказать ответ и токсичность лечения. [5] Диагноз SCC может быть подтвержден, если минимум 10% опухолевой массы резецированных образцов демонстрируют особенности трансформации, такие как кератинизация или внутриклеточные мостики.Если дифференцированный плоский элемент опухоли минимален, ставится диагноз малодифференцированного ПКР. Панель иммуногистохимии (ИГХ) вместе с окраской муцина может помочь идентифицировать подтипы НМРЛ. SCC также демонстрирует сильную экспрессию плоских биомаркеров, включая белки p63 и p40.
В 2015 году Всемирная организация здравоохранения пересмотрела классификацию, чтобы выделить три варианта SCC на основе гистологического исследования: [6]
Анамнез и физические данные
Симптомы NSCLC могут включать кашель, боль в груди, одышку, кровь в мокроте, свистящее дыхание, охриплость голоса, повторяющиеся инфекции грудной клетки (включая бронхит и пневмонию), потеря веса, потеря аппетита и усталость.Однако пациенты с НМРЛ часто не проявляют никаких симптомов на ранних стадиях заболевания. Метастазы могут возникать при запущенном заболевании, а симптомы могут включать боль в костях, ущемление спинного мозга и неврологические симптомы (головная боль, слабость или онемение конечностей, головокружение, судороги).
Оценка
После физического обследования для оценки ПКР можно использовать общий анализ крови (CBC), рентген грудной клетки или компьютерную томографию (CT) при условии, что опухоль имеет достаточный размер. Наличие полости, заполненной газом или жидкостью в опухолевой массе, является классическим признаком SCC.[1] Другие признаки могут включать легочные узелки, новообразование или инфильтрат, расширение средостения, ателектаз, увеличение корней и плевральный выпот. Дополнительные исследования, включая КТ брюшной полости с контрастированием, магнитно-резонансную томографию головного мозга (МРТ) с контрастированием и функциональные тесты легких (PFT), также могут быть выполнены после постановки первоначального диагноза. Также проводится оценка PD-L1, EGFR, онкогена слияния ALK и других мутаций.
Лечение / менеджмент
Лечение зависит от стадии рака.Хирургическая резекция — это первая линия лечения I и II стадий. Для 1А химиотерапия не играет никакой роли. Для 1B в некоторых случаях рассматривается хирургическая резекция с адъювантной химиотерапией, если размер опухоли превышает 4 см. Стадия II лечится хирургическим вмешательством с последующей химиотерапией, обычно предпочтительна лобэктомия, но при плохих кандидатах на операцию можно рассмотреть возможность субдолевой резекции. На стадии I и II лучевая терапия рассматривается, если есть положительные границы после операции, а также при плохих кандидатах на хирургическое вмешательство.
Большинство опухолей III стадии неоперабельны. На стадии IIIA, которая определенно назначается во время операции резекции, можно рассмотреть возможность последующей адъювантной химиотерапии, но химиотерапия с лучевой терапией является обычным выбором. Для стадии IIIB используется комбинированная химиотерапия и лучевая терапия. На IV стадии используется химиотерапия с паллиативным облучением. Множественные рандомизированные контролируемые исследования и масштабные метаанализы подтверждают превосходство комбинированных схем химиотерапии при распространенном НМРЛ.[2] Также, в зависимости от статуса мутации, используется таргетная терапия. При запущенном НМРЛ терапия должна основываться на молекулярных особенностях опухоли.
При НМРЛ с соматической мутацией показана терапия специфическими ингибиторами [7]. Для мутации рецептора роста эпидермиса используются ингибиторы тирозинкиназы, такие как эрлотиниб, гефитиниб, афатиниб. Кризотиниб — первая линия мутации ALK. Рассматривается НМРЛ, у которого отсутствует эта мутация в зависимости от экспрессии лиганда 1 запрограммированной гибели (PD-L1), только иммунотерапия или иммунотерапия с комбинированной химиотерапией.Химиотерапия для неоадъювантной и адъювантной терапии включает цисплатин с винорелбином или этопозидом, винбластин, гемцитабин, доцетаксел или пеметрексед. Пациентам, которые не переносят цисплатин, рекомендуется применение паклитаксела с карбоплатином. Системная терапия первой линии на поздних стадиях включает бевацизумаб, карбоплатин и паклитаксел. Другими вариантами являются цетуксимаб с цисплатином и винорелбином или эрлотиниб с химиотерапией на основе платины.
Дифференциальная диагностика
SSC легкого необходимо дифференцировать от других видов рака легких, включая мелкоклеточный рак легкого (SCLC) и другие NSCLC, такие как аденокарцинома и крупноклеточная карцинома.
Хирургическая онкология
Хирургическое лечение является предпочтительным методом лечения I и II стадии. На стадии IIIA хирургическое вмешательство рассматривается только в отдельных случаях.
Лучевая онкология
Лучевая терапия рассматривается для стадий I и II с положительными границами после операции или у плохих кандидатов на хирургическое вмешательство, у которых полная лобэктомия невозможна. Для стадии III лучевая терапия, наряду с химиотерапией, является лечением выбора. На стадии IV лучевая терапия применяется только в качестве паллиативной меры.
Соответствующие исследования и текущие испытания
Иммунотерапевтический атезолизумаб (анти-PDL1, RG7446, моноклональное антитело MPDL3280A против PD-L1 (лиганд запрограммированной смерти 1) оценивается в клинических испытаниях фазы III в качестве потенциального средства лечения первой линии. Пациенты с неплоскоклеточным или плоскоклеточным немелкоклеточным раком легкого, опухоли которых экспрессируют PDL1. Также продолжается испытание фазы I по оценке атезолизумаба в комбинации с эрлотинибом или алектинибом у пациентов с немелкоклеточным раком легкого.IPA-3 или OTSSP167 и ауранофин имели высокий синергетический эффект в клеточных линиях плоскоклеточной карциномы мутантных EGFR или KRAS и снижали объем опухоли в моделях на мышах [8].
Управление токсичностью и побочными эффектами
Химиотерапия на основе платины, наряду со вторыми активными цитотоксическими агентами, обычно рассматривается у пациентов, которым требуется химиотерапия. Вероятность токсичности увеличивается после четырех-шести циклов терапии и не рекомендуется после этого. У пациентов без оптимального ответа поддерживающую терапию можно продолжить одним или несколькими компонентами, но обычно терапию на основе платины прекращают из-за ее серьезной токсичности.[9] Пациенты должны находиться под наблюдением на нефротоксичность, ототоксичность, цитопении и выраженную невропатию. Обычно считается, что фолиевая кислота, витамин b12 и иногда дексаметазон помогают избежать некоторых побочных эффектов химиотерапии.
Стадия
Стадия рака легкого основана на изображениях компьютерной томографии в соответствии с системой стадирования опухолевых узлов и метастазов (TNM). Это краткое изложение 8-го издания TNM по раку легких, выпущенного IASLC (Международной ассоциацией по изучению рака легких) и заменяющего 7-е издание TNM.[10]
Предлагаемые дескрипторы T, N и M для восьмого издания классификации TNM для рака легких
Примечание. Изменения в седьмом издании выделены жирным шрифтом.
Предлагаемые группы стадий для восьмого издания классификации TNM для рака легких
Прогноз
Плоскоклеточный рак легкого может распространяться на несколько участков, включая мозг, позвоночник и другие кости, надпочечники и печень. Из-за отсутствия таргетной терапии SCC и поздней стадии обнаружения прогноз для этих пациентов часто неблагоприятный.
Осложнения
Осложнения SCC легкого могут включать:
Послеоперационная и реабилитационная помощь
Предоперационная гимнастика и программа реабилитации показали значительные послеоперационные результаты и снижение послеоперационных легочных осложнений.[11]. Однако послеоперационная легочная реабилитация без предоперационных упражнений показала лишь незначительное или умеренное влияние на послеоперационную способность к физической нагрузке в краткосрочном периоде наблюдения, но долгосрочное влияние на функциональную способность неизвестно. [12]
Консультации
]
Плоскоклеточный рак легкого — StatPearls
Непрерывное обучение
Плоскоклеточный рак легкого, также известный как плоскоклеточный рак легкого, представляет собой тип немелкоклеточного рака легкого ( НМРЛ).Плоскоклеточные опухоли легких часто возникают в центральной части легкого или в основных дыхательных путях, таких как левый или правый бронх. Основным возбудителем клеточной трансформации является табачный дым. В этом упражнении рассматривается оценка и лечение плоскоклеточного рака легкого и подчеркивается роль межпрофессиональной группы в ведении пациентов с этим заболеванием.
Целей:
Получите бесплатный доступ к вопросам с несколькими вариантами ответов по этой теме.
Введение
Плоскоклеточный рак легкого, также известный как плоскоклеточный рак легкого, представляет собой тип немелкоклеточного рака легкого (НМРЛ).Среди НМРЛ наиболее распространена аденокарцинома, за которой следует плоскоклеточный рак легкого, особенно у женщин. Это объясняется изменением характера курения сигарет, но окончательных доказательств нет.
Этиология
Примерно 80% случаев рака легких у мужчин и 90% случаев у женщин связаны с курением. [1] [2] SCC более тесно связан с курением, чем любой другой тип NSCLC. К другим факторам риска SCC относятся возраст, семейный анамнез, воздействие вторичного табачного дыма, минеральных и металлических частиц или асбеста.
Эпидемиология
Рак легкого — наиболее распространенный вид рака и причина смертности от рака во всем мире. [3] Заболеваемость раком легких в 2018 году оценивалась в 2 093 876 случаев во всем мире, что составляет 11,6% глобального бремени рака. Расчетная смертность от рака легких в 2018 г. составила 1 761 007 смертей во всем мире, что составляет около 18,4% глобальной смертности от рака. [4]
Глобальное распределение заболеваемости раком легких в 2018 году было следующим: Азия (58,5%), Европа (22,4%), Северная Америка (12.1%), LAC (4,3%), Африка (1,9%) и Океания (0,81%) [4].
Примерно 85% всех случаев рака легких являются НМРЛ. Аденокарцинома и плоскоклеточный рак являются наиболее распространенными подтипами, на которые приходится 50% и 30% случаев НМРЛ соответственно. [3]
Патофизиология
SCC заболевание легких возникает в результате трансформации плоскоклеточных клеток, выстилающих дыхательные пути. Плоские клетки — это тонкие плоские клетки, выстилающие многие органы человеческого тела. Плоскоклеточные опухоли легких часто возникают в центральной части легкого или в основных дыхательных путях, таких как левый или правый бронх.Основным возбудителем клеточной трансформации является табачный дым, который содержит более 300 вредных агентов и 40 потенциальных канцерогенов. Трансформированные плоские клетки характеризуются ороговением и / или межклеточными мостами и часто демонстрируют высокую частоту мутаций [4].
Гистопатология
Правильный гистологический диагноз становится все более важным, поскольку он может предсказать ответ и токсичность лечения. [5] Диагноз SCC может быть подтвержден, если минимум 10% опухолевой массы резецированных образцов демонстрируют особенности трансформации, такие как кератинизация или внутриклеточные мостики.Если дифференцированный плоский элемент опухоли минимален, ставится диагноз малодифференцированного ПКР. Панель иммуногистохимии (ИГХ) вместе с окраской муцина может помочь идентифицировать подтипы НМРЛ. SCC также демонстрирует сильную экспрессию плоских биомаркеров, включая белки p63 и p40.
В 2015 году Всемирная организация здравоохранения пересмотрела классификацию, чтобы выделить три варианта SCC на основе гистологического исследования: [6]
Анамнез и физические данные
Симптомы NSCLC могут включать кашель, боль в груди, одышку, кровь в мокроте, свистящее дыхание, охриплость голоса, повторяющиеся инфекции грудной клетки (включая бронхит и пневмонию), потеря веса, потеря аппетита и усталость.Однако пациенты с НМРЛ часто не проявляют никаких симптомов на ранних стадиях заболевания. Метастазы могут возникать при запущенном заболевании, а симптомы могут включать боль в костях, ущемление спинного мозга и неврологические симптомы (головная боль, слабость или онемение конечностей, головокружение, судороги).
Оценка
После физического обследования для оценки ПКР можно использовать общий анализ крови (CBC), рентген грудной клетки или компьютерную томографию (CT) при условии, что опухоль имеет достаточный размер. Наличие полости, заполненной газом или жидкостью в опухолевой массе, является классическим признаком SCC.[1] Другие признаки могут включать легочные узелки, новообразование или инфильтрат, расширение средостения, ателектаз, увеличение корней и плевральный выпот. Дополнительные исследования, включая КТ брюшной полости с контрастированием, магнитно-резонансную томографию головного мозга (МРТ) с контрастированием и функциональные тесты легких (PFT), также могут быть выполнены после постановки первоначального диагноза. Также проводится оценка PD-L1, EGFR, онкогена слияния ALK и других мутаций.
Лечение / менеджмент
Лечение зависит от стадии рака.Хирургическая резекция — это первая линия лечения I и II стадий. Для 1А химиотерапия не играет никакой роли. Для 1B в некоторых случаях рассматривается хирургическая резекция с адъювантной химиотерапией, если размер опухоли превышает 4 см. Стадия II лечится хирургическим вмешательством с последующей химиотерапией, обычно предпочтительна лобэктомия, но при плохих кандидатах на операцию можно рассмотреть возможность субдолевой резекции. На стадии I и II лучевая терапия рассматривается, если есть положительные границы после операции, а также при плохих кандидатах на хирургическое вмешательство.
Большинство опухолей III стадии неоперабельны. На стадии IIIA, которая определенно назначается во время операции резекции, можно рассмотреть возможность последующей адъювантной химиотерапии, но химиотерапия с лучевой терапией является обычным выбором. Для стадии IIIB используется комбинированная химиотерапия и лучевая терапия. На IV стадии используется химиотерапия с паллиативным облучением. Множественные рандомизированные контролируемые исследования и масштабные метаанализы подтверждают превосходство комбинированных схем химиотерапии при распространенном НМРЛ.[2] Также, в зависимости от статуса мутации, используется таргетная терапия. При запущенном НМРЛ терапия должна основываться на молекулярных особенностях опухоли.
При НМРЛ с соматической мутацией показана терапия специфическими ингибиторами [7]. Для мутации рецептора роста эпидермиса используются ингибиторы тирозинкиназы, такие как эрлотиниб, гефитиниб, афатиниб. Кризотиниб — первая линия мутации ALK. Рассматривается НМРЛ, у которого отсутствует эта мутация в зависимости от экспрессии лиганда 1 запрограммированной гибели (PD-L1), только иммунотерапия или иммунотерапия с комбинированной химиотерапией.Химиотерапия для неоадъювантной и адъювантной терапии включает цисплатин с винорелбином или этопозидом, винбластин, гемцитабин, доцетаксел или пеметрексед. Пациентам, которые не переносят цисплатин, рекомендуется применение паклитаксела с карбоплатином. Системная терапия первой линии на поздних стадиях включает бевацизумаб, карбоплатин и паклитаксел. Другими вариантами являются цетуксимаб с цисплатином и винорелбином или эрлотиниб с химиотерапией на основе платины.
Дифференциальная диагностика
SSC легкого необходимо дифференцировать от других видов рака легких, включая мелкоклеточный рак легкого (SCLC) и другие NSCLC, такие как аденокарцинома и крупноклеточная карцинома.
Хирургическая онкология
Хирургическое лечение является предпочтительным методом лечения I и II стадии. На стадии IIIA хирургическое вмешательство рассматривается только в отдельных случаях.
Лучевая онкология
Лучевая терапия рассматривается для стадий I и II с положительными границами после операции или у плохих кандидатов на хирургическое вмешательство, у которых полная лобэктомия невозможна. Для стадии III лучевая терапия, наряду с химиотерапией, является лечением выбора. На стадии IV лучевая терапия применяется только в качестве паллиативной меры.
Соответствующие исследования и текущие испытания
Иммунотерапевтический атезолизумаб (анти-PDL1, RG7446, моноклональное антитело MPDL3280A против PD-L1 (лиганд запрограммированной смерти 1) оценивается в клинических испытаниях фазы III в качестве потенциального средства лечения первой линии. Пациенты с неплоскоклеточным или плоскоклеточным немелкоклеточным раком легкого, опухоли которых экспрессируют PDL1. Также продолжается испытание фазы I по оценке атезолизумаба в комбинации с эрлотинибом или алектинибом у пациентов с немелкоклеточным раком легкого.IPA-3 или OTSSP167 и ауранофин имели высокий синергетический эффект в клеточных линиях плоскоклеточной карциномы мутантных EGFR или KRAS и снижали объем опухоли в моделях на мышах [8].
Управление токсичностью и побочными эффектами
Химиотерапия на основе платины, наряду со вторыми активными цитотоксическими агентами, обычно рассматривается у пациентов, которым требуется химиотерапия. Вероятность токсичности увеличивается после четырех-шести циклов терапии и не рекомендуется после этого. У пациентов без оптимального ответа поддерживающую терапию можно продолжить одним или несколькими компонентами, но обычно терапию на основе платины прекращают из-за ее серьезной токсичности.[9] Пациенты должны находиться под наблюдением на нефротоксичность, ототоксичность, цитопении и выраженную невропатию. Обычно считается, что фолиевая кислота, витамин b12 и иногда дексаметазон помогают избежать некоторых побочных эффектов химиотерапии.
Стадия
Стадия рака легкого основана на изображениях компьютерной томографии в соответствии с системой стадирования опухолевых узлов и метастазов (TNM). Это краткое изложение 8-го издания TNM по раку легких, выпущенного IASLC (Международной ассоциацией по изучению рака легких) и заменяющего 7-е издание TNM.[10]
Предлагаемые дескрипторы T, N и M для восьмого издания классификации TNM для рака легких
Примечание. Изменения в седьмом издании выделены жирным шрифтом.
Предлагаемые группы стадий для восьмого издания классификации TNM для рака легких
Прогноз
Плоскоклеточный рак легкого может распространяться на несколько участков, включая мозг, позвоночник и другие кости, надпочечники и печень. Из-за отсутствия таргетной терапии SCC и поздней стадии обнаружения прогноз для этих пациентов часто неблагоприятный.
Осложнения
Осложнения SCC легкого могут включать:
Послеоперационная и реабилитационная помощь
Предоперационная гимнастика и программа реабилитации показали значительные послеоперационные результаты и снижение послеоперационных легочных осложнений.[11]. Однако послеоперационная легочная реабилитация без предоперационных упражнений показала лишь незначительное или умеренное влияние на послеоперационную способность к физической нагрузке в краткосрочном периоде наблюдения, но долгосрочное влияние на функциональную способность неизвестно. [12]
Консультации
]
Плоскоклеточный рак легкого — StatPearls
Непрерывное обучение
Плоскоклеточный рак легкого, также известный как плоскоклеточный рак легкого, представляет собой тип немелкоклеточного рака легкого ( НМРЛ).Плоскоклеточные опухоли легких часто возникают в центральной части легкого или в основных дыхательных путях, таких как левый или правый бронх. Основным возбудителем клеточной трансформации является табачный дым. В этом упражнении рассматривается оценка и лечение плоскоклеточного рака легкого и подчеркивается роль межпрофессиональной группы в ведении пациентов с этим заболеванием.
Целей:
Получите бесплатный доступ к вопросам с несколькими вариантами ответов по этой теме.
Введение
Плоскоклеточный рак легкого, также известный как плоскоклеточный рак легкого, представляет собой тип немелкоклеточного рака легкого (НМРЛ).Среди НМРЛ наиболее распространена аденокарцинома, за которой следует плоскоклеточный рак легкого, особенно у женщин. Это объясняется изменением характера курения сигарет, но окончательных доказательств нет.
Этиология
Примерно 80% случаев рака легких у мужчин и 90% случаев у женщин связаны с курением. [1] [2] SCC более тесно связан с курением, чем любой другой тип NSCLC. К другим факторам риска SCC относятся возраст, семейный анамнез, воздействие вторичного табачного дыма, минеральных и металлических частиц или асбеста.
Эпидемиология
Рак легкого — наиболее распространенный вид рака и причина смертности от рака во всем мире. [3] Заболеваемость раком легких в 2018 году оценивалась в 2 093 876 случаев во всем мире, что составляет 11,6% глобального бремени рака. Расчетная смертность от рака легких в 2018 г. составила 1 761 007 смертей во всем мире, что составляет около 18,4% глобальной смертности от рака. [4]
Глобальное распределение заболеваемости раком легких в 2018 году было следующим: Азия (58,5%), Европа (22,4%), Северная Америка (12.1%), LAC (4,3%), Африка (1,9%) и Океания (0,81%) [4].
Примерно 85% всех случаев рака легких являются НМРЛ. Аденокарцинома и плоскоклеточный рак являются наиболее распространенными подтипами, на которые приходится 50% и 30% случаев НМРЛ соответственно. [3]
Патофизиология
SCC заболевание легких возникает в результате трансформации плоскоклеточных клеток, выстилающих дыхательные пути. Плоские клетки — это тонкие плоские клетки, выстилающие многие органы человеческого тела. Плоскоклеточные опухоли легких часто возникают в центральной части легкого или в основных дыхательных путях, таких как левый или правый бронх.Основным возбудителем клеточной трансформации является табачный дым, который содержит более 300 вредных агентов и 40 потенциальных канцерогенов. Трансформированные плоские клетки характеризуются ороговением и / или межклеточными мостами и часто демонстрируют высокую частоту мутаций [4].
Гистопатология
Правильный гистологический диагноз становится все более важным, поскольку он может предсказать ответ и токсичность лечения. [5] Диагноз SCC может быть подтвержден, если минимум 10% опухолевой массы резецированных образцов демонстрируют особенности трансформации, такие как кератинизация или внутриклеточные мостики.Если дифференцированный плоский элемент опухоли минимален, ставится диагноз малодифференцированного ПКР. Панель иммуногистохимии (ИГХ) вместе с окраской муцина может помочь идентифицировать подтипы НМРЛ. SCC также демонстрирует сильную экспрессию плоских биомаркеров, включая белки p63 и p40.
В 2015 году Всемирная организация здравоохранения пересмотрела классификацию, чтобы выделить три варианта SCC на основе гистологического исследования: [6]
Анамнез и физические данные
Симптомы NSCLC могут включать кашель, боль в груди, одышку, кровь в мокроте, свистящее дыхание, охриплость голоса, повторяющиеся инфекции грудной клетки (включая бронхит и пневмонию), потеря веса, потеря аппетита и усталость.Однако пациенты с НМРЛ часто не проявляют никаких симптомов на ранних стадиях заболевания. Метастазы могут возникать при запущенном заболевании, а симптомы могут включать боль в костях, ущемление спинного мозга и неврологические симптомы (головная боль, слабость или онемение конечностей, головокружение, судороги).
Оценка
После физического обследования для оценки ПКР можно использовать общий анализ крови (CBC), рентген грудной клетки или компьютерную томографию (CT) при условии, что опухоль имеет достаточный размер. Наличие полости, заполненной газом или жидкостью в опухолевой массе, является классическим признаком SCC.[1] Другие признаки могут включать легочные узелки, новообразование или инфильтрат, расширение средостения, ателектаз, увеличение корней и плевральный выпот. Дополнительные исследования, включая КТ брюшной полости с контрастированием, магнитно-резонансную томографию головного мозга (МРТ) с контрастированием и функциональные тесты легких (PFT), также могут быть выполнены после постановки первоначального диагноза. Также проводится оценка PD-L1, EGFR, онкогена слияния ALK и других мутаций.
Лечение / менеджмент
Лечение зависит от стадии рака.Хирургическая резекция — это первая линия лечения I и II стадий. Для 1А химиотерапия не играет никакой роли. Для 1B в некоторых случаях рассматривается хирургическая резекция с адъювантной химиотерапией, если размер опухоли превышает 4 см. Стадия II лечится хирургическим вмешательством с последующей химиотерапией, обычно предпочтительна лобэктомия, но при плохих кандидатах на операцию можно рассмотреть возможность субдолевой резекции. На стадии I и II лучевая терапия рассматривается, если есть положительные границы после операции, а также при плохих кандидатах на хирургическое вмешательство.
Большинство опухолей III стадии неоперабельны. На стадии IIIA, которая определенно назначается во время операции резекции, можно рассмотреть возможность последующей адъювантной химиотерапии, но химиотерапия с лучевой терапией является обычным выбором. Для стадии IIIB используется комбинированная химиотерапия и лучевая терапия. На IV стадии используется химиотерапия с паллиативным облучением. Множественные рандомизированные контролируемые исследования и масштабные метаанализы подтверждают превосходство комбинированных схем химиотерапии при распространенном НМРЛ.[2] Также, в зависимости от статуса мутации, используется таргетная терапия. При запущенном НМРЛ терапия должна основываться на молекулярных особенностях опухоли.
При НМРЛ с соматической мутацией показана терапия специфическими ингибиторами [7]. Для мутации рецептора роста эпидермиса используются ингибиторы тирозинкиназы, такие как эрлотиниб, гефитиниб, афатиниб. Кризотиниб — первая линия мутации ALK. Рассматривается НМРЛ, у которого отсутствует эта мутация в зависимости от экспрессии лиганда 1 запрограммированной гибели (PD-L1), только иммунотерапия или иммунотерапия с комбинированной химиотерапией.Химиотерапия для неоадъювантной и адъювантной терапии включает цисплатин с винорелбином или этопозидом, винбластин, гемцитабин, доцетаксел или пеметрексед. Пациентам, которые не переносят цисплатин, рекомендуется применение паклитаксела с карбоплатином. Системная терапия первой линии на поздних стадиях включает бевацизумаб, карбоплатин и паклитаксел. Другими вариантами являются цетуксимаб с цисплатином и винорелбином или эрлотиниб с химиотерапией на основе платины.
Дифференциальная диагностика
SSC легкого необходимо дифференцировать от других видов рака легких, включая мелкоклеточный рак легкого (SCLC) и другие NSCLC, такие как аденокарцинома и крупноклеточная карцинома.
Хирургическая онкология
Хирургическое лечение является предпочтительным методом лечения I и II стадии. На стадии IIIA хирургическое вмешательство рассматривается только в отдельных случаях.
Лучевая онкология
Лучевая терапия рассматривается для стадий I и II с положительными границами после операции или у плохих кандидатов на хирургическое вмешательство, у которых полная лобэктомия невозможна. Для стадии III лучевая терапия, наряду с химиотерапией, является лечением выбора. На стадии IV лучевая терапия применяется только в качестве паллиативной меры.
Соответствующие исследования и текущие испытания
Иммунотерапевтический атезолизумаб (анти-PDL1, RG7446, моноклональное антитело MPDL3280A против PD-L1 (лиганд запрограммированной смерти 1) оценивается в клинических испытаниях фазы III в качестве потенциального средства лечения первой линии. Пациенты с неплоскоклеточным или плоскоклеточным немелкоклеточным раком легкого, опухоли которых экспрессируют PDL1. Также продолжается испытание фазы I по оценке атезолизумаба в комбинации с эрлотинибом или алектинибом у пациентов с немелкоклеточным раком легкого.IPA-3 или OTSSP167 и ауранофин имели высокий синергетический эффект в клеточных линиях плоскоклеточной карциномы мутантных EGFR или KRAS и снижали объем опухоли в моделях на мышах [8].
Управление токсичностью и побочными эффектами
Химиотерапия на основе платины, наряду со вторыми активными цитотоксическими агентами, обычно рассматривается у пациентов, которым требуется химиотерапия. Вероятность токсичности увеличивается после четырех-шести циклов терапии и не рекомендуется после этого. У пациентов без оптимального ответа поддерживающую терапию можно продолжить одним или несколькими компонентами, но обычно терапию на основе платины прекращают из-за ее серьезной токсичности.[9] Пациенты должны находиться под наблюдением на нефротоксичность, ототоксичность, цитопении и выраженную невропатию. Обычно считается, что фолиевая кислота, витамин b12 и иногда дексаметазон помогают избежать некоторых побочных эффектов химиотерапии.
Стадия
Стадия рака легкого основана на изображениях компьютерной томографии в соответствии с системой стадирования опухолевых узлов и метастазов (TNM). Это краткое изложение 8-го издания TNM по раку легких, выпущенного IASLC (Международной ассоциацией по изучению рака легких) и заменяющего 7-е издание TNM.[10]
Предлагаемые дескрипторы T, N и M для восьмого издания классификации TNM для рака легких
Примечание. Изменения в седьмом издании выделены жирным шрифтом.
Предлагаемые группы стадий для восьмого издания классификации TNM для рака легких
Прогноз
Плоскоклеточный рак легкого может распространяться на несколько участков, включая мозг, позвоночник и другие кости, надпочечники и печень. Из-за отсутствия таргетной терапии SCC и поздней стадии обнаружения прогноз для этих пациентов часто неблагоприятный.
Осложнения
Осложнения SCC легкого могут включать:
Послеоперационная и реабилитационная помощь
Предоперационная гимнастика и программа реабилитации показали значительные послеоперационные результаты и снижение послеоперационных легочных осложнений.[11]. Однако послеоперационная легочная реабилитация без предоперационных упражнений показала лишь незначительное или умеренное влияние на послеоперационную способность к физической нагрузке в краткосрочном периоде наблюдения, но долгосрочное влияние на функциональную способность неизвестно. [12]
Консультации
]
Плоскоклеточный рак | Типы рака легких | Beaumont
Что такое плоскоклеточный рак?
Плоскоклеточный рак легкого, также известный как эпидермоидная карцинома, представляет собой форму рака легких.Существует два типа рака легких: мелкоклеточный рак легкого (SCLC) и немелкоклеточный рак легкого (NSCLC). Плоскоклеточный рак — это разновидность немелкоклеточного рака. Это самая распространенная форма рака легких у мужчин, причем у мужчин она встречается чаще, чем у женщин. Обычно это вызвано курением табака.
Плоскоклеточная карцинома названа в честь плоскоклеточных клеток, которые представляют собой плоские и тонкие клетки, похожие на чешую рыбы. Они находятся во многих частях вашего тела. Плоскоклеточная карцинома может возникнуть в любом месте, где есть плоскоклеточные клетки.
Эксперты распознают четыре типа плоскоклеточного рака легкого:
Есть некоторые свидетельства того, что базалоидные и некоторые мелкоклеточные типы могут иметь худший прогноз, чем другие виды плоскоклеточного рака.
Чем плоскоклеточный рак отличается от других карцином легких?
Плоскоклеточный рак обычно начинается в бронхах (проходах, по которым воздух попадает в легкие) и растет медленнее, чем другие основные формы рака легких, включая аденокарциному и мелкоклеточный рак легкого.
Факторы риска плоскоклеточного рака
Плоскоклеточный рак легкого тесно связан с курением табака в анамнезе. Это более тесно связано с курением табака, чем с другими формами рака легких.
Другие факторы риска рака легких включают:
Каковы симптомы плоскоклеточного рака?
Симптомы плоскоклеточного рака аналогичны симптомам других форм рака легких.Рак легких поначалу обычно не вызывает симптомов. Симптомы обычно появляются после того, как рак распространился.
Симптомы могут варьироваться от человека к человеку. К наиболее частым симптомам рака легких относятся:
Плоскоклеточный рак легкого также может вызывать симптомы, общие для других видов рака в целом, например как:
Наличие любого из этих признаков или симптомов не обязательно означает, что у вас есть рак легких.Только врач может сказать наверняка.
Как врачи диагностируют плоскоклеточный рак?
Врачи могут диагностировать плоскоклеточный рак и другие виды рака легких несколькими способами. Выбор врачей будет зависеть от ваших факторов риска, симптомов и возраста.
Диагностические тесты
Если ваш врач считает, что у вас может быть какой-либо тип рака легких, он или она может назначить различные тесты, чтобы помочь диагностировать рак или исключить другие заболевания. Эти тесты могут включать:
Ваш врач внимательно проанализирует результаты визуализации или образцы тканей, чтобы определить, есть ли у вас плоскоклеточная карцинома или другая форма рака легких.
У большинства людей с ранней стадией плоскоклеточного рака обычно нет симптомов, и раковые клетки не видны на рентгеновском снимке. Он имеет тенденцию распространяться за пределы грудной клетки медленнее (и позже), чем другие основные типы рака легких. Когда врачи исследуют биопсию, опухоли от плоскоклеточного рака могут варьироваться от хорошо дифференцированных до демонстрирующих только минимальные плоскоклеточные признаки.
Тесты для определения степени распространенности рака
После того, как врачи выяснят, какой у вас тип рака легких, ваш врач попытается выяснить, насколько продвинулся ваш рак (на какой стадии он находится) и распространился ли он за пределы ваших легких. .Стадии рака легких варьируются от 0 до IV, причем более низкие стадии указывают на рак, ограниченный легкими, а стадия IV указывает на то, что рак распространился на другие части тела. Знание стадии поможет вам и вашему врачу определить ваше лечение.
Тесты для определения стадии рака включают:
Как лечится плоскоклеточный рак?
Вы и ваш врач выберете план лечения рака легких в зависимости от типа вашего рака легких, стадии рака легких, а также вашего общего состояния здоровья и предпочтений.Вы можете получить один тип лечения или комбинацию нескольких видов лечения. Наиболее распространенными методами лечения рака легких являются хирургическое вмешательство, лучевая терапия и химиотерапия.
Хирургия
Вы и ваш врач можете решить, что операция вам подходит. Операция по поводу рака легких заключается в удалении раковой опухоли из легкого.
Существует три типа хирургических вмешательств, обычно используемых для лечения рака легких. К ним относятся:
Лучевая терапия
Лучевая терапия направляет пучки высокоэнергетического излучения для уменьшения размеров раковых клеток и уничтожения опухолей.Его можно использовать в сочетании с хирургией или химиотерапией. Есть два типа лучевой терапии. Иногда используются оба типа.
Химиотерапия
Химиотерапия — это препараты, убивающие рак. Химиотерапевтические препараты не позволяют раковым клеткам расти и воспроизводиться. Ваш врач может использовать его отдельно или вместе с лучевой терапией или операцией.
Другие методы лечения рака легких
Иногда врачи предлагают другие методы лечения людям с раком легких.
Откройте для себя варианты лечения в Beaumont
Если врачи считают, что у вас может быть рак легких, вы можете доверять Beaumont в удовлетворении ваших потребностей в лечении. Врачи в Бомонте выявляют рак на ранней стадии чаще, чем в любой другой больнице Мичигана.Мы используем самые современные методы лечения и новейшие технологии, чтобы предлагать пациентам индивидуально ориентированный уход. Наша многопрофильная клиника рака легких в больнице Бомонт, Трой, предлагает вам высококвалифицированную и опытную команду онкологов.
В рамках Междисциплинарной программы Бомонта по лечению рака легких мы разрабатываем индивидуальный план лечения, основанный на вашей уникальной ситуации. Ваш врач будет тесно сотрудничать с вами, чтобы разработать для вас наиболее эффективный план лечения.
Прогностическая модель для пожилых пациентов с плоскоклеточным немелкоклеточным раком легкого: популяционное исследование | Журнал трансляционной медицины
Таргетная терапия запущенного плоскоклеточного рака легкого
Введение
Рак легкого остается наиболее частой причиной смертности от рака в Соединенных Штатах. 1 Из всех случаев рака легких более 85% классифицируются как немелкоклеточный рак легкого (НМРЛ), при этом плоскоклеточный рак (SqCC) составляет примерно 30%.SqCC, когда-то являвшийся наиболее распространенным подтипом НМРЛ, за последние два десятилетия снизился по заболеваемости, что в основном связано с общим снижением частоты курения и изменениями в сигаретных фильтрах, которые способствуют дистальной доставке табачного дыма в легкие. 2 Последнее способствовало увеличению заболеваемости аденокарциномой, которая составляет большинство пациентов с НМРЛ. 3 Несмотря на снижение заболеваемости, СКК легких остается распространенным злокачественным новообразованием, на которое ежегодно приходится около 85 000 новых случаев в США и более 400 000 случаев во всем мире.SqCC создает множество терапевтических проблем, связанных с демографическими данными пациента, характеристиками опухоли и биологией опухоли. Пациенты, как правило, старше, с высокой частотой курения и более высокой частотой сопутствующих заболеваний, включая низкий легочный резерв и наличие ХОБЛ. 3,4 Кроме того, SqCC часто затрагивает центральные дыхательные пути, и расположение этих опухолей вблизи крупных кровеносных сосудов может создавать проблемы лечения, включая кровотечение и кровохарканье, что, в свою очередь, может противопоказать использование определенных терапевтических агентов. 4
С доступностью широко распространенного геномного секвенирования и введением специфических целевых агентов для подгрупп пациентов с аденокарциномой, например, с активирующими мутациями в рецепторе эпидермального фактора роста (EGFR) или гене киназы анапластической лимфомы (ALK) перестройки, выживаемость пациентов с неплоскоклеточным метастатическим НМРЛ значительно улучшилась. 5-7 В то же время терапевтический прогресс при плоскоклеточном раке легкого был относительно медленным, с относительной стагнацией показателей выживаемости в диапазоне 9–11 месяцев без существенного улучшения до самого недавнего времени.8 За исключением недавно одобренного некитумумаба, не было других разрешений Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) специально для SqCC легкого. Лечение SqCC легкого остается неудовлетворенной потребностью, и необходимы новые стратегии лечения, включая специфические целевые методы лечения, которые обеспечили бы клинически значимые результаты без неблагоприятного воздействия на качество жизни.
В последнее время молекулярное генотипирование привело к применению целевых агентов для мутаций, распространенных в SqCC. 9 В этом обзоре целевых методов лечения плоскоклеточного рака легкого освещаются эти недавние молекулярные достижения и обсуждается потенциальная роль новых молекулярных агентов, которые в настоящее время оцениваются для лечения запущенного SqCC.
Терапия первой линии Advanced SqCC
Дублеты на основе платины являются краеугольным камнем системной паллиативной терапии первой линии для продвинутой SqCC. Предыдущие испытания, проведенные с использованием схемы на основе цисплатина или карбоплатина с использованием различных платиновых партнеров, а именно паклитаксела, гемцитабина или доцетаксела, не показали каких-либо значительных различий в выживаемости.10 Совсем недавно в рандомизированном клиническом исследовании фазы III рандомизированного клинического исследования III фазы наблюдалось улучшение выживаемости при запущенном СКК для гемцитабин-цисплатина по сравнению с пеметрекседцисплатином (n = 473; 10,8 против 9,4 месяцев соответственно). 11,12 Основываясь на этих результатах, платиновый агент плюс гемцитабин или таксан остается наиболее часто используемой комбинацией первой линии, при этом выбор агентов обычно основан на токсичности и ранее существовавших медицинских проблемах. Набпаклитаксел — еще один вариант лечения пациентов с поздней стадией SqCC. 13,14 В анализе подгруппы исследования фазы III (n = 1052, комбинация наб-паклитаксел-карбоплатин первой линии продемонстрировала значительное улучшение частоты ответа по сравнению с паклитаксел-карбоплатином (41% против 24%; P < Хотя улучшение частоты ответа не привело к значительному увеличению выживаемости ни при SqCC (10,7 против 9,5 месяцев; отношение рисков [HR] 0,89), ни при неплоскоклеточном НМРЛ (13,1 против 13,0 месяцев; HR 0,95), Наб-паклитаксел плюс платиновый агент, обычно карбоплатин, остается жизнеспособным вариантом лечения первой линии для пациентов с SqCC, который может иметь некоторые преимущества, в основном меньшую частоту периферической невропатии, меньшее количество реакций на инфузию и более короткое время инфузии. 14
Кроме того, нецитумумаб, моноклональное антитело второго поколения, нацеленное на EGFR, было недавно одобрено (ноябрь 2015 г.) в комбинации с гемцитабином-цисплатином для лечения первой линии метастатического SqCC. Это одобрение было получено после демонстрации более высокой выживаемости при комбинированной терапии по сравнению с одной химиотерапией (11,5 против 9,9 месяцев; ОР 0,84; 95% ДИ от 0,74 до 0,96; P = 0,01), выживаемость без прогрессирования (ВБП) (5,7 против 5,5 месяцев; ОР 0,85; 95% ДИ 0.74 до 0,98; P = 0,02), а также скорость борьбы с заболеванием (82% против 77%; P = 0,043). 15 Это было одно из первых испытаний, показавших более высокую выживаемость нового агента в сочетании с химиотерапией по сравнению с одной химиотерапией при SqCC легкого. Профиль безопасности нецитумумаба соответствует антителам к EGFR в комбинации с химиотерапией, с более частыми венозными тромбоэмболиями и повышенной частотой кожных реакций степени> 3 и гипомагниемии. 15
Вторая и последующая линия терапии для SqCC
Парадигма терапии второй линии для SqCC значительно изменилась с утверждением ниволумаба и пембролизумаба в марте 2015 и октябре 2015, соответственно.Эти ингибиторы контрольных точек, которые блокируют путь запрограммированного белка клеточной смерти (PD-1), восстанавливают функцию иммунной системы и позволяют Т-клеткам действовать надлежащим образом против опухолей. Одобрение анти-PD-1 агента ниволумаба для лечения второй линии распространенного SqCC было основано на результатах исследования фазы III Checkmate 017, сравнивающего ниволумаб с доцетакселом (n = 272). 16,17 У пациентов, получавших ниволумаб, медиана общей выживаемости была значительно выше, чем у пациентов, получавших доцетаксел (9.2 против 6,0 месяцев; ЧСС 0,59; 95% ДИ от 0,44 до 0,79; P <0,001), повышенная медиана ВБП (3,5 против 2,8 месяца; ОР смерти или прогрессирования заболевания, 0,62; 95% ДИ, 0,47–0,81; P <0,001) и повышенная частота ответа (20% против 9%; P = 0,008). Годовая выживаемость составила 42% и 24% соответственно. Средняя продолжительность ответа не была достигнута в группе ниволумаба по сравнению с 8,4 месяцами в группе доцетаксела. Нежелательные явления 3 или 4 степени, связанные с лечением, регистрировались реже при приеме ниволумаба по сравнению с доцетакселом (7% против 55%).В исследовательском анализе у ограниченного числа пациентов, который использовал низкие пороговые значения для экспрессии PD-L1, преимущества OS и PFS с ниволумабом наблюдались независимо от уровней экспрессии PD-L1 в опухоли. Другой анти-PD-1 агент, пембролизумаб, получил ускоренное одобрение в США для лечения второй линии пациентов с распространенным НМРЛ, включая SqCC, опухоли которых экспрессируют PD-L1, на основании анализа подгрупп пациентов в KEYNOTE-001. исследование с показателем доли опухоли (TPS) экспрессии PD-L1 ≥50% (n = 61), для которого наблюдалась частота ответа 41% и большая продолжительность ответа.18 Кроме того, в исследовании KEYNOTE-010 фазы II / III второй линии (n = 1034) пембролизумаб продемонстрировал более длительную ОВ по сравнению с доцетакселом у пациентов с TPS PD-L1 ≥50% и TPS ≥1% независимо от гистологии. 19 Это преимущество было также замечено для подгруппы SqCC с HR 0,74 (ДИ 0,50–1,09). Другие анти-PD-1 и анти-PD-L1 агенты, такие как атезолизумаб и дурвалумаб, находятся в фазе III разработки для лечения распространенного НМРЛ, включая SqCC.
Другие агенты, такие как доцетаксел или эрлотиниб, считаются разумными терапевтическими вариантами, но они не одобрены специально для лечения СКК.Рамицирумаб, моноклональное антитело, нацеленное на VEGFR2, оценивали в рандомизированном исследовании фазы III (REVEL, n = 1253) в комбинации с доцетакселом у пациентов с распространенным НМРЛ, прогрессирующим после первичной химиотерапии на основе платины, независимо от гистологии опухоли. Рамуцирумаб плюс доцетаксел продемонстрировал улучшение медианы ОВ по сравнению с одним доцетакселом в общей популяции (10,5 против 9,1 месяцев; ОР 0,86; 95% ДИ 0,75–0,98; P = 0,023) .20 Сопоставимые, но несущественные преимущества ОВ наблюдались в подгруппе SqCC (n = 328 [26%]; 9.5 против 8,2 месяца; HR 0,88; 95% ДИ, от 0,69 до 1,13). Это единственный антиангиогенный препарат, у которого есть показания для SqCC.
Таргетная терапия для SqCC
До недавнего времени было мало что известно о геномике SqCC. С доступностью секвенирования генов и всесторонних геномных исследований наше понимание мутационного профиля SqCC значительно улучшилось. 9 Прогресс был медленным и все еще отстает от аденокарциномы. Генетические изменения в аденокарциномах легких и SqCC различны; например, в SqCC мало мутаций KRAS и EGFR.SqCC также имеет тенденцию быть генетически более сложным, с высокой частотой сложных мутаций и амплификацией множества рецепторов. Мы узнали, что SqCC легких характеризуются высокой общей мутационной нагрузкой со скоростью 8,1 мутаций на мегабазу. 9 Почти все SqCC обнаруживают соматические мутации TP53.
Наиболее частые изменения наблюдались в путях, связанных с ростом, пролиферацией и выживанием опухоли. Кроме того, амплификация рецептора-1 фактора роста фибробластов ( FGFR1 ) (примерно 25% от SqCC, используя 3.5-кратная амплификация, наблюдаемая примерно в 5%), мутации рецептора-2 дискоидинового домена (DDR2) (~ 4%) являются привлекательными и действенными мишенями.
В рамках проекта «Атлас генома рака» (TCGA) 178 образцов опухолей SqCC были проанализированы на предмет геномных изменений путем секвенирования всего экзома, секвенирования мРНК и других методов для всестороннего определения геномного ландшафта SqCC. Гены, такие как CDKN2A / RB1, NFE2L2 / KEAP1 / CUL3, PI3K / AKT и SOX2 / TP63 / NOTCh2 сигнальных путей, также часто изменялись. 9 В другом недавнем исследовании комплексный геномный анализ у пациентов с резекцией SqCC (n = 157) выявил соматические мутации в 73,9% случаев: TP53 (56,1%), CDKN2A (8,9%), PIK3CA ( 8,9%), KRAS (4,5%) и EGFR (3,2%). Изменения числа копий гена были выявлены в 75,8% случаев, включая амплификацию SOX2 (31,2%), делецию CDKN2A (21,7%), делецию PTEN (16,6%), амплификацию FGFR1 (15.9%), EGFR (14,0%), CCND1 (14,0%), HER2 (9,6%) и PDGFRA (7,6%). Положительная экспрессия VEGFR2, и PD-L1 и потеря экспрессии PTEN наблюдались в 80,5%, 47,2% и 42,7% случаев соответственно. 21
Из-за генетического разнообразия и отсутствия явных онкогенных факторов, вызывающих это заболевание, существует необходимость в разработке клинических испытаний, ориентированных исключительно на SqCC, которые могут оценить терапию с использованием одного агента и комбинированную таргетную терапию.
The Lung-MAP (основные клинические исследователи [ИП]: доктора Вали Пападимитракопулу, Рой Хербст, Дэвид Гандара; статистический исследователь Мэри У. Редман) — это основной протокол нескольких исследований, который включает геномное тестирование опухолей с помощью секвенирования следующего поколения (NGS) (Foundation Medicine) для пациентов с SqCC после прогрессирования терапии первой линии. Этот протокол, возглавляемый SWOG, представляет собой партнерство с участием Национального института рака (NCI) и его Руководящего комитета по злокачественным новообразованиям грудной клетки (TMSC), Фонда NIH (FNIH), фармацевтической промышленности, групп защиты интересов, таких как Friends of Cancer Research ( FOCR) и Федеральное управление по лекарствам (FDA).Это наиболее полное и совместное клиническое исследование рака легких, проводимое в Соединенных Штатах Америки, с целью определения безопасных и эффективных схем, соответствующих прогностическим биомаркерам и таргетным лекарствам. После геномного тестирования пациенты распределяются по одному из нескольких подисследований, каждое из которых оценивает экспериментальную таргетную терапию, основанную на идентификации потенциальных предиктивных биомаркеров, связанных с каждым подисследованием. Эти субисследования проводятся как одноэтапные исследования фазы II без рандомизации по доцетакселу, что делает его более привлекательным для пациентов с конкретными целевыми мутациями.Основная цель этих исследований — общий процент ответов. Если уровень объективного ответа, наблюдаемый в исследовании фазы II, будет сочтен достаточным, исследование перейдет в фазу III исследования, в котором пациенты будут рандомизированы для целевой терапии на основе биомаркеров по сравнению со стандартной терапией. Каждое подисследование будет работать автономно, открываться и закрываться независимо от других подисследований. Кроме того, он предлагает пациентам как таргетное лечение, так и иммунотерапевтическое лечение, все в рамках общей схемы основного протокола.Пациентам предлагаются группы иммунотерапии без соответствующих генетических изменений, и текущее исследование основывается на быстро меняющемся стандарте лечения. Дизайн Lung-MAP позволяет добавлять новые субисследования, оценивающие либо новые пары биомаркер / лекарство, либо новые таргетные методы лечения.
РИСУНОК 1
отображает общую схему для Lung-MAP и исходных тестируемых мишеней лекарств, PI3K, FGFR, CDK 4/6 . Пациенты, не являющиеся кандидатами на участие в подисследовании, основанном на биомаркерах, могут записаться на подисследование без совпадения и получать терапию ниволумабом или комбинацией ниволумаба и ипилимумаба.Быстрое получение результатов скрининга NGS в течение 16 дней позволяет в режиме реального времени назначить их в соответствующее подисследование. Lung-MAP может изменить способ разработки новых лекарств при раке легких, и этот подход будет экстраполирован на другие условия при раке легкого, а также на другие типы опухолей. Аналогичные усилия предпринимаются и в других странах, например, исследование SAFIR02_LUNG, проводимое во Франции (NCT02117167), и национальное исследование матрицы легких в Великобритании (NCT02664935). Это открытые рандомизированные исследования фазы II, в которых используется высокопроизводительный анализ генома в качестве инструмента принятия терапевтических решений, направленных на сравнение целевого лечения, назначенного в соответствии с выявленными молекулярными аномалиями опухоли, со стандартной терапией.
Путь фосфоинозитид-3-киназы
Фосфоинозитид-3-киназа ( PI3K ) представляет собой липидкиназу, участвующую в пролиферации, выживании и миграции опухолевых клеток при активации рецепторами фактора роста и интегринами. PI3K катализирует фосфорилирование фосфатидилинозитол-4,5-бисфосфата (PIP2) с образованием фосфатидилинозитол-3,4,5-трифосфата (PIP3), второго мессенджера, участвующего в фосфорилировании AKT и связанных белков в пути AKT-mTOR. .Активирующие и трансформирующие мутации, а также амплификация в субъединице p110α PI3K обычно обнаруживаются в солидных и гематологических опухолях. Кроме того, путь PI3K-AKT активируется при многих типах рака за счет передачи сигналов рецепторной тирозинкиназы, потери гомолога тензина фосфатазы (PTEN) или мутаций RAS. 22,23 GDC-0032 (тазелисиб) — мощный селективный низкомолекулярный ингибитор класса 1 для перорального применения PI3K , профиль безопасности которого был установлен в исследованиях фазы I, с частичными ответами на повышение дозы у пациентов с PIK3CA мутантные опухоли NSCLC.
Циклинзависимая амплификация киназ
Циклинзависимые киназы (CDK) образуют гетеродимерные белковые комплексы с циклинами и играют ключевую роль в развитии клеточного цикла и регуляции транскрипции. Было продемонстрировано, что плоскоклеточный рак легкого имеет изменения CCND1 и амплификации CDK4 / 6.9 Палбоциклиб, перорально активный пиридопиримидин, является мощным и высокоселективным обратимым ингибитором циклин-зависимой киназы (CDK) 4 и CDK6. Соединение предотвращает синтез клеточной ДНК, запрещая продвижение клеточного цикла от G1 к S-фазе, что продемонстрировано на лабораторных моделях и ранних клинических испытаниях.Палбоциклиб был протестирован в исследовании фазы I повышения дозы, при котором наблюдалась значительная часть пациентов со стабильным заболеванием. Он был одобрен при метастатическом раке груди для лечения гормонально-положительного заболевания. 24-27
Мутация / амплификация FGFR
Существует серьезное доклиническое обоснование для тестирования активности AZD4547 у пациентов с плоскоклеточным раком легкого, несущим аберрации рецептора фактора роста фибробластов ( FGFR ).Амплификации FGFR1 связаны с НМРЛ и были описаны до 20% плоскоклеточного рака легких с мутациями и слияниями в FGFR 2 и 3, встречающимися с меньшей частотой (каждый <4%). 21,28 AZD4547 является мощным и селективным ингибитором тирозинкиназ рецепторов FGFR 1, 2 и 3 (конечные точки ферментного и клеточного фосфорилирования) и имеет значительно более низкую эффективность в отношении ингибирования FGFR4, рецептора инсулиноподобного фактора роста 1. (IGF1R) и рецептор домена вставки киназы (KDR).Ингибирование FGFR-опосредованной передачи сигналов может приводить к антипролиферативной и / или проапоптотической активности, может иметь антиангиогенный эффект и может играть роль в резистентности к терапии ингибиторами сосудистого эндотелиального фактора роста (VEGF). В небольшом клиническом исследовании плоскоклеточного НМРЛ было по крайней мере 1 PR у 14 пациентов, получавших AZD4547. Пациент имел усиление FGFR1. 29
Другие цели
Другие цели с активными агентами, которые исследуются, включают PDGFR (NCT02109016), AKT путь и MET амплификацию.Специфические ингибиторы, нацеленные на TORC1 / 2, находятся в стадии активной разработки (NCT02417701), и активно исследуются комбинированные терапии с ингибированием FGFR + MEK (селуметиниб) (NCT02583542).
Заключение
Плоскоклеточный рак легкого остается терапевтической проблемой из-за его проявления, характеристик пациента, локализации заболевания и более высокой частоты сопутствующих заболеваний. Несмотря на то, что мы добились значительных успехов в терапии SqCC, включая одобрение иммунотерапии, остается значительная потребность в разработке целевых методов, обусловленная нашим улучшенным пониманием геномики SqCC.
Ссылки :

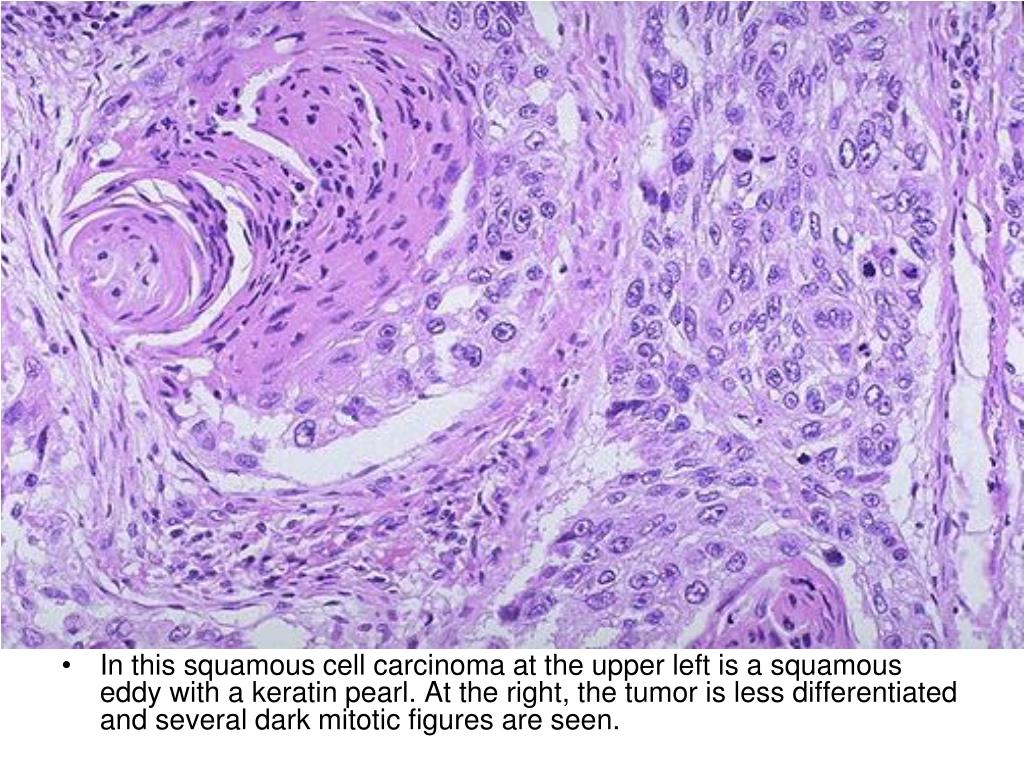 Для этого вида свойственно раннее метастазирование и образование первичного очага в корне легкого.
Для этого вида свойственно раннее метастазирование и образование первичного очага в корне легкого.
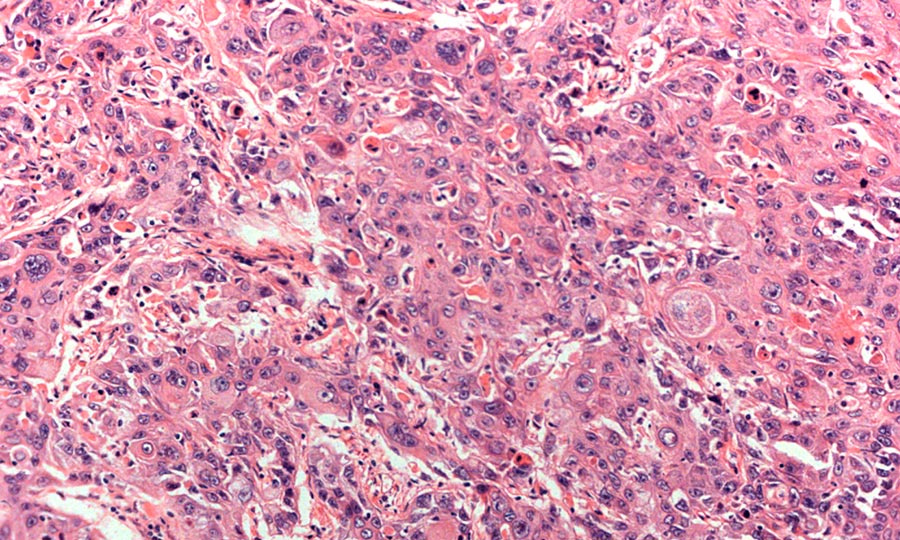 Они обладают разным механизмом действия, но приводят к одному и тому же результату —иммунная система начинает активно атаковать клетки рака легкого.
Они обладают разным механизмом действия, но приводят к одному и тому же результату —иммунная система начинает активно атаковать клетки рака легкого.