Page not found – МЕДИЦИНСКИЙ ЦЕНТР ГАЛИЛЕЯ
Dropdown *выберите странуАвстралияАвстрияАзербайджанАлбанияАлжирАнгильяАнголаАндорраАнтигуаАргентинаАрменияАрубаАфганистанБагамские о-ваБангладешБарбадосБахрейнБеларусьБелизБельгияБенинБермудские о-ваБолгарияБоливияБосния и ГерцеговинаБотсванаБразилияБрунейБуркина-ФасоБурундиБутанВануатуВатиканВеликобританияВенгрияВенесуэлаВиргинские о-ва (Великобритания)Виргинские о-ва (США)Восточное — Самоа (США)Восточный ТиморВьетнамГабонГавайские о-ваГаитиГайанаГамбияГанаГваделупаГватемалаГвиана – французскаяГвинеяГвинея-БисауГерманияГернсиГибралтарГондурасГонконгГренадаГренландияГрецияГрузияГуамДанияДжерсиДжибутиДиего Гарсия о-ваДоминикаДоминиканская РеспубликаЕгипетЗамбияЗанзибар о-вЗападное СамоаЗимбабвеИзраильИндияИндонезияИорданияИракИранИрландияИсландияИспанияИталияЙеменКабо-ВердеКазахстанКайманКамбоджаКамерунКанадаКатарКенияКипрКиргизияКирибатиКитайКокосовы (Килинг) о-ваКолумбияКоморские о-ваКонгоКонго (Демократическая республика)Корея СевернаяКорея ЮжнаяКоста-РикаКот-д’ИвуарКубаКувейтКука о-ваЛаосЛатвияЛесотоЛиберияЛиванЛивияЛитваЛихтенштейнЛюксембургМаврикийМавританияМадагаскарМайоттаМакаоМакедонияМалавиМалайзияМалиМальдивыМальтаМарианские о-ваМароккоМартиникаМаршалловы о-ваМексикаМидуэйМикронезияМозамбикМолдавияМонакоМонголияМонтсерратМьянмаМэнНамибияНауруНепалНигерНигерияНидерландыНикарагуаНиуэ о-вНовая ЗеландияНовая КаледонияНорвегияНормандские о-ваНорфолкОбъединённые Арабские ЭмиратыОлдерниОльстерОманПакистанПалауПалестинаПанамаПапуа Новая ГвинеяПарагвайПеруПольшаПортугалияПуэрто-РикоРеюньонРоссийская ФедерацияРуандаРумынияСальвадорСамоаСан-МариноСан-Томе и ПринсипиСаудовская АравияСвазилендСвятой Елены о-ваСейшельские о-ваСенегалСент-Винсент и ГренадиныСент-Кристофер и НевисСент-ЛюсияСент-Пьер и МиелокСербия и ЧерногорияСеута и МелильяСингапурСирияСловакияСловенияСоединенные Штаты АмерикиСоломоновы о-ваСомалиСуданСуринамСьерра-ЛеонеТаджикистанТаиландТайваньТанзанияТеркс и Кайкос о-ваТогоТокелауТонгаТринидад и ТобагоТристан-Да-Кунья ос-вТувалуТунисТуркменияТурцияУгандаУзбекистанУкраинаУоллис и Футуна о-ваУругвайУэйкФарерские о-ваФиджиФилиппиныФинляндияФолклендские (Мальвинские) о-ваФранцияФранцузская ПолинезияХорватияЦентральноафриканская РеспубликаЧадЧехияЧилиШвейцарияШвецияШпицбергенШри-ЛанкаЭквадорЭкваториальная ГвинеяЭритреяЭстонияЭфиопияЮжно-Африканская РеспубликаЯмайкаЯпония
Single Line Text
Методы обследования в пульмонологии | клиника «Евромед»
Специальные методы обследования в пульмонологии
1.
 Физикальные методы исследования.
Физикальные методы исследования.
К физикальным методам обследования относят осмотр пациента, перкуссию (выстукивание), пальпацию, аускультацию (выслушивание). Физикальные методы позволяют врачу выявить симптомы болезни при непосредственном контакте с пациентом, сформулировать предварительный диагноз и назначить обследование согласно находкам и диагнозу. Физикальное исследование обязательно к исполнению врачом клинических специальностей (хирурги всех специальностей, терапевты всех специальностей и т.д.)
2. Инструментальные методы диагностики.
Спирометрия (спирография) – исследование функции внешнего дыхания. Исследование позволяет оценить жизненную емкость легких, функциональную проходимость бронхов, форсированные объемы дыхания. Спирометрия — обязательный метод обследования в пульмонологии, особенно важен для диагностики таких болезней как бронхиальная астма, ХОБЛ, бронхит и т.д. В ряде случаев спирометрия выполняется с медикаментозной нагрузкой, т. н. тест с бронхолитиком. Вначале пациент делает дыхательные маневры в аппарат в обычном состоянии, затем его просят провести ингаляцию бронхорасширяющего вещества и спирометрию повторяют. При этом проводится сравнение результатов до, и после ингаляции. Если разница будет значима (прирост более 15%) – это свидетельствует об обратимых изменениях, которые наиболее вероятны для бронхиальной астмы. В арсенале современной пульмонологии имеется такой метод как спирометрия с бронхопровакационной пробой. Например, при ингаляции метахолина здоровым человеком – никаких изменений не произойдет, та же доза для больного с «истинной» бронхиальной астмой спровоцирует приступ бронхоспазма. Для проведения подобных исследований необходимо специальное оборудование, обученные специалисты и возможность оказать экстренную помощь пациенту.
н. тест с бронхолитиком. Вначале пациент делает дыхательные маневры в аппарат в обычном состоянии, затем его просят провести ингаляцию бронхорасширяющего вещества и спирометрию повторяют. При этом проводится сравнение результатов до, и после ингаляции. Если разница будет значима (прирост более 15%) – это свидетельствует об обратимых изменениях, которые наиболее вероятны для бронхиальной астмы. В арсенале современной пульмонологии имеется такой метод как спирометрия с бронхопровакационной пробой. Например, при ингаляции метахолина здоровым человеком – никаких изменений не произойдет, та же доза для больного с «истинной» бронхиальной астмой спровоцирует приступ бронхоспазма. Для проведения подобных исследований необходимо специальное оборудование, обученные специалисты и возможность оказать экстренную помощь пациенту.
Как правильно подготовиться к спирометрии?
Лучше всего спирометрию выполнять утром или по крайней мере в первой половине дня. Предпочтительно выполнение натощак или после очень легкого завтрака, что бы переполненный желудок или ощущение тяжести не влияли на дыхательные маневры. Если Вы пользуетесь ингаляторами, то в день спирометрии лучше их не использовать, что бы результат полученный при исследовании был объективный и достоверный. Если Вам назначен тест с бронхолитиком, лучше приобрести его заранее, предварительно уточнив у лечащего врача, какой именно бронхолитик необходим. Обычно используют Сальбутамол.
Если Вы пользуетесь ингаляторами, то в день спирометрии лучше их не использовать, что бы результат полученный при исследовании был объективный и достоверный. Если Вам назначен тест с бронхолитиком, лучше приобрести его заранее, предварительно уточнив у лечащего врача, какой именно бронхолитик необходим. Обычно используют Сальбутамол.
Рентгенологические методы:
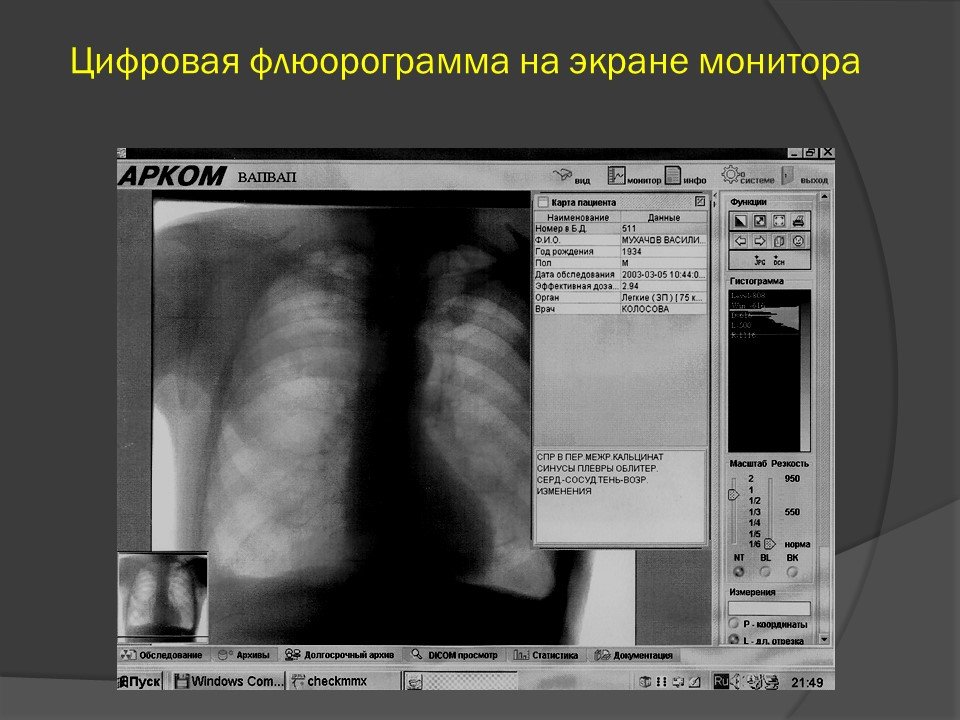
Флюорография – самый массовый метод рентгенологического исследования. Флюорограф обладает большой пропускной способностью, поэтому используется для скрининга населения (массовое обследование при медосмотрах).
Рентгенография грудной клетки – позволяет с большим разрешением, чем флюорограф, получить изображение легких, средостения, ребер и диафрагмы.
Мультиспиральная компьютерная томография — на сегодняшний день это самый лучший способ не инвазивной диагностики структурных изменений органов дыхания. Разрешающая способность компьютерной томографии в десятки раз превышает возможности обычной рентгенографии. Томограф позволяет провести детальную оценку состояния любого органа грудной клетки на структурном уровне с точностью до миллиметров. Помимо этого возможно точно измерить размеры патологических очагов, точно указать их локализацию, плотность, оценить их пропускную способность для крови (при контрастировании), создать трехмерные изображения и многое другое. В «Евромеде» мультиспиральная компьютерная томография проводится на уникальном 25-срезовом томографе SomatomDefinitionFlash — единственной установке за Уралом.
Томограф позволяет провести детальную оценку состояния любого органа грудной клетки на структурном уровне с точностью до миллиметров. Помимо этого возможно точно измерить размеры патологических очагов, точно указать их локализацию, плотность, оценить их пропускную способность для крови (при контрастировании), создать трехмерные изображения и многое другое. В «Евромеде» мультиспиральная компьютерная томография проводится на уникальном 25-срезовом томографе SomatomDefinitionFlash — единственной установке за Уралом.
Как правильно подготовиться к рентгеновским методам исследования?
Специальной подготовки не требуется. Если Вы являетесь носителем кардиостимулятора, об этом необходимо предупредить персонал рентгенологического кабинета. Желательно снять с шеи цепочки и украшения, которые могут помешать чтению снимков.
Фибробронхоскопия — эндоскопическое исследование с осмотром гортани, трахеи и бронхов. Выполняется под местной анестезией. Переоценить это исследование очень трудно, поскольку информация получаемая при его выполнении порой единственно точная. Фибробронхоскопия позволяет не только осмотреть слизистую оболочку дыхательных путей, но и произвести биопсию новообразований, взять смыв стенки слизистой оболочки на бактериологический посев, простую микроскопию и т.д. Фибробронхоскопия это и лечебный метод, позволяющий выполнить санацию трахео-бронхиального дерева.
Фибробронхоскопия позволяет не только осмотреть слизистую оболочку дыхательных путей, но и произвести биопсию новообразований, взять смыв стенки слизистой оболочки на бактериологический посев, простую микроскопию и т.д. Фибробронхоскопия это и лечебный метод, позволяющий выполнить санацию трахео-бронхиального дерева.
Как правильно подготовиться к фибробронхоскопии?
Исследование проводят утром натощак. Если Вам необходимо принять утром препараты (таблетки, капли, капсулы) – Вы можете это сделать, запив их количеством воды необходимым для этого, но не более. Если Вы страдаете сахарным диабетом, обязательно имейте при себе сахар или конфеты. Желательно больным с сахарным диабетом заранее позаботится о времени записи на исследование, и записаться не самые первые часы. В день исследование не следует курить (курить, вообще никогда не следует!!!). Пользоваться ингаляторами можно.
Эхокардиография (ЭХОКГ) — ультразвуковой метод исследования сердца, который очень важен в пульмонологии, поскольку многие хронические заболевания легких приводят к вторичным изменениям в сердце, усугубляющим тяжесть заболевания. С другой стороны, болезни сердца, могут проявляться легочными жалобами (одышка, кашель, кровохарканье). ЭХОКГ позволяет провести измерения размеров камер сердца, толщину миокарда, оценить состояние клапанного аппарата сердца. Важным методом диагностики, используемым при ЭХОКГ, является допплерометрия с измерением давления в легочной артерии.
С другой стороны, болезни сердца, могут проявляться легочными жалобами (одышка, кашель, кровохарканье). ЭХОКГ позволяет провести измерения размеров камер сердца, толщину миокарда, оценить состояние клапанного аппарата сердца. Важным методом диагностики, используемым при ЭХОКГ, является допплерометрия с измерением давления в легочной артерии.
Как правильно подготовиться к эхокардиографии?
Специальной подготовки не требуется. Желательно не пить перед исследованием кофе или крепкий чай, что бы не провоцировать учащенное сердцебиение.
3. Лабораторные методы диагностики, широко используемые в пульмонологии.
Исследование мокроты. Мокрота – это продукт работы специальных желез, расположенных в слизистой оболочке трахеи и бронхов. При различных заболеваниях количество, состав и характер мокроты изменяется, и она может стать ключом к правильному диагнозу. В мокроте можно обнаружить возбудителей болезни (палочка туберкулеза, грибы и т.д. ), можно выявить клеточные элементы, свидетельствующие об аллергии (эозинофилия при бронхиальной астме) и многое другое. Существуют разные методы исследования мокроты: простая цито и бактериоскопия, посев мокроты на стерильность и т.д.
), можно выявить клеточные элементы, свидетельствующие об аллергии (эозинофилия при бронхиальной астме) и многое другое. Существуют разные методы исследования мокроты: простая цито и бактериоскопия, посев мокроты на стерильность и т.д.
Специальной подготовки не требуется. Желательно не пить перед исследованием кофе или крепкий чай, что бы не провоцировать учащенное сердцебиение.
Как правильно подготовиться к сдаче мокроты?
Мокроту сдают в специальную посуду (стерильную или нет). Предварительно нужно очень тщательно прополоскать рот. Чистить зубы ненужно, поскольку кровь из десен может смешаться с мокротой и дать ложный результат. Только после гигиены полости рта можно откашливать и сплевывать мокроту.
Если кашель сухой или мокрота очень плохо откашливается – высок риск сдать вместо мокроты слюну. Во избежание этого проводится индукция мокроты. Для получения индуцированной мокроты используют гипертонический раствор хлорида натрия (очень крепкий раствор поваренной соли), который ингалируют обычным способом (дышат над емкостью с горячим солевым раствором) вместе с этим можно использовать Лазолван ингалируемый через небулайзер.
Функциональная диагностика
В Центре физиологии и патологии дыхания Вы можете пройти функциональную диагностику бронхо-легочной системы, сердечно-сосудистой системы и нервной системы.
Функциональная диагностика в пульмонологии:
Специалисты Центра физиологии и патологии дыхания имеют уникальный многолетний опыт работы в диагностике состояния дыхательной системы.
- Спирометрия (спирография) – применяется для оценки функции внешнего дыхания. Данный метод позволяет оценить объем легких, проходимость дыхательных путей, емкость входа и выхода.
Наши специалисты проводят спирометрию в нескольких режимах: во время спокойного дыхания, при резком и ускоренном выдохе, после физической нагрузки, а также после использования лекарственных препаратов, таких как беродуал, беротек, сальбутамол и атровент.
Спирометрия является одним из обязательных пунктов программы диагностики и лечения таких заболеваний органов дыхания как: бронхиальной астма, хронический бронхит, хроническая обструктивная болезнь легких и т. д.
д.
- Бодиплетизмография – экспертный метод оценки вентиляционной функции легких путем сопоставления показателей спирографии с показателями механического колебания грудной клетки во время дыхательного цикла.
На сегодняшний день это наиболее информативный метод определения общей емкости легких, позволяющий оценить все легочные объемы (включая остаточный объем), сопротивление дыхательных путей, а также состояние мембраны легочных альвеол.
Бодиплетизмография выполняется в специальной закрытой герметичной кабине с постоянным объемом воздуха. Пациент дышит через мундштук, соединенный с открытой в атмосферу дыхательной трубкой. Открытие и закрытие дыхательной трубки производится автоматически с помощью электронного устройства. Во время исследования вдыхаемый и выдыхаемый поток воздуха пациента измеряют с помощью спирографа.
Показания к проведению бодиплетизмографии:
- Ранняя диагностика заболевания легких и определение степени тяжести
- Подозрение на интерстициальные заболевания легких, эмфизему легких
- Дифференциальная диагностика обструктивного и рестриктивного типа вентиляционных нарушений
- Выявление смешанного типа нарушений вентиляционной функции легких при ХОБЛ, бронхиальной астме.

- Пульсоксиметрия – измеряет степень насыщения кислородом капиллярной крови.
Функциональная диагностика сердечно-сосудистой системы:
1. Велоэргометрия – это электрокардиографическое обследование (ЭКГ) с применением дозированной физической нагрузки.
Позволяет определить:
- Состояние сердечно-сосудистой системы
- Степень тяжести ишемической болезни сердца
- Уровень эффективности лечения ишемической болезни сердца
- Реакцию артериального давления на физическую нагрузку
- Нарушения ритма
- Уровень выносливости
2.ЭКГ (электрокардиограмма) –один из самых простых, доступных и информативных методов диагностики заболеваний сердца. Он основан на регистрации электрических импульсов, возникающих в сердце, и их графической записи в виде зубцов на специальную бумажную пленку.
 С помощью ЭКГ можно диагностировать множество различных заболеваний сердца (ишемическая болезнь сердца, инфаркт миокарда, аритмии, экстрасистолии и т.д.).
С помощью ЭКГ можно диагностировать множество различных заболеваний сердца (ишемическая болезнь сердца, инфаркт миокарда, аритмии, экстрасистолии и т.д.).3. ЭКГ с физической нагрузкой – информативный метод диагностики патологии сердечно-сосудистой системы до и после активного состояния. Такое обследования назначают при перебоях в работе сердца, боли за грудиной, дискомфорте и сдавлении за грудиной, одышке. Первый раз ЭКГ проводится в покое, затем пациент делает 20 приседаний, и ЭКГ снимается повторно.
4. Суточное мониторирование ЭКГ по холтеру — дает возможность отслеживать изменения в работе сердца и контролировать артериальное давление пациента в течение суток в условиях его естественной активности, расширяя диагностические возможности электрокардиографии.
Метод незаменим для:
- Локализации ишемической болезни сердца
- Определения взаимосвязи проявления стенокардии, а также бессимптомной ишемической болезни сердца с изменениями показателей ЭКГ и условиями возникновения патологий;
- Оценки нарушений ритма
- Выявления показаний к установке электрокардиостимулятора
Функциональная диагностика нервной системы:
1. Реоэнцефалография (РЭГ) –
Реоэнцефалография (РЭГ) –
метод, позволяющий осуществлять длительное наблюдение за состоянием мозгового кровообращения. Исследование заключается в регистрации колебаний электрического сопротивления тканей при прохождении через них слабого электрического тока высокой частоты.
Показанием для реоэнцефалографии являются головные боли и головокружения, черепно-мозговые травмы, внутричерепная гипертензия, нарушения кровообращения в связи с сужением или деформацией сосудов головного мозга.
2. Электроэнцефалография (ЭЭГ) — позволяет регистрировать спонтанную электрическую активность головного мозга с помощью размещенных на поверхности головы электродов, в результате чего можно оценить функциональное состояние коры головного мозга, а также степень имеющегося поражения и локализацию очага.
 Метод позволяет визуализировать движение крови в кровеносных сосудах, оценивать скорость и направление кровотока, а также выявлять препятствия, нарушающие кровообращение.
Метод позволяет визуализировать движение крови в кровеносных сосудах, оценивать скорость и направление кровотока, а также выявлять препятствия, нарушающие кровообращение.Основные показания к УЗДГ:
- Шум в голове
- Головные боли, мигрени, головокружения
- Артериальная гипертензия
- Выраженный остеохондроз
- Эпизоды внезапной потери сознания
- Эпизоды внезапной слабости, онемения руки или ноги, нарушения речи
- Длительное повышение уровня холестерина в крови
- Ишемическая болезнь сердца, стенокардия, инфаркт миокарда
4. Полисомнография – метод длительной регистрации различных параметров жизнедеятельности организма во сне в режиме реального времени.
Данное исследование позволяет определить стадии сна, их длительность, а также соотношение различных физиологических показателей со стадиями сна. Благодаря этому можно понять является ли нарушение сна первичным, или же, наоборот, сон страдает вторично вследствие соматических проблем, например, нарушения дыхания или болевого синдрома.
Определение точного механизма нарушения сна позволяет выбрать успешную тактику лечения и предупредить дальнейшее неблагоприятное течение заболевания.
Основные показания для проведения исследования:
- Нарушения сна: трудности с засыпанием, снижение общей продолжительности сна и его качества
- Храп или остановки дыхания во время сна
- Избыточная двигательная активность во сне (частая смена положения тела, непроизвольные движения конечностей и т.п.)
- Избыточная дневная сонливость, пониженная концентрация внимания, быстрая утомляемость
Данное исследование производится в амбулаторных условиях. Врач закрепляет электроды на теле обследуемого, после чего пациент отправляется домой, где ему необходимо уснуть
Приборы регистрируют такие параметры, как храп, дыхание, насыщение крови кислородом, активность мозга (энцефалограмма), движения глаз (электроокулограмма), тонус мышц (электромиограмма), движения ног, изменения положения тела. Полученная информация обрабатывается и в зависимости от установленной причины нарушения сна назначается либо дополнительное обследование, либо лечение.
Полученная информация обрабатывается и в зависимости от установленной причины нарушения сна назначается либо дополнительное обследование, либо лечение.
Врач-функциональной диагностики
Функциональная диагностика
Цена
Электрокардиография (ЭКГ)
350
ЭКГ с применением медикаментозных проб
500
ЭКГ с физическими упражнениями
650
ЭКГ с применением нагрузки на велоэргометре для выявления скрытой коронарной недостаточности
1500
Суточное мониторирование ЭКГ+реопульмонография (определение апноэ сна)
800
Суточное мониторирование ЭКГ+АД+реопульмонография
1000
Пульсоксиметрия
150
Пульсоксиметрия с диагностикой апноэ сна
900
Полисомнография
4900
Подбор режимов CPАР-терапии (для коррекции ночного апноэ и храпа)
1800
Спирометрия с определением кривой поток-объем
500
Спирометрия с определением кривой поток-объем с физическими упражнениями на определение постнагрузочного бронхоспазма
750
Исследование реактивности дыхательных путей: бронходилатационная проба с симпатомиметиком
600
Исследование реактивности дыхательных путей: бронходилатационная проба с холинолитиком
600
Исследование реактивности дыхательных путей: бронходилатационная проба с применением комбинированного бронхолитика (беродуал)
650
Исследование реактивности дыхательных путей: проба изокапнической гипервентиляцией холодным воздухом для диагностики холодовой гиперреактивности дыхательных путей
1500
Исследование реактивности дыхательных путей: ингаляционная провокационная проба с дистиллированной водой
1500
Исследование реактивности дыхательных путей: провокационная проба с дозированной физической нагрузкой для оценки постнагрузочного бронхоспазма
1500
Эргоспирометрия
3000
Бодиплетизмография
1200
Определение бронхиального сопротивления методом перекрытия + спирометрия
500
Определение диффузионной способности лёгких
1200
Суточный мониторинг бронхиальной проходимости методом пикфлоуметрии
300
Измерение температуры выдыхаемого воздуха
150
Риноманометрия
500
Выписка дубликатов
100
Электроэнцефалография (ЭЭГ)
600
Реоэнцефалография (РЭГ)
400
Ультразвуковая допплерография сосудов шеи и головного мозга (УЗДГ)
600
Возможности лабораторных методов исследования в дифференциальной диагностике заболеваний дыхательных путей | Игнатова Г.
 Л., Антонов В.Н.
Л., Антонов В.Н.
В статье представлены основные лабораторные методы исследования, применяемые при диагностике и дифференциальной диагностике хронических респираторных заболеваний
Актуальность
Заболевания органов дыхания являются наиболее актуальной проблемой современного здравоохранения [1, 2]. Во всем мире наблюдается рост острых и хронических респираторных заболеваний (ХРЗ). Всемирная организация здравоохранения (ВОЗ) уделяет данной проблеме немалое внимание. Под эгидой ВОЗ в 2006 г. был создан Всемирный альянс по борьбе с хроническими респираторными заболеваниями (GARD С Global Alliance against Chronic Respiratory Diseases). Деятельность данной организации является частью глобальной работы по профилактике хронических заболеваний и борьбе с ними. По мнению ВОЗ, необходимо предпринять усилия по улучшению диагностики и медицинского обслуживания населения. Во многих странах недостатки диагностики большинства ХРЗ влекут недостаточность лечения данных заболеваний, а в некоторых случаях имеется дефицит основных лекарственных средств. К числу наиболее распространенных ХРЗ эксперты ВОЗ относят бронхиальную астму (БА), хроническую обструктивную болезнь легких (ХОБЛ), аллергические проявления респираторных заболеваний, профессиональные заболевания легких и легочную гипертензию (ЛГ). Основными факторами риска развития данных заболеваний являются курение табака, загрязнение воздуха вне и внутри помещений, различные аллергены, профессиональные факторы риска [1].
К числу наиболее распространенных ХРЗ эксперты ВОЗ относят бронхиальную астму (БА), хроническую обструктивную болезнь легких (ХОБЛ), аллергические проявления респираторных заболеваний, профессиональные заболевания легких и легочную гипертензию (ЛГ). Основными факторами риска развития данных заболеваний являются курение табака, загрязнение воздуха вне и внутри помещений, различные аллергены, профессиональные факторы риска [1].
В клинической практике врачи первичного звена и пульмонологи сталкиваются как с изолированными формами данных заболеваний, так и с их сочетанным течением.
БА и ХОБЛ: для каждого заболевания характерны различные фенотипы, но у 10Р20% больных присутствуют признаки как ХОБЛ, так и БА [3]. В 2014 г. впервые выделен фенотип перекреста БА и ХОБЛ (ACOS: asthma-COPD overlap syndromе С синдром перекрывания астмы и ХОБЛ). Выявление данного синдрома позволяет прежде всего пульмонологу назначать рациональную терапию, в частности ингаляционные глюкокортикостероиды (ИГКС).
БА и аллергические заболевания: до 80% пациентов с симптомами БА имеют признаки тех или иных аллергических заболеваний [4]. В то же время наличие атопии не всегда говорит о присутствии у больного БА.
Профессиональные заболевания: в классификации основных профессиональных заболеваний особой строкой прописаны БА и ХОБЛ, развивающиеся вследствие воздействия промышленных аллергенов и ирритантов, вызывающих хронический воспалительный процесс [5].
ЛГ и ее прямое следствие С хроническое легочное сердце являются наиболее частыми осложнениями
ХРЗ [6].
Немаловажное значение при диагностике ХРЗ имеют лабораторные методы исследования. Особый вес они приобретают при дифференциальной диагностике, т. к. большинство пульмонологических заболеваний имеют схожие респираторные проявления.
Анализ крови
Общий анализ крови
Общий анализ крови (ОАК) относится к обязательным лабораторным методам исследования, рекомендованным международными и отечественными клиническими рекомендациями по соответствующим нозологиям, а также входит в алгоритмы оказания медицинской помощи согласно медико-экономическим стандартам [7, 8].
ОАК включает в себя определение концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов, скорости оседания эритроцитов (СОЭ), подсчет лейкоцитарной формулы. Последнее особенно важно в свете новых рекомендаций GOLD (Global Initiative for Chronic Obstructive Lung Disease С Глобальная инициатива по ХОБЛ) и GINA (Global Initiative for Asthma С Глобальная инициатива по бронхиальной астме) при учете эозинофильного воспаления у пациентов с БА и ХОБЛ. Референсные значения нормы составляют от 50 до 250 клеток в 1 мкл. Критическим уровнем является 450 клеток в 1 мкл, что указывает на патологический процесс, связанный с возможным влиянием эозинофилов на воспалительный процесс. При этом, как подчеркивают некоторые авторы, гиперэозинофилия может не коррелировать с тканевой эозинофилией и содержанием эозинофилов в бронхоальвеолярном лаваже [9]. Кроме того, уровень эозинофилов в периферической крови является важным показателем при решении вопроса о применении ИГКС у пациентов с ХОБЛ, а также при эскалации или деэскалации терапии.
Острофазовые белки
Острофазовые белки (ОБ) С это белки коагуляции, транспортные белки, которые также являются медиаторами иммунной системы. ОБ непосредственно участвуют в процессах элиминации повреждающих факторов, способствуют локализации очага повреждения и восстановлению нарушенной структуры клеток и органов, а также их функций. Фибриноген в большей степени имеет отношение к сосудистым реакциям при воспалении, в то же время другие маркеры, будучи многофункциональными, участвуют в реализации многочисленных иммунных процессов [10].
С-реактивный белок (СРБ) С стимулятор иммунных реакций, в т. ч. фагоцитоза, принимает участие в Т- и В-иммунных ответах, активирует классическую систему комплемента. Синтез СРБ происходит преимущественно в гепатоцитах, инициируется антигенами, иммунными комплексами, бактериями, грибами, при травме. Как правило, СРБ в сыворотке здорового человека отсутствует, за исключением некоторых физиологических процессов [10]. Тест на СРБ имеет прямую корреляцию с СОЭ. Оба показателя резко возрастают в начале заболевания, но СРБ реагирует раньше, чем изменяется СОЭ. В лабораторной диагностике этот тест применяется для наблюдения за течением заболевания и контроля эффективности проводимой терапии. Кроме того, концентрация СРБ в крови ассоциирована с активностью заболевания и стадией процесса.
Тест на СРБ имеет прямую корреляцию с СОЭ. Оба показателя резко возрастают в начале заболевания, но СРБ реагирует раньше, чем изменяется СОЭ. В лабораторной диагностике этот тест применяется для наблюдения за течением заболевания и контроля эффективности проводимой терапии. Кроме того, концентрация СРБ в крови ассоциирована с активностью заболевания и стадией процесса.
Уровень фибриногена имеет тенденцию к увеличению при различных воспалительных реакциях, это чувствительный маркер воспаления и некроза тканей, основной белок плазмы, напрямую влияющий на скорость оседания эритроцитов. С ростом концентрации фибриногена СОЭ также увеличивается. Рост концентрации фибриногена в плазме, в т. ч. при нормальных значениях, коррелирует с увеличением риска осложнений сердечно-сосудистых заболеваний.
Прокальцитонин (ПКТ) является более специфичным маркером бактериальной инфекции, чем СРБ. Является предшественником гормона кальцитонина и вырабатывается несколькими типами клеток в различных органах под влиянием провоспалительных агентов, в первую очередь бактерий. Уровень ПКТ выше 2 нг/мл с высокой вероятностью свидетельствует об инфекционной природе воспаления [11]. Контроль динамики уровня ПКТ может служить дополнительным высокоинформативным методом оценки эффективности проводимой терапии при инфекционном процессе.
Уровень ПКТ выше 2 нг/мл с высокой вероятностью свидетельствует об инфекционной природе воспаления [11]. Контроль динамики уровня ПКТ может служить дополнительным высокоинформативным методом оценки эффективности проводимой терапии при инфекционном процессе.
Натрийуретические пептиды
У 60% пациентов старше 65 лет наблюдается сочетанное течение ХРЗ, чаще всего с сердечно-сосудистыми заболеваниями. На этом этапе чрезвычайно важна дифференциальная диагностика одышки, как наиболее частого симптома при коморбидных заболеваниях. Определенную помощь в этом вопросе оказывает определение натрийуретических пептидов С BNP и NT-proBNP.
Для исключения хронической сердечной недостаточности принято использовать порог менее 125 пг/мл для возраста до 75 лет; порог менее 450 пг/мл для возраста старше 75 лет; для исключения острой сердечной недостаточности С менее 300 пг/мл [12].
Иммуноглобулин Е
IgE был выделен в 1960-х гг. из сывороток больных атопией и множественной миеломой. При контакте IgE, адсорбированного на клетках, с аллергеном образуются комплексы « IgE-специфический антиген», что сопровождается проникновением ионов кальция внутрь клетки-мишени, активацией в ней различных биохимических процессов и повышением концентрации гистамина и других биологически активных веществ (БАВ) из тучных клеток, базофилов и эозинофилов, на мембране которых как раз и фиксированы IgE. Поступление вышеперечисленных БАВ в межклеточное пространство сопровождается местной воспалительной реакцией, которую в клинике мы видим в виде ринита, бронхита, БА, анафилактического шока [13].
из сывороток больных атопией и множественной миеломой. При контакте IgE, адсорбированного на клетках, с аллергеном образуются комплексы « IgE-специфический антиген», что сопровождается проникновением ионов кальция внутрь клетки-мишени, активацией в ней различных биохимических процессов и повышением концентрации гистамина и других биологически активных веществ (БАВ) из тучных клеток, базофилов и эозинофилов, на мембране которых как раз и фиксированы IgE. Поступление вышеперечисленных БАВ в межклеточное пространство сопровождается местной воспалительной реакцией, которую в клинике мы видим в виде ринита, бронхита, БА, анафилактического шока [13].
Как указывает ряд авторов, при анализе уровня IgE необходимо учитывать некоторые особенности и диагностические ограничения.
При определении специфического IgE не следует преувеличивать его диагностическую роль и диагноз аллергии выставлять лишь на основании этого показателя.
Обнаружение аллерген-специфического IgE не является 100% патогномоничным.
В то же время отсутствие специфического IgE или его низкая концентрация в сыворотке периферической крови не исключает возможности участия IgE-зависимого механизма.
Антитела других классов иммуноглобулинов, имеющие высокую специфичность для данного аллергена, особенно класса IgG, могут в некоторых случаях стать причиной ложноотрицательных результатов.
Высокие концентрации общего IgE, к примеру у отдельных больных атопическим дерматитом, могут давать ложноположительные результаты.
Сходные результаты для различных аллергенов не означают их одинакового клинического значения, т. к. способность к связыванию с IgE у разных аллергенов может различаться [13].
Для определения сенсибилизации к респираторным аллергенам и оценки вероятности аллергического характера патологии при неясной симптоматике у пациентов с заболеваниями верхних дыхательных путей применяется тест Phadiatop ImmunoCAP. Он направлен на выявление IgE к смеси наиболее распространенных ингаляционных аллергенов (пыльцы деревьев, трав, аллергенов шерсти домашних животных, клещей домашней пыли, плесени). Это исследование предназначено для первичного скрининга с учетом возможной одновременной сенсибилизации к разным аллергенам или перекрестной сенсибилизации с охватом аллергенов, которые обычно являются основой развития атопии.
Это исследование предназначено для первичного скрининга с учетом возможной одновременной сенсибилизации к разным аллергенам или перекрестной сенсибилизации с охватом аллергенов, которые обычно являются основой развития атопии.
Эозинофильный катионный белок
Эозинофильный катионный белок (eosinophilic cationic protein С ECP) представляет собой один из компонентов специфических секреторных гранул эозинофилов человека. Основные свойства ЕСР обусловлены высоким содержанием аргинина. ECP связан с механизмами антигельминтной, антибактериальной, противоопухолевой, а также определенной противовирусной активности эозинофилов. Выраженное эозинофильное воспаление, которое наблюдается при аллергической реакции, может приводить к повреждению собственных тканей, одним их механизмов которого является токсическое действие ECP. Уровень ECP в большинстве случаев коррелирует с тяжестью клинических симптомов БА, отражая выраженность эозинофильного компонента воспаления, и может служить маркером определения тяжести БА с определенными ограничениями. У пациентов с атопией наблюдаются более высокие концентрации ECP, даже когда число эозинофилов в периферической крови имеет нормальные значения. В условиях широкого применения иммунобиологических препаратов для таргетной терапии важно, что уровень ECP превышает норму как при IgE-опосредованной, так и при не-IgE-опосредованной атопии.
У пациентов с атопией наблюдаются более высокие концентрации ECP, даже когда число эозинофилов в периферической крови имеет нормальные значения. В условиях широкого применения иммунобиологических препаратов для таргетной терапии важно, что уровень ECP превышает норму как при IgE-опосредованной, так и при не-IgE-опосредованной атопии.
Определение a1-антитрипсина
В Федеральных клинических рекомендациях по ведению пациентов с ХОБЛ подчеркивается, что пациентам с ХОБЛ моложе 45 лет, пациентам с быстрым прогрессированием ХОБЛ или при наличии эмфиземы преимущественно в базальных отделах легких рекомендуется определять уровень α1-антитрипсина в крови [8].
Связь дефицита α1-антитрипсина с повышенным риском развития эмфиземы легких была впервые показана в работах Laurell и Eriksson, которые в 1963 г. описали отсутствие α1-фракции у больных с панацинарной эмфиземой [14]. В дальнейшем была описана связь врожденного дефицита данного белка с заболеваниями печени. При воспалительном процессе в легочной ткани α1-антитрипсин подавляет функцию эластазы, выделяющейся из нейтрофилов, предотвращая деградацию белка соединительной ткани (эластина) в стенках альвеол и развитие эмфиземы легких. Он модулирует локальный иммунный ответ, обладает антиоксидантным и антимикробным действием, ингибирует протеолитические ферменты апоптоза. Концентрация α1-антитрипсина значительно повышается при остром воспалении различной этиологии, инфекционных, ревматических заболеваниях, злокачественных процессах, при заместительной терапии эстрогенами, приеме пероральных контрацептивов, повышении уровня эстрогенов при беременности, воспалительных процессах в гепатоцитах. Дефицит α1-антитрипсина коррелирует с высоким риском развития патологии легких [8].
При воспалительном процессе в легочной ткани α1-антитрипсин подавляет функцию эластазы, выделяющейся из нейтрофилов, предотвращая деградацию белка соединительной ткани (эластина) в стенках альвеол и развитие эмфиземы легких. Он модулирует локальный иммунный ответ, обладает антиоксидантным и антимикробным действием, ингибирует протеолитические ферменты апоптоза. Концентрация α1-антитрипсина значительно повышается при остром воспалении различной этиологии, инфекционных, ревматических заболеваниях, злокачественных процессах, при заместительной терапии эстрогенами, приеме пероральных контрацептивов, повышении уровня эстрогенов при беременности, воспалительных процессах в гепатоцитах. Дефицит α1-антитрипсина коррелирует с высоким риском развития патологии легких [8].
Исследование мокроты
Цитология мокроты. Клеточный состав индуцированной мокроты может характеризовать тип воспаления, который определяют по содержанию в мокроте эффекторных воспалительных клеток С эозинофилов, нейтрофилов, лимфоцитов, макрофагов. В настоящее время принято различать 4 клеточных фенотипа: 1) эозинофильный, если количество эозинофилов более 2%; 2) нейтрофильный при числе нейтрофилов 61% и выше; 3) смешанный; 4) неэозинофильный (менее 2% клеток) и ненейтрофильный (менее 61% клеток) [8, 15].
В настоящее время принято различать 4 клеточных фенотипа: 1) эозинофильный, если количество эозинофилов более 2%; 2) нейтрофильный при числе нейтрофилов 61% и выше; 3) смешанный; 4) неэозинофильный (менее 2% клеток) и ненейтрофильный (менее 61% клеток) [8, 15].
Определение данных фенотипов имеет чрезвычайно важное значение в выборе терапии, в частности при назначении ИГКС или антибактериальных препаратов.
Бактериологический анализ мокроты имеет диагностическое значение только при инфекционном обострении заболеваний, а также при определении чувствительности к антибиотикам [8].
Заключение
Основу диагностики и дифференциальной диагностики основных респираторных заболеваний конечно же составляют клинические методы исследования. Тщательный сбор анамнеза, учет различных нюансов эпидемиологии, особенностей индивидуума обеспечивают до 90% точности диагноза. В этой связи нельзя не вспомнить блестящие клинические описания болезней классиков русской терапевтической школы, когда диагноз напрямую был связан с опытом и наблюдательностью врача. Применение современных методов диагностики существенно облегчает постановку диагноза, но и может увести от правильной трактовки клинической ситуации. В этой связи становится актуальным тщательный анализ всех полученных клинических, лабораторных, инструментальных методов диагностики. Только сопоставив и тщательно взвесив все данные, думающий врач может прийти к единственно правильному решению.
Применение современных методов диагностики существенно облегчает постановку диагноза, но и может увести от правильной трактовки клинической ситуации. В этой связи становится актуальным тщательный анализ всех полученных клинических, лабораторных, инструментальных методов диагностики. Только сопоставив и тщательно взвесив все данные, думающий врач может прийти к единственно правильному решению.
Большинство лабораторных показателей не имеют 100% патогномоничного значения. Риск врачебной ошибки при этом повышается. Задача клинициста и врача лабораторной диагностики С свести этот риск к минимуму. Поэтому правильная интерпретация лабораторных показателей с учетом всех возможных нюансов играет важную роль в клинической медицине.
.
Диагностика заболеваний легких на основе протеомного анализа конденсата выдыхаемого воздуха | Анаев
1. Konstantinidi E.M., Lappas A. S., Tzortzi A.S., Behrakis P.K. Exhaled Breath Condensate: Technical and Diagnostic Aspects. Scientific World Journal. 2015; 2015: 435160. DOI: 10.1155/2015/435160.
S., Tzortzi A.S., Behrakis P.K. Exhaled Breath Condensate: Technical and Diagnostic Aspects. Scientific World Journal. 2015; 2015: 435160. DOI: 10.1155/2015/435160.
2. Borrill Z.L., Roy K., Singh D. Exhaled breath condensate biomarkers in COPD. Eur. Respir. J. 2008; 32 (2): 472–486. DOI: 10.1183/09031936.00116107.
3. Bloemen K., Hooyberghs J., Desager K. et al. Non-invasive biomarker sampling and analysis of the exhaled breath proteome. Proteomics Clin. Appl. 2009; 3 (4): 498–504. DOI: 10.1002/prca.200800095.
4. Lin J.L., Bonnichsen M.H., Nogeh E.U. et al. Proteomics in detection and monitoring of asthma and smoking-related lung diseases. Exp. Rev. Proteomics. 2010; 7 (3): 361–372. DOI: 10.1586/epr.10.9.
5. Lim M.Y., Thomas P.S. Biomarkers in exhaled breath condensate and serum of chronic obstructive pulmonary disease and non-small-cell lung cancer. Int. J. Chronic Dis. 2013; 2013: 578613. DOI: 10.1155/2013/578613.
Lim M.Y., Thomas P.S. Biomarkers in exhaled breath condensate and serum of chronic obstructive pulmonary disease and non-small-cell lung cancer. Int. J. Chronic Dis. 2013; 2013: 578613. DOI: 10.1155/2013/578613.
6. Nobakht M. Gh B.F., Aliannejad R., Rezaei-Tavirani M. et al. The metabolomics of airway diseases, including COPD, asthma and cystic fibrosis. Biomarkers. 2015; 20 (1): 5–16. DOI: 10.3109/1354750X.2014.983167.
7. Terracciano R., Pelaia G., Preiano M., Savino R. Asthma and COPD proteomics: current approaches and future directions. Proteomics Clin. Appl. 2015; 9 (1–2): 203–220. DOI: 10.1002/prca.201400099.
8. Czitrovszky A., Szymanski W., Nagy A., Jani P. A new method for the simultaneous measurement of particle size, complex refractive index and particle density. Meas Sci. Technol. 2002; 13: 303–308.
Meas Sci. Technol. 2002; 13: 303–308.
9. Horvath I., Lazar Z., Gyulai N. et al. Exhaled biomarkers in lung cancer. Eur. Respir. J. 2009; 34 (1): 261–275. DOI: 10.1183/09031936.00142508.
10. Lee Y.T., Chen S.C., Shyu L.Y. et al. Significant elevation of plasma cathepsin B and cystatin C in patients with community-acquired pneumonia. Clin. Chim. Acta. 2012; 413 (5–6): 630–635. DOI: 10.1016/j.cca.2011.12.010.
11. Buszewski B., Kesy M., Ligor T., Amann A. Human exhaled air analytics: biomarkers of diseases. Biomed Chromatogr. 2007; 21 (6): 553–566.
12. Conrad D.H., Goyette J., Thomas P.S. Proteomics as a method for early detection of cancer: a review of proteomics, exhaled breath condensate, and lung cancer screening. J. Gen. Intern. Med. 2008; 23 (Suppl. 1): 78–84. DOI: 10.1007/s11606-007-0411-1.
13. Horvath I., Hunt J., Barnes P.J. Exhaled breath condensate: methodological recommendations and unresolved questions. Eur. Respir. J. 2005; 26 (3): 523–548.
14. Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких. Пересмотр 2014 года. Доступно на: http://goldcopd.org/wp-content/uploads/2016/04/GOLD-Report-Russian2014.pdf
15. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Российское респираторное общество (РРО). Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ). Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых. Пульмонология. 2014; (4): 13–48.
16. Бычков М.Б., Горбунова В.А. Ассоциация онкологов России. Клинические рекомендации по диагностике и лечению больных раком легкого. М.; 2014. Доступно на: http://oncology-association.ru/docs/recomend/may2015/19vz-rek.pdf
17. Kurova V., Anaev E., Kononikhin A. et al. Proteomics of exhaled breath: methodological nuances and pitfalls. Clin. Chem. Lab. Med. 2009; 47 (6): 706–712. DOI: 10.1515/CCLM.2009.166.
18. Ishihama Y., Rappsilber J., Andersen J.S., Mann M. Microcolumns with self-assembled particle frits for proteomics. J. Chromatogr. A. 2002; 979 (1–2): 233–239.
19. Nesvizhskii A., Keller A., Kolker E., Aebersold R. A statistical model for identifying proteins by tandem mass spectrometry. Anal. Chem. 2003; 75 (17): 4646–4658.
20. Hoffmann H., Tabaksblat L., Enghild J., Dahl R. Human skin keratins are the major proteins in exhaled breath condensate. Eur. Respir. J. 2008; 31 (2): 380–384. DOI: 10.1183/09031936.00059707.
21. Schittek B., Hipfel R., Sauer B. et al. Dermcidin: a novel human antibiotic peptide secreted by sweat glands. Nat. Immunol. 2001; 2 (12): 1133–1137.
22. Ghosh R., Maji U.K., Bhattacharya R., Sinha A.K. The role of dermcidin isoform 2: a two-faceted atherosclerotic risk factor for coronary artery disease and the effect of acetyl salicylic acid on it. Thrombosis. 2012; 2012: 987932. DOI: 10.1155/2012/987932.
23. Lee Motoyama J.P., Kim-Motoyama H., Kim P. et al. Identification of dermcidin in human gestational tissue and characterization of its proteolytic activity. Biochem. Biophys. Res. Commun. 2007; 35 7(4): 828–833.
24. Cunningham T.J., Hodge L., Speicher D. et al. Identification of a survival-promoting peptide in medium conditioned by oxidatively stressed cell lines of nervous system origin. J. Neurosci. 1998; 18: 7047–7060.
25. Stewart G.D., Skipworth R.J., Pennington C.J. et al. Variation in dermcidin expression in a range of primary human tumours and in hypoxic/oxidatively stressed human cell lines. Br. J. Cancer. 2008; 99 (1): 126–132. DOI: 10.1038/sj.bjc.6604458.
26. Yano C.L., Ventrucci G., Field W.N. et al. Metabolic and morphological alterations induced by proteolysis-inducing factor from Walker tumour-bearing rats in C2C12 myotubes. BMC Cancer. 2008; 8: 24. DOI: 10.1186/1471-2407-8-24.
27. Urade Y., Hayaishi O. Prostaglandin D synthase: Structure and function. Vitam. Horm. 2000; 58: 89–120.
28. Mizon C., Piva F., Queyrel V. et al. Urinary bikunin determination provides insight into proteinase / proteinase inhibitor imbalance in patients with inflammatory diseases. Clin. Chem. Lab. Med. 2002; 40 (6): 579–586.
29. Leclerc E.A., Gazeilles L., Serre G. et al. The ubiquitous dermokine delta activates Rab5 function in the early endocytic pathway. PLoS One. 2011; 6 (3): e17816. DOI: 10.1371/journal.pone.0017816.
30. Hasegawa M., Higashi K., Yokoyama C. et al. Altered expression of dermokine in skin disorders. J. Eur. Acad. Dermatol. Venereol. 2013; 27 (7): 867–875. DOI: 10.1111/j.1468-3083.2012.04598.x.
31. Kinnula V.L., Vuorinen K., Ilumets H. et al. Thiol proteins, redox modulation and parenchymal lung disease. Curr. Med. Chem. 2007; 14 (2): 213–222.
32. Poschmann G., Sitek B., Sipos B. et al. Identification of proteomic differences between squamous cell carcinoma of the lung and bronchial epithelium. Mol. Cell Proteomics. 2009; 8 (5): 1105–1116. DOI: 10.1074/mcp.M800422MCP200.
33. Spik I., Brenuchon C., Angeli V. et al. Activation of the prostaglandin D2 receptor DP2/CRTh3 increases allergic inflammation in mouse. J. Immunol. 2005; 174 (6): 3703–3708.
34. Wei N., Deng X.W. The COP9 signalosome. Annu. Rev. Cell Dev. Biol. 2003; 19: 261–286. DOI:10.1146/annurev.cellbio.19.111301.112449.
35. Wang Q., Li X., Ren S. et al. Serum levels of the cancertestis antigen POTEE and its clinical significance in nonsmall-cell lung cancer. PLoS One. 2015; 10 (4): e0122792. DOI: 10.1371/journal.pone.0122792.
36. Wood L., Maher J., Bunton T., Resar L. The oncogenic properties of the HMG-I gene family. Cancer Res. 2000; 60 (15): 4256–4261.
37. Resar L. The high mobility group A1 gene: transforming inflammatory signals into cancer? Cancer Res. 2010; 70 (2): 436–439. DOI: 10.1158/0008-5472.CAN-09-1212.
38. Walmer D., Padin C., Wrona M. et al. Malignant transformation of the human endometrium is associated with overexpression of lactoferrin messenger RNA and protein. Cancer Res. 1995; 55: 1168–1175.
39. Ziolkowski P., Wozniak M., Dus K., Wisniewski J. The NUCKS: A novel tumor biomarker. J. Mol. Biomark. Diagn. 2013; 4 (145): 1000145.
Институт заболеваний дыхательных путей, легких и легочных функций
Институт легочных заболеваний и легочной функции в медицинском центре Шамир — «Ассаф Арофе» действует уже 15 лет и предоставляет обслуживание пациентам с легочными заболеваниями, которые прибывают на консультации, наблюдение и диагностику. Также в институте проводятся оценки пациентов с риском перед операциями
Общая информация
В последние годы среди общественности наблюдается устойчивый рост числа заболеваний легких и обнаружения рака легких, в связи с курением. Этот тревожащий факт сделал Институт легочных заболеваний и легочной функции краеугольным камнем медицинского обслуживания, предоставляемого в медицинском центре Шамир — «Ассаф Арофе».
Об институте
Институт легочных заболеваний и легочной функции в медицинском центре Шамир — «Ассаф Арофе» действует уже 15 лет и предоставляет обслуживание пациентам с легочными заболеваниями, которые прибывают на консультации, наблюдение и диагностику. Также в институте проводятся оценки пациентов с риском перед операциями. Институт предоставляет консультации другим отделениям, в основном хирургическим отделениям и отделениям внутренних болезней в медицинском центре. В то же время институт предоставляет лечение пациентам, которым требуется неинвазивная поддержка дыхательной функции вследствие хронической дыхательной недостаточности. В рамках амбулаторно-поликлинической помощи для них индивидуально подбираются аппараты искусственного дыхания и давление воздуха. В институте действует также лаборатория сна, которая проводит тесты диагностики нарушений сна для пациентов с подозрением на апноэ во сне.
Оценка дыхательно-функционального состояния в институте проводится в модернизированной лаборатории для физиологическо-дыхательных тестов, поверки на обструктивные заболевания (например, астма, скрытая или открытая) и проверки на чувствительность. Также в институте проводятся стресс-тесты, в рамках которых проверяется сердечная и легочная функция с целью распознания источника одышки. В дополнение, в институте проводится диагностика рака легких или других тяжелых легочных заболеваний, таких как устойчивые к антибиотикам пневмонии и туберкулез.
Помимо продвинутых визуализаций, в институте проводятся также такие эндоскопические процедуры, как бронхоскопия, в рамках которой вводится видеоустройство через ноздрю в целях диагностики заболевания. Дополнительной проверкой является легочная биопсия под управлением КТ, которая позволяет взять образец ткани легкого посредством биопсийной иглы через грудную клетку или дренаж плевральной жидкости посредством введения трубок. В рамках этой проверки вводится оптическое устройство в плевральное пространство для диагностики и забора образца.
Лечения и процедуры
Отделение предлагает следующие услуги процедуры:
- Спирометрии
- Тесты объема легких
- Стресс-тесты на обструктивные заболевания, такие как астма
- Легочно-кардиологические стресс-тесты
- Бронхоскопия
- Легочная и плевральная биопсия
Отделение функциональной диагностики
Единый многоканальный телефон:
8 (812) 775-75-50 доб. 1150
Адрес:
г. Санкт-Петербург, Лиговский пр., д.2-4
Заведующий отделением:
Кирюхина Лариса Дмитриевна
Ведущий научный сотрудник (Руководитель направления «Клиническая физиология»), к.м.н., врач функциональной диагностики высшей квалификационной категории
Сотрудники
Основные направления исследований:
- Изучение нарушений механики дыхания и легочного газообмена при различных клинических формах туберкулеза органов дыхания в разные этапы консервативного лечения.
- Оценка функциональных возможностей аппарата внешнего дыхания у пациентов в до и послеоперационном периоде с учетом объема и характера хирургических вмешательств.
- Изучение возможности операционного риска у больных туберкулезом легких, кандидатов на удаление легочной ткани и коллапсохирургических операций с учетом современных методов исследования легочного газообмена и индекса коморбидности.
В амбулаторно-консультативном отделении института проводится углубленное обследование функционального состояния внешнего дыхания при различных заболеваниях легких (бронхиальная астма, хроническая обструктивная болезнь легких, саркоидоз легких, фиброзирующие альвеолиты и другие заболевания легких, в том числе и профессионально обусловленные).
Отделение оснащено самым современным оборудованием экспертного класса ведущего производителя аппаратуры для исследования функции внешнего дыхания Erich Jaeger (Viasys Healthcare, Hoechberg, Германия).
Функциональные исследования системы дыхания и сердечно-сосудистой системы проводят врач высшей квалификационной категории по функциональной диагностике, кандидат медицинских наук Л.Д.Кирюхина, врач . функциональной диагностики, кандидат медицинских наук Н.Г.Нефедова, врачи функциональной диагностики О.С.Володич, Е.В.Кокорина, Н.В.Денисова.
В амбулаторно-консультативном отделении института проводится обследование больных пульмонологического профиля (бронхиальная астма, хроническая обструктивная болезнь легких, интерстициальные заболевания легких, в том числе и профессионально обусловленные и др.).
Услуги отделения функциональной диагностики
- Спирометрия (ФВД)
- Бодиплетизмография
- Импульсная осциллометрия
- Исследование силы дыхательных мышц
- Пробы с бронхолитиками
- Бронхопровакационная проба с нагрузкой на велоэргометре
- Исследование диффузионной способности легких
- Кардиопульмональное нагрузочное тестирование
- ЭКГ
- ЭХО-КГ с допплерографическим исследованием (с оценкой давления в легочной артерии)
- Суточное мониторирование ЭКГ и АД
- Стресс-ЭКГ
Прием амбулаторных пациентов
Осуществляется на коммерческой основе по адресу:
Лиговский пр., д.2-4, Консультативно-поликлиническое отделение, каб. №7.
Запись по телефону: 8(812)775-75-55
Симптомы и диагностика ХОБЛ | Американская ассоциация легких
Что такое симптомы ХОБЛ?
Многие люди не распознают симптомы ХОБЛ до более поздних стадий заболевания. Иногда люди думают, что у них одышка или они менее способны заниматься своей обычной деятельностью, потому что они «только стареют». Одышка может быть важным признаком заболевания легких. Если вы испытываете какие-либо из этих симптомов или думаете, что подвержены риску развития ХОБЛ, важно обсудить это со своим врачом.
- Хронический кашель
- Одышка при выполнении повседневных дел (одышка)
- Частые респираторные инфекции
- Синюшность губ или ногтевого ложа (цианоз)
- Усталость
- Выделение большого количества слизи (также называемой мокротой или мокротой) )
- Свистящее дыхание
Помните: не ждите, пока симптомы станут серьезными, потому что драгоценное время на лечение может быть потеряно. Раннее выявление ХОБЛ — ключ к успешному лечению.
Диагностика ХОБЛ
Чтобы диагностировать хроническую обструктивную болезнь легких (ХОБЛ), которая включает хронический бронхит и эмфизему, ваш врач оценит ваши симптомы, запросит полную историю вашего здоровья, проведет медицинское обследование и изучит результаты анализов.
История болезни
Ваш врач захочет узнать, если вы:
- Курите или курили в анамнезе
- Вы подвергаетесь воздействию вторичного табачного дыма, загрязнения воздуха, химикатов или пыли
- Имеете такие симптомы, как одышка, хроническая кашель или много слизи
- Имейте членов семьи, у которых была ХОБЛ
Тестирование на ХОБЛ
Спирометрия: Если вы подвержены риску ХОБЛ или имеете симптомы ХОБЛ, вам следует пройти обследование с помощью спирометрии.Спирометрия — это простой способ проверить, насколько хорошо работают ваши легкие. Для этого теста вы вдуваете воздух в мундштук и трубку, прикрепленную к небольшому устройству. Аппарат измеряет количество выдыхаемого вами воздуха и скорость его выдувания.
Спирометрия позволяет выявить ХОБЛ до появления симптомов. Ваш врач также может использовать результаты анализов, чтобы узнать, насколько серьезна ваша ХОБЛ, и определить цели вашего лечения.
Другие анализы: Ваш врач может также попросить вас сделать рентген грудной клетки и / или другие анализы, такие как анализ газов артериальной крови, который измеряет уровень кислорода в вашей крови.Этот тест может показать, насколько хорошо ваши легкие способны перемещать кислород в кровь и удалять из нее углекислый газ.
| [Модули навыков >> Легочное обследование >> Дифференциальный Dx ] Дифференциальный диагноз: легочныйЛегочные симптомы могут быть вызваны множеством заболеваний.Среди основных дифференциальных диагнозов, которые следует учитывать у пациента с одышкой, следующие:
Инфекция
Сердечный
Тромбоэмболия
Опухоли
Травмы или токсины
Интерститальная болезнь легких
Аномальный паттерн дыхания
(Источник: Фишман) |
Хроническая обструктивная болезнь легких (ХОБЛ)
IU Health Эксперты по пульмонологии и респираторной медицине предоставляют передовую медицинскую помощь, исследуя новые методы лечения легочных заболеваний, таких как ХОБЛ.В комплексной системе медицинского обслуживания IU Health применяется стационарное и амбулаторное лечение, такое как лекарства, легочная реабилитация и кислородная терапия, адаптированные к вашему образу жизни.
IU Больницы по всему штату включают отмеченные наградами услуги пульмонологии в Академическом центре здоровья в Индианаполисе. Ваша медицинская бригада IU Health будет стремиться помочь вам дышать лучше и продолжать вести активный образ жизни после диагноза ХОБЛ.
IU Health Врачи пульмонологии и респираторной медицины предлагают полный спектр вариантов лечения легких и тяжелых случаев ХОБЛ, включая:
- Образование. Наши специалисты проводят обучение по изменениям образа жизни, которые уменьшают тяжесть симптомов ХОБЛ, таким как правильное питание и безопасные упражнения.
- Помощь в отказе от курения
- Лекарства, отпускаемые по рецепту. У некоторых пациентов с ХОБЛ отпускаемые по рецепту лекарства, такие как ингаляторы, облегчают дыхание.
- Легочная реабилитация. Легочная реабилитация использует различные физические и дыхательные упражнения для улучшения функции легких и наблюдения за здоровьем легких.
- Кислородная терапия
- Буллэктомия
- Бронхиальная термопластика: Бронхиальная термопластика — это новый метод лечения, при котором используется тепло для сокращения избыточной мускулатуры в легких и уменьшения ограничения дыхательных путей. Процедура выполняется путем введения гибкой трубки через рот в легкие с последующей подачей тепловой энергии точно контролируемым образом.
- Операция по уменьшению объема легких. Удаление поврежденных частей легких хирургическим путем может облегчить дыхание.
- Пересадка легких. Зарезервировано для крайне тяжелых случаев ХОБЛ, только IU Health выполняет трансплантацию легких в штате Индиана.
границ | Какие современные и новые методы диагностики бактериальных респираторных заболеваний?
Введение
Дыхательные пути человека разделены на две пространственные среды: верхние дыхательные пути (ВДП), включая миндалины, носоглотку, ротовую полость, ротоглотку и гортань; и нижние дыхательные пути (LRT), включая трахею, бронхи и легкие.Состав микробиоты LRT, которая до недавнего времени считалась стерильной средой, был выявлен путем разработки передовых методов геномного секвенирования (Charlson et al., 2011) и показал, в частности, присутствие Proteobacteria, Firmicutes и Bacteroidetes (Huang et al., 2013; Yu et al., 2016). Это микробное сообщество является результатом равновесия между приобретением бактерий путем вдыхания и выведения (очищение легких) с участием движений мукоцилиарного покрова и иммунитета.Он также формируется многими факторами хозяина (такими как возраст, иммунологический статус, генетический фон, физиологические параметры, доступность питательных веществ и т. Д., Как показано на рисунке 1) и зависит от лечения антибиотиками, противовоспалительных соединений или основных заболеваний (Venkataraman et al. al., 2015; Rali et al., 2016). Кроме того, социально-демографические и социокультурные аспекты способствуют приобретению новых микроорганизмов (Savitha et al., 2007; Miyashita et al., 2018).
Рисунок 1. Факторы риска и связанные с ними респираторные патогены. Факторы риска, способствующие развитию инфекций, вызываемых конкретными респираторными патогенами. Факторы риска классифицируются по типу риска: возраст (зеленый), влияние окружающей среды (оранжевый) или иммунологическое состояние (синий). Оппортунистические патогены выделены желтым цветом. H. influenza: Haemophilus influenza, C. пневмония: Chlamydophila pneumoniae, M. catarrhalis: Moraxella catarrhalis, S. pneumoniae: Streptococcus pneumoniae, P.aeruginosa: Pseudomonas aeruginosa, K. pneumoniae: Klebsiella pneumoniae, M. tuberculosis: Mycobacterium tuberculosis, M. pneumoniae: Mycoplasma pneumoniae, S. pyogenes: Streptococcus pyogenes, C. trachomatis: A. trachomatisus, S. aureloculusure : Actinomyces israelii, Y. pestis: Yersinia pestis, B. pseudomallei: Burkholderia pseudomallei, F. tularensis: Francisella tularensis, B. anthracis: Bacillus anthracis .
LRT может стать резервуаром бактериальных патогенов [e.g., Mycobacterium tuberculosis (MTB), Streptococcus pneumoniae , Legionella pneumophila, Staphylococcus aureus, Haemophilus influenzae и многие другие, показанные на рисунке 2], которые могут привести к драматическим клиническим исходам (Savitha et al., 2007). ; Rali et al., 2016). В 2016 году ИДП были основной причиной смерти с учетом всех возрастных групп (включая пациентов в возрасте до 5 и старше 70 лет). Недоедание, загрязнение воздуха, а также чрезмерное употребление антибиотиков были определены как отягчающие факторы (GBD 2016 Lower Respiratory Infections Collaborators, 2018).Кроме того, многие бактериальные патогены, участвующие в ИДП, обладают множественной устойчивостью к лечению антибиотиками и рассматриваются Всемирной организацией здравоохранения в качестве приоритетных агентов для исследований и разработок [отчет ВОЗ об антибактериальных агентах в клинической разработке (Всемирная организация здравоохранения, 2019)]. Среди них МТБ, возбудитель туберкулеза, на сегодняшний день представляет собой убийцу номер один в мире от инфекционных заболеваний, вызывая 1,8 миллиона смертей в год (Furin et al., 2019).
Рисунок 2. Бактерии, вызывающие наиболее распространенные респираторные заболевания. Краткое описание бактерий, вызывающих респираторные инфекции, в URT (красная зона) и LRT (синяя зона). Бактерии сгруппированы по респираторной нише, которую они преимущественно заражают. Патогены, выделенные жирным шрифтом, соответствуют основным бактериям, встречающимся в дыхательных путях, а выделенные красным — условно-патогенным микроорганизмам.
Чтобы избежать использования эмпирической противомикробной терапии широкого спектра действия, которая четко определена как причина появления и распространения бактерий с множественной лекарственной устойчивостью (Leekha et al., 2011), требуется разработка новых быстрых и простых в использовании диагностических методов (Caliendo et al., 2013). За последние годы были достигнуты значительные успехи в области диагностики для выявления патогенных бактерий в легких с точки зрения точности и скорости. В этом обзоре мы решили сначала вспомнить различные методы отбора проб, то, как врачи могут быстро определить бактериальное или вирусное происхождение пневмонии, и фактические тесты, которые обычно используются для обнаружения патогенов. Затем мы сосредоточимся на последних технологических подходах и их потенциальные применения в области диагностики бактериальных инфекций легких.Сюда входят технологии, основанные на анализе изображений и экспресс-диагностических тестах.
Современные методы и инструменты для идентификации патогенов
Сбор образцов для диагностики пневмонии и традиционных методов скрининга
Диагноз определяется как установление характера болезни путем изучения ее симптомов и признаков. В случае инфекций URT, таких как средний отит и тонзиллит, для диагностики заболевания часто бывает достаточно клинического обследования, которое может привести к простому отбору местных микробиологических проб.Напротив, обнаружение и анализ НИОТ, таких как бактериальная пневмония, на основе этиологического исследования сложнее (Dasaraju and Liu, 1996). Это поднимает вопрос о взятии образцов для идентификации бактерий и назначении соответствующего терапевтического лечения. Сбор образцов включает, в первую очередь, неинвазивные (и, как правило, нестерильные) методы, которые заключаются в сборе мокроты в случае гнойной пневмонии. Однако эту технику бывает труднее применять у детей, поскольку у них есть трудности с отхаркиванием.Этому можно противодействовать выделением мокроты путем ингаляции распыленного стерильного физиологического раствора (Lagerström et al., 2004; Grant et al., 2012). Сбор мочи также может быть выполнен, и его легче попросить, особенно у детей. Он позволяет идентифицировать специфический бактериальный антиген для S. pneumoniae или L. pneumophila . С другой стороны, инвазивные методы предлагают эффективные и в большинстве своем бесплодные альтернативы идентификации патогенов. Что касается стерильных методик, в основном используются забор крови, торакоцентез (в случае плеврального выпота, очень частый симптом при бактериальной пневмонии), трансторакальная пункционная аспирация (TNA) и бронхоальвеолярные лаважи (BAL, выполняемые с помощью оптоволоконного бронхоскопа). .Затем можно провести культивирование образцов или полимеразную цепную реакцию (ПЦР) (Menezes-Martins et al., 2005; Loens et al., 2009). Забор крови также может служить для оценки воспалительного ответа (гемограмма, С-реактивный белок и т. Д.) И предлагается в первую очередь, особенно у детей (Loens et al., 2009). Щетка для защищенных образцов (PSB) представляет собой тонкую щетку для сбора образцов, защищенную оболочкой. Когда щетка достигает желаемой области, она расширяется для сбора выделений и клеток легких.Уже более 40 лет он считается эталонным тестом для диагностики пневмонии путем ограничения бактериального заражения из URT (Wimberley et al., 1979; Mertens et al., 1998).
Диагностические тесты на основе культур остаются золотым стандартом для идентификации организмов. Культуры готовят из секрета легких, если сбор образцов хорошего качества (Mandell et al., 2007). Однако использование техники культивирования для идентификации патогенов может быть затруднено, если образцы загрязнены бактериями из URT (Giuliano et al., 2019), и результаты обычно достигаются в течение как минимум 48 часов, задержка, которая может существенно повлиять на исход для пациента. Примечательно, что основным преимуществом культивирования является возможность определения чувствительности к антибиотикам к широкому спектру молекул, что позволяет проводить оптимальную антимикробную терапию.
Как отличить бактериально-ассоциированную пневмонию от вирус-ассоциированной пневмонии
Различие между бактериальной пневмонией и вирусной пневмонией имеет большое значение, особенно во избежание бесполезного лечения антибиотиками.Врачам общей практики с ограниченными техническими ресурсами бывает сложно поставить диагноз. При диагностике можно руководствоваться особенностями пациента, такими как тяжесть заболевания или сопутствующие заболевания, а также местной эпидемиологией. Graffelman et al. (2004) предложили систему баллов, основанную на очень простых критериях, которые могут помочь в ведении пациентов. Они наблюдали значительную связь головной боли, лихорадки и болезненных шейных лимфатических узлов с бактериальной инфекцией LRT, в отличие от ассоциации с ринитом или диареей, которые больше указывают на вирусную инфекцию LRT.
На клиническом уровне было организовано несколько тестов для подтверждения происхождения ИДП. С-реактивный белок (СРБ) — это диагностический маркер крови, который чаще повышается у инфицированных бактериями пациентов, чем у инфицированных вирусом (в 6 раз выше) (Noviello and Huang, 2019; Thomas et al., 2020). СРБ синтезируется гепатоцитами в ответ на острое воспаление тканей. Его продукция, которая специфически стимулируется интерлейкинами IL-6 и IL-1, может играть роль в опсонизации патогенов (García Vázquez et al., 2003). Было установлено, что уровень CRP выше 100 мг / л свидетельствует об острой бактериальной инфекции и требует лечения антибиотиками. Точно так же прокальцитонин (ПКТ) также используется в качестве биомаркера острой бактериальной пневмонии. Интересно, что дозировка ПКТ может быть получена менее чем за 1 час. Он синтезируется из клеток печени или мононуклеарных клеток периферической крови в ответ на выработку фактора некроза опухоли (TNF) или IL-6 (Creamer et al., 2019). Несколько исследований подтвердили, что тестирование на ПКТ играет ключевую роль в снижении смертности, потребления антибиотиков и связанных с ними побочных эффектов.В частности, был разработан тест BioMérieux VIDAS ® B.R.A.H.M.S PCT TM , который был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA, Noviello and Huang, 2019). Он позволяет определить концентрацию ПКТ в сыворотке или плазме за 20 мин. На основе алгоритма принятия решения, который следует за концентрацией ПКТ, пациентов с концентрацией ПКТ более 0,25 нг / мл следует лечить антибиотиками (из https://www.biomerieux.fr/diagnostic-clinique/vidasr-brahms-pct).
Текущие экспресс-диагностические тесты
Быстрые диагностические тесты (RDT) должны быть быстрыми, простыми в выполнении и чувствительными.Они могут быть выполнены в месте оказания медицинской помощи и позволяют поставить надежный диагноз в течение короткого периода времени. Следовательно, ДЭТ адаптированы для использования в условиях ограниченных ресурсов, чтобы быстро отвечать на неотложные потребности врачей. Несколько ДЭТ для лечения респираторных инфекций доступны уже много лет. Например, анализ мочи для одновременного обнаружения антигенов S. pneumoniae и L. pneumophila (ImmuView ® ) обычно используется в случаях подозрения на пневмонию уже более 10 лет (Kazandjian et al., 1997; Gutiérrez et al., 2003). Этот тест может использоваться для детей старше 8 лет и показывает более высокую чувствительность (от 85 до 89%), чем другие предлагаемые коммерческие тесты (от 72 до 77%). В настоящее время появляются новые ДЭТ, которые можно разделить на две основные категории: (i) синдромные тесты для определения возбудителя болезни; и (ii) специальные тесты для подтверждения наличия подозреваемого патогена. В этом разделе мы представим неполный список диагностических инструментов, которые либо обычно используются в медицинских учреждениях (и потенциально рекомендуются ВОЗ), либо многообещающие методы, которые были недавно разработаны (список в таблице 1).
Таблица 1. Список доступных в настоящее время быстрых диагностических тестов (синдромных и специфических) для выявления патогенов LRT.
Синдромные тесты
Синдромный подход основан на одновременном поиске наиболее распространенных микроорганизмов с подозрением на инфекционное заболевание. Синдромные тесты (СТ) позволяют идентифицировать возбудителя за несколько часов. В общем, СТ позволяют обнаруживать наиболее распространенные патогены, включая вирусы (например, ортомиксовирусы, коронавирусы, парамиксовирусы, аденовирусы, риновирусы…) и бактерии (например, ортомиксовирусы, коронавирусы, парамиксовирусы, аденовирусы и т. Д.).g., Mycoplasma pneumoniae, L. pneumophila, Chlamydophila pneumoniae, H. influenzae, Klebsiella pneumoniae. P. aeruginosa, S. aureus, S. pneumoniae …). Различие между вирусами и бактериями позволяет адаптировать лечение и сократить использование антибиотиков.
Многие мультиплексные ПЦР-панели уже существуют и доступны на рынке [например, респираторная панель QIAstat-Dx ® , BioFire ® FilmArray ® Pneumonia Panel plus (Parčina et al., 2020), Unyvero Lower Respiratory Tract (LRT) Panel (Collins et al., 2020) или RespiFinder ® SMART 22 FAST (Hattoufi et al., 2020)]. Эти технологии могут быть легко адаптированы к новым целям, хотя они имеют переменную чувствительность. Мы кратко опишем только две из этих технологий: BioFire FilmArray и DendriChips.
Технология FilmArray является примером синдромного диагностического теста, который сейчас широко используется в больницах. Он состоит из автоматизированных мультиплексных ПЦР. В частности, система BioFire ® FilmArray ® Pneumonia Panel plus от BioMérieux (одобрено FDA в 2018 г.) извлекает и очищает все нуклеиновые кислоты из необработанного респираторного образца (БАЛ, отхаркивающие выделения и эндотрахеальный аспират) и выполняет вложенную мультиплексную ПЦР.Специальное программное обеспечение автоматически анализирует данные кривой плавления конечной точки и сообщает, обнаружен ли каждый патоген в образце или нет. Этот метод позволяет полуколичественным образом идентифицировать 18 бактерий, связанных с пневмонией, а также определять 7 маркеров устойчивости (например, гены устойчивости к метициллину и карбапенему). Результаты достигаются через 1 час, что позволяет сэкономить дни ненужного лечения антибиотиками, а уровни чувствительности и специфичности достигают ≥ 96%.
Идентификация патогенов также возможна с помощью диагностического прибора DendrisChips ® .Эта технология предлагает обнаружение респираторных патогенов на основе 16S рДНК (рибосомной ДНК) с помощью ПЦР (Senescau et al., 2018). Использование активированной дендримером стеклянной поверхности (называемой дендрислайдами) позволяет достичь в 2 раза большей чувствительности (Le Berre et al., 2003) за счет более сильной иммобилизации зондов на чипах. Эта мультиплексная технология позволяет обнаруживать 11 бактерий, вызывающих инфекции дыхательных путей. Результат диагностики доставляется примерно через 4 часа как прогностическая ценность наличия / отсутствия патогенов с использованием алгоритма принятия решения, основанного на методах машинного обучения.
Специальные тесты
Специальные тесты могут идентифицировать отдельные бактерии, обычно встречающиеся при респираторных инфекциях. Новый тест, названный PneumoResp, нацелен на полисахарид клеточной стенки S. pneumoniae и может быть проведен непосредственно на респираторных образцах. Исследование, проведенное с участием 196 детей, показало, что по сравнению с анализом посева и ПЦР тест PneumoResp показал чувствительность и отрицательную прогностическую ценность секретов пациентов более 98%. По сравнению с классическими критериями S.pneumoniae пневмонии (сочетание типичных симптомов, рентгеновского изображения и посева ≥10 7 КОЕ / мл в мокроте или назофарингеальном секрете), чувствительность и отрицательная прогностическая ценность теста PneumoResp на образцах были выше (Haddar et al., 2020) . Это позволяет предложить противомикробное лечение, направленное на S. pneumoniae на 0 день.
Специальные тесты на
Mycoplasma pneumoniae
Быстрая диагностика особенно интересна при работе с привередливыми и медленнорастущими бактериями.Например, бактерия M. pneumoniae редко культивируется в лабораториях клинической микробиологии, поскольку для ее роста требуются недели, что приводит к задержке диагностики и увеличивает риск развития тяжелой пневмонии (She et al., 2010; Postma et al., 2015 ). Вместо этого подходы, основанные на нуклеиновой амплификации, включая индуцированную петлей изотермическую амплификацию (LAMP, нацелены на структуры ДНК петля-ствол) (Saito et al., 2005) или ПЦР (Di Marco, 2014), обычно применяются в больницах с результатами в пределах 3–4 часДля дальнейшего повышения скорости диагностики (в течение 15 минут) иммунохроматографические анализы антигена на основе коллоидного золота на мазках из носоглотки или образцах мокроты, нацеленные на мембранный белок P1 (Li et al., 2015) или рибосомный белок L7 / L12 ( Рекомендуется использовать Ribotest Mycoplasma ® , Asahi Kasei Pharma, Токио, Япония) (Miyashita et al., 2016), однако эти методы обладают низкой чувствительностью (около 70%) и настоятельно рекомендуются, когда у пациентов проявляются несколько клинических симптомов. Совсем недавно была предложена амплификация серебра в сочетании с иммунохроматографией.Анализ амплификации серебра объединяет формирование иммунной системы сэндвича с наночастицами золота (НЧЗ) и усилением серебра. Усиление серебра основано на восстановлении ионов серебра на поверхности ЗНЧ и обеспечивает значительное увеличение начального окрашивания, вызванного ЗНЧ (Namkoong et al., 2018). Чувствительность и специфичность теста выше по мере достижения, соответственно, 90 и 100% по сравнению с подходами ПЦР и, таким образом, могут быть полезны для непосредственного начала соответствующего лечения антибиотиками, поскольку эта бактерия от природы устойчива к β-лактамам (наиболее распространенное вероятностное лечение).
Специальные тесты на
M. tuberculosis (MTB)
Ежегодно 10 миллионов человек заболевают туберкулезом [ТБ, отчет ВОЗ (Всемирная организация здравоохранения, 2019)]. В развивающихся странах около 7% всех смертей связано с туберкулезом (Zaman, 2010). В странах с низким и средним уровнем доходов, где доступ к медицинскому обслуживанию затруднен, дешевые и простые в использовании ДЭТ имеют большую ценность. Среди конкретных тестов, доступных в настоящее время для выявления MTB и не подразумевающих технику культивирования или целевой ПЦР, мы выделим Xpert MTB / RIF Ultra, TB-LAMP и GenoType MTBDR plus (Eddabra and Ait Benhassou, 2018), которые широко используются и рекомендуются ВОЗ.Кратко напомним их характеристики и соответствующие преимущества.
Xpert MTB / RIF Ultra — это картридж для обнаружения MTB и связанной с ним устойчивости к рифампицину (RIF) (Cepheid, Саннивейл, Калифорния, США). Он заключается в автоматизированной вложенной амплификации в реальном времени в картридже с использованием платформы GeneXpert за 2 часа. Флуоресцентные зонды нацелены на ген rpoB (β-субъединица РНК-полимеразы), который отвечает за устойчивость к RIF (Arend and van Soolingen, 2018). С 2011 г. ВОЗ рекомендует использовать его в качестве первоначального диагностического теста при подозрении на туберкулез (Всемирная организация здравоохранения, 2013 г.).Хотя эта технология обеспечивает высокую чувствительность и специфичность (близкую к 100% по сравнению со стандартной ПЦР) для выявления MTB у взрослых, обнаружение MTB у детей намного сложнее из-за недостаточного количества образцов и редкости бактерий в образцах (López Ávalos and Prado Montes де Ока, 2012). Действительно, тесты обеспечивают чувствительность от 40 до 100% и специфичность от 93 до 100% в отношении различных проведенных исследований (Всемирная организация здравоохранения, 2013).
Тест
TB-LAMP с использованием коммерческого молекулярного анализа Loopamp TM MTBC Detection Kit официально признан Группой разработки рекомендаций ВОЗ (GDG) для выявления MTB в LRTI (Всемирная организация здравоохранения, 2016).TB-LAMP требует небольшого количества инфраструктур и дает результат относительно обнаружения MTB в течение 2 часов (Iwamoto et al., 2003). Однако он не может обнаружить образцы лекарственной устойчивости. Чувствительность TB-LAMP выше, чем у микроскопии мазка мазка, который до сих пор остается единственным лабораторным диагностическим тестом на легочный туберкулез в странах с низким и средним уровнем доходов (Pham et al., 2018).
Набор
FluoroType ® MTB (Bruker, Германия) основан на амплификации ДНК с использованием одноцепочечных ампликонов, меченных флуоресцентными зондами.Этот метод демонстрирует высокую чувствительность и специфичность по сравнению с методами эталонной культуры (соответственно 94 и 100%) в респираторных образцах (Hofmann-Thiel et al., 2016).
Одним из важнейших аспектов, требующих решения, является быстрое обнаружение MTB со свойствами множественной лекарственной устойчивости. ВОЗ разработала рекомендации по использованию молекулярно-генетических тестов, называемых «зондовыми анализами второй линии» (SL-LPA), для идентификации этих типов штаммов. В частности, ВОЗ настоятельно рекомендует использовать GenoType MTBDR sl VER 1.0 или VER 2.0 (Bruker, Германия), поскольку оба они обнаруживают мутации MTB, связанные с лекарственной устойчивостью. Эти тесты основаны на технологии полосок ДНК (разработанной Hain Lifescience в 2000-х годах), которая заключается в мультиплексной амплификации ДНК с биотинилированными праймерами с последующей денатурацией ДНК, которая дает одноцепочечные ампликоны. После связывания с их комплементарной цепью на полоске ампликоны выявляются посредством обработки щелочной фосфатазой, которая генерирует видимый краситель. GenoType MTBDR sl тестирует целевые мутации в: (i) gyrA (VER 1.0 и VER 2.0) и gyrB (VER 2.0) (кодирующих ДНК-гиразу A и B , участвующих в устойчивости к фторхинолонам), (ii) промоторы rrs (VER 1.0 и 2.0) и eis (VER 2.0) (кодирует 16S рибосомную РНК и аминогликозидацетилтрансферазу, участвующую в устойчивости к амикацину / канамицину), (iii) ген embB (VER 1.0) (кодирующий арабинозилтрансферазу, участвующую в устойчивости к этамбутолу). Кроме того, GenoType MTBDR plus (Bruker, Германия) позволяет обнаруживать устойчивость MTB как к антибиотикам рифампицина (RIF), так и к изониазиду (INH), нацеливая на значительные мутации в гене rpoB (кодирующем β-субъединицу РНК-полимераза), гены katG и inhA [кодирующие каталазу и NADH-еноил-ACP-редуктазу, обеспечивающие устойчивость к высоким и низким концентрациям изониазида (Nathavitharana et al., 2016)].
Следует отметить, что новый RDT, основанный на технологии CRISPR, также был недавно разработан и протестирован на когорте из 179 пациентов: тест CRISPR-MTB (Ai et al., 2019). Этот тест объединяет этап амплификации рекомбиназной полимеразы и следующий этап обнаружения Cas12a для целевого обнаружения S6110, последовательность вставки, специфичная для MTB, представлена 6–10 раз на геном. Тест CRISPR-MTB показал большую чувствительность по сравнению с методом определения посевов и Xpert, а также специфичность 98%. Следовательно, этот новый тест MTB предлагает большой потенциал в качестве нового метода диагностики легочного туберкулеза.
Нетуберкулезные микобактерии (NTM, 140 зарегистрированных видов), которые не связаны с MTB, но также вызывают пневмонию, такие как M. avium или M. kansassi , также могут быть протестированы с помощью Ezplex ® MTBC / Набор для ПЦР в реальном времени NTM. За 2 часа этот набор может тестировать образцы на наличие 100 различных видов NTM и показывает высокую чувствительность и специфичность (96–100%) по сравнению с классической ПЦР или тестами на культуру (Lee et al., 2018).
В заключение, ДЭТ позволяют быстро и эффективно диагностировать бактериальные инфекции легких.Кроме того, некоторые из них также предоставляют информацию о характере устойчивости к антибиотикам и, следовательно, могут потенциально ограничивать появление штаммов с множественной устойчивостью.
Новые RDT постоянно развиваются либо на основе новых технологий, либо на основе усовершенствований классических подходов RDT. Например, технология профилирования летучих органических соединений (ЛОС) появилась в 1990-х годах и с тех пор разрабатывается для диагностики. Использование «электронного носа» позволяет обнаруживать ЛОС непосредственно с помощью портативного устройства для газовой хроматографии в сочетании со спектрометрией ионной подвижности (GC-IMS) и недавно позволило диагностировать бактериальные ИРТ на выдыхаемом воздухе госпитализированных пациентов (Lewis et al., 2017). Эта многообещающая технология представляет собой простой неинвазивный, безопасный и быстрый метод, когда он выполняется специалистом, но ее чувствительность и специфичность все еще нуждаются в оптимизации (Schnabel et al., 2015; van der Schee et al., 2015) . Следует отметить, что для этого также требуется предварительная обработка данных (машинное обучение) с результатами дыхательной техники (Smolinska et al., 2014), что может объяснить текущую относительно низкую надежность этого метода. В целом, эти параметры предполагают, что эти методы трудно внедрить в медицинских учреждениях из-за нехватки специализированных сотрудников и трудоемкого анализа (van Oort et al., 2017).
Инновации в диагностике для лечения бактериальных легочных инфекций
Технологии на основе анализа изображений
Рентген грудной клетки (CXR) и компьютерная томография (CT) имеют решающее значение для врача при диагностике легочной инфекции и необходимы для оценки развития пневмонии, а также ее осложнений. Однако их интерпретация может оказаться сложной, поскольку рентгенограммы и компьютерная томография не могут определить природу инфекционных агентов (вирусных или бактериальных), ни их специфичность (профиль восприимчивости, патогенность) и рентгенологические показания не могут зависеть от иммунологического статуса пациента (Franquet). и Чанг, 2019).Следовательно, необходимы диагностические методы для быстрого и эффективного лечения легочных инфекций с помощью медицинской визуализации.
Искусственный интеллект (ИИ), который относится к системам, имитирующим человеческие мысли и действия, в настоящее время широко используется для интерпретации рентгенограмм для диагностики респираторных инфекций. Рентгеновская визуализация является наиболее распространенным и доступным диагностическим методом, используемым в мире, однако специалисты-специалисты не обязательно обучены расширенному анализу, и это привело к разработке стратегий с использованием искусственного интеллекта, поддерживающих врачей, с преимуществом ограниченной стоимости (Hashmi и другие., 2020). Машинное обучение (ML) и глубокое обучение (DL) являются частью искусственного интеллекта и за последние 2 года привлекли к себе много внимания. ML определяется как применение статистических методов для определения алгоритмов. Человек может постоянно «кормить» машину для большей эффективности, с данными с одной стороны и решениями с другой, с целью классификации новых примеров (Mekov et al., 2020). DL — это ветвь обучающейся машины, определяемая системой, которая обучается через нейронные сети (сети алгоритмов) без участия человека.Для выполнения этого анализа было разработано несколько сверточных нейронных сетей (CNN или ConvNet). Они состоят из многослойных нейронных сетей, которые распознают визуальные паттерны из пиксельных изображений (Shin et al., 2016). Среди различных недавно разработанных инструментов — существующие CNN CXNet-m1 (Xu et al., 2019), CheXNeXt (Rajpurkar et al., 2018), VGG16 и VGG19 (Toǧaçar et al., 2020), AlexNet (Rahman et al. , 2020; Rajaraman and Antani, 2020; Toǧaçar et al., 2020), ResNet18 (Rahman et al., 2020; Rajaraman and Antani, 2020), DenseNet201 (Rahman et al., 2020), SqueezeNet (Рахман и др., 2020), VGGNet (Раджараман и Антани, 2020), GoogLeNet (Сараива и др., 2019), наконец, Хашми и его сотрудники предложили наиболее точную и точную модель относительно ранее разработанных программ ( Hashmi et al., 2020) с использованием алгоритмов CNN ResNet18, Xception, InceptionV3, DenseNet121 и MobileNetV3. Они могли бы разработать надежную модель для обнаружения бактериальной пневмонии с помощью баз данных рентгенографии и компьютерной томографии больничного уровня, предоставленных соответственно Wang et al. (2017) (названный ChestX-ray 14) и Kermany et al.(2018). Все перечисленные здесь CNN показали высокие показатели точности с точки зрения точности. Однако их соответствующие характеристики трудно оценить, так как их соответствующие баллы (с точки зрения точности, чувствительности, специфичности, AUC и т. Д.) Проверяются по параметрам, присущим каждому исследованию с участием CNN или людей. В недавней статье, в которой сравнивается CXNet-m1 и VGG16 (которые являются одними из первых предложенных CNN в литературе) авторы показали, что они достигают, соответственно, 96,3 и 96,2% успеха в идентификации пневмонии без различия между бактериальным или вирусным происхождением (Rahman et al., 2020). Следует отметить, что дифференциация типа пневмонии приводит к потере работоспособности. Действительно, авторы определили DenseNet201 как наиболее точную сеть для обнаружения пневмонии (с точностью до 98%), но эта точность упала до 93%, когда приходилось различать бактериальное и вирусное происхождение.
Методы обучения также были оптимизированы для легочно-грудной сегментации и улучшения диагностики пневмонии в педиатрической медицине с помощью рентгенограмм грудной клетки (Longjiang et al., 2019). Действительно, анализ изменений формы легких или измерение размера могут предоставить прямой диагноз или ключ к разгадке серьезных заболеваний, таких как кардиомегалия и пневмоторакс. Однако разнообразие форм легких у детей делает сегментацию легких в педиатрической рентгенографии значительно более сложной, чем у взрослых. Чтобы обойти эту трудность, был разработан алгоритм, основанный на легочно-грудном соотношении, который направлен на определение точной сегментации легких для различения бактериальной и вирусной пневмонии, что помогает быстро провести адекватное лечение (Longjiang et al., 2019).
УЗИ легких — это технология, альтернативная рентгену. Недавнее исследование показало, что можно обучить искусственную нейронную сеть обнаруживать признаки инфильтрата пневмонии с помощью ультразвуковых изображений легких, полученных от маленьких госпитализированных детей с диагнозом пневмония (Correa et al., 2018). Этот метод показал высокий уровень успеха в выявлении паттернов, связанных с инфильтратами пневмонии (чувствительность 90,9%, специфичность 100%). Эта неионизирующая технология может быть применена к более портативным и менее дорогим ультразвуковым устройствам и может быть доставлена в отдаленные сельские районы, где диагностика пневмонии часто является проблемой.
В целом, анализ изображений на основе искусственного интеллекта представляет собой многообещающую технологию автоматической клинической диагностики бактериальных инфекций легких, поскольку он может помочь в принятии клинических решений за счет быстрого преобразования сложных данных в более действенную информацию. Этот тип диагностики может выступать в качестве «второго мнения», чтобы помочь клиницистам и радиологам оценить тяжесть пневмонии, коррелирующую с конкретным патогеном.
Omics приближается
Развитие технологий «Omics» значительно улучшило наши знания о генетическом разнообразии бактерий и о фундаментальных механизмах патогенности бактерий (Jean Beltran et al., 2017). Omics относится к набору технологий, которые позволяют глобальное понимание сложных и динамических биологических систем посредством анализа генов (геномных), РНК (транскриптомных), белков (протеомных) или метаболитов (метаболомных). Теперь эти высокопроизводительные технологии также используются для разработки новых диагностических подходов. Здесь мы сосредоточимся на использовании и потенциале метаболомики в диагностике ИРТ.
Метаболомика
Метаболомика заключается в анализе всего метаболома i.е., сумма всех молекул с низким молекулярным весом (<1500 дальтон) внутри клетки, ткани или организма в данном наборе физиологических, патологических или условий окружающей среды. Метаболомика может использоваться в качестве инструмента прогноза через открытие биомаркеров. Например, у пациентов с тяжелым бронхиолитом, который требует вентиляции с положительным давлением (PPV), метаболические профили сыворотки крови различаются в зависимости от степени тяжести (Stewart et al., 2019). Следовательно, такой подход должен позволить более быстро определять риски развития тяжелого бронхиолита.
Интересно, что забор мочи для метаболомного сканирования также может быть большим подспорьем для идентификации бактерий. Недавнее метаболомное исследование мочи (Del Borrello et al., 2020) показало, что можно отличить бактериальные от вирусных причин педиатрической внебольничной пневмонии путем поиска около 20 метаболитов, таких как андростендион (предшественник тестостерона) и прегнандиол ( производное прогестерона), которые значительно увеличиваются в случае пневмококковой инфекции.
Многочисленные исследования были посвящены использованию метаболомики для поиска новых биомаркеров легочного туберкулеза (Lau et al., 2015; Preez et al., 2019). Одно из осложнений туберкулеза, особенно у пациентов с ВИЧ (вирусом иммунодефицита человека), называется воспалительным синдромом восстановления иммунной системы, связанным с туберкулезом (TB-IRIS). Этот синдром приводит к парадоксальному появлению или обострению связанных с туберкулезом клинических симптомов (лихорадка, аденопатия, плеврит, легочный инфильтрат) после начала лечения после начального улучшения.Пилотное нецелевое метаболомное исследование показало, что можно различать пациентов с ВИЧ-ТБ с ТБ-ВСВИ и без них (Silva et al., 2019) путем сравнения их метаболизма арахидоновой кислоты, линолевой кислоты и глицерофосфолипидов в образцах плазмы с массой, полученной методом жидкостной хроматографии. спектрометрия.
В заключение, метаболомные подходы к биологическим образцам (например, моча, жидкости бронхоальвеолярного лаважа, плазма…) должны привести к идентификации новых биомаркеров, которые могут быть использованы в будущих экспресс-тестах, что позволит обеспечить соответствующее терапевтическое управление.
Метагеномика
Next Generation Sequencing (NGS) — это биотехнологическая революция, позволяющая секвенировать большие количества ДНК или РНК в рекордно короткие сроки. Использование NGS в больничных условиях является многообещающим, и многие исследования применяют этот подход для выявления патогенов при различных респираторных инфекциях. Метагеномное секвенирование (mNGS) позволяет идентифицировать организмы, не имея в виду цель и, возможно, некоторые из их функциональных характеристик, путем прямого секвенирования нуклеиновых кислот из респираторных образцов (Lecuit and Eloit, 2015).Его можно оценить по БАЛ, транстрахеальной аспирации или плевральному выпоту, и необходимо избегать заражения (Takeuchi et al., 2019). Метагеномное секвенирование включает, с одной стороны, целевую метагеномику, где есть начальный этап ПЦР (обычно нацеленный на ген 16S рРНК) перед секвенированием. С другой стороны, метагеномика дробовика основана на секвенировании ДНК как человеческого хозяина, так и микроорганизмов без стадии амплификации.
Технология Illumina, наиболее используемая технология секвенирования в мире, позволяет получать последовательности за 2–3 дня.Напротив, секвенирование MinION на основе нанопор быстрее позволяет идентифицировать виды бактерий и профиль чувствительности к антибиотикам в течение дня (Charalampous et al., 2019).
Одним из преимуществ mNGS является идентификация редких и требовательных микроорганизмов. Например, mNGS успешно использовался для диагностики тяжелой пневмонии, вызванной Chlamydophila psittaci , на основе ДНК, выделенной из крови или смывов альвеолярной жидкости пациентов (Chen et al., 2020). Это также позволяет идентифицировать сопутствующие инфекции и дает возможность помочь понять существующие взаимодействия между различными патогенами.Метагеномные методы дробовика использовались в диагностике легочного туберкулеза (Вотинцева и др., 2017), что позволило получить информацию о чувствительности к антибиотикам значительной части протестированных штаммов МТБ. Интересно, что метагеномика дробовика, благодаря большому и глубокому анализу последовательностей, также может выявить бактериальный резистом (Mac Aogáin et al., 2020) с использованием баз данных. Действительно, внедрение геномных баз данных, связанных с их паттерном множественной лекарственной устойчивости, позволяет быстро идентифицировать неожиданные элементы устойчивости в интересующей бактериальной последовательности.В настоящее время научному сообществу предлагается до 47 свободно доступных ресурсов по биоинформатике, которые постоянно пополняются через онлайн-репозитории геномных последовательностей и фенотипической информации (например, минимальная ингибирующая концентрация или анализ дисковой диффузии). Эти базы данных позволяют осуществлять «мониторинг на основе последовательностей», например, для помощи в отслеживании устойчивости местных бактерий (Hendriksen et al., 2019). К ним, в частности, относятся: инструменты биоинформатики CARD (Комплексная база данных устойчивости к противомикробным препаратам) (Jia et al., 2017), NDARO (Национальная база данных резистентных к антибиотикам организмов NCBI), MEGAResor ARDB (База данных генов устойчивости к антибиотикам).
Использование NGS в качестве теста с первым намерением все еще обсуждается, поскольку результаты обычно достигаются в течение 2–3 дней, метод является дорогостоящим и требует преданных и обученных людей для его применения. Можно было бы предложить применить его во втором намерении, если пациенты не отвечают на назначенное лечение. Однако клиницисты должны помнить, что этот метод может предложить большой потенциал, в частности, для предложения персонализированной медицины пациентам с хроническими инфекциями, такими как муковисцидоз, или пациентам с ослабленным иммунитетом (Lecuit and Eloit, 2015).
Заключение
Бактериальные инфекции нижних дыхательных путей являются основной причиной назначения антибиотиков во всем мире. Однако, главным образом из-за отсутствия надлежащего диагноза, антибиотики часто назначаются ненадлежащим образом и приводят к появлению штаммов бактерий с множественной устойчивостью, также называемых «супербактериями». Один из способов избежать неправильного назначения антибиотиков — это сократить процесс диагностики и достичь персонализированной, основанной на доказательствах медицины.
В этом обзоре мы попытались выделить проблемы, связанные с предложением точных минимально инвазивных и быстрых диагностических методов для выявления патогенов в LRT.Мы показали, что недавно разработанная диагностика, часто основанная на подключенных технологиях (искусственный интеллект, автоматическое определение последовательности, электроника…), предлагает многообещающие альтернативы традиционной диагностике на основе культуры. Доступность постоянно растущих баз данных о бактериях, ответственных за LRT, связанных с удобными для пользователя инструментами онлайн-анализа, также должна способствовать ускорению диагностики. Одним из таких примеров является бесплатный онлайн-инструмент под названием «MicrobeNet», предоставляемый Центром контроля заболеваний (CDC), который перечисляет генетические последовательности, белковые и биохимические профили (ферментативные пути и метаболизм) от редких болезнетворных микробов, выявленных во всем мире, в больницах. и лаборатории общественного здравоохранения.Остается приложить значительные усилия, чтобы предложить другие биомаркеры для обнаружения пневмонии и, в конечном итоге, идентификации штаммов.
Авторские взносы
Рукопись была написана в соавторстве с
HR, AJ, MC, AC и ER. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Это исследование финансировалось INSERM, CNRS и Парижским университетом. HR поддерживался стипендией DGA / AID (Délégation Générale à l’Armement / Agence de l’innovation de défense), а ER поддерживался грантом Национального агентства исследований (ANR-15-CE15-0017 StopBugEntry) .
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Сноски
Список литературы
Ai, J.-W., Zhou, X., Xu, T., Yang, M., Chen, Y., He, G.-Q., et al. (2019). Быстрый и сверхчувствительный диагностический тест на основе CRISPR для Mycobacterium tuberculosis . Emerg.Microb. Заразить. 8, 1361–1369. DOI: 10.1080 / 22221751.2019.1664939
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Калиендо, А.М., Гилберт, Д.Н., Джиноккио, К.С., Хэнсон, К.Э., Мэй, Л., Куинн, Т.С., и др. (2013). Лучшие анализы, лучший уход: улучшенная диагностика инфекционных заболеваний. Clin. Заразить. Дис. 57 (Дополнение 3), S139 – S170. DOI: 10.1093 / cid / cit578
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харалампус, Т., Кей, Г. Л., Ричардсон, Х., Айдин, А., Балдан, Р., Джин, К. и др. (2019). Метагеномика нанопор позволяет быстро диагностировать бактериальную инфекцию нижних дыхательных путей. Nat. Biotechnol. 37, 783–792. DOI: 10.1038 / s41587-019-0156-155
CrossRef Полный текст | Google Scholar
Чарлсон, Э. С., Биттингер, К., Хаас, А. Р., Фицджеральд, А. С., Франк, И., Ядав, А. и др. (2011). Топографическая преемственность бактериальных популяций в дыхательных путях здорового человека. Am. J. Respir. Крит. Care Med. 184, 957–963. DOI: 10.1164 / rccm.201104-0655OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, X., Цао, К., Вэй, Ю., Цянь, Ю., Лян, Дж., Донг, Д., и др. (2020). Метагеномное секвенирование нового поколения в диагностике тяжелых пневмоний, вызванных Chlamydia psittaci . Инфекция 145, 3096–3098. DOI: 10.1007 / s15010-020-01429-1420
CrossRef Полный текст | Google Scholar
Коллинз, М.Э., Попович Э. Б., Миллер М. Б. (2020). Оценка новой панели мультиплексной ПЦР по сравнению с количественной бактериальной культурой для диагностики инфекций нижних дыхательных путей. J. Clin. Microbiol. 58: e45. DOI: 10.1128 / JCM.02013-2019
CrossRef Полный текст | Google Scholar
Корреа, М., Зимич, М., Барриентос, Ф., Барриентос, Р., Роман-Гонсалес, А., Пахуэло, М. Дж. И др. (2018). Автоматическая классификация детской пневмонии на основе распознавания образов при УЗИ легких. PLoS One 13: e0206410. DOI: 10.1371 / journal.pone.0206410
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Creamer, A. W., Kent, A. E., and Albur, M. (2019). Прокальцитонин при респираторных заболеваниях: использование в качестве биомаркера для диагностики и проведения антибактериальной терапии. Дыши 15, 296–304. DOI: 10.1183 / 20734735.0258-2019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дасараджу, П. В., и Лю, К. (1996). Медицинская микробиология , 4-й Эдн, Галвестон, Техас: Медицинский университет Техаса.
Google Scholar
Дель Боррелло, Г., Стоккеро, М., Джордано, Г., Пирилло, П., Занконато, С., Да Дальт, Л. и др. (2020). Новое понимание педиатрической внебольничной пневмонии, полученное с помощью нецелевой метаболомики: предварительное исследование. Pediatr. Пульмонол. 55, 418–425. DOI: 10.1002 / ppul.24602
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ди Марко, Э. (2014). Обнаружение Mycoplasma pneumoniae с помощью ПЦР в режиме реального времени для диагностики внебольничной пневмонии. Methods Mol. Биол. 1160, 99–105. DOI: 10.1007 / 978-1-4939-0733-5_9
CrossRef Полный текст | Google Scholar
Эддабра, Р., Айт Бенхасу, Х. (2018). Молекулярные экспресс-тесты для выявления туберкулеза. Пневмония 10, 4–12. DOI: 10.1186 / s41479-018-0049-42
CrossRef Полный текст | Google Scholar
Гарсиа Васкес, Э., Мартинес, Х. А., Менса, Х., Санчес, Ф., Маркос, М. А., де Ру, А., и др. (2003). Уровни С-реактивного белка при внебольничной пневмонии. евро. Респир. J. 21, 702–705. DOI: 10.1183 / 0
36.03.00080203
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ГББ, 2016 г. Соавторы по инфекциям нижних дыхательных путей (2018 г.). Оценки глобальной, региональной и национальной заболеваемости, смертности и этиологии инфекций нижних дыхательных путей в 195 странах, 1990–2016 гг .: систематический анализ для исследования глобального бремени болезней, 2016 г. Lancet Infect. Дис. 18, 1191–1210. DOI: 10.1016 / S1473-3099 (18) 30310-30314
CrossRef Полный текст | Google Scholar
Джулиано К., Патель, К. Р., Кале-Прадхан, П. Б. (2019). Руководство по идентификации бактериальных культур и интерпретации результатов. PT 44, 192–200.
Google Scholar
Граффельман А. В., Кнуистинг Н. А., Ле Сесси С., Крус А. С. М., Спрингер М. П. и ван ден Брук П. Дж. (2004). Диагностическое правило этиологии инфекций нижних дыхательных путей как руководство для противомикробного лечения. Br. J. Gen. Pract. 54, 20–24.
Google Scholar
Грант, Л.Р., Хаммитт, Л. Л., Мердок, Д. Р., О’Брайен, К. Л., и Скотт, Дж. А. (2012). Процедуры взятия образцов индуцированной мокроты у детей. Clin. Заразить. Дис. 54 (Дополнение 2), S140 – S145. DOI: 10.1093 / cid / cir1069
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гутьеррес, Ф., Масиа, М., Родригес, Дж. К., Айело, А., Сольдан, Б., Себриан, Л. и др. (2003). Оценка иммунохроматографического анализа Binax NOW для обнаружения мочевого антигена Streptococcus pneumoniae в проспективном исследовании внебольничной пневмонии в Испании. Clin. Заразить. Дис. 36, 286–292. DOI: 10.1086 / 345852
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Haddar, C.H., Joly, J., Carricajo, A., Verhoeven, P.O., Grattard, F., Mory, O., et al. (2020). Стратегия использования нового антигенного теста для быстрой диагностики инфекции Streptococcus pneumoniae в респираторных образцах детей, обращающихся в больницу. BMC Microbiol. 20:79. DOI: 10.1186 / s12866-020-01764-1760
CrossRef Полный текст | Google Scholar
Хашми, М.Ф., Катияр, С., Кескар, А. Г., Бокде, Н. Д., и Джем, З. В. (2020). Эффективное обнаружение пневмонии на рентгеновских снимках грудной клетки с использованием глубокого трансферного обучения. Диагностика 10: 417. DOI: 10.3390 / диагностика10060417
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хаттуфи, К., Тлигуи, Х., Обтел, М., Фтух Эль, С., Харбах, А., и Баркат, А. (2020). молекулярная диагностика пневмонии с использованием мультиплексной ПЦР в реальном времени RespiFinder ® SMART 22 FAST в группе марокканских младенцев. Adv. Virol. 2020: 6212643. DOI: 10.1155 / 2020/6212643
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хендриксен, Р. С., Бортолая, В., Тейт, Х., Тайсон, Г. Х., Ареструп, Ф. М., и МакДермотт, П. Ф. (2019). Использование геномики для отслеживания глобальной устойчивости к противомикробным препаратам. Фронт. Общественное здравоохранение 7: 242. DOI: 10.3389 / fpubh.2019.00242
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Франке Т. и Чанг Дж. Х. (2019).«Визуализация легочной инфекции», в Заболевания грудной клетки, груди, сердца и сосудов 2019-2022 гг. , Vol. 152, ред. Дж. Ходлер, Р. Кубик-Хух и Г. фон Шультесс (Cham: Springer), 65–77. DOI: 10.1007 / 978-3-030-11149-6_7
CrossRef Полный текст | Google Scholar
Хофманн-Тиль, С., Молодцов, Н., Антоненко, У., Хоффманн, Х. (2016). Оценка тестов abbott RealTime MTB и RealTime MTB INH / RIF для прямого обнаружения комплекса Mycobacterium tuberculosis и маркеров резистентности в респираторных и внелегочных образцах. J. Clin. Microbiol. 54, 3022–3027. DOI: 10.1128 / JCM.01144-1116
CrossRef Полный текст | Google Scholar
Хуанг, Ю. Дж., Чарлсон, Э. С., Коллман, Р. Г., Коломбини-Хэтч, С., Мартинес, Ф. Д. и Сеньор, Р. М. (2013). Роль микробиома легких в здоровье и болезнях. Отчет о семинаре Национального института сердца, легких и крови. Am. J. Respir. Крит. Care Med. 187, 1382–1387. DOI: 10.1164 / rccm.201303-0488WS
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ивамото, Т., Сонобе, Т., и Хаяси, К. (2003). Петлевая изотермическая амплификация для прямого обнаружения комплекса Mycobacterium tuberculosis , M. avium и M. intracellulare в образцах мокроты. J. Clin. Microbiol. 41, 2616–2622. DOI: 10.1128 / jcm.41.6.2616-2622.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Жан Бельтран, П. М., Федершпиль, Дж. Д., Шенг, X., и Криста, И. М. (2017). Протеомика и интегративные омические подходы к пониманию взаимодействий хозяин-патоген и инфекционных заболеваний. Мол. Syst. Биол. 13: 922. DOI: 10.15252 / msb.20167062
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цзя Б., Рафенья А. Р., Алкок Б., Ваглехнер Н., Го П., Цанг К. К. и др. (2017). CARD 2017: расширение и модельно-ориентированное лечение всеобъемлющей базы данных по устойчивости к антибиотикам. Nucleic Acids Res. 45, D566 – D573. DOI: 10.1093 / nar / gkw1004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Казанджян, Д., Чью Р. и Гилберт Г. Л. (1997). Быстрая диагностика инфекции Legionella pneumophila серогруппы 1 с помощью иммуноферментного анализа мочи Binax. J. Clin. Microbiol. 35, 954–956. DOI: 10.1128 / jcm.35.4.954-956.1997
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кермани, Д. С., Гольдбаум, М., Цай, В., Валентим, К. С. С., Лян, Х., Бакстер, С. Л. и др. (2018). Выявление медицинских диагнозов и излечимых заболеваний с помощью глубокого обучения на основе изображений. Cell 172, 1122–1131.e9. DOI: 10.1016 / j.cell.2018.02.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lagerström, F., Fredlund, H., and Holmberg, H. (2004). Образцы мокроты можно получить у пациентов с внебольничной пневмонией в системе первичной медико-санитарной помощи. Сканд. J. Prim. Здравоохранение 22, 83–86. DOI: 10.1080 / 02813430410006468
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лау, С. К. П., Ли, К.-К., Curreem, S.O.T., Chow, W.-N., To, K. K. W., Hung, I. F. N., et al. (2015). Метаболомическое профилирование плазмы больных туберкулезом с помощью нецелевой масс-спектрометрии позволяет выявить новые биомаркеры для диагностики. J. Clin. Microbiol. 53, 3750–3759. DOI: 10.1128 / JCM.01568-1515
CrossRef Полный текст | Google Scholar
Ле Берре, В., Тревизиол, Э., Дагкессаманская, А., Сокол, С., Каминад, А.-М., Майорал, Дж. П. и др. (2003). Дендримерное покрытие предметных стекол для чувствительного анализа ДНК-микрочипов. Nucleic Acids Res. 31: e88. DOI: 10.1093 / nar / gng088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lee, S., Hwang, K.-A., Ahn, J.-H., and Nam, J.-H. (2018). Оценка набора EZplex MTBC / NTM для ПЦР в реальном времени: диагностическая точность и эффективность при вакцинации. Clin. Exp. Vac. Res. 7, 111–118. DOI: 10.7774 / cevr.2018.7.2.111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Льюис, Дж. М., Сэвидж, Р. С., Бичинг, Н.Дж., Бидсворт, М. Б. Дж., Физи, Н., Ковингтон, Дж. А. (2017). Определение сигнатур летучих метаболитов для диагностики бактериальной инфекции дыхательных путей с использованием технологии электронного носа: пилотное исследование. PLoS One 12: e0188879. DOI: 10.1371 / journal.pone.0188879
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли В., Лю Ю., Чжао Ю., Тао Р., Ли Ю. и Шан С. (2015). Быстрая диагностика Mycoplasma pneumoniae у детей с пневмонией с помощью иммунохроматографического анализа антигена. Sci. Rep. 5: 15539. DOI: 10.1038 / srep15539
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лоенс, К., Ван Хейрстратен, Л., Малхотра-Кумар, С., Гуссенс, Х., Иевен, М. (2009). Оптимальные места отбора проб и методы обнаружения патогенов, которые могут вызывать внебольничные инфекции нижних дыхательных путей. J. Clin. Microbiol. 47, 21–31. DOI: 10.1128 / JCM.02037-2038
CrossRef Полный текст | Google Scholar
Лунцзян, Э., Zhao, B., Guo, Y., Zheng, C., Zhang, M., Lin, J., et al. (2019). Использование методов глубокого обучения для легочно-грудной сегментации и улучшение диагностики пневмонии на рентгенограммах грудной клетки у детей. Pediatr. Пульмонол. 54, 1617–1626. DOI: 10.1002 / ppul.24431
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mac Aogáin, M., Lau, K. J. X., Cai, Z., Kumar Narayana, J., Purbojati, R. W., Drautz-Moses, D. I., et al. (2020). Метагеномика выявляет основной резистом к макролидам, связанный с микробиотой при хронических респираторных заболеваниях. Am. J. Respir. Крит. Care Med. 202, 433–447. DOI: 10.1164 / rccm.201911-2202OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mandell, L.A., Wunderink, R.G., Anzueto, A., Bartlett, J.G., Campbell, G.D., Dean, N.C., et al. (2007). Общество инфекционных болезней Америки / Американское торакальное общество согласовали руководящие принципы ведения внебольничной пневмонии у взрослых. Clin. Заразить. Дис. 44 (Приложение 2), S27 – S72. DOI: 10.1086 / 511159
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Меков, Э., Миравитлес, М., Петков, Р. (2020). Искусственный интеллект и машинное обучение в респираторной медицине. Эксперт. Преподобный Респир. Med. 14, 559–564. DOI: 10.1080 / 17476348.2020.1743181
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Менезес-Мартинс, Л. Ф., Менезес-Мартинс, Дж. Дж., Михаэльсен, В. С., Агиар, Б. Б., Эрмель, Т., и Мачадо, Д. К. (2005). Диагностика парапневмонического плеврального выпота по полимеразной цепной реакции у детей. J. Pediatr.Surg. 40, 1106–1110. DOI: 10.1016 / j.jpedsurg.2005.03.057
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мертенс, А. Х., Наглер, Дж. М., Гальдерманс, Д. И., Слаббинк, Х. Р., Вайз, Б., и Кулен, Д. (1998). Оценка качества защищенных образцов кисточки с помощью микроскопического подсчета клеток. Am. J. Respir. Крит. Care Med. 157, 1240–1243. DOI: 10.1164 / ajrccm.157.4.9709082
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мияшита, Л., Сури, Р., Деринг, Э., Мадуэй, И., Дав, Р. Е., Нил, Д. Р. и др. (2018). Пары электронных сигарет усиливают адгезию пневмококков к эпителиальным клеткам дыхательных путей. евро. Респир. J. 51: 1701592. DOI: 10.1183 / 13993003.01592-2017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мияшита Н., Кавай Ю., Като Т., Танака Т., Акаике Х., Тераниши Х. и др. (2016). Метод быстрой диагностики Mycoplasma pneumoniae, инфекции дыхательных путей. J. Infect. Chemother. 22, 327–330. DOI: 10.1016 / j.jiac.2016.02.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Намкунг, Х., Ямазаки, М., Ишизаки, М., Эндо, И., Харада, Н., Арамаки, М., и др. (2018). Клиническая оценка иммунохроматографической системы с использованием амплификации серебром для быстрого обнаружения Mycoplasma pneumoniae . Sci. Rep. 8, 1430–1437. DOI: 10.1038 / s41598-018-19734-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Натавитхарана, Р.Р., Хиллеманн, Д., Шумахер, С. Г., Шлютер, Б., Исмаил, Н., Омар, С. В. и др. (2016). Многоцентровая оценка не меньшей эффективности тестов hain genoType MTBDRplus Version 2 и nipro NTM + MDRTB для выявления устойчивости к рифампину и изониазиду. J. Clin. Microbiol. 54, 1624–1630. DOI: 10.1128 / JCM.00251-216
CrossRef Полный текст | Google Scholar
Новиелло, С., Хуанг, Д. Б. (2019). Основы и достижения в диагностике бактериальных инфекций нижних дыхательных путей. Диагностика 9:37. DOI: 10.3390 / диагностика
37
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Парчина, М., Шнайдер, У. В., Виссо, Б., Йозич, Р., Ханнет, И., и Лисби, Дж. Г. (2020). Многоцентровая оценка респираторной панели QIAstat — новый экспресс-анализ на основе ПЦР с высокой степенью мультиплексирования для диагностики острых инфекций дыхательных путей. PLoS One 15: e0230183. DOI: 10.1371 / journal.pone.0230183
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фам, Т.Х., Питер, Дж., Мелло, Ф. К. К., Паррага, Т., Лан, Н. Т. Н., Набета, П. и др. (2018). Проведение диагностического теста TB-LAMP в референс-лабораториях: результаты многоцентрового исследования. Внутр. J. Infect. Дис. 68, 44–49. DOI: 10.1016 / j.ijid.2018.01.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Постма, Д. Ф., ван Веркховен, К. Х., ван Элден, Л. Дж. Р., Тийсен, С. Ф. Т., Хёпельман, А. И. М., Клюйтманс, Дж. А. Дж. У. и др. (2015). Стратегии лечения антибиотиками внебольничной пневмонии у взрослых. N. Engl. J. Med. 372, 1312–1323. DOI: 10.1056 / NEJMoa1406330
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Приз, Д. И., Луис, Л., и Лутс, Д. Т. (2019). Применение метаболомики в исследованиях туберкулеза легких. Туберкулез 115, 126–139. DOI: 10.1016 / j.tube.2019.03.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рахман, Т., Чоудхури, М. Э. Х., Хандакар, А., Ислам, К. Р., Ислам, К.Ф., Махбуб, З. Б. и др. (2020). Передача обучения с помощью глубокой сверточной нейронной сети (CNN) для обнаружения пневмонии с помощью рентгена грудной клетки. Заявл. Sci. 10: 3233. DOI: 10.3390 / app10093233
CrossRef Полный текст | Google Scholar
Раджараман, С., и Антани, С. К. (2020). Ансамбли моделей глубокого обучения, зависящие от модальности, для улучшения выявления туберкулеза на рентгенограммах грудной клетки. Доступ IEEE. 8, 27318–27326. DOI: 10.1109 / доступ.2020.2971257
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Раджпуркар, П., Ирвин, Дж., Болл, Р. Л., Чжу, К., Янг, Б., Мехта, Х. и др. (2018). Глубокое обучение для диагностики рентгенограммы грудной клетки: ретроспективное сравнение алгоритма CheXNeXt с практикующими радиологами. PLoS Med. 15: e1002686. DOI: 10.1371 / journal.pmed.1002686
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рали П., Вир М., Гупта Н., Сингх А. К. и Бханот Н. (2016). Оппортунистические легочные инфекции у хозяев с ослабленным иммунитетом. Крит. Care Nurs.Q. 39, 161–175. DOI: 10.1097 / CNQ.0000000000000109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сайто Р., Мисава Ю., Мория К., Койке К., Убуката К. и Окамура Н. (2005). Разработка и оценка петлевой изотермической амплификации для быстрого обнаружения Mycoplasma pneumoniae . J. Med. Microbiol. 54, 1037–1041. DOI: 10.1099 / jmm.0.46071-46070
CrossRef Полный текст | Google Scholar
Сарайва, А.А., Сантос, Д. Б., Коста, Н. Дж., Соуза, Дж. В., Феррейра, Н. М., Валенте, А. и др. (2019). Модели обучения классификации рентгеновских изображений для выявления пневмонии с помощью нейронных сетей. Биовизуализация . DOI: 10.5220 / 0007346600760083
CrossRef Полный текст | Google Scholar
Савита, М. Р., Нандишвара, С. Б., Прадип, К. М. Дж., Уль-Хак, Ф. и Раджу, К. К. (2007). Изменяемые факторы риска острых инфекций нижних дыхательных путей. Indian J. Pediatr. 74, 477–482. DOI: 10.1007 / s12098-007-0081-83
CrossRef Полный текст | Google Scholar
Schnabel, R., Fijten, R., Smolinska, A., Dallinga, J., Boumans, M.-L., Stobberingh, E., et al. (2015). Анализ летучих органических соединений в выдыхаемом воздухе для диагностики пневмонии, связанной с вентилятором. Sci. Отчет 5: 17179. DOI: 10.1038 / srep17179
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сенескау А., Кемповски Т., Бернар Э., Мессье, С., Бесс, П., Фабр, Р. и др. (2018). Инновационная технология DendrisChips ® для синдромального подхода к диагностике in vitro: применение к респираторным инфекционным заболеваниям. Диагностика 8:77. DOI: 10.3390 / диагностика8040077
PubMed Аннотация | CrossRef Полный текст | Google Scholar
She, R. C., Thurber, A., Hymas, W. C., Stevenson, J., Langer, J., Litwin, C. M., et al. (2010). Ограниченная применимость культуры для Mycoplasma pneumoniae и Chlamydophila pneumoniae для диагностики инфекций дыхательных путей. J. Clin. Microbiol. 48, 3380–3382. DOI: 10.1128 / JCM.00321-310
CrossRef Полный текст | Google Scholar
Shin, H.-C., Roth, H.R., Gao, M., Lu, L., Xu, Z., Nogues, I., et al. (2016). Глубокие сверточные нейронные сети для автоматизированного обнаружения: архитектуры CNN, характеристики наборов данных и трансферное обучение. IEEE Trans. Med. Представь. 35, 1285–1298. DOI: 10.1109 / TMI.2016.2528162
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Силва, К.А. М., Грэм, Б., Уэбб, К., Эштон, Л. В., Хартон, М., Люткемейер, А. Ф. и др. (2019). Пилотное метаболомическое исследование воспалительного синдрома восстановления иммунной системы при туберкулезе. Внутр. J. Infect. Дис. 84, 30–38. DOI: 10.1016 / j.ijid.2019.04.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смолинска А., Хаушильд А.-К., Фийтен Р. Р., Даллинга Дж. У., Баумбах Дж. И ван Скутен Ф. Дж. (2014). Современная дыхательная техника — обзор методов предварительной обработки данных и машинного обучения в метаболомическом анализе дыхания. J. Breath Res. 8: 027105. DOI: 10.1088 / 1752-7155 / 8/2/027105
CrossRef Полный текст | Google Scholar
Стюарт, К. Дж., Мансбах, Дж. М., Пьедра, П. А., Тойвонен, Л., Камарго, К. А., и Хасегава, К. (2019). Ассоциация респираторных вирусов с метаболомом сыворотки крови у младенцев с тяжелым бронхиолитом. Pediatr. Allergy Immunol. 30, 848–851. DOI: 10.1111 / pai.13101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такеучи, С., Кавада, Дж.-И., Хориба, К., Окуно, Ю., Окумура, Т., Судзуки, Т. и др. (2019). Метагеномный анализ с использованием секвенирования нового поколения патогенов в жидкости бронхоальвеолярного лаважа от педиатрических пациентов с дыхательной недостаточностью. Sci. Rep. 9, 12909–12911. DOI: 10.1038 / s41598-019-49372-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Томас, Дж., Посюте, А., Кевалас, Р., Малинаускас, М., и Янкаускайте, Л. (2020). Биомаркеры крови, дифференцирующие вирусную и бактериальную этиологию пневмонии: обзор литературы. Ital. J. Pediatr. 46, 4–10. DOI: 10.1186 / s13052-020-0770-773
CrossRef Полный текст | Google Scholar
Toǧaçar, M., Ergen, B., Cömert, Z., and Özyurt, F. (2020). Модель глубокого обучения для обнаружения пневмонии с применением комбинации выбора функций mRMR и моделей машинного обучения. IRBM 41, 212–222. DOI: 10.1016 / j.irbm.2019.10.006
CrossRef Полный текст | Google Scholar
ван дер Ши, М. П., Хашимото, С., Шурман, А.C., van Driel, J. S. R., Adriaens, N., van Amelsfoort, R.M., et al. (2015). Измененные профили выдыхаемых биомаркеров у детей во время и после хрипов, вызванных риновирусом. евро. Респир. J. 45, 440–448. DOI: 10.1183 / 0
36.00044414
PubMed Аннотация | CrossRef Полный текст | Google Scholar
van Oort, P. M. P., de Bruin, S., Weda, H., Knobel, H. H., Schultz, M. J., Bos, L. D., et al. (2017). Метаболомика выдыхаемого дыхания для диагностики пневмонии у пациентов с интубированными и механически вентилируемыми отделениями интенсивной терапии (ОИТ). Внутр. J. Mol. Sci. 18: 449. DOI: 10.3390 / ijms18020449
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Венкатараман, А., Бассис, К. М., Бек, Дж. М., Янг, В. Б., Кертис, Дж. Л., Хаффнагл, Г. Б. и др. (2015). Применение модели нейтрального сообщества для оценки структурирования микробиома легких человека. мБио 6: 1382. DOI: 10.1128 / mBio.02284-2214
CrossRef Полный текст | Google Scholar
Вотинцева А.А., Брэдли П., Pankhurst, L., Del Ojo Elias, C., Loose, M., Nilgiriwala, K., et al. (2017). Данные диагностики и эпиднадзора за туберкулезом в тот же день с помощью полногеномного секвенирования прямых респираторных образцов. J. Clin. Microbiol. 55, 1285–1298. DOI: 10.1128 / JCM.02483-2416
CrossRef Полный текст | Google Scholar
Ван, X., Пэн, Ю., Лу, Л., Лу, З., Багери, М., и Саммерс, Р. М. (2017). ChestX-ray8: База данных рентгеновских снимков грудной клетки в масштабе больницы и контрольные показатели по классификации и локализации распространенных заболеваний грудной клетки под слабым контролем. IEEE CVPR 3462–3471. DOI: 10.1109 / CVPR.2017.369
CrossRef Полный текст | Google Scholar
Уимберли Н., Фалинг Л. Дж. И Бартлетт Дж. Г. (1979). Метод волоконно-оптической бронхоскопии для получения незагрязненного секрета из нижних дыхательных путей для бактериального посева. Am. Преподобный Респир. Дис. 119, 337–343. DOI: 10.1164 / arrd.1979.119.3.337
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Всемирная организация здравоохранения (2013 г.). Анализ Xpert MTB / RIF для диагностики легочного и внелегочного туберкулеза у взрослых и детей. Женева: Всемирная организация здравоохранения.
Google Scholar
Всемирная организация здравоохранения (2016 г.). Использование петлевой (-) опосредованной изотермической амплификации (TB-LAMP) для диагностики туберкулеза легких: рекомендации по политике. Женева: ВОЗ.
Google Scholar
Всемирная организация здравоохранения (2019 г.). Антибактериальные агенты в клинической разработке: анализ конвейера антибактериальных клинических разработок. Женева: ВОЗ.
Google Scholar
Сюй, С., Ву Х. и Би Р. (2019). CXNet-m1: обнаружение аномалий на рентгеновских снимках грудной клетки с помощью глубокого обучения на основе изображений. IEEE Access 7, 4466–4477. DOI: 10.1109 / ACCESS.2018.2885997
CrossRef Полный текст | Google Scholar
Yu, G., Gail, M.H., Consonni, D., Carugno, M., Humphrys, M., Pesatori, A.C., et al. (2016). Характеристика микробиоты легочной ткани человека и ее связи с эпидемиологическими и клиническими особенностями. Genome Biol. 17: 163. DOI: 10.1186 / s13059-016-1021-1021
CrossRef Полный текст | Google Scholar
Пульмонология (лечение заболеваний легких и органов дыхания у детей) | Детская больница CS Mott
Отделение детской пульмонологии при C.Детская больница С. Мотта предоставляет комплексную клиническую помощь и консультации младенцам, детям и молодым людям с острыми и хроническими проблемами дыхания.
Наша команда детских пульмонологов предлагает услуги по диагностике и лечению распространенных нарушений дыхания, а также редких заболеваний легких.
В дополнение к нашим сертифицированным преподавателям, пациенты детской пульмонологии UM имеют доступ к нашей многопрофильной команде, включая медсестер, диетологов, респираторных терапевтов, социальных работников и специалистов по детской жизни, что позволяет нам предоставлять комплексные услуги, ориентированные на пациента и семью. каждому ребенку, о котором мы имеем честь заботиться.
Опыт в области лечения респираторных заболеваний у детей
Мы лечим весь спектр респираторных симптомов и заболеваний, в том числе:
Расширенные возможности диагностики
Диагностика — это первый шаг в создании эффективного плана лечения для вашего ребенка. Отделение программы детской пульмонологии U-M предлагает широкий спектр диагностических услуг, в том числе:
- Современная детская легочная лаборатория, оснащенная для выполнения:
- Проба с метахолином (для диагностики астмы)
- Тестирование оксида азота в выдыхаемом воздухе (для измерения воспаления дыхательных путей)
- Назальный анализ оксида азота (для диагностики первичной цилиарной дискинезии)
- Потовые пробы (для диагностики муковисцидоза)
- Нагрузочные испытания
- Обследование функции легких у младенцев (для раннего выявления муковисцидоза легких и других заболеваний)
- Гибкая бронхоскопия для выявления структурных поражений дыхательных путей
- Бронхоальвеолярный лаваж для выявления инфекции или аспирации
- Протоколы визуализации грудной клетки с высоким разрешением для снижения радиационного облучения
- Комбинированные процедуры для уменьшения воздействия анестезии
- Генетические исследования муковисцидоза и интерстициальных заболеваний легких
- Биопсии ресничек и легких проанализированы специальной педиатрической бригадой
- Тест на кожную аллергию на общие аллергены, вызывающие астму
Инновационные исследования респираторных заболеваний
Отделение детской пульмонологии руководит программами фундаментальных и клинических исследований, связанных с астмой, муковисцидозом и бронхолегочной дисплазией.Исследования факультета в настоящее время финансируются Национальными институтами здравоохранения и Фондом кистозного фиброза. Узнайте больше о наших текущих исследованиях.
Запишитесь на прием, позвонив нам по телефону 734-764-4123.
Интерстициальная болезнь легких | Сидарс-Синай
Не то, что вы ищете?
Что такое интерстициальные заболевания легких?
Интерстициальная болезнь легких — это
название группы из более чем 200 текущих (хронических) заболеваний легких.Эти болезни
воспаление или рубцевание легких. Воспаление и рубцы затрудняют получение достаточного количества
кислород. Рубцевание называется легочным фиброзом.
Симптомы и течение этих заболеваний могут варьироваться от человека к человеку. Общая связь между многими формами болезни заключается в том, что все они начинаются с воспаления.
- Бронхиолит. Это воспаление мелких дыхательных путей (бронхиол).
- Альвеолит. Это воспаление
воздушные мешочки, в которых происходит обмен кислорода и углекислого газа в крови
(альвеолы). - Васкулит. Это воспаление, которое
влияет на мелкие кровеносные сосуды (капилляры).
Наиболее распространенными типами интерстициальной болезни легких являются:
- Заболевание, вызванное лекарствами
- Воздействие веществ на работе или в окружающей среде
- Повреждение легких вследствие радиации
Фиброз приводит к длительному
(необратимая) потеря способности ткани легких переносить кислород.Когда рубцовая ткань
формы, он разрушает воздушные мешочки. Он также разрушает легочную ткань вокруг воздушных мешочков.
и капилляры легких.
Болезнь может протекать медленно
или быстрый курс. Люди, у которых он есть, могут заметить вариации симптомов, начиная с очень легкой
от умеренного до очень тяжелого. Состояние может оставаться неизменным долгое время. Или это может
быстро меняются. Течение болезни непредсказуемо. Если прогрессирует, легкое
ткань утолщается и становится жесткой.Дыхание затрудняется.
Что вызывает интерстициальные заболевания легких?
Причина интерстициального заболевания легких неизвестна. Основными факторами, способствующими этому, являются курение и вдыхание загрязняющих веществ в окружающей среде или на производстве, таких как неорганическая или органическая пыль.
Другие способствующие факторы включают:
- Некоторые лекарства или лекарственные средства
- Определенные заболевания соединительной ткани или коллагена и саркоидоз
- Семейная история
- Лучевая терапия
Каковы симптомы интерстициальных заболеваний легких?
Симптомы у разных людей разные.Вот самые
общие:
- Одышка, особенно при
деятельность - Сухой отрывистый кашель, который не проходит
производить мокроту - Сильная усталость и слабость
- Нет аппетита
- Необъяснимая потеря веса
- Слабая боль в груди
- Затрудненное дыхание, которое может быть учащенным
и мелководный - Легкое кровотечение
Симптомы интерстициального легкого
заболевания могут выглядеть как другие заболевания легких или проблемы со здоровьем.Поговорите со своим
поставщик медицинских услуг для диагностики.
Как диагностируются интерстициальные заболевания легких?
В дополнение к полному здоровью
анамнез и физический осмотр, поставщик медицинских услуг также может запросить функцию легких
тесты. Эти тесты помогают измерить способность легких перемещать воздух в и из
легкие. Тесты часто проводятся на машинах, которыми вы дышите.Они могут включать
следующее.
Спирометрия
Спирометр — это устройство, используемое для проверки функции легких. Спирометрия — один из самых простых и распространенных тестов. Может использоваться для:
- Определите, насколько хорошо легкие получают, удерживают и перемещают воздух
- Ищите болезнь легких
- Посмотрите, насколько хорошо работает лечение
- Определить степень тяжести заболевания легких
- Узнайте, является ли заболевание легких
ограничительный (уменьшение потока воздуха) или препятствие (нарушение потока воздуха)
Контроль максимального расхода
Это устройство используется для измерения
как быстро вы можете выдувать воздух из легких.Изменения, связанные с заболеванием, могут вызвать
большие дыхательные пути в легких медленно сужаются. Это замедлит скорость выхода воздуха.
легкие. Это измерение очень важно для оценки того, насколько хорошо или плохо
болезнь находится под контролем.
Рентген грудной клетки
Этот тест позволяет сфотографировать внутренние ткани, кости и органы.
Анализы крови
Газ артериальной крови может быть выполнен для проверки количества углекислого газа и кислорода в крови.Другие анализы крови могут использоваться для поиска возможных инфекций.
КТ
В этом тесте используется комбинация
Рентген и компьютер, чтобы сделать снимки тела. КТ-сканирование более детализировано, чем
обычный рентген.
Бронхоскопия
Это прямое исследование основных дыхательных путей легких (бронхов) с помощью гибкой трубки, называемой бронхоскопом.Бронхоскопия помогает оценить и диагностировать проблемы с легкими, проверить закупорку, взять образцы ткани или жидкости и помочь удалить инородное тело. Бронхоскопия может включать биопсию или бронхоальвеолярный лаваж.
Бронхоальвеолярный лаваж
Этот тест удаляет ячейки из
нижние дыхательные пути, чтобы помочь найти воспаление и исключить определенные причины.
Биопсия легкого
Этот тест удаляет небольшой кусок
ткани из легкого, чтобы ее можно было проверить под микроскопом.
Как лечат интерстициальные заболевания легких?
Поскольку причин так много,
лечение будет отличаться. Некоторые интерстициальные заболевания легких неизлечимы. Лечение
направлена на предотвращение дальнейшего рубцевания легких, устранение симптомов и помощь в поддержании активности
и здоровый. Лечение не может исправить уже возникшее рубцевание легких.
Процедуры могут включать:
- Пересадка легкого
- Лекарство, принимаемое внутрь (перорально),
включая кортикостероиды для уменьшения воспаления и циклофосфамид для подавления
иммунная система - Кислородная терапия переносная
контейнеры - Легочная реабилитация
Проконсультируйтесь с лечащим врачом.
о прививках от гриппа и пневмококка.Ежегодная прививка от гриппа может помочь предотвратить
и грипп, и пневмония. Кроме того, пневмококковые бактерии могут вызывать незначительные проблемы.
такие как ушные инфекции. Но они также могут перерасти в опасные для жизни заболевания
легкие (пневмония), покровы головного и спинного мозга (менингит) и кровь
(бактериемия). Заболеть пневмококком может любой человек. Но к тем, кто подвергается наибольшему риску, относятся
дети младше 2 лет, взрослые 65 лет и старше, люди с определенным здоровьем
проблемы и курильщики.
Поговорите со своим врачом и поставщиком вашего ребенка о
пневмококковая вакцина. CDC рекомендует его всем детям младше 2 лет.
пожилые и все взрослые в возрасте 65 лет и старше.
Основные сведения об интерстициальных заболеваниях легких
- Интерстициальная болезнь легких — это название
для группы из более чем 200 заболеваний легких, вызывающих воспаление или рубцевание легких. - Причина часто не известна. Основной
способствующими факторами являются курение и вдыхание окружающей среды или производственной деятельности.
загрязняющие вещества. - Наиболее частыми симптомами являются одышка, особенно при физической активности, и сухой отрывистый кашель.
- Рентгеновские снимки и другие методы визуализации
используется для диагностики состояния. Как и тесты, которые помогают измерить способность легких
обменять кислород и углекислый газ. - Цель лечения — предотвратить
больше рубцов, справиться с симптомами и помочь вам оставаться активным и здоровым.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от визита к врачу:
- Знайте причину вашего визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Возьмите с собой кого-нибудь, кто поможет вам задать вопросы и запомнить, что вам говорит врач.
- Во время посещения запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите все новые инструкции, которые дает вам врач.
- Узнайте, почему прописано новое лекарство или лечение и как они вам помогут. Также знайте, какие бывают побочные эффекты.
- Спросите, можно ли вылечить ваше состояние другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если вы не примете лекарство, не пройдете тест или процедуру.
- Если вам назначена повторная встреча, запишите дату, время и цель этого визита.
- Узнайте, как вы можете связаться с вашим лечащим врачом, если у вас возникнут вопросы.
Не то, что вы ищете?
Тесты легочной функции | Johns Hopkins Medicine
Что такое легочные функциональные пробы?
Тесты функции легких (PFT) — это неинвазивные тесты, которые показывают, насколько хорошо
легкие работают.Тесты измеряют объем легких, емкость, скорость
расход и газообмен. Эта информация может помочь вашему врачу
диагностировать и назначать лечение определенных заболеваний легких.
Есть 2 типа нарушений, которые вызывают проблемы с поступлением воздуха и
из легких:
Препятствие.
Это когда воздух не выходит из легких из-за дыхательных путей.
сопротивление. Это вызывает уменьшение потока воздуха.Ограничительный.
Это когда легочная ткань и / или мышцы груди не могут расширяться
довольно. Это создает проблемы с воздушным потоком, в основном из-за более низкого
объемы легких.
PFT можно выполнить двумя способами. Эти 2 метода можно использовать вместе и
выполнять разные тесты в зависимости от информации, которую вы
провайдер ищет:
Спирометрия.
Спирометр — это устройство с мундштуком, подключенным к небольшому
электронная машина.Плетизмография.
Вы сидите или стоите внутри герметичной коробки, которая выглядит как короткая,
квадратная телефонная будка для проведения тестов.
Меры PFT:
Дыхательный объем (VT).
Это количество вдыхаемого или выдыхаемого воздуха во время нормального
дыхание.Минутный объем (МВ).
Это общее количество воздуха, выдыхаемое за минуту.Жизненная емкость (VC).
Это общий объем воздуха, который можно выдохнуть после вдоха.
столько, сколько вы можете.Функциональная остаточная емкость (FRC).
Это количество воздуха, оставшегося в легких после нормального выдоха.Остаточный объем.
Это количество воздуха, оставшегося в легких после выдоха.
как вы можете.Общий объем легких.
Это общий объем легких, когда они заполнены как можно большим количеством воздуха.
насколько возможно.Форсированная жизненная емкость легких (ФЖЕЛ).
Это количество воздуха, выдыхаемого с силой и быстро после
вдыхая как можно больше.Объем форсированного выдоха (ОФВ).
Это количество выдыхаемого воздуха в течение первого, второго и
третьи секунды теста FVC.Принудительный выдох (FEF).
Это средняя скорость потока в средней половине FVC.
тест.Пиковая скорость выдоха (PEFR).
Это самая высокая скорость, с которой вы можете вытеснить воздух из легких.
Нормальные значения PFT варьируются от человека к человеку. Количество воздуха
результаты теста на вдохе и выдохе сравниваются со средним значением для
кто-то того же возраста, роста, пола и расы.Результаты также сравниваются
к любому из ваших предыдущих результатов теста. Если у вас аномальные измерения PFT
или если ваши результаты изменились, вам могут потребоваться другие тесты.
Зачем мне могут понадобиться тесты на функцию легких?
Существует множество различных причин, по которым функциональные пробы легких (PFT) могут быть
сделано. Иногда они проводятся у здоровых людей как часть рутины.
физический. Они также обычно выполняются в определенных видах работ.
среды, обеспечивающие здоровье сотрудников (например, графитовые фабрики и угольные
мины).Или у вас могут быть PFT, если вашему врачу нужна помощь в
диагностировать у вас проблемы со здоровьем, такие как:
Аллергии
Респираторные инфекции
Проблемы с дыханием из-за травмы грудной клетки или недавней операции
Хронические заболевания легких, такие как астма, бронхоэктазы, эмфизема,
или хронический бронхитАсбестоз, заболевание легких, вызванное вдыханием волокон асбеста.
Ограничительные проблемы с дыхательными путями из-за сколиоза, опухолей или воспалений
или рубцевание легкихСаркоидоз, заболевание, вызывающее скопление воспалительных клеток.
вокруг органов, таких как печень, легкие и селезенкаСклеродермия, заболевание, вызывающее утолщение и упрочнение
соединительная ткань
PFT могут использоваться для проверки функции легких перед операцией или другими процедурами.
у пациентов с проблемами легких или сердца, курящих или имеющих
другие состояния здоровья.Еще одно применение PFT — оценка лечения
астма, эмфизема легких и другие хронические проблемы с легкими. Ваше здоровье
У провайдера могут быть и другие причины рекомендовать PFT.
Каковы риски функциональных проб легких?
Поскольку исследование функции легких не является инвазивной процедурой, это безопасно.
и быстро для большинства людей. Но человек должен уметь четко следовать,
простые направления.
Все процедуры сопряжены с определенными рисками. Риски этой процедуры могут включать:
В некоторых случаях человеку не должно быть PFT.Причины этого могут включать:
Недавняя операция на глазах из-за повышенного давления внутри глаз
во время процедурыНедавняя операция на животе или груди
Боль в груди, недавний сердечный приступ или нестабильное состояние сердца
Выпуклый кровеносный сосуд (аневризма) в груди, животе или головном мозге.
Активный туберкулез (ТБ) или респираторная инфекция, например, простуда
или грипп
Ваши риски могут варьироваться в зависимости от вашего общего состояния здоровья и других факторов.Просить
ваш поставщик медицинских услуг, который больше всего относится к вам. Поговорите с ним или
ей о любых проблемах, которые у вас есть.
Некоторые вещи могут сделать PFT менее точными. К ним относятся:
Степень терпеливого сотрудничества и усилий
Использование лекарств, открывающих дыхательные пути (бронходилататоры)
Использование обезболивающих
Беременность
Вздутие живота, которое влияет на способность делать глубокие вдохи
Сильная усталость или другие состояния, влияющие на
способность делать тесты (например, насморк)
Как мне подготовиться к тестам на функцию легких?
Ваш лечащий врач объяснит вам процедуру.Спросите его или ее
любые вопросы, которые у вас есть. Вас могут попросить подписать форму согласия, в которой
разрешение на проведение процедуры. Внимательно прочтите форму. Задавайте вопросы, если
ничего не понятно.
Сообщите своему врачу, если вы принимаете какие-либо лекарства. Это включает в себя
рецепты, лекарства, отпускаемые без рецепта, витамины и травяные
добавки.
Убедитесь, что:
Прекратите прием некоторых лекарств перед процедурой, если это указано.
вашим лечащим врачомБросьте курить до обследования, если это рекомендовано вашим лечащим врачом.
провайдер.Спросите своего поставщика, за сколько часов до теста вы
следует бросить курить.Не ешьте тяжелую пищу перед тестом, если это рекомендовано вашим врачом.
поставщик медицинских услугСледуйте любым другим инструкциям, которые дает вам ваш лечащий врач.
Ваш рост и вес будут записаны перед тестом. Это сделано так
что ваши результаты могут быть точно рассчитаны.
Что происходит во время проверки функции легких?
Вы можете пройти процедуру амбулаторно.Это означает, что вы идете домой
в тот же день. Или это может быть сделано в рамках более длительного пребывания в больнице. В
способ выполнения процедуры может отличаться. Это зависит от вашего состояния и вашего
методы поставщика медицинских услуг. В большинстве случаев процедура будет следовать
этот процесс:
Вас попросят ослабить тесную одежду, украшения или другие вещи.
это может вызвать проблемы с процедурой.Если вы носите зубные протезы, вам нужно будет носить их во время
процедура.Перед процедурой вам необходимо опорожнить мочевой пузырь.
Вы сядете в кресло. На нос наденут мягкий зажим. Этот
так что все ваше дыхание осуществляется через рот, а не через
нос.Вам дадут стерильный мундштук, прикрепленный к
спирометр.Вы плотно закрываете мундштук ртом.Вам будут предложены различные способы вдоха и выдоха.
Во время процедуры за вами будут внимательно наблюдать на предмет головокружения,
проблемы с дыханием или другие проблемы.После определенных анализов вам могут назначить бронходилататор. Тесты
затем будет повторяться через несколько минут после
бронходилататор подействовал.
Что происходит после проверки функции легких?
Если у вас в анамнезе есть проблемы с легкими или дыханием, вы можете устать после
тесты.После этого вам будет предоставлена возможность отдохнуть. Ваше здоровье
Провайдер обсудит с вами результаты вашего теста.

