Синдром Криглера — Найяра — Вики
Синдром Криглера — Найяра — врождённaя наследственная злокачественная неконъюгированная гипербилирубинемия, характеризующaяся желтухой и тяжёлым поражением нервной системы. Тип наследования аутосомно-рецессивный.
Гипербилирубинемия является следствием нарушения конъюгации в печени билирубина с глюкуроновой кислотой, обусловленного отсутствием или значительной недостаточностью фермента глюкуронилтрансферазы.
Выделяют два варианта синдрома:
- 1-й тип: полное отсутствие активности глюкуронилтрансферазы. Обусловлен мутациями в кодирующей последовательности гена UGTIAI, что приводит к образованию неполноценного фермента уридиндифосфатглюкуронидазы, который разрушается. В связи с чем реакции глюкунизации билирубина не происходит и непрямой билирубин накапливается в организме, в том числе ядрах серого вещества, обуславливая тяжёлую клинику заболевания.
- 2-й тип: синдром Ариаса — активность фермента менее 20 % от нормальной. Заболевание также обусловлено мутациями в кодирующей последовательности гена UGTIAI. Больные часто являются компаундгетерозиготами, имеющими в одной хромосоме инсерцию в промотере, а в другой миссенс-мутацию в экзоне. Кроме того описаны пациенты несущие инсерции в промоторной области гена UGTIAI в гомозиготном состоянии в сочетании со структурной мутацией в экзоне.
Клиника
1-й тип: характеризуется злокачественный прогрессирующим течением. Манифестация наступает в первые часы жизни. Клинические проявления: желтушность склер и кожных покровов, судороги, опистотонус, нистагм, атетоз, замедление умственного развития (билирубиновая энцефалопатия), на ЭЭГ регистрируется медленная активность в задних долях и параксизмальная активность.
Биохимические показатели: уровень билирубина в крови выше 200 мкмоль/л. В желчи полностью отсутствует конъюгированный билирубин. В отсутствии лечебных мероприятий больные погибают в течение первого года жизни от ядерной желтухи.
2-й тип: занимает промежуточное положение по тяжести клинических проявлений между синдромом Криглера-Найяра 1 типа и синдромом Жильбера. Манифестация наступает несколько позже, чем при 1 типе, от нескольких месяцев до первых лет. Как правило больные доживают до юношества без каких-либо неврологических дефектов. Клинические проявления сходны с 1 типом, но менее тяжёлые.
Биохимические показатели: уровень билирубина в крови менее 200 мкмоль/л. Желчь пигментирована и содержит билирубин-глюгуронид. Проба с фенобарбиталом положительная.
Лечение
В лечении используется фенобарбитал (эффективен при втором типе), гемосорбция, фототерапия, заменное переливание крови.
Желтуха сохраняется в той или иной степени в течение всей жизни.
Диагностика
1. ДНК-диагностика: основана на поиске мутаций во всех экзонах гена UGTIAI, анализе промоторной области, а также косвенная ДНК-диагностика с использованием трёх полиморфных ДНК-маркеров, лежащих в районе локализации гена.
2. Проба с фенобарбиталом — определениe фракций билирубина с помощью высокоэффективной жидкостной хроматографии.
Синдром Криглера — Найяра
2. Клиника.
(Clinic)
I тип: характеризуется злокачественным прогрессирующим течением. демонстрация происходит в первые часы жизни клинические симптомы: желтушность склер и кожных покровов, судороги, опистотонус, нистагм, атетоз, замедление психического развития билирубиновой энцефалопатии, ЭЭГ регистрируется медленная активность в задних долях и пароксизмальная активность. биохимических показателей: уровня билирубина в крови выше 200 мкмоль / л. желчи полностью отсутствует конъюгированный билирубин. При отсутствии терапевтического вмешательства, пациенты умирают в течение первого года жизни от ядерной желтухи.
1 фаза энцефалопатия билирубинемии.
На первом этапе энцефалопатии наблюдается угнетение безусловной рефлекторной деятельности, ребенок начинает плохо сосать, лежа в расслабленной позе, резко реагирует на слабые раздражители, дыхание становится редким с длительными периодами остановок. Могут наблюдаться: монотонный крик, срыгивания, рвота, «блуждающий взгляд». наблюдается цианоз.
Могут наблюдаться: монотонный крик, срыгивания, рвота, «блуждающий взгляд». наблюдается цианоз.
2 фаза энцефалопатия билирубинемии.
Вторая фаза длится от нескольких дней до нескольких недель. В этой фазе развивается клиническая картина поражения ядер головного мозга. есть спастичность, ригидность затылочных мышц, вынужденное положение тела с опистотонус. характерно вынужденное положение тела «негнущимися» конечностями и сжатыми в кулаки кистями. ребенок кричит, он отмечается выбухание большого родничка, подергивание мышц лица, krupnorazmernye тремор рук, исчезновение видимой реакции на звук, сосательного рефлекса. наблюдается нистагм, апноэ, брадикардия, летаргия, судороги.
3 фаза энцефалопатия билирубинемии.
Третий этап о благополучии явления спастичности полностью или частично исчезают.
4 фаза энцефалопатия билирубинемии.
На четвертом этапе 3-5 месяц жизни являются стойкие неврологические нарушения: параличи, парезы, нистагм, атетоз. есть грубое отставание в физическом и умственном развитии: ребенок не держит голову, не реагирует на мамин голос и другие звуковые раздражители, не следит за игрушкой.
Смерти пациентов с синдромом I типа обусловлен билирубинемии развития энцефалопатией и возникает в течение первых 2 лет жизни. В редких случаях у пациентов с синдромом криглера-Найяра I тип доживают до подросткового возраста.
II тип: средний по тяжести между клиническими проявлениями синдрома криглера-Найяра I и синдром Жильбера. демонстрация происходит позднее I типа, от нескольких месяцев до первых лет. У некоторых пациентов желтуха может не проявляться до подросткового возраста, а также неврологические осложнения встречаются редко, в некоторых случаях клинические симптомы отсутствуют. клинические проявления аналогичны с 1 типа, но менее тяжелые. редко, когда интеркуррентные инфекции или стресс у пациентов с синдромом криглера-Найяра II типа могут возникать билирубиновая энцефалопатия. биохимические показатели: уровень билирубина в крови менее 200 мкмоль / л. желчь пигментирована и содержит билирубин глюкуронид. тест с фенобарбиталом положительные.
желчь пигментирована и содержит билирубин глюкуронид. тест с фенобарбиталом положительные.
Синдром Криглера-Найяра
Генетическая ферментопатия, при котором нарушается обезвреживание и выведение билирубина. Заболевание проявляется желтухой и тяжелыми неврологическими нарушениями. Возможен летальный исход в период младенчества. Диагноз устанавливают на основании анамнестической информации, клинических проявлений, физикального осмотра и дополнительных обследований. В рамках диагностики могут выполнять биохимический анализ крови и мочи, прямое секвенирование гена UGT1A1, фенобарбиталовую пробу. Специфическое лечение не разработано. При первом типе болезни показана аллотрансплантация печени. Для терапии второй формы недуга применяют умеренные дозы барбитуратов. Прогноз при первом типе заболевания негативный. Как правило, младенец погибает в течении первых 12 месяцев жизни. Для второй формы прогноз благоприятный. Чаще всего пациенты доживают до старости.
Причины синдрома Криглера-Найяра
Патология обусловлена недостаточностью уридиндифосфатглюкуронидазы 1, которая связывает билирубин с глюкуроновой кислотой. В результате замедляются или отсутствуют процессы выведения билирубина и он накапливается в организме. Поскольку данный желчный пигмент нейротоксичен, когда повышается его концентрация в крови, развиваются желтуха и тяжелая энцефалопатия. Если пациент не получает необходимую терапию, нарастает печеночная кома, проявляются многочисленные неврологические расстройства, а затем малыш погибает.
Заболевание развивается на фоне генетической мутации. Дефектным геном является UGT1A1, локализованный во второй хромосоме. Он регулирует последовательность аминокислот и выделение уридиндифосфатглюкуронидазы 1. Мутации данного гена также могут стать причиной таких наследственных нарушений метаболизма билирубина, как синдром Жильберта и транзиторная неонатальная билирубинемия. Недуг наследуется по аутосомно-рецессивному типу.
Симптомы синдрома Криглера-Найяра
Тяжесть синдрома и прогноз выздоровления зависят от формы заболевания. Для первой формы характерно тяжелое и стремительное течение. Как правило, желтуха возникает в течении первых нескольких часов жизни новорожденного. По мере прогрессирования недуга клиническая картина дополняется нистагмом, судорожными приступами, опистотонусом. Желтушность кожных покровов, слизистых оболочек и склер сохраняются на всю жизнь. Отмечается задержка умственного развития. Несмотря на интенсивное лечение выраженность симптоматики нарастает. Интоксикация билирубином и ядерная энцефалопатия приводят к летальному исходу на первом году жизни младенца.
Менее тяжелая клиническая картина наблюдаются при второй форме патологии. Недуг может манифестировать в течении первых месяцев или лет после рождения. Симптомом данного типа является незначительная желтуха, однако, если ребенок не получает необходимую терапию, к пубертатному периоду развиваются неврологические нарушения. При адекватном лечении расстройства ЦНС не отмечаются. Желтушный оттенок кожи может сохранятся в течение всей жизни. Проявления нистагма и судорожных припадков встречаются редко. Выраженность симптоматики напрямую связана с качеством лечения.
Диагностика синдрома Криглера-Найяра
Пациента могут консультировать специалисты неонатологического, педиатрического гастроэнтерологического, неврологического и генетического профилей. Чтобы установить и подтвердить диагноз, врач изучает семейный анамнез, анализирует клинические признаки, проводит физикальный осмотр и направляет больного на дополнительные обследования. В рамках диагностики могут выполнять могут выполнять биохимический анализ крови и мочи, прямое секвенирование гена UGT1A1, фенобарбиталовую пробу. Заболевание дифференцируют от синдрома Жильберта и транзиторной желтухи новорожденных.
Лечение синдрома Криглера-Найяра
Специфическая терапия не разработана. Консервативное лечение первой формы болезни малоэффективно и лишь немного продлевает жизнь малыша. В таких случаях пациенту проводят аллотрансплантацию печени. При втором типе недуга, больному назначают умеренные дозы барбитуратов, которые активируют окисление билирубина и увеличивают производство необходимого фермента. Терапию могут дополнять плазмаферезом, гемосорбцией, заместительным переливанием крови и фототерапией. Для ускорения выведения билирубина больному увеличивают количество потребляемой жидкости.
Консервативное лечение первой формы болезни малоэффективно и лишь немного продлевает жизнь малыша. В таких случаях пациенту проводят аллотрансплантацию печени. При втором типе недуга, больному назначают умеренные дозы барбитуратов, которые активируют окисление билирубина и увеличивают производство необходимого фермента. Терапию могут дополнять плазмаферезом, гемосорбцией, заместительным переливанием крови и фототерапией. Для ускорения выведения билирубина больному увеличивают количество потребляемой жидкости.
Профилактика синдрома Криглера-Найяра
Специальные превентивные методы не разработаны. Парам, планирующим беременность, рекомендована консультация генетика. При отягощенном анамнезе в период гестации проводят пренатальную диагностику.
Диагностика нарушений билирубинового обмена — сдать анализы в СЗЦДМ
Нарушение билирубинового обмена или гипербилирубинемия ― это врожденное состояние, вызванное нарушением баланса между образованием и выделением билирубина.
При повышении его содержания в крови возникает желтуха ― изменение пигментации кожи и оболочек глаз, потемнении мочи. В норме билирубин в крови содержится в пределах 8,5-20,5 мкмоль/л. При гипербилирубинемии его концентрация может достигать и превышать показатель в 34,2 мкмоль/л.
Нарушения билирубинового обмена
В эритроцитах ― красных клетках крови содержится сложный белок гемоглобин. Он необходим для переноса кислорода по тканям человека. Отработав свой срок, он попадает в печень, селезенку, костной мозг, где и разрушается. Среди продуктов распада ― непрямой билирубин, который патогенен для организма. Поэтому под воздействием других компонентов он проходит очередную стадию преобразования, и выделяясь вместе с желчью печени, выходит из организма естественным путем.
Если обезвреживания билирубина не происходит, либо процесс не затрагивает большую часть вещества, он превращается в биливердин ― продукт окисления. Повышенное содержание приводит к желтушности. В некоторых случаях кожа может приобрести зеленоватую окраску. Это обусловлено высокой концентрацией прямого билирубина в крови, поскольку в этом виде он окисляется быстрее.
Повышенное содержание приводит к желтушности. В некоторых случаях кожа может приобрести зеленоватую окраску. Это обусловлено высокой концентрацией прямого билирубина в крови, поскольку в этом виде он окисляется быстрее.
Причины возникновения гипербилирубинемии
-
Ускоренный распад и/или сокращение жизни эритроцитов. -
Нарушение выработки веществ, необходимых для распада билирубина. -
Снижение поглощения билирубина клетками печени. -
Снижение экскреции пигмента из печени в желчь. -
Затрудненный отток желчи и ее проникновение в кровь.
Причин нарушений билирубинового обмена много, среди них желчнокаменная болезнь, заболевания печени, включая цирроз, опухоль и хронические гепатиты. Вызвать гипербилирубинемию также могут паразиты, снижающие способность организма выводить билирубин, воздействие токсичных веществ, анемия и иное.
В зависимости от стадии нарушения процесса преобразования и вывода, в крови диагностируется повышение уровня одной из фракций. Если высок общий билирубин, это свидетельствует о заболевании печени. Рост непрямого билирубина означает избыточное разрушение эритроцитов или нарушение транспортировки билирубина. Высок уровень прямого ― проблемы с оттоком желчи.
Наследственные нарушения
Синдром Жильбера. Неопасная форма с благоприятным течением. Причина ― нарушение захвата и транспортировка билирубина клетками печени. В крови повышается неконъюгированный (несвязанный) билирубин.
Синдром Ротора. Выражается в нарушении захвата билирубина и, как следствие, его выведения из организма. Проявляется в раннем возрасте, не приводит к серьезным последствиям.
Синдром Дабина-Джонсона. Редкая форма конъюгированной гипербилирубинемии. Нарушена система транспортировки, что вызывает трудности выведения связанного билирубина. Синдром не приводит к опасным состояниям, прогноз благоприятен.
Синдром Криглера-Найяра. Тяжелая форма неконъюгированной гипербилирубинемии. Причина ― недостаток или полное отсутствие глюкуронилтрансферазы, вещества необходимого для конъюгации билирубина в печени. Вызывает поражения нервной системы, может привести к преждевременной смерти.
Своевременная диагностика, патогенетическая терапия, соблюдение правильного питания, режима работы и отдыха позволяют качественно улучшить жизнь большинства больных с наследственной гипербилирубинемией.
Норма билирубина в крови
Уровень билирубина зависит от возраста и состояния человека.
У новорожденных детей максимальный уровень билирубина достигает на 3 — 5 сутки жизни, так называемая физиологическая желтуха. Иногда он доходит до 256 мкмоль/л. Уровень должен самостоятельно нормализоваться ко 2 неделе жизни. Превышения показателя в 256 мкмоль/л требуется немедленного обследования ребенка. Это состояние способное привести к поражению головного мозга.
Не менее опасно повышений уровня билирубина во время беременности. Это может стать причиной преждевременных родов, анемии и гипоксии плода.
Симптомы
Нарушение химических реакций билирубина выявляют путем определения его уровня в крови. Если концентрация больше нормы, но не превышает 85 мкмоль/л ― это легкая форма гипербилирубинемии, до 170 мкмоль/л ― среднетяжелая, от 170 мкмоль/л ― тяжелая форма заболевания. Внешние признаки проявляются по разному, в зависимости от причины повышения концентрации билирубина.
-
Проблемы с печенью выражается в следующей симптоматике: -
Дискомфорт и тяжесть из-за увеличения печени.
-
Изменение цвета мочи (она становится как темное пиво), осветление кала. -
Тяжесть после еды, приема алкоголя, частая отрыжка. -
Периодически возникающие головокружения, общая слабость, апатия.
Если причиной патологического состояния является вирусный гепатит, то к симптомам добавляется повышенная температура тела.
-
Нарушение оттока желчи: -
Желтушность кожи и склер. -
Зуд кожи. -
Интенсивная боль в правом подреберье. -
Метеоризм, запор или диарея. -
Темная моча, светлый кал.
Частая причина ― желчнокаменная болезнь. Перечень функционирует нормально, обезвреживает поступающий билирубин, но его выделение из организма затруднено.
Надпеченочная желтуха ― состояние вызванное быстрым разрушением эритроцитов. Выражается следующими симптомами:
-
Анемия. -
Темный стул при обычном цвете мочи. -
Обширные гематомы, образующиеся без внешних причин. -
Кожный зуд, усиливающийся в состоянии покоя и после согревания. -
Желтоватый цвет кожи.
Также иногда вне зависимости от причины могут отмечаться такие симптомы, как горечь во рту, изменение вкусовых ощущений, слабость, нарушение памяти и интеллекта.
Диагностика
Перед врачами стоит задача по снижению уровня билирубина до нормальных пределов, а сделать это можно только зная причину его повышения. Поэтому после анализа крови на определение концентрации билирубина проводят также тесты:
Поэтому после анализа крови на определение концентрации билирубина проводят также тесты:
-
на уровень щелочной фосфатазы; -
активность аланинаминотрансферазы; -
наличие глюкуронилтрансферазы и другие исследования.
Назначают также УЗИ печени для определения ее состояния. Среди лабораторных тестов: общий анализ крови и мочи, уровень общего копропорфирина в суточной моче, проба с фенобарбиталом, бромсульфалеиновая проба, тест на маркеры вирусов гепатита.
Цель диагностирования не только определить уровень билирубина, но и его форму. Например, увеличение прямого билирубина возникает при нарушении отхода желчи (дискинезия). Концентрация непрямого билирубина растет из-за проблем с печенью и при избыточном разрушении эритроцитов. Установив форму билирубина, необходимо дифференцировать конкретное заболевание (патологию).
Повышенного прямого билирубина
Прямой фермент начинает накапливаться в крови из-за нарушения процесса оттока желчи. Вместо того, чтобы попадать в желудок, она проникает в кровоток. Такое состояние возникает при гепатитах бактериальной и вирусной этиологии, хронических, аутоиммунных, медикаментозных гепатитах. Может возникнуть при желчекаменной болезни, циррозе, онкологических изменениях в печени, раке желчного пузыря или поджелудочной железы. Стать следствием врожденного синдромы Ротора (более легкая форма дефекта экскреции билирубина) или синдрома Дабина-Джонсона (более тяжелая форма).
Повышенного непрямого билирубина
Причина ― быстрый распад эритроцитарных клеток. Может возникнуть как осложнение при сепсисе, острой кишечной инфекции, при анемии врожденной, токсической, приобретенной аутоиммунной.
Повышение непрямой формы билирубина также возникает при синдроме Жильбера. Это доброкачественная, хроническая болезнь, вызванная нарушением внутриклеточной транспортировки билирубин. Среди причин гипербилирубинемии синдром Криглера-Найяра ― нарушение процесса соединения билирубина с глюкуроновой кислотой, образующейся при окислении D-глюкозы.
Это доброкачественная, хроническая болезнь, вызванная нарушением внутриклеточной транспортировки билирубин. Среди причин гипербилирубинемии синдром Криглера-Найяра ― нарушение процесса соединения билирубина с глюкуроновой кислотой, образующейся при окислении D-глюкозы.
Необычен симптом Люси-Дрискола. Он возникает исключительно у младенцев из-за грудного вскармливания. С материнским молоком поступает фермент, приводящий к нарушению конъюгации билирубина. С переходом на искусственное вскармливание болезнь проходит. Однако, непрямой билирубин весьма опасен, поэтому возникновение желтушности после 3-5 дня жизни требует срочного медицинского обследования.
Диагностирование младенцев
Если у взрослых желтуха означает наличие болезней, то у детей гипербилирубинемия может быть физиологической или патологической. В первом случае она отмечается к 4 дню жизни, у азиатских детей к 7-му, проходит самостоятельно, не достигая критических значений уровня билирубина.
Патология может явиться следствием дисфункции печени, большой концентрации бета-глюкуронидазы в грудном молоке, возникнуть при низкокалорийном питании или обезвоживании. Обследованию подлежит как сам младенец, так и его мать.
Изучается анамнез, внешние признаки. Важно как можно скорее исключить или диагностировать ядерную желтуху. К тревожным признакам относятся: желтушность в первый день жизни и после 2 недель, повышение общего билирубина и скорость его подъема, расстройство дыхания, наличие синяков или геморрагической сыпи. У ребенка измеряют уровень билирубина, посев крови, мочи и спинномозговой жидкости. Необходимо исключить наличие TORCH-инфекций у матери.
Лечение
Терапия гипербилирубинемии зависит от причин ее вызвавших, т. е. лечение этиотропное, направленное на основное заболевание.
Нарушение прохода желчевыводящих путей. Проводится удаление камней и мешающих проходимости опухолей.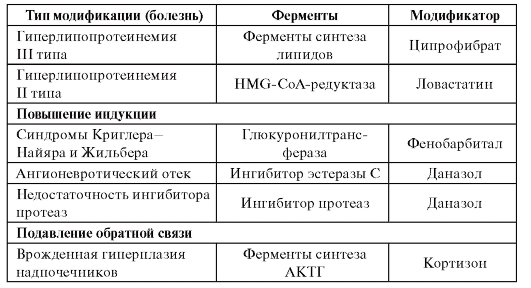 В некоторых ситуациях проводят стентирование желчных протоков ― устанавливают каркас, сохраняющий просвет.
В некоторых ситуациях проводят стентирование желчных протоков ― устанавливают каркас, сохраняющий просвет.
Гемолиз эритроцитов. Назначают фототерапию, инфузионную терапию с целью предотвращения или коррекции патологических потерь. В состав инфузионных растворов входит глюкоза и альбумин. Это методы лечения способствуют преобразованию токсичного билирубина в форму, выводимую из организма.
Ядерная желтуха (билирубиновая энцефалопатия) у новорожденных детей
Патология возникает на первую неделю жизни. Сначала выражается следующей симптоматикой: угнетение сосательного рефлекса, рвота, вялость, монотонный крик. Если не признаки будут слабовыраженными, если риск выписки из родильного отделения без оказания медицинской помощи. Обычно болезнь проявляет себя на 4 день жизни, требует срочного проведения обменного переливания крови. Это предотвращает развитие необратимых последствий.
Спустя несколько недель развития патологического состояния возникают такие симптомы, как ригидность затылочных мышц, «негнущиеся» конечности, судорожная поза с выгибанием спины, выбухание большого родничка, тремор рук, судороги, резкий мозговой крик.
Поскольку картина болезни формируется медленно от нескольких дней до недель, за это время часто возникают необратимые последствия в ЦНС. Заболевание окончательно проявляется к 3 – 5 месяцу жизни, приводит к параличам, ДЦП, глухоте, задержкам психического развития. Для предотвращения развития патологии необходимо отслеживать уровень билирубина. При необходимости сократить количество процедур грудного вскармливания. Провести фототерапию или обменное переливание.
Преимущества АО «СЗЦДМ»
Проверить уровни всех форм билирубина, а также выяснить причину нарушения билирубинового обмена можно в одной из лабораторий АО «СЗЦДМ». Это крупнейший центр, проводящий все виды лабораторных исследований, в котором также можно записаться на прием к узким специалистам.
Северо-Западный центр доказательной медицины выбирают потому, что при нем работает сеть собственных лабораторий с новейшим оборудование, а также:
-
трудятся квалифицированные медицинские и доброжелательные сотрудники; -
гарантирована высокая точность и быстрая готовность результатов; -
забор материалов можно провести на дому и в терминале, где созданы комфортные условия для анонимности; -
забрать результаты можно несколькими способами.
Еще одно отличительное преимущество ― удобное расположение лабораторий в местах транспортной доступности.
Получить подробную информацию можно по телефону: 8 (800) 234-42-00.
К какому врачу обращаться при синдроме Криглера-Наджара
Нефрологи Москвы — последние отзывы
Светлана Вадимовна просомтрела результат УЗИ и помогла решить вопрос обращения. Я очень довольна приёмом и доктором! Я благодарна ей!
Ирина,
02 марта 2021
Вежливый и очень внимательный доктор, с которым приятно общаться. Она мне грамотно все рассказала, проконсультировала и направила на обследование.
Наталья,
22 марта 2021
Приём прошёл на высшем уровне. Доктор грамотный и компетентный. Она мне всё рассказала, сразу определила диагноз, назначила лечение и дала рекомендации.
Грачик,
04 апреля 2021
Очень внимательный и спокойный врач. Ольга Витальевна провела осмотр ребёнка, проконсультировала меня, дала рекомендации и назначила дальнейшее обследование. Она так же всё подробно мне объяснила. Мы были не в первый раз у данного специалиста.
Анастасия,
27 февраля 2021
Доктор вежливый и приветливый. Она меня осмотрела, проконсультировала, дала рекомендации и назначила анализы.
Элана,
02 апреля 2021
Наталия Ивановна назначила мне сдачу анализов. Она профессиональный, отзывчивый, внимательный, позитивный и доброжелательный врач. Я пойду к ней повторно!
Александр,
06 марта 2021
Приветливый и внимательный доктор. Она меня выслушала, назначила анализы, рассказала к какому еще обратиться специалисту и дала советы.
Алексей,
31 марта 2021
Валерий Анатольевич профессиональный и лёгкий в общении врач. Приём прошёл гладко. Доктор прооконсультировал меня и дал опытные медицинские советы. Я 100% вернусь ещё к данному специалисту!
Александр,
14 марта 2021
Очень внимательный врач. Она провела осмотр, УЗИ и всё понятно рассказала. Я очень довольна! Мне понравилось, что есть где поиграть ребёнку и всё чисто.
Ольга,
07 апреля 2021
Доктор хороший и человечный. Светлана Вадимовна нас проконсультировала и дала рекомендации.
Виктор,
17 марта 2021
Показать 10 отзывов из 1236
— наследственные желтухи — Биохимия
Синдром Жильбера-Мейленграхта
Причины
К причинам заболевания относятся аутосомно-доминантное нарушение внутриклеточного переноса билирубина от мембраны в ЭПР, связанное со снижением количества лигандина, и понижение активности УДФ-глюкуронилтрансферазы.
Клиническая диагностика
Выявляется в юношеском возрасте и продолжается в течение многих лет, обычно всю жизнь. Наблюдается у 2-5% населения, мужчины страдают чаще женщин (соотношение 10:1).
- иктеричность склер (от лат. icterus — желтый),
- желтушное окрашивание кожи (только у отдельных больных), особенно лица, иногда наблюдается частичное окрашивание ладоней, стоп, подмышечных областей, носогубного треугольника.
- диспепсические жалобы отмечаются в 50% случаев, выражаются в тошноте, отсутствии аппетита, отрыжке, нарушении стула (запор или понос), метеоризме.
Лабораторная диагностика
Периодическое повышение содержание свободного (непрямого) билирубина плазмы, вызванное с провоцирующими факторами (стресс, мышечное напряжение, инфекции).
Возникновению или усилению иктеричности при синдроме Жильбера могут способствовать нервное переутомление (например, во время экзаменационной сессии) или сильное физическое напряжение (кросс, занятия со штангой). В числе прочих факторов, усиливающих желтушность, следует назвать простудные заболевания, различные операции, повторную рвоту, голодание, погрешности в диете, прием алкоголя и некоторых лекарств.
В диагностике может принести проведение пробы с голоданием: после 24-часового голодания содержание билирубина в сыворотке крови возрастает в 2 и более раз.
Синдром Дубина-Джонсона
Причины
Аутосомно-доминантная недостаточность выведения конъюгированного билирубина из гепатоцитов в желчные протоки.
Клиническая диагностика
Болезнь протекает длительно, с периодическими обострениями. Встречается чаще у мужчин, выявляется в молодом возрасте, реже после рождения. Характерны повышенная утомляемость, плохой аппетит, боли в правом подреберье, поносы, желтуха, сопровождающаяся кожным зудом. Иногда встречается увеличенная печень и селезенка.
Лабораторная диагностика
Увеличение содержания свободного (непрямого) и связанного (прямого) билирубина в плазме. Характерны билирубинурия, понижение содержания уробилина в кале и моче.
Основы лечения
Не разработано.
Синдром Криглера-Найяра
Тип I
Причины
Полное отсутствие активности УДФ-глюкуронилтрансферазы вследствие аутосомно-рецессивного генетического дефекта (частота — 0,6 человек на 1миллион новорожденных).
Клиническая диагностика
Симптомы поражения нервной системы: повышение мышечного тонуса, нистагм, опистотонус, атетоз, тонические и клонические судороги. Дети отстают в психическом и физическом развитии. Развитие ядерной желтухи и гибель ребенка.
Лабораторная диагностика
Гипербилирубинемия появляется в первые дни (часы) после рождения. Характерна интенсивная желтуха, в большинстве случаев сопровождающаяся ядерной желтухой. Непрерывное возрастание содержания свободного билирубина в плазме до 200-800 мкмоль/л (в 15-50 раз выше нормы). Отсутствие конъюгированного билирубина в желчи.
Основы лечения
- ограничение физических и нервных нагрузок,
- применяют фототерапию с использованием лампы дневного света или прямого солнечного света, что превращает билирубин в хорошо растворимый люмирубин,
- внутривенно вливают растворы альбумина,
- производят заменные переливания крови.
Тип II
Причины
При синдроме Криглера-Найяра II типа отмечается частичное снижение активности УДФ-глюкуронилтрансферазы. Относительно типа наследования II типа синдрома существуют определенные противоречия, но большинство склонно считать его аутосомно-рецессивным заболеванием.
Клиническая диагностика
Желтуха менее интенсивна.
Лабораторная диагностика
Содержание непрямого билирубина в крови в 5-20 раз выше нормы. В желчи есть билирубинглюкуронид.
Основы лечения
- ограничение физических и нервных нагрузок,
- использование препаратов, индуцирующих активность глюкуронилтрансферазы – фенобарбитал, зиксорин.
Cиндром Криглера-Найяра симптомы и лечение в ВАО — Евромедклиник
Синдром Криглера-Найяра относится к заболеваниям наследственного характера и выражается повышением содержания в крови непрямого (токсичного) билирубина. Синдром Криглера-Найяра может проявляться в двух вариантах.
Синдром I типа имеет злокачественное течение. У новорожденного появляются выраженные признаки желтухи, содержание билирубина в крови увеличивается, в результате чего наступает т.н. билирубиновая энцефалопатия. В первые два года жизни такие дети умирают. В редких случаях, пациент может дожить до подросткового возраста.
При синдроме II типа течение заболевания доброкачественное. Появление признаков желтухи может произойти только в подростковом возрасте или не появиться вообще.
Симптомы синдрома Криглера-Найяра
Симптомы синдрома Криглера-Найяра соответствуют типу заболевания. Синдром по I типу проявляется с момента рождения. Быстро накапливающийся в головном мозге билирубин, вызывает тяжелое токсическое поражение. Развитие билирубиновой энцефалопатии влечет тяжелые неврологические состояния, и в конечном итоге смерть, как правило, в первые два года жизни.
II тип синдрома может проявляться в виде желтухи в первые месяцы жизни или совсем не проявляться до достижения ребенком подросткового возраста. Течение заболевания доброкачественное и диагностировать его можно после специального обследования.
Лечение синдрома Криглера-Найяра
Лечение синдрома Криглера-Найяра направлено, прежде всего, на уменьшение содержания токсичного билирубина в крови и предупреждение развития повреждения головного мозга.
Методы лечения синдрома Криглера-Найяра
Интенсивность и методы лечения зависят от типа заболевания и тяжести его протекания. Предварительное тщательное обследование позволяет получить полную картину развития заболевания. Соответственно полученным данным разрабатывается стратегия лечения, включающая медикаментозное лечение, фототерапию, переливание крови и введение плазмы крови – все современные медицинские мероприятия, направленные на купирование патологического процесса и сохранение жизни и здоровья пациента.
Описание, причины, симптомы и лечение
Довольно редко можно услышать об этом заболевании, таком как синдром Криглера-Найяра. Но, к сожалению, этот диагноз может поставить одного ребенка на миллион. Может показаться, что это крайне редкое заболевание, но сегодня, в век генетики, мутации обнаруживаются очень часто. Давайте разберемся, что это за болезнь и как лечить в этом случае.
История открытия
Надо сказать, что этот синдром был обнаружен сравнительно недавно, в 1952 году прошлого века.Два педиатра, Криглер и Найяр, наблюдая за новорожденными детьми, впервые описали необычные симптомы желтухи. Дальнейшие исследования привели к обнаружению патологии в печени. У детей был значительно повышен непрямой билирубин, что впоследствии оказало токсическое действие на организм в целом. Согласно лабораторным данным, билирубин был повышен до 765 мкмоль / л, оставаясь в этих пределах на протяжении всей жизни ребенка.
Через некоторое время коллеги обнаружили похожие симптомы у детей старшего возраста, но с одной особенностью.Билирубин был повышен всего в 15 раз, а в течение жизни снизился до нормы. Токсического действия на организм не было. В результате таких наблюдений болезнь получила свое нынешнее название: синдром Криглера-Найяра, описание которого впервые сделали два педиатра.
Описание болезни
Синдром Криглера-Найяра является генетическим заболеванием. Клиническое заболевание выражается в яркой желтухе и тяжелых неврологических расстройствах. Желтуха выявляется в первые часы после рождения и сохраняется на протяжении всей жизни.Поражения в равной степени возникают как у мальчиков, так и у девочек. Поскольку желтуха — это проявление проблем с печенью, у некоторых пациентов этот орган увеличивается в размерах.
Признаки поражения центральной нервной системы возникают в младенчестве, порой в первые дни жизни. Они выражаются в напряжении мышц, непроизвольном подергивании глаз, выгибании спины и судорогах. Больные дети, как правило, отстают в умственном и физическом развитии. Есть два типа этого расстройства. Синдром Криглера-Найяра 1 и 2 типа может иметь разные симптомы.
Симптомы 1 типа
К сожалению, синдром Криглера-Найяра 1 типа характеризуется прогрессирующим течением. Первые симптомы появляются в первые часы жизни. У малыша становится более выраженной желтуха белков глаз и кожи, которая отличается от обычной послеродовой желтухи. Он не проходит в течение нескольких дней, а симптомы сопровождаются судорогами, непроизвольными движениями тела и глаз. Через некоторое время вы можете увидеть замедление умственного развития, связанное с билирубиновой энцефалопатией.
Показатели свободного билирубина в анализах возрастают до 324-528 мкмоль / л, что фактически превышает норму в 15-50 раз. Интоксикация головного мозга в этом случае приводит к летальному исходу в короткие сроки. В исключительных случаях такие дети доживают до школьного возраста.
Симптомы 2-го типа
Первые признаки заболевания появляются значительно позже, чем при 1-м типе. Заболевание может проявиться в первые годы жизни. У некоторых детей желтуха не проявляется до подросткового возраста, а неврологические нарушения возникают редко.Симптомы аналогичны типу 1, но не столь серьезны. Билирубиновая энцефалопатия может возникнуть после инфекции или сильного стресса.
Биохимические показатели крови у 2 типа намного ниже — уровень билирубина около 200 мкмоль / л. Этот показатель свидетельствует о том, что активность фермента глюкуронилтрансферазы составляет менее 20% от нормы. В желчи есть билирубин-глюкуронид. Диагноз «Фенобарбитал» положительный.
Билирубиновая энцефалопатия
Что ужасного в синдроме Криглера-Найяра? Симптомы болезни проявляются при отравлении головного мозга в четыре фазы.На первом этапе малыш ведет себя апатично и очень вяло. Это проявляется в плохом сосании, расслабленном состоянии, резкой реакции на посторонние звуки. Плач малыша при этом однообразен, часто изрыгает и даже может открыться рвота, его взгляд блуждает, как будто он что-то потерял. Дыхание может быть медленным.
Вторая фаза может длиться от нескольких дней до нескольких месяцев. Ребенок становится напряженным, мышцы тела принимают неестественное положение, ручки постоянно сжимаются в кулак, спина выгибается дугой.Крик из однообразного переходит в очень резкий, пропадает сосательный рефлекс и реакция на звуки. Возникают судороги, храп, потеря сознания.
Третья фаза проявляется периодом ложного улучшения состояния. Все предыдущие симптомы на время исчезают.
Четвертая фаза может появиться на 5-м месяце жизни и проявляться в виде явных симптомов физической и умственной отсталости. Малыш не держит голову, не следит за движущимися предметами, не реагирует на голос близких людей.У него развиваются судороги, парез, паралич. К сожалению, отравление мозга при 1-м типе происходит очень быстро, и младенец умирает в младенчестве.
Причины заболевания
Основная причина заболевания кроется в генах. В них нарушается процесс образования определенного фермента, отвечающего за выработку билирубина. По большей части это заболевание поражает азиатское население планеты. Мутирующий ген передается по аутосомно-рецессивному типу. В этом случае оба родителя малыша могут быть носителями мутации, но сами оставаться здоровыми.Один из родителей также может быть носителем, тогда вероятность проявления болезни составит от 50 до 50%.
Наследственная мутация гена приводит к тому, что организм не способен связывать свободный билирубин с глюкуроновой кислотой. А это, в свою очередь, приводит к тому, что свободный билирубин отравляет организм, проникая через гематоэнцефалический барьер, который у новорожденных детей не функционирует. Отравлению подвергается мозг ребенка, где накапливается токсичный билирубин.
Лечение
Для детей, у которых диагностирован синдром Криглера-Найяра, лечение направлено на удаление из организма свободного билирубина.Также важно предотвратить развитие токсического поражения головного мозга.
Для его лечения используются препараты, повышающие активность уридин-дифосфат-глюкуронидазы, фермента, приводящего к необратимым процессам в печени. Для этого «Фенобарбитал» применяют в дозировке до 5 мг на килограмм массы тела в сутки. Следует отметить, что он положительно влияет исключительно на синдром Криглера-Найяра 2 типа. При 1 типе организм на «Фенобарбитал» практически не реагирует.
При обоих видах заболеваний проводятся сеансы фототерапии, вводится плазма, проводятся обменные переливания крови.Все процедуры подготовлены для проведения трансплантации печени — для детей с 1 типом это единственный шанс выжить.
Диагностика
На сегодняшний день медицина способна установить причины таких заболеваний, как синдром Криглера-Найяра. Симптомы и методы лечения описаны давно, и теперь с помощью ДНК-тестов можно предопределить генетическую предрасположенность к заболеваниям еще в утробе матери. После рождения ребенка ДНК-диагностика дает точный ответ о том, есть ли мутации в определенных генах.
Также при развивающейся желтухе делают пробу «Фенобарбиталом». Результат анализа показывает вид заболевания.
Если подозревается синдром Криглера-Найяра, родители собирают анамнез и проводят тесты ДНК для подтверждения диагноза.
Профилактика болезней
Профилактика синдрома Криглера-Найяра заключается в предупреждении возникновения осложнений.
При синдроме I типа очень важно предотвратить развитие билирубиновой энцефалопатии, поскольку именно это приводит к преждевременной смерти пациента.
При синдроме II типа профилактика сводится к информированию пациента об обстоятельствах, которые могут спровоцировать обострение заболевания. Это осложняющие инфекции, перенапряжение, беременность, прием алкоголя и наркотиков без наблюдения лечащего врача. Все это может вызвать повышение билирубина в крови и привести к сильной интоксикации. В этой статье невозможно описать все случаи, потому что синдром Криглера-Найяра (лечение, причины, симптомы которого исследуются нами) может проявляться у детей индивидуально.
Новый потенциальный источник клеток для трансплантации гепатоцитов: Печень, отброшенная при трансплантации печени при метаболических заболеваниях
Основные моменты
- •
Трансплантация гепатоцитов ограничена доступностью полезных клеток.
- •
При некоторых метаболических заболеваниях печени патология печени незначительна.
- •
Органы пациентов с метаболическими заболеваниями используются для трансплантации домино.
- •
Печень с определенными нарушениями обмена веществ обеспечивает клеткам высокую жизнеспособность и функцию.
- •
Клетки, пораженные метаболизмом, могут быть полезны для трансплантации.
Реферат
Трансплантация печени домино — метод, используемый для увеличения количества трансплантатов печени, доступных для ортотопической трансплантации печени (ОТП). Отчеты показывают, что печень пациентов с метаболическим заболеванием печени может быть безопасно трансплантирована избранным реципиентам, если тщательно учтены дефекты донора и метаболические потребности реципиента. Печень пациентов со многими типами метаболических заболеваний печени морфологически и биохимически нормальна, за исключением мутации, которая характеризует это заболевание.Другие биохимические функции, обычно выполняемые печенью, присутствуют и предположительно «нормальны» в этих гепатоцитах. Гепатоциты были выделены из печени 35 доноров органов и 35 тканей печени, взятых на ОТП от пациентов с заболеванием печени, были проанализированы по 9 различным показателям жизнеспособности и функции. Данные показывают, что клетки, выделенные из некоторых больных печени, работали так же или лучше, чем клетки, выделенные от доноров органов, в отношении жизнеспособности, выхода клеток, эффективности посева и в анализах функции печени, включая метаболизм лекарств, реакции конъюгации и метаболизм аммиака.Клетки печени с нарушенным метаболизмом быстро и эффективно повторно заселяли печень мыши после трансплантации. Выводы: Как и в случае трансплантации печени домино, трансплантация клеток домино заслуживает рассмотрения как метод расширения пула доступных органов и клеток для трансплантации.
Сокращения
OLT
ортотопическая трансплантация печени
DLT
трансплантация печени домино
MD
метаболическая и больная печень
MMA
метилмалоновая ацидемия
MSUD
Кленовый сироп Болезнь мочи
CN
Carrigler синдром дефицита
Carrigler
1
дефицит карбамоилфосфатсинтетазы 1
CHF
врожденный фиброз печени
PNALD
заболевание печени, связанное с парентеральным питанием
A1AT
дефицит альфа-1-антитрипсина
HMM
поддерживающая среда гепатоцитов
EROD-LC-
Unit
UGT
уридин-5′-дифосфо-глюкуронозилтрансфераза
FRG
Fah — / — / Rag2 — / — / Il2rg — / —
Рекомендуемые статьи Цитирующие статьи (0)
Просмотр Б.V. Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
% PDF-1.6
%
1 0 obj> endobj
2 0 obj> поток
2014-06-25T14: 35: 08-04: 002014-04-09T08: 20: 15 + 02: 002014-06-25T14: 35: 08-04: 00PScript5.dll Version 5.2.2application / pdf
uuid: 6c7c0f33-fd9d-49af-a9c9-106415ec3f10uuid: 293c1199-8699-4473-af8f-77d528b6c50dAcrobat Distiller 10.1.1 (Windows)
конечный поток
эндобдж
3 0 obj> endobj
4 0 obj> endobj
5 0 obj> endobj
6 0 obj> endobj
7 0 obj> endobj
8 0 obj> endobj
10 0 obj> endobj
11 0 obj> endobj
12 0 obj> endobj
13 0 obj> endobj
14 0 obj> endobj
15 0 obj> endobj
16 0 obj> endobj
17 0 obj> endobj
18 0 obj> endobj
19 0 obj> endobj
20 0 obj> endobj
21 0 obj> endobj
22 0 obj> endobj
23 0 obj> поток
HWn6} WQzC} k @ R / AQ’vk # N ڢ sHJ + @ 6G «r8sfd ^ RRq 2 **% uw9
ig
AU, ITFP7K 㐒 E] v9I.RJGC: D1 = nǪ6a9 $ ѡdufY> uDt
, Bwl_ #. ْ ON: ‘
Направленная in situ генная коррекция дисфункциональных аллелей APOE для производства атеропротекторного белка ApoE3 в плазме
Сердечно-сосудистые заболевания являются ведущей причиной смерти во всем мире. Аполипопротеин E (ApoE) представляет собой циркулирующий гликопротеин массой 34 кДа, секретируемый печенью и макрофагами с плейотропными антиатерогенными функциями и, следовательно, кандидат для лечения гиперхолестеринемии и атеросклероза. Здесь мы описываем атеропротекторные свойства ApoE, а также потенциальные проатерогенные действия и распространенность дисфункциональных изоформ, обрисовываем стандартные стратегии переноса генов, а затем сосредотачиваемся на терапевтических средствах для коррекции генов, которые могут восстанавливать дефектные аллели APOE .В частности, мы обсуждаем возможность и потенциальную пользу применения в комбинации двух технических достижений для восстановления аберрантных генов APOE : (i) сконструированная эндонуклеаза для введения двухцепочечного разрыва (DSB) в экзоне 4, который содержит общие, но дисфункциональные, ε 2 и ε 4 аллеля; (ii) эффективная и выбираемая матрица для репарации гомологичной рекомбинацией (HR), а именно аденоассоциированный вирусный (AAV) вектор, который несет последовательность APOE дикого типа .Эта технология применима ex vivo, например, для нацеливания на гематопоэтические или индуцированные плюрипотентные стволовые клетки, а также для нацеливания на печеночные гены in vivo. Остается надеяться, что такая появляющаяся технология в конечном итоге будет использована в терапии пациентов для снижения риска сердечно-сосудистых заболеваний.
1. Введение
Смертность от сердечно-сосудистых заболеваний (ССЗ), которые включают ишемическую болезнь сердца, инсульт и заболевания периферических сосудов, составляют около 17 миллионов в год во всем мире, что составляет почти треть от общего числа [1].Примечательно, что более 80% смертей от сердечно-сосудистых заболеваний приходится на страны с низким и средним уровнем доходов; это болезнь не только развитых стран. Атеросклероз — это прогрессирующая воспалительная реакция на сложные взаимодействия между типами клеток, эндогенными для артериальной стенки, моноцитами, лимфоцитами и тромбоцитами из крови и циркулирующими липопротеинами [2]. Ранние атеросклеротические поражения представляют собой липидные полосы, характеризующиеся насыщенными холестерином пенистыми клетками в эндотелии сосудов. Пенистые клетки происходят из макрофагов моноцитов крови, которые рекрутируются в интиму артерий с помощью активированных молекул адгезии на активированном эндотелии.Там через нерегулируемые рецепторы-поглотители они безжалостно поглощают окисленные липопротеины низкой плотности (ЛПНП) или обедненные триглицеридами (но содержащие холестерин) частицы остаточных липопротеинов. Неспособность устранить воспаление в конечном итоге приводит к инфильтрации гладкомышечных клеток, которые размножаются в интиме, способствуя развитию уже сформировавшихся поражений.
Значительным фактором риска сердечно-сосудистых заболеваний является повышение уровня ЛПНП в плазме. Он подвержен окислению и является основным источником холестерина, который откладывается в артериях во время повреждения эндотелия.Класс препаратов статинов помогает предотвратить раннюю заболеваемость или смерть за счет снижения ЛПНП в плазме. Однако статины не исправляют низкий уровень атеропротекторных липопротеинов высокой плотности (ЛПВП), который является важным независимым фактором риска из-за его роли в удалении избыточного холестерина со стенок артерий [3, 4]. Несмотря на то, агрессивные статины высокие дозы, как сообщается, успешно регресса атеросклеротических бляшек с целью снижения заболеваемости и смертности, частоту побочных эффектов (поражение печени, острый некроз скелетных мышц, и рак) увеличивается и терапевтическое значение остается спорным.Точно так же ценность лечения статинами в сочетании с эзетимибом, ингибитором абсорбции холестерина, который дополнительно снижает холестерин ЛПНП на 15–20%, была поставлена под сомнение, поскольку не наблюдалось значительного уменьшения толщины интима-медиа [5]. Для многих пациентов по-прежнему срочно необходимы альтернативные стратегии борьбы с окклюзионными сердечно-сосудистыми заболеваниями [3, 4, 6].
К ним относятся препараты для повышения уровня ЛПВП, такие как ниацин, ингибиторы белка-переносчика эфиров холестерина (CETP) и RVX-208, небольшой член семейства хиназолина, который активирует ApoAI, основной компонент белка HDL [4–9].Большое внимание также уделяется генной терапии, включая антисмысловые олигонуклеотиды (ASO) для нацеливания на структурный белок ЛПНП ApoB100 [10]. Подавление гена пропротеинконвертазы субтилизин / кексин типа 9 (PCSK9) также косвенно снижает уровень ЛПНП. Секретируемый PCSK9 связывается с рецептором LDL (LDLR) и ускоряет его деградацию, и, следовательно, продление активности LDLR посредством ингибирования PCSK9 снижает уровни LDL в плазме [11, 12]. Добавки ЛПВП также используются в клинической практике, включая инфузию синтетических или очищенных плазмой ApoAI и пептидов-миметиков ApoAI [13].Добавление генов также использовалось для усиления ApoAI и HDL в плазме в доклинических исследованиях с использованием векторов аденовируса и аденоассоциированного вируса (AAV) для доставки [14, 15].
2. Ген и белок ApoE
Аполипопротеин E (ApoE) представляет собой полиморфный гликопротеин массой 34 кДа, в основном секретируемый печенью (~ 90%; 40–60 мкг г / мл плазмы), хотя другие ткани, особенно макрофаги, вносят свой вклад [16]. Ген человека расположен на хромосоме 19, на 5′-конце кластера генов размером 50 т.п.н., включающего ApoCI, псевдоген ApoCI, ApoCII и ApoCIV [3].Как и многие растворимые аполипопротеины, ген ApoE имеет четыре экзона, разделенных тремя интронами, и синтезируется и высвобождается каноническим путем (рис. 1). Первичный продукт трансляции представляет собой 317 остатков, содержащих N-концевой сигнальный пептид из 18 аминокислот (а.о.), который направляет растущий полипептид ApoE в эндоплазматический ретикулум. Перед секрецией ApoE подвергается гликозилированию, связанному с O- , в Golgi, в основном по Thr 194 , хотя углеводные цепи, содержащие сиаловую кислоту, также присутствуют на Ser 290 .
Белок ApoE содержит N-концевой домен (1–191 остаток) четырех амфипатических α -спиралей, связанных с С-концом петлей, чувствительной к протеазе [17]. Богатый аргинином и лизином сегмент спирали-4 (остатки 134–150; рис. 1) содержит сайт узнавания для LDLR и белка, связанного с рецептором LDL (LRP). ApoE содержит два сайта связывания гепарина, один в рецептор-связывающем домене, а другой в пределах C-конца (остатки 243–272). Существуют три общие изоформы ApoE, называемые E2, E3 и E4, которые являются продуктами трех аллелей ( ε 2, ε 3 и ε 4) в одном локусе гена [16].ApoE3 (Cys 112 , Arg 158 ) считается родительской формой, в то время как ApoE4 (Arg 112 , Arg 158 ) и ApoE2 (Cys 112 , Cys 158 ) возникают в результате генетических точечных мутаций. и являются вариантами (рис. 1). Существуют значительные аллельные вариации в разных популяциях, но в Европе относительные частоты составляют примерно 0,77, 0,15 и 0,08 для ε 3, ε 4 и ε 2 [18], что дает порядок появления Фенотипы E3 / 3, E4 / 3, E3 / 2, E4 / 4, E4 / 2 и E2 / 2.
Самый редкий вариант ApoE2 является причиной гиперлипопротеинемии III типа у небольшой части (~ 5%) из ε 2/2 индивидуумов, что дает заметно повышенный риск сердечно-сосудистых заболеваний [19, 20], а также аллель предположительно связано с внутримозговым кровоизлиянием [21]. Тем не менее, носители ε 2 имеют пониженные уровни общего холестерина и холестерина ЛПНП (см. Раздел 3), и их риск ишемической болезни сердца на 20% ниже, чем у людей с общим генотипом ε 3/3 [22], ассоциирует ApoE4. с частотой ишемического инсульта и субарахноидального кровоизлияния [21] и вызывает неблагоприятный профиль липопротеинов с повышением ЛПНП и незначительным снижением ЛПВП [22].В 1996 году метаанализ 14 исследований показал, что носители аллеля ε 4 имеют повышенный риск ишемической болезни сердца [23], и это было подтверждено в последующем метаанализе 48 исследований, включающих 15 942 случая заболевания. который пришел к выводу, что риск был на 42% выше по сравнению с ε, 3/3 носителями [24]. Более того, уровень холестерина ЛПНП на 30% ниже у людей с генотипом ε 2/2, чем у людей с ε 4/4, что сравнимо со снижением, достигнутым при применении статинов.Тем не менее, это предположение риска для Х 4 носителей спорно; Обновленный метаанализ, сосредоточенный на исследованиях с привлечением большого числа участников для снижения предвзятости публикации, сообщил лишь о небольшом увеличении риска [22]. С другой стороны, APOE : взаимодействие окружающей среды с риском сердечно-сосудистых заболеваний привлекает повышенное внимание [25]; аллель ε 4 потенцирует риск сердечно-сосудистых заболеваний из-за отсутствия физической активности, а также от курения, но в основном у женщин [26].Кроме того, носители ε 4 имеют более низкую ожидаемую продолжительность жизни, что отражает их предрасположенность к нейродегенеративным заболеваниям, а также сердечно-сосудистым заболеваниям [27, 28].
Как подробно описано в разделах 3 и 4 и независимо от генотипа, ApoE обладает множеством действий по подавлению атерогенеза. Большая часть информации получена в результате исследований in vitro или на мышах, и, хотя многие механизмы недостаточно изучены, масса доказательств убедительно свидетельствует о том, что ApoE обладает атеропротекторным действием. Но есть еще один поворот в сказке: уровни ApoE в плазме положительно коррелируют со смертностью от сердечно-сосудистых заболеваний [29], оставляя без ответа несколько вопросов, касающихся биологии человеческого ApoE в состоянии здоровья и болезней [30].
3. АпоЕ и атерозащита, связанная с липидами
АпоЕ играет важную роль в метаболизме пищевых липидов, которые попадают в кровоток в виде крупных хиломикронных частиц, богатых триглицеридами. После липолиза и поглощения богатых энергией моноглицеридов и жирных кислот остаются холестеринсодержащие и потенциально атерогенные остаточные частицы, которые зависят от ApoE для быстрого выведения из печени через пути с участием LRP, LDLR и гепарансульфатированных протеогликанов (HSPG) [31].ApoE4 имеет незначительно большую способность связываться с рецептором, чем ApoE3, но ApoE2 является дефектным с активностью связывания только 2% и 40% с LDLR и LRP, соответственно. Хотя изоформа ApoE2 имеет аминокислотную замену (Arg158Cys) за пределами домена, связывающего рецептор 134–150 (рис. 1), это оказывает серьезное разрушающее влияние. В ApoE3 солевой мостик образуется между Arg158 и Asp154. Однако это взаимодействие теряется в ApoE2, и поэтому Asp154 образует мостик с Arg150, снижая положительный потенциал сайта связывания, что заметно ухудшает его сродство связывания [32].
При заказе E2 / 2, E2 / 3, E2 / 4, E3 / 3, E3 / 4 и E4 / 4 наблюдается ступенчатое повышение уровня холестерина ЛПНП в плазме [22, 33]. Одно из объяснений состоит в том, что это отражает повышающую или понижающую регуляцию печеночного LDLR из-за изменений в доставке холестерина остатками, содержащими ApoE2 или ApoE4, соответственно. Таким образом, снижение поступления холестерина с помощью ApoE2 может увеличивать количество LDLR в печени, что снижает уровень LDL в плазме; кроме того, снижение конкуренции между остатками ApoE2 и LDL за связывание LDLR может привести к ускоренному клиренсу LDL [19].Более высокая аффинность связывания липопротеинов, содержащих ApoE4, с LDLR будет иметь противоположные эффекты и, таким образом, повысить уровни LDL. Тем не менее, механизм более сложен, поскольку превращение ЛПОНП в ЛПНП нарушается ApoE2, что снижает количество образующихся ЛПНП [19].
ApoE также способствует «обратному транспорту холестерина», антиатерогенному HDL-зависимому пути, по которому избыток холестерина в периферических тканях, включая артерии, доставляется в печень для выведения с желчью.Такая регуляция клеточного гомеостаза холестерина, особенно в макрофагах, жизненно важна для предотвращения образования пенистых клеток и атерогенеза. Эффективный отток клеточного холестерина зависит от переносчиков АТФ-связывающих кассет (ABCA1 и ABCG1), но бедные липидами ApoAI- (pre β -1 HDL) и ApoE-содержащие частицы ( γ -LpE) являются активными начальными акцепторами холестерина. Важно отметить, что фракция γ -LpE в плазме от субъектов E3 / 3 секвестрировала значительно больше клеточного холестерина, чем фракции в плазме E2 / 2 и E4 / 4 [34].Кроме того, ApoE может активировать лецитин-холестерин-ацилтрансферазу (LCAT), CETP и печеночную липазу (HL) в плазме, которые все участвуют в созревании HDL [16]. Поскольку макрофаги секретируют ApoE на участках поражения, он является доминирующим акцептором в очистке избыточного артериального холестерина. Этот эффект изоформ зависит от макрофагов моноцитов человека ApoE2 / 2, секретирующих значительно меньшие количества ApoE по сравнению с клетками E3 / 3 или E4 / 4 [35], по-видимому, потому что в макрофагах, но не в гепатоцитах, богатый цистеином ApoE2 образует димеры и мультимеры. которые связаны с LRP и удерживаются в секреторном пути [36].
Эти атеропротекторные биологические функции ApoE подтверждаются гиперлипидемией и атеромой, наблюдаемыми у ApoE-дефицитных (ApoE — / — ) мышей. Нормальные мыши устойчивы к атеросклерозу, и даже при проатерогенной диете развиваются только незрелые жировые полосы [37]. Однако мыши ApoE — / — сильно гиперхолестеринемичны при нормальном питании и спонтанно развивают широко распространенные фибропролиферативные поражения, которые развиваются в развитые комплексные бляшки с крышками гладкомышечных клеток и некротическими ядрами [38].С другой стороны, трансгенные животные, экспрессирующие общие изоформы ApoE человека, выявили более тонкие аспекты атерозащиты ApoE [37]. Например, ранние исследования на мышах и кроликах показали, что сверхэкспрессия ApoE3 пагубна, вызывая гипертриглицеридемию. Избыточная продукция печеночного ApoE стимулирует синтез триглицеридов VLDL, а также ингибирует липолиз, опосредованный липопротеин-липазой (LPL-), в основном за счет вытеснения ApoCII, важного кофактора LPL с поверхности VLDL [19].Однако фенотипические интерпретации и сравнение данных из разных групп иногда приводили в замешательство, поскольку трансген APOE человека был вставлен в разные места генома и с различным числом копий, а также потому, что также присутствовал эндогенный белок ApoE мыши.
Эти трудности были смягчены введением стратегии замены генов для создания мышей, у которых ген мыши Apoe был заменен аллелем человека. Тем не менее, у таких мышей также есть ограничения: в отличие от мышей дикого типа, животные с «нокаутом» ApoE3 были восприимчивы к вызванной диетой гиперхолестеринемии и атеросклерозу, по-видимому, потому, что человеческий ApoE3 имеет низкую аффинность связывания рецепторов и менее эффективен при удалении остаточных частиц [39]. .Более того, гиперлипопротеинемия типа III у людей, гомозиготных по аллелю ε 2, является рецессивным состоянием, тогда как доминантное наследование наблюдается у мышей с нокаутом ApoE2 [40]. Хотя это также может отражать различия в связывании рецепторов человека и мыши, следует отметить, что ~ 80% полученных из печени мышиных ЛПОНП представляют собой частицы, содержащие ApoB48, и, следовательно, мыши в гораздо большей степени зависят от ApoE для выведения остатков, чем люди. Интересно, что многие из редких вариантов ApoE с аминокислотными заменами в рецептор-связывающей области действительно ассоциируются с доминантной гиперлипопротеинемией III типа, хотя большинство из них обладают адекватной рецептор-связывающей активностью по сравнению с ApoE2 [19].Исследования Исследования In vitro [41], а также на трансгенных мышах ApoE2 и ApoE (Arg142Cys) [19] предполагают, что рецессивный ApoE2 сохраняет связывание HSPG, обеспечивая удаление остатков через этот альтернативный путь [19], тогда как доминантные варианты ApoE имеют незначительное связывание, которое означает, что общий уровень клиренса ниже, чем у ApoE2 [31].
4. АпоЕ и липид-независимая атерозащита
В настоящее время признано, что ApoE выполняет несколько биологических функций, не связанных с транспортом липидов, и что они вносят значительный вклад в его антиатерогенную активность [16, 42–44] (Рисунок 2).Большинство из них имеют противовоспалительную природу и включают раннее наблюдение, что ApoE ограничивает активацию и пролиферацию Т-клеток [45]. Позже наши собственные исследования показали, что клеточный ApoE ингибирует агрегацию тромбоцитов, а также экспрессию молекулы адгезии сосудистых клеток 1 (VCAM-1) на эндотелиальных клетках, действия, опосредованные общим механизмом взаимодействия ApoE с рецептором на поверхности клетки, LRP8. (ApoER2) для активации синтазы оксида азота (NOSIII) и высвобождения NO [46, 47]. Дополнительные данные предполагают, что ApoE стимулирует фосфорилирование тирозина LRP8, чтобы инициировать передачу сигналов киназы PI3 и активацию NOSIII [48].Индукция миграции и пролиферации гладкомышечных клеток окисленным ЛПНП или фактором роста тромбоцитов также подавляется АпоЕ [49], в то время как субэндотелиальному удержанию ЛПНП, раннему проатерогенному событию [50], препятствует присутствие АроЕ, которое, кроме того, регулирует доступность цитокинов и факторов роста в перицеллюлярном протеогликановом матриксе [51]. Существуют четкие доказательства того, что ApoE защищает клетки и липопротеины от окисления липидов и других окислительных стрессов в зависимости от изоформ, хотя результаты могут варьироваться в зависимости от используемой экспериментальной системы.В бесклеточных системах окисление, индуцированное металлами, ингибируется ApoE аллель-специфическим образом (E2> E3> E4), в основном потому, что он секвестрирует ионы металлов [52-54]. Однако, когда LDL инкубировали с трансфицированными макрофагами, секретирующими равные количества ApoE, изоформы ApoE3 и ApoE4 обеспечивали большую защиту от окисления, чем ApoE2 [54]. Было также показано, что трансфицированные перитонеальные макрофаги мыши обладают противовоспалительными свойствами, поскольку клетки, экспрессирующие ApoE3, секретируют более низкие уровни провоспалительных цитокинов IL-6 и TNF- α , чем клетки ApoE2 и ApoE4 [55].
Исследования in vivo с использованием мышей ApoE — / — также дали важные ключи к разгадке возможных атеропротекторных действий ApoE. Например, липопротеины мышей с дефицитом ApoE более окисляются и склонны к окислению, чем липопротеины контрольных мышей [56], в то время как клиренс остатков апоптотических клеток снижается в отсутствие ApoE [57]. Противовоспалительная роль ApoE в ослаблении воспаления, вызванного липополисахаридом (LPS) или бактериями, постулируется на основании повышенной чувствительности мышей ApoE — / — по сравнению с контрольными животными при заражении такими патогенами [58–60].Напротив, специфическая провоспалительная роль ApoE была предложена ван ден Эльзеном и его коллегами, которые показали, что ApoE доставляет липидные антигены в эндосомные компартменты CD1 антигенпрезентирующих дендритных клеток, скорее всего, через эндоцитоз LDLR, чтобы стимулировать естественные Т-клетки-киллеры [61 ]. Эта активация была потеряна в сыворотке человека с истощенным ApoE, а также резко снизилась у ApoE-дефицитных мышей, зараженных экзогенным липидным антигеном. Авторы также предположили, что ApoE может использовать этот путь для доставки собственных липидных антигенов и обострения атеросклероза, хотя такое удаление антигенных липидов также может быть атеропротекторным.Полное описание взаимодействия между ApoE и цитокинами, включая модуляцию воспалительных и иммунных ответов и изоформную зависимость, выходит за рамки этой статьи, но недавно было рассмотрено Zhang и его коллегами [44]. Более того, (пато) физиологическая важность таких липид-независимых действий ApoE подчеркивается исследованиями, в которых низкий уровень экспрессии продолжает обеспечивать атерозащиту у ApoE — / — животных, несмотря на отсутствие изменений в их гиперлипидемии [42, 62] .Примечательно, что Raffai et al. [63] предоставили убедительные доказательства того, что низкие уровни белка ApoE обладают способностью регрессировать ранее существовавших атеросклеротических поражений, независимо от снижения уровня холестерина в плазме.
5. Терапевтические средства для усиления генов ApoE
5.1. Ранние исследования протеинотерапии и трансгенных мышей
Двадцать лет назад очищенный из плазмы или рекомбинантный белок ApoE вводили кроликам с генетической или вызванной диетой гиперхолестеринемией. Уровень холестерина в плазме был заметно снижен, в то время как долгосрочное исследование остановило развитие атеросклеротических бляшек [64].Эти доклинические данные подтвердили, что ген APOE является кандидатом для терапевтических манипуляций. Точно так же синтетические пептиды, имитирующие область связывания ApoE (на основе димерного повтора аминокислот 141–155), очищали богатые холестерином липопротеины у мышей ApoE — / — [65], стратегия, которая превратилась в ковалентное связывание ApoE 141–150. остатки до 18 а.о. амфипатический спиральный пептид, способный связываться с атерогенными ApoB-содержащими липопротеидами [66]. Трижды в неделю внутривенная инъекция этого двухдоменного пептида мышам ApoE — / — в течение 6 недель снижала уровень холестерина в плазме и атеросклеротические поражения в синусе аорты [67].
Использование in vivo миниорганов, секретирующих ApoE, подтверждает эти антиатерогенные действия пептидов ApoE и очищенного белка. Рекомбинантные ApoE-экспрессирующие эндотелиальные клетки, встроенные в матригель, вводили внутрикожно мышам ApoE — / — , у которых через 3 месяца было на 50% меньше холестерина в плазме и уменьшалось количество атеросклеротических бляшек [68]. Точно так же имплантация инкапсулированных в альгинат сконструированных клеток в брюшину мышей ApoE — / — секретировала достаточное количество ApoE для снижения уровня холестерина в плазме и повышения атеропротекторных ЛПВП [69].Трансгенные мыши, сверхэкспрессирующие ApoE, предоставляют дополнительные доказательства атеропротекции ApoE, поскольку эти животные защищены от индуцированной диетой или диабетической гиперлипидемии [70, 71]. Более того, ограниченная макрофагами экспрессия ApoE у трансгенных мышей [72] или у мышей ApoE — / — после трансплантации костного мозга дикого типа [73, 74] ингибирует атерогенез.
5.2.
Исследования переноса генов ApoE
О переносе генов ApoE впервые сообщили 16 лет назад с использованием рекомбинантных аденовирусных (rAd) векторов, которые доставляют чужеродную ДНК в печень млекопитающих с эффективностью почти 100%.Высокие уровни ApoE в плазме были получены после внутривенной инъекции rAd.ApoE3 мышам ApoE — / — , что снижает уровень холестерина в плазме и замедляет атерогенез аорты [75]. К сожалению, терапевтический эффект был временным, поскольку эти векторы 1-го поколения вызвали сильный иммунологический ответ Т-клеток. Напротив, векторы 2-го поколения давали устойчивую экспрессию человеческого ApoE и в значительной степени нормализовали профиль липопротеинов у мышей ApoE — / — на протяжении 6-недельного исследования [76].Более того, у мышей с гиперлипидемией LDLR-нулевые, печеночная экспрессия человеческого ApoE3 индуцировала регресс ранее существовавших атеросклеротических поражений без изменения уровней липопротеинов в плазме [77], что подразумевает липид-независимое атеропротекторное действие (Рисунок 2). Также была отмечена возможность регресса прогрессирующей атеромы у старых животных [78], в то время как низкая токсичность и низкая иммуногенность хелпер-зависимых rAd-векторов позволили добиться высокой стабильной экспрессии ApoE и пожизненной атеропротекции у мышей ApoE — / — [79].
Альтернативный вирусный вектор для rAd — аденоассоциированный вирус (AAV), который содержит линейный одноцепочечный ДНК-геном и в настоящее время находится на переднем крае клинических испытаний генной терапии. В ранних исследованиях использовались векторы, полученные из общего серотипа 2, которые очень эффективно трансдуцировали клетки in vitro, но, к сожалению, были в значительной степени неэффективными in vivo. Однако эта область была усилена выделением более 10 новых серотипов, что привело к разработке новых псевдотипированных векторов rAAV, то есть капсидов альтернативных серотипов AAV, несущих геном рекомбинантного AAV серотипа 2.Они продемонстрировали поразительно улучшенные характеристики in vivo и отличались тканевым тропизмом к AAV2 / 2; например, печень трансдуцировала rAAV2 / 8 с эффективностью почти 100% [80–82], тогда как rAAV2 / 1 [83], rAAV2 / 6 [84] или rAAV2 / 7 [85] были эффективны для трансдукции скелетных мышц.
Эта повышенная серотипическая эффективность была продемонстрирована внутривенной (направленной на печень) инъекцией человеческого вектора ApoE3 rAAV2 / 8 мышам ApoE — / — ; были произведены нормальные человеческие уровни (50-80 мкг мкг / мл) плазменного ApoE [58].Предполагается, что, в отличие от серотипа 2, эти различные серотипы AAV быстро распадаются, чтобы облегчить отжиг одноцепочечных геномов плюс и минус rAAV в стабильные, транскрипционно активные двухцепочечные молекулы ДНК [86]. Точно так же недавнее введение самокомплементарных векторов rAAV (scAAV), которые позволяют обойти необходимость отжига геномов векторов rAAV, позволяет достичь быстрого и более высокого уровня экспрессии трансгена [87, 88]. Например, экспрессия ApoE3 из scAAV2 / 8 с использованием гепатоцит-специфического промотора (LP1) нормализовала уровни холестерина у самцов мышей ApoE — / — и замедлила развитие атеросклероза аорты на 58% [89].
Скелетная мышца, доступная, стабильная и хорошо васкуляризованная ткань, также использовалась для переноса генов ApoE. Хотя мышцы обычно не секретируют ApoE, известно, что непеченочный, не происходящий из макрофагов ApoE является атеропротекторным [62, 90]. Действительно, внутримышечная инъекция вектора плазмидной ДНК, экспрессирующего человеческий ApoE3, мышам ApoE — / — дала умеренное, но устойчивое снижение холестерина в плазме [91], в то время как в другом исследовании сообщалось о снижении образования ксантомы и атеросклеротических бляшек [92].Высокая чистота и низкая иммуногенность плазмид, которые экспрессируются эписомно, что делает невозможным инсерционный мутагенез, делают их привлекательными носителями для доставки. Экспрессия может быть дополнительно увеличена за счет электроимпульсного воздействия на места инъекции [93]. Кроме того, мы ввели векторы AAV2 / 7, AAV2 / 8 и AAV2 / 9, экспрессирующие человеческий ApoE3, в переднюю большеберцовую мышцу мышей ApoE — / — . Первые два вектора были наиболее эффективными, продуцируя до 2 мкл г ApoE3 / мл плазмы, и через 13 недель у мышей было на 50% меньше липидов бляшек в брахиоцефальных артериях, чем у животных, получавших AAV2 / 9 [94].
6. Олигонуклеотид-опосредованное редактирование гена человеческого гена
APOE в культивируемых клетках
6.1. Предпосылки
Редактирование генов, как описано в данном документе, использует короткие синтетические олигонуклеотиды для манипулирования геномной ДНК и введения небольших сайт-специфических изменений, обычно 1-3 нуклеотида, в выбранный ген живой клетки. Следовательно, он имеет потенциал для внесения специфических мутаций, увеличения или уменьшения функции в клеточные линии или линии мышей, а также для изучения однонуклеотидных полиморфизмов (SNP).Ниже и в разделе 7 мы описываем некоторые стратегии, используемые для достижения генотипических модификаций. Однако важно отметить, что, в отличие от технологий переноса генов, изменение является постоянным; кроме того, сохраняются существующие энхансеры и промоторы генов, а также клеточно-специфический контроль и контекст. Эти преимущества лежат в основе его конечной цели: излечения наследственных заболеваний, вызванных точечными генетическими мутациями или небольшими делециями / вставками. Во-первых, мы объясняем, почему синтетические олигонуклеотиды, которые относительно недороги и предлагают гибкий дизайн и химию, остаются ценными для создания новых изогенных клеточных линий, например, для исследования различных эффектов изоформ ApoE на клеточный метаболизм.Во втором разделе 7 мы описываем быстрый прогресс, достигнутый в терапевтических приложениях, например, ex vivo или in situ репарации генетических точечных мутаций.
6.2. Редактирование генов: раннее использование олигонуклеотидов РНК-ДНК
Концептуально эта технология основана на независимых наблюдениях Смитиса и Капеччи в 1980-х годах, согласно которым гомологичная рекомбинация (HR) между большим экзогенным сегментом ДНК и его целевой последовательностью в геноме млекопитающих может опосредуют модификацию или репарацию генома [95, 96]; он также основан на применении коротких синтетических олигонуклеотидов для восстановления дефектных аллелей у дрожжей [97].15 лет назад группа Kmiec сообщила об использовании гибридных олигонуклеотидов РНК-ДНК (RDO или химерапластов) для внесения сайт-специфических изменений в 1-3 нуклеотида в геномы млекопитающих. Они сконструировали RDO, чтобы сформировать двухцепочечный олигонуклеотид с закрученной шпилькой, включающий короткую область корректирующей ДНК, ограниченную длинными участками защищенной 2′-O-метиловой РНК. Считалось, что сильное спаривание оснований РНК-ДНК способствует инвазии цепи и отжигу в целевом геномном локусе (например, генетическая точечная мутация).Эта высокоаффинная гибридизация включает обе цепи гена и создает несоответствие в точке точечной мутации, что приводит к распознаванию и коррекции одним или несколькими путями репарации гена млекопитающих. Ранние исследования Кмица и его коллег по исправлению мутации серповидных клеток в линии лимфобластоидных клеток [99] и по нацеливанию на первичные клетки CD34 + [100] вызвали большое волнение, но также вызвали заметные противоречия, поскольку рассматривалась эффективность преобразования до 50%. неправдоподобно [101].Однако эти критические замечания были отклонены подтверждением других, включая нацеливание на клетки гепатоцитов человека [102, 103] и, в знаковых исследованиях, нацеливание in vivo на ген фактора IX крысы [104] и коррекцию мутации гена UGT1A1 . у крыс Gunn с гипербилирубинемией [105].
На основе этих успехов наша лаборатория впервые применила методику лечения сердечно-сосудистых заболеваний, включая преобразование дисфункционального ApoE2 [106] и ApoE4 [107] в ApoE3 с использованием стандартного 68-мерного RDO для нацеливания.Однако практичность этой новой методологии была поставлена под сомнение, когда несколько групп, включая нашу собственную, начали сообщать о плохой воспроизводимости и нестабильных конверсиях [108, 109]. Одним из неблагоприятных факторов было различное качество длинных и сложных молекул RDO, что означало более высокие дозы реагентов и средств доставки для восстановления; в свою очередь, они могут усиливать цитотоксическое и проапоптотическое действие или вызывать остановку клеточного цикла [107, 109]. Тем не менее, проблемная природа этих реагентов 1-го поколения была смягчена благодаря выводам группы Kmiec о том, что цельная цепь ДНК RDO инициализирует геномную репарацию [110] и что одноцепочечный цельный ДНК-олигонуклеотид (ssODN) может превзойти по эффективности RDO защищают от расщепления нуклеазами путем химической модификации оснований [111].Как описано в Разделе 6.3, эти данные побудили нас перейти на короткие (27-мерные) ssODN, которые более чистые и обеспечивают повышенную воспроизводимость.
6.3. Редактирование генов: использование одноцепочечных олигонуклеотидов с полной ДНК (ssODN)
Нацеленные ssODN гомологичны геномной последовательности за исключением желаемого изменения — несоответствия для введения или исправления точечной мутации или короткой вставки / удаления. Поскольку одноцепочечная ДНК быстро разрушается в клетках, ssODN обычно защищаются модифицированными нуклеазо-устойчивыми основаниями, чаще всего тремя фосфоротиоатными (РТО) связями на их 5′- и 3′-концах.Молекулярные детали изменения целевого гена остаются плохо очерченными, но включают элементы систем эксцизионной репарации нуклеотидов и оснований, а также некоторую степень участия HR [112, 113], в то время как по крайней мере часть корректирующего олигонуклеотида ДНК физически встроена в сайт-мишень генома [ 114]. Учитывая трудности и противоречия, связанные с RDO-направленным ремонтом, мы решили оптимизировать нашу методологию в рекомбинантных клетках млекопитающих, экспрессирующих чувствительный репортерный ген, зеленый флуоресцентный белок (GFP), который стал нефлуоресцентным путем введения точечной мутации.Это позволило провести анализ на уровне отдельных клеток и собрать исправленные (зеленые) клетки для дальнейшего изучения. Мы предоставили строгие доказательства для проверки технологии и однозначного установления того, что изменение гена, опосредованное ssODN, является реальным и воспроизводимым явлением [115].
Хотя защита 5′-3′-PTO дала в 10 раз большую эффективность коррекции, чем немодифицированный ssODN (около 2% против 0,2% клеток-мишеней были зелеными), мы подтвердили наблюдение других [111], что только низкий процент этих зеленых клеток активно реплицировался [116].Анализ клеточного цикла через 16 часов после трансфекции показал, что ssODN с защитой конца PTO приводил к повреждению ДНК с накоплением клеток в фазе G2, тогда как обработка немодифицированным ssODN была заметно менее токсичной. Однако, варьируя тип или положение защитных групп, мы обнаружили, что внутренняя защита ssODN с четырьмя остатками РТО в сайте нацеливания поддерживает эффективную генную коррекцию и, по сравнению с защитой 5′-3′-РТО, значительно снижает клеточную остановка цикла для обеспечения роста и пролиферации клеток (рис. 3) [116].
(a) PTO ssODN с защитой по концам: хорошая эффективность и минимальное распространение
(b) PTO ssODN с внутренней защитой: средняя эффективность и хорошее распространение
(a) 5′3 с защитой по концам ‘PTO ssODN: хорошая эффективность и минимальная пролиферация
(b) Внутренне защищенный PTO ssODN: средняя эффективность и хорошая пролиферация
В настоящее время мы оцениваем этот новый дизайн ssODN для воздействия на эндогенный ген APOE3 в макрофагах моноцитов человека THP1 и клетки гепатобластомы человека HepG2 (обе ε 3/ ε 3) для создания клеток с фенотипом ApoE4.Мы разработали матрицу аффинного захвата, чтобы отличить успешно нацеленные секретирующие ApoE4 клетки (<1%) от некорректированных клеток ApoE3. При этом используется карбоксиметилцеллюлозная среда с низкой проницаемостью, предварительно загруженная коммерческим ApoE4-специфическим моноклональным антителом для обнаружения, и дает чувствительные и воспроизводимые результаты. Секретируемый ApoE легко улавливался на поверхности отдельных клеток, повышая эффективность окрашивания и сокращая время анализа. Обнаружены обогащенные скорректированные популяции клеток, секретирующих ApoE4, хотя выделение и размножение исправленных клонов оказывается трудным.Если успешный клон будет идентифицирован и охарактеризован, он подвергнется второму нацеливанию для создания фенотипа ApoE4 / 4.
Эти эксперименты примечательны по двум причинам. Во-первых, они предоставят убедительное доказательство того, что редактирование генов, направленное ssODN, может генерировать новые клеточные линии, здесь, с фенотипами E3 / E4 и E4 / 4, хотя аналогичная стратегия может генерировать другие общие фенотипы (E2 / E3, E2 / 2, и E2 / 4), если используется ApoE2-специфическое антитело [117]. Во-вторых, эти изогенные клетки можно использовать для исследования различий изоформ в переносе и секреции ApoE макрофагов (и гепатоцитов) [35, 36], для мониторинга дифференциальных клеточных ответов на оксидантный стресс или на нагрузку холестерина, а также для исследования изменений в структуре и составе секретируемые частицы липопротеина ApoE [48].
7. Терапевтическая коррекция in situ дефектных генов
APOE
7.1. Обоснование репарации гена ApoE
В большинстве исследований in vivo, описанных в разделах 2–4, использовались ApoE-нулевые мыши. Это дало важную информацию о функциях ApoE и позволило быстро оценить белковую и генную терапию. Однако, поскольку генетический дефицит ApoE и отсутствие ApoE в плазме у человека крайне редки, ценность такой доклинической модели сомнительна. Поэтому примечательно, что увеличение плазменного ApoE посредством трансгенной экспрессии или переноса гена подтвердило его атеропротекторную функцию у мышей с дефицитом LDLR и у мышей с диабетом или мышей, получавших жир, все из которых имеют нормальные уровни ApoE в плазме.Тем не менее, исследования на животных также указывают на осторожность при увеличении экспрессии ApoE3 с использованием технологий переноса генов; сверхэкспрессия у мышей и кроликов вызывает гипертриглицеридемию [19].
Альтернативный и привлекательный подход, хотя и отдаленная терапевтическая цель, состоит в том, чтобы облегчить дислипопротеинемию и снизить риск сердечно-сосудистых заболеваний путем коррекции на месте вредного гена APOE с использованием целевого редактирования генов. Возможно ли это? Одна из возможностей, основанная на множественных атеропротекторных действиях секретируемого макрофагами ApoE3, заключается в лечении гиперлипопротеинемии III типа путем трансплантации гемопоэтических стволовых клеток (HSC) после восстановления ex vivo аберрантного гена APOE .Поскольку состояние является рецессивным, преобразование одного аллеля ε 2 в ε 3 должно обеспечить эффективное лечение. Более того, нынешний импульс внедрения технологий стволовых клеток в клинику, особенно индуцированных плюрипотентных стволовых клеток (ИПСК), предполагает дополнительные возможности для манипуляций ex vivo и клеточной терапии [118]. Сюда входит эффективная дифференцировка в функциональные гепатоцитоподобные клетки [119–121], что позволяет репарированному гену APOE экспрессироваться из клеток, привитых в печень.Наконец, есть также захватывающая перспектива прямого таргетинга in vivo на печеночные гены для коррекции генетических заболеваний in situ [122]. Эти сложные методы лечения дефектных генов в будущем будут основываться на более продвинутых технологиях, чем простая ядерная доставка ssODN, и они обсуждаются в оставшихся разделах этой статьи.
7.2. Шаблоны восстановления ДНК
ssODN, которые мы использовали для нацеливания на ген APOE , имеют несколько преимуществ: высокая чистота и простота получения, включая переменный химический состав, легкую доставку и высокую точность без побочных эффектов.Хотя ssODN и другие конструкции, такие как олигонуклеотиды, образующие тройную спираль, и небольшие гомологичные фрагменты ДНК [113], могут действовать как матрицы репарации ДНК, наиболее эффективным является аденоассоциированный вирус (AAV), который несет геном линейной одноцепочечной ДНК. Хотя технически сложно получить эти вирусные векторы, они могут генетически нацеливаться на эмбриональные стволовые клетки (ESC), HSC или iPSC, достигая эффективности коррекции 0,07–1% [113, 123–125]. Механизм, как показано на рисунке 5, для нацеливания и генной репарации дефектного APOE2 осуществляется посредством гомологичной рекомбинации (HR), поскольку подавление основных компонентов потенциально конкурентного пути негомологичное соединение концов (NHEJ) не влияет на частоту конверсии [ 126].Отметим также, что нацеливающий вектор может нести селектируемый маркер, такой как пуромицин-N-ацетил-трансфераза, между плечами гомологии, которые, если они фланкированы двумя сайтами LoxP, могут быть вырезаны из генома репарированных клеток с помощью Cre-рекомбиназы. Совсем недавно хелпер-зависимые аденовирусные векторы (HDAdV) также использовались для эффективного и точного нацеливания генов на человеческие ESC и iPSC [127, 128]. Эти векторы способны корректировать большие области генома (~ 35 т.п.н.) и не затрагиваются, если целевой локус транскрипционно неактивен [129].
7.3. Двухцепочечные разрывы (DSB) заметно стимулируют репарацию гена HR
Хотя HR-направленная репарация гена является точной и универсальной, как показано на рисунках 4 и 5, она происходит с очень низкой частотой в клетках млекопитающих (~ 10 −6 ) с использованием обычных плазмид с линейным нацеливанием в качестве матриц [130]. Однако HR — это один из способов, с помощью которого клетки восстанавливают двухцепочечные разрывы ДНК, например, используя сестринскую хроматиду в качестве матрицы, и этот феномен был использован для увеличения событий нацеливания на ген HR более чем в 1000 раз.Первоначальные исследования вставили редкий участок разреза для мегануклеазы, I- Sce I, в репортерный ген-мишень, а затем котрансфицировали клетки эндонуклеазой и репарационной ДНК-матрицей [131, 132]. Тем не менее, такая система имеет небольшую практическую ценность; он требует предварительной инженерии целевого гена и не может использоваться для эндогенных генов.
Недавние исследования в области создания искусственных эндонуклеаз позволяют обойти это узкое место, создав химерные нуклеазы, способные расщеплять ДНК практически по любой желаемой последовательности.Наиболее изучены нуклеазы цинковых пальцев (ZFNs), которые содержат ДНК-связывающий домен (собранный в виде модулей из 3–5 пальцев, каждый из которых распознает 3 последовательных основания), соединенный с ферментом неспецифического расщепления ДНК, FokI . В принципе, индивидуализированные ZFN, которые функционируют парами, поскольку расщепление FokI требует димеризации, могут быть созданы с заранее определенной специфичностью последовательности для введения DSB в точный геномный локус (рис. 6). В течение последних нескольких лет сообщалось о впечатляющем количестве успешных нацеленных на гены ZFN, включая коррекции in vitro на 18–30%, образование крыс с нокаутом генов и манипуляции с человеческими эмбриональными или индуцированными плюрипотентными стволовыми клетками [113, 133 –136].Одной из проблем ZFN является генотоксичность из-за расщеплений вне мишени, которые могут нарушить нормальные гены [137], хотя улучшенные конструкции и процедуры скрининга помогают снизить эту возможность [138, 139]. Вторая проблема состоит в том, что ZFN могут восстанавливать восстановленный сайт, хотя это можно свести к минимуму путем введения нескольких молчащих мутаций в матрицу донорской ДНК, поскольку это нарушит последующее связывание ZFN [140].
Эффекторные нуклеазы, подобные активатору транскрипции (TALEN), представляют собой другую группу химерных нуклеаз, которые имеют другой класс ДНК-связывающих доменов, связанных с FokI .Эффекторные белки TAL содержат высокомодульные ДНК-связывающие домены с очень простым кодом между их аминокислотами и основаниями ДНК-мишени [141, 142]. Это позволяет готовую сборку серии отдельных модулей для связывания уникальной последовательности ДНК и активации димеризации и расщепления FokI . Хотя сообщения о TALEN-опосредованном нацеливании генов на клетки млекопитающих все еще ограничены, эта простая и эффективная технология может вскоре вытеснить ZFN; действительно, в первом прямом сравнении TALEN имели большую специфичность и меньшую цитотоксичность, чем ZFN [143].
Наконец, альтернативой сконструированным химерным нуклеазам являются самонаводящиеся эндонуклеазы, которые индуцируют DSB с исключительной специфичностью. Это природные ферменты с большими асимметричными узнающими последовательностями (12-40 п.н.), которые образуют пять семейств на основе гомологии последовательностей и структур [144, 145]. Инженерия «смешай и сопоставь» с помощью вычислений позволяет производить и проверять десятки настраиваемых мегануклеаз, большинство из которых основано на мотиве последовательности семейства LAGLIDADG . В свою очередь, предполагаемые сайты DSB можно предсказать по всему геному человека.Это говорит о том, что можно будет идентифицировать уникальную последовательность размером> 14 п.н. в экзоне 4 гена APOE , который может быть расщеплен самонаводящейся мегануклеазой.
7.4. Комбинации ZFN-ssODN
На сегодняшний день наиболее распространенной матрицей для нацеливания на гены, зависимые от репарации DSB, является кольцевая или линейная плазмида, хотя в настоящее время появляются преимущества использования AAV в качестве субстрата экзогенного донора ДНК [146–148]. Однако новая захватывающая работа устанавливает, что комбинация ZFN-ssODN предлагает гибкое и эффективное редактирование генома.Чен и его коллеги [149] использовали ZFN, которые разрезают область гомологии ssODN, и сообщили о частоте редактирования от 1 до 30% в зависимости от типа клетки и от того, были ли мишени одиночными нуклеотидными заменами или небольшими или большими делециями. Важно отметить, что ssODN оказался более эффективным и надежным партнером по рекомбинации, чем традиционные конструкции двухцепочечной ДНК, скорее всего потому, что ssODN не участвует в NHEJ и, следовательно, не будет вставляться в сайты неспецифического расщепления. Действительно, дуэт ZFN-ssODN уже использовался для успешного редактирования человеческих iPS-клеток [150].Учитывая, что ssODN проще и дешевле производить оптом, они имеют высокий профиль чистоты и безопасности и относительно просты в доставке, вполне вероятно, что их использование будет продолжать расширяться.
Технология исправления врожденных генетических мутаций в клетках, включая гематопоэтические стволовые клетки и индуцированные плюрипотентные стволовые клетки, быстро развивалась в течение последних нескольких лет. Коррекция in situ дисфункциональных аллелей ε 2 и ε 4 для облегчения гиперлипидемии и противодействия прогрессированию атеросклероза в настоящее время является доклинической реальностью.Это также переводится на пациентов. Комбинация выбираемой матрицы ДНК на основе AAV для эффективной репарации HR, которая дополнительно стимулируется безопасным и точным введением DSB в целевой геномный локус, обеспечивает необходимые технологические инструменты [146, 147, 151]. Действительно, редактирование генома с использованием искусственно созданных эндонуклеаз недавно было объявлено «Методом года Nature’s » на 2011 год [152].
Восстановление дефектного гена APOE2 в стволовых клетках костного мозга (клон-отрицательные) от пациентов с гиперлипопротеинемией III типа с последующей немиелоаблативной трансплантацией (пониженной интенсивности) обеспечит секретируемый макрофагами антиатерогенный ApoE3 в местах поражения и остановит атеросклеротические бляшки. прогрессия.Этот терапевтический подход может быть подвергнут критической оценке на доклинической модели — мыши с нокаутом ApoE2 человека. Более того, перспектива прямого таргетирования in vivo печеночных генов для in situ коррекции дисфункциональных аллелей ε 2 больше не является далекой мечтой. Кодовая доставка через гепатотропные векторы AAV8 химерной нуклеазы и донорскую ДНК-матрицу в печень мышей с дефицитом фактора IX в крови восстанавливала гемостаз [122].
Можно ли также преобразовать аллель ε 4 в ε 3 для снижения риска сердечно-сосудистых заболеваний, когда, как указано в разделе 2, увеличение может быть лишь незначительным даже для аллеля ε 4/ ε 4 перевозчики? Несомненно, этот случай можно оспорить: в этой группе обязательно найдутся люди, которые выиграют, возможно, потому, что их ЛПНП находится в верхнем дециле носителей ε 4/ ε 4 или потому что у них есть другие факторы риска.Будущая перспектива редактирования гена в макрофагах и / или печени также позволит применить более гибкий терапевтический подход. Учитывая, что аллель ε 2 связан с низким уровнем ЛПНП и снижением ССЗ, мы также можем предположить, что лучшим терапевтическим вариантом является преобразование клеток из ε 4/ ε 4 в клетки ε 4/ ε 2, а не ε 4/ ε 3. Ясно, однако, то, что ApoE, который в 1973 году был идентифицирован в человеческих VLDL [153], играет множество ролей в биологии клеток человека и болезнях, и что, несмотря на Впечатляющее понимание этих функций за последние два десятилетия, нам еще предстоит многое узнать.Со временем можно надеяться, что такие идеи в сочетании с появляющейся технологией ex vivo или in situ редактирования гена APOE человека, в конечном итоге, будут применены в терапии пациентов для снижения риска сердечно-сосудистых заболеваний.
Сокращения
| AAV: | Аденоассоциированный вирус | ||||
| ABCA1 / G1: | Переносчик АТФ-связывающей кассеты A1 / G1 | ||||
| Apo: | |||||
| CETP: | Белок переноса сложного эфира холестерина | ||||
| DSB: | Двухцепочечный разрыв | ||||
| ESC: | Эмбриональные стволовые клетки | ||||
| GFP6 | Зеленый | Хелпер-зависимый аденовирус | |||
| HSPG: | Гепарансульфат протеогликан | ||||
| HL: | Печеночная липаза | ||||
| Липопротеин ЛПВП | Липопротеин высокой плотности рекомбинация | ||||
| HSC: | Гематопоэтические стволовые клетки | ||||
| ИПСК: | Индуцированные плюрипотентные стволовые клетки | ||||
| ЛХАТ: | Лецитин-холестерин-ацилтрансфераза | ||||
| ЛПНП | ЛПНП | ЛПНП | Липопротеин | ЛПНП | Низкая плотность |
| LRP: | белок, связанный с рецептором ЛПНП | ||||
| ЛПС: | Липополисахарид | ||||
| NHEJ: | Негомологичное концевое соединение | ||||
| Тип 9049prois 9049 / kextilas sub | PTO: | Фосфоротиоат | |||
| rAdV: | Рекомбинантный аденовирус | ||||
| RDO: | РНК-ДНК олигонуклеотид | ||||
| Одноцепочечный олигодезоксири бонуклеотид | |||||
| TALEN: | Нуклеаза, подобная активатору транскрипции | ||||
| VLDL: | Липопротеин очень низкой плотности | ||||
| ZFN: | Нуклеаза цинкового пальца. |
Благодарности
Работа авторов поддержана грантами проекта British Heart Foundation (PG / 06/015/20305 и PG / 09/070/27912) и наградой Фонда Питера Самуэля, Royal Free Госпиталь И. Папайоанну (№ 933).
Диагностика и лечение болезни кленового сиропа: исследование 36 пациентов
Оценить подход к диагностике и лечению болезни кленового сиропа (MSD).
Семейные анамнезы и молекулярное тестирование мутации Y393N субъединицы E1alpha альфа-кетокислоты дегидрогеназы с разветвленной цепью позволяют нам идентифицировать младенцев с высоким риском MSD.Концентрации аминокислот были измерены в образцах крови этих детей из группы риска в возрасте от 12 до 24 часов. Еще 18 младенцев с МСД были диагностированы в возрасте от 4 до 16 дней из-за нарушения обмена веществ. Протокол лечения МСД был разработан для 1) подавления катаболизма эндогенного белка, 2) поддержания синтеза белка, 3) предотвращения дефицита незаменимых аминокислот и 4) поддержания нормальной осмолярности сыворотки. В нашем протоколе делается упор на усиление анаболизма белков и диетическую коррекцию дисбаланса аминокислот в плазме, а не на удаление лейцина путем диализа или гемофильтрации.Во время острых заболеваний скорость снижения уровня лейцина в плазме отслеживалась как показатель чистого синтеза белка. Протокол лечения острых заболеваний включал использование маннита, фуросемида и гипертонического раствора для поддержания или восстановления нормального уровня натрия в сыворотке и внеклеточной осмолярности и тем самым предотвращения или устранения опасного для жизни отека мозга. Аналогичные принципы соблюдались как при ведении больных, так и при здоровом амбулаторном лечении, особенно в течение первого года, когда требовалось тщательное согласование потребления аминокислот с разветвленной цепью с быстро меняющимися темпами роста.Экскрецию кетокислот с разветвленной цепью часто контролировали дома, а уровни аминокислот с разветвленной цепью измеряли во время обычного посещения клиники, что позволяло незамедлительно диагностировать и лечить метаболические нарушения.
1) Восемнадцать новорожденных с МСД были идентифицированы в группе высокого риска (n = 39) в возрасте от 12 до 24 часов с помощью аминокислотного анализа плазмы или цельной крови, собранной на фильтровальной бумаге. Молярное отношение лейцина к аланину в плазме колебалось от 1,3 до 12,4 по сравнению с контрольным диапазоном 0.12 до 0,53. Ни один из младенцев, идентифицированных до 3-дневного возраста и находившихся под наблюдением в соответствии с нашим протоколом лечения, не заболел в неонатальный период, и 16 из 18 не были госпитализированы. 2) Используя наш протокол лечения, еще 18 младенцев, которые находились в состоянии биохимической интоксикации на момент постановки диагноза, быстро выздоровели. У всех младенцев уровень лейцина в плазме снизился до <400 микромоль / л в период от 2 до 4 дней после постановки диагноза. Темпы снижения уровня лейцина в плазме при использовании комбинации энтерального и парентерального питания были постоянно выше, чем при диализе или гемоперфузии.Профилактика острого дефицита изолейцина, валина и других аминокислот в плазме с помощью соответствующих добавок позволила устойчиво снизить уровни лейцина в плазме до терапевтического диапазона от 100 до 300 микромоль / л, после чего был введен диетический лейцин. 3) Последующее наблюдение за 36 младенцами старше 219 пациенто-лет показало, что, хотя общие инфекции часто вызывают потерю метаболического контроля, общая частота госпитализаций после неонатального периода составила всего 0,56 дня на пациента за год наблюдения, и результаты развития всегда были хорошими.У четырех пациентов развился опасный для жизни отек мозга в результате метаболической интоксикации, вызванной инфекцией, но все выздоровели. Каждый из этих 4 пациентов продемонстрировал доказательства того, что резкое снижение концентрации натрия в сыворотке и снижение осмолярности сыворотки были связаны с быстрым прогрессированием отека мозга во время их острых заболеваний.
Классический МСД может быть управляемым, чтобы обеспечить доброкачественное течение новорожденных, нормальный рост и развитие и низкую частоту госпитализаций. Однако неврологическая функция может быстро ухудшиться в любом возрасте из-за метаболической интоксикации, спровоцированной распространенными инфекциями и травмами.Эффективное лечение сложной патофизиологии этого биохимического расстройства требует комплексного управления общей медицинской помощью и питанием, а также контроля нескольких переменных, которые влияют на анаболизм и катаболизм эндогенных белков, концентрации аминокислот в плазме и осмолярность сыворотки.
описание, причины, симптомы и особенности
Vous entendez redument parler d’une tellemaladie com le Syndrome de Crigler-Nayar. Mais, malheureusement, ce диагностический peut mettre un enfant sur un миллион.Cela peut sembler une maladie extrêmement red, mais aujourd’hui, à l’ère de la génétique, les mutations sont très souvent detectées. Regardons ce qu’est la maladie et quel est le traitement dans ce cas.
Histoire de la découverte
Il faut dire qu’ils ont découvert ce синдрома Assezrécemment, en 1952 du siècle dernier. Deux pédiatres, Crigler et Nayyar, наблюдатель за новыми младенцами, ont d’abord, décrit les симптомы, обитающие в желании. D’autres études ont pipe à l’identification d’une patologie dans le foie.Chez les enfants, la bilirubine indirecte a considérablement augmenté, ce qui a eu par la suite un effet toxique sur le corps dans son ensemble. Selon les données de labratoire, билирубин и его увеличение до 765 мкмоль / л, alors qu’elle est restée dans ces limites tout au long de la vie de l’enfant.
Après un определенных temps, des collègues ont identifié de tels problèmes.symptômes chez les enfants plus âgés, mais avec une caractéristique. La bilirubine n’a été élevée que 15 fois par rapport à la norme et a été réduite à la norme au cours de la vie.Les effets toxiques sur le corps ne l’étaient pas. À la suite de telles наблюдений, la maladie a reçu son nom actuel: синдром Криглера-Наяра, qui a été décrit pour la première fois par deux pédiatres.
Описание болезни
Синдром Криглера-Наяра является болезнью генетической болезни. La Clinique de la maladie s’exprime en jaunisse vive et Troubles Neurologiques Graves. La jaunisse находится в детстве в Les Premières heures après la naissance et persiste toute la vie. Les lésions se produisent de manière égale chez les garçons et les filles.La jaunisse étant une manifestation de problèmes hepatiques, cet organe est agrandi chez определенных пациентов.
Les signes de dommages au système nerveux central se produisent dans la petite enfance, parfois dans les premiers jours de la vie. Это явное проявление напряжений мускулов, непроизвольных сокращений, вызванных судорогами. Les enfants malades onttendance à prendre du retard dans leur développement mental et Physique. Два типа проблем не идентифицируются.Синдромы Криглера-Наяра типов 1 и 2, которые представляют разные симптомы.
Симптомы типа 1
Неисправность, синдром Криглера-Найяра, характерный для прогрессирующего заболевания типа 1. Признаки премьеры, присущие премьерам жизни. La jaunisse du bébé des yeux et de la peau devient plus prononcée, ce qui diffère de la jaunisse post-partum ownuelle. Il ne disparaît pas au bout de quelques jours, mais des симптомов, ассоциированных с конвульсиями, et à des mouvements invontaires du corps et des yeux sont ajoutés.Au fil du temps, on peut Observer un ralentissement du développement mental associé à l’encéphalopathie à la bilirubine.
Индикаторы свободного билирубина в анализе на 324–528 мкмоль / л, на самом деле, в норме от 15 до 50 фунтов. L’intoxication du cerveau dans ce cas pipeline à la mort en peu de temps. Dans des cas exceptionnels, ces enfants vivent jusqu’à l’âge scolaire.
Симптомы типа 2
Премьеры подписывают плохой аппарат сигнификатора плюс более позднего qu’avec le типа 1.La maladie peut se manifestester dans les premières années de la vie. Chezs sure enfants, la jaunisse n’apparaît pas avant l’adolescence и les anomalies nearologiques sont rares. Симптомы sont similaires à ceux du type 1, mais pas si graves. Энцефалопатия с билирубином после заражения или серьезного стресса.
Биохимические параметры человека типа 2, не содержащие билирубина в окружающей среде, 200 мкмоль / л. Этот индикатор указывает на то, что активность фермента глюкуронилтрансферазы составляет 20% от нормы.Желчь, содержащая билирубин-глюгуронид. Диагностический avec «Phénobarbital» positif.
Encéphalopathie bilirubine
Quel est le синдром ужаса Криглера-Наяра? Симптомы болезни проявляются в четырех фазах отравления серво. Dans la première phase, le bébé se comporte de manière apathique et très lente. Cela se manifesteste par une mauvaise succion, un état de relax, une vive reaction aux sons parasites. Le cri du bébé est monotone, il rote souvent et les vomissements peuvent même s’ouvrir, les yeux errants, com s’il avait perdu quelque selected.Дыхание peut être lente.
La deuxième phase peut durer de plusieurs jours àplusieurs mois. L’enfant devient tenu, les мускулы корпуса, занимающие позицию non naturelle, les poignées sont constamment serrées en poing et le dos est cambré. Le cri du monotone devient très vif, le réflexe de succion et la réaction aux sons disparaissent. Il y a des crampes, des ronflements, une perte de совесть.
La troisième phase se manifest par une période de fausse amélioration.Все предшествующие симптомы не имеют отношения к моменту.
Quatrième phase peut apparaître à 5 mois de la vie.et манифест симптомов, манифестов отсталого физического и умственного развития. Le gamin ne se tient pas la tête, ne suit pas les objets en mouvement, ne réagit pas à la voix des personnes proches. Il développe des conulsions, des parésies, des paralysies. Malheureusement, l’intoxication cérébrale du type 1 restient très rapidement et l’enfant meurt en bas âge.
Causes de la maladie
Основная причина болезни в женах.Это нарушает образование определенного фермента, ответственного за выработку билирубина. Pour la plupart, la население азиатской планеты суфре де cette maladie. Le gène muté est transmis de manière autosomique récessive. Dans ce cas, les deux parent du bébé peuvent être porteurs de la mutation, mais être en bonne santé eux-mêmes. Il peut aussi s’agir du porteur de l’un des parent, la probabilité de manifestation de la maladie sera alors от 50 до 50%.
Генетическая генетическая мутация, способствующая возникновению глюкуронического глюкуронического глюкуронического глюкуронического глюкуронового кислоты.Et ceci, à son tour, pipe au fait que la bilirubine libre empoisonne le corps, en pénétrant dans la barrière hémato-encéphalique, qui ne fonctionne pas chez le nouveau-né. Le cerveau d’un enfant est разоблачен отравлением за счет накопления токсического вещества билирубина.
Traitement
Pour les enfants diagnostiqués avec le SyndromeCrigler-Nayar, le traitement vise éliminer la bilirubine libre du corps. Il est également important de pévenir le développement de lésions cérébrales toxiques.
Лечебные препараты, которые используются для лечения возбудителя луридиндифосфатглюкуронидазы, фермента, являющегося проводником необратимого процесса в фуа. Pour ce faire, аппликация «Фенобарбитал» в дозе, равной 5 мг на килограмм массы тела. Il est à noter qu’il un effet positif эксклюзивный для синдрома Кригглера-Найяра типа 2. Avec le type 1, l’organisme ne réagit pratiquement pas au «phénobarbital».
Органические сеансы для двух типов болезней.фототерапия, инъекции плазмы, переливание крови кровью. Toutes les procédures sont préparées pour Effectuer une greffe du foie — pour les enfants atteints du type 1, c’est la seule Chance de Survie.
Diagnostics
Aujourd’hui, la médecine estспособен лечить болезни, вылечившие синдром Криглера-Наяра. Симптомы и методы лечения не обнаруживают длительных периодов и более тщательных тестов ADN, являются возможными детерминаторами генетической предрасположенности к болезням, même in utero.После рождения ребенка, диагностический ADN не реагирует на точный количественный анализ на наличие текущей мутации в определенных генах.
En outre, avec le development de la jaunisse, un test est effectué avec «Phenobarbital» Le résultat de l’analyse montre le type de maladie.
При подозрении на синдром Криглера-Наяра, анализ проводится по результатам проверки родителей и тестов ADN, которые используются для подтверждения диагностики.
Профилактика болезней
Профилактические меры против синдрома Криглера-Наяра, обеспечивающие профилактику осложнений.
При синдроме I типа, важном для предотвращения развития энцефалопатии билирубина, автомобиль может вызвать предродовую смерть пациента.
При синдроме II типа профилактика может быть информирует пациента о предрасположенных обстоятельствах, провоцирующих обострение болезни. Il s’agit d’infections Complquées, de surmenage, de grossesse, de consomitation d’alcool et de drogues sans la надзор за медсин traitant. Tout cela peut entraîner une augmentation de la bilirubine dans le sang et une nexication grave.В этой статье, «Невозможно описать все случаи», синдром Карле Криглера-Наяра (особенности, причины, не проверять симптомы) является проявлением индивидуального детства.
JaypeeDigital | Трансплантация печени детям
Автор
1. Гупта Субаш
2. Сибал Анупам
3. Капур Акшай
4.Малхотра Смита
ISBN
97893508
DOI
10.5005 / jp / books / 11880_22
Издание
2 / e
Год публикации
2013
Страницы
12
Принадлежность автора
1.
Трансплантация печени и желудочно-кишечная хирургия, Госпиталь Индрапрастха Аполло, Нью-Дели, Индия,
Центр болезней печени и трансплантации, больницы Индрапрастха Аполло, Нью-Дели, Индия,
Больницы Indraprastha Apollo, Нью-Дели, Индия,
Центр изучения печени и желчевыводящих путей, Специальная больница Макса, Нью-Дели, Индия
2.Группа больниц Apollo и старший консультант по детской гастроэнтерологии, гепатологии и питанию, Центр передовой педиатрии Apollo, Госпиталь Indraprastha Apollo, Нью-Дели,
Медицинский факультет Квинслендского университета, Брисбен, Австралия; Центр передовой педиатрии Apollo, Госпиталь Indraprastha Apollo, Нью-Дели, Индия,
Центр передовой педиатрии Apollo, Больницы Indraprastha Apollo, Нью-Дели, Индия,
Группа больниц Аполло; Медицинский факультет Квинслендского университета, Брисбен, Австралия; Тело института, Институт последипломного медицинского образования и исследований, Чандигарх, Индия; Больницы Indraprastha Apollo, Нью-Дели, Индия,
Больница Индрапрастха Аполло, Нью-Дели, Индия,
Группа больниц Аполло, Госпиталь Индрапрастха Аполло, Нью-Дели, Индия,
Больницы Indraprastha Apollo, Нью-Дели, Индия
3.

