Кровотечения при туберкулезе реферат 2010 по медицине
Клиника Кровохарканье всегда является грозным симптомом многих заболеваний и требует нередко экстренных лечебных мероприятий. Причины кровохарканья всегда разнообразны, и по патогенетическому признаку можно лишь схематически разделить кровохарканья на следующие группы: 1) псевдокровохарканье; 2) кровохарканье без заболевания легких; 3) кровохарканье при нетуберкулезных заболеваниях легких; 4) кровохарканье при туберкулезе легких. В зависимости от количества выделенной крови различают кровотечения: малые (100мл), средние (500мл), профузные (свыше 500мл). Как ни многочисленны причины кровохарканий и легочных кровотечений, все же наиболее часто эти осложнения наблюдаются у больных туберкулезом. Кровохарканье у больных туберкулезом может быть при всякой форме процесса в легких и при любой степени его развития. Оно может быть первым симптомом туберкулеза, появляющимся еще до того, как современными методами диагностики удается определить локализацию процесса. Кровохарканье сопровождает развившийся легочный туберкулез в острой фазе и при хроническом течении болезни и бывает также после заживления участков деструкции, как при всяком другом пневмосклеротическом процессе. Кровохарканье может появляться как признак обострения туберкулеза после длительного, иногда многолетнего интервала после первой вспышки, сопровождать терминальные фазы туберкулеза, и, наконец, легочные крове течения могут быть непосредственной причиной смерти больного туберкулезом. При туберкулезе легких кровохарканье может быть следствием токсического влияния микобактерии туберкулеза на стенки капиллярных сосудов, специфических изменений в сосудах легкого и патологического развития сосудов в фиброзно измененной легочной ткани. Кровохарканье может происходить вследствие выхода из русла крови всех ингредиентов ее через неповрежденную стенку кровеносного сосуда (per diapedesin). Наиболее часто такое кровохарканье наблюдается при начальных формах туберкулеза, при свежих очаговых изменениях с перифокальной зоной вокруг, при инфильтратах и пневмонических фор мах туберкулеза, когда нет еще деструкции легочной ткани. Такой же механизм кровохарканья может быть и при хронических, далеко зашедших формах легочного туберкуле в период обострения, если кровохарканье возникает из участков легкого, занятых перифокальным воспалением. У больных фиброзно-кавернозным туберкулезом кровохарканья и легочные кровотечения большей частью возникают вследствие разрушения стенки кровеносного сосуда (per rexin). Развитие туберкулезного процесса в стенке кровеносного сосуда с последующим разрушением его вызывает обильное легочное кровотечение. Количество излившейся крови зависит от диаметра сосуда, быстроты образования и прочности тромба. Перфорация кровеносного сосуда, расположенного в стенке каверны, а иногда проходящего через каверну в виде трабекулы, вызывает часто обильное легочное кровотечение с последующей аспирацией крови в ниже лежащие отделы легкого или в противоположное легкое. Потеря крови имеет меньшее значение, чем последствия легочного кровотечения. Причиной смерти при кровотечениях, как правило, является не кровопотеря, а асфиксия вследствие заполнения воздухоносных путей кровью. При старых цирротических формах туберкулеза в участках обширного и массивного развития соединительной ткани на месте воспалительного или деструктивного процесса происходят деформация кровеносных сосудов и образование капиллярных аневризм. Разрушение этих аневризматических образований может быть причиной частого кровохарканья. Хотя выделение крови в подобных случаях происходит per rexin, потеря крови при этом незначительна. Введением больших доз газа (1000 см 3) в плевральную полость можно создать компрессионный пневмоторакс и прекратить легочное кровотечение. Из средств, уменьшающих проницаемость стенки капиллярных сосудов и повышающих свертываемость крови, шире кое применение имеет при кровохарканьях хлорид кальция. Он тормозит воспалительно-аллергические процессы и как активатор тромбокиназы повышает свертываемость крови. Наиболее часто назначаемый 10% хлорид кальция может быть заменен 10% раствором глюконата кальция, которые можно применять не только внутривенно, но и внутримышечно.
Такой же механизм кровохарканья может быть и при хронических, далеко зашедших формах легочного туберкуле в период обострения, если кровохарканье возникает из участков легкого, занятых перифокальным воспалением. У больных фиброзно-кавернозным туберкулезом кровохарканья и легочные кровотечения большей частью возникают вследствие разрушения стенки кровеносного сосуда (per rexin). Развитие туберкулезного процесса в стенке кровеносного сосуда с последующим разрушением его вызывает обильное легочное кровотечение. Количество излившейся крови зависит от диаметра сосуда, быстроты образования и прочности тромба. Перфорация кровеносного сосуда, расположенного в стенке каверны, а иногда проходящего через каверну в виде трабекулы, вызывает часто обильное легочное кровотечение с последующей аспирацией крови в ниже лежащие отделы легкого или в противоположное легкое. Потеря крови имеет меньшее значение, чем последствия легочного кровотечения. Причиной смерти при кровотечениях, как правило, является не кровопотеря, а асфиксия вследствие заполнения воздухоносных путей кровью. При старых цирротических формах туберкулеза в участках обширного и массивного развития соединительной ткани на месте воспалительного или деструктивного процесса происходят деформация кровеносных сосудов и образование капиллярных аневризм. Разрушение этих аневризматических образований может быть причиной частого кровохарканья. Хотя выделение крови в подобных случаях происходит per rexin, потеря крови при этом незначительна. Введением больших доз газа (1000 см 3) в плевральную полость можно создать компрессионный пневмоторакс и прекратить легочное кровотечение. Из средств, уменьшающих проницаемость стенки капиллярных сосудов и повышающих свертываемость крови, шире кое применение имеет при кровохарканьях хлорид кальция. Он тормозит воспалительно-аллергические процессы и как активатор тромбокиназы повышает свертываемость крови. Наиболее часто назначаемый 10% хлорид кальция может быть заменен 10% раствором глюконата кальция, которые можно применять не только внутривенно, но и внутримышечно. Обычное внутривенное введение хлорида кальция можно комбинировать с аутогемотерапией, т.е. применять аутогемо-кальциотрансфузию. После введения хлорида кальция шприц через ту же иглу набирают кровь, которую тотчас же вводят обратно в вену. Такая трансфузия может быть произведена несколько раз (2-3 раза). Необходимо внимательно следить за появлением признаков свертывания крови шприце, чтобы не вводить в вену свернувшуюся кровь. Ауто-гемокальциотрансфузия, по нашим наблюдениям, более эффективна, чем внутривенное введение только хлорида кальция. С целью понижения проницаемости стенки капиллярного сосуда применяется аскорбиновая кислота (витамин С) в инъекциях по 500 мг 1-2 раза в день. Антигеморрагический витамин К (каротин) эффективен при кровохарканье, связанном с гипопротромбинемией. Суточная доза витамина К (10 мг) вводится внутримышечно (1 мл 1 % раствора). Для повышения свертываемости крови можно применять желатин — 25-30 мл 10% раствора подкожно. С той же целью, но значительно реже следует прибегать к введению нормальной лошадиной или противодифтерийной сыворотки (30-50 мл). Применение сывороток как протеинотерапии может вызвать обострение туберкулезного процесса. Для прекращения кровохарканья и легочных кровотечений рекомендуют трансфузию крови в небольших количествах — по 80-100 мл крови одноименной группы или крови универсального донора. Широко применяется как гемостатическое средство под кожное введение кислорода (500-800 мл). Метод легко доступен, технически прост, не имеет противопоказаний и может быть применен в домашней и амбулаторной обстановке как при туберкулезном, так и при нетуберкулезном кровохарканье. Кислород под кожу вводят через иглу при помощи аппарата для искусственного пневмоторакса, а при отсутствии последнего можно вводить кислород непосредственно из подушки. Предполагают, что при подкожном введении кислорода изменяются физико-химические свойства крови, в результате чего повышается ее свертываемость. Переходя к средствам, способствующим перераспределению крови между малым и большим кругом кровообращения, прежде всего мы считаем необходимым упомянуть фармакологические препараты, назначение которых не рекомендуется при лечении легочных кровотечений.
Обычное внутривенное введение хлорида кальция можно комбинировать с аутогемотерапией, т.е. применять аутогемо-кальциотрансфузию. После введения хлорида кальция шприц через ту же иглу набирают кровь, которую тотчас же вводят обратно в вену. Такая трансфузия может быть произведена несколько раз (2-3 раза). Необходимо внимательно следить за появлением признаков свертывания крови шприце, чтобы не вводить в вену свернувшуюся кровь. Ауто-гемокальциотрансфузия, по нашим наблюдениям, более эффективна, чем внутривенное введение только хлорида кальция. С целью понижения проницаемости стенки капиллярного сосуда применяется аскорбиновая кислота (витамин С) в инъекциях по 500 мг 1-2 раза в день. Антигеморрагический витамин К (каротин) эффективен при кровохарканье, связанном с гипопротромбинемией. Суточная доза витамина К (10 мг) вводится внутримышечно (1 мл 1 % раствора). Для повышения свертываемости крови можно применять желатин — 25-30 мл 10% раствора подкожно. С той же целью, но значительно реже следует прибегать к введению нормальной лошадиной или противодифтерийной сыворотки (30-50 мл). Применение сывороток как протеинотерапии может вызвать обострение туберкулезного процесса. Для прекращения кровохарканья и легочных кровотечений рекомендуют трансфузию крови в небольших количествах — по 80-100 мл крови одноименной группы или крови универсального донора. Широко применяется как гемостатическое средство под кожное введение кислорода (500-800 мл). Метод легко доступен, технически прост, не имеет противопоказаний и может быть применен в домашней и амбулаторной обстановке как при туберкулезном, так и при нетуберкулезном кровохарканье. Кислород под кожу вводят через иглу при помощи аппарата для искусственного пневмоторакса, а при отсутствии последнего можно вводить кислород непосредственно из подушки. Предполагают, что при подкожном введении кислорода изменяются физико-химические свойства крови, в результате чего повышается ее свертываемость. Переходя к средствам, способствующим перераспределению крови между малым и большим кругом кровообращения, прежде всего мы считаем необходимым упомянуть фармакологические препараты, назначение которых не рекомендуется при лечении легочных кровотечений. Спорынья, стиптицин, гидрастис, эрготин, адреналин не должны применяться при кровохарканье. Уменьшая кровенаполнение сосудов большого круга кровообращения, они способствуют переполнению кровью легкого и создают условия для усиления кровохарканья. Не рекомендуется также применение морфина. Морфин, подавляя кашлевые рефлексы, способствует аспирации крови и развитию аспирационных пневмоний. Роль перечисленных выше медикаментозных средств при кровохарканье отрицательная. Наиболее эффективным фармакологическим средством при легочных кровотечениях и кровохарканьях является камфора в больших дозах: инъекции 10-20 мл 20% камфорного масла в сутки. Камфора улучшает кровообращение, причем усиливается работа левого желудочка сердца и уменьшаются застойные явления в легких. Камфора увеличивает кровоснабжение периферических сосудов тела. С целью уменьшения кровенаполнения малого круга кровообращения можно комбинировать инъекции камфоры с перетяжкой конечностей — наложением резиновых жгутов на нижние и верхние конечности поочередно на 30-40 мин (при перетяжке пульс должен прощупываться), что вызывает временное депонирование части крови в конечностях, тем самым уменьшая кровенаполнение легких. Подкожные инъекции 0,1% раствора атропина могут быть также рекомендованы при кровохарканье. Атропин, вызывая расширение сосудов брюшной полости, уменьшает кровенаполнение легкого. Большое значение имеют положение больного, условия отхаркивания крови, режим питания и движения во время кровохарканья. Покой для больного в этот период необходим, но абсолютная неподвижность и запрещение говорить весьма тягостны и действуют на больного неблагоприятно. Больному следует разрешить разговор тихим голосом и не резкие движения конечностями. Отхаркивание крови и мок роты должны происходить свободно; для этого больного надо держать в полусидячем положении. Из диеты больного следует исключить продукты, вызывающие метеоризм и запор. Пища не должна быть горячей, но и нельзя давать больному все блюда только в холодном виде.
Спорынья, стиптицин, гидрастис, эрготин, адреналин не должны применяться при кровохарканье. Уменьшая кровенаполнение сосудов большого круга кровообращения, они способствуют переполнению кровью легкого и создают условия для усиления кровохарканья. Не рекомендуется также применение морфина. Морфин, подавляя кашлевые рефлексы, способствует аспирации крови и развитию аспирационных пневмоний. Роль перечисленных выше медикаментозных средств при кровохарканье отрицательная. Наиболее эффективным фармакологическим средством при легочных кровотечениях и кровохарканьях является камфора в больших дозах: инъекции 10-20 мл 20% камфорного масла в сутки. Камфора улучшает кровообращение, причем усиливается работа левого желудочка сердца и уменьшаются застойные явления в легких. Камфора увеличивает кровоснабжение периферических сосудов тела. С целью уменьшения кровенаполнения малого круга кровообращения можно комбинировать инъекции камфоры с перетяжкой конечностей — наложением резиновых жгутов на нижние и верхние конечности поочередно на 30-40 мин (при перетяжке пульс должен прощупываться), что вызывает временное депонирование части крови в конечностях, тем самым уменьшая кровенаполнение легких. Подкожные инъекции 0,1% раствора атропина могут быть также рекомендованы при кровохарканье. Атропин, вызывая расширение сосудов брюшной полости, уменьшает кровенаполнение легкого. Большое значение имеют положение больного, условия отхаркивания крови, режим питания и движения во время кровохарканья. Покой для больного в этот период необходим, но абсолютная неподвижность и запрещение говорить весьма тягостны и действуют на больного неблагоприятно. Больному следует разрешить разговор тихим голосом и не резкие движения конечностями. Отхаркивание крови и мок роты должны происходить свободно; для этого больного надо держать в полусидячем положении. Из диеты больного следует исключить продукты, вызывающие метеоризм и запор. Пища не должна быть горячей, но и нельзя давать больному все блюда только в холодном виде.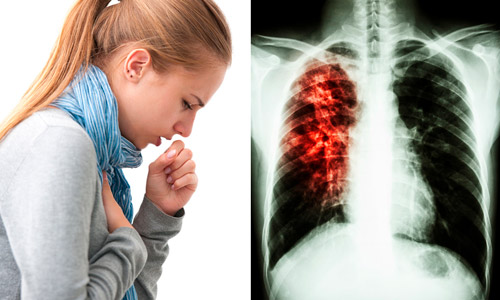 При легочных кровотечениях, учитывая возможность аспирации крови и развития аспирационных пневмоний, в генезе которых большое значение могут иметь гноеродные микробы, рекомендуется, кроме противотуберкулезных препаратов, назначать пенициллин по 600 000 — 1 000 000 ЕД в сутки. Применяя лечебные методы и средства с учетом в каждом отдельном случае их действия на патологический процесс, можно эффективно бороться с легочным кровотечением и кровохарканьем у больных туберкулезом.
При легочных кровотечениях, учитывая возможность аспирации крови и развития аспирационных пневмоний, в генезе которых большое значение могут иметь гноеродные микробы, рекомендуется, кроме противотуберкулезных препаратов, назначать пенициллин по 600 000 — 1 000 000 ЕД в сутки. Применяя лечебные методы и средства с учетом в каждом отдельном случае их действия на патологический процесс, можно эффективно бороться с легочным кровотечением и кровохарканьем у больных туберкулезом.
Пульмонэктомия при легочном кровотечении у больных туберкулезом Текст научной статьи по специальности «Клиническая медицина»
УДК: 616.24-005.1+616-002.5-089.87
ПУЛЬМОНЭКТОМИЯ ПРИ ЛЕГОЧНОМ КРОВОТЕЧЕНИИ У БОЛЬНЫХ ТУБЕРКУЛЕЗОМ
Т.М.КАРИЕВ, С.П.АБУЛКАСИМОВ, А.А.ИРГАШОВ
Pulmonectomy аt lung bleeding at patients with tuberculosis
T.M.Kariev, S.P.Abulkasimov, A.A.Irgashov
РСНПМЦ фтизиатрии и пульмонологии
Легочное кровотечение и рецидивирующее кровохарканье при распространенном фиброзно-кавернозном туберкулезе является тяжелым и грозным осложнением, угрожающим жизни больных. Терапевтическое лечение этого осложнения недостаточно эффективно или оказывает лишь временный эффект. Одним из основных методов лечения, который надежно избавляет больных от легочного кровотечения и распространенного туберкулеза легких, является пульмо-нэктомия. Наиболее эффективна (89,3%) пульмонэктомия, выполненная после стойкой остановки легочного кровотечения. В промежутке времени между легочным кровотечением или на его высоте эффективность пульмонэктомии снижается соответственно до 66,7 и 52,6%.
Ключевые слова: туберкулез легких, легочное кровотечение, хирургическое лечение, пульмонэктомия
Lung bleeding and bloodly cough are severe complications of fibrous-cavernous tuberculosis. The conservative treatment of this disease is insufficient, or temporally. Pulmonectomy is one of the main methods of prevention of lung bleeding due tuberculosis. Most high efficacy (89,3%) was obtained in pulmonectomy after stable bleeding stop. In the period of time between lung bleeding or its high point the efficacy of pulmonectomy decreases up to 66,7% end 52,6%, respectively.
The conservative treatment of this disease is insufficient, or temporally. Pulmonectomy is one of the main methods of prevention of lung bleeding due tuberculosis. Most high efficacy (89,3%) was obtained in pulmonectomy after stable bleeding stop. In the period of time between lung bleeding or its high point the efficacy of pulmonectomy decreases up to 66,7% end 52,6%, respectively.
Key-words: tuberculosis, lung bleeding, surgical treatment, pulmonectomy
Легочное кровотечение при деструктивном туберкулезе легких — одно из опасных осложнений, которое нередко представляет угрозу жизни больных. Частота этого осложнения при различных формах легочного туберкулеза варьирует от 5,2 до 6,5%, при фиброзно-кавернозном туберкулезе достигает 31,7%, а массивные и опасные профузные легочные кровотечения встречаются в 8-12% случаев [3,4,6].
В патогенезе легочных кровотечений и рецидивирующих кровохарканий при легочной патологии важная роль принадлежит гипертензии малого круга, обусловленной хроническим фиброзно-цирротическим процессом в легочной ткани и в системе легочной артерии, особенно бронхиального кровоснабжения, с формированием аневризматических расширений и венозно-артериальных свищей [1,5].
Рациональный выбор лечебной тактики при легочном кровотечении и рецидивирующем кровохарканьи у больных туберкулезом остается актуальной проблемой, которая требует окончательного решения. Так, комплексное терапевтическое лечение (гемостатическая, гипотензивная, трансфузионная терапия с использованием белковых препаратов,
синтетических кровезаменителей, по показаниям -свежеприготовленной одногруппной крови и др.) при легочных кровотечениях не эффективно или оказывает временный клинический эффект. При
этом летальность достигает 75-85% [1,3-5]. Наиболее обоснованным целесообразным методом лечения легочных кровотечений при деструктивном туберкулезе, несмотря на высокий оперативный риск из-за тяжести состояния больных, следует признать хирургический [1,2,5,7]. Улучшение результатов хирургического лечения легочных кровотечений зависит от своевременного определения показаний, совершенствования методики операции, обеспечения анестезиологической безопасности и полноценной послеоперационной комплексной терапии.
Наиболее обоснованным целесообразным методом лечения легочных кровотечений при деструктивном туберкулезе, несмотря на высокий оперативный риск из-за тяжести состояния больных, следует признать хирургический [1,2,5,7]. Улучшение результатов хирургического лечения легочных кровотечений зависит от своевременного определения показаний, совершенствования методики операции, обеспечения анестезиологической безопасности и полноценной послеоперационной комплексной терапии.
Материал и методы
Под нашим наблюдением находились 143 (28,8%) больных туберкулезом легких, которым выполнена пульмонэктомия по поводу легочного кровотечения. Всего же пульмонэктомия по поводу распространенного и осложненного фиброзно-кавернозного туберкулеза произведена 497 пациентам. Мужчин было 98, женщин 45, 107 (74,8%) были в молодом возрасте от 20 до 30 лет.
Продолжительность легочного туберкулеза у 26 (18,2%) больных составляла 2 года, у 77 (53,8%) — от 2 до 5 лет, у 40 (28,0%) — более 5 лет. В течение этого времени больные неоднократно получали химиотерапию без эффекта.
Подробное изучение анамнеза показало, что рецидивирующее кровохарканье в течение последних 6-12 месяцев наблюдалось у 91 больного,
Пульмонэктомия при легочном кровотечении у больных туберкулезом
а неоднократное легочное кровотечение — у 52. По классификации М.И.Перельмана (2007) малые кровотечения (до 100 мл) наблюдались у 91 больного, средние (до 500 мл) — у 44, большие или профузные кровотечения (свыше 500 мл) — у 8. В мокроте микобактерии туберкулеза обнаружены у 97 (67,8%) больных, из них у 68 (70,1%) -устойчивые формы. Устойчивость к 1 химиопрепарату (стрептомицину) обнаружена у 4 (5,9%) больных, к 2 (изониазиду, стрептомицину) — у 21 (30,9%), 3 и более (изониазиду, рифампицину, стрептомицину, этамбутолу) — у 43 (63,2%). Устойчивость микобактерий туберкулеза к лекарственным препаратам значительно ограничивала терапевтические возможности и служила одной из существенных причин неэффективности предшествующей противотуберкулезной химиотерапии.
Устойчивость микобактерий туберкулеза к лекарственным препаратам значительно ограничивала терапевтические возможности и служила одной из существенных причин неэффективности предшествующей противотуберкулезной химиотерапии.
На основании рентгенологического исследования грудной клетки (обзорная и боковая рентгенография, томография на разных уровнях) распространенный фиброзно-кавернозный
туберкулез диагностирован у всех 143 больных. На стороне доминирующего легочного поражения одна фиброзная каверна размером от 4 до 6 см в диаметре с очаговой диссеминацией и фиброзно-цирротической трансформацией легочной ткани установлена у 41 (28,7%) больного, множественные фиброзные каверны разных размеров (от 1,5 до 7 см) — у 54 (37,8%), большие и гигантские каверны диаметром более 10 см — у 48 (33,5%). Распространенный характер легочного процесса, обусловленный наличием фиброзных каверн, очаговых и фиброзно-цирротических изменений в легочной ткани, служил причиной анатомической и функциональной неполноценности пораженного легкого. У 15 (10,5%) из 143 больных деструктивный туберкулез выявлен в противоположном менее пораженном легком, из них очаговый с распадом — у 8, инфильтративный с распадом — у 2, туберкулема с распадом — у 1, кавернозный туберкулез — у 4.
Результаты и обсуждение
После госпитализации на основании результатов клинико-рентгенологического
обследования тяжесть болезни оценивалась как тяжелая и среднетяжелая за счет выраженной туберкулезной интоксикации организма, полиморфизма общей и бронхолегочной симптоматики (общая слабость, плохой аппетит, повышение температуры тела, кашель с выделением слизисто-гнойной мокроты с прожилками свежей крови или ее сгустков, одышка, боли в грудной клетке). У 52 больных отмечался дефицит массы тела до 20 кг, у 62 имелись значительные изменения в гемограмме (анемия, сдвиг лейкоцитарной формулы влево, высокая СОЭ). Высокая температурная реакция была связана как с активной фазой туберкулезного процесса, так и с присоеди-
Высокая температурная реакция была связана как с активной фазой туберкулезного процесса, так и с присоеди-
нившейся аспирационной пневмонией.
Непосредственно после госпитализации в клинику до выполнения пульмонэктомии всем больным проводилась интенсивная противотуберкулезная терапия 4-5 противотуберкулезными препаратами основного (изониазид, рифампицин, этамбутол, пиразинамид, стрептомицин) и резервного ряда (капреомпицин, офлоксацин, протионамид) и неспецифическая антибиотикотерапия (цефалоспорины, макролиды) с целью стабилизации легочного процесса. Важной составной частью предоперационной подготовки была интенсивная гемостатическая терапия, которая включала: 1) гипотензивные средства для снижения артериального давления и гипертензии малого круга кровообращения, 2) препараты, повышающие активность показателей свертывающей системы крови (по показаниям гемотрансфузия свежезаготовленной одногруппной крови или прямое переливание крови, внутривенное введение белковых препаратов — фибриногена, сухой и замороженной плазмы), 3) препараты снижающие активность антисвертывающей и фибринолитической систем (внутривенное введение 5% аминокапроновой кислоты, 10% хлорида натрия, дицинона, тремина). В качестве общеукрепляющих назначались витамины группы В и С, 40% глюкоза, сердечно-сосудистая терапия. Комплексная терапия сочеталась с применением пневмоперитонеума.
Интенсивное комплексное лечение способствовало остановке легочного кровотечения и рецидивирующего кровохарканья у 112 из 143 больных. У 31 больного полностью купировать легочное кровотечение и кровохарканье не удалось. Хирургическая тактика зависела от общего состояния больных, продолжительности, интенсивности легочного кровотечения и гемостатического эффекта, от проведенного терапевтического лечения. При продолжающемся легочном кровотечении пульмонэктомия выполнена 19 больным, в «светлом» периоде после временной остановки легочного кровотечения -12, после стойкой остановки кровотечения — 112.
Все операции осуществлялись под эндотрахеальным обезболиванием с
искусственной вентиляцией легких. У 19 больных, оперированных на высоте легочного кровотечения, проведена раздельная интубация правого или левого главного бронхов двухпросветной трубкой Кларенса. Это способствовало максимальной защите дыхательных путей контралатерального здорового легкого от затекания мокроты и крови и служило профилактикой развития послеоперационной пневмонии, ателектаза и дыхательной недостаточности. В ходе операции из пораженного легкого проводилась постоянная аспирация
бронхиального секрета. У 12 больных, оперированных в «светлом» промежутке между
28
Вестник экстренной медицины, 2010, № 4
www.sta.uz
Т.М.Кариев, С.П.Абулкасимов, А.А.Иргашов
легочным кровотечением, и у 112 больных после стойкой остановки кровотечения интубация трахеи проводилась однопросветной трубкой, а в ходе операции осуществлялась постоянная аспирация и санация трахеобронхиальных путей.
Правосторонняя пульмонэктомия выполнена у 65 (45,5%) больных, левосторонняя — у 78 (54,5%). Переднебоковой доступ использован у 87 (60,8%), заднебоковой — у 56 (39,2%) пациентов. Главный бронх и магистральные артериальные и венозные сосуды корня легкого обработаны раздельно у 105 (73,4%) больных с ушиванием главного бронха механическим швом, а легочных сосудов -циркулярной и прошивной лигатурой. Из-за тяжести общего состояния, значительной операционной кровопотери и необходимости быстрого окончания операции у 15 больных бронхососудистые элементы корня легкого ушиты механическим швом в едином блоке. У 23 больных верхняя и нижняя легочные вены лигированы и прошиты раздельно узловыми синтетическими швами, а главный бронх и легочная артерия ушиты вместе механическим швом.
У 23 больных верхняя и нижняя легочные вены лигированы и прошиты раздельно узловыми синтетическими швами, а главный бронх и легочная артерия ушиты вместе механическим швом.
В послеоперационном периоде бронхиальный свищ и эмпиема плевры возникли у 19 больных, эмпиема плевры без свища — у 5, острая легочно-сердечная недостаточность — у 6, ДВС-синдром — у 1, прогрессирование туберкулезного процесса в единственном легком наблюдалось у 5. Осложнения ликвидированы у 16 из 36 больных, в том числе консервативно (тщательная пункционная аспирация и санация инфицированной плевральной полости, интенсивная антибиотикотерапия, сердечно-сосудистая терапия, ингаляции кислорода) у 10 больных и повторными операциями — у 6 (реампутация культи главного бронха — у 3, торакомиопластика остаточной плевральной полости — у 3).
Хороший клинический эффект после пульмонэктомии достигнут у 118 (82,5%) больных, удовлетворительный результат получен — у 3 (2,1%), неудовлетворительный — у 4 (2,8%). После операции умерли 18 (12,6%) больных: от прогрессирования легочно-сердечной недостаточности — 6, бронхиального свища и эмпиемы плевры — 8, гнойной интоксикации организма — 4.
После стойкой остановки легочного кровотечения хорошие результаты наблюдались у 100 (89,3%) из 112 больных. При выполнении пульмонэктомии в «светлом» промежутке между легочным кровотечением хороший эффект получен у 66,7%, а на высоте легочного кровотечения — только у 52,6% оперированных.
Заключение
Легочное кровотечение и рецидивирующее кровохарканье при распространенном фиброзно-кавернозном туберкулезе является тяжелым и
грозным осложнением, угрожающим жизни больных. Терапевтическое лечение этого осложнения недостаточно эффективно или оказывает лишь временный эффект. Одним из основных методов лечения, который надежно избавляет больных от легочного кровотечения и распространенного туберкулеза легких, является пульмонэктомия. Наиболее эффективна (89,3%) пульмонэктомия, выполненная после стойкой остановки легочного кровотечения. В промежутке времени между легочным кровотечением или на его высоте эффективность пульмонэктомии снижается соответственно до 66,7 и 52,6%. Пульмонэктомию при легочном кровотечении необходимо выполнять в специализированном легочно-хирургическом отделении, что обеспечивает максимальную безопасность операции и снижает хирургический риск.
Одним из основных методов лечения, который надежно избавляет больных от легочного кровотечения и распространенного туберкулеза легких, является пульмонэктомия. Наиболее эффективна (89,3%) пульмонэктомия, выполненная после стойкой остановки легочного кровотечения. В промежутке времени между легочным кровотечением или на его высоте эффективность пульмонэктомии снижается соответственно до 66,7 и 52,6%. Пульмонэктомию при легочном кровотечении необходимо выполнять в специализированном легочно-хирургическом отделении, что обеспечивает максимальную безопасность операции и снижает хирургический риск.
ЛИТЕРАТУРА
1. Киргинцев А.Г. Тактика хирургического лечения больных с легочным кровотечением. Автореф. дис. … д-ра мед. наук. М 2002; 35.
2. Перельман М.И., Наумов В.Н., Добкин В.Г. и др. Показания к хирургическому лечению больных туберкулезом легких. Пробл туб 2002; 2: 51-55.
3. Левашов Ю.Н., Ю.М. Репин. Руководство по легочному и внелегочному туберкулезу. СПб 2006; 514.
4. Убайдуллаев А.М. Сил касаллиги (кулланма). Тошкент 2009; 606.
5. Фомичева Н.И. Легочные кровотечения и кровохаркания у больных туберкулезом (Частота, патогенез, диагностика, лечение). Автореф. дис. . д-ра мед. наук. Киев 1988; 34.
6. Фтизиатрия. Национальное руководство. Под ред. М.И.Перельмана. М 2007; 506.
7. Худзик Л.Б. Легочные кровотечения и неотложная помощь. Пробл туб 1997; 5: 48-51.
СИЛ КАСАЛЛАРИДА УПКАДАН ЦОН КЕТИШДА ПУЛЬМОНЭКТОМИЯ
Кориев Т.М., Абулкасимов С.П., Иргашов А. А. Фтизиатрия ва пульмонология РИИАТМ
А. Фтизиатрия ва пульмонология РИИАТМ
Фиброз-кавакли сил билан огриган 143 беморда упкадан кон кетишда пульмонэктомия бажарилган. Пульмонэктомия упкадан кон кетиши узил-кесил тухтагач килинганда 89,3%, кон кетиш вактинчалик тухтаган «ёруг» даврда килинганда 66,7%, кон кетаётган даврда бажарилганда 52,6% да яхши самара олинди.
Контакт: проф. Кариев Тулкин Мукситович РСНПМЦ фтизиатрии и пульмонологии 100086, Ташкент, ул. Ш.А.Алимова, Тел: 278-04-70
виды при разных причинах, быстрая диагностика в Анапе
Кровохарканье – пугающее состояние, при котором во время кашля периодически выделяется вместе с мокротой кровь. В одних случаях это лишь кровянистые вкрапления, а в других кровь полностью окрашивает мокроту. По виду и количеству кровяных примесей можно примерно предположить источник и причину кровотечения, но затягивать визит к врачу недопустимо. В Анапе диагностикой и лечением заболеваний, вызывающих гемоптизис, занимаются в медицинском центре «НеоМед».
Основные причины гемоптизиса
Кровохарканье вызывают болезни и новообразования дыхательной системы, сердечно-сосудистые патологии, проблемы ЖКТ, инородные тела в органах дыхания, травмы.
Болезни легких приводят к кровохарканью, если начинают распадаться ткани и повреждаются сосуды. Причиной может оказаться:
- пневмония – воспаление легочной ткани;
- бронхоэктатическая болезнь – расширение бронхов в результате гнойно-воспалительного процесса;
- бронхит – воспаление слизистой оболочки бронхов;
- васкулит, разрушающий стенки кровеносных сосудов;
- туберкулез;
- гангрена;
- бронхиальные свищи;
- грибки и паразиты;
- врожденные пороки развития;
- хроническая обструктивная болезнь легких.
Сильный затянувшийся кашель при инфекциях дыхательных путей может привести к разрыву мелких кровеносных сосудов в слизистой гортани. Крови в таких случаях немного, она выделяется вкраплениями. Незначительное количество кровянистых выделений возможно при гайморите и фронтите.
Крови в таких случаях немного, она выделяется вкраплениями. Незначительное количество кровянистых выделений возможно при гайморите и фронтите.
Туберкулез сопровождает слизисто-гнойная мокрота с кровяными включениями яркого красного оттенка, чередующаяся с выделением чистой крови.
Вид мокроты при пневмонии зависит от типа:
- При крупозной – необильная бурого или коричневатого оттенка.
- При геморрагической – ярко-красная.
- Во время острой пневмонии может быть кашель чистой кровью или с примесями.
При злокачественных опухолях в легких отхаркиваются малиновой мокротой. Гемоптизис вызывают аденома бронха, гемангиома, другие новообразования.
Кровохарканье бывает тревожным признаком заболеваний сердечно-сосудистой системы. При митральном стенозе кровь с алыми прожилками. В случае с атеросклеротическим кардиосклерозом, гипертонией, инфарктом миокарда в начале кашля выделяется алая мокрота, переходящая в более насыщенную кровянистую.
Кровь выходит с кашлем при язве желудка или двенадцатиперстной кишки. У женщин кровохарканье может оказаться следствием эндометриоза – разрастания клеток эндометрия в респираторные органы.
Методы комплексной диагностики
Обследование начинается со сбора анамнеза – врач изучает жалобы пациента и расспрашивает его о характере и периодичности кровохарканья. На основании этих данных специалист уже может определить зону вероятного очага кровотечения. Для точного диагноза и установки провоцирующего заболевания проводят комплексную диагностику.
- Анализы крови. Объем анализа индивидуален. Возможно, врач посчитает нужным узнать уровень гемоглобина, выявить или исключить нарушения свертываемости.
- Исследование мокроты на наличие бактерий, грибков, атипичных клеток.
- Рентгенография грудной клетки проводится всегда, так как чаще всего кровохарканье вызывают болезни легких. Флюорография показывает туберкулез, пневмонию, другие патологии.

- Компьютерная томография дает более точную картину состояния легких. С ее помощью выявляют доброкачественные и злокачественные опухоли, состояние сердца.
- Бронхоскопия – эндоскопический метод исследования изнутри трахеи и бронхов для выявления изменений в дыхательных путях, новообразований, инородных тел. Это наиболее информативный метод установки причины кровохарканья. Бронхоскоп вводят через рот или нос. При необходимости сразу выполняют лечебные манипуляции и хирургические действия.
- Биопсия – взятие образца мокроты или тканей для цитологического или гистологического исследования. Биопсию выполняют в процессе бронхоскопии. Помогает на ранних стадиях выявить опасные патологии, если даже их признаки не обнаружены на КТ.
- ЭКГ для первичного выявления заболеваний сердца. Если есть подозрения – более детальное обследование.
При подозрении на кровотечение необходимо вызвать скорую помощь. Если кровохарканье носит эпизодический характер, обратитесь в диагностический центр «НеоМед». Здесь быстро установят диагноз и окажут эффективную помощь.
Консультативно-диагностический центр г. Таганрога
Что такое туберкулез и как он проявляется?
Всем нам ежедневно приходится общаться с огромным количеством людей — в магазинах, общественном транспорте, на работе или учебе… При этом мы редко задумываемся о собственном здоровье и безопасности, говорим «будь здоров» чихнувшему, деликатно не обращаем внимание на кашель. Что уж говорить о нас самих, если работа превыше здоровья — зачастую мы предпочитаем выпить пару таблеток и продолжать работать, в суете большого города, стремясь заработать побольше денег и не думая о том, что здоровье не купишь. В свете выше перечисленного ежегодные профилактические осмотры, прохождение флюорографии как-то отходит на второй план. Казалось бы — ну, что может со мной таким молодым, сильным, успешным случиться?
Что такое туберкулез?
Туберкулез (устаревшее название «чахотка») — инфекционное заболевание, вызываемое несколькими разновидностями микобактерий.
По данным Всемирной Организации Здравоохранения, около 2 миллиардов людей, то есть каждый третий в нашем с вами окружении, инфицированы микобактерией туберкулеза. Пока человек здоров, организм справляется с этой бактерией, и туберкулез никак себя не проявляет. При неблагоприятных условиях: тяжелое заболевание, плохие условия жизни, плохое питание, — болезнь в организме может «проснуться». Кроме того, развитие заболевания возможно (особенно это касается людей с ослабленным иммунитетом) и при тесном контакте с больными активной формой туберкулеза.
Ежегодно туберкулезом заболевает 9 миллионов человек во всём мире, из них 3 миллиона умирают от его осложнений. 75% больных туберкулезом составляют люди в возрасте 20-40 лет, люди трудоспособного и детородного возраста. В настоящее время абсолютное большинство случаев туберкулеза можно излечить, при ранней диагностике и своевременном лечение, разумеется.
Специалисты часто называют туберкулез болезнью с множеством масок, ведь его проявления могут быть самыми различными и часто выдают себя за симптомы других болезней. Основной орган, который поражается болезнью — легкие, хотя в общем, симптомы туберкулеза зависят и от типа развития болезни и ее формы, и от места локализации инфекционного процесса и, как и многие другие заболевания, от индивидуальных особенностей организма больного. Разнообразие симптомов затрудняет распознавание болезни, что в свою очередь является причиной позднего обращения к врачу, со всеми вытекающими отсюда последствиями.
Следует учитывать и то, что заболеваемость туберкулёзом в немалой степени зависит от неблагоприятных условий среды (например, содержание в местах заключения). Существуют также факторы, вызывающие повышенную чувствительность человека к этой инфекции, одним из наиболее значимых является вирус иммунодефицита человека.
Итак, какие же симптомы должны заставить вас задуматься о своем здоровье и пройти обследование?
Общая симптоматика независимо от локализации процесса будет проявляться повышенной утомляемостью, слабостью, особенно в утренние часы, характерно снижение работоспособности. Дети начинают отставать в учебе, плохо спят, теряют аппетит. В зависимости от распространенности процесса состояние может быть очень тяжелым. Больные туберкулезом быстро теряют в весе и потому выглядят худыми, лицо бледное, черты лица заостряются, на фоне бледной кожи лица на щеках заметен румянец.
Дети начинают отставать в учебе, плохо спят, теряют аппетит. В зависимости от распространенности процесса состояние может быть очень тяжелым. Больные туберкулезом быстро теряют в весе и потому выглядят худыми, лицо бледное, черты лица заостряются, на фоне бледной кожи лица на щеках заметен румянец.
Самая распространенная форма туберкулеза — туберкулез легких — может длительное время протекать бессимптомно или малосимптомно и обнаружиться случайно при проведении флюорографии или рентгеновском снимке грудной клетки.
Характерные симптомы
Длительное повышение температуры — оно может быть незначительным до 37,5-38 С. Температура обычно повышается вечером или в ночное время, ночью наблюдаются сильные поты, озноб. В этом состоит главное отличие температуры при туберкулезе от температуры при других болезнях: при ОРЗ, бронхите, пневмонии температура может достичь более высоких отметок, но быстро проходит и не сопровождается обильным ночным потоотделением. Высокая температура характерна только для массивного поражения туберкулезом.
Кашель является постоянным симптомом туберкулеза легких. В начале болезни он сухой, настойчивый, усиливается утром. В дальнейшем, при развитии болезни, может стать влажным с выделением мокроты. При ОРЗ, бронхите или пневмонии также может быть кашель, однако в отличие от кашля при туберкулезе, кашель в случае этих болезней длится не так долго и имеет другой характер. Кашель при туберкулезе является хроническим, поэтому присутствие кашля более 3 недель должно насторожить и стать причиной обращения к врачу.
Еще один из основных признаков туберкулеза легких — кровохарканье. Обычно возникает после приступа кашля, в этом случае вместе с мокротой больной отхаркивает и небольшое количество крови. При туберкулезе легких возможно развитие легочного кровотечения («кровь горлом») – тяжелое и опасное для жизни больного состояние, требующее немедленной медицинской помощи. Кровохарканье при туберкулезе следует отличать от кровохарканья при раке легкого или при сердечной недостаточности, но и в этом случае необходимо срочное обращение за медицинской помощью.
Поражение других органов
Поражение любого из внутренних органов проявляется определенными симптомами, однако диагноз «туберкулез внутренних органов» устанавливается только после исключения всех других возможных болезней с похожими симптомами или в том случае, когда у больного уже была когда-либо выявлена легочная форма туберкулеза. Хотя нередко встречаются случаи развития туберкулёза внутренних органов и без каких-либо текущих клинических или рентгенологических признаков поражения лёгких и без такового поражения в истории болезни. Cимптомы туберкулеза в этом случае будут зависеть от локализации болезни.
Туберкулез головного мозга и мозговых оболочек обычно развивается достаточно медленно (1-2 недели). Особенно часто он развивается у детей и у больных со сниженной функцией иммунной системы (больные сахарным диабетом, ВИЧ-положительные). В начале болезни появляется температура, раздражительность, нарушения сна (бессонница или сонливость), на второй неделе появляется рвота и упорные головные боли. К концу первой недели заболевания появляются признаки раздражения мозговых оболочек — напряженность затылочных мышц шеи, боль в спине при вытягивании ног или при наклоне головы к груди в положении лежа. Туберкулез головного или спинного мозга проявляется различными нервными расстройствами.
Поражение органов пищеварительного тракта проявляется периодическими запорами и диареей, вздутием и болями в животе, может появиться кровь в каловых массах. Эти симптомы сопровождаются длительным повышением температуры и в тяжелых случаях могут осложняться непроходимостью кишечника.
Туберкулез костей и суставов проявляется болями в пораженных частях скелета, ограничением подвижности, патологическими переломами — данные случаи необходимо дифференцировать от множества других болезней опорно-двигательного аппарата человека. Поражение кожи проявляется в виде уплотнений и плотных узелков под кожей, которые постепенно увеличиваются в размерах, прорывают кожу и высвобождают беловатые творожистые массы (однако, возможны и другие проявления).
Туберкулез органов мочеполовой системы может локализоваться в любом из органов мочеполовой системы мужчин и женщин. Чаще всего поражаются почки, что проявляется болью в спине, повышением температуры, появлением крови в моче. Реже туберкулез поражает мочеточники, мочевой пузырь, мочеиспускательный канал. В таких случаях появляются различные нарушения процесса мочеиспускания (боль, задержка мочи, моча с кровью). Поражение половых органов может вызвать бесплодие.
Естественно диагноз туберкулеза внутренних органов устанавливается только после исключения всех других возможных болезней с похожими симптомами, что в любом случае не пойдет на вред здоровью.
Лечение туберкулёза является сложным делом, требующим длительного времени и терпения, а также комплексного подхода. Основой лечения туберкулёза сегодня является поликомпонентная противотуберкулёзная химиотерапия, сроки лечения составляют от 8 до 18 месяцев в зависимости от формы и стадии заболевания. В запущенных случаях может понадобиться хирургическое лечение.
Невеселая картина получается, а ведь для того чтобы предупредить осложнения и вовремя пройти лечение необходимо просто регулярно проходить флюорографическое обследование в поликлинике.
Информация о туберкулезе — Пациентам — Расписание, услуги, информация — Официальный сайт государственного бюджетного учреждения здравоохранения «Областная туберкулезная больница №3»
ТУБЕРКУЛЕЗ
О том, что туберкулез заразен, знали еще в древности, но возбудитель его долго был неизвестен. Лишь в 1882 году немецкий ученый Роберт Кох, рассматривая под микроскопом мокроту больных туберкулезом, обнаружил тонкую, неподвижную, слегка изогнутую палочку. При дальнейшем изучении оказалось, что это и есть возбудитель туберкулеза. В честь ученого, открывшего туберкулезную палочку ее назвали бациллой Коха. Теперь она называется микобактерией туберкулеза.
Возбудитель туберкулеза устойчив к различным физическим и химическим воздействиям: хорошо переносит низкую температуру — остается живым при минус 260 градусах и ниже, около 30 мин.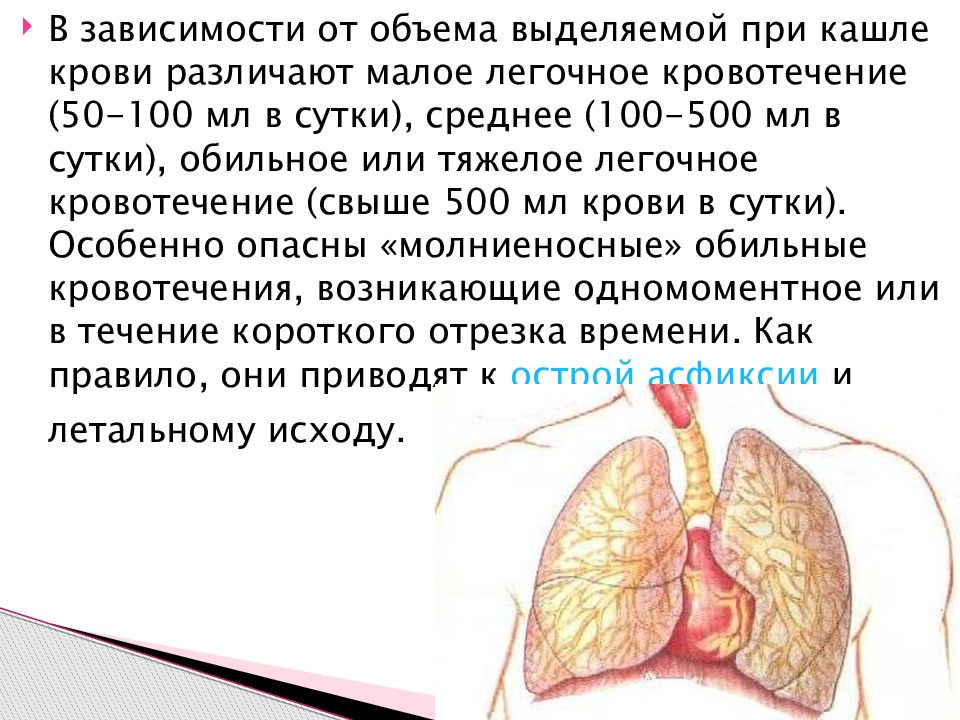 выдерживает нагревание до 80-90 градусов. Вне живого организма микобактерии не размножаются, но сохраняют жизнеспособность многие месяцы, и особенно в темных сырых помещениях, почве и сточных водах. Прямой солнечный свет убивает их за 1-2 часа, а облучение ультрафиолетовыми лучами(кварцем) – за несколько минут.
выдерживает нагревание до 80-90 градусов. Вне живого организма микобактерии не размножаются, но сохраняют жизнеспособность многие месяцы, и особенно в темных сырых помещениях, почве и сточных водах. Прямой солнечный свет убивает их за 1-2 часа, а облучение ультрафиолетовыми лучами(кварцем) – за несколько минут.
ПУТИ ЗАРАЖЕНИЯ ТУБЕРКУЛЕЗОМ
Различают пять типов микобактерии туберкулеза: человеческий, бычий, птичий, мышиный и рыбий. Два из них, человеческий и бычий, особенно опасны для человека. Источником распространения заболевания является человек, больной активной формой туберкулеза. Некипяченое молоко или не проваренное мясо, полученные от больных туберкулезом коров, свиней, коз также могут быть источником заражения.
В 80-90% случаев заражения микобактерии туберкулеза проникают в организм человека через дыхательные пути при вдыхании зараженной пыли или мельчайших капелек мокроты, выделяемой больными при разговоре, чихании и кашле. Туберкулезом можно заразиться и через предметы обихода больного(полотенце, носовые платки. Постельное и нательное белье, верхняя одежда, посуда , книги), которые обычно загрязнены капельками мокроты и слюны.
Однако заразиться туберкулезом — не значит обязательно заболеть им, так как большинстве случаев, благодаря сопротивляемости организма, палочки погибают, а если и остаются живыми, то теряют силу. Заболевают в основном люди, организм которых ослаблен. Туберкулезные палочки, попав в той или иной орган, начинают размножаться, выделять токсины, возникает туберкулезное воспаление.
Чаще всего туберкулез поражает легкие человека, однако он может возникнуть в костях и суставах, в лимфатических узлах и в почках, в кишечнике, в половых железах в мозговых оболочках и т.д.
Каковы же начальные проявления туберкулеза?
Часто эта болезнь начинается с небольшой слабости, быстрой утомляемости, она обычно нарастет к концу рабочего дня. У многих больных появляется повышенная раздражительность, плохой аппетит, потливость, особенно после сна, под утро, сердцебиение, плохой сон, боли в груди кашель , повышается температура, больной быстро теряет в весе.:max_bytes(150000):strip_icc()/117452319-56a17a485f9b58b7d0bfadf4.jpg) Иногда туберкулез начинается остро: резко повышается температура, появляется насморк, кашель, изредка боль в горле. Температура через несколько дней падает до нормальной или почти нормальной, насморк проходит, и человек приступает к работе, хотя полного восстановления сил не чувствует. Но через некоторое время температура вновь повышается,больному трудно работать; он вынужден лечь в постель ,и врач выявляет туберкулез. Одно из проявлений туберкулеза- кровохарканье ,появление при кашле прожилок крови. Некоторые больнее не обращают на это внимание, полагая, что кровоточат десны. Иногда туберкулез выявляется случайно у людей, считающих себя здоровыми. При опросе выясняется, что пациент последнее время часто кашлял, быстро уставал, хотя и не придавал этому значения.
Иногда туберкулез начинается остро: резко повышается температура, появляется насморк, кашель, изредка боль в горле. Температура через несколько дней падает до нормальной или почти нормальной, насморк проходит, и человек приступает к работе, хотя полного восстановления сил не чувствует. Но через некоторое время температура вновь повышается,больному трудно работать; он вынужден лечь в постель ,и врач выявляет туберкулез. Одно из проявлений туберкулеза- кровохарканье ,появление при кашле прожилок крови. Некоторые больнее не обращают на это внимание, полагая, что кровоточат десны. Иногда туберкулез выявляется случайно у людей, считающих себя здоровыми. При опросе выясняется, что пациент последнее время часто кашлял, быстро уставал, хотя и не придавал этому значения.
Многие из перечисленных признаков туберкулеза могут быть и при других заболеваниях, но разобраться в этом может только врач. Очень важно, чтобы больные при появлении начальных признаков заболевания немедленно обратились к врачу. Не ослабляйте организм вредными привычками, откажитесь от курения.
Не забывайте и о правильном питании. В настоящее время доказано, что важно не столько количество принимаемой пищи, сколько ее состав. Наиболее полезны не жиры и углеводы, как считалось раньше, а белки и витамины, особенно витамины группы «В» и «С» (аскорбиновая кислота).
Витамин «С» в большом количестве содержится в зеленом луке, плодах шиповника, черной смородине, апельсинах, лимонах, мандаринах, землянике, клубнике. Для профилактики туберкулеза кожи и слизистых оболочек лечебное значение имеет витамин «Д» ,его много в печени , яичном желтке и рыбьем жире.
Профилактика туберкулеза:
Для профилактики туберкулеза необходимо, чтобы все люди без исключения своевременно проходили флюорографическое обследование. Оно совершенно безвредно для организма. Массовые профилактические осмотры и флюорография помогают своевременно выявить больных.
ОБЯЗАТЕЛЬНО ПОСЕТИТЕ КАБИНЕТ ФЛЮОРОГРАФИИ !
Чтобы предупредить заболевание, проводится противотуберкулезная вакцинация. Прививка делается всем новорожденным, затем повторяется в возрасте 6-7 лет.
Прививка делается всем новорожденным, затем повторяется в возрасте 6-7 лет.
ТУБЕРКУЛЕЗ — заболевание инфекционное, но опасность заражения им возникает лишь там, где больной или окружающие его члены семьи, соседи не выполняют профилактических мер. Для успешной борьбы с туберкулезом, наряду с защитой от заражения ,очень важно укреплять здоровье, закаливать организм. Занятия физической культурой, спортом, водные процедуры, пребывание на свежем воздухе — все это укрепляет здоровье, защищает от туберкулеза.
Pulmonary tuberculosis not recognized before surgery | Fattakhova
В противотуберкулезные стационары довольно часто поступают больные с неспецифической патологией органов дыхания в связи с подозрением у них болезней туберкулезной этиологии. В литературе достаточно хорошо освещен вопрос о причинах ошибочной диагностики в таких случаях. Наряду с этим имеет место связанная с ошибкой диагноза госпитализация туберкулезных больных в нетуберкулезные больницы.
В настоящей работе мы попытались проанализировать причины диагностических ошибок у больных, оперированных в Казанской дорожной клинической больнице поповоду неспецифических заболеваний легких, у которых после операции в резекционном материале выявлен туберкулез. Таких случаев оказалось 38 из 1721 операции (2,2%), произведенной с 1963 по 1975 г. по поводу различных заболеваний легких и средостения.
Перед операцией у пациентов были диагностированы: у 8 — хроническая пневмония, у 8 — периферический рак легкого, у 7 — абсцесс легкого, у 4 — округлая тень неясной этиологии, у 4 — киста, у 3 — бронхоэктатическая болезнь, у 2 — поликистоз, у 1 — синдром средней доли, у 1 — доброкачественная опухоль.
Давность заболевания до операции составляла у 16 больных до 6 мес, у 12 — до 3 лет, у остальных 10 — свыше 3 лет. У 7 пациентов патология в легких была выявлена при профилактическом обследовании. Остальные больные неоднократнонаблюдались и лечились у терапевтов и фтизиатров. которые после операции оказались туберкулемами. При направлении на операцию у 8 из них был поставлен диагноз периферического рака, у 1 — доброкачественная опухоль, у остальных — округлое образование неясной этиологии. 9 больных были старше 4’0 лет, что особенно настораживало в отношении возможности опухолевой природы болезни и даже оправдывало оперативное вмешательство при неясной этиологии округлого образования в легких.
которые после операции оказались туберкулемами. При направлении на операцию у 8 из них был поставлен диагноз периферического рака, у 1 — доброкачественная опухоль, у остальных — округлое образование неясной этиологии. 9 больных были старше 4’0 лет, что особенно настораживало в отношении возможности опухолевой природы болезни и даже оправдывало оперативное вмешательство при неясной этиологии округлого образования в легких.
Из этих 13 пациентов лишь у 3 больных имелись клинические проявления болезни в виде субфебрильной температуры, слабости, потливости; у 5 больных была увеличена СОЭ до 40—56 мм/ч, у 3 лейкоцитоз составлял 13,9 * 109 в 1 л. Боль в груди, одышка, кровохарканье наблюдались только у одного. В 1 случае выслушивались небольшие влажные хрипы в межлопаточном пространстве пораженной стороны. Проба Манту на 1 ТЕ была отрицательной у одного больного, умеренно выраженной у 2. У остальных 10 человек пробу не ставили.
У 5 больных округлые образования локализовались во 2-м сегменте, у 4 — в 6-м, у 2 — в 10-м и лишь у 1 — в 4-м. Размеры тени у 5 были крупными, у остальных больных они были средних и малых размеров. Округлая тень имела большую интенсивность в 8, гомогенность в 7, ровные четкие контуры в 8 случаях; окружающая ткань была неизмененной у 8 дациентов, связь с корнем имелась у 4 и у 2 был распад.
У 1 больного детальный ретроспективный анализ характера округлого образования оказался невозможным из-за плохого качества томограмм.
Из этих 13 пациентов у 7 человек заболевание было выявлено фтизиатрами или больные были ими консультированы; диагноз туберкулеза был отвергнут.
Приводим следующее наблюдение.
Т., 37 лет, считает себя больной в течение 9 лет после перенесенной тяжелой пневмонии. С тех пор постоянно беспокоил сухой кашель, за последние 3 года наблюдалось кровохарканье при физической нагрузке. Физикальное исследование отклонений не выявило. Справа на шее пальпировались плотные безболезненные мелкие множественные лимфоузлы. Картина крови была в пределах нормы. Мокроту на БК не исследовали. На рентгенограмме в зоне 6-го сегмента была видна овальной формы негомогенная тень с четкими неровными контурами размером 5X3 см. В окружающей легочной ткани имелась масса плотных очаговых теней разных размеров и формы, в корне легких петрификаты. Перед операцией у больной была диагностирована доброкачественная опухоль. Однако ретроспективный анализ показал, что локализация, форма, неоднородность тени, неровность контуров, наличие очагов вокруг, тяжелая пневмония в анамнезе (возможно «маска» туберкулеза), сухой кашель, кровохарканье давали возможность усомниться в диагнозе доброкачественной опухоли, и заподозрить туберкулез. Отсутствие симптомов интоксикации не исключало специфического поражения.
Картина крови была в пределах нормы. Мокроту на БК не исследовали. На рентгенограмме в зоне 6-го сегмента была видна овальной формы негомогенная тень с четкими неровными контурами размером 5X3 см. В окружающей легочной ткани имелась масса плотных очаговых теней разных размеров и формы, в корне легких петрификаты. Перед операцией у больной была диагностирована доброкачественная опухоль. Однако ретроспективный анализ показал, что локализация, форма, неоднородность тени, неровность контуров, наличие очагов вокруг, тяжелая пневмония в анамнезе (возможно «маска» туберкулеза), сухой кашель, кровохарканье давали возможность усомниться в диагнозе доброкачественной опухоли, и заподозрить туберкулез. Отсутствие симптомов интоксикации не исключало специфического поражения.
На бронхограмме отмечалось незаполнение верхнедолевого бронха, что тоже часто бывает при туберкулезе. После верхнедолевой лобэктомии и резекции 6-го сегмента гистологически выявлена конгломеративная туберкулема.
Ретроспективный анализ историй болезни установил, что в ряде случаев ошибочная диагностика была оправдана, но у части больных с округлыми образованиями в легких имелись признаки, весьма характерные для туберкулеза. И причина ошибки заключалась в неполном обследовании и недостаточной оценке дифференциально-диагностических признаков туберкулеза.
У остальных 25 больных, направленных на операцию с диагнозом неспецифического воспалительного процесса, была более или менее выраженная клиническая картина болезни в виде лихорадки, кашля с различным количеством мокроты, слабости и потливости, похудания, у одного больного было кровохарканье. У 10 лиц процесс был двусторонним с распространением патологии на 2 доли и более, у 8 чел. он локализовался в верхних долях, чаще (Справа, у остальных были поражены нижние доли. В значительной части случаев в анамнезе больных имелись указания на неоднократно перенесенные пневмонии. По-видимому, вспышки специфического процесса иногда принимались за обострение неспецифического воспаления, хотя практика показывает, что фтизиатры чаще ошибаются, проявляя склонность к гипердиагностике. Однако при нижнедолевых процессах дифференциально-диагностические трудности возникают не только из-за необычайности локализации и рентгенологической картины, идентичной с хроническими пневмониями, но и в связи с возможностью смешанной инфекции.
Однако при нижнедолевых процессах дифференциально-диагностические трудности возникают не только из-за необычайности локализации и рентгенологической картины, идентичной с хроническими пневмониями, но и в связи с возможностью смешанной инфекции.
Ретроспективный анализ показывает, что в некоторых случаях были неправильно интерпретированы анамнестические, клинические и лабораторные данные, совокупность которых позволяла заподозрить туберкулезное поражение легких. В частности, были случаи недооценки указания на перенесенный в прошлом туберкулез, на контакт с туберкулезными больными, недоучет своеобразия интоксикационного синдрома. Поскольку при воспалительных заболеваниях легких большинство клинико-рентгенологических признаков имеет относительную ценность, при дифференциации этиологии болезней главной причиной ошибочной диагностики в этих случаях нужно признать недостаточное обследование на бацилловыделение.
Приводим пример.
3,, 15 лет, с 13-летнего возраста состоит на учете как контактный. Отец болен фиброзно-кавернозным туберкулезом легких, бациллярен. С детства у больного часто бывал кашель со скудной мокротой, частая субфебрильная температура, слабость, отмечалось отставание в физическом и умственном развитии. Заболел в декабре 1969 г., когда усилился кашель, увеличилось количество выделяемой мокроты, температура поднялась до 38—39°, мальчик госпитализирован с диагнозом «пневмония». Лечение в течение месяца неспёцифическими препаратами оказалось неэффективным, и больной был переведен в хирургическую клинику с диагнозом обострения бронхоэктатической болезни.
При поступлении отмечена бледность кожных покровов, похудание, невыраженная одышка, отсутствие аппетита, потливость, кашель с гнойной мокротой до 20—30 мл в сутки.
Физикально — слева в межлопаточном пространстве выслушиваются скудные влажные хрипы. Анализ крови: НЪ 1,2 ммоль/л, лейкоцитоз 16,8 * 109 в 1 л, сдвиг лейкоцитарной формулы влево. СОЭ — 40 мм/ч. БК при ’ однократном обследовании методом бактериоскопии отсутствуют. Туберкулиновые пробы положительны.
БК при ’ однократном обследовании методом бактериоскопии отсутствуют. Туберкулиновые пробы положительны.
На фасной рентгенограмме слева соответственно 2—3-му сегменту была видна негомогенная тень вытянутой формы с нечеткими, неровными контурами средней интенсивности, тесно связанная с корнем. Головка корня увеличена. В правом легком вверхней зоне были видны мелкие очаговые тени, местами сливающиеся. В зоне 2-го сегмента имелось теневое образование кольцевидной формы диаметром 10 мм. На бронхограмме выявлены бронхоэктатические изменения в зоне язычкового и 3-го сегмента слева.
Поставлен диагноз бронхоэктатической болезни с абсцедированием, и 20/1 1970 г. произведена верхняя лобэктомия слева. Гистологически выявлен свежий туберкулезлегких и казеозные изменения в лимфоузлах корня легкого.
Вследствие нерезультативное оперативного лечения, проведенного на фоне резкого снижения общей неспецифической иммунологической реактивности организма и без предварительной химиотерапии, а в последующем ввиду нерегулярной терапиииз-за недисциплинированности пациента больной через 4 года после операции скончался от прогрессирующего туберкулеза.
В данном случае не были учтены особенности рентгенологической картины первичного туберкулезного бронхоаденита с ателектазом 3-го сегмента и не было произведено достаточное обследование больного на бацилловыделение.
Т. О. Мельникова с соавт. (1974), проанализировав 24 истории болезни больных туберкулезным бронхоаденитом, у которых ошибочно была диагностирована затянувшаяся или хроническая пневмония, пришла к заключению, что врачи еще плохо осведомлены о такой ‘форме специфического процесса, как аденогенный бронхо-легочный туберкулез у взрослых. Об этом же пишут Т. Н. Оленева и И. А. Шульга (1971). Они подчеркивают, что аденогенному туберкулезу у взрослых, кроме хронического» течения, свойственны неспецифические осложнения, обусловленные нарушением» вентиляции легких. При необратимых изменениях в бронхиальной системе часто» бывает показано хирургическое лечение, но после соответствующей противотуберкулезной химиотерапии.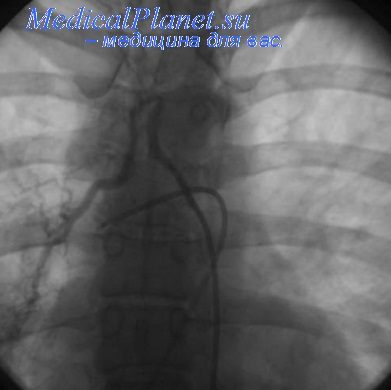
У одного из наших больных расхождение диагноза было связано со своеобразием формы инфильтративного туберкулеза, которую А. Е. Рабухин (1976) выделяет как ракоподобную. В нашем наблюдении псевдотуморозная форма туберкулеза установлена после патоморфологического исследования резецированного легкого; ретроспективно проанализировав клинико-рентгенологическую картину болезни, можно было прийти к выводу, что она протекала как опухоль легкого.
Ш., 47 лет, в мае 1974 г. стал замечать боли, неприятные ощущения под левой лопаткой, субфебрильную температуру. После рентгеноскопии был направлен в противотуберкулезный диспансер, где после обследования туберкулезная этиология болезни была отвергнута.
В хирургическое отделение больной поступил в начале сентября 1974 г. При поступлении отмечена выраженная слабость, потливость, периодическая субфебрильная температура, сухой кашель. При аускультации справа в межлопаточной области дыхание ослаблено, единичные сухие хрипы. В мокроте микробактерии не обнаружены. В гемограмме выявлен лейкоцитоз до 10,15 109 в 1 л, лейкоформула была без существенных сдвигов, СОЭ 57 мм/ч. Реакция Манту нормергическая. Повторные цитологические исследования мокроты дали отрицательный результат. При рентгенографии в верхней доле легкого определялось уплотнение легочной ткани, интимно связанное «дорожкой» с головкой корня. Консервативная терапия антибиотиками широкогоспектра действия и сульфаниламидными препаратами оказалась неэффективной. Диагностирована правосторонняя верхнедолевая бронхокарцинома? Хроническая пневмония? 24/Х 1974 г. произведена резекция 1—2—6-го сегментов правого легкого.
При гистологическом исследовании препарата обнаружена картина распространенного продуктивно-экссудативного туберкулеза. После операции долго сохранялась остаточная полость, которая постепенно заполнилась. Больной для дальнейшего лечения переведен в противотуберкулезный диспансер.
На основании анализа этого материалу можно выделить основные факторы, ставшие причиной ошибочных диагнозов.
1.Объективные трудности, которые проявились в основном при дифференциальной диагностике округлых образований.
2. Ошибки, связанные с недостаточным знанием дифференциально-диагностических признаков туберкулеза и особенностей его течения в современных условиях, что вело к неполному обследованию больных. В большинстве случаев не была проведена даже туберкулиновая диагностика, а мокрота исследована на ВК весьма поверхностно.
В заключение хотелось бы отметить, что в большинстве случаев диагноз туберкулеза был возможен на основании традиционных методов обследования, однако некоторые сложные методы диагностики, например бронхография, только путали картину, особенно при свежем туберкулезе, который может вести и к ампутации, и деформации бронхов.
По-видимому, в торакальных отделениях, работающих не на базе фтизиатрических учреждений, необходима особенно большая настороженность в отношении диагностики туберкулеза, большое внимание к качеству лабораторных исследований на ВК и тесный контакт в работе с фтизиатрами высокой квалификации.
Что нужно знать о туберкулезе для личной безопасности? / СПб ГБПОУ «СПб ТКУиК»
Туберкулез—это воздушно-капельная инфекция, которая вызывается микобактериями туберкулеза. Источник инфекции: человек больной
активным туберкулезом легких. Возбудитель туберкулеза попадает в организм человека при вдыхании «зараженного» воздуха вместе с
капельками слюны и мокроты, которые выбрасываются больным при разговоре, кашле, чихании.
Треть населения земного шара инфицирована микобактериями туберкулеза, но далеко не все им болеют.
У большинства людей защитные силы организма препятствуют развитию туберкулеза.
В ряде случаев, при массивном инфицировании микобактериями туберкулеза, быстро развивается болезнь.
В других случаях, под влиянием защитных сил инфекция приобретает «дремлющий» характер. Развитию туберкулеза в этом случае способствуют факторы, ослабляющие защитные силы организма: переутомление, продолжительное чрезмерное волнение, неполноценное питание, употребление наркотиков, алкоголя, а также хронические болезни, когда «дремлющие» микобактерии туберкулеза начинают размножаться и вызывают болезнь.
Чаще всего туберкулезом поражаются легкие, но инфекция может поразить и любой другой орган.
Туберкулез заразен и очень опасен!
Признаки туберкулеза:
- Незначительное повышение температуры тела по вечерам.
- Общая слабость и быстрая утомляемость, повышенная потливость.
- Снижение аппетита, потеря веса.
- Кашель более 2-3 недель.
- Боль в грудной клетке более 3 недель.
- Кровохарканье.
При появлении этих признаков обратитесь к врачу! Чем раньше выявлен туберкулез, тем легче он поддается лечению!
Как выявляется туберкулез?
К методам раннего выявления туберкулеза у взрослого населения относится флюорография и проба Манту, у детей проба Манту или Диаскин-тест.
Флюорография позволяет диагностировать все случаи туберкулеза легких от малых до деструктивных форм и многообразную другую патологию органов грудной клетки: опухоли, воспаления легких.
Поэтому, для своевременного выявления туберкулеза, жителям Санкт-Петербурга необходимо проходить флюорографию ежегодно.
Проба Манту позволяет определить инфицированы ли вы туберкулезной палочкой.
Что означает инфицирование?
Инфицирование туберкулезом происходит в основном в детском возрасте и к 17 годам около 50% подростков в нашем городе тубинфицированы.
Вначале при первом контакте с микобактерией туберкулеза происходит так называемое инфицирование, когда внешних проявлений нет, и факт проникновения в организм возбудителя заболевания можно определить только по измененной реакции МАНТУ.
Реакция МАНТУ это не прививка, а диагностическая проба, которая показывает наличие аллергической реакции на туберкулез.
Если результаты обследования указывают на возможность инфицирования туберкулезом, ребенок подлежит обязательному обследованию в противотуберкулезном диспансере. В этой ситуации большую роль играет отношение родителей и осознание ими необходимости тщательного обследования, в дальнейшем лечения или проведения профилактических курсов лечения. Отказ родителей от лечения, уклонение от обследования часто приводит к развитию у инфицированного ребенка активного туберкулеза.
В этой ситуации большую роль играет отношение родителей и осознание ими необходимости тщательного обследования, в дальнейшем лечения или проведения профилактических курсов лечения. Отказ родителей от лечения, уклонение от обследования часто приводит к развитию у инфицированного ребенка активного туберкулеза.
Для того, чтобы не заболеть туберкулезом следует:
Правильно питаться. Питание должно быть достаточным и сбалансированным.
В рацион необходимо включить продукты, укрепляющие иммунную систему: мясо, яйца, фасоль, рыба, сыр, творог, горох, орехи, овощи, фрукты.
Избавьтесь от вредных привычек, так как курение, алкоголь, наркотики снижают защитные силы организма.
Внимательное отношение к собственному здоровью, своевременное обращение к врачу при появлении признаков туберкулеза помогут избежать развития заболевания!
Ваше здоровье — в ваших руках!
территориальный отдел
Управления Роспотребнадзора по городу Санкт-Петербургу
в Выборгском и Калининском районах
Постпервичное легочное кровохарканье — когда больше, чем кажется на первый взгляд
Резюме
Кровохарканье вызывает беспокойство как у пациента, так и у медицинского работника и указывает на наличие тяжелого основного заболевания легких, требующего исследования. Приблизительно 8% пациентов с инфекцией туберкулеза легких (ЛТБ) в какой-то момент жизни испытают кровохарканье [1; 2] . Этиология кровохарканья на фоне ПТБ разнообразна и может возникать во время активной или после перенесенной инфекции ПТБ из-за легочных осложнений.Мы описываем случай 33-летней женщины, у которой в двух разных случаях в течение пятимесячного периода произошло массивное кровохарканье. Ее предыстория включала в себя ПТБ за 6 лет до и последующие посттуберкулезные бронхоэктазы с разрушенным левым легким и развитие апикальной мицетомы. Несмотря на многочисленные ранее существовавшие этиологии, которые могли объяснить кровохарканье у этого пациента, при этом поступлении недавно выявленная разорванная аневризма Расмуссена была идентифицирована с помощью ангиографии и успешно вылечена артериальной эмболизацией.Этот отчет призван выделить множество причин кровохарканья у пациента с деструкцией легких после ПТБ и связанные с этим диагностические проблемы, которые могут присутствовать. В частности, мы выделяем аневризму Расмуссена, редко встречающуюся, как скрытую причину кровохарканья, когда, несмотря на обширное паренхиматозное заболевание легких, выявленное при рентгенографии грудной клетки, для подтверждения диагноза требуется специальная визуализация.
Несмотря на многочисленные ранее существовавшие этиологии, которые могли объяснить кровохарканье у этого пациента, при этом поступлении недавно выявленная разорванная аневризма Расмуссена была идентифицирована с помощью ангиографии и успешно вылечена артериальной эмболизацией.Этот отчет призван выделить множество причин кровохарканья у пациента с деструкцией легких после ПТБ и связанные с этим диагностические проблемы, которые могут присутствовать. В частности, мы выделяем аневризму Расмуссена, редко встречающуюся, как скрытую причину кровохарканья, когда, несмотря на обширное паренхиматозное заболевание легких, выявленное при рентгенографии грудной клетки, для подтверждения диагноза требуется специальная визуализация.
1. Общие сведения
Туберкулез (ТБ) остается серьезным бременем для здоровья в развивающихся странах, несмотря на медицинские и технологические достижения.По состоянию на 2015 г. Южная Африка остается в шестерке лидеров как по заболеваемости, так и по распространенности ТБ в мире, причем кровохарканье является тесно связанным симптомом [3]. Несмотря на то, что 81% пациентов с PTB достигли выздоровления, кровохарканье может присутствовать у пациентов, перенесших PTB, и может быть связано с деформацией паренхимы и сопутствующими сосудистыми осложнениями, связанными с предшествующим PTB [3]. Этот отчет направлен на то, чтобы выделить многочисленные этиологии кровохарканья у пациентов с пост-первичным ПТБ, с акцентом на аневризму Расмуссена, редкую, но устоявшуюся сущность с возможными опасными для жизни последствиями.
2. Пример из практики
У 32-летней пациентки с серонегативным ВИЧ, в настоящее время работающей научным сотрудником в медицинском учреждении, в течение 5 месяцев развился второй эпизод массивного кровохарканья. У нее был диагностирован микробиологически подтвержденный PTB за 6 лет до госпитализации, и она прошла 6 месяцев терапии. Однако это было осложнено фиброзно-кавитационной деструкцией ее левого легкого с посттуберкулезными бронхоэктазами (). В ходе последующего наблюдения в пульмонологической клинике и за 2 года до этой презентации у нее развилась апикальная мицетома, которая была выявлена при компьютерном топографическом сканировании грудной клетки (), и из-за явного кровохарканья ее сочли левосторонней. пневмонэктомия.Функциональный тест ее легких показал ограничительный паттерн легких с ОФВ1 64%, ФЖЕЛ 67% (ОФВ1 / ФЖЕЛ 95) и DLCO 74. Кроме того, сканирование раздельной перфузии ядерной медицины показало отсутствие заметной перфузии в пораженное легкое. . Были выполнены электрокардиограмма и эхокардиограмма, указывающие на наличие легочной гипертензии.
В ходе последующего наблюдения в пульмонологической клинике и за 2 года до этой презентации у нее развилась апикальная мицетома, которая была выявлена при компьютерном топографическом сканировании грудной клетки (), и из-за явного кровохарканья ее сочли левосторонней. пневмонэктомия.Функциональный тест ее легких показал ограничительный паттерн легких с ОФВ1 64%, ФЖЕЛ 67% (ОФВ1 / ФЖЕЛ 95) и DLCO 74. Кроме того, сканирование раздельной перфузии ядерной медицины показало отсутствие заметной перфузии в пораженное легкое. . Были выполнены электрокардиограмма и эхокардиограмма, указывающие на наличие легочной гипертензии.
Рентген грудной клетки демонстрирует сдвиг средостения вторичный по отношению к фиброзно-кавитационной деструкции левого легкого.
Компьютерная томография, показывающая бронхоэктаксические изменения с мицетомой менее сантиметра.
При осмотре во время госпитализации она была гемодинамически стабильной с артериальным давлением 127/82 мм рт. Ст. И синусовой тахикардией 110 уд / мин. У нее не было лихорадки, ее частота дыхания составляла 20 вдохов в минуту, и она была цианотичной на воздухе помещения с насыщением кислородом 93%. Отмечались выраженная дигитальная булава и субконъюнктивальная бледность. При респираторном обследовании были обнаружены признаки левосторонней потери объема с уменьшенным расширением левой грудной стенки и компенсаторной гиперинфляцией правой.Звуки дыхания справа были везикулярными по своей природе, но с левой стороны звуки дыхания были пониженной интенсивности с амфорическими звуками дыхания и грубым потрескиванием преимущественно в верхней зоне. При обследовании сердечно-сосудистой системы не было обнаружено признаков декомпенсированного легочного сердца, но были очевидны легочная гипертензия и сдвиг средостения влево. Были выявлены парагрудинная припухлость с пальпируемым Р2, а также громкий легочный компонент второго тона сердца. Ее верхушечный толчок был смещен к передней подмышечной линии в пятом межреберье с отклонением трахеи влево. Первоначальные лабораторные результаты показали микроцитарную гипохромную анемию с гемоглобином 7,7 г / дл (MCV = 73,8 мкл; MCHC = 31,4 г / дл) и количеством тромбоцитов 487 × 10 9 / л. Дальнейшее гематологическое обследование показало железодефицитную анемию с ферритином 37 мкг / л, процентным насыщением 5% и соответствующими морфологическими особенностями. Функциональные пробы почек и печени были нормальными. Ее С-реактивный белок составлял 32 мг / л, а ее МНО — 1,28. Был проведен анализ Xpert MTB / RIF, который показал отрицательный результат на mycobacterium tuberculosis .
Первоначальные лабораторные результаты показали микроцитарную гипохромную анемию с гемоглобином 7,7 г / дл (MCV = 73,8 мкл; MCHC = 31,4 г / дл) и количеством тромбоцитов 487 × 10 9 / л. Дальнейшее гематологическое обследование показало железодефицитную анемию с ферритином 37 мкг / л, процентным насыщением 5% и соответствующими морфологическими особенностями. Функциональные пробы почек и печени были нормальными. Ее С-реактивный белок составлял 32 мг / л, а ее МНО — 1,28. Был проведен анализ Xpert MTB / RIF, который показал отрицательный результат на mycobacterium tuberculosis .
Поступила в поликлинику. Перелили 1 единицу эритроцитов и начали пероральный кодеинфосфат. Была выполнена экстренная компьютерная топографическая ангиограмма легких (CTPA), которая позволила предположить наличие аневризмы Расмуссена, но формальная ангиография была сочтена необходимой для подтверждения. Прямая ангиография показала покраснение легочной артерии рядом с левой верхней полостью легкого, что подтвердило наличие аневризмы Расмуссена (). Несмотря на сложную первоначальную вентиляцию легких из-за заболевания легкого, была проведена выборочная интубация правого бронха и успешная эмболизация артерии.После 48 часов постпроцедурного наблюдения в условиях интенсивной терапии ее перевели в общую медицинскую палату, где после 6 дней отсутствия кровохарканья она была выписана домой и в настоящее время ожидает левосторонней пневмонэктомии.
Прямая ангиография во время спиральной эмболизации, показывающая артериальный румянец, вторичный по отношению к разорванной аневризме.
3. Обсуждение
Кровохарканье, откашливание или отхождение мокроты с кровью, является тревожным симптомом и обычно служит индикатором тяжелой основной патологии легких.Массивное кровохарканье — это термин, обозначающий большой объем крови, отхаркиваемый в течение 24-часового периода, с возможностью заболеваемости и смертности из-за гемодинамической нестабильности, нарушения дыхательных путей и аномалий газообмена. Не существует единого мнения о точном объеме крови для определения массивного кровохарканья, и наиболее приемлемое количественное определение относится к значениям в диапазоне от 200 до 1000 мл за 24-часовой период до скорости кровотечения 100 мл в час [4].
Не существует единого мнения о точном объеме крови для определения массивного кровохарканья, и наиболее приемлемое количественное определение относится к значениям в диапазоне от 200 до 1000 мл за 24-часовой период до скорости кровотечения 100 мл в час [4].
Южная Африка является страной с высоким бременем ВОЗ [3], но существует нехватка литературы, оценивающей распространенность заболеваний легких, связанных с пост-PTB, в Южной Африке, однако эксперты в области легочной медицины Южной Африки считают, что PTB вносит значительный вклад. к хроническому заболеванию легких в этом регионе и является важной причиной кровохарканья.Активный ПТБ может проявляться как незначительной, так и значительной степенью кровохарканья, и значительная часть кровохарканья является вторичной по отношению к активному ПТБ, как показано в более ранней серии случаев в Южной Африке, где до 73% массивного кровохарканья были связаны с активным туберкулезом, и это подтверждается согласно недавнему исследованию ВИЧ-положительных пациентов с диабетом, у которых вероятность развития активной формы ТБ была в 31 раз выше, если кровохарканье было характерным симптомом [5,6]. Хотя кровохарканье тесно связано с активной инфекцией легочного ТБ, оно также может проявляться после разрешения острого заболевания из-за последующих легочных осложнений [1,2].К сожалению, нет данных, оценивающих распространенность кровохарканья среди пациентов с активным ПТБ по сравнению с пациентами с кровохарканьем в результате легочных осложнений после первичного ПТБ. Таким образом, даже несмотря на то, что этиология кровохарканья разнообразна и носит мультисистемный характер, в условиях высокого бремени ТБ его присутствие всегда должно предупреждать врача о возможности активного ПТБ.
Кровохарканье возникает из-за местного кровоснабжения, происходящего как из легочных, так и из бронхиальных артерий. Легочная артериальная система передает весь сердечный выброс через систему относительно низкого давления для оксигенации, в то время как бронхиальная артерия и ее притоки переносят насыщенную кислородом кровь в паренхиму легких, и, несмотря на гораздо меньший объем, находятся под высоким системным давлением. В 90% случаев при массивном кровохарканье кровотечение происходит из этих сетей бронхиальных артерий высокого давления [7]. При рассмотрении этиологии кровохарканья у пациентов с пост-первичным туберкулезом открываются многочисленные возможности. Хотя патогенез кровохарканья как последствия ПТБ чаще всего возникает из-за деструкции и структурного ремоделирования паренхимы легкого и его сосудистой сети, у этих пациентов могут возникать другие сопутствующие заболевания, приводящие к кровохарканью. Это представляет собой диагностическую проблему для врача при определении причины у таких пациентов, а также при выборе необходимой терапии.Таким образом, несмотря на явно очевидную деструкцию паренхимы легких, множество других возможностей все еще могут объяснить кровохарканье.
В 90% случаев при массивном кровохарканье кровотечение происходит из этих сетей бронхиальных артерий высокого давления [7]. При рассмотрении этиологии кровохарканья у пациентов с пост-первичным туберкулезом открываются многочисленные возможности. Хотя патогенез кровохарканья как последствия ПТБ чаще всего возникает из-за деструкции и структурного ремоделирования паренхимы легкого и его сосудистой сети, у этих пациентов могут возникать другие сопутствующие заболевания, приводящие к кровохарканью. Это представляет собой диагностическую проблему для врача при определении причины у таких пациентов, а также при выборе необходимой терапии.Таким образом, несмотря на явно очевидную деструкцию паренхимы легких, множество других возможностей все еще могут объяснить кровохарканье.
До 40–60% пациентов с предшествующим легочным ТБ страдают от деструкции дыхательных путей и паренхимы с фиброзом и кавитацией, отличительной чертой которых является апикальный и задний тракционный бронхоэктаз с фиброкавитацией верхней доли и смещением средостения в сторону пораженного легкого [8]. Посттуберкулезное фиброзно-кавитационное заболевание и бронхоэктазы приводят к необратимому повреждению и расширению дыхательных путей и связанной с ними сосудистой сети.Сосудистая сеть бронхов становится гипертрофированной, эктазированной и обнаженной. Гиперваскулярность, нарушенная архитектурная опора и открытое обнажение этих сосудов делают их склонными к кровотечению, и эти аномалии являются причиной большинства клинически очевидных кровохарканья у пациентов после ПТБ [9].
Значительное пост-первичное повреждение паренхимы легкого с кавитацией служит идеальной средой для грибковой колонизации и инфицирования патогенными видами, такими как Aspergillus spp.Легочный аспергиллез может проявляться в виде полостей, содержащих грибковые клубочки, которые называются мицетомой, или хроническим кавитационным или фиброзирующим аспергиллезом [10]. Встречается у 7–11% пациентов после предшествующего ПТБ, наличие мицетомы на рентгенологических изображениях (при КТ демонстрирует большую диагностическую точность, чем стандартная рентгенография грудной клетки [11]), а также антител к аспергиллезу в сыворотке приводит к увеличению заболеваемости. клинически выраженного кровохарканья [12]. Эрозия соседней сосудистой сети и внутриполостное кровотечение служат причиной кровохарканья у этих пациентов [6].
клинически выраженного кровохарканья [12]. Эрозия соседней сосудистой сети и внутриполостное кровотечение служат причиной кровохарканья у этих пациентов [6].
Опосредованное микобактерией гранулематозное воспаление и лимфаденит могут прогрессировать до кальцификации ткани, известной как бронхолиты. Посттуберкулезные бронхолиты могут быть нечеткими, но редко кальцинированные узлы могут разрушать и разрушать соседние бронхи, а при вовлечении сосудистых сетей бронхов может быть очевидным кровохарканье [8,13]. Хотя редко, рак легкого и туберкулез могут сосуществовать, при этом пост-первичное рубцевание легкого при ПТБ предрасполагает к развитию злокачественных новообразований (рубцовая карцинома), поскольку такое кровохарканье с подозрительными поражениями на радиологических изображениях не следует игнорировать и требует дальнейшей оценки [8, 13].
Прямое поражение сосудов ПТБ может также происходить, поскольку и артерии, и вены могут демонстрировать активный некротизирующий гранулематозный васкулит, индуцированный микобактериями, приводящий к воспалению с аневризматическими изменениями, бронхо-легочными и артериовенозными связями [8]. Аневризма Расмуссена относится к псевдоаневризме легочной артерии, прилегающей к туберкулезной полости. Серия вскрытий, названная в честь датского врача Фрица Вальдемара Расмуссена, показала распространенность до 5% у пациентов с кавитационной туберкулезной болезнью [14].Его развитие происходит из-за гранулематозного воспаления артериальной стенки, ведущего к ремоделированию сосудов с участием фибрина и последующему казеозу с прогрессирующим ослаблением сосудистой выстилки с аневризматическим расширением [2,8]. Последующий разрыв стенки сосуда или утечка из аневризмы Расмуссена может привести к массивному кровохарканью, с летальным исходом более 50% [15]. Рентгенография грудной клетки и клиническое обследование могут выявить наличие посттуберкулезных осложнений, но могут не учитывать сосудистые поражения, и, если есть подозрение, необходима радиологическая или формальная ангиография для подтверждения диагноза.
При лечении кровохарканья у пациента, перенесшего первичный туберкулез, критически важно осознавать возможность опасного для жизни кровохарканья, уделяя особое внимание мониторингу объема кровотечения пациента, скорости кровотечения и основных жизненно важных параметров. В настоящее время отсутствуют местные руководящие принципы или рекомендации, касающиеся кровохарканья после ПТБ, поскольку такое лечение регулируется больничными протоколами, основанными на международной литературе. Защита дыхательных путей и гемодинамическая стабильность — это начальный шаг перед исследованием, особенно с учетом того, что у этой группы пациентов низкий основной резерв легких [16].Если происходит продолжающееся кровохарканье; требуется дальнейшее исследование, помимо грубых аномалий, выявленных на рентгенограмме грудной клетки. Оптоволоконная бронхоскопия приносит пользу пациентам с активным кровотечением в соседнем кровоточащем бронхиальном сосуде. Возможна прямая визуализация кровотечения и немедленные меры контроля, такие как прямая коагуляция или эффекты тампонады [17,18]. Аневризматические поражения требуют детальной характеристики, поэтому CTPA используется с чувствительностью 80% [19].Неопределенность диагностики может потребовать прямой ангиографии, ее использование особенно важно, когда показана артериальная эмболизация, например, у нашего пациента [17,18]. В то время как туберкулезный артериит, вызванный некротизирующими гранулематозными изменениями, играет ключевую роль в развитии, биопсия сосудов и микроскопическая визуализация нецелесообразны и неосуществимы. Успешное прекращение кровохарканья при эмболизации артерий достигает 90%, но может потребоваться повторная эмболизация. В случае неудачи может потребоваться хирургическая резекция легкого, и хотя плановая резекция может привести к летальности 18%, артериальная эмболизация является важным мостом в терапии [7,20].Была использована экстренная резекция легкого по поводу опасного для жизни кровохарканья, но смертность в этом случае достигает 40%. Таким образом, первоначальная артериальная ангиография с намерением и использованием эмболизации остается основой терапии в условиях неотложной помощи, особенно с учетом того, что она может служить мостом к окончательной терапии у пациентов со значительными периоперационными проблемами [17]. Интервенционные методы остаются основой терапии массивного кровохарканья, но в отчетах о случаях и сериях исследований подчеркивается использование лучевой терапии грудной клетки у пациентов с кровохарканьем из-за мицетомы [21], в настоящее время в Южной Африке проводятся испытания для дальнейшей валидации ее использования у неоперабельных пациентов.В условиях ограниченных ресурсов необходимые диагностические инструменты и управленческий опыт вряд ли будут доступны, смертность от нелеченого массивного кровохарканья превышает 50% [22], поэтому пациентов с массивным кровохарканьем следует реанимировать и срочно направлять в центр, где требуется диагностика. доступны методы и управленческий опыт.
Таким образом, первоначальная артериальная ангиография с намерением и использованием эмболизации остается основой терапии в условиях неотложной помощи, особенно с учетом того, что она может служить мостом к окончательной терапии у пациентов со значительными периоперационными проблемами [17]. Интервенционные методы остаются основой терапии массивного кровохарканья, но в отчетах о случаях и сериях исследований подчеркивается использование лучевой терапии грудной клетки у пациентов с кровохарканьем из-за мицетомы [21], в настоящее время в Южной Африке проводятся испытания для дальнейшей валидации ее использования у неоперабельных пациентов.В условиях ограниченных ресурсов необходимые диагностические инструменты и управленческий опыт вряд ли будут доступны, смертность от нелеченого массивного кровохарканья превышает 50% [22], поэтому пациентов с массивным кровохарканьем следует реанимировать и срочно направлять в центр, где требуется диагностика. доступны методы и управленческий опыт.
Постпервичное легочное кровохарканье — когда больше, чем кажется на первый взгляд
Резюме
Кровохарканье вызывает беспокойство как у пациента, так и у медицинского работника и указывает на наличие тяжелого основного заболевания легких, требующего исследования.Приблизительно 8% пациентов с инфекцией туберкулеза легких (ЛТБ) в какой-то момент жизни испытают кровохарканье [1; 2] . Этиология кровохарканья на фоне ПТБ разнообразна и может возникать во время активной или после перенесенной инфекции ПТБ из-за легочных осложнений. Мы описываем случай 33-летней женщины, у которой в двух разных случаях в течение пятимесячного периода произошло массивное кровохарканье. Ее предыстория включала в себя ПТБ за 6 лет до и последующие посттуберкулезные бронхоэктазы с разрушенным левым легким и развитие апикальной мицетомы.Несмотря на многочисленные ранее существовавшие этиологии, которые могли объяснить кровохарканье у этого пациента, при этом поступлении недавно выявленная разорванная аневризма Расмуссена была идентифицирована с помощью ангиографии и успешно вылечена артериальной эмболизацией. Этот отчет призван выделить множество причин кровохарканья у пациента с деструкцией легких после ПТБ и связанные с этим диагностические проблемы, которые могут присутствовать. В частности, мы выделяем аневризму Расмуссена, редко встречающуюся, как скрытую причину кровохарканья, когда, несмотря на обширное паренхиматозное заболевание легких, выявленное при рентгенографии грудной клетки, для подтверждения диагноза требуется специальная визуализация.
Этот отчет призван выделить множество причин кровохарканья у пациента с деструкцией легких после ПТБ и связанные с этим диагностические проблемы, которые могут присутствовать. В частности, мы выделяем аневризму Расмуссена, редко встречающуюся, как скрытую причину кровохарканья, когда, несмотря на обширное паренхиматозное заболевание легких, выявленное при рентгенографии грудной клетки, для подтверждения диагноза требуется специальная визуализация.
1. Общие сведения
Туберкулез (ТБ) остается серьезным бременем для здоровья в развивающихся странах, несмотря на медицинские и технологические достижения. По состоянию на 2015 г. Южная Африка остается в шестерке лидеров как по заболеваемости, так и по распространенности ТБ в мире, причем кровохарканье является тесно связанным симптомом [3]. Несмотря на то, что 81% пациентов с PTB достигли выздоровления, кровохарканье может присутствовать у пациентов, перенесших PTB, и может быть связано с деформацией паренхимы и сопутствующими сосудистыми осложнениями, связанными с предшествующим PTB [3].Этот отчет направлен на то, чтобы выделить многочисленные этиологии кровохарканья у пациентов с пост-первичным ПТБ, с акцентом на аневризму Расмуссена, редкую, но устоявшуюся сущность с возможными опасными для жизни последствиями.
2. Пример из практики
У 32-летней пациентки с серонегативным ВИЧ, в настоящее время работающей научным сотрудником в медицинском учреждении, в течение 5 месяцев развился второй эпизод массивного кровохарканья. У нее был диагностирован микробиологически подтвержденный PTB за 6 лет до госпитализации, и она прошла 6 месяцев терапии.Однако это было осложнено фиброзно-кавитационной деструкцией ее левого легкого с посттуберкулезными бронхоэктазами (). В ходе последующего наблюдения в пульмонологической клинике и за 2 года до этой презентации у нее развилась апикальная мицетома, которая была выявлена при компьютерном топографическом сканировании грудной клетки (), и из-за явного кровохарканья ее сочли левосторонней. пневмонэктомия. Функциональный тест ее легких показал ограничительный паттерн легких с ОФВ1 64%, ФЖЕЛ 67% (ОФВ1 / ФЖЕЛ 95) и DLCO 74.Кроме того, раздельное сканирование перфузии ядерной медицины не показало заметной перфузии в пораженное легкое. Были выполнены электрокардиограмма и эхокардиограмма, указывающие на наличие легочной гипертензии.
пневмонэктомия. Функциональный тест ее легких показал ограничительный паттерн легких с ОФВ1 64%, ФЖЕЛ 67% (ОФВ1 / ФЖЕЛ 95) и DLCO 74.Кроме того, раздельное сканирование перфузии ядерной медицины не показало заметной перфузии в пораженное легкое. Были выполнены электрокардиограмма и эхокардиограмма, указывающие на наличие легочной гипертензии.
Рентген грудной клетки демонстрирует сдвиг средостения вторичный по отношению к фиброзно-кавитационной деструкции левого легкого.
Компьютерная томография, показывающая бронхоэктаксические изменения с мицетомой менее сантиметра.
При осмотре во время госпитализации она была гемодинамически стабильной с артериальным давлением 127/82 мм рт. Ст. И синусовой тахикардией 110 уд / мин.У нее не было лихорадки, ее частота дыхания составляла 20 вдохов в минуту, и она была цианотичной на воздухе помещения с насыщением кислородом 93%. Отмечались выраженная дигитальная булава и субконъюнктивальная бледность. При респираторном обследовании были обнаружены признаки левосторонней потери объема с уменьшенным расширением левой грудной стенки и компенсаторной гиперинфляцией правой. Звуки дыхания справа были везикулярными по своей природе, но с левой стороны звуки дыхания были пониженной интенсивности с амфорическими звуками дыхания и грубым потрескиванием преимущественно в верхней зоне.При обследовании сердечно-сосудистой системы не было обнаружено признаков декомпенсированного легочного сердца, но были очевидны легочная гипертензия и сдвиг средостения влево. Были выявлены парагрудинная припухлость с пальпируемым Р2, а также громкий легочный компонент второго тона сердца. Ее верхушечный толчок был смещен к передней подмышечной линии в пятом межреберье с отклонением трахеи влево. Первоначальные лабораторные результаты показали микроцитарную гипохромную анемию с гемоглобином 7,7 г / дл (MCV = 73.8fl; MCHC = 31,4 г / дл) и количество тромбоцитов 487 × 10 9 / л. Дальнейшее гематологическое обследование показало железодефицитную анемию с ферритином 37 мкг / л, процентным насыщением 5% и соответствующими морфологическими особенностями. Функциональные пробы почек и печени были нормальными. Ее С-реактивный белок составлял 32 мг / л, а ее МНО — 1,28. Был проведен анализ Xpert MTB / RIF, который показал отрицательный результат на mycobacterium tuberculosis .
Функциональные пробы почек и печени были нормальными. Ее С-реактивный белок составлял 32 мг / л, а ее МНО — 1,28. Был проведен анализ Xpert MTB / RIF, который показал отрицательный результат на mycobacterium tuberculosis .
Поступила в поликлинику.Перелили 1 единицу эритроцитов и начали пероральный кодеинфосфат. Была выполнена экстренная компьютерная топографическая ангиограмма легких (CTPA), которая позволила предположить наличие аневризмы Расмуссена, но формальная ангиография была сочтена необходимой для подтверждения. Прямая ангиография показала покраснение легочной артерии рядом с левой верхней полостью легкого, что подтвердило наличие аневризмы Расмуссена (). Несмотря на сложную первоначальную вентиляцию легких из-за заболевания легкого, была проведена выборочная интубация правого бронха и успешная эмболизация артерии.После 48 часов постпроцедурного наблюдения в условиях интенсивной терапии ее перевели в общую медицинскую палату, где после 6 дней отсутствия кровохарканья она была выписана домой и в настоящее время ожидает левосторонней пневмонэктомии.
Прямая ангиография во время спиральной эмболизации, показывающая артериальный румянец, вторичный по отношению к разорванной аневризме.
3. Обсуждение
Кровохарканье, откашливание или отхождение мокроты с кровью, является тревожным симптомом и обычно служит индикатором тяжелой основной патологии легких.Массивное кровохарканье — это термин, обозначающий большой объем крови, отхаркиваемый в течение 24-часового периода, с возможностью заболеваемости и смертности из-за гемодинамической нестабильности, нарушения дыхательных путей и аномалий газообмена. Не существует единого мнения о точном объеме крови для определения массивного кровохарканья, и наиболее приемлемое количественное определение относится к значениям в диапазоне от 200 до 1000 мл за 24-часовой период до скорости кровотечения 100 мл в час [4].
Южная Африка является страной с высоким бременем ВОЗ [3], но существует нехватка литературы, оценивающей распространенность заболеваний легких, связанных с пост-PTB, в Южной Африке, однако эксперты в области легочной медицины Южной Африки считают, что PTB вносит значительный вклад. к хроническому заболеванию легких в этом регионе и является важной причиной кровохарканья.Активный ПТБ может проявляться как незначительной, так и значительной степенью кровохарканья, и значительная часть кровохарканья является вторичной по отношению к активному ПТБ, как показано в более ранней серии случаев в Южной Африке, где до 73% массивного кровохарканья были связаны с активным туберкулезом, и это подтверждается согласно недавнему исследованию ВИЧ-положительных пациентов с диабетом, у которых вероятность развития активной формы ТБ была в 31 раз выше, если кровохарканье было характерным симптомом [5,6]. Хотя кровохарканье тесно связано с активной инфекцией легочного ТБ, оно также может проявляться после разрешения острого заболевания из-за последующих легочных осложнений [1,2].К сожалению, нет данных, оценивающих распространенность кровохарканья среди пациентов с активным ПТБ по сравнению с пациентами с кровохарканьем в результате легочных осложнений после первичного ПТБ. Таким образом, даже несмотря на то, что этиология кровохарканья разнообразна и носит мультисистемный характер, в условиях высокого бремени ТБ его присутствие всегда должно предупреждать врача о возможности активного ПТБ.
к хроническому заболеванию легких в этом регионе и является важной причиной кровохарканья.Активный ПТБ может проявляться как незначительной, так и значительной степенью кровохарканья, и значительная часть кровохарканья является вторичной по отношению к активному ПТБ, как показано в более ранней серии случаев в Южной Африке, где до 73% массивного кровохарканья были связаны с активным туберкулезом, и это подтверждается согласно недавнему исследованию ВИЧ-положительных пациентов с диабетом, у которых вероятность развития активной формы ТБ была в 31 раз выше, если кровохарканье было характерным симптомом [5,6]. Хотя кровохарканье тесно связано с активной инфекцией легочного ТБ, оно также может проявляться после разрешения острого заболевания из-за последующих легочных осложнений [1,2].К сожалению, нет данных, оценивающих распространенность кровохарканья среди пациентов с активным ПТБ по сравнению с пациентами с кровохарканьем в результате легочных осложнений после первичного ПТБ. Таким образом, даже несмотря на то, что этиология кровохарканья разнообразна и носит мультисистемный характер, в условиях высокого бремени ТБ его присутствие всегда должно предупреждать врача о возможности активного ПТБ.
Кровохарканье возникает из-за местного кровоснабжения, происходящего как из легочных, так и из бронхиальных артерий. Легочная артериальная система передает весь сердечный выброс через систему относительно низкого давления для оксигенации, в то время как бронхиальная артерия и ее притоки переносят насыщенную кислородом кровь в паренхиму легких, и, несмотря на гораздо меньший объем, находятся под высоким системным давлением.В 90% случаев при массивном кровохарканье кровотечение происходит из этих сетей бронхиальных артерий высокого давления [7]. При рассмотрении этиологии кровохарканья у пациентов с пост-первичным туберкулезом открываются многочисленные возможности. Хотя патогенез кровохарканья как последствия ПТБ чаще всего возникает из-за деструкции и структурного ремоделирования паренхимы легкого и его сосудистой сети, у этих пациентов могут возникать другие сопутствующие заболевания, приводящие к кровохарканью. Это представляет собой диагностическую проблему для врача при определении причины у таких пациентов, а также при выборе необходимой терапии.Таким образом, несмотря на явно очевидную деструкцию паренхимы легких, множество других возможностей все еще могут объяснить кровохарканье.
Это представляет собой диагностическую проблему для врача при определении причины у таких пациентов, а также при выборе необходимой терапии.Таким образом, несмотря на явно очевидную деструкцию паренхимы легких, множество других возможностей все еще могут объяснить кровохарканье.
До 40–60% пациентов с предшествующим легочным ТБ страдают от деструкции дыхательных путей и паренхимы с фиброзом и кавитацией, отличительной чертой которых является апикальный и задний тракционный бронхоэктаз с фиброкавитацией верхней доли и смещением средостения в сторону пораженного легкого [8]. Посттуберкулезное фиброзно-кавитационное заболевание и бронхоэктазы приводят к необратимому повреждению и расширению дыхательных путей и связанной с ними сосудистой сети.Сосудистая сеть бронхов становится гипертрофированной, эктазированной и обнаженной. Гиперваскулярность, нарушенная архитектурная опора и открытое обнажение этих сосудов делают их склонными к кровотечению, и эти аномалии являются причиной большинства клинически очевидных кровохарканья у пациентов после ПТБ [9].
Значительное пост-первичное повреждение паренхимы легкого с кавитацией служит идеальной средой для грибковой колонизации и инфицирования патогенными видами, такими как Aspergillus spp.Легочный аспергиллез может проявляться в виде полостей, содержащих грибковые клубочки, которые называются мицетомой, или хроническим кавитационным или фиброзирующим аспергиллезом [10]. Встречается у 7–11% пациентов после предшествующего ПТБ, наличие мицетомы на рентгенологических изображениях (при КТ демонстрирует большую диагностическую точность, чем стандартная рентгенография грудной клетки [11]), а также антител к аспергиллезу в сыворотке приводит к увеличению заболеваемости. клинически выраженного кровохарканья [12]. Эрозия соседней сосудистой сети и внутриполостное кровотечение служат причиной кровохарканья у этих пациентов [6].
Опосредованное микобактерией гранулематозное воспаление и лимфаденит могут прогрессировать до кальцификации ткани, известной как бронхолиты. Посттуберкулезные бронхолиты могут быть нечеткими, но редко кальцинированные узлы могут разрушать и разрушать соседние бронхи, а при вовлечении сосудистых сетей бронхов может быть очевидным кровохарканье [8,13]. Хотя редко, рак легкого и туберкулез могут сосуществовать, при этом пост-первичное рубцевание легкого при ПТБ предрасполагает к развитию злокачественных новообразований (рубцовая карцинома), поскольку такое кровохарканье с подозрительными поражениями на радиологических изображениях не следует игнорировать и требует дальнейшей оценки [8, 13].
Посттуберкулезные бронхолиты могут быть нечеткими, но редко кальцинированные узлы могут разрушать и разрушать соседние бронхи, а при вовлечении сосудистых сетей бронхов может быть очевидным кровохарканье [8,13]. Хотя редко, рак легкого и туберкулез могут сосуществовать, при этом пост-первичное рубцевание легкого при ПТБ предрасполагает к развитию злокачественных новообразований (рубцовая карцинома), поскольку такое кровохарканье с подозрительными поражениями на радиологических изображениях не следует игнорировать и требует дальнейшей оценки [8, 13].
Прямое поражение сосудов ПТБ может также происходить, поскольку и артерии, и вены могут демонстрировать активный некротизирующий гранулематозный васкулит, индуцированный микобактериями, приводящий к воспалению с аневризматическими изменениями, бронхо-легочными и артериовенозными связями [8]. Аневризма Расмуссена относится к псевдоаневризме легочной артерии, прилегающей к туберкулезной полости. Серия вскрытий, названная в честь датского врача Фрица Вальдемара Расмуссена, показала распространенность до 5% у пациентов с кавитационной туберкулезной болезнью [14].Его развитие происходит из-за гранулематозного воспаления артериальной стенки, ведущего к ремоделированию сосудов с участием фибрина и последующему казеозу с прогрессирующим ослаблением сосудистой выстилки с аневризматическим расширением [2,8]. Последующий разрыв стенки сосуда или утечка из аневризмы Расмуссена может привести к массивному кровохарканью, с летальным исходом более 50% [15]. Рентгенография грудной клетки и клиническое обследование могут выявить наличие посттуберкулезных осложнений, но могут не учитывать сосудистые поражения, и, если есть подозрение, необходима радиологическая или формальная ангиография для подтверждения диагноза.
При лечении кровохарканья у пациента, перенесшего первичный туберкулез, критически важно осознавать возможность опасного для жизни кровохарканья, уделяя особое внимание мониторингу объема кровотечения пациента, скорости кровотечения и основных жизненно важных параметров. В настоящее время отсутствуют местные руководящие принципы или рекомендации, касающиеся кровохарканья после ПТБ, поскольку такое лечение регулируется больничными протоколами, основанными на международной литературе. Защита дыхательных путей и гемодинамическая стабильность — это начальный шаг перед исследованием, особенно с учетом того, что у этой группы пациентов низкий основной резерв легких [16].Если происходит продолжающееся кровохарканье; требуется дальнейшее исследование, помимо грубых аномалий, выявленных на рентгенограмме грудной клетки. Оптоволоконная бронхоскопия приносит пользу пациентам с активным кровотечением в соседнем кровоточащем бронхиальном сосуде. Возможна прямая визуализация кровотечения и немедленные меры контроля, такие как прямая коагуляция или эффекты тампонады [17,18]. Аневризматические поражения требуют детальной характеристики, поэтому CTPA используется с чувствительностью 80% [19].Неопределенность диагностики может потребовать прямой ангиографии, ее использование особенно важно, когда показана артериальная эмболизация, например, у нашего пациента [17,18]. В то время как туберкулезный артериит, вызванный некротизирующими гранулематозными изменениями, играет ключевую роль в развитии, биопсия сосудов и микроскопическая визуализация нецелесообразны и неосуществимы. Успешное прекращение кровохарканья при эмболизации артерий достигает 90%, но может потребоваться повторная эмболизация. В случае неудачи может потребоваться хирургическая резекция легкого, и хотя плановая резекция может привести к летальности 18%, артериальная эмболизация является важным мостом в терапии [7,20].Была использована экстренная резекция легкого по поводу опасного для жизни кровохарканья, но смертность в этом случае достигает 40%. Таким образом, первоначальная артериальная ангиография с намерением и использованием эмболизации остается основой терапии в условиях неотложной помощи, особенно с учетом того, что она может служить мостом к окончательной терапии у пациентов со значительными периоперационными проблемами [17].
В настоящее время отсутствуют местные руководящие принципы или рекомендации, касающиеся кровохарканья после ПТБ, поскольку такое лечение регулируется больничными протоколами, основанными на международной литературе. Защита дыхательных путей и гемодинамическая стабильность — это начальный шаг перед исследованием, особенно с учетом того, что у этой группы пациентов низкий основной резерв легких [16].Если происходит продолжающееся кровохарканье; требуется дальнейшее исследование, помимо грубых аномалий, выявленных на рентгенограмме грудной клетки. Оптоволоконная бронхоскопия приносит пользу пациентам с активным кровотечением в соседнем кровоточащем бронхиальном сосуде. Возможна прямая визуализация кровотечения и немедленные меры контроля, такие как прямая коагуляция или эффекты тампонады [17,18]. Аневризматические поражения требуют детальной характеристики, поэтому CTPA используется с чувствительностью 80% [19].Неопределенность диагностики может потребовать прямой ангиографии, ее использование особенно важно, когда показана артериальная эмболизация, например, у нашего пациента [17,18]. В то время как туберкулезный артериит, вызванный некротизирующими гранулематозными изменениями, играет ключевую роль в развитии, биопсия сосудов и микроскопическая визуализация нецелесообразны и неосуществимы. Успешное прекращение кровохарканья при эмболизации артерий достигает 90%, но может потребоваться повторная эмболизация. В случае неудачи может потребоваться хирургическая резекция легкого, и хотя плановая резекция может привести к летальности 18%, артериальная эмболизация является важным мостом в терапии [7,20].Была использована экстренная резекция легкого по поводу опасного для жизни кровохарканья, но смертность в этом случае достигает 40%. Таким образом, первоначальная артериальная ангиография с намерением и использованием эмболизации остается основой терапии в условиях неотложной помощи, особенно с учетом того, что она может служить мостом к окончательной терапии у пациентов со значительными периоперационными проблемами [17]. Интервенционные методы остаются основой терапии массивного кровохарканья, но в отчетах о случаях и сериях исследований подчеркивается использование лучевой терапии грудной клетки у пациентов с кровохарканьем из-за мицетомы [21], в настоящее время в Южной Африке проводятся испытания для дальнейшей валидации ее использования у неоперабельных пациентов.В условиях ограниченных ресурсов необходимые диагностические инструменты и управленческий опыт вряд ли будут доступны, смертность от нелеченого массивного кровохарканья превышает 50% [22], поэтому пациентов с массивным кровохарканьем следует реанимировать и срочно направлять в центр, где требуется диагностика. доступны методы и управленческий опыт.
Интервенционные методы остаются основой терапии массивного кровохарканья, но в отчетах о случаях и сериях исследований подчеркивается использование лучевой терапии грудной клетки у пациентов с кровохарканьем из-за мицетомы [21], в настоящее время в Южной Африке проводятся испытания для дальнейшей валидации ее использования у неоперабельных пациентов.В условиях ограниченных ресурсов необходимые диагностические инструменты и управленческий опыт вряд ли будут доступны, смертность от нелеченого массивного кровохарканья превышает 50% [22], поэтому пациентов с массивным кровохарканьем следует реанимировать и срочно направлять в центр, где требуется диагностика. доступны методы и управленческий опыт.
Постпервичное легочное кровохарканье — когда больше, чем кажется на первый взгляд
Резюме
Кровохарканье вызывает беспокойство как у пациента, так и у медицинского работника и указывает на наличие тяжелого основного заболевания легких, требующего исследования.Приблизительно 8% пациентов с инфекцией туберкулеза легких (ЛТБ) в какой-то момент жизни испытают кровохарканье [1; 2] . Этиология кровохарканья на фоне ПТБ разнообразна и может возникать во время активной или после перенесенной инфекции ПТБ из-за легочных осложнений. Мы описываем случай 33-летней женщины, у которой в двух разных случаях в течение пятимесячного периода произошло массивное кровохарканье. Ее предыстория включала в себя ПТБ за 6 лет до и последующие посттуберкулезные бронхоэктазы с разрушенным левым легким и развитие апикальной мицетомы.Несмотря на многочисленные ранее существовавшие этиологии, которые могли объяснить кровохарканье у этого пациента, при этом поступлении недавно выявленная разорванная аневризма Расмуссена была идентифицирована с помощью ангиографии и успешно вылечена артериальной эмболизацией. Этот отчет призван выделить множество причин кровохарканья у пациента с деструкцией легких после ПТБ и связанные с этим диагностические проблемы, которые могут присутствовать. В частности, мы выделяем аневризму Расмуссена, редко встречающуюся, как скрытую причину кровохарканья, когда, несмотря на обширное паренхиматозное заболевание легких, выявленное при рентгенографии грудной клетки, для подтверждения диагноза требуется специальная визуализация.
В частности, мы выделяем аневризму Расмуссена, редко встречающуюся, как скрытую причину кровохарканья, когда, несмотря на обширное паренхиматозное заболевание легких, выявленное при рентгенографии грудной клетки, для подтверждения диагноза требуется специальная визуализация.
1. Общие сведения
Туберкулез (ТБ) остается серьезным бременем для здоровья в развивающихся странах, несмотря на медицинские и технологические достижения. По состоянию на 2015 г. Южная Африка остается в шестерке лидеров как по заболеваемости, так и по распространенности ТБ в мире, причем кровохарканье является тесно связанным симптомом [3]. Несмотря на то, что 81% пациентов с PTB достигли выздоровления, кровохарканье может присутствовать у пациентов, перенесших PTB, и может быть связано с деформацией паренхимы и сопутствующими сосудистыми осложнениями, связанными с предшествующим PTB [3].Этот отчет направлен на то, чтобы выделить многочисленные этиологии кровохарканья у пациентов с пост-первичным ПТБ, с акцентом на аневризму Расмуссена, редкую, но устоявшуюся сущность с возможными опасными для жизни последствиями.
2. Пример из практики
У 32-летней пациентки с серонегативным ВИЧ, в настоящее время работающей научным сотрудником в медицинском учреждении, в течение 5 месяцев развился второй эпизод массивного кровохарканья. У нее был диагностирован микробиологически подтвержденный PTB за 6 лет до госпитализации, и она прошла 6 месяцев терапии.Однако это было осложнено фиброзно-кавитационной деструкцией ее левого легкого с посттуберкулезными бронхоэктазами (). В ходе последующего наблюдения в пульмонологической клинике и за 2 года до этой презентации у нее развилась апикальная мицетома, которая была выявлена при компьютерном топографическом сканировании грудной клетки (), и из-за явного кровохарканья ее сочли левосторонней. пневмонэктомия. Функциональный тест ее легких показал ограничительный паттерн легких с ОФВ1 64%, ФЖЕЛ 67% (ОФВ1 / ФЖЕЛ 95) и DLCO 74.Кроме того, раздельное сканирование перфузии ядерной медицины не показало заметной перфузии в пораженное легкое. Были выполнены электрокардиограмма и эхокардиограмма, указывающие на наличие легочной гипертензии.
Были выполнены электрокардиограмма и эхокардиограмма, указывающие на наличие легочной гипертензии.
Рентген грудной клетки демонстрирует сдвиг средостения вторичный по отношению к фиброзно-кавитационной деструкции левого легкого.
Компьютерная томография, показывающая бронхоэктаксические изменения с мицетомой менее сантиметра.
При осмотре во время госпитализации она была гемодинамически стабильной с артериальным давлением 127/82 мм рт. Ст. И синусовой тахикардией 110 уд / мин.У нее не было лихорадки, ее частота дыхания составляла 20 вдохов в минуту, и она была цианотичной на воздухе помещения с насыщением кислородом 93%. Отмечались выраженная дигитальная булава и субконъюнктивальная бледность. При респираторном обследовании были обнаружены признаки левосторонней потери объема с уменьшенным расширением левой грудной стенки и компенсаторной гиперинфляцией правой. Звуки дыхания справа были везикулярными по своей природе, но с левой стороны звуки дыхания были пониженной интенсивности с амфорическими звуками дыхания и грубым потрескиванием преимущественно в верхней зоне.При обследовании сердечно-сосудистой системы не было обнаружено признаков декомпенсированного легочного сердца, но были очевидны легочная гипертензия и сдвиг средостения влево. Были выявлены парагрудинная припухлость с пальпируемым Р2, а также громкий легочный компонент второго тона сердца. Ее верхушечный толчок был смещен к передней подмышечной линии в пятом межреберье с отклонением трахеи влево. Первоначальные лабораторные результаты показали микроцитарную гипохромную анемию с гемоглобином 7,7 г / дл (MCV = 73.8fl; MCHC = 31,4 г / дл) и количество тромбоцитов 487 × 10 9 / л. Дальнейшее гематологическое обследование показало железодефицитную анемию с ферритином 37 мкг / л, процентным насыщением 5% и соответствующими морфологическими особенностями. Функциональные пробы почек и печени были нормальными. Ее С-реактивный белок составлял 32 мг / л, а ее МНО — 1,28. Был проведен анализ Xpert MTB / RIF, который показал отрицательный результат на mycobacterium tuberculosis .
Поступила в поликлинику.Перелили 1 единицу эритроцитов и начали пероральный кодеинфосфат. Была выполнена экстренная компьютерная топографическая ангиограмма легких (CTPA), которая позволила предположить наличие аневризмы Расмуссена, но формальная ангиография была сочтена необходимой для подтверждения. Прямая ангиография показала покраснение легочной артерии рядом с левой верхней полостью легкого, что подтвердило наличие аневризмы Расмуссена (). Несмотря на сложную первоначальную вентиляцию легких из-за заболевания легкого, была проведена выборочная интубация правого бронха и успешная эмболизация артерии.После 48 часов постпроцедурного наблюдения в условиях интенсивной терапии ее перевели в общую медицинскую палату, где после 6 дней отсутствия кровохарканья она была выписана домой и в настоящее время ожидает левосторонней пневмонэктомии.
Прямая ангиография во время спиральной эмболизации, показывающая артериальный румянец, вторичный по отношению к разорванной аневризме.
3. Обсуждение
Кровохарканье, откашливание или отхождение мокроты с кровью, является тревожным симптомом и обычно служит индикатором тяжелой основной патологии легких.Массивное кровохарканье — это термин, обозначающий большой объем крови, отхаркиваемый в течение 24-часового периода, с возможностью заболеваемости и смертности из-за гемодинамической нестабильности, нарушения дыхательных путей и аномалий газообмена. Не существует единого мнения о точном объеме крови для определения массивного кровохарканья, и наиболее приемлемое количественное определение относится к значениям в диапазоне от 200 до 1000 мл за 24-часовой период до скорости кровотечения 100 мл в час [4].
Южная Африка является страной с высоким бременем ВОЗ [3], но существует нехватка литературы, оценивающей распространенность заболеваний легких, связанных с пост-PTB, в Южной Африке, однако эксперты в области легочной медицины Южной Африки считают, что PTB вносит значительный вклад. к хроническому заболеванию легких в этом регионе и является важной причиной кровохарканья. Активный ПТБ может проявляться как незначительной, так и значительной степенью кровохарканья, и значительная часть кровохарканья является вторичной по отношению к активному ПТБ, как показано в более ранней серии случаев в Южной Африке, где до 73% массивного кровохарканья были связаны с активным туберкулезом, и это подтверждается согласно недавнему исследованию ВИЧ-положительных пациентов с диабетом, у которых вероятность развития активной формы ТБ была в 31 раз выше, если кровохарканье было характерным симптомом [5,6]. Хотя кровохарканье тесно связано с активной инфекцией легочного ТБ, оно также может проявляться после разрешения острого заболевания из-за последующих легочных осложнений [1,2].К сожалению, нет данных, оценивающих распространенность кровохарканья среди пациентов с активным ПТБ по сравнению с пациентами с кровохарканьем в результате легочных осложнений после первичного ПТБ. Таким образом, даже несмотря на то, что этиология кровохарканья разнообразна и носит мультисистемный характер, в условиях высокого бремени ТБ его присутствие всегда должно предупреждать врача о возможности активного ПТБ.
Активный ПТБ может проявляться как незначительной, так и значительной степенью кровохарканья, и значительная часть кровохарканья является вторичной по отношению к активному ПТБ, как показано в более ранней серии случаев в Южной Африке, где до 73% массивного кровохарканья были связаны с активным туберкулезом, и это подтверждается согласно недавнему исследованию ВИЧ-положительных пациентов с диабетом, у которых вероятность развития активной формы ТБ была в 31 раз выше, если кровохарканье было характерным симптомом [5,6]. Хотя кровохарканье тесно связано с активной инфекцией легочного ТБ, оно также может проявляться после разрешения острого заболевания из-за последующих легочных осложнений [1,2].К сожалению, нет данных, оценивающих распространенность кровохарканья среди пациентов с активным ПТБ по сравнению с пациентами с кровохарканьем в результате легочных осложнений после первичного ПТБ. Таким образом, даже несмотря на то, что этиология кровохарканья разнообразна и носит мультисистемный характер, в условиях высокого бремени ТБ его присутствие всегда должно предупреждать врача о возможности активного ПТБ.
Кровохарканье возникает из-за местного кровоснабжения, происходящего как из легочных, так и из бронхиальных артерий. Легочная артериальная система передает весь сердечный выброс через систему относительно низкого давления для оксигенации, в то время как бронхиальная артерия и ее притоки переносят насыщенную кислородом кровь в паренхиму легких, и, несмотря на гораздо меньший объем, находятся под высоким системным давлением.В 90% случаев при массивном кровохарканье кровотечение происходит из этих сетей бронхиальных артерий высокого давления [7]. При рассмотрении этиологии кровохарканья у пациентов с пост-первичным туберкулезом открываются многочисленные возможности. Хотя патогенез кровохарканья как последствия ПТБ чаще всего возникает из-за деструкции и структурного ремоделирования паренхимы легкого и его сосудистой сети, у этих пациентов могут возникать другие сопутствующие заболевания, приводящие к кровохарканью. Это представляет собой диагностическую проблему для врача при определении причины у таких пациентов, а также при выборе необходимой терапии.Таким образом, несмотря на явно очевидную деструкцию паренхимы легких, множество других возможностей все еще могут объяснить кровохарканье.
Это представляет собой диагностическую проблему для врача при определении причины у таких пациентов, а также при выборе необходимой терапии.Таким образом, несмотря на явно очевидную деструкцию паренхимы легких, множество других возможностей все еще могут объяснить кровохарканье.
До 40–60% пациентов с предшествующим легочным ТБ страдают от деструкции дыхательных путей и паренхимы с фиброзом и кавитацией, отличительной чертой которых является апикальный и задний тракционный бронхоэктаз с фиброкавитацией верхней доли и смещением средостения в сторону пораженного легкого [8]. Посттуберкулезное фиброзно-кавитационное заболевание и бронхоэктазы приводят к необратимому повреждению и расширению дыхательных путей и связанной с ними сосудистой сети.Сосудистая сеть бронхов становится гипертрофированной, эктазированной и обнаженной. Гиперваскулярность, нарушенная архитектурная опора и открытое обнажение этих сосудов делают их склонными к кровотечению, и эти аномалии являются причиной большинства клинически очевидных кровохарканья у пациентов после ПТБ [9].
Значительное пост-первичное повреждение паренхимы легкого с кавитацией служит идеальной средой для грибковой колонизации и инфицирования патогенными видами, такими как Aspergillus spp.Легочный аспергиллез может проявляться в виде полостей, содержащих грибковые клубочки, которые называются мицетомой, или хроническим кавитационным или фиброзирующим аспергиллезом [10]. Встречается у 7–11% пациентов после предшествующего ПТБ, наличие мицетомы на рентгенологических изображениях (при КТ демонстрирует большую диагностическую точность, чем стандартная рентгенография грудной клетки [11]), а также антител к аспергиллезу в сыворотке приводит к увеличению заболеваемости. клинически выраженного кровохарканья [12]. Эрозия соседней сосудистой сети и внутриполостное кровотечение служат причиной кровохарканья у этих пациентов [6].
Опосредованное микобактерией гранулематозное воспаление и лимфаденит могут прогрессировать до кальцификации ткани, известной как бронхолиты. Посттуберкулезные бронхолиты могут быть нечеткими, но редко кальцинированные узлы могут разрушать и разрушать соседние бронхи, а при вовлечении сосудистых сетей бронхов может быть очевидным кровохарканье [8,13]. Хотя редко, рак легкого и туберкулез могут сосуществовать, при этом пост-первичное рубцевание легкого при ПТБ предрасполагает к развитию злокачественных новообразований (рубцовая карцинома), поскольку такое кровохарканье с подозрительными поражениями на радиологических изображениях не следует игнорировать и требует дальнейшей оценки [8, 13].
Посттуберкулезные бронхолиты могут быть нечеткими, но редко кальцинированные узлы могут разрушать и разрушать соседние бронхи, а при вовлечении сосудистых сетей бронхов может быть очевидным кровохарканье [8,13]. Хотя редко, рак легкого и туберкулез могут сосуществовать, при этом пост-первичное рубцевание легкого при ПТБ предрасполагает к развитию злокачественных новообразований (рубцовая карцинома), поскольку такое кровохарканье с подозрительными поражениями на радиологических изображениях не следует игнорировать и требует дальнейшей оценки [8, 13].
Прямое поражение сосудов ПТБ может также происходить, поскольку и артерии, и вены могут демонстрировать активный некротизирующий гранулематозный васкулит, индуцированный микобактериями, приводящий к воспалению с аневризматическими изменениями, бронхо-легочными и артериовенозными связями [8]. Аневризма Расмуссена относится к псевдоаневризме легочной артерии, прилегающей к туберкулезной полости. Серия вскрытий, названная в честь датского врача Фрица Вальдемара Расмуссена, показала распространенность до 5% у пациентов с кавитационной туберкулезной болезнью [14].Его развитие происходит из-за гранулематозного воспаления артериальной стенки, ведущего к ремоделированию сосудов с участием фибрина и последующему казеозу с прогрессирующим ослаблением сосудистой выстилки с аневризматическим расширением [2,8]. Последующий разрыв стенки сосуда или утечка из аневризмы Расмуссена может привести к массивному кровохарканью, с летальным исходом более 50% [15]. Рентгенография грудной клетки и клиническое обследование могут выявить наличие посттуберкулезных осложнений, но могут не учитывать сосудистые поражения, и, если есть подозрение, необходима радиологическая или формальная ангиография для подтверждения диагноза.
При лечении кровохарканья у пациента, перенесшего первичный туберкулез, критически важно осознавать возможность опасного для жизни кровохарканья, уделяя особое внимание мониторингу объема кровотечения пациента, скорости кровотечения и основных жизненно важных параметров. В настоящее время отсутствуют местные руководящие принципы или рекомендации, касающиеся кровохарканья после ПТБ, поскольку такое лечение регулируется больничными протоколами, основанными на международной литературе. Защита дыхательных путей и гемодинамическая стабильность — это начальный шаг перед исследованием, особенно с учетом того, что у этой группы пациентов низкий основной резерв легких [16].Если происходит продолжающееся кровохарканье; требуется дальнейшее исследование, помимо грубых аномалий, выявленных на рентгенограмме грудной клетки. Оптоволоконная бронхоскопия приносит пользу пациентам с активным кровотечением в соседнем кровоточащем бронхиальном сосуде. Возможна прямая визуализация кровотечения и немедленные меры контроля, такие как прямая коагуляция или эффекты тампонады [17,18]. Аневризматические поражения требуют детальной характеристики, поэтому CTPA используется с чувствительностью 80% [19].Неопределенность диагностики может потребовать прямой ангиографии, ее использование особенно важно, когда показана артериальная эмболизация, например, у нашего пациента [17,18]. В то время как туберкулезный артериит, вызванный некротизирующими гранулематозными изменениями, играет ключевую роль в развитии, биопсия сосудов и микроскопическая визуализация нецелесообразны и неосуществимы. Успешное прекращение кровохарканья при эмболизации артерий достигает 90%, но может потребоваться повторная эмболизация. В случае неудачи может потребоваться хирургическая резекция легкого, и хотя плановая резекция может привести к летальности 18%, артериальная эмболизация является важным мостом в терапии [7,20].Была использована экстренная резекция легкого по поводу опасного для жизни кровохарканья, но смертность в этом случае достигает 40%. Таким образом, первоначальная артериальная ангиография с намерением и использованием эмболизации остается основой терапии в условиях неотложной помощи, особенно с учетом того, что она может служить мостом к окончательной терапии у пациентов со значительными периоперационными проблемами [17].
В настоящее время отсутствуют местные руководящие принципы или рекомендации, касающиеся кровохарканья после ПТБ, поскольку такое лечение регулируется больничными протоколами, основанными на международной литературе. Защита дыхательных путей и гемодинамическая стабильность — это начальный шаг перед исследованием, особенно с учетом того, что у этой группы пациентов низкий основной резерв легких [16].Если происходит продолжающееся кровохарканье; требуется дальнейшее исследование, помимо грубых аномалий, выявленных на рентгенограмме грудной клетки. Оптоволоконная бронхоскопия приносит пользу пациентам с активным кровотечением в соседнем кровоточащем бронхиальном сосуде. Возможна прямая визуализация кровотечения и немедленные меры контроля, такие как прямая коагуляция или эффекты тампонады [17,18]. Аневризматические поражения требуют детальной характеристики, поэтому CTPA используется с чувствительностью 80% [19].Неопределенность диагностики может потребовать прямой ангиографии, ее использование особенно важно, когда показана артериальная эмболизация, например, у нашего пациента [17,18]. В то время как туберкулезный артериит, вызванный некротизирующими гранулематозными изменениями, играет ключевую роль в развитии, биопсия сосудов и микроскопическая визуализация нецелесообразны и неосуществимы. Успешное прекращение кровохарканья при эмболизации артерий достигает 90%, но может потребоваться повторная эмболизация. В случае неудачи может потребоваться хирургическая резекция легкого, и хотя плановая резекция может привести к летальности 18%, артериальная эмболизация является важным мостом в терапии [7,20].Была использована экстренная резекция легкого по поводу опасного для жизни кровохарканья, но смертность в этом случае достигает 40%. Таким образом, первоначальная артериальная ангиография с намерением и использованием эмболизации остается основой терапии в условиях неотложной помощи, особенно с учетом того, что она может служить мостом к окончательной терапии у пациентов со значительными периоперационными проблемами [17]. Интервенционные методы остаются основой терапии массивного кровохарканья, но в отчетах о случаях и сериях исследований подчеркивается использование лучевой терапии грудной клетки у пациентов с кровохарканьем из-за мицетомы [21], в настоящее время в Южной Африке проводятся испытания для дальнейшей валидации ее использования у неоперабельных пациентов.В условиях ограниченных ресурсов необходимые диагностические инструменты и управленческий опыт вряд ли будут доступны, смертность от нелеченого массивного кровохарканья превышает 50% [22], поэтому пациентов с массивным кровохарканьем следует реанимировать и срочно направлять в центр, где требуется диагностика. доступны методы и управленческий опыт.
Интервенционные методы остаются основой терапии массивного кровохарканья, но в отчетах о случаях и сериях исследований подчеркивается использование лучевой терапии грудной клетки у пациентов с кровохарканьем из-за мицетомы [21], в настоящее время в Южной Африке проводятся испытания для дальнейшей валидации ее использования у неоперабельных пациентов.В условиях ограниченных ресурсов необходимые диагностические инструменты и управленческий опыт вряд ли будут доступны, смертность от нелеченого массивного кровохарканья превышает 50% [22], поэтому пациентов с массивным кровохарканьем следует реанимировать и срочно направлять в центр, где требуется диагностика. доступны методы и управленческий опыт.
Постпервичное легочное кровохарканье — когда больше, чем кажется на первый взгляд
Резюме
Кровохарканье вызывает беспокойство как у пациента, так и у медицинского работника и указывает на наличие тяжелого основного заболевания легких, требующего исследования.Приблизительно 8% пациентов с инфекцией туберкулеза легких (ЛТБ) в какой-то момент жизни испытают кровохарканье [1; 2] . Этиология кровохарканья на фоне ПТБ разнообразна и может возникать во время активной или после перенесенной инфекции ПТБ из-за легочных осложнений. Мы описываем случай 33-летней женщины, у которой в двух разных случаях в течение пятимесячного периода произошло массивное кровохарканье. Ее предыстория включала в себя ПТБ за 6 лет до и последующие посттуберкулезные бронхоэктазы с разрушенным левым легким и развитие апикальной мицетомы.Несмотря на многочисленные ранее существовавшие этиологии, которые могли объяснить кровохарканье у этого пациента, при этом поступлении недавно выявленная разорванная аневризма Расмуссена была идентифицирована с помощью ангиографии и успешно вылечена артериальной эмболизацией. Этот отчет призван выделить множество причин кровохарканья у пациента с деструкцией легких после ПТБ и связанные с этим диагностические проблемы, которые могут присутствовать. В частности, мы выделяем аневризму Расмуссена, редко встречающуюся, как скрытую причину кровохарканья, когда, несмотря на обширное паренхиматозное заболевание легких, выявленное при рентгенографии грудной клетки, для подтверждения диагноза требуется специальная визуализация.
В частности, мы выделяем аневризму Расмуссена, редко встречающуюся, как скрытую причину кровохарканья, когда, несмотря на обширное паренхиматозное заболевание легких, выявленное при рентгенографии грудной клетки, для подтверждения диагноза требуется специальная визуализация.
1. Общие сведения
Туберкулез (ТБ) остается серьезным бременем для здоровья в развивающихся странах, несмотря на медицинские и технологические достижения. По состоянию на 2015 г. Южная Африка остается в шестерке лидеров как по заболеваемости, так и по распространенности ТБ в мире, причем кровохарканье является тесно связанным симптомом [3]. Несмотря на то, что 81% пациентов с PTB достигли выздоровления, кровохарканье может присутствовать у пациентов, перенесших PTB, и может быть связано с деформацией паренхимы и сопутствующими сосудистыми осложнениями, связанными с предшествующим PTB [3].Этот отчет направлен на то, чтобы выделить многочисленные этиологии кровохарканья у пациентов с пост-первичным ПТБ, с акцентом на аневризму Расмуссена, редкую, но устоявшуюся сущность с возможными опасными для жизни последствиями.
2. Пример из практики
У 32-летней пациентки с серонегативным ВИЧ, в настоящее время работающей научным сотрудником в медицинском учреждении, в течение 5 месяцев развился второй эпизод массивного кровохарканья. У нее был диагностирован микробиологически подтвержденный PTB за 6 лет до госпитализации, и она прошла 6 месяцев терапии.Однако это было осложнено фиброзно-кавитационной деструкцией ее левого легкого с посттуберкулезными бронхоэктазами (). В ходе последующего наблюдения в пульмонологической клинике и за 2 года до этой презентации у нее развилась апикальная мицетома, которая была выявлена при компьютерном топографическом сканировании грудной клетки (), и из-за явного кровохарканья ее сочли левосторонней. пневмонэктомия. Функциональный тест ее легких показал ограничительный паттерн легких с ОФВ1 64%, ФЖЕЛ 67% (ОФВ1 / ФЖЕЛ 95) и DLCO 74.Кроме того, раздельное сканирование перфузии ядерной медицины не показало заметной перфузии в пораженное легкое. Были выполнены электрокардиограмма и эхокардиограмма, указывающие на наличие легочной гипертензии.
Были выполнены электрокардиограмма и эхокардиограмма, указывающие на наличие легочной гипертензии.
Рентген грудной клетки демонстрирует сдвиг средостения вторичный по отношению к фиброзно-кавитационной деструкции левого легкого.
Компьютерная томография, показывающая бронхоэктаксические изменения с мицетомой менее сантиметра.
При осмотре во время госпитализации она была гемодинамически стабильной с артериальным давлением 127/82 мм рт. Ст. И синусовой тахикардией 110 уд / мин.У нее не было лихорадки, ее частота дыхания составляла 20 вдохов в минуту, и она была цианотичной на воздухе помещения с насыщением кислородом 93%. Отмечались выраженная дигитальная булава и субконъюнктивальная бледность. При респираторном обследовании были обнаружены признаки левосторонней потери объема с уменьшенным расширением левой грудной стенки и компенсаторной гиперинфляцией правой. Звуки дыхания справа были везикулярными по своей природе, но с левой стороны звуки дыхания были пониженной интенсивности с амфорическими звуками дыхания и грубым потрескиванием преимущественно в верхней зоне.При обследовании сердечно-сосудистой системы не было обнаружено признаков декомпенсированного легочного сердца, но были очевидны легочная гипертензия и сдвиг средостения влево. Были выявлены парагрудинная припухлость с пальпируемым Р2, а также громкий легочный компонент второго тона сердца. Ее верхушечный толчок был смещен к передней подмышечной линии в пятом межреберье с отклонением трахеи влево. Первоначальные лабораторные результаты показали микроцитарную гипохромную анемию с гемоглобином 7,7 г / дл (MCV = 73.8fl; MCHC = 31,4 г / дл) и количество тромбоцитов 487 × 10 9 / л. Дальнейшее гематологическое обследование показало железодефицитную анемию с ферритином 37 мкг / л, процентным насыщением 5% и соответствующими морфологическими особенностями. Функциональные пробы почек и печени были нормальными. Ее С-реактивный белок составлял 32 мг / л, а ее МНО — 1,28. Был проведен анализ Xpert MTB / RIF, который показал отрицательный результат на mycobacterium tuberculosis .
Поступила в поликлинику.Перелили 1 единицу эритроцитов и начали пероральный кодеинфосфат. Была выполнена экстренная компьютерная топографическая ангиограмма легких (CTPA), которая позволила предположить наличие аневризмы Расмуссена, но формальная ангиография была сочтена необходимой для подтверждения. Прямая ангиография показала покраснение легочной артерии рядом с левой верхней полостью легкого, что подтвердило наличие аневризмы Расмуссена (). Несмотря на сложную первоначальную вентиляцию легких из-за заболевания легкого, была проведена выборочная интубация правого бронха и успешная эмболизация артерии.После 48 часов постпроцедурного наблюдения в условиях интенсивной терапии ее перевели в общую медицинскую палату, где после 6 дней отсутствия кровохарканья она была выписана домой и в настоящее время ожидает левосторонней пневмонэктомии.
Прямая ангиография во время спиральной эмболизации, показывающая артериальный румянец, вторичный по отношению к разорванной аневризме.
3. Обсуждение
Кровохарканье, откашливание или отхождение мокроты с кровью, является тревожным симптомом и обычно служит индикатором тяжелой основной патологии легких.Массивное кровохарканье — это термин, обозначающий большой объем крови, отхаркиваемый в течение 24-часового периода, с возможностью заболеваемости и смертности из-за гемодинамической нестабильности, нарушения дыхательных путей и аномалий газообмена. Не существует единого мнения о точном объеме крови для определения массивного кровохарканья, и наиболее приемлемое количественное определение относится к значениям в диапазоне от 200 до 1000 мл за 24-часовой период до скорости кровотечения 100 мл в час [4].
Южная Африка является страной с высоким бременем ВОЗ [3], но существует нехватка литературы, оценивающей распространенность заболеваний легких, связанных с пост-PTB, в Южной Африке, однако эксперты в области легочной медицины Южной Африки считают, что PTB вносит значительный вклад. к хроническому заболеванию легких в этом регионе и является важной причиной кровохарканья. Активный ПТБ может проявляться как незначительной, так и значительной степенью кровохарканья, и значительная часть кровохарканья является вторичной по отношению к активному ПТБ, как показано в более ранней серии случаев в Южной Африке, где до 73% массивного кровохарканья были связаны с активным туберкулезом, и это подтверждается согласно недавнему исследованию ВИЧ-положительных пациентов с диабетом, у которых вероятность развития активной формы ТБ была в 31 раз выше, если кровохарканье было характерным симптомом [5,6]. Хотя кровохарканье тесно связано с активной инфекцией легочного ТБ, оно также может проявляться после разрешения острого заболевания из-за последующих легочных осложнений [1,2].К сожалению, нет данных, оценивающих распространенность кровохарканья среди пациентов с активным ПТБ по сравнению с пациентами с кровохарканьем в результате легочных осложнений после первичного ПТБ. Таким образом, даже несмотря на то, что этиология кровохарканья разнообразна и носит мультисистемный характер, в условиях высокого бремени ТБ его присутствие всегда должно предупреждать врача о возможности активного ПТБ.
Активный ПТБ может проявляться как незначительной, так и значительной степенью кровохарканья, и значительная часть кровохарканья является вторичной по отношению к активному ПТБ, как показано в более ранней серии случаев в Южной Африке, где до 73% массивного кровохарканья были связаны с активным туберкулезом, и это подтверждается согласно недавнему исследованию ВИЧ-положительных пациентов с диабетом, у которых вероятность развития активной формы ТБ была в 31 раз выше, если кровохарканье было характерным симптомом [5,6]. Хотя кровохарканье тесно связано с активной инфекцией легочного ТБ, оно также может проявляться после разрешения острого заболевания из-за последующих легочных осложнений [1,2].К сожалению, нет данных, оценивающих распространенность кровохарканья среди пациентов с активным ПТБ по сравнению с пациентами с кровохарканьем в результате легочных осложнений после первичного ПТБ. Таким образом, даже несмотря на то, что этиология кровохарканья разнообразна и носит мультисистемный характер, в условиях высокого бремени ТБ его присутствие всегда должно предупреждать врача о возможности активного ПТБ.
Кровохарканье возникает из-за местного кровоснабжения, происходящего как из легочных, так и из бронхиальных артерий. Легочная артериальная система передает весь сердечный выброс через систему относительно низкого давления для оксигенации, в то время как бронхиальная артерия и ее притоки переносят насыщенную кислородом кровь в паренхиму легких, и, несмотря на гораздо меньший объем, находятся под высоким системным давлением.В 90% случаев при массивном кровохарканье кровотечение происходит из этих сетей бронхиальных артерий высокого давления [7]. При рассмотрении этиологии кровохарканья у пациентов с пост-первичным туберкулезом открываются многочисленные возможности. Хотя патогенез кровохарканья как последствия ПТБ чаще всего возникает из-за деструкции и структурного ремоделирования паренхимы легкого и его сосудистой сети, у этих пациентов могут возникать другие сопутствующие заболевания, приводящие к кровохарканью.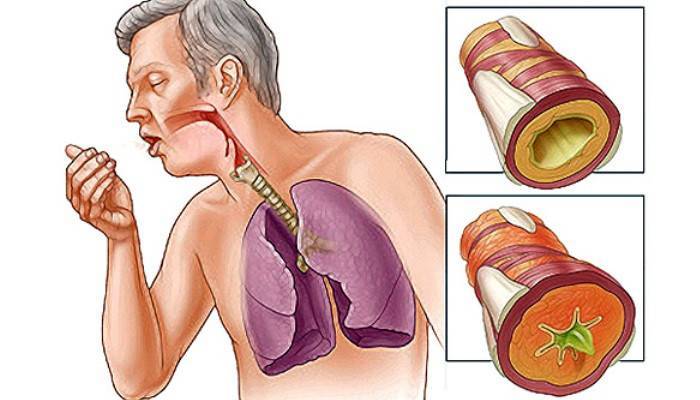 Это представляет собой диагностическую проблему для врача при определении причины у таких пациентов, а также при выборе необходимой терапии.Таким образом, несмотря на явно очевидную деструкцию паренхимы легких, множество других возможностей все еще могут объяснить кровохарканье.
Это представляет собой диагностическую проблему для врача при определении причины у таких пациентов, а также при выборе необходимой терапии.Таким образом, несмотря на явно очевидную деструкцию паренхимы легких, множество других возможностей все еще могут объяснить кровохарканье.
До 40–60% пациентов с предшествующим легочным ТБ страдают от деструкции дыхательных путей и паренхимы с фиброзом и кавитацией, отличительной чертой которых является апикальный и задний тракционный бронхоэктаз с фиброкавитацией верхней доли и смещением средостения в сторону пораженного легкого [8]. Посттуберкулезное фиброзно-кавитационное заболевание и бронхоэктазы приводят к необратимому повреждению и расширению дыхательных путей и связанной с ними сосудистой сети.Сосудистая сеть бронхов становится гипертрофированной, эктазированной и обнаженной. Гиперваскулярность, нарушенная архитектурная опора и открытое обнажение этих сосудов делают их склонными к кровотечению, и эти аномалии являются причиной большинства клинически очевидных кровохарканья у пациентов после ПТБ [9].
Значительное пост-первичное повреждение паренхимы легкого с кавитацией служит идеальной средой для грибковой колонизации и инфицирования патогенными видами, такими как Aspergillus spp.Легочный аспергиллез может проявляться в виде полостей, содержащих грибковые клубочки, которые называются мицетомой, или хроническим кавитационным или фиброзирующим аспергиллезом [10]. Встречается у 7–11% пациентов после предшествующего ПТБ, наличие мицетомы на рентгенологических изображениях (при КТ демонстрирует большую диагностическую точность, чем стандартная рентгенография грудной клетки [11]), а также антител к аспергиллезу в сыворотке приводит к увеличению заболеваемости. клинически выраженного кровохарканья [12]. Эрозия соседней сосудистой сети и внутриполостное кровотечение служат причиной кровохарканья у этих пациентов [6].
Опосредованное микобактерией гранулематозное воспаление и лимфаденит могут прогрессировать до кальцификации ткани, известной как бронхолиты. Посттуберкулезные бронхолиты могут быть нечеткими, но редко кальцинированные узлы могут разрушать и разрушать соседние бронхи, а при вовлечении сосудистых сетей бронхов может быть очевидным кровохарканье [8,13]. Хотя редко, рак легкого и туберкулез могут сосуществовать, при этом пост-первичное рубцевание легкого при ПТБ предрасполагает к развитию злокачественных новообразований (рубцовая карцинома), поскольку такое кровохарканье с подозрительными поражениями на радиологических изображениях не следует игнорировать и требует дальнейшей оценки [8, 13].
Посттуберкулезные бронхолиты могут быть нечеткими, но редко кальцинированные узлы могут разрушать и разрушать соседние бронхи, а при вовлечении сосудистых сетей бронхов может быть очевидным кровохарканье [8,13]. Хотя редко, рак легкого и туберкулез могут сосуществовать, при этом пост-первичное рубцевание легкого при ПТБ предрасполагает к развитию злокачественных новообразований (рубцовая карцинома), поскольку такое кровохарканье с подозрительными поражениями на радиологических изображениях не следует игнорировать и требует дальнейшей оценки [8, 13].
Прямое поражение сосудов ПТБ может также происходить, поскольку и артерии, и вены могут демонстрировать активный некротизирующий гранулематозный васкулит, индуцированный микобактериями, приводящий к воспалению с аневризматическими изменениями, бронхо-легочными и артериовенозными связями [8]. Аневризма Расмуссена относится к псевдоаневризме легочной артерии, прилегающей к туберкулезной полости. Серия вскрытий, названная в честь датского врача Фрица Вальдемара Расмуссена, показала распространенность до 5% у пациентов с кавитационной туберкулезной болезнью [14].Его развитие происходит из-за гранулематозного воспаления артериальной стенки, ведущего к ремоделированию сосудов с участием фибрина и последующему казеозу с прогрессирующим ослаблением сосудистой выстилки с аневризматическим расширением [2,8]. Последующий разрыв стенки сосуда или утечка из аневризмы Расмуссена может привести к массивному кровохарканью, с летальным исходом более 50% [15]. Рентгенография грудной клетки и клиническое обследование могут выявить наличие посттуберкулезных осложнений, но могут не учитывать сосудистые поражения, и, если есть подозрение, необходима радиологическая или формальная ангиография для подтверждения диагноза.
При лечении кровохарканья у пациента, перенесшего первичный туберкулез, критически важно осознавать возможность опасного для жизни кровохарканья, уделяя особое внимание мониторингу объема кровотечения пациента, скорости кровотечения и основных жизненно важных параметров. В настоящее время отсутствуют местные руководящие принципы или рекомендации, касающиеся кровохарканья после ПТБ, поскольку такое лечение регулируется больничными протоколами, основанными на международной литературе. Защита дыхательных путей и гемодинамическая стабильность — это начальный шаг перед исследованием, особенно с учетом того, что у этой группы пациентов низкий основной резерв легких [16].Если происходит продолжающееся кровохарканье; требуется дальнейшее исследование, помимо грубых аномалий, выявленных на рентгенограмме грудной клетки. Оптоволоконная бронхоскопия приносит пользу пациентам с активным кровотечением в соседнем кровоточащем бронхиальном сосуде. Возможна прямая визуализация кровотечения и немедленные меры контроля, такие как прямая коагуляция или эффекты тампонады [17,18]. Аневризматические поражения требуют детальной характеристики, поэтому CTPA используется с чувствительностью 80% [19].Неопределенность диагностики может потребовать прямой ангиографии, ее использование особенно важно, когда показана артериальная эмболизация, например, у нашего пациента [17,18]. В то время как туберкулезный артериит, вызванный некротизирующими гранулематозными изменениями, играет ключевую роль в развитии, биопсия сосудов и микроскопическая визуализация нецелесообразны и неосуществимы. Успешное прекращение кровохарканья при эмболизации артерий достигает 90%, но может потребоваться повторная эмболизация. В случае неудачи может потребоваться хирургическая резекция легкого, и хотя плановая резекция может привести к летальности 18%, артериальная эмболизация является важным мостом в терапии [7,20].Была использована экстренная резекция легкого по поводу опасного для жизни кровохарканья, но смертность в этом случае достигает 40%. Таким образом, первоначальная артериальная ангиография с намерением и использованием эмболизации остается основой терапии в условиях неотложной помощи, особенно с учетом того, что она может служить мостом к окончательной терапии у пациентов со значительными периоперационными проблемами [17].
В настоящее время отсутствуют местные руководящие принципы или рекомендации, касающиеся кровохарканья после ПТБ, поскольку такое лечение регулируется больничными протоколами, основанными на международной литературе. Защита дыхательных путей и гемодинамическая стабильность — это начальный шаг перед исследованием, особенно с учетом того, что у этой группы пациентов низкий основной резерв легких [16].Если происходит продолжающееся кровохарканье; требуется дальнейшее исследование, помимо грубых аномалий, выявленных на рентгенограмме грудной клетки. Оптоволоконная бронхоскопия приносит пользу пациентам с активным кровотечением в соседнем кровоточащем бронхиальном сосуде. Возможна прямая визуализация кровотечения и немедленные меры контроля, такие как прямая коагуляция или эффекты тампонады [17,18]. Аневризматические поражения требуют детальной характеристики, поэтому CTPA используется с чувствительностью 80% [19].Неопределенность диагностики может потребовать прямой ангиографии, ее использование особенно важно, когда показана артериальная эмболизация, например, у нашего пациента [17,18]. В то время как туберкулезный артериит, вызванный некротизирующими гранулематозными изменениями, играет ключевую роль в развитии, биопсия сосудов и микроскопическая визуализация нецелесообразны и неосуществимы. Успешное прекращение кровохарканья при эмболизации артерий достигает 90%, но может потребоваться повторная эмболизация. В случае неудачи может потребоваться хирургическая резекция легкого, и хотя плановая резекция может привести к летальности 18%, артериальная эмболизация является важным мостом в терапии [7,20].Была использована экстренная резекция легкого по поводу опасного для жизни кровохарканья, но смертность в этом случае достигает 40%. Таким образом, первоначальная артериальная ангиография с намерением и использованием эмболизации остается основой терапии в условиях неотложной помощи, особенно с учетом того, что она может служить мостом к окончательной терапии у пациентов со значительными периоперационными проблемами [17]. Интервенционные методы остаются основой терапии массивного кровохарканья, но в отчетах о случаях и сериях исследований подчеркивается использование лучевой терапии грудной клетки у пациентов с кровохарканьем из-за мицетомы [21], в настоящее время в Южной Африке проводятся испытания для дальнейшей валидации ее использования у неоперабельных пациентов.В условиях ограниченных ресурсов необходимые диагностические инструменты и управленческий опыт вряд ли будут доступны, смертность от нелеченого массивного кровохарканья превышает 50% [22], поэтому пациентов с массивным кровохарканьем следует реанимировать и срочно направлять в центр, где требуется диагностика. доступны методы и управленческий опыт.
Интервенционные методы остаются основой терапии массивного кровохарканья, но в отчетах о случаях и сериях исследований подчеркивается использование лучевой терапии грудной клетки у пациентов с кровохарканьем из-за мицетомы [21], в настоящее время в Южной Африке проводятся испытания для дальнейшей валидации ее использования у неоперабельных пациентов.В условиях ограниченных ресурсов необходимые диагностические инструменты и управленческий опыт вряд ли будут доступны, смертность от нелеченого массивного кровохарканья превышает 50% [22], поэтому пациентов с массивным кровохарканьем следует реанимировать и срочно направлять в центр, где требуется диагностика. доступны методы и управленческий опыт.
Постпервичное легочное кровохарканье — когда больше, чем кажется на первый взгляд
Резюме
Кровохарканье вызывает беспокойство как у пациента, так и у медицинского работника и указывает на наличие тяжелого основного заболевания легких, требующего исследования.Приблизительно 8% пациентов с инфекцией туберкулеза легких (ЛТБ) в какой-то момент жизни испытают кровохарканье [1; 2] . Этиология кровохарканья на фоне ПТБ разнообразна и может возникать во время активной или после перенесенной инфекции ПТБ из-за легочных осложнений. Мы описываем случай 33-летней женщины, у которой в двух разных случаях в течение пятимесячного периода произошло массивное кровохарканье. Ее предыстория включала в себя ПТБ за 6 лет до и последующие посттуберкулезные бронхоэктазы с разрушенным левым легким и развитие апикальной мицетомы.Несмотря на многочисленные ранее существовавшие этиологии, которые могли объяснить кровохарканье у этого пациента, при этом поступлении недавно выявленная разорванная аневризма Расмуссена была идентифицирована с помощью ангиографии и успешно вылечена артериальной эмболизацией. Этот отчет призван выделить множество причин кровохарканья у пациента с деструкцией легких после ПТБ и связанные с этим диагностические проблемы, которые могут присутствовать.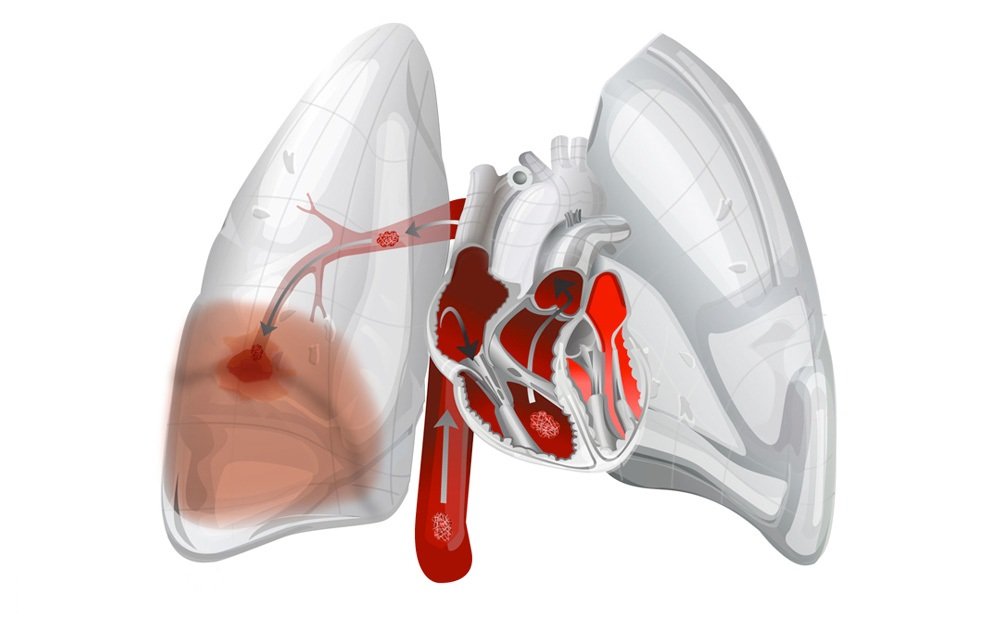 В частности, мы выделяем аневризму Расмуссена, редко встречающуюся, как скрытую причину кровохарканья, когда, несмотря на обширное паренхиматозное заболевание легких, выявленное при рентгенографии грудной клетки, для подтверждения диагноза требуется специальная визуализация.
В частности, мы выделяем аневризму Расмуссена, редко встречающуюся, как скрытую причину кровохарканья, когда, несмотря на обширное паренхиматозное заболевание легких, выявленное при рентгенографии грудной клетки, для подтверждения диагноза требуется специальная визуализация.
1. Общие сведения
Туберкулез (ТБ) остается серьезным бременем для здоровья в развивающихся странах, несмотря на медицинские и технологические достижения. По состоянию на 2015 г. Южная Африка остается в шестерке лидеров как по заболеваемости, так и по распространенности ТБ в мире, причем кровохарканье является тесно связанным симптомом [3]. Несмотря на то, что 81% пациентов с PTB достигли выздоровления, кровохарканье может присутствовать у пациентов, перенесших PTB, и может быть связано с деформацией паренхимы и сопутствующими сосудистыми осложнениями, связанными с предшествующим PTB [3].Этот отчет направлен на то, чтобы выделить многочисленные этиологии кровохарканья у пациентов с пост-первичным ПТБ, с акцентом на аневризму Расмуссена, редкую, но устоявшуюся сущность с возможными опасными для жизни последствиями.
2. Пример из практики
У 32-летней пациентки с серонегативным ВИЧ, в настоящее время работающей научным сотрудником в медицинском учреждении, в течение 5 месяцев развился второй эпизод массивного кровохарканья. У нее был диагностирован микробиологически подтвержденный PTB за 6 лет до госпитализации, и она прошла 6 месяцев терапии.Однако это было осложнено фиброзно-кавитационной деструкцией ее левого легкого с посттуберкулезными бронхоэктазами (). В ходе последующего наблюдения в пульмонологической клинике и за 2 года до этой презентации у нее развилась апикальная мицетома, которая была выявлена при компьютерном топографическом сканировании грудной клетки (), и из-за явного кровохарканья ее сочли левосторонней. пневмонэктомия. Функциональный тест ее легких показал ограничительный паттерн легких с ОФВ1 64%, ФЖЕЛ 67% (ОФВ1 / ФЖЕЛ 95) и DLCO 74.Кроме того, раздельное сканирование перфузии ядерной медицины не показало заметной перфузии в пораженное легкое./Ukr/10/4.jpg) Были выполнены электрокардиограмма и эхокардиограмма, указывающие на наличие легочной гипертензии.
Были выполнены электрокардиограмма и эхокардиограмма, указывающие на наличие легочной гипертензии.
Рентген грудной клетки демонстрирует сдвиг средостения вторичный по отношению к фиброзно-кавитационной деструкции левого легкого.
Компьютерная томография, показывающая бронхоэктаксические изменения с мицетомой менее сантиметра.
При осмотре во время госпитализации она была гемодинамически стабильной с артериальным давлением 127/82 мм рт. Ст. И синусовой тахикардией 110 уд / мин.У нее не было лихорадки, ее частота дыхания составляла 20 вдохов в минуту, и она была цианотичной на воздухе помещения с насыщением кислородом 93%. Отмечались выраженная дигитальная булава и субконъюнктивальная бледность. При респираторном обследовании были обнаружены признаки левосторонней потери объема с уменьшенным расширением левой грудной стенки и компенсаторной гиперинфляцией правой. Звуки дыхания справа были везикулярными по своей природе, но с левой стороны звуки дыхания были пониженной интенсивности с амфорическими звуками дыхания и грубым потрескиванием преимущественно в верхней зоне.При обследовании сердечно-сосудистой системы не было обнаружено признаков декомпенсированного легочного сердца, но были очевидны легочная гипертензия и сдвиг средостения влево. Были выявлены парагрудинная припухлость с пальпируемым Р2, а также громкий легочный компонент второго тона сердца. Ее верхушечный толчок был смещен к передней подмышечной линии в пятом межреберье с отклонением трахеи влево. Первоначальные лабораторные результаты показали микроцитарную гипохромную анемию с гемоглобином 7,7 г / дл (MCV = 73.8fl; MCHC = 31,4 г / дл) и количество тромбоцитов 487 × 10 9 / л. Дальнейшее гематологическое обследование показало железодефицитную анемию с ферритином 37 мкг / л, процентным насыщением 5% и соответствующими морфологическими особенностями. Функциональные пробы почек и печени были нормальными. Ее С-реактивный белок составлял 32 мг / л, а ее МНО — 1,28. Был проведен анализ Xpert MTB / RIF, который показал отрицательный результат на mycobacterium tuberculosis .
Поступила в поликлинику.Перелили 1 единицу эритроцитов и начали пероральный кодеинфосфат. Была выполнена экстренная компьютерная топографическая ангиограмма легких (CTPA), которая позволила предположить наличие аневризмы Расмуссена, но формальная ангиография была сочтена необходимой для подтверждения. Прямая ангиография показала покраснение легочной артерии рядом с левой верхней полостью легкого, что подтвердило наличие аневризмы Расмуссена (). Несмотря на сложную первоначальную вентиляцию легких из-за заболевания легкого, была проведена выборочная интубация правого бронха и успешная эмболизация артерии.После 48 часов постпроцедурного наблюдения в условиях интенсивной терапии ее перевели в общую медицинскую палату, где после 6 дней отсутствия кровохарканья она была выписана домой и в настоящее время ожидает левосторонней пневмонэктомии.
Прямая ангиография во время спиральной эмболизации, показывающая артериальный румянец, вторичный по отношению к разорванной аневризме.
3. Обсуждение
Кровохарканье, откашливание или отхождение мокроты с кровью, является тревожным симптомом и обычно служит индикатором тяжелой основной патологии легких.Массивное кровохарканье — это термин, обозначающий большой объем крови, отхаркиваемый в течение 24-часового периода, с возможностью заболеваемости и смертности из-за гемодинамической нестабильности, нарушения дыхательных путей и аномалий газообмена. Не существует единого мнения о точном объеме крови для определения массивного кровохарканья, и наиболее приемлемое количественное определение относится к значениям в диапазоне от 200 до 1000 мл за 24-часовой период до скорости кровотечения 100 мл в час [4].
Южная Африка является страной с высоким бременем ВОЗ [3], но существует нехватка литературы, оценивающей распространенность заболеваний легких, связанных с пост-PTB, в Южной Африке, однако эксперты в области легочной медицины Южной Африки считают, что PTB вносит значительный вклад. к хроническому заболеванию легких в этом регионе и является важной причиной кровохарканья. Активный ПТБ может проявляться как незначительной, так и значительной степенью кровохарканья, и значительная часть кровохарканья является вторичной по отношению к активному ПТБ, как показано в более ранней серии случаев в Южной Африке, где до 73% массивного кровохарканья были связаны с активным туберкулезом, и это подтверждается согласно недавнему исследованию ВИЧ-положительных пациентов с диабетом, у которых вероятность развития активной формы ТБ была в 31 раз выше, если кровохарканье было характерным симптомом [5,6]. Хотя кровохарканье тесно связано с активной инфекцией легочного ТБ, оно также может проявляться после разрешения острого заболевания из-за последующих легочных осложнений [1,2].К сожалению, нет данных, оценивающих распространенность кровохарканья среди пациентов с активным ПТБ по сравнению с пациентами с кровохарканьем в результате легочных осложнений после первичного ПТБ. Таким образом, даже несмотря на то, что этиология кровохарканья разнообразна и носит мультисистемный характер, в условиях высокого бремени ТБ его присутствие всегда должно предупреждать врача о возможности активного ПТБ.
Активный ПТБ может проявляться как незначительной, так и значительной степенью кровохарканья, и значительная часть кровохарканья является вторичной по отношению к активному ПТБ, как показано в более ранней серии случаев в Южной Африке, где до 73% массивного кровохарканья были связаны с активным туберкулезом, и это подтверждается согласно недавнему исследованию ВИЧ-положительных пациентов с диабетом, у которых вероятность развития активной формы ТБ была в 31 раз выше, если кровохарканье было характерным симптомом [5,6]. Хотя кровохарканье тесно связано с активной инфекцией легочного ТБ, оно также может проявляться после разрешения острого заболевания из-за последующих легочных осложнений [1,2].К сожалению, нет данных, оценивающих распространенность кровохарканья среди пациентов с активным ПТБ по сравнению с пациентами с кровохарканьем в результате легочных осложнений после первичного ПТБ. Таким образом, даже несмотря на то, что этиология кровохарканья разнообразна и носит мультисистемный характер, в условиях высокого бремени ТБ его присутствие всегда должно предупреждать врача о возможности активного ПТБ.
Кровохарканье возникает из-за местного кровоснабжения, происходящего как из легочных, так и из бронхиальных артерий. Легочная артериальная система передает весь сердечный выброс через систему относительно низкого давления для оксигенации, в то время как бронхиальная артерия и ее притоки переносят насыщенную кислородом кровь в паренхиму легких, и, несмотря на гораздо меньший объем, находятся под высоким системным давлением.В 90% случаев при массивном кровохарканье кровотечение происходит из этих сетей бронхиальных артерий высокого давления [7]. При рассмотрении этиологии кровохарканья у пациентов с пост-первичным туберкулезом открываются многочисленные возможности. Хотя патогенез кровохарканья как последствия ПТБ чаще всего возникает из-за деструкции и структурного ремоделирования паренхимы легкого и его сосудистой сети, у этих пациентов могут возникать другие сопутствующие заболевания, приводящие к кровохарканью. Это представляет собой диагностическую проблему для врача при определении причины у таких пациентов, а также при выборе необходимой терапии.Таким образом, несмотря на явно очевидную деструкцию паренхимы легких, множество других возможностей все еще могут объяснить кровохарканье.
Это представляет собой диагностическую проблему для врача при определении причины у таких пациентов, а также при выборе необходимой терапии.Таким образом, несмотря на явно очевидную деструкцию паренхимы легких, множество других возможностей все еще могут объяснить кровохарканье.
До 40–60% пациентов с предшествующим легочным ТБ страдают от деструкции дыхательных путей и паренхимы с фиброзом и кавитацией, отличительной чертой которых является апикальный и задний тракционный бронхоэктаз с фиброкавитацией верхней доли и смещением средостения в сторону пораженного легкого [8]. Посттуберкулезное фиброзно-кавитационное заболевание и бронхоэктазы приводят к необратимому повреждению и расширению дыхательных путей и связанной с ними сосудистой сети.Сосудистая сеть бронхов становится гипертрофированной, эктазированной и обнаженной. Гиперваскулярность, нарушенная архитектурная опора и открытое обнажение этих сосудов делают их склонными к кровотечению, и эти аномалии являются причиной большинства клинически очевидных кровохарканья у пациентов после ПТБ [9].
Значительное пост-первичное повреждение паренхимы легкого с кавитацией служит идеальной средой для грибковой колонизации и инфицирования патогенными видами, такими как Aspergillus spp.Легочный аспергиллез может проявляться в виде полостей, содержащих грибковые клубочки, которые называются мицетомой, или хроническим кавитационным или фиброзирующим аспергиллезом [10]. Встречается у 7–11% пациентов после предшествующего ПТБ, наличие мицетомы на рентгенологических изображениях (при КТ демонстрирует большую диагностическую точность, чем стандартная рентгенография грудной клетки [11]), а также антител к аспергиллезу в сыворотке приводит к увеличению заболеваемости. клинически выраженного кровохарканья [12]. Эрозия соседней сосудистой сети и внутриполостное кровотечение служат причиной кровохарканья у этих пациентов [6].
Опосредованное микобактерией гранулематозное воспаление и лимфаденит могут прогрессировать до кальцификации ткани, известной как бронхолиты. Посттуберкулезные бронхолиты могут быть нечеткими, но редко кальцинированные узлы могут разрушать и разрушать соседние бронхи, а при вовлечении сосудистых сетей бронхов может быть очевидным кровохарканье [8,13]. Хотя редко, рак легкого и туберкулез могут сосуществовать, при этом пост-первичное рубцевание легкого при ПТБ предрасполагает к развитию злокачественных новообразований (рубцовая карцинома), поскольку такое кровохарканье с подозрительными поражениями на радиологических изображениях не следует игнорировать и требует дальнейшей оценки [8, 13].
Посттуберкулезные бронхолиты могут быть нечеткими, но редко кальцинированные узлы могут разрушать и разрушать соседние бронхи, а при вовлечении сосудистых сетей бронхов может быть очевидным кровохарканье [8,13]. Хотя редко, рак легкого и туберкулез могут сосуществовать, при этом пост-первичное рубцевание легкого при ПТБ предрасполагает к развитию злокачественных новообразований (рубцовая карцинома), поскольку такое кровохарканье с подозрительными поражениями на радиологических изображениях не следует игнорировать и требует дальнейшей оценки [8, 13].
Прямое поражение сосудов ПТБ может также происходить, поскольку и артерии, и вены могут демонстрировать активный некротизирующий гранулематозный васкулит, индуцированный микобактериями, приводящий к воспалению с аневризматическими изменениями, бронхо-легочными и артериовенозными связями [8]. Аневризма Расмуссена относится к псевдоаневризме легочной артерии, прилегающей к туберкулезной полости. Серия вскрытий, названная в честь датского врача Фрица Вальдемара Расмуссена, показала распространенность до 5% у пациентов с кавитационной туберкулезной болезнью [14].Его развитие происходит из-за гранулематозного воспаления артериальной стенки, ведущего к ремоделированию сосудов с участием фибрина и последующему казеозу с прогрессирующим ослаблением сосудистой выстилки с аневризматическим расширением [2,8]. Последующий разрыв стенки сосуда или утечка из аневризмы Расмуссена может привести к массивному кровохарканью, с летальным исходом более 50% [15]. Рентгенография грудной клетки и клиническое обследование могут выявить наличие посттуберкулезных осложнений, но могут не учитывать сосудистые поражения, и, если есть подозрение, необходима радиологическая или формальная ангиография для подтверждения диагноза.
При лечении кровохарканья у пациента, перенесшего первичный туберкулез, критически важно осознавать возможность опасного для жизни кровохарканья, уделяя особое внимание мониторингу объема кровотечения пациента, скорости кровотечения и основных жизненно важных параметров. В настоящее время отсутствуют местные руководящие принципы или рекомендации, касающиеся кровохарканья после ПТБ, поскольку такое лечение регулируется больничными протоколами, основанными на международной литературе. Защита дыхательных путей и гемодинамическая стабильность — это начальный шаг перед исследованием, особенно с учетом того, что у этой группы пациентов низкий основной резерв легких [16].Если происходит продолжающееся кровохарканье; требуется дальнейшее исследование, помимо грубых аномалий, выявленных на рентгенограмме грудной клетки. Оптоволоконная бронхоскопия приносит пользу пациентам с активным кровотечением в соседнем кровоточащем бронхиальном сосуде. Возможна прямая визуализация кровотечения и немедленные меры контроля, такие как прямая коагуляция или эффекты тампонады [17,18]. Аневризматические поражения требуют детальной характеристики, поэтому CTPA используется с чувствительностью 80% [19].Неопределенность диагностики может потребовать прямой ангиографии, ее использование особенно важно, когда показана артериальная эмболизация, например, у нашего пациента [17,18]. В то время как туберкулезный артериит, вызванный некротизирующими гранулематозными изменениями, играет ключевую роль в развитии, биопсия сосудов и микроскопическая визуализация нецелесообразны и неосуществимы. Успешное прекращение кровохарканья при эмболизации артерий достигает 90%, но может потребоваться повторная эмболизация. В случае неудачи может потребоваться хирургическая резекция легкого, и хотя плановая резекция может привести к летальности 18%, артериальная эмболизация является важным мостом в терапии [7,20].Была использована экстренная резекция легкого по поводу опасного для жизни кровохарканья, но смертность в этом случае достигает 40%. Таким образом, первоначальная артериальная ангиография с намерением и использованием эмболизации остается основой терапии в условиях неотложной помощи, особенно с учетом того, что она может служить мостом к окончательной терапии у пациентов со значительными периоперационными проблемами [17].
В настоящее время отсутствуют местные руководящие принципы или рекомендации, касающиеся кровохарканья после ПТБ, поскольку такое лечение регулируется больничными протоколами, основанными на международной литературе. Защита дыхательных путей и гемодинамическая стабильность — это начальный шаг перед исследованием, особенно с учетом того, что у этой группы пациентов низкий основной резерв легких [16].Если происходит продолжающееся кровохарканье; требуется дальнейшее исследование, помимо грубых аномалий, выявленных на рентгенограмме грудной клетки. Оптоволоконная бронхоскопия приносит пользу пациентам с активным кровотечением в соседнем кровоточащем бронхиальном сосуде. Возможна прямая визуализация кровотечения и немедленные меры контроля, такие как прямая коагуляция или эффекты тампонады [17,18]. Аневризматические поражения требуют детальной характеристики, поэтому CTPA используется с чувствительностью 80% [19].Неопределенность диагностики может потребовать прямой ангиографии, ее использование особенно важно, когда показана артериальная эмболизация, например, у нашего пациента [17,18]. В то время как туберкулезный артериит, вызванный некротизирующими гранулематозными изменениями, играет ключевую роль в развитии, биопсия сосудов и микроскопическая визуализация нецелесообразны и неосуществимы. Успешное прекращение кровохарканья при эмболизации артерий достигает 90%, но может потребоваться повторная эмболизация. В случае неудачи может потребоваться хирургическая резекция легкого, и хотя плановая резекция может привести к летальности 18%, артериальная эмболизация является важным мостом в терапии [7,20].Была использована экстренная резекция легкого по поводу опасного для жизни кровохарканья, но смертность в этом случае достигает 40%. Таким образом, первоначальная артериальная ангиография с намерением и использованием эмболизации остается основой терапии в условиях неотложной помощи, особенно с учетом того, что она может служить мостом к окончательной терапии у пациентов со значительными периоперационными проблемами [17]. Интервенционные методы остаются основой терапии массивного кровохарканья, но в отчетах о случаях и сериях исследований подчеркивается использование лучевой терапии грудной клетки у пациентов с кровохарканьем из-за мицетомы [21], в настоящее время в Южной Африке проводятся испытания для дальнейшей валидации ее использования у неоперабельных пациентов.В условиях ограниченных ресурсов необходимые диагностические инструменты и управленческий опыт вряд ли будут доступны, смертность от нелеченого массивного кровохарканья превышает 50% [22], поэтому пациентов с массивным кровохарканьем следует реанимировать и срочно направлять в центр, где требуется диагностика. доступны методы и управленческий опыт.
Интервенционные методы остаются основой терапии массивного кровохарканья, но в отчетах о случаях и сериях исследований подчеркивается использование лучевой терапии грудной клетки у пациентов с кровохарканьем из-за мицетомы [21], в настоящее время в Южной Африке проводятся испытания для дальнейшей валидации ее использования у неоперабельных пациентов.В условиях ограниченных ресурсов необходимые диагностические инструменты и управленческий опыт вряд ли будут доступны, смертность от нелеченого массивного кровохарканья превышает 50% [22], поэтому пациентов с массивным кровохарканьем следует реанимировать и срочно направлять в центр, где требуется диагностика. доступны методы и управленческий опыт.
Archivos de Bronconeumología
Archivos de Bronconeumologia — это научный журнал, который преимущественно публикует перспективные оригинальные исследовательские статьи, содержание которых основано на результатах, касающихся нескольких аспектов респираторных заболеваний, таких как эпидемиология, патофизиология, клиники, хирургия и фундаментальные исследования.Другие типы статей, такие как обзоры, редакционные статьи, несколько специальных статей, представляющих интерес для общества и редколлегии, научные письма, письма в редакцию и клинические изображения, также публикуются в журнале. Это ежемесячный журнал, который публикует в общей сложности 12 выпусков и несколько приложений, которые содержат статьи, относящиеся к разным разделам.
Все рукописи, поступившие в Журнал, оцениваются редакторами и отправляются на экспертную рецензию, в то время как их обрабатывает редактор и / или младший редактор из группы.Журнал издается ежемесячно на испанском и английском языках. Таким образом, приветствуется подача рукописей, написанных на испанском или английском языках. Переводчики, работающие в журнале, берут на себя соответствующие переводы.
Рукописи будут представлены в электронном виде с использованием следующего веб-сайта: https://www.editorialmanager.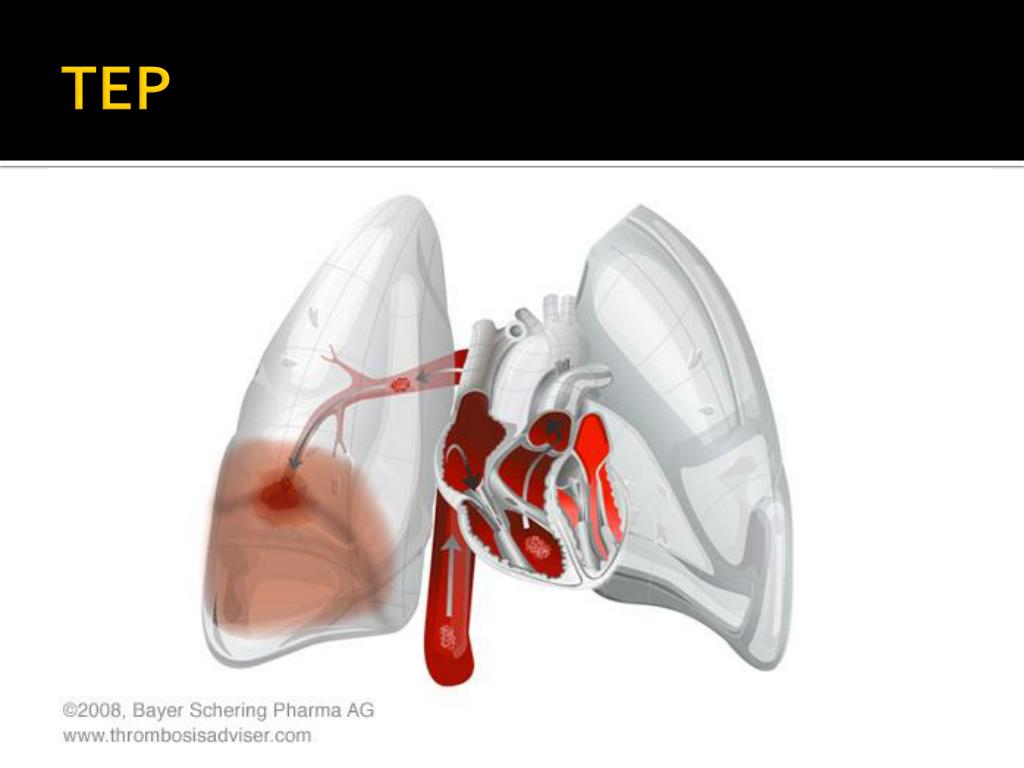 com/ARBR/, ссылка на который также доступна через главную веб-страницу Archivos de Bronconeumologia.
com/ARBR/, ссылка на который также доступна через главную веб-страницу Archivos de Bronconeumologia.
Доступ к любой опубликованной статье на любом языке возможен через веб-страницу журнала, а также из PubMed, Science Direct и других международных баз данных.Кроме того, журнал также присутствует в Twitter и Facebook. Журнал выражает голос Испанского респираторного общества пульмонологии и торакальной хирургии (SEPAR), а также других научных обществ, таких как Латиноамериканское торакальное общество (ALAT) и Иберийско-американская ассоциация торакальной хирургии (AICT).
Авторы также могут присылать свои статьи под сопутствующим заголовком журнала в открытом доступе — Open Respiratory Archives .
67-летний мужчина с массивным кровохарканьем
Этот мужчина страдает массивным кровохарканьем, которое в литературе определяется как кровохарканье, в результате чего объем откашливаемой крови составляет от 200 до 600 мл в течение 24 часов (1).Хотя смерть от кровохарканья случается редко, массивное кровохарканье представляет собой угрозу для жизни, поскольку кровь может затопить трахеобронхиальное дерево, что приведет к удушью и остановке дыхания.
В опубликованной литературе отсутствуют согласованные руководящие принципы, помогающие клиницистам оптимизировать лечение массивного кровохарканья. Несмотря на это, по общему мнению, первоначальная помощь пациенту с массивным кровохарканьем должна быть направлена на обеспечение адекватной вентиляции, защиту непораженных дыхательных путей и обеспечение стабильности гемодинамики (2).Описанный выше пациент явно страдал респираторным дистресс-синдромом, поэтому приоритетом была немедленная интубация и контроль дыхательных путей. Быстрое или безжалостное кровохарканье, нестабильность гемодинамики и гипоксемия или тяжелая одышка на фоне дополнительной подачи кислорода — все это показания для немедленной интубации. По возможности следует выбирать эндотрахеальные трубки с внутренним диаметром 8,0 мм или больше, чтобы облегчить будущую волоконно-оптическую бронхоскопию или другие процедуры. Если известна сторона кровотечения, пациента следует поместить в положение лежа на боку кровоточащей стороной вниз, чтобы защитить непораженные дыхательные пути от пролива крови.
Если известна сторона кровотечения, пациента следует поместить в положение лежа на боку кровоточащей стороной вниз, чтобы защитить непораженные дыхательные пути от пролива крови.
Методы селективной интубации дыхательных путей или использование двухпросветной эндотрахеальной трубки могут быть полезны при лечении массивного кровохарканья. Селективная интубация дыхательных путей заключается в помещении однопросветной эндотрахеальной трубки непосредственно в правый или левый главный бронх с целью вентиляции легкого без кровотечения и одновременной защиты этих дыхательных путей от пролития крови из противоположного кровоточащего легкого. Чтобы этот маневр был эффективным, необходимо знать место кровотечения.Анатомия дыхательных путей упрощает выборочную интубацию правого главного бронха по сравнению с левым. Однако интубация правой основной ствола часто приводит к обструкции верхнедолевого бронха и, как следствие, к коллапсу долей. Требуется значительный опыт в этой процедуре. Двухпросветные эндотрахеальные трубки, предназначенные для избирательной интубации правой или левой основной стволовой трубки (3), также использовались для защиты некровоточащих легких от перелива крови. Однако использование этих трубок требует наличия опытного оператора, поскольку описаны многочисленные недостатки.К ним относятся сложность установки и легкость неправильной установки при изменении положения пациента (4), а также их меньший внутрипросветный диаметр, который может предрасполагать к свертыванию крови или препятствовать прохождению бронхоскопа в будущем. Во время неотложной помощи при массивном кровохарканье и компьютерная томография, и бронхоскопия могут определить место кровоизлияния; однако у нестабильного пациента эти варианты являются вторичными по сравнению с контролем проходимости дыхательных путей. Дополнительным преимуществом бронхоскопии является возможность вмешательства посредством размещения баллонного катетера, непосредственного введения вазоактивного препарата в кровоточащий бронх (адреналин, разведенный в соотношении 1: 20 000), либо с помощью электрокаутеризации или криотерапии. По этим причинам после интубации следует срочно рассмотреть возможность проведения бронхоскопии (2, 5). Поскольку примерно 90% всех эпизодов массивного кровохарканья возникает из-за кровообращения в бронхиальной артерии, ангиография и эмболизация бронхиальной артерии также являются разумным вмешательством, которое можно использовать для остановки кровохарканья, но это следует учитывать после того, как дыхательные пути будут защищены. Наконец, пациенты с массивным кровохарканьем подвержены риску сильного кровотечения и обескровливания, хотя это бывает редко. Немедленное переливание крови следует рассматривать как начальную меру у любого гемодинамически нестабильного пациента.
По этим причинам после интубации следует срочно рассмотреть возможность проведения бронхоскопии (2, 5). Поскольку примерно 90% всех эпизодов массивного кровохарканья возникает из-за кровообращения в бронхиальной артерии, ангиография и эмболизация бронхиальной артерии также являются разумным вмешательством, которое можно использовать для остановки кровохарканья, но это следует учитывать после того, как дыхательные пути будут защищены. Наконец, пациенты с массивным кровохарканьем подвержены риску сильного кровотечения и обескровливания, хотя это бывает редко. Немедленное переливание крови следует рассматривать как начальную меру у любого гемодинамически нестабильного пациента.
Пациенту в отделении неотложной помощи проведена немедленная эндотрахеальная интубация. Рентгенограмма грудной клетки показана на рисунке 1, демонстрируя наличие эндотрахеальной трубки, а также плотные помутнения, в основном присутствующие в правой нижней и средней долях. Кроме того, наблюдаются очаговые затемнения в левой средней и нижней зонах легких. Вскоре после интубации была проведена оптоволоконная бронхоскопия, но в целом без особенностей, за исключением ярко-красной крови в правой средней и нижней долях с медленным продолжающимся кровотечением из этих областей.
Пациент в настоящее время проходит лечение от активного туберкулеза после недавнего диагноза. Хотя обширный спектр заболеваний может вызывать массивное кровохарканье (6), наиболее вероятной причиной этого пациента является туберкулез. Вышеописанный пациент — иммигрант из Эфиопии, страны с высокой распространенностью туберкулеза (7). Хотя в этом случае был известен туберкулезный статус, врачи должны иметь высокий индекс подозрения на туберкулез при уходе за пациентами с массивным кровохарканьем из стран с высокой распространенностью этого заболевания.Фактически туберкулез остается ведущей причиной кровохарканья в этих странах (1, 2, 7). Другие перечисленные варианты реже вызывают массивное кровохарканье, но имеют важное значение. Обследование любого пациента с кровохарканьем требует первоначального исключения носоглоточного или желудочно-кишечного источника кровотечения, который иногда путают с истинным кровохарканьем. У указанного выше пациента не было свидетельств этого ни в анамнезе, ни при физическом обследовании. Гранулематоз Вегенера, а также другие иммунологические заболевания, такие как синдром Гудпастура и системная красная волчанка, могут вызывать массивное кровохарканье.Эти васкулиты часто вызывают не кровохарканье, возникающее из-за поражения дыхательных путей, а альвеолярный капиллярит, приводящий к синдрому диффузного альвеолярного кровоизлияния, который не часто сопровождается массивным кровохарканьем. Наличие кожной сыпи или гематурии может указывать на наличие гранулематоза Вегенера (9, 10). Легочная эмболия обычно вызывает кровохарканье меньшего объема, но это может перерасти в массивное кровохарканье при применении тромболитиков. Наконец, бронхогенная карцинома — нечастая причина массивного кровохарканья.Однако это часто вызывает кровохарканье меньшего объема. Хотя вышеуказанный пациент курит и имеет риск рака легких, отсутствие поражения дыхательных путей при бронхоскопии в сочетании с туберкулезом в анамнезе делает этот диагноз менее вероятным.
Обследование любого пациента с кровохарканьем требует первоначального исключения носоглоточного или желудочно-кишечного источника кровотечения, который иногда путают с истинным кровохарканьем. У указанного выше пациента не было свидетельств этого ни в анамнезе, ни при физическом обследовании. Гранулематоз Вегенера, а также другие иммунологические заболевания, такие как синдром Гудпастура и системная красная волчанка, могут вызывать массивное кровохарканье.Эти васкулиты часто вызывают не кровохарканье, возникающее из-за поражения дыхательных путей, а альвеолярный капиллярит, приводящий к синдрому диффузного альвеолярного кровоизлияния, который не часто сопровождается массивным кровохарканьем. Наличие кожной сыпи или гематурии может указывать на наличие гранулематоза Вегенера (9, 10). Легочная эмболия обычно вызывает кровохарканье меньшего объема, но это может перерасти в массивное кровохарканье при применении тромболитиков. Наконец, бронхогенная карцинома — нечастая причина массивного кровохарканья.Однако это часто вызывает кровохарканье меньшего объема. Хотя вышеуказанный пациент курит и имеет риск рака легких, отсутствие поражения дыхательных путей при бронхоскопии в сочетании с туберкулезом в анамнезе делает этот диагноз менее вероятным.
Туберкулез, бронхоэктазы и абсцесс легкого, вероятно, составляли подавляющее большинство случаев кровохарканья в США в прошлом. Однако более современные данные свидетельствуют о том, что частота этих заболеваний значительно снизилась (11-13). Например, проведенное в США исследование преимущественно немассивного кровохарканья продемонстрировало ведущую этиологию как бронхит (26%), рак легких (23%), пневмонию (10%) и туберкулез (8%) (13).Другое исследование, проведенное в США, показало, что основными причинами кровохарканья являются бронхоэктазы (25%), рак легких (16%), туберкулез (12%) и aspergillus (12%) (14). Кроме того, объем откашливаемой крови может сузить дифференциальный диагноз. Например, когда кровохарканье находится в больших объемах, бронхоэктазы и нарушения свертываемости крови являются более вероятными виновниками по сравнению с кровохарканьем меньшего объема, где чаще являются причиной рака легких и бронхита (15). Два исследования массивного кровохарканья в Африке, где более высока распространенность туберкулеза, продемонстрировали, что туберкулез является основной причиной кровохарканья, а бронхоэктазы и некротическая пневмония — другими частыми причинами.В таблице 1 перечислены некоторые из многих причин массивного кровохарканья, более подробно рассмотренных в другом месте (6).
Частые причины | Редкие причины |
Туберкулез | Легочная АВМ |
Бронхоэктаз | Рак легких |
Абсцесс легкого | Легочная эмболия |
Мицетома | Митральный стеноз |
Кровоточащий диатез | Заболевание легких, вызванное иммунологическими заболеваниями (СКВ, синдром Гудпасчера) |
Таблица 1: Причины массивного кровохарканья
Продолжение дела:
Была предпринята попытка немедленной эмболизации бронхиальной артерии правой нижней доли без успешного прекращения кровотечения.Чтобы лучше определить анатомию и источник кровотечения, была сделана КТ-ангиограмма легких (рис. 2, 3).
КТ-ангиограмма легких демонстрирует правую аневризму 11 x 7 мм (рис. 2, стрелка), прилегающую к полости нижней доли. Также имеются данные о плотной консолидации правой нижней доли, а также о консолидации и полостном заболевании в левой средней и нижней зонах легких. На переформатированном корональном изображении показана аневризма (рис. 3, стрелка) как часть легочного артериального кровообращения. Аневризмы солитарной легочной артерии встречаются редко, их этиология включает травму, инфекцию, врожденные и приобретенные легочные сосудистые аномалии и легочную гипертензию.Когда деструктивная патология возникает в легком и разрушает ткани по касательной через стенку сосуда легочной артерии, среда сосуда разрушается, что приводит к выпячиванию утолщенной интимы и аневризме. Когда туберкулез легких служит этиологией этого деструктивного процесса, аневризма носит эпоним «аневризма Расмуссена» (16). Эти аневризмы часто распространяются периферически, за пределы основных легочных артерий и крупных ветвей (17). Другие ответы не соответствуют этой компьютерной томографии.
Туберкулез может вызывать кровохарканье несколькими механизмами (6). Во время активного заболевания участки полостной и / или внеполостной деструкции ткани могут быть связаны с кровотечением в различной степени. Разрыв аневризмы Расмуссена, как описано выше, является хорошо известной причиной массивного кровохарканья. Области бронхоэктазов, оставшиеся от предшествующего активного заболевания, также могут служить источником кровохарканья. Наконец, область разрешенного пневмонита от предшествующего заболевания может развиться в рубцовую карциному и служить очагом кровотечения.
Оптимальное лечение массивного кровохарканья с точки зрения окончательного лечения в настоящее время обсуждается. Исторически хирургическая резекция служила окончательным методом лечения пациентов с массивным кровохарканьем, особенно при латерализации. Ранняя консультация торакального хирурга должна оставаться приоритетом при ведении таких пациентов (2). Хотя сообщалось, что заболеваемость и смертность выше при экстренной хирургии массивного кровохарканья по сравнению со стабилизацией и более поздним плановым хирургическим вмешательством, более современные отчеты указывают на то, что неотложная операция безопасна и спасает жизнь (18, 19).Совсем недавно ангиографическая диагностика и эндоваскулярное лечение возникли как отдельный и менее инвазивный вариант. Отчеты показывают, что это безопасная и эффективная альтернатива хирургическому лечению (20-22). Однако о повторных кровотечениях сообщается в значительном меньшинстве, особенно в случаях хронического туберкулеза, мицетомы и рака (23–26). Самым серьезным осложнением этой процедуры является непреднамеренная эмболизация спинномозговой артерии, ведущая к ишемической миелопатии.

