лечение, диагностика, симптомы – Киев
Одним из характерных свойств злокачественных опухолей является их способность метастазировать — распространяться через кровь или лимфатические сосуды в другие органы и ткани, давая начало в них новым очагам роста. Продолжительность жизни пациента при большинстве злокачественных опухолей определяется процессом метастазирования.
Злокачественные опухоли печени бывают первичными (когда опухоль возникает и развивается в самой печени) и метастатическими (когда в печень попадают клетки другой опухоли). Метастазы рака в печень характерны для каждой третьей злокачественной опухоли.
Лечение
Печень является одним из основных огранов-мишеней для метастазирования, это означает, что с высокой долей вероятности пациенту одновременно с лечением первичной опухоли предстоит лечение метастазов в печень.
Тактика лечения метастазов в печень предусматривает одновременное лечение первичной опухоли и метастазов КиберНожом (радиохирургия), либо хирургическое удаление пораженных участков печени метастазами (если проводилось хирургическое лечение первичной опухоли), а также лучевую терапию. Также в качестве лечения метастазов рака в печень применяться химиотерапия.
Также в качестве лечения метастазов рака в печень применяться химиотерапия.
Хирургическое лечение метастазов в печень предусматривает использование щадящих миниинвазивных лапароскопических методик, которые позволяют избежать послеоперационных осложнений и значительно сократить период реабилитации пациента.
Наталья Лисовская, химиотерапевт
«Современная противоопухолевая терапия, которая осуществляется (в том числе, лечение иммунотерапевтическими и таргетными препаратами) в сочетании с высокоточной лучевой терапией IMRT, позволяет не только повысить эффективность лечения метастатического рака, но и улучшить показетели безрецидивности выживания пациентов после лечения», — Наталья Лисовская, кандидат медицинских наук, зав. отделением химиотерапии, клинический онколог, химиотерапевт.
КиберНож против метастазов рака в печень: преимущества радиохирургического метода лечения
Лечение метастазов в печень на единственной в Украине радиохирургической системе КиберНож
Бесконтактная дистанционная радиохирургия, которой является система КиберНож, — “золотой стандарт” лечения опухолей и новообразований небольшого размера, в особенности, единичных и множественных метастазов рака, который внесен в современные протоколы терапии онкологических заболеваний.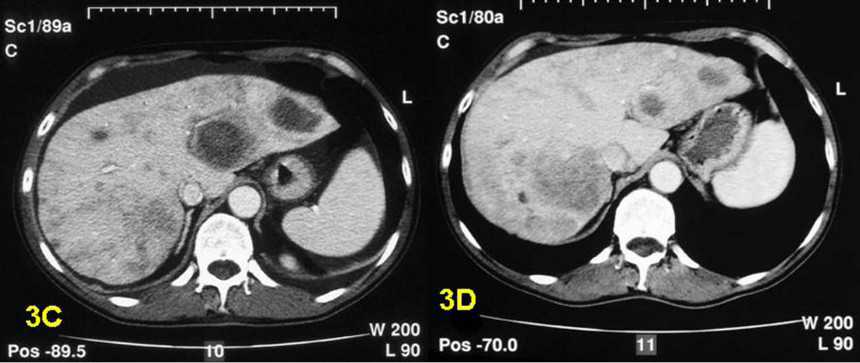
За один-два сеанса лечения высокими дозами ионизирующего излучения, которые доставляются в объем метастазов КиберНожом с точностью до 0,04 мм, происходит полное разрушение раковых клеток. Отсутствие необходимости в хирургическом удалении участков пораженной метастазами печени и связанных с оперативным вмешательством рисками / побочными эффектами лечения является главным аргументом применения радиохирургии в качестве основного метода борьбы с метастазами рака в печень.
“Лечение метастазов в печени на КиберНоже является неинвазивным, нетоксичным и безопасным воздействием на организм, которое дает возможность организму пациента восстановиться и набраться сил перед следующим этапом лечения опухолевого процесса”, – Ирина Дионисьева, врач-радиолог.
О том, как щадящее радиохирургическое лечение способствует скорейшему выздоровлению пациента, можно ознакомиться в статье врача.
Безоперационное лечение — система КиберНож
Точность роботизированной системы КиберНож позволяет создать зону высокой дозы ионизирующего облучения непосредственно в объеме каждого из метастазов.
Воздействие на здоровые ткани печени в таком случае будет минимальным — высокая доза складывается в точках пересечения множества из отдельных пучков ионизирующего излучения, которые КиберНож подает из различных положений.
Траектория каждого из пучков и их количество рассчитывается в плане лечения, который строится исходя из визуальной цифровой 3D-модели взаимного размещения опухоли и органа в организме. Кроме того, при прохождении каждого отдельного пучка излучения, которые формируют необходимую радикальную дозу в объеме метастаза, учитывается необходимость защиты других частей организма, воздействие излучения на которые нежелательно. Для таких органов и структур на цифровой модели задаются так называемые «холодные зоны», через которую исключается прохождение даже одного пучка.
Метастазы в печень — КиберНож предлагает лечение без операции
КиберНож способен обеспечить лечение до 10 метастазов в пределах одного сеанса, а само проведение радиохирургического лечения не предусматривает необходимости наркоза.
Симптомы
Метастатическое поражение печени протекает, как правило, бессимптомно. Тяжесть и боль в правом подреберье появляются лишь при распространенном опухолевом процессе.
Множественные метастазы в печени являются следствием следующих онкологических заболеваний:
В начале заболевания они не проявляют себя никаким образом. Постепенно замещая ткань печени, они снижают ее функциональные возможности. При разрушении печеночных клеток отмечается подъем уровня ферментов (АЛТ, АСТ). При массивном поражении печени может возникать желтуха, выраженная интоксикация.
Диагностика
Компьютерная томография
Применяются все известные современной медицине методы обследования организма, которые позволяют с высокой точностью диагностировать злокачественные опухоли и доброкачественные новообразования.
Наиболее достоверным методом диагностики метастазов в печень является компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). Эти методы позволяют полностью просмотреть ткань печени и детально описать все новообразования, что имеет огромное значение для лечения.
Эти методы позволяют полностью просмотреть ткань печени и детально описать все новообразования, что имеет огромное значение для лечения.
Более простым и распространенным методом диагностики метастазов в печень является ультразвуковое исследование (УЗИ). Он менее информативный, чем КТ и МРТ, однако значительно дешевле и доступнее для пациента, к тому же регулярное прохождение УЗИ в составе программ наблюдения за состоянием здоровья пациента, получившего лечение от первичной опухоли не несет нагрузки на организм, этот метод недорог и не требует занчительного времени для проведения исследования.
При наличии подозрений на распространение метастазов в печень пациенту будет предложено дополнительное исследование, в том числе КТ / МРТ. И уже на основании углубленных исследований междисциплинарный консилиум врачей будет определять тактику лечения, опираясь также на мировые протоколы.
Лечение метастаз печени в Москве, цена
Наиболее частой причиной метастатического поражения печени является колоректальный рак (рак ободочной кишки и прямой кишки)
Колоректальный рак (КРР) является четвертым по распространенности раком и второй причиной смерти от онкологических заболеваний. Риск заболеть КРР повышен среди курильщиков, а также повышается при употреблении в пищу красного мяса, мясных полуфабрикатов, при злоупотреблении алкоголем, у диабетиков, при низкой физической активности и избыточной массе тела.
Риск заболеть КРР повышен среди курильщиков, а также повышается при употреблении в пищу красного мяса, мясных полуфабрикатов, при злоупотреблении алкоголем, у диабетиков, при низкой физической активности и избыточной массе тела.
Около 25% пациентов при первичной диагностике КРР уже имеют метастазы в печени. Появление метастазов колоректального рака (КРР) в печени формально свидетельствует о переходе заболевания в 4 стадию, которая означает диссеминацию опухоли (распространение в орган или органы, не имеющие анатомических связей в первичным очагом поражения) или т.н., отдаленное метастазирование. Чаще всего метастазы появляются в печени, вторым по частоте рубежом для метастазирования являются легкие.
Выход опухолевого процесса за пределы первичной локализации опухоли и бассейна ее лимфатического дренажа представляет серьезную проблему для лечения, и до недавнего времени являлась эквивалентом потери контроля за болезнью. Пациенты с 4-ой стадией КРР до начала 90-х гг. прошлого столетия автоматически переводились в категорию инкурабельных, что означало завершение всяких попыток справиться с опухолью, как хирургическим путем, так и с помощью лекарственных препаратов. Поэтому основные усилия были направлены, прежде всего, на поиск действенных химиотерапевтических средств, которые, позволяя замедлить или остановить распространение опухоли, открывали бы перспективы для хирургического лечения. В течение прошедшей четверти века произошел постепенный, но принципиальный сдвиг в сторону повышения эффективности всех методов лечения метастатического КРР. Помимо эффективных цитостатиков (оксалиплатин, иринотекан), применяемых в составе различных режимов химиотерапии, в этот же период появилось и активно развивается новое направление лечения многих злокачественных опухолей – биологическая терапия. Этот вид лекарственного лечения подразумевает использование для борьбы с опухолью животных белков (антител), имеющих высокую способность связываться с определенными белками (рецепторами) на поверхности и внутри опухолевых клеток, тем самым блокируя важные для жизнедеятельности опухолевой клетки процессы. Чаще для обозначения этого метода лечения используется термин «таргентная» (целевая) терапия, а препараты называются таргетными.
Поэтому основные усилия были направлены, прежде всего, на поиск действенных химиотерапевтических средств, которые, позволяя замедлить или остановить распространение опухоли, открывали бы перспективы для хирургического лечения. В течение прошедшей четверти века произошел постепенный, но принципиальный сдвиг в сторону повышения эффективности всех методов лечения метастатического КРР. Помимо эффективных цитостатиков (оксалиплатин, иринотекан), применяемых в составе различных режимов химиотерапии, в этот же период появилось и активно развивается новое направление лечения многих злокачественных опухолей – биологическая терапия. Этот вид лекарственного лечения подразумевает использование для борьбы с опухолью животных белков (антител), имеющих высокую способность связываться с определенными белками (рецепторами) на поверхности и внутри опухолевых клеток, тем самым блокируя важные для жизнедеятельности опухолевой клетки процессы. Чаще для обозначения этого метода лечения используется термин «таргентная» (целевая) терапия, а препараты называются таргетными. Использование различных комбинаций новых и более старых цитостатиков с таргентными препаратами значительно повышает эффективность лекарственного лечения, а также создает запас вариантов (схем) сочетания различных лекарств, позволяя добиться эффекта при замене неработающей комбинации препаратов на более действенную.
Использование различных комбинаций новых и более старых цитостатиков с таргентными препаратами значительно повышает эффективность лекарственного лечения, а также создает запас вариантов (схем) сочетания различных лекарств, позволяя добиться эффекта при замене неработающей комбинации препаратов на более действенную.
Без преувеличения, революционные изменения в лекарственной терапии, не могли не повлиять на развитие хирургических технологий. Хирургическое лечение метастазов в печень КРР, ранее считавшееся бесперспективным направлением и ограничивавшееся удалением единичных очагов небольшого размера, постепенно развернулось в серьезную и сложную самостоятельную отрасль хирургии. Удаление метастатической опухоли на фоне эффективной химиотерапии стало золотым стандартом успешного лечения 4 стадии КРР, позволившей практически реализовать колоссальный потенциал обоих методов лечения (лекарственного и хирургического), не имевших серьезных перспектив при их раздельном использовании. Продолжительность жизни больных увеличилась кратно, а некоторых ситуациях – на порядки.
Международные консенсусные рекомендации.
В 2012 – 2013 гг. опубликованы международные консенсусные рекомендации, которые внесли ясность во многие спорные вопросы лечения пациентов с метастазаами КРР в печень.
Основные принципы этих рекомендаций заключаются в следующем:
-Выбор метода лечения пациента с метастазами КРР в печень определяет мультидисциплинарная команда, включающая онколога, хирурга и специалиста лучевой диагностики.
Сочетание резекции печени с химиотерапией при метастазах КРР улучшает выживаемость.
Резекция печени остается главной целью лечения пациента с метастазами КРР в печень, поскольку именно удаление метастазов позволяет надеяться на максимальную продолжительность жизни и выздоровление.
- Основной целью химиотерапии у больных с нерезектабельными метастазами в печень является достижение резектабельности метастазов, а не полное их исчезновение.
Поэтому длительность предоперационной химиотерапии должна максимально короткой, а резекция печени должна выполняться как можно раньше при отсутствии прогрессирования заболевания.
Химиотерапия является обязательным элементом лечения больных с резектабельными и нерезектабельными (удалимыми и неудалимыми посредством резекции печени) метастазами колоректального рака (КРР) в печень. Практически не вызывает разногласий необходимость обязательного проведения химиотерапии после резекции печени по поводу метастазов КРР. Решение вопроса о необходимости проведения химиотерапии перед операцией на печени зависит от возможности надежно удалить метастазы в пределах злоровых тканей (не оставляя опухолевую ткань, в том числе на микроскопическом уровне). При наличии такой возможности целесообразно вначале выполнить удаление метастазов, затем перейти к обязательной химиотерапии.
Очевидно, что химиотерапия является стартовым, а иногда единственным методом лечения пациентов с нерезектабельными (неудалимыми хирургическим путем) метастазами. Международные эксперты единодушны во мнении, что основной целью химиотерапии у больных с нерезектабельными метастазами в печень является достижение резектабельности метастазов, а не полное их исчезновение.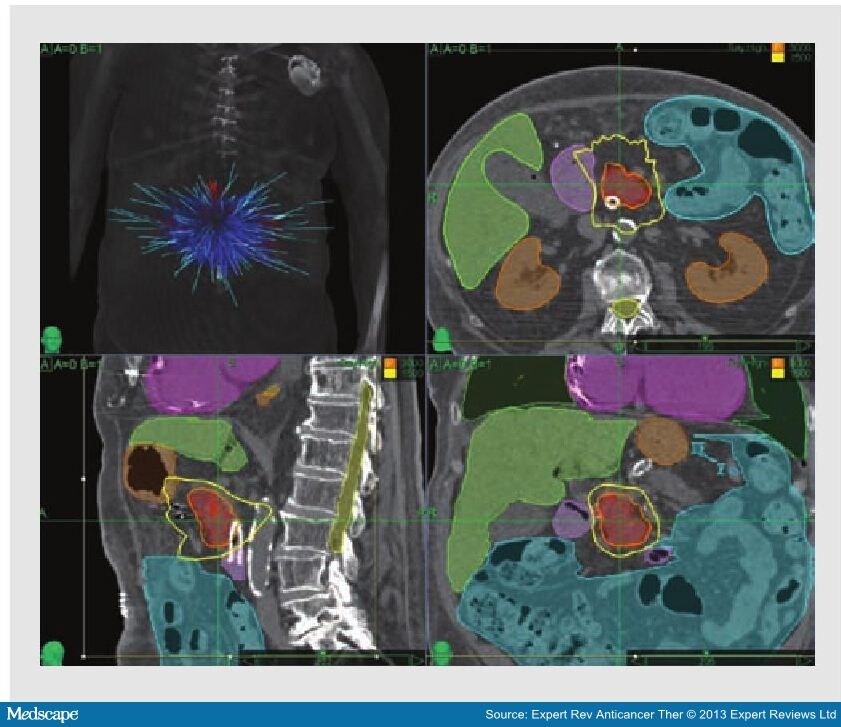
Перед началом химиотрепаии каждый пациент должен пройти изучение опухоли на наличие генетических мутаций генов KRAS, NRAS и BRAF в опухолевой ткани (изучается удаленная вместе с частью кишки опухоль).
Оптимальной признана оценка ответа на химиотерапию после 4 курсов. В случае отсутствия эффекта (рост и появление новых метастазов) после первых 4 курсов химиотерапии или при достижении только стабилизации процесса при оценке через 4 мес. рекомендуется смена препаратов 1-ой линии на 2-ю линию. Рекомендована оценка эффекта химиотерапии каждые 2 месяца.
Такая же тактика применяется у пациентов с, так называемыми, погранично резектабельными метастазами, когда хирург не может быть полностью уверен в радикальном удалении опухоли. Операция выполняется при достижении ответа на химиотерапию, заключающемся в уменьшении или стабилизации размеров метастазов.
Основные принципы лечения метастатического КРР печени.
Хирургия метастатического КРР печени претерпела существенную эволюцию за прошедшие четверть века активного внедрения новых хирургических технологий и новых лекарственных средств. Её основные принципы, суть которых более подробно изложена в последующих разделах, можно сформулировать следующим образом:
Её основные принципы, суть которых более подробно изложена в последующих разделах, можно сформулировать следующим образом:
1. Резекция печени показана при наличии резектабельных метастазов или при достижении их резектабельности в результате проведенного неоадъювантного (предоперационного) лекарственного лечения.
2. Резекция печени должна выполняться в радикальном объеме (R0). Выполнение паллиативных резекций (R1/2) нецелесообразно.
3. При наличии технической возможности резекция печени должна выполняться в органосохраняющем (тканесохраняющем) варианте. Если радикальность R0 может быть достигнута посредством сегментарной резекции, выполнение обширной резекции нецелесообразно.
4. При необходимости выполнения обширной резекции требуется тщательная оценка объема и сохранности функционального резерва будущего остатка печени. При его недостаточности показаны двухэтапные вмешательства.
5. При рецидиве заболевания и появлении новых метастазов после ранее перенесенной резекции печени целесообразно выполнять повторную резекцию печени.
6. Малоинвазивные резекции печени (лапароскопические и робот-ассистированные) не уступают в радикальности традиционным (открытым) резекциям печени и превосходят их по ближайшим результатам.
Робот-ассистированные резекции печени. Оценка ближайших результатов
International consensus statement on robotic hepatectomy surgery in 2018
7. В ряде случаев резекция печени может быть заменена малоинвазивным вмешательством – чрескожной радиочастотной термоабляцией (РЧА), которая выполняется по строгим показаниям (наличие небольшой, менее 3 см опухоли, не контактирующей с сосудами печени). Применение РЧА в других ситуациях приводит к рецидиву заболевания с ухудшением его прогноза.
Существует много детальных вопросов, которые являются предметом активного обсуждения в профессиональных сообществах. Более подробную информацию о принципах принятии решения о выборе наиболее подходящей тактики лечения в различных ситуациях можно найти на сайте клиники хирургии печени и поджелудочной железы МКНЦ (www. khirurgiyapecheni.ru).
khirurgiyapecheni.ru).
Пациентам, перенесшим хирургическое лечение по поводу метастазов КРР в печень (резекция печени и/или РЧА), рекомендуется проведение (или продолжение начатой до операции) лекарственной терапии в течение 6 мес. (около 6 курсов). Предпочтительными являются схемы с оксалиплатином (FOLFOX, CapeOX). Режим лекарственной терапии определяется онкологом-химиотерапевтом.
В течение первых 2 лет после операции на печени выполнять КТ с внутривенным контрастированием грудной клетки, брюшной полости и малого таза каждые 3-6 мес., затем в каждые 6-12 мес. в течение 5 лет.
Необходимо определение уровня в крови онкомаркера СЕА (РЭА) каждые 3-6 мес. в течение 2 лет, затем в каждые 6-12 мес. в течение 5 лет.
Колоноскопия должна быть выполнена в течение 3-6 мес. после удаления первичной опухоли, если до ее удаления полноценное эндоскопическое исследование прямой и толстой кишки не было выполнено из-за обструкции (перекрытия) просвета кишки опухолью. Если полноценная колоноскопия была выполнена до удаления первичной опухоли, рекомендуется провести это исследование повторно через 1 год, затем через 3 и 5 лет. Но колоноскопию необходимо выполнять ежегодно, если в прямой и/или толстой кишке выявлялись полипы, а также при возрасте пациента менее 50 лет.
Но колоноскопию необходимо выполнять ежегодно, если в прямой и/или толстой кишке выявлялись полипы, а также при возрасте пациента менее 50 лет.
Expanding indications for laparoscopic parenchyma-sparing resection of posterosuperior liver segments in patients with colorectal metastases: comparison with open hepatectomy for immediate and long-term outcomes
Выживаемость после лапароскопических и открытых резекций печени по поводу метастазов колоректального рака. Сравнительный анализ с использованием псевдорандомизации
можно ли обойтись без операции?
Метастазы в печень, вызванные опухолями других локализаций (метастатический рак печени, метастатическое поражение печени) встречаются гораздо чаще, чем злокачественные опухоли, развивающиеся из клеток печени (первичный рак печени). О том, как выглядит современная диагностика и лечение метастазов в печень — сегодняшний материал.
Откуда возникают метастазы в печень?
Метастазы в печень, как правило, являются гематогенными — распространяются с кровотоком от опухолей, располагающихся вблизи крупных кровеносных сосудов. После разрастания злокачественного новообразования в просвет вены или артерии, частицы опухоли начинают циркуляцию в организме. Печень — природный “фильтр”, в котором кровь очищается, замедляя скорость своего течения. Именно поэтому циркулирующие микрометастазы с высокой долей вероятности оседают в тканях органа, вызывая рост вторичной опухоли — метастаза в печени.
Какие опухоли чаще всего дают метастазы в печень?
Учитывая активную роль печени в фильтрации крови, она — распространенный “орган-мишень” для метастазов рака ряда локализаций
- рак поджелудочной железы;
- рак кишечника;
- рак желудка;
- рак молочной железы;
- рак пищевода.
Почти все из опухолей этих локализаций могут протекать скрытно даже на момент начала метастазирования, поэтому нередки случаи, когда метастазы в печень демонстрируют более выраженную симптоматику, чем первичная опухоль, и становятся поводом обращения к врачу. При обнаружении опухолевого процесса в печени, еще до проведения морфологического исследования с целью выявления типа опухолевых клеток, из которых состоит новообразование, врач, владеющий статистикой метастазирования различных видов рака в печень, получает ценный сигнал для поиска первичной опухоли — источника метастазов.
При обнаружении опухолевого процесса в печени, еще до проведения морфологического исследования с целью выявления типа опухолевых клеток, из которых состоит новообразование, врач, владеющий статистикой метастазирования различных видов рака в печень, получает ценный сигнал для поиска первичной опухоли — источника метастазов.
Симптомы метастазов в печень
Симптоматика при метастатическом раке печени, в целом, аналогична симптомам других заболеваний печени — вздутие живота, тошнота, тяжесть в правом подреберье, нарушения стула, интоксикация, слабость. Более точные симптомы зависят от размера и расположения новообразования в каждом из конкретных клинических случаев.
При лечении первичных опухолей, часто метастазирующих в печень важна не столько выраженность симптомов, сколько само их наличие. Настороженность врача и пациента к возможному возникновению симптомов поражения печени позволяет своевременно выявить и начать лечение метастазов рака в печень.
Метастазы в печень — диагностика
Повышает шансы пациентов с метастазами в печень высокая доступность такого метода регулярного контроля, как ультразвуковое исследование. УЗИ печени неинвазивно, стоит недорого, проводится быстро, обеспеченность данным видом исследований высока даже в небольших городах уровня районного центра.
УЗИ печени неинвазивно, стоит недорого, проводится быстро, обеспеченность данным видом исследований высока даже в небольших городах уровня районного центра.
Однако, при появлении симптоматики, указывающей на нарушения работы печени, которые могут быть вызваны метастазами первичной опухоли (например, рака желудка), требуется привлечение более информативных диагностических методов. Чаще всего диагностика и последующее лечение метастазов в печень требует данных компьютерной томографии (КТ), реже — магнитно-резонансной томографии (МРТ) или позитронно-эмиссионной томографии (ПЭТ).
После подтверждения наличия новообразования в органе мировые стандарты онкологии предусматривают проведение биопсии метастаза в печень (забора фрагмента новообразования) для последующего морфологического изучения, в т.ч. иммуногистохимия. Тонкоигольная биопсия печени, проводимая в зоне расположения метастаза под контролем УЗИ или КТ, позволяет дать ответ о типе и особенностях клеток, из которых состоит метастаз. Это помогает выявить источник метастазов в печень — первичную опухоль, а также указывает на дополнительную возможность для комплексной терапии — иммуногистохимия может показать чувствительность опухоли и ее метастаза в печень к таргетному лечению или иммунотерапии.
Это помогает выявить источник метастазов в печень — первичную опухоль, а также указывает на дополнительную возможность для комплексной терапии — иммуногистохимия может показать чувствительность опухоли и ее метастаза в печень к таргетному лечению или иммунотерапии.
Радикальное лечение метастазов в печень
Традиционно, метастазы в печень, независимо от типа первичного рака, удаляются хирургическим путем вместе с поврежденными опухолью структурами и тканями органа. Недостаток хирургии в качестве единственного метода радикального лечения метастазов в печень — значительная травматичность операции и ограничения по возможности ее проведения — ослабленный лечением первичной опухоли (хирургия, лучевая терапия, химиотерапия) организм зачастую не в состоянии будет выдержать еще одно вмешательство под общим наркозом.
Развитие технологий в медицине открыло пациентам с метастатическим раком печени иные виды щадящего радикального лечения:
- химиоэмболизация, заключающаяся в краткосрочном подведении к печени вместо крови препаратов химиотерапии в более высокой концентрации, чем при системном введении;
- радиочастотная абляция, представляющая собой воздействие на опухоль радиоволнами высокой частоты, что приводит к разрушению биологических тканей метастаза в печень вследствие их нагрева до значительных температур;
- таргетная терапия, воздействующая на клеточном уровне лишь на первичную опухоль и ее метастазы при условии ряда особенностей строения раковых клеток;
- иммунотерапия, основанная на природном механизме разрушения злокачественных клеток.

Радиохирургическое лечение метастазов в печень (КиберНож, TrueBeam STx и др.)
Наиболее совершенным методом радикального лечения метастазов в печень, является радиохирургия на КиберНоже. Также, радиохирургию позволяют реализовать некоторые модели современных линейных ускорителей, например, специализированный линейный ускоритель TrueBeam STx, который работает в отделении радиохирургии Онкологической клиники МИБС.
Высокая точность лечения метастазов в печень на линейном ускорителе TrueBeam STx: на плане лечения представлен предварительный расчет, который показывает, что высокую дозу получит только зона внутри синего контура, отвечающая по своей пространственной форме контуру метастаза в печени. Задача врачей задать контуры здоровых и пораженных тканей, а количество, формы и траекторию, по которым суперсовременный медицинский роботизированный комплекс подаст поля облучения, рассчитает мощнейший программный комплекс. Но контроль все равно за человеком – каждый план лечения утверждают медицинский физик и лучевой терапевт
Подводимая при радиохирургии на этих установках высокая (абляционная) доза ионизирующего излучения приводит к остановке биологических процессов в заданном объеме метастаза в печень. При этом повреждение здоровых тканей сведено к минимуму — разрезов не требуется, а требуемая доза губительного для тканей метастаза в печень излучения складывается из одиночных доз каждого из множественных тонких пучков. При этом каждый пучок излучения подается точно по заданной траектории, проходя через различные участки организма, не передавая дозы, способной нанести необратимое воздействие на здоровые ткани.
Преимущества метода радиохирургии:
- радикальность воздействия на заданный объем опухолевого поражения;
- безопасность для окружающих тканей;
- минимальная инвазивность, позволяющая проводить лечение амбулаторно;
- невысокая общая стоимость лечения, ввиду короткого срока пребывания в онкологической клинике и отсутствие потребности в реабилитации.
Точность радиохирургии на КиберНоже обеспечивается предварительным формированием цифровой пространственной модели формы и объема расположения метастаза в печени пациента. Визуальная модель, которая будет использована для задания параметров плана радиохирургии (зона высокой дозы, ее значение, зоны нулевой дозы для защиты критических органов и структур), строится на основе слияния нескольких источников диагностической информации, чаще всего, массивов снимков КТ и МРТ.
Лечение метастаза в печень, план радиохирургии на КиберНоже. Заметно, что отдельные тонкие пучки ионизирующего излучения (бирюзового цвета) пронизывают опухоль с различных сторон. При этом в зоне, в которой располагается сердце или спинной мозг, не проходит траектории ни одного луча. Зато опухолевые ткани (внутри контура салатового цвета) получают максимальную заданную дозу.
КиберНож и хирургия в лечении метастазов в печень: не конкуренты, а коллеги
Современные протоколы лечения метастатического рака печени базируются на комплексном подходе, в котором, исходя из потребностей конкретного клинического случая, сочетаются и хирургическое лечение (в том числе удаление пораженных лимфоузлов), и химиотерапия, а также лучевая терапия, радиохирургия, иммунотерапия. В таком случае врач, при условии применения щадящего метода лапароскопической хирургии, может принять решение об удалении тех метастазов, к которым имеется безопасный доступ, либо сегментов печени, пораженных значительным числом мелких метастазов.
Отделение хирургии Онкологической клиники МИБС имеет все необходимое для проведения хирургических вмешательств любой сложности, в том числе, по удалению метастазов в печень, а решение о тактике лечения принимает междисциплинарный консилиум с участием врачей-онкологов различных специальностей: клинического онколога, химиотерапевта, хирурга, лучевого терапевта, радиохирурга. Только такой подход позволяет применить любой из современных методов лечения, а не предоставляет пациенту выбор из методов, имеющихся в распоряжении конкретного онкоцентра.
Есть ли выбор эффективной тактики лечения у пациента в той клинике, где могут предложить только один вариант — радикальное хирургическое вмешательство?
КиберНож при метастазах в печень: противопоказания
Прямых противопоказаний, чтобы проводить лечение метастазов в печень КиберНожом — нет. Ограничением может являться множественное метастазирование при сравнительно небольших размерах наиболее крупных из новообразований. В таком случае противопоказаний с точки зрения медицины нет, но отсутствует финансовая целесообразность — прямого влияния на качество жизни пациента такое лечение не окажет. Также нецелесообразно проводить радиохирургию при метастазах, превышающих показатели эффективного применения системы КиберНож — как правило, семь и более сантиметров в диаметре. Но столь крупные метастазы в печень выявляются относительно редко.
Однако внимательности требует подготовка к лечению метастазов в печень на КиберНоже у пациентов с пониженной свертываемостью крови. Да, лечение КиберНожом происходит дистанционно, без контакта с организмом, но точкой “наведения” на метастаз служит метка — крошечная частица золота, которая видна на снимках системы позиционирования комплекса КиберНож. Золотые метки вводятся непосредственно в печень. Важно проводить эту процедуру одновременно с биопсией метастаза в печени (забором части новообразования для последующего морфологического анализа и контролировать показатели свертываемости крови у пациента перед началом процедуры.
Сколько стоит лечение метастазов в печень?
Оценивая стоимость лечения, особенно при сравнении программ, предлагаемых в различных онкологических центрах, следует рассматривать не только стоимость радикального лечения, но и стоимость восстановительной терапии, финансовые потери от временной потери трудоспособности, и т.д.
В случае применения КиберНожа для бесконтактного разрушения метастазов в печень более высокая стоимость лечения компенсируется отсутствием необходимости в анестезии (так как нет разрезов), нет необходимости в реабилитационных процедурах и ограничения в трудоспособности пациента (лечение выполняется амбулаторно).
При лечении за пределами своего населенного пункта, появляются затраты на проезд, перелет, проживание пациента и его сопровождающих (особенно в зарубежных клиниках), существенно увеличивает общую стоимость лечения, не гарантируя его качества.
Для жителей Санкт-Петербурга затраты на лечение в Онкологической клинике МИБС могут быть покрыты в рамках “квот”, для проживающих в других регионах России стоимость лечения может быть покрыта из бюджета регионов в случае выделения местным комитетом целевого финансирования для лечения именно в МИБС. При этом в регионах вопрос прохождения контрольного наблюдения после лечения решается проще и дешевле (без необходимости визита в Санкт-Петербург) благодаря развитой сети Диагностических центров МИБС в России и ряде соседних стран.
Насколько эффективно лечение метастазов в печень?
Современные методы терапии позволяют достичь остановки роста метастазов и даже его регресса в большинстве случаев. Однако, следует четко понимать, что лечение метастазов в печень — лишь часть задачи, которая стоит перед Вашим онкологом. Наличие метастазов говорит о распространенности процесса, и радиохирургия метастаза в печень решает только локальную проблему. А задача адекватной терапии первичной опухоли и метастазов в другие органы требует тактики комплексного лечения, определяемой при участии группы специалистов (“междисциплинарный консилиум” или “tumor-board”). Такой подход доказал свою эффективность в мировой практике и применяется в Онкологической клинике МИБС.
Вам или Вашим близким показано лечение метастазов в печень? Звоните нам сейчас!
Вторичные (метастатические) опухоли печени
Общее число больных с метастазами в печень составляет приблизительно одну треть от общего количества больных злокачественными опухолями.
В России ежегодно выявляют около 450 тысяч новых больных раком.
У значительной части из них уже имеются метастазы в печени, у других пациентов метастазы в печень могут быть выявлены в разные сроки после установления диагноза рака.
Количество всех больных с метастазами в печени в России составляет более 100 тысяч, что в десятки раз превосходит количество всех больных первичными опухолями печени и внутрипеченочных желчных протоков.
Метастазы в печень наиболее часто наблюдаются у больных с первичной опухолью толстой кишки, легких, желудка, поджелудочной железы, молочной железы. Рак желчевыводящих путей, пищевода, яичников, предстательной железы, почек, а также меланома реже поражают печень.
Чаще всего метастазы в печени повторяют строение первичных опухолей. Однако в ряде случаев метастазы отличаются от первичных опухолей по степени дифференцировки (созревания) опухолевых клеток, что затрудняет установление принадлежности первичной опухоли.
Как правило, метастатическое опухоли печени редко наблюдаются у больных циррозом печени. Это можно объяснить плохими условиями для фиксации и размножения опухолевых клеток в рубцовоизмененном органе.
Метастатический рак печени обычно характеризуется быстрым прогрессированием и отсутствием специфических лабораторных и клинических признаков.
Нарастающая слабость (36%), ухудшение аппетита, похудание (18%), неинтенсивные давящие боли (72%) в области желудка, увеличение размеров печени (22%), периодический подъем температуры (20%) — свидетельствуют о значительном поражении печени, вовлечении в процесс обеих долей органа.
Всех больных с метастазами в печени делят на две группы независимо от источников метастазирования:
- больные с единичными метастазами в печени;
- больные с множественными метастазами в печени.
(Более трех метастазов считаются множественными).
У больных с единичными метастазами симптомы заболевания напоминают проявления первичного рака печени (увеличение печени и тупые боли в правом подреберье при незначительных размерах опухоли).
У пациентов с множественными метастазами местные и общие симптомы более выражены и характеризуются нарастающей печеночной недостаточностью и осложнениями в виде механической желтухи.
У некоторых больных возникает отек нижних конечностей и расширение вен передней брюшной стенки в результате сдавления нижней полой вены. У 30% больных уже в момент установления диагноза имеется асцит (скопление жидкости в животе) за счет поражения брюшины.
Диагностика
Регулярное наблюдение и обследование больных, перенесших лечение по поводу злокачественной опухоли, позволяет относительно рано выявить метастазы в печени и провести соответствующее лечение. Прогноз (исход) заболевания лучше в случае обнаружения метастазов в печени после окончания лечения первичного рака различных локализаций по сравнению с больными, у которых метастазы выявлены в момент диагностики первичной опухоли.
Исследование иммунохимических онкомаркеров (альфа-фетопротеин — АФП, раковоэмбриональный антиген — РЭА, хорионический гонадотропин — ХГ, простатспецифический антиген — ПСА и др.) позволяет уточнить локализацию первичной опухоли.
К основным биохимическим маркерам метастатического поражения печени относятся: щелочная фосфатаза — ЩФ, трансаминазы, лактатдегидрогеназа (ЛДГ) и др.
Ультразвуковое исследование (УЗИ) позволяет решить большинство диагностических задач: размеры метастазов, связь их с крупными сосудами и протоками печени. Использование УЗИ во время операции дает возможность выявить дополнительные очаги опухоли внутри печени и помогает использовать методы местного воздействия на метастазы.
Рентгеновская компьютерная томография (РКТ) и магнитно-резонансная томография (МРТ) обычно не более эффективны, чем УЗИ, однако могут дать дополнительную полезную информацию, особенно при решении вопроса о хирургическом лечении метастазов в печени.
Пункционная биопсия (взятие кусочка ткани) печени показана в тех случаях, когда природа очагов в печени вызывает сомнения.
Ангиография (контрастное исследование сосудов) печени целесообразна при хорошо кровоснабжающихся метастазах и может помочь в уточнении локализации опухолевых очагов и их происхождении.
Всестороннее обследование позволяет решить комплекс вопросов, связанных с первичной опухолью, и определить план лечения по поводу метастатического поражения печени.
Лечение и прогноз (исход)
Лечение больных с метастазами в печень имеет особенности, отличные от лечения больных с первичными злокачественными опухолями печени и внутрипеченочных желчных протоков.
Ввиду биологических особенностей рака толстой кишки и его метастазирования, больные этой группы с метастазами в печень выделены в отдельную группу.
При хирургическом лечении метастазов рака толстой кишки большое значение придается прогностическим факторам, позволяющим судить об исходе заболевания.
К таким факторам относятся:
- характер роста опухоли (инфильтративный или нет),
- наличие фиброзной капсулы,
- инфильтрация лимфоцитами вокруг метастазов,
- поражение сосудов печени,
- врастание метастатической опухоли в окружающие печень органы и структуры,
- количество метастазов в печени,
- поражение одной или двух долей печени,
- размеры метастазов и многие другие факторы.
5-летняя выживаемость больных с метастазами рака толстой кишки в печень, перенесших частичное удаление печени, составляет 25-35%. При первично неоперабельных (неудалимых) метастазах рака толстой кишки в печени возможно проведение системной (внутривенной) и регионарной (через сосуды печени) химиотерапии. При этом после такого лечения у 15% больных удается выполнить операцию.
В первые два года у 40-60% оперированных больных может развиться рецидив (возврат) заболевания в печени. К концу третьего года без рецидива остаются около 30% оперированных больных.
К локальным методам лечения метастазов рака толстой кишки в печени относятся: радиочастотная термодеструкцая (разрушение опухоли высокой температурой), криодеструкция (уничтожение метастазов низкими температурами), введение в опухолевые узлы этанола и др.
Для системной химиотерапии больных с метастазами рака толстой кишки используют различные противоопухолевые препараты и их комбинации: фторурацил, тегафур, капецитабин, иринотекан, оскалиплатин, ралтитрексед. Эффект от химиотерапии наблюдается у 14-50% больных.
Комбинированное (сочетанное) лечение больных с метастазами рака толстой кишки в печень дает наилучшие отдаленные результаты.
Лечение метастазов других опухолей в печень
Выживаемость больных при хирургическом лечении не зависит от сроков обнаружения метастазов после удаления первичной опухоли, объема оперативных вмешательств, размеров и количества метастазов. Показатели отдаленной выживаемости лучше после резекции печени, чем при химиотерапии. Непременным условием резекции печени по поводу метастазов является полное удаление первичной опухоли. Криодеструкция, микроволновая гипертермическая коагуляция, внутриопухолевое введение этанола, уксусной кислоты, ультразвуковая фокусная, лазерная, радиочастотная термодеструкция метастазов в печени в сочетании с местной или системной химиотерапией и резекцией печени носят паллиативный характер и направлены на увеличение продолжительности жизни. Все указанные методы лечения характеризуются удовлетворительной переносимостью больными.
Комбинированное лечение
У больных с химиочувствительными метастазами в печени (рак молочной железы, рак яичка, рак яичников) оптимальным является применение операции с предварительной химиотерапией и возможной химиотерапией после операции по поводу изолированного поражения печени.
Другим вариантом лечения может быть операция в комбинации с местным воздействием (радиочастотная термодеструкция, криодеструкция, введение в опухоль этанола и др.)
Резекция печени в сочетании с внутрисосудистым назначением химиотерапии — еще один из методов лечения печеночных метастазов.
Метастазы в печени: симптомы, лечение метастаз в печени, сколько живут с метастазами печени, МТС печени
Что такое метастазы рака в печень?
Метастазами называют вторичные очаги, которые возникают, когда раковые клетки из основной, «материнской», опухоли отрываются и мигрируют с током крови или лимфы в разные части тела. Метастазы могут возникать в разных органах. Зачастую их обнаруживают в печени.
Если опухоль изначально развивается из печеночной ткани, возникает первичный рак печени. Метастатический рак называют вторичным — он всегда происходит из других органов. Большинство злокачественных опухолей печени — вторичный рак.
Мне поставили метастазы в печени с первичным очагом в кишечнике. Очень надеялся, что успеем пролечить кишечник, но не успели — я долго тянул с бумагами в другой клинике. Так вот, когда они обнаружились — у меня, естественно, опустились руки, и я уже мысленно представил себе оставшиеся недели. Благо, в современное обезболивание я верю, а в то, что с поражениями в печени можно выжить — не верилось. Так оно и было бы, если бы я не попал к доктору Пылёву. Он нашёл выход. И это меня спасло.
Показать полностью »
Не помню точное название операции — оно очень длинное, с какими-то индексами, но, по сути, как Андрей Львович объяснил мне на пальцах — на моё счастье, три очага образовались в одной доле печени. На моё несчастье — в той что больше, а значит, важнее. Просто взять и отрезать её нельзя. Оставшийся кусок не выдержит нагрузки.
Решение состояло из двух операций. Первая — он как-то перенаправил кровоток в печени таким образом, чтобы меньшая часть печени получала больше крови чем та, что больше. За счет этого, малая доля начала расти! И значит, стала принимать на себя всё больше нагрузки. Чуть меньше чем через месяц она уже была такого размера, которого хватает на почти нормальную работу печени как органа.
Второй операцией он удалил заражённую долю. И малая теперь работает в одиночку, но адаптируется к нагрузкам.
Не думал, конечно, что мне в жизни придётся обо всём этом узнать, а тем более испытать на себе. Но, как сказал доктор, ещё недавно такие операции не проводились совсем. Вот уже прошло полгода после первоначального диагноза. Я думаю, их у меня не было бы, если бы не моя удача — попасть к этим докторам.
Хватит ли вообще каких-то слов, чтобы выразить благодарность от меня и детей? Не думаю. Но всё равно, спасибо им.
Откуда раковые клетки метастазируют в печень?
Метастатический рак печени часто происходит из легких, желудка, толстой и прямой кишки, молочных желез, пищевода, поджелудочной железы.
При раке легких, желудка и колоректальном раке метастазы в печени обнаруживаются в 50% случаев, при раке груди, меланоме — в 30% случаев.
Редко в печень метастазируют злокачественные опухоли матки и яичников, глотки, полости рта, мочевого пузыря, почек. Метастазы в печени при раке головного мозга практически не встречаются.
Почему многие опухоли метастазируют в печень?
Печень — один из самых больших органов. Она выполняет важные функции: очищает кровь от токсинов, вырабатывает желчь, производит разные белки, ферменты, хранит запасы гликогена, который является источником энергии.
Через печень проходит огромное количество крови — примерно 1,5 литра в минуту. Около 30–35% крови поступает по артериям, остальные 70–75% — по воротной вене от кишечника. Внутри печени находятся особые синусоидные капилляры (синусоиды), в которых кровоток замедляется, артериальная кровь смешивается с венозной, вместе они возвращаются к сердцу по нижней полой вене.
Такая особенная система кровоснабжения печени способствует распространению раковых клеток.
Прежде чем основать собственную «колонию» — метастатическую опухоль — в печени, раковой клетке приходится проделать длинный путь. Она должна оторваться от материнской опухоли, проникнуть в кровеносный или лимфатический сосуд, совершить путешествие по организму и осесть в печеночной ткани. Она может погибнуть (и многие раковые клетки погибают) на любом этапе.
До определенного момента материнская опухоль и иммунитет сдерживают рост метастазов. Мигрировавшие раковые клетки либо неактивны, либо размножаются очень медленно. Затем начинается их бурный рост. Ученым до конца не известно, почему это происходит. По мере того как раковых клеток в метастазе становится больше, они начинают вырабатывать факторы роста, которые стимулируют рост новых сосудов, питающих опухоль.
Как проявляются метастазы рака в печень? При каких симптомах нужно обратиться к врачу?
На ранних стадиях, как и при многих злокачественных опухолях, метастазы рака в печени никак себя не проявляют. Со временем очаги увеличиваются, начинают мешать кровотоку и оттоку желчи. Работа печени нарушается, возникают различные симптомы:
- Слабость, утомляемость, снижение работоспособности.
- Снижение веса вплоть до крайней степени истощения — кахексии.
- Ухудшение аппетита вплоть до анорексии.
- Тошнота, рвота.
- Землистый цвет кожи или желтуха.
- Тупые боли под правым ребром. Чувство тяжести, распирания, давления.
- Увеличение живота из-за водянки (асцита).
- Расширенные вены под кожей живота (зачастую картина весьма характерна: вены расходятся во все стороны от пупка и напоминают «голову медузы»).
- Сосудистые звездочки на коже.
- Учащение сердцебиения.
- Повышение температуры.
- Кожный зуд.
- Нарушение работы кишечника, вздутие живота.
- Кровотечения в пищеводе.
- Гинекомастия (увеличение и нагрубание молочных желез у мужчин).
Такие расстройства встречаются не только при раке печени. Конечно, нет поводов для паники, если из этого списка вас беспокоит только слабость, повышенная температура и вздутие живота.
Самые грозные симптомы, которые должны стать поводом для немедленного визита к врачу: упорная рвота: более 1 дня, более 2-х раз в день, рвота с кровью, быстрая необъяснимая потеря веса, стул черного цвета, сильное увеличение живота, желтуха.
Метастазы в любом органе, в том числе в печени, могут стать причиной постоянных мучительных болей.
Как диагностируют метастазы рака в печень?
Обследование может включать разные исследования и анализы:
- УЗИ печени — простой и доступный метод диагностики, его часто используют для скрининга. Но он не всегда помогает найти метастазы и получить о них нужную информацию.
- Методы визуализации: мультиспиральная КТ, МРТ, ПЭТ, ангиография (исследование, во время которого в сосуды вводят контрастное вещество). Помогают не только обнаружить метастазы в печени, но и оценить их размеры, количество, расположение, характер роста, обнаружить нагноение и распад, распространение в соседние ткани и органы.
- Зачастую для того чтобы назначить эффективное лечение, врачу нужно знать, какое строение опухолевая ткань имеет на микроскопическом уровне, насколько сильно раковые клетки отличаются от нормальных. Для этого проводят биопсию: фрагмент опухолевой ткани получают при помощи иглы (тонкоигольная аспирационная биопсия) или специального инструмента — трепана (кор-биопсия, трепанобиопсия). Процедуру проводят под контролем УЗИ.
- Анализы крови, в частности, на уровень печеночных ферментов, помогают понять, насколько сильно нарушена работа печени.
«Во время биопсии в опухоль втыкают иглу. Могут ли из-за этого раковые клетки отрываться и метастазировать?»
Это миф. Биопсия не повышает риск метастазирования.
Зачастую во время обследования сначала выявляют метастазы в печени, а затем начинают искать первичную опухоль. Задачу облегчает биопсия: зная, как выглядят под микроскопом раковые клетки, врач может понять, из какого органа они происходят.
Как лечат метастазы в печени?
Тактика лечения будет зависеть от некоторых факторов:
- Количество метастазов: являются ли они одиночными или множественными.
- Тип рака.
- Выраженность нарушений работы печени и других органов.
Основные методы лечения — те же, что и при других онкологических заболеваниях. Одиночные метастазы (или несколько небольших) можно удалить хирургическим путем. Проводят долевую, сегментарную, атипичную резекцию (удаление части органа).
Назначают курсы химиотерапии, лучевой терапии.
Врачи «Евроонко» в Москве применяют современный метод лечения метастатического рака печени, который часто практикуется в зарубежных клиниках — чрескожную чреспеченочную радиочастотную аблацию (РЧА).
Результаты лечения
| 3A — метастазы рака в печени 3В — редукция опухоли после проведенной химиоэмболизации 3C — уменьшение метастазов после радиочастотной аблации (РЧА) 3D — результат терапии через 6 месяцев |
Во время процедуры в метастаз вводят специальную иглу-электрод и подают через неё радиоволны, которые уничтожают раковые клетки. В итоге происходит контролируемый асептический некроз опухоли без повреждения окружающих здоровых тканей. Это позволяет значительно повысить выживаемость и снизить риск рецидива.
РЧА уникальна тем, что её можно применять повторно, если в печени выявлены новые метастазы. Методику успешно применяют при первичном раке печени, когда одновременно имеется цирроз и высокий риск печеночной недостаточности.
Например, мы смогли добиться стойкой ремиссии и, возможно, полного выздоровления у одной пациентки, у которой был диагностирован рак молочной железы с одиночными метастазами в печени. Врачи клиники «Евроонко» в Москве выполнили радикальную мастэктомию и долевую резекцию печени, которые были дополнены курсом химиотерапии.
Также хороший результат был достигнут у пациента с раком толстой кишки и пятью небольшими метастазами в разных долях печени. Мы выполнили резекцию (удалили часть кишки), провели курс химиотерапии и радиочастотную аблацию печени.
Лечение метастазов рака в печень имеет некоторые сложности. Например, метастатический рак часто не реагирует на препараты, которые помогали против первичной опухоли. Приходится подбирать оптимальную терапию, комбинировать разные виды лечения. Плохо реагируют метастазы в печени и на системную химию. Наилучший эффект дает введение препаратов в печеночную артерию.
Химиопрепараты помогают замедлить рост метастазов, уменьшить их количество, продлить жизнь больного и избавить от мучительных симптомов. На ранних стадиях курс химиотерапии снижает риск метастазирования. В случаях, когда это необходимо, наши врачи применяют имплантируемые венозные и артериальные порт-системы, регионарную инфузию химиопрепаратов внутриартериально.
Лучевая терапия при метастазах рака в печень помогает избавиться от боли, но не увеличивает продолжительность жизни.
Таргетная терапия предусматривает использование препаратов, которые имеют конкретную «мишень» — определенную молекулу, необходимую для роста и выживания раковых клеток. При метастатическом раке печени используют единственный таргетный препарат с доказанной эффективностью — сорафениб. Он зарегистрирован более чем в 60 странах мира для лечения первичного и метастатического рака печени.
Эмболизация — перспективный метод лечения метастазов в печени и других злокачественных опухолей, который применяется в отделении интервенционной онкологии и эндоваскулярной хирургии. Суть метода состоит в том, что в сосуд, питающий опухоль, вводят специальный препарат, который нарушает приток крови.
Наиболее эффективна химиоэмболизация, когда в сосуд вводят микросферы, которые выделяют химиопрепарат. Химиоэмболизация в настоящее время — «золотой стандарт» лечения в случаях, когда не удается выполнить хирургическое удаление опухоли или трансплантацию.
Во время химиоэмболизации достигается двойной эффект. Микросферы перекрывают кровоток, лишая опухоль необходимых веществ, а выделяющийся химиопрепарат атакует опухолевые клетки.
В «Евроонко» доступны все существующие препараты для химиоэмболизации.
О возможностях современной высокотехнологичной медицины в лечении опухолей печени в программе Health Kitchen на телеканале Дождь.
Восстановление печени после удаления метастаза
Если после хирургического лечения по поводу метастазов в печени при 4 стадии рака в органе больше не обнаруживаются раковые клетки, врач порекомендует делать снимки (УЗИ, КТ или МРТ) и сдавать анализы (на уровень альфа-фетопротеина, веществ, которые характеризуют функцию печени) раз в 3–6 месяцев в течение первых двух лет, затем — раз в 6–12 месяцев. Это помогает вовремя обнаружить рецидив или возможные побочные эффекты лечения.
Ускорить восстановление печени и всего организма помогает здоровая диета, физическая активность в соответствии с рекомендациями врача.
Какие могут возникать осложнения? Когда нужны экстренные меры?
Опухоль в печени может сдавить воротную вену, нижнюю полую вену, желчные протоки. В последнем случае нарушается отток желчи. Содержащийся в ней токсичный продукт распада гемоглобина — билирубин — начинает поступать в кровь. Кожа, склеры и слизистые оболочки окрашиваются в желтый цвет — возникает механическая желтуха. Это состояние опасно тем, что билирубин токсичен для головного мозга и других органов, сильное повышение его уровня может привести к гибели. Кроме того, из-за механической желтухи невозможно выполнить операцию и провести курс химиотерапии.
Отток желчи восстанавливают хирургическим путем, под контролем УЗИ (пункционная холангиография) или рентгенотелевидения. Дренирование бывает двух видов:
- Наружное — желчь выводится наружу.
- Наружно-внутреннее: часть желчи выводится наружу, часть — в просвет кишечника.
Если опухоль сдавливает несколько желчных протоков в разных частях печени, устанавливают несколько дренажей. Врачи «Евроонко» применяют современный метод одномоментного стентирования. При этом наружный дренаж оставляют всего на 1–2 дня, либо можно обойтись вовсе без него.
Каковы прогнозы при метастазах рака в печень?
Пациентов, которые поступают в клиники «Евроонко» с таким диагнозом, в первую очередь волнует вопрос: «можно ли вылечить метастазы в печени при раке 4 стадии?». Эффективность лечения будет зависеть от типа рака, его молекулярно-генетических характеристик, местоположения и степени злокачественности опухоли. Большинство пациентов, после того как у них впервые выявлены метастазы в печени, живут в течение 6–18 месяцев. При раке толстой и прямой кишки, после больших циторедуктивных операций прогноз более благоприятен.
Если метастазы имеются не только в печени, но и в других частях тела, например, метастазы в печени и костях, прогноз ухудшается. Но и при этом возможно хирургическое лечение.
Врачи «Евроонко» имеют большой опыт в комбинированном лечении метастазов в печени. Благодаря этому мы можем существенно продлевать жизнь пациентов. Самые лучшие результаты удается получать, когда в печень метастазирует рак толстой кишки. У нас разработаны четкие критерии, руководствуясь которыми, иногда мы можем воздержаться от хирургического лечения, если очаги обнаружены в обеих долях печени. В таких случаях лечение начинается с курса химиотерапии.
Если метастазы в печени возникли при опухоли легкого, поджелудочной железы, желудка и др., удаление части печени как самостоятельный метод лечения малоэффективно, но оно может хорошо работать в сочетании с химиотерапией.
Если одновременно имеются метастазы в печени и лимфатических узлах, это существенно ухудшает прогноз. Пятилетняя выживаемость снижается примерно в два раза. Но и в этом случае все еще возможно лечение.
Где лечить метастазы печени в России?
Многие российские пациенты, столкнувшись с этим страшным диагнозом — «рак с метастазами» — считают, что это приговор, и ничего сделать уже нельзя, либо эффективную помощь получить можно, но лишь за границей. На самом деле в России доступны все современные технологии и препараты. Современную квалифицированную помощь можно получить в клиниках «Евроонко».
Мы считаем, что помочь можно всегда, и поэтому беремся за лечение пациентов с онкологическими заболеваниями на любой стадии. Наши доктора имеют большой опыт, проводят сложные инвазивные процедуры и хирургические вмешательства, химиотерапию по международным протоколам. Мы знаем, как помочь.
Список литературы:
[1] The prognostic value of tumor cells blood circulation after liver surgery for cancer lesions — Patiutko IuI, Tupitsyn NN, Sagaĭdak IV, Podluzhnyĭ DV, Pylev AL, Zabezhinskiĭ DA. — Khirurgiia (Mosk). 2011;(6): 22–6.
[2] Surgical and combined treatment of multiple and bilobar metastatic affection of the liver. — Patiutko IuI, Sagaĭdak IV, Pylev AL, Podluzhnyĭ DV. — Khirurgiia (Mosk). 2005;(6): 15–9.
[3] Современные подходы к лечению метастазов колоректального рака в печени — А. Л. Пылёв, И. В. Сагайдак, А. Г. Котельников, Д. В. Подлужный, А. Н. Поляков, Патютко Ю.И.,.. — Вестник хирургической гастроэнтерологии — Номер: 4 Год: 2008 Страницы: 14–28.
[4] Десятилетняя выживаемость больных злокачественными опухолями печени после хирургического лечения — Ю. И. Патютко, А. Л. Пылёв, И. В. Сагайдак, А. Г. Котельников, Д. В. Подлужный, М. Г. Агафонова,.. — Анналы хирургической гепатологии 2010.
[5] Surgical and combined treatment of patients with metastatic liver and lymph nodes invasion by colorectal cancer — Patiutko IuI, Pylev AL, Sagaĭdak IV, Poliakov AN, Chuchuev ES, Abgarian MG, Shishkina NA. — Khirurgiia (Mosk). 2010;(7): 49–54.
Лечение метастазов в печени, метастатического рака
Среди всех злокачественных опухолей печени наиболее распространен вторичный, или метастатический рак. Чаще всего первичная опухоль находится в одном из следующих органов:
- Толстая и прямая кишка
- Легкие
- Молочная железа
- Поджелудочная железа
- Желудок
В печень часто метастазируют нейроэндокринные опухоли, меланома. Ситуация наиболее благоприятна, когда в печени обнаружен лишь один очаг. К сожалению, чаще всего метастазов много, и бороться с ними довольно сложно. Но даже в таких случаях пациенту все еще можно помочь. Врачи могут избавить от симптомов, продлить жизнь.
Специалисты компании Меднави помогут найти врача-эксперта, который специализируется на лечении злокачественных опухолей печени. Мы сотрудничаем с лучшими российскими и зарубежными онкологическими клиниками. Свяжитесь с нами: +7 (495) 023-10-24.
Симптомы метастазов в печени
Печень — самая большая железа в организме человека, и она хорошо умеет регенерировать. Поэтому, когда часть органа поражена опухолевой тканью, он продолжает нормально функционировать, и метастазы могут долго никак себя не проявлять.
Симптомы вторичного рака печени сильно зависят от того, в какой ее части находятся опухолевые узлы, от их размеров, количества. Специфических для рака признаков нет, зачастую они напоминают проявления других заболеваний, например, гепатита, желчнокаменной болезни.
Если вас беспокоят некоторые симптомы из этого списка, если они не проходят и усиливаются со временем, нужно посетить врача:
- Тошнота и рвота.
- Снижение аппетита.
- Желтуха — когда кожа и белки глаз приобретают желтый цвет.
- Кожный зуд.
- Дискомфорт, боли в животе, под правым ребром.
- Увеличение живота.
- Отеки на ногах.
- Необъяснимая потеря веса.
- Постоянная разбитость, повышенная утомляемость.
Если эти симптомы появились у человека, у которого уже диагностирован рак, например, кишечника или легкого, подозрение в первую очередь должно пасть на метастазы в печени.
Методы диагностики метастазов
Если есть подозрение на метастазы в печени, в первую очередь врач назначит следующие методы диагностики:
- Ультразвуковое исследование помогает оценить размеры, форму, внутреннюю структуру печени, обнаружить в ней узлы. УЗИ — быстрый, простой и недорогой метод диагностики, поэтому обследование чаще всего начинают именно с него.
- Компьютерная томография позволяет получить снимки в поперечном сечении, по которым можно оценить размеры, количество, расположение опухолевых очагов, в том числе по отношению к кровеносным сосудам. КТ и УЗИ используют во время биопсии, чтобы точно направить иглу в опухоль.
- Магнитно-резонансная томография необходима в случаях, когда после КТ и УЗИ у врача все еще остаются сомнения.
- ПЭТ-сканирование — исследование, во время которого в организм вводят специальный радиофармпрепарат. Он накапливается в опухолевых клетках, в результате чего очаги становятся заметны на снимках, выполненных специальным аппаратом. В настоящее время ПЭТ — «золотой стандарт» при поиске метастазов, она позволяет проверить не только печень, но и другие органы.
Для того чтобы подтвердить наличие опухолевых клеток в узлах, прибегают к биопсии. Врач вводит в печень под контролем УЗИ или КТ иглу и получает некоторое количество опухолевой ткани. Ее отправляют в лабораторию для гистологического и цитологического исследования. Молекулярно-генетический анализ помогает правильно подобрать лечение. Биопсию печени также можно провести во время диагностической лапароскопии.
Назначают биохимический анализ крови для оценки функции печени, развернутый общий анализ крови, исследование свертываемости.
Современные методы лечения
При метастазах в печени применяют разные виды лечения, в зависимости от происхождения первичной опухоли, размеров, количества и расположения вторичных очагов, сохранности функции печени.
Хирургические вмешательства
Если в печени обнаружены небольшие единичные узлы, их можно удалить хирургически. Но такая ситуация — большое везение. Выполняют резекцию (частичное удаление печени). Это сложная операция, ее должен выполнять хирург, который специализируется на таких вмешательствах. Резекция печени может быть выполнена как через разрез, так и лапароскопически — через проколы в животе. Лапароскопические операции требуют специального оснащения, их проводят далеко не во всех клиниках.
Чаще всего резекцию печени удается выполнить при колоректальном раке.
Небольшую опухоль можно уничтожить с помощью радиочастотной аблации (сокращенно — РЧА). Во время этой процедуры в узел под контролем УЗИ или КТ вводят иглу. На нее подают ток высокой частоты, благодаря чему опухолевая ткань сильно нагревается и разрушается.
Химиотерапия
Метастазы в печени лечат теми же химиопрепаратами, что и первичную опухоль. Помимо системной (когда препарат вводят внутривенно или принимают в виде таблеток, капсул), используют и другие виды химиотерапии:
- Внутриартериальная химиотерапия предусматривает введение химиопрепаратов в печеночную артерию. Таким образом, лекарство сразу достигает опухоли, не поступая в системный кровоток. Благодаря этому можно увеличить дозу, не боясь серьезных побочных эффектов. Однако, внутриартериальная химиотерапия — достаточно сложная процедура, поэтому к ней прибегают не очень часто и не во всех клиниках.
- Химиоэмболизация — процедура, во время которой в питающий опухоль сосуд вместе с химиопрепаратом вводят эмболизирующий препарат. Последний состоит из микроскопических частиц-эмболов, которые перекрывают просвет сосуда. Опухолевые клетки лишаются кислорода и питательных веществ, это приводит к их гибели.
Гормональная терапия
Иногда, например, при некоторых типах рака молочной железы, на рост опухолевых клеток влияют гормоны. В таких случаях применяют гормональную терапию. Это могут быть препараты, которые блокируют рецепторы на поверхности раковых клеток или подавляют активность гормонов, либо хирургическое вмешательство — удаление яичников. Некоторые химиопрепараты тоже являются частью гормональной терапии, потому что они подавляют функцию женских половых желез и, как следствие, производство гормонов.
Таргетная терапия
Клетки человеческого тела «общаются» между собой с помощью особых сигнальных молекул. Когда такая сигнальная молекула соединяется с рецептором на поверхности клетки, она вызывает определенные эффекты. В раковых клетках некоторые молекулярные механизмы работают неправильно. Например, если на поверхности клетки много рецептора, она начинает бесконтрольно размножаться.
Когда ученые изучили эти процессы и поняли, что на них можно повлиять, были созданы таргетные препараты. Каждый такой препарат имеет специфическую «мишень» — блокирует определенную молекулу.
Некоторые таргетные препараты применяют при метастазах в печени:
- При колоректальном раке: цетуксимаб, бевацизумаб.
- При раке поджелудочной железы — эрлотиниб.
Таргетная терапия эффективна лишь в случаях, когда раковые клетки обладают определенными молекулярными характеристиками. Иными словами, для того чтобы препарат подействовал, в опухоли должна быть «мишень». Это выясняют с помощью молекулярно-генетического анализа.
Лучевая терапия
С классической лучевой терапией при злокачественных опухолях печени есть одна проблема. Дело в том, что печеночные клетки — гепатоциты — очень чувствительны к облучению. Из-за этого можно навредить здоровой ткани. Существуют технологии, которые помогают избежать этого риска:
- Стереотаксическая лучевая терапия. Специальный аппарат испускает несколько лучей, каждый из них слаб, но вместе они фокусируются там, где находится опухоль, раковые клетки получают большую дозу и погибают. При этом окружающая здоровая ткань практически не затрагивается.
- Радиоэмболизация. Этот метод похож на химиоэмболизацию. В печеночную артерию вводят эмболы, которые одновременно являются источником ионизирующего излучения. Облучение не проникает глубоко в ткани, поэтому почти вся доза приходится на опухоль.
Прогноз выживаемости при метастазах в печени
Нельзя точно сказать, сколько проживет человек, у которого диагностирован рак с метастазами в печени. Это зависит от многих факторов. Например, играет роль происхождение злокачественной опухоли: при раке молочной или предстательной железы средняя продолжительность жизни измеряется годами, а при раке легкого — лишь месяцами.
На какую продолжительность жизни можно рассчитывать в конкретном случае — этот вопрос лучше всего обсудить с лечащим врачом.
Конечно же, многое зависит и от возможностей, оснащения клиники. Существуют онкологи, которые специализируются на лечении рака печени — таких врачей называют гепатоонкологами. Мы подберем для вас лучших врачей-экспертов в России и за рубежом, поможем с ними связаться, попасть на лечение в клинику, где вы сможете получить наиболее эффективное лечение. Воспользуйтесь нашими знаниями и опытом, звоните +7 (495) 023-10-24.
Рак печени — еще не приговор — Российская газета
В не столь уж отдаленные времена рак печени, опухоль поджелудочной железы считались диагнозами смертельными. Потому операция не назначалась, да и никакого иного лечения фактически не предпринималось. Все ограничивалось снятием болей.
— Дело в том, что печень и поджелудочная железа — органы с очень своеобразной анатомией, — рассказывает один из ведущих хирургов-онкологов-гематологов, доктор медицинских наук, заведующий хирургическим отделением опухолей печени и поджелудочной железы Российского онкологического научного центра им. Блохина РАМН профессор Юрий Патютко. — Печень — это целая лаборатория организма. Все процессы его очистки она берет на себя. Человек может жить с одним легким, с одной почкой, без желчного пузыря, без селезенки, даже без желудка. Но как нельзя жить без сердца, так немыслимо существование без печени.
— А без поджелудочной?
— Жить можно, но не лучшим образом — развивается диабет, необходима постоянная заместительная терапия, ибо никакой другой орган не может на себя взять секреторные функции этой железы.
— Операции на этих органах очень сложны. И не так много в стране специалистов, которые их проводят. Вот вчера почти четыре часа вы оперировали 53-летнего пациента, у которого оказался распространенный рак печени, с прорастанием. Все это на фоне цирроза. Прогноз не благоприятный. И это не единственный случай. Почему вы беретесь за такие «не выигрышные» операции?
— Кто-то должен их делать. Тем более что сейчас у нас при первичном раке печени 40 процентов пятилетней выживаемости.
— А сколько было?
— Нисколько. До пятидесятых годов вовсе не проводились подобные операции.
— Однако раком печени люди страдали…
— Эта локализация не была распространенной в странах Европы. Она в основном была и остается уделом Юго-Восточной Азии и Центральной Африки. А вот теперь не исключено, что из-за появления многих страдающих гепатитами, особенно гепатитами В и С, и в нашей стране начнется рост первичного рака печени. Кстати, больной, которого вчера оперировал, тоже перенес гепатит В, причем без всяких клинических проявлений. Он даже не знал, что стал носителем вируса.
— Если я вас правильно поняла, то рак печени становится все актуальнее для россиян?
— Актуален не только сам первичный рак печени, а метастатический рак этого органа. Беда в том, что почти все злокачественные опухоли дают метастазы именно в печень. Однако даже среди медиков существует мнение, что метастатический рак печени не подлежит хирургическому вмешательству. В лучшем случае назначают химиотерапию. Чаще же всего — лишь симптоматическое лечение. А данные и нашей, и мировой статистики, ведущих клиник свидетельствуют: при единичных метастазах рака толстой кишки в печень пятилетняя выживаемость достигает пятидесяти процентов. Примерно такие же результаты дает хирургическое лечение метастазов рака почки и надпочечника в печень. При других локализациях первичной опухоли результаты хуже. Но и тут в некоторых случаях удается добиться пятилетней выживаемости.
— Что значит пятилетняя выживаемость? Это полноценная жизнь или продление мучительных страданий на пять лет?
— Качество жизни этих больных довольно высокое. Большинство из них работают. У нас просто принято приводить цифры умерших от рака и не принято обнародовать данные о тех, кто живет после нашего лечения. Нормально живет. А ведь это, наверное, главное. Вы же знаете, что до недавнего времени у нас было не принято сообщать пациенту его истинный диагноз.
— А вы, Юрий Иванович, своим пациентам говорите всю правду о характере болезни?
— В последние годы большинству больных диагноз сообщаем. Пациент должен знать, что ему, как правило, предстоит многоэтапное лечение: не только операция, но и курсы химио- и лучевой терапии. Пациент морально, да и материально должен быть к этому готов.
— Большинству. Почему не всем?
— Потому что если пациент пришел к нам с четвертой, последней, стадией опухоли, когда уже ничего сделать невозможно, когда предписывается только симптоматическое лечение, нет смысла «убивать» диагнозом.
— Вы уже 35 лет занимаетесь в Онкоцентре опухолями печени и поджелудочной железы. Ваши выводы и рекомендации?
— Важнейшие причины возникновения первичного рака печени — гепатиты и злоупотребление алкоголем. Совет тут один и совершенно банальный: меньше спиртного, стараться не заразиться и не заболеть вирусным гепатитом. Не уклоняйтесь от прививок против гепатита В. От гепатита С вакцины пока, к сожалению, нет нигде в мире.
— Вот к вам обратился пациент, у которого выявлен рак печени. Что ему предстоит?
— Прежде всего мы уточняем диагноз опухоли и степень ее распространения. Если опухоль операбельна, то начинается подготовка к серьезному оперативному вмешательству. Операция на печени, как правило, предполагает удаление ее половины — правой или левой. Печень «умеет» регенерироваться, и удаленная часть постепенно восстанавливается.
— Известно, что печень состоит из восьми сегментов, и многие хирурги во время операции удаляют один, два. А вы сторонник обширных резекций. Почему?
— Особенности распространения опухоли в печени таковы, что именно подобный объем операции позволяет добиться лучших результатов. Это подтверждено нашим опытом, включающим более пятисот операций при злокачественном поражении печени.
Очень важно, чтобы опухоль была выявлена вовремя. Как и все иные виды злокачественных опухолей, рак печени сперва не подает никаких сигналов. А уже когда сигналы есть, то это, как правило, уже третья стадия, и очень проблематичными становятся усилия специалистов. Хочу тут сказать, что, как правило, сегодня ранняя диагностика не только рака печени, но и всех иных органов не представляет больших трудностей. Единственная сложность: каждый должен осознать, что даже при полном видимом благополучии со здоровьем необходимо проходить обследование. К великому сожалению, диспансеризация, которая была когда-то, теперь не существует. А коммерциализация здравоохранения привела к тому, что порой профилактические исследования просто недоступны. Я не специалист в области организации здравоохранения. Мне сложно оценивать изменения в службе здоровья, которые намечаются в стране. Но знаю точно: профилактика, лечение — даже самые сложные, самые дорогостоящие, должны быть общедоступны. Иначе все бессмысленно. Иначе все достижения современной медицины сходят на нет.
Лечение метастазов в печени | Мемориальный онкологический центр им. Слоуна Кеттеринга
Поскольку метастазы в печень распространяются в печень из другой части тела, их может быть очень трудно лечить. Но при правильном подходе у некоторых пациентов возможна ремиссия и даже излечение.
Чтобы составить для вас наиболее эффективный план, наши эксперты по метастазам в печень тщательно изучают новейшие хирургические и интервенционные радиологические методы, включая минимально инвазивные подходы, которые часто могут уменьшить боль и время, необходимое для восстановления.
Нет двух одинаковых видов рака. Чтобы разработать для вас индивидуальный подход к лечению, мы хотим узнать о
где в вашем теле находится первичный рак
размер и количество метастазов в печени, которые у вас есть
ваше общее состояние здоровья
В целом, прогресс в хирургических подходах и стратегиях лечения увеличил продолжительность и качество жизни людей, у которых диагностированы метастазы в печени.Варианты лечения, которые мы можем рассмотреть, включают хирургическое вмешательство, интервенционную терапию под визуальным контролем, лучевую терапию, химиотерапию и таргетную терапию.
Наша цель — предоставить варианты лечения, которые дадут вам максимально возможное качество жизни и шанс на выживание. Передовые методы лечения метастазов в печени в Memorial Sloan Kettering позволяют нам:
использовать сложные методы визуализации для нацеливания и уменьшения или устранения опухолей печени без хирургического вмешательства
провести генетическое тестирование опухолей, которое даст нам информацию о молекулярной модели вашего конкретного рака.Это понимание позволяет вашей терапевтической бригаде предсказать, какие лекарства, например, химиотерапевтические препараты, могут быть для вас более эффективными.
сочетать химиотерапию печеночной артерии (HAC) с хирургическим вмешательством. Эта процедура позволяет нам доставлять лекарства непосредственно в печень через абдоминальный насос. Такой подход дал многим нашим пациентам с метастазами в печень, которые начались в толстой или прямой кишке, шанс на долгосрочное выживание и даже на излечение.
Лечение рака печени по стадиям
Хотя система стадирования AJCC (TNM) (см. Стадии рака печени) часто используется для описания распространения рака печени, врачи используют более практичную систему для определения вариантов лечения. Рак печени часто классифицируют как:
- Рак потенциально операбельный или трансплантируемый
- Неоперабельный (неоперабельный) рак, не распространившийся
- Рак запущенной стадии
Потенциально операбельный или трансплантируемый рак печени (рак I и некоторые стадии II)
Потенциально резектабельный
Если ваш рак находится на ранней стадии и остальная часть вашей печени здорова, вас может вылечить хирургическое вмешательство (частичная гепатэктомия).Лишь небольшое количество людей с раком печени попадает в эту категорию. Важными факторами, которые могут повлиять на результат, являются размер опухоли (опухолей) и поражение близлежащих кровеносных сосудов. Более крупные опухоли или опухоли, поражающие кровеносные сосуды, с большей вероятностью вернутся в печень или распространятся в другом месте после операции. Также важно, насколько хорошо работает ваша печень и ваше общее состояние здоровья. Для некоторых людей с раком печени на ранней стадии пересадка печени может быть другим вариантом.
Клинические испытания в настоящее время изучают, получат ли пациенты, перенесшие частичную гепатэктомию, другие виды лечения в дополнение к хирургическому вмешательству.Некоторые исследования показали, что использование химиоэмболизации или других методов лечения наряду с хирургическим вмешательством может помочь некоторым пациентам прожить дольше. Необходимы дополнительные исследования, чтобы узнать ценность (если таковая имеется) добавления других методов лечения к хирургии.
Возможна трансплантация
Если ваш рак находится на ранней стадии, но остальная часть вашей печени нездорова, вы можете пройти лечение с помощью трансплантации печени. Трансплантация также может быть вариантом, если опухоль находится в той части печени, которую трудно удалить (например, очень близко к большому кровеносному сосуду).Кандидатам на трансплантацию печени, возможно, придется долго ждать, пока печень станет доступной. Пока они ждут, им часто назначают другие методы лечения, такие как абляция или эмболизация, чтобы держать рак под контролем.
Неоперабельный (неоперабельный) рак печени, не распространившийся
Неоперабельные виды рака включают раковые образования, которые еще не распространились на лимфатические узлы или отдаленные части тела, но которые нельзя безопасно удалить с помощью частичной гепатэктомии. Это может быть потому, что:
- Опухоль слишком велика для безопасного удаления.
- Опухоль находится в той части печени, которую трудно удалить (например, очень близко к большому кровеносному сосуду).
- Есть несколько опухолей или рак распространился по печени.
- Человек недостаточно здоров для операции на печени.
Варианты лечения опухоли (опухолей) печени могут включать абляцию, эмболизацию или и то, и другое. Другие варианты могут включать таргетную терапию, иммунотерапию, химиотерапию (системную или путем инфузии печеночной артерии) и / или лучевую терапию.Для некоторых из этих видов рака лечение может уменьшить опухоль (опухоли) в достаточной степени, чтобы стало возможным хирургическое вмешательство (частичная гепатэктомия или трансплантация).
Эти методы лечения вряд ли помогут вылечить рак, но они могут уменьшить симптомы и даже помочь человеку прожить дольше. Поскольку эти виды рака трудно поддаются лечению, во многих случаях клинические испытания новых методов лечения могут стать хорошим вариантом.
Распространенный (метастатический) рак печени (включает все опухоли N1 или M1)
Рак печени распространился на лимфатические узлы или другие органы.Поскольку эти виды рака широко распространены, их нельзя удалить хирургическим путем.
Для людей, печень которых функционирует достаточно хорошо (класс A или B по классификации Чайлд-Пью), варианты начального лечения могут включать:
- Иммунотерапевтический препарат атезолизумаб (Тецентрик) плюс целевой препарат бевацизумаб (Авастин)
- Либо из целевых препаратов сорафениб (Нексавар), либо ленватиниб (Ленвима)
Если эти препараты больше не работают, можно использовать другие целевые препараты, такие как регорафениб (Стиварга), кабозантиниб (Кабометикс) или рамуцирумаб (Цирамза).Также могут быть полезны препараты иммунотерапии, такие как пембролизумаб (Кейтруда) или ниволумаб (Опдиво) в сочетании с ипилимумабом (Ервой).
Как и в случае неоперабельного рака печени, который не распространился, могут оказаться полезными клинические испытания новых таргетных методов лечения, иммунотерапии, новых подходов к химиотерапии (новые препараты и способы проведения химиотерапии), новых форм лучевой терапии и других новых методов лечения. Эти клинические испытания также важны для улучшения результатов для будущих пациентов.
Для облегчения боли и других симптомов также можно использовать такие виды лечения, как облучение. Обязательно обсудите любые симптомы со своей онкологической бригадой, чтобы они могли эффективно их лечить.
Рецидив рака печени
Рак, который возвращается после лечения, называется рецидивирующим . Рецидив может быть локальным (в том же месте или рядом с ним) или отдаленным (распространяться на такие органы, как легкие или кости). Лечение рака печени, который возвращается после начальной терапии, зависит от многих факторов, в том числе от того, где он возвращается, типа начального лечения и того, насколько хорошо функционирует печень.
Люди с операбельным раком, рецидивирующим в печени, могут иметь право на дальнейшую операцию или местные методы лечения, такие как абляция или эмболизация.
Если рак широко распространен, можно использовать таргетную терапию, иммунотерапию или химиотерапевтические препараты. Пациенты также могут спросить своего врача, подходит ли им клиническое испытание.
Также может быть назначено лечение для облегчения боли и других побочных эффектов. Обязательно обсудите любые симптомы со своей онкологической бригадой, чтобы их можно было эффективно вылечить.
Текущее лечение метастазов в печень при колоректальном раке
World J Gastroenterol. 2003 15 февраля; 9 (2): 193–200.
Лянь-Синь Лю, Вэй-Хуэй Чжан, Хун-Чи Цзян, отделение хирургии, Первый клинический колледж, Харбинский медицинский университет, Харбин 150001, провинция Хэйлунцзян, Китай
Вклад авторов: Все авторы внесли равный вклад в работу.
Для корреспонденции: Д-р Лянь-Синь Лю, отделение хирургии, Первый клинический колледж, Харбинский медицинский университет, No.23 Youzheng Street, Nangang District, Харбин 150001, провинция Хэйлунцзян, Китай. moc.uhos@nixnailuil
Телефон: + 86-451-3643849-5885 Факс: + 86-451-3670428
Получено 24 июля 2002 г .; Пересмотрено 4 августа 2002 г .; Принято 7 августа 2002 г.
Copyright © Автор (ы) 2003. Опубликовано Baishideng Publishing Group Inc. Все права защищены. Эта статья цитируется в других статьях PMC.
Abstract
Печень является наиболее частым местом отдаленных метастазов колоректального рака, и почти у половины пациентов с колоректальным раком в конечном итоге поражается печень во время их заболеваний.Хирургия — единственная терапия, которая дает возможность вылечить пациентов с метастатическими заболеваниями печени. Пятилетняя выживаемость после резекции всех обнаруживаемых метастазов в печень может достигать 40%. К сожалению, только 25% пациентов с колоректальными метастазами в печень являются кандидатами на резекцию печени, в то время как остальные не поддаются хирургической резекции. Пациентам с изолированными неоперабельными метастазами, но без внепеченочных заболеваний, могут быть предложены региональные методы лечения, такие как радиочастотная абляция и криотерапия.Катетерная химиотерапия печеночной артерии и химиоэмболизация и эмболизация воротной вены часто используются для пациентов с обширными метастазами в печень, но без внепеченочных заболеваний, которые не подходят для регионарной абляции. Для пациентов с метастатическим колоректальным раком вне печени системная химиотерапия является более подходящим выбором. Иммунотерапия также является хорошим вариантом, когда другие методы лечения используются в комбинации для повышения эффективности. Селективная внутренняя лучевая терапия — это новый лучевой метод, который может использоваться у пациентов, которым другие стандартные методы лечения не оказывают никакого эффекта.
ВВЕДЕНИЕ
Колоректальный рак является одной из самых распространенных солидных опухолей у человека и является причиной примерно 10% смертей от рака в западном мире [1-5]. В последнее время в Китае также увеличилась заболеваемость колоректальным раком [6-8]. Печень является наиболее частым местом отдаленных метастазов при этом заболевании, и почти у половины пациентов с колоректальным раком в конечном итоге поражается печень во время их заболевания. Лечение первичного колоректального рака с помощью хирургической резекции в сочетании с химиотерапией и лучевой терапией в некоторых случаях эффективно для многих пациентов.Но около 10-25% пациентов имели метастазы в печень на момент постановки первичного диагноза, а еще у 20-25% пациентов развились метахронные метастазы в печень [9-12].
Смерть от колоректального рака часто является результатом метастазов в печень. Более половины пациентов умерли от метастатических заболеваний печени. Хирургическая резекция отдаленных метастазов при колоректальном раке может обеспечить долгосрочное выживание и излечение у некоторых выбранных пациентов. Хирургия — единственная терапия, которая предлагает любую возможность излечения пациентов с метастатическими заболеваниями печени.Пятилетняя выживаемость после резекции всех обнаруживаемых метастазов в печени может достигать 40%. К сожалению, только 25% пациентов с колоректальными метастазами в печень являются кандидатами на резекцию печени, в то время как остальные не поддаются хирургической резекции. Ожидается, что химиотерапия и некоторые новые методы лечения увеличат время выживания неоперабельных колоректальных метастазов в печени [13-15].
В этой статье рассматривается естественная история метастазов колоректального рака в печени, оценка пациентов перед лечением, хирургическая резекция метастазов в печени, химиотерапия системной и печеночной артерии (инфузия печеночной артерии, HAC, HAI), химиоэмболизация печеночной артерии, эмболизация воротной вены, иммунотерапия и др. селективная внутриартериальная лучевая терапия (SIRT) и другие региональные методы лечения, включая криотерапию, радиочастотную абляцию (RFA).
ЕСТЕСТВЕННАЯ ИСТОРИЯ
Понимание естественной истории колоректального рака полезно для оценки ценности различных методов лечения. Приблизительно у 60% пациентов, перенесших лечебную операцию по поводу колоректального рака, разовьется местный, региональный или отдаленный рецидив. Около 85% рецидивов опухолей выявляются в течение 2,5 лет после удаления первичного колоректального рака, а остальные 15% выявляются в течение следующих 2,5 лет. Средняя выживаемость этих пациентов составила от 5 до 9 месяцев [16,17].Однако у большинства пациентов в предыдущих исследованиях были диагностированы запущенные заболевания без использования современных методов визуализации. Несколько предыдущих исследований ретроспективно определили выживаемость пациентов с потенциально невылеченными метастазами колоректального рака в печени. Было обнаружено, что пятилетняя выживаемость 0% для пациентов с нелеченными, но потенциально операбельными метастазами в печени по сравнению с пятилетней выживаемостью 28% для оперированных пациентов с резецированными метастазами в печень [18]. Другое исследование показало, что средняя выживаемость пациентов с нелечеными, но потенциально резектабельными метастазами в печени составляла 21 год.3 мес [19]. Другое исследование показало, что пациенты с нелеченным единичным метастазом в печень имели медианную выживаемость 19 месяцев, при этом ни один из пациентов не дожил до 5 лет, в то время как пациенты с удаленным единичным метастазом в печень имели медианную выживаемость 36 месяцев, при этом 25% пациентов дожили до пяти лет [20 ]. Хорошо известно, что резекция метастазов колоректального рака в печени улучшает долгосрочную выживаемость.
ПРЕДВАРИТЕЛЬНАЯ ОЦЕНКА
Синхронные метастазы в печень от колоректального рака могут быть обнаружены до операции или во время операции.При подозрении на поражение печени следует провести биопсию и направить на патологию замораживания во время операции. Метахронные метастазы в печень могут быть обнаружены после операции по поводу колоректального рака при физикальном обследовании, анализе крови и радиологической визуализации. Дальнейшая оценка пациентов с метастазами колоректального рака в печень зависит от доступных лечебных процедур. Если пациенты не подходят для операции, достаточно подтверждения наличия метастатических поражений с помощью УЗИ и компьютерной томографии, независимо от количества и размера поражений.Если пациенты являются кандидатами на хирургическую резекцию метастазов в печени, необходимо провести серию обследований, чтобы определить функцию печени и общее состояние, чтобы они могли переносить резекцию печени, чтобы точно очертить анатомию поражений, включая количество, размер и соотношение с сосудами и желчью. протоков, а также для исключения наличия внепеченочного заболевания.
Кандидаты на хирургическую резекцию метастазов колоректального рака в печени должны пройти подробный анамнез и физическое обследование, гематологическое исследование, функциональный тест печени, рентген грудной клетки, а также компьютерную томографию брюшной полости и таза.Пациентам следует пройти колоноскопию, чтобы исключить рецидив первичного колоректального рака или развитие второго первичного колоректального рака, если они еще не сделали этого в течение последних 6 месяцев. Ряд методов визуализации, включая трансабдоминальное УЗИ, компьютерную томографию, компьютерную артериопортографию (CTAP), магнитно-резонансную томографию (MRI) и позитронно-эмиссионную томографию (PET), могут предоставить информацию о метастазах в печени и внепеченочных заболеваниях [21]. При трансабдоминальном ультразвуковом исследовании печени правильно выявляется около 52–58% пациентов с метастазами в печень.Ультразвук может быть наиболее целесообразным, поскольку он самый дешевый и доступный. Но трансабдоминальное УЗИ не играет роли в предоперационной оценке потенциальных кандидатов на резекцию печени [22-24]. КТ брюшной полости в основном используется для оценки метастазов в печень, при которых изображения обычно имеют пониженную аттенюацию по сравнению с нормальной печенью. Использование внутривенного контраста увеличивает обнаруживаемость метастазов в печени, поскольку нормальная печень перфузируется в основном воротной веной, а метастазы в печень перфузируются в основном печеночной артерией.Гипоаттенуированные метастазы в печень легче распознать после внутривенного контрастирования на компьютерной томографии во время фазы воротной вены. Чувствительность спиральной КТ метастазов в печень составила 80% [25,26]. Мы часто использовали более чувствительную КТ-артериопортографию (CTAP), которая является инвазивным методом исследования метастатических поражений печени. Сначала мы поместили катетер в верхнюю брыжеечную артерию, а затем сделали КТ-изображения печени во время артериальной и портальной венозной фазы после инъекции контрастного вещества.Общая чувствительность при обнаружении метастазов в печени спиральными CTAP превышала 90%. Но при CTAP часто наблюдались нарушения перфузии и псевдоповреждения, что значительно снижает специфичность этого метода [27-29]. Магнитно-резонансная томография (МРТ) все чаще используется для диагностики и характеристики поражений печени, в частности, используются контрастные вещества, специфичные для печени, и динамическое сканирование. Одно специфическое для печени контрастное вещество, марганец-пиридоксальдифосфат (Mn-DPDP), представляет собой парамагнитный агент, который поглощается преимущественно гепатоцитами и выводится с желчью.Популярность МРТ также объясняется ее неинвазивностью в некоторых центрах [30,31]. ПЭТ — это новый метод, позволяющий сканировать все тело. В основном он используется для исключения потенциальных внепеченочных заболеваний, которые не могли быть идентифицированы другими методами до операции [32,33].
Лапароскопия обычно используется для предоперационной оценки метастатических заболеваний печени. Лапароскопия с лапароскопическим ультразвуком может быть наиболее чувствительным методом визуализации для обнаружения метастазов в печени. Лапароскопия может предотвратить лапаротомию в некоторых неоперабельных случаях с метастазами в печень, которые были признаны резектабельными до операции с помощью обычных визуализационных исследований [34].Но это все еще инвазивная процедура, требующая общей анестезии. Таким образом, лапароскопия обычно не применялась, если резектабельность поражений не определялась другими методами.
ХИРУРГИЯ
Пациенты без внепеченочных заболеваний, с хорошей функцией печени и общим состоянием являются кандидатами на хирургическую резекцию, в то время как все метастазы в печени могут быть удалены с краем не менее 1 см без опухоли. При нормальной функции печени можно удалить до 75% печени.Признание сегментарной анатомии печени привело к развитию сегментарной резекции. Это оказало особое влияние на операции по поводу колоректальных метастазов, поскольку позволяет иссечение двусторонних или множественных поражений печени, которые ранее могли считаться неоперабельными. Поэтапная резекция — еще один метод, который может быть полезен при объемных двусторонних поражениях. Фактически, одна или несколько сегментарных резекций часто могут сэкономить больше нормальной печени, чем обширная резекция, или позволить резекцию метастазов, не охватываемых традиционной большой резекцией [35–39].
Хирургическая резекция метастазов колоректального рака в печень сначала включает диагностическую лапаротомию через правый подреберный разрез. Брюшную полость исследуют на наличие признаков внепеченочного заболевания, и из подозрительных участков берут биопсию. Печень полностью мобилизуется путем рассечения поддерживающих связок и пальпируется для выявления повреждений. На этом этапе используется интраоперационное ультразвуковое исследование для выявления непальпируемых поражений и определения анатомии сосудов. Независимо от того, выполняется ли традиционная резекция печени или сегментарная резекция, цель операции — полное удаление всех метастазов с краем без опухоли не менее 1 см.Хотя существуют различные методы разделения паренхимы печени, я предпочитаю использовать ультразвуковой хирургический аспиратор при нормальной печени и комбинацию ультразвукового хирургического аспиратора и зажимного перелома при циррозе печени. Мелкие сосуды контролируются электрокоагулянтом или гемоклипсом, а крупные сосуды контролируются швами. Коагулятор с аргоновым пучком также можно использовать для достижения гемостаза в области резекции [40-42].
Методы окклюзии сосудов, в частности маневр Прингла, оказали большое влияние на минимизацию кровопотери и снижение заболеваемости, связанной с резекцией печени.Селективная окклюзия сосудов широко применяется при резекции сегмента у пациентов с ограниченной функцией печени. Полное исключение сосудов стало широко распространенным средством минимизации кровопотери при операциях на сложных поражениях. Хотя немногие хирурги обычно используют полное исключение сосудов, это метод, который облегчает иссечение поражений, затрагивающих полую вену или тех, которые лежат рядом с соединением печеночных вен и полой вены. Некоторые поражения, которые ранее считались неоперабельными, теперь можно резецировать с помощью реконструированных сегментов печеночной сосудистой структуры притока или оттока.Замена печеночной вены и полой вены аутологичной веной и протезными трансплантатами, соответственно, была выполнена с использованием полного исключения сосудов и ряда методов трансплантации печени. Использование венозного обходного анастомоза в сочетании с in situ, гипотермической перфузией и ex situ резекцией и аутотрансплантацией, оба были важными дополнениями для хирургов печени [43,44].
Операционная смертность при больших резекциях печени снизилась благодаря улучшенным оперативным методам и послеоперационному уходу, но все еще остается значительной.Операционная летальность колебалась от 0% до 7%. Причины смерти включают кровотечение, сепсис и печеночную недостаточность. Заболеваемость резекцией печени составляла от 22% до 39%, а причины заболеваемости включали кровотечение, утечку желчи или свищ, печеночную недостаточность, абсцесс вокруг печени, раневую инфекцию и пневмонию. Средняя выживаемость варьировала от 28 до 46 месяцев. Пятилетняя выживаемость составляла от 24% до 38% [45–48].
Сколько поражений слишком много при метастазах колоректального рака в печени, лежащих в основе резекции печени? Многие хирурги раньше считают четыре и более опухолей в печени противопоказанием для хирургической резекции.Но все больше авторов считают, что количество не было ограничением при резекции печени метастазов колоректального рака с использованием новых методик. Последующее наблюдение показало, что не было значительной разницы в смертности, заболеваемости и пятилетней выживаемости между пациентами, у которых поражение было больше четырех, и у пациентов меньше четырех [49].
РАДИОЧАСТОТНАЯ АБЛЯЦИЯ (RFA)
Так называемая радиочастотная термоабляция работает путем преобразования радиочастотных волн в тепло. Высокочастотный переменный ток (от 100 до 500 кГц), в основном 460 кГц, проходит от неизолированного наконечника электрода в окружающие ткани и вызывает ионную вибрацию, поскольку ионы пытаются следовать за изменением направления быстро переменного тока.Эта ионная вибрация вызывает нагревание трением тканей, окружающих электрод, а не тепло, выделяемое самим датчиком. Целью РЧА является достижение локальных температур, вызывающих разрушение тканей [50–55]. Нагревание ткани также вытесняет внеклеточную и внутриклеточную воду из ткани и приводит к дальнейшему разрушению ткани из-за коагуляционного некроза. Помимо этого, различные исследования показали, что гипертермия может вызывать ускоренную эмиграцию и миграцию мононуклеарных клеток периферической крови, активацию эффективных клеток, индукцию и секрецию цитокинов, экспрессию белков теплового шока и повышенную индукцию апоптоза [56-58].
Большинство первых сообщений об использовании РЧА для лечения метастазов колоректального рака в печени было сделано Росси в Италии. В 1996 году они сообщили о своих результатах чрескожной РЧА у 50 пациентов, из которых у 11 пациентов было 13 метастазов диаметром от 1 до 9 см. Использовались монополярные и биполярные иглы, проводились множественные вставки зондов и сеансы лечения. Связанных осложнений или летальных исходов не было. Из 11 пациентов с метастазами двое подверглись последующей хирургической резекции, у одного из них при гистопатологическом исследовании был обнаружен полный некроз опухоли.При среднем сроке наблюдения 22,6 мес. 10 (90%) из 11 пациентов были живы, двое (18%) имели местный рецидив и семь (64%) имели стойкое или отдаленное заболевание. Таким образом, только один (9%) пациент остался жив без болезней. Эти исследования показали, что, хотя РЧА эффективна в предотвращении местного рецидива метастазов, она не может влиять на прогрессирующее течение рака [59].
Wood TF сообщил о 231 опухоли у 84 пациентов, получавших 91 процедуру РЧА. У большинства пациентов были метастатические поражения (213 очагов у 73 пациентов).РЧА проводилась только в 51 из 91 лечения. Остальные 40 включали РЧА в сочетании с хирургической резекцией, криоаблацией и химиотерапией вливанием печеночной артерии. Из 91 процедуры РЧА 39 были удалены лапаротомией, 27 — лапароскопией и 25 — чрескожно. Размер опухолей от 0,3 до 9,0 см. Произошло три смерти, одна (1%) из которых была напрямую связана с процедурой РЧА. Десяти пациентам была выполнена вторая процедура РЧА (последовательные абляции). Это связано с прогрессирующими (у семи пациентов) и рецидивирующими (у трех пациентов) поражениями.Третья процедура РЧА на больших размерах была проведена одному пациенту. При среднем сроке наблюдения 9 месяцев (диапазон 1-27 месяцев) у 15 (18%) пациентов развился местный рецидив. Из оставшихся 69 пациентов 34 были живы без болезней, 14 живы с болезнями и 21 умерли. Новые опухоли печени или внепеченочные заболевания возникли у 35 пациентов. Средняя продолжительность госпитализации составила 3,6 дня [60].
Хотя РЧА имеет много преимуществ при лечении метастатических опухолей печени, она все же имеет ряд недостатков и осложнений.Эти осложнения включали симптоматический плевральный выпот, лихорадку, боль, подкожную гематому, субкапсулярную гематому печени и фибрилляцию желудочков. Серьезным осложнением является смерть, связанная с лечением. Что касается методов, связанных с опухолями, результат термоабалации RF требует навыков хирурга, выполняющего процедуру. Точное размещение абляционных игл требует значительных навыков и некоторой степени догадок со стороны радиолога и хирурга, которые могут быть наиболее опытными в интервенционных процедурах.Рецидив на границе лечения может быть результатом неспособности адекватно убить опухоль паренхимой печени, прилегающей к леченным опухолям. Обильный кровоток в воротной вене, присутствующий в нормальной паренхиме печени, действует как тепловой насос, что делает создание термического повреждения в нормальной печени более трудным, чем в опухолях печени. RF также вызывал ожог кожи при чрескожных процедурах, кровотечение, диафрагмальный некроз, абсцесс печени, повреждения печеночной артерии, повреждения желчных протоков, почечную недостаточность, коагулопатию и печеночную недостаточность, которые были тяжелыми и, в конечном итоге, смертельными [61–64].
Хотя долгосрочные наблюдения недоступны, РЧА определенно поможет хирургу и улучшит прогноз для пациентов. Но РЧА вряд ли будет излечивающим для большинства пациентов, она может облегчить симптомы пациентов и улучшить качество жизни пациентов. Было показано, что РЧА безопаснее и лучше переносится по сравнению с другими абляционными методами, такими как криотерапия, лазерная абляция и микроволновая абляция. РЧА была связана с меньшим количеством местных рецидивов.РЧА при неоперабельных опухолях печени обеспечивает относительно безопасный и высокоэффективный метод контроля местного заболевания у некоторых пациентов с метастазами в печень, которые не являются кандидатами на резекцию печени. РЧА также показала большее уважение в сочетании с хирургической резекцией, химиотерапией печеночной артерии. Наиболее интересной особенностью РЧА является минимальная инвазивность с нулевым уровнем смертности, значительно меньшее количество осложнений, меньшие затраты и количество дней в стационаре по сравнению с хирургическим вмешательством и другими видами лечения. Кроме того, в сочетании с другими процедурами РЧА улучшит выживаемость пациентов с метастазами колоректального рака в печень [65,66].
КРИОТЕРАПИЯ
Криотерапия в течение длительного времени в основном использовалась в качестве региональной терапии во всем мире [67,68]. Криотерапия печени включает в себя замораживание и оттаивание опухолей печени с помощью криозонда, вставленного в опухоли. Во время циклов замораживания / оттаивания внутриклеточное и внеклеточное образование льда происходит в области, называемой «ледяной шар», что приводит к разрушению опухоли. Криотерапия печени обычно предназначена для пациентов с метастазами в печень от колоректального рака, у которых одно или несколько поражений не подлежат хирургическому удалению.Некоторые центры предлагают криотерапию печени в качестве альтернативы хирургической резекции [69–71]. Криотерапия может лечить множественные поражения и спасти более не вовлеченную паренхиму печени, чем хирургическая резекция. Криотерапия также может использоваться для лечения опухолей, тесно связанных с крупными сосудами. Но крупные сосуды могут служить «поглотителями тепла» и препятствовать адекватному замерзанию непосредственно прилегающих опухолей. Окклюзия притока печени может снизить частоту неадекватного замораживания опухолей, прилегающих к крупным кровеносным сосудам.Криотерапия также может лечить пациентов, у которых после резекции печени остается положительный хирургический край, что называется «краевой криотерапией». Криотерапия также может применяться у пациентов, у которых основное заболевание или печеночная недостаточность препятствуют хирургической резекции [72–74].
Криотерапия печени выполняется путем разреза брюшной полости с последующим исследованием брюшной полости для поиска внепеченочных метастазов. Интраоперационное ультразвуковое исследование используется для выявления и оценки внутрипеченочных поражений [75,76].При поверхностных поражениях криозонд можно поместить в центр поражения под прямым наблюдением. При более глубоких поражениях зонд можно ввести в центр опухоли под контролем ультразвука. Иногда при больших поражениях можно использовать два или три зонда. Замораживание продолжают до тех пор, пока ледяной шар не выйдет за опухоль минимум на 1 см. Следует выполнить два или три цикла или совместить замораживание с перекрытием притока печени, чтобы увеличить деструктивный ледяной шар опухоли и отрицательный край ледяного шара в некоторых поражениях.Это также можно сделать чрескожно под контролем УЗИ и компьютерной томографии [77].
Осложнения криотерапии включают последующее кровоизлияние в замороженную печень, сбор желчи, желчный свищ, правосторонний плевральный выпот, абсцесс печени, тромбоцитопению, миоглобинурию, аритмию, острую почечную недостаточность и криошок из-за полиорганной недостаточности с ДВС-синдромом. Общая заболеваемость колеблется от 6% до 29%. Показатели смертности колеблются от 0% до 8%, при общем уровне смертности 1,6%.Средняя выживаемость варьировала от 8 до 43 месяцев. Новые или улучшенные системы доставки жидкого азота вместе с интраоперационным ультразвуком привели к значительному прогрессу в криотерапии за последние несколько лет, и ее осуществимость и безопасность в настоящее время хорошо приняты. Хотя долгосрочная выживаемость после криотерапии печени метастазов колоректального рака неясна, криотерапия печени по-прежнему является вариантом для пациентов, которые не являются кандидатами на хирургическую резекцию, но достаточны для криоабляции всех поражений.Криотерапия также является важным дополнением к хирургической резекции и приносит пользу пациентам с метастазами в печени от колоректального рака в сочетании с хирургическим вмешательством [78,79].
ХИМИОТЕРАПИЯ ГЕПАТИЧЕСКОЙ АРТЕРИИ
После резекции метастазов в печени от колоректального рака рецидив будет происходить у 60% -70% пациентов, чаще всего в печени, поэтому также требуется эффективное послеоперационное адъювантное лечение, во время которого химиотерапия является основным методом . Химиотерапия также необходима при неоперабельных метастазах в печени для поддержания выживаемости [80–83].Однако следует уточнить оптимальный режим и способ доставки. Поскольку у большинства лекарств крутая дозозависимая кривая, основной фармакокинетический принцип заключается в том, что при увеличении доставки лекарства к опухолям скорость ответа может возрасти. Таким образом, альтернативный подход к метастазам в печень заключается во внутриартериальной доставке препарата [84,85]. Катетерная химиотерапия печеночной артерии уже много лет является терапевтической возможностью для лечения неоперабельных метастазов в печени. Рациональность химиотерапии с использованием катетера печеночной артерии основана на том факте, что метастазы в печени более 1 см получают большую часть кровоснабжения из печеночной артерии.Другой рациональный вариант — высокая экстракция через печень при первом прохождении препарата, используемого для этого подхода. Оба фактора вызывают высокие локальные концентрации лекарств со сниженной системной токсичностью и позволяют применять относительно более высокие дозы по сравнению с внутривенным лечением [86,87].
В некоторых исследованиях внутриартериальная химиотерапия сравнивалась с традиционной системной химиотерапией, и они показали стабильно более высокие показатели ответа у пациентов, получающих внутриартериальную химиотерапию [88]. В Соединенном Королевстве пациенты были рандомизированы для получения внутриартериальной химиотерапии с помощью полностью имплантируемого устройства для инфузии; Пациентам другой группы была назначена системная химиотерапия.Выживаемость была значительно дольше во внутриартериальной группе (медиана выживаемости 405 дней по сравнению с 226 днями). У внутриартериальной группы также было лучшее качество жизни, чем у тех, кто получал системную химиотерапию [89]. Другие исследования показали, что частота ответа составила 43% в группе внутриартериальной химиотерапии по сравнению с 9% в группе системной химиотерапии. Кроме того, внутриартериальная группа показала значительное увеличение одногодичной выживаемости (64% против 44%) и двухлетней выживаемости (23% против 13%).Другие исследования также показали более высокую частоту ответа при внутриартериальной химиотерапии, чем при системной химиотерапии [90].
Во всех исследованиях для артериального пути введения были выбраны 5-FU и FUDR. Поскольку 84% -99% FUDR извлекается печенью при первом прохождении, казалось логичным использовать FUDR для достижения двойной цели — высоких уровней в опухоли и низких уровней в плазме, тем самым увеличивая вероятность ответа опухоли при минимизации системная токсичность [91]. Но у 55% пациентов, использующих FUDR в исследованиях Великобритании и Франции, развился внепеченочный прогресс, что позволяет предположить, что у этих пациентов могло быть скрытое внепеченочное заболевание на момент включения в исследование или во время внутриартериальной химиотерапии.Более низкий уровень лекарств в плазме был неуместен, в то время как 5-FU, который имеет более высокий уровень в плазме, чем FUDR, должен быть предпочтительным. Несмотря на то, что при HAC есть некоторые осложнения, он по-прежнему применим при метастазах в печень от колоректального рака. Большинство осложнений было связано с техникой хирургического вмешательства и уходом за пациентами [92].
Сравнение внутриартериальной химиотерапии с системной химиотерапией — важная тема, которая не решена должным образом. Некоторым группам не удалось обнаружить никаких различий в рецидивах колоректальных метастазов в печени после резекции печени среди групп, получавших системную, внутриартериальную или внутрипортальную химиотерапию.Существует множество новых агентов, таких как Кселода, которые в настоящее время оцениваются как адъювантное лечение как при первичном колоректальном раке, так и после резекции метастатических поражений печени [93-102].
ХИМОЭМБОЛИЗАЦИЯ ПЕЧЕННОЙ АРТЕРИИ
Химиоэмболизатор печеночной артерии (HACE) был разработан для лечения неоперабельных недиссеминированных опухолей печени [103,104]. Хотя HACE не продемонстрировал какого-либо улучшения выживаемости, он увеличил скорость ответа по сравнению с системным введением цитотоксических агентов.HACE изучалась в основном при лечении гепатоцеллюлярной карциномы, которая также использовалась при метастазах колоректального рака в печени в некоторых клинических исследованиях [105]. Предоперационная HACE была предложена как возможное средство уменьшения периоперационной диссеминации опухоли, но только у небольшого числа пациентов. Некоторые центры сообщили, что HACE у пациентов с пограничными резектабельными опухолями вызывал уменьшение опухоли, достаточное для проведения резекции. Рутинная HACE не привела к увеличению выживаемости у пациентов с резектабельными опухолями.Он использовался только при неоперабельных опухолях в качестве сопутствующего лечения [106,107].
ЭМБОЛИЗАЦИЯ ПОРТАЛЬНОЙ ВЕНЫ
Предоперационная эмболизация воротной вены вызвала гипертрофию нормальной печени, которая будет остаточной и снизит вероятность печеночной недостаточности, возникающей после обширной резекции печени [108,109]. Он не только в основном используется при холангиокарциноме, но иногда используется при метастазах в печень от колоректального рака. Эмболизация воротной вены может выполняться либо путем чрескожной пункции радикала воротной вены под контролем УЗИ, либо путем оперативного воздействия на подвздошно-ободочную вену для доступа к воротной вене.Это может быть выполнено не только в правой воротной вене, чтобы допустить левостороннюю гипертрофию у тех, кто получит правую гепатэктомию, но также и в левой воротной вене, чтобы разрешить правую гипертрофию у тех, кто получит расширенную левую гепатэктомию. Эмболизация воротной вены хорошо переносилась и вызывала менее тяжелую системную реакцию, чем внутриартериальная химиоэмболизация [110–113].
ИММУНОТЕРАПИЯ
Иммунотерапия в основном используется при запущенных заболеваниях, которые не поддаются лечению традиционными методами.Левамизол, неспецифический иммуностимулятор, использовался в дополнительной терапии 5-ФУ в качестве иммуномодулятора [114]. Более подробное изучение различных комбинаций может предоставить новые схемы адъювантной терапии. Некоторые ученые недавно сообщили о клинических испытаниях фазы I-II неоадъювантной иммонотерапии интерлюкином 2 перед гепатэктомией по поводу метастазов в печень колоректального рака у 19 пациентов. Предварительная обработка интерлейкином 2 предотвратила послеоперационную иммунодепрессию, наблюдаемую у контрольных пациентов [115, 116].Клинические испытания также показали, что моноклональное антитело 17-1A было эффективным в увеличении выживаемости после резекции первичных колоректальных опухолей Dukes C. Его также можно использовать в качестве адъювантного лечения до или после резекции печени при метастазах в печень колоректального рака [88,117-119].
РАДИОТЕРАПИЯ
Традиционное внешнее лучевое облучение не нашло места в лечении опухолей печени из-за особо радиочувствительной природы нормальных тканей печени, что ограничивает общую дозу 30-35 Гр [120-122].Селективная внутренняя лучевая терапия (SIRT) — это новый метод, который может быть ценным у пациентов с метастатическим колоректальным раком печени, который не подходил для резекции, RFA и криотерапии. SIRT — это метод, который позволяет облучать опухоли печени высокими средними дозами излучения в 200-300 Гр с минимальным серьезным воздействием на неопухолевую печень. Лечение включает в себя доставку обычно одной дозы микросфер иттрия в печеночную артерию, которая благодаря почти исключительному артериальному снабжению опухолей печени по сравнению с преимущественным снабжением воротной портальной системой нормальной печени, что приводит к избирательному захвату опухоли и облучению.90Иттрий является особенно подходящим изотопом для использования в медицине в этой ситуации. Как чистый бета-излучатель, его проще в обращении и использовании, чем гамма-излучатели или смешанные бета- и гамма-излучатели, такие как йод-131 [123,124]. Кроме того, для этой цели подходят его период полураспада 2,7 дня и максимальное проникновение в мягкие ткани 11 мм. Микросферы не разлагаются и имеют размер 29-35 мм, что означает, что они захвачены артериолярными капиллярами. Чтобы избежать возможного лучевого пневмонита и панкреатита, а также язвы желудка и двенадцатиперстной кишки, вызванной непреднамеренной перфузией.Размещение порта печеночной артерии особенно важно с точки зрения безопасности и эффективности. Сообщается о высокой скорости ответа и благоприятной выживаемости от SIRT для гепатоцеллюлярных и печеночных метастазов колоректального рака [125, 126].
ЗАКЛЮЧЕНИЕ
Пациенты с метастазами в печень от колоректального рака, которые потенциально могут быть хирургическими, должны быть обследованы опытными хирургами и радиологами, потому что хирургическая резекция остается лучшим методом лечения для долгосрочного выживания, хотя небольшая часть пациентов поддается резекции.Пациенты, которые не подходят для хирургической резекции и у которых нет внепеченочных заболеваний, могут рассматриваться для региональной терапии, такой как РЧА и криотерапия. Пациенты с обширными метастазами в печень, химиотерапия с использованием катетера печеночной артерии и химиоэмболизация могут рассматриваться как альтернатива системной химиотерапии. Эмболизацию воротной вены можно комбинировать при лечении пациентов с обширными метастазами. SIRT следует использовать для пациентов без внепеченочных метастазов, которым не удалось пройти курс лечения 5-ФУ и другими цитотоксическими агентами.Системную химиотерапию следует назначать пациентам с внепеченочными заболеваниями. Иммунотерапия может использоваться только для усиления эффективности комбинации противоопухолевых цитотоксических агентов.
Сноски
При поддержке Молодежного фонда естественных наук провинции Хэйлунцзян
Под редакцией Ма JY
Ссылки
1. Renehan AG, Egger M, Saunders MP, O’Dwyer ST. Влияние интенсивного наблюдения после радикальной резекции колоректального рака на выживаемость: систематический обзор и метаанализ рандомизированных исследований.BMJ. 2002; 324: 813. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Гвин К., Sinicrope FA. Химиопрофилактика колоректального рака. Am J Gastroenterol. 2002; 97: 13–21. [PubMed] [Google Scholar] 3. Айер РБ, Сильверман П.М., Дюброу Р.А., Чарнсангавей К. Визуализация в диагностике, постановке и последующем наблюдении колоректального рака. AJR Am J Roentgenol. 2002; 179: 3–13. [PubMed] [Google Scholar] 4. Джонс Л. Е., Хоулстон Р. С.. Систематический обзор и метаанализ риска семейного колоректального рака. Am J Gastroenterol. 2001; 96: 2992–3003.[PubMed] [Google Scholar] 5. Landheer ML, Therasse P, van de Velde CJ. Важность обеспечения качества в хирургической онкологии при лечении колоректального рака. Surg Oncol Clin N Am. 2001; 10: 885–914, х. [PubMed] [Google Scholar] 6. Ли XW, Ding YQ, Cai JJ, Yang SQ, An LB, Qiao DF. Исследования механизма действия антигена Сиали-Льюис-X при метастазах в печень колоректальной карциномы человека. Мир Дж. Гастроэнтерол. 2001. 7: 425–430. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Лю QZ, Tuo CW, Wang B, Wu BQ, Zhang YH.Модели метастазов колоректальной карциномы человека в печени, полученные у мышей nude с помощью ортотопической трансплантации, и их биологические характеристики. Мир Дж. Гастроэнтерол. 1998. 4: 409–411. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Ruers T, Bleichrodt RP. Лечение метастазов в печени, информация о возможностях и результатах. Eur J Cancer. 2002; 38: 1023–1033. [PubMed] [Google Scholar] 10. Биаско Дж., Галлерани Э. Лечение метастазов в печени от колоректального рака: какой подход сегодня лучше всего? Dig Liver Dis.2001; 33: 438–444. [PubMed] [Google Scholar] 11. Юн СС, Танабэ К.К. Многопрофильное лечение метастатического колоректального рака. Surg Oncol. 1998. 7: 197–207. [PubMed] [Google Scholar] 12. Cromheecke M, de Jong KP, Hoekstra HJ. Текущее лечение рака прямой кишки с метастазами в печень. Eur J Surg Oncol. 1999; 25: 451–463. [PubMed] [Google Scholar] 13. Geoghegan JG, Scheele J. Лечение колоректальных метастазов в печени. Br J Surg. 1999. 86: 158–169. [PubMed] [Google Scholar] 14. Чиаппа А., Збар А.П., Бьелла Ф., Штаудахер К.Выживаемость после повторной резекции печени по поводу рецидивирующих колоректальных метастазов. Гепатогастроэнтерология. 1999; 46: 1065–1070. [PubMed] [Google Scholar] 15. Фонг Ю., Фортнер Дж., Сан Р.Л., Бреннан М.Ф., Блюмгарт Л.Х. Клиническая оценка для прогнозирования рецидива после резекции печени по поводу метастатического колоректального рака: анализ 1001 последовательного случая. Ann Surg. 1999; 230: 309–318; обсуждение 318-321. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Luna-Perez P, Rodriguez-Coria DF, Arroyo B, Gonzalez-Macouzet J. Естественная история метастазов в печень от колоректального рака.Arch Med Res. 1998. 29: 319–324. [PubMed] [Google Scholar] 17. Heslin MJ, Medina-Franco H, Parker M, Vickers SM, Aldrete J, Urist MM. Колоректальные метастазы в печень: резекция, местная абляция и инфузионный насос печеночной артерии связаны с длительным выживанием. Arch Surg. 2001. 136: 318–323. [PubMed] [Google Scholar] 18. Уилсон С.М., Адсон М.А. Хирургическое лечение метастазов в печень колоректального рака. Arch Surg. 1976; 111: 330–334. [PubMed] [Google Scholar] 19. Вагнер Дж. С., Адсон М. А., Ван Херден Дж. А., Адсон М. Х., Ильструп Д. М..Естественная история метастазов в печень от колоректального рака. Сравнение с резективным лечением. Ann Surg. 1984; 199: 502–508. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Ванебо Х.Дж., Семоглу С., Аттье Ф., Стернс М.Дж. Хирургическое лечение пациентов с первичным операбельным колоректальным раком и синхронными метастазами в печени. Am J Surg. 1978; 135: 81–85. [PubMed] [Google Scholar] 21. Гловер С., Доус П., Кейн П., Карани Дж., Мейре Х., Мохаммадтаги С., Аллен-Мерш Т.Г. Точность исследования бессимптомных колоректальных метастазов в печени.Dis Colon Rectum. 2002. 45: 476–484. [PubMed] [Google Scholar] 22. Рыдзевски Б., Дехдашти Ф., Гордон Б.А., Тифей С.А., Страсберг С.М., Сигель Б.А. Полезность интраоперационной сонографии для выявления метастазов в печень от колоректального рака у пациентов, отобранных для операции после прохождения FDG PET. AJR Am J Roentgenol. 2002. 178: 353–358. [PubMed] [Google Scholar] 23. Грюнбергер Т., Чжао Дж., Кинг Дж., Чанг Т., Клинган П.Р., Моррис Д.Л. Эхогенность метастазов колоректальной карциномы в печень является независимым прогностическим фактором у пациентов, получавших региональную химиотерапию.Рак. 2002; 94: 1753–1759. [PubMed] [Google Scholar] 24. Cervone A, Sardi A, Conaway GL. Интраоперационное УЗИ (ВМО) имеет важное значение при лечении метастатических колоректальных поражений печени. Am Surg. 2000. 66: 611–615. [PubMed] [Google Scholar] 25. Li L, Wu PH, Mo YX, Lin HG, Zheng L, Li JQ, Lu LX, Ruan CM, Chen L. КТ артериальная портография и КТ артериография печени в выявлении микрочастиц рака печени. Мир Дж. Гастроэнтерол. 1999; 5: 225–227. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Шмидт Дж., Штротцер М., Фраунгофер С., Бёдекер Х., Цирнгибл Х.Интраоперационная ультрасонография в сравнении с спиральной компьютерной томографией и компьютерной томографией с артериопортографией в диагностике колоректальных метастазов в печени: анализ поражения за поражением. Мир J Surg. 2000; 24: 43–47; обсуждение 48. [PubMed] [Google Scholar] 27. Окано К., Ямамото Дж., Окабаяси Т., Сугавара Ю., Шимада К., Косуге Т., Ямасаки С., Фурукава Х., Мурамацу Ю. КТ-изображение интрабилиарного роста метастазов колоректальной печени: сравнение патологических результатов резецированных образцов. Br J Radiol.2002; 75: 497–501. [PubMed] [Google Scholar] 28. Валлс С., Андия Э., Санчес А., Гума А., Фигерас Дж., Торрас Дж., Серрано Т. Метастазы в печени от колоректального рака: предоперационное выявление и оценка резектабельности с помощью спиральной КТ. Радиология. 2001; 218: 55–60. [PubMed] [Google Scholar] 29. Парк Дж. Х., Назарян Л. Н., Халперн Е. Дж., Фельд Р. И., Лев-Тофф А. С., Паркер Л., Векслер Р. Дж.. Сравнение спиральной КТ без усиления и с контрастным усилением для оценки изменения интервалов у пациентов с колоректальными метастазами в печени. Acad Radiol.2001; 8: 698–704. [PubMed] [Google Scholar] 30. Zheng WW, Zhou KR, Chen ZW, Shen JZ, Chen CZ, Zhang SJ. Характеристика очаговых поражений печени с помощью МРТ с усилением SPIO. Мир Дж. Гастроэнтерол. 2002; 8: 82–86. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Уорд Дж., Наик К.С., Гатри Дж. А., Уилсон Д., Робинсон П. Дж.. Обнаружение поражения печени: сравнение МРТ после введения суперпарамагнитного оксида железа с двухфазной КТ с использованием анализа рабочих характеристик приемника без альтернативных ответов.Радиология. 1999; 210: 459–466. [PubMed] [Google Scholar] 32. Zealley IA, Skehan SJ, Rawlinson J, Coates G, Nahmias C, Somers S. Отбор пациентов для резекции метастазов в печени: улучшенное выявление внепеченочных заболеваний с помощью FDG pet. Рентгенография. 2001; 21 Номер спецификации: S55 – S69. [PubMed] [Google Scholar] 33. Бойкин К.Н., Зибари Г.Б., Лилиен Д.Л., Макмиллан Р.В., Оултман Д.Ф., Макдональд Дж. К.. Использование ФДГ-позитронно-эмиссионной томографии для оценки колоректальных метастазов в печени. Am Surg. 1999; 65: 1183–1185.[PubMed] [Google Scholar] 34. Фигерас Дж., Валлс С. Использование лапароскопической ультрасонографии в предоперационном исследовании пациентов с колоректальными метастазами в печени. Ann Surg. 2000; 232: 721–723. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Петровски Х., Гонен М., Ярнагин В., Лоренц М., ДеМаттео Р., Генрих С., Энке А., Блюмгарт Л., Фонг Ю. Вторая резекция печени — безопасное и эффективное лечение рецидивирующих метастазов в печень от колоректального рака: двухинституциональный анализ. Ann Surg. 2002; 235: 863–871.[Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Малафосс Р., Пенна С., Са Кунья А., Нордлингер Б. Хирургическое лечение метастазов в печени от колоректальных злокачественных новообразований. Энн Онкол. 2001; 12: 887–894. [PubMed] [Google Scholar] 38. Рис М., Джон Т.Г. Текущее состояние хирургии колоректальных метастазов в печень. Гепатогастроэнтерология. 2001; 48: 341–344. [PubMed] [Google Scholar] 40. Роджерс MS, Макколл JL. Хирургия колоректальных метастазов в печень с поражением печеночных лимфатических узлов: систематический обзор. Br J Surg.2000; 87: 1142–1155. [PubMed] [Google Scholar] 41. Fiorentini G, Poddie DB, De Giorgi U, Guglielminetti D, Giovanis P, Leoni M, Latino W, Dazzi C, Cariello A, Turci D и др. Глобальный подход к метастазам в печень от колоректального рака: показания и результаты внутриартериальной химиотерапии и других методов лечения, направленных на печень. Med Oncol. 2000. 17: 163–173. [PubMed] [Google Scholar] 42. Ямагути Дж., Ямамото М., Комута К., Фуджиока Х., Фуруи Дж. И., Канемацу Т. Резекции печени при метастазах в печень с двухстворчатыми стенками колоректального рака.J Hepatobilation Pancreat Surg. 2000; 7: 404–409. [PubMed] [Google Scholar] 43. Bozzetti F, Bignami P, Baratti D. Хирургические стратегии при метастатическом колоректальном раке в печень. Тумори. 2000; 86: 1–7. [PubMed] [Google Scholar] 44. Bozzetti F, Bignami P. Рекомендации по хирургическому лечению колоректальных метастазов в печени. Энн Онкол. 2000; 11: 243–244. [PubMed] [Google Scholar] 45. Choti MA, Sitzmann JV, Tiburi MF, Sumetchotimetha W, Rangsin R, Schulick RD, Lillemoe KD, Yeo CJ, Cameron JL. Тенденции долгосрочной выживаемости после резекции печени по поводу метастазов колоректального рака в печень.Ann Surg. 2002. 235: 759–766. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Болтон Дж. С., Фурман Г. М.. Выживаемость после резекции множественных двулопастных метастазов в печень колоректальной карциномы. Ann Surg. 2000; 231: 743–751. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Lorenz M, Staib-Sebler E, Hochmuth K, Heinrich S, Gog C, Vetter G, Encke A, Müller HH. Хирургическая резекция метастазов колоректальной карциномы в печень: краткосрочные и отдаленные результаты. Семин Онкол. 2000. 27: 112–119. [PubMed] [Google Scholar] 49.Моррис DL. Операция при метастазах в печень: сколько. ANZ J Surg. 2002; 72: 2. [PubMed] [Google Scholar] 51. Вуд Б.Дж., Рамкарансингх-младший, Фоджо Т., Вальтер М.М., Либутти СК. Чрескожная абляция опухоли с помощью радиочастоты. Рак. 2002; 94: 443–451. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Парих А.А., Керли С.А., Форнаж Б.Д., Эллис Л.М. Радиочастотная абляция метастазов в печени. Семин Онкол. 2002. 29: 168–182. [PubMed] [Google Scholar] 53. Чой Х., Лойер Е.М., Дюброу Р.А., Каур Х., Дэвид К.Л., Хуанг С., Керли С., Чарнсангавей К.Радиочастотная абляция опухолей печени: оценка терапевтического ответа и осложнений. Рентгенография. 2001; 21 Номер спецификации: S41 – S54. [PubMed] [Google Scholar] 54. Гольдберг С.Н. Радиочастотная абляция опухолей: принципы и методы. Eur J Ultrasound. 2001. 13: 129–147. [PubMed] [Google Scholar] 55. Лю CL, Fan ST. Нерезекционные методы лечения гепатоцеллюлярной карциномы. Am J Surg. 1997. 173: 358–365. [PubMed] [Google Scholar] 56. Бускарини Л., Бускарини Э., Ди Стази М., Валлиса Д., Кваретти П., Рокка А. Чрескожная радиочастотная абляция небольшой гепатоцеллюлярной карциномы: долгосрочные результаты.Eur Radiol. 2001; 11: 914–921. [PubMed] [Google Scholar] 57. Hager ED, Dziambor H, Höhmann D, Gallenbeck D, Stephan M, Popa C. Глубокая гипертермия с радиочастотой у пациентов с метастазами в печень от колоректального рака. Anticancer Res. 1999; 19: 3403–3408. [PubMed] [Google Scholar] 58. Росси С., Ди Стази М., Бускарини Э., Кваретти П., Гарбагнати Ф., Сквассанте Л., Пациес СТ, Сильверман Д. Е., Бускарини Л. Чрескожная интерстициальная термоабляция RF при лечении рака печени. AJR Am J Roentgenol.1996. 167: 759–768. [PubMed] [Google Scholar] 59. Wood TF, Rose DM, Chung M, Allegra DP, Foshag LJ, Bilchik AJ. Радиочастотная абляция 231 неоперабельной опухоли печени: показания, ограничения и осложнения. Энн Сург Онкол. 2000. 7: 593–600. [PubMed] [Google Scholar] 60. Солбиати Л., Иераче Т., Тонолини М., Ости В., Кова Л. Радиочастотная термическая абляция метастазов в печени. Eur J Ultrasound. 2001; 13: 149–158. [PubMed] [Google Scholar] 61. Machi J. Радиочастотная абляция множественных метастазов в печени.Энн Сург Онкол. 2001; 8: 379–380. [PubMed] [Google Scholar] 62. Бильчик А.Ю., Вуд Т.Ф., Аллегра Д.П. Радиочастотная абляция неоперабельных злокачественных новообразований печени: извлеченные уроки. Онколог. 2001; 6: 24–33. [PubMed] [Google Scholar] 63. Вонг С.Л., Эдвардс М.Дж., Чао С., Симпсон Д., Макмастерс К.М. Радиочастотная абляция при неоперабельных опухолях печени. Am J Surg. 2001. 182: 552–557. [PubMed] [Google Scholar] 64. Пирсон А.С., Иззо Ф., Флеминг Р.Й., Эллис Л.М., Дельрио П., Ро М.С., Гранчи Дж., Керли С.А. Интраоперационная радиочастотная абляция или криоабляция при злокачественных новообразованиях печени.Am J Surg. 1999; 178: 592–599. [PubMed] [Google Scholar] 65. Curley SA, Izzo F, Delrio P, Ellis LM, Granchi J, Vallone P, Fiore F, Pignata S, Daniele B, Cremona F. Радиочастотная абляция неоперабельных первичных и метастатических злокачественных новообразований печени: результаты у 123 пациентов. Ann Surg. 1999; 230: 1–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Гилламс А. Р., Лис В. Р.. Выживаемость после чрескожной термической абляции метастазов в печени при колоректальном раке под визуальным контролем. Dis Colon Rectum. 2000; 43: 656–661.[PubMed] [Google Scholar] 67. Сотский Т.К., Равикумар Т.С. Криотерапия в лечении метастазов в печень колоректального рака. Семин Онкол. 2002; 29: 183–191. [PubMed] [Google Scholar] 68. Зайферт Дж. К., Ахенбах Т., Хайнц А., Бёттгер Т. К., Юнгингер Т. Криотерапия метастазов в печень. Int J Colorectal Dis. 2000. 15: 161–166. [PubMed] [Google Scholar] 69. Нилман Н., Воббс Т., Ягер Г.Дж., Руерс Т.Дж. Криохирургия как метод лечения колоректальных метастазов в печени. Гепатогастроэнтерология. 2001. 48: 325–329. [PubMed] [Google Scholar] 70.Ruers TJ, Jager GJ, Wobbes T. Криохирургия колоректальных метастазов в печени. Семин Онкол. 2000. 27: 120–125. [PubMed] [Google Scholar] 71. Sikma MA, Coenen JL, Kloosterziel C, Hasselt BA, Ruers TJ. Прорыв в криохирургии. Surg Endosc. 2002; 16: 870. [PubMed] [Google Scholar] 72. Финлей И.Г., Зайферт Дж. К., Стюарт Дж. Дж., Моррис Д. Л.. Резекция колоректальных метастазов в печени с криотерапией имеет такую же выживаемость, как и только резекция печени. Eur J Surg Oncol. 2000; 26: 199–202. [PubMed] [Google Scholar] 73. Rivoire M, De Cian F, Meeus P, Gignoux B, Fréring B, Kaemmerlen P.Криохирургия как средство улучшения хирургического лечения пациентов с множественными неоперабельными метастазами в печени. Anticancer Res. 2000. 20: 3785–3790. [PubMed] [Google Scholar] 74. Зайферт Дж. К., Моррис Д. Л.. Факторы прогноза после криотерапии метастазов в печень колоректального рака. Ann Surg. 1998. 228: 201–208. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Зайферт Дж.К., Моррис Д.Л. Показатели рецидива после криотерапии метастазов в печень колоректального рака. Br J Surg. 1999; 86: 234–240.[PubMed] [Google Scholar] 76. Уоллес-младший, христиане К.К., Питт Х.А., Квеббеман Э.Дж. Криотерапия расширяет показания к лечению колоректальных метастазов в печени. Хирургия. 1999; 126: 766–772; обсуждение 772-774. [PubMed] [Google Scholar] 77. Хуанг А., Макколл Дж. М., Уэстон, доктор медицины, Матур П., Куинн Х., Хендерсон, округ Колумбия, Аллен-Мерш Т.Г. Фаза I исследования чрескожной криотерапии при колоректальном метастазе в печень. Br J Surg. 2002; 89: 303–310. [PubMed] [Google Scholar] 78. Грюнбергер Т., Журдан Дж.Л., Чжао Дж., Кинг Дж., Моррис Д.Л.Снижение риска рецидива пораженных или неадекватных краев с помощью краевой криотерапии после резекции печени по поводу колоректальных метастазов. Arch Surg. 2001; 136: 1154–1157. [PubMed] [Google Scholar] 79. Ruers TJ, Joosten J, Jager GJ, Wobbes T. Долгосрочные результаты лечения колоректальных метастазов в печени с помощью криохирургии. Br J Surg. 2001; 88: 844–849. [PubMed] [Google Scholar] 80. Ragnhammar P, Hafström L, Nygren P, Glimelius B. Систематический обзор эффектов химиотерапии при колоректальном раке. Acta Oncol. 2001; 40: 282–308.[PubMed] [Google Scholar] 81. Köhne CH, Cunningham D, Di Costanzo F, Glimelius B, Blijham G, Aranda E, Scheithauer W., Rougier P, Palmer M, Wils J, et al. Клинические детерминанты выживаемости у пациентов с метастатическим колоректальным раком на основе 5-фторурацила: результаты многомерного анализа 3825 пациентов. Энн Онкол. 2002; 13: 308–317. [PubMed] [Google Scholar] 82. Piedbois P, Zelek L, Cherqui D. Химиотерапия неоперабельных колоректальных метастазов в печени. Гепатогастроэнтерология. 2001; 48: 711–714.[PubMed] [Google Scholar] 83. Хасуике Й, Такеда Й, Мисима Х, Нишишоу И., Цудзинака Т., Киккава Н. [Системная химиотерапия запущенного колоректального рака с метастазами в печень] Ган То Кагаку Риохо. 2002; 29: 866–872. [PubMed] [Google Scholar] 84. Ensminger WD. Внутрипеченочная артериальная инфузия химиотерапии: фармакологические принципы. Семин Онкол. 2002. 29: 119–125. [PubMed] [Google Scholar] 85. ван Риель Дж. М., ван Грёнинген С. Дж., Джакконе Дж., Пинедо Х. М.. Химиотерапия печеночной артерии при метастатическом поражении колоректального рака в печень.Онкология. 2000. 59: 89–97. [PubMed] [Google Scholar] 86. Альдригетти Л., Арру М., Анджели Э., Вентурини М., Сальвиони М., Ронзони М., Катерини Р., Ферла Г. Чрескожная и хирургическая установка постоянных катетеров в печеночной артерии для регионарной химиотерапии. Гепатогастроэнтерология. 2002; 49: 513–517. [PubMed] [Google Scholar] 87. Хауэлл Дж. Д., Уоррен Х. В., Андерсон Дж. Х., Керр Д. Д., МакАрдл К. С.. Внутриартериальный 5-фторурацил и внутривенная фолиевая кислота в лечении метастазов в печени от колоректального рака. Eur J Surg.1999; 165: 652–658. [PubMed] [Google Scholar] 88. Lygidakis NJ, Sgourakis G, Dedemadi G, Safioleus MC, Nestoridis J. Региональная химиоиммунотерапия неоперабельной метастатической болезни печени колоректального происхождения. Проспективное рандомизированное исследование. Гепатогастроэнтерология. 2001; 48: 1085–1087. [PubMed] [Google Scholar] 89. Аллен-Мерш Т.Г., Эрлам С., Форди К., Абрамс К., Хоутон Дж. Качество жизни и выживаемость при непрерывной инфузии флоксуридина в печеночную артерию при колоректальных метастазах в печени. Ланцет. 1994; 344: 1255–1260.[PubMed] [Google Scholar] 90. Howell JD, McArdle CS, Kerr DJ, Buckles J, Ledermann JA, Taylor I, Gallagher HJ, Budden J. Исследование фазы II региональной 2-недельной инфузии 5-фторурацила с внутривенной фолиевой кислотой при лечении метастазов колоректального отдела печени. Br J Рак. 1997. 76: 1390–1393. [Бесплатная статья PMC] [PubMed] [Google Scholar] 91. Pelosi E, Bar F, Battista S, Bellò M, Bucchi MC, Alabiso O, Molino G, Bisi G. Химиотерапия инфузией печеночной артерии при неоперабельных ограниченных метастазах в печени: прогнозирование системной токсичности с применением сцинтиграфического и фармакокинетического подхода.Cancer Chemother Pharmacol. 1999; 44: 505–510. [PubMed] [Google Scholar] 92. Кемени Н., Фата Ф. Печеночно-артериальная химиотерапия. Ланцет Онкол. 2001; 2: 418–428. [PubMed] [Google Scholar] 93. Weinreich DM, Александр HR. Трансартериальная перфузия метастазов в печень. Семин Онкол. 2002; 29: 136–144. [PubMed] [Google Scholar] 94. Sasson AR, Watson JC, Sigurdson ER. Инфузионная химиотерапия в печеночную артерию при колоректальных метастазах в печени. Cancer Treat Res. 2001; 109: 279–298. [PubMed] [Google Scholar] 95. Матур П., Аллен-Мерш Т.Г.Химиотерапия печеночной артерии при колоректальных метастазах в печени. Гепатогастроэнтерология. 2001. 48: 317–319. [PubMed] [Google Scholar] 96. Блум А.И., Гордон Р.Л., Ахл К.Х., Керлан Р.К., Лаберж Дж.М., Уилсон М.В., Венук А.П., Уоррен Р. Транскатетерная эмболизация для лечения неправильной перфузии после имплантации химиоинфузионного насоса в печеночную артерию. Энн Сург Онкол. 1999. 6: 350–358. [PubMed] [Google Scholar] 97. Kohnoe S, Endo K, Yamamoto M, Ikeda Y, Toh Y, Baba H, Tajima T., Okamura T. Длительная инфузия печеночной артерии с низкими дозами цисплатина плюс 5-фторурацил при неоперабельных метастазах в печень от колоректального рака.Хирургия. 2002; 131: S128 – S134. [PubMed] [Google Scholar] 98. Link KH, Sunelaitis E, Kornmann M, Schatz M, Gansauge F, Leder G, Formentini A, Staib L, Pillasch J, Beger HG. Региональная химиотерапия неоперабельных колоректальных метастазов в печени митоксантроном, 5-фторурацилом, фолиевой кислотой и митомицином C может продлить выживаемость. Рак. 2001; 92: 2746–2753. [PubMed] [Google Scholar] 99. Müller H, Nakchbandi W., Chatzissavvidis I, Valek V. Внутриартериальная инфузия 5-фторурацила плюс гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) и химиоэмболизация мелфаланом при лечении диссеминированных метастазов в толстой и прямой кишке.Eur J Surg Oncol. 2001. 27: 652–661. [PubMed] [Google Scholar] 100. Fiorentini G, De Giorgi U, Giovanis P, Guadagni S, Cantore M, Marangolo M. Внутриартериальная печеночная химиотерапия (IAHC) при метастазах в печень при колоректальном раке: необходимы руководящие принципы для размещения катетера, управления портом и антикоагулянтной терапии. Энн Онкол. 2001; 12: 1023. [PubMed] [Google Scholar] 101. Copur MS, Capadano M, Lynch J, Goertzen T., McCowan T., Brand R, Tempero M. Альтернативная инфузия печеночной артерии и системная химиотерапия метастазов в печень от колоректального рака: испытание фазы II с использованием периодического чрескожного доступа к печеночной артерии.J Clin Oncol. 2001; 19: 2404–2412. [PubMed] [Google Scholar] 102. van Riel JM, van Groeningen CJ, Albers SH, Cazemier M, Meijer S, Bleichrodt R, van den Berg FG, Pinedo HM, Giaccone G. 5-фторурацил в печеночной артерии у пациентов с метастазами колоректального рака в печень: опыт одноцентровых исследований в 145 пациентов. Энн Онкол. 2000; 11: 1563–1570. [PubMed] [Google Scholar] 103. Чен М.С., Ли Дж.К., Чжан YQ, Лу LX, Чжан В.З., Юань Ю.Ф., Го Ю.П., Линь XJ, Ли Г.Х. Транскатетерная артериальная химиоэмболизация высокими дозами йодированного масла для пациентов с крупноклеточной гепатоцеллюлярной карциномой.Мир Дж. Гастроэнтерол. 2002; 8: 74–78. [Бесплатная статья PMC] [PubMed] [Google Scholar] 104. У ZQ, Fan J, Qiu SJ, Zhou J, Tang ZY. Значение послеоперационной регионарной химиотерапии печени в профилактике рецидивов после радикальной резекции первичного рака печени. Мир Дж. Гастроэнтерол. 2000. 6: 131–133. [Бесплатная статья PMC] [PubMed] [Google Scholar] 105. Хуан XQ, Хуан ZQ, Дуань В.Д., Чжоу NX, Фэн YQ. Тяжелые билиарные осложнения после эмболизации печеночной артерии. Мир Дж. Гастроэнтерол. 2002. 8: 119–123. [Бесплатная статья PMC] [PubMed] [Google Scholar] 106.Абрамсон Р.Г., Розен М.П., Перри Л.Дж., Брофи Д.П., Реберн С.Л., Стюарт К.Э. Экономическая эффективность химиоэмболизации печеночной артерии при колоректальных метастазах в печень, резистентных к системной химиотерапии. Радиология. 2000; 216: 485–491. [PubMed] [Google Scholar] 107. Попов И., Лаврнич С., Елич С., Ездич С., Ясович А. Химиоэмболизация метастазов в печень при колоректальной карциноме: риск или польза. Новообразования. 2002; 49: 43–48. [PubMed] [Google Scholar] 108. Azoulay D, Castaing D, Smail A, Adam R, Cailliez V, Laurent A, Lemoine A, Bismuth H.Резекция неоперабельных метастазов рака прямой кишки после чрескожной эмболизации воротной вены. Ann Surg. 2000. 231: 480–486. [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Azoulay D, Castaing D, Krissat J, Smail A, Hargreaves GM, Lemoine A, Emile JF, Bismuth H. Чрескожная эмболизация воротной вены увеличивает возможность и безопасность крупной резекции печени при гепатоцеллюлярной карциноме в поврежденной печени. Ann Surg. 2000; 232: 665–672. [Бесплатная статья PMC] [PubMed] [Google Scholar] 110.Кемени Н., Фата Ф. Артериальная, портальная или системная химиотерапия для пациентов с метастазами колоректальной карциномы в печень. J Hepatobilation Pancreat Surg. 1999; 6: 39–49. [PubMed] [Google Scholar] 111. Кокудо Н., Тада К., Секи М, Охта Х, Азекура К., Уэно М., Охта К., Ямагути Т., Мацубара Т., Такахаши Т. и др. Пролиферативная активность внутрипеченочных колоректальных метастазов после предоперационной эмболизации гемипеченочной воротной вены. Гепатология. 2001; 34: 267–272. [PubMed] [Google Scholar] 112. Элиас Д., Уэлле Дж. Ф., Де Бэр Т., Лассер П., Рош А.Предоперационная селективная эмболизация воротной вены перед гепатэктомией при метастазах в печень: отдаленные результаты и влияние на выживаемость. Хирургия. 2002; 131: 294–299. [PubMed] [Google Scholar] 113. Имамура Х., Кавасаки С., Миягава С., Икегами Т., Китамура Х., Шимада Р. Агрессивный хирургический подход к рецидивирующим опухолям после гепатэктомии по поводу метастатического распространения колоректального рака в печень. Хирургия. 2000; 127: 528–535. [PubMed] [Google Scholar] 114. Лоде Х.Н., Сян Р., Беккер Дж. С., Гиллис С.Д., Райсфельд Р.А. Иммуноцитокины: многообещающий подход к иммунотерапии рака.Pharmacol Ther. 1998. 80: 277–292. [PubMed] [Google Scholar] 115. Окуно К., Канеда К., Ясутоми М. Региональная иммунохимиотерапия колоректальных метастазов в печени на основе ИЛ-2. Гепатогастроэнтерология. 1999; 46 Дополнение 1: 1263–1267. [PubMed] [Google Scholar] 116. Okuno K, Hirai N, Takemoto Y, Kawai I., Yasutomi M. Интерлейкин-2 как модулятор 5-фторурацила в иммунохимиотерапии печеночной артерии при метастазах в печень. Гепатогастроэнтерология. 2000; 47: 487–491. [PubMed] [Google Scholar] 117. Лу К., Чен З.Н., Бянь Х.Д., Ли Дж., Чжоу С.Б.Фармакокинетика радиоиммунотерапевтического средства прямого мечения mAb 188Re-HAb18. Мир Дж. Гастроэнтерол. 2002; 8: 69–73. [Бесплатная статья PMC] [PubMed] [Google Scholar] 118. Buchegger F, Roth A, Allal A, Dupertuis YM, Slosman DO, Delaloye AB, Mach JP. Радиоиммунотерапия метастазов колоректального рака в печени: сочетание с лучевой терапией. Ann N Y Acad Sci. 2000; 910: 263–269; обсуждение 263-269 ;. [PubMed] [Google Scholar] 119. Buchegger F, Allal AS, Roth A, Papazyan JP, Dupertuis Y, Mirimanoff RO, Gillet M, Pelegrin A, Mach JP, Slosman DO.Комбинированная радиоиммунотерапия и лучевая терапия метастазов в печень от колоректального рака: технико-экономическое обоснование. Anticancer Res. 2000; 20: 1889–1896. [PubMed] [Google Scholar] 120. Малик У., Мохиуддин М. Внешняя лучевая терапия в лечении метастазов в печени. Семин Онкол. 2002; 29: 196–201. [PubMed] [Google Scholar] 121. Лю Л., Цзян Цз., Дэн Дж. Дж., Сон Дж. З., Чжан Д. С., Го К. М., Фанг В., Хе С. К., Го Дж. Х. Клинико-экспериментальное исследование регионального применения стеклянных микросфер фосфора 32 при лечении рака печени.Мир Дж. Гастроэнтерол. 1999; 5: 492–505. [Бесплатная статья PMC] [PubMed] [Google Scholar] 122. Гун Y, Лю К.Д., Чжоу Г., Сюэ Ц., Чен С.Л., Тан З.Й. Радиоиммуно-визуализация опухолей химерного антитела у мышей nude с ксенотрансплантатом гепатомы. Мир Дж. Гастроэнтерол. 1998; 4: 7–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 123. Стаббс Р.С., Кэннан Р.Дж., Митчелл А.В. Селективная внутренняя лучевая терапия (SIRT) с использованием микросфер иттрия 90 для обширных колоректальных метастазов в печени. Гепатогастроэнтерология. 2001. 48: 333–337. [PubMed] [Google Scholar] 124.Стаббс Р.С., Кэннан Р.Дж., Митчелл А.В. Селективная внутренняя лучевая терапия с использованием микросфер из 90 иттрия при обширных колоректальных метастазах в печени. J Gastrointest Surg. 2001; 5: 294–302. [PubMed] [Google Scholar] 125. Дэнси Дж. Э., Шеперд Ф. А., Пол К., Снайдерман К. В., Хоул С., Габрис Дж., Хендлер А. Л., Гоин Дж. Э. Лечение неоперабельной гепатоцеллюлярной карциномы внутрипеченочными 90Y-микросферами. J Nucl Med. 2000; 41: 1673–1681. [PubMed] [Google Scholar] 126. Кэмпбелл А.М., Бейли И.Х., Бертон Массачусетс. Анализ распределения внутриартериальных микросфер в печени человека после терапии печеночными микросферами иттрием-90.Phys Med Biol. 2000; 45: 1023–1033. [PubMed] [Google Scholar]
Метастатический рак печени: распространение, симптомы и лечение
Рак печени, также называемый раком печени, развивается в тканях печени, одного из крупнейших органов человеческого тела. Печень выполняет множество функций, включая детоксикацию, расщепление жиров, синтез белков и помощь в пищеварении.
Путешествуя по лимфатическим или кровеносным сосудам, раковые клетки иногда перемещаются по всему телу, вторгаясь в новые ткани или органы в процессе, называемом метастазированием.Метастатический рак печени — это запущенная стадия заболевания, которая началась в печени, но распространилась на другие части тела.
Метастатические симптомы в печень
Симптомы рака печени часто не проявляются на ранних стадиях. В результате рак печени, как правило, диагностируется на более поздней стадии. Если у вас были другие заболевания печени или в семейном анамнезе был рак печени, у вас повышен риск развития рака печени, и вам следует регулярно посещать врача.
Симптомы метастатического рака печени различаются в зависимости от того, где образуются новые опухоли. Например, если рак печени распространяется на кости, это может вызвать переломы костей.
Общие симптомы метастатического рака печени включают:
- Боль в животе
- Боль, возникающая около правой лопатки или в верхней части живота
- Потеря аппетита, потеря веса или тошнота
- Вздутие или вздутие живота в брюшной полости
- Пожелтение кожи и глаз (желтуха)
- Постоянная усталость или слабость
- Необъяснимая лихорадка
Варианты лечения метастатического рака печени
При метастазах рака печени он чаще всего распространяется в легкие и кости.Пятилетняя выживаемость пациента, у которого рак печени распространился на окружающие ткани, органы и / или лимфатические узлы, оценивается в 11 процентов. Пятилетняя выживаемость пациента, у которого рак печени распространился на отдаленные ткани, органы и / или лимфатические узлы, оценивается в 3 процента.
В Центрах лечения рака Америки® (CTCA) мы предлагаем несколько вариантов лечения пациентов с метастатическим раком печени. Мы также предлагаем методы лечения, предназначенные для облегчения симптомов, часто связанных с раком печени.
При метастатическом раке печени химиоэмболизация, форма химиотерапии, может быть рекомендованным курсом лечения. Таргетная терапия может помочь замедлить рост опухоли. Мы также предлагаем методы лечения, которые могут помочь облегчить симптомы, часто связанные с раком печени, такие как боль, потеря аппетита и тошнота.
Следующая тема: Какие стадии рака печени?
4 достижения в области лечения рака печени
В последние годы в лечении рака печени был достигнут ряд успехов.При удалении
рак печени
хирургическое вмешательство может быть эффективным методом лечения рака печени для некоторых
пациентам, он подходит не всем пациентам. Поскольку исследователи продолжают
открывать новые и инновационные методы лечения, у врачей есть больше возможностей для
подумайте о своих пациентах.
Достижения химиотерапии
В последнее десятилетие
химиотерапия
видел революционные достижения в исследованиях. С новыми лекарствами пациенты живут дольше после простой химиотерапии.Химиотерапия назначается отдельно или в сочетании с другими методами лечения. Во многих случаях химиотерапевтическое лечение может уменьшить размер опухолей, чтобы их было легче удалить хирургическим путем.
Внутриартериальная терапия рака печени
Часто опухоли печени получают кровоснабжение из артерии, кровоснабжающей печень. Эти опухоли действуют как паразиты для кровоснабжения вашего тела. При внутриартериальной терапии гранулы для химиоэмболии доставляют лекарство, убивающее рак, к опухоли через артерию.Эти шарики также блокируют приток крови к опухоли, что помогает предотвратить ее рост.
Химиоэмболизация эффективна как отдельно, так и в сочетании с химиотерапией при лечении и / или уменьшении размера опухолей.
В некоторых случаях пациенты, которые изначально не соответствовали требованиям для трансплантации, могут получить право на лечение после химиоэмболизации и химиотерапии из-за уменьшения размера опухоли.
Эти процедуры выполняются интервенционными радиологами в Johns Hopkins.
Методы абляции опухоли печени
Абляционная терапия убивает опухоль печени вместо ее удаления. В этих методах врачи используют зонд, чтобы убить опухоль горячей энергией. Этот минимально инвазивный подход наиболее эффективен для опухолей размером менее 3 см.
В Johns Hopkins специалисты проводят микроволновую абляцию опухолей, которые невозможно удалить с помощью других хирургических вмешательств. Этот метод может выполняться хирургическим путем в операционной или интервенционными радиологами.
Успехи по пересадке печени
Трансплантация печени оказалась наиболее эффективным методом лечения пациентов с гепатоцеллюлярной карциномой, распространенным типом рака печени. Если у пациента есть заболевание печени, такое как цирроз, трансплантация печени также может еще больше снизить риск рецидива после лечения. Однако не все пациенты будут кандидатами на трансплантацию; это должно быть определено с помощью оценки мультидисциплинарной группы Джонса Хопкинса, которая включает трансплантологию.Они работают в тесном сотрудничестве, чтобы обеспечить пациентам оптимальную стратегию лечения.
Прежде чем рекомендовать пересадку печени, врачи принимают во внимание:
- Количество новообразований
- Размер опухоли
- Здоровье пациента
Рак печени — Диагностика и лечение
Как узнать, что у меня рак печени?
Скрининг для раннего выявления первичного рака печени обычно не проводится, но его можно рассмотреть для людей с высоким риском заболевания.Однако исследования не определили, полезен ли скрининг людям, не входящим в группу повышенного риска. Чтобы диагностировать рак печени, врач должен исключить другие причины нарушения функции печени.
В группу высокого риска входят пациенты с заболеванием, называемым гемохроматозом, хроническим гепатитом, и алкоголики.
Дополнительные тесты включают:
- Анализы крови, измеряющие опухолевые маркеры — уровни этих веществ повышаются в крови, если у кого-то есть особый рак, — могут помочь в диагностике.Рак печени выделяет вещество, называемое альфа-фетопротеином (AFP), которое обычно присутствует у плода, но исчезает при рождении. Повышенный уровень АФП у взрослых может указывать на рак печени, поскольку он вырабатывается в 70% случаев рака печени. Повышенный уровень железа также может быть опухолевым маркером.
- Визуализация с помощью ультразвука — это начальный диагностический тест, поскольку он может обнаруживать опухоли размером до одного сантиметра. КТ высокого разрешения и МРТ с контрастированием используются для диагностики и определения стадии этих опухолей.
- Биопсия печени позволит отличить доброкачественную опухоль от злокачественной.Однако, в зависимости от результатов других тестов, биопсия может не потребоваться для диагностики рака.
- Лапароскопия с использованием инструментов и камер через небольшие разрезы полезна для обнаружения небольших опухолей, определения степени цирроза или получения биопсии, а также для подтверждения предыдущих тестов, среди прочего.
Какие методы лечения рака печени?
Любой рак печени трудно вылечить. Первичный рак печени редко выявляется на ранней стадии, когда он наиболее поддается лечению.Вторичный или метастатический рак печени трудно лечить, потому что он уже распространился. Сложная сеть кровеносных сосудов и желчных протоков в печени затрудняет операцию. Большая часть лечения направлена на то, чтобы пациенты чувствовали себя лучше и, возможно, прожили дольше.
Пациенты с опухолями на ранней стадии, которые можно удалить хирургическим путем, имеют наилучшие шансы на долгосрочное выживание. К сожалению, большинство видов рака печени неоперабельны на момент постановки диагноза либо потому, что рак находится на слишком поздней стадии, либо потому, что печень слишком больна, чтобы разрешить операцию.Некоторым пациентам химиотерапия вводится непосредственно в печень (химиоэмболизация), чтобы уменьшить опухоль до размера, при котором возможно хирургическое вмешательство. Это также может быть сделано без химиотерапии (мягкая эмоболизация) в некоторых случаях, используя вместо этого этанол. Пациенты в стадии ремиссии должны находиться под тщательным наблюдением на предмет возможного рецидива.
Криотерапия, или замораживание опухоли, и радиочастотная абляция (РЧА) с использованием радиоволн для разрушения опухоли могут использоваться для лечения некоторых случаев рака печени. Лучевая терапия может проводиться различными способами, но имеет свои ограничения из-за низкой толерантности печени к радиации.Роль излучения при использовании заключается в облегчении симптомов за пределами печени или облегчении боли в печени за счет уменьшения опухоли. При радиоэмболизационной терапии используются вещества, которые перекрывают кровоснабжение опухоли.
Трансплантация печени может быть вариантом для людей с раком печени и циррозом. Хотя эта процедура рискованна, она дает некоторые шансы на долгосрочное выживание.
Распространенный рак печени не имеет стандартного лечения. Химиотерапия и низкие дозы облучения могут контролировать распространение рака и облегчить боль, однако они имеют умеренную пользу при этом типе рака.Большинство пациентов получают обезболивающие вместе с лекарствами для снятия тошноты, улучшения аппетита и уменьшения отека живота или нижней части тела. Препарат сорафениб (Нексавар) является первым препаратом, значительно улучшающим общую выживаемость при запущенном раке печени, и считается препаратом выбора для таких пациентов.
Люди с прогрессирующим раком печени могут принять участие в клинических испытаниях новых подходов к лечению.
Первичное лечение рака печени у взрослых (PDQ®) — версия для пациента
О PDQ
Запрос данных врача (PDQ) — это обширная база данных по раку Национального института рака (NCI).База данных PDQ содержит резюме последней опубликованной информации о профилактике, обнаружении, генетике, лечении, поддерживающей терапии, а также дополнительной и альтернативной медицине. Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке. Версии для пациентов написаны на понятном нетехническом языке. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке.
PDQ — это услуга NCI. NCI является частью Национальных институтов здравоохранения (NIH). NIH — это центр биомедицинских исследований при федеральном правительстве. Обзоры PDQ основаны на независимом обзоре медицинской литературы. Это не политические заявления NCI или NIH.
Цель этого обзора
В этом обзоре информации о раке PDQ содержится текущая информация о лечении первичного рака печени у взрослых. Он предназначен для информирования и помощи пациентам, семьям и лицам, осуществляющим уход.Он не дает официальных руководящих принципов или рекомендаций для принятия решений в отношении здравоохранения.
Рецензенты и обновления
Редакционные коллегии составляют сводки информации о раке PDQ и поддерживают их в актуальном состоянии. Эти советы состоят из экспертов в области лечения рака и других специальностей, связанных с раком. Резюме регулярно пересматриваются, и в них вносятся изменения при появлении новой информации. Дата в каждой сводке («Обновлено») — это дата самого последнего изменения.
Информация в этом обзоре пациента была взята из версии для медицинских работников, которая регулярно проверяется и обновляется по мере необходимости редакционной коллегией PDQ по лечению взрослых.
Информация о клиническом испытании
Клиническое испытание — это исследование, призванное ответить на научный вопрос, например, лучше ли одно лечение, чем другое. Испытания основаны на прошлых исследованиях и на том, что было изучено в лаборатории. Каждое испытание отвечает на определенные научные вопросы, чтобы найти новые и более эффективные способы помощи больным раком. Во время клинических испытаний лечения собирается информация об эффектах нового лечения и о том, насколько хорошо оно работает. Если клиническое испытание покажет, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным».«Пациенты могут захотеть принять участие в клиническом испытании. Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Клинические испытания можно найти в Интернете на сайте NCI. Для получения дополнительной информации позвоните в Информационную службу рака (CIS), контактный центр NCI, по телефону 1-800-4-CANCER (1-800-422-6237).
Разрешение на использование данного обзора
PDQ является зарегистрированным товарным знаком. Содержимое документов PDQ можно свободно использовать как текст. Его нельзя идентифицировать как сводную информацию о раке NCI PDQ, если не отображается вся сводка и не обновляется регулярно.Тем не менее, пользователю будет разрешено написать такое предложение, как «В сводке информации о раке PDQ NCI о профилактике рака груди указываются риски следующим образом: [включить выдержку из резюме]».
Лучший способ процитировать это резюме PDQ:
Редакционная коллегия PDQ® Adult Treatment. PDQ Первичное лечение рака печени у взрослых. Бетесда, Мэриленд: Национальный институт рака. Обновлено <ММ / ДД / ГГГГ>. Доступно по адресу: https://www.cancer.gov/types/liver/patient/adult-liver-treatment-pdq.Дата обращения <ММ / ДД / ГГГГ>. [PMID: 26389251]
Изображения в этом обзоре используются с разрешения автора (ов), художника и / или издателя только для использования в обзорах PDQ. Если вы хотите использовать изображение из сводки PDQ и не используете все сводки, вы должны получить разрешение от владельца. Он не может быть предоставлен Национальным институтом рака. Информацию об использовании изображений в этом обзоре, а также многих других изображений, связанных с раком, можно найти в Visuals Online. Visuals Online — это коллекция из более чем 3000 научных изображений.
Заявление об отказе от ответственности
Информация, содержащаяся в этом резюме, не должна использоваться для принятия решений о страховом возмещении. Более подробную информацию о страховом покрытии можно найти на сайте Cancer.

