Качественная модификации ПЦР в первичной диагностике ИППП. Медико-биологический Союз
Место качественной модификации метода ПЦР в первичной диагностике ИППП и контроле эффективности лечения.
© Е.А.Ивашков, 2001
материал взят с сайта «ЛабоRUтория»
В немалой степени успеху полимеразной цепной реакции (ПЦР) способствовало появление на медицинском рынке высокотехнологичных коммерческих тест-систем, значительно упростивших и ускоривших проведение реакции. В то же время применение нового метода поставило и ряд вопросов, один из которых – интерпретация результатов ПЦР. Высокая чувствительность метода имеет и оборотную сторону – выявляемые десятки и сотни копий микроорганизмов в пробе не всегда «достаточны» для возникновения заболевания. Положительные результаты ПЦР в отсутствие клинических признаков заболевания (нередко сопровождаемые отрицательными результатами других лабораторных исследований) позволило «предъявить обвинения» этому методу в гипердиагностике. Открытым остаётся вопрос о трактовке результатов контрольных исследований методом ПЦР: качественный метод не позволяет достоверно оценить динамику популяции возбудителя под влиянием проводимого лечения.
Открытым остаётся вопрос о трактовке результатов контрольных исследований методом ПЦР: качественный метод не позволяет достоверно оценить динамику популяции возбудителя под влиянием проводимого лечения.
Тест-системы, создаваемые для количественного определения патогенов методом ПЦР, либо обладают меньшей чувствительностью по сравнению с «качественными» (большинство наборов с внутренним контролем), либо требуют значительно больших затрат расходных материалов (метод последовательного разведения). Кроме того, в условиях использования реального клинического материала нередко наблюдаются парадоксальные ситуации, когда образцы с большим содержанием определяемой ДНК дают более слабое свечение, чем пробы, бедные «мишенями», и наоборот.
Целью данной работы была оценка эффективности качественного определения возбудителей инфекций, передающихся половым путём (ИППП) на основании сопоставления частоты их обнаружения до проведения лечения и по окончании терапии.
Материалы и методы. Материал (моча, соскобы из цервикального канала, уретры, эпителий из заднего свода влагалища, аспираты из полости матки) получали от женщин, обращавшихся за помощью к врачам-гинекологам женских консультаций г. Хабаровска. Всего было обследовано 2112 человек, 1747 из них – при первичном посещении врача и 365 – после проведения лечения. Количество анализов составило соответственно 6728, 6179 и 549. Контрольное исследование осуществляли не ранее, чем через 14 дней (для хламидий – не ранее одного месяца) после окончания терапии. Для проведения ПЦР использовались российские диагностические тест-системы («горячий старт») по технологии, рекомендованной производителем наборов. Результаты детекции документировались фотографированием геля на фотоплёнку «Микрат-300». За счёт высокого коэффициента контрастности (g = 4,0) и длительной экспозиции фиксировались полосы амплификата, недоступные для визуального различения. Данные хранились и обрабатывались в СУБД MS Access 97.
Материал (моча, соскобы из цервикального канала, уретры, эпителий из заднего свода влагалища, аспираты из полости матки) получали от женщин, обращавшихся за помощью к врачам-гинекологам женских консультаций г. Хабаровска. Всего было обследовано 2112 человек, 1747 из них – при первичном посещении врача и 365 – после проведения лечения. Количество анализов составило соответственно 6728, 6179 и 549. Контрольное исследование осуществляли не ранее, чем через 14 дней (для хламидий – не ранее одного месяца) после окончания терапии. Для проведения ПЦР использовались российские диагностические тест-системы («горячий старт») по технологии, рекомендованной производителем наборов. Результаты детекции документировались фотографированием геля на фотоплёнку «Микрат-300». За счёт высокого коэффициента контрастности (g = 4,0) и длительной экспозиции фиксировались полосы амплификата, недоступные для визуального различения. Данные хранились и обрабатывались в СУБД MS Access 97.
Результаты и обсуждение. Проведённое исследование показало, что Chlamydia trachomatis и Mycoplasma hominis присутствовали соответственно в 20,5 и 31,8% исследованных образцов. Частота выявления этих микроорганизмов существенно не отличалась во время первого посещения врача и при контрольном исследовании после лечения. Кажущийся парадокс легко объясним: терапия была назначена тем женщинам, у которых был обнаружен возбудитель заболевания, иначе говоря, — инфицированность в этой группе первоначально составляла 100% а после проведения лечения снизилась для микоплазм втрое и впятеро для хламидий.
Проведённое исследование показало, что Chlamydia trachomatis и Mycoplasma hominis присутствовали соответственно в 20,5 и 31,8% исследованных образцов. Частота выявления этих микроорганизмов существенно не отличалась во время первого посещения врача и при контрольном исследовании после лечения. Кажущийся парадокс легко объясним: терапия была назначена тем женщинам, у которых был обнаружен возбудитель заболевания, иначе говоря, — инфицированность в этой группе первоначально составляла 100% а после проведения лечения снизилась для микоплазм втрое и впятеро для хламидий.
M. genitalium в пробах, взятых до начала терапии, встречалась в 9,3% (в контроле после лечения – 6,4%), U. urealitycum — 62,8% (53%). Персистенция цитомегаловируса в цервикальном канале установлена в 21,1% (проводимое лечение снизило этот процент до 13,3), вирус простого герпеса обнаружен в 18,3% (9,1%).
Приведённые результаты с определёнными оговорками позволяют оценить устойчивость различных групп микроорганизмов к терапии (в частности, учитывая того, что большой объём выборки по различным медицинским учреждениям нивелировал особенности схем лечения). Так, практически при одинаковой частоте обнаружения трихомонад и кандид до начала терапии (около 23%), первые впоследствии идентифицированы только у 14,3%, а вторые выявлены у 40% лечившихся женщин. Полученные данные хорошо вписываются в наблюдаемую нами в последнее время картину: трихомониаз и гонорея, в отличие от других ЗППП, стали встречаться реже (это же показывает и Российская статистика). В то же время, рецидивирующие кандидозы и бактериальные вагинозы (БВ) стали настолько обычным явлением (например, последние мы диагносцируем у 26% женщин), что некоторые врачи стали считать их вариантом нормы. Что же показывает проведённое исследование? Gardnerella vaginalis не только чаще других обнаруживает себя в генитальном тракте женщин, но и делит пальму первенства по устойчивости к проводимой терапии (50%) с U. urealitycum (53%) – вторым, едва ли не облигатным компонентом биоценоза влагалища при БВ. О третьем компоненте — Mycoplasma hominis- было сказано выше.
Так, практически при одинаковой частоте обнаружения трихомонад и кандид до начала терапии (около 23%), первые впоследствии идентифицированы только у 14,3%, а вторые выявлены у 40% лечившихся женщин. Полученные данные хорошо вписываются в наблюдаемую нами в последнее время картину: трихомониаз и гонорея, в отличие от других ЗППП, стали встречаться реже (это же показывает и Российская статистика). В то же время, рецидивирующие кандидозы и бактериальные вагинозы (БВ) стали настолько обычным явлением (например, последние мы диагносцируем у 26% женщин), что некоторые врачи стали считать их вариантом нормы. Что же показывает проведённое исследование? Gardnerella vaginalis не только чаще других обнаруживает себя в генитальном тракте женщин, но и делит пальму первенства по устойчивости к проводимой терапии (50%) с U. urealitycum (53%) – вторым, едва ли не облигатным компонентом биоценоза влагалища при БВ. О третьем компоненте — Mycoplasma hominis- было сказано выше.
Понимая безусловную неприемлемость полуколичественной оценки ПЦР в каждом отдельно взятом исследовании, мы предприняли попытку использовать данный метод для сравнительной оценки относительно больших групп (женщин до начала лечения и после его завершения). В этом случае девиации, связанные с наличием ингибиторов термостабильной полимеразы и т.п. взаимно гасятся в обеих исследуемых группах, поскольку начинают “работать” законы статистики для больших популяций.
В этом случае девиации, связанные с наличием ингибиторов термостабильной полимеразы и т.п. взаимно гасятся в обеих исследуемых группах, поскольку начинают “работать” законы статистики для больших популяций.
Интенсивность свечения полосы продукта амплификации сопоставляли с люминесценцией амплифицированного фрагмента соответствующей контрольной ДНК (4 балла, или 4+). Невидимой глазом, фиксированной только на фотоплёнке светящейся полосе амплификата соответствовал 1+. Остальные градации занимали промежуточное положение.
Результаты такого “полуколичественного” исследования приведены в Таблице. Наиболее интересным нам представляется оценка интенсивности реакции в группе хламидий. Если при первичном исследовании полосы продукта амплификации светились довольно ярко (во все “балльные” интервалы попало приблизительно одинаковое число проб), то в контрольном тесте явно преобладали крайне слабые (невидимые глазом, но совершенно чётко зафиксированные на фотоплёнке) сигналы. “Видимые” полосы составили в контроле менее трети от всех обнаруженных!
Как указывалось, контрольное исследование на хламидии проводили через месяц и более после завершения терапии, когда происходило полное замещение клеток призматического эпителия и элиминация находящихся в них погибших ретикулярных и элементарных частиц хламидий. Проводимые контрольные исследования не показали наличия полос в “отрицательных контролях”. Поэтому приведённые выше результаты не могут быть следствием технологических погрешностей.
Проводимые контрольные исследования не показали наличия полос в “отрицательных контролях”. Поэтому приведённые выше результаты не могут быть следствием технологических погрешностей.
По-видимому, приведённые факты должны побудить сделать соответствующие выводы исследователей, игнорирующих применение фотографических или электронных (чувствительная видеокамера — компьютер) технологий фиксации результатов амплификации.
При трактовке результатов ПЦР врач должен учитывать современное состояние вопроса: хламидийная инфекция коварна. Этот вид микроорганизмов представляет собой реальную угрозу для женщины и ребёнка даже в минимальных количествах, выявляемых молекулярно-биологическими методами.
Не существует чётких критериев степени опасности присутствия разного количества CMV и HSV в цервикальном канале, но достоверно известно, что сам факт их персистенции определяет значительно более высокий процент инфицирования ребёнка в родах даже у серопозитивных, обладающих определённым иммунитетом, женщин. При первичном инфицировании частота и тяжесть вирусных поражений многократно возрастают.
При первичном инфицировании частота и тяжесть вирусных поражений многократно возрастают.
Несколько сложнее трактовка выявления микоплазм. Известно, что, например, уреаплазмы могут длительное время персистировать в урогенитальном тракте, не вызывая видимых патологических изменений. Высокий процент обнаружения данного вида микроорганизмов в наших исследованиях также косвенно свидетельствует об отсутствии 100% патогенности. Учитывая побочные действия антибиотиков, при отсутствии клинических проявлений обнаружение уреаплазм не должно служить показанием к антибиотикотерапии (исключение – планируемая беременность – см. ниже), может быть рекомендована коррекция иммунитета. Тем не менее, при воспалительном процессе выявление уреаплазм в отсутствии других патогенов позволяет считать их этиологическим фактором заболевания. Не располагают к благодушию и приведённые выше результаты: U. urealitycum неожиданно оказалась микроорганизмом, максимально устойчивым к проводимой терапии. Многие исследователи указывают на взаимосвязь присутствия уреаплазм в цервикальном канале беременных с преждевременным разрывом амниотической оболочки и излитием околоплодных вод; профилактическая антибиотикотерапия уменьшала как частоту выявления уреаплазм, так и риск преждевременных родов.
Таким образом, при выявлении потенциально патогенных бактерий и вирусов не следует забывать о том, что болезнь есть взаимодействие микро- и макроорганизма. Во многих случаях количественные критерии оказываются неприменимыми: инфекционный процесс может быть гораздо более опасным в присутствии относительного небольшого количества высокопатогенных возбудителей, при активном синергизме патогенов, при временном ослаблении иммунной системы.
Всё это позволяет считать, что даже количественная модификация метода ПЦР может и должна применяться при установлении этиологических факторов заболеваний урогенитальной сферы. Метод высоко информативен не только при первичной диагностике инфицирования урогенитального тракта, но и при контроле излеченности от ИППП. В сочетании с другими методами диагностики он даёт думающему врачу полную информацию для принятия правильного решения.
© Е.А.Ивашков, 2001. Все права защищены.
Сдать анализ на гепатит С ПЦР количественный
Метод определения
ПЦР с детекцией в режиме «реального времени».
Исследуемый материал
Сыворотка крови
Доступен выезд на дом
Онлайн-регистрация
Синонимы: Вирус гепатита С (ВГС), количественное определение РНК. Hepatitis C Virus RNA, Quantitative, Real-Time PCR; Blood, HCV Viral Load; Hepatitis C Virus RNA Quant.
Краткое описание исследования «Количественное определение РНК вируса гепатита С методом ПЦР [вирусная нагрузка] в сыворотке крови»
Гепатит С вызывается РНК-содержащим вирусом семейства Flaviviridae – вирусом гепатита С (ВГС, HCV). Вирус передается парентерально (использование загрязненных игл, шприцев и других медицинских инструментов), реже половым путем, а также (4-6%) от инфицированной матери ребенку (вертикальный путь). Клиническое течение острого гепатита С обычно бывает легким.
Клиническое течение острого гепатита С обычно бывает легким.
Вирус гепатита С проявляет большую вариабельность генома, у инфицированных лиц происходит быстрая мутация вируса, с чем, возможно, связано ускользание его от механизмов иммунной защиты и большая частота хронизации этой инфекции. Хроническая инфекция вирусом гепатита С характеризуется, с одной стороны, постоянной репликацией вируса, а с другой – активным, но недостаточным иммунным ответом организма. В отличие от гепатита В, антигены вируса гепатита С в крови не улавливаются в достаточных количествах (их обнаруживают в биоптатах печени). Это ограничивает возможности лабораторной оценки течения и активности инфекционного процесса. Диагноз гепатита С в настоящее время основывается на прямом обнаружении вирусной РНК методами ПЦР и обнаружении anti-HCV антител.
Количественная характеристика содержания РНК вируса гепатита С в клинических образцах важна для оценки эффективности противовирусной терапии и имеет прогностическое значение для определения хронизации данного гепатита.
В данном исследовании определение РНК вируса гепатита С в сыворотке крови проводится методом полимеразной цепной реакции (ПЦР) с детекцией в режиме реального времени.
Аналитические показатели:
- определяемый фрагмент – специфический участок РНК вируса гепатита С;
- специфичность определения – 100%;
- чувствительность определения – 60 МЕ/мл;
- линейный диапазон: 102 — 1х108 МЕ/мл.
С какой целью проводят исследование «Количественное определение РНК вируса гепатита С методом ПЦР [вирусная нагрузка] в сыворотке крови»
Выявление РНК гепатита С в сыворотке крови используется при ведении пациентов с хронической ВГС-инфекцией для оценки вирусологического ответа на ранних этапах курса антивирусной терапии.
Новые исследования методом ПЦР
С осени 2011 г. в ТНИИКИП проводятся следующие исследования методом ПЦР:
1. Выявление ДНК вируса гепатита В («ПЦР HBV кач» качественный тест, результат в виде «обнаружено – не обнаружено», высокочувствительный метод ПЦР в «реальном времени»)
Выявление ДНК вируса гепатита В («ПЦР HBV кач» качественный тест, результат в виде «обнаружено – не обнаружено», высокочувствительный метод ПЦР в «реальном времени»)
Чувствительность: 100 ГЭ/мл, в 5 раз выше, чем при обычном методе («по конечной точке» — чувствительность 500 ГЭ/мл).
Забор крови в вакутейнер с ЭДТА (сиреневая пробка)
Хранить не более 6 ч
Ожидание результата 10 дней
2. Количественное определение ДНК вируса гепатита В («ПЦР HBV кол», определение концентрации вируса)
Для контроля изменения вирусной нагрузки в процессе лечения
Чувствительность: 300 ГЭ/мл, линейный диапазон измерения:300-3х108 ГЭ/мл
Забор крови в вакутейнер с ЭДТА (сиреневая пробка)
Хранить не более 6 ч
Ожидание результата 10 дней
3. Выявление РНК вируса гепатита С («ПЦР HСV кач» качественный тест, результат в виде «обнаружено – не обнаружено», высокочувствительный метод ПЦР в «реальном времени»)
Чувствительность: 50 МЕ/мл, в 5 раз выше, чем при обычном методе («по конечной точке» — чувствительность 250 МЭ/мл).
Забор крови в вакутейнер с ЭДТА (сиреневая пробка)
Хранить не более 6 ч
Ожидание результата 10 дней
4. Количественное определение РНК вируса гепатита С («ПЦР HСV кол», определение концентрации вируса)
Для контроля изменения вирусной нагрузки в процессе лечения
Чувствительность: 500 МЕ /мл, линейный диапазон измерения: 500-5х107 МЕ/мл
Забор крови в вакутейнер с ЭДТА (сиреневая пробка)
Хранить не более 6 ч
Ожидание результата 10 дней
5. Генотипирование вируса гепатита С («ПЦР HСV генотип», выявление и дифференциация генотипа 1а, 1b, 2, 3, 4 в одной пробе крови)
Для подбора оптимальной терапии
Чувствительность: 104 МЕ/мл
Забор крови в вакутейнер с ЭДТА (сиреневая пробка)
Хранить не более 6 ч
Ожидание результата 10 дней
6. Выявление ДНК возбудителя токсоплазмоза (Toxoplasma gondii) в клетках крови методом ПЦР в «реальном времени» («ПЦР т/пл» качественный тест результат в виде «обнаружено – не обнаружено»)
Забор крови в вакутейнер с ЭДТА (сиреневая пробка)
Хранить не более 6 ч
Чувствительность: 400 копий/мл
Ожидание результата 10 дней
7. Выявление и количественное определение ДНК цитомегаловируса человека методом ПЦР в «реальном времени» (необходимо указать в направлении «качественный тест» или «количественный тест»: «ПЦР СМV кач» или «ПЦР СМV кол»)
Выявление и количественное определение ДНК цитомегаловируса человека методом ПЦР в «реальном времени» (необходимо указать в направлении «качественный тест» или «количественный тест»: «ПЦР СМV кач» или «ПЦР СМV кол»)
Материал для исследования: плазма или лейкоциты крови, слюна, смывы и мазки из ротоглотки, моча (а также амниотическая жидкость, спинномозговая жидкость, бронхоальвеолярный лаваж)
Забор в стерильную посуду:
моча – в стерильный контейнер на 60 мл, сбор первой утренней порции 20-30 мл, доставить в течение 6 ч.
мазки из ротоглотки – стерильным зондом в специальную пробирку с транспортной средой для респираторных мазков,
забор крови в вакутейнер с ЭДТА (сиреневая пробка), хранить не более 6 ч
Чувствительность: 400 копий/мл (безклеточный материал) или 5 копий ДНК CMV на 105 клеток (для клеток). Линейный диапазон измерения: 500-107копий/мл.
Ожидание результата 10 дней
8. Выявление и количественное определение ДНК вируса Эпштейна-Барр методом ПЦР в «реальном времени» (указать в направлении «качественный тест» или «количественный тест»: «ПЦР ЕBV кач» или«ПЦР ЕBV кол»)
Выявление и количественное определение ДНК вируса Эпштейна-Барр методом ПЦР в «реальном времени» (указать в направлении «качественный тест» или «количественный тест»: «ПЦР ЕBV кач» или«ПЦР ЕBV кол»)
Материал для исследования: плазма или лейкоциты крови, слюна, смывы и мазки из ротоглотки, моча (а также амниотическая жидкость, спинномозговая жидкость, бронхоальвеолярный лаваж)
Забор в стерильную посуду:
моча – в стерильный контейнер на 60 мл, сбор первой утренней порции 20-30 мл, доставить в течение 6 ч.
мазки из ротоглотки – стерильным зондом в специальную пробирку с транспортной средой для респираторных мазков,
забор крови в вакутейнер с ЭДТА (сиреневая пробка)
хранить не более 6 ч
Чувствительность: 400 копий/мл, 5 копий ДНК EBV на 105 клеток Линейный диапазон измерения: 500 – 10.000.000 копий/мл.
Ожидание результата 10 дней
9. Выявление ДНК вируса простого герпеса I и II типов («ПЦР HSV1,2» качественный тест результат в виде «обнаружено – не обнаружено»)
Материал для исследования: осадок утренней мочи, соскобы и мазки
Забор в стерильную посуду:
моча – в стерильный контейнер на 60 мл, сбор первой утренней порции 20-30 мл, доставить в течение 6 ч.
мазки урогенитальные – в специальную пробирку с транспортной средой, на приеме у гинеколога/уролога провести сбор мазка стерильным зондом или цитощеткой в пробирку с транспортной средой для мазков ТСМ, доставить на исследование в течение 2 суток
Чувствительность: 103 ГЭ/мл
Ожидание результата 10 дней
10. Выявление ДНК микобактерий туберкулеза (Mycobacterium tuberculosis complex) («ПЦР MBT» качественный тест, результат в виде «обнаружено – не обнаружено»)
Материал для исследования: смывы с объектов окружающей среды, бронхо-альвеолярный лаваж, моча, кровь,
Забор в стерильную посуду:
смывы – специальным стерильным зондом в специальную пробирку с транспортной средой для респираторных мазков,
моча – в стерильный контейнер на 60 мл, сбор первой утренней порции 20-30 мл,
Доставить в течение 6 ч.
кровь – в вакутейнер с ЭДТА
Чувствительность: 102–103 м.т. /мл.
/мл.
Ожидание результата 10 дней
11. Комплексное выявление возбудителей острых кишечных инфекций в одном образце фекалий: одновременное выявление и дифференциация ДНК (РНК) микроорганизмов рода Шигелла (Shigella spp.) и энтероинвазивных E. coli (EIEC), Сальмонелла (Salmonella spp.) и термофильных Кампилобактерий (Campylobacter spp.), аденовирусов группы F (Adenovirus F) и ротавирусов группы А (Rotavirus A), норовирусов 2 генотипа (Norovirus 2 генотип) и астровирусов (Astrovirus))
Результат в виде «обнаружено – не обнаружено» «ПЦР ОКИ»
Материал для исследования – фекалии
Забор: в специальный стерильный контейнер,
собрать кал из продезинфицированного судна одноразовой лопаточкой на крышке контейнера, доставить в течение 6 ч
Ожидание результата 10 дней
12. Комплексное выявление возбудителей инфекций, передаваемых половым путем, в одном образце клинического материала: одновременное выявление и дифференциация ДНК Neisseria gonorrhoeae, Chlamydia trachomatis, Mycoplasma genitalium и Trichomonas vaginalis («ПЦР ИППП» качественный тест результат в виде «обнаружено – не обнаружено», высокочувствительный метод ПЦР в «реальном времени»)
Материал для исследования: соскобное отделяемое слизистых оболочек урогенитального тракта, прямой кишки, ротоглотки; отделяемое конъюнктивы глаз; образцы мочи
Забор в стерильную посуду:
моча – в стерильный контейнер на 60 мл, сбор первой утренней порция 20-30 мл, доставить в течение 6 ч.
мазки урогенитальные – в специальную пробирку с транспортной средой, на приеме у гинеколога/уролога провести сбор мазка стерильным зондом или цитощеткой в пробирку с транспортной средой для мазков ТСМ, доставить на исследование в течение 2 суток
Ожидание результата 10 дней
Вирусный гепатит В (HBV), количественный
Вирусный гепатит В (HBV), количественный
Вирусный гепатит В (HBV), количественный- исследование для выявления возбудителя гепатита B (HBV), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени (РТ-ПЦР) определяется наличие генетического материала (ДНК) вируса и его количество (вирусная нагрузка) в образце крови. Вирусный гепатит В (ВГВ) – инфекционное заболевание печени, вызванное ДНК-содержащим вирусом гепатита В (HBV). Среди всех причин развития острого гепатита и хронической вирусной инфекции вирус гепатита В считается одной из самых распространенных в мире. Полимеразная цепная реакция отличается высокой чувствительностью и специфичностью. Методом ПЦР можно определить ДНК вируса качественно или количественно. Количественное определение вирусной нагрузки позволяет оценить интенсивность развития болезни, эффективность проводимой терапии или развитие устойчивости к противовирусным препаратам.
Методом ПЦР можно определить ДНК вируса качественно или количественно. Количественное определение вирусной нагрузки позволяет оценить интенсивность развития болезни, эффективность проводимой терапии или развитие устойчивости к противовирусным препаратам.
Существует зависимость между концентрацией вируса в крови и исходом острого вирусного гепатита В. При низком уровне виремии вероятность перехода инфекции в хроническую форму близка к нулю, а инфицированный человек неопасен для окружающих. При высокой вирусной нагрузке (< 105 копий/мл) хронизация возникает часто и больной является потенциальным источником инфекции. Эффективность противовирусной терапии оценивается по уменьшению количества ДНК вируса в крови. Через 3-6 месяцев после начала лечения вирусная нагрузка при адекватном терапевтическом ответе должна уменьшиться на 1-2 порядка. Отсутствие уменьшения количества вируса или его увеличение на фоне проводимого лечения требует пересмотра и изменения терапии. Количественное определение ДНК вируса гепатита В совместно с клинической картиной заболевания и биохимическими показателями, маркерами инфекции, а также результатом пункционной биопсии печени позволяет дать прогноз заболевания и оценить необходимость противовирусной терапии. 7 МЕ/мл).
7 МЕ/мл).
На результаты могут влиять
загрязнение биоматериала;
наличие в образце ингибиторов – химических и белковых субстанций, влияющих на различные компоненты ПЦР;
присутствие в крови гепарина.
Уровень вирусной нагрузки крови не указывает на степень повреждения печени и тяжесть заболевания. Для их оценки необходимо исследовать биохимические показатели и материалы биопсии.
Количественное определение ДНК вируса гепатита В является обязательным исследованием до назначения противовирусной терапии. Во время курса лечения анализ необходимо повторить через 3-6 месяцев.
Вирусный гепатит В нередко сочетается с вирусным гепатитом D.
Назначается в комплексе с
HBsAg
anti-HBc, антитела
anti-HBe, антитела
anti-HBs, антитела
HBеAg
HBV, ДНК [ПЦР качественный]
anti-HDV, антитела
Anti-HCV, антитела, ИФА
Биохимический анализ крови при заболеваниях ЖКТ
Коагулограмма базовая
Как правильно сдать анализы на гепатит C?
Анализы крови при гепатите C
1. Антитела к гепатиту С (anti-HCV). Если вы подозреваете, что можете быть заражены вирусом или хотите провериться, то это первый анализ крови, который нужно сдать. Антитела — это маркер того, что иммунная система вашего организма знакома с вирусом и выработала защитные антитела к нему. Однако наличие антител еще не говорит о болезни.
Антитела к гепатиту С (anti-HCV). Если вы подозреваете, что можете быть заражены вирусом или хотите провериться, то это первый анализ крови, который нужно сдать. Антитела — это маркер того, что иммунная система вашего организма знакома с вирусом и выработала защитные антитела к нему. Однако наличие антител еще не говорит о болезни.
После попадания вируса гепатита в кровь формируется острая форма гепатита С, у которой есть 2 возможных исхода:
- По различным данным в 15-40% случаев происходит спонтанное излечение. Антитела остаются в крови навсегда.
- В остальном большинстве острая форма гепатита становится хронической (ХВГС).
2. Качественный анализ на вирус гепатита С (РНК вируса) методом ПЦР (полимеразная цепная реакция) — следующий этап обследования, в случае выявления антител к вирусу гепатита С. Анализ выявляет генетический материал вируса (РНК). Положительный результат свидетельствует о присутствии и размножении вируса в крови и о необходимости лечения.
Вирус определяется в среднем через 2-6 месяцев после заражения. Чтобы убедиться, что активного вируса в организме нет, необходимо сдавать анализ на антитела через 3, 6 и 12 месяцев после предполагаемого заражения.
3. Количественный анализ на гепатит С методом ПЦР — следующий этап. Выявление количества копий/МЕ вируса на 1 мл крови (вирусная нагрузка) очень важно для оценки активности вируса, прогноза течения заболевания и, в последующем, оценки результативности терапии.
В гастро-гепатоцентре ЭКСПЕРТ качественный и количественный анализ выполняется наиболее точным методом молекулярно-биологического анализа в условиях лаборатории Центра по профилактике и борьбе со СПИД и инфекционными заболеваниями.
Одновременно с количественным анализом следует провести генотипирование вируса. В России встречаются 1, 2, 3 и 4 генотипы вируса гепатита С. От результата этого анализа полностью зависит выбор препаратов для лечения заболевания.
После успешного прохождения лечения качественный анализ рекомендуется сдавать в течение 1 года в качестве контроля и далее 1 раз в год.
Прейскурант
Перечень
платных услуг с указанием цен, оказываемых
в КОГБУЗ «Инфекционная клиническая больница»
Правила оказания платных медицинских услуг
Лицензии и сертификаты
Правила подготовки к исследованиям
Сроки лабораторных исследований
Бесплатные медицинские услуги
Образец простой письменной доверенности для получения результатов анализов другим лицом
Стоимость комплексных исследований
Стоимость забора анализов
ВИЧ-инфекция
Вирусные гепатиты
Коронавирусная инфекция
Герпес-вирусные инфекции
Инфекции, передаваемые половым путем
Другие вирусные инфекции
Клещевые инфекции
Бактериальные инфекции
Паразитарные заболевания
Гельминтозы
Кишечные инфекционные заболевания
Онкомаркеры
Гормоны
Определение иммунного статуса
Исследования крови
Коагулогические исследования
Исследования мочи
Исследования кала
Исследования спиномозговой жидкости
Прочие исследования, не вошедшие в другие разделы лабораторной диагностики
УЗИ
Рентгенография
Другие виды диагностики
Взятие крови из вены на дому Взятие крови из периферической вены в вакутейнер на дому | 562,00 |
Взятие крови из вены Взятие крови из периферической вены в вакутейнер | 75,00 |
Забор материала на УГИ у женщин Получение мазка с шейки матки | 60,00 |
Забор материала на цитологическое Получение мазка с шейки матки для цитологического исследования у женщин | 290,00 |
Забор материала на УГИ у мужчин Получение уретрального отделяемого — соскоб | 60,00 |
Получение мазков со | 200,00 |
Дуоденальное зондирование с анализом | 220,00 |
Для граждан РФ исследование на выявление антител и
антигена р24 к ВИЧ проводится бесплатно
Тест на ВИЧ Определение антител классов M, G (IgM, IgG) к вирусу | 200,00 |
ВИЧ, иммуноблот Определение антител классов M, G (IgM, IgG) к вирусу | 3410,00 |
ВИЧ-1, РНК, Качественное определение РНК вируса иммунодефицита человека методом ПЦР | 1270,00 |
ВИЧ-1, вирусная нагрузка Количественное определение РНК вируса иммунодефицита человека ВИЧ-1 в | 1930,00 |
Лекарственная резистентность ВИЧ Молекуляряно-генетическое исследование плазмы крови на наличие мутаций | 1950,00 |
Гепатит А, Определение антител класса М (anti-HAV IgM) к вирусу | 150,00 |
Гепатит А, anti-HAV Обнаружение антител класса G (anti-HAV IgG) к вирусу | 150,00 |
Гепатит В, HbeAg Определение антигена (HbeAg) вируса гепатита В | 160,00 |
Гепатит В, HBsAg, Определение антигена (HBsAg) вируса гепатита В в | 380,00 |
Гепатит В, HBsAg, качество Определение антигена (HBsAg) вируса гепатита В | 120,00 |
Гепатит В, Определение антител к е-антигену (anti-HBe) вируса | 160,00 |
Гепатит В Определение антител классов к ядерному антигену | 140,00 |
Гепатит В анти-HBcor-IgM Определение антител класса М к ядерному антигену | 150,00 |
Гепатит В anti-HBs, Определение антител к поверхностному антигену | 160,00 |
Гепатит В anti-HBs, Определение антител к поверхностному антигену | 360,00 |
Гепатит В, Определение ДНК вируса гепатита B (Hepatitis B | 830,00 |
Гепатит В, вирусная нагрузка Определение ДНК вируса гепатита B в крови методом ПЦР, количественное | 1480,00 |
Гепатит С, Определение суммарных антител классов М и G (anti-HCV | 190,00 |
Гепатит С, анти-HСV Определение антител к вирусу гепатиту С в крови | 170,00 |
Гепатит С, вирусная нагрузка,
Определение РНК вируса гепатита C в крови методом | 1740,00 |
Гепатит С, вирусная нагрузка
Определение РНК вируса гепатита C в крови методом ПЦР, количественное | 1600,00 |
Гепатит С, РНК, качество
Определение РНК вируса гепатита C в крови методом ПЦР, качественное | 850,00 |
Гепатит С (определение генотипа 1/2/3)
Определение генотипа 1/2/3 вируса гепатита C | 1210,00 |
Гепатит С (определение подтипа
Определение генотипа вируса гепатита C с определением подтипа 1а/1в/2/3а | 2090,00 |
Гепатит D anti-HDV IgM
Определение антител класса М (anti-HDV IgM) | 180,00 |
Гепатит D anti-HDV IgM, IgG суммарно
Определение антител IgM, IgG к вирусу гепатита D в | 180,00 |
Гепатит Е, anti-HEV IgM
Определение антител класса М (anti-HEV IgM) к вирусу | 190,00 |
Гепатит Е
Определение антител класса G к вирусу гепатита Е в крови | 180,00 |
Исследование
возбудителя новой коронавирусной инфекции COVID-19 SARS-cov2
(забор анализов производится в Центре СПИД по адресу Маклина, 3 с понедельника по пятницу с 12-00 до
18-30, 1-й этаж здания,
вход со двора, по предварительной записи по телефону 21-88-98)
Срок изготовления — 2 рабочих дня не считая дня забора
Коронавирус, РНК*
Определение РНК коронавируса ТОРС (SARS-cov) в мазках со слизистой | 970,00 |
Коронавирус, экспресс-тест (при условии заключения договора, для юридических лиц)
Определение антител класса IgG, M к коронавирусу SARS-cov2 в крови | 1590,00 |
Коронавирус, IgM,
Определение антител класса IgM, G к коронавирусу SARS-cov2 IgM, G в крови | 990,00 |
Коронавирус, IgM
Определение антител класса IgM к коронавирусу SARS-cov2 IgM в крови | 500,00 |
Коронавирус, IgG
Определение антител класса IgG к коронавирусу SARS-cov2 IgG в крови | 500,00 |
Справка об отсутствии
| 60,00 |
| Получение мазков со слизистой оболочки носоглотки | 200,00 |
| Взятие крови из вены | 75,00 |
*Цены указаны без стоимости забора анализа
Вирус Эпштейна-Барр, авидность
Определение антител классов М, G (IgМ, | 640,00 |
Вирус Эпштейна-Барр, IgG к ЕА
Определение антител класса G к | 280,00 |
Вирус Эпштейна-Барр, IgG к NA
Определение антител класса G (IgG) к ядерному антигену (NA) | 280,00 |
Вирус Эпштейна-Барр, качество
Определение ДНК вируса Эпштейна-Барр методом ПЦР в периферической и | 1310,00 |
Вирус Эпштейна-Барр, количесвто
Определение ДНК вируса Эпштейна-Барр методом ПЦР в периферической и | 1560,00 |
Герпес, авидность
Определение антител к вирусу простого герпеса в крови методом ИФА (IgM, | 600,00 |
Герпес 6 типа, качество
Определение ДНК вируса герпеса 6 типа (HHV6) методом ПЦР в периферической | 1325,00 |
Герпес 6 типа, количество
Определение ДНК вируса герпеса 6 типа (HHV6) методом ПЦР в периферической | 1716,00 |
Герпес 1 и 2 типов, ДНК, соскоб
Определение ДНК вируса простого герпеса 1 и 2 типов в отделяемом из | 640,00 |
Герпес 1 и 2 типов, ДНК, кровь
Определение ДНК вируса простого герпеса 1 и 2 типов методом ПЦР в крови, качественное | 660,00 |
Сифилиис (RW)
Антитела к бледной трепонеме в крови, | 140,00 |
Хламидиоз (хл.
Антитела IgA, IgM, IgG к хламидии пневмонии в крови, ИФА | 450,00 |
Хламидиоз (хл.трахоматис)
Антитела IgA, IgG к хламидии трахоматис в крови, ИФА | 380,00 |
Хламидиоз, ДНК
ДНК хламидии трахоматис, соскоб, ПЦР | 630,00 |
Уреаплазмомз, ДНК
ДНК уреаплазмы, соскоб, ПЦР, | 580,00 |
Микоплазмоз, ДНК
ДНК микоплазмы хоминис, соскоб, ПЦР, качественное исследование | 630,00 |
Микоплазмоз, IgM, IgG
Антитела IgM, IgG к микоплазме пневмонии в крови, ИФА | 864,00 |
Мико и уроеаплазмоз, бак-посев
Исследование на мико и уреаплазму, соскоб, бак-посев на среде DUO | 730,00 |
Мико и уроеаплазмоз,
Определение антибиотикочувствительности микроорганизмов (мико, | 1230,00 |
Токсоплазмоз, IgM, IgG
Антитела IgM, IgG-Авидность к токсоплазме в крови, ИФА | 660,00 |
Токсоплазмоз
Молекулярно-биологическое исследование крови на токсоплазмы | 730,00 |
Папилломавирус (ВПЧ ВКР)
Определение ДНК вирусов папилломы человека высокого канцерогенного риска | 740,00 |
Мазок на GN
Микроскопическое исследования | 290,00 |
Цитомегаловирус (ЦМВ), авидность
Определение антител классов М, G (IgM, IgG) к цитомегаловирусу в крови | 770,00 |
Цитомегаловирус (ЦМВ), ДНК, соскоб
Определение ДНК цитомегаловируса в отделяемом из уретры методом | 570,00 |
Цитомегаловирус (ЦМВ), ДНК, кровь
Определение ДНК цитомегаловируса | 650,00 |
Краснуха Определение антител IgM, IgG, авидность к вирусу краснухи в крови методом | 680,00 |
Ротавирус Определение антигенов ротавирусов в образцах фекалий методом ИФА | 330,00 |
Хантавирус (ГЛПС)
Определение антител к хантавирусам, возбудителям геморрагической лихорадки почечным синдромом в крови методом ИФА | 620,00 |
Норвовирус
Определение антигенов норовирусов в образцах фекалий методом ИФА | 380,00 |
Грипп Исследование мазков со слизистой оболочки носоглотки на вирус гриппа. | 850,00 |
Грипп А, РНК
Определение РНК вируса гриппа А в | 1134,00 |
Грипп А, РНК h2N1 и h4N2
Определение РНК вируса гриппа А в | 1134,00 |
Риновирусы
Молекулярно-биологическое исследование мазков со слизистой оболочки | 1260,00 |
Полиовирусы Молекулярно-биологическое исследование фекалий на полиовирусы — РНК | 1010,00 |
Клещевой энцефалит, IgM, IgG
Определение антител к вирусу клещевого энцефалита в крови (IgM, IgG), ИФА | 490,00 |
Клещевой энцефалит, клещ
Определение антигена вируса клещевого энцефалита — исследование клеща методом ПЦР | 504,00 |
Боррелиоз, IgM, IgG
Определение антител к возбудителям иксодовых клещевых боррелиозов в | 510,00 |
Боррелиоз, ДНК
Молекулярно-биологическое исследование крови на | 708,00 |
Эрлихиоз и анаплазмоз, кровь
Исследование крови на эрлихиоз и анаплазмоз, | 880,00 |
Боррелиоз, Эрлихиоз, Анаплазмоз, клещ
Исследование клеща на антиген вируса | 940,00 |
Менингококк, слизь
Микробиологическое (культуральное) исследование слизи с задней стенки | 900,00 |
Менингококк, спинномозговая жидкость
Микробиологическое (культуральное) исследование спинномозговой | 1450,00 |
Коклюш Антитела IgM, IgG к возбудителю | 752,00 |
Паракоклюш Антитела к возбудителю паракоклюша в крови (IgM, IgG), ИФА | 752,00 |
Менингококк, слизь
Микробиологическое (культуральное) исследование слизи с задней стенки | 900,00 |
Лептоспироз IgM
Антитела IgM к лептоспире интерроганс в крови, ИФА | 1053,00 |
Лептоспироз IgG
Антитела IgG к лептоспире интерроганс в крови, ИФА | 863,00 |
Хеликобактер пилори
Антитела к хеликобактер пилори в крови, ИФА | 370,00 |
Дифтерия
Микробиологическое исследование слизи и пленок с миндалин на палочку | 370,00 |
Туляремия
Антитела к бруцеллам в крови, ИФА | 280,00 |
Риккетсиоз Антитела к риккетсиям — возбудителям клещевых пятнистых лихорадок в крови, ИФА | 270,00 |
Коксиеллёз
Антител IgG фаза 2 к коксиелле Бернета в крови, ИФА | 576,00 |
Стафилококк, кал
Определение антител к стафилококкам в кале | 750,00 |
Микобактерии, мокрота
Микроскопическое исследование мокроты на микобактерии (Mycobacterium | 260,00 |
Туберкулез, мокрота
Микроскопическое исследование нативного и окрашенного препарата мокроты | 280,00 |
Иерсиниоз (энтероколитика)
Антитела IgM, IgG к иерсинии энтероколитика в крови, ИФА | 837,00 |
Иерсиниоз (псевдотуберкулез)
Антитела IgM, IgG к иерсинии псевдотуберкулеза в крови, ИФА | 701,00 |
Иерсиниоз, кал
Микробиологическое (культуральное) исследование фекалий/ректального | 560,00 |
Лямблиоз Антитела IgM, IgA, IgG к лямблиям в крови, ИФА | 370,00 |
Лямблиоз (определение титра)
Антитела классов IgM, IgA, IgG к лямблиям в крови с определением титра, ИФА | 730,00 |
Малярия Микроскопическое исследование «толстой капли» и «тонкого» мазка крови на малярийные плазмодии | 480,00 |
Кал на яйца глист
Микроскопическое | 200,00 |
Энтеробиоз, соскоб
Взятие | 170,00 |
Аскаридоз
Антитела IgG к аскаридам в крови с | 810,00 |
Описторхоз Антитела IgМ, IgG, циркулирующие | 580,00 |
Описторхоз (определение
Антитела IgG к возбудителю описторхоза в | 770,00 |
Токсокароз (определение
Антитела IgG к токсокаре в крови с | 713,00 |
Эхинококкоз Антитела IgG к эхинококку однокамерному | 457,00 |
Эхинококкоз (определение
Антитела IgG к эхинококку однокамерному | 880,00 |
Трихинеллёз Антител к трихинеллам в крови (IgM, IgG), ИФА | 450,00 |
Трихинеллёз (определение
Определение антител к трихинеллам (Trichinella | 744,00 |
Кампилобактерии Определение ДНК патогенных кампилобактерий в образцах фекалий методом ПЦР | 1160,00 |
Сальмонеллез, кал
Микробиологическое (культуральное) исследование фекалий/ректального | 670,00 |
Сальмонеллез, кровь
Антитела к сальмонелле кишечной в крови | 440,00 |
Паратиф А
Антитела к сальмонелле паратифа А в крови | 400,00 |
Паратиф В
Антитела к сальмонелле паратифа В в крови | 400,00 |
Паратиф С
Антител к сальмонелле паратифа С в | 400,00 |
Брюшной тиф (Vi антиген)
Антитела к сальмонелле тифи в крови (к Vi антигену) | 738,00 |
Брюшной тиф и паратиф, кал
Микробиологическое (культуральное) исследование фекалий на возбудители | 670,00 |
Брюшной тиф и паратиф, кровь
Микробиологическое (культуральное) исследование крови | 590,00 |
Дизенетрия, кал
Микробиологическое (культуральное) исследование фекалий/ректального | 670,00 |
Шигеллез (Дизенетерия)
Антитела IgM, IgG к шигелле дизентерии в крови | 400,00 |
Шигеллез (шигелла Боуди)
Антитела IgM, IgG к шигелле Боуди в крови | 360,00 |
Шигеллез (шигелла Зонне)
Антитела IgM, IgG к шигелле Зонне в крови | 400,00 |
Шигеллез (шигелла Флекснера)
Анттела IgM, IgG к шигелле Флекснера в крови | 400,00 |
Энтеровирус Определение РНК не полиомиелитных | 760,00 |
Холера Микробиологическое (культуральное) исследование фекалий | 450,00 |
СА-125 (карбоантиген)
Опухолеассоциированная протеинкиназа в крови | 290,00 |
ПСА Простатспецифический антиген в крови | 259,00 |
ТТГ (тиреотропный гормон) в крови | 210,00 |
Т3 общий
(уровень общего трийодтиронина) в крови | 200,00 |
Т3 свободный
(уровень свободного трийодтиронина СТ3) в крови | 240,00 |
Т4 общий
(уровень общего тироксина) сыворотки крови | 200,00 |
Т4 свободный
(уровень свободного тироксина СТ4) в сыворотке крови | 220,00 |
Анти-ТГ
(содержание антител к тироглобулину) в сыворотке крови | 230,00 |
Анти-ТПО
(содержания антител к тиреопероксидазе) в крови | 240,00 |
Клеточный иммунитет, фагоцитоз (иммунограмма)
Исследование фагоцитарной активности лейкоцитов периферической крови | 3630,00 |
Макрофагальная активность (НСТ)
Исследование крови | 345,00 |
Фагоцитарная активность нейтрофилов и
Исследование крови | 1060,00 |
Уровень ЦИК
Исследование уровня циркулирующих иммунных комплексов в крови, | 110,00 |
Иммуноглобулина классов А, М, G
Исследование уровня иммуноглобулинов классов А,М,G в крови (IgA, IgM, | 780,00 |
Иммуноглобулин Е Исследование уровня общего иммуноглобулина Е в крови (IgE) | 210,00 |
Иммуноглобулин А
Исследование уровня иммуноглобулинов класса А в крови (IgA) | 373,00 |
Иммуноглобулин M
Исследование уровня иммуноглобулинов класса M в крови (IgМ) | 373,00 |
Иммуноглобулин G
Исследование уровня иммуноглобулинов класса G в крови (IgG) | 373,00 |
Кровь на стерильность
Микробиологическое (культуральное) исследование крови на стерильность | 820,00 |
Группа крови, резус-фактор
Определение основных групп по системе AB0 и определение | 310,00 |
Подгруппа крови
Определение подгруппы и других групп крови меньшего значения А-1, А-2, D, | 870,00 |
Общий анализ крови
| 194,00 |
Общий анализ крови развернутый (лейкоциатрная
| 226,00 |
СОЭ
Исследование скорости оседания эритроцитов | 70,00 |
Тромбоциты Исследование уровня тромбоцитов в крови | 170,00 |
Ретикулоциты Исследование уровня ретикулоцитов в крови | 140,00 |
Тест Кумбса
Непрямой антиглобулиновый тест — определение антиэритроцитарных антител | 320,00 |
Антистрептолизин-О
Определение антистрептолизина-О в сыворотке крови | 250,00 |
Ревматоидные факторы
Исследование ревматоидных факторов в крови | 284,00 |
Газы крови
Исследование кислотно-основного состояния и газов крови | 220,00 |
Железо Исследование уровня железа сыворотки крови | 170,00 |
С-реактивный белок
Исследование уровня С-реактивного белка в сыворотке крови | 180,00 |
Общий белок
Исследование уровня общего белка в крови | 70,00 |
Альбумин
Исследование уровня альбумина в крови | 150,00 |
Мочевина Исследование уровня мочевины в крови | 190,00 |
Креатинин
Исследование уровня креатинина в крови | 190,00 |
Билирубин общий
Исследование уровня общего билирубина в крови | 190,00 |
Билирубин прямой
Исследование уровня билирубина связанного (конъюгированного) в крови | 190,00 |
Глюкоза Исследование уровня | 190,00 |
Лактат крови
Исследование уровня лактата в спинномозговой жидкости | 240,00 |
Триглицериды
Исследование уровня триглицеридов в крови | 200,00 |
Общий холестерин
Исследование уровня холестерина в крови | 190,00 |
Холестерин ЛПВП
Исследование уровня липопротеинов в крови | 100,00 |
Холестерин ЛПНП
Исследование уровня холестеринна липопротеинов низкой плотности в крови | 120,00 |
Гликированный гемоглобин
Исследование уровня гликированного гемоглобин в крови | 1347,00 |
Мочевая кислота
Исследование уровня мочевой кислоты в крови | 161,00 |
Альфа-фетопротеин
Исследование уровня альфа-фетопротеина в сыворотке крови | 430,00 |
Ферритин Исследование уровня ферритина в крови | 572,00 |
Лактатдегидрогеназа (ЛДГ)
Определение активности лактатдегидрогеназы в крови (ЛДГ) | 170,00 |
АСТ- аспартатаминотрансфераза
Определение активности аспартатаминотрансферазы в крови (АSТ) | 180,00 |
АЛТ — аланинаминотрансфераза
Определение активности аланинаминотрансферазы в крови (АЛТ) | 140,00 |
КФК — креатинкиназа Определение активности креатинкиназы в крови (КФК) | 150,00 |
J-глютамилтрансфераза
Определение активности гамма-глютамилтрансферазы в крови | 140,00 |
Амилаза Определение активности амилазы в крови | 140,00 |
Щелочная фосфатаза
Определение активности щелочной фосфатазы в крови | 150,00 |
Прокальцитонит
Исследование уровня прокальцитонита в крови | 320,00 |
Калий Исследование уровня калия в крови | 150,00 |
Натрий Исследование уровня натрия в крови | 150,00 |
Кальций Исследование уровня общего кальция в | 150,00 |
Хлориды Исследование уровня хлоридов в крови | 150,00 |
Фибриноген Исследование уровня фибриногена в крови | 240,00 |
Тромбопластиновое время (АЧТВ, свертываемость) Активированное частичное тромбопластиновое время (АЧТВ) | 210,00 |
Времени кровотечения по Дюке
| 90,00 |
Д-димер
Исследование фибринолитической активности крови (Д-димер) | 660,00 |
Протромбиновое время (по Квику, МНО)
Определение протромбинового (тромбопластинового) времени в крови или в плазме | 190,00 |
Тромбиновое время
Определение тромбинового времени в крови | 230,00 |
Время свертывания плазмы
Определение время свертывания плазмы, активированное каолином (и/или) кефалином (ВСК) | 190,00 |
Общий
| 220,00 |
Аэробы, анаэробы, УПМ
Микробиологическое (культуральное) исследование спинномозговой | 530,00 |
Исследование мочи методом Нечипоренко
| 120,00 |
Исследование мочи методом Зимницкого
| 190,00 |
Общий анализ мочи
| 170,00 |
Клиренс креатинина
Исследование уровня креатинина в моче | 100,00 |
Желчны пигменты
Исследование уровня желчных пигментов в моче | 100,00 |
Белок Определение белка в моче | 80,00 |
Глюкоза Исследование уровня глюкозы в моче | 97,00 |
Кетоновые тела, экспресс-тест
Обнаружение кетоновых тел в моче экспресс-методом (тест-полоска) | 100,00 |
Альфа-амилаза
Определение активности альфа-амилазы в моче | 140,00 |
Аэробы, анаэробы и УПМ
Микробиологическое исследование мочи на аэробные и | 530,00 |
Копрологическое исследование
| 270,00 |
Условно-патогенная флора
Микробиологическое (культуральное) исследование кала | 750,00 |
Дисбактериоз
Исследование микробиоценоза кишечника | 1700,00 |
Кал на скрытую кровь
Экспресс-исследование кала на скрытую кровь иммунохроматографическим | 281,00 |
Условно-патогенная флора, слизь
Микробиологическое (культуральное) исследование слизи с миндалин и задней | 790,00 |
Анаэробы, гнойное отделяемое
Микробиологическое (культуральное) исследование гнойного отделяемого диабетических язв на анаэробные | 820,00 |
Аэробы, анаэробы суставной жидкости
Микробиологическое (культуральное) исследование синовиальной жидкости на | 820,00 |
Аэробы, анаэробы лаважной жидкости
Микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы | 810,00 |
Аэробы, анаэробы плевральной жидкости
Микробиологическое (культуральное) исследование плевральной жидкости на аэробные и | 810,00 |
Аэробы, анаэробы желчи
Микробиологическое (культуральное) исследование желчи на аэробные и факультативно-анаэробные | 810,00 |
Аэробы, анаэробы грудного молока
Микробиологичское (культуральное) исследование грудного молока на аэробные и факультативно-анаэробные | 598,00 |
Микробиологичское | 676,00 |
Золотистый стафилококк
Микробиологичское (культуральное) | 598,00 |
Чувствительность к антибиотикам
Определение чувствительности микроорганизмов к антимикробным | 520,00 |
Чувствительность к бактериофагам
Определение чувствительности микроорганизмов к бактериофагам | 560,00 |
Комплексные исследования
Исследования, рекомендуемые при подготовке к оперативным вмешательствам
Исследования на антитела к ВИЧ (тест на ВИЧ) – бесплатно для граждан РФ
Определение антигена к вирусу гепатита B (HbsAg Hepatitis B virus) в крови (HBsAg) – 120,00 р.
Определение антител классов M, G (IgM, IgG) к вирусному гепатиту C (Hepatitis C virus)
в крови (анти-НСV сумм.) – 190,00 р.
Определение антител к бледной трепонеме (Treponema pallidum) в крови (Исследование на сифилис методом ИФА
и РМП) – 140,00 р.
Забор крови из вены – 75,00 р.
Итого: 525,00 р.
Дополнительно возможно определение группы крови и резус-фактора – 310,00 р.
Забор крови из вены – 75,00 р
Комплексное обследование на заболевания, передающиеся половым путем (урогенитальные инфекции)
ДЛЯ ЖЕНЩИН
(на 6-8 день от первого дня менструации;)
Стоимость комплексного обследования: от 2615,00 р.
Включает в себя
1. Исследование крови на:
— определение антител к ВИЧ – бесплатно для граждан РФ
— определение антигена к вирусу гепатита B (HbsAg) в крови – 120,00 р.
— определение антител классов M, G (IgM, IgG) к вирусному гепатиту C в крови (анти-НСV сумм. ) – 190,00 р.
) – 190,00 р.
— определение антител к бледной трепонеме (Treponema pallidum) в крови (Исследование на сифилис методом ИФА и РМП) – 140,00 р.
— определение антител к хламидии трахоматис в крови (Хламидиоз методом ИФА (IgA, IgG) – 380,00 р.
— забор крови из вены – 75,00 р.
2. Исследование мазков (соскоб)
— молекулярно-биологическое исследование отделяемого из уретры на хламидии (Chlamydia trachomatis) (Выявление ДНК Сhlamydia trachomatis (хламидиоз – соскоб) – 630,00 р.
— микробиологическое
исследование на уреаплазму (Мико, уреаплазмоз – бак-посев на среде DUO) – 730,00 р.
— исследования
на флору (микроскопия мазков) – 290,00 р.
— забор материала на УГИ у женщин – 60,00 р.
По рекомендации врача Вы можете пройти молекулярно-биологическое
исследование на вирус папилломы человека высокого канцерогенного риска (ВПЧ – соскоб) – 740,00 р.
Итого (с учетом дополнительных исследований): 3355,00 р.
Обследование на внутриутробные инфекции (рекомендуется при планировании беременности)
Стоимость обследования: от 2785,00 р.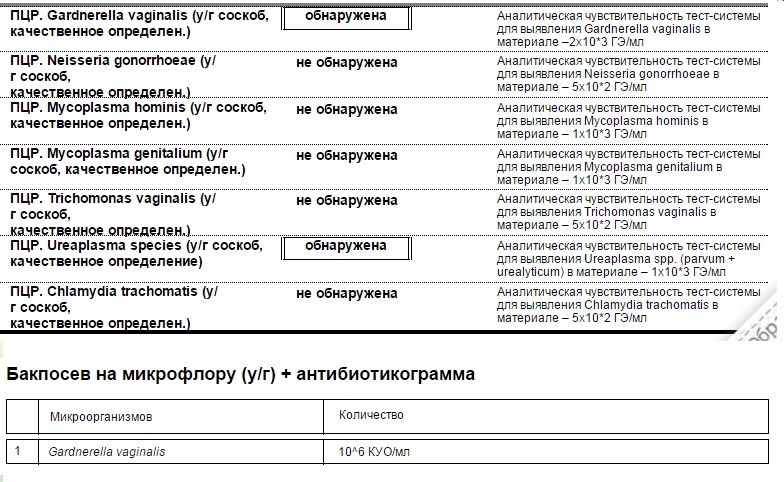
Включает в себя:
— определение
антител к токсоплазме (Toxoplasma gondii) в крови (метод ИФА) – 660,00 р.
— определение
антител классов M, G (IgM, IgG) к цитомегаловирусу в крови (метод ИФА) – 770,00 р.
— определение
антител классов M, G (IgM, IgG) к вирусу краснухи в крови (метод ИФА) – 680,00 р.
— определение
антител классов M, G (IgM, IgG) к вирусу простого герпеса в крови (метод ИФА) – 600,00 р.
— забор крови из вены – 75,00 р.
Комплексное обследование на заболевания, передающиеся половым путем (урогенитальные инфекции)
ДЛЯ МУЖЧИН
Стоимость комплексного обследования: от 2615,00 р.
Включает в себя:
1. Исследование крови на:
— определение антител к ВИЧ – бесплатно для граждан РФ
— определение антигена к вирусу гепатита B (HbsAg) в крови – 120,00 р.
— определение антител классов M, G (IgM, IgG) к вирусному гепатиту C в крови (анти-НСV сумм.) – 190,00 р.
— определение антител к бледной трепонеме (Treponema pallidum) в крови (Исследование на сифилис методом ИФА и РМП) – 140,00 р.
— определение антител к хламидии трахоматис в крови (Хламидиоз методом ИФА (IgA, IgG) – 380,00 р.
— забор крови из вены – 75,00 р.
2. Исследование мазков (соскоб)
— молекулярно-биологическое исследование отделяемого из уретры на хламидии (Chlamydia trachomatis) (Выявление ДНК Сhlamydia trachomatis (хламидиоз – соскоб) – 630,00 р.
— микробиологическое
исследование на уреаплазму (Мико, уреаплазмоз – бак-посев на среде DUO) – 730,00 р.
— исследования
на флору (микроскопия мазков) – 290,00 р.
— забор материала на УГИ у мужчин – 60,00 р.
Для повышения точности
диагностики возможно проведение дополнительных исследований методом ПЦР:
— выявление ДНК Ureaplasma
urealiticum (уреаплазмоз) – соскоб – 580,00 р.
— выявление ДНК Mycoplasma
hominis (микоплазмоз) – соскоб – 650,0 р.
Итого (с учетом дополнительных исследований): от 3845,00 р.
Прием (осмотр, консультация) врача-акушера-гинеколога первичный | 130,00 |
Прием (осмотр, консультация) врача-акушера-гинеколога повторный | 95,00 |
Прием (осмотр, консультация) врача-аллерголога-иммунолога первичный | 190,00 |
Прием (осмотр, консультация) врача-аллерголога-иммунолога повторный | 130,00 |
Прием (осмотр, консультация) врача-дерматовенеролога первичный | 80,00 |
Прием (осмотр, консультация) врача-дерматовенеролога повторный | 70,00 |
Прием (осмотр, консультация) врача-инфекциониста первичный | 175,00 |
Прием (осмотр, консультация) врача-инфекциониста повторный | 130,00 |
Прием (осмотр, консультация) врача-педиатра первичный | 190,00 |
Прием (осмотр, консультация) врача-педиатра повторный | 150,00 |
Прием (осмотр, консультация) врача-терапевта первичный | 170,00 |
Прием (осмотр, консультация) врача-терапевта повторный | 140,00 |
Удаление поверхностно расположенного инородного тела (удаление клеща) | 140,00 |
Оформление сертификата об отсутствии ВИЧ-инфекции для иностранных | 745,00 |
Оформление сертификата об отсутствии ВИЧ-инфекции для граждан РФ | 480,00 |
Справка об отсутствии ВИЧ-инфекции | 50,00 |
| Справка об отсутствии коронавирусной инфекции SARS-CoV-2 | 60,00 |
Услуги предоставляются по адресу ул. Ленина, 207
Ленина, 207
Запись по телефону 22-30-22
УЗИ
Ультразвуковое исследование органов | 800,00 |
Ультразвуковое исследование органов | 880,00 |
Ультразвуковое исследование почек | 460,00 |
Ультразвуковое исследование почек | 480,00 |
Ультразвуковое исследование мочевого | 306,00 |
Ультразвуковое исследование мочевого | 334,00 |
Ультразвуковое исследование щитовидной | 312,00 |
Ультразвуковое исследование щитовидной | 326,00 |
Ультразвуковое исследование печени | 1214,00 |
Рентгенография
Рентгенография легких (в одной проекции) | 322,00 |
Рентгенография легких (в двух проекциях) | 508,00 |
Рентгенография легких | 408,00 |
Рентгенография легких | 602,00 |
Томография легких | 991,00 |
Томография легких | 1185,00 |
Рентгенография придаточных пазух носа | 343,00 |
Рентгенография придаточных пазух | 408,00 |
Рентгенография всего черепа, в одной или | 505,00 |
Рентгенография всего черепа, в одной или | 602,00 |
Обзорный снимок брюшной полости и | 620,00 |
Обзорный снимок брюшной полости и | 740,00 |
Рентгенография всего таза | 343,00 |
Рентгенография всего таза | 408,00 |
Рентгенография шейного отдела | 343,00 |
Рентгенография шейного отдела | 408,00 |
Рентгенография грудного отдела | 505,00 |
Рентгенография грудного отдела | 602,00 |
Рентгенография поясничного отдела | 343,00 |
Рентгенография поясничного отдела | 408,00 |
Внутривенная урография | 1314,00 |
Внутривенная урография | 1524,00 |
Рентгенография кисти руки | 341,00 |
Рентгенография кисти руки | 408,00 |
Рентгенография коленного сустава | 343,00 |
Рентгенография коленного сустава | 408,00 |
Обзорная урография (рентгенография | 538,00 |
Обзорная урография (рентгенография | 635,00 |
Рентгенография локтевого сустава | 365,00 |
Рентгенография локтевого сустава | 435,00 |
Рентгенография стопы в двух проекциях | 424,00 |
Рентгенография стопы в двух | 502,00 |
Рентгенография пальцев фаланговых костей | 365,00 |
Рентгенография пальцев фаланговых костей | 435,00 |
Рентгенография стопы в одной проекции | 350,00 |
Рентгенография стопы в одной | 435,00 |
Рентгенография фаланг пальцев ноги | 350,00 |
Рентгенография фаланг пальцев ноги | 435,00 |
Рентгенография поясничного и крестцового | 505,00 |
Рентгенография поясничного и крестцового | 542,00 |
Рентгенография крестца и копчика | 365,00 |
Рентгенография крестца и копчика | 435,00 |
Рентгенография ребра (ребер) | 365,00 |
Рентгенография ребра (ребер) | 435,00 |
Рентгенография плечевой кости | 365,00 |
Рентгенография плечевой кости | 435,00 |
Рентгенография плечевой кости | 365,00 |
Рентгенография плечевой кости | 435,00 |
Рентгенография локтевой кости и лучевой | 365,00 |
Рентгенография локтевой кости и лучевой | 435,00 |
Рентгенография запястья | 365,00 |
Рентгенография запястья | 435,00 |
Рентгенография головки и шейки бедренной | 365,00 |
Рентгенография головки и шейки бедренной | 435,00 |
Рентгенография лучезапястного сустава | 365,00 |
Рентгенография лучезапястного | 435,00 |
Рентгенография голеностопного сустава | 365,00 |
Рентгенография голеностопного | 435,00 |
Рентгенография височно-нижнечелюстного | 421,00 |
Рентгенография височно-нижнечелюстного | 520,00 |
Рентгенография мягких тканей лица | 365,00 |
Рентгенография мягких тканей лица | 435,00 |
Рентгенография мягких тканей шеи | 343,00 |
Рентгенография мягких тканей шеи | 408,00 |
Рентгенография мягких тканей верхних | 343,00 |
Рентгенография мягких тканей верхних | 408,00 |
Рентгенография мягких тканей нижней | 343,00 |
Рентгенография мягких тканей нижней | 408,00 |
Рентгенография мягких тканей туловища | 421,00 |
Рентгенография мягких тканей | 520,00 |
Другие
виды исследований
Ректороманоскопия (в стационарном | 441,00 |
ЭКГ (Регистрация электрокардиограммы ЭКГ Телефон | 230,00 |
Электрокардиография с физической | 240,00 |
Услуги предоставляются при госпитализации в отделения стационара по адресу г. Киров, ул. Ленина, 207
Киров, ул. Ленина, 207
Консультации специалистов стационара
Прием (осмотр, консультация) врача-инфекциониста первичный | 170,00 |
Прием (осмотр, консультация) врача-инфекциониста повторный | 120,00 |
Прием (осмотр, консультация) врача-невролога первичный | 170,00 |
Прием (осмотр, консультация) врача-невролога повторный | 120,00 |
Прием (осмотр, консультация) врача-терапевта первичный | 170,00 |
Прием (осмотр, консультация) врача-терапевта повторный | 140,00 |
Осмотр (консультация) врача-физиотерапевта | 80,00 |
Пребывание в стационаре. Стоимость за 1 койко-день, рубли
Стоимость за 1 койко-день, рубли
Ежедневный осмотр врачом-инфекционистом с | 2015,00 |
Ежедневный осмотр врачом-инфекционистом с | 1900,00 |
Ежедневный осмотр врачом-инфекционистом с | 2000,00 |
Ежедневный осмотр врачом-инфекционистом с наблюдением | 2000,00 |
Ежедневный осмотр врачом-инфекционистом с | 2415,00 |
Суточное наблюдение реанимационного пациента в | 8820,00 |
Пребывание в палате повышенной комфортности | 480,00 |
Прочие медицинские
услуги стационара.
Стоимость за 1 процедуру
Подкожное введение лекарственных препаратов | 40,00 |
Внутрикожное введение лекарственных препаратов | 50,00 |
Внутримышечное введение лекарственных препаратов | 40,00 |
Взятие крови из пальца | 50,00 |
Взятие крови из периферической вены (Взятие крови из вены в вакутейнер) | 75,00 |
Катетеризация кубитальной и других периферических вен | 90,00 |
Внутривенное введение лекарственных препаратов (В/венное введение | 140,00 |
Услуги физиотерапевтического
кабинета стационара
Стоимость за 1 процедуру
Электрофорез лекарственных препаратов | 165,00 |
Электрофорез лекарственных препаратов эндоназальный | 165,00 |
Электрофорез лекарственных препаратов при патологии легких | 110,00 |
Внутриушной электрофорез лекарственных препаратов | 70,00 |
Воздействие токами ультравысокой частоты | 117,00 |
Воздействие токами ультравысокой частоты | 110,00 |
Ультрафиолетовое облучение ротоглотки | 110,00 |
Ультрафиолетовое облучение слизистой носа | 110,00 |
Ингаляторное введение лекарственных препаратов через небулайзер | 110,00 |
ПЦР исследования — Медицинский центр «КОНСУЛЬТАНТ»
Полимеразная цепная реакция (ПЦР) – высокоточный метод молекулярно-генетической диагностики, который позволяет выявить у человека различные инфекционные и наследственные заболевания, как в острой стадии, так и задолго до того, как заболевание может себя проявить.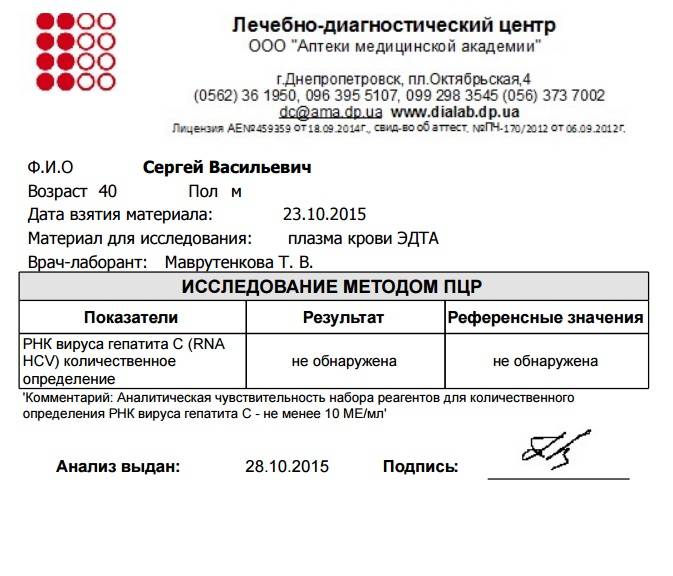
Это самый современный метод молекулярной биологии.
В настоящее время метод амплификации нуклеиновых кислот (НК) полимеразной цепной реакцией (ПЦР) уже достаточно широко используется в нашем центре как эффективный инструмент лабораторной диагностики.
Лаборатория оснащена необходимым современным оборудованием для ПЦР. В наличии имеется Амплификатор с детекцией в режиме реального времени CFX 96 Touch. Данный прибор относится к новейшей линейке приборов компании BIO-RAD (США) — амплификаторам серии 1000. Он занимает одно из лидирующих мест на рынке ПЦР-диагностики. Позволяет проводить мультиплексный анализ до 5 мишеней (5 инфекций в одной пробирке) в 96 пробах одновременно. Также имеется амплификатор АЛА ¼ производства Латвии. При помощи данного прибора проводится исследование по «конечной точке», т.е. на наличие ДНК/РНК возбудителя (без определения количества). Диагностические наборы реагентов для выявления и количественного определения ДНК/РНК возбудителей урогенитальных инфекций, гепатитов и пневмоний приобретаются в ООО «ИнтерЛабСервис» г. Москва.
Москва.
Материалом для ПЦР-исследования, в котором можно выявить чужеродную ДНК или РНК бактерии или вируса могут служить различные биологические среды и жидкости человека: моча, плазма крови, мокрота, соскоб эпителиальных клеток, сок простаты, околоплодные воды, плевральная жидкость.
При обследовании на инфекции, передающиеся половым путем (ИППП), у мужчин и женщин с помощью стерильного зонда из половых органов делается соскоб из шейки матки, влагалища или соскоб из уретры (мочеиспускательного канала), моча.
При обследовании на инфекции (герпетические инфекции, ЦМВИ, гепатиты В, С, Д) на ПЦР забирают кровь.
При обследовании на вирусы Эпштейн-Барра, Цитомегаловирус и Герпес 6-го типа в качестве материала забираются кровь из вены, слюна или соскоб из ротовой полости.
Перечень исследований:
1.Определение ДНК вируса гепатита В (HBV) в плазме крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени».

Аналитические показатели
Определяемый фрагмент – специфичный участок ДНК вируса гепатита В. Специфичность определения — 100%. Чувствительность определения — 50 МЕ/мл.
2. Количественное определение ДНК вируса гепатита В (HBV) (оценка вирусной нагрузки) в плазме крови методом ПЦР с детекцией в режиме реального времени.
Аналитические показатели
Определяемый фрагмент – специфический участок ДНК вируса гепатита В. Клиническая специфичность теста: 100%. Чувствительность теста составляет 75 МЕ/мл.
Количественная характеристика содержания ДНК гепатита В в клинических образцах важна для оценки эффективности противовирусной терапии.
3. Определение РНК вируса гепатита С (HСV) в плазме крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени».
Аналитические показатели
Определяемый фрагмент — специфичный участок РНК вируса гепатита С. 5 МЕ/мл наряду с определением генотипа вируса является независимым и наиболее информативным параметром прогнозирования эффективности лечения. Снижение концентрации РНК гепатита С к третьему дню от начала терапии на 85% является быстрым и точным параметром для предсказания эффективности терапии, приводящей к раннему вирусологическому ответу.
5 МЕ/мл наряду с определением генотипа вируса является независимым и наиболее информативным параметром прогнозирования эффективности лечения. Снижение концентрации РНК гепатита С к третьему дню от начала терапии на 85% является быстрым и точным параметром для предсказания эффективности терапии, приводящей к раннему вирусологическому ответу.
5. Определение РНК вируса гепатита D (НDV) в сыворотке крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени».
Вирус гепатита D передаётся парентеральным путём и обнаруживается только у лиц, инфицированных вирусом гепатита В. Развивающийся в этом случае хронический гепатит, протекает очень тяжело, c массивным поражением печени, часто сопровождается отёками и асцитом.
Аналитические показатели
Определяемый фрагмент — специфичный участок РНК вируса гепатита D. Специфичность определения — 100%. Чувствительность определения — 50 МЕ/мл.
6. Определение ДНК вируса простого герпеса (HSV) I типа (губного или лабиального) и II типа (генитального) в соскобах эпителиальных клеток урогенитального тракта методом полимеразной цепной реакции (ПЦР).
Вирусы простого герпеса 1-го (ВПГ-1) типа и 2-го (ВПГ-2) типа относят к семейству герпесвирусов (Herpesviridae), общим свойством которых является постоянное персистирование в организме после инфицирования. Попадают в организм через слизистые (обычно «входные ворота» для ВПГ-1 – слизистые ротовой полости и носоглотки, для ВПГ-2 – слизистые половых органов). Клинические проявления герпетической инфекции в любой форме (высыпания на коже и слизистых оболочках, симптомы поражения нервных клеток и др.), как правило, свидетельствуют о снижении иммунитета. Первичная герпетическая инфекция и реактивация инфекции (в гораздо меньшей степени) в период беременности могут вызывать патологию беременности, внутриутробное инфицирование плода или инфицирование ребенка во время родов.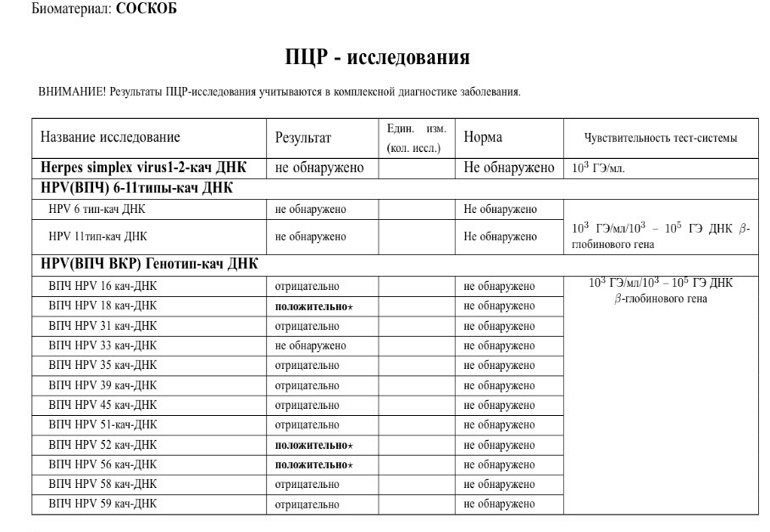
7. Определение ДНК Цитомегаловируса (CMV) в крови и соскобах эпителиальных клеток урогенитального тракта методом полимеразной цепной реакции (ПЦР).
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинические проявления CMV-инфекции отмечаются чаще всего у пациентов с врождёнными или приобретенными иммунодефицитами (в том числе вследствие ВИЧ-инфекции, применения иммунодепрессантов при трансплантации органов и др.), а также на фоне физиологических иммунодефицитных состояний (дети первых 3 — 5 лет жизни, беременные).
Первичная инфекция или (в меньшей степени) реактивации инфекции в период беременности связаны с риском внутриутробной инфекции, опасной для развития плода. Проявления инфекции зависят от особенностей иммунитета матери, вирулентности и локализации вируса. В целях выявления возможной инфицированности организма цитомегаловирусом, оценки риска возникновения острой инфекции, распознавания первичной инфекции целесообразно выявление вирусной ДНК методом ПЦР.
В целях выявления возможной инфицированности организма цитомегаловирусом, оценки риска возникновения острой инфекции, распознавания первичной инфекции целесообразно выявление вирусной ДНК методом ПЦР.
Важно! CMV-инфекция входит в группу TORCH-инфекций (название образовано начальными буквами в латинских наименованиях — Toxoplasma, Rubella, Cytomegalovirus, Herpes), считающихся потенциально опасными для развития ребёнка. Лабораторное обследование на TORCH-инфекции наиболее целесообразно проводить за 2 — 3 месяца до планируемой беременности. Это даёт возможность предпринять необходимые лечебные или профилактические меры, и служит точкой сравнения с результатами обследований во время беременности.
8. Качественное обнаружение ДНК вируса папилломы человека (HPV) 14 типов высокого онкогенного риска: 16, 18, 31, 33, 35, 39, 45, 52, 58, 59, 67 в соскобе эпителиальных клеток урогенитального тракта.
Вирус папилломы человека (ВПЧ) может быть причиной возникновения рака гениталий у женщин и плоскоклеточного рака у мужчин и женщин. Доказано, что этот вирус является причиной возникновения остроконечных кондилом, кондилом и новообразований шейки матки. Различные виды ВПЧ являются причиной различных поражений. Некоторые из них являются факторами высокого онкогенного риска.
Доказано, что этот вирус является причиной возникновения остроконечных кондилом, кондилом и новообразований шейки матки. Различные виды ВПЧ являются причиной различных поражений. Некоторые из них являются факторами высокого онкогенного риска.
Формат выдачи результата включает суммарный ответ по всем указанным типам ВПЧ-обнаружено/не обнаружено. Результат ОБНАРУЖЕНО следует интерпретировать как наличие в образце специфических участков ДНК одного или нескольких типов ВПЧ без указания конкретного типа (16 тип идентифицируется). Результат НЕ ОБНАРУЖЕНО следует интерпретировать как отсутствие в образце специфических участков ДНК ВПЧ всех указанных типов.
9. Определение ДНК возбудителя гонореи (Neisseria gonorrhoeae) в соскобе эпителиальных клеток урогенитального тракта методом полимеразной цепной реакции (ПЦР).
Гонорея — венерическое заболевание вызывается грамотрицательным диплококком — Neisseria gonorrhoeae. Передаётся половым путем, поражая преимущественно слизистые оболочки мочеполовой системы.
У мужчин возбудитель гонореи является причиной уретритов, стриктуры уретры, эпидидимита, простатита, орхита и других заболеваний яичек и его придатков.
У женщин проявляется как уретрит, бартолинит, эндоцервицит, эндометрит, сальпингит и пельвиоперитонит. Симптомы хронической гонореи у женщин могут быть минимальными, заболевание трудно диагностируется.
Новорожденные могут заразиться гонореей при прохождении ребёнка через родовые пути матери (бленнорея новорожденных).
10. Определение ДНК гарднереллы (Gardnerella vaginalis) в соскобах эпителиальных клеток урогенитального тракта методом полимеразной цепной реакции (ПЦР).
Гарднереллёз (бактериальный вагиноз) чаще выявляется у женщин детородного возраста. Заболевание возникает как следствие резкого нарушения баланса микрофлоры влагалища: преобладающие в норме лактобактерии замещаются анаэробными микроорганизмами. Гарднереллёз может являться причиной осложнений беременности: воспалительных заболеваний, маточных кровотечений, послеродового эндометрита, пневмонии у новорождённых.
11. Качественное определение ДНК микоплазмы (Mycoplasma genitalium) в соскобах эпителиальных клеток урогенитального тракта, методом полимеразной цепной реакции (ПЦР).
Mycoplasma genitalium – микроорганизм, обладающий высокой патогенностью по отношению к клеткам эпителия мочеполовых органов человека, обладает высокой контагиозностью, то есть почти всегда передается половому партнеру. Часто являться причиной негонококкового уретрита и простатита, патологии беременности и плода, бесплодия у женщин и мужчин. Микоплазма гениталиум способна прикрепляться к сперматозоидам и снижать их функциональность (в том числе подвижность), а это может приводить к развитию мужского бесплодия. У женщин этот возбудитель все чаще выявляется при острых эндометритах и аднекситах – воспалениях матки с придатками. Установлено, что Mycoplasma genitalium может вызывать трубное бесплодие у женщин.
12. Определение ДНК Mycoplasma pneumoniae в соскобе эпителиальных клеток из ротоглотки методом полимеразной цепной реакции (ПЦР).

13. Определение ДНК Chlamydia pneumoniae в соскобе эпителиальных клеток из ротоглотки методом полимеразной цепной реакции (ПЦР).
Микоплазменная и/или хламидийная пневмония. Атипичные микроорганизмы, вызывающие пневмонию, составляют от 8 до 25% случаев заболевания. В половине случаев ошибочно диагностируются бронхит, трахеит или ОРЗ. Поэтому диагностика микроплазменной и хламидийной пневмоний основывается в первую очередь на выявлении с помощью полимеразно-цепной реакции (ПЦР).
14. Определение ДНК микоплазмы (Mycoplasma hominis) в соскобах эпителиальных клеток урогенитального тракта методом полимеразной цепной реакции (ПЦР).
В настоящее время микоплазмы принято считать условно-патогенными микробами.
Микоплазмы передаются половым путём, могут являться причиной негонококкового уретрита и простатита, воспалительных заболеваний, патологии беременности и плода, бесплодия у женщин и мужчин.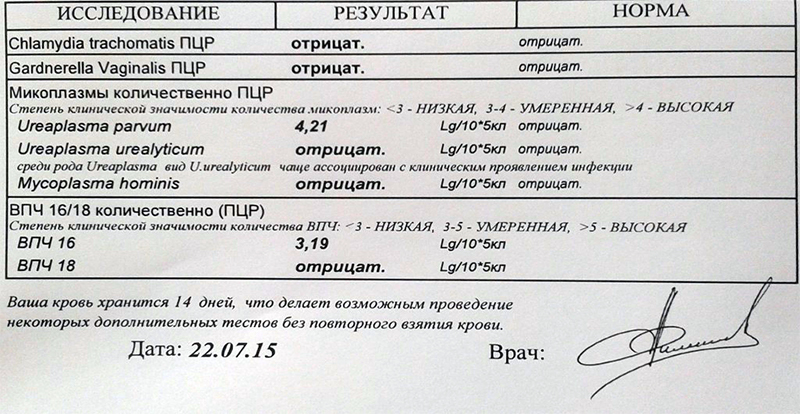 Эти микроорганизмы можно обнаружить, по разным данным, у 15-50% здоровых женщин.
Эти микроорганизмы можно обнаружить, по разным данным, у 15-50% здоровых женщин.
15. Определение ДНК yреаплазмы (Ureaplasma urealyticum/parvum) в соскобе эпителиальных клеток урогенитального тракта методом полимеразной цепной реакции (ПЦР).
Уреаплазмы в настоящее время принято считать условно-патогенными микробами. Уреаплазмы передаются при половых контактах, могут являться причиной негонококкового уретрита и простатита, воспалительных заболеваний, патологии беременности и плода, бесплодия у женщин и мужчин.
16. Определение ДНК хламидии (Chlamydia trachomatis) в соскобе эпителиальных клеток урогенитального тракта методом полимеразной цепной реакции (ПЦР).
Хламидии — облигатные внутриклеточные паразиты, передающиеся преимущественно половым путём, и вызывающие хламидиоз (в первую очередь, поражения слизистых оболочек половых путей, конъюнктивиты). Достаточно широко распространённая инфекция, может протекать бессимптомно, часто переходит в хроническую форму, сопровождается различными осложнениями, которые иногда у женщин являются причиной бесплодия и невынашивания беременности.
Особенности жизненного цикла Chlamydia trachomatis приводят к частому возникновению персистирующей формы инфекции, малочувствительной к терапии. Реактивация инфекции может произойти под действием изменения иммунного или гормонального статуса, травмы, операции, стресса. У Chlamydia trachomatis низкая иммуногенность, вследствие чего у 50% инфицированных людей антитела не обнаруживаются. Поэтому (особенно в сомнительных случаях, при отсутствии антител к хламидии) микроорганизм выявляют только высокочувствительным и специфичным прямым методом – ПЦР.
17. Определение ДНК Кандиды (Candida albicans) в соскобе эпителиальных клеток урогенитального кожи методом полимеразной цепной реакции (ПЦР).
Кандиды выявляются на слизистых оболочках полости рта и желудочно-кишечного тракта у 30-50% здоровых людей и на слизистых оболочках гениталий у 20-30% здоровых женщин. При этом важно различать кандидоз и колонизацию слизистых оболочек и кожи. Микозы обычно развиваются у пациентов с различными нарушениями в системе противоинфекционной защиты (факторами риска).
Микозы обычно развиваются у пациентов с различными нарушениями в системе противоинфекционной защиты (факторами риска).
18. Определение ДНК трихомонады (Trichomonas vaginalis) в соскобах эпителиальных клеток урогенитального тракта, методом полимеразной цепной реакции (ПЦР).
Трихомониаз — заболевание мочеполового тракта. Trichomonas vaginalis относится к роду простейших жгутиковых, является строгим облигатным паразитом человека. Это одно из самых частых заболеваний, передающихся половым путем. У мужчин поражается уретра, предстательная железа и семенные пузырьки, у женщин – влагалище, шейка матки и уретра.
19. Определение ДНК вируса Эпштейн-Барра (Epstein-Barr virus) в крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени».
Вирус Эпштейн-Барр — является наиболее частой причиной инфекционного мононуклеоза у молодых людей. Характеризуется лихорадкой, недомоганием, фарингитом, лимфоаденопатией и лимфоцитозом.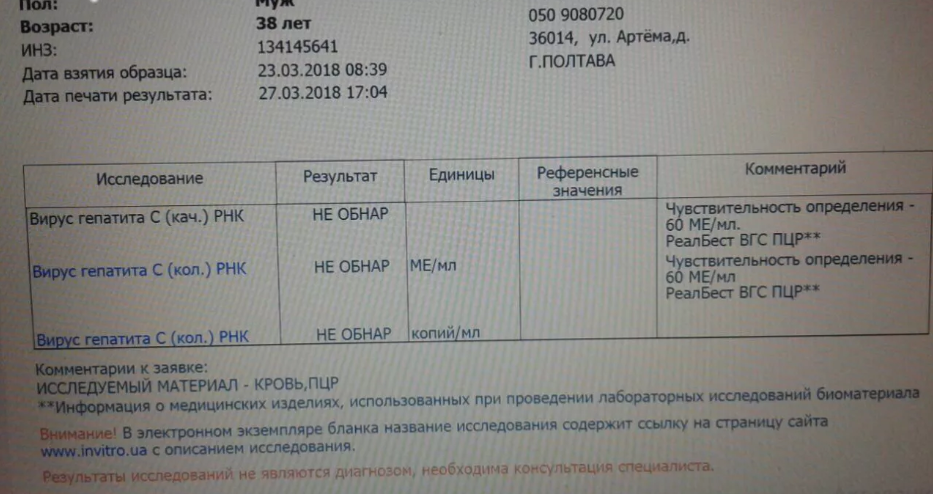 Вирус передается оральным (через слюну) и половым путем.
Вирус передается оральным (через слюну) и половым путем.
20. Определение ДНК вируса герпеса 6 типа в крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени».
Вирус герпеса 6 типа вызывает у детей (в возрасте младше 2,5 лет) внезапную экзантему. В начале высыпания появляются на спине и шее, затем на руках и ногах, на лице сыпь отсутствует. У некоторых заболевших детей лихорадка может приводить к эпилептическим припадкам. Вирус передается оральным и аэрозольным путем. Аналитическая чувствительность тестов для урогенитальных инфекций составляет 1х103 ГЭ/мл.
Задать вопрос специалисту Вы можете по следующим электронным адресам: [email protected], [email protected].
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Что нужно знать о тестировании на гепатит C
ПЦР-тест на РНК HCV — это анализ крови, который помогает врачу диагностировать гепатит C. Тест измеряет уровень вируса гепатита C в кровотоке.
Гепатит С (ВГС) — это инфекция, которая вызывает рубцевание печени и снижает функцию этого жизненно важного органа. Тяжелый гепатит С может привести к печеночной недостаточности. Однако ранняя диагностика может снизить риск тяжелой инфекции.
В этой статье мы рассмотрим, как работает тест и что означают его результаты.
ПЦР-тест на РНК HCV — это анализ крови. Лаборант ищет генетический материал вируса HCV или его рибонуклеиновую кислоту (РНК). Они используют процесс, называемый полимеразной цепной реакцией (ПЦР).
Результаты теста PCR на РНК HCV помогают врачу рекомендовать различные способы снижения вирусной нагрузки. Вирусная нагрузка показывает, сколько вирусных частиц HCV находится в крови.
Если врач подозревает, что у человека есть ВГС, он порекомендует этот тест на ранней стадии диагностического процесса, даже если это не первый тест, который они проводят.
Этот тест позволяет обнаружить присутствие самого вируса, а не антител, которые организм вырабатывает в ответ на вирус.
Это означает, что человеку не нужно ждать появления симптомов инфекции для постановки диагноза.
После начала инфекции ВГС для выявления антител может потребоваться в среднем 6–8 недель. Однако врач может идентифицировать сам вирус примерно через 1-2 недели с помощью ПЦР или других средств прямого обнаружения вирусов.
Врач будет запрашивать анализ несколько раз в течение курса лечения хронического ВГС. Повторное тестирование позволяет врачам измерить реакцию организма на определенный метод лечения и внести коррективы для достижения наилучших результатов.
Врачи используют ПЦР РНК HCV одним из двух способов:
- качественный тест определяет, присутствует ли вирус
- количественный тест измеряет количество HCV в кровотоке
Есть небольшие различия в процесс для каждой формы теста.
Качественный
Врач может не знать, есть ли у человека ВГС или нет.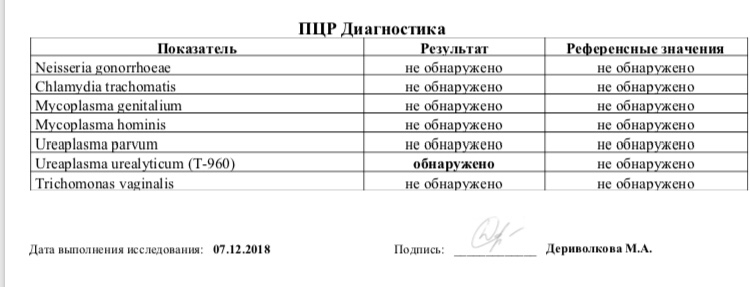 Они могут запросить этот тест для обнаружения вируса в кровотоке.
Они могут запросить этот тест для обнаружения вируса в кровотоке.
Качественный тест определяет только наличие вируса. Он не определяет количество вирусных частиц HCV в организме.
Врач обычно рекомендует пройти ПЦР-тест на РНК HCV после положительного результата теста на антитела к HCV. Этот тест покажет, вырабатывает ли организм антитела, которые борются с HCV.
Хотя тест, выявляющий антитела, обычно является хорошим признаком инфекции ВГС, возможны ложноположительные результаты.
Положительный тест может быть получен, если человек ранее был инфицирован ВГС. Это может означать, что у человека еще есть антитела, но организм уже избавился от инфекции. Это происходит примерно в 15–25% тестов.
Вероятность исчезновения вируса выше у людей, симптомы которых развиваются на ранней стадии инфекции. Вот почему врачи обычно проводят тест на антитела к ВГС с помощью ПЦР-теста на РНК ВГС для подтверждения диагноза.
В некоторых случаях врачи могут также рекомендовать третий тест для подтверждения наличия гепатита С. Врачи называют это тестом транскрипционной амплификации (ТМА).
Врачи называют это тестом транскрипционной амплификации (ТМА).
Тест ТМА не требуется во многих случаях, когда тест ПЦР на РНК ВГС показывает достаточно веские доказательства инфекции ВГС.
Количественный
Поделиться на Pinterest Результаты количественного теста на ВГС могут помочь врачу определить эффективность лечения.
Количественный ПЦР-тест РНК HCV показывает количество вирусных копий HCV в крови. Он работает, определяя, сколько генетического материала присутствует в небольшом количестве крови.
Для многих количественный тест заменил качественный. Это связано с тем, что знание и понимание вирусной нагрузки является решающим шагом в процессе лечения людей с ВГС.
Врач вычисляет измерения, чтобы они соответствовали стандартным показаниям, которые представляют собой количество международных единиц на миллилитр (МЕ / мл).
Врачи часто используют количественный тест при установлении диагноза и для контроля количества HCV в кровотоке во время лечения. Это позволяет им узнать, насколько хорошо организм реагирует на лечение, а также помогает им принять решение о любых необходимых изменениях в лечении.
Это позволяет им узнать, насколько хорошо организм реагирует на лечение, а также помогает им принять решение о любых необходимых изменениях в лечении.
Вирусная нагрузка
Вирусная нагрузка может значительно различаться по результатам количественного теста.
Врачи обычно считают вирусную нагрузку более 800 000 МЕ / мл высокой. Низкая вирусная нагрузка будет менее 800 000 МЕ / мл.
Если количественный тест показывает неопределяемые уровни вирусных частиц, но качественный тест обнаруживает ВГС, это означает, что у человека чрезвычайно низкие уровни ВГС в кровотоке.
Врачи используют качественный тест ПЦР на РНК ВГС, чтобы определить, присутствует ли вирус гепатита С в крови.
Если вирус присутствует, тест будет положительным. Если тест не обнаружит вирус, результат будет отрицательным.
Если результат положительный, человеку необходимо пройти количественный анализ РНК HCV PCR. По этой причине многие врачи теперь предпочитают пропускать первый тест и сразу же использовать количественный тест.
Количественные результаты теста показывают, сколько ВГС находится в организме.Однако, низкая или высокая, вирусная нагрузка не отражает уровни повреждения печени.
Другие анализы крови, ультразвук и, в редких случаях, биопсия печени помогут врачу определить общее состояние печени.
Поделиться на Pinterest Подавляющее большинство людей достигают УВО и не допускают гепатита С на всю оставшуюся жизнь.
После проведения ПЦР-теста на РНК ВГС для подтверждения наличия ВГС врачи выяснят, какой штамм вируса активен в организме. Это помогает врачу спланировать курс лечения.
Основная цель лечения — снизить вирусную нагрузку в организме до полного избавления от вируса. Врачи называют это устойчивым вирусологическим ответом (УВО).
УВО возникает, когда вирус не определяется в течение 12 недель или дольше после лечения.
Достижение УВО — лучший результат лечения, так как это часто означает, что человек свободен от гепатита С или что лечение вылечило гепатит С.
Однако важно помнить, что как только человек достигает УВО, он все еще может получить еще одну инфекцию ВГС.Им необходимо будет продолжать вносить изменения в образ жизни, чтобы предотвратить ВГС. Изменения включают прекращение использования внутривенных наркотиков и обеспечение того, чтобы всегда практиковать секс с использованием презерватива или другой формы барьерной контрацепции.
Врачи также будут совмещать лечение с другими тестами, позволяющими отслеживать осложнения ВГС, включая цирроз и рак печени.
Врач часто направляет человека, у которого есть признаки этих осложнений, к специалисту для более конкретного лечения.
Здесь вы узнаете, как предотвратить ВГС.
ПЦР-тесты РНК HCV являются важной частью диагностики и лечения HCV. Даже после первоначального диагноза людям все равно будут требоваться периодические анализы крови, чтобы убедиться, что лечение работает.
По данным Министерства по делам ветеранов США, 99% людей, достигших УВО, остаются свободными от ВГС.
Соблюдение врачебного плана лечения и регулярное ПЦР-тестирование на РНК ВГС может дать людям наилучшие шансы на УВО и жить без хронического ВГС.
Узнайте больше о последствиях ВГС и способах его лечения.
Q:
Доступен ли аналогичный тест для других типов гепатита?
A:
Да. Когда человек болеет или подозревает, что у него гепатит B, врач измеряет его вирусную нагрузку с помощью теста ПЦР ДНК HBV.
Кэмерон Уайт, доктор медицины, MPH Ответы отражают мнение наших медицинских экспертов. Весь контент носит исключительно информационный характер и не может рассматриваться как медицинский совет.
Как работает этот тест на вирус гепатита С, результаты, подробнее
ПЦР-тест на РНК ВГС используется для определения наличия вируса гепатита С (ВГС) в вашем кровотоке.
Если вирус присутствует, тест также может определить точное количество вируса в вашей крови. Количество вируса в вашей крови называется вирусной нагрузкой.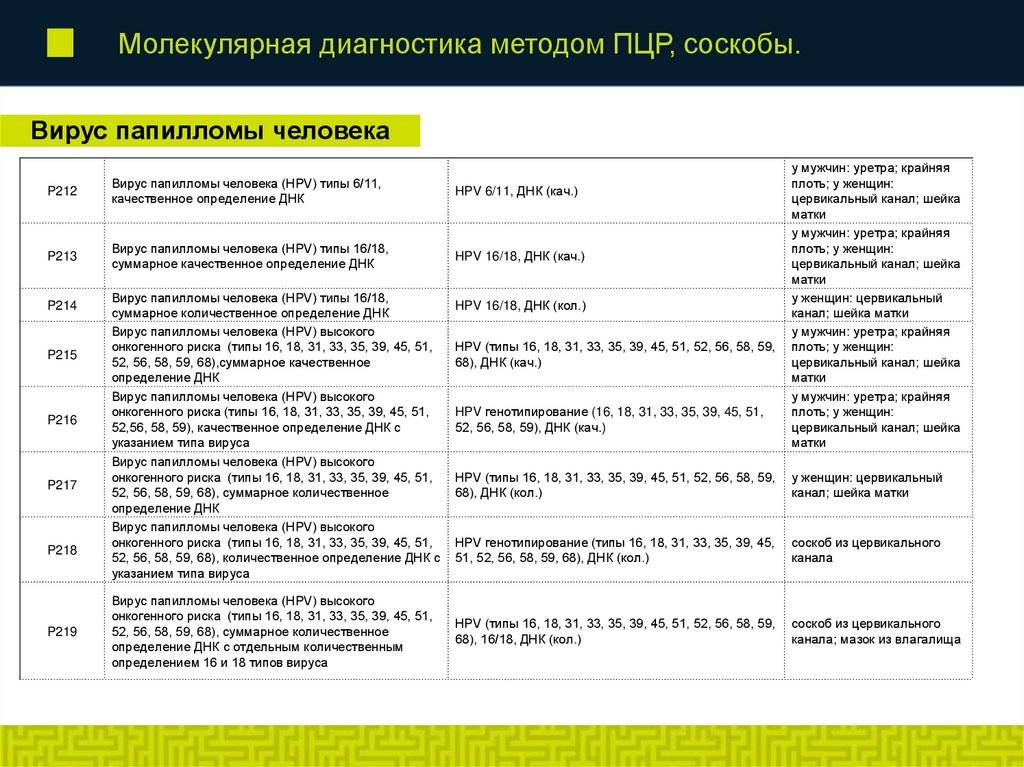
ПЦР-тест на РНК HCV также может помочь вашему врачу решить, как лучше лечить вирус и снизить вирусную нагрузку. Проведение теста до и во время лечения позволяет врачу точно увидеть, как ваше тело реагирует на определенные процедуры.
Продолжайте читать, чтобы узнать больше.
Медицинский работник возьмет образец крови на анализ.
Перед исследованием сообщите им, если вам неудобно пользоваться определенными иглами или вы когда-нибудь теряли сознание при виде крови. Они могут дать вам перекус, чтобы снизить риск потери сознания.
Игла может немного ужалить при попадании на кожу, и в течение нескольких дней на месте вытяжки может оставаться синяк.
Результаты обычно доступны в течение нескольких дней или, самое большее, недель.
ПЦР на РНК HCV проводится с помощью процесса, называемого полимеразной цепной реакцией (ПЦР). Есть два подхода к этому процессу: качественный и количественный.
Качественный тест
Этот тест часто используется для диагностики ВГС. Он подтверждает наличие вируса в вашем теле, но не показывает, сколько вируса присутствует.
Он подтверждает наличие вируса в вашем теле, но не показывает, сколько вируса присутствует.
Качественный тест часто является вторым тестом, который врач будет использовать для подтверждения наличия HCV в крови.Обычно он следует за тестом на антитела к ВГС.
Тест на антитела показывает, вырабатывает ли ваш организм антитела для борьбы с инфекцией ВГС. Если ваш тест на антитела к ВГС окажется положительным, ваш врач проведет ПЦР-анализ РНК ВГС, чтобы подтвердить и измерить количество ВГС в вашей крови.
Ваш врач может также порекомендовать аналогичный качественный тест, известный как тест транскрипционной амплификации (ТМА). Некоторые исследования показывают, что это гораздо более чувствительный тест на ВГС.Ваш врач может не подумать, что это необходимо вам, если тест ПЦР дает достаточные результаты.
Количественный тест
Этот метод тестирования измеряет точное количество HCV в вашей крови в международных единицах на миллилитр (МЕ / мл). Это число определяет, высокая или низкая у вас вирусная нагрузка.
Количественный тест полезен для отслеживания количества ВГС в крови с течением времени или измерения вашей реакции на лечение, направленное на снижение вирусной нагрузки.
Когда измерение вашей вирусной нагрузки упадет до 15 МЕ / мл или менее, количество вируса будет считаться необнаружимым.На этом этапе качественный тест может подтвердить, действительно ли вируса больше нет в вашем теле или все еще присутствует только небольшое количество вируса.
Качественные результаты показывают, что HCV присутствует в вашей крови. Результат теста будет либо «обнаружен», либо «необнаружен».
«Обнаружен» означает, что вирус действительно есть в вашей крови. «Не обнаружено» означает, что в вашей крови нет вируса или у вас есть небольшое количество вируса, которое не может быть обнаружено с помощью этого теста.
Качественные результаты анализов могут быть положительными, даже если ваша вирусная нагрузка резко снизилась в результате лечения.
Количественные результаты теста показывают точное количество HCV в вашей крови. Этот номер помогает вашему врачу подтвердить, высокая или низкая у вас вирусная нагрузка.
Этот номер помогает вашему врачу подтвердить, высокая или низкая у вас вирусная нагрузка.
Измерение вирусной нагрузки до лечения позволяет врачу контролировать вирусную нагрузку во время и после лечения.
Измерение вирусной нагрузки не показывает, насколько серьезна ваша инфекция ВГС или цирроз. Вашему врачу необходимо будет взять биопсию или образец ткани вашей печени, чтобы узнать больше о том, как ваша печень пострадала от инфекции ВГС.
Результаты количественной ПЦР-теста могут составлять от 15 до 100 000 000 МЕ / л.
Если ваши результаты:
- Менее 15 МЕ / мл: Вирус обнаружен, но его количество невозможно точно измерить. Возможно, вам придется вернуться позже для другого теста, чтобы увидеть, изменились ли измерения.
- Менее 800 000 МЕ / мл: Обнаружена низкая вирусная нагрузка.
- Более 800 000 МЕ / мл: Обнаружена высокая вирусная нагрузка.
- Более 100000000 МЕ / мл: Вирус обнаружен, происходит активное заражение.

- Безрезультатно: РНК HCV не может быть измерена, и необходимо взять новый образец.
Если ваш врач определит наличие гепатита С, он вместе с вами разработает план лечения.
Цель лечения — снизить вирусную нагрузку до тех пор, пока вирус не будет полностью выведен из организма. Ваш врач может повторить эти тесты во время лечения, чтобы следить за вашим прогрессом.
Если ваш врач считает, что ваша печень была повреждена вирусом, он может порекомендовать вам обратиться к специалисту для дальнейшего лечения.
Какова роль качественной полимеразной цепной реакции (ПЦР) в диагностике цитомегаловирусной (ЦМВ) инфекции?
Чжан Л.Дж., Ханфф П., Резерфорд К., Черчилль У.Х., Крампакер С.С. Обнаружение ДНК, РНК и антител цитомегаловируса человека в крови нормального донора. Дж. Инфекция Дис. . 1995 Апрель 171 (4): 1002-6. [Медлайн].
Guinan ME, Thomas PA, Pinsky PF, Goodrich JT, Selik RM, Jaffe HW. Гетеросексуальные и гомосексуальные пациенты с синдромом приобретенного иммунодефицита.Сравнение данных наблюдения, интервью и лабораторных данных. Энн Интерн Мед. . 1984 Февраль 100 (2): 213-8. [Медлайн].
Hodson EM, Jones CA, Webster AC, Strippoli GF, Barclay PG, Kable K. Противовирусные препараты для предотвращения цитомегаловирусной болезни и ранней смерти у реципиентов трансплантации твердых органов: систематический обзор рандомизированных контролируемых испытаний. Ланцет .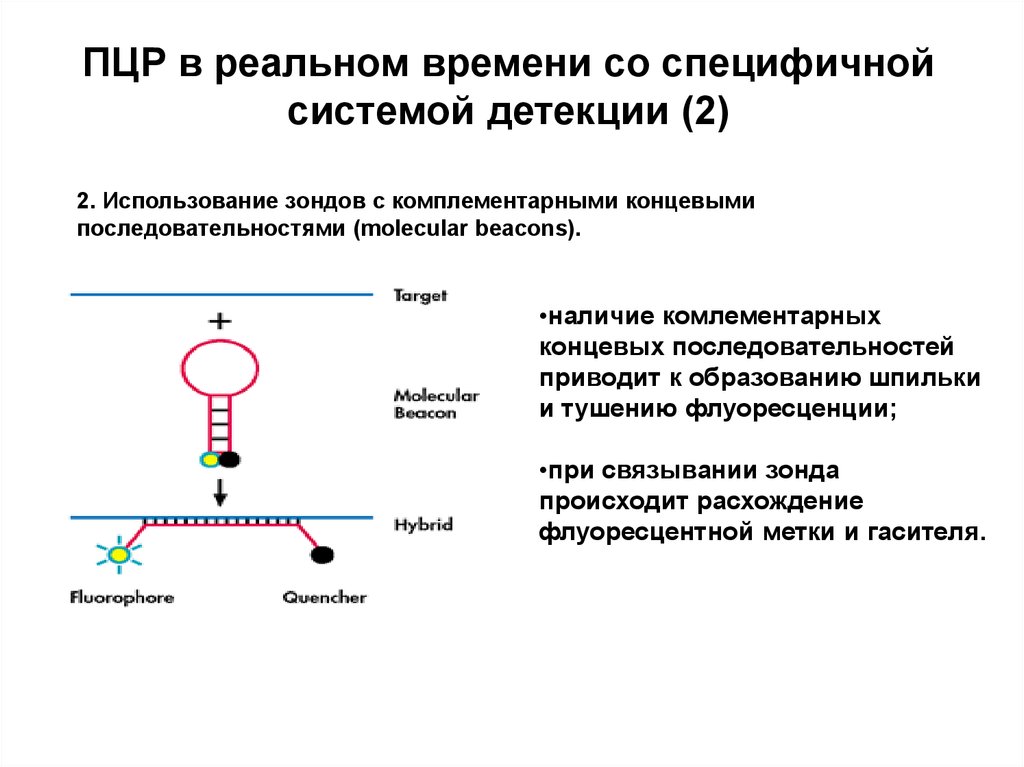 2005 18-24 июня. 365 (9477): 2105-15. [Медлайн].
2005 18-24 июня. 365 (9477): 2105-15. [Медлайн].
Staras SA, Dollard SC, Radford KW, Flanders WD, Pass RF, Cannon MJ.Распространенность цитомегаловирусной инфекции в США, 1988–1994 гг. Клиническая инфекция . 2006 г. 1. 43 (9): 1143-51. [Медлайн].
Bate SL, Dollard SC, Cannon MJ. Распространенность цитомегаловируса по серологии в Соединенных Штатах: национальные обследования здоровья и питания, 1988-2004 гг. Клиническая инфекция . 1 июня 2010 г. 50 (11): 1439-47. [Медлайн].
Ljungman P, Griffiths P, Paya C. Определения цитомегаловирусной инфекции и болезни у реципиентов трансплантата. Клиническая инфекция . 2002 15 апреля. 34 (8): 1094-7. [Медлайн].
Cunha BA. Цитомегаловирусная пневмония: внебольничная пневмония у иммунокомпетентных хозяев. Инфекция Dis Clin North Am . 2010 марта, 24 (1): 147-58. [Медлайн].
Инфекция Dis Clin North Am . 2010 марта, 24 (1): 147-58. [Медлайн].
Дейтон-младший, профессор Сабин Калифорния, Джонсон Массачусетс, Эмери В.К., Уилсон П., Гриффитс, полиция. Важность цитомегаловирусной виремии в риске прогрессирования заболевания и смерти у ВИЧ-инфицированных пациентов, получающих высокоактивную антиретровирусную терапию. Ланцет . 2004, 26 июня, 363 (9427): 2116-21. [Медлайн].
Stagno S, Pass RF, Cloud G, Britt WJ, Henderson RE, Walton PD. Первичная цитомегаловирусная инфекция при беременности. Заболеваемость, передача плоду и клинический исход. Джама . 1986, 10 октября. 256 (14): 1904-8. [Медлайн].
Цитомегаловирус стагно С. Ремингтон Дж. С., Кляйн Дж. Инфекционные болезни плода и новорожденного . Филадельфия: У. Б. Сондерс; 2001 г.389-424.
Уолтер Э.А., Гринберг П.Д., Гилберт М.Дж. Восстановление клеточного иммунитета против цитомегаловируса у реципиентов аллогенного костного мозга путем передачи клонов Т-клеток от донора. N Engl J Med . 1995 19 окт.333 (16): 1038-44. [Медлайн].
Бонковский Х.Л., Ли Р.В., Клацкин Г. Острый гранулематозный гепатит. Возникновение цитомегаловирусного мононуклеоза. Джама . 1975 22 сентября. 233 (12): 1284-8. [Медлайн].
Майзельман М.С., Виолончель Дж. П., Маргареттен В. Цитомегаловирусный колит. Отчет о клинических, эндоскопических и патологических данных у двух пациентов с синдромом приобретенного иммунодефицита.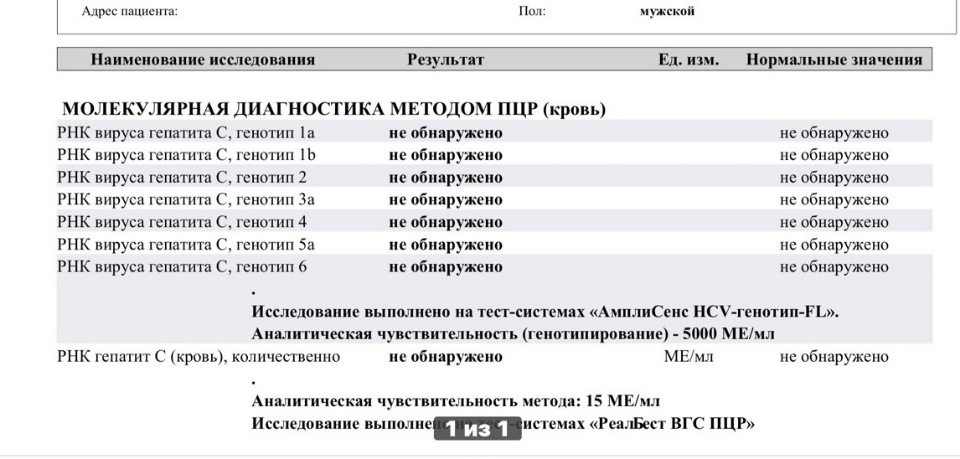 Гастроэнтерология . 1985, январь 88 (1, 1): 171-5.[Медлайн].
Гастроэнтерология . 1985, январь 88 (1, 1): 171-5.[Медлайн].
Орликовски Д., Порчер Р., Сивадон-Тарди В. и др. Синдром Гийена-Барре после первичной цитомегаловирусной инфекции: проспективное когортное исследование. Клиническая инфекция . 2011 Апрель 52 (7): 837-44. [Медлайн].
Джабс Д.А., Ван Натта М.Л., Кемпен Дж. Х., Рид Паван П., Лим Дж. И., Мерфи Р. Л. и др. Характеристика больных цитомегаловирусным ретинитом в эпоху высокоактивной антиретровирусной терапии. Ам Дж. Офтальмол .2002, январь, 133 (1): 48-61. [Медлайн].
Karavellas MP, Plummer DJ, Macdonald JC, Torriani FJ, Shufelt CL, Azen SP. Заболеваемость витритом восстановления иммунитета у пациентов с цитомегаловирусным ретинитом после успешного проведения высокоактивной антиретровирусной терапии. Дж. Инфекция Дис. . 1999, март 179 (3): 697-700. [Медлайн].
. 1999, март 179 (3): 697-700. [Медлайн].
Wohl DA, Kendall MA, Owens S, Holland G, Nokta M, Spector SA. Безопасность прекращения поддерживающей терапии цитомегаловирусного (ЦМВ) ретинита и частота иммунного увеита после мощной антиретровирусной терапии. Клинические испытания ВИЧ . 2005 май-июнь. 6 (3): 136-46. [Медлайн].
Райт М.Э., Сузман Д.Л., Чаки К.Г., Мазур Х., Полис М.А., Робинсон MR. Обширная неоваскуляризация сетчатки как позднее обнаружение у инфицированных вирусом иммунодефицита пациентов с увеитом иммунного восстановления. Клиническая инфекция . 2003 15 апреля. 36 (8): 1063-6. [Медлайн].
Ричардсон В.П., Колвин РБ, Чизмен Ш. Гломерулопатия, связанная с цитомегаловирусной виремией в почечных аллотрансплантатах. N Engl J Med . 1981, 9 июля. 305 (2): 57-63. [Медлайн].
Torok-Storb B, Boeckh M, Hoy C. Ассоциация конкретных генотипов цитомегаловируса со смертью от миелосупрессии после трансплантации костного мозга. Кровь . 1997 Сентябрь 1. 90 (5): 2097-102. [Медлайн].
Мануэль О., Асберг А., Панг Х, Роллаг Х, Эмери В. К., Прейксайтис Дж. Влияние генетических полиморфизмов гликопротеина В цитомегаловируса на исходы у реципиентов трансплантата солидных органов с цитомегаловирусной болезнью. Клиническая инфекция . 2009 15 октября. 49 (8): 1160-6. [Медлайн].
Ивасенко Дж. М., Ховард Дж., Арбакл С. и др. Цитомегаловирусная инфекция человека часто выявляется у мертворожденных и связана с тромботической васкулопатией плода. Дж. Инфекция Дис. . 2011 Июнь 203 (11): 1526-33. [Медлайн].
Klemola E, Von Essen R, Henle G, Henle W.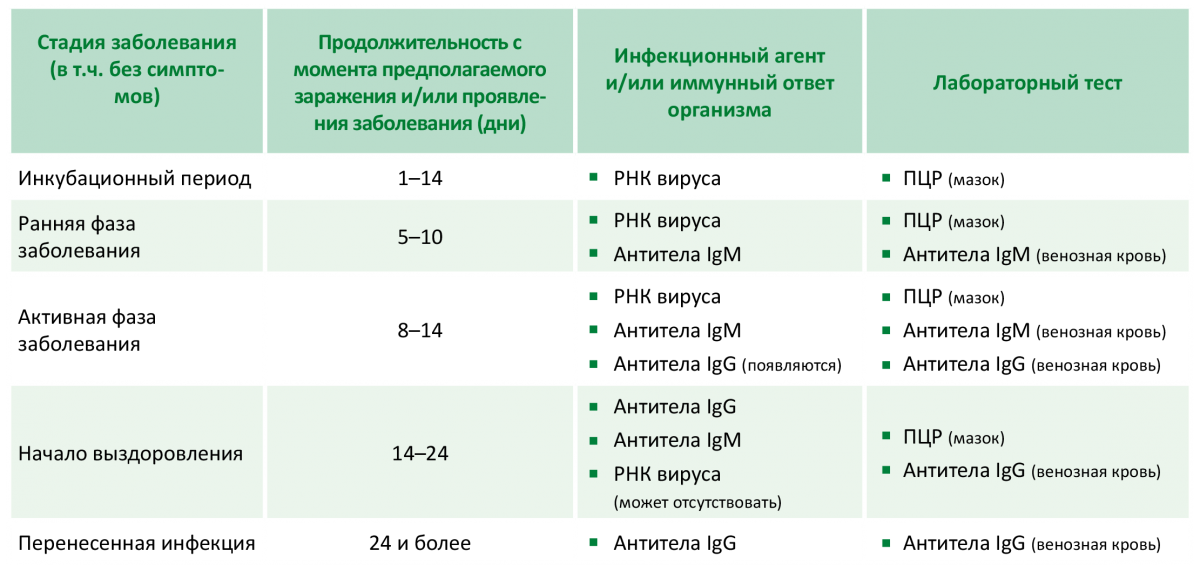 Заболевание, подобное инфекционному мононуклеозу, с отрицательным тестом на агглютинацию гетерофилов. Клинические особенности в отношении антител к вирусу Эпштейна-Барра и цитомегаловирусу. Дж. Инфекция Дис. . 1970 Июнь 121 (6): 608-14. [Медлайн].
Заболевание, подобное инфекционному мононуклеозу, с отрицательным тестом на агглютинацию гетерофилов. Клинические особенности в отношении антител к вирусу Эпштейна-Барра и цитомегаловирусу. Дж. Инфекция Дис. . 1970 Июнь 121 (6): 608-14. [Медлайн].
Коэн Дж. И., Кори Г. Р.. Цитомегаловирусная инфекция у нормального хозяина. Медицина (Балтимор) . 1985 Март 64 (2): 100-14. [Медлайн].
Horwitz CA, Henle W., Henle G. Клиническая и лабораторная оценка мононуклеоза, вызванного цитомегаловирусом, у ранее здоровых людей. Отчет о 82 случаях. Медицина (Балтимор) . 1986 марта 65 (2): 124-34. [Медлайн].
Klemola E, Stenström R, von Essen R. Пневмония как клиническое проявление цитомегаловирусной инфекции у ранее здоровых взрослых. Сканд Дж. Инфекция Дис . 1972. 4 (1): 7-10. [Медлайн].
Jaber S, Chanques G, Borry J, Souche B, Verdier R, Perrigault PF. Цитомегаловирусная инфекция у тяжелобольных: сопутствующие факторы и последствия. Сундук . 2005 Январь 127 (1): 233-41. [Медлайн].
von Müller L, Klemm A, Weiss M, et al.Активная цитомегаловирусная инфекция у больных септическим шоком. Emerg Infect Dis . 2006 12 октября (10): 1517-22. [Медлайн]. [Полный текст].
Калил АС, Флореску Д.Ф. Распространенность и смертность, связанные с цитомегаловирусной инфекцией, у пациентов с иммуносупрессией в отделении интенсивной терапии. Crit Care Med . 2009 37 августа (8): 2350-8. [Медлайн].
Cook CH, Yenchar JK, Kraner TO, Davies EA, Ferguson RM. Вирусы семейства оккультных герпесов могут повышать смертность тяжелобольных хирургических пациентов. Am J Surg . 1998 Октябрь 176 (4): 357-60. [Медлайн].
Am J Surg . 1998 Октябрь 176 (4): 357-60. [Медлайн].
De Vlieger G, Meersseman W, Lagrou K, et al. Серологический статус и исходы цитомегаловируса у критически больных пациентов с неиммунодефицитом. Crit Care Med . 2012 января 40 (1): 36-42. [Медлайн].
Ким Дж. М., Ким С. Дж., Дж. Дж. У. и др. Опасна ли цитомегаловирусная инфекция у серопозитивных реципиентов по цитомегаловирусу после трансплантации печени ?. Трансплантация печени .2011 г., 17 (4): 446-55. [Медлайн].
Рубин Р.Х. Косвенное влияние цитомегаловирусной инфекции на исход трансплантации органов. Джама . 1989, 23-30 июня. 261 (24): 3607-9. [Медлайн].
Фишман Ю.А., Рубин Р.Х. Инфекция у реципиентов трансплантата. N Engl J Med . 1998 11 июня. 338 (24): 1741-51. [Медлайн].
338 (24): 1741-51. [Медлайн].
Снайдман ДР. Инфекция при трансплантации твердых органов. Transpl Infect Dis .1999 Март 1 (1): 21-8. [Медлайн].
Johanssson I, Mårtensson G, Andersson R. Цитомегаловирус и отдаленные исходы после трансплантации легких в Гетеборге, Швеция. Сканд Дж. Инфекция Дис . 2010. 42 (2): 129-36. [Медлайн].
Reed EC, Bowden RA, Dandliker PS. Лечение цитомегаловирусной пневмонии ганцикловиром и внутривенным введением цитомегаловирусного иммуноглобулина у пациентов с трансплантатами костного мозга. Энн Интерн Мед. .15 ноября 1988 г. 109 (10): 783-8. [Медлайн].
Ид AJ, Артурс СК, Дезил П.Дж., Вильгельм депутат, Razonable RR. Клинические предикторы рецидива после лечения первичного цитомегаловирусного заболевания желудочно-кишечного тракта у реципиентов солидных органов. Трансплантат Am J . 2010 января, 10 (1): 157-61. [Медлайн].
Трансплантат Am J . 2010 января, 10 (1): 157-61. [Медлайн].
Дитрих Д.Т., Рахмин М. Цитомегаловирусный колит при СПИДе: презентация у 44 пациентов и обзор литературы. Синдр иммунодефицита J Acquir .1991. 4 Прил. 1: С29-35. [Медлайн].
McCutchan JA. Цитомегаловирусные инфекции нервной системы у больных СПИДом. Клиническая инфекция . 1995 г., 20 (4): 747-54. [Медлайн].
Shanahan A, Malani PN, Kaul DR. Рецидивирующая цитомегаловирусная инфекция у реципиентов солидных трансплантатов. Transpl Infect Dis . 2009 г. 11 (6): 513-8. [Медлайн].
Моноклональное антитело к непосредственному раннему антигену против цитомегаловируса (CMV), неконъюгированное, клон 3G9.2 от CHEMICON. www.chemicon.com. Доступно по адресу http://www. bio-medicine.org/biology-products/Anti-Cytomegalovirus—28CMV-29-Immediate-Early-Antigen-Monoclonal-Antibody—Unconjugated—Clone-3G9-2-from-CHEMICON -2132-1 /. Доступ: 17 марта 2010 г.
bio-medicine.org/biology-products/Anti-Cytomegalovirus—28CMV-29-Immediate-Early-Antigen-Monoclonal-Antibody—Unconjugated—Clone-3G9-2-from-CHEMICON -2132-1 /. Доступ: 17 марта 2010 г.
Мартин-Давила П., Фортун Дж., Гутьеррес С., Марти-Бельда П., Канделас А., Гонрубия А. и др. Анализ количественного ПЦР-анализа на ЦМВ-инфекцию у реципиентов трансплантата печени: цель поиска оптимального порогового значения. Дж. Клин Вирол .2005 июн. 33 (2): 138-44. [Медлайн].
Aitken C, Barrett-Muir W, Millar C, Templeton K, Thomas J, Sheridan F. Использование молекулярных анализов в диагностике и мониторинге цитомегаловирусной болезни после трансплантации почки. Дж. Клин Микробиол . 1999 Сентябрь 37 (9): 2804-7. [Медлайн]. [Полный текст].
Gerna G, Zipeto D, Parea M, Revello MG, Silini E, Percivalle E. Мониторинг цитомегаловирусных инфекций человека и лечение ганцикловиром у реципиентов трансплантата сердца путем определения виремии, антигенемии и ДНКемии. Дж. Инфекция Дис. . 1991 Сентябрь 164 (3): 488-98. [Медлайн].
Мониторинг цитомегаловирусных инфекций человека и лечение ганцикловиром у реципиентов трансплантата сердца путем определения виремии, антигенемии и ДНКемии. Дж. Инфекция Дис. . 1991 Сентябрь 164 (3): 488-98. [Медлайн].
Tanabe K, Tokumoto T., Ishikawa N, Koyama I., Takahashi K, Fuchinoue S. Сравнительное исследование анализа антигенемии цитомегаловируса (CMV), полимеразной цепной реакции, серологических исследований и анализа пробирки в оболочке для ранней диагностики и мониторинга инфекции CMV после трансплантация почек. Трансплантация . 1997 Dec 27. 64 (12): 1721-5. [Медлайн].
Боппана С.Б., Росс С.А., Шимамура М., Палмер А.Л., Ахмед А., Майклс М.Г. и др.Полимеразно-цепная реакция слюны для скрининга цитомегаловируса у новорожденных. N Engl J Med . 2 июня 2011 г. 364 (22): 2111-8. [Медлайн]. [Полный текст].
Джабс Д.А., Мартин Б.К., Форман М.С., Рикс МО.Цитомегаловирусная (ЦМВ) нагрузка ДНК в крови, прогрессирование ЦМВ-ретинита и возникновение резистентного ЦМВ у пациентов с ЦМВ-ретинитом. Дж. Инфекция Дис. . 2005 15 августа. 192 (4): 640-9. [Медлайн].
Рош Молекулярная диагностика. Тест COBAS AMPLICOR CMV MONITOR. Доступно по адресу http://molecular.roche.com/assays/Pages/COBASAMPLICORCMVMONITORTest.aspx. Доступ: 10 июля 2012 г.
Рош Молекулярная диагностика. Тест COBAS AmpliPrep / COBAS TaqMan CMV.Доступно по ссылке http://molecular.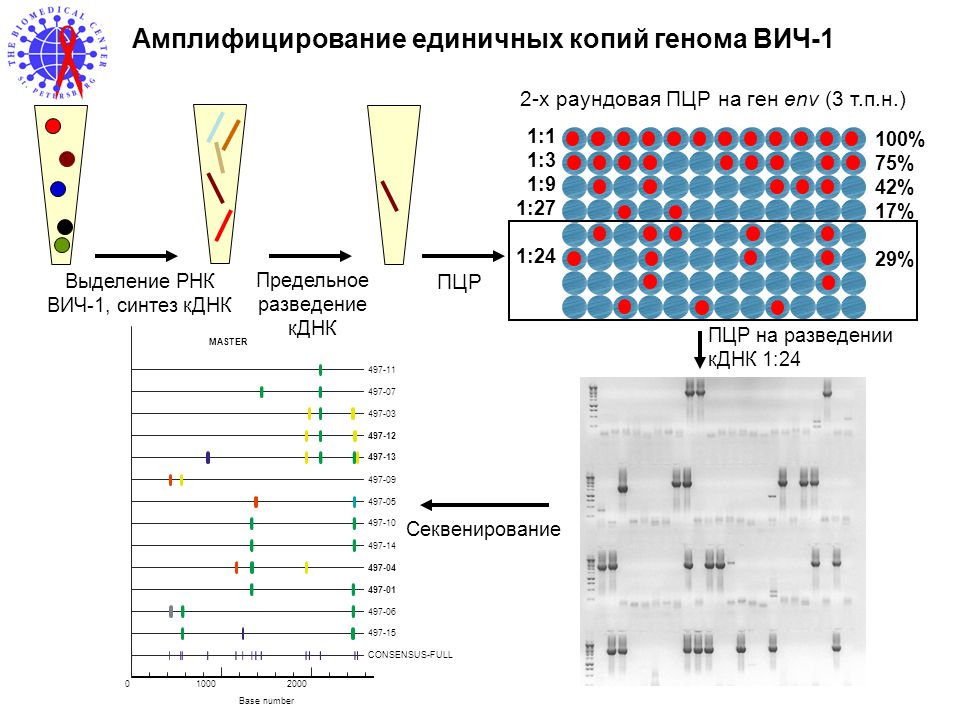 roche.com/assays/Pages/COBASAmpliPrepCOBASTaqManCMVTest.aspx. Доступ: 10 июля 2012 г.
roche.com/assays/Pages/COBASAmpliPrepCOBASTaqManCMVTest.aspx. Доступ: 10 июля 2012 г.
Smith TF, Espy MJ, Mandrekar J, Jones MF, Cockerill FR, Patel R. Количественная полимеразная цепная реакция в реальном времени для оценки ДНКемии, вызванной цитомегаловирусом, вирусом Эпштейна-Барра и вирусом BK у реципиентов трансплантата твердых органов. Клиническая инфекция . 2007 15 октября. 45 (8): 1056-61. [Медлайн].
Дрю В.Л. Тестирование на устойчивость к цитомегаловирусу: подводные камни и проблемы для врача. Клиническая инфекция . 2010 г. 1. 50 (5): 733-6. [Медлайн].
Дрю В.Л., Майнер Р., Салех Э. Тестирование чувствительности к противовирусным препаратам цитомегаловируса: критерии выявления устойчивости к противовирусным препаратам. Клин Диагн Вирол . 1993 августа, 1 (3): 179-85. [Медлайн].
[Медлайн].
Lischka P, Hewlett G, Wunberg T., Baumeister J, Paulsen D, Goldner T. и др. Активность нового антицитомегаловирусного соединения AIC246 in vitro и in vivo. Противомикробные агенты Chemother .2010 Март 54 (3): 1290-7. [Медлайн].
Melendez DP, Razonable RR. Летермовир и ингибиторы терминазного комплекса: новый многообещающий класс исследуемых противовирусных препаратов против цитомегаловируса человека. Устойчивость к инфекционным препаратам . 2015 5 августа, 8: 269-77. [Медлайн].
Бодро М., Сабе Н., Льядо Л. и др. Профилактика по сравнению с превентивной терапией цитомегаловирусной болезни у реципиентов трансплантата печени с высоким риском. Трансплантация печени .2012 сентября 18 (9): 1093-9. [Медлайн].
Witzke O, Hauser IA, Bartels M, Wolf G, Wolters H, Nitschke M. Профилактика валганцикловиром по сравнению с превентивной терапией у реципиентов почечного аллотрансплантата с положительным результатом на цитомегаловирус: годичные результаты рандомизированного клинического исследования. Трансплантация . 2012 15 января. 93 (1): 61-8. [Медлайн].
Профилактика валганцикловиром по сравнению с превентивной терапией у реципиентов почечного аллотрансплантата с положительным результатом на цитомегаловирус: годичные результаты рандомизированного клинического исследования. Трансплантация . 2012 15 января. 93 (1): 61-8. [Медлайн].
Фишман Дж. А., Эмери В., Фриман Р., Паскуаль М., Ростаинг Л., Шлитт Х. Дж. Цитомегаловирус при трансплантации — вызов статус-кво. Клиническая трансплантация . 2007 март-апрель. 21 (2): 149-58. [Медлайн].
Legendre C, Pascual M. Улучшение результатов для реципиентов трансплантата твердых органов, подверженных риску цитомегаловирусной инфекции: болезнь с поздним началом и косвенные последствия. Клиническая инфекция . 2008 г. 1. 46 (5): 732-40. [Медлайн].
Авторы не указаны. Валганцикловир: новый препарат. ЦМВ-ретинит: более простое пероральное лечение. Прескрайр Инт . 2003 Август.12 (66): 133-5. [Медлайн].
ЦМВ-ретинит: более простое пероральное лечение. Прескрайр Инт . 2003 Август.12 (66): 133-5. [Медлайн].
Caldés A, Gil-Vernet S, Armendariz Y, Colom H, Pou L, Niubó J, et al. Последовательное лечение цитомегаловирусной инфекции или заболевания коротким курсом внутривенного введения ганцикловира с последующим пероральным приемом валганцикловира: эффективность, безопасность и фармакокинетика. Transpl Infect Dis . 9 декабря 2009 г. [Medline].
Dieterich DT, Chachoua A, Lafleur F. Лечение ганцикловиром желудочно-кишечных инфекций, вызванных цитомегаловирусом, у пациентов со СПИДом. Ред. Заразить Dis . 1988 июль-август. 10 Приложение 3: S532-7. [Медлайн].
Kalil AC, Mindru C, Florescu DF. Эффективность валганцикловира 900 мг по сравнению с 450 мг для профилактики цитомегаловируса при трансплантации: метаанализ прямого и непрямого сравнения лечения. Клиническая инфекция . 2011 Февраль 52 (3): 313-21. [Медлайн].
Клиническая инфекция . 2011 Февраль 52 (3): 313-21. [Медлайн].
Эйвери РК. Валганцикловир в низких дозах для профилактики цитомегаловируса при трансплантации органов: меньше действительно больше ?. Клиническая инфекция . 2011 Февраль 52 (3): 322-4. [Медлайн].
Цитомегаловирус. Трансплантат Am J . 2004, 4 ноября, Дополнение 10: 51-8. [Медлайн].
Паудис Н., Мехметай А., Дзанацци М., Москарелли Л., Пиперно Р., Ди Мария Л. Превентивная терапия для профилактики цитомегаловирусной болезни у реципиентов почечного трансплантата: наш предварительный опыт. Протокол трансплантологии . 2009 Май. 41 (4): 1204-6. [Медлайн].
Бокх М., Гули Т.А., Майерсон Д.Раннее лечение цитомегаловируса pp65 под контролем антигенемии ганцикловиром по сравнению с ганцикловиром при приживлении после аллогенной трансплантации костного мозга: рандомизированное двойное слепое исследование. Кровь . 1996 15 ноября. 88 (10): 4063-71. [Медлайн].
Кровь . 1996 15 ноября. 88 (10): 4063-71. [Медлайн].
Marty FM, Ljungman P, Chemaly RF, Maertens J, Dadwal SS, Duarte RF и др. Летермовир Профилактика цитомегаловируса при трансплантации гемопоэтических клеток. N Engl J Med . 2017 6 декабря [Medline]. [Полный текст].
Avery RK, Marty FM, Strasfeld L, Lee I, Arrieta A, Chou S.Пероральный марибавир для лечения рефрактерных или резистентных цитомегаловирусных инфекций у реципиентов трансплантата. Transpl Infect Dis . 2010 декабря 12 (6): 489-96. [Медлайн].
Marty FM, Ljungman P, Papanicolaou GA, Winston DJ, Chemaly RF, Strasfeld L. Профилактика марибавиром для предотвращения цитомегаловирусной болезни у реципиентов аллогенных трансплантатов стволовых клеток: фаза 3, двойное слепое, плацебо-контролируемое, рандомизированное исследование . Ланцет Инфекция Дис .2011 Апрель 11 (4): 284-92. [Медлайн].
Ланцет Инфекция Дис .2011 Апрель 11 (4): 284-92. [Медлайн].
Trofe J, Pote L, Wade E, Blumberg E, Bloom RD. Марибавир: новый противовирусный агент с активностью против цитомегаловируса. Энн Фармакотер . 2008 г., 42 (10): 1447-57. [Медлайн].
Джон Г.Т., Маниваннан Дж., Чанди С., Питер С., Джейкоб С.К. Терапия лефлуномидом цитомегаловирусной болезни у реципиентов почечного аллотрансплантата. Трансплантация . 2004 15 мая. 77 (9): 1460-1. [Медлайн].
Джон Г.Т., Маниваннан Дж., Чанди С., Питер С., Флеминг Д.Х., Чанди С.Дж. и др.Проспективная оценка терапии лефлуномидом цитомегаловирусной болезни у реципиентов почечного трансплантата. Протокол трансплантологии . 2005 декабрь 37 (10): 4303-5. [Медлайн].
Леви М. Э., Мандава Н., Чан Л.К., Вайнберг А., Олсон Д.Л. Лечение цитомегаловирусного ретинита с множественной лекарственной устойчивостью с помощью системного введения лефлуномида. Transpl Infect Dis . 2006 марта 8 (1): 38-43. [Медлайн].
Э., Мандава Н., Чан Л.К., Вайнберг А., Олсон Д.Л. Лечение цитомегаловирусного ретинита с множественной лекарственной устойчивостью с помощью системного введения лефлуномида. Transpl Infect Dis . 2006 марта 8 (1): 38-43. [Медлайн].
Battiwalla M, Paplham P, Almyroudis NG, McCarthy A, Abdelhalim A, Elefante A.Неспособность лефлуномида контролировать рецидивирующую цитомегаловирусную инфекцию в условиях почечной недостаточности после трансплантации аллогенных стволовых клеток. Transpl Infect Dis . 2007 марта 9 (1): 28-32. [Медлайн].
Valantine HA, Luikart H, Doyle R, Theodore J, Hunt S, Oyer P. Влияние цитомегаловирусного гипериммунного глобулина на исход после кардиоторакальной трансплантации: сравнительное исследование комбинированной профилактики с применением гипериммунного глобулина CMV плюс ганцикловир по сравнению с ганцикловиром. Трансплантация . 2001 27 ноября. 72 (10): 1647-52. [Медлайн].
2001 27 ноября. 72 (10): 1647-52. [Медлайн].
Go V, Поллард РБ. Цитомегаловирусная вакцина для трансплантации: мы ближе ?. Дж. Инфекция Дис. . 15 июня 2008 г. 197 (12): 1631-3. [Медлайн].
Schleiss MR. Вакцина против цитомегаловируса укрощает тролля трансплантологов. Ланцет . 2011, 9 апреля. 377 (9773): 1216-8. [Медлайн].
Pass RF, Zhang C, Evans A, Simpson T., Andrews W., Huang ML, et al.Вакцинная профилактика материнской цитомегаловирусной инфекции. N Engl J Med . 2009 19 марта. 360 (12): 1191-9. [Медлайн]. [Полный текст].
Цена NB, Причард М.Н. Прогресс в разработке новых методов лечения герпесвирусных инфекций. Curr Opin Virol . 2011 декабрь 1 (6): 548-54. [Медлайн].
Wolf DG, Shimoni A, Resnick IB, Stamminger T., Neumann AU, Chou S. Кинетика цитомегаловируса человека после введения артесуната после трансплантации гемопоэтических стволовых клеток. Антивирусный Рес . 2011 Июнь 90 (3): 183-6. [Медлайн].
Шапира М.Ю., Резник И.Б., Чоу С. и др. Артесунат как сильнодействующее противовирусное средство у пациента с поздней лекарственно-устойчивой цитомегаловирусной инфекцией после трансплантации гемопоэтических стволовых клеток. Клиническая инфекция . 2008 г. 1. 46 (9): 1455-7. [Медлайн].
Каул Д.Р., Стулбен С., Кобер Э.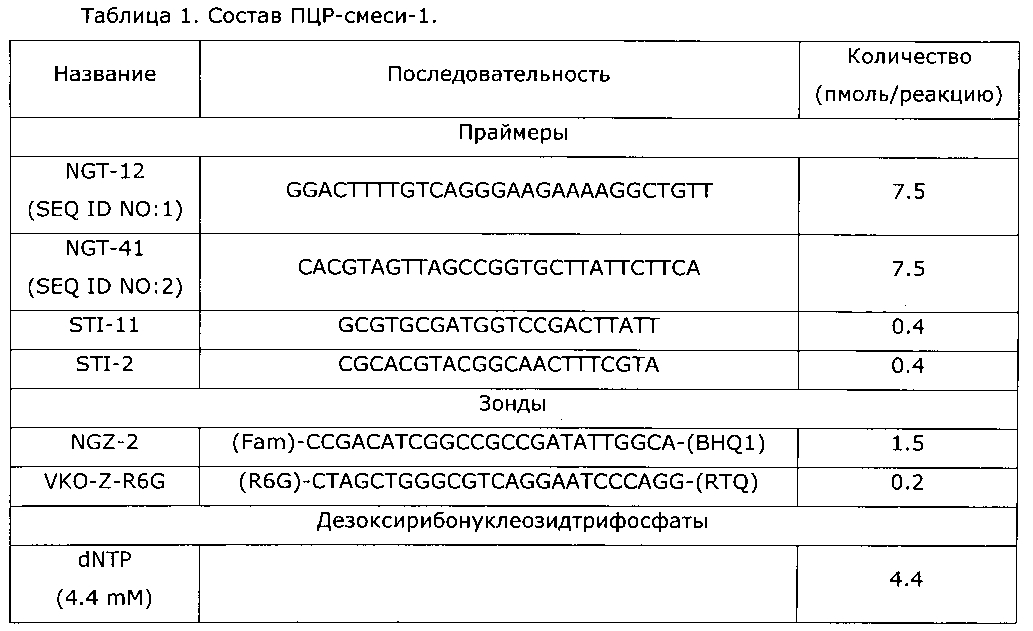 , Охо Т., Сандаски Э., Лишка П. Первый отчет об успешном лечении цитомегаловирусной болезни с множественной лекарственной устойчивостью с помощью нового анти-CMV соединения AIC246. Трансплантат Am J . 2011 Май. 11 (5): 1079-84. [Медлайн].
, Охо Т., Сандаски Э., Лишка П. Первый отчет об успешном лечении цитомегаловирусной болезни с множественной лекарственной устойчивостью с помощью нового анти-CMV соединения AIC246. Трансплантат Am J . 2011 Май. 11 (5): 1079-84. [Медлайн].
Александр Б.Т., Хладник Л.М., Огюстен К.М., Касабар Э., Маккиннон П.С., Райхли Р.М. Использование цитомегаловирусного внутривенного иммуноглобулина для дополнительного лечения цитомегаловируса у реципиентов трансплантата гемопоэтических стволовых клеток. Фармакотерапия . 30 июня 2010 г. (6): 554-61. [Медлайн].
Анджела М. Калиендо, MD, PhD. Тестирование вирусной нагрузки на цитомегаловирус у реципиентов солидных трансплантатов. Доступно по адресу http://www.uptodate.com/online/content/topic.do?topicKey=viral_in/21207&selectedTitle=6%7E150&source=search_result#h3. Доступ: 11 июля 2013 г.
Эйвери Р.К., Моссад С.Б., Поджио Э., Лард М., Будев М., Болвелл Б. Полезность лефлуномида в лечении сложных цитомегаловирусных синдромов. Трансплантация . 27 августа 2010 г. 90 (4): 419-26. [Медлайн].
Bueno J, Ramil C, Green M. Текущие стратегии управления для профилактики и лечения цитомегаловирусной инфекции у педиатрических реципиентов трансплантата. Препараты для педиатрии . 2002. 4 (5): 279-90. [Медлайн].
Cesaro S, Zhou X, Manzardo C, Buonfrate D, Cusinato R, Tridello G. Цидофовир для реактивации цитомегаловируса у педиатрических пациентов после трансплантации гемопоэтических стволовых клеток. Дж. Клин Вирол . 2005 Октябрь 34 (2): 129-32. [Медлайн].
Дж. Клин Вирол . 2005 Октябрь 34 (2): 129-32. [Медлайн].
Cunha BA, Gouzhva O, Nausheen S. Тяжелая внебольничная пневмония (ВП), вызванная цитомегаловирусом (ЦМВ), провоцирующая обострение системной красной волчанки (СКВ). Сердце легкое . 2009 май-июнь. 38 (3): 249-52. [Медлайн].
Cunha BA, Pherez F, Walls N. Тяжелая внебольничная пневмония (ВП), вызванная цитомегаловирусом (ЦМВ), у хозяина без иммунодефицита. Сердце легкое . 2009 май-июнь. 38 (3): 243-8. [Медлайн].
Клинг Дж. Цидофовир перспективен в отношении устойчивого цитомегаловируса. Доступно на http://www.medscape.com/viewarticle/811494. Доступ: 7 октября 2013 г.
Schleiss MR.VCL-CB01, инъекционная двухвалентная плазмидная ДНК-вакцина для потенциальной защиты от заболевания и инфекции ЦМВ.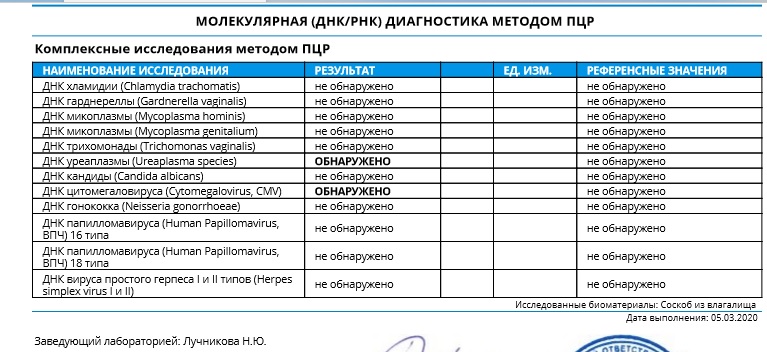 Curr Opin Mol Ther . 2009 Октябрь 11 (5): 572-8. [Медлайн].
Curr Opin Mol Ther . 2009 Октябрь 11 (5): 572-8. [Медлайн].
Thorne JE, Jabs DA, Kempen JH, Holbrook JT, Nichols C, Meinert CL. Причины снижения остроты зрения у больных СПИДом и цитомегаловирусным ретинитом в эпоху высокоактивной антиретровирусной терапии. Офтальмология . 2006 август 113 (8): 1441-5. [Медлайн].
Wloch MK, Smith LR, Boutsaboualoy S, Reyes L, Han C, Kehler J.Безопасность и иммуногенность вакцины на основе бивалентной ДНК цитомегаловируса у здоровых взрослых людей. Дж. Инфекция Дис. . 2008 15 июня. 197 (12): 1634-42. [Медлайн].
Оценка количественной ПЦР в реальном времени для обнаружения респираторно-синцитиального вируса при легочных заболеваниях
Реферат
Респираторно-синцитиальный вирус (RSV), как известно, вызывает острые инфекции нижних дыхательных путей (ОРИ) у детей раннего возраста и участвует в обострении хронической обструктивной болезни легких (ХОБЛ) у взрослых. Роль RSV в стабильной ХОБЛ и вирусной нагрузки при различных респираторных заболеваниях до настоящего времени не исследована.
Роль RSV в стабильной ХОБЛ и вирусной нагрузки при различных респираторных заболеваниях до настоящего времени не исследована.
Авторы настоящего изобретения разработали и оценили количественный анализ полимеразной цепной реакции TaqMan® в реальном времени, специфичный для подгруппы А RSV. Абсолютная количественная оценка для определения входной вирусной нагрузки была достигнута с использованием контрольной плазмиды. Анализ позволил количественное определение в диапазоне> 6 log и предел обнаружения <10 копий RSV на реакционную смесь.
Анализ был в 30 раз более чувствительным, чем обычные тесты вложенной полимеразной цепной реакции. Среднее значение Interassay sd составило 1,3, а коэффициент вариации — 4,7%. Клинические образцы от младенцев с ОРИ (n = 62) и пожилых людей с ХОБЛ (n = 125) сравнивали на вирусную нагрузку. В общей сложности 47% RSV-положительных образцов были обнаружены в группе исследования ARI и 28% в группе исследования COPD. Выявлено, что вирусная нагрузка обеих исследуемых групп существенно различалась. В группе исследования ОРИ вирусная нагрузка была увеличена почти в 2000 раз, что свидетельствует об острой инфекции в этой группе и бывшей или латентной инфекции в группе ХОБЛ.
В группе исследования ОРИ вирусная нагрузка была увеличена почти в 2000 раз, что свидетельствует об острой инфекции в этой группе и бывшей или латентной инфекции в группе ХОБЛ.
Анализ респираторно-синцитиального вируса TaqMan® в режиме реального времени с полимеразной цепной реакцией — это чувствительный и быстрый метод определения вирусной нагрузки в клинических образцах. Это позволяет получить дифференциальные заключения относительно участия респираторно-синцитиального вируса в острых инфекциях нижних дыхательных путей и хронической обструктивной болезни легких.
Это исследование было поддержано грантами Bundesministerium für Bildung und Forschung (BMBF) 01GC-9802/8 и 01GC-0101.
Респираторно-синцитиальный вирус человека (RSV) — один из наиболее важных и частых вирусов инфекций дыхательных путей. Во всем мире RSV вызывает тяжелые инфекции нижних отделов желудочно-кишечного тракта, такие как бронхиолит или пневмония, у младенцев и детей младшего возраста 1 и является частой причиной госпитализации. Связь между первичной инфекцией RSV и хроническими нарушениями функции легких, особенно детской астмой, можно предположить в результате долгосрочного проспективного исследования у детей после инфицирования RSV 2.RSV также часто встречается у взрослых, но обычно вызывает легкое заболевание верхних дыхательных путей. Однако в определенных группах взрослого населения, например, пожилые люди и / или взрослые с хронической обструктивной болезнью легких (ХОБЛ), RSV может вызывать серьезные инфекции нижних дыхательных путей 3.
Связь между первичной инфекцией RSV и хроническими нарушениями функции легких, особенно детской астмой, можно предположить в результате долгосрочного проспективного исследования у детей после инфицирования RSV 2.RSV также часто встречается у взрослых, но обычно вызывает легкое заболевание верхних дыхательных путей. Однако в определенных группах взрослого населения, например, пожилые люди и / или взрослые с хронической обструктивной болезнью легких (ХОБЛ), RSV может вызывать серьезные инфекции нижних дыхательных путей 3.
RSV представляет собой оболочечный вирус рибонуклеиновой кислоты из рода Pneumovirus из семейства Paramyxoviridae . Известны две антигенно разные подгруппы, группа A и B 5. Эпидемиологические исследования показали, что существует три типа эпидемий RSV: те, в которых вирусы группы A или B были доминирующими, и те, в которых обе группы циркулируют одновременно 6.У детей штаммы подгруппы A выявлялись по крайней мере в три раза чаще, чем подгруппа B в большинстве лет 7.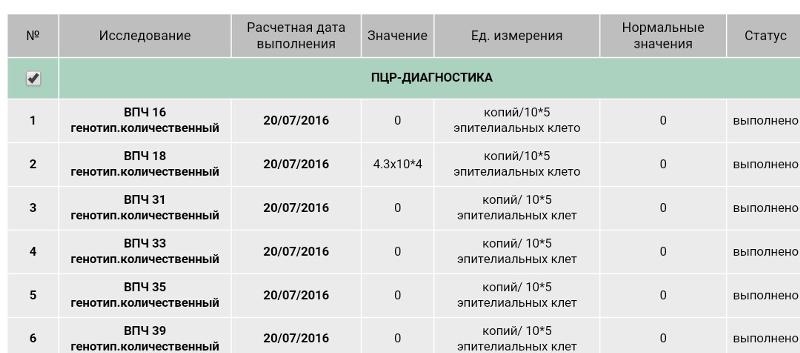 Более того, было показано, что течение болезни при инфекциях штаммом А RSV обычно более тяжелое 8.
Более того, было показано, что течение болезни при инфекциях штаммом А RSV обычно более тяжелое 8.
Диагностический метод, который все чаще используется для обнаружения вирусных патогенов как причин инфекций, — это полимеразная цепная реакция (ПЦР). По сравнению с традиционно используемыми стандартными лабораторными методами, вирусными культурами или твердофазными иммуноферментными анализами, ПЦР не только обеспечивает более высокую специфичность и чувствительность 10–12, но и облегчает практическую работу, особенно при скрининге большого количества образцов 11.В настоящее время используется множество различных методов ПЦР. До недавнего времени ПЦР использовалась в основном для качественного анализа путем визуализации количества амплифицированных целевых молекул в конце реакции (обычная ПЦР). Чувствительность таких анализов можно повысить с помощью вложенной ПЦР (nePCR), при которой анализируются образцы с очень небольшим количеством исходных вирусных геномов, но для этого требуется второй длительный запуск ПЦР и повышается риск перекрестного заражения. С другой стороны, количественная ПЦР в реальном времени (кПЦР), основанная на 5′-3′-экзонуклеазной активности полимеразы Thermus acquaticus (Taq), показала повышенную чувствительность и специфичность 14–16.Благодаря измерению продукта амплификации в экспоненциальной фазе реакции можно выявить различия в количестве исходных вирусных молекул 15 и измерить начальную концентрацию в определенном объеме (вирусная нагрузка). Дополнительная информация о вирусной нагрузке может быть полезным диагностическим инструментом для прогнозирования вирус-ассоциированных заболеваний, оценки статуса заболевания, выявления различных состояний вирусной инфекции или мониторинга эффективности противовирусной терапии 18–23. Результаты экспериментов кПЦР, для которых обычно требуется <2 ч, можно анализировать напрямую, без каких-либо пост-ПЦР.
С другой стороны, количественная ПЦР в реальном времени (кПЦР), основанная на 5′-3′-экзонуклеазной активности полимеразы Thermus acquaticus (Taq), показала повышенную чувствительность и специфичность 14–16.Благодаря измерению продукта амплификации в экспоненциальной фазе реакции можно выявить различия в количестве исходных вирусных молекул 15 и измерить начальную концентрацию в определенном объеме (вирусная нагрузка). Дополнительная информация о вирусной нагрузке может быть полезным диагностическим инструментом для прогнозирования вирус-ассоциированных заболеваний, оценки статуса заболевания, выявления различных состояний вирусной инфекции или мониторинга эффективности противовирусной терапии 18–23. Результаты экспериментов кПЦР, для которых обычно требуется <2 ч, можно анализировать напрямую, без каких-либо пост-ПЦР.
Целью текущего исследования членов группы клинических исследований «Вирусные инфекции при острых и хронических респираторных заболеваниях у детей и взрослых» была оценка чувствительного и быстрого анализа qPCR, специфичного для RSV-A, для определения вирусной нагрузки в различных респираторных системах. болезни. Образцы госпитализированных детей с острой респираторной инфекцией (ОРИ) и взрослых с ХОБЛ были проанализированы на наличие и количество RSV-A. Вторая цель настоящего исследования заключалась в том, чтобы определить, можно ли обнаружить RSV-A у пациентов с ХОБЛ с признаками обострения и без них, используя высокочувствительный метод.
болезни. Образцы госпитализированных детей с острой респираторной инфекцией (ОРИ) и взрослых с ХОБЛ были проанализированы на наличие и количество RSV-A. Вторая цель настоящего исследования заключалась в том, чтобы определить, можно ли обнаружить RSV-A у пациентов с ХОБЛ с признаками обострения и без них, используя высокочувствительный метод.
Материалы и методы
Запас вирусов и культура
RSV подгруппа A Длинный штамм (номер АТСС VR-26) и клетки-хозяева Hep-2 (номер АТСС CCL-23) были любезно предоставлены Институтом медицинской микробиологии и вирусологии (Рурский университет Бохума, Германия). После инкубации в течение 72 часов супернатант вируса титровали серийным разведением и рассчитывали 50% инфекционную дозу для культуры ткани (TCID 50 ) с использованием формулы Кербера.Исходный RSV разделяли на аликвоты и хранили при -70 ° C.
Пациенты и респираторные образцы
Клинические образцы были получены из двух исследовательских групп. В первой группе исследования назофарингеальные выделения были собраны в период с января по июнь 2001 г. у 62 детей, госпитализированных последовательно с ОРИ путем отсасывания через обе ноздри. В исследование были включены все пациенты в возрасте до 36 месяцев с первичной (n = 54) или нозокомиальной (n = 8) инфекцией нижних дыхательных путей.Диагноз: спазматический круп, бронхит, бронхит с хрипами, бронхиолит и пневмония. Критерии исключения: наличие противопоказаний к назальной аспирации и иммуносупрессивной терапии. Пациенты с первичным или вторичным иммунодефицитом или врожденным пороком сердца не включались. Девять из 29 RSV-положительных пациентов (31%) и пять из 33 контрольных (15%) родились преждевременно (гестационный возраст <35 недель). Все образцы были получены по действующему методу 24 в Детской больнице Бохума (Бохум, Германия) и хранили при -70 ° C.
В первой группе исследования назофарингеальные выделения были собраны в период с января по июнь 2001 г. у 62 детей, госпитализированных последовательно с ОРИ путем отсасывания через обе ноздри. В исследование были включены все пациенты в возрасте до 36 месяцев с первичной (n = 54) или нозокомиальной (n = 8) инфекцией нижних дыхательных путей.Диагноз: спазматический круп, бронхит, бронхит с хрипами, бронхиолит и пневмония. Критерии исключения: наличие противопоказаний к назальной аспирации и иммуносупрессивной терапии. Пациенты с первичным или вторичным иммунодефицитом или врожденным пороком сердца не включались. Девять из 29 RSV-положительных пациентов (31%) и пять из 33 контрольных (15%) родились преждевременно (гестационный возраст <35 недель). Все образцы были получены по действующему методу 24 в Детской больнице Бохума (Бохум, Германия) и хранили при -70 ° C.
Вторая группа состояла из 125 госпитализированных пожилых пациентов (средний возраст 69 лет, диапазон 43–81 лет) с ХОБЛ. В общей сложности 79 из этих пожилых пациентов были госпитализированы по поводу острого обострения ХОБЛ (AE-COPD), которое характеризовалось следующим: усиление одышки, кашля и отхаркивания мокроты. Остальные 46 пожилых пациентов имели стабильную ХОБЛ и были госпитализированы по другим медицинским причинам. У этих пациентов не было обострения в течение последних 30 дней до госпитализации, и в течение последних 14 дней не было изменений в терапии (включая ингаляционные и пероральные препараты).Обе группы ХОБЛ имели умеренное заболевание (Глобальная инициатива по хронической обструктивной болезни легких: GOLD II) 25. Наиболее частыми сопутствующими заболеваниями в группе НЯ-ХОБЛ были: гипертония (45/79, 57%), ишемическая болезнь сердца (23 / 79, 29%), гиперлипопротеинемия (20/79, 25%) и диабет (18/79, 23%). У стабильных пациентов с ХОБЛ наиболее распространенными сопутствующими заболеваниями были: артериальная гипертензия (27/46, 59%), гиперлипопротеинемия (16/46, 35%), ишемическая болезнь сердца (10/46, 22%) и диабет (7/46, 15%).
В общей сложности 79 из этих пожилых пациентов были госпитализированы по поводу острого обострения ХОБЛ (AE-COPD), которое характеризовалось следующим: усиление одышки, кашля и отхаркивания мокроты. Остальные 46 пожилых пациентов имели стабильную ХОБЛ и были госпитализированы по другим медицинским причинам. У этих пациентов не было обострения в течение последних 30 дней до госпитализации, и в течение последних 14 дней не было изменений в терапии (включая ингаляционные и пероральные препараты).Обе группы ХОБЛ имели умеренное заболевание (Глобальная инициатива по хронической обструктивной болезни легких: GOLD II) 25. Наиболее частыми сопутствующими заболеваниями в группе НЯ-ХОБЛ были: гипертония (45/79, 57%), ишемическая болезнь сердца (23 / 79, 29%), гиперлипопротеинемия (20/79, 25%) и диабет (18/79, 23%). У стабильных пациентов с ХОБЛ наиболее распространенными сопутствующими заболеваниями были: артериальная гипертензия (27/46, 59%), гиперлипопротеинемия (16/46, 35%), ишемическая болезнь сердца (10/46, 22%) и диабет (7/46, 15%). %), ни у одного из этих пациентов не было иммунодефицита.Жидкость для промывания носа и индуцированная мокрота были собраны в период с октября 1999 г. по октябрь 2001 г. в Департаменте внутренней медицины (Университетская клиника Бергманшайль, Бохум, Германия). Все образцы были получены по методике, описанной Rohde et al. 26. Образцы подвергали центрифугированию, и клетки и бесклеточные супернатанты замораживали при -70 ° C.
%), ни у одного из этих пациентов не было иммунодефицита.Жидкость для промывания носа и индуцированная мокрота были собраны в период с октября 1999 г. по октябрь 2001 г. в Департаменте внутренней медицины (Университетская клиника Бергманшайль, Бохум, Германия). Все образцы были получены по методике, описанной Rohde et al. 26. Образцы подвергали центрифугированию, и клетки и бесклеточные супернатанты замораживали при -70 ° C.
Экстракция рибонуклеиновой кислоты и обратная транскрипция
Процедуру выделения
РНК проводили сразу после оттаивания с использованием 250 мкл клеток (RNeasy Mini Kit; QIAGEN, Hilden, Германия) и 1000 мкл бесклеточного супернатанта (QIAamp DNA Blood Mini Kit; QIAGEN) в соответствии с инструкциями производителя.RSV-инфицированные клетки HEp-2 и исходный супернатант RSV, используемый в качестве контроля, обрабатывали таким же образом, как образцы клеток и бесклеточные супернатанты. Конечные объемы выделенной РНК составляли 150 мкл для клеточных образцов и 100 мкл для бесклеточных супернатантов.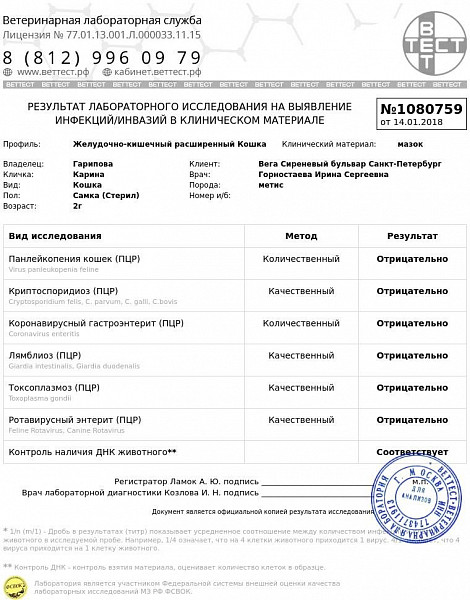 Все образцы были разделены на аликвоты и сохранены при -70 ° C. Комплементарную дезоксирибонуклеиновую кислоту (кДНК) синтезировали с 2,5 мкМ случайных гексамеров с использованием 10 мкл экстрагированной РНК в конечном объеме 50 мкл с использованием набора реагентов для обратной транскрипции TaqMan® (Applied Biosystems, Foster City, CA, USA).Образцы кДНК хранили при -20 ° C.
Все образцы были разделены на аликвоты и сохранены при -70 ° C. Комплементарную дезоксирибонуклеиновую кислоту (кДНК) синтезировали с 2,5 мкМ случайных гексамеров с использованием 10 мкл экстрагированной РНК в конечном объеме 50 мкл с использованием набора реагентов для обратной транскрипции TaqMan® (Applied Biosystems, Foster City, CA, USA).Образцы кДНК хранили при -20 ° C.
Дизайн праймеров и зонда
Последовательности прямого и обратного праймера и зонда были разработаны с помощью программного обеспечения Primer Express (Primer Express TM , версия 1.0; Applied Biosystems, США) с учетом общих правил конструирования праймеров и зондов. Настоящая система праймеров и зондов (таблица 1) расположена в области генома RSV, кодирующей субъединицу F1 слитого белка, и предполагаемая длина ампликона составляет 76 пар оснований (п.о.).Было выполнено поисковое сопоставление, подтверждающее специфичность праймеров и зонда для штамма RSV-A Long.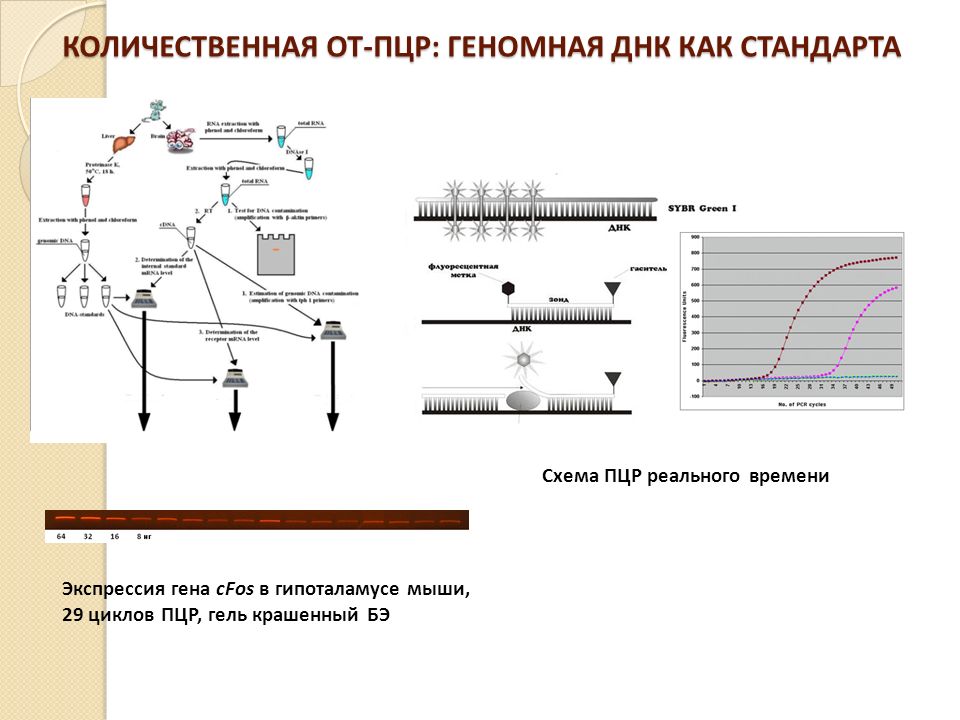 Зонд содержал флуоресцентный репортерный краситель 6-карбоксифлуоресцеин (FAM) на 5′-конце и флуоресцентный краситель-гаситель 6-карбокситетраметилродамин (TAMRA) на 3′-конце. Праймеры и зонд (Applied Biosystems, Дармштадт, Германия) разделяли на аликвоты, чтобы избежать потери стабильности при замораживании и оттаивании, и хранили при -20 ° C.
Зонд содержал флуоресцентный репортерный краситель 6-карбоксифлуоресцеин (FAM) на 5′-конце и флуоресцентный краситель-гаситель 6-карбокситетраметилродамин (TAMRA) на 3′-конце. Праймеры и зонд (Applied Biosystems, Дармштадт, Германия) разделяли на аликвоты, чтобы избежать потери стабильности при замораживании и оттаивании, и хранили при -20 ° C.
Таблица 1
Последовательности олигонуклеотидов, используемых в качестве праймеров и зондов в специфическом количественном анализе полимеразной цепной реакции в режиме реального времени, специфическом для респираторно-синцитиального вируса (RSV)
Количественная полимеразная цепная реакция в реальном времени
ПЦР-реакций проводили в виде обратной транскриптазы (RT) -qPCR с 5 мкл кДНК в объеме 25 мкл с помощью набора реагентов TaqMan® PCR Core Reagent Kit (Applied Biosystems, США).Праймеры и зонд использовали в концентрации 300 нМ и 200 нМ соответственно. Для всех амплификаций ПЦР были включены положительный и отрицательный контроли.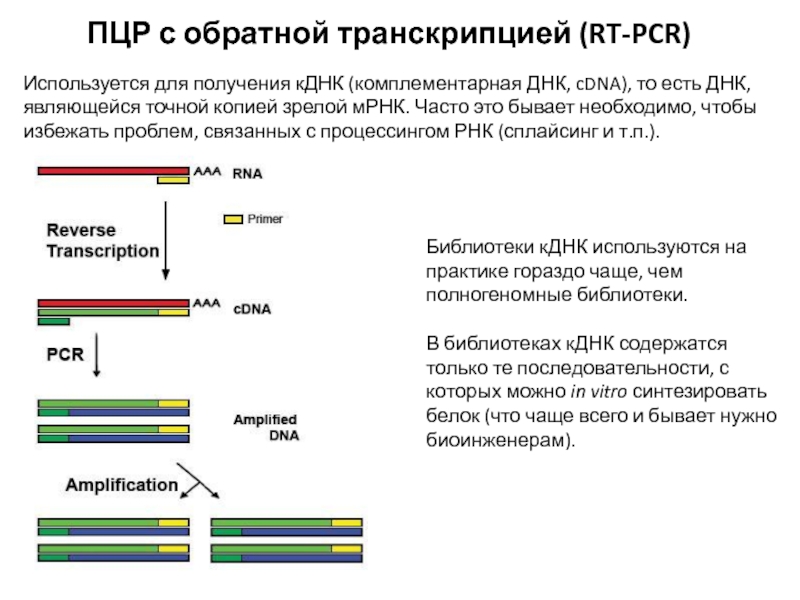 Положительные контроли состояли из нуклеиновой кислоты, экстрагированной из супернатанта RSV, и / или стандартной плазмиды дезоксирибонуклеиновой кислоты (ДНК). Отрицательные контроли проводили с водой вместо РНК. ПЦР проводили в соответствии со стандартным ПЦР-профилем TaqMan®. Амплификацию целевой ДНК и обнаружение продуктов ПЦР проводили с помощью системы обнаружения последовательностей GeneAmp® 5700 (Applied Biosystems, США).Амплификацию целевой последовательности детектировали по увеличению флуоресценции выше базовой линии при отсутствии или небольшом изменении флуоресценции. Для анализа данных флуоресценция репортера (FAM) была автоматически нормализована к пассивному эталону, чтобы избежать измерения флуоресценции, не связанной с ПЦР. Порог был установлен выше базовой линии, а значение порогового цикла (Ct) было определено как номер цикла, при котором флуоресценция превышает фиксированный порог и впервые обнаруживается статистически значимое увеличение флуоресценции.
Положительные контроли состояли из нуклеиновой кислоты, экстрагированной из супернатанта RSV, и / или стандартной плазмиды дезоксирибонуклеиновой кислоты (ДНК). Отрицательные контроли проводили с водой вместо РНК. ПЦР проводили в соответствии со стандартным ПЦР-профилем TaqMan®. Амплификацию целевой ДНК и обнаружение продуктов ПЦР проводили с помощью системы обнаружения последовательностей GeneAmp® 5700 (Applied Biosystems, США).Амплификацию целевой последовательности детектировали по увеличению флуоресценции выше базовой линии при отсутствии или небольшом изменении флуоресценции. Для анализа данных флуоресценция репортера (FAM) была автоматически нормализована к пассивному эталону, чтобы избежать измерения флуоресценции, не связанной с ПЦР. Порог был установлен выше базовой линии, а значение порогового цикла (Ct) было определено как номер цикла, при котором флуоресценция превышает фиксированный порог и впервые обнаруживается статистически значимое увеличение флуоресценции.
Вложенная полимеразная цепная реакция
НеПЦР выполняли с использованием последовательностей праймеров, специфичных для подгруппы А RSV, как описано Rohwedder et al. 27 и протокол полимеразы Taq QIAGEN (QIAGEN). Все реакции nePCR выполняли как RT-PCR.
27 и протокол полимеразы Taq QIAGEN (QIAGEN). Все реакции nePCR выполняли как RT-PCR.
Hexaplex® Multiplex полимеразная цепная реакция с обратной транскриптазой
Все реакции множественной ОТ-ПЦР проводили в Институте медицинской микробиологии и вирусологии Рурского университета (Бохум, Германия) с использованием системы Hexaplex® Multiplex RT-PCR (Prodesse, Waukesha, WI, США).
Иммуноферментный анализ
Иммуноферментный анализ RSV был обнаружен с помощью тест-пакета ABBOTT RSV (Abbott, Висбаден, Германия) и выполнен в Детской больнице Рурского университета (Бохум, Германия).
Исключение перекрестной реактивности
Для изучения специфичности кПЦР было выбрано
образцов дыхательных путей, положительных на риновирус, грипп A или парагриппа 3, или положительных на множественные инфекции этими вирусами и RSV (анализ с помощью nePCR или мультиплексной ПЦР).
Количественный анализ продуктов полимеразной цепной реакции в реальном времени и построение стандарта
Прогнозируемая длина продукта амплификации кПЦР была подтверждена единственной прозрачной полосой длиной 76 п.н. на окрашенном бромидом этидия 4% агарозном геле NuSieve® (FCM BioProducts, Rockland, ME, USA) при ультрафиолетовом освещении. Кроме того, продукты ПЦР были клонированы с помощью набора для секвенирования TOPO TA Cloning® (Invitrogen, Karlsruhe, Германия) в вектор pCR4®-TOPO и трансформированы в соответствующий бактериальный штамм (TOP10).Полученные клоны оценивали с помощью кПЦР для подтверждения присутствия плазмиды, содержащей вставку RSV. Выделение плазмидной ДНК проводили с помощью набора QIAprep Spin Miniprep (QIAGEN), и концентрацию рассчитывали на основе измерений оптической плотности при 260 нм на спектрофотометре Beckman Du®-70. Плазмидную ДНК секвенировали с помощью набора для реакции BigDye Terminator Cycle Sequencing Ready (Applied Biosystems, США) на генетическом анализаторе ABI PRISM TM 310 (Applied Biosystems, США).
Абсолютное количественное определение
Для стандартизации анализа использовали плазмидную ДНК (pCR4-T1 / 6), выделенную из предварительно отобранного клона T1 / 6, прошедшего положительный скрининг.Концентрация была рассчитана точно на основании измерений оптической плотности, и количество копий плазмидной ДНК было рассчитано путем умножения произведения концентрации (пМ · мкг -1 ) и разведения (мкг · мкл -1 ) на константу Авогадро. Последовательные 10-кратные разведения известных количеств, в диапазоне от 10 пг · мкл -1 до 1 × 10 −4 пг · мкл -1 , что соответствует 4,8 × 10 6 –48 RSV-копий · мкл -1 были приготовлены, разделены на аликвоты и хранили при -20 ° C.Результаты 22 измерений каждой стандартной концентрации были использованы для построения общей стандартной кривой для средних значений Ct, чтобы рассчитать количество копий в образцах различных исследуемых групп, когда необходимо было сравнить средние значения (см. Раздел «Результаты»).
Раздел «Результаты»).
Статистический анализ
Система определения последовательности ABI PRISM TM от Applied Biosystems использовалась для мониторинга увеличения флуоресценции репортера во время ПЦР, и весь процесс вычисления значений Ct, подготовки стандартной кривой и определения начального числа копий для неизвестных образцов выполнялся с помощью программное обеспечение.Данные были представлены в виде графика амплификации, показывающего флуоресцентные значения, нанесенные на график по сравнению с — числом цикла, и в виде стандартной кривой, отображающей пороговый цикл по сравнению с — логарифмом определенных количеств (числа копий) сконструированных стандартных образцов плазмид. Количество копий неизвестных образцов было автоматически выведено из линии регрессии. Значения вирусной нагрузки указываются как количество копий на реакционную смесь для ПЦР и количество копий на мл, соответственно, для клинических образцов.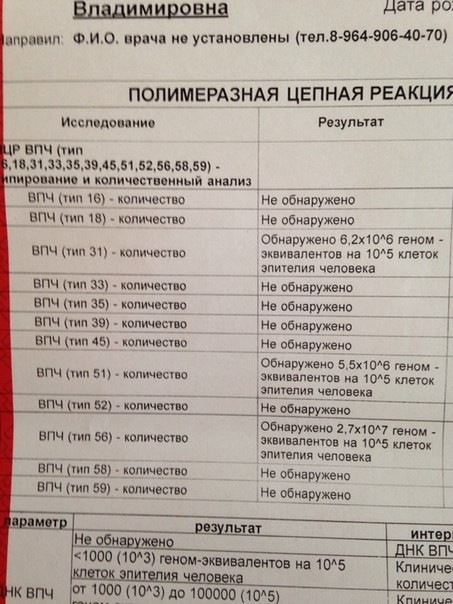 Для оценки воспроизводимости для каждой стандартной концентрации в рамках отдельных прогонов ПЦР и между ними рассчитывались sds и коэффициенты вариации (CV) внутри и между анализами. Для сравнения результатов, полученных в разных группах исследования, использовался тест Колмогорова-Смирнова на нормальность. В случае неудачного нормального распределения использовался критерий суммы рангов Манна-Уитни. Для всех тестов был выбран уровень значимости 5%.
Для оценки воспроизводимости для каждой стандартной концентрации в рамках отдельных прогонов ПЦР и между ними рассчитывались sds и коэффициенты вариации (CV) внутри и между анализами. Для сравнения результатов, полученных в разных группах исследования, использовался тест Колмогорова-Смирнова на нормальность. В случае неудачного нормального распределения использовался критерий суммы рангов Манна-Уитни. Для всех тестов был выбран уровень значимости 5%.
Результаты
Оценка подгруппы респираторно-синцитиального вируса Специфическая количественная полимеразная цепная реакция в реальном времени
Проводили амплификацию стандартной плазмидной ДНК qPCR, демонстрируя графики амплификации, соответствующие средним значениям Ct 17.66–36.82 (рис. 1⇓). Для абсолютного количественного определения вирусных геномов стандартная кривая была построена на основе значений Ct, построенных на графике против логарифма стандартных концентраций (рис. 2a⇓). Авторы обнаружили очень значимую линейную зависимость между логарифмом числа копий входной целевой ДНК и значениями Ct, что позволяет интерполировать входную концентрацию RSV (вирусную нагрузку) образцов, содержащих неизвестные количества RSV-РНК. На основании стандартной кривой предел обнаружения вирусной РНК составлял восемь копий RSV на реакционную смесь (таблица 2).
2a⇓). Авторы обнаружили очень значимую линейную зависимость между логарифмом числа копий входной целевой ДНК и значениями Ct, что позволяет интерполировать входную концентрацию RSV (вирусную нагрузку) образцов, содержащих неизвестные количества RSV-РНК. На основании стандартной кривой предел обнаружения вирусной РНК составлял восемь копий RSV на реакционную смесь (таблица 2).
Рис. 1.—
Графики амплификации pCR4-T1 / 6-стандартной дезоксирибонуклеиновой кислоты. Десятикратные серийные разведения были сделаны с 4,8 × 10 6 до 48 копий респираторно-синцитиального вируса на реакционную смесь. Эти типичные количественные графики амплификации с помощью полимеразной цепной реакции (ПЦР) TaqMan® в режиме реального времени показывают амплификацию целевой последовательности как увеличение сигнала репортерной флуоресценции (Rn) по сравнению с числа цикла во время прогона ПЦР. Значения порогового цикла рассчитываются автоматически путем определения точки, в которой флуоресценция превышает фиксированную пороговую линию (=).
Рис. 2.—
a) Стандартная кривая для pCR4-T1 / 6-стандартной дезоксирибонуклеиновой кислоты (ДНК) с входными концентрациями (Log CO) от 10 до 1 × 10 -4 пг на реакционную смесь. Количества генома неизвестного респираторно-синцитиального вируса (RSV) в клинических образцах определяли с помощью программного обеспечения ABI PRISM® 5700 Sequence Detection System путем интерполяции из стандартной кривой. б) Стандартная кривая шести стандартных разведений ДНК pCR4-T1 / 6, оцененных как стандартная кривая среднего значения.Каждая точка представляет собой значение среднего порогового цикла (Ct) и рассчитывается по результатам 22 амплификаций полимеразной цепной реакции.
Таблица 2
Корреляция между обнаружением респираторно-синцитиального вируса (RSV) в разведении RSV-рибонуклеиновой кислоты, определяемой количественной полимеразной цепной реакцией в реальном времени (qPCR) и вложенной PCR (nePCR)
Для определения точности и воспроизводимости настоящего анализа были проанализированы значения Ct, полученные из 22 повторов каждого стандартного разведения. SD варьировались от 0,58 до 1,71 для циклов внутри анализа и от 0,56 до 1,95 для циклов между анализами, причем более высокие значения были обнаружены для разведений с меньшим числом копий (таблица 3). Эти результаты позволили построить общую стандартную кривую для средних значений Ct, чтобы вычислить количество копий в образцах из различных групп исследования (рисунок 2b⇑). Более высокое значение sd для самой низкой концентрации соответствует результатам чувствительности анализа, которая снизилась до 77,3% в диапазоне 48 копий на реакционную смесь. Хотя точность количественного определения ниже этого числа копий может стать немного неточной, qPCR авторов обнаружила <48 копий RSV на реакционную смесь (таблица 2).CV внутри анализа и между анализами составляли в среднем 4,15% (диапазон 3,1–5,4%) и 4,68% (диапазон 3,2–5,9%) и не показали значительной разницы.
SD варьировались от 0,58 до 1,71 для циклов внутри анализа и от 0,56 до 1,95 для циклов между анализами, причем более высокие значения были обнаружены для разведений с меньшим числом копий (таблица 3). Эти результаты позволили построить общую стандартную кривую для средних значений Ct, чтобы вычислить количество копий в образцах из различных групп исследования (рисунок 2b⇑). Более высокое значение sd для самой низкой концентрации соответствует результатам чувствительности анализа, которая снизилась до 77,3% в диапазоне 48 копий на реакционную смесь. Хотя точность количественного определения ниже этого числа копий может стать немного неточной, qPCR авторов обнаружила <48 копий RSV на реакционную смесь (таблица 2).CV внутри анализа и между анализами составляли в среднем 4,15% (диапазон 3,1–5,4%) и 4,68% (диапазон 3,2–5,9%) и не показали значительной разницы.
Таблица 3
Точность (повторяемость) межисследований респираторно-синцитиального вируса (РСВ) — специфическая количественная полимеразная цепная реакция в реальном времени
Обнаружение респираторно-синцитиального вируса с помощью количественной полимеразной цепной реакции в реальном времени и вложенной полимеразной цепной реакции
Чувствительность праймеров кПЦР и системы зондов тестировали с кДНК, полученной из исходного материала RSV. Использовали десятикратные серийные разведения изолированной RSV-РНК, соответствующие TCID 50 от 1,2 × 10 4 до 1,2 × 10 -9 , подвергали обратной транскрипции и анализировали с помощью qPCR. Авторы обнаружили успешную амплификацию кДНК RSV в первых десяти разведениях до TCID 50 1,2 × 10 -5 . Значения Ct распространяются по диапазону измерения от Ct 15,21 до Ct 39,44, что соответствует вычисленному количеству копий 1,67 × 10 7 копий на реакционную смесь до 8,43 копий на реакционную смесь.
Использовали десятикратные серийные разведения изолированной RSV-РНК, соответствующие TCID 50 от 1,2 × 10 4 до 1,2 × 10 -9 , подвергали обратной транскрипции и анализировали с помощью qPCR. Авторы обнаружили успешную амплификацию кДНК RSV в первых десяти разведениях до TCID 50 1,2 × 10 -5 . Значения Ct распространяются по диапазону измерения от Ct 15,21 до Ct 39,44, что соответствует вычисленному количеству копий 1,67 × 10 7 копий на реакционную смесь до 8,43 копий на реакционную смесь.
Результаты анализа авторов сравнивали с результатами, полученными с помощью хорошо зарекомендовавшей себя неПЦР для обнаружения RSV, описанной Rohwedder et al. 27. Положительная амплификация nePCR приводит к получению продукта PCR размером 326 пар оснований, который может быть обнаружен как одна полоса с помощью электрофореза в агарозном геле. Оба протокола ПЦР применялись к одним и тем же разведениям РНК из исходного материала RSV, как описано выше. Результаты обоих методов ПЦР соответствовали первым восьми разведениям RSV-РНК, но обнаружение nePCR остановилось на TCID 50 из 1.2 × 10 -4 , тогда как qPCR была более чувствительной на два журнала (таблица 2⇑).
Результаты обоих методов ПЦР соответствовали первым восьми разведениям RSV-РНК, но обнаружение nePCR остановилось на TCID 50 из 1.2 × 10 -4 , тогда как qPCR была более чувствительной на два журнала (таблица 2⇑).
Исследование линии клеток человека, инфицированной респираторно-синцитиальным вирусом
Было изучено
RSV-инфицированных клеток HEp-2, чтобы проверить способность анализа авторов детектировать RSV-РНК, специфично и чувствительно в сложной смеси с человеческой РНК. Клетки HEp-2 были инфицированы RSV с различной множественностью инфекции (moi 1 × 10 -2 -1 × 10 -6 ) при постоянном времени инкубации, равном 2.5 ч. РНК выделяли, подвергали обратной транскрипции и ко всем образцам применяли протокол qPCR. Было обнаружено, что анализ успешен при обнаружении различных количеств вирусной нуклеиновой кислоты в инфицированных RSV клетках HEp-2, соответствующих разной множественности инфекции (данные не показаны). Более того, может быть продемонстрирована репликация вируса в клетках HEp-2. На Фигуре 3 показано увеличение RSV-РНК в инфицированных клетках HEp-2 (moi 0,01) в шести временных точках в течение 24 часов инкубации. Анализ авторов qPCR показал, что в конце времени инкубации вирусная нагрузка инфицированных RSV клеток HEp-2 увеличилась в 43 раза по сравнению со значением, измеренным через 2 часа инкубации.
Более того, может быть продемонстрирована репликация вируса в клетках HEp-2. На Фигуре 3 показано увеличение RSV-РНК в инфицированных клетках HEp-2 (moi 0,01) в шести временных точках в течение 24 часов инкубации. Анализ авторов qPCR показал, что в конце времени инкубации вирусная нагрузка инфицированных RSV клеток HEp-2 увеличилась в 43 раза по сравнению со значением, измеренным через 2 часа инкубации.
Рис. 3.—
Увеличение геномов респираторно-синцитиального вируса (RSV) после размножения RSV в клетках HEp-2. Клетки HEp-2 инфицировали RSV (множественность инфицирования 0,01) и инкубировали в течение 24 ч при 37 ° C. В шести временных точках инкубация была остановлена, рибонуклеиновую кислоту выделяли из клеток HEp-2, подвергали обратной транскрипции и проводили количественную амплификацию полимеразной цепной реакции в реальном времени. Число копий RSV после 2 ч инкубации составило 4,3 × 10 4 на реакционную смесь, увеличиваясь до 43-кратного числа вирусных геномов (1. 8 × 10 6 копий на реакционную смесь).
8 × 10 6 копий на реакционную смесь).
Анализ продукта qPCR-амплификации с помощью электрофореза в агарозном геле показал единственную прозрачную полосу, соответствующую предполагаемой длине. Последующее секвенирование продукта ПЦР подтвердило специфичность для штамма RSV-A Long.
Перекрестная реактивность с другими респираторными вирусами человека
Для дальнейшего анализа специфичности анализа авторы настоящего документа исследовали, были ли другие респираторные вирусы человека (риновирус, вирус парагриппа-3 и вирус гриппа-A) обнаружены протоколом qPCR или препятствовали ли обнаружению RSV при наличии множественных вирусных инфекций.Для этого были изучены образцы пациентов с подтвержденной не-RSV-инфекцией. Ни в образцах, положительных ни на риновирус, ни на вирус парагриппа-3, ни на вирус гриппа A, не было обнаружено какой-либо ПЦР-амплификации с использованием праймеров и зонда qPCR, специфичных для RSV-A. Более того, ни один тестируемый образец с подтвержденной множественной инфекцией не дал положительного результата ПЦР при наличии RSV.
Более того, ни один тестируемый образец с подтвержденной множественной инфекцией не дал положительного результата ПЦР при наличии RSV.
Исследование клинических образцов с помощью метода количественной полимеразной цепной реакции в режиме реального времени, специфичного для респираторно-синцитиального вируса А
Определение РСВ методом КПЦР в клинических образцах изучали с использованием назофарингеального секрета младенцев с ОРИ (n = 62).Всего 29 (46,8%) из этих 62 образцов (образцов клеток) были положительными на RSV-A, а 33 образца не показали никакой амплификации в реакции ПЦР. Кроме того, анализ qPCR авторов предоставил информацию о количестве нуклеиновой кислоты RSV в группе исследования ARI. Вирусная нагрузка, обнаруженная в этих образцах дыхательных путей младенцев, находилась в диапазоне 5,4 × 10 3 –8,5 × 10 8 копий · мл -1 (медиана 1,2 · 10 7 копий · мл -1 ). Кроме того, результаты кПЦР в группе с ОРИ сравнивали с результатами двух других диагностических тестов, Мультиплексной ОТ-ПЦР Hexaplex® и иммуноферментного анализа для быстрого обнаружения антигена RSV. Оба теста выявляют группы А и В RSV, но только система мультиплексной ПЦР может дифференцировать оба штамма. Чтобы проанализировать специфичность и чувствительность анализа кПЦР, результаты сравнивали с образцами, положительными или отрицательными для обоих, мультиплексного и антигенного теста (n = 43), определенных как стандарт. Специфичность и чувствительность кПЦР, специфичной для RSV-A, составляли 95% и 91,3% соответственно.
Оба теста выявляют группы А и В RSV, но только система мультиплексной ПЦР может дифференцировать оба штамма. Чтобы проанализировать специфичность и чувствительность анализа кПЦР, результаты сравнивали с образцами, положительными или отрицательными для обоих, мультиплексного и антигенного теста (n = 43), определенных как стандарт. Специфичность и чувствительность кПЦР, специфичной для RSV-A, составляли 95% и 91,3% соответственно.
Во второй исследовательской группе пожилых госпитализированных пациентов с ХОБЛ РНК была извлечена из 125 образцов носовых лаважей и клеток мокроты.В общей сложности 35 образцов (28%) были обнаружены как RSV-A положительные (27,9% в подгруппе AE-COPD и 28,3% в подгруппе COPD). Не было существенной разницы между вирусной нагрузкой положительных образцов промывания носа и вирусной нагрузкой положительных образцов мокроты. Вирусная нагрузка во второй исследуемой группе значительно отличалась от результатов вирусной нагрузки, полученных в детской исследуемой группе (рис. 4⇓). Медиана вирусной нагрузки респираторных образцов исследуемой группы ХОБЛ составила 6,1 × 10 3 копий · мл −1 (диапазон 3.2 × 10 3 –1,5 × 10 7 копий · мл –1 ), что в 1967 раз меньше, чем в группе исследования ARI. Авторы обнаружили всего 15 геномов RSV (медиана) в среднем на реакционную смесь в респираторных образцах группы исследования ХОБЛ, показав, что количественная ПЦР способна обнаруживать даже очень низкие числа копий молекул вирусных нуклеиновых кислот в клинических образцах.
4⇓). Медиана вирусной нагрузки респираторных образцов исследуемой группы ХОБЛ составила 6,1 × 10 3 копий · мл −1 (диапазон 3.2 × 10 3 –1,5 × 10 7 копий · мл –1 ), что в 1967 раз меньше, чем в группе исследования ARI. Авторы обнаружили всего 15 геномов RSV (медиана) в среднем на реакционную смесь в респираторных образцах группы исследования ХОБЛ, показав, что количественная ПЦР способна обнаруживать даже очень низкие числа копий молекул вирусных нуклеиновых кислот в клинических образцах.
Рис. 4.—
Вирусная нагрузка респираторно-синцитиального вируса (RSV) в клинических образцах проанализирована с помощью количественной полимеразной цепной реакции в режиме реального времени.Вирусная нагрузка RSV показана для респираторных образцов, взятых у госпитализированных детей с острыми респираторными инфекциями (ОРИ; n = 62) и пожилых пациентов с хронической обструктивной болезнью легких (ХОБЛ) (n = 125). В общей сложности 29 и 22 образца оказались RSV-положительными в группах ОРИ и ХОБЛ соответственно. Среднее количество 1,2 × 10 7 геномов RSV · мл -1 было обнаружено в группе ARI (диапазон 8,5 × 10 8 –5,4 × 10 3 геномов RSV · мл -1 ) значительно выше среднего числа 6.1 × 10 3 геномов RSV · мл -1 , обнаруженных в группе ХОБЛ (диапазон от 1,5 · 10 7 до 3,2 · 10 3 RSV-геномов · мл -1 ). ***: p <0,001.
Среднее количество 1,2 × 10 7 геномов RSV · мл -1 было обнаружено в группе ARI (диапазон 8,5 × 10 8 –5,4 × 10 3 геномов RSV · мл -1 ) значительно выше среднего числа 6.1 × 10 3 геномов RSV · мл -1 , обнаруженных в группе ХОБЛ (диапазон от 1,5 · 10 7 до 3,2 · 10 3 RSV-геномов · мл -1 ). ***: p <0,001.
Кроме того, авторы изучили супернатанты бесклеточных образцов с помощью анализа qPCR и сравнили результаты с результатами образцов клеток. В группе ОРИ положительные и отрицательные результаты бесклеточных и бесклеточных образцов соответствовали 100% (n = 62/62), тогда как в группе ХОБЛ соответствие было только 17% (n = 82/125).
Обсуждение
В настоящем исследовании был оценен анализ qPCR, специфичный для RSV-A, и применен к клиническим образцам. RSV является основной причиной детского вирусного ОРИ 28 и был обнаружен среди других респираторных вирусов, в основном вирусов гриппа A, риновируса, коронавирусов и вирусов парагриппа, при обострениях ХОБЛ 29–32. Было показано, что для пожилых людей диагностика RSV с помощью менее чувствительных тестов может быть трудной и не всегда надежной, что приводит к дополнительному использованию различных методов для обнаружения RSV 33.Основными преимуществами анализа qPCR, специфичного для RSV-A, являются высокая специфичность и чувствительность, а также его точное количественное определение и воспроизводимость. Обнаружение RSV-A было надежным как в респираторных образцах детей, так и у пожилых пациентов. Сравнение результатов кПЦР с данными, полученными с помощью неПЦР, выявило почти 30-кратное увеличение чувствительности, что соответствует результатам других исследований 35. Кроме того, было обнаружено минимальное изменение анализа, представленное средним CV стандартной плазмидной ДНК в 4% по сравнению с 14%, о которых сообщалось. для обычных ПЦР-тестов 36.
Было показано, что для пожилых людей диагностика RSV с помощью менее чувствительных тестов может быть трудной и не всегда надежной, что приводит к дополнительному использованию различных методов для обнаружения RSV 33.Основными преимуществами анализа qPCR, специфичного для RSV-A, являются высокая специфичность и чувствительность, а также его точное количественное определение и воспроизводимость. Обнаружение RSV-A было надежным как в респираторных образцах детей, так и у пожилых пациентов. Сравнение результатов кПЦР с данными, полученными с помощью неПЦР, выявило почти 30-кратное увеличение чувствительности, что соответствует результатам других исследований 35. Кроме того, было обнаружено минимальное изменение анализа, представленное средним CV стандартной плазмидной ДНК в 4% по сравнению с 14%, о которых сообщалось. для обычных ПЦР-тестов 36.
Важность респираторных вирусов в обострениях ХОБЛ была показана в ряде исследований с использованием менее чувствительных методов 29 и в исследованиях с использованием технологии ПЦР 26. Более того, вирусные патогены были зарегистрированы при ХОБЛ без ухудшения респираторного статуса 26. Был обнаружен RSV-A в настоящем исследовании с аналогичным процентом в группах исследования ХОБЛ с обострением и без обострения (27,9 и 28,3% соответственно). Роль RSV и других вирусов при ХОБЛ недавно была изучена Seemungal et al. 37 с помощью nePCR, результаты которого подтверждают большое количество RSV-положительных образцов (23,5%) среди стабильных пациентов с ХОБЛ. В предыдущем исследовании RSV не удалось обнаружить в этой группе с помощью технологии nePCR 26. Greenberg et al. 32 обнаружили уровни выявления RSV при документально подтвержденных вирусных инфекциях дыхательных путей 11,4% для ХОБЛ и 9,9% для контрольных пациентов с помощью вирусной серологии. Из-за высокой чувствительности анализа кПЦР могут быть обнаружены очень низкие значения вирусной нагрузки, которые, вероятно, не включены в исследования с использованием менее чувствительных методов.Однако сравнение результатов различных исследований возможно лишь отчасти из-за различий в дизайне исследований, исследуемой популяции, определении заболевания и методах выявления с разной специфичностью и чувствительностью.
Более того, вирусные патогены были зарегистрированы при ХОБЛ без ухудшения респираторного статуса 26. Был обнаружен RSV-A в настоящем исследовании с аналогичным процентом в группах исследования ХОБЛ с обострением и без обострения (27,9 и 28,3% соответственно). Роль RSV и других вирусов при ХОБЛ недавно была изучена Seemungal et al. 37 с помощью nePCR, результаты которого подтверждают большое количество RSV-положительных образцов (23,5%) среди стабильных пациентов с ХОБЛ. В предыдущем исследовании RSV не удалось обнаружить в этой группе с помощью технологии nePCR 26. Greenberg et al. 32 обнаружили уровни выявления RSV при документально подтвержденных вирусных инфекциях дыхательных путей 11,4% для ХОБЛ и 9,9% для контрольных пациентов с помощью вирусной серологии. Из-за высокой чувствительности анализа кПЦР могут быть обнаружены очень низкие значения вирусной нагрузки, которые, вероятно, не включены в исследования с использованием менее чувствительных методов.Однако сравнение результатов различных исследований возможно лишь отчасти из-за различий в дизайне исследований, исследуемой популяции, определении заболевания и методах выявления с разной специфичностью и чувствительностью.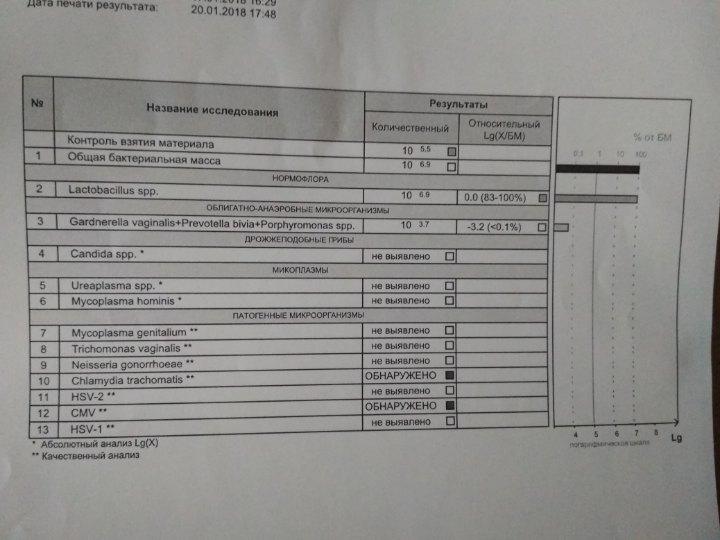
Основной целью настоящего исследования было точное количественное определение количества вирусных частиц в клинических образцах и сравнение различных респираторных заболеваний путем анализа вирусной нагрузки. В последние годы методы определения вирусной нагрузки были разработаны и успешно применяются для нескольких инфекционных заболеваний 18–23, даже в качестве критерия для различения острой и латентной инфекции 39.Результаты настоящего исследования показывают, что qPCR, специфичная для RSV-A, способна обнаруживать и количественно определять широкий спектр различных вирусных нагрузок в образцах дыхательных путей. Из-за генетической гетерогенности обеих подгрупп RSV исключено обнаружение RSV-B с помощью специфической для RSV-A количественной ПЦР. Это ограничивает метод обнаружения только RSV-A, но, поскольку RSV-A более распространен 7–9, это не ограничивает интерпретацию представленных здесь данных. Более того, анализ, описанный в этом исследовании, позволяет дифференцированно говорить о влиянии RSV на различные заболевания. Авторы обнаружили значительную разницу между средними значениями RSV-копий, обнаруженных у детей с ОРИ, по сравнению с пациентами с ХОБЛ. В группе детей с ОРИ авторы обнаружили очень высокую вирусную нагрузку. Эти дети страдали острым заболеванием, которое требовало госпитализации. В этот особенный момент времени были собраны и проанализированы образцы. Объединив эти данные и учитывая использованные дополнительные методы диагностики, авторы не сомневаются, что эти дети страдали острой инфекцией RSV-A.Однако в группе ХОБЛ авторы обнаружили два разных клинических проявления. У одного было обострение, у другого — стабильная болезнь. Хотя в одной подгруппе было обострение и потребовалась госпитализация, авторы обнаружили одинаковые низкие вирусные нагрузки в обеих группах без значительных различий. Как наблюдали в детской исследовательской группе, можно было ожидать, что высокая вирусная нагрузка связана с острой инфекцией. Поэтому авторы предположили, что низкие вирусные нагрузки указывают на латентную инфекцию или небольшое количество остаточного генома RSV от предыдущей инфекции.
Авторы обнаружили значительную разницу между средними значениями RSV-копий, обнаруженных у детей с ОРИ, по сравнению с пациентами с ХОБЛ. В группе детей с ОРИ авторы обнаружили очень высокую вирусную нагрузку. Эти дети страдали острым заболеванием, которое требовало госпитализации. В этот особенный момент времени были собраны и проанализированы образцы. Объединив эти данные и учитывая использованные дополнительные методы диагностики, авторы не сомневаются, что эти дети страдали острой инфекцией RSV-A.Однако в группе ХОБЛ авторы обнаружили два разных клинических проявления. У одного было обострение, у другого — стабильная болезнь. Хотя в одной подгруппе было обострение и потребовалась госпитализация, авторы обнаружили одинаковые низкие вирусные нагрузки в обеих группах без значительных различий. Как наблюдали в детской исследовательской группе, можно было ожидать, что высокая вирусная нагрузка связана с острой инфекцией. Поэтому авторы предположили, что низкие вирусные нагрузки указывают на латентную инфекцию или небольшое количество остаточного генома RSV от предыдущей инфекции. Учитывая низкую вирусную нагрузку, обнаруженную в группе АЕ-ХОБЛ, авторы убеждены, что RSV-A не был причиной обострения. На основании данных настоящего исследования можно предположить, что низкая вирусная нагрузка RSV-A могла способствовать инфицированию другими респираторными патогенами. Однако настоящее исследование не было разработано для изучения латентной инфекции RSV-A при ХОБЛ, так как потребуется анализ нескольких образцов, взятых в разные моменты времени, в проспективном продольном исследовании.
Учитывая низкую вирусную нагрузку, обнаруженную в группе АЕ-ХОБЛ, авторы убеждены, что RSV-A не был причиной обострения. На основании данных настоящего исследования можно предположить, что низкая вирусная нагрузка RSV-A могла способствовать инфицированию другими респираторными патогенами. Однако настоящее исследование не было разработано для изучения латентной инфекции RSV-A при ХОБЛ, так как потребуется анализ нескольких образцов, взятых в разные моменты времени, в проспективном продольном исследовании.
Разница между соответствием результатов клеточных и бесклеточных образцов в группах ОРИ (100%) и ХОБЛ (17%) также может указывать на различную роль RSV в этих заболеваниях.Высокая вирусная нагрузка при острой инфекции всегда приводит к лизису клеток, тогда как при хронической инфекции с низкой вирусной нагрузкой это может быть не так.
Таким образом, авторский респираторно-синцитиальный вирус — специфический количественный анализ полимеразной цепной реакции в режиме реального времени является специфическим, чувствительным, надежным и быстрым методом для медицинской диагностики и количественной оценки генома респираторно-синцитиального вируса в клинических образцах. Он имеет ряд преимуществ по сравнению с традиционными методами обнаружения вирусов и другими технологиями полимеразной цепной реакции.Точное определение вирусной нагрузки позволяет дифференцированно интерпретировать результаты и в дальнейшем получить доступ к изучению роли респираторно-синцитиального вируса при заболеваниях дыхательных путей. В качестве примера авторы демонстрируют, что различные роли респираторно-синцитиальной вирусной инфекции у детей по сравнению со взрослыми с хронической обструктивной болезнью легких могут быть обнаружены с помощью количественного анализа полимеразной цепной реакции в реальном времени. Дальнейшие исследования покажут, является ли это специфическим для респираторно-синцитиальной вирусной инфекции или также может быть обнаружено с другими вирусами.
Он имеет ряд преимуществ по сравнению с традиционными методами обнаружения вирусов и другими технологиями полимеразной цепной реакции.Точное определение вирусной нагрузки позволяет дифференцированно интерпретировать результаты и в дальнейшем получить доступ к изучению роли респираторно-синцитиального вируса при заболеваниях дыхательных путей. В качестве примера авторы демонстрируют, что различные роли респираторно-синцитиальной вирусной инфекции у детей по сравнению со взрослыми с хронической обструктивной болезнью легких могут быть обнаружены с помощью количественного анализа полимеразной цепной реакции в реальном времени. Дальнейшие исследования покажут, является ли это специфическим для респираторно-синцитиальной вирусной инфекции или также может быть обнаружено с другими вирусами.
Благодарности
Авторы хотели бы поблагодарить U. Arinir, A. Wiethege, A. Schürmann и P. Keller за клиническое ведение пациентов и набор группы исследования хронической обструктивной болезни легких, и особенно M. Kauth за полезные обсуждения. Авторы также благодарны Э. Дретаки-Шнакенбергу и С. Вернеру за их отличную техническую помощь (все из Университетской клиники Бергманшайль, Отделение внутренней медицины, Отделение пульмонологии, аллергологии и медицины сна, Германия).
Kauth за полезные обсуждения. Авторы также благодарны Э. Дретаки-Шнакенбергу и С. Вернеру за их отличную техническую помощь (все из Университетской клиники Бергманшайль, Отделение внутренней медицины, Отделение пульмонологии, аллергологии и медицины сна, Германия).
- Получено 24 сентября 2002 г.
- Принято 29 января 2003 г.
Ссылки
- ↵
Макинтош К.М., Чанок Р.М. .. Респираторно-синцитиальный вирус В : Филдс Б.Н., изд. Вирусология, Нью-Йорк, Raven Press, 1985; С. 1285–1304.
- ↵
Hall CB, Hall WJ, Gala CL, MaGill FB, Leddy JP. Долгосрочное проспективное исследование у детей после респираторно-синцитиальной вирусной инфекции.J Pediatr 1984; 105: 358–364.
- ↵
Falsey AR, Treanor JJ, Betts RF, Walsh EE. Вирусные респираторные инфекции у лиц пожилого возраста: клинические и эпидемиологические данные. J Am Geriatr Soc 1992; 40: 115–119.
Falsey AR, Cunningham CK, Barker WH, et al. Респираторно-синцитиальный вирус и инфекции гриппа А у госпитализированных пожилых людей. J Infect Dis 1995; 172: 389–394.
- ↵
Андерсон LJ, Hierholzer JC, Tsou C, et al. Антигенная характеристика штаммов респираторно-синцитиального вируса с помощью моноклональных антител. Журнал Infect Dis 1985; 151: 626–633.
- ↵
Hall CB, Walsh EE, Schnabel KC, et al. Распространенность респираторно-синцитиального вируса групп A и B в течение 15 лет: связанные эпидемиологические и клинические характеристики у детей, госпитализированных и амбулаторных.J Infect Dis 1990; 162: 1283–1290.
- ↵
Mufson MA, Belshe RB, Orvell C, Norrby E. Эпидемии респираторно-синцитиального вируса: переменное преобладание штаммов подгрупп A и B среди детей, 1981–1986. J. Infect Dis 1988; 157: 143–148.
- ↵
McConnochie KM, Hall CB, Walsh EE, Roghmann KJ. Различия в степени тяжести респираторно-синцитиальных инфекций в зависимости от подтипа. J Pediatr 1990; 1177: 52–62.
- ↵
Walsh EE, McConnochie KM, Long CE, Hall CB. Тяжесть респираторно-синцитиальной вирусной инфекции зависит от штамма вируса. J. Infect Dis 1997; 175: 814–820.
- ↵
Патон А.В., Патон Дж. К., Лоуренс А. Дж., Голдуотер П. Н., Харрис Р. Дж. Быстрое обнаружение респираторно-синцитиального вируса в носоглоточных аспиратах с помощью обратной транскрипции и амплификации полимеразной цепи. J Clin Microbiol 1992; 30: 901–904.
- ↵
Вальдивия А., Савон С., Чакон Д., и др. Анализ респираторно-синцитиального вируса в клинических образцах с помощью картирования рестрикции обратной транскриптазы-полимеразной цепной реакции. Mem Inst Oswaldo Cruz 1997; 92: 389–393.
- ↵
Freymuth F, Vabret A, Brouard J, et al. Выявление вирусных, Chlamydia pneumoniae, и Mycoplasma pneumoniae, инфекций при обострениях астмы у детей.Дж. Клин Вирол, 1999; 13: 131–139.
Gilbert LL, Dakhama A, Bone BM, Thomas EE, Hegele RG. Диагностика вирусных инфекций дыхательных путей у детей с помощью ПЦР-панели с обратной транскрипцией. J Clin Microbiol 1996; 34: 140–143.
- ↵
Ли Л.Г., Коннелл С.Р., Блох В. Распознавание аллелей с помощью ПЦР с ник-трансляцией с флуорогенными зондами. Nucleic Acids Res 1993; 21: 3761–3766.
- ↵
Ливак К.Дж., Флад С.Дж., Мармаро Дж., Гуисти В., Дитц К.Олигонуклеотиды с флуоресцентными красителями на противоположных концах обеспечивают систему гашеных зондов, полезную для обнаружения продукта ПЦР и гибридизации нуклеиновых кислот. Методы ПЦР, приложение 1995; 4: 357–362.
- ↵
Бустин С.А. Абсолютное количественное определение мРНК с использованием анализов полимеразной цепной реакции с обратной транскрипцией в реальном времени. Дж. Мол Эндокринол 2000: 169–193.
Хайд Калифорния, Стивенс Дж., Ливак К.Дж., Уильямс П.М.Количественная ПЦР в реальном времени. Genome Res 1996; 6: 986–694.
- ↵
Schutten M, van den Hoogen B, van der Ende ME, Gruters RA, Osterhaus AD, Niesters HG. Разработка количественной ОТ-ПЦР в реальном времени для обнаружения РНК ВИЧ-2 в плазме. Дж. Вирол Методы 2000; 88: 81–87.
Лоэб К., Джером К., Годдард Дж., Хуанг М., Цент А, Кори Л. Высокопроизводительный количественный анализ ДНК вируса гепатита В в сыворотке с использованием флуорогенной системы обнаружения TaqMan.Гепатология 2000; 32: 626–629.
Josefsson A, Livak K, Gyllensten U. Обнаружение и количественная оценка вируса папилломы человека с использованием флуоресцентного анализа 5′-экзонуклеаз. J Clin Microbiol 1999; 37: 490–496.
Lallemand F, Desire N, Rozenbaum W., Nicolas JC, Marechal V. Количественный анализ вирусной нагрузки вируса герпеса 8 человека с использованием ПЦР-анализа в реальном времени. J Clin Microbiol 2000; 38: 1404–1408.
Locatelli G, Santoro F, Veglia F, Gobbi A, Lusso P, Malnati MS. Количественная ПЦР в реальном времени на ДНК вируса герпеса 6 человека. J Clin Microbiol 2000; 38: 4042-4048.
- ↵
Guiver M, Fox AJ, Mutton K, Mogulkoc N, Egan J. Оценка вирусной нагрузки ЦМВ с помощью количественной ПЦР TaqMan CMV и сравнение с антигенемией ЦМВ у реципиентов сердца и легких. Трансплантация 2001; 71: 1609–1615.
- ↵
Hall CB, Douglass RG, Geiman M. Клинический полезный метод выделения респираторно-синцитиального вируса. J Infect Dis 1975; 131: 1–5.
- ↵
Пауэлс Р.А., Буист А.С., Калверли А.М., Дженкинс С.Р., Херд С. Научный комитет GOLD. Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких. Итоги семинара Глобальной инициативы NHLBI / ВОЗ по хронической обструктивной болезни легких (GOLD).Am J Respir Crit Care Med 2001; 163: 1256–1276.
- ↵
Rohde G, Wiethege A, Borg I, et al. Респираторные вирусы при обострениях хронической обструктивной болезни легких, требующих госпитализации — исследование случай-контроль. Thorax 2003; 58: 37–42.
- ↵
Rohwedder A, Keminer O, Forster J, Schneider K, Schneider E, Werchau H. Обнаружение РНК респираторно-синцитиального вируса в крови новорожденных с помощью полимеразной цепной реакции.Журнал Мед Вирол 1998; 54: 320–327.
- ↵
Авила М.М., Карбаллал Г., Ровалетти Х., Эбекян Б., Цусмински М., Вайссенбахер М. Вирусная этиология острых инфекций нижних дыхательных путей у детей из закрытого сообщества. Am Rev Respir Dis 1989; 140: 634–637.
- ↵
Гамп Д.В., Филипс Калифорния, Форсайт Б.Р., Макинтош К., Ламборн К.Р., Стач WH. Роль инфекции при хроническом бронхите. Am Rev Respir Dis 1976; 113: 465–474.
Smith CB, Golden CA, Kanner RE, Renzetti AD Jr. Ассоциация вирусных инфекций и Mycoplasma pneumoniae инфекций с острым респираторным заболеванием у пациентов с хроническими обструктивными заболеваниями легких. Am Rev Respir Dis 1980; 121: 225–232.
Walsh EE, Falsey AR, Hennessey PA. Респираторно-синцитиальные и другие вирусные инфекции у лиц с хроническими сердечно-легочными заболеваниями.Am J Respir Crit Care Med 1999; 160: 791–795.
- ↵
Гринберг С.Б., Аллен М., Уилсон Дж., Атмар Р.Л. Респираторные вирусные инфекции у взрослых с хронической обструктивной болезнью легких и без нее. Am J Respir Crit Care Med 2000; 162: 167–173.
- ↵
Falsey AR, McCann RM, Hall WJ, Criddle MM. Оценка четырех методов диагностики респираторно-синцитиальной вирусной инфекции у пожилых людей.J Am Geriatr Soc 1996; 44: 71–73.
Johnston SL, Siegel CS. Оценка прямой иммунофлуоресценции, иммуноферментного анализа, центрифугирования культуры и традиционной культуры для обнаружения респираторно-синцитиального вируса. J Clin Microbiol 1990; 28: 2394–2397.
- ↵
Schmittgen TD, Zakrajsek BA, Mills AG, Gorn V, Singer MJ, Reed MW. Количественная полимеразная цепная реакция с обратной транскрипцией для изучения распада мРНК: сравнение конечной точки и методов в реальном времени.Анал Биохим 2000; 285: 194–204.
- ↵
Zhang J, Dessai M, Ozanne SE, Doherty C, Hales CN, Byrne CD. Два варианта количественной ПЦР с обратной транскриптазой, используемые для демонстрации дифференциальной экспрессии генов альфа-, бета- и гамма-фибриногена в долях печени крыс. Biochem J 1997; 321: 769–775.
- ↵
Seemungal T., Harper-Owen R, Bhowmik A, et al. Респираторные вирусы, симптомы и маркеры воспаления при обострениях и стабильной хронической обструктивной болезни легких.Am J Respir Crit Care Med 2001; 164: 1618–1623.
Бушо Р.О., Сакстан Д., Шульц П.С., Финч Э., Муфсон М.А. Инфекции, вызванные вирусами и Mycoplasma pneumoniae, при обострении хронического бронхита. J. Infect Dis 1978; 137: 377–383.
- ↵
Кимура Х., Морита М., Ябута Ю., и др. Количественный анализ вирусной нагрузки Эпштейна-Барра с использованием ПЦР в реальном времени.J Clin Microbiol 1999; 37: 132–136.
Получение наилучших результатов с помощью количественного ПЦР-анализа с обратной транскрипцией
Параметры успешной обратной транскрипции
Очистка РНК
При выборе метода выделения РНК необходимо учитывать ряд параметров. Хотя выход часто является основным соображением, удаление геномной ДНК (гДНК) и перенос ингибитора также важны. Если учесть, что кПЦР обнаруживает молекулы в 106-кратном диапазоне, метод очистки с двукратным увеличением выхода, но более низкой чистотой не дает реального преимущества.Фактически, выбор метода, который дает более высокий выход, но более низкую чистоту, особенно в отношении переноса гДНК, может быть плохим выбором, если образец предназначен для RT-qPCR. Даже небольшое загрязнение гДНК может вызвать вариабельность результатов кПЦР, в то время как большое количество загрязнения гДНК может вызвать явные ошибки количественного определения.
Один из способов помочь устранить опасения по поводу загрязнения гДНК — это включить этап ДНКазы в метод выделения РНК. В конце любого метода можно добавить этап обработки ДНКазой.Кроме того, в ваш эксперимент всегда должен быть включен контроль без обратной транскриптазы. Любые продукты амплификации из этого контроля обусловлены присутствием гДНК, и вы должны предположить, что такое же количество гДНК также присутствует в экспериментальных образцах.
Оценка качества РНК
Успешная обратная транскрипция зависит от целостности и чистоты РНК. Есть несколько методов оценки вашей РНК, прежде чем перейти к этапу RT. Целостность РНК можно оценить качественно с помощью гель-электрофореза или количественно с помощью таких систем, как Agilent Bioanalyzer, в котором используется микрофлюидика для разделения по размеру и количественного определения РНК.Если вас беспокоит деградация РНК, обязательно следуйте процедурам создания и поддержания среды, свободной от рибонуклеаз (без РНКазы), чтобы минимизировать деградацию РНК. Их хорошее описание можно найти в Blumberg, 1987 (1). Настоятельно рекомендуется использовать ингибитор РНКазы (например, Рекомбинантный ингибитор рибонуклеазы RNasin®).
Количество и чистоту РНК можно оценить по оптической плотности. Поглощение при A260 используется для определения количества РНК, а соотношение поглощения при A260 / A280 используется в качестве меры чистоты.Высококачественная РНК должна иметь минимальное соотношение A260 / 280 около 2. Эксперименты с добавлением РНК, в которых РНК неизвестного качества добавляется к RT-qPCR, которая хорошо амплифицировалась в прошлом, можно использовать для обнаружения ингибиторов. Рекомендуется включить контрольную реакцию кПЦР без ОТ для обнаружения загрязнения гДНК. Наконец, количественное определение РНК поможет нормализовать количество РНК, которое вы включаете в каждую реакцию.
RT Праймеры
Существует три типа праймеров RT. Первый праймер специфически отжигается с поли (А) частью 3′-конца транскрипта (олиго (dT) праймер).Праймеры олиго (dT) могут быть проблематичными, когда ваша целевая область находится на 5′-концах длинных мРНК или когда молекулы имеют значительную вторичную структуру, которая может вызвать остановку обратной транскриптазы во время синтеза кДНК. Второй тип праймеров — это случайные гексамерные праймеры. Они могут запускать обратную транскрипцию во многих точках транскрипта, и по этой причине они полезны для длинных мРНК и транскриптов со значительной вторичной структурой. Ген-специфические праймеры часто используются в одноэтапной (связанной) ОТ-ПЦР.
Для приложений RT-qPCR, где конечная длина ампликона составляет около 100 пар оснований или меньше, использование более высоких концентраций случайных праймеров может быть полезным. У вас будет более высокая вероятность прайминга на 3´ конце мРНК, большая вероятность того, что из каждого транскрипта произведено несколько кДНК, и более высокая вероятность прайминга редких транскриптов. Независимо от выбора праймера, может потребоваться оптимизация конечной концентрации праймера.
Одностадийная и двухэтапная ОТ-ПЦР
ОТ-ПЦР может выполняться с использованием одной из двух стратегий: одностадийной ОТ-ПЦР или двухэтапной ОТ-ПЦР.Принципиальное различие между этими двумя подходами заключается в том, выполняется ли этап RT отдельно от ПЦР или в одной пробирке. Для одноэтапной ОТ-ПЦР этапы ОТ и ПЦР выполняются последовательно в одной пробирке с использованием всего количества продуктов синтеза кДНК в качестве матрицы для ПЦР. Для двухэтапной ОТ-ПЦР этапы ОТ и ПЦР также выполняются последовательно, но только часть продуктов кДНК используется в качестве матрицы для ПЦР, которая проводится в отдельной пробирке. По этой причине одностадийная ОТ-ПЦР может быть более чувствительным подходом.Однако двухэтапная ОТ-ПЦР позволяет проводить несколько ПЦР из одной реакции ОТ, что хорошо подходит для количественной оценки нескольких мишеней или для проведения повторных анализов.
Одностадийная ОТ-ПЦР обычно использует специфичные для генов праймеры как для стадий ОТ, так и для стадий ПЦР, причем один из праймеров ПЦР также действует как праймер ОТ. Двухэтапная RT-qPCR может использовать олиго (dT) праймеры или случайные праймеры для стадии RT, но также можно использовать праймер, специфичный для последовательности.
Подходы к ПЦР в реальном времени
Флуоресцентные ДНК-связывающие красители
Использование флуоресцентных ДНК-связывающих красителей — один из самых простых подходов к ПЦР для обнаружения ампликонов в реальном времени.Краситель просто добавляется в реакцию, и флуоресценция измеряется в каждом цикле ПЦР. Поскольку флуоресценция этих красителей резко возрастает в присутствии двухцепочечной ДНК, синтез ДНК можно отслеживать по увеличению флуоресцентного сигнала. Однако часто необходимо провести предварительную работу, чтобы гарантировать, что условия ПЦР дают только конкретный продукт. В последующих реакциях конкретную амплификацию можно проверить с помощью анализа кривой плавления. Кривые термического плавления получают, позволяя всему продукту образовывать двухцепочечную ДНК при более низкой температуре (приблизительно 60 ° C) и медленно повышая температуру до денатурирующих уровней (приблизительно 95 ° C).Длина и последовательность продукта влияют на температуру плавления (Tm), поэтому кривая плавления используется для характеристики гомогенности ампликона. Неспецифическую амплификацию можно определить по широким пикам на кривой плавления или пикам с неожиданными значениями Tm. Различая специфические и неспецифические продукты амплификации, кривая плавления добавляет аспект контроля качества во время рутинного использования. Однако невозможно построить кривые плавления с помощью анализов, основанных на 5´ → 3´ экзонуклеазной активности ДНК-полимеразы Taq, таких как технология TaqMan® на основе зондов.
Примером технологии qPCR, в которой используется ДНК-связывающий краситель, является смесь GoTaq® qPCR Master Mix (№ по каталогу A6001). Эта система содержит запатентованный флуоресцентный ДНК-связывающий краситель, который часто демонстрирует большее усиление флуоресценции при связывании с двухцепочечной ДНК и меньшее ингибирование ПЦР, чем обычно используемый краситель SYBR® Green I. При использовании тех же фильтров и настроек для обнаружения. Краситель включен в смесь GoTaq® qPCR Master Mix и не препятствует амплификации, что приводит к более ранним значениям цикла количественного определения и расширенному линейному диапазону (рис. 1).Для получения дополнительной информации просмотрите видео GoTaq® qPCR Master Mix.
Меченые праймеры или зонды
ПЦР в реальном времени с использованием меченых олигонуклеотидных праймеров или зондов использует два разных флуоресцентных репортера и основывается на передаче энергии от одного репортера (донор энергии) второму репортеру (акцептор энергии), когда репортеры находятся в непосредственной близости. Второй репортер может быть тушителем или флюором. Если второй репортер является тушителем, энергия от первого репортера поглощается, но повторно излучается в виде тепла, а не света, что приводит к уменьшению флуоресцентного сигнала.В качестве альтернативы, если второй репортер представляет собой флюор, энергия может поглощаться и повторно излучаться на другой длине волны посредством флуоресцентного резонансного переноса энергии (FRET, обзор в Didenko, 2001 (2)). Во время экспоненциальной фазы ПЦР изменение флуоресценции пропорционально накоплению продукта ПЦР. В разных дизайнах анализов для отслеживания накопления продукта по-разному используется тушение / уменьшение гашения или FRET. Некоторые примеры представлены ниже.
КПЦР на основе праймера
Одним из примеров подхода на основе праймеров являются системы Plexor® qRT-PCR, для которых требуются два праймера для ПЦР, только один из которых имеет флуоресцентную метку.Эти системы используют специфическое взаимодействие между двумя модифицированными нуклеотидами (3) (4) (5). Два новых основания, изогуанин (iso-dG) и 5´-метилизоцитозин (iso-dC), образуют уникальную пару оснований в двухцепочечной ДНК (4). Для проведения флуоресцентной количественной ПЦР с использованием этой новой технологии синтезируется один праймер с остатком iso-dC в качестве 5´-концевого нуклеотида и флуоресцентной меткой на 5´-конце; второй праймер не помечен. Во время ПЦР этот меченый праймер отжигается и удлиняется, становясь частью матрицы, используемой во время последующих раундов амплификации.Комплементарный iso-dGTP, который доступен в смеси нуклеотидов как dabcyl-iso-dGTP, специфически спаривается с iso-dC. Когда дабцил-изо-dGTP включен, непосредственная близость гасителя дабцила и флуоресцентной метки на противоположной цепи эффективно гасит флуоресцентный сигнал. Этот процесс проиллюстрирован на Рисунке 2. Начальный уровень флуоресценции меченых праймеров является высоким в реакциях Plexor® System. По мере накопления продукта амплификации сигнал уменьшается.
Методы количественной ПЦР на основе зондов
Некоторые стратегии кПЦР используют дополнительные зонды нуклеиновых кислот для количественной оценки ДНК-мишени.Эти зонды также можно использовать для обнаружения однонуклеотидных полиморфизмов (6) (7). Существует несколько общих категорий зондов для ПЦР в реальном времени, включая зонды гидролиза, шпильки и простые зонды гибридизации. Эти зонды содержат комплементарную последовательность, которая позволяет зонду отжигаться с накапливающимся продуктом ПЦР, но зонды могут различаться по количеству и расположению флуоресцентных репортеров. Использование простых гибридизационных зондов включает два меченых зонда или, альтернативно, один меченый зонд и меченый праймер для ПЦР.В первом подходе энергия, излучаемая флюором на одном зонде, поглощается флюором на втором зонде, который гибридизуется поблизости. Во втором подходе излучаемая энергия поглощается вторым фтором, который включается в продукт ПЦР как часть праймера. Оба этих подхода приводят к усилению флуоресценции акцептора энергии и снижению флуоресценции донора энергии.
Методы количественной ПЦР на основе меток
Преимущество методов на основе меток перед методами с использованием ДНК-связывающих красителей заключается в способности к мультиплексированию.Хотя ДНК-связывающие красители не являются последовательностями, подходы, основанные на метках, специфичны для последовательности, поскольку флуоресцентный маркер находится на праймере амплификации и дает сильный сигнал только при связывании с ДНК-мишенью. Меченый праймер может быть помечен одной из многих распространенных флуоресцентных меток, что позволяет использовать мультиплексирование от двух до четырех цветов в зависимости от используемого инструмента. Это означает, что вы можете анализировать как целевой, так и контрольный ген в одной лунке. Наконец, простота конструкции праймера для метода на основе меченых праймеров является явным преимуществом по сравнению с подходами количественной ПЦР на основе зондов.
Анализ крови на ВИЧ-1, РНК, количественный, ПЦР в реальном времени
Категории
Анализ крови на ВИЧ-1 полезен для оценки прогноза, отслеживания прогрессирования инфекции ВИЧ-1 и контроля эффекта антиретровирусной лекарственной терапии.
Код теста: 40085
Также известен как: Вирусная нагрузка ВИЧ, Вирусная нагрузка, ВИЧ
Методология: полимеразная цепная реакция в реальном времени
Подготовка: Специальной подготовки не требуется.
Результаты тестов: 3-5 дней. Может занять больше времени в зависимости от погоды, праздников или задержек в лаборатории.
Описание
ВИЧ (вирус иммунодефицита человека) передается через контакт с инфицированной кровью и биологическими жидкостями, в основном половым контактом и совместным использованием игл во время внутривенного употребления наркотиков . ВИЧ-инфекция часто протекает бессимптомно. Когда симптомы действительно возникают, их обычно описывают как гриппоподобные.ВИЧ атакует иммунную систему, разрушая Т-клетки. Со временем ВИЧ может привести к развитию СПИДа. Агентство по охране здоровья (HPA) сообщило, что каждый четвертый человек с ВИЧ не знает, что он инфицирован. Недиагностированные случаи ВИЧ угрожают не только инфицированному человеку, но и всем, кто потенциально может распространить вирус. Тестирование на ВИЧ может помочь в ранней диагностике и лечении. При эффективном лечении у людей, инфицированных ВИЧ, гораздо больше шансов прожить нормальную жизнь.
Скрининг на ВИЧ рекомендуется всем, кто ведет половую жизнь , но особенно тем, кто ведет рискованное поведение , например, половой контакт с несколькими партнерами и внутривенное употребление наркотиков.Любой, кто узнает, что предыдущий или нынешний партнер дал положительный результат на ВИЧ, должен пройти тест на ВИЧ сам. Беременным женщинам рекомендуется пренатальное тестирование на ВИЧ из-за риска передачи инфекции их ребенку. Раннее выявление является ключом к эффективному лечению ВИЧ, поэтому рекомендуется пройти тестирование, даже если у вас нет симптомов.
Этот тест предназначен для использования в сочетании с клиническими проявлениями и другими лабораторными маркерами развития болезни для клинического ведения пациентов, инфицированных ВИЧ-1.

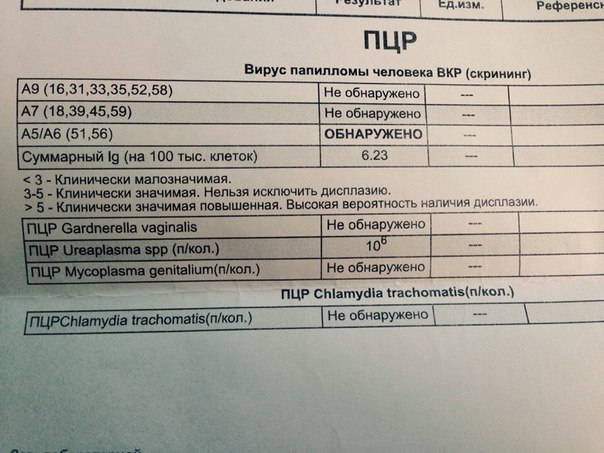

 )
) пневмонии)
пневмонии)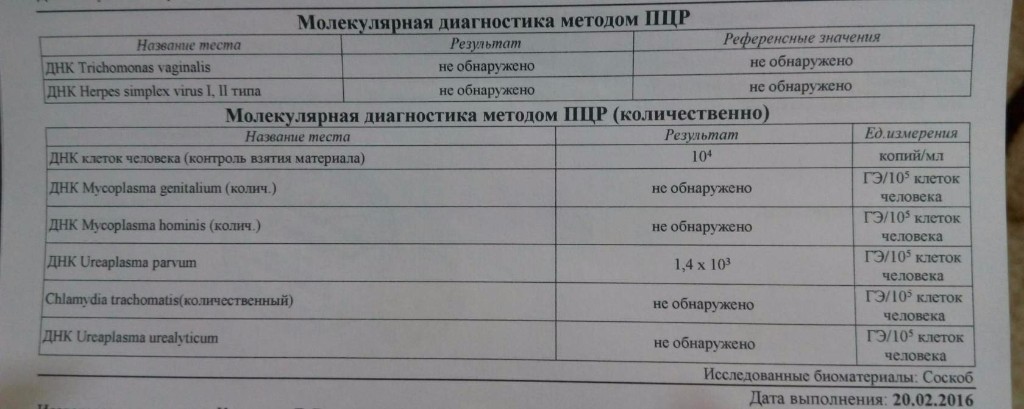
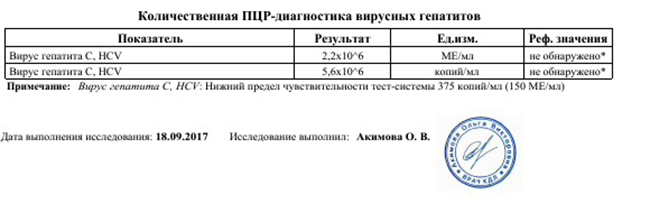 )
)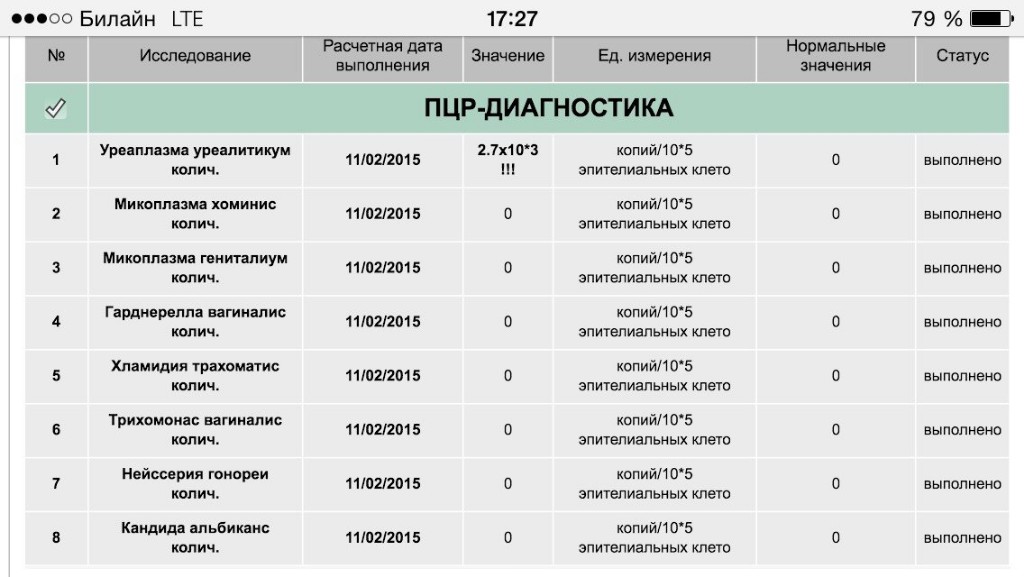 ) в крови (IgG) с определением титра, ИФА
) в крови (IgG) с определением титра, ИФА биологического материала
биологического материала
