Прогноз выживаемости при раке толстой кишки
Заведующая онкологическим отделением в клинике Ихилов.
Онколог с 20-летним стажем.
Задать вопрос
Содержание
Как пройти дистанционное лечение рака в Израиле во время эпидемии коронавируса?
Большинство пациентов беспокоятся по поводу прогноза своего заболевания. В настоящее время существует несколько разных способов оценки прогноза пациентов, наиболее важный из которых основывается на анализе стадии развития заболевания.
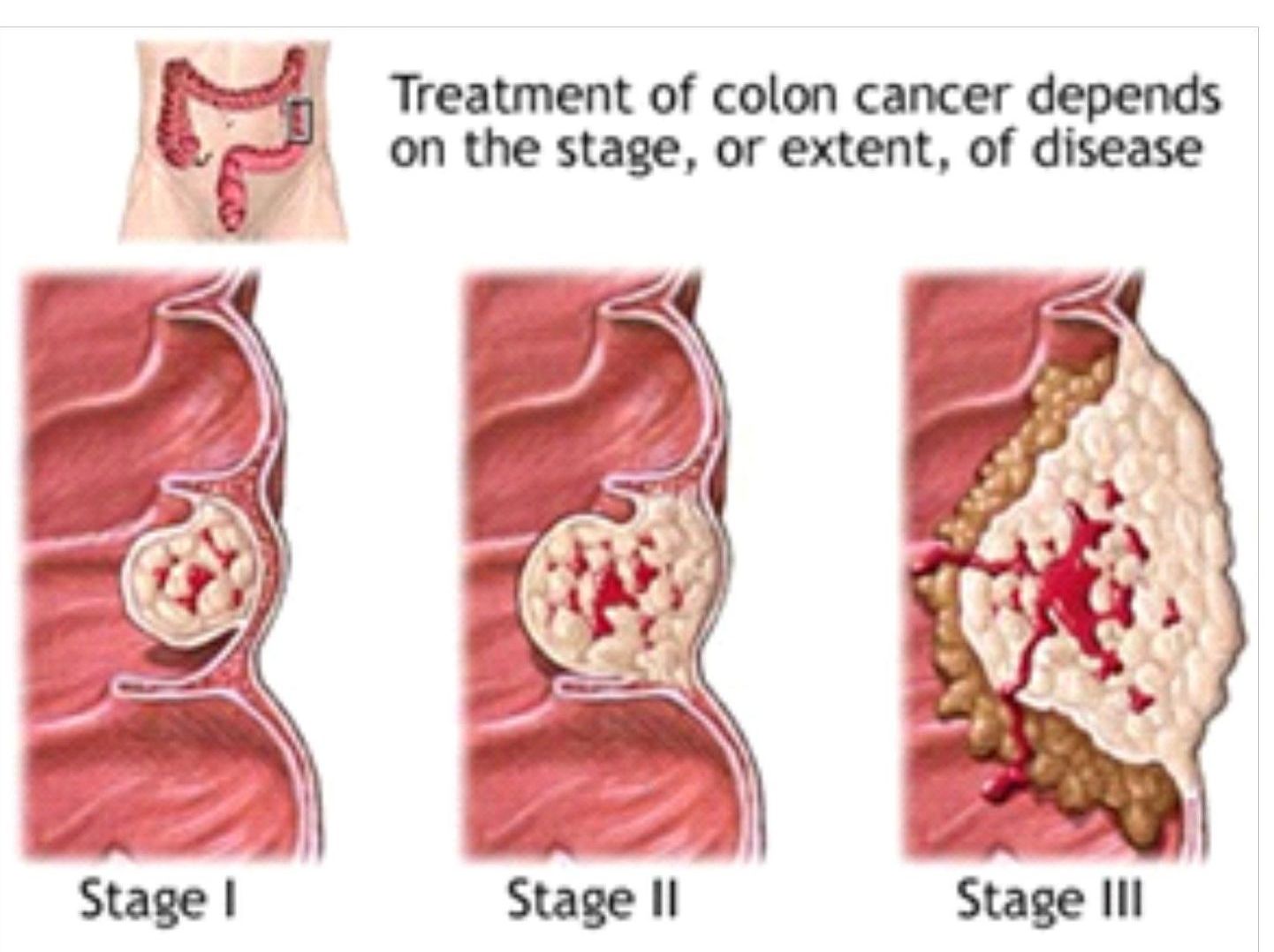
Выделают 4 стадии рака толстой кишки:
- Опухоль не проросла через стенку кишки
- Опухоль охватывает всю толщину стенки кишки
- Опухоль распространилась на лимфоузлы
- Имеются отдаленные метастазы опухоли
Каков прогноз на различных стадиях рака толстой кишки?
Само собой, при раке на первой стадии удаление совсем небольшой опухоли ведет к дальнейшему благоприятному прогнозу. В данном случае почти все пациенты полностью излечиваются. Однако если опухоль вырастает в размере или распространяется в лимфатические узлы, прогноз ухудшается. Сегодня онкологи применяют разнообразные способы лечения в целях улучшения итогового результата с помощью адъювантной химиотерапии. При метастатическом заболевании речь идет об активно развивающемся, смертельно опасном раке, и химиотерапия необходима для увеличения общей выживаемости.
В данном случае почти все пациенты полностью излечиваются. Однако если опухоль вырастает в размере или распространяется в лимфатические узлы, прогноз ухудшается. Сегодня онкологи применяют разнообразные способы лечения в целях улучшения итогового результата с помощью адъювантной химиотерапии. При метастатическом заболевании речь идет об активно развивающемся, смертельно опасном раке, и химиотерапия необходима для увеличения общей выживаемости.
За последние 10 лет общая выживаемость превысила показатель в 30 месяцев, то есть 2,5 с половиной года. Это небывалый успех. При отсутствии лечения выживаемость составит примерно 6 или 8 месяцев.
Изменения касаются не только данного показателя – значительно улучшилось и качество жизни пациентов. Медицина постоянно совершенствуется, врачи теперь владеют некоторыми клиническими патологическими критериями, и при изучении биоматериалов с помощью микроскопа специалисты могут определить потенциальную степень агрессивности опухолей – такие новообразования обычно низкодифференцированны. Чем больше у опухоли метастазов, тем хуже конечный прогноз. Если рак проник в печень, легкое, кость или головной мозг, болезнь хуже поддается лечению и прогноз не так благоприятен, как в случае обнаружения одиночных очагов в печени или легком.
Чем больше у опухоли метастазов, тем хуже конечный прогноз. Если рак проник в печень, легкое, кость или головной мозг, болезнь хуже поддается лечению и прогноз не так благоприятен, как в случае обнаружения одиночных очагов в печени или легком.
Как новые методы диагностики помогают уточнить прогноз заболевания?
В настоящее время врачи овладевают все большим объемом информации о молекулярных маркерах, и пациенты могут пройти соответствующее обследование. Обнаружение мутации в гене BRAF свидетельствует о неблагоприятном прогнозе. Об этом врачу всегда тяжело говорить пациенту. Однако он имеет право знать о наличии у него такой генной мутации и о плохом прогнозе; хорошая новость заключается в том, что современная наука разработала медикаменты с таргетным воздействием именно на этот прогностический маркер.
Вероятно, в будущем ученые обнаружат еще больше прогностических маркеров, позволяющих выбрать оптимальный метод лечения рака в Израиле и лучше понять, как подобрать химиотерапию в индивидуальном порядке для каждого пациента, используя таргетные препараты, разработанные специально для этой мутации.
Понадобится более тщательный мониторинг состояния таких пациентов, потому что у них могут рано образоваться метастазы – в том числе в таких необычных областях, как головной мозг. Поэтому по мере внедрения новых технологий в клиническую практику врачи смогут разрабатывать максимально индивидуализированные схемы лечения и наблюдения за состоянием пациентов. Эти инновации будут полезными для всех онкобольных, так как чем больше врачи знают о заболевании, тем ответственнее они подходят к терапии.
Стоимость диагностики рака толстой кишки в онкоцентре Ихилов
| Вид диагностики или лечения | Стоимость |
|---|---|
| ПЭТ-КТ (для определения возможных метастазов) | $1714 |
| Анализы крови (включая онкомаркеры) | $870 |
| Консультация онколога | $563 |
Первый шаг к выздоровлению вы можете сделать прямо сейчас. Для этого заполните заявку – и в течение 2 часов с вами свяжется один из наших врачей. Либо позвоните по телефону:+972-3-376-03-58 в Израиле и +7-495-777-6953 в России.
Либо позвоните по телефону:+972-3-376-03-58 в Израиле и +7-495-777-6953 в России.
Эта консультация ни к чему вас не обязывает и является совершенно бесплатной. Мы гарантируем вам полную конфиденциальность и сохранение медицинской тайны. Мы поможем вам, как помогли и другим пациентам.
Колоректальный рак с синхронными метастазами в легких: клинические характеристики, лечение, прогноз | Расулов
1. Steele G. Jr. Natural History Studies and the Evolution of Regional Treatment Modalities for Patients With Isolated Liver Metastases From Primary Colon and Rectum Carcinoma. Cancer Control 1996;3(1):34–41.
2. Kanas G.P., Taylor A., Primrose J.N. et al. Survival after liver resection in metastatic colorectal cancer: review and meta-analysis of prognostic factors. Clin Epidemiol 2012;4:283–301.
3. Saltz L.B., Clarke S., Diaz-Rubio E. et al. Bevacizumab in combination with oxaliplatinbased chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 2008;26(12):2013–9.
4. Stathopoulos G.P., Batziou C., Trafalis D. et al. Treatment of colorectal cancer with and without bevacizumab: a phase III study. Oncology 2010;78(5–6):376–81.
5. Langenbuch C. Ein Fall von Resection eines linksseitigen Schurlappens der Leber. Berl Klin Wochenschr 1888;25:37–9.
6. Kemeny N.E. Treatment of metastatic colon cancer: “the times they are A-changing”. J Clin Oncol 2013;31(16):1913–6.
7. Tan K.K., Lopes Gde L. Jr, Sim R. How uncommon are isolated lung metastases in colorectal cancer? A review from database of 754 patients over 4 years. J Gastrointest Surg 2009;13(4):642–8.
Tan K.K., Lopes Gde L. Jr, Sim R. How uncommon are isolated lung metastases in colorectal cancer? A review from database of 754 patients over 4 years. J Gastrointest Surg 2009;13(4):642–8.
8. Blalock A. Recent advances in surgery. New Engl J Med 1944;231:261–7.
9. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: rectal cancer 1.2016. Available at: http://www.nccn.org/professionals/physician_gls/pdf/rectal.pdf 2015.
10. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: colon cancer 2.2016. Available at: http://www.nccn.org/professionals/physician_gls/pdf/colon.pdf 2015.
11. Poston G.J., Tait D., O’Connell S. et al. Diagnosis and management of colorectal cancer: summary of NICE guidance. BMJ 2011;343:d6751.
et al. Diagnosis and management of colorectal cancer: summary of NICE guidance. BMJ 2011;343:d6751.
12. Gonzalez M., Gervaz P. Risk factors for survival after lung metastasectomy in colorectal cancer patients: systematic review and meta-analysis. Future Oncol 2015;11(2 Suppl):31–3.
13. Aberg T., Malmberg K.A., Nilsson B., Nöu E. The effect of metastasectomy: fact or fiction? Ann Thorac Surg 1980;30(4):378–84.
14. Penna C., Nordlinger B. Colorectal metastasis (liver and lung). Surg Clin North Am 2002;82(5):1075–90.
15. Mitry E., Guiu B., Cosconea S. et al. Epidemiology, management and prognosis of colorectal cancer with lung metastases: a 30-year population-based study. Gut 2010;59(10):1383–8.
16. Nozawa H., Sunami E., Nakajima J. et al. Synchronous and metachronous lung metastases in patients with colorectal cancer: A 20-year monocentric experience. Exp Ther Med 2012;3(3):449–56.
17. Poultsides G.A., Paty P.B. Reassessing the need for primary tumor surgery in unresectable metastatic colorectal cancer: overview and perspective. Ther Adv Med Oncol 2011;3(1):35–42.
18. Yedibela S., Klein P., Feuchter K. et al. Surgical management of pulmonary metastases from colorectal cancer in 153 patients. Ann Surg Oncol 2006;13(11):1538–44.
19. Watanabe K., Nagai K., Kobayashi A. et al. Factors influencing survival after complete resection of pulmonary metastases from colorectal cancer.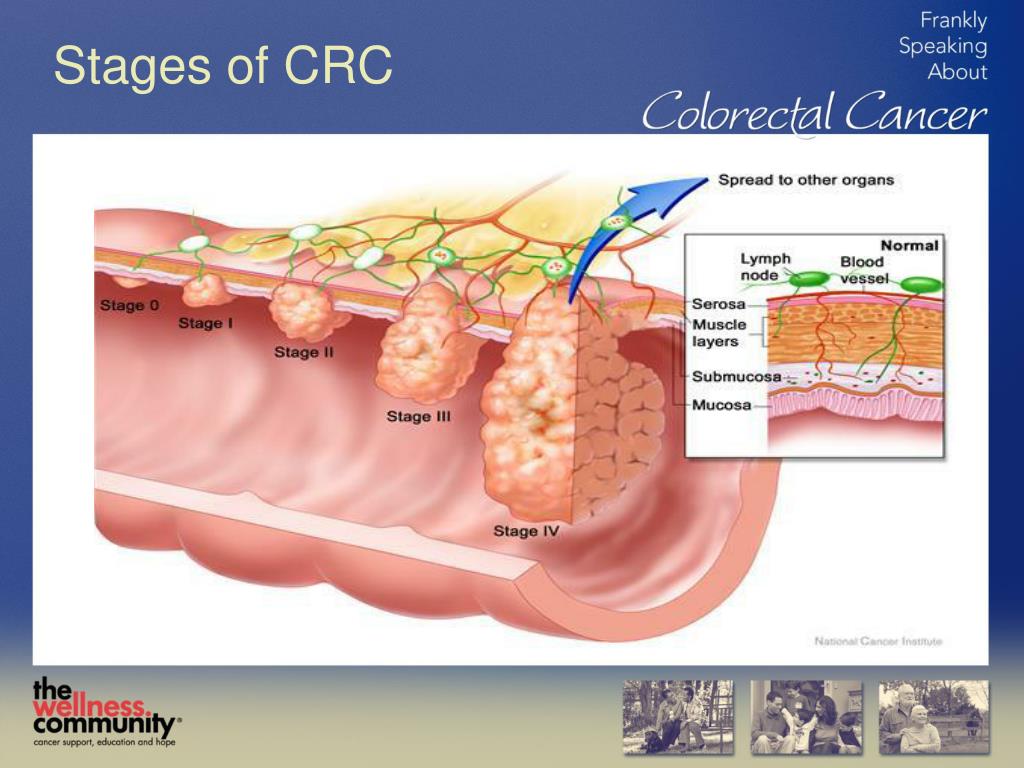 Br J Surg 2009;96(9): 1058–65.
Br J Surg 2009;96(9): 1058–65.
20. Onaitis M.W., Petersen R.P., Haney J.C. et al. Prognostic factors for recurrence after pulmonary resection of colorectal cancer metastases. Ann Thorac Surg 2009;87(6): 1684–8.
21. Rama N., Monteiro A., Bernardo J.E. et al. Lung metastases from colorectal cancer: surgical resection and prognostic factors. Eur J Cardiothorac Surg 2009;35(3):444–9.
22. Hattori N., Kanemitsu Y., Komori K. et al. Outcomes after hepatic and pulmonary metastasectomies compared with pulmonary metastasectomy alone in patients with colorectal cancer metastasis to liver and lungs. World J Surg 2013;37(6):1315–21.
Рак кишечника – затаившийся враг. Какие симптомы должны насторожить? | ЗДОРОВЬЕ
Мы привыкли, что наш организм обычно даёт нам знать о том или ином заболевании. Простыл? Покраснело горло и заложило нос. Это, конечно, самый простой пример. Есть и такие недуги, которые поначалу никак не проявляются и оттого опаснее вдвойне. Одно из таких заболеваний – рак толстой кишки.
Простыл? Покраснело горло и заложило нос. Это, конечно, самый простой пример. Есть и такие недуги, которые поначалу никак не проявляются и оттого опаснее вдвойне. Одно из таких заболеваний – рак толстой кишки.
Что приводит к заболеванию и как защитить своё здоровье? Разбираемся вместе с заместителем главного врача по хирургической помощи, онкологом-хирургом высшей категории ГБУЗ ПК «Пермский краевой онкологический диспансер» Михаилом Денисовым.
Болезнь наступает
Ирина Вервильская, корреспондент «АиФ-Прикамье»: Как часто в Прикамье болеют раком кишечника?
Михаил Денисов: Рак толстой кишки занимает третье место по заболеваемости злокачественными новообразованиями и четвёртое в структуре смертности. В 2020 году в мире такой диагноз поставили 943 000 человек, умерли от этого недуга 491 000. В 2019 году в Прикамье выявили 750 первичных случаев рака толстой кишки. Это 11,6% от всех онкозаболеваний. Средний возраст, в котором ставят такой диагноз, – 67 лет. 98 % пациентов старше 50 лет. Уровень заболеваемости за 10 лет вырос на 30%.
Средний возраст, в котором ставят такой диагноз, – 67 лет. 98 % пациентов старше 50 лет. Уровень заболеваемости за 10 лет вырос на 30%.
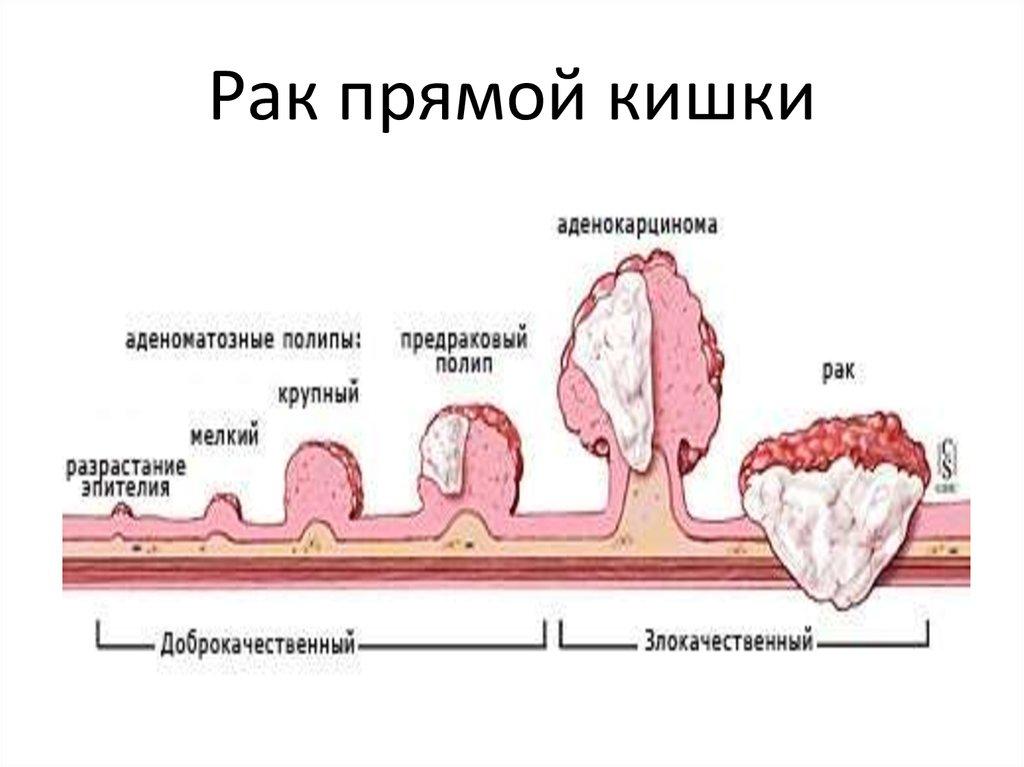
– Сложно ли диагностировать заболевание?
– Нет. Толстая кишка «удобный» орган для диагностики. Главное своевременно этим заняться. Рак толстой кишки в 90% случаев возникает на фоне полипов. С момента формирования полипа до перерождения его в злокачественную опухоль может пройти до 10 лет. Задача скрининга (система первичного обследования) – выявить и удалить полипы (это снижает риск заболеть на 32%, вероятность смерти от рака толстой кишки — на 50%), обнаружить ранние формы рака и начать лечение. Основные методы скрининга: исследование кала на скрытую кровь иммунохимическим методом (людям в возрасте 49-73 лет следует делать это 1 раз в 3 года) и колоноскопия (проводится по назначению врача при подозрении на рак). Другие методы диагностики: виртуальная или компьютерная колонография, ирригоскопия, капсульная эндоскопия.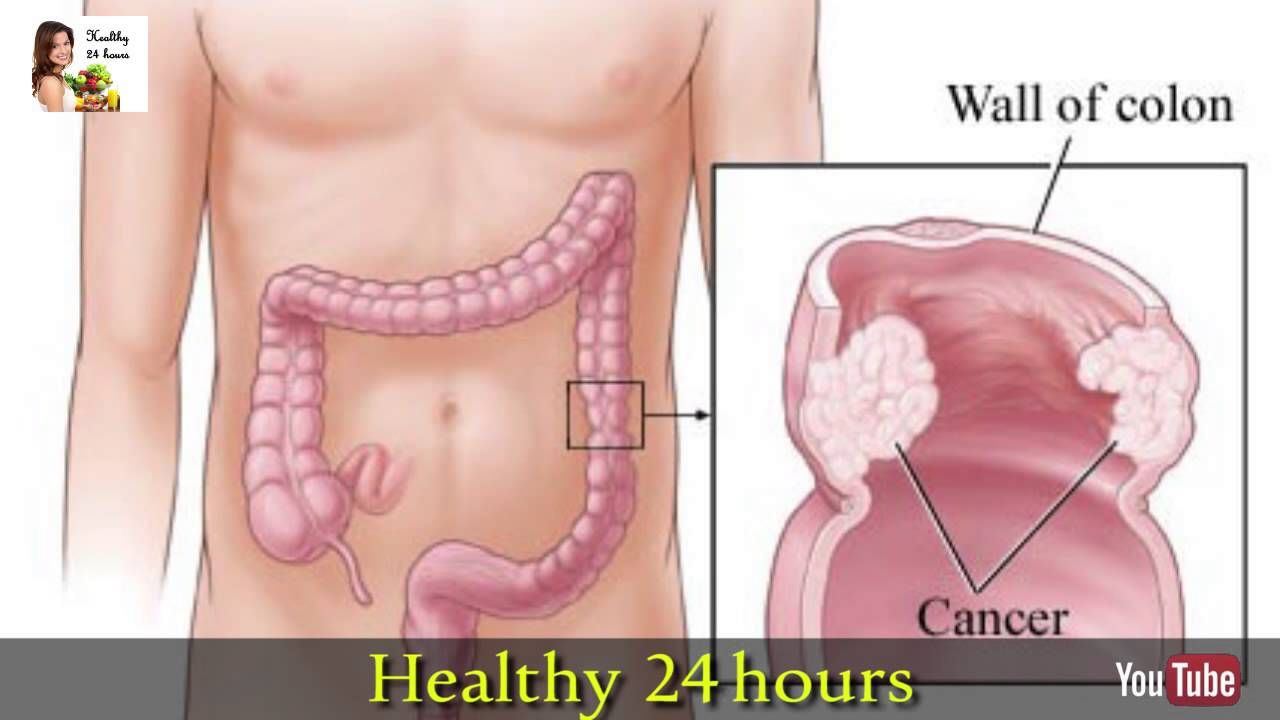
Важно выявить заболевание на ранней стадии. Фото: АиФ/ Кирилл Романов
– Выявить болезнь несложно. Почему же ситуация ухудшается?
– Подавляющее большинство пациентов поступает в стационар с прогрессирующими формами рака. Одна из причин запоздалого выявления опухоли – большой интервал между первыми её проявлениями и началом лечения. Несмотря на достаточно яркие симптомы заболевания (примесь крови в каловых массах, боли в животе, нарушение опорожнения кишечника) более половины пациентов обращаются к врачу только через полгода или позже. А 22% – приходят спустя год или более. Причины кроются, во-первых, в недостаточной осведомлённости населения о симптомах заболевания, во-вторых, в попытках самолечения, в-третьих, в недоверии к врачам поликлиник. Также стоит учесть, что много времени проходит от первого обращения к врачу до выявления онкозаболевания. По данным Государственного научного центра колопроктологии Минздрава РФ, лишь у 5,2% пациента опухоль диагностируют в течение двухнедельного обследования, у 28,3% процесс занимает от 6-12 месяцев, почти у 32,5% — более года.
– В чём причина?
– Основная причина длительного выявления опухоли – недостаточная онконастороженность врачей, которые не выполняют элементарные диагностические мероприятия. В их числе: пальцевое исследование, ректороманоскопия, ирригоскопия, колоноскопия. Также необходима биопсия опухоли с целью морфологического подтверждения диагноза. Для диагностики степени развития болезни и выявления возможных метастазов применяют ультразвуковое исследование органов брюшной полости, забрюшинного пространства и малого таза, компьютерную и магнитно-резонансную томографию, позитронно-эмиссионную томографию. Все вышеперечисленные методы обследования доступны для жителей Пермского края.
– Какие преимущества даёт выявление опухоли на ранней стадии?
– Это позволяет по максимуму применить арсенал малоинвазивных технологий и ускорит реабилитацию. Лечение ранних форм рака не требует дорогостоящих видов лечения (химио- и лучевой терапии).
Первые звоночки
– Что приводит к заболеванию?
– Непродуманная диета, высокое содержание в рационе красного мяса и животного жира (они ускоряют рост кишечных бактерий, вырабатывающих канцерогены), употребление алкоголя, избыточная масса тела, воспалительные заболевания толстой кишки. У пациентов с язвенным колитом в 2,4 раза выше риск заболеваемости раком толстой кишки. При болезни Крона в 18-40 раз выше риск развития рака тонкой кишки и лимфомы.
Фото: pixabay.com/ Причиной заболевания может стать непродуманная диета.
Также среди факторов риска: наследственные формы колоректального рака, Линч синдром, Х синдром, семейный аденоматозный полипоз (в 3-5 раз повышает риск развития у кровных родственников), полипы толстой кишки (в зависимости от размеров, срока развития, разновидности, морфологической структуры являются предраковым заболеванием и требуют обязательного удаления).
– Каковы первые тревожные симптомы?
– К сожалению, на ранней стадии заболевание никак себя не проявляет.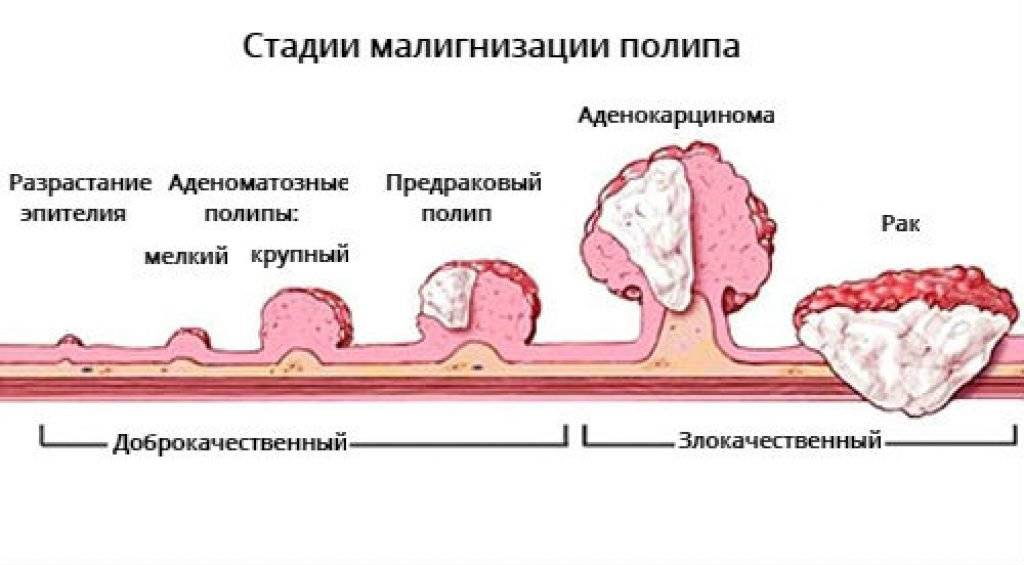 Симптомы появляются, когда опухоль достигла определённых размеров и привела к сужению просвета кишечника, поражению сосудов, нервных окончаний, сдавливанию соседних органов. Это: дискомфорт и боли в животе, расстройство дефекации, примесь крови в каловых массах, запоры. Затем, при дальнейшем развитии болезни, приходят: общая слабость, плохой аппетит, отвращение к пище, похудение. Появление метастазов сопровождают симптомы, характерные для поражения определённых органов, чаще это печень и лёгкие.
Симптомы появляются, когда опухоль достигла определённых размеров и привела к сужению просвета кишечника, поражению сосудов, нервных окончаний, сдавливанию соседних органов. Это: дискомфорт и боли в животе, расстройство дефекации, примесь крови в каловых массах, запоры. Затем, при дальнейшем развитии болезни, приходят: общая слабость, плохой аппетит, отвращение к пище, похудение. Появление метастазов сопровождают симптомы, характерные для поражения определённых органов, чаще это печень и лёгкие.
– К кому обратиться, если эти симптомы есть?
– Диагностикой и лечением этой патологии занимаются врачи терапевты, онкологи и коло-проктологи поликлиник и стационаров.
– Как часто следует проходить обследования для профилактики?
– В профилактических целях всему населению необходимо после 50 лет проходить скрининговое обследование 1 раз в 3-5 лет, если есть родственники с колоректальным раком — каждые 3-5 лет начиная с 35 лет. Пациенты, которые страдают язвенным колитом более 10 лет, нуждаются в резекции (удаление части органа, пораженного болезнью. – Авт.) толстой кишки и ежегодной колоноскопии с биопсией. Людям с семейным полипозом необходимы: исследование кишки каждые 6 месяцев и резекция повреждённых тканей. Если нет клинических проявлений болезни, скрининг показан людям в возрасте 50-75 лет.
– Авт.) толстой кишки и ежегодной колоноскопии с биопсией. Людям с семейным полипозом необходимы: исследование кишки каждые 6 месяцев и резекция повреждённых тканей. Если нет клинических проявлений болезни, скрининг показан людям в возрасте 50-75 лет.
Путь к здоровью
– Какой образ жизни вести, чтобы себя обезопасить?
– Любой вид физической активности приводит к снижению риска заболеваемости раком толстой кишки. Если говорить о питании, полезны цельнозерновые и молочные продукты, еда с пищевыми волокнами, фрукты, некрахмалистые овощи. Кстати, у вегетарианцев рак кишки бывает реже. В некоторых исследованиях отмечено влияние аспирина и препаратов кальция на снижение заболеваемости. Отказ от курения в 5 раз уменьшает риск развития колоректального рака.
Любой вид физической активности приводит к снижению риска заболеваемости раком толстой кишки. Фото: pixabay.com
– Часто ли удается побороть болезнь и вернуться к обычному образу жизни?
– Прогноз при раке толстой кишки относительно благоприятен. Есть такой показатель, как 5-летняя выживаемость (выявляется процент пациентов, которые жили как минимум 5 лет после того, как у них обнаружили рак толстой кишки). В Пермском крае он колеблется в пределах 45-60%.
Есть такой показатель, как 5-летняя выживаемость (выявляется процент пациентов, которые жили как минимум 5 лет после того, как у них обнаружили рак толстой кишки). В Пермском крае он колеблется в пределах 45-60%.
– В чём залог успешного лечения?
– Успех лечения зависит от стадии опухоли. Чем выше стадия (всего их 5: 0-1-2-3-4), тем затратнее лечение и хуже результаты. Колоректальный рак на начальной стадии успешно лечится хирургическим удалением первичной опухоли с применением малоинвазивных (оперативное вмешательство через точечные проколы тканей или естественные физиологические отверстия.– Авт.) технологий и пятилетняя выживаемость при этом составляет 90%.
– Какие меры необходимы, чтобы исправить суитацию в Прикамье?
– Это более активная пропаганда здорового образа жизни, внедрение скрининговых мероприятий. Необходимо расширять компетенцию врачей первичного звена, увеличивать число специалистов и кабинетов для эндоскопических исследований.
Метастазы в кишечнике | Лечение
Метастазы в кишечнике свидетельствуют о том, что болезнь находится на поздних стадиях, когда клетки первичного очага по лимфатическим или кровеносным сосудам перемещаются в другие органы и прорастают новыми опухолями — метастазируют. Лечение позволяет замедлить процесс, уменьшить проявление симптомов и продлить жизнь больного.
Госпитализация онкологических больных. Ежедневно. Круглосуточно
Нам доверяют 9500 пациентов ежегодно.
Обычно новообразования пищеварительного тракта являются первичными, при этом прорастают метастазы при раке кишечника в печень чаще всего, также в легкие и костные ткани. Повышает риски неправильное питание, обилие в рационе мяса, полуфабрикатов и колбасных изделий, рафинированных продуктов, недостаток овощей и, соответственно, клетчатки, а также наследственность и хронические заболевания.
Метастазы в кишечнике: симптомы
Метастатический рак означает, что злокачественный процесс достиг четвертой стадии.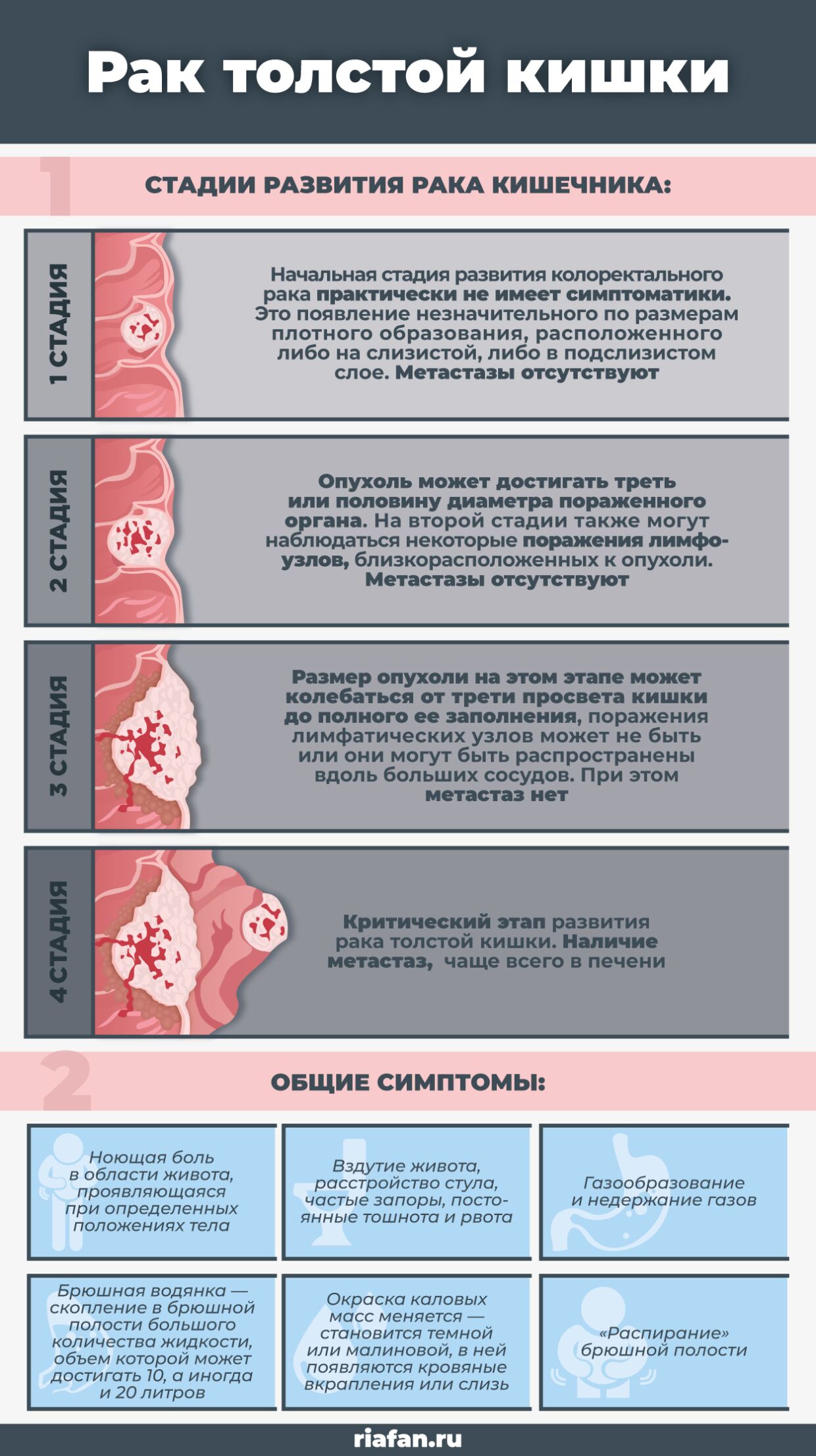 При этом становятся выраженными нарушения в органе, пораженном первичным очагом, наблюдаются:
При этом становятся выраженными нарушения в органе, пораженном первичным очагом, наблюдаются:
- боли, которые постепенно усиливаются;
- слабость и повышенная утомляемость;
- потеря аппетита и резкое снижение веса;
- субфебрильная температура, на которую не влияет прием жаропонижающих средств.
Наш эксперт в этой сфере:
Иванов Антон Александрович
Медицинский директор, врач онколог-хирург, к.м.н
При раковых опухолях в ЖКТ:
- болезненность в области живота;
- запоры, ощущение постороннего предмета при дефекации;
- примесь крови в кале;
Эти же признаки характеризуют поздние стадии рака кишечника с метастазами. Для установления точного диагноза, обнаружения всех образований и определения дальнейшей лечебной стратегии используют современные методики исследований и анализы: КТ, МРТ, УЗИ, тесты на онкомаркеры и т.д.
Для установления точного диагноза, обнаружения всех образований и определения дальнейшей лечебной стратегии используют современные методики исследований и анализы: КТ, МРТ, УЗИ, тесты на онкомаркеры и т.д.
Лечение
При раке кишечника с метастазами прогноз сложно назвать позитивным — по статистике, через 5 лет после лечения на IV стадии выживает только 6–10 %, но продлить жизнь на 1–3 года вполне реально. Чтобы относительно нормализовать стул, используют хирургические методы. Химиотерапия и лучевые методики помогают замедлить патологический процесс, уничтожить оставшиеся раковые клетки. Также применяют иммунотерапию, средства для уменьшения симптоматики и т. д. При назначении лечения учитываются состояние пациента, анамнез и специфику болезни.
Отправьте документы на почту [email protected]. Возможность проведения лечения рассмотрит главный врач клиники Антон Александрович Иванов, онколог-хирург, кмн
Специалисты клиники НАКФФ помогут вам в ситуациях, когда вас или ваших близких коснулась проблема рака. Запишитесь на предварительную консультацию по телефону +7 (495) 259-44-44.
Запишитесь на предварительную консультацию по телефону +7 (495) 259-44-44.
Как определяются метастазы при раке кишечника: симптомы и лечение, куда дает метастазы рак кишечника?
Метастазирование — это процесс распространения раковых клеток из первичного очага с током крови и лимфы в различные органы. При раке толстой кишки метастазы чаще всего обнаруживаются в печени и легких, реже — в брюшине, головном мозге, других органах. Если в ходе обследования выявлены вторичные очаги, у пациента диагностируют рак четвертой стадии. Прогноз при этом сильно ухудшается. Ремиссия, как правило, становится невозможна. Но существуют методы лечения, которые помогают увеличить продолжительность жизни, избавить от мучительных симптомов.
Рак кишечника может быть изначально диагностирован на четвертой стадии. В других случаях метастатические очаги могут быть обнаружены спустя некоторое время после того, как завершено лечение. Это говорит о том, что произошел рецидив.
Почему и как возникают метастазы при раке кишечника?
Метастазирование злокачественных опухолей — сложный, процесс, его причины и механизмы до конца не изучены. В нем выделяют несколько стадий:
- Раковая клетка отрывается от первичного очага и проникает через стенку кровеносного или лимфатического сосуда.
- Раковая клетка мигрирует с током лимфы или крови.
- Затем она «застревает» в сосудах небольшого диаметра. Некоторые исследования показали, что в этом процессе играет важную роль не только диаметр сосуда, но и скорость кровотока в нем.
- Опухолевая клетка проникает через стенку кровеносного сосуда в окружающие ткани — в будущем они станут ее новым «местом жительства».
- В течение некоторого времени раковая клетка может «спать». Когда наступает благоприятный момент, она начинает быстро размножаться и дает начало вторичному очагу.
Опухолевые клетки могут распространяться не только через кровеносные и лимфатические сосуды, но и «расползаясь» по брюшине.
Самая большая проблема в диагностике и лечении метастатического рака кишечника и других органов в том, что метастазов обычно много, многие из них имеют микроскопические размеры и не видны на снимках, их нельзя обнаружить и удалить во время хирургического вмешательства.
Какими симптомами проявляется рак кишечника с метастазами?
Проявления зависят от того, в каком органе находятся вторичные очаги, насколько сильно они нарушают их функцию. Но существуют и некоторые общие симптомы:
- Плохое самочувствие, постоянная слабость, недомогание, повышенная утомляемость.
- Потеря аппетита.
- Необъяснимая потеря массы, вплоть до сильного истощения, кахексии.
Симптомы могут отсутствовать вообще. При этом метастазы обнаруживаются лишь во время обследования.
Как диагностируют рак кишечника с метастазами?
Обычно первичную опухоль обнаруживают с помощью колоноскопии — эндоскопического исследования, во время которого в толстую кишку через задний проход вводят специальный инструмент — колоноскоп. Если во время колоноскопии выявлено патологическое образование, врач получает фрагмент ткани из него и отправляет в лабораторию для изучения под микроскопом, молекулярно-генетического анализа. Этот метод диагностики называется биопсией, он помогает окончательно подтвердить диагноз.
Если во время колоноскопии выявлено патологическое образование, врач получает фрагмент ткани из него и отправляет в лабораторию для изучения под микроскопом, молекулярно-генетического анализа. Этот метод диагностики называется биопсией, он помогает окончательно подтвердить диагноз.
Когда рак кишки подтвержден, применяют разные исследования для поиска метастазов в брюшной полости и за ее пределами:
- КТ, МРТ
- УЗИ органов брюшной полости
- ПЭТ-сканирование
- Рентгенографию грудной клетки
- Бронхоскопию
- Рентгенографию костей
- Ангиографию печени
- При необходимости проводят диагностическую лапароскопию
Метастазы рака кишки в печени
Метастазы в печени при раке толстой кишки обнаруживаются в 20–25% случаев в ходе первичного обследования и в 40% случаев после хирургического лечения первичной опухоли. При этом могут возникать такие симптомы, как желтуха, кожный зуд, увеличение живота, боль под правым ребром, отеки из-за нарушения синтеза в печени белков-альбуминов, которые обеспечивают онкотическое давление плазмы крови.
Лечение метастазов в печени при раке кишечника
За последние десятилетия в лечении метастазов печени при раке толстой кишки достигнут немалый прогресс. Расширились показания к резекции печени: если опухоль относительно небольшая и не прорастает в сосуды, ее можно удалить. Если метастатические очаги невозможно удалить хирургически, либо они рецидивировали, в некоторых случаях прибегают к радиочастотной аблации — сокращенно РЧА. Под контролем УЗИ или КТ в узел вводят специальный электрод в виде иглы и уничтожают опухолевую ткань с помощью тока высокой частоты. Проведение РЧА возможно при соблюдении некоторых условий:
- Вторичный очаг должен иметь небольшой диаметр.
- Он должен быть хорошо виден во время УЗИ и КТ.
- Очаг должен располагаться так, чтобы во время введения иглы не было риска повредить кровеносный сосуд.
- Желательно, чтобы очагов было не более 4.
Прибегают к химиотерапии — ее назначают как дополнение к хирургическому вмешательству, либо, если последнее невозможно, в качестве самостоятельного метода лечения.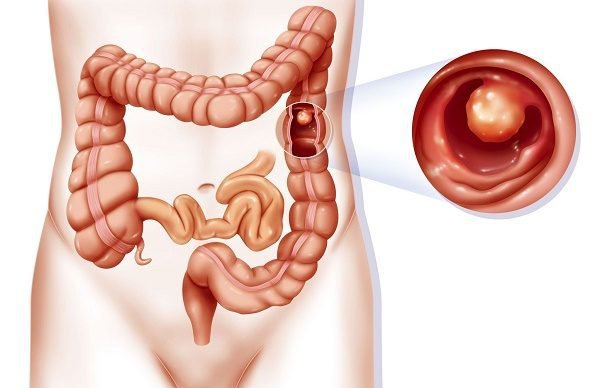 Химиопрепараты можно вводить не только системно (внутривенно), но и непосредственно в сосуд, питающий опухоль, с помощью катетера, проведенного через бедренную артерию через прокол в верхней части бедра. Во время химиоэмболизации в питающий опухоль сосуд вводят не только химиопрепарат, но и эмболизирующий препарат — микросферы, которые перекрывают просвет сосуда и лишают опухолевую ткань притока крови.
Химиопрепараты можно вводить не только системно (внутривенно), но и непосредственно в сосуд, питающий опухоль, с помощью катетера, проведенного через бедренную артерию через прокол в верхней части бедра. Во время химиоэмболизации в питающий опухоль сосуд вводят не только химиопрепарат, но и эмболизирующий препарат — микросферы, которые перекрывают просвет сосуда и лишают опухолевую ткань притока крови.
В некоторых случаях для разрушения небольших очагов в печени может быть применена современная технология под названием Кибернож. Специальный аппарат генерирует множество пучков рентгеновских волн. Каждый из них по отдельности слаб и не может нанести вреда тканям, но вместе они сходятся в одной точке — там, где находится опухоль, и здесь создается очень высокая доза. Она уничтожает раковые клетки.
В сочетании с химиопрепаратами или самостоятельно применяют таргетные препараты — противоопухолевые средства, которые блокируют молекулы, активирующие размножение раковых клеток и рост новых сосудов, снабжающих опухоль необходимыми веществами, кислородом. При раке кишечника, метастазировавшем в печень, применяют таргетные препараты: цетуксимаб, панитумумаб, афлиберцепт, бевацизумаб, регорафениб.
При раке кишечника, метастазировавшем в печень, применяют таргетные препараты: цетуксимаб, панитумумаб, афлиберцепт, бевацизумаб, регорафениб.
Лечение метастазов в легких при раке толстой кишки
Метастазы в легких при раке кишечника могут проявляться в виде одышки, упорного кашля, мокроты с примесью крови.
При единичных опухолях, имеющих относительно небольшие размеры, возможно хирургическое лечение. Чаще всего выполняют клиновидную резекцию легкого. Как и при метастазах в печени, прибегают к радиочастотной аблации, химиотерапии, таргетной терапии. К лучевой терапии прибегают не очень часто, как правило, ее используют для борьбы с болью и некоторыми другими симптомами.
Канцероматоз брюшины при раке толстой кишки
Если раковые клетки распространяются в брюшину, прогноз сильно ухудшается. Возникает асцит — в брюшной полости скапливается жидкость. Для борьбы с этим состоянием прибегают к лапароцентезу — в брюшной стенке делают прокол и выводят жидкость. Для постоянного оттока жидкости устанавливают перитонеальный катетер. Проводят внутриполостную химиотерапию, по показаниям выполняют хирургические вмешательства, направленные на обеспечение оттока жидкости из брюшной полости.
Для постоянного оттока жидкости устанавливают перитонеальный катетер. Проводят внутриполостную химиотерапию, по показаниям выполняют хирургические вмешательства, направленные на обеспечение оттока жидкости из брюшной полости.
Средняя продолжительность жизни таких пациентов при применении классических методов лечения составляет 2–6 месяцев. Но в последние 20 лет активно развивается новый метод лечения — гипертермическая интраперитонеальная химиотерапия (HIPEC). Процедура состоит из двух этапов:
- Выполняют хирургическое вмешательство, во время которого в брюшной полости удаляют все видимые очаги. Это долгая (в среднем 6–9 часов) и сложная операция.
- Затем брюшную полость промывают химиопрепаратом, нагретым до 42–43 °C.
Метод HIPEC помог сильно увеличить выживаемость пациентов с канцероматозом брюшины.
Химиотерапия при раке толстой кишки с метастазами
При нерезектабельном раке кишечника с метастазами в качестве лечения первой линии, как правило, применяют одну из трех схем химиотерапии:
- FOLFOX: лейковорин, 5-фторурацил и оксалиплатин;
- FOLFIRI: лейковорин, 5-фторурацил и иринотекан;
- CAPEOX или CAPOX: капецитабин (Кселода) и оксалиплатин.

Эти схемы можно применять в сочетании с таргетными препаратами.
Как долго продолжают лечение? До тех пор, пока оно не перестанет помогать (опухоль снова начинает прогрессировать), либо у пациента не возникнет серьезных побочных эффектов. Главная проблема схем, включающих оксалиплатин, состоит в том, что этот препарат часто приводит к побочному эффекту в виде нейропатии — состояния, при котором беспокоит жжение, онемение в руках и ногах. Некоторые эксперты рекомендуют для профилактики этого осложнения проводить лечение препаратами первой линии в течение некоторого времени, а затем переходить на поддерживающую химиотерапию другими схемами.
Пациенту стоит заранее поговорить со своим лечащим врачом, узнать, какие препараты планируется назначить, к каким побочным эффектам они могут привести, и каков будет план действий в случае их возникновения.
Иммунотерапия
У некоторых пациентов, страдающих раком кишечника с метастазами, эффективен иммунопрепарат под названием пембролизумаб (Кейтруда). Он относится к группе блокаторов контрольных точек и ингибирует молекулу, которая подавляет работу иммунных клеток. В результате последние активируются и атакуют опухолевую ткань.
Он относится к группе блокаторов контрольных точек и ингибирует молекулу, которая подавляет работу иммунных клеток. В результате последние активируются и атакуют опухолевую ткань.
Прогноз выживаемости
Пятилетняя выживаемость при раке толстого кишечника с метастазами составляет 12%. Но с развитием новых методов лечения ситуация улучшается. Никто не может заранее точно сказать, кто из пациентов попадет в эти 12%. Надежда есть у каждого, поэтому никогда не стоит сдаваться.
Рак толстой кишки — состояние проблемы | Базин И.С., Гарин А.М., Жарков С.А., Нариманов М.Н.
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Статистические аспекты, вопросы канцерогенеза и факторы прогноза
Ежегодно в мире регистрируются 600 тыс. новых больных раком толстой кишки (РТК), половина из них умирает [1].
Ежегодно в мире регистрируются 600 тыс. новых больных раком толстой кишки (РТК), половина из них умирает [1].
новых больных раком толстой кишки (РТК), половина из них умирает [1].
Отмечается рост заболеваемости в большинстве стран. Заболеваемость РТК в России с 1990 по 2000 год возросла у мужчин при раке ободочной кишки на 18,7%, прямой – 16,2%, а у женщин прирост составил 18,9 и 6,6% соответственно.
В России ежегодно регистрируется более 40 тыс. новых случаев рака толстой кишки (за 2000 год 47530 – первичных больных, умерло 34341 пациентов) [2].
До 6% пациентов от общего числа заболевших имеют наследственную природу болезни. Наследственный РТК включает в себя семейный неполипозный РТК (синдром Линча), а также рак, возникший из наследственных аденоматозных и гамартомных полипов.
Более чем у 90% больных возникает спорадический рак толстой кишки. К самым большим достижениям фундаментальной науки следует отнести идентификацию генетических изменений при спорадическом раке толстой кишки, которая дала возможность приступить к разработке генной терапии этого заболевания.
Впервые модель канцерогенеза РТК была представлена в литературе в 1988 году [3,4]. Ген АРС (аденоматозного полипоза кишки) ответственен за развитие аденом у больных семейным полипозом. Мутация этого гена (потеря аллели в 5–й хромосоме) ведет к гиперпролиферации нормального эпителия. При наследственном РТК потеря аллели в 5–й хромосоме не наблюдается никогда, при спорадическом ненаследственном РТК она отмечается у 30–50% больных.
Образование ранних аденом – второй этап в развитии РТК – связывают с мутированным колоректальным раковым геном ММС (ген, участвующий в передаче сигнальной трансдукции) и метилированием ДНК [5]. Метилирование ДНК необходимо для регуляции экспрессии генов и важно для метаболизма цитозин нуклеотидов. Гипометилирование по современным представлениям дополняет клеточную генетическую нестабильность [6].
Переход ранних аденом в «промежуточные» обусловлен генами ras. Мутации К–ras и N–ras генов обнаруживаются у 45–50% больных РТК. При аденомах размером менее 1 см мутации гена встречаются у 10% больных, при размерах более 1 см – у 50%.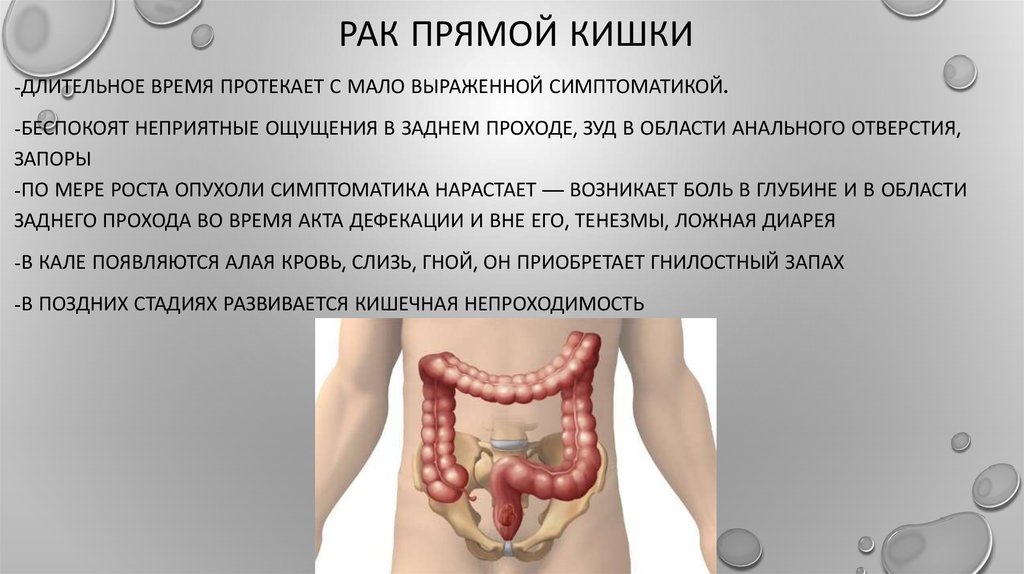 Мутации приводят к расстройствам трансдукционных сигналов с клеточной мембраны в ядро клетки [7,8].
Мутации приводят к расстройствам трансдукционных сигналов с клеточной мембраны в ядро клетки [7,8].
Потеря аллели в 18 хромосоме отмечается у 70% больных РТК и 50% больных с поздними аденомами. Потерянная аллель обычно содержит ген DCC (D от слова deleted – потерянный, СС – рак ободочной кишки). DCC – это супрессорный ген, ответственный за процессы клеточной адгезии. Снижение экспрессии гена DCC ведет к метастазированию [9,10]. При развитии РТК важную роль выполняет и ген Р–53. Мутации этого супрессорного гена, тормозящего клеточную прогрессию и трансформацию, приводят к потере контроля над процессом пролиферации [11,12].
Замещение или подавление мутированных генов ras, MMC, P–53 восстановление гена DCC и т.д. – являются вполне достижимыми целями будущего лечения больных РТК.
Возраст – основной фактор риска развития РТК у здорового человека. Так, заболеваемость РТК у 40–летних составляет 8 заболевших, у 60–летних – 150 на 100 тыс. населения.
Доказано, что риск возникновения РТК у лиц, не имеющих предрасполагающих обстоятельств, составляет 1–3%; если у родственников 1–го порядка был РТК, риск повышается до 5%, среди больных язвенным колитом риск развития РТК равен 15–30%; среди пациентов с болезнью Крона – 15%, с неполипозным наследственным колоректальным раком – 15–20%; наследственным семейным полипозом 30–100% [13]. Данные группы риска должны подвергаться обязательным профилактическим осмотрам, что в ряде случаев способствует раннему выявлению РТК. Американское раковое общество рекомендует лицам старше 50 лет пройти тестирование на скрытую кровь и раз в год подвергаться сигмоскопии.
Поскольку РТК часто возникает метахронно, больные, леченные хирургически по поводу РТК, также должны рассматриваться, как группа риска – на предмет возникновения второй опухоли в кишечнике. У 50% таких больных могут возникнуть новые полипы, и в 5% случаев они малигнизируются [14].
Наиболее известный маркер РТК – карциноэмбриональный антиген (СЕА) [15]. Диагностическое и прогностическое значение карциноэмбрионального антигена обсуждается с середины 80–х годов [16,17]. Карциноэмбриональный антиген отнюдь не обязательный маркер – у 40% больных РТК он не выявляется. Этот маркер нельзя назвать и специфическим, поскольку он обнаруживается и при других злокачественных опухолях (раке молочной железы, поджелудочной железы, легкого, яичников и даже саркомах), а также в эмбриональной ткани и незлокачественных заболеваниях (гепатотоксичность, гидронефроз, желчекаменная болезнь) [18].
Диагностическое и прогностическое значение карциноэмбрионального антигена обсуждается с середины 80–х годов [16,17]. Карциноэмбриональный антиген отнюдь не обязательный маркер – у 40% больных РТК он не выявляется. Этот маркер нельзя назвать и специфическим, поскольку он обнаруживается и при других злокачественных опухолях (раке молочной железы, поджелудочной железы, легкого, яичников и даже саркомах), а также в эмбриональной ткани и незлокачественных заболеваниях (гепатотоксичность, гидронефроз, желчекаменная болезнь) [18].
Высокие цифры СЕА после операции являются признаком нерадикальности последней, возможного рецидива, короткой выживаемости. После радикальных хирургических операций систематическое определение СЕА позволяет выявить в 47% случаев рецидивы, в том числе и бессимптомные [19,20].
Американской гастроэнтерологической ассоциацией в 1989 году сформулирован консенсус по вопросам послеоперационного ведения больных РТК. Его порядок представлен в таблице 1 [21].
Информативным считается уровень СЕА в плазме более 10 ng/ml.
Маркер Са–19–9 имеет прогностическое значение при РТК. Если его уровень превышает 37 ед/мл, риск смерти в течение 3 лет после операции увеличивается в 4 раза по сравнению с теми, у кого этот показатель был отрицательным или более низким [22].
При РТК в 28% случаев экспрессируются цитокератинные антигены (СК 17 и 18). Больные, у которых обнаружена экспрессия этих антигенов, имеют наихудший прогноз выживаемости [23]. Вместе с тем цитокератинные антигены стали мишенью для моноклональных антител. В рандомизированном исследовании радикально оперированные пациенты получали раз в месяц адъювантно мышиные антитела против цитокератинного антигена 17 либо плацебо. Летальность сократилась на 30%, а частота рецидивов на 27% [24].
Муцинозные гликопротеины экспрессируют сиалозил –Тn антиген (Sialosyl–Tn). У 86% больных РТК определяется этот маркер. Те, у кого его нет, выжили 5 лет в 100% случаев, пятилетняя выживаемость больных с положительным сиалозил Тн маркером составила 73% [25].
Самой частой формой РТК является аденокарцинома тубулярной или ворсинчатой структуры – 95%. Другие варианты составляют всего 5% (это перстневидноклеточный рак, плоскоклеточный рак, аденоплоскоклеточный рак, мелкоклеточный рак и недифференцированный рак) [26].
Главным прогностическим фактором является стадия рака толстой кишки в момент первичной диагностики. К другим прогностическим факторам относят: возраст, пол, симптомность, наличие опухолевых осложнений, инвазию нервов и сосудов, число пораженных лимфоузлов, степень дифференцировки, высокие цифры ЛДГ и числа лейкоцитов в крови, плоидность ДНК, холецистэктомию в анамнезе, облучение таза в анамнезе. Остановимся на наиболее важных из них.
Чем моложе пациент, тем хуже прогноз [27]. У женщин прогноз лучше, чем у мужчин [28]. Наличие симптомов рака толстой кишки при постановке диагноза усугубляет прогноз. Бессимптомные больные (со случайной диагностикой) живут 5 лет в 71% случаев; больные, имевшие симптомы болезни до первичного диагноза, переживают пять лет в 49% случаев [29].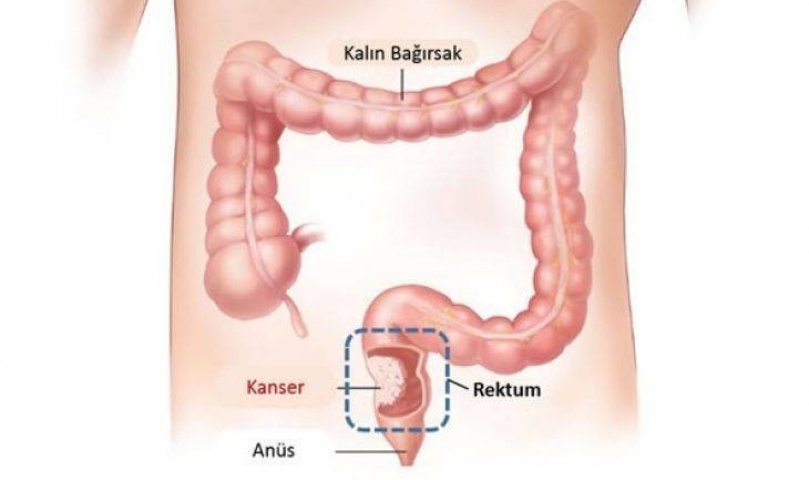 Наличие опухолевых осложнений (перфорации или непроходимости) ухудшает прогноз. Пятилетняя выживаемость в Дании среди имевших эти осложнения РТК (219 больных) составила 23%, а больных без этих осложнений (732 пациента) – 35% [30].
Наличие опухолевых осложнений (перфорации или непроходимости) ухудшает прогноз. Пятилетняя выживаемость в Дании среди имевших эти осложнения РТК (219 больных) составила 23%, а больных без этих осложнений (732 пациента) – 35% [30].
Опухоли толстой кишки получают потенциал метастазирования после прорастания подслизистого слоя кишечника, богатого лимфатическими сосудами [31]. Если опухоль не прорастает все слои кишечника, метастазы в лимфоузлы обнаруживаются лишь в 10%, если пенетрируется серозная оболочка – в 60% [32]. Если в лимфоузлах обнаруживается реактивная гиперплазия – это хороший прогностический признак [33].
При прорастании серозной оболочки, покрывающей частично прямую кишку и большую часть ободочной кишки, возможна диссеминация по брюшине [34].
Метастазы в печени обнаруживаются на секционном материале в 40% случаев, рак толстой кишки после метастазирования в печень может широко диссеминироваться по органам и тканям – легкие, кости и т.д. [35]. Ведение больных РТК представлено в таблице 1.
Лечение рака толстой кишки
Главным методом лечения РТК остается хирургическая операция. Ее принципы не изменились за много лет и состоят: в удалении опухоли с проксимальным и дистальным запасом неизмененной кишки для элиминации подслизистого лимфатического распространения клеток; удалении региональных брыжеечных лимфоузлов; визуальном интраоперационном стадировании болезни; стремлении минимизировать постхирургические функциональные нарушения.
По современным данным, резектабильность рака ободочной кишки составляет 70–80%, послеоперационная летальность до 5%. Общая пятилетняя выживаемость варьирует от 50 до 70% в разных центрах.
Результаты хирургических операций при раке ободочной кишки в первую очередь зависят от вовлеченности в опухолевый процесс лимфоузлов и стадийности по Dukes.
При негативных лимфоузлах и Dukes A 5 лет выживают 90%, когда нет метастазов в лимфоузлах, но когда опухоль прорастает мышцу (Dukes B), выживают этот срок 80%, при Dukes C этот показатель снижается до 60%.
Если во время операции были удалены пораженные раковой опухолью лимфоузлы, пятилетняя выживаемость различается в зависимости от степени инвазии опухолью стенки кишки – 74% (Dukes A), 48% (Dukes B) – 30% (Dukes C) [36].
Результаты хирургического лечения рака прямой кишки также зависят от вовлеченности лимфоузлов и классификации по Dukes. Считается, что выживают 5 лет 50% больных. Локальные рецидивы возникают у 10% (обычно в первые 2 года).
Особое место занимает хирургия диссеминированных больных. На первом месте стоит хирургическое лечение метастазов в печень. После удаления одиночных метастазов в печень, 5–летняя выживаемость составляет 25%. Перспективной технологией является коагуляционная гипертермия метастазов (Radiofrequency, RF). Чрескожно или интраоперационно в центр метастаза вводится электрод, связанный с радиочастотным генератором. Таким методом обычно лечат метастазы, не превышающие 1,5 см в диаметре [37,38].
В практику хирургии РТК вошли эндоскопические операции, сокращающие сроки пребывания пациентов в больнице, уменьшающие частоту некоторых осложнений. Вместе с тем метод ограниченно позволяет ориентироваться в брюшной полости (исключена возможность пальпации). Операции длительны даже в руках опытных хирургов, нередки случаи неадекватного удаления лимфоузлов [39].
Вместе с тем метод ограниченно позволяет ориентироваться в брюшной полости (исключена возможность пальпации). Операции длительны даже в руках опытных хирургов, нередки случаи неадекватного удаления лимфоузлов [39].
Улучшить результаты хирургического лечения РТК возможно при использовании адъювантной терапии. На 141 больном В и С стадии колоректального рака проведено рандомизированое исследование, в котором сравнивалась пятилетняя выживаемость в контроле, в группе, где больные получали один фторурацил, и в группе, где применялся фторурацил + левамизол. 5 лет прожили в контроле 48% больных, в группе с фторурацилом – 56% и в группе с фторурацилом и левамизолом – 68% [40].
В исследовании, проведенном на 408 больных, было подтверждено, что комбинация левамизола и фторурацила уменьшает частоту рецидивов по сравнению с контролем. Выживаемость достоверно улучшилась лишь при стадии Dukes C [41].
Окончательное мнение среди онкологов по поводу ценности профилактического применения фторурацила и левамизола сложилось после публикации итогов межгруппового международного исследования (Moertel). В группе больных со стадией С летальность сократилась на 33%, а частота рецидивов на 41% по сравнению с контролем [42].
В группе больных со стадией С летальность сократилась на 33%, а частота рецидивов на 41% по сравнению с контролем [42].
Итак, для адъювантной терапии рака ободочной кишки в стадии С (с вовлечением в опухолевый процесс регионарных лимфоузлов) следующий режим применения фторурацила и левамизола признается стандартным: левамизол 50 мг х 3 раза в день внутрь, 3 дня, каждые 4 недели; фторурацил 450 мг/м2 внутривенно 5 дней, затем с 28 дня один раз в неделю. Лечение проводится в течение года после операции [43].
Тем не менее эта комбинация уступает в популярности режиму фторурацил + кальция фолинат. В четырех крупных рандомизированных исследованиях (в Европе, США и Канаде) было доказано преимущество в выживаемости и безрецидивном течении применения фторурацила и кальций фолината. Разница с контролем по выживаемости составила от 5 до 14%, а по безрецидивному течению от 9 до 15%. Во всех исследованиях эта разница была достоверной [44,45,46,47].
Следующая комбинация признана стандартной для адъювантной терапии рака ободочной кишки в В и С стадиях:
– фторурацил 370–425 мг/м2 внутривенно 1–5 дни,
– кальций фолинат 300 мг/м2 внутривенно 1–5 дни.
Каждые 28 дней, 6 месяцев после операции.
В 1998 г. закончен анализ кооперированного международного сравнения эффективности адъювантной терапии РТК фторурацилом и кальция фолинатом и фторурацилом, кальция фолинатом и левамизолом. Последняя комбинация не улучшила выживаемость. От комбинации фторурацил + кальция фолинат выжило 66%, от комбинации фторурацил + кальция фолинат + левамизол – 67% [48].
В лечении рака прямой кишки, помимо химиотерапии, важная роль отводится лучевой терапии. Гастроинтестинальная исследовательская группа в США осуществила рандомизированное исследование на 277 послеоперационных больных раком прямой кишки в стадиях В и С. Больные были разделены на 4 группы: контроль, облучение таза (40 gy), фторурацил + семустин в течение 18 месяцев, облучение + фторурацил + семустин. После 10 лет наблюдений, статистически достоверной оказалась разница в результатах контроля и группы, где комбинировалось облучение и химиотерапия. Безрецидивное течение было соответственно в 45% и 65%, выживаемость 26% и 45% [49,50].
В исследованиях Северной онкологической группы США (NCCTG) были показаны преимущества комбинации послеоперационного облучения и химиотерапии по сравнению с одним облучением (45 gy). В исследование было включено 240 больных раком прямой кишки в стадиях В и С. Больные наблюдались 7 лет. Безрецидивное течение отмечалось в комбинированной группе в 63%, в чисто лучевой – в 42%, 5 лет прожили соответственно 58% и 47% [51].
Методические модификации применения фторурацила были осуществлены в Гастроинтестинальной исследовательской группе США. 210 больных ректальным раком В и С стадий были разделены на две группы после радикальной операции: 1) облучение (50–54 gy) + фторурацил 500 мг/м2 3 дня во время 1–й и 5–й недель облучения; 2) облучение (50–54 gy) + фторурацил на протяжении облучения 225 мг/м2 в сутки, инфузионно. После 46 месяцев наблюдения и безрецидивное течение, и выживаемость были на 10% выше в группе с продленной инфузией фторурацила, нежели в группе со струйным введением этого препарата (безрецидивное течение 63% и 53%, выживаемость 70% и 60%) [52]. Инфузия фторурацила вместе с послеоперационным облучением считается лучшим методом адъювантной терапии рака прямой кишки.
Инфузия фторурацила вместе с послеоперационным облучением считается лучшим методом адъювантной терапии рака прямой кишки.
Крупное Японское контролируемое исследование более чем на 300 больных показало, что 4–х летняя выживаемость на 13% выше в группе, где больные после операции в течение 2 лет получали UFT по 400 мг в сутки, по сравнению с группой пациентов, подвергнутых только операции [53].
Среди еще незаконченных исследований в области адъювантной химиотерапии – сравнение в рамках разных методов введения фторурацила (длительные инфузии или струйные), сравнение эффективности разных сроков адъювантной терапии (начало сразу после операции или отсроченное), продолжительность адъювантной терапии.
В настоящее время идет исследование по сравнению режима De Gramont и этой комбинации + современный противоопухолевый агент из группы кампотоцинов. Исследование не завершено.
Среди новых программ адъювантной терапии при РТК – сравнение раптитрексида и комбинации фторурацил + кальций фолинат после операций по поводу РТК Dukes C стадия.
В США планируется большое кооперированное сравнение эффективности UFT + кальций фолинат и фторурацил + кальций фолинат.
В рамках EORTC организовано сравнительное исследование адъювантной эффективности при опухолях со стадией Dukes C раптитрексида и фторурацила с кальций фолинатом. Современные режимы приема 5–фторурацила с кальций фолинатом представлены в таблице 2.
Лучевая терапия – метод, который чаще используется при ректальном раке, нежели при раке ободочной кишки. При раке прямой кишки метод применяется, как дооперационный, для уменьшения стадийности и улучшения местного контроля. Послеоперационное облучение призвано сократить локальные рецидивы, которые возникают у 25–50% оперированных больных, если первичная опухоль квалифицировалась, как Т3 или Т4 и как основной метод неоперабельного местнораспространенного ректального рака [55,56].
Идея послеоперационного облучения возникла в связи с довольно высокой констатацией локальных рецидивов до 30% при Т3N0 и 50% при Т3N1 [57]. Кооперированное исследование на большом числе больных выявило лишь уменьшение рецидивов от послеоперационного облучения (50 gy за 7 недель) в группе со стадией Dukes C; у больных со стадиями А и В рецидивы встречались одинаково в обеих группах, у 10% были постлучевые осложнения, на отдаленной выживаемости добавление лучевой терапии не сказалось. Лучше были лишь двухгодичные результаты: после облучения – 82%, в хирургической группе – 67% [58]. Подобные результаты получены и в других рандомизированных исследованиях [59].
Разумеется, лучевой метод является основным при неоперабельном местнораспространенном раке прямой кишки. Обычная доза 55 gy. У половины больных достигаются объективный (уменьшение опухоли) и симптоматический эффекты – уменьшение болей у 80% пациентов, прекращение кровотечения в 70%, тенезмов. 5 лет выживают лишь 5% таких больных. Однако, несомненно, улучшается качество жизни, и в небольшом числе случаев удавалось даже выполнить радикальные операции. При рецидивах рака прямой кишки можно помочь 15% больных, медиана их выживаемости < 2 лет.
Роль лучевой терапии ободочной кишки менее значительна, ее применяют при С2 и В стадиях по Dukes после операций для сокращения локальных рецидивов [60].
Многие годы основным препаратом для лечения РТК считался фторурацил. Хотя с момента синтеза FU прошло около 50 лет, этот препарат не потерял своего значения и в наши дни. Фторурацил способен вызвать объективное улучшение в среднем у 20% больных. Медиана продолжительности ремиссии – 4–5 месяцев, и на выживаемости пациентов этот эффект не сказывается [61,62].
Поскольку фторурацил довольно быстро элиминируется из крови при струйном введении, были разработаны методы инфузий этого препарата. Эффект при длительных инфузиях увеличился до 30%, а токсичноть уменьшилась (за исключением hand–foot синдрома, парестезии и эритродизестезии пальцев рук и ног) [63,64,65,66].
Введение кальций фолината повышает в среднем эффективность фторурацила при РТК до 30–40% [67]. Спорным является вопрос о режимах кальций фолината. Одинаковые результаты достигаются при дозах 20 мг/м2 5 дней подряд и 500 мг/м2 внутривенно еженедельно, при соответствующих дозах фторурацила 425 мг/м2 и 600 мг/м2. В рандомизированных исследованиях при ежедневном введении фторурацила и кальций фолината в малой дозе эффект был 35%, а медиана выживаемости –9,3 мес., при еженедельном назначении обоих препаратов соответственно 31% и 10,7 мес. [68]. Современные режимы FU с LV представлены в таблице 2 [69].
В терапии РТК иногда используются и другие модуляторы эффекта фторурацила: PALA, метотрексат, интерфероны.
В современной практике большое распространение получают оральные фторпирмидины.
Первым препаратом для лечения РТК был фторафур – продраг фторурацила. Эффект близок к FU – в диапазоне 20–25%.
Среди других препаратов, проявляющих интересную противоопухолевую активность при РТК, назовем UFT.
В режиме монотерапии UFT оказался эффективным при раке толстой кишки в 25%. Медиана выживаемости больных – 32 недели [70,71].
После констатации этого факта UFT изучался в Японии, США и межнациональных исследованиях в комбинации с кальций фолинатом. Объективный эффект зарегистрирован в диапазоне 25–42% (в среднем 38%) [72]. Чаще регрессируют метастазы рака толстой кишки в печень, хотя наблюдались эффекты и при метастазах в легкие и кости. Оба препарата вводились внутрь ежедневно в течение 28 дней. UFT по 300 мг/м2 в сутки, кальций фолинат по 150 мг. Суточная доза делилась на 3 приема – каждые 8 часов [73,74,75].
В Испанском исследовании специально оценили эффективность и переносимость UFT у больных раком толстой кишки в возрасте старше 72 лет. Больные получали UFT – 400 мг в сутки и кальций фолинат 45 мг в сутки до токсичности (3–4 степеней). 126 пациентов были включены в исследование (средний возраст 74 года). Рвота зарегистрирована у 14%, диарея – 9%, мукозит в 1 случае, тромбоцитопения у 1 больного; у 4 пациентов (5%) отмечен полный эффект, у 9 – частичный (11,6%), у 22 (28,6%) – длительная стабилизация, медиана выживаемости – 14,4 месяца [76].
Новой разработкой японских ученых является создание очередного модулятора фторурацила – S–1, состоящего из фторафура, урацила и оксолата калия, прерывающего метаболизм FU в нормальных клетках.
При оценке препарата на больных РТК (63 пациента) эффект отмечен в 35,5% (в 27,5% в печени и 39,3% в легких). Гематотоксичность 3 степени наблюдалась в 10% случаев [77].
Новый фторпиримидиновый карбамат – капецитабин, по существу, это продраг, который быстро всасывается из желудка и затем, после ряда промежуточных превращений, активируется в опухолях с помощью опухолевого ангиогенного фактора – тимидин фосфорилазы во фторурацил. Таким образом, основной особенностью действия капецитабина является избирательная активация его в опухоли. Что касается главной мишени, то это опять непрямое торможение тимидилат синтетазы [78].
При раке толстой кишки эффект достигается у 30% больных, усиливается от приема капецитабина с кальций фолинатом [79].
При сравнении САР с FU + LV отмечена большая эффективность первого препарата при равной токсичности и выживаемости [80].
Раптитрексид – прямой ингибитор тимидилат синтетазы также вошел в практику лечения РТК. Cunningham тщательно проанализировал результаты нескольких международных сравнений эффективности раптитрексида и комбинации фторурацил + кальций фолинат. При одинаковой эффективности особенно тяжелые для больных мукозиты, лейкопении и алопеции чаще регистрировались от фторурацила и кальций фолината. 87% больных с колоректальным раком отдали предпочтение раптитрексиду, нежели фторурацилу с кальций фолинатом [81].
Известно, что раптитрексид с фторурацилом обладает выраженным синергизмом. Причем важен порядок применения. При введении в начале фторурацила, а затем раптитрексида синергизм при воздействии на больных колоректальным раком не отмечается [82,83].
Наиболее интенсивно раптитрексид изучался на больных раком толстой кишки. Результаты сравнивались с эффектом фторурацила в комбинации с кальций фолинатом. По материалам 62 центров мира, эффекты от монотерапии раптитрексидом и комбинации фторурацил + кальций фолинат были одинаковыми (19,3% и 16,7%), медиана выживаемости диссеминированных больных в обеих группах была 10 месяцев [84].
В нашей клинике использовались высокие дозы фторурацила (в диапазоне 2000–2600 мг/м2 1 раз в неделю 24–х часовая инфузия, в течение 5 недель). Во вторую и пятую недели вводился Tom в дозе от 2,4 мг/м2. Режим был мало токсичен. Диарея и рвота отмечались у части больных не более чем II степени. Эффективность 48%, медиана выживаемости 13 месяцев.
Из группы камптотецинов при РТК наиболее изучен принотекам. Препарат является ингибитором ядерного энзима топоизомеразы I.
У нелеченных больных раком толстой кишки – эффект, в основном частичный, достигается в 20–32%. Обычно ремиссии продолжаются до 6 месяцев. Наблюдалась регрессия метастазов в легких и печени, а также первичной опухоли [85,86].
Эффект монотерапии принотекамом у леченных ранее больных фторурацилом также демонстрировался, он регистрируется менее чем в 20% случаев. Но описываются даже полные регрессии [87,88,90].
В мультицентровом рандомизированном исследовании на 279 больных, резистентных к фторурацилу, было показано преимущество лечения принотекамом в сравнении с чисто поддерживающей симптоматической терапией. Один год выжило 36,2% больных, получавших принотекам, и 13,8% пациентов, получавших лишь симптоматическую терапию. Вновь продемонстрирована целесообразность применения Cpt–11 в режиме по 250 мг/м2 1 раз в 2 недели при резистентном к фторурацилу РТК. Объективный эффект наблюдался в 13% случаев, медиана ответа – 8,1 месяца. Отмечено снижение карциноэмбрионального антигена более чем 60%. Медиана стабилизации роста опухоли равнялась 4,5 месяцев [91]. Комбинация принотекама и митомицина С была активна у 20% больных РТК, в том числе у 10% регистрировалась полная ремиссия [92].
Особое значение имеют два недавно законченных кооперированных исследования с дизайном FU + LV±Cpt–11. Saltz et al. на 437 больных ранее нелеченным метастатическим РТК показали:
– в группе получавших FU в дозе 425 мг/м2 + LV 20 мг/м2 (оба препарата в течение 5 дней) общий эффект был зарегистрирован в 21% случаев, время до прогрессирования – 4,3 месяца, медиана выживаемости составила 12,6 месяцев;
– в группе, где применялся дополнительно Cpt–11, эффект был 39% (на 18% больше), время до прогрессирования – 7 месяцев (на 62% больше) и медиана выживаемости составила 14,3 месяцев (на 17,5% больше).
Все указанные результаты статистически достоверны [93].
В исследовании Douillard FU применялся либо в режиме de Gramont (400 мг/м2 струйно, затем 600 мг/м2 в течение 22 часов + LV 200 мг/м2; оба препарата вводились 1 раз в 2 недели), либо FU в виде 24–часовых инфузий (по 2300 мг/м2 1 раз в неделю, 6 недель, а LV 200 мг/м2 1 раз в неделю, 6 недель).
Во 2–й группе больные получали один из вышеуказанных режимов FU + LV + Cpt–11 (либо 180 мг/м2 1 раз в две недели вместе с режимом de Gramont, либо по 80 мг/м2 1 раз в неделю вместе с 24–часовым инфузионным еженедельным введением FU (вместе с LV)).
Эффект непосредственный в 1–й группе – 22%, во 2–й – 35% (на 13% выше), время до прогрессирования соответственно 4,4 и 6,7 месяцев (на 52,2% дольше), медиана выживаемости 14,1 и 17,4 месяца (на 23,4% дольше) [94].
Комбинированный анализ этих двух исследований показал, что добавление принотекама к фторурацилу и кальций фолинату на 36% уменьшает риск прогрессирования и на 20% уменьшает риск смерти. Режим признан стандартом 1 линии терапии диссеминированного РТК в США и некоторых других странах [95].
Из новых препаратов, проявивших активность при РТК, отметим оксалиплатин (Оха). Он относится к 3–й генерации ненефротоксических производных платины. Эффект этого препарата в режиме монотерапии не превышал 10%. Однако замечен был синергический эффект с фторурацилом и кальций фолинатом. Он зафиксирован в 46% случаев, а при соблюдении хронобиологических принципов подходит даже к 58%, при медиане выживания в 15 месяцев. Этот FolFox режим (цикл состоит из 2–х дней лечения) выглядит следующим образом: день первый – кальций фолинат 500 мг/м2 внутривенно в 2 часа ночи, оксалиплатин 100 мг/м2 внутривенно тоже в 2 часа ночи, инфузия фторурацила в дозе 1500–2000 мг/м2 длилась 24 часа; день второй – кальций фолинат 500 мг/м2 внутривенно в 2 часа ночи, инфузия фторурацила длилась 24 часа и во вторые сутки в дозе 1,5–2,0 г/м2. Повторный цикл терапии осуществлялся через 2 недели [96,97,98].
Режим Оха 60 мг/м2 в 1 день с 24–часовой инфузией фторурацила по 2,6 г/м2 1 раз в неделю в течение 4 недель и кальций фолината 500 мг/м2 в дни введения FU, а затем повтор через 2 недели был использован в качестве 2–й линии терапии у больных после прогрессирования на режиме монотерапии фторурацилом. Эффект и стабилизация наблюдались у 78% больных. Токсичность была не выражена, диарея и мукозиты у 11% [99].
Комбинация Оха + Cpt–11 считается также одной из самых активных. Описаны эффекты у больных, получавших этот режим, в 43–45% случаев с медианой выживаемости в 16 месяцев [100].
У резистентных к FU больных РТК от комбинации принотекам + Оха удается добиться противоопухолевого ответа в 34% [101].
В последние годы взор онкологов все чаще обращается к фундаментальной науке. Успехи последней в молекулярной биологии, генетике и генной инженерии позволили синтезировать и предоставить в распоряжение клиницистов оружие будущего – препараты целевой терапии.
Есть единичные работы, показывающие возможность увеличения продолжительности жизни больных с распространенным РТК после применения МАВ–17–1А (12 месяцев у получавших этот препарат и лишь 4 месяца в контроле) [102].
Среди новых разработок, предназначенных для лечения РТК на основе идентификации молекулярных мишеней – ингибиторы мутированного супрессорного гена Р–53, васкулярного эндотелиального фактора роста (VEGT), основного фибробластного фактора роста (GFGF), рецепторов эпидермального фактора роста, циклинзависимых киназ, матрикс металлопротеиназ и др. [103].
Заключение
Рак толстой кишки – актуальная проблема из–за высокой заболеваемости и значительной смертности больных. С лечением этой формы рака связаны огромные экономические потери.
Для устранения проблемы необходимо решить ряд социальных задач. Прежде всего это пропаганда здорового образа жизни и правильного питания, а также широкое внедрение в практику скрининга на рак толстой кишки в группах риска и соответственно ранняя диагностика рака.
К лечению заболевших людей необходимо подходить комплексно. Основным методом является хирургический. В последнее десятилетие резектабильность РТК составляет 70–80%, послеоперационная летальность сократилась до 5%. Пятилетние результаты в большинстве стран в диапазоне 50–60%. При ранних стадиях следует шире использовать метод эндоскопического удаления опухолей, позволяющий уменьшить сроки пребывания пациента в стационаре и избежать некоторых послеоперационных осложнений. В хирургии рака прямой кишки использовать сфинктеросохраняющие операции, даже при опухолях нижней трети. При лечении метастазов в печень целесообразно сочетать лекарственное воздействие и операцию.
Все больные с 2«в» и 3 стадией должны получать адъювантную терапию. Стандартными режимами для адъювантной терапии рака ободочной кишки признаны комбинация фторурацила и кальций фолината, при этом достигается улучшение отдаленных результатов на 15–20% по сравнению с контролем. Современное адъювантное лечение рака прямой кишки осуществляется на базе фторурацила и кальций фолината с послеоперационным облучением.
Лучевая терапия включена в стандарт лечения рака прямой кишки для уменьшения стадийности предоперационно, для сокращения частоты локальных рецидивов послеоперационно и как основной метод лечения неоперабельного местнораспространенного рака прямой кишки.
В первую линию терапии диссеминированного рака толстой кишки, базирующуюся на фторурациле и модуляции его эффекта кальций фолинатом, прочно вошли новые препараты принотекам и оксалиплатин. Не обладая перекрестной резистентностью, эти комбинации позволили значительно увеличить медиану продолжительности жизни больных и улучшить ее качество.
Такие пероральные препараты, как фторафур, UFT, капецетабин создали дополнительные возможности для более длительной циркуляции фторурацила в крови и опухолевых клетках.
Генетическая модель канцерогенеза в толстой кишке, составленная после идентификации генетических изменений, открывает конкретные мишени для генной терапии и профилактики рака толстой кишки.
Идет активный поиск решения проблемы лечения рака толстой кишки фундаментальной и клинической онкологией.
Литература:
1. Mortality Database 1994–1997, WHO, 1999
2. Давыдов М.Н., Аксель Е.Н. «Статистика злокачественных новообразований в России и странах СНГ (состояние онкологической помощи, заболеваемость и смертность)».М., 2002
3. Vogelstein B., Fearon E.R., Hamilton S.R., et.al. «Genetic alterations during colorectal tumor development». N.Engl.j.Med. 1988; 319–525.
4. Fearon E.R., Vogelstein B. «A genetic model for colorectal tumorigenesis».Cell 1990; 6:759–767.
5. Kinzler K., Nibert M., Vogelstein B., et.al. «Identification of gene located chromosome 5q 21 that is mutated in colorectal cancers».Science 1991; 251:1366–1370.
6. Goelz S.E., Vogelstein B., Hamilton S.R., et.al. «Hypomethylation of DNA from benign and malignant human colon neoplasms». Science 1985; 228:187–190.
7. Bos J.L.»Ras oncogenes in human cancer: A review». Canc. Res. 1989; 49:4682–4689.
8. Fearon E.R., Hamilton S.R., Vogelstein B. «Clonal analysis of human colorectal tumors».Science 1987; 238:193–197
9. Fearon E.R., Cho K.R., Nigro J.M., et.al. «Indentification of a chromosome 18q gene which is altered in colorectal cancer».Science 1990; 247:49–56.
10. Zetter B.R. «Adhesion molecules in tumor metastasis». Sem.Canc.Biol.1993; 4:219–229.
11. Yamaguchi A., Kurosaka Y., Fushida S., et.al. «Expression of p53 protein in colorectal cancer and its relationship to short–term prognosis» Canc.1992; 70:2778–2784.
12. Scott N., Sagar P.,Stewart J., et.al. «P–53 in colorectal cancer: clinicopathological correlation and prognostic significance». Br.j.Canc. 1991; 63:317–319.
13. Lynch H.T., Smyrk T.,, Watson P. Et.al. «Hereditary colorectal cancer».Sem.Oncol.1991; 18:337–366.
14. Steele G. «Follow–up plans after «curative» resection of primary colon or rectum cancer». In «Colorectal cancer». Eds.Steele G. And Osteen R.T. NY 1986; 247–279. Lancet 1990; 336:357.
15. Gold P., Freedman S.O. «Specific carcinoembryonic antigens of the human digestive system». J.Exp.Med.1965; 122:467–481.
16. Bates S.E., Longo D.L. «Use of serum tumor markers in cancer diagnosis and management». Sem.in Oncol.1987; 14:102.
17. Northover J. «Carcinoembryonic antigen and recurrent colorectal cancer». Gut. 1986; 27:117–122.
18. Clarke C., Nine K.R., Dykes P.W., et.al. «Carcinoembryonic antigen and smoking». J.Royal Coll.Phys.Lond 1980; 14:227–230.
19. Rocklin M.S., Slomski C.A., Watne A.L. «Postoperative surveillance of patients with carcinoma of the colon and rectum». Am.Surg. 1990, 56:22.
20. Audisio R.A., Setti Carraro P., Segala M., et.al. «Follow–up in colorectal cancer patients: a cost–benefit analysis». Ann Surg.Oncol. 1996; 3:349.
21. Fleischer D.E., Coldberg S.B., Browning T.H., et.al. «Detection and surveillance of colorectal cancer». JAMA 1989; 261:580.
22. Diez M., Cerdan F.J., Pollan M., et.al. «Prognostic significance of pre–operative serum CA–19–9 assay in patients with colorectal carcinoma».Anticanc.Res. 1994; 14:2819–2825.
23. Lindenmann F., Achlimok G., Dirschedl P., et.al. «Prognostic significance of micrometastatic tumour cells in bone marrow of colorectal cancer patients». Lancet 1992; 340:685–689.
24. Riethmuller G., Schneider–Gadicke E., Schlimok G. «Randomized trial of monoclonal antibody for adjuvant therapy of resected Dukes’C colorectal carcinoma». Lancet 1994; 343:1177–1183.
25. Itzkowitz S.H., Yuan M., Montgomery C.K., et.al. «Expression of Tn, Sialosyl–Tn and T antigens in human colon cancer». Canc.Res. 1989; 49:197–204.
26. Jass J., Sobin L. «WHO histological typing of intestinal tumors».1989, Geneva.
27. Regio B., Bussey H.J.R. «The pathology and prognosis of carcinoma of the rectum in the young». Proc.R.Soc.Lond. 1965; 58:789–790.
28. Koch M., McPherson T.A., Egedahl R.D. «Effect of sex and reproductive history on the survival of patients with colorectal cancer». J.Chronic. Dis. 1982; 35:69–72.
29. Beahrs O.H., Sanfelippo I.M. «Factors in the prognosis of colon and rectal cancer». Canc. 1971; 28:213–217.
30. Bulow S. «Colorectal cancer in patients less than 40 years of age in Denmark 1943–1967». Dis.Col.Rect. 1980; 23:327–336.
31. Fenoglio C., et.al. «Distribution of human colonic lymphatics in normal, hyperplastic and adenomatous tissues». Gastroenter. 1973; 64:51–66.
32. Morson B., Dawson J. «Gastrointestinal pathology». Oxford 1979.
33. Talbot J., et.al. «Invasion of veins by carcinoma of the rectum: method of detection, histological features and significance». Histopath. 1981; 5:141–163.
34. Newland R., et.al. «The prognostic value of substaging colorectal carcinoma:a prospective study of 1117 cases with standardized pathology». Canc.1987; 60:852–857.
35. Weiss L., et.al. «Heamatogenous metastatic patterns in colonic carcinoma: an analysis of 1541 necropsies». J.Path. 1986; 150:195–203.
36. Cohen A.M., Shank B., Friedman M.A. Colorectal cancer. In «Cancer Principle a Practice of oncology». Eds. DeVita V.S., et.al. 1989; pp.895–964.
37. Solbiati L., Lerace T., Goldberg S.N., et.al. «Percutaneous US–guided radio–frequency tissue ablation in the treatment of liver metastases». Radiol. 1997, 202:205–210
38. Rossi S., Di Stasi M., Buscarini E., et.al. «Percutaneous RT intersticial thermal ablation in the treatment of hepatic cancer». Am.j.Roentgenol. 1997, 122:759–768.
39. Pazdur R., Coia L., Wagman L.D., Ayoub J.P. «Colorectal and anal cancer». In «Cancer Management: A multidisciplinary approach». Eds. Pazdur R., et.al., 1998; pp.65–93.
40. Windle R., Bell R.E., Shaw D. «Five year results of a randomized trial of adjuvant 5–fluorouracil in colorectal cancer». Br.j.Surg. 1987; 74:569–572.
41. Laurie J.A., Moertel C.G., Fleming T.R., et.al. «Surgical adjuvant therapy of large bowel carcinoma. An evaluation of levamisole and the combination of levamisol and fluorouracil». J.Clin.Oncol. 1989; 7:1447–1456.
42. Moertel C., Fleming T., MacDonald J., et.al. «Fluorouracil plus levamisole as effective adjuvant therapy after resection of stage II colon carcinoma: A final report». Ann Int.Med. 1995; 122:321–326.
43. National Institutes of Health Consensus Conference Adjuvant Therapy for patients with colon and rectal cancer. JAMA 1990; 264:1444–1450.
44. Wolmark N., Rockette H., Fisher B., et.al. «The benefit of leucovorin–modulated fluorouracil as postoperative adjuvant therapy for primary colon cancer: Results from National Surgical Adjuvant Breast and Bowel Project protocol C–03». J.Clin.Oncol. 1993; 11:1979–1987.
45. Erlichman C., Marsoni S., Seitz J., et.al. «Event free and overall survival is increased by FUFA in resected B and C colon cancer: A prospective pooled analysis of 3 randomized trials». Proc.ASCO, 1994; ab.562.
46. O’Connell M., Mailbard J., MacDonald J., et.al. «An intergroup trial of intensive course 5–FU and low dose leucovorin as surgical adjuvant therapy for high risk colon cancer». Proc.ASCO, 1993; ab.522.
47. Trancini G., Petrioli R., Lorenzini L., et.al. «Folinic acid and 5–fluorouracil as adjuvant chemotherapy in colon ca
.
Рак толстой кишки — лечение и прогноз
Каковы причины образования рака толстой кишки?
В 10 % случаев причиной образования может быть наследственная предрасположенность, во всех остальных случаях раковое заболевание образовывается спонтанно.
Существуют несколько факторов, которые значительно увеличивают риск заболевания. Например, недостаточное потребление балластных веществ, кальция, витаминов, при этом чрезмерное потребление животных жиров. А также малоподвижный образ жизни, заболевания кишечника и ожирение.
Проявление каких симптомов рака кишечника должно насторожить?
Ощутимые для пациента симптомы проявляются, как правило, на поздних стадиях рака кишечника. Нерегулярность стула в виде запоров или поносов, кровь в кале, тошнота, рвота, боль в животе, резкая потеря веса и общее изнеможение.
На ранних стадиях пациенты не ощущают практически никаких симптомов. Это должно быть главным мотиватором для пациентов от 50 лет для прохождения профилактических исследований – классической или виртуальной колоноскопии. Если во время диагностики обнаружатся какие-либо изменения, можно тут же провести операцию — полипэктомию — для удаления полипов (новообразований слизистой оболочки).
Полипы, как правило, перерастают в раковые опухоли, поэтому я рекомендую своевременно пройти диагностику рака кишечника и удаление полипов. Это самый простой способ предотвратить болезнь.
Какие виды лечения рака кишечника Вы практикуете?
Выбор метода терапии зависит от нескольких факторов. Например, если опухоль без метастаз, то в данном случае наиболее целесообразным является хирургическое удаление. Если же опухоль невозможно оперировать без удаления сфинктера, то для начала мы проводим комбинированную медикаментозно-лучевую терапию, для уменьшения размеров образования, и затем удаляем его щадящим методом. Для лечения метастазных опухолей рекомендуется проведение химиотерапии и позже удаление опухоли специальными хирургическими методами.
Мы применяем также новые методы лечения рака желудочно-кишечного тракта препаратами Erbitux и Avastin. Erbitux и Avastin содержат моноклональные антитела, которые распознают рецепторы роста на поверхности раковых клеток и блокируют их. Таким образом, рецептор перестает принимать сигналы роста, и опухоль перестает расти.
Каков шанс на выздоровление после прохождения терапии рака кишечника?
Шанс на выздоровление зависит от стадии развития опухоли и состояния лимфатических узлов. На первой стадии вероятность отсутствия рецидива в последующие 5 лет составляет примерно от 90 до 100 %. На второй и третьей стадии вероятность снижается — 85-60%.
Похожие статьи: лечение рака в Австрии
Статистика выживаемости при раке кишечника | Cancer Research UK
Выживаемость рака толстой кишки в Великобритании по сравнению с Европой
Пятилетняя относительная выживаемость мужчин при раке толстой кишки в Англии (51%) ниже среднего показателя по Европе (56%). Уэльс (50%) и Шотландия (54%) также ниже средних показателей по Европе, но Северная Ирландия (53%) сопоставима со средними показателями по Европе [1]. Во всех европейских странах, по которым имеются данные, пятилетняя относительная выживаемость мужчин колеблется от 43% (Латвия) до 61% (Германия).[1]
Пятилетняя относительная выживаемость при раке толстой кишки у женщин в Англии (52%) ниже среднего показателя по Европе (56%). Уэльс (50%) и Шотландия (54%) также ниже средних показателей по Европе, но Северная Ирландия (55%) сопоставима со средними показателями по Европе [1]. В европейских странах, по которым имеются данные, относительная пятилетняя выживаемость женщин колеблется от 43% (Латвия) до 65% (Исландия) [1].
Рак толстой кишки (C18), пятилетняя относительная выживаемость, стандартизированная по возрасту, взрослые (в возрасте 15+), европейские страны, 2000-2007 гг.
Возможные объяснения стойких международных различий в выживаемости включают различия в биологии рака, использование диагностических тестов и скрининга, стадию постановки диагноза, доступ к высококачественной помощи и методы сбора данных.[1]
Выживаемость рака прямой кишки в Великобритании по сравнению с Европой
Пятилетняя относительная выживаемость мужчин при раке прямой кишки в Англии (53%) ниже среднего показателя по Европе (55%). Уэльс (49%) также ниже среднего по Европе, но Шотландия (53%) и Северная Ирландия (52%) аналогичны среднему европейскому уровню [1]. В европейских странах, по которым имеются данные, пятилетняя относительная выживаемость мужчин колеблется от 37% (Латвия) до 78% (Исландия) [1].
Пятилетняя относительная выживаемость при раке прямой кишки у женщин в Англии (56%) ниже среднего показателя по Европе (58%).Уэльс (57%), Шотландия (56%) и Северная Ирландия (58%) соответствуют среднему европейскому уровню [1]. В европейских странах, по которым имеются данные, относительная пятилетняя выживаемость женщин колеблется от 36% (Латвия) до 67% (Исландия) [1].
Рак прямой кишки (C19, C20, C21), пятилетняя относительная выживаемость, стандартизированная по возрасту, взрослые (в возрасте 15+), европейские страны, 2000-2007 гг.
Возможные объяснения стойких международных различий в выживаемости включают различия в биологии рака, использование диагностических тестов и скрининга, стадию постановки диагноза, доступ к высококачественной помощи и методы сбора данных.[1]
Выживание | Рак кишечника | Исследования рака, Великобритания
Рак кишечника — это рак, который начинается в толстой кишке (рак толстой кишки) или в заднем проходе (рак прямой кишки). Он также известен как колоректальный рак.
Выживание зависит от многих факторов. Никто не может сказать вам точно, сколько вы проживете.
Это общая статистика, основанная на больших группах людей. Помните, они не могут сказать вам, что произойдет в вашем конкретном случае.
Ваш врач может дать вам дополнительную информацию о вашем собственном прогнозе.Вы также можете поговорить об этом с медсестрами отдела исследования рака Великобритании по бесплатному телефону 0808 800 4040 с 9 до 17 часов с понедельника по пятницу.
Выживание по этапам
В Великобритании нет доступных статистических данных по выживаемости при раке кишечника по стадиям.
Статистика выживаемости доступна для каждой стадии рака кишечника в Англии. Эти цифры относятся к мужчинам и женщинам, диагностированным в период с 2013 по 2017 год.
1 этап
Около 90 из 100 человек (около 90%) с раком кишечника 1 стадии (также называемым Dukes ‘A) переживут рак в течение 5 или более лет после постановки диагноза.
2 этап
Более 80 из 100 человек (более 80%) с раком кишечника 2 стадии (также называемым Dukes ‘B) переживут рак в течение 5 или более лет после постановки диагноза.
3 этап
Почти 70 из 100 человек (почти 70%) с раком кишечника 3 стадии (также называемым Dukes ‘C) переживут рак в течение 5 или более лет после постановки диагноза.
4 этап
10 из 100 человек (10%) с раком кишечника 4 стадии (также называемым D Dukes) переживут рак в течение 5 или более лет после постановки диагноза.
Если рак распространился на печень и хирург может удалить его, более 40 из 100 человек (более 40%) переживут рак в течение 5 или более лет после операции.
Выживаемость рака по стадиям на момент постановки диагноза для Англии, 2019
Управление национальной статистики
Эти цифры относятся к людям, диагностированным в Англии в период с 2013 по 2017 год.
Эти статистические данные относятся к чистой выживаемости. Чистая выживаемость оценивает количество людей, переживших рак, а не подсчитывает количество людей, у которых диагностирован рак, которые еще живы. Другими словами, это выживаемость больных раком с учетом того, что некоторые люди умерли бы от других причин, если бы у них не было рака.
Хирургическое лечение и исходы метастазов колоректального рака в печень
EJ A. Morris и другие
British Journal of Surgery Год — 2010 Номер тома — 97 Номер детали — 7 страниц — 1110-8
Выживаемость при раке кишечника на всех стадиях
Обычно для людей с раком кишечника в Англии:
- почти 80 из 100 человек (почти 80%) выживают после рака в течение 1 года или более
- почти 60 из 100 человек (почти 60%) переживают рак в течение 5 лет или более
- почти 55 из 100 человек (почти 55%) выживают после рака 10 и более лет
Выживаемость рака по стадиям на момент постановки диагноза для Англии, 2019
Управление национальной статистики
Эти цифры относятся к людям, диагностированным в Англии в период с 2013 по 2017 год.
Эти статистические данные предназначены для чистой выживаемости. Чистая выживаемость оценивает количество людей, переживших рак, а не подсчитывает количество людей, у которых диагностирован рак, которые еще живы. Другими словами, это выживаемость больных раком с учетом того, что некоторые люди умерли бы от других причин, если бы у них не было рака.
Что влияет на выживаемость
Ваш прогноз зависит от стадии рака, когда он был диагностирован. Это означает, насколько он велик и распространился ли он.
Тип рака и степень злокачественности раковых клеток также могут повлиять на вашу выживаемость. Степень означает, насколько ненормально клетки выглядят под микроскопом.
Ваше общее состояние здоровья и физическая форма также влияют на выживаемость. Чем лучше вы станете, тем лучше вы сможете справиться с раком и лечиться.
Некоторые виды рака кишечника вырабатывают белок, называемый карциноэмбриональным антигеном (CEA). Люди с высоким уровнем РЭА до лечения могут иметь худший прогноз.
Рак кишечника иногда может вызывать непроходимость кишечника (кишечную непроходимость).Если это произойдет, у вас есть небольшой риск образования дыры в стенке кишечника. Это называется перфорацией. У людей с раком кишечника, у которых есть непроходимость или перфорация кишечника, прогноз хуже.
Об этой статистике
Термины 1 год выживания и 5 лет не означают, что вы проживете только 1 или 5 лет.
Информацию собирают Управление национальной статистики (ONS) и исследователи. Они наблюдают, что происходит с людьми, больными раком, через годы после постановки диагноза.5 лет — это обычная временная точка для измерения выживаемости. Но некоторые люди живут намного дольше этого.
5-летняя выживаемость — это количество людей, которые не умерли от рака в течение 5 лет после постановки диагноза.
Дополнительная статистика
Для получения более подробной информации о выживаемости и раке кишечника перейдите в раздел «Статистика рака».
Прогноз на
— Рак кишечника Австралия
Пятилетняя относительная выживаемость при раке кишечника увеличилась с 52.От 3% до 70,3%
в период с 1987-1991 по 2013-2017 годы.
Когда кому-то ставят диагноз рак кишечника, один из первых вопросов, который они могут задать: «Каковы шансы, что я выживу?»
На этот вопрос специалисты отвечают с помощью статистики.
Статистика — это оценки, которые описывают тенденции в отношении большого числа людей. Они могут помочь с предсказаниями, но не могут предсказать, что с вами на самом деле произойдет.
Как долго человек будет жить после постановки диагноза (прогноза) рака кишечника, зависит от ряда факторов, таких как конкретные характеристики человека, включая его возраст и общее состояние здоровья на момент постановки диагноза, тип и стадию рака. есть и полученное лечение.
Исследователи обычно приводят статистику выживаемости в виде показателей для определенных типов рака.
- Выживаемость — процент людей, которые будут живы в определенное время после постановки диагноза. «Общая выживаемость» — это когда он включает всех людей с определенным типом рака.
Показатели выживаемости могут описывать любой заданный отрезок времени. Однако исследователи обычно приводят статистику рака как 5-летнюю относительную выживаемость.
- 5-летняя относительная выживаемость — процент людей, которые будут живы через 5 лет после постановки диагноза.В него не входят те, кто умирает от других болезней.
Пример: 5-летняя относительная выживаемость людей с раком кишечника составляет 70,1%. Это означает, что около 70 из каждых 100 человек с раком кишечника будут живы через пять лет после постановки диагноза.
Исследователи также рассчитывают статистику выживаемости для определенных стадий рака. Этап помогает описать, где находится рак, распространился ли он и где он распространился, а также влияет ли он на другие части тела. Статистика выживания может варьироваться в зависимости от стадии.
Пример: 5-летняя относительная выживаемость людей с диагнозом рака кишечника 1 стадии составляет 98,6%. Это означает, что почти 99 из каждых 100 человек с раком кишечника 1 стадии будут живы через 5 лет после постановки диагноза.
Исследователи основывают статистику 5-летней выживаемости людей, от рака которых лечили не менее пяти лет назад. Статистика может не отражать последние достижения в лечении.
Выживаемость без болезней и прогрессирования
Пятилетняя относительная выживаемость включает людей в стадии ремиссии.Ремиссия — это временное или постоянное отсутствие болезни. Этот показатель выживаемости также включает тех, кто все еще получает лечение.
Статистика безрецидивной выживаемости (DFS) и статистика выживаемости без прогрессирования (PFS) более конкретны. Специалисты часто используют их для оценки лечения рака.
- Безрецидивная выживаемость — процент людей, находящихся в полной ремиссии после завершения лечения.
- Коэффициент выживаемости без прогрессирования — процент людей, у которых не было роста новой опухоли или рака, распространившегося во время или после лечения.Заболевание могло полностью или частично поддаваться лечению, или заболевание могло быть стабильным. Это означает, что рак все еще существует, но не растет и не распространяется.
Использование статистики выживаемости для определения прогноза
Прогноз зависит от стадии рака на момент постановки диагноза. Например, 5-летняя относительная выживаемость при раке кишечника на ранней стадии достигает 98,6%. Для метастатического рака кишечника этот показатель составляет около 13,4%.
Использование статистики выживаемости для оценки вариантов лечения
Специалисты часто используют 5-летнюю относительную выживаемость для оценки и сравнения вариантов лечения.Они считают выживаемость хорошим показателем следующего:
- Подействует ли рак на лечение
- Продлит ли лечение успешно жизнь
Статистика выживаемости помогает специалистам решить, какое лечение приносит наибольшую пользу. Они также помогают специалистам взвешивать преимущества и риски. Например, определенное лечение может быть очень эффективным при лечении рака, но у человека могут возникнуть неприятные побочные эффекты от него.
Статистика может предоставить полезную информацию, но это не единственный фактор, используемый для планирования лечения.
Понятие «лечение»
Слово «лечение» не совсем применимо к раку. Иногда необнаруженные раковые клетки все еще остаются в организме после лечения. Эти клетки могут вызвать рецидив рака позже. Специалисты называют это рецидивом или рецидивом.
Медицинское сообщество считает многие виды рака «излеченными», если специалисты не могут обнаружить рак через пять лет после постановки диагноза.Но повторение через пять лет все еще возможно.
Источник: по материалам Cancer Facts & Figures 2020, Американское онкологическое общество (январь 2020 г.)
Прогноз рака толстой кишки стадии IV
Когда ваш врач скажет вам, что у вас рак толстой кишки, который распространился на другие части вашего тела, у вас, естественно, возникнет множество вопросов, в том числе, что это будет значить для вашего будущего.
Все разные. Даже если болезнь невозможно вылечить, существуют методы лечения, которые могут помочь вам прожить дольше и уменьшить боль, чтобы качество вашей жизни было как можно лучше.
Вы захотите работать с врачом, который специализируется на лечении рака толстой кишки IV стадии. Вы также можете попросить второе мнение, чтобы быть уверенным в том, что вы понимаете свою ситуацию и возможности.
После лечения
Ваш врач будет лечить ваш рак толстой кишки с помощью операции, химиотерапии, таргетной терапии, лучевой терапии или комбинации этих методов лечения. Если одно лечение не работает или перестает работать, вы можете попробовать что-нибудь другое.
После того, как вы закончите, вы будете посещать врача каждые несколько месяцев.Одна из причин обратиться к врачу — это контролировать любые побочные эффекты лечения, которые у вас есть.
Ваш врач также проведет анализы, чтобы убедиться, что ваш рак не вернулся. Рак, который возвращается, называется рецидивом. Рак толстой кишки, скорее всего, рецидивирует в течение первых 5 лет после лечения.
Если рак все же возвращается, регулярные посещения врача помогут обнаружить его на ранней стадии, когда его легче всего вылечить. Спросите своего врача, как могут выглядеть симптомы рецидива. Немедленно позвоните, если заметите эти симптомы.
У вас будет лучший результат, если вы останетесь здоровыми во время выздоровления после лечения рака толстой кишки. Следуйте этим советам:
Клинические испытания
Если вы попробовали несколько методов лечения рака толстой кишки, но они не помогли или перестали работать, у вас может быть другой вариант: клиническое испытание.
В клинических испытаниях ученые ищут новые способы лечения рака толстой кишки IV стадии. Эти испытания проверяют новые методы лечения, чтобы убедиться, что они безопасны и работают. Часто они позволяют людям попробовать новое лекарство, доступное далеко не каждому.Ваш врач может сказать вам, подходит ли вам одно из этих испытаний.
Паллиативная помощь
В вашем медицинском обслуживании есть нечто большее, чем лекарства или хирургическое вмешательство, направленное на рак. Врачи также должны помочь вам справиться с любой болью, возникающей в результате рака. Ваше социальное, эмоциональное и духовное здоровье также может нуждаться в поддержке, когда вы боретесь с таким серьезным заболеванием.
Паллиативная помощь делает все это. Это не то же самое, что хоспис, и не только для людей, находящихся на грани смерти.Вы по-прежнему будете получать всю остальную медицинскую помощь для борьбы с раком. Паллиативная помощь предоставляется в дополнение к другим видам лечения, а не вместо них.
Национальный институт рака заявляет, что паллиативная помощь «должна начинаться с постановки диагноза» и сосредоточена на качестве вашей жизни. Врачи, медсестры, диетологи, фармацевты и социальные работники — вот некоторые из специалистов здравоохранения, которые помогают в этом. Они могут стать неоценимым помощником в борьбе с болезнью.
Общая картина
Если один из вопросов, который у вас на уме, касается выживаемости при вашем раке, вы сначала захотите получить некоторую перспективу.Статистика не раскрывает всей картины.
Показатели выживаемости похожи на вид с высоты 30 000 футов: они широкие, но не детализированные. Эти цифры являются оценкой того, как долго могут жить люди с определенным типом рака и стадией. Относительная 5-летняя выживаемость рака толстой кишки на стадии IV составляет около 14%. Это означает, что около 14% людей с раком толстой кишки IV стадии, вероятно, будут живы через 5 лет после постановки диагноза.
Но вы не число. Никто, включая вашего врача, не может сказать вам точно, сколько вы проживете.Ваше мировоззрение зависит от многих вещей, в том числе от вашего возраста, состояния здоровья, места распространения рака и вида лечения.
Учтите, что цифры меняются — в лучшую сторону.
Растущее число людей с раком толстой кишки IV стадии живут дольше 2 лет. А для небольшой группы людей с раком, который распространился только на вашу печень или легкие, операция может даже вылечить его.
Также помните, что показатели выживаемости основаны на исследованиях, проведенных несколько лет назад.По мере улучшения лечения эти цифры могут возрасти.
В прошлом рак толстой кишки было труднее лечить, если он распространился. Достижения в области лечения улучшили прогноз, замедлили развитие рака.
Стадия и прогноз рака кишечника
Эти тесты помогают определить, есть ли у вас рак кишечника и распространился ли он с исходного места на другие части тела. Это называется стадированием и помогает вашей команде порекомендовать вам наиболее подходящее лечение.
Подробнее о:
Стадия рака кишечника
В Австралии для определения стадии рака кишечника используются две основные системы:
- Австралийская система стадирования клинико-патологической (ACPS)
- Система стадирования TNM (опухоль – узлы – метастаз) — в этой системе каждой букве присвоен номер, чтобы показать, насколько далеко продвинулся рак.
Ваш врач объединит результаты ваших ранних тестов, а также тесты на раковые ткани и лимфатические узлы, удаленные во время операции, чтобы определить общую стадию рака. Раку кишечника будет присвоена стадия 0–4 (часто обозначаемая римскими цифрами как 0, I, II, III или IV). В целом, на более ранних этапах результаты лучше. Почти 50% случаев рака кишечника в Австралии диагностируются на стадии 1 или 2.
Стадии рака кишечника
| стадия 1 (ACPS A) | опухоль обнаружена только в слизистой оболочке кишечника |
| стадия 2 (ACPS B) | опухоль распространилась глубже в слои стенок кишечника |
| стадия 3 (ACPS C) | опухоль распространилась на близлежащие лимфатические узлы |
| стадия 4 (ACPS D) | опухоль распространилась за пределы кишечника на другие части тела, такие как печень или легкие, или отдаленные лимфатические узлы |
Если вам трудно понять стадию, попросите кого-нибудь из вашей медицинской бригады объяснить это понятным для вас образом.
Прогноз
Прогноз означает ожидаемый исход болезни. Вы можете обсудить свой прогноз и варианты лечения со своим врачом, но никто не может предсказать точное течение болезни. Ваш врач может рассказать вам об общих проблемах, с которыми сталкиваются люди с раком кишечника.
Как правило, чем раньше диагностируется рак кишечника, тем выше шансы на успешное лечение. Если рак обнаружен после того, как он распространился за пределы кишечника на другие части тела, он все еще может хорошо поддаваться лечению, и его часто можно держать под контролем.
Результаты анализов, тип рака, скорость и глубина роста опухоли, вероятность ответа на лечение и такие факторы, как ваш возраст, уровень физической подготовки и история болезни, важны для оценки вашего прогноза. Эти сведения также помогут вашему врачу посоветовать вам лучшие варианты лечения.
Выживаемость рака прямой кишки по стадиям
Ключевое сообщение:
Ранняя диагностика рака кишечника жизненно важна для улучшения результатов.Более 90% пациентов, у которых диагностирована самая ранняя стадия заболевания, выжили через пять лет после постановки диагноза, по сравнению с только 6,6% пациентов, у которых диагностирована запущенная стадия заболевания, которая распространилась на другие части тела.
Фон
Все мужчины и женщины в Англии в возрасте от 60 до 69 лет приглашаются на обследование для выявления рака прямой кишки на ранней стадии. Стадия заболевания при постановке диагноза имеет большое влияние на пятилетнюю выживаемость. В этом брифинге впервые представлены национальные популяционные оценки выживаемости по стадиям заболевания, основанные на данных, собранных онкологическими регистрами.
Выживание при колоректальном раке
Общая пятилетняя относительная выживаемость пациентов с колоректальным раком в Англии составляет 50,7%. Однако существуют значительные различия в зависимости от стадии заболевания на момент постановки диагноза. 93,2% пациентов, у которых диагностирована самая ранняя стадия заболевания (Dukes A), выжили через пять лет после постановки диагноза по сравнению с только 6,6% пациентов с запущенным заболеванием, которое распространилось на другие части тела при постановке диагноза (Dukes D). В настоящее время только около 13% пациентов с колоректальным поражением имеют диагноз рака Дьюка А, но эта доля должна увеличиться в результате национальной программы скрининга рака кишечника.
| Стадия диагноза | Количество случаев | Процент случаев (%) | Процент случаев без учета неизвестных (%) | 5-летняя относительная выживаемость (%) | Доверительный интервал (95%) |
|---|---|---|---|---|---|
| Герцоги A | 26 727 | 8.7 | 13,2 | 93,2 | 92,5 — 93,9 |
| Герцоги B | 74,784 | 24,2 | 36,9 | 77,0 | 76,4 — 77,5 |
| Герцоги К | 72 806 | 23,6 | 35,9 | 47,7 | 47,1 — 48,3 |
| Герцоги Д | 28 377 | 9,2 | 14,0 | 6,6 | 6,1 — 7,0 |
| Неизвестно | 106040 | 34.3 | 35,4 | 35,0 — 35,8 | |
| Итого | 308 734 | 100,0 | 100,0 | 50,7 | 50,4 — 51,0 |
Пятилетняя относительная выживаемость пациентов с колоректальным раком (диагностированным в 1996–2002 гг.) По стадиям постановки диагноза, Англия.
Технические характеристики
Методы выживания
Показанные оценки относительной выживаемости определяются как отношение наблюдаемой вероятности выживания к вероятности, которую можно было бы ожидать, если бы пациенты испытали нормальную (фоновую) смертность в популяции, в которой они живут, при одинаковом распределении таких факторов, как как возраст, пол и календарный период.Оценки основывались на пациентах, которым был поставлен диагноз с 1996 по 2006 год, а пятилетние оценки основывались на пациентах, диагностированных между 1996 и 2002 годами. Если у пациентов был множественный колоректальный рак, их выживаемость рассчитывалась с даты постановки диагноза их первого рака. Фоновая смертность была рассчитана Правительственным офисом региона с использованием таблиц дожития, предоставленных Cancer Research UK Cancer Survival Group Лондонской школы гигиены и тропической медицины.
Княжеский этап
Если раковые заболевания были зарегистрированы с другой стадией, кроме Dukes (e.грамм. TNM ), он был преобразован в сцену герцогов. Этап описывает, насколько далеко рак распространился анатомически. Dukes ‘A означает, что рак находится только в самой внутренней оболочке кишечника или немного прорастает в мышечный слой. Dukes ‘B означает, что рак разросся через мышечный слой кишечника. C означает, что рак распространился по крайней мере на один лимфатический узел в области, близкой к кишечнику. D означает, что рак распространился на другие части тела.
За рассматриваемый период времени значительная часть регистраций (34%) была зарегистрирована с отсутствующей информацией о стадии.Это значительно различается (от 22 до 54%) в восьми онкологических регистрах Англии. Анализы были повторены для подмножества данных, предоставленных тремя реестрами, которые имели минимум 75% полной промежуточной информации и были получены очень похожие результаты.
После исключения случаев с неизвестной стадией диагноза распределение пациентов по стадиям Дьюкса было почти идентично тому, которое сообщалось в Национальном аудите рака кишечника (Smith JJ et al, 2007; Национальный проект аудита рака кишечника 2007: Улучшение качества и открытость). Составление отчетов.Информационный центр: Лондон)
Узнать больше
NYCRIS — ведущий регистр рака прямой кишки NCIN — infoan.nycris по адресу nhs dot net link [email protected]
.
Другие полезные ресурсы в рамках партнерства NCIN:
Рак кишечника | Причины, симптомы и лечение
Что такое рак кишечника?
Рак кишечника, также известный как колоректальный рак, развивается из внутренней оболочки кишечника, и ему обычно предшествуют новообразования, называемые полипами, которые могут стать инвазивным раком, если их не обнаружить.В зависимости от того, где начинается рак, рак кишечника может быть назван раком прямой или толстой кишки.
Рак кишечника является третьим по распространенности раком как у мужчин, так и у женщин в Австралии и чаще встречается у людей старше 50 лет.
Около 90 процентов случаев рака кишечника — это аденокарциномы, которые возникают в железистых тканях, выстилающих кишечник. Другие, менее распространенные виды рака также могут поражать кишечник, включая лимфомы и нейроэндокринные опухоли.
Рак также может начаться в тонкой кишке, но это редкий вид рака.
Предполагается, что в 2021 году в Австралии будет диагностировано 15 540 случаев рака кишечника.
Вероятность выживания при раке кишечника в течение как минимум пяти лет составляет 70%.
Узнайте больше о том, как исследователи Совета по борьбе с раком борются с раком кишечника в национальном масштабе.
Симптомы рака кишечника
Симптомы рака кишечника включают:
изменение привычки кишечника, включая диарею, запор или ощущение неполного опорожнения
изменение внешнего вида или консистенции дефекации, например, тонкую стул из кишечника
кровь в стуле
боль в животе, вздутие живота или спазмы
анальная или ректальная боль
шишка в анусе или прямой кишке
необъяснимая потеря веса
усталость
усталость и / или анемия (бледность лица, слабость и одышка)
кровь в моче или мочеиспускание часто или во время ночи смена цвета мочи на темный, ржавый или коричневый.
Причины рака кишечника
Некоторые факторы, повышающие риск рака кишечника, включают:
наследственный генетический риск и семейный анамнез
воспалительное заболевание кишечника, такое как болезнь Крона
высокий красный потребление мяса, особо обработанного мяса
полипов
избыточный вес или ожирение
высокое потребление алкоголя
курительный табак
наличие ранее диагностированного рака кишечника.
Диагностика рака кишечника
Для диагностики рака кишечника используется ряд тестов. Сначала ваш врач проведет физический осмотр, чтобы определить, есть ли у вас вздутие живота. Ваш врач также проведет пальцевое ректальное обследование, чтобы проверить наличие шишек или припухлостей в прямой кишке или анусе.
Анализы крови
Вы можете сдать анализ крови, чтобы увидеть, есть ли какие-либо признаки потери крови в стуле. Он также может проверить количество красных кровяных телец, так как низкий уровень эритроцитов часто встречается у людей с раком кишечника.
Иммунохимический анализ кала на скрытую кровь (iFOBT)
В зависимости от симптомов вам может быть назначен iFOBT. Тест может быть использован при болях в животе, изменении привычек кишечника, необъяснимой потере веса или анемии. Не рекомендуется при кровотечении из прямой кишки.
С iFOBT вы можете взять образец своего стула дома. Образец исследуют под микроскопом на наличие следов крови, которые могут быть признаком полипов, рака или другого состояния кишечника.Он не диагностирует рак, но при обнаружении крови ваш врач порекомендует провести колоноскопию не позднее, чем через 30 дней после получения результата.
Колоноскопия
Лучшим тестом на рак кишечника является колоноскопия, при которой исследуется длина толстой кишки. Воздух нагнетается в толстую кишку через гибкую трубку, которая вводится в задний проход. Камера на конце трубки позволяет врачу искать патологические ткани, которые удаляются для дальнейшего исследования.
Гибкая ректороманоскопия используется для исследования прямой кишки и левой части нижней части ободочной кишки.Любую необычную ткань можно удалить для дальнейшего исследования.
Гибкая ректороманоскопия
Гибкая ректороманоскопия используется для исследования прямой кишки и левой части нижней части ободочной кишки. Любую необычную ткань можно удалить для дальнейшего исследования.
МРТ
МРТ позволяет получить подробные изображения поперечного сечения тела и показать размер любых опухолей.
КТ
КТ дает трехмерные изображения нескольких органов одновременно и может использоваться для исследования кишечника.
После диагностики рака кишечника
Узнав, что у вас рак кишечника, вы можете чувствовать себя шокированным, расстроенным, тревожным или сбитым с толку. Это нормальные ответы. Диагноз рака кишечника влияет на каждого человека по-разному. Для большинства это будет трудное время, однако некоторым удается продолжать свои обычные повседневные дела.
Ваш гид по лучшему лечению рака кишечника
«Ваш гид по лучшему лечению рака» предлагает специальные руководства по лечению рака, в которых описывается высококачественное лечение, которого вы должны ожидать на каждом этапе лечения и за его пределами.
Лечение рака кишечника
Лечение рака кишечника на ранних стадиях
Хирургия
Основным методом лечения рака кишечника на ранних стадиях является хирургическое вмешательство. Самая распространенная операция при раке, который начинается в толстой кишке, — это колэктомия. Тип выполняемой колэктомии будет зависеть от того, нужно ли удалить толстую кишку полностью или частично.
Лучевая терапия (лучевая терапия)
Лучевая терапия (лучевая терапия) часто используется перед операцией по поводу местнораспространенного рака прямой кишки и может использоваться в сочетании с химиотерапией для уменьшения количества и размера раковых клеток.
Адъювантное лечение
Химиотерапия может быть рекомендована после операции по поводу рака прямой или толстой кишки. Это направлено на снижение риска возврата рака.
Паллиативная помощь
В некоторых случаях рака кишечника ваша медицинская бригада может поговорить с вами о паллиативной помощи. Паллиативная помощь направлена на улучшение качества вашей жизни за счет облегчения симптомов рака, а не на его лечение.
Паллиативное лечение не только замедляет распространение рака кишечника, но и облегчает боль и помогает справиться с другими симптомами.Лечение может включать лучевую терапию, химиотерапию или другие лекарственные препараты.
Лечение рака толстой кишки на поздних стадиях
Системное лечение
Системное лечение запущенного рака кишечника использует лекарства, которые проходят через кровоток и достигают раковых клеток по всему телу. Системное лечение может включать химиотерапию и таргетную терапию.
Хирургия
Вам могут предложить операцию по удалению небольших вторичных раков, если рак распространился на другие части тела.
Побочные эффекты
Лечение рака кишечника и даже самого рака может вызывать побочные эффекты. Типы и тяжесть любых побочных эффектов, которые вы можете испытывать, будут зависеть от типа лечения, которое вы проходите, и могут варьироваться от человека к человеку. Большинство побочных эффектов являются временными, и их можно предотвратить, уменьшить или контролировать.
Некоторые из побочных эффектов, которые вы можете испытать, включают:
Поговорите со своим лечащим врачом о любых изменениях, которые вы испытываете во время и после лечения.
Лечебная бригада
В зависимости от вашего лечения ваша лечащая бригада может состоять из ряда различных медицинских специалистов, таких как:
- GP (врач общей практики) — следит за вашим общим состоянием здоровья и работает с вашими специалистами для координации лечения.
- Колоректальный хирург — диагностирует рак кишечника и выполняет операции на кишечнике.
- Гастроэнтеролог — специализируется на заболеваниях органов пищеварения.
- Врач-онколог — назначает и координирует курс химиотерапии.
- Врач-лучевой онколог — назначает и координирует лечение лучевой терапией.
- Онкологические медсестры — помогают с лечением, а также предоставляют информацию и поддержку на протяжении всего лечения.
- Диетолог — рекомендует придерживаться плана питания во время лечения и восстановления.
- Другие специалисты в области здравоохранения, такие как социальные работники, фармацевты и консультанты.
Скрининг на рак кишечника
Рекомендуется скрининг с использованием неинвазивного теста на кровь в фекалиях, который можно проводить дома. для всех австралийцев в возрасте от 50 до 74 лет.Этот тест, известный как анализ кала на скрытую кровь (FOBT), предназначен только для людей из группы низкого риска без симптомов рака кишечника. FOBT не предназначен для людей с семейным анамнезом рака кишечника. В этом случае могут потребоваться скрининговые колоноскопии.
С 2020 года Национальная программа скрининга рака кишечника с использованием FOBT теперь предлагается бесплатно каждые два года всем австралийцам в возрасте от 50 до 74 лет.
Для получения дополнительной информации позвоните по телефону 1800 118 868 или посетите сайт Cancerscreening.gov.au.
Профилактика рака кишечника
Риск рака кишечника можно снизить, отказавшись от курения, соблюдая здоровую диету с большим количеством свежих фруктов и овощей, ограничивая потребление красного мяса, избегая обработанного мяса и поддерживая здоровую массу тела.
Прогноз рака кишечника
Прогноз относится к ожидаемому исходу заболевания. Ни один врач не может предсказать точное течение болезни. Прогноз человека зависит от типа и стадии рака, а также от его возраста и общего состояния здоровья на момент постановки диагноза. Эта информация также поможет вашему врачу посоветовать лучшие варианты лечения.
Как правило, чем раньше диагностируется рак кишечника, тем лучше результаты.
Источники
- Понимание рака кишечника, Онкологический совет Австралии © 2021. Последний медицинский обзор буклета с источниками: январь 2021 года. Университет Квинсленда, QLD, и Университет Сиднея, Новый Южный Уэльс; A / профессор Сиддхартха Бакси, радиационный онколог и медицинский директор, GenesisCare Gold Coast, QLD; Д-р Hooi Ee, специалист-гастроэнтеролог и руководитель отделения гастроэнтерологии, больница сэра Чарльза Гэрднера, Вашингтон; Энни Харви, потребитель; A / профессор Луиза Нотт, медицинский онколог, онкологический центр Icon, Хобарт, ТАС; Кейли Шнайд, аккредитованный практикующий диетолог, GenesisCare, St Leonards and Frenchs Forest, Новый Южный Уэльс; Крис Сибторп, 13 11 20 консультант, Онкологический совет Квинсленда; Д-р Алина Стоита, гастроэнтеролог и гепатолог, Сиднейская больница Святого Винсента, Новый Южный Уэльс; Кэтрин Треваскис, медсестра-специалист по онкологическим заболеваниям желудочно-кишечного тракта, больница Канберры, ACT; Ричард Валланс, потребитель.