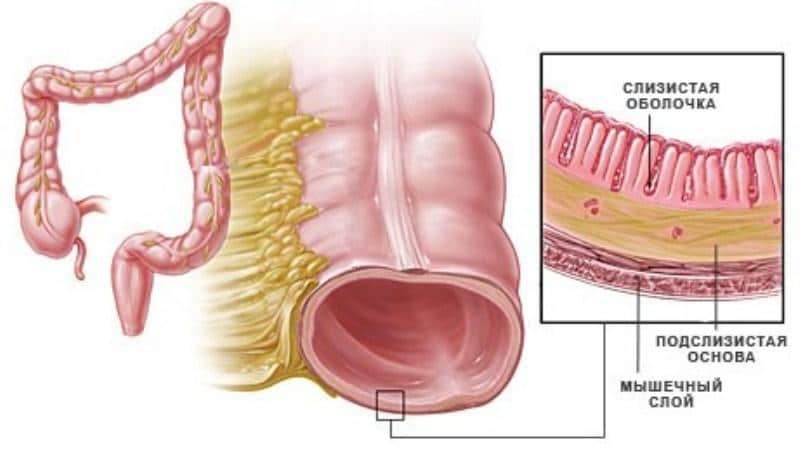
Рак толстой кишки — Специализация
Рак толстого кишечника относится к наиболее часто встречаемым раковым заболеваниям. Отделы тонкого кишечника реже поражаются раком. Поэтому под раком кишечника обычно в повседневном обиходе понимается рак именно толстой кишки. Частота поражения этим раком женщин и мужчин приблизительно одинакова. После 50 лет риск заболевания раком толстого кишечника значительно возрастает. Рак кишечника развивается практически исключительно из маленьких полипов, так называемых кишечных полипов. Поэтому людям с повышенным риском заболевания раком кишечника крайне важно регулярно проходить профилактические контрольные обследования. Это позволит ещё на раннем этапе удалить такие полипы. Риск заболевания раком кишечника считается повышенным при наличии следующих факторов риска:
- Семейный анамнез отягощён случаями рака кишечника
- Полипоз толстого кишечника
- Хронические воспалительные заболевания кишечника
- Избыточный вес
- Недостаточная подвижность
Рак кишечника долгое время протекает малосимптомно, либо вообще без жалоб.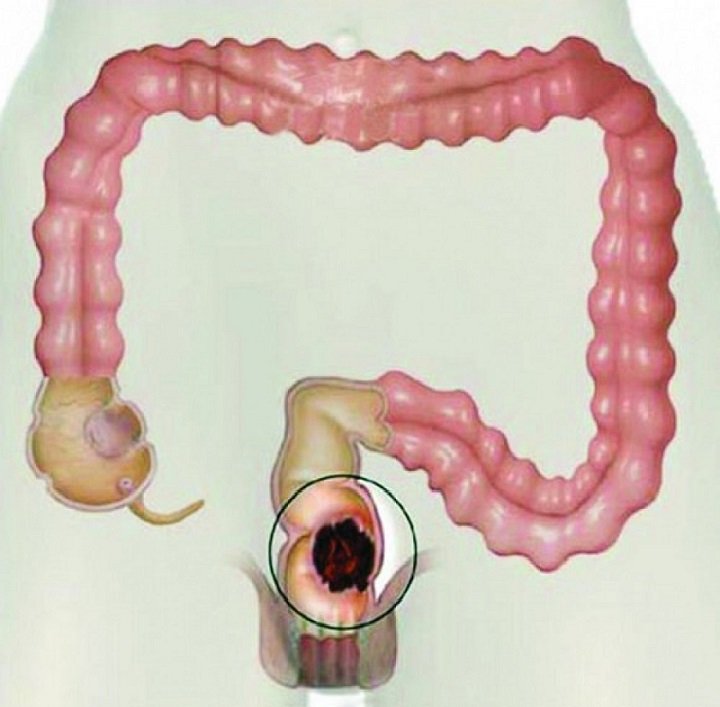 Важные признаки, указывающие на возможный рак кишечника — это изменение привычек акта дефекации, позывы к дефекации без последовавшего опорожнения кишечника, чередование запоров и диареи, а также кровь в стуле. Также потеря веса и чувство усталости могут быть общими жалобами при заболевании раком. Рак кишечника редко проявляется в форме болей в животе.
Важные признаки, указывающие на возможный рак кишечника — это изменение привычек акта дефекации, позывы к дефекации без последовавшего опорожнения кишечника, чередование запоров и диареи, а также кровь в стуле. Также потеря веса и чувство усталости могут быть общими жалобами при заболевании раком. Рак кишечника редко проявляется в форме болей в животе.
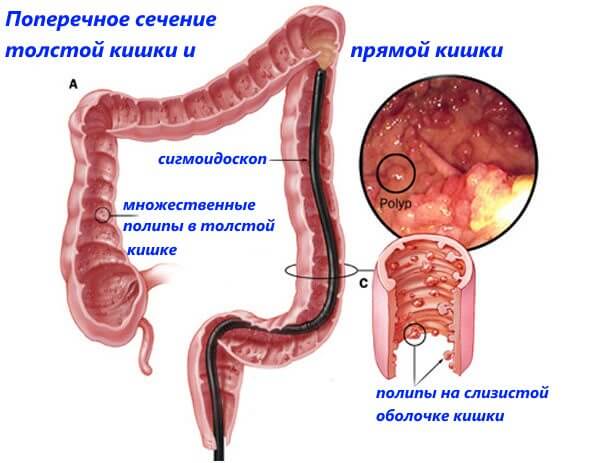
Для диагностики рака кишечника проводят эндоскопическое исследование толстого кишечника (колоноскопию). В рамках этого исследования из области подозрительных изменений берут образцы тканей на исследование, по результатам которого может быть поставлен диагноз рака толстого кишечника. Маленькие полипы толстой кишки могут быть сразу удалены в рамках эндоскопии.
Для ранней диагностики рака кишечника важно проходить профилактические контрольные обследования, вкл. эндоскопию толстого кишечника или анализ кала (кровь).
Выбор терапии зависит от стадии рака. Хирургическое удаление раковой опухоли кишечника на ранних стадиях даёт хорошие шансы на излечение.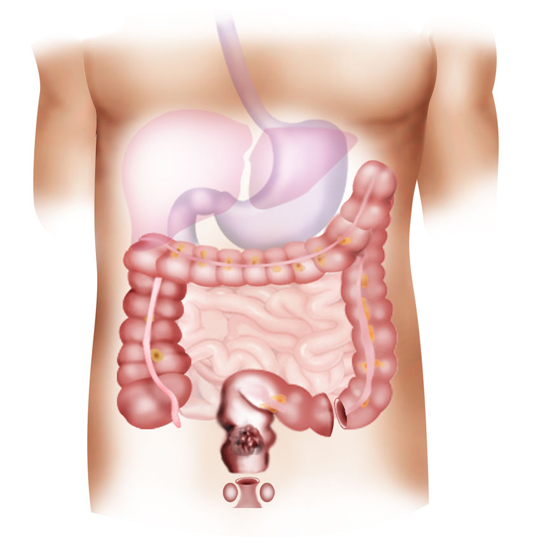 Условие чтобы опухоль ещё не проросла в кишечник и не дала метастазов. На прогрессирующей стадии заболевания хирургическое лечение комбинируют с лучевой терапией (облучением) или химиотерапией.
Условие чтобы опухоль ещё не проросла в кишечник и не дала метастазов. На прогрессирующей стадии заболевания хирургическое лечение комбинируют с лучевой терапией (облучением) или химиотерапией.
ЗАБОЛЕВАЕМОСТЬ РАКОМ ПРЯМОЙ КИШКИ НАСЕЛЕНИЯ МОСКОВСКОЙ ОБЛАСТИ В 2010–2014 ГГ. | Балканов
1. Гуров АН, Балканов АС, Катунцева НА, Огнева ЕЮ. Анализ онкозаболеваемости и смертности населения Московской области за 2014 год. Альманах клинической медицины. 2015;41:6–11. doi: 10.18786/2072-0505-2015-41-6-11.
2. Phipps AI, Scoggins J, Rossing MA, Li CI, Newcomb PA. Temporal trends in incidence and mortality rates for colorectal cancer by tumor location: 1975–2007. Am J Public Health. 2012;102(9): 1791–7. doi: 10.2105/ AJPH.2011.300393.
3. Ait Ouakrim D, Lockett T, Boussioutas A, Keogh L, Flander LB, Winship I, Giles GG, Hopper JL, Jenkins MA. Screening practices of Australian men and women categorized as «at or slightly above average risk» of colorectal cancer. Cancer Causes Control. 2012;23(11): 1853–64. doi: 10.1007/s10552-012-0067-y.
Ait Ouakrim D, Lockett T, Boussioutas A, Keogh L, Flander LB, Winship I, Giles GG, Hopper JL, Jenkins MA. Screening practices of Australian men and women categorized as «at or slightly above average risk» of colorectal cancer. Cancer Causes Control. 2012;23(11): 1853–64. doi: 10.1007/s10552-012-0067-y.
4. Austin H, Henley SJ, King J, Richardson LC, Eheman C. Changes in colorectal cancer incidence rates in young and older adults in the United States: what does it tell us about screening. Cancer Causes Control. 2014;25(2): 191–201. doi: 10.1007/s10552-013-0321-y.
5. Myers EA, Feingold DL, Forde KA, Arnell T, Jang JH, Whelan RL. Colorectal cancer in patients under 50 years of age: a retrospective analysis of two institutions’ experience. World J Gastroenterol. 2013;19(34): 5651–7. doi: 10.3748/wjg.v19.i34.5651.
6. Brooke HL, Talbäck M, Martling A, Feychting M, Ljung R. Socioeconomic position and incidence of colorectal cancer in the Swedish population. Cancer Epidemiol. 2016;40:188–95. doi: 10.1016/j.canep.2016.01.004.
Brooke HL, Talbäck M, Martling A, Feychting M, Ljung R. Socioeconomic position and incidence of colorectal cancer in the Swedish population. Cancer Epidemiol. 2016;40:188–95. doi: 10.1016/j.canep.2016.01.004.
7. Simon MS, Thomson CA, Pettijohn E, Kato I, Rodabough RJ, Lane D, Hubbell FA, O’Sullivan MJ, Adams-Campbell L, Mouton CP, Abrams J, Chlebowski RT. Racial differences in colorectal cancer incidence and mortality in the Women’s Health Initiative. Cancer Epidemiol Biomarkers Prev. 2011;20(7): 1368–78. doi: 10.1158/1055-9965. EPI-11-0027.
8. Raskov H, Pommergaard HC, Burcharth J, Rosenberg J. Colorectal carcinogenesis – update and perspectives. World J Gastroenterol. 2014;20(48): 18151–64. doi: 10.3748/wjg.v20. i48.18151.
9. Shroff J, Thosani N, Batra S, Singh H, Guha S. Reduced incidence and mortality from col-orectal cancer with flexible-sigmoidoscopy screening: a meta-analysis. World J Gastroenterol. 2014;20(48): 18466–76. doi: 10.3748/wjg. v20.i48.18466.
Reduced incidence and mortality from col-orectal cancer with flexible-sigmoidoscopy screening: a meta-analysis. World J Gastroenterol. 2014;20(48): 18466–76. doi: 10.3748/wjg. v20.i48.18466.
10. Lieberman DA, Williams JL, Holub JL, Morris CD, Logan JR, Eisen GM, Carney P. Race, ethnicity, and sex affect risk for polyps > 9 mm in average-risk individuals. Gastroenterology. 2014;147(2): 351–8. doi: 10.1053/j.gas-tro.2014.04.037.
11. McClellan DA, Ojinnaka CO, Pope R, Simmons J, Fuller K, Richardson A, Helduser JW, Nash P, Ory MG, Bolin JN. Expanding access to colorectal cancer screening: benchmarking quality indicators in a Primary Care Colonoscopy Program. J Am Board Fam Med. 2015;28(6): 713–21. doi: 10.3122/jabfm.2015.06.140342.
12. Rahman R, Schmaltz C, Jackson CS, Simoes EJ, Jackson-Thompson J, Ibdah JA. Increased risk for colorectal cancer under age 50 in racial and ethnic minorities living in the United States. Cancer Med. 2015;4(12): 1863–70. doi: 10.1002/cam4.560.
Increased risk for colorectal cancer under age 50 in racial and ethnic minorities living in the United States. Cancer Med. 2015;4(12): 1863–70. doi: 10.1002/cam4.560.
13. Siegel RL, Jemal A, Ward EM. Increase in incidence of colorectal cancer among young men and women in the United States. Cancer Epidemiol Biomarkers Prev. 2009;18(6): 1695–8. doi: 10.1158/1055-9965.EPI-09-0186.
клинический случай. История пациента Клиники Спиженко
Рак толстой и прямой кишки (колоректальный рак) — одно из наиболее распространенных онкологических заболеваний толстой кишки. Именно с такой проблемой в Клинику Спиженко обратился пациент, житель украинской провинции.
День выписки из Клиники Спиженко. На фото с пациентом хирурги онкологического центра: М. Сильвестров, зав. отделением хирургии, и М. Ковальчук
История о лечении заболевания “неизвестной” природы, которая произошла с мужчиной до обращения в профильный онкологический центр, к сожалению, для Украины не редкость. На протяжении многих лет у пациентов сложилось стойкое недоверие к врачам, а слова “онкология” и “рак” у многих до сих пор вызывают шок.
На протяжении многих лет у пациентов сложилось стойкое недоверие к врачам, а слова “онкология” и “рак” у многих до сих пор вызывают шок.
Традиционно, в заключительной части статьи мы расскажем об элементарных мерах профилактики рака толстой и прямой кишки. Но для начала — история, рассказанная Михаилом и врачами Центра онкологии «Клиника Спиженко».
История пациента Клиники Спиженко
Со слов пациента:
На протяжении длительного периода времени у меня была повышенная температура тела, поэтому я обратился за помощью в местную больницу. Врачи диагностировали заболевание легких и назначили лечение антибиотиками. Однако, после выписки из больницы прогнозируемое улучшение на наступило.
Дети обеспокоились состоянием моего здоровья, и мы отправились в областной центр, где прошли диагностику, сделали снимки. Все это время я мучился от высокой температуры, буквально, не мог стоять на ногах. По возвращению домой снова пролечился в местной больнице. Спустя некоторое время врачи приняли решение сделать колоноскопию. Во время обследования взяли образец ткани, мне сказали, что есть подозрение на “что-то нехорошее”.
Спустя некоторое время врачи приняли решение сделать колоноскопию. Во время обследования взяли образец ткани, мне сказали, что есть подозрение на “что-то нехорошее”.
В тот же день мы собрались всей семьей обсудить сложившуюся ситуацию и решить, как действовать дальше. Обзвонили знакомых, у которых была онкология. Были родственники, которые лечились в Клинике Спиженко, по их рекомендации мы обратились именно сюда. На следующий день мы уже были в клинике, прошли диагностику, сделали все анализы. Приехали в пятницу, а на понедельник уже была назначена операция.
Татьяна Рослякова, главный клинический онколог, зав. консультативно-диагностическим департаментом
Рассказывает Татьяна Рослякова, главный клинический онколог Клиники Спиженко, зав. консультативно-диагностическим департаментом, врач высшей категории:
Пациент поступил к нам с жалобами на слабость, повышение температуры до 39° С, наличие крови и слизи в кале. На протяжении трех недель мужчину беспокоила тяжелейшая слабость, он обследовался у невропатолога, терапевта. По месту жительства пациенту лечили воспаление легких.
На протяжении трех недель мужчину беспокоила тяжелейшая слабость, он обследовался у невропатолога, терапевта. По месту жительства пациенту лечили воспаление легких.
Спустя некоторое время после терапии, мужчине была назначена колоноскопия, ввиду появления жалоб на вздутие живота. Во время исследования было обнаружено новообразование и взят образец ткани (биопсия), для последующего гистологического исследования. С этим образцом мужчина и прибыл к нам в клинику на консультацию онколога.
На первичном осмотре пациент пребывал в тяжелом состоянии, обусловленным также синдромом интоксикации. Максимально оперативно он был дообследован: проведены компьютерная томография грудной, брюшной полости и таза, все необходимые лабораторные анализы. На консилиуме было принято решение о необходимости хирургического лечения и начата предоперационная подготовка.
В данном клиническом случае была выполнена лапароскопическая операция Гартмана, в результате которой удалена вся опухоль сигмовидной кишки, проведена полная лимфодиссекция (удалено 18 лимфатических узлов).
М. Сильвестров, зав.отделением хирургии, онкохирург высшей категории
Максим Сильвестров, зав. отделением хирургии Клиники Спиженко, врач-онкохирург высшей категории:
Пациенту выполнена лапароскопическая операция, которая позволила ему избавиться от проблемы с минимальной травматичностью.
Несмотря на размеры опухоли и наличие воспалительного процесса, операция была проведена лапароскопически, без большого срединного разреза живота. Мы применили малотравматичный подход, несмотря на это, операция была проведена в радикальном объеме — опухоль удалена с соблюдением онкологических принципов и требований.
После хирургического лечения в клинике были получены результаты планового гистологического исследования образцов ткани опухоли. Всех порадовал тот факт, что ни в одном из удаленных 18-ти лимфатических узлов не было обнаружено метастазов рака, метастатических поражений других органов также не было, края резекции — свободны от опухоли.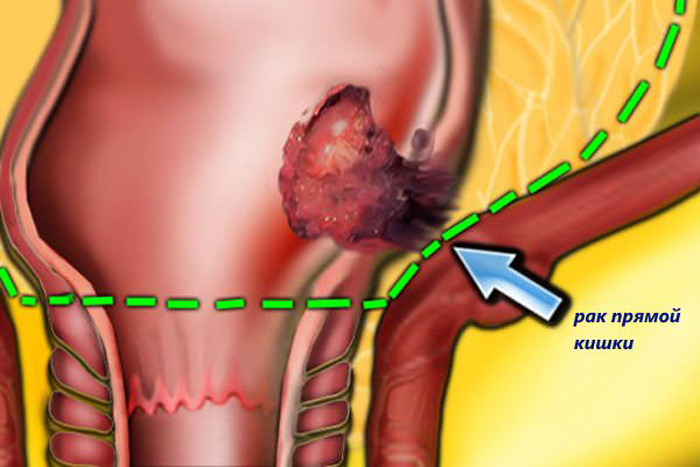
С такими характеристиками онкологического процесса пациенту не требуется дополнительное лечение в виде химио- или лучевой терапии, а только лишь динамическое наблюдение у онколога.
Спустя 3 месяца после лечения контрольное обследование не выявило рецидива опухоли, что позволило провести пациенту реконструкцию кишечника. Данная операция также была выполнена лапароскопически.
Рекомендации специалистов Клиники Спиженко по профилактике рака толстой и прямой кишки
Колоректальный рак — один из самых распространенных видов онкологических заболеваний у мужчин и женщин старшего возраста. К сожалению, значительное количество пациентов со злокачественными опухолями кишечника обращаются к специалистам на поздних стадиях. Причиной тому — недостаточная информированность как самих пациентов, так и врачей первичного звена о мерах профилактики рака толстой и прямой кишки.
Кто в группе риска?
Мужчины и женщины в возрасте от 45-ти лет.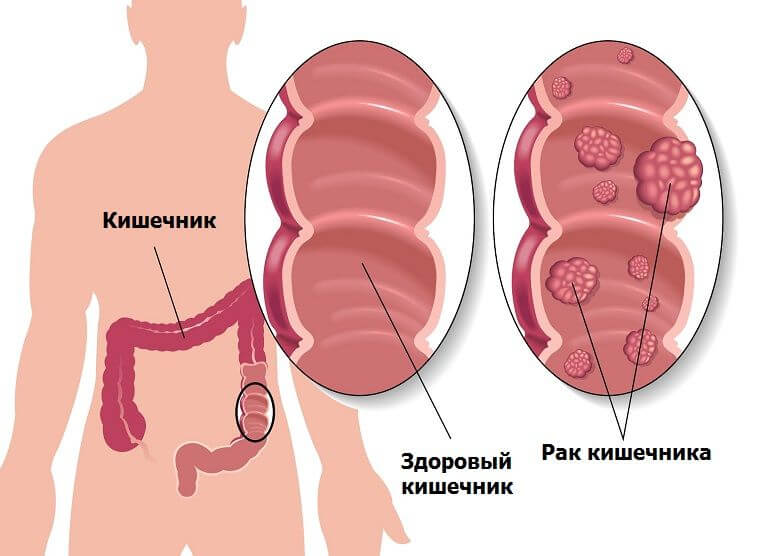 Факторы риска рака толстой и прямой кишки:
Факторы риска рака толстой и прямой кишки:
- злоупотребление алкоголем;
- табакокурение;
- наследственность.
Что делать?
Принцип онкологии — чем раньше выявлен опухолевый процесс, тем эффективнее его лечение, в полной мере относится к раку толстой и прямой кишки. На ранних стадиях развития аденоматозные полипы и колоректальные карциномы являются бессимптомными. Методом ранней диагностики колоректального рака является эндоскопическое исследование толстой кишки — колоноскопия.
Этот метод позволяет легко и четко диагностировать опухоль, а также выявить и удалить аденомы (полипы), из которых данный вид рака и развивается.
Поэтому рекомендацией врачей для профилактики колоректального рака является: колоноскопия и удаление полипов.
Отдаленные результаты хирургического и комбинированного лечения больных раком верхнеампулярного отдела прямой кишки | Мадьяров
1. Glimelius B., Gronberg H., Jarhult J. et al. A systematic overview of radiation therapy effects in rectal cancer. Acta Oncol 2013; 42(5–6):476–92.
Glimelius B., Gronberg H., Jarhult J. et al. A systematic overview of radiation therapy effects in rectal cancer. Acta Oncol 2013; 42(5–6):476–92.
2. Статистика злокачественных новообразований в России и странах СНГ в 2012 году. Под ред. М. И. Давыдова, Е. М. Аксель. 2014. [Statistics of malignant tumors in Russia and CIS countries in 2012. Ed. by: М. I. Davydov, Е. М. Аksel’. Мoscow, 2014. 226 p. (In Russ.)].
3. Cecil T.D., Sexton R., Moran B.J., Heald R.J. Total mesorectal excision results in low local recurrence rates in lymph node-positive rectal cancer. Dis Colon Rectum 2004;47:1145–9.
4. Kapiteijn E., Marijnen C. A., Nagtegaal I. D. et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. Engl J Med 2001;345(9): 638–46.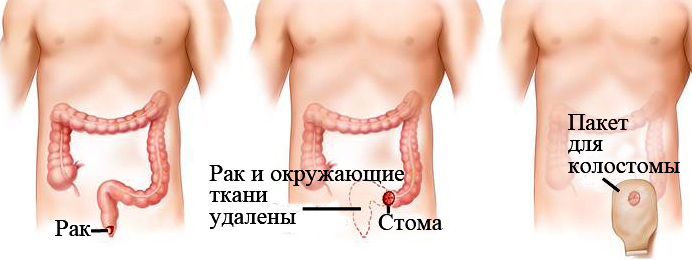
5. Kripp M., Wieneke J., Kienle P. et al. Intensified neoadjuvant chemoradiotherapy in locally advanced rectal cancer – impact on long-term quality of life. Eur J Surg Oncol 2012;38(6):472–7.
6. De Caluwe L., Van Nieuwenhove Y., Ceelen W. P. Preoperative chemoradiation versus radiation alone for stage II and III resectable rectal cancer. Cochrane Database Syst Rev 2013;2. CD006041.
7. Folkesson J., Birgisson H., Pahlman L. et al. Swedish Rectal Cancer Trial: long lasting benefits from radiotherapy on survival and local recurrence rate. J Clin Oncol 2005;23(24):5644–50.
8. The Association of Coloproctology of Great Britain and Ireland. Guidelines for the management of colorectal cancer 3rd edition. 2007.
2007.
9. Sauer R., Becker H., Hohenberger W. et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004;351(17):1731–40.
10. Quirke P., Steele R., Monson J. et al. Effect of the plane of surgery achieved on local recurrence in patients with operable rectal cancer: a prospective study using data from the MRC CR07 and NCIC–CTG CO16 randomised clinical trial. Lancet 2009;373(9666):821–8.
11. Peeters K. C., Marijnen C. A., Nagtegaal I. D. et al. The TME trial after a median follow-up of 6 years: increased local control but no survival benefit in irradiated patients with resectable rectal carcinoma. Ann Surg 2007;246(5):693–701.
12. ESMO Clinical Practice Guidelines. [Электронный ресурс]. 2014. Режим доступа: http://www.esmo.org/content/download/30934/621019/file/ESMO-2014-Industry-Guidelines.
[Электронный ресурс]. 2014. Режим доступа: http://www.esmo.org/content/download/30934/621019/file/ESMO-2014-Industry-Guidelines.
13. Marinello F. G., Frasson M., Baguena G. et al. Selective approach for upper rectal cancer treatment. Hospital Universitarioi Politècnic La Fe Valencia, 2015.
14. Pucciarelli S., Gagliardi G., Maretto I. et al. Long-term oncologic results and complications after preoperative chemoradiotherapy for rectal cancer: a singleinstitution experience after a median followup of 95 months. Ann Surg Oncol 2009;6(4):893–9.
15. Kusters M., Marijnen C. A., van de Velde C. J. et al. Patterns of local recurrence in rectal cancer; a study of the Dutch TME trial. Eur J Surg Oncol 2010;36(5): 470–6.
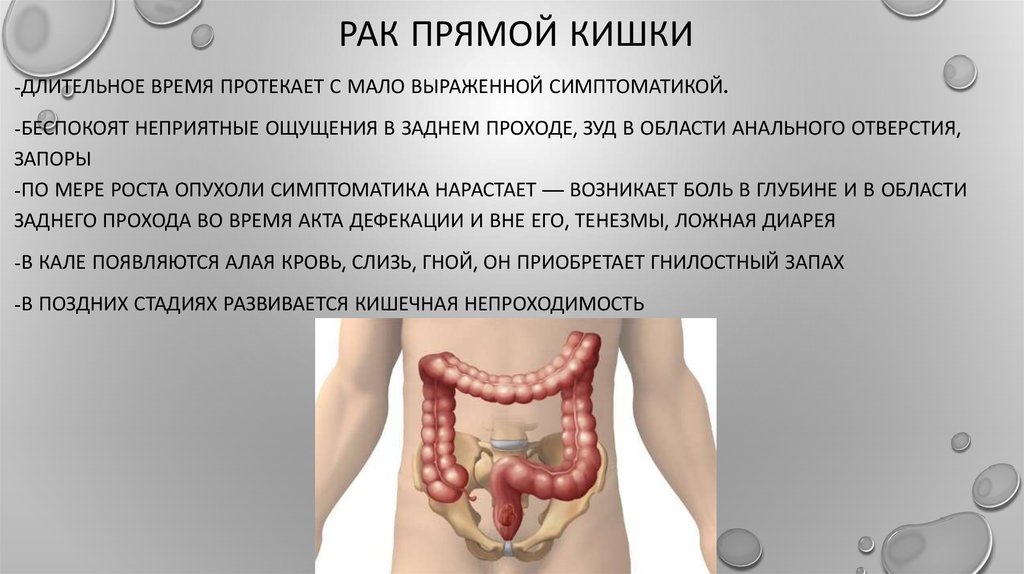
Рак прямой кишки.
 Послеоперационная профилактика расстройств
Послеоперационная профилактика расстройств
Хирургическое лечение рака прямой кишки в начале разработки этой проблемы было связано с обеспечением безопасности оперативных вмешательств и борьбой с интраоперационными осложнениями, затем — с возрастанием радикальности операций и расширением зоны лимфодиссекции. Впервые радикальную операцию по поводу рака прямой кишки — брюшно-промежностную экстирпацию — выполнил W.Miles. Суть операции заключалась в футлярном удалении непосредственно самой прямой кишки. В отечественной хирургии приоритет в разработке и внедрении в клиническую практику передней (чрезбрюшинной) резекции прямой кишки принадлежит Б.А. Петрову, впервые выполнившему эту ССО в 1937 году.
Уважаемые пациенты! Обратите внимание на следующие материалы сайта:
|
Новые возможности для увеличения доли ССО появились с внедрением в хирургическую практику циркулярных сшивающих аппаратов последних моделей в сочетании с зажимом для наложения кисетного шва и монофиламентных нитей на прямых гнущихся иглах.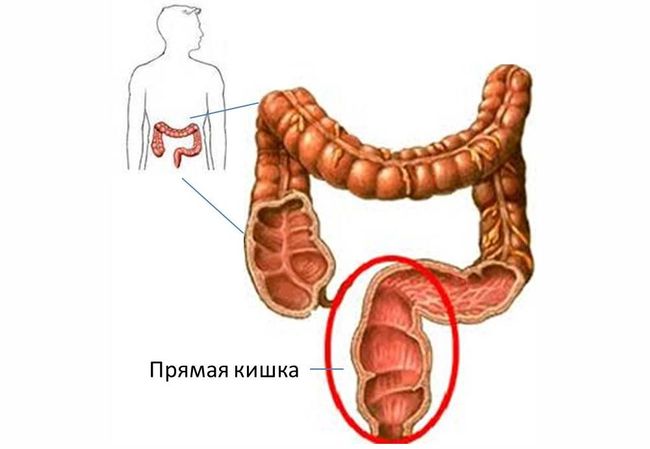 Все это упростило выполнение предельно низких от анокутанной линии резекций прямой кишки. К этому добавились специальные исследования об особенностях внутрикишечного распространения ракового поля в дистальном направлении от видимого края опухоли. Оказалось, что достаточно отступить на 1,5 — 2 см от нижней границы пальпируемой части раковой опухоли, чтобы линия резекции пришлась по здоровой, непораженной опухолевыми клетками кишке. Стали выполняться не только низкие, но и ультранизкие резекции прямой кишки. Появились сообщения из высококвалифицированных и специализированных лечебно-научных учреждений о транссфинктерных резекциях ПК.
Все это упростило выполнение предельно низких от анокутанной линии резекций прямой кишки. К этому добавились специальные исследования об особенностях внутрикишечного распространения ракового поля в дистальном направлении от видимого края опухоли. Оказалось, что достаточно отступить на 1,5 — 2 см от нижней границы пальпируемой части раковой опухоли, чтобы линия резекции пришлась по здоровой, непораженной опухолевыми клетками кишке. Стали выполняться не только низкие, но и ультранизкие резекции прямой кишки. Появились сообщения из высококвалифицированных и специализированных лечебно-научных учреждений о транссфинктерных резекциях ПК.
Профилактика послеоперационных колоректальных расстройств
при раке прямой кишки
В последние годы с целью профилактики послеоперационных колоректальных расстройств широкое распространение получили операции формирования толстокишечного резервуара при резекциях прямой кишки. Исходные позиции этого предложения очевидны — создать вместо утраченных после резекции прямой кишки накопительной и эвакуаторной функций, подобие их, за счет резервуара из толстой кишки. Работ в этом плане довольно много. Использовался при этом многолетний опыт формирования тонкокишечных резервуаров при тотальной проктоколэктомии. Со временем стало очевидным, что чисто механически замена утраченных функций прямой кишки так просто не решается и последовала оценка результатов операций с формированием толстокишечных резервуаров, сообщения об изменении методики операции и новые предложения. Термин «неоректум» стал применяться все реже и реже.
Работ в этом плане довольно много. Использовался при этом многолетний опыт формирования тонкокишечных резервуаров при тотальной проктоколэктомии. Со временем стало очевидным, что чисто механически замена утраченных функций прямой кишки так просто не решается и последовала оценка результатов операций с формированием толстокишечных резервуаров, сообщения об изменении методики операции и новые предложения. Термин «неоректум» стал применяться все реже и реже.
Первоначально резервуар стремились формировать достаточно объемным 7,5-10 см. По мере изучения функциональных результатов резекций ПК с созданием толстокишечных резервуаров становилось очевидным, что лучшие данные выявляются при резервуарах меньшего размера — 5 см. Так, Jin-Ichi Hida et all. (1996 г.) проводили рандомизированные исследования с формированием резервуаров 10 и 5 см (длина). Первая группа (10 см) — 20 чел., вторая группа (5 см) — тоже 20 чел. Оценивали результаты через 1 год. Эвакуаторная функция при резервуаре 5 см была значительно выше, чем при «неоректум» 10 см.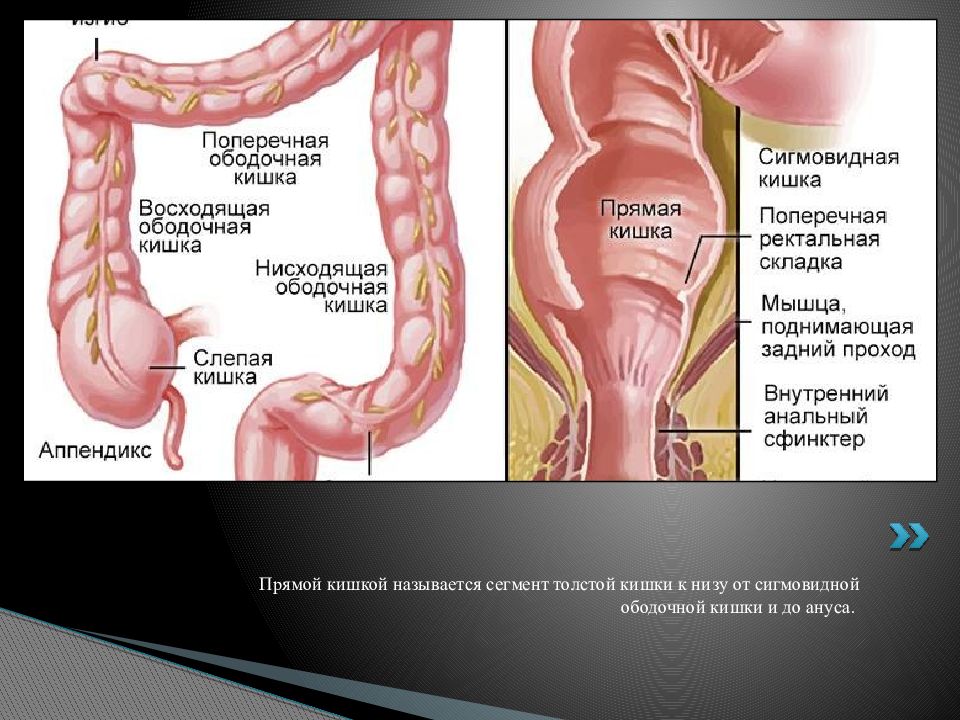 Сфинктерная функция была одинаковой в обеих группах. Оценивая функцию по ряду параметров, авторы определенно высказываются за создание толстокишечного резервуара 5 см. Они пишут: «J-резервуар 5 см дает адекватную резервуарную функцию без компрометирующей эвакуации». Через 3 года авторы вернулись к этому вопросу и убежденно пришли к заключению, что наблюдающиеся затруднения с эвакуацией кишечного содержимого после операций определенно связаны с размером резервуара — чем он больше, тем чаше наблюдаются затруднения.
Сфинктерная функция была одинаковой в обеих группах. Оценивая функцию по ряду параметров, авторы определенно высказываются за создание толстокишечного резервуара 5 см. Они пишут: «J-резервуар 5 см дает адекватную резервуарную функцию без компрометирующей эвакуации». Через 3 года авторы вернулись к этому вопросу и убежденно пришли к заключению, что наблюдающиеся затруднения с эвакуацией кишечного содержимого после операций определенно связаны с размером резервуара — чем он больше, тем чаше наблюдаются затруднения.
Необходимость формирования толстокишечного резервуара возникает при низких резекциях прямой кишки. Правда понятие «низкая резекция» определяется по-разному и значение здесь имеет каждый сантиметр. Обычно речь идет о раке среднеампулярного отдела прямой кишки с определением нижней границы резекции. Т.С.Одарюк с соавт. (2000 г.) пишут, что это в среднем 1,5 см от аноректальной линии. Необходимость в резервуаре авторы обуславливали развитием «Синдрома низкой передней резекции» после прямых наданальных анастомозов.
Jin-ichi Hida et all (1998 г.) приходят к заключению, что при резекции прямой кишки выше 4 см от зубчатой линии нужно выполнять прямой колоанальный анастомоз, а ниже 4 см — формировать J-резервуар.
Для оценки колоректальной функции у больных после резекций прямой кишки с формированием толстокишечного резервуара используется метод анкетирования (вопросник) и объективные исследования аноректальной функции в разные сроки после оперативного вмешательства.
Наряду с безусловно положительной оценкой резекции прямой кишки при раковом ее поражении с формированием толстокишечного резервуара, ряд авторов обращает внимание на недостатки такой операции. Справедливо замечают Г.И.Воробьев с соавт. (2000 г.), что «до настоящего времени сохраняется нестабильность и непредсказуемость функциональных результатов, особенно в отдаленные сроки после данного вмешательства (операции с резервуарами)». Так, у 15-20% больных не удается добиться нужной континенции.
В связи с выявленными негативными сторонами J-резервуаров в литературе стали обращать внимание на особенности формирования самого толстокишечного резервуара. Г.А.Покровский с соавт. (1998 г.) вместо J-образного создавали Э-образный резервуар, но число таких операций невелико — всего пять оперированных больных. G.A.Maurer et all (1999 г.) высказывают мнение, что короткий толстокишечный резервуар более физиологичен и приближается к «неоректум». В эксперименте на свинках они формировали несколько видов резервуаров и наиболее приемлемой оказалась простая конструкция с поперечной колопластикой которая создает подобие ампулы прямой кишки. Они анастомозировали ее с оставшейся частью анального канала. R.Ruppert &D.Staimmer (1999 г.), зная эти экспериментальные исследования на свинках и видя недостатки J-резервуаров, использовали колопласткиу у 31 больного. Функциональные результаты оказались заметно лучше.
Г.А.Покровский с соавт. (1998 г.) вместо J-образного создавали Э-образный резервуар, но число таких операций невелико — всего пять оперированных больных. G.A.Maurer et all (1999 г.) высказывают мнение, что короткий толстокишечный резервуар более физиологичен и приближается к «неоректум». В эксперименте на свинках они формировали несколько видов резервуаров и наиболее приемлемой оказалась простая конструкция с поперечной колопластикой которая создает подобие ампулы прямой кишки. Они анастомозировали ее с оставшейся частью анального канала. R.Ruppert &D.Staimmer (1999 г.), зная эти экспериментальные исследования на свинках и видя недостатки J-резервуаров, использовали колопласткиу у 31 больного. Функциональные результаты оказались заметно лучше.
Интересный вариант ССО предложили В.В.Яновой с соавт. при низких резекциях ПК, когда опухоль располагается не выше 3 см от зубчатой линии анального канала. Эти авторы с 1989 г. делают в низведенной кишке две продольные насечки с последующим сшиванием их поперек, что создает S-образный изгиб и увеличивает объем кишки. Функция финктерного аппарата признана хорошей и удовлетворительной у 60.5% больных: 5-летнее выживание — 69%. Опыт авторов — лечение 700 больных РПК.
Функция финктерного аппарата признана хорошей и удовлетворительной у 60.5% больных: 5-летнее выживание — 69%. Опыт авторов — лечение 700 больных РПК.
Поиск лучших вариантов формирования толстокишечных резервуаров и оценка колоанальной функции в таких случаях продолжается. Совершенствование колопластических операций в этом плане, вероятно, займет определяющее место.
Склонностью к лимфотропизму при раке прямой кишки
В связи с тем, что рак прямой кишки, согласно исследованиям, обладает склонностью к лимфотропизму, именно лимфаденэктомии в хирургическом лечении рака прямой кишки придается весьма важное значение. Лимфогенное метастазирование рака прямой кишки является одной из вероятных причин развития локорегионального рецидива после операции. Поэтому наряду с удалением первичной опухоли целью хирургического лечения является радикальное удаление зон регионарного метастазирования опухоли.
Еще W.Miles в 1908 г. были определены три основные пути лимфогенного метастазирования при раке прямой кишки — восходящий, нисходящий и латеральный, что послужило началом разработки принципов лимфодиссекции при неопластических образованиях ПК.
- Восходящее метастазирование охватывает параректальные, верхние ректальные и нижние брыжеечные лимфоузлы.
- Латеральное метастазирование затрагивает средние ректальные, запирательные, внутренние подвздошные и общие подвздошные узлы.
- Нисходящее метастазирование — паховые лимфоузлы.
Периневральная инвазия
При наличии инвазии опухоли в нервную ткань метастазы в лимфоузлах обнаруживается в 81%, а без такового — в 37%.
Первичный рак прямой кишки характеризуется тем, что опухоль остается длительное время локализованной и относительно медленно растет по сравнению с другими опухолями пищеварительного тракта. Локализованный и медленный рост характерен так же и для метастазов в лимфоузлы. Исходя из этой биологической особенности рака прямой кишки, было сделано предположение, что, увеличив объем лимфаденэктомии, можно достичь снижения количества рецидивов.
Впервые расширенная лимфаденэктомия была описана Kuru в 1942 г. Однако, результаты исследований не показали статистически значимой разницы в 5-летней выживаемости между группами больных, которым проводились стандартная и расширенная лимфаденэктомия. Вновь интерес к расширенной лимфаденэктомии появился в 80-е годы, когда Heald и соавт. предложили выполнение тотальной мезоректумэктомии, т.е. удаление совокупности тканей и органов, находящихся в пределах фасциальной оболочки прямой кишки, включающей в себя параректальную клетчатку, кровеносные и лимфатические сосуды. Используя данную методику, этим авторам удалось снизить частоту местных рецидивов до 5%, что, однако не удалось воспроизвести другим исследователям, но вновь возник интерес к расширенной лимфаденэктомии.
Вновь интерес к расширенной лимфаденэктомии появился в 80-е годы, когда Heald и соавт. предложили выполнение тотальной мезоректумэктомии, т.е. удаление совокупности тканей и органов, находящихся в пределах фасциальной оболочки прямой кишки, включающей в себя параректальную клетчатку, кровеносные и лимфатические сосуды. Используя данную методику, этим авторам удалось снизить частоту местных рецидивов до 5%, что, однако не удалось воспроизвести другим исследователям, но вновь возник интерес к расширенной лимфаденэктомии.
Takahashi T. и соавт. предложили различать несколько вариантов лимфаденэктомии: ограниченную, стандартную и расширенную. Однако такое деление не является общепризнанным.
- Ограниченной лимфаденэктомии соответствует тотальная мезоректумэктомия.
- Стандартная лимфаденэктомия — ограниченная + высокая перевязка нижней брыжеечной артерии у аорты и удаление лимфоузлов по ходу подвздошных сосудов.
- Расширенная лимфаденэктомия — стандартная + лимфодиссекция в запирательном пространстве.

По мнению японских хирургов, ограниченная лимфаденэктомия показана при ранних стадиях рака прямой кишки, стандартная — при распространенном раке верхних отделов ПК, расширенная — при распространенном раке нижних отделов ПК.
Данные о влиянии расширенной лимфаденэктомии на 5-летнюю выживаемость больных раком стадии В и С по Dukes весьма противоречивы. Необходимы дальнейшие многоцентровые исследования.
Недостатки лимфаденэктомии при раке прямой кишки
Основным недостатком лимфаденэктомии является нарушение мочевой и половой функций, которые встречаются в 30% и 80 — 100% наблюдений соответственно. Такие нарушения могут быть связаны с разными причинами, но, несомненно, они возникают при пересечении вегетативных нервов таза. Выясняя функциональные результаты ССО выполненных по поводу РПК, мы также обращали внимание на частоту мочеполовой дисфункции у этих больных. Это послужило поводом для проведения собственных исследований по выяснению особенностей строения и расположения вегетативных нервов таза.
Казалось бы очевидным, что для получения лучших функциональных результатов после низкой резекции ПК необходимо позаботиться о сохранении вегетативной иннервации органов таза, однако специальных исследований в этом плане очень мало. Вероятно, правы Yasutomi Masayuki et all. (1995 г.), которые пишут, что в предыдущие годы все внимание было сосредоточено на повышение радикальности операций. К этому нужно добавить, что не существует, а мы специально интересовались, специфических методов идентификации нервных структур (окраска, свечение и т.д.).
Проблему составляет сохранение иннервации при резекциях ПК и ряд хирургов призывают бережно относиться к нервным структурам таза. В этом отношении нужно отметить определенную настойчивость и последовательность исследований японских хирургов.
Сохранение вегетативных нервов малого таза при операциях у больных РПК реально при начальных формах ракового поражения при стадиях по Dukes А и В. Окончательно неясным и спорным является вопрос о возможности и целесообразности сохранения гипогастральных нервов при более распространенных формах опухолевого поражения ПК, не пренебрегая онкологическими интересами.
Оригинальные исследования T.Kono et all. (1998 г.), которые провели исследование на крысах по трансплантации тазовых нервов после их предварительного иссечения. Через 6 недель они уже регистрировали ритмичные сокращения мочевого пузыря у всех подопытных. Авторы делают смелый вывод, что трансплантация нервов таза успешно восстанавливает функцию мочевого пузыря и поэтому такую операцию можно рекомендовать в практику.
Yasutomi M. et all. при низких резекциях ПК у 185 больных ранними формами ракового поражения всегда стремились сохранить пучки вегетативных нервов. Дисфункция мочеиспускания после операции уменьшилась до 15% (раньше — 33%), половая потенция снизилась до 21% (раньше — 81%), 5-летняя выживаемость — 81%.
Sugihara Kenichi et all., сохраняя нервные пучки с обеих сторон при резекциях прямой кишки отметили способность к произвольному мочеиспусканию у 93,5%, а половую потенцию — у 70,4%. При ранних раках прямой кишки, замечают авторы, нервы должны сохраняться полностью, а при обнаружении метастазов опухоли в тазу — следует стремиться к сохранению нервов хотя бы с одной стороны.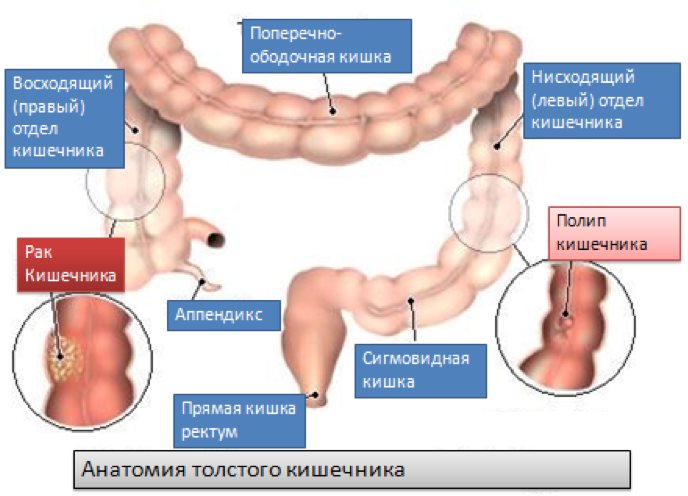 5-летняя выживаемость составила при стадиях по Dukes А — 96,4%, В — 84,0%, С — 67,3%. Ishikura S. et all. (1999 г.) оперировали 50 больных низким РПК, сохраняя нервные тазовые пучки. 3-летняя выживаемость составила в среднем — 88%. При I-II стадиях — 97%, при III стадии — 73%. Авторы подчеркивают, что сохранение нервных пучков не было причиной местного рецидива раковой опухоли. Matsumoto A. et all. (1995 г.) обращают внимание на то, что рассечение пучка гипогастрального нерва с одной стороны не нарушает функцию мочевого пузыря. Sugihara K. et all. (1996 г.) при операции 214 больных с низким РПК сберегали нервы таза. У 70,4% мужчин сохранилась половая функция. 5-летняя выживаемость после таких операций составила: при стадии А — 96,4%, В — 84%, С — 67,3%.
5-летняя выживаемость составила при стадиях по Dukes А — 96,4%, В — 84,0%, С — 67,3%. Ishikura S. et all. (1999 г.) оперировали 50 больных низким РПК, сохраняя нервные тазовые пучки. 3-летняя выживаемость составила в среднем — 88%. При I-II стадиях — 97%, при III стадии — 73%. Авторы подчеркивают, что сохранение нервных пучков не было причиной местного рецидива раковой опухоли. Matsumoto A. et all. (1995 г.) обращают внимание на то, что рассечение пучка гипогастрального нерва с одной стороны не нарушает функцию мочевого пузыря. Sugihara K. et all. (1996 г.) при операции 214 больных с низким РПК сберегали нервы таза. У 70,4% мужчин сохранилась половая функция. 5-летняя выживаемость после таких операций составила: при стадии А — 96,4%, В — 84%, С — 67,3%.
Интересна работа хирургов из Нидерланд. Хирурги этой страны обратили внимание на то обстоятельство, что после операций по поводу рака на прямой кишке, возникает значительное число мочеполовых нарушений, что, безусловно, сказывается на КЖ этих пациентов. В связи с этим они пригласили японских хирургов и с их помощью оперировали 47 больных с низким раком ПК, которым сохраняли нервы таза. Мочевых расстройств не развилось ни у кого из больных. 19 из 30 мужчин были сексуально активны. Половое бессилие связано по их наблюдениям с повреждением гипогастрального сплетения. Для сохранения эякуляции необходимо сохранение верхнего гипогастрального сплетения. Авторы заключают, что операции с сохранением нервов таза должны стать хирургическим стандартом при оперативном лечении начальных форм рака прямой кишки.
В связи с этим они пригласили японских хирургов и с их помощью оперировали 47 больных с низким раком ПК, которым сохраняли нервы таза. Мочевых расстройств не развилось ни у кого из больных. 19 из 30 мужчин были сексуально активны. Половое бессилие связано по их наблюдениям с повреждением гипогастрального сплетения. Для сохранения эякуляции необходимо сохранение верхнего гипогастрального сплетения. Авторы заключают, что операции с сохранением нервов таза должны стать хирургическим стандартом при оперативном лечении начальных форм рака прямой кишки.
О возможности сохранения нервов таза при резекциях прямой кишки сообщают и отечественные авторы: Г.И.Воробьев с соавт., П.В.Царьков с соавт. А.И.Темников и Ю.П.Дугин.
Мы провели собственное исследование с целью изучить некоторые особенности и варианты расположения верхнего подчревного сплетения, подчревных нервов и их ветвей, с целью возможного сохранения их при операциях по поводу низкого рака ПК.
Материалом для исследования послужили 12 бальзамированных и 5 нефиксированных трупов людей, умерших от причин не связанных с патологией органов малого таза. Методика исследования заключалась в проведении общей и специальной антропометрии, препарирования, зарисовки, протоколирования, фотографирования, видеозаписи.
Методика исследования заключалась в проведении общей и специальной антропометрии, препарирования, зарисовки, протоколирования, фотографирования, видеозаписи.
Верхнее подчревное сплетение формируется при слиянии вегетативных нервов расположенных впереди нижней части абдоминального отдела аорты и, как правило, по своей ширине соответствует поперечным размерам аорты в области ее бифуркации. В результате проведенных исследований было выявлено в основном два варианта строения верхнего подчревного сплетения — многоветвистая и маловетвистая формы. Многоветвистая форма представлена нервным сплетением в виде широкой «пластины», имеющей треугольную или трапецивидную форму с основанием обращенным вниз, образованной большим количеством нервных волокон, формирующих густую сеть ниже бифуркации аорты. При этом сплетение располагается кзади от позадипрямокишечной клетчатки и прямокишечных сосудов. Позади верхнего подчревного сплетения располагается пристеночный листок фасции таза и левая общая подвздошная вена. Нижний край сплетения определялся четко при выделении тупфером и располагался ниже мыса крестца (по средней сагиттальной линии) на 0,4 — 2,4 см. От нижнего края сплетения, являясь продолжением его, отходят правый и левый подчревные нервы. Они располагаются на заднебоковой поверхности таза и направляются вниз, вдоль и медиальнее мочеточников и внутренней подвздошной артерии. В местах перекреста мочеточника с маточной артерией или семенным протоком, эти нервы располагаются так, что артерия матки (семенной проток) находится спереди, а мочеточник сзади от нервов. В этой зоне нервы распадаются преимущественно на три группы нервных волокон, образуя нижнее подчревное билатеральное сплетение. Эти группы нервных волокон направляются соответственно: к мочевому пузырю, к матке (семенным пузырькам, простате), к прямой кишке. К стенке кишки волокна нервов подходят в составе боковой связки прямой кишки вместе со средней прямокишечной артерией и веной, располагаясь произвольно относительно друг друга.
Нижний край сплетения определялся четко при выделении тупфером и располагался ниже мыса крестца (по средней сагиттальной линии) на 0,4 — 2,4 см. От нижнего края сплетения, являясь продолжением его, отходят правый и левый подчревные нервы. Они располагаются на заднебоковой поверхности таза и направляются вниз, вдоль и медиальнее мочеточников и внутренней подвздошной артерии. В местах перекреста мочеточника с маточной артерией или семенным протоком, эти нервы располагаются так, что артерия матки (семенной проток) находится спереди, а мочеточник сзади от нервов. В этой зоне нервы распадаются преимущественно на три группы нервных волокон, образуя нижнее подчревное билатеральное сплетение. Эти группы нервных волокон направляются соответственно: к мочевому пузырю, к матке (семенным пузырькам, простате), к прямой кишке. К стенке кишки волокна нервов подходят в составе боковой связки прямой кишки вместе со средней прямокишечной артерией и веной, располагаясь произвольно относительно друг друга.
Маловетвистая форма строения нервов характеризовалась наличием отдельных, немногочисленных, относительно толстых волокон с единичными анастомозами между ними. Волокна сплетения так же располагаются кзади от позадипрямокишечной клетчатки, верхних прямокишечных сосудов и не связаны с этими образованиями.
С учетом особенностей топографо-анатомического расположения автономных нервов таза, мы применили нерв-сберегающую технику оперирования при выполнении операций на прямой кишке по поводу рака ее различной локализации.
Показанием к операции у всех больных была аденокарцинома. Большинство новообразований соответствовало стадии Dukes B с высокой и умеренной степенью дифференцировки опухоли и локализацией ее в средне и нижнеампулярном отделах. Преобладающим типом операции была низкая передняя аппаратная резекция и брюшно-промежностная экстирпация прямой кишки. Обязательными этапами операции у всех больных были: высокая перевязка нижнебрыжеечной артерии и вены непосредственно у аорты, иссечение мезоректальной клетчатки, определение формы верхнего подчревного сплетения, выделение, взятие на «держалку» и мобилизация правого и левого подчревных нервов.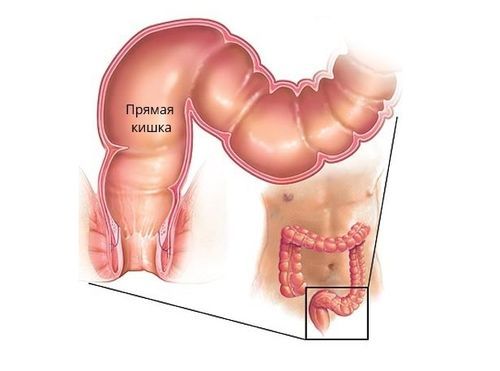
После предварительной перевязки нижних мезентериальных сосудов у аорты и пересечения сигмовидной кишки, мы считали необходимым выяснить особенности строения верхнего гипогастрального сплетения, а затем приступали к выделению правого и левого подчревных нервов, до этапа мобилизации прямой кишки. Ориентиром для определения верхнего гипогастрального сплетения является тазовый мыс, где нетрудно визуализировать его нижний край. Над поверхностью нерва тупфером сдвигали жировую ткань, брали его на “держалку” и преимущественно острым путем выделяли из параректальной клетчатки, передвигая “держалку” вниз к боковой связке прямой кишки. С помощью такого приема выделяли нерв с другой стороны. После этого подчревные нервы становились подвижными и смещаемыми в стороны на 5 — 6 см. Это обстоятельство является весьма важным, так как дает возможность производить иссечение мезоректальной клетчатки в необходимом объеме, без ущерба для онкологических принципов проведения операции. У большинства больных гипогастральные нервы никак не выделяются, а сливаются с окружающими тканями и представляются в виде тонкой и узкой “полоски”. Именно у таких пациентов подчревные нервы могут быть легко повреждены при мобилизации прямой кишки или иссечения мезоректальной клетчатки. Только у трех больных подчревные нервы были представлены хорошо контурирующимися, достаточно толстыми стволами и легко визуализировались.
Именно у таких пациентов подчревные нервы могут быть легко повреждены при мобилизации прямой кишки или иссечения мезоректальной клетчатки. Только у трех больных подчревные нервы были представлены хорошо контурирующимися, достаточно толстыми стволами и легко визуализировались.
При дальнейшей мобилизации прямой кишки, мы старались выделить и визуализировать боковые связки ее (которые пересекаем на зажимах), с тем чтобы в инструмент, вместе со средними прямокишечными сосудами, попали только те веточки нижнего билатерального сплетения, которые направляются к стенке прямой кишки. Ветви идущие к другим органам малого таза, сохраняли с удалением окружающей их клетчатки. В тех случаях, когда раковая опухоль распространялась на окружающие ткани и вовлекала гипогастральный нерв с одной стороны, мы принебрегали им, соблюдая онкологические принципы оперирования и старались сохранить целостность подчревного нерва с другой стороны. Так мы оперировали трех больных.
В тех же случаях, когда опухоль распространяется на окружающие ткани с вовлечением вегетативных нервов таза с обеих сторон, ее следует удалять единым блоком совместно с нервами.
Мочевую функцию оценивали путем расспроса пациентов о характере позывов, частоте мочеиспускания и объеме выделяемой мочи, после удаления мочевого катетера, который вводили на 2 — 4 суток. У 94% больных было свободное, произвольное мочеиспускание сразу после извлечения катетера Фоллея. Пациенты не отмечали разницы в характере позывов, частоте мочеиспускания и объеме мочи, по сравнению с дооперационным периодом. У всех сексуально-активных мужчин сохранилась половая функция.
- Мы представили современное состояние проблемы, связанной с функциональными результатами после операций на прямой кишке при раковом поражении ее.
- Мы не склонны давать категорические рекомендации относительно выбора одного единственного способа лечения, для уменьшения частоты функциональных расстройств после операций на прямой кишке.
- Знание литературы этой проблемы — залог для оперирующих хирургов правильно подойти к выбору нужной тактики в каждом конкретном случае. Однако несомненно, что соблюдение онкологических принципов оперирования нужно иметь в виду прежде всего.
 Далее — всегда следует стремиться к выполнению ССО, если даже для этого придется делать интерсфинктерные резекции ПК. Несомненно, оперирующим на ПК хирургам нужно освоить методику формирования толстокишечных резервуаров и колопластику.
Далее — всегда следует стремиться к выполнению ССО, если даже для этого придется делать интерсфинктерные резекции ПК. Несомненно, оперирующим на ПК хирургам нужно освоить методику формирования толстокишечных резервуаров и колопластику. - Бережное отношение к нервам таза — еще одна забота при операциях на прямой кишке. Это реально, о чем свидетельствуют, как литературные данные, так и наши целенаправленные исследования и результаты проводившихся оперативных вмешательств.
Методы лечения рака прямой кишки
Доктор Вадим Бережной
Основатель платформы MediGlobus. Медицинский эксперт, Заведующий отделением врачей-координаторов.
Медицинский эксперт, Заведующий отделением врачей-координаторов.
Каждый год рак прямой кишки диагностируют у 746,000 пациентов. Лучше всего этот вид рака лечится на 0 и 1 стадиях. Но и на более поздних этапах есть шанс избавиться от болезни или улучшить качество жизни. В этой статье мы расскажем, какие методы лечения рака прямой кишки используют в ведущих клиниках мира.
Методы лечения рака прямой кишки
Выбор метода терапии зависит от стадии болезни. План лечения рака прямой кишки у женщин и мужчин одинаковый. Различия могут быть только на последних стадиях и связаны они с местом локализации метастазов. Рассмотрим схемы лечения при разных степенях равития рака прямой кишки:
0 стадия. На этом этапе рак толстой кишки удаляют в ходе операции. Чаще всего это эндоскопическая операция и проводят ее во время колоноскопии. Если раковая опухоль большая, назначают частичную колэктомию — удаление пораженной части кишки.
Чаще всего это эндоскопическая операция и проводят ее во время колоноскопии. Если раковая опухоль большая, назначают частичную колэктомию — удаление пораженной части кишки.
1 стадия. На этой стадии рак прорастает в глубокие слои кишки, но не распространяется на лимфоузлы. Основной метод лечения — частичная колэктомия или колоноскопия с удалением опухоли. Второй метод применяют для опухолей в виде полипа.
2 стадия. Рак прорастает в соседние с кишкой ткани, но еще не затрагивает лимфоузлы. Врачи рекомендуют частичную колэктомию с удалением лимфоузлов. Если есть вероятность рецидива, назначают химиотерапию.
3 стадия. На этом этапе рак прорастает в глубокие ткани органа и лимфоузлы. Основной метод лечения — операция и химиотерапия. Врачи делают частичную колэктомию с удалением лимфоузлов, а затем проводят химию. Если пациент не операбельный, доктора рекомендуют лучевую терапию.
4 стадия. Рак характеризуется метастазами в отдаленные органы и ткани. Цель лечения — улучшить качество жизни и снять болезненные симптомы. В зависимости от места локализации метастазов, применяют операцию или лучевую терапию. Дополнительно врачи назначают таргетную терапию, иммунотерапию и химию.
Рак характеризуется метастазами в отдаленные органы и ткани. Цель лечения — улучшить качество жизни и снять болезненные симптомы. В зависимости от места локализации метастазов, применяют операцию или лучевую терапию. Дополнительно врачи назначают таргетную терапию, иммунотерапию и химию.
Хирургическое лечение рака прямой кишки
Операция — это основной метод лечения рака прямой кишки. Он помогает убрать опухоль из организма. Благодаря этому дальнейшее лечение проходит проще и эффективнее. На ранних стадиях онкологии делают эндоскопическую операцию. Это иссечение ракового полипа или небольшой опухоли прямо во время колоноскопии. После такого вмешательства пациент восстанавливается за 1-2 дня. Операцию проводят в амбулаторном режиме.
На более поздних стадиях применяют колэктомию — полное или частичное удаление кишки. После оперативного лечения рака прямой кишки, части органа сшиваются. В некоторых случаях пациенту устанавливают колостому, то есть часть кишки выводят через брюшную полость наружу. Как правило — это временная мера на период восстановления.
Как правило — это временная мера на период восстановления.
Хирургическое лечение рака прямой кишки проводят открытым или лапароскопическим способами. В первом случае хирург делает разрез в брюшной полости и удаляет опухоль. Во втором — операцию проводят через несколько небольших проколов в брюшине. Благодаря этому уход за послеоперационной раной проще, а пациент восстанавливается быстрее.
Лечение рака прямой кишки лучевой терапией
Радиотерапия — это лечение рака прямой кишки без операции, с помощью радиоактивного облучения. Этот метод не является основным. Облучение назначают для неоперабельных опухолей или для уменьшения новообразования перед операцией. На 4 стадии рака прямой кишки радиотерапию применяют для борьбы с метастазами и облегчения симптомов болезни.
При лечения рака прямой кишки применяют внешнюю лучевую терапию и интраоперационное облучение. Внешнее облучение проходит на аппаратах КиберНож и Гамма-нож.
В современных клиниках применяют технологию IMRT — радиотерапию с модулированной интенсивностью. Она помогает точно подобрать дозу облучения и настроить луч так, чтобы не повредить здоровые ткани.
Интраоперационное облучения проводят прямо во время операции по удалению опухоли. Оно помогает убить раковые клетки в соседних тканях и снизить риск рецидива.
Получить бесплатную консультацию
Абляция и эмболизация при раке прямой кишки
Абляция и эмболизация — одни из методов безоперационного лечения рака прямой кишки. Они применяются для небольших (до 4 см) опухолей на 0-1 стадиях болезни. Абляция — это удаление опухоли с помощью ультразвука или радиоволн. Они нагревают и разрушают злокачественные клетки, опухоль погибает.
Процесс эмболизации заключается в разрушении или закупоривании сосудов, которые снабжают опухоль кровью. Метод применяют для лечения метастазов в легких, мочевом пузыре, печени. В последнем случае в печеночную артерию вводят препарат, который блокирует сосуд, опухоль не может расти и погибает. Кровь для клеток печени поставляется через портальную вену, поэтому блокировка артерии не влияет на нормальную работу органа.
В последнем случае в печеночную артерию вводят препарат, который блокирует сосуд, опухоль не может расти и погибает. Кровь для клеток печени поставляется через портальную вену, поэтому блокировка артерии не влияет на нормальную работу органа.
Химио, таргетная и иммунотерапия при раке прямой кишки
Химиотерапия — вспомогательный метод лечения опухолей прямой кишки. Доктора применяют адъювантную химию для борьбы с раковыми клетками после операции и неоадъювантную для уменьшения опухоли перед операцией. Большинство препаратов химии вводят системно, они действуют на раковые клетки во всем организме. Для лечения локальных метастазов, например в печени, применяют региональную химию — лекарства вводят в печеночную артерию. Для лечения рака прямой кишки применяют 5-фторурацил, оксоплатин, трифлуридин и другие препараты. Длительность химиотерапии и количество курсов назначают индивидуально, исходя из стадии болезни и состояния пациента.
Таргетные и иммунотерапевтические препараты используются для лечения рака кишечника на последних стадиях, а также в терапии рецидивов. Цель таргетной терапии — направленное воздействие на раковые клетки. Есть два подхода. В первом случае лекарства блокируют рост новых кровеносных сосудов опухоли, из-за недостатка питательных веществ новообразование погибает. Во втором случае происходит остановка роста самих раковых клеток. В таргетной терапии используют препараты Авастин, Цетуксимаб.
Цель таргетной терапии — направленное воздействие на раковые клетки. Есть два подхода. В первом случае лекарства блокируют рост новых кровеносных сосудов опухоли, из-за недостатка питательных веществ новообразование погибает. Во втором случае происходит остановка роста самих раковых клеток. В таргетной терапии используют препараты Авастин, Цетуксимаб.
Иммунотерапия рака толстого кишечника направлена на активацию иммунной системы организма. Иммунные препараты помогают защитным клеткам находить рак и уничтожать его. В таком лечении используют препараты Кейтруда и Опдиво.
Прогноз при раке прямой кишки
Прогноз при раке прямой кишки характеризуется показателем “5-летняя выживаемость”. Он обозначает вероятность того, что человек проживет 5 и больше лет после установки диагноза или лечения.
Где пройти лечение рака прямой кишки
При поиске вариантов терапии рака прямой кишки важно подобрать клинику, которая работает согласно международным онкологическим протоколам. Это гарантирует качество лечения и правильный подбор процедур. Большинство пациентов Mediglobus выбирает лечение рака прямой кишки в Турции, Германии, Израиле, Австрии и Испании.
Это гарантирует качество лечения и правильный подбор процедур. Большинство пациентов Mediglobus выбирает лечение рака прямой кишки в Турции, Германии, Израиле, Австрии и Испании.
Подробнее про клиники для лечения рака кишечника и стоимость процедур читайте в нашей статье
Рак прямой кишки — один из самых распространенных видов онкологии у мужчин и женщин. При выявлении болезни важно немедленно приступить к лечению, это увеличит шансы полностью выздороветь. Чтобы получить консультацию в подборе клиники и доктора для лечения рака толстой кишки обратитесь к специалистам Mediglobus.
Получить бесплатную консультацию
Доктор Вадим Бережной
Основатель платформы MediGlobus.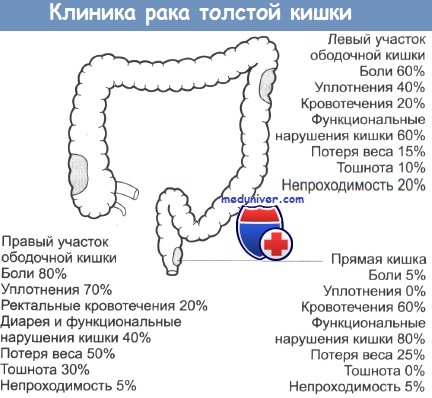 Медицинский эксперт, Заведующий отделением врачей-координаторов.
Медицинский эксперт, Заведующий отделением врачей-координаторов.
Editor
Более 2 лет пишет медицинские тексты. Опыт работы в сфере копирайтинга превышает 6 лет. Имеет образование по направлению “Социально-правовая защита”. Освоила программу медицинских курсов. Изучает коммуникативные техники ведения переговоров с пациентами. В свободное время посещает тренинги и семинары по медицинской психологии.
Похожие посты
Как работает вирусная терапия — прорыв в лечении рака кожи
Читать дальше
Какая выживаемость пациенток с раком шейки матки на разных стадиях?
Читать дальше
FDA одобрили Козела (Трилациклиб) при мелкоклеточном раке легких
Читать дальше
Рак прямой кишки | Тамбовская областная клиническая больница имени В.
 Д. Бабенко
Д. Бабенко
Вопросы диагностики и лечения рака прямой кишки в последние годы приобретают все большую актуальность.
Рак прямой кишки – злокачественная опухоль дистального отдела толстого кишечника, исходящая из эпителия прямой кишки. Среди злокачественных поражений ЖКТ рак прямой кишки составляет 45%; вместе с тем, 70% случаев рака толстого кишечника локализуется именно в его дистальном отделе. Рак прямой кишки в полтора раза чаще возникает у мужчин, риск его развития повышается с возрастом, в группу риска входят лица старше сорока лет. Предположительно это связано с возрастными изменениями в эпителиальных клетках внутрикишечной выстилки. Несмотря на доступность прямой кишки для осмотра и исследования, большинство случаев рака данной локализации диагностируется уже на поздних сроках, когда радикальные методы лечения оказываются малоэффективными. Пятилетняя выживаемость при раке прямой кишки составляет 40-60%, что обусловливает актуальность данной проблемы для проктологии и онкологии.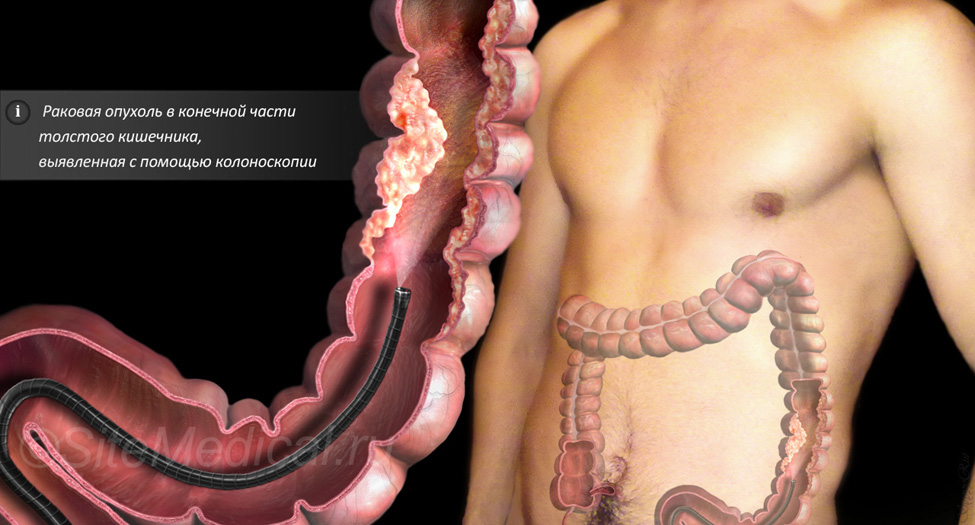
Частота рака прямой кишки в общей структуре злокачественных опухолей составляет до 10%.Статистические данные о заболеваемости раком прямой кишки в различных странах мира на 100 000 населения неодинаковы: в США — 33,2%, Швеции — 17,8%, Великобритании — 25,8%, Японии — 15,7%, Сенегале — 2,5%.Самая высокая заболеваемость раком прямой кишки отмечается в США, где в структуре заболеваемости он занимает второе место после рака легкого у мужчин. За исключением Японии рак прямой кишки наиболее часто встречается в экономически развитых странах, что подтверждает взаимосвязь между степенью экономического развития страны и частотой возникновения рака прямой кишки. Наиболее низкие показатели заболеваемости раком прямой кишки наблюдаются — в центральной Африке. В экономически развитых странах мира рак прямой кишки занимает одно из ведущих мест по темпам прироста, значительно опережая большинство других солидных злокачественных новообразований. Рак прямой кишки встречается в любом возрасте, однако лица старше сорока лет больных составляет 65 — 70% от общего количества больных. В 15% случаев возраст больных раком прямой кишки превышает 80 лет. Заболеваемость раком прямой кишки городского населения выше чем у сельского, при этом чаще заболевают мужчины чем женщины. Считается, что большему риску заболевания раком прямой кишки подвержено население старше 40 лет. Многие ученые считают, что учитывая большой контингент населения подлежащий обследованию, целесообразно максимально ограничить круг лиц подлежащих регулярным профилактическим медицинским осмотрам формируя группы риска. Прослеживается взаимосвязь между заболеваемостью раком прямой кишки и экономическим развитием, в частности — особенностями питания в экономически развитых странах. Предполагается, что наиболее существенным моментом в возникновении рака толстой кишки является образование эндоканцерогенных веществ из жиров и белков пищи. Обнаружено, что избыточное введение животного жира влияет на уровень желчных кислот в организме, которые являются потенциальными канцерогенами и коканцерогенами, то есть изменяют активность определенной микрофлоры кишечника, которая начинает продуцировать канцерогенные вещества.
В 15% случаев возраст больных раком прямой кишки превышает 80 лет. Заболеваемость раком прямой кишки городского населения выше чем у сельского, при этом чаще заболевают мужчины чем женщины. Считается, что большему риску заболевания раком прямой кишки подвержено население старше 40 лет. Многие ученые считают, что учитывая большой контингент населения подлежащий обследованию, целесообразно максимально ограничить круг лиц подлежащих регулярным профилактическим медицинским осмотрам формируя группы риска. Прослеживается взаимосвязь между заболеваемостью раком прямой кишки и экономическим развитием, в частности — особенностями питания в экономически развитых странах. Предполагается, что наиболее существенным моментом в возникновении рака толстой кишки является образование эндоканцерогенных веществ из жиров и белков пищи. Обнаружено, что избыточное введение животного жира влияет на уровень желчных кислот в организме, которые являются потенциальными канцерогенами и коканцерогенами, то есть изменяют активность определенной микрофлоры кишечника, которая начинает продуцировать канцерогенные вещества. Питание содержащее грубоволокнистую клетчатку, антиоксидантные комплексы витаминов по мнению некоторых авторов выполняет защитную функцию по отношению к возникновению рака прямой кишки и может быть использована для его профилактики. Отмечена зависимость между распространенностью аденоматозных полипов, ворсинчатых опухолей, дивертикулеза толстой кишки, неспецифического язвенного колита и частотой возникновения рака прямой кишки. Не установлена зависимость между распространенностью хронических воспалительных процессов прямой кишки, геморроя, дивертикулитов, инфекционных заболеваний толстой кишки и частотой возникновения рака прямой кишки.
Питание содержащее грубоволокнистую клетчатку, антиоксидантные комплексы витаминов по мнению некоторых авторов выполняет защитную функцию по отношению к возникновению рака прямой кишки и может быть использована для его профилактики. Отмечена зависимость между распространенностью аденоматозных полипов, ворсинчатых опухолей, дивертикулеза толстой кишки, неспецифического язвенного колита и частотой возникновения рака прямой кишки. Не установлена зависимость между распространенностью хронических воспалительных процессов прямой кишки, геморроя, дивертикулитов, инфекционных заболеваний толстой кишки и частотой возникновения рака прямой кишки.
Ведущим методом в лечении рака прямой кишки до настоящего времени остается хирургический. Основной причиной отсутствия заметного улучшения отдаленных результатов лечения рака прямой кишки является большое количество рецидивов и метастазов возникающих в различные сроки у радикально прооперированных больных. По видимому, такой высокий процент рецидивов и метастазов является следствием того, что более половины больных к моменту операции имеют III-IV стадии заболевания, а у 25 — 30% больных выявляют отдаленные метастазы. Как показал клинический опыт, а так же результаты экспериментальных цитологических и патологоанатомических исследований, причинами рецидивов и метастазов рака прямой кишки являются диссеминация и имплантация опухолевых клеток в операционной ране, лимфой гематогенное метастазирование. Таким образом, на современном этапе развития онкологии рак прямой кишки является актуальной медицинской и социально-экономической проблемой из-за роста заболеваемости и смертности, поздней диагностики, недостаточной разработки скрининговых программ профилактики и их высокой стоимости, неудовлетворительных результатов лечения. Повышение отдаленных результатов лечения рака прямой кишки может быть достигнуто за счет улучшения диагностики этого заболевания с одной стороны, и разработки комбинированных и комплексных методов лечения рака прямой кишки — с другой стороны. Именно последние десятилетия характеризуются поисками оптимальных схем комбинированного и комплексного лечения рака прямой кишки за счет сочетания хирургического метода с лучевой или химиотерапией.
Как показал клинический опыт, а так же результаты экспериментальных цитологических и патологоанатомических исследований, причинами рецидивов и метастазов рака прямой кишки являются диссеминация и имплантация опухолевых клеток в операционной ране, лимфой гематогенное метастазирование. Таким образом, на современном этапе развития онкологии рак прямой кишки является актуальной медицинской и социально-экономической проблемой из-за роста заболеваемости и смертности, поздней диагностики, недостаточной разработки скрининговых программ профилактики и их высокой стоимости, неудовлетворительных результатов лечения. Повышение отдаленных результатов лечения рака прямой кишки может быть достигнуто за счет улучшения диагностики этого заболевания с одной стороны, и разработки комбинированных и комплексных методов лечения рака прямой кишки — с другой стороны. Именно последние десятилетия характеризуются поисками оптимальных схем комбинированного и комплексного лечения рака прямой кишки за счет сочетания хирургического метода с лучевой или химиотерапией. Целью воздействия пред- или послеоперационного комплекса повреждающих факторов является девитализация наиболее активных, низкодифференцированных клеток опухоли, снижение их имплантационной и репродуктивной способности перед их возможным распространением в операционном поле во время операции, ликвидация микрокомплексов опухолевых клеток находящихся в путях гемо- и лимфооттока, параректальной клетчатке.
Целью воздействия пред- или послеоперационного комплекса повреждающих факторов является девитализация наиболее активных, низкодифференцированных клеток опухоли, снижение их имплантационной и репродуктивной способности перед их возможным распространением в операционном поле во время операции, ликвидация микрокомплексов опухолевых клеток находящихся в путях гемо- и лимфооттока, параректальной клетчатке.
Какие же симптомы рака прямой кишки могут насторожить человека? Чаще всего ранние стадии рака прямой кишки протекают без клинической симптоматики, что значительно затрудняет диагностирование и своевременное выявление злокачественного процесса. Со временем прогрессирование опухоли начинает проявляться разнообразными симптомами.
Самые распространенные проявления: нарушение дефекации (запоры или поносы), кишечная непроходимость, кровотечение из заднего прохода, примесь крови в кале, анемия неясной этиологии, похудание, боль в низу живота, «ленточный» («карандашный») стул.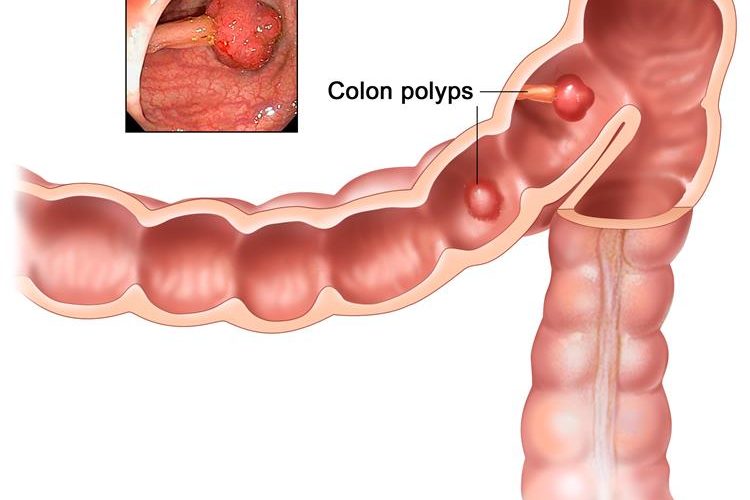
Клинически рак прямой кишки проявляется наличием патологических примесей в кале (слизи, крови), кровотечением из прямой кишки, болью в крестце и промежности, слабостью, похуданием, анемией.
Методами диагностики рака прямой кишки является исследование кала на скрытую кровь, определение лабораторных маркеров, ректороманоскопия, биопсия с морфологическим исследованием. Лечение хирургическое (резекция/экстирпация прямой кишки), с возможным назначением химиотерапии при метастазах рака в регионарные лимфатические узлы.
В нашей больнице проводится диагностика рака прямой кишки.
Лабораторные методы включают общий и биохимический анализ крови, тестирование на онкомаркеры, копрограмму.
Для раковых опухолей прямой кишки характерно выявления ракового эмбрионального антигена и онкомаркера. Выявление онкомаркеров может также свидетельствовать о неспецифическом язвенном колите, доброкачественных опухолях. Концентрация эмбрионального ракового антигена повышается у заядлых курильщиков.
К инструментальным методам диагностики опухолей толстого кишечника относится ректороманоскопия (обследуется внутренняя стенка прямой и сигмовидной кишки), колоноскопия (эндоскопическое исследование всего толстого кишечника), ирригоскопия (рентгенографическое исследование толстого кишечника с контрастным веществом).
Эндоскопические методики позволяют подробно изучить состояние слизистой оболочки кишечной стенки, имеющиеся опухолевые образования, произвести биопсию для последующего гистологического и цитологического исследования. Диагностика рака прямой кишки производится только на сновании обнаружения раковых клеток при цитологическом исследовании биоптата.
Кроме того, обнаружить опухолевое образование в кишечнике возможно с помощью ультразвукового исследования (для обследования прямой кишки производят интраректальное УЗИ), магнитно-резонансной и компьютерной томографии.
Спиральная компьютерная томография (МСКТ) применяется для исследования органов и систем на предмет выявления метастазов, а так же позволяет осуществить прицельную биопсию печени при наличие в ней сомнительных в отношении метастазирования участков.
Методикой с высокой степень специфичности в отношении выявления метастазов является позитронно-эмиссионная томография (ПЭТ). Методика заключается в ведении в организм позитрон-излучающих изотопов и сканирование их распределения в тканях. Пораженные злокачественными клетками ткани склонны накапливать радиоизотопы и определяться при сканировании в виде участков с повышенным излучением.
Профилактика рака прямой кишки
Профилактические меры злокачественных новообразований толстого кишечника включают регулярное обследование лиц, входящих в группу риска (люди старше 50 лет, больные с хроническими заболеваниями толстого кишечника). Особое внимание уделяется пациентам с полипами толстого кишечника.
В скрининговые мероприятия входят: ежегодный анализ кала на скрытую кровь для больных хроническими заболеваниями толстой кишки, а также ректоманоскопия, сигмоскопия — по показаниям.
Лица, страдающие семейным полипозом, подлежат обследованию каждые 2-3 года. План обследования граждан, входящих в группу онкологического риска, обсуждается с врачом индивидуально.
План обследования граждан, входящих в группу онкологического риска, обсуждается с врачом индивидуально.
Общие меры профилактики рака прямой кишки включают активный образ жизни, правильное сбалансированное питание, богатое растительной клетчаткой без перегруженности животными жирами, отказ от курения и злоупотребления алкогольными напитками, своевременное выявление и лечение заболеваний, провоцирующих развитие злокачественных опухолей.
Вторичная профилактика рака прямой кишки заключается в предотвращении болезни путем раннего обнаружения патологии, в результате чего увеличиваются шансы на успешное излечение. Диспансерное наблюдение с регулярными осмотрами рекомендовано лицам, которые находятся в группе риска. К ним относятся пациенты с полипами и полипозом, проктитами, язвами, трещинами, свищами и др. Конечно, при появлении первых симптомов следует незамедлительно отправляться к врачу. Однако на начальной стадии заболевание протекает бессимптомно, а появление первых признаков свидетельствует о том, что болезнь перешла на более поздний этап. Но во время регулярного профилактического осмотра можно обнаружить опухоль, когда о ее появлении пациент даже не догадывается.
Но во время регулярного профилактического осмотра можно обнаружить опухоль, когда о ее появлении пациент даже не догадывается.
- При пальцевом ректальном исследовании диагностируется около 40% случаев болезни.
- После проведения ректоманоскопии подтверждается до 95% всех диагнозов.
Для более детальной информации назначается дальнейшее обследование. Следует помнить, что при вовремя начатом лечении прогноз весьма благоприятный.
Благодаря раннему выявлению болезни лечение удается начать на ранней стадии болезни. В таком случае существует возможность проведения сфинктеросохраняющей операции, при которой в дальнейшем акт дефекации по-прежнему будет физиологичным.
В «ТОКБ им. В.Д. Бабенко» Вы можете пройти широкий спектр диагностических исследований и получить консультации, лечение и помощь высококвалифицированных специалистов.
Врач-колопроктолог высшей категории Виктор Семёнович Шурухин
7 симптомов рака толстой кишки у мужчин
Пищеварительная система сложна, что затрудняет выявление симптомов рака толстой кишки. Поэтому очень важно регулярно проходить обследования на рак толстой кишки.
Поэтому очень важно регулярно проходить обследования на рак толстой кишки.
Рак толстой кишки, также называемый колоректальным раком, является третьей по значимости причиной смерти от рака как у мужчин, так и у женщин в Соединенных Штатах. Для мужчин общий риск развития рака толстой кишки составляет примерно один из 22, что составляет 4,49 процента.
Многие симптомы могут указывать на рак толстой кишки, но если у кого-то есть эти симптомы, это не обязательно означает, что у него это заболевание.Есть много других объяснений симптомов, таких как инфекции или воспалительное заболевание кишечника (ВЗК).
Тем не менее, любой человек, у которого появляются новые симптомы, может пожелать посетить врача для постановки диагноза.
Симптомы рака толстой кишки одинаковы у мужчин и женщин и включают в себя следующее:
Поделиться на PinterestЧеловек, подозревающий, что у него может быть рак толстой кишки, должен поговорить с врачом.
Расстройство желудка или незначительная инфекция часто могут вызывать изменения в кишечнике, такие как запор, диарея или очень узкий жидкий стул. Однако эти проблемы обычно решаются в течение нескольких дней, когда болезнь проходит.
Однако эти проблемы обычно решаются в течение нескольких дней, когда болезнь проходит.
Изменения в кишечнике, которые длятся более нескольких дней, могут быть признаком серьезной проблемы со здоровьем.
Если у человека эти симптомы появляются регулярно или дольше, чем несколько дней, ему следует обратиться к врачу.
Периодические судороги или вздутие живота — распространенные проблемы с пищеварением, которые могут возникать из-за расстройства желудка, газов или употребления определенных продуктов.
Частые, необъяснимые спазмы и вздутие живота могут быть признаком рака толстой кишки, хотя чаще эти симптомы являются результатом других проблем со здоровьем.
Если новообразование превращается в закупорку толстой кишки, это может вызвать у человека ощущение, будто он никогда не сможет опорожнить свой кишечник.
Даже если их кишечник пуст, они все равно будут чувствовать потребность снова сходить в туалет.
Кровь в стуле может пугать. Стул может иметь полосы свежей красной крови или весь стул может иметь более темный дегтеобразный вид.
Есть много других возможных причин кровавого стула, например, геморрой. Тем не менее, любой человек, у которого есть кровь в стуле, должен все же обратиться к врачу для постановки диагноза.
Внезапная и неожиданная потеря веса — признак нескольких видов рака. Непреднамеренная потеря 10 фунтов и более в течение 6 месяцев может быть признаком обращения к врачу.
У больных раком потеря веса может быть связана с тем, что раковые клетки потребляют больше энергии тела. Иммунная система также усиленно борется с раковыми клетками.
Если опухоль большая, это может привести к закупорке толстой кишки, что может вызвать изменения кишечника и дальнейшую потерю веса.
Люди с раком толстой кишки могут чувствовать постоянную усталость или слабость, возможно, из-за того, что раковые клетки используют дополнительную энергию, а также из-за стрессовых симптомов кишечника.Хотя время от времени чувство усталости является нормальным явлением, хроническая усталость не проходит с отдыхом.
Хроническая усталость обычно является признаком основного заболевания. Любой, кто испытывает усталость, должен обратиться к врачу, чтобы определить причину.
Когда рак начинает истощать организм и наступает усталость, люди часто испытывают связанные с ним симптомы, такие как одышка.
Им может быть трудно перевести дыхание или они могут очень быстро запыхаться от чего-то столь простого, как прогулка на небольшое расстояние или смех.
Поделиться на PinterestАфроамериканцы имеют более высокий риск развития рака толстой кишки, чем люди из других этнических групп.
Некоторые факторы могут увеличить риск развития рака толстой кишки, в том числе:
- личный анамнез проблем с пищеварением, таких как колоректальные полипы или IBD
- семейный анамнез полипов или колоректального рака
- некоторые унаследованные генные мутации, такие как наследственный неполипозный колоректальный рак (HNPCC)
- старение
- диабет 2 типа
- некоторые этнические группы, в том числе афроамериканцы или евреи ашкенази
Невозможно предотвратить рак во всех случаях, но необходимо изменить образ жизни, чтобы устранить Некоторые факторы риска могут помочь человеку снизить вероятность развития рака толстой кишки.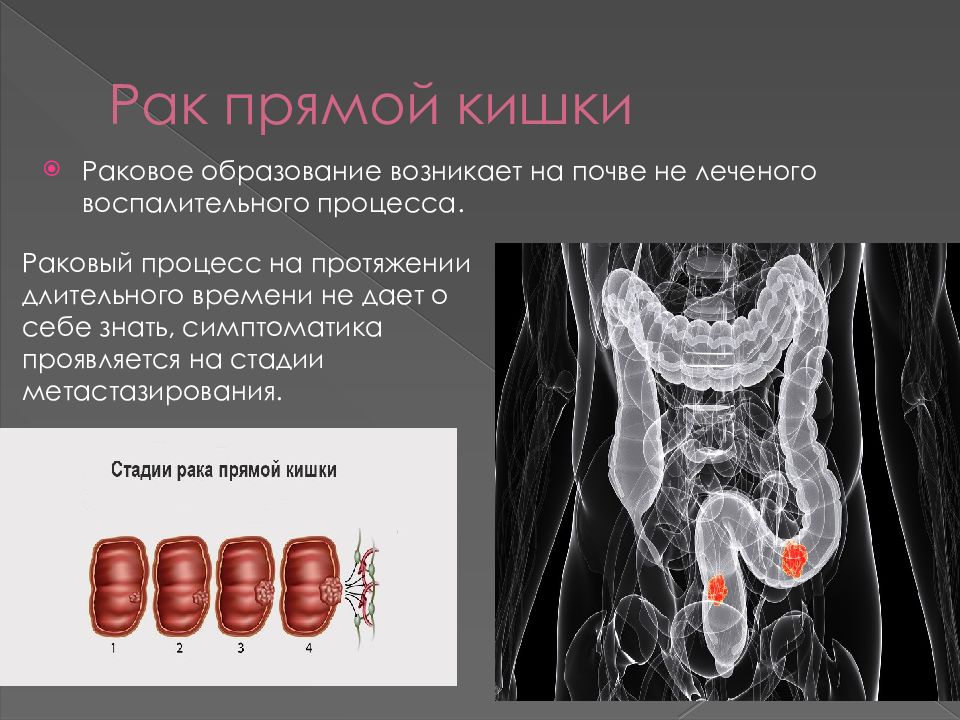
Диета
Как отмечает Американское онкологическое общество (ACS), диета с высоким содержанием красного мяса или мясных продуктов увеличивает риск колоректального рака.
Эти продукты включают:
- говядину
- свинину
- баранину
- оленину
- печень
- хот-доги
- нарезки
- обеденное мясо
Приготовление мяса при очень высоких температурах, например, на гриле или в жаровне или фритюрнице выделяет канцерогенные химические вещества.Эти химические вещества могут также увеличить риск заболевания раком толстой кишки, хотя связь между методами приготовления мяса и раком все еще неясна.
Вес
Избыточный вес или ожирение увеличивает риск развития или смерти от рака толстой кишки.
Согласно ACS, связь между ожирением и колоректальным раком также сильнее проявляется у мужчин. Похудение может помочь снизить риск.
Отсутствие активности
Отсутствие физической активности увеличивает риск развития рака толстой кишки. Оставайтесь активными, выполняя даже легкие тренировки каждый день, чтобы снизить этот риск.
Оставайтесь активными, выполняя даже легкие тренировки каждый день, чтобы снизить этот риск.
Употребление алкоголя
Люди, которые много или регулярно пьют, также могут подвергать себя большему риску рака толстой кишки. Мужчинам следует ограничить употребление алкоголя не более чем двумя порциями в день.
Курение
У курильщиков больше шансов заболеть или умереть от рака толстой кишки, чем у тех, кто этого не делает. Курение сигарет также увеличивает риск многих других видов рака.
Рак толстой кишки хорошо поддается лечению и часто излечим, если диагноз ставится на ранней стадии, когда рак находится только в кишечнике и не распространился на другие части тела.
Хирургия — это наиболее распространенный метод лечения рака толстой кишки первой линии, излечивающий от которого около 50 процентов.
Хирург удалит злокачественную опухоль и все близлежащие лимфатические узлы, а также часть здоровой ткани, окружающую опухоль. Затем они повторно соединят здоровые части кишечника.
Многие ранние формы рака толстой кишки не требуют дальнейшего лечения.
Если рак находится на поздней стадии, хирургам может потребоваться удалить большую часть толстой кишки, а если болезнь достигает прямой кишки, хирург может удалить эту часть толстой кишки.
Иногда врачи рекомендуют химиотерапию людям с повышенным риском рецидива опухолей.
В большинстве случаев симптомы со стороны пищеварения не указывают на рак. Однако, если симптомы необычны, появляются более регулярно или неуклонно ухудшаются, лучше обратиться к врачу, поскольку другого способа диагностировать эти проблемы нет.
Даже если основной причиной не является рак толстой кишки, врач может выявить и диагностировать отдельное заболевание, для которого он может порекомендовать лечение.
Многие люди с раком толстой кишки не проявляют никаких ранних симптомов, поэтому появление симптомов может быть признаком того, что рак растет или распространяется. ACS рекомендует мужчинам и женщинам со средним риском рака толстой или толстой кишки начинать обследование в возрасте 45 лет. Врачи могут диагностировать и лечить рак толстой кишки на ранних стадиях, если человек регулярно посещает обследования.
Врачи могут диагностировать и лечить рак толстой кишки на ранних стадиях, если человек регулярно посещает обследования.
Любой, кто замечает новые необъяснимые симптомы со стороны пищеварения или не уверен в их симптомах, должен обратиться к врачу.
Раннее обследование и диагностика имеют решающее значение для людей с раком толстой кишки. Когда врачи диагностируют рак толстой кишки до того, как он распространится, 5-летняя относительная выживаемость составляет 92 процента. Однако показатели выживаемости ниже среди людей, которым диагноз поставлен только на более поздней стадии.
7 симптомов рака толстой кишки у мужчин
Пищеварительная система сложна, что затрудняет выявление симптомов рака толстой кишки. Поэтому очень важно регулярно проходить обследования на рак толстой кишки.
Рак толстой кишки, также называемый колоректальным раком, является третьей по значимости причиной смерти от рака как у мужчин, так и у женщин в Соединенных Штатах. Для мужчин общий риск развития рака толстой кишки составляет примерно один из 22, что составляет 4,49 процента.
Многие симптомы могут указывать на рак толстой кишки, но если у кого-то есть эти симптомы, это не обязательно означает, что у него это заболевание. Есть много других объяснений симптомов, таких как инфекции или воспалительное заболевание кишечника (ВЗК).
Тем не менее, любой человек, у которого появляются новые симптомы, может пожелать посетить врача для постановки диагноза.
Симптомы рака толстой кишки одинаковы у мужчин и женщин и включают в себя следующее:
Поделиться на PinterestЧеловек, подозревающий, что у него может быть рак толстой кишки, должен поговорить с врачом.
Расстройство желудка или незначительная инфекция часто могут вызывать изменения в кишечнике, такие как запор, диарея или очень узкий жидкий стул. Однако эти проблемы обычно решаются в течение нескольких дней, когда болезнь проходит.
Изменения в кишечнике, которые длятся более нескольких дней, могут быть признаком серьезной проблемы со здоровьем.
Если у человека эти симптомы появляются регулярно или дольше, чем несколько дней, ему следует обратиться к врачу.
Периодические судороги или вздутие живота — распространенные проблемы с пищеварением, которые могут возникать из-за расстройства желудка, газов или употребления определенных продуктов.
Частые, необъяснимые спазмы и вздутие живота могут быть признаком рака толстой кишки, хотя чаще эти симптомы являются результатом других проблем со здоровьем.
Если новообразование превращается в закупорку толстой кишки, это может вызвать у человека ощущение, будто он никогда не сможет опорожнить свой кишечник.
Даже если их кишечник пуст, они все равно будут чувствовать потребность снова сходить в туалет.
Кровь в стуле может пугать. Стул может иметь полосы свежей красной крови или весь стул может иметь более темный дегтеобразный вид.
Есть много других возможных причин кровавого стула, например, геморрой. Тем не менее, любой человек, у которого есть кровь в стуле, должен все же обратиться к врачу для постановки диагноза.
Внезапная и неожиданная потеря веса — признак нескольких видов рака. Непреднамеренная потеря 10 фунтов и более в течение 6 месяцев может быть признаком обращения к врачу.
Непреднамеренная потеря 10 фунтов и более в течение 6 месяцев может быть признаком обращения к врачу.
У больных раком потеря веса может быть связана с тем, что раковые клетки потребляют больше энергии тела. Иммунная система также усиленно борется с раковыми клетками.
Если опухоль большая, это может привести к закупорке толстой кишки, что может вызвать изменения кишечника и дальнейшую потерю веса.
Люди с раком толстой кишки могут чувствовать постоянную усталость или слабость, возможно, из-за того, что раковые клетки используют дополнительную энергию, а также из-за стрессовых симптомов кишечника.Хотя время от времени чувство усталости является нормальным явлением, хроническая усталость не проходит с отдыхом.
Хроническая усталость обычно является признаком основного заболевания. Любой, кто испытывает усталость, должен обратиться к врачу, чтобы определить причину.
Когда рак начинает истощать организм и наступает усталость, люди часто испытывают связанные с ним симптомы, такие как одышка.
Им может быть трудно перевести дыхание или они могут очень быстро запыхаться от чего-то столь простого, как прогулка на небольшое расстояние или смех.
Поделиться на PinterestАфроамериканцы имеют более высокий риск развития рака толстой кишки, чем люди из других этнических групп.
Некоторые факторы могут увеличить риск развития рака толстой кишки, в том числе:
- личный анамнез проблем с пищеварением, таких как колоректальные полипы или IBD
- семейный анамнез полипов или колоректального рака
- некоторые унаследованные генные мутации, такие как наследственный неполипозный колоректальный рак (HNPCC)
- старение
- диабет 2 типа
- некоторые этнические группы, в том числе афроамериканцы или евреи ашкенази
Невозможно предотвратить рак во всех случаях, но необходимо изменить образ жизни, чтобы устранить Некоторые факторы риска могут помочь человеку снизить вероятность развития рака толстой кишки.
Диета
Как отмечает Американское онкологическое общество (ACS), диета с высоким содержанием красного мяса или мясных продуктов увеличивает риск колоректального рака.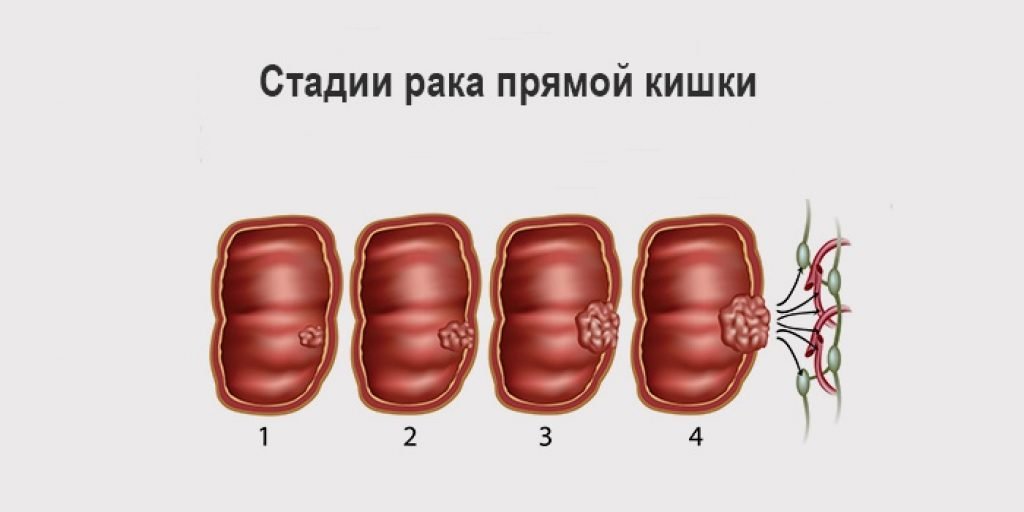
Эти продукты включают:
- говядину
- свинину
- баранину
- оленину
- печень
- хот-доги
- нарезки
- обеденное мясо
Приготовление мяса при очень высоких температурах, например, на гриле или в жаровне или фритюрнице выделяет канцерогенные химические вещества.Эти химические вещества могут также увеличить риск заболевания раком толстой кишки, хотя связь между методами приготовления мяса и раком все еще неясна.
Вес
Избыточный вес или ожирение увеличивает риск развития или смерти от рака толстой кишки.
Согласно ACS, связь между ожирением и колоректальным раком также сильнее проявляется у мужчин. Похудение может помочь снизить риск.
Отсутствие активности
Отсутствие физической активности увеличивает риск развития рака толстой кишки.Оставайтесь активными, выполняя даже легкие тренировки каждый день, чтобы снизить этот риск.
Употребление алкоголя
Люди, которые много или регулярно пьют, также могут подвергать себя большему риску рака толстой кишки. Мужчинам следует ограничить употребление алкоголя не более чем двумя порциями в день.
Мужчинам следует ограничить употребление алкоголя не более чем двумя порциями в день.
Курение
У курильщиков больше шансов заболеть или умереть от рака толстой кишки, чем у тех, кто этого не делает. Курение сигарет также увеличивает риск многих других видов рака.
Рак толстой кишки хорошо поддается лечению и часто излечим, если диагноз ставится на ранней стадии, когда рак находится только в кишечнике и не распространился на другие части тела.
Хирургия — это наиболее распространенный метод лечения рака толстой кишки первой линии, излечивающий от которого около 50 процентов.
Хирург удалит злокачественную опухоль и все близлежащие лимфатические узлы, а также часть здоровой ткани, окружающую опухоль. Затем они повторно соединят здоровые части кишечника.
Многие ранние формы рака толстой кишки не требуют дальнейшего лечения.
Если рак находится на поздней стадии, хирургам может потребоваться удалить большую часть толстой кишки, а если болезнь достигает прямой кишки, хирург может удалить эту часть толстой кишки.
Иногда врачи рекомендуют химиотерапию людям с повышенным риском рецидива опухолей.
В большинстве случаев симптомы со стороны пищеварения не указывают на рак. Однако, если симптомы необычны, появляются более регулярно или неуклонно ухудшаются, лучше обратиться к врачу, поскольку другого способа диагностировать эти проблемы нет.
Даже если основной причиной не является рак толстой кишки, врач может выявить и диагностировать отдельное заболевание, для которого он может порекомендовать лечение.
Многие люди с раком толстой кишки не проявляют никаких ранних симптомов, поэтому появление симптомов может быть признаком того, что рак растет или распространяется. ACS рекомендует мужчинам и женщинам со средним риском рака толстой или толстой кишки начинать обследование в возрасте 45 лет. Врачи могут диагностировать и лечить рак толстой кишки на ранних стадиях, если человек регулярно посещает обследования.
Любой, кто замечает новые необъяснимые симптомы со стороны пищеварения или не уверен в их симптомах, должен обратиться к врачу.
Раннее обследование и диагностика имеют решающее значение для людей с раком толстой кишки. Когда врачи диагностируют рак толстой кишки до того, как он распространится, 5-летняя относительная выживаемость составляет 92 процента. Однако показатели выживаемости ниже среди людей, которым диагноз поставлен только на более поздней стадии.
Факторы риска колоректального рака
Заболеть колоректальным раком может любой человек. Врачи часто не знают, почему это происходит, но они знают некоторые факторы, которые повышают вероятность заражения людей. К ним относятся:
Возраст. Заболевание чаще всего встречается у людей старше 50 лет, и вероятность заболеть колоректальным раком возрастает с каждым десятилетием старше 40 лет. Рак очень редко встречается у людей моложе 40 лет, за исключением тех, у кого есть сильная семейная история болезни.
Пол. Колоректальный рак чаще встречается у мужчин. Мужчины и женщины в равной степени подвержены риску рака толстой кишки, но мужчины чаще заболевают раком прямой кишки.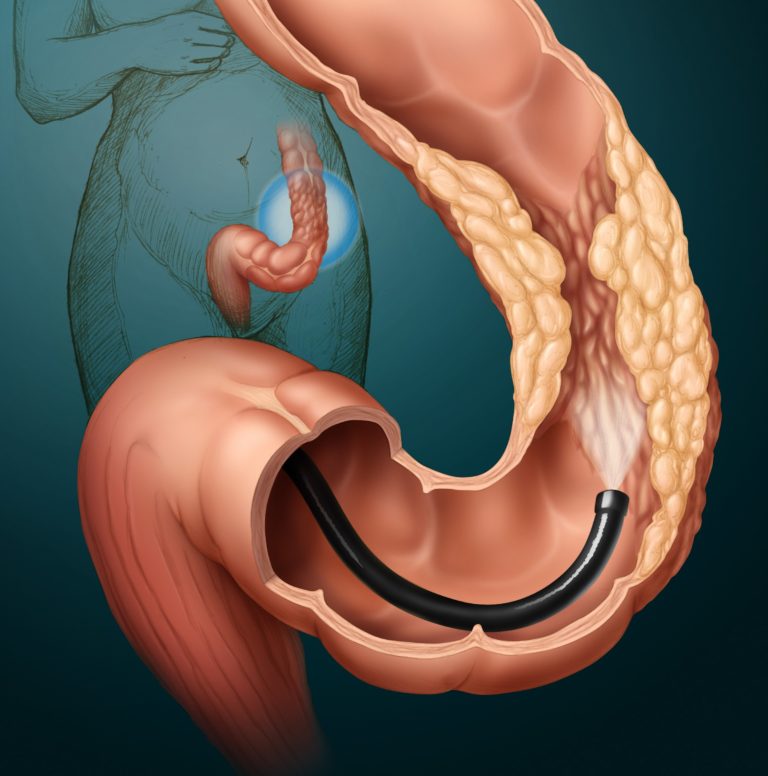
Полипы. Эти наросты на внутренней стенке толстой или прямой кишки не являются раком, но могут к нему привести.Они довольно часто встречаются у людей старше 50 лет. Один тип полипа, называемый аденомой, повышает вероятность колоректального рака. Аденомы — это первый шаг к раку прямой и толстой кишки.
История вашего здоровья. Если у вас раньше был колоректальный рак, вы могли бы заболеть им снова, особенно если вы впервые заболели им до 60 лет. То же самое верно и в случае полипов. Кроме того, люди с хроническими заболеваниями, связанными с воспалением толстой кишки, такими как язвенный колит или болезнь Крона, более склонны к развитию колоректального рака.
Продолжение
Семейный анамнез. Необычные гены в клетках толстой кишки, которые способствуют развитию полипов и рака, могут передаваться в вашей семье. Поэтому, если у вас есть родитель, брат, сестра или ребенок, болевший колоректальным раком, у вас больше шансов заболеть им. Ваш риск выше, если родственнику поставили диагноз до 45 лет или если у вас много членов семьи с колоректальными полипами или раком. Если в вашей семье есть такие заболевания, как семейный аденоматозный полипоз, MYH-ассоциированный полипоз или наследственный неполипозный колоректальный рак, это также повышает риск рака толстой кишки (и других видов рака).
Ваш риск выше, если родственнику поставили диагноз до 45 лет или если у вас много членов семьи с колоректальными полипами или раком. Если в вашей семье есть такие заболевания, как семейный аденоматозный полипоз, MYH-ассоциированный полипоз или наследственный неполипозный колоректальный рак, это также повышает риск рака толстой кишки (и других видов рака).
Диета. Люди, которые едят много красного мяса, жиров и холестерина, а также мало клетчатки или свежих овощей, могут быть более подвержены колоректальному раку.
Образ жизни. У вас может быть больше шансов заболеть колоректальным раком, если вы употребляете много алкоголя, курите и мало занимаетесь спортом, а также если у вас избыточный вес.
Продолжение
Диабет. Люди с диабетом чаще заболевают колоректальным раком.
Продолжение
Гонка. афроамериканцы чаще, чем представители других расовых и этнических групп США, заболевают колоректальным раком.
Если у вас сочетание этих факторов риска, у вас гораздо больше шансов получить полипы или рак. Обсудите с врачом свои риски и сообщите ему, если что-то изменится. Они могут посоветовать способы снизить ваши шансы и сообщить, когда вам нужно пройти обследование.
Следите за такими симптомами, как ректальное кровотечение или изменение привычек в ванной. Они могут означать, что вам нужно внимание помимо проверки.
Растущий риск для юношей
Рак — гистопатологическое изображение карциноида толстой кишки. Предоставлено: Википедия / CC BY-SA 3.0.
Когда несколько месяцев назад Чедвик Боузман умер от рака толстой кишки, я был удивлен, насколько он был молод — я всегда думал, что это болезнь пожилого человека. Каковы факторы риска для молодых людей, особенно мужчин?
Вы абсолютно правы.Боузману был поставлен диагноз рака толстой кишки в 39 лет, и он умер в 43 года — намного моложе, чем средний человек, которому поставлен диагноз или умирает от этого заболевания. Фактически, средний возраст мужчин при постановке диагноза составляет 68 лет (по сравнению с 72 годами у женщин).
Фактически, средний возраст мужчин при постановке диагноза составляет 68 лет (по сравнению с 72 годами у женщин).
В целом, колоректальный рак (который включает рак прямой и толстой кишки) является третьим наиболее часто диагностируемым раком как у мужчин, так и у женщин и второй ведущей причиной смерти от рака как у мужчин, так и у женщин, согласно данным Colorectal Cancer Alliance (CCA, ccalliance.org). Но колоректальный рак, как и большинство других видов рака, не является заболеванием равных возможностей. Помимо того, что им поставили диагноз в более молодом возрасте, мужчины также умирают от болезни гораздо чаще, чем женщины. А у афроамериканцев самые высокие показатели (на 20% выше по диагнозу, на 40% выше по смертности).
Хорошая новость заключается в том, что в целом заболеваемость раком прямой и толстой кишки снижается примерно с середины 1980-х годов, по данным Американского онкологического общества (ACS, Cancer.org). Но, что интересно, это снижение в основном связано с тем, что у пожилых людей диагностируется меньше — число новых случаев заболевания среди людей в возрасте 55 лет и старше сократилось примерно на 3. 5% ежегодно. И это в значительной степени связано с лучшими методами скрининга, которые теперь позволяют диагностировать потенциальные виды рака (включая полипы) раньше, когда их легче лечить, согласно ACS.
5% ежегодно. И это в значительной степени связано с лучшими методами скрининга, которые теперь позволяют диагностировать потенциальные виды рака (включая полипы) раньше, когда их легче лечить, согласно ACS.
К сожалению, есть и плохие новости: количество диагностированных лиц в возрасте до 55 лет увеличивается на 2% в год. Иными словами, новый отчет ACS оценивает, что человек, родившийся в 1990 году (которому сегодня было бы около 30 лет), в два раза чаще заболевает раком толстой кишки и в четыре раза чаще заболевает раком прямой кишки, чем человек 1950 года рождения (которому было бы 70 сегодня).
В результате этого медленного, но резкого увеличения числа молодых людей (особенно мужчин и / или афроамериканцев), у которых диагностируется колоректальный рак, новые рекомендации по скринингу теперь рекомендуют людям со «средним риском» должны пройти обследование начиная с 45 лет. Однако, согласно CCA, если у вас есть семейная история колоректального рака или полипов, вам следует пройти обследование в возрасте 40 или 10 лет до возраста самого молодого пациента в вашей семье. Если у вас есть генетическая связь с колоректальным раком, вам может потребоваться пройти тестирование уже в 20 лет.Кроме того, если у вас в анамнезе был какой-либо другой тип рака, особенно если вы получили облучение брюшной полости или таза, или у вас есть язвенный колит, болезнь Крона или воспалительное заболевание кишечника, поговорите со своим врачом, чтобы узнать, следует ли вам начать тестирование раньше 45.
Если у вас есть генетическая связь с колоректальным раком, вам может потребоваться пройти тестирование уже в 20 лет.Кроме того, если у вас в анамнезе был какой-либо другой тип рака, особенно если вы получили облучение брюшной полости или таза, или у вас есть язвенный колит, болезнь Крона или воспалительное заболевание кишечника, поговорите со своим врачом, чтобы узнать, следует ли вам начать тестирование раньше 45.
Другие факторы риска колоректального рака включают:
- Быть старше 55
- Быть афроамериканцем или евреем-ашкенази
- Диабетом 2 типа
- Избыточный вес
- Употребление большого количества красного мяса
- Курение
- Пьянство
- Отсутствие физических упражнений
И, наконец, если у вас есть какие-либо из следующих симптомов, обратитесь к своему провайдеру.
- Изменения в привычках кишечника (например, диарея или запор), длящиеся более нескольких дней
- Частые газы или вздутие живота (время от времени — это нормально, но каждый день — нет)
- Кровь в стуле или черная / смолистая кровь стул
- Необъяснимая потеря веса
- Необъяснимая усталость
- Одышка
Для получения дополнительной информации о колоректальном и других рекомендуемых обследованиях посетите сайт getitchecked. com.
com.
Кого следует обследовать на колоректальный рак?
© 2020 Армин Бротт
Распространяется компанией Tribune Content Agency, LLC
Ссылка :
Рак толстой кишки: растущий риск для молодых мужчин (23 ноября 2020 г.)
получено 1 марта 2021 г.
из https: // medicalxpress.ru / news / 2020-11-col-Cancer-young-men. html
html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
фактов о раке толстой кишки | Коалиция против рака толстой кишки
Список фактов может напугать.Обдумывая приведенную здесь информацию, помните, что при своевременном обследовании
и своевременной оценке симптомов рак толстой кишки можно предотвратить, вылечить и победить!
О колоректальном раке
- Рак толстой кишки — это рак толстой кишки. Рак прямой кишки — это рак прямой кишки. Вместе они составляют колоректальный .

- Это третий наиболее часто диагностируемый рак и вторая по значимости причина смерти от рака.
- Колоректальный рак в равной степени поражает мужчин и женщин, а также людей всех рас и национальностей.
- Половина всех новых диагнозов колоректального рака приходится на людей в возрасте 66 лет и младше.
- 5-летняя относительная выживаемость при раке толстой кишки 1 и 2 стадии составляет 90%; 5-летняя выживаемость для пациентов, у которых диагностирована стадия III, составляет 71%, а стадия IV — 14%.
- Часто те, у кого диагностирован колоректальный рак, не испытывают никаких признаков или симптомов, связанных с этим заболеванием.
Семейная история
- Люди, родители, братья или сестры или дети которых болеют колоректальным раком, имеют в 2 или 3 раза больший риск развития рака толстой кишки по сравнению с теми, у кого это заболевание не было в семейном анамнезе.
- В то время как у большинства людей с диагнозом рак толстой кишки нет семейного анамнеза этого заболевания, тем, у кого есть семейный анамнез, следует начинать скрининг в более раннем возрасте.

- Когда родственнику поставлен диагноз в молодом возрасте или если заболевание имеет более одного родственника, риск развития колоректального рака увеличивается в три-шесть раз по сравнению с населением в целом.
Колоректальный рак у молодых людей
- В 2020 году будет диагностировано около 18 000 случаев колоректального рака у людей в возрасте до 50 лет, что эквивалентно 49 новым случаям в день.
- Возраст каждого пятого пациента с колоректальным раком составляет от 20 до 54 лет.
- Это 3-я ведущая причина смерти от рака среди молодых людей.
- Риск колоректального рака увеличивается с возрастом; 90% случаев диагностируются у лиц в возрасте 50 лет и старше.
- В то время как заболеваемость колоректальным раком снижается среди взрослых в возрасте 50 лет и старше, заболеваемость колоректальным раком увеличивается среди взрослых в возрасте до 50 лет.
- У людей, родившихся после 1990 года, в 2 раза выше риск развития рака толстой кишки и в 4 раза выше риск развития рака прямой кишки, чем у людей, родившихся в 1950 году.

- В 2020 году будет зарегистрировано 49 новых случаев колоректального рака у людей моложе 50 лет, диагностированных в день, или 18 000 за год.
- У людей молодого возраста чаще, чем у пожилых людей, диагностировали позднюю стадию рака толстой или прямой кишки, поскольку они не достигли рекомендованного возраста для проведения скрининга.
Как насчет скрининга?
- По данным Американского онкологического общества, мужчины и женщины должны начинать скрининг на колоректальный рак в возрасте 45 лет.
- Существует множество доступных скрининговых тестов, в том числе некоторые неинвазивные недорогие тесты, которые можно провести в уединении вашего собственного дома.
- По оценке Национального круглого стола по вопросам колоректального рака, если бы 80% подходящего населения прошли скрининг в возрасте 50 лет, количество смертей, связанных с колоректальным раком, могло бы сократиться на 230 000.
- Скрининг имеет потенциал для выявления и даже предотвращения колоректального рака, поскольку полипы (предшественники рака) могут быть удалены во время скрининга с помощью колоноскопии.

- Прохождение скрининга с рекомендованной частотой увеличивает вероятность того, что при наличии колоректального рака он будет обнаружен на более ранней стадии.
- Когда колоректальный рак обнаружен на ранних стадиях, вероятность его излечения выше, лечение менее обширное, а выздоровление происходит намного быстрее.
- Риск развития колоректального рака или смерти от него можно снизить, поддерживая здоровую массу тела, регулярно занимаясь физическими упражнениями, ограничивая потребление красного и переработанного мяса, а также отказываясь от курения.
Что еще?
- За последние десять лет показатели скрининга на колоректальный рак увеличились, но показатели все еще остаются низкими, особенно среди тех, кто не застрахован.
- Уровень заболеваемости колоректальным раком у лиц возраста скрининга снижается в США с середины 1980-х годов из-за повышения осведомленности и скрининга.
- Колоректальный рак обычно развивается медленно в течение 10-15 лет.

- Заболеваемость раком прямой кишки в США сильно различается в зависимости от географического региона.Факторы, способствующие этому, включают региональные различия в факторах риска и доступ к скринингу и лечению.
- Расовые / этнические группы имеют более высокий уровень смертности от колоректального рака, потому что они с меньшей вероятностью будут обследованы вовремя, у них меньше доступа к скринингу и с меньшей вероятностью будет обнаружен колоректальный рак на самых ранних стадиях.
- 51% людей в возрасте от 50 до 54 лет не прошли обследование на колоректальный рак.
- Общая стоимость лечения колоректального рака в США составляет около 14 миллиардов долларов в год.
- При своевременном обследовании и тестировании колоректальный рак можно предотвратить , излечить и победить .
Список литературы
Американское онкологическое общество: основные статистические данные по колоректальному раку
Пресс-релиз Американского онкологического общества: бремя колоректального рака переносится на более молодых людей
Американское онкологическое общество: выживаемость при колоректальном раке
Национальные институты здравоохранения: прогноз затрат на лечение рака
Далее >> Каковы симптомы?
Информация на этих страницах предназначена только для информационных целей. Перед принятием каких-либо медицинских решений проконсультируйтесь со своим врачом.
Перед принятием каких-либо медицинских решений проконсультируйтесь со своим врачом.
Смерть звезды «Черная пантера» проливает свет на риск рака толстой кишки у молодых людей | Рак
Возможные факторы, связанные с колоректальным раком
1. Генетические заболевания
До 35% людей, у которых развивается рак до 50 лет, имеют генетические мутации, по сравнению с 3–5% всех случаев колоректального рака. Эти цифры предполагают, что генетика влияет на более молодых пациентов гораздо больше, чем на пациентов старшего возраста, но нам нужны дополнительные исследования, чтобы сказать наверняка.
Две распространенные формы генетических состояний, которые мы наблюдаем у пациентов с колоректальным раком, включают семейный аденоматозный полипоз (FAP), когда сотни полипов покрывают внутреннюю оболочку толстой кишки, и синдром Линча, который является синдромом неполипоза, который увеличивает риск развития колоректального рака и других злокачественных новообразований.
В настоящее время проводятся интересные исследования, касающиеся генетических мутаций, которые еще предстоит идентифицировать. Хотя нам известны многие генетические мутации, приводящие к колоректальному раку, мы не знаем их всех.Скрининг на возможные генетические мутации чрезвычайно важен для выявления предрасположенности пациента и его первых родственников не только к раку толстой кишки, но и к другим видам рака органов. Более того, знание того, являются ли пациенты носителями определенной генетической мутации, может иметь значение для выбора типа хирургического вмешательства или химиотерапии. В настоящее время каждые несколько лет обнаруживаются новые генетические мутации. Поэтому пациенты, которые прошли тестирование несколько лет назад и не имели генетических мутаций, сегодня могут иметь другой результат.Успешное прохождение тестирования могло помочь не только им, но и их родственникам и детям. Люди могут сделать это, записавшись на консультацию по генетическим вопросам.
2.
 Диета
Диета
В течение многих лет предполагалось, что диета с низким содержанием клетчатки, высоким содержанием животного белка и красного мяса также может увеличить риск рака толстой кишки. У нас нет окончательных доказательств, подтверждающих любую из этих теорий, но общее состояние здоровья пациентов только выиграет от здорового питания, в котором приоритет отдается фруктам, овощам и клетчатке с высоким содержанием зерна.Кроме того, новые исследования показали, что определенные продукты могут негативно повлиять на микробиом или популяцию бактерий в толстой кишке, что может привести к более высокому риску колоректального рака.
Употребление большого количества алкоголя или более двух порций алкоголя в день для мужчин и одного напитка в день для женщин является еще одним важным фактором риска развития колоректального рака. Я предлагаю пациентам сделать все возможное, чтобы предотвратить чрезмерное употребление алкоголя, потому что это связано с множеством различных последствий для здоровья.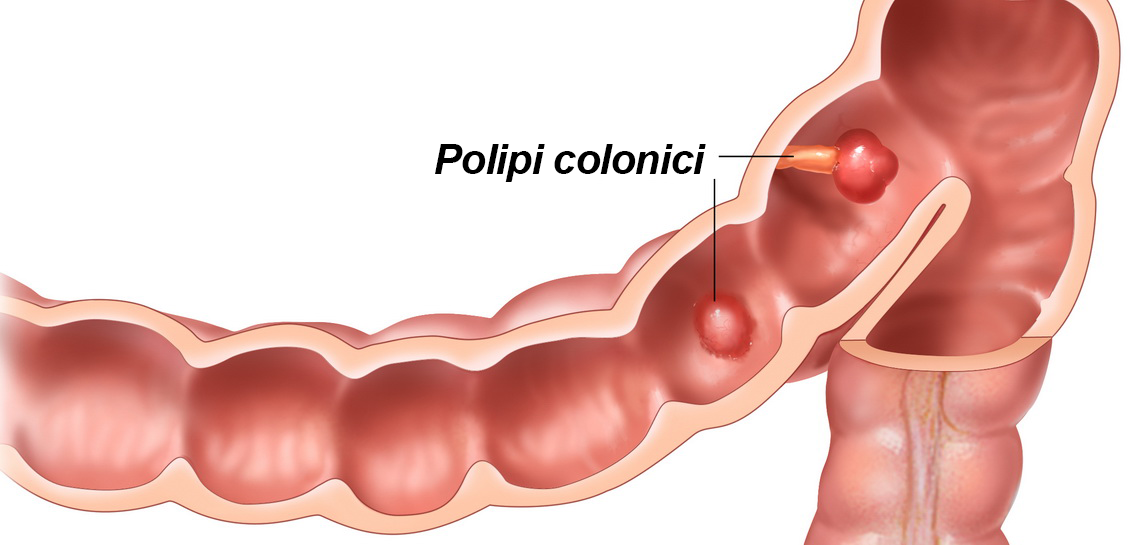
3. Курение
Курение сигарет — хорошо известная причина рака легких, но оно также связано со многими другими видами рака. Фактически, исследования показывают, что у людей, которые курят в течение длительного периода времени, больше шансов заболеть колоректальным раком, чем у некурящих.
4. Ожирение
Было показано, что ожирение и избыток жира в организме связаны с увеличением заболеваемости колоректальным раком. Более того, недавнее исследование показало, что избыток жира в организме в раннем возрасте может быть связан с риском рака толстой кишки в более позднем возрасте.
5. Язвенный колит
Язвенный колит или тип воспалительного заболевания кишечника — это состояние, которое вызывает длительное воспаление и язвы в самой внутренней части толстой и прямой кишки. Пациенты с язвенным колитом имеют более высокий риск развития колоректального рака по сравнению с населением в целом. Эти пациенты должны работать с врачом, чтобы спланировать частые обследования на колоректальный рак, чтобы исключить наличие заболевания.
Дополнительная литература : 6 способов, которыми миллениалы и представители поколения X могут снизить риск колоректального рака
6.Неравенство в уходе
Ограниченный доступ к уходу, недостаточное страховое покрытие, а также социальная и системная предвзятость со временем привели к разным результатам в оказании медицинской помощи черным пациентам.
Юго-западный университет Юго-Западного университета, как академический медицинский центр, процветает за счет разнообразия. Наше желание состоит в том, чтобы отразить разнообразие нашего сообщества в нашей команде поставщиков, нашем штате сотрудников и в нашем уходе за пациентами.
Что нужно знать представителям поколения X и миллениалам> Новости> Йельская медицина
Никто в возрасте 20, 30 или 40 лет не заболевает колоректальным раком, верно? Неправильный.Правда в том, что колоректальный рак растет у молодых людей уже много лет. Вот почему хирурги Йельской медицины, которые лечат его, призывают людей моложе 50 лет — даже студентов колледжей — рассказывать своим врачам о любых подозрительных симптомах, таких как запор, ректальное кровотечение или внезапные изменения дефекации.
Йельская медицина хирургия толстой кишки и прямой кишки
Врачи сообщают, что в наши дни чаще обращаются к маленьким пациентам с диагнозом колоректальный рак.Несколько месяцев назад они диагностировали рак толстой кишки у отца четверых детей в возрасте 30 лет, который в течение нескольких месяцев думал, что его ректальное кровотечение было вызвано геморроем. В течение последней недели все семь пациентов с диагнозом «рак прямой кишки» были молодыми; самому старому было 35. Самому молодому пациенту с колоректальным раком, диагностированным в этом месте в последние месяцы, было 18 лет.
В начале 2018 года Американское онкологическое общество опубликовало самый масштабный анализ этой тенденции в журнале Национального института рака .Они обнаружили, что люди 1990 года рождения — которым в этом году исполнится 28 лет — имеют в два раза больше риска рака толстой кишки и в четыре раза больше риска рака прямой кишки по сравнению с людьми, родившимися около 1950 года.
«Мы наблюдаем явный рост колоректального рака у молодых поколений», — говорит Хэддон Пантел, доктор медицины, колоректальный хирург Йельской медицины.
Что делает этот рост особенно загадочным, так это тот факт, что общая заболеваемость колоректальным раком снизилась на 45 процентов с середины 1980-х годов.Хотя рак по-прежнему чаще всего диагностируется у людей старше 55 лет, исследование показало, что у пациентов моложе 55 лет на 58 процентов выше вероятность того, что у них будет диагностировано запущенное заболевание.
Если у кого-то изменились привычки кишечника, если у него есть кровотечение — даже если они думают, что это геморрой, и он не проходит — просто сделайте колоноскопию.
Викрам Редди, доктор медицинских наук, колоректальный хирург
Несмотря на то, что колоректальный рак часто хорошо поддается лечению, этот диагноз может стать серьезным испытанием для миллениалов и представителей поколения X, возраст которых варьируется от 20 до 50. Это может помешать карьере и нанести ущерб личным финансам. Молодым людям с диагнозом колоректальный рак может потребоваться быстрое принятие критических решений по таким вопросам, как сохранение спермы или яйцеклеток на случай, если лечение повлияет на их фертильность.
Это может помешать карьере и нанести ущерб личным финансам. Молодым людям с диагнозом колоректальный рак может потребоваться быстрое принятие критических решений по таким вопросам, как сохранение спермы или яйцеклеток на случай, если лечение повлияет на их фертильность.
Около десяти лет назад хирург Йельской медицины Викрам Редди, доктор медицинских наук, провел одно из первых исследований, выявивших рост заболеваемости колоректальным раком среди молодых людей. «Мы все еще наблюдаем эту тенденцию, так что это не было временным явлением», — говорит доктор Редди.
Доктор.Редди и его коллеги увлечены обучением людей, чтобы рак диагностировался на ранней стадии, когда он наиболее поддается лечению. «Если у кого-то изменились привычки кишечника, если у него есть кровотечение — даже если они думают, что это геморрой, и он не проходит, — просто сделайте колоноскопию», — говорит доктор Редди.
В онкологической больнице Смилова колоректальные хирурги Yale Medicine лечат большое количество пациентов со всеми типами рака толстой и прямой кишки.


/colon-cancer-symptoms-5b2bc220303713003762fd9f.png)