Доброкачественные новообразования прямой кишки и анального канала
Доброкачественные новообразования прямой кишки и анального канала, именуемые полипами, исходят из слизистой оболочки аноректальной области. Развитие чаще всего без каких-либо проявлений — бессимптомно! Однако, возможно появление зуда, дискомфортом в заднем проходе, выделении слизи и крови.
Рисунок 1 — Одиночный полип прямой кишки
Как любые доброкачественные образования полипы прямой кишки и анального канала рано или поздно могут трансформироваться в злокачественные опухоли (Рисунок 1). Полипы могут быть как одиночные, так и множественные (Рисунок 2), они встречаются у людей любого возраста и пола.
Рисунок 2 — Множественные полипы сигмовидной кишки
Мужское население страдает полипами в полтора раза чаще. Указание на наличие полипов у близких родственников является причиной для обращения к проктологу и своевременной профилактики.
При обнаружении полипов любых размеров требуется их удаление! (Рисунок 3)
Рисунок 3 — Эндоскопическое удаление полипа
По исследованию AACR (Американская ассоциация раковых заболеваний) у людей старше 45 лет полипы в кишке определяются в 10% случаев, в абсолютном большинстве этих случаев жалобы отсутствуют! Ранняя диагностика до появления злокачественных клеток улучшает результаты лечения (выживаемость составляет более 85%).
В классификации различают несколько подходов: по количеству и распространению: одиночный полип, множественный полипы (группы образований в различных отделах толстого кишечника) и диффузный семейный полипоз.
По морфологической структуре полипы бывают: железистые, железисто-ворсинчатые и ворсинчатые, гиперпластические, кистозно-гранулирующиеся (ювенильные) и фиброзные. Кроме того, выделяют псевдополипоз — разрастания слизистой оболочки по типу полипов при хроническом воспалении. Клинический диагноз так же включает информацию о наличии или отсутствии малигнизации (озлокачествления) (Рисунок 4).
Рисунок 4 — Злокачественное новообразование (рак) сигмовидной кишки
Причины возникновения до конца не изучены. Наиболее распространена теория развития в следствие хронического воспаления слизистой оболочки кишечной стенки.
Чаще всего доброкачественные новообразования обнаруживают при эндоскопическом исследовании случайно. Абсолютное большинство злокачественных новообразований толстой кишки — это результат озлокачествления полипов. Ранняя диагностика и лечение новообразований позволяет добиться выздоровления в 90% случаев.
Ранняя диагностика и лечение новообразований позволяет добиться выздоровления в 90% случаев.
Полипы не подвергаются консервативному лечению — «золотым стандартом” является удаление, при эндоскопии, или при низко расположенных образованиях — трансанальное иссечение. Выявление полипов в прямой кишке и их удаление — основной метод профилактики рака прямой кишки.
Берегите свое здоровье!
Записаться на прием проктолога
Врач хирург-проктолог — Кузнецов Михаил Николаевич
Записаться можно по телефону (391) 218−35−13 или через личный кабинет
Опухоли толстой кишки — лапароскопическая операция, лапароскопия [Видео]
Лапароскопия в лечении доброкачественных опухолей толстой кишки
Лапароскопия в лечении доброкачественных опухолей толстой кишки.
Оперирует профессор Пучков К. В. (2020 г.)
В видео Пучков К. В. демонстрирует такое оперативное вмешательство, где лапароскопически убирает опухоль размером 3,5 см
При проведении колоноскопии (ФКС) и выявлении объемного образования (полип, опухоль и тд. ) в толстой кишке, врач берет биопсию.
) в толстой кишке, врач берет биопсию.
В ободочной кишке по результатам гистологического исследования могут быть выявлены следующие образования:
гиперпластический полип;
группа доброкачественных опухолей, к которым относятся тубулярная аденома, ворсинчатая аденома, тубуло-ворсинчатая аденома, аденоматозный полип;
При выявлении доброкачественной опухоли важно помнить, что они могут «переродиться» в рак.
Уникальность данного заболевания заключается в четко прослеживающемся развитии от предракового состояния до собственно злокачественной опухоли.
Наличие полипа является показанием для его удаления.
Относительно небольшие, либо крупные полипы с выраженной ножкой относительно легко удаляются электроэксцизией петлей или электрокоагуляцией во время ректороманоскопии или фиброколоноскопии.
Значительно усложняется удаление опухоли у больных со стелющимися или крупными полипами на широком основании.
Использование стандартной эндоскопической техники в данной ситуации чревато высоким риском развития осложнений (перфорация, кровотечения, оставление части образования и т. д.).
д.).
В тоже время, максимально высокой степенью малигнизации обладают именно виллезные аденомы на широком основании размером более 2 см, то есть такие образования, удаление которых эндоскопическим трансанальным способом представляет наибольшие трудности, как с технической стороны, так и с точки зрения угрозы возникновения осложнений и рецидива.
Альтернативной техникой удаления крупных доброкачественных опухолей ободочной кишки является лапароскопическая колотомия, иссечение образования с последующим ушиванием раны кишки.
Подробнее о методиках Вы можете прочитать на личном сайте профессора Пучкова Константина Викторовича перейти
Добрый день! У меня 19.102015 г. обнаружена экзофитная опухоль прямой …
Добрый день! У меня 19.102015 г. обнаружена экзофитная опухоль прямой кишки в ампулярном отделе на расстоянии 8 см. Опухоль на широком основании с неровным бугристым контуром 5,0 х3,0 см.( это из заключения ирригоскопии. Взяты анализы на гистологию. Что касается состояния, то до ушиба области крестца (04.09.2015г.) всё было более менее нормально. Запоры, конечно, существовали на протяжении длительного времени ( 20 лет), но хотя бы были позывы на дефекацию. После ушиба кишка прямая как замерла, то есть газы отходят, а опорожнять кишечник приходится клизмами или слабительными и то не очень эффективно, т. к. ирригоскопия показала, что прямая кишка забита каловыми массами. После ушиба появилось жжнение в прямой кишке и боль при натуживании, я подумала, что наверное при падении произошел ушиб прямой кишки. Пошла к проктологу, она нашла трещину на 6 часах и выписала свечи проктозан. При пальпации кишки ничего не нашла. Через неделю я снова пришла к проктологу, т. к. появилась алая кровь в кале, слизь на кале, кал приобрел лентовидную форму, а количество его с каждым днем становилось всё меньше и меньше. Проктолог направил к гатроэнтэрологу для лечения запоров.Гастроэнтэролог направил на колоноскопию и выписал дюфалак, который мне так и не помог очистить кишечник.
Взяты анализы на гистологию. Что касается состояния, то до ушиба области крестца (04.09.2015г.) всё было более менее нормально. Запоры, конечно, существовали на протяжении длительного времени ( 20 лет), но хотя бы были позывы на дефекацию. После ушиба кишка прямая как замерла, то есть газы отходят, а опорожнять кишечник приходится клизмами или слабительными и то не очень эффективно, т. к. ирригоскопия показала, что прямая кишка забита каловыми массами. После ушиба появилось жжнение в прямой кишке и боль при натуживании, я подумала, что наверное при падении произошел ушиб прямой кишки. Пошла к проктологу, она нашла трещину на 6 часах и выписала свечи проктозан. При пальпации кишки ничего не нашла. Через неделю я снова пришла к проктологу, т. к. появилась алая кровь в кале, слизь на кале, кал приобрел лентовидную форму, а количество его с каждым днем становилось всё меньше и меньше. Проктолог направил к гатроэнтэрологу для лечения запоров.Гастроэнтэролог направил на колоноскопию и выписал дюфалак, который мне так и не помог очистить кишечник. Я в третий раз пошла к проктологу, но уже к другому и он сразу же обнаружил опухоль и взял материал на гистологию. Выписал таблетки доцинон для остановки кровотечения, хотя кровь не в значительном объеме, больше беспокоит жжение и длительные запоры, аппетит пока нормальный, но есть боюсь из-за завалов в кишечнике. У меня вопрос. Может ли ушиб быть причиной опухоли или она уже была, а сильный ушиб спровоцировал её рост? Могу ли я рассчитывать на то, что опухоль не злокачественная или нет? А если по результатам гистологии анализ будет положительным, то как я к вам могу попасть и можно ли рассчитывать на квоту.
Я в третий раз пошла к проктологу, но уже к другому и он сразу же обнаружил опухоль и взял материал на гистологию. Выписал таблетки доцинон для остановки кровотечения, хотя кровь не в значительном объеме, больше беспокоит жжение и длительные запоры, аппетит пока нормальный, но есть боюсь из-за завалов в кишечнике. У меня вопрос. Может ли ушиб быть причиной опухоли или она уже была, а сильный ушиб спровоцировал её рост? Могу ли я рассчитывать на то, что опухоль не злокачественная или нет? А если по результатам гистологии анализ будет положительным, то как я к вам могу попасть и можно ли рассчитывать на квоту.
Удаление доброкачественных опухолей прямой кишки
В 90% случаев у переболевших covid выявляют остаточные явления изменения легких. Наиболее распространен фиброз, когда в легких появляется рубцовая ткань и нарушается насыщение крови кислородом. При ковид-инфекции также могут поражаться почки, печень, желудочно-кишечный тракт, сердце.
Распространенные последствия
Поражение легких:
- одышка при физической нагрузке
-
кашель -
повышенная температура тела в пределах 37. 0° — 37.5° продолжительное время
0° — 37.5° продолжительное время
Повышенное тромбообразование:
опасное для жизни состояние, в результате образования тромбов может развиваться инсульт, инфаркт миокарда или тромбоэмболия.
Заболевания сердца:
нарушения ритма, воспаление миокарда, проявляющимися тяжестью в области сердца, перебоями в работе сердца.
Заболевание почек:
нарушение выделительной функции, развитие почечной недостаточности.
Расстройство нервной системы:
головная боль, нарушение зрения, рассеянность, снижение памяти, снижение концентрации внимания, нарушение сна, чувство страха, депрессия.
Расстройство желудочно-кишечного тракта:
боли в животе, тяжесть в правом подреберье, тошнота, нарушение пищеварения.
Слабость и боль в мышцах
Мужское бесплодие
Консультация врачом пульмонологом
- Исследование функции внешнего дыхания (ФВД)
-
Лабораторную диагностику -
Пульсоксиметрия
Программа реабилитации после Ковид-19
Программа может корректироваться и дополняться лечащим врачом с учетом состояния пациента и особенности перенесенного заболевания.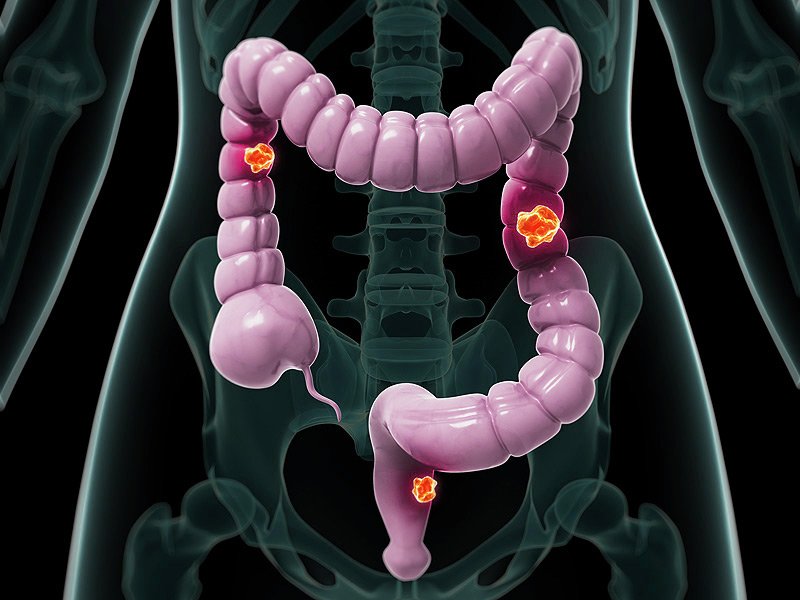
Индивидуальный подбор лекарственных препаратов
Дыхательная гимнастика
Позволяет улучшить вентиляцию лёгких и насыщения крови кислородом. Регулярное выполнение упражнений увеличивает объём лёгких.
ВЛОК (внутривенное лазерное облучение крови)
Оздоровление организма при помощи действия световой энергии на кровь непосредственно в самих сосудах. Процедура проводится с помощью аппарата — АЛТ «Матрикс-ВЛОК». Сеанс длится 15-20 мин. Помогает улучшить свойства крови, повысить иммунитет, снизить отёчность, снабдить органы кислородом, восстановить обмен веществ.
Ингаляции
Лечение, основанное на вдыхании паров необходимых лекарств через небулайзер в дыхательные пути. Местный эффект от использования ингалятора наступает моментально.
Лечебный массаж
Нормализует работу дыхательной системы. Массирующие движения обеспечивают повышение интенсивности кровоснабжения и проходимости бронхов.
Рефлексотерапия
Лечебный способ воздействия на определённые акупунктурные точки организма при помощи специальных игл. Активизирует и восстанавливает внутренние природные силы организма человека.
Комплексная реабилитация позволит полностью восстановиться
- Уменьшить очаги воспаления в кратчайшие сроки;
-
Улучшить вентиляцию легких; -
Нормализовать поступления кислорода в организм; -
Устранить обструкцию бронхов; -
Предотвратить формирование фиброзной ткани, как основной причины развития дыхательной недостаточности после пневмонии.
Реабилитация необходима абсолютно всем пациентам, перенесшим коронавирусную инфекцию, пневмонию и ОРВИ, для восстановления и сохранения качества жизни!
Программу ведут
Эндоскопическая хирургия и фотодинамическая терапия в лечении доброкачественных и малигнизированных новообразований толстой кишки | Разживина
1. Ивашкин В.Т. Колоректальный рак // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 1999. – №1. – С. 88–95.
Ивашкин В.Т. Колоректальный рак // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 1999. – №1. – С. 88–95.
2. Леоненкова Н.В., Гафтон Г.И., Егоренков В.В. и др. Роль трансректального ультразвукового исследования в выборе тактики лечения больных при раке прямой кишки // Амбулаторная хирургия. Стационарозамещающие технологии. – 2006. – №2. – С. 49–51.
3. Нешитов С.П. Лечение ворсинчатых аденом дистальных отделов толстой кишки // Хирургия. – 2001. – №7. – С. 30–33.
4. Федоров В.Д. О лечебной тактике при полипах толстой кишки // Хирургия. – 1988. – №1. – С. 82–86.
5. Веселов В.В., Власов С.Б., Кузнецов А.Н. и др. Результаты эндоскопического лечения ранних форм рака тол- стой кишки // Клиническая эндоскопия. – 2005. – №2. – С. 6–10.
– 2005. – №2. – С. 6–10.
6. Кузьмин-Крутецкий М.И. Возможности эндоскопии в лечении малигнизированных полипов и поверхностных типов раннего рака желудка и толстой кишки // Амбулаторная хирургия. Стационарозамещающие технологии. – 2003. – №2. – С. 38–40.
7. Kudo S. Endoscopic mucosal resection of flat and depressed type of early colorectal cancer // Endoscopy. – 1993. – №25. – Р. 455–461.
8. Tanaka S., et al. Conditions of curability after endoscopic resection for colorectal carcinoma with submucosally massive invasion // Oncol Rep. – 2000. – 7(4) – Р. 783–788.
9. Colacchio T.A., et al. Endoscopic polypectomy: inadequate treatment for invasive colorectal carcinoma // Ann Surg. – 1981. – 194. – Р. 704–707.
– 1981. – 194. – Р. 704–707.
10. Балалыкин А.С. Эндоскопическая абдоминальная хирургия. – М.: ИМА-пресс, 1996. – 152 с. 11. Савельев В.С., Буянов В.М., Корнилов Ю.М., Балалыкин А.С. Полипэктомия из желудка и толстой кишки через фиброскоп // Вестнхирургии. – 1975. – №2. – С. 26–31.
11. Заикин С.И., Левченко. Новая технология эндоскопической резекции слизистой оболочки при небольших плоских неоплазиях толстой кишки // Сибирский онкологический журнал. – 2010. – №2. – С. 22–23.
12. Евстигнеев А.Р. Применение полупроводниковых лазеров и светодиодов в медицине (научно-методический мате- риал). – Калуга: ЛАН РФ. – 2000. – 57 с.
13. Cooper H.S. Surgical Pathology of endoscopicaly removed malignant polyps of the colon and rectum // Am. J. Surg. Pathology. – 1983. – №7. – Р. 613–623.
J. Surg. Pathology. – 1983. – №7. – Р. 613–623.
14. Kyzer S., Begin L.R., Cordon P.H. et al. The care of patients with colorectal polyps that contein invasive adenocarcinoma // Cancer. – 1992. – № 70. – Р. 2040–2050.
15. Крылов Н. Н., Анисимова О. В. Колоректальный рак: актуальные проблемы // Хирургия. – 2005. – №1. – С. 67–69.
16. Kudo S. Early colorectal cancer. Detection of depressed types of colorectal carcinoma. – Tokyo: Igaku-Shoin, 1996. – 166 р.
17. Сhristie J.P. Polypectomy or colectomy? Management of 106 consecutively encountered colorectal polypes // Ann. Surgery. – 1988. – 54 (2) – Р. 93–99.
18. Ueno H., et al. Risk Factors for an Adverse Outcome in Early Invasive Colorectal Carcinoma // Gastroent. – 2004. – №127. – Р. 385–394.
Ueno H., et al. Risk Factors for an Adverse Outcome in Early Invasive Colorectal Carcinoma // Gastroent. – 2004. – №127. – Р. 385–394.
19. Williams B. The Rational for Current Practice in the Management of Malignant Colonic Polyps // Endoscopy. – 1993. – 25(7). – Р. 469–474.
20. Федоров В.Д. Эндоскопия при заболеваниях прямой и ободочной кишок: Атлас. – М.: Медицина. – 1978. – 183 с.
21. Корнилов Ю.М. Эндоскопическая хирургия подслизистых образований желудочно-кишечного тракта // Хирургия. – 1980. – №7. – С. 117–118.
22. Смагин В.Г. Проблемы эндоскопии в хирургической клинике // Хирургия. – 1976. – №7. – С. 59–67.
23. Spencer R.J., Coates H.L., Anderson M.J. Colonoscopic polypectomies // Mayo clin. Proc. – 1974. – Vol. 49, №1. – Р. 40–43.
Spencer R.J., Coates H.L., Anderson M.J. Colonoscopic polypectomies // Mayo clin. Proc. – 1974. – Vol. 49, №1. – Р. 40–43.
24. Karita M., Tada M., Okita K. The successive strip biopsy partial resection technique for large early gastric and colon cancers // Gastrointest. Endosc. – 1992. – Vol. 38. – Р.174–178.
25. Rembacken BJ, Gotoda T, Fujii T. et al. Endoscopic mucosal resection // Endoscopy. – 2001. – 33. – Р. 709–718.
26. Bergmann U., Beger H.G. Endoscopic mucosal resection for advanced non-polypoid colorectal adenoma and early stage carcinoma // Surg. Endosc. – 2003. – Vol. 17. – P. 475–479.
27. Ell C., May A., Gossner L. et al. Endoscopic mucosection of arly cancer and high-grade dysplasia in Barrett’s esophagus // Gastroenterology. – 2000. – Vol. 118. – P. 670–677.
– 2000. – Vol. 118. – P. 670–677.
28. Muto T., Kamiya J., Sawada T. et al. Small flat adenoma of the large bowel with special reference to its clinicopatological feature // Dis. Colon Rectum. – 1985. – Vol. 28: – Р. 857–861.
29. Десятов Е.Н., Алиев Ф.Ш., Машкин А.М. Возможности метода аргоноплазменной коагуляции в лечении стелющихся образований прямой кишки // Медицинский альманах. – 2010. – 3(12) – С. 146–149.
30. Tamura S., NaKajo K., Yokoyama Y. et al. Evaluation of EMR for laterally spreading rectul tumors // Endoscopy. – 2004. – Vol. 36. – Р. 306–312.
31. Yokata T., Sugihara K., Yoshida S. Endoscopic mucosal resection for colorectal neoplastic lesions // Dis. Colon Rectum.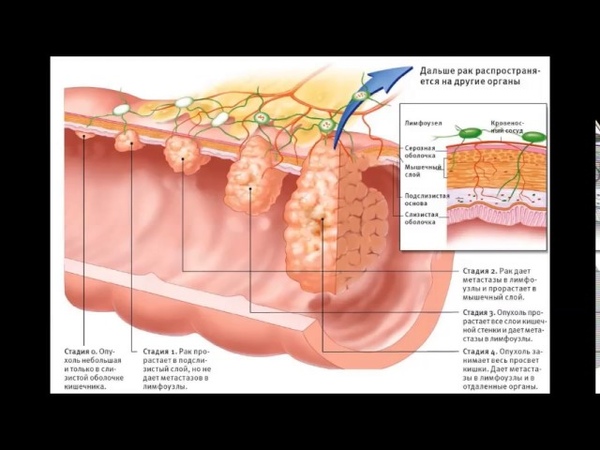 – 1994. – Vol. 37. – Р. 1108–1111.
– 1994. – Vol. 37. – Р. 1108–1111.
32. Ponchon T: Endoscopic mucosal resection // J. Clin Gastroenterol. – 2001. – 32. – Р. 6–10.
33. Соловьев И.А. Современные возможности эндоскопического лечения ранних форм рака прямой кишки // Вестник Национального медико-хирургического Центра им. Н.И.Пирогова. – 2007. – Т.2, № 2. – С. 46–49.
34. Chakravarty A., Compton C.C., Shellito P.C., et al. Long-term Follow-up of patients with rectal cancer managed by local excision with and without adjuvant irradiation // Ann. Surgery. – 1999. – №230 (1). – Р. 49–54.
35. Wagman R., Minsky B.D., Cohen A.M., et al. Conservative management of rectal cancer with local excision and postoperative adjuvant therapy // Int. J. Radiat. Oncol. Biol. Phys. 1999. – 44 (4) – Р. 841.
J. Radiat. Oncol. Biol. Phys. 1999. – 44 (4) – Р. 841.
36. Черемисина О.В., Вусик М.В., Солдатов А.Н., Рейнер И.В. Современные возможности эндоскопических лазерных техно- логий в клинической онкологии // Сибирский онкологический журнал. – 2007. – 4 (24). – C. 5–11.
37. Кузьмин-Крутецкий М.И. Возможности эндоскопического лече- ния раннего рака желудка и толстой кишки // Кремлевская медицина. Клинический вестник. – 2000. – No 6. – C. 9–13.
38. Bleday R. Local excision of rectal cancer // Word J. Surgery. – 1997. – №21 (7) – Р. 706–714.
39. Heinz A., Morschel M., Junginger T. Rectal carcinoma. Optimizing therapy by local excision // Zentralbl. Chir. – 1999. – 124 (5). – P. 436.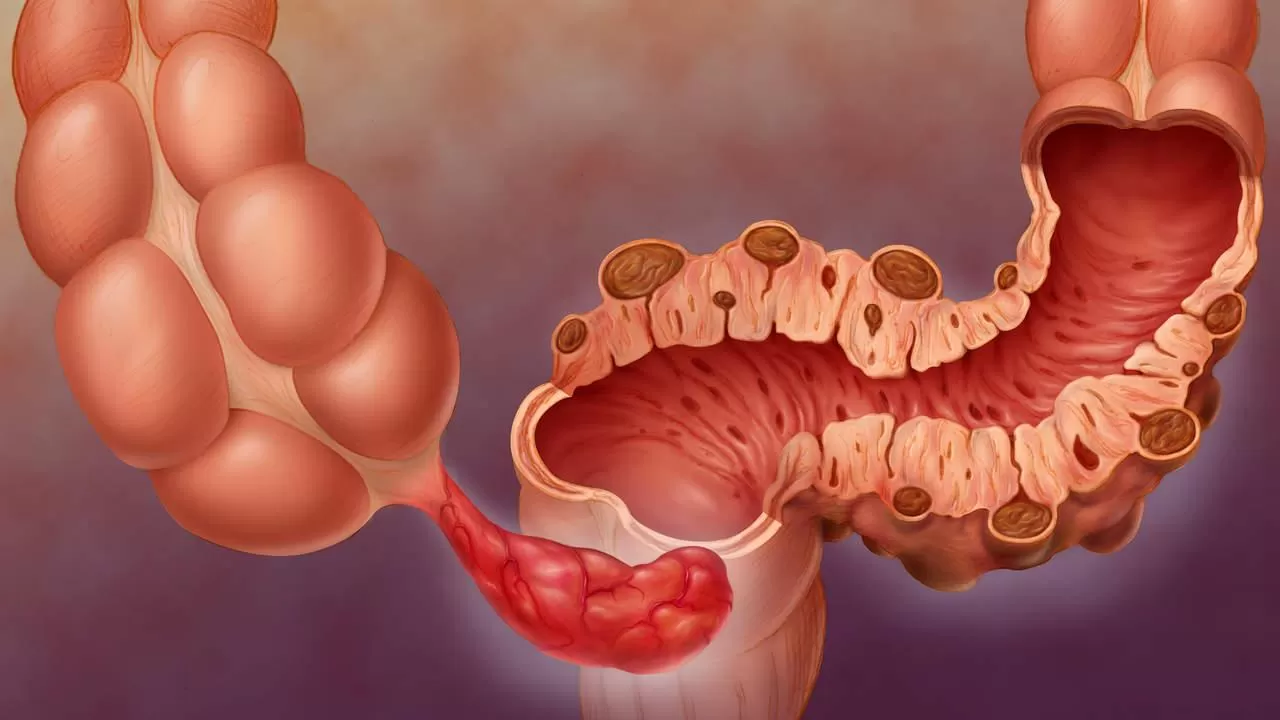
40. Pidala M.J., Oliver J.S. Local treatment of rectal cancer // Am. Fem. Physician. – 1997. – 56 (6). – P. 1622.
41. Varma N.G., Rogers S.J., Schrock T.R., et al. Local Excision of rectal carcinoma // Arch. Surgery. – 1999. – 138(8) – Р. 863.
Новообразования (опухоли) кишечника | Ветеринарная клиника доктора Шубина
Заболеваемость и факторы риска
Источниками развития новообразования в стенках кишечника могут служить эпителиальные, мезенхимальные, нейроэндокринные и дискретные/круглые клетки. В США, кишечные опухоли составляют менее 10% всех новообразований собак и кошек, и порядка 20%-30% всех алиментарных опухолей
Лимфома кишечника по частоте встречаемости стоит на первом месте, составляет порядка 30% всех новообразований кишечника у кошек и порядка 6% у собак. Аденокарцинома – вторая по встречаемости опухоль кишечника у собак и кошек, на третьем месте у кошек стоит мастоцитома, у собак – лейомиосаркома. Из доброкачественных опухолей чаще встречается слизистая аденома (полип). Малые полипы могут представлять из себя предраковые состояние (карцинома in situ), даже при множественных поражениях. Спорадически встречаются лейомиома, экстрамедуллярная плазмацитома, вне скелетная остеосаркома, гемангиосаркома и некоторые другие. У кошек новообразования кишечника чаще поражаются тонкие отделы кишечника, у собак чаще отмечаются колоректальные опухоли. Большинство новообразований тонкого отдела кишечника собак – злокачественные, колоректальные опухоли чаще доброкачественные (полипы, аденома или карцинома in situ).
Аденокарцинома – вторая по встречаемости опухоль кишечника у собак и кошек, на третьем месте у кошек стоит мастоцитома, у собак – лейомиосаркома. Из доброкачественных опухолей чаще встречается слизистая аденома (полип). Малые полипы могут представлять из себя предраковые состояние (карцинома in situ), даже при множественных поражениях. Спорадически встречаются лейомиома, экстрамедуллярная плазмацитома, вне скелетная остеосаркома, гемангиосаркома и некоторые другие. У кошек новообразования кишечника чаще поражаются тонкие отделы кишечника, у собак чаще отмечаются колоректальные опухоли. Большинство новообразований тонкого отдела кишечника собак – злокачественные, колоректальные опухоли чаще доброкачественные (полипы, аденома или карцинома in situ).
Как и большинство опухолей, новообразования кишечника чаще отмечаются у животных среднего и пожилого возраста. Средний возраст развития опухолей кишечника у кошек составляет 10-12 лет, риск развития начинает повышаться после 7-летнего возраста. Ранняя заболеваемость кошек лимфомой кишечника чаще связана с инфицированием вирусом лейкоза кошек (ВЛК, FeLV). Средний возраст развития опухолей кишечника у собак составляет 6-9 лет. Как у собак, так и у кошек отмечено небольшое повышение заболеваемости опухолями кишечника у самцов. Существует некоторая породная предрасположенность к заболеванию тем или иным видом опухолей кишечника: сиамские кошки более предрасположены к развитию аденокарциномы; собаки больших и гигантских пород более предрасположены к новообразованиям гладкой мускулатуры; колли и немецкая овчарка предрасположены к развитию аденокарциномы, ректальной карциномы и полипам; мальтезе более предрасположены к развитию мастоцитомы (среди миниатюрных пород).
Ранняя заболеваемость кошек лимфомой кишечника чаще связана с инфицированием вирусом лейкоза кошек (ВЛК, FeLV). Средний возраст развития опухолей кишечника у собак составляет 6-9 лет. Как у собак, так и у кошек отмечено небольшое повышение заболеваемости опухолями кишечника у самцов. Существует некоторая породная предрасположенность к заболеванию тем или иным видом опухолей кишечника: сиамские кошки более предрасположены к развитию аденокарциномы; собаки больших и гигантских пород более предрасположены к новообразованиям гладкой мускулатуры; колли и немецкая овчарка предрасположены к развитию аденокарциномы, ректальной карциномы и полипам; мальтезе более предрасположены к развитию мастоцитомы (среди миниатюрных пород).
Единственный установленный причинный фактор способный повлиять на вероятность развития лимфомы у кошек – реовирусы (ВЛК, ВИК), в остальных случаях новообразования кишечника причинные факторы не определяются. Заражение вирусом лейкоза кошек может вызывать развитие лимфосаркомы в любом возрасте, но при этом опухоли чаще локализуются вне кишечника.
Патология, поведение
Кишечная лимфома собак одинаково часто развивается в желудке и тонком отделе кишечника, и достаточно часто отмечается одновременное поражение как желудка так и тонкого отдела, в толстом кишечнике встречается достаточно редко. Поражения обычно диффузные с вовлечением подслизистого слоя и lamina propria кишечной стенки. Вероятно вовлечение в процесс других органов.
У кошек выделено несколько подтипов лимфомы (лимфосаркомы) кишечника: лимфоцитарный, лимфобластный, эпителиотропный подтипы, а также подтип больших зернистых лимфоцитов (оригинал LGL – large granular lymphocyte type). Поведение лимфомы кишечника кошек зависит от подтипа опухоли: кошки с лимфоцитарным/мелкоклеточным подтипом лимфомы при проведении химиотерапии в 69% случаев получают полную ремиссию со средним сроком жизни 2 года; кошки с лимфобластной лимфомой при проведении химиотерапии только в 18% случаев получают полную ремиссию со средним сроком жизни менее 3 месяцев.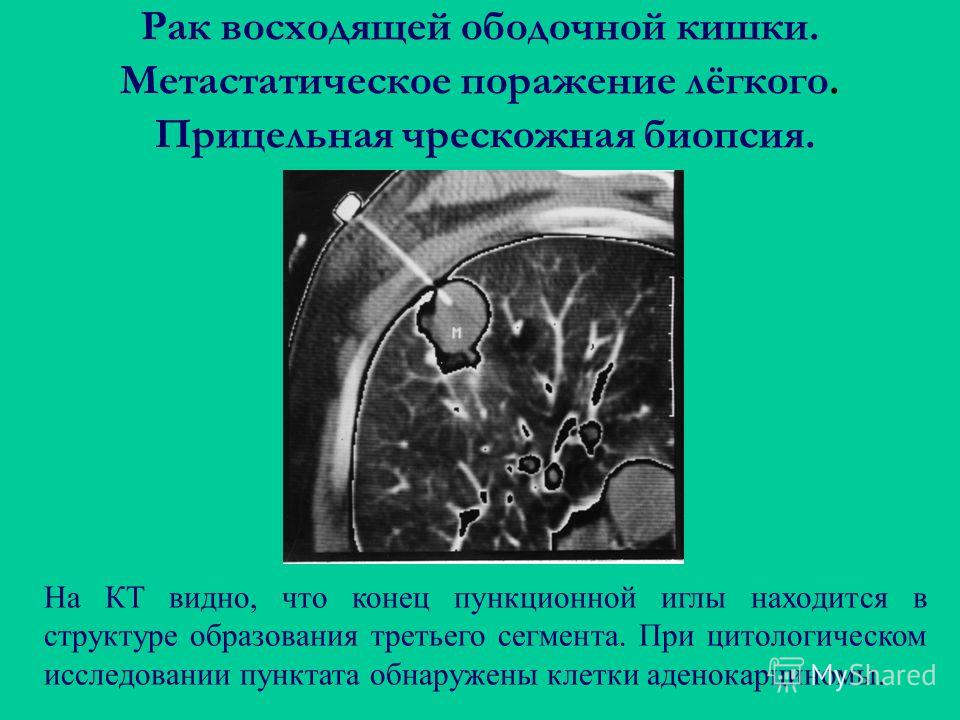 LGL лимфома кошек отличается крайне агрессивным поведением. Также, кошки с лимфобластной лимфомой чаще имеют пальпируемые массы на момент осмотра и чаще требуют проведения резекции кишечника для восстановления его проходимости по сравнению с лимфоцитарной лимфомой.
LGL лимфома кошек отличается крайне агрессивным поведением. Также, кошки с лимфобластной лимфомой чаще имеют пальпируемые массы на момент осмотра и чаще требуют проведения резекции кишечника для восстановления его проходимости по сравнению с лимфоцитарной лимфомой.
Большинство аденокарцином кишечника кошек локализуется в тонком отделе, у собак аденокарцинома чаще поражает ободочную и прямую кишку. При колоректальной аденокарциноме, прямая кишка поражается чаще чем ободочная. Внешне, колорекатальная аденокарцинома может быть с ножкой (особенно в дистальных отделах прямой кишки), в виде булыжника (средняя часть прямой кишки) или в виде кольца (средняя часть прямой кишки), что может корелировать с поведением и прогнозами.
Лейомиосаркома и желудочно-кишечная стромальная опухоль чаще поражают слепую кишку. Лейомиосаркома характерная для собак, у кошек встречается редко. Желудочно-кишечная стромальная опухоль (GIST) – нелимфоидная опухоль мезенхимального происхождения, описана для собак. Изначально диагностировалась как лейомиосаркома, отдифференцирована в отдельный вид достаточно не давно. Предположительно, данная опухоль развивается из клеток кишечных клеток Кахаля (Cajal), которые регулируют моторику кишечника через автономный эффект пейсмейкера.
Изначально диагностировалась как лейомиосаркома, отдифференцирована в отдельный вид достаточно не давно. Предположительно, данная опухоль развивается из клеток кишечных клеток Кахаля (Cajal), которые регулируют моторику кишечника через автономный эффект пейсмейкера.
Кишечная мастоцитома у кошек стоит на третьем месте по встречаемости после лимфомы и аденокарциномы, но истинная заболеваемость и поведение опухоли изучены не достаточно. Возникают некоторые трудности при дифференциации мастоцитомы от эозинофильного энтерита. Также, данный вид опухоли может быть спутан с карциноидом. Поражения чаще локализованы в тонком отделе кишечника, характерно трансмуральное поражение стенки кишки. У собак, мастоцитома чаще локализуется в желудке и двенадцатиперстной кишке.
Аденоматозные полипы чаще обнаруживаются в прямой кишке собак, а карцинома in situ обнаруживается как в ободочной так и прямой кишке. Большинство поражений у собак солитарные, однако вероятно формирование множественных и диффузных поражений, что может быть связано с повышенной частотой рецидивирования. У кошек поражения характерная локализация полипов – двенадцатиперстная кишка, обычно это солитарные поражения, но вероятна их множественность при при инфекции Strongyloides tumerfaciens.
У кошек поражения характерная локализация полипов – двенадцатиперстная кишка, обычно это солитарные поражения, но вероятна их множественность при при инфекции Strongyloides tumerfaciens.
Далее описаны опухоли кишечника, которые встречаются достаточно редко но заслуживают упоминания.
Карциноид, сам термин заболевания определяет опухоль развивающуюся из диффузной эндокринной системы, не смотря на гистологическое сходство с карциномой. Карциноид развивается из энтерохромаффинных клеток слизистой кишечника, и содержит секреторные гранулы которые способны продуцировать серотонин, секретин, соматостатин, гастрин и некоторые другие. Карциноид описан у множества видов животных, может развиваться как в толстом так и тонком отделах кишечника и часто метастазирует в печень. Карциноид характеризуется агрессивным поведением.
Экстрамедуллярная плазмацитома определяется как солитарная опухоль без признаков системной множественной миеломы. У собак и кошек встречается крайне редко.
У собак и кошек встречается крайне редко.
Внескелетная остеосаркома – описано поражение двенадцатиперстной кишки у кошек. Также у кошек описано несколько случаев кишечной гемангиосаркомы, которая отличалась крайне агрессивным поведением. У собаки описан единичный случай ганглионейромы прямой кишки, хирургическая резекция которая привела к длительной ремиссии.
Далее представлена характерная локализация метастазов при опухолях кишечника в порядке убывания: брыжеечные лимфоузлы (особенно аденокарцинома, печень (особенно лейомиосаркома), брыжейка, сальник, селезенка, почки, кости, брюшина/карциноматоз и легкие. У собак вероятно формирование метасатазов аденокарциномы кишечника в семенники. Лимфома желудочно-кишечного тракта зачастую имеете системное распространение, в 25% случаев у собак и 80% случаев у кошек лимфома кроме пищеварительного тракта поражает другие органы.
Таблица. Описание и некоторые особенности наиболее встречаемых новообразований (опухолей) кишечника собак и кошек.
Вид опухоли | Локализация | Особенности |
Лимфома собак | Желудок = тонкий кишечник > толстый кишечник | • Диффузные образования; инфильтрация в подслизистый слой и lamina propria |
Лимфома кошек | • Подтипы: лимфоцитарный, лимфобластный, эпителиотропный (только Т-клеточный) и LGL (быстро фатальный). | |
Аденокарцинома собак | Ободочная и прямая кишки. | • На ножке (особенно в дистальных участках прямой кишки), в виде булыжника (средний отдел прямой кишки), кольцеобразная (средний отдел прямой кишки). |
Аденокарцинома кошек | Чаще в тонком чем в толстом, но в толстом отделе – самая частая опухоль. | • Ободочная кишка – единственная опухоль ободочной кишки при которой химиотерапия повышает выживаемость. |
Мастоцитома | Желудок и тонкий кишечник | • Обычно плохо гранулирована |
Мастоцитома | Дистальный отдел тонкого кишечника и ободочная кишка | • Третья по распространенности опухоль кишечника кошек. |
Лейомиосаркома | Слепая кишка | |
Желудочно-кишечная стромальня опухоль (GIST) собак | Слепая кишка | • Развивается из кишечных клеток Кахаля (Cajal), которые регулируют моторику кишечника через автономный эффект пейсмейкера. |
Карциноид | Толстый и тонкий отделы кишечника | • Развивается из диффузной эндокринной системы |
Экстрамедуллярная плазмацитома собак и кошек | Чаще в ротовой полости, в кишечнике редко | • Отсутствуют системные признаки множественной миеломы |
Внескелетная остеосаркома кошек | Двеннадцатиперстная кишка | • Редкая опухоль |
Гемангиосаркома | Нет предрасположенности к месту | Агрессивное поведение, все кошки померли в течение 1 недели после операции |
Полипы собак | Прямая кишка | Чаще солитарные, но встречаются и множественные, диффузные поражения чаще рецидивируют |
Полипы кошек | Двенадцатиперстная кишка | Солитарные, но вероятны множественные массы при инфеицировании Strongyloides tumerfaciens |
Клинические признаки
Время от начала развития опухолей кишечника до момента обращения за помощью в среднем составляет 6-8 недель, но может варьировать от 1 дня до нескольких месяцев. Поводом обращения чаще служит потеря массы тела, рвота, понос, снижение аппетита, реже мелена и бледность (анемия).
Поводом обращения чаще служит потеря массы тела, рвота, понос, снижение аппетита, реже мелена и бледность (анемия).
История заболевания и клинические признаки во много связаны с локализацией новообразования в желудочно-кишечном тракте животного. Проксимальные опухоли тонкого отдела кишечника чаще вызывают такие признаки как рвота, потеря веса, новообразования слепой кишки чаще приводят к перфорации и перитониту, новообразования толстого отдела кишечника чаще вызывают гематохезию, тенезмы. Новообразования тонкого отдела кишечника чаще связаны с потерей массы тела животного, что может привести к более раннему обращению и идентификации опухоли на ранних этапах.
Абдоминальная пальпация выявляет новообразования кишечника в 20%-50% случаев у собак и 50%-86% случаев у кошек. Ректальное исследование способно идентифицировать массы или кольцеобразные структуры при опухолях и полипах прямой кишки.
Диагностика
При проведении обзорной радиографии брюшной полости, вероятно обнаружение локального утолщения кишечника (солидные массы), вероятна также идентификация обструктивного паттерна. Контрастная радиография может выявить место обструкции, определить место положение опухоли и оценить те участки кишечника которые не поддаются диагностической ультразвуковой визуализации из за скопления газов. Радиографическое исследование грудной клетки применяется не только для идентификации вероятных метастазов, но также для полной оценки пациента.
Контрастная радиография может выявить место обструкции, определить место положение опухоли и оценить те участки кишечника которые не поддаются диагностической ультразвуковой визуализации из за скопления газов. Радиографическое исследование грудной клетки применяется не только для идентификации вероятных метастазов, но также для полной оценки пациента.
Ультразвуковое исследование позволяет провести локализацию опухоли, идентифицировать метастазы и провести забор материала для цитологического исследования. УЗИ при новообразованиях кишечника обладает большей диагностической ценностью по сравнению с радиографическим исследованием.
Эндоскопическое исследование в последнее время находит все большее применение ввиду малой инвазивности и высокой диагностической ценности. Вероятно применения как эндоскопической лапароскопии так и эндоскопической оценки толстых и тонких отделов кишечника.
В случаях, когда неинвазивные и малоинвазивные методы не позволяют поставить окончательный диагноз – может быть показана диагностическая лапаротомия. Преимущества диагностической лапаротомии – возможность непосредственной визуализации поражений а также возможность забора биопсийного материала с захватом всей толщины стенки кишечника. У пациентов вероятно одновременное проведение хирургическое коррекции солидных опухолей – иссечения с наложением анастомозов.
Преимущества диагностической лапаротомии – возможность непосредственной визуализации поражений а также возможность забора биопсийного материала с захватом всей толщины стенки кишечника. У пациентов вероятно одновременное проведение хирургическое коррекции солидных опухолей – иссечения с наложением анастомозов.
Окончательный диагноз устанавливается по результатам патоморфологического исследования опухоли.
Лечение и прогнозы
За исключением лимфомы (лимфосаркомы) и некоторых случаев мастоцитом – основу лечения составляет хирургическая резекция, которая достижима во многих случаях. Эффективность химиотерапии у кошек и собак после хирургической резекции новообразований кишечника – не определена. У кошек и собак в начальных стадиях заболевания вероятно достижение длительной ремиссия после успешной резекции первичного новообразования.
При лимфоме кишечника кошек, основным методом лечения является химиотерапия, и основным прогностическим фактором способным определить выживаемость является ответ на химиотерапевтическое лечение. При адекватном ответе на химиотерапевтические препараты, среднее время жизни составляет порядка 17 месяцев. Дополнительным прогностическим фактором является инфекция вирусом лейкоза кошек (ВЛК), у ВЛК-положительных животных среднее время жизни не превышает 3 месяцев. Эффективность хирургического иссечения дискретных, солитарных лимфосарком кишечника не определена.
При адекватном ответе на химиотерапевтические препараты, среднее время жизни составляет порядка 17 месяцев. Дополнительным прогностическим фактором является инфекция вирусом лейкоза кошек (ВЛК), у ВЛК-положительных животных среднее время жизни не превышает 3 месяцев. Эффективность хирургического иссечения дискретных, солитарных лимфосарком кишечника не определена.
У кошек при аденокарциноме, порядка 50% случаев метастазируют в региональные лимфоузлы, 30% в брюшину (карциноматоз) и до 20% в легкие. При попытке хирургической резекции отмечается значительный периоперационный риск, но кошки выжившие 2 недели после операции способны к длительной жизни без рецидивов.
У собак при аденокарциноме и лейомиосаркоме порядка 50% случаев метастазируют в региональные лимфоузлы. Периоперативная смертность может достигать 30%-50%, основными ее причинами служат сепсис, перитонит или решение владельца животного об эвтаназии при неоперабельности опухоли. При успешности оперативного лечения – вероятна длительная ремиссия, у собак переживших операцию при лейомиосаркоме и желудочно-кишечной стромальной опухоли, среднее время жизни составляет 7,8-21,3 месяца.
При мастоцитоме кишечника собак успешность хирургического лечения не определена, большинство собак погибает в первый месяц после операции.
При колоректальной аденокарциноме собак прогнозы во многом зависят от стадии заболевания, на начальных стадиях вероятно полное иссечение новообразований с большой продолжительностью жизни.
При доброкачественных опухолях толстого отдела кишечника собак, прогнозы как правило благоприятные после адекватного хирургического лечения.
В качестве паллиативных мероприятий при неоперабельности опухолей могут быть предложены размягчители стула и колостомия.
Валерий Шубин, ветеринарный врач, г. Балаково
Структура доброкачественных новообразований толстой кишки, выявляемых при проведении скрининговых диагностических мероприятий на базе регионального консультативно-диагностического центра Текст научной статьи по специальности «Клиническая медицина»
О. А. Поповкина. — М.- 2008.- №8.- С.26-28.
— М.- 2008.- №8.- С.26-28.
3. Проблемы стоматологии / В.Д. Вагнер [и др.].— Екатеринбург. — 2005.- №1.- С. 22-23.
4. Ватте, А. Дент Арт.- 2002.- № 1.- С. 46-55.
5. Грошиков, М.И. Некарнозные поражения твердых тканей зубов / М.И. Грошиков.- М.: Медицина.- 1985.- 167 с.
6. Костиленко, Ю.П., Бойко И.В. Стоматология.- 2005.-№5.- С.10-13.
7. Селина, О.Б. Морфофункциональные аспекты заболеваний твёрдых тканей зубов, пародонта и слизистой оболочки полости рта: сб. научных тр. / О.Б. Селина.- Воронеж, 2004.- С. 77-82.
THE STRUCTURE OF SYSTEMIC AND LOCAL REASONS OF DISCOLOURING AND TOOTH SOLID TISSUES DEMINERALIZATION IN THE YOUNG AGE
S.YU. MAKSYUKOV, O.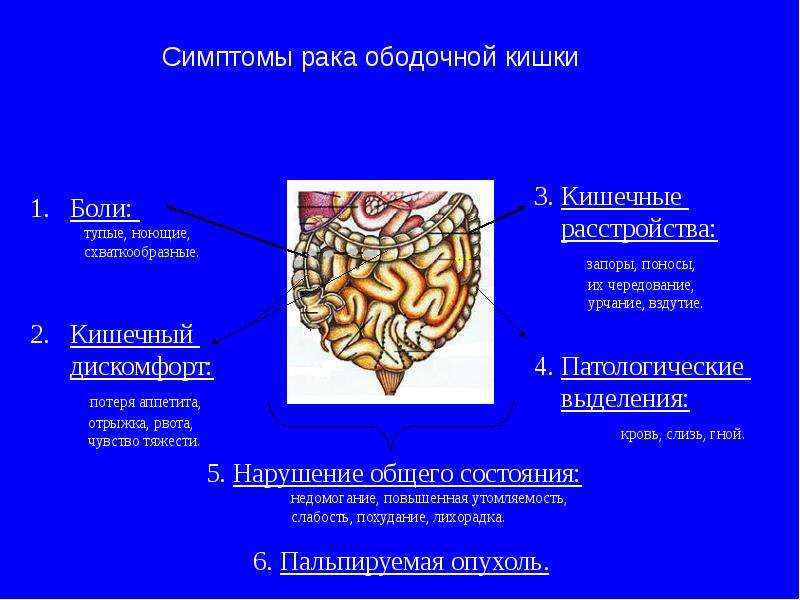 I. SHAKHBAZOV, D.N. GADZHIYEVA,
I. SHAKHBAZOV, D.N. GADZHIYEVA,
E.V. KURBATOVA
Rostov State Medical University
The article presents the analysis of the prevalence and reasons of discolouring and solid tooth tissue demineralization in young people. To prevent complications of whitening tooth discolouring before it hyperesthesia should be removed from solid tissues of teeth with taking into account the etiology of pathology.
Key words: discolouring, solid tooth tissue demineralization, prevalence, causes.
УДК: 616.318-006.6-039.19-039.3
СТРУКТУРА ДОБРОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ТОЛСТОЙ КИШКИ, ВЫЯВЛЯЕМЫХ ПРИ ПРОВЕДЕНИИ СКРИНИНГОВЫХ ДИАГНОСТИЧЕСКИХ МЕРОПРИЯТИЙ НА БАЗЕ РЕГИОНАЛЬНОГО КОНСУЛЬТАТИВНО-ДИАГНОСТИЧЕСКОГО ЦЕНТРА
Д. В. БУРЦЕВ*
В. БУРЦЕВ*
Проведен анализ структуры доброкачественных новообразований толстой кишки у пациентов, подвергнутых комплексу
диагностических скрининговых мероприятий на базе Ростовского областного консультативно-диагностического центра. В структуре доброкачественных новообразований толстой кишки по частоте преобладают полипы сигмовидной и прямой кишки, ободочной кишки. Колоноскопия является ведущим скрининговым методом по своевременному выявлению доброкачественных новообразований толстой кишки, ее активное использование в региональных консультативно-диагностических центрах позволяет своевременно выявить полипы толстой кишки и по результатам гистологического исследования кишечных биоптатов, определить начавшийся процесс перерождения полипов.
Ключевые слова: доброкачественные новообразования, толстая кишка, скрининг.
Скудность симптоматики колоректального рака и ее схожесть со многими другими заболеваниями толстой кишки [1], поздняя обращаемость за медицинской помощью — основные причины того, что только 30-40% пациентов раком толстой кишки могут быть подвергнуты радикальному хирургическому лечению, а в 60-70% случаев диагноз ставится на поздних стадиях заболевания [2].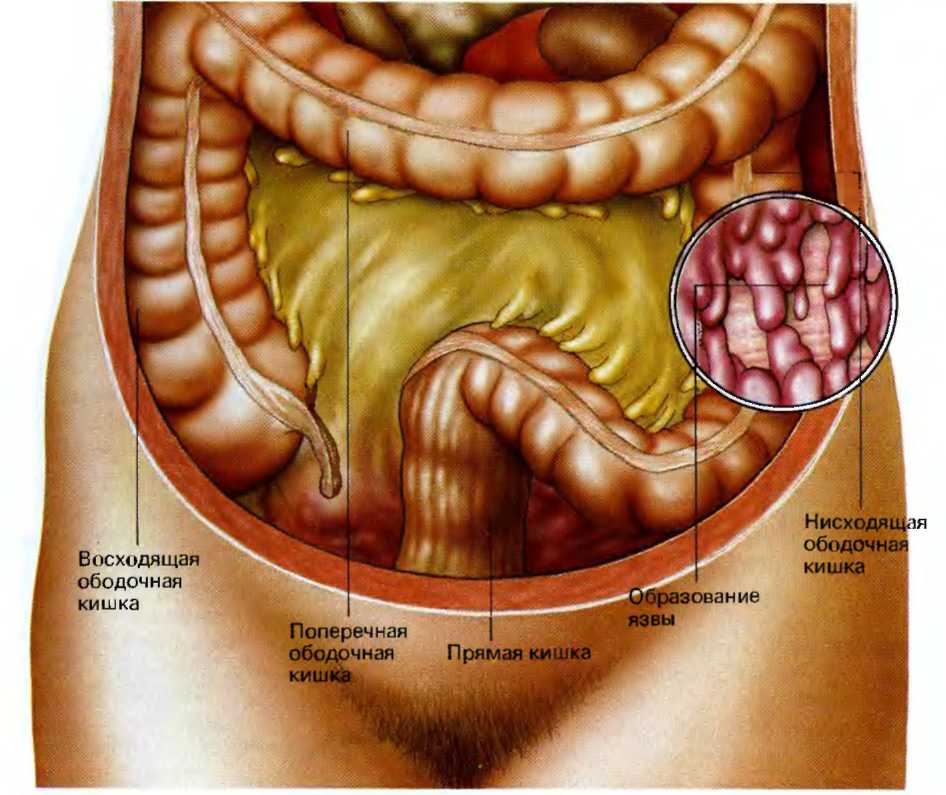 У большинства пациентов с колоректальным раком жалобы являются той отправной точкой, с которой начинается его контакт с врачом. По меткому выражению немецкого врача Vаclav Payer, одного из основоположников хирургии, рак может быть выявлен тогда, когда он заподозрен [2]. В современных условиях онконастороженность врачей общей практики и их тесное сотрудничество со специалистами региональных консультативно-диагностических центров является обязательным фактором в улучшении диагностики колоректального рака. На сегодняшний день при наличии подозрения у больного на полипы толстой кишки, пациент незамедлительно должен быть обследован на предмет верификации заболевания.
У большинства пациентов с колоректальным раком жалобы являются той отправной точкой, с которой начинается его контакт с врачом. По меткому выражению немецкого врача Vаclav Payer, одного из основоположников хирургии, рак может быть выявлен тогда, когда он заподозрен [2]. В современных условиях онконастороженность врачей общей практики и их тесное сотрудничество со специалистами региональных консультативно-диагностических центров является обязательным фактором в улучшении диагностики колоректального рака. На сегодняшний день при наличии подозрения у больного на полипы толстой кишки, пациент незамедлительно должен быть обследован на предмет верификации заболевания.
Новообразования толстой кишки развиваются медленно, проходя стадию аденоматозного полипа с последующим достаточно длительным процессом малигнизации. Эпидемиологические исследования показали, что на преобразование полипа толстой кишки в раковую опухоль уходит от 10 до 12 лет [3]. Боль-
Боль-
* ГБУ РО «Областной консультативно-диагностический центр», ул. Пушкинская, 127, г. Ростов-на-Дону, 344010, тел.: +7 (8632) 240-42-96, e-mail: [email protected]
шое значение имеют размеры и морфологическое строение аденоматозных полипов. Так, по морфологической структуре выделяют тубулярные, тубулярно-ворсинчатые и ворсинчатые аденомы. Частота малигнизации этих типов аденом составляет, соответственно, 5%, 23% и более 40-45% [4]. Такое же значение имеет и размер опухоли: при размере ворсинчатой опухоли до 1 см частота озлокачествления составляет около 10%, а более 2 см -53% [4]. У 20% больных, оперированных по поводу рака толстой кишки, недалеко от опухоли обычно обнаруживаются полипы [4]. Указанные выше наблюдения требуют самого настороженного и серьезного отношения к больным, у которых обнаружены полипы толстой кишки.
Цель исследования — выявление структуры доброкачественных новообразований толстой кишки у пациентов, подвергнутых комплексу диагностических скрининговых мероприятий на базе Ростовского областного консультативно-диагностического центра.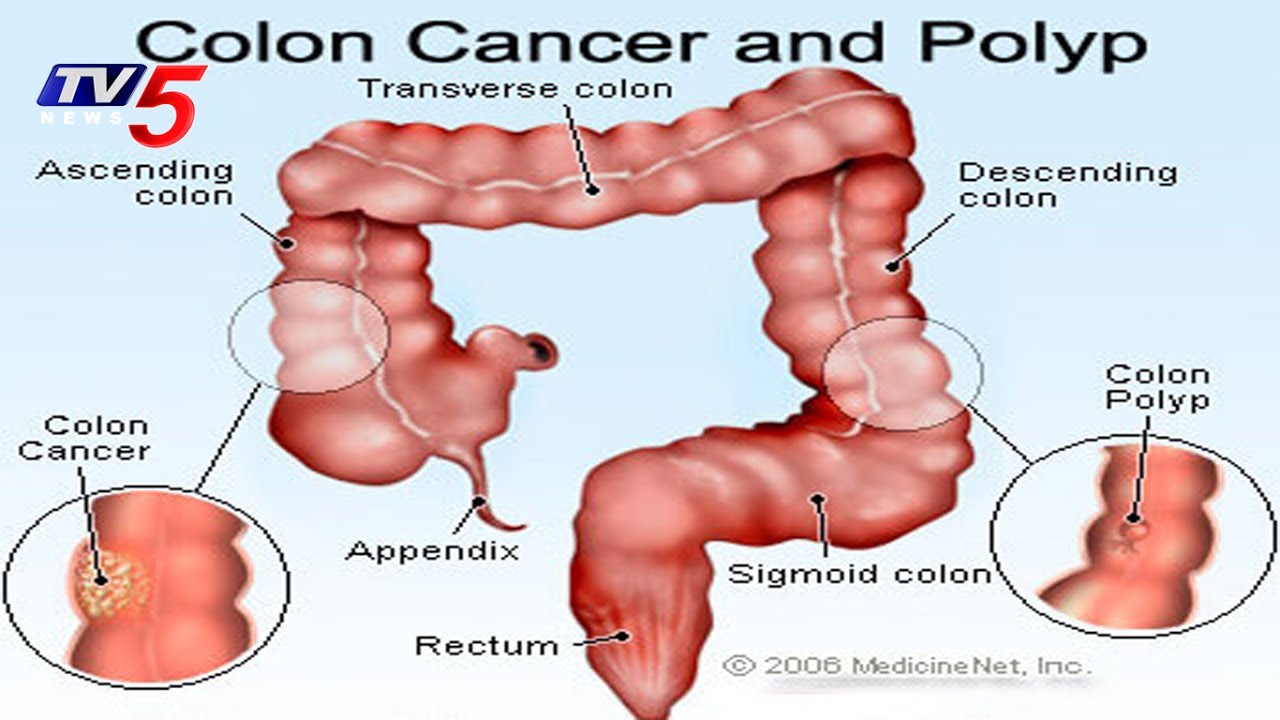
Материалы и методы исследования. Оценка распространенности доброкачественных новообразований толстой кишки (Э12.0-Э12.9 по МКБ-10) проведена среди больных, направленных в ГБУ РО «Областной консультативно-диагностический центр» г.Ростова-на-Дону с 2008 по 2011 гг. из лечебнопрофилактических учреждений первичного звена или по системе добровольного медицинского страхования. Для диагностики полипов толстой кишки были использованы скрининговые диагностические мероприятия: исследование стула на скрытую кровь, определение в крови уровня раково-эмбрионального антигена, онкомаркеров СА-19-9, СА-242, эндоскопические методики -колоноскопия и сигмоидоскопия. Диагноз доброкачественных новообразований толстой кишки был верифицирован по данным колоноскопии с биопсией кишки и последующим гистологическим анализом биоптата. Колоноскопия выполнялась с использованием видеоинформационных систем У-70, ЕУІ8 ЕХЕЯА и ЕУІ8 ЕХЕЯА-2 «ОЬУМРИЗ» (Япония), оснащенных видеоколо-носкопами. При этом по показаниям при выявлении патологических объектов применяли, кроме стандартной, магнификацион-ную эндоскопию с использованием видеоколоноскопа СР-180АІ с функцией 74-электронного увеличения без потери качества, что делало возможным различать мельчайшие структуры слизистой и позволяло проводить исследование, близкое по качеству к микроскопическому, а также узкоспектральную эндоскопию с помощью видеоколоноскопов «180» для коррекции изображения. При проведении колоноскопии прицельно забирали биоптаты толстой кишки для последующего гистологического исследования. Препараты окрашивали гематоксилином и эозином, проводили световую микроскопию. Структуру доброкачественных новообразований толстой кишки различной локализации оценивали в относительных единицах. Рассчитывали диагностическую нагрузку на одного пациента для верификации полипов толстой кишки определенной локализации.
При этом по показаниям при выявлении патологических объектов применяли, кроме стандартной, магнификацион-ную эндоскопию с использованием видеоколоноскопа СР-180АІ с функцией 74-электронного увеличения без потери качества, что делало возможным различать мельчайшие структуры слизистой и позволяло проводить исследование, близкое по качеству к микроскопическому, а также узкоспектральную эндоскопию с помощью видеоколоноскопов «180» для коррекции изображения. При проведении колоноскопии прицельно забирали биоптаты толстой кишки для последующего гистологического исследования. Препараты окрашивали гематоксилином и эозином, проводили световую микроскопию. Структуру доброкачественных новообразований толстой кишки различной локализации оценивали в относительных единицах. Рассчитывали диагностическую нагрузку на одного пациента для верификации полипов толстой кишки определенной локализации.
Статистическую обработку результатов проводили с использованием компьютерной программы
8ТАТІ8ТІСА 7. 0 (StatSoft, США).
0 (StatSoft, США).
Результаты и их обсуждение. У больных за 2008-2011 гг. при скрининговых мероприятиях на базе регионального консультативно-диагностического центра доброкачественные новообразования толстой кишки были выявлены у 1325 больных. Верификация диагноза происходила после гистологического исследования биоптатов стенки толстой кишки.
Структура доброкачественных новообразований толстой кишки, выявленных в результате скрининговых мероприятий, реализованных на базе Ростовского консультативнодиагностического центра (РОКДЦ), представлена в табл.1.
В 2008 году в структуре доброкачественных новообразований толстой кишки на первом месте по частоте находились случаи опухолей сигмовидной кишки (36%), на втором — полипы прямой кишки (15,6%) и на третьей — полипы восходящей ободочной кишки (11,8%). В 2009 году чаще других локализаций наблюдались доброкачественные новообразования сигмовидной (33,8%), прямой (15,3%) и нисходящей ободочной кишки (10,5%).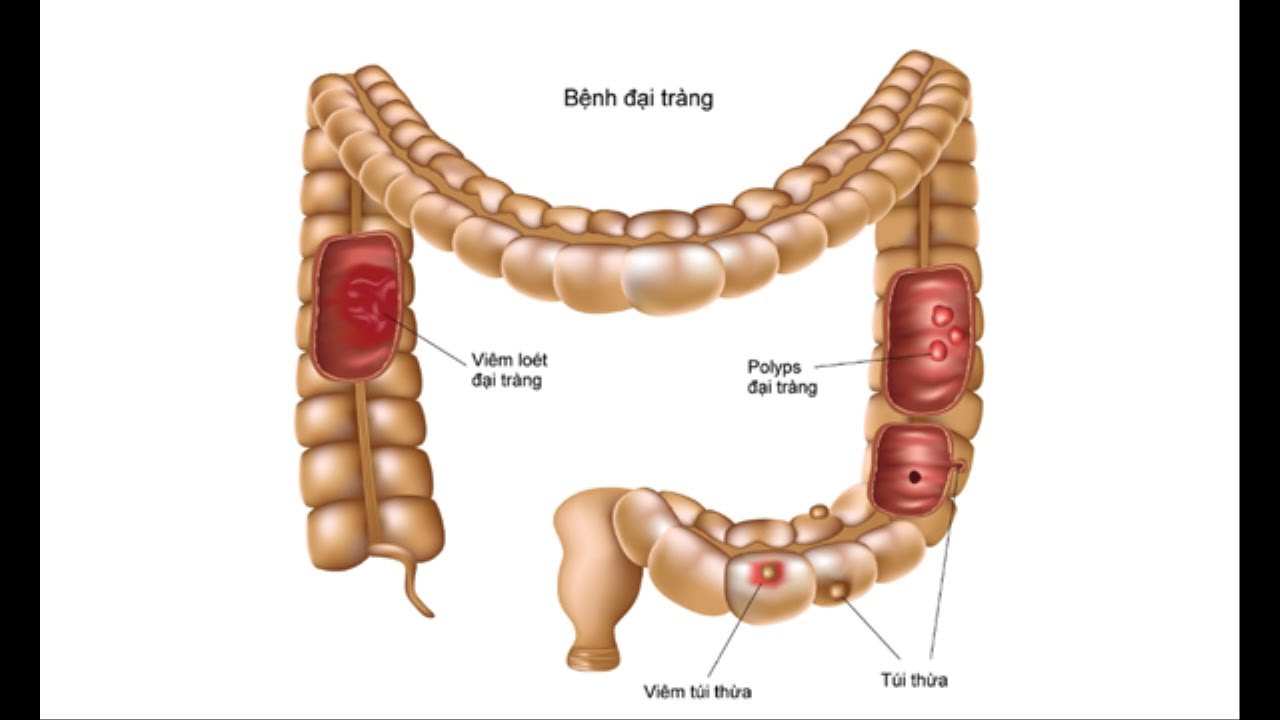 В 2010 и 2011 гг. частота доброкачественных новообразований сигмовидной кишки также преобладала над всеми другими локализациями и составила в 2010 году — 33,6%, а в 2011 году -37,9%. В 2010-2011 гг. частыми были случаи полипов прямой кишки, поперечной и восходящей ободочной кишки.
В 2010 и 2011 гг. частота доброкачественных новообразований сигмовидной кишки также преобладала над всеми другими локализациями и составила в 2010 году — 33,6%, а в 2011 году -37,9%. В 2010-2011 гг. частыми были случаи полипов прямой кишки, поперечной и восходящей ободочной кишки.
Таблица 1
Структура доброкачественных новообразований толстой кишки, выявленных в результате скрининговых мероприятий на базе РОКДЦ
Наименование выявленной патологии 2008 2009 2010 2011
абс. % абс. % абс. % абс. %
ДН слепой кишки (012.0) 7 3,3 23 7,3 20 5,3 23 5,5
ДН восходящей ободочной кишки (012.2) -с дисплазией 25 11,8 29 2 9,2 0,6 31 4 8,2 1,1 46 2 10,9 0,5
ДН поперечной ободочной ъкишки (012. 3) -с дисплазией 18 8,5 30 2 9,6 0,6 48 12,7 44 10,4
3) -с дисплазией 18 8,5 30 2 9,6 0,6 48 12,7 44 10,4
ДН нисходящей ободочной кишки (012.4) -с дисплазией 14 6,6 33 1 10,5 0,3 32 1 8,5 0,3 36 1 8,5 0,2
ДН сигмовидной кишки (012.5) -с дисплазией 76 7 36,0 3,3 106 6 33,8 1,9 127 8 33,6 2,1 160 7 37,9 1,7
ДН ободочной кишки неуточненной локализации (012.6) -с дисплазией 17 1 8,1 0,5 11 1 3,5 0,3 12 3,2 18 4,3
ДН ректосигмовидного соединения (012.7) 10 4,7 14 4,5 17 4,5 16 3,8
ДН прямой кишки (012.8) -с дисплазией 33 2 15,6 0,9 48 2 15,3 0,6 56 7 14,8 1,9 67 1 15,9 0,2
ДН ануса и анального канала (012.9) 1 0,5 6 1,9 15 4,0 1 0,2
Всего 211 100,0 314 100,0 378 100,0 422 100,0
Примечание: ДН — доброкачественное новообразование. В скобках указан шифр заболевания по МКБ
В скобках указан шифр заболевания по МКБ
Таблица 2
Количество диагностических исследований при верификации полипов толстой кишки различной локализации
Наименование выявленной патологии Общее количество исследований Количество исследований на 1 больного
2008 2009 2010 2011 2008 2009 2010 2011
ДН слепой кишки (012.0) 19 102 110 104 2,7 4,4 5,5 4,5
ДН восходящей ободочной кишки (012.2) -с дисплазией 108 123 8 160 30 204 8 4,3 4,2 4,0 5,2 7,5 4,4 4,0
ДН поперечной ободочной кишки (012.3) -с дисплазией 46 116 27 250 223 2,6 3,9 13,5 5,2 5,1
ДН нисходящей ободочной кишки (012. 4) -с дисплазией 55 133 2 122 3 204 6 3,9 4.0 2.0 3,8 3,0 5,7 6,0
4) -с дисплазией 55 133 2 122 3 204 6 3,9 4.0 2.0 3,8 3,0 5,7 6,0
ДН сигмовидной кишки (012.5) -с дисплазией 261 21 462 30 663 60 817 55 3,4 3,0 4,4 5,0 5,2 7,5 5,1 7,9
ДН ободочной кишки неуточнен-ной локализации (012.6) -с дисплазией 66 8 43 4 80 132 3,9 8,0 3,9 4,0 6,7 7,3
ДН ректосигмовидного соединения (012.7) 34 63 96 78 3,4 4,5 5,6 4,9
ДН прямой кишки (012.8) -с дисплазией 135 4 191 15 321 36 364 14 4,1 2,0 4,0 7,5 5,7 5,1 5,4 14,0
ДН ануса и анального канала (012.9) 6 23 87 4 6,0 3,8 5,8 4,0
Всего 763 1342 2018 2213 3,6 4,3 5,3 5,2
Количество диагностических исследований при верификации полипов толстой кишки различной локализации представлено в табл. 2.
2.
При пересчете количества исследований на 1 больного, удалось определить диагностическую нагрузку при выявлении доброкачественных опухолей толстой кишки различной локализации. В 2008 году диагностические трудности были наибольшими при верификации опухолей ободочной кишки. В 2009 году наибольшее количество исследований потребовалось для верификации полипов прямой и сигмовидной кишки. В 2010 году наблюдалось повышение количества исследований на 1 больного по всем изучаемым нозологиям, что объяснялось внедрением в лабораториях центра новых методик по определению онкомаркеров. Наибольшие диагностические трудности в 2010-2011гг. наблюдались при выявлении полипов ободочной кишки.
Таким образом, частой локализацией полипов толстой кишки являлись трудно доступные области поперечной оодочной кишки. Причем, диагностические трудности при выявлении доброкачественных новообразований этих областей были высокими. Объяснить это обстоятельство можно тем, что наиболее уязви-
Объяснить это обстоятельство можно тем, что наиболее уязви-
мыми местами толстой кишки являются места ее физиологического сужения, где чаще всего происходит длительная задержка кишечного содержимого, в результате чего изменяется количественный и качественный состав кишечной микрофлоры, накапливаются токсические вещества [1]. В связи с выявленными обстоятельствами, колоноскопия — является ключевым методом среди скрининговых диагностических мероприятий для выявления доброкачественных новообразований толстой кишки.
Согласно концепции развития системы здравоохранения в Российской Федерации до 2020 года, средства системы обязательного медицинского страхования (ОМС) доводятся до лечебных учреждений через частные страховые организации, которые не заинтересованы в повышении качества медицинской помощи застрахованным и снижении издержек на ее оказание. Дополнительным каналом поступления средств в лечебно-профилактические учреждения являются платные медицинские услуги и программы добровольного медицинского страхования (ДМС). Наличие этих источников, с одной стороны, позволяет лечебнопрофилактическим учреждениям в условиях недофинансирования получить дополнительные средства для зарплаты сотрудников и текущего содержания учреждения. Однако, существует мнение, что ДМС приводит к снижению доступности и качества медицинской помощи населению, обслуживаемому по программе государственных гарантий. В нашем исследовании было проанализировано, какова доля обслуживания больных по системе ОМС и ДМС при верификации полипов толстой кишки (табл.3).
Наличие этих источников, с одной стороны, позволяет лечебнопрофилактическим учреждениям в условиях недофинансирования получить дополнительные средства для зарплаты сотрудников и текущего содержания учреждения. Однако, существует мнение, что ДМС приводит к снижению доступности и качества медицинской помощи населению, обслуживаемому по программе государственных гарантий. В нашем исследовании было проанализировано, какова доля обслуживания больных по системе ОМС и ДМС при верификации полипов толстой кишки (табл.3).
Таблица 3
Количество исследований по системе ОМС и ДМС для верификации доброкачественных новообразований толстой кишки
Годы ОМС ДМС Всего
абс. % абс. % абс. %
2008 560 73,4 203 26,6 763 12,0
2009 900 67,1 442 32,9 1342 21,2
2010 1085 53,8 933 46,2 2018 31,8
2011 1246 56,3 967 43,7 2213 34,9
Всего 3791 59,8 2545 40,2 6336 100,0
В результате было установлено, что больные, обследованные по системе ДМС, составляли значимую долю среди пациентов, которым был установлен диагноз доброкачественных новообразований толстой кишки. Следовательно, прямые затраты на проведение исследования, были оправданы своевременно постановленным диагнозом заболевания.
Следовательно, прямые затраты на проведение исследования, были оправданы своевременно постановленным диагнозом заболевания.
Итак, проведение скрининговых мероприятий по выявлению доброкачественных новообразований толстой кишки на базе областного консультативно-диагностического центра является эффективным мероприятием как по системе ОМС, так и ДМС и способствует своевременной диагностике и лечению полипов толстой кишки, что предупреждает их последующую
малигнизацию и тем самым является профилактикой рака.
Выводы:
1. В структуре доброкачественных новообразований толстой кишки по частоте преобладают опухоли сигмовидной и прямой кишки, а также поражение ободочной кишки.
2. Колоноскопия является ведущим скрининговым методом
по своевременному выявлению доброкачественных
новообразований толстой кишки, ее активное использование в региональных консультативно-диагностических центрах позволяет своевременно выявить полипы толстой кишки и по результатам гистологического исследования кишечных биоптатов, определить начавшийся процесс перерождения
полипов или дисплазии.
Литература
1. Емельянов, С.И., Эндоскопическая хирургия / С.И. Емельянов, С.Е. Урядов.-№ 4.- 2010.- С 18-23.
2. Мейерхардт, Дж. Рак толстой кишки./ Дж. Мейерхардт, М. Сандерз.- М.: ООО «Рид Элсивер».- 2009.- 186 с.
3. Пророков, В.В. Практическая онкология:избранные лекции / В.В. Пророков, А.Г. Малихов, В.И. Кныш.- СПб., 2004.-С. 162-167.
4. Урядов, С.Е. Диагностическая и лечебная колоноскопия /С.Е. Урядов.- М.: Издательство Панфилова.- 2010.- 176 с.
STRUCTURE OF GOOD-QUALITY TUMOURS OF COLON, IDENTIFIED IN THE SCREENING DIAGNOSTIC ACTIVITIES BASED ON REGIONAL
CONSULTATIVE-DIAGNOSTIC CENTER D.V. BURTSEV Rostov-on-Don Regional Consultative and Diagnostic Centre
The article presents the analysis of colon non-malignant growth structure at patients after complex diagnostic screening on the basis of the Rostov Regional Consultative and Diagnostic Centre. In the structure of colon non-malignant neoplasms sigmoid, rectum and colon polyps predominate. Colonoscopy is a leading screening method for early detecting colon malignant neoplasms, its active application in the regional consultative-diagnostic centres allows identifying colon polyps and histological study of intestinal bioptats, define the process of rebirth polyps.
Key words: good-quality tumours, colon, screening.
УДК 616.284-004
ЛАЗЕРНЫЙ АВТОДИННЫЙ ЭФФЕКТ И ЕГО ПРИМЕНЕНИЕ В ИЗМЕРЕНИИ КОЛЕБАНИЙ БАРАБАННОЙ ПЕРЕПОНКИ
О.В. МАРЕЕВ*, Д.А. УСАНОВ**, А.В. СКРИПАЛЬ**, Г.О. МАРЕЕВ*
Исследование посвящено оценке состояния структур среднего уха при помощи современных нанотехнологических методов. Приведены результаты собственных исследований подвижности барабанной перепонки при помощи лазерного автодинного измерителя и их значение в дифференциальной диагностике заболеваний уха.
Ключевые слова: лазерный автодин, среднее ухо, барабанная перепонка, тугоухость.
Материалы и методы исследования. В настоящее время в связи с созданием лазерных автодинов на квантоворазмерных структурах появилась возможность проводить измерения микро-и нановибраций биологической ткани in vivo. Для автодинной системы ближайшим аналогом является интерференционная система, но в отличие от нее в автодине опорное и измерительное плечо являются совмещенными, что устраняет необходимость применения делителей излучения, приводя к уменьшению потерь в «полезном сигнале» и уменьшая требования к мощности используемого излучателя. В отличие от гетеродинных систем с двумя излучателями мы используем гомодинную конфигурацию, в которой один генератор выступает в качестве источника и приемника излучения, вследствие этого нет необходимости контроля обеспечения равенства рабочих частот, как в гетеродинной системе.
Автодинный эффект основан на изменении режима работы лазерного диода при возвращении части излучения обратно в его резонатор, данная система обладает высокой чувствительностью к отраженному сигналу. В основу большинства лазерных гомо-динных методов для измерения амплитуды синусоидальных колебаний положена прямо пропорциональная зависимость, связывающая амплитуды спектральных составляющих выходного сигнала детектора с функциями Бесселя соответствующих порядков. Благодаря указанной зависимости можно использовать закономерности, присущие функциям Бесселя, для обработки интерференционного сигнала [1,2].
Для измерения амплитуды колебаний барабанной перепонки человека экспериментальная установка для измерения нановибраций лазерным автодинным методом должна быть модифицирована таким образом, чтобы отвечать условиям проведения экспериментов in-vivo и in-vitro. Для исключения посторонний вибраций установка должна быть жестко сопряжена с объектом исследования. В состав измерительной автодинной системы (рис. 1) В состав измерительной лазерной автодинной системы (внешний вид — рис. 2.5, принципиальная схема устройства -рис. 2.6) входит автодинный лазерный диод типа RLD-650 на квантоворазмерных структурах с дифракционно-ограниченной одиночной пространственной модой с характеристиками: мощность излучения 5 мВт, длина волны 652 нм, пороговый ток 20 мА. На барабанную перепонку 1 направлено когерентное излучение от лазерного диода 3, запитываемого от источника тока
4. Для обеспечения прямой видимости барабанной перепонки использована воронка 2. Отраженное от барабанной перепонки 1 лазерное излучение регистрируется с помощью фотоприемника 5.
Сигнал с фотоприемника поступает через широкополосный усилитель, содержащий фильтр переменного сигнала 6 в аналогоцифровой преобразователь 7 и затем — в персональный компьютер 8, где специальной программой производится обработка его сигнала — построение спектра автодинного сигнала и по команде оператора — вычисление амплитуды колебаний барабанной перепонки. Сигнал подается при помощи генератора звукового сигнала 9 с усилителем в громкоговоритель 10, таким образом, все исследование проходит в свободном звуковом поле. В качестве аналого-цифрового преобразователя нами был использован преобразователь Е14-140 производства отечественной фирмы Ь-Сагё. Для исследований нами использовался режим работы каналов аналого-цифрового преобразователя 0.625 В и частота дискретизации 50-100 кГц.
Рис. 1. Принципиальная схема работы лазерного автодинного измерителя колебаний барабанной перепонки: 1 — барабанная перепонка,
2 — расширительная воронка, 3 — лазерный диод на квантово размерных структурах, 4 — источника тока лазерного диода, 5 — фотоприемник,
6 — широкополосный усилитель, содержащий фильтр переменного сигнала, 7 — аналого-цифровой преобразователь, 8 — компьютер, 9 — генератор звуковых колебаний, 10 — излучатель звуковых волн.
ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского, ул. Б. Казачья, д. 112, г. Саратов, 410012
ФГБОУ ВПО Саратовский государственный университет им. Н.Г. Чернышевского, ул. Астраханская, 8, г. Саратов, 410012
Рис. 2. Средние АЧХ интактного среднего уха человека при измерениях при различных УЗД частотном диапазоне 250-4000 Гц со стимуляцией в свободном звуковом поле. Для 75 и 85 дБ показаны границы дисперсии средних значений (нормативные значения для сравнений с патологическими изменениями АЧХ в других группах)
Для обработки сигнала нами была использована оригинальная программа математического анализа спектра автодинного сигнала «Виброметр — многофункциональный СВЧ и лазерный измерительный комплекс для решения задач нано- и биомедицинских исследований», разработанная на кафедре физики твердого тела Саратовского государственного медицинского университета. Программа написана на языке Visual C и работает на персональных компьютерах с операционной системой Windows XP и средой Microsoft.NET. В режиме реального времени эта программа позволяет производить выборку из непрерывно поступающего на анализ автодинного сигнала и проводить вычисление амплитуды смещения по любому из трех способов обработки сигнала, которые были изложены в предыдущем разделе. Выбор способа обработки производится оператором в зависимости от вида спектра автодинного сигнала. Также программа позволяет сохранять автодинный сигнал в файлы для дальнейшей обработки.
Для измерения подвижности барабанной перепонки in vivo использовалась лазерная автодинная установка, описанная выше, укрепленная на голове обследуемого при помощи устройства для фиксации ее на голове обследуемого. На устройство для фиксации оптических измерительных приборов на голове обследуемого нами получен патент на полезную модель №95997. Для боль-
Симптомы, причины, диагностика и лечение
ИСТОЧНИКИ:
Клиника Кливленда, отделение гастроэнтерологии и гепатологии.
CDC.
Американская ассоциация семейных врачей.
Национальные институты здравоохранения.
Целевая группа профилактических услуг США.
Американское общество клинической онкологии: «Колоректальный рак», «Роль химиотерапии в улучшении выживаемости у пациентов с раком толстой кишки стадии IV без операции: анализ NCDB», «Последующее наблюдение при колоректальном раке.«
Американское онкологическое общество:« Колоректальный рак »,« Стромальная опухоль желудочно-кишечного тракта (GIST) »,« Ингибиторы иммунных контрольных точек для лечения рака »,« Что такое иммунотерапия рака? »« Противораковые вакцины »,« Моноклональные антитела для лечения рака », «Сколько людей заболевают колоректальным раком?» «Как диагностируется колоректальный рак?» «Шесть способов снизить риск рака толстой кишки», «Скрининговые тесты на рак прямой кишки», «Часто задаваемые вопросы о колоноскопии и сигмоидоскопии», «Иммунотерапия колоректального рака», «Понимание целевой терапии», «Руководство по паллиативной или поддерживающей терапии». , »« Что такое иммунотерапия »,« Что происходит после лечения колоректального рака? »« Если лечение колоректального рака перестает работать »,« Каковы основные статистические данные о колоректальном раке? » «Как лечится колоректальный рак?» «Хирургия колоректального рака», «Абляция и эмболизация для лечения колоректального рака», «Химиотерапия колоректального рака», «Таргетная терапия колоректального рака», «Вопросы, которые могут возникнуть у вас о таргетной терапии рака», «Лучевая терапия при колоректальном раке.»
Американский колледж гастроэнтерологии:« Колоректальный рак ».
Американская академия семейных врачей: «Колоректальный рак».
Cancer Research UK: «Рак кишечника», «Побочные эффекты лучевой терапии рака кишечника».
Национальный институт рака: «Колоректальный рак — версия для пациентов», «Словарь терминов по раку NCI», «Лечение рака толстой кишки (PDQ), «Целенаправленная терапия рака», «Последующее наблюдение после лечения рака».
Клиника Мэйо: «Рак толстой кишки», «Типы процедур биопсии, используемые для диагностики рака», «Ниволумаб (внутривенное введение): побочные эффекты.»
WebMD Медицинский справочник Американского колледжа врачей:« Раздел 12 V Colorectal Cancer. ”
CDC:« Что такое колоректальный рак? »
Дайслер, Д. Журнал клинической колоректальной хирургии, августа 2007 г.
Медицина Джона Хопкинса: «Брахитерапия».
Национальный центр биотехнологической информации: «Колоректальный рак: диагностика и лечение колоректального рака».
Медицинский центр Университета Миссисипи: «Биопсия и патология колоректального рака.«
Screenforcoloncancer.org:« Колоноскопия ».
Университетские больницы Онкологический центр Сейдмана:« Колоноскопия ».
Онкологический совет (Австралия):« Лечение рака на поздних стадиях ».
FDA: «Руководство по лекарствам Keytruda».
Техасская онкология: «Рак толстой кишки IV стадии».
UptoDate: «Обучение пациентов: лечение колоректального рака; метастатический рак (помимо основ)».
CancerNetwork.com: «Сможет ли ДНК-вакцина TetMYB изменить правила игры при прогрессирующем колоректальном раке?»
Американское общество хирургов толстой и прямой кишки.
Кливлендская клиника: «Рак прямой и толстой кишки».
Национальная комплексная онкологическая сеть: «Ответственность за последующее наблюдение».
Опухоли тонкой кишки | Больницы и клиники Университета Айовы
Опухоли тонкой кишки встречаются редко. Они могут быть доброкачественными (незлокачественными) или злокачественными (злокачественными). Некоторые изначально доброкачественные опухоли могут прогрессировать в злокачественные. Обычно опухоли тонкой кишки остаются незамеченными в течение длительного времени. Большинство из них обнаруживаются при обследовании кишечника по другим причинам.
Доброкачественные опухоли тонкой кишки
В тонком кишечнике может развиваться множество различных видов доброкачественных опухолей.
- Лейомиома
- Это опухоли, которые растут в мышечном слое кишечной стенки, они могут вызывать кровотечение и их трудно диагностировать. Этот тип опухоли может стать злокачественным.
- Аденомы
- Это опухоли, которые развиваются в железистых клетках. Они часто становятся злокачественными и могут вызвать закупорку кишечника.
- Липомы
- Это обычно безвредные скопления жира на стенке кишечника. Они не могут стать злокачественными, их нужно удалять только в том случае, если они становятся очень большими и вызывают осложнения.
- Гемангиомы
- Это скопления кровеносных сосудов, которые образуют доброкачественные сосудистые опухоли в стенке желудка и кишечника. Они могут вызвать сильное кровотечение в желудочно-кишечном тракте и могут потребовать лечения.
- Нейрогенные опухоли
- Это доброкачественные опухоли, которые развиваются из нервной ткани.
Злокачественные опухоли тонкой кишки
Раковая опухоль классифицируется как злокачественная. Рак тонкой кишки подразделяется на пять различных типов. Классификация зависит от типа клеток, в которых впервые развивается рак. Типами рака, обнаруживаемого в тонком кишечнике, являются аденокарцинома, саркома, карциноидные опухоли, стромальная опухоль желудочно-кишечного тракта и лимфома. Аденокарцинома — самый распространенный тип рака тонкой кишки.
Аденокарцинома начинается в слизистой оболочке тонкой кишки в железистых клетках.Опухоли, которые развиваются при этом типе рака, возникают в верхней части тонкой кишки и могут разрастаться, блокируя кишечник.
Факторы риска рака тонкой кишки
Наличие в семье рака тонкой кишки является самым большим фактором риска. Другие факторы и состояния, которые могут увеличить риск развития рака тонкой кишки, включают:
- Диета с высоким содержанием жиров
- Болезнь Крона
- Глютен
- Унаследованные синдромы
Унаследованный синдром может увеличить риск развития рака тонкой кишки.Генетические тесты могут определить, есть ли у вас синдром наследственного рака. Если вы считаете, что в вашей семье может быть наследственный синдром рака, поговорите со своим врачом.
Симптомы опухоли тонкой кишки
Признаки опухоли тонкой кишки очень похожи на признаки и симптомы других желудочно-кишечных заболеваний. Если вы испытываете симптомы, обратитесь к врачу.
- Боль / спазмы в животе
- Необъяснимая потеря веса
- Тошнота / рвота
- Кровь в стуле (чаще всего черного или смолистого цвета)
- Шишка в брюшной полости
Диагностика
Многие из перечисленных выше опухолей очень сложно диагностировать.Если вы страдаете от симптомов опухоли тонкой кишки, ваш врач может провести ряд анализов, чтобы определить причину. Сюда могут входить:
- Эндоскопия
- Небольшую гибкую трубку с камерой можно ввести во многие области желудочно-кишечного тракта, включая тонкий кишечник. Во время этого обследования также может быть сделана биопсия — образец ткани для исследования. Биопсия может определить, является ли опухоль доброкачественной или злокачественной.
- Эндоскопическое УЗИ
- Это обследование может помочь врачам увидеть и определить, где может быть опухоль в стенке кишечника.
- Верхняя серия GI
- После употребления жидкости, содержащей барий, будет сделана серия рентгеновских снимков пищевода, желудка и тонкой кишки. Бариевое покрытие помогает врачам улучшить зрение. Рентген можно делать в разное время, когда барий проходит через желудочно-кишечный тракт.
- Дополнительные визуализационные тесты
- КТ или МРТ могут показать аномалии желудочно-кишечного тракта и помочь исключить другие состояния.
Лечение
Если в тонкой кишке обнаружена опухоль, методы лечения могут сильно различаться.В зависимости от типа опухоли, ее серьезности, доброкачественности или злокачественности, все зависит от лечения. Если опухоль симптоматическая, ее, скорее всего, необходимо удалить хирургическим путем.
Лечение рака тонкой кишки
Рак тонкой кишки встречается редко по сравнению с раком желудка или толстой кишки. Стадии рака тонкой кишки зависят от того, насколько далеко он распространился и на какие участки тела он проник. Скорее всего, будет использовано комбинированное лечение хирургии, лучевой терапии и химиотерапии.
92% колоректальных полипов у пациентов, направленных на операцию, были доброкачественными, что позволяет предположить, что передовые эндоскопические методы лечения могут быть жизнеспособным вариантом — ScienceDaily
заболеваемость раком на самом деле ниже, чем предполагалось ранее, и использование более продвинутых эндоскопических методов, которые защищают толстую кишку, может быть лучшей и более безопасной альтернативой традиционной операции в определенных случаях, согласно результатам исследования, опубликованным в Интернете в журнале Американского колледжа Хирурги перед публикацией в печати.
Скрининг и удаление предраковых полипов во время колоноскопии в значительной степени ответственны за снижение заболеваемости колоректальным раком среди американцев. Однако у значительной части людей, которым проводят колоноскопию, большие полипы считаются слишком сложными для эндоскопического удаления. В таких случаях таких пациентов направляют на хирургическую резекцию для удаления полипов.
«В настоящее время большинство пациентов подвергаются резекции толстой кишки по поводу больших полипов, не содержащих раковых клеток, что означает, что во многих случаях толстая кишка удаляется по доброкачественным причинам, основанным на субъективных критериях», — сказал ведущий автор исследования Эмре Горгун. MD, FACS, FASCRS, штатный хирург отделения колоректальной хирургии клиники Кливленда, Огайо.
В рамках исследования доктор Горгун и его коллеги стремились оценить фактическую заболеваемость инвазивным раком у пациентов, направленных на хирургическую резекцию больших, очевидно доброкачественных колоректальных полипов.
В этом единственном центре ретроспективного исследования клиники Кливленда исследователи изучили медицинские записи 439 пациентов, перенесших колэктомию за 15-летний период. Колоректальные полипы считались слишком сложными для стандартного эндоскопического лечения. Решение о эндоскопическом лечении полипа зависит от множества факторов, включая размер полипа, риск кровотечения и перфорации (стенка толстой кишки тонкая и легко может быть разорвана), сложность локализации и усмотрение эндоскописта.
У всех пациентов, включенных в это исследование, были полипы, которые не были диагностированы как рак до хирургических вмешательств. Во время колоноскопии полип, который может казаться доброкачественным (например, иметь мягкую консистенцию), удаляется, а ткань отправляется патологу для подтверждения биопсии.
Всего рак был выявлен в финальной патологии всего у 37 пациентов. «Важным открытием этого исследования является то, что только 8 процентов пациентов, перенесших колэктомию по поводу большого, очевидно доброкачественного полипа, имели рак, а это означает, что у 92 процентов пациентов удалили толстую кишку по доброкачественным причинам», — сказал доктор.- сказал Горгун. «Но резекция толстой кишки не является бесплатной — это серьезная операция на брюшной полости, связанная с риском серьезных побочных эффектов».
Частота осложнений после колоректальных процедур в исследовании составила почти 20 процентов. В общей сложности у 83 пациентов развились осложнения в течение 30 дней после операции, и частота осложнений была одинаковой в группах доброкачественных и злокачественных опухолей.
«Наше исследование по-настоящему открывает глаза; это первый шаг, демонстрирующий низкую заболеваемость раком в этих больших полипах, что не так, как считалось ранее», — сказал доктор.- сказал Горгун.
Помимо улучшения качества жизни пациентов и снижения затрат для систем здравоохранения, лечение этих типов полипов с помощью более совершенных эндоскопических методов могло бы избежать многих осложнений. Более продвинутые методы включают две процедуры, называемые эндоскопической резекцией слизистой оболочки (EMR) и эндоскопической диссекцией подслизистой оболочки (ESD).
Однако эти передовые процедуры эндоскопии и другие передовые подходы, сочетающие эндоскопию и лапароскопию, требуют врачей со специальными навыками и подготовкой.Хорошая новость заключается в том, что опытные врачи могут успешно лечить эти большие, технически сложные полипы без ущерба для толстой кишки.
«Эти данные свидетельствуют о том, что нам необходимо изменить наш хирургический подход, чтобы обеспечить более качественное обслуживание каждого пациента. У пациента с эндоскопически неоперабельным колоректальным полипом, который выглядит доброкачественным, обычно безопасен более консервативный, органосохраняющий подход к их удалению», — сказал доктор Горгун. «Наши результаты показывают, что следует рассмотреть передовые эндоскопические методы или лапароскопический подход, если нет высокого подозрения на рак.«
Авторы исследования отметили, что основными ограничениями исследования являются его ретроспективный характер и длительный интервал времени, в течение которого оно проводилось. За последнее десятилетие было сделано много медицинских и технических достижений. Тем не менее, авторы приходят к выводу, что количество и однородность популяции пациентов в этом исследовании позволяют прокомментировать риск недиагностированного рака у явно доброкачественных колоректальных полипов и последствия невыполнения этого диагноза до операции.
мезенхимальных опухолей слизистой оболочки толстой и прямой кишки — это доброкачественные лейомиомы, которые следует отделять от стромальных опухолей желудочно-кишечного тракта — клинико-патологическое и иммуногистохимическое исследование восьмидесяти случаев толстой кишки
В этом исследовании мы проанализировали серию из 88 лейомиом слизистой оболочки. и прямая кишка. Эти опухоли в настоящее время все чаще признаются случайными находками при колоректальной эндоскопии, проводимой для скрининга рака или наблюдения за полипами. В некоторых случаях их называют подслизистыми лейомиомами, но на самом деле они возникают в слизистой мышечной оболочки, которая облитерируется, и тогда поражение располагается непосредственно под поверхностным эпителием.Ограничение поражений мышечной оболочкой слизистой оболочки делает их пригодными для полного эндоскопического удаления, поскольку при захвате поражения инструментом втягивается не вовлеченная подслизистая оболочка.
Все мезенхимальные опухоли, возникающие из или ограниченные мышечной слизистой оболочкой, представляли собой лейомиомы, состоящие из хорошо дифференцированных гладкомышечных клеток, которые однородно положительны на актин и десмин и отрицательны на CD34 и CD117, аналогично нормальным мышечным мышцам слизистой оболочки и собственной мышечной ткани толстой кишки. Эти опухоли отличаются от конкретных GIST клинически, гистологически и иммунофенотипически.
В то время как лейомиомы положительны на актин и десмин и отрицательны на CD34 и CD117 (KIT), GIST имеют противоположную картину. Мы видели только четыре ГИСО толстой кишки размером менее 1 см. Все они затрагивали внешний мышечный слой и были удалены с серозной стороны (14). В этом исследовании не было выявлено KIT-положительных GIST, ограниченных слоем мышечной оболочки слизистой оболочки. Нормальный слой слизистой оболочки muscularis не содержит CD117-положительных клеток Кахаля или мультипотенциальных стволовых клеток, что, вероятно, объясняет, почему GIST не встречаются в слое слизистой оболочки muscularis или присутствуют в виде небольших внутрипросветных полипов.
Было трудно установить специфические симптомы этих опухолей, и они, вероятно, в основном были случайными находками. Согласно нашему опыту, основанному на сочетании одного больничного материала и справочного материала AFIP, лейомиомы слизистой оболочки muscularis как минимум в два раза чаще встречаются в толстой кишке, чем GIST, тогда как такое же количество этих опухолей было замечено в прямой кишке в одном больничном материале. .
Другим местом, где лейомиомы наблюдаются с высокой относительной частотой, является пищевод, где интрамуральные лейомиомы являются наиболее распространенными мезенхимальными опухолями и превосходят по численности GIST на 48:17 = 2.8: 1) (15). Однако интрамуральные лейомиомы в толстой и прямой кишке встречаются крайне редко. Аналогичным образом, согласно нашему опыту, прототипные лейомиомы очень редко встречаются в желудке и тонком кишечнике.
Лейомиомы слизистой мышечной оболочки чаще встречаются у пожилых людей (средний возраст 62 года). Хотя это может частично отражать популяцию пациентов, подвергающихся колоноскопии, также молодые пациенты часто подвергаются колоноскопии для наблюдения за воспалительными заболеваниями кишечника, однако только два пациента в возрасте до 40 лет имели лейомиому мышечной слизистой оболочки.
Лейомиомы слизистой оболочки muscularis имеют значительное мужское преобладание 2,5: 1, аналогично тому, что было обнаружено при лейомиоме пищевода (3: 1) (15). Хотя генетический механизм развития лейомиомы muscularis mucosae неизвестен, делеции в генах альфа 5 и альфа 6 коллагена типа IV, расположенных в X-хромосоме, описаны как при семейных, так и при спорадических лейомиомах пищевода (16, 17). У мужчин любые делеции, затрагивающие Х-хромосому, являются гомозиготными, что потенциально объясняет преобладание у мужчин заболеваний с таким генетическим вовлечением.
Значительная атипия была редкой находкой при лейомиомах слизистой мышечной оболочки. Это похоже на атипию, наблюдаемую при других лейомиомах, таких как лейомиомы матки и мужских гениталий и обычно называемые «симпластическими лейомиомами». Без митотической активности такая атипия, по-видимому, не имеет большого клинического значения, поскольку ни одно из поражений не показало рецидива опухоли, несмотря на консервативную петлевую полипэктомию. Тем не менее, мы считаем целесообразным убедиться, что атипичное поражение ограничивается слизистой оболочкой, или, если есть сомнения, выполнить дополнительное эндоскопическое иссечение основания полипа для гистологического исследования или, по крайней мере, обеспечить тщательное наблюдение.
Типичные актин- и / или десмин-положительные лейомиосаркомы очень редко встречаются в толстой кишке и часто проявляются как внутрипросветные полиповидные поражения. Хотя эти опухоли теоретически могут иметь мышечное происхождение слизистой оболочки, такое происхождение не может быть продемонстрировано в нашем недавнем обзоре истинных лейомиосарком толстой кишки (14). Наши данные не подтверждают связь между лейомиомами слизистой мышечной оболочки и истинными лейомиосаркомами толстой кишки. Однако нельзя исключать возможность того, что истинная лейомиосаркома толстой кишки происходит из мышечной слизистой оболочки.
Полипы толстой кишки — Полипы — это доброкачественные новообразования (доброкачественные опухоли или новообразования), затрагивающие слизистую оболочку кишечника.
Многие эксперты рекомендуют колоноскопию в качестве метода диагностики рака толстой кишки. Колоноскопия может обнаружить полипы. Одним из преимуществ колоноскопии перед другими методами скрининга является то, что любые обнаруженные или подозреваемые полипы могут быть удалены во время той же процедуры, что и обследование.
Что такое полип толстой кишки?
Полипы — это доброкачественные новообразования (доброкачественные опухоли или новообразования), затрагивающие слизистую оболочку кишечника.Они могут возникать в нескольких местах желудочно-кишечного тракта, но чаще всего встречаются в толстой кишке. Они различаются по размеру от менее четверти дюйма до нескольких дюймов в диаметре. Они выглядят как небольшие шишки, вырастающие из слизистой оболочки кишечника и выступающие в просвет (полость кишечника). Иногда они растут на «стебле» и выглядят как грибы. Некоторые полипы также могут быть плоскими. У многих пациентов имеется несколько полипов, разбросанных в разных частях толстой кишки. Некоторые полипы могут содержать небольшие участки рака, но подавляющее большинство полипов — нет.
Насколько распространены полипы толстой кишки? Что их вызывает?
Полипы очень часто встречаются у взрослых, у которых повышается вероятность их приобретения, особенно с возрастом. Хотя это довольно редко у 20-летних, по оценкам, средний 60-летний мужчина без особых факторов риска развития полипов имеет 25-процентную вероятность возникновения полипа. Мы не знаем, что вызывает полипы. Некоторые эксперты считают, что диета с высоким содержанием жиров и низким содержанием клетчатки может быть предрасположенностью к образованию полипов. Также может существовать генетический риск развития полипов.
Колоноскопия, самый точный способ обнаружения полипов среди доступных методов, почти всегда проводится в амбулаторных условиях и обычно занимает менее 45 минут.
Какие известные риски развития полипов?
Самым большим фактором риска развития полипов является возраст старше 50 лет. Семейный анамнез полипов толстой кишки или рака толстой кишки увеличивает риск полипов. Кроме того, пациенты, у которых в анамнезе были полипы или рак толстой кишки, подвержены риску развития новых полипов.Кроме того, существуют некоторые редкие синдромы полипов или рака, которые передаются по наследству и увеличивают риск возникновения полипов в более молодом возрасте.
Существуют ли разные типы полипов?
Существует два распространенных типа: гиперпластический полип и аденома. Гиперпластический полип обычно не подвержен риску развития рака. Аденома, однако, считается предшественником (источником) почти всех видов рака толстой кишки, хотя большинство аденом никогда не перерастают в рак. Гистология (исследование ткани под микроскопом) — лучший способ отличить гиперпластический полип от аденоматозного.Хотя невозможно сказать, какие аденоматозные полипы станут раком, более крупные полипы с большей вероятностью станут раком, а некоторые из самых крупных (размером более 1 дюйма) уже могут содержать небольшие участки рака. Поскольку ваш врач обычно не может определить тип ткани по внешнему виду полипа, врачи обычно рекомендуют удалить все полипы, обнаруженные во время колоноскопии.
При колоноскопии врач проводит эндоскоп через прямую кишку в толстую кишку, чтобы исследовать ткань стенки толстой кишки на предмет аномалий, таких как полипы.
Как обнаруживаются полипы?
Большинство полипов протекает бессимптомно. Более крупные могут вызвать кровь в стуле, но даже они обычно протекают бессимптомно. Поэтому лучший способ обнаружить полипы — это обследовать людей без симптомов. Доступно несколько других методов скрининга: исследование образцов стула на наличие следов крови, выполнение ректороманоскопии для изучения нижней трети толстой кишки или использование радиологического теста, такого как бариевая клизма или КТ-колонография.
Если один из этих тестов обнаруживает или подозревает полипы, ваш врач обычно рекомендует колоноскопию для их удаления.Поскольку колоноскопия является наиболее точным способом обнаружения полипов, многие эксперты в настоящее время рекомендуют колоноскопию в качестве метода скрининга, чтобы любые обнаруженные или подозреваемые полипы можно было удалить во время той же процедуры.
Как удаляются полипы?
Большинство полипов, обнаруженных во время колоноскопии, можно полностью удалить во время процедуры. Доступны различные методы удаления; большинство из них включают их удаление с помощью проволочной петли, щипцов для биопсии и / или сжигания основания полипа электрическим током. Это называется резекцией полипа.Поскольку слизистая оболочка кишечника не чувствительна к порезам или ожогам, резекция полипа не вызывает дискомфорта. Затем удаленные полипы исследуются патологом под микроскопом, чтобы определить тип ткани и выявить рак. Если большой полип или полип необычного вида удален или оставлен для возможного хирургического вмешательства, эндоскопист может пометить место, введя небольшое количество стерильных чернил или сажи в стенку кишечника. Это называется эндоскопической татуировкой.
Эндоскоп — это медицинское устройство, используемое опытными врачами для осмотра пищеварительного тракта на предмет аномалий, таких как полипы.Опытный врач контролирует движение гибкой трубки с помощью ручки эндоскопа.
Каковы риски удаления полипа?
Удаление полипа (или полипэктомия) во время колоноскопии — обычная амбулаторная процедура. Возможные осложнения, которые встречаются редко, включают кровотечение из места полипэктомии и перфорацию (отверстие или разрыв) толстой кишки. Кровотечение из места полипэктомии может быть немедленным или отсроченным на несколько дней; стойкое кровотечение почти всегда можно остановить лечением во время очередной колоноскопии.Перфорации возникают редко и могут потребовать хирургического вмешательства.
Как часто мне нужна колоноскопия, если мне удалили полипы?
Ваш врач решит, когда вам понадобится следующая колоноскопия. Сроки зависят от нескольких факторов, включая количество и размер удаленных полипов, тип ткани полипов и качество очистки толстой кишки для вашей предыдущей процедуры. Качество очищения влияет на способность вашего врача видеть поверхность толстой кишки. Если полипы были небольшими и вся толстая кишка была хорошо видна во время колоноскопии, врачи обычно рекомендуют повторную колоноскопию через три-пять лет.Если ваша повторная колоноскопия не выявила никаких признаков полипов, возможно, вам не понадобится другая процедура в течение дополнительных пяти лет. Однако, если полипы были большими и плоскими, ваш врач может порекомендовать интервал всего в несколько месяцев перед повторной колоноскопией, чтобы гарантировать полное удаление полипа. Ваш врач обсудит с вами эти варианты.
div # education {
дисплей: нет;
}
Колоректальный рак (карцинома) — Диагностика и лечение
Колоректальный рак или колоректальная карцинома — это рак толстой и / или прямой кишки.Ваш врач может провести колоноскопию, КТ-колонографию (также известную как виртуальная колоноскопия) или бариевую клизму с воздушным контрастом, чтобы помочь диагностировать ваше состояние. Ваш врач также может назначить КТ брюшной полости и таза, ПЭТ / КТ, МРТ органов малого таза или эндоректальное ультразвуковое исследование, чтобы помочь оценить рак и найти любые признаки распространения.
В зависимости от размера, степени и стадии рака может потребоваться операция. В запущенных случаях может потребоваться лечение лучевой терапией, например, дистанционная лучевая терапия (EBT).Ваш врач может также назначить химиотерапию, чтобы уменьшить вероятность возврата опухоли в другое место тела.
Что такое колоректальный рак?
Колоректальная карцинома — это рак или злокачественная опухоль толстой кишки, которая может поражать толстую или прямую кишку. Обычно толстая кишка — это верхние пять-шесть футов толстой кишки, а прямая кишка — это нижние пять-семь дюймов, расположенные над анальным каналом.
Такие факторы, как возраст, раса, личный или семейный анамнез заболевания толстой кишки и диета, могут играть значительную роль в повышении риска развития колоректального рака.
Многие виды рака толстой кишки развиваются в течение длительного периода времени и часто возникают из-за предраковых полипов толстой кишки, которые постепенно разрастаются и могут перейти в рак. Многие виды рака толстой кишки на ранней стадии вообще не вызывают никаких симптомов. Поэтому в настоящее время рекомендуются различные методы скрининга рака толстой кишки в надежде найти полип или рак в то время, когда его можно будет удалить и вылечить. Вам следует поговорить со своим врачом о том, будет ли уместен скрининг на рак толстой кишки и когда.
Если рак вырос до размеров, вызывающих симптомы, они могут включать:
- Боль в животе, спазмы или газы
- Похудание
- Усталость
- Изменения дефекации, такие как диарея, запор, вздутие живота или очень жидкий стул
- Кровь в стуле или ректальное кровотечение
- Частичная или полная закупорка стула / кала
начало страницы
Как диагностируется и оценивается колоректальный рак?
Для диагностики рака толстой кишки врач может заказать:
- Колоноскопия: при этом обследовании используется гибкая трубка с крошечной камерой на конце, которая вводится через задний проход в толстую кишку.Камера делает снимки внутренней части толстой кишки. Полипы и / или образцы тканей могут быть удалены и оценены, чтобы определить, являются ли они злокачественными.
- КТ Колонография: в прямую кишку вводится небольшая трубка, и воздух используется для надувания толстой кишки. Затем получают КТ-изображения брюшной полости и таза с низкой дозой облучения, когда вы лежите на спине, а затем на животе. Вас также могут попросить лечь на бок. Специально обученные радиологи обычно интерпретируют результаты этого исследования с помощью программного обеспечения, разработанного для КТ-колонографии.Этот экзамен также может обнаружить полипы и новообразования. Если обнаружены отклонения, вам, как правило, потребуется обычная колоноскопия.
- Бариевая клизма с воздушным контрастом: это рентгеновское исследование толстой кишки, также называемое нижним желудочно-кишечным обследованием, позволяет радиологам просматривать толстую и прямую кишку в режиме реального времени и обнаруживать аномальные новообразования.
Другие типы визуализационных исследований, которые может назначить ваш врач, включают:
- КТ брюшной полости и таза: в этой процедуре визуализации используется рентгеновское излучение для быстрого определения источников боли или аномалий в желудочно-кишечном тракте.
- ПЭТ / КТ : Позитронно-эмиссионная томография (ПЭТ) — это вид сканирования в ядерной медицине, при котором для визуализации функций организма используется небольшое количество радиоактивного материала. Исследование ПЭТ / КТ объединяет изображения ПЭТ и КТ для обнаружения и анатомической локализации рака и определения степени распространения рака.
- Магнитно-резонансная томография (МРТ) тела : В этом тесте визуализации используются магнитное поле и радиочастотные импульсы для получения подробных изображений внутренних органов.Он может определить степень заболевания, если у пациента диагностирован рак прямой кишки, посмотреть на стадию опухоли или оценить другие органы на предмет метастазов. Никакой радиации.
- Эндоректальное УЗИ : В этом визуализирующем тесте используются высокочастотные звуковые волны, генерируемые датчиком, который вводится в прямую кишку. Звуковые волны создают картину стенки прямой кишки и окружающей ткани. Никакой радиации. Этот тест может использоваться для определения локальной степени заболевания, если у пациента диагностирован рак прямой кишки.
начало страницы
Как лечится колоректальный рак?
В зависимости от размера и степени распространения рака пациентам может потребоваться операция по удалению части или всей толстой кишки, чтобы удалить опухоль. Некоторым пациентам может потребоваться илеостомия или колостомия, при которой содержимое кишечника отводится во внешний мешок. В запущенных случаях перед операцией может потребоваться лучевая терапия (обычно в сочетании с химиотерапией). Обычно это дается как:
- Внешняя лучевая терапия (EBT) : Это лечение представляет собой форму лучевой терапии, проводимой путем наведения нескольких пучков высокоэнергетических рентгеновских лучей непосредственно на опухоль пациента в течение от одной до шести недель.Эти рентгеновские лучи доставляют излучение к опухоли пациента, чтобы разрушить раковые клетки, минимизируя воздействие на окружающие здоровые ткани. Наиболее частыми побочными эффектами являются утомляемость и изменение частоты опорожнения кишечника.
Во многих случаях химиотерапия может использоваться как отдельное лечение или в сочетании с лучевой терапией. Химиотерапия назначается для уменьшения вероятности возврата опухоли в другое место тела или для уменьшения количества опухоли во всем теле, если все опухоли не могут быть удалены хирургическим путем.Обычно его назначают с течением времени и чередуют с периодами отсутствия лечения. Могут возникнуть побочные эффекты, такие как аномальное количество клеток крови, усталость, диарея, язвы во рту и ослабленная иммунная система.
начало страницы
Эта страница была просмотрена 05 марта 2019 г.
Колоректальная неоплазия
Введение
Колоректальный рак (CRC) является третьим по распространенности раком и третьим по значимости причиной смерти от рака в Соединенных Штатах.По оценкам, в 2016 году будет диагностировано около 135 000 новых случаев CRC и 50 000 случаев смерти от колоректального рака. 1 Скрининг CRC был связан со снижением заболеваемости и смертности от CRC. 2 К сожалению, только 65% подходящих американцев проходят рекомендованный скрининг. Колоректальный рак, обнаруженный при скрининге, с большей вероятностью будет ранней стадией и излечимым по сравнению с раком, обнаруженным при обследовании, проведенном на предмет симптомов, связанных с опухолью.Усилия должны быть сосредоточены на повышении частоты скрининга, распознавании и смягчении факторов риска, соблюдении интервалов, основанных на доказательствах, для колоноскопического наблюдения и повышении качества колоноскопии.
В начало
Патофизиология
Молекулярные пути
Три хорошо установленных молекулярных пути, хромосомная нестабильность (CIN), микросателлитный фенотип метилатора CpG-островка (CIMP) и микросателлитная нестабильность (MSI), расширили наши представления о патогенезе CRC.Большинство CRC возникают через путь CIN, где в результате генетических изменений, включая потерю гетерозиготности и прогрессирующие мутации, происходят по мере того, как аденомы прогрессируют до рака. Активация онкогенов (например, крысиная саркома Кирстен [K – ras] KRAS, c – src и c – myc) и деактивация генов-супрессоров (например, APC и p53) приводят к неконтролируемой клеточной пролиферации и нарушению апоптоза. 3 Со временем в пораженных клетках продолжают накапливаться мутации, часто изменяющие общее количество хромосом, пока они не трансформируются в аденому и, в конечном итоге, в инвазивную аденокарциному.
До 30% CRC возникают из зубчатых полипов сидячей точки (SSP) по пути CIMP. Основная причина клеточной дисфункции в этом пути происходит через эпигенетические или приобретенные модификации генов посредством метилирования CG-богатых промоторных областей, которые влияют на экспрессию и функцию генов. Два наиболее часто затрагиваемых гена в пути SSP – CRC включают мутации в онкогене BRAF и метилирование гена репарации ошибочного спаривания ДНК MLh2 .
Третий путь характеризуется дефектами в аппарате репарации ошибочного спаривания ДНК (MMR), что приводит к ошибкам репликации в областях генома, содержащих простые повторяющиеся нуклеотидные последовательности, называемые MSI. 4 CRC, которые имеют доказательства MSI, могут быть результатом мутации зародышевой линии в одном из генов MMR, который является непременным условием синдрома Линча, из-за биаллельных соматических генетических изменений в генах MMR опухоли или из-за метилирование опухоли MLh2 , которое является отличительной чертой CRC, возникающих из SSP.
В начало
Поражения предшественников и естественная история
CRC возникает из неопластических эпителиальных полипов, включая аденоматозные и зубчатые полипы на сидячей кости. Наиболее распространенным предраковым полипом толстой кишки является аденома, которая считается предшественником примерно 80% CRC. Исследования людей со средним риском CRC и старше 50 лет показали, что от 22% до 42% имеют аденомы. 5
Аденоматозные полипы можно дополнительно классифицировать по гистологическим признакам (тубулярные, трубчато-ворсинчатые и ворсинчатые) и степени дисплазии (низкая и высокая степень). Убедительные доказательства демонстрируют, что особенности полипа, наиболее тесно связанные с будущим риском развития аденомы или CRC, включают большой размер (≥10 мм), количество полипов (> 2), дисплазию высокой степени и наличие ворсинок в полипе ( Таблица 1). 6-8
Таблица 1: Характеристики аденомы, связанные с метахронным риском прогрессирующей колоректальной неоплазии
| Исходный признак аденомы | Отношение шансов (95% ДИ) |
|---|---|
| 2 аденомы против 1 аденомы | 1.39 (1,17–1,66) |
| 3 аденомы против 1 аденомы | 1,85 (1,46–2,34) |
| 4 аденомы против 1 аденомы | 2,41 (1,71–3,40) |
| Проксимальный и дистальный | 1,68 (1,43–1,98) |
| 5–9 мм или | 1,17 (0,95–1,42) |
| 10–19 мм или | 2,27 (1,84–2,78) |
| Тубуловидные / ворсинчатые vs трубчатые | 1.28 (1.07–1.52) |
ДИ = доверительный интервал.
Данные Martinez et al. 6 .
Зазубренные полипы — это полипы, которые микроскопически выглядят как зуб пилы. К 3 типам зубчатых полипов толстой кишки относятся гиперпластический полип (HP), зубчатая аденома на сидячем месте (SSP) и традиционная зубчатая аденома (TSA). Считается, что SSP являются предшественниками CRC в 20–35% случаев и выявляются у 2–10% пациентов, проходящих скрининговую колоноскопию со средним риском. 9,10 Их молекулярные характеристики включают высокие уровни CIMP, мутацию v600E BRAF и MSI из-за метилирования MLh2 . 4,11 Они часто располагаются в проксимальном отделе толстой кишки, плоские и их трудно обнаружить. Различие между SSP и HP основано на морфологии основания железистого эпителия крипт. Гиперпластические полипы являются наиболее распространенными зубчатыми полипами и встречаются примерно у 25% пациентов. Чаще всего они маленькие и в основном обнаруживаются в прямой кишке и сигмовидной кишке.Считается, что малые HP в ректо-сигмовидной кишке не обладают злокачественным потенциалом. Традиционные зубчатые аденомы очень редки (
Вернуться к началу
Распространенность и факторы риска
Распространенность
Мужчины и женщины в США в течение всей жизни сталкиваются с риском развития CRC, составляющим почти 5% (таблица 2). 1 Более 90% случаев заболевания возникают у лиц старше 50 лет. 2 Чернокожие мужчины и женщины имеют самый высокий уровень заболеваемости CRC и смертности от CRC, скорректированной по стадиям (рис. 1). 1 Самая низкая заболеваемость CRC наблюдается среди выходцев из Азии / тихоокеанских островов, и среди всех рас и этнических групп заболеваемость ниже у женщин по сравнению с мужчинами. 1 Распространенность аденом и CRC примерно на треть выше у мужчин, чем у женщин; Причина этого неясна, однако взаимосвязь между предрасположенностью к метилированию ДНК в слизистой оболочке толстой кишки, обусловленной полом, различными гормональными уровнями и воздействием факторов риска, связанных с питанием и образом жизни, такими как употребление красного мяса и алкоголя, курение и физическая активность, может быть факторы. 12 Интересно, что показатели заболеваемости также различаются в зависимости от географического положения в США, с самыми высокими показателями на северо-востоке и самыми низкими на юго-западе, что частично может быть связано с воздействием солнца и уровнями витамина D. 13
Таблица 2: Вероятность диагностики инвазивного колоректального рака в зависимости от возраста и пола
a
| От рождения до 49 лет,% | 50–59 лет,% | 60–69 лет,% | 70 лет и старше,% | От рождения до смерти,% | |
|---|---|---|---|---|---|
| Мужской | 0.3 (1 из 300) | 0,7 (1 из 149) | 1,2 (1 из 82) | 3,7 (1 из 27) | 4,7 (1 из 21) |
| Женский | 0,3 (1 из 318) | 0,5 (1 из 195) | 0,9 (1 из 117) | 3,4 (1 из 30) | 4.4 (1 из 23) |
населения США, 2010–2012 гг.
Данные Siegel et al. 1
Факторы риска
Эпидемиологические исследования выявили ряд факторов, связанных с повышенным риском CRC, включая нездоровую диету и образ жизни, темнокожую расу, пожилой возраст, хронический колит, а также личный и семейный анамнез колоректальных полипов и CRC (Таблица 3). 14-16 Чем больше количество и более молодой возраст родственников с полипами или CRC, а также близость семейных отношений влияет на индивидуальный риск CRC. 17,18
Таблица 3: Выберите изменяемые факторы риска, связанные с колоректальным раком
| Фактор риска | Относительный риск (95% ДИ) |
|---|---|
| Алкоголь: тяжелый (140–257 г / нед.) По сравнению с непьющим | 1,56 (1,42–1,7) a |
| Ожирение: ИМТ ≥30 против ≤25 | 1.19 (1.11–1.29) a |
| Курение: курящий или никогда не куривший | 1,16 (1,09–1,24) a |
| Диабет | 1,23 (1,17–1,30) б |
| Потребление красного мяса (увеличение на 100 г / день) | 1,17 (1,05–1,31) c |
| Потребление мясных полуфабрикатов (увеличение на 50 г / день) | 1,18 (1,10–1.28) с |
ДИ = доверительный интервал; ИМТ = индекс массы тела.
a Данные Huxley et al. 14
b Данные Yuhara et al. 15
c Данные Chan et al. 16 .
Лица с самым высоким риском CRC — это люди с наследственным синдромом CRC из-за мутации гена зародышевой линии. Почти все наследственные синдромы CRC наследуются по аутосомно-доминантному типу и составляют примерно 10% случаев CRC.Наиболее распространенные синдромы CRC включают семейный аденоматозный полипоз (FAP), полипоз, ассоциированный с MYH и (MAP), и синдром Линча. Пациенты и семьи с наследственными синдромами CRC должны проходить генетическое консультирование и генетическое тестирование и придерживаться рекомендованных руководств по интенсивному наблюдению за раком и профилактическим хирургическим вмешательствам. 19,20
Семейный аденоматозный полипоз вызван мутацией гена-супрессора опухоли APC. Ко второму десятилетию жизни у людей с ФАП развиваются от сотен до тысяч колоректальных аденом.КРР развивается почти у всех пациентов с ФАП к 40 годам, если профилактическая колэктомия не выполняется. У лиц с аттенуированным подтипом FAP (AFAP) меньшее количество полипов толстой кишки (обычно менее 100) возникает в более позднем возрасте, и пожизненный риск CRC ниже, чем у лиц с FAP. Экстраколонические проявления FAP / AFAP включают аденомы двенадцатиперстной кишки. ассоциированные с периампулярным раком, раком щитовидной железы, полипозом желудка и раком желудка, доброкачественными опухолями мягких тканей (липомами, фибромами, кистами сальных желез), остеомами, дополнительными зубами, аденомами надпочечников, десмоидными опухолями и врожденной гипертрофией пигментного эпителия сетчатки.
MAP вызывается двуаллельными мутациями гена MYH и наследуется по аутосомно-рецессивному типу. Лица с MAP имеют 19% риск возникновения CRC к 50 годам с фенотипом колоректального полипа, имитирующим ослабленный FAP. Внеколоночные проявления MAP похожи, хотя и менее распространены, чем FAP.
Синдром
Линча (LS) определяется как человек, несущий мутацию зародышевой линии в одном из четырех генов восстановления несоответствия ДНК или в гене EPCAM .Сообщается, что пожизненный риск CRC составляет до 74%, хотя зависит от генотипа и может быть снижен с помощью колоноскопического наблюдения. У пациентов с ЛС встречается рак эндометрия, яичников, тонкой кишки, уротелия, кожи, желудка и мозга. Женщинам с ЛС рекомендуется раннее начало и частое обследование на рак эндометрия и яичников, а также профилактическая тотальная гистерэктомия и двусторонняя сальпингооферэктомия. Исторически диагноз LS основывался на Амстердамских критериях I и II и пересмотренных критериях Bethesda. 20 Критерии не обладают достаточной диагностической чувствительностью или специфичностью для идентификации пациентов с ЛС. Поскольку MSI является отличительной чертой CRC из-за LS, в настоящее время рекомендуется тестирование всех пациентов с CRC на наличие MSI или дефицита MMR, известное как универсальное тестирование, чтобы помочь в выявлении пациентов, которые могут иметь LS. 20
Хроническое воспаление толстой кишки, вызванное воспалительным заболеванием кишечника (ВЗК), включая язвенный колит и болезнь Крона, связано с повышенным риском CRC.Риск зависит от анатомической протяженности пораженной толстой кишки (выше сигмовидной кишки), тяжести воспаления и продолжительности заболевания (> 8 лет). 21 Сопутствующий первичный склерозирующий холангит (ПСХ) и ВЗК является сильным фактором риска КРР с почти пятикратным повышением риска по сравнению с пациентами с ВЗК без ПСХ. 22
Вернуться к началу
Профилактика и скрининг
Заболеваемость CRC значительно снизилась за последние 3 десятилетия у взрослых в возрасте старше 50 лет, в основном за счет более частого скрининга CRC.Несколько профессиональных обществ имеют рекомендации по скринингу на колоректальный рак. Целевая группа профилактических услуг США (USPSTF) недавно опубликовала обновленные рекомендации по скринингу CRC, в которых одобряются различные доступные методы скрининга для лиц в возрасте от 50 до 75 лет (Таблица 4). 23 Лица в возрасте от 76 до 85 лет, которые ранее проходили скрининг, получают меньше пользы, чем те, кто никогда не проходил скрининг. Таким образом, обследование лиц в возрасте от 76 до 85 лет, которые ранее проходили обследование, и лиц моложе 50 лет должно быть индивидуальным решением.Американский колледж гастроэнтерологии рекомендует проводить скрининг афроамериканцев в возрасте 45 лет из-за увеличения заболеваемости и более раннего возраста начала CRC в этой популяции. 24
Доступные скрининговые тесты можно разделить на те, которые выявляют рак, и те, которые предотвращают CRC путем обнаружения и лечения предраковых поражений толстой кишки. В качестве предпочтительного метода скрининга часто рекомендуется высококачественная колоноскопия.Преимущества включают длительный интервал между обычными обследованиями, прямую визуализацию слизистой оболочки и возможность удаления поражений.
Таблица 4: Рекомендации Целевой группы США по профилактическим службам по скринингу на колоректальный рак у взрослых от 50 до 75 лет
| Метод | Интервал просеивания |
|---|---|
| Высокая чувствительность gFOBT или FIT | Ежегодно |
| ДНК стула | 1 или 3 года |
| Компьютерная томографическая колонография | Каждые 5 лет |
| Гибкая ректороманоскопия | Каждые 5 лет или каждые 10 лет с ежегодным FIT |
| Колоноскопия | Каждые 10 лет |
gFOBT = анализ скрытой крови гваякового кала; FIT = иммунохимический тест кала.
Данные Целевой группы США по профилактическим услугам. 23 .
Условия проверки CRC
Анализы кала на скрытую кровь
Анализы кала на скрытую кровь (FOBT) обнаруживают кровотечение из больших аденом и CRC. Существует 2 типа FOBT: тест на основе гваяковой кислоты и иммунохимический тест. Гуаяк FOBT (gFOBT) использует пероксидазную активность гемоглобина, которая может быть обнаружена в стуле по изменению цвета, когда он катализирует окисление гваяковой кислоты пероксидным реагентом.Три рандомизированных контролируемых испытания показали, что использование ежегодных gFOBT снижает смертность от CRC до 33% по сравнению с пациентами, не прошедшими скрининг. 25 В исследовании с участием 46 551 участника в возрасте от 50 до 80 лет в течение 30 лет наблюдения ежегодный скрининг и скрининг раз в два года в меньшей степени снижали риск смерти от CRC по сравнению с обычным уходом. 26 Единственным gFOBT, одобренным Управлением по контролю за продуктами и лекарствами США (FDA), является Hemoccult Sensa (Beckman Coulter).Псевдопероксидазы в пищевых продуктах могут вызывать ложноположительные гваяковые тесты; поэтому рекомендуется придерживаться специальной диеты (например, диеты с высоким содержанием остатков мяса и овощей с пероксидазной активностью, таких как репа и хрен) в течение не менее 24 часов, прежде чем каждые 1 день будут собираться 3 отдельных образца стула. Руководящие принципы USPSTF одобряют вариант использования gFOBT с высокой чувствительностью ежегодно. Любой человек с положительным результатом теста gFOBT должен быть обследован с помощью колоноскопии.
Иммунохимические тесты FOBT, известные как иммунохимические тесты фекалий (FIT), используют антитела к человеческому глобину для обнаружения крови в стуле.Преимущество FIT заключается в повышении соответствия, поскольку требуется только один образец и никаких диетических ограничений не требуется, поскольку антитела FIT не перекрестно реагируют с нечеловеческим гемоглобином или пероксидазой из пищевых источников. Гемоглобин не проходит через верхние отделы желудочно-кишечного тракта, поэтому тест специфичен для колоректального кровотечения. FIT может быть как качественным, так и количественным. Порог фекального гемоглобина для положительного теста может быть изменен. При использовании порогового значения ≥75 нг / мл чувствительность обнаружения CRC составляет 94%, а специфичность — 87.5%, а клинически значимая чувствительность новообразования составляет 67%, а специфичность — 91,4%.
FIT показал в исследованиях «случай – контроль» снижение смертности от CRC до 80%. Крупное ретроспективное исследование показало, что программное ежегодное тестирование на соответствие требованиям в организованной системе здравоохранения оставалось высокочувствительным на уровне 78% для CRC в течение 4 лет скрининга. Соблюдение ежегодного FIT у 48% участников, участвовавших в первом раунде скрининга, варьировалось от 75% до 86% в течение периода скрининга. 28
Точность одноразового FIT для обнаружения CRC и продвинутых аденом выше, чем с gFOBT. Сообщается, что чувствительность CRC с FIT составляет 87,5% и 82% по сравнению с gFOBT, как сообщается, 54,2% и 64,3%. 29,30 Чувствительность выявления прогрессирующих аденом почти вдвое выше при FIT на уровне 42,6% по сравнению с 23% для gFOBT. 29 Специфичность каждого метода превышает 98%. Ежегодный FIT одобрен USPSTF. Любой положительный тест должен сопровождаться колоноскопией.
Анализ ДНК стула
Клетки отслаиваются из эпителиальной выстилки желудочно-кишечного тракта и ежедневно проходят с калом. Отслоившиеся неопластические клетки, несущие генетические изменения опухолей, могут быть обнаружены в кале с помощью анализа ДНК стула. В настоящее время 1 тест ДНК стула коммерчески доступен, Cologuard (Exact Sciences). Он сочетает в себе FIT с анализом различных генетических изменений, которые, как известно, связаны с колоректальной неоплазией.В отличительном испытании, сравнивающем тест ДНК-FIT стула с FIT с использованием колоноскопии в качестве золотого стандарта, точность одноразового теста ДНК-FIT стула для CRC составила 92,3% по сравнению с FIT на 73,8%. Чувствительность обнаружения запущенных новообразований с помощью ДНК-FIT стула составила 42,4%, а с помощью FIT — 23,8%. 31 Стул ДНК-FIT выявила 42,4% пациентов с зубчатыми полипами на сидячей кости размером 1 см или больше, тогда как FIT выявила 5,1%. Количество, необходимое для скрининга для обнаружения 1 CRC с FIT, составляло 208, с ДНК-FIT стула — 166, а с колоноскопией — 154.USPSTF 2016 одобряет вариант тестирования ДНК-FIT стула каждые 1 или 3 года. 23 Положительный результат требует колоноскопии.
Тесты на основе сыворотки
FDA одобрило скрининговый тест CRC в 2016 году, который обнаруживает циркулирующую метилированную ДНК в плазме. Около 8000 человек в возрасте 50 лет и старше, подходящих для скрининга CRC в Германии и США, взяли плазменную сыворотку перед колоноскопией. По сравнению с 53 случаями CRC, обнаруженными при колоноскопии, чувствительность к метилированной ДНК плазмы составила 48%, а специфичность — 91.5%. Чувствительность была лучшей для CRC IV стадии и составляла 77,4%, но всего 35% для CRC I стадии и 11,2% для продвинутых аденом. 32 Имея ограниченные доказательства и низкую чувствительность, USPTF не дает официальных рекомендаций по тестированию на основе сыворотки и не перечисляет его в качестве одной из предпочтительных стратегий скрининга.
Компьютерная томографическая колонография (КТК)
За последнее десятилетие были достигнуты значительные успехи в технологии компьютерной томографической колонографии (КТК), позволяющей улучшить обнаружение аденоматозных полипов.Нет данных для определения влияния ЦКО на смертность от CRC. Испытания, сравнивающие КТК с колоноскопией для выявления аденоматозных полипов ≥6 мм, сообщают о чувствительности в диапазоне от 73% до 98% и специфичности от 89% до 91%. 23 CTC менее инвазивен, чем колоноскопия, может повысить частоту скрининга CRC, не требует седативного действия и может не требовать подготовки кишечника, хотя частота выявления поражений улучшается с подготовкой кишечника. 33 К сожалению, CTC менее эффективен при обнаружении SSP.Последние данные показывают, что у 0,8% пациентов, перенесших КТК, был диагностирован 1 или более SSP по сравнению с 4,3% пациентов, перенесших колоноскопию. 34 Разница была значительной для плоских SSP, SSP с дисплазией и SSP в правой ободочной кишке. КТК каждые 5 лет одобрен USPTF в качестве варианта скрининга, хотя целевая группа нашла недостаточные доказательства для оценки вреда от обнаружения случайных находок или радиационного облучения. CTC как вариант проверки CRC не может быть покрыт страховкой.Колоноскопия требуется для удаления поражений, обнаруженных на ЦКО.
Гибкая сигмоидоскопия
Гибкая ректороманоскопия (ФС) позволяет визуализировать дистальную треть толстой кишки. Три крупных европейских и одно рандомизированное контролируемое исследование в США недавно показали, что FS снижает частоту возникновения CRC, а в большинстве исследований — снижение смертности от CRC в течение более чем десятилетнего периода наблюдения (Таблица 5). 35-38 Руководства USPSTF рекомендуют использовать только гибкую ректороманоскопию каждые 5 лет или каждые 10 лет в сочетании с ежегодным FIT-тестированием.Компьютерные модели прогнозирования показывают улучшение жизни пациентов — количество лет, сэкономленных за счет ежегодного FIT, в сочетании с гибкой сигмоидоскопией каждые 10 лет стратегии скрининга. 23
Таблица 5: Рандомизированные клинические испытания гибкого скрининга с помощью сигмоидоскопии в отношении заболеваемости и смертности от колоректального рака
| Кабинет | Кол-во участников | Возраст, лет | Дизайн | Среднее время наблюдения, лет | Результаты |
|---|---|---|---|---|---|
| Аткин 2010 35 (Великобритания) | 170432 (170,038 в анализе) | 55–64 | Предлагаемый FS против бесконтактного | 11.2 | Заболеваемость снизилась на 23%, а смертность на 31% в группе, предложенной FS |
| Сегнан 2011 36 (Италия) | 34 292 (34 272 в анализе) | 55–64 | Предлагаемый FS против бесконтактного | 10,2 | Заболеваемость снизилась на 18%, а смертность на 22% в группе, предложенной FS |
| Schoen 2012 37 (U.С.) | 154 900 | 55–74 | ПС на исходном уровне и через 3 или 5 лет по сравнению с обычным уходом | 11,9 года | Заболеваемость снизилась на 21%, а смертность на 26% в группе FS + |
| Холм 2011 38 (Норвегия) | 100 210 (98 792 в анализе) | 50–64 | FS или FS и FOBT по сравнению с отсутствием вмешательства | 7 лет | Заболеваемость снизилась на 36%, а смертность на 31% |
FS = гибкая ректороманоскопия; FOBT = анализ кала на скрытую кровь.
Пациентам с небольшими гиперпластическими полипами на FS рекомендуется продолжить выполнение рекомендаций по скринингу среднего риска. 39 Пациенты с аденомами, обнаруженными на FS, имеют повышенный риск проксимальной прогрессирующей неоплазии. Исследования показали, что среди пациентов с распространенными дистальными аденомами распространенность проксимального новообразования на поздней стадии составляет 11,5%, а относительный риск прогрессирующего проксимального новообразования составляет 4 для пациентов с аденомами дистальных канальцев и 6,7 для пациентов с развитыми дистальными полипами по сравнению с пациентами без дистальных аденома. 40,41 Таким образом, колоноскопия рекомендуется пациентам с аденомами, обнаруженными на ФС. FS каждые 5 лет или каждые 10 лет с ежегодным FIT одобрены USPTF в качестве вариантов проверки. 23
Колоноскопия
Колоноскопический скрининг лиц со средним риском оказался рентабельным, схожим с рентабельностью в расчете на год сохраненной жизни при скрининге рака шейки матки и груди. Хотя рандомизированных контролируемых испытаний скрининговой колоноскопии нет, данные наблюдений демонстрируют, что скрининговая колоноскопия связана со снижением частоты и смертности от CRC с устойчивым защитным эффектом, продолжающимся более 10 лет. 42-44 Метаанализ обсервационных исследований скрининг-колоноскопии оценивает снижение частоты CRC на 69% с более сильным защитным эффектом для дистального, чем проксимального, CRC. Исследования смертности от CRC, связанной с колоноскопией, неизменно показывают снижение смертности до 68%. 42 USPSTF рекомендует проводить колоноскопию каждые 10 лет у лиц со средним риском. 23
Меры качества были разработаны для повышения эффективности колоноскопии и снижения уровня CRC после колоноскопии (PCCRC).Также известный как интервальный CRC, PCCRC был зарегистрирован у 9% пациентов с диагнозом CRC, подвергшихся колоноскопии в течение предыдущих 3-5 лет. 45-46 Считается, что основной причиной интервального CRC является пропущенное обнаружение поражения. Частота выявления аденомы, частота интубации слепой кишки, время отмены и качество подготовки кишечника — это некоторые из установленных показателей качества, связанных с частотой и смертностью от интервального CRC, и их должны отслеживать все колоноскописты (Таблица 6). 47 Доступны различные препараты для кишечника разного объема, вкусовых качеств и стоимости. 48-49 Данные показывают, что пациенты, которые принимают не менее 50% препарата кишечника в день процедуры (так называемое разделенное дозирование), имеют улучшенные показатели очищения кишечника и выявления полипов по сравнению с пациентами, принимающими препарат за день до процедуры. Несколько исследований продемонстрировали, что одобренные FDA препараты для кишечника с разделенными дозами малого объема (2 л) столь же эффективны, как и препараты с разделенными дозами 4 л.Выбор препарата для кишечника зависит от сопутствующих заболеваний и характеристик препарата. Пациенты, которым проводят колоноскопию слепой кишки, но у которых обнаруживается недостаточная подготовка кишечника, определяемая как недостаточная для обнаружения полипов размером> 5 мм, должны пройти повторную колоноскопию в течение года из-за высокой частоты необнаруженных прогрессирующих аденом. 49
Таблица 6: Выбор показателей качества для процедур скрининговой колоноскопии
| Метрика качества | Гол |
|---|---|
| Частота интубации слепой кишки | ≥95% |
| Частота выявления аденомы | 25% Самки ≥ Мужчины ≥ |
| В соответствии с опубликованными стандартами и задокументированными показаниями | > 80% |
| Недостаточная подготовка кишечника | |
| Среднее время вывода (отрицательные результаты) | ≥6 минут |
Данные Rex, et al. 47
Популяции с риском CRC выше среднего
Возраст начала и частота скрининга CRC и колоноскопического наблюдения зависят от личных факторов риска и семейного анамнеза колоректальных полипов или рака (Таблица 7). 24 Лица с большими, многочисленными или гистологически развитыми аденоматозными или зубчатыми полипами требуют более частого наблюдения, чем люди без таких характеристик полипа (рис. 2). 39 Людям с наследственным синдромом CRC следует рекомендовать пройти обследование толстой кишки и экстра-толстых органов с возрастом и частотой в соответствии с установленными руководящими принципами. 19-20
Таблица 7: Рекомендации по скринингу для лиц с семейным анамнезом аденом или колоректального рака
| Состояние риска | Начать просмотр | Интервал скрининга |
|---|---|---|
| CRC или развитая аденома a , диагностированная у родственника 1-й степени | Ранее: возраст 40 или 10 лет до того возраста, в котором родственнику был поставлен диагноз CRC или продвинутая аденома | 5 лет |
| Родственник 1-й степени в возрасте ≥60 лет с CRC или развитой аденомой | Возраст 50 | 10 лет |
| Синдром Линча (подтвержденная мутация) | Возраст 20–25 | 2 года (возраст 1 год (возраст ≥40) |
| Линч-подобный синдром или семейный колоректальный тип | Возраст 20–25 | 1-2 года |
| FAP, AFAP или MAP | Период полового созревания | 1-2 года (1 год при установленных полипах) |
a Аденома ≥1 см, с ворсинками или дисплазией высокой степени.
AFAP = ослабленный семейный аденоматозный полипоз; FAP = семейная аденоматозная
полипоз; MAP = MYH -ассоциированный полипоз.
Данные Rex, et al. 24
Болезнь Крона (БК) и язвенный колит связаны с повышенным риском развития CRC через путь дисплазия-карцинома. Колоноскопическое наблюдение за дисплазией должно начинаться через 8 лет после постановки диагноза обширного поражения толстой кишки (выше левой ободочной кишки) и каждые 1-3 года после этого.При заболевании, ограниченном левой ободочной кишкой, наблюдение может начаться через 15 лет после постановки диагноза 50-51 . Риск КРР наиболее высок у лиц с хроническим язвенным колитом с обширным заболеванием и у лиц с ПСХ. Пациентам с диагнозом ПСХ рекомендуется пройти базовую колоноскопию во время диагностики ПСХ для оценки ВЗК. Обследование следует повторять каждые 1-2 года при диагностировании ВЗК и каждые 5 лет при отсутствии ВЗК. Было предложено использовать хромоэндоскопию для увеличения выявления видимой дисплазии вместо случайной биопсии. 52 Интервал наблюдения, риск КРР и хирургическое лечение пациентов с дисплазией зависит от того, является ли дисплазия одноочаговой или многоочаговой, видимой или невидимой, а также от полноты резекции. 50, 52
В начало
Химиопрофилактика колоректальной неоплазии
Исследования о пользе и вреде использования витаминов, минералов или микроэлементов для профилактики CRC и аденомы неоднозначны. 53-58 В настоящее время нет убедительных доказательств, подтверждающих добавление антиоксидантов, фолиевой кислоты, кальция или витамина D для предотвращения колоректальных аденом или рака. Сильные данные наблюдений показали преимущества длительного использования аспирина в профилактике и смерти от CRC. 59 Данные исследований по профилактике первичных и вторичных сердечно-сосудистых заболеваний (ССЗ) показывают, что у участников, получавших аспирин, снизилась 20-летняя смертность от CRC (относительный риск = 0,67) и снизилась частота CRC (относительный риск = 0.60) От 5 до 10 лет после начала приема аспирина по сравнению с участниками, получавшими плацебо. 59 В своем последнем обновлении USPSTF рекомендует ежедневное использование низких доз аспирина (60 Подходящие пациенты — это пациенты, не подверженные повышенному риску кровотечения, ожидаемая продолжительность жизни не менее 10 лет и готовые принимать низкие дозы). -Дозируйте аспирин ежедневно в течение не менее 10 лет. Решение об использовании аспирина у людей в возрасте от 60 до 69 должно быть индивидуальным. Другие нестероидные противовоспалительные препараты (НПВП), такие как ингибиторы циклооксигеназы 2 (ЦОГ-2), были показаны в многочисленные испытания по уменьшению рецидивов аденомы. 61-63 К сожалению, неблагоприятные сердечно-сосудистые события не позволяют использовать их для предотвращения колоректальной неоплазии у пациентов со спорадическими аденомами. 64 Трехлетнее испытание с использованием комбинации дифторметилорнитина и НПВП сулиндак у пациентов с 3 или более исходными аденомами существенно уменьшило аденому и рецидив аденомы на поздней стадии. 65 Многочисленные исследования с использованием целекоксиба или сулиндака для регрессии колоректального полипа у пациентов с ФАП показали снижение количества полипов.Они часто используются в качестве дополнения к эндоскопии у пациентов с ослабленным ФАП с интактной толстой кишкой или после колэктомии для контроля аденом прямой кишки или подвздошной кишки. 66-70 Рандомизированное контролируемое исследование пациентов с синдромом Линча обнаружило снижение частоты CRC через 55 месяцев у пациентов, принимавших 600 мг аспирина в день в среднем в течение 2 лет, по сравнению с пациентами, принимавшими плацебо. 71
В начало
Признаки и симптомы CRC
Большинство аденом и ранних стадий CRC не имеют симптомов.Кровопотеря в толстой кишке является наиболее частым признаком CRC, и пациенты могут иметь положительный FOBT, железодефицитную анемию или гематохезию. Когда опухоль прогрессирует, может возникнуть необъяснимая анорексия, потеря веса, изменение привычки кишечника, боль в животе или непроходимость. 72 Отсутствие симптомов на ранних стадиях заболевания подчеркивает важность бессимптомного скрининга.
В начало
Лечение
Инвазивный CRC может проявляться эндоскопически в виде опухолевой массы или содержаться в полипе.Хирургия лечит большинство опухолей ранней стадии (TNM I – II). En bloc, полностью удаленные злокачественные полипы с благоприятными гистопатологическими признаками можно вылечить только с помощью эндоскопической полипэктомии. Злокачественные полипы, которые хорошо дифференцированы, с краями без рака ≥2 мм, без какой-либо сосудистой или лимфатической инвазии и которые не проникают через подслизистую основу, можно лечить эндоскопически с благоприятным исходом для пациентов. 73 Хирургическое лечение должно быть рекомендовано пациентам со злокачественными полипами с неблагоприятными гистологическими особенностями и должно рассматриваться для пациентов с плоскими или плоскими злокачественными полипами, если пациент является подходящим кандидатом на хирургическое вмешательство. 74
Пациентам с раком толстой кишки III стадии (поражение лимфатических узлов) в настоящее время рекомендуется пройти послеоперационную адъювантную химиотерапию, которая может улучшить общую выживаемость и выживаемость без рецидивов. 75 Использование адъювантной химиотерапии у пациентов с раком толстой кишки II стадии может быть рассмотрено у конкретных пациентов, таких как пациенты с неадекватно взятыми пробами лимфатических узлов, поражениями Т4, перфорацией или плохо дифференцированной гистологией. Паллиативная химиотерапия играет важную роль у некоторых пациентов с метастатическим заболеванием и может сочетаться с хирургическим вмешательством для облегчения симптомов (например, обструкции толстой кишки или кровотечения из опухоли) или лечения метастатических поражений в легких или печени.
Раковые образования в пределах 12 см от анальной границы классифицируются как рак прямой кишки. Хирургическая резекция излечивает рак прямой кишки I стадии. Комбинированная терапия с хирургическим вмешательством и периоперационным химиолучевым лечением рекомендуется большинству пациентов со II и III стадиями рака прямой кишки. 76 Как правило, расположение опухоли в прямой кишке определяет методику удаления. Целью операции является выполнение широкой резекции и полного мезоректального иссечения. При полном мезоректальном иссечении хирург резко рассекает мезоректальную фасцию и удаляет прямую кишку и все ткани, прилегающие к висцеральной фасции, включая жировую ткань, лимфатические узлы и лимфатические сосуды.В зависимости от локализации опухоли хирург может также выполнить резекцию нижнего переднего отдела или абдоминоперинеальную резекцию. Опухоли, поражающие соседние структуры таза, требуют мультидисциплинарного подхода, который включает удаление опухоли других органов, химиотерапию, лучевую терапию или и то, и другое.
Пациентам, пролеченным по поводу CRC, рекомендуется послеоперационное наблюдение для выявления метахронной неоплазии. 75,76 Эпиднадзорная колоноскопия связана с улучшением общей выживаемости, хотя и не специфической для рака (таблица 8). 77
Таблица 8: Наблюдение за колоноскопией после резекции колоректального рака
| Рак | Тест | Интервал наблюдения |
|---|---|---|
| Колоректальный рак | Колоноскопия | В возрасте 1, 3 и 5 лет после постановки диагноза. В дальнейшем каждые 5 лет, если нормально, чаще — в ожидании результатов |
| Рак прямой кишки * | Эндоскопическое ультразвуковое исследование или гибкая ректороманоскопия | Каждые 3–6 месяцев в течение 2–3 лет |
* В дополнение к рекомендациям по интервалам колоноскопии.
Данные Kahi, et al. 77
В начало
Сводка
- Колоректальный рак (CRC) — третья по частоте причина рака у мужчин и женщин в США
- Лица с наследственными синдромами колоректального рака подвергаются наибольшему риску развития CRC. Кроме того, эпидемиологические исследования выявили ряд факторов, связанных с повышенным риском CRC.
- Заболеваемость CRC снизилась благодаря скринингу, и в настоящее время доступны несколько методов скрининга. В качестве предпочтительного метода скрининга часто рекомендуется высококачественная колоноскопия.
- Большинство аденом и ранних стадий CRC не имеют симптомов, что еще раз подчеркивает важность скрининга с учетом возраста.
Вернуться к началу
Список литературы
- Сигел Р.Л., Миллер К.Д., Джемал А.Статистика рака, 2016. CA Cancer J Clin 2016; 66: 7–30.
- Американское онкологическое общество. Факты и цифры о колоректальном раке за 2014-2016 гг. Атланта: Американское онкологическое общество, 2014 г. Доступно по адресу http://www.cancer.org/acs/groups/content/documents/document/acspc-042280.pdf.
- Mundade R, Imperiale TF, Prabhu L, Loehrer PJ, Lu T. Генетические пути, профилактика и лечение спорадического колоректального рака. Онкология 2014; 1: 400–406.
- Боланд CR, Гоэль А. Нестабильность микросателлитов при колоректальном раке. Гастроэнтерология 2010; 138: 2073–2087.
- Heitman SJ, Ronksley PE, Hilsden RJ, Manns BJ, Rostom A, Hemmelgarn BR. Распространенность аденом и колоректального рака у лиц среднего риска: систематический обзор и метаанализ. Clin Gastroenterol Hepatol 2009; 7: 1272–1278.
- Мартинес М.Э., Барон Дж. А., Либерман Д. А. и др. Объединенный анализ диагнозов поздней колоректальной неоплазии после колоноскопической полипэктомии. Гастроэнтерология 2009; 136: 832–841.
- Либерман Д.А., Вайс Д.Г., Харфорд В.В. и др. Пятилетнее наблюдение за толстой кишкой после скрининг-колоноскопии. Гастроэнтерология 2007; 133: 1077–1085.
- O’Brien MJ, Winawer SJ, Zauber AG, et al. Национальное исследование полипов. Характеристики пациентов и полипов, связанные с дисплазией высокой степени при колоректальных аденомах. Гастроэнтерология 1990; 98: 371–379.
- Rex DK, Ahnen DJ, Baron JA, Batts KP, et al.Зубчатые поражения толстой кишки: обзор и рекомендации экспертной комиссии. Am J Gastroenterol 2012; 107: 1315–1329.
- Sanaka MR, Gohel T., Podugu A, et al. Частота обнаружения аденомы и зубчатого полипа на сидячей кости: варьируется в зависимости от пола пациента и сегмента толстой кишки, но не по специальности эндоскописта. Dis Colon Rectum 2014; 57: 1113–1119.
- Леггетт Б., Уайтхолл В. Роль зубчатого пути в патогенезе колоректального рака. Гастроэнтерология 2010; 138: 2088–2100.
- Мерфи Г., Девеса СС, Кросс А.Дж., Инскип П.Д., МакГлинн К.А., Кук МБ. Половые различия в заболеваемости колоректальным раком в зависимости от анатомической локализации, расы и возраста. Int J Cancer 2011; 128: 1668–1675.
- Джованнуччи Э. Эпидемиология колоректального рака и уровни витамина D: недавние открытия. Curr Opin Gastroenterol 2006, 22: 24–29 ..
- Huxley RR, Ansary-Moghaddam A, Clifton P, Czernichow S, Parr CL, Woodward M.Влияние факторов риска, связанных с питанием и образом жизни, на риск колоректального рака: количественный обзор эпидемиологических данных. Int J Cancer 2009; 125: 171–180.
- Yuhara H, Steinmaus C, Cohen SE, Corley DA, Tei Y, Buffler PA. Является ли сахарный диабет независимым фактором риска рака толстой и прямой кишки? Am J Gastroenterol 2011; 106: 1911–1921.
- Чан DSM, Лау Р., Ауне Д. и др. Красное и переработанное мясо и заболеваемость колоректальным раком: метаанализ проспективных исследований. PLoS ONE 2011 г .; 6: e20456. DOI: 10.1371 / journal.pone.0020456.
- Cottet V, Pariente A, Nalet B, et al. Колоноскопический скрининг родственников первой степени родства пациентов с большими аденомами: повышенный риск колоректальных опухолей. Гастроэнтерология 2007; 133: 1086–1092.
- Баттерворт А.С., Хиггинс Дж. П., Фароа П. Относительный и абсолютный риск колоректального рака для лиц с семейным анамнезом: метаанализ. евро J Cancer 2006; 42: 216–227.
- Syngal S, Brand RE, Church JM и др .; Американский колледж гастроэнтерологии. Клинические рекомендации ACG: генетическое тестирование и лечение наследственных синдромов рака желудочно-кишечного тракта. Am J Gastroenterol 2015; 110: 223–262.
- Giardiello FM, Allen JI, Axilbund JE, et al. Рекомендации по генетической оценке и лечению синдрома Линча: согласованное заявление Целевой группы многих обществ США по колоректальному раку. Dis Colon Rectum 2014; 57: 1025–1048.
- Beaugerie L, Itzkowitz SH. Раковые заболевания, осложняющие воспалительные заболевания кишечника. N Engl J Med 2015; 372: 1441–1452.
- Torres J, Pineton de, Chambrun G, Itzkowitz S, Sachar DB, Colombel JF. Обзорная статья: колоректальная неоплазия у пациентов с первичным склерозирующим холангитом и воспалительным заболеванием кишечника. Aliment Pharmacol Ther 2011; 34: 497–508.
- Целевая группа превентивных служб США; Биббинс-Доминго К., Гроссман Д.К., Карри С.Дж. и др.Скрининг колоректального рака: рекомендация Целевой группы по профилактическим службам США. JAMA 2016; 315: 2564–2575.
- Рекс Д.К., Джонсон Д.А., Андерсон Дж. С., Шенфельд П.С., Берк, Калифорния, Инадоми Дж. М.; Американский колледж гастроэнтерологии. Рекомендации Американского колледжа гастроэнтерологии по скринингу на колоректальный рак, 2009 г. [исправлено]. Am J Gastroenterol 2009; 104: 739–750.
- Mandel JS, Bond JH, Church TR, et al. Снижение смертности от колоректального рака за счет выявления скрытой фекальной крови. N Engl J Med 1993; 328: 1365–1371.
- Шаукат А., Монгин С.Дж., Гейссер М.С. и др. Долгосрочная смертность после обследования на колоректальный рак. N Engl J Med 2013; 369: 1106–1114.
- Леви З., Розен П., Хазази Р. и др. Количественный иммунохимический анализ кала на скрытую кровь на колоректальную неоплазию. Ann Intern Med 2007; 146: 244–255.
- Дженсен С.Д., Корли Д.А., Куинн В.П. и др. Выполнение программы иммунохимического анализа кала в течение 4 раундов ежегодного скрининга: ретроспективное когортное исследование. Ann Intern Med 2016; 164: 456–463.
- Смит А., Янг Г.П., Коул С.Р., Бэмптон П. Сравнение иммунохимического теста фекальных масс на гемоглобин с использованием чувствительного анализа кала на скрытую кровь на основе гваяковой кислоты при обнаружении колоректальной неоплазии. Cancer 2006; 107: 2152–2159.
- Allison JE, Sakoda LC, Levin TR, et al. Скрининг колоректальных новообразований с помощью новых анализов кала на скрытую кровь: обновленная информация об эксплуатационных характеристиках. J Natl Cancer Inst 2007; 99: 1462–1470.
- Imperiale TF, Ransohoff DF, Itzkowitz SH, et al. Многоцелевой анализ ДНК стула для скрининга колоректального рака. N Engl J Med 2014; 370: 1287–1297.
- Church TR, Wandell M, Lofton-Day C. и др .; для Руководящего комитета клинических исследований PRESEPT, исследователей и исследовательской группы. Проспективная оценка метилированного SEPT9 в плазме для выявления бессимптомного колоректального рака. Gut 2014; 63: 317–325.
- Дэвис В., Нисбет П., Заяц С., Кук П., Тейлор С.А. КТ-колонография без слабительного средства с меткой фекалий на основе бария: полезна ли дополнительная фосфатная клизма и хорошо ли она переносится? Br J Radiol 2011; 84: 120–125.
- IJspeert JEG, Nolthenius CJT, Kuipers EJ, et al. КТ-колонография в сравнении с колоноскопией для выявления зубчатых полипов на сидячей кости высокого риска. Am J Gastroenterol 2016; 111: 516–522.
- Аткин WS, Эдвардс Р., Краль-Ханс И. и др .; Исследователи испытаний гибкой сигмоидоскопии в Великобритании. Одноразовый гибкий скрининг с помощью ректороманоскопии в профилактике колоректального рака: многоцентровое рандомизированное контролируемое исследование. Ланцет 2010 г .; 375: 1624–1633.
- Segnan N, Armaroli P, Bonelli L, et al; Рабочая группа SCORE. Одноразовая ректороманоскопия в скрининге на колоректальный рак: последующие результаты итальянского рандомизированного контролируемого исследования — SCORE. J Natl Cancer Inst 2011; 103: 1310–1322.
- Schoen RE, Pinsky PF, Weissfeld JL, et al; для команды проекта PLCO. Заболеваемость и смертность от рака прямой кишки с гибкой скрининговой сигмоидоскопией. N Engl J Med 2012; 366: 2345–2357.
- Holme ∅, Løberg M, Kalager M, et al. Влияние гибкого скрининга с помощью ректороманоскопии на заболеваемость и смертность от рака прямой кишки: рандомизированное клиническое исследование. JAMA 2014; 312: 606–615.
- Либерман Д.А., Рекс Д.К., Винавер С.Дж. и др.Рекомендации по колоноскопическому наблюдению после скрининга и полипэктомии: согласованное обновление Целевой группы США по колоректальному раку. Гастроэнтерология 2012; 143: 844–857.
- Imperiale TF, Wagner DR, Lin CY, Larkin GN, Rogge JD, Ransohoff DF. Риск развития проксимальных новообразований на поздних стадиях у бессимптомных взрослых, согласно данным дистальных колоректальных исследований. N Engl J Med 2000; 343: 169–174.
- Schoen RE, Weissfeld JL, Pinsky PF, Riley T.Выход на прогрессирующую аденому и рак на основе размера полипа, обнаруженного при скрининговой гибкой сигмоидоскопии. Гастроэнтерология 2006; 131: 1683–1689.
- Brenner H, Stock C, Hoffmeister M. Влияние скрининг-сигмоидоскопии и скрининг-колоноскопии на заболеваемость и смертность от колоректального рака: систематический обзор и метаанализ рандомизированных контролируемых испытаний и обсервационных исследований. BMJ 2014; 348: g2467.
- Singh H, Turner D, Xue L, Targownik LE, Bernstein CN.Риск развития колоректального рака после отрицательного результата колоноскопического обследования за 10-летний интервал между колоноскопиями. JAMA 2006; 295: 2366–2373.
- Нишихара Р., Ву К., Лочхед П. и др. Долгосрочная заболеваемость колоректальным раком и смертность после эндоскопии нижних отделов. N Engl J Med 2013; 369: 195–1105.
- Baxter NN, Sutradhar R, Forbes SS, Paszat LF, Saskin R, Rabeneck L. Анализ административных данных обнаруживает, что показатели качества эндоскопистов связаны с постколоноскопическим колоректальным раком. Гастроэнтерология 2011; 140: 65–72.
- Робертсон Д. Д., Либерман Д. А., Винавер С. Дж. И др. Колоректальный рак вскоре после колоноскопии: объединенный многокогортный анализ. Gut 2014; 63: 949–956.
- Rex DK, Schoenfeld PS, Cohen J, Pike IM, et al. Показатели качества колоноскопии. Am J Gastroenterol 2015; 110: 72–90.
- Комитет по стандартам практики ASGE; Зальцман Дж. Р., Кэш Б. Д., Паша С. Ф. и др.Подготовка кишечника перед колоноскопией. Gastrointest Endosc 2015; 81: 781–794.
- Джонсон Д.А., Баркун А.Н., Коэн Л.Б. и др. Оптимизация адекватности очищения кишечника для колоноскопии: рекомендации Целевой группы многих обществ США по колоректальному раку. Am J Gastroenterol 2014; 109: 1528–1545.
- Фаррей Ф.А., Одзе РД, Иден Дж., Ицковиц Ш. Технический обзор AGA по диагностике и лечению колоректальной неоплазии при воспалительном заболевании кишечника. Гастроэнтерология 2010; 138: 746–774.
- Kornbluth A, Sachar DB; Комитет по параметрам практики Американского колледжа гастроэнтерологии. Практические рекомендации по лечению язвенного колита у взрослых: Американский колледж гастроэнтерологии, Комитет по параметрам практики. Am J Gastroenterol 2010; 105: 501–523.
- Laine L, Kaltenbach T., Barkun A, McQuaid KR, Subramanian V, Soetikno R; Панель разработки рекомендаций SCENIC. Заявление SCENIC о международном консенсусе по надзору и лечению дисплазии при воспалительном заболевании кишечника. Gastrointest Endosc 2015; 81: 489–501.
- Cole BF, Baron JA, Sandler RS и др .; для исследовательской группы по профилактике полипов. Фолиевая кислота для профилактики колоректальных аденом: рандомизированное клиническое исследование. JAMA 2007; 297: 2351–2359.
- Bonovas S, Fiorino G, Lytras T, Malesci A, Danese S. Добавки кальция для профилактики колоректальных аденом: систематический обзор и метаанализ рандомизированных контролируемых исследований. World J Gastroenterol 2016; 22: 4594–4603.
- Lee JE. Уровни циркуляции витамина D, полиморфизм рецепторов витамина D и колоректальная аденома: метаанализ. Nutr Res Pract 2011; 5: 464-470.
- Yin L, Grandi N, Raum E, Haug U, Arndt V, Brenner H. Мета-анализ: сывороточный витамин D и риск колоректальной аденомы. Prev Med 2011; 53: 10–16.
- Baron JA, Barry EL, Mott LA, et al.Проба кальция и витамина D для профилактики колоректальных аденом. N Engl J Med 2015; 373: 1519–1530.
- Чунг М., Ли Дж., Терасава Т., Лау Дж., Трикалинос Т.А. Витамин D с добавлением кальция или без него для профилактики рака и переломов: обновленный метаанализ для Целевой группы профилактических служб США. Ann Intern Med 2011; 155: 827–838.
- Чубак Дж., Уитлок Е.П., Уильямс С.Б. и др. Использование аспирина для профилактики колоректального рака: систематический обзор данных для U.S. Целевая группа по профилактическим услугам. Ann Intern Med 2016; 164: 814–825.
- Биббинс-Доминго К; Целевая группа по профилактическим услугам США. Использование аспирина для первичной профилактики сердечно-сосудистых заболеваний и колоректального рака: заявление рабочей группы США по профилактическим службам. Ann Intern Med 2016; 164: 836–845.
- Бертаньолли М.М., Игл С.Дж., Заубер А.Г. и др. Целекоксиб для профилактики спорадических колоректальных аденом. N Engl J Med 2006; 355: 873–884.
- Арбер Н., Игл С.Дж., Спикак Дж. И др. Целекоксиб для профилактики колоректальных аденоматозных полипов. N Engl J Med 2006; 355: 885–895.
- Baron JA, Sandler RS, Bresalier RS, et al. Рандомизированное испытание рофекоксиба для химиопрофилактики колоректальных аденом. Гастроэнтерология 2006; 131: 1674–1682.
- Solomon S, McMurray JJ, Pfeffer MA и др .; Профилактика аденомы с помощью исследователей исследования целекоксиба (APC).Сердечно-сосудистый риск, связанный с целекоксибом в клинических испытаниях по профилактике колоректальной аденомы. N Engl J Med 2005; 352: 1071–1080.
- Meyskens FL Jr, McLaren CE, Pelot D, et al. Дифторметилорнитин плюс сулиндак для профилактики спорадических колоректальных аденом: рандомизированное плацебо-контролируемое двойное слепое исследование. Cancer Prev Res (Phila) 2008; 1: 32–38.
- Giardiello FM, Hamilton SR, Krush AJ и др.Лечение аденом толстой и прямой кишки сулиндаком при семейном аденоматозном полипозе. N Engl J Med 1993; 328: 1313–1316.
- Labayle D, Fischer D, Vielh P, et al. Сулиндак вызывает регресс ректальных полипов при семейном аденоматозном полипозе. Гастроэнтерология 1991; 101: 635–639.
- Giardiello FM, Yang VW, Hylind LM и др. Первичная химиопрофилактика семейного аденоматозного полипоза сулиндаком N Engl J Med 2002; 346: 1054–1059.
- Steinbach G, Lynch PM, Phillips RK и др.Эффект целекоксиба, ингибитора циклокигеназы-2, при семейном аденоматозном полипозе. N Engl J Med 2000; 342: 1946–1952.
- Lynch PM, Ayers GD, Hawk E, et al. Безопасность и эффективность целекоксиба у детей с семейным аденоматозным полипозом. Am J Gastroenterol 2010; 105: 1437–1443.
- Burn J, Gerdes AM, Macrae F и др .; CAPP2 Investigators. Долгосрочное влияние аспирина на риск рака у носителей наследственного колоректального рака: анализ рандомизированного контролируемого исследования CAPP2.Ланцет 2011; 378: 2081–2087.
- Moreno CC, Mittal PK, Sullivan PS, et al. Первичный диагноз колоректального рака: скрининговая колоноскопия, диагностическая колоноскопия или экстренная хирургия, а также стадия и размер опухоли при первичном обращении. Clin Colorectal Cancer 2016; 15: 67–73.
- Volk EE, Goldblum JR, Petras RE, Carey WD, Fazio VW. Ведение и исходы пациентов с инвазивной карциномой, возникающей из колоректальных полипов. Гастроэнтерология 1995; 109: 1801–1807.
- Фишер Д.А., Шергилл А.К., Ранний Д.С. и др .; Комитет по стандартам практики Американского общества гастроинтестинальной эндоскопии.

 0° — 37.5° продолжительное время
0° — 37.5° продолжительное время Форма опухоли может быть связана с поведением и прогнозами.
Форма опухоли может быть связана с поведением и прогнозами.