Холинергический – определение, эффекты и лекарства
Холинергическое определение
Холинергический термин используется для обозначения молекула ацетилхолин. Обычно он используется для определения нейронов, рецепторов или синапсов, которые используют ацетилхолин. Например, холинергический нейрон – это нейрон, который выделяет ацетилхолин, а холинергический рецептор является рецептором, с которым связывается ацетилхолин. Ацетилхолин является сигнальной молекулой в нервная система который используется нервными клетками для передачи информации. Он широко представлен в периферическая нервная система, который участвует в сокращении скелета и гладкая мышца и в расширении кровь суда, среди других функций. Ацетилхолин играет важную роль в нервно-мышечное соединение то есть в суставе между нервными клетками и мускул, Кроме того, ацетилхолин также присутствует в Центральная нервная система где он играет роль в когнитивных процессах, таких как память, обучение и возбуждение.
Неудивительно, что его роль в многочисленных процессах периферической и центральной нервной систем сделала холинергическую систему мишенью при множественном лечении. В свою очередь, несколько холинергических препаратов были разработаны как для клинических, так и для косметических целей. Например, некоторые холинергические препараты используются для лечения сильных мышечных спазмов, другие – для замедления прогрессирования болезни Альцгеймера, а другие – для уменьшения морщин. Тем не менее, в дополнение к терапевтическим и косметическим эффектам, холинергические препараты могут также вызывать ряд побочных эффектов, включая паралич автономная нервная система.
В свою очередь, несколько холинергических препаратов были разработаны как для клинических, так и для косметических целей. Например, некоторые холинергические препараты используются для лечения сильных мышечных спазмов, другие – для замедления прогрессирования болезни Альцгеймера, а другие – для уменьшения морщин. Тем не менее, в дополнение к терапевтическим и косметическим эффектам, холинергические препараты могут также вызывать ряд побочных эффектов, включая паралич автономная нервная система.
Функция ацетилхолина
Ацетилхолин присутствует в периферической и центральной нервной системах. В периферической нервной системе ацетилхолин в значительной степени вовлечен в движение мышц и в другие функции, такие как расширение кровеносных сосудов. В центральной нервной системе он участвует в когнитивных функциях.
Ацетилхолин действует путем связывания с холинергическими рецепторами, двумя основными типами которых являются мускариновый и никотиновый. Мускариновые рецепторы ацетилхолина (mAChR) представляют собой рецепторы, связанные с G-белками (GPCR), которые модулируют активность клетка путем активации клеточных механизмов с участием вторичных мессенджеров. Есть пять идентифицированных типов, известных как M1 – M5. Мускариновые рецепторы М1, М3 и М5 обычно являются возбуждающими и относятся к типу Gq; таким образом, они выполняют свою функцию, активируя фосфолипазу C (PLC), которая, в свою очередь, активирует IP3передача сигнала каскад, позволяющий кальцию из внутриклеточных запасов высвобождаться в цитозоль, Рецепторы M2 и M4 обычно являются ингибиторными и относятся к типу Gi или Go, то есть они действуют путем уменьшения циклического АМФ (цАМФ) в клетке. Никотиновые рецепторы ацетилхолина (nAChR), другой основной тип, являются лиганд ионные каналы, которые при активации ацетилхолином непосредственно позволяют ионам входить (например, натрий) или выходить из клетки (например, калий).
Есть пять идентифицированных типов, известных как M1 – M5. Мускариновые рецепторы М1, М3 и М5 обычно являются возбуждающими и относятся к типу Gq; таким образом, они выполняют свою функцию, активируя фосфолипазу C (PLC), которая, в свою очередь, активирует IP3передача сигнала каскад, позволяющий кальцию из внутриклеточных запасов высвобождаться в цитозоль, Рецепторы M2 и M4 обычно являются ингибиторными и относятся к типу Gi или Go, то есть они действуют путем уменьшения циклического АМФ (цАМФ) в клетке. Никотиновые рецепторы ацетилхолина (nAChR), другой основной тип, являются лиганд ионные каналы, которые при активации ацетилхолином непосредственно позволяют ионам входить (например, натрий) или выходить из клетки (например, калий).
Ацетилхолин в периферической нервной системе
Ацетилхолин является основным игроком на нервно-мышечное соединение, Нервно-мышечное соединение является местом, где нервная клетка (нейрон) и скелетная мышца (вид мышц, которые добровольно сокращаются) связаны между собой. Для сокращения мышц головной мозг посылает электрохимические сигналы от одного нейрона к другому, пока не будет создан потенциал действия (электрический сигнал) на моторный нейрон, который является нейроном, который связывается с мышечным волокном. В нервно-мышечном соединении ацетилхолин высвобождается моторный нейрон в синаптическую щель, которая затем связывается с никотиновыми рецепторами ацетилхолина, присутствующими в клетке мышечного волокна. Никотиновые ацетилхолиновые рецепторы позволяют натрию поступать в мышечная клетка, после чего серия внутриклеточных сигналов приводит к сокращению мышц. Аномалии периферической холинергической передачи связаны с двигательными расстройствами, такими как миастения, расстройство, характеризующееся усталостью и мышечной слабостью.
Для сокращения мышц головной мозг посылает электрохимические сигналы от одного нейрона к другому, пока не будет создан потенциал действия (электрический сигнал) на моторный нейрон, который является нейроном, который связывается с мышечным волокном. В нервно-мышечном соединении ацетилхолин высвобождается моторный нейрон в синаптическую щель, которая затем связывается с никотиновыми рецепторами ацетилхолина, присутствующими в клетке мышечного волокна. Никотиновые ацетилхолиновые рецепторы позволяют натрию поступать в мышечная клетка, после чего серия внутриклеточных сигналов приводит к сокращению мышц. Аномалии периферической холинергической передачи связаны с двигательными расстройствами, такими как миастения, расстройство, характеризующееся усталостью и мышечной слабостью.
Ацетилхолин также является широко используемым нейротрансмиттером в вегетативной нервной системе – частью периферической нервной системы, участвующей в контроле бессознательных и непроизвольных функций организма. В частности, ацетилхолин высвобождается нейронами из центральной нервной системы, которые выступают в нейроны вегетативной нервной системы, последние из которых обнаруживают ацетилхолин через никотиновые рецепторы ацетилхолина. Эти нейроны, в свою очередь, проецируются на части тела, которые не принадлежат нервной системе, такие как желудочно-кишечный тракт. В некоторых случаях ацетилхолин также выделяется в этом соединении между периферической нервной системой и другими частями тела.
В частности, ацетилхолин высвобождается нейронами из центральной нервной системы, которые выступают в нейроны вегетативной нервной системы, последние из которых обнаруживают ацетилхолин через никотиновые рецепторы ацетилхолина. Эти нейроны, в свою очередь, проецируются на части тела, которые не принадлежат нервной системе, такие как желудочно-кишечный тракт. В некоторых случаях ацетилхолин также выделяется в этом соединении между периферической нервной системой и другими частями тела.
Ацетилхолин в центральной нервной системе
В центральной нервной системе холинергическая активность связана, среди прочего, с возбуждением, осознанием, обучением, памятью, вниманием и вознаграждением. Не удивительно, что ненормальная холинергическая передача была связана с болезнью Альцгеймера, нейродегенеративным состоянием, характеризующимся потерей памяти.
Холинергические препараты
Участие ацетилхолина в заболеваниях нервной системы естественным образом делает холинергическую систему мишенью для терапевтических целей. С целью лечения ряда нейропсихиатрических состояний были разработаны лекарственные средства, которые активируют (агонисты) или инактивируют (антагонисты) рецепторы ацетилхолина, а также лекарства, которые модулируют холинергическую активность путем облегчения или предотвращения производства, высвобождения или деградации ацетилхолина.
С целью лечения ряда нейропсихиатрических состояний были разработаны лекарственные средства, которые активируют (агонисты) или инактивируют (антагонисты) рецепторы ацетилхолина, а также лекарства, которые модулируют холинергическую активность путем облегчения или предотвращения производства, высвобождения или деградации ацетилхолина.
Агонисты
Ацетилхолин имеет очень короткую жизнь: он не длится долго в кровотоке, потому что он очень быстро разлагается. Следовательно, ацетилхолин сам по себе не используется в качестве лекарственного средства, но вместо этого используются аналогичные соединения, которые активируют рецепторы ацетилхолина, чтобы активировать их. Эти сходные соединения, которые связываются и активируют рецепторы ацетилхолина, известны как агонисты ацетилхолина.
Пример агонист пилокарпин, который активирует мускариновые рецепторы и обычно применяется в зрачке глаза для лечения нейродегенеративного заболевания, которое вызывает слепоту, называемую глаукомой. Другим примером агониста является никотин, найденный в табаке.
Другим примером агониста является никотин, найденный в табаке.
Антагонисты
Многие холинергические препараты являются антагонистами ацетилхолиновых рецепторов, которые блокируют рецепторы ацетилхолина. Некоторыми антагонистами являются атропин, скополамин, гексаметоний и триметафан. Атропин и скополамин инактивируют мускариновые рецепторы и используются для подавления секреции организма (например, слезы или слизи) и для расслабления гладких мышц (например, мышц в желудочно-кишечном тракте) во время анестезии и для лечения укачивания. Гексаметоний и триметафан блокируют никотиновые рецепторы и используются для снижения высокого кровяного давления. Другие агенты, которые блокируют никотиновые рецепторы, используются из-за их воздействия на нервно-мышечное соединение; Эти агенты предотвращают сокращение скелетных мышц и часто используются во время операции, чтобы удержать пациентов от непроизвольных движений.
Другие наркотики
В дополнение к холинергическим агонистам и антагонистам другие лекарственные средства могут модулировать активность ацетилхолина путем увеличения или уменьшения его продукции, высвобождения или деградации. Например, инактивация ацетилхолинтрансферазы, которая является ферментом, расщепляющим ацетилхолин, используется для повышения уровня ацетилхолина и для лечения миастении, нервно-мышечного расстройства. Подобные лекарства, такие как неостигмин и пиридостигмин, не проникают через гематоэнцефалический барьер и, следовательно, используются для воздействия на нервно-мышечное соединение и сокращение скелетных мышц.
Например, инактивация ацетилхолинтрансферазы, которая является ферментом, расщепляющим ацетилхолин, используется для повышения уровня ацетилхолина и для лечения миастении, нервно-мышечного расстройства. Подобные лекарства, такие как неостигмин и пиридостигмин, не проникают через гематоэнцефалический барьер и, следовательно, используются для воздействия на нервно-мышечное соединение и сокращение скелетных мышц.
Тем не менее, антихолинергические средства – препараты, которые уменьшают или блокируют действие ацетилхолина – более широко используются для лечения многочисленных состояний. Некоторые из них – непроизвольные движения, желудочно-кишечные расстройства, недержание мочи и болезнь Паркинсона. Другим соединением, которое блокирует выделение ацетилхолина, является ботулин. токсин – агент, производимый бактерией определенного типа – который парализует скелетные мышцы, так что организм больше не может двигаться и может даже привести к смерти. При местном применении ботулинический токсин расслабляет мышцы и, следовательно, используется для лечения тяжелых мышечных спазмов. Это же соединение используется для уменьшения морщин, расслабляя мышцы и кожа ; мы знаем это под торговым названием Ботокс.
Это же соединение используется для уменьшения морщин, расслабляя мышцы и кожа ; мы знаем это под торговым названием Ботокс.
Холинергические эффекты
Эффекты активации холинергических рецепторов включают сокращение мышц, сердце скорость замедления, сужение радужки (миоз ) и хрусталика, слизь секреция и бронхо-сужение. И наоборот, эффекты инактивации холинергических рецепторов включают расслабление мышц, ускорение сердечного ритма, расширение зрачка (мидриаз) и уплощение хрусталика (циклопегия), сухость верхних дыхательных путей ( дыхательная система ), подавление образования слез, задержка мочи, сухость во рту, замедление слизисто-дыхательной активности в дыхательных путях, запоры и расслабление мышц (скелетные и гладкие мышцы).
Побочные эффекты холинергических препаратов
Холинергические препараты могут помочь в лечении некоторых расстройств и ослабления симптомов, но они также имеют негативные побочные эффекты. Большинство холинергических лекарств являются антихолинергическими, то есть они уменьшают или блокируют действие ацетилхолина. Например, антагонисты ацетилхолина гексаметоний и триметафан, используемые для лечения высокого кровяного давления, могут вызывать паралич вегетативной нервной системы, вызывая такие эффекты, как нарушение зрения и неспособность мочиться. Антихолинергические препараты в целом могут вызывать повышение температуры тела, поскольку они уменьшают потоотделение; они также могут вызывать сонливость, галлюцинации, спутанность сознания, сухость во рту, запоры, затруднение мочеиспускания и дефицит памяти. У пожилых людей они могут вызвать замешательство, потерю памяти и ухудшение когнитивных функций. Смешивание антихолинергических препаратов с алкоголем имеет такие же побочные эффекты, как и передозировка антихолинергическими средствами, которые включают головокружение, лихорадку, спутанность сознания, учащенное сердцебиение, проблемы с дыханием, галлюцинации, потерю сознания и даже смерть. Поэтому следует соблюдать осторожность при приеме холинергических препаратов.
Например, антагонисты ацетилхолина гексаметоний и триметафан, используемые для лечения высокого кровяного давления, могут вызывать паралич вегетативной нервной системы, вызывая такие эффекты, как нарушение зрения и неспособность мочиться. Антихолинергические препараты в целом могут вызывать повышение температуры тела, поскольку они уменьшают потоотделение; они также могут вызывать сонливость, галлюцинации, спутанность сознания, сухость во рту, запоры, затруднение мочеиспускания и дефицит памяти. У пожилых людей они могут вызвать замешательство, потерю памяти и ухудшение когнитивных функций. Смешивание антихолинергических препаратов с алкоголем имеет такие же побочные эффекты, как и передозировка антихолинергическими средствами, которые включают головокружение, лихорадку, спутанность сознания, учащенное сердцебиение, проблемы с дыханием, галлюцинации, потерю сознания и даже смерть. Поэтому следует соблюдать осторожность при приеме холинергических препаратов.
викторина
1. Где ацетилхолин играет главную роль?A. На нервно-мышечном соединении.B. На кортикоспинальном тракте.C. Во всей периферической нервной системе.D. Во всей центральной нервной системе.E. Все вышеперечисленное.
Где ацетилхолин играет главную роль?A. На нервно-мышечном соединении.B. На кортикоспинальном тракте.C. Во всей периферической нервной системе.D. Во всей центральной нервной системе.E. Все вышеперечисленное.
Ответ на вопрос № 1
верно. Ацетилхолин участвует в некоторых, но не во всех процессах периферической и центральной нервной системы. Однако он играет важную роль в нервно-мышечном соединении, где моторные нейроны встретить мышечные волокна.
2. Каковы некоторые эффекты инактивации холинергических рецепторов?A. Замедление сердечного ритма и расслабление мышц.B. Ускорение сердечного ритма и мышечные спазмы.C. Расширение зрачка и мышечные спазмы.D. Задержка мочи, сухость верхних дыхательных путей и расслабление мышц.
Ответ на вопрос № 2
D верно. Блокирование ацетилхолиновых рецепторов приводит к множественным эффектам, два из которых – задержка мочи, сухость верхних дыхательных путей и расслабление мышц.
3. Какие расстройства лечат антагонистами ацетилхолина или антихолинергическими препаратами?A. Желудочно-кишечные расстройства, биполярное расстройство и укачивание.B. Желудочно-кишечные расстройства, болезнь Паркинсона и высокое кровяное давление.C. Глаукома, болезнь Альцгеймера, болезнь Паркинсона и низкое кровяное давление.D. Глаукома, болезнь Альцгеймера и высокое кровяное давление.
Ответ на вопрос № 3
В верно. Из-за его влияния на желудочно-кишечный тракт, на движения мышц и расширение кровеносных сосудов блокирование эффектов ацетилхолина с помощью антагонистов или антихолинергических препаратов используется для лечения множества клинических состояний, некоторые из которых – желудочно-кишечные расстройства, болезнь Паркинсона и высокое кровяное давление.
Вегетативная иннервация голосовых складок человека
Введение. Изменения трофического состояния тканей гортани, в том числе дистрофические процессы, связанные с нарушением адаптационно-трофической функции вегетативной нервной системы (ВНС), могут оказывать воздействие как на функциональную активность слизистой оболочки голосовых складок, так и на работу мышц гортани.
Материал и методы. В качестве материала использовали гортани, взятые у 15 погибших в возрасте 51 года — 82 лет в результате травм, несовместимых с жизнью во время секционного исследования (через 8—24 ч после смерти). Проведен гистохимический анализ вегетативной иннервации голосовых складок. Препараты обрабатывали с использованием гистохимических реакций, позволяющих выявить адренергические и холинергические нервные волокна на одном и том же срезе. Холинергические нервные структуры исследовали с помощью гистохимической реакции с использованием в качестве субстрата ацетилтиохолинйодид (АТХ), а для выявления адренергических нервных структур применяли глиоксиловую кислоту. Адренергическую иннервацию изучали с помощью люминесцентного микроскопа, используя светофильтр с длиной волны 480 нм, а холинергическую иннервацию с помощью микроскопа МБИ-6.
Результаты. В результате было обнаружено, что адренергические нервные волокна в голосовых складках находились непосредственно среди мышечных волокон. Наибольшее сосредоточение нервной ткани отмечалось в апикальной части мышечного волокна. Часто встречались перивазальные крупнопетлистые адренергические нервные сплетения, от которых отходили тонкие нервные волоконца. Нередко по ходу сосудисто-нервных пучков располагались клетки, обладающие ярко-желтой люминесценцией, что свидетельствовало об их моноаминергической природе. В слизистой оболочке голосовой складки выявлялись упорядоченные нервные сплетения с варикозными расширениями. Нервные волокна достигали подэпителиального пространства и располагались параллельно базальной мембране эпителия. Отдельные нервные волокна сплетений ответвлялись от них и приближались к эпителиальным клеткам. Холинергические нервные волокна, иннервирующие голосовые складки, ориентировались вдоль мышечного волокна, близко прилегая к нему, и имели более толстые стволики с меньшим числом варикозностей. Наибольшее сосредоточение нервных волокон отмечалось в апикальной части мышц голосовой складки, вблизи от места прикрепления к хрящевой ткани.
Наибольшее сосредоточение нервной ткани отмечалось в апикальной части мышечного волокна. Часто встречались перивазальные крупнопетлистые адренергические нервные сплетения, от которых отходили тонкие нервные волоконца. Нередко по ходу сосудисто-нервных пучков располагались клетки, обладающие ярко-желтой люминесценцией, что свидетельствовало об их моноаминергической природе. В слизистой оболочке голосовой складки выявлялись упорядоченные нервные сплетения с варикозными расширениями. Нервные волокна достигали подэпителиального пространства и располагались параллельно базальной мембране эпителия. Отдельные нервные волокна сплетений ответвлялись от них и приближались к эпителиальным клеткам. Холинергические нервные волокна, иннервирующие голосовые складки, ориентировались вдоль мышечного волокна, близко прилегая к нему, и имели более толстые стволики с меньшим числом варикозностей. Наибольшее сосредоточение нервных волокон отмечалось в апикальной части мышц голосовой складки, вблизи от места прикрепления к хрящевой ткани. Как и адренергические волокна, холинергические нервные проводники часто отходили от перивазальных нервных сплетений и образовывали собственные нервные сплетения. От них ответвлялись отдельные терминали и приближались к эпителиальным клеткам слизистой оболочки.
Как и адренергические волокна, холинергические нервные проводники часто отходили от перивазальных нервных сплетений и образовывали собственные нервные сплетения. От них ответвлялись отдельные терминали и приближались к эпителиальным клеткам слизистой оболочки.
Заключение. В целом исследование секционного материала показало, что в голосовых складках топография адренергических и холинергических нервных проводников в основном аналогична. Они используют, как правило, общие пути проникновения в гортань по ходу кровеносных сосудов и в составе гортанных нервов.
Источник…
Метоклопрамид инструкция по применению: показания, противопоказания, побочное действие – описание Metoclopramid таб. 10 мг: 50 шт. (1622)
При одновременном применении с антихолинергическими средствами возможно взаимное ослабление эффектов.
При одновременном применении с нейролептиками (особенно фенотиазинового ряда и производных бутирофенона) повышается риск возникновения экстрапирамидных реакций.
При одновременном применении усиливается абсорбция ацетилсалициловой кислоты, парацетамола, этанола.
Метоклопрамид при в/в введении повышает скорость абсорбции диазепама и повышает его максимальную концентрацию в плазме крови.
При одновременном применении с медленно растворяющейся лекарственной формой дигоксина возможно уменьшение концентрации дигоксина в сыворотке крови на 1/3. При одновременном применении с дигоксином в жидкой лекарственной форме или в виде быстрорастворимой лекарственной формы взаимодействия не отмечено.
При одновременном применении с зопиклоном ускоряется абсорбция зопиклона; с каберголином — возможно уменьшение эффективности каберголина; с кетопрофеном — уменьшается биодоступность кетопрофена.
Вследствие антагонизма в отношении допаминовых рецепторов метоклопрамид может уменьшать противопаркинсоническое действие леводопы, при этом возможно повышение биодоступности леводопы вследствие ускорения ее эвакуации из желудка под влиянием метоклопрамида. Результаты взаимодействия неоднозначны.
Результаты взаимодействия неоднозначны.
При одновременном применении с мексилетином ускоряется абсорбция мексилетина; с мефлохином — повышается скорость абсорбции мефлохина и его концентрация в плазме крови, при этом возможно уменьшение его побочных эффектов.
При одновременном применении с морфином ускоряется абсорбция морфина при приеме внутрь и усиливается его седативное действие.
При одновременном применении с нитрофурантоином уменьшается абсорбция нитрофурантоина.
При применении метоклопрамида непосредственно перед введением пропофола или тиопентала может потребоваться уменьшение их индукционных доз.
У пациентов, получающих метоклопрамид, усиливаются и пролонгируются эффекты суксаметония хлорида.
При одновременном применении с толтеродином уменьшается эффективность метоклопрамида; с флувоксамином — описан случай развития экстрапирамидных нарушений; с флуоксетином — имеется риск развития экстрапирамидных нарушений; с циклоспорином — повышается абсорбция циклоспорина и увеличивается его концентрация в плазме крови.
Neurohumoral regulation in rheumatism | Shcherbatenko
Ревматизм, как наиболее частая причина сердечно-сосудистых заболеваний у лиц молодого возраста и рано наступающей инвалидности, до сих пор остается актуальной проблемой медицины.
Наши исследования были посвящены изучению нейрогуморальной регуляции при ревматизме — одной из важнейших функций организма, во многом определяющей неспецифичсскую реактивность. Нейрогуморальная регуляция, возникающая в процесе эволюции, обеспечивает широкие возможности приспособления организма как в нормальных, так и в патологических условиях. Следует отметить недостаточную изученность (состояния системы ацетилхолин — холинэстераза при ревматизме,, «особенно при различных вариантах его течения, тогда как значение этих показателей для понимания участия нервной системы в патогенезе заболевания, обоснования патогенетической терапии в приступном и межприступном периодах ревматизма очень велико.
У всех больных с ревматизмом были однонаправленные закономерные сдвиги в системе ацетилхолин — холинэстераза, коррелирующие с выраженностью клинических проявлений болезни, изменениями картины крови и гемодинамических показателей. При острой форме ревматизма — ревматическом полиартрите и первичном ревматическом кардите — сдвиги в составе крови были наиболее выраженными.
При острой форме ревматизма — ревматическом полиартрите и первичном ревматическом кардите — сдвиги в составе крови были наиболее выраженными.
В остром периоде заболевания,, когда, с одной стороны, происходит максимальная мобилизация защитных механизмов, а с другой — наиболее остро проявляются все симптомы, присущие данному состоянию, наблюдается значительное повышение содержания ацетилхолина в крови. Активность холинэстеразы крови в этом периоде была ниже нормы. У всех больных ревматическим полиартритом была выявлена активная очаговая инфекция. Особенно1 высокое содержание ацетилхолина и низкая активность холинэстеразы в крови были обнаружены при выраженных признаках воспалительного процесса в суставах, высокой температуре, отчетливых сдвигах в картине крови, что соответствовало III степени активности. Эти изменения носили динамический характер. По мере клинического улучшения происходила нормализация данных показателей. Высокая концентрация ацетилхолина в крови больных с острыми проявлениями ревматического полиартрита рассматривается нами как показатель высокой степени сенсибилизации организма. Исходя из представления о ведущей роли инфекции при ревматизме, мы применяли для лечения больных с острым полиартритом комплексную терапию антибиотиками, салицилатами или кортикостероидами. По нашему мнению, изолированное применение пенициллина в начале заболевания способствует хорошей реализации его эффекта с быстрым уменьшением стрептококковой интоксикации. Последующее применение салицилатов или кортикостероидов приводит к более полному проявлению их противовоспалительного и противоаллергического действия.
Исходя из представления о ведущей роли инфекции при ревматизме, мы применяли для лечения больных с острым полиартритом комплексную терапию антибиотиками, салицилатами или кортикостероидами. По нашему мнению, изолированное применение пенициллина в начале заболевания способствует хорошей реализации его эффекта с быстрым уменьшением стрептококковой интоксикации. Последующее применение салицилатов или кортикостероидов приводит к более полному проявлению их противовоспалительного и противоаллергического действия.
По изменению холинергической реакции крови можно не только судить об эффективности лечения больных острым ревматическим полиартритом, но и получить определенное представление о прогнозе заболевания. Стойкая ремиссия отмечалась лишь у тех больных, у которых в процессе лечения была достигнута полная нормализация концентрации ацетилхолина и активности холинэстеразы.
Наши исследования убедительно показали, что ревматизм в активной фазе сопровождается строго закономерными’ сдвигами в холинергической реакции крови. Являясь отражением глубоких изменений, происходящих в нейрогуморальной системе организма больного, эти сдвиги имеют, несомненно, большое значение в чисто клиническом плане. Они могут быть использованы в диагностических и прогностических целях.
Являясь отражением глубоких изменений, происходящих в нейрогуморальной системе организма больного, эти сдвиги имеют, несомненно, большое значение в чисто клиническом плане. Они могут быть использованы в диагностических и прогностических целях.
Исследование холинергической реакции крови у больных с затяжным течением ревматического кардита выявило изменения противоположного характера: резкое снижение уровня ацетилхолина и низкую активность холинэстеразы. Комплексное лечение пенициллином и противовоспалительными препаратами, осуществляемое в течение 4 нед, не сопровождалось изменениями этих показателей, что свидетельствовало о продолжающемся воспалительном процессе и требовало более активной терапии, в частности кортикостероидами.
Закономерные изменения в системе ацетилхолин — холинэстераза наблюдались при ревматическом кардите II степени активности: нами отмечены высокое содержание в крови ацетилхолина и низкая активность холинэстеразы — состояние холинергической субкомпенсации. Снижение уровня ацетилхолина и повышение активности холинэстеразы всегда соответствовали наступлению полной ремиссии с исчезновением всех признаков ревматизма и служили показанием для прекращения активной терапии.
Снижение уровня ацетилхолина и повышение активности холинэстеразы всегда соответствовали наступлению полной ремиссии с исчезновением всех признаков ревматизма и служили показанием для прекращения активной терапии.
Ревматический кардит III степени активности также характеризовался высоким содержанием ацетилхолина и низкой активностью холинэстеразы, что расценивалось нами как состояние холинергической декомпенсации. Эффект от лечения у больных этой группы наступал медленно, почти всегда в терапию включали стероидные гормоны в средних терапевтических дозах. Однако только у 15% пациентов было достигнуто состояние физиологической компенсации холинергической системы. Эта группа больных нуждается в обязательной пролонгированной терапии иногда на протяжении многих лет.
Особый интерес представляло изучение холинергической системы у больных, оперированных по поводу ревматических пороков сердца. Обычные клинические и параклинические методы исследования у них, как правило, не выявляли активности ревматического процесса. Однако у 76% больных при так называемом межприступ- ном течении ревматизма были отмечены отклонения в соотношении ацетилхолин — холинэстераза, свидетельствовавшие об активной стадии ревматизма. Если состояние кровообращения позволяло отложить оперативное вмешательство, мы проводили активную противоревматическую терапию и направляли больных на операцию только после нормализации системы ацетилхолин — холинэстераза. У таких больных отмечался наилучший эффект лечения. При Состоянии кровообращения, требовавшем незамедлительного вмешательства, больных оперировали в состоянии холинергической декомпенсации, что у 76% пациентов вызвало тяжелое обострение ревматизма в ближайшем послеоперационном периоде.
Однако у 76% больных при так называемом межприступ- ном течении ревматизма были отмечены отклонения в соотношении ацетилхолин — холинэстераза, свидетельствовавшие об активной стадии ревматизма. Если состояние кровообращения позволяло отложить оперативное вмешательство, мы проводили активную противоревматическую терапию и направляли больных на операцию только после нормализации системы ацетилхолин — холинэстераза. У таких больных отмечался наилучший эффект лечения. При Состоянии кровообращения, требовавшем незамедлительного вмешательства, больных оперировали в состоянии холинергической декомпенсации, что у 76% пациентов вызвало тяжелое обострение ревматизма в ближайшем послеоперационном периоде.
Представлялось интересным подробно изучить состояние холинергической системы при бактериальном эндокардите, также изменившем в последнее время свое клиническое течение. В клинике бактериального эндокардита практически отсутствуют ведущие признаки септического состояния: заболевание протекает с незначительным ознобом, субфебрильной лихорадкой, число лейкоцитов в крови остается в пределах нормы. Если учесть возможность развития процесса на фоне старого ревматического порока сердца, то станут очевидными те трудности, с которыми встречается врач при дифференциальной диагностике септического и ревматического эндокардита.
Если учесть возможность развития процесса на фоне старого ревматического порока сердца, то станут очевидными те трудности, с которыми встречается врач при дифференциальной диагностике септического и ревматического эндокардита.
Чем же вызваны такие изменения в клинических проявлениях септического процесса? Ответить на постав!ленный вопрос сложно. Этому способствуют, очевидно, многие факторы: изменчивость возбудителя, изменение реактивности макроорганизма в результате длительного лечения антибиотиками больных с активным ревматизмом. В каждом отдельном случае одни факторы являются ведущими, другие — сопутствующими.
Согласно нашим данным, атипичною течение болезни у ряда больных вызвано длительным, порой бессистемным лечением антибиотиками ревматического эндокардита, диагностированного за несколько лет до настоящего заболевания. Трудность выявления септического1 эндокардита в ‘современной «неклассической» форме послужила причиной для исследования холинергической системы крови.
У больных бактериальным эндокардитом, развившимся на фюне ревматического порока сердца, обнаружены существенные различия в соотношении ацетилхолин — холинэстераза. Септическому процессу, в отличие от ревматизма, присуще резкое угнетение холинергических систем крови, что мы использовали, наряду с другими тестами, для дифференциальной диагностики.
В ходе лечения антибиотиками ни у одного больного не произошло нормализации системы ацетилхолин — холинэстераза. Только- после присоединения кортикостероидной терапии в большинстве случаев наблюдалось восстановление ее показателей.
Представлялось важным изучить состояние системы ацетилхолин — холинэстераза и при других заболеваниях, в частности при ревматоидном полиартрите. Хорошо I известно, что (иногда назначение высокой дозы гормональных иммуносупрессоров быстро изменяет течение заболевания, ликвидируя ведущие клинические признаки болезни и не влияя на сущность патологического процесса. Однако быстрое прекращение лечения приводит к вспышке заболевания, трудно купируемой в дальнейшем. В то же время длительное лечение адекватными дозами гормонов способно изменить течение основного процесса, у больного наступает полная и длительная клиническая ремиссия, близкая к выздоровлению.
В то же время длительное лечение адекватными дозами гормонов способно изменить течение основного процесса, у больного наступает полная и длительная клиническая ремиссия, близкая к выздоровлению.
Таким образом, клиницисту нужны тонкие критерии активности ревматоидного полиартрита, позволяющие в ходе кортикостероидной терапии достоверно определять продолжительность лечения в каждом конкретном случае.
Для больных с ревматоидным полиартритом было свойственно сочетание нормальной или повышенной концентрации ацетилхолина в крови и низкой активности холинэстеразы. Наряду с общими закономерностями в изменениях системы ацетилхолин — холинэстераза крови у них выявлены (особенности, присущие больным с разной степенью активности. Так, при активности I степени наиболее характерно резкое снижение концентрации ацетилхолина и умеренное понижение активности холинэстеразы, при II — умеренное повышение концентрации ацетилхолина в крови или резкое уменьшение и снижение активности холинэстеразы. Серопозитивная фаза заболевания сопровождается повышением концентрации ацетилхолина и умеренным понижением активности холинэстеразы.
Серопозитивная фаза заболевания сопровождается повышением концентрации ацетилхолина и умеренным понижением активности холинэстеразы.
Под действием терапии наблюдалось медленное восстановление нарушенного равновесия в холинергической системе крови. Наиболее изменчивым при этом оказался уровень ацетилхолина, у большинства больных ревматоидным полиартритом он перестал выявляться. Активность холинэстеразы и после наступления ремиссии оставалась, как правило, низкой. Предвестником обострения процесса являлось обычно повышение содержания ацетилхолина в крови, признаком выраженного обострения — прогрессирующее падение активности холинэстеразы.
Особенно резкие изменения в активности системы ацетилхолин — холинэстераза нами констатированы у больных с системной красной волчанкой — наиболее тяжелым заболеванием группы коллагенозов. Практически у всех больных с активным течением волчанки было отмечено значительное угнетение холинергической активности крови даже в случае наступления клинической (ремиссии. По глубине угнетения холинергической системы крови системная красная волчанка занимает особое место среди болезней соединительной ткани.
По глубине угнетения холинергической системы крови системная красная волчанка занимает особое место среди болезней соединительной ткани.
Наши многолетние наблюдения за течением ревматизма, ревматоидного полиартрита и, особенно, системной красной волчанки показывают, что существует многочисленная группа больных с резкими нарушениями в холинергической системе организма, которые не поддаются терапии, общепринятой при данных заболеваниях. В связи с этим продолжается поиск новых лекарственных препаратов. В последние годы возрос интерес к применению негормюнальных иммуносупрессоров, поскольку они способны подавлять «рост и дифференцировку иммунных клеток и синтез антител путем прекращения клеточного деления на уровне синтеза ДНК и РНК.
Пока еще нет единого мнения о показаниях и противопоказаниях к назначению цитостатиков, об их оптимальной дозировке, сроках лечения, иммунологической эффективности, весьма разнообразны схемы лечения. В то же время опыт показывает, что целенаправленное использование иммунодепрессантов в клинике коллагеновых заболеваний оправдывает дальнейшее изучение терапевтических возможностей цитостатических средств.
Показанием для назначения негормональных иммуносупрессоров для нас служил высокоактивный и генерализованный процесс при отсутствии должного эффекта или невозможности лечения кортикостероидными препаратами в эффективных дозах. Мы отметили, что иммуносупрессоры резко изменяют состояние системы ацетилхолин — холинэстераза, часто нормализуя его при положительном клиническом результате. По нашему мнению, негормональные иммуносупрессоры займут должное место в ряду неспецифических методов терапии болезней соединительной ткани.
Таким образом, холинергическая система вовлекается в патогенез активного ревматизма, но изменения ее в каждом конкретном случае различны, что, по всей вероятности, обусловлено многообразием вариантов течения ревматизма, особенностями реакции больного на лекарственное воздействие.
Мы выявили варианты взаимоотношений между ацетилхолином и холинэстеразой, что дало возможность выделить 4 типа реакций, соответствующих особенностям,клинического течения и дающих возможность определять выбор терапии и дальнейшую программу профилактики рецидивов.
- Реакция физиологической компенсации свойственна больным с неактивным течением ревматизма.
- Реакция холинергической гиперергии характерна для активного течения ревматизма, хорошо поддающегося комплексной антибактериальной и неспецифической противовоспалительной терапии.
- Холинергическая суб- и декомпенсация наблюдается’ при так называемом латентном течении ревматизма, склонном к длительным и частым рецидивам. При данном типе реакции лечение следует прекращать, исходя не столько из общепринятых критериев активности, сколько из показателей холинергических процессов, наиболее адекватно’ отражающих активность заболевания.
- Гипоэргия чаще встречается при благоприятном течении ревматизма.
- В настоящее время коллектив нашей кафедры расширяет и углубляет исследования нейрогуморальной регуляции при ревматизме.
1) Актовая речь, произнесенная на заседании ученого совета Казанского ордена Трудового Красного Знамени медицинского института имени С. В. Курашова 10 мая 1984 г
В. Курашова 10 мая 1984 г
INFLUENCE OF BRAIN BASAL CHOLINERGIC SYSTEM DYSFUNCTIONON THE CONDITION OF COGNITIVE FUNCTIONS (LITERATURE REVIEW) | Lobzin
This article is dedicated to the impact of dysfunction of the basal cholinergic system on the state of cognitive functions in various diseases of the brain. domestic and foreign literature is completely reviewed. The pathogenetic mechanisms of dysfunction cholinergic system of the brain are described in myasthenia gravis. Modern approaches in the treatment of cognitive impairment with using central cholinomimetics are described.
Базальная холинергическая система мозга играет важную роль в регуляции внимания, вре- менной и декларативной памяти, обучения и дру- гих когнитивных процессов [1]. Холинергические нейроны широко распространены в центральной нервной системе, образуя скопления в области гиппокампальной извилины, гипоталамуса, сред- него мозга и коры больших полушарий [2]. Основным источником холинергической иннервации коры головного мозга является ба- зальное крупноклеточное ядро Мейнерта, рас- положенное в области внутренней капсулы, ниже медиального сегмента бледного шара [3]. Проекции ядра Мейнерта иннервируют практи- чески все отделы неокортекса, однако наиболее значимые холинергические связи модулируют активность медиальных отделов височной доли и орбито-фронтальной коры [4]. Получая аффе- рентную иннервацию от структур лимбической системы, нейроны ядра Мейнерта принимают участие в реакциях на различные эмоциональ- ные стимулы [5]. другая группа холинергических нейронов сконцентрирована в области покрышки средне- го мозга и представлена педункулопонтинным ядром и смежными ядрами ствола мозга. Об- разуя многочисленные связи с гипоталамусом, гиппокампальной извилиной, миндалиной и префронтальной корой, данная холинергиче- ская субсистема участвует в формировании циркадных ритмов и инициирует фазу быстро- го сна [6].
Холинергические нейроны широко распространены в центральной нервной системе, образуя скопления в области гиппокампальной извилины, гипоталамуса, сред- него мозга и коры больших полушарий [2]. Основным источником холинергической иннервации коры головного мозга является ба- зальное крупноклеточное ядро Мейнерта, рас- положенное в области внутренней капсулы, ниже медиального сегмента бледного шара [3]. Проекции ядра Мейнерта иннервируют практи- чески все отделы неокортекса, однако наиболее значимые холинергические связи модулируют активность медиальных отделов височной доли и орбито-фронтальной коры [4]. Получая аффе- рентную иннервацию от структур лимбической системы, нейроны ядра Мейнерта принимают участие в реакциях на различные эмоциональ- ные стимулы [5]. другая группа холинергических нейронов сконцентрирована в области покрышки средне- го мозга и представлена педункулопонтинным ядром и смежными ядрами ствола мозга. Об- разуя многочисленные связи с гипоталамусом, гиппокампальной извилиной, миндалиной и префронтальной корой, данная холинергиче- ская субсистема участвует в формировании циркадных ритмов и инициирует фазу быстро- го сна [6]. Ее активность максимальна в период бодрствования и уменьшается во время медлен- новолнового сна [7]. Ацетилхолин является основным нейротранс- миттером регулирующим активность базаль- ной холинергической системы. Ацетилхолин синтезируется в пресинаптических терминалях из ацетил-коэнзима А и холина под действием фермента ацетилхолинтрансферазы. При помо- щи везикулярного транспортера ацетилхолина (VAChT) осуществляется перенос ацетилхоли- на, содержащегося в цитозоле нейрона, в синап- тический пузырек. Выделяясь в синаптическую щель, ацетилхолин взаимодействует с рецепто- рами на постсинаптической мембране, далее рас- щепляется под влиянием ацетилхолинэстеразы и бутирилхолинэстеразы до уксусной кислоты и холина, которые абсорбируются обратно в пре- синаптическую терминаль [8, 9]. Ацетилхолин может взаимодействовать с двумя основными типами рецепторов — му- скариновыми (М-холинорецепторы) и нико- тиновыми (Н-холинорецепторы) [10]. Пере- дача импульсов через М-холинорецепторы осуществляется посредством мембранных гетеротримерных G-белков.
Ее активность максимальна в период бодрствования и уменьшается во время медлен- новолнового сна [7]. Ацетилхолин является основным нейротранс- миттером регулирующим активность базаль- ной холинергической системы. Ацетилхолин синтезируется в пресинаптических терминалях из ацетил-коэнзима А и холина под действием фермента ацетилхолинтрансферазы. При помо- щи везикулярного транспортера ацетилхолина (VAChT) осуществляется перенос ацетилхоли- на, содержащегося в цитозоле нейрона, в синап- тический пузырек. Выделяясь в синаптическую щель, ацетилхолин взаимодействует с рецепто- рами на постсинаптической мембране, далее рас- щепляется под влиянием ацетилхолинэстеразы и бутирилхолинэстеразы до уксусной кислоты и холина, которые абсорбируются обратно в пре- синаптическую терминаль [8, 9]. Ацетилхолин может взаимодействовать с двумя основными типами рецепторов — му- скариновыми (М-холинорецепторы) и нико- тиновыми (Н-холинорецепторы) [10]. Пере- дача импульсов через М-холинорецепторы осуществляется посредством мембранных гетеротримерных G-белков. Методом клони- рования кдНК обнаружено пять подтипов М-холинорецепторов (М -М ), четыре из них удалось идентифицировать функционально и фармакологически [11]. М -рецепторы ло- кализуются в области коры головного мозга и гиппокампальной извилины. Они являются основными постсинаптическими холинорецеп- торами, регулирующими когнитивные функ- ции. М — рецепторы обнаруживаются преиму- щественно в стволе мозга и мозжечке. При их активации ингибируется дальнейшее выделе- ние ацетилхолина [4]. Том 9 № 4 2017 53 ОБЗОР Н-холинорецепторы являются трансмем- бранными белками, состоящими из 5 субъединиц компактно сгруппированных вокруг централь- ного канала [12]. В настоящее время идентифи- цированы 9 α (1-9) и 4 (1-4) β-субъединицы. α1 и β1 локализуются в нервно-мышечных синапсах, α2-9 и β2-4 в различных структурах центральной нервной системы [13]. Среди большого разноо- бразия подтипов Н-холинорецепторов, в голов- ном мозге наиболее важны два: 4α2β (состоящие из 4 α- и 2 β-субъединиц) и α7 (состоящие из 7 α-субъединиц).
Методом клони- рования кдНК обнаружено пять подтипов М-холинорецепторов (М -М ), четыре из них удалось идентифицировать функционально и фармакологически [11]. М -рецепторы ло- кализуются в области коры головного мозга и гиппокампальной извилины. Они являются основными постсинаптическими холинорецеп- торами, регулирующими когнитивные функ- ции. М — рецепторы обнаруживаются преиму- щественно в стволе мозга и мозжечке. При их активации ингибируется дальнейшее выделе- ние ацетилхолина [4]. Том 9 № 4 2017 53 ОБЗОР Н-холинорецепторы являются трансмем- бранными белками, состоящими из 5 субъединиц компактно сгруппированных вокруг централь- ного канала [12]. В настоящее время идентифи- цированы 9 α (1-9) и 4 (1-4) β-субъединицы. α1 и β1 локализуются в нервно-мышечных синапсах, α2-9 и β2-4 в различных структурах центральной нервной системы [13]. Среди большого разноо- бразия подтипов Н-холинорецепторов, в голов- ном мозге наиболее важны два: 4α2β (состоящие из 4 α- и 2 β-субъединиц) и α7 (состоящие из 7 α-субъединиц). 4α2β-рецепторы регулируют выброс дофамина в прилежащем ядре и играют важную роль в регуляции психического стату- са. Основная функция α7 рецепторов связана с регуляцией различных когнитивных функций [14]. Установлено, что при болезни Альцгеймера откладывающийся β-амилоид взаимодействует с α7 рецепторами, приводя к уменьшению их чис- ленности, особенно в лобных и височных обла- стях коры головного мозга [15, 16]. Основная психофизиологическая роль аце- тилхолина связана с обеспечением запомина- ния новой информации. дефицит ацетилхолина нарушает процесс перевода кратковременной памяти в долговременную, за счет ингибиру- ющего действия интеркуррентных стимулов. В нормальных условиях, поступающий новый значимый стимул проходит цикл обработки, во время которого нейроны гиппокампальной из- вилины остаются рефрактерными к другим сти- мулам. После обработки, возникает тета-ритм, синхронизированный с активностью нейронов неокортекса. При нарушении холинергической иннервации нейрональные популяции гипота- ламуса становятся чрезвычайно реактивными и неустойчивыми к любым незначительным стимулам, что вызывает нестабильность гип- покампального тета-ритма и нарушение консо- лидации полученной информации [17].
4α2β-рецепторы регулируют выброс дофамина в прилежащем ядре и играют важную роль в регуляции психического стату- са. Основная функция α7 рецепторов связана с регуляцией различных когнитивных функций [14]. Установлено, что при болезни Альцгеймера откладывающийся β-амилоид взаимодействует с α7 рецепторами, приводя к уменьшению их чис- ленности, особенно в лобных и височных обла- стях коры головного мозга [15, 16]. Основная психофизиологическая роль аце- тилхолина связана с обеспечением запомина- ния новой информации. дефицит ацетилхолина нарушает процесс перевода кратковременной памяти в долговременную, за счет ингибиру- ющего действия интеркуррентных стимулов. В нормальных условиях, поступающий новый значимый стимул проходит цикл обработки, во время которого нейроны гиппокампальной из- вилины остаются рефрактерными к другим сти- мулам. После обработки, возникает тета-ритм, синхронизированный с активностью нейронов неокортекса. При нарушении холинергической иннервации нейрональные популяции гипота- ламуса становятся чрезвычайно реактивными и неустойчивыми к любым незначительным стимулам, что вызывает нестабильность гип- покампального тета-ритма и нарушение консо- лидации полученной информации [17]. Таким образом, базальная холинергическая система обеспечивает запоминание поступающей ин- формации путем стабилизации функциональ- ной активности структур гиппокампа. Ацетилхолин играет ключевую роль в обеспе- чении устойчивости внимания за счет активиру- ющего влияния на кору головного мозга. дис- функция базальной холинергической системы приводит к повышенной отвлекаемости, снижен- ной концентрации внимания и как следствие бы- строй утрате приобретенной информации [18]. В ходе проведенных нейропсихологических исследований выявлено отрицательное влияние антихолинергических средств на выполнение тестов, оценивающих память [19]. Антагони- сты холинергических рецепторов, в частности скополамин, нарушают процесс запоминания новой информации из-за большого количества посторонних стимулов, возникающих в момент обработки информации. Напротив, использо- вание средств, усиливающих холинергическую трансмиссию, приводит к улучшению показа- телей нейропсихологического тестирования у больных с различными органическими пораже- ниями головного мозга или после приема анти- холинергических средств [20].
Таким образом, базальная холинергическая система обеспечивает запоминание поступающей ин- формации путем стабилизации функциональ- ной активности структур гиппокампа. Ацетилхолин играет ключевую роль в обеспе- чении устойчивости внимания за счет активиру- ющего влияния на кору головного мозга. дис- функция базальной холинергической системы приводит к повышенной отвлекаемости, снижен- ной концентрации внимания и как следствие бы- строй утрате приобретенной информации [18]. В ходе проведенных нейропсихологических исследований выявлено отрицательное влияние антихолинергических средств на выполнение тестов, оценивающих память [19]. Антагони- сты холинергических рецепторов, в частности скополамин, нарушают процесс запоминания новой информации из-за большого количества посторонних стимулов, возникающих в момент обработки информации. Напротив, использо- вание средств, усиливающих холинергическую трансмиссию, приводит к улучшению показа- телей нейропсихологического тестирования у больных с различными органическими пораже- ниями головного мозга или после приема анти- холинергических средств [20]. Роль холинергической системы в развитие нейродегенеративных заболеваний Известно, что дисфункция базальной холи- нергической системы принимает участие в фор- мировании когнитивных нарушений, которые наиболее полно изучены при болезни Альцгей- мера [21]. Установлено, что уменьшение холи- нергических влияний на кору головного мозга является основным патогенетическим механиз- мом в формировании нарушений декларативной памяти при данном заболевании [22]. церебраль- ная холинергическая денервация обусловлена значительным снижением численности холинер- гических синапсов в теменной, лобной, височной долях коры больших полушарий и в гиппокам- пальной извилине, а также уменьшением актив- ности фермента ацетилхолинтрансферазы [23]. Причиной данных нарушений является гибель холинергических нейронов в базальном ядре Мейнерта и в холинергическом септально-гип- покампальном тракте [24]. По мере прогрессирования болезни Альцгей- мера патологический процесс, начавшийся с ме- диальных отделов височной доли, постепенно распространяется на новые области головного мозга, обуславливая характерную динамику клинических проявлений заболевания [25].
Роль холинергической системы в развитие нейродегенеративных заболеваний Известно, что дисфункция базальной холи- нергической системы принимает участие в фор- мировании когнитивных нарушений, которые наиболее полно изучены при болезни Альцгей- мера [21]. Установлено, что уменьшение холи- нергических влияний на кору головного мозга является основным патогенетическим механиз- мом в формировании нарушений декларативной памяти при данном заболевании [22]. церебраль- ная холинергическая денервация обусловлена значительным снижением численности холинер- гических синапсов в теменной, лобной, височной долях коры больших полушарий и в гиппокам- пальной извилине, а также уменьшением актив- ности фермента ацетилхолинтрансферазы [23]. Причиной данных нарушений является гибель холинергических нейронов в базальном ядре Мейнерта и в холинергическом септально-гип- покампальном тракте [24]. По мере прогрессирования болезни Альцгей- мера патологический процесс, начавшийся с ме- диальных отделов височной доли, постепенно распространяется на новые области головного мозга, обуславливая характерную динамику клинических проявлений заболевания [25]. Считается, что морфологическим маркером заболевания является численность нейрофи- блиллярных клубочков (НФК) в том или ином отделе мозга. Выявлена корреляция между ко- личеством НФК в базальном ядре Мейнерта и успешностью выполнения тестов оценивающих память [4]. Кроме того, определена зависимость между степенью когнитивных нарушений и численностью синапсов в височно-теменных и лобных отделах коры больших полушарий [26]. дисфункция базальной холинергической системы рассматривается как важный патоге- нетический механизм развития когнитивных нарушений при сосудистой деменции [27, 28]. 54 Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова ОБЗОР Поражение белого вещества головного мозга по типу субкортикального или перивентрику- лярного лейкоареоза, приводит к повреждению холинергических проекций от базального ядра Мейнерта к коре головного мозга [29]. Нару- шение холинергической иннервации префрон- тальных отделов коры обуславливает раннее развитие регуляторных когнитивных и пове- денческих расстройств, включая депрессию и апатико-абулический синдром.
Считается, что морфологическим маркером заболевания является численность нейрофи- блиллярных клубочков (НФК) в том или ином отделе мозга. Выявлена корреляция между ко- личеством НФК в базальном ядре Мейнерта и успешностью выполнения тестов оценивающих память [4]. Кроме того, определена зависимость между степенью когнитивных нарушений и численностью синапсов в височно-теменных и лобных отделах коры больших полушарий [26]. дисфункция базальной холинергической системы рассматривается как важный патоге- нетический механизм развития когнитивных нарушений при сосудистой деменции [27, 28]. 54 Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова ОБЗОР Поражение белого вещества головного мозга по типу субкортикального или перивентрику- лярного лейкоареоза, приводит к повреждению холинергических проекций от базального ядра Мейнерта к коре головного мозга [29]. Нару- шение холинергической иннервации префрон- тальных отделов коры обуславливает раннее развитие регуляторных когнитивных и пове- денческих расстройств, включая депрессию и апатико-абулический синдром. Холинергиче- ская иннервация медиальных отделов височных долей, при сосудистых когнитивных нарушени- ях, по-видимому, страдает в меньшей степени, чем при болезни Альцгеймера [4]. По данным Pantoni L. et al., (2007) [30] определена прямая зависимость между выраженностью лейкоарео- за и тяжестью когнитивных нарушений. В основе поведенческих и когнитивных на- рушений при деменции с тельцами Леви лежит прогрессирующий холинергический дефицит, вызванный дегенерацией холинергических ней- ронов в базальном ядре Мейнерта [31]. Установ- лено, что дисфункция базальной холинергиче- ской системы при деменции с тельцами Леви выражена в большей степени, чем при болезни Альцгеймера. Это подтверждается более низ- ким уровнем посмертно определяемой актив- ности холинацетилтрансферазы в лобной коре, а также более выраженным уменьшением ко- личества крупных холинергических нейронов в ядре Мейнерта [32]. Кроме того, центральная холинергическая недостаточность наблюдается при болезни Пар- кинсона и выражена в наибольшей степени при сочетании болезни Паркинсона с деменцией [33].
Холинергиче- ская иннервация медиальных отделов височных долей, при сосудистых когнитивных нарушени- ях, по-видимому, страдает в меньшей степени, чем при болезни Альцгеймера [4]. По данным Pantoni L. et al., (2007) [30] определена прямая зависимость между выраженностью лейкоарео- за и тяжестью когнитивных нарушений. В основе поведенческих и когнитивных на- рушений при деменции с тельцами Леви лежит прогрессирующий холинергический дефицит, вызванный дегенерацией холинергических ней- ронов в базальном ядре Мейнерта [31]. Установ- лено, что дисфункция базальной холинергиче- ской системы при деменции с тельцами Леви выражена в большей степени, чем при болезни Альцгеймера. Это подтверждается более низ- ким уровнем посмертно определяемой актив- ности холинацетилтрансферазы в лобной коре, а также более выраженным уменьшением ко- личества крупных холинергических нейронов в ядре Мейнерта [32]. Кроме того, центральная холинергическая недостаточность наблюдается при болезни Пар- кинсона и выражена в наибольшей степени при сочетании болезни Паркинсона с деменцией [33]. В настоящее время получены данные о вли- янии дисфункции базальной холинергической системы на состояние когнитивных функций у больных миастенией [34]. В исследовании Joshi d. et al., 2006 [35] представлены данные о вы- сокой распространенности когнитивных рас- стройств среди пациентов с миастенией. Про- веденное нейропсихологическое обследование (mini mental state examination, comprehensive neuropsychological battery in hindi) 40 больных выявило наличие нарушений памяти различной степени выраженности у 75% и интеллектуаль- ных нарушений у 68% испытуемых в сравнении с показателями контрольной группы. Известно, что в гипоталамусе, гиппокампальной извили- не, среднем мозге, коре головного мозга име- ются ацетилхолиновые рецепторы структурно и генетически сходные с рецепторами на пост- синаптической мембране нервно-мышечного синапса. Перекрестное взаимодействие антител между данными рецепторами может вызывать формирования когнитивных нарушений при миастении [36, 37]. Таким образом, вне зависимости от преобла- дания первичного нейродегенеративного про- цесса или сосудистого поражения головного мозга общим патогенетическим механизмом в развитии когнитивных нарушений и деменции является дефицит ацетилхолина в структурах, отвечающих за когнитивные функции [38].
В настоящее время получены данные о вли- янии дисфункции базальной холинергической системы на состояние когнитивных функций у больных миастенией [34]. В исследовании Joshi d. et al., 2006 [35] представлены данные о вы- сокой распространенности когнитивных рас- стройств среди пациентов с миастенией. Про- веденное нейропсихологическое обследование (mini mental state examination, comprehensive neuropsychological battery in hindi) 40 больных выявило наличие нарушений памяти различной степени выраженности у 75% и интеллектуаль- ных нарушений у 68% испытуемых в сравнении с показателями контрольной группы. Известно, что в гипоталамусе, гиппокампальной извили- не, среднем мозге, коре головного мозга име- ются ацетилхолиновые рецепторы структурно и генетически сходные с рецепторами на пост- синаптической мембране нервно-мышечного синапса. Перекрестное взаимодействие антител между данными рецепторами может вызывать формирования когнитивных нарушений при миастении [36, 37]. Таким образом, вне зависимости от преобла- дания первичного нейродегенеративного про- цесса или сосудистого поражения головного мозга общим патогенетическим механизмом в развитии когнитивных нарушений и деменции является дефицит ацетилхолина в структурах, отвечающих за когнитивные функции [38]. терапевтические подходы коррекции холинергической дисфункции Наличие холинергического дефицита у боль- ных с деменцией является основанием для при- менения ингибиторов ацетилхолинэстеразы (иАХЭ), улучшающих холинергическую пере- дачу путем уменьшения распада ацетилхолина в синаптической щели [39]. Использование иАХЭ в лечении деменции различной этиологии до- стоверно приводит к уменьшению выраженно- сти когнитивных и поведенческих расстройств, улучшению памяти, внимания, нормализации сна, повышению самостоятельности пациентов и регрессу психических расстройств [40]. В настоящее время для лечения больных с де- менцией используются три иАХЭ (галантамин, ривастигмин, донепезил), имеющие определен- ные фармакологические различия между собой. донепезил селективно ингибирует активность ацетилхолинэстеразы; в отличие от него, рива- стигмин в равной степени блокирует как аце- тилхолинэстеразу, так и бутирилхолинэстеразу. Галантамин, помимо ингибирующего влияния на ацетилхолинэстеразу, оказывает модулиру- ющее действие на α7-холинорецеторы, повы- шая их чувствительность к ацетилхолину [41].
терапевтические подходы коррекции холинергической дисфункции Наличие холинергического дефицита у боль- ных с деменцией является основанием для при- менения ингибиторов ацетилхолинэстеразы (иАХЭ), улучшающих холинергическую пере- дачу путем уменьшения распада ацетилхолина в синаптической щели [39]. Использование иАХЭ в лечении деменции различной этиологии до- стоверно приводит к уменьшению выраженно- сти когнитивных и поведенческих расстройств, улучшению памяти, внимания, нормализации сна, повышению самостоятельности пациентов и регрессу психических расстройств [40]. В настоящее время для лечения больных с де- менцией используются три иАХЭ (галантамин, ривастигмин, донепезил), имеющие определен- ные фармакологические различия между собой. донепезил селективно ингибирует активность ацетилхолинэстеразы; в отличие от него, рива- стигмин в равной степени блокирует как аце- тилхолинэстеразу, так и бутирилхолинэстеразу. Галантамин, помимо ингибирующего влияния на ацетилхолинэстеразу, оказывает модулиру- ющее действие на α7-холинорецеторы, повы- шая их чувствительность к ацетилхолину [41]. Эффективность иАХЭ напрямую зависит от со- хранности холинергических нейронов и постси- наптических М- и Н-холинорецепторов и может снижаться на поздних стадиях заболевания. Проведенные рандомизированные исследо- вания демонстрируют положительное влияние иАХЭ на состояние когнитивных функций у пациентов с болезнью Альцгеймера и синдро- мом легкой или умеренной деменции [42, 43, 44]. Установлено, что раннее назначение иАХЭ позволяет отсрочить формирование тяжелых поведенческих осложнений (агрессии, бреда, психотических нарушений), что позволяет со- хранить возможность пребывания больного в семье и снижает потребность в применении раз- личных психотропных средств [45]. Том 9 № 4 2017 55 ОБЗОР По результатам крупных рандомизирован- ных испытаний установлен благоприятный эф- фект иАХЭ на когнитивные функции у больных с сосудистой деменцией. Назначение любого из трех иАХЭ второго поколения приводит к уме- ренному регрессу когнитивных нарушений при использовании препаратов в максимальных до- зах, в сравнении с эффектом плацебо [46, 47, 48].
Эффективность иАХЭ напрямую зависит от со- хранности холинергических нейронов и постси- наптических М- и Н-холинорецепторов и может снижаться на поздних стадиях заболевания. Проведенные рандомизированные исследо- вания демонстрируют положительное влияние иАХЭ на состояние когнитивных функций у пациентов с болезнью Альцгеймера и синдро- мом легкой или умеренной деменции [42, 43, 44]. Установлено, что раннее назначение иАХЭ позволяет отсрочить формирование тяжелых поведенческих осложнений (агрессии, бреда, психотических нарушений), что позволяет со- хранить возможность пребывания больного в семье и снижает потребность в применении раз- личных психотропных средств [45]. Том 9 № 4 2017 55 ОБЗОР По результатам крупных рандомизирован- ных испытаний установлен благоприятный эф- фект иАХЭ на когнитивные функции у больных с сосудистой деменцией. Назначение любого из трех иАХЭ второго поколения приводит к уме- ренному регрессу когнитивных нарушений при использовании препаратов в максимальных до- зах, в сравнении с эффектом плацебо [46, 47, 48]. Кроме положительного влияния на пока- затели когнитивных функций, иАХЭ способны тормозить образование амилоидных бляшек в головном мозге. В исследовании Ballard C.G. et al. (2007) [49] показано, что длительное при- менение иАХЭ снижает почти на 70% содержа- ние β-амилоида в паренхиме головном мозга у пациентов с деменцией с тельцами Леви [4]. В экспериментальных исследованиях показано, что иАХЭ способны замедлять трансформацию β-амилоида в токсическую нерастворимую фор- му, защищать культуру нейрональных клеток от токсического влияния глутамата и свободных радикалов, оказывать противовоспалительное действие и улучшать кровоснабжение коры го- ловного мозга и гиппокампа [50]. Раннее назна- чение иАХЭ тормозит развитие церебральной атрофии, в частности медиальных отделов ви- сочных долей [51]. Побочные эффекты иАХЭ представлены преимущественно расстройствами желудоч- но-кишечного тракта (диарея, тошнота, рво- та, снижение массы тела) и регрессируют при уменьшении дозы препарата, что, однако, может приводить к снижению терапевтической эффек- тивности [52].
Кроме положительного влияния на пока- затели когнитивных функций, иАХЭ способны тормозить образование амилоидных бляшек в головном мозге. В исследовании Ballard C.G. et al. (2007) [49] показано, что длительное при- менение иАХЭ снижает почти на 70% содержа- ние β-амилоида в паренхиме головном мозга у пациентов с деменцией с тельцами Леви [4]. В экспериментальных исследованиях показано, что иАХЭ способны замедлять трансформацию β-амилоида в токсическую нерастворимую фор- му, защищать культуру нейрональных клеток от токсического влияния глутамата и свободных радикалов, оказывать противовоспалительное действие и улучшать кровоснабжение коры го- ловного мозга и гиппокампа [50]. Раннее назна- чение иАХЭ тормозит развитие церебральной атрофии, в частности медиальных отделов ви- сочных долей [51]. Побочные эффекты иАХЭ представлены преимущественно расстройствами желудоч- но-кишечного тракта (диарея, тошнота, рво- та, снижение массы тела) и регрессируют при уменьшении дозы препарата, что, однако, может приводить к снижению терапевтической эффек- тивности [52]. для уменьшения частоты побоч- ных реакций используют медленное повышение дозы, малый шаг титрации, а также безопасные лекарственные формы и новые способы введе- ния препаратов. Таким образом, назначение иАХЭ на стадии легкой и умеренной деменции способствует не только улучшению показателей когнитивных функций, но и позволяет замедлить прогресси- рование заболевания, оказывая нейропротек- торное действие.
для уменьшения частоты побоч- ных реакций используют медленное повышение дозы, малый шаг титрации, а также безопасные лекарственные формы и новые способы введе- ния препаратов. Таким образом, назначение иАХЭ на стадии легкой и умеренной деменции способствует не только улучшению показателей когнитивных функций, но и позволяет замедлить прогресси- рование заболевания, оказывая нейропротек- торное действие.
S V Lobzin
North-Western State Medical university named after I.I. Mechnikov
M G Sokolova
North-Western State Medical university named after I.I. Mechnikov
S A Nalkin
North-Western State Medical university named after I.I. Mechnikov
- Cuello A.C. Basal Forebrain Cholinergic Neurons // Encyclopedia of Psychopharmacology — Springer Berlin Heidelberg, 2010.
 — P. 201-201.
— P. 201-201. - Макотрова Т.А. Роль α7 никотиновых ацетилхолиновых рецепторов в фармакотерапии нейродегенеративных заболеваний // Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. — 2012. — Т. 112. — № 10. — С. 57-59.
- Данилова Р.К. Руководство по гистологии. Т1. Санкт-Петербург, СпецЛит, 2010 — 831 с.
- Ranganath C., Rainer G. Neural mechanisms for detecting and remembering novel events // Nature Reviews Neuroscience. — 2003. — Vol. 4. — № 3. — P. 193-202.
- Левин О.С. Диагностика и лечение деменции в неврологической практике. 4-е издание. М. МЕДпресс-информ, 2014 — 256 с.
- Woolf N.J., Butcher L.L. Cholinergic systems mediate action from movement to higher consciousness // Behavioural brain research. — 2011. — Vol. 221. — № 2. — P. 488-498.
- Xu M. et al. Basal forebrain circuit for sleep-wake control // Nature neuroscience.
 — 2015. — Vol. 18. — № 11. — P. 1641-1647.
— 2015. — Vol. 18. — № 11. — P. 1641-1647. - Giboureau N. et al. PET radioligands for the vesicular acetylcholine transporter (VAChT) // Current topics in medicinal chemistry. — 2010. — Vol. 10. — № 15. — P. 1569-1583.
- Amenta F., Tayebati S.K. Pathways of acetylcholine synthesis, transport and release as targets for treatment of adult-onset cognitive dysfunction // Current medicinal chemistry. — 2008. — Vol. 15. — № 5. — P. 488-498.
- Wonnacott S., Barik J. Nicotinic ACh receptors // Tocris Rev. — 2007. — Vol. 28. — P. 1-20.
- Wess J., Eglen R.M., Gautam D. Muscarinic acetylcholine receptors: mutant mice provide new insights for drug development // Nature reviews Drug discovery. — 2007. — Vol. 6. — № 9. — P. 721-733.
- Нежинская Г.И., Владыкин А.Л., Сапронов Н.С. Фармакологический анализ неканонических лигандов никотиновых холинорецепторов // Психофармакология и биологическая наркология.
 — 2008. — Т. 7. — № 2. — С. 1528-1532.
— 2008. — Т. 7. — № 2. — С. 1528-1532. - Агафонов Б.В., Сидорова О.П., Котов С.В. Миастения и врожденные миастенические синдромы. М. (МИА). 2013 г. 244 с.
- Söderman A. et al. Activation of nicotinic α 7 acetylcholine receptor enhances long term potentation in wild type mice but not in APP swe/PS1ΔE9 mice // Neuroscience letters. — 2011. — Vol. 487. — № 3. — P. 325-329.
- Wessler I., Kirkpatrick C.J. Acetylcholine beyond neurons: the non-neuronal cholinergic system in humans // British journal of pharmacology. — 2008. — Vol. 154. — № 8. — P. 1558-1571.
- Маньковский Н.Б., Кузнецова С.М. Возрастные изменения нейротрансмиттерных систем мозга как фактор риска цереброваскулярной патологии // Журнал неврологии им. Б.М. Маньковського. — № 2. — 2013. — С 5-13.
- Полунина А.Г., Брюн Е.А. Эпизодическая память: неврологические и нейромедиаторные механизмы // Анналы клинической и экспериментальной неврологии.
 — 2012. — Т. 6. — № 3. — С. 53-60.
— 2012. — Т. 6. — № 3. — С. 53-60. - Захаров В.В., Яхно Н.Н. Когнитивные расстройства в пожилом и старческом возрасте // Методическое пособие для врачей. М. — 2005. — С. 71.
- Bunce J.G., Sabolek H.R., Chrobak J.J. Intraseptal infusion of the cholinergic agonist carbachol impairs delayed-non-match-to-sample radial arm maze performance in the rat // Hippocampus. — 2004. — Vol. 14. — № 4. — P. 450-459.
- Hasselmo M.E. The role of acetylcholine in learning and memory // Current opinion in neurobiology. — 2006. — Vol. 16. — № 6. — P. 710-715.
- Pákáski M., Kálmán J. Interactions between the amyloid and cholinergic mechanisms in Alzheimer’s disease // Neurochemistry international. — 2008. — Vol. 53. — № 5. — P. 103-111.
- Мухин В.Н. Патогенетические механизмы дисфункции базальной холинергической системы при болезни Альцгеймера // Российский физиологический журнал им.
 И.М. Сеченова. — 2013. — Т. 99. — № 7. — С. 793-804.
И.М. Сеченова. — 2013. — Т. 99. — № 7. — С. 793-804. - Devanand D.P. et al. Hippocampal and entorhinal atrophy in mild cognitive impairment prediction of Alzheimer disease // Neurology. — 2007. — Vol. 68. — № 11. — P. 828-836.
- Parameshwaran K., Dhanasekaran M., Suppiramaniam V. Amyloid beta peptides and glutamatergic synaptic dysregulation // Experimental neurology. — 2008. — Vol. 210. — № 1. — P. 7-13.
- Grothe M., Heinsen H., Teipel S.J. Atrophy of the cholinergic basal forebrain over the adult age range and in early stages of Alzheimer’s disease // Biological psychiatry. — 2012. — Vol. 71. — № 9. — P. 805-813.
- Yao Z. et al. Abnormal Cortical Networks in Mild Cognitive Impairment and Alzheimer’s Disease // PLoS Computational Biology. — 2010. — Vol. 6. — № 11.
- Гаврилова С.И. Фармакотерапия болезни Альцгеймера. — М. — 2007. — 360 с.
- Емелин А.
 Ю. Структурная нейровизуализация в дифференциальной диагностике сосудистых когнитивных нарушений // Вестник Российской военно-медицинской академии. — 2010. — № 3. — С. 97-102.
Ю. Структурная нейровизуализация в дифференциальной диагностике сосудистых когнитивных нарушений // Вестник Российской военно-медицинской академии. — 2010. — № 3. — С. 97-102. - Behl P. et al. Strategic subcortical hyperintensities in cholinergic pathways and executive function decline in treated Alzheimer patients // Archives of Neurology. — 2007. — Vol. 64. — № 2. — P. 266-272.
- Pantoni L., Poggesi A., Inzitari D. The relation between white-matter lesions and cognition // Current opinion in neurology. — 2007. — Vol. 20. — № 4. — P. 390-397.
- Левин О.С. и др. Деменция с тельцами Леви // Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. — 2012. — Т. 112. — № 10. — С. 3-12.
- Klein J.C. et al. Neurotransmitter changes in dementia with Lewy bodies and Parkinson disease dementia in vivo // Neurology. — 2010. — Vol. 74. — № 11. — P. 885-892.
- Литвиненко И.
 В. и др. Структура когнитивных нарушений на разных стадиях болезни Паркинсона // Вестник Российской Военно-медицинской академии. — 2007. — Т. 3. — № 19. — С. 43-50.
В. и др. Структура когнитивных нарушений на разных стадиях болезни Паркинсона // Вестник Российской Военно-медицинской академии. — 2007. — Т. 3. — № 19. — С. 43-50. - Mao Z. et al. Association between myasthenia gravis and cognitive function: A systematic review and meta-analysis // Annals of Indian Academy of Neurology. — 2015. — Vol. 18. — № 2. — P. 131.
- Joshi D., Bhatia M., Gupta S., et al. Cognitive evaluation in myasthenia gravis: A P300 and neuropsychological study // Neurology Asia. — 2006. Vol. 11. — P. 97-102.
- Hamed S. et al. Assessment of cognitive function in patients with myasthenia gravis // Neuroimmunology and Neuroinflammation. — 2014. — Vol. 1. — № 3. — P. 141-141.
- Kaltsatou A. et al. Cognitive impairment as a central cholinergic deficit in patients with Myasthenia Gravis // BBA clinical. — 2015. — Vol. 3. — P. 299-303.
- Парфенов В.А., Захаров В.
 В., Преображенская И.С. Когнитивные расстройства. М.: Ремедиум, 2014.
В., Преображенская И.С. Когнитивные расстройства. М.: Ремедиум, 2014. - Аносов Н.Н. Лекарственные воздействия на холинергические структуры нервной системы как метод восстановительной терапии: Дисс. … докт. мед. наук. — Л. — 1963. — 184 с.
- Яхно Н.Н. Когнитивные расстройсства // Неврол. вестник. — 2007. — Т. 39. — Вып. 1. — С. 134-138.
- Коберская Н.Н. Болезнь Альцгеймера: новые критерии диагностики и терапевтические аспекты в зависимости от стадии болезни // Медицинский совет. — 2017. — № 10. — С. 18-24.
- Birks J.S. Cholinesterase inhibitors for Alzheimer’s disease // The Cochrane Library. — 2006. — P. 75.
- Santoro A. et al. Effects of donepezil, galantamine and rivastigmine in 938 Italian patients with Alzheimer’s disease // CNS drugs. — 2010. — Vol. 24. — № 2. — P. 163-176.
- Bond M. et al. The effectiveness and cost-effectiveness of donepezil, galantamine, rivastigmine and memantine for the treatment of Alzheimer’s disease (review of Technology Appraisal № 111): a systematic review and economic model // Health technology assessment (Winchester, England).
 — 2012. — Vol. 16. — № 21. — P. 1-470.
— 2012. — Vol. 16. — № 21. — P. 1-470. - Miller L. The use of cognitive enhancers in behavioral disturbances of Alzheimer’s disease // The Consultant Pharmacist. — 2007. — Vol. 22. — № 9. — P. 754-762.
- Ballard C. et al. Efficacy, safety and tolerability of rivastigmine capsules in patients with probable vascular dementia: the VantagE study // Current medical research and opinion. — 2008. — Vol. 24. — № 9. — P. 2561-2574.
- Dichgans M. et al. Donepezil in patients with subcortical vascular cognitive impairment: a randomised double-blind trial in CADASIL // The Lancet Neurology. — 2008. — Vol. 7. — № 4. — P. 310-318.
- Kavirajan H., Schneider L.S. Efficacy and adverse effects of cholinesterase inhibitors and memantine in vascular dementia: a meta-analysis of randomised controlled trials // The Lancet Neurology. — 2007. — Vol. 6. — № 9. — P. 782-792.
- Ballard C.
 G. et al. Cholinesterase inhibitors reduce cortical Aβ in dementia with Lewy bodies // Neurology. — 2007. — Vol. 68. — № 20. — P. 1726-1729.
G. et al. Cholinesterase inhibitors reduce cortical Aβ in dementia with Lewy bodies // Neurology. — 2007. — Vol. 68. — № 20. — P. 1726-1729. - Bär K.J. et al. Influence of galantamine on vasomotor reactivity in Alzheimer’s disease and vascular dementia due to cerebral microangiopathy // Stroke. — 2007. — Vol. 38. — № 12. — P. 3186-3192.
- Winblad B. et al. Safety and efficacy of galantamine in subjects with mild cognitive impairment // Neurology. — 2008. — Vol. 70. — № 22. — P. 2024-2035.
- Преображенская И.С., Громова Д.О. Некоторые аспекты терапии нейродегенеративных деменций // Медицинский совет. — 2014. — № 10.
Views
Abstract — 399
PDF (Russian) — 361
Cited-By
Article Metrics
PlumX
Dimensions
Refbacks
- There are currently no refbacks.

Антиэметики – статьи по ветеринарии от специалистов «Свой Доктор»
Рвота – распространенный клинический признак в ветеринарной практике мелких домашних животных. Она требует рационального подхода к лечению, основанного, в первую очередь, на предположительной или установленной патологии. Для исследования животного с рвотой необходим полный и подробный анамнез. Наиболее важно отличать рвоту от регургитации, так как их этиология, от которой зависят специфические диагностические исследования, разная. Регургитация – пассивный процесс, когда непереваренная пища или слюна выбрасывается самопроизвольно под действием силы тяжести, в то время как рвота представляет собой рефлекс, сопровождающийся признаками тошноты, повышенного слюноотделения и сокращениями брюшных мышц.
Маропитант. Торговое название Серения/Cerenia
Этот препарат действует как противорвотное средство, блокируя рецептор нейрокинина-1 (NK1). Нейрокинин-1 является нейромедиатором, инициирующим рвоту из рвотного центра. Хотя рецепторы NK1 участвуют в других физиологических и поведенческих реакциях, в дозах, используемых для контроля рвоты, не было зафиксировано побочных эффектов, связанных с блокадой других рецепторов. Маропитант может ингибировать рвоту, которая стимулируется как центральными, так и периферическими источниками, опосредованными ацетилхолином, гистамином, дофамином и серотонином. Рецептор NK1 также участвует в передаче боли (через вещество Р). Блокада рецептора NK1 может иметь потенциал в качестве дополнительного лечения для некоторых типов боли (например, висцеральной боли), но в настоящее время нет клинических исследований, демонстрирующих анальгетический эффект от маропитанта. [1], [2], [3], [7]
Нейрокинин-1 является нейромедиатором, инициирующим рвоту из рвотного центра. Хотя рецепторы NK1 участвуют в других физиологических и поведенческих реакциях, в дозах, используемых для контроля рвоты, не было зафиксировано побочных эффектов, связанных с блокадой других рецепторов. Маропитант может ингибировать рвоту, которая стимулируется как центральными, так и периферическими источниками, опосредованными ацетилхолином, гистамином, дофамином и серотонином. Рецептор NK1 также участвует в передаче боли (через вещество Р). Блокада рецептора NK1 может иметь потенциал в качестве дополнительного лечения для некоторых типов боли (например, висцеральной боли), но в настоящее время нет клинических исследований, демонстрирующих анальгетический эффект от маропитанта. [1], [2], [3], [7]
Препарат эффективно подавляет рвоту от химиотерапии, при желудочно-кишечных заболеваний, интоксикаций, заболеваний почек, вестибулярных раздражителей (укачивание). [4]
Побочные реакции: болевая реакция во время инъекции. Очень высокие дозы у кошек могут вызвать гемолиз. Инъекции не следует смешивать с любым другим средством, поскольку исследований на совместимость нет.
Очень высокие дозы у кошек могут вызвать гемолиз. Инъекции не следует смешивать с любым другим средством, поскольку исследований на совместимость нет.
Маропитант выпускается в виде таблеток по 16, 24, 60 или 160 мг и раствора для инъекций 10 мг/мл. Однако в РФ таблетированная форма не доступна.
Дозировка: собаки, кошки: 1 мг/кг в сутки или 2 мг/кг перорально каждые 24 часа. Для предотвращения укачивание в иностранной литературе используются таблетки в дозе 8 мг/кг в сутки в течение максимум 2 дня.
Метоклопрамид. Торговое название Церукал/Reglan/Maxolon
Противорвотный и прокинетический препарат. Метоклопрамид стимулирует моторику верхних отделов желудочно-кишечного тракта и является противорвотным средством центрального действия. Среди предлагаемых механизмов — стимуляция 5-HT (серотониновых) рецепторов или увеличение высвобождения ацетилхолина в желудочно-кишечном тракте. Сродство к 5-HT4 рецепторам низкое по сравнению с другими, более эффективными препаратами, модифицирующими моторику. Тормозит расслабление желудка, вызванное дофамином, таким образом, усиливая холинергические реакции гладкой мускулатуры желудка для увеличения подвижности. Это также повышает тонус нижнего пищеводного сфинктера. Метоклопрамид действует централизованно, ингибируя дофамин, который отвечает за противорвотные эффекты. Противорвотное действие достигается благодаря его антидопаминовому (D2) действию.
Тормозит расслабление желудка, вызванное дофамином, таким образом, усиливая холинергические реакции гладкой мускулатуры желудка для увеличения подвижности. Это также повышает тонус нижнего пищеводного сфинктера. Метоклопрамид действует централизованно, ингибируя дофамин, который отвечает за противорвотные эффекты. Противорвотное действие достигается благодаря его антидопаминовому (D2) действию.
Основной эффект у собак проявляется в его противорвотных свойствах. Поскольку этот препарат временно увеличивает секрецию пролактина, был интерес к его применению для лечения агалактии у животных, но его эффективность не была определена. [5]
Неблагоприятные эффекты связаны с блокадой центральных дофаминергических рецепторов. Недопустимо использование у пациентов с эпилепсией или с заболеваниями, вызванными непроходимостью ЖКТ. [6]
Чаще всего используется для общих противорвотных целей, но дозы до 2 мг/кг использовались для предотвращения рвоты во время химиотерапии рака (более высокие дозы могут вызывать антисеротониновые эффекты). [3]
[3]
Метоклопрамид выпускается в виде таблеток по 5 и 10 мг, перорального раствора 1 мг / мл и инъекций по 5 мг/мл во флаконах по 2, 10 и 30 мл.
Дозировка: 0,2-0,5 мг/кг каждые 6-8 часов в/в, в/м или перорально. Для противорвотного лечения при химиотерапии рака применяемая доза составляет до 2 мг / кг в сутки.
Ондансетрон. Торговое название Латран/Эметрон/Зофран/Zofran
Ондансетрон является противорвотным препаратом из класса препаратов, называемых антагонистами серотонина. Как и другие препараты этого класса, ондансетрон действует путем ингибирования рецепторов серотонина типа 3 (5-HT3).
У кошек оральная абсорбция составляет 32% от перорального введения и 75% от подкожного введения. У собак он гораздо менее биодоступен (менее 10%) после перорального приема и имеет более короткий период полураспада — 30 минут, что вызывает вопросы о клинической эффективности ондансетрона у собак.
Доступна только ограниченная информация об эффективности ондансетрона у животных, но онкологи обнаружили, что он эффективен для лечения рвоты от химиотерапии у животных. [3], [5]
О побочных эффектах ондансетрона у животных не сообщалось. Важных противопоказаний у животных не выявлено. Изменение дозы у животных с почечной недостаточностью не требуется.
Ондансетрон выпускается в виде таблеток по 4 и 8 мг и инъекций по 2 мг/мл. Дозировка для собак и кошек: 0,5-1 мг/кг за 30 мин до введения химиотерапевтических препаратов. Другие причины рвоты: 0,2-0.3 мг/кг, медленная внутривенная инъекция и повторение каждые 6-12 часов. При отсутствии эффекта увеличивают до 0,5 мг/кг.
[1] De La Puente-Redondo, «Efficacy of maropitant for treatment and prevention of emesis caused by intravenous infusion of cisplatin in dogs», 2007
[2] Vail, «Efficacy of injectable maropitant in a randomized clinical trial for prevention and treatment of cisplatin-induced emesis in dogs presented as veterinary patients», 2011
[3] Valverde, «Effects of acepromazine on the incidence of vomiting associated with opioid administration in dog», 2004
[4] Benchaoui, «Efficacy of maropitant for preventing vomiting associated with motion sickness in dogs», 2007
[5] Hubbard, «Risk of vomiting and diarrhoea in dogs», 2007
[6] Capak, «Incidence of foreign-bodyinduced ileus in dogs», 2001
[7] Conder, Sedlacek, Boucher, «Efficacy and safety of maropitant, a selective neurokinin 1 receptor antagonist, in two randomized clinical trials for prevention of vomiting due to motion sickness in dogs», 2008
Ветеринарный врач
Володин А. Д.
Д.
СВК «Свой доктор» филиал «Дзержинский»
Препараты для лечения деменции — Фонд Альцрус
Лекарства от деменции помогают снизить тревожность, улучшить самочувствие, замедлить прогрессию заболевания. Помните, сейчас нет чудесных препаратов, которые могли бы вернуть память. Будьте внимательны!
Основные задачи лечения деменции:
- улучшение когнитивных функций
- поддержание функциональной активности
- снижение выраженности поведенческих нарушений.
Выбор терапии зависит:
- от индивидуальных клинических симптомов каждого конкретного пациента
- от наличия сопутствующих заболеваний,
- от переносимости лекарственных средств и ряда других параметров.
Три группы лекарственных препаратов:
1 ГРУППА
Холинергические препараты — ингибиторы ацетилхолинэстеразы (АХЭ): ривастигмин, донепезил, галантамин
Ингибиторы холинэстераз представляют собой группу препаратов, направленных на ингибирование ферментов, разрушающих ацетилхолин в синаптической щели. В соответствии с механизмами их действия различают 2 класса ингибиторов холинэстераз:
В соответствии с механизмами их действия различают 2 класса ингибиторов холинэстераз:
I класс — ингибиторы ацетилхолинэстеразы (реминил (галантамин), арисепт (донепезил)
II класс — ингибиторы ацетилхолинэстеразы и бутирилхолинэстеразы (экселон, ривастигмин)
2 ГРУППА
препараты, взаимодействующие с NMDA-рецепторами (мемантин)
3 ГРУППА
нейропротекторные лекарственные средства, блокаторы кальциевых каналов, препараты, влияющие на амилоидогенез, иммуномодулирующие препараты и т.д.
В случае возникновения у пациентов эмоционально-аффективных и психотических реакций врач может назначить соответствующую сопутствующую терапию. При этом необходимо учитывать совместимость препаратов, а также вероятность развития нежелательных явлений.
Следует соблюдать осторожность при назначении нейролептиков (антипсихотиков) пациентам с деменцией, так как при деменции с тельцами Леви, которая имеет схожую клиническую картину с болезнью Альцгеймера, использование антипсихотиков противопоказано и может привести у ухудшению состояния.
Как лечат деменцию
Болезнь Альцгеймера и другие формы деменций на сегодняшний день относятся к неизлечимым заболеваниям. Но за последние десятилетия появление средств для медикаментозного лечения позволило облегчить тяжесть проявления основных симптомов деменции и отдалить наступление необратимого снижения на значительный период времени.
Препараты, доказавшие свою эффективность для лечения деменций
- препараты первого выбора — ингибиторы ацетилхолинэстеразы (активное вещество: ривастигмин или галантамин или донепезил). Рекомендованы для терапии всех стадий заболевания в руководствах по лечению деменции в Европе и США.
- препараты второго выбора — антагонисты NMDA-глутаматных рецепторов (активное вещество — мемантин). Они добавляются к препаратам первого выбора при снижении эффективности терапии или назначаются пациентам, которые поздно обращаются к врачу (при средней и тяжелой стадии деменции)
О возможностях лечения для своего родственника проконсультируйтесь с вашим лечащим врачом или задайте вопрос на Горячую линию Альцрус. Наши эксперты- врачи не смогут прописать вам лекарства, но смогут дать второе мнение на терапию, которая прописана вашему близкому и другие советы.
Наши эксперты- врачи не смогут прописать вам лекарства, но смогут дать второе мнение на терапию, которая прописана вашему близкому и другие советы.
Важно помнить!
- чем раньше начато лечение, тем лучший результат может быть получен
- замедление течения болезни, достигнутое на фоне приема лекарств, означает, что многие функции мозга могут быть сохранены на более длительное время
- в результате своевременного и правильного лечения больной дольше сможет сохранить самостоятельность, лучше ориентироваться в быту, соответственно, нагрузка на родственников будет снижена
Дополнительные лекарственные препараты
На ранних этапах болезни могут возникнуть депрессии, беспокойства, возбуждение у пациента. При этих состояниях дополнительно могут назначать следующие препараты:
- средства для улучшения настроения (антидепрессанты)
- средства для снятия беспокойства и возбуждения (нейролептики)
К дозированию этих препаратов нужно подходить очень осторожно, с учетом многих осложняющих факторов, свойственных пациентам пожилого возраста, таких как сахарный диабет, ревматизм, повышенное артериальное давление и другие заболевания сердечно-сосудистой системы.
Схема и дозировка должна быть согласована с вашим лечащим врачом!
Холинергический кризис — StatPearls — Книжная полка NCBI
Непрерывное обучение
Холинергический кризис развивается в результате чрезмерной стимуляции никотиновых и мускариновых рецепторов в нервно-мышечных соединениях. Обычно это вторично по отношению к инактивации или ингибированию ацетилхолинэстеразы (AChE), фермента, ответственного за разложение ацетилхолина (ACh). Чрезмерное накопление ацетилхолина (ACh) в нервно-мышечных соединениях и синапсах вызывает симптомы как мускариновой, так и никотиновой токсичности.К ним относятся судороги, повышенное слюноотделение, слезотечение, мышечная слабость, паралич, мышечная фасцикуляция, диарея и нечеткое зрение. В этом упражнении изучаются представление и оценка пациента, переживающего холинергический кризис, а также роль команды медицинских работников в координации лечения этого острого состояния.
Цели:
Опишите анамнез и результаты физикального обследования, которые обычно наблюдаются у пациентов с холинергическим кризом.

Просмотрите, как оценить холинергический криз.
Определите компоненты, участвующие в управлении холинергическим кризисом.
Опишите стратегии межпрофессиональной команды для улучшения координации помощи и коммуникации для улучшения результатов для пациентов, пострадавших от холинергического кризиса.
Заработайте кредиты на непрерывное образование (CME / CE) по этой теме.
Введение
Холинергический криз — это клиническое состояние, которое развивается в результате чрезмерной стимуляции никотиновых и мускариновых рецепторов в нервно-мышечных соединениях и синапсах.Обычно это вторично по отношению к инактивации или ингибированию ацетилхолинэстеразы (AChE), фермента, ответственного за разложение ацетилхолина (ACh). Чрезмерное накопление ацетилхолина (ACh) в нервно-мышечных соединениях и синапсах вызывает симптомы как мускариновой, так и никотиновой токсичности. К ним относятся судороги, повышенное слюноотделение, слезотечение, мышечная слабость, паралич, мышечная фасцикуляция, диарея и нечеткое зрение [1] [2] [3].
В клинической практике это состояние чаще всего встречается у:
Пациенты с миастенией, получающие лечение высокими дозами ингибиторов ацетилхолинэстеразы.
Пациенты после общей анестезии, получавшие высокие дозы ингибиторов ацетилхолинэстеразы для отмены эффектов нервно-мышечных блокаторов, например неостигмина.
Воздействие химического вещества, которое вызывает инактивацию ацетилхолинэстеразы. Примерами таких веществ являются нервно-паралитический газ, такой как зарин, табун, зоман, и другие органофосфаты, такие как пестициды и инсектициды.
Этиология
Несколько клинических состояний могут вызвать холинергический криз.Ниже описаны наиболее часто встречающиеся заболевания:
Избыточное лечение ингибиторами ацетилхолинэстеразы AChEI при лечении миастении Gravis
Myasthenia gravis (MG) — это аутоиммунное заболевание, которое влияет на нервно-мышечный переход путем выработки аутоантител против рецепторов ACh в постсинаптическая мембрана [4]. Это клиническое заболевание характеризуется общей слабостью или легкой утомляемостью, которые могут быстро прогрессировать до дыхательной недостаточности [5].Другая форма MG, обычно наблюдаемая у женщин, связана с выработкой антител против мышечно-специфической тирозинкиназы (MuSK) [6] [7].
Это клиническое заболевание характеризуется общей слабостью или легкой утомляемостью, которые могут быстро прогрессировать до дыхательной недостаточности [5].Другая форма MG, обычно наблюдаемая у женщин, связана с выработкой антител против мышечно-специфической тирозинкиназы (MuSK) [6] [7].
Одним из методов лечения миастении гравис является использование ингибиторов ацетилхолинэстеразы (AChEI), таких как пиридостигмин. АХЭИ предотвращает разрушение АХЭ, инактивируя АХЭ. Это останавливает распад ACh и увеличивает его уровень и продолжительность действия на постсинаптической мембране. Чрезмерное использование АХЭИ при лечении пациента с MG может спровоцировать холинергический криз, который характеризуется как мускариновой, так и никотиновой токсичностью [2].
Миастенический криз — осложнение МГ. Причины миастенического криза включают инфекцию, хирургическое вмешательство, менструацию и некоторые лекарства, такие как хинидин, блокаторы кальциевых каналов (верапамил, нифедипин, фелодипин) и антибиотики (гентамицин, ампициллин, стрептомицин, эритромицин, ципрофлоксацин) [8] [9]. Клиническая симптоматика миастенического криза и холинергического криза очень похожа. Холинергический криз всегда следует рассматривать при миастеническом кризисе, хотя холинергический криз не так часто встречается при миастеническом кризисе [10] [11] [12].
Клиническая симптоматика миастенического криза и холинергического криза очень похожа. Холинергический криз всегда следует рассматривать при миастеническом кризисе, хотя холинергический криз не так часто встречается при миастеническом кризисе [10] [11] [12].
Важно определить, какое из двух состояний вызывает мышечную слабость. Простой тест, который можно сделать, включает введение дозы 2 мг эдрофония внутривенно. Лекарство вызывает клиническое улучшение при миастеническом кризе, но ухудшение симптомов при холинергическом кризе
Воздействие органофосфатов
Холинергический кризис может быть спровоцирован воздействием препаратов, ингибирующих АХЭ, например нервно-паралитического газа и фосфорорганических соединений, используемых в пестицидах и инсектицидах , и гербициды.Воздействие может происходить через вдыхание паров, проглатывание или прямой контакт химического вещества с кожей или слизистой оболочкой [13] [14].
Органофосфаты — это химические соединения, широко используемые в качестве боевых отравляющих веществ. Нервно-паралитические газы — один из самых смертоносных агентов химического оружия. Примерами таких химических веществ являются зарин, табун, зоман, GF и VX. Органофосфаты действуют, подавляя действие AChE. Это вызывает чрезмерную стимуляцию мускариновых и никотиновых рецепторов на постсинаптической мембране.ACh связывается с замыкательными пластинками гладких мышц и секреторных желез, вызывая тошноту, рвоту, бронхоспазм, миоз, нечеткое зрение, бронхорею и сиалохоррею. Никотиновый эффект на скелетные мышцы может вызвать фасцикуляцию и вялый паралич. Отравление нервно-паралитическим газом может варьироваться от легкой до средней или тяжелой степени.
Нервно-паралитические газы — один из самых смертоносных агентов химического оружия. Примерами таких химических веществ являются зарин, табун, зоман, GF и VX. Органофосфаты действуют, подавляя действие AChE. Это вызывает чрезмерную стимуляцию мускариновых и никотиновых рецепторов на постсинаптической мембране.ACh связывается с замыкательными пластинками гладких мышц и секреторных желез, вызывая тошноту, рвоту, бронхоспазм, миоз, нечеткое зрение, бронхорею и сиалохоррею. Никотиновый эффект на скелетные мышцы может вызвать фасцикуляцию и вялый паралич. Отравление нервно-паралитическим газом может варьироваться от легкой до средней или тяжелой степени.
Острое или хроническое воздействие пестицидов и инсектицидов, содержащих органофосфаты, также может вызвать холинергический кризис. Обычно используемые инсектициды — это малатион, паратион, диазинон, фентион и трихлорфон.Обычно пациенты встречаются в сельской местности, где широко используются пестициды и гербициды. Примерами пестицидов, помимо органофосфатов, являются инсектициды карбамата, хлорорганических соединений и пиретроиды. Помимо мускариновых и никотиновых эффектов, наблюдаемых при холинергическом кризе, пациенты, подвергшиеся воздействию органофосфатов, могут также проявлять неврологические симптомы, такие как головная боль, головокружение, тремор и парестезия [15].
Помимо мускариновых и никотиновых эффектов, наблюдаемых при холинергическом кризе, пациенты, подвергшиеся воздействию органофосфатов, могут также проявлять неврологические симптомы, такие как головная боль, головокружение, тремор и парестезия [15].
Реверсирование нервно-мышечной блокады
Наконец, использование реверсивного агента, такого как неостигмин или пиридостигмин, для нервно-мышечной блокады также может вызвать холинергический кризис [16] [17].Неостигмин — это соединение, которое ингибирует AChE и обычно используется для отмены эффектов недеполяризующих паралитических агентов, таких как векуроний, рокуроний, мивакуриум и панкуроний. Ингибирование AChE позволяет накапливать ACh в нервно-мышечном соединении, преодолевая, таким образом, конкурентное ингибирование недеполяризующих блокирующих агентов. Неостигмин, как и другие ингибиторы AChE, может стимулировать мускариновые рецепторы и вызывать холинергический криз. Бронхоспазм, миоз, усиление перистальтики и секреции обычно наблюдаются после введения неостигмина. Чтобы свести к минимуму эти эффекты на мускариновые рецепторы, одновременно вводят антихолинергический агент, такой как гликопирролат, во время отмены нервно-мышечных блокаторов.
Чтобы свести к минимуму эти эффекты на мускариновые рецепторы, одновременно вводят антихолинергический агент, такой как гликопирролат, во время отмены нервно-мышечных блокаторов.
Эпидемиология
Данных по эпидемиологии холинергического криза очень мало. Тем не менее, это известный факт, что холинергический криз часто наблюдается у детей и пациентов с миастенией. В детской возрастной группе этот кризис обычно возникает в результате случайного контакта или проглатывания органофосфатов.Дети, живущие в сельской местности, подвергаются очень высокому риску. С 2013 года в США действуют более строгие федеральные правила продажи органофосфатов.
Во всем мире около трех миллионов человек ежегодно подвергались отравлению фосфорорганическими соединениями и примерно 300 000 смертей. Отравление происходит в результате случайного или преднамеренного проглатывания сельскохозяйственных инсектицидов или пестицидов. При холинергическом кризисе, связанном с органофосфатами, отравление может быть вызвано пищевыми продуктами, такими как пшеница, мука, растительное масло, фрукты и овощи.
После Второй мировой войны производство нервно-паралитических газов, таких как зарин и табун, было ограничено. Производство нервно-паралитического газа считалось военным преступлением со времен Женевской конвенции 1925 года [2]. Снижение производства в наше время значительно снизило количество случаев отравления нервно-паралитическими газами. Последнее крупномасштабное использование нервно-паралитического газа произошло в Сирии в 2013 году [15].
Патофизиология
Синтез нейротрансмиттера ацетилхолина
Холинергический кризис вызван чрезмерной стимуляцией постсинаптической мембраны нейромедиатором ацетилхолином (АХ).ACh — это химическое вещество, которое было впервые доказано как нейротрансмиттер Loewi в 1921 году. ACh обнаруживается в синапсах ганглиев, нервно-мышечном соединении и мышечной системе висцеральных органов. Он синтезируется на нервном окончании из ацетилкофермента А (ацетил-КоА).
Ацетил-КоА получают из глюкозы и холина в результате реакции, катализируемой холинацетилтрансферазой (CAT). Затем ACh упаковывается в пресинаптическую мембрану в пузырьки. Каждая везикула может содержать примерно до 10 000 молекул ACh, которые впоследствии высвобождаются при стимуляции.Ион кальция стимулирует высвобождение АХ. Действие ACh на постсинаптической мембране прекращается не повторным захватом нейромедиатора, а скорее действием мощного гидролитического фермента ацетилхолинэстеразы AChE. Этот фермент находится в синаптической щели. Под действием этого фермента АХ расщепляется на холин и ацетат. Холинергический нервный терминал имеет транспортер холина натрия, который поглощает холин, образующийся при гидролизе ACh [18] [19].
Затем ACh упаковывается в пресинаптическую мембрану в пузырьки. Каждая везикула может содержать примерно до 10 000 молекул ACh, которые впоследствии высвобождаются при стимуляции.Ион кальция стимулирует высвобождение АХ. Действие ACh на постсинаптической мембране прекращается не повторным захватом нейромедиатора, а скорее действием мощного гидролитического фермента ацетилхолинэстеразы AChE. Этот фермент находится в синаптической щели. Под действием этого фермента АХ расщепляется на холин и ацетат. Холинергический нервный терминал имеет транспортер холина натрия, который поглощает холин, образующийся при гидролизе ACh [18] [19].
ACh действует как на мускариновые, так и на никотиновые рецепторы.
Мускариновые рецепторы расположены по всему телу. Они активируются действием мускарина и АХ. Эти рецепторы являются частью рецепторов, связанных с G-белком. При активации происходит увеличение внутриклеточного циклического аденозинмонофосфата (АМФ). Активация циклического АМФ запускает действие протеинкиназы. Мускариновые рецепторы являются частью парасимпатических рецепторов, которые помогают регулировать секрецию (как в бронхиальном дереве, так и в желудочно-кишечном тракте), частоту сердечных сокращений, реакцию зрачков и мочеиспускание.
Мускариновые рецепторы являются частью парасимпатических рецепторов, которые помогают регулировать секрецию (как в бронхиальном дереве, так и в желудочно-кишечном тракте), частоту сердечных сокращений, реакцию зрачков и мочеиспускание.
Мускариновые эффекты ACh
Миоз глаз и нечеткое зрение,
Желудочно-кишечная система: тошнота, рвота и диарея
Дыхательная система: низкая эластичность легких,
и бронхоспазм
014 Секреторная система: повышенная секреция в трахеобронхиальной и желудочно-кишечной системе
Сердечно-сосудистая система: брадикардия
Мочеполовая система: частота и срочность мочеиспускания
Никотиновые рецепторы относятся к семейству рецепторов, управляемых лигандами.Они стимулируются АХ и никотином. Они расположены в мышечных волокнах в нервно-мышечных соединениях и вегетативных ганглиях как симпатической, так и парасимпатической нервной системы [2].
Никотиновые эффекты ACh
ACh связывается с замыкательной пластинкой скелетных мышц и синаптических ганглиев, вызывая следующие эффекты
Произвольная фасцикуляция мышц: вялый паралич
Сердечно-сосудистые эффекты: тахикардия, которая может прогрессировать до тахикардии противоположные эффекты стимуляции мускариновых и никотиновых рецепторов.
История и физика
Диагностическая работа при холинергическом кризе может представлять клиническую проблему, особенно для тех, кто не знаком с клиническими признаками и симптомами. Необходим очень подробный сбор анамнеза с тщательным физическим обследованием. При физикальном обследовании особое внимание следует уделять нервной, дыхательной, сердечно-сосудистой и желудочно-кишечной системе, поскольку именно здесь клинические проявления наиболее выражены. Хорошая мнемоника для запоминания — SLUDGEM и DUMBELS для мускаринового эффекта ACh.
Клинические результаты, связанные со стимуляцией мускариновых рецепторов
S — Слюноотделение
L — Слезотечение
U — Частота мочеиспускания
D — боль
E — Рвота
M — Миоз
Еще одна мнемоника, которая обычно используется для обозначения симптомов, — это «ДУМБЕЛИ».
D — Потоотделение и диарея
U — Частота мочеиспускания
M — Миоз
B — Бронхоспазм и бронхорея
000
— Эхо S — Слюноотделение
Клинические результаты, связанные со стимуляцией никотиновых рецепторов
Клинические результаты, связанные со стимуляцией
Центральная нервная система
Клинический диагноз холинергического криза может быть установлен на основании перечисленных выше токсидромов.
При сборе анамнеза очень уместно определить причину холинергических кризов:
Лекарства для лечения миастении или глаукомы, включая пиридостигмин
Проглатывание или воздействие инсектицидов, пестицидов или гербицидов
Воздействие нервно-паралитического газа
Устранение нервно-мышечной блокады
Время имеет первостепенное значение при первоначальной оценке. Когда, как и где произошло проглатывание или воздействие, необходимо выяснить из истории.Это связано с тем, что существует 48-часовое окно, в течение которого можно вводить пралидоксим в качестве противоядия. Пралидоксим будет реагировать с ферментом, который расщепляет ACh после контакта с ингибитором AChE, в данном случае нервно-паралитическим газом или инсектицидом. Реактивированный фермент AChE ускоряет молекулярную деградацию ACh. Распад ACh прекратит чрезмерную стимуляцию постсинаптической мембраны ACh.
Когда, как и где произошло проглатывание или воздействие, необходимо выяснить из истории.Это связано с тем, что существует 48-часовое окно, в течение которого можно вводить пралидоксим в качестве противоядия. Пралидоксим будет реагировать с ферментом, который расщепляет ACh после контакта с ингибитором AChE, в данном случае нервно-паралитическим газом или инсектицидом. Реактивированный фермент AChE ускоряет молекулярную деградацию ACh. Распад ACh прекратит чрезмерную стимуляцию постсинаптической мембраны ACh.
Оценка
Оценка пациентов с холинергическим кризом включает подробный сбор анамнеза и физикальное обследование на токсидромы, связанные с кризисом.
В оценку включены дополнительные исследования:
Общий анализ крови (CBC) , чтобы проверить, есть ли повышение количества лейкоцитов, чтобы исключить инфекционный процесс.
Комплексная метаболическая панель (CMP) для исключения нарушений электролитов, связанных с отравлением фосфорорганическими соединениями
- Активность холинэстеразы красных кровяных телец обычно снижена, и это может помочь в подтверждении диагноза.Также можно использовать плазменную псевдохолинэстеразу, но она менее точна, чем активность холинэстеразы эритроцитов [20].
Электрокардиография для проверки наличия аритмии, связанной с отравлением фосфорорганическими соединениями.
Рентген грудной клетки для оценки наличия отека легких или аспирации.
Компьютерная томография головы указывается, если психическое состояние пациента изменилось или есть значительные изменения в шкале комы Глазго.
Лечение / ведение
Ведение холинергического криза включает три этапа: (1) догоспитальная помощь, (2) управление отделением неотложной помощи и (3) стационарное лечение.
Догоспитальная помощь
Догоспитальная помощь включает в себя первоначальную стабилизацию состояния пациента и удаление вызывающего токсическое действие агента. Если отравление фосфорорганическими соединениями или нервно-паралитическим газом является основной причиной холинергического криза, необходимо как можно скорее начать дезинфекцию.Вся одежда должна быть снята с тела пациента, чтобы предотвратить дальнейшее заражение и предотвратить перекрестное заражение лиц, оказывающих первую помощь.
Приемная
Менеджмент
Независимо от этиологии холинергических кризов, основным принципом стабилизации является ABC: дыхательные пути, дыхание и кровообращение.
Дыхательные пути и дыхание
Следует проявлять осторожность, чтобы обеспечить проходимость дыхательных путей и самопроизвольное дыхание пациента.Дыхательные пути должны быть защищены, если есть опасения по поводу нарушения проходимости дыхательных путей.
Показаниями для расширенного контроля проходимости дыхательных путей и интубации при холинергическом кризе являются:
Обильные выделения из полости рта и носа, нарушающие проходимость дыхательных путей
Измененное психическое состояние с оценкой комы по Глазго менее 8
Свидетельства о наличии гемодинамическая нестабильность
Глубокая слабость дыхательной мускулатуры
Кровообращение
Сосудистый доступ должен быть установлен немедленно через два периферических внутривенных доступа большого диаметра.Жидкость следует начать для поддержания адекватного кровообращения с непрерывной пульсоксиметрией и мониторингом жизненно важных функций. В случае гемодинамической нестабильности следует установить доступ к центральным венам для инфузии вазоактивных препаратов.
В отделении неотложной помощи основное внимание на начальном этапе лечения уделяется поддержанию проходимости дыхательных путей и стабильности гемодинамики. Если пациент уже интубирован, необходимо продолжить искусственную вентиляцию легких.
Стационарное лечение
Стационарное лечение включает постоянную сердечно-легочную поддержку и мониторинг.Пациенты с холинергическим кризом должны быть госпитализированы в реанимацию.
Антидоты при холинергическом кризе
При холинергическом кризе используются два типа антидотов: атропин и оксимы.
Атропин
Первым противоядием является атропин. Это эффективное средство для мускаринового действия ацетилхолина. Он конкурентно связывается с постсинаптическим мускариновым рецептором, предотвращая дальнейшее действие ACh.Доза атропина составляет около 0,03-0,05 мг / кг для детей и около 2 мг для взрослых пациентов. Рекомендуется давать атропин до появления признаков атропинизации:
Признаки атропинизации
Атропин не влияет на никотиновые рецепторы.
Оксимы
Для никотинового эффекта при холинергическом кризе антидот представляет собой класс препаратов, называемых «оксимами». Примерами оксимов являются пралидоксим и обидоксим [21].
В США наиболее часто применяемым противоядием является хлорид пралидоксима. Его механизм действия подобен механизму «молекулярного лома», который отделяет связанный нервно-паралитический газ или органофосфат от ацетилхолинэстеразы. После этого отделенный АХЭ может продолжить процесс химического разложения АХЭ. Существует период окна, в течение которого оксимы можно вводить до того, как произойдет необратимое связывание нервно-паралитического газа с АХЭ. Это явление известно как «старение [22]». Период полувыведения составляет от двух минут для зомана до нескольких часов для зарина
Пралидоксим следует назначать пациентам с признаками слабости дыхательных мышц или общей мышечной слабости.Его следует вводить до улучшения мышечной слабости. Он не проникает через гематоэнцефалический барьер, поэтому эффект отравления фосфорорганическими соединениями на центральную нервную систему не нейтрализуется. Это достигается с помощью атропина.
Другие лекарства при холинергическом кризе
Судороги и возбуждение при холинергическом кризе можно лечить бензодиазепиноподобным мидазоламом или лоразепамом. Следует также соблюдать осторожность, чтобы избегать приема таких препаратов, как петлевые диуретики, теофиллин, кофеин и сукцинилхолин, при отравлении фосфорорганическими соединениями, поскольку это может усугубить симптомы отравления.
При лечении холинергического криза, вторичного по отношению к устранению нервно-мышечной блокады, с помощью неостигмина можно вводить атропин или гликопирролат для уменьшения холинергических эффектов восстановления нервно-мышечной блокады.
При лечении холинергического криза рекомендуется консультация клинического токсиколога и реаниматолога.
Дифференциальный диагноз
Миастенический криз следует дифференцировать от холинергического криза с помощью эдрофониевой пробы.Введение 2 мг эдрофония ухудшит клинические симптомы холинергического криза. Напротив, миастенический криз. При дифференциальной диагностике следует учитывать другие причины холинергического криза, такие как воздействие нервно-паралитического газа, органофосфатов и использование реверсивного агента для нервно-мышечной блокады.
Прогноз
Смертность при холинергическом кризе колеблется от 3% до 25%. Наиболее частой причиной смерти является прогрессирующая дыхательная недостаточность.
Осложнения
При холинергическом кризе могут развиться следующие осложнения.Эти проблемы связаны с чрезмерной стимуляцией мускариновых и никотиновых рецепторов.
Ниже описаны сложности, влияющие на каждую систему.
Дыхательная система
Сердечно-сосудистая система
Брадикардия
Гипотония
Гипертензия
Аритмия
Приступ
Измененное психическое состояние
9118
Аритмия
Психоз
Желудочно-кишечная система
Улучшение результатов команды здравоохранения
Для правильного ведения необходимо детальное знание холинергического кризиса.Для улучшения результатов лечения пациентов требуется межпрофессиональный подход медсестер, фельдшеров и врачей к лечению, особенно когда это связано с отравлением. Хорошим ресурсом для использования в управлении является Центр борьбы с отравлениями
Повышение квалификации / обзорные вопросы
Ссылки
- 1.
- Котари MJ. Миастения гравис. J Am Osteopath Assoc. 2004 сентябрь; 104 (9): 377-84. [PubMed: 15452103]
- 2.
- Лакомис Д. Миастенический кризис.Neurocrit Care. 2005; 3 (3): 189-94. [PubMed: 16377829]
- 3.
- Сильвестри Н.Дж., Вулф Г.И., Бромберг М., Лакомис Д. Что в литературе? J Clin Neuromuscul Dis. 2016 июн; 17 (4): 227-38. [PubMed: 27224441]
- 4.
- Чаудхури А., Бехан П.О. Миастенический криз. QJM. 2009 Февраль; 102 (2): 97-107. [PubMed: 1
20]
- 5.
- Живкович С.А., Клеменс П.Р., Лакомис Д. Характеристики миастении с поздним началом. J Neurol. 2012 Октябрь; 259 (10): 2167-71. [PubMed: 22476514]
- 6.
- Винсент А., Лейте Мичиган. Аутоиммунное заболевание нервно-мышечного соединения: мышечные антитела к киназе и методы лечения миастении. Curr Opin Neurol. 2005 Октябрь; 18 (5): 519-25. [PubMed: 16155434]
- 7.
- Эволи А., Альбоини П.Е., Дамато В., Иорио Р., Провенцано С., Барточчони Е., Марино М. Myasthenia gravis с антителами к MuSK: обновление. Ann N Y Acad Sci. 2018 Янв; 1412 (1): 82-89. [PubMed: 29266255]
- 8.
- Ван Ш., Се Ю.С., Цзян Б., Чжан Дж.Й., Цюй Й, Чжао Ю., Ли И, Цяо С.С., Сюй К.Л.[Обострение миастении, ассоциированной с фторхинолоном: клинический анализ 9 случаев]. Чжунхуа И Сюэ За Чжи. 2013 7 мая; 93 (17): 1283-6. [PubMed: 24029473]
- 9.
- Фрэнсис Дж. К., Хиггинс Э. Постоянная периферическая невропатия: отчет о редком, но серьезном ослабляющем побочном эффекте приема фторхинолонов. Отчет по делу J Investig Med High Impact, 2014 июль-сентябрь; 2 (3): 2324709614545225. [Бесплатная статья PMC: PMC4528905] [PubMed: 26425618]
- 10.
- Венделл Л.С., Левин Дж. М..Миастенический криз. Нейрогоспиталист. 2011 Янв; 1 (1): 16-22. [Бесплатная статья PMC: PMC3726100] [PubMed: 23983833]
- 11.
- ХОККАНЕН Э. АНТИБИОТИКИ ПРИ МИАСТЕНИИ ГРАВИСА. Br Med J. 1964, 25 апреля; 1 (5390): 1111-2. [Бесплатная статья PMC: PMC1814432] [PubMed: 14113831]
- 12.
- May EF, Calvert PC. Обострение миастении эритромицином. Энн Нейрол. 1990 Октябрь; 28 (4): 577-9. [PubMed: 2252369]
- 13.
- Ньюмарк Дж. Нервные агенты. Невролог. 2007 Янв; 13 (1): 20-32.[PubMed: 17215724]
- 14.
- Barthold CL, Schier JG. Органические соединения фосфора — нервно-паралитические агенты. Crit Care Clin. 2005 Октябрь; 21 (4): 673-89, v-vi. [PubMed: 16168308]
- 15.
- Растоги С.К., Трипати С., Равишанкер Д. Исследование неврологических симптомов воздействия фосфорорганических пестицидов у детей сельскохозяйственных рабочих. Индийский J Occup Environ Med. 2010 августа; 14 (2): 54-7. [Бесплатная статья PMC: PMC2992866] [PubMed: 21120082]
- 16.
- Neely GA, Sabir S, Kohli A.StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 2 сентября 2020 г. Neostigmine. [PubMed: 29261883]
- 17.
- Шривастава А., Хантер Дж. М.. Снятие нервно-мышечного блока. Br J Anaesth. 2009 июль; 103 (1): 115-29. [PubMed: 19468024]
- 18.
- LOEWI О. О внутриневральном состоянии ацетилхолина. Experientia. 1956 15 сентября; 12 (9): 331-3. [PubMed: 13365584]
- 19.
- LOEWI O. На фоне открытия нейрохимической передачи.J Mt Sinai Hosp N Y.1957 ноябрь-декабрь; 24 (6): 1014-6. [PubMed: 13481646]
- 20.
- Eckert S, Eyer P, Herkert N, Bumm R, Weber G, Thiermann H., Worek F. Сравнение оксим-индуцированной реактивации ацетилхолинэстеразы эритроцитов и мышц после ингибирования зарином или параоксоном , используя модель перфузии для определения активности мембраносвязанной ацетилхолинэстеразы в реальном времени. Biochem Pharmacol. 2008 г., 01 февраля; 75 (3): 698-703. [PubMed: 17977518]
- 21.
- Эйер П.Роль оксимов в лечении отравлений фосфорорганическими пестицидами. Toxicol Rev.2003; 22 (3): 165-90. [PubMed: 15181665]
- 22.
- Burillo-Putze G, Hoffman RS, Howland MA, Duenas-Laita A. Позднее введение пралидоксима при отравлении органофосфатом (фенитротионом). Am J Emerg Med. 2004 июл; 22 (4): 327-8. [PubMed: 15258887]
Холинергическая токсичность — StatPearls — NCBI Bookshelf
Непрерывное обучение
Холинергическая токсичность вызывается веществами, которые стимулируют, усиливают или имитируют нейротрансмиттер ацетилхолин, первичный нейротрансмиттер паразитарной нервной системы.Ацетилхолин стимулирует мускариновые и никотиновые рецепторы, вызывая сокращение мышц и секрецию желез. Холинергическая токсичность возникает, когда в рецепторном синапсе присутствует слишком много ацетилхолина, что приводит к чрезмерным парасимпатическим эффектам. В этом упражнении рассматривается представление, оценка и лечение холинергической токсичности и подчеркивается роль межпрофессионального командного подхода к уходу за пораженными пациентами.
Цели:
Опишите анамнез и результаты физикального обследования, которые обычно наблюдаются у пациентов с холинергической токсичностью.
Обобщите соответствующее лечение холинергической токсичности.
Обзор патофизиологии холинергической токсичности.
Объясните способы улучшения координации помощи между членами межпрофессиональной группы с целью улучшения результатов для пациентов, страдающих холинергической токсичностью.
Заработайте кредиты на непрерывное образование (CME / CE) по этой теме.
Введение
Холинергическая токсичность вызывается лекарствами, лекарствами и веществами, которые стимулируют, усиливают или имитируют нейромедиатор ацетилхолин.Ацетилхолин является основным нейромедиатором парасимпатической нервной системы. Ацетилхолин стимулирует мускариновые и никотиновые рецепторы, вызывая сокращение мышц и секрецию желез. Холинергическая токсичность возникает, когда в рецепторном синапсе присутствует слишком много ацетилхолина, что приводит к чрезмерным парасимпатическим эффектам.
Этиология
Холинергическая токсичность может быть результатом инсектицидов, нервно-паралитических агентов, лекарств и грибов. Наиболее частой причиной холинергической токсичности во всем мире является воздействие фосфорорганических и карбаматных инсектицидов.Воздействие этих инсектицидов может происходить при вдыхании паров, проглатывании или прямом контакте химического вещества с кожей или слизистой оболочкой.
Зарин — газ нервно-паралитического действия, обычно используемый в химической войне. Газ зарин был первоначально произведен в Германии в 1938 году как пестицид. Хорошо известно, что он участвовал в террористических актах в Японии в 1994 и 1995 годах.
Холинергические препараты могут вызывать холинергический кризис во время клинического применения или после передозировки. Эти препараты включают препараты, используемые для лечения миастении, такие как эдрофониум и неостигмин, пилокарпин, применяемый при глаукоме, ипратропий, и препараты для лечения болезни Альцгеймера, такие как ривастигмин и донепезил.По сути, любой агент, который создает изобилие ацетилхолина в синапсе, может вызывать холинергическую токсичность. Эти препараты могут вызывать слабость, но холинергический криз очень редко возникает при приеме лекарств в терапевтических дозах.
Эпидемиология
Органофосфаты используются во всем мире в качестве инсектицидов более 50 лет, хотя за последние 10–20 лет их использование снизилось. Ежегодно во всем мире происходит около 3000000 контактов с органофосфатами или карбаматами, в результате которых погибает около 200000 человек.[1] Один миллион из этих воздействий оказался непреднамеренным, в то время как другие 2 миллиона воздействий были вторичными по отношению к попыткам суицида. [2] Американская ассоциация токсикологических центров сообщила о 86914 контактах людей с пестицидами только в США в 1996 году [3]. Отравления в результате профессионального облучения составляли лишь пятую часть случайных контактов, а уровень смертности составлял менее 1%. Более 90% инцидентов, не связанных с профессиональной деятельностью, были умышленными, со смертельным исходом более 10%.Остальные 10% приходилось на случайное воздействие, а на убийство — менее 1%.
Зарин — широко известное боевое химическое вещество, которое по-прежнему представляет угрозу во всем мире. Нервно-паралитические агенты использовались террористическими группами и диктаторами в метро для подавления сообществ внутри страны.
Патофизиология
Основным механизмом холинергической токсичности является чрезмерная стимуляция холинергических рецепторов, которая может быть вызвана веществами, имитирующими, стимулирующими или усиливающими ацетилхолин.Симптомокомплекс, производимый агентом, зависит от того, какой тип рецептора или комбинация рецепторов активируется. Холинергические рецепторы бывают трех типов: центральные, мускариновые и никотиновые. Избыток ацетилхолина на мускариновых рецепторах приведет к усилению секреции симптомов, бронхоспазму, брадикардии, рвоте и спазмам в животе. Избыток ацетилхолина на никотиновых рецепторах вызывает мышечные фасцикуляции или паралич из-за активации нервно-мышечного соединения. Избыток ацетилхолина в центральной нервной системе может вызвать спутанность сознания, головную боль или сонливость.[1]
История и физика
Результаты физикального осмотра зависят от того, в каких рецепторах происходит накопление ацетилхолина. Накопление ацетилхолина в мускариновых рецепторах вызывает увеличение секреции, что может проявляться в виде бронхореи, слюноотделения, слезотечения и потоотделения, бронхоспазма, стеснения в груди, хрипов, брадикардии, рвоты, повышенной перистальтики желудочно-кишечного тракта, стеснения в животе, диареи и спазмов. Активация мускариновых рецепторов в глазах избытком ацетилхолина вызывает миоз и нечеткое зрение.Повышенный уровень ацетилхолина в никотиновых участках нервно-мышечного соединения вызывает фасцикуляции мышц и вялый паралич из-за избытка ацетилхолина в нервно-мышечном соединении. Избыток ацетилхолина в головном мозге пациентов может вызвать головную боль, бессонницу, головокружение, спутанность сознания и сонливость. Более серьезное воздействие может вызвать центральную депрессию, приводящую к невнятной речи, судорогам, коме и угнетению дыхания. Смерть может наступить из-за воздействия на сердце, дыхание и мозг.
Две полезные мнемоники для запоминания мускариновых эффектов избытка ацетилхолина: SLUDGE или DUMBELS
S — Слюноотделение
L — Слезотечение
U — Частое мочеиспускание
D — Диафорез / понос
Боль в желудочно-кишечном тракте
E — Рвота
D — Диарея / потоотделение
U — Частота мочеиспускания
M — Миоз
B — Бронхоспазм / бронхорея
E — Рвота
L — Лакримация
Слюноотделение
Слюноотделение Диагностика холинергической токсичности зависит от способности распознать клиническую картину и связать ее с анамнезом, что сделало бы возможным этот токсидром.Для постановки этого диагноза критически важны подробный анамнез и физикальное обследование. Если токсидром присутствует, важно попытаться идентифицировать агент, поскольку эффекты и продолжительность токсичности зависят от агента.
Не существует специальных лабораторных или рентгенологических исследований, которые позволили бы поставить окончательный диагноз. Уровни ацетилхолинэстеразы в эритроцитах можно измерить, но большинство больничных лабораторий не предлагают этот тест.
Лечение / ведение
Оценка и ведение каждого пациента должны начинаться с ABC (дыхательные пути, дыхание, кровообращение, инвалидность и воздействие).Обычная поддержка дыхательных путей и кровообращения необходима за двумя исключениями. Во время интубации нельзя использовать сукцинилхолин, потому что недостаток ацетилхолинэстеразы, вызванный отравлением, вызовет длительный паралич. Необходима агрессивная дезактивация. Всю одежду следует снять и выбросить. Кожу и глаза следует промыть во избежание дальнейшего всасывания средства. Медицинские работники должны носить защитное снаряжение для предотвращения воздействия агента на кожу и при вдыхании.
При подозрении на лечение лечение должно состоять из внутривенного введения атропина и пралидоксима.Сначала назначают атропин, поскольку пралидоксим может временно ухудшить симптомы. Атропин физиологически действует как прямой антидот, противодействуя действиям мускариновых рецепторов избыточного ацетилхолина, таким как бронхорея, брадикардия, слюноотделение и бронхоспазм. Атропин может преодолевать гематоэнцефалический барьер и может помочь снизить активность избыточного ацетилхолина центрального действия. Начальная доза атропина внутривенно составляет от 2 до 5 мг для взрослых и 0,05 мкг / кг для детей каждые 5 минут до улучшения легочных симптомов.Атропин необходимо титровать, чтобы облегчить бронхорею и бронхоспазм; для этого могут потребоваться большие дозы атропина, и лечение может продолжаться в течение нескольких дней. Больничная аптека должна получить предварительное уведомление о том, что может потребоваться дополнительный запас атропина.
Поскольку атропин не связывается с никотиновыми рецепторами, он не лечит нервно-мышечную дисфункцию. Оксимы, такие как пралидоксим, обладают тремя действиями, которые показывают преимущество при острой холинергической токсичности. Пралидоксим реактивирует ацетилхолинэстеразу, оказывает эндогенное антихолинергическое действие и выводит токсины на несвязанные органофосфаты.Оксимы используются для воздействия на никотиновый нервно-мышечный переход, поэтому их следует назначать при наличии признаков мышечной слабости, особенно если слабость проявляется в дыхательной системе [4]. Большинству пациентов с отравлением фосфорорганическими соединениями требуется лечение оксимом; это связано с вариабельностью ответов на оксимы и возможностью отсроченной токсичности. Утвержденная FDA дозировка пралидоксима при токсичности фосфорорганических соединений составляет от 1 до 2 г инфузии в течение 30 минут, которую можно повторить через час, если мышечная слабость сохраняется.После болюсной дозы также может потребоваться непрерывная инфузия. Если возможно, обратитесь за консультацией в токсикологический или токсикологический центр.
При припадках следует лечить бензодиазепинами, а не противоэпилептическими средствами. Профилактический прием диазепама снижает невропатологические повреждения после отравления фосфорорганическими соединениями [5].
Дифференциальная диагностика
Многие заболевания и токсические эффекты, которые могут имитировать холинергическую токсичность. К ним относятся токсичность карбамата, никотиновая токсичность, передозировка карбахол-метахолина, бетанехола или пилокарпина, токсичность пиридостигмина, токсичность неостигмина, отравление грибами, миастения гравис, синдром Итона-Ламберта, синдром Гийена-Барре, ботулизм, передозировка опиоидов, тяжелая токсичность, алкогольная астма. обострение и тяжелый гастроэнтерит.
Прогноз
Медикаментозное лечение холинергической токсичности может быть затруднено, и, таким образом, уровень летальности обычно превышает 15%. [6]
Осложнения
Поскольку холинергическая токсичность затрагивает парасимпатическую нервную систему, могут возникнуть многие серьезные осложнения. Из-за сильного бронхоспазма и бронхореи дыхательная система может дать сбой и потребовать вспомогательной вентиляции. Дыхательная недостаточность также может возникать из-за сильной мышечной слабости, которая может влиять на мышцы диафрагмы.Сердечно-сосудистая система может разрушиться из-за глубокой брадикардии, гипотонии, гипертонии или аритмий, которые могут ускоряться у пациента с известным заболеванием коронарной артерии, известной хронической сердечной недостаточностью или другими сердечно-сосудистыми заболеваниями. Эти воздействия на сердечно-сосудистую и дыхательную системы могут привести к остановке сердечно-сосудистой системы и смерти. Электролитные нарушения могут также возникать в результате чрезмерной рвоты и диареи, связанных с холинергической токсичностью, что подвергает пациента риску аритмий и смерти.
Консультации
Консультации в местном токсикологическом центре или токсикологе уместны при подтвержденной или предполагаемой холинергической токсичности.
Сдерживание и обучение пациентов
Пациенты, которые могут контактировать с инсектицидами или пестицидами, нуждаются в обучении правильному обращению с такими веществами и уходу за ними. Правильные процедуры обращения могут снизить воздействие этого химического вещества на рабочем месте и, следовательно, уменьшить количество инцидентов во всем мире.[7]
Жемчуг и другие проблемы
Холинергическая токсичность может проявляться при использовании пестицидов или лекарств, но наиболее серьезные воздействия связаны с воздействием фосфорорганических или карбаматных пестицидов.
От этого отравления погибло около 200000 человек во всем мире, особенно в Азиатско-Тихоокеанском регионе.
Диагноз ставится на основании выявления холинергического токсидрома при подозрении на заболевание в анамнезе.
Токсичность может быть немедленной или отсроченной.
Лечение — это агрессивная поддерживающая терапия плюс таргетная терапия холинергической токсичности: атропин с последующим приемом доступного оксима, такого как пралидоксим.
Необходимо использовать дезинфицирующие средства и средства индивидуальной защиты, чтобы предотвратить дальнейшее поглощение агента пациентом и причинение вреда лицам, осуществляющим уход.
Рекомендуется консультация токсиколога или токсикологического центра.
Улучшение результатов команды здравоохранения
Самым сложным аспектом в лечении холинергической токсичности является первоначальное распознавание процесса болезни, которое позволит быстро начать лечение и, следовательно, улучшить результаты. Медсестры и врачи должны информировать пациентов о воздействии пестицидов и о том, как распознать симптомы.Строгие правила дезактивации могут помочь уменьшить непреднамеренное воздействие на медсестер и медицинских работников отделения неотложной помощи. Сокращение использования пестицидов во всем мире может помочь снизить случаи случайной токсичности из-за профессионального воздействия. Фармацевты должны просмотреть записи о лекарствах пациента, чтобы убедиться, что нет лекарств, которые могут вызвать холинергическую токсичность или усугубить существующую токсичность. Лечение холинергической токсичности требует межпрофессионального командного подхода, который включает врачей, медсестер, фармацевтов, экспертов по токсикологии и токсикологов для обеспечения оптимального ухода за пациентами и результатов.
Повышение квалификации / обзорные вопросы
Ссылки
- 1.
- Отравление фосфорорганическими инсектицидами. EJIFCC. 1999 июл; 11 (2): 30-35. [Бесплатная статья PMC: PMC6357250] [PubMed: 30720257]
- 2.
- Джейаратнам Дж. Острое отравление пестицидами: серьезная глобальная проблема здравоохранения. World Health Stat Q.1990; 43 (3): 139-44. [PubMed: 2238694]
- 3.
- Литовиц Т.Л., Смилкштейн М., Фельберг Л., Кляйн-Шварц В., Берлин Р., Морган Дж. Л.. Годовой отчет Американской ассоциации центров контроля за токсичными веществами за 1996 год.Am J Emerg Med. 1997 сентябрь; 15 (5): 447-500. [PubMed: 9270389]
- 4.
- Эйер П. Роль оксимов в лечении отравлений фосфорорганическими пестицидами. Toxicol Rev.2003; 22 (3): 165-90. [PubMed: 15181665]
- 5.
- Туовинен К. Судороги, вызванные фосфорорганическими соединениями, и профилактика невропатологических повреждений. Токсикология. 2004 г. 01; 196 (1-2): 31-9. [PubMed: 15036754]
- 6.
- Эддлстон М., Бакли Н.А., Эйер П., Доусон А.Х. Лечение острого отравления фосфорорганическими пестицидами.Ланцет. 2008 16 февраля; 371 (9612): 597-607. [Бесплатная статья PMC: PMC2493390] [PubMed: 17706760]
- 7.
- Лутовак М., Попова О.В., Йованович З., Бериса Х., Кристина Р., Кетин С., Бойич М. Управление, диагностическая и прогностическая значимость ацетилхолинэстеразы токсического воздействия пестицидов на людей, подвергающихся профессиональному воздействию. Открытый доступ Maced J Med Sci. 2017 15 декабря; 5 (7): 1021-1027. [Бесплатная статья PMC: PMC5771273] [PubMed: 29362639]
Холинергическая токсичность — StatPearls — NCBI Bookshelf
Continuing Education Activity
Холинергическая токсичность вызывается веществами, которые стимулируют, усиливают или имитируют нейротрансмиттер — нейротрансмиттер ацетилхолин. парасимпатическая нервная система.Ацетилхолин стимулирует мускариновые и никотиновые рецепторы, вызывая сокращение мышц и секрецию желез. Холинергическая токсичность возникает, когда в рецепторном синапсе присутствует слишком много ацетилхолина, что приводит к чрезмерным парасимпатическим эффектам. В этом упражнении рассматривается представление, оценка и лечение холинергической токсичности и подчеркивается роль межпрофессионального командного подхода к уходу за пораженными пациентами.
Цели:
Опишите анамнез и результаты физикального обследования, которые обычно наблюдаются у пациентов с холинергической токсичностью.
Обобщите соответствующее лечение холинергической токсичности.
Обзор патофизиологии холинергической токсичности.
Объясните способы улучшения координации помощи между членами межпрофессиональной группы с целью улучшения результатов для пациентов, страдающих холинергической токсичностью.
Заработайте кредиты на непрерывное образование (CME / CE) по этой теме.
Введение
Холинергическая токсичность вызывается лекарствами, лекарствами и веществами, которые стимулируют, усиливают или имитируют нейромедиатор ацетилхолин.Ацетилхолин является основным нейромедиатором парасимпатической нервной системы. Ацетилхолин стимулирует мускариновые и никотиновые рецепторы, вызывая сокращение мышц и секрецию желез. Холинергическая токсичность возникает, когда в рецепторном синапсе присутствует слишком много ацетилхолина, что приводит к чрезмерным парасимпатическим эффектам.
Этиология
Холинергическая токсичность может быть результатом инсектицидов, нервно-паралитических агентов, лекарств и грибов. Наиболее частой причиной холинергической токсичности во всем мире является воздействие фосфорорганических и карбаматных инсектицидов.Воздействие этих инсектицидов может происходить при вдыхании паров, проглатывании или прямом контакте химического вещества с кожей или слизистой оболочкой.
Зарин — газ нервно-паралитического действия, обычно используемый в химической войне. Газ зарин был первоначально произведен в Германии в 1938 году как пестицид. Хорошо известно, что он участвовал в террористических актах в Японии в 1994 и 1995 годах.
Холинергические препараты могут вызывать холинергический кризис во время клинического применения или после передозировки. Эти препараты включают препараты, используемые для лечения миастении, такие как эдрофониум и неостигмин, пилокарпин, применяемый при глаукоме, ипратропий, и препараты для лечения болезни Альцгеймера, такие как ривастигмин и донепезил.По сути, любой агент, который создает изобилие ацетилхолина в синапсе, может вызывать холинергическую токсичность. Эти препараты могут вызывать слабость, но холинергический криз очень редко возникает при приеме лекарств в терапевтических дозах.
Эпидемиология
Органофосфаты используются во всем мире в качестве инсектицидов более 50 лет, хотя за последние 10–20 лет их использование снизилось. Ежегодно во всем мире происходит около 3000000 контактов с органофосфатами или карбаматами, в результате которых погибает около 200000 человек.[1] Один миллион из этих воздействий оказался непреднамеренным, в то время как другие 2 миллиона воздействий были вторичными по отношению к попыткам суицида. [2] Американская ассоциация токсикологических центров сообщила о 86914 контактах людей с пестицидами только в США в 1996 году [3]. Отравления в результате профессионального облучения составляли лишь пятую часть случайных контактов, а уровень смертности составлял менее 1%. Более 90% инцидентов, не связанных с профессиональной деятельностью, были умышленными, со смертельным исходом более 10%.Остальные 10% приходилось на случайное воздействие, а на убийство — менее 1%.
Зарин — широко известное боевое химическое вещество, которое по-прежнему представляет угрозу во всем мире. Нервно-паралитические агенты использовались террористическими группами и диктаторами в метро для подавления сообществ внутри страны.
Патофизиология
Основным механизмом холинергической токсичности является чрезмерная стимуляция холинергических рецепторов, которая может быть вызвана веществами, имитирующими, стимулирующими или усиливающими ацетилхолин.Симптомокомплекс, производимый агентом, зависит от того, какой тип рецептора или комбинация рецепторов активируется. Холинергические рецепторы бывают трех типов: центральные, мускариновые и никотиновые. Избыток ацетилхолина на мускариновых рецепторах приведет к усилению секреции симптомов, бронхоспазму, брадикардии, рвоте и спазмам в животе. Избыток ацетилхолина на никотиновых рецепторах вызывает мышечные фасцикуляции или паралич из-за активации нервно-мышечного соединения. Избыток ацетилхолина в центральной нервной системе может вызвать спутанность сознания, головную боль или сонливость.[1]
История и физика
Результаты физикального осмотра зависят от того, в каких рецепторах происходит накопление ацетилхолина. Накопление ацетилхолина в мускариновых рецепторах вызывает увеличение секреции, что может проявляться в виде бронхореи, слюноотделения, слезотечения и потоотделения, бронхоспазма, стеснения в груди, хрипов, брадикардии, рвоты, повышенной перистальтики желудочно-кишечного тракта, стеснения в животе, диареи и спазмов. Активация мускариновых рецепторов в глазах избытком ацетилхолина вызывает миоз и нечеткое зрение.Повышенный уровень ацетилхолина в никотиновых участках нервно-мышечного соединения вызывает фасцикуляции мышц и вялый паралич из-за избытка ацетилхолина в нервно-мышечном соединении. Избыток ацетилхолина в головном мозге пациентов может вызвать головную боль, бессонницу, головокружение, спутанность сознания и сонливость. Более серьезное воздействие может вызвать центральную депрессию, приводящую к невнятной речи, судорогам, коме и угнетению дыхания. Смерть может наступить из-за воздействия на сердце, дыхание и мозг.
Две полезные мнемоники для запоминания мускариновых эффектов избытка ацетилхолина: SLUDGE или DUMBELS
S — Слюноотделение
L — Слезотечение
U — Частое мочеиспускание
D — Диафорез / понос
Боль в желудочно-кишечном тракте
E — Рвота
D — Диарея / потоотделение
U — Частота мочеиспускания
M — Миоз
B — Бронхоспазм / бронхорея
E — Рвота
L — Лакримация
Слюноотделение
Слюноотделение Диагностика холинергической токсичности зависит от способности распознать клиническую картину и связать ее с анамнезом, что сделало бы возможным этот токсидром.Для постановки этого диагноза критически важны подробный анамнез и физикальное обследование. Если токсидром присутствует, важно попытаться идентифицировать агент, поскольку эффекты и продолжительность токсичности зависят от агента.
Не существует специальных лабораторных или рентгенологических исследований, которые позволили бы поставить окончательный диагноз. Уровни ацетилхолинэстеразы в эритроцитах можно измерить, но большинство больничных лабораторий не предлагают этот тест.
Лечение / ведение
Оценка и ведение каждого пациента должны начинаться с ABC (дыхательные пути, дыхание, кровообращение, инвалидность и воздействие).Обычная поддержка дыхательных путей и кровообращения необходима за двумя исключениями. Во время интубации нельзя использовать сукцинилхолин, потому что недостаток ацетилхолинэстеразы, вызванный отравлением, вызовет длительный паралич. Необходима агрессивная дезактивация. Всю одежду следует снять и выбросить. Кожу и глаза следует промыть во избежание дальнейшего всасывания средства. Медицинские работники должны носить защитное снаряжение для предотвращения воздействия агента на кожу и при вдыхании.
При подозрении на лечение лечение должно состоять из внутривенного введения атропина и пралидоксима.Сначала назначают атропин, поскольку пралидоксим может временно ухудшить симптомы. Атропин физиологически действует как прямой антидот, противодействуя действиям мускариновых рецепторов избыточного ацетилхолина, таким как бронхорея, брадикардия, слюноотделение и бронхоспазм. Атропин может преодолевать гематоэнцефалический барьер и может помочь снизить активность избыточного ацетилхолина центрального действия. Начальная доза атропина внутривенно составляет от 2 до 5 мг для взрослых и 0,05 мкг / кг для детей каждые 5 минут до улучшения легочных симптомов.Атропин необходимо титровать, чтобы облегчить бронхорею и бронхоспазм; для этого могут потребоваться большие дозы атропина, и лечение может продолжаться в течение нескольких дней. Больничная аптека должна получить предварительное уведомление о том, что может потребоваться дополнительный запас атропина.
Поскольку атропин не связывается с никотиновыми рецепторами, он не лечит нервно-мышечную дисфункцию. Оксимы, такие как пралидоксим, обладают тремя действиями, которые показывают преимущество при острой холинергической токсичности. Пралидоксим реактивирует ацетилхолинэстеразу, оказывает эндогенное антихолинергическое действие и выводит токсины на несвязанные органофосфаты.Оксимы используются для воздействия на никотиновый нервно-мышечный переход, поэтому их следует назначать при наличии признаков мышечной слабости, особенно если слабость проявляется в дыхательной системе [4]. Большинству пациентов с отравлением фосфорорганическими соединениями требуется лечение оксимом; это связано с вариабельностью ответов на оксимы и возможностью отсроченной токсичности. Утвержденная FDA дозировка пралидоксима при токсичности фосфорорганических соединений составляет от 1 до 2 г инфузии в течение 30 минут, которую можно повторить через час, если мышечная слабость сохраняется.После болюсной дозы также может потребоваться непрерывная инфузия. Если возможно, обратитесь за консультацией в токсикологический или токсикологический центр.
При припадках следует лечить бензодиазепинами, а не противоэпилептическими средствами. Профилактический прием диазепама снижает невропатологические повреждения после отравления фосфорорганическими соединениями [5].
Дифференциальная диагностика
Многие заболевания и токсические эффекты, которые могут имитировать холинергическую токсичность. К ним относятся токсичность карбамата, никотиновая токсичность, передозировка карбахол-метахолина, бетанехола или пилокарпина, токсичность пиридостигмина, токсичность неостигмина, отравление грибами, миастения гравис, синдром Итона-Ламберта, синдром Гийена-Барре, ботулизм, передозировка опиоидов, тяжелая токсичность, алкогольная астма. обострение и тяжелый гастроэнтерит.
Прогноз
Медикаментозное лечение холинергической токсичности может быть затруднено, и, таким образом, уровень летальности обычно превышает 15%. [6]
Осложнения
Поскольку холинергическая токсичность затрагивает парасимпатическую нервную систему, могут возникнуть многие серьезные осложнения. Из-за сильного бронхоспазма и бронхореи дыхательная система может дать сбой и потребовать вспомогательной вентиляции. Дыхательная недостаточность также может возникать из-за сильной мышечной слабости, которая может влиять на мышцы диафрагмы.Сердечно-сосудистая система может разрушиться из-за глубокой брадикардии, гипотонии, гипертонии или аритмий, которые могут ускоряться у пациента с известным заболеванием коронарной артерии, известной хронической сердечной недостаточностью или другими сердечно-сосудистыми заболеваниями. Эти воздействия на сердечно-сосудистую и дыхательную системы могут привести к остановке сердечно-сосудистой системы и смерти. Электролитные нарушения могут также возникать в результате чрезмерной рвоты и диареи, связанных с холинергической токсичностью, что подвергает пациента риску аритмий и смерти.
Консультации
Консультации в местном токсикологическом центре или токсикологе уместны при подтвержденной или предполагаемой холинергической токсичности.
Сдерживание и обучение пациентов
Пациенты, которые могут контактировать с инсектицидами или пестицидами, нуждаются в обучении правильному обращению с такими веществами и уходу за ними. Правильные процедуры обращения могут снизить воздействие этого химического вещества на рабочем месте и, следовательно, уменьшить количество инцидентов во всем мире.[7]
Жемчуг и другие проблемы
Холинергическая токсичность может проявляться при использовании пестицидов или лекарств, но наиболее серьезные воздействия связаны с воздействием фосфорорганических или карбаматных пестицидов.
От этого отравления погибло около 200000 человек во всем мире, особенно в Азиатско-Тихоокеанском регионе.
Диагноз ставится на основании выявления холинергического токсидрома при подозрении на заболевание в анамнезе.
Токсичность может быть немедленной или отсроченной.
Лечение — это агрессивная поддерживающая терапия плюс таргетная терапия холинергической токсичности: атропин с последующим приемом доступного оксима, такого как пралидоксим.
Необходимо использовать дезинфицирующие средства и средства индивидуальной защиты, чтобы предотвратить дальнейшее поглощение агента пациентом и причинение вреда лицам, осуществляющим уход.
Рекомендуется консультация токсиколога или токсикологического центра.
Улучшение результатов команды здравоохранения
Самым сложным аспектом в лечении холинергической токсичности является первоначальное распознавание процесса болезни, которое позволит быстро начать лечение и, следовательно, улучшить результаты. Медсестры и врачи должны информировать пациентов о воздействии пестицидов и о том, как распознать симптомы.Строгие правила дезактивации могут помочь уменьшить непреднамеренное воздействие на медсестер и медицинских работников отделения неотложной помощи. Сокращение использования пестицидов во всем мире может помочь снизить случаи случайной токсичности из-за профессионального воздействия. Фармацевты должны просмотреть записи о лекарствах пациента, чтобы убедиться, что нет лекарств, которые могут вызвать холинергическую токсичность или усугубить существующую токсичность. Лечение холинергической токсичности требует межпрофессионального командного подхода, который включает врачей, медсестер, фармацевтов, экспертов по токсикологии и токсикологов для обеспечения оптимального ухода за пациентами и результатов.
Повышение квалификации / обзорные вопросы
Ссылки
- 1.
- Отравление фосфорорганическими инсектицидами. EJIFCC. 1999 июл; 11 (2): 30-35. [Бесплатная статья PMC: PMC6357250] [PubMed: 30720257]
- 2.
- Джейаратнам Дж. Острое отравление пестицидами: серьезная глобальная проблема здравоохранения. World Health Stat Q.1990; 43 (3): 139-44. [PubMed: 2238694]
- 3.
- Литовиц Т.Л., Смилкштейн М., Фельберг Л., Кляйн-Шварц В., Берлин Р., Морган Дж. Л.. Годовой отчет Американской ассоциации центров контроля за токсичными веществами за 1996 год.Am J Emerg Med. 1997 сентябрь; 15 (5): 447-500. [PubMed: 9270389]
- 4.
- Эйер П. Роль оксимов в лечении отравлений фосфорорганическими пестицидами. Toxicol Rev.2003; 22 (3): 165-90. [PubMed: 15181665]
- 5.
- Туовинен К. Судороги, вызванные фосфорорганическими соединениями, и профилактика невропатологических повреждений. Токсикология. 2004 г. 01; 196 (1-2): 31-9. [PubMed: 15036754]
- 6.
- Эддлстон М., Бакли Н.А., Эйер П., Доусон А.Х. Лечение острого отравления фосфорорганическими пестицидами.Ланцет. 2008 16 февраля; 371 (9612): 597-607. [Бесплатная статья PMC: PMC2493390] [PubMed: 17706760]
- 7.
- Лутовак М., Попова О.В., Йованович З., Бериса Х., Кристина Р., Кетин С., Бойич М. Управление, диагностическая и прогностическая значимость ацетилхолинэстеразы токсического воздействия пестицидов на людей, подвергающихся профессиональному воздействию. Открытый доступ Maced J Med Sci. 2017 15 декабря; 5 (7): 1021-1027. [Бесплатная статья PMC: PMC5771273] [PubMed: 29362639]
Холинергическая токсичность — StatPearls — NCBI Bookshelf
Continuing Education Activity
Холинергическая токсичность вызывается веществами, которые стимулируют, усиливают или имитируют нейротрансмиттер — нейротрансмиттер ацетилхолин. парасимпатическая нервная система.Ацетилхолин стимулирует мускариновые и никотиновые рецепторы, вызывая сокращение мышц и секрецию желез. Холинергическая токсичность возникает, когда в рецепторном синапсе присутствует слишком много ацетилхолина, что приводит к чрезмерным парасимпатическим эффектам. В этом упражнении рассматривается представление, оценка и лечение холинергической токсичности и подчеркивается роль межпрофессионального командного подхода к уходу за пораженными пациентами.
Цели:
Опишите анамнез и результаты физикального обследования, которые обычно наблюдаются у пациентов с холинергической токсичностью.
Обобщите соответствующее лечение холинергической токсичности.
Обзор патофизиологии холинергической токсичности.
Объясните способы улучшения координации помощи между членами межпрофессиональной группы с целью улучшения результатов для пациентов, страдающих холинергической токсичностью.
Заработайте кредиты на непрерывное образование (CME / CE) по этой теме.
Введение
Холинергическая токсичность вызывается лекарствами, лекарствами и веществами, которые стимулируют, усиливают или имитируют нейромедиатор ацетилхолин.Ацетилхолин является основным нейромедиатором парасимпатической нервной системы. Ацетилхолин стимулирует мускариновые и никотиновые рецепторы, вызывая сокращение мышц и секрецию желез. Холинергическая токсичность возникает, когда в рецепторном синапсе присутствует слишком много ацетилхолина, что приводит к чрезмерным парасимпатическим эффектам.
Этиология
Холинергическая токсичность может быть результатом инсектицидов, нервно-паралитических агентов, лекарств и грибов. Наиболее частой причиной холинергической токсичности во всем мире является воздействие фосфорорганических и карбаматных инсектицидов.Воздействие этих инсектицидов может происходить при вдыхании паров, проглатывании или прямом контакте химического вещества с кожей или слизистой оболочкой.
Зарин — газ нервно-паралитического действия, обычно используемый в химической войне. Газ зарин был первоначально произведен в Германии в 1938 году как пестицид. Хорошо известно, что он участвовал в террористических актах в Японии в 1994 и 1995 годах.
Холинергические препараты могут вызывать холинергический кризис во время клинического применения или после передозировки. Эти препараты включают препараты, используемые для лечения миастении, такие как эдрофониум и неостигмин, пилокарпин, применяемый при глаукоме, ипратропий, и препараты для лечения болезни Альцгеймера, такие как ривастигмин и донепезил.По сути, любой агент, который создает изобилие ацетилхолина в синапсе, может вызывать холинергическую токсичность. Эти препараты могут вызывать слабость, но холинергический криз очень редко возникает при приеме лекарств в терапевтических дозах.
Эпидемиология
Органофосфаты используются во всем мире в качестве инсектицидов более 50 лет, хотя за последние 10–20 лет их использование снизилось. Ежегодно во всем мире происходит около 3000000 контактов с органофосфатами или карбаматами, в результате которых погибает около 200000 человек.[1] Один миллион из этих воздействий оказался непреднамеренным, в то время как другие 2 миллиона воздействий были вторичными по отношению к попыткам суицида. [2] Американская ассоциация токсикологических центров сообщила о 86914 контактах людей с пестицидами только в США в 1996 году [3]. Отравления в результате профессионального облучения составляли лишь пятую часть случайных контактов, а уровень смертности составлял менее 1%. Более 90% инцидентов, не связанных с профессиональной деятельностью, были умышленными, со смертельным исходом более 10%.Остальные 10% приходилось на случайное воздействие, а на убийство — менее 1%.
Зарин — широко известное боевое химическое вещество, которое по-прежнему представляет угрозу во всем мире. Нервно-паралитические агенты использовались террористическими группами и диктаторами в метро для подавления сообществ внутри страны.
Патофизиология
Основным механизмом холинергической токсичности является чрезмерная стимуляция холинергических рецепторов, которая может быть вызвана веществами, имитирующими, стимулирующими или усиливающими ацетилхолин.Симптомокомплекс, производимый агентом, зависит от того, какой тип рецептора или комбинация рецепторов активируется. Холинергические рецепторы бывают трех типов: центральные, мускариновые и никотиновые. Избыток ацетилхолина на мускариновых рецепторах приведет к усилению секреции симптомов, бронхоспазму, брадикардии, рвоте и спазмам в животе. Избыток ацетилхолина на никотиновых рецепторах вызывает мышечные фасцикуляции или паралич из-за активации нервно-мышечного соединения. Избыток ацетилхолина в центральной нервной системе может вызвать спутанность сознания, головную боль или сонливость.[1]
История и физика
Результаты физикального осмотра зависят от того, в каких рецепторах происходит накопление ацетилхолина. Накопление ацетилхолина в мускариновых рецепторах вызывает увеличение секреции, что может проявляться в виде бронхореи, слюноотделения, слезотечения и потоотделения, бронхоспазма, стеснения в груди, хрипов, брадикардии, рвоты, повышенной перистальтики желудочно-кишечного тракта, стеснения в животе, диареи и спазмов. Активация мускариновых рецепторов в глазах избытком ацетилхолина вызывает миоз и нечеткое зрение.Повышенный уровень ацетилхолина в никотиновых участках нервно-мышечного соединения вызывает фасцикуляции мышц и вялый паралич из-за избытка ацетилхолина в нервно-мышечном соединении. Избыток ацетилхолина в головном мозге пациентов может вызвать головную боль, бессонницу, головокружение, спутанность сознания и сонливость. Более серьезное воздействие может вызвать центральную депрессию, приводящую к невнятной речи, судорогам, коме и угнетению дыхания. Смерть может наступить из-за воздействия на сердце, дыхание и мозг.
Две полезные мнемоники для запоминания мускариновых эффектов избытка ацетилхолина: SLUDGE или DUMBELS
S — Слюноотделение
L — Слезотечение
U — Частое мочеиспускание
D — Диафорез / понос
Боль в желудочно-кишечном тракте
E — Рвота
D — Диарея / потоотделение
U — Частота мочеиспускания
M — Миоз
B — Бронхоспазм / бронхорея
E — Рвота
L — Лакримация
Слюноотделение
Слюноотделение Диагностика холинергической токсичности зависит от способности распознать клиническую картину и связать ее с анамнезом, что сделало бы возможным этот токсидром.Для постановки этого диагноза критически важны подробный анамнез и физикальное обследование. Если токсидром присутствует, важно попытаться идентифицировать агент, поскольку эффекты и продолжительность токсичности зависят от агента.
Не существует специальных лабораторных или рентгенологических исследований, которые позволили бы поставить окончательный диагноз. Уровни ацетилхолинэстеразы в эритроцитах можно измерить, но большинство больничных лабораторий не предлагают этот тест.
Лечение / ведение
Оценка и ведение каждого пациента должны начинаться с ABC (дыхательные пути, дыхание, кровообращение, инвалидность и воздействие).Обычная поддержка дыхательных путей и кровообращения необходима за двумя исключениями. Во время интубации нельзя использовать сукцинилхолин, потому что недостаток ацетилхолинэстеразы, вызванный отравлением, вызовет длительный паралич. Необходима агрессивная дезактивация. Всю одежду следует снять и выбросить. Кожу и глаза следует промыть во избежание дальнейшего всасывания средства. Медицинские работники должны носить защитное снаряжение для предотвращения воздействия агента на кожу и при вдыхании.
При подозрении на лечение лечение должно состоять из внутривенного введения атропина и пралидоксима.Сначала назначают атропин, поскольку пралидоксим может временно ухудшить симптомы. Атропин физиологически действует как прямой антидот, противодействуя действиям мускариновых рецепторов избыточного ацетилхолина, таким как бронхорея, брадикардия, слюноотделение и бронхоспазм. Атропин может преодолевать гематоэнцефалический барьер и может помочь снизить активность избыточного ацетилхолина центрального действия. Начальная доза атропина внутривенно составляет от 2 до 5 мг для взрослых и 0,05 мкг / кг для детей каждые 5 минут до улучшения легочных симптомов.Атропин необходимо титровать, чтобы облегчить бронхорею и бронхоспазм; для этого могут потребоваться большие дозы атропина, и лечение может продолжаться в течение нескольких дней. Больничная аптека должна получить предварительное уведомление о том, что может потребоваться дополнительный запас атропина.
Поскольку атропин не связывается с никотиновыми рецепторами, он не лечит нервно-мышечную дисфункцию. Оксимы, такие как пралидоксим, обладают тремя действиями, которые показывают преимущество при острой холинергической токсичности. Пралидоксим реактивирует ацетилхолинэстеразу, оказывает эндогенное антихолинергическое действие и выводит токсины на несвязанные органофосфаты.Оксимы используются для воздействия на никотиновый нервно-мышечный переход, поэтому их следует назначать при наличии признаков мышечной слабости, особенно если слабость проявляется в дыхательной системе [4]. Большинству пациентов с отравлением фосфорорганическими соединениями требуется лечение оксимом; это связано с вариабельностью ответов на оксимы и возможностью отсроченной токсичности. Утвержденная FDA дозировка пралидоксима при токсичности фосфорорганических соединений составляет от 1 до 2 г инфузии в течение 30 минут, которую можно повторить через час, если мышечная слабость сохраняется.После болюсной дозы также может потребоваться непрерывная инфузия. Если возможно, обратитесь за консультацией в токсикологический или токсикологический центр.
При припадках следует лечить бензодиазепинами, а не противоэпилептическими средствами. Профилактический прием диазепама снижает невропатологические повреждения после отравления фосфорорганическими соединениями [5].
Дифференциальная диагностика
Многие заболевания и токсические эффекты, которые могут имитировать холинергическую токсичность. К ним относятся токсичность карбамата, никотиновая токсичность, передозировка карбахол-метахолина, бетанехола или пилокарпина, токсичность пиридостигмина, токсичность неостигмина, отравление грибами, миастения гравис, синдром Итона-Ламберта, синдром Гийена-Барре, ботулизм, передозировка опиоидов, тяжелая токсичность, алкогольная астма. обострение и тяжелый гастроэнтерит.
Прогноз
Медикаментозное лечение холинергической токсичности может быть затруднено, и, таким образом, уровень летальности обычно превышает 15%. [6]
Осложнения
Поскольку холинергическая токсичность затрагивает парасимпатическую нервную систему, могут возникнуть многие серьезные осложнения. Из-за сильного бронхоспазма и бронхореи дыхательная система может дать сбой и потребовать вспомогательной вентиляции. Дыхательная недостаточность также может возникать из-за сильной мышечной слабости, которая может влиять на мышцы диафрагмы.Сердечно-сосудистая система может разрушиться из-за глубокой брадикардии, гипотонии, гипертонии или аритмий, которые могут ускоряться у пациента с известным заболеванием коронарной артерии, известной хронической сердечной недостаточностью или другими сердечно-сосудистыми заболеваниями. Эти воздействия на сердечно-сосудистую и дыхательную системы могут привести к остановке сердечно-сосудистой системы и смерти. Электролитные нарушения могут также возникать в результате чрезмерной рвоты и диареи, связанных с холинергической токсичностью, что подвергает пациента риску аритмий и смерти.
Консультации
Консультации в местном токсикологическом центре или токсикологе уместны при подтвержденной или предполагаемой холинергической токсичности.
Сдерживание и обучение пациентов
Пациенты, которые могут контактировать с инсектицидами или пестицидами, нуждаются в обучении правильному обращению с такими веществами и уходу за ними. Правильные процедуры обращения могут снизить воздействие этого химического вещества на рабочем месте и, следовательно, уменьшить количество инцидентов во всем мире.[7]
Жемчуг и другие проблемы
Холинергическая токсичность может проявляться при использовании пестицидов или лекарств, но наиболее серьезные воздействия связаны с воздействием фосфорорганических или карбаматных пестицидов.
От этого отравления погибло около 200000 человек во всем мире, особенно в Азиатско-Тихоокеанском регионе.
Диагноз ставится на основании выявления холинергического токсидрома при подозрении на заболевание в анамнезе.
Токсичность может быть немедленной или отсроченной.
Лечение — это агрессивная поддерживающая терапия плюс таргетная терапия холинергической токсичности: атропин с последующим приемом доступного оксима, такого как пралидоксим.
Необходимо использовать дезинфицирующие средства и средства индивидуальной защиты, чтобы предотвратить дальнейшее поглощение агента пациентом и причинение вреда лицам, осуществляющим уход.
Рекомендуется консультация токсиколога или токсикологического центра.
Улучшение результатов команды здравоохранения
Самым сложным аспектом в лечении холинергической токсичности является первоначальное распознавание процесса болезни, которое позволит быстро начать лечение и, следовательно, улучшить результаты. Медсестры и врачи должны информировать пациентов о воздействии пестицидов и о том, как распознать симптомы.Строгие правила дезактивации могут помочь уменьшить непреднамеренное воздействие на медсестер и медицинских работников отделения неотложной помощи. Сокращение использования пестицидов во всем мире может помочь снизить случаи случайной токсичности из-за профессионального воздействия. Фармацевты должны просмотреть записи о лекарствах пациента, чтобы убедиться, что нет лекарств, которые могут вызвать холинергическую токсичность или усугубить существующую токсичность. Лечение холинергической токсичности требует межпрофессионального командного подхода, который включает врачей, медсестер, фармацевтов, экспертов по токсикологии и токсикологов для обеспечения оптимального ухода за пациентами и результатов.
Повышение квалификации / обзорные вопросы
Ссылки
- 1.
- Отравление фосфорорганическими инсектицидами. EJIFCC. 1999 июл; 11 (2): 30-35. [Бесплатная статья PMC: PMC6357250] [PubMed: 30720257]
- 2.
- Джейаратнам Дж. Острое отравление пестицидами: серьезная глобальная проблема здравоохранения. World Health Stat Q.1990; 43 (3): 139-44. [PubMed: 2238694]
- 3.
- Литовиц Т.Л., Смилкштейн М., Фельберг Л., Кляйн-Шварц В., Берлин Р., Морган Дж. Л.. Годовой отчет Американской ассоциации центров контроля за токсичными веществами за 1996 год.Am J Emerg Med. 1997 сентябрь; 15 (5): 447-500. [PubMed: 9270389]
- 4.
- Эйер П. Роль оксимов в лечении отравлений фосфорорганическими пестицидами. Toxicol Rev.2003; 22 (3): 165-90. [PubMed: 15181665]
- 5.
- Туовинен К. Судороги, вызванные фосфорорганическими соединениями, и профилактика невропатологических повреждений. Токсикология. 2004 г. 01; 196 (1-2): 31-9. [PubMed: 15036754]
- 6.
- Эддлстон М., Бакли Н.А., Эйер П., Доусон А.Х. Лечение острого отравления фосфорорганическими пестицидами.Ланцет. 2008 16 февраля; 371 (9612): 597-607. [Бесплатная статья PMC: PMC2493390] [PubMed: 17706760]
- 7.
- Лутовак М., Попова О.В., Йованович З., Бериса Х., Кристина Р., Кетин С., Бойич М. Управление, диагностическая и прогностическая значимость ацетилхолинэстеразы токсического воздействия пестицидов на людей, подвергающихся профессиональному воздействию. Открытый доступ Maced J Med Sci. 2017 15 декабря; 5 (7): 1021-1027. [Бесплатная статья PMC: PMC5771273] [PubMed: 29362639]
Холинергическая токсичность — StatPearls — NCBI Bookshelf
Continuing Education Activity
Холинергическая токсичность вызывается веществами, которые стимулируют, усиливают или имитируют нейротрансмиттер — нейротрансмиттер ацетилхолин. парасимпатическая нервная система.Ацетилхолин стимулирует мускариновые и никотиновые рецепторы, вызывая сокращение мышц и секрецию желез. Холинергическая токсичность возникает, когда в рецепторном синапсе присутствует слишком много ацетилхолина, что приводит к чрезмерным парасимпатическим эффектам. В этом упражнении рассматривается представление, оценка и лечение холинергической токсичности и подчеркивается роль межпрофессионального командного подхода к уходу за пораженными пациентами.
Цели:
Опишите анамнез и результаты физикального обследования, которые обычно наблюдаются у пациентов с холинергической токсичностью.
Обобщите соответствующее лечение холинергической токсичности.
Обзор патофизиологии холинергической токсичности.
Объясните способы улучшения координации помощи между членами межпрофессиональной группы с целью улучшения результатов для пациентов, страдающих холинергической токсичностью.
Заработайте кредиты на непрерывное образование (CME / CE) по этой теме.
Введение
Холинергическая токсичность вызывается лекарствами, лекарствами и веществами, которые стимулируют, усиливают или имитируют нейромедиатор ацетилхолин.Ацетилхолин является основным нейромедиатором парасимпатической нервной системы. Ацетилхолин стимулирует мускариновые и никотиновые рецепторы, вызывая сокращение мышц и секрецию желез. Холинергическая токсичность возникает, когда в рецепторном синапсе присутствует слишком много ацетилхолина, что приводит к чрезмерным парасимпатическим эффектам.
Этиология
Холинергическая токсичность может быть результатом инсектицидов, нервно-паралитических агентов, лекарств и грибов. Наиболее частой причиной холинергической токсичности во всем мире является воздействие фосфорорганических и карбаматных инсектицидов.Воздействие этих инсектицидов может происходить при вдыхании паров, проглатывании или прямом контакте химического вещества с кожей или слизистой оболочкой.
Зарин — газ нервно-паралитического действия, обычно используемый в химической войне. Газ зарин был первоначально произведен в Германии в 1938 году как пестицид. Хорошо известно, что он участвовал в террористических актах в Японии в 1994 и 1995 годах.
Холинергические препараты могут вызывать холинергический кризис во время клинического применения или после передозировки. Эти препараты включают препараты, используемые для лечения миастении, такие как эдрофониум и неостигмин, пилокарпин, применяемый при глаукоме, ипратропий, и препараты для лечения болезни Альцгеймера, такие как ривастигмин и донепезил.По сути, любой агент, который создает изобилие ацетилхолина в синапсе, может вызывать холинергическую токсичность. Эти препараты могут вызывать слабость, но холинергический криз очень редко возникает при приеме лекарств в терапевтических дозах.
Эпидемиология
Органофосфаты используются во всем мире в качестве инсектицидов более 50 лет, хотя за последние 10–20 лет их использование снизилось. Ежегодно во всем мире происходит около 3000000 контактов с органофосфатами или карбаматами, в результате которых погибает около 200000 человек.[1] Один миллион из этих воздействий оказался непреднамеренным, в то время как другие 2 миллиона воздействий были вторичными по отношению к попыткам суицида. [2] Американская ассоциация токсикологических центров сообщила о 86914 контактах людей с пестицидами только в США в 1996 году [3]. Отравления в результате профессионального облучения составляли лишь пятую часть случайных контактов, а уровень смертности составлял менее 1%. Более 90% инцидентов, не связанных с профессиональной деятельностью, были умышленными, со смертельным исходом более 10%.Остальные 10% приходилось на случайное воздействие, а на убийство — менее 1%.
Зарин — широко известное боевое химическое вещество, которое по-прежнему представляет угрозу во всем мире. Нервно-паралитические агенты использовались террористическими группами и диктаторами в метро для подавления сообществ внутри страны.
Патофизиология
Основным механизмом холинергической токсичности является чрезмерная стимуляция холинергических рецепторов, которая может быть вызвана веществами, имитирующими, стимулирующими или усиливающими ацетилхолин.Симптомокомплекс, производимый агентом, зависит от того, какой тип рецептора или комбинация рецепторов активируется. Холинергические рецепторы бывают трех типов: центральные, мускариновые и никотиновые. Избыток ацетилхолина на мускариновых рецепторах приведет к усилению секреции симптомов, бронхоспазму, брадикардии, рвоте и спазмам в животе. Избыток ацетилхолина на никотиновых рецепторах вызывает мышечные фасцикуляции или паралич из-за активации нервно-мышечного соединения. Избыток ацетилхолина в центральной нервной системе может вызвать спутанность сознания, головную боль или сонливость.[1]
История и физика
Результаты физикального осмотра зависят от того, в каких рецепторах происходит накопление ацетилхолина. Накопление ацетилхолина в мускариновых рецепторах вызывает увеличение секреции, что может проявляться в виде бронхореи, слюноотделения, слезотечения и потоотделения, бронхоспазма, стеснения в груди, хрипов, брадикардии, рвоты, повышенной перистальтики желудочно-кишечного тракта, стеснения в животе, диареи и спазмов. Активация мускариновых рецепторов в глазах избытком ацетилхолина вызывает миоз и нечеткое зрение.Повышенный уровень ацетилхолина в никотиновых участках нервно-мышечного соединения вызывает фасцикуляции мышц и вялый паралич из-за избытка ацетилхолина в нервно-мышечном соединении. Избыток ацетилхолина в головном мозге пациентов может вызвать головную боль, бессонницу, головокружение, спутанность сознания и сонливость. Более серьезное воздействие может вызвать центральную депрессию, приводящую к невнятной речи, судорогам, коме и угнетению дыхания. Смерть может наступить из-за воздействия на сердце, дыхание и мозг.
Две полезные мнемоники для запоминания мускариновых эффектов избытка ацетилхолина: SLUDGE или DUMBELS
S — Слюноотделение
L — Слезотечение
U — Частое мочеиспускание
D — Диафорез / понос
Боль в желудочно-кишечном тракте
E — Рвота
D — Диарея / потоотделение
U — Частота мочеиспускания
M — Миоз
B — Бронхоспазм / бронхорея
E — Рвота
L — Лакримация
Слюноотделение
Слюноотделение Диагностика холинергической токсичности зависит от способности распознать клиническую картину и связать ее с анамнезом, что сделало бы возможным этот токсидром.Для постановки этого диагноза критически важны подробный анамнез и физикальное обследование. Если токсидром присутствует, важно попытаться идентифицировать агент, поскольку эффекты и продолжительность токсичности зависят от агента.
Не существует специальных лабораторных или рентгенологических исследований, которые позволили бы поставить окончательный диагноз. Уровни ацетилхолинэстеразы в эритроцитах можно измерить, но большинство больничных лабораторий не предлагают этот тест.
Лечение / ведение
Оценка и ведение каждого пациента должны начинаться с ABC (дыхательные пути, дыхание, кровообращение, инвалидность и воздействие).Обычная поддержка дыхательных путей и кровообращения необходима за двумя исключениями. Во время интубации нельзя использовать сукцинилхолин, потому что недостаток ацетилхолинэстеразы, вызванный отравлением, вызовет длительный паралич. Необходима агрессивная дезактивация. Всю одежду следует снять и выбросить. Кожу и глаза следует промыть во избежание дальнейшего всасывания средства. Медицинские работники должны носить защитное снаряжение для предотвращения воздействия агента на кожу и при вдыхании.
При подозрении на лечение лечение должно состоять из внутривенного введения атропина и пралидоксима.Сначала назначают атропин, поскольку пралидоксим может временно ухудшить симптомы. Атропин физиологически действует как прямой антидот, противодействуя действиям мускариновых рецепторов избыточного ацетилхолина, таким как бронхорея, брадикардия, слюноотделение и бронхоспазм. Атропин может преодолевать гематоэнцефалический барьер и может помочь снизить активность избыточного ацетилхолина центрального действия. Начальная доза атропина внутривенно составляет от 2 до 5 мг для взрослых и 0,05 мкг / кг для детей каждые 5 минут до улучшения легочных симптомов.Атропин необходимо титровать, чтобы облегчить бронхорею и бронхоспазм; для этого могут потребоваться большие дозы атропина, и лечение может продолжаться в течение нескольких дней. Больничная аптека должна получить предварительное уведомление о том, что может потребоваться дополнительный запас атропина.
Поскольку атропин не связывается с никотиновыми рецепторами, он не лечит нервно-мышечную дисфункцию. Оксимы, такие как пралидоксим, обладают тремя действиями, которые показывают преимущество при острой холинергической токсичности. Пралидоксим реактивирует ацетилхолинэстеразу, оказывает эндогенное антихолинергическое действие и выводит токсины на несвязанные органофосфаты.Оксимы используются для воздействия на никотиновый нервно-мышечный переход, поэтому их следует назначать при наличии признаков мышечной слабости, особенно если слабость проявляется в дыхательной системе [4]. Большинству пациентов с отравлением фосфорорганическими соединениями требуется лечение оксимом; это связано с вариабельностью ответов на оксимы и возможностью отсроченной токсичности. Утвержденная FDA дозировка пралидоксима при токсичности фосфорорганических соединений составляет от 1 до 2 г инфузии в течение 30 минут, которую можно повторить через час, если мышечная слабость сохраняется.После болюсной дозы также может потребоваться непрерывная инфузия. Если возможно, обратитесь за консультацией в токсикологический или токсикологический центр.
При припадках следует лечить бензодиазепинами, а не противоэпилептическими средствами. Профилактический прием диазепама снижает невропатологические повреждения после отравления фосфорорганическими соединениями [5].
Дифференциальная диагностика
Многие заболевания и токсические эффекты, которые могут имитировать холинергическую токсичность. К ним относятся токсичность карбамата, никотиновая токсичность, передозировка карбахол-метахолина, бетанехола или пилокарпина, токсичность пиридостигмина, токсичность неостигмина, отравление грибами, миастения гравис, синдром Итона-Ламберта, синдром Гийена-Барре, ботулизм, передозировка опиоидов, тяжелая токсичность, алкогольная астма. обострение и тяжелый гастроэнтерит.
Прогноз
Медикаментозное лечение холинергической токсичности может быть затруднено, и, таким образом, уровень летальности обычно превышает 15%. [6]
Осложнения
Поскольку холинергическая токсичность затрагивает парасимпатическую нервную систему, могут возникнуть многие серьезные осложнения. Из-за сильного бронхоспазма и бронхореи дыхательная система может дать сбой и потребовать вспомогательной вентиляции. Дыхательная недостаточность также может возникать из-за сильной мышечной слабости, которая может влиять на мышцы диафрагмы.Сердечно-сосудистая система может разрушиться из-за глубокой брадикардии, гипотонии, гипертонии или аритмий, которые могут ускоряться у пациента с известным заболеванием коронарной артерии, известной хронической сердечной недостаточностью или другими сердечно-сосудистыми заболеваниями. Эти воздействия на сердечно-сосудистую и дыхательную системы могут привести к остановке сердечно-сосудистой системы и смерти. Электролитные нарушения могут также возникать в результате чрезмерной рвоты и диареи, связанных с холинергической токсичностью, что подвергает пациента риску аритмий и смерти.
Консультации
Консультации в местном токсикологическом центре или токсикологе уместны при подтвержденной или предполагаемой холинергической токсичности.
Сдерживание и обучение пациентов
Пациенты, которые могут контактировать с инсектицидами или пестицидами, нуждаются в обучении правильному обращению с такими веществами и уходу за ними. Правильные процедуры обращения могут снизить воздействие этого химического вещества на рабочем месте и, следовательно, уменьшить количество инцидентов во всем мире.[7]
Жемчуг и другие проблемы
Холинергическая токсичность может проявляться при использовании пестицидов или лекарств, но наиболее серьезные воздействия связаны с воздействием фосфорорганических или карбаматных пестицидов.
От этого отравления погибло около 200000 человек во всем мире, особенно в Азиатско-Тихоокеанском регионе.
Диагноз ставится на основании выявления холинергического токсидрома при подозрении на заболевание в анамнезе.
Токсичность может быть немедленной или отсроченной.
Лечение — это агрессивная поддерживающая терапия плюс таргетная терапия холинергической токсичности: атропин с последующим приемом доступного оксима, такого как пралидоксим.
Необходимо использовать дезинфицирующие средства и средства индивидуальной защиты, чтобы предотвратить дальнейшее поглощение агента пациентом и причинение вреда лицам, осуществляющим уход.
Рекомендуется консультация токсиколога или токсикологического центра.
Улучшение результатов команды здравоохранения
Самым сложным аспектом в лечении холинергической токсичности является первоначальное распознавание процесса болезни, которое позволит быстро начать лечение и, следовательно, улучшить результаты. Медсестры и врачи должны информировать пациентов о воздействии пестицидов и о том, как распознать симптомы.Строгие правила дезактивации могут помочь уменьшить непреднамеренное воздействие на медсестер и медицинских работников отделения неотложной помощи. Сокращение использования пестицидов во всем мире может помочь снизить случаи случайной токсичности из-за профессионального воздействия. Фармацевты должны просмотреть записи о лекарствах пациента, чтобы убедиться, что нет лекарств, которые могут вызвать холинергическую токсичность или усугубить существующую токсичность. Лечение холинергической токсичности требует межпрофессионального командного подхода, который включает врачей, медсестер, фармацевтов, экспертов по токсикологии и токсикологов для обеспечения оптимального ухода за пациентами и результатов.
Повышение квалификации / обзорные вопросы
Ссылки
- 1.
- Отравление фосфорорганическими инсектицидами. EJIFCC. 1999 июл; 11 (2): 30-35. [Бесплатная статья PMC: PMC6357250] [PubMed: 30720257]
- 2.
- Джейаратнам Дж. Острое отравление пестицидами: серьезная глобальная проблема здравоохранения. World Health Stat Q.1990; 43 (3): 139-44. [PubMed: 2238694]
- 3.
- Литовиц Т.Л., Смилкштейн М., Фельберг Л., Кляйн-Шварц В., Берлин Р., Морган Дж. Л.. Годовой отчет Американской ассоциации центров контроля за токсичными веществами за 1996 год.Am J Emerg Med. 1997 сентябрь; 15 (5): 447-500. [PubMed: 9270389]
- 4.
- Эйер П. Роль оксимов в лечении отравлений фосфорорганическими пестицидами. Toxicol Rev.2003; 22 (3): 165-90. [PubMed: 15181665]
- 5.
- Туовинен К. Судороги, вызванные фосфорорганическими соединениями, и профилактика невропатологических повреждений. Токсикология. 2004 г. 01; 196 (1-2): 31-9. [PubMed: 15036754]
- 6.
- Эддлстон М., Бакли Н.А., Эйер П., Доусон А.Х. Лечение острого отравления фосфорорганическими пестицидами.Ланцет. 2008 16 февраля; 371 (9612): 597-607. [Бесплатная статья PMC: PMC2493390] [PubMed: 17706760]
- 7.
- Лутовак М., Попова О.В., Йованович З., Бериса Х., Кристина Р., Кетин С., Бойич М. Управление, диагностическая и прогностическая значимость ацетилхолинэстеразы токсического воздействия пестицидов на людей, подвергающихся профессиональному воздействию. Открытый доступ Maced J Med Sci. 2017 15 декабря; 5 (7): 1021-1027. [Бесплатная статья PMC: PMC5771273] [PubMed: 29362639]
| Концепции | Травма или отравление ( T037 ) |
| ICD9 | 971.0 |
| SnomedCT | 212680000, 61356009 |
| Английский | ХОЛИНЕРГИЧЕСКИЙ СИНДРОМ, ПАРАСИМПАТОМИМЕТИЧЕСКИЙ СИНДРОМ, холинергическое отравление БДУ, парасимпатомиметическая токсичность (диагноз), парасимпатомиметическая токсичность, холинергический синдром, парасимпатомиметический синдром, синдром парасимпатомиметических, парасимпатомиметический синдром, парасимпатомиметические отравления (парасимпатические химические расстройства) отравление, Холинергический синдром, Отравление холинергическим препаратом, Отравление парасимпатомиметическим препаратом (расстройство), Отравление парасимпатомиметическим препаратом, Отравление холинергическим препаратом, БДУ, Отравление парасимпатомиметическим препаратом, БДУ, Отравление холинергическими препаратами, Отравление парасимпатиками |
| Итальянский | Sindrome colinergica, Sindrome parasimpaticomimetica, Avvelenamento da parasimpaticomimetici (colinergici) |
| Голландский | парасимпатикомиметический синдром, синдром холинерга, синдром парасимпатомиметики, вергифтификация дверной парасимпатикомиметики (холинергика), холинергический синдром |
| Французский | Синдром parasympathomimétique, SYNDROME CHOLINERGIQUE, SYNDROME PARASYMPATHOMIMETIQUE, Intoxication par parasympathomimétiques (холинергический), холинергический синдром |
| Немецкий | Syndrom, Parasympathomimetikum, Parasympathomimetikum-Syndrom, Syndrom cholinerg, CHOLINERGES SYNDROM, PARASYMPATHIKOMIMETISCHE SYMPTOMA, Vergiftung durch Parasympathomimetika (Cholinergika), cholinerges Syndrom |
| Португальский | Síndrome parassimpaticomimética, Síndrome parassimpaticomémitica, SINDROME COLINERGICO, SINDROME PARASIMPATICOMIMETICO, Intoxicação por parassimpaticomiméticos (colinérgicos), Síndrome colinérgica |
| Испанский | SINDROME parasimpaticomimético, COLINERGICO, SINDROME, PARASIMPATICOMIMETICO, SINDROME, Intoxicación Por parasimpaticomiméticos (colinérgicos), intoxicación colinérgica, SAI (trastorno), intoxicación colinérgica, SAI, intoxicación Por Droga colinérgica (trastorno), intoxicación Por Droga colinérgica, intoxicación Por Droga parasimpaticomimética, SINDROME colinérgico, Síndrome colinérgico |
| Японский | コ リ ン 作 動 性 症候群, 副 交感 神 経 作 動 性 症候群, コ リ ン サ ド ウ セ イ シ ョ ウ コ ウ グ ン, フ ク コ ウ カ ン シ ン ケ イ サ ド ウ セ イ シ ョ ウ コ ウ グ ン, 副 交感 神 経 作用 薬 (コ リ ン 作用 薬) 中毒, フ ク コ ウ カ ン シ ン ケ イ サ ヨ ウ ヤ ク コ リ ン サ ヨ ウ ヤ ク チ ュ ウ ド ク |
| Чешский | Холинергний синдром, Парасимпатомиметический синдром, Парасимпатомиметический синдром, Отрава парасимпатомиметики (холинергики) |
| Венгерский | Синдром Parasympathomimeticus, синдром Parasympathomimetikus, синдром Cholinergiás, синдром Cholinerg, Paraszimpatomimetikumok (kolinerg szerek) által okozott mérgezés |
Холинергический кризис — обзор
Нервные агенты
Нервные агенты — это органофосфатные соединения, которые ингибируют холинэстеразу в синаптических и нервно-мышечных соединениях, вызывая избыток ацетилхолина, ведущий к холинергическому кризису.В качестве оружия были произведены пять нервно-паралитических агентов: табун, зарин, зоман, GF и VX.
Ацетилхолин связывается с рецепторами на постсинаптической клеточной мембране, концевых пластинах гладких мышц и секреторных железах, вызывая мускариновые эффекты ацетилхолина. Мускариновые эффекты включают бронхоспазм, низкую податливость легких, тошноту, рвоту, диарею, миоз, помутнение зрения, брадикардию и гиперсекрецию ротоглотки, конъюнктивы, трахеобронхиального дерева и желудочно-кишечного тракта.
Ацетилхолин также связывается с концевыми пластинами скелетных мышц и синаптическими ганглиями, вызывая никотиновые эффекты. Никотиновые эффекты ацетилхолина включают фасцикуляции, вялый паралич, тахикардию и гипертензию. Частота сердечных сокращений во время холинергического кризиса варьируется из-за противоположного действия никотинового и мускаринового эффектов. Пациенты могут испытывать начальную тахикардию, переходящую в брадикардию по мере увеличения тяжести холинергического криза.
По степени тяжести отравление нервно-паралитическим агентом классифицируется как легкое, среднее или тяжелое.Пациенты, находящиеся в коме, судорогах или апноэ, классифицируются как тяжело травмированные, и им требуется госпитализация в отделение интенсивной терапии с вентиляционной поддержкой. Пациенты, находящиеся в положении лежа на спине с хрипами, фасцикуляциями и недержанием мочи, классифицируются как травмы средней степени тяжести. Амбулаторный пациент с холинергическими симптомами классифицируется как имеющий легкую травму.
Есть два отдельных противоядия от холинергического криза. Атропин является очень эффективным противоядием от мускариновых эффектов, но не влияет на никотиновые эффекты.Атропин конкурентно связывается с постсинаптическим мускариновым рецептором, тем самым вытесняя ацетилхолин. Атропин следует назначать до тех пор, пока секреция не уменьшится и не улучшится комплаентность легких.
Противоядие от никотинового эффекта ацетилхолина — это класс препаратов, называемых оксимами.

 — P. 201-201.
— P. 201-201. — 2015. — Vol. 18. — № 11. — P. 1641-1647.
— 2015. — Vol. 18. — № 11. — P. 1641-1647. — 2008. — Т. 7. — № 2. — С. 1528-1532.
— 2008. — Т. 7. — № 2. — С. 1528-1532. — 2012. — Т. 6. — № 3. — С. 53-60.
— 2012. — Т. 6. — № 3. — С. 53-60. И.М. Сеченова. — 2013. — Т. 99. — № 7. — С. 793-804.
И.М. Сеченова. — 2013. — Т. 99. — № 7. — С. 793-804. Ю. Структурная нейровизуализация в дифференциальной диагностике сосудистых когнитивных нарушений // Вестник Российской военно-медицинской академии. — 2010. — № 3. — С. 97-102.
Ю. Структурная нейровизуализация в дифференциальной диагностике сосудистых когнитивных нарушений // Вестник Российской военно-медицинской академии. — 2010. — № 3. — С. 97-102.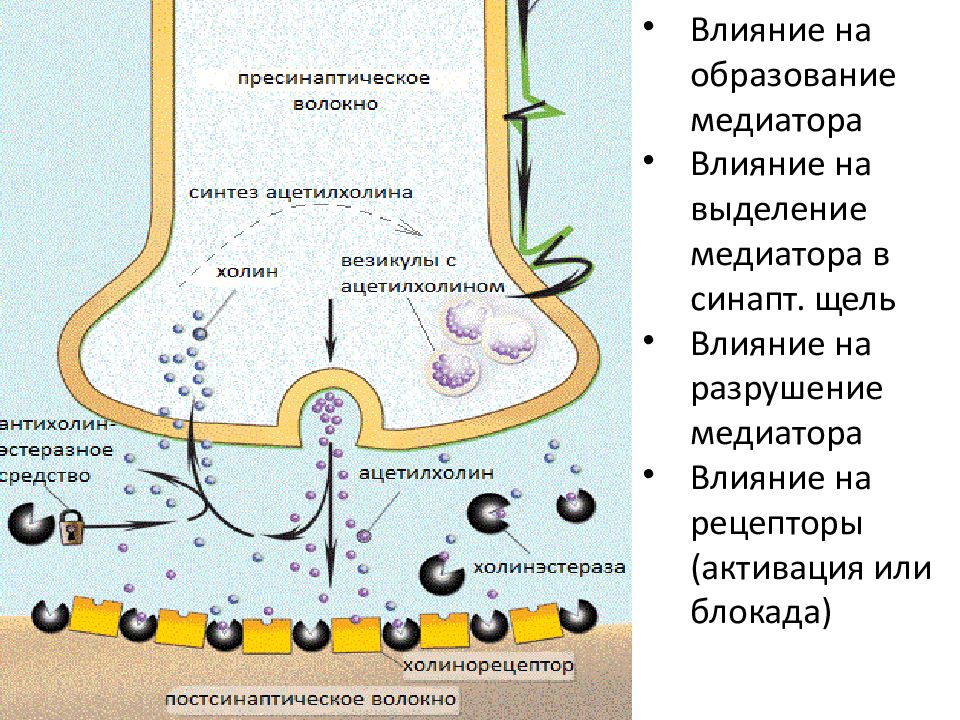 В. и др. Структура когнитивных нарушений на разных стадиях болезни Паркинсона // Вестник Российской Военно-медицинской академии. — 2007. — Т. 3. — № 19. — С. 43-50.
В. и др. Структура когнитивных нарушений на разных стадиях болезни Паркинсона // Вестник Российской Военно-медицинской академии. — 2007. — Т. 3. — № 19. — С. 43-50. В., Преображенская И.С. Когнитивные расстройства. М.: Ремедиум, 2014.
В., Преображенская И.С. Когнитивные расстройства. М.: Ремедиум, 2014. — 2012. — Vol. 16. — № 21. — P. 1-470.
— 2012. — Vol. 16. — № 21. — P. 1-470. G. et al. Cholinesterase inhibitors reduce cortical Aβ in dementia with Lewy bodies // Neurology. — 2007. — Vol. 68. — № 20. — P. 1726-1729.
G. et al. Cholinesterase inhibitors reduce cortical Aβ in dementia with Lewy bodies // Neurology. — 2007. — Vol. 68. — № 20. — P. 1726-1729.
