Для чего нужны ингаляции с физраствором
Плазмозамещающее средство оказывает регидратирующее, дезинтоксионное средство. Используется при обезвоживании организма, размножении болезнетворной микрофлоры. Для чего нужны ингаляции с физраствором, приблизительно знают все, но с точным назначением препарата предстоит разобраться.
Показания к применению
Физраствором называют хлористый натрий. Важный компонент, поддерживающий осмотическое давление в теле человека. Раствор принимают внутрь, вводят через капельницу, уколы при обезвоживании организма, токсикозе. Раствор не имеет противопоказаний, не вызывает побочных эффектов. При необходимости назначается маленьким детям, беременным, кормящим.
Для чего делают ингаляции с физраствором – для выведения токсинов, гнойных образований, восстановления слизистой, водно-солевого баланса. Процедуры назначают при болезнях верхних, нижних дыхательных путей. В особенности лечат гайморит, ангину, бронхит, пневмонию, плеврит, др. Препарат используется как самостоятельное средство либо в сочетании с медикаментами. На основе физического раствора готовят лекарственное средство для небулайзера.
Препарат используется как самостоятельное средство либо в сочетании с медикаментами. На основе физического раствора готовят лекарственное средство для небулайзера.
Для чего дышать физраствором через ингалятор
Специалисты назначают ингаляции для получения нескольких терапевтических эффектов:
- увлажнения слизистой;
- восстановления тканей;
- остановки воспалительного процесса;
- уничтожения болезнетворной микрофлоры;
- выведения слизи, мокроты;
- нормализации дыхательных функций органов верхних, нижних дыхательных путей.
В большинстве случаев хлористый натрий в качестве диффузного раствора используют для лечения кашля с образованием мокроты, затруднением ее выведения. При тяжелых заболеваниях изначально ингаляции проводят с помощью медикаментов, которые обязательно нужно развести физраствором. После исчезновения острой симптоматики продолжают курс чистым хлористым натрием.
Зачем дышать физраствором через небулайзер детям
Медицинский препарат часто используется в педиатрии.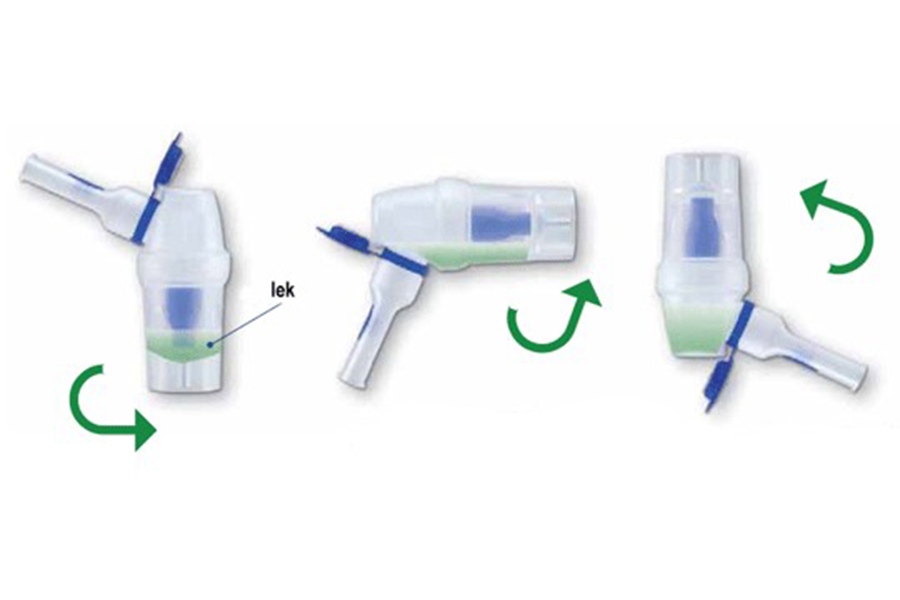 Назначают детям с рождения. Препарат не имеет противопоказаний, не вызывает побочных эффектов, подходит аллергикам. Единственный случай, когда нельзя использовать средство – повышенное количество натрия в организме.
Назначают детям с рождения. Препарат не имеет противопоказаний, не вызывает побочных эффектов, подходит аллергикам. Единственный случай, когда нельзя использовать средство – повышенное количество натрия в организме.
Физраствором детям рекомендуют промывать, опрыскивать нос, полоскать горло. Через небулайзер используют при диагностике гайморита, бронхита, пневмонии. Ингалятор распыляет средство на капельки разного размера. Большие оседают на чаше небулайзера, слизистой носа, горла, маленькие – попадают в нижние дыхательные пути (легкие, бронхи).
Ингаляции детям проводят для очищения организма от мокроты, гнойных образований, увлажнения слизистых, уничтожения микробов. Физраствор усиливает действие медикаментов, поэтому все лекарства разводят данным препаратом.
Можно ли приготовить в домашних условиях
Средство в готовом виде можно купить в аптеке. Продается в ампулах, флаконах. Теоретически в домашних условиях самостоятельно приготовить можно. Необходимые компоненты – кипяченая либо дистиллированная вода, соль кухонная или морская. Нужно взять 100 мл теплой воды, добавить 0,9 г соли, тщательно размешать. Дать постоять несколько минут, слить аккуратно, чтобы оставить осадок. Использовать в течение дня.
Нужно взять 100 мл теплой воды, добавить 0,9 г соли, тщательно размешать. Дать постоять несколько минут, слить аккуратно, чтобы оставить осадок. Использовать в течение дня.
Однако специалисты утверждают, что использовать самодельный раствор разрешается только для полоскания горла, носа. В ингаляторе применять не стоит, поскольку невозможно обеспечить полную стерильность посуды в процессе приготовления.
Процедура проведения ингаляции
В чашу небулайзера наливают в среднем 5 мл раствора. Дыхательную процедуру проводят взрослым 3 минуты, детям 2. Перерыв между ингаляциями должен составлять не менее 2 часов. При использовании хлористого натрия для разведения медикамента, соблюдают соотношения, указанные в инструкции. Дозировка может существенно отличаться от 1:1 до 1:30.
При лечении болезней нижних дыхательных путей используют:
- Вентолин;
- Декасан;
- Пульмикорт;
- Лазолван;
- Амброксол;
- Атровент;
- Мукалтин.

Курс терапии подбирается индивидуально специалистом. После исчезновения острой симптоматики ингаляции с физическим раствором нужно проводить еще в течение 3-5 дней. Для профилактики заболеваний препарат не используется.
Дополнительную информацию по теме читайте в статье: Можно ли заливать физраствор в ингалятор.
Показания к проведению ингаляции у детей. Особенности процедуры
Применение ингаляций для детей – когда нужно делать, технология процесса, особенности процедуры
Лечение простуды у детей – дело хлопотное, но если пользоваться не только современными лекарственными препаратами, а и хорошо знакомыми, проверенными методами, то можно значительно упростить этот процесс. Применение ингаляций для детей во время простуды всегда считалось оправданным – и народная медицина, и официальные научные мужи одобряют подобные процедуры, а такое единодушие встретишь редко.
Родители должны понимать, что ингаляции – лечебная процедура, поэтому ее нужно проводить с соблюдением некоторых правил.
Особенности проведения ингаляций детям
Очень важно понимать, что ингаляции должны делаться ребенку только после консультации с врачом – специалист не только оценит возможные риски проведения такой процедуры, но и подробно расскажет, какие делать ингаляции ребенку, как долго и в каких дозировках. Но если врача «под рукой» нет, то стоит запомнить следующие рекомендации:
- Ингаляции будут полезными при любом виде кашля – сухом или мокром. Воздействуя непосредственно на слизистые дыхательных путей, ингаляционный пар способствует образованию и полноценному отхождению мокроты.
- Простуда, как правило, сопровождается не только кашлем, и многие родители задаются вопросом, делать ли ребенку ингаляции при насморке. Ответ специалистов однозначный – обязательно! Причем, одинаково эффективными будут ингаляции на отварах лекарственных трав, на эфирных маслах и назначенных врачом медикаментах. Кстати, родители могут совмещать ингаляции от кашля и насморка, лечебный эффект все равно будет оказываться.

- Делать ингаляции нужно только через пару часов после приема пищи. Нужно приложить усилия, чтобы ребенок делал правильные вдохи и выдохи, не рекомендуется отвлекать его книжкой или мультфильмами, разговаривать во время процедуры больному также нельзя.
Более подробную информацию о том, сколько дней можно делать ингаляции ребенку, какие лекарственные растения и эфирные масла могут использоваться, можно получить на страницах нашего сайта Добробут. ком.
Очень важно понимать, что даже такие безобидные, на первый взгляд, процедуры, имеют противопоказания к проведению. Например, ингаляции для ребенка будут находиться под запретом в случае частого возникновения у него носовых кровотечений, при ангине и диагностированных заболеваний сердца. Многие родители задаются вопросом, можно ли делать ингаляции при температуре детям? Ответ категоричен – нет! Даже незначительное повышение температуры тела (до субфебрильных показателей) является строгим противопоказанием к проведению ингаляций.
Как правильно проводить ингаляции
Ингаляции могут проводиться старым способом – в кастрюлю или другую посуду наливается подготовленный раствор с лекарственным средством, ребенок наклоняется над сосудом, а сверху его накрывают одеялом. Родители должны быть предельно внимательны и не допускать нахождения в таком «укрытии» ребенка одного, стоит вместе с ним пройти процедуру. Температура воды должна быть не выше 40 градусов, а максимальное расстояние между лицом ребенка и водой должно быть 30 см. В связи с развитием современной медицины и введением в эксплуатацию многочисленных инструментов и приборов возникает закономерный вопрос, можно ли делать ингаляции небулайзером ребенку. Да, врачи разрешают такие процедуры, тем более этот прибор просто в применении и позволяет обеспечить направленное воздействие лечебного пара.
Какие средства лучше использовать для ингаляций:
- эфирные масла ментола, сосны, эвкалипта, можжевельника и герани помогут избавиться от заложенности носа и снизят отечность слизистой при насморке;
- чабрец, душица, лаванда, мать-и-мачеха эффективны при першении в горле и сухом кашле;
- листья дуба, березы, цветки ромашки лекарственной, можжевельник и листья черной смородины помогают в начальной стадии ринита, когда из носовых ходов выделяется прозрачная слизь;
- раствор пищевой соды, сбор из листьев малины и перечной мяты, липовый цвет, мать-и-мачеха целесообразно использовать при проведении ингаляций против кашля (и влажного, и сухого).

Обратите внимание: все перечисленные ингредиенты относятся к категории аллергенов, поэтому перед проведением ингаляционных процедур нужно обязательно исключить неадекватную реакцию детского организма на них.
Обычно ингаляции назначаются детям старше 2 лет, но есть ситуации, когда именно эта лечебная процедура может быстро облегчить состояние больного, имеется четкая инструкция, как делать ингаляции детям до года, но целесообразно будет доверить эту работу профессионалам.
Ингаляции могут стать единственно эффективным способом быстро вылечить простуду у ребенка или облегчить его состояние, снизив интенсивность кашля. Самое главное – правильно их проводить, чтобы выздоровление не сопровождалось неприятными последствиями.
Связанные услуги:
Консультация педиатра
ГБУЗ СО «Тольяттинская городская клиническая больница №5»
Ингаляция – хороший способ лечения дыхательных путей.
Лекарственные вещества в ингаляторах охватывают всю слизистую и быстрее таблеток всасывается в кровь. Однако у ингаляторов есть некоторые противопоказания и свои особенности. Мы рассказажем, как правильно использовать ингаляторы, чтобы еще больше не навредить своему здоровью.
Современная медицина может предложить три вида ингаляторов: небулайзерный, компрессорный и ультразвуковой.
Небулайзерный поможет избавиться от воспаления в бронхах, трахеях и проблем с легкими.
Компрессор – не самый эффективный, однако самый простой в обращении.
Ультразвуковой – неплохой вариант, но если у вас проблемы с задней стенкой горла и носоглоткой, лучше выбрать набулайзерный ингалятор. Он лучше других вылечивает бронхи и трахеи.
Ингалятор стоит держать в каждом доме из-за большого количества показаний. Во-первых, это заболевания лор-органов: для задней стенки глотки, для нёбных миндалин, при хроническом тонзиллите, для носоглотки, для слизистой оболочки полости носа, при воспалении слизистой, при аденоидах у детей, при синуситах – тоже назначаются для того, чтобы разжижить слизь в носу, при ларингитах. Также для бронхолегочной системы. Это заболевания трахеи – трахеиты, бронхов – бронхиты, и заболевания легких – это пневмония и воспаление легких.
Также для бронхолегочной системы. Это заболевания трахеи – трахеиты, бронхов – бронхиты, и заболевания легких – это пневмония и воспаление легких.
Ингаляции можно использовать с препаратами или антистатиком, разжижающие слизь. При сильно кашле они тоже хорошо помогают, потому что снижают напряжение слизистой.
Ингалятор необходим детям, у которых по ночам происходит острое воспаление гортани. Оно проявляется сухим кашлем или хрипом. Ингалятор в этом случае увлажнит слизистую и снимет симптомы. А если добавить кортикостероидные ингаляционные препараты и подышать ими, то отек и воспаление быстро будут купированы.
При сухом воздухе возникает огромное желание кашлянуть. В таком случае ингаляторы помогут увлажнить слизистую, которая страдает от сухости.
Однако есть случаи, когда ингаляторы использовать категорически нельзя!
Если у вас поднялась температура выше 38,5 градусов, появился отек и на лицо явные признаки ангины, то ингаляторы использовать вредно. В обострении хронического тонзиллита тоже запрещено. При температуре от 38,9 ингаляция может привести к отеку и удушению.
В обострении хронического тонзиллита тоже запрещено. При температуре от 38,9 ингаляция может привести к отеку и удушению.
Кроме того, ингаляции противопоказаны при грибковой флоре. Потому что это может привести к распространению грибков со слизистой в гортань и бронхи и вызвать серьёзные последствия.
Применение ингалятора обязательно нужно согласовывать с врачом. Только он сможет рассчитать для вас конкретный тип и точную дозировку.
Есть исключения: если речь идет о ложном крупе у детей, то ингаляторы можно применить самостоятельно, – пояснил врач. – Здесь нужно применять ингалятор с физраствором, а затем вызвать скорую помощь. Если ребенку нужно отхаркивающее, используйте физраствор, а затем добавьте препарат, который разжижает мокроту (соотношение: 1 мл препарата, 10 мл физраствора).
ГБУЗ СО «Тольяттинская городская клиническая больница №5»
Ингаляция – хороший способ лечения дыхательных путей.
Лекарственные вещества в ингаляторах охватывают всю слизистую и быстрее таблеток всасывается в кровь. Однако у ингаляторов есть некоторые противопоказания и свои особенности. Мы рассказажем, как правильно использовать ингаляторы, чтобы еще больше не навредить своему здоровью.
Однако у ингаляторов есть некоторые противопоказания и свои особенности. Мы рассказажем, как правильно использовать ингаляторы, чтобы еще больше не навредить своему здоровью.
Современная медицина может предложить три вида ингаляторов: небулайзерный, компрессорный и ультразвуковой.
Небулайзерный поможет избавиться от воспаления в бронхах, трахеях и проблем с легкими.
Компрессор – не самый эффективный, однако самый простой в обращении.
Ультразвуковой – неплохой вариант, но если у вас проблемы с задней стенкой горла и носоглоткой, лучше выбрать набулайзерный ингалятор. Он лучше других вылечивает бронхи и трахеи.
Ингалятор стоит держать в каждом доме из-за большого количества показаний. Во-первых, это заболевания лор-органов: для задней стенки глотки, для нёбных миндалин, при хроническом тонзиллите, для носоглотки, для слизистой оболочки полости носа, при воспалении слизистой, при аденоидах у детей, при синуситах – тоже назначаются для того, чтобы разжижить слизь в носу, при ларингитах. Также для бронхолегочной системы. Это заболевания трахеи – трахеиты, бронхов – бронхиты, и заболевания легких – это пневмония и воспаление легких.
Также для бронхолегочной системы. Это заболевания трахеи – трахеиты, бронхов – бронхиты, и заболевания легких – это пневмония и воспаление легких.
Ингаляции можно использовать с препаратами или антистатиком, разжижающие слизь. При сильно кашле они тоже хорошо помогают, потому что снижают напряжение слизистой.
Ингалятор необходим детям, у которых по ночам происходит острое воспаление гортани. Оно проявляется сухим кашлем или хрипом. Ингалятор в этом случае увлажнит слизистую и снимет симптомы. А если добавить кортикостероидные ингаляционные препараты и подышать ими, то отек и воспаление быстро будут купированы.
При сухом воздухе возникает огромное желание кашлянуть. В таком случае ингаляторы помогут увлажнить слизистую, которая страдает от сухости.
Однако есть случаи, когда ингаляторы использовать категорически нельзя!
Если у вас поднялась температура выше 38,5 градусов, появился отек и на лицо явные признаки ангины, то ингаляторы использовать вредно. В обострении хронического тонзиллита тоже запрещено. При температуре от 38,9 ингаляция может привести к отеку и удушению.
В обострении хронического тонзиллита тоже запрещено. При температуре от 38,9 ингаляция может привести к отеку и удушению.
Кроме того, ингаляции противопоказаны при грибковой флоре. Потому что это может привести к распространению грибков со слизистой в гортань и бронхи и вызвать серьёзные последствия.
Применение ингалятора обязательно нужно согласовывать с врачом. Только он сможет рассчитать для вас конкретный тип и точную дозировку.
Есть исключения: если речь идет о ложном крупе у детей, то ингаляторы можно применить самостоятельно, – пояснил врач. – Здесь нужно применять ингалятор с физраствором, а затем вызвать скорую помощь. Если ребенку нужно отхаркивающее, используйте физраствор, а затем добавьте препарат, который разжижает мокроту (соотношение: 1 мл препарата, 10 мл физраствора).
Ингаляции при сухом кашле
Сегодня ингаляции являются самым популярным и надежным способом лечения сухого кашля, насморка и других заболеваний дыхательной системы. В настоящей статье мы попытаемся разобраться можно ли делать ингаляцию при сухом кашле, и какое использовать лекарство для ингалятора при кашле.
В настоящей статье мы попытаемся разобраться можно ли делать ингаляцию при сухом кашле, и какое использовать лекарство для ингалятора при кашле.
Ингаляция при сухом кашле
Прежде всего, стоит понять, что такое сухой кашель, который также называется непродуктивным. Главное отличие этого кашля от других заключается в том, что при нем не эвакуируется мокрота. Соответственно, выздоровление и процесс лечения затрудняется и растягивается на долгое время. Данный кашель также является признаком серьезных респираторных заболеваний. Например, бронхит,
Ингаляция при сухом кашля отличается своим исключительно положительным влиянием. Такое благоприятное влияние достигается из-за того, что воздействие происходит непосредственно на дыхательные пути. Когда лекарство доставляется напрямую в легкие, сопротивление инфекций значительно снижается. Большим плюсом является тот факт, что делать ингаляции при сухом кашле можно делать в домашних условиях.
Ингаляции при влажном кашле
Данный способ лечения будет особо эффективен не только при сухом кашле, но также и при влажном виде кашля. Ингаляции при влажном кашле позволяют уменьшить количество слизи в дыхательных путях, разжижает ее, тем самым устраняя раздражителей в дыхательных путях. Основное преимущество этого метода лечения заключается в том, что оно может облегчить чувство раздражения и опухшие кровеносные сосуды в дыхательных путях.
Ингаляции при влажном кашле позволяют уменьшить количество слизи в дыхательных путях, разжижает ее, тем самым устраняя раздражителей в дыхательных путях. Основное преимущество этого метода лечения заключается в том, что оно может облегчить чувство раздражения и опухшие кровеносные сосуды в дыхательных путях.
Ингаляции при кашле с мокротой
Когда при кашле активно выделяется мокрота, то использование ингаляций будет самым лучшим решением. Ингалятор помогает разжижать слизь в бронхах, что позволяет им легче опустошаться. Это может позволить вашему дыханию нормализоваться, по крайней мере, в течение короткого периода времени.
Ингаляции физраствором при кашле
С чем можно сделать ингаляцию от кашля? Нас самом деле, медикаментов для ингаляции существует огромное количество, но также некоторые специалисты не исключают использование физиологических растворов. Почему физраствор? В отличие от других препаратов, ингаляции физраствором при сухом кашле не вызывает аллергической реакции, так как в его составе нет синтетических веществ. По этой причине применяется при заболевании как у взрослых, так и у детей раннего возраста. Щелочные ингаляции при сухом кашле с физраствором позволяет вывести мокроту из легких без особых затруднений, а также снимает ощущение сухости.
Ингаляции физраствором при сухом кашле
Стерильные физиологические растворы используются с целью открыть дыхательные пути и устранить инфекционные выделения. Это может значительно снизить количество слизи в легких. Данный способ отлично подходит для ингаляции от бронхита в домашних условиях.
Ингаляции боржоми при сухом кашле
Ингаляции от сухого кашля можно проводить с разными полезными веществами, в том числе и с минеральной водой Боржоми. Всем известно, в Боржоми содержатся специальные минеральные вещества, которые крайне необходимы человеку. ингаляции боржоми при сухом кашле будут крайне эффективна, так как при ингаляциях минеральные соли превращаются в более мелкие капли, что позволяет легче проникнуть в бронхи и лёгкие, а также в носовые пути. полезный состав данной минеральной воды позволяет Стоит отметить, что популярностью пользуются как обычные ингаляции, так и ингаляция с Боржоми через небулайзер.
Не стоит забывать о том, что при лечении респираторных заболеваний особенно опасно проводить самостоятельное лечение и в процессе использовать народные средства. Если вы действительно заботитесь о своем здоровье, то получите консультацию от высококлассных специалистов в клинике “Аллергомед”!
Сколько дышать ингалятором взрослому и ребенку
Ларингиты, трахеиты, фарингиты, бронхиты сопровождают нас с тех пор, как ребенок начал ходить в детский сад. Устав от бесконечных сиропов, таблеток и инъекций, обратились к опытному педиатру, который и порекомендовал купить ингалятор в качестве домашнего средства лечения насморка и кашля. Выбирали долго, тщательно изучали каждую модель. После приобретения возник вопрос, сколько дышать ингалятором, чтобы не нанести вреда организму. Скрупулезно собирали материал и хотим поделиться полученной информацией.
Сколько дышать ингалятором взрослому и ребенку при кашле
Ингаляции при кашле различной природы очень эффективны. Лекарственное средство распыляется в мелкодисперсный аэрозоль и целенаправленно поступает в пораженную зону дыхательных путей. При этом препарат минует кишечник и желудок, что позволяет достичь быстрого результата. Но любые фармсредства требуют дозированного применения. И очень важно знать, сколько дышать ингалятором взрослому и ребенку при кашле:
- процедуры с физраствором для разжижения мокроты и увлажнения дыхательных путей – взрослым и подросткам для одной процедуры взять 3 мл и дышать не менее 5 минут, детям допускается брать до 2 мл в течение 2-х минут; как правило, регулярность – дважды в сутки в течение 5-7 дней; при необходимости разрешается до 4-х раз в сутки в течение 7 дней;
- для лечения влажного кашля пользуются лазолваном или амбробене – их разводят физраствором; малышам до 1-го года не больше 1 мл до двух раз ежесуточно в течение пяти дней; старшим детям и взрослым дозу увеличивают до 2-3 мл с такой же периодичностью;
- сухой кашель устраняют с помощью беродуала; взрослым и детям больше 12 лет для лечения необходимо 40 капель препарата, детям до 6 лет нужно уменьшить вдвое – до 20 капель, малышам дошкольного возраста потребуется 10 капель; процедуры проводятся трижды в день на протяжении пяти дней;
- при бронхитном кашле эффективны ингаляции с раствором фурацилина – взрослым и подросткам необходимо 4 мл готовой смеси; процедуры проводятся дважды в лень в течение пяти суток.
В медицинской практике используется множество лекарственных средств от кашля разной природы – аллергического, астматического, бактериального, бронхитного. Выбор конкретного препарата всегда оставляйте за лечащим врачом. Он же устанавливает дозировку, продолжительность и сроки ингаляционных процедур. Самолечение в данном случае противопоказано, поскольку чревато серьезными осложнениями.
Сколько дышать ингалятором взрослому и ребенку при насморке
Насморк относится к числу самых распространенных недугов среди дошкольников. У малышей многие сосудосуживающие средства вызывают высыхание слизистой, аллергическую реакцию. На собственном опыте убедились, что гораздо эффективнее использовать ингаляции. Выбрали на сайте ingalyator-market.ru/ingalyatory/b-well-wn-114-child-cena – ингалятор B.Well WN-114 kids для ребенка простой, удобный аппарат для домашнего применения. Правила использования:
- абсолютно безопасны и комфортны процедуры с физраствором или минеральной водой (типа Боржоми или Нарзана) – допускается дышать ежедневно с интервалом в 4 часа по 5 минут детям и до 10 минут взрослым в течение 5-10 дней до улучшения состояния;
- для облегчения состояния при насморке можно применять эфирные масла (эвкалипта, хвойных растений, облепихи) – процедуры проводится один раз в сутки на протяжении 5-10 дней; используется только паровой ингалятор с крупнодисперсным аэрозолем – мелкие частицы могут достигнуть бронхиол и стать причиной масляной пневмонии;
- прополис перед ингаляцией необходимо растворить физраствором (1:20) – для процедуры взять готового раствора в количестве 3 мл, заполнить ингалятор и дышать в течение 10 минут взрослым, можно и детям – до 5 минут.
При насморке допускаются ингаляции отварами лекарственных трав – календулы, шалфея, череды, ромашки. Новорожденным и младенцам ингаляции проводятся не больше 1 мин, поскольку носовые проходы у них очень узкие и могут закупориться набухшей слизью. Ингаляции у детей вне зависимости от продолжительности производятся обязательно в присутствии взрослых.
Чем нас лечат: Физраствор — Индикатор
Используется физраствор и для такой процедуры, как промывание мочевого пузыря при проблемах с мочеиспусканием (врачи вводят раствор через катетер). Однако Кохрейновский обзор и на эту тему не дает нам однозначного ответа: все проанализированные статьи оказались неподходящими с методологической точки зрения, и по ним нельзя было даже установить, полезно или вредно такое вмешательство.
Indicator.Ru рекомендует: применяйте, но не переборщите с солями
Физиологический раствор недаром значится в списке самых эффективных и необходимых в здравоохранении лекарств и медицинских средств. У него есть множество вариантов использования, которые можно условно поделить на три группы: растворитель или основа для других лекарств; средство для восстановления водно-солевого (а в случае сложных растворов — кислотно-щелочного) баланса в крови, например при обезвоживании, нехватке солей или других проблемах; и как стерильная жидкость для промывания — будь то нос при насморке или загрязненные раны. Третий вариант не требует действительно лекарственных компонентов: он связан с очищением и выведением бактерий. Несмотря на слова из песни, правильно приготовленный физраствор не должен жечь или щипать.
Но побочные эффекты у такого, казалось бы, безопасного средства тоже есть. Так, гипотонический раствор (с пониженной концентрацией соли) может навредить клеткам крови из-за низкого осмотического давления, а из-за изо- или гипертонического в организм поступит слишком много соли. Поэтому при больших дозировках физраствора, чтобы не перегрузить организм солью, но и не заставить эритроциты разбухать, медики часто готовят гипотонический раствор, дополняя его декстрозой или глюкозой. А вот ингаляции с гипертоническим раствором помогают облегчать симптомы муковисцидоза и быстрее выздоравливать при бронхиолите. Как и при многих показаниях, гарантии нет (слишком дешевый состав для сложных и дорогих клинических испытаний), но почему бы не попробовать. Его можно было бы даже изготовить самостоятельно, если позаботиться о правильном соотношении и стерильности компонентов.
Со стандартом тоже не все так просто. Группа ученых проследила по первоисточникам, что физиологический раствор, который мы используем, возможно, вовсе не физиологический: сама цифра 0,9%, на которой основан его состав (в «простой» версии), пришла к нам из исследования на эритроцитах, проведенного в 1896 году в пробирке датским физиологом со смешной фамилией Гамбургер. В то же время Рингер, его предшественники в 1830-х, пытавшиеся лечить внутривенным введением раствора соли от холеры, а также его последователи предлагали и проверяли на людях и животных другие концентрации — от 0,6 до 0,75%. Так что не исключено, что медики сегодня используют «ненормальный» нормальный (именно так переводится с английского название простого физраствора) состав.
Наши рекомендации нельзя приравнивать к назначению врача. Перед тем, как начать принимать тот или иной препарат, обязательно посоветуйтесь со специалистом.
Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс.Новостей и читайте нас чаще.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram, Одноклассники.
применений, дозировка, побочные эффекты, взаимодействия, предупреждение
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Общие
Альбутерол, как и все симпатомиметические амины, следует использовать с осторожностью у пациентов с сердечно-сосудистыми заболеваниями, особенно с коронарной недостаточностью, гипертензией и сердечной аритмией; у пациентов с судорожными расстройствами, гипертиреозом или сахарным диабетом; и у пациентов, которые необычно чувствительны к симпатомиметическим аминам.Клинически значимые изменения систолического и диастолического артериального давления наблюдались у отдельных пациентов, и можно ожидать, что они возникнут у некоторых пациентов после применения любого бета-адренергического бронходилататора.
Сообщалось, что большие дозы альбутерола внутривенно обостряют ранее существовавший сахарный диабет и кетоацидоз. Как и другие бета-агонисты, альбутерол может вызывать значительную гипокалиемию у некоторых пациентов, возможно, из-за внутриклеточного шунтирования, которое может вызывать неблагоприятные сердечно-сосудистые эффекты.Уменьшение обычно носит временный характер и не требует дополнительных приемов пищи.
Повторное введение 0,15 мг / кг ингаляционного раствора альбутерола детям в возрасте от 5 до 17 лет, у которых изначально была нормокалиемия, было связано с бессимптомным снижением уровня калия в сыворотке крови на 20-25%.
Информация для пациентов
Действие VENTOLIN Inhalation Solution может длиться до 6 часов или дольше. ВЕНТОЛИН раствор для ингаляции не следует использовать чаще, чем рекомендуется.Не увеличивайте дозу или частоту VENTOLIN Inhalation Solution, не посоветовавшись с врачом. Если вы обнаружите, что лечение с помощью VENTOLIN Inhalation Solution становится менее эффективным для облегчения симптомов, ваши симптомы ухудшаются и / или вам необходимо использовать продукт чаще, чем обычно, вам следует немедленно обратиться за медицинской помощью. Пока вы используете раствор для ингаляции VENTOLIN, другие вдыхаемые препараты и лекарства от астмы следует принимать только по указанию врача. Общие побочные эффекты включают учащенное сердцебиение, боль в груди, учащенное сердцебиение, тремор или нервозность.Если вы беременны или кормите грудью, обратитесь к врачу по поводу использования раствора для ингаляции ВЕНТОЛИН. Эффективное и безопасное использование раствора для ингаляции VENTOLIN включает понимание того, как его следует вводить.
Чтобы избежать микробного заражения, каждый раз при открытии бутылки следует использовать соответствующие асептические методы. Следует принять меры для предотвращения контакта кончика капельницы флакона с любой поверхностью, включая резервуар небулайзера и связанное с ним вентиляционное оборудование.Кроме того, если раствор изменит цвет или станет мутным, его не следует использовать.
Совместимость лекарств (физическая и химическая), эффективность и безопасность раствора для ингаляции ВЕНТОЛИН при смешивании с другими лекарствами в небулайзере не установлены.
См. Иллюстрированное руководство для пациента по применению.
Канцерогенез, мутагенез, нарушение фертильности: В двухлетнем исследовании на крысах Sprague-Dawley сульфат альбутерола вызывал значительное дозозависимое увеличение частоты доброкачественных лейомиом мезовариума при дозах 2 в рационе.0, 10 и 50 мг / кг (приблизительно 2, 8 и 40 раз, соответственно, максимальная рекомендуемая суточная доза ингаляции для взрослых на основе мг / м 2 или приблизительно 3/5, 3 и 15 раз, соответственно максимальная рекомендуемая суточная ингаляционная доза у детей на основе мг / м ( 2 ). В другом исследовании этот эффект был заблокирован одновременным введением пропранолола, неселективного антагониста бета-адренорецепторов. В 18-месячном исследовании на мышах CD-1 сульфат альбутерола не показал признаков онкогенности при диетических дозах до 500 мг / кг (примерно в 200 раз больше максимальной рекомендованной суточной ингаляционной дозы для взрослых на основе мг / м 2 или примерно в 75 раз больше максимальной рекомендованной суточной ингаляционной дозы для детей на основе мг / м ( 2 ).В 22-месячном исследовании на золотистых хомячках сульфат альбутерола не показал признаков онкогенности при диетических дозах до 50 мг / кг (примерно в 25 раз больше максимальной рекомендованной суточной ингаляционной дозы для взрослых на основе мг / м 2 или примерно в 10 раз больше максимальной рекомендованной суточной ингаляционной дозы для детей на основе мг / м ( 2 ).
Сульфат альбутерола не был мутагенным в тесте Эймса с метаболической активацией или без нее с использованием тестовых штаммов S. typhimurium TA1537, TA1538 и TA98 или E.coli WP2, WP2uvrA и WP67. Не было обнаружено прямой мутации в штамме дрожжей S. cerevisiae S9 и какой-либо конверсии митотического гена в штамме дрожжей S. cerevisiae JD1 с метаболической активацией или без нее. Анализы флуктуации в S. typhimurium TA98 и E. coli WP2, оба с метаболической активацией, были отрицательными. Сульфат альбутерола не был кластогенным в анализе периферических лимфоцитов человека или в анализе микроядер мыши штамма Ah2 при внутрибрюшинных дозах до 200 мг / кг.
Исследования репродукции на крысах не продемонстрировали никаких доказательств нарушения фертильности при пероральных дозах до 50 мг / кг (примерно в 40 раз больше максимальной рекомендованной суточной ингаляционной дозы для взрослых на основе мг / м 2 ).
Беременность
Тератогенные эффекты: Категория беременности C. Было показано, что альбутерол обладает тератогенным действием на мышей. Исследование на мышах CD-1 при подкожных дозах 0,025, 0,25 и 2,5 мг / кг (приблизительно 1/100, 1/10 и 1.0 раз, соответственно, максимальная рекомендуемая суточная ингаляционная доза для взрослых на основе мг / м ( 2 ) выявило образование волчьей пасти у 5 из 111 (4,5%) плодов при 0,25 мг / кг и у 10 из 108 (9,3%) плоды в дозе 2,5 мг / кг. Препарат не вызывал образования волчьей пасти в самой низкой дозе 0,025 мг / кг. Расщелина неба также возникла у 22 из 72 (30,5%) плодов от женщин, получавших 2,5 мг / кг изопротеренола (положительный контроль) подкожно (примерно в 1,0 раза больше максимальной рекомендованной суточной ингаляционной дозы для взрослых на основе мг / м 2 ). .
Исследование репродукции на кроликах Stride Dutch выявило краниошизис у 7 из 19 (37%) плодов при пероральном введении альбутерола в дозе 50 мг / кг (примерно в 80 раз превышающей максимальную рекомендуемую суточную ингаляционную дозу для взрослых в мг / м3). 2 базис).
Адекватных и хорошо контролируемых исследований у беременных женщин не проводилось. Альбутерол следует использовать во время беременности, только если потенциальные выгоды оправдывают потенциальный риск для плода.
В ходе всемирного маркетингового опыта редко сообщалось о различных врожденных аномалиях, в том числе волчьей пасти и дефектах конечностей у потомков пациентов, получавших альбутерол.Некоторые матери во время беременности принимали несколько лекарств. Невозможно выделить какой-либо устойчивый паттерн дефектов, и не установлена взаимосвязь между употреблением альбутерола и врожденными аномалиями.
Использование в родах и родах
Из-за потенциального влияния бета-агонистов на сократительную способность матки использование раствора для ингаляции ВЕНТОЛИНА для облегчения бронхоспазма во время родов должно быть ограничено теми пациентами, для которых преимущества явно перевешивают риск.
Токолиз: Альбутерол не был одобрен для лечения преждевременных родов. Соотношение польза: риск при применении альбутерола для токолиза не установлено. Сообщалось о серьезных побочных реакциях, включая отек легких у матери, во время или после лечения преждевременных родов бета- 2 -агонистами, включая альбутерол.
Кормящих матерей
Неизвестно, выделяется ли этот препарат с грудным молоком.Из-за потенциальной канцерогенности альбутерола, показанной в некоторых исследованиях на животных, следует принять решение о прекращении кормления грудью или о прекращении приема препарата, принимая во внимание важность препарата для матери.
Использование в педиатрии
Безопасность и эффективность VENTOLIN Inhalation Solution доказаны для детей от 2 лет и старше. Использование VENTOLIN Inhalation Solution в этих возрастных группах подтверждается данными адекватных и хорошо контролируемых исследований VENTOLIN Inhalation Solution у взрослых; вероятность того, что течение заболевания, патофизиология и действие препарата у детей и взрослых в значительной степени схожи; и опубликованные отчеты об исследованиях с участием педиатрических пациентов в возрасте 3 лет и старше.Рекомендуемая доза для педиатрической популяции основана на трех опубликованных сравнительных исследованиях эффективности и безопасности у детей от 5 до 17 лет, а также на профиле безопасности как у взрослых, так и у педиатрических пациентов при дозах, равных или превышающих рекомендуемые дозы. Безопасность и эффективность VENTOLIN Inhalation Solution у детей младше 2 лет не установлены.
Влияние ингаляционного гипертонического (7%) физиологического раствора на функциональный тест легких у детей дошкольного возраста с муковисцидозом: результаты перекрестного рандомизированного клинического исследования | Итальянский педиатрический журнал
Настоящее двойное слепое рандомизированное перекрестное исследование с участием 12 детей дошкольного возраста с муковисцидозом в клинически стабильных условиях показывает, что вдыхание HS два раза в день является безопасным лечением.Насколько нам известно, это первое исследование, в котором тестируется методика Rint, объективное измерение функции легких в этом диапазоне возрастов [10, 12, 13, 14], в течение курса лечения HS у детей с муковисцидозом. Наши данные, по-видимому, подтверждают краткосрочные и среднесрочные преимущества HS для небольшой группы молодых людей на ранней стадии поражения легких, широко описанные в литературе о взрослых пациентах [1, 2, 7, 15, 16]. Фактически после 16-недельной терапии HS было зарегистрировано значительное улучшение спирометрических показателей, тогда как в группе NS было обнаружено их ухудшение.Аналогичным образом Rosenfeld et al. продемонстрировали значительное улучшение ОФВ0,5 в группе 7% детей младше 6 лет с муковисцидозом, даже если не было достигнуто снижения легочных обострений [6]. Эти небольшие изменения могут отражать тенденцию к улучшению работы дыхательных путей, что может иметь клинически значимые последствия. Суббарао и др. [4] было пилотным исследованием, в котором анализировались полезность, безопасность и переносимость ГВ у детей. Единственное ранее проведенное исследование функций легких (с помощью спирометрии и техники быстрой торакоабдоминальной компрессии с повышенным объемом) у детей дошкольного возраста (5.7 ± 0,8 года) с муковисцидозом, получавшим терапию HS, было проведено Dellon et al. [5].
Благоприятное влияние вдыхаемого HS на дыхательные пути осуществляется несколькими постулированными молекулярными механизмами: HS разрушает ионные связи в слизи и экранирует отрицательные заряды, тем самым снижая вязкость секрета; регидратирует поверхность дыхательных путей, улучшая реологию слизи; наконец, вызывает кашель [1, 17, 18]. Кроме того, HS способствует улучшению экспираторного, а также инспираторному снижению сопротивления дыхательных путей за счет уменьшения воспалительного отека дыхательных путей.
В нашей небольшой серии HS оказался безопасным и переносимым препаратом. Наиболее частыми нежелательными явлениями, ожидаемыми при введении терапии, были кашель, раздражение горла и неприятный соленый привкус [2]. В нашем исследовании два пациента указали на усиление кашля, а один пожаловался на раздражение ротоглотки. Кашель обычно уменьшается со временем. Однако мы использовали премедикацию бронходилататорами для предотвращения сужения бронхов дыхательных путей.
Настоящее исследование может представлять интерес также с методологической точки зрения, поскольку оно является первым, в котором для оценки функции легких у детей дошкольного возраста используется метод сопротивления прерыванию — золотой стандарт для этой возрастной группы.Фактически, измерение функции легких у детей младшего возраста может быть затруднено и подвержено увеличению частоты отказов и повышенной вариабельности. Обычные функциональные тесты легких, такие как спирометрия и бодиплетизмография, имеют ограниченное применение, потому что эти методы требуют высокой степени понимания и сотрудничества субъекта [19, 20].
Дети этой возрастной группы слишком стары, чтобы получать седативные препараты, но они не могут активно сотрудничать во многих физиологических маневрах, необходимых для функциональных тестов легких.Вероятно, по этой причине не было получено статистически значимых результатов измерения ОФВ1 с помощью спирометрии.
Ринт и спирометрия отражают различные аспекты функции легких и не совсем взаимозаменяемы: Ринт больше зависит от функции крупных дыхательных путей, и он измеряет общую систему сопротивления и некоторое дополнительное сопротивление грудной стенки. Более того, это быстрая неинвазивная мера респираторного сопротивления во время приливного дыхания, которую дошкольникам легче выполнить, чем спирометрию [21, 22].Этот метод появился как надежный инструмент при диагностике легочной функции у молодых пациентов с МВ [10, 12, 13, 14], даже если его использование, стандартизированное рабочей группой ERS / ATS, сообщило мало доказательств, подтверждающих клиническая польза для дошкольников с МВ [22]. Мы считаем, что Rint и спирометрия могут сыграть роль в оценке детей дошкольного возраста с CF, потому что они могут улучшить нашу способность выявлять и лечить ранние заболевания легких и обострения, особенно в детских респираторных центрах, где другие более дорогие методы недоступны.
В настоящее время терапию HS нельзя рассматривать как альтернативу рчДНазе, которая продемонстрировала большую способность улучшать функцию легких [3, 23,24,25] и уменьшать легочные осложнения, но мы всегда должны помнить, что терапия рчДНазой стоит дорого, и его использование в настоящее время ограничено во многих странах только для пациентов с умеренным или тяжелым респираторным усилием.
Лечение гипертоническим раствором достаточно дешево и безопасно и позволяет хотя бы на кратковременное и среднесрочное улучшение дыхательной функции.Появление в последнее время препарата ГС вместе с гиалуроновой кислотой может быть полезным для дальнейшего предотвращения кашля и жжения, вызванных единственным ГВ [26]. Однако у детей с МВ, чтобы избежать потенциального риска, связанного с загрязнением растворов ГВ, мы должны рекомендовать использовать стерильные единичные лекарственные формы [27].
В нашем исследовании могут быть выявлены некоторые ограничения, в частности, небольшое количество серий, набор в один центр и отсутствие периода вымывания между базовыми показателями.
Кроме того, мы решили обследовать детей с МВ в стабильных условиях с вполне нормальными спирометрическими показателями и параметрами Rint при зачислении. Наконец, мы ограничили функциональные тесты легких спирометрией и ринтом, поскольку были недоступны многократные вдохи инертного газа и техника принудительных колебаний.
Какова роль ингаляции гипертонического солевого раствора в лечении муковисцидоза (МВ)?
LeGrys VA, Yankaskas JR, Quittell LM, Marshall BC, Mogayzel PJ Jr. Диагностическое тестирование пота: рекомендации Фонда кистозного фиброза. Дж. Педиатр . 2007 июль 151 (1): 85-9. [Медлайн].
Ramsey BW, Davies J, McElvaney NG, et al. Потенциатор CFTR у пациентов с муковисцидозом и мутацией G551D. N Engl J Med . 2011 г., 3 ноября. 365 (18): 1663-72. [Медлайн].
Янкаскас-младший, Мэллори ГБ-младший. Трансплантация легких при муковисцидозе: консенсусное заявление конференции. Сундук . 1998, январь, 113 (1): 217-26. [Медлайн].
Дэвис ПБ, Драмм М, Констан МВт.Муковисцидоз. Am J Respir Crit Care Med . 1996 Ноябрь 154 (5): 1229-56. [Медлайн].
Роу С.М., Клэнси JP. Достижения в лечении муковисцидоза. Curr Opin Pediatr . 2006 Декабрь 18 (6): 604-13. [Медлайн].
Rutland J, Cole PJ. Мукоцилиарный клиренс носа и частота биений ресничек при муковисцидозе по сравнению с синуситом и бронхоэктазами. Грудь . 1981. 36: 654-658.
Hauber HP, Manoukian JJ, Nguyen LHP.Повышенная экспрессия интерлейкина-9, рецептора интерлейкина-9 и активируемого кальцием хлоридного канала hCLCA1 в верхних дыхательных путях пациентов с муковисцидозом. Ларингоскоп . 2003. 113: 1037-1042.
Collaco JM, Vanscoy L, Bremer L, et al. Взаимодействие пассивного курения с генами, влияющими на кистозный фиброз легких. ЯМА . 2008 30 января, 299 (4): 417-24. [Медлайн].
GREEN MN, CLARKE JT, SHWACHMAN H.Исследования при муковисцидозе поджелудочной железы; белковый паттерн в кишечной непроходимости мекония. Педиатрия . 1958 21 апреля (4): 635-41. [Медлайн].
Gross R. Кишечная непроходимость у новорожденных, вызванная Meconium Ileus. Хирургия младенцев и детства . 1953. 175–191.
Rommens JM, Iannuzzi MC, Kerem B, et al. Идентификация гена муковисцидоза: хромосомная ходьба и прыжки. Наука . 1989 8 сен.245 (4922): 1059-65. [Медлайн].
Консорциум генетического анализа муковисцидоза. База данных мутаций муковисцидоза-. Статистика CFMDB. Доступно по адресу http://www.genet.sickkids.on.ca/cftr/StatisticsPage.html. Дата обращения: 14 октября 2011 г.
Джулиан Зеленски, Анлуан О’Брайен и Лап-Чи Цуй. База данных мутаций цистисного фиброза. Консорциум генетического анализа кистозного фиброза. Доступно по адресу http://www.genet.sickkids.on.ca/cftr/StatisticsPage.html.Доступ: 24 июня 2008 г.
Gambardella S, Biancolella M, D’Apice MR, et al. Исследование профиля экспрессии генов в линиях бронхиальных клеток с мутацией CFTR. Clin Exp Med . 2006 Декабрь 6 (4): 157-65. [Медлайн].
Chaudry G, Navarro OM, Levine DS, Oudjhane K. Абдоминальные проявления муковисцидоза у детей. Педиатр Радиол . 2006 марта. 36 (3): 233-40. [Медлайн].
Блэкман С.М., Диринг-Брозе Р., МакВильямс Р. и др.Относительный вклад генетических и негенетических модификаторов в кишечную непроходимость при муковисцидозе. Гастроэнтерология . 2006 октябрь 131 (4): 1030-9. [Медлайн]. [Полный текст].
Young FD, Newbigging S, Choi C, Keet M, Kent G, Rozmahel RF. Улучшение муковисцидоза слизистой оболочки кишечника у мышей за счет восстановления mCLCA3. Гастроэнтерология . 2007 декабрь 133 (6): 1928-37. [Медлайн].
Консенсус национальных институтов здравоохранения.Генетическое тестирование на муковисцидоз. Заявление конференции по развитию консенсуса Национального института здравоохранения о генетическом тестировании на муковисцидоз. Arch Intern Med . 1999, 26 июля, 159 (14): 1529-39. [Медлайн].
Лодка TF. Муковисцидоз. Учебник педиатрии Нельсона . Филадельфия, Пенсильвания: WB Saunders Co; 2000. 1315-1327.
Фонд муковисцидоза. Годовой отчет реестра пациентов Fibrosis Foundation за 2008 год .Bethesda, MD: Фонд кистозного фиброза; 2009.
Элборн Дж.С., Шейл Диджей, Бриттон Дж. Р. Муковисцидоз: текущая выживаемость и популяционные оценки к 2000 г. Грудь . 1991 декабрь 46 (12): 881-5. [Медлайн]. [Полный текст].
Sharma GD, Doershuk CF, Stern RC. Эрозия стенки лобной пазухи, вызванная мукопиоцеле при муковисцидозе. Дж. Педиатр . 1994 Май. 124 (5 Пет 1): 745-7. [Медлайн].
Barr HL, Britton J, Smyth AR, Fogarty AW.Связь между социально-экономическим статусом, полом и возрастом смерти от муковисцидоза в Англии и Уэльсе (1959–2008 гг.): Перекрестное исследование. BMJ . 23 августа 2011 г. 343: d4662. [Медлайн].
Fogarty AW, Britton J, Clayton A, Smyth A. Связаны ли измерения габитуса тела со смертностью при муковисцидозе ?. Сундук . 2012 23 февраля [Medline].
Йен Э. Х., Куинтон Х., Боровиц Д. Лучшее состояние питания в раннем детстве связано с улучшенными клиническими результатами и выживаемостью у пациентов с муковисцидозом. Дж. Педиатр . 2012 г., 11 октября [Medline].
Berk DR, Ciliberto HM, Sweet SC, Ferkol TW, Bayliss SJ. Аквагенное сморщивание ладоней при муковисцидозе: сравнение с контролем и корреляции генотип-фенотип. Дерматол Арки . 2009 ноябрь 145 (11): 1296-9. [Медлайн].
Келли А., Шалл Дж., Столлингс В.А., Земель Б.С. Дефицит трабекулярной и кортикальной кости присутствует у детей и подростков с муковисцидозом. Кость . 2016 29 апреля. [Medline].
Боггс В. Дефицит костей, часто встречающийся у детей с муковисцидозом. Информация о здоровье Reuters. Доступно на http://www.medscape.com/viewarticle/863370. 18 мая 2016 г .; Дата обращения: 8 июня 2016 г.
Zielenski J, Patrizio P, Corey M, et al. Вариант гена CFTR для пациентов с врожденным отсутствием семявыносящего протока. Ам Дж. Хам Генет . 1995 Октябрь 57 (4): 958-60. [Медлайн]. [Полный текст].
Vande Velde S, Van Biervliet S, Robberecht E.Муковисцидоз, проявляющийся в виде несахарного диабета, невосприимчивого к десмопрессину. Acta Gastroenterol Belg . 2007 июль-сен. 70 (3): 300-1. [Медлайн].
[Рекомендации] Комо AM, Accurso FJ, White TB, et al. Рекомендации по внедрению программ скрининга новорожденных на муковисцидоз: отчет о семинаре Фонда муковисцидоза. Педиатрия . 2007, февраль, 119 (2): e495-518. [Медлайн]. [Полный текст].
Hale JE, Parad RB, Comeau AM.Скрининг новорожденных показывает снижение заболеваемости муковисцидозом. N Engl J Med . 2008 28 февраля. 358 (9): 973-4. [Медлайн].
Cystic Fibrosis Foundation., Borowitz D, Parad RB, Sharp JK, Sabadosa KA, Robinson KA, et al. Практические рекомендации Фонда кистозного фиброза по ведению младенцев с метаболическим синдромом, связанным с трансмембранным регулятором проводимости, в течение первых двух лет жизни и в последующий период. Дж. Педиатр . 2009 декабрь155 (6 приложение): S106-16. [Медлайн].
Фаррелл PM, Koscik RE. Концентрация хлоридов в поте у младенцев, гомозиготных или гетерозиготных по муковисцидозу F508. Педиатрия . 1996 Апрель 97 (4): 524-8. [Медлайн].
Фаррелл PM, Белый TB, Ren CL, Hempstead SE, Accurso F, Derichs N и др. Диагностика муковисцидоза: согласованные рекомендации Фонда муковисцидоза. Дж. Педиатр . 2017 Февраль 181S: S4-S15.e1. [Медлайн].
Леонидас JC, Бердон В.Е., Бейкер Д.Х., Сантулли ТВ. Мекониальная кишечная непроходимость и ее осложнения. Переоценка диагностических критериев рентгеновского снимка. Am J Roentgenol Radium Ther Nucl Med . 1970 Март 108 (3): 598-609. [Медлайн].
Сандерс ДБ, Ли З., Броуди А.С., Фаррелл П.М. Оценка степени тяжести КТ грудной клетки связана с будущим прогрессированием заболевания легких у детей с МВ. Am J Respir Crit Care Med . 7 июля 2011 г. [Medline].
Розенов Т., Рэмси К., Туркович Л., Мюррей С.П., Мок Л.С., Холл Г.Л. и др. Улавливание воздуха при раннем кистозном фиброзе легких — КТ рассказывает всю историю? Педиатр Пульмонол . 6 июля 2017 г. [Medline].
Dicke JM, Crane JP. Сонографически обнаруженный гиперэхогенный кишечник плода: значение и значение для ведения беременности. Акушерский гинекол . 1992 ноябрь 80 (5): 778-82. [Медлайн].
Savant AP, McColley SA.Муковисцидоз Обзор за 2016 год. Pediatr Pulmonol . 2017 Август 52 (8): 1092-1102. [Медлайн].
Smith L, Marshall H, Aldag I, Horn F, Collier G, Hughes D, et al. Продольная оценка детей с легким МВ с использованием МРТ гиперполяризованного газа легких и LCI. Am J Respir Crit Care Med . 29 июня 2017 г. [Medline].
Marshall H, Horsley A, Taylor CJ, Smith L, Hughes D, Horn FC и др. Выявление раннего субклинического заболевания легких у детей с муковисцидозом с помощью визуализации вентиляции легких с помощью МРТ с гиперполяризованным газом. Грудь . 2017 Август 72 (8): 760-762. [Медлайн].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. FDA разрешает продажу четырех устройств для секвенирования генов «следующего поколения» [пресс-релиз]. 19 ноября 2013 г. Доступно по адресу http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm375742.htm. Дата обращения: 25 ноября 2013 г.
Brooks M. FDA одобряет устройства для секвенирования генов нового поколения для клинического использования. Медицинские новости Medscape . 20 ноября 2013 г.[Полный текст].
Розенфельд М., Аллен Дж., Аретс Б.Х., Аврора П., Бейдон Н., Калоджеро С. и др. Официальный отчет семинара Американского торакального общества: оптимальные функциональные тесты легких для мониторинга муковисцидоза, бронхолегочной дисплазии и повторяющихся хрипов у детей младше 6 лет. Анн Ам Торак Соц . 2013 г., 10 (2): S1-S11. [Медлайн].
Filburn AG, Lumeng CN, Nasr SZ. Тестирование функции легких у младенцев служит руководством при лечении муковисцидоза легких. Респираторная медицина CME . 2011. 4: 17-19.
Ren CL, Brucker JL, Rovitelli AK, Bordeaux KA. Изменения функции легких, измеренные спирометрией и методом принудительных колебаний у пациентов с муковисцидозом, проходящих лечение по поводу обострения дыхательных путей. Педиатр Пульмонол . 2006 апр. 41 (4): 345-9. [Медлайн].
Тейлор-Робинсон Д., Уайтхед М., Дидериксен Ф., Олесен Х.В., Пресслер Т., Смит Р.Л. и др. Понимание естественного прогрессирования снижения% ОФВ1 у пациентов с муковисцидозом: продольное исследование. Грудь . 2012 г. 3 мая. [Medline].
Дэвис Дж. С., Каннингем С., Олтон Е. В., Иннес Дж. А.. Индекс клиренса легких при МВ: чувствительный маркер тяжести заболевания легких. Грудь . 2008 Февраль 63 (2): 96-7. [Медлайн].
Моран А., Пеков П., Гровер П. и др. Инсулинотерапия для улучшения ИМТ при диабете, связанном с муковисцидозом, без гипергликемии натощак: результаты исследования терапии диабета, связанного с муковисцидозом. Уход за диабетом .2009 г., 32 (10): 1783-8. [Медлайн]. [Полный текст].
Lum S, Gustafsson P, Ljungberg H, Hülskamp G, Bush A, Carr SB. Раннее выявление кистозного фиброза легких: смыв при многократном выдохе по сравнению с тестами на повышенный объем. Грудь . 2007 апр. 62 (4): 341-7. [Медлайн].
Owens CM, Aurora P, Stanojevic S, Bush A, Wade A, Oliver C. Индекс очищения легких и HRCT являются дополнительными маркерами патологий легких у маленьких детей с CF. Грудь . 2011 июн.66 (6): 481-8. [Медлайн].
Стивен LC, Gavel G, Young D, Carachi R. Уровни иммунореактивного трипсина у новорожденных с мекониевой непроходимостью. Педиатр Хирург Инт . 2006 22 марта (3): 236-9. [Медлайн].
Santulli TV, Blanc WA. Врожденная атрезия кишечника: патогенез и лечение. Энн Сург . 1961 Декабрь 154: 939-48. [Медлайн]. [Полный текст].
Шинохара Т., Цуда М., Кояма Н.Лечение кишечной непроходимости, связанной с меконием, у младенцев с очень низкой массой тела при рождении. Педиатр Инт . 2007 Октябрь 49 (5): 641-4. [Медлайн].
Ян С., Монтгомери М. Дорназа альфа при муковисцидозе. Кокрановская база данных Syst Rev . 2018 6 сентября: CD001127. [Медлайн].
Sagel SD, Khan U, Jain R, Graff G, Daines CL, Dunitz JM, et al. Эффекты мультивитаминов, обогащенных антиоксидантами, при муковисцидозе. Рандомизированное контролируемое многоцентровое клиническое исследование. Am J Respir Crit Care Med . 2018 1 сентября 198 (5): 639-647. [Медлайн].
Wainwright CE, Elborn JS, Ramsey BW, Marigowda G, Huang X, Cipolli M и др. Люмакафтор-ивакафтор у пациентов с муковисцидозом, гомозиготным по Phe508del CFTR. N Engl J Med . 2015 17 мая. [Medline]. [Полный текст].
Taylor-Cousar JL, Munck A, McKone EF, van der Ent CK, Moeller A, Simard C и др. Тезакафтор-ивакафтор у пациентов с муковисцидозом, гомозиготным по Phe508del. N Engl J Med . 2017 23 ноября. 377 (21): 2013-2023. [Медлайн].
Rowe SM, Daines C, Ringshausen FC, Kerem E, Wilson J, Tullis E, et al. Тезакафтор-ивакафтор у гетерозигот с остаточной функцией с муковисцидозом. N Engl J Med . 2017 23 ноября. 377 (21): 2024-2035. [Медлайн].
Дональдсон С.Х., Беннетт В.Д., Земан К.Л., Ноулз М.Р., Тарран Р., Бушер Р.С. Очистка слизи и функция легких при муковисцидозе с применением гипертонического раствора. N Engl J Med . 2006 19 января. 354 (3): 241-50. [Медлайн].
Уорк П., Макдональд В.М. Распыленный гипертонический раствор при муковисцидозе. Кокрановская база данных Syst Rev . 2018 27 сентября. 9: CD001506. [Медлайн].
Элкинс М.Р., Робинсон М., Роуз Б.Р. и др. Контролируемое испытание длительного применения ингаляционного гипертонического раствора у пациентов с муковисцидозом. N Engl J Med . 2006 19 января. 354 (3): 229-40. [Медлайн].
Flume PA, O’Sullivan BP, Robinson KA, et al.Рекомендации по лечению муковисцидоза легких: хронические препараты для поддержания здоровья легких. Am J Respir Crit Care Med . 2007 15 ноября. 176 (10): 957-69. [Медлайн].
Yu H, Burton B, Huang CJ, Worley J, Cao D, Johnson JP Jr и др. Потенцирование ивакафтора нескольких каналов CFTR с помощью стробирующих мутаций. J Cyst Fibros . 2012 май. 11 (3): 237-45. [Медлайн].
Роу, Стивен М. и др. Тезакафтор-ивакафтор у гетерозигот с остаточной функцией с муковисцидозом. Медицинский журнал Новой Англии . 2017 23 ноября. 377 (21): 2024-2035. [Медлайн]. [Полный текст].
Taylor-Cousar JL, et al. Тезакафтор-ивакафтор у пациентов с муковисцидозом, гомозиготным по Phe508del. N Engl J Med . 2017 23 ноября. 377 (21): 2013-2023. [Медлайн]. [Полный текст].
Симдеко (тезакафтор / ивакафтор) [вкладыш в упаковке]. Бостон, Массачусетс: Vertex Pharmaceuticals, Inc., июнь 2019 г. Доступно на [Полный текст].
Ченг К., Эшби Д., Смит Р.Л.Пероральные стероиды для длительного применения при муковисцидозе. Кокрановская база данных Syst Rev . 2011 г. 5 октября. CD000407. [Медлайн].
Aitken ML, Bellon G, De Boeck K, Flume PA, Fox HG, Geller DE, et al. Маннитол в виде вдыхаемого сухого порошка при муковисцидозе: международное рандомизированное исследование. Am J Respir Crit Care Med . 2012 15 марта. 185 (6): 645-52. [Медлайн].
FDA одобрило TOBI Podhaler для лечения бактериальной инфекции легких у пациентов с муковисцидозом.Выпуск новостей FDA. 22 марта 2013 г. Доступно по адресу http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm345123.htm. Доступ: 1 апреля 2013 г.
Льюис Р. Муковисцидоз: бисфосфонат увеличивает плотность костной ткани у детей. Медицинские новости Medscape . 6 июня 2013 г. [Полный текст].
Bianchi ML, Assael B, Dubini A, et al. Лечение низкой плотности костной ткани у молодых людей с муковисцидозом: многоцентровое проспективное открытое обсервационное исследование кальция и кальцифедиола с последующим рандомизированным плацебо-контролируемым исследованием алендроната. Ланцет Респ Мед . 2 июня 2013 г. [EPUB перед печатью].
Бест С., Брирли А., Гайяр П. и др. Предварительное ретроспективное исследование пациентов с муковисцидозом и гастростомическими трубками. J Педиатр Гастроэнтерол Нутр . 2011 Октябрь 53 (4): 453-8. [Медлайн].
Schwarzenberg SJ, Hempstead SE, McDonald CM, Powers SW, Wooldridge J, Blair S и др. Энтеральное зондовое питание для людей с муковисцидозом: руководящие принципы Фонда кистозного фиброза, основанные на фактических данных. J Cyst Fibros . 2016 15 ноября (6): 724-735. [Медлайн].
Liou TG, Adler FR, Cox DR, Cahill BC. Трансплантация легких и выживаемость у детей с муковисцидозом. N Engl J Med . 2007 22 ноября. 357 (21): 2143-52. [Медлайн]. [Полный текст].
Аллен Дж., Виснер Г. Трансплантация легких при муковисцидозе — primum non nocere ?. N Engl J Med . 2007 22 ноября. 357 (21): 2186-8. [Медлайн].
Аль-Салех С., Делл С.Д., Грасеманн Х., Яу Ю.С., Уотерс В., Мартин С. и др.Индукция мокроты в повседневной клинической практике детей с муковисцидозом. Дж. Педиатр . 2010 декабрь 157 (6): 1006-1011.e1. [Медлайн].
Робинсон К.А., Оделола О.А., Салдана И.Дж., Маккой Н.А. Паливизумаб для профилактики респираторно-синцитиальной вирусной инфекции у детей с муковисцидозом. Кокрановская база данных Syst Rev . 2012 15 февраля. 2: CD007743. [Медлайн].
Kazmerski TM, Borrero S, Tuchman LK, Weiner DJ, Pilewski JM, Orenstein DM, et al.Отношение медработников и пациентов к сексуальному здоровью молодых женщин с муковисцидозом. Педиатрия . 2016 июн. 137 (6): [Medline].
Konstan MW, McKone EF, Moss RB, Marigowda G, Tian S, Waltz D, et al. Оценка безопасности и эффективности длительного лечения комбинацией люмакафтора и ивакафтора у пациентов с муковисцидозом, гомозиготными по мутации F508del-CFTR (PROGRESS): фаза 3, расширенное исследование. Ланцет Респир Мед .2017 Февраль 5 (2): 107-118. [Медлайн].
Morgan WJ, Wagener JS, Pasta DJ, Millar SJ, VanDevanter DR, Konstan MW и др. Связь лечения антибиотиками с восстановлением после острого снижения ОФВ 1 у детей с муковисцидозом. Анн Ам Торак Соц . 14 июня 2017 г. (6): 937-942. [Медлайн].
Smyth AR, Bhatt J. Дозирование один раз в день или несколько раз в день с внутривенными аминогликозидами при муковисцидозе. Кокрановская база данных Syst Rev .2012 15 февраля. 2: CD002009. [Медлайн].
Шустер А., Халиберн С., Деринг Г., Гольдман М.Х. Безопасность, эффективность и удобство сухого порошка колистиметата натрия для ингаляции (Colobreathe DPI) у пациентов с муковисцидозом: рандомизированное исследование. Грудь . 2012 4 декабря [Medline].
Сайман Л., Маршалл BC, Майер-Хэмблетт Н. и др. Азитромицин у пациентов с муковисцидозом, хронически инфицированных Pseudomonas aeruginosa: рандомизированное контролируемое исследование. ЯМА . 2003 Октябрь 1. 290 (13): 1749-56. [Медлайн].
Nick JA, Moskowitz SM, Chmiel JF, et al. Азитромицин может противодействовать вдыхаемому тобрамицину при нацеливании на синегнойную палочку при муковисцидозе. Анн Ам Торак Соц . 2014 марта 11 (3): 342-50. [Медлайн].
Taccetti G, Bianchini E, Cariani L, Buzzetti R, Costantini D, Trevisan F, et al. Раннее лечение антибиотиками для эрадикации синегнойной палочки у пациентов с муковисцидозом: рандомизированное многоцентровое исследование, сравнивающее два разных протокола. Грудь . 2012 29 февраля. [Medline].
Брукс М. FDA разрешило расширенное использование ивакафтора (Калидеко) при муковисцидозе. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/821097. Доступ: 1 марта 2014 г.
Гибсон Р.Л., Эмерсон Дж., Макнамара С. и др. Значительный микробиологический эффект ингаляционного тобрамицина у детей раннего возраста с муковисцидозом. Am J Respir Crit Care Med . 2003 15 марта. 167 (6): 841-9.[Медлайн]. [Полный текст].
Суббарао П., Станоевич С., Браун М. и др. Индекс клиренса легких как показатель результатов клинических испытаний у детей раннего возраста с муковисцидозом. Пилотное исследование с использованием ингаляционного гипертонического раствора. Am J Respir Crit Care Med . 2013 15 августа. 188 (4): 456-60. [Медлайн]. [Полный текст].
Milla CE, Ratjen F, Marigowda G, Liu F, Waltz D, Rosenfeld M и др. Люмакафтор / ивакафтор у пациентов в возрасте 6-11 лет с муковисцидозом и гомозиготных по F508del-CFTR. Am J Respir Crit Care Med . 2017 г., 1. 195 (7): 912-920. [Медлайн].
респираторных процедур
Понимание того, как действуют эти лекарства и почему вы принимаете их в определенном порядке, поможет вам оценить важность выбора времени. Поскольку лечение CF является индивидуальным, некоторым людям могут быть прописаны не все перечисленные лекарства, и в этом случае вы просто следуете порядку, исключая лекарства, которые вам не прописаны.
Шаг 1. Откройте дыхательные пути с помощью бронходилататора
(Пример: Альбутерол, ProAir, Вентолин, Провентил)
Бронходилататор расслабляет гладкие мышцы дыхательных путей, открывая их и обеспечивая лучший воздушный поток и облегчая очистку дыхательных путей.
Шаг 2. Увлажните дыхательные пути осмотическим агентом
(Пример: гипертонический солевой раствор)
Вдыхание 7% -ного гипертонического солевого раствора (HTS) помогает гидратировать густую слизь, облегчая ее движение. Поскольку HTS может вызвать бронхоспазм, рекомендуется всегда давать бронходилататор в первую очередь.
Шаг 3: Разжижайте слизь муколитиком
(Пример: Pulmozyme, Mucomyst)
Муколитики разжижают густую липкую слизь в легких. Когда слизь меньше вязкой и липкой, ее легче мобилизовать, кашлять или выдыхать.
Шаг 4. Удалите слизь с помощью техники очистки дыхательных путей
(Пример: CPT, Vest, acapella, huffing, PEP)
Когда дыхательные пути расслаблены и более открыты, а муколитик разжижает слизь, пора применить метод очистки дыхательных путей (ACT).ACT поможет мобилизовать слизь из более мелких дыхательных путей в более крупные, где ее удалит кашель или раздражение. Обычно при МВ слизь в легких содержит миллионы бактерий, поэтому, чтобы избавиться от нее, как обычно, можно выполнять шаги 1,2,3 в таком порядке, пока вы находитесь в жилете или принимаете CPT
.
Обычно процедура с жилетом занимает 20-30 минут. Настройки вашего жилета, возможно, со временем придется отрегулировать, как и размер вашего жилета. Обычно мы начинаем подбирать жилетки детям примерно в возрасте 2 лет, и размер жилета часто меняется в зрелом возрасте.Большинство страховых компаний теперь без проблем покрывают жилеты для всех пациентов, и компании, занимающиеся жилетом, будут работать с вами с любыми вашими трудностями, включая ремонт, модернизацию и т. Д.
Шаг 5. Убейте бактерии вдыхаемым антибиотиком
(Пример: Tobi, Tobi podhaler, Colistin, Cayston)
После того, как очистка дыхательных путей и маневр кашля или грохота очистили ваши легкие от разрыхленной слизи, пришло время для вдыхания антибиотика, который помогает убить бактерии, оставшиеся в легких. .
Шаг 6. Уменьшите отек дыхательных путей с помощью противовоспалительного средства
Пример: Flovent, Advair)
CF дыхательные пути могут воспаляться от слизи и инфекции. Снизить отек помогут противовоспалительные препараты. Лучше всего принимать это в последнюю очередь после того, как будут приняты все другие лекарства. Всегда не забывайте полоскать рот после вдыхания стероидов.
Чтобы получить более подробную информацию о вышеуказанных лекарствах, щелкните здесь.
Щелкните здесь, чтобы получить более подробные инструкции от CF Foundation по проведению дыхательных процедур с вашим младенцем или малышом
Щелкните здесь, чтобы получить инструкции по очистке небулайзера
Пожалуйста, задавайте команде CF любые вопросы, которые могут у вас возникнуть.
Распыленный гипертонический раствор запускает опосредованную нервной системой активную секрецию жидкости при муковисцидозе трахеи свиней
Животные
Свиньи-самки и самцы дикого типа были приобретены в Центре свиней прерий Университета Саскачевана. Однонедельные поросята (~ 3 кг) использовали для визуализации in vivo ; Молодых свиней ~ 5-недельного возраста (~ 15 кг) использовали для экспериментов с изолированными трахеями. Кроме того, для визуализации дыхательных путей ex vivo , CFTR — / — трахеи были получены от 6 новорожденных (от 6 до 12 часов после рождения) свиней с нокаутом CFTR с коррекцией кишечника ( CFTR — / — ; TgFABP > свиней pCFTR ), приобретенных в Exemplar Genetics (Exemplar Genetics, Sioux Center, IA, USA).Трахеи рассекали в течение 30 минут после эвтаназии, зажимали с обоих концов для предотвращения попадания жидкости в просвет и помещали в ледяной физиологический раствор Кребса-Рингера 23 . В солевом растворе Кребса-Рингера, не содержащем бикарбонатов, 25 мМ NaHCO 3 заменяли 24 мМ NaCl и 1 мМ HEPES, pH 7,4, уравновешенными O 2 42 . Оба раствора имели одинаковое осмотическое давление 270 ± 0,7 и 269 ± 0,5 (n = 6).
Рентгеновская установка на основе синхротрона
Мы использовали новый метод визуализации на основе синхротрона для количественной оценки секреции ASL в дыхательных путях 23,24 .Эксперименты проводились с использованием изгибающего магнита для биомедицинской визуализации и терапии (BMIT-BM) 05B1-1 в канадском источнике света (CLS), Саскачеван, Канада. Экспериментальная будка находится в 25,5 метрах от накопительного кольца. Фазово-контрастное изображение (PCI) выполняли с использованием монохроматического рентгеновского излучения 33,4 кэВ (λ = 0,37 нм) для визуализации живых свиней и рентгеновского излучения 20 кэВ (λ = 0,062 нм) для визуализации изолированной трахеи, выбранных с помощью стандартного двухкристального монохроматора. . Размер луча составлял 100,0 мм (ширина) x 8.0 мм (по вертикали). Расстояние между образцом и детектором составляло 100 см (для in vivo визуализации ) и 65 см (для ex vivo визуализации изолированной трахеи). Изображения были получены с помощью оптоволоконной камеры (C4742-56-12HR, Hamamatsu Photonics, Сан-Хосе, Калифорния, США) или рентгеновского преобразователя высокого разрешения (AA-60, Hamamatsu Photonics, Сан-Хосе, Калифорния, США) с детектор с зарядовой связью (CCD) (C9300-124, Hamamatsu Photonics, San Jose, CA, USA). Размер изображения в пикселях 11,2 × 11.2 мкм (волоконно-оптическая камера) или 8,75 × 8,75 мкм (камера CCD). Время выдержки составляло от 500 до 900 мс.
Приготовление шариков агарозы
Мы использовали шарики агарозы в качестве «мерных стержней» для определения высоты слоя ASL, которая измерялась как расстояние между интерфейсом воздух / ASL и краем шарика агарозы, касающимся поверхностного эпителия, поскольку подробно описано в другом месте 24 . Гранулы агарозы получали в стерильных условиях с 4% агарозой в PBS, как описано 23,24 .Все растворы, использованные в процессе изготовления шариков агарозы, автоклавировали при 250 ° C в течение не менее 20 мин. Готовили теплый (50–55 ° C) 4% раствор агарозы в PBS. Раствор агарозы смешивали с теплым (50–55 ° C) тяжелым парафиновым маслом и быстро перемешивали, получая воронку глубиной 2 см. Смешанный раствор агарозы и масла оставляли в химическом стакане на 11 минут, а затем вокруг стакана медленно добавляли лед на 7 минут. После 7 мин охлаждения раствор агарозы / масла выливали в делительную воронку, содержащую теплый (50–55 ° C) 0.5% дезоксихолат натрия в PBS для смывания минерального масла с шариков. Гранулы агарозы оставляли для осаждения и затем трижды промывали PBS при комнатной температуре, чтобы смыть дезоксихолат натрия. Затем отбирали верхнюю треть гранул агарозы со дна делительной воронки и использовали для экспериментов. Гранулы агарозы, содержащие лидокаин и капсаицин, были приготовлены путем смешивания химикатов с теплым (50–55 ° C) 4% раствором агарозы непосредственно перед процедурой гелеобразования.
Предварительные эксперименты показали, что шарики не видны, если мы не добавили контрастное вещество.Таким образом, чтобы сделать шарики видимыми на рентгеновских лучах, мы добавили BaSO 4 (номинал 1 M) в качестве контрастного вещества к PBS. Эта соль была выбрана потому, что она нерастворима в воде и не влияет на осмотическое давление шарика. Осмолярность растворов шариков составляла 278 ± 0,1 и 276 ± 0,3 для PBS и PBS плюс 1 М BaSO 4 , соответственно 23 .
Экспериментальная установка
Для визуализации свиней in vivo животное держали в положении лежа на спине и надевали маску, подключенную к анестезиологическому аппарату, дающему 2% изофлурана в чистом медицинском кислороде со скоростью 1 л / мин (рис.1А). На протяжении всего эксперимента животные дышали спонтанно. Контролируют частоту дыхания, частоту сердечных сокращений, температуру тела и уровень насыщения O 2 , а также плоскость анестезии. Гортань опрыскивали лидокаином, чтобы предотвратить рефлекторный ответ при подготовке к интубации для каждого эксперимента. Эндотрахеальная трубка была помещена в отверстие гортани в трахею, и шарики агарозы (диаметром от ~ 400 до 1200 мкм) 24 были введены через эндотрахеальную трубку в трахею с потоком воздуха, после чего эндотрахеальный канал трубку сразу удалили.
Для визуализации дыхательных путей ex vivo трахею зажимали с обоих концов, чтобы предотвратить загрязнение просвета кровью или другими жидкостями. Хрящ был удален с помощью скальпеля и тонкого элеватора с тупым концом для улучшения доступа лекарств к эпителию и нервной ткани. Препарат трахеи был помещен в специальную камеру. Ткань погружали в раствор Кребса плюс 1 мкМ индометацина при 35 ° C и уравновешивали 95% O 2 и 5% CO 2 .Просвет препарата трахеи оставался свободным от раствора и запечатанным, чтобы предотвратить высыхание просвета, но исследователи могли открыть его и получить к нему доступ для введения гранул агарозы. Гранулы агарозы (диаметром от ~ 400 до 1000 мкм) промокали насухо и помещали в просвет препарата с помощью ватного тампона 23 . Чтобы проверить влияние нейронов дыхательных путей и эпителия на лечение HTS, атропин, тетродотоксин, CFTRinh272, блокатор NK-1 L-703606, буметанид и нифлуминовую кислоту растворяли в растворе Кребса с использованием специальной камеры.
Каждый шарик был помещен в место, где граница раздела воздух / ASL была параллельна рентгеновским лучам, проникающим в образец, то есть вверху или внизу препарата 23,24 , с использованием моторизованного экспериментального столика с компьютерным управлением для вращения. препарат (т.е. изолированный препарат и живое животное). Гипертонический (7% раствор NaCl в / в) и изотонический (0,9% раствор NaCl в / в) физиологические процедуры вводили с использованием небулайзера (705-445, AMG Medical Inc, Монреаль, Квебек, Канада), который производит жидкие аэрозоли с средний диаметр 4 мкм.Распыление проводили в течение 90 с с выдачей всего 0,3 мл жидкости. Для экспериментов in vivo и распыляемая жидкость подавалась непосредственно в лицевую маску, закрывающую свиней. Для экспериментов ex vivo аэрозоль подавали через один конец изолированной трахеи, а другой конец был открыт, чтобы позволить избыточному аэрозолю вытекать из препарата. Обработка гипертоническим солевым раствором или изотоническим солевым раствором начиналась в момент времени 0, а увеличение объема ASL было проверено через 18 минут после обработки.Изображения были получены за 3 минуты до лечения (-3 мин) и через 6, 12 и 18 минут после обработки (рис. 1С).
Измерение высоты ASL
Мы использовали большую разницу показателей преломления между воздухом и слоем ASL, которая дает сильный сигнал на интерфейсе воздух / ASL, используя фазово-контрастное изображение (PCI) (рис. 1B) 23,24 , 25,43,44 . Поскольку PCI не может очертить границу раздела ASL / ткани, мы установили положение ткани по отношению к интерфейсу воздух / ASL, используя гранулы агарозы в качестве «мерных стержней».Гранулы агарозы помещаются в ASL и вступают в прямой контакт с поверхностным эпителием из-за силы, создаваемой поверхностным натяжением ASL, как показано в другом месте 24 . Поверхностное натяжение ASL иммобилизует шарики на поверхности эпителия (то есть шарики не удаляются ресничками дыхательных путей), а жидкость, выделяемая дыхательными путями, которая обычно выводится из дыхательных путей за счет мукоцилиарного клиренса, сохраняется. вокруг статического шарика, что позволяет нам измерить накопление ASL, произведенного секрецией жидкости 23,24 .В небольшом количестве случаев, в 1 из 29 из экспериментов in vivo и в 3 из 70 из экспериментов ex vivo , дыхательные пути показали изменение диаметра во время эксперимента. Поскольку это могло повлиять на наши измерения, мы удалили эти эксперименты из нашего набора данных, чтобы устранить любые возможные артефакты, которые могут затруднить интерпретацию данных.
Исследователь, не знающий условий эксперимента, измерил высоту слоя ASL как расстояние между границей раздела воздух / ASL и краем шарика агарозы, касающимся поверхностного эпителия (рис.1Б) 23,24 . Данные представлены в виде разницы в высоте ASL (Δ слоя жидкости) в каждый момент времени и в виде начального измерения за 3 минуты до распыления (время –3 мин).
Статистика
Чтобы проверить эффект каждого экспериментального условия, мы сравнили высоту ASL, полученную каждым препаратом за 18 мин, используя ANOVA и тесты множественных сравнений Тьюки в GraphPad Prism 5 (GraphPad Software Inc., Сан-Диего, Калифорния, США) , с p <0,05 считающимися значимыми. Данные представлены как среднее ± S.E.M., где каждая отдельная гранула агарозы представляет собой точку данных 23,24 .
Наборы данных, обозначенные как HTS и ITS на рис. 1D, такие же, как и на рис. 2A, B. Наборы данных, обозначенные HTS и ITS на фиг. 1E, F, такие же, как и на фиг. 3A, B и D; и Фиг. 4A, B. Наборы данных, обозначенные HTS + 172 и ITS + 172 на фиг. 3B, такие же, как на фиг. 3C, E и G; и Фиг. 4A, B и C.
Реагенты
Лекарства были получены от Sigma-Aldrich, если не указано иное. CFTRinh272 был приобретен в Cedarlane Labs (Берлингтон, Онтарио, Калифорния), тетродотоксин был получен в Alomone labs (Иерусалим, Израиль), а спрей с гидрохлоридом лидокаина был приобретен в Odan Laboratories LTD (Монреаль, Канада).Исходные растворы CFTRinh272, лидокаина, атропина, буметанида, нифлумовой кислоты и L-703606 растворяли в ДМСО. Конечная концентрация ДМСО была менее 0,1%. Тетродотоксин растворяли непосредственно в очищенной воде.
Одобрение исследования
Все эксперименты проводились с одобрения Канадского источника света и Комитета по этике животных Университета Саскачевана. Все эксперименты проводились в соответствии с соответствующими руководящими принципами и правилами, установленными Комитетом по этике животных Университета Саскачевана и Канадским советом по уходу за животными.
Распыленный альбутерол в гипертоническом солевом растворе, а не в физиологическом растворе, может снизить количество госпитализаций у маленьких детей с острым свистящим дыханием
Распыление альбутерола в гипертоническом растворе, а не в физиологическом растворе, может снизить количество госпитализаций у маленьких детей с острым хрипом
Еженедельный обзор DynaMed — Том 7, выпуск 27
Прочтите полный еженедельный отчет / заработайте кредит CME
Вызванное вирусом свистящее дыхание является частой причиной посещения отделения неотложной помощи для маленьких детей, и симптомы часто не поддаются лечению бронходилататорами и кортикостероидами (N Engl J Med 2009, 22 января; 360 (4): 339, N Engl J Med 2009 22 января; 360 (4): 329).Существуют предыдущие доказательства того, что распыленный гипертонический раствор, отдельно или в смеси с адреналином, может улучшить исходы у младенцев с бронхиолитом (Cochrane Database Syst Rev, 2011, 16 марта; (3): CD006458, J Pediatr 2010 Oct; 157 (4): 630). В новом небольшом рандомизированном исследовании оценивались эффекты добавления гипертонического раствора к альбутеролу у 41 ребенка в возрасте от 1 до 6 лет, посещавших отделение неотложной помощи с эпизодами острого свистящего дыхания. После однократной ингаляции альбутерола с физиологическим раствором дети были рандомизированы для получения альбутерола, смешанного с гипертоническим солевым раствором 5% vs.альбутерол, смешанный с физиологическим раствором. Исследуемый препарат вводили дважды в отделении неотложной помощи с 20-минутным перерывом между приемами, а затем 4 раза в день, если ребенок был госпитализирован. Дети с вирусным бронхиолитом были исключены.
Альбутерол с гипертоническим солевым раствором был связан со значительным сокращением госпитализации по сравнению с альбутеролом плюс физиологический раствор (62,2% против 92%, p <0,05, NNT 4). физиологический раствор (p = 0.027). Показатели клинической тяжести были значительно ниже в обеих группах по сравнению с исходным уровнем, без существенных различий между группами (Pediatrics 2012 Jun; 129 (6): e1397).
Для получения дополнительной информации см. Раздел «Острый бронхит» в DynaMed.
Гипертонический раствор в лечении легочных заболеваний при муковисцидозе
Патогенез заболевания легких при муковисцидозе характеризуется уменьшением объема жидкости на поверхности дыхательных путей и последующим нарушением нормального мукоцилиарного клиренса.Слизь в дыхательных путях, пораженных муковисцидозом, обогащена отрицательно заряженными матрицами, состоящими из ДНК, высвобождаемой колонизирующими бактериями или воспалительными клетками, а также F-актином и повышенными концентрациями анионных гликозаминогликанов. Терапия, действующая против слизи в дыхательных путях при муковисцидозе, включает гипертонический раствор в виде аэрозоля. Было показано, что гипертонический раствор обладает муколитическими свойствами и способствует мукоцилиарному клиренсу за счет восстановления жидкого слоя, выстилающего дыхательные пути. Однако недавние клинические и лабораторные исследования начинают расширять наши взгляды на полезные эффекты гипертонического раствора, которые теперь включают противоинфекционные, а также противовоспалительные свойства.Этот обзор направлен на обсуждение описанных терапевтических преимуществ гипертонического раствора и, в частности, на выявление новых моделей действия гипертонического раствора независимо от гидратации дыхательных путей.
1. Введение
Муковисцидоз (МВ) — сложное генетическое заболевание с разнообразными проявлениями, наиболее важным из которых является повышенный риск хронического заболевания легких, приводящего к терминальной дыхательной недостаточности [1]. CF представляет собой аутосомно-рецессивное заболевание, вызванное мутациями в хлоридном канале регулятора трансмембранной проводимости CFTR.Было идентифицировано более 1000 мутаций в гене CFTR, которые приводят к неправильной укладке белка CFTR. Сообщаемые мутации можно в широком смысле классифицировать по классам мутаций, которые изменяют процессинг CFTR (классы I, II и V), а также мутации, возникающие в результате нерегулируемой секреции хлоридов (классы III, IV и VI) (рис. 1). Самый распространенный генетический дефект в процессинге CFTR включает мутацию ΔF508, из которых 90% страдающих МВ несут одну копию [2]. Дефекты функции белка CFTR не только влияют на цАМФ-зависимую секрецию хлоридов, но также приводят к увеличению абсорбции ионов, опосредованной эпителиальным натриевым каналом (ENaC-), в эпителии поверхностных дыхательных путей [3, 4].Как следствие, повышенная реабсорбция воды эпителиальными клетками дыхательных путей приводит к экстремальному обезвоживанию жидкого слоя на поверхности дыхательных путей, хроническому мукостазу и обструкции дыхательных путей [5]. Эта утолщенная слизь обеспечивает идеальную среду для бактериальной инфекции дыхательных путей, при этом Staphylococcus aureus ( S. aureus ) является основным бактериальным патогеном в ранние годы, а Pseudomonas aeruginosa ( P. aeruginosa ) — известным патогеном в взрослые пациенты [6, 7].
Обезвоживание жидкого слоя на поверхности дыхательных путей считается первичным инициирующим событием при заболевании легких, связанном с МВ [9], и терапевтические вмешательства для улучшения клиренса слизи являются краеугольным камнем лечения МВ [10]. Такие вмешательства включают регулярную физиотерапию грудной клетки, муколитики, такие как дорназа-альфа (ДНКаза) [11], а также гипертонический раствор в виде аэрозоля (HTS; 3–7% NaCl) [12]. HTS определяется как раствор, обладающий осмотическим давлением выше, чем у физиологического изотонического солевого раствора (0.9% NaCl). Было предложено, чтобы ингаляция HTS значительно улучшила мукоцилиарный клиренс [13], и популярность его использования возросла на основании ряда клинических испытаний [14-17]. Было предложено несколько механизмов для наблюдаемой эффективности, включая изменения реологических характеристик слизи в дыхательных путях [18], увеличение гидратации жидкости на поверхности дыхательных путей [19], ингибирование ENaC [20], а также иммуномодулирующие эффекты [21–23]. В то время как в крупном контролируемом исследовании сообщалось о умеренном положительном влиянии HTS на функцию легких [24], дальнейшие исследования вновь привлекли к нему внимание [25], и именно в этом контексте в этом обзоре будут собраны доказательства использования HTS в лечении. лиц с МВ.
2. Физические свойства слизи в дыхательных путях при муковисцидозе
В нормальном легком слизистый гель в основном состоит из гликопротеинов муцина, которые либо секретируются, либо связаны с клеточной мембраной. Эпителиальные клетки дыхательных путей экспрессируют три гелеобразующих муцина, включая MUC2, MUC5AC и MUC5B, хотя MUC5AC и MUC5B считаются основными гелеобразующими муцинами в секретах здоровых дыхательных путей. В то время как молекулярная масса муцинов в образцах CF и здоровых контрольных образцах дыхательных путей сопоставима, концентрация MUC5AC и MUC5B в мокроте CF заметно снижается [27].Это очень важно и побудило к исследованиям, направленным на изучение причинно-следственной связи, приводящей к образованию густой гнойной слизи в дыхательных путях при МВ. Основной причиной дегидратированной густой слизи является повышенная реабсорбция воды эпителиальными клетками дыхательных путей с дефектом CFTR. Однако второй причиной густой вязкой слизи при МВ является обогащение анионными полиэлектролитами, включая ДНК, продуцируемую колонизирующими бактериями или высвобождающуюся из лизированных воспалительных клеток [28, 29]. Более того, F-актин, высвобождаемый из некротических клеток в дыхательных путях при МВ, играет важную роль во вторичной полимерной сети мокроты при МВ [30].С помощью лазерной сканирующей конфокальной микроскопии были обнаружены сополимеры ДНК и F-актина, которые, как полагают, влияют на вязкоупругость CF мокроты [31, 32]. Кроме того, повышенные концентрации анионных гликозаминогликанов (ГАГ) были обнаружены в образцах слизи детей с МВ [33] (рис. 2). Например, сообщалось о значительном повышении уровня гиалуроновой кислоты в бронхах [34], при этом концентрация в мокроте в 100 раз выше, чем при остром бронхите. Более того, было показано, что мокрота при CF содержит значительно повышенные уровни хондроитина [35] и гепарансульфата [36], а ферментативное расщепление ГАГ хондроитиназой ABC in vitro, а не переваривание белка трипсином, снижает вязкоэластичность гнойной мокроты при CF [37]. .Важно отметить, что исследования также показали, что мутации в CFTR приводят к аберрантным уровням сульфатации. Конкретные изменения в цепях GAG и паттернах сульфатации могут способствовать усилению взаимодействий, обычно ионного характера, с различными белками, включая антимикробные пептиды [21] и провоспалительные стимулы [36, 38-40]. Данные, подтверждающие этот феномен, продемонстрировали синтез сверхсульфатированных гликоконъюгатов тканью CF в культуре органов [41] и эпителиальных клетках дыхательных путей [42, 43]. По сути, независимо от точной или комбинированной причины повышенной вязкости, утолщенная слизь в дыхательных путях при МВ отделяется от ресничек, и мукоцилиарный транспорт нарушается, что является основной причиной заболевания легких и смертности при МВ.Считается, что HTS действует путем вытягивания воды из эпителиальных клеток дыхательных путей с дефектом CFTR, тем самым регидратируя перицилиарный слой [44] и поддерживая мукоцилиарный клиренс [25] (Рисунок 3). Таким образом, HTS является одним из первых методов лечения, механизм действия которого позволяет обойти основной дефект CFTR.
3. Гипертонический раствор в лечении заболевания дыхательных путей при МВ
В 2006 году Элкинс и его коллеги из Национальной группы исследования гипертонического раствора при муковисцидозе провели исследование 164 пациентов, которые были рандомизированы для получения 7% HTS или изотонического раствора 0.9% физиологический раствор. Результаты не выявили существенной разницы в скорости изменения функции легких (измеренной по форсированной жизненной емкости и объему форсированного выдоха за одну секунду (ОФВ1)), но абсолютная разница в функции легких между группами была значимой (= 0,03). Очень важно то, что это исследование предоставило первые доказательства долгосрочной эффективности HTS и показало заметное снижение количества обострений по сравнению с пациентами, получавшими изотонический физиологический раствор [24]. Аналогичным образом, в исследовании, проведенном Дональдсоном и его коллегами (2006), пациенты, получавшие HTS (7% четыре раза в день в течение 14 дней с амилоридом (ингибитор ENaC) или без него), продемонстрировали улучшение мукоцилиарного клиренса и FEV1 при применении отдельно, а не при конъюгации. с амилоридом [25].Эффект HTS в этом последнем исследовании можно было сравнить только с исходным уровнем, поскольку не была включена контрольная группа изотонического солевого раствора [25], однако их выводы были поддержаны в дальнейшем исследовании с использованием радиоаэрозольной технологии [13]. В этом последнем исследовании пациенты с МВ, получавшие HTS, имели значительно увеличенный мукоцилиарный клиренс по сравнению с пациентами, получавшими амилорид или изотонический раствор [13]. Еще одно соображение при обсуждении эффективности HTS — это вводимый объем. В исследованиях, проведенных Elkins et al., [24] и Donaldson et al. , [25] 4 и 5 мл HTS были распылены, соответственно, и их исследования зафиксировали меньшее улучшение функции легких по сравнению с Ballmann и von der Hardt [15] и Eng et al. , [16], которые доставили 10 мл HTS. Более того, в недавней стратифицированной оценке воздействия HTS на легочные обострения МВ Dmello et al. , (2011) рассмотрели 340 случаев, из которых 99 были связаны с лечением HTS. Благодаря использованию многомерного логистического регрессионного анализа их результаты подтвердили лечение с помощью HTS в контексте уменьшения легочных обострений, связанных с заболеванием легких CF [45].
Было показано, что HTS увеличивает мукоцилиарный клиренс у взрослых с МВ [13, 25, 44], но, напротив, не значительно улучшает мукоцилиарный клиренс у детей с МВ (средний возраст 10,5 лет) [46]. Однако различия в терапевтической эффективности HTS у взрослых и детей могут быть связаны со степенью поражения дыхательных путей. Тем не менее, если HTS может улучшить мукоцилиарный клиренс, воздействуя на фундаментальный дефект гидратации, он может оказаться наиболее успешным при лечении пациентов подросткового возраста и подростков до того, как возникнет заболевание дыхательных путей.С этой целью в недавнем исследовании 18 молодых участников (в возрасте 12–30 месяцев), которые получали 7% HTS два раза в день в течение 14 дней, Rosenfeld и соавторы (2011) показали, что HTS хорошо переносится при высокой приверженности пациента [47]. . Кроме того, индекс клиренса легких, показатель физиологии легких, полученный в результате множественных тестов на вымывание дыханием, улучшился у педиатрических пациентов (6–18 лет), получавших 7% HTS, по сравнению с изотоническим физиологическим раствором (0,9%) [14]. Кроме того, исследование, оценивающее безопасность и переносимость ингаляционных HTS, предварительно обработанных распыленными бета-адренергическими агонистами (сальбутамолом), у детей дошкольного возраста (средний возраст 5 лет.7 ± 0,8 года) и младенцы (средний возраст 1,6 ± 1 года) с МВ не показали клинически значимого снижения FEV1, FVC или FEF 25–75 после лечения HTS. Только у одного пациента отмечалось клинически значимое снижение (> 20%) легочной функции, однако у этого пациента был ранее установлен диагноз гиперактивности бронхов [48].
Индуцированный кашель также может быть важным механизмом, с помощью которого HTS улучшает мукоцилиарный клиренс у пациентов с CF. Пациенты, получавшие HTS, после лечения имеют больше эпизодов кашля [48], и это само по себе может улучшить мукоцилиарный клиренс за счет создания сильного стресса, который способствует удалению слизи с поверхности дыхательных путей [49].Оптимальная доза HTS все еще является предметом дискуссий, поскольку увеличение доз (с 3% до 7%) требует увеличения времени распыления, что является потенциально нереалистичным бременем для пациентов [50], при этом комплаентность составляет только 64% [24]. В этом отношении было показано, что коаэрозолизация 7% HTS с 0,1% гиалуронатом значительно улучшает переносимость и приятное ощущение по сравнению с одним HTS [51]. Более того, влияние HTS на мукоцилиарный клиренс оказывается дозозависимым. В исследовании, проведенном Робинсоном и коллегами (1997), уровни мокроты, очищенной за 90 минут, увеличивались по мере постепенного увеличения концентрации NaCl (0.9%, 3%, 7% и 12%). Однако пациенты испытывают значительное раздражение ротоглотки при концентрациях, приближающихся к 12%, что делает это верхним пределом переносимости для большинства пациентов.
Улучшение мукоцилиарного клиренса с помощью HTS может стать полезным дополнением для увеличения количества мокроты, доступной для микробиологической оценки у пациентов, например, у пациентов с легкими заболеваниями или маленьких детей, которым трудно отхаркивать мокроту. Этим пациентам часто проводят гибкую бронхоскопию и бронхоальвеолярный лаваж, чтобы получить адекватные объемы образцов для посева и чувствительности.Таким образом, индуцированная HTS мокрота может быть клинически полезной за счет увеличения объема откашливаемой мокроты, доступной для микробиологического посева [52], как ранее было показано для детей с МВ [53].
4. Влияние гипертонического раствора на инфекцию и воспаление
HTS действительно улучшает мукоцилиарный клиренс и функцию легких у пациентов с CF, но в ряде исследований также изучалась возможность того, что HTS может влиять на воспалительную реакцию в дыхательных путях и в дыхательных путях. конкретные уровни провоспалительного хемокина нейтрофилов, интерлейкина (ИЛ) -8.В долгосрочном контролируемом исследовании ингаляционных HTS у пациентов с CF, проведенном Elkins и соавторами (2006), измерения провоспалительных цитокинов IL-6, IL-8, IL-10 и фактора некроза опухоли альфа (TNF-альфа) ) были сделаны в мокроте во время скрининга и в нескольких более поздних точках до 48 недель после внедрения HTS-распыления [24]. Однако не было обнаружено значительных различий в уровнях мокроты между этими группами (IL-6, = 0,94; IL-8, = 0,36; IL-10, = 0,81, и TNF-альфа, = 0.38), хотя все протестированные образцы были взяты из периода после рандомизации, и прямого сравнения между образцами мокроты до и после ингаляции или образцами, взятыми перед началом лечения HTS, не проводилось. Во втором исследовании Aitken et al. (2003) измеряли количество IL-8 и нейтрофилов в мокроте при МВ в 5 последовательных временных точках в течение 20 минут после распыления HTS. Хотя процент нейтрофилов снизился (с 89 ± 5% до 86 ± 4%; = 0,03), концентрация IL-8 осталась прежней [54]. Благоприятный эффект HTS на снижение количества нейтрофилов в дыхательных путях также наблюдался на животной модели индуцированного повреждения легких, после чего 7.5% HTS значительно снизил количество клеток в жидкости бронхиального лаважа с 46,8 ± 4,4 × 10 3 до 24,5 ± 5,9 × 10 3 клеток / мл (<0,05).
Неожиданно было также показано, что условия HTS могут фактически увеличивать продукцию IL-8 клетками железы CF через путь NF- κ B [55] и экспрессию IL-8 в эпителиальных клетках бронхов человека через митоген p38 — активировали активацию протеинкиназ [56]. Более того, исследование людей с астмой или ХОБЛ (по 10 пациентов в каждой группе) показало, что вдыхание HTS вызывает низкий уровень воспаления в дыхательных путях с увеличением уровней IL-6 и TNF-альфа, регистрируемых в конденсате выдыхаемого воздуха [ 57].Напротив, на клеточном уровне было обнаружено, что положительные эффекты HTS включают снижение арахидоновой кислоты и индуцированное лейкотриеном-B 4 праймирование респираторного выброса изолированных нейтрофилов [58] и подавление активности mTOR в мононуклеарных клетках [59]. ]. В дополнительных исследованиях положительные эффекты HTS были выявлены в виде повышения уровня HTS глутатиона и тиоцианата, которые защищают от окислителей в легких [60].
Дальнейшее исследование Suri et al. (2001) сравнивало эффекты HTS и дорназы-альфа на медиаторы воспаления и не обнаружило значительной разницы в уровнях IL-8 в мокроте при МВ до и через 18 часов после распыления HTS [17].Действительно, было высказано предположение, что рчДНКаза может фактически способствовать воспалению за счет высвобождения катионных медиаторов, связанных с внеклеточной ДНК, таких как протеазы, а также активного ИЛ-8, которые могут усиливать нейтрофильное воспаление, вызывая дальнейшее повреждение легких [61, 62]. Этот последний пункт, очевидно, вызывает беспокойство, но исследования нашей группы показали, что когда IL-8 высвобождается из отрицательно заряженных матриц, включая ГАГ, это делает хемокины чувствительными к протеолизу, и что существует период времени, в течение которого уровни IL-8 остаются значительно снизился после лечения HTS [23].Согласно результатам, продемонстрированным Frevert et al. (2003) [63], в рамках нашего исследования мы обнаружили, что IL-8 в жидкости бронхиального лаважа при МВ присутствует в высокомолекулярных комплексах с участием ГАГ, включая гепаран и хондроитинсульфат [23]. Нарушая ионные взаимодействия между IL-8 и GAG, HTS вытесняет IL-8 из матриц GAG, делая хемокины чувствительными к протеолитической деградации нейтрофильной эластазой, тем самым влияя на воспаление [23]. Другой ключевой медиатор воспаления, который обнаружен в легких при МВ и, как считается, играет важную роль в патофизиологии заболевания легких при МВ, — это антимикробный пептид кателицидин (LL-37) [64, 65].LL-37 демонстрирует антимикробную активность против ряда бактерий, включая S. aureus , Escherichia coli [66] и P. aeruginosa [21], и, хотя он присутствует в высоких концентрациях в легких CF, активность LL -37 ингибируется связыванием с ГАГ [66]. Высвобождение LL-37 в ЖБАЛ при CF было вызвано ферментативным расщеплением ГАГ (гиалуронидазой, хондроитиназой ABC или гепариназой II), тем самым увеличивая бактерицидную эффективность CF BALF против бактерий Pseudomonas и Staphylococcus [21].В свою очередь, HTS может также улучшать функцию легких, нарушая электростатические взаимодействия между ГАГ и антимикробными пептидами. В поддержку этой теории in vivo LL-37 в мокроте CF высвобождались из ГАГ после распыления HTS (7%), что приводило к усилению антимикробного эффекта [21]. Таким образом, терапия HTS может напрямую влиять на жизнеспособность бактерий в дыхательных путях при МВ. Фактически, эффект HTS на P. aeruginosa проявляется многократно, при этом высокая ионная сила влияет не только на подвижность, опосредованную флагеллином [22], но и на жизнеспособность субпопуляции слизистой оболочки [67].
5. Чем отличается гипертонический раствор с другими методами лечения?
В то время как HTS является рентабельным [68] и был предложен для улучшения мукоцилиарного клиренса и функции легких при МВ, другие оцениваемые методы мобилизации слизи включают дорназу-альфа [69], ингаляционный маннит [70], гельзолин, расщепляющий актин. филаменты [30] и производные тиола, такие как н-ацетилцистеин, хотя клинические преимущества последнего лечения неясны [71]. Поскольку высокие концентрации ДНК способствуют вязкости секрета дыхательных путей, лечение дорназой-альфа, ферментом, расщепляющим полимеры ДНК, приводит к значительному снижению вязкости слизисто-гнойной мокроты [72].Рандомизированные контролируемые испытания продемонстрировали улучшение ОФВ1 у пациентов, получавших дорназу-альфа [73–75], и, хотя она кажется более эффективной, чем HTS, некоторые вариации в ответах отдельных пациентов были очевидны [76]. Небольшое рандомизированное исследование 14 пациентов, проведенное Ballmann и Von Der Hardt, показало среднее увеличение ОФВ1 на 7,7% у пациентов, получавших HTS, по сравнению с 9,3% у пациентов, получавших дорназу-альфа [15]. Более крупное исследование 48 детей, рандомизированных на 12 недель ежедневного приема дорназы-альфа (2.5 мг), через день дорназа-альфа и два раза в день HTS (7%) продемонстрировали среднее увеличение ОФВ1 на 16% (стандартное отклонение 25%), 14% (стандартное отклонение 22%) и 3% (стандартное отклонение 21%) в каждой из групп лечения соответственно. Эти исследования убедительно свидетельствуют о том, что дорназа-альфа более эффективна, чем HTS [17].
Ингаляционная терапия маннитом была предложена в качестве дополнительной стратегии для улучшения гидратации поверхности дыхательных путей и мукоцилиарного клиренса у пациентов с МВ. Маннитол — это осмотический агент с высокой молекулярной массой, который улучшает гидратацию поверхности дыхательных путей за счет медленного притока воды через перицеллюлярный путь [70].Более ранние исследования показали, что маннит улучшает мукоцилиарный клиренс у пациентов с астмой и бронхоэктазами, не связанными с МВ [77, 78]. Двухнедельный курс ингаляционного маннита у пациентов с МВ привел к увеличению среднего FEV1 по сравнению с исходным уровнем на 7% (95% доверительный интервал, от 3,3 до 10,7), а также среднего FEF 25–75 на 15,5% (95% доверительный интервал от –6,5 до 24,6) по сравнению с плацебо [79]. В то время как международное испытание, оценивающее влияние вдыхаемого сухого порошка маннита на функцию легких при МВ, показало устойчивое клиническое преимущество маннита независимо от рчДНазы [80], крупных рандомизированных испытаний, сравнивающих влияние HTS и маннита при лечении пациентов, не проводилось. .Однако небольшое исследование, сравнивающее вдыхаемые HTS и маннитол с плацебо, показало, что как HTS, так и маннит показали улучшение клиренса бронхиальной слизи в период после вмешательства (8,7 ± 3,3% и 10,0 ± 2,3% соответственно) [81].
6. Гипертонический раствор при лечении других заболеваний дыхательных путей
В то время как в данном обзоре основное внимание уделялось бронхоэктазам, связанным с МВ, бронхоэктазы, не связанные с МВ, являются частым клиническим состоянием и обнаруживаются гораздо чаще. в США более 110 000 человек.В то время как несколько исследований продемонстрировали преимущества HTS при CF, есть предварительные данные о терапевтических преимуществах HTS у пациентов с бронхоэктазами, отличными от CF, которые имеют отношение к этому обзору. В двойном слепом исследовании 96 младенцев, получавших многократные дозы распыленного 3% HTS или изотонического солевого раствора, у детей, получавших HTS, наблюдалось клинически значимое сокращение продолжительности пребывания в больнице на 26% [82]. В небольшом исследовании 24 человек со стабильными бронхоэктазами, не связанными с МВ, Келлетт и его коллеги (2005) сообщили, что пациенты, получавшие 7% HTS, показали значительно более высокий вес мокроты, снижение вязкости мокроты и легкость отхаркивания, чем пациенты, получавшие изотонический физиологический раствор ( <0.0001). Медиана ОФВ1 и ФЖЕЛ продемонстрировали статистически значимое улучшение (= 0,043) [83]. Кроме того, недавнее исследование того же автора показало, что HTS эффективен в уменьшении задержки мокроты у пациентов с бронхоэктазами, не связанных с МВ, что приводит к улучшению функции легких и снижению годового использования антибиотиков и использования неотложной медицинской помощи [84].
Бронхиолит — основная причина госпитализации младенцев с вирусной инфекцией, которая начинается как инфекция верхних дыхательных путей и затем прогрессирует с поражением нижних мелких дыхательных путей легкого.В исследовании Al-Ansari et al. (2010) оценивалась клиническая полезность HTS по сравнению с изотоническим солевым раствором при лечении детей с бронхиолитом и показано, что распыление 5% HTS улучшило оценку тяжести бронхиолита у пациентов с вирусным бронхиолитом по сравнению с лечением. с 0,9% и 3% физиологическим раствором [85]. HTS также предлагалось использовать при хронических заболеваниях легких (ХОБЛ), астме и пневмонии [86–90]. Исследование безопасности выделения мокроты у 100 человек с ХОБЛ показало, что HTS можно использовать, адаптируя лечение к конкретным потребностям пациента при ХОБЛ средней и тяжелой степени [90].Более того, в многоцентровом исследовании 79 пациентов с астмой средней и тяжелой степени, показатели воспаления (IL-8, миелопероксидаза, эозинофильный катионный белок и эластаза нейтрофилов) в HTS-индуцированной мокроте были такими же воспроизводимыми, как и показатели, присутствующие в мокроте после метахолина PC. 20 обращения [87].
7. Заключение
Терапия, действующая против слизи в дыхательных путях при МВ, включает декстран, нацистелин [91] и гельсолин [30], которые обладают муколитическими свойствами, но доказательств того, что эти агенты вызывают стойкое облегчение обструкции дыхательных путей при хроническом заболевании легких, нет.При сравнении положительных эффектов аэрозольного введения дорназы-альфа и HTS [17], дорназа-альфа улучшала ОФВ1 и уменьшала частоту легочных обострений [73], но проиллюстрировала комбинированный эффект при введении HTS для очистки гнойной мокроты от CF [ 18]. Лечение HTS связано с улучшением функции легких и заметным преимуществом в отношении обострений (таблица 1) [24, 25, 92, 93]. Как заявили Элкинс и Бай (2006), «HTS широко применяется в качестве недорогой терапии для большинства пациентов с МВ» [92] и имеет огромную ценность в индивидуальном порядке для пациентов, не переносящих дорназу-альфа [12].
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Подобно манниту [94], положительный эффект распыленных HTS на мукоцилиарный клиренс основан на восстановлении жидкого слоя, выстилающего дыхательные пути [26, 95] .Эта простая схема, которая в течение многих лет служила удовлетворительной рабочей гипотезой, может быть неполной. В настоящее время исследования показывают, что HTS также могут функционировать, высвобождая основные противомикробные и иммунные молекулы из комплекса с ионными матрицами, что улучшает как антимикробную эффективность, так и разрешение воспаления (рис. 4). Эти наблюдения предполагают, что HTS имеет полезные терапевтические эффекты, помимо простого увеличения мукоцилиарного клиренса, и поэтому крайне необходимы дальнейшие исследования потенциальных механизмов этой доступной в настоящее время терапии.
Благодарности
Авторы хотели бы поблагодарить Совет по исследованиям в области здравоохранения Ирландии за грант No. PHD / 2007/11, Благотворительная группа медицинских исследований, Научный фонд Ирландии в рамках программы Research Frontiers (11 / RFP / BMT / 3094) и Программа исследований в институтах третьего уровня, находящаяся в ведении Управления высшего образования для поддержки.



