Лапароскопия печени в Израиле | Клиника Ихилов
Каковы показания к проведению лапароскопической резекции печени?
Показания к лапароскопической резекции печени не отличаются от показаний к резекции открытым методом; иными словами, если операция открытым методом противопоказана, то противопоказана и лапароскопическая резекция. Это относится и к операциям на других органах.
Резекция печени проводится с целью удаления части печени, пораженной доброкачественной или злокачественной опухолью.
Благодаря удивительной способности печени к регенерации, можно удалить до 70% ее тканей, не нанеся ей необратимый ущерб и без непоправимых последствий для пациента.
При этом удаление доброкачественной опухоли рекомендуется лишь в тех случаях, когда она является источником ярко выраженных нежелательных симптомов (к примеру, из-за большого размера давит на расположенные рядом структуры), а также когда существует риск ее превращения в злокачественную опухоль (как это происходит с некоторыми аденомами).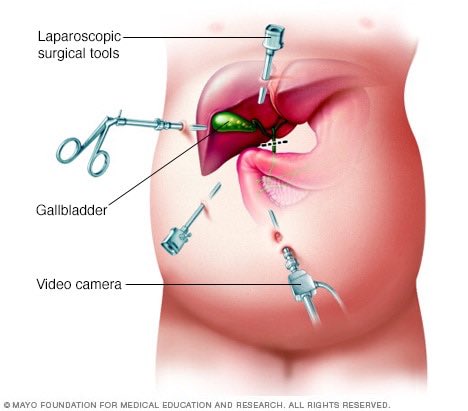
Злокачественная опухоль в печени может быть первичной (когда ее источником является ткани самой печени, как в случае гепатоцеллюлярной карциномы или холангиокарциномы) или вторичной (когда речь идет о метастазах, источником которых является рак толстой кишки или других органов, расположенных в брюшной полости или вне её).
Каковы показания к выполнению лапароскопической резекции?
Печень делится на 8 сегментов. Опухоли, расположенные в более поверхностных сегментах (2-м, 3-м, части 4-го, 5-м и 6-м), больше всего подходят для лапароскопического вмешательства. Однако и более обширные резекции (например, резекция правой или левой доли) могут быть выполнены с помощью малоинвазивных методов.
Как правило, размер опухоли составляет менее 5-7 см. Злокачественные опухоли вполне можно удалять лапароскопическим методом.
Как проходит операция?
Операция проводится под общим наркозом. По необходимости, на любой стадии хирург может перейти к открытой операции.
После окончания приготовлений и подачи наркоза, хирург делает крошечные надрезы в коже и вводит через них «рукава» (полые трубки) диаметром от 5 до 12 мм. Он раздувает брюшную полость при помощи углекислого газа, чтобы создать рабочее пространство.
Он раздувает брюшную полость при помощи углекислого газа, чтобы создать рабочее пространство.
Надрезы (обычно их 4 или 5) расположены в верхней части брюшной полости, в районе печени.
Операция начинается с осмотра брюшной полости и самой печени и ультразвукового исследования печеночной ткани, которое позволяет распознать опухоль и окружающие ее кровеносные сосуды, а также обнаружить другие опухоли, если они имеются.
После того как опухоль удалена, хирург должен убедиться в отсутствии кровотечения и просачивания желчи. Надрезы зашиваются абсорбирующимся (рассасывающимся) шовным материалом.
По окончании операции пациента переводят в послеоперационную палату, чтобы он мог постепенно отойти от наркоза. Затем он поступает в отделение хирургии, где находится под постоянным наблюдением медперсонала. В большинстве случаев госпитализация является короткой и длится от 1 до 3 дней, в зависимости от объема операции и индивидуального темпа восстановления.
Что происходит после операции?
Как правило, после лапароскопии восстановление происходит быстрее, чем после операции, проведенной открытым методом. Вместе с тем следует помнить, что речь идет о сложном хирургическом вмешательстве. Все осложнения, характерные для обычной резекции печени, могут произойти и после лапароскопической операции.
Вместе с тем следует помнить, что речь идет о сложном хирургическом вмешательстве. Все осложнения, характерные для обычной резекции печени, могут произойти и после лапароскопической операции.
Как правило, в первые дни после операции пациент будет отдыхать. Процесс восстановления характеризуется постепенным возвращением к нормальной жизнедеятельности: больной начинает пить, есть и ходить. В конце этого процесса пациента выписывают, и он возвращается домой, продолжая лечение и обследования амбулаторно.
Пациента пригласят на обследование в клинике, где хирург проверит его состояние и обсудит с ним результаты гистологического анализа удаленной части печени и продолжение лечения.
Что произойдет после выписки из больницы?
Темп выздоровления зависит от объема резекции и того, как прошла операция.
При маленьких и средних резекциях восстановление включает в себя пробуждение после наркоза, нормализацию деятельности пищеварительной системы и заживление раны. Госпитализация в среднем длится несколько дней, и после выписки пациент довольно быстро возвращается к нормальной жизни.
При обширных резекциях восстановление происходит медленнее. После выписки из больницы начинается период реабилитации, во время которого печень постепенно регенерирует до размеров, соответствующих физиологическим и метаболическим потребностям пациента. Этот процесс занимает от 6 до 8 недель, во время которых больной может ощущать слабость.
В течение первых 6-8 недель после операции рекомендуется избегать активной физической деятельности и половых контактов. Если в этот период вы чувствуете усталость или головокружение, лучше не садиться за руль, пока эти ощущения не пройдут.
Для поддержания гигиены желательно дважды в день мыть прооперированный участок водой с мылом.
Спустя примерно месяц после операции пациент будет приглашен на осмотр у оперировавшего его хирурга.
Если температура поднялась выше 38 градусов, следует обратиться в приемный покой, где проведут дальнейшее обследование.
Опухоль печени — лапароскопическая операция, лапароскопия [Видео]
Лапароскопическая резекция печени (2-3 сегменты, ФНГ 7 см)
Лапароскопическая резекция печени (2-3 сегменты, ФНГ 7 см)
Оперирует профессор Э. А. Галлямов, модерирует профессор К. В. Пучков, ассистирует к.м.н. Д. К. Пучков (2018 г).
А. Галлямов, модерирует профессор К. В. Пучков, ассистирует к.м.н. Д. К. Пучков (2018 г).
Мастер-класс 6.07. с комментариями, г. Дербент.
В фильме показана техника резекции печени ( 2,3 сегментов), с сохранением 4 сегмента при фокальной нодулярной гиперплазией (7 см). Мобилизация печени проводится с помощью 5 мм инструмента Harmonic Scalpel Ethicon и инструментами Компании Karl Storz, с последовательным пересечением круглой и серповидной связок. Намечается линия резекции. Далее последовательно гармоническим скальпелем и биполярным пинцетом выполняется диссекция печёночной паренхимы до секреторной ножки и вены 2 и 3 сегментов. Эти образования выделяются печеночным диссектором (Aesculap), лигируются системой Hem-o-lock и пересекаются между клипсами. Затем выделяется левая печеночная вена, которая берётся на держалку, прошивается и пересекается аппаратом Endo GIA MEDTRONIC COVIDIEN сосудистой белой кассетой 45 мм. Окончательный точечный гемостаз выполняется биполяром и гемостатиком PerClot (Italy). Препарат с опухолью погружается в специальный пластиковый контейнер MEDTRONIC COVIDIEN, который извлекается через поперечный минидоступ над лоном 6 см. Объём кровопотери составил 500 мл. Время операции 2ч 40 минут
Препарат с опухолью погружается в специальный пластиковый контейнер MEDTRONIC COVIDIEN, который извлекается через поперечный минидоступ над лоном 6 см. Объём кровопотери составил 500 мл. Время операции 2ч 40 минут
Лапароскопическая левосторонняя гемигепатэктомия
Лапароскопическая левосторонняя гемигепатэктомия. Оперирует профессор А. ФОРДЖИОНЕ (2017)
Операция проводится по поводу метастаза в левую долю печени. В видео показана техника лапароскопической левосторонней гемигепатэктомии с помощью 5 мм инструмента Harmonic Scalpel Ethicon , биполяра, клипирования сосудистых структур и желчных протоков, прошивания и пересечения вены аппаратом Endo GIA MEDTRONIC COVIDIEN белой кассетой 45 мм. Препарат погружается в специальный пластиковый контейнер MEDTRONIC COVIDIEN, который в конце операции извлекается через расширенный доступ.
Удаление опухолей печени — лапароскопия или робот «Да Винчи»?
Печень – один из самых важнейших органов человеческого организма, значение которого для нормального функционирования нашего организма трудно переоценить. Печень нейтрализует вредные вещества – алкоголь, лекарства – которые мы получаем как из внешней среды, так и те, которые образуются внутри самого организма, она вырабатывает желчь, синтезирует белок крови.
Печень нейтрализует вредные вещества – алкоголь, лекарства – которые мы получаем как из внешней среды, так и те, которые образуются внутри самого организма, она вырабатывает желчь, синтезирует белок крови.
Рак печени излечим!
Рак печени, благодаря применению современных инновационных технологий, поддается лечению. На ранних стадиях рака печени самым действенным способом лечения остается хирургическое удаление опухоли, чаще всего требуется резекция части пораженного органа. Тысячи операций на печени выполняются во всем мире и в Израиле каждый год, и, как правило, они имеют положительные результаты.
Три основных метода хирургии – открытая хирургическая операция, миниинвазивная лапароскопическая хирургия, роботизированные операции – используются сегодня хирургами Израиля для лечения злокачественных новообразований печени.
Цель хирургической операции заключается в удалении пораженных участков, на которых появились раковые клетки и метастазы, и сохранении при этом здоровых тканей печени для того, чтобы не нарушить функций печени. Возможности печени, как органа, способного регенерировать, позволяет удалить до 80% поражений – и в течение четырех-шести недель произойдет восстановление клеток печени.
Возможности печени, как органа, способного регенерировать, позволяет удалить до 80% поражений – и в течение четырех-шести недель произойдет восстановление клеток печени.
Методы хирургического удаления печени в Израиле
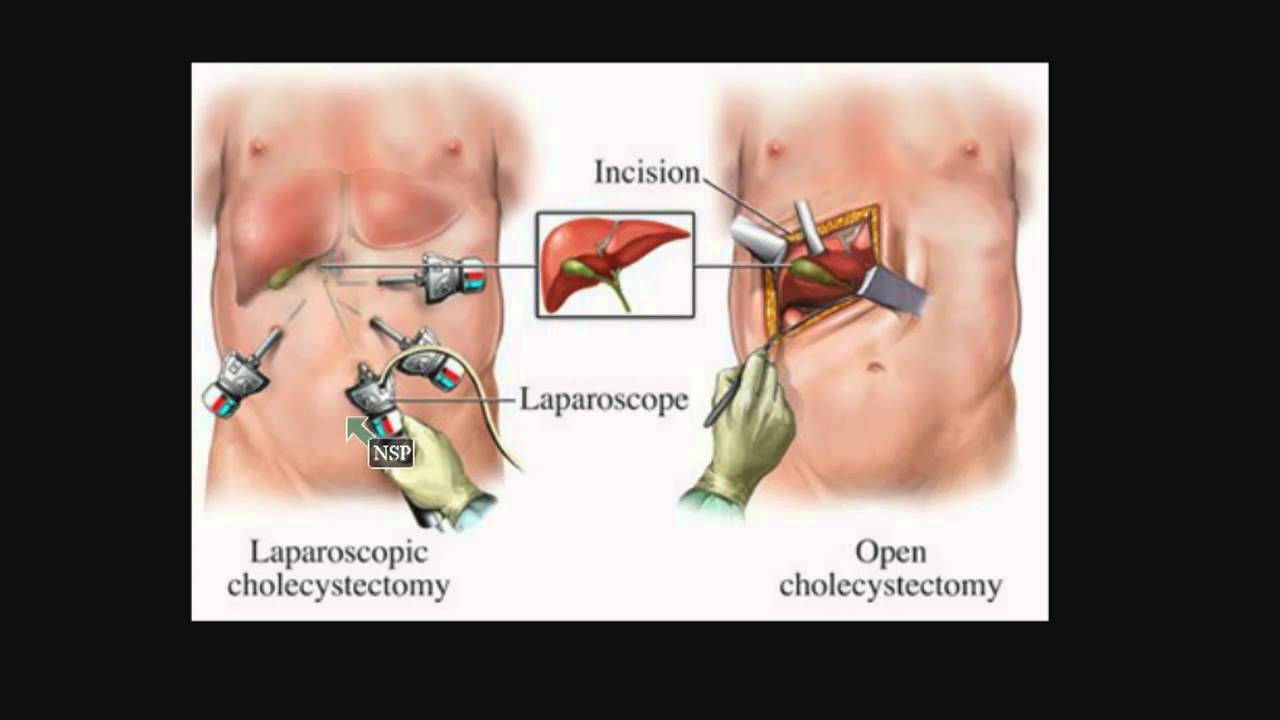
- Открытая операция – еще совсем недавно оставалась единственным вариантом хирургического вмешательства. Доступ к печени, которая находится в верхней правой части живота, требовал большого хирургического разреза.
Как и любая другая открытая операция, операция на печени может сопровождаться различными осложнениями, как в процессе самой операции, так и в последующие часы. К самым распространенным осложнениям относятся: открывшееся во время операции, или в течение 24 последующих часов, кровотечение, гнойные воспаления на месте разреза, утечка желчи с места резекции участка печени, печеночная недостаточность, повреждение близлежащих кровеносных сосудов.
В последние годы традиционная хирургия все чаще заменяется на менее травматичные лапароскопические методы резекции печени. Ежегодно в мире проводятся тысячи удачных лапароскопических операций на печени.
Ежегодно в мире проводятся тысячи удачных лапароскопических операций на печени.
- Что такое лапароскопическая хирургия?
Лапароскопическая техника хирургического вмешательства не требует больших разрезов в брюшной полости больного. Хирургом выполняется несколько небольших разрезов, через которые потом вставляются тонкие трубки, диаметром до 12 мм с миниатюрной камерой, через которую изображение передается на экран. Хирурги могут видеть область, на которой производится операция, что позволяет избежать ошибок и осложнений традиционной хирургии.
Преимущества лапароскопических методов очевидны: после проведения операции практически не остается рубцов, пациент меньше страдает от послеоперационных болей, сокращается период госпитализации, и пациент может быстрее вернуться к привычному образу жизни, а, в случаях раковых заболеваний – быстрее начать лечение химиотерапией.
- Роботизированная хирургия – робот «Да Винчи»
Роботизированная хирургия также относится к миниинвазивным лапароскопическим операциям, только в отличие от обычных лапароскопических методов, производится посредством специального робота. Все сложные манипуляции выполняются роботом – сам хирург находится в отдалении и руководит действиями робота, находясь у монитора. Хирург может контролировать глубину разреза, его точность, правильность местоположения, что еще больше снижает риски и осложнения, возможные при проведении хирургического вмешательства.
Все сложные манипуляции выполняются роботом – сам хирург находится в отдалении и руководит действиями робота, находясь у монитора. Хирург может контролировать глубину разреза, его точность, правильность местоположения, что еще больше снижает риски и осложнения, возможные при проведении хирургического вмешательства.
Так какой хирургический подход выбрать?
Решение о выборе метода хирургического удаления печени зависит от нескольких факторов, таких как количество и расположение пораженных очагов в печени, общего состояния здоровья пациента, и, самое главное, наличия опыта хирурга при проведении операции тем, или другим методом. Именно лечащий хирург выбирает наиболее безопасный метод для конкретного пациента с лучшими шансами полного удаления опухоли.
ТЕХНИКА ЛАПАРОСКОПИЧЕСКОЙ ДОНОРСКОЙ ЭКСПЛАНТАЦИИ ЛЕВОГО ЛАТЕРАЛЬНОГО СЕКТОРА ПЕЧЕНИ ДЛЯ ТРАНСПЛАНТАЦИИ | Загайнов
1. Kluger M.D., Vigano L. , Barroso R., Cherqui D. The learning curve in laparoscopic major liver resection. J. Hepatobiliary Pancreat. Sci. 2013; 20 (2): 131–136. DOI: 10.1007/s00534-012-0571-1.
, Barroso R., Cherqui D. The learning curve in laparoscopic major liver resection. J. Hepatobiliary Pancreat. Sci. 2013; 20 (2): 131–136. DOI: 10.1007/s00534-012-0571-1.
2. Dutkowski P., De Rougemont O., Müllhaupt B., Clavien P.A. Current and future trends in liver transplantation in Europe. Gastroenterology. 2010; 138 (3): 802–809. e1-802-809.e4. DOI: 10.1053/j.gastro.2010.01.030.
3. Moon D.B., Lee S.G., Hwang S., Kim K.H., Ahn C.S., Ha T.Y., Song G.W., Jung D.H., Park G.C., Namkoong J.M., Park H.W., Park Y.H., Park C.S. Toward more than 400 liver transplantations a year at a single center. Transplant. Proc. 2013; 45 (5): 1937–1941. DOI: 10.1016/j.transproceed.2012.12.015.
4. Kim K.H., Jung D.H., Park K.M., Lee Y.J., Kim D.Y., Kim K.M., Lee S.G. Comparison of open and laparoscopic live donor left lateral sectionectomy. Br. J. Surg. 2011; 98 (9): 1302–1308. DOI: 10.1002/bjs.7601.
Br. J. Surg. 2011; 98 (9): 1302–1308. DOI: 10.1002/bjs.7601.
5. Troisi R.I. Open or laparoscopic living donor liver hepatectomy: still a challenging operation! Am. J. Transplant. 2014; 14 (3): 736. DOI: 10.1111/ajt.12611.
6. Buell J.F., Cherqui D., Geller D.A., O’Rourke N., Iannitti D., Dagher I., Koffron A.J., Thomas M., Gayet B., Han H.S., Wakabayashi G., Belli G., Kaneko H., Ker C.G., Scatton O., Laurent A., Abdalla E.K., Chaudhury P., Dutson E., Gamblin C., D’Angelica M., Nagorney D., Testa G., Labow D., Manas D., Poon R.T., Nelson H., Martin R., Clary B., Pinson W.C., Martinie J., Vauthey J.N., Goldstein R., Roayaie S., Barlet D., Espat J., Abecassis M., Rees M., Fong Y., McMasters K.M., Broelsch C., Busuttil R., Belghiti J., Strasberg S., Chari R.S. The international position on laparoscopic liver surgery: The Louisville Statement, 2008. Ann. Surg. 2009; 250 (5): 825–830.
Ann. Surg. 2009; 250 (5): 825–830.
7. Шумаков В.И., Гальперин Э.И., Журавлёв В.А., Неклюдова Е.А. Пересадка левой доли печени (анатомическое исследование). Хирургия. 1977; 3: 43–60. Shumakov V.I., Gal’perin E.I., Zhuravlyov V.A., Nekludova E.A. Left liver lobe transplantation (anatomical study). Khirurgiya. 1977; 3: 43–60. (In Russian)
8. Шумаков В.И., Гальперин Э.И., Неклюдова Е.А. Пересадка левой доли печени в эксперименте и клинике. Хирургия. 1978; 6: 22–29. Shumakov V.I., Gal’perin E.I., Neklyudova E.A. Left liver lobe transplantation in the experiment and clinic. Khirurgiya. 1978; 6: 22–29. (In Russian)
9. Soubrane O., Schwarz L., Cauchy F., Perotto L.O., Brustia R., Bernard D., Scatton O. A conceptual technique for laparoscopic right hepatectomy based on facts and oncologic principles: the caudal approach. Ann. Surg. 2015; 261 (6): 1226–1231. DOI: 10.1097/SLA.0000000000000737.
Ann. Surg. 2015; 261 (6): 1226–1231. DOI: 10.1097/SLA.0000000000000737.
10. Broelsch C.E., Emond J.C., Whitington P.F., Thistlethwaite J.R., Baker A.L., Lichtor J.L. Application of reduced-size liver transplants as split grafts, auxiliary orthotopic grafts, and living related segmental transplants. Ann. Surg. 1990; 212 (3): 368–377.
11. Broelsch C.E., Whitington P.F., Emond J.C., Heffron T.G., Thistlethwaite J.R., Stevens L., Piper J., Whitington S.H., Lichtor J.L. Liver transplantation in children from living related donors. Ann. Surg. 1991; 214 (4): 428–438.
12. Готье С.В., Баранов А.А., Каганов Б.С., Зайнудинов З.М. Трансплантация печени у детей: состояние проблемы. Российский педиатрический журнал. 2003; 1: 39–44. Got’e S.V., Baranov A.A., Kaganov B. S., Zajnudinov Z.M. Liver transplantation in children: state of the problem. Rossijskij pediatricheskij zhurnal. 2003; 1: 39–44. (In Russian)
S., Zajnudinov Z.M. Liver transplantation in children: state of the problem. Rossijskij pediatricheskij zhurnal. 2003; 1: 39–44. (In Russian)
13. Schweitzer E.J., Wilson J., Jacobs S., Machan C.H., Philosophe B., Farney A., Colonna J., Jarrell B.E., Bartlett S.T. Increased rates of donation with laparoscopic donor nephrectomy. Ann. Surg. 2000; 232 (3): 392–400.
14. Cai X., Li Z., Zhang Y., Yu H., Liang X., Jin R., Luo F. Laparoscopic liver resection and the learning curve: a 14-year, single-center experience. Surg. Endosc. 2014; 28 (4): 1334–1341. DOI: 10.1007/s00464-013-3333-5.
15. Chang S., Laurent A., Tayar C., Karoui M., Cherqui D. Laparoscopy as a routine approach for left lateral sectionectomy. Br. J. Surg. 2007; 94 (1): 58–63.
16. Giulianotti P.C., Tzvetanov I., Jeon H., Bianco F., Spaggiari M., Oberholzer J., Benedetti E. Robot-assisted right lobe donor hepatectomy. Transpl. Int. 2012; 25 (1): e5–e9. DOI: 10.1111/j.1432-2277.2011.01373.x.
Giulianotti P.C., Tzvetanov I., Jeon H., Bianco F., Spaggiari M., Oberholzer J., Benedetti E. Robot-assisted right lobe donor hepatectomy. Transpl. Int. 2012; 25 (1): e5–e9. DOI: 10.1111/j.1432-2277.2011.01373.x.
17. Dokmak S., Raut V., Aussilhou B., Ftériche F.S., Farges O., Sauvanet A., Belghiti J. Laparoscopic left lateral resection is the gold standard for benign liver lesions: a case-control study. HPB (Oxford). 2014; 16 (2): 183–187. DOI: 10.1111/hpb.12108.
18. Bourdeaux C., Darwish A., Jamart J., Tri T.T., Janssen M., Lerut J., Otte J.B., Sokal E., de Ville de Goyet J., Reding R Living-related versus deceased donor pediatric liver transplantation: a multivariate analysis of technical and immunological compli cations in 235 recipients. Am. J. Transplant. 2007; 7 (2): 440–447.
19. Cherqui D., Soubrane O., Husson E., Barshasz E., Vignaux O., Ghimouz M., Branchereau S., Chardot C., Gauthier F., Fagniez P.L., Houssin D. Laparoscopic living donor hepatectomy for liver transplantation in children. Lancet. 2002; 359 (9304): 392–396.
Cherqui D., Soubrane O., Husson E., Barshasz E., Vignaux O., Ghimouz M., Branchereau S., Chardot C., Gauthier F., Fagniez P.L., Houssin D. Laparoscopic living donor hepatectomy for liver transplantation in children. Lancet. 2002; 359 (9304): 392–396.
20. Шкалова Л.В., Васенин С.А., Минина М.Г., Ильинский И.М., Загайнов В.Е., Цирульникова О.М. Патоморфологические критерии оценки состояния печени у потенциальных мультиорганных доноров со смертью мозга. Современные технологии в медицине. 2011; 4: 7–13. Shkalova L.V., Vasenin S.A., Minina M.G., Il’inskij I.M., Zagajnov V.E., Cirul’nikova O.M. Pathomorphological criteria of liver assessment in potential multi-organ donors with brain death. Sovremennye tekhnologii v medicine. 2011; 4: 7–13. (In Russian)
21. Müller S.A., Mehrabi A., Schmied B.M., Welsch T., Fonouni H., Engelmann G., Schemmer P. , Weitz J., Schmidt J. Partial liver transplantation-living donor liver transplantation and split liver transplantation. Nephrol. Dial. Transplant. 2007; 22 (Suppl. 8): viii13–viii22.
, Weitz J., Schmidt J. Partial liver transplantation-living donor liver transplantation and split liver transplantation. Nephrol. Dial. Transplant. 2007; 22 (Suppl. 8): viii13–viii22.
Симультанные лапароскопические резекции печени: опыт одного центра | Ахаладзе
1. Piros L, Máthé Z. Laparoscopy in liver surgery. Magy Onkol. 2018;62(1): 37–44.
2. Xie SM, Xiong JJ, Liu XT, Chen HY, Iglesia-García D, Altaf K, Bharucha S, Huang W, Nunes QM, Szatmary P, Liu XB. Laparoscopic versus open liver resection for colorectal liver metastases: a comprehensive systematic review and meta-analysis. Sci Rep. 2017;7(1): 1012. doi: 10.1038/s41598-017-00978-z.
3. Aghayan DL, Pelanis E, Avdem Fretland Å, Kazaryan AM, Sahakyan MA, Røsok BI, Barkhatov L, Bjørnbeth BA, Jakob Elle O, Edwin B. Laparoscopic parenchyma-sparing liver resection for colorectal metastases. Radiol Oncol. 2017;52(1): 36–41. doi: 10.1515/raon-20170046.
Laparoscopic parenchyma-sparing liver resection for colorectal metastases. Radiol Oncol. 2017;52(1): 36–41. doi: 10.1515/raon-20170046.
4. Buell JF, Cherqui D, Geller DA, O’Rourke N, Iannitti D, Dagher I, Koffron AJ, Thomas M, Gayet B, Han HS, Wakabayashi G, Belli G, Kaneko H, Ker CG, Scatton O, Laurent A, Abdalla EK, Chaudhury P, Dutson E, Gamblin C, D’Angelica M, Nagorney D, Testa G, Labow D, Manas D, Poon RT, Nelson H, Martin R, Clary B, Pinson WC, Martinie J, Vauthey JN, Goldstein R, Roayaie S, Barlet D, Espat J, Abecassis M, Rees M, Fong Y, McMasters KM, Broelsch C, Busuttil R, Belghiti J, Strasberg S, Chari RS; World Consensus Conference on Laparoscopic Surgery. The international position on laparoscopic liver surgery: The Louisville Statement, 2008. Ann Surg. 2009;250(5): 825–30. doi: 10.1097/SLA.0b013e3181b3b2d8.
5. Wakabayashi G, Cherqui D, Geller DA, Buell JF, Kaneko H, Han HS, Asbun H, O’Rourke N, Tanabe M, Koffron AJ, Tsung A, Soubrane O, Machado MA, Gayet B, Troisi RI, Pessaux P, Van Dam RM, Scatton O, Abu Hilal M, Belli G, Kwon CH, Edwin B, Choi GH, Aldrighetti LA, Cai X, Cleary S, Chen KH, Schön MR, Sugioka A, Tang CN, Herman P, Pekolj J, Chen XP, Dagher I, Jarnagin W, Yamamoto M, Strong R, Jagannath P, Lo CM, Clavien PA, Kokudo N, Barkun J, Strasberg SM. Recommendations for laparoscopic liver resection: a report from the second international consensus conference held in Morioka. Ann Surg. 2015;261(4): 619–29. doi: 10.1097/SLA.0000000000001184.
Recommendations for laparoscopic liver resection: a report from the second international consensus conference held in Morioka. Ann Surg. 2015;261(4): 619–29. doi: 10.1097/SLA.0000000000001184.
6. Abu Hilal M, Aldrighetti L, Dagher I, Edwin B, Troisi RI, Alikhanov R, Aroori S, Belli G, Besselink M, Briceno J, Gayet B, D’Hondt M, Lesurtel M, Menon K, Lodge P, Rotellar F, Santoyo J, Scatton O, Soubrane O, Sutcliffe R, Van Dam R, White S, Halls MC, Cipriani F, Van der Poel M, Ciria R, Barkhatov L, Gomez-Luque Y, Ocana-Garcia S, Cook A, Buell J, Clavien PA, Dervenis C, Fusai G, Geller D, Lang H, Primrose J, Taylor M, Van Gulik T, Wakabayashi G, Asbun H, Cherqui D. The Southampton Consensus Guidelines for laparoscopic liver surgery: from indication to implementation. Ann Surg. 2018;268(1): 11–8. doi: 10.1097/SLA.0000000000002524.
7. Siriwardena AK, Mason JM, Mullamitha S, Hancock HC, Jegatheeswaran S. Management of colorectal cancer presenting with synchronous liver metastases. Nat Rev Clin Oncol. 2014;11(8): 446–59. doi: 10.1038/nrclinonc.2014.90.
Management of colorectal cancer presenting with synchronous liver metastases. Nat Rev Clin Oncol. 2014;11(8): 446–59. doi: 10.1038/nrclinonc.2014.90.
8. Ivanecz A, Krebs B, Stozer A, Jagric T, Plahuta I, Potrc S. Simultaneous pure laparoscopic resection of primary colorectal cancer and synchronous liver metastases: a single institution experience with propensity score matching analysis. Radiol Oncol. 2017;52(1): 42–53. doi: 10.1515/raon-2017-0047.
9. Wei M, He Y, Wang J, Chen N, Zhou Z, Wang Z. Laparoscopic versus open hepatectomy with or without synchronous colectomy for colorectal liver metastasis: a meta-analysis. PLoS One. 2014;9(1):e87461. doi: 10.1371/journal.pone.0087461.
10. Ikeda T, Mano Y, Morita K, Hashimoto N, Kayashima H, Masuda A, Ikegami T, Yoshizumi T, Shirabe K, Maehara Y. Pure laparoscopic hepatectomy in semiprone position for right hepatic major resection. J Hepatobiliary Pancreat Sci. 2013;20(2): 145–50. doi: 10.1007/s00534-012-0558-y.
Pure laparoscopic hepatectomy in semiprone position for right hepatic major resection. J Hepatobiliary Pancreat Sci. 2013;20(2): 145–50. doi: 10.1007/s00534-012-0558-y.
ЛАПАРОСКОПИЧЕСКАЯ ЛЕВОСТОРОННЯЯ ЛАТЕРАЛЬНАЯ СЕКТОРЭКТОМИЯ У ПРИЖИЗНЕННОГО ДОНОРА | Готье
1. Готье CВ. Трансплантация печени: Руководство для врачей / Готье CВ, Константинов БА, Цирульникова ОМ. М.: Мед. информационное агентство, 2008. Gautier CV. Transplantaciya pecheni: Rukovodstvo dlya vrachej / Gautier CV, Konstantinov BA, Tsiroul’nikova OM. M.: Med. informacionnoe agentstvo, 2008.
2. Готье СВ и др. Клинические аспекты получения фрагментов печени от живых родственных доноров. Бюллетень сибирской медицины. 2007; 1. Gautier CV et al. Klinicheskie aspekty polucheniya fragmentov pecheni ot zhivyh rodstvennyh donorov. Byulleten’ sibirskoj mediciny. 2007; 1.
Byulleten’ sibirskoj mediciny. 2007; 1.
3. Константинов БА, Готье СВ. Трансплантация печени в России: проблемы, перспективы ближайшего десятилетия. Анн. хир. гепатол. 1998; 3. Konstantinov BA, Gautier SV. Transplantaciya pecheni v Rossii: problemy, perspektivy blizhajshego desyatiletiya. Ann. hir. gepatol. 1998; 3.
4. Готье СВ. Трансплантация печени детям: анализ шестилетнего опыта / Готье СВ, Ахаладзе ДГ. Вестник трансплантологии и искусственных органов. 2014; 16. Gautier SV. Transplantaciya pecheni detyam: analiz shestiletnego opyta / Gautier SV, Ahaladze DG. Vestnik transplantologii i iskusstvennyh organov. 2014; 16.
5. Kleemann M, Deichmann S, Esnaashari H. Laparoscopic Navigated Liver Resection: Technical Aspects and Clinical Practice in Benign Liver Tumors. Case Rep. Surg. 2012. doi: 10.1155/2012/265918.
Case Rep. Surg. 2012. doi: 10.1155/2012/265918.
6. Reddy SK, Tsung A, Geller DA. Laparoscopic liver resection. World J. Surg. 2011. doi: 10.1007/s00268-010-0906-5.
7. Cherqui D, Soubrane O, Husson E, Barshasz E, Vigna
Лапароскопические методы лечения ожирения
Лапароскопические методы лечения ожирения
Проблема снижения веса беспокоит около трети взрослого населения земли, и не только с точки зрения эстетики. За косметическими дефектами скрываются тяжелые нарушения обмена веществ, которые реально укорачивают жизнь. У людей с избыточной массой тела ускоренно развиваются все основные «заболевания современной цивилизации»: гипертоническая болезнь, ишемическая болезнь сердца, сахарный диабет 2-го типа, онкологические заболевания. Именно избыточный вес является виновником возникновения инфарктов, инсультов и многих форм рака. Существует множество методик снижения веса, но чаще всего они не дают удовлетворяющего результата. Ведь важно не просто «немного похудеть», а избавиться от значительной (иногда и всей) «лишней» массы тела и, главное, удержаться в таком состоянии.
Именно избыточный вес является виновником возникновения инфарктов, инсультов и многих форм рака. Существует множество методик снижения веса, но чаще всего они не дают удовлетворяющего результата. Ведь важно не просто «немного похудеть», а избавиться от значительной (иногда и всей) «лишней» массы тела и, главное, удержаться в таком состоянии.
Многие люди, и даже некоторые врачи, считают, что существует «простая» схема: меньше ешь и больше двигайся. Но те, кто проверил на себе это утверждение, знают, что это не так. Мировая практика показывает, что большинство людей не в состоянии сами радикально изменить привычный образ жизни и питания. Консервативное лечение дает хорошие результаты менее чем у 5% пациентов с морбидным (патологическим) ожирением. И только «одному проценту» из них удается «удержаться» в пределах достигнутого, все остальные возвращаются к исходному или даже большему весу.
Бесконечные попытки избавиться от лишних килограммов, используя различные способы снижения массы тела, ведут лишь к потере драгоценного времени. Человек, потративший долгие годы на борьбу с лишним весом, может радикально решить эту проблему только с помощью хирургических методов. Операция дает возможность не только стать красивее и привлекательнее, но и жить дольше и лучше. Очень важно, что после проведения бариатрических вмешательств снижение веса сопровождается стабилизацией или нормализацией артериального давления, снижением уровня холестерина, улучшением контроля течения, а иногда полным излечением, сахарного диабета 2 типа. Существует много публикаций о благотворном влиянии хирургических методов лечения ожирения на течение неалкогольного стеатогепатита (жировой гепатоз печени, жировая дистрофия печени).
Человек, потративший долгие годы на борьбу с лишним весом, может радикально решить эту проблему только с помощью хирургических методов. Операция дает возможность не только стать красивее и привлекательнее, но и жить дольше и лучше. Очень важно, что после проведения бариатрических вмешательств снижение веса сопровождается стабилизацией или нормализацией артериального давления, снижением уровня холестерина, улучшением контроля течения, а иногда полным излечением, сахарного диабета 2 типа. Существует много публикаций о благотворном влиянии хирургических методов лечения ожирения на течение неалкогольного стеатогепатита (жировой гепатоз печени, жировая дистрофия печени).
Раздел хирургии, занимающийся лечением патологического ожирения, называется бариатрией. Сегодня в мире используется несколько методик бариатрических операций.
Регулируемое бандажирование желудка
Суть метода заключается в наложении на верхнюю часть желудка кольца (как правило, силиконового). Сегодня такие кольца могут регулироваться. С помощью бандажирования можно избавиться от 30–60% избыточной массы тела.
Продольная резекция желудка
Или как ее еще называют — «рукавная» гастропластика. По этой методике большую часть желудка удаляют, а из оставшейся части формируют рукав – тонкую трубку диаметром 1 см. Уникальность методики состоит в том, что при правильном выполнении операции резецируется часть желудка, ответственная за выработку грилинов – гормонов аппетита и набора веса. Таким образом, операция изменяет гормональный баланс и обмен веществ в сторону снижения веса. Это наиболее физиологичное ремоделирование желудочно-кишечного тракта с очень хорошими отдаленными результатами. Снижение избытка массы тела составляет 55-70%.
Желудочное шунтирование
При этом способе желудок разделяют на два отдела: маленький (50 мл) и большой (остальная часть желудка). К маленькому отделу коротким путем подшивают тонкую кишку. В результате человек может съесть совсем немного пищи и значительная ее часть проходит коротким путем, и, следовательно, всасывание питательных веществ снижается. Эта методика позволяет снизить избыточную массу тела на 80%.
Билиопанкреатическое шунтирование
Эта группа операций является наиболее сложной, но и наиболее эффективной, особенно при сахарном диабете 2 типа. При билиопанкреатическом шунтировании желудок тоже разделяют и к малому желудку по совсем короткому пути подшивают тонкую кишку таким образом, что жиры могут всасываться лишь на участке длиной около 50 см. Поэтому эффект достигается за счет очень существенного уменьшения всасывания питательных веществ. Эта методика приводит к снижению избыточной массы до 80%. С помощью билиопанкреатического шунтирования можно вылечить некоторые формы сахарного диабета 2-го типа.
В Клинической больнице № 122 выполняется ВЕСЬ спектр бариатрических вмешательств, причем подавляющее большинство из них проводится лапароскопическим способом.
Пример
К нам обратилась пациентка 35 лет. Ее вес составлял 135 кг, а индекс массы тела был равен 45. Она испробовала многие консервативные меры: фитнес, плавание, многочисленные диеты, лечебное голодание. К сожалению, после частичного эффекта (снижение массы на 6–10 кг) вес не только возвращался к исходным значениям, но и начинал превышать их. После всестороннего обследования было принято решение выполнить лапароскопическую пластику желудка. Суть этой операции – уменьшение и ремоделирование желудка с использованием современных сшивающих аппаратов.
Операция прошла успешно. Пациентка была выписана на третий день после вмешательства. Снижение веса началось после операции и происходило плавно, но неуклонно, приблизительно на 2–4 кг в месяц. Через полтора года женщина похудела на 41 кг. Как говорит она сама: «Похудение не приносит мне дискомфорта и страданий. Операция изменила мое восприятие мира. В частности, то, что раньше мне казалось нормой, сейчас я воспринимаю со словами «Как можно столько есть?». Снижение веса сопровождалось улучшением общего самочувствия, повышением работоспособности, стабилизацией артериального давления, снижением уровня холестерина и улучшением параметров функциональных проб.
Наши преимущества
Центр возглавляет профессор М. Б. Фишман, обладающий самым большим опытом бариатрических операций в Северо-Западном регионе.
Мы используем только проверенные и гарантированные методы лечения, узаконенные в странах Европы и в России.
Столь сложные хирургические вмешательства могут быть успешно выполнены только в крупной многопрофильной больнице.
Отделение анестезиологии и реанимации обеспечивает проведение анестезии высокого уровня и безопасный выход из наркоза.
Наши коллеги из центра респираторной терапии и сомнологии минимизируют риски респираторных осложнений в послеоперационном периоде и сделают его более комфортным.
Успешное лечение сахарного диабета 2-го типа с помощью хирургических методов проходит под контролем эндокринологов отделения терапии.
Как определить, имеется ли у вас избыточный вес?
Для этого нужно определить индекс массы тела (ИМТ), разделив массу тела (в кг) на квадрат роста (в м2):
ИМТ = Вес (кг)/Рост (м2)
Если ИМТ выше 34, вам необходима консультация специалиста.
В кратчайший срок после обследования и детализации всех сторон доктор вместе с вами виндивидуальном порядке выберет оптимальный метод лечения.
Лапароскопическая резекция печени
Обзор
Лапароскопические процедуры минимально инвазивны, они достигают той же цели, что и традиционные открытые процедуры. Целью резекции печени является безопасное и эффективное удаление новообразования печени (доброкачественного или злокачественного). По сравнению с открытой процедурой лапароскопический доступ позволяет пациентам делать разрезы меньшего размера, что позволяет быстрее выздороветь и получить лучший косметический результат. Пациенты часто испытывают меньше боли и могут быстрее вернуться к своей нормальной деятельности.
Наши специалисты работают совместно с многопрофильной командой врачей Массачусетской больницы общего профиля, чтобы определить план лечения, который лучше всего подходит для каждого пациента.
Что происходит во время этой процедуры и сколько времени она занимает?
После того, как пациента засыпают под общим наркозом, для удаления новообразования в печени делают от трех до семи небольших разрезов. В зависимости от количества и расположения поражений, а также от того, сколько печени необходимо удалить, процедура может занять от одного до семи часов.
Какая подготовка требуется перед процедурой?
Пациентам рекомендуется вести физически активный образ жизни и сводить к минимуму потребление алкоголя в течение недель, предшествующих операции. Пациенты встретятся со своим хирургом, чтобы обсудить конкретные шаги, которые необходимо выполнить перед процедурой. Большинству пациентов делают щадящую подготовку кишечника, чтобы облегчить движение толстой кишки во время операции. Мягкая подготовка кишечника также помогает избежать послеоперационных запоров.
Какое время восстановления?
Пациенты проведут в больнице от одной до шести ночей в зависимости от степени операции на печени.По итогам процедуры хирург обсудит с каждым пациентом особенности послеоперационного восстановительного периода. Поскольку печень восстанавливается, восстановление будет зависеть от того, сколько печени пациента необходимо для повторного роста. Большинство пациентов будут испытывать сильную усталость в течение двух-четырех недель после операции. Боль контролируется ибупрофеном и низкими дозами наркотических обезболивающих.
Что может повлиять на результаты?
Пациенты, которые физически сильнее, обычно легче восстанавливаются после процедуры.Прогулка по 15-30 минут ежедневно до и после операции ускоряет выздоровление. Пациентам следует ограничить употребление алкоголя и других токсичных для печени веществ до и после операции. Ваш врач поможет вам определить любые добавки или лекарства, которые могут отягощать вашу печень.
Насколько безопасна процедура?
Пациенты в целом переносят процедуру очень хорошо. Любая важная процедура сопряжена с риском. Тем не менее, многие исследования показали, что результаты лучше в больницах, таких как Mass General, в которых выполняется большое количество процедур.Эти риски будут подробно описаны хирургом перед выполнением любой хирургической процедуры.
Почему массовый генерал?
Mass General неизменно входит в число лучших больниц страны по версии U.S. News & World Report. Наши хирурги привыкли принимать как местных, так и иностранных пациентов с множеством заболеваний и имеют большой опыт выполнения сложных гепатобилиарных и лапароскопических операций.
Сравнение лапароскопической и открытой операции на печени
Подходит ли лапароскопический доступ всем пациентам?
Мы стараемся предложить всем пациентам лапароскопическую операцию на печени, однако в зависимости от локализации поражения и / или предшествующих операций, которым подвергся пациент, лапароскопический подход может быть не лучшим подходом для каждого пациента.
Смогу ли я быстрее восстановиться после лапароскопической процедуры?
По сравнению с открытой процедурой у пациентов может быть меньше боли и они могут двигаться быстрее и чаще после лапароскопической операции. Пациентам часто требуются более низкие дозы обезболивающих из-за уменьшения боли при лапароскопической процедуре. Значительный компонент выздоровления пациента определяется объемом печени, который необходимо восстановить. Лапароскопический доступ не влияет на объем необходимой регенерации печени.
Если у меня опухоль в печени злокачественная, вы проводите процедуру открытым или лапароскопическим способом?
Наша цель — всегда обеспечивать безопасность пациента и проводить максимально качественную операцию. Независимо от того, является ли процедура открытой или лапароскопической, наши цели остаются неизменными.
Лапароскопия | Рак печени | Исследования рака, Великобритания
Лапароскопия — это небольшая операция по изучению вашего живота (живота). Это также называется хирургией замочной скважины. Возможно, это поможет вашему врачу решить, возможна ли операция по удалению рака.
Ваш хирург вводит тонкую трубку со светом и камерой (лапароскопом) через небольшой разрез в брюшной полости. Они проверяют печень и область вокруг нее. Они также могут взять образцы тканей (биопсии).
Перед лапароскопией
Вы идете в больницу за 1 или 2 дня до лапароскопии, чтобы убедиться, что вы подходите для процедуры. Медсестра взвешивает вас и измеряет артериальное давление, пульс и температуру.
У вас также может быть:
- анализы крови
- след сердца (ЭКГ)
- рентген грудной клетки
Вы можете задать любые вопросы и подписать форму согласия.
Подготовка к лапароскопии
Сообщите своему врачу, если вы принимаете лекарство, которое изменяет процесс свертывания крови. Эти лекарства включают:
- клопидогрель
- лекарство от артрита
- варфарин
Ваш врач скажет вам, нужно ли вам прекратить прием лекарств или изменить дозу перед лапароскопией.
За 6 часов до операции нельзя есть. Возможно, вам удастся получить воду не более чем на 2 часа. Персонал больницы даст вам инструкции по этому поводу.
Сообщите своему врачу, если отказ от еды может быть для вас проблемой, например, если у вас диабет.
Что происходит
Обычно вам делают лапароскопию в дневном режиме, поэтому вы можете пойти домой позже в тот же день.
Вам сделали операцию, пока вы спите (под общим наркозом). На это уходит около получаса.
Хирург обычно делает 2 или 3 небольших разреза:
- один в вашем животе или рядом с ним
- на одной или обеих сторонах живота
Они вводят газ (углекислый газ) в ваш живот.Так хирургу будет проще увидеть ваши органы, включая печень, желудок и желчный пузырь.
Ваш хирург вводит тонкую трубку со светом и камерой (лапароскопом) через один из разрезов. Они могут видеть картинки на экране телевизора. В остальные порезы вставляют хирургические инструменты.
Они ищут признаки рака в:
- подкладка живота
- Поверхностный слой органов брюшной полости
Они берут образцы тканей (биопсии) и жидкости для отправки в лабораторию для проверки на наличие раковых клеток.
Затем ваш хирург удаляет трубку и инструменты. Маленькие дырочки закрывают стежками.
После лапароскопии
Вы просыпаетесь в зоне восстановления, а затем возвращаетесь в палату. У вас может быть жидкость через капельницу на тыльной стороне ладони или предплечья. Когда вы просыпаетесь и пьете, медсестра берет капельницу. Как только почувствуете, что сможете есть и пить, вы сможете нормально есть и пить.
У вас может быть некоторая боль в вашем:
- живот на несколько дней
- плечо на день или два из-за газа в брюшной полости
Обычно на раны накладываются бумажные швы (Steri-Strips) или рассасывающиеся швы.На них также накладывается водонепроницаемая повязка или специальный клей для кожи.
Вы можете намочить повязку и бумажные швы через 5 дней после операции, если они еще не отпали.
Не садитесь за руль в течение 24 часов после общего наркоза. Попросите кого-нибудь отвезти вас домой из больницы и остаться с вами на ночь.
Получение результатов
Через 1-2 недели после теста вы должны получить результаты у своего специалиста. Ожидание результатов может вызывать у вас беспокойство.
У вас могут быть контактные данные медсестры-специалиста, и при необходимости вы можете связаться с ними для получения информации. Возможно, вам будет полезно поговорить с близким другом или родственником о том, что вы чувствуете.
Для получения поддержки и информации вы можете позвонить медсестрам Cancer Research UK по бесплатному телефону 0808 800 4040. Телефонные линии открыты с 9:00 до 17:00 с понедельника по пятницу.
Возможные риски
У большинства людей не будет проблем с этим типом операций. Ваш врач убедится, что польза от его приема перевешивает риски, в том числе:
- раневая инфекция — это лечится антибиотиками
- кровотечение во время или после операции — вам может потребоваться переливание крови или другая операция
- тромб в ногах (тромбоз глубоких вен или ТГВ) — вы встаете вскоре после операции операция по снижению риска образования тромбов
- небольшое отверстие (перфорация) в стенке кишечника — это очень редко и лечится антибиотиками и жидкостями через капельницу, или операция по восстановлению отверстия
Ваша медсестра скажет вам на что обращать внимание.Они также дадут вам номер телефона, по которому можно связаться, если у вас возникнут проблемы.
Обратитесь к терапевту или в больницу, если у вас есть:
- высокая температура или плохое самочувствие
- покраснение или припухлость вокруг раны или утечка жидкости
- боль в животе, которая усиливается,
- покраснение или припухлость на одной или обеих ногах
Обратитесь в отделение неотложной помощи, если у вас есть одышка, боль в груди или кашель с кровью.
Все о лапароскопической резекции печени
Стенограмма подкаста
Скотт Стил: Buts and Guts, подкаст Кливлендской клиники, от начала до конца исследующий состояние вашего пищеварения и хирургии.
Добро пожаловать в очередной эпизод «Но и кишки». Я принимаю вас, Скотт Стил, председатель отделения колоректальной хирургии клиники Кливленда в прекрасном Кливленде, штат Огайо. Сегодня мы поговорим немного о техническом аспекте процесса болезни, а именно о лапароскопической резекции печени. Я очень рад видеть доктора Дэвида Квона, который является директором отделения лапароскопической хирургии печени в хирургическом отделении клиники Кливленда. Дэвид, добро пожаловать в Buts and Guts.
Дэвид Квон: Привет, Скотт. Рад встрече.
Скотт Стил: Нам всегда нравится начинать с того, что все наши гости рассказывают немного о том, откуда вы, где вы родились, где вы тренировались и как вы пришли к такому выводу. здесь, в клинике Кливленда?
Дэвид Квон: Ну, у меня совсем другое образование. Большую часть образования я получил еще в Южной Корее, а карьеру я начал еще в Южной Корее, потому что Корея — это регион, где у нас много заболеваний печени.Там я был подвержен множеству заболеваний печени, и именно здесь я смог развить большую часть своей карьеры. Там мне сделали много резекций печени, а также много пересадок печени от живого донора. Это моя подготовка. Я интересовался лапароскопическим подходом с 2005 года. Мне пришло в голову, что это то, что полезно для пациентов и должно быть перенесено на новый уровень. В те времена лапароскопическая резекция печени была чем-то очень кровавым.
Мы не знали, как остановить кровотечение.Раньше у нас было много проблем, но было очевидно, что после того, как операция была сделана хорошо, пациенты получили большую пользу. Мне удалось совместить лапароскопическую операцию с трансплантацией печени от живого донора. Я разработал программу лапароскопического подхода, чтобы предложить живым донорам пересадку печени, донорам печени, и клиника Кливленда хотела, чтобы я получил эту установленную долю. Вот как я оказался здесь. В настоящее время я пытаюсь разработать более обширную программу лапароскопической резекции печени, а также программу лапароскопической резекции живых доноров.
Скотт Стил: Что ж, мы очень рады видеть вас здесь. Сегодня мы снова, как мы уже сказали, поговорим немного о лапароскопической резекции печени и немного о программе живых доноров. Но прежде чем мы углубимся, давайте немного поговорим о печени для тех слушателей, которые этого не знали. Что за печень? Какова его основная функция? Где он сидит?
Дэвид Квон: Что ж, печень — самый большой орган в нашем теле.Его вес составляет около двух килограммов, что составляет около четырех или пяти фунтов, и он так похож на фабрику. Все, что вы едите, сначала проходит через печень. Он выводит токсины. Он превращает белки в аминокислоты. Он создает все блоки, которые необходимы вашей энергии для вашего бодибилдинга. Это фундаментально для поддержания вашего здорового метаболизма в вашем теле.
Скотт Стил: В каких случаях или при каких заболеваниях требуется резекция печени? Куда вы заходите?
Дэвид Квон: Ну, в U.Чаще всего резекция печени проводится у больных с колоректальным раком печени, с метастазами в печень. Вероятно, это самый высокий уровень заболеваемости. Второй по величине является первичная опухоль печени, так называемый рак печени. Эти двое могут быть причиной, по которой обычно делают резекцию печени.
Скотт Стил: Какие типы тестов полезны, чтобы определить, какая часть печени поражена, и можно ли провести операцию на печени? Как вы во всем этом разобрались?
Дэвид Квон: Что ж, поскольку печень, как я уже сказал, является одним из основных органов, поддерживающих жизнь, мы не можем удалить слишком много печени.Как правило, мы оцениваем, какой у вас резерв функции печени, прежде чем рассматривать любую резекцию, и, во-вторых, степень резекции, которую мы должны выполнить. Степень обычно определяется с помощью компьютерной томографии или магнитно-резонансной томографии, поэтому мы можем увидеть, где находится опухоль, наряду с близостью к крупным сосудам вокруг, сколько печени мы можем сэкономить и сколько мы должны удалить. Это, помимо того, сколько у вас есть резерва печени, определяет, подходите ли вы для резекции печени, или нам придется иметь другой выбор на столе.
Скотт Стил: Я колоректальный хирург, и у меня постоянно есть пациенты, и у них могут появиться метастазы в печень. Как вы определяете, является ли это роль хирургического вмешательства в их лечении или кого-то здесь вроде: «Знаете что? У вас заболевание, которое не поддается хирургическому лечению».
Дэвид Квон: Что ж, хирургия обеспечивает лучшую выживаемость. Хирургия всегда приходит … Если оперативно, мы делаем операцию. Если это невозможно, мы не делаем операцию.Может быть, мы примем другие меры. Мы ставим операцию на первое место среди вариантов лечения. Поддается ли это лечению или нет, зависит от размера опухоли, места ее расположения и количества опухолей. Как я уже сказал, с помощью чисел, размеров и местоположения, глядя на КТ или МРТ, мы обычно можем сказать, сколько печени мы можем оставить, удаляя всю необходимую опухоль.
Если мы думаем, что сможем удалить всю опухоль и у вас будет достаточный резерв функции печени, тогда мы идем на операцию.Принимая во внимание, что мы думаем, что если опухоль слишком большая или ее слишком много, и невозможно сбросить все опухоли, мы сначала идем на химиотерапию или облучение, прежде чем идти на операцию.
Скотт Стил: Для пациентов с другими основными заболеваниями, которые могут влиять на печень, например, с циррозом, как это влияет на ваш мыслительный процесс и ведение болезни с точки зрения того, как хирургически вы можете приближаться к этим пациентам или не подходить к ним?
Дэвид Квон: Что ж, пациенты с колоректальным метастазом в печень обычно не имеют фонового цирроза печени, потому что сама болезнь исходит не из печени, а из толстой или прямой кишки, и опухоль метастазирует в печень.Однако вторым по частоте происшествием, которым является опухоль печени, часто бывает гепатит С, или гепатит В, или НАСГ, неалкогольный стеатогепатит. В таком случае у вас фоновый цирроз печени. Если у вас фоновый цирроз печени по результатам лабораторных исследований, которые мы проводим перед операцией, мы обычно можем определить, какой запас печени у вас останется после операции. Как я уже сказал, проверьте, насколько хорошо у вас функционирует печень и сколько печени нам нужно принять, — вот что определяет, пойдете ли вы на операцию или нет.
Скотт Стил: Прежде чем мы перейдем к техническим аспектам резекции печени, предположим, что я пациент, слушаю этот подкаст, и мне только что сказал мой лечащий врач или даже хирург, который говорит: «Ты должен пойти навестить хирурга печени «. Чего им ожидать во время этой встречи в поликлинике?
Дэвид Квон: Печень — это очень специфическая область, в которой есть много способов приблизиться к случаям, которые другие хирурги считают неоперабельными, и на самом деле специалист по печени может считать их такими же операбельными.Я думаю, это то, что вы должны учитывать, когда посещаете офис любого хирурга-специалиста по печени.
Скотт Стил: Когда к вам в кабинет приходит пациент, просматриваете ли вы с ним компьютерную томографию? Они понимают этот экзамен? Что это за визит, потому что могу вас заверить, что есть некоторая тревога или даже страх, идя к хирургу печени. На что похож этот визит в офис?
Дэвид Квон: Обычно мы сначала оцениваем, как я уже сказал, функцию печени.Рисуем там кровь. Смотрим компьютерную томографию. Мы часто в наши дни, потому что МРТ немного более специфична, чем компьютерная томография, мы часто, если мы думаем, что нам придется резектировать, мы делаем МРТ, прежде чем мы начнем проектировать весь процесс операции. Обычно МРТ — это еще один дополнительный тест, который вы можете пройти при посещении клиники.
Скотт Стил: Что такое лапароскопическая резекция печени? Как она выполняется и отличается ли она от роботизированной резекции печени и открытой? О чем это все?
Дэвид Квон: Лапароскопия и роботизация похожи в том смысле, что они оба минимально инвазивны, что означает, что вы не открываете всю брюшную полость, делая огромную лапаротомию, чтобы получить доступ к органам, которые вам нужно прооперировать, а скорее проделывая маленькие дырочки в брюшной полости и действуя как длинные щипцы, длинные палки.По своей природе, потому что вы делаете три или четыре разреза размером в полдюйма и делаете с ними всю операцию. Из-за этого малоинвазивного характера пациенты обычно выздоравливают намного быстрее. Вы испытываете намного меньше боли.
Однако сама операция, например, мы резектируем левую часть печени, если вы планируете резекцию левой части печени лапароскопическим или открытым способом, резекция самой печени такая же, но это просто то, что вы ‘ Вы не делаете большую лапаротомию, а делаете весь процесс через маленькие отверстия на животе.
Скотт Стил: Вам нужно сделать разрез, чтобы удалить часть того, что вы удалили?
Дэвид Квон: Ну, это зависит от обстоятельств. Если вы иссекаете огромную опухоль, мы обычно делаем разрез, называемый разрезом Пфанненштиля, который обычно делает женщина, когда у вас C-sec. Размер разреза обычно составляет около 10 сантиметров, около трех дюймов, что составляет примерно от одной трети до одной четвертой нормальных разрезов, которые мы делаем, когда нам нужна такая же операция.Но когда размер опухоли невелик и мы извлекаем только небольшую часть, обычно мы расширяем одно из отверстий, через которое мы вставляли троакары для проведения операции, и выводим его через него. На самом деле у вас остаются очень маленькие шрамы, и все. У вас нет больших шрамов от лапаротомии.
Скотт Стил: Вы упомянули, что печень — это орган, через который проходит большая часть кровотока. Я полагаю, что лапароскопическая резекция печени связана с некоторыми потенциальными рисками.Насколько это безопасно и каковы некоторые из этих потенциальных рисков?
Дэвид Квон: Что ж, из всех областей лапароскопии резекция печени была одной из последних областей исследования. Основная причина в том, что это технически очень и очень сложно, а во-вторых, это связано с большим кровотечением, если оно сделано неправильно. Иногда остановить кровотечение может быть довольно сложно, если не сделать его должным образом. Вот почему хирургам потребовалось много времени, чтобы адаптировать эту новую технику.Однако, если вы посмотрите на последние данные, то увидите огромное улучшение техники и подхода, которые на самом деле многие недавние данные предполагают, что у вас меньше кровотечений при лапароскопии. Общий уровень осложнений ниже при лапароскопическом вмешательстве, чем при открытом.
Я думаю, что сейчас мы вступаем в новую эру хирургии печени, в которой мы можем позволить себе пациентов с гораздо меньшими осложнениями и гораздо более быстрым выздоровлением, чем мы говорили 10 лет назад.
Скотт Стил: Каково выздоровление после лапароскопической резекции печени?
Дэвид Квон: По сравнению с открытыми, обычно, если вы посмотрите на данные, они используют около одной трети обезболивающего, которое им обычно требуется для традиционной лапаротомии. Возвращение к нормальной жизни обычно сокращается до 50%. Допустим, если вы делаете обычную открытую резекцию печени, вашим пациентам обычно требуется около трех месяцев, чтобы вернуться к работе и не испытывать чрезмерного стресса.В то время как при использовании лапароскопического доступа обычно требуется от одного до двух месяцев, чтобы вернуться к работе и почувствовать себя в порядке во время работы.
Скотт Стил: Когда пациент просыпается после лапароскопической резекции печени, есть ли у него в носу трубка? У них дренаж в животе? Есть что-нибудь из этого?
Дэвид Квон: Осушение живота зависит от объема выполняемого разреза печени. Если делается небольшая клиновидная резекция, дренажи обычно не ставят.Но если вам сделают серьезную гепатэктомию, серьезную резекцию печени, тогда мы вставим дренаж, потому что у вас могут быть некоторые осложнения, связанные с резекцией печени. Это из соображений безопасности. Кроме того, тюбики обычно оставляем там на два-три дня и вынимаем. Трубки в носу и все такое, это работа старого поколения. Если нам нужна трубка, мы обычно вынимаем ее в палате восстановления или в операционной, прежде чем разбудить вас. Восстановиться намного легче.
Скотт Стил: Дэвид, вы говорили о живом доноре печени.Не могли бы вы немного рассказать об этой программе и для кого она? Как бы вы в этом участвовали, если бы вам это было интересно? Как вы, ребята, продвигаетесь в этой программе? Насколько это безопасно? Вот лишь некоторые из обобщений.
Дэвид Квон: Для трансплантации печени от живого донора вам понадобится живой донор. Обычно у живых доноров вы берете от 60% до 40% своей печени и жертвуете ее реципиенту. Печень хорошо восстанавливается. Это как если вы начинаете со 100% печени, вы делите ее на две, вы отдаете 60% получателя, фактически примерно через год, ваши 40%, которые у вас есть, вырастают до 100, а 60%, которые были отданы получатель вырастает до 100.Вы делите 100 на два, и получается 200. В этом прелесть трансплантации печени от живого донора. После того, как я начал программу, лапароскопический подход стал очень ясным и очевидным, что он очень полезен для пациента.
Пациентам это нравится. Одна из причин, потому что я также часто делал донорские операции, одна из причин заключалась в том, что обычно доноры … Они очень альтруистичны. Они хотят спасти чью-то жизнь. Они хотят пожертвовать собой, чтобы сделать все это. Я всегда думал, что должен предоставить донорам один из лучших вариантов восстановления, доступных хирургическим путем.Но главное с живым донором — это то, что у вас не может быть никаких несчастных случаев с донором, потому что ваши пациенты раньше были здоровыми. Принцип номер один в трансплантации печени от живого донора заключается в том, что мы должны вернуть его донора здоровым и безопасным и вернуться к работе. Все, что он делал или она делала раньше, является принципом номер один в трансплантации печени от живого донора.
Поскольку лапароскопическая операция сама по себе технически сложнее, чем открытая операция, и раньше она считалась более опасной, многие хирурги очень скептически относились к тому, что лапароскопический доступ может быть применен к донорам, поскольку сообщалось о смерти донора после операции.Раньше считалось, что это опаснее. Для доноров это нехорошо. Однако в ходе курса лапароскопической резекции печени я узнал, что многие вещи, которые раньше считались очень опасными, на самом деле можно сделать очень безопасно лапароскопически. Когда я понял это, я начал свою лапароскопическую донорскую программу еще в Южной Корее, и эта программа сейчас является крупнейшей программой в мире.
Но на протяжении всего этого опыта я узнал, что, используя лапароскопический доступ к донорам, на самом деле доноры выздоравливают намного быстрее.Косметика, которая у вас есть после операции, намного лучше. Они намного более довольны и в конечном итоге все еще спасают чью-то жизнь после всей этой большой операции.
Скотт Стил: Что ждет лапароскопическую резекцию печени в будущем?
Дэвид Квон: Раньше лапароскопическая резекция печени выполнялась при небольших поражениях. Очень просто взять за клинья. Если вы посмотрите на данные США, то из 100 резекций печени, выполняемых ежегодно, едва ли 10%, всего 10 случаев выполняются лапароскопически, а остальные 90% — открытым методом.Однако это можно значительно расширить. Я думаю, что операция похожа на правую гепатэктомию, которая похожа на очень большую операцию, которую многие хирурги с трудом выполняют, и которая раньше считалась очень, очень сложной и опасной с лапароскопической точки зрения. В настоящее время мы можем сделать это относительно безопасно за очень короткое время работы. Думаю, этот горизонт еще больше расширится.
Правая гепатэктомия может стать вытянутой вправо, центральной. Множество сложных операций, которые когда-то считалось слишком сложным для лапароскопических, теперь я думаю, что мы можем сделать это лапароскопически.Когда-то у нас гораздо больше возможностей использовать лапароскопический доступ при заболеваниях, чем когда-то, как мы думали, будет только открытый вариант.
Скотт Стил: Что ж, это фантастика, и мы очень рады видеть вас здесь, в клинике Кливленда. Мы хотели бы, чтобы все наши гости рассказали немного о вас и расскажем о парочке быстрых нападающих. Какая твоя любимая еда?
Дэвид Квон: Мое любимое блюдо — пибимпап. Это корейское блюдо. Это смесь риса, свежих овощей и мяса.Это очень полезно для здоровья и очень вкусно.
Скотт Стил: Какой твой любимый вид спорта?
Дэвид Квон: Мой любимый вид спорта, раньше я любил теннис. Раньше я любил заниматься спортом, но сейчас, наверное, это велосипед. Я думаю, что Кливленд — очень хорошее место для катания на велосипеде.
Скотт Стил: Какую последнюю немедицинскую книгу вы прочитали?
Дэвид Квон: Последняя немедицинская книга, которую я прочитал, это Switch.Это книга Чипа и Дэна Хита. Я их заядлый фанат. У них есть очень хорошие книги, которые они пишут. Речь идет об изменении культуры организации, или это может касаться человека, и есть небольшие шаги. Есть несколько важных шагов, которые вам нужно сделать, чтобы внести изменения. Если кто-то заинтересован в изменении культуры своей организации или своих привычек, я бы рекомендовал эту книгу всем.
Скотт Стил: Кроме того, учитывая ваше прошлое и относительную новизну в Кливленде, что вам больше всего нравится в жизни в Кливленде?
Дэвид Квон: Кливленд, здесь не так много людей.Это не похоже на Нью-Йорк или Лос-Анджелес, но атмосфера города все равно сохраняется. У вас по-прежнему есть очень хорошие рестораны. У вас по-прежнему фантастический оркестр. У вас все еще есть рок-н-ролл, но нет движения. Это то, что мне больше всего нравится в Кливленде.
Скотт Стил: Что ж, это фантастика. Чтобы узнать больше, посетите clevelandclinic.org/liver. Это clevelandclinic.org/liver. Чтобы записаться на прием к специалисту по лечению печени Cleveland Clinic, позвоните по телефону (216) 444-7000.Это (216) 444-7000. Дэвид, спасибо, что присоединились к нам на Buts and Guts.
Дэвид Квон: Большое спасибо.
Скотт Стил: Вот и все здесь, в клинике Кливленда. До следующего раза, спасибо, что послушали Buts and Guts.
обзор современных показаний и хирургических методик
Hepatobilial Surg Nutr. 2018 Авг; 7 (4): 277–288.
, 1, # , 2, # , 3 , 4 , 1 и 1
Хирургический центр Чэньян Цзя
1 Трансплантация печени, Западно-Китайская больница Сычуаньского университета, Чэнду 610041, Китай;
Hongyu Li
2 Отделение хирургии поджелудочной железы, Западно-Китайская больница Сычуаньского университета, Чэнду 610041, Китай;
Нинюань Вэнь
3 Колледж клинической медицины, Сычуаньский университет, Чэнду 610065, Китай;
Цзюньхуа Чен
4 Отделение общей хирургии, Первая народная больница Чэнду, Чэнду 610200, Китай
Юнган Вэй
1 Отделение хирургии печени, Центр трансплантации печени, Западно-Китайская больница Сычуаньского университета, Чэндуань 610041, Китай;
Бо Ли
1 Отделение хирургии печени, Центр трансплантации печени, Западно-Китайская больница Сычуаньского университета, Чэнду 610041, Китай;
1 Отделение хирургии печени, Центр трансплантации печени, Западно-Китайская больница Сычуаньского университета, Чэнду 610041, Китай;
2 Отделение хирургии поджелудочной железы, Западно-Китайская больница Сычуаньского университета, Чэнду 610041, Китай;
3 Колледж клинической медицины, Сычуаньский университет, Чэнду 610065, Китай;
4 Отделение общей хирургии, Первая народная больница Чэнду, Чэнду 610200, Китай
Автор, ответственный за переписку.
Сообщений: (I) Концепция и дизайн: Все авторы; (II) Административная поддержка: Y Wei, B Li; (III) Предоставление материала для исследования или пациентов: Y Wei, B Li, H Li; (IV) Сбор и сбор данных: C Jia; (V) Анализ и интерпретация данных: C Jia, N Wen, J Chen; (VI) Написание рукописи: Все авторы; (VII) Окончательное утверждение рукописи: Все авторы.
# Эти авторы внесли равный вклад в данную работу.
Для корреспонденции: Yonggang Wei, MD.Отделение хирургии печени, Центр трансплантации печени, Западно-Китайская больница Сычуаньского университета, № 37 Guoxue Road, Чэнду 610041, провинция Сычуань, Китай. Электронная почта: moc.361@gywruoy.
Поступило 4 декабря 2017 г .; Принята к печати 12 февраля 2018 г.
Copyright 2018 Hepatobilation Surgery and Nutrition. Все права защищены.Эта статья цитировалась в других статьях в PMC.
Abstract
Лапароскопическая резекция печени (LLR) стала самым впечатляющим достижением в области хирургии печени за последние два десятилетия.Технические инновации и накопленный опыт сделали LLR безопасной и эффективной процедурой с более быстрым послеоперационным восстановлением. Несмотря на быстрое распространение процедуры, детали относительно показаний, онкологических исходов и технических требований оставались спорными. Для решения этих проблем были проведены две международные конференции по консенсусу, чтобы обновить знания в этой области. Тезисы обеих конференций не были окончательными и требуются более качественные исследования. В этой статье мы рассмотрели развитие и текущее состояние LLR.Также обсуждались показания, исходы, хирургические методы и устройства, используемые в LLR.
Ключевые слова: Лапароскопическая резекция печени (LLR), минимально инвазивная, показания, техника
Введение
Радикальная хирургическая резекция по-прежнему остается одним из наиболее важных методов лечения большинства новообразований печени. Попытки лечить заболевания гепато-билиарной системы с помощью лапароскопа были начаты в 1987 году, хирурги выполнили первый случай лапароскопической холецистэктомии (1).С тех пор лапароскопический доступ вскоре стал широко принятой стандартной процедурой для пациентов, которым требуется холецистэктомия. Однако, поскольку технические ограничения и дефекты оборудования все еще оставались, только 4 года спустя была сделана первая попытка лапароскопической резекции печени (LLR) (2). Первоначальные отчеты о LLR показали, что результаты пациентов были сопоставимы с традиционным открытым подходом, что привело к положительным выводам о том, что для отдельных пациентов LLR может быть безопасным и эффективным лечением.С тех пор LLR стала потенциально альтернативой традиционной открытой резекции печени.
Начальное развитие LLR было медленным, сообщалось только о единичных случаях с местной резекцией (3-6). Левая боковая секционнаяэктомия впервые была описана в 1996 году, что вызвало интерес хирургов к LLR, хотя первый случай был преобразован в открытую операцию из-за интраоперационного массивного кровотечения (7,8). С тех пор, с накопленным опытом, случаи LLR резко возросли во всем мире, быстро расширившись до лапароскопической гемигепатэктомии, одиночной сегментэктомии (не ограничиваясь II или III), трисекционной резекции (расширенная или ограниченная анатомическая резекция) и донорства печени от живого донора. (9-11).
Первая международная конференция экспертов по консенсусу была проведена в 2008 году для подведения итогов и оценки осуществимости и безопасности замечательной разработки (12). Концепция крупных резекций печени была определена как гемигепатэктомия, трисекционная резекция и резекции сложных задних сегментов (IVa, VII, VIII). Конференция подтвердила, что LLR является безопасным и эффективным подходом к лечению хирургического заболевания печени в руках хорошо обученных хирургов с опытом гепатобилиарной и лапароскопической хирургии.С другой стороны, в нем также перечислены проблемы злоупотребления LLR, в том числе неуместные расширенные показания и нестабильные клинические результаты, связанные с отсутствием стандартов обучения и полномочий. В 2015 году вторая конференция обновила консенсус, оценив статус LLR с данными рекомендациями (13), которые в основном были сосредоточены на преимуществах, рисках и методах LLR и содержали ссылки на его развитие. Эти две конференции вместе с несколькими ретроспективными исследованиями подтвердили, что LLR не только не уступает открытой процедуре как для малых, так и для крупных резекций печени с точки зрения онкологических исходов, но также имеет преимущества во многих областях: меньшая кровопотеря, снижение послеоперационной заболеваемости и более короткие сроки. пребывание в больнице (10,14-18).Однако до сих пор были доступны ограниченные выводы из рандомизированных контролируемых испытаний, которые проводились во всем мире, некоторые проблемы все еще остаются спорными: каковы соответствующие показания и противопоказания? Как хирурги должны выполнять точные операции? Могут ли пациенты получить пользу от лапароскопического доступа и как?
В этом обзоре мы обсудим основные проблемы, связанные с LLR, а также недавний прогресс в этой области, который, как мы надеемся, может помочь в переоценке и стандартизации процедуры LLR.
Отбор пациентов (открытый или лапароскопический)
В соответствии с рекомендациями барселонской клинической системы определения стадии рака печени (BCLC) резекция остается методом лечения первой линии для гепатоцеллюлярной карциномы (HCC) стадии 0-A (19,20). Для подходящих пациентов, отобранных для LLR, необходимо принимать во внимание три важных фактора: наличие цирроза, расположение и размер новообразования. Важность последних двух факторов различна для доброкачественных и злокачественных заболеваний. Общепринято считать, что при злокачественном заболевании сдавливание очага и плохой рассекающий край отрицательно влияют на отдаленный исход.В нижеследующем обсуждении мы сосредоточимся в основном на LLR злокачественных опухолей.
Расположение опухоли
Принимая во внимание плохую экспозицию области операции и сложный контроль кровотечения, было сложно выполнить LLR для поражений в задневерхней части печени (21). Консенсус в Луисвилле отметил, что единичные поражения размером не более 5 см, расположенные в периферической области печени (сегменты II-VI), будут подходящим признаком LLR (12). По мере накопления навыков и опыта резекция сложных сегментов (VII, VIII и IVa) и даже хвостовой доли оказалась безопасной и повторяемой.Dulucq et al. поделились своим опытом двух изолированных лапароскопических резекций хвостатой доли печени без событийного послеоперационного течения (22). Стоит упомянуть, что в одном случае было осложнение в виде повреждения нижней полой вены (НПВ), которое усложнило процедуру, хотя она не привела к конверсии. Araki et al. доказал возможность резекции хвостовой доли, проанализировав такие случаи примерно за 14 лет с 2000 по 2014 год (23). Данные из многоцентрового исследования показали, что LLR для задневерхних отделов печени осуществим и безопасен (24-26).Кроме того, авторы указали, что хирургические методы должны быть индивидуализированы в соответствии с локализацией опухоли и ее соотношением с основными сосудами печени. Zheng et al. суммировал 281 пациента, получившего LLR для поражений, расположенных в задне-верхних сегментах печени (I, IVa, VII и VIII), у которых кровопотеря, частота осложнений, пребывание в больнице и рецидив опухоли существенно не отличались от переднебоковых (II, III, IVb , V и VI), несмотря на более длительное время операции, более высокую степень конверсии и меньшую границу резекции (27).До сих пор в опытных центрах локализация опухоли больше не могла технически препятствовать лапароскопическому доступу, если опухоль оценивается как резектабельная при традиционной лапаротомии.
Размер опухоли
Было признано, что размер опухоли является фактором риска как при лапароскопической, так и при открытой резекции опухоли печени. Инвазия важных структур, которые должны быть сохранены с учетом лучшего притока и оттока остаточной паренхимы большой опухолью печени, является очень распространенным явлением, для LLR обнажение и удаление опухоли обязательно увеличит вероятность распространения опухоли.Чтобы избежать негативного влияния процедуры, в заявлении Луисвилля рекомендовалось, что опухоль размером более 5 см не является хорошим кандидатом для LLR. Интересно, что в последние годы в нескольких отчетах были представлены данные о LLR для опухоли более 5 см, результаты которых показали, что размер опухоли не может быть отрицательным фактором риска как для краткосрочного, так и для долгосрочного исхода.
Ai et al. провел одноцентровое исследование для оценки результатов LLR для HCC с размером опухоли 5–10 см (28).Девяносто семь из 275 включенных пациентов получили LLR, остальные прошли открытую процедуру. Средняя продолжительность операции, средняя оценка интраоперационной кровопотери и скорость переливания крови существенно не различались. Однако в группе LLR наблюдалось более короткое послеоперационное пребывание в стационаре и меньшее количество послеоперационных осложнений. Результаты периода последующего наблюдения (среднее общее время наблюдения составило 21 месяц, а среднее время наблюдения выживших — 23 месяца) не показали существенной разницы в частоте рецидивов опухоли.Показатели общей выживаемости (OS) в течение 1 и 3 лет, а также показатели выживаемости без признаков заболевания (DFS) также существенно не различались между двумя группами. И это дало положительные доказательства в ответ на опасения по поводу неадекватной границы резекции и неудовлетворительной скорости радикальной резекции в LLR по поводу HCC. Другое ретроспективное сравнительное исследование было проведено между пациентами, перенесшими LLR по поводу ГЦК ≥5 и <5 см (29). Результаты показали, что коэффициент конверсии, время операции, кровопотеря, послеоперационное пребывание в больнице, время DFS и OS (среднее время наблюдения 37 месяцев) были сопоставимы между двумя группами.
Также было доступно исследование LLR для большой внутрипеченочной холангиокарциномы (ICC). Помимо проблем, схожих с проблемами ГЦК (неадекватный край резекции, разрыв опухоли, неконтролируемое кровотечение и засева опухоли), нельзя игнорировать неэффективность лимфодиссекции при лапароскопии. Wei et al. проанализировали периоперационные и отдаленные исходы у пациентов, страдающих большими (≥5 см) или множественными (≥2 поражения) ИКК (30). В исследовании был сделан вывод, что по сравнению с LLR для небольших ICC, LLR для больших поражений был технически безопасным, выполнимым и онкологически эффективным у отдельных пациентов.Кроме того, в этом исследовании были проведены сравнения с открытой резекцией печени при большой или множественной резекции, и нет доказательств, указывающих на то, что LLR уступает как по краткосрочным, так и по долгосрочным результатам.
Злокачественная опухоль размером более 10 см в настоящее время больше не является абсолютным противопоказанием для LLR. Исследование LLR для колоректальных метастазов в печени показало, что LLR для опухолей диаметром более 10 см является безопасным и эффективным, поэтому был сделан вывод, что размер опухоли больших колоректальных метастазов в печени не должен препятствовать выбору лапароскопического доступа (31).Недавно было опубликовано несколько случаев LLR огромных доброкачественных образований (> 10 см) (32-34). Процедуры показали оптимистичные результаты. Однако количество таких случаев невелико, и этого может быть недостаточно, чтобы доказать, что LLR может широко применяться у этой группы пациентов. С другой стороны, увеличенное время операции, требуемое в LLR для огромной опухоли, может добавить дополнительные риски, такие как несчастный случай с анестезией, легочная инфекция и проблемы с уходом. Эти потенциальные проблемы могут добавить дополнительных опасений по поводу применения LLR у пациентов с большими доброкачественными новообразованиями.
Лапароскопическое донорство живой печени
В области трансплантации печени от живого донора (включая взрослого ребенку и взрослого взрослому) LLR предлагает безопасный минимально инвазивный подход для доноров. Отчет о первой лапароскопической гепатэктомии живого донора был опубликован в 2002 г. (11). Это был случай от взрослого к ребенку, и последователи быстро переняли эту процедуру. Затем была выполнена лапароскопическая левосторонняя или правосторонняя гепатэктомия при трансплантации взрослого взрослому (35,36). Доказано, что лапароскопическая левосторонняя резекция у живого донора является безопасной и повторяемой и стала стандартной процедурой в опытных центрах (37).Что касается лапароскопического донорства правой печени, несколько отчетов показали выполнимость этой процедуры, и она действительно имеет преимущества в послеоперационном восстановлении и косметических требованиях (38,39). С другой стороны, нельзя игнорировать гораздо более сложную операцию и чрезвычайно строгие критерии отбора доноров. Хотя были зарегистрированы успешные случаи, эксперты по-прежнему считали лапароскопическую гепатэктомию правого донора незрелой техникой, и требовалось больше данных (40).
Цирроз
LLR для опухоли, осложненной основным заболеванием печени, в основном относящимся к циррозу печени, является спорным.Трансплантация печени рассматривалась как лечебное средство для пациентов с ГЦК с циррозом печени (41,42). К сожалению, нехватка донора и высокая стоимость процедуры сделали трансплантацию печени последним средством для этой группы пациентов. Резекция печени остается методом выбора в большинстве случаев (19, 20). Лечение цирроза печени под лапароскопом должно быть более терпеливым и осторожным, поскольку трудно идентифицировать важные анатомические структуры и ослабленную реакцию паренхимы печени на энергетическое оборудование.В раннем периоде ряд отчетов подтвердил безопасность и осуществимость малых LLR при ГЦК у пациентов с циррозом печени (21,43-45). Но было документально подтверждено, что пациенты с ГЦК с циррозом печени могут иметь более высокий уровень трансфузий, конверсии и осложнений (45). С целью дальнейшей оценки процедуры исследование, проведенное Belli et al. сравнил результаты между лапароскопической и открытой группами пациентов с циррозом печени (46). Лапароскопическая хирургия имела более низкий уровень заболеваемости, чем открытая операция, и это могло быть связано с тем, что группа LLR имела меньший средний размер опухоли, чем открытая группа, и LLR была менее обширной.Уровень общей выживаемости в течение 1 и 3 лет составлял 94% и 67% соответственно при средней выживаемости 63 месяца, а частота DFS через 1 и 3 года составляла 78% и 53% соответственно при медиане DFS 38 месяцев. Не было существенной разницы в показателях OS и DFS между лапароскопической и открытой группами. Подобные исследования показали, что LLR для HCC при циррозе печени может уменьшить тяжелые осложнения и сократить время пребывания в больнице. Кроме того, в этих исследованиях предлагалась 5-летняя выживаемость и показатель DFS (47,48). На основе аналогичной хирургической границы наблюдалась тенденция к лучшему показателю общей выживаемости в группе LLR, хотя данные не имели статистической разницы (70% в группе LLR vs. 46% в открытой группе). Недавно были доступны исследования основного LLR цирроза печени. Юн и др. , Xu et al. предоставили данные о главном LLR цирроза печени в своих центрах, соответственно (49,50). Их исследования могут предоставить доказательства более высокого уровня за счет использования анализа по шкале предрасположенности (51). В отличие от открытой процедуры, LLR при циррозе печени требовал более длительного времени операции из-за трудностей с рассечением паренхимы печени. Кровопотеря, частота послеоперационных осложнений, 2-летняя общая выживаемость и DFS были сопоставимы с открытой группой.Все эти доказательства подтверждают, что LLR может быть жизнеспособной альтернативой открытой процедуре даже у пациентов с циррозом печени.
Хирургические инструменты и методы
Развитие LLR было тесно связано с внедрением постоянно обновляемых хирургических инструментов (52,53). Как правило, инструменты можно разделить на вспомогательные части для принятия решений и конкретные рабочие части.
Интраоперационная ультрасонография (IOUS) и система флуоресцентной визуализации
IOUS не только полезен, но и незаменим, и он значительно способствует прогрессу LLR (45,54-56).Некоторые важные параметры принятия решения, размер опухоли, отношение к кровеносным сосудам и потенциальная плоскость резекции могут быть четко и легко отображены. доказано, что анатомическая резекция злокачественных опухолей дает лучшие отдаленные результаты (57,58). В анатомическом LLR идентификация печеночных вен и системы глиссона имеет жизненно важное значение при выборе плоскости рассечения. Тщательная идентификация и лечение ветвей этих сосудов с помощью ВМОЗИ может минимизировать риск повреждения сосудов.Еще одно преимущество заключается в том, что ИОУЗИ может идентифицировать пропущенные поражения и оказывать значительное влияние на принятие решения об операции. Использование IOUS в LLR рекомендовано в нескольких руководствах (13,59,60).
Однако диапазон резекции в случае одиночной анатомической сегментэктомии не может быть точно определен одним только ультразвуком. Методы интраоперационной флуоресцентной визуализации с использованием индоцианинового зеленого (ICG) необходимы для определения границы сегментов с помощью лапароскопической флуоресцентной визуализации (61-63).Путем инъекции ICG в портальную ветвь целевых сегментов резекции или соседние сегменты после пережатия сегментарной портальной ножки, карта гиперфлуоресценции или области гипофлуоресценции печени появлялась под определенной зрительной системой (в отчете была выбрана система лапароскопической камеры в ближнем инфракрасном диапазоне). Метод, представленный в отчетах, считается рекомендацией для стандартного анатомического LLR с целью достижения лучшего онкологического результата. Между тем, был опыт, указывающий на то, что методы интраоперационной флуоресцентной визуализации в LLR могут предоставить диагностическую информацию для идентификации злокачественных новообразований в качестве компенсации ограниченной пальпации (64).
Инструменты для рассечения паренхимы
Что касается конкретной операции, то было использовано множество инновационных устройств. При пересечении печени еще нет заключения о том, какое устройство лучше, чем паренхиматозное рассечение (13,65).
Ультразвуковой скальпель, степлер, кавитронный ультразвуковой хирургический аспиратор (CUSA) и водоструйная струя были наиболее часто упоминаемыми устройствами, используемыми для пересечения паренхимы, в то время как монополярная и биполярная коагуляция, коагулятор аргонового луча, микроволновый коагулятор использовались для управления кровотечением из режущей поверхности.Собрав данные о 1499 случаях LLR из 10 международных центров, Buell et al. сообщил, что пересечение паренхимы с использованием степлера обеспечивает преимущества меньшей кровопотери и более короткого времени операции по сравнению с электрохирургической резекцией (включая радиочастотную абляцию, тканевую связь, лигатуру и ультразвуковую диссекцию) (66). Однако резекция с использованием степлера обеспечивает меньшую патологическую границу, чем электрохирургическая техника, что приводит к онкологическим проблемам.
Был проведен обзор, показывающий, что по сравнению с CUSA и тупым рассечением водная струя лучше снижает кровопотерю и время рассечения (67).Но при использовании струи воды при рассечении паренхимы камера часто будет размыта устройством, поэтому требуется частая чистка, что затрудняет процесс.
Эффективность биполярных компрессионных устройств и ультразвуковых устройств для LLR была оценена в ретроспективном контрольном исследовании (68). Было доказано, что биполярные компрессионные устройства имеют преимущества в сокращении времени рассечения. Несмотря на отсутствие значительной разницы в оценке кровопотери, устройства для биполярной компрессии имели тенденцию обеспечивать лучший контроль кровотечения.Ультразвуковые устройства использовали вибрацию лезвий для резки и коагуляции. С другой стороны, небольшие сосуды (≤3 мм) можно легко контролировать с помощью ультразвуковых устройств, биполярных компрессионных устройств, что позволяет закрывать сосуды диаметром до 7 мм (69-71). Более того, принцип работы биполярного сжатия позволяет постепенно сжимать и прижигать ткань, а затем мгновенно запаивать и коагулировать. Коагулятор с аргоновым пучком был представлен как эффективная система гемостаза в плоскости пересечения.В то время как многоцентровые данные продемонстрировали, что коагулятор из фасоли аргона увеличивает риск газовой эмболии, его популяризация была ограничена (13,72,73).
Стоит отметить, что хирурги должны иметь полное представление о преимуществах и ограничениях своих предпочтений для обеспечения постоянной безопасной работы (65). Таблица различных инструментов для рассечения паренхимы печени показывает их преимущества и недостатки (). Система с ручным управлением была принята для выполнения так называемого ручного LLR, чтобы снизить степень сложности (74,75).Благодаря накопленному практическому опыту, ручные LLR стали реже.
Таблица 1
Характеристики нескольких инструментов для рассечения паренхимы печени
| Категория | Утилита | Преимущество | Недостаток |
|---|---|---|---|
| Степлер | Обрезка и зашивание больших трубчатых структур | Простота использования, экономия времени и труда | Относительно дорого |
| CUSA † | Разделение паренхимы шанс повредить сосудистую стенку | — | |
| Струя воды | Отдельная паренхима | Меньше шансов повредить сосудистую стенку | Камера легко размывается |
| Коагулятор бобов аргона | — Гемостаз nповышенный риск газовой эмболии | ||
| Моно / биполярный микроволновый коагулятор | Гемостаз | — | — |
Положение и подходы
Обратное положение Тренделенбурга с расставлением ног или без 13,59).В этом положении кровоток, возвращаемый к сердцу, уменьшается под действием силы тяжести, и центральное венозное давление (ЦВД) может поддерживаться на низком уровне (рекомендуется <5 см вод. Ст. 2 O). Кроме того, поперечная ободочная кишка, тонкий кишечник и сальник могут держаться на расстоянии от нижней поверхности печени, обеспечивая лучший обзор и большее рабочее пространство. Давление в пневмоперитонеуме CO 2 обычно устанавливается на уровне 10–14 мм рт. Для чистого LLR при необходимости вставляли четыре, пять или более троакаров.Обычно в качестве места наблюдения выполнялся над- или субубиликальный разрез, а подреберные троакары использовались как основные операционные порты. Большинство LLR технически могут работать таким образом. При лечении небольших поражений, расположенных в передне-верхней или задней части, особенно в сегменте VII и VIII, локальная или одиночная сегментэктомия может стать проблемой из-за более высокого риска недостаточного хирургического края и затрудненного гемостаза. многократное сжатие ткани печени для мобилизации и обнажения поражения также увеличивает риск разрыва и распространения опухоли.Поэтому расширенные резекции (резекция правой задней доли или гемигепатэктомия) применяются в случаях с большой потерей нормальной ткани. Новый метод положения лежа на животе был разработан японцем, чтобы обеспечить новое зрение (76,77). Пациент был установлен в левое боковое положение, хирурги стояли слева, после осторожной фиксации операционного стола, повернутого на 20–25 ° из полуниженного положения. Использование этого метода увеличило долю LLR у пациентов с поражениями в передне-верхнем и заднем сегментах в их центре (78).Было рассмотрено 56 пациентов, которые выполняли упражнения в положении полулежа, по сравнению с традиционным положением лежа на спине, этот новый подход был безопасным и показал преимущества в снижении кровопотери и продолжительности пребывания в больнице. Помимо подреберных портов, межреберный порт может предлагать другое направление для уменьшения поражения в печеночном куполе. Точно так же, как сила тяжести работает в обратном положении Тренделенбурга, вес печени способствует мобилизации и контролю над правой печеночной веной. Задний сегмент расположен над НПВ, что потенциально может снизить венозное давление.Chen et al. оценил LLR с положением складного ножа (79). Положение складного ножа, как и положение полулежа, направлено на лечение поражений в сегменте VI, VII и VIII. Однако плохое обнажение портальной зоны затрудняет контроль притока.
Сложность LLR зависит от диапазона резекции. Помимо частичной гепатэктомии в маргинальной области, лапароскопический левый боковой разрез (LLLR) считается простым и практичным методом для начинающих (80). Была достигнута договоренность о рассмотрении LLLR в качестве стандарта лечения на первой международной конференции (12).Хотя не существовало процедуры точной стандартизированной хирургической техники для LLLR, лапароскопическая левосторонняя резекция с помощью скоб широко применялась во многих центрах в результате минимизации кровопотери и времени операции (81–84). Два эндоскопических сшивателя для вкладышей служат ключевой частью процедуры для безопасного разделения ножек левой боковой доли и левой печеночной вены. Помимо этих двух структур, редко встречаются важные крупные сосуды или желчный проток, лежащие в левой части серповидной связки, что обеспечивает надежное рассечение.
Основные LLR все еще остаются проблемой на протяжении десятилетий и должны выполняться только экспертами (10,14). Мобилизация правых задних сегментов, выявление внутрипеченочных анатомических изменений, умение накладывать швы и лигирование с помощью лапароскопических аппаратов, а также точная и постоянная операция в течение нескольких часов затрудняют освоение основного LLR. Традиционный подход к резекции правой печени требует мобилизации правой печени и контроля правой печеночной вены перед пересечением паренхимы.Для тех крупных поражений, расположенных в правой доле печени, морфологические нарушения, адгезия окружающих структур и нестабильный статус опухоли затрудняют реализацию традиционного подхода, и то же самое верно в отношении LLR. Передний доступ был представлен в 1990-х годах как альтернатива традиционному. Этот метод оптимизировал порядок процедуры, сначала выполняя рассечение паренхимы, а в конце — мобилизацию, и часто использовался при вскрытии правой гепатэктомии в качестве его различных преимуществ (85–87).Soubrane et al. выполнили аналогичный каудальный доступ в LLR (13,88). Процедура началась с внутрифасциальной диссекции правой воротной ножки, линии Кантли, края НПВ и средней печеночной вены (MHV), которые являются важными ориентирами при резекции паренхимы. В отличие от традиционного подхода, сначала контролировали MHV, и только после того, как резекция достигла конца, MHV можно было наложить скобами. Ретроспективное сравнительное исследование вместе с несколькими описаниями случаев подтвердило безопасность и осуществимость каудального доступа (89–92).По сравнению с традиционным подходом, каудальный подход обеспечивает аналогичные послеоперационные результаты и преимущества снижения коэффициента конверсии.
Чтобы справиться с различными ситуациями, были также внедрены другие новые подходы. Yamashita et al. представил тотальный трансторакальный доступ (93). В этом отчете пациенты ранее перенесли 3 крупные операции на брюшной полости. Трансторакальный доступ позволил провести резекцию опухоли печени без проблем, избегая большого хаоса в брюшной полости.Левосторонний доступ был проведен Cai et al. для удобства анатомической резекции каудального отдела (94). Левосторонний доступ имел преимущества, особенно для поражений, возникших из доли Шпигеля с или без распространения на правую часть хвостатой доли, так как большинство этих подходов были описаны в ограниченных случаях, необходимы дальнейшие исследования, чтобы доказать их повторяемость.
Массивная кровопотеря и необходимость переливания крови при резекции печени имеют тесную связь с периоперационными осложнениями и рецидивом злокачественных новообразований (95,96).Контроль кровотечения — одна из основных задач всей LLR. Как обсуждалось ранее, LLR действительно имеет преимущества в снижении кровопотери и скорости переливания. Соответствующий баланс между давлением CO 2 пневмоперитонеума и ЦВД будет иметь важное значение для уменьшения венозного кровотечения и поддержания стабильной гемодинамики (97). Давление пневмоперитонеума обычно устанавливали на уровне 10–14 мм рт. Ст. И регулировали в соответствии с параметрами дыхательных путей, градиент ЦВД был необходим для снижения риска газовой эмболии (98–100).Между тем, хирурги должны понимать, что необходим тщательный гемостаз в плоскости рассечения, поскольку кровотечение из мелких вен может временно прекратиться под действием положительного давления в брюшной полости. Низкое ЦВД (<5 см вод. Ст. 2 O) необходимо для контроля кровотечения. Помогает обратное положение Тренделенбурга, ограниченная инфузия жидкости и кратковременное отключение механической вентиляции легких в экстренных случаях.
Система оценки / классификации сложности и кривая обучения LLR
Как упоминалось ранее, сложность процедуры сильно варьируется от типа к типу.Система оценки сложности или классификации необходима для предоперационной подготовки, особенно для начинающих. Ban et al. разработал систему оценки сложности, основанную на нескольких критических факторах (объем резекции, размер и расположение опухоли, близость к важным трубчатым структурам и функция печени). Система разделила сложный индекс на три уровня, которые служат руководством для хирургов (80). Несмотря на свои ограничения, эта новая система сложности получила широкое распространение. Другой аналогичный метод классификации трудностей, представленный Кавагути, упростил этапы оценки (101).Однако оценка сложных уровней только на основании операционных факторов не сможет удовлетворить потребности в точном и индивидуальном лечении. Международный обзор потенциальных факторов, которые могут усложнить операцию, проведенный до 80 опытных хирургов, показал, что следует также учитывать общее состояние пациента (102). Эти факторы включали ИМТ, историю химиотерапии, повторную резекцию печени и сопутствующие процедуры. Хасегава выдвинул новую модель для прогнозирования хирургических трудностей LLR.В эту модель были включены ожирение и количество тромбоцитов.
На данный момент был достигнут консенсус, что степень резекции и расположение поражения были двумя основными факторами. левосторонняя секционная резекция и гемигепатэктомия считались двумя водоразделами для новичков, продвинутых учеников и профессионалов. К сожалению, ни одна из представленных сложных систем не была полностью удовлетворена. Таким образом, всегда приветствовались новые идеи, которые могут включать, по крайней мере, цирроз печени. С другой стороны, для справки может быть полезна другая независимая система — кривая обучения.
Кривая обучения описывает процесс освоения операции согласованной бригады с использованием кумулятивной суммы или анализа кумулированной суммы с поправкой на риск, который касается общего времени операции и общей интраоперационной кровопотери в качестве основных показателей наблюдения. Согласно литературным данным, кривая обучения большой гепатэктомии составляла около 45 случаев, среднее время операции составляло около 250–350 минут, а средняя кровопотеря составляла около 300–500 мл (103–107). Результат показывает, что хирурги могут получить стабильные результаты после обучения почти в 45 случаях при условии квалифицированного выполнения открытой гепатэктомии и простого LLR.По мере того, как LLR выполняла все больше и больше по всему миру, ценный опыт непрерывно накапливался. Кривая обучения сложному LLR может стать круче, а это означает, что потребуется меньше случаев. Предполагается, что хирурги должны начать с клиновидной резекции и не рисковать, пытаясь выполнить сложный LLR, если только они не могут очень хорошо выполнить левостороннюю резекцию. На самом деле, овладение основным LLR — действительно сложная работа, даются рекомендации, что хирургам следует выполнять основные LLR с большой осторожностью, даже если они хорошо знакомы с лапароскопической хирургией.
Робот-гепатэктомия
Роботизированная система — еще один минимально инвазивный подход, который широко используется в желудочно-кишечных, мочевых и гинекологических операциях (108). Его применяли в хирургии печени в начале 2010-х годов, первоначальный опыт показал, что роботизированная система может использоваться не только при малой, но и при большой резекции печени (109, 110). Недавние обзоры суммировали полувековые разработки роботизированной хирургии печени (111, 112). Не ограничиваясь аналогичной эффективностью по сравнению с традиционным лапароскопическим доступом, его уникальные преимущества, заключающиеся в облегчении наложения швов под лапароскопом, позволяют ему предоставить больше возможностей в будущем.Но с другой стороны, сравнение, проведенное Цунгом, показало, что роботизированная гепатэктомия может оказаться не такой идеальной, как мы ожидали (113). Более того, более высокая стоимость роботизированной хирургии печени, вероятно, делает ее менее привлекательной для пациентов, ограниченная доступность устройств, относительное фиксированное положение пациента и скомпрометированная помощь ассистента также будут влиять на выбор хирургов при затруднении сложного случая.
Послеоперационное восстановление
Концепция ускоренного восстановления после операции (ERAS) была введена Кехлетом в 1997 году (114).ERAS ориентирован на оптимизацию периоперационного ведения с целью улучшения восстановления, снижения послеоперационной заболеваемости и общих затрат. Общие стратегии включают предоперационное обучение, индивидуальную поддержку питания, ранний прием внутрь и мобилизацию, соответствующую анальгезию и т. Д. Достижения, достигнутые во многих других областях хирургии, побудили ERAS к применению в хирургии печени (115). Рандомизированное контрольное исследование, проведенное для оценки ERAS в LLR, подтвердило эти преимущества (116). Пациенты, прошедшие программу ERAS, выиграли от более низкой заболеваемости, более высокого качества жизни и меньшей стоимости.Среди различных стратегий важную роль играли периоперационное обучение пациентов, ранняя послеоперационная мобилизация, уменьшение количества дренажных трубок, усиленный контроль боли, ограничение внутривенного введения жидкости и пероральное питание, которые также были рекомендованы руководством ERAS для хирургии печени (117).
Стоимость
Стоимость лечения — это финансовая проблема, которую беспокоят как медики, так и пациенты. LLR служит минимально инвазивным подходом, виды высокотехнологичного лапароскопического оборудования и инструментов незаменимы и могут увеличить операционные расходы.Однако опросы, проведенные в нескольких центрах, показали, что в большинстве случаев общая госпитальная стоимость LLR была не выше, чем при традиционном открытом подходе (118–121). Этот результат, вероятно, связан с более коротким послеоперационным пребыванием в больнице и более быстрым восстановлением при лапароскопическом доступе. Более того, поскольку развитие LLR идет быстрее, можно применять новые недорогие методы без ущерба для хирургических результатов. И это дает оптимистичный взгляд на будущее LLR.
Выводы
В заключение, благодаря усилиям хирургов печени и медицинских инженеров за последние два десятилетия, LLR стал технически осуществимым методом лечения заболеваний печени.Показания LLR расширились от местной резекции до сложных случаев, даже для донорства аллотрансплантата от живого донора. с кривой обучения 45–60 случаев, хирурги могут выполнять непрерывные высококачественные операции LLR (105). Было подсчитано, что до 2015 года во всем мире было выполнено более 9000 LLR, и это число все еще растет в геометрической прогрессии. Несмотря на то, что в настоящее время доступно небольшое количество РКИ, в условиях быстро накапливаемых случаев, многие важные вопросы, касающиеся онкологических, рентабельных и технических аспектов, скоро появятся.
Сноски
Конфликт интересов: Авторы не заявляют о конфликте интересов.
Список литературы
1. Литинский Г.С.
Профили в лапароскопии: Муре, Дюбуа и Периссат: лапароскопический прорыв в Европе (1987-1988).
JSLS
1999; 3: 163-7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Райх Х., МакГлинн Ф., ДеКаприо Дж. И др.
Лапароскопическое удаление доброкачественных образований печени.
Акушер Гинеколь
1991; 78: 956-8. [PubMed] [Google Scholar] 3. Катхуда Н., Фабиани П., Бенизри Э. и др.Лазерная резекция эхинококковой кисты печени при видеолапароскопии.
Br J Surg
1992; 79: 560-1. 10.1002 / bjs.18007 [PubMed] [CrossRef] [Google Scholar] 4. Klotz HP, Schlumpf R, Weder W. и др.
Минимально инвазивная хирургия для лечения увеличенных симптоматических кист печени.
Хирургическая лапароскопическая эндоскопия
1993; 3: 351-3. [PubMed] [Google Scholar] 5. Каннингем Дж. Д., Кац Л. Б., Брауэр С. Т. и др.
Лапароскопическая резекция двух гемангиом печени.
Хирургическая лапароскопическая эндоскопия
1995; 5: 277-80. [PubMed] [Google Scholar] 6. Хашизуме М., Такенака К., Янага К. и др.Лапароскопическая резекция печени по поводу гепатоцеллюлярной карциномы.
Эндоскопическая хирургия
1995; 9: 1289-91. 10.1007 / BF001
Лапароскопическая анатомическая (печеночная) латеральная сегментэктомия слева — технические аспекты.
Эндоскопическая хирургия
1996; 10: 758-61. 10.1007 / BF00193052 [PubMed] [CrossRef] [Google Scholar] 8. Канеко Х., Такаги С., Шиба Т.
Лапароскопическая частичная гепатэктомия и левосторонняя сегментэктомия: техника и результаты клинической серии.
Хирургия
1996; 120: 468-75.10.1016 / S0039-6060 (96) 80065-1 [PubMed] [CrossRef] [Google Scholar] 9. Сасаки А., Нитта Х., Оцука К. и др.
Десятилетний опыт тотальной лапароскопической резекции печени в одном учреждении.
Br J Surg
2009; 96: 274-9. 10.1002 / bjs.6472 [PubMed] [CrossRef] [Google Scholar] 10. Дагер И., О’Рурк Н., Геллер Д.А. и др.
Лапароскопическая большая гепатэктомия: эволюция стандартов лечения.
Энн Сург
2009; 250: 856-60. 10.1097 / SLA.0b013e3181bcaf46 [PubMed] [CrossRef] [Google Scholar] 11. Черки Д., Субрейн О., Хассон Э. и др.Лапароскопическая гепатэктомия живого донора при трансплантации печени у детей.
Ланцет
2002; 359: 392-6. 10.1016 / S0140-6736 (02) 07598-0 [PubMed] [CrossRef] [Google Scholar] 12. Буэлл Дж. Ф., Черки Д., Геллер Д. А. и др.
Международная позиция по лапароскопической хирургии печени: заявление Луисвилля, 2008 г.
Энн Сург
2009; 250: 825-30. 10.1097 / SLA.0b013e3181b3b2d8 [PubMed] [CrossRef] [Google Scholar] 13. Вакабаяси Г., Черки Д., Геллер Д.А. и др.
Рекомендации по лапароскопической резекции печени: отчет второй международной консенсусной конференции, состоявшейся в Мориоке.Энн Сург
2015; 261: 619-29. [PubMed] [Google Scholar] 14. Нгуен К.Т., Гамблин Т.К., Геллер Д.А.
Мировой обзор лапароскопической резекции печени — 2804 пациента.
Энн Сург
2009; 250: 831-41. 10.1097 / SLA.0b013e3181b0c4df [PubMed] [CrossRef] [Google Scholar] 15. Транчарт Х, Дагер И.
Лапароскопическая резекция печени: обзор.
J Visc Surg
2014; 151: 107-15. 10.1016 / j.jviscsurg.2013.10.003 [PubMed] [CrossRef] [Google Scholar] 16. Цай XJ, Ян Дж., Ю Х и др.
Клиническое исследование лапароскопической и открытой гепатэктомии при злокачественных опухолях печени.Эндоскопическая хирургия
2008; 22: 2350-6. 10.1007 / s00464-008-9789-z [PubMed] [CrossRef] [Google Scholar] 17. Сюй Х, Лю Ф, Ли Х и др.
Результаты после лапароскопической и открытой обширной гепатэктомии: метаанализ.
Сканд Дж Гастроэнтерол
2017; 52: 1307-14. [PubMed] [Google Scholar] 18. Сириа Р., Черки Д., Геллер Д.А. и др.
Сравнительные краткосрочные преимущества лапароскопической резекции печени: 9000 случаев и лазание.
Энн Сург
2016; 263: 761-77. 10.1097 / SLA.0000000000001413 [PubMed] [CrossRef] [Google Scholar] 19. Брюикс Дж., Шерман М., Комитет по практическим рекомендациям и др.
Лечение гепатоцеллюлярной карциномы.Гепатология
2005; 42: 1208-36. 10.1002 / hep.20933 [PubMed] [CrossRef] [Google Scholar] 20. Bruix J, Sherman M, Llovet JM и др.
Клиническое лечение гепатоцеллюлярной карциномы. Выводы конференции Barcelona-2000 EASL. Европейская ассоциация изучения печени.
J Hepatol
2001; 35: 421-30. 10.1016 / S0168-8278 (01) 00130-1 [PubMed] [CrossRef] [Google Scholar] 21. Канеко Х., Такаги С., Оцука Ю. и др.
Лапароскопическая резекция печени при гепатоцеллюлярной карциноме.
Am J Surg
2005; 189: 190-4. 10.1016 / j.amjsurg.2004.09.010 [PubMed] [CrossRef] [Google Scholar] 22. Дулюк Дж. Л., Винтрингер П., Стабилини С. и др.
Изолированная лапароскопическая резекция хвостатой доли печени: хирургическая техника и отчет о 2 случаях.
Хирургическая операция Laparosc Endosc Percutan Tech
2006; 16: 32-5. 10.1097 / 01.sle.0000202183.27042.63 [PubMed] [CrossRef] [Google Scholar] 23. Араки К., Фукс Д., Номи Т. и др.
Возможность лапароскопической резекции печени по хвостатой доле: техническая стратегия и сравнительный анализ с передне-нижним и задневерхним сегментами.Эндоскопическая хирургия
2016; 30: 4300-6. 10.1007 / s00464-016-4747-7 [PubMed] [CrossRef] [Google Scholar] 24. Чо Джи, Хан Х.С., Юн Й.С. и др.
Опыт лапароскопической резекции печени с поражением задневерхних сегментов печени.
Эндоскопическая хирургия
2008; 22: 2344-9. 10.1007 / s00464-008-9966-0 [PubMed] [CrossRef] [Google Scholar] 25. Сян Л., Сяо Л., Ли Дж. И др.
Безопасность и возможность лапароскопической гепатэктомии при гепатоцеллюлярной карциноме задневерхних сегментов печени.
Мир J Surg
2015; 39: 1202-9.10.1007 / s00268-015-2946-3 [PubMed] [CrossRef] [Google Scholar] 26. Тео Дж. Й., Кам Дж. Х., Чан С. Ю. и др.
Лапароскопическая резекция печени по поводу задневерхних и переднебоковых поражений — опыт сравнения в азиатском центре.
Хирургический гепатобилиарный Нутр
2015; 4: 379-90. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Чжэн Б., Чжао Р., Ли Х и др.
Сравнение лапароскопической резекции печени при поражениях, расположенных в переднебоковом и задневерхнем сегментах: метаанализ.
Эндоскопическая хирургия
2017; 31: 4641-8. 10.1007 / s00464-017-5527-8 [PubMed] [CrossRef] [Google Scholar] 28.Ай Дж. Х., Ли Дж. У., Чен Дж. И др.
Возможность и безопасность лапароскопической резекции печени при гепатоцеллюлярной карциноме с размером опухоли 5-10 см.
PLoS One
2013; 8: e72328. 10.1371 / journal.pone.0072328 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 29. Квон Й., Хан Х.С., Юн Й.С. и др.
Являются ли большие гепатоцеллюлярные карциномы противопоказанием для лапароскопической резекции печени?
J Laparoendosc Adv Surg Tech A
2015; 25: 98-102. 10.1089 / lap.2014.0226 [PubMed] [CrossRef] [Google Scholar] 30. Wei F, Lu C, Cai L, et al.Может ли лапароскопическая резекция печени быть благоприятным вариантом для пациентов с большими или множественными внутрипеченочными холангиокарциномами?
Эндоскопическая хирургия
2017; 31: 3646-55. 10.1007 / s00464-016-5399-3 [PubMed] [CrossRef] [Google Scholar] 31. Номи Т., Фукс Д., Луве С. и др.
Результаты лапароскопической резекции печени у пациентов с большими колоректальными метастазами в печени: анализ с учетом конкретных случаев.
Мир J Surg
2016; 40: 1702-8. 10.1007 / s00268-016-3467-4 [PubMed] [CrossRef] [Google Scholar] 32. Ким С.Х., Ким К.Х., Киршнер В.А. и др.Чистая лапароскопическая правосторонняя гепатэктомия по поводу гигантской гемангиомы с использованием переднего доступа.
Эндоскопическая хирургия
2017; 31: 2338-9. 10.1007 / s00464-016-5224-z [PubMed] [CrossRef] [Google Scholar] 33. Ван С., Гао Дж, Ян М. и др.
Внутриопухолевая коагуляция с помощью радиочастотной абляции облегчила лапароскопическую резекцию гигантской гемангиомы печени: отчет о хирургической технике двух случаев.
Oncotarget
2017; 8: 52006-11. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. van Rosmalen BV, Bieze M, Besselink MG и др.
Отдаленные результаты резекции у пациентов с симптоматическими доброкачественными опухолями печени.Е.П.Б. (Оксфорд)
2016; 18: 908-14. 10.1016 / j.hpb.2016.07.013 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 35. Самштейн Б., Черки Д., Ротеллар Ф. и др.
Полностью лапароскопическая полная левая гепатэктомия при трансплантации печени от живого донора у подростков и взрослых.
Am J трансплантат
2013; 13: 2462-6. 10.1111 / ajt.12360 [PubMed] [CrossRef] [Google Scholar] 36. Субрейн О., Пердигао Котта Ф., Скаттон О.
Чистая лапароскопическая правосторонняя гепатэктомия у живого донора.
Am J трансплантат
2013; 13: 2467-71. 10.1111 / ajt.12361 [PubMed] [CrossRef] [Google Scholar] 37.Пак Джи, Ким К.Х., Ли С.Г.
Лапароскопическая гепатэктомия у живого донора: обзор текущего состояния.
J Гепатобилиарная панкреатология
2015; 22: 779-88. 10.1002 / jhbp.288 [PubMed] [CrossRef] [Google Scholar] 38. Сух К.С., Хонг С.К., Ли К.В. и др.
Чистая лапароскопическая гепатэктомия живого донора: основное внимание уделяется 55 донорам, перенесшим правую гепатэктомию.
Am J трансплантат
2018; 18: 434-43. 10.1111 / ajt.14455 [PubMed] [CrossRef] [Google Scholar] 39. Такахара Т., Вакабаяси Г., Нитта Н. и др.
Первое сравнительное исследование периоперационных результатов чистой лапароскопической донорской гепатэктомии и лапароскопической донорской гепатэктомии в одном учреждении.Трансплантация
2017; 101: 1628-36. 10.1097 / TP.0000000000001675 [PubMed] [CrossRef] [Google Scholar] 40. Хан Х.С., Чо Дж.Й., Канеко Х. и др.
Заявление группы экспертов по лапароскопической гепатэктомии от живого донора.
Dig Surg
2018; 35: 284-8. 10.1159 / 000479242 [PubMed] [CrossRef] [Google Scholar] 41. Лловет Дж. М., Фустер Дж., Брюикс Дж.
Анализ намерения лечить хирургического лечения ранней гепатоцеллюлярной карциномы: резекция по сравнению с трансплантацией.
Гепатология
1999; 30: 1434-40. 10.1002 / hep.510300629 [PubMed] [CrossRef] [Google Scholar] 42.Яо Ф.Й., Басс Н.М., Николай Б. и др.
Трансплантация печени при гепатоцеллюлярной карциноме: анализ выживаемости в соответствии с принципом назначения лечения и исключения из списка ожидания.
Трансплантация печени
2002; 8: 873-83. 10.1053 / jlts.2002.34923 [PubMed] [CrossRef] [Google Scholar] 43. Яманака Н., Танака Т., Танака В. и др.
Лапароскопическая частичная гепатэктомия.
Гепатогастроэнтерология
1998; 45: 29-33. [PubMed] [Google Scholar] 44. Черки Д., Хассон Э., Хаммуд Р. и др.
Лапароскопическая резекция печени: технико-экономическое обоснование у 30 пациентов.Энн Сург
2000; 232: 753-62. 10.1097 / 00000658-200012000-00004 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Жиго Дж. Ф., Глинер Д., Сантьяго Азагра Дж. И др.
Лапароскопическая резекция печени при злокачественных опухолях печени: предварительные результаты многоцентрового европейского исследования.
Энн Сург
2002; 236: 90-7. 10.1097 / 00000658-200207000-00014 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 46. Белли Дж., Лимонгелли П., Фантини С. и др.
Лапароскопическое и открытое лечение гепатоцеллюлярной карциномы у пациентов с циррозом печени.Br J Surg
2009; 96: 1041-8. 10.1002 / bjs.6680 [PubMed] [CrossRef] [Google Scholar] 47. Труант С., Бурас А.Ф., Хеббар М. и др.
Лапароскопическая резекция по сравнению с открытой резекцией печени по поводу периферической гепатоцеллюлярной карциномы у пациентов с хроническим заболеванием печени: исследование с сопоставлением случаев.
Эндоскопическая хирургия
2011; 25: 3668-77. 10.1007 / s00464-011-1775-1 [PubMed] [CrossRef] [Google Scholar] 48. Cheung TT, Dai WC, Tsang SH и др.
Чистая лапароскопическая гепатэктомия по сравнению с открытой гепатэктомией при гепатоцеллюлярной карциноме у 110 пациентов с циррозом печени: анализ склонности в одном центре.Энн Сург
2016; 264: 612-20. 10.1097 / SLA.0000000000001848 [PubMed] [CrossRef] [Google Scholar] 49. Юн Йи, Ким К.Х., Кан Ш.и др.
Чистая лапароскопическая и открытая правая гепатэктомия при гепатоцеллюлярной карциноме у пациентов с циррозом: анализ, сопоставленный с оценкой предрасположенности.
Энн Сург
2017; 265: 856-63. 10.1097 / SLA.0000000000002072 [PubMed] [CrossRef] [Google Scholar] 50. Сюй Х.В., Лю Ф., Ли Х.Й. и др.
Результаты после лапароскопической и открытой обширной гепатэктомии по поводу гепатоцеллюлярной карциномы у пациентов с циррозом: анализ с сопоставлением по шкале предрасположенности.Эндоскопическая хирургия
2018; 32: 712-9. 10.1007 / s00464-017-5727-2 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Остин ПК.
Введение в методы оценки предрасположенности для уменьшения влияния искажений в наблюдательных исследованиях.
Многовариантное поведение Res
2011; 46: 399-424. 10.1080 / 00273171.2011.568786 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 53. Dagher I, Caillard C, Proske JM и др.
Лапароскопическая правосторонняя гепатэктомия: оригинальная методика и результаты.
J Am Coll Surg
2008; 206: 756-60. 10.1016 / j.jamcollsurg.2007.09.012 [PubMed] [CrossRef] [Google Scholar] 54. Santambrogio R, Opocher E, Ceretti AP и др.
Влияние интраоперационной ультрасонографии в лапароскопической хирургии печени.
Эндоскопическая хирургия
2007; 21: 181-8. 10.1007 / s00464-005-0738-9 [PubMed] [CrossRef] [Google Scholar] 55. Lai EC, Tang CN, Ha JP, et al.
Развитие влияния лапароскопии и лапароскопического УЗИ на пациентов с гепатоцеллюлярной карциномой.
Am J Surg
2008; 196: 736-40. 10.1016 / j.amjsurg.2007.08.073 [PubMed] [CrossRef] [Google Scholar] 56.Араки К., Конрад С., Огисо С. и др.
Интраоперационная ультрасонография лапароскопической гепатэктомии: ключевой метод безопасного пересечения печени.
J Am Coll Surg
2014; 218: e37-41. 10.1016 / j.jamcollsurg.2013.10.022 [PubMed] [CrossRef] [Google Scholar] 57. Косуге Т., Макуучи М., Такаяма Т. и др.
Отдаленные результаты после резекции гепатоцеллюлярной карциномы: опыт 480 случаев.
Гепатогастроэнтерология
1993; 40: 328-32. [PubMed] [Google Scholar] 58. Хасегава К., Кокудо Н., Имамура Х. и др.
Прогностическое влияние анатомической резекции гепатоцеллюлярной карциномы.Энн Сург
2005; 242: 252-9. 10.1097 / 01.sla.0000171307.37401.db [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Национальная группа хирургии печени Общество хирургии CMA
Консенсус экспертов по лапароскопической гепатэктомии (версия 2013 г.).
J Huazhong Univ Sci Technolog Med Sci
2013; 33: 791-7. 10.1007 / s11596-013-1200-1 [PubMed] [CrossRef] [Google Scholar] 61. Сакода М., Уэно С., Иино С. и др.
Анатомическая лапароскопическая гепатэктомия при гепатоцеллюлярной карциноме с использованием флуоресцентной визуализации индоцианинового зеленого.
J Laparoendosc Adv Surg Tech A
2014; 24: 878-82.10.1089 / lap.2014.0243 [PubMed] [CrossRef] [Google Scholar] 62. Исидзава Т., Цукер Н.Б., Кокудо Н. и др.
Положительное и отрицательное окрашивание сегментов печени с использованием методов флуоресцентной визуализации во время лапароскопической гепатэктомии.
Arch Surg
2012; 147: 393-4. 10.1001 / archsurg.2012.59 [PubMed] [CrossRef] [Google Scholar] 63. Исидзава Т., Сайура А., Кокудо Н.
Клиническое применение визуализации с флуоресценцией индоцианинового зеленого во время гепатэктомии.
Хирургический гепатобилиарный Нутр
2016; 5: 322-8. 10.21037 / hbsn.2015.10.01 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 64.Кудо Х., Исидзава Т., Тани К. и др.
Визуализация субкапсулярных злокачественных новообразований печени с помощью флуоресцентной визуализации индоцианинового зеленого цвета во время лапароскопической гепатэктомии.
Эндоскопическая хирургия
2014; 28: 2504-8. 10.1007 / s00464-014-3468-z [PubMed] [CrossRef] [Google Scholar] 65. Оцука Ю., Канеко Х., Клири С.П. и др.
Какой метод пересечения паренхимы лучше всего при лапароскопической резекции печени? Всесторонний обзор клинического вопроса на 2-й Международной конференции консенсуса по лапароскопической резекции печени.J Гепатобилиарная панкреатология
2015; 22: 363-70. 10.1002 / jhbp.216 [PubMed] [CrossRef] [Google Scholar] 67. Рау Х.Г., Дюссель А.П., Вурцбахер С.
Применение водоструйной диссекции при открытой и лапароскопической резекции печени.
Е.П.Б. (Оксфорд)
2008; 10: 275-80. 10.1080 / 13651820802167706 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 68. Мбах Н.А., Браун Р.Э., Бауэр М.Р. и др.
Различия между биполярной компрессией и ультразвуковыми устройствами для пересечения паренхимы при лапароскопической резекции печени.
Е.П.Б. (Оксфорд)
2012; 14: 126-31.10.1111 / j.1477-2574.2011.00414.x [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 69. Хорган П.Г.
Новый метод разделения паренхимы во время гепатэктомии.
Am J Surg
2001; 181: 236-7. 10.1016 / S0002-9610 (01) 00556-6 [PubMed] [CrossRef] [Google Scholar] 70. Герч П., Пеллони А., Герра А. и др.
Первоначальный опыт использования гармонического скальпеля в хирургии печени.
Гепатогастроэнтерология
2000; 47: 763-6. [PubMed] [Google Scholar] 71. Гарольд К.Л., Поллингер Х., Мэтьюз Б.Д. и др.
Сравнение ультразвуковой энергии, биполярной тепловой энергии и сосудистых зажимов для гемостаза малых, средних и крупных артерий.Эндоскопическая хирургия
2003; 17: 1228-30. 10.1007 / s00464-002-8833-7 [PubMed] [CrossRef] [Google Scholar] 72. Икегами Т., Шимада М., Имура С. и др.
Эмболия газом аргона при применении лапароскопической микроволновой коагуляционной терапии.
J Хирургия гепатобилиарной поджелудочной железы
2009; 16: 394-8. 10.1007 / s00534-008-0039-5 [PubMed] [CrossRef] [Google Scholar] 73. Коно М., Яхаги Н., Китахара М. и др.
Остановка сердца, связанная с использованием коагулятора аргонового луча во время лапароскопической холецистэктомии.
Br J Anaesth
2001; 87: 644-6. 10.1093 / bja / 87.4.644 [PubMed] [CrossRef] [Google Scholar] 74. Хуанг М.Т., Ли В.Дж., Ван В. и др.
Ручная лапароскопическая гепатэктомия по поводу солидной опухоли в задней части правой доли: первоначальный опыт.
Энн Сург
2003; 238: 674-9. 10.1097 / 01.sla.0000094301.21038.8d [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 75. Курокава Т., Инагаки Х., Сакамото Дж. И др.
Ручная лапароскопическая анатомическая лобэктомия левой лобэктомии с использованием методики контроля гемигепатических сосудов.
Эндоскопическая хирургия
2002; 16: 1637-8. 10.1007 / s00464-002-4212-7 [PubMed] [CrossRef] [Google Scholar] 76.Икеда Т., Йонемура Ю., Уэда Н. и др.
Чистая лапароскопическая правосторонняя гепатэктомия в положении полулежа с использованием внутрипеченочного глиссоновского доступа и модифицированного маневра подвешивания для минимизации интраоперационного кровотечения.
Хирург сегодня
2011; 41: 1592-8. 10.1007 / s00595-010-4479-6 [PubMed] [CrossRef] [Google Scholar] 77. Икеда Т., Мано Й, Морита К. и др.
Чистая лапароскопическая гепатэктомия в полупронном положении для большой резекции правой печени.
J Гепатобилиарная панкреатология
2013; 20: 145-50. 10.1007 / s00534-012-0558-y [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 78.Икеда Т., Тошима Т., Харимото Н. и др.
Лапароскопическая резекция печени в положении полупроника при опухолях передневерхнего и заднего сегментов с использованием новой техники двойного обращения и биполярной ирригационной системы.
Эндоскопическая хирургия
2014; 28: 2484-92. 10.1007 / s00464-014-3469-y [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 80. Бан Д., Танабе М., Ито Х. и др.
Новая система оценки сложности лапароскопической резекции печени.
J Гепатобилиарная панкреатология
2014; 21: 745-53. 10.1002 / jhbp.166 [PubMed] [CrossRef] [Google Scholar] 81.Linden BC, Humar A, Sielaff TD.
Лапароскопическая резекция печени левого бокового сегмента скобками — техника и результаты.
J Gastrointest Surg
2003; 7: 777-82. 10.1016 / S1091-255X (03) 00099-4 [PubMed] [CrossRef] [Google Scholar] 82. Чанг С., Лоран А., Тайар С. и др.
Лапароскопия как рутинный подход к левосторонней резекции.
Br J Surg
2007; 94: 58-63. 10.1002 / bjs.5562 [PubMed] [CrossRef] [Google Scholar] 83. Белли Дж., Фантини С., Д’Агостино А. и др.
Лапароскопическая лобэктомия левой боковой доли печени: более безопасный и быстрый метод.J Хирургия гепатобилиарной поджелудочной железы
2006; 13: 149-54. 10.1007 / s00534-005-1023-й [PubMed] [CrossRef] [Google Scholar] 84. Ван Х, Ли Дж, Ван Х и др.
Валидация лапароскопически прошитого доступа в качестве стандартного метода резекции печени на левом боковом сегменте.
Мир J Surg
2013; 37: 806-11. 10.1007 / s00268-013-1912-1 [PubMed] [CrossRef] [Google Scholar] 85. Лю CL, Fan ST, Cheung ST и др.
Передний доступ по сравнению с традиционным доступом резекция правой печени при крупной гепатоцеллюлярной карциноме: проспективное рандомизированное контролируемое исследование.Энн Сург
2006; 244: 194-203. 10.1097 / 01.sla.0000225095.18754.45 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 86. Ву Т.Дж., Ван Ф., Лин Ю.С. и др.
Правая гепатэктомия передним методом с подвешиванием печени по сравнению с традиционным доступом при больших гепатоцеллюлярных карциномах.
Br J Surg
2010; 97: 1070-8. 10.1002 / bjs.7083 [PubMed] [CrossRef] [Google Scholar] 87. Капуссотти Л., Ферреро А., Руссолилло Н. и др.
Рутинный передний доступ во время правой гепатэктомии: результаты проспективного рандомизированного контролируемого исследования.J Gastrointest Surg
2012; 16: 1324-32. 10.1007 / s11605-012-1894-6 [PubMed] [CrossRef] [Google Scholar] 88. Субрейн О., Шварц Л., Коши Ф. и др.
Концептуальная техника лапароскопической правой гепатэктомии, основанная на фактах и онкологических принципах: каудальный доступ.
Энн Сург
2015; 261: 1226-31. 10.1097 / SLA.0000000000000737 [PubMed] [CrossRef] [Google Scholar] 89. Cai L, Wei F, Yu Y и др.
Лапароскопическая правая гепатэктомия каудальным подходом по сравнению с традиционным подходом: сравнительное исследование.
J Laparoendosc Adv Surg Tech A
2016; 26: 540-7.10.1089 / lap.2015.0628 [PubMed] [CrossRef] [Google Scholar] 90. Такахаши М., Вакабаяси Г., Нитта Х. и др.
Чистая лапароскопическая правосторонняя гепатэктомия передним доступом с маневром подвешивания при большой внутрипеченочной холангиокарциноме.
Эндоскопическая хирургия
2013; 27: 4732-3. 10.1007 / s00464-013-3202-2 [PubMed] [CrossRef] [Google Scholar] 91. Tomishige H, Morise Z, Kawabe N и др.
Каудальный доступ к чистой лапароскопической задней секционнойэктомии с точки зрения специфики лапароскопии.
World J Gastrointest Surg
2013; 5: 173-7.10.4240 / wjgs.v5.i6.173 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 92. Номи Т., Фукс Д., Агравал А. и др.
Полностью лапароскопическая правая гепатэктомия в сочетании с резекцией нижней полой вены передним доступом.
Энн Сург Онкол
2015; 22: 851. 10.1245 / s10434-014-4030-x [PubMed] [CrossRef] [Google Scholar] 93. Ямасита С., Лойер Э, Канг Х.С. и др.
Тотальный трансторакальный доступ облегчает лапароскопическую резекцию печени у пациентов, перенесших значительную абдоминальную операцию в анамнезе.
Энн Сург Онкол
2017; 24: 1376-7.10.1245 / s10434-016-5685-2 [PubMed] [CrossRef] [Google Scholar] 94. Цай X, Чжао Дж, Ван И и др.
Левосторонний, чисто лапароскопический подход к анатомической хвостовой гепатэктомии: опыт единого центра.
J Laparoendosc Adv Surg Tech A
2016; 26: 103-8. 10.1089 / lap.2015.0223 [PubMed] [CrossRef] [Google Scholar] 95. Квон А.Х., Мацуи Ю., Камияма Ю.
Периоперационное переливание крови при гепатоцеллюлярной карциноме: влияние иммунологического профиля и безрецидивной выживаемости.
Рак
2001; 91: 771-8. 10.1002 / 1097-0142 (20010215) 91: 4 <771 :: AID-CNCR1063> 3.0.CO; 2-9 [PubMed] [CrossRef] [Google Scholar] 96. de Boer MT, Molenaar IQ, Porte RJ.
Влияние кровопотери на исход после резекции печени.
Dig Surg
2007; 24: 259-64. 10.1159 / 000103656 [PubMed] [CrossRef] [Google Scholar] 97. Транчарт Х., Ди Джиуро Дж., Лайнас П. и др.
Лапароскопическая резекция печени с предварительным селективным контролем сосудов.
Am J Surg
2013; 205: 8-14. 10.1016 / j.amjsurg.2012.04.015 [PubMed] [CrossRef] [Google Scholar] 98. Оцука Ю., Катагири Т., Исии Дж. И др.
Газовая эмболия при лапароскопической гепатэктомии: каково оптимальное пневмоперитонеальное давление при лапароскопической большой гепатэктомии?
J Гепатобилиарная панкреатология
2013; 20: 137-40.10.1007 / s00534-012-0556-0 [PubMed] [CrossRef] [Google Scholar] 99. Кобаяши С., Хонда Дж., Курата М. и др.
Экспериментальное исследование взаимосвязи между давлением в дыхательных путях, давлением пневмоперитонеума и центральным венозным давлением при чистой лапароскопической гепатэктомии.
Энн Сург
2016; 263: 1159-63. 10.1097 / SLA.0000000000001482 [PubMed] [CrossRef] [Google Scholar] 100. Эйрикссон К., Форс Д., Рубертссон С. и др.
Высокое внутрибрюшное давление во время экспериментальной лапароскопической резекции печени снижает кровотечение, но увеличивает риск газовой эмболии.Br J Surg
2011; 98: 845-52. 10.1002 / bjs.7457 [PubMed] [CrossRef] [Google Scholar] 101. Кавагути Ю., Фукс Д., Кокудо Н. и др.
Сложность лапароскопической резекции печени: предложение по новой классификации.
Энн Сург
2018; 267: 13-7. 10.1097 / SLA.0000000000002176 [PubMed] [CrossRef] [Google Scholar] 102. Холлз М.С., Черки Д., Тейлор М.А. и др.
Рассказывают ли текущие оценки сложности лапароскопической хирургии печени всю историю? Международный обзор и рекомендации на будущее.
Е.П.Б. (Оксфорд)
2018; 20: 231-6.10.1016 / j.hpb.2017.08.028 [PubMed] [CrossRef] [Google Scholar] 103. Cai X, Li Z, Zhang Y и др.
Лапароскопическая резекция печени и кривая обучения: 14-летний опыт работы в одном центре.
Эндоскопическая хирургия
2014; 28: 1334-41. 10.1007 / s00464-013-3333-5 [PubMed] [CrossRef] [Google Scholar] 104. Номи Т., Фукс Д., Кавагути Ю. и др.
Кривая обучения лапароскопической большой гепатэктомии.
Br J Surg
2015; 102: 796-804. 10.1002 / bjs.9798 [PubMed] [CrossRef] [Google Scholar] 105. Браун К.М., Геллер Д.А.
Какова кривая обучения лапароскопической большой гепатэктомии?
J Gastrointest Surg
2016; 20: 1065-71.10.1007 / s11605-016-3100-8 [PubMed] [CrossRef] [Google Scholar] 106. Томассини Ф., Скудери В., Колман Р. и др.
Единая кривая обучения хирургу лапароскопической резекции печени: непрерывный процесс, развивающийся через поэтапные трудности.
Медицина (Балтимор)
2016; 95: e5138. 10.1097 / MD.0000000000005138 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 107. ван дер Поэль М.Дж., Бесселинк М.Г., Чиприани Ф. и др.
Кривая результатов и обучения у 159 последовательных пациентов, перенесших тотальную лапароскопическую гемигепатэктомию.JAMA Surg
2016; 151: 923-8. 10.1001 / jamasurg.2016.1655 [PubMed] [CrossRef] [Google Scholar] 108. Ханли Э.Дж., Таламини М.А.
Роботизированная абдоминальная хирургия.
Am J Surg
2004; 188: 19С-26С. 10.1016 / j.amjsurg.2004.08.020 [PubMed] [CrossRef] [Google Scholar] 109. Джулианотти П.С., Коратти А., Сбрана Ф. и др.
Роботизированная хирургия печени: результаты 70 резекций.
Хирургия
2011; 149: 29-39. 10.1016 / j.surg.2010.04.002 [PubMed] [CrossRef] [Google Scholar] 110. Choi GH, Choi SH, Kim SH и др.
Роботизированная резекция печени: методика и результаты 30 последовательных процедур.Эндоскопическая хирургия
2012; 26: 2247-58. 10.1007 / s00464-012-2168-9 [PubMed] [CrossRef] [Google Scholar] 111. Nota CL, Rinkes IHB, Hagendoorn J.
Создание программы роботизированной гепатэктомии: западноевропейский опыт и перспективы.
Хирургический гепатобилиарный Нутр
2017; 6: 239-45. 10.21037 / hbsn.2016.12.05 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 113. Цунг А., Геллер Д.А., Сукато Д.К. и др.
Роботизированная и лапароскопическая гепатэктомия: согласованное сравнение.
Энн Сург
2014; 259: 549-55. 10.1097 / SLA.0000000000000250 [PubMed] [CrossRef] [Google Scholar] 114.Кехлет Х.
Мультимодальный подход к контролю послеоперационной патофизиологии и реабилитации.
Br J Anaesth
1997; 78: 606-17. 10.1093 / bja / 78.5.606 [PubMed] [CrossRef] [Google Scholar] 115. Пейдж AJ, Ejaz A, Spolverato G и др.
Протоколы ускоренного восстановления после операции по открытой гепатэктомии — физиология, иммуномодуляция и выполнение.
J Gastrointest Surg
2015; 19: 387-99. 10.1007 / s11605-014-2712-0 [PubMed] [CrossRef] [Google Scholar] 116. Лян Х, Инь Х, Ван Х и др.
Расширенная программа восстановления по сравнению с традиционным лечением при лапароскопической гепатэктомии.Медицина (Балтимор)
2016; 95: e2835. 10.1097 / MD.0000000000002835 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 117. Меллул Э., Хубнер М., Скотт М. и др.
Руководство по периоперационному уходу при хирургии печени: рекомендации общества по расширенному восстановлению после операции (ERAS).
Мир J Surg
2016; 40: 2425-40. 10.1007 / s00268-016-3700-1 [PubMed] [CrossRef] [Google Scholar] 118. Гобардхан П.Д., Субар Д., Гайет Б.
Лапароскопическая хирургия печени: обзор литературы и опыта одного центра.Лучшая практика Res Clin Gastroenterol
2014; 28: 111-21. 10.1016 / j.bpg.2013.11.012 [PubMed] [CrossRef] [Google Scholar] 119. Мартин Р.К., 2-й, Мбах Н.А., Сент-Хилл Р. и др.
Сравнение лапароскопической и открытой резекции печени при гепатоцеллюлярной карциноме: улучшение результатов и аналогичные затраты.
Мир J Surg
2015; 39: 1519-26. 10.1007 / s00268-015-2974-z [PubMed] [CrossRef] [Google Scholar] 120. Клири С.П., Хан Х.С., Ямамото М. и др.
Сравнительная стоимость лапароскопической и открытой резекции печени: отчет для 2-й Международной консенсусной конференции по лапароскопической резекции печени.Эндоскопическая хирургия
2016; 30: 4691-6. 10.1007 / s00464-016-4801-5 [PubMed] [CrossRef] [Google Scholar] 121. Кавагути Й., Оцука Й., Канеко Х. и др.
Сравнение финансовых и краткосрочных результатов лапароскопической и открытой гепатэктомии: преимущества для пациентов и больниц.
Хирург сегодня
2016; 46: 535-42. 10.1007 / s00595-015-1189-0 [PubMed] [CrossRef] [Google Scholar]
Минимально инвазивная хирургия печени | Мемориальный онкологический центр им. Слоуна Кеттеринга
За последние 15 лет минимально инвазивная общая хирургия быстро расширилась, включив лапароскопические и роботизированные методы холецистэктомии, колэктомии, снижения веса желудка и других процедур.Например, холецистэктомия, процедура, которая раньше требовала 10-дюймового разреза в брюшной стенке, сегодня обычно требует только нескольких небольших разрезов, все размером менее одного дюйма.
Напротив, при операциях на печени и поджелудочной железе малоинвазивные методы применялись медленнее из-за сложности этих процедур. Хирурги из гепатопанкреатобилиарной службы Мемориала Слоуна Кеттеринга за последние 19 лет выполнили более 4000 резекций печени по поводу злокачественных новообразований при широком спектре злокачественных заболеваний печени, как первичных, так и вторичных.
Как мировой лидер в этой области, мы разработали и продолжаем совершенствовать малоинвазивные методы, как лапароскопические, так и роботизированные, а также интраоперационную навигацию, чтобы расширить возможности лечения пациентов со злокачественными новообразованиями печени.
Техника лапароскопической хирургии печени
Первоначально лапароскопические резекции печени выполнялись при небольших злокачественных опухолях или доброкачественных опухолях с симптомами. По мере накопления опыта и развития технологий мы расширили использование лапароскопии во всех аспектах хирургии печени.В настоящее время мы ежегодно выполняем более 40 малоинвазивных резекций печени (рис. 1).
Одна из первых проблем заключалась в том, будут ли исходы рака, такие как границы и частота местных рецидивов, такими же при лапароскопических операциях, как и при открытых операциях.
Из анализа нашего исследования случай-контроль индивидуально подобранных пар, прооперированных с 1998 по 2008 гг., Мы обнаружили, что лапароскопия была связана со значительным снижением кровопотери, частоты переливаний, частоты маневра Прингла, послеоперационной заболеваемости, времени восстановления, продолжительности пребывание в больнице и частота возникновения послеоперационной грыжи.
Кроме того, для пациентов со злокачественными опухолями мы обнаружили, что не было нарушения хирургических границ или местного рецидива в обеих группах, и что общая картина рецидивов была аналогичной. Короче говоря, было показано, что лапароскопическая резекция приводит к сходным оперативным исходам и исходам рака у тщательно отобранных пациентов. (1)
Вернуться наверх
Роботизированная техника хирургии печени
Совсем недавно мы разработали роботизированные методы хирургии печени с использованием хирургической системы da Vinci® (рис. 2).Роботизированные инструменты могут предоставить хирургу большую гибкость в некоторых минимально инвазивных условиях благодаря движению запястья, которое имитирует движения руки человека. Этот прибор работает в сочетании с трехмерной камерой высокой четкости. Мы увеличили объем роботизированных операций на печени с нуля в 2009 году до 15 случаев в год в 2012 году. Кроме того, мы ежегодно выполняем более 15 роботизированных холецистэктомий. Институциональная приверженность Memorial Sloan Kettering к роботизированной хирургии помогла нам в этом росте, и теперь у нас есть пять роботов da Vinci® Si последнего поколения.
Вернуться наверх
Резекция печени с абляцией
По мере расширения показаний к хирургическому лечению метастазов в печень использование мультимодальных методов лечения стало более распространенным. Сегодня примерно 20 процентов наших резекций печени сочетаются с абляцией — техникой, в которой для уничтожения или удаления опухоли используется тепловая энергия от радиочастотных или микроволновых генераторов. Абляция играет ключевую роль в сохранении паренхимы печени, поскольку она позволяет лечить опухоли в областях, которые не поддаются резекции, и потому, что ее можно комбинировать с резекцией другой области печени. (2)
Кроме того, абляция дает возможность повторного лечения рецидивов с уменьшением заболеваемости. (3) Для лечения небольших гепатоцеллюлярных карцином накопились данные ретроспективных исследований в поддержку абляции вместо резекции. (4)
В ретроспективном исследовании нашей проспективно поддерживаемой базы данных мы проанализировали характер рецидивов метастазов колоректального рака в печени, леченных аблацией с помощью лапаротомии в период с 1996 по 2010 год, и обнаружили, что интраоперационная абляция, по-видимому, является высокоэффективным лечением колоректального рака. метастазы рака печени размером не более 1 сантиметра. (5)
Лапароскопическая абляция связана с более низкой частотой местных рецидивов по сравнению с чрескожной абляцией. (4) Кроме того, этот метод позволяет определить стадию всего живота и остальной части печени с помощью лапароскопического ультразвукового исследования. Кроме того, любое кровотечение, вызванное процедурой, контролируется под прямым наблюдением, а зона абляции контролируется в режиме реального времени.
Вернуться наверх
Система управления изображениями
В целях дальнейшего развития мы оценивали одобренную FDA систему управления изображениями ExplorerTM, которая позволяет использовать трехмерную модель для управления минимально инвазивной хирургией печени, включая абляции.Эта система управления изображениями потенциально очень ценна для пациентов со стеатозом (часто связанным с длительным курсом химиотерапии), поскольку может быть трудно визуализировать небольшие (<1 см) опухоли глубоко в печени, используя только ультразвук в операционной. .
Эта система создает трехмерную модель на основе предоперационных компьютерных томографов (рис. 3), и модель обновляется в реальном времени, чтобы направлять хирургические инструменты во время резекции или абляции. Результаты нашего протокола, в котором с целью проверки напрямую сравнивались навигационные данные из лапароскопической системы управления изображениями с данными из открытой системы управления изображениями, показали, что были созданы аналогичные трехмерные модели.Дальнейшее совершенствование интраоперационного руководства улучшит хирургическую технику как при лапароскопических, так и при открытых операциях на печени. (6)
Будущее малоинвазивной хирургии печени является захватывающим. Было показано, что как лапароскопические, так и роботизированные процедуры в общей хирургии имеют крутые кривые обучения. (7) Для хирургии печени кривая еще более экстремальна. Обладая опытом более 300 резекций печени в год, хирурги гепатопанкреатобилиарной службы в Memorial Sloan Kettering хорошо подходят для использования как лапароскопических, так и роботизированных методов, чтобы продолжать улучшать результаты операций на печени.
Рис. 2 — Доктор Т. Питер Кингхэм выполняет роботизированную операцию на печени с помощью хирургической системы da Vinci®.
Рис. 3. Панель дисплея системы управления изображением Explorer ™, используемой в лапароскопической хирургии печени.
Вернуться наверх
Повторная лапароскопическая операция на печени при рецидиве злокачественного новообразования после предыдущей открытой или лапароскопической резекции
1.Фонг Y, Блюмгарт Л. Х., Коэн А., Фортнер Дж., Бреннан М. Ф. Повторные резекции печени при метастатическом колоректальном раке. Энн Сург 1994; 220: 657-62.
DOIPubMedPMC
2. Tuttle TM, Curley SA, Roh MS. Повторная резекция печени как эффективное лечение рецидивирующих метастазов толстой кишки в печени. Энн Сург Онкол 1997; 4: 125-30.
DOI
3. Петровски Х., Гонен М., Ярнагин В., Лоренц М., ДеМаттео Р., Генрих С., Блюмгарт Л., Фонг Ю. Вторая резекция печени — безопасное и эффективное лечение рецидивирующих метастазов в печень от колоректального рака: би- институциональный анализ.Энн Сург 2002; 235: 863-71.
DOIPubMedPMC
4. Исигуро С., Акасу Т., Фудзимото Ю., Ямамото Дж., Сакамото Ю., Сано Т., Шимада К., Косуге Т., Ямамото С., Фудзита С., Мория Ю. Вторая гепатэктомия при рецидивирующем колоректальном метастазе в печени: анализ предоперационные прогностические факторы. Энн Сург Онкол 2006; 13: 1579-87.
DOI
5. Wicherts DA, de Haas RJ, Salloum C, Andreani P, Pascal G, Sotirov D, Adam R, Castaing D, Azoulay D. Повторите гепатэктомию при рецидивирующих колоректальных метастазах.Br J Surg 2013; 100: 808-18.
DOIPubMed
6. Белли G1, Cioffi L, Fantini C, D’Agostino A, Russo G, Limongelli P, Belli A. Лапароскопическая повторная хирургия рецидива гепатоцеллюлярной карциномы у пациентов с циррозом: возможность, безопасность и результаты. Surg Endosc 2009; 23: 1807-11.
DOIPubMed
7. Белли Дж., Фантини К., Д’Агостино А., Чиоффи Л., Лимонгелли П., Руссо Дж., Белли А. Лапароскопическая резекция печени VI сегмента с использованием положения лежа на левом боку: индивидуально модифицированная техника.J Gastrointest Surg 2008; 12: 2221-6.
DOIPubMed
8. Белли Дж., Лимонгелли П., Руссо Дж., Фантини С., Д’Агостино А., Чоффи Л., Белли А. Лапароскопическая резекция рецидивирующей гепатоцеллюлярной карциномы. В: Asbun HJ, Geller DA. Мультимедийный атлас хирургии ACS: Объем хирургии печени. Вудбери: Сине-Мед; 2014. ACSV4-36.
9. Белли Дж., Д’Агостино А., Фантини С., Чиоффи Л., Белли А., Руссолилло Н., Лангелла С. Лапароскопическая радиочастотная абляция в сочетании с лапароскопической резекцией печени при более чем одном ГЦК при циррозе.Surg Laparosc Endosc Percutan Tech 2007; 17: 331-4.
DOIPubMed
10. Becker JM, Dayton MT, Fazio VW, Beck DE, Stryker SJ, Wexner SD, Wolff BG, Roberts PL, Smith LE, Sweeney SA, Moore M. Профилактика послеоперационных спаек в брюшной полости с помощью гиалуроната натрия. биорезорбируемая мембрана на основе: проспективное рандомизированное двойное слепое многоцентровое исследование. J Am Coll Surg 1996; 183: 297-306.
PubMed
11. Dindo D, Demartines N, Clavien PA. Классификация хирургических осложнений: новое предложение с оценкой в когорте 6336 пациентов и результатами анкетирования.Энн Сург 2004; 240: 205-13.
DOIPubMedPMC
12. Poon RT, Fan ST, Lo CM, Ng IO, Liu CL, Lam CM, Wong J. Улучшение результатов выживаемости после резекции гепатоцеллюлярной карциномы: проспективное исследование 377 пациентов в течение 10 лет. Энн Сург 2001; 234: 63-70.
DOIPubMedPMC
13. Тан З.Ы. Гепатоцеллюлярная карцинома — причина, лечение и метастазы. Всемирный журнал J Gastroenterol 2001; 7: 445-54.
DOIPubMedPMC
14. Homayounfar K, Bleckmann A, Conradi LC, Sprenger T., Lorf T, Niessner M, Sahlmann CO, Meller J, Liersch T., Ghadimi BM.Рецидив метастазов после полной резекции метастазов колоректального отдела печени: влияние хирургического вмешательства и химиотерапии на выживаемость. Int J Colorectal Dis 2013; 28: 1009-17.
DOIPubMedPMC
15. Лян X, Цай XJ, Yu H, Wang YF, Liang YL. Вторая лапароскопическая резекция по поводу рецидива гепатоцеллюлярной карциномы после начальной лапароскопической гепатэктомии: клинический случай. Чин Мед Ж. (англ.) 2009; 122: 1359-60.
16. Cheung TT, Ng KK, Poon RT, Chan SC, Lo CM, Fan ST. Случай лапароскопической гепатэктомии по поводу рецидива гепатоцеллюлярной карциномы.Всемирный журнал J Gastroenterol 2010; 16: 526-30.
DOIPubMedPMC
17. Ху М., Чжао Г., Сюй Д., Лю Р. Лапароскопическая повторная резекция рецидивирующей гепатоцеллюлярной карциномы. Мировой журнал J Surg 2011; 35: 648-55.
DOIPubMed
18. Shafaee Z, Kazaryan AM, Marvin MR, Cannon R, Buell JF, Edwin B, Gayet B. Возможна ли лапароскопическая повторная гепатэктомия? Триинституциональный анализ. J Am Coll Surg 2011; 212: 171-9.
DOIPubMed
19. Накахира С., Такеда Й, Кавашима Х, Мукай Й, Хаманака М, Оно Х, Учияма С., Канемура Т, Такено А., Сузуки Р., Наката К., Мики Х, Окамура С., Като Т, Тамура С.Чистая лапароскопическая операция при повторной гепатэктомии. Ган То Кагаку Риохо 2011; 38: 2478-80.
PubMed
20. Цучия М., Оцука Ю., Маеда Т., Исии Дж., Тамура А., Канеко Х. Эффективность лапароскопической хирургии рецидивирующей гепатоцеллюлярной карциномы. Гепатогастроэнтерология 2012; 59: 1333-7.
DOI
21. Канадзава А., Цукамото Т., Симидзу С., Кодай С., Ямамото С., Ямазоэ С., Охира Г., Накадзима Т. Лапароскопическая резекция печени для лечения рецидивирующей гепатоцеллюлярной карциномы. J Hepatobilary Pancreat Sci 2013; 20: 512-7.
DOIPubMed
22. Шелат В.Г., Серин К., Самим М., Бесселинк М.Г., Аль Саати Х., Джойя П.Д., Пирс Н.В., Абу Хилал М. Результаты повторной лапароскопической резекции печени по сравнению с первичной резекцией. Мировой журнал J Surg 2014; 38: 3175-80.
DOIPubMed
23. Белли Дж., Фантини С., Д’Агостино А., Чиоффи Л., Руссо Дж., Белли А., Лимонгелли П. Лапароэндоскопическая резекция печени на одном участке при рецидиве гепатоцеллюлярной карциномы при циррозе: первое техническое примечание. Surg Laparosc Endosc Percutan Tech 2011; 21: e166-8.
DOIPubMed
24. Белли Дж., Д’Агостино А., Фантини С., Чиоффи Л., Белли А., Руссолилло Н., Лангелла С. Лапароскопическая пластика послеоперационной и пупочной грыжи у пациентов с циррозом печени. Surg Laparosc Endosc Percutan Tech 2006; 16: 330-3.
DOIPubMed
Хирургия печени при гепатоцеллюлярной карциноме: лапароскопический и открытый доступ
В этом исследовании мы пытаемся сравнить преимущества лапароскопических и открытых оперативных вмешательств. Пациенты и методы . Сто шестнадцать пациентов прошли лапароскопическую резекцию печени (LR), а еще 208 пациентов прошли открытую резекцию печени (OR) по поводу гепатоцеллюлярной карциномы (HCC).Отбор пациентов для открытого или лапароскопического доступа не производился случайным образом. Результатов . Показатель CLIP для LR и OR составил 0,59 ± 0,75 и 0,86 ± 1,04 соответственно (). Время операции составило 156,3 ± 308,2 и 190,9 ± 79,2 мин для групп LR и OR соответственно. Необходимость переливания крови была обнаружена у 8 пациентов (6,9%) и 106 пациентов (50,9%) для групп LR и OR. Пациенты возобновили полноценную диету на 2-й и 3-й день после операции, а средняя продолжительность пребывания в больнице составила 6 дней и 12 дней для групп LR и OR.Частота осложнений и смертность составляли 0% и 6,0%, 2,9% и 30,2% для групп LR и OR соответственно. 1-летняя, 3-летняя и 5-летняя выживаемость составила 87,0%, 70,4%, 62,2% и 83,2%, 76,0%, 71,8% для групп LR и OR, соответственно, несущественной разницы. Исходя из этих результатов, пациенты с ГЦК, принимавшие лапароскопический или открытый доступ, не имели существенных различий между их показателями выживаемости.
1. Введение
Гепатоцеллюлярная карцинома (ГЦК) — широко известное заболевание на Тайване.На сегодняшний день литература по лапароскопической хирургии печени не является распространенной, и эта методика считается инновационной [1, 2]. В 1998 году мы начали применять лапароскопический доступ к хирургии печени по поводу рака печени [2]. В исследовании Santambrogio et al. [3], оценка с помощью лапароскопической эхографии необходима, чтобы гарантировать точное определение локализации сегментарной опухоли и взаимосвязи опухоли с соседними сосудистыми и желчными структурами, которые были важны при периоперационной диссекции печени.
С усовершенствованием лапароскопической техники и развитием новых технологий и оборудования, лапароскопическая резекция печени стала возможной и безопасной для опытных хирургов. В 2000 году Descottes et al. [4] сообщили о лобэктомии правой печени и считают, что использование этого нового технического подхода дает много преимуществ, но требует обширного опыта в гепатобилиарной хирургии и лапароскопических навыков. Кроме того, можно удалить только хвостатую долю, не подвергая скарификации другие части печени, о которых сообщили Dulucq et al.[5]. Поэтому в некоторых учреждениях лапароскопическая техника была принята для крупной резекции печени постепенно [6].
В отличие от лапароскопической холецистэктомии, лапароскопическая гепатэктомия сопряжена с техническими трудностями. Расширение масштабов лапароскопической хирургии печени будет зависеть от способности опытных хирургов и технологических достижений решить проблему кровотечения и гемостаза [7]. Как мы знали, открытая резекция печени с помощью большого кожного разреза обычно вызывает сильную послеоперационную боль и более длительное время восстановления.В дополнение к преимуществам, присущим всем лапароскопическим процедурам, лапароскопическая операция на печени также имеет теоретические преимущества у некоторых пациентов с ГЦК. Поэтому целью данного исследования является сравнение результатов лапароскопической процедуры с открытой техникой у пациентов с ГЦК.
2. Пациенты и методы
2.1. Данные и показания пациентов
Сто шестнадцать пациентов (92 мужчины и 24 женщины) были встречены и перенесли лапароскопическую резекцию печени, а еще 208 пациентов (156 мужчин и 52 женщины) прошли традиционную резекцию, не рандомизированную с 1998 по 2006 год.Критериями резекции печени были ГЦК с окончательным патологическим диагнозом. Основные данные и основные состояния заболеваний печени показаны в Таблице 1.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.2. Процедуры лапароскопического доступа
Пациенты находились в положении лежа на спине под общей анестезией, и места введения троакаров зависели от места опухоли.Обычно требовалось ввести четыре троакара для проведения дополнительных оперативных манипуляций. Первый троакар был установлен через небольшой разрез ниже пупка для создания пневмобрюшинного пространства. Давление в брюшной полости поддерживалось низким на уровне 8–12 мм рт. Ст. В дополнение к подтяжке живота, если это необходимо. Общее состояние печени можно было оценить непосредственно при лапароскопическом обследовании, а затем принять решение о следующей процедуре. Локализация или распространение опухолей и их связь с сосудистой сетью были подтверждены лапароскопической ультрасонографией.Линия предполагаемого рассечения и сосуды, питающие опухоль, и печеночные вены были отмечены на поверхности печени с помощью диатермии. СВЧ-коагуляция по линии резекции выполнялась перед рассечением паренхимы печени. С этой техникой риск кровотечения во время рассечения будет меньше. При левосторонней резекции были разделены круглая, ложно-треугольная и левотреугольная связки и малый сальник. Все линии рассечения пунктировали лапароскопическим микроволновым тканевым коагулятором, чтобы свести к минимуму кровотечение во время рассечения печени.Была использована ультразвуковая диссекторная система (CUSA), сосуды были разветвлены, а протоки были обрезаны и рассечены. Критическая точка на левой печеночной артерии потребовала двойного клипирования. Однако левая воротная вена и левая печеночная вена были перевязаны шелком и большими зажимами. Операционное поле промывали и проверяли кровотечение или утечку желчи, а остаточную жидкость удаляли отсасыванием. Электрокоагулятор применялся для обеспечения гемостаза на поверхности резекции. После полного рассечения левой печени образец можно было удалить, расширив рану эпигастрального порта.Наконец, была установлена дренажная трубка для послеоперационного дренирования. Периодически оценивали хирургическую процедуру, послеоперационное течение и амбулаторное наблюдение через 1, 3 и 5 лет. Проспективно собирались следующие данные: включая продолжительность операции, кровопотерю, периоперационные переливания, хирургические события, послеоперационные осложнения, пребывание в больнице и выживаемость.
2.3. Биостатистический анализ
Клинические характеристики пациентов и послеоперационные результаты, все значения, были выражены как средние значения со стандартными отклонениями.Использовали критерий Стьюдента t и односторонний дисперсионный анализ (ANOVA). Метод Каплана-Мейера использовался для измерения кривой выживаемости, а критерий логарифмического ранга использовался для определения сравнения между показателями выживаемости групп LR и OR. SPSS (версия b12.0) для Windows XP использовался для анализа данных. Значение P менее 0,05 считалось статистически значимым.
3. Результаты
3.1. Интраоперационные результаты
Лапароскопическая операция выполнена 116 пациентам.Все пациенты, перенесшие лапароскопическую резекцию печени, включали один сегмент или меньше у 97 пациентов, левостороннюю сегментэктомию (удаление сегмента 2 и 3) у семи, левую лобэктомию (удаление сегмента 2, 3 и 4) у четырех и правую переднюю сектоэктомию у четырех пациентов. восемь пациентов. Поражения были локализованы в правой печени у 61 пациента и в левой печени у 55 пациентов. Тип операций LR и OR представлен в таблице 2. Переход к открытой лапаротомии произошел у 6 пациентов (5,2%) из-за анатомических ограничений.Средний размер опухоли, измеренный на хирургическом образце, составлял и см для групп LR и OR соответственно. У наших пациентов, перенесших операцию по поводу злокачественного новообразования, был получен запас по крайней мере на 1 см за пределами опухоли, за исключением ситуации, когда основание опухоли прилегает к основным сосудам. Среднее время операции и кровопотеря для LR и OR показаны в таблице 2. Переливание крови потребовалось 8 из 116 пациентов (6,9%). Ни у одного из наших пациентов не было признаков, указывающих на газовую эмболию.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Послеоперационные результаты
Не было операционной летальности в группе LR, но 2,9% (6/202) в группе OR (). Послеоперационные осложнения составили 7 и 63 пациента в группе LR и OR (). У пациентов с циррозом развился преходящий асцит у 2 в группе LR и у 26 в группе OR (), но их хорошо контролировали с помощью лекарств. Случаев послеоперационного кровотечения или утечки желчи в группе LR не было, кроме шести и четырех пациентов в группе OR. Среднее пребывание в больнице для всей серии составило дни для группы LR и дни для группы OR со значительной разницей ().После среднего периода наблюдения 94 месяца ни у одного пациента, перенесшего операцию по поводу злокачественного заболевания, метастазов в порт не наблюдалось. Показатели выживаемости в течение 1, 3 и 5 лет составили 87,0%, 70,4%, 62,2% и 83,2%, 76,0%, 71,8% для групп LR и TR, соответственно, без существенной разницы ( ), как показано на рисунке 1. Кроме того, лапароскопический доступ не может быть связан с рецидивом опухоли в течение периода последующего наблюдения.
4. Обсуждение
В 1993 году Норд и Брэди [8] начали использовать лапароскоп для хирургии печени с усовершенствованием лапароскопических методов и разработкой новых специализированных технологий.Обычно ограниченные резекции печени выполнялись на ранней стадии, а дальнейшие лапароскопические анатомические резекции печени все еще находились в разработке. Hilscher et al. [9] сообщили об инициированной ими формальной лапароскопической резекции печени у отобранных 20 пациентов и одной бисегментэктомии с неодинаковыми результатами в 1998 году. Однако у большинства их пациентов были метастатические опухоли печени от рака толстой кишки, а у этих пациентов цирроз печени был реже. Лапароскопический подход к формальной резекции печени не является рутинной техникой хирургии печени, но может быть многообещающей процедурой в отдельных случаях, когда опухоль может быть удалена с помощью ограниченной резекции.Большинство хирургов печени думают об интраоперационном кровотечении, и с ним трудно справиться. Канеко и др. [10] сообщили, что трем пациентам была выполнена левосторонняя сегментэктомия, а у восьми — частичная гепатэктомия. Они по-прежнему считали, что разница наблюдалась в кровопотере, а послеоперационная боль была минимальной по сравнению с открытой гепатэктомией. При использовании этой техники послеоперационное восстановление было быстрым и плавным, и пациенты остались довольны операцией [11]. Таким образом, лапароскопический доступ к левой боковой сектоэктомии или правой гепатэктомии считался безопасным и в последнее время может рассматриваться в качестве рутинной процедуры у некоторых пациентов [6, 12].Даже лапароскопическая повторная операция по поводу рецидива ГЦК у пациентов с циррозом печени является выполнимой процедурой с хорошими краткосрочными результатами [13].
Наиболее важными факторами при выборе кандидатов для лапароскопической резекции были природа опухоли (доброкачественная или злокачественная) и анатомическое расположение опухоли [14, 15]. По нашему опыту, мы полагаем, что поражения левой доли печени (II и III) и переднего сектора (IVa, V и VI) являются хорошим показанием для лапароскопического доступа, тогда как поражения заднего и верхнего сегментов печени (I, IVc, VII и VIII) технически сложны, и подходить к ним следует только с особой осторожностью или с помощью ручного метода.Другим фактором выбора для лапароскопической хирургии является небольшой размер опухоли, как и в большинстве описанных серий (в среднем менее 5 см). В нашей серии они были сантиметрами, и в большинстве наших случаев они были периферическими и выступали из паренхимы печени. При традиционной гепатэктомии размер опухоли составлял см (). Таким образом, ограниченная резекция (без одного сегмента) была обнаружена в 97 случаях (83,6%) в нашей серии по сравнению с традиционным методом, который составлял 38 случаев (18,3%) (). Среднее время пребывания в стационаре в послеоперационном периоде составило 6 и 12 дней после лапароскопической и традиционной резекции печени соответственно в нашей серии.По сравнению с отчетом Morino et al. [15], послеоперационное пребывание в стационаре составило 6,4 дня (диапазон 2–16) в группе лапароскопии, 5,7 дня для пациентов без цирроза и 12,6 дня для пациентов с циррозом. В целом, пациенты, получавшие лапароскопический доступ, находились в больнице недолго. Что касается среднего времени работы, оно составило 160,5 минут, а коэффициент конверсии составил 8%, как сообщает Национальный реестр из Испании [16]. Анальгезия применялась менее 48 часов в 55% случаев, и в нашей серии случаев летальности не было.Мы твердо верили, что лапароскопический доступ может снизить кровопотерю и уменьшить послеоперационное пребывание в больнице. Одной из причин такого результата было то, что ограниченные резекции были крупными в группе LR.
Интраоперационное кровотечение было самой большой проблемой при лапароскопической резекции печени. В нашем исследовании восемь пациентов (8/108) нуждаются в переливании крови. Управление кровотечением во время рассечения требует технического опыта и, что более важно, адекватная предоперационная оценка является лучшей гарантией.Микроволновый коагулятор и CUSA оказались полезными при лапароскопической резекции, поскольку они могут коагулировать и рассекать паренхиму печени для достижения адекватного гемостаза во время процедур. Кроме того, потенциальный риск газовой эмболии побудил некоторых авторов использовать безгазовую суспензионную лапароскопию [17]. Однако необходимы такие меры предосторожности, как мониторинг низкого давления в брюшной полости на уровне 6–8 м [16, 18, 19]. По нашему опыту, будет безопасно, если пневмоперитонеум будет установлен на уровне 6–10 мм рт.Кроме того, у наших пациентов не наблюдалось метастазов в портовые участки, о чем также упоминали Cherqui et al. [20].
Лапароскопическая резекция печени у пациентов с ГЦК с хроническим заболеванием печени связана с более низкой заболеваемостью, чем открытые резекции, о которых обычно сообщалось [15, 21, 22], и результаты были аналогичными в нашей серии. В отчете Buell et al. [22], осложнения включали повторную операцию по поводу кровотечения, утечки желчи и даже смерть от печеночной недостаточности. Средняя продолжительность пребывания составила 2 человека.9 дней (диапазон = 1–14 дней). В более крупной серии из 243 выполненных гепатэктомий 113 (46,5%) были выполнены лапароскопически [23]. Что касается выживаемости, другое ретроспективное исследование было проведено в одиннадцати хирургических центрах в Европе в отношении их опыта лапароскопической резекции злокачественных новообразований печени, 37 пациентов с ГЦК были включены в многоцентровое европейское исследование [24]. При среднем периоде наблюдения 14 месяцев 2-летняя выживаемость без признаков заболевания составила 44% для пациентов с ГЦК. Во время наблюдения метастазов в портовые участки не наблюдалось.3-летняя общая выживаемость и выживаемость без признаков заболевания для пациентов с ГЦК (средний период наблюдения 40 месяцев), по данным Vibert et al., Составили 85% и 68%. [23] и 93% и 64%, соответственно, Cherui et al. [25]. 5-летняя общая кумулятивная выживаемость для 69 пациентов составила 63,9%. Пятилетняя кумулятивная выживаемость для пациентов с ГЦК диаметром менее 2 см составила 76,0% и 56,3% для пациентов с ГЦК диаметром более 2 см [25]. Нам казалось, что лапароскопические процедуры лучше всего подходят для пациентов с высокодифференцированным ГЦК [25, 26].После среднего периода наблюдения в нашей серии 94 месяца разницы в выживаемости между двумя группами не было. Пятилетняя выживаемость составила 62,2% и 71,8% для лапароскопических и традиционных методов, соответственно, без существенной разницы () в этой серии. Это не означало, что лапароскопический метод был лучше, чем формальный открытый метод, потому что размер опухоли был меньше в группе лапароскопии. Однако, как показывает наш опыт, неожиданный диагноз раннего ГЦК можно было получить только лапароскопическим методом.
Хирургическая техника является важным фактором предотвращения интраоперационных и послеоперационных осложнений в хирургии печени. Лапароскопический доступ при расширенной гепатэктомии стал возможен благодаря накоплению опыта и совершенствованию инструментов в настоящее время [27]. Были разработаны различные методы безопасного рассечения паренхимы печени. Таким образом, лапароскопическая резекция печени с ручной ассистенцией является более подходящей процедурой для удаления более или менее двух сегментов печени [28].Процедура ручного порта может обеспечить прямое ощущение рукой хирурга и делает возможной процедуру, которая почти идентична открытой операции. Этот метод обеспечивает лучшую визуализацию операционного поля и края рассечения, а немедленный гемостаз также достигается за счет нажатия на точку кровотечения вручную. Лапароскопическая резекция печени с использованием системы Hand-Port возможна для отдельных пациентов с поражениями даже в задней части правой доли печени, требующей ограниченной резекции [29].В дополнение к ручной ассистированной, лапароскопическая ассистированная может быть принята недавно и стала более популярной [30]. Из отчета Inagaki et al. [31] при резекции печени с использованием лапароскопического и тотального лапароскопических методов не было различий во времени операции, количестве переливаний, начальных днях диеты пациентов, частоте осложнений или продолжительности пребывания в больнице между группы лапароскопических или открытых методов.
