Дисбактериоз кишечника: симптомы, коррекция и лечение дисбиоза у взрослых и детей, степени, анализы и профилактика
Дисбактериозом (дисбиоз) называют симптоматическое состояние, характеризующееся нарушением микрофлоры кишечника. В кишечнике в этот момент размножаются патологические бактерии, и нарушается естественный микробный баланс.
Причины дисбактериоза
Существуют различные предпосылки и состояния, которые способны привести к развитию дисбактериоза:
- заболевания органов ЖКТ,
- прием лекарственных препаратов, нарушающих микрофлору кишечника (антибиотики),
- неправильное питание,
- физиологические возрастные изменения,
- прием гормональных препаратов,
- курсы лучевой и химиотерапии,
- стрессы и неправильный режим дня,
- пищевые отравления,
- инфекционные процессы в организме.
Банальные респираторные инфекции или аллергические заболевания могут стать причиной нарушения микрофлоры кишечника, так как в этот период пациенту могут назначаться различные лекарственные препараты, негативно влияющие на микробный баланс.
Как понять, что у вас дисбиоз?
На разных стадиях заболевания симптоматика дисбактериоза различна. Специалисты рекомендуют обращать внимание на следующие проявления:
- отрыжка,
- тошнота,
- урчащие звуки в животе,
- вздутие и метеоризм,
- ноющие или режущие боли в области живота,
- запоры либо диарея и жидкий стул,
- сухость кожных покровов,
- неприятный привкус и запах изо рта,
- утомляемость и нарушение сна.
Наличие одного или нескольких перечисленных симптомов – повод обратиться к врачу.
Диагностика дисбактериоза
Самостоятельно диагностировать состояние дисбактериоза невозможно. Поставить точный диагноз способен только опытный специалист, который обследует пациента при помощи лабораторных методов и специальной аппаратуры. Обратившись за медицинской помощью, пациент проходит обследование, которое включает:
- исследования мочи и кала,
- ПЦР-диагностику микрофлоры,
- визуальный осмотр кожных покровов.

Профилактика дисбактериоза
Развитие заболевания можно предотвратить, если внимательно следить за питанием, избегать стрессовых состояний, соблюдать режим сна и отдыха, не употреблять необоснованных лекарственных препаратов, занимаясь самолечением, контролировать состояние органов желудочно-кишечного тракта.
Что будет, если не лечить дисбактериоз?
Если не лечить дисбиоз, заболевание может перейти в более тяжелую форму, и не исключено появление осложнений. В результате этих процессов в кишечнике будут образовываться токсические вещества, которые с кровотоком будут разнесены по всем органам и тканям. Всасывание и усвоение минералов и витаминов будет нарушено, иммунитет организма ослабнет, и защитные свойства значительно снизятся. Пациент будет легко подвержен различным инфекциям, банальное расстройство кишечника может привести к серьезным заболеваниям, лечение которых нередко требует оперативного вмешательства.
Как вылечить дисбактериоз?
При лечении дисбактериоза важнейшим шагом становится лечение основного заболевания, которое вызвало патологию в кишечнике пациента. Затем проводится терапия по восстановлению микрофлоры кишечника, наиболее правильно подбирать препараты на основе лабораторных исследований посева.
Затем проводится терапия по восстановлению микрофлоры кишечника, наиболее правильно подбирать препараты на основе лабораторных исследований посева.
Диета при дисбактериозе
В период лечения и для предупреждения рецидивов необходимо исключить употребление жирного, острого, соленого, жареного, не пить алкоголь. Питание должно быть сбалансированным и щадящим, в рационе должны присутствовать кисломолочные продукты.
Проконсультироваться о диагностике и лечении дисбактериоза и записаться к специалисту вы можете, позвонив в нашу клинику или записавшись через форму на сайте.
УЗНАТЬ ЦЕНЫ
Дисбактериоз кишечника. Как лечить дисбактериоз
Организм человека – очень сложная и слаженная система, для нормальной работы которой важно поддержание внутреннего баланса. Но у организма есть и помощники – полезные бактерии, живущие в кишечнике. Они помогают переваривать пищу, получать питательные вещества, более того, они необходимы для работы иммунной системы и защищают организм от распространения вредных, патогенных бактерий. Однако иногда баланс микроорганизмов нарушается, что приводит к неприятным последствиям – развивается дисбактериоз.
Однако иногда баланс микроорганизмов нарушается, что приводит к неприятным последствиям – развивается дисбактериоз.
Дисбактериоз кишечника – это нарушение состава нормальной микрофлоры кишечника. Количество полезных бактерий снижается, а патогенные микроорганизмы начинают усиленно размножаться. Это заболевание приводит к расстройству пищеварения, дефициту некоторых микроэлементов, снижению иммунитета и плохому самочувствию.
Дисбактериоз кишечника встречается очень часто: по некоторым данным ему подвержены до 90% всех взрослых людей. Еще чаще возникает дисбактериоз кишечника у детей – 95% грудных малышей страдают от этого заболевания. Причин дисбактериоза множество: плохая экология, хронический стресс, неправильное питание. Кроме того, дисбактериоз кишечника может быть вызван бесконтрольным применением антибиотиков и иммунодепрессантов. У детей он часто возникает в связи с переходом на искусственное вскармливание. В то время как грудное молоко богато полезными микроорганизмами и помогает заселить ими кишечник ребенка, искусственные смеси могут нарушить состав микрофлоры и привести к дисбактериозу.
Как лечить дисбактериоз?
Если по тем или иным причинам баланс нормальной кишечной микрофлоры был нарушен и развился дисбактериоз кишечника, лечение лучше начинать сразу, до перехода состояния в затяжную форму и развития более серьезных симптомов. Лечение дисбактериоза должно быть комплексным, поэтому как лечить дисбактериоз в каждом конкретном случае лучше всего расскажет лечащий врач. Дело в том, что дисбактериоз не является самостоятельным заболеванием и может быть симптомом различных болезней, чтобы избавиться от дисбактериоза, необходимо вылечить в первую очередь заболевание его вызвавшее.
Тем не менее, существуют общие рекомендации по лечению дисбактериоза кишечника. Для нормализации состава микрофлоры кишечника применяют, так называемые, бактериальные препараты, например, Линекс, Бификол, Энтерол и другие. Эти препараты содержат живые культуры, характерные для нормальной микрофлоры и помогут восстановить баланс. Кроме того, при дисбактериозе полезно употребление продуктов, содержащих лактобактерии и бифидобактерии. Для нормализации работы пищеварительной системы стоит исключить из рациона продукты, раздражающие слизистую кишечника, т.е. на время отказаться от острого, соленого и маринованного. Для того, чтобы предотвратить распространение патогенных микроорганизмов при дисбактериозе кишечника иногда применяют антибактериальные препараты. Однако выбор препарата и продолжительность курса должен оценивать врач. Применение антибиотиков без рекомендации врача может привести к усугублению дисбактериоза.
Для нормализации работы пищеварительной системы стоит исключить из рациона продукты, раздражающие слизистую кишечника, т.е. на время отказаться от острого, соленого и маринованного. Для того, чтобы предотвратить распространение патогенных микроорганизмов при дисбактериозе кишечника иногда применяют антибактериальные препараты. Однако выбор препарата и продолжительность курса должен оценивать врач. Применение антибиотиков без рекомендации врача может привести к усугублению дисбактериоза.
Ещё статьи:
Клинические проблемы дисбактериоза кишечника | Еженедельник АПТЕКА
НОРМАЛЬНАЯ МИКРОБНАЯ ФЛОРА КИШЕЧНИКА
В кишечнике человека содержится от 400 до 500 различных видов микробов, общее количество которых достигает 1014. Количество микроорганизмов увеличивается в дистальном направлении и в толстой кишке в 1 г кала содержится 1011 бактерий, что составляет 1/3 сухого остатка кишечного содержимого [5, 12].
В тощей кишке здоровых людей количество бактерий не превышает 104–105 в 1 мл кишечного содержимого. Здесь обнаруживаются стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 107–108, в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Просвет кишки заселяют быстроразмножающиеся микробы — лактобациллы и клостридии. На поверхности ворсинок находятся преимущественно грамотрицательные формы, а в глубине крипт — факультативные анаэробные формы. Некоторые микроорганизмы оказывают цитотоксическое действие и повреждают эпителий тонкой кишки. Это приводит к уменьшению высоты ворсинок, углублению крипт, а с помощью электронной микроскопии можно увидеть дегенерацию микроворсинок, митохондрий и эндоплазматической сети [7, 11].
Здесь обнаруживаются стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 107–108, в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Просвет кишки заселяют быстроразмножающиеся микробы — лактобациллы и клостридии. На поверхности ворсинок находятся преимущественно грамотрицательные формы, а в глубине крипт — факультативные анаэробные формы. Некоторые микроорганизмы оказывают цитотоксическое действие и повреждают эпителий тонкой кишки. Это приводит к уменьшению высоты ворсинок, углублению крипт, а с помощью электронной микроскопии можно увидеть дегенерацию микроворсинок, митохондрий и эндоплазматической сети [7, 11].
ДИСБАКТЕРИОЗ ТОЛСТОЙ КИШКИ
Состав микрофлоры толстой кишки может изменяться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные силы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами, различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки значительную роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, лучевая терапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
КЛИНИЧЕСКИЕ ОСОБЕННОСТИ ДИСБАКТЕРИОЗА
Избыточное бактериальное обсеменение тонкой кишки иногда происходит без клинических проявлений. Дисбактериоз может быть одним из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях (например, дивертикулез тонкой кишки), при частичной кишечной непроходимости или состоянии после оперативных вмешательств на желудке и кишечнике — вызывать тяжелую диарею, стеаторею и В12-дефицитную анемию (схема).
В большинстве случаев показатели бактериологического исследования кала не позволяют определить особенности клинического течения заболевания у лиц с различными дисбактериозами толстой кишки. Можно отметить, что у пациентов с хроническими заболеваниями кишечника чаще наблюдаются острые кишечные инфекции, что, вероятно, обусловлено ослаблением антагонистических свойств нормальной микрофлоры кишечника, прежде всего из-за частого отсутствия бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Эту тяжелую форму дисбактериоза вызывают токсины, которые выделяет синегнойная палочка Clostridium difficile, размножающаяся в кишечнике при угнетении нормальной микробной флоры.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
МЕТОДЫ ДИАГНОСТИКИ
Достаточно сложной является диагностика дисбактериоза. Из 400–500 известных видов микробов с диагностической целью изучают лишь 10–20. Важно, в каком отделе кишечника — в тощей, подвздошной или толстой кишке — проводится исследование микробного состава.
Для диагностики дисбактериоза тонкой кишки выполняют посев сока тонкой кишки, полученного с помощью стерильного зонда. У больных натощак могут определять концентрацию водорода в выдыхаемом воздухе, поскольку она находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. Применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. При бактериальном обсеменении тонкой кишки максимальная концентрация водорода развивается гораздо быстрее, чем в норме [2].
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются уменьшение количества основных бактериальных симбионтов — молочнокислых палочек — и отсутствие бифидобактерий. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. Среди отдельных бактериальных симбионтов появляются патологические формы (гемолизирующая флора, кишечные палочки и др.).
Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. Среди отдельных бактериальных симбионтов появляются патологические формы (гемолизирующая флора, кишечные палочки и др.).
Таким образом, дисбактериоз — бактериологическое понятие, это состояние наблюдается в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Дисбактериоз может быть одним из проявлений или осложнением основного заболевания, но не самостоятельной формой.
ЛЕЧЕНИЕ
Лечение дисбактериоза должно быть комплексным. Оно включает:
1) устранение избыточного бактериального обсеменения тонкой кишки;
2) нормализацию микробной флоры толстой кишки;
3) улучшение кишечного пищеварения и всасывания;
4) восстановление нарушенной моторики кишечника;
5) повышение реактивности организма.
Антибактериальные препараты
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Обычно применяют антибиотики группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (офлоксацин, нитроксолин) и метронидазол [4, 9]. Антибиотики широкого спектра действия значительно нарушают эубиоз в толстой кишке. Поэтому их следует применять только при заболеваниях с нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней. При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лучше использовать препараты, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов [6]. К ним относятся антисептики: комбинация тилихинола и тилброхинола, нифуроксазид, нитроксолин, фуразолидон и др. При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: офлоксацин, пипемидовую кислоту, метронидазол, а также ко-тримоксазол, налидиксовую кислоту. Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: офлоксацин, пипемидовую кислоту, метронидазол, а также ко-тримоксазол, налидиксовую кислоту. Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
При развитии псевдомембранозного колита прежде всего отменяют антибиотик, обусловивший развитие заболевания. Назначают ванкомицин по 125 мг внутрь 4 раза в сутки в течение 7–10 дней, при необходимости дозу можно повысить до 500 мг 4 раза в сутки. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки (бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата). При обезвоживании применяют адекватную инфузионную терапию для нормализации водно-электролитного баланса. Для связывания токсинов используют колестирамин.
Бактерийные препараты
В кишечнике человека выживают 1–10% живых культур нормальной микробной флоры от общего количества, поступившего в организм с препаратом, которые способны в определенной степени выполнять в организме свою физиологическую функцию. Бактерийные препараты можно назначать без предварительного проведения антибактериальной терапии или после нее. Курс лечения в среднем длится 1–2 мес.
Бактерийные препараты можно назначать без предварительного проведения антибактериальной терапии или после нее. Курс лечения в среднем длится 1–2 мес.
Продукты микробного метаболизма
Существует еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма бактерий, отнесенных к нормальной микрофлоре кишечника. На их основе 50 лет назад был создан препарат ХИЛАК ФОРТЕ, который до настоящего времени применяют для лечения больных с патологией кишечника [1, 3, 13]. ХИЛАК ФОРТЕ представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочную кислоту, лактозу, аминокислоты и жирные кислоты. Эти вещества способствуют восстановлению физиологической среды в кишечнике, необходимой для существования нормальной микрофлоры, и подавлению роста патогенных микроорганизмов. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов [8, 10]. 1 мл препарата соответствует такому количеству биосинтетических активных веществ, которое продуцируют 100 млрд нормальных микроорганизмов. ХИЛАК ФОРТЕ назначают по 40–60 капель 3 раза в сутки (курс лечения — до 4 нед) в сочетании с препаратами антибактериального действия или после их применения.
ХИЛАК ФОРТЕ назначают по 40–60 капель 3 раза в сутки (курс лечения — до 4 нед) в сочетании с препаратами антибактериального действия или после их применения.
Регуляторы пищеварения и моторики кишечника
Больным с нарушением полостного пищеварения назначают препараты панкреатических ферментов. В целях улучшения функции всасывания назначают гепатотропные препараты, так как они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника регулируют с помощью лоперамида и тримебутина.
Стимуляторы реактивности организма
Для повышения реактивности организма ослабленным больным целесообразно назначать иммуностимулирующие средства. Курс лечения должен продолжаться в среднем 4 нед. Одновременно назначают витамины.
Профилактика дисбактериоза
Первичная профилактика дисбактериоза является очень сложной задачей, решение которой связано с общими проблемами профилактики: улучшением экологии, рациональным питанием, улучшением благосостояния и др.
Вторичная профилактика направлена на рациональное (обоснованное) применение антибиотиков и других лекарственных препаратов, нарушающих эубиоз, своевременное и эффективное лечение заболеваний органов пищеварения, сопровождающихся нарушением микробиоценоза.
А.И. Парфенов
Центральный научно-исследовательский институт гастроэнтерологии, Москва
По материалам, предоставленным
представительством компании «ratiopharm» в Украине
Схема
Причины избыточного бактериального обсеменения тонкой кишки
СПИСОК ЛИТЕРАТУРЫ | |
|
Как победить состояние дисбактериоза у детей?
Дисбактериоз в последнее время — весьма распространённое состояние у детей, особенно у грудничков. Оно доставляет дискомфорт малышам, ухудшая их общее состояние, самочувствие, мешает нормальному набору веса ребенка и причиняет массу беспокойств их родителям. Кроме того, микрофлора играет немаловажную роль в жизнедеятельности человека. Она регулирует перистальтику кишечника, поддерживает и стимулирует иммунную систему, синтезирует многие витамины, обеспечивает противовирусную защиту хозяина, нормализует обменные процессы, помогает усваивать многие микроэлементы и аминокислоты, помогает очищать организм от токсинов и препятствует проникновению чужеродных микробов в кровь. Всего в организме человека в кишечнике в высушенном виде находится 1,5 килограмма полезных микробов – это целый «орган». Их деятельность, значимость, можно сравнить с функцией двух органов печени и почек вместе взятых! О причинах возникновения дисбактериоза и методах борьбы с ним рассказывает заведующий отделением детской гастроэнтерологии Челябинской областной детской клинической больницы, врач высшей категории Вадим Земляков.
Всего в организме человека в кишечнике в высушенном виде находится 1,5 килограмма полезных микробов – это целый «орган». Их деятельность, значимость, можно сравнить с функцией двух органов печени и почек вместе взятых! О причинах возникновения дисбактериоза и методах борьбы с ним рассказывает заведующий отделением детской гастроэнтерологии Челябинской областной детской клинической больницы, врач высшей категории Вадим Земляков.
— Вадим Леонидович, дисбактериоз некоторые врачи считают болезнью. Каково Ваше мнение по этому поводу?
— Дисбактериоз – это состояние, которое может развиваться при различных заболеваниях или неблагоприятных окружающих условиях человека. Приведу простой пример: вы сидите на лекции или в кино, в зале душно нарастает количество углекислого газа в воздухе. В этой ситуации постепенно начинает развиваться состояние дисбактериоза. На работе отругал начальник, человек получил новую порцию стресса, усилилась моторика кишечника, положено начало к развитию состояния дисбактериоза. На нормальную кишечную флору, и не только кишечную, но и на флору всех полостных органов влияет: неправильное питание, плохая экология, изменение климата, различные ионизирующие излучения, которые окружают человека в повседневной жизни, воспалительные заболевания, прием лекарственных средств. Но это не болезнь – это изменение флоры (состояние временное) в зависимости от внешних условий воздействия.
На нормальную кишечную флору, и не только кишечную, но и на флору всех полостных органов влияет: неправильное питание, плохая экология, изменение климата, различные ионизирующие излучения, которые окружают человека в повседневной жизни, воспалительные заболевания, прием лекарственных средств. Но это не болезнь – это изменение флоры (состояние временное) в зависимости от внешних условий воздействия.
— Дисбактериоз может быть только в кишечнике или этому подвержены все слизистые оболочки организма?
— Нарушенная кишечная флора будет отрицательно действовать на слизистую всех полостных органов в которых она имеется (полость рта, пищевод, желудок, кишечник, влагалище и др.). Здесь появляется цепочка взаимосвязей: болезнь слизистой кишки влияет на состояние микрофлоры, нарушенная микрофлора – на слизистую.
— По каким признакам родители могут определить, что у ребенка имеется состояние дисбактериоза?
— Родителям стоит задуматься, если у ребенка снижается аппетит, ребенок бледный с синюшными кругами под глазами и под носом. Если у ребенка периодически отмечается подташнивание, бурчание и боли в животе, меняется стул, в кале присутствует зелень или кусочки непереваренной пищи. Ребенок плохо прибавляет в весе, срыгивает, начинает часто болеть простудными заболеваниями. Возможно, вечером, а именно в семь часов, отмечается субфебрильная температура — 37,1-37,2. При условии, что держат ртутный стеклянный (а не электронный) градусник именно 10 минут — это очень важно. Данные признаки могут говорить о болезнях органов пищеварения и в частности о состоянии дисбактериоз.
Если у ребенка периодически отмечается подташнивание, бурчание и боли в животе, меняется стул, в кале присутствует зелень или кусочки непереваренной пищи. Ребенок плохо прибавляет в весе, срыгивает, начинает часто болеть простудными заболеваниями. Возможно, вечером, а именно в семь часов, отмечается субфебрильная температура — 37,1-37,2. При условии, что держат ртутный стеклянный (а не электронный) градусник именно 10 минут — это очень важно. Данные признаки могут говорить о болезнях органов пищеварения и в частности о состоянии дисбактериоз.
— Насколько состояние кишечной флоры влияет на иммунитет ребенка?
— При изменении кишечной микрофлоры ребенка в худшую сторону происходит снижение иммунитета. Когда у ребенка появляются частые простудные заболевания, это тоже говорит о том, что органы пищеварения не позволяют иметь 100%-ный иммунитет. Ведь у человека иммунитет на 98% зависит от состояния микрофлоры толстой кишки. И когда она нарушается, иммунитет падает, а, значит, появляются частые простуды._575.gif)
— То есть, если у родителей часто болеет ребенок, они должны задуматься о посещении гастроэнтеролога?
— Как один из моментов. Мы знаем, что многие болезни: кожи, зубов, слизистых, вплоть до бронхиальной астмы, – это порой осложнение болезней органов пищеварения. Когда мне задают подобные вопросы, я сразу вспоминаю один случай: выходит конферансье на сцену и говорит: «У меня сегодня что-то болит голова». Его напарник отвечает: «Наверное, ты что-то не то съел». Зрители в зале смеются, но ведь он сказал все правильно. Головная боль может быть прямым следствием проблем желудочно-кишечного тракта.
— Как врач определяет наличие у ребенка состояния дисбактериоза?
— Существуют различные методы исследования микробной флоры у человека. Очень важно при оценке анализа кала на дисбактериоз учитывать возраст пациента, принципы его питания, период посева: как его собирали, и когда был сдан кал. И без учета данных факторов нельзя правильно оценить полученный результат. Потому что цифры в конечном итоге будут разные. Приведу простой пример: если пациент употребляет больше кисломолочных продуктов, то у него бактерий coli будет значительно меньше, но это не значит, что это болезнь. Если он ест больше мяса, у него бактерий coliбудет больше, а бифидум меньше и так далее. Поэтому сам анализ нужно интерпретировать с учетом этих всех моментов.
Потому что цифры в конечном итоге будут разные. Приведу простой пример: если пациент употребляет больше кисломолочных продуктов, то у него бактерий coli будет значительно меньше, но это не значит, что это болезнь. Если он ест больше мяса, у него бактерий coliбудет больше, а бифидум меньше и так далее. Поэтому сам анализ нужно интерпретировать с учетом этих всех моментов.
— Когда ребенок сдает анализ, все эти факторы обследуются досконально?
— Нет, конечно.
— Тогда получается нельзя с точностью определить у ребенка наличие дисбактериоза?
— Без учета данных факторов нельзя. Поэтому многие родители, когда обращаются к нам за помощью, часто удивляются, почему мы спрашиваем все тонкости и подробности питания, которые в принципе никто никогда не спрашивает. Поэтому мы положительно отличаемся и в плане лечения, и в плане диагностики, и в плане результата. И поэтому к нам всегда огромная очередь.
— Какие методы лечения состояния дисбактериоза существуют и надо ли его вообще лечить?
— Лечить обязательно надо! Начинать лечение необходимо с основного заболевания, приведшего к этому состоянию или с той причины, которая привела к нему. Естественно, первично назначаются лекарственные препараты, которые воздействуют непосредственно на устранение основной причины. Предположим, у ребенка имеется гастрит, проводится его лечение и плюс назначаются препараты улучшающие микрофлору кишечника ребенка. Если ребенок находится в помещениях, где имеются различные домашние «приборы-излучатели» (телевизор, компьютер, микроволновая печь, радиотелефон, и другие, то, соответственно, их необходимо использовать, как можно реже. Если фактором, приводящим к болезни, являются лекарственные препараты (антибиотики и др.), то их по возможности надо заменить или исключить совсем. То есть, сначала необходимо убрать факторы, отрицательно влияющие на нормальную кишечную флору ребенка. И только после этого, появляется возможность ее восстанавливать.
Естественно, первично назначаются лекарственные препараты, которые воздействуют непосредственно на устранение основной причины. Предположим, у ребенка имеется гастрит, проводится его лечение и плюс назначаются препараты улучшающие микрофлору кишечника ребенка. Если ребенок находится в помещениях, где имеются различные домашние «приборы-излучатели» (телевизор, компьютер, микроволновая печь, радиотелефон, и другие, то, соответственно, их необходимо использовать, как можно реже. Если фактором, приводящим к болезни, являются лекарственные препараты (антибиотики и др.), то их по возможности надо заменить или исключить совсем. То есть, сначала необходимо убрать факторы, отрицательно влияющие на нормальную кишечную флору ребенка. И только после этого, появляется возможность ее восстанавливать.
— Врач сможет точно определить, отчего именно развился дисбактериоз?
— Чаще всего, мы видим причину.
— Существует ли профилактика дисбактериоза?
— В первую очередь необходимо следить за состоянием здоровья ребенка. Обязательно нужно придерживаться принципов здорового питания. В ежедневном рационе ребенка должна содержаться растительная клетчатка (овощи, фрукты, зерновые каши), которая способствует восстановлению кишечной микрофлоры. Естественно, набор должен быть полный: микроэлементы, витамины, ферменты. В рационе должна преобладать растительная пища, обязательно ребенку необходимо употреблять кисломолочные продукты и белки, в виде яиц, мяса, курицы, рыбы. Это будет способствовать восстановлению нормальной кишечной флоры.
Обязательно нужно придерживаться принципов здорового питания. В ежедневном рационе ребенка должна содержаться растительная клетчатка (овощи, фрукты, зерновые каши), которая способствует восстановлению кишечной микрофлоры. Естественно, набор должен быть полный: микроэлементы, витамины, ферменты. В рационе должна преобладать растительная пища, обязательно ребенку необходимо употреблять кисломолочные продукты и белки, в виде яиц, мяса, курицы, рыбы. Это будет способствовать восстановлению нормальной кишечной флоры.
— Можно вести здоровый образ жизни, но ведь от стрессов и излучений уберечься гораздо сложнее. Какой выход в этом случае?
— Единственный – избавиться от источника негатива. Если, допустим, у вас стресс на работе, то нужно заменить место работы. И это абсолютно серьезно, ведь мы живем один раз. Быть в постоянном стрессе и лечиться от болезней – это не лучшее решение проблемы. Это просто бессмысленно. Не зря считают японцы, что место работы надо менять один раз в пять лет. И на каждом предприятии у них имеется комната разгрузки, в которой стоят муляжи начальников. Если начальник тебя обидел, заходишь в эту комнату и имеющейся там палкой лупишь по данному муляжу. Начальника, чей муляж разрушается быстрее остальных, увольняют с предприятия. Это и есть профилактика болезней у сотрудников и борьба за более высокую производительность на предприятии.
И на каждом предприятии у них имеется комната разгрузки, в которой стоят муляжи начальников. Если начальник тебя обидел, заходишь в эту комнату и имеющейся там палкой лупишь по данному муляжу. Начальника, чей муляж разрушается быстрее остальных, увольняют с предприятия. Это и есть профилактика болезней у сотрудников и борьба за более высокую производительность на предприятии.
— Получается, что также не рационально жить в Челябинской области, где экология не самая лучшая?
— Безусловно, проживать у Средиземного моря или в горах Грузии гораздо полезнее, чем в Челябинской области. Приведу простой пример: в 1991 году мы по линии «Зеленого креста» детей с гастроэнтерологической паталогией вывозили для оздоровления в Карловы Вары. Я взял с собой огромную коробку с лекарствами на случай обострения болезней, потому что каждый ребенок имел серьезное заболевание органов пищеварения. И прожив там 1,5 месяца, ни один из детей не пожаловался на плохое самочувствие. Но как только мы пересекли Брест и сходили в ресторан в поезде, ровно в течение двух суток, которые мы ехали, были использованы все припасенные лекарства. У детей начались проблемы со здоровьем в связи с ухудшением качества питания, воды и воздуха.
У детей начались проблемы со здоровьем в связи с ухудшением качества питания, воды и воздуха.
— А какова роль наследственности в развитии болезней ЖКТ?
— Безусловно, большую роль в здоровье ребенка играет здоровье его родителей. Они передают ему предрасположенность к заболеваниям органов пищеварения. Если мама нездорова, то качество ее грудного молока будет низким, что является следующим фактором не в пользу ребенка.
— Во время грудного вскармливания мама должна соблюдать особый режим питания или диету?
— Питание должно быть полноценным и разнообразным. При наличии заболеваний ЖКТ у матери с профилактической целью могут быть назначены лекарства, улучшающие ее состояние. На это мама сама должна обратить внимание врача-гинеколога, потому что ее состояние здоровья на момент рождения ребенка играет большую роль в формировании здоровья малыша. В частности, насколько полноценным будет состав его микрофлоры кишечника. Ведь заселение нормальных микробов в кишечник ребенка происходит в утробе матери, начиная 26-28 недели.
— Какие продукты детям не рекомендуется употреблять в пищу?
— Существует пять основных вредных продуктов – это газированные напитки, майонез, кетчуп, чипсы и жевательная резинка. Это все продукты генной инженерии. Например, длительное использование жевательной резинки приводит к слабоумию (наличие в ней фенолов). Более того, она покрыта вредным вкусообразующим веществом. А частое ее использование ведет к нарушению пищевого рефлекса. И в следующий раз при глотании пищи желудок не будет готов к ее перевариванию.
— А какие продукты лучше не давать до трех лет?
— Все продукты до трех лет должны быть натуральными, не консервированными! Использовать их можно в сыром или вареном виде. Жареное и копченое, маринованное, шоколадное, естественно, нельзя. Хотя в последнее время надо уже говорить и о вредных привычках у детей раннего возраста, когда малышам матери начинают давать по чайной ложке водки на ночь, чтобы они лучше спали. А для аппетита детям стали давать пиво. Это встречается достаточно часто в последнее время. К нам поступают дети раннего возраста с циррозом печени, потому что мама, вскармливая ребенка грудью, употребляла алкогольные напитки и курила.
Это встречается достаточно часто в последнее время. К нам поступают дети раннего возраста с циррозом печени, потому что мама, вскармливая ребенка грудью, употребляла алкогольные напитки и курила.
— Как вы относитесь к употреблению молока в питании детей?
— Учитывая тот факт, что идеально здоровых детей нет, употребление молока многим из них может быть не на пользу. Молоко может способствовать излишнему росту микрофлоры, а порой, организм ребенка не способен его переварить (лактазная недостаточность). Поэтому мы, гастроэнтерологи, больше ратуем за употребление кисломолочных продуктов, сыров.
— Если ребенок вынужден принимать антибиотики, что нужно делать в профилактических целях, чтобы не развился дисбактериоз?
— Лучше всего прием антибиотиков сочетать с отваром трав, например, тысячелистника, подорожника, ромашки или душицы. Они на 80% снижают отрицательное воздействие антибиотиков на слизистую кишечника и его микрофлору.
— Как часто встречаются заболевания органов пищеварения?
— Заболевания желудочно-кишечного тракта у детей находятся на втором месте после респираторных инфекций. И это если учесть, что ребенок болеет ОРВИ 2-3 раза за год, а диагноз заболевания ЖКТ ставится однократно.
И это если учесть, что ребенок болеет ОРВИ 2-3 раза за год, а диагноз заболевания ЖКТ ставится однократно.
— Вы лечите детей только с области или из Челябинска тоже?
— ЧОДКБ обслуживает жителей Челябинской области вне зависимости от ее территорий, то есть сюда входит и Челябинск. Но учитывая тот факт, что в Челябинске имеются в достаточном количестве гастроэнтерологические койки и специалисты, диагностика тоже на высоком уровне, мы стараемся брать из Челябинска только самые тяжелые и сложные случаи. И последним этапом, если уже мы не можем оказать помощь, пациентами занимается институт педиатрии в Москве.
— Каким образом дети попадают к вам?
— Они приезжают по направлению врачей из территорий области на консультативный прием в детскую областную поликлинику к специалисту-гастроэнтерологу. Осмотрев ребенка, и проведя необходимые исследования, врач решает необходимость его госпитализации или лечения в амбулаторных условиях. Вторым вариантом прибытия пациента в областную детскую поликлинику или на госпитализацию в отделение является осмотр врача-гастроэнтеролога «выездной поликлиники». Это когда наши специалисты консультируют детей по месту их проживания.
Это когда наши специалисты консультируют детей по месту их проживания.
Ольга Мельчакова, информационное агентство «Уралпресс»
Дисбактериоз — миф российской медицины
Тем не менее, как дань дремучим совковым традициям, «дисбактериоз» продолжает слетать с языка многих практикующих врачей, особенно педиатров. По-прежнему стандарты медосмотров малышей включают тестирование кала на «дисбактериоз». При этом давно известно, что искать корреляцию между составом флоры в кале и реальным ее соотношением в криптах кишечника — все равно, что гадать на кофейной гуще. Во-первых, основу кишечной флоры составляют бактероиды, которые не растут на питательных средах. Во-вторых, соотношение бактерий на выходе имеет очень мало общего с тем, что живет в кишке. В-третьих, все то время, пока вы собираете и несете ваши бесценные фекалии в лабораторию, жизнь в них не прекращается, и уже через несколько часов вся флора и фауна кала радикально видоизменяется. А потому все заключения о «преобладании патогенной флоры над нормальной» в таком анализе попросту смехотворны.
В общем, всем нам надо понимать, что такого самостоятельного заболевания, как дисбактериоз, в природе нет.
Существуют лишь ряд временных состояний организма (те же вирусные диареи или длительная антибиотикотерапия), которые могут привести к временному же дисбалансу нормальной флоры. При этом дисбаланс этот, как правило, не качественный, а количественный. В пример могу привести чрезмерный рост бактерии Clostridium difficile с развитием псевдомембранозного колита на фоне длительной терапии антибиотками.
Чаще же всего дискомфорт в животе обусловлен не мифическими заболеваниями, а совершенно реальным бунтом организма против всякой колы и прочей мак-дряни. Если вашего ребенка в животе не прекращается “шум и гам”, в первую очередь посмотрите, что он у вас ест.
У взрослых под «дисбактериозом» нередко скрываются синдром раздраженного кишечника, синдром избыточного бактериального роста в тонкой кишке, лактазная недостаточность, а также другие невыявленные состояния, при которых нарушается баланс кишечной флоры. Эти расстройства надо лечить, воздействуя на причину такого дисбаланса, а не сам дисбаланс, который является лишь следствием.
Эти расстройства надо лечить, воздействуя на причину такого дисбаланса, а не сам дисбаланс, который является лишь следствием.
На теме дисбактериоза активно паразитируют различные производители кисломолочных продуктов питания, пробиотиков (препаратов с живыми бактериальными культурами) и пребиотиков (веществ, не перевариваемых человеком, но являющихся пищей для ряда бактерий).
Как я уже объяснил в колонке о кишечной флоре, бактерии пробиотиков могут становиться лишь транзитными колонистами, тогда как цель всех лечебных мероприятий заключается в восстановлении баланса СОБСТВЕННОЙ микрофлоры.
В ряду многочисленных препаратов для коррекции дисбактериоза хочу выделить особо абсурдный класс лекарств — бактериофаги. Бактериофаги — это такие вирусы, которые поражают бактерий. Когда-то ученые предложили использовать их против стафилококков, кишечных палочек и других возбудителей диарей. Однако исследования показали, что бактериофаги полностью разрушаются в желудке, и от таких препаратов во всем мире давно уже отказались. Точнее, во всем мире, кроме России — у нас эти псевдолекарства популярны и по сей день, и особенно хорошо неэффективные препараты лечат несуществующие дисбактериозы.
Точнее, во всем мире, кроме России — у нас эти псевдолекарства популярны и по сей день, и особенно хорошо неэффективные препараты лечат несуществующие дисбактериозы.
Если ваш врач уверенно заявляет, что ваша микрофлора разбалансирована, и вы вовсю уже «страдаете дисбактериозом», не паникуйте! Попытайтесь отыскать грамотного специалиста, который не станет жонглировать несуществующими диагнозами и назначать фуфломицины, а займется общепринятой диагностикой, которая позволит отличить инфекционную или органическую патологию кишечного тракта от физиологических и психосоматических расстройств. И не спешите разоряться в аптеках! Лучше сэкономьте деньги на полноценное питание себе и вашим детям, «подкормите» микрофлору естественным образом — здоровой пищей. Растительные волокна овощей, фруктов и зерновых — лучшая поддержка для
41-mini лекция «Восстановление микрофлоры кишечника»
Нормальная микрофлора толстого кишечника неоднородна и состоит из 200 разных видов микроорганизмов. Под воздействием внутренних и внешних негативных факторов может наблюдаться уменьшение количества бифидум и лактобактерий, а также ускоренное размножение условно-патогенных и патогенных микроорганизмов.
Под воздействием внутренних и внешних негативных факторов может наблюдаться уменьшение количества бифидум и лактобактерий, а также ускоренное размножение условно-патогенных и патогенных микроорганизмов.
Данное состояние носит название дисбактериоз. Кишечный дисбиоз с одинаковой частотой возникает у людей различного возраста, независимо от пола. Хронический дисбаланс микрофлоры приводит к серьезным последствиям, включая иммунодефицитные состояния, расстройства пищеварения, структурные поражения толстого кишечника и ухудшение общего состояния. Перед тем как восстановить микрофлору кишечника, необходимо ознакомиться с причинами дисбактериоза.
Что такое дисбактериоз кишечника
Дисбактериоз или дисбиоз — это хроническое, вялотекущее состояние, при котором наблюдается изменение соотношения полезных и патогенных микроорганизмов кишечника. Полезные микроорганизмы обитающие в кишечнике, участвуют в расщеплении биологически-активных компонентов, поступающих с пищей, синтезируют отдельные витамины, подавляют гнилостные и бродильные процессы, а также являются важным звеном общего иммунитета.
Снижение популяции бифидум и лактобактерий приводит к ускоренному размножению таких болезнетворных микроорганизмов, как стрептококки, стафилококки, грибок Саndida. Накопление продуктов жизнедеятельности патогенных микроорганизмов приводит к интоксикации, ухудшению общего состояния и поражению слизистой оболочки кишечника. Восстановление микрофлоры после антибиотиков у ребенка и взрослого человека, является вопросом сохранения здоровья на долгие годы.
Причины изменения состава микрофлоры
Спровоцировать нарушение баланса кишечной микрофлоры может как один внешний или внутренний фактор, так и их совокупность. К основным причинам, которые напрямую или косвенно приводят к развитию дисбактериоза, относят:
1. Нерациональное питание, преобладание в меню белковой или жирной пищи.
2. Употребление алкоголя.
3. Регулярное воздействие стрессового фактора на организм, физическое и эмоциональное переутомление.
4. Длительный прием антибиотиков.
5. Обострение хронических заболеваний желудочно-кишечного тракта. К таким заболеваниям относится холецистит, болезнь Крона, неспецифический язвенный колит, целиакия, панкреатит, гепатит и цирроз печени.
Обострение хронических заболеваний желудочно-кишечного тракта. К таким заболеваниям относится холецистит, болезнь Крона, неспецифический язвенный колит, целиакия, панкреатит, гепатит и цирроз печени.
6. Проживание на территории с неблагоприятной экологической обстановкой.
7. Прием лекарственных медикаментов из группы иммуносупрессоров, кишечных сорбентов, секретолитиков, противотуберкулезных средств, слабительных и противоопухолевых.
8. Наличие глистных инвазий (аскаридоз).
9. Ранее перенесенные оперативные вмешательства на кишечнике.
Сезонные изменения в питании и специфика трудовой деятельности, также могут повлечь за собой развитие дисбактериоза. Перед тем как восстановить микрофлору кишечника, лекарства необходимо согласовывать с лечащим врачом.
Как нормализовать состав кишечной микрофлоры
В период межсезонья наблюдаются вспышки гриппа, ОРВИ и ротавирусной инфекции, что заставляет людей принимать противовирусные и антибактериальные средства. Подобное лечение в 90% случаев заканчивается кишечным дисбиозом. Независимо от причины развития дисбаланса, лучшие показатели в восстановлении микрофлоры после антибиотиков наблюдались при назначении пробиотиков «Соя-лактум» и «Соя-бифидум»выпускаемые компанией «Экобиос».
Подобное лечение в 90% случаев заканчивается кишечным дисбиозом. Независимо от причины развития дисбаланса, лучшие показатели в восстановлении микрофлоры после антибиотиков наблюдались при назначении пробиотиков «Соя-лактум» и «Соя-бифидум»выпускаемые компанией «Экобиос».
Прием биологически-активных добавок «Соя-лактум» и «Соя-бифидум» осуществляется согласно инструкции по применению.
ВНИМАНИЕ: Пробиотические препараты компании «Экобиос» — имеют высокую эффективность в борьбе с дисбактериозом кишечника человека!
Бифиформ Бэби | Bifiform ru
Бифиформ — эффективный препарат для лечения дисбактериоза!
Для нормализации микрофлоры у взрослых и детей старше 2 лет.
Где Купить
Состав:
В каждой капсуле кишечнорастворимой содержатся:
- Действующие вещества (пробиотики): Bifidobacterium longum не менее 1х107 КОЕ и Enterococcus faecium не менее 1х107 КОЕ;
- вспомогательные вещества.

Показания к применению:
- Диарея, вызванная острым и обострением хронического гастроэнтерита, ротавирусной инфекцией; антибиотик-ассоциированная диарея; диарея путешественника.
- В комплексной терапии острых кишечных инфекций.
- В комплексной терапии хронических заболеваний желудочно-кишечного тракта, таких как колит, синдром раздраженного кишечника и других желудочно-кишечных расстройств функционального генеза.
- Нормализация микрофлоры кишечника, лечение и профилактика дисбактериозов и поддержание иммунной системы у детей старше 2-х лет и взрослых.
- Непереносимость лактозы.
- В составе комплексной стандартной эрадикационной терапии у пациентов с хеликобактерной инфекцией.
Способ применения и дозы:
При острой диарее препарат необходимо принимать по 1 капсуле 4 раза в день до нормализации стула. Затем прием препарата необходимо продолжить в дозе 2-3 капсулы в сутки до полного исчезновения симптомов.
Затем прием препарата необходимо продолжить в дозе 2-3 капсулы в сутки до полного исчезновения симптомов.
Для нормализации микрофлоры кишечника и поддержки иммунной системы препарат назначают в дозе 2-3 капсулы в сутки 10-21 день.
Пациентам с непереносимостью лактозы рекомендуется принимать препарат по 1 капсуле 3 раза в сутки.
При проведении эрадикационной терапии Бифиформ назначают по 2 капсулы 2 раза в день на протяжении двух недель с первого дня эрадикационной терапии.
Детям с 2-х лет по 1 капсуле 2-3 раза в день. Длительность приема может быть скорректирована по рекомендации врача. При назначении детям и пациентам, которые не могут проглотить целую капсулу, ее следует аккуратно надломить, осторожно, избегая потерь, высыпать содержимое в ложку и смешать с небольшим количеством жидкости.
При возникновении вопросов, пожалуйста, проконсультируетесь с врачом.
В чем преимущества препарата?
- Изученные бактерии
В состав препарата входят изученные, безопасные и полезные пробиотические бактерии от ведущей микробиологической лаборатории «Кристиан Хансен» (Дания).

- Двухслойная защитная оболочка
Капсула Бифиформ имеет двухслойную защитную оболочку, благодаря которой весь комплекс полезных пробиотических бактерий доставляется именно в кишечник. Бактерии не разрушаются под действием кислой среды желудка и сохраняют свои полезные свойства, попадая в кишечник.
- Специальная питательная среда для полезных бактерий
Бифиформ помимо полезных бактерий содержит специальную питательную среду для их питания, роста и размножения.
- Бифиформ не содержит лактозы
- Нет связи с приемом пищ
Влияние подготовки кишечника на микробиом и метаболом кишечника человека
Дизайн исследования, условия и участники
Восемь субъектов (5 мужчин; средний возраст 32,8 года; средний индекс массы тела (ИМТ) 21,1), которым была запланирована подготовка кишечника были набраны из Национального центра глобального здравоохранения и медицины (NCGM), Токио, Япония. Данные с образцами ДНК 23 контрольных субъектов, которые не подвергались процедуре (5 мужчин; средний возраст 22,0 года; средний ИМТ 20,2), были получены из опубликованной статьи 13 .Исходные характеристики показаны в дополнительной таблице 4. Ни у одного из субъектов не было какого-либо основного заболевания, или он не лечился антибиотиками, иммунодепрессантами или антацидами в течение предшествующих 3 месяцев. Это исследование было одобрено этическим комитетом Национального центра глобального здравоохранения и медицины Японии (одобрение № 2014) и было выполнено в соответствии с положениями Хельсинкской декларации. Письменное информированное согласие было получено от всех участников, участвовавших в этом исследовании.
Данные с образцами ДНК 23 контрольных субъектов, которые не подвергались процедуре (5 мужчин; средний возраст 22,0 года; средний ИМТ 20,2), были получены из опубликованной статьи 13 .Исходные характеристики показаны в дополнительной таблице 4. Ни у одного из субъектов не было какого-либо основного заболевания, или он не лечился антибиотиками, иммунодепрессантами или антацидами в течение предшествующих 3 месяцев. Это исследование было одобрено этическим комитетом Национального центра глобального здравоохранения и медицины Японии (одобрение № 2014) и было выполнено в соответствии с положениями Хельсинкской декларации. Письменное информированное согласие было получено от всех участников, участвовавших в этом исследовании.
Сбор образцов в группе подготовки кишечника и контрольной группе
В группе подготовки кишечника мы собрали 24 образца кала до, во время и после подготовки кишечника (рис. 5). Все образцы в группе подготовки кишечника были собраны в нашей больнице с использованием полипропиленовых пробирок и сохранены при -80 ° C в течение 15 минут после дефекации до момента проведения анализа. Вкратце, образцы фекалий собирали перед введением слабительных и подготовкой кишечника (день 0). Затем испытуемые ели коммерческую пищу с низким содержанием остатков и принимали слабительные, в составе которых 0.67–1,0 мл гидрата пикосульфата натрия (Laxoberon; Teijin Pharma Co., Ltd., Токио, Япония) и 12 мг сеннозида (Sennoside; Sawai Pharma Co., Ltd., Осака, Япония) на ночь за один день до подготовки кишечника (Day 0). Утром следующего дня (День 1) испытуемые прошли подготовку кишечника с помощью 2-литрового раствора для лаважа большого объема (Magcorol P; Horii Pharma Industries, Ltd., Осака, Япония, содержащий цитрат магния 68 г) 14 , выпить в течение 4 ч. Образцы кала собирали сразу же при первой дефекации после перорального приема большого объема лаважа (день 1).Колоноскопию планировалось провести после 13:00. Образцы фекалий собирали через 14 дней после подготовки кишечника.
Вкратце, образцы фекалий собирали перед введением слабительных и подготовкой кишечника (день 0). Затем испытуемые ели коммерческую пищу с низким содержанием остатков и принимали слабительные, в составе которых 0.67–1,0 мл гидрата пикосульфата натрия (Laxoberon; Teijin Pharma Co., Ltd., Токио, Япония) и 12 мг сеннозида (Sennoside; Sawai Pharma Co., Ltd., Осака, Япония) на ночь за один день до подготовки кишечника (Day 0). Утром следующего дня (День 1) испытуемые прошли подготовку кишечника с помощью 2-литрового раствора для лаважа большого объема (Magcorol P; Horii Pharma Industries, Ltd., Осака, Япония, содержащий цитрат магния 68 г) 14 , выпить в течение 4 ч. Образцы кала собирали сразу же при первой дефекации после перорального приема большого объема лаважа (день 1).Колоноскопию планировалось провести после 13:00. Образцы фекалий собирали через 14 дней после подготовки кишечника.
Рисунок 5
Время взятия пробы кала в группе подготовки кишечника и контрольной группе.
В контрольной группе было собрано 46 образцов кала в день 0 и день 14 (рис. 5). Свежесобранные фекалии перевозили в лабораторию в анаэробных условиях в AnaeroPack (Mitsubishi Gas Chemical Company, Inc., Токио, Япония) при 4 ° C, немедленно замораживали в жидком азоте в фосфатно-солевом буфере, содержащем 20% глицерина, и хранили. при −80 ° C до анализа 13 .
В обеих группах испытуемых специально просили не менять свою диету, и никто из них не принимал никаких антибиотиков, антацидов или пробиотиков в течение периода исследования.
Экстракция бактериальной ДНК и секвенирование ампликона гена 16S рРНК
Для экстракции фекальной бактериальной ДНК мы использовали метод ферментативного лизиса с лизоцимом (Sigma-Aldrich Co., Сент-Луис, Миссури) и ахромопептидазой (Wako Pure Chemical Industries, Ltd, Осака, Япония) для всех субъектов, как описано ранее 13 .Для амплификации участков V3 – V4 бактериального гена 16S рРНК мы использовали прямой праймер для ПЦР ампликона 16S (5′-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG-3 ‘) и последовательности обратного праймера 16S-ампликона PCRATGATGATGATGATGATGAT (5′-GTGCGTCGCCGACT для последовательностей 5’-GTGCGTCGCCGACT для обратного праймера 16S ампликона (5′-GTGACGTCGACT) Индексирование Illumina. ПЦР проводили в течение 25 циклов с использованием набора KAPA HiFi HotStart ReadyMix PCR Kit (Nippon Genetics Co., Ltd, Токио, Япония). Ампликоны очищали с помощью гранул для магнитной очистки AMPure ® XP (Beckman Coulter, Inc., Бреа, Калифорния) и количественно определено с помощью 4200 TapeStation (Agilent Technologies Japan, Ltd., Токио, Япония). Равные количества ампликонов из всех образцов секвенировали с помощью системы MiSeq (Illumina, Inc., Tokyo Japan) в соответствии с инструкциями производителя 13 . В контрольной группе мы повторно проанализировали последовательность 16S рРНК в области V3-V4 таким же образом, как и для группы подготовки кишечника из консервированных образцов ДНК, и не использовали какие-либо ранее полученные данные 13 .
ПЦР проводили в течение 25 циклов с использованием набора KAPA HiFi HotStart ReadyMix PCR Kit (Nippon Genetics Co., Ltd, Токио, Япония). Ампликоны очищали с помощью гранул для магнитной очистки AMPure ® XP (Beckman Coulter, Inc., Бреа, Калифорния) и количественно определено с помощью 4200 TapeStation (Agilent Technologies Japan, Ltd., Токио, Япония). Равные количества ампликонов из всех образцов секвенировали с помощью системы MiSeq (Illumina, Inc., Tokyo Japan) в соответствии с инструкциями производителя 13 . В контрольной группе мы повторно проанализировали последовательность 16S рРНК в области V3-V4 таким же образом, как и для группы подготовки кишечника из консервированных образцов ДНК, и не использовали какие-либо ранее полученные данные 13 .
Метаболомный анализ
Мы провели времяпролетную масс-спектрометрию с капиллярным электрофорезом (CE-TOF-MS), как описано ранее 15 .Образцы фекалий лиофилизировали с использованием лиофилизатора VD-800R (TAITEC, Сайтама, Япония) в течение 24 часов. Лиофилизированный кал разрушали с помощью 3,0-мм циркониевых шариков (Bio Medical Science, Токио, Япония) путем энергичного встряхивания (1500 об / мин в течение 10 минут) с использованием Shake Master (Bio Medical Science). Метаболиты фекалий экстрагировали с использованием протокола экстракции метанол: хлороформ: вода. Эксперименты CE-TOF-MS проводились с использованием системы CE, системы G3250AA LC / MSD TOF, двоичного насоса HPLC серии 1,100, адаптера G1603A CE-MS и распылителя G1607A CE-ESI-MS (все Agilent Technologies, Санта-Клара, Калифорния).У нас не было никаких контролей в метаболическом анализе, и мы анализировали только метаболические изменения до и после подготовки кишечника.
Лиофилизированный кал разрушали с помощью 3,0-мм циркониевых шариков (Bio Medical Science, Токио, Япония) путем энергичного встряхивания (1500 об / мин в течение 10 минут) с использованием Shake Master (Bio Medical Science). Метаболиты фекалий экстрагировали с использованием протокола экстракции метанол: хлороформ: вода. Эксперименты CE-TOF-MS проводились с использованием системы CE, системы G3250AA LC / MSD TOF, двоичного насоса HPLC серии 1,100, адаптера G1603A CE-MS и распылителя G1607A CE-ESI-MS (все Agilent Technologies, Санта-Клара, Калифорния).У нас не было никаких контролей в метаболическом анализе, и мы анализировали только метаболические изменения до и после подготовки кишечника.
Анализ данных
Весь анализ данных был выполнен таким же образом, как описано для установленного трубопровода 13,16 . После того как качество прочтений, прошедших фильтр, со средним значением качества, превышающим 25, было проверено на химеры, таксономия высококачественных прочтений была назначена с использованием трех общедоступных баз данных: Ribosomal Database Project версии 10. 27, CORE (http://microbiome.osu.edu/), и эталонная база данных последовательностей генома, полученная с FTP-сайта Национального центра биотехнологической информации (ftp://ftp.ncbi.nih.gov/genbank/, декабрь 2011 г. ). Затем мы отобрали те чтения с совпадениями BLAST, превышающими 90%, с репрезентативной последовательностью в одной из трех баз данных. Из считываний, прошедших фильтр, было случайным образом выбрано 3000 высококачественных считываний для каждого образца, чтобы минимизировать переоценку видового богатства в кластеризации из-за внутренней ошибки секвенирования, как ранее сообщалось 13 .Индекс охвата Good’s, составляющий 95,2%, показал, что 3000 считываний было достаточно для оценки общего видового богатства и разнообразия. Среднее значение (стандартное отклонение) индекса охвата Гуда было высоким в каждой группе: 94,9 (1,70) в контрольных образцах дня 0, 95,7 (1,18) в контрольных образцах дня 14, 94,2 (1,84) в образцах для подготовки кишечника в день 0, 94,6 (1,62) в образцах кишечника первого дня.
27, CORE (http://microbiome.osu.edu/), и эталонная база данных последовательностей генома, полученная с FTP-сайта Национального центра биотехнологической информации (ftp://ftp.ncbi.nih.gov/genbank/, декабрь 2011 г. ). Затем мы отобрали те чтения с совпадениями BLAST, превышающими 90%, с репрезентативной последовательностью в одной из трех баз данных. Из считываний, прошедших фильтр, было случайным образом выбрано 3000 высококачественных считываний для каждого образца, чтобы минимизировать переоценку видового богатства в кластеризации из-за внутренней ошибки секвенирования, как ранее сообщалось 13 .Индекс охвата Good’s, составляющий 95,2%, показал, что 3000 считываний было достаточно для оценки общего видового богатства и разнообразия. Среднее значение (стандартное отклонение) индекса охвата Гуда было высоким в каждой группе: 94,9 (1,70) в контрольных образцах дня 0, 95,7 (1,18) в контрольных образцах дня 14, 94,2 (1,84) в образцах для подготовки кишечника в день 0, 94,6 (1,62) в образцах кишечника первого дня. подготовительные образцы и 93,6 (2,03) в образцах для подготовки кишечника на 14 день. После удаления обеих последовательностей праймеров считанные данные были отсортированы и сгруппированы в рабочие таксономические единицы (OTU) с порогом идентичности последовательностей 97%.Таксономическое присвоение каждой OTU было выполнено с помощью программы GLSEARCH. Таксономические группы с относительной численностью более 0,1% у любого субъекта были включены в последующий анализ. Из 70 образцов кала было получено 898 035 высококачественных считываний, в диапазоне от 9 152 до 9840 считываний на образец. Все 3000 прошедших фильтр прочтений последовательностей 16S V3 – V4, проанализированных в этом исследовании, были депонированы в базе данных DDBJ / GenBank / EMBL под номерами доступа DRA 007110.
подготовительные образцы и 93,6 (2,03) в образцах для подготовки кишечника на 14 день. После удаления обеих последовательностей праймеров считанные данные были отсортированы и сгруппированы в рабочие таксономические единицы (OTU) с порогом идентичности последовательностей 97%.Таксономическое присвоение каждой OTU было выполнено с помощью программы GLSEARCH. Таксономические группы с относительной численностью более 0,1% у любого субъекта были включены в последующий анализ. Из 70 образцов кала было получено 898 035 высококачественных считываний, в диапазоне от 9 152 до 9840 считываний на образец. Все 3000 прошедших фильтр прочтений последовательностей 16S V3 – V4, проанализированных в этом исследовании, были депонированы в базе данных DDBJ / GenBank / EMBL под номерами доступа DRA 007110.
α-разнообразие микробных сообществ в каждом образце оценивали с использованием метода Шеннона. индекс разнообразия.Коэффициенты корреляции Спирмена использовались для сравнения общих бактериальных и метаболомных составов между разными временами сбора образцов. Для анализа расстояния UniFrac использовались показатели на основе филогенетического дерева для измерения различий в общем бактериальном составе в разное время сбора образцов 17 . Для оценки различий в бактериальном и метаболическом составе внутри субъектов в разное время сбора образцов использовался знаковый ранговый тест Вилкоксона (например,грамм. Расстояние или коэффициент UniFrac между образцами дня 0 и дня 1 по сравнению с образцами дня 0 и дня 14). Тест суммы рангов Вилкоксона использовался для оценки разницы в бактериальном составе между группами внутри субъектов (например, расстояние или коэффициент UniFrac между группой подготовки кишечника и контрольной группой). PCoA применяли для анализа микробных и метаболических данных. Мы использовали шкалу единичной дисперсии в качестве меры описания данных для метаболитов 18 , со стандартным отклонением в качестве масштабного коэффициента 18 .Статистически значимыми считались значения p <0,05. Все статистические анализы были выполнены с помощью программного пакета R (v3.
Для анализа расстояния UniFrac использовались показатели на основе филогенетического дерева для измерения различий в общем бактериальном составе в разное время сбора образцов 17 . Для оценки различий в бактериальном и метаболическом составе внутри субъектов в разное время сбора образцов использовался знаковый ранговый тест Вилкоксона (например,грамм. Расстояние или коэффициент UniFrac между образцами дня 0 и дня 1 по сравнению с образцами дня 0 и дня 14). Тест суммы рангов Вилкоксона использовался для оценки разницы в бактериальном составе между группами внутри субъектов (например, расстояние или коэффициент UniFrac между группой подготовки кишечника и контрольной группой). PCoA применяли для анализа микробных и метаболических данных. Мы использовали шкалу единичной дисперсии в качестве меры описания данных для метаболитов 18 , со стандартным отклонением в качестве масштабного коэффициента 18 .Статистически значимыми считались значения p <0,05. Все статистические анализы были выполнены с помощью программного пакета R (v3. 2.2).
2.2).
Как соблюдать диету при дисбактериозе для лечения нездорового кишечника
Что такое дисбактериоз? Дисбиоз — это когда вредные бактерии одолели ваши полезные бактерии, что может вызвать вздутие живота, депрессию, IBS и, в конечном итоге, даже рак.
Дисбактериоз может возникать на вашей коже — это верно, на вашей коже живут полезные бактерии — во рту, во влагалище, прямой кишке или в кишечнике.Давайте пока сосредоточимся на дисбактериозе кишечника.
Вы можете исправить дисбактериоз с помощью диеты, которую мы приводим ниже. Ваш врач может также порекомендовать добавки или лекарства, которые помогут вылечить дисбактериоз кишечника.
Дисбиоз: определение и общие симптомы
Дисбиоз относится к бактериальному (иногда грибковому) дисбалансу в вашем теле или внутри него, например, в кишечной флоре.
Этот дисбаланс в составе микробиоты кишечника может привести к различным симптомам и осложнениям.
По оценкам, человеческое тело содержит в десять раз больше бактерий, чем человеческих клеток! Эти бактерии необходимы для пищеварения, иммунной функции, профилактики заболеваний и восстановления тканей, а также для многих других функций
Но если эти кишечные микробы повреждены или выброшены из строя, вредные бактерии или дрожжи начнут колонизировать. Это может вызвать хроническое воспаление, депрессию или даже дисфункцию иммунной системы.
Это может вызвать хроническое воспаление, депрессию или даже дисфункцию иммунной системы.
Сколько времени нужно, чтобы вылечить дисбактериоз кишечника? Прежде чем дисбактериоз кишечника будет излечен, необходимо как минимум пару недель изменить здоровую диету. У некоторых через две недели — мгновенно — они заживают. В других случаях могут потребоваться месяцы диетической коррекции, добавок и / или лекарств, чтобы навсегда обратить вспять дисбактериоз кишечника.
Может ли дисбактериоз вызвать потерю веса? Нет, дисбактериоз обычно вызывает прибавку в весе .Дисбиоз нарушает ваш метаболизм и пищеварение, и то и другое может привести к увеличению веса.
Каковы общие симптомы дисбактериоза?
- Вздутие живота
- Расстройство желудка
- Бессонница
- Усталость
- Беспокойство
- Депрессия
- Повышенная масса тела
- Неприятный запах изо рта
- Сыпь
- Расстройство желудка
- Тошнота
- Запор
- Диарея
- Затрудненное мочеиспускание
- Ректальное или вагинальное кровотечение
- Нарушение обмена веществ
- Воспаление
- Аутоиммунное заболевание
Продукты, которые нужно есть для лечения дисбактериоза
Существует несколько диет, которые могут исправить проблемы с кишечником, включая диету с низким содержанием FODMAP и диету с микробиомом. Типичные западные диеты основаны на сахаре и обработанных пищевых продуктах, что может привести к расстройствам желудочно-кишечного тракта, таким как дисбактериоз. Присоединяйтесь к нашей 6-недельной элиминационной диете онлайн, чтобы найти диету, которая хорошо подходит для вашего тела.
Типичные западные диеты основаны на сахаре и обработанных пищевых продуктах, что может привести к расстройствам желудочно-кишечного тракта, таким как дисбактериоз. Присоединяйтесь к нашей 6-недельной элиминационной диете онлайн, чтобы найти диету, которая хорошо подходит для вашего тела.
Какой бы ни была диета, ваш врач-терапевт позаботится о том, чтобы она вернула вашему кишечнику форму.
Продукты питания с низким содержанием FODMAP
FODMAP обозначает ферментируемые олигосахариды, дисахариды, моносахариды и полиолы . Эти короткоцепочечные жирные кислоты и сахарные спирты могут привести к дисбактериозу.
Диета с низким содержанием FODMAP — распространенное лечение СРК. Это неудивительно, поскольку удаление FODMAP из рациона снижает ферментацию и газообразование в кишечнике.
- Все непереработанное мясо, особенно рыба
- Яйца
- Фрукты с низким содержанием фруктозы (лимоны, лаймы, клубника, виноград, ананас)
- Помидоры
- Картофель
- Перец
- Морковь
- Зеленая фасоль
- Зеленая капуста
- Бамия
- Кале
- имбирь
- Чай зеленый
- Миндальное молоко
- Вода
Пребиотики и пробиотики
Мы должны быть осторожны с диетическими пробиотиками и пребиотиками. Поскольку они содержат полезные бактерии (пробиотики) или являются предшественниками роста полезных бактерий (пребиотики), они, как правило, представляют собой ферментируемые углеводы (FODMAP).
Поскольку они содержат полезные бактерии (пробиотики) или являются предшественниками роста полезных бактерий (пребиотики), они, как правило, представляют собой ферментируемые углеводы (FODMAP).
Но пробиотики (такие как Bifidobacterium и Lactobacillus ) и пребиотики, как известно, улучшают здоровье кишечника и восстанавливают баланс полезных бактерий.
Вот пробиотики и пребиотики, которые вы можете добавить в свой рацион, не нарушая дисбактериоз кишечника:
- Козий йогурт или кокосовый йогурт (без коровьего молока)
- Мягкие сыры (не рикотта)
- Темпе
- Мисо (только органическое)
- Овес
- Семена льна
- Незрелые бананы или бананы
- Водоросли
- Какао-порошок
- Инулин (FODMAP, поэтому употребляйте с осторожностью)
- Кефир (FODMAP, поэтому употребляйте с осторожностью)
- Комбуча (FODMAP, поэтому употребляйте с осторожностью)
Продукты, которых следует избегать для лечения дисбактериоза
Давайте разделим продукты, чтобы избегать их, так же, как продукты, которые нужно есть.
Избегайте обработанных пищевых продуктов, ферментируемых углеводов и сахаров. В приведенном ниже списке будет указано, каких продуктов следует избегать.
FODMAP
- пшеница
- Большинство молочных продуктов
- Репчатый лук
- Чеснок
- Фрукты с высоким содержанием фруктозы (особенно яблоки)
- Артишок
- Спаржа
- Цветная капуста
- Лимская фасоль
- Печёная фасоль
- Чай улун, чай с фенхелем, чай с ромашкой
Готовые продукты
- Приготовление пищи в микроволновке
- Мясные деликатесы
- Колбаса
- Бекон
- Мороженое
- Картофельные чипсы
- Картофель фри
- Сухие завтраки
- Масло канолы
Продукты с высоким содержанием сахара
- Сладкие напитки
- Конфеты
- Многие приправы (например, кетчуп)
- Нектар агавы
- Сухофрукты
- Арахисовое масло
- Заправки для салатов
6 добавок от дисбактериоза для улучшения питания
У следующих пищевых добавок есть несколько преимуществ для здоровья, но восстановление кишечных бактерий и лечение дисбактериоза кишечника — это общая тема, подтвержденная исследованиями.
- Пробиотики
- Пребиотики
- Мультивитаминный комплекс B
- Кальций
- Магний
- имбирь
Всегда консультируйтесь с врачом перед приемом новой пищевой добавки.
Как ваш врач диагностирует дисбактериоз кишечника
Диагностика дисбактериоза не займет много времени. Ваш врач поговорит с вами об истории болезни и любых симптомах дисбактериоза, которые у вас проявились.
Ваш врач также спросит, относится ли к вам какой-либо из факторов риска дисбактериоза кишечника.Пропустите два раздела, чтобы узнать больше о факторах риска.
Функциональный врач, вероятно, также спросит о вашей семейной истории болезни. История вашей семьи многое говорит вам о том, чего ожидать от собственной жизни и как к этому подготовиться.
Вот четыре распространенных теста на дисбактериоз:
- Анализ мочи (измерение ваших органических кислот)
- Водородный дыхательный тест (тесты на SIBO)
- Комплексный анализ пищеварительного стула
- Тест кишечной проницаемости
В отличие от обычных врачей, ваш функциональный врач сделает акцент на вашей диете как на лечении дисбактериоза кишечника . К сожалению, большинство обычных врачей почти не обучаются питанию, а это означает, что они не всегда осведомлены о том, как использовать пищу в качестве лекарства для лечения дисбактериоза кишечника.
К сожалению, большинство обычных врачей почти не обучаются питанию, а это означает, что они не всегда осведомлены о том, как использовать пищу в качестве лекарства для лечения дисбактериоза кишечника.
Лекарства и другие методы лечения для восстановления баланса кишечника
Обычные врачи полагаются на фармацевтические препараты для лечения болезней.
Хотя PrimeHealth является практикой функциональной медицины, мы не сбрасываем со счетов эффективность некоторых лекарств. Мы просто не полагаемся на это, поскольку изменения в диете и образе жизни помогают избавиться от искусственных химикатов и побочных эффектов.
Вот некоторые антибиотики, которые врач может назначить вам при дисбактериозе кишечника:
- Рифаксимин
- Неомицин
- Метронидазол или тинидазол
- Дифлюкан
- Нистатин
На самом деле эти антибиотики лечат симптомы дисбактериоза, возможно, убивая при этом полезные бактерии. Но в крайних случаях необходимо соблюдать баланс.
Пересадка фекальной микробиоты (FMT) — еще одно возможное лечение дисбактериоза кишечника.Звучит мерзко, не правда ли? Но исследования показывают, что FMT может предотвратить дисбактериоз пищеварительного тракта.
FMT в настоящее время является экспериментальным лечением, и вокруг него возникли некоторые противоречия. Однако похоже, что это лечение может получить более широкое распространение, поскольку положительные результаты будут видны в клинических испытаниях на людях.
Факторы риска дисбактериоза кишечника
Кто подвержен риску дисбактериоза кишечника? Основными факторами риска являются:
- Избыточный бактериальный рост тонкого кишечника (SIBO), когда чрезмерное количество бактерий колонизируется в тонком кишечнике
- Чрезмерное употребление антибиотиков, убивающих хорошие бактерии с помощью плохих
- Новое лекарство
- Новая диета, например повышенное потребление сахара или полуфабрикатов
- Употребление более одного алкогольного напитка в день
- Плохая гигиена полости рта
Осложнения дисбактериоза кишечника
Исследования показывают, что дисбактериоз кишечника связан с удивительным количеством заболеваний. Следующие нарушения являются осложнениями дисбактериоза кишечника , если их не лечить .
Следующие нарушения являются осложнениями дисбактериоза кишечника , если их не лечить .
Взгляд в будущее
Дисбактериоз кишечника хорошо поддается лечению. Диета при дисбактериозе должна навсегда исправить ваши проблемы с кишечником, если вы будете придерживаться этих диетических изменений.
Мы в PrimeHealth верим, что наш функциональный подход заключается в том, чтобы навсегда вылечить дисбактериоз. Наш функциональный подход сотворил чудеса с сотнями пациентов , которые не добились успеха у обычных врачей.
Чтобы заказать бесплатную телефонную консультацию, пожалуйста, нажмите здесь .
— Медицинское освидетельствование Soyona Rafatjah, MD. 26 мая 2020 года
Источники
- Кроули, Дж., Болл, Л., и Хиддинк, Дж. Дж. (2019). Питание в медицинском образовании: систематический обзор. The Lancet Planetary Health , 3 (9), e379-e389.
 Полный текст.
Полный текст. - Чонг, П.П., Чин, В. К., Луи, К. Ю., Вонг, В. Ф., Мадхаван, П., и Йонг, В. К. (2019). Микробиом и синдром раздраженного кишечника — Обзор патофизиологии, текущих исследований и будущей терапии. Frontiers in microbiology , 10 , 1136. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6579922/
- Магге, С., и Лембо, А. (2012). Диета с низким содержанием FODMAP для лечения синдрома раздраженного кишечника. Гастроэнтерология и гепатология , 8 (11), 739.Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3966170/
- Альтобелли, Э., Дель Негро, В., Анджелетти, П. М., и Лателла, Г. (2017). Диета с низким содержанием FODMAP улучшает симптомы синдрома раздраженного кишечника: метаанализ. Питательные вещества , 9 (9), 940. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5622700/
- Wosinska, L., Cotter, P. D., O’Sullivan, O., & Guinane, C. (2019). Возможное влияние пробиотиков на микробиом кишечника спортсменов.
 Питательные вещества , 11 (10), 2270.Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6835687/
Питательные вещества , 11 (10), 2270.Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6835687/ - Шарма В., Родионов Д. А., Лейн, С. А., Тран, Д., Яблоков, С. Н., Динг, Х.,… и Петерсон, С. Н. (2019). Совместное использование витамина B способствует стабильности микробных сообществ кишечника. Frontiers in microbiology , 10 , 1485. Полный текст: https://www.frontiersin.org/articles/10.3389/fmicb.2019.01485/full
- Чаплин А., Парра П., Лараичи С., Серра Ф. и Палоу А. (2016). Добавки кальция модулируют микробиоту кишечника пребиотическим образом у мышей с ожирением, которые питаются ожирением. Молекулярное питание и исследования пищевых продуктов , 60 (2), 468-480. Аннотация: https://www.ncbi.nlm.nih.gov/pubmed/26582185
- Кроули, Э. К., Лонг-Смит, К. М., Мерфи, А., Паттерсон, Э., Мерфи, К., О’Горман, Д. М.,… и Нолан, Ю. М. (2018). Пищевая добавка со смесью морских минералов, богатых магнием, увеличивает разнообразие желудочно-кишечной микробиоты.
 Морские препараты , 16 (6), 216. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6024889/
Морские препараты , 16 (6), 216. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6024889/ - Кумар Сингх, А., Кабрал, К., Кумар, Р., Гангули, Р., Кумар Рана, Х., Гупта, А.,… и Пандей, А. К. (2019). Благоприятное влияние пищевых полифенолов на микробиоту кишечника и стратегии повышения эффективности доставки. Питательные вещества , 11 (9), 2216. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6770155/
- Нью-Йорк-Среднеатлантический консорциум генетических служб и служб скрининга новорожденных. (2009). Понимание генетики: руководство для пациентов и медицинских работников в Нью-Йорке, Средней Атлантике .Лулу. com. Полный текст: https://www.ncbi.nlm.nih.gov/books/NBK115560/
- Шмидт, Э. К., Торрес-Эспин, А., Рапосо, П. Дж., Мадсен, К. Л., Кигерл, К. А., Попович, П. Г.,… и Фуад, К. (2020). Трансплантат фекалий предотвращает дисбактериоз кишечника и тревожное поведение после травмы спинного мозга у крыс.
 Plos one , 15 (1), e0226128. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6961833/
Plos one , 15 (1), e0226128. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6961833/ - Келли, К. Р., Ихунна, К., Фишер, М., Хоруц, А., Суравич, К., Афзали, А.,… и Гордон, С. (2014). Трансплантат фекальной микробиоты для лечения инфекции Clostridium difficile у пациентов с ослабленным иммунитетом. Американский журнал гастроэнтерологии, 109 (7), 1065. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5537742/
- Уилкинс, Л. Дж., Монга, М., и Миллер, А. В. (2019). Определение дисбактериоза для группы хронических заболеваний. Научные отчеты , 9 (1), 1-10. Полный текст: https://www.nature.com/articles/s41598-019-49452-y
- Мутлу, Э., Кешаварзян, А., Энген, П., Форсайт, К. Б., Сикаруди, М., и Жиллевет, П. (2009). Дисбактериоз кишечника: возможный механизм алкогольной эндотоксемии и алкогольного стеатогепатита у крыс. Алкоголизм: клинические и экспериментальные исследования , 33 (10), 1836-1846.
 Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3684271/
Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3684271/ - Шиппа, С., и Конте, М. П. (2014). Дисбиотические явления в микробиоте кишечника: влияние на здоровье человека. Питательные вещества , 6 (12), 5786-5805.Аннотация: https://www.ncbi.nlm.nih.gov/pubmed/25514560/ Загрузить PDF: https://scholar.google.com/scholar_url?url=https://www.mdpi.com/2072-6643 / 6/12/5786 / pdf & hl = en & sa = T & oi = gsb-gga & ct = res & cd = 0 & d = 632278
- 48841533 & ei = M9CqXu-AAoGzmAGyv6DwCw & scisig = AAGBfm3t_fLhRGDhp
- Чан, Ю. К., Эстаки, М., и Гибсон, Д. Л. (2013). Клинические последствия дисбактериоза, вызванного диетой. Annals of Nutrition and Metabolism , 63 (Suppl.2), 28-40. Полный текст: https://www.karger.com/Article/Fulltext/354902
- Шефлин, А. М., Уитни, А. К., и Вейр, Т. Л. (2014). Раковые эффекты микробного дисбиоза. Текущие онкологические отчеты , 16 (10), 406. Полный текст: https://www.ncbi.nlm.nih.
 gov/pmc/articles/PMC4180221/
gov/pmc/articles/PMC4180221/
Уничтожает ли очищение толстой кишки микробиом кишечника?
В. Разве клизма перед колоноскопией практически не уничтожит внутренний микробиом?
А. Для подготовки к колоноскопии необходимо очистить кишечник натощак, принять слабительный напиток и, в некоторых случаях, поставить клизму. Хотя такой препарат может изменить микробиом, богатый спектр микробов, присутствующих в кишечнике, исследования показывают, что микробиом приходит в норму примерно через две-четыре недели.
«Это значительно изменит сообщество на короткий период времени, но, насколько нам известно, не имеет каких-либо долгосрочных последствий», — сказал д-р Ильсеунг Чо, гастроэнтеролог и доцент медицины в NYU Langone Medical. Центр.
«Даже клизма не избавит толстую кишку от всех бактерий», — сказал доктор Ари Гринспан, гастроэнтеролог из медицинской школы Икана на горе Синай. Микробиомы людей, как правило, становятся очень стабильными после трехлетнего возраста.
«Если вы поедете в Таиланд и съедите интересную еду или заразитесь каким-либо насекомым, ваш микробиом изменится, но в большинстве случаев он вернется в норму. после этого его нормальное состояние », — сказал доктор Гринспан.
Одно исследование, проведенное в 2014 году с участием 23 человек, показало, что микробиомы добровольцев восстанавливались быстрее, если они выпили две литровые дозы напитка для подготовки кишечника, которые обычно используются перед колоноскопией — одну вечером и одну на следующее утро, а не полностью. два литра утром в день процедуры.
«Итак, для микробиома кишечника и для подготовки кишечника лучше принимать две отдельные дозы», — сказала Гейл Креши, гастроэнтерологический исследователь из клиники Кливленда, которая специализируется на микробиоме кишечника. Но ваш график подготовки кишечника будет зависеть от рекомендаций врача.
Доктор Мартин Блазер, который руководит Программой микробиома человека в Нью-Йоркском университете Лангоне, сказал, что он не думает, что ученые достаточно хорошо понимают микробиом, чтобы сделать вывод о том, что он полностью восстанавливается после такой процедуры, как колоноскопия, или лечения, например, антибиотика. По его словам, в исследованиях могут отсутствовать более тонкие изменения.
По его словам, в исследованиях могут отсутствовать более тонкие изменения.
«Мы когда-нибудь вернемся на 100 процентов назад, или мы вернемся назад на 95 процентов или 98 процентов?» — спросил доктор Блазер. Он сказал, что когда-нибудь эта разница может иметь значение.
Действительно, ученые только начинают понимать, как работает микробиом, как и почему он изменяется, а также его общее влияние на здоровье.
Использование пробиотиков для коррекции дисбактериоза нормальной микробиоты после болезни или разрушительных событий: систематический обзор
Введение
Популярность пробиотиков в последнее время выросла в геометрической прогрессии, но наряду с их возросшим использованием ведутся споры о том, как следует регулировать пробиотики и следует ли рассматривать пробиотики в качестве лечебного питания, лекарства или пищевой добавки.В США пробиотики обычно доступны в виде пищевых добавок и, таким образом, ограничены заявлением о «структуре или функции» для здоровья и, в отличие от лекарств, отпускаемых по рецепту, не имеют права заявлять, что «лечат» или «излечивают» болезнь. В Европе и Великобритании пробиотики имеют право заявлять о своей полезности или функциональности. Эти утверждения должны быть подтверждены хорошо проведенными испытаниями на людях в целевой популяции или на здоровых добровольцах, но Европейское управление по безопасности пищевых продуктов (EFSA) отклонило> 80% заявлений, поданных им.1–3 Во многих случаях научное обоснование конкретного заявления о пользе для здоровья было сочтено недостаточным или основанным на косвенном эффекте4. Одно из таких функциональных заявлений, сделанных для пробиотических продуктов, заключается в том, что они устраняют дисбактериоз (или нарушение существования бактерий и грибов после применения антибиотиков или других средств). разрушительные воздействия) и, таким образом, могут быть полезны для поддержания здоровья. Пробиотики активны в течение этого чувствительного окна с момента разрушительного события до момента восстановления нормальной микробиоты. Для пробиотиков задокументировано множество механизмов действия (от блокирования участков прикрепления патогенов, разрушения патогена бактериоцинами или протеазами, разлагающими токсины до регуляции иммунной системы) 5, 6, и хотя клинические данные подтверждают Эффективность некоторых пробиотических штаммов, доказательства, связывающие эти механизмы действия с определенными заявлениями о здоровье или функции, не так очевидны.
В Европе и Великобритании пробиотики имеют право заявлять о своей полезности или функциональности. Эти утверждения должны быть подтверждены хорошо проведенными испытаниями на людях в целевой популяции или на здоровых добровольцах, но Европейское управление по безопасности пищевых продуктов (EFSA) отклонило> 80% заявлений, поданных им.1–3 Во многих случаях научное обоснование конкретного заявления о пользе для здоровья было сочтено недостаточным или основанным на косвенном эффекте4. Одно из таких функциональных заявлений, сделанных для пробиотических продуктов, заключается в том, что они устраняют дисбактериоз (или нарушение существования бактерий и грибов после применения антибиотиков или других средств). разрушительные воздействия) и, таким образом, могут быть полезны для поддержания здоровья. Пробиотики активны в течение этого чувствительного окна с момента разрушительного события до момента восстановления нормальной микробиоты. Для пробиотиков задокументировано множество механизмов действия (от блокирования участков прикрепления патогенов, разрушения патогена бактериоцинами или протеазами, разлагающими токсины до регуляции иммунной системы) 5, 6, и хотя клинические данные подтверждают Эффективность некоторых пробиотических штаммов, доказательства, связывающие эти механизмы действия с определенными заявлениями о здоровье или функции, не так очевидны.
Классическим примером последствий дисбактериоза является диарея, связанная с антибиотиками (AAD) .7, 8 Хотя антибиотики могут быть эффективными в уничтожении патогенных организмов, общим, непреднамеренным эффектом является уничтожение или подавление полезных микробов из-за общей восприимчивости к антибиотику. Одна из многих функций нормальной микробиоты — это способность противостоять инфекции патогенными организмами, называемая «резистентностью к колонизации» 9, 10. Например, потеря субпопуляции нормальной микробиоты может привести к потере способности нарушать пуховые волокна и крахмалы в абсорбируемые короткоцепочечные жирные кислоты, что приводит к высокому уровню непереваренных углеводов, которые могут вызвать диарею.11 Было показано, что нарушение нормальной микробиоты приводит к более высокому уровню инфекций в других системах организма, кроме кишечного тракта, включая кожу, 12, 13 влагалище, 14, 15 дыхательные пути, 16, 17 и ротовую полость18. –20
Основной проблемой при установлении причины и следствия улучшения дисбактериоза пробиотиками является отсутствие стандартного определения «нормальной» микробиоты. Виды микробов, присутствующих в разных нишах тела, существенно различаются между индивидуумами, которые также зависят от возраста, географического района и состояния здоровья хозяина.Кроме того, полный учет микробиоты в настоящее время невозможен, так как нет анализов для обнаружения всех> 10 13 –10 14 организмов в кишечнике, а стандартные методы микробного культивирования пропускают 75–95% этих организмов. 21, 22 Развитие метагеномики (каталогизация профилей индивидуальных и специфичных для болезней бактериальных генов) и создание международного проекта «Микробиом человека» открыли новую эру в нашем понимании сложности этих взаимодействий в организме.23, 24 Этот сдвиг парадигмы от культивирования к метагеномному анализу расширил наши возможности документировать изменения микробных популяций до беспрецедентной степени, но интерпретация этих сдвигов продолжает оставаться предметом споров.25-28 С появлением этих новых метагеномных инструментов, пересматривается роль пробиотиков в восстановлении нормальной микробиоты.
Виды микробов, присутствующих в разных нишах тела, существенно различаются между индивидуумами, которые также зависят от возраста, географического района и состояния здоровья хозяина.Кроме того, полный учет микробиоты в настоящее время невозможен, так как нет анализов для обнаружения всех> 10 13 –10 14 организмов в кишечнике, а стандартные методы микробного культивирования пропускают 75–95% этих организмов. 21, 22 Развитие метагеномики (каталогизация профилей индивидуальных и специфичных для болезней бактериальных генов) и создание международного проекта «Микробиом человека» открыли новую эру в нашем понимании сложности этих взаимодействий в организме.23, 24 Этот сдвиг парадигмы от культивирования к метагеномному анализу расширил наши возможности документировать изменения микробных популяций до беспрецедентной степени, но интерпретация этих сдвигов продолжает оставаться предметом споров.25-28 С появлением этих новых метагеномных инструментов, пересматривается роль пробиотиков в восстановлении нормальной микробиоты. 29
29
В свете новых руководящих документов и рекомендаций цель этого систематического обзора состоит в том, чтобы определить, как требования о восстановлении нормальной микробиоты и коррекции дисбактериоза изучались с помощью хорошо спланированных испытаний и какие штаммы пробиотиков имеют доказательные данные. чтобы поддержать эти утверждения.
Методы
Цель исследования
Систематический обзор литературы для анализа доказательств того, что пробиотики могут исправить дисбактериоз нормальной микробиоты по результатам рандомизированных контролируемых испытаний.
Стратегия поиска
Поисковые запросы включали: пробиотики + заявления о здоровье, восстановление нормальной микробиоты, дисбиоз, нормальная микробиота, фармакокинетика, метагеномика, пробиотики, пищевые добавки, рандомизированные контролируемые исследования, AAD, Clostridium difficile, инфекция (CDI), воспалительные заболевания кишечника (IBD), синдром раздраженного кишечника (СРК), диарея путешественника (TD), искоренение Heliobacter pylori, бактериального вагиноза (BV) или вагинита, лечение острой детской диареи и специфические штаммы или продукты пробиотиков. Первоначально стратегии поиска были широкими, а затем сузились до клинических испытаний пробиотиков.
Первоначально стратегии поиска были широкими, а затем сузились до клинических испытаний пробиотиков.
Источники данных
PubMed (1985–2013), EMBASE (1985–2013), Кокрановская база данных систематических обзоров (1990–2013), CINAHL (1985–2013), AMED (1985–2013) и ISI Web of Science (2000–2013). Был проведен поиск по трем онлайновым регистрам клинических испытаний: Кокрановскому центральному регистру контролируемых испытаний (http://www.cochrane.org), метарегистру контролируемых испытаний (http: www.controlled-trials.com/mrct) и Национальным институтам здравоохранения. (http: // www.Clinicaltrials.gov).
Критерии отбора исследований и извлечения данных
Отрывки из всех цитат были рассмотрены одним автором и оценены для включения в рандомизированные контролируемые испытания пробиотических препаратов. Полные статьи были извлечены, если были упомянуты нормальные анализы микробиоты. Испытания на неанглийском языке переводились и включались по возможности. Критерии исключения включали доклинические исследования (модели на животных или анализы in vitro), исследования безопасности или фазы 2, обзоры, испытания эффективности без анализов для нормальных видов микробиоты, только метагеномные методы, механизм действия нормальной микробиоты или пробиотика, перекрестные исследования, отчеты о случаях или серии случаев, дублированные отчеты или исследования неуказанных типов пробиотиков.Были рассмотрены все фармакокинетические исследования на людях, поскольку в их рефератах часто не содержались данные нормального анализа микробиоты. Процесс извлечения данных и обзора соответствовал руководящим принципам заявления о предпочтительных элементах отчетности для систематических обзоров и метаанализов (PRISMA) с использованием контрольного списка из 27 пунктов и блок-схемы.30 Для сбора данных о пробиотике (тип штамма) использовалась стандартизированная форма извлечения данных. , суточная доза, продолжительность), тип контроля (плацебо, активное лечение или отсутствие лечения), дизайн исследования (состояние микробиоты на исходном уровне и время последующего наблюдения), тип анализа микробиоты (микробное культивирование, молекулярные биомаркеры и т.
Критерии исключения включали доклинические исследования (модели на животных или анализы in vitro), исследования безопасности или фазы 2, обзоры, испытания эффективности без анализов для нормальных видов микробиоты, только метагеномные методы, механизм действия нормальной микробиоты или пробиотика, перекрестные исследования, отчеты о случаях или серии случаев, дублированные отчеты или исследования неуказанных типов пробиотиков.Были рассмотрены все фармакокинетические исследования на людях, поскольку в их рефератах часто не содержались данные нормального анализа микробиоты. Процесс извлечения данных и обзора соответствовал руководящим принципам заявления о предпочтительных элементах отчетности для систематических обзоров и метаанализов (PRISMA) с использованием контрольного списка из 27 пунктов и блок-схемы.30 Для сбора данных о пробиотике (тип штамма) использовалась стандартизированная форма извлечения данных. , суточная доза, продолжительность), тип контроля (плацебо, активное лечение или отсутствие лечения), дизайн исследования (состояние микробиоты на исходном уровне и время последующего наблюдения), тип анализа микробиоты (микробное культивирование, молекулярные биомаркеры и т. д.), включенное исследование популяция (взрослые и дети, здоровые добровольцы, болезненное состояние), тип и время действия деструктивного агента (антибиотики, химиотерапия и т. д.), размер и отсев исследования, оценка результатов (эффективность и / или статус микробиоты в конце исследования, нежелательные явления) и вид заявления о состоянии здоровья.
д.), включенное исследование популяция (взрослые и дети, здоровые добровольцы, болезненное состояние), тип и время действия деструктивного агента (антибиотики, химиотерапия и т. д.), размер и отсев исследования, оценка результатов (эффективность и / или статус микробиоты в конце исследования, нежелательные явления) и вид заявления о состоянии здоровья.
Результаты и определения
Первичный результат — это степень коррекции или улучшения микробиоты с помощью определенного (ых) пробиотического штамма (ов). Вторичный результат — это связь между степенью коррекции дисбиоза и чистой эффективностью, обнаруженной в рандомизированных контролируемых испытаниях пробиотических вмешательств. Дисбиоз определяется как изменение или нарушение нормальной микробиоты (бактериальные или грибковые виды) из-за воздействия разрушающего фактора (например, антибиотиков, хронических заболеваний, стресса, медицинских процедур или лекарств и т. Д.).Поскольку в настоящее время не существует стандартного определения «нормальной» микробиоты, для этого обзора восстановление нормальной микробиоты определяется как возвращение к анализируемым видам или профилю микробов, взятым у здорового человека (до того, как произойдет разрушительное событие). Включенные исследования должны иметь по крайней мере анализ лечения препробиотиками и анализ лечения постпробиотиками. В течение периода поиска (1985–2013) было доступно множество микробных анализов, включая документирование микробиоты либо с помощью микробных культур, либо с помощью метагеномных методов (нацеленные на 16s рРНК зонды с использованием флуоресцентной гибридизации in situ (FISH) или другого метода ПЦР) 8, 21, 28, 31 или косвенными методами (по шкале Ньюджента).15 баллов по шкале Ньюджента (от 0 до 10) используются для диагностики бактериального вагиноза (баллы ≥7) или нормальной микробиоты влагалища (баллы 0–3) на основе количественных морфотипов малых грамотрицательных палочек ( Gardnerella vaginalis / bacteroides spp) и изогнутые грамотрицательные палочки ( Mobiluncus spp), полученные при окраске по Граму мазков из влагалищных выделений. Микробиологические анализы только штаммов, содержащихся в пробиотическом продукте, считаются фармакокинетическими исследованиями и не включаются в профили нормальной микробиоты.
Включенные исследования должны иметь по крайней мере анализ лечения препробиотиками и анализ лечения постпробиотиками. В течение периода поиска (1985–2013) было доступно множество микробных анализов, включая документирование микробиоты либо с помощью микробных культур, либо с помощью метагеномных методов (нацеленные на 16s рРНК зонды с использованием флуоресцентной гибридизации in situ (FISH) или другого метода ПЦР) 8, 21, 28, 31 или косвенными методами (по шкале Ньюджента).15 баллов по шкале Ньюджента (от 0 до 10) используются для диагностики бактериального вагиноза (баллы ≥7) или нормальной микробиоты влагалища (баллы 0–3) на основе количественных морфотипов малых грамотрицательных палочек ( Gardnerella vaginalis / bacteroides spp) и изогнутые грамотрицательные палочки ( Mobiluncus spp), полученные при окраске по Граму мазков из влагалищных выделений. Микробиологические анализы только штаммов, содержащихся в пробиотическом продукте, считаются фармакокинетическими исследованиями и не включаются в профили нормальной микробиоты.
Модели дисбактериоза
Для определения воздействия на нормальную микробиоту были включены только прямые доказательства изменения микробиоты (виды, профили, индексы разнообразия или диагностические критерии), а косвенные эффекты были исключены (изменения кишечных ферментов, параметров иммунной системы или симптомов заболевания). Степень улучшения дисбактериоза подразделяется на три уровня: (1) восстановление нормальной микробиоты до исходного уровня; (2) изменение или улучшение нормальной микробиоты; и (3) отсутствие изменений нормальной микробиоты.
Литература содержала три модели дисбиоза: модель A (восстановление нормальной микробиоты), в которой анализировали пациентов, зарегистрированных со здоровой, ненарушенной микробиотой, а затем снова анализировали после разрушительного события (такого как воздействие антибиотиков) и терапии пробиотиками; модель B (изменение микробиоты) исследовала пациентов с уже существующей нарушенной микробиотой (например, уже существующее хроническое заболевание или активное заболевание), а затем после пробиотической терапии; Модель C (без дисбактериоза) тестировала добровольцев без разрушительного события (до или во время клинического испытания) как в препробиотический, так и в постпробиотический периоды, как показано на рисунке 1. «Восстановление» нормальной микробиоты определяется как восстановление микробиоты до нормального здорового исходного уровня. Восстановление может быть полным (все проанализированные уровни микробов вернулись к исходному уровню) или неполным восстановлением (частичное восстановление некоторых штаммов микробов, но не все вернулись к исходным уровням). В исследованиях, в которых участвовали участники с дисбиозом на исходном уровне (обычно из-за хронических заболеваний), невозможно показать восстановление нормального уровня микробиоты, поскольку нормальная, ненарушенная микробиота не присутствовала у этих типов участников исследования на момент включения в исследование.Следовательно, наиболее веские аргументы в пользу конструкции модели B — это «изменение или улучшение» микробиоты. В этой статье были проанализированы только данные участников, подвергшихся воздействию пробиотиков. Данные из контрольных групп использовались для подтверждения дисбактериоза у участников с хроническими заболеваниями или после разрушительного воздействия, такого как антибиотики или химиотерапия, не затронутых воздействием пробиотиков.
«Восстановление» нормальной микробиоты определяется как восстановление микробиоты до нормального здорового исходного уровня. Восстановление может быть полным (все проанализированные уровни микробов вернулись к исходному уровню) или неполным восстановлением (частичное восстановление некоторых штаммов микробов, но не все вернулись к исходным уровням). В исследованиях, в которых участвовали участники с дисбиозом на исходном уровне (обычно из-за хронических заболеваний), невозможно показать восстановление нормального уровня микробиоты, поскольку нормальная, ненарушенная микробиота не присутствовала у этих типов участников исследования на момент включения в исследование.Следовательно, наиболее веские аргументы в пользу конструкции модели B — это «изменение или улучшение» микробиоты. В этой статье были проанализированы только данные участников, подвергшихся воздействию пробиотиков. Данные из контрольных групп использовались для подтверждения дисбактериоза у участников с хроническими заболеваниями или после разрушительного воздействия, такого как антибиотики или химиотерапия, не затронутых воздействием пробиотиков. 32–34
32–34
Рис. 1
Временная последовательность событий и три модели дизайна исследования, определяющие три различные степени коррекции дисбактериоза пробиотиками.
Оценка методологической устойчивости и качества
Система GRADE (классификация рекомендаций, оценка, разработка и оценка) для оценки общего качества исследования будет использоваться для каждого пробиотического штамма или типа (отдельные штаммы и смеси штаммов) .35 Рекомендация в поддержку заявления о каждом пробиотическом штамме или смесь могут быть оценены по общей силе доказательств («сильные», многие рандомизированные контролируемые испытания показывают значительное восстановление микробиоты, или «умеренные» — только одно рандомизированное контролируемое исследование; или «слабые», только серии случаев или отчеты, ограниченное количество малых испытаний и т. д.).
Качество доказательств основано на дизайне исследования и оценивается как «высокое качество» (четко определенный дизайн исследования для определения восстановления с нормальной микробиотой, модель A) или «среднее качество» (нарушение микробиоты на исходном уровне, модель B) или «низкое качество» (нарушение работы не произошло, модель C). Измерение систематической ошибки публикации в данном обзоре не оценивалось, поскольку объединенные оценки эффективности результатов не проводились, что типично для метаанализа, но все исследования с анализами микробиоты были включены для ограничения систематической ошибки.
Измерение систематической ошибки публикации в данном обзоре не оценивалось, поскольку объединенные оценки эффективности результатов не проводились, что типично для метаанализа, но все исследования с анализами микробиоты были включены для ограничения систематической ошибки.
Рейтинг чистой эффективности
Чтобы определить, связана ли способность корректировать дисбактериоз с клинической эффективностью, используйте опубликованную литературу для рандомизированных контролируемых исследований (РКИ) или мета-анализы пробиотиков для различных показаний заболевания, включая AAD, 5, 36, 37 CDI, 5, 38 IBD , 39 IBS, 40 TD, 41 эрадикация H. pylori , 36, 37 BV42 и лечение острой детской диареи были рассмотрены.43–45 Чистый рейтинг был рассчитан путем вычитания количества РКИ, показавших незначительную или эквивалентную эффективность из числа РКИ, показавших значительную эффективность.Ранги были разделены на следующие категории: ++, ≥2 чистых РКИ, показывающих значительную эффективность; +, чистые РКИ, показывающие значительную эффективность; 0, равное количество РКИ, показывающих значимые и незначимые результаты эффективности, и -, ≥1 чистое отрицательное или незначимое РКИ. Пробиотики, не прошедшие РКИ, не оценивались.
Пробиотики, не прошедшие РКИ, не оценивались.
Результаты
Обзор литературы за 1985–2013 гг. Обнаружил 353 статьи, посвященные лечению пробиотиками и их потенциальному влиянию на нормальную микробиоту.
Исключенные исследования
Как показано на рисунке 2, в общей сложности 272 статьи были исключены по следующим причинам: обзоры (n = 116), исследования эффективности пробиотиков без данных о нормальных анализах микробиоты (n = 54), модели пробиотиков на животных и изменения микробиоты. (n = 38), только метагеномные методы или методы микробиоты (n = 17), исследования нормальной микробиоты, но без использования пробиотиков (n = 14), анализы микробиоты in vitro (n = 10), дублирующие отчеты (n = 2 ) или разные (n = 21), которые включали исследования механизма действия пробиотиков, исследования безопасности, дублирующие отчеты, перекрестные исследования и два с плохо описанными пробиотическими вмешательствами.46, 47 В общей сложности была рассмотрена 81 полная статья, в которой упоминались изменения в нормальной микробиоте или указывались на полезность пробиотиков и их влияние на нормальную микробиоту.
Рисунок 2
Блок-схема результатов обзора литературы (1985–2013 гг.) Включенных и исключенных исследований по восстановлению или улучшению нормальной микробиоты с помощью пробиотиков. РКИ — рандомизированные контролируемые испытания; МОА, механизм действия; НМ, нормальная микробиота.
Фармакокинетические исследования пробиотиков (n = 18), в которых сообщалось о концентрациях пробиотических штаммов до и после лечения, но не анализировались на другие виды нормальной микробиоты, были исключены.Хотя в нескольких исследованиях, использующих этот дизайн исследования, утверждается, что пробиотики оказали влияние на нормальную микробиоту, тип полученных данных — это фармакокинетическое поведение самих пробиотиков, а не нормальная микробиота. Несколько исследований заявили, что нормальная микробиота была изменена, потому что после введения пробиотиков наблюдалось увеличение количества различных видов бактерий, но анализируемые виды были теми, которые содержались в пробиотическом продукте, поэтому это увеличение не является неожиданным.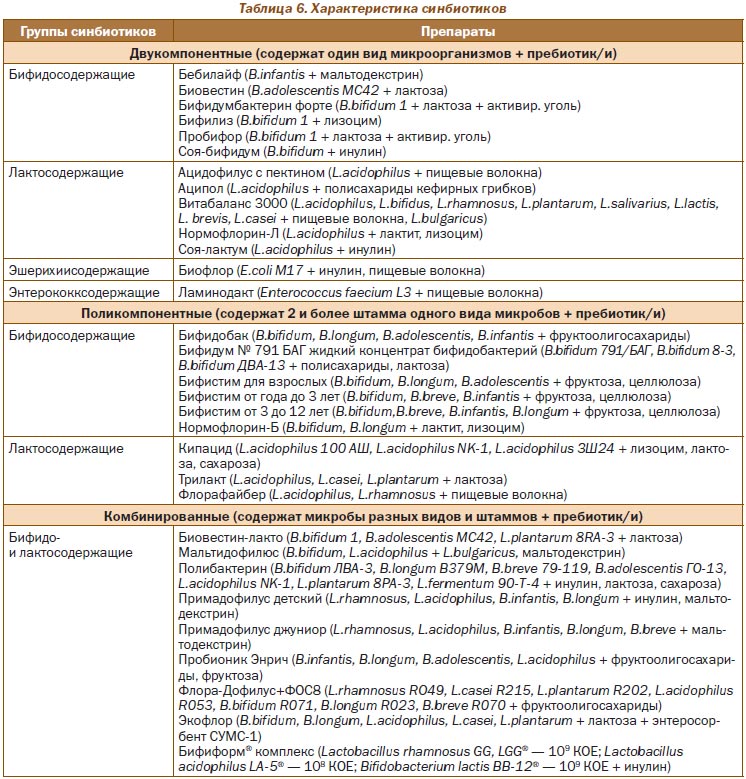 Фармакокинетические исследования документально подтвердили, что пробиотические штаммы, принимаемые перорально, могут выжить при прохождении через кишечный тракт со степенью выделения с фекалиями от <1% до 22%.48, 49 Эти фармакокинетические исследования были исключены из этого анализа, так как они не тестировали другие типы нормальной микробиоты, не обнаруженные в пробиотическом продукте.
Фармакокинетические исследования документально подтвердили, что пробиотические штаммы, принимаемые перорально, могут выжить при прохождении через кишечный тракт со степенью выделения с фекалиями от <1% до 22%.48, 49 Эти фармакокинетические исследования были исключены из этого анализа, так как они не тестировали другие типы нормальной микробиоты, не обнаруженные в пробиотическом продукте.
Включенные исследования
Из 63 включенных клинических испытаний пять испытаний включали несколько групп лечения, в результате чего в общей сложности было проанализировано 69 групп лечения. Engelbrektson и др. 50 тестировали смесь из пяти штаммов пробиотиков на добровольцах, подвергавшихся воздействию антибиотиков, а также тестировали смесь из четырех штаммов пробиотиков на здоровых добровольцах, не подвергавшихся воздействию антибиотиков.Zoppi и др. 51 использовали восемь различных групп лечения в своем исследовании, и в наш анализ были включены группы пробиотиков ( Saccharomyces boulardii, отдельно и Lactobacillus rhamnosus GG ), смесь двух пробиотиков ( L. acidophilus и Bifido bifidum ) и смесь трех пробиотических штаммов ( L. acidophilus, L. rhamnosus и B. bifidum ). Orrhage et al. 52 использовали две группы лечения ( Bifido longum только и смесь B.longum и L. acidophilus ). Ларсен и др. 53 тестировали два отдельных пробиотика ( B. lactis и L. acidophilus ) в разных группах лечения. Lidbeck et al. 54 давали либо эноксацин, либо клиндамицин и рандомизировали пациентов либо L. acidophilus , либо плацебо.
acidophilus и Bifido bifidum ) и смесь трех пробиотических штаммов ( L. acidophilus, L. rhamnosus и B. bifidum ). Orrhage et al. 52 использовали две группы лечения ( Bifido longum только и смесь B.longum и L. acidophilus ). Ларсен и др. 53 тестировали два отдельных пробиотика ( B. lactis и L. acidophilus ) в разных группах лечения. Lidbeck et al. 54 давали либо эноксацин, либо клиндамицин и рандомизировали пациентов либо L. acidophilus , либо плацебо.
Нормальные методы анализа микробиоты
Из 69 лечебных групп, в которых проводились нормальные анализы микробиоты, для профилирования микробиоты использовались различные методы.Во многих исследованиях использовались только стандартные микробиологические анализы культур (37, 54%), в то время как в других (28, 40%) использовались методы обнаружения некультивируемых бактериальных штаммов, которые включали метагеномные анализы (FISH, TRFLP, секвенирование 16 s рРНК) или другие ПЦР. техники. В некоторых исследованиях (4,6%) использовалась косвенная оценка нормальной микробиоты с использованием шкалы Ньюджента для диагностики бактериального вагиноза, которая основывается на окрашивании по Граму вагинальных выделений, pH влагалища и симптомах, чтобы определить, присутствует ли нормальная микробиота или нет.15
техники. В некоторых исследованиях (4,6%) использовалась косвенная оценка нормальной микробиоты с использованием шкалы Ньюджента для диагностики бактериального вагиноза, которая основывается на окрашивании по Граму вагинальных выделений, pH влагалища и симптомах, чтобы определить, присутствует ли нормальная микробиота или нет.15
Штаммы пробиотиков
В 69 группах лечения большинство (36, 52%) использовали один штамм пробиотика, в то время как 14 (20%) тестировали смесь двух пробиотических штаммов и 19 (28%) тестировали смесь трех или более пробиотических штаммов. Распределение пробиотиков одного штамма по сравнению с несколькими штаммами существенно не менялось в зависимости от модели исследования (= 2,3, p = 0,32). Из 15 групп реставрационного исследования (модель A) 47% использовали один штамм пробиотика и 53% использовали несколько штаммов. Из 25 групп лечения с нарушенной микробиотой на исходном уровне (модель B) 44% использовали один штамм и 56% использовали несколько штаммов. Из 29 групп исследования с неповрежденной микробиотой (модель C) 62% использовали один штамм и 38% использовали несколько штаммов.
Из 29 групп исследования с неповрежденной микробиотой (модель C) 62% использовали один штамм и 38% использовали несколько штаммов.
Модель восстановления нормальной микробиоты (модель A)
Было найдено только 10 исследований (с 15 группами лечения) с использованием модели А для определения восстановления микробиоты (таблица 1) .32, 34, 50–52, 54–58 Тип включенных участников варьировался от здоровых добровольцев до детей с нелеченными респираторные инфекции, педиатрическим больным раком. Для участников с острыми инфекциями или раком базовые анализы проводились перед разрушающим агентом (антибиотиками или химиотерапией).Число участников, получавших пробиотики, составляло в среднем 20 на исследование и варьировалось от 5 до 83. В 93% разрушающим фактором было воздействие антибиотиков, а в одном исследовании химиотерапия вызвала нарушение микробиоты. Только 8 (53%) групп исследования выполнили анализ в течение периода наблюдения 1-8 недель после прекращения приема пробиотика.
Таблица 1
Доказательные данные восстановления нормальной микробиоты (НМ) для 12 пробиотиков из 10 исследований (15 лечебных групп; модель A)
Анализ пробиотических штаммов по отдельности выявил только два пробиотических продукта в более чем одном рандомизированном контролируемом исследовании.Смесь пробиотиков L. acidophilus и B. bifidum показала полное восстановление в одном исследовании, но только частичное восстановление в другом (сила: сильная, качество: высокое). Пробиотическая смесь L. acidophilus (2 штамма) с B. bifidum и B. animalis показала полное восстановление в одном исследовании, но только частичное восстановление в другом (сила: сильная, качество: высокое). Пять других пробиотических продуктов только в одном подтверждающем клиническом испытании показали восстановление микробиоты ( B.longum , Clost. butyricum , L. acidophilus , смесь L. acidophilus с L. paracasei и B. lactis и смесь L. acidophilus с L. paracasei и B. bifidum и два штамма B. lactis ; Прочность: умеренная, Качество: высокое). Три пробиотических продукта с одним подтверждающим клиническим испытанием показали частичное восстановление ( S. boulardii , L. rhamnosus GG, смесь L.rhamnosus с L. bifidus и L. acidophilus ; Прочность: умеренная, Качество: высокое). Только два пробиотических продукта с использованием модели A не показали изменений в микробиоте ( B. breve и смесь L. acidophilus и B. longum ; сила: умеренная, качество: высокое). Таким образом, 10 из 12 (83%) пробиотических продуктов показали полное или частичное восстановление нормальной микробиоты.
lactis и смесь L. acidophilus с L. paracasei и B. bifidum и два штамма B. lactis ; Прочность: умеренная, Качество: высокое). Три пробиотических продукта с одним подтверждающим клиническим испытанием показали частичное восстановление ( S. boulardii , L. rhamnosus GG, смесь L.rhamnosus с L. bifidus и L. acidophilus ; Прочность: умеренная, Качество: высокое). Только два пробиотических продукта с использованием модели A не показали изменений в микробиоте ( B. breve и смесь L. acidophilus и B. longum ; сила: умеренная, качество: высокое). Таким образом, 10 из 12 (83%) пробиотических продуктов показали полное или частичное восстановление нормальной микробиоты.
Из 11 пробиотических продуктов с заявлением о «восстановлении или улучшении нормальной микробиоты» 10 (91%) были поддержаны этим обзором, но только семь показали полное восстановление, а пять — частичное восстановление микробиоты (таблица 1). Смесь L. acidophilus и B. longum не показала никаких изменений в микробиоте. Wada и др. 32 заявили, что B. breve «усилены кишечными анаэробами», но это сравнивалось только с группой плацебо. Их данные показали, что химиотерапия является разрушительным событием, приводящим к увеличению количества энтеробактерий в кишечнике в группе плацебо, но к концу 8-недельного периода наблюдения в группе пробиотика или плацебо не наблюдалось значительных различий по сравнению с исходной микробиотой. уровни.
Смесь L. acidophilus и B. longum не показала никаких изменений в микробиоте. Wada и др. 32 заявили, что B. breve «усилены кишечными анаэробами», но это сравнивалось только с группой плацебо. Их данные показали, что химиотерапия является разрушительным событием, приводящим к увеличению количества энтеробактерий в кишечнике в группе плацебо, но к концу 8-недельного периода наблюдения в группе пробиотика или плацебо не наблюдалось значительных различий по сравнению с исходной микробиотой. уровни.
Нарушение нормальной микробиоты при исходных исследованиях (модель B)
Двадцать четыре исследования (с 25 группами лечения) использовали модель B, в которую были включены участники с ранее существовавшей нарушенной микробиотой, связанной с текущим заболеванием или состояниями (таблица 2) .33, 53, 59–80 Среднее количество участников, получавших пробиотики, составляло 23 ± 16 / исследование и варьировались от 7 до 83 участников. Типы уже существующих факторов, нарушающих микробиоту, включали пациентов с атопическим дерматитом, аллергии, цирроз, бактериальный вагиноз, синдром раздраженного кишечника, воспалительные заболевания кишечника (язвенный колит и поучит), идиопатическую диарею, энтеральное питание, синдром короткой кишки и рак толстой кишки. .Только 10 (40%) исследуемых групп проводили анализ в течение периода последующего постпробиотического наблюдения.
.Только 10 (40%) исследуемых групп проводили анализ в течение периода последующего постпробиотического наблюдения.
Таблица 2
Доказательные данные по улучшению или изменению нормальной микробиоты (NM) в 18 пробиотиках из 24 исследований (25 групп лечения) с нарушенной микробиотой на исходном уровне (модель B)
Три пробиотика прошли несколько клинических испытаний, чтобы подтвердить утверждение об улучшении микробиоты за счет пробиотика. S. boulardii использовался в двух испытаниях либо с пациентами с энтеральным питанием, либо с пациентами с активной диареей и обнаружил улучшение привычной микробиоты у пациентов с активной диареей, 66 но продемонстрировал только косвенные доказательства изменений короткоцепочечных жирных кислот в Другое исследование65 (Сила: сильная, Качество: умеренное).Смесь из четырех пробиотических штаммов (2 штамма: L. rhamnosus , P. freudenreichii + B. breve ) показала улучшение микробиоты в двух клинических испытаниях74, 75 (сила: сильная, качество: умеренное). Из четырех клинических испытаний смеси семи пробиотических штаммов, два не показали значительных изменений в микробиоте, 77, 78 одно показало большее количество анаэробов при постпробиотической обработке79, а одно обнаружило уменьшение количества видов бактероидов80 (сила: сильная, качество: умеренная). В трех клинических испытаниях было установлено, что не было значительных изменений в связи с Lactobacillus plantarum 299v62–64 (сила: сильная, качество: умеренное).Из этих пробиотиков только одно подтверждающее клиническое испытание (сила: умеренная, качество: умеренное), два отдельных штамма пробиотиков ( E. coli, Nissle и L. casei rhamnosus ) и пять различных смесей пробиотических штаммов подтверждают утверждение, что пробиотик изменяет микробиоту (таблица 2). Таким образом, 10 из 18 (56%) пробиотических продуктов изменили или улучшили микробиоту у людей с ранее существовавшим заболеванием.
Из четырех клинических испытаний смеси семи пробиотических штаммов, два не показали значительных изменений в микробиоте, 77, 78 одно показало большее количество анаэробов при постпробиотической обработке79, а одно обнаружило уменьшение количества видов бактероидов80 (сила: сильная, качество: умеренная). В трех клинических испытаниях было установлено, что не было значительных изменений в связи с Lactobacillus plantarum 299v62–64 (сила: сильная, качество: умеренное).Из этих пробиотиков только одно подтверждающее клиническое испытание (сила: умеренная, качество: умеренное), два отдельных штамма пробиотиков ( E. coli, Nissle и L. casei rhamnosus ) и пять различных смесей пробиотических штаммов подтверждают утверждение, что пробиотик изменяет микробиоту (таблица 2). Таким образом, 10 из 18 (56%) пробиотических продуктов изменили или улучшили микробиоту у людей с ранее существовавшим заболеванием.
Из 25 лечебных групп утверждение статьи было подтверждено в 14 (56%) исследованиях. Не было значительного изменения микробиоты из-за пробиотика в девяти группах лечения и только изменение микробиоты в пяти других (таблица 2). Наш обзор не согласился с заявленными результатами в 11 (46%) других группах лечения. В семи группах лечения было заявлено, что тестируемый пробиотик «восстановил нормальную микробиоту», но неясно, как был сделан этот вывод, поскольку не было времени, когда нормальная неповрежденная микробиота присутствовала. Из семи исследований, в которых утверждалось, что пробиотики «восстановили» нормальную микробиоту, наш анализ показал, что ни одно из них не способно подтвердить восстановление, но в этих исследованиях подтверждено, что пробиотики улучшили или изменили микробиоту.В четырех исследованиях утверждалось, что пробиотик «изменил или улучшил» нормальную микробиоту, но в этом обзоре не было обнаружено значительных различий при сравнении постпробиотических и исходных анализов для групп пробиотиков. Girard-Pipau и др. 65 пришли к выводу, что S.
Не было значительного изменения микробиоты из-за пробиотика в девяти группах лечения и только изменение микробиоты в пяти других (таблица 2). Наш обзор не согласился с заявленными результатами в 11 (46%) других группах лечения. В семи группах лечения было заявлено, что тестируемый пробиотик «восстановил нормальную микробиоту», но неясно, как был сделан этот вывод, поскольку не было времени, когда нормальная неповрежденная микробиота присутствовала. Из семи исследований, в которых утверждалось, что пробиотики «восстановили» нормальную микробиоту, наш анализ показал, что ни одно из них не способно подтвердить восстановление, но в этих исследованиях подтверждено, что пробиотики улучшили или изменили микробиоту.В четырех исследованиях утверждалось, что пробиотик «изменил или улучшил» нормальную микробиоту, но в этом обзоре не было обнаружено значительных различий при сравнении постпробиотических и исходных анализов для групп пробиотиков. Girard-Pipau и др. 65 пришли к выводу, что S. boulardii «изменил нормальную флору», потому что в группе пробиотиков было обнаружено больше грамположительных анаэробов по сравнению с контрольной группой, а в группе наблюдалось увеличение трех короткоцепочечных жирных кислот. S. boulardii группа .Однако, когда анализ ограничивается тенденциями, наблюдаемыми только в группе пробиотиков, не наблюдалось значительных различий в профилях препробиотической и постпробиотической микробиоты. Вентури и др. 77 пришли к выводу, что смесь из семи пробиотических штаммов увеличивает концентрацию некоторых полезных штаммов в кишечнике. Однако единственными штаммами, у которых наблюдалось значительное увеличение, были штаммы, содержащиеся в смеси пробиотиков, а не конкретно нормальная микробиота хозяина. Поскольку это исследование не имело исходного уровня микробиоты, увеличенное количество лактобацилл и бифидобактерий могло не отражать их нормальные уровни.Van der Aa и др. 59 утверждали, что B. breve «успешно модулирует кишечную флору», но при сравнении исходных уровней с постпробиотическими уровнями не наблюдалось значительных изменений в группе пробиотиков.
boulardii «изменил нормальную флору», потому что в группе пробиотиков было обнаружено больше грамположительных анаэробов по сравнению с контрольной группой, а в группе наблюдалось увеличение трех короткоцепочечных жирных кислот. S. boulardii группа .Однако, когда анализ ограничивается тенденциями, наблюдаемыми только в группе пробиотиков, не наблюдалось значительных различий в профилях препробиотической и постпробиотической микробиоты. Вентури и др. 77 пришли к выводу, что смесь из семи пробиотических штаммов увеличивает концентрацию некоторых полезных штаммов в кишечнике. Однако единственными штаммами, у которых наблюдалось значительное увеличение, были штаммы, содержащиеся в смеси пробиотиков, а не конкретно нормальная микробиота хозяина. Поскольку это исследование не имело исходного уровня микробиоты, увеличенное количество лактобацилл и бифидобактерий могло не отражать их нормальные уровни.Van der Aa и др. 59 утверждали, что B. breve «успешно модулирует кишечную флору», но при сравнении исходных уровней с постпробиотическими уровнями не наблюдалось значительных изменений в группе пробиотиков. Odamaki и др. 33 действительно показали увеличение Faecalibacterium spp и Bacteroides fragilis spp в конце лечения B. longum BB536, но такое же увеличение наблюдалось и в группе плацебо.
Odamaki и др. 33 действительно показали увеличение Faecalibacterium spp и Bacteroides fragilis spp в конце лечения B. longum BB536, но такое же увеличение наблюдалось и в группе плацебо.
Непрерывные исследования нормальной микробиоты (модель C)
В 29 испытаний были включены здоровые взрослые люди, у которых во время исследования не присутствовал деструктивный фактор (отсутствие антибиотиков, отсутствие лекарственного воздействия или наличие острого или хронического заболевания), которые могли бы повлиять на нормальную микробиоту, как показано в таблице 3.14, 49, 50, 81–106. Среднее количество участников, получавших пробиотики, составляло 23 человека в исследовании и варьировалось от 7 до 160 человек в исследовании. Из 29 групп исследования анализы проводились в течение периода наблюдения только в 52%. Fujiwara и др. 84 культивировали семь здоровых добровольцев и обнаружили энтеробактерии и Clostridial видов после B. longum было снижено на 10 1 / г по сравнению с исходным уровнем (p <0,03), но никаких других изменений в микробиоте не произошло. были обнаружены. Karlsson et al 94 обнаружили значительное увеличение кишечного разнообразия у девяти добровольцев мужского пола с атеросклерозом, получавших L.plantarum 299v, но поскольку тесты полиморфизма длины концевых рестрикционных фрагментов использовались вместо культур для видов бактерий, специфические изменения в видах микробиоты не могли быть определены. Ян и Шеу культивировали 63 ребенка (55% с Helicobacter pylori ), которым давали йогурт с L. acidophilus и B. lactis , но обнаружили только снижение количества E. coli в H.pylori отрицательных в подгруппе детей, существенных изменений нормальной микробиоты у H.pylori — положительные дети. 100 Кубота и др. 103 обследовали 29 участников с аллергией на пыльцу японского кедра и обнаружили, что молоко, ферментированное с помощью L.
longum было снижено на 10 1 / г по сравнению с исходным уровнем (p <0,03), но никаких других изменений в микробиоте не произошло. были обнаружены. Karlsson et al 94 обнаружили значительное увеличение кишечного разнообразия у девяти добровольцев мужского пола с атеросклерозом, получавших L.plantarum 299v, но поскольку тесты полиморфизма длины концевых рестрикционных фрагментов использовались вместо культур для видов бактерий, специфические изменения в видах микробиоты не могли быть определены. Ян и Шеу культивировали 63 ребенка (55% с Helicobacter pylori ), которым давали йогурт с L. acidophilus и B. lactis , но обнаружили только снижение количества E. coli в H.pylori отрицательных в подгруппе детей, существенных изменений нормальной микробиоты у H.pylori — положительные дети. 100 Кубота и др. 103 обследовали 29 участников с аллергией на пыльцу японского кедра и обнаружили, что молоко, ферментированное с помощью L. rhamnosus GG и L. gasseri TMC0356, подавляло изменения микробиоты (меньше изменений кишечного профиля), но не удалось определить изменения конкретных видов бактерий из-за типа используемого анализа (FISH и TRFLP) .103 Таким образом, только 4 из 19 (21%) пробиотических продуктов изменили микробиоту у здоровых людей, у которых не было разрушительного события.
rhamnosus GG и L. gasseri TMC0356, подавляло изменения микробиоты (меньше изменений кишечного профиля), но не удалось определить изменения конкретных видов бактерий из-за типа используемого анализа (FISH и TRFLP) .103 Таким образом, только 4 из 19 (21%) пробиотических продуктов изменили микробиоту у здоровых людей, у которых не было разрушительного события.
Таблица 3
Модель C: Доказательные данные об улучшении или изменении нормальной микробиоты (NM) в 19 пробиотиках у здоровых добровольцев, включенных в 29 исследований (29 лечебных групп) в исследованиях без разрушительного воздействия
Из семи исследований, в которых утверждалось, что их пробиотики «восстанавливают или изменяют» нормальную микробиоту, только четыре утверждения были подтверждены. Сьерра и др. 96 заявили, что Lactobacillus salivarius дали 20 здоровым взрослым «улучшенная микробиота кишечника», но были обнаружены только повышенные уровни Lactobacilli и никаких других изменений у нормальных видов микробиоты обнаружено не было. Единственное другое свидетельство было косвенным из наблюдаемых изменений иммунных параметров. He и др. 99 заявили о смеси B. longum и B. animalis «модифицированной» микробиоты, но изменения наблюдались только во время приема йогурта, а не после периода наблюдения в течение 1 недели. Витали и др. 14 утверждали, что смесь из четырех штаммов лактобактерий и трех штаммов бифидобактерий «модулировала вагинальную микробиоту», но единственные существенные изменения были связаны с увеличением видов бактерий, содержащихся в смеси пробиотиков.
Единственное другое свидетельство было косвенным из наблюдаемых изменений иммунных параметров. He и др. 99 заявили о смеси B. longum и B. animalis «модифицированной» микробиоты, но изменения наблюдались только во время приема йогурта, а не после периода наблюдения в течение 1 недели. Витали и др. 14 утверждали, что смесь из четырех штаммов лактобактерий и трех штаммов бифидобактерий «модулировала вагинальную микробиоту», но единственные существенные изменения были связаны с увеличением видов бактерий, содержащихся в смеси пробиотиков.
Из пробиотиков, подтвержденных многочисленными клиническими испытаниями ( B. animalis , B. longum , L. casei , L. plantarum 299v, смесь B. animalis и B. lactis ), 13 испытаний (87%) подтверждают, что нет значительных изменений в нормальной микробиоте, если микробиота не нарушена (сила: сильная, качество: низкое).
Ассоциация клинической эффективности и восстановления нормальной микробиоты
В нескольких исследованиях одновременно сравнивалась клиническая эффективность и способность восстанавливать или улучшать нормальную микробиоту после дисбактериоза. Был проведен синтез литературы по РКИ по восьми распространенным показаниям болезни и оценена общая сила сети. Эффективность пробиотиков, способных восстанавливать нормальную микробиоту, часто подтверждалась РКИ, как показано в таблице 4. Из 10 пробиотиков с доказательствами восстановления 7 (70%) также прошли по крайней мере одно рандомизированное испытание по крайней мере для одного из восьми. болезней, в то время как 30% не имели поддерживающих РКИ по эффективности. Из семи пробиотиков, включенных в ассоциированные РКИ, только два пробиотика ( S.boulardii и L. acidophilus ) имеют убедительные доказательства эффективности при большинстве показаний к заболеваниям, тогда как пять пробиотиков, способных восстанавливать микробиоту, имели слабые доказательства эффективности или отсутствовали. Например, S. boulardii , у которого есть исследования, поддерживающие восстановление, имеет убедительные доказательства клинической эффективности для AAD (рейтинг ++: 11 РКИ имели значимые результаты, а 6 имели незначительные результаты), CDI (рейтинг ++: было два РКИ со значительными результатами.
Был проведен синтез литературы по РКИ по восьми распространенным показаниям болезни и оценена общая сила сети. Эффективность пробиотиков, способных восстанавливать нормальную микробиоту, часто подтверждалась РКИ, как показано в таблице 4. Из 10 пробиотиков с доказательствами восстановления 7 (70%) также прошли по крайней мере одно рандомизированное испытание по крайней мере для одного из восьми. болезней, в то время как 30% не имели поддерживающих РКИ по эффективности. Из семи пробиотиков, включенных в ассоциированные РКИ, только два пробиотика ( S.boulardii и L. acidophilus ) имеют убедительные доказательства эффективности при большинстве показаний к заболеваниям, тогда как пять пробиотиков, способных восстанавливать микробиоту, имели слабые доказательства эффективности или отсутствовали. Например, S. boulardii , у которого есть исследования, поддерживающие восстановление, имеет убедительные доказательства клинической эффективности для AAD (рейтинг ++: 11 РКИ имели значимые результаты, а 6 имели незначительные результаты), CDI (рейтинг ++: было два РКИ со значительными результатами. ), IBD (с рейтингом ++: было два РКИ со значительными результатами), IBS (с рейтингом 0: было одно РКИ со значительной эффективностью и одно РКИ с незначительными результатами), TD (с рейтингом +: 3 РКИ со значительной эффективностью и 2 с незначительными эффективность), H.pylori (ранжирование: 2 РКИ со значительными результатами и 4 с незначительными результатами) и отсутствие исследований по BV. L. acidophilus , который частично восстановил микробиоту в исследовании, связан с клинической эффективностью в отношении AAD, IBS и BV, но не в отношении TD или ликвидации H. pylori и лечения острой детской диареи (рейтинг ++: имел 19 РКИ со значительной защитой и пять с незначительными результатами). Напротив, L. rhamnosus GG, другой пробиотик, способный восстанавливать микробиоту, часто упоминается в метаанализе как имеющий значительную эффективность в отношении AAD.Наши результаты обновленного обзора литературы указывают на чистую слабую оценку клинической эффективности по всем показаниям болезни: AAD (оценено -: 3 РКИ имели значимые результаты, а 6 — незначительные результаты), CDI (оценено -: два РКИ с несущественные результаты), IBD (ранг -: одно РКИ с несущественными результатами), IBS (оценка 0: 2 РКИ со значительной эффективностью и два РКИ с незначительными результатами), TD (ранг 0: одно РКИ со значительной эффективностью и один с незначительной эффективностью), H.
), IBD (с рейтингом ++: было два РКИ со значительными результатами), IBS (с рейтингом 0: было одно РКИ со значительной эффективностью и одно РКИ с незначительными результатами), TD (с рейтингом +: 3 РКИ со значительной эффективностью и 2 с незначительными эффективность), H.pylori (ранжирование: 2 РКИ со значительными результатами и 4 с незначительными результатами) и отсутствие исследований по BV. L. acidophilus , который частично восстановил микробиоту в исследовании, связан с клинической эффективностью в отношении AAD, IBS и BV, но не в отношении TD или ликвидации H. pylori и лечения острой детской диареи (рейтинг ++: имел 19 РКИ со значительной защитой и пять с незначительными результатами). Напротив, L. rhamnosus GG, другой пробиотик, способный восстанавливать микробиоту, часто упоминается в метаанализе как имеющий значительную эффективность в отношении AAD.Наши результаты обновленного обзора литературы указывают на чистую слабую оценку клинической эффективности по всем показаниям болезни: AAD (оценено -: 3 РКИ имели значимые результаты, а 6 — незначительные результаты), CDI (оценено -: два РКИ с несущественные результаты), IBD (ранг -: одно РКИ с несущественными результатами), IBS (оценка 0: 2 РКИ со значительной эффективностью и два РКИ с незначительными результатами), TD (ранг 0: одно РКИ со значительной эффективностью и один с незначительной эффективностью), H. pylori (рейтинг -: 3 РКИ с незначительными результатами), отсутствие РКИ по БВ и лечению острой детской диареи (рейтинг ++: 10 РКИ со значительной эффективностью и одно с незначительными результатами).
pylori (рейтинг -: 3 РКИ с незначительными результатами), отсутствие РКИ по БВ и лечению острой детской диареи (рейтинг ++: 10 РКИ со значительной эффективностью и одно с незначительными результатами).
Таблица 4
Сравнение способности пробиотика восстанавливать или улучшать дисбактериоз с ранжированной клинической эффективностью при различных показаниях
Испытания эффективности не проводились так часто для пробиотиков, которые, как было показано, обладают способностью только изменять или улучшать, но не восстанавливать микробиоту после дисбиоза.Из девяти пробиотиков, которые могут изменять микробиоту, 6 (67%) имели поддерживающие РКИ по крайней мере для одного заболевания, но разнообразие исследованных заболеваний было более ограниченным. L. casei имел умеренную чистую силу для AAD и бактериального вагиноза, но был нейтральным для способности уничтожить H. pylori и другие показания к болезни не тестировались в РКИ с L. casei . Пробиотическая смесь L. reuteri и L. fermentum имеет убедительные доказательства бактериального вагиноза, но не имеет никаких других показаний к болезни, перечисленных в таблице 4.
reuteri и L. fermentum имеет убедительные доказательства бактериального вагиноза, но не имеет никаких других показаний к болезни, перечисленных в таблице 4.
Из восьми пробиотиков, не способных изменять или восстанавливать нормальную микробиоту, только L. plantarum 299v имели РКИ на ААД и СРК, оба с чистой отрицательной или слабой клинической эффективностью. B. lactis и смесь L. rhamnosus и L. reuteri имели чистую нейтральную оценку эффективности для лечения острой детской диареи. Для других четырех пробиотических продуктов, не влияющих на нормальную микробиоту, не было РКИ клинической эффективности.В исследованиях с использованием Bacillus clausii не проводился анализ на нормальную микробиоту, и были получены несущественные результаты испытаний для эрадикации H. pylori и лечения детской диареи.
Из шести пробиотиков с данными только о фармакокинетике самого пробиотика и без других исследований других нормальных штаммов микробиоты, пять имели РКИ, показывающие различную чистую эффективность при различных показаниях к болезни, как показано в таблице 4.
Шесть популярных пробиотиков ( B.clausii , B. infantis , L. reuteri , L. acidophilus + L. helveticus , L. acidophilus + L. casei и L. acidophilus + B. animalis ) имеют только РКИ клинической эффективности, но не опубликовали исследования, посвященные их роли в восстановлении или улучшении нормальной микробиоты.
Обсуждение
Разработка и оценка заявлений о полезности или функциональности пробиотиков является важной проблемой и в настоящее время определена как приоритетная для исследований несколькими международными организациями, включая Всемирную гастроэнтерологическую организацию107 и Американское общество питания.2 Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США борется с обоснованными утверждениями о пользе для здоровья пробиотических продуктов и в настоящее время рекомендует использовать утверждения о структуре / функции, такие как «поддерживает регулярность кишечника», но требование о восстановлении нормальной микробиоты все еще обсуждается. 108 Европейское агентство по безопасности пищевых продуктов (EFSA) предоставляет руководящие материалы, которые рекомендуют, чтобы заявления о здоровье или функциональности пробиотиков имели положительный физиологический эффект и имели соответствующие научные исследования для подтверждения заявлений о здоровье.3 Приемлемые утверждения о здоровье кишечника могут включать функциональные утверждения (улучшенное время прохождения, более мягкая консистенция стула, уменьшение желудочно-кишечного дискомфорта, защита от патогенов). Поскольку в настоящее время невозможно определить стандартный профиль нормальной микробиоты, EFSA рекомендует, чтобы функциональные заявления о восстановлении нормальной микробиоты документировали восстановление здоровой микробиоты и сопровождались благоприятным физиологическим или клиническим результатом3. Кроме того, поскольку эффективность и механизмы зависят от штамма и могут варьироваться в зависимости от штамма пробиотика, данные должны анализироваться для каждого пробиотического продукта индивидуально.
108 Европейское агентство по безопасности пищевых продуктов (EFSA) предоставляет руководящие материалы, которые рекомендуют, чтобы заявления о здоровье или функциональности пробиотиков имели положительный физиологический эффект и имели соответствующие научные исследования для подтверждения заявлений о здоровье.3 Приемлемые утверждения о здоровье кишечника могут включать функциональные утверждения (улучшенное время прохождения, более мягкая консистенция стула, уменьшение желудочно-кишечного дискомфорта, защита от патогенов). Поскольку в настоящее время невозможно определить стандартный профиль нормальной микробиоты, EFSA рекомендует, чтобы функциональные заявления о восстановлении нормальной микробиоты документировали восстановление здоровой микробиоты и сопровождались благоприятным физиологическим или клиническим результатом3. Кроме того, поскольку эффективность и механизмы зависят от штамма и могут варьироваться в зависимости от штамма пробиотика, данные должны анализироваться для каждого пробиотического продукта индивидуально. 5, 6, 9, 109 — 112
5, 6, 9, 109 — 112
Недооцененным открытием было влияние дизайна исследования и исследуемых групп на интерпретацию результатов исследования. В литературе обычно встречаются пять различных типов дизайна исследований, касающихся пробиотиков. Наиболее распространенным типом исследования является рандомизированное контролируемое исследование, в котором проверяются результаты эффективности и безопасности у пациентов, но в этих исследованиях обычно не документировалось влияние пробиотика на нормальную микробиоту. Вторым наиболее распространенным типом дизайна исследования являются фармакокинетические исследования (документирование восстановления пероральной дозы пробиотика или увеличения пробиотических штаммов после лечения по сравнению с предварительной обработкой или клиренсом пробиотика).Несмотря на то, что в этих кинетических исследованиях не проводился анализ на штаммы, не являющиеся пробиотиками, некоторые экстраполировали их результаты и пришли к выводу, что их пробиотики наблюдали некоторый эффект или улучшение нормальной микробиоты. 19, 111 Эти два первых типа исследований не поддерживают доказательную базу выводы о восстановлении или изменении нормальной микробиоты и были исключены из этого обзора.
19, 111 Эти два первых типа исследований не поддерживают доказательную базу выводы о восстановлении или изменении нормальной микробиоты и были исключены из этого обзора.
Для изучения дисбактериоза подходят три типа исследований. В первом типе исследования нормальная микробиота анализировалась как минимум дважды (на исходном уровне, то есть до воздействия разрушительного события или пробиотиков, а затем еще раз во время или после лечения пробиотиками), чтобы продемонстрировать фактическое восстановление исследуемой нормальной микробиоты до здоровых исходных уровней.Второй тип дизайна исследования начался с неподходящих исходных условий (исходные образцы, взятые после того, как нормальная микробиота была нарушена хроническим заболеванием). Для пациентов с установленными хроническими заболеваниями нет исходного уровня «нормальной микробиоты» ни в группе пробиотиков, ни в контрольной группе. Даже если исходные данные взяты во время ремиссии, на микробиоту все еще могут влиять хронические заболевания или острая диарея. Исследования пробиотиков при хронических заболеваниях или острых заболеваниях обычно сообщают о «пре-пробиотическом лечении» и «пост-пробиотическом лечении» и могут показывать значительные изменения в микробных видах, но неясно, отражает ли это истинное восстановление нормальных профилей микробиоты. .В исследование третьего типа были включены здоровые добровольцы, которым не вводили антибиотики (так что нормального нарушения микробиоты не происходило), и они демонстрировали только влияние пробиотиков на здоровую микробиоту (как правило, слабые или нулевые эффекты). Контрольные группы не требовались для нашей оценки воздействия пробиотиков на микробиоту, но контрольные группы могут задокументировать степень нарушения нормальной микробиоты провоцирующими агентами (антибиотиками, началом болезни и т. Д.).
Исследования пробиотиков при хронических заболеваниях или острых заболеваниях обычно сообщают о «пре-пробиотическом лечении» и «пост-пробиотическом лечении» и могут показывать значительные изменения в микробных видах, но неясно, отражает ли это истинное восстановление нормальных профилей микробиоты. .В исследование третьего типа были включены здоровые добровольцы, которым не вводили антибиотики (так что нормального нарушения микробиоты не происходило), и они демонстрировали только влияние пробиотиков на здоровую микробиоту (как правило, слабые или нулевые эффекты). Контрольные группы не требовались для нашей оценки воздействия пробиотиков на микробиоту, но контрольные группы могут задокументировать степень нарушения нормальной микробиоты провоцирующими агентами (антибиотиками, началом болезни и т. Д.).
Пять пробиотиков с одним штаммом ( B.longum , Clost. butyricum , L. acidophilus, L. rhamnosus и S. boulardii ) и пять пробиотических смесей (( L. acidophilus + B. bifidum) , ( L. rhamnosus + L. bifidus + L. acidophilus) , ( L. acidophilus + L. paracasei + B. lactis), (L. acidophilus , 2 штамма, B. bifidum, B. animalis) и (L . acidophilus + L. paracasei + B. bifidum + 2 штамма B.lactis )) задокументировано полное или частичное восстановление нормальной микробиоты (модель A). Только две смеси пробиотиков ((смесь двух штаммов: L. acidophilus + B. bifidum ) и (смесь четырех штаммов: L. acidophilus , 2 штамма, B. bifidum, B. animalis )) были поддержаны подтверждающее исследование. Доказательства того, что пробиотики могут изменять или улучшать нормальную микробиоту (модель B), были обнаружены для трех пробиотиков одного штамма ( E. coli Nissle, S. boulardii и L.casei rhamnosus ) и семь смесей из 2-7 пробиотических штаммов. Из этих 10 пробиотиков, обнаруживших изменение микробиоты, только три прошли несколько испытаний: S.
acidophilus + B. bifidum) , ( L. rhamnosus + L. bifidus + L. acidophilus) , ( L. acidophilus + L. paracasei + B. lactis), (L. acidophilus , 2 штамма, B. bifidum, B. animalis) и (L . acidophilus + L. paracasei + B. bifidum + 2 штамма B.lactis )) задокументировано полное или частичное восстановление нормальной микробиоты (модель A). Только две смеси пробиотиков ((смесь двух штаммов: L. acidophilus + B. bifidum ) и (смесь четырех штаммов: L. acidophilus , 2 штамма, B. bifidum, B. animalis )) были поддержаны подтверждающее исследование. Доказательства того, что пробиотики могут изменять или улучшать нормальную микробиоту (модель B), были обнаружены для трех пробиотиков одного штамма ( E. coli Nissle, S. boulardii и L.casei rhamnosus ) и семь смесей из 2-7 пробиотических штаммов. Из этих 10 пробиотиков, обнаруживших изменение микробиоты, только три прошли несколько испытаний: S. boulardii , смесь из четырех штаммов (2 штамма L. rhamnosus + P. Freudenreichii + B. breve ) и смесь из семи штаммов. (4 лактобациллы и 3 штамма бифидобактерий), но только у одного были стабильные результаты, свидетельствующие об улучшении микробиоты.74, 75 Очевидно, что для подтверждения воздействия пробиотика на нормальную микробиоту необходимо более одного исследования.Из 19 пробиотических штаммов (или смесей), изученных на здоровых добровольцах, которые не подвергались воздействию разрушающих факторов (модель C), никаких изменений в нормальной микробиоте не наблюдалось для 79%, что указывает на устойчивость микробиоты.
boulardii , смесь из четырех штаммов (2 штамма L. rhamnosus + P. Freudenreichii + B. breve ) и смесь из семи штаммов. (4 лактобациллы и 3 штамма бифидобактерий), но только у одного были стабильные результаты, свидетельствующие об улучшении микробиоты.74, 75 Очевидно, что для подтверждения воздействия пробиотика на нормальную микробиоту необходимо более одного исследования.Из 19 пробиотических штаммов (или смесей), изученных на здоровых добровольцах, которые не подвергались воздействию разрушающих факторов (модель C), никаких изменений в нормальной микробиоте не наблюдалось для 79%, что указывает на устойчивость микробиоты.
Улучшение нормальной микробиоты за счет определенных штаммов пробиотиков, по-видимому, было связано с лучшими клиническими конечными точками. В рамках восьми распространенных заболеваний, обычно лечатся пробиотиками, большее количество испытаний со значительной эффективностью было связано с пробиотическими штаммами, восстанавливающими нормальную микробиоту, и только одно испытание со значительной эффективностью было найдено для пробиотиков, которые не меняли микробиоту. Однако немногие пробиотики прошли испытания на эффективность при всех восьми заболеваниях, а многие не имели испытаний на эффективность.
Однако немногие пробиотики прошли испытания на эффективность при всех восьми заболеваниях, а многие не имели испытаний на эффективность.
Для некоторых пробиотиков, эффективность которых при различных заболеваниях была опубликована, не было исследований, изучающих влияние пробиотика на нормальную микробиоту: B. clausii , B. infantis , L. brevis , L. reuteri , смесь двух штаммов ( L. acidophilus + L. helveticus ), смесь двух штаммов ( L. acidophilus + L.casei ) или ( L. acidophilus + B. animalis ), смесь четырех штаммов ( L. rhamnosus (два штамма), P. freudenreichii + B. animalis )) и смесь семи штаммы ( L. sporogens, L. bifidum, L. bulgaricus, L. thermophilus, L. acidophilus, L. casei, L. rhamnosus) .
Сравнение результатов с другими исследованиями
Другие обзоры в литературе заявлений о пробиотиках, связанных с изменениями в нормальной микробиоте, были сосредоточены на широких вопросах нормативной стандартизации заявлений о здоровье или функциях, использовании надлежащего дизайна исследований и задаче определения биомаркеров для «здоровой микробиоты». .3, 29, 112 Донован и др. 2 рекомендует, чтобы заявления о пользе пробиотиков для здоровья подтверждались хорошо проведенными испытаниями на людях в целевой группе населения. Эти обзоры также рекомендуют коррелировать биомаркеры кишечника с клиническими конечными точками, однако ни один из этих обзоров не пытался этого сделать.29, 112 В предыдущих обзорах не предпринимались попытки проанализировать связь между штаммами пробиотиков и их влиянием на нормальную микробиоту путем стратификации по качество дизайна исследования.111 В этом обзоре эти проблемы были устранены путем анализа штаммов пробиотиков по качеству дизайна исследования и включения только испытаний, в которых оценивалась нормальная микробиота (либо с помощью микробного культивирования, либо с помощью биомаркеров молекулярных штаммов) и оценивалась степень улучшения дисбиоза с помощью клинических результаты для каждого пробиотического штамма.
.3, 29, 112 Донован и др. 2 рекомендует, чтобы заявления о пользе пробиотиков для здоровья подтверждались хорошо проведенными испытаниями на людях в целевой группе населения. Эти обзоры также рекомендуют коррелировать биомаркеры кишечника с клиническими конечными точками, однако ни один из этих обзоров не пытался этого сделать.29, 112 В предыдущих обзорах не предпринимались попытки проанализировать связь между штаммами пробиотиков и их влиянием на нормальную микробиоту путем стратификации по качество дизайна исследования.111 В этом обзоре эти проблемы были устранены путем анализа штаммов пробиотиков по качеству дизайна исследования и включения только испытаний, в которых оценивалась нормальная микробиота (либо с помощью микробного культивирования, либо с помощью биомаркеров молекулярных штаммов) и оценивалась степень улучшения дисбиоза с помощью клинических результаты для каждого пробиотического штамма.
Возможности для будущих исследований
В большинстве исследований (80%) с использованием модели А для документирования восстановления нормальной микробиоты использовались только методы микробиологического культивирования, которые позволяют обнаруживать только те организмы, которые растут в культуре. Использование более совершенных молекулярных метагеномных методов показало, что одно культивирование пропускает до 95% этих организмов.21, 22 Использование метагеномных методов было более распространено в исследованиях с использованием модели B (48%) и модели C (45%). ) планы исследований, которые направлены только на возможное изменение микробиоты.Характеристика микробиоты — сложный вопрос, и всесторонний учет всех бактериальных и грибковых штаммов в организме выходит за рамки наших текущих возможностей. Следовательно, любые исследования изменений микробиоты в лучшем случае неполны, но общие тенденции в бактериальных филотипах могут быть задокументированы с помощью ДНК-зондов и метагеномных методов. Ошибка дифференциального обнаружения может присутствовать из-за разнообразия анализов, используемых в этих исследованиях, и ее следует учитывать в будущих исследованиях.
Использование более совершенных молекулярных метагеномных методов показало, что одно культивирование пропускает до 95% этих организмов.21, 22 Использование метагеномных методов было более распространено в исследованиях с использованием модели B (48%) и модели C (45%). ) планы исследований, которые направлены только на возможное изменение микробиоты.Характеристика микробиоты — сложный вопрос, и всесторонний учет всех бактериальных и грибковых штаммов в организме выходит за рамки наших текущих возможностей. Следовательно, любые исследования изменений микробиоты в лучшем случае неполны, но общие тенденции в бактериальных филотипах могут быть задокументированы с помощью ДНК-зондов и метагеномных методов. Ошибка дифференциального обнаружения может присутствовать из-за разнообразия анализов, используемых в этих исследованиях, и ее следует учитывать в будущих исследованиях.
Еще одно предложение для будущих исследований состоит в том, чтобы включить постпробиотический период в соответствующий период наблюдения. Менее половины рассмотренных исследований проводили анализы на нормальную микробиоту в течение соответствующего периода наблюдения. Как было показано, восстановление от разрушающего фактора может быть продлено (обычно 8 недель) 7, 8, и исследования, которые не смогли обнаружить восстановление микробиоты, могли обнаружить возврат к нормальным исходным уровням, если для восстановления было уделено достаточно долгое время. произошло. В будущих исследованиях должно быть предусмотрено время для восстановления нормальной микробиоты.
Менее половины рассмотренных исследований проводили анализы на нормальную микробиоту в течение соответствующего периода наблюдения. Как было показано, восстановление от разрушающего фактора может быть продлено (обычно 8 недель) 7, 8, и исследования, которые не смогли обнаружить восстановление микробиоты, могли обнаружить возврат к нормальным исходным уровням, если для восстановления было уделено достаточно долгое время. произошло. В будущих исследованиях должно быть предусмотрено время для восстановления нормальной микробиоты.
Поскольку действие пробиотиков зависит от штамма, и во многих исследованиях обычно указывается только род и вид протестированного пробиотика, будущие отчеты должны включать полное описание пробиотика до уровня окрашивания.5, 112
Сильные и слабые стороны
Сильные стороны этого обзора включали полноту стратегии поиска, которая проверяла несколько баз данных цитирования, реестры испытаний и поиск авторов, использование установленных протоколов PRISMA для обзоров и использование схемы классификации результатов для различных степеней оценки микробного восстановления. Этот анализ контролировал смешанные эффекты различных исследуемых популяций и дизайнов исследований, представленных в литературе.Были исключены фармакокинетические исследования только самого пробиотического штамма (ов), и были включены только испытания, в которых анализировали другие виды, обнаруженные в микробиоте. Применяя стандартное определение для «восстановления» и «улучшения» нормальной микробиоты, можно различать существенные различия по типу используемых дизайнов исследований и различным эффектам различных штаммов пробиотиков. Ограничения этого обзора включают: один автор проанализировал и извлек литературу, объединил испытания, проведенные в разных популяциях (взрослые и педиатрические), а также использовались разные дозы и схемы пробиотиков.Неполный поиск всех исследований, оценивающих влияние пробиотиков на микробиоту человека, также является потенциальным ограничением любого поиска в литературе. Другое ограничение заключается в том, что улучшение дисбактериоза и клиническая эффективность пробиотических штаммов также косвенно связаны, прямая причинно-следственная связь с типами проведенных исследований невозможна.
Этот анализ контролировал смешанные эффекты различных исследуемых популяций и дизайнов исследований, представленных в литературе.Были исключены фармакокинетические исследования только самого пробиотического штамма (ов), и были включены только испытания, в которых анализировали другие виды, обнаруженные в микробиоте. Применяя стандартное определение для «восстановления» и «улучшения» нормальной микробиоты, можно различать существенные различия по типу используемых дизайнов исследований и различным эффектам различных штаммов пробиотиков. Ограничения этого обзора включают: один автор проанализировал и извлек литературу, объединил испытания, проведенные в разных популяциях (взрослые и педиатрические), а также использовались разные дозы и схемы пробиотиков.Неполный поиск всех исследований, оценивающих влияние пробиотиков на микробиоту человека, также является потенциальным ограничением любого поиска в литературе. Другое ограничение заключается в том, что улучшение дисбактериоза и клиническая эффективность пробиотических штаммов также косвенно связаны, прямая причинно-следственная связь с типами проведенных исследований невозможна. Еще одно ограничение — отсутствие в настоящее время стандартного определения того, что составляет «нормальную микробиоту». Состав микробиоты зависит от человека, возраста, географического положения и состояния здоровья хозяина.Современные микробиологические методы улучшаются, но не могут обнаружить все виды, присутствующие в организме хозяина.
Еще одно ограничение — отсутствие в настоящее время стандартного определения того, что составляет «нормальную микробиоту». Состав микробиоты зависит от человека, возраста, географического положения и состояния здоровья хозяина.Современные микробиологические методы улучшаются, но не могут обнаружить все виды, присутствующие в организме хозяина.
(PDF) Сохраняющиеся изменения микробиоты кишечника после промывания кишечника и колоноскопии
нескольких европейских младенцев имели низкую частоту
Enterobacteriaceae из-за современного западного и
гигиенического образа жизни. Во всех образцах, проанализированных через 1 месяц после колоноскопии
, мы также обнаружили, что Streptococcaceae
были значительно выше по сравнению с образцами, взятыми перед очисткой кишечника.Семейство Streptococcaceae
положительно связано с продукцией фекальных
протеаз, которые участвуют в нескольких физиологических механизмах
, таких как прогрессия клеточного цикла, пролиферация и гибель клеток, коагуляция, ремоделирование тканей,
иммунный ответ и репликация ДНК [23–25].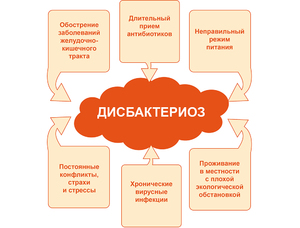 Несколько исследований
Несколько исследований
сообщили о связи между высокими уровнями фекальных протеаз
и развитием ВЗК у лиц
, генетически предрасположенных к развитию патологии
[26–29].Более того, высокие уровни протеаз в кале увеличивают воспаление кишечника, повышают проницаемость для кишечника. Протеазы действительно могут разрушать
барьеров слизистой оболочки, модулируя иммунный ответ хозяина
и обеспечивая метаболическое преимущество для бактерий.
Кроме того, высокая распространенность протеаз у нескольких
патогенных бактерий усиливает гипотезу о том, что эти
ферментов могут играть ключевую роль в патологических процессах
, вредных для здоровья человека [29].
Сразу после очищения кишечника микробиота кишечника была менее богата
Lactobacillaceae, и это уменьшение количества бактерий было основным —
даже через 1 месяц после колоноскопии. Lactobacilli
являются основными бактериальными родами среди семейства Lactobacillaceae
, и потеря лактобацилл может отрицательно сказаться на установлении иммунной толерантности
и развитии иммунной системы
[30]. В отличие от патогенных бактерий
В отличие от патогенных бактерий
teria, некоторые комменсальные лактобациллы индуцируют временные воспалительные реакции, отличные от
, стимулируя поляризацию
иммунных Т-клеток по отношению к регуляторным Т (Treg) -клеткам [31, 32].
Более того, лактобациллы создают барьер для колонизации
патогенов, участвуют в ферментации
неперевариваемых волокон, утилизации энергии в виде короткоцепочечных
жирных кислот (SCFA) и синтезе витамина К [33].
Следовательно, потеря или сокращение лактобацилл
может привести к тяжелым патологическим последствиям для организма
не только в кишечной среде, но и на системном уровне
. Интересно, что уменьшение количества лактобацилл на
уже наблюдалось в микробиоте кишечника
пациентов с глютеновой болезнью, у которых было небольшое количество лактоба-
видов ресничек и пониженная концентрация кишечных
SCFA [34].SCFA представляют собой основное топливо для колоноцитов
и необходимы для абсорбции электролитов и воды слизистой оболочкой толстой кишки
, прежде всего во время диареи [34]. Очевидно, что заметное снижение этих метаболических соединений может иметь неблагоприятные последствия для здоровья человека,
Очевидно, что заметное снижение этих метаболических соединений может иметь неблагоприятные последствия для здоровья человека,
, хотя увеличение численности Eubacteriaceae
, наблюдаемое в этом исследовании, может компенсировать гипотетическое снижение количества SCFA на
из-за низкой численности
Lactobacillaceae.Eubacteriaceae, действительно, представляют собой бактериальное семейство
, принадлежащее Firmicutes и участвующее в продуцировании SCFA
и разложении пищевых волокон.
Однако воздействие очищения кишечника на микробиоту кишечника
может быть связано с видом раствора электролита
, используемого для подготовки толстой кишки. Яланка и его коллеги, действительно, сообщили, что микробиота восстанавливается до
.
напоминает исходный состав за 2 недели, когда раствор для лаважа
принимался двумя дозами по 1 литру, но
, когда использовалась однократная доза 2 литра. для очищения кишечника
микробиота кишечника значительно отличалась от исходных образцов
в течение 1 месяца после медицинской процедуры
[4]. Таким образом, данное исследование дает еще одно обоснование
Таким образом, данное исследование дает еще одно обоснование
для рекомендации разделенной дозы в дополнение к
, дающему лучшую подготовку. Мы решили исследовать эффект
очищения кишечника объемом 4 литра, поскольку промывание кишечника с большим объемом
может вызвать лучшее очищение толстой кишки, чем препараты
в небольшом объеме [35]. Мы не использовали только разделенную дозу
, потому что на момент проведения исследования разделенная доза
не была включена в протокол программы скрининга CRC
.В заключение, наше исследование обнаружило глубокое влияние
лаважа толстой кишки на состав кишечной микробиоты
, по крайней мере, через 1 месяц после клинического лечения
, так как микробиота не полностью вернулась к
, напоминающему состав, наблюдаемый до колоноскопии. .
Некоторые семейства бактерий вернулись к сходству с исходным составом
через 1 месяц после колоноскопии, тогда как некоторые
изменений оставались долгое время после того, как был проведен промывание кишечника
.
Одним из ограничений настоящего исследования является относительно небольшое количество пациентов, включенных в него. Тем не менее, мы считаем настоящую работу важным предварительным исследованием
, направленным на оценку того, сохраняются ли изменения в положении микробиоты после промывания кишечника через 1 месяц. Из курса
необходимы дальнейшие исследования, чтобы лучше понять влияние
очищения кишечника на большее количество индивидов
двойных, отслеживая не только изменения микробиоты после
лаважа толстой кишки, но и состояние здоровья всех пациентов.
участвовали в исследовании в разные моменты времени после
эндоскопического исследования.
С точки зрения восстановления микробиоты, введение
пробиотической терапии сразу после колоноскопии может быть полезным для восстановления бактериального баланса кишечника
, увеличивая количество полезных бактерий на
, такие как лактобациллы, которые могут защитить
хозяина от действия патогенных микроорганизмов.
Тем не менее, наши результаты действительно позволили понять общий эффект промывания кишечника на микробиоту кишечника,
, что указывает на то, что рутинная практика промывания кишечника незначительно может изменить и исказить кишечные бактерии
гомеостаз.
Благодарности
Конфликты интересов
Конфликтов интересов нет.
Ссылки
1 Rex DK, Schoenfeld PS, Cohen J, Pike IM, Adler DG, Fennerty MB,
et al. Показатели качества колоноскопии. Am J Gastroenterol 2015;
110: 72–90.
2 Harewood GC, Sharma VK, de Garmo P. Влияние качества анализа до
на колоноскопию на обнаружение подозреваемой неоплазии толстой кишки.
Gastrointest Endosc 2003; 58: 76–79.
3 Jalanka J, Salonen A, Salojärvi J, Ritari J, Immonen O, Marciani L, et al.
Влияние очищения кишечника на микробиоту кишечника. Gut 2015;
64: 1562–1568.
4 Hill DA, Hoffmann C, Abt MC, Du Y, Kobuley D, Kirn TJ и др.
Метагеномные анализы выявляют индуцированные антибиотиками временные и пространственные
изменения микробиоты кишечника с соответствующими изменениями иммунного гомеостаза
клеток. Mucosal Immunol 2010; 3: 148–158.
5 Pace NR, Olsen GJ, Woese CR. Филогения рибосомных РНК и первичные линии эволюционного происхождения
. Cell 1986; 45: 325–326.
536 Европейский журнал гастроэнтерологии и гепатологии, май 2016 г. • Том 28 • Номер 5
Авторские права r2016 Wolters Kluwer Health, Inc. Все права защищены.
IJMS | Бесплатный полнотекстовый | Желудочно-кишечные расстройства и метаболический синдром: дисбактериоз как ключевое звено и общие биологически активные компоненты питания, полезные для их лечения
1.Введение
Нарушения со стороны желудочно-кишечного тракта (ЖКТ), распространенность которых возросла за последние несколько десятилетий, характеризуются физиологическими и морфологическими аномалиями системы ЖКТ, которые часто возникают в сочетании и включают нарушения моторики, висцеральную гиперчувствительность, изменение слизистой и иммунной функции, а также измененные кишечная микробиота [1,2]. Среди расстройств желудочно-кишечного тракта воспалительные заболевания кишечника (ВЗК), включая болезнь Крона (БК), хроническое заболевание кишечника, вызывающее очаги воспаления в желудочно-кишечном тракте [3], и язвенный колит (ЯК), который поражает только внутреннюю стенку кишечника. толстой кишки, являются наиболее серьезными заболеваниями [4].Другие распространенные идиопатические и хронические воспалительные расстройства желудочно-кишечного тракта включают дивертикулярную болезнь, хроническое состояние небольших карманов кишечника и синдром раздраженного кишечника (СРК), определяемый как «дискомфорт в животе, связанный с измененными привычками кишечника» [5]. Основными причинами желудочно-кишечных расстройств являются генетическая предрасположенность к заболеванию, фармакологические методы лечения (т. Е. Антибиотики, не ограничиваясь теми, которые вводятся для использования человеком, но также потенциально включают те, которые используются на сельскохозяйственных животных и сельскохозяйственных культурах и потребляются с полученными продуктами питания), нестероидные препараты.
Среди расстройств желудочно-кишечного тракта воспалительные заболевания кишечника (ВЗК), включая болезнь Крона (БК), хроническое заболевание кишечника, вызывающее очаги воспаления в желудочно-кишечном тракте [3], и язвенный колит (ЯК), который поражает только внутреннюю стенку кишечника. толстой кишки, являются наиболее серьезными заболеваниями [4].Другие распространенные идиопатические и хронические воспалительные расстройства желудочно-кишечного тракта включают дивертикулярную болезнь, хроническое состояние небольших карманов кишечника и синдром раздраженного кишечника (СРК), определяемый как «дискомфорт в животе, связанный с измененными привычками кишечника» [5]. Основными причинами желудочно-кишечных расстройств являются генетическая предрасположенность к заболеванию, фармакологические методы лечения (т. Е. Антибиотики, не ограничиваясь теми, которые вводятся для использования человеком, но также потенциально включают те, которые используются на сельскохозяйственных животных и сельскохозяйственных культурах и потребляются с полученными продуктами питания), нестероидные препараты. противовоспалительные препараты (НПВП) (i.е., аспирин, ибупрофен, диклофенак) и нездоровый образ жизни, включая нерегулярное питание, отсутствие физической активности, курение и диету с низким содержанием клетчатки [6,7,8,9]. Более того, около 50% мирового населения поражено Helicobacter pylori, грамотрицательным бактериальным патогеном, который может вызывать ВЗК и функциональные расстройства ЖКТ [10]. Все расстройства желудочно-кишечного тракта обычно проявляются болью в животе, запором, диареей, вздутием живота, кислотностью желудочного сока, желудочно-кишечной рефлюксной болезнью (ГЭРБ), кровотечением из желудочно-кишечного тракта (ЖКТ), мальабсорбцией или недоеданием и кишечной непроходимостью [11,12].Некоторые из лекарственных средств, применяемых в настоящее время для лечения желудочно-кишечных расстройств, включают слабительные, противодиарейные, опиоиды, противорвотные средства, усилители моторики, а также противокислотные, противоязвенные и противовоспалительные средства [13].
противовоспалительные препараты (НПВП) (i.е., аспирин, ибупрофен, диклофенак) и нездоровый образ жизни, включая нерегулярное питание, отсутствие физической активности, курение и диету с низким содержанием клетчатки [6,7,8,9]. Более того, около 50% мирового населения поражено Helicobacter pylori, грамотрицательным бактериальным патогеном, который может вызывать ВЗК и функциональные расстройства ЖКТ [10]. Все расстройства желудочно-кишечного тракта обычно проявляются болью в животе, запором, диареей, вздутием живота, кислотностью желудочного сока, желудочно-кишечной рефлюксной болезнью (ГЭРБ), кровотечением из желудочно-кишечного тракта (ЖКТ), мальабсорбцией или недоеданием и кишечной непроходимостью [11,12].Некоторые из лекарственных средств, применяемых в настоящее время для лечения желудочно-кишечных расстройств, включают слабительные, противодиарейные, опиоиды, противорвотные средства, усилители моторики, а также противокислотные, противоязвенные и противовоспалительные средства [13]. Обычные методы лечения ВЗК включают кортикостероиды, иммунодепрессанты и антитела против фактора некроза опухолей (TNF) -α, которые часто коррелируют с риском оппортунистических инфекций и дисплазий, что имеет дорогостоящие последствия для управления системой здравоохранения [14,15]. Факты свидетельствуют о том, что диета западного образца (WPD) привела к широкому распространению ГЭРБ.Исследования показали, что распространенность ГЭРБ составляет 18,1–27,8% (североамериканцы), 8,8–25,9% (Европа), 11,6% (Австралия), 23% (Южная Америка), 2,5–7,8% (Восточная Азия) и 8,7%. –33,1% (Ближний Восток) [16]. Распространенность диспепсии может варьироваться от страны к стране, однако объединенная распространенность сообщается Ford et al. составлять 21% [17]. Среди взрослого населения США диарея является причиной более 128 000 госпитализаций и 3000 смертей [18,19]. Аналогичным образом, доступная литература предполагает, что 12% населения мира страдали запорами [20].Найроп и др. (2007) оценили среднегодовые прямые затраты на медицинское обслуживание некоторых расстройств желудочно-кишечного тракта в расчете на группу пациентов, посещающих клинику желудочно-кишечного тракта, в 5049 долларов США (IBS), 6140 долларов США (диарея), 7522 доллара США (запор) и 7646 долларов США (боль в животе) [21].
Обычные методы лечения ВЗК включают кортикостероиды, иммунодепрессанты и антитела против фактора некроза опухолей (TNF) -α, которые часто коррелируют с риском оппортунистических инфекций и дисплазий, что имеет дорогостоящие последствия для управления системой здравоохранения [14,15]. Факты свидетельствуют о том, что диета западного образца (WPD) привела к широкому распространению ГЭРБ.Исследования показали, что распространенность ГЭРБ составляет 18,1–27,8% (североамериканцы), 8,8–25,9% (Европа), 11,6% (Австралия), 23% (Южная Америка), 2,5–7,8% (Восточная Азия) и 8,7%. –33,1% (Ближний Восток) [16]. Распространенность диспепсии может варьироваться от страны к стране, однако объединенная распространенность сообщается Ford et al. составлять 21% [17]. Среди взрослого населения США диарея является причиной более 128 000 госпитализаций и 3000 смертей [18,19]. Аналогичным образом, доступная литература предполагает, что 12% населения мира страдали запорами [20].Найроп и др. (2007) оценили среднегодовые прямые затраты на медицинское обслуживание некоторых расстройств желудочно-кишечного тракта в расчете на группу пациентов, посещающих клинику желудочно-кишечного тракта, в 5049 долларов США (IBS), 6140 долларов США (диарея), 7522 доллара США (запор) и 7646 долларов США (боль в животе) [21]. Несмотря на недавний прогресс в знаниях о патофизиологических механизмах, участвующих в расстройствах ЖКТ, их этиопатогенез еще не полностью выяснен, и нет маркера, который может привести к их окончательному диагнозу. Были идентифицированы некоторые этиологические факторы, такие как висцеральная гиперчувствительность, инфекции, генетические и эпигенетические факторы, стресс и изменения кишечной микробиоты, ведущие к дисбактериозу [22,23].Метаболический синдром (РС) — это состояние хронического воспаления низкой степени, обусловленное как генетическими, так и средовыми факторами, включая ряд факторов риска серьезных заболеваний, таких как гипергликемия, абдоминальное ожирение, гиперлипидемия и гипертония [24,25]. Клиническое значение рассеянного склероза было подчеркнуто Ривеном в 1988 г. при описании роли инсулинорезистентности в заболевании человека [26]. Отсутствие лечения и стойкое состояние рассеянного склероза может привести к ряду патологий, наиболее распространенными из которых являются сердечно-сосудистые заболевания (ишемическая болезнь сердца, сердечная недостаточность и инсульт), сахарный диабет 2 типа и нарушения функции печени, такие как стеатоз печени [27, 28,29].
Несмотря на недавний прогресс в знаниях о патофизиологических механизмах, участвующих в расстройствах ЖКТ, их этиопатогенез еще не полностью выяснен, и нет маркера, который может привести к их окончательному диагнозу. Были идентифицированы некоторые этиологические факторы, такие как висцеральная гиперчувствительность, инфекции, генетические и эпигенетические факторы, стресс и изменения кишечной микробиоты, ведущие к дисбактериозу [22,23].Метаболический синдром (РС) — это состояние хронического воспаления низкой степени, обусловленное как генетическими, так и средовыми факторами, включая ряд факторов риска серьезных заболеваний, таких как гипергликемия, абдоминальное ожирение, гиперлипидемия и гипертония [24,25]. Клиническое значение рассеянного склероза было подчеркнуто Ривеном в 1988 г. при описании роли инсулинорезистентности в заболевании человека [26]. Отсутствие лечения и стойкое состояние рассеянного склероза может привести к ряду патологий, наиболее распространенными из которых являются сердечно-сосудистые заболевания (ишемическая болезнь сердца, сердечная недостаточность и инсульт), сахарный диабет 2 типа и нарушения функции печени, такие как стеатоз печени [27, 28,29]. Как сообщил Садеги, различные метаболические нарушения, включая гипертензию, гипергликемию и подагру, были описаны еще в 1920-х годах [30]. Позже, в 1947 году, Ваг описал фенотип ожирения как связанный с метаболическими нарушениями, сахарным диабетом 2 типа (СД2) и сердечно-сосудистыми заболеваниями [31]. Определение ВОЗ и Европейская группа по изучению инсулинорезистентности согласны с тем, что непереносимость глюкозы и инсулинорезистентность являются важными компонентами РС [32,33].Используются несколько определений указанного синдрома, но с 2004 года Международная диабетическая федерация (IDF) установила единое определение рассеянного склероза, подчеркивая ключевую роль ожирения как фактора риска заболеваний, о которых сообщалось выше [34]. Основными факторами риска развития РС являются семейный анамнез [35], курение [36], чрезмерное употребление алкоголя [37], старение, низкий социально-экономический статус, постменопаузальный статус [38], малоподвижный образ жизни [39], нездоровый режим питания [40] и прием некоторых лекарств (атипичные антипсихотики) [41].
Как сообщил Садеги, различные метаболические нарушения, включая гипертензию, гипергликемию и подагру, были описаны еще в 1920-х годах [30]. Позже, в 1947 году, Ваг описал фенотип ожирения как связанный с метаболическими нарушениями, сахарным диабетом 2 типа (СД2) и сердечно-сосудистыми заболеваниями [31]. Определение ВОЗ и Европейская группа по изучению инсулинорезистентности согласны с тем, что непереносимость глюкозы и инсулинорезистентность являются важными компонентами РС [32,33].Используются несколько определений указанного синдрома, но с 2004 года Международная диабетическая федерация (IDF) установила единое определение рассеянного склероза, подчеркивая ключевую роль ожирения как фактора риска заболеваний, о которых сообщалось выше [34]. Основными факторами риска развития РС являются семейный анамнез [35], курение [36], чрезмерное употребление алкоголя [37], старение, низкий социально-экономический статус, постменопаузальный статус [38], малоподвижный образ жизни [39], нездоровый режим питания [40] и прием некоторых лекарств (атипичные антипсихотики) [41]. На рисунке 1 показано влияние нерегулируемого метаболизма на человеческий организм, иллюстрируя патогенный путь рассеянного склероза. Нарушения обмена веществ имеют общие патофизиологические механизмы, и поэтому различные фармакологические объекты используются в комбинации в терапевтических целях [42]. Эффективные вмешательства могут включать физические упражнения, модификации диеты и фармакологические агенты, такие как сенсибилизаторы инсулина, ингибиторы ренин-ангиотензин-альдостероновой системы (РААС), статины и фибраты [43,44]. За последние два десятилетия во всем мире произошло значительное увеличение числа людей с РС, связанное с глобальной эпидемией ожирения и СД2.Около 20–25% взрослого населения мира живет с РС [45]. По оценкам ВОЗ, около 650 миллионов человек живут с ожирением, 422 миллиона — с диабетом и 1,13 миллиарда — с гипертонией [46, 47, 48]. Растущие данные свидетельствуют о том, что дисбактериоз микробиоты кишечника вызван множеством внутренних и внешних факторов, таких как генетические вариации, диета, стресс и фармакологическая терапия [49] связаны с патогенезом как кишечных, так и внекишечных заболеваний (рис.
На рисунке 1 показано влияние нерегулируемого метаболизма на человеческий организм, иллюстрируя патогенный путь рассеянного склероза. Нарушения обмена веществ имеют общие патофизиологические механизмы, и поэтому различные фармакологические объекты используются в комбинации в терапевтических целях [42]. Эффективные вмешательства могут включать физические упражнения, модификации диеты и фармакологические агенты, такие как сенсибилизаторы инсулина, ингибиторы ренин-ангиотензин-альдостероновой системы (РААС), статины и фибраты [43,44]. За последние два десятилетия во всем мире произошло значительное увеличение числа людей с РС, связанное с глобальной эпидемией ожирения и СД2.Около 20–25% взрослого населения мира живет с РС [45]. По оценкам ВОЗ, около 650 миллионов человек живут с ожирением, 422 миллиона — с диабетом и 1,13 миллиарда — с гипертонией [46, 47, 48]. Растущие данные свидетельствуют о том, что дисбактериоз микробиоты кишечника вызван множеством внутренних и внешних факторов, таких как генетические вариации, диета, стресс и фармакологическая терапия [49] связаны с патогенезом как кишечных, так и внекишечных заболеваний (рис. 2). Фактически, взаимодействие между микробиотой и иммунной системой хозяина считается ключевым элементом для нового понимания патогенеза большого спектра заболеваний, включая расстройства желудочно-кишечного тракта и рассеянный склероз [50].Текущие исследования подчеркивают роль здоровой микробиоты кишечника в модулировании возникновения различных заболеваний ЖКТ, таких как ВЗК, рак толстой кишки, целиакия и СРК. Кроме того, дисбактериоз является одним из движущих факторов нарушения метаболизма. Hur et al. сообщают о важной роли микробиоты кишечника в патогенезе СД2, влияя на массу тела, провоспалительную активность и инсулинорезистентность [51]. Ключевая роль микробиоты кишечника — это ферментация пищевых полисахаридов, которые человеческий организм не может переварить иначе.Пищевые волокна состоят из неперевариваемой части растительных пищевых углеводов, содержащих нерастворимые и растворимые волокна. Растворимые волокна перевариваются ферментами, полученными из микробиоты кишечника, в короткоцепочечные жирные кислоты (SCFA).
2). Фактически, взаимодействие между микробиотой и иммунной системой хозяина считается ключевым элементом для нового понимания патогенеза большого спектра заболеваний, включая расстройства желудочно-кишечного тракта и рассеянный склероз [50].Текущие исследования подчеркивают роль здоровой микробиоты кишечника в модулировании возникновения различных заболеваний ЖКТ, таких как ВЗК, рак толстой кишки, целиакия и СРК. Кроме того, дисбактериоз является одним из движущих факторов нарушения метаболизма. Hur et al. сообщают о важной роли микробиоты кишечника в патогенезе СД2, влияя на массу тела, провоспалительную активность и инсулинорезистентность [51]. Ключевая роль микробиоты кишечника — это ферментация пищевых полисахаридов, которые человеческий организм не может переварить иначе.Пищевые волокна состоят из неперевариваемой части растительных пищевых углеводов, содержащих нерастворимые и растворимые волокна. Растворимые волокна перевариваются ферментами, полученными из микробиоты кишечника, в короткоцепочечные жирные кислоты (SCFA). SCFAs (бутират, ацетат и пропионат) всасываются в кишечнике и используются хозяином в качестве энергии. Помимо своей роли в качестве энергетических субстратов, SCFA действуют как регуляторы потребления пищи или энергии и воспаления [52,53]. В частности, бутират способствует регенерации и защите клеток кишечника, выработке муцина, снижению уровня гиперхолестеринемии, а также высвобождению гормонов и / или нейромедиаторов, важных для регуляции перистальтики кишечника и резистентности к инсулину [54].У пациентов с СРК наблюдалось уменьшение боли в животе после приема бутирата из-за изменения высвобождения нейротрансмиттеров и снижения гиперчувствительности кишечных механорецепторов, что может привести к снижению давления в просвете и / или перистальтики [55,56].
SCFAs (бутират, ацетат и пропионат) всасываются в кишечнике и используются хозяином в качестве энергии. Помимо своей роли в качестве энергетических субстратов, SCFA действуют как регуляторы потребления пищи или энергии и воспаления [52,53]. В частности, бутират способствует регенерации и защите клеток кишечника, выработке муцина, снижению уровня гиперхолестеринемии, а также высвобождению гормонов и / или нейромедиаторов, важных для регуляции перистальтики кишечника и резистентности к инсулину [54].У пациентов с СРК наблюдалось уменьшение боли в животе после приема бутирата из-за изменения высвобождения нейротрансмиттеров и снижения гиперчувствительности кишечных механорецепторов, что может привести к снижению давления в просвете и / или перистальтики [55,56].
Сегодня образ жизни и диета признаны краеугольными камнями профилактики таких патологий, как сердечно-сосудистые заболевания, СД2, РС и расстройства желудочно-кишечного тракта. Более того, регулирование дисбактериоза кишечника с помощью пищевых добавок, согласно последним данным, используется для восстановления равновесия микробиоты кишечника. Учитывая, что дисбактериоз может быть общей связью между расстройствами желудочно-кишечного тракта и рассеянным склерозом, а правильная диета может использоваться для восстановления измененной микробиоты и считается первым подходом к лечению как расстройств желудочно-кишечного тракта, так и рассеянного склероза, цель этого обзора состоит в том, чтобы обобщить текущие знания о защитной роли функциональных диетических компонентов при желудочно-кишечном тракте и рассеянном склерозе, а также помочь в выработке общей точки зрения на эти обширные области.
Учитывая, что дисбактериоз может быть общей связью между расстройствами желудочно-кишечного тракта и рассеянным склерозом, а правильная диета может использоваться для восстановления измененной микробиоты и считается первым подходом к лечению как расстройств желудочно-кишечного тракта, так и рассеянного склероза, цель этого обзора состоит в том, чтобы обобщить текущие знания о защитной роли функциональных диетических компонентов при желудочно-кишечном тракте и рассеянном склерозе, а также помочь в выработке общей точки зрения на эти обширные области.
Дисбиоз кишечника и его лечение
Желудочно-кишечный тракт человека (включая желудок и кишечник) содержит как «хорошие», так и «плохие» бактерии, которые составляют кишечную флору, также известную как микробиота кишечника.Другие мелкие организмы, также встречающиеся в желудочно-кишечном тракте, включают микрогрибы, грибы (группа одноклеточных или многоклеточных спорообразующих организмов), вирусы и паразиты.
Человеческое тело полно колоний безобидных бактерий: большинство этих бактерий положительно влияют на наше здоровье и способствуют естественным процессам в организме, но когда одна из этих колоний не сбалансирована, это может привести к дисбактериозу.
Дисбиоз обычно возникает, когда бактерии в желудочно-кишечном тракте страдают от дисбаланса.Некоторые эффекты дисбактериоза кишечника временные и довольно легкие.
Причины
Любое изменение баланса кишечной флоры (т. Е. Кишечной микробиоты) может вызвать дисбактериоз. Когда дисбактериоз возникает в желудочно-кишечном тракте, он обычно вызывается следующими причинами:
- Изменение диеты, в результате которого увеличивается потребление белка, сахара или пищевых добавок.
- Случайное употребление химических веществ, таких как пестициды, которые остаются на коже или кожуре овощей и фруктов.
- Употребление двух и более алкогольных напитков в день.
- Использование лекарственных средств, влияющих на кишечную флору, например, антибиотиков.
- Высокий уровень стресса и беспокойства, которые могут ослабить иммунную систему.
- Незащищенный секс, при котором человек может подвергнуться воздействию опасных бактерий.

Варианты лечения
Если лекарство является причиной дисбаланса бактерий, ваш врач, скорее всего, посоветует вам прекратить его прием до тех пор, пока баланс бактерий не будет восстановлен.Ваш врач может также назначить определенные лекарства, которые помогут контролировать бактерии, например:
- Ципрофлоксацин, антибиотик, используемый для лечения кишечных инфекций, вызванных дисбактериозом.
- Рифаксимин, антибиотик, используемый для лечения симптомов синдрома раздраженного кишечника, распространенного заболевания, связанного с дисбактериозом.
Кроме того, есть несколько травяных препаратов, которые могут быть очень полезны при лечении:
- Пробиотики
- Пребиотики
- Лечебные травы
- Эфирные масла
- Гомеопатические лекарственные средства.
Принятие диеты, которая содержит продукты с достаточным количеством питательных веществ для поддержания бактериального баланса в кишечнике, такие как витамины B (особенно витамины B6 и B12), кальций, магний, бета-каротин и цинк, является наиболее эффективным способом поддержки вашего кишечника.


 — 1997. — T. VII, № 5. — С. 96–97.
— 1997. — T. VII, № 5. — С. 96–97. — Vol. 35, № 1 — P. 23–26.
— Vol. 35, № 1 — P. 23–26. 106, № 3. — P. 615–623.
106, № 3. — P. 615–623.

 Полный текст.
Полный текст. Питательные вещества , 11 (10), 2270.Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6835687/
Питательные вещества , 11 (10), 2270.Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6835687/ Морские препараты , 16 (6), 216. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6024889/
Морские препараты , 16 (6), 216. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6024889/ Plos one , 15 (1), e0226128. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6961833/
Plos one , 15 (1), e0226128. Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6961833/ Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3684271/
Полный текст: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3684271/ gov/pmc/articles/PMC4180221/
gov/pmc/articles/PMC4180221/