Самые опасные инфекции в истории человечества — Биографии и справки
ТАСС-ДОСЬЕ. По данным на 24 января 2020 года, число подтвержденных случаев пневмонии в Китае, вызванной новым типом коронавируса 2019-nCoV, достигло 900. Случаи заражения зафиксированы также во Вьетнаме, в Таиланде, Республике Корея, США, Сингапуре и Японии.
Информация о наиболее опасных инфекционных заболеваниях — в материале ТАСС.
Чума
Чума (или чумная болезнь) — инфекционное заболевание, возбудителем которой является бактерия чумной палочки (лат. Yersinia Pestis; открыта в 1894 году), встречающаяся на мелких животных (грызунах) и на обитающих на них паразитах — блохах. К человеку передается через укус зараженной блохи, при прямом контакте с инфицированными материалами или воздушно-капельным путем от заболевшего. Инкубационный период — 3-7 дней, затем развиваются типичные для гриппа симптомы: внезапное повышение температуры, озноб, головная боль и ломота в теле, а также слабость, тошнота и рвота. Существует три формы чумы. При бубонной — наиболее распространенной форме — бацилла чумы поражает лимфосистему. В результате лимфоузел становится твердым, на теле возникает бубон. В поздней стадии заболевания воспаленные лимфоузлы превращаются в гноящиеся раны. При септической форме инфекция проникает через трещины в кожном покрове и попадает сразу в кровь. Легочная — наиболее тяжелая и наименее распространенная форма чумы — сопровождается поражением органов дыхания. При отсутствии лечения болезнь может привести к тяжелым осложнениям и смерти (смертность — 30%-60%). В борьбе против чумы эффективно лечение антибиотиками, а также поддерживающая терапия. При отсутствии лечения болезнь может в короткий срок привести к летальному исходу.
Существует три формы чумы. При бубонной — наиболее распространенной форме — бацилла чумы поражает лимфосистему. В результате лимфоузел становится твердым, на теле возникает бубон. В поздней стадии заболевания воспаленные лимфоузлы превращаются в гноящиеся раны. При септической форме инфекция проникает через трещины в кожном покрове и попадает сразу в кровь. Легочная — наиболее тяжелая и наименее распространенная форма чумы — сопровождается поражением органов дыхания. При отсутствии лечения болезнь может привести к тяжелым осложнениям и смерти (смертность — 30%-60%). В борьбе против чумы эффективно лечение антибиотиками, а также поддерживающая терапия. При отсутствии лечения болезнь может в короткий срок привести к летальному исходу.
Первые сведения о заболевании со сходными симптомами относятся к временам Древнего Рима. Однако считается, что оно имело распространение и в более ранний период на территории современных Ливии, Сирии и Египта. В прошлом чума вызывала широкомасштабные пандемии. В XIV в. одна из форм чумы, более известная как «черная смерть», по некоторым данным, унесла жизни 50 млн человек. По сведениям Всемирной организации здравоохранения (ВОЗ), в 2010-2015 годах было зарегистрировано 3 тыс. 248 случаев заболевания чумой разных форм, от болезни умерли 584 человека.
В XIV в. одна из форм чумы, более известная как «черная смерть», по некоторым данным, унесла жизни 50 млн человек. По сведениям Всемирной организации здравоохранения (ВОЗ), в 2010-2015 годах было зарегистрировано 3 тыс. 248 случаев заболевания чумой разных форм, от болезни умерли 584 человека.
Оспа
Натуральная оспа вызывается вирусом вариола (лат. Variola). Передается воздушно-капельным путем, а также через предметы, с которыми контактировал инфицированный. Инкубационный период — 7-17 дней. Заболевание начинается с резкого повышения температуры, головной боли, нередко тошноты и рвоты. Через 2-3 дня температура спадает, на коже и слизистых появляется узелково-пузырьчатая сыпь, оставляющая после себя рубцы (оспины). В 30% случаев наблюдается летальный исход, при редких формах (сливная, геморрагическая, пурпурная) смертность достигает 70% и выше.
До недавнего времени считалось, что оспа появилась к Африке или Азии в IV-м тысячетелетии до н. э. Однако сегодня ученые высказывают предположение, что вирус человека близок вирусу верблюжьей оспы и перешел к человеку в ближневосточном регионе в начале нашей эры. Эпидемия оспы впервые прокатилась по Китаю в IV в., в VI в. поразила Корею. В VIII в. болезнь была завезена в Европу (в XVII-XVIII вв. эпидемиями было охвачено практически все население Европы, ежегодно от этой болезни умирали более 1,5 млн человек; в России наивысшего распространения это заболевание достигло в XVIII в.). К началу XVI в. относятся первые упоминания об оспе в Америке, куда ее могли завезти испанские завоеватели. В конце XVIII в. оспа была завезена в Австралию.
Эпидемия оспы впервые прокатилась по Китаю в IV в., в VI в. поразила Корею. В VIII в. болезнь была завезена в Европу (в XVII-XVIII вв. эпидемиями было охвачено практически все население Европы, ежегодно от этой болезни умирали более 1,5 млн человек; в России наивысшего распространения это заболевание достигло в XVIII в.). К началу XVI в. относятся первые упоминания об оспе в Америке, куда ее могли завезти испанские завоеватели. В конце XVIII в. оспа была завезена в Австралию.
Справиться с болезнью удалось благодаря реализуемой со второй половины 1960-х годов глобальной программе ВОЗ по вакцинации. Последний случай заболевания человека натуральной оспой был зафиксирован 26 октября 1977 года в Сомали. Официально о победе над болезнью было объявлено в 1980 году. Право на хранение вируса и проведения исследований имеют только две лаборатории — российский Государственный научный центр вирусологии и биотехнологии «Вектор» (пос. Кольцово, Новосибирская обл.) и американский Центр по контролю и профилактике заболеваний (г. Атланта, шт. Джорджия).
Атланта, шт. Джорджия).
Холера
Холера — острая кишечная инфекция, вызываемая бактериями вида Vibrio cholerae, характеризующаяся поражением желудочно-кишечного тракта, нарушением водно-солевого обмена и обезвоживанием организма. Распространяется через загрязненную воду и продукты питания, тесно связана с плохими санитарными условиями и нехваткой чистой питьевой воды. Холера известна еще с античных времен и до середины XX в. оставалась одной из наиболее опасных эпидемических болезней. В XIX в. холера распространилась из своего первоначального резервуара в дельте реки Ганг в Индии по всему миру. Шесть последовательных пандемий унесли жизни нескольких миллионов людей по всему миру. Седьмая эпидемия началась в 1961 году в Южной Азии и распространилась в 1971 году на Африку, в 1991 году — на Америку. В настоящее время отдельные случаи и вспышки заболевания возникают в развивающихся и бедных странах, особенно при массовых стихийных бедствиях. Так, после разрушительного землетрясения на Гаити в январе 2010 года, число жертв вспышки холеры превысило 7,5 тыс. В январе 2011 года холера из Гаити была перенесена в Венесуэлу, Доминиканскую Республику, Испанию, США и Мексику, в 2012 году — на Кубу.
В январе 2011 года холера из Гаити была перенесена в Венесуэлу, Доминиканскую Республику, Испанию, США и Мексику, в 2012 году — на Кубу.
По данным ВОЗ, ежегодно происходит от 3 млн до 5 млн случаев заболевания холерой, из них более 100 тыс. — с летальным исходом. Для предупреждения этого заболевания используется два вида вакцин. Они обеспечивают устойчивую защиту на уровне более 50% в течение двух лет.
«Свиной грипп»
«Свиной грипп» (англ. Swine Influenza) — условное название вирусной инфекционной болезни человека, первоначально распространившейся среди домашних свиней (в 2009 году в Мексике и США). Вирус передается бытовым и воздушно-капельным путем и вызывает типичные для гриппа и ОРВИ симптомы — кашель, головную боль, повышение температуры, рвоту, диарею, насморк. Наиболее опасны осложнения, в первую очередь — пневмония. «Свиной грипп» относится к наиболее часто встречающемуся гриппу типа А и объединяет подтипы h2N1 (самый распространенный), h2N2, h4N1, h4N2 и h3N3. Наиболее надежным способом избежать заражения «свиным гриппом» является сезонная прививка.
Наиболее надежным способом избежать заражения «свиным гриппом» является сезонная прививка.
В 1957-1958 годах к пандемии привел вирус h3N2, тогда переболело от 20% до 50% населения Земли и погибли от 1 млн до 4 млн человек, при этом чаще всего грипп поражал детей. Другой возбудитель — вирус h4N2 — вызвал эпидемию 1968-1969 годов, первые случаи которой были зафиксированы в Гонконге. Распространившаяся по всему миру болезнь унесла жизни до 4 млн человек. Значительная вспышка вируса h2N1 произошла в 2009-2010 годах. По данным ВОЗ, тогда пандемия охватила 30% населения Земли в 214 странах, умерли более 18 тыс. человек.
Считается, что одним из видов «свиного гриппа» была т. н. испанка — эпидемия 1918-1919 годов, распространившаяся по миру из Испании. Тогда заболели более 500 млн человек, погибли от 20 млн до 50 млн. Это самая массовая по количеству летальных исходов пандемия в истории человечества.
Эбола
Болезнь, вызванная вирусом Эбола (БВВЭ), поражает человека и некоторые виды животных. Впервые вирус был зафиксирован в 1976 году в Заире (ныне Демократическая Республика Конго, ДР Конго), в селении на берегу реки Эбола, в связи с чем и получил название. Считается, что носителями вируса изначально были летучие мыши. Он передается людям от диких животных и распространяется от человека человеку при тесном контакте через слизистую оболочку или повреждения на кожном покрове. Болезнь проявляется лихорадкой, желтухой, геморрагическим синдромом и почечной недостаточностью. Инкубационный период варьируется от 2 до 21 дня. В ходе вспышек заболевания смертность достигает 90%. Специалисты выделяют пять разновидностей вируса: Бундибуджио (BDBV), Заир (EBOV), Судан (SUDV), Таи Форест (TAFV), Рестон (RESTV; поражает только животных).
Впервые вирус был зафиксирован в 1976 году в Заире (ныне Демократическая Республика Конго, ДР Конго), в селении на берегу реки Эбола, в связи с чем и получил название. Считается, что носителями вируса изначально были летучие мыши. Он передается людям от диких животных и распространяется от человека человеку при тесном контакте через слизистую оболочку или повреждения на кожном покрове. Болезнь проявляется лихорадкой, желтухой, геморрагическим синдромом и почечной недостаточностью. Инкубационный период варьируется от 2 до 21 дня. В ходе вспышек заболевания смертность достигает 90%. Специалисты выделяют пять разновидностей вируса: Бундибуджио (BDBV), Заир (EBOV), Судан (SUDV), Таи Форест (TAFV), Рестон (RESTV; поражает только животных).
Вспышки лихорадки были зафиксированы в ДР Конго в 1976, 1995 и 2007 годы, в Судане в 1976 году, в Уганде в 2000 году и в Республике Конго в 2003 году. Наибольшее количество жизней унесла эпидемия в 2013-2016 годах, охватившая Гвинею, Сьерра-Леоне и Либерию. Случаи заболевания были зафиксированы также в Мали, Нигерии, Сенегале, Испании, Великобритании, Италии и США. По данным ВОЗ, с начала этой эпидемии заразились около 30 тыс. человек, умерли 11,3 тыс. человек. В 2018-2019 годах вспышки эпидемии с перерывами проходили в ДР Конго (3,4 тыс. заболевших, 2,3 тыс. умерших).
Случаи заболевания были зафиксированы также в Мали, Нигерии, Сенегале, Испании, Великобритании, Италии и США. По данным ВОЗ, с начала этой эпидемии заразились около 30 тыс. человек, умерли 11,3 тыс. человек. В 2018-2019 годах вспышки эпидемии с перерывами проходили в ДР Конго (3,4 тыс. заболевших, 2,3 тыс. умерших).
СПИД
Синдром приобретенного иммунодефицита (СПИД) — заболевание, развивающееся при инфицировании вирусом иммунодефицита человека (ВИЧ). Вирус поражает иммунную систему и ослабляет защиту организма от инфекций и болезней. ВИЧ может передаваться при сексуальном контакте, переливании зараженной крови, использовании зараженных игл или острых инструментов, а также от матери ребенку во время беременности, родов и грудного вскармливания. СПИД может развиться через 2-15 лет после инфицирования. Лекарства, излечивающего от ВИЧ-инфекции, нет. Однако благодаря лечению антиретровирусными препаратами вирус можно контролировать, предотвращать его передачу и ослаблять разрушительное действие на организм.
Некоторые ученые считают, что ВИЧ передался от обезьян к человеку еще в 1920-х годах. Первой жертвой этого заболевания, предположительно, был мужчина, умерший в Конго в 1959 году (к такому выводу медики пришли, проанализировав позднее его историю болезни). Впервые симптомы заболевания, характерные для ВИЧ-инфекции, были описаны в июне 1981 года в США. В 1983 году исследователи из США и Франции описали вирус, который способен вызывать ВИЧ/СПИД.
Согласно данным Объединенной программы ООН по проблемам ВИЧ/СПИД, в 2018 году в мире насчитывалось около 37,9 млн ВИЧ-инфицированных, из них 1,7 млн — дети в возрасте до 15 лет. Наиболее неблагоприятным регионом являются страны Восточной и Южной Африки, где проживают порядка 20,6 млн зараженных. Число новых случаев заражения ВИЧ сократилось на 40% по сравнению с 1997 годом, когда этот показатель достиг пикового значения, — с 2,9 млн до 1,7 млн. В России с 1987 года, когда был выявлен первый случай заболевания, по 30 июня 2019 года было зарегистрировано 1,38 млн ВИЧ-инфекции среди граждан РФ, из них умерли 335 тыс. 867 человек.
867 человек.
Коронавирусы
Коронавирусы — это разновидности вирусов, принадлежащие к подсемейству Coronavirinae семейства Coronaviridae (порядок Nidovirales). Впервые они были открыты в 1960-х годах, являются причиной желудочно-кишечных и респираторных инфекций как у человека, так и у животных. Насчитывается 39 коронавирусов, в том числе вирусы Тяжелого острого респираторного синдрома и Ближневосточного респираторного синдрома.
Тяжелый острый респираторный синдром (ТОРС), также известный как атипичная пневмония — острое инфекционное респираторное заболевание, которое характеризуется скоротечным развитием и вероятностью летального исхода около 10%. Инкубационный период (интервал между инфицированием и появлением симптомов) обычно составляет до 10 дней. Болезнь начинается с повышения температуры (более 38 градусов Цельсия), появления лихорадки, озноба, головной боли и боли в мышцах. По истечении 3-7 дней начинается фаза ухудшения состояния дыхательной системы. Заболевание распространяется воздушно-капельным и контактно-бытовым путем.
Впервые вспышка ТОРС была зарегистрирована в ноябре 2002 года в южно-китайской провинции Гуандун. В дальнейшем многочисленные случаи заболевания фиксировались в Китае, во Вьетнаме, в Новой Зеландии, Индонезии, Таиланде и на Филиппинах. Помимо азиатских стран, атипичная пневмония была зарегистрирована в Северной Америке и в Европе. В России был зафиксирован только один случай заболевания (пациент излечился). По данным ВОЗ, за время эпидемии в 2002-2003 годах общее число заболевших в 37 странах мира достигло 8 тыс. 437 человек, из них умерли более 800.
Ближневосточный респираторный синдром (БВРС) был выявлен в 2012 году в Саудовской Аравии, откуда он перекинулся на другие страны Ближнего Востока. По одной из версий ВОЗ, носителями вируса выступали верблюды. Проявления БВРС похожи на обычный грипп: повышенная температура, кашель, затрудненное дыхание, общее недомогание, диарея. Инкубационный период составляет 7-14 дней. Редко передается детям (по статистике, дети до 14 лет составляют 3% всех заболевших)..gif) Смертность — 35%-40%. В 2012-2015 годах случаи заболевания были зафиксированы более чем в 20 странах, включая Великобританию, Германию, Китай и США. Всего в мире с сентября 2012 года, по данным ВОЗ, было зафиксировано более 1,3 тыс. лабораторно подтвержденных случаев инфицирования, в том числе более 460 со смертельным исходом. Применяется лечение с использованием плазмы крови пациентов, которые успешно перенесли заражение коронавирусом.
Смертность — 35%-40%. В 2012-2015 годах случаи заболевания были зафиксированы более чем в 20 странах, включая Великобританию, Германию, Китай и США. Всего в мире с сентября 2012 года, по данным ВОЗ, было зафиксировано более 1,3 тыс. лабораторно подтвержденных случаев инфицирования, в том числе более 460 со смертельным исходом. Применяется лечение с использованием плазмы крови пациентов, которые успешно перенесли заражение коронавирусом.
АкБарс Мед — Пандемия «Мы уже две недели находимся в аду»
17 ноября 20091340 просмотров
В управлении Роспотребнадзора сообщают, что случаев летального исхода от гриппа в Татарстане не зарегистрировано. Но, как горько шутят врачи, от гриппа еще никто не умирал — умирают от его осложнений. Для свиного гриппа характерны осложнения на легкие. Так вот, семилетний мальчик, недавно побывавший с родителями в Египте, умер от скоротечной пневмонии. А ровно за месяц до этого в ДРКБ умерла школьница из Нижнекамска с таким же диагнозом — ее туда доставили в бессознательном состоянии. И в обоих случаях анализы показали: ни свиного, ни иного гриппа у детей не было.
И в обоих случаях анализы показали: ни свиного, ни иного гриппа у детей не было.
По данным республиканского управления Роспотребнадзора, за неделю заболеваемость ОРВИ и гриппом в Татарстане возросла почти на 103 процента, превысив эпидпорог в 2,6 раза. Болеет или переболел каждый 73-й житель республики. А так называемый свиной грипп — пандемический вирус А/Н1N1 — к понедельнику был подтвержден лабораторными исследованиями в Центре гигиены и эпидемиологии у 444 татарстанцев, в том числе у 167 казанцев. Но смертельных исходов от него не зарегистрировано.
Тем не менее, как сказала корреспонденту «ВК» вчера по телефону начмед ДРКБ, «мы уже две недели находимся в аду». Как бороться с пандемией, не знают не только наши медики — врачи всего мира в недоумении. Вчера на видеоконференции в Минздраве РТ докторов знакомили с мировым опытом. Сообщили, что пандемического вируса свиней в первую очередь следует опасаться детям и молодым женщинам, особенно беременным. Кстати, в Татарстане санврачи делят гриппующее население лишь на детей и взрослых, а по полу у этой статистики и вовсе нет никакой градации.
Замначальника горздрава Альбина Малова в разговоре с корреспондентом «ВК» порекомендовала пить противовирусные препараты. Особенно тем, у кого дома уже есть больные. Она одобрила тех казанцев, которые в отсутствие аптечных масок сами шьют марлевые повязки (кстати, марли в них должно быть 4 слоя). У самодельных масок есть плюс: они многоразовые, их можно кипятить и гладить. И главное при «маскараде» хоть с помощью аптечных, хоть с помощью подручных средств — вовремя маску менять. Если ее надевает больной, чтобы не заразить окружающих, не реже чем через 2 часа, если здоровый, чтобы не заразиться, то через 3 — 4 часа.
А самое главное, сказала Малова, если вы врача по поводу ОРВИ на дом вызвали, но его пока нет (не успевают врачи, количество вызовов чуть не в три раза выросло), а температура у больного резко пошла вверх и самочувствие быстро ухудшается, срочно звоните в скорую.
Р.S. Вчера вечером стало известно, что в нижнекамской больнице от пневмонии умерла 19-летняя женщина.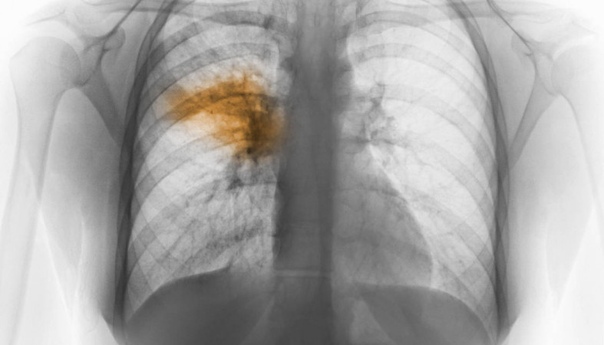 Как утверждают врачи, организм ее был ослаблен: незадолго до этого она на седьмом месяце беременности потеряла ребенка. С диагнозом «пневмония» в Нижнекамске в реанимации в настоящее время находятся 10 человек. 65 жителям города поставлен диагноз «свиной грипп», среди заболевших — 7 детей.
Как утверждают врачи, организм ее был ослаблен: незадолго до этого она на седьмом месяце беременности потеряла ребенка. С диагнозом «пневмония» в Нижнекамске в реанимации в настоящее время находятся 10 человек. 65 жителям города поставлен диагноз «свиной грипп», среди заболевших — 7 детей.
Вечерняя Казань,№163/3937
Почему нельзя заниматься самолечением при подозрении на COVID-19 — Реальное время
«При неправильном стартовом лечении все ворота для перехода в тяжелую пневмонию открыты»
«Это не просто вопрос, это проблема», — комментировала сегодня главный терапевт Минздрава Татарстана, заведующая кафедрой госпитальной терапии КГМУ Диана Абдулганиева все возрастающую тягу татарстанцев к самолечению явного и мнимого COVID-19. Осенью рост случаев самолечения зафиксировали врачи по всей республике.
— Осенью мы столкнулись с тем, что население республики очень активно себя лечит. Как это происходит: кто-то из родственников переболел, ему назначили схему лечения, он ее начинает тиражировать среди всех своих знакомых. Раньше, когда мы спрашивали, что принимал пациент, он говорил: «Ну, парацетамол». Сейчас пациенты называют сразу 5—6 препаратов.
Раньше, когда мы спрашивали, что принимал пациент, он говорил: «Ну, парацетамол». Сейчас пациенты называют сразу 5—6 препаратов.
В Минздраве республики практики самолечения категорически не приветствуют. Тому есть целый ряд причин, объясняет Абдулганиева.
Даже при легком течении коронавирусной инфекции существуют три разные схемы, описанные в федеральных методических рекомендациях. «Все люди разные, и новая коронавирусная инфекция у разных возрастных групп протекает по-разному. Стартовая терапия — она у всех разная», — говорит Диана Абдулганиева.
Диана Абдулганиева: «Раньше, когда мы спрашивали, что принимал пациент, он говорил: «Ну, парацетамол». Сейчас пациенты называют сразу 5—6 препаратов»
При этом препараты для лечения ковида имеют определенные противопоказания и несовместимость. Например, люди старшего возраста, как правило, принимают препараты от хронических заболеваний, и межлекарственное взаимодействие должно быть согласовано с врачом.
Еще один момент — высокая температура. Пациенты, кроме жаропонижающих, активно начинают принимать глюкокортикостероиды. Это приводит к размножению вируса.
Кроме того, пациент не всегда способен самостоятельно отличить COVID-19 от другой ОРВИ.
— Самолечение — не есть хорошо, человек не знает, от чего лечится. Повышение температуры не означает 100%, что идет коронавирусная инфекция. Сейчас идет подъем ОРВИ, и вместо коронавируса может оказаться грипп — а там лечение совсем другое. И если грипп лечить как коронавирус, то можно очень сильно навредить, — говорит главный внештатный специалист по инфекционным болезням Минздрава России в ПФО, доцент кафедры инфекционных болезней КГМУ Ирина Кравченко.
Самое страшное последствие неправильного самолечения — кратно возрастающий риск перехода COVID-19 в тяжелую форму, продолжает Абдулганиева. Таким образом, этот вопрос становится уже вопросом жизни и смерти.
— Коронавирусная инфекция — это короткая болезнь, 14 дней. И потенциально смертельная, это все хорошо знают. […] Проблема самолечения — у нас нет методов профилактики развития пневмонии. Но у нас есть медикаментозные заслоны. Когда идет поражение верхних дыхательных путей, то при правильном лечении оно не перейдет в вирусную пневмонию или перейдет в легкую форму. А при неправильном стартовом лечении все ворота для перехода в тяжелую пневмонию открыты. А тяжелая пневмония — это ИВЛ и летальный исход в 80% случаев.
И потенциально смертельная, это все хорошо знают. […] Проблема самолечения — у нас нет методов профилактики развития пневмонии. Но у нас есть медикаментозные заслоны. Когда идет поражение верхних дыхательных путей, то при правильном лечении оно не перейдет в вирусную пневмонию или перейдет в легкую форму. А при неправильном стартовом лечении все ворота для перехода в тяжелую пневмонию открыты. А тяжелая пневмония — это ИВЛ и летальный исход в 80% случаев.
Ирина Кравченко: «Если грипп лечить как коронавирус, то можно очень сильно навредить»
Когда звать врача?
Тем не менее возникает несколько парадоксальная ситуация. С одной стороны, Минздрав ранее обращал внимание на то, что осенью система здравоохранения испытывает высокую нагрузку, так как люди, обеспокоенные эпидемиологической ситуацией, обращаются туда при малейшем недомогании (проблему признают и специалисты — участники сегодняшней пресс-конференции). С другой — обратиться все же нужно.
Ирина Кравченко назвала симптомы, с которыми точно пора звать врача.
— Это высокая температура, нарушение вкуса, обоняния, тяжесть в грудной клетке — с высокой вероятностью говорят о коронавирусной инфекции и требуют вызова врача. Но есть легкие формы, которые могут маскироваться под ОРВИ. Здесь нужно учитывать и эпиданамнез — если на работе или где-то был контакт с больным коронавирусом, то обязательно нужно обратиться к врачу и исключить «корону». Тест-системы сейчас позволяют достаточно быстро пройти обследование и убедиться. Если в семье уже был случай заражения COVID-19, точно надо обращаться. […] Задача пациента — заявить о себе в медицинскую организацию, что есть такие симптомы, и получить рекомендации по лечению.
Решение о тесте на ковид также принимает врач, добавила Кравченко, хотя сейчас ничто не мешает сделать его и самостоятельно, правда, за деньги.
Если у вас температура — вы заявляете в поликлинику однозначно. Вам дают рекомендации в соответствии с симптомами. Если есть необходимость, к вам пришлют сотрудников для забора материала на ковид. Если есть желание, можете сами сходить и сдать, коммерческие лаборатории принимают.
Если есть желание, можете сами сходить и сдать, коммерческие лаборатории принимают.
Главный пульмонолог Минздрава Татарстана, заведующий кафедрой фтизиопульмонологии КГМУ Александр Визель посетовал, что аптечные сети потворствуют тяге народа к самолечению и безрецептурным, но опасным в случае ковида лекарствам.
— Человек приходит в аптеку, аптека продает ему антибиотики или гормональные препараты. Читаю чаты в WhatsApp: «Вот мне доктор назначил, а родственник сказал: «У тебя же пневмония, а там нужны два антибиотика». Это вирусная пневмония, а не бактериальная. Если человек начнет рано принимать антибиотики, он лишает себя возможности спастись от инфекции на поздних этапах, — рассказал Визель.
Тот же «Фавипиравир», который позиционируется как лекарство от коронавируса, специалисты Минздрава Татарстана самостоятельно принимать категорически не советуют.
Самостоятельный прием этих препаратов вообще не показан. Даже в стационаре решение о назначении принимается врачебной комиссией с согласия пациента. Бесконтрольный прием может, во-первых, не иметь требуемого эффекта, во-вторых, иметь серьезные побочные эффекты, добавляет Кравченко.
Бесконтрольный прием может, во-первых, не иметь требуемого эффекта, во-вторых, иметь серьезные побочные эффекты, добавляет Кравченко.
Александр Визель: «Это вирусная пневмония, а не бактериальная. Если человек начнет рано принимать антибиотики, он лишает себя возможности спастись от инфекции на поздних этапах»
Вопросы масок и сатурации
Однако Визель обращает внимание, что самолечение и самодиагностика — разные вещи. Второе он рекомендует поощрять. Например, Визель порекомендовал иметь дома прибор для измерения насыщения крови кислородом (сатурациии), но пользоваться им с умом.
— Устройство называется пульсоксиметр, продается без рецепта. В принципе, очень надежное. Вставил пальчик — и все. Норма — 95 и больше. С холода пришли — может быть и 93. Но это не ковид, это холодные руки. Это не самолечение, а самодиагностика, нужно рекомендовать иметь дома пульсоксиметр. Мы рекомендуем еще со времен свиного гриппа. И еще один момент — если 94—95, то поприседайте, если вверх пошло — вы здоровы, если падает — что-то не в порядке.
Параллельно с этим Визель обратил внимание на то, как нужно пользоваться масками. Ношение красивых «многоразовых» масок от правильного использования очень далеко — если только после каждого раза их не стирают в горячей воде.
— Первое — вы пришли с улицы, вы должны вымыть руки, умыться, сполоснуть рот. Выкинуть маску — вот я сейчас уйду и выкину маску. Не должно быть: когда смотришь, как таксист снял маску, надел, поехал. Маска может быть разносчиком инфекции. Меня, как и других, напрягают эти «многоразовые» красивые маски. Маска должна быть одноразовой. В США если вы идете в магазин в маске с клапаном, то на нее еще заставляют надеть обычную маску. Клапан защищает вас, но не других.
Александр Артемьев, фото tatar-inform.ru
ОбществоМедицина Татарстан
Преходящее тахипноэ новорожденных
ОБЗОР: Что нужно знать каждому практикующему врачу
Вы уверены, что у вашего пациента преходящее тахипноэ новорожденного? Каковы типичные проявления этого заболевания?
Преходящее тахипноэ у новорожденных (TTN) является наиболее частой причиной респираторного дистресса у доношенных детей и часто поражает недоношенных детей. Пораженные пациенты могут также упоминаться как имеющие задержку легочной жидкости плода. TTN возникает в результате нарушения нормального неонатального перехода от внутриутробной жизни к дыханию воздухом.Младенцы, рожденные с помощью планового кесарева сечения, подвергаются значительно повышенному риску. Это диагноз исключения, который ставится только после исключения других причин респираторного дистресса у новорожденного. Наиболее частые симптомы включают:
Пораженные пациенты могут также упоминаться как имеющие задержку легочной жидкости плода. TTN возникает в результате нарушения нормального неонатального перехода от внутриутробной жизни к дыханию воздухом.Младенцы, рожденные с помощью планового кесарева сечения, подвергаются значительно повышенному риску. Это диагноз исключения, который ставится только после исключения других причин респираторного дистресса у новорожденного. Наиболее частые симптомы включают:
Тахипноэ (частота дыхания> 60 вдохов в секунду у новорожденного), развивающееся в первые несколько часов жизни
Повышенная работа дыхания, о чем свидетельствует расширение носа, его втягивание или хрюканье
Гипоксемия (обычно легкая)
Переходный период новорожденного
При рождении новорожденный должен перейти от плацентарного газообмена к легочному за считанные минуты.Однако во время самопроизвольных вагинальных родов процесс в эпителии легких продолжается в течение нескольких дней.
Во время развития легкое является секреторным органом, и секреция легочной жидкости плода необходима для нормального развития легких и способствует увеличению объема амниотической жидкости.
За несколько дней до родов эпителий легких замедляет производство жидкости, постепенно превращаясь в абсорбирующую поверхность. Этот процесс зависит от натриевых каналов (ENac) в эпителии легких.Триггер этого переключения неизвестен, но хорошо известно, что активация гормональных путей (эндогенных кортикостероидов и катехоламинов) происходит, управляя процессом. Это приводит к уменьшению объема легочной жидкости до родов примерно на 40%, а еще 20% удаляется во время родов. Оставшаяся часть жидкости резорбируется сосудистой сетью и лимфатическими сосудами после воздействия растяжения и относительной гипероксии комнатного воздуха. Механические силы, такие как вагинальное сжатие, играют ограниченную роль в этом процессе.
Эти пути развития регулируются, так что недоношенность увеличивает риск отсроченного перехода.
Каковы последствия задержки клиренса легочной жидкости?
Задержанная жидкость вызывает рефлекторную дугу через дыхательный центр, что приводит к тахипноэ. Обычно у этих новорожденных учащенное, поверхностное дыхание, часто превышающее 100 вдохов в минуту. Работа дыхания обычно не увеличивается. Тахипноэ продолжается до тех пор, пока жидкость не будет выведена, но обычно проходит менее чем через 72 часа после рождения.У некоторых младенцев может развиться вторичная легочная гипертензия, и у них может быть более сложное клиническое течение с гипоксией / респираторным дистрессом, требующим дополнительной поддержки.
Какое другое заболевание / состояние имеет некоторые из этих симптомов?
Существует множество причин респираторного дистресса у новорожденного, которые требуют специального лечения и могут быть опасными для жизни. Хотя клинические проявления часто более серьезны, чем при TTN, они в значительной степени перекрываются.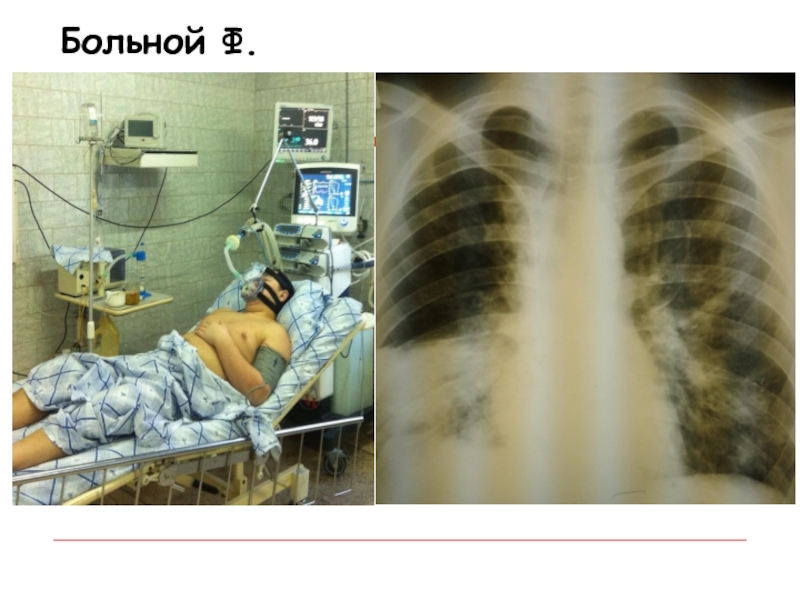
• пневмония или сепсис
У новорожденного присутствуют бактериальные и вирусные причины; Общие патогены включают Streptococcus группы B (GBS), Listeria, Escherichia coli и вирус простого герпеса
Анамнез родов может выявить лихорадку у матери или тахикардию плода, но также может быть неспецифическим
Часто сопровождается системными признаками и симптомами
Рентгенограмма грудной клетки также неспецифична; долевые инфильтраты редко встречаются у новорожденных
• респираторный дистресс-синдром (РДС)
Дефицит поверхностно-активного вещества или болезнь гиалиновых мембран
В первую очередь болезнь недоношенных, но могут поражаться доношенные дети
Более выраженный респираторный дистресс с задержкой CO2
Рентген грудной клетки обычно имеет зернистый вид, воздушные бронхограммы и гипоаэрацию
• аспирационные синдромы
Аспирация мекония, аспирация крови или амниотической жидкости
Должно быть подтверждено из истории болезни и рентгенологического исследования
Повышенный риск легочной гипертензии
• пневмоторакс
Утечка воздуха может быть результатом любой причины респираторного расстройства, включая TTN, но также может быть спонтанной или вторичной по отношению к поддержке положительным давлением
Рентген грудной клетки диагностический
• врожденные пороки легкого / грудной клетки
Врожденная диафрагмальная грыжа (ВДГ), Врожденная аномалия легочных дыхательных путей (ВРАМ), Бронхолегочная секвестрация, другие
Если дистресс возникает в неонатальном периоде, часто требуется раннее хирургическое вмешательство.
Врожденные аномалии грудной стенки и гипоплазия легких часто проявляются в неонатальном периоде.
• легочная гипертензия
Отсутствие падения давления в легочных сосудах вызывает шунтирование справа налево и последующую гипоксию, которая часто бывает тяжелой.
Часто вторично по отношению к другой причине респираторной недостаточности; также может быть основной проблемой
• врожденный порок сердца
Может иметь место выраженная гипоксия с более легкой формой респираторного дистресса, также может иметь место системное заболевание
Оксигенация обычно не улучшается или улучшается лишь незначительно при добавлении кислорода.
Рентген грудной клетки и ЭКГ могут помочь в диагностике. Эхокардиограмма диагностическая.
• метаболические нарушения
Гипокальциемия и гипогликемия
Метаболический ацидоз любой причины может привести к тахипноэ.
Церебральные причины тахипноэ часто связаны с алкалозом.
Что послужило причиной развития этой болезни в это время?
Клинический анамнез часто свидетельствует о TTN. Многие связанные с этим факторы риска нарушают нормальный процесс родов или вызывают относительную незрелость младенца.Диагноз чаще всего встречается у младенцев, родившихся с помощью планового кесарева сечения при отсутствии родов, хотя он может возникнуть у младенцев, родившихся после спонтанных родов, и у младенцев, родившихся естественным путем. Недоношенные дети (<36-6 / 7 недель) и недоношенные дети (37-38-6 / 7 недель) подвержены повышенному риску. Другие хорошо задокументированные факторы риска развития TTN включают отсутствие разрыва плодных оболочек, мужской пол, астму у матери, диабет у матери и преэклампсию у матери.
Какие лабораторные исследования следует запросить для подтверждения диагноза? Как следует интерпретировать результаты?
Первоначально может наблюдаться младенец с умеренным тахипноэ, без гипоксии и системно здоровый.
 Если тахипноэ сопровождается респираторной недостаточностью, сохраняется более 6 часов или связано с другими симптомами, то показаны лабораторные исследования. Для выявления инфекционной этиологии необходимо сделать общий анализ крови (ОАК) с дифференциальным и посевом. Пациенты с TTN обычно имеют нормальный общий анализ крови без увеличения количества лейкоцитов или незрелых клеток. Полицитемия также может вызывать респираторный дистресс и, если она значительна, может потребоваться обменное переливание.
Если тахипноэ сопровождается респираторной недостаточностью, сохраняется более 6 часов или связано с другими симптомами, то показаны лабораторные исследования. Для выявления инфекционной этиологии необходимо сделать общий анализ крови (ОАК) с дифференциальным и посевом. Пациенты с TTN обычно имеют нормальный общий анализ крови без увеличения количества лейкоцитов или незрелых клеток. Полицитемия также может вызывать респираторный дистресс и, если она значительна, может потребоваться обменное переливание.Если гипоксия развивается, требуя дополнительного кислорода, следует выполнить анализ газов артериальной крови (ГКК) для оценки оксигенации, вентиляции и выявления ацидоза.Тяжелые нарушения оксигенации и вентиляции необычны для TTN, но могут возникать. Это также поможет в дальнейшем лечении, таком как усиление респираторной поддержки или интубация.
У детей грудного возраста с длительным тахипноэ или факторами риска (например, у матери, страдающей диабетом), следует провести биохимический анализ и определить уровень глюкозы в крови.

Нет доступных тестов, подтверждающих диагноз TTN. Скорее, предполагаемый анамнез, нормальная лабораторная оценка, типичные результаты рентгенографии грудной клетки (см. Ниже) и, в конечном итоге, типичный курс с полным выздоровлением через 48-72 часа подтвердят диагноз.
Были бы полезны визуализирующие исследования? Если да, то какие?
У младенцев с подозрением на TTN следует выполнять рентгенографию грудной клетки. Это необходимо для оценки других причин тахипноэ (например, анатомических аномалий, пневмоторакса, пневмонии). Типичные результаты также могут помочь подтвердить диагноз TTN. Обычно достаточно одной переднезадней пленки, хотя боковая пленка может быть полезна при идентификации пневмомедиастинума или пневмоторакса.Если состояние ребенка улучшается в течение следующих 24-72 часов, повторная визуализация не требуется.
На данном рентгенологическом исследовании (рис.
 1) обнаружены многие из находок, типичных для TTN, включая усиление перихилярной маркировки, полосатое помутнение, гиперинфляцию с уплощенными диафрагмами и остаточную плевральную жидкость в междолевых трещинах (см. Справа).
1) обнаружены многие из находок, типичных для TTN, включая усиление перихилярной маркировки, полосатое помутнение, гиперинфляцию с уплощенными диафрагмами и остаточную плевральную жидкость в междолевых трещинах (см. Справа).
Рисунок 1.
Типичный рентген грудной клетки у младенца с TTN
Подтверждение диагноза
Не существует конкретных клинических алгоритмов диагностики или лечения TTN.Поддерживающая терапия — это основа лечения с исключением, по возможности, других причин респираторной недостаточности. Окончательный диагноз может быть поставлен только после исключения других причин тахипноэ и полного выздоровления пациента.
Если вы можете подтвердить, что у пациента преходящее тахипноэ новорожденных, какое лечение следует начать?
Поддерживающая терапия
Основой лечения TTN является поддерживающая терапия.
 Младенцы с изолированным тахипноэ без гипоксемии могут быть не в состоянии кормить и нуждаться в внутривенной гидратации, даже если респираторная поддержка не требуется. В общем, если тахипноэ не улучшилось к 6 часам жизни или есть какие-либо симптомы гипогликемии, следует начать внутривенное введение жидкости, содержащей декстрозу. Приготовление 10% раствора декстрозы без электролитов подходит для новорожденного в нулевой день жизни из расчета от 60 до 80 мл / кг / день. Пока диагноз TTN не будет уточнен, младенцев часто следует лечить антибиотиками.Ампициллин, который охватывает стрептококки группы B и листерии, обычно используется в сочетании с грамотрицательными агентами, такими как гентамицин.
Младенцы с изолированным тахипноэ без гипоксемии могут быть не в состоянии кормить и нуждаться в внутривенной гидратации, даже если респираторная поддержка не требуется. В общем, если тахипноэ не улучшилось к 6 часам жизни или есть какие-либо симптомы гипогликемии, следует начать внутривенное введение жидкости, содержащей декстрозу. Приготовление 10% раствора декстрозы без электролитов подходит для новорожденного в нулевой день жизни из расчета от 60 до 80 мл / кг / день. Пока диагноз TTN не будет уточнен, младенцев часто следует лечить антибиотиками.Ампициллин, который охватывает стрептококки группы B и листерии, обычно используется в сочетании с грамотрицательными агентами, такими как гентамицин.В степени респираторной поддержки следует руководствоваться степенью заболевания. Само по себе тахипноэ может не требовать специального лечения. Следует использовать пульсоксиметрию и обеспечивать дополнительный кислород для поддержания насыщения кислородом выше 90%. Это можно сделать через назальную канюлю или кислородный колпак.
 С осторожностью следует использовать высокие уровни кислородной добавки, например, при помощи 100% кислородного вытяжного шкафа.
С осторожностью следует использовать высокие уровни кислородной добавки, например, при помощи 100% кислородного вытяжного шкафа.Младенцы с признаками дистресса, отличными от тахипноэ, такими как хрюканье или втягивание, или потребность в кислороде> 40% кислорода, должны быть обследованы с помощью анализа газов артериальной крови. Может потребоваться дополнительная поддержка, такая как постоянное положительное давление в дыхательных путях через нос (NCPAP) или интубация. Этим младенцам также следует выполнить рентгенографию.
Пневмоторакс — редкое, но серьезное потенциальное осложнение ТТН. Если степень недомогания легкая, этого следует придерживаться.Исторически вымывание азотом захваченного воздуха с помощью 100% кислородного колпака использовалось для ускорения разрешения пневмоторакса. Этот метод изучен недостаточно. Учитывая известные опасности воздействия 100% кислорода, включая образование свободных радикалов и развитие ателектаза, сейчас это вызывает споры.
 Большие и симптоматические утечки воздуха могут потребовать декомпрессии иглы или установки дренажной трубки.
Большие и симптоматические утечки воздуха могут потребовать декомпрессии иглы или установки дренажной трубки.
Специальная терапия
Никакие специфические методы лечения не считаются стандартом лечения TTN.Небольшие исследования, проведенные с применением Lasix (перорально и внутривенно), показали увеличение потери веса, но не повлияли на продолжительность симптомов или потребность в респираторной поддержке. Знание о роли катехоламинов в клиренсе легочной жидкости привело к недавним пилотным исследованиям с использованием вдыхаемого адреналина и бета-2-агониста сальбутамола. Лечение эпинефрином не повлияло на результаты, но в пилотном исследовании ингаляционный сальбутамол снизил максимальную потребность в кислороде и продолжительность пребывания в небольшой группе пациентов. Необходимы дальнейшие исследования.
Какие побочные эффекты связаны с каждым вариантом лечения?
В типичных случаях ТТН легкой и средней степени тяжести, когда добавление жидкости внутривенно и ограниченное количество респираторной поддержки являются единственными необходимыми методами лечения, серьезные побочные эффекты возникают редко. Однако эти методы лечения требуют приема в отделение интенсивной терапии, отделения от семьи и прерывания ранних отношений и кормления. Пока диагноз не станет ясным, младенцев часто лечат внутривенными антибиотиками, в которых, в конечном счете, нет необходимости.Прием, лечение и длительное пребывание в больнице требует значительных финансовых затрат, которых можно избежать, поскольку некоторых случаев TTN можно избежать.
Однако эти методы лечения требуют приема в отделение интенсивной терапии, отделения от семьи и прерывания ранних отношений и кормления. Пока диагноз не станет ясным, младенцев часто лечат внутривенными антибиотиками, в которых, в конечном счете, нет необходимости.Прием, лечение и длительное пребывание в больнице требует значительных финансовых затрат, которых можно избежать, поскольку некоторых случаев TTN можно избежать.
В очень необычных случаях у новорожденных с клиническим анамнезом, лабораторными исследованиями и результатами рентгенологического исследования грудной клетки, классическими для преходящего тахипноэ новорожденных, разовьется тяжелая гипоксемия, требующая значительной респираторной поддержки, включая интубацию. Интубация сопряжена с риском травмы гортани и голосовых связок и увеличивает риск последующей пневмонии.Воздействие высокой доли вдыхаемого кислорода, даже при необходимости, может вызвать обострение воспаления легких, выработку свободных радикалов и, в конечном итоге, более высокий риск хронических заболеваний легких.
Младенцы с этой тяжелой версией TTN также подвержены риску замедленного расслабления легочной сосудистой сети, что приводит к легочной гипертензии. Это можно лечить кислородом, вдыханием оксида азота и, в конечном итоге, экстракорпоральной мембранной оксигенацией (ЭКМО). ЭКМО требует антикоагуляции, а риск смертельного внутричерепного кровоизлияния у новорожденного составляет примерно 5%.
Каковы возможные исходы транзиторного тахипноэ у новорожденных?
Прогноз преходящего тахипноэ у новорожденных в целом отличный, полное выздоровление ожидается у трех четвертей пострадавших младенцев к 48 часам жизни. Пребывание в больнице младенцев, получающих лечение от TTN, обычно на день или два дольше, чем для здоровых доношенных детей, но ожидается, что у младенцев с TTN не будут развиваться долгосрочные последствия болезни. Реже тахипноэ может быть продолжительным и требует длительного пребывания в больнице.Младенцы, которым требуется длительная респираторная поддержка и назогастральное кормление, часто имеют слабые оромоторные навыки, хотя обычно это временное явление. Младенцы с TTN необычной степени тяжести, требующие интубации, значительной респираторной поддержки или даже терапии ЭКМО, могут иметь значительные остаточные заболевания легких в младенчестве и детстве.
Младенцы с TTN необычной степени тяжести, требующие интубации, значительной респираторной поддержки или даже терапии ЭКМО, могут иметь значительные остаточные заболевания легких в младенчестве и детстве.
Что вызывает это заболевание и как часто оно встречается?
Имеются ограниченные данные о точной частоте преходящего тахипноэ у новорожденных, но, по оценкам, оно затрагивает около 5/1000 (0.5%) доношенные дети. Заболеваемость среди лиц с факторами риска значительно выше. Это наиболее частая этиология респираторного дистресс-синдрома у доношенных новорожденных и вторая по частоте у недоношенных новорожденных. Заболеваемость на сроке 34 недели оценивается в 6,4%, частота снижается с увеличением срока беременности. На 39 неделе беременности оценочная частота TTN составляет всего 0,3% в сочетании для всех типов родов.
Плановое кесарево сечение является известным изменяемым фактором риска TTN на всех сроках беременности.
 Даже на 39 неделе частота TTN в этой популяции оценивается в 2,7%, что почти в десять раз больше, чем в целом. Существуют разногласия по поводу того, являются ли роды до кесарева сечения (вторичное кесарево сечение) защитными. У этих младенцев частота респираторных заболеваний находится на промежуточном уровне между младенцами, родившимися через естественные родовые пути, и младенцами, родившимися в плановом порядке.
Даже на 39 неделе частота TTN в этой популяции оценивается в 2,7%, что почти в десять раз больше, чем в целом. Существуют разногласия по поводу того, являются ли роды до кесарева сечения (вторичное кесарево сечение) защитными. У этих младенцев частота респираторных заболеваний находится на промежуточном уровне между младенцами, родившимися через естественные родовые пути, и младенцами, родившимися в плановом порядке.Эпидемиологические данные свидетельствуют о генетическом вкладе в развитие преходящего тахипноэ у новорожденных.Наблюдается семейная группировка необъяснимых случаев TTN. Семейный анамнез астмы, особенно у матери, также связан с повышенным риском ее развития. Изученные полиморфизмы генов сурфактантного белка B (SPB) и эпителиальных натриевых каналов (ENac) не были связаны, в то время как потеря функции полиморфизма бета-адренорецепторов наблюдалась все чаще у доношенных детей, у которых был диагностирован TTN. . Генетические исследования ограничены и в настоящее время доступны только на экспериментальной основе.

Как эти патогены / гены / воздействия вызывают болезнь?
Считается, что основным патофизиологическим фактором, связанным с TTN, является отсроченное резорбция легочной жидкости плода. Гормональные изменения, которые происходят до и во время самопроизвольных родов, играют ключевую роль в этом процессе. Повышенный уровень стероидных гормонов и циркулирующих катехоламинов приводит к усилению транскрипции генов и снижению деградации основных эпителиальных натриевых каналов (ENac), резорбции жидкости в легких плода и подготовке к дыханию.Практика, препятствующая самопроизвольным родам, например плановое кесарево сечение, задержит этот переход.
Другим причинным фактором замедленного выведения жидкости из легких плода является недоношенность. Системы, с помощью которых происходит выведение жидкости, регулируются в процессе развития, так что недоношенный ребенок не так хорошо подготовлен к реакции на роды.
 Подача каналов ENac, которые играют критическую роль в резорбции жидкости, у недоношенных младенцев ниже и со временем необходимо увеличивать.Причины незрелости легких у доношенных детей, такие как материнский диабет и врожденная диафрагмальная грыжа, также связаны с задержкой клиренса легочной жидкости.
Подача каналов ENac, которые играют критическую роль в резорбции жидкости, у недоношенных младенцев ниже и со временем необходимо увеличивать.Причины незрелости легких у доношенных детей, такие как материнский диабет и врожденная диафрагмальная грыжа, также связаны с задержкой клиренса легочной жидкости.Генетический вклад также, вероятно, играет большую роль в том, что младенцы, рожденные в аналогичных обстоятельствах, имеют клинические симптомы и диагностированы TTN. Знания пока ограничены. Аномалии любого из генов, участвующих в начале родов, подготовке ребенка к родам или неонатальном переходе, могут легко привести к развитию TTN.Поскольку сами роды плохо изучены, многие из этих генов еще не известны.
Другие клинические проявления, которые могут помочь в диагностике и лечении
У некоторых младенцев наблюдается тахипноэ, перемежающееся приступами апноэ. Усталость дыхательных мышц была предложена как возможная причина, но исследований, подтверждающих такую связь, как правило, недостаточно. Младенцы с TTN могут иметь проблемы с началом перорального кормления и имеют более высокий риск связанных с этим осложнений, таких как гипогликемия и выраженная физиологическая желтуха.
Младенцы с TTN могут иметь проблемы с началом перорального кормления и имеют более высокий риск связанных с этим осложнений, таких как гипогликемия и выраженная физиологическая желтуха.
Какие осложнения вы можете ожидать от болезни или лечения болезни?
Так как заболевание часто проходит самостоятельно и проходит доброкачественно, лечение не рекомендуется. Риски, связанные с высокой концентрацией кислорода и вентиляцией с положительным давлением, относительно редки, но могут вызвать серьезные осложнения.
Доступны ли дополнительные лабораторные исследования; даже те, которые не широко доступны?
Периодически проводятся научные исследования, включающие генетическое тестирование или химию легких у пораженных младенцев, включая выработку сурфактанта.Ни один из этих тестов в настоящее время не является клинически полезным.
Как можно предотвратить преходящее тахипноэ у новорожденных?
Один из ключей к профилактике TTN — ограничение кесарева сечения, когда это возможно, и планирование плановых кесарева сечения, когда это будет сочтено необходимым, на 39 неделе беременности или после нее. Ретроспективные исследования ясно показали, что все роды через кесарево сечение связаны с повышенным уровнем респираторных заболеваний новорожденных. Это не полностью устраняется присутствием родов до родов.При рассмотрении вопроса о первичном кесаревом сечении необходимо учитывать множество факторов, влияющих на здоровье матери и плода.
Ретроспективные исследования ясно показали, что все роды через кесарево сечение связаны с повышенным уровнем респираторных заболеваний новорожденных. Это не полностью устраняется присутствием родов до родов.При рассмотрении вопроса о первичном кесаревом сечении необходимо учитывать множество факторов, влияющих на здоровье матери и плода.
Роль пренатального бетаметазона, хорошо известного в улучшении заболеваемости из-за респираторного дистресс-синдрома у недоношенных детей, была оценена как потенциальное лечение TTN, особенно того, которое происходит после планового кесарева сечения. Пренатальное введение стероидов младенцам, родившимся в позднем недоношенном периоде (от 34 до 36-6 / 7 недель), не снижает риск респираторного дистресс-синдрома (RDS), хотя большинство исследований не позволяли оценить снижение TTN.Одно рандомизированное исследование было проведено в популяции терминальных больных. Было показано, что бетаметазон перед плановым кесаревым сечением снижает риск поступления в отделение интенсивной терапии по поводу респираторного дистресс-синдрома, но не снижает общую частоту госпитализации в отделение интенсивной терапии. Такая терапия со временем может стать стандартной практикой, но необходимо провести дополнительные исследования. Еще одно крупное исследование, спонсируемое Национальными институтами здравоохранения, оценивает роль антенатального бетаметазона при поздних преждевременных родах.
Такая терапия со временем может стать стандартной практикой, но необходимо провести дополнительные исследования. Еще одно крупное исследование, спонсируемое Национальными институтами здравоохранения, оценивает роль антенатального бетаметазона при поздних преждевременных родах.
Какие доказательства?
Тита, АТ, Лэндон, МБ, Спонг, СЮ.«Сроки планового повторного кесарева сечения при доношенных и неонатальных исходах». N Engl J Med. т. 360. 2009. С. 111-20. • Это когортное исследование неонатальных заболеваний у 13 528 доношенных новорожденных, рожденных после планового повторного кесарева сечения. Частота всех неонатальных заболеваний, включая респираторные осложнения, TTN и госпитализацию в отделение интенсивной терапии, была значительно выше у младенцев, родившихся на 37 и 38 неделях, по сравнению с надиром на 39-40 неделях. Частота TTN составила 4,8% на 37 неделе, 3,9% на 38 неделе и 2.7% на 39 неделе (p для тенденции <0,001). Эти данные подтверждают рекомендацию ACOG, в которой не рекомендуется проводить чисто плановое кесарево сечение до 39 недель беременности.
Эти данные подтверждают рекомендацию ACOG, в которой не рекомендуется проводить чисто плановое кесарево сечение до 39 недель беременности.
Hibbard, JU, Wilkins, I, Sun, L. «Заболеваемость респираторными заболеваниями при поздних преждевременных родах». JAMA. т. 304. 2010. С. 419-25. • Сбор ретроспективных данных проводился по 233 844 родам, из которых 19 334 были недоношенными (LPT) новорожденными (от 34 до 36-6 / 7 недель), которые сравнивались с доношенными детьми. Показатели материнской заболеваемости и кесарева сечения без родов были выше у поздних недоношенных.Респираторные осложнения были частыми, чаще всего RDS (респираторный дистресс-синдром), за которым следовали TTN, которые имели OR 14,7 (11,7-18,4) на 34 неделе, 11,1 (9,1-13,6) на 35 неделе и 6,1 (5,1-7,4) на 36 недель по сравнению с младенцами, родившимися на сроке от 39 до 40 недель (все способы родоразрешения).
Тутдиби, Э., Грис, К., Бюхелер, М. «Влияние родов на исходы при преходящем тахипноэ у новорожденных: популяционное исследование». Педиатрия. т. 125. 2010. С. e577-83. • Данные, собранные из перинатальных и неонатальных баз данных, выявили 1423 доношенных ребенка (> 37 недель) с диагнозом TTN, что составляет 5 случаев.9/1000 населения. Влияние наличия или отсутствия родов изучалось путем сравнения младенцев, рожденных после первичного кесарева сечения (CD), с младенцами, родившимися после родов естественным путем или путем вторичного сечения. Риск TTN был значительно увеличен в группе CD; этот риск был дополнительно увеличен у младенцев по сравнению с детьми, родившимися после 40 недель беременности. Младенцы с CD также имели повышенную тяжесть TTN, о чем свидетельствует более длительная потребность в кислороде (p <0,02) и повышенная частота искусственной вентиляции легких (p <0.002).
Педиатрия. т. 125. 2010. С. e577-83. • Данные, собранные из перинатальных и неонатальных баз данных, выявили 1423 доношенных ребенка (> 37 недель) с диагнозом TTN, что составляет 5 случаев.9/1000 населения. Влияние наличия или отсутствия родов изучалось путем сравнения младенцев, рожденных после первичного кесарева сечения (CD), с младенцами, родившимися после родов естественным путем или путем вторичного сечения. Риск TTN был значительно увеличен в группе CD; этот риск был дополнительно увеличен у младенцев по сравнению с детьми, родившимися после 40 недель беременности. Младенцы с CD также имели повышенную тяжесть TTN, о чем свидетельствует более длительная потребность в кислороде (p <0,02) и повышенная частота искусственной вентиляции легких (p <0.002).
Силаси, М., Кунрод, Д.В., Ким, М., Драхман, Д. «Преходящее тахипноэ у новорожденного: защищают ли роды до кесарева сечения?». Am J Perinatol. т. 27. 2010. С. 797-802. • Исследование случай-контроль с использованием записей о рождении было проведено на 1600 младенцах, срок беременности от 35 до 41 недели, у 800 детей был диагностирован TTN.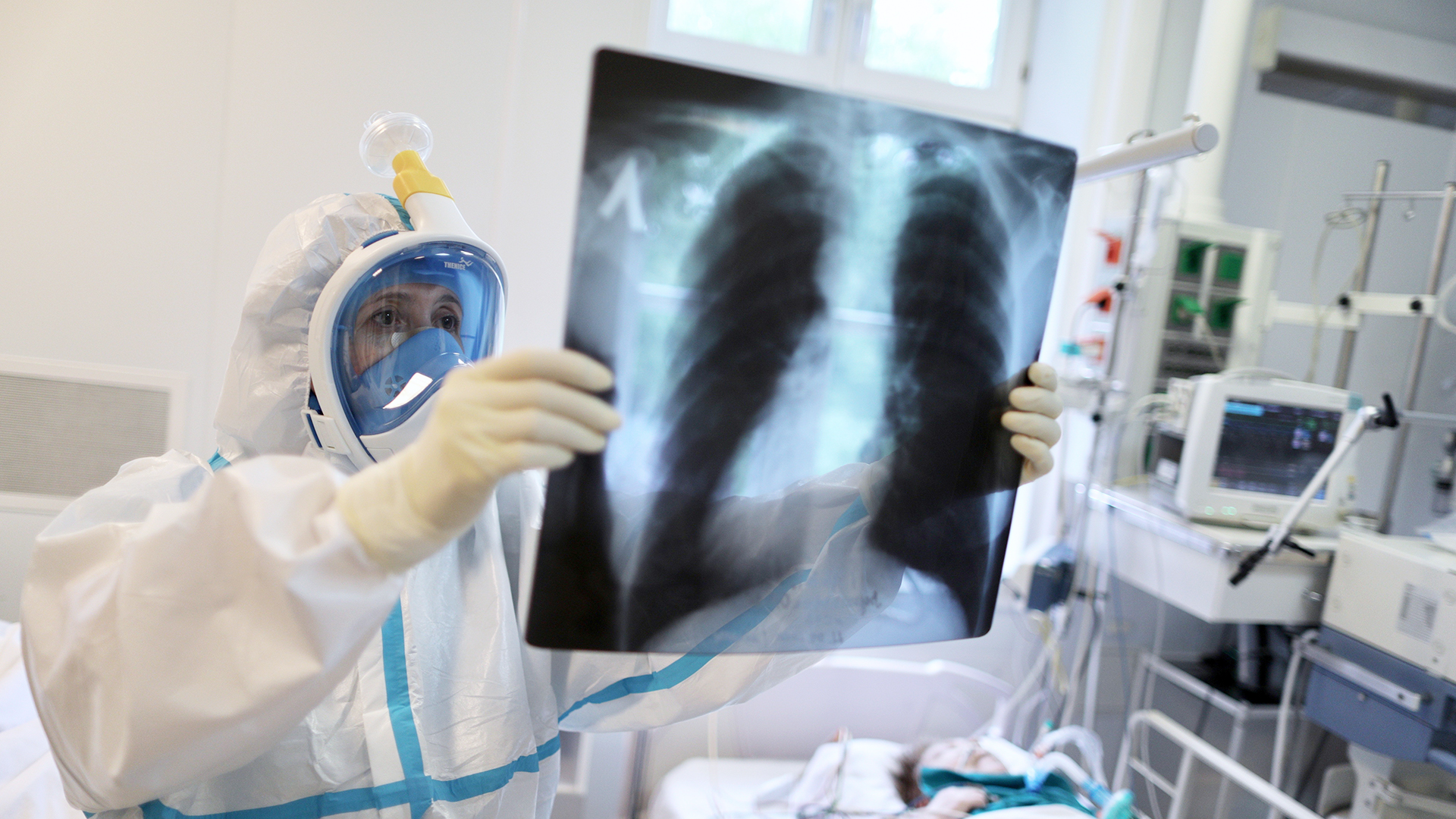 Кесарево сечение было связано с повышенным риском TTN [OR 2,58 (1,99 -3,36)], но это не компенсировалось наличием родов до кесарева сечения.
Кесарево сечение было связано с повышенным риском TTN [OR 2,58 (1,99 -3,36)], но это не компенсировалось наличием родов до кесарева сечения.
Статчфилд, П., Уитакер, Р., Рассел, И. «Антенатальный бетаметазон и частота респираторного дистресс-синдрома новорожденных после планового кесарева сечения: прагматическое рандомизированное исследование». BMJ. т. 331. 2005. pp. 662 • В этом рандомизированном неслепом исследовании сравнивались результаты для младенцев, рожденных посредством планового кесарева сечения (после 37 недель), которые получали пренатальный бетаметазон, с группой плацебо, не получавшей этого. Средний срок беременности при родах составлял 38-3 / 7 недель. Бетаметазон снизил частоту госпитализаций в отделение интенсивной терапии по поводу респираторных осложнений (p = 0.02), но исследование было недостаточно мощным для выявления различий в конкретных диагнозах, таких как TTN и RDS. Однако общая частота госпитализаций в ОИТН по всем причинам не различалась между двумя группами. Заболевания чаще встречались в обеих группах на 37 и 38 неделях по сравнению с 39 неделями.
Заболевания чаще встречались в обеих группах на 37 и 38 неделях по сравнению с 39 неделями.
Армангил, Д., Юрдакок, М., Коркмаз, А. «Ингаляционный бета-2 агонист сальбутамол для лечения преходящего тахипноэ у новорожденных». J Pediatr. т. 159. 2011. С. 398-403. • В этом пилотном исследовании было рандомизировано 54 ребенка в возрасте 34–39 недель для лечения однократной дозой ингаляционного сальбутамола или солевого раствора плацебо.32 младенца получили лечение и были обследованы через четыре часа. Были обнаружены статистически значимые изменения частоты дыхания и доли вдыхаемого кислорода, а также более короткая продолжительность пребывания в стационаре в группе лечения. В этом пилотном исследовании не было замечено значительных побочных эффектов, и авторы пришли к выводу, что необходимы более масштабные исследования.
Продолжающиеся споры относительно этиологии, диагностики и лечения
Во-первых, продолжаются споры о высокой частоте кесарева сечения, как первичных, так и повторных, которые, несомненно, увеличили частоту TTN. Сторонники оперативных родов считают, что эти вмешательства уменьшили разрыв матки, мертворождение и асфиксию при рождении. Однако абсолютное количество этих, возможно, серьезных осложнений невелико по сравнению с гораздо более частыми осложнениями, такими как TTN. Неясно, где находится идеальный баланс для кесарева сечения и искусственных родов.
Сторонники оперативных родов считают, что эти вмешательства уменьшили разрыв матки, мертворождение и асфиксию при рождении. Однако абсолютное количество этих, возможно, серьезных осложнений невелико по сравнению с гораздо более частыми осложнениями, такими как TTN. Неясно, где находится идеальный баланс для кесарева сечения и искусственных родов.
Во-вторых, многие центры предлагают раннюю и агрессивную респираторную поддержку кислородом / положительным давлением новорожденным с симптомами.Высокие концентрации кислорода, вводимые в вытяжные шкафы / палатки, могут привести к прогрессирующему ателектазу из-за вымывания азота из альвеолярных пространств. Существует дополнительный риск кислородного отравления свободными радикалами. Ателектаз можно предотвратить с помощью СИПАП при использовании высоких концентраций кислорода (> 40%), но влечет за собой риск утечки воздуха.
Наконец, фундаментальные научные исследования показывают, что антенатальные стероиды должны улучшать клиренс легочной жидкости и способствовать неонатальному переходу, особенно в ситуациях, когда выброс эндогенных стероидов не произошел (как при плановом кесаревом сечении). Потребуются дополнительные исследования, чтобы оценить долгосрочные риски воздействия стероидов на большое количество матерей и их плодов, прежде чем можно будет рекомендовать такое лечение.
Потребуются дополнительные исследования, чтобы оценить долгосрочные риски воздействия стероидов на большое количество матерей и их плодов, прежде чем можно будет рекомендовать такое лечение.
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
Тахипноэ: причины, симптомы и лечение
Тахипноэ — это медицинский термин, обозначающий учащенное поверхностное дыхание.Недостаток кислорода или слишком много углекислого газа в организме — частая причина. Это также может быть следствием других проблем со здоровьем. Тахипноэ — это не болезнь, а симптом того, что организм пытается исправить другую проблему.
У новорожденных с развивающимися легкими после рождения может быть тахипноэ. У детей может развиться тахипноэ, если вирусная респираторная инфекция вызывает жар или хрипы. Бронхит и астма также могут вызывать тахипноэ у детей.
Бронхит и астма также могут вызывать тахипноэ у детей.
В целом, тахипноэ могут вызывать многие состояния, включая пневмонию на ранних стадиях.
Основные симптомы:
- ощущение одышки
- синий оттенок пальцев и губ
- втягивание или втягивание грудной клетки при дыхании
Многие заболевания и состояния, вызывающие тахипноэ, поддаются лечению. Ниже приведены некоторые из наиболее частых причин.
Одна из причин, по которой человек дышит быстрее, чем обычно, — это потреблять больше кислорода. Уровень кислорода в организме может быть слишком низким или уровень углекислого газа может быть слишком высоким.Организм пытается исправить это, дыша быстрее.
При некоторых заболеваниях легких снижается содержание кислорода в крови или повышается уровень углекислого газа, вызывая тахипноэ.
Эти заболевания и состояния включают:
Когда у новорожденного появляется тахипноэ, врачи обычно называют это преходящим тахипноэ новорожденного (TTN). Это имеет тенденцию развиваться в течение первых 24 часов после рождения.
Это имеет тенденцию развиваться в течение первых 24 часов после рождения.
TTN возникает из-за того, что легкие ребенка пытаются получить дополнительный кислород.
Во время развития в утробе легкие содержат жидкость.Когда ребенок достигает срока, его тело начинает поглощать жидкость, чтобы его легкие могли подготовиться к дыханию воздухом после рождения.
У некоторых новорожденных эта жидкость не всасывается полностью, что приводит к учащенному дыханию.
TTN у новорожденных также может вызывать:
- синий цвет лица, особенно губ и носа
- шумное дыхание, включая хрюканье или стоны
- втягивание грудной клетки при дыхании
- приподнимание головы и вниз
- расширенные ноздри
Врачи могут лечить TTN в больнице дополнительным кислородом, а ребенку может потребоваться помощь в отделении интенсивной терапии новорожденных.
TTN обычно быстро разрешается при правильной медицинской помощи. Младенцам, родившимся очень преждевременно, может потребоваться более длительное пребывание в больнице, поскольку их легкие продолжают развиваться.
У детей такие заболевания, как грипп, бронхит или респираторно-синцитиальный вирус, могут вызывать тахипноэ.
Согласно некоторым исследованиям, проведенным в 2009 году, дети, посещающие детские сады с раннего возраста, как правило, чаще заражаются этими заболеваниями до достижения ими 4-летнего возраста. Однако по сравнению с другими детьми у этой группы может быть меньше симптомов, связанных с дыхательными путями, поскольку они стареют.
Если лицо, осуществляющее уход, замечает учащенное дыхание, синий оттенок кожи или тянущее усилие в груди, ему следует обратиться за медицинской помощью. Ребенку может потребоваться лечение, чтобы открыть дыхательные пути или иным образом повысить уровень кислорода.
Врач может измерить уровень кислорода у ребенка или назначить рентген грудной клетки для проверки на пневмонию. Они также учтут любые другие симптомы при определении причины учащенного дыхания. Ребенку может потребоваться дополнительный кислород в больнице.
Тахипноэ может быть способом охлаждения организма из-за лихорадки или жаркой окружающей среды.
Если человек становится перегретым из-за факторов окружающей среды, врачи называют это неотложной медицинской помощью.
Тахипноэ — лишь один из симптомов перегрева. Другие включают:
- мышечные судороги
- головокружение
- спутанность сознания
- сильная жажда
- головная боль
- потливость
- обморок или потеря сознания
- тошнота или рвота
- отсутствие высокой температуры тела
9 припадки
9 а , даже если человек чувствует себя горячим
Некоторые из этих симптомов указывают на риск теплового удара, который требует неотложной медицинской помощи.Всем, кто подозревает, что у человека тепловой удар, следует обратиться за неотложной медицинской помощью.
Лихорадка наряду с тахипноэ не всегда является поводом для беспокойства, поскольку эти симптомы могут быть следствием легких заболеваний. Тем не менее, лица, ухаживающие за маленькими детьми, всегда должны поговорить с педиатром, если у ребенка жар или тахипноэ. Это для исключения серьезных проблем.
Тем не менее, лица, ухаживающие за маленькими детьми, всегда должны поговорить с педиатром, если у ребенка жар или тахипноэ. Это для исключения серьезных проблем.
Если ребенок также хрипит, втягивает грудную клетку или у него посинели губы или пальцы, немедленно обратитесь за медицинской помощью.
Сепсис — это крайняя реакция иммунной системы на болезнь или инфекцию.
Когда иммунная система обнаруживает инфекцию, она посылает химические вещества в кровь. Они вызывают воспаление во всем теле и могут мешать кровотоку к жизненно важным органам.
Сепсис может быть причиной тахипноэ, если человек также имеет:
- недавно перенёс болезнь или инфекцию, например пневмонию или инфекцию мочевыводящих путей
- лихорадка выше 101 ° F
- учащенное сердцебиение
- озноб
- путаница
Группы с более высоким риском сепсиса включают:
- детей младшего возраста
- людей с другими заболеваниями
- людей с ослабленной иммунной системой
- людей старше 65 лет
Всем с симптомами сепсиса следует получить неотложную медицинскую помощь, поскольку сепсис опасен для жизни.
Организм поддерживает баланс кислоты в крови, и если уровень слишком высок, человек может быстро дышать. Это способ организма избавиться от углекислого газа, который может вызвать повышение уровня кислоты.
К состояниям здоровья, которые могут повысить уровень кислоты в крови, относятся:
- диабетический кетоацидоз, который чаще всего возникает у людей с диабетом 1 типа
- лактоацидоз, который может возникнуть в результате другого заболевания, такого как сепсис, рак, или болезнь сердца
- печеночная энцефалопатия, которая может возникнуть в результате прогрессирующего заболевания печени
Если человек страдает таким заболеванием, как диабет, болезнь сердца, болезнь печени или рак, и быстро дышит, обратитесь за неотложной медицинской помощью.
Человек с паническим расстройством, генерализованным тревожным расстройством или расстройством, связанным с фобией, может испытывать тахипноэ во время панической атаки. Это может произойти без предупреждения и вызвать:
- сильный страх
- дрожь
- учащенное сердцебиение
- головокружение или дурноту
- тошноту
- озноб или потливость
- стеснение в груди
тахипноэ обычно проходит, когда паническая атака закончилась.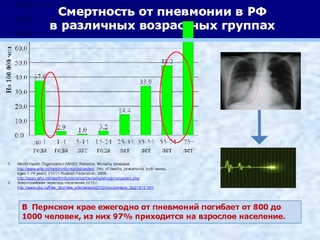
Паническая атака может случиться с кем угодно, в том числе с людьми, у которых психическое состояние не диагностировано.
Знание, как справиться с панической атакой, и обращение за лечением могут помочь человеку справиться с симптомами и улучшить качество жизни.
Национальный институт психического здоровья заявляет, что без лечения панические расстройства могут привести к другим расстройствам психического здоровья.
Поделиться на PinterestВрач может использовать зажим для пульсоксиметрии для измерения уровня кислорода в организме человека.
Варианты лечения тахипноэ широко варьируются.
Если врач еще не знает первопричину, он проведет тесты, изучит историю болезни человека и рассмотрит другие симптомы.
Некоторые проверки могут включать:
- прослушивание дыхания с помощью стетоскопа
- измерение уровня кислорода с помощью зажима для пульсоксиметрии на пальце
- анализы крови для проверки уровня кислоты
- компьютерная томография грудной клетки
- Рентген грудной клетки
Как только врач определит вероятную причину, он может начать лечение. Люди, страдающие астмой или ХОБЛ, могут получать ингаляционные лекарства, которые расширяют или расширяют дыхательные пути.
Люди, страдающие астмой или ХОБЛ, могут получать ингаляционные лекарства, которые расширяют или расширяют дыхательные пути.
Если врач диагностирует бактериальную пневмонию, человеку могут назначать антибиотики.Как отмечает Американская ассоциация легких, пневмония, вызванная вирусом, не поддается лечению антибиотиками.
Люди, страдающие паническим расстройством, могут лечить тахипноэ дома. Однако им следует обсудить свой опыт с медицинским работником.
Тахипноэ может пугать, но не всегда свидетельствует о серьезной проблеме.
Людям не следует пытаться лечить тахипноэ в домашних условиях. Причины широко варьируются, и некоторые из них требуют немедленной медицинской помощи.
Лучше всего немедленно обратиться к врачу, чтобы определить причину и обеспечить быстрое лечение.
% PDF-1.4
%
1 0 obj
> / Шрифт>
/ ExtGState> / ProcSet [/ PDF / Text] >>
/ Содержание 146 0 руб.
/ ArtBox [57,25999 58,11 666,34 848,69299]
/ TrimBox [57.25999 58. 11 666.34 848.69299]
11 666.34 848.69299]
/ BleedBox [57.25999 58.11 666.34 848.69299]
/ MediaBox [0 0 612 792]
/ CropBox [0 0 612 792]
/ Повернуть 0
/ Аннотации 144 0 руб.
>>
endobj
4 0 obj
> / Шрифт>
/ ExtGState> / ProcSet [/ PDF / Text] >>
/ Содержание 152 0 руб.
/ ArtBox [57,25999 58,11 666,34 848.69299]
/ TrimBox [57.25999 58.11 666.34 848.69299]
/ BleedBox [57.25999 58.11 666.34 848.69299]
/ MediaBox [0 0 612 792]
/ CropBox [0 0 612 792]
/ Повернуть 0
/ Аннотации 150 0 руб.
>>
endobj
7 0 объект
> / Шрифт>
/ ExtGState> / ProcSet [/ PDF / Text] >>
/ Содержание 158 0 руб.
/ ArtBox [57,25999 58,11 666,34 848,69299]
/ TrimBox [57.25999 58.11 666.34 848.69299]
/ BleedBox [57.25999 58.11 666.34 848.69299]
/ MediaBox [0 0 612 792]
/ CropBox [0 0 612 792]
/ Повернуть 0
/ Аннотации 156 0 руб.
>>
endobj
10 0 obj
> / Шрифт>
/ ExtGState> / ProcSet [/ PDF / Text] >>
/ Содержание 164 0 руб.
/ ArtBox [57.25999 58,11 666,34 848,69299]
/ TrimBox [57.25999 58.11 666.34 848.69299]
/ BleedBox [57.25999 58.11 666.34 848.69299]
/ MediaBox [0 0 612 792]
/ CropBox [0 0 612 792]
/ Повернуть 0
/ Аннотации 162 0 руб.
>>
endobj
13 0 объект
> / Шрифт>
/ ExtGState> / ProcSet [/ PDF / Text] >>
/ Содержание 170 0 руб.
/ ArtBox [57,25999 58,11 666,34 848,69299]
/ TrimBox [57.25999 58.11 666.34 848.69299]
/ BleedBox [57.25999 58.11 666.34 848.69299]
/ MediaBox [0 0 612 792]
/ CropBox [0 0 612 792]
/ Повернуть 0
/ Аннотации 168 0 руб.
>>
endobj
16 0 объект
> / Шрифт>
/ ExtGState> / ProcSet [/ PDF / Text] >>
/ Содержание 176 0 руб.
/ ArtBox [57.25999 58,11 666,34 848,69299]
/ TrimBox [57.25999 58.11 666.34 848.69299]
/ BleedBox [57.25999 58.11 666.34 848.69299]
/ MediaBox [0 0 612 792]
/ CropBox [0 0 612 792]
/ Повернуть 0
/ Аннотации 174 0 руб.
>>
endobj
19 0 объект
> / Шрифт>
/ ExtGState> / ProcSet [/ PDF / Text] >>
/ Содержание 182 0 руб.
/ ArtBox [57,25999 58,11 666,34 848,69299]
/ TrimBox [57.25999 58.11 666.34 848.69299]
/ BleedBox [57.25999 58.11 666.34 848.69299]
/ MediaBox [0 0 612 792]
/ CropBox [0 0 612 792]
/ Повернуть 0
/ Аннотации 180 0 руб.
>>
endobj
22 0 объект
> / Шрифт>
/ ExtGState> / ProcSet [/ PDF / Text] >>
/ Содержание 188 0 руб.
/ ArtBox [57.25999 58,11 666,34 848,69299]
/ TrimBox [57.25999 58.11 666.34 848.69299]
/ BleedBox [57.25999 58.11 666.34 848.69299]
/ MediaBox [0 0 612 792]
/ CropBox [0 0 612 792]
/ Повернуть 0
/ Аннотации 186 0 руб.
>>
endobj
25 0 объект
>
endobj
26 0 объект
>
endobj
27 0 объект
>
endobj
28 0 объект
>
endobj
29 0 объект
>
endobj
30 0 объект
>
endobj
31 0 объект
>
транслировать
Живая ауксотрофная вакцина обеспечивает иммунитет слизистых оболочек и защиту от летальной пневмонии, вызываемой Pseudomonas aeruginosa.
Образец цитирования: Cabral MP, Correia A, Vilanova M, Gärtner F, Moscoso M, García P, et al.(2020) Живая ауксотрофная вакцина обеспечивает иммунитет слизистых оболочек и защиту от летальной пневмонии, вызываемой Pseudomonas aeruginosa . PLoS Pathog 16 (2):
e1008311.
https://doi.org/10.1371/journal.ppat.1008311
Редактор: Дэвид Скурник, Лаборатория Ченнинга, Бригам энд Женская больница, СОЕДИНЕННЫЕ ШТАТЫ
Поступила: 11 апреля 2019 г .; Одобрена: 6 января 2020 г .; Опубликовано: 10 февраля 2020 г.
Авторские права: © 2020 Cabral et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах с вспомогательной информацией.
Финансирование: Эта работа была поддержана проектами PI15 / 00860 и PI18 / 00501 — ISCIII, REIPI RD16 / 0016/0006 и «Innova Saúde» — СЕРГАС — Служба здравоохранения Галиции.MPC частично поддерживался SEIMC. AC был поддержан грантом FCT (SFRH / BPD / /2012). AP была поддержана программой Хуана де ла Сьервы (MINECO, IJCI-2016-29524) и SEIMC. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Pseudomonas aeruginosa (PA) — один из наиболее распространенных грамотрицательных патогенов, вызывающих пневмонию у пациентов с ослабленным иммунитетом [1].Более того, уровень смертности от вентилятор-ассоциированной пневмонии (ВАП) из-за ФА выше, чем от других патогенов [2]. Острая нозокомиальная пневмония, вызванная ПА, обычно является результатом прямой травмы, такой как повреждение эпителия из-за механической вентиляции у пациентов с ВАП [3].
Во время острой инфекции PA выделяет в окружающую среду экзотоксины, которые повреждают ткани хозяина. А именно, система секреции типа III (TTSS) работает как молекулярный шприц, доставляя токсины в цитозоль эукариотических клеток-мишеней.ExoU, один из этих токсинов, нарушает целостность липидной мембраны, вызывая повреждение эпителиальных клеток и повреждение легких. Он также способствует высвобождению медиаторов воспаления, которые вызывают воспаление и септический шок. Действительно, высокая цитотоксичность, тяжесть повреждения эпителия легких и распространение бактерий в кровоток коррелировали с генотипом exoU в различных штаммах PA [4].
Уровень резистентности PA увеличивается во многих частях мира: недавние исследования показали широкое присутствие клонов с высокой лекарственной устойчивостью (ШЛУ) высокого риска в медицинских учреждениях [5].Таким образом, несколько развивающихся стратегий трансляции исследуются для контроля и терапии PA, включая иммунотерапию [6], фаговую терапию [7] и вакцинацию. Несколько типов вакцин были разработаны и протестированы в ходе клинических испытаний I – III фаз [8]; однако в настоящее время нет одобренного варианта для использования у людей.
Инфекции дыхательных путей обычно возникают или инициируются на поверхности слизистой оболочки, такой как та, которая выстилает просвет легкого [9]. На поверхности дыхательных путей вдыхаемый ПА застревает в вязком слизистом слое.Затем жгутики, липополисахариды и пили типа 4 распознаются рецепторами распознавания паттернов хозяина, такими как TLR, таким образом, инициируя воспалительную реакцию [9]. После распознавания активированные альвеолярные макрофаги, а также нейтрофилы рекрутируются фагоцитозом IL-8 и убивают PA. Дендритные клетки (ДК) берут пробу в просвете легких и запускают адаптивный ответ, представляя антигены Т-клеткам. Следовательно, вакцинационный иммунитет против PA в идеале должен вызывать местный иммунитет на слизистой оболочке легких.
Вакцинация слизистой оболочки обладает большей способностью вызывать местные иммунные ответы слизистой оболочки по сравнению с системной вакцинацией [10].Кроме того, иммунизация на одном участке слизистой оболочки может привести к системной секреции антител, а также на других выбранных участках слизистой оболочки [10]. Эти особенности могут предотвратить возникновение и распространение инфекции, особенно если она возникает на поверхности слизистой оболочки.
Ранее мы охарактеризовали экспериментальную живую вакцину против PA (вакцина α-PA), состоящая из ауксотрофного штамма D-глутамата (D-Glu) с инактивированной глутаматрацемазой (MurI), ключевым ферментом, который обеспечивает D-Glu, необходимый для пептидогликана. биосинтез [11].Эта живая вакцина имеет самоограничивающийся рост in vivo , выявляет функциональные и перекрестно-реактивные антитела, запускает клеточный иммунитет и обеспечивает защиту от заболевания, вызываемого различными штаммами PA в модели мышиного сепсиса. Надежная защита, наблюдаемая у иммунизированных мышей — ~ 100% эффективность вакцины — и пока что скудное описание эффективных прототипов вакцин побудили нас оценить, обладает ли этот ауксотроф D-Glu потенциалом иммуногенности и эффективности против летальной пневмонии, вызванной PA.
В настоящем исследовании мы изучили способ вакцинации слизистой оболочки для доставки нашей живой вакцины α-PA, обнаружив, что она вызывает многофакторный иммунитет, включающий Т-клетки и системные и продуцируемые через слизистые оболочки антитела. Этот многофакторный иммунитет коррелировал с частичной, но значительной защитой от острой фатальной инфекции легких, вызываемой двумя высоковирулентными ExoU-положительными цитотоксическими штаммами PA, и мягкой защитой от диссеминированного клона XDR, также ExoU-положительного. Некоторые ограничения, вызванные наблюдаемым умеренным дозозависимым токсическим эффектом, побудили нас также протестировать парентеральные пути иммунизации и их влияние на иммунитет слизистой оболочки против острой пневмонии.Внутримышечная, внутрикожная и подкожная иммунизация дала значительное улучшение выживаемости мышей, инфицированных PA14, однако временные побочные реакции наблюдались у последних двух. Внутримышечная иммунизация обеспечивала лишь умеренную защиту, однако при применении в сочетании с интраназальным путем она позволяла использовать более низкие и более безопасные дозы вакцины интраназально, что приводило к значительной эффективности.
Мы пришли к выводу, что наш ауксотрофный штамм D-Glu обеспечивает как местный, так и системный иммунитет, обеспечивая гетерогенную, но значительную защиту от летальной пневмонии, вызванной штаммами, продуцирующими цитотоксин, поэтому в будущем его следует рассматривать как перспективный прототип вакцины против ПА.
Результаты
Характеристика индуцированных вакциной α-PA ответов антител после интраназальной иммунизации
PA PAO1 ранее подвергали генетическим манипуляциям для получения ауксотрофного штамма D-Glu, PAO1 Δ murI , путем удаления кодирующего гена MurI, murI [11]. Мышам интраназально (IN) инокулировали PAO1 Δ murI (2 × 10 8 КОЕ) — живую вакцину α-PA — в дни 0 и 14. Дополнительная иммунизация была проведена на 8 день при использовании трех доз. график.Контрольным мышам вводили физиологический раствор. Уровни PAO1-специфических антител определяли в сыворотках, полученных в разные моменты времени. При использовании схемы с двумя дозами (рис. 1A) значительно повышенные уровни IgM присутствовали на 7 день, в то время как повышенные титры IgG1, IgG2a, IgG2b и IgG3 были обнаружены на 20 и 42 дни. Уровни IgM были значительно снижены на 42 день, с указанием переключения изотипа.
Рис. 1. Вакцина α-PA вырабатывает перекрестно-реактивные антитела и гетерогенную защиту от PA-пневмонии.
(A) График иммунизации и титры антител против PAO1 у вакцинированных ( n = 7) и контрольных ( n = 7) мышей после одной или двух иммунизаций IN вакциной α-PA (2 × 10 8 КОЕ) или введение физиологического раствора соответственно. (B) титров IgG против различных живых штаммов и штаммов Hk PA у вакцинированных ( n = 6-7) и контрольных ( n = 5-7) мышей после двух иммунизаций IN вакциной α-PA (2 × 10 8 КОЕ) или введение физиологического раствора соответственно. (C) График иммунизации и титры антител против PAO1 у вакцинированных ( n = 5) и контрольных ( n = 6-7) мышей после трех иммунизаций IN вакциной α-PA (2 × 10 8 КОЕ ) или введение физиологического раствора соответственно. (A-C) S, физиологический раствор; Д, день. (A, B) * P <0,05 (тест Крускала-Уоллиса) по сравнению с физиологическим раствором и между указанными группами. (B) # P <0,05 (U-критерий Манна-Уитни) по сравнению с группой, получавшей физиологический раствор. (C) * P <0,05 (U-критерий Манна-Уитни) по сравнению с группой, получавшей физиологический раствор. (D) График иммунизации, выживаемость мышей и оценка тяжести заболевания у мышей (MDSS) после IN введения вакцины α-PA (2 × 10 8 КОЕ) или физиологического раствора и заражения IN с PAO1 ExoU + ( 7 × 10 5 КОЕ, n = 7), PA14 (1 × 10 6 КОЕ, n = 8), ST235 (3 × 10 7 КОЕ, n = 7) и PAO1 (2 × 10 6 КОЕ, n = 7–8). (E) Выживание мышей после заражения IN разными дозами PAO1 ( n = 3-5 мышей / группа). (F) Схема иммунизации и выживаемость мышей после IN введения вакцины α-PA (2 × 10 8 КОЕ, n = 6) или физиологического раствора ( n = 7) и заражения IN с PA14 (1 × 10 6 КОЕ). (G) Выживание мышей после иммунизации IN вакциной α-PA (2 × 10 8 КОЕ, n = 8), инактивированным PAO1 (2 × 10 8 КОЕ, n = 8) или физиологическим раствором введение ( n = 15) и заражение IN с PA14 (1 × 10 6 КОЕ) в соответствии с графиком (D) . (D, F и G) * P <0,05 (лог-ранговый тест) по сравнению с группой, получавшей физиологический раствор. (D) # P <0,05 (U-критерий Манна-Уитни). (G) # P <0,05 (лог-ранговый тест) по сравнению с мышами, которым вводили инактивированный PAO1.
https://doi.org/10.1371/journal.ppat.1008311.g001
Перекрестная реактивность общего IgG, повышенная с использованием схемы с двумя дозами, была определена против 11 гетерологичных штаммов PA (таблица S1 и рис. 1B).Уровни анти-PA14 (штамм, продуцирующий ExoU), -ST235 (клон высокого риска XDR), -ST175 (клон высокого риска XDR), -LES400 и -12142 (эпидемические штаммы от пациентов с МВ), -51442390 (Mem R мукоидный изолят от пациента с МВ), -29606 и -28757 (мукоидный изолят от пациентов с МВ), -LES431 (эпидемический штамм от пациента без МВ), -51441321 и -28562 (МЛУ / мукоидные изоляты от пациентов с бронхоэктазами. ) IgG были значительно повышены на 42 день по сравнению с группой, получавшей физиологический раствор. Мукоидный фенотип связан с хроническими инфекциями у пациентов с муковисцидозом [12].При использовании схемы из трех доз вакцина IN также привела к значительному повышению уровня PAO1-специфических антител всех оцениваемых изотипов (рис. 1C). Титры IgG против вареных PAO1 и PA14 (которые должны разрушать термолабильные белковые эпитопы) (рис. 1B) были аналогичны титрам, распознающим целые бактерии, что указывает на то, что антитела IgG, полученные при иммунизации, в основном распознают термостабильные антигены, которые могут включать O-антиген.
Оценка защитной эффективности против острой легочной инфекции с использованием вакцинации α-PA IN
Мы оценили выживаемость мышей, инфицированных IN тремя цитотоксин-продуцирующими PA штаммами, вызывающими острую легочную инфекцию, для тестирования перекрестной защиты вакцины α-PA и надежности модели пневмонии (рис. 1D).
PAO1 ExoU + является производным от PAO1, несущим ген exoU . Введение этого гена в PAO1 придает цитотоксический фенотип и повышенную вирулентность на мышиной модели острой пневмонии и системного распространения [13]. PA14 является высокоцитотоксичным эталонным штаммом exoU + [14,15], представляющим наиболее распространенную клональную группу во всем мире [16]. PA ST235 — международный клон XDR высокого риска, который является одним из наиболее распространенных клонов XDR в больницах по всему миру [17].ST111 и ST175, вероятно, являются другими более распространенными [5,18,19]. Здесь мы использовали ранее описанный штамм 8 ST235 [15], поскольку он способен вызывать смертность на модели перитонита / сепсиса у мышей, в отличие от ST111 и ST175. Кроме того, ST235 содержит экзотоксин, кодируемый exoU [17].
Выживаемость вакцинированных мышей с использованием схемы вакцинации с двумя дозами составила 86, 88 и 29% после заражения PAO1 ExoU + , PA14 и ST235 соответственно; тогда как контрольные мыши показали выживаемость 0, 13 и 0% (рис. 1D).Несмотря на эту гетерогенную защиту, различия в выживаемости были значительными для трех анализов, что указывает на общее снижение тяжести заболевания у вакцинированных животных.
Мы также протестировали эффективность вакцины против PAO1 дикого типа, так как ExoU-отрицательные штаммы обычно требуют более высоких доз заражения, чтобы вызвать 100% летальность, что дает лучшую оценку эффективности вакцины. Действительно, в то время как инокуляция 7 × 10 5 КОЕ PAO1 ExoU + вызвала 100% смертность (рис. 1D), контрольные дозы до 4 × 10 7 КОЕ PAO1 были необходимы для наблюдения 100% смерти (рис. 1E).Но поскольку инфицированные мыши демонстрировали показатели боли, страдания и болезни, для мониторинга суррогатных конечных точек и определения тяжести заболевания после контрольного заражения с более низкой дозой использовалась шкала тяжести заболевания мышей (MDSS). Были оценены пять критериев, чтобы получить общий балл от 1 до 10, который впоследствии определял клиническое состояние и / или эвтаназию (HEP, конечная точка для человека) (таблица S2). Умершие мыши и HEP получили оценку 11. По сравнению с вакцинированными мышами, ложно иммунизированные мыши имели значительно более высокий средний балл (0.71 против 10 соответственно) (рис. 1D). Более того, 2 из 8 контрольных мышей умерли, тогда как 3 имели оценки, совместимые с HEP, что указывает на снижение тяжести инфекции. При использовании схемы иммунизации с тремя дозами выживаемость вакцинированных мышей составила 83% после заражения PA14, тогда как все контрольные мыши погибли (рис. 1F). Учитывая, что использование дополнительной дозы иммунизации не привело к значительному усилению защитного эффекта вакцины, мы сохранили двухдозовый график для задней иммунизации IN.Чтобы дополнительно изучить, имеет ли наш ауксотрофный штамм какое-либо преимущество в качестве вакцины по сравнению с инактивированными бактериями, мы сравнили его защитную эффективность с инактивированным формалином PAO1. Как показано на рис. 1G, только одна из 8 мышей, которым вводили вакцину α-PA и инфицированные PA14, умерла, тогда как 93% контрольных мышей скончались от острой пневмонии в течение 84 часов. В отличие от живой вакцины, 75% мышей, которым вводили инактивированный формалином PAO1, умерли от инфекции. Защита, обеспечиваемая вакциной α-PA, была значительно выше по сравнению с инактивированным формалином PAO1.Эти результаты показывают, что иммунизация IN вакциной α-PA дает преимущество перед инактивированными бактериями дикого типа в улучшении выживаемости.
Клеточный иммунный ответ, индуцированный вакцинацией α-PA IN до и после инфекции
Как показано на рис. 2, доля Т-клеток CD4 + , отображающих фенотипы CD44 + CD62L — и CD44 + CD62L + , была немного, но значительно увеличена в селезенке мышей, вакцинированных α-PA. по сравнению с контролем, что соответственно указывает на стимуляцию эффекторных и центральных Т-клеток CD4 + памяти.Стратегия стробирования, используемая для различения ячеек памяти с помощью проточной цитометрии, представлена на S1 Рис.
.
Рис. 2. Продукция Т-клеток памяти CD4 + у вакцинированных мышей.
(A) мышей ( n = 6 / группа) иммунизировали α-PA вакциной (2 × 10 8 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем были собраны селезенки. (B) Процент эффекторной памяти селезенки (CD44 + CD62L — ), центральной памяти (CD44 + CD62L + ) и наивной (CD44 — CD62L + ) CD4 + + клетки.Контурные графики соответствуют репрезентативному примеру CD4-управляемых T-клеток анализируемых образцов. Области анализа были установлены в соответствии с образцами, окрашенными FMO и изотипическим контролем. Числа внутри участков графика представляют собой средние значения ± стандартное отклонение частоты клеток из-за соответствующего окрашивания клеток. Столбики представляют собой среднее значение ± стандартное отклонение данных. * P <0,05 (t-критерий).
https://doi.org/10.1371/journal.ppat.1008311.g002
Для лучшего понимания эффекторной функции CD4 + Т-клеток, индуцированных вакцинацией, соотношение CD4 + Т-клеток селезенки и легких, продуцирующих IL -17A (фиг. 3), IFN-γ, IL-10, IL-4 и TNF-α (S2 фиг.) Определяли анализом проточной цитометрии как у инфицированных, так и у неинфицированных мышей.Типичные точечные диаграммы, показывающие различные клеточные популяции, представлены на рис. 3 и на рис. S3 и S4. Соответствующая стратегия стробирования представлена на фиг. S5. Повышенная частота CD4 + Т-клеток селезенки, экспрессирующих IL-17A, наблюдалась для вакцинированных мышей по сравнению с контролем как у инфицированных, так и у неинфицированных мышей (фиг. 3C). То же самое наблюдалось для CD4 + Т-клеток, экспрессирующих IL-17A из легких (фиг. 3D). Частоты CD4 + Т-клеток селезенки, экспрессирующие IFN-γ, IL-10 и TNF-α, были обнаружены сходными у вакцинированных и контрольных мышей, тогда как снижение частоты CD4 + IL-4 + клеток наблюдалось на инфекции у вакцинированных мышей (S2 фиг.).В легких не было обнаружено различных пропорций клеток, продуцирующих какие-либо из этих цитокинов, между вакцинированными мышами и контрольными мышами, за исключением пониженной частоты CD4 + Т-клеток, экспрессирующих TNF-α, у неинфицированных вакцинированных мышей (S2 фиг.). Также было показано, что γδ Т-клетки являются мощным источником IL-17 и, в некоторых случаях, производят больше IL-17, чем αβ Т-клетки [20]. Как показано на фиг. S6, значительное увеличение IL-17A + γδ Т-клеток было обнаружено в легких после инфицирования, однако это не отличалось между вакцинированными и контрольными группами мышей.Кроме того, не наблюдали значительных различий в IFN-γ + γδ Т-клетках между вакцинированными и контрольными мышами (стратегия стробирования показана на S7 фиг.). Это говорит о том, что защита, обеспечиваемая нашей вакциной, не зависит от этих популяций Т-клеток.
Рис. 3. Повышенная продукция IL-17A CD4 + Т-клетками вакцинированных мышей.
(A, B) Мышей ( n = 6 / группа) иммунизировали α-PA вакциной (2 × 10 8 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем были собраны селезенки и легкие.В (B) мышей ( n = 6 / группа) были инфицированы PA14 (1 × 10 6 КОЕ) за 9 часов до получения селезенки и легких. (C, D) Типичные примеры и процент CD4-управляемых T-клеток, экспрессирующих IL-17A, полученных из селезенки (C) и легких (D) инфицированных и неинфицированных мышей, обнаруженных с помощью внутриклеточного окрашивания после стимуляции с PMA / иономицином. Области анализа были установлены в соответствии с образцами, окрашенными FMO и изотипическим контролем.Числа внутри областей точечного графика представляют собой средние значения ± стандартное отклонение частоты клеток из-за окрашивания соответствующих цитокинов. Столбики представляют собой среднее значение ± стандартное отклонение данных. * P <0,05, ** P <0,01 (t-критерий).
https://doi.org/10.1371/journal.ppat.1008311.g003
Для подтверждения типа Т-клеточного ответа, вызванного вакциной α-PA, IFN-γ, IL-17A, IL-10 и IL-4 уровни оценивали в супернатантах культур антиген-стимулированных спленоцитов, полученных от вакцинированных и невакцинированных мышей до и после инфицирования PA14.Как показано на фиг. S8, спленоциты, выделенные из вакцинированных инфицированных мышей, ответили на убитый нагреванием (Hk) PA14, продуцируя значительно более высокие количества провоспалительных цитокинов IL-17A и IFN-γ, чем иммунизированные контроли. Тем не менее, результаты культур спленоцитов неинфицированных мышей показывают, что иммунизация преимущественно индуцирует обязательство отвечающих клеток на продукцию IL-17A, поскольку антиген PA14 индуцировал продукцию IFN-γ также в клетках неиммунизированных животных. Более высокая продукция противовоспалительного цитокина IL-10 наблюдалась также для клеток, полученных от вакцинированных мышей, однако в меньших количествах, чем IL-17A и IFN-γ.ИЛ-4 не был обнаружен ни в одном оцениваемом состоянии.
Эти результаты показывают, что вакцина α-PA запускает клеточный иммунный ответ, поляризованный на продукцию IL-17A в селезенке и легких, предполагая, что этот цитокин опосредует защитный эффект вакцины против острого инфекционного процесса в легких.
Удаление бактерий требует активности фагоцитов, а нейтрофилы и другие фагоциты являются важными врожденными клеточными эффекторами для иммунитета против PA-пневмонии [9,21–23].Таким образом, количество миелоидных клеток различных популяций определяли в легких вакцинированных α-PA и контрольных мышей до и после инфицирования PA с помощью проточной цитометрии (S9, фиг.). Нейтрофилы, эозинофилы, альвеолярные макрофаги (AM), рекрутированные моноциты и популяции дендритных клеток (DC) были определены, как показано в стратегии стробирования, представленной на рис. S10. IN вакцинация α-PA привела к значительному увеличению количества DC в легких. как подгруппы CD11b —, так и CD11b + , а также моноциты / макрофаги Ly6C — (Mo / Mφ).Увеличение CD11b + особенно актуально, поскольку они включают профессиональные антигенпрезентирующие клетки (APC). После инфицирования количество CD11b + DC у вакцинированных мышей оставалось выше контроля. Ly6C — Моноциты / макрофаги (Mo / Mφ), часто распознаваемые как резидентные моноциты, которые являются предшественниками тканевых макрофагов [24], все еще были повышены после инфицирования. Альвеолярные макрофаги и нейтрофилы также были обнаружены в увеличенном количестве у инфицированных вакцинированных мышей по сравнению с контролем.Эти результаты предполагают, что вакцинация увеличивала набор / пролиферацию мононуклеарных и полиморфонуклеарных клеток в легкие, что могло способствовать большему очищению от бактерий.
Внутримышечная (IM) иммунизация вакциной α-PA стимулирует гуморальный иммунитет, но обеспечивает пониженную защиту от инфекции
Поскольку различные вакцины-кандидаты против инфекций PA были протестированы в клинических испытаниях с использованием внутримышечного введения [25,26], мы протестировали иммунный ответ, вызванный вакциной α-PA, используя этот путь.Мышам внутримышечно прививали α-PA вакцину (3 × 10 7 КОЕ) на 0, 7 и 14 дни. Контрольных мышей иммунизировали физиологическим раствором. Для оценки гуморального ответа, вызванного иммунизацией, в сыворотках определяли уровни PAO1-специфических изотипов IgM и IgG (фиг. 4A). Перекрестная реактивность IgG, полученного после завершения графика вакцинации, также определялась, как и раньше. Уровни антител в сыворотке были сравнимы с уровнями, полученными при использовании пути IN на 42 день (фиг. 4B и 1A), за исключением IgM, который оставался повышенным после иммунизации IM.Иммунизация внутримышечно также привела к увеличению уровней анти-PA IgG1, IgG2a, IgG2b и IgG3. Аналогичная тенденция наблюдалась для перекрестной реактивности полученного сывороточного IgG и для антител, распознающих термостабильные антигены (рис. 4C). Таким образом, маловероятно, что разные пути иммунизации могут индуцировать антитела IgG с явно различающейся специфичностью, такие как белковые против углеводных антигенов.
Рис. 4. В / м иммунизация вакциной α-PA генерирует системные и перекрестно-реактивные антитела, но снижает защиту от пневмонии.
(A) График иммунизации для (B), и (C). (B) Титры антител против PAO1 у вакцинированных ( n = 6) и контрольных ( n = 6) мышей после внутримышечной иммунизации вакциной α-PA (3 × 10 7 КОЕ) или введения физиологического раствора, соответственно. . (C) титров IgG против различных живых штаммов и штаммов Hk PA у вакцинированных ( n = 6) и контрольных ( n = 6) мышей после внутримышечной иммунизации вакциной α-PA (3 × 10 7 КОЕ) , или введение физиологического раствора соответственно. (B, C) S, физиологический раствор; Д, день. * P <0,05 (U-критерий Манна-Уитни) по сравнению с группой, получавшей физиологический раствор. (D) График иммунизации и выживаемость мышей после внутримышечной иммунизации вакциной α-PA (3 × 10 7 КОЕ, n = 8) или введения физиологического раствора ( n = 9) и контрольного заражения PAO1 ExoU + (1 × 10 5 КОЕ). (E) График иммунизации и выживаемость мышей после внутримышечной иммунизации вакциной α-PA (3 × 10 7 КОЕ, n = 8) или введения физиологического раствора ( n = 8) и контрольного заражения PA14 (9 × 10 5 КОЕ). (F) График иммунизации и выживаемость мышей после внутримышечной иммунизации вакциной α-PA (3 × 10 7 КОЕ, n = 9) или введения физиологического раствора ( n = 9) и контрольного заражения ST235 (5 × 10 6 КОЕ). (D-F) * P <0,05 (логранговый тест).
https://doi.org/10.1371/journal.ppat.1008311.g004
Затем мы оценили, снижает ли иммунный ответ, вызванный внутримышечной иммунизацией, тяжесть заболевания на том же уровне, что и ИН иммунизация.Хотя для внутримышечной и внутримышечной доставки использовались разные схемы вакцинации, мы установили это сравнение, поскольку полученные уровни антител и полученная перекрестная реактивность были одинаковыми между ними. После заражения мышей PAO1 ExoU + внутримышечная вакцинация привела к 100% выживаемости (фиг. 4D). Этот результат превосходит результат, полученный при иммунизации IN (выживаемость 86%, рис. 1D). Однако, когда контрольное заражение было выполнено с помощью PA14, выживаемость IM-вакцинированных мышей составила 38% (фиг. 4E), в отличие от 88% выживаемости, наблюдаемой для IN-вакцинированных мышей (фиг. 1D).Наконец, при использовании штамма ST235 все мыши, получавшие вакцину IM-α-PA, не пережили летального заражения (фиг. 4F), в отличие от 29% выживаемости, представленной IN-вакцинированными мышами (фиг. 1D). Это говорит о том, что вакцина α-PA менее эффективна против пневмонии, вызванной штаммами, продуцирующими цитотоксин, при внутримышечном введении, обеспечивая пониженную защиту.
Чтобы выяснить, может ли более низкая защита против LPS-гетерологичного штамма PA14 быть связана с отсутствием клеточных иммунных ответов, мы выполнили анализ проточной цитометрии и количественное определение цитокинов в культуральных супернатантах, как это было сделано ранее для IN-вакцинированных мышей.В отличие от IN-иммунизированных мышей, у неинфицированных IM-вакцинированных мышей не наблюдалось увеличения количества эффекторных и центральных Т-клеток памяти CD4 + , что указывает на то, что этот путь иммунизации не стимулирует адаптивный ответ на том же уровне, что и IN-route (S11 Рис). В селезенке IM-иммунизированных мышей частоты CD4 + Т-клеток, экспрессирующих IL-17A, IFN-γ, IL-10 и TNF-α, оказались сходными по сравнению с контролем как до, так и после заражения. Единственным исключением была значительная повышенная частота CD4 + Т-клеток IL-4 + у неинфицированных мышей.В легких не было обнаружено различий в популяциях CD4 + Т-клеток (S12, фиг.). В этом случае ни один из оцененных цитокинов не вырабатывался в значительной степени у IM-вакцинированных мышей, за исключением IL-17A (S13 фиг.). Однако эти уровни IL-17A были намного ниже по сравнению с IN-вакцинацией (среднее значение 127 против 2489 пг / мл до заражения; среднее 422 против 4782 пг / мл после заражения; стимулы 1: 1). В отличие от вакцинации IN не наблюдалось значительного увеличения количества DC в легких (ни подгруппы CD11b — , ни подгруппы CD11b + ) после иммунизации IM (S14 фиг.).Это могло бы подтвердить наблюдение, что дифференцировка Т-клеток по существу не различалась у IM-вакцинированных и контрольных мышей. Более того, увеличение количества моноцитов / макрофагов Ly6C — (Mo / Mφ) было умеренным по сравнению с вакцинацией IN (S14 фиг., Панели A и C). Каким-то неожиданным образом рекрутирование моноцитов / макрофагов (Mo / Mφ) Ly6C + стимулировалось после иммунизации IM, но не после иммунизации IN. Хотя моноциты Ly6C + могут дифференцироваться в моноциты Ly6C — или moDC, при инфицировании не было обнаружено увеличения количества клеток таких популяций.После инфицирования значительно большее количество Ly6C — Mo / Mφ и нейтрофилов было обнаружено у IM-вакцинированных мышей по сравнению с контролем, как ранее наблюдалось у IN-вакцинированных мышей, но не у альвеолярных макрофагов (S14 фиг., Панели B и D). Короче говоря, эти результаты могут указывать на то, что внутримышечная иммунизация живой α-PA вакциной не способствует накоплению DC в легких на том же уровне, что и IN вакцинация, и предполагать незначительное влияние этого пути иммунизации на количество миелоидных популяций легких.
Мы также сравнили различные специфичности антисывороток от IN- и IM-иммунизированных мышей против PA14, используя эксперименты по пассивной иммунизации. Однако у мышей, которым вводили обогащенную IgG сыворотку против ПА от иммунизированных доноров, не наблюдалось значительных различий в выживаемости по сравнению с мышами, получавшими наивную сыворотку (0,3% против 0,2% против 0,2% выживаемости, соответственно) (S15, фиг.). Эти результаты предполагают, что улучшение выживаемости, обеспечиваемое вакцинацией ИН, не зависит от сывороточных антител IgG, и, таким образом, более низкая защита, наблюдаемая при внутримышечном введении, не может быть связана с различными специфичностями системного ответа.
Оценка безопасности вакцины α-PA
Вакцину
α-PA или носитель (физиологический раствор) вводили мышам IN и IM приблизительно в соответствии с предыдущими схемами и графиками. Поскольку клинические токсикологические признаки трудно различить при визуальном осмотре, мы регистрировали массу тела мышей до и во время схем иммунизации (S16, рис.). При использовании пути IN (2 × 10 8 КОЕ) наблюдалась потеря веса в среднем 13% после первого введения вакцины α-PA на 2 день.После второго введения (16 день) у мышей потеря веса составила 15%. Эти различия были значительными при использовании смешанного дисперсионного анализа с «днем исследования» в качестве фактора внутри субъектов. Хотя до завершения эксперимента наблюдались значительные различия в весе по сравнению с контрольными животными, эти животные восстановили свою массу тела при предварительной обработке на 8 и 22 дни (S16A фиг.). В отличие от ИН иммунизации, потери массы тела у мышей, вакцинированных внутримышечно, не наблюдалось (S16B фиг.).
Учитывая, что внутримышечная иммунизация проводилась с использованием более низкой дозы вакцины (3 × 10 7 КОЕ), мы протестировали тот же режим дозирования, но с использованием пути IN (S16C, фиг.).В этом случае значительная потеря веса наблюдалась только после первой иммунизации (13%, день 2), более того, различия в массе тела по сравнению с контролем были временными. Это может указывать на то, что введение вакцины α-PA через путь IN индуцирует дозозависимый токсический эффект от легкого до умеренного. При использовании IN доз живой α-PA вакцины ниже 3 × 10 7 КОЕ (8 × 10 5 КОЕ и 7 × 10 6 КОЕ, n = 8 мышей / группа) вакцинированные мыши представляли результаты аналогичны контрольным результатам после заражения PA14, что свидетельствует об отсутствии защитного эффекта (S17, фиг.).
Мы также протестировали комбинацию ИН плюс внутримышечная иммунизация с 3 × 10 7 КОЕ вакцины α-PA (S16D, рис.): Одно внутримышечное введение плюс внутримышечное введение в дни 0 и 14 и дополнительная иммунизация внутримышечно на 7 день. мы наблюдали некоторую потерю веса (незначительную) после первого и второго введения вакцины, совпадающую с иммунизацией IN, но не после IM введения, на 7 день. Это может свидетельствовать о том, что сочетание этих двух путей иммунизации не увеличивает токсичность вакцины. Опять же, различия в массе тела вакцинированных мышей были временными по сравнению с контролем.
Далее, мы оценили, может ли вакцина α-PA колонизировать и размножаться в организме хозяина после внутримышечного или внутримышечного введения. Таким образом, мы измерили нагрузку вакцины α-PA в крови, легких и печени IN- ( n = 4) и IM- ( n = 4) вакцинированных мышей (3 × 10 7 КОЕ). Через 2 ч после вакцинации в крови мышей не было обнаружено КОЕ. Кроме того, легкие и печень, полученные на 8-й день, были стерильными. Таким образом, кажется маловероятным, что штамм вакцины α-PA может колонизировать хозяина.
Комбинация иммунизации IN плюс IM с вакциной α-PA обеспечивает долгосрочную защиту от пневмонии
Мониторинг массы тела показал, что использование схемы с двумя дозами с 3 × 10 7 КОЕ вакцины α-PA, введенной ИН, может быть менее токсичным, чем использование 2 × 10 8 КОЕ. Чтобы проверить эффективность этого альтернативного режима дозирования, мы провоцировали мышей PAO1 ExoU + , используя предыдущую модель летальной инфекции легких. Мы одновременно проверили защиту в долгосрочной перспективе, провоцируя мышей через 6 месяцев после последней иммунизации (рис. 5А).Как показано, выживаемость вакцинированных мышей (путь IN) составила 100%, тогда как 86% контрольных мышей погибли. Таким образом, ИН иммунизация с использованием 3 × 10 7 КОЕ вакцины α-PA обеспечила значительную защиту в долгосрочной перспективе. Таким образом, мы использовали эту дозу и в дальнейшем. Когда вакцина вводилась внутримышечно (с использованием 3 × 10 7 КОЕ) или комбинируя пути ИН + внутримышечно, наблюдалась выживаемость мышей 88% и 100% соответственно, что соответствует предыдущим результатам, предполагающим, что внутримышечный путь не является таким защитным. как IN один.В этом эксперименте мы также выполнили макроскопическое наблюдение легких и печени мышей в двух разных точках времени. Первой проанализированной группой были те мыши, которые скончались от инфекции через 16-24 ч после заражения. В этом случае все легкие мыши показали видимый и рассеянный кровавый вид, что указывало на серьезную гиперемию и внутриальвеолярное кровоизлияние. В свою очередь, печень была бледнее, чем обычно, что свидетельствует о воспалении. Вторую группу составляли выжившие мыши, которых умерщвляли через 7 дней после заражения.В легких этих животных не было заметных признаков кровотечений, а в печени не было видимых признаков воспаления.
Рис. 5. Комбинация иммунизации IN плюс IM с вакциной α-PA и защитой от пневмонии.
(A) График иммунизации и выживаемость мышей после иммунизации IN плюс IM вакциной α-PA (3 × 10 7 КОЕ) (IN + IM, n = 7), иммунизация IM вакциной α-PA (3 × 10 7 КОЕ, n = 8), иммунизация IN вакциной α-PA (3 × 10 7 КОЕ) (IN, n = 5) или введение физиологического раствора (IM, n = 8; IN, n = 8) и вызов с PAO1 ExoU + (4 × 10 5 КОЕ).* P <0,05 (логранговый тест). На изображениях показаны легкие и печень, взятые у мышей, подвергшихся заражению физиологическим раствором, которые умерли от инфекции через 16 ч после заражения, и у случайно вакцинированных мышей, умерщвленных через неделю после заражения. Пунктирные квадраты указывают на легочные кровотечения и бледные зоны в печени. (B) График иммунизации и выживаемость мышей после иммунизации IN плюс IM вакциной α-PA (3 × 10 7 КОЕ) (IN + IM, n = 9), IN иммунизации вакциной α-PA (3 × 10 7 КОЕ) (IN, n = 9), или введение физиологического раствора (IN + IM, n = 9) и контрольное заражение PA14 (1 × 10 6 CFU).* P <0,05 (логранговый тест). (C) График иммунизации и выживаемость мышей после иммунизации IN плюс IM вакциной α-PA (3 × 10 7 КОЕ) (IN + IM, n = 9), иммунизация IM вакциной α-PA (3 × 10 7 КОЕ, n = 9), ИН иммунизация вакциной α-PA (3 × 10 7 КОЕ) (IN, n = 9) или введение физиологического раствора (IN + IM, n = 8; IM, n = 9; IN, n = 9) и провокация PA14 (1 × 10 6 КОЕ).* P <0,05 (логранговый тест). Изображения показывают легкие и печень, полученные через 12 дней после заражения у случайно вакцинированных мышей. (D) График иммунизации и бактериальная нагрузка в легких и печени мышей после иммунизации IN плюс IM вакциной α-PA (3 × 10 7 КОЕ) (IN + IM, n = 8), иммунизация IM с Вакцина α-PA (3 × 10 7 КОЕ, n = 10), ИН иммунизация вакциной α-PA (3 × 10 7 КОЕ) (IN, n = 8) или введение физиологического раствора ( IN + IM, n = 8; IN, n = 8) и провокация PA14 (1 × 10 6 КОЕ).* P <0,05 (U-критерий Краскела-Уоллиса и Манна-Уитни использовался для сравнения в 3 и 2 группах соответственно).
https://doi.org/10.1371/journal.ppat.1008311.g005
Затем мы сравнили защитный эффект вакцины α-PA с использованием IN и комбинации IN + IM путей против летальной пневмонии PA14. Как показано на фиг. 5B, вакцинированные IN мыши показали выживаемость только 67%, тогда как 100% мышей, которым вводили второй режим, выжили. Это говорит о том, что одна вакцинация IN не так эффективна против PA14, как комбинация IN + IM.Затем мы выполнили тот же эксперимент, но также с использованием внутримышечного пути и заражения мышей на 113 день (~ 3 месяца после последней иммунизации) (рис. 5C). Существенное снижение выживаемости наблюдалось при внутримышечном и внутримышечном способах введения; 33 и 44% соответственно. Тем не менее, введение вакцины α-PA ИН плюс в / м дало 78% выживаемость. Легкие и печень, взятые случайным образом у вакцинированных мышей, которые выжили после заражения, не показали ни количества бактерий PA14, ни видимой патологии (фиг. 5C, правая панель).
Далее, мы измерили бактериальную нагрузку PA14 в легких и печени вакцинированных и контрольных мышей, зараженных через ~ 3 месяца после последней иммунизации, чтобы найти корреляцию между бактериальной нагрузкой и выживаемостью, наблюдаемой в предыдущем эксперименте (рис. 5C). Как показано на фиг. 5D, высокие количества КОЕ были получены в легких всех мышей, но с небольшим снижением у вакцинированных мышей (IM и IN + IM). Вакцинация привела во всех случаях к более выраженному снижению бактериальной нагрузки в печени, при этом уровни у некоторых вакцинированных не были обнаружены.Не удалось установить четкой корреляции между КОЕ и защитой, наблюдаемой в долгосрочной перспективе с различными путями иммунизации, однако кажется вероятным, что вакцинация снижает местную и системную бактериальную нагрузку.
Гистологический анализ легких после вакцинации α-PA и инфекции PA14
Мы оценили дифференциальные исходы для неинфицированных и инфицированных мышей после иммунизации (IN и IN плюс внутримышечное введение) и контрольных мышей с помощью гистологического анализа легких (рис. 6).Как показано на фиг. 6C, в легких мышей, которым вводили вакцину α-PA, были обнаружены некоторые периваскулярные и периартериолярные очаги воспалительного инфильтрата мононуклеарного типа (стрелки), свидетельствующие о легком или умеренном воспалении, но с общим сохранением архитектуры альвеол и дыхательных путей. Неинфицированные контрольные мыши не показали признаков воспаления. Гистопатология легких вакцинированных и невакцинированных мышей, впоследствии инфицированных PA14 (рис. 6D), показала обширную полиморфно-ядерную (PMN) инфильтрацию, рассредоточенную по паренхиме легких (стрелки).Это согласуется с привлечением воспалительных клеток и ролью нейтрофилов как важных медиаторов защиты хозяина в легких от инфекции PA [27]. Однако, в то время как у мнимо иммунизированных мышей наблюдались инфильтраты PMN, заполняющие большую часть альвеол (стрелки), у вакцинированных мышей наблюдалась скудная альвеолярная инфильтрация, что могло указывать на менее тяжелое заболевание из-за меньшего количества повреждающих ткани нейтрофилов [28] в этих областях (альвеолах). сохранение).
Рис. 6. Гистопатология легких, вызванная PA-пневмонией у вакцинированных и наивных мышей.
(A) График иммунизации и сбора легких для (C). (B) График иммунизации, контрольного заражения и сбора легких для (D). (C) Репрезентативные микрофотографии гистологических срезов легких, полученных от мышей после иммунизации IN (IN) вакциной α-PA (3 × 10 7 КОЕ) ( n = 3), IN плюс IM (IN + IM) иммунизация вакциной α-PA (3 × 10 7 КОЕ) ( n = 3) и введение физиологического раствора (IN + IM) ( n = 3). (C) Стрелками показаны периваскулярные и периартериолярные очаги воспалительного инфильтрата мононуклеарного типа в паренхиме. (D) Репрезентативные микрофотографии гистологических срезов легких, полученных от мышей после иммунизации IN (IN) вакциной α-PA (3 × 10 7 КОЕ) ( n = 6), IN плюс IM (IN + IM ) иммунизация вакциной α-PA (3 × 10 7 КОЕ) ( n = 5), введение физиологического раствора (IN + IM) ( n = 5) и заражение PA14 (1 × 10 6 КОЕ ). (D) Стрелки показывают тяжелый воспалительный инфильтрат полиморфно-ядерного типа, рассредоточенный по паренхиме легких. Стрелки показывают полиморфно-ядерный инфильтрат, заполняющий большую часть альвеол (физиологический раствор), области скудного воспалительного мононуклеарного инфильтрата (IN-иммунизированные мыши) и области воспалительного инфильтрата лейкоцитов полиморфно-ядерного типа с внутрибронхиальным расположением (IN + IM-иммунизированные мыши), соответственно. (C, D) В столбцах показаны изображения с увеличением × 25 (слева), × 100 (в центре слева), × 200 (в центре справа) и × 400 (справа).
https://doi.org/10.1371/journal.ppat.1008311.g006
В целом эти результаты показывают, что назальная вакцинация вакциной α-PA защищает животных от обширного бактериального распространения в легких, вызванного инфекцией, таким образом, она может уменьшить повреждающие эффекты, вызванные вторжением нейтрофилов в альвеолы.
Антитела в слизистой оболочке после иммунизации вакциной α-PA
Мы исследовали местный и дистальный ответ слизистой оболочки на вакцину α-PA после иммунизации мышей через IN, IN плюс IM и IM пути.Антитела IgA количественно определяли в бронхоальвеолярных лавадах (БАЛ) и жидкостях вагинального лаважа (VLF) (рис. 7A и 7B). Значительно повышенные уровни IgA были обнаружены в ЖБАЛ мышей, вакцинированных IN и IN плюс IM, причем более высокие количества продуцировались после иммунизации IN. IN иммунизация стимулировала продукцию IgA также в VLF. Иммунизация внутримышечно вызвала небольшое повышение уровня антител IgA к VLF. Таким образом, мы предполагаем, что интраназальная вакцинация может влиять на иммунитет слизистых оболочек через секрецию IgA.
Рис. 7. Живая вакцина α-PA генерирует ответы антител слизистой оболочки и функциональный IgG в крови.
(A) График иммунизации и титры IgA в БАЛ после ИН плюс IM иммунизация вакциной α-PA (3 × 10 7 КОЕ; IN + IM, n = 9), IM иммунизация α-PA вакцина (3 × 10 7 КОЕ; IM, n = 7), ИН иммунизация вакциной α-PA (3 × 10 7 КОЕ; IN, n = 8) или введение физиологического раствора (IN + IM, n = 9; IM, n = 9; IN, n = 9).Титры были нормализованы до 50 мкл. (B) График иммунизации и титры IgA в VLF после IN плюс IM иммунизация вакциной α-PA (3 × 10 7 КОЕ; IN + IM, n = 8), IM иммунизация вакциной α-PA ( 3 × 10 7 КОЕ; IM, n = 7), ИН иммунизация вакциной α-PA (3 × 10 7 КОЕ; IN, n = 8) или введение физиологического раствора (IN + IM, n = 8; IM, n = 8; IN, n = 8). (A, B) S, физиологический раствор.* P <0,05 (критерий Краскела-Уоллиса) между указанными группами. (C) Схема иммунизации и анализ in vitro OPKA, представляющие процентное уничтожение PAO1 (2 × 10 4 КОЕ) и PA14 (2 × 10 4 КОЕ) сывороткой α-PA (или исходной сывороткой) в присутствии PMN человека. α-PA и наивные сыворотки получали из крови мышей после иммунизации IN вакциной α-PA (3 × 10 7 −2 × 10 8 КОЕ, n = 6) или введения физиологического раствора ( n = 6) соответственно.* P <0,05 (критерий Манна-Уитни).
https://doi.org/10.1371/journal.ppat.1008311.g007
IN иммунизация вакциной α-PA индуцирует функциональные антитела против LPS-гомологичной серогруппы
Ранее мы наблюдали, что мыши, вакцинированные α-PA-IN, зараженные сепсисом PAO1, показали выживаемость 88,9%, тогда как все контрольные мыши погибли [11]. Основываясь на этом прецеденте, мы выдвинули гипотезу, что антимикробная активность сывороточных антител, генерируемых иммунизацией IN, может также представлять опосредованное комплементом убийство и опсонофагоцитоз против PA.Таким образом, мы измерили активность PAO1 и PA14-специфических опсонофагоцитарных убивающих антител (OPKA), используя сыворотку α-PA, полученную из крови мышей после иммунизации IN, и наивную сыворотку контрольных мышей. Как показано на фиг. 7C, происходило значительное уничтожение PAO1 в присутствии α-PA сыворотки и человеческих PMN, но не PA14. Для PAO1 не наблюдалось значительного уничтожения без PMN (0 против 19% убийств; наивное против α-PA сыворотки, соответственно). Эти данные согласуются с ранее наблюдаемым отсутствием пассивно переносимой защиты (S15 фиг.) И предполагают, что независимый от антител механизм может быть ответственным за опосредованную вакциной α-PA защиту против LPS-гетерологичного штамма PA14.
Изучение альтернативных путей иммунизации для иммунитета слизистых оболочек
Мы также протестировали защитный иммунитет слизистой оболочки, создаваемый внутрикожной (ID) и подкожной (SC) доставкой, учитывая, что эти пути иммунизации вызывают как системный, так и слизистый иммунитет. У мышей, вакцинированных с использованием ID и SC путей (S18A и S18C, фиг.), Потери массы тела не наблюдали, что напоминает предыдущие результаты, полученные с IM иммунизацией. Однако через 6 дней после первой ID инъекции вакцины α-PA (1.5 × 10 8 КОЕ), у всех мышей наблюдались поражения кожи в месте инокуляции (S18B фиг.). Эти поражения были временными и не были заметными после 9-го дня. Аналогичным образом, у 2 из 8 мышей через 6 дней после подкожной иммунизации развились поражения в области шеи (1,5 × 10 8 КОЕ) (S18D фиг.). Опять же, эти поражения прошли через 3 дня. Эти результаты предполагают, что вакцина α-PA может вызывать временные местные побочные реакции при введении ID и SC в высоких дозах, таких как 1,5 × 10 8 КОЕ.
Затем мышей заражали IN с помощью PA14 (S19, фиг.).Как показано на фиг. S19B, все мыши, которым вводили 1,5 × 10 8 КОЕ вакцины α-PA, пережили инфекцию, тогда как все контрольные мыши умерли от острой пневмонии. Мыши, которым вводили 3 × 10 7 КОЕ вакцины α-PA, давали 67% выживаемость. Таким образом, кажется вероятным, что вакцина α-PA, вводимая ID, обеспечивает значительную защиту от острой легочной инфекции, вызванной PA14, будучи, по-видимому, более эффективной при использовании более высоких доз, таких как 1,5 × 10 8 КОЕ. Повышенные уровни IgG наблюдались у всех иммунизированных мышей (S19C фиг.).Титры IgG у 3 × 10 7 КОЕ-вакцинированных мышей были не ниже, чем при использовании 1,5 × 10 8 КОЕ.
Затем мы проверили эффективность вакцины подкожно. Как проиллюстрировано на фиг. S7E, мыши, которым вводили 1,5 × 10 8 КОЕ и 3 × 10 7 КОЕ вакцины α-PA, показали выживаемость 88 и 25%, соответственно, что позволяет предположить, что подкожный путь не может вызывать такой же уровень защиты, как ID маршрута. Опять же, повышенные уровни IgG присутствовали у всех иммунизированных мышей (S19F фиг.), Но не наблюдали различий между 3 × 10 7 КОЕ и 1.5 × 10 8 мышей, вакцинированных КОЕ. Это наблюдение согласуется с результатами, полученными при использовании ID-иммунизации, подтверждая, что наблюдаемая защита слизистой оболочки может не зависеть только от системных антител.
Обсуждение
PA является одним из нескольких высокоустойчивых грамотрицательных патогенов, идентифицированных как новые патогены как в США, так и в других частях мира, группа под названием ESKAPE [29]. Это также ведущий патоген, вызывающий внутрибольничные инфекции, часто возникающие при острой пневмонии, связанной с механической вентиляцией легких (ВАП) [30].ВАП, производные от PA, имеют высокую смертность, от 13,5% [31] до 38% [32]. Серьезную озабоченность вызывает рост во всем мире распространенности МЛУ- и ШЛУ-устойчивых РА, что делает необходимость разработки вакцины для защиты от пневмонии. В нашем предыдущем исследовании ауксотрофный штамм D-Glu был выбран и протестирован в качестве прототипа вакцины против сепсиса, происходящего от PA, с использованием внутрибрюшинной иммунизации [11]. Тем не менее инъекция веществ в брюшную полость редко применяется у крупных млекопитающих и людей.Теперь эта работа направлена на определение того, обладает ли этот ауксотроф D-Glu потенциалом иммуногенности и эффективности на модели летальной пневмонии. Хотя были протестированы другие пути (IM, SC и ID), мы сосредоточились на иммунизации IN, поскольку слизистая оболочка носа обеспечивает универсальный входной портал для PA, вызывая местные иммунные ответы слизистой оболочки [33]. При введении этим путем наша живая вакцина вызывала как гуморальный, так и клеточный иммунитет и значительно сокращала количество выживших мышей после заражения двумя ExoU-положительными штаммами PA.Также наблюдалась некоторая защита от диссеминированного клона ST235 XDR. Хотя ExoU-положительные штаммы не несут ответственности за большинство внутрибольничных инфекций PA, мы выбрали их для заражения, поскольку у мышей вероятность смерти выше, чем у мышей, инокулированных ExoU-отрицательными штаммами. Более того, ExoU является наиболее мощным цитотоксином, присутствующим примерно в 30% штаммов, связанных с наиболее тяжелыми инфекциями, включая сепсис [34,35]. Таким образом, относительная вирулентность, связанная с этим эффекторным белком типа III, может иметь более важные прогностические последствия для пациентов, инфицированных PA.
Несмотря на то, что уровни защиты для PAO1 ExoU + и PA14 в некоторых случаях были ниже 100%, при использовании иммунизации IN наблюдалась тенденция к снижению тяжести заболевания. Однако ни одна из исследованных иммунологических детерминант не могла объяснить неравную защиту от ST235. Согласно нашим наблюдениям, иммунизация ИН с использованием более низкой дозы вакцины (3 × 10 7 КОЕ) привела к 67% выживаемости мышей, инфицированных PA14, в отличие от 88%, наблюдаемых при использовании 2 × 10 8 КОЕ, это могло предположить, что использование более высоких доз вакцины может компенсировать низкую эффективность вакцины, наблюдаемую против штамма ST235; однако мы не смогли проверить эту гипотезу из-за запаса прочности при введении ИН.
Многочисленные исследования показали защитную роль IL-17A при пневмонии ПА [21,36,37]. Было показано, что продуцирующие IL-17 γδ Т-клетки способствуют хемотаксису нейтрофилов, уничтожают бактерии PA во время острой легочной инфекции [38] и участвуют в активации B-клеток [39]. Однако наши результаты, по-видимому, показывают, что Т-хелперные клетки CD4 + , а не γδ Т-клетки, стимулируются α-PA вакциной для производства IL-17A, поскольку IN-иммунизированные мыши демонстрируют повышенную частоту IL-17A + CD4 + клеток в легких, чем в контроле, тогда как продуцирующие IL-17 γδ Т-клетки были обнаружены с одинаковой частотой в обеих группах.Таким образом, IL-17A, продуцируемый клетками Th27, вероятно, участвует в защитном эффекте вакцины α-PA против острой легочной инфекции. Действительно, эта популяция Т-клеток ранее была вовлечена в индуцированную вакцинацией защиту от PA [21,36] и других бактерий, вызывающих легочные инфекции [40].
Защита, обеспечиваемая IL-17A, была связана с быстрым привлечением нейтрофилов в дыхательные пути и последующим снижением бактериальной нагрузки [41]. Соответственно, вакцинированные мыши имели большее количество нейтрофилов в легких, чем контрольные.Несмотря на выраженную инфильтрацию нейтрофилов в паренхиму легких, вакцинированные мыши, тем не менее, продемонстрировали заметно меньшую трансмиграцию нейтрофилов в альвеолярное воздушное пространство, что связано с повреждением альвеолярного эпителия и нарушением функции альвеол [28]. Мононуклеарные клетки CD11b + , присутствующие в повышенных количествах в легких вакцинированных мышей, могут способствовать уменьшению воспалительной патологии у этих мышей, как это было ранее показано в состоянии чрезмерного воспаления легких [42].Макрофаги, которых было обнаружено больше в легких вакцинированных мышей, также могут способствовать защите от чрезмерного воспаления. Действительно, воспаление, повреждающее ткани хозяина, у мышей, инфицированных ПА, было связано с более низкой бактерицидной активностью макрофагов [43]. Ответ мононуклеарных клеток, который наблюдался у вакцинированных мышей, но не у контрольных мышей, может, таким образом, объяснить более высокую защиту хозяина при более низкой стоимости воспалительного процесса.
Сыворотка, полученная от IN-вакцинированных мышей, показала опсоническую активность в отношении PAO1.Таким образом, сывороточные антитела, продуцируемые иммунизацией, могут таким образом опосредовать противомикробные функции посредством опсонизации, либо способствуя отложению комплемента и лизису клеток, и / или способствуя фагоцитозу и уничтожению клетками врожденного иммунитета через распознавание рецептора Fc. Это может помочь уменьшить или предотвратить распространение бактерий в кровоток, действуя синергетически с IgA в легких, чтобы предотвратить обострение заболевания. Однако отсутствие опсонической активности в отношении PA14 предполагает, что независимый от антител механизм в качестве помощи Т-клеток может быть необходим для содействия эффективному уничтожению штамма PA14 фагоцитарными клетками.
IM-иммунизация вакциной α-PA вызвала титры сывороточных антител, сравнимые с титрами, обнаруженными при иммунизации IN. Однако наблюдалась пониженная защита от штамма PA14. Взятые вместе результаты экспериментов по пассивной иммунизации, OPKA, проточной цитометрии и количественного определения цитокинов, вероятно, что более низкая защита, наблюдаемая после иммунизации IM, связана с более низкой активацией клеточного иммунитета (включая более низкую активацию Th27). Эта гипотеза дополнительно подтверждается недавними открытиями, описывающими связь между локальными ответами IgA и установлением Th27 в легких после иммунизации дыхательных путей [44].Соответственно, IgA не было обнаружено в БАЛ иммунизированных IM мышей. Действительно, повышенная предрасположенность к ПА-пневмонии наблюдалась у пациентов с вторичным дефицитом IgA [45].
Несмотря на то, что введение ИН 2 × 10 8 КОЕ вакцины α-PA предлагало лучшее улучшение выживаемости мышей, чем внутримышечное введение, оно, тем не менее, вызывало значительную потерю веса тела и легкое воспаление в легких. Это может быть связано с патогенностью, присущей штамму PA PAO1 [46], что подчеркивает необходимость использования низких доз.Действительно, при использовании более низкой дозы вакцины α-PA (3 × 10 7 КОЕ) потери массы тела были временными и не наблюдались через неделю после каждой иммунизации. Считалось, что этот эффект имеет токсикологическое значение от легкой до умеренной степени и, по-видимому, зависит от дозы. Таким образом, путь иммунизации ИН с использованием 3 × 10 7 КОЕ был объединен с доставкой внутримышечно, причем последняя дала снижение защиты, но не приводила к значительной потере массы тела. Комбинированное введение ИН плюс внутримышечное введение с вакциной α-ПА было очевидно более эффективным в снижении тяжести заболевания, чем вакцинация только ИН, поскольку выживаемость мышей была выше.Следовательно, сочетание двух путей иммунизации может быть вариантом преодоления токсического эффекта введения ИН.
Мы также протестировали защитный эффект, вызываемый ID- и SC-доставкой, поскольку сообщалось, что эти пути вакцинации вызывают как системные иммунные ответы, так и иммунные ответы слизистых оболочек [47,48]. ID и подкожное введение вакцины α-PA обеспечивало значительную защиту от PA14 при использовании высоких доз вакцины, однако наблюдались временные местные побочные реакции, и этот побочный эффект следует учитывать в будущем.
Результаты, полученные в этом исследовании, все еще ограничены из-за новизны этой ауксотрофной вакцины D-Glu, что препятствует точному сравнению с другими зарегистрированными вакцинами α-PA. В самом деле, наиболее сходные описанные вакцины-кандидаты представляют собой живые аттенуированные aroA делетантов PAO1 [49] и PA14 [21], но ни одна из этих стратегий не основана на использовании бактериальной ауксотрофии для D-Glu. Возможно, какое-то сходство можно установить с BPZE1, генетически модифицированным штаммом Bordetella pertussis , который был разработан как живая аттенуированная вакцина против коклюша для носа путем генетической элиминации или детоксикации 3 токсинов [50].Было показано, что BPZE безопасен для людей [51], способен временно колонизировать носоглотку человека и вызывать ответы антител при использовании 10 3 , 10 5 и 10 7 КОЕ посредством доставки IN. Однако, несмотря на то, что в будущих исследованиях следует рассмотреть вопрос об оптимизации дозы вакцины α-PA, разумно предположить, что эта вакцина может аналогичным образом обеспечивать приемлемый уровень эффективности без ущерба для безопасности. Более того, можно было бы изучить возможность усовершенствования этого прототипа вакцины путем делеции генов вирулентности для отмены наблюдаемого токсического эффекта.Дополнительным ограничением является то, что исследований in vivo, исследований проводились только на мышах BALB / c, и при использовании других линий мышей могут существовать различия в иммунитете.
В то время как несколько кандидатов на вакцинацию против α-PA обсуждались [8], пациенты, которым назначена операция на сердце [52], и пациенты, которым проводится искусственная вентиляция легких [53], являются наиболее очевидными целевыми лицами. Другой важной инфекционной группой являются пациенты, проходящие химиотерапию [54], или пациенты со СПИДом [55].Но поскольку живые вакцины обычно противопоказаны пациентам с тяжелым иммунодефицитным статусом, существуют некоторые споры о нацеливании на этих людей. Однако, поскольку живая аттенуированная сальмонелла, экспрессирующая антиген PA-O, была иммуногенной и эффективной у мышей с ослабленным иммунитетом [56], кажется разумным рассмотреть возможность использования ауксотрофных живых вакцин в будущем после дальнейшего ослабления вирулентности.
Таким образом, эти результаты предполагают, что живая вакцина α-PA, описанная здесь, может быть многообещающим подходом для достижения иммунитета слизистой оболочки против пневмонии, вызываемой высокопатогенными штаммами PA и, возможно, теми, которые устойчивы к антибиотикам широкого спектра действия.Иммунизация с использованием пути IN кажется благоприятным по сравнению с обычными путями парентеральной доставки, обеспечивая местный, а также системный иммунитет и улучшая выживаемость в модели летальной пневмонии. Однако необходимы дальнейшие исследования эффектов устранения генов токсичности на фоне вакцинного штамма PAO1, чтобы рассмотреть возможность введения через нос.
Материалы и методы
Заявление об этике
Все эксперименты на животных проводились с одобрения Comité Ético de Experimentación Animal of Complejo Hospitalario Universitario A Coruña , Spain , в соответствии с лицензией на проект номер 15002/2016/08 и в соответствии с Real Decreto 53/2013 , от 1 st февраль , который устанавливает основные правила, применимые для защиты животных, используемых в экспериментах и других научных целях, включая обучение.
Штаммы бактерий и условия культивирования
Все бактериальные штаммы и плазмиды, использованные в этом исследовании, перечислены в таблице S1. Все штаммы PA выращивали в бульоне Лурия-Бертани (LB) или на агаре LB при 37 ° C. Когда указано, использовали D-Glu в концентрации 10 мМ.
Животные
Всех мышей содержали в специальном помещении, свободном от патогенов, в Centro Tecnológico de Formación de la Xerencia de Xestión Integrada A Coruña. Самцов и самок мышей BALB / c разводили в нашей колонии и использовали для первых процедур в возрасте от 6 до 8 недель.Исследования не были слепыми.
Иммунизация и заражение летальной пневмонией
Для подготовки инокулята для активной иммунизации и инфекций бактерии культивировали при 37 ° C при перемешивании (180–210 об / мин) до достижения OD 600 нм = 0,7. Культуры собирали центрифугированием (4000 g, 20 мин, 4 ° C), осадки дважды промывали, суспендировали и доводили в стерильном NaCl 0,9% до различных доз (носитель вакцины всегда был NaCl 0,9% — солевой раствор). Перед инокуляцией мышей бактериальный инокулят определяли подсчетом КОЕ в чашках с агаром.Более подробно, штаммы PA и PA Δ murI (вакцина α-PA) культивировали в LB и LB с D-Glu, соответственно, при 37 ° C и 180 об / мин, собирали центрифугированием, дважды промывали LB и, наконец, корректировали с помощью физиологический раствор, как указано выше. Для получения инактивированного формалином PAO1 культуры собирали центрифугированием, промывали физиологическим раствором и инактивировали в 1% (мас. / Об.) Параформальдегиде в PBS путем инкубации при 37 ° C при перемешивании (180 об / мин) в течение 2 часов. Затем бактерии дважды промывали 0,9% NaCl и регулировали, как прежде.Убийство бактерий проверяли посевом на агар LB для определения отсутствия колоний после инкубации в течение ночи. Для анализа активной иммунизации мышам инокулировали IN вакциной α-PA (или инактивированным формалином PAO1) общим объемом 20 мкл. Контрольным мышам вводили физиологический раствор. Для внутримышечных, подкожных и внутримышечных инъекций α-PA вакцины мы использовали общий объем 100 (половина объема на ногу), 200 и 40 мкл соответственно. Через четыре недели после последней иммунизации (по крайней мере) мышей анестезировали и заражали IN (20 мкл) вирулентными штаммами PA.Чтобы облегчить миграцию посевного материала в альвеолы, мышей держали в вертикальном положении головой вверх в течение 2 мин. Затем за мышами наблюдали смертность.
Отбор мышей
Образцы крови были взяты из поднижнечелюстной вены анестезированных мышей, и сыворотки были отделены от клеток крови центрифугированием (1500 g, 15 мин). Для оценки бактериальной нагрузки в легких и печени мышей умерщвляли в указанные моменты времени, ткани извлекали в асептических условиях, гомогенизировали в стерильном NaClO.9% и КОЕ подсчитывают путем посева 10 -2 -кратных серийных разведений на чашки с агаром. VLF получали путем промывания влагалища самок мышей дважды 50 мкл стерильного NaCl 0,9%, затем VLF центрифугировали и прозрачный супернатант использовали для анализов. БАЛ проводился путем введения катетера в трахею окончательно анестезированных мышей, через который 5-8 мл стерильного физиологического раствора закапывали в бронхиолы и осторожно отводили для максимального извлечения жидкости.
ELISA
Количественное определение IgM, IgG, IgG1, IgG2a, IgG2b и IgG3 в сыворотке мышей выполняли с помощью непрямого ELISA, как описано в [11].Hk PAO1 и PA14 получали выращиванием клеток в LB при 37 ° C при перемешивании (180 об / мин) до достижения OD 600 нм = 1,0. Затем бактерии собирали центрифугированием (3900 g, 20 мин, 4 ° C), промывали, суспендировали в стерильном NaCl 0,9% и инактивировали нагреванием путем инкубации при 100 ° C в течение 2 часов. Убийство бактерий проверяли посевом на агар LB и инкубацией в течение ночи при 37 ° C. Количественное определение антител IgA в VLF и BAL выполняли с помощью непрямого ELISA в соответствии с [57], используя вторичные антитела, конъюгированные с щелочной фосфатазой, против IgA мыши, разведенные 1: 500.Планшеты «покрывали» инактивированным формалином PAO1, который фиксировали на дне лунок после инкубации в течение ночи при 4 ° C в 100 мМ карбонатно-бикарбонатном буфере, pH 9,6. Титры IgA в БАЛ были нормализованы до 50 мкл, того же объема, что и для образцов VLF.
Обнаружение цитокинов в культурах спленоцитов
Суспензии единичных клеток селезенки, суспендированные в полной среде RPMI-1640, высевали в 96-луночные планшеты с круглым дном (5 × 10 5 / лунку) и стимулировали Hk PA14 (5 × 10 5 КОЕ и 5 × 10 4 КОЕ) при соотношении спленоциты: бактерии 1: 1 и 1: 0.1 в течение 3 дней при 37 ° C и 5% CO 2 . Hk PA14 получали, как описано выше, но выращивали клетки в LB до достижения OD 600 нм = 0,7. Затем бактерии инактивировали нагреванием, как и раньше. В контрольные спленоциты добавляли только RPMI-1640 (без стимулов). Образцы от всех животных использовали в дублирующих лунках. Концентрации IFN-γ, IL-17A и IL-4 в супернатантах клеточных культур были количественно определены с помощью Ready-SET-Go! Наборы ELISA для мышиного IFN-γ, IL-17A и IL-4 (eBioscience) соответственно. Концентрацию IL-10 определяли с использованием системы разработки Mouse IL-10 DuoSet ELISA (R&D Systems).
Анализ проточной цитометрии
Оценку клонов клеточной поверхности или маркеров активации на различных популяциях лейкоцитов селезенки и легких проводили с помощью анализа проточной цитометрии (анализ с помощью флюоресцентно-активированного клеточного сортировщика [FACS]), как описано в разделе «Дополнительная информация, материалы и методы S1».
Пассивная иммунизация
Мышам давали антисыворотку, обогащенную IgG (100 мкл IP, 400 мкг IgG / мышь) или наивную сыворотку, за 4 часа до заражения PA14.Антисыворотка, обогащенная IgG, была приготовлена с использованием очищенных антител, полученных от IN- и IM-иммунизированных мышей с использованием предыдущих схем вакцинации (фиг. 1A и 4A), которые затем были разбавлены исходной сывороткой. Очистку антител проводили на гравитационных колонках Protein G GraviTrap (GE Healthcare Life Science, Inc., США). После этого для обессоливания и концентрации элюированных антител использовали фильтрующие устройства Amicon Ultra-15 (Millipore, Inc., США).
Гистопатология
Легкие собирали и фиксировали в 4% параформальдегиде с pH 7.0 минимум на 24 часа. Затем фиксированные ткани обычно обрабатывали и заключали в парафин, разрезали на срезы 3 мкм и окрашивали гематоксилином и эозином (HE) после депарафинизации в ксилоле и регидратации при уменьшении концентрации этанола для гистологической оценки патологом. Срезы легкого по всему органу оценивали под микроскопом, чтобы оценить распределение и характер патологических изменений, а также картину воспаления легких. Все обследования проводились опытным ветеринаром-патологом-экспериментатором, не знающим условий эксперимента.
Опсонофагоцитарный анализ киллинга (OPKA)
OPKA оценивали в отношении PAO1, как ранее [11], с использованием сыворотки α-PA, полученной из крови мышей после иммунизации IN, и наивной сыворотки от контрольных мышей. Целевые штаммы, 5 × 10 5 полиморфно-ядерных лейкоцитов (PMN) от людей-добровольцев, 2,5% сыворотка комплемента от кроликов и тестовые сыворотки (конечное разведение 1: 8) были приготовлены в среде RPMI 1640, содержащей 10% FBS. PMN были получены из цельной крови с использованием единственного градиента плотности Перколла [58].
Статистика
Данные, представленные в виде прямоугольных диаграмм, были проанализированы с использованием теста Манна-Уитни для двух экспериментальных групп-сравнение и Крускала-Уоллиса для трех или более групп-сравнения (с помощью теста множественного сравнения Данна). В противном случае средние значения сравнивались с использованием критерия Стьюдента. Данные о выживаемости сравнивались с использованием лог-рангового теста. Статистическая значимость потери веса у мышей оценивалась смешанным дисперсионным анализом с «днем исследования» в качестве фактора внутри субъектов и «группой лечения» в качестве фактора между субъектами, с последующим тестом множественного сравнения Бонферрони.Сферичность проверяли с помощью теста Мочли. Различия считались значимыми, когда P <0,05. Существенные изменения внутри групп из-за увеличения массы тела мышей с течением времени не показаны для ясности.
Дополнительная информация
S1 Рис. Стратегия стробирования, используемая для определения наивных CD4 T и антиген-испытанных клеток в селезенке неинфицированных мышей.
Дебрис исключали (клетки минус дебрис) на основании параметров FSC и SSC, а дублеты исключали (одиночные клетки) на графиках FSC-H по сравнению с FSC-A.Жизнеспособные клетки (живые клетки) считали клетками, отрицательными по окрашиванию, для фиксации жизнеспособности. CD4 Т-клетки были определены как CD3 + CD4 + , и квадранты были установлены на основе окрашивания FMO на контурных графиках для определения наивных (CD62L + CD44 —) центральной памяти (CD62L + CD44 ). + ) и эффекторной памяти (CD62L — CD44 + ) клеток.
https://doi.org/10.1371/journal.ppat.1008311.s002
(JPG)
S2 Рис. Профиль дифференцировки цитокинов CD4
+ Т-клеток от мышей, которым вводили вакцину α-PA, до и после инфицирования PA.
(A) мышей BALB / c ( n = 6 / группа) иммунизировали живой вакциной α-PA (2 × 10 8 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем в указанный день собирали селезенки и легкие. (B) мышей BALB / c ( n = 6 / группа) иммунизировали живой α-PA вакциной (2 × 10 8 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем мышей инфицировали PA14 (1 × 10 6 КОЕ) в указанный день.Селезенки и легкие собирали через 9 часов. (C) Частота (процент) CD4-управляемых Т-клеток селезенки и легких, экспрессирующих IFN-γ, IL-10, IL-4 и TNF-α инфицированных и неинфицированных мышей, обнаруженная посредством внутриклеточного окрашивания после стимуляции PMA / иономицин. Столбики представляют собой среднее значение ± стандартное отклонение данных. * P <0,05, ** P <0,01, *** P <0,001 (t-критерий) по сравнению с группой, получавшей физиологический раствор. нс , незначительно.
https://doi.org/10.1371/journal.ppat.1008311.s003
(JPG)
S3 Рис. Профиль дифференцировки цитокинов CD4 селезенки
+ Т-клеток от мышей, которым вводили вакцину α-PA, до и после инфицирования PA, обнаруженный с помощью интрацитоплазматического окрашивания и проточного цитометрического анализа.
(A) мышей BALB / c ( n = 6 / группа) иммунизировали живой вакциной α-PA (2 × 10 8 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем в указанный день собирали селезенки. (B) мышей BALB / c ( n = 6 / группа) иммунизировали живой α-PA вакциной (2 × 10 8 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем мышей инфицировали PA14 (1 × 10 6 КОЕ) в указанный день. Селезенки собирали через 9 часов. (C) Типичные примеры CD4-управляемых Т-клеток селезенки, полученных от инфицированных и неинфицированных мышей, обнаруженных с помощью внутриклеточного окрашивания, после стимуляции PMA / иономицином. Области анализа были установлены в соответствии с образцами, окрашенными FMO и изотипическим контролем.Числа внутри областей точечного графика представляют собой средние значения ± стандартное отклонение частоты клеток из-за окрашивания соответствующих цитокинов.
https://doi.org/10.1371/journal.ppat.1008311.s004
(JPG)
S4 Рис. Профиль дифференцировки цитокинов CD4
+ Т-клеток из легких мышей, которым вводили вакцину α-PA IN, до и после инфицирования PA, обнаруженный с помощью проточного цитометрического анализа.
(A) мышей BALB / c ( n = 6 / группа) иммунизировали живой вакциной α-PA (2 × 10 8 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем в указанный день собирали легкие. (B) мышей BALB / c ( n = 6 / группа) иммунизировали живой α-PA вакциной (2 × 10 8 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем мышей инфицировали PA14 (1 × 10 6 КОЕ) в указанный день. Легкие были собраны через 9 часов. (C) Репрезентативные примеры CD4-управляемых T-клеток легких, полученных от инфицированных и неинфицированных мышей, обнаруженных с помощью внутриклеточного окрашивания, после стимуляции PMA / иономицином. Области анализа были установлены в соответствии с образцами, окрашенными FMO и изотипическим контролем.Числа внутри областей точечного графика представляют собой средние значения ± стандартное отклонение частоты клеток из-за окрашивания соответствующих цитокинов.
https://doi.org/10.1371/journal.ppat.1008311.s005
(JPG)
S5 Фиг. Стратегия стробирования проточной цитометрии, используемая для определения CD4 T-клеток селезенки и легких мышей, продуцирующих цитокины IFN-γ, IL-17A, IL-10 и IL-4.
Клетки стимулировали PMA / иономицином в присутствии брефельдина A в течение 4 часов с последующим окрашиванием поверхности маркером линии. Производимые цитокины метили внутриклеточным окрашиванием.Лимфоциты отбирали на основании параметров FSC и SSC, затем исключали дублеты (одиночные клетки), а жизнеспособные клетки (живые клетки) считывали как фиксируемые клетки, отрицательные по красителю по жизнеспособности. CD4 Т-клетки были определены как CD3 + CD4 + , и квадранты были установлены на основе окрашивания FMO на контурных графиках для определения цитокин-продуцирующих клеток. Показаны характерные контурные графики CD4 T-клеток селезенки, продуцирующих IFN-γ, IL-17A, IL-10 и IL-4.
https://doi.org/10.1371/journal.ppat.1008311.s006
(JPG)
S6 Рис. Анализ γδ Т-клеток мышей, которым вводили вакцину α-PA, до и после заражения PA.
(A) мышей BALB / c ( n = 6 / группа) иммунизировали живой вакциной α-PA (2 × 10 8 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем в указанный день собирали селезенки и легкие. (B) мышей BALB / c ( n = 6 / группа) иммунизировали живой α-PA вакциной (2 × 10 8 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем мышей инфицировали PA14 (1 × 10 6 КОЕ) в указанный день.Селезенки и легкие собирали через 9 часов. (C, D) Типичные примеры и частота (процент) γδ-управляемых Т-клеток легких, экспрессирующих IL-17A (C) и IFN-γ (D) инфицированных и неинфицированных мышей, обнаруженных с помощью внутриклеточного окрашивание после стимуляции в течение 4 часов PMA / иономицином в присутствии Brefeldin A. Области анализа устанавливали в соответствии с FMO и образцами, окрашенными изотипическим контролем. Числа внутри областей точечного графика представляют собой средние значения ± стандартное отклонение частоты клеток из-за окрашивания соответствующих цитокинов.Столбики представляют собой среднее значение ± стандартное отклонение данных. * P <0,05, ** P <0,01 (t-критерий) по сравнению с группой, получавшей физиологический раствор.
https://doi.org/10.1371/journal.ppat.1008311.s007
(JPG)
S7 Рис. Стратегия стробирования, используемая для идентификации γδ Т-клеток, продуцирующих IFN-γ и IL-17A, в легких мышей с помощью проточного цитометрического анализа.
Клетки стимулировали PMA / иономицином в присутствии брефельдина A в течение 4 часов с последующим окрашиванием поверхности маркером линии. Производимые цитокины метили внутриклеточным окрашиванием.Дебрис исключали (клетки минус дебрис), а лимфоциты отбирали на основе параметров FSC и SSC. Затем были исключены дублеты (отдельные клетки) с последующим исключением мертвых клеток (живые клетки). Т-клетки γδ были определены как γδ TCR + , и квадранты были установлены на основе окрашивания FMO для определения клеток, продуцирующих цитокины. Показаны характерные контурные графики γδ Т-клеток легких, продуцирующих IFN-γ и IL-17A.
https://doi.org/10.1371/journal.ppat.1008311.s008
(JPG)
S8 Фиг.IN иммунизация вакциной α-PA запускает секрецию цитокинов IFN-γ, IL-17A и IL-10 мышиными спленоцитами.
(A, B) Мышей ( n = 6-7 / группа) иммунизировали α-PA вакциной (2 × 10 8 КОЕ) или вводили физиологический раствор согласно схемам; затем были собраны селезенки. В примере (B) мышей заражали PA14 (1 × 10 6 КОЕ) за 9 ч до получения селезенки. (A, B) На графиках показаны концентрации IFN-γ, IL-17A и IL-10 в супернатантах культур спленоцитов вакцинированных и невакцинированных мышей после стимуляции ex vivo Hk PA14 (5 × 10 5 КОЕ и 5 × 10 4 КОЕ для 1: 1 и 1: 0.1 соотношение спленоциты: бактерии соответственно) в течение 3 дней. К контрольным спленоцитам стимулы не добавляли. Среднее ± SD. * P <0,05, (критерий Манна-Уитни).
https://doi.org/10.1371/journal.ppat.1008311.s009
(JPG)
S9 Рис. Анализ миелоидных клеток в легких мышей, вакцинированных IN α-PA.
(A, B) Мышей ( n = 6 / группа) иммунизировали α-PA вакциной (2 × 10 8 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем были собраны легкие.В (B) мышей ( n = 6 / группа) были инфицированы PA14 (1 × 10 6 КОЕ) за 9 часов до получения легких. (C, D) Общее количество клеток в легких неинфицированных (C) и инфицированных (D) мышей, обнаруженных проточной цитометрией при окрашивании поверхности в соответствии с графиками, указанными в (A) и (B) соответственно. Области анализа были установлены в соответствии с контрольными окрашенными образцами FMO. Столбики представляют собой среднее значение ± стандартное отклонение данных.* P <0,05, ** P <0,01, *** P <0,001, **** P <0,0001 (t-критерий).
https://doi.org/10.1371/journal.ppat.1008311.s010
(JPG)
S10 Рис. Стратегия стробирования, используемая для идентификации основных субпопуляций миелоидных клеток в легких мыши с помощью анализа проточной цитометрии.
Клетки, выделенные из переваренных коллагеназой легких мыши, окрашивали смесью антител, конъюгированных с флуорофором, после стадии предварительной инкубации с антимышиным CD16 / CD32 (FcBlock).Стратегия последовательного стробирования использовалась для идентификации популяций клеток на основе их поверхностной экспрессии специфических маркеров. После исключения дебриса (клетки минус дебрис) и дублетов (одиночные клетки) иммунные клетки блокировали на основе экспрессии CD45 (CD45 + клетки) с последующим исключением мертвых клеток (живые клетки). Нейтрофилы были определены как клетки CD11b + Ly6G + ; дендритные клетки (DC) были идентифицированы как Ly6G — CD11c + F4 / 80 — MHC class II + , которые можно было далее разделить на подгруппы CD11b + и CD11b — DC; альвеолярные макрофаги (AM) были определены как Ly6G — CD11c + F4 / 80 + MHC class II — , а интерстициальные макрофаги (IM) были определены как Ly6G- CD11c + F4 / 80 + MHC класс II + ; в популяции Ly6G — CD11c — CD11b + F4 / 80 + клетки были разделены на основе их экспрессии Ly6C и характеристик бокового рассеяния: Ly6C + моноцитов / макрофагов (Ly6C + Mo / MΦ) были определены как Ly6G — CD11c — CD11b + F4 / 80 + Ly6C + , Ly6C — Mo / MΦ как Ly6G — CD11c — CD11b + / CD 80 + и SSC lo и эозинофилы как Ly6G — CD11c — CD11b + F4 / 80 + и SSC hi .
https://doi.org/10.1371/journal.ppat.1008311.s011
(JPG)
S11 Рис. CD4 памяти
+ Т-клеточный ответ после внутримышечной иммунизации живой α-PA вакциной.
(A) мышей ( n = 6 / группа) иммунизировали α-PA вакциной (3 × 10 7 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем были собраны селезенки. (B) Процент эффекторной памяти селезенки (CD44 + CD62L — ), центральной памяти (CD44 + CD62L + ) и наивной (CD44 — CD62L + ) CD4 + + клетки.Среднее ± стандартное отклонение данных. * P <0,05 (t-критерий).
https://doi.org/10.1371/journal.ppat.1008311.s012
(JPG)
S12 Рис. Профиль дифференцировки цитокинов CD4
+ Т-клеток от мышей, которым вводили вакцину α-PA, до и после инфицирования PA14.
(A) мышей BALB / c ( n = 6 / группа) иммунизировали живой вакциной α-PA (3 × 10 7 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем в указанный день собирали селезенки и легкие. (B) мышей BALB / c ( n = 6 / группа) иммунизировали живой α-PA вакциной (3 × 10 7 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем мышей инфицировали PA14 (1 × 10 6 КОЕ) в указанный день. Селезенки и легкие собирали через 9 часов. (C) Частота (процент) CD4-управляемых Т-клеток селезенки и легких, экспрессирующих IL-17A, IFN-γ, IL-10, IL-4 и TNF-α инфицированных и неинфицированных мышей, обнаруженная с помощью внутриклеточного окрашивания после стимуляции PMA / иономицином.Столбики представляют собой среднее значение ± стандартное отклонение данных. * P <0,05 (t-критерий).
https://doi.org/10.1371/journal.ppat.1008311.s013
(JPG)
S13 Рис. Продукция цитокинов после внутримышечной иммунизации вакциной α-PA.
(A, B) Мышей ( n = 6 / группа) иммунизировали α-PA вакциной (3 × 10 7 КОЕ) или вводили физиологический раствор согласно схемам; затем были собраны селезенки. В примере (B) мышей заражали PA14 (1 × 10 6 КОЕ) за 9 ч до получения селезенки. (A, B) Графики показывают концентрации IFN-γ, IL-17A, IL-10 и IL-4 в супернатантах культур спленоцитов вакцинированных и невакцинированных мышей после стимуляции ex vivo Hk PA14 (5 × 10 5 КОЕ и 5 × 10 4 КОЕ для соотношения спленоцитов: бактерий 1: 1 и 1: 0,1 соответственно) в течение 3 дней. К контрольным спленоцитам стимулы не добавляли. Среднее ± SD. * P <0,05, (критерий Манна-Уитни).
https://doi.org/10.1371/journal.ppat.1008311.s014
(JPG)
S14 Рис. Анализ миелоидных клеток в легких IM-вакцинированных мышей.
(A, B) Мышей ( n = 6 / группа) иммунизировали α-PA вакциной (3 × 10 7 КОЕ) или вводили физиологический раствор в соответствии с графиком; затем были собраны легкие. В (B) мышей ( n = 6 / группа) были инфицированы PA14 (1 × 10 6 КОЕ) за 9 часов до получения легких. (C, D) Общее количество клеток в легких неинфицированных (C) и инфицированных (D) мышей, обнаруженных проточной цитометрией при окрашивании поверхности в соответствии с графиками, указанными в (A) и (B) соответственно.Области анализа были установлены в соответствии с контрольными окрашенными образцами FMO. Столбики представляют собой среднее значение ± стандартное отклонение данных. * P <0,05 (t-критерий).
https://doi.org/10.1371/journal.ppat.1008311.s015
(JPG)
S15 Рис. Отсутствие пассивно передаваемой защиты с использованием иммунной сыворотки α-PA.
Выживаемость мышей после пассивной иммунизации мышиной антисывороткой, обогащенной IgG, полученной от IN- и IM-иммунизированных мышей (живая вакцина α-PA), или наивной сывороткой и контрольным заражением PA14 (3 × 10 6 КОЕ) ( n = 6–11 мышей / группа).
https://doi.org/10.1371/journal.ppat.1008311.s016
(JPG)
S16 Рис. Различные пути иммунизации и влияние на массу тела мышей.
(A) Процент изменения веса мышей после иммунизации IN вакциной α-PA (2 × 10 8 КОЕ, n = 8) и введения физиологического раствора ( n = 8). (B) Процент изменения веса мышей после внутримышечной иммунизации α-PA вакциной (3 × 10 7 КОЕ, n = 7) и введения физиологического раствора ( n = 7). (C) Процент изменения веса мышей после иммунизации IN вакциной α-PA (3 × 10 7 КОЕ, n = 9) и введения физиологического раствора ( n = 8). (D) Процент изменения веса мышей после иммунизации IN плюс IM вакциной α-PA (3 × 10 7 КОЕ, n = 9) и введения физиологического раствора ( n = 8). (C, D) Для сравнения использовали ту же контрольную группу — мыши, которым вводили физиологический раствор путем IN + IM. (A-D) Среднее ± стандартное отклонение. * P <0,05 (попарное сравнение веса вакцинированных мышей, смешанный дисперсионный анализ ANOVA). # P <0,05, (попарное сравнение весов между группами, смешанный ANOVA).
https://doi.org/10.1371/journal.ppat.1008311.s017
(JPG)
S17 Рис. Тестирование безопасности и эффективности иммунизации IN с использованием низких доз вакцины α-PA.
(A) Мышей иммунизировали вакциной α-PA (8 × 10 5 КОЕ, n = 8; 7 × 10 6 КОЕ, n = 8) или вводили физиологический раствор ( n = 8) по расписанию; затем мышей заражали PA14 (1 × 10 6 КОЕ) в указанный день.Систему MDSS применяли для определения тяжести заболевания и суррогатных конечных точек через 16 часов после заражения. Бактериальная нагрузка в легких была определена сразу после этого. (B) Процент изменения веса мышей после иммунизации IN вакциной α-PA или введением физиологического раствора. Среднее ± SD. * P <0,05, 7 × 10 6 CFU-вакцинированная группа (попарное сравнение весов внутри групп, смешанный ANOVA). # 1 P <0,05, физиологический раствор против 8 × 10 5 КОЕ, 8 × 10 5 против 7 × 10 6 КОЕ; # 2 P <0.05, физиологический раствор против 7 × 10 6 КОЕ, 8 × 10 5 против 7 × 10 6 КОЕ (попарное сравнение весов между группами, смешанный ANOVA). (C) MDSS после иммунизации различными дозами вакцины α-PA и контрольного заражения PA14. (D) Бактериальная нагрузка в легких мышей после иммунизации различными дозами вакцины α-PA и контрольного заражения PA14.
https://doi.org/10.1371/journal.ppat.1008311.s018
(JPG)
S18 Фиг.Оценка токсичности живой вакцины α-PA с использованием ID и SC маршрутов иммунизации.
(A) Процент изменения веса мышей после ID-иммунизации живой α-PA вакциной (1,5 × 10 8 КОЕ, n = 8; 3 × 10 7 КОЕ, n = 9) или введение физиологического раствора ( n = 8). (B) Повреждение кожи, вызванное ID инъекцией живой α-PA вакцины (1,5 × 10 8 КОЕ). (C) Процент изменения веса мышей после подкожной иммунизации живой α-PA вакциной (1.5 × 10 8 КОЕ, n = 8; 3 × 10 7 КОЕ, n = 8) или введение физиологического раствора ( n = 8). (D) Поражение кожи, вызванное подкожной инъекцией живой α-PA вакцины (1,5 × 10 8 КОЕ). (A, C) Среднее ± стандартное отклонение.
https://doi.org/10.1371/journal.ppat.1008311.s019
(JPG)
S19 Рис. Защитная эффективность и системные ответы антител, вызванные введением живой α-PA вакцины ID и SC.
(A) Схема иммунизации с использованием пути ID, взятия образцов мышей и заражения легочной инфекцией. (B) Выживаемость мышей после ID-иммунизации живой α-PA вакциной (1,5 × 10 8 КОЕ, n = 7; 3 × 10 7 КОЕ, n = 9) или введения физиологического раствора ( n = 7) и заражение PA14 (1 × 10 6 КОЕ), вызывающее острую пневмонию. (C) Титры PAO1-специфических антител после ID-иммунизации живой α-PA вакциной (3 × 10 7 КОЕ, n = 6; 1,5 × 10 8 КОЕ, n = 7) или введение физиологического раствора ( n = 5). (D) Схема иммунизации с использованием подкожного пути, взятия образцов мышей и заражения легочной инфекцией. (E) Выживаемость мышей после подкожной иммунизации живой α-PA вакциной (1,5 × 10 8 КОЕ, n = 8; 3 × 10 7 КОЕ, n = 8) или введения физиологического раствора ( n = 8) и заражение PA14 (1 × 10 6 КОЕ), вызывающее острую пневмонию. (F) Титры PAO1-специфических антител после подкожной иммунизации живой α-PA вакциной (3 × 10 7 КОЕ, n = 7; 1.5 × 10 8 КОЕ, n = 8) или введение физиологического раствора ( n = 8). (B, E) * P <0,05 (лог-ранговый тест) по сравнению с группой, получавшей физиологический раствор. (C, F) S, физиологический раствор. * P <0,05 (критерий Краскела-Уоллиса) по сравнению с группой, получавшей физиологический раствор.
https://doi.org/10.1371/journal.ppat.1008311.s020
(JPG)
Голубиный парамиксовирус типа 1 со смертельным исходом у человека вызывает пневмонию у экспериментально инфицированных макак cynomolgus (Macaca fascicularis) | Ветеринарные исследования
Препарат вируса
Изолят hPPMV-1 / Netherlands / 579/2003 был получен от взрослой пациентки из Нидерландов с множественной миеломой, которая умерла от дыхательной недостаточности после проведения аллогенной трансплантации костного мозга и иммуносупрессивного лечения [11] (неопубликованные наблюдения).Изолят вируса дважды пассировали на клетках рабдомиосаркомы человека и один раз на клетках Vero. Перед инокуляцией изолят вируса культивировали в 10-дневных куриных яйцах без специфических патогенов с эмбрионами, используя стандартные методы, и собирали при 2 dpi. Исходный вирус титровали анализом конечной точки разведения в клетках Vero clone 118. Для определения инфекции клетки окрашивали куриным поликлональным антителом против APMV-1 и кроличьим FITC-меченным антителом против куриного IgG (разведение 1: 2000 и 1: 1000 соответственно; оба из Abcam, Кембридж, Великобритания) через 72 часа после инокуляции. .Титры вирусов рассчитывали по методу Рида и Мюнча [18]. Титр инфекционного вируса в этом исходном материале составлял 5 × 10 8 средней инфекционной дозы культуры ткани (TCID 50 ) на мл.
Протокол эксперимента
Три самца макак-яванок в возрасте 3,5 лет были выведены в колонии и содержались в групповых помещениях, где их ежегодно обследовали — и дали отрицательный результат — на следующие инфекции: обезьяний вирус 40, полиомавирус, Mycobacterium tuberculosis , вирус кори, вирус паротита, вирус обезьяньего иммунодефицита, обезьяний ретровирус типа D и вирус обезьяньей Т-клеточной лейкемии.До заражения они прошли клиническое обследование и признаны здоровыми ветеринаром. За месяц до начала эксперимента внутрибрюшинно имплантировали датчик температуры Data Storage Tag (Star-Oddi, Брюссель, Бельгия), настроенный на регистрацию температуры каждые 10 минут. За неделю до инокуляции макак помещали вместе в изолирующую клетку с отрицательным давлением, фильтрованную НЕРА. Им давали коммерческие кормовые гранулы и воду ad libitum. Макак инокулировали 1.0 × 10 8 TCID 50 hPPMV-1 / Netherlands / 579/2003, который суспендировали в 4,5 мл фосфатно-солевого буфера (PBS). Приблизительно 3 мл вводили интратрахеально с помощью катетера, 0,5 мл в каждую ноздрю и 0,25 мл на каждую конъюнктиву. За макаками ежедневно наблюдали на предмет недомогания, кашля, экссудата из глаз или носа, форсированного дыхания и любых других признаков болезни. Макак умерщвляли при 3 dpi путем обескровливания под анестезией кетамином и медетомидина гидрохлоридом.Непосредственно перед заражением и ежедневно до эвтаназии макак анестезировали кетамином и гидрохлоридом медетомидина, собирали мазки из глотки, носа, глаза и ректальные мазки в 1 мл транспортной среды [19] и хранили при -70 ° C до проведения количественной ОТ-ПЦР. (qRT-PCR) и / или выделение вируса. Кроме того, в каждую из этих временных точек брали 4 мл крови из паховой вены и собирали в пробирки Vacuette Z Serum Sep Clot Activator (Greiner Bio One, Alphen aan den Rijn, Нидерланды).
Клиническая биохимия
Образцы свернувшейся крови центрифугировали и 100 мкл отделенной сыворотки анализировали с помощью дисков с реагентами Piccolo BioChemistry Panel Plus (Abaxis, Дармштадт, Германия), которые обрабатывали с использованием химического анализатора Piccolo Xpress (Abaxis) в соответствии с инструкциями производителя. Были получены измерения глюкозы, азота мочевины крови, креатинина, кальция, альбумина, общего белка, аланинаминотрансферазы, аспартатаминотрансферазы, щелочной фосфатазы, γ-глутамилтранспептидазы, амилазы и С-реактивного белка.Контрольные значения (если указаны) были получены из дополнительных данных публикации Xie et al. [20].
Вскрытие и забор тканей
Вскрытие проводилось по стандартному протоколу. Органы были исследованы на наличие повреждений и взяты образцы для лабораторных анализов. Для гистопатологии и иммуногистохимии образцы надпочечников, ствола мозга, мозжечка, головного мозга, конъюнктивы, решетчатой кости, глаза, века, сердца (левый и правый желудочек), почки, толстой кишки, легкого (левый и правый; верхний, средний и нижний доли), печень, брыжеечные лимфатические узлы, носовые раковины, поджелудочную железу, тонкий кишечник, селезенку, миндалины и трахеобронхиальные лимфатические узлы собирали в 10% формалине с нейтральным буфером (легкие после надувания формалином) и оставляли для фиксации в течение 1 недели.Для кОТ-ПЦР выполняли бронхоальвеолярный лаваж (БАЛ) путем прямой инфузии PBS в правый главный бронх. Извлеченную жидкость БАЛ центрифугировали, клеточный осадок ресуспендировали в TRIzol и хранили при -80 ° C до дальнейшего анализа. Кроме того, образцы надпочечников, головного мозга, спинномозговой жидкости, конъюнктивы, сердца, почек, брыжеечных лимфатических узлов, легкого (правые верхние и нижние доли), толстой кишки, печени, носовых раковин, носовой перегородки, поджелудочной железы, главного бронха, тонкой кишки. , селезенку, трахею и трахео-бронхиальные лимфатические узлы собирали в RNAlater (Life Technologies, Bleiswijk, Нидерланды) и хранили при -80 ° C до дальнейшего анализа.Для выделения вируса образцы из тех же тканей, что и для qRT-PCR, хранили без добавок при -80 ° C до дальнейшего анализа.
Histopathology
Образцы для гистопатологического анализа заливали парафином, делали срезы толщиной 3 мкм и окрашивали гематоксилином и эозином (H&E) для исследования с помощью световой микроскопии. В качестве отрицательного контроля использовали срезы тканей клинически здоровой молодой макаки cynomolgus, которая не была инфицирована PPMV-1.
Иммуногистохимия
Фиксированные формалином, залитые парафином срезы толщиной 3 мкм тех же тканей, исследованных гистопатологически, окрашивали с использованием иммунопероксидазного метода.Срезы тканей помещали на предметные стекла с покрытием (Klinipath, Duiven, Нидерланды), депарафинизировали и регидратировали. Эндогенную пероксидазу блокировали инкубацией срезов в 3% H 2 O 2 в PBS в течение 10 минут при комнатной температуре (RT). Антиген извлекали трис-ЭДТА-буфером (pH 9) в течение 15 мин. Затем срезы промывали PBS, содержащим 0,05% Tween 20 (Fluka, Chemie AG, Buchs, Швейцария), и инкубировали в PBS с 0,1% BSA (Aurion, Wageningen, Нидерланды) в течение 10 минут при комнатной температуре.После этого срезы инкубировали в PBS с 0,1% BSA с моноклональным мышиным антителом IgG2a к APMV-1 (разведение 1: 100, MAb 6h22, специфическое к рибонуклеопротеину; штамм La Sota, Hytest Ltd, Турку, Финляндия) или с отрицательным контрольное моноклональное антитело мыши изотипа (разведение 1: 100, MAb 003, R&D System, Миннеаполис, США) в течение 1 ч при комнатной температуре. После промывки срезы инкубировали с козьими антимышиными антителами (разведение 1: 400, Southern Biotech, Бирмингем, штат Алабама, США), меченными пероксидазой хрена (HRP), в течение 1 ч при комнатной температуре.Активность HRP выявляли путем инкубации срезов в 3-амино-9-этилкарбазоле (Sigma Chemical Co., Сент-Луис, США) в растворе N , N -диметилформамида (Sigma Chemical Co.) в течение 10 мин при комнатной температуре. , в результате чего образуется красный осадок. Срезы контрастировали гематоксилином. Срезы ткани головного мозга баклана ( Phalacrocorax auritus ), который, как известно, инфицирован APMV-1, использовали в качестве положительного контроля. В качестве отрицательного контроля использовали срезы тканей клинически здоровой молодой макаки cynomolgus, которая не была инфицирована PPMV-1.
Выделение РНК и анализ qRT-PCR
Образцы BAL, хранящиеся в TRIzol, были обработаны в соответствии с инструкциями производителя для выделения РНК. Образцы тканей, хранящиеся в RNAlater, взвешивали, размораживали, переносили в пробирки, содержащие керамическую сферу диаметром четверть дюйма в среде для переноса вирусов, и гомогенизировали с использованием тканевого гомогенизатора FastPrep 24 (MP Biomedicals, Эйндховен, Нидерланды). Гомогенаты центрифугировали, и очищенные супернатанты использовали для выделения РНК.200 мкл очищенного супернатанта образцов ткани, а также 200 мкл других образцов (транспортная среда мазков, плазма) были объединены с 300 мкл лизисного буфера из набора Total Nucleic Acid Isolation kit (Roche, Woerden, Нидерланды) и РНК. был выделен в объеме 50 мкл с использованием машины MagNA Pure LC (Roche) в соответствии с инструкциями производителя.
NDV-специфическая qRT-PCR была проведена на 5 мкл (образцы TRIzol) или 19,5 мкл (образцы MagNA Pure) РНК в системе определения последовательности ABI PRISM 7000 с использованием 1-этапной мастер-смеси TaqMan Fast Virus (оба от Life Technologies) в общий объем 30 мкл, используя праймеры, как описано Wise et al.[21]. Стадия RT составляла 5 минут при 50 ° C, затем 95 ° C в течение 20 с. Цикл включал 45 циклов: 3 с денатурации при 95 ° C, 5 с отжига при 54 ° C и 31 с удлинения при 60 ° C.
Выделение вируса
200 мкл транспортной среды из собранных мазков или 200 мкл супернатанта из гомогенизированных образцов ткани вводили в двух экземплярах в 10-дневные куриные яйца, свободные от специфических патогенов. Через 2 дня аллантоисную жидкость собирали и тестировали на наличие вируса с помощью анализа гемагглютинации.
Вот что коронавирус делает с телом
Многое остается неизвестным о новом коронавирусе, распространяющемся по Китаю, но одно можно сказать наверняка. Болезнь способна обрушить шторм на все человеческое тело.
Такова была природа прошлых зоонозных коронавирусов, которые передавались от животных к людям, например, SARS и MERS. В отличие от своих кузенов, вызывающих простуду, эти новые коронавирусы могут вызвать вирусный пожар во многих органах человека, и новое заболевание, названное Всемирной организацией здравоохранения «COVID-19», не является исключением, когда оно является серьезным. .
Это помогает объяснить, почему эпидемия COVID-19 унесла жизни более 1800 человек, что превышает число погибших от SARS за считанные недели. Хотя уровень смертности от COVID-19, похоже, составляет пятую часть от SARS, новый коронавирус распространяется быстрее.
Число подтвержденных случаев увеличилось до более чем 60 000 в прошлый четверг, что почти на 50 процентов больше, чем в предыдущий день, и с тех пор число увеличилось еще на 13 000. Этот скачок отражает изменение способов диагностики инфекций китайскими властями, а не масштабное изменение масштабов вспышки.Вместо того, чтобы ждать, пока пациенты дадут положительный результат на вирус, в диагноз теперь включается любой, чье сканирование грудной клетки выявляет характерную картину пневмонии COVID-19. Мы надеемся, что этот метод позволит властям быстрее изолировать и лечить пациентов.
Если эта вспышка продолжит распространяться, неизвестно, насколько опасной она может стать. На этой неделе ведущий эпидемиолог из Университета Гонконга предупредил, что COVID-19 может заразить 60 процентов земного шара, если его не остановить.
В понедельник Китайский центр по контролю и профилактике заболеваний опубликовал клиническую информацию о первых 72 314 пациентах, которым был поставлен диагноз до 11 февраля.Отчет показывает, что COVID-19 убил 2,3 процента пациентов, а это означает, что в настоящее время он в 23 раза более смертельный, чем сезонный грипп. Тяжелые заболевания и смертельные случаи были зарегистрированы во всех возрастных группах, за исключением детей до девяти лет.
Тем временем страны изо всех сил пытаются эвакуировать своих граждан с круизного лайнера, находящегося на карантине у берегов Японии. Во вторник министерство здравоохранения Японии объявило, что еще 88 пассажирам на лайнере был поставлен диагноз COVID-19, в результате чего общее количество достигло 542 человек.Из более чем 300 американцев, репатриированных с корабля, у 14 положительный результат теста на коронавирус.
Но что на самом деле происходит с вашим телом, когда оно заражено коронавирусом? Новый штамм настолько генетически похож на SARS, что унаследовал название SARS-CoV-2. Таким образом, объединение ранних исследований новой вспышки с прошлыми уроками SARS и MERS может дать ответ.
Легкие: нулевой уровень
Для большинства пациентов COVID-19 начинается и заканчивается в их легких, потому что, как и грипп, коронавирусы являются респираторными заболеваниями.
Обычно они передаются, когда инфицированный человек кашляет или чихает, распыляя капли, которые могут передать вирус любому, кто находится в тесном контакте. Коронавирусы также вызывают гриппоподобные симптомы: пациенты могут начинать с лихорадки и кашля, которые переходят в пневмонию или хуже. (Узнайте, как коронавирус распространяется в самолете, и о том, где лучше всего сидеть).
После вспышки атипичной пневмонии Всемирная организация здравоохранения сообщила, что болезнь обычно поражала легкие в три этапа: репликация вируса, гиперреактивность иммунитета и разрушение легких.
Не все пациенты прошли все три фазы — фактически, только 25 процентов пациентов с SARS страдали дыхательной недостаточностью, что является определяющим признаком тяжелых случаев. Аналогичным образом, COVID-19, согласно предварительным данным, вызывает более легкие симптомы примерно в 82 процентах случаев, а остальные — тяжелые или критические.
Посмотрите глубже, и новый коронавирус, похоже, следует другим моделям SARS, говорит доцент Медицинской школы Университета Мэриленда Мэтью Б. Фриман, изучающий высокопатогенные коронавирусы.
На первых порах инфекции новый коронавирус быстро проникает в клетки легких человека. Эти клетки легких подразделяются на два класса: клетки, вырабатывающие слизь, и клетки с волосковыми дубинками, называемые ресничками.
Медицинский персонал обнимает друг друга в изоляторе в больнице в Цзоупине в китайской провинции Шаньдун на востоке страны.
Фотография сделана STR / AFP через Getty Images
Пожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Слизь, несмотря на то, что вне тела она грубая, помогает защитить ткань легких от патогенов и следить за тем, чтобы ваш орган дыхания не пересыхал.Клетки ресничек вращаются вокруг слизи, удаляя мусор, например, пыльцу или вирусы.
Фриман объясняет, что SARS любил заражать и убивать клетки ресничек, которые затем отшелушивались и заполняли дыхательные пути пациентов мусором и жидкостями, и он предполагает, что то же самое происходит с новым коронавирусом. Это потому, что самые ранние исследования COVID-19 показали, что у многих пациентов развивается пневмония в обоих легких, сопровождающаяся такими симптомами, как одышка.
Вот тут-то и начинается вторая фаза и иммунная система.Возбужденные присутствием вирусного захватчика, наши тела вступают в борьбу с болезнью, наполняя легкие иммунными клетками, чтобы устранить повреждения и восстановить легочную ткань.
При правильной работе этот воспалительный процесс жестко регулируется и ограничивается только инфицированными участками. Но иногда ваша иммунная система выходит из строя, и эти клетки убивают все на своем пути, включая ваши здоровые ткани.
«Таким образом, вы получаете больше повреждений, а не меньше от иммунного ответа», — говорит Фриман.Еще больше мусора забивает легкие, и пневмония ухудшается. (Узнайте, как новый коронавирус сравнивается с гриппом, лихорадкой Эбола и другими серьезными вспышками).
Во время третьей фазы повреждения легких продолжают накапливаться, что может привести к дыхательной недостаточности. Даже если смерти не происходит, некоторые пациенты выживают с необратимым повреждением легких. По данным ВОЗ, атипичная пневмония пробила дыры в легких, придавая им «сотовый вид», — и эти поражения присутствуют и у тех, кто страдает новым коронавирусом.
Легкие наполняют организм живительным кислородом. Узнайте об анатомии легких, о том, как органы делают возможным дыхание и насколько они уязвимы для болезней.
Эти дыры, вероятно, создаются гиперактивной реакцией иммунной системы, которая создает шрамы, которые защищают легкие и укрепляют их.
Когда это происходит, пациентам часто приходится включать аппараты ИВЛ, чтобы облегчить дыхание. Между тем, воспаление также делает более проницаемыми мембраны между воздушными мешочками и кровеносными сосудами, что может наполнять легкие жидкостью и влиять на их способность насыщать кровь кислородом.
«В тяжелых случаях вы просто переполняете легкие и не можете дышать», — говорит Фриман. «Вот как умирают люди».
Желудок: общий шлюз
Во время вспышек SARS и MERS почти у четверти пациентов была диарея — гораздо более важная особенность этих зоонозных коронавирусов. Но Фриман говорит, что до сих пор неясно, играют ли желудочно-кишечные симптомы основную роль в последней вспышке, учитывая, что диарея и боль в животе были редкими.Но почему респираторный вирус вообще беспокоит кишечник?
Когда любой вирус попадает в ваше тело, он ищет человеческие клетки со своими любимыми дверными проемами — белками снаружи клеток, называемыми рецепторами. Если вирус находит совместимый рецептор в клетке, он может вторгнуться.
Некоторые вирусы разборчивы в выборе двери, но другие более разборчивы. «Они могут очень легко проникать во все типы клеток», — говорит Анна Сук-Фонг Лок, заместитель декана по клиническим исследованиям Медицинской школы Мичиганского университета и бывший президент Американской ассоциации по изучению заболеваний печени.
Ученые из USAMRID, Медицинского научно-исследовательского института инфекционных болезней армии США, работают с одними из самых смертоносных форм жизни на Земле — вирусами-убийцами. Узнать больше.
Вирусы SARS и MERS могут получить доступ к клеткам, выстилающим ваш кишечник, а также толстую и тонкую кишку, и эти инфекции, по-видимому, процветают в кишечнике, потенциально вызывая повреждение или утечку жидкости, которая переходит в диарею.
Но Фриман говорит, что мы еще не знаем, делает ли новый коронавирус то же самое.Исследователи полагают, что COVID-19 использует тот же рецептор, что и SARS, и этот дверной проем можно найти в ваших легких и тонком кишечнике.
Два исследования — одно в журнале New England Journal of Medicine и одно препринт в medRxiv с участием 1099 случаев — также обнаружили вирус в образцах стула, что может указывать на то, что вирус может распространяться через фекалии. Но это далеко не окончательный вывод.
«Имеет ли место этот вид фекальной передачи для этого вируса Ухань, мы вообще не знаем», — говорит Фриман.«Но это определенно похоже на то, что он находится в стуле, и похоже, что у людей действительно есть желудочно-кишечные симптомы, связанные с этим».
Кровавый шторм
Коронавирусы также могут вызывать проблемы в других системах организма из-за гиперактивного иммунного ответа, о котором мы упоминали ранее.
Исследование 2014 года показало, что у 92 процентов пациентов с MERS было хотя бы одно проявление коронавируса вне легких. Фактически, признаки вспышки всего тела наблюдались у всех трех зоонозных коронавирусов: повышенные ферменты печени, пониженное количество лейкоцитов и тромбоцитов и низкое кровяное давление.В редких случаях пациенты страдали острым повреждением почек и остановкой сердца.
Но это не обязательно признак того, что сам вирус распространяется по всему телу, — говорит Анджела Расмуссен, вирусолог и младший научный сотрудник Школы общественного здравоохранения им. Мэйлмана Колумбийского университета. Это может быть цитокиновый шторм.
Цитокины — это белки, используемые иммунной системой в качестве сигнальных маяков — они привлекают иммунные клетки к месту инфекции. Затем иммунные клетки убивают инфицированную ткань, чтобы спасти остальную часть тела.
Обычно кровотечение выходит из кровеносных сосудов.
Анжела Расмуссенвиролог
Люди полагаются на нашу иммунную систему, чтобы сохранять хладнокровие перед лицом угрозы. Но во время безудержной коронавирусной инфекции, когда иммунная система сбрасывает цитокины в легкие без какого-либо регулирования, этот отбор становится всеобщим, говорит Расмуссен: «Вместо того, чтобы стрелять в цель из ружья, вы используете ракетную установку. ,» она сказала. Вот где возникает проблема: ваше тело нацелено не только на инфицированные клетки.Он поражает и здоровые ткани.
Последствия выходят за пределы легких. Цитокиновые бури вызывают воспаление, которое ослабляет кровеносные сосуды в легких и заставляет жидкость просачиваться в воздушные мешочки. «В основном у вас кровотечение из кровеносных сосудов», — говорит Расмуссен. Ураган проникает в вашу кровеносную систему и создает системные проблемы во многих органах.
После этого ситуация может резко измениться к худшему. В некоторых из наиболее тяжелых случаев COVID-19 цитокиновый ответ — в сочетании с уменьшенной способностью перекачивать кислород к остальному телу — может привести к полиорганной недостаточности.Ученые не знают, почему у некоторых пациентов возникают осложнения, не связанные с легкими, но это может быть связано с такими заболеваниями, как сердечные заболевания или диабет.
«Даже если вирус не попадает в почки, печень, селезенку и другие объекты, он может оказывать явное последующее воздействие на все эти процессы», — говорит Фриман. И тогда все может стать серьезным.
Печень: побочный ущерб
Когда зоонозный коронавирус распространяется из дыхательной системы, часто страдает ваша печень.Врачи видели признаки поражения печени при SARS, MERS и COVID-19 — часто в легкой форме, хотя более серьезные случаи приводили к серьезному повреждению печени и даже к печеночной недостаточности. Так что же происходит?
«Как только вирус попадает в ваш кровоток, он может попасть в любую часть вашего тела», — говорит Лок. «Печень — очень сосудистый орган, поэтому [коронавирус] очень легко может попасть в вашу печень».
Ваша печень очень много работает, чтобы ваше тело могло нормально функционировать. Его основная задача — обрабатывать вашу кровь после того, как она покидает желудок, отфильтровывая токсины и создавая питательные вещества, которые ваше тело может использовать.Он также вырабатывает желчь, которая помогает тонкому кишечнику расщеплять жиры. Ваша печень также содержит ферменты, которые ускоряют химические реакции в организме.
В нормальном организме, объясняет Лок, клетки печени постоянно отмирают и выделяют ферменты в кровоток. Затем этот находчивый орган быстро регенерирует новые клетки и продолжает свою жизнь. Благодаря этому процессу регенерации печень может выдержать множество травм.
Однако, когда у вас аномально высокий уровень ферментов в крови, что является обычной характеристикой пациентов, страдающих SARS и MERS, это предупреждающий знак.Это может быть легкое повреждение, от которого печень быстро оправится, или что-то более серьезное — даже печеночная недостаточность.
Лок говорит, что ученые не совсем понимают, как эти респираторные вирусы ведут себя в печени. Вирус может напрямую заражать печень, реплицируясь и убивая сами клетки. Или эти клетки могут быть сопутствующим повреждением, поскольку иммунный ответ вашего организма на вирус вызывает серьезную воспалительную реакцию в печени.
В любом случае, она отмечает, что печеночная недостаточность никогда не была единственной причиной смерти пациентов с SARS.«К моменту отказа печени, — говорит она, — часто вы обнаруживаете, что у пациента не только проблемы с легкими и печенью, но также могут быть проблемы с почками. К тому времени это становится системной инфекцией ».
Почки: все взаимосвязано
Да, ваши почки тоже в этом беспорядке. Шесть процентов пациентов с SARS и целая четверть пациентов с MERS страдали острым повреждением почек. Исследования показали, что новый коронавирус может делать то же самое. Это может быть относительно необычный признак заболевания, но он является фатальным.В конечном итоге 91,7% пациентов с SARS с острой почечной недостаточностью умерли, согласно исследованию 2005 года, проведенному в Kidney International .
Как и печень, ваши почки действуют как фильтр для крови. Каждая почка заполнена примерно 800000 микроскопических перегонных единиц, называемых нефронами. Эти нефроны состоят из двух основных компонентов: фильтра для очистки крови и небольших трубок, которые возвращают полезные вещества обратно в ваше тело или отправляют отходы в мочевой пузырь в виде мочи.
Зоонозные коронавирусы, по-видимому, больше всего поражают почечные канальцы.После вспышки атипичной пневмонии ВОЗ сообщила, что вирус был обнаружен в канальцах почек, которые могут воспаляться.
Нередко можно обнаружить вирус в канальцах, если он попал в кровоток, — говорит Кар Ненг Лай, почетный профессор Университета Гонконга и нефролог-консультант в санатории и больнице Гонконга. Поскольку ваши почки постоянно фильтруют кровь, иногда клетки канальцев могут улавливать вирус и вызывать временное или более легкое повреждение.
Эта травма может стать летальной, если вирус проникнет в клетки и начнет реплицироваться.Но Лай, который также был членом первой группы исследователей, сообщавших о SARS и участвовал в исследовании Kidney International , говорит, что нет никаких доказательств того, что вирус SARS реплицируется в почках.
Посмотрите, как вирус гриппа атакует, мутирует и становится заразным, что может привести к вспышке или даже пандемии.
Это открытие, говорит Лай, предполагает, что острое повреждение почек у пациентов с атипичной пневмонией может быть вызвано целым рядом причин, включая низкое кровяное давление, сепсис, лекарства или нарушение обмена веществ.Между тем, в более тяжелых случаях, которые привели к острой почечной недостаточности, наблюдались признаки — как вы уже догадались — цитокинового шторма.
Острая почечная недостаточность также иногда может быть вызвана антибиотиками, полиорганной недостаточностью или длительным подключением к аппарату искусственной вентиляции легких. Все связано.
Беременность и коронавирус?
Великая ирония эпохи Твиттера в том, что мы слишком мало знаем о новом коронавирусе, поскольку тонем в обновлениях информации о нем. Медицинские журналы опубликовали несколько исследований об этой вспышке, некоторые из которых были проверены больше, чем другие, поскольку исследователи спешат накормить пасть.Между тем, новостные агентства сообщают обо всех событиях. Вся эта информация крутится в Интернете, где отличить факты от вымысла — печально известная задача.
«Это действительно беспрецедентно с точки зрения самой последней информации о том, что происходит в этих исследованиях», — говорит Расмуссен. «Это действительно сложно — попытаться отсортировать всю информацию и выяснить, что действительно поддерживается, что является предположением, а что явно не так».
Например, на прошлой неделе врачи больницы в Ухане сообщили, что у двух младенцев был положительный результат на новый коронавирус, у одного всего через 30 часов после рождения.Естественно, этот тревожный заголовок распространился по новостным организациям, учитывая, что он поднял вопросы о том, могут ли беременные женщины заразить своих будущих детей внутриутробно или может ли болезнь передаваться во время родов или через грудное молоко.
Но давайте поработаем тормозами. Передача от матери ребенку не наблюдалась ни при SARS, ни при MERS, несмотря на многочисленные случаи заболевания беременных женщин. Кроме того, по словам Расмуссена, новорожденный может заразиться коронавирусом и другими способами, например, если он родился в больнице, переполненной инфицированными пациентами, во время чрезвычайной ситуации.
Фактически, новое исследование, опубликованное в четверг в The Lancet , предлагает предварительные доказательства того, что коронавирус не может передаваться от матери к ребенку.
В отчете исследователи наблюдали за девятью женщинами в Ухане, у которых была пневмония COVID-19. У некоторых женщин были осложнения во время беременности, но все случаи закончились живорождением без доказательств передачи инфекции. Хотя это исследование не полностью исключает возможность передачи инфекции во время беременности, оно подчеркивает необходимость проявлять осторожность при рассуждениях об этом заболевании.
«Прежде чем вы сможете сказать, что это происходит окончательно, прежде чем вы начнете вносить изменения в то, как ведутся клинические дела или с точки зрения государственной политики, необходим высокий стандарт доказательств», — говорит Расмуссен.
Фриман соглашается. Он надеется, что эта эпидемия приведет к увеличению финансирования исследований коронавируса, как недавние обещания Европейского союза и Фонда Билла и Мелинды Гейтс. В прошлый четверг Национальная комиссия здравоохранения Китая заявила, что более 1700 медицинских работников заболели новым вирусом, и это заявление было сделано всего через день после того, как ВОЗ завершила саммит, посвященный лучшим протоколам больничной помощи и разработке терапевтических средств, таких как вакцины.
Frieman хочет, чтобы поддержка и интерес сохранялись, даже если эта вспышка в конечном итоге исчезнет, в отличие от того, что произошло с исследованием SARS.
«Сразу после вспышки атипичной пневмонии у нас была большая куча денег, а потом они ушли», — говорит Фриман. «Почему у нас нет этих ответов? Никто не финансировал эти вещи ».
Примечание редактора: Эта статья была обновлена с учетом количества погибших и случаев заболевания по состоянию на 18 февраля. Первоначально она была опубликована 14 февраля.Кроме того, в статье изначально неверно указано название Анны Сук-Фонг Лок. Она является заместителем декана по клиническим исследованиям в Медицинской школе Мичиганского университета и бывшим президентом Американской ассоциации по изучению заболеваний печени.
Симптомы, причины, диагностика и лечение
Аспирационная пневмония — это тип пневмонии, вызванной случайным проникновением пищи или других веществ изо рта или желудка в легкие. Состояние может быть вызвано бактериями, которые обычно обитают во рту или носовых проходах, или вызвано неинфекционными токсинами, которые повреждают ткань легких.
Рентген грудной клетки и другие тесты могут помочь отличить аспирационную пневмонию от других типов пневмонии. Бактериальные инфекции лечат антибиотиками, в то время как при химической пневмонии могут потребоваться стероиды и нестероидные препараты, чтобы уменьшить воспаление.
Веривелл / Эмили Робертс
Симптомы
Симптомы аспирационной пневмонии в основном такие же, как и при любом другом типе пневмонии, что затрудняет ее клиническую дифференциацию. То же самое относится и к различиям между аспирационной пневмонией и химической пневмонией, с некоторыми заметными различиями.
Наиболее частые симптомы аспирационной пневмонии включают:
- боль в груди
- одышка (одышка)
- свистящее дыхание
- лихорадка
- кашель, иногда с желтой или зеленоватой мокротой (смесь слюны и слизи)
- усталость
- затруднение глотания (дисфагия)
- неприятный запах изо рта
- синюшный цвет кожи (цианоз), вызванный низким уровнем кислорода в крови
99 обильное потоотделение
Если воздействие было вызвано токсичным веществом, также могут быть ожоги полости рта или носа, опухший язык или горло, охриплость голоса, учащенное сердцебиение (тахикардия), измененное психическое состояние и другие признаки отравления.
Осложнения
При отсутствии лечения аспирационная пневмония иногда может привести к тяжелым и потенциально опасным для жизни осложнениям, в том числе:
- парапневмонический выпот, который представляет собой накопление жидкости в нижней доле легкого
- эмпиема, скопление гноя в легком
- абсцесс легкого, заполненная гноем полость в легких
- супрейнфекция, возникновение вторичная инфекция даже после лечения первой
- Бронхоплевральный свищ, аномальное отверстие между дыхательными путями легкого и пространством вокруг легких (плевральная полость)
При отсутствии активного и своевременного лечения осложнения аспирационной пневмонии могут привести к дыхательной недостаточности и смерти.
По данным исследования, проведенного в больнице Университета Норт-Шор на Лонг-Айленде, такие состояния, как бронхоплевральный свищ, сами по себе несут от 18 до 67 процентов риска смерти. При необходимости важно обратиться за медицинской помощью.
Причины
Аспирационная пневмония характеризуется отказом физиологических механизмов, препятствующих попаданию пищи и других веществ в трахею (дыхательное горло) и легкие. Аспирация (всасывание) этих веществ может вызвать воспаление, инфекцию или обструкцию дыхательных путей.Большинство эпизодов вызывают преходящие симптомы пневмонита (воспаление воздушных мешков легкого) без инфекции или непроходимости.
Подтип аспирационной пневмонии, известный как химическая пневмония, включает попадание в легкие кислоты желудочного сока или других неинфекционных токсинов, которые непосредственно повреждают ткани дыхательных путей.
Здоровые люди обычно вдыхают небольшое количество пищи и других веществ в легкие, но естественные рефлексы организма (рвота, кашель) обычно без труда устраняют их.Проблемы возникают только в том случае, если вдыхается большее количество препарата или если поражение легких или нервной системы ослабляет эти глоточные рефлексы.
Многие случаи аспирационной пневмонии связаны либо с неврологическим заболеванием, либо с эпизодом нарушения сознания, которое блокирует этот рефлекс.
Примеры состояний, которые могут нарушить этот рефлекс и потенциально привести к аспирационной пневмонии, включают:
- неврологические состояния, такие как инсульт, болезнь Паркинсона, болезнь Альцгеймера, рассеянный склероз, церебральный паралич, боковой амиотрофический склероз (БАС), миастения и травмы головного мозга, для которых характерна дисфагия (затруднение глотания)
- рвота, во время которой сильная спазмы могут позволить пище выскользнуть из пищевода (питательной трубки) в трахею
- алкоголь, седативные или запрещенные препараты, которые могут изменить ваш уровень сознания и отключить нормальный рвотный рефлекс
- припадки, при которых непроизвольные спазмы могут способствовать аспирации
- общая анестезия, которая также отключает глотательный рефлекс
- стоматологические процедуры, при которых анестезия и оральные манипуляции могут сделать возможным аспирацию
- желудочные трубки и эндотрахеальные трубки, которые обеспечивают удобный путь доступа из желудка в легкие
- гастроэзофагеальная рефлюксная болезнь (ГЭРБ), характеризующаяся кислотным рефлюксом и повышенным риском ch химическая пневмония
- ахалазия, нарушение моторики пищевода
- рак горла
- утопление без смертельного исхода
При химической пневмонии желудочная кислота является наиболее частой причиной, хотя токсичные газы (например, газообразный хлор), пары (например, дым от мусоросжигателя и пестициды), частицы, переносимые по воздуху (например, химические удобрения), и жидкости также могут проникать в трахею и вызывать воспаление легких. .
Известно, что даже некоторые слабительные масла, используемые для лечения запора (например, минеральное или касторовое масло), вызывают химическую пневмонию при случайном вдыхании.
Факторы риска
Аспирационная пневмония чаще встречается у пожилых людей из-за состояний, изменяющих сознание (например, седативных средств), наряду с повышенным риском болезни Альцгеймера и других неврологических расстройств, связанных со старением.
Помимо возраста, к другим факторам риска относятся:
- плохая гигиена полости рта, способствующая колонизации бактерий во рту
- ослабленная иммунная система
- длительная госпитализация и / или механическое дыхание
- поврежденная ткань легких из-за курения, ХОБЛ (хроническая обструктивная болезнь легких) или по другим причинам
- длительное или ненадлежащее использование антипсихотических препаратов
- длительное использование ингибиторов протонной помпы и ингибиторов АПФ
- расстройства моторики желудочно-кишечного тракта
- лучевая терапия головы и шеи
- алкоголизм или токсикомания
- недоедание
- грыжа пищеводного отверстия диафрагмы
- диабет
Диагностика
Часто подозревают аспирационную пневмонию, если симптомы развиваются вскоре после провоцирующего события, такого как сильная рвота, воздействие общей анестезии или промышленных паров, или тонико-клонический приступ.Иногда причина может быть неизвестна, что затрудняет дифференциацию диагноза.
Типичными причинами пневмонии являются грипп A, B, вирусы птичьего гриппа или бактерии Streptococcus pneumoniae (обнаруживаются при большинстве инфекций пневмонии в общинах). Если ничего из этого не обнаружено, аспирационная пневмония может быть исследована как причина с помощью медицинского осмотра и различных визуализационных исследований и лабораторных тестов.
Физический осмотр
Одна из первых подсказок, которые врачи ищут при исследовании аспирационной пневмонии, — это внезапное появление лихорадки и проблем с дыханием после аспирационной пневмонии.Они также будут искать на стетоскопе характерные звуки дыхания, такие как треск (крепитация) в определенных зонах легких. Зловонное дыхание также является обычным явлением (и в остальном нехарактерно для «обычной» пневмонии).
Хроническая аспирация, часто вызванная ГЭРБ (гастроэзофагеальной рефлюксной болезнью) или ахалазией, может свидетельствовать о появлении влажного кашля сразу после еды.
Исследования изображений
Рентген грудной клетки обычно может предоставить убедительные доказательства аспирационной пневмонии.Например, если есть подозрение на аспирацию, когда человек находился без сознания или в агонии от приступа, это может означать уплотнение жидкости в задней части верхнего легкого.
Если аспирация происходила стоя или сидя, консолидация обычно происходила бы с обеих сторон нижней доли.
При рентгенологическом исследовании грудной клетки врач будет искать в легких белые пятна (так называемые инфильтраты), которые идентифицируют инфекцию.
При аспирационной пневмонии на рентгеновском снимке часто будет область плотности, где инфильтраты сгруппированы вокруг области обструкции.При «обычной» пневмонии уплотнение будет определенным, но более неоднородным.
Компьютерная томография (КТ) с контрастным красителем более чувствительна и обычно назначается при подозрении на абсцесс легкого, эмпиему или бронхоплевральный свищ.
Лабораторные испытания
В то время как медицинский осмотр и рентген могут предоставить все доказательства, необходимые для окончательного диагноза аспирационной пневмонии, для подтверждения диагноза могут быть назначены лабораторные тесты. Это особенно верно при попытке дифференцировать аспирационную пневмонию и химическую пневмонию от других возможных причин.
Вообще говоря, анализы крови дают одинаковые результаты независимо от того, является ли заболевание инфекционным или воспалительным. В обоих случаях количество лейкоцитов (WBC) будет неизменно повышено, что приведет к лейкоцитозу.
Посев мокроты может быть заказан, но это также проблематично, поскольку заражение другими патогенами во рту (бактерии, вирусы и грибки) является обычным явлением. Хотя иногда назначают посев крови, аспирационная пневмония обычно диагностируется и лечится задолго до получения результатов.
Тест, называемый насыщением кислородом (SaO), будет проводиться для измерения количества кислорода в крови, в первую очередь, для оценки тяжести пневмонии. Реже бронхоскопия (введение гибкого зонда в трахею и дыхательные пути) может быть заказана, если частица особенно велика, или для получения образца ткани легкого для анализа в лаборатории.
Дифференциальная диагностика
Типы пневмонии бывает трудно различить, потому что все они очень похожи.Аспирационная пневмония уникальна тем, что она может включать аэробные бактерии (в том числе связанные с другими типами пневмонии), а также анаэробные бактерии, которые естественным образом обитают во рту, носу и горле (но не в легких).
Химическая пневмония, напротив, характеризуется отсутствием инфекции (хотя повреждение легких иногда может привести к вторичной инфекции).
Чтобы дифференцировать возможные причины, врачи будут искать определяющие признаки, характеризующие разные типы пневмонии, и изучать другие заболевания легких с аналогичными симптомами.К ним относятся:
- внебольничная пневмония, обычно связанная с Streptococcus pneumoniae, Haemophilus influenzae и Staphylococcus aureus.
- Внутрибольничная пневмония, обычно связанная со Staphylococcus aureus
- пневмоцистная пневмония, дифференцированная по диффузному «матовому стеклу» на рентгеновских снимках, обычно у людей с тяжелым подавлением иммунитета (например, на поздней стадии ВИЧ). жидкость в легких), дифференцируемая по симметричной непрозрачности на рентгенограмме грудной клетки и отсутствием лейкоцитоза
- ателектаз (коллапс легкого), дифференцированная по отсутствию лейкоцитоза и других маркеров инфекции, а также по потере объема легких на Рентгеновский
Лечение
Антибиотики обычно используются для лечения аспирационной пневмонии.Даже если причина неврологическая или химическая, все равно будет назначен курс антибиотиков. Это связано с тем, что часто бывает трудно исключить бактериальную инфекцию как основную или сопутствующую причину.
Стандартно используются антибиотики широкого спектра действия, которые лечат несколько штаммов бактерий и могут включать клиндамицин, моксифлоксацин, унасин (ампициллин / сульбактам), меррем (меропенем) и инванц (эртапенем).
Стандартный курс может длиться от недели до двух недель.
При предположительном назначении антибиотик можно прекратить через три-четыре дня, если на рентгенограмме грудной клетки нет признаков инфильтратов. Независимо от тяжести вашего состояния вам необходимо принимать антибиотики в соответствии с предписаниями, не пропуская дозы, даже если симптомы исчезнут.
Отсутствие доз или преждевременное прекращение лечения может привести к появлению устойчивых к антибиотикам штаммов. Если это произойдет, вылечить бактериальную инфекцию в будущем будет гораздо сложнее.
Поддерживающая терапия может включать механическую вентиляцию легких с дополнительным кислородом для облегчения дыхания. Если в легких есть жидкость, может быть проведена процедура, называемая торакоцентез. Это включает введение иглы через стенку грудной клетки для слива скопившейся жидкости из плевральной полости.
Профилактика
Если вы подвержены риску аспирационной пневмонии, вы можете кое-что сделать, чтобы снизить этот риск. Полезные советы по профилактике включают отказ от седативных препаратов и алкоголя, если у вас хроническая дисфагия и / или рефлюкс.Это особенно актуально перед сном, поскольку аспирация обычно происходит во время сна. Если у вас хроническая дисфагия и / или рефлюкс, во время сна поднимайте голову на 30 градусов, чтобы предотвратить обратный поток содержимого желудка в трахею.
Людям с хронической дисфагией может быть рекомендована диета при дисфагии. В зависимости от степени тяжести вам могут посоветовать есть протертые продукты, не требующие жевания (уровень 1), мягкие, влажные продукты, требующие небольшого пережевывания (уровень 2), или мягкие, не хрустящие продукты, требующие пережевывания (уровень 3).
Дополнительные полезные профилактические советы включают:
- Работа с логопедом для укрепления мышц и систем, необходимых для глотания.
- следуя инструкциям вашего врача о голодании, чтобы предотвратить аспирацию во время операции или любой медицинской процедуры, связанной с общей анестезией.
- поддержание хорошей гигиены полости рта для предотвращения проникновения бактерий из полости рта в трахею и легкие.
- не курить. Курение повреждает естественную защиту легких от инфекций.
Слово от Verywell
При соответствующем лечении аспирационная пневмония обычно хорошо поддается лечению и поддерживающей терапии. Хотя риск смерти при неосложненной аспирационной пневмонии составляет около 5 процентов, этот риск может значительно возрасти, если лечение откладывается.
Немедленно обратитесь к врачу, если у вас возникнет внезапное свистящее дыхание, одышка, боли в груди, жар, кашель или затрудненное глотание. Отсутствие назальных симптомов должно говорить вам, что вы имеете дело не с гриппом, а с потенциально серьезной респираторной инфекцией.
.

 Если тахипноэ сопровождается респираторной недостаточностью, сохраняется более 6 часов или связано с другими симптомами, то показаны лабораторные исследования. Для выявления инфекционной этиологии необходимо сделать общий анализ крови (ОАК) с дифференциальным и посевом. Пациенты с TTN обычно имеют нормальный общий анализ крови без увеличения количества лейкоцитов или незрелых клеток. Полицитемия также может вызывать респираторный дистресс и, если она значительна, может потребоваться обменное переливание.
Если тахипноэ сопровождается респираторной недостаточностью, сохраняется более 6 часов или связано с другими симптомами, то показаны лабораторные исследования. Для выявления инфекционной этиологии необходимо сделать общий анализ крови (ОАК) с дифференциальным и посевом. Пациенты с TTN обычно имеют нормальный общий анализ крови без увеличения количества лейкоцитов или незрелых клеток. Полицитемия также может вызывать респираторный дистресс и, если она значительна, может потребоваться обменное переливание.
 1) обнаружены многие из находок, типичных для TTN, включая усиление перихилярной маркировки, полосатое помутнение, гиперинфляцию с уплощенными диафрагмами и остаточную плевральную жидкость в междолевых трещинах (см. Справа).
1) обнаружены многие из находок, типичных для TTN, включая усиление перихилярной маркировки, полосатое помутнение, гиперинфляцию с уплощенными диафрагмами и остаточную плевральную жидкость в междолевых трещинах (см. Справа). Младенцы с изолированным тахипноэ без гипоксемии могут быть не в состоянии кормить и нуждаться в внутривенной гидратации, даже если респираторная поддержка не требуется. В общем, если тахипноэ не улучшилось к 6 часам жизни или есть какие-либо симптомы гипогликемии, следует начать внутривенное введение жидкости, содержащей декстрозу. Приготовление 10% раствора декстрозы без электролитов подходит для новорожденного в нулевой день жизни из расчета от 60 до 80 мл / кг / день. Пока диагноз TTN не будет уточнен, младенцев часто следует лечить антибиотиками.Ампициллин, который охватывает стрептококки группы B и листерии, обычно используется в сочетании с грамотрицательными агентами, такими как гентамицин.
Младенцы с изолированным тахипноэ без гипоксемии могут быть не в состоянии кормить и нуждаться в внутривенной гидратации, даже если респираторная поддержка не требуется. В общем, если тахипноэ не улучшилось к 6 часам жизни или есть какие-либо симптомы гипогликемии, следует начать внутривенное введение жидкости, содержащей декстрозу. Приготовление 10% раствора декстрозы без электролитов подходит для новорожденного в нулевой день жизни из расчета от 60 до 80 мл / кг / день. Пока диагноз TTN не будет уточнен, младенцев часто следует лечить антибиотиками.Ампициллин, который охватывает стрептококки группы B и листерии, обычно используется в сочетании с грамотрицательными агентами, такими как гентамицин. С осторожностью следует использовать высокие уровни кислородной добавки, например, при помощи 100% кислородного вытяжного шкафа.
С осторожностью следует использовать высокие уровни кислородной добавки, например, при помощи 100% кислородного вытяжного шкафа. Большие и симптоматические утечки воздуха могут потребовать декомпрессии иглы или установки дренажной трубки.
Большие и симптоматические утечки воздуха могут потребовать декомпрессии иглы или установки дренажной трубки. Даже на 39 неделе частота TTN в этой популяции оценивается в 2,7%, что почти в десять раз больше, чем в целом. Существуют разногласия по поводу того, являются ли роды до кесарева сечения (вторичное кесарево сечение) защитными. У этих младенцев частота респираторных заболеваний находится на промежуточном уровне между младенцами, родившимися через естественные родовые пути, и младенцами, родившимися в плановом порядке.
Даже на 39 неделе частота TTN в этой популяции оценивается в 2,7%, что почти в десять раз больше, чем в целом. Существуют разногласия по поводу того, являются ли роды до кесарева сечения (вторичное кесарево сечение) защитными. У этих младенцев частота респираторных заболеваний находится на промежуточном уровне между младенцами, родившимися через естественные родовые пути, и младенцами, родившимися в плановом порядке.