Стафилококк в горле: что это такое
В лабораторию Новополоцкого городского центра гигиены и эпидемиологии часто обращаются пациенты с просьбой проверить их на наличие стафилококка в верхних дыхательных путях. Стафилококк в горле — один из самых распространенных возбудителей ЛОР-заболеваний. Однако, следует иметь в виду, что около 80% заболеваний верхних дыхательных путей связаны не со стафилококком, а с вирусами.
Существует около 20 видов стафилококка, большинство из них принадлежат к условно-патогенной флоре. Они есть у каждого здорового человека в незначительном количестве и не причиняют особого беспокойства. При снижении иммунитета по различным причинам или попадании в организм дополнительной инфекции бактерии активизируются. Начинается воспалительный процесс, проявляются болезненные симптомы: покраснение в горле и боль, особенно при глотании Когда произошел сбой и ослабленный человек столкнулся со стафилококковой инфекцией, то возможно стремительное развитие ринита, если возбудитель находится в носу, либо фарингита, тонзиллита при попадании патогенного микроорганизма в область горла.
Самым распространенным путем заражения является контактный: при использовании общих предметов гигиены, посуды, косметики. Иногда стафилококк у детей передается, например, при коллективном откусывании кусков от яблока, наличии общих игрушек. Немытые руки — отдельный фактор риска. После прямого взаимодействия кожи, на которой уже есть бактерии, со слизистой оболочкой и происходит передача инфекции.
Воздушно-капельный путь заражения известен всем. Нездоровый организм выделяет в окружающую среду при выдохе, чихании, кашле патогенную микрофлору, которая попадает на слизистую ослабленного человека и начинает усиленно развиваться в горле и носу.
Существует еще ряд возможностей переноса инфекции (например, алиментарный при грудном вскармливании, от матери к ребенку), но они не столь распространены, а симптомы заболевания аналогичны стандартным.
Распространено такое понятие, как носительство стафилококка. Носители –это в общем здоровые люди, в носоглотке которых тем не менее содержится определённое количество стафилококков, выделяющихся во внешнюю среду. Здоровые носители не могут заразить окружающих людей контактным или воздушно-капельным путём. Количество выделяемых ими стафилококков мало и его не достаточно для возникновения заболевания у другого человека. Однако, если такой здоровый носитель работает на пищевом предприятии, то он может обсеменить стафилококком некоторые пищевые продукты, являющиеся для него благоприятной питательной средой. Такими продуктами являются в первую очередь различные кондитерские изделия (особенно торты, пирожные и т.п.). В них содержится большое количество сахара и влаги. В этой среде стафилококки быстро размножаются и выделяют опасный отравляющий токсин. Стафилококковое отравление-очень опасное заболевание. Чтобы его избежать необходимо соблюдать три положения: не допускать к работе на пищевых предприятиях носителей стафилококка, строго соблюдать технологию приготовления пищевых продуктов и не допускать реализации и употребления продуктов с истёкшим сроком годности
Носители –это в общем здоровые люди, в носоглотке которых тем не менее содержится определённое количество стафилококков, выделяющихся во внешнюю среду. Здоровые носители не могут заразить окружающих людей контактным или воздушно-капельным путём. Количество выделяемых ими стафилококков мало и его не достаточно для возникновения заболевания у другого человека. Однако, если такой здоровый носитель работает на пищевом предприятии, то он может обсеменить стафилококком некоторые пищевые продукты, являющиеся для него благоприятной питательной средой. Такими продуктами являются в первую очередь различные кондитерские изделия (особенно торты, пирожные и т.п.). В них содержится большое количество сахара и влаги. В этой среде стафилококки быстро размножаются и выделяют опасный отравляющий токсин. Стафилококковое отравление-очень опасное заболевание. Чтобы его избежать необходимо соблюдать три положения: не допускать к работе на пищевых предприятиях носителей стафилококка, строго соблюдать технологию приготовления пищевых продуктов и не допускать реализации и употребления продуктов с истёкшим сроком годности
Важно помнить, что лечение проявлений стафилококковой инфекции без антибиотиков не будет эффективным. А основное лекарство должен назначить врач. Самостоятельно принимаемые меры могут только осложнить ситуацию, способствовать смазанному течению проявлений недуга.
Микробиологическая лаборатория Новополоцкого центра гигиены и эпидемиологии проводит исследования на наличие стафилококка в дыхательных путях и грудном молоке. Перед обращением желательно проконсультироваться с врачом. Телефон для справок в микробиологической лаборатории: 75-54-97
Заведующий микробиологической лабораторией НГЦГЭ
Богданов Л.Г.
Мазок из носа и зева на стафилококки, эозинофилы, микрофлору: расшифровка
Мазок из носа и зева на стафилококк (микрофлору) – это один из видов бактериологического исследования, целью которого является изучение микробной флоры носоглотки. Он позволяет не только выявить микроба, послужившего возбудителем заболевания ЛОР-органов, но и определить его чувствительность к антибиотикам.
Он позволяет не только выявить микроба, послужившего возбудителем заболевания ЛОР-органов, но и определить его чувствительность к антибиотикам.
Если у пациента на протяжении достаточно длительного времени сохраняются симптомы ринита, то можно предположить его аллергическую природу. Для подтверждения диагноза в данном случае выполняют взятие слизи из носа на эозинофилы.
Показания к исследованию
Мазок из носа и зева на микрофлору назначается с целью выявления возбудителя тонзиллита (ангины), фарингита. Некоторые пациенты считают данные заболевания несерьезными и потому не требующими никаких лабораторных исследований. Однако следует знать, что нередко они вызываются бета-гемолитическим стрептококком группы А. Коварство этой бактерии состоит в том, что она не только вызывает инфекции, поражающее горло, но и может стать причиной развития у пациента таких тяжелых заболеваний как ревматизм и гломерулонефрит.
Мазок из носа и зева на стафилококки чаще всего назначается пациентам, страдающим фурункулезом. Дело в том, что очень часто возбудителем данного заболевания являются штаммы золотистого стафилококка. Они образуют колонии на слизистой оболочке ротоносовой полости, откуда и попадают на участки кожи, вызывая гнойно-воспалительное поражение волосяных фолликулов.
Мазок из зева и носа также выполняют и при подозрении на дифтерию. Помимо этого, показанием к его проведению является выявление носителей бациллы (палочки) Лефлера – возбудителя дифтерии. В этом случае в направлении в лабораторию указывается: «мазок на Bl».
Мазок на эозинофилы: что это такое?
Если у пациента на протяжении достаточно длительного времени сохраняются симптомы ринита, то можно предположить его аллергическую природу. Для подтверждения диагноза в данном случае выполняют взятие слизи из носа на эозинофилы. Правильно этот анализ называется риноцитограммой. Он строится на анализе цитологической картины, то есть наличия в исследуемом биологическом материале тех или иных клеток (эритроциты, нейтрофилы, макрофаги, эозинофилы, лимфоциты, микроорганизмы).
Мазок из носа и зева на микрофлору назначается с целью выявления возбудителя тонзиллита (ангины), фарингита.
При аллергическом характере ринита в риноцитограмме будет повышено число эозинофилов, а при бактериальном – нейтрофилов. С целью проведения дополнительной дифференциальной диагностики этих двух заболеваний врач может назначить пациенту и анализ крови на лейкоформулу, который показывает соотношение субпопуляций белых клеток крови между собой.
Подготовка к мазку из горла и носа
Подготовка к анализу достаточно проста:
- За 72 часа до взятия биологического материала необходимо прекратить применение спреев, назальных мазей и растворов для полоскания горла, содержащих в своем составе антибиотики или иные противомикробные средства. Это связано с тем, что препараты этих групп изменяют микробное соотношение, что может стать причиной неправильно поставленного диагноза и, соответственно, неверно подобранного лечения.
- Утром, в день сдачи анализа, не следует чистить зубы, пить и принимать пищу, так как это также может стать причиной изменения микробиологической и цитологической картины мазка.
Как берется мазок из носа и зева?
Для взятия мазка из горла пациенту предлагают слегка запрокинуть голову назад и широко открыть рот. На язык надавливают шпателем и проводят по слизистой оболочке зева и миндалин стерильным ватным тампоном, намотанным на тонкую палочку. Процедура совершенно безболезненная, но неприятная, так как прикосновение тампона к задней стенке горла может спровоцировать достаточно сильные рвотные позывы.
При взятии мазка из носа сначала в одну, а затем в другую ноздрю вводят стерильный тампон и проводят им по стенкам носовой полости.
Процедура взятия мазка у детей точно такая же, как и у взрослых. При заборе материала у ребенка первых лет жизни необходим помощник, который будет фиксировать голову малыша в момент процедуры.
Мазок из носа и зева на стафилококки чаще всего назначается пациентам, страдающим фурункулезом.
Тампоны с кусочками слизи переносят в пробирку с питательной средой или стерильным физиологическим раствором, которые вместе с направлением доставляют в лабораторию.
Сколько дней делается анализ?
Полученный материал может быть исследован разными способами.
Антигенные тесты
Быстрые антигенные тесты. Позволяют выявить присутствие в слизи из носоглотки определенного типа бактерий. Чаще всего этот анализ используется для обнаружения бета-гемолитического стрептококка группы А. Быстрые антигенные тесты отличаются высокой чувствительностью и специфичностью. Их результат бывает готов в течение 10–40 минут.
Бактериологическое исследование
Бактериологический посев. Слизь из носоглотки переносят на питательную среду, а затем пробирку помещают в термостат. В благоприятной среде бактерии начинают активно размножаться, приводя к образованию колоний. Этот метод лабораторной диагностики позволяет выявить возбудителя того или иного заболевания ЛОР-органов, а также определить его чувствительность к антибактериальным препаратам. Длительность бактериологического исследования составляет от 3 до 10 дней.
Полимеразная цепная реакция (ПЦР). В ходе этого анализа устанавливают, какие именно микробы населяют полость носа и горла по их фрагментам ДНК, содержащимся в слизи. В зависимости от используемой методики длительность исследования составляет от нескольких часов до нескольких дней.
Расшифровка результатов
Расшифровка анализа мазка из зева и носа достаточно сложна. Для правильной оценки полученных результатов следует учитывать взаимосвязь между выявленными микроорганизмами и имеющейся патологией. Например, если пациент страдает рецидивирующим фурункулезом, то выявление в мазке золотистого стафилококка будет иметь диагностическую ценность. В то же время выявление у этого же пациента грибков рода кандида не является основанием для постановки диагноза микотического поражения и, соответственно, не требует лечения.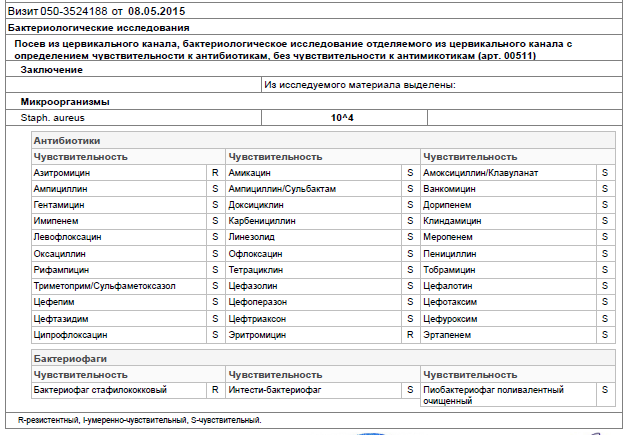
Мазок из зева и носа позволяет не только выявить микроба, послужившего возбудителем заболевания ЛОР-органов, но и определить его чувствительность к антибиотикам.
Даже у совершенно здорового человека в посеве слизи с носа и зева могут обнаруживаться разные микроорганизмы. Присутствие условно-патогенных микробов является вариантом нормы, если их количество незначительно, и они не вызывают заболеваний.
При микроскопии мазка из носа могут обнаруживаться и следующие типы клеток:
- эозинофилы – в норме их не должно содержаться более 10% от общего числа лейкоцитов в мазке. Повышение этого показателя является лабораторным признаком аллергического ринита. В тоже время нормальное содержание эозинофилов не позволяет полностью исключить аллергическую природу ринита. Еще одной причиной повышенного содержания эозинофилов в мазке из носа может стать эозинофильный неаллергический ринит;
- нейтрофилы – повышенное содержание в мазке нейтрофилов свидетельствует о том, что воспалительный процесс в полости вызван бактериями или вирусами и находится в острой стадии;
- лимфоциты – повышенный уровень лимфоцитов в риноцитограмме чаще всего бывает обусловлен хроническим воспалением слизистой оболочки носовой полости;
- эритроциты – в норме отсутствуют. Их появление в мазке связано с повышенной проницаемостью стенок кровеносных сосудов слизистой оболочки носа, что наблюдается при ринитах, вызванных вирусом гриппа или дифтерийной палочкой.
Видео с YouTube по теме статьи:
Источник:
http://www.neboleem.net/stati-o-zdorove/18394-mazok-iz-nosa-i-zeva-na-mikrofloru-jeozinofily-chto-jeto-takoe.php
Что показывает мазок (посев) из зева и носа на микрофлору и чувствительность к антибиотикам, расшифровка
Мазок из зева — лабораторный анализ, в ходе которого исследуется состояние микрофлоры ротовой полости и носа. Исследование способствует выявлению инфекционной и вирусной патогенной микрофлоры, возбудителей различных заболеваний носоглотки. Результаты анализа помогают поставить точный диагноз, назначить эффективное лечение.
Исследование способствует выявлению инфекционной и вирусной патогенной микрофлоры, возбудителей различных заболеваний носоглотки. Результаты анализа помогают поставить точный диагноз, назначить эффективное лечение.
Когда назначают мазок из зева и носа
Бакпосев из носоглотки проводится в следующих случаях:
- ангина, вызванная стрептококком, с высокими рисками осложнений;
- подозрение на золотистый стафилококк;
- воспалительные процессы в носоглотке;
- коклюш;
- менингит;
- ларингит, абсцессы;
- мононуклеоз;
- заболевания респираторного характера;
- туберкулез;
- заболевания центральной нервной системы.
Обязательно мазок на микрофлору берется у детей в рамках подготовительной диагностической программы при поступлении в детский сад, школу. Исследование показано беременным женщинам, в особенности анализ на микоплазму, которая при беременности может стремительно развиваться и спровоцировать ряд осложнений.
Бакпосев из носоглотки регулярно проводится лицам, постоянно контактирующим с большим количеством посторонних людей, гипотетически являющимися носителями патогенной микрофлоры. Это касается воспитателей в детских садах, учителей, медицинских работников, поваров и других сотрудников общепита.
Бактериологический посев из зева может определить чувствительность к антибиотикам патогенной микрофлоры. Данные анализа нужны для назначения эффективного лечения. Бакпосев из носоглотки берется при развитии у человека частых насморков.
Подготовка к сдаче анализа
Исследование микроорганизмов носоглотки покажет достоверный результат только при правильной сдаче биологического материала и подготовке пациента к забору биологического материала:
- За 1 неделю до того, как сдавать бактериологический посев, отменяется использование растворов антибактериального действия, которые уничтожат патогенную микрофлору и окажут негативное воздействие на полезные микроорганизмы.

- Запрещается применять какие-либо растворы для полоскания ротовой полости, назальные спреи, препараты местного спектра действия.
- Берут мазок для проведения анализа строго на пустой желудок. Чтобы анализ показал достоверный результат, утром категорически запрещено что-либо употреблять в пищу и пить, исключается чистка зубов, запрещается жевать жвачку. Исключается и употребление простой воды.
- Если в носу есть слизь, перед взятием образца биологического материала ее нужно убрать. Корочки на слизистой носа убираются путем их размягчения специальным раствором. Наличие слизи может негативно сказаться на правдивости и информативности проводимого анализа.
Проведение процедуры
Взятие мазка для проведения бактериологического анализа проводится в условиях лаборатории:
- Пациент садится на кушетку или стул.
- Для непосредственного забора мазка из ротовой полости пациент широко открывает рот.
- Медицинский работник с помощью специального шпателя прижимает к нижней челюсти язык. Берет образец микрофлоры ватным тампоном.
- Тампон сразу же помещается в стерильную пробирку, которая плотно закрывается крышкой.
Процедура взятия мазка из горла не вызывает болезненных ощущений, но может спровоцировать рвотный рефлекс. Чтобы минимизировать процесс обратной перистальтики, человеку нужно правильно подготовиться к процедуре — ничего не есть и не пить.
Из носа проба биологического материала берется следующим образом: пациент садится на кушетку, запрокидывает голову назад. Кожный покров ноздрей перед процедурой дезинфицируется медицинским спиртом. Сначала лаборант вводит ватный тампон в одну ноздрю, прокручивает его по поверхности слизистых оболочек. Затем процедура повторяется другим стерильным ватным тампоном со следующей ноздрей.
У ребенка процедура взятия биологического материала проводится по тому же алгоритму, что и у взрослого пациента.
Сколько ждать результатов?
Время, необходимое для анализа биологического материала, занимает от 5 до 10 минут. Бактериологический посев микрофлоры из носоглотки проводится с помощью антигенного теста, обладающего высокой чувствительностью. Каждый тест отвечает за выявление одного из видов болезнетворной микрофлоры.
Бактериологический посев микрофлоры из носоглотки проводится с помощью антигенного теста, обладающего высокой чувствительностью. Каждый тест отвечает за выявление одного из видов болезнетворной микрофлоры.
Какие показатели должны быть в норме
Бактериологический анализ на флору у здорового человека покажет наличие полезных микроорганизмов, выполняющих защитные функции, препятствующих проникновению на слизистые оболочки носоглотки болезнетворных организмов.
При правильно проведенном анализе в зеве у здорового человека определяется незначительная концентрация условно-патогенной микрофлоры. Ее показатели не должны превышать результат от 103 до 104 КОЕ/мл.
Если анализ показывает превышение допустимого количества условно-патогенных микроорганизмов, это говорит о наличии у человека в носоглотке микрофлоры, являющейся причиной развития заболеваний ЛОР-органов.
Стафилококк
Стафилококк ауреус, норма которого не должна превышать показатель в 104 КОЕ/мл, представляет собой условно-патогенный микроорганизм. Это означает, что он содержится в минимальном количестве на слизистой носоглотки и не провоцирует развития каких-либо заболеваний ЛОР-системы.
Превышение показателей нормы говорит о заражении стафилококком, который является причиной развития следующих заболеваний:
- ангина и фарингит;
- стоматит, тонзиллит;
- синусит;
- гингивит.
Активный рост стафилококка связан со снижением защитных функций иммунитета. В группе риска находятся дети, люди пожилого возраста. Лечение проводится препаратами антибактериального спектра действия.
Стрептококк
Стрептококк — условно-патогенный микроорганизм. В минимальном количестве находится на слизистых оболочках носоглотки. Является провокатором ангины и скарлатины. Наличие повышенной концентрации патогенной микрофлоры в носу может стать причиной развития синусита бактериального типа.
На развитие инфекционного процесса в носоглотке указывает показатель стрептококка в 105 КОЕ/мл.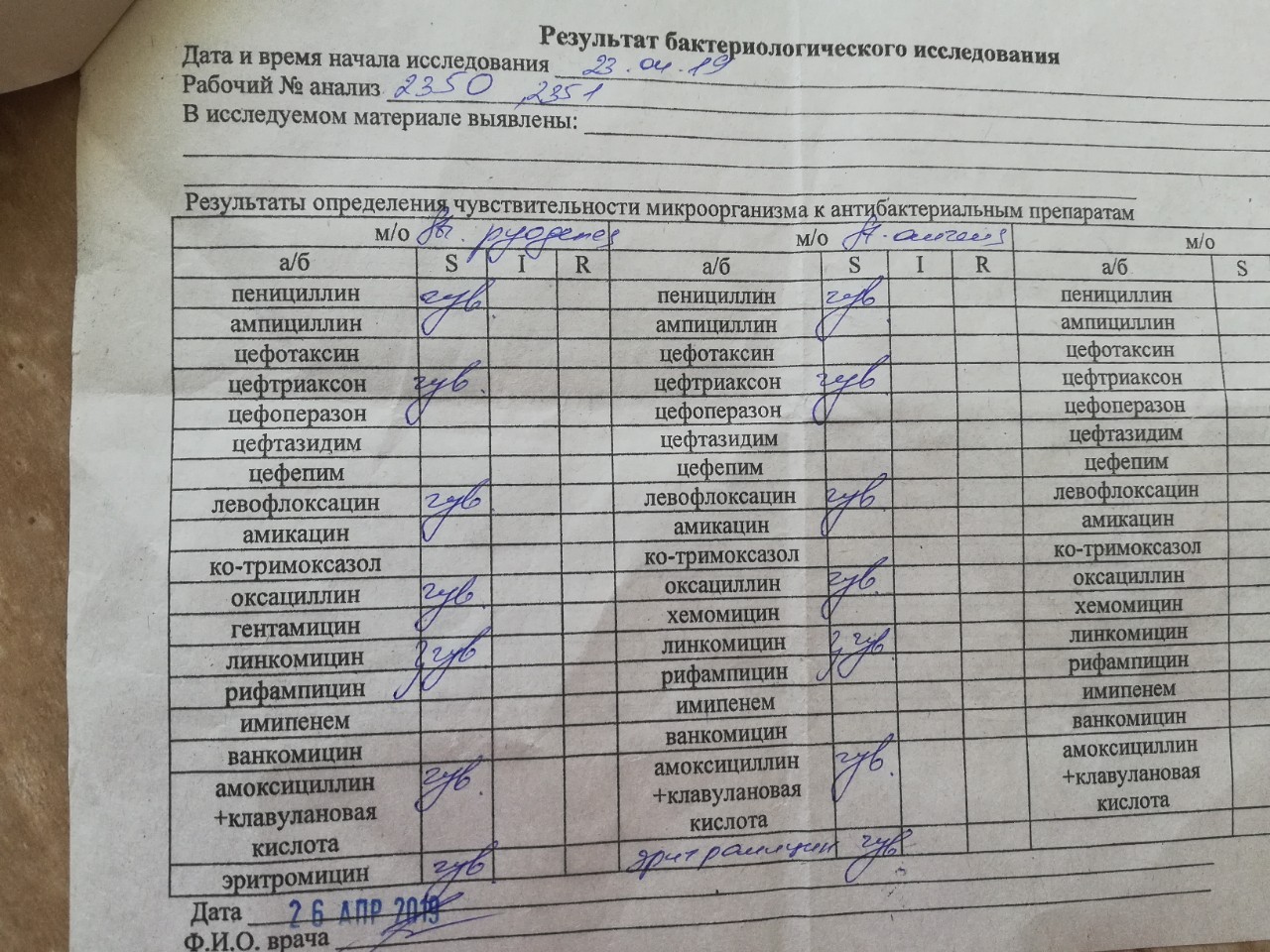 Диагноз ставится по наличию у человека специфической симптоматической картины.
Диагноз ставится по наличию у человека специфической симптоматической картины.
Грибки Кандида
Определение в зеве концентрации грибка Кандида в 105 КОЕ/мл и более указывает на заражение пациента кандидозом. Заболевание развивается быстро, имеет выраженную и интенсивную симптоматическую картину, может спровоцировать развитие осложнений в органах дыхания. Нормой является полное отсутствие грибка в мазке из зева или максимально допустимое количество не выше 104 КОЕ/мл.
Нейссерия и пневмококк
Нейссерия, или кишечная палочка, как и пневмококк, в незначительном количестве содержится в мазке из слизистой носоглотки.
Пневмококк является причиной развития следующих заболеваний:
- пневмония;
- бронхит;
- сепсис органов дыхательной системы;
- ларингит, фарингит, трахеит;
- отит среднего уха;
- остеомиелит.
Вызывает превышенная концентрация нейссерии и пневмококка ряд различных инфекционных и воспалительных заболеваний органов дыхательной системы.
В зависимости от количества патогенной микрофлоры в мазке из носоглотки назначается соответствующее лечение либо профилактические мероприятия, направленные на снижение концентрации патогена и уменьшение рисков развития заболеваний. Терапия заключается в применении препаратов антибактериального спектра действия.
Какие показатели опасны
Расшифровка результатов бактериологического посева указывает точное количество патогенной микрофлоры на слизистой оболочке носоглотки. Наличие патогенного микроорганизма может находиться в пределах нормы (от 101 до 104 КОЕ/мл).
Настораживают и являются признаком развития инфекционных и воспалительных заболеваний носоглотки следующие показатели:
- 103-104 — концентрация патогенных возбудителей находится в пределах нормы, вероятность развития заболеваний при отсутствии провоцирующих факторов минимальная.
- 105-107 — содержание болезнетворных микроорганизмов высокое.
 Вероятность развития заболеваний максимальная. Требуется незамедлительное проведение профилактических мероприятий по предупреждению развития воспалений носоглотки.
Вероятность развития заболеваний максимальная. Требуется незамедлительное проведение профилактических мероприятий по предупреждению развития воспалений носоглотки. - Сливной результат — данным показателем называют крайне высокое содержание патогенных микроорганизмов, количество которых не удается посчитать.
При получении сливного результата назначается срочная антибактериальная терапия, направленная на уничтожение болезнетворной микрофлоры. При наличии у человека специфических признаков, указывающих на воспалительные процессы, протекающие в носоглотке, проводится одновременно с антибактериальным лечением симптоматическая терапия.
Возбудитель коклюша
Бактерия Бордетелла пертуссис, вызывающая коклюш, в мазке из носоглотки у здорового человека должна отсутствовать. Расшифровка анализа на бакпосев флоры из зева имеет 2 интерпретации результата:
- положительный — бактерия присутствует;
- отрицательный — патоген не выявлен.
Если результат положительный, определяется количество патогенного организма. По концентрации бактерии делается заключение о стадии развития заболевания.
Возбудитель дифтерии
При нормальном состоянии здоровья патоген, вызывающий дифтерию, Corynebacterium diphtheriae, должен отсутствовать. При несоблюдении пациентом правил подготовки к взятию биологического материала может быть получен ложноположительный результат. Если анализ показал наличие болезнетворной бактерии, но соответствующая симптоматическая картина отсутствует, анализ бакпосева из зева проводится повторно.
Гемолитический стрептококк
Наличие высокого содержания гемолитического стрептококка всегда указывает на высокие риски развития ангины с осложнением — фарингита. Антибактериальная терапия для уменьшения численности гемолитического стрептококка не проводится, так как с патогеном можно уменьшить концентрацию полезной защитной микрофлоры, что приведет к ослаблению местного иммунитета. Антибиотики применяются только при развитии фарингита.
Особенность гемолитического стрептококка в том, что данный вид патогенной микрофлоры провоцирует развитие ангины, которая практически всегда без своевременного лечения дает осложнение на сердечную мышцу. Если у человека внезапно заболело горло и появились другие признаки фарингита, бактериологический посев на определение вида болезнетворной микрофлоры необходимо сдавать незамедлительно.
Грибки Кандида Альбиканс
Грибки Кандида в минимальном количестве, не превышающем показатель в 104 КОЕ/мл, всегда присутствуют на слизистой носоглотки человека и не являются патологией. Превышение показателей нормы, даже при отсутствии характерной соответствующей симптоматики — это повод для скорейшего проведения антибактериальной терапии.
Источник:
http://viplor.ru/gorlo/mazok-iz-zeva
Зачем делают мазок на BL из зева и носа?
При воспалительных заболеваниях носа и ротоглотки врач может назначить мазок на BL – микробиологическое исследование, которое позволяет выявить наличие дифтерии.
Возбудителем заболевания являются бактерии Corynebacterium diphtheriae (бациллы Леффлера), отсюда и название анализа – мазок на БЛ или BL на латинице, посев на дифтерийную палочку.
Чаще всего мазок назначают при подозрении на дифтерию и для более точной диагностики заболеваний, протекающих со схожими симптомами: ангины, мононуклеоз, ларинготрахеит, абсцесс, коклюш и пр.
Мазок могут взять и для подтверждения эффективности проводимой противомикробной терапии, перед госпитализацией в профилактических целях.
Забор материала
Правильный забор материала для исследования включает отдельные мазки из зева и носа. Каждый мазок собирают специальной тонкой петлей из проволоки, обернутой стерильной ватой.
Для забора материала из носа пациенту вводят петлю сначала в одну ноздрю, а затем в другую, примерно на 10 – 20 мм, и аккуратно проводят по слизистой носовых проходов.
Для выявления дифтерийной палочки петлю с материалом для анализа погружают в сухую стерильную пробирку и доставляют в лабораторию в течение 3 часов.
Если же транспортировка до лаборатории занимает больше времени, то петли с материалом для анализа погружают в раствор глицерина для консервации.
Перед проведением процедуры пациенту рекомендуется прочистить полость носа (высморкаться) без применения дополнительных средств, растворов или медикаментов.
Для забора мазка на БЛ из зева врачу потребуется специальная проволочная петля со стерильной ватой и стерильный шпатель (чаще всего одноразовый).
Врач шпателем прижимает корень языка больного, чтобы петля для забора не касалась слизистой ротовой полости, особенно языка.
Затем аккуратно проводит петлей с ватой по небным дужкам, миндалинам и задней стенке ротоглотки.
Наиболее достоверным считается мазок, взятый с границы воспаленных и здоровых тканей, возле очагов налета – именно в этих областях скапливается максимальное количество болезнетворных бактерий.
Так же, как и материал при мазке из носовой полости, шпатель с полученным материалом помещают в сухую стерильную пробирку или раствор глицерина.
Перед проведением процедуры больному рекомендуется избегать применения противомикробных или антибактериальных препаратов (пастилок, ингаляторов, растворов, травяных отваров и пр.)
Минимум за 2 часа до забора материала необходимо отказаться от употребления пищи и жидкостей, не чистить зубы и не полоскать горло.
Расшифровка результатов
Мазок из зева и носа на BL транспортируют в лабораторию, где проводят «посев» – полученный биоматериал помещают в различные питательные среды для выявления наличия возбудителей тех или иных заболеваний.
Если слизь из носовой области и гортани была транспортирована в сухой пробирке, то результаты анализа будут готовы через 1-2 дня.
Если же пришлось помещать пробу в консервант (раствор глицерина), то результатов теста придется ждать немного дольше, обычно 2 – 4 суток.
Если по результатам анализа вам выдают результат «нет роста» – это означает, что бактерий БЛ не обнаружено. В большинстве случаев если бактерии в мазке не присутствуют, то заражения дифтерией нет.
В большинстве случаев если бактерии в мазке не присутствуют, то заражения дифтерией нет.
Исключение составляют случаи, когда больной находится или недавно завершил курс антибактериальной терапии – в таком случае, возможно, потребуется сдать мазок повторно.
Если же у больного не обнаружено роста БЛ, но у кого-то из членов семьи результаты анализа положительные, то диагноз «дифтерия» подтверждается.
Мазок на BL может дать положительные результаты и у человека, не проявляющего никаких внешних симптомов заболевания (нет боли в горле, воспаления, налета, повышения температуры).
Такой пациент считается носителем дифтерии, хотя сам активно заболевание не переносит. Как правило, врач порекомендует дальнейшие действия: антибактериальную терапию или временную изоляцию, чтобы предотвратить заражение других.
Что такое дифтерия?
Дифтерия – это острое инфекционное заболевание, которое может поражать как взрослых, так и детей. Чаще всего дифтерия ассоциируется с воспаленным горлом и образованием язвочек или пленок, но эта болезнь может поражать и другие органы: сердце, почки, кожный покров и т. д.
Заболевание провоцирует особый вид микробов, дифтерийные палочки, но основной вред наносят не сами бактерии, а токсичные продукты их жизнедеятельности.
Дифтерия может поражать зев, гортань, нос, глаза, уши, половые органы, кожу и т. д. Чаще всего заболевание проявляется воспалением слизистой, отеком и образованием характерных пленок.
Но существует и атипичная форма заболевания, которая не сопровождается образованием пленок, но является наиболее опасной для здоровья.
Дифтерия передается в основном воздушно-капельным путем от человека к человеку, т. е. заразиться от домашних питомцев или других животных невозможно.
Самая быстрая, но не единственная, форма распространения – контакт с носителем дифтерийной палочки.
Причем носитель бактерий не всегда сам подвергается заболеванию. В редких случаях дифтерия может передаваться через третьи лица или предметы обихода, посуду, продукты питания.
Лучше всего заболевание распространяется в холодное время года, поскольку микробы не боятся низких температур. Зимой бактерии могут выживать до полугода на предметах, сохраняя свои опасные свойства.
Прямой солнечный свет, высокие температуры и антибактериальные средства эти микроорганизмы переносят плохо, поэтому для профилактики распространения заболевания рекомендуется перестирать белье больного в горячей воде, тщательно вымыть и обдать кипятком посуду, которой он пользовался.
Если болезнь перенес ребенок, то необходимо предпринять меры по обеззараживанию игрушек.
Источник:
http://moydiagnos.ru/issledovaniya/mazok/na-bl-iz-zeva-i-nosa.html
Посев на дифтерию (Corynebacterium diphtheriae)
Микробиологическое исследование, позволяющее выявить возбудителя дифтерии (C. diphtheriae) в исследуемом биоматериале.
Посев на бациллы Леффлера, посев на BL, посев на дифтерийную палочку.
Corynebacterium diphtheriae сulture, Diphtheria сulture.
Какой биоматериал можно использовать для исследования?
Мазок из зева и носа.
Как правильно подготовиться к исследованию?
- За 3-4 часа до взятия мазков из ротоглотки (зева) не употреблять пищу, не пить, не чистить зубы, не полоскать рот/горло, не жевать жевательную резинку, не курить. За 3-4 часа до взятия мазков из носа не закапывать капли/спреи и не промывать нос. Взятие мазков оптимально выполнять утром, сразу после ночного сна.
Общая информация об исследовании
Corynebacterium diphtheriae (бациллы Леффлера) – это грамположительные бактерии рода Corynebacterium, являющиеся возбудителями дифтерии и способные к выработке дифтерийного токсина. Заболевание передается воздушно-капельным путем, источником инфекции являются больные люди или бактерионосители.
Инкубационный период составляет в среднем 2-5 дней. Происходит фибринозное воспаление слизистых оболочек ротоглотки и дыхательных путей с формированием псевдомембран и с симптомами общей интоксикации.
При токсической форме дифтерии также может поражаться сердце и нервная система. В некоторых случаях возможно бессимптомное носительство.
Диагноз “дифтерия” основывается на клинических данных, посев на дифтерию проводится для подтверждения.
Для чего используется исследование?
- Для подтверждения диагноза “дифтерия”.
- Для дифференциальной диагностики заболеваний, протекающих со сходными симптомами, таких как ангины различного происхождения, паратонзиллярный абсцесс, инфекционный мононуклеоз, острый ларинготрахеит, эпиглоттит, бронхиальная астма.
- Чтобы оценить эффективность проводимой антибактерильной терапии.
Когда назначается исследование?
- При подозрении на дифтерию.
- Когда известно, что пациент контактировал с больными дифтерией.
- После проведения антибактериальной терапии – не менее чем через 2 недели после окончания курса антибиотиков.
- В некоторых случаях перед госпитализацией в стационар (с профилактической целью).
Что означают результаты?
Референсные значения: нет роста.
Выявление возбудителя дифтерии подтверждает диагноз “дифтерия” или, если симптомы заболевания отсутствуют, свидетельствует о бактерионосительстве. При отрицательном результате посева у больного с подозрением на дифтерию диагноз может быть подтвержден в том случае, когда у контактных лиц результат посева положительный, то есть выделяется возбудитель дифтерии.
Причины положительного результата
- Дифтерия или бессимптомное носительство C. diphtheriae.
Причины отрицательного результата
- Отсутствие дифтерии. Исключение составляют случаи, когда на момент исследования проводилось лечение антибиотиками.
Что может влиять на результат?
- Предшествующая антибактериальная терапия.

Диагноз “дифтерия” основывается на клинической картине заболевания, поэтому лечение должно быть начато до получения лабораторного подтверждения заболевания. При положительном результате посева необходимо исследовать выделенный штамм С. diphtheriae на токсигенность.
Кто назначает исследование?
Инфекционист, терапевт, врач общей практики, педиатр, ЛОР.
Источник:
http://helix.ru/kb/item/10-010
Анализ мазка на стафилококк
Мазок для исследования клеточного состава на слизистой оболочке ротоглотки позволяет подтвердить наличие болезнетворных микроорганизмов. На основании результатов анализа врач диагностирует заболевание, назначает лекарственные средства для борьбы с возбудителем.
Содержание статьи
Одним из наиболее часто проводимых исследований является мазок из зева на стафилококк.
- с профилактической целью перед трудоустройством в пищевую промышленность, учебные и лечебные учреждения. На основании результатов определяется, здоров ли человек, можно ли начинать работу.
- беременным женщинам для установления риска развития тяжелых инфекционных заболеваний, которые могут осложнить течение беременности и оказать негативное воздействие на плод.
- для профилактического обследования ребенка перед посещением учебного учреждения во избежание развития эпидемии инфекционной болезни в детском коллективе.
- обследование пациента перед госпитализацией, а также перед операцией, так как патогенные микроорганизмы могут существенно осложнить течение послеоперационного периода и замедлить процесс выздоровления.
- установления риска развития заболевания после контакта с больным человеком, что позволяет предупредить дальнейшее распространение инфекции.
- для диагностики ЛОР-заболеваний, определения вида микрофлоры, на основании чего удается правильно подобрать лекарственные средства.
Подготовка к диагностике
Достоверные результаты исследования можно получить лишь при соблюдении определенных правил.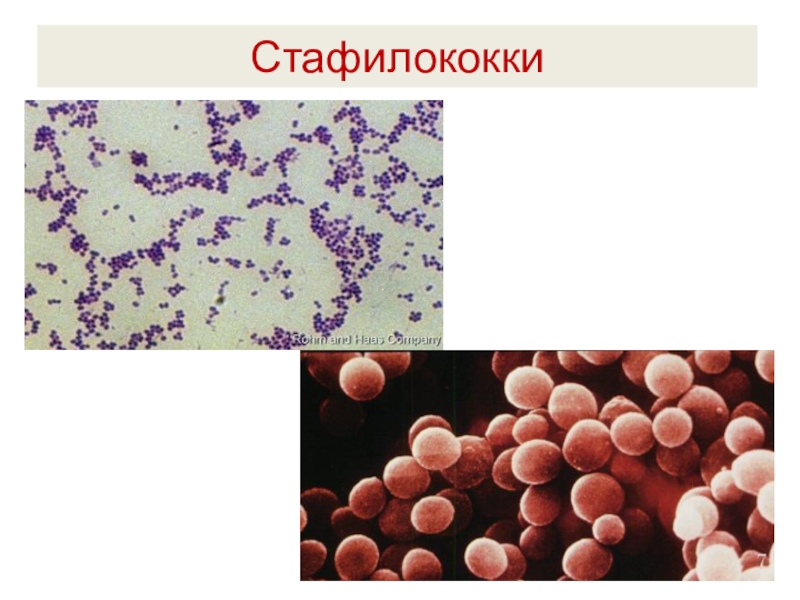 Пациенту необходимо начинать подготовку к анализу за несколько дней. Мазок из горла покажет истинный качественный и количественный состав микроорганизмов при некоторых условиях:
Пациенту необходимо начинать подготовку к анализу за несколько дней. Мазок из горла покажет истинный качественный и количественный состав микроорганизмов при некоторых условиях:
- за 4 дня до анализа запрещается использовать антисептические растворы для полоскания ротоглотки, а также мази, спреи с противомикробным действием. Они приводят к смыванию патогенных микроорганизмов, уменьшая их численность. Таким образом, результаты обследования не считаются верными.
- за 3 часа до диагностики не следует принимать пищу, жидкость, жевать жвачку.
- в день сдачи материала не нужно чистить зубы;
- антибактериальные препараты для внутреннего приема отменяются за неделю до обследования.
Особенности процедуры
Пациент располагается на кушетке в положении сидя. Рот необходимо максимально раскрыть для четкой визуализации структур полости. Для улучшения положения рекомендуется несколько запрокинуть голову назад.
Специалист фиксирует язык с помощью шпателя (металлический, деревянный), опуская его ко дну ротовой полости. Стерильным ватным тампоном на удлиненной металлической петле следует провести по поверхности слизистой оболочки зева.
Тампон не должен соприкасаться с другими поверхностями при введении и выведении его из полости рта во избежание получения недостоверных данных.
Процесс сбора материала не доставляет болезненных ощущений пациенту, возможен лишь небольшой дискомфорт. У людей с выраженным рвотным рефлексом могут наблюдаться неприятные ощущения при прикосновении к задней глоточной стенке.
Собранный материал на тампоне помещается в стерильную колбу со средой, которая обеспечивает максимально благоприятные условия для сохранения патогенных микробов. Это дает возможность транспортировать материал в лабораторию без погибших микроорганизмов.
В условиях лаборатории материал помещается в питательные среды различного состава для активации процессов размножения и роста инфекционных возбудителей. В зависимости от реакции, которую следует оценить через определенный период времени.
В зависимости от реакции, которую следует оценить через определенный период времени.
Результаты анализа
Чтобы специалист правильно расшифровал полученные результаты, он используется таблицы показателей нормального количественного и качественного состава микрофлоры слизистой оболочки ротоглотки. На бланке указывается вид микроорганизмов, их количество, которое указывается в колониеобразующих единицах.
Для определения КОЕ используется специальная питательная среда, благодаря которым наблюдается рост определенного вида патогенных возбудителей. Колонии микробов вырастают в форме пятен. При необходимости из колонии можно вырастить новых инфекционных возбудителей.
На следующем этапе осуществляется подсчет микроорганизмов с помощью специальных методик. В случае серийного разведения набранный материал подвергается 10-кратному разведению, после чего он помещается во вторую пробирку. Далее разведенный материал объемом 10 мл снова разбавляется в 10 раз, помещается в третью пробирку. Специалист повторяет манипуляцию около 10 раз.
Из каждой пробирки часть материала высеивается на питательную среду. Этого необходимо для облегчения процесса роста микробов. При максимальной концентрации возбудителей рост практически отсутствует. Расшифровка подобного анализа не считается достоверной.
В таблице указывается вид инфекционных микроорганизмов, их количество. При нормальных условиях на слизистой оболочке ротоглотки можно обнаружить эпидермальные, зеленящиеся стафилококковые, пневмококковые микробы, небольшая часть грибков Кандида, непатогенные нейссерии.
Из болезнетворных микробов в мазках могут выявляться стрептококки, грибки, бацилла Леффлера, возбудитель коклюша и другие.
Стрептококки являются причиной множества заболеваний, например, ангины, пневмонии, ревматизма, скарлатины. Подробнее остановимся на стафилококковой и дифтерийной палочках, так как они чаще всего обнаруживаются в материале.
Стафилококковый возбудитель
Зачастую стафилококк в мазках из ротоглотки обнаруживается после сильного переохлаждения, иммунодефиците на фоне авитаминоза, простуды. Стафилококк относится к возбудителям, которые в норме присутствуют в микрофлоре, однако они не вызывают болезни. Однако при воздействии благоприятных для них факторов, они активизируются. Стафилококки передаются через зараженные предметы обихода, а также попадают в организм посредством респираторной системы при вдыхании инфекции. В редких случаях регистрируется алиментарное заражение.
Стафилококк относится к возбудителям, которые в норме присутствуют в микрофлоре, однако они не вызывают болезни. Однако при воздействии благоприятных для них факторов, они активизируются. Стафилококки передаются через зараженные предметы обихода, а также попадают в организм посредством респираторной системы при вдыхании инфекции. В редких случаях регистрируется алиментарное заражение.
Не стоит пугаться, если у новорожденного будет обнаружен стафилококк, ведь младенец обладает слабой иммунной защитой, поэтому имеет высокий риск заражения.
В диагностический комплекс входит обязательный посев или баканализ. В зависимости от количественного состава высеянного возбудителя врач принимает решение о назначении лекарственных препаратов. Стафилококки провоцирует развитие:
- воспаления носо-/ротоглотки;
- пищевой токсикоинфекции;
- остеомиелита;
- пневмонии;
- пиодермии.
Стафилококк может приводить к сепсису, что критически отягощает течение хронических заболеваний.
Стафилококк в мазке из зева может выявляться с помощью микроскопического метода путем окрашивания материала по Грамму. При диагностике обнаруживаются кокки (шаровидной формы) поодиночке или скоплениями. Стафилококк окрашивается в синий цвет. Для него характерна неподвижность и сферическая форма. Микроскопия проводится для предварительной диагностики.
Чтобы точно установить состав флоры, используется культуральный метод. Посев материала помогает вывести чистую культуру, что подтверждает диагноз и помогает установить ответную реакцию на антибиотики. Оптимальная температура для роста бактерий составляет 30-36 градусов. Стафилококки не прихотливы к питательным средам, поєтому рост их колоний возможен на различных средах:
- мясопептидный агар, на котором микробы растут гладкими и блестящими колониями округлой формы, возвышающие над средой.
 Золотистый стафилококк имеет золотистую окраску колоний, что обусловлено присутствием пигмента. Он выделяется при росте бактерий, отчего получил свое название.
Золотистый стафилококк имеет золотистую окраску колоний, что обусловлено присутствием пигмента. Он выделяется при росте бактерий, отчего получил свое название. - мясопептидный бульон. Стафилококк приводит к его помутнению и формированию осадка на дне.
- солевой агар содержит до 10% хлорида натрия. На данной среде растет исключительно стафилококковый возбудитель, так как другие микроорганизмы не выдерживают такую высокую концентрацию солей.
- кровяной агар. Вокруг стафилококковых колоний наблюдается зона гемолиза, где располагаются разрушенные эритроциты под действием гемолизина.
Для определения чувствительности микробов к антибактериальным препаратам требуется антибиотикограмма. Для этого необходимо произвести посев бактерий на твердую среду, после чего на ее поверхность располагаются диски, пропитанные разными антибактериальными средствами.
Если рост патогенных микроорганизмов угнетается под определенным диском с антибиотиком, подтверждается его эффективность в борьбе с возбудителем. В результате этого врач выбирает данный препарат для лечения заболевания. В большинстве случаев для гибели стафилококков назначаются пенициллины или ванкомицин.
Вследствие длительного использования пенициллинов для лечения стафилококковых болезней, у микробов выработалась устойчивость. Защита от антибиотика обеспечивается пенициллиназой, которая его расщепляет.
Бацилла Леффлера
Подозрение на активацию дифтерийной бактерии появляется при наличии:
- синдрома интоксикации;
- воспалительного очага в ротоглотке;
- нарушения дыхания, одышки, приступов удушья;
- дисфункции почек;
- пленочного налета на миндалинах, носу;
- кардиальной патологии.
Дифтерия – серьезное заболевание, при отсутствии лечения которого возможен летальный исход. В связи с высоким риском развития тяжелых осложнений, специально была разработана вакцина. Первая прививка проводится в 3-месячном возрасте, после дважды требуется повторное введение через 6 недель. Ревакцинация выполняется в 1,5 года, 6-летнем возрасте, после этого спустя 8 и 4 года.
Ревакцинация выполняется в 1,5 года, 6-летнем возрасте, после этого спустя 8 и 4 года.
Если контакт ребенка с больным дифтерией человеком произошел до момента окончания полной вакцинации, ему выполняется реакцию Шика. Если у ребенка, выполнив, мазок из зева на дифтерию bl, результат положительный, его необходимо изолировать от других детей до полного выздоровления.
Кроме того, в учебной группе, где находился больно ребенок, следует с профилактической целью обследовать всех детей. Им также берется мазок из ротоглотки для выявления возбудителя. Все предметы мебели, игрушки подвергаются дезинфекции.
Специалисты выделяют несколько видов палочки Леффлера. Так, различают mitis, gravis, а также intermedius. Они передаются при разговоре, дыхании, оседая на слизистые оболочки респираторных органов, или распространяются через предметы.
Благодаря анализу, при котором исследуется материал из ротоглотки, специалист обнаруживает возбудителя и устанавливает его штамм. От этого зависит агрессивность инфекции и соответственно, тяжесть заболевания. Классифицируются бактериальные агенты на основании ферментативных, культуральных и структурных особенностей.
Микроскопический анализ необходим для предварительного исследования материала. Морфологические признаки микроба настолько разнообразны, что требуется дальнейший бакпосев. Для окраски используются несколько методик (Грамма, Нейссера, а также Леффлера):
- метод Грамма дает возможность установить способность бактерии взаимодействовать с генцианвиолетом. Несмотря на то, что дифтерийный возбудитель относится к грамположительным микроорганизмам, это свойство взаимодействия непостоянно. Свойства микроба резко изменяются при отсутствии питания и при контакте с антибактериальными средствами.
- метод Нейссера – наиболее информативный, однако трудоемкий. Для окраски используется уксуснокислая синька, растворы Люголя и хризоидина.
 После нанесения синьки и Люголя препарат ополаскивается дистиллированной водой, после чего материал окрашивается хризоидином.
После нанесения синьки и Люголя препарат ополаскивается дистиллированной водой, после чего материал окрашивается хризоидином. - Метод Леффлера используется чаще всего. Для окрашивания применяется синька (метиленовая щелочная).
В процессе диагностики важно отличить истинные дифтерийные бациллы с палочками Гофмана и Ксероза. В мазках после окраски дифтерийные микробы располагаются в виде римской цифры 5.
Для проведения бактериологического метода необходимо тщательно подбирать питательную среду, так как бациллы очень прихотливые. Для посева используются такие питательные среды:
- свернутая сыворотка Ру, на котрой бациллы вырастают шероховатыми, R-формой;
- теллуритовые дифсреды;
- сывороточно-/кровяно-теллуритовые агары;
- среда Клаубера;
- хинозольная среда Бучина.
Благодаря теллуритовым средам удается не только выявить возбудителя, но и провести дифференцировку между штаммов:
- дифтерийная палочка серая, розеткообразная;
- mitis – черной окраски, неблестящие, с гладкой поверхностью;
- gravis – с радиальностью;
- intermedius – серо-черного оттенка, с гладкой поверхностью;
- ложнодифтерийные микробы Гофмана – серой окраски, с блестящей поверхностью, конусовидные, возвышающиеся над средой;
- дифтероиды Ксероза – серо-черные, отличить их удается с помощью хинозольной среды, где они вырастают бесцветными.
Диагноз инфекционного заболевания подтверждается на основании результатов лабораторной и инструментальной диагностики. Кроме того, необходимо обращать внимание на выраженность клинических симптомов. Помимо бакпосева и микроскопии целесообразно проведение серологического исследования. Благодаря комплексному обследованию врачу удается максимально точно установить вид инфекционного возбудителя. Это дает возможность точно подобрать лекарственные препараты и предупредит развитие тяжелых осложнений.
Источник:
http://globalmedclub.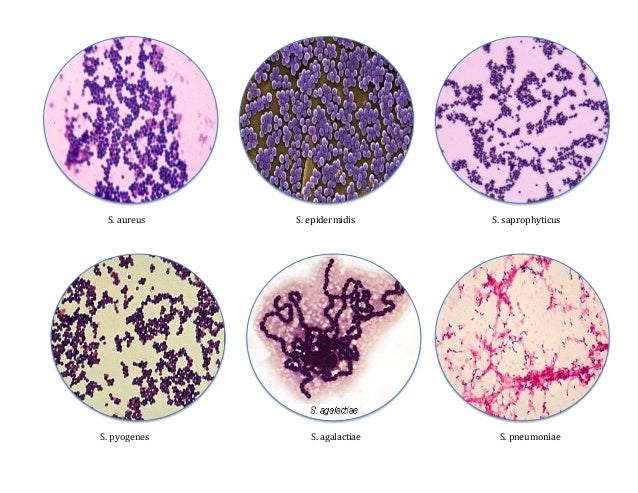 ru/simptomy-gorla/diagnostika/mazok-iz-zeva-na-stafilokokk.html
ru/simptomy-gorla/diagnostika/mazok-iz-zeva-na-stafilokokk.html
Стафилококк 10 в 2, 3, 4, 5, 6 степени: что это значит и что делать
В мире, помимо животных и растений, обитает масса микроорганизмов, которые могут быть полезными или вредными для человека. Это бактерии и вирусы. И если говорить об одном из наиболее сложных в лечении и, соответственно, опасном виде, то это золотистый стафилококк, по латыни – Staphylococcus aureus.
Общая информация о золотистом стафилококке
Что это? Бактерия, относящаяся к классу анаэробных, то есть, способных жить без воздуха, неподвижная, Грам-положительная. Существует немало типов стафилококка, но именно золотистый наиболее опасный. Назвали его так не из-за цвета. Ауреус – потому что при посеве в питательную среду колония бактерий дает желто-золотистое окрашивание.
Сразу можно подумать, что микроорганизм редко встречается, но на самом деле, его можно обнаружить везде. Бактерия живет на коже и слизистых человека, прекрасно себя чувствует в окружающей среде: на мебели, игрушках, посуде, деньгах.
Это объясняется высокой устойчивостью микроорганизма к антисептикам, моющим средства, даже кипячению (гибнет только через 10 минут), замораживанию. Не боится стафилококк и спирта, перекиси водорода. Единственное из доступных средств, которое может убить бактерию – обычная «Зеленка».
Чаще всего обнаруживается золотистый стафилококк в носу.
Впрочем, несмотря на распространенность, этот микроорганизм вызывает заболевания редко, даже живя на теле человека. Для того чтобы развилось воспаление, необходимо снижение иммунитета. Только в этом случае бактерии начнут активную деятельность и вызовут самые разные болезни кожи и слизистых.
Опасность золотистого стафилококка в том, что он устойчив к пенициллиновым антибиотикам за счет выработки лидазы и пенициллиназы – ферментов, разрушающих белки. Эти же вещества расплавляют кожу и слизистые, помогая бактериям проникнуть в организм.
Кроме того, стафилококк вырабатывает эндотоксин, вызывающий у человека интоксикацию, пищевое отравление и инфекционно-токсический шок – опасное состояние, которое крайне сложно поддается лечению.
Стоит прибавить к этому отсутствие постоянного иммунитета к таким бактериям. То есть, переболев инфекцией, человек все так же рискует заболеть вновь.
Подобрать лекарства от паразитов
Этот сервис — небольшой помощник в поиске лекарств от паразитов. Чтобы начать им пользоваться, выберите вид паразита. Если вы не знаете, каким паразитом заражены – вам поможет этот определитель паразитов по симптомам.
Норма показателей золотистого стафилококка
Как уже было сказано выше, бактерия есть везде. Но если был обнаружен стафилококк, это еще не повод для паники, есть определенные нормы содержания его на коже, слизистых, предметах.
Многие начинают переживать, получив результаты анализа: стафилококк золотистый 10 в 4, или, к примеру, золотистый стафилококк 10 в 3.
Чтобы разобраться, нужно понимать принципы определения количества микроорганизмов в биоматериале.
Существует 4 степени роста бактерий:
- – слабый рост;
- – рост до 10 колоний одного вида;
- – рост от 10 до 100 колоний;
- – рост больше 100 колоний;
Понятно, что чем больше степень, тем выше количество бактерий, соответственно, активнее патологический процесс. Первые две степени говорят о присутствии бактерии в биоматериале, третья – о том, что началась болезнь, стафилококк 4 степени – это уже выраженная патология.
Как расшифровать данные посева? Для каждого органа есть свои нормы. Так, золотистый стафилококк 10 в 6 степени – верхняя граница нормы. Обнаруживаемый микроорганизм в носу, зеве или горле, посевах кала пока еще не несет опасности.
То есть, если анализы показывают золотистый стафилококк 10 в 5 степени или ниже, причин для особой паники нет. Возможно, потребуется лечение, но в каждом конкретном случае решает врач, учитывая многие нюансы.

Конечно же, чем меньше цифра, тем лучше, но если обнаруживается стафилококк 10 в 3 степени, это вариант нормы.
Пройти тест на наличие глистов
Диагностика и степени заражения
Данный микроорганизм присутствует в организме каждого человека. Нормальным показателем является 10 в 3 степени. Если степень заражения превышает эти показатели, но негативная симптоматика не наблюдается, лечение не проводят – иммунная система может самостоятельно справиться с таким количеством бактерий.
Для обнаружения бактерии назначают:
- коагулазный тест;
- латекс-агглютинацию;
- общий анализ крови;
- анализ мочи;
- посев на питательные среды;
- реакция Видаля;
- фаготипирование;
- посев кала.
Лечение Staphylococcus Aureus
Обычно лечение staphylococcus aureus назначают, если анализы дают результат КОЕ 10*4. Однако важно учитывать – если такая степень заражения не проявляется негативной симптоматикой, лечение не требуется.
Показатели 10*5 характеризуются массивным инфицированием, обычно сопровождаются выраженной, интенсивной симптоматикой. В таких случаях необходимо подобрать антибактериальное лечение. Терапия проходит комплексно и включает в себя симптоматическое лечение.
Врач подбирает наиболее эффективные антибиотики, которые могут воздействовать на бактерию. Курс лечения сопровождается приемом иммуномодуляторов и витаминных комплексов, пробиотиков.
Все препараты направлены на борьбу с инфекцией, восстановление местной микрофлоры, укрепления защитных функций организма и исключение вероятности рецидива, чему способствует соблюдение профилактических правил.
В некоторых случаях требуется удаление поврежденных тканей с помощью хирургических методов.
Золотистый стафилококк является опасным для человека микроорганизмом. Он присутствует в организме каждого и никак себя не проявляет, но если иммунная система ослабевает, человек сталкивается с развитием серьезных патологических состояний.
Самолечение в этом случае крайне не рекомендуется – оно может значительно усугубить проблему, осложнить процесс дальнейшей терапии и выздоровления. Без своевременной медицинской помощи инфекция может стать причиной гибели человека.
Какой должна быть норма?
Норма результата зависит от того, из какой среды взят мазок. В основном действует правило, чем меньше, тем лучше.
- Кровь и моча у здорового человека стерильны, не содержат бактерий.
- В кале здорового пациента содержится незначительное количество микроорганизмов – стафилококки не являются основой кишечной микрофлоры. Положительный результат говорит о бактерионосительстве или гнойном заболевании.
- Наличие инфекции в ране говорит о гнойной инфекции или высоком риске её развития.
- На слизистых верхней границей нормы считается 10*6 степени – если бактерий больше, это говорит о наличии заболевания.
Отдельные показатели
Результат выдаётся в виде цифры – это количество бактериальных клеток, ставших основами колонии (КОЕ) на 1 мл среды. Тест проводится на питательной среде для бактерий – исследуемый материал помещают в специальную закрытую ёмкость, и если возбудители присутствуют, то они начнут активно размножаться.
10 в 2 степени
- Если такой показатель обнаружен на коже, в носу или глотке – это вариант нормы. Никаких действий в этом случае предпринимать не надо. Если есть какие-либо проблемы с кожей, то вызваны они другими микроорганизмами.
- Если такая концентрация обнаружена в кале, то при хорошем самочувствии она считается нормой. Возможно, врач выдаст рекомендации по питанию. Если имеются симптомы расстройства пищеварения, то пациенту необходимо начать лечение от дисбактериоза.
- Во влагалище такой результат характерен для мазка на степень чистоты 3 или 4. Это ещё не означает заболевание, но предрасполагает к нему. Желательно пройти санацию влагалища, но это не срочно. Опасным такой результат становится только при беременности.

- В моче небольшое количество стафилококка может говорить о воспалительном процессе или кратковременной бактериурии. Требуется повторный забор мочи через 2-3 дня.
- В крови любое количество микроорганизмов – опасный признак. Если нет симптомов сепсиса, требуется повторный анализ через 2-3 дня после получения результатов.
- В ране появление такого количества микроорганизмов не является важным диагностическим признаком. Требуется повторный анализ.
10 в 3
- Для кожи такое значение вполне нормально. Слизистая рта и носа показывает такой результат как в норме, так и при начинающихся заболеваниях.
- Обнаружение в кале – возможное бактерионосительство, требуется повторный анализ.
- Во влагалище ситуация аналогична предыдущему пункту.
- В моче – скорее всего имеет место воспалительный процесс в мочевыводящих путях (мочекаменная болезнь, реже – цистит).
- В ране – признак высокого риска развития гнойной инфекции.
10 в 4
- На коже фиксируется при угревой болезни лёгкой степени, но может наблюдаться в норме.
- Слизистая носа и глотки – признак хронических респираторных инфекций.
- В кале – бактерионосительство или дисбактериоз, пациенту не рекомендована работа с пищевыми продуктами или контакт с детьми (требуется санация), в других случаях она не обязательна.
- Во влагалище – показатель активного роста патогенной микрофлоры.
- В моче характерен для мочекаменной болезни и цистита в стадии ремиссии.
- В ране – указывает на начавшийся инфекционный процесс.
10 в 5
- На коже – угревая сыпь, фурункулёз, может наблюдаться у здоровых людей.
- Носоглотка – хронические респираторные патологии, простуда с риском осложнений.
- Кал – носительство или активно протекающая инфекция.
- Во влагалище — бактериальный вагинит.
- Моча – острый цистит.
10 в 6
- На коже – верхняя граница нормальных значений, может встречаться при угревой болезни разной степени выраженности.

- В носоглотке – при инфекционных болезнях.
- Другие среды – острый воспалительный процесс.
Заключение
Своевременное обнаружение возбудителя необходимо для лечения и профилактики различных проблем со здоровьем. В первую очередь это касается кожного покрова и слизистых оболочек, поскольку именно там чаще всего выявляется патогенная микрофлора. Бороться с ней можно антибиотиками и средствами, повышающими иммунитет (общий и местный). Также не следует забывать о личной гигиене, правильном питании и закаливании.
фото бактерии, обнаружили стафилококк в зеве
Стафилококк – это не заболевание, а вид микроорганизмов. Поскольку бактерии данного вида являются условно-патогенными, их негативное воздействие может не проявиться на протяжении всей жизни зараженного.
Но при определенных обстоятельствах стафилококк в горле взрослого человека может привести к таким осложнениям, при которых понадобится хирургическое вмешательство.
Содержание статьи
Стафилококк: что это
Современные микробиологи выделяют более двадцати видов стафилококка. Это небольшие микроорганизмы, встречающиеся как среди людей, так и среди животных.
Фактически это условно-патогенные бактерии, которые часто относят к обычной микрофлоре человеческого организма.
Многие виды этих микроорганизмов могут обитать на кожном и слизистом покрове человека, никогда не вызывая развития заболеваний.
Однако условная патогенность заключается в том, что при стечении определенных обстоятельств стафилококк, находящийся в зеве у взрослого, может начать активную деятельность, что в итоге приведет к развитию осложнений и болезней.
Наиболее выделяется в этом плане золотистый стафилококк. Большинство стафилококковых инфекций провоцируются именно этим видом микроорганизмов.
Слизистая носоглотки и влагалища – наиболее распространенная среда обитания данной бактерии.
ВНИМАНИЕ! Необходимо обратить внимание на различие понятий стафилококк и стафилококковая инфекция. Первое – микроорганизм, второе – воспалительные процессы, провоцируемые данным микроорганизмом.
По своей форме стафилококк – шарообразная бактерия, размерами от 0,5 до 1,5 мкм.
Данные микроорганизмы очень хорошо переносят как высокие температуры, так и высушивание. Кроме того, они устойчивы к воздействию медицинского спирта.
Условно-патогенные бактерии не приносят вреда человеку, с нормальным уровнем иммунитета. Осложнения начинаются только при общем ослаблении иммунной системы.
По статистическим данным, переносчиком стафилококка является едва ли не каждый пятый житель планеты. Причем наиболее распространенная форма – так называемое носительство.
Хотя зараженный человек не знает о наличии бактерии, он активно распространяет ее среди всех, с кем контактирует.
Таким образом, причиной проявления стафилококковой инфекции являются микроорганизмы, относящиеся к стафилококкам.
Непосредственное развитие заболевания — следствие наличия данных бактерий в организме человека и ухудшения его иммунитета (из-за заболевания, приема антибиотиков и воздействия прочих подобных факторов).
Заражение
Как уже было сказано ранее, носитель бактерии может заразить ею здорового человека. Заражение может произойти разными путями.
Бактерии стафилококка могут появиться в горле человека из-за контакта со следующими источниками заражения:
- Предметы быта. Микроорганизм попадает на кожу человека, а с нее в ротовую полость. Несоблюдение основных правил гигиены увеличивает риск заражения.
- Воздух. Кашляя, чихая, дыша во время разговора, зараженное лицо «выдыхает» в воздух бактерии. Здоровый человек, дыша данным воздухом, вдыхает вместе с ним ранее выделенные микроорганизмы.
- Пыль. Как уже было сказано ранее, стафилококки очень выносливы.
 Часто они содержатся в частицах пыли. Вдыхая их, человек заражается.
Часто они содержатся в частицах пыли. Вдыхая их, человек заражается. - Продукты питания. Из-за неправильной обработки продуктов питания, недостаточной чистоты посуды и столовых приборов, бактерии могут попасть в организм во время употребления пищи. Грудное вскармливание от зараженной матери – еще один фактор риска.
- Медицинские приборы. Если медицинский персонал после осмотра пациента недостаточно обрабатывает приборы, при помощи которых потом обследуется другой пациент, последний может заразиться стафилококком.
Стоит учесть тот факт, что условно-патогенные микроорганизмы могут стать патогенными при снижении иммунитета и повреждениях носоглотки.
Стафилококк в зеве – что делать
То, что в ходе диагностики врачи обнаружили стафилококк в горле обследуемого, не является поводом к началу немедленной терапии. Значение имеет количество бактерий в горле.
По медицинским нормам, если количество микроорганизмов не превышает 104 единицы, лечение не требуется. В противном случае оно является обязательным.
Из-за активной деятельности золотистого стафилококка, самого агрессивного вида данных бактерий, может развиться:
- ангина;
- ларингит;
- фарингит.
Кроме того, возможно появление небольших язв и эрозий на горле.
В запущенных случаях наблюдается образование гнойных наложений и некрозов.
ВАЖНО! Пребывая в горле, стафилококк может попасть через него в другие органы, вызывая развитие заболеваний в них.
Основу лечения при обнаружении стафилококка составляет медикаментозная терапия. Если обнаружен стафилококк в зеве, сначала применяются антибиотики.
В силу сильной устойчивости микроорганизмов к таким препаратам, используются медикаменты нового поколения. Среди них:
- «Рифаксимин»;
- «Тетрациклин»;
- «Неомицин»;
- «Амоксиклав»;
- «Офлокацин».

Назначая конкретный препарат, специалист будет ориентироваться на результаты бактериологического посева и чувствительность обнаруженных бактерий к определенным веществам.
Если стафилококк в горле привел к появлению некрозов и гнойных воспалений, примеры которых можно увидеть на фото, может понадобиться хирургическое вмешательство.
Если по тем или иным причинам лечение антибиотиками проводить нельзя, применятся бактериофаги. Суть метода заключается во внедрении в организм носителя вируса, который уничтожит стафилококк.
Терапия обязательно сопровождается мерами для поднятия иммунитета. Поэтому больному назначают иммуностимуляторы и иммуномодуляторы.
ОСТОРОЖНО! В особенно сложных случаях может понадобиться переливание крови.
Заключение
Таким образом, волноваться стоит только в случае выхода количества бактерий в горле за норму. В других случаях эти условно-патогенные микроорганизмы не представляют опасности для человека.
Наиболее опасным для человеческого организма является золотистый стафилококк.
Если концентрация данных бактерий вышла за установленные нормы, понадобится медикаментозное лечение. В некоторых случаях может потребоваться хирургическое вмешательство.
Вконтакте
Google+
Одноклассники
Посев на золотистый стафилококк и чувствительность к антибиотикам
Исследуемый материал
Смотрите в описании
Существует три типа болезнетворных стафилококков: сапрофитный, эпидермальный, золотистый. Последний из них самый печально известный. Большинство медицинских проблем, связанных со стафилококком, подразумевают наличие именно золотистого стафилококка. Его воздействию подвержены все: взрослые, старики, дети.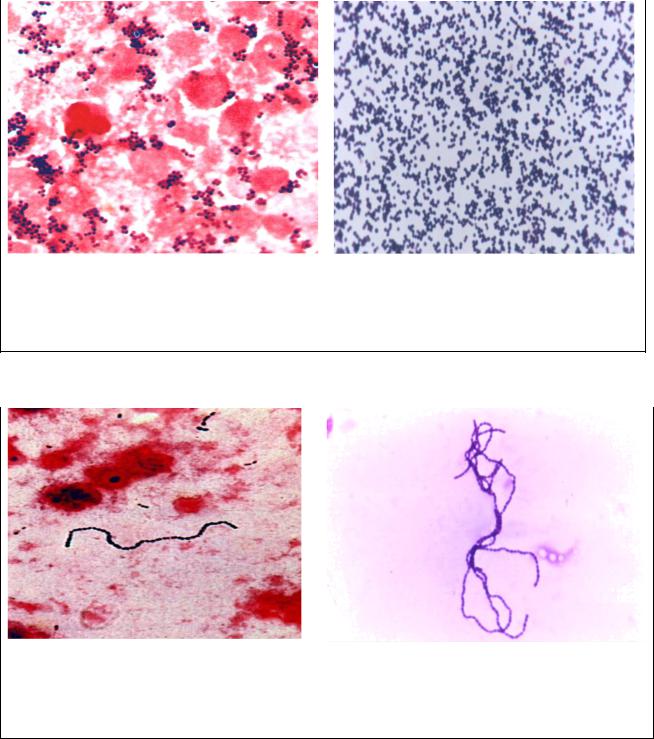 Он проникает в каждый орган человека, где вызывает воспаление. Не менее ста серьезных человеческих болезней напрямую связаны с золотистым стафилококком.
Он проникает в каждый орган человека, где вызывает воспаление. Не менее ста серьезных человеческих болезней напрямую связаны с золотистым стафилококком.
Микроб чрезвычайно устойчив во внешней среде. Многие бактерии обладают такой устойчивостью, но при неблагоприятных факторах они погибают, оставляя споры. При этом, золотистый стафилококк живет под прямыми солнечными лучами 12 часов, выдерживает температуру 150 С более 10 минут, не погибает в этиловом спирте, выживает в растворе натрия хлорида и перекись водорода ему не страшна.
Инкубационный период процесса в зависимости от нахождения очага инфекции может длиться несколько часов или несколько дней.
Противостоять такому «агрессору» может система местного и общего иммунитета человека. Выявление стафилококка при бак посеве без реальных симптомов болезни не является поводом для немедленного лечения.
Как выявить инфицированность стафилококком
Инфицированность стафилококком выявляется путем микробиологического исследования, которое также позволяет определять его чувствительность к антибиотикам.
Биоматериал для исследования
Чтобы сдать анализ на стафилококк, необходимо предоставить биоматериал, для исследования берут:
- разовую порцию мочи,
- мокроту,
- посев из носа,
- мазок с конъюнктивиты,
- мазок из зева,
- отделяемое уха,
- мазок урогенитальный,
- соскоб раны,
- вагинальный мазок.
Проводится также анализ грудного молока.
Симптомы стафилококка
Стафилококк проявляет себя разнообразно, от очагов на коже до болезни нервной системы. У детей он чаще проявляется высыпаниями, воспалением в кишечнике. Особую опасность представляет выявление микроба у новорожденных. Все чаще педиатры устанавливают дисбактериоз кишечника у грудничков. Назначив анализ на золотистый стафилококк, врач обнаруживает в кале у грудничка данный микроб.
- Стафилококк в горле является причиной ангин.

- Микроб в носу часто обнаруживается при беременности, однако, только при больших концентрациях назначают лечение.
- Если посев на стафилококк выявляет его присутствие в мазке без признаков вагинита, то это является нормой. Но его большое количество наряду с повышением лейкоцитов, требует лечения.
- Стафилококк в сперме — частое явление в урологии, это может означать, что он есть в соседних железах или в простате. Чтобы в этом убедиться делают посев на золотистый стафилококк.
Быстро и безопасно сдать анализ крови на стафилококк вы всегда можете в лаборатории ИНВИТРО, где проводят бактериологические исследования и других биоматериалов. Наши специалисты деликатно возьмут анализ, как у взрослых, так и у ребенка. При этом стоимость исследований вполне доступна.
Стафилококк в вашем доме: откуда берутся опасные штаммы
Микробиологи изучили пути распространения опасных штаммов золотистого стафилококка. Выяснилось, что шаровидная бактерия может задержаться в доме из-за безобидного отбеливателя или любимого питомца. Исследование на эту тему опубликовано в журнале Applied and Environmental Microbiology.
Золотистый стафилококк – шаровидная бактерия, которая вызывает сепсис (заражение крови), пневмонию и другие тяжелые инфекции. Стафилококк может существовать в состоянии покоя на коже, слизистых человека. Носитель даже не будет догадываться о присутствии в своем организме этой опасной бактерии. Но стоит только попасть стафилококку в другую среду, например, в ранку, начинаются серьезные проблемы.
Самым опасным считается золотистый стафилококк MRSA (methicillin-resistant Staphylococcus aureus). Его штамм весьма устойчив ко многим лекарствам. Именно MRSA является частой причиной внутрибольничных инфекций. Присутствие его в медицинском учреждении можно объяснить низким иммунитетом пациентов, там микроорганизмы могут передавать друг другу гены устойчивости ко многим лекарствам. Бороться с такой инфекцией крайне тяжело.
Бороться с такой инфекцией крайне тяжело.
Оказывается, золотистый стафилококк часто свирепствует и в домашних условиях. Причиной, которая поддерживает жизнь этой бактерии, может быть наличие домашнего питомца. При этом, если в доме есть мыши, тараканы, тогда, наоборот, вероятность появления устойчивых штаммов снижается.
Кроме того, использование обеззараживающих чистящих средств (например, отбеливателей) также помогает золотистому стафилококку повышать устойчивость ко многим лекарствам. Такие штаммы могут заново появляться в доме, провоцируя новые вспышки инфекций.
Еще одним главным пунктом выработки «иммунитета» у MRSA является прием антибиотиков. Речь идет о лечении мупироцином инфекций кожи и носовых проходов.
Стоит отметить живучесть опасных штаммов. Так, в древней гробнице американские ученые нашли стафилококк. Инфекцию обнаружили в скелете женщины, похороненной в древнем городе Троя более 800 лет назад.
Сдаем анализы на стафилококк: как подготовиться к исследованию
Стафилококки относятся к группе условно-патогенных бактерий. Это микроорганизмы, которые присутствуют на коже и слизистых оболочках и на общем благоприятном фоне не оказывают негативного воздействия на организм — до тех пор, пока в порядке иммунитет. Как только происходит сбой, бактерии начинают атаковать. Чтобы выявить конкретный штамм стафилококка, ставший причиной воспалительного процесса, и его чувствительность к антибиотикам, важно знать, какие именно анализы вам потребуется сдать.
В первую очередь стафилококковой атаке подвергаются пациенты с хроническими заболеваниями, пожилые люди, дети, беременные и кормящие женщины. Следствием становится целый «букет» проблем: от лор-заболеваний до поражений костей, суставов, оболочек сердца, мозга и общего заражения крови. Однако в силах человека — предупредить развитие патологии, обратить внимание на тревожные симптомы и обратиться к врачу за назначением лабораторной диагностики и последующего лечения. Рассмотрим подробнее, как происходит диагностика, как правильно сдавать анализ на стафилококк и где это можно сделать.
Однако в силах человека — предупредить развитие патологии, обратить внимание на тревожные симптомы и обратиться к врачу за назначением лабораторной диагностики и последующего лечения. Рассмотрим подробнее, как происходит диагностика, как правильно сдавать анализ на стафилококк и где это можно сделать.
Врач назначил анализ на стафилококк: почему?
Стафилококки — это малоподвижные округлые бактерии, внешне напоминающие виноградные грозди. Их обнаружили еще 150 лет назад. Французский биолог Луи Пастер доказал взаимосвязь стафилококка и гнойного воспаления. Современным микробиологам известно около 20-ти типов бактерий этой группы, большинство из которых не наносят вреда здоровью. Существуют штаммы, опасные только для животных. Есть те, которые вызывают патологические реакции и у животных, и у человека. Наиболее часто гнойно-воспалительные процессы провоцируют S.aureus, S.saprophiticus и S.epidermidis . При ослаблении защитных сил организма они вызывают заболевания, общую совокупность которых называют стафилококковой инфекцией. Возникает она и в случаях, когда бактерии попадают в те органы, где их быть не должно.
Стафилококки обладают биохимической активностью. Они вырабатывают токсины, которые оказывают сильное воздействие на системы органов и тканей. Сложность профилактики и лечения обусловлена высокой устойчивостью бактерии к антибиотикам и факторам внешней среды. Микроорганизмы не боятся солнечных лучей, активно размножаются на воздухе, живут в воде и пищевых продуктах, полгода способны храниться в замороженном или высушенном состоянии, не погибают под воздействием спирта, хлорида натрия, перекиси водорода.
Путей заражения стафилококком несколько. Основные из них:
- Контактный. Факторы передачи — одежда, предметы обихода и гигиены, постельное белье, домашняя пыль, перевязочные материалы.
- Воздушно-капельный. Распространение происходит через воздух. Возможный фактор передачи — при вдыхании кондиционированного воздуха или воздуха, прошедшего по системе вентиляции.

- Пищевой. Стафилококк активно размножается в несвежих продуктах: молоке, кефире, консервах, сладостях и т.д.
- Парентеральный — через биологические жидкости: кровь, слюну, слезную жидкость, грудное молоко.
Это интересно
Ученые-микробиологи из университета Манчестера обнаружили бактерии стафилококка даже на мобильном телефоне. Объясняется это тем, что во время разговора на корпус попадают частички слюны, происходит частый контакт с руками. Кроме того, телефон постоянно находится в тепле, а во время использования дополнительно нагревается. Это усиливает размножение бактерий.
Человек часто не подозревает о наличии у него стафилококка и невольно становится разносчиком. Особенно это опасно, если по долгу службы ему приходится работать с большими группами людей. Речь идет о таких профессиях, как школьные учителя, продавцы, раздатчики готовых блюд в общепите, медицинские работники. Последние, впрочем, регулярно проходят обследование. Для остальных факт носительства может оставаться неизвестным на протяжении многих лет. Врачи условно выделяют группы лиц, которые в большей степени подвержены воздействию стафилококка. Среди них онкобольные, пациенты с диабетом, дети и пожилые люди, больные с открытыми ранами, травмами и ожогами, кормящие матери, военнослужащие, заключенные, работники образовательных и лечебных учреждений.
На заметку
Золотистый стафилококк по праву завоевал славу «больничной» инфекции. Объясняется это массовым поражением пациентов в стационарах вопреки всем методам профилактики, которые предпринимает персонал. Особенно опасно это в родильных домах, для некоторых из них становится выходом строительство новых зданий.
Симптомы, которые указывают на инфекцию, крайне разнообразны, сразу обнаружить истинную причину проблемы удается далеко не всегда. Между тем развивается она стремительно, переходя из одной стадии в другую. Стафилококковой инфекции в целом присущи симптомы интоксикации:
- подъем температуры тела;
- снижение аппетита;
- сонливость;
- слабость.

Болезнь имеет и местные проявления в зависимости от того, в какой части организма локализован процесс.
- кожа : гнойнички, фурункулы, абсцессы, воспаление пупка у новорожденных;
- кости и суставы : покраснения кожи, боли в руках и ногах при движении и надавливании;
- дыхательные пути : налет на миндалинах, боль в горле, насморк, сухой кашель, покраснение;
- оболочки сердца : резкий подъем температуры, шумы;
- ЖКТ : боли в животе, вздутие, жидкий стул, тошнота, рвота.
- мочеполовая система : частое и болезненное мочеиспускание, боль в спине.
Именно стафилококк в 95% случаев становится причиной остеомиелита — воспаления костного мозга с разрушением костных слоев. Если поражение переходит на суставы, возникает артрит. При попадании стафилококка к сердцу разрушается сердечный клапан, что влечет за собой закупорку периферических артерий, абсцесс миокарда, сердечную недостаточность. При поражении стафилококком головного мозга развивается абсцесс (образование гнойной полости), возникает менингит. Бактерии в дыхательной системе провоцируют воспаление легких и плевры. Существует понятие стафилококкового сепсиса — это состояние, для которого характерно поражение всех органов и систем. Оно требует неотложной помощи и несет прямую угрозу жизни. Все эти осложнения плохо поддаются терапии, часто оставляют последствия на всю жизнь или приводят к инвалидности.
Клиническая картина стафилококковой инфекции обширна. Симптомы часто схожи с признаками других заболеваний, не связанных с бактериальным заражением. Тем не менее в совокупности проявлений грамотный специалист способен заподозрить стафилококк, диагностировать наличие которого можно лишь лабораторно. Отсюда — важность своевременного и качественного анализа на стафилококк. Часто анализ является обязательным перед госпитализацией больного в стационар либо при наличии в больнице инфекции.
Выписать направление может терапевт, педиатр, врач общей практики, инфекционист или лор. В результате исследования определяют тип бактерии и степень устойчивости к антимикробным препаратам.
В результате исследования определяют тип бактерии и степень устойчивости к антимикробным препаратам.
Какие анализы на выявление инфекции могут быть назначены
В числе известных медицине видов стафилококка чаще всего речь идет о трех из них:
- Золотистый стафилококк . Он вызывает инфекции у взрослых и детей практически в любом органе и участке тела, затрагивает слизистые оболочки, кожу и даже нервную ткань.
- Эпидермальный стафилококк. Наиболее опасен для людей с ослабленным иммунитетом, для больных с онкологией и ВИЧ, а также для недоношенных детей.
- Сапрофитный стафилококк. Провоцирует заболевания мочеполовой системы, встречается, как правило, у женщин.
В каждой группе несколько разновидностей. В зависимости от штамма, бактерии поражают те или иные органы. Решение о том, какие анализы на стафилококк сдавать пациенту, принимает только квалифицированный специалист, ориентируясь на жалобы и общую картину заболевания. Для диагностики в лаборатории проводят микробиологическое исследование биоматериала. Для анализа берут кровь, кал, мочу, мокроту, грудное молоко, жидкости из раны или уха и различные виды мазков: ректальный, урогенитальный, из носоглотки и полости рта. У каждой процедуры — свои особенности проведения, которые напрямую влияют на результаты. Для того чтобы исследование оказалось достоверным, к сдаче анализов на стафилококк необходимо подготовиться.
Готовимся к процедуре
Анализ на золотистый и другие виды стафилококка проводят до начала антибактериальной терапии. Если она назначена по другому поводу, пациенту следует отказаться от приема антибиотиков (после консультации с врачом), чтобы не допустить ложноотрицательного результата исследования на стафилококк. За 48 часов, также по согласованию, прекращают прием мочегонных препаратов. В числе других рекомендаций:
- за 12 часов до исследования мокроты выпить максимально возможное количество воды, чтобы мокрота легко отхаркивалась и не была вязкой;
- не ходить в туалет за 3–4 часа до анализа мочи или урогенитального мазка;
- женщинам — не сдавать анализ мочи и урогенитальный мазок во время менструации и 2 дня до/после;
- при анализе кала — за 3 дня прекратить использование ректальных свечей, слабительных препаратов и средств, влияющих на перистальтику кишечника и окраску каловых масс.
 К числу таких препаратов относят пилокарпин, белладонну, сернокислый барий, висмут, железо.
К числу таких препаратов относят пилокарпин, белладонну, сернокислый барий, висмут, железо.
Помимо подготовительных мероприятий, крайне важен правильный забор материала для анализа. Необходимо использовать специальные контейнеры, пробирки, тампоны и другие атрибуты лабораторного исследования. В некоторых случаях пациенту предоставляют право собрать материал в домашних условиях, обращая внимание на необходимость точного следования инструкции.
Как берут биоматериал для анализа на стафилококк
Самостоятельно собранный биоматериал у пациентов принимают, когда речь идет об анализе кала на стафилококк, исследованиях мочи и грудного молока. Общее правило: для сбора используют стерильную тару (пластиковый одноразовый контейнер с винтовой крышкой), которую доставляют в лабораторию максимально быстро. Современные медицинские центры при подготовке к исследованию выдают пациентам подробную инструкцию, как правильно собрать материал.
Требования к сбору кала для анализа на стафилококк:
- каловые массы должны быть естественными, не допускается применение слабительных препаратов;
- собирать кал на чистую поверхность (лист бумаги или полиэтилен). Не рекомендован сбор из унитаза;
- судно промыть с мылом под проточной водой, ошпарить кипятком и высушить;
- для забора использовать специальную ложечку. Контейнер достаточно наполнить на 1/3.
Требования к сбору грудного молока:
- перед сцеживанием вымыть руки с мылом. Область сосков обработать 70%-ным спиртом. Для каждой железы — отдельный тампон;
- первые 5–10 мл сцедить в отдельную посуду — они не подходят для анализа. Дальше сцеживают молоко в контейнер, не касаясь стенок руками или грудью;
- молоко из разных желез поместить в разные контейнеры.
Требования к сбору мочи:
- наружные половые органы следует предварительно ополоснуть водой. Женщинам — использовать 4 ватных шарика, смоченных в мыльном растворе, каждым проводя только один раз.

- первую струю мочи для анализа не использовать. В процессе сбора не прикасаться контейнером к телу. Емкость следует наполнять до середины.
Прочие виды анализов проводят непосредственно в лаборатории. Для определения стафилококка часто исследуют ротовую полость и носоглотку. Анализ из зева на стафилококк проводят при помощи мазка. Его берут натощак или через 3 часа после еды. Язык аккуратно прижимают шпателем, стерильным тампоном проводят между дужками миндалин по язычку и задней стенке глотки, не затрагивая губы и щеки. Затем тампон погружают в транспортную среду и отправляют в лабораторию. Аналогичны действия врача и при заборе материала для анализа из носа на стафилококк. Тампон вводят в носовой ход на глубину 2–3 см на уровне носовой раковины, прижимают к перегородке и несколько раз вращают.
Перед мазком не следует предварительно промывать рот или носоглотку. Если на слизистых оболочках имеются гнойники и язвенные образования, материал берут с области на стыке зараженной и здоровой ткани, поскольку там концентрируется наибольшее количество бактерий. Далее в лабораторных условиях производят посев. Частичку слизи переносят на подготовленную среду, в которой микробы быстро размножаются и образуют колонии. Это позволяет врачам определить разновидность бактерий, а также установить чувствительность к антибактериальным препаратам, что является решающим фактором при назначении лечения.
Читаем бланк результатов исследования
Бактериологический посев занимает в среднем 7 дней. В результатах анализов представлены данные о наличии или отсутствии роста бактерий. Отрицательный результат говорит об отсутствии стафилококковой инфекции. Положительный — о ее наличии или бессимптомном носительстве. В норме золотистого стафилококка ( S. aureus ) у человека быть не должно. Сапрофитный и эпидермальный могут присутствовать до определенных отметок. К примеру, количество бактерий при анализе кала на стафилококк у детей не должно превышать 10 4 степени КОЕ/г.
Стафилококковую инфекцию излечивают с помощью антибиотиков. Какие именно вещества окажутся эффективны, также показывает исследование. В результатах теста представлен список антимикробных препаратов, которые используются для лечения бактериальных инфекций. В их числе бензилпенициллин, оксациллин, цефокситин, амоксициллин, цефазолин, цефуроксим и многие другие. Напротив каждого лаборант ставит отметку «R» или «S» . Первая означает устойчивость к антибиотику, вторая — чувствительность. Из тех препаратов, к которым бактерия чувствительна, и будет состоять лечение.
Итоговый диагноз пациенту ставят на основании общей картины заболевания, совокупности симптомов и положительного анализа на стафилококк. Недооценивать важность своевременной диагностики нельзя. Инфекция способна быстро распространяться, создавая необратимые проблемы для здоровья. Кроме того, с каждым годом растет число штаммов, имеющих устойчивость к препаратам, которые еще недавно использовали для лечения, поэтому при каждом новом симптоме анализы необходимо сдавать заново.
мазков из горла необходимы для надежного определения носителей золотистого стафилококка | Клинические инфекционные болезни
Аннотация
Передние ноздри являются наиболее важным местом для скрининга колонизации Staphylococcus aureus. Мы проверили 2966 человек на наличие носительства S. aureus с помощью мазков из ноздрей и глотки. Всего 37,1% людей были носителями носа, а 12,8% — носителями только горла. Скрининг мазков из зева значительно увеличивает чувствительность выявления носителей на 25.7%.
Передние ноздри считаются первичным местом колонизации Staphylococcus aureus [1,2–3]. Примерно 30% здорового населения носят S. aureus в передних ноздрях [4, 5]. Носительство S. aureus в носу, по-видимому, играет ключевую роль в эпидемиологии и патогенезе инфекции и связано с повышенным риском инфекционных осложнений после операции у пациентов с терминальной почечной недостаточностью и у пациентов с внутрисосудистыми устройствами [ 1, 6].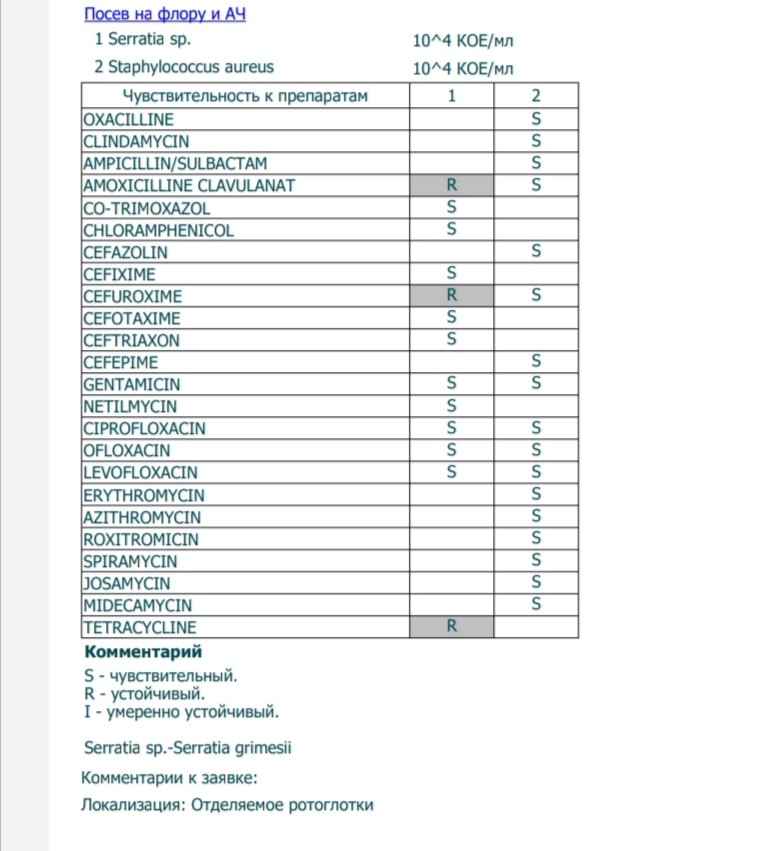 Примерно 80% инвазивных внутрибольничных инфекций имеют эндогенное происхождение у носителей носа [7, 8].
Примерно 80% инвазивных внутрибольничных инфекций имеют эндогенное происхождение у носителей носа [7, 8].
Появление метициллин-резистентного S. aureus (MRSA) в больницах и в обществе привело к появлению множества программ скрининга для выявления носителей S. aureus , в частности, MRSA. Раннее выявление носителей — важный шаг в программах профилактики MRSA; это особенно верно для стратегий «поиск и уничтожение», которые рекомендуются в Нидерландах [9].В настоящее время в Соединенных Штатах обсуждается вопрос об обследовании всех поступающих в больницу.
Большинство программ скрининга S. aureus , которые включают MRSA, требуют получения мазка только из передних носовых ходов; мазок из горла еще не считается стандартом. Дополнительный результат культивирования горла считается незначительным, поскольку он добавляет дискомфорта для пациента и увеличивает стоимость системы здравоохранения без значительного увеличения чувствительности.Это убеждение основано на наблюдении, что горловые носители S. aureus , вероятно, также несут S. aureus в ноздрях. Однако колонизация глотки, но не ноздрей, может быть более распространенной, чем это считается в настоящее время.
В публикациях 1940-х годов сообщалось о степени колонизации горла от 4 до 63% [3]. Недавнее исследование подтвердило наблюдение, что горло может быть селективно колонизировано и избежать текущих рутинных программ скрининга [10].
Нераспознанные носители могут распространять MRSA и делать программы борьбы с инфекциями бесполезными.Поэтому мы поставили под сомнение практику скрининга только передних носовых ходов и оценили дополнительные преимущества скрининга как ноздрей, так и глотки в 4 различных исследуемых популяциях.
Пациенты и методы. Мы собрали данные от 4 разных групп людей. В первую группу вошли пациенты и медицинские работники, которые были обследованы после контакта с носителем MRSA в течение 2000–2005 годов. С 1997 года эта процедура является частью политики больницы по предотвращению распространения MRSA.Вторая группа состояла из медицинских работников, которые участвовали в торговой ярмарке медицинского и больничного оборудования (конференция Internationale Fachmesse für Arzt- und Spitalbedorf в выставочном центре в Цюрихе, Швейцария) 26–29 октября 2004 г. и которые вызвались участвовать в ней. исследование распространенности носителей S. aureus среди населения Швейцарии. Третья группа включала здоровых доноров крови, которые были проверены на S. aureus в 2005 году. Группа 4 состоит из большой выборки культур из носа и горла, которые были объединены в лаборатории; отдельные результаты недоступны.Эта группа состоит из пациентов и медицинских работников, как и в группе 1.
С 1997 года эта процедура является частью политики больницы по предотвращению распространения MRSA.Вторая группа состояла из медицинских работников, которые участвовали в торговой ярмарке медицинского и больничного оборудования (конференция Internationale Fachmesse für Arzt- und Spitalbedorf в выставочном центре в Цюрихе, Швейцария) 26–29 октября 2004 г. и которые вызвались участвовать в ней. исследование распространенности носителей S. aureus среди населения Швейцарии. Третья группа включала здоровых доноров крови, которые были проверены на S. aureus в 2005 году. Группа 4 состоит из большой выборки культур из носа и горла, которые были объединены в лаборатории; отдельные результаты недоступны.Эта группа состоит из пациентов и медицинских работников, как и в группе 1.
носителей MRSA были проанализированы отдельно, чтобы избежать любой потенциальной систематической ошибки, поскольку неизвестно, имеет ли MRSA тот же паттерн колонизации, что и чувствительный к метициллину S. ). Скрининг проводился медсестрами инфекционного контроля или врачами после соответствующей подготовки. Исследование было одобрено комитетом по человеческим предметам Базельского университета (Швейцария).
Образцы были получены с помощью стерильного тампона с наконечником из полиэфирного волокна, смоченного стерильным физиологическим раствором; образцы были взяты из передних носовых ходов (5 оборотов в каждой передней ноздре) и из задней стенки глотки с помощью второго тампона.Мазки отправляли в лабораторию в транспортной пробирке (M40 Transystem; Copan) и обрабатывали в течение 24 часов. Для культивирования инокулировали селективный обогащающий бульон (бульон для инфузии сердца мозга с 6% NaCl). После инкубации при 35 ° C в течение ночи бульон пересевали как на хромогенный агар для S. aureus (Chromagar Staph. Aureus; Hy Laboratories), так и на колумбийский агар с 5% овечьей крови (Becton Dickinson). Планшеты были прочитаны через 24 и 48 часов, и колонии, предположительно содержащие S. aureus были дополнительно проанализированы. S. aureus был идентифицирован на основе различных признаков, таких как типичный рост на хромогенной среде и / или кровяном агаре и обнаружение фактора слипания, протеина А и капсульных антигенов (Pastorex Staph-Plus; Bio-Rad). Изоляты S. aureus были протестированы на устойчивость к оксациллину с использованием оксациллинового диска, агаровой чашки для скрининга оксациллина или, совсем недавно, диска цефокситина, в соответствии с руководящими принципами, выпущенными Институтом клинических и лабораторных стандартов (ранее NCCLS).Если результаты были неоднозначными или предполагалось наличие MRSA, проводились дополнительные тесты, а именно: наличие ауреазы определялось с помощью Rapidec staph (bioMérieux), MRSA-Screen (Denka Seiken) использовался для обнаружения пенициллин-связывающего белка 2a и ПЦР использовали для обнаружения генов mecA и femA ; Кроме того, была проведена комплексная антибиотикограмма в соответствии с рекомендациями Института клинических и лабораторных стандартов.
aureus были дополнительно проанализированы. S. aureus был идентифицирован на основе различных признаков, таких как типичный рост на хромогенной среде и / или кровяном агаре и обнаружение фактора слипания, протеина А и капсульных антигенов (Pastorex Staph-Plus; Bio-Rad). Изоляты S. aureus были протестированы на устойчивость к оксациллину с использованием оксациллинового диска, агаровой чашки для скрининга оксациллина или, совсем недавно, диска цефокситина, в соответствии с руководящими принципами, выпущенными Институтом клинических и лабораторных стандартов (ранее NCCLS).Если результаты были неоднозначными или предполагалось наличие MRSA, проводились дополнительные тесты, а именно: наличие ауреазы определялось с помощью Rapidec staph (bioMérieux), MRSA-Screen (Denka Seiken) использовался для обнаружения пенициллин-связывающего белка 2a и ПЦР использовали для обнаружения генов mecA и femA ; Кроме того, была проведена комплексная антибиотикограмма в соответствии с рекомендациями Института клинических и лабораторных стандартов.
Результаты. Всего в наше исследование был включен 5041 человек.Три группы (группы 1–3), которые включали в общей сложности 2966 человек, были проверены на носительство S. aureus с отдельными результатами носительства в носу и глотке. Четвертая группа (группа 4) состояла из 2075 человек, для которых данные мазков из носа и горла были объединены в лаборатории. Средний возраст составлял 50 × 21 год, и 50,4% испытуемых составляли женщины. В группах 1–3 всего 1480 человек (49,9%) дали положительный результат на S. aureus (таблица 1). Всего 37,1% исследуемой популяции (в группах 1-3) имели носительство S.aureus с положительными результатами посева из горла или без них. В общей сложности 380 человек (12,8% исследуемой популяции и 25,7% носителей S. aureus ) были колонизированы только в горле. Таким образом, скрининг горла значительно повысил чувствительность на 25,7%. Передние ноздри были местом, наиболее часто заселенным S. aureus , за исключением группы доноров крови; Среди доноров крови мазки из горла выявляли на S. aureus на чаще, чем культуры мазков из ноздрей.Частота носительства S. aureus в группе 4 (т. Е. Группе объединенных результатов) составила 52,1%, что аналогично тому, которое наблюдалось при комбинированных результатах для культур мазков из носа и глотки в группах 1-3.
Передние ноздри были местом, наиболее часто заселенным S. aureus , за исключением группы доноров крови; Среди доноров крови мазки из горла выявляли на S. aureus на чаще, чем культуры мазков из ноздрей.Частота носительства S. aureus в группе 4 (т. Е. Группе объединенных результатов) составила 52,1%, что аналогично тому, которое наблюдалось при комбинированных результатах для культур мазков из носа и глотки в группах 1-3.
Таблица 1
Скорость выделения Staphylococcus aureus из передних носовых ходов и глотки.
Таблица 1
Скорость выделения Staphylococcus aureus из передних ноздрей и глотки.
Анализ подгруппы был проведен для 37 субъектов с носительством MRSA (0.74% всех обследованных лиц). У 23 носителей MRSA были доступны отдельные результаты для посева образцов мазков из горла и носа. Дополнительный выход культур из горла был сопоставим с результатами, описанными для MSSA: 5 из 23 (22% всех носителей MRSA против 25,7% всех носителей MSSA).
Обсуждение. Насколько нам известно, это крупнейшее исследование, в котором оценивалась важность горла в носительстве S. aureus . Дополнительные посевы мазков из носа увеличили выход с 37% (посев только мазков из носа) до почти 50% (посевы мазков из носа и горла вместе), что повысило чувствительность на 25.7%. Результаты для группы 4 (объединенная группа образцов) — отдельные культуры образцов мазков из ноздрей и глотки не проводились — подтвердили результаты для групп 1-3 с распространенностью носительства S. aureus на 49,9% и 52,1%. , соответственно. Таким образом, объединение результатов посева мазков из ноздрей и глотки может быть подходящим методом для оптимизации выхода S. aureus — положительный результат при сохранении затрат на дополнительные посевы.
Сегодня скрининг S. aureus в основном проводится для выявления носителей MRSA.Неопознанные носители горла могут распространять MRSA, что частично объясняет, почему многие схемы деколонизации подвержены неудачам. Горло носительство даже спровоцировало крупную вспышку инфекции MRSA, которая была прослежена до медицинского работника, у которого была колония исключительно в горле. Обычный назальный скрининг не смог выявить этого носителя [11]. Скрининг избранных пациентов или всех пациентов, направленный на борьбу с инфекцией MRSA, проводится во многих больницах, но в большинстве учреждений скрининг сосредоточен на ноздрях [9].Тем не менее, образцы мазка из зева регулярно собираются в Нидерландах на протяжении десятилетий в рамках успешной политики поиска и уничтожения, которая изложена в их национальных руководствах (http://www.wip.nl).
Горло носительство даже спровоцировало крупную вспышку инфекции MRSA, которая была прослежена до медицинского работника, у которого была колония исключительно в горле. Обычный назальный скрининг не смог выявить этого носителя [11]. Скрининг избранных пациентов или всех пациентов, направленный на борьбу с инфекцией MRSA, проводится во многих больницах, но в большинстве учреждений скрининг сосредоточен на ноздрях [9].Тем не менее, образцы мазка из зева регулярно собираются в Нидерландах на протяжении десятилетий в рамках успешной политики поиска и уничтожения, которая изложена в их национальных руководствах (http://www.wip.nl).
Наши данные подтверждают результаты предыдущих исследований, согласно которым передние ноздри являются единственным наиболее заселенным сайтом S. aureus. Только у доноров крови частота носительства была выше в горле, чем в ноздрях (группа 3). Это открытие может быть связано с тем, что только 1 обученный и высокомотивированный исследователь получил все эти образцы мазков.Нетренированным исследователям может быть трудно провести скрининг задней стенки глотки, избегая при этом дискомфорта пациента. С другой стороны, горло носительство действительно может быть более распространенным среди здоровых людей, чем среди людей, которые находятся в контакте с системой здравоохранения, но такая гипотеза требует подтверждения другими исследователями в различных группах населения, не связанных с медицинским обслуживанием.
В целом распространенность носительства составляла ~ 50%, что выше, чем показатель, сообщаемый в большинстве других исследований (25–35%) [5].Это несоответствие можно объяснить несколькими факторами. Во-первых, в других исследованиях горловое носительство не принималось во внимание. Фактически, частота носительства через нос (за исключением данных из горла) была сопоставимой и составила 37,1%. Во-вторых, обогащающий бульон мог дополнительно повысить чувствительность культуры [12]. В-третьих, только специально обученные медицинские работники получали образцы мазков, поэтому образцы были взяты из задней стенки глотки, а не изо рта.
Добавление посевов из зева к посеву мазков из передних носовых ходов значительно увеличило чувствительность скрининга на 25.7%. В целом, 37,1% субъектов имели носительство S. aureus в носу, но 12,8% пациентов носили только горло, и эти субъекты избежали традиционных методов скрининга. Следовательно, любой скрининг на S. aureus — в частности, скрининг на MRSA — должен включать как посев образцов мазков из передних носовых ходов, так и из глотки. Объединение образцов может снизить дополнительные расходы, связанные со скринингом горла, при сохранении чувствительности.
Благодарности
Финансовая поддержка. Швейцарский национальный научный фонд (3200BO-104179).
Возможный конфликт интересов. Через год после завершения исследования A.T. принял должность в F. Hoffmann – La Roche. Все остальные авторы: конфликтов нет.
Список литературы
1,,.
Носительство золотистого стафилококка : эпидемиология, лежащие в основе механизмы, сопутствующие риски
,
Clin Microbiol Rev
,
1997
, vol.
10
(стр.
505
—
20
) 2.
Staphylococcus aureus инфекций
,
N Engl J Med
,
1998
, vol.
339
(стр.
520
—
32
) 3.
Здоровое носительство Staphylococcus aureus : значение его распространенности
,
Bacteriol Rev
,
1963
, vol.
27
(стр.
56
—
71
) 4« и др.
Носительство Staphylococcus aureus среди потребителей инъекционных наркотиков: более низкая распространенность в программе поддерживающей терапии героином путем инъекций, чем в программе приема перорального метадона
,
Infect Control Hosp Epidemiol
,
2004
, vol.
25
(стр.
133
—
7
) 5« и др.
Роль носительства в Staphylococcus aureus инфекциях
,
Lancet Infect Dis
,
2005
, vol.
5
(стр.
751
—
62
) 6,.
Значение носительства золотистого стафилококка частота послеоперационной раневой инфекции
,
J Hosp Infect
,
1995
, vol.
31
(стр.
13
—
24
) 7,,,,.
Носовое носительство как источник Staphylococcus aureus бактериемии. Study Group
,
N Engl J Med
,
2001
, vol.
344
(стр.
11
—
6
) 8« и др.
Риск исхода нозокомиальной Staphylococcus aureus бактериемии у носителей через нос по сравнению с не-носителями
,
Lancet
,
2004
, vol.
364
(стр.
703
—
5
) 9« и др.
Низкая распространенность метициллин-резистентного Staphylococcus aureus (MRSA) при госпитализации в Нидерландах: ценность поиска разрушает ограничительное использование антибиотиков
,
J Hosp Infect
,
2004
, vol.
56
(стр.
321
—
5
) 10,.
Staphylococcus aureus Колонизация глотки встречается чаще, чем колонизация в передних ноздрях
,
J Clin Microbiol
,
2006
, vol.
44
(стр.
3334
—
9
) 11« и др.
Вспышка метициллин-устойчивого Staphylococcus , инициированная пищевыми продуктами, проанализирована методом феногенотипирования
,
J Clin Microbiol
,
1995
, vol.
33
(стр.
1121
—
8
) 12,,,.
Сравнение методов скрининга культур для выявления носительства метициллин-устойчивого Staphylococcus aureus : проспективное исследование, сравнивающее 32 метода
,
J Clin Microbiol
,
2003
, vol.
41
(стр.
3163
—
6
)
© 2007 Американского общества инфекционистов
Эксклюзивное горло носительства золотистого стафилококка: группы риска | Инфекционные болезни | JAMA Internal Medicine
Фон
Примерно 25% носителей Staphylococcus aureus имеют исключительное горло носительство. Мы стремились выявить группы риска для носительства исключительно через горло, чтобы повысить чувствительность к выявлению носителей.
Мы стремились выявить группы риска для носительства исключительно через горло, чтобы повысить чувствительность к выявлению носителей.
Методы
Четыре группы прошли скрининг носа и горла на S aureus . Были обследованы три группы людей в сообществе (n = 2632) с различными предполагаемыми уровнями воздействия системы здравоохранения (HCS), включая 1500 здоровых доноров крови, 498 пациентов из школы стоматологической медицины и 634 медицинских работника ( Медработники) на торговой ярмарке.В четвертую группу вошли госпитализированные пациенты и медработники (n = 832), которые считались группой с наибольшим предполагаемым воздействием на них. В качестве основного результата мы проанализировали факторы риска носительства исключительно через горло у носителей исключительно через горло по сравнению со всеми носителями носа через нос.
Результаты
Из 3464 человек, прошедших скрининг, 428 (12,4%) имели носительство исключительно в глотке, а 1260 (36,4%) имели носительство только в ноздрях или в ноздрях и глотке. Самым важным независимым фактором риска носительства исключительно горла был возраст 30 лет и младше (отношение шансов, 1.66; P <0,001). Воздействие HCS было значительным защитным фактором для исключительного носительства в горле (отношение шансов 0,67; P = 0,001). У здоровых доноров крови почти в два раза больше шансов иметь носительство исключительно через горло, чем у госпитализированных пациентов и медицинских работников (30,2% против 18,4% всех носителей, P <0,001).
Выводы
Отсутствие контакта с HCS и более молодой возраст предсказывали исключительных носителей горла, популяции с высоким риском развития резистентности к метициллину в сообществе S aureus .Скрининг на S aureus должен включать мазки из передних отделов ноздрей и из глотки, чтобы повысить вероятность выявления носителей.
S Taphylococcus aureus — наиболее распространенный нозокомиальный патоген, составляющий примерно 20% всех нозокомиальных патогенов. 1 Носители подвергаются более высокому риску развития стафилококковых инфекций после инвазивных медицинских или хирургических процедур, чем лица, не являющиеся носителями 2 , и в 2–9 раз чаще страдают инфекциями в области хирургического вмешательства. 3 Аналогичным образом, носители носителей S aureus , не являющиеся хирургическими, имеют значительно более высокий риск развития внутрибольничной бактериемии S aureus , 4 , которая в 80% случаев вызывается тем же штаммом, что и в их ноздрях. 5 Экологическая ниша S aureus — это передние ноздри, и от 25% до 30% взрослого населения в данный момент колонизируются. 6 Лечение носителей носа снижает риск внутрибольничной инфекции S aureus . 7 Таким образом, было разработано несколько подходов для выявления носителей и лечения стадии носительства до развития инфекции.
1 Носители подвергаются более высокому риску развития стафилококковых инфекций после инвазивных медицинских или хирургических процедур, чем лица, не являющиеся носителями 2 , и в 2–9 раз чаще страдают инфекциями в области хирургического вмешательства. 3 Аналогичным образом, носители носителей S aureus , не являющиеся хирургическими, имеют значительно более высокий риск развития внутрибольничной бактериемии S aureus , 4 , которая в 80% случаев вызывается тем же штаммом, что и в их ноздрях. 5 Экологическая ниша S aureus — это передние ноздри, и от 25% до 30% взрослого населения в данный момент колонизируются. 6 Лечение носителей носа снижает риск внутрибольничной инфекции S aureus . 7 Таким образом, было разработано несколько подходов для выявления носителей и лечения стадии носительства до развития инфекции.
Появление метициллин-резистентного S aureus (MRSA) 8 повысило важность скрининга, чтобы избежать последующего заражения и эпидемического распространения MRSA. В последнее время распространение MRSA (CO-MRSA) 9 , вызываемого сообществами, усилило потребность в точном скрининге S aureus . Фактически, MRSA более распространен, чем чувствительный к метициллину S aureus (MSSA) среди инфекций кожи и мягких тканей, вызванных S aureus в отделениях неотложной помощи США, 10 , и быстрое увеличение колонизации MRSA наблюдалось в период с 2001 года. и 2004. 11
Центры по контролю и профилактике заболеваний недавно рекомендовали рутинный скрининг поступающих в районы высокого риска, 12 , и общий скрининг всех госпитализированных пациентов обсуждается в Соединенных Штатах. При скрининге основное внимание уделяется MRSA, а не S aureus . Однако принципы скрининга S aureus практически идентичны при поиске MSSA или MRSA. 13
Скрининг ограничен ноздрями в большинстве учреждений, и дополнительный скрининг глотки считается ненужным, поскольку передние ноздри признаны первичным местом колонизации S aureus .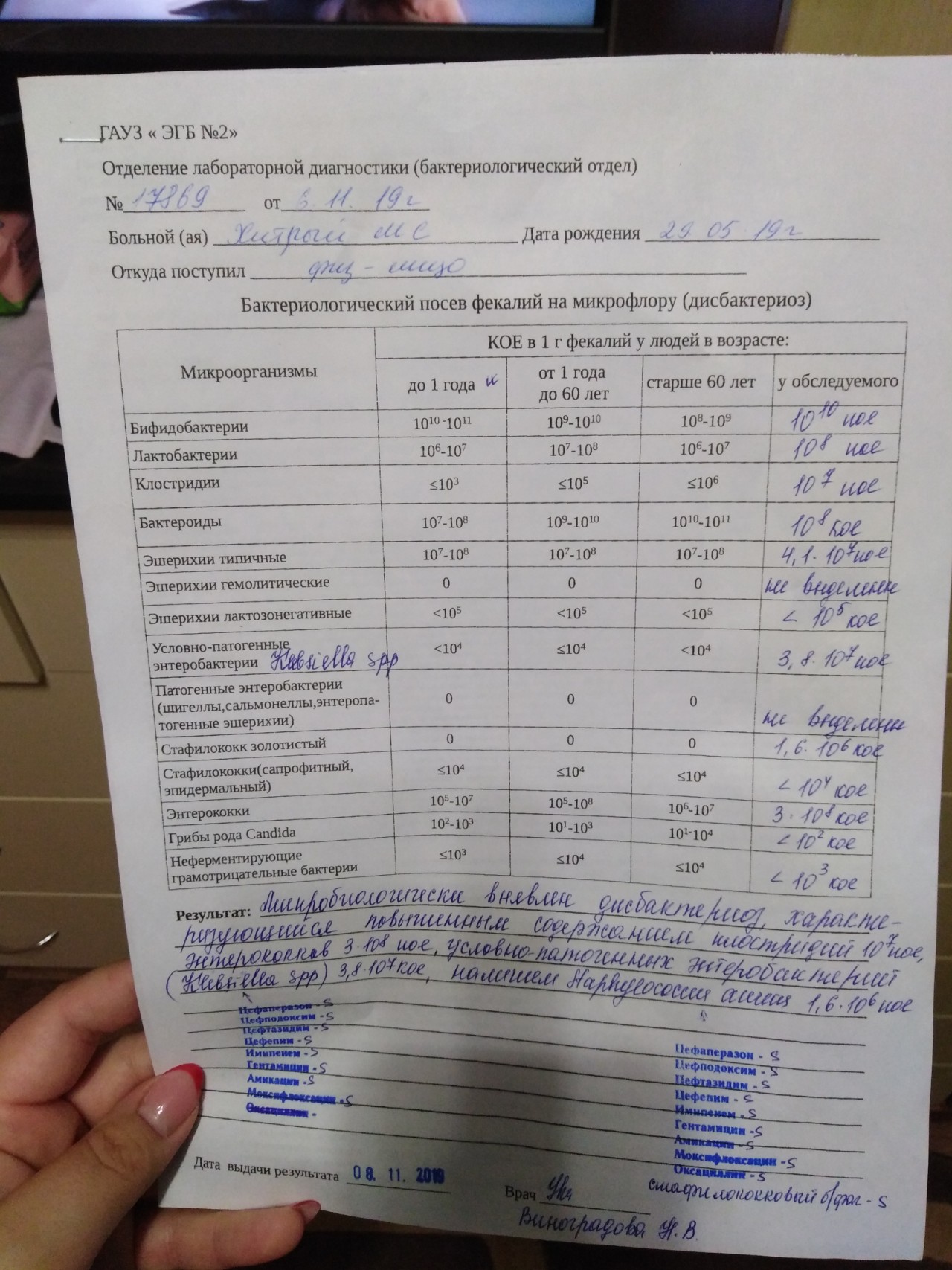 3 Предыдущие исследования показали, что частота горлового носительства S aureus колеблется от 4% до 64%. 14 Исследования 15 -17 показали, что индивидуумы могут иметь колонизацию исключительно в горле, которые могут быть пропущены при скрининге, ограниченном передними ноздрями. В двух исследованиях (, 15, , , 16, ) результат мазков из зева был выше, чем мазков из носа. Недавно наша группа подтвердила важность дополнительных мазков из зева. 18 Анализ (состоящий из части набора данных настоящего исследования) продемонстрировал, что уровень колонизации S aureus составляет 37,1% в передних ноздрях с дополнительным выходом 12,8% из мазков из глотки. Недавние исследования 13 , 15 подтвердили эти результаты для MRSA.
3 Предыдущие исследования показали, что частота горлового носительства S aureus колеблется от 4% до 64%. 14 Исследования 15 -17 показали, что индивидуумы могут иметь колонизацию исключительно в горле, которые могут быть пропущены при скрининге, ограниченном передними ноздрями. В двух исследованиях (, 15, , , 16, ) результат мазков из зева был выше, чем мазков из носа. Недавно наша группа подтвердила важность дополнительных мазков из зева. 18 Анализ (состоящий из части набора данных настоящего исследования) продемонстрировал, что уровень колонизации S aureus составляет 37,1% в передних ноздрях с дополнительным выходом 12,8% из мазков из глотки. Недавние исследования 13 , 15 подтвердили эти результаты для MRSA.
Однако рутинный скрининг горла в дополнение к передним ноздрям увеличивает трудозатраты и затраты на скрининговые лаборатории и вызывает дискомфорт для пациента.Таким образом, мы стремились выявить группы риска для носительства исключительно через горло, которые могут быть пропущены при обычном назальном скрининге. Это позволит проводить целевые программы скрининга и повысить рентабельность.
Мы собрали данные от 4 групп людей с различным предполагаемым воздействием системы здравоохранения (HCS) (Таблица 1). Насколько нам известно, четкой и подтвержденной количественной оценки воздействия HCS не существует. Таким образом, медицинское воздействие определялось как лечение пациента в стационаре или амбулаторно в течение последних 12 месяцев или регулярный контакт медицинского работника (медсестер, терапевтов, физиотерапевтов и профессиональных терапевтов) с пациентами.
Группа 1 (n = 1500) состояла из здоровых доноров крови, прошедших скрининг на S aureus в течение 2005 года. Доноры крови в Швейцарии не получают финансовой компенсации за свою сдачу крови, проходят интенсивное лабораторное обследование (включая рутинное тестирование на гепатит B и гепатит C, а также для вируса иммунодефицита человека) и предоставлять подробную информацию о состоянии здоровья перед каждой сдачей крови. 2-ю группу (n = 498) составили пациенты стоматологической школы, прошедшие обследование в 2006 г.Группа 3 (n = 634) состояла из медработников на национальной выставке больничного оборудования (Internationale Fachmesse für Arzt und Spitalbedorf; 26-29 октября 2004 г .; Цюрих, Швейцария), которые добровольно приняли участие в исследовании распространенности S aureus перевозка. В группу 4 (n = 832) вошли госпитализированные пациенты и медработники, прошедшие обследование после контакта с пациентами с MRSA (2000–2005 гг.). С 1997 года рутинный скрининг на MRSA является частью нашей больничной политики по предотвращению распространения MRSA. Двадцать три носителя MRSA (0.66% всех участников исследования) были исключены из дальнейшего анализа, чтобы избежать возможной систематической ошибки. За исключением группы 4, все участники исследования (в присутствии исследователя [Н.П. или М.З.]) заполнили и подписали анкету о возможных факторах риска носительства MRSA. Скрининг проводился медсестрами инфекционного контроля или врачами после соответствующей подготовки.
2-ю группу (n = 498) составили пациенты стоматологической школы, прошедшие обследование в 2006 г.Группа 3 (n = 634) состояла из медработников на национальной выставке больничного оборудования (Internationale Fachmesse für Arzt und Spitalbedorf; 26-29 октября 2004 г .; Цюрих, Швейцария), которые добровольно приняли участие в исследовании распространенности S aureus перевозка. В группу 4 (n = 832) вошли госпитализированные пациенты и медработники, прошедшие обследование после контакта с пациентами с MRSA (2000–2005 гг.). С 1997 года рутинный скрининг на MRSA является частью нашей больничной политики по предотвращению распространения MRSA. Двадцать три носителя MRSA (0.66% всех участников исследования) были исключены из дальнейшего анализа, чтобы избежать возможной систематической ошибки. За исключением группы 4, все участники исследования (в присутствии исследователя [Н.П. или М.З.]) заполнили и подписали анкету о возможных факторах риска носительства MRSA. Скрининг проводился медсестрами инфекционного контроля или врачами после соответствующей подготовки.
Для первичного анализа эксклюзивные носители через горло сравнивали со всеми носителями через нос (исключительно носителями через нос и комбинированными носителями [т. Е. Индивидуумами с колонизацией как передних носовых ходов, так и горла]).Во вторичном анализе эксклюзивные носители горла сравнивались с эксклюзивными носителями носа и с не носителями, чтобы дополнительно охарактеризовать эксклюзивных носителей горла.
Методы скрининга подробно описаны в другом месте. 18 Короче говоря, мазки получали из передних носовых ходов и из задней стенки глотки и культивировали в бульоне селективного обогащения (бульон для инфузии мозга и сердца с 6% хлоридом натрия). После инкубации при 35 ° C в течение ночи бульон пересевали на хромогенный агар для S aureus (Chromagar S aureus ; Hy Laboratories, Реховот, Израиль) и на колумбийский агар с 5% овечьей крови.Идентификация S aureus была основана на типичном росте в хромогенной среде или кровяном агаре, а также на обнаружении фактора слипания, протеина А и капсульных антигенов (Pastorex Staph-Plus; Bio-Rad, Марн-ла-Кокетт, Франция. ). Согласно руководящим принципам Института клинических и лабораторных стандартов, 19 изолятов S aureus были протестированы на устойчивость к оксациллину с использованием оксациллинового диска или скринингового агарового планшета или, в последнее время, диска цефокситина. Для получения сомнительных результатов или MRSA были проведены дополнительные тесты на наличие ауреазы (Rapidec Staph; bioMérieux, Marcy l «Etoile, Франция), для обнаружения пенициллин-связывающего белка 2a (MRSA-Screen; Denka Seiken, Токио, Япония), и для полимеразной цепной реакции генов mecA и femA .
). Согласно руководящим принципам Института клинических и лабораторных стандартов, 19 изолятов S aureus были протестированы на устойчивость к оксациллину с использованием оксациллинового диска или скринингового агарового планшета или, в последнее время, диска цефокситина. Для получения сомнительных результатов или MRSA были проведены дополнительные тесты на наличие ауреазы (Rapidec Staph; bioMérieux, Marcy l «Etoile, Франция), для обнаружения пенициллин-связывающего белка 2a (MRSA-Screen; Denka Seiken, Токио, Япония), и для полимеразной цепной реакции генов mecA и femA .
Результаты были проанализированы с использованием коммерчески доступного статистического программного обеспечения (SPSS 14.0; SPSS Inc, Чикаго, Иллинойс). Для проверки одномерной статистической значимости использовались критерий χ 2 для категориальных данных и критерий Манна-Уитни для некатегориальных данных. Для многомерного анализа все переменные вводились в модель логистической регрессии без пошагового исключения. χ 2 Тест на тенденцию был использован для анализа носительства исключительно в горле в отношении расчетного уровня воздействия HCS на группу.Таким образом, 4 группы были сгруппированы в соответствии с предполагаемым воздействием HCS, и была выбрана нулевая гипотеза о том, что нет разницы в распространенности исключительно глоточного носительства среди всех носителей. P <0,05 (двусторонний) считался статистически значимым.
Исследование было одобрено Этическим комитетом Базельского университета, Базель, Швейцария. Письменное информированное согласие было получено от всех лиц, которые не были госпитализированы.
В целом, 1688 человек (48,7%) были идентифицированы как носителей S aureus в обследованной популяции из 3464 человек (Таблица 1). В общей сложности 428 человек (12,4% обследованной популяции) имели исключительно глоточное носительство, 719 (20,8%) имели колонизацию в обоих местах, а 541 (15,6%) имели исключительно носительство через нос. Для первичного анализа исключительные носители через горло сравнивались со всеми носителями через нос (исключительно носителями через нос и комбинированными носителями [т. Е. Индивидуумами с колонизацией как в передних ноздрях, так и в глотке]).
Для первичного анализа исключительные носители через горло сравнивались со всеми носителями через нос (исключительно носителями через нос и комбинированными носителями [т. Е. Индивидуумами с колонизацией как в передних ноздрях, так и в глотке]).
Лица, не контактировавшие с HCS, с большей вероятностью имели исключительно глоточное носительство (Таблица 2). Как показано на Рисунке 1, предполагаемое отсутствие воздействия HCS среди различных групп достоверно коррелировало с процентной долей носительства эксклюзивного S aureus в глотке среди всех носителей ( P <0,001). Самый низкий дополнительный выход мазков из зева для выявления носителей S aureus был обнаружен в группе 4 (18,4% от носителей S aureus ).Самый высокий дополнительный выход был обнаружен в группе 1 (30,2% носителей S aureus ). Группа 3 меньше подвергалась воздействию HCS, чем группа 4; только 515 из 634 членов группы (81,2%) работали медсестрами, терапевтами, физиотерапевтами или эрготерапевтами с регулярным контактом с пациентами.
Однофакторный и многофакторный анализы выявили возраст 30 лет и младше как фактор риска носительства исключительно через горло по сравнению со всеми носителями через нос (Таблица 2). У лиц 30 лет и младше колонизация чаще происходила в горле, чем в ноздрях (рис. 2).У людей старше 30 лет наблюдалось значительное уменьшение колонизации горла, в то время как носовая колонизация оставалась стабильной до шестого десятилетия жизни. Все показатели колонизации (носительство, носительство в горле и носительство в целом) значительно зависели от возраста ( P <0,001).
Все люди в группах с 1 по 3 заполнили анкету, и их предполагаемый контакт с HCS (будь то стационарные, амбулаторные или медработники) был подробно проанализирован.В этом анализе только статус медработника был значимым независимым защитным фактором для исключительного носительства в горле (таблица 3). Подобно пожилым людям, пациенты с хроническими кожными заболеваниями и женщины реже имели исключительную колонизацию в горле, а у одиноких людей чаще было исключительно горловое носительство.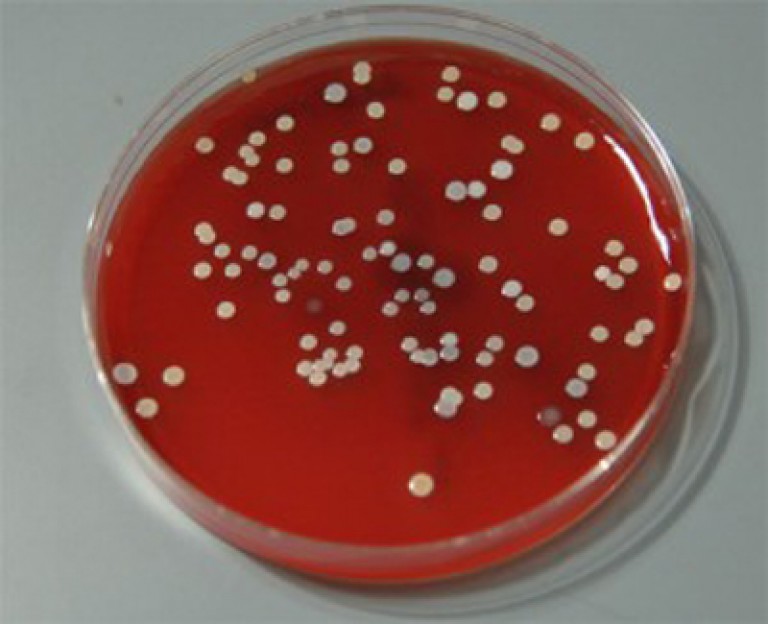
Чтобы дополнительно охарактеризовать 428 исключительно носителей горла (12,4% исследуемой популяции), их сравнивали с 541 носителями исключительно через нос (15.6%), которые вместе составили 969 человек (28,0% исследуемой популяции). Были подтверждены те же факторы риска, что и в первичном анализе, при этом возраст 30 лет или младше был значимым независимым фактором риска во всех группах для носительства исключительно через горло (отношение шансов [OR], 2,54; 95% доверительный интервал [CI], 1,80- 3,60; P <0,001). Воздействие HCS снова оказалось независимым защитным фактором (OR, 0,61; 95% ДИ, 0,46-0,79; P <0,001). Дополнительный анализ, сравнивающий исключительно носителей горла с не носителями, подтвердил те же факторы риска.Многофакторный анализ показал, что возраст 30 лет и младше был значимым независимым фактором риска носительства исключительно через горло (OR 2,73; 95% ДИ 2,09–3,56; P <0,001), а воздействие HCS оказалось отрицательным. защитный фактор для исключительной горловой перевозки (0,58; 0,47-0,72; P <0,001).
Выявление носителей S aureus — ключевой компонент программы инфекционного контроля, позволяющий проводить лечение до развития инфекции.Кроме того, быстрая идентификация носителей MRSA позволяет принять соответствующие меры контроля для предотвращения распространения. 20 Простейшим подходом было бы обследование всех пациентов на различных участках тела, но такая политика будет дорогостоящей и не поддерживается рекомендациями общества (Общество эпидемиологии здравоохранения Америки и Ассоциация специалистов по инфекционному контролю и эпидемиологии, Inc.) . 21 Однако целевой скрининг зависит от выбора пациентов с риском носительства 22 и от выбора участка тела для обследования.Несомненно, у госпитализированных пациентов наиболее часто колонизируются передние ноздри. 3 Однако скрининг передних носовых ходов не выявил носительства S aureus у 12,4% обследованной популяции, состоящей в основном из молодых здоровых людей.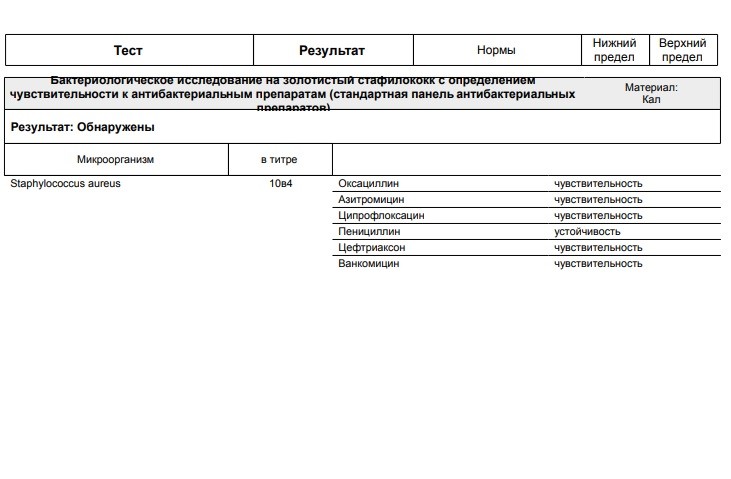
Важность дополнительных мазков из зева была снова подтверждена в настоящем исследовании группой 2, которая служила внешним контролем для предыдущих групп исследования. 18 Подобно 3 группам, изученным ранее, мы обнаружили дополнительный выход в 9 раз.8% при скрининге горла (23,6% всех носителей носили исключительно горло). Учитывая все 4 группы, 12,4% исследуемой популяции или 25,4% из носителей S aureus имели исключительно глоточное носительство и не могли быть идентифицированы при скрининге, ограниченном передними ноздрями.
Было обнаружено, что предполагаемый уровень воздействия HCS независимо предсказывает частоту исключительно носительства в глотке: 18,4% носителей S aureus имели исключительное носительство в глотке в группах 4 и 30.2% в группе 1. Таким образом, дополнительный скрининг горла наиболее важен в обществе, в то время как носовой скрининг значительно более надежен в условиях больницы, особенно в отделении интенсивной терапии. 23 Низкая частота носительства в больницах в целом может быть связана с использованием противомикробных препаратов в этих условиях. Можно предположить, что воздействие противомикробных агентов приводит к деколонизации и снижает общий уровень колонизации. С другой стороны, самый высокий уровень комбинированного носительства в глотке и передних носовых ходах был обнаружен в группе 4 с самым высоким воздействием HCS, что может быть объяснено гипотезой о том, что воздействие антимикробных агентов в первую очередь приводит к деколонизации среди людей. с низкой нагрузкой носительства S aureus , но не среди тех, у кого есть колонизация как в глотке, так и в передних ноздрях.Пациенты с заболеваниями, связанными с более высокой распространенностью носительства, например, те, кто проходит диализ, или медработники, тесно контактирующие с носителями S aureus , могут иметь более частые состояния комбинированного носительства из-за большего воздействия S aureus . Кроме того, вероятно, что существует более высокая вероятность обнаружения прерывистых носителей в условиях больницы, чем в сообществе. 3 Однако скрининг как ноздрей, так и глотки повышает чувствительность даже в этой популяции с наименьшим риском носительства исключительно в глотке.Вывод о том, что частота носительства исключительно через горло выше у лиц, живущих в одиночестве, также можно объяснить предполагаемым воздействием S aureus : воздействие в домашнем хозяйстве, вероятно, ниже среди лиц, живущих в одиночестве, что контрастирует с обстановкой в больнице.
Кроме того, вероятно, что существует более высокая вероятность обнаружения прерывистых носителей в условиях больницы, чем в сообществе. 3 Однако скрининг как ноздрей, так и глотки повышает чувствительность даже в этой популяции с наименьшим риском носительства исключительно в глотке.Вывод о том, что частота носительства исключительно через горло выше у лиц, живущих в одиночестве, также можно объяснить предполагаемым воздействием S aureus : воздействие в домашнем хозяйстве, вероятно, ниже среди лиц, живущих в одиночестве, что контрастирует с обстановкой в больнице.
Вторым независимым фактором, влияющим на характер осанки, является возраст. Уменьшение колонизации S aureus в ноздрях с возрастом хорошо известно и недавно было подтверждено. 24 Результаты нашего исследования аналогичны. Общий уровень колонизации носительства, носительства и носительства в целом снизился с возрастом до 75 лет, с дополнительным увеличением только в последние десятилетия жизни. Тем не менее, частота носительства через нос (28–41%) на протяжении многих лет была более стабильной, чем частота носительства через горло (20–50%). Мы пришли к выводу, что колонизация S aureus уменьшается с возрастом, что недооценивалось в прошлом, поскольку основное внимание уделялось мазкам только из передних ноздрей, поскольку этот эффект более выражен в глотке.
Возрастной фактор и меньшее значение носительства через горло в условиях больницы являются возможными причинами неиспользования мазков из горла для скрининга S aureus , поскольку большинство анализов проводится среди типичного больничного населения (например, медработников, пациентов и пожилых людей). ). Очевидно, что модель колонизации отличается в сообществах с меньшим воздействием HCS и среди молодых здоровых взрослых. Молодые здоровые люди подвергаются наибольшему риску носительства исключительно через горло, среди которых обычно наблюдается CO-MRSA. 10 Быстрое распространение CO-MRSA даже в странах с низкой распространенностью MRSA среди больниц может быть связано с предвзятостью выявления носителей в обществе.
Растущее признание важности идентификации носителей S aureus , особенно MRSA, стимулирует поиск новых методов обнаружения, основанных на молекулярном, а не на традиционном скрининге. 25 Эти методы кажутся экономически эффективными для скрининга MRSA, учитывая высокую стоимость ненужной изоляции. 26 Однако даже самые изощренные методы, дающие результаты за считанные минуты, не работают, если не проверять соответствующие участки тела. Можно предположить, что скрининг горла для повышения чувствительности может быть эпидемиологически более важным, чем получение быстрого результата с более низкой чувствительностью. Неизвестные носители являются установленными источниками вспышек, особенно CO-MRSA. Горловое носительство спровоцировало крупную вспышку MRSA, которая была прослежена до единственного медицинского работника с колонизацией в горле; Обычный назальный скрининг не смог выявить этого носителя. 27
Как недавно было показано, 18 расходы на дополнительный скрининг горла можно минимизировать путем объединения культур без значительного снижения чувствительности. В отличие от наших данных, словенская группа показала 14% ложноотрицательных результатов среди объединенных культур MRSA, что они не рекомендовали. 28 В этом исследовании использовался другой метод с объединением до 5 мазков в культуру. С каждым последующим объединением мазка бульон становился более разбавленным, что, скорее всего, снижало чувствительность объединения.В нашем исследовании только 2 мазка были объединены в бульон без дополнительного разведения, что может объяснить высокий выход S aureus в наших объединенных культурах. Если необходимо быстрое обнаружение, можно провести полимеразную цепную реакцию с использованием мазков как из ноздрей, так и из глотки, что может значительно сократить время до уведомления, 25 подход, заслуживающий дальнейших клинических испытаний. Однако почти все исследования с использованием методов, основанных на полимеразной цепной реакции, были сосредоточены только на мазках из ноздрей, вероятно, при отсутствии 25% носителей. Неспособность идентифицировать носительство в горле может объяснить низкий успех усилий по деколонизации MRSA, поскольку носительство в горле искоренить труднее, чем на любом другом участке тела. 29
Неспособность идентифицировать носительство в горле может объяснить низкий успех усилий по деколонизации MRSA, поскольку носительство в горле искоренить труднее, чем на любом другом участке тела. 29
Следует упомянуть несколько ограничений этого исследования. Во-первых, в литературе нет доказательств того, что существует большая разница в предпочтительных участках тела между MSSA и MRSA, 15 , но необнаруженные различия все же могут присутствовать. Кроме того, не было обнаружено значительных различий в моделях колонизации среди исследуемых популяций. 13 , 18 Тем не менее, результаты требуют подтверждения в исследованиях среди других групп населения, особенно в районах с высокой распространенностью MRSA. Распространенность MRSA среди населения, прошедшего скрининг для настоящего исследования, была низкой — 0,66% (23 из 3464). Результаты не отличаются, если эти люди включены в анализ. Они были исключены, чтобы избежать возможной предвзятости. Последовательный скрининг 1051 пациента с января 2008 года в отделении неотложной помощи нашей больницы подтвердил распространенность менее 0.1% пациентов с MRSA при поступлении (данные не представлены).
Второе ограничение исследования связано с разными исследователями, выполняющими мазки. Самый высокий выход положительных мазков из горла был обнаружен в группе 1, здоровых доноров крови. В этой группе все мазки брал один высокомотивированный и квалифицированный медицинский работник. Тем не менее, другие люди прошли аналогичную подготовку, и все лица, взявшие мазки, были хорошо обученными медработниками. Сравнительные испытания с различиями в методиках отсутствуют.Кроме того, на протяжении всего исследования использовался один и тот же тип мазка, и четкая корреляция между уровнем воздействия HCS и типом колонизации свидетельствует о фактической разнице, не объясненной различиями в выборке.
Третье ограничение касается предполагаемого воздействия HCS на основе определения 4 групп. Насколько нам известно, четких критериев для измерения уровня воздействия HCS опубликовано не было. Тем не менее, группа 1 представляет здоровое население, а группа 4 — население внутри HCS.Различия между группами не анализировались в многомерной модели из-за значительной корреляции между переменной воздействия медицинской помощи и предполагаемым уровнем воздействия в 4 группах. Следовательно, мы не можем исключить возможную предвзятость при оценке этих 4 групп, потому что другие факторы (недоступные для анализа) могли повлиять на характер носительства между группами.
Насколько нам известно, четких критериев для измерения уровня воздействия HCS опубликовано не было. Тем не менее, группа 1 представляет здоровое население, а группа 4 — население внутри HCS.Различия между группами не анализировались в многомерной модели из-за значительной корреляции между переменной воздействия медицинской помощи и предполагаемым уровнем воздействия в 4 группах. Следовательно, мы не можем исключить возможную предвзятость при оценке этих 4 групп, потому что другие факторы (недоступные для анализа) могли повлиять на характер носительства между группами.
Отсутствие контакта с HCS и более молодой возраст предсказывают исключительное горловое носительство.Популяция с такими характеристиками также подвержена высокому риску CO-MRSA. В этом случае скрининг на S aureus должен включать мазки как из передних носовых ходов, так и из глотки, чтобы повысить вероятность выявления носителей.
Адрес для корреспонденции: Андреас Ф. Видмер, доктор медицинских наук, Отделение инфекционных болезней и больничной эпидемиологии, Университетская больница Базеля, Петерсграбен 4, CH-4031 Базель, Швейцария ([email protected]).
Принята к публикации: 15 июня 2008 г.
Вклад авторов: Доктора Мерц и Видмер имели полный доступ ко всем данным в исследовании и несли ответственность за целостность данных и точность анализа данных. Концепция и дизайн исследования : Мертц и Видмер. Сбор данных : Фрей, Периат, Циммерли и Видмер. Анализ и интерпретация данных : Мертц, Баттегай, Флюкигер и Видмер. Составление рукописи : Мерц и Видмер. Критический пересмотр рукописи на предмет важного интеллектуального содержания : Мерц, Фрей, Периат, Циммерли, Баттегай и Флюкигер. Статистический анализ : Мертц и Видмер. Получено финансирование : Видмер. Административная, техническая и материальная поддержка : Мерц, Фрей, Периат, Циммерли и Видмер.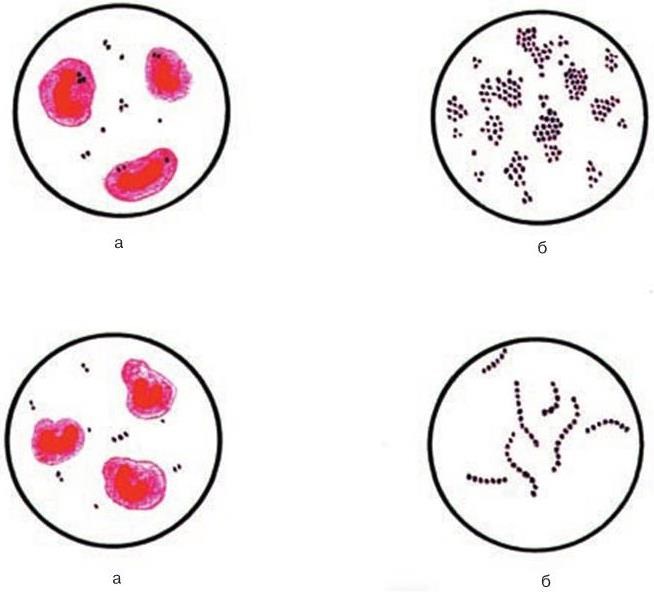 Научное руководство : Баттегай, Флюкигер и Видмер.
Научное руководство : Баттегай, Флюкигер и Видмер.
Раскрытие финансовой информации: Не сообщалось.
Финансирование / поддержка: Это исследование было частично поддержано грантом 3200BO-104179 Швейцарского национального научного фонда (д-р Видмер).
Предыдущая презентация: Это исследование было представлено в виде резюме на 47-й Международной конференции по антимикробным агентам и химиотерапии; 17 сентября 2007 г .; Чикаго, Иллинойс.
2. белый
A Повышенная частота инфицирования тяжелых носовых носителей 1 коагулаза-положительного стафилококка. Antimicrob Agents Chemother (Bethesda) 1963; 30667-670Google Scholar3.Kluytmans
Жван Белкум
AVerbrugh
H Назальное носительство Staphylococcus aureus : эпидемиология, основные механизмы и связанные риски. Clin Microbiol Rev 1997; 10
(3)
505-520PubMedGoogle Scholar4.Wertheim
HFVos
MCOtt
А
и другие. Риск и исход внутрибольничной бактериемии Staphylococcus aureus у носителей через нос по сравнению с лицами, не являющимися носителями. Ланцет 2004; 364
(9435)
703-705PubMedGoogle ScholarCrossref 5. фон Эйфф
CBecker
КМачка
KStammer
HPeters
G Назальное носительство как источник бактериемии Staphylococcus aureus . N Engl J Med 2001; 344
(1)
11-16PubMedGoogle ScholarCrossref 6. Вертхайм
HFMelles
DCVos
MC
и другие. Роль носительства в инфекциях, вызванных Staphylococcus aureus, . Ланцет Infect Dis 2005; 5
(12)
751-762PubMedGoogle ScholarCrossref 7. van Rijen
MMBonten
MWenzel
Р.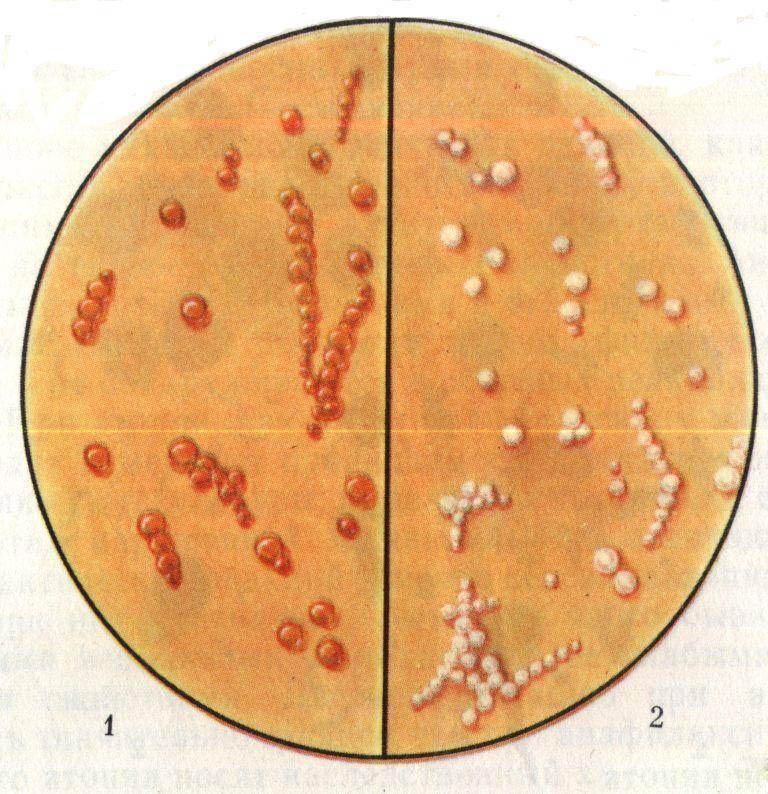 П.Клюйтманс
П.Клюйтманс
JA Интраназальный мупироцин для уменьшения инфекций Staphylococcus aureus у хирургических пациентов с носительством носа: систематический обзор. J Antimicrob Chemother 2008; 61
(2)
254-261PubMedGoogle ScholarCrossref 8.Barrett
FF McGehee
РФ
JrFinland
M Метициллин-устойчивый Staphylococcus aureus в Бостонской городской больнице: бактериологические и эпидемиологические наблюдения. N Engl J Med 1968; 279
(9)
441- 448PubMedGoogle ScholarCrossref 9.Weber
JT Метициллин-устойчивый, ассоциированный с населением Staphylococcus aureus. Clin Infect Dis 2005; 41
((добавление 4))
S269- S272PubMedGoogle ScholarCrossref 10.Моран
GJKrishnadasan
AGorwitz
RJ
и другие. EMERGEncy ID Net Study Group, Метициллин-устойчивые инфекции S. aureus среди пациентов в отделении неотложной помощи. N Engl J Med 2006; 355
(7)
666–674PubMedGoogle ScholarCrossref 11. Горвиц
Р. Дж. Крушон-Моран
Д. Макаллистер
SK
и другие. Изменения в распространенности колонизации носа Staphylococcus aureus в США, 2001-2004 гг. J Infect Dis 2008; 197
(9)
1226–1234PubMedGoogle ScholarCrossref 12.Сигель
JRhinehart
EJackson
Мчиарелло
L Управление микроорганизмами с множественной лекарственной устойчивостью в медицинских учреждениях . Атланта, Центры по контролю и профилактике заболеваний штата Джорджия, 2006 г .; http://www.cdc.gov/ncidod/dhqp/guidelines.html. По состоянию на 7 октября 2008 г. 14 Уильямс
RR Здоровое носительство Staphylococcus aureus : распространенность и значение. Bacteriol Rev 1963; 2756-71PubMedGoogle Scholar16. Nilsson
Nilsson
Припа
T Staphylococcus aureus Колонизация глотки встречается чаще, чем колонизация передних носовых ходов. J Clin Microbiol 2006; 44
(9)
3334-3339PubMedGoogle ScholarCrossref 17. Рингберг
H Катрин Петерссон
AWalder
MHugo Johansson
PJ Горло: важное место для колонизации MRSA. Scand J Infect Dis 2006; 38
(10)
888-893PubMedGoogle ScholarCrossref 18.Mertz
DFrei
RJaussi
B
и другие. Мазки из горла необходимы для надежного выявления носителей золотистого стафилококка . Clin Infect Dis 2007; 45
(4)
475-477PubMedGoogle ScholarCrossref 19.
Институт клинических лабораторных стандартов, Стандарты эффективности тестирования чувствительности к противомикробным препаратам . Уэйн, Институт стандартов клинических лабораторий Пенсильвании, 2005 год; документ M100-S15
20.
ABeaumont
JLPaule
SM
и другие. Универсальный эпиднадзор за метициллинорезистентным стафилококком Staphylococcus в 3 дочерних больницах. Ann Intern Med 2008; 148
(6)
409-418PubMedGoogle ScholarCrossref 21.Weber
SGHuang
SSOriola
S
и другие.Законодательные предписания для использования активных культур наблюдения для скрининга на метициллин-устойчивый Staphylococcus aureus и устойчивые к ванкомицину энтерококки: заявление о позиции для совместной рабочей группы SHEA и APIC. Am J Infect Control 2007; 35
(2)
73-85PubMedGoogle ScholarCrossref 23. Харбарт
SSchrenzel
JRenzi
GAkakpo
CRicou
B Необходим ли скрининг горла для выявления колонизации MRSA при поступлении? J Clin Microbiol 2007; 45
(3)
1072-1073PubMedGoogle ScholarCrossref 24.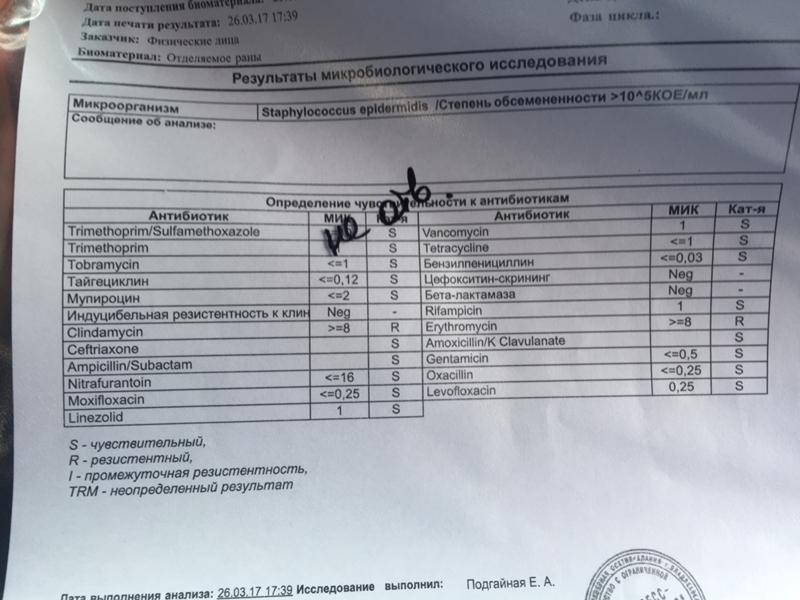 Kuehnert
Kuehnert
MJKruszon-Moran
DHill
HA
и другие. Распространенность носовой колонии Staphylococcus aureus в США, 2001-2002 гг. J Infect Dis 2006; 193
(2)
172-179PubMedGoogle ScholarCrossref 26. Верниц
MHKeck
SSwidsinski
SSchulz
SVeit
SK Анализ затрат на программу селективного скрининга метициллин-резистентных носителей Staphylococcus aureus (MRSA) в масштабах всей больницы в контексте оплаты групп, связанных с диагнозом (DRG). Clin Microbiol Infect 2005; 11
(6)
466-471PubMedGoogle ScholarCrossref 27.Kluytmans
Джван Левен
WGoessens
W
и другие. Вспышка метициллин-устойчивого Staphylococcus aureus , инициированная пищевыми продуктами, проанализирована с помощью фено- и генотипирования. J Clin Microbiol 1995; 33
(5)
1121- 1128PubMedGoogle Scholar28.Grmek-Kosnik
IIhan
ADermota
URems
МКосник
MJorn Kolmos
H Оценка отдельных и объединенных культур мазков, различных сред, обогащенного бульона и анатомических участков скрининга для выявления метициллин-резистентного Staphylococcus aureus в клинических образцах. J Hosp Infect 2005; 61
(2)
155–161PubMedGoogle ScholarCrossref 29.Buehlmann
MFrei
RFenner
LDangel
М.Флюкигер
Увидмер
A Высокоэффективный режим деколонизации метициллин-резистентных носителей Staphylococcus aureus (MRSA). Инфекционный контроль Hosp Epidemiol 2008; 29
(6)
510-516PubMedGoogle ScholarCrossref
Тонзиллэктомия при устойчивом носительстве MRSA в горле — описание трех случаев
Основные моменты
- •
В некоторых странах политика поиска и уничтожения является частью стандарта медицинской помощи.

- •
Ликвидация метициллин-устойчивого носительства Staphylococcus aureus (MRSA) преследует две цели: предотвращение инфекции и предотвращение передачи.
- •
Каретка MRSA может быть разделена на несложную и сложную, причем обе имеют свои собственные рекомендации по лечению.
- •
В меньшинстве случаев эрадикационная терапия не дает результатов, несмотря на повторное лечение в соответствии с рекомендациями, и горло носительство связано с неудачей лечения.
- •
Описаны три случая, когда тонзиллэктомия была выполнена после повторной неудачи лечения. Во всех случаях один курс лечения антибиотиками после тонзиллэктомии был успешным в устранении MRSA из горла.
Реферат
В некоторых странах, включая Нидерланды, политика поиска и уничтожения является частью стандарта обслуживания. Из-за этой политики и ограниченного использования антибиотиков распространенность метициллин-устойчивого Staphylococcus aureus (MRSA) в Нидерландах — носительства и инфекций — одна из самых низких в мире.В Нидерландах медицинским работникам, являющимся носителями MRSA, не разрешается выполнять работу, связанную с непосредственным уходом за пациентами. Это означает, что неудачное лечение может иметь серьезные последствия для их трудовой карьеры. Несмотря на повторное лечение в соответствии с руководящими принципами, искоренение MRSA не удается в меньшинстве случаев. Похоже, что выполнение тонзиллэктомии может быть частью решения этой проблемы. Пока что тонзиллэктомия не рекомендуется в качестве дополнительного лечения стойкого носительства MRSA в горле.Есть несколько мнений экспертов, предполагающих, что тонзиллэктомия может быть полезной при деколонизации. В этой статье сообщается о трех недавних случаях, в которых эрадикация MRSA была успешной только после тонзиллэктомии. Считается, что если необходима ликвидация, следует рассмотреть возможность удаления миндалин.
Ключевые слова
MRSA
Тонзиллэктомия
Carrier
Staphylococcus aureus
Рекомендуемые статьиЦитирующие статьи (0)
Просмотреть аннотацию
© 2017 Автор (ы).Опубликовано Elsevier Ltd от имени Международного общества инфекционных болезней.
Рекомендуемые статьи
Цитирующие статьи
% PDF-1.4
%
32 0 объект
>
эндобдж
xref
32 89
0000000015 00000 н.
0000002075 00000 н.
0000002368 00000 н.
0000071002 00000 п.
0000070183 00000 п.
0000070266 00000 п.
0000070349 00000 п.
0000070431 00000 п.
0000070512 00000 п.
0000070594 00000 п.
0000070676 00000 п.
0000070757 00000 п.
0000070838 00000 п.
0000070920 00000 н.
0000069854 00000 п.
0000069935 00000 н.
0000070018 00000 п.
0000070100 00000 п.
0000068090 00000 н.
0000120087 00000 н.
0000119016 00000 н.
0000119139 00000 н.
0000076512 00000 п.
0000076549 00000 п.
0000119294 00000 н.
0000079222 00000 п.
0000119381 00000 п.
0000127232 00000 н.
0000093021 00000 п.
0000093682 00000 п.
0000094230 00000 п.
0000086144 00000 п.
0000079304 00000 п.
0000079895 00000 п.
0000080352 00000 п.
0000102226 00000 н.
0000102718 00000 н.
0000103095 00000 н.
0000119469 00000 н.
0000119806 00000 н.
0000132148 00000 н.
0000088920 00000 н.
0000089402 00000 п.
0000089712 00000 п.
0000047939 00000 п.
0000108762 00000 н.
0000108813 00000 н.
0000109217 00000 п.
0000111834 00000 н.
0000116029 00000 н.
0000116152 00000 н.
0000116275 00000 н.
0000116398 00000 н.
0000116521 00000 н.
0000116644 00000 н.
0000116767 00000 н.
0000116890 00000 н.
0000117013 00000 н.
0000117137 00000 н.
0000117311 00000 н.
0000117534 00000 н.
0000117861 00000 п.
0000086336 00000 п.
0000086821 00000 п.
0000087103 00000 п.
0000117925 00000 н.
0000071521 00000 п.
0000075640 00000 п.
0000075763 00000 п.
0000075887 00000 п.
0000076012 00000 п.
0000076137 00000 п.
0000076262 00000 п.
0000076387 00000 п.
0000108016 00000 н.
0000109668 00000 н.
0000111382 00000 н.
0000068565 00000 п.
0000068741 00000 п.
0000068885 00000 п.
0000069000 00000 п.
0000069131 00000 п.
0000069257 00000 п.
0000118605 00000 н.
0000118708 00000 н.
0000118820 00000 н.
0000118918 00000 н.
0000118956 00000 н.
0000067654 00000 п.
трейлер
>
startxref
0
%% EOF
33 0 объект
>
/ Контуры 119 0 R
/ PageMode / UseOutlines
>>
эндобдж
34 0 объект
[35 0 руб.
]
эндобдж
35 0 объект
>
/ Ж 36 0 Р
>>
эндобдж
36 0 объект
>
эндобдж
37 0 объект
>
эндобдж
38 0 объект
>
эндобдж
39 0 объект
>
эндобдж
40 0 объект
>
эндобдж
41 0 объект
>
эндобдж
42 0 объект
>
эндобдж
43 0 объект
>
эндобдж
44 0 объект
>
эндобдж
45 0 объект
>
эндобдж
46 0 объект
>
эндобдж
47 0 объект
>
эндобдж
48 0 объект
>
эндобдж
49 0 объект
>
эндобдж
50 0 объект
>
/ ExtGState>
/ XObject>
/ Шрифт>
>>
/ Большой палец 76 0 R
/ Тип / Страница
/ BleedBox [9
9
585
783
]
/ Родитель 79 0 R
>>
эндобдж
51 0 объект
> поток
x \ kƕ> U * wN * d $$ h) _ {8GT5 Ս- Wjo _; / 6W / CW! V) YMU3k ܆] wuw; jm} v9; ffg = dz7wϽf9.z: ܗ L_ ~ Ochg ۇ cB (+ yyfudCe21, a # @ 3
Профили колонизации глотки и лекарственной устойчивости Morraxella catarrrhalis, Streptococcus pneumoniae, Staphylococcus aureus и Haemophilus influenzae среди ВИЧ-инфицированных детей, посещающих клинику ART, Эфиопия, Фелегехи,
)
Аннотация
Фон
Бессимптомная колонизация глотки потенциальными бактериями является основным резервуаром бактерий в популяции и считается предпосылкой для развития основных детских болезней, таких как синусит, средний отит, пневмония, бактериемия и менингит.Однако данных о колонизации и структуре лекарственной устойчивости основных бактериальных патогенов в глотке ВИЧ-инфицированных детей в Эфиопии недостаточно. Таким образом, в этом исследовании была определена колонизация глотки и профиль лекарственной устойчивости бактериальных патогенов у ВИЧ-инфицированных детей, посещающих клинику АРТ при больнице Felegehiwot (FHRH), регион Амхара, Эфиопия.
Методы
Больничное перекрестное исследование проводилось с мая 2016 г. по июнь 2017 г. в клинике АРТ при FHRH.В исследовании приняли участие 300 ВИЧ-инфицированных детей. Данные о социально-демографических характеристиках участников исследования были собраны с помощью личного интервью и просмотра карты пациента с использованием структурированного вопросника. Бактериальные виды были идентифицированы с использованием стандартных бактериологических методов. Тестирование лекарственной чувствительности проводилось методом дисковой диффузии. Тест хи-квадрат был проведен для определения ассоциаций между переменными.
Результаты
Средний возраст участников составлял 11 лет.В целом, 153 (51%) детей были колонизированы респираторными бактериями в глотке. Уровень колонизации был выше у детей от матерей, окончивших колледж и выше, чем у других (P = 0,04). Он также был выше у детей без признаков недоедания, чем у других (P = 0,004). Скорость колонизации S . золотистый , M . catarrhalis , S . pneumoniae и H . influenzae были 88 (29%), 37 (12.3%), 31 (10,3%) и 6 (2%) соответственно. S . золотистый — M . catarrhalis одновременная колонизация была обнаружена у 14 (4,7%) детей. Возраст (P = 0,03), образование (P = 0,045) и насморк в анамнезе (P = 0,043) были значимо связаны с S . aureus колонизация. Проживание в городских условиях (P = 0,042) и дети от матерей с высшим образованием и выше (P = 0,002) были достоверно связаны с M . catarrhalis колонизация. Большинство изолятов были устойчивы к пенициллину (68,5%) и котримоксазолу (52,5%). S . aureus Изоляты были устойчивы к пенициллину (84,1%) и котримоксазолу (51,1%). М . catarrhalis изолятов были устойчивы к пенициллину (94,6%), эритромицину (86,5%) и котримоксазолу (78,4%). В целом 99 (59,3%) изолятов имели множественную лекарственную устойчивость (МЛУ). Общие показатели MDR среди S . золотистый , M . catarrhalis и S . pneumoniae изолятов составляли 65,9%, 78,4% и 22,6% соответственно.
Выводы
Глоточная колонизация респираторными бактериями у ВИЧ-инфицированных детей является серьезной проблемой общественного здравоохранения. Среди респираторных колонизаторов тревожно высока устойчивость к однократным и множественным антибиотикам. Поэтому для предотвращения развития тяжелых оппортунистических инфекций рекомендуется регулярный скрининг ВИЧ-инфицированных детей на культуру и определение чувствительности к противомикробным препаратам.
Образец цитирования: Mulu W, Yizengaw E, Alemu M, Mekonnen D, Hailu D, Ketemaw K, et al. (2018) Профили колонизации глотки и лекарственной устойчивости Morraxella catarrrhalis , Streptococcus pneumoniae , Staphylococcus aureus и Haemophilus influenzae среди ВИЧ-инфицированных детей, посещающих АРТ клиники Фелегивот Реферальной больницы. PLoS ONE 13 (5):
e0196722.
https://doi.org/10.1371/journal.pone.0196722
Редактор: Ray Borrow, Public Health England, UNITED KINGDOM
Поступила: 30 ноября 2017 г .; Одобрена: 18 апреля 2018 г .; Опубликован: 10 мая 2018 г.
Авторские права: © 2018 Mulu et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его вспомогательных информационных файлах.
Финансирование: Исследовательский проект финансировался Колледжем медицины и медицинских наук Университета Бахир Дар. Средства были использованы для закупки реагентов, сбора, анализа и интерпретации данных.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Лица, инфицированные вирусом иммунодефицита человека (ВИЧ), подвергаются высокому риску бактериальной колонизации и заболеваний [1, 2].В развивающихся странах у детей с ВИЧ часто возникают отит, пневмония, менингит и сепсис, вызванные бактериями [1, 2]. Колонизация верхних дыхательных путей (ВДП) патогенными бактериями является предпосылкой для развития основных детских заболеваний, таких как бактериальный синусит, средний отит, пневмония, бактериемия и менингит [1, 3, 4].
Streptococcus pneumoniae ( S . pneumoniae ), Staphylococcus aureus ( S . aureus ), Haemophilus influenzae ( H . influenzae ) и Morraxella catarrrhalis ( M . catarrhalis ) являются основными бессимптомными колонизаторами носа и горла 1. S . pneumoniae является основной причиной детской бактериальной пневмонии и является причиной не менее 800 000 детских смертей ежегодно в развивающихся странах [5, 6]. Ежегодно один миллион детей умирает от пневмонии и инвазивных заболеваний [1, 2, 7, 8].Ежедневно во всем мире от пневмонии умирают 4300 детей. В Эфиопии пневмония является ведущей инфекционной причиной смерти детей, на которую приходится 28% смертности детей в возрасте до пяти лет [9–12].
Даже при соответствующем лечении пневмококковый менингит убивает примерно одну треть пораженных африканскими детьми детей. Почти у 30–60% выживших развивается длительная потеря слуха, неврологические дефекты и нейропсихологические нарушения [2]. В Африке к югу от Сахары — ю.ш. . pneumoniae На приходится> 30% случаев менингита у детей в возрасте до 5 лет, а уровень летальности составляет> 50% [1].
Н . influenzae — основная причина плохого состояния здоровья и преждевременной смерти младенцев и детей раннего возраста в развивающихся странах [13]. М . catarrrhalis также является условно-патогенным микроорганизмом, вызывающим пневмонию, синусит и средний отит у детей и пациентов с ослабленным иммунитетом [13]. Для лиц, инфицированных ВИЧ, S . Инфекция aureus вызывает значительную заболеваемость [14, 15]. Носительство URT является важным фактором риска стафилококковой сепсиса.У носителей инфекция развивается чаще, чем у лиц, не являющихся носителями [15]. Средний отит — это наиболее часто встречающаяся детская бактериальная инфекция. S . pneumoniae , H . influenzae и M . catarrrhalis являются преобладающими документально подтвержденными этиологическими агентами среднего отита [5, 6].
В нескольких исследованиях установлено, что возраст, иммунный статус, недавнее употребление антибиотиков, скученность при дневном уходе, предшествующая госпитализация, тюрьмы, размер семьи, количество братьев и сестер, бедность и курение влияют на колонизацию ВДП человека бактериальными патогенами [1, 3, 15].
Быстрое распространение устойчивости к противомикробным препаратам среди инфекционных организмов является глобальной проблемой общественного здравоохранения [16]. Неправильное использование антибиотика оказывает избирательное давление, способствующее появлению устойчивых штаммов не только у патогенных бактерий, но и у комменсальной флоры людей, подвергшихся воздействию [16]. Перевозка пенициллина и других устойчивых к антибиотикам S . pneumoniae в глотке у детей встречается во всем мире [1]. Кроме того, распространение устойчивых к метициллину S . aureus (MRSA) как в клинических условиях, так и в общественных местах стало реальной угрозой общественному здоровью [16]. М . catarrhalis может также защищать другие респираторные патогены от действия пенициллина или ампициллина, продуцируя β-лактамазу [17].
Хотя пневмококковая конъюгированная вакцина очень эффективна в снижении носительства и последующих заболеваний, вызываемых S . pneumoniae , охват вакцинацией ограничен и трудно предотвратить распространение невакцинных серотипов [18].Более того, различные отчеты продемонстрировали обратную зависимость между носоглоточным носительством вакцины типа S . pneumoniae и S . aureus [19] и увеличивает долю среднего отита из-за нетипируемого H . influenzae после вакцинации против ЦВС7 [1, 20].
Несомненно, бактерии, переносимые в глотке ВИЧ-инфицированных детей, отражают штаммы, вызывающие инфекцию, которые в настоящее время распространяются в группах риска.Бессимптомное носительство является предпосылкой для развития инвазивных и неинвазивных заболеваний, а носители служат источником инфекции для других людей в сообществе и в больнице. В Эфиопии дети страдают от чрезвычайно высокого бремени потенциальных респираторных патогенных заболеваний, и лечение таких заболеваний остается эмпирическим. Однако, насколько нам известно, распространенность колонизации и характер лекарственной устойчивости потенциальными глоточными бактериями не изучались у ВИЧ-инфицированных детей в Эфиопии.Таким образом, целью данного исследования было определение колонизации глотки и паттерна лекарственной устойчивости респираторных бактерий у ВИЧ-инфицированных детей в возрасте от 6 до 16 лет, посещающих клинику АРТ в специализированной больнице Фелегехивот (FHRH), Национальный региональный штат Амхара (ANRS) Эфиопия.
Методы и материалы
Дизайн исследования, период и постановка
Больничное перекрестное исследование проводилось с мая 2016 года по июнь 2017 года в клинике антиретровирусной терапии (АРТ) FHRH, ANRS и Эфиопии.FHRH — одна из государственных больниц, предоставляющих услуги по АРТ. Больница предоставляет как консультации, так и услуги АРТ ВИЧ-инфицированным пациентам. Здесь более 273 коек, предлагающих различные специализированные услуги. Его клиника АРТ обеспечивает последующее наблюдение как педиатрам до и после АРТ, так и взрослым пациентам специалистами и обученными специалистами в области здравоохранения. Услуги АРТ предоставляются ВИЧ-инфицированным пациентам, находящимся в Бахир-Даре и его окрестностях. Кроме того, больница обслуживает пациентов, направленных на АРТ из разных частей региона.Число ВИЧ-положительных детей, посещающих клинику АРТ, колеблется от 1760 до 2200 в год, и это составляет исходную популяцию.
Размер выборки и выборка
Размер выборки был рассчитан с использованием формулы единой доли населения (N = z2 p (1-p) / d2). Его определяли, принимая степень точности 5%, уровень достоверности 95%, долю бактериального глоточного носительства 33,3% [9]. Таким образом, был рассчитан размер выборки 341 человек. Однако полные данные были получены только по 300 ВИЧ-инфицированным детям.Все ВИЧ-инфицированные дети, посещающие клинику АРТ при FHRH, были включены в исследование до тех пор, пока не был достигнут требуемый размер выборки.
Переменные
Глоточная колонизация респираторными бактериями, такими как S . pneumoniae , S . золотистый , M . catarrhalis и H . influenzae были зависимыми переменными, в то время как социально-демографические, клинические и другие объясняющие переменные были независимыми переменными.
Сбор данных
Информация о социально-демографических переменных, школьном образовании, привычке ковыряться в носу, привычке протирать ноготь зубами, проживании с медицинскими работниками, наличии младших братьев и сестер в семье и подверженности пассивному курению была собрана у каждого участника лично. Лицо интервью с использованием структурированной анкеты. Кроме того, клиническая информация, такая как статус инфекции дыхательных путей в течение последнего месяца, признаки недоедания, насморк за последние две недели и насморк за последние два месяца, была собрана посредством обзора карты пациента [таблица S1].
Сбор и обработка образцов из глотки
После завершения интервью образцы из глотки были взяты теми же обученными врачами общей практики, работающими в клинике уха, носа и горла FHRH в соответствии со стандартными микробиологическими методами [7]. Два глоточных образца каждого ребенка были собраны стерильным синтетическим ватным тампоном на гибкой алюминиевой проволоке путем вращения 4–5 раз по часовой стрелке и против часовой стрелки перед изъятием. После отбора пробы мазки немедленно помещали в транспортную среду Amies (Oxoid, Великобритания) и транспортировали в микробиологическую лабораторию Института общественного здравоохранения Амхары (APHI).Один из образцов тампона был инокулирован на солевой агар Manitol, а другой тампон сначала был внесен в агар с овечьей кровью с добавлением 5 мг / мл гентамицина (Oxoid, UK), а затем в шоколадный агар в течение четырех часов после сбора. Чашки с кровью и шоколадным агаром инкубировали в сосуде для свечей с образованием около 5% CO 2 . Все инокулированные среды инкубировали при 37 ° C в течение 18–24 часов.
Идентификация бактериальных изолятов
S . pneumoniae изолятов были идентифицированы альфа-гемолитическими колониями на кровяном агаре, которые были чувствительны к оптохину и желчи. Н . influenzae был идентифицирован по бесцветным колониям среднего размера на шоколадном агаре и строгим требованиям для факторов X (Hemin) и V (NAD +). Аналогично М . catarrhalis изолятов были идентифицированы по негемолитическим колониям от серого до белого цвета на кровяном агаре, которые дали положительный результат на каталазу и оксидазу. Золотисто-желтые колонии на маннитоловом солевом агаре, которые дали положительный результат на оксидазу и каталазу, считались S . aureus [7].
Тестирование чувствительности к противомикробным препаратам
Тестирование на чувствительность к противомикробным препаратам проводили на агаре Мюллера-Хинтона с добавлением 5% овечьей крови (Oxoid, Великобритания) методом дисковой диффузии Кирби-Бауэра.Были протестированы следующие противомикробные агенты: цефокситин (30 мкг), клиндамицин (30 мкг), котримоксазол (25 мкг), ципрофлоксацин (5 мкг), эритромицин (15 мкг), тетрациклин (30 мкг), пенициллин (10 МЕ) и хлорамфеникол (30 мкг) ( Oxoid, Англия) [21]. Стандарт МакФарланда 0,5 использовали для стандартизации мутности суспензии посевных культур. В течение 15 минут после регулирования мутности суспензии инокулятов стерильный ватный тампон погружали в полученную суспензию. Планшеты с высушенной поверхностью инокулировали, нанося мазок мазком на всю поверхность стерильного агара.Антимикробные диски помещали на лужайку бактериальных изолятов с помощью стерильных пинцетов. Засеянные среды инкубировали в атмосфере 5% CO 2 в течение 18–24 часов при 37 ° C. Диаметр зоны ингибирования измеряли штангенциркулем. Результаты интерпретировались с использованием стандартных размеров зон, указанных в рекомендациях Института клинических и лабораторных стандартов (CLSI, 2015) [22]. Все S . aureus изолятов подвергали тесту на дисковую диффузию цефокситина на чашках с агаром Мюллера-Хинтона.Чувствительность к пенициллину S . pneumoniae определяли с использованием оксациллиновых дисков, поскольку реактивы для определения МИК отсутствовали. Планшеты инкубировали при 35 ° C в течение 18–24 часов, и диаметр зоны ингибирования ≥ 21 мм считался устойчивым к метициллину и ≥ 22 мм считался чувствительным к метициллину [22].
Контроль качества
Эталонные штаммы S . aureus ATCC25923, S . pneumoniae ATCC49619 и H . Influenzae ATCC 49241 использовались для контроля качества тестирования на чувствительность к противомикробным препаратам. Обнаружение метициллин-устойчивых S . aureus (MRSA) проводили с использованием диска цефокситина. Для получения правильных лабораторных результатов соблюдали стандартизированную бактериологическую процедуру. Регулярно и всякий раз, когда готовится новая партия штамма или реагента, стандартные штаммы S . aureus ATCC25923, S . pneumoniae ATCC49619 и H . influenzae ATCC 49241 использовали в качестве положительного контроля. Стерильность среды проверяли путем инкубации среды в течение ночи перед ее использованием.
Анализ данных
Данные были введены и проанализированы с использованием статистического пакета для социальных наук 22 (IBM Corp — выпущен в 2011 году. Статистика IBM SPSS. Армонк, штат Нью-Йорк: IBM Corp). Описательная статистика использовалась для описания соответствующих переменных. Для определения связи между зависимыми и независимыми переменными были получены критерий хи-квадрат и точный критерий Фишера.Значение P <0,05 считалось статистически значимым.
Этические соображения
Этическое разрешение было получено от Институционального наблюдательного совета Колледжа медицины и медицинских наук Университета Бахир-Дар. Письмо-разрешение было получено от FHRH. Письменное информированное согласие было получено от родителей / опекунов детей, прежде чем приступить к сбору данных. Дети, у которых был обнаружен возбудитель, были обращены к врачам для прохождения лечения и любой другой помощи.Информация, полученная в ходе исследования, была конфиденциальной.
Результаты
Характеристики участников
Таблица 1 отображает демографические характеристики участников. В исследование было включено 300 детей, инфицированных ВИЧ, с показателем ответа (88%). Из них 153 (51%) были мужчинами и 257 (85,7%) были городскими жителями. Возрастной диапазон составлял 6–16 лет (медиана = 11). Большинство (89,3%) детей проживали со своими семьями. Уровень образования матери показал, что 130 (43.3%) были неграмотными, а 44 (14,7%) имели высшее образование и выше. Из общего числа ВИЧ-инфицированных детей 235 (78,3%) посещали школу (Таблица 1).
Скорость колонизации глотки и частота бактериальных изолятов
В целом, 153 (51%) детей были носителями патогенных бактерий в глотке. У ВИЧ-инфицированных детей было выделено 56,3% аэробных глоточных бактерий. Наиболее частым изолятом был S . aureus (29,3%) со скоростью колонизации S . pneumoniae (10,3%). Причем скорость колонизации M . catarrhalis и H . influenzae составляли 12,3% и 2,3% соответственно (таблица 2). Одновременно S . золотистый — М . catarrhalis и S . aureus- S . pneumoniae колонизация была обнаружена у 4,7% и 3,1% детей соответственно (таблица 2).
Общий уровень колонизации был выше у детей от матерей, окончивших колледж и получивших образование выше (79.5%), чем неграмотные (43,1%) (P = 0,04). Уровень колонизации глотки был выше среди детей-сирот (56,3%), чем у других детей (50,4%). Однако разница не была статистически значимой (P = 0,16) (таблица 3). Уровень колонизации глоточных бактериальных патогенов был значительно выше у детей без признаков неправильного питания (58,5%) по сравнению с другими (23,4%) (P = 0,004) (Таблица 3).
Доля S . aureus колонизация была выше у более старых (37.6%) по сравнению с детьми младшего возраста (22,4%) (P = 0,03). Он был выше у детей, у которых был насморк (40%), по сравнению с детьми, у которых не было (26,7%) (P = 0,046). Скорость колонизации S . aureus был выше среди школьников (35,1%) по сравнению с детьми, не посещающими школу (19,5%) (P = 0,045) (Таблица 3). Скорость колонизации M . catarrhalis был выше у детей от матерей с высшим образованием и выше (25,6%), чем у неграмотных (7,7%) (P = 0,002). Причем скорость колонизации M . catarrhalis был выше у городских (13,7%) по сравнению с сельскими (4,5%) жителями (P = 0,042) (Таблица 3).
Профили лекарственной устойчивости бактериальных изолятов
Большинство бактериальных изолятов были устойчивы к пенициллину (68,5%) и котримоксазолу (52,5%). S . aureus Изоляты были устойчивы к пенициллину (84%) и котримоксазолу (51,1%). Доля MRSA составила 29 (33%). Однако S . aureus изолятов были чувствительны к хлорамфениколу (6.8%), клиндамицин (26,1%), ципрофлоксацин (27,3%) и эритромицин (35,2%). М . catarrrhalis изолятов были устойчивы к пенициллину (94,6%), эритромицину (86,5%), котримоксазолу (78,4%) и клиндамицину (73%). S . pneumoniae изолятов выявили устойчивость к котримоксазолу, эритромицину, тетрациклину и хлорамфениколу соответственно на 26,7%, 35,5% и 36,7% (таблица 4).
Профили множественной лекарственной устойчивости изолятов
Тридцать один (18.6%) изолятов были чувствительны ко всем протестированным препаратам. Сто тридцать два (79%) изолятов оказались устойчивыми к одному и более протестированным препаратам. МЛУ к двум и более различным классам препаратов обнаружен у 99 (59,3%) изолятов. Общий показатель MDR среди S . aureus и M . catarrhalis изолятов составляли 65,9% и 78,4% соответственно (таблица 5).
Обсуждение
Несмотря на то, что профилактика котримоксазолом и пневмококковая конъюгированная вакцина для ВИЧ-инфицированных были начаты для предотвращения развития некоторых из наиболее серьезных и распространенных бактериальных оппортунистических инфекций у детей, текущий уровень колонизации глотки бактериальными патогенами согласуется с различными исследованиями. отдельные возбудители [23–27].Это означает, что ВИЧ-инфицированные дети могут быть источником бактериальной инфекции для других школьников и семей, представляющих высокий риск развития инвазивных и неинвазивных бактериальных заболеваний. У ВИЧ-инфицированных детей были выделены пять различных видов бактерий. S . aureus был преобладающим организмом, переносимым ВИЧ-положительными детьми в этом исследовании. Однако в аналогичных исследованиях в Камбодже [26] и Турции [27] M . catarrrhalis был указан как ведущий изолят.Они отражают наличие вариаций в составе респираторных бактерий, которые могут быть связаны с различиями в географических регионах и другими факторами [1, 4, 6].
В этом исследовании доля бактериальной колонизации глотки была значительно выше у ВИЧ-инфицированных детей от матерей с уровнем образования в колледже и выше, чем у других (P = 0,04). Это могло быть связано с приобретением организмов из школы. Более того, уровень бактериальной колонизации глотки был значительно выше среди детей, не имевших признаков недоедания, по сравнению с детьми с признаками недоедания (P = 0.004), которые могут быть связаны с заражением бактериями в школе или детском саду. Вышеупомянутое объяснение также подтверждается Таблицей 3, следовательно, для S были значительно связаны возраст, образование и проживание в городской местности. aureus и M . catarrhalis колонизации соответственно.
Уровень колонизации глотки S . pneumoniae (10,3%) в настоящем исследовании сопоставимы с более ранними результатами, полученными в Камеруне (11.6–18,2%) [20], Сеул, Корея (12,2%) [3] и Таиланд (12,9%) [24]. Однако более высокий уровень колонизации был зарегистрирован в Северной и Южной Эфиопии (41–43,8%) [9, 25], Эстонии (17%) [28], Уганде (18%) [29], Западной Бенгалии (15,6%) [30]. ], Гана (30,5%) [31], сельские районы Уганды (58,6%) [32], Танзания (56%) [33] и Южная Африка (22,2%) [34]. С другой стороны, более низкий (5,1%) уровень колонизации был зарегистрирован в Камбодже [26]. Различия в скорости колонизации могут быть связаны с различиями в возрастном диапазоне участников, вакцинационном статусе, условиях жизни, сезоне сбора данных и методологии.Более того, в настоящем исследовании использовались мазки из глотки, в то время как в других выполнялись мазки из носоглотки или ротоглотки [1, 4].
В этом исследовании уровень колонизации глотки S . aureus (29,3%) согласуется с более ранней находкой в Мекелле, Эфиопия (32,5%) [23]. Однако это было меньше, чем в исследованиях, проведенных в Гондэре, Эфиопии (51,5%) [9] и Танзании (66%) [33]. С другой стороны, это было выше, чем в предыдущих отчетах из Камеруна (6–12,3%) [20], Ганы (22%) [31], Южной Африки (20.4%) [34] Сеул, Корея (18,2%) [3] и юг Центральной Танзании (23,2%) [35]. Различия в скорости колонизации могут быть связаны с различиями в ВИЧ-статусе детей [6], типом собранных образцов и возрастом участников.
Частота носительства MRSA в настоящем исследовании (33%) была выше, чем в предыдущих исследованиях в Мекелле, Эфиопия (2,4%) [23] и Гана (3,4%) [3]. Более высокий уровень носительства MRSA в текущем исследовании может быть связан с частым посещением этими пациентами медицинских учреждений, поскольку повторные посещения медицинских учреждений или контакт с руками медицинских работников у ВИЧ-инфицированных лиц представляют собой серьезный риск. фактор колонизации.
Доля колонизации глотки M . catarrrhalis (12,3%) в текущем исследовании было выше, чем в предыдущих отчетах в Камбодже (6,2%) и Киргизии (7,2%) [26]. Однако это было ниже, чем результаты, полученные в Эстонии (16%) [28], Гане (39,8%) [31], Танзании (50%) [33], южной части центральной Танзании (90,8%) [35], Сеуле, Корее. (20,2%) [3] и Турция (23,9%) [27]. Вариация может быть связана с различиями в возрасте участников и типом собранных образцов.Однако из-за нехватки предыдущих данных по Эфиопии сравнение не проводилось.
В этом исследовании уровень колонизации H . influenzae (2%) из глотки ВИЧ-инфицированных детей было сопоставимо с предыдущим отчетом в городе Дакка (1,5%) [36]. Однако это было ниже, чем данные, полученные в Танзании (14%) [33], Западной Бенгалии (13,8%) [30], Ботсване (3–8%) [37], Южной Африке (21,8%) [34], Кэмерон. (13,8–24,4%) [20], Сеул, Корея (18,9%) [3], Эстония (16%) [28] и Турция (7.2%) [27]. Нижняя скорость колонизации H . influenzae в настоящем исследовании может быть связано с различиями в возрастном диапазоне участников исследования, так как дети в возрасте до пяти лет не были включены в настоящее исследование.
В этом исследовании большинство изолятов были устойчивы к котримоксазолу. Это согласуется с предыдущими исследованиями, проведенными в Дарс-Саламе, Танзания [38] и Уганда [29]. Высокий уровень устойчивости может быть связан с тем, что котримоксазол является наименее дорогим антибиотиком для перорального введения и легко доступен без рецепта во многих учреждениях, а препарат широко используется для профилактики оппортунистических инфекций у ВИЧ-инфицированных пациентов.
В настоящем исследовании большая часть (84,5%) из S . изолятов aureus были устойчивы к пенициллину. Это согласуется с предыдущими результатами, полученными в Северо-Западной Эфиопии [12] и Гане [31], где сообщалось о резистентности 90–100%. Это факт, что большинство штаммов S . aureus в настоящее время устойчивы к пенициллину за счет продукции бета-лактамаз и изменения связывающих пенициллин белков.
Хотя на уровне S . pneumoniae Устойчивость к котримоксазолу (22,6%), наблюдаемая в настоящем исследовании, ниже, чем предыдущие результаты, в Гондэре, Эфиопия (29,2%) [12], деревне Гамбии (39%) [39], юго-западе Эфиопии (43,7%) [ 23], сельские районы Уганды (58,3%) [32], Уганды (98,9%) [29], Дарес-Салам, Танзания (82,6%) [38], Кувейт (62,8%) [40], Индонезия (59%) [ 41], Эстонии (62,1%) [28], Индии (91%) [42] и Таиланда (78,9%) [24], текущий уровень устойчивости предполагает распространение лекарственно-устойчивого S . pneumoniae в сообществе, что может быть связано с использованием котримоксазола в качестве профилактики у ВИЧ-инфицированных пациентов.Более того, котримоксазол дешев и легко доступен для населения, что может привести к его частому использованию.
Относительно более высокий уровень S . pneumoniae В настоящем исследовании сообщалось об устойчивости к эритромицину (35,5%), тетрациклину (35,5%) и хлорамфениколу (38,7%). Они совпадают с данными, задокументированными в Гондэре, Эфиопии [12] и Гамбии [43]. Это может быть связано с доступностью этих лекарств, самолечением, незаконной покупкой без лекарств, широким распространением этих лекарств для лечения различных инфекций на местах, что приводит к злоупотреблению антибиотиками.
В этом исследовании общий показатель МЛУ шиллингов . pneumoniae составило 22,6% [Таблица 5]. Это было выше, чем в исследованиях в Гане (16,7%) [31], итальянском городе (16,5%) [44], Индии (15,9%) [42], Дарс-Саламе, Танзании (16,5%) [38], юго-западе Эфиопии ( 17,7%) [23] и Таиланд (31,6%) [24]. В данном исследовании большая часть (94,7%) из M . catarrrhalis изолятов были устойчивы к пенициллину. Это было сопоставимо с предыдущими результатами, полученными в Камероне [20] и Турции [30], где сообщалось об уровне устойчивости 100% и 84% соответственно.Это может быть связано с инактивацией препарата ферментами бета-лактамаз, как и многие штаммы M . catarrhalis — продуценты бета-лактамаз. Относительно более высокий уровень MDR S . pneumoniae сигнализирует о лечении инфекций, вызванных S . pneumoniae следует руководствоваться посевом и тестированием на чувствительность к противомикробным препаратам.
Общий показатель MDR M . catarrrhalis в этом исследовании было 78.4% (таблица 5). Это было похоже на предыдущие результаты в Гане (57,4%) [31]. Это действительно шокирующий уровень устойчивости со стороны важных с медицинской точки зрения комменсальных бактерий, с которыми будет трудно справиться, если они вызывают оппортунистические инфекции.
Большинство из M . catarhalis изолятов в этом исследовании были устойчивы к эритромицину, котримоксазолу и клиндамицину. Однако сравнение не производилось из-за отсутствия документированных данных. Высокий уровень М . catarhalis к разным классам антибиотиков может быть связано со способностью патогена иметь множественный механизм устойчивости, а широкое распространение лекарств способствует селективному давлению на нормальных колонизаторов.
Из-за перекрестного характера исследования не удалось получить определяющие факторы колонизации. Различные серотипы каждого вида не были охарактеризованы из-за ограниченной лабораторной инфраструктуры.
Выводы
Глоточная колонизация респираторными бактериями у ВИЧ-инфицированных детей является серьезной проблемой общественного здравоохранения.Большинство изолятов были устойчивы к пенициллину и котримоксазолу. Множественная лекарственная устойчивость S . золотистый , M . catarhalis и S . pneumoniae были тревожно высокими. Для последующего наблюдения за этими детьми рекомендуется регулярный скрининг ВИЧ-инфицированных детей.
Благодарности
Это исследование финансировалось Колледжем медицины и медицинских наук Университета Бахир Дар. Мы хотели бы поблагодарить Институт общественного здравоохранения Амхара за разрешение проводить лабораторные работы в их условиях.Мы также благодарим за техническую поддержку сотрудников Института общественного здравоохранения Амхара. Мы также благодарим Региональное бюро здравоохранения Амхары за их разрешение на проведение исследования в специализированной больнице Фелегехивот.
Ссылки
- 1.
Энтони Л., Михан А., Амос Б., Мтове Г., Мджема Дж., Малахийо Р. и др. Носоглоточное носительство Streptococcus pneumoniae : распространенность и факторы риска у ВИЧ-положительных детей в Танзании. IntJ Infect Dis. 2012; 16 (2012 г.) e753 – e757. - 2.
Богерт Д., Гроот Р. Д., Херманс П. Streptococcus pneumoniae колонизация: ключ к пневмококковой инфекции. Lancet Infect Dis. 2004; 4: 144–154. pmid: 14998500 - 3.
Bae S, Yu J, Lee K, Lee S, Park B, Kang Y. Колонизация носа четырьмя потенциальными респираторными бактериями у здоровых детей, посещающих детский сад или начальную школу в Сеуле, Корея. J Med Microbiol. 2012; 61: 678–685. pmid: 22282460 - 4.
Данн Э.М., Мэннинг Дж., Рассел Ф.М., Робинс-Браун Р.М., Малхолланд Э.К., Сацке К.Влияние пневмококковой вакцины на носоглоточное носительство Streptococcus pneumoniae , Haemophilus influenzae , Moraxella catarrhalis и Staphylococcus aureus у детей Фиджи. J Clin Microbiol. 2012; 50 (3): 1034–1038. pmid: 22170924 - 5.
Шири Т., Нунес М.С., Адриан П.В., Никерк Н.В., Клугман К.П., Мадхи С.А. Взаимосвязь Streptococcus pneumoniae , Haemophilus influenzae и Staphylococcus aureus колонизация внутри и между парами мать-ребенок, ранее не получавшими вакцину от пневмококка.BMC Infect Dis. 2013; 13: 2–9. - 6.
Лейбовиц Э., Драгомир С., Сфарц С., Порат Н., Ягупский П., Джика С. и др. Назофарингеальное носительство полирезистентного Streptococcus pneumoniae у ВИЧ-инфицированных и ВИЧ-отрицательных детей в специализированных учреждениях на северо-востоке Румынии. IntJ Infect Dis.1999; 3 (4): 211–215. - 7.
Всемирная организация здоровья. Вакцины против пневмококка. Документ с изложением позиции ВОЗ. Wkly Epidemiol Rec. 2003; 78: 97e120. - 8.
Валенсуэла М.Т., О’Лафлин Р., Де Ла Хоз Ф., Гомес Э., Констенла Д., Синха А. и др.Бремя пневмококковой инфекции среди детей Латинской Америки и Карибского бассейна: обзор доказательств. Преподобный Панам Салуд Публика. 2009; 25: 270e9. - 9.
Assefa A, Gelaw B, Shiferaw Y, Tigabu Z. Назофарингеальное носительство и антимикробная чувствительность Streptococcus pneumoniae среди педиатрических амбулаторных пациентов в больнице Гондарского университета, Северо-Западная Эфиопия. Pediatr Neonatol. 2013; 54: 315–321. pmid: 23680262 - 10.
Всемирная организация здоровья.Альянс ГАВИ выступает партнером по борьбе с детским убийцей в Эфиопии. Пресс-релиз ГАВИ, 2011 г. http://www.who.int/immunization/newsroom/press/introduction_pneumococcal_vaccine_inEthiopia/en/index.html По состоянию на 10 июля 2014 г. - 11.
Федеральное министерство здравоохранения. Национальная стратегия выживания детей в Эфиопии. FMOH; 2005. - 12.
Родригес Л., Сервантес Э., Ортис Р. Недоедание и желудочно-кишечные и респираторные инфекции у детей: проблема общественного здравоохранения.Int J Environ Res Public Health. 2011; 8: 1174e205. - 13.
Чизбург М. Окружная лабораторная практика в тропических странах. Часть II. 2-е изд. Издательство Нью-Йоркского Кембриджского университета; 2006. - 14.
Хидрон А., Кемпкер Р., Моанна А., Римланд Д. Метициллин-устойчивый Staphylococcus aureus у ВИЧ-инфицированных пациентов. Устойчивость к заражению лекарствами. 2010; 3: 73–86. pmid: 21694896 - 15.
Paulino C, Garcia RD, Ong S. Staphylococcus aureus Показатели носительства среди детей в возрасте от одного до пяти лет в Барангае-Пио-дель-Пилар, Макати: ретроспективное когортное исследование, сравнивающее эффективность излечения ампициллина, хлорамфеникола, ампициллина и хлорамфеникола комбинация и цефалоспорины третьего поколения в качестве начальной антибактериальной терапии.Pediatr Infect Dis J. 2013; 14 (1): 24–33. - 16.
Кеджела Т., Бача К. Распространенность и картина чувствительности к антибиотикам метициллин-устойчивого Staphylococcus aureus (MRSA) среди детей начальной школы и заключенных в городе Джимма, юго-запад Эфиопии. Анн Клин Микробиол Антимикроб. 2013; 12: 2–11. - 17.
Брюггер С.Д., Фрей П., Эби С., Хайндс Дж., Мюлеманн К. Множественная колонизация с S . pneumoniae до и после введения семивалентной конъюгированной пневмококковой полисахаридной вакцины.PLoS One 5: e11638. pmid: 20661289 - 18.
Quintero B, Araque M, Jongh CUG, Hermans PWM. Эпидемиология колонизации Streptococcus pneumoniae и Staphylococcus aureus у здоровых венесуэльских детей. Eur J Clin Microbiol Infect Dis. 2011; 30: 7–19. pmid: 20803226 - 19.
Кейси Дж. Р., Адловиц Д. Г., Пичичеро МЭ. Новые паттерны отопатогенов, вызывающих острый средний отит, через шесть-восемь лет после введения пневмококковой конъюгированной вакцины.Pediatr Infect Dis J. 2010; 29: 304–309. pmid: 19935445 - 20.
NdipR N, Ntiege EA, NdipI M, Nkwelang G, Akoachere JF, NkuoAkenji T. Устойчивость к противомикробным препаратам бактериальных агентов верхних дыхательных путей школьников в Буэа, Камерун. J Health Popul Nutr. 2008; 26 (4): 397–404. pmid: 118 - 21.
Bauer AW, Kirby WMM, Sherris JC, Turck M. Тестирование чувствительности к антибиотикам стандартным методом с одним диском. Am J Clin Path. 1966; 45: 493–496. pmid: 5325707 - 22.Институт клинических лабораторных стандартов. Стандарты эффективности тестирования на чувствительность к противомикробным препаратам; Двадцать пятая информационная. Добавка. Документ CLSI M100-S25. Уэйн, Пенсильвания: CLSI, 2015.
- 23.
Gebremedhn G, TeweldeGebremariam TT, Wasihun AG, Dejene TA, Saravanan M. Распространенность и факторы риска колонизации устойчивых к метициллину Staphylococcus aureus среди пациентов с ВИЧ в Мекелле, Северная Эфиопия. Springer Plus. 2016; 5: 877. pmid: 28443214 - 24.Thummeepak R, Leerach N, Kunthalert D, Tangchaisuriya U, Thanwisai AC, Sitthisak S. Высокая распространенность мультирезистентного Streptococcus pneumoniae среди здоровых детей в Таиланде. J заразить общественное здравоохранение. 2015; 8: 274–281. pmid: 25541228
- 25.
Гебре Т., Тадессе Т., Арагау Д., Фейе Д., Бейене Х.Б., Сейюм Д., Меконнен М. Носоглоточное носительство и паттерны чувствительности к антимикробным препаратам Streptococcus pneumoniae среди детей в возрасте до пяти лет на юго-западе Эфиопии.Дети. 2017; 4:27; pmid: 28422083 - 26.
Сувада Дж., Лискова А., Сладецкова В., Бенка Дж., Горнерова Л., Миколасова Г. Чувствительность к антибиотикам респираторных изолятов среди ВИЧ-положительных детей в Кыргызстане выше по сравнению с детьми Камбоджи: важен ли амбулаторный статус? CSWHI 2016; 7 (3): 35–37. - 27.
Торун М.М., Намал Н., Демирджи М., Бахар Х. Носоглоточное носительство и устойчивость к антибиотикам Haemophilus influenzae , Streptococcus pneumoniae и Morraxella catarrhalis у здоровых школьников в Турции.Индийский журнал J Med Microbiol.2017; 30 (27): 86–88. - 28.
Наахер П., Тамм Э., Пуцепп А., Колиалг С., Майметс М. Носоглоточное носительство и антибактериальная чувствительность Streptococcus pneumoniae , Haemophilus influenzae и Moraxella catarrhalis у детей Эстонии. Clin Microbiol Infect. 2000; 6 (12): 675–677. pmid: 11284928 - 29.
Nackers F, Cohuet S, Waroux OP, Langendorf C, Nyehangane D, Ndazima D, et al. Распространенность носительства и распределение серотипов Streptococcus pneumoniae до внедрения 10-валентной пневмококковой вакцины: популяционное поперечное исследование в Юго-Западной Уганде, 2014 г.Вакцина. 2017; 5271–5277. pmid: 28784282 - 30.
Бхаттачарья С.Д., Нийогиск С.К., Бхаттачарья С., Фитцуотер С., Чаухан Н., Судар А., Мандал С. Высокая скорость колонизации лекарственно-устойчивыми Haemophilus influenzae типа B и Streptococcus pneumoniae у невакцинированных ВИЧ-инфицированных детей из Западной Бенгалии. Индийский J Pediatr. 2011; 78 (4): 423–429. pmid: 21165717 - 31.
Сампан-Донкор Э., Бадое Э.В., Аннан Дж. А., Нии-Треби Н. Колонизация устойчивых к антибиотикам бактерий в когорте ВИЧ-инфицированных детей в Гане.Pan Afri Med J. 2017; 26:60 pmid: 28451037 - 32.
Rutebemberwa E, Mpeka B, Pariyo G, Peterson S, Mworozi E, Bwanga F и др. Высокая распространенность устойчивости к антибиотикам в изолятах носоглоточных бактерий от здоровых детей в сельских районах Уганды: перекрестное исследование. Ups J Med Sci. 2015; 120: 249–256. pmid: 26305429 - 33.
Кинабо Г.Д., Вандервен А., Л.Мсуя Л.Дж., Шайо А.М., Шимана В., Ндаро А. и др. Динамика бактериальной колонизации носоглотки у младенцев раннего возраста, контактировавших с ВИЧ, в Танзании. Trop Med Int Health.2013; 18 (3): 286–295. pmid: 23320622 - 34.
Хлопок М.Ф., Вассерман Э., Смит Дж., Вайтлоу А, Зар Х.Дж. Высокая частота устойчивых к противомикробным препаратам организмов, включая энтеробактерии, продуцирующие бета-лактамазы расширенного спектра, и устойчивый к метициллину Staphylococcus aureus в носоглоточных изолятах и изолятах крови ВИЧ-инфицированных детей из Кейптауна, Южная Африка. BMC Infect Dis. 2008; 20:40, id: 18380900 - 35.
Чочуа С., Д’Акремонт В., Ханке С., Альфа Д., Шак Дж., Киловоко М. и др.Повышенная плотность носоглотки и одновременное носительство Streptococcus pneumoniae , Haemophilus influenzae и Moraxella catarrrhalis связаны с пневмонией у детей с лихорадкой. PLoS ONE 11 (12): e0167725. pmid: 276
- 36.
Бхуян Г.С., Хоссейн М.А., Саркер С.К., Рахат А., Ислам М.Т., Хак Т.Н. и др. Спектры бактериальных и вирусных патогенов острых респираторных инфекций у детей до 5 лет в больницах города Дакка. PLOS ONE.2017; https: //doi.org/10.1371/journal.pone.0174488 - 37.
Huebner RE, Wasas A, Mushi A, Mazhani, Klugman K. Назофарингеальное носительство и устойчивость к противомикробным препаратам у изолятов Streptococcus pneumoniae и Haemophilus influenzae типа b у детей в возрасте до 5 лет в Ботсване. Int J Infect Dis. 1998; 3: 18–25. pmid: 9831671 - 38.
Мойо С.Дж., Стейнбек М., Абуд С., Мкопин Н., Касуби М., Бломберг Б. и др. Устойчивость к пенициллину и распределение серотипов Streptococcus pneumoniae у детей в возрасте до пяти лет, носящих носоглотку, в Дарес-Салам, Танзания.J Med Microbiol. 2012; 61: 952–959. pmid: 22442292 - 39.
Hill PC, Akisanya A, Sankareh K, Cheung YB, Saaka M, Lahai G и др. Носоглоточное носительство Streptococcus pneumoniae у жителей села Гамбии. Clin Infect Dis, 2006; 43: 673–679. pmid: 167 - 40.
Джонни М., Бабелли М., Аль-Обейд I, Аль-Бенван К., Удо Э. Устойчивость к противомикробным препаратам клинических изолятов Streptococcus pneumoniae в специализированной больнице в Кувейте, 1997–2007 годы: значение для эмпирической терапии.J заразить общественное здравоохранение. 2010; 3: 60–66. pmid: 20701893 - 41.
Сафари Д., Курниати Н., Васлия Л., Хоер М. М., Путри Т., Богерт Д. Распределение серотипов и чувствительность к антибиотикам штаммов Streptococcus pneumoniae , переносимых детьми, инфицированными вирусом иммунодефицита человека. PLoS ONE 9 (10): e110526. pmid: 25343448 - 42.
Шариф М., Чоудхари Дж., Захур С., Деб М. Характеристика изолятов Streptococcus pneumoniae из Индии с особым упором на их типы последовательностей.J Infect Dev Ctries. 2013; 7 (2): 101–109. pmid: 23416655 - 43.
Mwenya DM, Charalamboos BM, Phillips PPJ, Mwansa JCL, Batt SC, Nunn AJ, et al. Влияние котримоксазола на носительство и устойчивость к антибиотикам Streptococcus pneumoniae и Haemophilus influenzae у ВИЧ-инфицированных детей в Замбии. Антимикробные агенты Chemother.2010; 54 (9): 3756–3762. pmid: 20585110 - 44.
Маркизио П., Жирони С., Эспозито С., Скито Г.С., Маннелли С., Принципин Н. и др.Сезонные колебания носоглоточного носительства респираторных патогенов у здоровых итальянских детей, посещающих детские сады или школы. J Med Microbiol. 2001; 50 (2001): 1995–1099.
IJERPH | Бесплатный полнотекстовый | Обнаружение золотистого стафилококка в глотке как возможного фактора, связанного с чувствительностью к отвращению у людей
1. Введение
Отвращение — это эмоция самозащиты, которая вызывает негативное воздействие на потенциально болезнетворные источники, вызывая поведенческое избегание патогенов и различных приспособлений. снижение активности.Хотя поведенческое отвращение, вызванное отвращением, дает очевидные преимущества, связанные с предотвращением инфекций [1,2], существуют также затраты, такие как избирательность питания, потеря энергии и время, затрачиваемое на предотвращение болезней. Таким образом, чтобы быть адаптивной, поведенческая иммунная система должна быть гибкой, варьироваться в зависимости от индивидуального уровня иммунитета и риска заражения патогенами [2, 3], и более сильные отвращающие реакции должны возникать, когда иммунитет низкий, воспринимающие более восприимчивы к инфекции, и потенциальная стоимость инфекции высока [2].Предыдущие исследования показали, что уровень здоровья и иммунитета может объяснить межличностные и внутриличностные различия в чувствительности к отвращению. Например, женщины в первом триместре беременности, когда материнский иммунитет подавлен, проявляют повышенную чувствительность к отвращению [4]. Более того, лонгитюдные исследования показали, что изменения в чувствительности к патогенам отвращения в менструальном цикле соответствуют изменениям иммуноуязвимости, которая колеблется в пределах цикла после изменений в уровнях иммуномодулирующих гормонов, таких как прогестерон [5,6]; но см. также без результата [2,7].Кроме того, кокаинозависимые люди, чьи иммунные функции нарушены, проявляют гиперчувствительность к стимулам, несущим риск заражения, и увеличение секреции слюнного ИЛ-6 в ответ на провокацию отвращения, что, возможно, указывает на механизм предупреждения неизбежного инфекционного заражения [ 8]. Кроме того, было показано, что самооценка здоровья и частота инфекций, о которых сообщают сами, отрицательно связаны с повышенной чувствительностью к заражению [3,9] или со страхом перед беспозвоночными, имеющими отношение к болезни [10].Недавно было показано, что избегание патогенов связано с более сильной реакцией на угрозу COVID-19 [11]. Другие исследования показали, что чувствительность к патогенам отрицательно связана с силой захвата рук, простой мерой общего состояния здоровья человека [12]. Кроме того, было показано, что чувствительность к отвращению увеличивается с возрастом, когда иммунная система ослабевает [13]. Более того, чувствительность к отвращению также влияет на социальное поведение и отношения в ситуациях, связанных с риском заражения некоторыми патогенами.Ксенофобия (отрицательное отношение к другим) и этноцентризм (положительное отношение к собственной культурной группе), по-видимому, положительно связаны с риском заболевания в данной географической области [14,15]. Кроме того, люди, получившие высокие баллы по показателю предполагаемой уязвимости к болезням, с меньшей вероятностью сообщали о наличии друзей или знакомых с ограниченными возможностями и имели более сильное антииммигрантское отношение к иммигрантам из субъективно чужих мест [16,17]. Предыдущие исследования показали это отвращение. чувствительность может даже играть поддерживающую роль для физиологического иммунитета.Отвращение повышает внутреннюю температуру тела, уровень пирогенных цитокинов, таких как TNF-α, и уровень альбумина, которые являются одним из первых индикаторов активации иммунного ответа [18,19]. Визуальное восприятие симптомов инфекционного заболевания у других людей заставляет белые кровяные тельца производить более высокие уровни провоспалительных цитокинов в ответ на стимуляцию модельными бактериями. Это предполагает, что простое визуальное восприятие симптомов инфекционного заболевания может вызвать более агрессивный ответ иммунной системы [20].Золотистый стафилококк (S. aureus), широко распространенный в организме человека как комменсальная бактерия, при некоторых обстоятельствах может выступать в качестве опасного патогена. Типичной экологической нишей S. aureus у человека являются передние ноздри, но из-за его потенциала вирулентности он, безусловно, является наиболее патогенным для человека видом из рода Staphylococcus, и он может легко колонизировать многие ткани и вызывать множество острых и хронических инфекций. [21,22]. Хотя при бессимптомной долговременной колонизации S. aureus в значительной степени остается незамеченным хозяином из-за особого баланса между факторами вирулентности патогенов и механизмами защиты хозяина [23], колонизирующие штаммы вызывают активацию иммунной системы (например.g., индуцирует экспрессию антибактериальных пептидов и цитокинов) и служат эндогенным резервуаром для многих клинических инфекций [24]. Даже при местной иммуносупрессии, инфекции, вызванной другими патогенами, или когда естественные барьеры нарушаются из-за пореза кожи, ожогов или ран после операции, патоген может проникнуть в другие ткани и вызвать системную потенциально летальную инфекцию [25]. Более частые аутоинфекции наблюдаются у носителей, состояние здоровья и иммунная защита которых нарушены, т.е.например, диабетические [26] или ВИЧ-инфицированные [27]. Поскольку колонизация S. aureus часто является результатом ослабления механизмов иммунной защиты, и даже бессимптомная колонизация представляет собой постоянную угрозу как источник последующих инфекций и требует физиологических затрат на человека [28,29], можно ожидать, что она может быть связана с повышение чувствительности человека к отвращению. Симптоматическая колонизация S. aureus в верхних дыхательных путях очень распространена среди людей [30]. Примерно 20% здоровых людей почти всегда страдают от перенапряжения.Большая часть населения (около 60%) является носителем S. aureus периодически, и штаммы меняются с разной частотой. Лишь меньшинство (20%) почти никогда не переносят S. aureus [30]. Исследования показывают, что существует несколько генетических факторов, предрасполагающих к носительству S. aureus [23], и эти гены также отвечают за эффективность иммунной системы человека [31], что может свидетельствовать о связи между иммунитетом и риском бактериальной колонизации. Таким образом, в соответствии с профилактической гипотезой, объясняющей вариацию чувствительности к отвращению, можно было ожидать, что бессимптомная колонизация S.aureus может быть положительно связан с уровнем чувствительности человека к отвращению. Целью этого исследования было проверить, связана ли колонизация глотки Staphylococcus aureus с чувствительностью человека к отвращению. Мы предположили, что люди, колонизированные S. aureus, характеризуются более высокой чувствительностью к отвращению по сравнению с неколонизированными людьми. Хотя нас в основном интересовало отвращение к патогенам, компонент отвращения, который, как предполагалось, развивается, чтобы мотивировать избегание черт или веществ, связанных с болезнетворными агентами в среде предков [1], мы дополнительно проверили связь между S.aureus, а также сексуальное и моральное отвращение. Было выдвинуто предположение, что эти два компонента отвращения развиваются, чтобы мотивировать избегание сексуальных партнеров и поведение, которое может снизить долгосрочный репродуктивный успех (сексуальное отвращение: [2]), и избегать людей, которые наносят социальные издержки себе или членам своего общества. сеть (моральное отвращение: [32]). Мы предположили, что люди, колонизированные S. aureus, характеризуются более высокой сексуальной и моральной чувствительностью к отвращению по сравнению с неколонизированными.Кроме того, поскольку на уровень отвращения могут влиять некоторые продолжающиеся инфекции [33], мы контролировали воспалительное состояние на основе уровня С-реактивного белка (СРБ). Кроме того, поскольку ожирение, кортизол и тестостерон модулируют иммунные функции [34] и могут быть связаны либо с носительством S. aureus [31], либо с чувствительностью отвращения [35], эти факторы также контролировались в анализах.
2. Материалы и методы
2.1. Участники и общая процедура
Участников набирали на основе информации, размещенной в социальных сетях, информации в местных газетах и информации в местных пабах и барах.В исследовании приняли участие 95 женщин (M , возраст = 26,33, SD , возраст = 2,73) и 137 мужчин (M , возраст = 27,97, SD , возраст = 2,98). Мужчины и женщины были отобраны для участия, если они соответствовали следующим критериям: отсутствие диагностированного хронического заболевания (диабет, гипо / гипертиреоз, аутоиммунные нарушения или метаболические проблемы) или гормональных нарушений, отказ от приема каких-либо гормональных препаратов, отсутствие текущих инфекций и недавнее употребление антибиотиков. Дополнительными критериями для женщин были отказ от гормональной контрацепции и регулярный менструальный цикл (от 21 до 36 дней).Кроме того, женщин набирали в один и тот же момент менструального цикла. Их попросили связаться с исследовательской группой в 1-й день менструального цикла (самооценка) и пригласили принять участие в исследовании между 2-м и 4-м днем менструального цикла (ранняя фолликулярная фаза). Протокол, используемый для набора участников и сбора данных, был одобрен Комиссией по биоэтике при Палате врачей и стоматологов Нижней Силезии (номер утверждения HREC 1 / BO / 2016). Все участники прочитали и подписали форму информированного согласия на участие в исследовании и использовании данных в научных целях.Участники были подробно проинформированы обо всех процедурах, проведенных в исследовании, но не были проинформированы о целях исследования или экспериментальных гипотезах.
Протокол исследования состоял из взятия мазков из зева, взятия крови натощак, измерения ожирения и ответов на личный вопросник. Процентное содержание жира в организме (BFP) измеряли натощак с помощью биоимпеданса с использованием анализатора (Bodycomp MF, AKERN, Pontassieve, Италия) и компьютерного программного обеспечения (BodyGram 1.2, Akern Bioresearch, Pontassieve, Италия).Все процедуры проводились в один день, рано утром.
Общая анкета, разработанная для этого исследования, содержала вопросы о факторах, потенциально важных для уровня чувствительности отвращения или вероятности обнаружения S. aureus в глотке. Мы запросили демографические данные (дата рождения, место проживания), уровень образования и вид работы, текущие и прошлые проблемы со здоровьем, курение сигарет и употребление антибиотиков (таблица 1). Все участники заявили об отсутствии хронических или реальных проблем со здоровьем, и никто из участников не принимал антибиотики в течение последних нескольких месяцев.Чувствительность человека к отвращению или распространенность S. aureus не зависели от места проживания, уровня образования, статуса курения или вида работы (p> 0,05).
2.2. Опросник для трех областей отвращения (TDDS)
Чувствительность к отвращению измерялась с помощью трехкомпонентной шкалы отвращения (TDDS; [32]). TDDS из 21 пункта — это инструмент самоотчета, который измеряет чувствительность к отвращению отдельно для патогенных, сексуальных и моральных сфер, причем каждая подшкала содержит описание семи действий или утверждений.TDDS просит участников оценить степень, в которой они находят различные концепции отвратительными, по семибалльной шкале Лайкерта от «0» (совсем не отвратительно) до «6» (крайне отвратительно). Инструкции к анкете были следующими: «Следующие пункты описывают различные концепции. Оцените, насколько отвратительными вы находите концепции, описанные в пунктах, где 0 означает, что вы вообще не находите эту концепцию отвратительной, а 6 означает, что вы находите концепцию крайне отвратительной » Примеры патогенных элементов: «Стоять рядом с человеком, у которого есть запах тела» или «Видеть плесень на старых остатках еды в холодильнике» (α Кронбаха = 0.70). Примеры сексуального отвращения включают: «Слышать, как два незнакомца занимаются сексом» или «Незнакомец противоположного пола намеренно трет ваше бедро в лифте» (коэффициент Кронбаха α = 0,81). Вопросы, вызывающие моральное отвращение, включают «Воровство у соседа» или «Кража шоколадного батончика из круглосуточного магазина» (α Кронбаха = 0,79).
2.3. Выделение и идентификация S. aureus
Образцы мазков из горла были взяты с задней стенки глотки с использованием транспортных тампонов с закрытыми пробирками, содержащих стерильные тампоны с вискозным наконечником и транспортной средой AMIES (Deltalab, Барселона, Испания).В течение 12 часов после сбора мазки наносили штрихами на колумбийский агар с 5% овечьей кровью (кровяной агар) (Biocorp, Варшава, Польша) и солевым агаром с маннитолом (MSA) (BioMerieux SA, Marcy l’Etoile, Франция). Обе чашки инкубировали в аэробных условиях при 37 ° C: 24 часа для COS и 48 часов для MSA. Планшеты считывали через 1-2 дня инкубации. Кремовые или желтые колонии с β-гемолизом на кровяном агаре использовали в дальнейшей процедуре для идентификации S. aureus. Желтые колонии на MSA, отражающие способность штамма ферментировать маннит, были идентифицированы как S.aureus. Одиночные колонии из кровяного агара и MSA также тестировали с помощью теста агглютинации на латексных слайдах (Staphyloslide latex test kit, Becton Dickinson, Franklin Lakes, США). S. aureus обладает фактором слипания и / или протеином А и может быть легко дифференцирован с помощью теста Staphyloslide ® (Becton Dickinson, Franklin Lakes, США) от других стафилококков. Положительные результаты идентификации S. aureus были основаны как на морфологии колонии, так и на положительном тесте агглютинации. Чтобы свести к минимуму предвзятость наблюдателя, образцы были закодированы и закрыты для наблюдателя.
2.4. Общая оценка состояния здоровья
Общее состояние здоровья участников контролировалось с помощью основных физиологических параметров, обычно используемых в клинической практике. Морфология крови с мазком состоит из общего количества лейкоцитов (включая каждую субпопуляцию, например, нейтрофилы, лимфоциты и фракцию моноцитов), количества эритроцитов, количества тромбоцитов, уровня гемоглобина и гематокрита. Все участники имели параметры морфологии крови в пределах нормы или имели один параметр, немного превышающий рекомендуемый стандарт, который в клинической практике признается «здоровым».Уровень высокой чувствительности CRP (hsCRP) оценивали с использованием коммерческих наборов (номер по каталогу DE740011, Demeditec Diagnostics GmbH, Киль, Германия). Процедура тестирования проводилась в соответствии с инструкцией, прилагаемой к набору. Поскольку у нескольких участников значение вчСРБ было немного выше нормального диапазона (т.е. выше 5 мкг / мл), эта переменная контролировалась при статистическом анализе.
2,5. Измерения гормонов
Концентрации кортизола и свободного тестостерона (fT) в сыворотке измеряли с помощью иммуноферментного анализа (ELISA) и коммерческих наборов (каталожный номер DE1887 и DE2924 соответственно, Demeditec Diagnostics GmbH, Киль, Германия).Образцы сыворотки анализировали в двух экземплярах в соответствии с инструкциями производителя, прилагаемыми к набору. Как внутри, так и между анализами вариабельность была менее 10% при чувствительности анализа 2,5 нг / мл для кортизола и 0,06 пг / мл для fT. Стандартная кривая была построена путем построения графика зависимости поглощения каждого стандарта (вертикальная ось) от его концентрации (горизонтальная ось). Концентрацию каждого образца рассчитывали относительно стандартной кривой и выражали в нг / мл для кортизола и в пг / мл для fT.
2.6. Статистический анализ
Поскольку значения кортизола, тестостерона и вчСРБ не распределялись нормально, в статистическом анализе использовались логарифмические значения.
Взаимосвязь между категориальными переменными (например, пол и носительство S. aureus) анализировалась с помощью критериев хи-квадрат. Разница в контролируемых переменных (fT, кортизол, вчСРБ и ожирение) и уровень отвращения между полами и между людьми, колонизированными и неколонизированными S. aureus, были проанализированы с помощью t-критерия для независимых переменных.Связь между непрерывными переменными (чувствительность отвращения и контролируемые переменные) проверялась с использованием коэффициента корреляции.
Наконец, были запущены две модели регрессионного анализа, отдельно для мужчин и женщин, чтобы проверить взаимосвязь между присутствием S. aureus в глотке и чувствительностью отвращения при контроле на fT, кортизол, уровень hsCRP и ожирение тела. Поскольку возраст участников не был связан ни с чувствительностью к отвращению, ни со статусом глоточной колонизации S. aureus, мы не учитывали возраст в анализах.
Анализы выполняли с помощью программы Statistica 12.0 (StatSoft Polska, Краков, Польша). Результаты были достоверными на уровне p <0,05.
3. Результаты
3.1. Описательная статистика
Описательная статистика и половые различия в чувствительности к отвращению представлены в таблице 2. Женщины проявляли более высокую общую чувствительность к отвращению, что в основном было обусловлено разницей в чувствительности к сексуальному отвращению (таблица 2). Описательная статистика контролируемых переменных (кортизол, fT) , вчСРБ и ожирение) для мужчин и женщин отдельно представлены в таблице 3.
Результаты корреляционного анализа Пирсона показали, что общий (r = -0,09, p = 0,30, CI95% [-0,25; 0,98]), моральный (r = 0,01, p = 0,88, CI95% [-0,16; 0,18]), и чувствительность к патогенам отвращения (r = 0,04, p = 0,64, CI95% [-0,13; 0,21]) не коррелировали с уровнем fT, но чувствительность к сексуальному отвращению отрицательно коррелировала с fT у мужчин (r = -0,23, p = 0,01, ДИ 95% [-0,38; -0,06]). Уровень кортизола не коррелировал с общим (r = -0,03, p = 0,73, CI95% [-0,20; 0,14]) патогеном (r = -0,02, p = 0.82, ДИ 95% [-0,19; 0,15]) или чувствительности к моральному отвращению (r = 0,13, p = 0,14, CI95% [-0,04; 0,29]), но это незначительно, отрицательно коррелировало с чувствительностью к сексуальному отвращению (r = -0,17, p = 0,052, CI95%. [-0,33; -0,002]) у мужчин. Уровень вчСРБ не коррелировал с общим (r = 0,03, p = 0,73, CI95% [-0,14; 0,20]), патогеном (r = 0,04, p = 0,60, 95% CI [-0,13; 0,21]), половым (r = 0,05, p = 0,59, CI95% [-0,12; 0,22]), ни с чувствительностью к моральному отвращению (r = -0,03, p = 0,73, CI95% [-0,20; 0,14]). Ожирение не коррелировало с общим (r = -0.01, р = 0,93, ДИ 95% [-0,18; 0,16]), морального (r = -0,16, p = 0,06, 95% доверительного интервала [-0,32; 0,01]), сексуального (r = 0,01, p = 0,86, 95% доверительного интервала [-0,16; 0,18]) и чувствительности к патогенам ( r = 0,13, p = 0,12, CI95% [-0,04; 0,29]) у мужчин.
Результаты корреляционного анализа Пирсона показали, что у женщин общее (r = -0,08, p = 0,46, CI95% [-0,27; 0,12]), моральное (r = 0,02, p = 0,85, CI95% [-0,18; 0,22]), сексуальной (r = -0,03, p = 0,74, CI95% [-0,23; 0,17]) и чувствительности к патогенам (r = -0,15, p = 0,14, CI95% [-0.34; 0,05]) не коррелировали с уровнем fT. Уровень кортизола не коррелировал с общим (r = -0,16, p = 0,12, CI95% [-0,35; 0,04]), моральным (r = -0,10, p = 0,33, CI95% [-0,29; 0,10]) и патогеном. чувствительность к отвращению (r = 0,05, p = 0,63, CI95% [-0,15; 0,25]), но отрицательно коррелировала с чувствительностью к сексуальному отвращению (r = -0,25, p = 0,01, CI95% [-0,43; -0,05]) у женщин. . Уровень hsCRP не коррелировал с общим (r = -0,06, p = 0,58, CI95% [-0,26; 0,14]), моральным (r = -0,16, p = 0,13, CI95% [-0,35; 0.04]), сексуальной (r = 0,04, p = 0,72, CI95% [-0,16; 0,24]) и чувствительности к патогенам отвращения (r = -0,004, p = 0,97, 95% CI [-0,20; 0,20]) у женщин. Ожирение не коррелировало с общим (r = -0,10, p = 0,34, CI95% [-0,29; 0,10]), моральным (r = -0,01, p = 0,92, CI95% [-0,21; 0,19]), сексуальным ( r = -0,10, p = 0,31, CI95% [-0,29; 0,10]) и чувствительность к патогенам отвращения (r = -0,09, p = 0,39, CI95% [-0,28; 0,11]) у женщин.
Результаты теста хи-квадрат показали, что S. aureus чаще выявляется у женщин по сравнению с мужчинами (X 2 (1) = 7.74, р = 0,005). В общей сложности 47 мужчин (против 90 без S. aureus) и 50 женщин (против 45 без S. aureus) были колонизированы S. aureus.
3.2. Чувствительность к отвращению и колонизация глотки S. aureus
Результаты t-теста показали, что разница в чувствительности к отвращению между колонизированными и неколонизированными людьми была значительной только у мужчин. Мужчины, колонизированные S. aureus, проявляли более сильное отвращение к патогенам (p = 0,04) по сравнению с неколонизированными мужчинами. Разница в чувствительности к сексуальному отвращению между людьми, колонизированными и неколонизированными S.aureus был близок к уровню статистической значимости на уровне p = 0,06, а колонизированные мужчины демонстрировали более высокую чувствительность к сексуальному отвращению. Не было различий в чувствительности к моральному отвращению между колонизированными и неколонизированными мужчинами (таблица 4). Модель регрессии показала, что колонизация S. aureus была связана только с отвращением к патогенам у мужчин, но не у женщин, и при контроле на ожирение, кортизол, фт и Уровни вчСРБ (таблица 5).
4. Обсуждение
Результаты нашего исследования показали, что мужчины, колонизированные S.aureus проявлял более высокую чувствительность к отвращению по сравнению с неколонизированными мужчинами. Женщины в целом проявляли более высокую чувствительность к отвращению по сравнению с мужчинами, но не было никакого влияния статуса колонизации S. aureus на уровень чувствительности к отвращению у женщин. Также стоит отметить, что половая разница в чувствительности отвращения была вызвана областью сексуального отвращения, тогда как разница, наблюдаемая для общей чувствительности отвращения у колонизированных и неколонизированных мужчин, в основном определялась областью отвращения к патогенам.Разница в чувствительности к отвращению между колонизированными и неколонизированными мужчинами не зависела от иммуномодулирующих гормонов (тестостерона и кортизола), маркеров воспаления (вчСРБ) или ожирения.
Эндогенная инфекция S. aureus может быть чрезвычайно инвазивной из-за его способности продуцировать многие факторы вирулентности, такие как адгезивные белки, поверхностные молекулы, капсульные полисахариды и высоковирулентные токсины (токсин синдрома токсического шока, энтеротоксин B или лейкоцидин Пантона-Валентина) , что делает возможным распространение бактерий, инвазию тканей хозяина и лизис клеток [36].Хотя в бессимптомном состоянии носительства экспрессия токсинов снижена, во время активной инфекции токсины могут экспрессироваться в больших количествах [37]. Повышенное избегание потенциально инфекционных агентов, вызванное повышенной чувствительностью отвращения к патогенам у бессимптомных носителей, может помочь снизить риск развития аутоинфекции, чтобы минимизировать возможные вредные эффекты повышенной экспрессии токсинов. Кроме того, поскольку отвращение повышает эффективность иммунной системы, вызывая более агрессивный ответ [3,18,19,20], повышается чувствительность к патогенам отвращения у людей, колонизированных S.aureus может повышать иммунную защиту, помогая поддерживать баланс между факторами вирулентности S. aureus и эффективностью иммунной системы хозяина. Половые различия во взаимосвязи между чувствительностью к патогенам и присутствием S. aureus в глотке могут быть объяснены половыми различиями в иммунитете. Успешная колонизация S. aureus зависит от многих факторов, включая бактериальную вирулентность (способность проникать в ткани хозяина), а также эффективность механизмов иммунной защиты хозяина. Хорошо задокументировано, что пол влияет на форму иммунного ответа, что отражается в более низкой распространенности аутоиммунных заболеваний, более высокой восприимчивости к инфекции, более низкой антибактериальной иммунной защите и более низком иммунном ответе на вакцину у мужчин по сравнению с женщинами [38,39].Предыдущие исследования показали, что риск многих серьезных инфекций выше у колонизированных S. aureus по сравнению с неколонизированными людьми [22,28]. Новоприобретенные патогены могут не только инициировать процесс распространения комменсального S. aureus, приводящего к переходу S. aureus от бессимптомного носительства к инфекции и вызывая серьезные заболевания [40], но также часто возникают сочетанные инфекции S. более вирулентный и более устойчивый к эрадикации с помощью фармакологического лечения, чем инфекция одним патогеном [41,42].Поскольку мужчины более уязвимы к инфекциям по сравнению с женщинами [38,39,43], они также могут получить больше пользы от повышенного избегания патогенов, будучи носителями S. aureus. Половые различия в иммунитете предположительно связаны с иммуносупрессивными свойствами тестостерона [44 ]. Однако в нашем исследовании уровень тестостерона не влиял на взаимосвязь между чувствительностью к патогенам отвращения и статусом колонизации S. aureus ни у мужчин, ни у женщин. Кроме того, несмотря на то, что уровень кортизола способствует восприимчивости к стресс-индуцированным инфекциям [34,45], а полиморфизм в гене рецептора глюкокортикоидов влияет на состояние носительства S.aureus [31,46], как и уровень тестостерона, не было обнаружено различий в уровне кортизола между людьми, колонизированными и неколонизированными S. aureus, что позволяет предположить, что генетика и другие факторы хозяина более важны, чем уровни гормонов как таковые [47]. более высокое сексуальное отвращение по сравнению с мужчинами, но не было никакой разницы в сексуальном отвращении между женщинами, которые были колонизированы, и женщинами, которые не были колонизированы S. aureus. Разница в чувствительности к сексуальному отвращению между колонизированными и неколонизированными мужчинами была близка к статистической значимости, что позволяет предположить, что S.носительство aureus может также повлиять на чувствительность к сексуальному отвращению только у мужчин. Сексуальное избегание, мотивированное отвращением, каким-то образом отличается от избегания патогенов с точки зрения природы оптимального поведения избегания, а также потому, что оценка пригодности партнера и риска заражения требует различных наборов информации [32]. В то время как обнаружение патогенов основывается на таких сигналах, как биологические жидкости, грязь или плесень, оценка пригодности партнера зависит также от других сигналов, многие из которых не имеют отношения к проксимальному избеганию патогенов (например,g., избегание сигналов о возможном инцесте). Таким образом, изменение чувствительности к сексуальному отвращению может быть не столь выраженным, как смещение домена отвращения к патогенам в ответ на потенциально инфекционные агенты. Кроме того, результаты нашего исследования показали, что чувствительность к сексуальному отвращению отрицательно связана с уровнем кортизола (хотя для мужчин результат был лишь незначительно значимым). Было показано, что уровень кортизола отрицательно связан с биологическим состоянием человека и ценностью партнера [48], поэтому можно ожидать, что люди с более высоким уровнем кортизола (т.е., менее привлекательный) должен демонстрировать более низкую чувствительность к сексуальному отвращению, позволяя снизить выбор и сексуальную вседозволенность, увеличивая шансы на воспроизводство. У женщин сексуальное отвращение также отрицательно связано с более высоким ожирением и положительно с уровнем вчСРБ, двумя факторами, которые могут быть связаны с более низкой привлекательностью женщины, ее воспринимаемым здоровьем и ценностью партнера [48,49]. Однако необходимы дальнейшие исследования с использованием нескольких гормональных измерений, чтобы проверить взаимосвязь между уровнем кортизола и восприимчивостью к сексуальному отвращению у обоих полов.Мы не обнаружили связи между присутствием S. aureus в глотке и чувствительностью к моральному отвращению. Моральное отвращение относится к социальным нарушениям, включая антиобщественные действия, такие как ложь, обман и воровство, которые причиняют прямой вред другим и / или приводят к диффузным издержкам для социальной группы. Такое поведение напрямую связано с издержками и может нарушить отношения сотрудничества, социальные сети и сплоченность группы [35]. Хотя все три области отвращения имеют общие нейронные корреляты [50], моральное отвращение вызывается разными сигналами, имеет разные личностные корреляты [51], а также мотивирует поведенческую стратегию, отличную от патогена и сексуального отвращения [35].Принимая во внимание, что отвращение патогенов, как ожидается, будет мотивировать непосредственное избегание предполагаемых рисков заражения, а сексуальное отвращение побуждает избегать людей в конкретном контексте сексуальных взаимодействий, моральное отвращение должно мотивировать избегание социальных отношений с людьми, нарушающими нормы [35] и, таким образом, может быть необязательно связанных с функционированием иммунной системы. Наконец, необходимо устранить некоторые ограничения нашего исследования. Основное ограничение заключается в том, что для определения S.статус колонизации aureus. Хотя не существует стандартной процедуры, определяющей, сколько мазков позволяет определить статус носительства, некоторые продольные исследования показывают, что для диагностики стойкого носительства необходимы два последовательных положительных результата мазков с S. aureus, полученные в течение нескольких дней [52]. В соответствии с этим группа «носителей» в этом исследовании может включать как прерывистых, так и постоянных носителей S. aureus. Поскольку стойкие носители имеют более высокую бактериальную нагрузку [53], более высокий титр специфических антител [23] и более высокий риск последующих инфекций [28] по сравнению с прерывистыми носителями, можно ожидать, что эти две группы также могут различаться по чувствительности к отвращению и должны быть анализируются отдельно.Однако эти предположения потребуют дальнейших исследований, поскольку, основываясь на результатах этого исследования и современной литературе, мы не можем объяснить непосредственный механизм взаимосвязи между присутствием S. aureus в глотке и чувствительностью человека к отвращению. Неясно, может ли титр специфических антител или более высокая бактериальная нагрузка влиять на профилактическое поведение носителя или существует какой-то другой механизм, определяющий взаимосвязь между колонизацией S. aureus и чувствительностью к отвращению. Кроме того, в дальнейших исследованиях стоит попытаться охарактеризовать обнаруженный S.aureus с точки зрения генов вирулентности, которые придают способность вызывать различные заболевания, чтобы дифференцировать потенциальную патогенность отдельных штаммов и ее связь с индивидуальной чувствительностью к отвращению. может не точно отражать реальное поведение избегания. Более отчетливые эффекты и более сильные реакции могли бы наблюдаться, если бы люди столкнулись с более экологически обоснованными возбудителями отвращения, например.ж., фотографии, фильмы, предметы [4], или были опрошены об их поведении в реальной жизни. Кроме того, помимо кортизола и тестостерона, другие гормоны, которые не контролировались в этом исследовании (например, прогестерон), также могут влиять на чувствительность человека к отвращению [5,6]. Хотя недавние исследования показали, что изменения уровня половых гормонов в менструальном цикле не связаны с чувствительностью к отвращению [7], в будущих исследованиях стоит контролировать уровни эстрадиола и прогестерона. Кроме того, это позволит проверить момент менструального цикла, о котором он сам сообщил.Наконец, можно также предположить, что, если латентное присутствие S. aureus в глотке может повлиять на чувствительность человека к отвращению, также возможно, что другие латентные патогены (например, вирус Эпштейна-Барра, цитомегаловирус и т. Д.), Которые не были включены в это исследование , также может играть роль в модулировании чувствительности к отвращению. Это следует проверить в будущих исследованиях.
Нормальная бактериальная флора человека
Нормальная бактериальная флора человека (страница 3)
(В этой главе 5 страниц)
© Кеннет Тодар, доктор философии
The
Состав нормальной флоры.
Нормальная флора человека чрезвычайно сложна и состоит из
из
более
более 200 видов бактерий.Состав нормальной флоры может быть
под влиянием различных факторов, включая генетику, возраст, пол, стресс,
питание
и
диета индивидуума.
Три изменения в развитии человека, отлучение от груди,
прорезывание зубов, а также появление и прекращение
функций яичников, неизменно влияют на состав нормального
Флора
в кишечном тракте, полости рта и влагалище соответственно.Однако в пределах этих колебаний бактериальная флора
из
человека достаточно постоянен, чтобы дать общее описание
ситуация.
Человек впервые становится колонизированным нормальной флорой в момент
рождение и прохождение по родовым путям.В утробе матери плод
бесплодна, но когда у матери рвутся воды и начинается процесс родов
начинается колонизация поверхностей тела. Обработка и
кормление младенца после рождения приводит к установлению
стабильная нормальная флора на коже, полости рта и кишечном тракте при
около 48
часы.
Было подсчитано, что взрослый человек имеет около 10 12
бактерии на коже, 10 10 во рту и 10 14
в желудочно-кишечном тракте. Последнее число намного превышает
то
количество эукариотических клеток во всех тканях и органах, которые составляют
человек.Преобладающие бактерии на поверхности
человеческого тела перечислены в Таблице 3. Неофициальные названия идентифицируют бактерии.
в этой таблице.
Официальные таксономические названия организмов приведены в таблице 1. Таблица
3.
Преобладающие бактерии в различных анатомических точках у взрослых.
| Анатомический Расположение | преобладающий бактерии |
| Кожа | стафилококки и коринебактерии |
| Конъюнктива | разреженный, Грамположительные кокки и Грамотрицательные палочки |
| Полость рта | |
зубы | стрептококков, лактобациллы |
слизистые оболочки | стрептококков и молочный кислые бактерии |
| верхний дыхательные пути | |
ноздри (носовые перепонки) | стафилококки и коринебактерии |
глотка (горло) | стрептококков, нейссерия Грамотрицательные палочки и кокки |
| Нижний дыхательные пути | нет |
| Желудочно-кишечный тракт тракт | |
желудок | Хеликобактер pylori (до 50%) |
тонкий кишечник | молочнокислый, кишечные препараты, энтерококки, бифидобактерии |
толстая кишка | бактероидов, молочнокислые, кишечные, энтерококки, клостридии, метаногены |
| Мочевыводящие пути | |
передняя уретра | разреженный, стафилококки, коринебактерии, энтерикс |
влагалище | молочная кислота бактерии во время детородные годы; в остальном смешанный |
Нормальная флора кожи
взрослый
человек покрыт примерно 2 квадратных метра кожи.В
плотность
и состав нормальной флоры кожи меняется в зависимости от анатомических
локаль.
Высокая влажность подмышечной впадины, паха и участков между ними.
пальцы ног
поддерживает активность и рост относительно высоких плотностей
бактериальный
клеток, но плотность бактериальных популяций на большинстве других участков составляет
довольно низкий, обычно в 100 или 1000 на квадратный сантиметр.Большинство бактерий на
кожа секвестрируется в потовые железы.
Кожные микробы, встречающиеся в большинстве
поверхностный
слои эпидермиса и верхние части волосяных фолликулов
Грамположительные кокки ( Staphylococcus epidermidis и Micrococcus
sp.) и коринебактерии, такие как Propionibacterium
sp. Как правило, они непатогенные и непатогенные.
обдуманный
быть комменсалом, хотя мутуалистические и паразитические роли
назначенный
им. Например, стафилококки и пропионибактерии производят жирные
кислоты, подавляющие рост грибков и дрожжей на
кожа.Но если
Propionibacterium acnes, а
нормальный обитатель кожи, становится
попавший в волосяной фолликул, он может быстро расти и вызывать воспаление
и
угревая сыпь.
Иногда потенциально патогенным Staphylococcus aureus является
обнаруживается на лице и руках у носовых
перевозчики.Это потому, что лицо и руки могут стать
заражены бактериями на носовых оболочках. Такие люди
могут автоматически заразиться патогеном или передать его другим
люди или продукты.
Нормальная Флора
Конъюнктива
Из нормальной конъюнктивы можно культивировать различные бактерии,
но
количество организмов обычно невелико. Эпидермальный стафилококк
и некоторые коринеформы (Propionibacterium
acnes) являются доминирующими. Стафилококк
aureus, некоторые стрептококков, Haemophilus sp. и Neisseria
sp. иногда встречаются. Конъюнктива остается влажной и здоровой
по
непрерывные выделения из слезных желез.Мигание стирает
конъюнктива каждые несколько секунд механически смывает посторонние предметы
включая бактерии. Слезные выделения (слезы) также содержат:
бактерицидный
вещества, в том числе лизоцим. Возможности для
микроорганизмы
колонизировать конъюнктиву без специальных механизмов прикрепления к
эпителиальные поверхности и некоторая способность противостоять атаке лизоцима.
Патогены
которые действительно инфицируют конъюнктиву (например, Neisseria gonorrhoeae и
Хламидиоз
trachomatis ), как полагают, могут прикрепляться к
конъюнктивальный
эпителий. Новорожденные младенцы могут быть особенно предрасположены к бактериальным заболеваниям.
вложение.С хламидиозом
и Нейссерия может быть
присутствует на эпителии шейки матки и влагалища инфицированной матери,
нитрат серебра или антибиотик может быть введен в глаза новорожденному, чтобы
избегать заражения после прохождения по родовым путям.
Рисунок
4.Колонии
из Propionibacterium
угри,
обнаруживается на коже и конъюнктиве.
Нормальная флора дыхательных путей
Урочище
Большое количество видов бактерий колонизируют верхние дыхательные пути.
тракт
(носоглотка).Ноздри (ноздри) всегда сильно колонизированы,
преимущественно с Staphylococcus
epidermidis и коринебактерии, а часто (примерно в 20% случаев
Общее
популяция) с золотистым стафилококком, из которых являются основными
перевозчик
местонахождение этого важного возбудителя.Здоровые носовые пазухи, напротив,
стерильный. Глотка (горло) обычно заселяется
стрептококки и различные грамотрицательные кокки. Иногда возбудители такие
как Streptococcus
pneumoniae, Streptococcus pyogenes, Haemophilus influenzae и Neisseria
meningitidis колонизируют глотку.
Нижние дыхательные пути
(трахея,
бронхи,
и легочные ткани) практически не содержат микроорганизмов,
в основном из-за эффективного очищающего действия реснитчатого
эпителий
который выстилает тракт.Любые бактерии, достигающие нижних дыхательных путей.
тракт
уносятся вверх под действием мукоцилиарного покрова, которое выстилает
то
бронхи, которые впоследствии удаляются при кашле, чихании, глотании,
и т. д. Если эпителий дыхательных путей повреждается, как в
бронхит
или вирусная пневмония, человек может стать восприимчивым к инфекции
патогенами, такими как H.influenzae или
С.
pneumoniae , спускающаяся из носоглотки.
Нормальная флора мочеполовых органов
Урочище
Моча обычно стерильна, и поскольку мочевыводящие пути промываются
мочу каждые несколько часов, у микроорганизмов проблемы с доступом и
становясь установленным.Флора передней уретры по показаниям
в основном
посева мочи, предполагает, что в районе моего проживания
относительно
стабильная нормальная флора, состоящая из S taphylococcus epidermidis,
Энтерококк
faecalis и некоторые альфа-гемолитические стрептококки.Их количество
нет
однако в изобилии. Кроме того, некоторые кишечные бактерии (например, E.
coli, Proteus )
и коринебактерии, которые, вероятно, являются загрязнителями кожи,
вульва
или прямая кишка, иногда может быть обнаружена в передней части уретры.
Влагалище становится колонизированным вскоре после рождения коринебактериями,
стафилококки, стрептококки, E. coli и молочная кислота
бактерия
исторически
названный «палочка Додерлейна» ( Lactobacillus acidophilus ).В течение
репродуктивная жизнь, от полового созревания до менопаузы, вагинальный эпителий
содержит
гликоген из-за действия циркулирующих эстрогенов. Додерлейна
бацилла
преобладает, будучи способным метаболизировать гликоген до молочной кислоты. В
молочная кислота и другие продукты метаболизма подавляют колонизацию
все
кроме этой лактобациллы и определенного количества молочной кислоты
бактерии.В результате низкий pH влагалищного эпителия предотвращает образование
по
большинство других бактерий, а также потенциально патогенные дрожжи, Candida
albicans.
Это
является ярким примером защитного действия нормального бактериального
флора для своего человеческого хозяина.
Рисунок
5. Вид Lactobacillus,
возможно
Бацилла Додерлейна, в ассоциации
с вагинальной эпителиальной клеткой.
Нормальная флора ротовой полости
Полость
Наличие питательных веществ, эпителиального мусора и секрета заставляет
во рту обитает большое количество бактерий.Устный
бактерии
включают стрептококки, лактобациллы, стафилококки и коринебактерии,
с
большое количество анаэробов, особенно бактероидов.
Рот представляет собой последовательность различных экологических ситуаций
с
возраста, а это соответствует изменениям в составе нормального
Флора.При рождении полость рта состоит исключительно из мягких тканей.
губ, щек, языка и неба, которые остаются влажными благодаря
выделения
слюнных желез. При рождении полость рта стерильна, но быстро
колонизируется из окружающей среды, особенно из матери в
первое кормление. Streptococcus salivarius является доминирующим и
май
составляют 98% от общей флоры полости рта до появления зубов
(6
— 9 месяцев у человека). Прорезывание зубов в течение первого года
приводит к колонизации S. mutans и S.sanguis .
Эти
бактериям требуется недесквамационная (неэпителиальная) поверхность, чтобы
колонизировать. Они будут сохраняться до тех пор, пока остаются зубы. Другие штаммы
стрептококки
плотно прилегают к деснам и щекам, но не к зубам. В
создание
области десневой щели (опорные конструкции зубов)
увеличивается
среда обитания множества найденных анаэробных видов.Сложность
флоры полости рта со временем продолжает увеличиваться, а бактероиды и
спирохеты колонизируются в период полового созревания.
Рисунок
6. Различные
стрептококки в биопленке в полости рта.
Нормальная бактериальная флора полости рта явно выигрывает от
их хозяин, который обеспечивает питательные вещества и среду обитания.Может быть
выгоды, а также
хозяин. Нормальная флора занимает доступные места колонизации, которые
делает
другим микроорганизмам (не аборигенным видам) труднее
становиться
учредил. Кроме того, флора полости рта способствует питанию хозяина за счет
синтез витаминов, и они способствуют укреплению иммунитета, вызывая
низкий уровень циркулирующих и секреторных антител, которые могут перекрестно реагировать
с возбудителями.Наконец, бактерии полости рта проявляют микробный антагонизм.
против
некоренные виды путем производства ингибирующих веществ, таких как
жирные кислоты,
перекиси и бактериоцины.
С другой стороны, флора полости рта — обычная причина различных
оральные заболевания
у людей, включая абсцессы, кариес зубов, гингивит и
парадантоз.Если бактерии полости рта могут проникнуть в
более глубокие ткани, они могут вызвать абсцессы альвеолярной кости, легкого,
мозг или конечности. Такие инфекции обычно содержат смесь
бактерии
с Bacteroides melaninogenicus часто играет доминирующую роль.
Если оральные стрептококки попали в раны, созданные стоматологическим
манипуляции или лечение,
они могут прилипать к сердечным клапанам и
инициировать
подострый бактериальный эндокардит.
Рисунок
7. Колонии
из E. coli , растущих на агаре EMB.
Нормальный
Флора
Желудочно-кишечный тракт
Бактериальная флора желудочно-кишечного тракта животных
был изучен больше
больше, чем на любом другом сайте.Состав отличается
между
различных видов животных и внутри одного вида животных. У людей есть
различия в составе флоры, на которые влияют
возраст, диета, культурные условия и использование антибиотиков. В
последний
сильно нарушает состав кишечной флоры.
В верхних отделах желудочно-кишечного тракта взрослых людей пищевод содержит только
то
бактерии проглатываются со слюной и пищей. Из-за высокой кислотности
желудочный сок, очень мало бактерий (в основном кислотоустойчивых
лактобациллы)
можно культивировать из нормального желудка.Однако не менее половины
то
население США колонизировано патогенными бактериями,
Хеликобактер
пилори. С 1980-х годов эта бактерия была известна как
причиной язвы желудка, и, вероятно, причиной желудочных и
рак двенадцатиперстной кишки.Австралийский микробиолог Барри Маршалл,
получил Нобелевскую премию по физиологии и медицине в 2005 г. за
демонстрируя связь между Helicobacter и желудочным
язвы.
Рисунок
8. Helicobacter
пилори. ASM
В проксимальном отделе тонкой кишки относительно мало грамположительных
Флора,
состоящий в основном из лактобацилл и Enterococcus faecalis.
В этом регионе около 10 5 -10 7 бактерий на мл.
из
жидкость.Дистальная часть тонкой кишки содержит большее количество
бактерий (10 8 / мл) и дополнительных видов, в том числе
колиформные (кишечная палочка и
родные)
и Bacteroides, помимо лактобацилл и энтерококков.
Флора толстого кишечника (ободочной кишки) качественно аналогична таковой
нашел
в кале.Популяции бактерий в толстой кишке достигают уровня 10 11 / мл.
кал. Колиформы становятся более заметными, а энтерококки, клостридии и
лактобациллы можно найти регулярно, но преобладающими видами являются
анаэробный
Бактероиды
и анаэробные молочнокислые бактерии рода Bifidobacterium
( Bifidobacterium bifidum ).Этих организмов может быть больше, чем E.
кишечная палочка
от 1,000: 1 до 10,000: 1. Иногда значительное количество
анаэробный
метаногены (до 10 10 / г) могут находиться в
двоеточие
людей.Это единственная наша обычная прямая связь с археями.
Флора. Диапазон встречаемости определенных бактерий в большой
кишечник
людей показано в Таблице 4 ниже.
Таблица 4. Бактерии, обнаруженные в
толстая кишка
людей.
| БАКТЕРИЙ | ДИАПАЗОН ЗАБОЛЕВАНИЯ |
| Бактероиды fragilis | 100 |
| Бактероиды melaninogenicus | 100 |
| Бактероиды оралис | 100 |
| Lactobacillus | 20-60 |
| Clostridium perfringens | 25-35 |
| Clostridium септик | 5-25 |
| Clostridium тетани | 1-35 |
| Бифидобактерии бифидум | 30-70 |
| стафилококк aureus | 30-50 |
| Энтерококк faecalis | 100 |
| Escherichia coli | 100 |
| Сальмонелла энтеритидис | 3-7 |
| Клебсиелла sp. | 40-80 |
| Enterobacter sp. | 40-80 |
| Протеус mirabilis | 5-55 |
| Псевдомонады aeruginosa | 3-11 |
| Пептострептококк sp. | ? Общий |
| Пептококк sp. | ? Общий |
При рождении весь кишечник стерилен, но бактерии попадают в него.
с первой подачей.Первоначальные колонизирующие бактерии меняются в зависимости от пищи.
источник младенца. У младенцев, находящихся на грудном вскармливании, бифидобактерии составляют
более 90% от общего числа кишечных бактерий. Enterobacteriaceae
и энтерококки присутствуют регулярно, но в небольших количествах, в то время как
бактероиды,
стафилококки, лактобациллы и клостридии практически отсутствуют.В
искусственно вскармливаемый
у младенцев бифидобактерии не преобладают. При грудном вскармливании младенцев
являются
перешли на диету из коровьего молока или твердой пищи, бифидобактерии
постепенно
к ним присоединяются кишечные, бактероиды, энтерококки, лактобациллы и
клостридии.
Очевидно, грудное молоко содержит фактор роста, который обогащает
рост
бифидобактерий, и эти бактерии играют важную роль в
предотвращение
колонизация кишечного тракта младенцев некоренными или
патогенный
разновидность.
Рисунок
9. Clostridium
difficile. Окраска по Граму. Рост C. diff в кишечнике.
тракт обычно контролируется другими представителями нормальной флоры.
Когда антибиотики, назначаемые при других инфекциях, вызывают побочный ущерб
нормальная кишечная флора, клостридий может «вырасти»
и вызывают серьезный диарейный синдром, называемый псевдомембранозным.
колит.Это пример «диарейного заболевания, вызванного антибиотиками».
Состав флоры желудочно-кишечного тракта различен.
вместе
тракт (на продольных уровнях) и поперек тракта (на горизонтальном
уровни), где определенные бактерии прикрепляются к желудочно-кишечному тракту.
эпителий
и другие возникают в просвете.Часто бывает очень близкий
ассоциация
между конкретными бактериями в кишечной экосистеме и конкретном кишечнике
ткани или клетки (свидетельство тканевого тропизма и специфической адгезии).
Грамположительные бактерии, такие как стрептококки и лактобациллы, являются
считается, что прилипает к эпителию желудочно-кишечного тракта с помощью
полисахарид
капсулы или тейхоевые кислоты клеточной стенки для прикрепления к специфическим рецепторам на
эпителиальные клетки.Грамотрицательные бактерии, такие как
кишечные препараты
может прикрепляться с помощью специфических фимбрий, которые
связывать
к гликопротеинам на поверхности эпителиальных клеток.
Именно в кишечном тракте мы видим наибольшее действие
бактериальная флора на хозяине. Это связано с их большой массой и
числа.Было показано, что бактерии в желудочно-кишечном тракте человека продуцируют
витамины и могут иным образом способствовать
питанию и пищеварению.

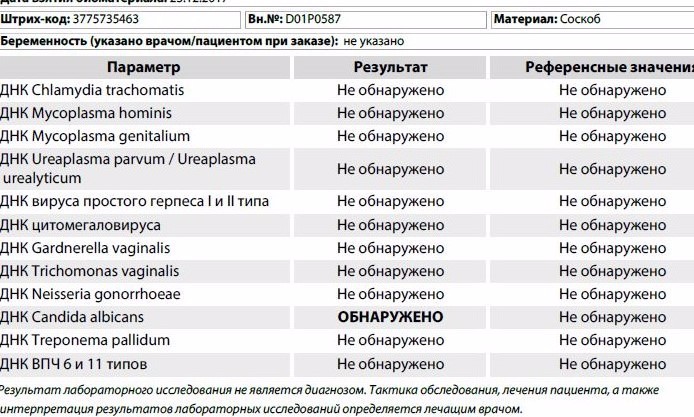

 Вероятность развития заболеваний максимальная. Требуется незамедлительное проведение профилактических мероприятий по предупреждению развития воспалений носоглотки.
Вероятность развития заболеваний максимальная. Требуется незамедлительное проведение профилактических мероприятий по предупреждению развития воспалений носоглотки.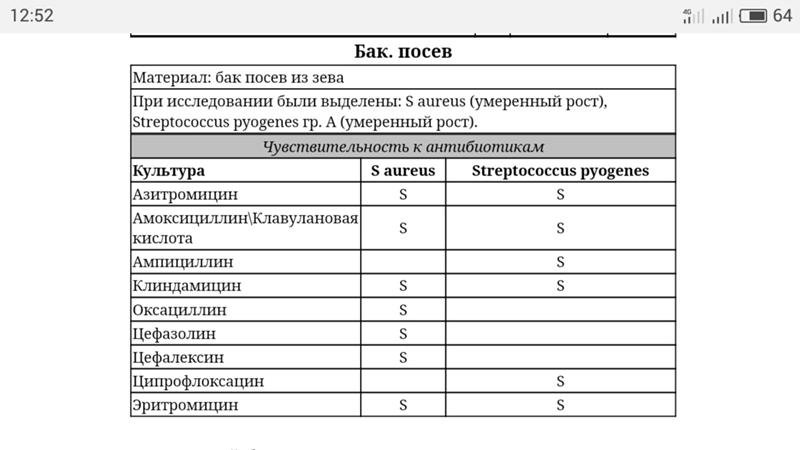
 Золотистый стафилококк имеет золотистую окраску колоний, что обусловлено присутствием пигмента. Он выделяется при росте бактерий, отчего получил свое название.
Золотистый стафилококк имеет золотистую окраску колоний, что обусловлено присутствием пигмента. Он выделяется при росте бактерий, отчего получил свое название. После нанесения синьки и Люголя препарат ополаскивается дистиллированной водой, после чего материал окрашивается хризоидином.
После нанесения синьки и Люголя препарат ополаскивается дистиллированной водой, после чего материал окрашивается хризоидином.
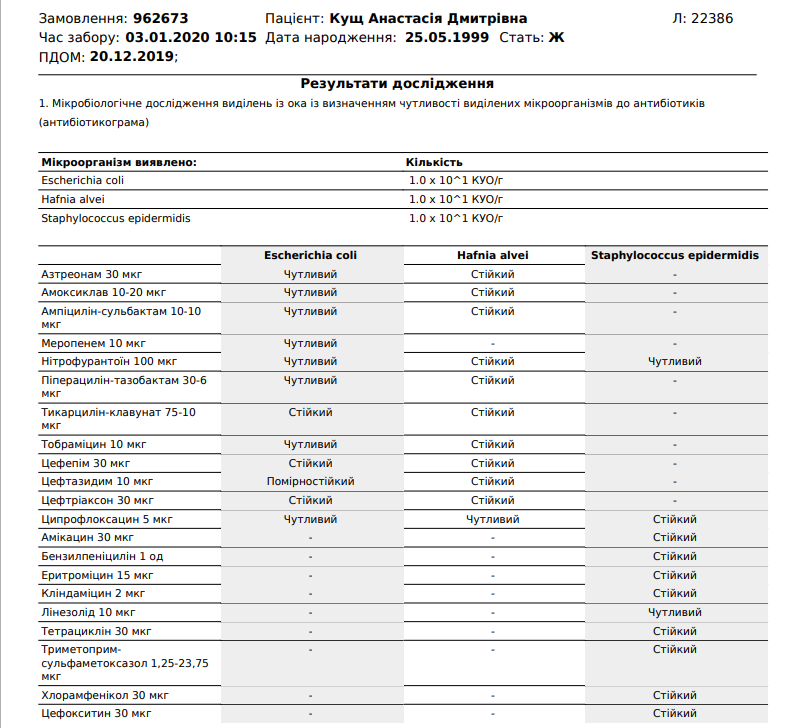
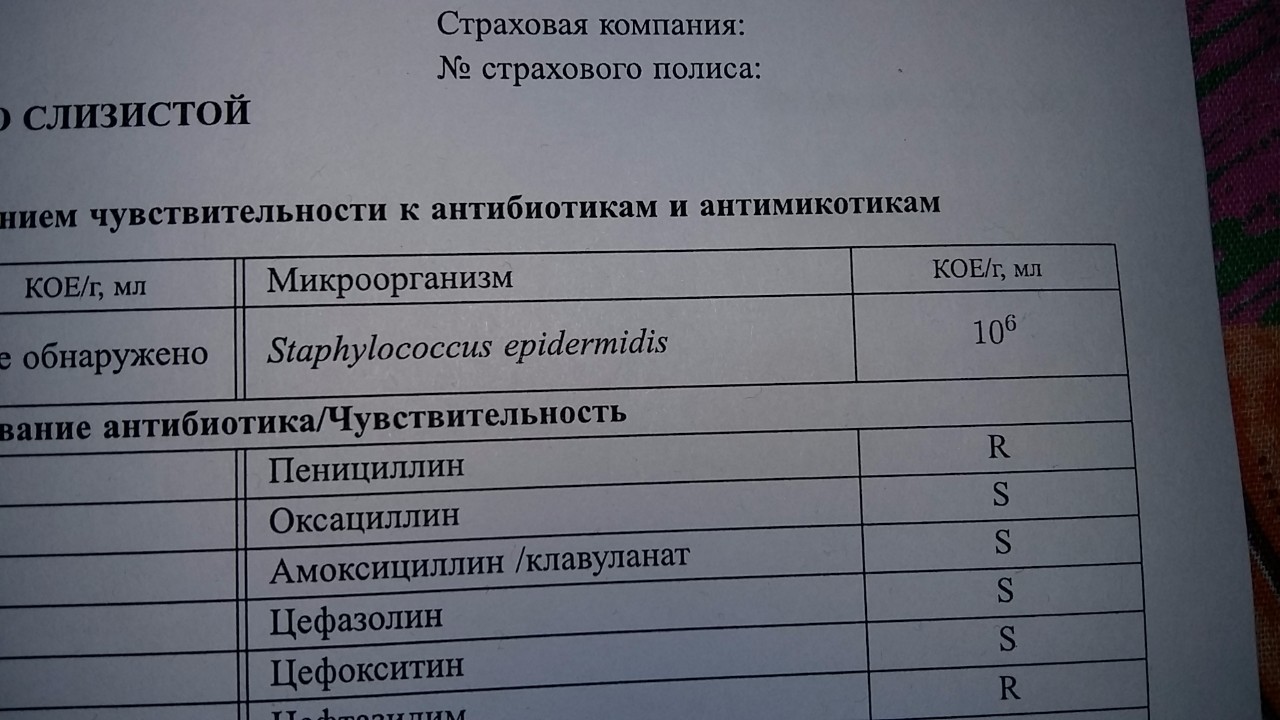
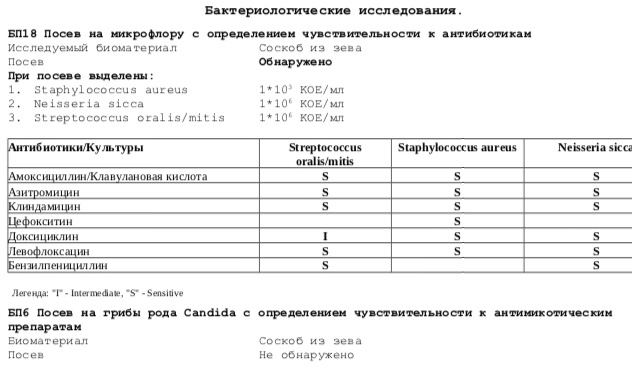 Часто они содержатся в частицах пыли. Вдыхая их, человек заражается.
Часто они содержатся в частицах пыли. Вдыхая их, человек заражается.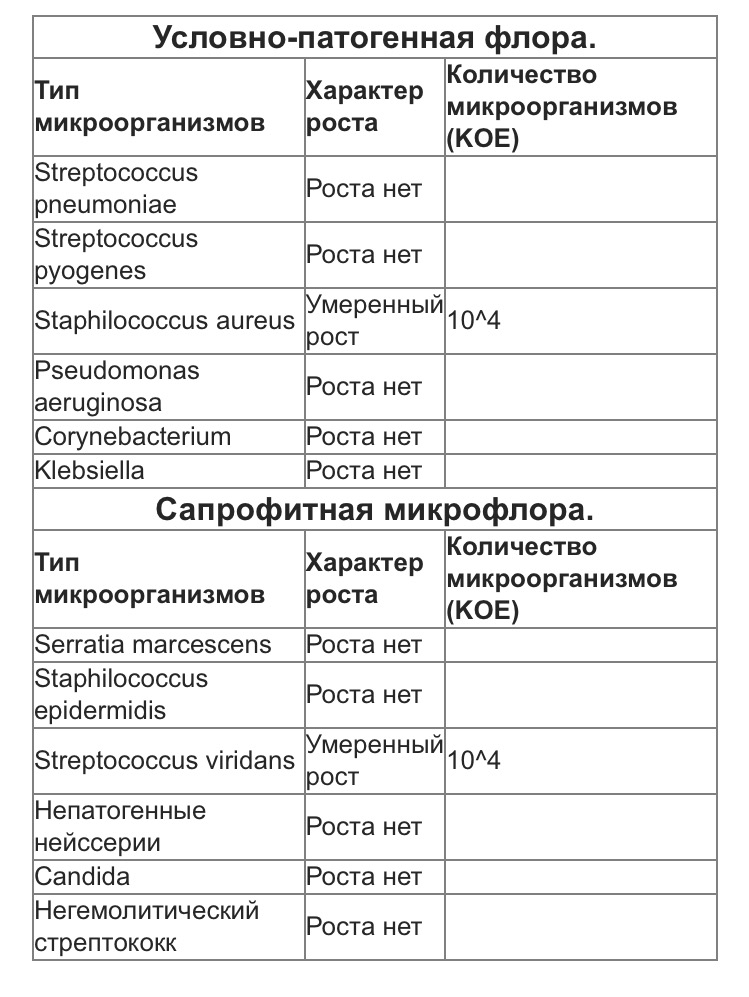

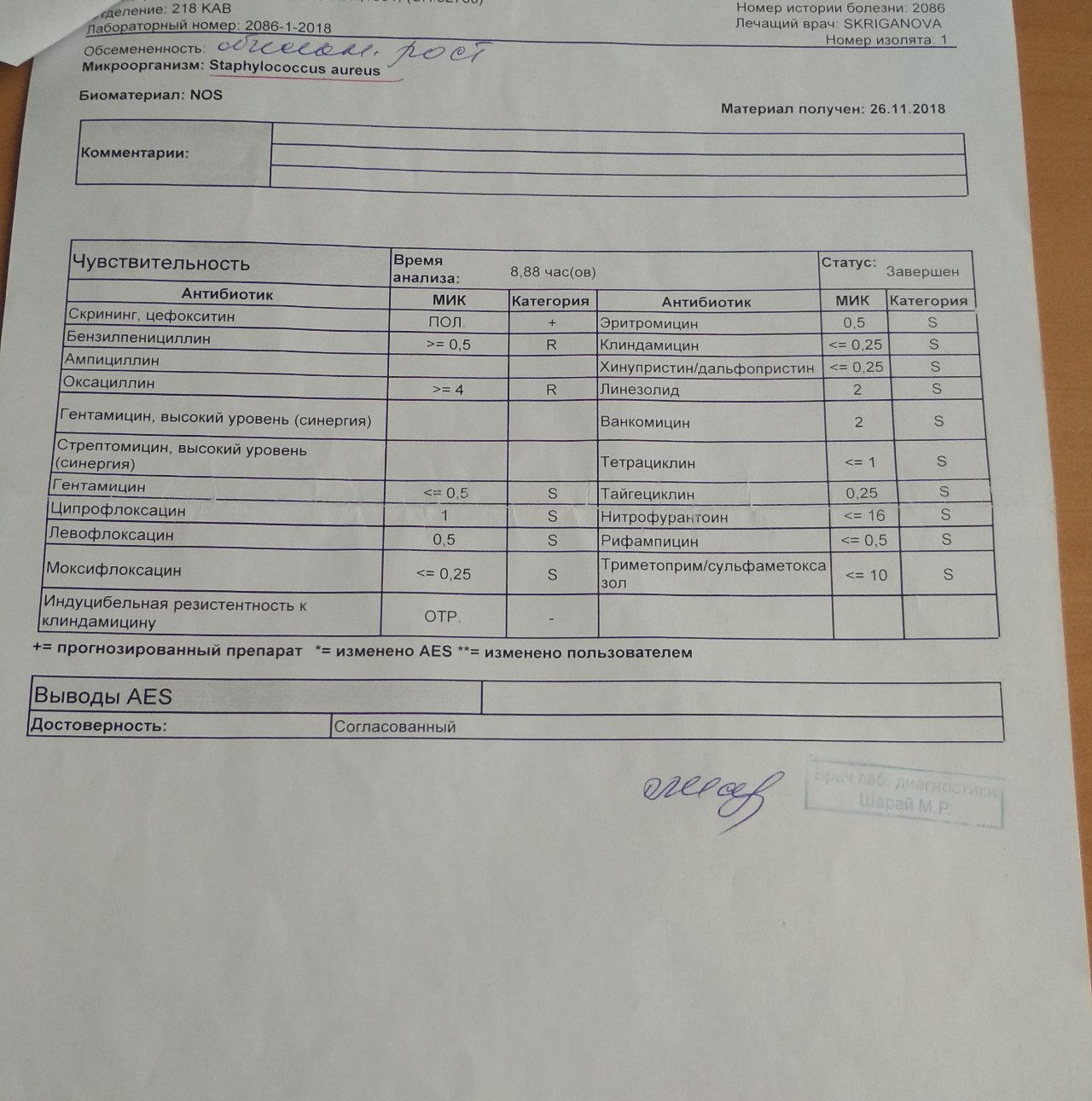
 К числу таких препаратов относят пилокарпин, белладонну, сернокислый барий, висмут, железо.
К числу таких препаратов относят пилокарпин, белладонну, сернокислый барий, висмут, железо.