Pак легких : Подробнее о раке лёгкого — Победим рак вместе
Рак лёгкого – самый смертоносный вид рака во Франции. В большинстве случаев он начинает своё развитие в бронхах. Как и у рака печени или предстательной железы, ранние признаки рака легких являются не специфическими, и чаще всего он диагностируется на самой поздней стадии своего развития.
Каждый второй случай этого вида раковой опухоли обнаруживается, когда метастазы уже распространились на соседние органы или ткани. Поэтому его тяжело лечить, а интенсивный кровоток в лёгких способствует его быстрому распространению. Чаще всего рак лёгкого обнаруживается у людей между 50 и 65 лет. И мужчины затронуты в наименьшей степени, чем раньше, а женщины в наибольшей.
Число случаев рака лёгкого у женщин увелечилось в 4 раза за последние 30 лет и всё это по причине курения.
Курение является главным фактором возникновения рака лёгкого. Сигарета содержит в себе около 50 канцерогенных веществ, поражающих клетки лёгкого. Эти опасные вещества присутствуют уже в организме курящих молодых людей.
Эти опасные вещества присутствуют уже в организме курящих молодых людей.
Именно у них риск появления рака лёгкого в 10 раз выше, чем у некурящего. Курение ответственно за 92% случаев смертности у мужчин и 71% – у женщин. Риск появления этого вида опухоли зависит от количества сигарет и длительности курения.
Курение является главным фактором возникновения рака лёгкого.
Сигарета содержит в себе около 50 канцерогенных веществ, поражающих клетки лёгкого. Эти опасные вещества присутствуют уже в организме курящих молодых людей. Именно у них риск появления рака лёгкого в 10 раз выше, чем у некурящего.
Курение ответственно за 92% случаев смертности у мужчин и 71% – у женщин. Риск появления этого вида опухоли зависит от количества сигарет и длительности курения.
Ещё не менее важный фактор, способствующий развитию раковой опухоли лёгкого является вдыхание асбестовой пыли в профессиональной сфере.
Этот фактор провоцирует 12 % случаев рака лёгкого у мужчин старше 55 лет и 7 % в возрасте между 35 и 55 годами, характеризующихся появлением мезотелиомы плевры. Точно так же, частое взаимодействие с другими опасными химическими веществами (такими как кристаллический кремнезём, хром, битум, углеводород) провоцирует развитие злокачественной опухоли лёгкого.
Точно так же, частое взаимодействие с другими опасными химическими веществами (такими как кристаллический кремнезём, хром, битум, углеводород) провоцирует развитие злокачественной опухоли лёгкого.
Появление симптимов рака лёгкого чаще всего характеризуется проблемами с дыханием (кашель, хронический бронхит, одышка), острыми или хроническими болями (резкая боль похожая на разрыв мышцы или боль в плече похожая на ревматизм), а также отхаркиваниями со следами крови.
Ряд обследований позволит диагностировать степень и распространение опухоли – лучевая терапия, сканер груди и лёгочная эндоскопия, в процессе которой осуществляется изъятие клеток или тканей (биопсия). Все эти методы покажут наличие вероятных метастаз (в печени, лёгких, внутригрудных лимфатических узлов или надпочечных.)
Три метода лечения применяются для лечения рака лёгкого – хирургическое вмешательство, лучевая и химиотерапия. Избранный метод лечения зависит от общего состояния, возраста и истории болезни пациента.
К сожалению, шансы на выживание достаточно низкие – 14 % живут не более 5 лет, 9 % – не более 10 лет. Риск вторичного появления рака лёгкого напрямую зависит от стадии развития в момент его обнаружения, а также продолжения или прекращения курения. В большинстве случаев, рецидивы появляются в течении двух лет с момента лечения.
Институт Кюри. Рак лёгкого – На пути к индивидуальному лечению
Гос. Институт по Онкологии, Рак лёгкого. Курение – фактор риска
Рак легкого
Легкие являются органом дыхания и расположены в грудной клетке. Правое легкое состоит из трех долей, а левое – из двух и по размеру меньше правого за счет того, что сердце занимает часть объема левой половины грудной клетки. Через легкие воздух поступает в организм, принося кислород, а затем выводится вместе с углекислым газом.
Оболочка вокруг легких, называемая плеврой, защищает легкие и помогает их движению во время дыхания. По трахее воздух поступает в легкие. Трахея делится на бронхи, а те, в свою очередь, — на более мелкие бронхи, называемые бронхиолами. На конце этих мелких ветвей находятся очень маленькие воздушные мешочки – альвеолы.
На конце этих мелких ветвей находятся очень маленькие воздушные мешочки – альвеолы.
Большинство злокачественных опухолей легких развивается из эпителия бронхов, но они могут возникать и в других местах – трахее, бронхиолах и альвеолах. Нередко для развития рака требуется много лет. Если рак легкого возник, то он может распространяться (метастазировать) в другие части тела. Рак легкого является опасным для человека заболеванием, так как нередко выявляется уже в распространенной стадии.
Различают два основных вида рака легкого: мелкоклеточный и немелкоклеточный рак. Если опухоль имеет черты обоих видов рака, то он называется смешанным мелко-крупноклеточным раком.
Немелкоклеточный рак легкого – наиболее частый вид рака легкого и составляет 80% от числа всех злокачественных опухолей легкого. На долю мелкоклеточного рака легкого приходится около 20% от числа всех опухолей легких. Опухолевые клетки при этой форме рака быстро размножаются, образуют крупные опухолевые узлы и метастазируют (распространяются) в другие органы: головной мозг, печень и кости.
Мелкоклеточный рак почти всегда вызывается курением и очень редко возникает у некурящих людей.
Как часто возникает рак легкого?
В 2002 г. в России было выявлено 60 337 первичных случаев рака легкого. Из них у мужчин рак легкого диагностирован в 83,6% случаев. Приблизительно подсчитано, что в США в 2004 году заболеет 173770 человек раком легкого: 93100 мужчин и 80660 — женщин. Около 160440 больных умрет от этой болезни в том же году: 91930 мужчин и 68510 женщин.
Ежегодно во всем мире умирает около 1 200 000 больных раком легкого. Рак легкого является ведущей причиной смерти среди мужчин и женщин. От рака легкого умирает больше людей, чем от рака толстой кишки, молочной железы и предстательной железы вместе взятых. Самые высокие показатели смертности от рака легкого среди мужчин (более 60 случаев на 100 000 населения) отмечены в странах восточной и центральной Европы.
В России число умерших мужчин от рака легкого в 2002 году составило 68 на 100 000 населения.
Рак легкого очень редко диагностируется у людей до 40-летнего возраста. Средний возраст выявления рака легкого — 60 лет.
Что вызывает рак легкого?
Факторы риска, повышающие вероятность развития рака, при различных опухолях разные. Одни факторы, например, курение, можно изменить. Другие, такие как возраст или семейный анамнез, изменить нельзя. Наличие одного или нескольких факторов риска еще не означает, что у этого человека возникнет рак.
Курение является основным фактором риска рака легкого.
Курение табака вызывает 8 из 10 случаев рака легкого. Чем дольше курит человек и чем больше пачек сигарет в день, тем выше риск. Если человек прекращает курить до возникновения рака легкого, то легочная ткань постепенно возвращается к норме. Прекращение курения в любом возрасте снижает риск развития рака легкого. Курение сигар и трубки аналогично курению сигарет и сопровождается таким же риском. До настоящего времени не существует доказательств в пользу того, что курение сигарет с низким содержанием смол снижает риск рака легкого.
Некурящие люди, вдыхающие дым табака (пассивное курение), также имеют повышенный риск рака легкого. Если один из супругов курит, то риск возникновения рака легкого у второго некурящего повышается на 30% по сравнению с некурящей парой.
У работников алюминиевой промышленности, газификации и коксования угля, литейной промышленности, производства изопропилового спирта, резиновой промышленности и добычи гематита также имеется большая вероятность заболевания раком легкого.
Асбест является еще одним фактором риска рака легкого. Люди, работающие с асбестом, имеют повышенный риск развития рака легкого. В случае если они еще и курят, то риск значительно повышается. Мезотелиома (злокачественная опухоль), связанная с асбестом, часто развивается из плевры.
Радон является радиоактивным газом, возникающим в результате естественного распада урана. Радон нельзя увидеть, попробовать или понюхать. Радон может сконцентрироваться внутри помещения и привести к повышенному риску рака.
К веществам, вызывающим рак, относятся: уран, мышьяк, винилхлорид, никель, продукты угля, иприт, хлорметиловые эфиры, дизельные выхлопы. Люди, работающие с этими веществами, должны соблюдать осторожность и правила техники безопасности.
Марихуана. Сигареты из марихуаны содержат больше смол по сравнению с обычными сигаретами. В марихуане содержатся многие вещества, которые вызывают рак, как и в сигаретах. Есть указания на то, что марихуана может вызывать рак полости рта и глотки.
Туберкулез и некоторые виды воспаления легких часто оставляют после себя рубцы, и эти рубцы могут повысить риск развития рака легкого.
Минеральные вещества. Тальк может повысить риск рака легкого у тех, кто добывает его или работает с ним. Люди с заболеваниями, вызванными вдыханием некоторых минеральных веществ, также имеют повышенный риск возникновения рака легкого.
Личный или семейный анамнез. Если Вы перенесли рак легкого, то имеется повышенный риск возникновения другой злокачественной опухоли легкого. У братьев, сестер и детей лиц, перенесших рак легкого, незначительно повышен риск той же формы рака.
У братьев, сестер и детей лиц, перенесших рак легкого, незначительно повышен риск той же формы рака.
Диета с низким содержанием фруктов и овощей может повысить риск рака легкого у людей, находящихся под воздействием табачного дыма. Предполагают, что яблоки, лук и некоторые другие фрукты и овощи обладают защитным эффектом против рака легкого.
Пол. Некоторыми исследованиями показано, что легкие женщин под действием табачного дыма чаще подвергаются злокачественному перерождению.
За последние годы достигнут большой прогресс в понимании того, каким образом факторы риска приводят к изменениям ДНК клеток легкого, заставляя их превращаться в злокачественные. Можно надеяться на то, что выявленные изменения ДНК позволят диагностировать рак легкого на ранних стадиях, Кроме того, ведутся работы над тем, как восстановить или заместить измененные гены для того, чтобы остановить рост опухоли и предотвратить распространение рака.
Можно ли предотвратить рак легкого?
Наилучшим способом предотвращения рака легкого является отказ от курения и пребывания около курящих людей.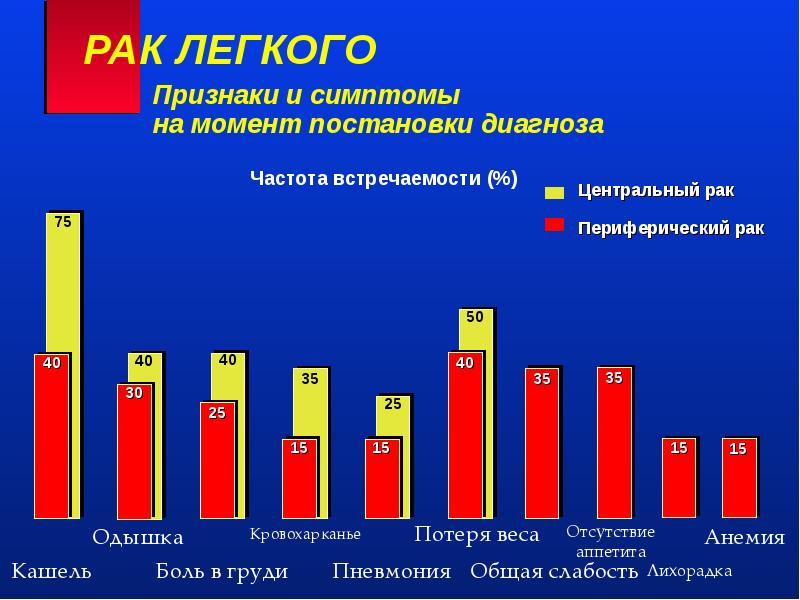 Если Вы уже курите, то должны постараться избавиться от этой пагубной привычки. Избегайте нахождения в помещениях, где курят.
Если Вы уже курите, то должны постараться избавиться от этой пагубной привычки. Избегайте нахождения в помещениях, где курят.
Выясните наличие вокруг Вас химических веществ, вызывающих рак, и предпримите шаги к защитным мерам. Если Вы проживаете в зоне естественных отложений урана в почве, которые выделяют радоновый газ, то необходимо измерять уровень радона в Вашем жилище.
Даже при соблюдении вышеуказанных рекомендаций у некоторых людей, не имеющих явных факторов риска, может возникнуть рак легкого. Поэтому невозможно дать совет как предотвратить все случаи рака легкого.
Что предпринимать, если имеется подозрение на рак легкого?
Если заподозрен рак легкого, то врач назначит обследование для выяснения того, существует ли у Вас опухоль или нет. При необходимости будет выполнена биопсия ткани легкого, которая подтвердит или исключит диагноз рака и также позволит выбрать метод лечения. Если диагноз рака подтвержден, то необходимо проведение более детального обследования для выяснения степени распространения заболевания.
При рентгенорадиологическом и изотопном исследованиях используются рентгеновские лучи, магнитные поля, звуковые волны или радиоактивные вещества с целью осмотра внутренних органов и тканей. Для уточнения распространенности рака легкого используют рентгенографию, компьютерную томографию, магнитно-резонансную томографию, позитронно-эмиссионную томографию, ангиографию и сканирование костей.
Ниже приведенные методы применяют для того, чтобы убедиться, что выявленное образование в результате предшествующего обследования является именно раком. Кроме того, при этом уточняется вид рака легкого и степень его распространения.
Цитологическое исследование мокроты с помощью микроскопа позволяет обнаружить опухолевые клетки..
Игловая биопсия. Иглу вводят в опухолевое образование и получают кусочек ткани, который затем исследуется под микроскопом на наличие опухолевых клеток.
Бронхоскопия. Гибкая трубка с осветителем вводится через рот в бронх. Это метод позволяет не только обнаружить опухоль, но и взять ее кусочек или жидкость для поиска раковых клеток.
Это метод позволяет не только обнаружить опухоль, но и взять ее кусочек или жидкость для поиска раковых клеток.
Медиастиноскопия. Процедура проводится под общим обезболиванием (наркозом). Делается небольшой разрез на передней поверхности шеи и удаляются отдельные лимфатические узлы по ходу трахеи. Последующее микроскопическое изучения удаленной ткани позволяет подтвердить или исключить опухолевый процесс.
Торакоцентез и торакоскопия. Эти методы дают возможность получить жидкость в плевральной полости и выяснить ее причину (рак или доброкачественные состояния, такие как сердечная недостаточность или инфекция).
Биопсия костного мозга. С помощью специальной иглы получают маленький кусочек кости и костного мозга из тазовой кости для поиска опухолевых клеток.
Биохимический анализ крови помогает выяснить, распространился ли рак в печень или кости.
Можно ли обнаружить рак легкого на ранней стадии?
Обычно симптомы рака легкого не появляются до тех пор, пока опухоль не становится распространенной. Однако в некоторых случаях рак легкого выявляется на ранней стадии, но он обнаруживается случайно при обследовании по поводу других заболеваний. Например, опухоль может быть обнаружена во время рентгенографии или компьютерной томографии грудной клетки, бронхоскопии (осмотра бронхов изнутри с помощью специального устройства — бронхоскопа) или цитологического исследования мокроты, выполненных по поводу других причин у больных с заболеваниями сердца, воспалением легких и пр.
Однако в некоторых случаях рак легкого выявляется на ранней стадии, но он обнаруживается случайно при обследовании по поводу других заболеваний. Например, опухоль может быть обнаружена во время рентгенографии или компьютерной томографии грудной клетки, бронхоскопии (осмотра бронхов изнутри с помощью специального устройства — бронхоскопа) или цитологического исследования мокроты, выполненных по поводу других причин у больных с заболеваниями сердца, воспалением легких и пр.
Скрининг — это использование методов обследования с целью выявления заболевания у людей, у которых отсутствуют признаки болезни. Например, микроскопическое исследование мазка с шейки матки применяется для ранней диагностики рака шейки матки.
В связи с тем, что рак легкого обычно уже выходит за пределы легких еще до появления симптомов заболевания, эффективный скрининг с целью ранней диагностики мог бы спасти многие жизни.
Значение рентгенограмм и микроскопического исследования мокроты с целью выявления раковых клеток изучалось в течение многих лет. Результаты исследований показали, что эти методы не позволяют обнаружить многие случаи рака легкого на ранних стадиях и не увеличивают шансов на излечение. Поэтому скрининг рака легкого не является рутинной (обычной) практикой для населения и даже для лиц с повышенным риском, например, для курильщиков.
Результаты исследований показали, что эти методы не позволяют обнаружить многие случаи рака легкого на ранних стадиях и не увеличивают шансов на излечение. Поэтому скрининг рака легкого не является рутинной (обычной) практикой для населения и даже для лиц с повышенным риском, например, для курильщиков.
Недавно появился новый рентгенологический метод — спиральная низкодозная компьютерная томография, позволяющая выявлять рак легкого на ранних стадиях среди курильщиков. Однако еще не доказано, что данный метод даст возможность снизить вероятность смерти от рака легкого.
Люди, которые курят в настоящее время, должны осознавать, что наилучший способ избежать смерти от рака легкого — это прекратить курение. Выявление изменений в ДНК бронхиальных клеток, возможно, поможет в ранней диагностике рака легкого, однако значение таких исследований еще не доказано.
Люди, которые курили ранее или продолжают курить в настоящее время, а также те, которые находились под воздействием табачного дыма или работали с материалами, повышающими риск развития рака легкого, имеют повышенный риск рака легкого.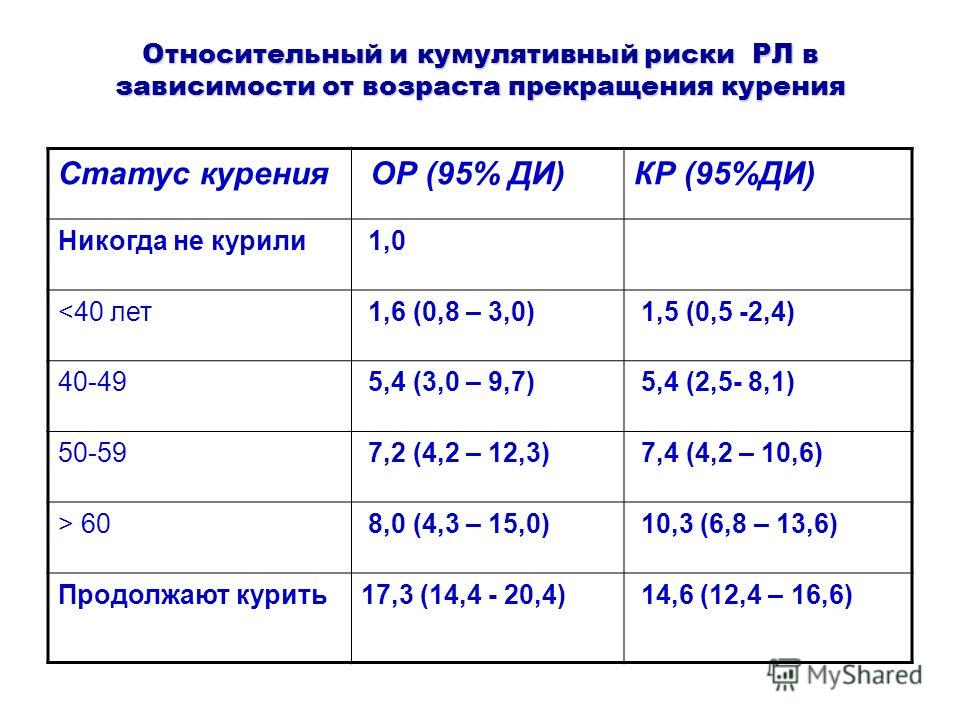
Как выявляется рак легкого?
В связи с тем, что у большинства людей с ранними стадиями рака легкого не имеется никаких симптомов, лишь около 15% случаев диагностируется своевременно. Раннее обнаружение рака легкого обычно связано с проведением рентгенографии грудной клетки, компьютерной томографии или других методов, назначенных по другому поводу.
Хотя большинство опухолей легких не вызывает симптомов до тех пор, пока они не становятся распространенными, следует срочно обратиться к врачу при появлении ниже приведенных симптомов:
- Длительный не проходящий кашель.
- Боль в грудной клетке, усиливающаяся при глубоком дыхании.
- Появление охриплости голоса.
- Потеря веса и ухудшение аппетита.
- Одышка.
- Повторные инфекции в виде бронхита или воспаления легких.
Распространение рака легкого в другие отдаленные органы может вызвать:
- Боль в костях.

- Слабость или онемение рук или ног.
- Головокружение.
- Изменение цвета кожи или глаз (желтуху).
Лечение рака легкого
Если диагностирован рак легкого, то в зависимости от вида рака, стадии заболевания и других факторов, могут быть предложены: операция, лучевая терапия и химиотерапия в отдельности или в сочетании.
В выборе метода лечения также принимается во внимание общее физическое состояние больного, возможные побочные эффекты и осложнения лечения.
Что нужно знать, чтобы не болеть раком легких
Рак легкого занимает первое место по заболеваемости и смертности от злокачественных опухолей в мире и в России. В России ежегодно от рака легкого умирает более 60000 человек, 50000 мужчин и 10000 женщин.
Самые высокие показатели смертности от рака легкого среди мужчин отмечены в странах восточной и центральной Европы (Венгрии, Польше, Хорватии, России, Чехии). География смертности от рака легкого среди женщин несколько иная. Наиболее высокая смертность наблюдается в США, Дании, Канаде.
Наиболее высокая смертность наблюдается в США, Дании, Канаде.
Факторы риска рака легкого
1.Курение — является главной причиной возникновения рака легкого.
По данным Международного агентства по изучению рака (МАИР) курение является главной причиной возникновения рака легкого. Табакокурение относится к группе факторов, канцерогенность которых для человека доказана. В состав табачного дыма входит кроме никотина несколько десятков токсичных и канцерогенных веществ, в том числе полициклические ароматические углеводы (ПАУ) — такие как бензо(а)пирен, ароматические амины , летучие нитрозосоединения, табакспецифические нитрозоамины, винилхлорид, бензол, канцерогенные металлы и др.
По разным данным от 85-95% случаев рака легкого у мужчин и 65-80% рака легкого у женщин связано с курением. Относительный риск развития рака легкого во многом зависит от возраста начала курения, длительности курения и количества сигарет, выкуриваемых в день. В России курение является причиной 90% всех случаев рака легкого среди мужчин.
В России курение является причиной 90% всех случаев рака легкого среди мужчин.
Заболеваемость раком легкого среди женщин в России еще невелика ввиду того, что женщины в большинстве случаев начали курить значительно позже, чем мужчины, а для реализации эффекта канцерогенного воздействия требуется 20-25-летний латентный период. Рост числа курящих женщин в России приведет к росту заболеваемости и смертности от рака легкого.
Курение трубки и сигар также может привести к развитию рака легкого, хотя относительный риск ниже, чем при курении сигарет. Относительный риск значительно выше у курильщиков, которые глубоко затягиваются, чем у курильщиков, которые не вдыхают дым.
Концентрация смолы в табачном дыме в последние годы снизилась до 10-12 мг на сигарету, что повлияло на снижение риска рака легкого, связанного с курением.
В то же время в дыме современных сигарет больше табакспецифических нитрозосоединений, что влияет на изменение структуры рака легкого.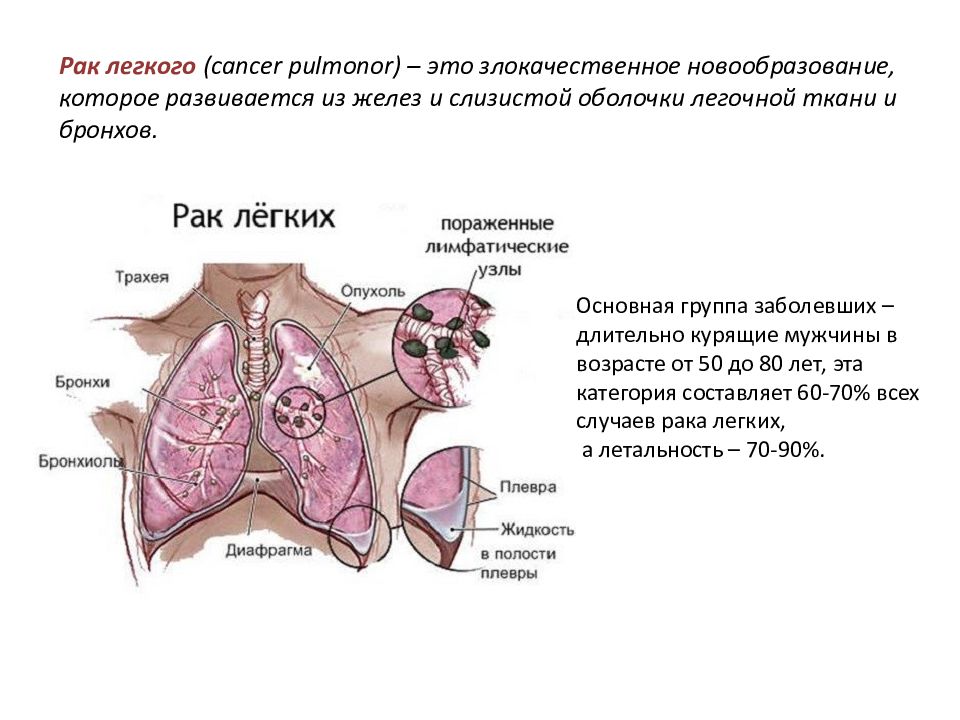
На основании многочисленных эпидемиологических исследований, проведенных в последние 10-15 лет, показано, что ПАССИВНОЕ КУРЕНИЕ также повышает риск рака легкого у никогда не куривших людей. Пассивное курение ответственно за 3000 случаев рака легкого в год (США). По данным МАИР пассивное курение увеличивает риск развития рака легкого на 17-20%.
2. Профессиональные факторы
Анализ экспериментальных и эпидемиологических исследований проведенных МАИР показал, что 29 химических и 13 производственных процессов являются канцерогенными для человека.
К химическим веществам, производственные процессы и другие факторы канцерогенность которых доказана для человека и приводит к повышенному риску развития рака легкого.
Химические и физические факторы- асбест, берилий и его соединения, Бис- (хлорметил)эфир, винилхлорид, горчичныйц газ, 2,3,7, 8-тетрахлоробензо-пара-диоксин, кадмий иего соединения, кремний кристалический, мышьяк и его соединения, никель и его соединения, тальк, содержащий асбестподобные волокна, хром и его соединеиия, ионизирующая радиация, радон.
Производственные процессы- алюминиевая промышленность, газификация угля, коксование угля, литейная промышленность, производство изопропилового спирта, производство фуксина, резиновая промышленность, добыча гематита (подземная). Взаимодействие двух и более неблагоприятных факторов в значительной степени увеличивает относительный риск развития рака легкого.
Так, относительный риск рака легкого у рабочих асбестовой промышленности увеличивается при сочетании с курением более чем в 10 раз.
3.Индивидуальная предрасположенность к развитию рака.
По признаку предрасположенности к развитию рака, которая определяется генами системы цитохром 450, ответственной за функцию сотни генов, продукцию ферментов, которая является защитной системой организма против токсических и канцерогенных веществ в окружающей среде. «Неблагоприятный» генотип может встречаться у 30-50% населения. Выявление индивидуальной предрасположенности к раку, а именно генотипирование — является перспективным направлением в профилактике рака.
Профилактика рака легкого.
1. Отказ от курения.
2. Вторичная профилактика рака легкого.
Скрининг рака легкого — целью которого является раннее выявление бессимптомного рака и его лечение. Термин «скрининг» обозначает активное выявление бессимптомного рака среди населения, в то время как «диагностика» — к выявлению заболевания среди больных, которые обратились за медицинской помощью и имеют те или иные жалобы или симптомы заболевания. Для скрининга рака легкого использовались такие методы как рентгенография органов грудной клетки и цитологическое исследование мокроты, которые оказались неэффективными. В настоящее время проводится внедрение метода спиральной компьютерной томографии (СКТ). СКТ значительно повышает вероятность выявления маленьких очагов рака легкого, в то время как этот метод имеет низкую специфичность. Большие надежды возлагаются на выявление ранних молекулярных маркеров рака легкого.
Рак легкого у больных молодого возраста
БАГИРОВ РАХМАТ РАГИМ ОГЛЫ
РАК ЛЕГКОГО У БОЛЬНЫХ МОЛОДОГО ВОЗРАСТА
14. 01.12- онкология
01.12- онкология
АВТОРЕФЕРАТ диссертации на соискание ученой степени кандидата медицинских наук
□□3492528
Москва-2010
003492528
Работа выполнена в Учреждении Российской Академии Медицинских Наук Российском онкологическом научном центре им. Н.Н.Блохина (директор — академик РАН и РАМН, профессор М.И. Давыдов).
Научный руководитель:
доктор медицинских наук, профессор Б.Е.ПОЛОЦКИЙ
Официальные оппоненты:
доктор медицинских наук, профессор К.П.ЛАКТИОНОВ доктор медицинских наук, профессор В.С.МАЗУРИН Ведущее учреждение:
ФГУ Российский научный центр рентгенорадиологии МЗ и СР РФ
Защита диссертации состоится «11» марта 2010 года в_часов
на заседании диссертационного совета (Д. 001.017.01) РОНЦ им. Н.Н.Блохина РАМН (Москва 115478, Каширское шоссе, 24).
С диссертацией можно ознакомиться в библиотеке РОНЦ им. Н.Н.Блохина РАМН.
Автореферат разослан «10» февраля 2010 г.
Ученый секретарь Диссертационного совета, Доктор медицинских наук, профессор Ю.В.ШШ
Общая характеристика диссертации
Актуальность проблемы. Рак легкого является наиболее распространенной формой злокачественных опухолей и представляет собой одну из актуальных проблем клинической онкологии. В 35 развитых странах мира и в Российской Федерации этого заболевания остается главной причиной смертности онкологических больных, преимущественно мужчин. Годовой прирост заболеваемости раком легкого в России составляет в настоящее время 3,4%, ежегодно заболевают около 60 тыс. человек (Аксель Е.М. 2006).
Рак легкого в основном развивается в возрасте 50-80 лет. Относительная редкость его у лиц молодого возраста зачастую приводит к его позднему распознаванию и диагностическим ошибкам. Одной из причин этого предположительно могут быть биологические различия опухоли у больных молодого и пожилого возраста, а также клинические морфологические и другие особенности рака легкого у молодых (Зайцев В. Ф., 1989; Трахтенберг А.Х., 1987; Харченко В.П., с соавт., 1994,1999; De Саго L., et al., 1983).
Ф., 1989; Трахтенберг А.Х., 1987; Харченко В.П., с соавт., 1994,1999; De Саго L., et al., 1983).
Вопрос о хирургическом лечении рака легкого у больных молодого возраста освещен недостаточно полно, противоречиво. Во многих публикациях имеются данные (Воронцов А.Ю., с соавт., 2000; Green LS., et al., 1993; Neuman HW., et al., 1956; Tsai СМ., et al., 1988) о неутешительных результатах хирургического лечения у молодых в сравнении с больными старших возрастных групп. В то же время другие данные литературы показывают одинаковую и даже лучшую общую выживаемость молодых пациентов (Давыдов М.И., с соавт., 2005; Capewell S., et al., 1992; Da-li Tian, et al., 2003; Kuo CW., et al., 2000; Kreuzer M., et al., 1998; Minami H., et al., 2001; Nugent WC., et al., 1997; Ramalin-gam S., et al., 1998). Также остаются весьма спорными такие вопросы, как возможность применения не только лобэктомии, но и пневмонэктомии, так как функциональные возможности организма этих больных позволяют это делать.
Практически в литературе не освещены особенности внутригрудного лимфогенного метастазирования, возможности комбинированных методов ле-
чения немелкоклеточного рака легкого у больных молодого возраста, поэтому изучение этих вопросов заслуживает внимания.
Несмотря на многочисленность публикаций, нет единого представления о клиническом течении заболевания и результатах лечения в различных возрастных группах. Поэтому представляет интерес сравнительная оценка результатов хирургического лечения немелкоклеточного рака легкого у больных молодого, среднего и пожилого возраста с целью уточнения современных подходов и результатов лечения в различных возрастных группах пациентов.
Цель исследования — Улучшение результатов хирургического и комбинированного лечения больных немелкоклеточным раком легкого молодого возраста.
Для достижения поставленной цели решены следующие задачи:
1. Оценка частоты различных гистологических форм рака легкого и степени дифференцировки в возрастных группах больных.
2. Изучение особенностей лимфогенного внутригрудного метастазирова-ния у больных молодого возраста относительно больных старших возрастных групп.
3. Сравнение отдаленных результатов радикального хирургического лечения больных немелкоклеточным раком легкого молодого возраста и больных старших возрастных групп в зависимости от распространенности опухоли и объема выполненного оперативного вмешательства.
4. Сравнительная оценка результатов хирургического и комбинированного лечения рака легкого в возрастных группах больных.
Научная новизна
На большом клиническом материале изучены особенности лимфогенного метастазирования и отдаленные результаты хирургического лечения больных раком легкого молодого возраста относительно пациентов старших возрастных групп в зависимости от распространенности, размера первичной опухоли, ее гистологической структуры, проксимальной границы поражения бронха. Оценены прогностически важные клинико-морфологические факторы, влияющие
на результаты радикального хирургического лечения. Изучены результаты хирургического лечения в зависимости от объема операции при сравнимой распространенности заболевания в возрастных группах пациентов. Показано, что объем хирургического лечения при сравнимой распространенности опухолевого процесса не влияет на показатели выживаемости в сравниваемых возрастных группах. Изучены результаты хирургического и комбинированного лечения в зависимости от распространенности опухолевого процесса. Показано, что во всех возрастных группах пациентов результаты хирургического лечения при I и II стадиях рака легкого достоверно превосходили результаты комбинированного лечения, в то же время при III стадии существенных различий не получено.
Показано, что во всех возрастных группах пациентов результаты хирургического лечения при I и II стадиях рака легкого достоверно превосходили результаты комбинированного лечения, в то же время при III стадии существенных различий не получено.
Практическая значимость исследования
Частота рака легкого у молодых в нашем исследовании составила 9,9%, что говорит о необходимости онкологической настороженности врачей при лечении больных этой группы. Внедрение результатов исследования в практику хирургического лечения больных немелкоклеточным раком легкого у больных молодого возраста позволяет повысить радикальность операций и улучшает результаты хирургического вмешательства. Объем операции должен определяться распространенностью опухоли. Расширение объема операции до пневмонэк-томии у молодых больных при онкологической возможности выполнения резекции легкого не оправдано, так как результаты лечения не отличаются от таковых у пациентов более старших возрастных групп, после лобэктомии.
Апробация диссертации состоялась 30 июня 2009 года на совместной научной конференции с участием хирургического торакального отделения тора-ко-абдоминального отдела, отделения диагностики опухолей, отделения абдоминальной онкологии, патологоанатомического отделения, поликлинического отделения РОНЦ им. Н.Н.Блохина РАМН, кафедры онкологии лечебного факультета ММА им. И.М.Сеченова.
Публикации
По теме диссертации опубликовано 3 работы в центральных медицинских журналах.
Объем и структура диссертации
Диссертация построена по традиционному стилю и состоит из введения, четырех глав, включающих литературный обзор, материалы и методы, две главы по результатам исследования, а также заключение, выводы и список литературы, содержащий 164 источника, из которых 66 — отечественных и 98 — зарубежных авторов. Работа представлена на 148 страницах машинописного текста, иллюстрирована 63 таблицами и 42 рисунками. СОДЕРЖАНИЕ РАБОТЫ Материалы исследования
В исследование включены 1727 больных, получивших хирургическое лечение в торакальном отделении РОНЦ им. Н.Н.Блохина РАМН с 1 января 1985 по 31 декабря 2007.
Н.Н.Блохина РАМН с 1 января 1985 по 31 декабря 2007.
В исследование включены пациенты, получившие хирургическое или комбинированное лечение по поводу немелкоклеточного рака легкого.
Больные были распределены по возрастным группам в соответствии с классификацией ВОЗ (1978) следующим образом: до 45 лет — больные молодого возраста; от 46 до 59 лет — больные среднего возраста; от 60 до 74 лет — больные пожилого возраста.
Из 1727 больные молодого возраста составили 171 (9,9%), среднего возраста 888 (51,4%) и пожилого возраста 668 (38,7%) пациентов. В нашем исследовании возраст самого молодого больного составил 23 года, а самого старого — 74 года. Соотношение мужчин (1488 — 86,2%) и женщин (239 — 13,8%) составило 6,2:1 с преобладанием мужчин во всех возрастных группах. В группе больных молодого возраста, соотношение «мужчины : женщины» составило 3,6:1, в группе больных среднего и пожилого возраста это соотношение составило 8,3:1 и 5,2:1 соответственно, разница статистически достоверна. Из общего числа (1727) наблюдений, 1464 (84,8%) пациента были оперированы радикально, 131 (7,5%) — паллиативно и 132 (7,7%) больным выполнена пробная торакотомия (табл. 1).
Из общего числа (1727) наблюдений, 1464 (84,8%) пациента были оперированы радикально, 131 (7,5%) — паллиативно и 132 (7,7%) больным выполнена пробная торакотомия (табл. 1).
Распределение больных по характеру операций
Характер операций Возраст
молодой средний ПОЖИЛОЙ
Радикальные 142 (83,1%) 742 (83,6%) 580 (86,8%)
Паллиативные 12(7,0%) 64 (7,2%) 55 (8,3%)
Эксплоративные 17(9,9%) 82 (9,2%) 33 (4,9%)
Всего(%) 171 (100%) 888 (100%) 668(100%)
Резектабельность (%) 90% 90,7% 95%
Из представленной таблицы видно, что радикальные и паллиативные операции во всех возрастных группах производились с одинаковой частотой (90,1%, 90,8% и 95,1%), однако в пожилом возрасте реже выполнялись оперативные вмешательства, завершившиеся пробной торакотомией (4,9% против 9,9% и 9,2%, 1=2,3 р<0,05) что, скорее всего, связано с отбором больных этой группы для лечения. Резектабельность в возрастных группах больных оказалась идентичной — 90,0; 90,7 и 95,0%, соответственно.
Морфологические формы опухолей установлены по «Международной классификации онкологических болезней; МКБ-О» (ВОЗ, 1995 г.). В структуре опухолей преобладал плоскоклеточный рак (всего 69,6%). Аденокарцинома по частоте занимала второе место, составляя 24,6%. В исследование также были включены редкие формы рака легкого. Из них бронхиолоальвеолярный рак составлял 2,3%, крупноклеточный 1,3%, диморфный 2,1% (табл. 2).
У молодых пациентов отмечена более высокая частота аденокарциномы по сравнению со старшими возрастными группами. Так соотношение аденокарциномы и плоскоклеточного рака у больных молодого возраста составило 31,6% (54) : 62,6% (107) (1:1,98), в то же время, у больных среднего возраста составило 21,6% : 72,3%, (1:3,3), у больных пожилого возраста 26,8% : 67,8% (1:2,5) (относительно больных среднего возраста разница статистически достоверна 1=2,43 р<0,01; относительно больных пожилого возраста 1=1,27 р<0,5).
Редкие формы рака легкого во всех возрастных группах встречаются одинаково часто.
Таблица 2
Типы гистологических форм рака в возрастных группах _
Структура опухоли Возраст Всего %
молодой средний пожилой
Плоскоклеточный рак 107 (62,6%) 642 (72,3%) 453 (67,8%) 69,6
Аденокарцинома 54 (31,6%) 192 (21,6%) 179 (26,8%) 24,6
БАР 5 (2,9%) 22 (2,5%) 13 (1,9%) 2,3
Крупноклеточный рак 2(1,2%) 10(1,1%) 11 (1,7%) 1,3
Диморфный рак 3 (.1,7%) 22 (2,5%) 12(1,8%) 2,1
Всего 171 (100%) 888 (100%) 668(100%) 1727 (100%)
Распределение больных по степени дифференцировки плоскоклеточного рака в сравниваемых возрастных группах одинаково. Однако при аденокарци-номе легкого выявлено статистически значимое преобладание низкодифферен-цированной формы в группе больных молодого возраста относительно контрольных групп (22,2% против 7,8% и 8,4% (t=2,41 р<0,02)).
Стадирование заболевания проводилось в соответствии с TNM классификацией (ВОЗ, 1997). Радикальные операции выполнены у 142 (из 171) больных молодого, 742 (из 888) среднего и 580 (из 668) больных пожилого возраста.
I стадия заболевания достоверно чаще диагностирована у больных среднего и пожилого возраста 42,2% и 54,3%, соответственно, против 29,6% — у молодых пациентов. В то же время у молодых пациентов чаще выявлялась IIIA стадия рака легкого — 33,1% против 22,6% и 21,2% (р<0,02) (табл. 3).
Распределение больных по объему выполненного радикального оперативного вмешательства представлено в таблице 4.
Стадия TNM в возрастных группах у радикально оперированных больных
pTNM Возраст
молодой средний пожилой
абс. % абс. % абс. %
Стадия I 42 29,6 313 42,2 315 54,3
T,NoMo 17 12,0 78 10,5 80 13,8
T2N0M0 25 17,6 235 31,7 235 40,5
Стадия II 35 24,6 198 26,7 109 18,8
T,N,M0 3 2,1 15 2,0 15 2,6
T2N,M0 20 14,1 ИЗ 15,2 58 10,0
t3n0m0 12 8,4 70 9,5 36 6,2
Стадия III 63 44,3 227 30,6 145 25,0
Стадия IIIA 47 33,1 168 22,6 123 21,2
T,N2M0 6 4,2 19 2,5 22 3,8
T2N2M0 22 15,5 80 10,8 64 11,0
T3N1M0 8 5,7 35 4,7 17 2,9
T3N2M0 11 7,7 34 4,6 20 3,5
Стадия HIB 16 11,2 59 8,0 22 3,8
T1N3M0 0 0 0 0 0 0
t2n3m0 3 2Д 3 0,4 2 0,3
t3n3m0 1 0,7 0 0 0 0
t4n0m0 5 3,4 20 2,8 9 1,6
t4n1m0 2 1,5 7 0,9 4 0,7
T4N2M0 5 3,5 27 3,6 5 0,9
t4n3m0 0 0 2 0,3 2 0,3
Стадия IV 2 1,5 4 0,5 11 1,9
TMNOM, 2 1,5 0 0 4 0,7
T1.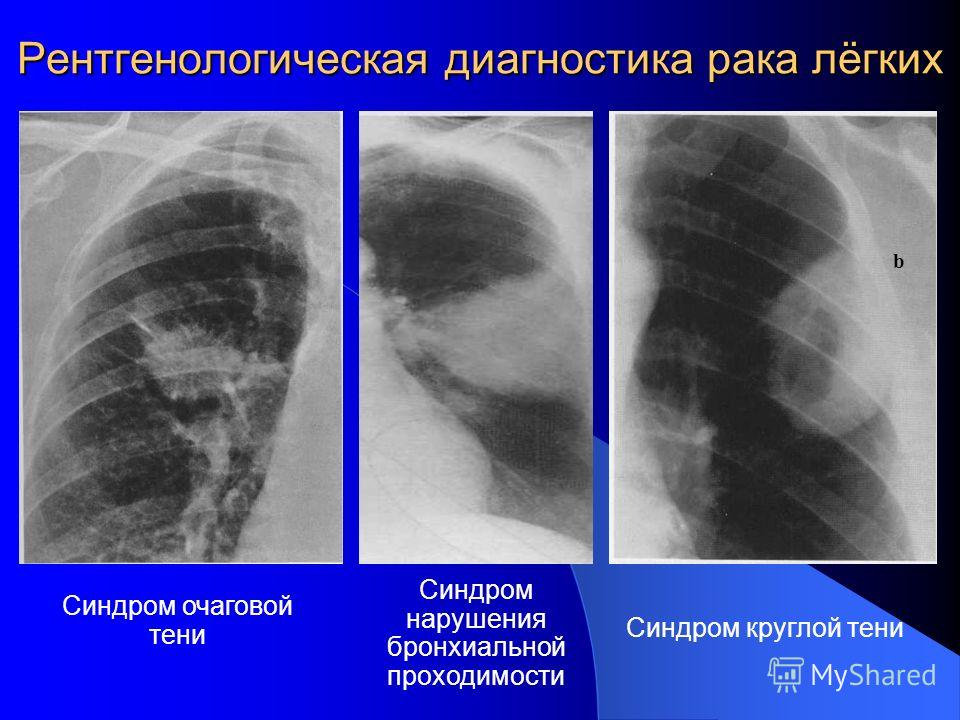 4N1M1 0 0 2 0,3 2 0,3
4N1M1 0 0 2 0,3 2 0,3
TmN2M, 0 0 1 0,1 5 0,9
TmN3M, 0 0 1 ОД 0 0
Всего (n=1464) 142 100% 742 100% 580 100%
Таблица 4
Распределение больных по объему радикальных оперативных вмешательств
Объем операций — Молодой возраст Средний возраст Пожилой возраст
Атипичные резекции 3 (2,1%) 9(1,2%) 13 (2,2%)
Сегментэктомии 1 (0,7%) 4 (0,5%) 5 (0,9%)
Лоб/билобэктомии 53 (37,3%) 296 (39,9%) 337(58,1%)
Пневмонэктомии 85 (59,9%) 433 (58,4%) 225 (38,8%)
Всего 142 (100%) 742(100%) 580 (100%)
Обращает на себя внимание более частое выполнение пневмонэктомии у радикально оперированных пациентов молодого и среднего возраста (59,9% (85 из 142) и 58,4% (433 из 742) соответственно). В пожилом же возрасте преобладали закономерно более щадящие вмешательства.
Чисто хирургическое лечение получили 110 (64,3%) пациентов молодого возраста, а комбинированное — 61 (35,7%) (табл. 5).
Таблица 5
Вид лечения Возраст
■молодой средний пожилой
Хирургическое 110(64,3%) 673 (75,8%) 554 (82,9%)
Комбинированное 61 (35,7%) 215 (24,2%) 114(17,1%)
Всего 171 (100%) 888 (100%) 668 (100%)
Обращает на себя внимание относительно большая частота комбинированного лечения у молодых больных. Так, соотношение хирургического и комбинированного лечения у молодых составило 64,3% : 35,7%, больных среднего возраста 75,8% : 24,2%, больных пожилого возраста 82,9% : 17,1%. Различия оказались статистически достоверными за счет пожилых пациентов, которые чаще получали чисто хирургическое лечение (1=2,9 р<0,005).
Варианты комбинированного лечения больных раком легкого представлены в таблице 6.
Таблица б
Варианты проведенного комбинированного лечения в возрастных группах
Варианты комбинированного лечения Возраст
молодой средний пожилой
абс. % абс.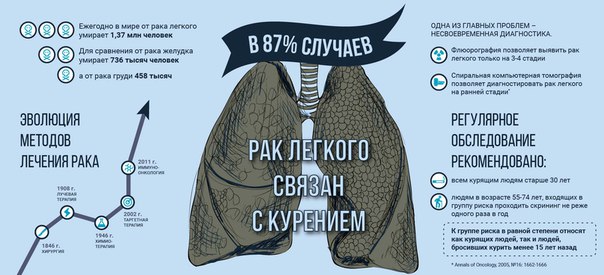 % абс. Г %
% абс. Г %
ХТ + Операция 8 13,1 27 12,5 12 10,6
ЛТ + Операция 7 11,5 55 25,6 13 11,4
Операция +ХТ 8 13,1 19 8,8 20 17,5
Операция + ЛТ 20 32,8 69 32,1 55 48,2
ХТ + Операция + ЛТ 3 4,9 23 10,8 6 5,3
ХТ+ЛТ+операция 3 4,9 4 1,9 4 3,5
Комбинированная лимфохимиотерапия 12 19,7 18 8,3 4 3,5
Всего 61 100% 215 100% 114 100%
Лучевая терапия проводилась преимущественно в режиме среднего фракционирования, в суммарной дозе 30-40Гр. Химиотерапия проводилась преимущественно с применением препаратов платины. Приведенные данные показывают многообразие комбинаций химиотерапии и лучевой терапии с операцией. Помимо этого, необходимо отметить, что комбинированное лечение проводилось в разных режимах и дозировках. В связи с вышесказанным, в нашем исследовании изучены только непосредственные и отдаленные результаты комбинированного лечения в целом.
Статистический анализ полученных результатов Достоверность различий количественных показателей в трех возрастных группах оценивалась по t-критерию Стьюдента.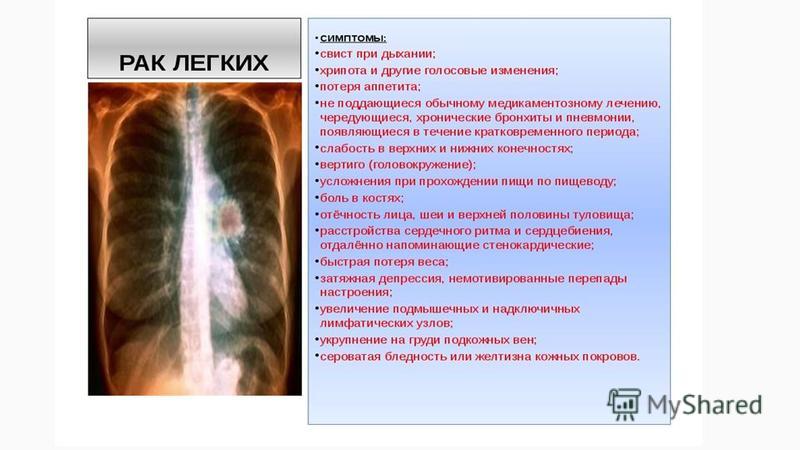
Для оценки критерия «выживаемости» использовался моментный метод построения таблиц дожития (Kaplan E.L. и Meier Р., 1958) с использованием компьютерной программы Statistic 6.0. Для сравнения кривых общей выживаемости, рассчитанных по методу Kaplan-Meier, использовались Log-rank тест, а также критерий (%2) — метод Пирсона. Уровень достоверности, необходимый для утвердительного ответа, составлял 95% и более (р<0,05). Результаты собственных исследований Лимфогенное метастазирование у больных молодого возраста Анализ лимфогенного метастазирования в возрастных группах проведен по клинико-анатомическим формам рака легкого с их последующим сравнением в зависимости от различных клинических факторов. В связи с небольшим числом больных в исследуемой группе (171 человек), сравнительный анализ лимфогенного метастазирования проведен по уровню поражения лимфоколлек-торов, а не по группам лимфоузлов.
Наиболее прогностически важным фактором, определяющим высокий метастатический потенциал был размер опухоли, как при центральном, так и при периферическом раке легкого.
Характеристика метастазирования в регионарные лимфоколлекторы в зависимости от размера первичной опухоли при центральном раке представлена в таблице 7.
Таблица 7
Характеристика метастазирования в регионарные лимфоколлекторы в зависимости от размера первичной опухоли при центральном раке_
«р>1» Размер опухоли
0-3 см 3,1-5 см >5 см
Возраст больных
ДО 45 46-59 60-74 до 45 46-59 60-74 до 45 46-59 60-74
рЫ+ 7 (46,7%) 36 (40,0%) 32 (48,5%) . 26 (52,0%) 77 (35,2%) 40 (29,8%) 42 (95,4%) 219 (82,3%) 91 (74,6%)
рМ0 8 (53,3%) 54 (60,0%) 34 (51,5%) 24 (48,0%) 142 (64,8%) 94 (70,2%) 2 (4,6%) 47 (17,7%) 31 (25,4%)
3 (20,0%) 20 (22,2%) 14 (21,2%) 9 (18,0%) 50 (22,9%) 22. ! (16,4%) 9 (20,4%) 64 (24,1%) 20 (16,4%)
рК2 4 (26,7%) 15 (16,7%) 18 (27,3%) 16 (32,0%) 25 (11,4%) 16 (11,9%) 29 (65,9%) 145 (54,5%) 68 (55,7%)
рМ3 0 1 (1,1%) 0 1 (2,0%) 2 (0,9%) (1,5%) 4 (9,1%) 10 (3,7%) 3 (2,5%)
Всего 15 (100%) 90 (100%) 66 (100%) 50 (100%) 219 (100%) 134 (100%) 44 (100%) 266 (100%) 122 (100%)
Опухоли более 5,0 см характеризовались стабильно высоким метастатическим потенциалом у больных молодого возраста, метастазы выявлялись почти у всех (95,4%) пациентов. В контрольных возрастных группах этот показатель оказался также высоким и составил 82,3% и 74,6%, соответственно (разница между возрастными группами статистически достоверна, р<0,001). Помимо этого, во всех возрастных группах метастазы достоверно чаще реализовались в медиастинальные лимфатические узлы, так, соотношение «Ы2 к N1», у молодых составило 65,9 к 20,4%, у больных среднего возраста 54,5 к 24,1%, а у пожилого возраста 55,7 к 16,4%. Различия в пределах каждой возрастной группы статистически достоверны (р<0,001) (табл. 7).
В контрольных возрастных группах этот показатель оказался также высоким и составил 82,3% и 74,6%, соответственно (разница между возрастными группами статистически достоверна, р<0,001). Помимо этого, во всех возрастных группах метастазы достоверно чаще реализовались в медиастинальные лимфатические узлы, так, соотношение «Ы2 к N1», у молодых составило 65,9 к 20,4%, у больных среднего возраста 54,5 к 24,1%, а у пожилого возраста 55,7 к 16,4%. Различия в пределах каждой возрастной группы статистически достоверны (р<0,001) (табл. 7).
В наблюдениях с размером первичной опухоли до 3,0 см обращает на себя внимание приблизительно одинаковое распределение метастатического поражения, как первого, так и второго уровня лимфоколлекторов. Так, у молодых
больных поражение только лимфоузлов первого уровня выявлено в 20,0%, а второго уровня в 26,7% случаев. Аналогичные показатели мы получили в наблюдениях у больных среднего и пожилого возраста, так соотношение «N1 к Ы2» составило 22,2 к 16,7% и 21,2 к 27,3% соответственно. Поражение лимфо-коллекторов уровня n3 при размере первичного опухолевого очага до 3,0 см нами выявлено лишь в одном наблюдении у больных среднего возраста. Одинаковое число наблюдений без лимфогенных метастазов во всех возрастных группах больных опухолью размером менее 3,0 см — 53,3; 60,0 и 51,5%, соответственно (р>0,5). Таким образом, в возрастных группах больных, опухоли размером до 3,0 см характеризовались одинаково низким и сопоставимым метастатическим потенциалом (р<0,5).
Поражение лимфо-коллекторов уровня n3 при размере первичного опухолевого очага до 3,0 см нами выявлено лишь в одном наблюдении у больных среднего возраста. Одинаковое число наблюдений без лимфогенных метастазов во всех возрастных группах больных опухолью размером менее 3,0 см — 53,3; 60,0 и 51,5%, соответственно (р>0,5). Таким образом, в возрастных группах больных, опухоли размером до 3,0 см характеризовались одинаково низким и сопоставимым метастатическим потенциалом (р<0,5).
Опухоли от 3,0 до 5,0 см, у больных молодого возраста характеризовались достоверно более высоким, чем в контрольных группах метастатическим потенциалом (52,0%; 35,2%; 29,8%). Поражение лимфоколлекторов уровня N1 в возрастных группах больных оказалось почти идентичным: — 18,0%; 22,9% и 16,4% соответственно. Однако поражение уровня N2 у молодых больных составило 32,0%, у больных среднего и пожилого возраста — 11,4 и 11,9%, соответственно (разница статистически достоверна 1=2,97 р<0,005 и 1=2,81 р<0,005).
Таким образом, у молодых больных наличие опухоли, превышающей 3,0 см, может оказаться прогностически значимым фактором, определяющим повышенный риск внутригрудного метастазирования.
Характеристика метастазирования в регионарные лимфоколлекторы в зависимости от размера первичной опухоли при периферическом раке представлена в таблице 8.
В нашем исследовании частота метастазирование во внутригрудные лимфатические узлы при опухолях до 3,0 см во всех возрастных группах не превышала 36,4% случаев. Показатели метастатического поражения каждого определенного уровня лимфоколлекторов, во всех возрастных группах статистически не различались.
Таблица 8
Регионарное метастазирование периферического рака в зависимости от ___размера первичного опухолевого очага_
«р№> Размер опухоли
0-3 см 3,1-5 см >5 см
Возраст больных
до 45 46-59 60-74 до 45 46-59 60-74 до 45 46-59 60-74
рК+ 9 (34,6%) 36 (36,4%) 39 (31,9%) 12 (66,7%) 32 (30,5%) 38 (29,6%) 12 (66,7%) 71 (65,1%) 53 (55,2%)
рИ0 17 (65,4%) 63 (63,6%) 83 (68,0%) 6 (33,3%) 73 (69,5%) 90 (70,4%) 6 (33,3%) 38 (34,9%) 43 (44,8%)
рИ, 3 (11,6%) 16 (16,2%) 19 (15,5%) ‘8 (44,4%) 13 (12,4%) 19 (14,8%) 3 (16,7%) 26 (23,8%) 12 (12,5%)
6 (23,0%) 20 (20,2%) 20 (16,4%) 4 (22,3%) 19 (18,1%) 19 (14,8%) 8 (44,4%) 41 (37,6%) 40 (41,7%)
рИ3 0 0 0 0 0 0 ‘ 1 (5,6%) 4 (3,7%) 1 (1,0%)
Всего 26 (100%) 99 (100%) 122 (100%) 18 (100%) 105 (100%) 128 (100%) 18 (100%) 109 (100%) 96 (100%)
Опухоли размером от 3,0 до 5,0 см у молодых больных при периферическом раке легкого характеризовались более высоким показателем внутригруд-ного метастазирования. Так, частота метастазирования в лимфатические узлы уровня N1 составила 44,4%, что в три раза больше, чем у больных среднего и пожилого возраста — 12,4% и 14,8%, соответственно. Разница статистически достоверна (1=2,57 р<0,01 и 1=2,38 р<0,02). В то же время, поражение лимфо-коллекторов уровня N2 существенно не различалось.
Так, частота метастазирования в лимфатические узлы уровня N1 составила 44,4%, что в три раза больше, чем у больных среднего и пожилого возраста — 12,4% и 14,8%, соответственно. Разница статистически достоверна (1=2,57 р<0,01 и 1=2,38 р<0,02). В то же время, поражение лимфо-коллекторов уровня N2 существенно не различалось.
Частота лимфогенного метастазирования опухолей размером более 5,0 см в исследуемой и контрольных группах оказалась одинаково высокой — 66,7%, 65,1%, 55,2% соответственно.
Таким образом, во всех возрастных группах больных, как при центральном, так и при периферическом раке легкого с увеличением размера первичного опухолевого очага отмечено возрастание лимфогенного метастазирования в целом. Опухоли размером от 3,0 до 5,0 см у молодых больных характеризовались более агрессивным течением лимфогенного метастазирования относительно больных контрольных возрастных групп.
У больных центральным раком легкого молодого возраста в случае поражения сегментарного бронха метастазы определялись в 62,5%, а у больных среднего и пожилого возраста в 42,2% и 36,4% наблюдений соответственно (разница между возрастными группами статистически не достоверна 1=1,09 р<0,5 и 1=1,40 р<0,1) (табл. 9).
9).
Таблица 9
Характеристика регионарного метастазирования в возрастных группах при центральном раке легкого в зависимости от проксимальной границы
поражения бронхиального дерева
«р№> Проксимальная граница поражения бронха
Сегментарный бронх Долевой бронх Главный бронх
Воз эаст больных
до 45 46-59 60-74 до 45 46-59 60-74 до 45 46-59 60-74
5 (62,5%) 19 (42,2%) 16 (36,4%) 55 (67,9%) 229 (55,6%) 111 (49,3%) 15 (75,0%) 84 (71,2%) 36 (67,9%)
3 (37,5%) 26 (57,8%) 28 (63,6%) 26 (32,1%) 183 (44,4%) 114 (50,7%) 5 (25,0%) 34 (28,8%) 17 (32,1%)
Р>Г, 1 (12,5%) 11 (24,4%) 6 (13,6%) 18 (22,2%) 102 (24,8%) 41 (18,2%) 2 (10,0%) 21 (17,8%) 9 (17,0%)
рИ2 3 (37,5%) 8 (17,8%) 9 (20,5%) 33 (40,8%) 120 (29,1%) 68 (30,2%) 13 (65,0%) 57 (48,3%) 25 (47,1%)
рМ3 1 (12,5%) 0 1 (2,3%) 4 (4,9%) 7 (1,7%) 2 (0,9%) 0 6 (5,1%) 2 (3,8%)
Всего 8 (100%) 45 (100%) 44 (100%) 81 (100%) 412 (100%) 225 (100%) 20 (100%) 118 (100%) 53 (100%)
Поражение долевого бронха у молодых больных определило более высокий процент метастазирования — метастазы в регионарные лимфатические узлы реализовались в 67,9% наблюдений.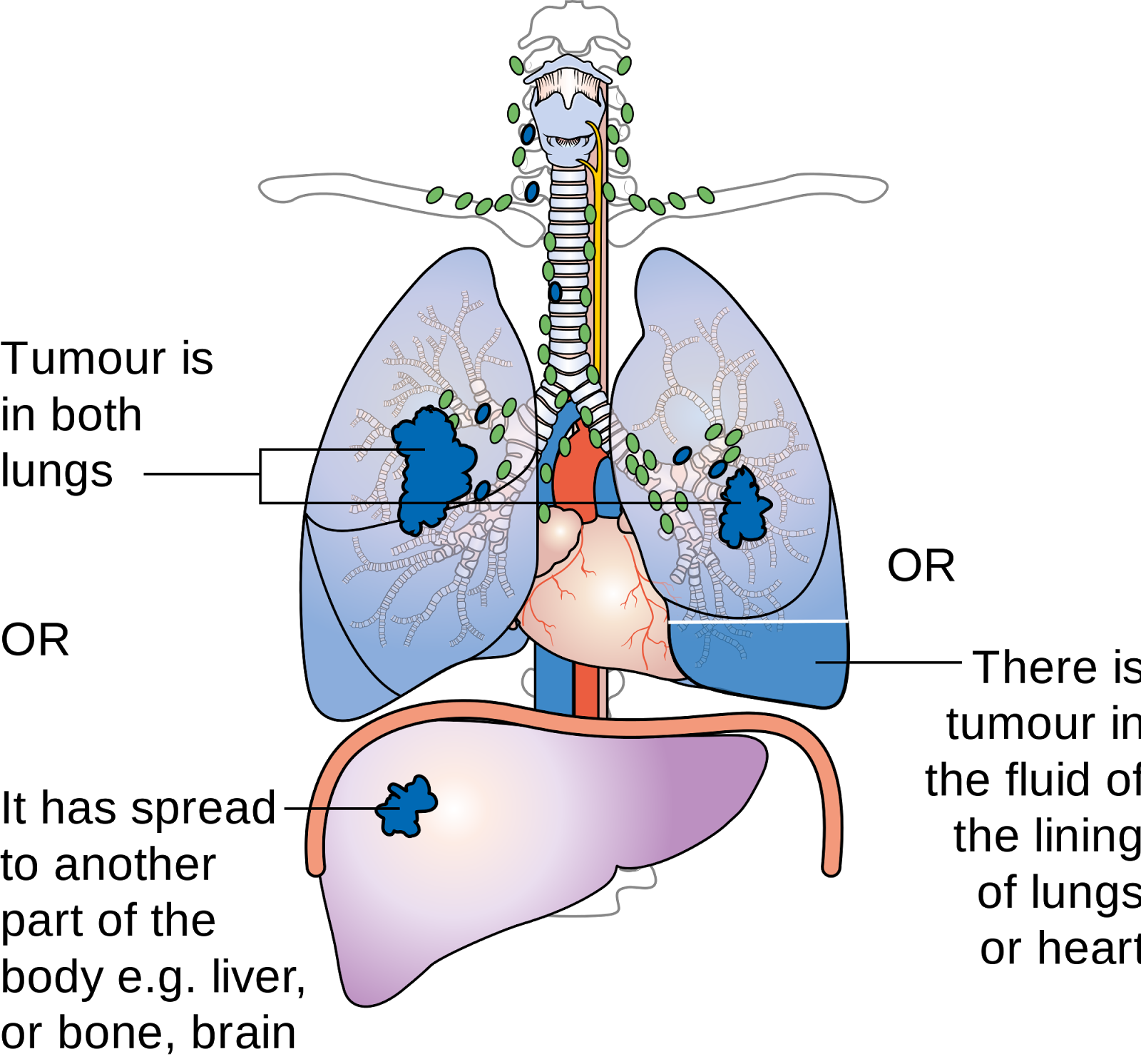 В то же время у больных среднего и пожилого возраста при поражении долевого бронха общая частота метастазирования составила 55,6% и 49,3%, соответственно (разница между основной и контрольными группами статистически достоверна 1=2,14 р<0,02 и 1=3,02 р<0,002). Отмеченная разница в частоте метастазирования достигается за счет N2, так как частота метастазирования в первый уровень лимфоколлекторов в сравниваемых группах сопоставима (22,2; 24,8 и 18,2%), а для второго уровня лимфоколлекторов — 40,8% у молодых больных достоверно больше, чем 29,1%
В то же время у больных среднего и пожилого возраста при поражении долевого бронха общая частота метастазирования составила 55,6% и 49,3%, соответственно (разница между основной и контрольными группами статистически достоверна 1=2,14 р<0,02 и 1=3,02 р<0,002). Отмеченная разница в частоте метастазирования достигается за счет N2, так как частота метастазирования в первый уровень лимфоколлекторов в сравниваемых группах сопоставима (22,2; 24,8 и 18,2%), а для второго уровня лимфоколлекторов — 40,8% у молодых больных достоверно больше, чем 29,1%
и 30,2% у пациентов среднего и пожилого возраста соответственно (1=1,98 р<0,05 и 1=1,89 р<0,05).
При поражении главного бронха у молодых больных метастазы во внут-ригрудные лимфатические узлы реализовывались в 75,0% наблюдений, а поражение лимфоколлекторов второго уровня составило 65,0%. Аналогичные данные нами получены в наблюдениях у больных среднего и пожилого возраста — № 71,2%; N2 48,3% и 67,9%; N2 47,1%, соответственно.
Таким образом, уровень поражения бронха при центральном раке легкого может являться значимым фактором в прогнозировании внутригрудного мета-стазирования. Так, у больных молодого возраста, и в контрольных возрастных группах с приближением проксимальной границы опухоли от сегментарного бронха к главному возрастает показатель общей частоты метастазирования в основном за счет поражения второго уровня лимфоколлекторов.
При аденокарциноме как центральной, так и периферической локализации каких-либо существенных различий структуры лимфогенного метастазирования в возрастных группах нами не обнаружено. Однако при плоскоклеточном раке легкого у молодых больных отмечено более агрессивное поведение опухоли (табл. 10).
Таблица 10
Характеристика регионарного метастазирования в возрастных группах при
центральном плоскоклеточном раке
«рЫ» Возраст
молодой средний пожилой
абс. % абс. % абс. %
60 67,4 280 56,1 133 47,3
N0 29 32,6 219 43,9 148 52,7
N. 20 22,5 119 23,8 50 17,8
20 22,5 119 23,8 50 17,8
N2 36 40,4 151. 30,3 79 28,1
N3 4 4,5- 10 2,0 4 1,4
Всего 89 100% 499 100% 281 100%
При центральном плоскоклеточном раке легкого отмечена высокая частота лимфогенного метастазирования у больных молодого возраста в основном за счет поражения лимфоколлекторов уровня N2, которое составило 40,4%. Ана-
логичные данные у больных среднего и пожилого возраст составили 30,3% и 28,1%, соответственно. Разница оказалась статистически достоверной относительно больных пожилого возраста (1=2,10 р<0,05), а относительно больных среднего возраста она приближалась к достоверности (1=1,82 р<0,1). Также общая частота лимфогенного метастазирования у больных молодого возраста достоверно выше, чем у больных среднего и пожилого возраста (67,4% против 56,1% и 47,3%, 1=2,08 р<0,02 и 1=3,47 р<0,001).
Характеристика внутригрудного метастазирования при периферическом плоскоклеточном раке легкого представлена в таблице 11.
Таблица 11
Характеристика внутригрудного метастазирования при периферическом
плоскоклеточном раке легкого
«рИ» Возраст
молодой средний пожилой
абс. % абс. % абс. %
N0 7 38,9 84 58,7 109 63,4
N1 3 16,7 26 18,2 26 15,1
N2 8 44,4 33 23,1 37 21,5
N3 0 0 0 0 0 0
Всего 18 100% 143 100% 172 100%
Отсутствие поражения лимфатических узлов (N0) у молодых встречается достоверно реже, чем у больных среднего и пожилого возраста — 38,9% против 58,7% и 63,4%. Целесообразно отметить, что у молодых пациентов относительно больных контрольных возрастных групп при одинаковой частоте поражения лимфоколлекторов уровня N1 (16,6; 18,2 и 15,1%, соответственно), число поражения лимфоколлекторов уровня N2 оказалось достоверно выше (44,4% против 23,1% и 21,5%; р<0,05).
Результаты радикального хирургического лечения При расчетах выживаемости больных из общего числа наблюдений исключены случаи послеоперационной летальности, смерти от сопутствующих заболеваний, а также пациенты с отдаленными метастазами (М|) на момент операции.
Показатели 5-летней выживаемости у радикально оперированных молодых больных (рис. 1) оказались низкими. Так, 5-летний период пережили 34,2% (43 из 127) больных молодого возраста, 40,1% (257 из 645) больных среднего возраста и 43,3% (210 из 486) больных пожилого возраста. Разница статистически оказалась достоверной относительно больных пожилого возраста (р<0,05, Х2=1,69, k=l Log-rank test), а относительно больных среднего возраста мы лишь получили тенденцию к достоверности (р<0,2).
Рис. 1. Общая выживаемость после радикальных операций в зависимости от
возраста
Данные общей выживаемости у радикально оперированных больных в за-
висимости от стадии болезни представлены в таблице 12.
Таблица 12
_ Выживаемость в зависимости от стадии рака легкого_
Стадии Молодой возраст Средний возраст Пожилой возраст «р»
Выживаемость (%)
3 года 5 лет (п) 3 года 5 лет (п) 3 года 5 лет (п)
IA 62,5% 50,0% 15 80,3% 59,7% 72 72,6% 68,5% 63 p=Q,5
IB 62,6% 56,5% 22 66,6% 54,4% 203 68,3% 52,4% 204 Р=0,5
IIA — — 3 29,9% 29,7% 13 55,5% 36,9% 13 -
IIB 50,2% 39,6% 31 42,9% 33,1% 156 46,9% 37,3% 84 р=0,5
IIIA 44,4% 15,0% 44 34,6% 28,8% 149 30,4% 22,1% 105 р=0,05
IIIB 20,0% 20,0% 12 27,3% 16,7% 52 37,5% 29,0% 17 Р=0,5
п — число наблюдений
При IA стадии рака легкого максимальная 5-летняя выживаемость отмечена у больных пожилого возраста — 68,5% (42 из 63), в то же время, у больных молодого и среднего возраста — 50,0% (8 из 15) и 59,7% (41 из 72), соответственно. Однако, различия в сравниваемых возрастных группах статистически не достоверны (р<0,5, %2=2,20, k=l Log-rank test). При IB стадии общая выживаемость молодых больных также оказалась идентичной выживаемости больных старших возрастных групп: 56,5% (12 из 22), 54,4% (109 из 203) и 52,4% (106 из 205), соответственно (р>0,05, х2=0,63, k=l Log-rank test). При IIB стадии общая 5-летняя выживаемость молодых составила 39,6% (12 из 31), больных среднего и пожилого возрастаЗЗ,1% (51 из 156) и 37,3% (31 из 84), соответственно. Разница статистически недостоверна (р<0,5, %2=0,37, k=l Logrank test).
Однако, различия в сравниваемых возрастных группах статистически не достоверны (р<0,5, %2=2,20, k=l Log-rank test). При IB стадии общая выживаемость молодых больных также оказалась идентичной выживаемости больных старших возрастных групп: 56,5% (12 из 22), 54,4% (109 из 203) и 52,4% (106 из 205), соответственно (р>0,05, х2=0,63, k=l Log-rank test). При IIB стадии общая 5-летняя выживаемость молодых составила 39,6% (12 из 31), больных среднего и пожилого возрастаЗЗ,1% (51 из 156) и 37,3% (31 из 84), соответственно. Разница статистически недостоверна (р<0,5, %2=0,37, k=l Logrank test).
При IIIA стадии общая выживаемость молодых больных оказалась достоверно ниже выживаемости больных среднего и пожилого возраст — 15,0% (7 из 44) против 28,8% (43 из 149) и 22,1% (23 из 105). (р<0,05, г =6,22 k=l Log-rank test) (рис. 2).
Рис. 2. Общая выживаемость больных раком легкого IIIA стадии в зависимости от возраста При IIIB стадии различий выживаемости молодых относительно больных
старших возрастных групп нами не выявлено (р<0,5, х2=1,29 k=l Log-rank test).
Сравнительный анализ выживаемости больных в возрастных группах в зависимости от объема операции и стадии болезни показал, что 5-летняя выживаемость больных раком легкого I стадии, оперированных в объеме лоб/билобэктомии статистически не различалась: 44,2% (9 из 21) — молодые больные; 58,4% (89 из 153) — средний возраст; 55,7% (104 из 186) — пожилые пациенты (р<0,2 и р<0,5, %2=0,65 k=l Log-rank test) (рис. 3).
Рис. 3. Общая выживаемость больных раком легкого I стадии, оперированных в объеме лоб/билобэктомии
Аналогичные результаты получены и для больных раком легкого, оперированных в объеме пневмонэктомии. 5-летняя выживаемость молодых — 66,7% (9 из 14) против 54,4% (60 из 110) и 51,7% (35 из 67) для групп среднего и пожилого возраста соответственно (р<0,5 и р<0,5, %2=1,07 k=l Log-rank test) (рис.
4).
100
молодой возраст средний возраст пожилой возраст
2 годы з
Рис. 4. Общая выживаемость больных раком легкого I стадии, оперированных
в объеме пневмонэктомии 5-летняя выживаемость молодых больных раком легкого II стадии, оперированных в объеме лоб/билобэктомии статистически не отличалась от выживаемости пациентов контрольных возрастных групп — 49,8; 35,0 и 29,5% (р<0,5, х2=2,55 k=l Log-rank test) (рис. 5).
5).
Рис. 5. Общая выживаемость больных раком легкого II стадии, оперированных
в объеме лоб/билобэктомии Аналогичная картина имеет место и для больных раком легкого II стадии,
оперированных в объеме пневмонэктомий — 49,2; 41,0 и 31,9%, соответственно
(р<0,5 и р<0,5, %2=1,75 k=l Log-rank test) (рис. 6).
Рис. 6. Общая выживаемость больных раком легкого II стадии, оперированных
в объеме тевмонэктомии -Показатели 5-летней выживаемости больных раком легкого III стадии,
оперированных в объеме лоб/билобэктомии, у больных молодого, среднего и пожилого возраста оказались идентичными и составили 25,8; 35,6 и 23,0%, соответственно. Различия статистически недостоверны (р<0,5 и р<0,5, %2=3,19 к=1 Log-rank test) (рис. 7).
Рис. 7. Общая выживаемость больных раком легкого III стадии, оперированных в объеме лоб/билобэктомии
Для больных раком легкого III стадии, оперированных в объеме пневмо-нэктомии 5-летняя выживаемость в сравниваемых группах больных также ста-
тистически не различалась — 14,2; 23,0 и 23,2%, соответственно (р<0,5 и р<0,5, Х2=2,70 k=l Log-rank test) (рис. 8).
8).
Рис. 8. Общая выживаемость больных раком легкого III стадии, оперированных в объеме пневмонэктомии Влияние гистологического варианта опухоли на результаты радикального
хирургического лечения характеризовалось некоторыми особенностями. Так, при I и II стадиях заболевания 5-летняя выживаемость во всех возрастных группах больных плоскоклеточным раком легкого фактически оказалась идентичной — 58,2; 57,6 и 57,8%, соответственно. А при III стадии выживаемость молодых пациентов оказалась достоверно хуже выживаемости больных контрольных возрастных групп — 10,8% (4 из 39) против 30,0% (43 из 143) и 30,3% (24 из 79), соответственно (р<0,002 и р<0,01, соответственно) (табл. 13).
Напротив, при всех стадиях аденокарциномы легкого показатели общей 5-летней выживаемости у молодых пациентов оказались лучше, так, при I, II и III стадиях заболевания общая выживаемость молодых больных составила 55,6% (9 из 16), 40,0% (4 из 10) и 41,0% (6 из 14), соответственно; выживаемость больных среднего возраста составила 46,5% (27 из 58), 22,3% (8 из 35) и 8,3% (4 из 47), а пожилых пациентов — 44,0% (33 из 75), 21,5% (4 из 21) и 11,7% (4 из 38), соответственно. Однако разница оказалась статистически достоверной только при III стадии рака легкого (р<0,02 и р<0,05, соответственно) (табл. 13).
Однако разница оказалась статистически достоверной только при III стадии рака легкого (р<0,02 и р<0,05, соответственно) (табл. 13).
Таблица 13
Общая выживаемость в зависимости от стадии заболевания _при плоскоклеточном раке и аденокарциноме__
Структура опухоли Стадии 5-летняя выживаемость (%) «р»
молодой возраст средний возраст пожилой возраст
Плоскоклеточный рак 1 58,2% 57,6% 57,8% р<0,5
II 41,4% 35,6% 45,2% Р<0,5
III 10,8% 30,0% 30,3% р<0,002 р<0,01
Число наблюдений (п) 17/23/39 195/125/143 180/69/79
Аденокарцинома I — 55,6% 46,5% 44,0% р<0,5
II • 40,0% 22,3% 21,5% Р<0,5
III 41,0% 8,3% 11,7% р<0,02 р<0,05
Число наблюдений (п) 16/10/14 58/35/47 75/21/38
Наиболее прогностически значимым клиническим фактором, влияющим
на результаты радикального хирургического лечения у молодых пациентов, оказался размер опухоли менее 3,0 см. Так, общай 5-летняя выживаемость оказалась одинаково выше в возрастных группах и составила 57,0% (20 из 35), 47,2% (80 из 169) и 47,3% (71 из 151), соответственно (р<0,5 и р<0,5, х2=0,84 k=l Log-rank test) (табл. 14).
Так, общай 5-летняя выживаемость оказалась одинаково выше в возрастных группах и составила 57,0% (20 из 35), 47,2% (80 из 169) и 47,3% (71 из 151), соответственно (р<0,5 и р<0,5, х2=0,84 k=l Log-rank test) (табл. 14).
Таблица 14
Выживаемость радикально оперированных больных в зависимости от _ размера первичного опухолевого очага _
Размер опухоли Выживаемость (%) «р»
годы молодой возраст средний возраст пожилой возраст
До 3 см 3 года 66,6% 60,9% 56,8% Р<0,5 р<0,5
5 лет 57,0% 47,2% 47,3%
Медиана выжив, (мес.) 61 мес. 54 мес. 49 мес.
Число наблюдений (п) 35 169 151
От 3 до 5 см 3 года 49,5% 57,5% 64,4% р<0,05 р<0,05
5 лет 33,1% 47,9% 48,5%
Медиана выжив, (мес.) 29 мес. 50 мес. 51 мес.
Число наблюдений (п) 56 261 212
Более 5 см 3 года 33,6% 36,0% 37,6% р<0,2 р<0,1
5 лет 16,8% 26,5% 30,4%
Медиана выжив, (мес. ) 19 мес. 23 мес. 21 мес.
) 19 мес. 23 мес. 21 мес.
Число наблюдений (п) 36 215 123
При размере первичного опухолевого очага от 3,0 до 5,0 см результаты 5-летней выживаемости у молодых оказались достоверно хуже, составляя 33,1% (18 из 56) против 47,9% (125 из 261) и 48,5% (102 из 212), соответственно (р<0,05 и р<0,05, х2=3,86 k=l Log-rank test).
При опухолях размером более 5,0 см в возрастных группах больных установлены одинаково низкие показатели 5-летней выживаемости — 16,8% (6 из 36) против 26,5% (57 из 215) и 30,4% (37 из 123), соответственно (р<0,2 и р<0,1, X2=l,30 k=l Log-rank test).
Более низкие показатели 5-летней выживаемости молодых пациентов по сравнению с другими возрастными группами получены и при опухолях, соответствующих значению символа «Т3». Так, 5-летняя выживаемость молодых пациентов составила 14,3% (5 из 31) против 30,4% (36 из 120) и 31,6% (19 из 60) (р<0,01, /2= 10,50 k=l Log-rank test).
Общая выживаемость больных в зависимости от стадии болезни при хирургическом и комбинированном лечении представлена в таблице 15.
Таблица 15
Общая выживаемость в зависимости от стадии болезни при хирургическом и _ комбинированном лечении___
Вид лечения Стадия Молодой возраст Средний возраст Пожилой возраст
5-летняя выживаемость (%)
Хирургический I 60,0% 58,7% 55,7% р<0,5
II 45,8% 37,3% 39,8% р<0,5
III 18,0% 27,9% 23,7% р<0,5 Р<0,5
Число наблюдений (п) 33/21/20 246/131/111 241/79/83
Комбинированный I — 22,2% 48,5% -
II 39,8% 18,8% 26,2% р<0,5
III 17,9% 23,2% 21,4% р<0,5 р<0,5
Число наблюдений (п) 4/13/36 29/38/90 26/18/39
Сравнительный анализ переведен между «первой и второй» и «первой и третей» возрастнъши группами
Достоверных различий в выживаемости молодых больных по сравнению с другими возрастными группами, как после хирургического, так и комбинированного лечения при одинаковых стадиях заболевания не выявлено.
Сравнительный анализ результатов хирургического и комбинированного лечения рака легкого в пределах каждой возрастной группы позволил выявить следующее:
• у молодых пациентов результаты хирургического и комбинированного лечения при всех стадиях за исключением I стадии оказались идентичными.
• у больных среднего возраста при I и II стадиях рака легкого результаты хирургического лечения с большой достоверностью превосходили
1
результаты комбинированного лечения (р<0,0001). Однако при III стадии рака легкого результаты хирургического и комбинированного лечения фактически оказались идентичными (р<0,5).
• у пожилых больных результаты хирургического лечения оказались достоверно лучше только при I стадии заболевания (р<0,01), при II и III стадиях рака легкого результаты хирургического и комбинированного лечения оказались сопоставимы.
Выводы
1. Среди оперированных по поводу немелкоклеточного рака легкого молодые пациенты составляют всего 9,9% (171 из 1727). Во всех возрастных группах преобладающим гистологическим типом является плоскоклеточный рак. Однако среди пациентов молодого возраста относительно преобладают женщины и больные аденокарциномой низкой степени дифференцировки по сравнению с больными среднего и пожилого возраста.
2. Характеристики опухолей — «Т2.з», размер от 3,0 до 5,0 см, проксимальная граница на уровне долевого бронха, плоскоклеточный рак — являются отрицательными прогностическими клиническими факторами, определяющими повышенную частоту лимфогенного метастазирования у больных молодого возраста относительно пациентов среднего и пожилого возраста.
3. В целом 5-летняя выживаемость молодых больных после радикального хирургического лечения ниже относительно пожилых — 34,2% против 43,3% (р<0,05). Однако при I и II стадиях заболевания у молодых пациентов и в стар-
ших возрастных группах выживаемость одинакова; она ухудшается только при IIIA стадии — 15,0; 28,8 и 22,1% (р<0,05, yj=6,22 k=l Log-rank test), соответственно. При опухолях, соответствующих значению «Тз», с размером от 3,0 до 5,0 см без учета лимфогенного метастазирования (N), выживаемость молодых пациентов также ниже, чем в группе среднего и пожилого возраста (р<0,01, Х2=10,5 k=l Log-rank test).
4. При центральном раке выживаемость пациентов пожилого возраста достоверно выше относительно пациентов молодого и среднего возраста — 47,2; 33,2 и 37,6%, соответственно (р<0,05). Поражение регионарных лимфатических узлов при верхнедолевой локализации опухоли прогностически более неблагоприятно у больных молодого возраста: так 5-летняя выживаемость оказалась достоверно ниже — 14,3; 27,9 и 29,1%, соответственно (р<0,05).
При центральном раке выживаемость пациентов пожилого возраста достоверно выше относительно пациентов молодого и среднего возраста — 47,2; 33,2 и 37,6%, соответственно (р<0,05). Поражение регионарных лимфатических узлов при верхнедолевой локализации опухоли прогностически более неблагоприятно у больных молодого возраста: так 5-летняя выживаемость оказалась достоверно ниже — 14,3; 27,9 и 29,1%, соответственно (р<0,05).
5. Как при плоско клеточном раке, так и при аденокарциноме выживаемость в возрастных группах больных при 1 и II стадиях оказалась идентичной. Однако при III стадии заболевания 5-летняя выживаемость молодых больных аденокарциномой оказалась выше, а плоскоклеточным раком ниже. Так, при аденокарциноме она составила 41,0; 8,3 и 11,7%, соответственно (р<0,02 и р<0,05), а при плоскоклеточном раке — 10,8; 30,0 и 30,3%, соответственно (р<0,002 и р<0,01).
6. Объем хирургического вмешательства при сравнимой распространенности опухоли не оказал влияния на показатели выживаемости в сравниваемых возрастных группах.
7. У молодых пациентов результаты хирургического и комбинированного лечения при всех стадиях заболевания существенно не различались. А в старших возрастных группах при I и II стадиях рака легкого результаты хирургического лечения превосходили результаты комбинированного лечения (р<0,05). Однако при III стадии в контрольных возрастных группах больных результаты хирургического и комбинированного лечения существенно не различались.
8. Несмотря на некоторые клинические различия, большая частота про-грессирования процесса у больных молодого возраста лишь соответствует
большей распространенности первичных опухолей, а не отражает «более злокачественное» течение заболевания в молодом возрасте.
Список научных трудов, опубликованных по теме диссертации
1. Багиров P.P., Полоцкий Б.Е./Рак легкого у больных молодого возрас-та//Российский Биотерапевтический Журнал. — 2009. — Т.8. — №4. — С. 89-94.
2. Багиров P.P.. Лактионов К.К., Аллахвердиев А. К., Никуличев Л.А., Бахтадзе Л.А., Полоцкий Б.Е., Давыдов М.И./Хирургическое лечение рака легкого у больных молодого возраста//Вестник РОНЦ им. Н.Н.Блохина РАМН.’- 2009. — Т.20. — №4. — С. 48-56.
К., Никуличев Л.А., Бахтадзе Л.А., Полоцкий Б.Е., Давыдов М.И./Хирургическое лечение рака легкого у больных молодого возраста//Вестник РОНЦ им. Н.Н.Блохина РАМН.’- 2009. — Т.20. — №4. — С. 48-56.
3. Davydov Mikhail, Allakhverdiyev Arif, Polotsky Boris, Laktionov Konstantin, Davydov Mikhail M., Nikulichev Lev, Bagirov Rahmat. Gotsadze Ilya/Systematic lymph node dissection (SLND) — the mainstay of surgical management of stage II and IIIA lung cancer//Scientific Abstracts of the 13th World Conference on Lung Cancer. — San Francisco, USA. -2009. — July 31-August 4. — PD11.1.5.
/
I
Подписано в печать 08.02.1Q Формат 60X84/16 Бумага офисная «8уек>Сору». Тираж 100 экз. Заказ № 114 Отпечатано на УМТ РОНЦ им. Н.Н.Блохина РАМН 115478, Москва, Каширское ш., 24
Онкологи назвали средний возраст диагностики рака в России :: Общество :: РБК
Средний возраст диагностики онкологических заболеваний среди россиян составляет 64,5 года.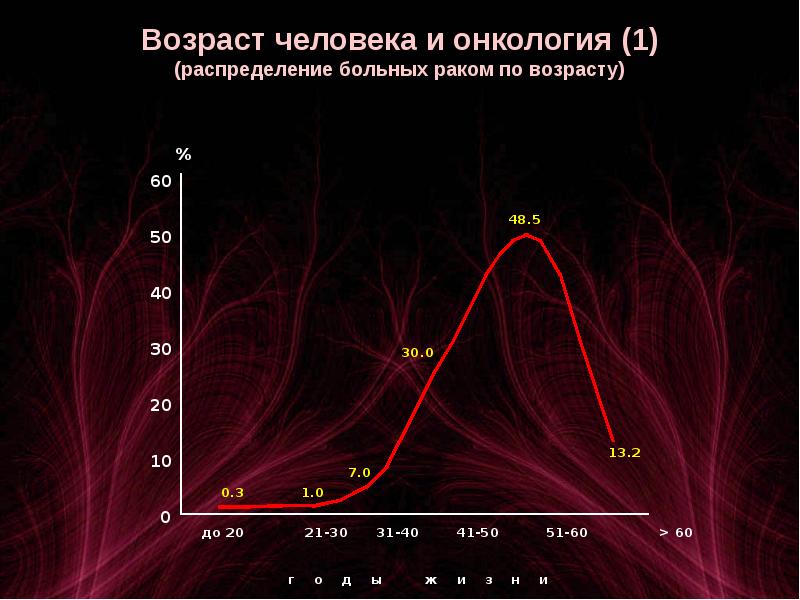 Об этом сообщает RT со ссылкой на Российское общество клинической онкологии.
Об этом сообщает RT со ссылкой на Российское общество клинической онкологии.
Для представителей мужского пола этот возраст составил 64,9 лет, для женщин — 64,2. Отмечается, что за девять лет этот показатель вырос с 63,8 и 63,3 года соответственно.
Отмечается, что у людей от 60 лет и старше диагностируется 71,3% случаев заболевания среди мужчин и 65,8% среди женщин. Данные статистики эксперты Российского общества клинической онкологии объясняют особенностями болезни, так как злокачественные образования появляются при накоплении молекулярных нарушений, свойственных для более старшего поколения.
Онколог предупредил о скачке смертности от рака в ближайшие годы
В частности, рак молочной железы диагностируется в возрасте от 60 до 74 лет, рак легких диагностируется в среднем в 65 лет, рак прямой кишки — в 66 лет, поджелудочной железы — 65 лет для мужчин и 70 лет для женщин. Пик заболеваемости раком печени приходится на мужчин старше 55 лет и женщин старше 60 лет.
Пик заболеваемости раком печени приходится на мужчин старше 55 лет и женщин старше 60 лет.
7 фактов о раке легкого, ПЭТ-Технолоджи
У курильщиков риск развития рака легкого в 10 раз выше по сравнению с теми, кто не подвержен этой привычке.
1. Рак лёгкого связан не только с курением
У курильщиков риск развития рака легкого в 10 раз выше по сравнению с теми, кто не подвержен этой привычке. Однако по статистике в большинстве случаев рак лёгкого развивается у людей, бросивших курить или не куривших регулярно. Это связано с тем, что доля таких людей в популяции значительно выше, чем доля курильщиков. Только 10% больных вообще не пробовали курить. Зачастую симптомы рака лёгкого среди людей, ведущих здоровый образ жизни, менее заметны, а иногда даже отличаются от симптомов рака лёгкого у курящих.
У курильщиков риск развития рака легкого в 10 раз выше
2. Рак лёгкого можно предотвратить
Отказ от курения является лишь одним из важных решений, приняв которые можно значительно снизить риск развития рака лёгкого. Некоторые профессиональные вредности, к примеру асбестовая пыль, повышает риск его развития в несколько раз. Газ радон, концентрация которого зависит от геологической обстановки, также способен при вдыхании нанести вред легким и повысить риск развития рака на 10-30%. Здоровый образ жизни, умеренная диета и регулярная физическая нагрузка снижает риск развития данной патологии.
Некоторые профессиональные вредности, к примеру асбестовая пыль, повышает риск его развития в несколько раз. Газ радон, концентрация которого зависит от геологической обстановки, также способен при вдыхании нанести вред легким и повысить риск развития рака на 10-30%. Здоровый образ жизни, умеренная диета и регулярная физическая нагрузка снижает риск развития данной патологии.
3. Заболеваемость раком легкого среди женщин растет
По данным ВОЗ, за период с 1991 по 2005 год заболеваемость раком лёгкого среди мужчин снизилась на 2%, что ученые связывают с отказом от курения, а заболеваемость среди женщин повысилась на 0,5%.
Заболеваемость среди женщин растет
4. Даже после выявления заболевания следует бросить курить
Многие курильщики считают, что если рак лёгкого уже выявлен, то смысла бросать пагубную привычку нет. Однако доказано, что отказ от курения в любом случае может благоприятно сказаться на здоровье пациента, повысить эффективность оперативного лечения, и снизить смертность.
5. Эффективность терапии практически не зависит от возраста
Возраст пациента не должен его пугать — по данным исследований, пожилой человек с хорошим состоянием сердечно-сосудистой системы так же хорошо переносят химиотерапию, как и более молодые пациенты. Качество жизни после своевременного оперативного лечения также схожее. Основным показателем переносимости любого вида лечения является функциональный класс пациента, то есть возможность самостоятельно выполнять повседневные задачи.
Рак лёгкого — не приговор
6. Хирургическое вмешательство не приводит к метастазированию
Широко распространён миф о том, что при воздействии воздуха на патологический очаг при раке лёгкого происходит метастазирование. Операция не вызывает метастазирование, а при своевременной диагностике патологии с помощью совмещенной позинтронно-эмиссионной и компьютерной томографии (ПЭТ/КТ) она даёт шанс полностью излечиться от рака лёгкого.
7. Рак лёгкого — не приговор
Несмотря на агрессивный характер опухоли ученые значительно продвинулись в понимании данной патологии. К последним достижениям в лечении любых форм рака лёгкого на разных стадиях можно отнести КиберНож — роботизированную систему сверхточного облучения больных тканей. Кроме того, современная медицина помимо традиционных методов химиотерапии располагает рядом таргетных препаратов, поражающих только опухолевые клетки. Эти лекарства способны значительно продлить жизнь больным раком легкого — в том числе на поздних стадиях заболевания.
К последним достижениям в лечении любых форм рака лёгкого на разных стадиях можно отнести КиберНож — роботизированную систему сверхточного облучения больных тканей. Кроме того, современная медицина помимо традиционных методов химиотерапии располагает рядом таргетных препаратов, поражающих только опухолевые клетки. Эти лекарства способны значительно продлить жизнь больным раком легкого — в том числе на поздних стадиях заболевания.
Следующий раздел
Профилактика
онкологических
заболеваний
Далее
Можно ли победить рак легкого
Ассоциация исследователей легочных заболеваний Соединенных Штатов Америки утверждает, что в 80-90 % случаев причиной развития рака легкого является курение. Уже на протяжении нескольких десятилетий табакозависимость считается одним из смертельных пороков человечества.
Вредная привычка, которая за короткое время переросла в настоящую пандемию, за последние 50 лет погубила более 60 миллионов человек в мире.
После того, как курение перестало быть прерогативой светского общества, это «развлечение» превратилось в социальную болезнь. Ведь табак пагубно влияет не только на здоровье курящего, но и оказывает вредное воздействие на окружающих. Можно ли избавить общество от табачной зависимости: об этом рассуждает заведующий отделом организации противораковой борьбы Республиканского научно-практического центра онкологии и медицинской радиологии им. Н. Н. Александрова, кандидат медицинских наук Павел Моисеев.
Павел Иванович, каждый из нас знает, что курение вредно для здоровья, так как оно приводит к развитию различных заболеваний. Влияет ли эта информация на людей — количество курящих людей в Беларуси становится меньше?
Рак легкого — это одна из самых древних опухолей, которая известна человечеству. Не забывайте, что данное заболевание появилось задолго до того, как Колумб открыл Америку и привез табак в Европу. Интересно, что в Старом Свете изначально за курение человеку грозила смертная казнь. Люди уже тогда понимали: табак вреден для здоровья.
Люди уже тогда понимали: табак вреден для здоровья.
На славянских землях это зелье прижилось с подачи реформатора Петра I: в то время курение насаждалось практически насильно. Несмотря на информированность современного общества, распространение курения с каждым годом набирает обороты. Если раньше среди молодых людей старше 18 лет курящих было не более 10%, то сегодня это цифра увеличилась в два раза. А ведь уже давно доказано, что практически 30% онкозаболеваний связано именно с курением (остальные — это воздействие стресса, экологии, внешнего дыхания, вируса папилломы человека, генетические проблемы и др.). Кстати, табак приводит не только к развитию рака легкого, но и к раку молочной железы, гортани, мочевого пузыря.
Почему сигарета так долго остается популярным «развлечением» у нас, в Беларуси? Мы привыкли перенимать опыт Запада, однако там уже давно прошла никотиновая мода. Если раньше сигарета в руках у женщины считалась признаком самодостаточности, а у мужчины — мужественности, то сегодня все знают, что табак — это смерть замедленного действия. И курящий человек не вызывает уважения.
И курящий человек не вызывает уважения.
В Европе каждый пятый случай смерти от злокачественных новообразований связан с раком легкого (в Беларуси — 27,2%, то есть каждый четвертый).
Наихудшие последствия «табачной эпидемии» еще впереди, особенно среди женщин: когда сегодняшние молодые курильщики достигнут среднего или пожилого возраста, ежегодно в мире будут регистрировать около 10 млн. смертей.
У кого чаще диагностируют рак легкого: у мужчин или женщин?
Если 25 лет назад число женщин среди больных раком легкого составляло достаточно небольшой процент, то сегодня их число неуклонно растет. Статистика показывает, что только за последние 10 лет заболеваемость женщин раком легкого увеличилась с 8,2 на 100 тыс. до 10,9. Количество курящих женщин растет с небывалой скоростью — это еще одна проблема нашего общества. Правда до мужчин им пока далеко: заболеваемость раком легкого среди них составляет 84,7 на 100 тыс. случаев.
Какие существуют разновидности рака?
По морфологической структуре рак легкого принципиально делится на две группы: немелкоклеточный и мелкоклеточный (10-15 % от всех случаев рака легкого). Немелкоклеточный отличается более медленным развитием. С момента зарождения раковой клетки до образования опухоли, которую можно диагностировать с помощью рентгенограммы, проходит более 10 лет.
Немелкоклеточный отличается более медленным развитием. С момента зарождения раковой клетки до образования опухоли, которую можно диагностировать с помощью рентгенограммы, проходит более 10 лет.
Мелкоклеточный рак характеризуется очень быстрым и бурным прогрессированием. Маленькая опухоль, не превышающая в диаметре 1 см, способна давать метастазы, поражающие печень, головной и косный мозг. Время удвоения объема данной опухоли (промежуток времени, в течение которого объем опухоли увеличивается в два раза) составляет в среднем 33 дня. Очень часто мелкоклеточный рак выявляется, когда в организме уже есть метастазы.
Также рак легкого делят по локализации на периферический и центральный. Периферический рак зачастую имеет шаровидную форму, исходит из мелких бронхов и локализуется в легочной ткани. Центральная опухоль поражает бронх крупного диаметра. Когда происходит полное его закрытие, часть легкого перестает дышать. Это можно диагностировать с помощью рентгенографии — на снимке часть легкого или все целиком будет затемнено. Если же в легких проходимость воздуха еще не потеряна, то увидеть опухоль на обычных рентгенограммах достаточно сложно. В таких случаях помогает бронхоскопия, компьютерная томография.
Если же в легких проходимость воздуха еще не потеряна, то увидеть опухоль на обычных рентгенограммах достаточно сложно. В таких случаях помогает бронхоскопия, компьютерная томография.
Вообще, человек, который несколько раз перенес пневмонию в одном и том же легком, обязательно должен сделать бронхоскопическое исследование, так как повторяющаяся пневмония, чаще всего, является признаком нарушения вентиляции легкого. Возможно, в этом месте растет опухоль.
Известны ли другие виды диагностики рака?
Сегодня оптимальным вариантом диагностики рака легкого является компьютерная томография. Есть специальные низкодозные компьютерные томографы, предлагаемые в качестве скрининга рака легкого, однако данные по поводу их эффективности и рационального соотношения затрат и реальной отдачи еще находятся в стадии обработки. Вообще же, рентгенологическое исследование человек обязательно должен делать хотя бы раз в год.
Можно перечислить симптомы развития рака легкого?
К сожалению, рак легкого, как и многие другие онкологические заболевания, не имеет специфических симптомов. Те симптомы, которые описаны в старых учебниках (кровохарканье, одышка, кашель, боль в грудной клетке), уже указывают на рак легкого как минимум III стадии. И в данном случае говорить об успехе лечения не приходится.
Те симптомы, которые описаны в старых учебниках (кровохарканье, одышка, кашель, боль в грудной клетке), уже указывают на рак легкого как минимум III стадии. И в данном случае говорить об успехе лечения не приходится.
В Беларуси был период, когда существовала система флюорографических исследований.
Однако сейчас от нее отказались. Хотя программа и была задумана для выявления туберкулеза, она давала определенные результаты и в онкологической сфере. В результате сегодня у нас растет не только заболеваемость туберкулезом, но и рак легкого поздно диагностируется.
Опишите, что происходит в организме человека при каждой из четырех стадий онкозаболевания.
При первой стадии рака легкого опухоль имеет небольшие размеры — до 3 см в диаметре, без метастазов. В качестве лечения используется хирургическое вмешательство (удаляется только одна доля легкого). После этого человек может вернуться к полноценной жизни. Пятилетняя выживаемость пациентов приближается к 80%.
При второй стадии опухоль поражает близлежащие лимфоузлы. Когда заболевание достигает третей стадии, метастазы поражают все лимфоузлы грудной клетки и опухоль может прорастать в окружающие структуры. Кроме хирургического вмешательства, во время которого практически всегда удаляется легкое целиком, для лечения пациента понадобится провести лучевую и химиотерапию. С точки зрения трудоспособности, человек уже не будет считаться физически полноценным: он сможет выполнять только легкий физический труд.
При четвертой стадии опухоль дает отдаленные метастазы по всему организму (головной мозг, печень и т.д.), выживаемость пациентов в таких случаях не превышает 5%.
Каждый год в Беларуси выявляют более 4200 человек, заболевших раком легкого и, к сожалению, почти в 64% случаев болезнь находится на III-IV стадиях.
— В каком возрасте человек чаще заболевает раком легкого?
На данный момент онкопатологию чаще всего диагностируют у пациентов, достигнувших 60-70 лет и старше.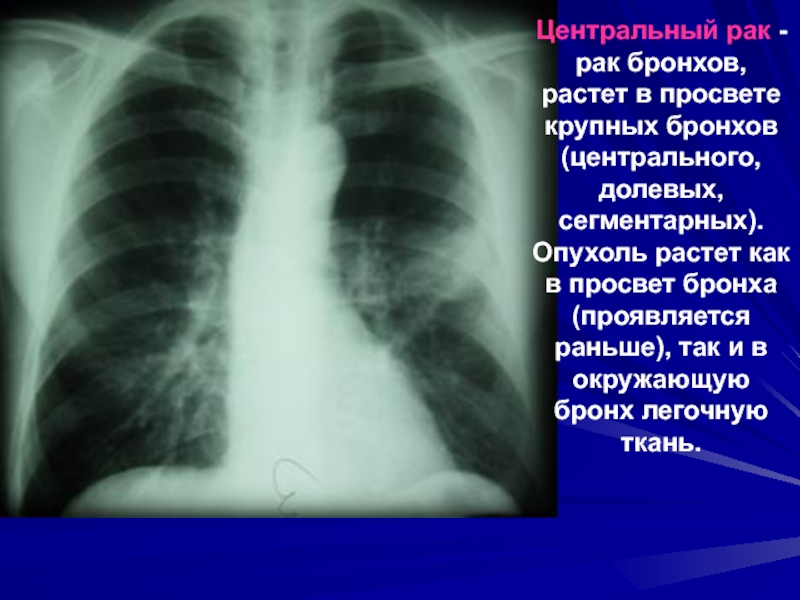 Именно в этом возрасте происходит реализация эффекта от воздействия никотина и табачных смол на человека. До 39 лет заболевает 1 из 58 мужчин и 1 из 52 женщин; в возрасте 40-59 лет — 1 из 13 мужчин и 1 из 11 женщин, в возрасте 60-79 лет — 1 из 3 мужчин и 1 из 4 женщин. Но ведь курение — это не только рак легкого, но и, например, сердечнососудистые болезни. Ежегодно по причине употребления табака погибает 5 млн. человек. Ни одна прибыль от продажи сигарет не стоит такого «эффекта».
Именно в этом возрасте происходит реализация эффекта от воздействия никотина и табачных смол на человека. До 39 лет заболевает 1 из 58 мужчин и 1 из 52 женщин; в возрасте 40-59 лет — 1 из 13 мужчин и 1 из 11 женщин, в возрасте 60-79 лет — 1 из 3 мужчин и 1 из 4 женщин. Но ведь курение — это не только рак легкого, но и, например, сердечнососудистые болезни. Ежегодно по причине употребления табака погибает 5 млн. человек. Ни одна прибыль от продажи сигарет не стоит такого «эффекта».
Как часто развивается рак легкого у пассивных курильщиков?
Часто слышу от обывателей утверждение: пассивное курение не влияет на здоровье. Если бы это соответствовало действительности, то сегодня медицинское сообщество не обсуждало бы тему о недоношенных детях, о развитии различных заболеваний у новорожденных. Наверняка каждый из нас неоднократно наблюдал, как молодые папа или мама курят возле коляски с ребенком. Так вот: у членов семьи курильщика рак легкого возникает в 1,5-2 раза чаще, чем в некурящих семьях. Пассивное курение при контакте с курильщиком на работе повышает риск развития онкозаболевания на 17%.
Пассивное курение при контакте с курильщиком на работе повышает риск развития онкозаболевания на 17%.
Между прочим, американцы уже давно столкнулись с такой проблемой, как развитие рака легкого у домашних животных, владельцами которых являются курильщики. Если пассивное курение пагубно влияет на здоровье питомцев, то на людей тем более.
В последнее время помимо привычных нам сигарет, люди стали курить и кальян. Насколько он вреден для здоровья?
Кальян — очень интересный прибор даже с точки зрения общественной гигиены. Ведь он не проходит санобработку после каждого использования. Откуда вы знаете, какой человек только что курил, используя этот кальян. Конечно, в барах, кафе никто не требует у посетителей справку о состоянии здоровья. Не удивлюсь, если внутри этого прибора мы обнаружим весь микробный спектр.
Во-вторых, кальян можно сравнить с курением трубки. Поскольку человек постоянно раздражает слизистую, трубка вызывает рак губы раньше, чем рак легкого. При курении кальяна происходит примерно то же самое.
При курении кальяна происходит примерно то же самое.
Как предохранить себя от рака легкого: существует ли его профилактика?
Табак — единственный товар народного потребления, убивающий большинство своих потребителей! Чтобы решить данную проблему, государство должно проводить более жесткую антитабачную политику (один из шагов в этом направлении — закон о запрете курения в общественных местах). Не стоит оставлять без внимания и общественную культуру: если человек сам не понимает, что курение приводит к раку легкого и сигареты в принципе вредны для здоровья, то Министерство здравоохранения тут не поможет.
Пару лет назад во время одного интервью я сказал, что сигареты должны продаваться в магазинах химреактивов, потому что весь спектр таблицы Менделеева, включая самые вредные вещества, есть в сигаретах. Вообще я курильщиков сравниваю с самоубийцами: обычно человек не спрыгивает с окна — он знает, что может разбиться. А вот табак люди употребляют осознанно лишь потому, что рак легкого возникает не сразу, а спустя 20-30 лет после начала курения.
Если говорить об антитабачной программе в широком смысле слова, то она должна быть комплексной и межотраслевой и содержать следующие последовательные действия:
- Запрет курения в общественных местах и на работе (на остановках, в кафе, ресторанах, гостиницах и т.д.).
- Повышение цены на сигареты.
- Изъятие сигарет из мест общей торговли (особенно у касс).
- Проведение экологических мероприятий, направленных на снижение выброса газов в атмосферу и общее улучшение экологической обстановки и условий труда.
- Переход на использование экологически безопасного транспорта.
- Ограничение въезда автомобилей в центр города.
- Развитие велотранспортной инфраструктуры.
Заболеваемость злокачественными новообразованиями в странах Европейского Союза за последние 10-15 лет снизилась на 15% в результате воплощения в жизнь программы «Европа против рака».
Но главное — воспитание физической культуры (в полном смысле этого слова) у людей с раннего детства. Ее отсутствие — вот одна из причин терпимости по отношению к табакокурению. Если в семье родители курят, то глупо надеяться на то, что дети не будут этого делать.
Ее отсутствие — вот одна из причин терпимости по отношению к табакокурению. Если в семье родители курят, то глупо надеяться на то, что дети не будут этого делать.
Кстати, стоит обратить внимание общественности на электронные сигареты — они помогают избавиться от табачной зависимости.
Рак лёгких — диагностика и лечение в центре онкологии ЕМС в Москве
Рак легкого, или бронхогенная карцинома, – злокачественное новообразование, происходящее из ткани бронхов или легочной паренхимы. Рак легких – одно из наиболее распространенных онкологических заболеваний у мужчин и женщин во всем мире.
Виды рака легкого
-
Мелкоклеточный рак легкого (МКРЛ) диагностируется у 10-15% пациентов. Имеет тенденцию к более агрессивному течению, быстрому распространению, рецидивам.
-
Немелкоклеточный рак легкого (НМКРЛ) включает в себя все остальные виды рака легкого и диагностируется у 85-90% пациентов.
 НМКРЛ имеет подкатегории, наиболее распространенными среди которых являются аденокарцинома и плоскоклеточный рак. Этот вид рака легких нередко является показанием к хирургическому лечению, особенно на ранних стадиях заболевания.
НМКРЛ имеет подкатегории, наиболее распространенными среди которых являются аденокарцинома и плоскоклеточный рак. Этот вид рака легких нередко является показанием к хирургическому лечению, особенно на ранних стадиях заболевания.
Мелкоклеточный и немелкоклеточный рак лёгкого предполагают разные подходы к хирургическому лечению, лучевой и химиотерапии. До недавнего времени простое гистологическое разделение НМКРЛ и МКРЛ наряду со стадией было адекватным для принятия решения о лечении при впервые установленном диагнозе рака легкого. Сегодня уже доказано, что для определения оптимальной терапии важно отличать аденокарциному, плоскоклеточную карциному и другие гистологические формы опухоли.
Симптомы рака легкого
На ранних стадиях заболевания, при которых лечение будет наиболее эффективным, симптомы незначительны и отсутствуют, что подчеркивает актуальность скрининговых исследований у пациентов, имеющих высокий онкологический риск.
Наиболее частыми клиническими проявлениями рака легкого являются:
-
Кашель – у 50-75 % пациентов
-
Кровохарканье – у 25-50 % пациентов
-
Одышка – у 25 % пациентов
-
Боль в груди – у 20 % пациентов
Появление симптомов, как правило, свидетельствует о далеко зашедшем процессе.
Реже рак легкого может проявляться отклонениями в лабораторных показателях вследствие метастазирования в другие органы (чаще всего в печень, кости, головной мозг) или паранеопластическим синдромом – это комплекс проявлений, не связанных непосредственно с опухолью, но вызванных воздействием раковых клеток на организм.
Паранеопластический синдром включает:
-
гиперкальциемию (повышение концентрации кальция в плазме крови),
-
синдром Кушинга (повышенное выделение гормона кортизола корой надпочечников),
-
гиперкоагуляционные нарушения (усиление свертываемости крови),
-
различные неврологические синдромы (нарушения координации, проблемы с равновесием, трудности при ходьбе, затрудненная речь, глотание и т.д.).
Мелкоклеточный и немелкоклеточный рак легкого могут проявляться одинаковыми симптомами. Но для мелкоклеточного рака характерны:
-
быстрое прогрессирование симптомов,
-
паранеопластический синдром,
-
объемные множественные метастазы в медиастинальные лимфоузлы,
-
синдром верхней полой вены,
-
костные метастазы и метастазы в головной мозг.

Тогда как синдром Панкоста (слабость и боль в руке, вызванная прорастанием опухоли верхней доли легкого в плечевое сплетение) и гиперкальциемия чаще обнаруживаются у пациентов с немелкоклеточным раком легкого.
Диагностика рака легкого
Пациенту с подозрением на рак лёгкого назначается компьютерная топография (КТ) грудной полости и верхних отделов брюшной полости (обычно с контрастированием) для оценки степени распространенности первичной опухоли и возможного распространения в средостение, печень и надпочечники.
Окончательный диагноз рака устанавливается только на основании цитологического исследования (например, плевральной жидкости) или гистологического исследования (биопсии ткани).
Биопсия может быть выполнена одним из следующих способов:
-
Бронхоскопия
-
Эндобронхиальная ультразвуковая бронхоскопия, или EBUS, — техника, которая сочетает в себе применение гибкого бронхоскопа с ультразвуком
-
Тонкоигольная биопсия под контролем КТ -
Игольная аспирация
-
Торакоцентез
- В том случае, если другие процедуры биопсии не позволили определить диагноз, может потребоваться операция.
 Наиболее распространенными хирургическими процедурами являются медиастиноскопия, которая используется для биопсии лимфатических узлов в центральной части грудной полости; видео-ассистированная торакоскопическая операция (VATS) — менее инвазивный метод для биопсии легочной ткани; и торакотомия, которая представляет собой полостную операцию по удалению крупных частей легочной ткани или опухолей.
Наиболее распространенными хирургическими процедурами являются медиастиноскопия, которая используется для биопсии лимфатических узлов в центральной части грудной полости; видео-ассистированная торакоскопическая операция (VATS) — менее инвазивный метод для биопсии легочной ткани; и торакотомия, которая представляет собой полостную операцию по удалению крупных частей легочной ткани или опухолей.
Радиолог, специалист по диагностике онкологических заболеваний Института онкологии EMC профессор Евгений Либсон (Израиль) имеет многолетний опыт проведения тонкоигольных биопсий под контролем КТ, что позволяет многим пациентам избежать открытой операции, выполняемой с диагностической целью.
После биопсии материал отправляется в Гистологическую лабораторию EMC для установки точного диагноза и получения важных характеристик опухоли, которые помогают в дальнейшем выборе лечения.
При необходимости или по желанию пациента проводится верификация диагноза в ведущих клиниках США, Великобритании, Израиля, Германии, Франции, Швейцарии (методом телепатологии). Получение «второго мнения» зарубежного специалиста входит в стандартную стоимость исследования.
Получение «второго мнения» зарубежного специалиста входит в стандартную стоимость исследования.
Молекулярный анализ опухоли
В Институте онкологии EMC проводится также молекулярный анализ опухоли для определения специфических биомаркеров опухоли или генных мутаций. Это позволяет составить так называемый «молекулярный портрет» опухоли и проводить терапию таргетными препаратами, которая даёт лучший эффект, чем стандартная химиотерапия. Наиболее распространенными биомаркерами рака лёгкого являются мутации EGFR, транслокации ALK и транслокации c-ROS онкогена 1 (онкогена ROS1).
Стадирование
После установления диагноза необходимо провести дообследование для правильного стадирования заболевания. С этой целью могут быть назначены:
-
Ультразвуковые исследования плевральных и брюшной полости, сосудов, лимфатических узлов (для диагностики распространения и вызванных опухолью осложнений)
-
МРТ головного мозга (при наличии неврологической симптоматики)
-
Рентген тазовой области (при боли в области таза)
-
Эхокардиография для оценки злокачественного плеврального выпота (при наличии гипотензии с синусовой тахикардией).

Лабораторные исследования
При подозрении на рак легкого по данным КТ выполняются следующие исследования:
-
Общий анализ крови
-
Электролиты
-
Кальций
-
Щелочная фосфатаза
-
АЛТ, АСТ, билирубин общий
-
Креатинин
-
Общий белок, альбумин и лактатдегидрогеназы (не обязательно)
-
Коагулограмма
Клинический осмотр и лабораторные исследования проводятся для выявления возможных метастазов. Отклонения лабораторных показателей от нормы являются основанием для назначения дополнительных инструментальных исследований.
В EMC применяется современный высокоточный метод стадирования рака легкого — ПЭТ/КТ всего тела. ПЭТ/КТ проводится пациентам с I, II и III стадией заболевания, обязательно проведение исследования перед операцией. ПЭТ/КТ может обнаружить очаги опухоли в лимфатических узлах, не детектируемые с помощью КТ, а также отдаленные метастазы в других органах. Зачастую по результатам ПЭТ/КТ пересматривается первоначальная стадия и тактика лечения.
ПЭТ/КТ может обнаружить очаги опухоли в лимфатических узлах, не детектируемые с помощью КТ, а также отдаленные метастазы в других органах. Зачастую по результатам ПЭТ/КТ пересматривается первоначальная стадия и тактика лечения.
Стадии немелкоклеточного рака легкого определяются исходя из следующих факторов:
-
размера и расположения опухоли
-
распространения опухоли в лимфатические узлы и ткани внутри грудной полости
-
распространения опухоли за пределы грудной полости (например, рак лёгкого может метастазировать в кости, печень, надпочечники или другие органы).
Стадии немелкоклеточного рака легкого варьируются от I до IV:
-
Стадия I – диаметр опухоли меньше или равен 3 см, опухоль не распространилась ни в какие другие ткани или лимфоузлы.
-
Стадия II – Стадия II означает, что опухоль имеет размер от 3 до 7 см или распространилась в лимфоузлы, или проникла в ткани, окружающие лёгкое, или начала прорастать в просвет бронхов.

-
Стадия IIIA – Стадия IIIA заболевания означает, что опухоль может быть больше 7 см или распространяться в лимфатические узлы в центре грудной полости (средостения), или проросла в ребра, сердце, пищевод или трахею.
-
Стадия IIIB – Стадия IIIB заболевания означает, что опухоль распространилась на лимфатические узлы за пределами средостения или в лимфатические узлы выше или ниже ключицы. К стадии IIIB также относят опухоли, которые распространились на ребра, сердце, пищевод или трахею без вовлечения лимфоузлов средостения.
-
Стадия IV – Стадия IV означает, что рак распространился за пределы грудной полости или на противоположную сторону средостения. На IV стадии рак может привести к скоплению жидкости вокруг легкого или сердца (злокачественный выпот).
Стадии мелкоклеточного рака лёгкого. Техническое разделение мелкоклеточного рака на стадии происходит точно так же, как и для немелкоклеточного рака. Однако варианты лечения обычно определяются по более простой схеме. Обычно мелкоклеточный рак лёгкого характеризуют как «ограниченный» или «распространенный» процесс.
Однако варианты лечения обычно определяются по более простой схеме. Обычно мелкоклеточный рак лёгкого характеризуют как «ограниченный» или «распространенный» процесс.
-
ограниченный процесс – это мелкоклеточный рак лёгкого, который ограничен одной стороной грудной полости и поражением регионарных лимфоузлов.
-
распространенный процесс – это мелкоклеточный рак лёгкого, который распространился на противоположную сторону грудной клетки и другие органы за пределами грудной клетки.
Лечение рака легкого
В Институте онкологии EMC реализованы все возможности для оказания помощи пациентам с раком легкого по международным стандартам.
Лечение рака легкого в EMC:
-
Международная команда врачей: специалисты с опытом работы в США, Израиле, Западной Европе.
-
Каждый клинический случай обсуждается на мультидисциплинарном консилиуме. Команда специалистов, включающая в себя онкологов, хирургов, радиологов, морфологов, лучевых терапевтов, определяет тактику лечения индивидуально для каждого пациента.

-
Комплексная диагностика (КТ, МРТ, ПЭТ/КТ)
-
Химиотерапия по современным европейским и американским протоколам, препараты последнего поколения ведущих мировых производителей. -
Таргетная терапия, основанная на молекулярном анализе опухоли -
Иммунотерапия -
Новейшие системы для проведения лучевой терапии и стереотактической лучевой терапии Varian EDGE, Truebeam, США. -
Психотерапевтическая поддержка пациента и его семьи.
Ранние стадии рака лёгкого обычно поддаются хирургическому лечению с удалением опухоли и окружающей ткани лёгкого. На III стадии рака лёгкого часто показано комбинированное лечение — сочетание химиолучевой терапии и хирургической операции на различных этапах терапии. Если рак распространился за пределы грудной полости (стадия IV), химиотерапия и лучевая терапия применяются для контроля заболевания и его симптомов.
Для пациентов с МКРЛ системная химиотерапия является одним из наиболее важных компонентов лечения, поскольку практически у всех пациентов на момент обращения уже имеет место распространенный МКРЛ. Для пациентов с ограниченной стадией применяется лучевая терапия грудной полости в сочетании с химиотерапией. Часто проводится профилактическая лучевая терапия на головной мозг, чтобы снизить частоту развития метастазов в головном мозге и увеличить выживаемость. Профилактическая лучевая терапия в области головы и грудной клетки также может иметь положительное воздействие у пациентов с полным или частичным ответом на первичную системную химиотерапию.
Хирургическое лечение рака легкого
Хирургическая резекция обеспечивает наилучшую длительную выживаемость и нередко полное излечение у пациентов с немелкоклеточным раком легкого. Однако даже при наличии опухоли, поддающейся удалению, пациент может быть «неоперабельным» ввиду недостаточности функции лёгких или из-за сопутствующих заболеваний, поэтому всестороннее обследование имеет большое значение при подготовке к операции.
Хирургические вмешательства у пациентов с подозрением или установленным диагнозом рака легкого могут быть различными по объему и целям, которые необходимо достичь в результате операции. Прогнозирование объема операции проводится по результатам обследования и совместным решением междисциплинарного консилиума EMC.
При подозрении на рак легкого и невозможности взятия материала для гистологического исследования может понадобиться диагностическая операция:
- Биопсия лимфатических узлов средостения.
Выполняется с использованием современных малоинвазивных технологий – видеомедиастиноскопии или видеоторакоскопии с малыми хирургическими разрезами (1-2 см) и минимальной травмой мышц и других тканей. Операция, как правило, хорошо переносится, длительность госпитализации редко превышает 2-3 дней.
- Биопсия легкого.
Также может быть выполнена видеоторакоскопическим доступом.
Существуют хирургические вмешательства, направленные на удаление плевры или индукцию плевродеза (спаечного процесса в плевральной полости). Проведение таких операций помогает купировать осложнения, связанные с поражением плевры метастазами и развитием рецидивирующего плеврита. Такие осложнения могут не только препятствовать проведению химиотерапии, но и угрожать жизни.
Проведение таких операций помогает купировать осложнения, связанные с поражением плевры метастазами и развитием рецидивирующего плеврита. Такие осложнения могут не только препятствовать проведению химиотерапии, но и угрожать жизни.
Выбор метода радикального хирургического лечения рака легкого зависит от локализации опухоли, ее размеров, признаков прорастания соседних структур и поражения лимфатических узлов. По объему можно выделить следующие операции:
-
Лобэктомия
-
Пневмонэктомия
-
Билобэктомия и лобэктомия с бронхопластикой или ангиопластикой
-
Сегментэктомия
При выявлении рака легкого на ранней стадии, когда нет прорастания соседних органов и размеры опухоли менее 5-6 см, возможно выполнение операции малоинвазивным доступом – с использованием видеоторакоскопии и малых разрезов.
Лучевая терапия рака легкого в EMC
Стереотаксическая радиохирургия SBRT (Stereotactic Body Radiation Therapy), известная также как SABR (Stereotactic Ablative Body Radiotherapy) является эффективным и безопасным неинвазивным методом лечения немелкоклеточного рака легкого 1 стадии, то есть опухолей размером до 5 см и с интактными лимфатическими узлами). Исследования показали равноценную общую выживаемость и локальный контроль над опухолью при сравнении хирургии (лобэктомии, стандарта лечения на сегодняшний день) и SBRT у пожилых или неоперабельных по сопутствующей патологии пациентов.
Исследования показали равноценную общую выживаемость и локальный контроль над опухолью при сравнении хирургии (лобэктомии, стандарта лечения на сегодняшний день) и SBRT у пожилых или неоперабельных по сопутствующей патологии пациентов.
Используется от 3 до 5 сеансов (фракций) SBRT.
Центр лучевой терапии EMC под руководством главного радиотерапевта г. Москвы д-ра Нидаля Салима является одним из немногих отделений радиотерапии в мире, где метод стереотаксической радиохирургии используется при лечении первичных и метастатических опухолей легкого, печени, предстательной и поджелудочной железы, головного и спинного мозга и костей. В Центре установлены новейшие системы лучевой терапии EDGE и Truebeam, США, которые позволяют применять самые современные методы лучевого лечения.
Современные технологии в лучевой терапии, такие как IMRT, VMAT/RapidArc, IGRT, позволяют повысить точность облучения и сохранить окружающие опухоль здоровые ткани.
При облучении опухолей легкого, особенно локализующихся в нижних долях, наблюдается высокая подвижность очага на разных фазах дыхания. Применение технологии Gated RapidArc дает возможность облучать опухоль с учетом ее реального отклонения на всех фазах дыхания либо временно останавливать облучение при вдохе/выдохе за пределами заданного интервала.
Применение технологии Gated RapidArc дает возможность облучать опухоль с учетом ее реального отклонения на всех фазах дыхания либо временно останавливать облучение при вдохе/выдохе за пределами заданного интервала.
Опухоль Панкоста лечение
Опухоль Панкоста (опухоль верхней борозды лёгкого) относится к немелкоклеточному раку легкого, который расположен в верхней части легкого. Опухоль затрагивает нервы, вызывая характерные симптомы, такие как:
-
Боль в плече или в руке
-
Мышечная слабость в руке
-
Гиперемия и чрезмерное потоотделение на одной стороне лица
По мере прогрессирования опухоли происходит опущение века (птоз), и полностью прекращается потоотделение на стороне поражения. При отсутствии отделенных метастазов, лечение опухоли Панкоста состоит из химиолучевой терапии и последующей операции.
Лечение рака легких IV стадии
Пациенты с IV стадией заболевания обычно получают лечение системными средствами или симптоматическую паллиативную терапию. У должным образом отобранных пациентов химиотерапия, молекулярная таргетная терапия и/или иммунотерапия могут увеличивать выживаемость без ущерба качеству жизни. Некоторым пациентам целесообразно проведение лучевой терапии и операции в качестве симптоматического паллиативного лечения.
У должным образом отобранных пациентов химиотерапия, молекулярная таргетная терапия и/или иммунотерапия могут увеличивать выживаемость без ущерба качеству жизни. Некоторым пациентам целесообразно проведение лучевой терапии и операции в качестве симптоматического паллиативного лечения.
У пациентов с IV стадией заболевания с отдаленными метастазами (например, в головном мозге, надпочечниках), благоприятное влияние может оказать резекция метастазов, а также агрессивное лечение первичной опухоли.
В Институте онкологии EMC созданы все возможности для оказания помощи пациентам с метастатическим раком легкого, в том числе применение новейших препаратов для иммунотерапии (Ниволумаб, Пемброзилумаб), которые продемонстрировали эффективность в повышении выживаемости у пациентов с IV стадией заболевания.
Для улучшения качества жизни пациентов с IV стадией заболевания применяется паллиативная терапия. Мы оказываем всю необходимую помощь тяжелобольным пациентам, включая адекватное обезболивание, проведение паллиативных операций и лучевой терапии, в том числе в экстренном режиме. Одышка в результате полного вовлечения центральных дыхательных путей может поддаваться паллиативному лечению путём удаления опухоли с помощью жёсткого или гибкого бронхоскопа и лазерной коагуляции или криотерапии. Стентирование может потребоваться для поддержания проходимости дыхательных путей, и чтобы создать условия для наружной дистанционной лучевой терапии.
Одышка в результате полного вовлечения центральных дыхательных путей может поддаваться паллиативному лечению путём удаления опухоли с помощью жёсткого или гибкого бронхоскопа и лазерной коагуляции или криотерапии. Стентирование может потребоваться для поддержания проходимости дыхательных путей, и чтобы создать условия для наружной дистанционной лучевой терапии.
Прогноз при раке легкого
Для пациентов с немелкоклеточным раком легкого фактором, который оказывает наибольшее влияние на прогноз, является стадия по TNM на момент обращения. Выживаемость прогрессивно снижается при более высокой степени заболевания, составляя, в среднем, от 59 месяцев для пациентов с IA стадией заболевания до четырёх месяцев для пациентов с IV стадией.
Клинические признаки на момент установления диагноза также позволяют прогнозировать выживаемость, независимо от стадии болезни. Большинство таких факторов было выявлено в исследованиях, которые преимущественно включали в себя пациентов с прогрессирующими или неоперабельными формами НМКРЛ. Было установлено, что низкая работоспособность и потеря веса связаны со сниженной выживаемостью. Сниженный аппетит, фактор, предшествующий потере веса, также имеет негативное прогностическое значение.
Было установлено, что низкая работоспособность и потеря веса связаны со сниженной выживаемостью. Сниженный аппетит, фактор, предшествующий потере веса, также имеет негативное прогностическое значение.
Наиболее важным прогностическим фактором у пациентов с МКРЛ служит степень распространенности заболевания на момент обращения. Для пациентов с ограниченными стадиями болезни средняя продолжительность жизни составляет от 15 до 20 месяцев, пятилетняя выживаемость составляет 10-13%. Для пациентов с прогрессирующими стадиями заболевания средняя продолжительность жизни составляет 8-13 месяцев, а пятилетняя выживаемость — 1-2%. Необходимо учитывать, что это среднестатистические показатели, прогноз в каждом отдельном случае индивидуален.
Факторы риска
Среди всех факторов риска развития рака легкого лидирующая роль принадлежит курению, которое «отвечает» за 90 % случаев развития рака легкого. Риск заболеть раком легкого у человека, выкуривающего пачку сигарет в день на протяжении 40 лет, в 20 раз выше, чем у некурящего. Наличие других канцерогенных факторов, как например, воздействие асбеста, дополнительно увеличивает риск заболевания.
Наличие других канцерогенных факторов, как например, воздействие асбеста, дополнительно увеличивает риск заболевания.
Отказ от курения снижает вероятность развития заболевания, особенно у тех, кто бросил курить в возрасте до 30 лет. Но у бывших курильщиков риск заболеть раком легкого с возрастом выше, чем у тех, кто не курил никогда.
Среди других доказанных факторов риска:
-
Лучевая терапия на область легких. Риск развития рака легких выше у пациентов, которые ранее проходили лучевую терапию по поводу другого онкологического заболевания (в частности, у пациентов, которым проводилась лучевая терапия при раке молочной железы и лимфоме Ходжкина)
-
Экзогенные токсины (асбест, радон, мышьяк, хром, никель, ионизирующее излучение, полициклические ароматические углеводороды, а также пассивное курение).
-
Пневмосклероз (фиброз легких) – по результатам нескольких исследований, риск заболеть раком легких примерно в семь раз выше у пациентов, страдающих легочным фиброзом.

-
ВИЧ-инфекция
-
Генетическая предрасположенность
Роль алкоголя в развитии рака легких требует дальнейшего изучения. Попытки снизить заболеваемость у групп высокого риска с помощью диеты (антиоксидантов, фитоэстрогенов) пока не увенчались успехом. Напротив, в ходе одного из исследований было доказано, что прием курильщиками бета-каротина в составе витаминных препаратов привел к увеличению заболеваемости.
Скрининг рака легкого
Скрининг — исследование, позволяющее выявить заболевания до появления симптомов. До недавнего времени скрининг рака легкого не был широко распространен, так как по результатам нескольких исследований рентгенография грудной клетки и цитологическое исследование мокроты не приводили к снижению смертности от рака легкого.
За последние несколько лет появились более точные методы исследования, такие как низкодозовая компьютерная томография легких. Лучевая нагрузка при проведении данного исследования в 5-10 раз меньше по сравнению со стандартной КТ, что позволяет использовать метод в качестве скрининга.
В результате крупного исследования, проведенного Национальным институтом рака США было установлено, что низкодозовая КТ, проводившаяся курильщикам со стажем, позволила снизить смертность от рака легких на 20% по сравнению с курильщиками, которым в аналогичном режиме выполнялась рентгенография грудной клетки.
На сегодняшний день этот метод рекомендован специальной комиссией США по профилактике заболеваний (United States Preventive Service Task Force — USPSTF) для скрининга рака легкого людям в возрастной группе от 55 до 80 лет и которые при этом имеют 30-летнюю историю курения или бросили курить не более чем 15 назад.
EMC одним из первых центров в России внедрил в практику низкодозовую КТ легких для ранней диагностики рака легкого.
Какой средний возраст для диагностики рака легких?
Средний возраст постановки диагноза рака легких в Соединенных Штатах составляет около 70 лет. За последние 50 лет этот средний возраст постепенно увеличивался, при этом большинство случаев все еще диагностируется на поздних стадиях, когда люди становятся старше. Средний возраст для Согласно данным наблюдения, опубликованным Национальным институтом рака (NCI), диагноз рака легких в Соединенных Штатах — 71 год. С 1975 по 1999 год средний возраст составлял 66 лет.Взаимодействие с другими людьми
Средний возраст для Согласно данным наблюдения, опубликованным Национальным институтом рака (NCI), диагноз рака легких в Соединенных Штатах — 71 год. С 1975 по 1999 год средний возраст составлял 66 лет.Взаимодействие с другими людьми
При рассмотрении данных ученые склонны использовать медиану, а не средний (средний) возраст, главным образом потому, что медиана лучше учитывает несбалансированное распределение возрастов.
Понимание данных
Средний возраст: Все возрасты сложены и разделены на количество случаев.
Средний возраст: Средняя точка, ниже которой возникает половина более молодых случаев и выше которой возникает половина более старых случаев.
Хотя исследователи могут сделать твердые выводы только на основе больших наборов данных, давайте возьмем группу из девяти пациентов с раком легкого в качестве примера.Пациентам 44, 52, 67, 70, 73, 76, 81, 82 и 85 лет.
Средний возраст этой группы чуть больше 69 лет; средний возраст — 72 года.
Используя медианное значение, становится яснее, что большинство случаев рака легких приходится на людей старше 70 лет.
Чиннапонг / Getty Images
Возраст женщин и мужчин
В большинстве исследований средний возраст рака легких у мужчин и женщин немного различается. Женщины, как правило, заболевают раком легких в более молодом возрасте, чем мужчины, примерно на два года.Согласно исследованию 2018 года, опубликованному в журнале New England Journal of Medicine , женщины также непропорционально часто заболевают раком легких в возрасте до 50 лет.
В возрасте от 30 до 54 лет у женщин чаще, чем у мужчин, диагностируется рак легких, отчасти из-за более раннего появления симптомов.
Диагностика для всех возрастных групп
Риск рака легких увеличивается с возрастом, достигая пика в возрасте 75 лет и затем постепенно снижаясь — часто потому, что пожилой человек умрет не от рака легких, а от других причин.Взаимодействие с другими людьми
Согласно данным наблюдения NCI, процент случаев рака легких по возрастным группам распределяется следующим образом:
| Возрастной диапазон | % При раке легких |
|---|---|
| До 20 лет | 1% |
| 20-34 | 2,7% |
| 35-44 | 5,2% |
| 45-54 | 14,1% |
| от 55 до 64 | 24. 1% 1% |
| от 65 до 74 | 25,4% |
| от 75 до 84 | 19,6% |
| 85 и старше | 7,8% |
Моложе 40 лет
По данным Американского онкологического общества, большинству диагностированных людей не менее 65 лет, а немногим моложе 45 лет. Учитывая это, новости особенно застают врасплох многих людей младше 40 лет, у которых диагностирован рак легких.
По-прежнему верно, что пожилые люди составляют большинство пациентов с впервые диагностированным раком легких, но исследования показывают, что уровень заболеваемости раком легких у молодых людей увеличивается — и часто это не связано с курением.Взаимодействие с другими людьми
Согласно исследованию, опубликованному в журнале Journal of Cancer, более 70% из 8734 молодых людей с раком легких не курили, и примерно половина из них никогда в жизни не касалась сигарет.
Считается, что генетика вносит свой вклад в риск рака легких, при этом до 59% молодых людей, страдающих заболеванием, имеют генетическую мутацию, связанную с этим заболеванием.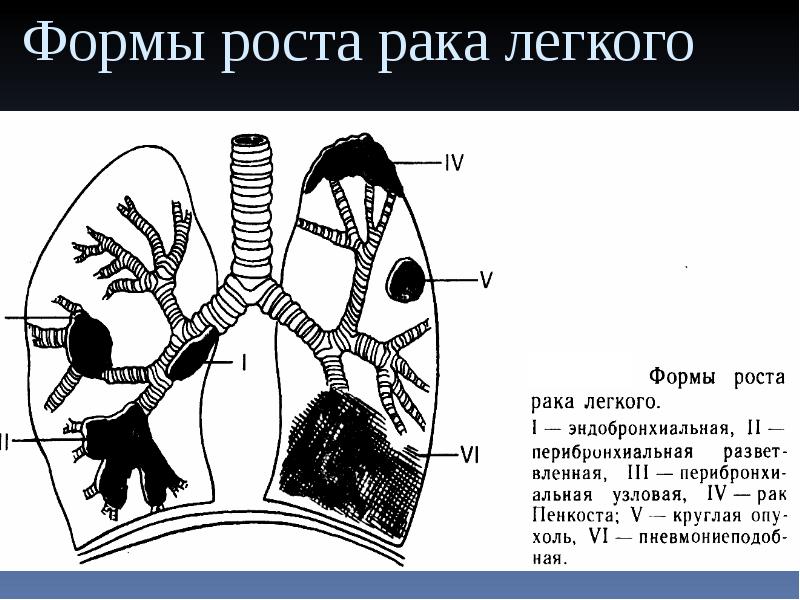 К ним относятся мутации EGFR, перестройки ROS1 и перестройки ALK.
К ним относятся мутации EGFR, перестройки ROS1 и перестройки ALK.
Поскольку рак легких обычно не ожидается у молодых людей, его часто пропускают до стадии 4, когда злокачественное новообразование метастазирует (распространяется).Даже в этом случае люди моложе 40 лет, которые лечатся от рака легких, часто добиваются большего успеха, потому что их можно лечить более агрессивно. Это включает использование новейших целевых методов лечения, которые могут идентифицировать и уничтожать опухоли со специфическими мутациями EGFR, ROS1 или ALK.
Из-за этого молодые люди, как правило, живут дольше, чем пожилые люди с этим заболеванием, даже если у них диагностирован рак на поздней стадии. Текущие исследования показывают, что пятилетняя выживаемость молодых людей со всеми стадиями рака легких составляет 54%, в то время как пятилетняя выживаемость всех людей с раком легких составляет 16%.Взаимодействие с другими людьми
Несмотря на то, что существует множество отличных организаций, к которым можно обратиться, если у вас рак легких, Фонд рака легких Бонни Аддарио призван помогать молодым людям с множеством медицинских и социальных проблем, связанных с диагностикой рака легких.
старше 70
Один из распространенных мифов о раке легких состоит в том, что люди старше 70 лет не могут переносить агрессивные методы лечения и неизменно чувствуют себя хуже, чем взрослые в возрасте 40, 50 и 60 лет.
Хотя это правда, что большинство смертей, связанных с раком легких, происходит в более позднем возрасте, только возраст не может предсказать, насколько хорошо или плохо вы реагируете на лечение.Помимо стадии и степени рака, статус работоспособности человека — а именно, насколько хорошо он выполняет обычные повседневные задачи во время лечения — является ключевым фактором, на который врачи будут обращать внимание при выборе подходящей терапии рака легких.
Исследования показали, что взрослые старше 80 лет с хорошей работоспособностью могут переносить лечение и реагировать на него так же, как и молодые люди. Сюда входят новейшие иммунотерапевтические препараты и таргетная терапия.
В конце концов, к людям старше 70 лет не следует относиться иначе, чем к более молодым людям с тем же типом и стадией рака легких, если только нет смягчающих обстоятельств, таких как крайняя слабость.
Если вы сомневаетесь в уходе, который вы получаете, будучи пожилым человеком, не стесняйтесь обратиться за помощью к другому специалисту или при необходимости заручитесь услугами адвоката пациента.
Слово Verywell
Постарайтесь не зацикливаться на выживаемости при раке легких. Они основаны на среднем значении для всех групп независимо от основных состояний здоровья или осложнений заболевания. Вместо этого сосредоточьтесь на том, чтобы стать сильнее с помощью лучшего питания, физических упражнений, эмоциональной поддержки и всего того, что может заставить вас чувствовать себя лучше, чем вы можете, независимо от того, 30 вам или 80 лет.
Спасибо за отзыв!
Ограничение обработанных пищевых продуктов и красного мяса может помочь предотвратить риск рака. В этих рецептах основное внимание уделяется продуктам, богатым антиоксидантами, чтобы лучше защитить вас и ваших близких. Зарегистрируйтесь и получите своего гида!
Зарегистрироваться
Ты в!
Спасибо, {{form. email}}, за регистрацию.
email}}, за регистрацию.
Произошла ошибка. Пожалуйста, попробуйте еще раз.
Что вас беспокоит?
Другой
Неточный
Трудно понять
Verywell Health использует только высококачественные источники, в том числе рецензируемые исследования, для подтверждения фактов в наших статьях.Ознакомьтесь с нашей редакционной процедурой, чтобы узнать больше о том, как мы проверяем факты и обеспечиваем точность, надежность и надежность нашего контента.
Американское онкологическое общество. Ключевая статистика рака легких. Обновлено 8 января 2020 г.
Национальный институт рака. Обзор статистики рака SEER (CSR) 1975-2017. Обновлено 15 апреля 2020 г.
Barrera-Rodriguez R, Morales-Fuentes J. Рак легких у женщин. Рак легких (Окл) . 2012; 3: 79-89. DOI: 10.2147 / LCTT.S37319
Джемал А., Миллер К.Д., Ма Дж. И др. Заболеваемость раком легких среди молодых женщин выше, чем у молодых мужчин в Соединенных Штатах.
 N Engl J Med . 2018; 378 (21): 1999-2009. DOI: 10.1056 / NEJMoa1715907
N Engl J Med . 2018; 378 (21): 1999-2009. DOI: 10.1056 / NEJMoa1715907Venuta F, Diso D, Onorati I, Anile M, Mantovani S, Rendina EA. Рак легких у пожилых пациентов. Дж. Торакальный диск . 2016; 8 (Дополнение 11): S908-14. DOI: 10.21037 / jtd.2016.05.20
Национальный институт рака. Возраст и риск рака.19 апреля 2015 г.
Kozielski J, Kaczmarczyk G, Porębska I, Szmygin-milanowska K, Gołecki M. Рак легких у пациентов в возрасте до 40 лет. Contemp Oncol (Познань) . 2012; 16 (5): 413-5. DOI: 10.5114 / wo.2012.31770
Лю Б., Цюань Х, Сюй С. и др. Рак легких у молодых людей в возрасте 35 лет и младше: полномасштабный анализ и обзор. J Рак. 2019; 10 (15): 3553-9. DOI: 10.7150 / jca.27490
Кармайкл Дж. А., Винг-Сан Мак Д, О’Брайен М.Обзор последних достижений в лечении пожилых людей и больных НМРЛ с низкой эффективностью. Раки (Базель) . 2018; 10 (7): 236. DOI: 10.3390 / Cancers10070236
Verywell Health является частью издательской семьи Dotdash.
Основные причины и факторы риска рака легких
Ежегодно в США у более 230 000 человек диагностируется рак легких. Никто не знает, разовьется ли болезнь и когда, но понимание факторов риска рака легких может помочь вам принять профилактические меры, чтобы снизить вероятность развития болезни.
Что вызывает рак легких?
Рак легких возникает, когда мутировавшие клетки в легких бесконтрольно разрастаются, образуя опухоль. Во многих случаях эти измененные клетки умирают или подвергаются атаке иммунной системы. Но некоторые клетки избегают иммунной системы и выходят из-под контроля, образуя опухоль в легком.
Хотя точная причина рака легких у человека может быть неизвестна, с этим заболеванием тесно связаны определенные факторы риска, особенно курение табака. Кроме того, воздействие определенных химических веществ, газов или загрязнителей с течением времени может увеличить риск развития рака легких.
Основные причины рака легких
Известные факторы риска рака легких включают:
Риск по возрасту: Примерно два из трех случаев рака легких диагностируются у людей старше 65 лет, и большинство людей старше 45 лет. Средний возраст на момент постановки диагноза составляет 71 год.
Семейная история:
У некоторых людей генетическая предрасположенность к раку легких. Лица, ближайшие родственники которых болеют или болели раком легких (а также не курили или не курили), могут быть более склонны к развитию этого заболевания.
Курение и пассивное курение: Курение широко считается основной причиной рака легких. Для тех, кто не курит, но подвергается воздействию дыма дома или на работе, пассивное курение может значительно повысить риск рака легких. Национальный институт рака (NCI) сообщает, что курение табака вызывает примерно девять из 10 случаев рака легких у мужчин и восемь из 10 — у женщин.
Воздействие асбеста или других загрязнителей: Канцерогенные химические вещества на рабочем месте повышают риск рака легких, особенно если вы курите.
Воздействие радона: Радон — это бесцветный радиоактивный газ без запаха, который содержится в некоторых домах и является основной причиной рака легких.
Факторы риска рака легких зависят от типа
Причины немелкоклеточного рака легкого
Генетические факторы риска
Семейный анамнез: Семейный анамнез рака легких может увеличить риск немелкоклеточного рака легких (НМРЛ). Некоторые данные указывают на генетическую связь в нескольких случаях.Однако исследователи не определили, играют ли общие экологические или поведенческие факторы, такие как газ радон или курение, большую роль в семейном анамнезе рака легких, чем генетика.
Факторы риска, связанные с образом жизни
Употребление табака: Курение табака (сигареты, трубки или сигары) связано более чем с четырьмя из пяти случаев рака легких. Заядлые курильщики и те, кто начал курить в молодом возрасте, подвергаются повышенному риску развития заболевания. Если бросить курить, можно значительно снизить риск рака легких.По данным Центров США по контролю и профилактике заболеваний, у курильщиков сигарет вероятность развития рака легких в 15-30 раз выше, чем у некурящих, а курение связано примерно с 80-90 процентами смертей от рака легких.
Пассивное курение: Даже если вы не курите, у вас может быть повышенный риск развития рака легких, если вы подвергаетесь воздействию табачного дыма.
Радон: Естественный газ без запаха, радон может быть обнаружен в некоторых домах или зданиях.Агентство по охране окружающей среды США считает воздействие газообразного радона причиной номер один рака легких у некурящих. Доступны наборы для проверки на радон в вашем доме или офисе.
Асбест: Долгосрочное воздействие асбеста связано с повышенным риском рака легких. Шахтеры, рабочие заводов или люди, которые, возможно, вдыхали волокна асбеста, подвергаются большему риску развития рака легких.
Воздействие на производстве или на рабочем месте: Вдыхание химикатов или минералов, таких как асбест, мышьяк, хром, никель, сажа или смола, со временем может повысить риск НМРЛ человека.Работники определенных производственных или горнодобывающих предприятий могут подвергаться повышенному воздействию этих химикатов. Выхлопные газы дизельного двигателя и загрязнение воздуха также могут быть вредными.
Предыдущие процедуры
Наличие в анамнезе заболеваний легких, включая ранее перенесенный рак легких, может повысить риск развития этого заболевания. Также существует риск, связанный с другими видами лечения рака, такими как лучевая терапия.
Причины мелкоклеточного рака легкого
Генетические факторы риска
Семейный анамнез: Любой, у кого ранее был диагностирован рак легких, или кто-либо с семейным анамнезом этого заболевания, имеют повышенный риск.В частности, у людей, унаследовавших хромосому 6, больше шансов заболеть раком легких.
Факторы риска, связанные с образом жизни
Курение: Сигаретный дым — ведущий фактор риска мелкоклеточного рака легких (МРЛ). Риск возрастает с увеличением количества выкуриваемых сигарет в день в течение любого длительного периода времени. Курильщики, которые бросили курить до того, как разовьется рак легких, могут жить дольше, чем люди, которые продолжают курить. Это потому, что как только курильщик бросает курить, легкие способны восстанавливать поврежденные ткани.
Пассивное курение: Некурящие, которые регулярно подвергаются воздействию вторичного сигаретного дыма, также подвергаются повышенному риску развития МРЛ.
Радон: Когда уран распадается в почве и горных породах, он выделяет естественный радиоактивный газ, называемый радоном. Этот газ может быть обнаружен в подвалах старых домов или зданий. Воздействие концентрированного количества газообразного радона увеличивает риск развития МРЛ. Широко доступны тестовые наборы, которые могут обнаруживать и измерять уровни радона.
Воздействие на рабочем месте: Существует множество отраслей, где рабочие регулярно подвергаются воздействию канцерогенов, таких как асбест, что увеличивает риск рака легких. Другие агенты на рабочем месте, повышающие риск SCLC, включают радиоактивные руды, вдыхаемые химические вещества или минералы, такие как бериллий, кадмий, кремнезем, винилхлорид и соединения никеля, а также выхлопные газы дизельных двигателей.
Предыдущие процедуры
Наличие в анамнезе заболеваний легких, включая ранее перенесенный рак легких, может повысить риск развития этого заболевания.Также существует риск, связанный с другими видами лечения рака, такими как лучевая терапия.
Причины метастатического рака легкого
Курение: Курение является самым большим фактором риска метастатического рака легких или рака, который распространяется из легких или легких на другие части тела. Для курильщиков количество и скорость, с которой вы курите, могут увеличить ваши шансы на рак легких, поэтому, если вы выкуриваете чрезмерное количество сигарет каждый день, у вас может быть более высокий риск развития болезни, чем если бы вы курили время от времени.Поскольку симптомы часто остаются незамеченными, высока вероятность распространения рака из легких на другие части тела. Рак легких, который распространяется на другие органы или ткани, считается метастатическим раком легких, независимо от того, где он распространился. Например, рак легких, метастазирующий в мозг, по-прежнему считается раком легких, а не раком мозга.
Профилактика рака легких
Знание факторов риска рака легких — ключ к принятию мер по предотвращению этого заболевания. Отказ от курения, отказ от пассивного курения, отказ от ВИЧ-инфекции, а также понимание и предотвращение воздействия факторов окружающей среды, таких как радон, могут помочь снизить ваш риск.По данным Национального института рака, исследования показали, что курение сигарет с низким содержанием смол или никотина не снижает риск. Однако, если вы курите, отказ от курения — с помощью продуктов, заменяющих никотин, консультирования или других мер по прекращению курения — может помочь снизить ваш будущий риск.
Следующая тема: Каковы симптомы рака легких?
Рак легких • 7: Лечение рака легких у пожилых пациентов
Пик заболеваемости раком легких в Великобритании приходится на возраст 75-80 лет, по сообщениям 751 на 100 000 мужчин старше 75 лет, 1 с более половина из 500 000 пациентов, ежегодно диагностируемых во всем мире, старше 70 лет. 2, 3 Таким образом, это является огромным бременем для здоровья нашего стареющего населения и в среднесрочной перспективе станет серьезной проблемой для служб здравоохранения во всем мире, поскольку возрастное распределение населения смещается в сторону восьмидесятилетнего населения. Больные раком легких могут ожидать большого количества симптомов, особенно от усталости и одышки, 4, 5 вместе с самыми высокими показателями сопутствующих заболеваний среди всех опухолей 6, 7 , включая сердечно-сосудистые заболевания (23 %), хронической обструктивной болезни дыхательных путей (ХОБЛ) (22%) и других злокачественных новообразованиях (15%). 7 Действительно, распространенность сопутствующих заболеваний среди больных раком легких значительно выше у пациентов в возрасте> 70 лет вместе с пропорциональным увеличением числа сопутствующих заболеваний на одного пациента. 7, 8 У пациентов с немелкоклеточным раком легкого (НМРЛ) IV стадии повышенная сопутствующая патология связана со снижением процента пациентов, получающих химиотерапию. 9 Наиболее частыми сочетаниями сопутствующих заболеваний были ХОБЛ с сердечно-сосудистыми заболеваниями (17%), ХОБЛ с другими злокачественными новообразованиями (13%) и ХОБЛ с артериальной гипертензией (11%). 7 В недавнем обзоре 966 пациентов с раком легких и средним возрастом 70 лет ХОБЛ и комбинированные сердечные и цереброваскулярные заболевания были диагностированы у 7,6% и 26,3%, соответственно, каждая из которых отрицательно коррелировала с выживаемостью (p = 0,0275 и p = 0,0466). соответственно, по сравнению со статусом производительности и стадией, оба p <0,0001). 10, 11 Интересно, что более 70% этих пациентов относились к группе восточной кооперативной онкологии (ECOG) со статусом 0–1.
При рассмотрении вариантов лечения важны несколько факторов, включая точный диагноз и стадию опухоли, знание родственных симптомов, сопутствующих заболеваний и статус работоспособности.Ясно, что, несмотря на рост заболеваемости раком легких с возрастом, дискриминация по возрасту — частое явление. Пожилые люди получают более низкие показатели гистологического подтверждения, 1, 12 менее точное стадирование, 7 и более низкие показатели окончательного лечения, но пациенты в возрасте> 65 лет составляют более 50% больных раком легких с отличными или хорошими показателями. статус. 1, 13 Использование хирургических вмешательств и химиотерапии у пациентов с НМРЛ составило 18% и 21%, соответственно, пациентов в возрасте <65 лет по сравнению с 2.1% и 0% для пациентов старше 75 лет. Аналогичным образом, при мелкоклеточном раке легкого (SCLC) 79% пациентов в возрасте <65 лет и 41% пациентов в возрасте> 75 лет получали химиотерапию, при этом различия в лечении сохранялись для обеих групп даже после учета статуса работоспособности и проверки врачом-терапевтом. 1 В популяционном исследовании 3864 пациентов с раком легкого увеличение возраста и наличие сопутствующих заболеваний отрицательно повлияло на хирургическое вмешательство при локализованном НМРЛ (p = 0,0001 и p = 0.002, соответственно), в то время как только увеличение возраста отрицательно было связано с химиотерапией по поводу SCLC (p = 0,0001). 7 Состояние работоспособности и клиническая стадия заболевания не сильно различались в обзоре 5404 пациентов с раком легких в зависимости от возраста> 50 или <50 лет, хотя существуют весьма значимые различия в распределении лечения в пользу более молодых пациентов по всем модальностям (химиотерапия , хирургия, операция + химиотерапия или лучевая терапия, все p <0,001). 14 Пациенты пожилого возраста получали только симптоматическое лечение (p <0.001), в то время как более молодые пациенты имели значительное преимущество в выживаемости (p = 0,011). 14
Таким образом, очевидно, что значительная часть пожилых пациентов не направляется или не получает лечения, сопоставимого с более молодыми пациентами, и, как следствие, может получить худшую выживаемость и временное облегчение. Однако это не обязательно означает, что пожилые люди получат такую же пользу от современных диагностических и терапевтических методов, как и пожилые пациенты, несмотря на коррекцию работоспособности, возрастное снижение физиологии сердца, почек и печени. 15 Поэтому важно определить, действительно ли пожилые люди (> 65 лет) выиграют от тех же стандартов ведения, что и их более молодые коллеги.
МЕТОДЫ ДИАГНОСТИКИ
Показатели гистологического подтверждения у пожилых значительно хуже, чем у более молодых пациентов, и могут повлиять на последующее правильное ведение пациентов с раком легкого. Предполагается, что это связано с предполагаемой способностью пациента выдерживать бронхоскопию, биопсию под контролем КТ, другие инвазивные методы и лечение.
Фибробронхоскопия
В своем резюме рекомендаций по диагностической гибкой бронхоскопии Британское торакальное общество не считает возраст препятствием для применения этой техники. 16 Из проспективного исследования пациентов, перенесших гибкую бронхоскопию, очевидно, что переносимость процедуры не зависела от возраста, 17 и два ретроспективных исследования в 1980-х годах также подтверждают эту точку зрения, особенно у пожилых людей, 18, 19 даже при выраженном нарушении дыхания.Кроме того, недавний обзор гибкой бронхоскопии у пожилых не обнаружил доказательств того, что возраст влияет на производительность или результат этой процедуры. 20 Однако ХОБЛ является частым сопутствующим заболеванием у больных раком легких, и при наличии тяжелого заболевания может увеличивать частоту осложнений. 21 Более низкий порог спирометрии и / или анализа артериальных газов может быть оправдан. Точно так же осторожное использование лигнокаина и мидазолама рекомендовано пожилым людям, учитывая возможность скрытой печеночной или сердечной недостаточности. 16 В остальном частота осложнений чрезвычайно низка: заболеваемость <1% и 0% смертность. 22
Торакальная биопсия под контролем КТ
Для пожилых людей имеется мало информации о переносимости биопсии легких под визуальным контролем. В проспективном исследовании трансторакальной тонкоигольной биопсии у более чем 500 пациентов частота осложнений не пострадала, несмотря на включение пациентов в возрасте до 94 лет, при этом более 60% показали различную степень эмфиземы радиологически.Процедурная переносимость также была хорошей, позволяя выписку через 30 минут без заметных осложнений и летальности. 23 Биопсия с режущей иглой предлагает мало дополнительной информации, если клиническая картина предполагает рак легкого, хотя в единичных легочных узлах или менее явных случаях лимфому и доброкачественные образования можно диагностировать с большей уверенностью с помощью биопсии с разрезанной иглой без хирургического вмешательства 24 и предпочтительнее независимо от возраста. Точно так же у ряда пациентов с опухолями средостения в возрасте до 82 лет чрескожная биопсия с помощью режущей иглы вызвала тканеспецифический диагноз более чем в 90% биоптатов с минимальной болезненностью. 25
Тонкоигольная эндоскопическая аспирация под контролем ультразвука (EU-FNA) обещает улучшить стадирование рака легких у всех пациентов и может, как следствие толерантности, быть особенно полезной для пожилых людей. Проспективное исследование оценивало EU-FNA на 86 пациентах с лимфаденопатией средостения и позволяло отличить доброкачественные узлы от злокачественных с отрицательной и положительной прогностической ценностью 94% и 100% соответственно. Особое значение имел переход на безоперационное лечение у 80% пациентов. 26 Конкретные данные о переносимости трансторакальной биопсии у пожилых получены из ретроспективного анализа пациентов с подозрением на злокачественное новообразование в возрасте 70–90 лет, что указывает на то, что трансторакальная игольная биопсия имеет такую же безопасность и переносимость процедур, как и у более молодых пациентов, и в большинстве случаев выполняется в дневном режиме. 27
Стадия
Всем пациентам с подозрением на рак легких следует пройти КТ грудной клетки, поскольку точное определение стадии обеспечивает правильные решения о лечении и соответствующее консультирование.Как упоминалось выше, у пожилых людей часто не учитывается точная стадия, 7 , вероятно, из-за низких показателей направления к специалистам для нехирургического лечения. Тем не менее, поощряя направление пожилых пациентов на лечение, особенно хирургическое или радикальную лучевую терапию, важно избегать ненужных заболеваний. Позитронно-эмиссионная томография (ПЭТ) с фтордезоксиглюкозой (ФДГ) F-18 способна улучшить обычную стадию (снижение стадии у 10% пациентов и повышение стадии у 33%), влияя на цель лечения в значительной части случаев, то есть от лечебного к паллиативному в 22% пациентов и от паллиативного к лечебному у 4% пациентов.Существует также значительно улучшенная прогностическая стратификация по сравнению с обычным стадированием — например, обычное стадирование значительно уступает стадированию ПЭТ (p = 0,013 v p <0,0001) в отношении выживаемости. 28 Кроме того, высокая частота неожиданных отдаленных метастазов была обнаружена у пациентов с НМРЛ I – III стадии, которые в противном случае были бы кандидатами на хирургическое вмешательство, радикальную химио- / лучевую терапию или радикальную лучевую терапию. ПЭТ-сканирование увеличило обнаружение метастазов у пациентов с I стадией заболевания, прошедших КТ, на 7.5%, увеличиваясь до 24% при КТ у пациентов с III стадией заболевания. 29 Кроме того, проспективное исследование ПЭТ-сканирования отметило изменение стадии, оцененной с помощью компьютерной томографии, у пациентов с операбельным НМРЛ в 60,7% случаев, сделав вывод о возможности улучшения выявления локальных и отдаленных метастазов. 30 Учитывая, что возраст большинства больных раком легких превышает 65 лет, это имеет важные последствия для эффективного лечения этого заболевания у пожилых людей, вызывая ненужную заболеваемость, задержку в лечении и неправильный выбор метода лечения. 31 К сожалению, F-18 FDG-PET не имеет широкого распространения. Альтернативные традиционные стратегии, направленные на обнаружение скрытых метастазов при резектабельном заболевании, по-видимому, не способны сократить количество ненужных хирургических вмешательств на ранней стадии заболевания. 32
Стратегии лечения немелкоклеточного рака легкого (НМРЛ)
Хирургия
Британское торакальное общество в своих рекомендациях по отбору пациентов для операции по лечению рака легких рекомендует, чтобы все пациенты имели равный доступ к услугам по лечению рака легких, независимо от возраста. 33 Вопрос о том, является ли возраст фактором риска хирургического вмешательства при раке легких, остается спорным. В обзоре более 1000 пациентов, перенесших торакотомию по поводу рака легкого в период с 1977 по 1996 год, способ представления был одинаковым для всех возрастных групп (<60 лет, 60–69 лет,> 70 лет), хотя более молодые пациенты имели более запущенное заболевание. . Тем не менее, частота исследовательской торакотомии и пневмонэктомии была выше у пациентов в возрасте <70 лет, вместе с более высокой частотой лобэктомии и «меньшей резекции» у пациентов в возрасте> 70 лет.Смертность при меньших резекциях имела пограничное значение с возрастом, но не при пневмонэктомии. 34 Ретроспективный обзор пожилых пациентов показал незначительную разницу в операционной смертности для пациентов в возрасте <69 лет, 70–79 лет и> 80 лет на 1,6%, 4,2% и 2,8% соответственно. Однако пневмонэктомия была значительно связана со смертностью пожилых людей. Нарушение функции легких или положительный сердечный анамнез не коррелировали с повышенным общим или специфическим риском. 35 В других ретроспективных обзорах хирургии рака легких у пожилых людей (возраст> 70 лет) указывается, что послеоперационная смертность составляет 3,1–21%, а заболеваемость — 34–42%. Более высокие показатели смертности очевидны для более обширных резекций (пневмонэктомия / билобэктомия), для обзоров с более высокой долей пациентов со стадией II / III и у пациентов с сопутствующими заболеваниями (таблица 1). В двух дополнительных больших ретроспективных обзорах отмечалось увеличение заболеваемости и смертности у пациентов в возрасте> 65 лет, а также более короткая общая выживаемость по сравнению с более молодыми пациентами. 36– 38 В целом многомерный анализ пришел к выводу, что возраст не важен для долгосрочного выживания. 36, 39– 41 Помимо обычных факторов, таких как стадия, длительная выживаемость коррелирует с характером (лобэктомия v пневмонэктомия ) и режимом (торакоскопическая v торакотомия) резекции. 42 Licker et al. 43 показали, что возраст> 70 лет был предиктором осложнений при однофакторном анализе, хотя при многомерном анализе только длительная операция и объем операции был значительным.Это подтверждается возрастной непереносимостью пневмонэктомии, и несколько исследований подтвердили, что пожилой возраст является значимым предиктором операционной смертности, выживаемости и заболеваемости. 44, 45 Особый интерес представляет высокая смертность среди пожилых людей после правой пневмонэктомии при наличии ишемической болезни сердца, что следует рассматривать как относительное противопоказание к пневмонэктомии. 46 Также представляет интерес отсутствие влияния на смертность других сопутствующих заболеваний, таких как диабет, гипертония, заболевания периферических сосудов и цереброваскулярные заболевания в этой возрастной группе. 46 Обнадеживает тот факт, что за последние два десятилетия увеличился средний возраст пациентов, перенесших операцию, в сочетании с увеличением 5-летней выживаемости и более низкой операционной смертностью. 47 Об изменении смертности также сообщалось у 385 пожилых пациентов, при этом смертность от пневмонэктомии упала с 11,1% в 1971–82 до 2,6% в 1983–94; последняя не отличалась от указанной контрольной группы. 35 На сегодняшний день имеются данные, подтверждающие, что пожилые люди поступают так же хорошо, как и более молодые пациенты (таблица 2), и, действительно, при современной хирургической практике пожилые пациенты могут получить дополнительную пользу.
Стол 1
Операционная смертность больных немелкоклеточным раком легкого I – III стадии
Стол 2
Долгосрочная выживаемость после операции у пожилых пациентов с немелкоклеточным раком легкого (НМРЛ)
Увеличение возраста пациентов, подвергающихся хирургическому вмешательству, наряду с приемлемой заболеваемостью и смертностью, по-видимому, является отражением отбора случаев, включающего детальную оценку состояния легких и сердца, улучшенную анестезиологическую помощь, обезболивание, послеоперационные возможности и современные хирургические методы.В руководстве BTS представлены подробные рекомендации, основанные на фактических данных, по отбору пациентов для хирургического вмешательства при раке легких. 33 Тем не менее, он пришел к выводу, что использование торакоскопической хирургии с помощью видео (VATS) еще слишком рано, чтобы делать твердые выводы, и менее 2% торакальных хирургов в Великобритании используют эту технику. 48 Тем не менее, результаты торакоскопических методов и использование ограниченной резекции могут сыграть значительную роль в увеличении числа пожилых пациентов, подвергающихся потенциально лечебной резекции, поскольку этот метод может помочь справиться с накопленным избытком сопутствующих заболеваний. состояния в этой группе пациентов.Особые преимущества этого метода включают уменьшение хирургической травмы, минимальную послеоперационную боль, более короткое пребывание в больнице и быстрое возобновление нормальной деятельности 49 с последующим сокращением затрат. Стадия средостения и диагностика могут быть адекватно выполнены с помощью VATS, 50 , что снижает частоту исследовательской торакотомии. 51
VATS был выполнен легко и безопасно при резекции легочных узелков размером до 5 см, 52– 54 , хотя частота осложнений может увеличиваться при поражениях размером более 2 см.Ретроспективная оценка лобэктомии VATS при НМРЛ I – IIIA стадии может обеспечить 3-летнюю и 4-летнюю выживаемость 90% и 70%, соответственно, наряду с низкими послеоперационными осложнениями (10–12,8%), более коротким или эквивалентным пребыванием в больнице до торакотомии и 6–10% конверсия в торакотомию. 55– 57 В серии из 171 крупной торакоскопической резекции легких (165 лобэктомий, шесть пневмонэктомий) не было зарегистрировано периоперационной смертности, у 90% пациентов послеоперационное течение протекало без осложнений, хотя у 15 пожилых пациентов наблюдалась длительная утечка воздуха. 58 Проспективные исследования, сравнивающие лобэктомию VATS с торакотомией, также пришли к выводу, что лобэктомия VATS сравнима с торакотомией, хотя интраоперационная кровопотеря, послеоперационная боль, пребывание в больнице и послеоперационная легочная функция значительно лучше с лобэктомией VATS 59– 61 ; Однако проспективные данные о 5-летней выживаемости отсутствуют. Лобэктомия VATS, выполняемая у пожилых людей, также связана с превосходной сердечной динамикой, которая, в отличие от традиционной торакотомии, распространяется на послеоперационный период. 62 Точно так же ограниченная торакотомия или минииторакотомия с помощью видео может ограничить время операции и улучшить послеоперационную функцию легких и заболеваемость по сравнению с традиционной торакотомией. 63, 64 У пожилых пациентов с нарушением дыхательного резерва следует рассмотреть возможность ограниченной резекции. 65
Ретроспективный анализ пациентов, перенесших сегментэктомию (сложную операцию) по сравнению с лобэктомией, не показал значительных различий в операционной смертности или осложнениях, хотя спирометрические параметры улучшились в группе сегментэктомии; Следовательно, эта процедура потенциально полезна для пациентов с пограничной респираторной функцией.Пятилетняя выживаемость не изменилась у 96,8%. 66 Клиновидная резекция или сегментэктомия при опухолях <2 см была оценена проспективно и может оказаться приемлемой альтернативой лобэктомии. 67 Однако существуют опасения относительно частоты местных рецидивов после ограниченной резекции и их влияния на выживаемость. 68 Высокий уровень сопутствующих заболеваний у пожилых людей, а также давление со стороны рейтинговых таблиц могут удерживать хирурга от проведения оперативного вмешательства; сердечно-сосудистые заболевания остаются независимым предиктором смертности при пневмонэктомии 45 , а предполагаемая переносимость плохого дыхательного резерва исключает многих пациентов из рассмотрения.Однако у пациентов с ХОБЛ легкой и средней степени тяжести лобэктомия легочной артерии не повлияла на операционную или актуарную выживаемость или на послеоперационные осложнения. Также наблюдалось значительное сохранение функции легких через 6 месяцев у пациентов с объемом форсированного выдоха за 1 секунду (ОФВ 1 ) 40–80% от прогнозируемого. 69 Аналогичным образом в небольшой группе пожилых пациентов с тяжелой ХОБЛ хирургическая резекция (обычная или торакоскопическая) оказалась приемлемой без ухудшения легочной функции.Было предсказано, что это улучшится, если место опухоли и сцинтиграфический дефект перфузии будут соответствовать. 70, 71 Кроме того, пациенты с ОФВ 1 <60% и соотношением ОФВ 1 / ФЖЕЛ <60% вряд ли потеряли дополнительную вентиляционную функцию после лобэктомии. 72 Обнадеживающие сообщения о восьмидесятилетнем возрасте с раком легкого, использующих ограниченную торакоскопическую резекцию и включающих пациентов с недостаточным кардиореспираторным резервом, должны стимулировать нас к тому, чтобы убедиться, что возраст не является действительным критерием исключения для отбора пациентов для операции, 73– 76 и критически и прозрачно оценивать сопутствующие заболевания на междисциплинарных совещаниях.
Из отчета совместной рабочей группы Британского торакального общества и Общества кардиоторакальных хирургов Великобритании и Ирландии 77 видно, что предоставление торакальной хирургии в Великобритании находится в кризисе. Менее 10% случаев рака легких подвергаются резекции (менее половины показателей в США и Европе), а у пожилых пациентов в Великобритании гораздо меньше шансов получить оперативное вмешательство. Является ли это результатом неуместных подсознательных влияний, остается под вопросом. 78 Поскольку только 2% торакальных хирургов в Великобритании практикуют торакоскопические процедуры, показатели среди пожилых людей вряд ли быстро улучшатся. Давление на наших коллег-хирургов огромно, с неадекватным числом консультантов и постоянно увеличивающейся нагрузкой на время из-за рекомендаций отчета Калмана-Хайна и сокращения рабочего времени младших врачей. В отчете делается вывод о том, что требуется 50 дополнительных торакальных хирургов, чтобы соответствовать средним европейским стандартам, вместе с соразмерным увеличением количества коек и инфраструктуры и радикальным пересмотром подготовки.Это должно включать торакоскопические методы, если все большее число пожилых пациентов с раком легких должно иметь равный доступ к услугам. Рандомизированные испытания торакоскопической резекции у пожилых пациентов вместе с ограниченной резекцией (в зависимости от респираторной функции) теперь оправданы, чтобы определить место этих методов в лечении рака легких. Роль дополнительных местных методов лечения после ограниченной резекции также требует уточнения.
Радикальная лучевая терапия и НМРЛ
Радикальная лучевая терапия считается лечением выбора у пациентов, недостаточно пригодных для операции с I / II стадией заболевания.Недавний систематический обзор выявил отсутствие высококачественных рандомизированных испытаний с участием радикальной лучевой терапии и обнаружил только два рандомизированных испытания, только одно из которых отвечало критериям отбора для анализа. В нем сделан вывод о том, что в отсутствие исследования фазы III, сравнивающего немедленную радикальную лучевую терапию с паллиативной лучевой терапией по мере развития симптомов, радикальная лучевая терапия обеспечивает лучшую выживаемость, чем можно было бы ожидать, если бы лечение было отложено. 79 Однако оптимальная доза облучения и метод лечения остаются неопределенными.В ретроспективном исследовании пожилых пациентов было проанализировано 97 пациентов, получивших лучевую терапию в высоких дозах, которые были неоперабельными или неоперабельными. Разделение на три группы в зависимости от возраста позволило сравнить результаты (группа I <75 лет, группа II 75–79 лет и группа III> 80 лет) с 2- и 5-летней выживаемостью в группах I, II и III примерно 36%. и 12%, 32% и 13% и 28% и 4% соответственно, и никакой статистически значимой разницы между тремя группами. Между этими группами также не было значительных различий в выживаемости при I – II стадии болезни, хотя выживаемость восьмидесятилетних детей с болезнью III стадии была хуже.Ухудшение работоспособности при лечении наблюдалось только у меньшинства (группа I, 5%; группы II / III, 8%). 80
Проспективный анализ данных о качестве жизни, полученных до и после радикальной лучевой терапии, выявил хороший симптоматический контроль кровохарканья, боли и анорексии и поставил под сомнение широко распространенное мнение об облегчении кашля, которое, наряду с одышкой и утомляемостью, было плохо облегчено. Плохо отреагировали на физическое и ролевое функционирование, равно как и на качество жизни в целом.Однако социальное и когнитивное функционирование дало более 50% ответов. 81 Ретроспективный обзор 347 пациентов с НМРЛ I стадии пришел к выводу, что нигилистический подход к лечению пожилых пациентов, непригодных для операции или отказавшихся от нее, более не оправдан, учитывая, что 5-летняя выживаемость пациентов в возрасте> 70 лет, получающих радикальную лучевую терапию, сопоставима с или лучше, чем младшие возрастные группы. 82 Очевидно, что требуется больше информации об оптимальном месте проведения радикальной лучевой терапии, хотя кажется, что радикальная лучевая терапия безопасна, эффективна и минимально влияет на состояние здоровья пожилых пациентов с ограниченными заболеваниями.Однако контроль симптомов не является универсальным, и качество жизни в некоторых областях отрицательно сказывается. Еще неизвестно, предпочтут ли пожилые пациенты выживаемость, а не качество жизни, особенно потому, что общая и специфическая для рака выживаемость различается: многие пациенты умирают преждевременно, но не страдают от рака (2-летняя выживаемость: 22–72% против 54–93% 3-летняя выживаемость: 17–55% против 22–56% и 5-летняя выживаемость: 0–42% против 13–39%). 79 Имеющиеся на сегодняшний день данные, хотя и не относящиеся к радикальной лучевой терапии, позволяют предположить, что пожилые люди могут отдавать предпочтение качеству жизни, а не выживаемости, в отличие от своих более молодых коллег, хотя они в равной степени принимают лечение. 83, 84
Химиолучевая терапия при НМРЛ III стадии
Комбинированное лечение местнораспространенного неоперабельного заболевания было рекомендовано после метаанализа, сравнивающего только лучевую терапию с химиотерапией плюс лучевая терапия, который показал лучшую выживаемость через 1 и 2 года для пациентов, получающих химиотерапию, особенно на основе платины. 85, 86 Впоследствии исследование фазы III подтвердило превосходство последовательной конформной лучевой терапии с комбинированной химиотерапией на основе платины без увеличения токсичности лечения. 87 Комбинированная одновременная химиолучевая терапия на основе платины превосходит последовательную химиолучевую терапию 88– 90 и может рассматриваться как стандарт лечения, хотя для пожилых пациентов могут потребоваться альтернативные стратегии, учитывая избыточную токсичность при одновременных схемах. 91 Интересно, что возраст ≥60 лет был очень значимым благоприятным прогностическим фактором при многофакторном анализе в рандомизированном исследовании, сравнивавшем одновременную гиперфракционированную (HFX) лучевую терапию плюс химиотерапию этопозидом платины и только лучевую терапию HFX. 92 Необходимы специальные исследования с использованием конформных полей и гиперфракционированных режимов для выяснения переносимости этих режимов у пожилых людей.
Химиотерапия и НМРЛ
Недавний метаанализ 52 рандомизированных исследований не выявил доказательств того, что группы, указанные по возрасту, не получали равной пользы от химиотерапии, 86 и субанализ работы Каллена и др. 93 не показали значительной выживаемости разница для пациентов старше 65 лет.Несмотря на эти и другие данные, некоторые медицинские работники — независимо от их взглядов на возраст — все же должны быть убеждены в пользе химиотерапии при позднем НМРЛ. Анализ опухолевого реестра выживаемости, эпидемиологии и конечных точек (SEER) пришел к выводу, что химиотерапия у пожилых пациентов с болезнью IV стадии и у пациентов с сопутствующими заболеваниями имела такую же эффективность, что и в рандомизированных исследованиях. 94 Действительно, результаты рандомизированных контролируемых испытаний химиотерапии при распространенном НМРЛ плюс лучшая поддерживающая терапия по сравнению с одной только лучшей поддерживающей терапией (концепция, охватывающая паллиативную лучевую терапию, психосоциальную поддержку, анальгетики и другие лекарства, связанные с опухолями, а также нутритивную поддержку) последовательно подтверждают использование химиотерапии со значительным улучшением качества жизни и выживаемости (таблица 3).Однако большинство пациентов, участвовавших в этих испытаниях, имели хороший статус работоспособности, и, возможно, менее 45% пациентов были в возрасте> 65 лет. 93, 95 Поэтому трудно, учитывая изменившуюся физиологию пожилых людей, 3 экстраполировать эти результаты, даже если учесть статус работоспособности.
Стол 3
Рандомизированные испытания, сравнивающие химиотерапию при распространенном НМРЛ с наилучшей поддерживающей терапией (1988–2001)
Несмотря на это, однако, было обнаружено, что у пожилых людей винорелбин обладает более высокой эффективностью, чем только лучшая поддерживающая терапия, со значительным увеличением выживаемости и улучшенными показателями качества жизни, включая глобальное состояние здоровья, роль, когнитивные, социальные и физические функции, усталость и боль. и четко определяет потенциал химиотерапии в этой возрастной группе. 96 Кроме того, гемцитабин, являющийся одним агентом, продемонстрировал подтвержденную активность и благоприятный профиль токсичности у пожилых пациентов с распространенным НМРЛ, при этом пациенты старшего возраста переносили ту же интенсивность дозы, что и более молодые, хотя с более высокой частотой анемии 3-4 степени (таблица 4). ). 97– 99 Комбинированный анализ четырех исследований фазы II показал, что гемцитабин в виде монотерапии был столь же эффективен у пожилых пациентов, как и у более молодых, несмотря на значительное увеличение у пациентов в возрасте> 65 лет с IV стадией заболевания. 100 Frasci et al 101 показали, что комбинация гемцитабина с винорелбином у пожилых людей превосходит только винорелбин с прогнозируемой выживаемостью в течение 1 года 30%, явной задержкой прогрессирования симптомов и сохранением качества лечения. жизнь. Однако данные исследования MILES, в котором сравнивали гемцитабин плюс винорелбин с одним винорелбином или только с гемцитабином, не смогли продемонстрировать превосходство для какой-либо схемы. 102, 103
Стол 4
Однократная и комбинированная химиотерапия у пожилых людей: данные исследований фазы II
Комбинированная химиотерапия на основе платины также изучалась у пожилых людей (таблица 4).Цисплатин при использовании различных схем приема в комбинации с гемцитабином, вводимым каждые 3 или 4 недели, обеспечил частоту ответа 15–53% и среднюю выживаемость 7,7–11 месяцев 104– 106 без существенной разницы в исходах для пациентов моложе или старше 70 лет. 104 Аналогичным образом, прием гемцитабина плюс карбоплатин каждые 3 недели обеспечивал частоту ответа 39,2% и среднюю выживаемость 11 месяцев. 107 Добавление винорелбина к цисплатину 3 еженедельно дало частоту ответа 54% и общую выживаемость 31 неделю. 108 Профили токсичности всех этих режимов были приемлемыми и в основном были связаны с миелосупрессией. Кроме того, таксаны с одним агентом использовались в фазе II у пожилых людей по еженедельному графику дозирования. 109, 110 Интересно, что пациенты со статусом работоспособности 0–1 и 2 достигли эквивалентной выживаемости в течение 1 года с доцетакселом (28%) и без серьезной гематологической токсичности. 109 Добавление гемцитабина к доцетакселу усиливало общий ответ за счет миелотоксичности.Данных о выживаемости пока нет. 109 В исследовании применения монотерапии паклитакселом у пожилых людей, включая пациентов с функциональным статусом 2–3, была обнаружена медиана и 1-летняя выживаемость 10,3 месяца и 45% соответственно. 110
Таким образом, химиотерапия у пожилых пациентов с НМРЛ в настоящее время показана пациентам с запущенным заболеванием и функциональным статусом 0–2 с использованием монотерапии винорелбином или гемцитабином или комбинацией платины. Новые режимы требуют дополнительного анализа фазы III, но исследования фазы II обнадеживают, и необходимо изучить как режимы с одним агентом, так и комбинированные, не обязательно включая платину.Также потребуются дополнительные данные о переливаниях крови, потребностях в антибиотиках, госпитализации и качестве жизни.
СТРАТЕГИИ ЛЕЧЕНИЯ МАЛОКЛЕТОЧНОГО РАКА ЛЕГКОГО (SCLC)
Химиотерапия при ПКРЛ
Химиотерапия используется при лечении МРЛ. Вследствие значительного медианного и общего прироста выживаемости, наблюдаемого при лечении за последние два десятилетия, 12, 111– 113 большинство пожилых пациентов получают активное лечение (хирургическое вмешательство, химиотерапия, лучевая терапия) в отличие от пожилые пациенты с НМРЛ (возраст 75+: 78%, против , 42%). 1 Эта разница в направлениях существует после осмотра терапевтом и предполагает, что пожилые пациенты в целом подходят для химиотерапии и что отказ от направления к специалистам является функцией предполагаемой эффективности лечения, возможно, предположением о «хороших возможностях» или патернализме. . В одном исследовании фазы III пожилые пациенты имели значительно меньшую общую выживаемость и время до прогрессирования заболевания при сравнении высоких доз эпирубицина / цисплатина с цисплатином / этопозидом. 114 Albain et al показали, что возраст> 70 лет является значительным неблагоприятным прогностическим показателем как при обширном (не содержащие платину режимах), так и при ограниченном течении болезни (режимы, содержащие платину). 115 Однако большой французский ретроспективный многомерный анализ 787 пациентов, использующих различные режимы, не обнаружил такой корреляции. Однако степень заболевания, участие в клиническом исследовании, тип химиотерапии и использование облучения средостения были важными независимыми прогностическими переменными. 113 Это повышает вероятность того, что тип химиотерапии может отрицательно повлиять на выживаемость пожилых людей, возможно, в отношении переносимости. Пациенты пожилого возраста получают значительно меньше химиотерапии (общая доза, номер цикла и интенсивность дозы) с более высокой частотой фебрильной нейтропении. 114 Следовательно, снижение воздействия фебрильной нейтропении, когда риск смертельной инфекции выше у пациентов в возрасте> 60 лет 116 или разработка схем с меньшей гематологической токсичностью, являются жизнеспособными подходами к ведению пожилых пациентов с МРЛ, особенно с плохим прогнозом.
Заболеваемость и эффекты фебрильной нейтропении можно предотвратить с помощью гранулоцитарных колониестимулирующих факторов (G-CSF) и профилактических антибиотиков.Рандомизированное исследование, сравнивающее разные дозы G-CSF у пожилых пациентов, проходящих химиотерапию на основе платины, показало, что доза G-CSF в 4 мкг / кг значительно сократила продолжительность лечения и вызвала более короткую продолжительность нейтропении 4 степени и более высокий уровень нейтрофилов. Кроме того, произошло значительное снижение частоты нейтропении 4 степени, продолжающейся> 4 дней, вместе с устранением потребности в антибиотиках после химиотерапии (p = 0,01). 117 В качестве альтернативы, использование ципрофлоксацина и рокситромицина на 4-13 дни после химиотерапии доксорубицином, циклофосфамидом и этопозидом (АПФ) (стандартные дозы или усиленное лечение) значительно снизило частоту фебрильной нейтропении, использование терапевтических антибиотиков, инфекционных заболеваний. смертности и госпитализации по поводу фебрильной нейтропении, а также снижения грамотрицательных, грамположительных и клинически подтвержденных инфекций. 118
Несмотря на опасения по поводу гематологической токсичности, пожилым пациентам с хорошим прогнозом следует рассмотреть возможность агрессивного лечения. Карбоплатин-этопозид с ускоренной гиперфракционированной лучевой терапией у пожилых пациентов с ограниченной стадией заболевания может обеспечить 2-летнюю и 5-летнюю выживаемость 32% и 13% соответственно. 119 Комбинация цисплатина, доксорубицина, винкристина и этопозида у пожилых пациентов также показала хорошую активность (частота ответа 92%) и медиана выживаемости 70 недель 120 ; оба требуют оценки фазы III.Аналогичным образом, 2-летняя и 5-летняя выживаемость 47% и 26%, соответственно, была достигнута при применении цисплатин-этопозида одновременно с лучевой терапией два раза в день, что является значительным улучшением по сравнению с режимом лучевой терапии один раз в день. 121 Хотя это исследование не проводилось специально для пожилых людей, возраст 30–40% населения был старше 65 лет, и отдельный анализ показал, что пациенты пожилого возраста получили аналогичные ответы и показатели выживаемости. 122 У пациентов с обширным заболеванием комбинация цисплатин-этопозид-эпидоксорубицин и циклофосфамид в возрасте до 75 лет вызвала значительно более высокие показатели ответа, время до прогрессирования заболевания и выживаемость, чем один цисплатин-этопозид, без статистически значимого влияния возраста на эти переменные. 123 Другие исследования, в которые были включены пациенты со средним возрастом> 65 лет, показали благоприятный ответ и данные о выживаемости, а также предположение об улучшении контроля симптомов, меньшем количестве госпитализаций и снижении риска опасного для жизни сепсиса. 124– 127 Совсем недавно было показано, что комбинация цисплатин-иринотекан более эффективна при обширной стадии заболевания, чем цисплатин-этопозид, и этот эффект сохранялся, несмотря на поправку на возраст (до 70 лет) и статус работоспособности. 128 Ранние сообщения о новых комбинациях также появляются с обнадеживающей скоростью ответа в исследованиях фазы II. Комбинации топотекан-этопозид, карбоплатин-винорелбин, цисплатин-этопозид-гемцитабин и гемцитабин-карбоплатин недавно показали частоту ответа 54–76% с нейтропенией 4 степени 25–60% в популяции со средним возрастом ≥65 лет. 129– 132
Пациентам пожилого возраста с хорошим прогнозом, определяемым характеристиками до лечения, 133 с ограниченной стадией МРЛ требуется лечение с целью достижения долгосрочной выживаемости.Пациентам с более неблагоприятным прогнозом следует предлагать паллиативную химиотерапию, помня о высокой частоте опасного для жизни сепсиса у этих пациентов, который можно уменьшить с помощью профилактического Г-КСФ или антибиотиков.
Лучевая терапия и SCLC
Текущая стандартная практика поддерживает назначение профилактического облучения черепа (ЧКВ) пациентам с МРЛ, которые достигают полного ответа на химиотерапию. 134 Имеющиеся данные позволяют предположить, что ни одна подгруппа, включая пожилых людей, не получила более или менее пользы от ЧКВ. 135 Более спорные вопросы, такие как время проведения ЧКВ и оптимальная доза, необходимая для снижения частоты церебральных метастазов, применимы ко всем пациентам независимо от возраста и по-прежнему требуют дополнительных исследований. Тем не менее, обзор 987 пациентов с МКРЛ в полной ремиссии показал тенденции к более высоким дозам облучения и более раннему назначению ЧКВ для снижения риска метастазов в мозг, хотя это не повлияло на выживаемость. 135 Вдобавок и, возможно, большое значение для пожилых людей имело отсутствие изменений нейропсихологической функции между группами, получавшими или не получавшими ЧКВ, хотя долгосрочные данные недоступны.
Переносимость и эффективность грудного облучения при ограниченных стадиях заболевания более ясны, 115, 136, 137 , хотя остается неясным, достигают ли пожилые люди такой же пользы по сравнению с более молодыми пациентами. 115, 136, 138 Мета-анализ, изучающий место торакальной лучевой терапии, показал, что выживаемость может быть выше у лиц моложе 55 лет, в то время как обзор 520 пациентов с ограниченной стадией SCLC и ранним или поздним лучевая терапия выявила небольшую разницу в выживаемости между пациентами в возрасте 65–75 лет и в возрасте <65 лет.Однако выживаемость пациентов в возрасте> 75 лет была значительно ниже, чем у пациентов <75 лет. 136 Pignon et al 136 не смогли уточнить, какая лучевая терапия лучше — ранняя или поздняя, в своем метаанализе. Результаты трех рандомизированных клинических испытаний показывают преимущество ранней одновременной химиолучевой терапии для выживаемости по сравнению с отсроченной одновременной химиолучевой терапией. 139– 141 Более раннее исследование Perry et al. , 142, 143 , однако, не показало преимуществ ранней параллельной химиолучевой терапии по сравнению с отсроченным лечением, и не было замечено значительных преимуществ для ранней грудной клетки по сравнению с более поздней грудью. облучение и последовательная химиотерапия. 144 Подтверждающие данные для ранней параллельной химиолучевой терапии, особенно с фракционированием лучевой терапии два раза в день, были представлены Turrissi et al. 121 , а многомерный анализ серии испытаний Юго-западной онкологической группы показал, что лечение с ранней одновременной химиолучевая терапия была сильным независимым показателем выживаемости. 115 Следовательно, ранняя одновременная лучевая терапия с химиотерапией платино-этопозидом теперь может рассматриваться как стандартное лечение. 141 Кроме того, пациенты в возрасте> 75 лет могут иметь более низкую выживаемость по сравнению с более молодыми пациентами, 136 , но пожилые пациенты с ограниченным SCLC (средний возраст 72 года, ~ 40% пациентов> 75 лет) могут получить благоприятную выживаемость с сокращенная (2 цикла) химиотерапия на основе платины и одновременная лучевая терапия грудной клетки. 145
Хирургия и SCLC
Использование хирургического вмешательства при лечении МКРЛ является предметом продолжающихся дискуссий, и его точное место в лечении четко не определено. 146, 147 Резекция ранней стадии заболевания (стадии I – II) с последующей химиолучевой терапией или химиотерапией с хирургической резекцией и последующей лучевой терапией / химиотерапией представляет собой серьезную физиологическую проблему; поэтому вполне вероятно, что только несколько пожилых пациентов будут кандидатами для этого подхода. Данные рандомизированных контролируемых исследований не подтверждают предпочтение этого подхода перед стандартными режимами химиотерапии с лучевой терапией или без нее.
ЗАКЛЮЧЕНИЕ
Пожилые — сложная группа пациентов с нарастающей сопутствующей патологией и сокращением физиологического резерва.Тщательный отбор отдельных пациентов посредством оптимального обследования и адаптации предлагаемых методов лечения с учетом сопутствующих заболеваний и вероятного прогноза может позволить нам обеспечить эффективное лечение этого сложного заболевания. Отрицание пожилым людям важных достижений в лечении рака легких на основе одних предубеждений больше не оправдано. Лечение этого заболевания далеко от идеала; задача состоит в том, чтобы своевременно расширить доступ к жизнеобеспечивающим препаратам для людей всех возрастов, чтобы обеспечить эффективное паллиативное лечение и улучшить выживаемость.Появление целевого лечения с использованием текущих знаний уже привело к новым агентам, направленным на рецептор эпидермального фактора роста и фарнезилтрансферазу, и может оказаться полезным у пожилых людей либо отдельно, либо в сочетании с существующими методами лечения с дальнейшим влиянием на выживаемость. Важные вопросы по-прежнему требуют ответов; Включение пожилых пациентов в рандомизированные клинические испытания приведет к прогрессу, а также обеспечит прочную научную основу для принятия решений о лечении.
ССЫЛКИ
- ↵
Коричневый JS , Eraut D, Trask C, и др. . Возраст и лечение рака легких. Thorax1996; 51: 564–8.
- ↵
Стивенс RJ , Джонсон DH. Лечение и результаты для пожилых пациентов с мелкоклеточным раком легкого. Лекарства от старения 2000; 17: 229–47.
- ↵
Депперманн К .Влияние возраста и сопутствующих заболеваний на химиотерапевтическое лечение рака легких. Рак легких, 2001; 33 (Дополнение 1): S115–20.
- ↵
Stone P , Харди Дж., Бродли К., и др. . Усталость при распространенном раке: проспективное контролируемое поперечное исследование. Br J Cancer1999; 79: 1479–86.
- ↵
O’Driscoll M , Corner J, Bailey C. Опыт одышки при раке легких.Eur J Cancer Care1999; 8: 37–43.
- ↵
Coebergh JW , Janssen-Heijnen ML, Post PN, и др. . Серьезная сопутствующая патология среди неизбираемых онкологических больных, впервые диагностированная в юго-восточной части Нидерландов в 1993–1996 гг. J Clin Epidemiol1999; 52: 1131–6.
- ↵
Janssen-Heijnen ML , Schipper RM, Razenberg PP, и др. . Распространенность сопутствующих заболеваний у пациентов с раком легких и ее связь с лечением: популяционное исследование.Рак легкого 1998; 21: 105–13.
- ↵
Куришима К. , Сато Х., Исикава Х., и др. . Рак легких у пациентов среднего возраста. Онкол Rep2001; 8: 851–3.
- ↵
Earle CC , Venditti LN, Neumann PJ, и др. . Кто получает химиотерапию при метастатическом раке легких? Chest2000; 117: 1239–46.
- ↵
Куришима К. , Сато Х., Исикава Х., и др. .Больные раком легких с хронической обструктивной болезнью легких. Онкол Rep2001; 8: 63–5.
- ↵
Куришима К. , Сато Х., Исикава Х., и др. . Больные раком легких с сердечно- и цереброваскулярными заболеваниями. Онкол Rep2001; 8: 1251–3.
- ↵
Connolly CK , Crawford SM, Rider PL, и др. . Карцинома бронхов в Йоркшире, Англия, 1976–1990 годы: тенденции с 1984 года.Eur Respir J1997; 10: 397–403.
- ↵
Muers MF , круглый CE. Смягчение симптомов немелкоклеточного рака легкого: исследование торакальной группы Йоркширской региональной онкологической организации. Thorax1993; 48: 339–43.
- ↵
Radzikowska E , Roszkowski K, Glaz P. Рак легких у пациентов младше 50 лет. Рак легких, 2001; 33: 203–11.
- ↵
Депперманн КМ .Влияние возраста и сопутствующих заболеваний на химиотерапевтическое лечение рака легких. Рак легких, 2001; 33 (Дополнение 1): S115–20.
- ↵
Британское торакальное общество . Рекомендации BTS по диагностической гибкой бронхоскопии. Thorax2001; 56 (Приложение 1): i1–21.
- ↵
Lechtzin N , Rubin HR, Jenckes M, et al . Предикторы контроля боли у пациентов, подвергающихся гибкой бронхоскопии.Am J Respir Crit Care Med2000; 162: 440–5.
- ↵
Knox AJ , Mascie-Taylor BH, Page RL. Фиброоптическая бронхоскопия у пожилых: опыт 4-х лет. Br J Dis Chest 1988; 82: 290–3.
- ↵
Macfarlane JT , Сторр A, Wart MJ, и др. . Безопасность, полезность и приемлемость фибробронхоскопии у пожилых людей. Возраст Ageing 1981; 10: 127–31.
- ↵
Hehn B , Haponik EF.Гибкая бронхоскопия у пожилых людей. Clin Chest Med, 2001; 22: 301–9, viii.
- ↵
Peacock M , Johnson J, Blanton H. Осложнения гибкой бронхоскопии у пациентов с тяжелой обструктивной болезнью легких. J Bronchol1994; 1: 181–6.
- ↵
Pue CA , Pacht ER. Осложнения фибробронхоскопии в университетской больнице. Chest1995; 107: 430–2.
- ↵
Dennie CJ , Matzinger FR, Marriner JR, и др. .Трансторакальная пункционная биопсия легкого: результаты ранней выписки у 506 амбулаторных больных. Радиология, 2001; 219: 247–51.
- ↵
Старосельский А.Н. , Шварц Ю., Ман А, и др. . Дополнительная информация, полученная при чрескожной биопсии с помощью тонкоигольной пункции при диагностике поражений грудной клетки. Chest1998; 113: 1522–5.
- ↵
Greif J , Staroselsky AN, Gernjac M, et al .Чрескожная игольчатая биопсия в диагностике опухолей средостения. Рак легких, 1999; 25: 169–73.
- ↵
Wiersema MJ , Vazquez-Sequeiros E, Wiersema LM. Оценка лимфаденопатии средостения с помощью эндоскопической тонкоигольной аспирационной биопсии под контролем УЗИ. Радиология, 2001; 219: 252–7.
- ↵
Brown TS , Kanthapillai P. Трансторакальная пункционная биопсия при подозрении на злокачественное новообразование грудной клетки у пожилых пациентов с использованием компьютерной томографии.Clin Radiol 1998; 53: 116–9.
- ↵
Hicks RJ , Kalff V, MacManus MP, и др. . (18) ПЭТ с F-FDG обеспечивает высокоэффективную и мощную прогностическую стратификацию при постановке недавно диагностированного немелкоклеточного рака легкого. Журнал Nucl Med, 2001; 42: 1596–604.
- ↵
MacManus MP , Hicks RJ, Matthews JP, и др. . Высокий уровень выявления у домашних животных неожиданных отдаленных метастазов при очевидном немелкоклеточном раке легкого III стадии: значение для радикальной лучевой терапии.Int J Radiat Oncol Biol Phys2001; 50: 287–93.
- ↵
Pieterman RM , van Putten JW, Meuzelaar JJ, и др. . Предоперационная стадия немелкоклеточного рака легкого с помощью позитронно-эмиссионной томографии. N Engl J Med2000; 343: 254–61.
- ↵
MacManus MP , Hicks RJ, Ball DL, и др. . Постановка позитронно-эмиссионной томографии с фтордезоксиглюкозой F-18 у кандидатов на радикальную лучевую терапию с немелкоклеточной карциномой легких: сильная корреляция с выживаемостью и большое влияние на лечение.Рак, 2001; 92: 886–95.
- ↵
Канадская группа онкологии легких . Изучение внегрудных метастазов у пациентов с явно операбельным раком легкого. Ann Thorac Surg, 2001; 71: 425–33; обсуждение 433–4.
- ↵
Британское торакальное общество . Методические рекомендации по отбору больных раком легкого для операции. Thorax2001; 56: 89–108.
- ↵
de Perrot M , Licker M, Reymond MA, и др. .Влияние возраста на операционную смертность и долгосрочную выживаемость после резекции легкого по поводу бронхогенной карциномы. Eur Respir J1999; 14: 419–22.
- ↵
Pagni S , McKelvey A, Riordan C, и др. . Легочная резекция при злокачественных новообразованиях у пожилых людей: возраст по-прежнему является фактором риска? Eur J Cardiothorac Surg 1998; 14: 40–4; обсуждение 44–5.
- ↵
Jazieh AR , Hussain M, Howington JA, и др. .Факторы прогноза у пациентов с немелкоклеточным раком легкого I и II стадии хирургического удаления. Энн Торак Сург 2000; 70: 1168–71.
Riquet M , Medioni J, Manac’h D, et al . Немелкоклеточный рак легкого: хирургические тенденции в зависимости от возраста (на французском языке). Ред. Мал Респир, 2001; 18: 173–84.
- ↵
Filippetti M , Crucitti G, Andreetti C, и др. .10-летний опыт хирургического лечения рака легких у пожилых пациентов (на итальянском языке). Чир Итал 2001; 53: 167–74.
- ↵
Thomas P , Piraux M, Jacques LF, et al . Клинические закономерности и тенденции исходов у пожилых пациентов с бронхогенной карциномой. Eur J Cardiothorac Surg 1998; 13: 266–74.
- ↵
Oliaro A , Leo F, Filosso PL, и др. .Резекция бронхогенной карциномы у пожилых людей. J. Cardiovasc Surg (Турин) 1999; 40: 715–9.
- ↵
Bouchardy C , Fioretta G, Perrot MD, и др. . Детерминант долгосрочной выживаемости после операции по поводу рака легкого: популяционное исследование. Cancer1999; 86: 2229–37.
- ↵
Zhang D , Zhang R, Cheng G. Хирургическое лечение рака легких: ретроспективный анализ случаев 2004 года.Chin Med J (англ.) 1999; 112: 25–8.
- ↵
Licker M , Spiliopoulos A, Frey JG, и др. . Ведение и исход пациентов, перенесших торакальные операции в областном медицинском центре грудной клетки. Eur J Anaesthesiol, 2001; 18: 540–7.
- ↵
Alexiou C , Beggs D, Rogers ML, и др. . Пневмонэктомия при немелкоклеточном раке легкого: предикторы операционной смертности и выживаемости.Eur J Cardiothorac Surg, 2001; 20: 476–80.
- ↵
Бернар А , Дешам С., Аллен М.С., и др. . Пневмонэктомия при злокачественном заболевании: факторы, влияющие на раннюю заболеваемость и смертность. J. Thorac Cardiovasc Surg, 2001; 121: 1076–82.
- ↵
Au J , el-Oakley R, Cameron EW. Пневмонэктомия при бронхогенной карциноме у пожилых людей. Eur J Cardiothorac Surg, 1994; 8: 247–50.
- ↵
Osaki T , Oyama T, Takenoyama M, и др. . Результаты хирургического лечения первичного рака легких; временные тенденции выживаемости и клинико-патологические особенности (на японском языке). J Uoeh3001; 23: 277–83.
- ↵
Регистр торакальной хирургии Великобритании , 1994–96. Общество кардиоторакальных хирургов Великобритании и Ирландии.
- ↵
Roviaro G , Varoli F, Vergani C, и др. .Техники пневмонэктомии. Видеоассистированная торакальная хирургическая пневмонэктомия. Chest Surg Clin N Am1999; 9: 419–36, xi-xii.
- ↵
Roviaro G , Varoli F, Nucca O, и др. . Видеоторакоскопический доступ к первичной патологии средостения. Chest2000; 117: 1179–83.
- ↵
Roviaro GC , Varoli F, Rebuffat C, и др. . Видеоторакоскопическое оперативное вмешательство при раке легкого.Int Surg1996; 81: 252–4.
- ↵
Хименес М.Ф. . Проспективное исследование видеоассистированной торакоскопической хирургии при резекции легочных узелков: 209 случаев из Испанской исследовательской группы видеоассистированной торакальной хирургии. Eur J Cardiothorac Surg, 2001; 19: 562–5.
Lizza N , Eucher P, Haxhe JP, и др. . Торакоскопическая резекция легочных узелков после маркировки спиралей под компьютерной томографией.Энн Торак Сург, 2001; 71: 986–8.
- ↵
Okumura T , Kondo H, Suzuki K, и др. . Торакоскопическая хирургия с помощью рентгеноскопии после бронхоскопической маркировки бария под контролем компьютерной томографии. Энн Торак Сург, 2001; 71: 439–42.
- ↵
Solaini L , Prusciano F, Bagioni P, и др. . Большие резекции легкого в торакальной хирургии с помощью видеосъемки. Настоящий опыт.Eur J Cardiothorac Surg, 2001; 20: 437–42.
Сираиси Т. , Йошинага Ю., Йонеда С., и др. . Клиническая оценка лобэктомии VATS при раке легких (на японском языке). Киобу Гека 2000; 53: 4–7.
- ↵
McKenna RJ Jr , Wolf RK, Brenner M, и др. . Является ли лобэктомия с помощью торакальной видеосъемки адекватной операцией при раке? Энн Торак Сург 1998; 66: 1903–198.
- ↵
Roviaro G , Varoli F, Vergani, et al . Крупные резекции легких с помощью видеоторакоскопической хирургии (VATS): опыт Италии. Semin Thorac Cardiovasc Surg 1998; 10: 313–20.
- ↵
Ohbuchi T , Morikawa T, Takeuchi E, и др. . Лобэктомия: видеоассистированная торакальная хирургия по сравнению с заднебоковой торакотомией. Jpn J Thorac Cardiovasc Surg1998; 46: 519–22.
Sugiura H , Morikawa T, Kaji M, и др. . Долгосрочные преимущества для качества жизни после видеоассистированной торакоскопической лобэктомии у пациентов с раком легкого. Surg Laparosc Endosc Percutan Tech 2999; 9: 403–8.
- ↵
Nagahiro I , Andou A, Aoe M, и др. . Функция легких, послеоперационная боль и уровень цитокинов в сыворотке после лобэктомии: сравнение VATS и стандартной процедуры.Энн Торак Сург, 2001; 72: 362–5.
- ↵
Миками I , Коидзуми К., Танака С. Изменения в работе правого желудочка у пожилых пациентов, перенесших лобэктомию с использованием видео-ассистированной торакальной хирургии по поводу первичного рака легких. Jpn J Thorac Cardiovasc Surg, 2001; 49: 153–9.
- ↵
Takahashi N , Tsunematsu K, Sugawara H, и др. . Ограниченная торакотомия как хирургическое лечение рака легких: лобэктомия и лимфодиссекция с помощью кожного разреза 12 см (на японском языке).Киобу Гека, 2001; 54: 197–202.
- ↵
Инаока М. , Обама Т., Кавахарада Н. Видео-миниторакотомия по сравнению с традиционной заднебоковой торакотомией для выполнения лобэктомии карциномы легкого (на японском языке). Киобу Гека 2000; 53: 18–21.
- ↵
Yoshimura M , Tsubota N. Резекция клина при раке легкого (на японском языке). Ниппон Гека Гаккаи Засши 200; 102: 521–4.
- ↵
Sagawa M , Koike T, Sato M, и др. .Сегментэктомия при рентгенографически скрытой бронхогенной плоскоклеточной карциноме. Энн Торак Сург, 2001; 71: 1100–4.
- ↵
Yamato Y , Tsuchida M, Watanabe T, и др. . Первые результаты проспективного исследования ограниченной резекции бронхиолоальвеолярной аденокарциномы легкого. Энн Торак Сург, 2001; 71: 971–4.
- ↵
Korst RJ , Ginsberg RJ. Соответствующее хирургическое лечение операбельного немелкоклеточного рака легкого.World J Surg2001; 25: 184–8.
- ↵
Santambrogio L , Nosotti M, Baisi A, и др. . Легочная лобэктомия при раке легких: проспективное исследование для сравнения пациентов с объемом форсированного выдоха за 1 секунду, превышающим или менее 80% от прогнозируемого. Eur J Cardiothorac Surg, 2001; 20: 684–7.
- ↵
Hayashi K , Fukushima K, Sagara Y, et al . Хирургическое лечение больных раком легкого, осложненным тяжелой эмфиземой легких.Jpn J Thorac Cardiovasc Surg1999; 47: 583–7.
- ↵
Эдвардс JG , Дати DJ, Уоллер Д.А. Операция по уменьшению долевого объема: метод увеличения частоты резекции рака легкого у пациентов с эмфиземой. Thorax2001; 56: 791–5.
- ↵
Korst RJ , Ginsberg RJ, Ailawadi M, и др. . Лобэктомия улучшает дыхательную функцию у отдельных пациентов с тяжелой формой ХОБЛ.Энн Торак Сург 1998; 66: 898–902.
- ↵
Pagni S , Federico JA, Ponn RB. Резекция легкого при раке легкого у восьмидесятилетних детей. Ann Thorac Surg 1997; 63: 785–9.
Hanagiri T , Muranaka H, Hashimoto M, и др. . Результаты хирургического лечения рака легкого у восьмидесятилетних детей. Рак легких, 1999; 23: 129–33.
Кобаяши С. , Окада С., Хасуми Т., и др. .Долгосрочная выживаемость восьмидесятилетнего ребенка из группы низкого риска после клиновидной резекции в соответствии с VATS по поводу мелкоклеточного рака легкого: отчет о случае. Surg Today2000; 30: 286–90.
- ↵
Inoue N , Kosino T., Abe T. Случай, леченный торакоскопической резекцией клина по поводу рака легкого cT1N0M0, осложненного хронической обструктивной болезнью легких (ХОБЛ) и гипофункцией левого желудочка у восьмидесятилетнего ребенка. Киобу Гека, 2001; 54: 164–7.
- ↵
Британское торакальное общество / Общество кардиоторакальных хирургов Великобритании и Ирландии . Критический при оказании торакальной хирургии в Великобритании . Отчет совместной рабочей группы Британского торакального общества и Общества кардиоторакальных хирургов Великобритании и Ирландии, 2001 г.
- ↵
Куропатка M . Торакальная хирургия в критическом состоянии. BMJ2002; 324: 376–7.
- ↵
Роуэлл NP , Уильямс CJ. Радикальная лучевая терапия для немелкоклеточного рака легкого I / II стадии у пациентов, которые недостаточно подходят для операции или отказываются от нее (с медицинской точки зрения неоперабельны): систематический обзор.Thorax2001; 56: 628–38.
- ↵
Hayakawa K , Mitsuhashi N, Katano S, и др. . Высокодозная лучевая терапия для пожилых пациентов с неоперабельным или неоперабельным немелкоклеточным раком легкого. Рак легких, 2001; 32: 81–8.
- ↵
Langendijk JA , Aaronson NK, de Jong JM, et al . Проспективное исследование качества жизни до и после радикальной лучевой терапии немелкоклеточного рака легкого.Дж. Клин Онкол, 2001; 19: 2123–33.
- ↵
Gauden SJ , Tripcony L. Лечебное лечение немелкоклеточного рака легкого I стадии только с помощью лучевой терапии у пожилых людей. Рак легких, 2001; 32: 71–9.
- ↵
Йеллен SB , Cella DF, Leslie WT. Возраст и принятие клинических решений у онкологических больных. J Natl Cancer Inst, 1994; 86: 1766–70.
- ↵
Silvestri G , Pritchard R, Welch HG.Предпочтения химиотерапии у пациентов с распространенным немелкоклеточным раком легкого: описательное исследование, основанное на интервью по сценарию. BMJ1998; 317: 771–5.
- ↵
Marino P , Preatoni A, Cantoni A. Рандомизированные испытания одной лучевой терапии в сравнении с комбинированной химиотерапией и лучевой терапией на стадиях IIIa и IIIb немелкоклеточного рака легкого. Метаанализ. Cancer1995; 76: 593–601.
- ↵
Совместная группа по немелкоклеточному раку легких .Химиотерапия при немелкоклеточном раке легкого: метаанализ с использованием обновленных данных об отдельных пациентах из 52 рандомизированных клинических испытаний. BMJ1995; 311: 899–909.
- ↵
Sim S , Rosenzweig KE, Schindelheim R, et al . Индукционная химиотерапия плюс трехмерная конформная лучевая терапия в окончательном лечении местнораспространенного немелкоклеточного рака легкого. Int J Radiat Oncol Biol Phys2001; 51: 660–5.
- ↵
Furuse K , Fukuoka M, Kawahara M, и др. .Исследование фазы III одновременной и последовательной лучевой терапии грудной клетки в сочетании с митомицином, виндезином и цисплатином при неоперабельном немелкоклеточном раке легкого III стадии. J Clin Oncol1999; 17: 2692–9.
Movsas B , Scott C, Curran W, и др. . Качественно скорректированное время без симптомов токсикологического анализа онкологической группы лучевой терапии 94-10 (аннотация 1247). Proc Am Soc Clin Oncol 2001; 20: 313a.
- ↵
Curran W , Scott C, Langer C, и др. .Сравнение фазы III последовательного и одновременного химиолучевого лечения пациентов с нерезецированным немелкоклеточным раком легкого III стадии (аннотация 1891). Proc Am Soc Clin Oncol2000; 19: 484a.
- ↵
Гаспар ЛЭ . Оптимизация подходов к химиолучевой терапии при неоперабельном немелкоклеточном раке легкого III стадии. Curr Opin Oncol2001; 13: 110–5.
- ↵
Jeremic B , Shibamoto Y.Факторы прогноза до лечения у пациентов с немелкоклеточным раком легкого III стадии, получавших гиперфракционированную лучевую терапию с сопутствующей химиотерапией или без нее. Рак легких, 1995; 13: 21–30.
- ↵
Каллен М.Х. , Биллингем Л.Дж., Вудрофф К.М., и др. . Митомицин, ифосфамид и цисплатин при неоперабельном немелкоклеточном раке легкого: влияние на выживаемость и качество жизни. J Clin Oncol1999; 17: 3188–94.
- ↵
Earle CC , Tsai JS, Gelber RD, и др. .Эффективность химиотерапии при распространенном раке легких у пожилых людей: анализ инструментальных переменных и предрасположенности. Дж. Клин Онкол, 2001; 19: 1064–70.
- ↵
Roszkowski K , Pluzanska A, Krzakowski M, et al . Многоцентровое рандомизированное исследование фазы III доцетаксела в сочетании с наилучшей поддерживающей терапией по сравнению с наилучшей поддерживающей терапией у не получавших химиотерапию пациентов с метастатическим или неоперабельным локализованным немелкоклеточным раком легкого (НМРЛ).Рак легких 2000; 27: 145–57.
- ↵
Итальянская группа по изучению винорелбина по раку легких у пожилых людей . Влияние винорелбина на качество жизни и выживаемость пожилых пациентов с распространенным немелкоклеточным раком легкого. J Natl Cancer Inst, 1999; 91: 66–72.
- ↵
Yokoyama A , Furuse K, Kurita Y, et al . Гемцитабин в качестве единственного средства в лечении пациентов пожилого возраста (> 70 лет) с НМРЛ III-IV стадии по сравнению с пациентами <70 лет (аннотация 2056).Proc Am Soc Clin Oncol2000; 19: 523a.
- ↵
Martoni A , Fabio FD, Guaraldi M, и др. . Гемцитабин как единственное средство в лечении пожилых пациентов с НМРЛ IIIb-IV стадии: предварительные результаты итальянского многоцентрового исследования (аннотация, 1991 г.). Proc Am Soc Clin Oncol1999; 18: 517a.
- ↵
Ricci S , Antouzzo A, Galli L, и др. . Монотерапия гемцитабином у пожилых пациентов с далеко зашедшим немелкоклеточным раком легкого.Многоцентровое исследование фазы II. Рак легких 2000; 27: 75–80.
- ↵
Shepherd F , Abratt R, Anderson H. Гемцитабин в лечении пожилых пациентов с распространенным НМРЛ. Семин Онкол 1997; 24 (Дополнение 7): 50–5.
- ↵
Frasci G , Lorusso V, Panza N, и др. . Гемцитабин плюс винорелбин по сравнению с одним винорелбином у пожилых пациентов с далеко зашедшим немелкоклеточным раком легкого.Дж. Клин Онкол 2000; 18: 2529–36.
- ↵
Gridelli C , Cigolari S, Bilancia D. Исследование фазы II гемцитабина и гемцитабина плюс винорелбин у пожилых пациентов с запущенным НМРЛ в рамках рандомизированного исследования фазы III MILES (аннотация 2092). Proc Am Soc Clin Oncol2000; 19: 532a.
- ↵
Gridelli C , Perrone P, Cigolari S, и др. . Исследование фазы III MILES: гемцитабин плюс винорелбин в сравнении с винорелбином и гемцитабином у пожилых пациентов с запущенным НМРЛ (аннотация 1230).Proc Am Soc Clin Oncol 2001; 20: 308a.
- ↵
Nguyen B , Sandler A, Denham C. Безопасность и эффективность гемцитабина плюс цисплатин у пожилых пациентов с хемонацином НМРЛ (возраст> 70 лет) по сравнению с пациентами в возрасте <70 лет. Proc Am Soc Clin Oncol1999; 18: 471a.
- ↵
Lippe P , Silva R, Monterubbianesi M, и др. . Распространенный НМРЛ у пожилых: облегчение симптомов после еженедельного приема гемцитабина и цисплатина (аннотация, 1984).Proc Am Soc Clin Oncol1999; 18: 514a.
- ↵
Фелиу Дж. , Мартин Г., Родригес-Хараис М., и др. . Фаза II исследования низких доз цисплатина плюс гемцитабина у пожилых пациентов с распространенным НМРЛ. Предварительные результаты (аннотация 2763). Proc Am Soc Clin Oncol 2001; 20: 253b.
- ↵
Maestu I , Torregrossa D, Llorca C, и др. . Эффективность карбоплатина и гемцитабина в лечении пожилых пациентов с распространенным НМРЛ (аннотация 1599).Proc Am Soc Clin Oncol 2001; 20: 401a.
- ↵
Мартинс С. , Перейра Дж., Икари Ф., и др. . Химиотерапия цисплатином и винорелбином у пожилых пациентов с НМРЛ (аннотация 1804). Proc Am Soc Clin Oncol1999; 18: 468a.
- ↵
Hainsworth JD , Burris HA 3rd, Greco FA. Еженедельное введение доцетаксела в качестве единственного средства и в комбинации с гемцитабином у пожилых людей и пациентов с плохой работоспособностью с распространенным немелкоклеточным раком легкого.Семин Онкол 2001; 28 (3 Прил. 9): 21–5.
- ↵
Фидиас П. , Супко Дж., Мартинс Р., и др. . Исследование фазы II еженедельного введения паклитаксела у пожилых пациентов с распространенным немелкоклеточным раком легкого. Clin Cancer Res2001; 7: 3942–9.
- ↵
Коннолли СК , Джонс WG, Торогуд Дж., и др. . Исследование, лечение и прогноз рака бронхов в Йоркшире, Англия, 1976–1983 гг.Br J Cancer1990; 61: 579–83.
Янне П. , Фридлин Б., Саксман С., и др. . Выживаемость пациентов, получавших лечение от мелкоклеточного рака легкого на ограниченной стадии, в Северной Америке увеличилась за последние 20 лет (аннотация 1264). Proc Am Soc Clin Oncol 2001; 20: 317a.
- ↵
Lebitasy MP , Hedelin G, Purohit A, и др. . Прогресс в лечении и исходе мелкоклеточного рака легкого во французском регионе с 1981 по 1994 год.Br J Cancer 2001; 85: 808–15.
- ↵
Лагеря C , Artal A, Gomez-Codina J, et al . Возраст как прогностический фактор при мелкоклеточном раке легкого: рандомизированное испытание высоких доз эпирубицин-цисплатина по сравнению с цисплатин-этопозидом при SCLC. Ретроспективный анализ (аннотация 2871). Proc Am Soc Clin Oncol 2001; 20: 280b.
- ↵
Albain KS , Crowley JJ, LeBlanc M, и др. .Детерминанты улучшенного исхода при мелкоклеточном раке легкого: анализ базы данных Юго-Западной онкологической группы с участием 2580 пациентов. J Clin Oncol1990; 8: 1563–74.
- ↵
Remiszewski P , Slodkowska J, Wiatr E, et al . Смертельная инфекция у пациентов, леченных от мелкоклеточного рака легких в Институте туберкулеза и болезней грудной клетки в 1980–1994 гг. Рак легких, 2001; 31: 101–10.
- ↵
Oshita F , Yamada K, Nomura I, et al .Рандомизированное исследование модификации дозы или режима гранулоцитарного колониестимулирующего фактора в химиотерапии на основе платины для пожилых пациентов с раком легких. Онкол Rep2001; 8: 861–6.
- ↵
Tjan-Heijnen VC , Postmus PE, Ardizzoni A, и др. . Уменьшение фебрильной лейкопении, вызванной химиотерапией, с помощью профилактического применения ципрофлоксацина и рокситромицина у пациентов с мелкоклеточным раком легкого: двойное слепое плацебо-контролируемое исследование III фазы EORTC.Энн Онкол, 2001; 12: 1359–68.
- ↵
Jeremic B , Shibamoto Y, Acimovic L, и др. . Карбоплатин, этопозид и ускоренная гиперфракционная лучевая терапия для пожилых пациентов с ограниченной мелкоклеточной карциномой легкого: исследование фазы II. Cancer1998; 82: 836–41.
- ↵
Westeel V , Murray N, Gelmon K, и др. . Новая комбинация старых препаратов для пожилых пациентов с мелкоклеточным раком легкого: исследование фазы II режима PAVE.J Clin Oncol1998; 16: 1940–7.
- ↵
Turrisi AT , Ким К., Блюм Р., и др. . Дважды в день по сравнению с торакальной лучевой терапией один раз в день при ограниченном мелкоклеточном раке легкого, леченном одновременно с цисплатином и этопозидом. N Engl J Med1999; 340: 265–71.
- ↵
Yuen AR , Zou G, Turrisi AT, и др. . Аналогичный результат у пожилых пациентов в межгрупповом исследовании 0096: цисплатин, этопозид и торакальная лучевая терапия назначались один или два раза в день при ограниченной стадии мелкоклеточной карциномы легкого.Cancer2000; 89: 1953–60.
- ↵
Pujol JL , Daures JP, Riviere A, и др. . Этопозид плюс цисплатин с комбинацией 4′-эпидоксорубицина и циклофосфамида или без нее при лечении обширного мелкоклеточного рака легкого: многоцентровое рандомизированное исследование фазы III Французской федерации онкологических институтов. J Natl Cancer Inst, 2001; 93: 300–8.
- ↵
Мацуи К. , Масуда Н., Фукуока М., и др. .Фаза II исследования карбоплатина плюс пероральный этопозид у пожилых пациентов с мелкоклеточным раком легкого. Br J Cancer1998; 77: 1961–5.
Grunberg SM , Crowley J, Hande KR, и др. . Лечение мелкоклеточного рака легких с обширным заболеванием с плохим прогнозом пероральным режимом приема этопозида и циклофосфамида: клиническое и фармакокинетическое исследование Юго-Западной онкологической группы. Cancer Chemother Pharmacol1999; 44: 461–8.
Белый SC , Лориган П., Миддлтон MR, и др. .Рандомизированное исследование фазы II циклофосфамида, доксорубицина и винкристина по сравнению с монотерапией карбоплатином у пациентов с мелкоклеточной карциномой легких с плохим прогнозом. Рак, 2001; 92: 601–8.
- ↵
Hickish TF , Smith IE, Nicolson MC, и др. . Пилотное исследование химиотерапии MVP (митомицин-C, винбластин и цисплатин) при мелкоклеточном раке легкого. Br J Cancer1998; 77: 1966–70.
- ↵
Noda K , Nishiwaki Y, Kawahara M, и др. .Иринотекан плюс цисплатин в сравнении с этопозидом плюс цисплатином при обширном мелкоклеточном раке легкого. N Engl J Med2002; 346: 85–91.
- ↵
Стил JP . Гемцитабин / карбоплатин в сравнении с цисплатином / этопозидом для пациентов с мелкоклеточным раком легкого с плохим прогнозом: рандомизированное исследование фазы III с оценкой качества жизни. Семин Онкол2001; 28 (3 Дополнение 10): 15–8.
Marinis FD , Cortesi E, Pauluzzi L, и др. .Цисплатин, этопозид и гемцитабин у нелеченных пациентов с мелкоклеточным раком легкого: предварительные результаты мультиинституционального исследования фазы II (аннотация 2062). Proc Am Soc Clin Oncol2000; 19: 525a.
Данлоп Д. , Коннери Л., О’Брайен М., и др. . Фаза II исследования карбоплатина (AUC5) и винорелбина при мелкоклеточном раке легкого (аннотация 2033). Proc Am Soc Clin Oncol2000; 19: 519a.
- ↵
Mok T , Chan A, Leung T, et al .Последовательное введение топотекана и перорального этопозида при лечении мелкоклеточного рака легкого (аннотация 2018). Proc Am Soc Clin Oncol2000; 19: 515a.
- ↵
Cerny T , Blair V, Anderson H, et al . Факторы прогноза до лечения и система баллов у 407 пациентов с мелкоклеточным раком легкого. Int J Cancer1987; 39: 146–9.
- ↵
Грегор А. , Калл А., Стивенс Р. Дж., и др. .Профилактическое краниальное облучение показано после полного ответа на индукционную терапию при мелкоклеточном раке легкого: результаты многоцентрового рандомизированного исследования. Координационный комитет Соединенного Королевства по исследованию рака (UKCCCR) и Европейская организация по исследованию и лечению рака (EORTC). Eur J Cancer 1997; 33: 1752–8.
- ↵
Auperin A , Arriagada R, Pignon JP, и др. . Профилактическое краниальное облучение пациентов с мелкоклеточным раком легкого в полной ремиссии.Совместная группа по обзору профилактического облучения черепа. N Engl J Med1999; 341: 476–84.
- ↵
Pignon JP , Arriagada R, Ihde DC, и др. . Метаанализ торакальной лучевой терапии мелкоклеточного рака легкого. N Engl J Med1992; 327: 1618–24.
- ↵
Warde P , Payne D. Улучшает ли грудное облучение выживаемость и местный контроль при мелкоклеточном раке легкого на ограниченной стадии? Метаанализ.Дж. Клин Онкол, 1992; 10: 890–5.
- ↵
Quon H , Shepherd FA, Payne DG, и др. . Влияние возраста на доставку, переносимость и эффективность грудного облучения в комбинированном методе лечения мелкоклеточного рака легкого на ограниченной стадии. Int J Radiat Oncol Biol Phys1999; 43: 39–45.
- ↵
Мюррей Н. , Кой П., Патер Дж. Л., и др. . Важность выбора времени для облучения грудной клетки в комбинированном методе лечения мелкоклеточного рака легкого на ограниченной стадии.Группа клинических испытаний Национального института рака Канады. Дж. Клин Онкол, 1993; 11: 336–44.
Jeremic B , Shibamoto Y, Acimovic L, и др. . Сравнение начальной и отсроченной ускоренной гиперфракционированной лучевой терапии и одновременной химиотерапии при ограниченном мелкоклеточном раке легкого: рандомизированное исследование. Дж. Клин Онкол, 1997; 15: 893–900.
- ↵
Tsukada H , Yokoyama A, Goto K, и др. .Параллельная и последовательная лучевая терапия мелкоклеточного рака легкого. Семин Онкол 2001; 28 (2 Дополнение 4): 23–6.
- ↵
Perry MC , Eaton WL, Propert KJ, и др. . Химиотерапия с лучевой терапией или без нее при ограниченной мелкоклеточной карциноме легкого. N Engl J Med1987; 316: 912–8.
- ↵
Perry MC , Herndon 3rd JE, Eaton WL, и др. . Лучевая терапия грудной клетки добавлена к химиотерапии мелкоклеточного рака легких: обновление исследования 8083 группы B по раку и лейкемии.J Clin Oncol1998; 16: 2466–7.
- ↵
Работа E , Nielsen OS, Bentzen SM, и др. . Рандомизированное исследование первичного и позднего облучения грудной клетки в сочетании с химиотерапией при мелкоклеточном раке легкого на ограниченной стадии. Орхусская группа рака легких. Дж. Клин Онкол, 1997; 15: 3030–7.
- ↵
Мюррей Н. , Графтон С., Шах А., и др. . Сокращенное лечение для пожилых, немощных или неподходящих пациентов с мелкоклеточным раком легкого на ограниченной стадии.Дж. Клин Онкол, 1998; 16: 3323–8.
- ↵
Rea F , Callegaro D, Favaretto A, и др. . Отдаленные результаты хирургического вмешательства и химиотерапии при мелкоклеточном раке легкого. Eur J Cardiothorac Surg 1998; 14: 398–402.
- ↵
Turrisi AT , Sherman CA. Лечение ограниченного мелкоклеточного рака легкого. отчет о достигнутом прогрессе и перспективах на будущее. Eur J Cancer, 2002; 38: 279–91.
- ↵
Massard G , Moog R, Wihlm JM, и др. . Бронхогенный рак у пожилых людей: операционный риск и долгосрочный прогноз. Thorac Cardiovasc Surg 1996; 44: 40–5.
- ↵
Джорджио А , Арноне Д., Казали Г., и др. . Хирургическое иссечение новообразований легких у пожилых людей. Минерва Чир 1994; 49: 917–27.
- ↵
Roxburgh JC , Thompson J, Goldstraw P.Госпитальная летальность и отдаленная выживаемость после резекции легкого у пожилых людей. Энн Торак Сург, 1991; 51: 800–3.
- ↵
Rapp E , Pater JL, Willan A, и др. . Химиотерапия может продлить выживаемость пациентов с далеко зашедшим немелкоклеточным раком легкого: отчет канадского многоцентрового рандомизированного исследования. Дж. Клин Онкол, 1988; 6: 633–41.
- ↵
Ganz PA , Figlin RA, Haskell CM, и др. .Поддерживающая терапия по сравнению с поддерживающей терапией и комбинированной химиотерапией при метастатическом немелкоклеточном раке легкого. Имеет ли значение химиотерапия? Рак 1989; 63: 1271–8.
- ↵
Helsing M , Bergman B, Thaning L, и др. . Качество жизни и выживаемость у пациентов с распространенным немелкоклеточным раком легкого, получающих поддерживающую терапию плюс химиотерапию карбоплатином и этопозидом или только поддерживающую терапию. Многоцентровое рандомизированное исследование III фазы.Совместная группа по изучению рака легких. Eur J Cancer1998; 34: 1036–44.
- ↵
Thongprasert S , Sanguanmitra P, Juthapan W, и др. . Взаимосвязь между качеством жизни и клиническими исходами при распространенном немелкоклеточном раке легкого: лучшая поддерживающая терапия (BSC) по сравнению с BSC плюс химиотерапия. Рак легких, 1999; 24: 17–24.
- ↵
Рэнсон М. , Дэвидсон Н., Николсон М., и др. .Рандомизированное исследование паклитаксела в сочетании с поддерживающей терапией и поддерживающей терапией для пациентов с распространенным немелкоклеточным раком легкого. J Natl Cancer Inst2000; 92: 1074–80.
- ↵
Shepherd FA , Дэнси Дж., Рамлау Р., и др. . Проспективное рандомизированное исследование доцетаксела по сравнению с наилучшей поддерживающей терапией у пациентов с немелкоклеточным раком легкого, ранее получавших химиотерапию на основе платины. Дж. Клин Онкол 2000; 18: 2095–103.
- ↵
Андерсон Х. , Хопвуд Р., Стивенс Дж., и др. .Гемцитабин плюс лучшая поддерживающая терапия (BSC) по сравнению с BSC при неоперабельном немелкоклеточном раке легкого: рандомизированное испытание с качеством жизни в качестве основного результата. UK NSCLC Gemcitabine Group. Немелкоклеточный рак легкого. Br J Cancer2000; 83: 447–53.
- ↵
Bianco V , Di Girolamo B, Pignatelli E, и др. . Гемцитабин в качестве монотерапевтического средства при запущенном немелкоклеточном раке легкого и повышении качества жизни пожилых людей. Panminerva Med2001; 43: 15–9.
- ↵
Манегольд С . Лечение пациентов пожилого возраста с немелкоклеточным раком легкого. Онкология, 2001; 15 (3 приложение 6): 46–51.
Возраст является прогностическим фактором, влияющим на выживаемость больных раком легкого
Введение
В настоящее время рак легких представляет собой серьезную проблему для здоровья. В
в США было зарегистрировано 222 500 новых случаев рака легких.
диагностировано и 157 300 смертей произошло из-за болезни в
2010 (1).Рак легких — самый
распространенный смертельный рак у мужчин и женщин, и прогнозируется
составляют 29% (86220) всех мужчин и 26% (71 080) всех женщин
смертность от рака (1). Это
превзошла рак груди как ведущую причину связанных с раком
смертность женщин в 1987 году. Кроме того, данные показывают, что это
является вторым по распространенности раком у мужчин и женщин.
Прогноз рака легких остается плохим. До 85%
больных диагностируются на запущенной стадии. Несмотря на все усилия
при лечении прогноз больных раком легкого неудовлетворительный,
со средней выживаемостью ~ 1 год и 5-летней выживаемостью
всего 16% (1).Безоперационный
варианты лечения, включая химиотерапию или таргетную терапию, имеют
были исследованы, чтобы определить, продлевают ли они общий
выживаемость пациентов с распространенным раком легких. Из-за умеренного
прогресс обеспечен химиотерапевтическими препаратами, исследования изучили
можно ли выделить подгруппы пациентов, чтобы определить, кто
больше всего выиграют от конкретных лечебных стратегий (2). Это может привести к улучшению
отбор пациентов с плохим прогнозом для лечения только
поддерживающая терапия и может избежать ненужных побочных эффектов и
осложнения системной химиотерапии.Некоторые прогностические факторы
предсказывают выживаемость пациентов с раком легких. Хорошо
прогностические факторы включают раннюю стадию заболевания на момент постановки диагноза, хорошо
статус работоспособности (PS), нет значительной потери веса (не> 5%)
и женский пол (2). Мутации
ген супрессора опухолей р53, активация протоонкогена
K-ras и другие биологические маркеры могут иметь большое значение в
прогнозирование плохого прогноза (3,4).
Руководство Национальной комплексной онкологической сети (версия 2011 г.)
указать, что возраст пациентов в дополнение к гистологическому
подтип имеет прогностическое значение.
Рак — одна из пяти основных причин
смертность во всех возрастных группах среди мужчин и женщин; это
ведущая причина смертности мужчин и женщин в возрасте 40–79 лет
(1). Среди мужчин в возрасте ≥40 лет
рак легкого — самый распространенный рак со смертельным исходом. Однако среди
у женщин рак легких занимает первое место у лиц в возрасте ≥60 лет.
Поэтому рак легких воспринимается как заболевание пожилых людей.
население (5,6). Заболеваемость раком легких увеличивается
с возрастом, причем 60% пациентов старше 65 лет.Поскольку
гериатрическое население увеличивается в мире, рак легких продолжается
быть важной проблемой общественного здравоохранения сегодня и в будущем.
Возраст признан прогностическим фактором в
множественные виды рака, леченные с определенным намерением. В дополнение к
многочисленные переменные, которые считаются значимыми
прогностические факторы рака легких, несколько исследований
продемонстрировали, что возраст является важным независимым прогностическим фактором
влияющие на выживаемость пациентов (5–7).
Более того, пожилым пациентам обычно помогают однократные и
комбинированные схемы химиотерапии.Данные о раке легких у пожилых людей
пациенты и важность возраста для выживаемости при раке легких
пациенты ограничены. В настоящем исследовании мы стремились выявить
и оценить известные клинико-патологические факторы и выяснить
Клиническое значение возраста пациента для исхода заболевания легких
рак.
Пациенты и методы
Пациенты
Это исследование включало 110 последовательных пациентов.
поступил в Институт онкологии Стамбульского университета.
(Турция) с гистологически или цитологически подтвержденными немалыми
клеточный рак легкого (NSCLC) и мелкоклеточный рак легкого (SCLC), которые были
лечились и наблюдались в нашей клинике; данные были записаны с
медицинские карты.Пациенты с болезнью, поддающейся двумерному измерению
без истории химио- или лучевой терапии в течение последних шести месяцев
были включены в исследование. Стадия пациентов с метастазами была
выполняется с использованием различных методов визуализации, включая компьютерные
томография (КТ), магнитно-резонансная томография и позитронная эмиссия
томография / КТ. Установлен патологический диагноз рака легких.
создан в соответствии с пересмотренным документом World Health
Организационная классификация опухолей легкого (8) и стадия согласно уточненной
TNM стадия рака легких (9).Это исследование было одобрено этическим комитетом Института
Онкология, Стамбульский университет. Письменное информированное согласие было
полученные от пациентов.
Лечение
Предварительная оценка включала подробную
история болезни и медицинский осмотр с серией
биохимические тесты и полный анализ крови. Те, у кого
Восточная кооперативная онкологическая группа PS ≤2 и соответствующая кровь
химиотерапия проходила химиотерапию амбулаторно
содержащие соединения платины с лучевой терапией или без нее,
в зависимости от стадии заболевания.Пациенты получали лечение
различные схемы химиотерапии в виде одного агента или комбинации
терапия. Схемы однократной или комбинированной химиотерапии были
выбирается на основе PS пациентов и распространенности болезни. Препарат, средство, медикамент
схемы состояли из платиновых агентов в сочетании с более новыми
цитотоксические препараты, включая паклитаксел, доцетаксел, гемцитабин и
винорелбин.
Был оценен ответ на химиотерапию
рентгенологически после двух-трех курсов химиотерапии
согласно международным критериям, пересмотренный ответ
Критерии оценки в рекомендациях по солидным опухолям (версия 1.1).
Пациенты, не ответившие на химиотерапию, и пациенты с рецидивом получали лечение
с химиотерапией второй линии, если у них был хороший PS. Химиотерапия
продолжали до прогрессирования заболевания или до неприемлемой токсичности.
Программы последующего наблюдения состояли из клинических, лабораторных и
радиологические оценки выполняются с 8-недельными интервалами во время
химиотерапия или каждые 12 недель для пациентов, не получающих противоопухолевые препараты
лечение.
Статистический анализ
Непрерывные переменные классифицированы с использованием медианы
значения в качестве точки отсечения.Оценка корреляций и
сравнения между различными клиническими / лабораторными параметрами были
выполнено с использованием U-критерия Манна-Уитни и критерия Краскела-Уоллиса для 2
и 3 группы соответственно. Выживаемость рассчитывалась с даты
первого поступления в больницу до смертности в результате любого
вызвать или продлить контакт с пациентом или любым членом семьи. В
Для оценки выживаемости использовался метод Каплана-Мейера.
распределение и различия в выживаемости оценивались
лог-ранговая статистика. Был проведен многомерный анализ выживаемости.
с использованием регрессионной модели пропорциональных рисков Кокса.P <0,05 было
считается, что это указывает на статистически значимое различие.
Статистический анализ проводился с использованием программы SPSS 16.0 (SPSS
Inc., Чикаго, Иллинойс, США).
Результаты
Демографические, лабораторные и клинико-патологические
особенности пациентов перечислены в таблице I. В этом ретроспективном исследовании мы
проанализировали исходы 110 пациентов с раком легких, которые были
лечились и наблюдались в нашей клинике. Было 100 (91%) мужчин
пациенты со средним возрастом 59 лет (диапазон 35–88 лет).В
у большинства пациентов был НМРЛ (84%), метастатическая стадия (56%)
и имели нормальный сывороточный гемоглобин (71%), лейкоциты (WBC; 77%),
уровни тромбоцитов (65%) и лактатдегидрогеназы (ЛДГ) (75%).
Более того, ответ на химиотерапию составил почти 50%.
Таблица I Характеристики пациента и |
Таблица I
Характеристики пациента и
распределения параметров по возрасту пациентов.
| Параметры | Все пациенты,% (n = 110) | <60 лет,% (n = 57) | ≥60 лет,% (n = 53) | P-значение |
|---|---|---|---|---|
| Пациенты | 100 | 52 | 48 | |
| Пол | 0,32 | |||
| 0,32 | ||||
| 91 Мужской | 88 | 94 | ||
| Женский | 9 | 12 | 6 | |
| Гистология | 0.19 | |||
| NSCLC | 84 | 81 | 89 | 0,26 |
| Адено | 30 | 25 | 36 | |
| Squamous | 26 | 950 | 26 | 9 |
| Другое (несекретно) | 28 | 33 | 23 | |
| SCLC | 16 | 19 | 11 | |
| Стадия болезнь | ||||
| NSCLC | 0.41 | |||
| Местное (этап I + II) | 6 | 4 | 11 | |
| Продвинутый локально (стадия III) | 33 | 44 | 34 | |
| Метастатическая (стадия IV) | 45 | 52 | 55 | |
| SCLC | 0,40 | |||
| Limited | 5 | 36 | 17 | 64 | 83 |
| Гемоглобин сыворотки уровень | 0.02 | |||
| Низкий (<11,9 г / дл) | 29 | 19 | 39 | |
| Нормальный (≥12 г / дл) | 71 | 81 | 61 | |
| Сыворотка WBC количество | 0,20 | |||
| Нормальный (<10,999) | 77 | 72 | 82 | |
| Повышенный (≥11,000) | 23 | 28 | 18 | |
| Тромбоциты сыворотки количество | 0.65 | |||
| Нормальный (<349,000) | 65 | 63 | 67 | |
| Повышенный (≥350,000) | 35 | 37 | 33 | |
| Эритроцит скорость осаждения (/ ч) | 0,14 | |||
| Нормальный (<40) | 45 | 38 | 53 | |
| Повышенный (≥41) | 55 | 62 | 47 | |
| Сыворотка ЛДГ уровень | 1.00 | |||
| Нормальный (<449 Ед / л) | 75 | 75 | 75 | |
| Повышенный (≥450 Ед / л) | 25 | 25 | 25 | |
| Ответ на химиотерапия | 0,01 | |||
| Да | 47 | 68 | 37 | |
| Нет | 53 | 32 | 63 | 0.01 |
| Живой | 72 | 83 | 60 | |
| Умерший | 28 | 17 | 40 | |
Распределение прогностических факторов по
возраст пациентов в целом был аналогичным (Таблица I). Однако процент
пациенты, ответившие на химиотерапию, были ниже у пожилых
пациентов (37 против 68%; P = 0,01). Точно так же процент
пациентов с анемией было выше у пожилых пациентов по сравнению с
более молодые пациенты (39 vs.19%; P = 0,02). Большинство
летальность наблюдалась у пожилых пациентов (40% против 17%; P = 0,01).
Среднее время наблюдения составило 20,3 недели (диапазон,
4,4–72,6 недель). На момент анализа 31 пациент (19,4%) имел
умер из-за связанных с заболеванием или не связанных факторов. Медиана
Время выживания пациентов составило 57 недель (95% ДИ, 45,6–68,3 недели).
Годовая выживаемость составила 55,1 ± 7,7%. В анализе подмножеств это
было выявлено, что 40% пожилых и 17% более молодых пациентов
поддался болезни.Среднее время выживания пожилых людей
пациенты (37,8 недель; 95% ДИ 11,6–64,0) были значительно ниже
чем у более молодых пациентов (57 недель; 95% ДИ 45,8–68,1)
(Р = 0,009). Годовая выживаемость у молодых и пожилых
больных составили 67,3 ± 11,3 и 42,5 ± 1,0% соответственно (рис. 1).
В одномерном анализе у пожилых пациентов
худшие результаты по сравнению с более молодыми пациентами (P = 0,009; Таблица II). Кроме того, более высокий уровень ЛДГ
(P = 0,001) и отсутствие ответа на химиотерапию (P <0.001) были
связано с более коротким временем выживания. В многомерном
Анализ показал, что у пожилых пациентов прогноз хуже (P = 0,023).
Таблица II Одномерный и многомерный анализ |
Таблица II
Одномерный и многомерный анализ
выживаемости и клинических и лабораторных показателей.
| Переменные | Одномерный анализ P-значение | Многовариантный анализ P-значение |
|---|---|---|
| Возраст (<60 vs.≥60 лет) | 0,009 | 0,023 |
| Пол (женский vs. самец) | 0,415 | 0,690 |
| Гистология (НМРЛ vs. SCLC) | 0,446 | 0,104 |
| Стадия заболевания (неметастатический или метастатический) | 0,109 | 0,053 |
| ЛДГ (<450 vs. ≥450 МЕ / л) | 0,001 | 0,263 |
| Гемоглобин (<12 vs.≥12 г / дл) | 0,412 | 0,158 |
| Лейкоцит (<11000 против ≥11000 / мм 3 ) | 0,829 | 0,023 |
| Тромбоциты (<350,000 по сравнению с ≥350,000 / мм 3 ) | 0,763 | 0,105 |
| Седиментация (<40 против ≥40 мм / ч) | 0,524 | 0,116 |
| Реакция на химиотерапия (да vs. нет) | <0,001 | 0.004 |
Таблица III
обобщает анализ связи между возрастом пациентов.
и различные клинические и лабораторные параметры. В младшем
группе пациентов анализы показали, что значительный
прогностические факторы, связанные с выживаемостью, были стадией заболевания
и сывороточные уровни ЛДГ. Пожилые пациенты с диагнозом SCLC имели
худший результат по сравнению с пациентами с НМРЛ (P = 0,009) и старше
пациенты с повышенным уровнем ЛДГ в сыворотке имели более короткое время выживания
по сравнению с показателями с нормальными значениями (P = 0.042).
Таблица III Оценка выживаемости пациентов |
Таблица III
Оценка выживаемости пациентов
проанализированы по возрасту.
| Возраст <60 лет | Возраст ≥60 лет | |||
|---|---|---|---|---|
| Переменные | Медианная ОС (недель) | Значение P | Медиана ОС (недель) | Значение P |
| Пол (женский vs.мужской) | 49,7 / 53,8 | 0,923 | 37,8 / 49,1 | 0,465 |
| Гистология (НМРЛ против SCLC) | 57,0 / NR | 0,848 | 49,1 / 7,2 | 0,009 |
| Подтип гистологии (аденокарцинома по сравнению с другими) | 49,7 / 57,0 | 0,850 | 62,1 / 30,8 | 0,072 |
| Стадия НМРЛ (неметастатический или метастатический) | 57,0 / 41,8 | 0.035 | 62,1 / 29,8 | 0,192 |
| LDH (<450 vs. ≥450 МЕ / л) | NR / 50,5 | 0,004 | 62,1 / 20,0 | 0,042 |
| Гемоглобин (<12 против ≥12 г / дл) | NR / 57,0 | 0,553 | NR / 37,8 | 0,689 |
| WBC (<11000 vs. ≥11000 / мм 3 ) | 57,0 / NR | 0,554 | 49,1 / 37,8 | 0.660 |
| Тромбоциты (<350,000 по сравнению с ≥350,000 / мм 3 ) | NR / 57,0 | 0,493 | 49,1 / NR | 0,230 |
| Седиментация (<40 против ≥40 мм / ч) | NR / NR | 0,560 | 62,1 / 20,1 | 0,226 |
| Ответ на химиотерапия (да или нет) | NR / 49,7 | 0,817 | NR / 20,1 | 0,378 |
Обсуждение
В связи с увеличением продолжительности жизни и увеличением
риск рака с возрастом, рак легких часто встречается у пожилых людей
лиц.Более половины случаев рака легких диагностируется в
пациенты в возрасте> 65 лет (5–7). В
средний возраст установления диагноза рака легких составляет от 64 до 70 лет.
(6,7). Возраст на момент постановки диагноза также зависит от
политика здравоохранения страны. Если пациенты пожилого возраста не получают
диагностические процедуры при подозрении на рак легких, медиана
возраст, вероятно, будет ниже, чем в стране, где пожилые пациенты
тщательно изучены. В опросе, проведенном на базе общественных больниц в
Франция, пациенты в возрасте ≥70 лет с патологически подтвержденным легким
рак составлял 32% из 5667 пациентов, зарегистрированных во время
2000 год и 18 пациентов старше 80 лет.1%
(10). И наоборот, в США
пациенты в возрасте> 65 лет составляли две трети от общего числа
количество случаев рака легких и средний возраст постановки диагноза
почти 70 лет, с аналогичным процентом пациентов в возрасте ≥80 лет
лет, как во французском исследовании (11).
НМРЛ составляют 85% всех случаев рака легких у пожилых людей, как в
их младшие коллеги (6).
Плоскоклеточный рак чаще встречается у пожилых людей по сравнению с
у более молодых пациентов (5,6). Распределение по полу в
пожилые люди похожи на пациентов более молодого возраста в США; в то время как,
во Франции наблюдается уменьшение соотношения мужчин и женщин с
возрастной возраст (10,11).
Лечение пожилых пациентов с раком легких позами
огромный вызов (5). Несмотря на то что
пациенты пожилого возраста составляют большинство случаев рака легких, они
недостаточно представлены в клинических испытаниях по лечению рака, где
они составляют лишь 30–40% включенных в исследование пациентов (12). В национальном раке
Клинические испытания, спонсируемые институтом, <1% взрослых в возрасте 75–79 лет
лет (13).
Следовательно, пациенты этого возраста не могут получить оптимальное лечение.
(13,14). Возможные объяснения этого
ситуации - наличие сопутствующих заболеваний у пациентов, ограниченное
ожидания в отношении долгосрочной пользы от химиотерапии и для этих
причины, исключение пожилых людей на основе
критерии неприемлемости.
Пациенты пожилого возраста, включенные в клинические испытания в
какие молодые пациенты также включены, представляют собой весьма
выборочная популяция пациентов, так как они должны максимально удовлетворить
строгие критерии включения. Таким образом, полученные результаты не могут быть
экстраполировано на всю популяцию пожилых пациентов (5,6,14–16).
Поэтому рекомендации по химиотерапии при пожилом НМРЛ
пациенты основаны на анализе подгрупп пожилых пациентов
включены в клинические испытания без верхнего возрастного ограничения, только в редких случаях
специальные исследования и фазовые испытания, специально предназначенные для пожилых людей
пациенты с распространенным раком легких (6,14,15,17).Лишь небольшая часть пациентов старше 65 лет получает химиотерапию по поводу
продвинутый НМРЛ, как показано в обзоре Службы наблюдения
Программа эпидемиологии и конечных результатов; только 25,8% из 21 285
пациенты в возрасте ≥66 лет с НМРЛ, диагностированным в период с 1997 по 2002 гг.
(7,18).
Исследования, проведенные на пожилых пациентах с различными
злокачественные новообразования показывают, что пожилые пациенты получают пользу от химиотерапии
в той же степени, что и у более молодых пациентов, с управляемыми
побочные эффекты (19–21). Подавляющее большинство этих подгрупп
Анализы показали, что результаты эффективности аналогичны в
пациенты в возрасте <70 лет и в возрасте ≥70 лет
(20–24).В этих испытаниях разницы в
выживаемость наблюдалась в зависимости от возраста. Однако было больше
побочные эффекты, включая лейкопению, потерю веса, респираторные и
сопутствующие сердечно-сосудистые заболевания у пациентов пожилого возраста. Единственное исследование
показывающая более короткую выживаемость у пожилых пациентов, является комбинированным
анализ двух исследований Юго-Западной онкологической группы, одно сравнение
цисплатин отдельно с цисплатином-винорелбином и другие сравнения
цисплатин-винорелбин в карбоплатин-паклитаксел (25–27).
Тяжелые нейтропении чаще встречались в старшей группе; Однако,
возникновение фебрильной нейтропении было таким же.
Обычно используемые руководства по онкологии [Американские
Общество клинической онкологии (ASCO) и Европейская организация
Исследования и лечение рака (EORTC)] основаны на подгруппах
анализы пациентов пожилого возраста, включенных в группу лиц пожилого возраста
испытания, поэтому специальные исследования, посвященные пожилым пациентам
следует проводить и переводить пожилых пациентов
иначе в клинической практике. Примечательно, что несколько исследований фазы III
специально предназначенные для пожилых пациентов с распространенным НМРЛ, имеют
выполнено (28–30).В этих исследованиях пожилые пациенты с
распространенные НМРЛ были рандомизированы между одноагентной химиотерапией,
например, только винорелбин, и лучшая поддерживающая терапия (28). Дополнительно винорелбин-гемцитабин
лечение сравнивали с одним винорелбином и / или
только гемцитабин в двух испытаниях (29,30).
В результате этих испытаний в 2004 г. ASCO рекомендовала
лечение пожилых пациентов с распространенным НМРЛ с помощью монотерапии
химиотерапия (31). Винорелбин и
гемцитабин был наиболее часто изучаемым препаратом с аналогичным
результаты.Однако было обнаружено, что химиотерапия доцетакселом одним агентом
быть столь же эффективным, как при использовании одного винорелбина (32). С начала последнего
десятилетие химиотерапия одним агентом была принята в качестве стандарта
лечение НМРЛ, при этом винорелбин и гемцитабин являются наиболее
часто употребляемые наркотики в Европе и США (29,30,33,34),
и доцетаксел наиболее часто используется в Японии (32,35).
Было показано, что дублеты на основе платины превосходят
монотерапия у молодых и здоровых пациентов с распространенным НМРЛ (22,36–39).Хотя был ряд указаний на анализ подгрупп
клинических испытаний, которые не были специально посвящены пожилым
пациентам дуплет на основе платины также может принести пользу пожилым
пациенты.
Возраст не должен быть критерием выбора лучших
лечение в соответствии с рекомендациями ASCO 2009 г. (40). И наоборот, рекомендации EORTC
опубликованы в 2010 г. (41) продолжают
рекомендована монотерапия в качестве лечения пожилых пациентов с
продвинутый НМРЛ. Поскольку было показано, что дублеты на основе платины
превосходит монотерапию у молодых и здоровых пациентов с
НМРЛ, парадигма лечения пожилых пациентов, возможно, должна
быть модифицированным с одного агента на двойную химиотерапию.Тенденции
монотерапии у пожилых пациентов в возрасте ≥70 лет с хорошим PS
возможно, следует изменить в пользу комбинации карбоплатина
с еженедельным введением паклитаксела. Есть ли другие дублеты на основе карбоплатина
предоставить такую же выгоду, еще предстоит оценить
Более того, конкретных исследований не проводилось.
касается спасительной химиотерапии для пожилых пациентов с НМРЛ. В
единственное доступное исследование — это анализ подгрупп 86 пациентов в возрасте ≥70 лет.
лет среди 571 пациента, включенного в исследование III фазы
сравнение пеметрекседа и доцетаксела в качестве терапии второй линии
(42).Исходы пожилых пациентов
были похожи на таковые у более молодых пациентов, а пеметрексед имел
профиль безопасности лучше, чем у доцетаксела у пожилых пациентов.
Токсические явления при химиотерапии чаще встречаются у
пожилые пациенты. Изменения физиологических функций,
особенно функции почек и кроветворения, с возрастом могут
объяснить повышенную токсичность химиотерапии у пожилых пациентов
(6,43–45).
Препараты с почечным метаболизмом или высоким уровнем гематотоксичности
следует правильно отрегулировать их дозировку.Хотя гематологический
ожидается, что токсичность будет более серьезной у пожилых пациентов,
Факторы роста, по-видимому, имеют такую же эффективность, как и у молодых
пациенты и должны быть рассмотрены (46,47).
Первичная профилактика колониестимулирующим фактором гранулоцитов
(G-CSF) представляет особый интерес, так как самый высокий уровень заболеваемости
токсичность, приводящая к смерти пациента, возникает в течение первых
цикл. Следует сократить профилактическое использование Г-КСФ, чтобы уменьшить
риск нейтропении у пожилых пациентов с распространенным НМРЛ при
их лечат миелотоксическими препаратами (46).Кроме того, у пожилых пациентов
больше сопутствующих заболеваний, чем у их более молодых коллег, и поэтому часто
принимать лекарства, которые могут мешать химиотерапевтическому препарату
метаболизм. Сопутствующие заболевания ответственны за увеличение
смертность пациентов даже после поправки на возраст и стадию
(6,25,48).
PS является основным прогностическим фактором выживаемости в легких.
онкологических больных, а также является руководством для наиболее подходящих
лечение распространенного НМРЛ. PS, который предоставляет полезное руководство в
принятие решения о лечении для молодых пациентов часто
недостаточно для оценки общего состояния пожилых пациентов
(49).Хотя у PS есть прогностический
воздействие на пожилых пациентов, независимо от сопутствующих заболеваний, не
достаточная оценка реальной ситуации и всесторонняя
гериатрическая оценка (CGA) добавляет важную информацию (48). Интерпретация PS заметно больше
трудно у пожилых пациентов. Атипичная депрессия, недоедание,
деменция и саркопения встречаются чаще и, возможно,
занижена у пожилых пациентов (48). Эти ситуации могут вызвать ложные
интерпретация PS. Кроме того, некоторые гериатрические заболевания
(падения, пренебрежение, жестокое обращение и слабоумие) также недооцениваются даже
родственниками (49).CGA — это
длительная процедура, и несколько исследований предложили определенные
скрининговые тесты, позволяющие выбрать пациентов, которым требуется CGA,
рекомендовать специальные скрининговые тесты для всех гериатрических пациентов
и CGA для отдельных пациентов (50–52).
В этом исследовании мы продемонстрировали, что возраст является одним из
основные прогностические факторы, влияющие на выживаемость при раке легких
пациенты. Уровень смертности был выше у пожилых пациентов;
таким образом, среднее время выживания пожилых пациентов было
значительно ниже по сравнению с пациентами более молодого возраста в
одномерный и многомерный анализ.У пожилых пациентов диагностирован
с гистологией SCLC имели худшие результаты по сравнению с пациентами с
НМРЛ и пожилые пациенты с повышенным уровнем ЛДГ в сыворотке имели
более короткое время выживания по сравнению с людьми с нормальным уровнем.
Кроме того, было обнаружено, что пожилые пациенты более страдают анемией и
менее восприимчив к химиотерапии по сравнению с более молодыми пациентами.
Однако, когда старшие и младшие группы оценивались отдельно,
влияние реакции на химиотерапию на выживаемость не
различаются, предполагая, что разница в выживаемости между молодыми
и старшие группы не были связаны с ответом на химиотерапию
показатель.
Что касается критики настоящего исследования, мы
невозможно проанализировать смертность по не связанным причинам
кроме рака и сопутствующих им заболеваний. Химиотерапия
схемы и уровни токсичности не сравнивались в настоящем исследовании,
поскольку наша цель состояла только в том, чтобы показать значение возраста для выживаемости в
связь с проведением химиотерапии и других
вероятные прогностические факторы. Несмотря на эти ограничения, это исследование
важно, так как данные, исследующие исходы рака легких в
пожилые пациенты и влияние возраста на выживаемость при раке легких
ограничено.
В заключение, почти все пациенты с запущенной
рак легких имеет неблагоприятный прогноз. Установление четкого прогноза
переменные во время первоначальной диагностики могут помочь врачам принять решение
каким пациентам следует рассматривать только поддерживающую терапию,
химиотерапия с одним агентом, комбинированная химиотерапия или
варианты мультимодального лечения. В этом исследовании мы продемонстрировали, что
возраст пациентов — один из основных прогностических факторов
влияет на выживаемость больных раком легких. Только возраст не должен
препятствовать получению этими пациентами химиотерапии.лечение
решения должны основываться на физиологических, а не
хронологический возраст. Факторы, требующие оценки у пожилых людей
пациенты включают функциональный статус, сопутствующие заболевания и когнитивные способности.
Список литературы
1 | Джемал А., Сигель Р., Сюй Дж. И Уорд Е.: Рак |
2 | Финкельштейн Д.М., Эттингер Д.С. и |
3 | Слебос Р.Дж., Киббелаар Р.Э., Далезио О. и др.: |
4 | Хорио Ю., Такахаши Т., Куроиси Т. и др.: |
5 | Макрантонакис П.Д., Галани Э. и Харпер П.Г .: |
6 | Майоне П., Росси А., Sacco PC и др.: |
7 | Овоникоко Т.К., Рагин С.К., Белани С.П. и др.: |
8 | Брамбилла Э., Трэвис У.Д., Колби ТВ и др.: |
9 | Деттербек, Boffa DJ и Tanoue LT: The |
10 | Бланшон Ф., Гриво М., Зурейк М. и др.: |
11 | Quoix E и Lemarié E: эпидемиологические |
12 | Хатчинс Л. Ф., Унгер Дж. М., Кроули Дж. Дж., Колтман |
13 | Льюис Дж. Х., Килгор М. Л., Голдман Д. П. и др.: |
14 | Лихтман С.М., Вильдьерс Х., Шательют Э. и др. |
15 | Ятой А., Хиллман С., Стелла П. и др.: |
16 | Перроне Ф., Галло С и Гриделли С: |
17 | Эрл С.К., Нойман П.Дж., Гелбер Р.Д., Вайнштейн |
18 | Райс ЛАГ, член парламента Эйснера и Косари КЛ: ВИДАТЕЛЬ |
19 | Эрл С.К., Цай Дж. С., Гелбер Р. Д., Вайнштейн |
20 | Лангер С.Дж., Манола Дж., Бернардо П. и др.: |
21 | Лангер С.Дж., Вангель М. и Шиллер Дж.: |
22 | Lilenbaum RC, Herndon JE II, List MA и др. |
23 | Belani CP и Fossella FV: исследование III фазы |
24 | Ансари Р.Х., Соцински М.А., Эдельман М.Дж. и др.: |
25 | Келли К., Кроули Дж., Банн П.А. младший и другие: |
26 | Рэмси С.Д., Мойнпур С.М., Ловато Л.К. и др.: |
27 | Келли К., Джарритта С. и Хейс С. |
28 | Авторы не указаны. Эффекты винорелбина |
29 | Фраски Г., Лоруссо В., Панза Н. и др.: |
30 | Гриделли С., Перроне Ф., Галло С. и др.: |
31 | Гриделли К., Аапро М., Ардиццони А. и др.: |
32 | Кудо С., Такеда К., Накагава К. и др.: |
33 | Депьер А., Частанг С., Кууа Э и другие: |
34 | Андерсон Х., Хопвуд П., Стивенс Р. Дж. И др.: |
35 | Roszkowski K, Pluzanska A, Krzakowski M, |
36 | Ле Шевалье Т., Брисган Д., Дуйяр Дж. Я., |
37 | Авторы не указаны.Химиотерапия в |
38 | Сандлер А.Б., Немунайтис Дж., Денхэм С. и др.: |
39 | Crinò L, Scagliotti G, Marangolo M и другие: |
40 | Аззоли К.Г., Джакконе Дж., Темин С. и др.: |
41 | Pallis AG, Gridelli C, van Meerbeeck J и др. |
42 | Вайс Г.Дж., Лангер С., Розелл Р. и др.: |
43 | Балдуччи Л., Харди К.Л. и Лайман Г.Х .: |
44 | Balducci L: Гериатрическая онкология: вызов |
45 | Репетто Л., Вентурино А., Фратино Л. и др.: |
46 | Wijermans P, Lübbert M, Verhoef G и др.: |
47 | Репетто Л., Биганзоли Л., Кёне Ч. и др.: |
48 | Репетто Л., Вентурино А., Верчелли М. и др.: |
49 | Альдосс ИТ, Таши Т., Гонсалвес В. и др.: |
50 | Extermann M и Hurria A: комплексные |
51 | Ферруччи Л., Гуральник Дж. М., Каваццини С., |
52 | Репетто Л., Фратино Л., Аудисио Р.А. и др.: |
Каковы возрастные и половые демографические характеристики мелкоклеточного рака легкого (SCLC)?
Malhotra J, Boffetta P, Mucci L.Рак легкого, гортани и плевры. Адами Х., Хантер Д., Лаглоу П., Муччи Л., ред. Учебник эпидемиологии рака . 3-е изд. Нью-Йорк, Нью-Йорк: издательство Оксфордского университета; 2018. 327-54.
Pietanza MC, Krug LM, Wu AJ, Kris MG, Rudin CM, Travis WD. Мелкоклеточные и нейроэндокринные опухоли легких. ДеВита В.Т. младший, Лоуренс Т.С., Розенберг С.А., ред. Рак ДеВиты, Хеллмана и Розенберга: принципы и практика онкологии . 10-е изд. Филадельфия, Пенсильвания: Wolters Kluwer Health; 2015 г.536-59.
Cascone T, Gold KA, Glisson BS. Мелкоклеточная карцинома легкого. Kantarjian H, Wolff R, ред. Руководство по медицинской онкологии доктора медицины Андерсона . 3-е изд. Нью-Йорк, Нью-Йорк: образование Макгроу-Хилл; 2016. 323-42.
Калемкериан Г.П., Шнайдер Б.Дж. Достижения в области мелкоклеточного рака легких. Гематол Онкол Клин Норт Ам . 2017 31 февраля (1): 143-156. [Медлайн].
Виндер Э.Л., Грэм Э.А. Табакокурение как возможный этиологический фактор бронхиогенной карциномы; исследование 684 доказанных случаев. Дж. Ам Мед Ассо . 1950, 27 мая. 143 (4): 329-36. [Медлайн].
Pesch B, Kendzia B, Gustavsson P, Jockel KH, Johnen G, et al. Курение сигарет и рак легких — оценки относительного риска для основных гистологических типов на основе объединенного анализа исследований случай-контроль. Инт Дж. Рак . 2012 Сентябрь 1. 131 (5): 1210-9. [Медлайн]. [Полный текст].
Парсонс А., Дейли А., Бег Р., Авеард П. Влияние отказа от курения после диагностики рака легких на ранней стадии на прогноз: систематический обзор обсервационных исследований с метаанализом. BMJ . 21 января 2010 г. 340: b5569. [Медлайн]. [Полный текст].
Сигель Р.Л., Миллер К.Д., Джемаль А. Статистика рака, 2020. CA Cancer J Clin . 2020 января 70 (1): 7-30. [Медлайн]. [Полный текст].
Говиндан Р., Пейдж Н., Моргенштерн Д., Рид В., Тирни Р., Влахиотис А. и др. Изменение эпидемиологии мелкоклеточного рака легкого в Соединенных Штатах за последние 30 лет: анализ базы данных эпиднадзора, эпидемиологии и конечных результатов. Дж. Клин Онкол . 2006 г., 1. 24 (28): 4539-44. [Медлайн].
Американское онкологическое общество. Факты и цифры о раке, 2020 г. Доступно по адресу https://www.cancer-org/content/dam/cancer-org/research/cancer-facts-and-statistics/annual-cancer-facts-and-figures/2020/cancer- факты и цифры-2020.pdf. Доступ: 3 апреля 2020 г.
Лечение мелкоклеточного рака легких (PDQ®): версия для специалистов в области здравоохранения. Национальный институт рака. Доступно по адресу http: // www.ncbi.nlm.nih.gov/books/NBK65909/#CDR0000062945__1. 24 марта 2020 г .; Дата обращения: 19 июня 2020 г.
[Рекомендации] Früh M, De Ruysscher D, Popat S, Crinò L, Peters S, Felip E, et al. Мелкоклеточный рак легкого (SCLC): Руководство ESMO по клинической практике по диагностике, лечению и последующему наблюдению. Энн Онкол . 2013 24 октября Дополнение 6: vi99-105. [Медлайн]. [Полный текст].
Всемирная организация здравоохранения. Информационный бюллетень по раку № 297. Доступно по адресу http: // www.who.int/mediacentre/factsheets/fs297/en/. 12 сентября 2018 г .; Доступ: 3 апреля 2020 г.
Джемал А., Миллер К.Д., Ма Дж., Сигел Р.Л., Федева С.А., Ислами Ф. и др. Более высокая заболеваемость раком легких у молодых женщин, чем у молодых мужчин в Соединенных Штатах. N Engl J Med . 2018 24 мая. 378 (21): 1999-2009. [Медлайн].
Джекман DM, Johnson BE. Мелкоклеточный рак легкого. Ланцет . 2005 15-21 октября. 366 (9494): 1385-96. [Медлайн].
Janne PA, Freidlin B, Saxman S, Johnson DH, Livingston RB, Shepherd FA, et al.Двадцать пять лет клинических исследований пациентов с мелкоклеточной карциномой легкого на ограниченной стадии в Северной Америке. Рак . 2002 Октябрь 1. 95 (7): 1528-38. [Медлайн].
Wu C, Xu B, Yuan P, Miao X, Liu Y, Guan Y и др. Полногеномный опрос определяет варианты YAP1, связанные с выживаемостью пациентов с мелкоклеточным раком легкого. Cancer Res . 2010 декабрь 1. 70 (23): 9721-9. [Медлайн].
Xun WW, Brennan P, Tjonneland A, Vogel U, Overvad K, el at.Однонуклеотидные полиморфизмы (5p15.33, 15q25.1, 6p22.1, 6q27 и 7p15.3) и выживаемость при раке легких в Европейском проспективном исследовании рака и питания (EPIC). Мутагенез . 2011 26 сентября (5): 657-66. [Медлайн].
Гермес А., Вашки Б., Рек М. Гипонатриемия как прогностический фактор мелкоклеточного рака легкого — ретроспективный анализ одного учреждения. Респир Мед . 2012 июн.106 (6): 900-4. [Медлайн].
Campling BG, Sarda IR, Baer KA, Pang SC, Baker HM, Lofters WS и др.Секреция предсердного натрийуретического пептида и вазопрессина мелкоклеточным раком легкого. Рак . 1995 15 мая. 75 (10): 2442-51. [Медлайн].
Shepherd FA, Laskey J, Evans WK, Goss PE, Johansen E, Khamsi F. Синдром Кушинга, связанный с эктопическим производством кортикотропина и мелкоклеточным раком легких. Дж. Клин Онкол . 1992 января 10 (1): 21-7. [Медлайн].
Sher E, Gotti C, Canal N, Scoppetta C, Piccolo G, Evoli A и др.Специфичность аутоантител к кальциевым каналам при миастеническом синдроме Ламберта-Итона. Ланцет . 1989 16 сентября. 2 (8664): 640-3. [Медлайн].
[Директива] Вендер Р., Фонтам Э. Т., Баррера Э. мл., Колдиц Г. А., Черч Т. Р., Эттингер Д. С. и др. Рекомендации Американского онкологического общества по скринингу рака легких. CA Cancer J Clin . 2013 март-апрель. 63 (2): 107-17. [Медлайн]. [Полный текст].
[Рекомендации] Рак легких: Скрининг. Целевая группа по профилактическим услугам США.Доступно по адресу http://www.uspreventiveservicestaskforce.org/Page/Document/UpdateSummaryFinal/lung-cancer-screening. 25 сентября 2014 г .; Доступ: 3 апреля 2020 г.
Katki HA, Kovalchik SA, Petito LC, Cheung LC, Jacobs E, Jemal A, et al. Значение девяти моделей прогнозирования риска для выбора курильщиков для компьютерной томографии скрининга рака легких. Энн Интерн Мед. . 15 мая 2018 г. [Полный текст].
Дженкинс К. Какие курильщики должны проходить обследование на рак легких ?.Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/896582. 14 мая 2018 г .; Дата обращения: 22 мая 2018 г.
[Руководство] NCCN Руководство по клинической практике в онкологии: мелкоклеточный рак легкого. Национальная всеобъемлющая онкологическая сеть. Доступно на http://www.nccn.org/professionals/physician_gls/pdf/sclc.pdf. Версия 3.2020 — 5 февраля 2020 г .; Доступ: 3 апреля 2020 г.
[Директива] Деттербек ФК, Льюис С.З., Дикемпер Р., Аддризо-Харрис Д., Альбертс В.М.Краткое содержание: Диагностика и лечение рака легких, 3-е изд. Руководства по клинической практике Американского колледжа грудных врачей. Сундук . 2013 май. 143 (5 доп.): 7С-37С. [Медлайн]. [Полный текст].
[Рекомендации] Ung YC, Maziak DE, Vanderveen JA, Smith CA, Gulenchyn K, Evans WK, для группы сайтов по лечению рака легких. Позитронно-эмиссионная томография с 18-фтордезоксиглюкозой в диагностике и определении стадии рака легкого: руководство по клинической практике.Торонто, Онтарио: Онкологический центр Онтарио; 2007. [Полный текст].
Томсон Д., Халс П., Лориган П., Фавр-Финн С. Роль позитронно-эмиссионной томографии в лечении мелкоклеточного рака легких. Рак легких . 2011 август 73 (2): 121-6. [Медлайн].
Американский объединенный комитет по раку. Легкое. Руководство AJCC по стадированию рака Amin MB, Edge S, Greene F, Byrd DR, Brookland RK, et al, eds. AJCC Руководство по стадированию рака . 8-е издание.Нью-Йорк, Нью-Йорк: Спрингер; 2016.
Dresler CM, Olak J, Herndon JE 2nd, Richards WG, el at. Фаза III межгрупповое исследование содержания талька в сравнении со склерозом тальковой суспензии при злокачественном плевральном выпоте. Сундук . 2005 Март 127 (3): 909-15. [Медлайн].
Zakowski MF. Патология мелкоклеточного рака легкого. Семин Онкол . 30 февраля 2003 г. (1): 3-8. [Медлайн].
Стадии мелкоклеточного рака легкого.Американское онкологическое общество. Доступно по адресу http://www.cancer.org/cancer/lungcancer-smallcell/detailedguide/small-cell-lung-cancer-staging. 1 октября 2019 г .; Доступ: 3 апреля 2020 г.
Micke P, Faldum A, Metz T, Beeh KM, Bittinger F, Hengstler JG и др. Стадия мелкоклеточного рака легкого: группа по изучению легких при администрации ветеранов против Международной ассоциации по изучению рака легких — что ограничивает ограниченное заболевание? Рак легких . 2002 Сентябрь 37 (3): 271-6. [Медлайн].
[Рекомендации] Национальный центр сотрудничества по раку. Рак легких. Диагностика и лечение рака легких. Публикация № 121. Лондон, Великобритания: Национальный институт здоровья и передовой клинической практики; 2011. [Полный текст].
Halvorsen TO, Sundstrøm S, Fløtten Ø, Brustugun OT, Brunsvig P, Aasebø U, et al. Коморбидность и исходы одновременной химио- и лучевой терапии при мелкоклеточном раке легкого с ограниченным заболеванием. Акта Онкол .2016 23. 1-9 августа. [Медлайн].
Spigel DR, Townley PM, Waterhouse DM, Fang L, Adiguzel I, et al. Рандомизированное исследование фазы II бевацизумаба в сочетании с химиотерапией при ранее нелеченном обширном мелкоклеточном раке легкого: результаты исследования SALUTE. Дж. Клин Онкол . 2011, 1 июня. 29 (16): 2215-22. [Медлайн].
Lally BE, Urbanic JJ, Blackstock AW, Miller AA, Perry MC. Мелкоклеточный рак легкого: добились ли мы прогресса за последние 25 лет ?. Онколог . 2007 сентября 12 (9): 1096-104. [Медлайн].
Hanna NH, Einhorn LH. Мелкоклеточный рак легкого: современное состояние. Клин Рак легких . 2002 Сентябрь 4 (2): 87-94. [Медлайн].
Хорн Л., Мэнсфилд А.С., Щенсна А., Гавел Л., Кшаковски М., Хохмаир М.Дж. и др. Первая линия атезолизумаб в сочетании с химиотерапией при обширной стадии мелкоклеточного рака легкого. N Engl J Med . 2018 декабря 6. 379 (23): 2220-2229. [Медлайн]. [Полный текст].
Харрисон П. После десятилетий, новый стандарт лечения мелкоклеточного рака легкого. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/0. 28 сентября 2018 г .; Доступ: 10 октября 2018 г.
Amarasena IU, Уолтерс Дж. А., Вуд-Бейкер Р., Фонг К. Платиновые и неплатиновые схемы химиотерапии при мелкоклеточном раке легкого. Кокрановская база данных Syst Rev . 8 октября 2008 г. CD006849. [Медлайн].
Нода К., Нишиваки Ю., Кавахара М., Негоро С., Сугиура Т., Йокояма А. и др.Иринотекан плюс цисплатин в сравнении с этопозидом плюс цисплатином при обширном мелкоклеточном раке легкого. N Engl J Med . 2002, 10 января. 346 (2): 85-91. [Медлайн].
Jiang L, Yang KH, Guan QL, Mi DH, Wang J. Цисплатин плюс этопозид по сравнению с другими схемами на основе платины для пациентов с обширным мелкоклеточным раком легкого: систематический обзор и метаанализ рандомизированных контролируемых исследований. Медицинский работник J . 2012 декабрь 42 (12): 1297-309. [Медлайн].
Ханна Н., Банн П.А. младший, Лангер С., Эйнхорн Л., Гатри Т. младший, Бек Т. и др.Рандомизированное испытание фазы III, сравнивающее иринотекан / цисплатин с этопозидом / цисплатином у пациентов с мелкоклеточным раком легкого, ранее нелеченным на обширной стадии заболевания. Дж. Клин Онкол . 2006 г. 1. 24 (13): 2038-43. [Медлайн].
Ready NE, Pang HH, Gu L, Otterson GA, Thomas SP, Miller AA, et al. Химиотерапия с или без поддерживающего сунитиниба для нелеченого обширного мелкоклеточного рака легкого: рандомизированное двойное слепое плацебо-контролируемое исследование фазы II — CALGB 30504 (Alliance). Дж. Клин Онкол . 2015 20 мая. 33 (15): 1660-5. [Медлайн].
Schmittel A, Sebastian M, Fischer von Weikersthal L, et al. Немецкое многоцентровое рандомизированное исследование III фазы, в котором сравнивают иринотекан-карбоплатин и этопозид-карбоплатин в качестве терапии первой линии при распространенном мелкоклеточном раке легкого. Энн Онкол . 2011 22 августа (8): 1798-804. [Медлайн].
Росси А., Ди Майо М., Чиодини П., Радд Р. М., Окамото Н., Скарлос Д. В. и др.Химиотерапия на основе карбоплатина или цисплатина в терапии первой линии мелкоклеточного рака легкого: метаанализ COCIS индивидуальных данных пациента. Дж. Клин Онкол . 2012 10 мая. 30 (14): 1692-8. [Медлайн].
Klasa RJ, Murray N, Coldman AJ. Дозо-интенсивный метаанализ схем химиотерапии при мелкоклеточной карциноме легкого. Дж. Клин Онкол . 1991 марта, 9 (3): 499-508. [Медлайн].
Arriagada R, Le Chevalier T, Pignon JP, Riviere A, Monnet I, Chomy P, et al.Начальные химиотерапевтические дозы и выживаемость у пациентов с ограниченным мелкоклеточным раком легкого. N Engl J Med . 1993 16 декабря. 329 (25): 1848-52. [Медлайн].
Такада М., Фукуока М., Кавахара М., Сугиура Т., Йокояма А., Йокота С. и др. Исследование фазы III сопутствующей и последовательной лучевой терапии грудной клетки в сочетании с цисплатином и этопозидом при мелкоклеточном раке легкого на ограниченной стадии: результаты исследования японской группы клинической онкологии 9104. J Clin Oncol .2002 15 июля. 20 (14): 3054-60. [Медлайн].
Turrisi AT 3rd, Kim K, Blum R, Sause W.T., Livingston RB, Komaki R, et al. Дважды в день по сравнению с торакальной лучевой терапией один раз в день при ограниченном мелкоклеточном раке легкого, леченном одновременно с цисплатином и этопозидом. N Engl J Med . 1999, 28 января. 340 (4): 265-71. [Медлайн].
Слотман Б., Фавр-Финн С., Крамер Г., Рэнкин Е., Сни М., Хаттон М. и др. Профилактическое краниальное облучение при обширном мелкоклеточном раке легкого. N Engl J Med . 2007 16 августа. 357 (7): 664-72. [Медлайн].
Schild SE, Foster NR, Meyers JP, Ross HJ, Stella PJ, et al. Профилактическое краниальное облучение при мелкоклеточном раке легкого: результаты объединенного анализа North Central Cancer Treatment Group. Энн Онкол . 2012 23 ноября (11): 2919-24. [Медлайн].
Паз-Арес Л., Дворкин М., Чен Ю. и др. Дурвалумаб плюс этопозид платины в сравнении с этопозидом платины в терапии первой линии обширной стадии мелкоклеточного рака легкого (CASPIAN): рандомизированное контролируемое открытое исследование фазы 3. Ланцет . 2019 23 ноября. 394 (10212): 1929-1939. [Медлайн].
Натале Р., Лара П., Чански К. и др. Рандомизированное исследование фазы III, сравнивающее иринотекан / цисплатин (IP) с этопозидом / цисплатином (EP) у пациентов (pts) с ранее нелеченым обширным мелкоклеточным раком легкого (E-SCLC). J Clin Oncol. 2008; 26 (доп.): 400с.
Heigener D, Freitag L, Eschbach C et al. Топотекан / цисплатин (TP) по сравнению с цисплатином / этопозидом (PE) для пациентов с обширным заболеванием мелкоклеточным раком легкого (ED-SCLC): окончательные результаты рандомизированного исследования III фазы.J Clin Oncol. 2008; 26 (доп.): 400с.
Slotman BJ, van Tinteren H, Praag JO, Knegjens JL, El Sharouni SY, Hatton M, et al. Использование торакальной лучевой терапии для лечения мелкоклеточного рака легких на обширной стадии: рандомизированное контролируемое исследование фазы 3. Ланцет . 2015 г. 3 января. 385 (9962): 36-42. [Медлайн]. [Полный текст].
Такахаши Т., Яманака Т., Сето Т., Харада Х, Нокихара Х, Сака Х и др. Профилактическое краниальное облучение по сравнению с наблюдением у пациентов с мелкоклеточным раком легкого с обширным заболеванием: многоцентровое рандомизированное открытое исследование фазы 3. Ланцет Онкол . 2017 май. 18 (5): 663-671. [Медлайн].
Харрис С., Чан М.Д., Ловато Дж.Ф., Эллис Т.Л., Таттер С.Б., Бурланд Дж. Д. и др. Стереотаксическая радиохирургия гамма-ножом как терапия спасения после неэффективности лучевой терапии всего мозга у пациентов с мелкоклеточным раком легкого. Int J Radiat Oncol Biol Phys . 2012 1 мая. 83 (1): e53-9. [Медлайн].
GlaxoSmithKline. GSK получила одобрение на применение капсул Hycamtin® (топотекан) для лечения рецидива мелкоклеточного рака легкого [пресс-релиз].15 октября 2007 г. Доступно по адресу https://www.fiercebiotech.com/biotech/press-release-gsk-receives-approval-for-hycamtin-capsules. 15 октября 2007 г .; Доступ: 7 сентября 2018 г.
Jotte R, Conkling P, Reynolds C, Galsky MD, Klein L, Fitzgibbons JF и др. Рандомизированное испытание фазы II монотерапии амрубицином или топотеканом в качестве терапии второй линии у пациентов с мелкоклеточным раком легкого, чувствительных к химиотерапии на основе платины первой линии. Дж. Клин Онкол . 2011 20 января.29 (3): 287-93. [Медлайн].
Goto K, Ohe Y, Shibata T., Seto T, Takahashi T., Nakagawa K, et al. Комбинированная химиотерапия с цисплатином, этопозидом и иринотеканом по сравнению с одним топотеканом в качестве лечения второй линии для пациентов с чувствительным рецидивирующим мелкоклеточным раком легкого (JCOG0605): многоцентровое открытое рандомизированное исследование фазы 3. Ланцет Онкол . 2016 17 августа (8): 1147-1157. [Медлайн].
Zepzelca (лурбинектин) [вставка в упаковку].Пало-Альто, Калифорния: Jazz Pharmaceuticals, Inc., июнь 2020 г. Доступно на [Полный текст].
Ready N, Farago AF, de Braud F, Atmaca A, Hellmann MD, Schneider JG, et al. Монотерапия ниволумабом третьей линии при рецидивирующем SCLC: CheckMate 032. J Thorac Oncol . 2019 14 февраля (2): 237-244. [Медлайн]. [Полный текст].
Ott PA, Elez E, Hiret S, Kim DW, Morosky A, Saraf S и др. Пембролизумаб у пациентов с мелкоклеточным раком легких в обширной стадии: результаты исследования фазы Ib KEYNOTE-028. Дж. Клин Онкол . 2017 г. 1. 35 (34): 3823-3829. [Медлайн].
Marabelle A, Le DT, Ascierto PA, Di Giacomo AM, De Jesus-Acosta A, Delord JP, et al. Эффективность пембролизумаба у пациентов с неколоректальной высокой микросателлитной нестабильностью / раком с недостаточностью восстановления несоответствия: результаты исследования фазы II KEYNOTE-158. Дж. Клин Онкол . 2020 1 января. 38 (1): 1-10. [Медлайн].
Шрайбер Д., Райнир Дж., Вонгтама Д. и др.Следует ли изменить парадигму хирургии при мелкоклеточном раке легкого на ограниченной стадии? Анализ на основе SEER. Дж Клин Онкол (Дополнение) . 2008. 26: 403с.
Anraku M, Waddell TK. Хирургия мелкоклеточного рака легкого. Semin Thorac Cardiovasc Surg . 2006 Осень. 18 (3): 211-6. [Медлайн].
[Рекомендации] Яклич М.Т., Якобсон Флорида, Остин Дж. Х., Филд Дж. К., Джетт Дж. Р., Кешавджи С. и др. Рекомендации Американской ассоциации торакальной хирургии по скринингу рака легких с использованием низкодозных компьютерных томографов для выживших после рака легких и других групп высокого риска. J Thorac Cardiovasc Surg . 2012 Июль 144 (1): 33-8. [Медлайн].
[Рекомендации] Rivera MP, Mehta AC, Wahidi MM. Установление диагноза рака легких: Диагностика и лечение рака легких, 3-е изд: Руководящие принципы клинической практики Американского колледжа грудных врачей, основанные на доказательствах. Сундук . 2013 май. 143 (5 доп.): E142S-65S. [Медлайн]. [Полный текст].
[Рекомендации] Рудин С.М., Исмаила Н., Ханн С.Л., Малхотра Н., Мовсас Б., Норрис К. и др.Лечение мелкоклеточного рака легкого: одобрение Американским обществом клинической онкологии Руководства Американского колледжа грудных врачей. Дж. Клин Онкол . 2015 г. 1. 33 (34): 4106-11. [Медлайн]. [Полный текст].
Франк А.Л. Эпидемиология рака легких. Roth JA, Ruckdeschel J, Weisenburger T, ред. Торакальная онкология . Филадельфия, Пенсильвания: WB Saunders Co; 1989. 6-15.
Mazzone PJ, Silvestri GA, Patel S, Kanne JP, Kinsinger LS, Wiener RS и др.Скрининг на рак легких: Руководство CHEST и отчет экспертной комиссии. Сундук . 2018 Апрель 153 (4): 954-985. [Медлайн]. [Полный текст].
Рак легких и бронхов — Статистика рака
Краткий обзор
Предполагаемое количество новых случаев заражения в 2020 году 228820
% всех новых случаев рака 12,7%
Предполагаемое количество смертей в 2020 г. 135720
% всех смертей от рака 22,4%
5-летняя
Относительная выживаемость
20.5%
2010–2016 гг.
| Год | Количество новых случаев — SEER 9 | Количество новых случаев — SEER 13 | Уровень смертности — США | 5-летнее относительное выживание — SEER 9 | ||||
|---|---|---|---|---|---|---|---|---|
| Соблюдается | Смоделированный тренд | Соблюдается | Смоделированный тренд | Соблюдается | Смоделированный тренд | Соблюдается | Смоделированный тренд | |
| 1975 | 52.24 | 53,37 | – | – | 42,56 | 42,77 | 11,50% | 11,63% |
| 1976 | 55,41 | 54,72 | – | – | 44,20 | 44,04 | 12.60% | 11.77% |
| 1977 | 56,69 | 56,10 | – | – | 45,49 | 45,34 | 12,70% | 11,91% |
| 1978 | 57,84 | 57,52 | – | – | 46.88 | 46,69 | 13,05% | 12,05% |
| 1979 | 58,62 | 58,98 | – | – | 47,69 | 48,07 | 12,93% | 12,20% |
| 1980 | 60,65 | 60.47 | – | – | 49,41 | 49,49 | 12.60% | 12,34% |
| 1981 | 62,03 | 62,00 | – | – | 49,99 | 50,38 | 12,77% | 12,48% |
| 1982 | 63.29 | 63,57 | – | – | 51,43 | 51,28 | 13,24% | 12,63% |
| 1983 | 63,45 | 64,17 | – | – | 52,40 | 52,20 | 13,50% | 12.77% |
| 1984 | 65,49 | 64,78 | – | – | 53,36 | 53,14 | 12,67% | 12,92% |
| 1985 | 64,61 | 65,40 | – | – | 54.32 | 54,10 | 13,16% | 13,07% |
| 1986 | 65,77 | 66.02 | – | – | 55,04 | 55,07 | 12,87% | 13,21% |
| 1987 | 67,90 | 66.65 | – | – | 56,24 | 56,05 | 12,82% | 13,36% |
| 1988 | 68,06 | 67,29 | – | – | 56,97 | 57,06 | 13,07% | 13,51% |
| 1989 | 67.56 | 67,93 | – | – | 57,90 | 58.09 | 13,44% | 13,66% |
| 1990 | 68,08 | 68,57 | – | – | 58,85 | 59,13 | 13,37% | 13.81% |
| 1991 | 69,19 | 69,22 | – | – | 58,99 | 59,00 | 13,71% | 13,97% |
| 1992 | 69,46 | 68,75 | 67,03 | 66,84 | 58.90 | 58,87 | 13,95% | 14,12% |
| 1993 | 67,75 | 68,27 | 65,71 | 66,18 | 59,13 | 58,74 | 14,29% | 14,27% |
| 1994 | 67,17 | 67.80 | 64,69 | 65,53 | 58,54 | 58,61 | 14,31% | 14,43% |
| 1995 | 66,85 | 67,33 | 64,96 | 64,88 | 58,38 | 58,48 | 14,64% | 14.58% |
| 1996 | 66,46 | 66,86 | 64,37 | 64,24 | 57,91 | 57,92 | 14,68% | 14,74% |
| 1997 | 66,63 | 66,40 | 63,82 | 63,61 | 57.51 | 57,37 | 14,79% | 14,90% |
| 1998 | 67,55 | 65,94 | 64,44 | 62,98 | 57,08 | 56,82 | 14,70% | 15,06% |
| 1999 | 65,83 | 65.48 | 62,89 | 62,36 | 55,42 | 56,28 | 15,27% | 15,21% |
| 2000 | 64,14 | 65,03 | 60,80 | 61,74 | 55,85 | 55,75 | 15,78% | 15.37% |
| 2001 | 64,16 | 64,58 | 60,86 | 61,13 | 55,32 | 55,22 | 15,11% | 15,53% |
| 2002 | 64.06 | 64,13 | 60,33 | 60,53 | 55.00 | 54,69 | 15,69% | 16,00% |
| 2003 | 64,77 | 63,69 | 60,61 | 59,93 | 54,19 | 54,17 | 16,16% | 16,47% |
| 2004 | 62,24 | 63.25 | 58,61 | 59,34 | 53,37 | 53,66 | 16,89% | 16,95% |
| 2005 | 63,03 | 62,81 | 59,04 | 58,75 | 52,85 | 53,15 | 17,55% | 17.43% |
| 2006 | 62,30 | 62,37 | 58,04 | 58,17 | 51,73 | 51,86 | 17,70% | 17,92% |
| 2007 | 62,10 | 61,94 | 57,73 | 57,60 | 50.71 | 50,61 | 18,51% | 18,42% |
| 2008 | 60,39 | 60,58 | 56,11 | 56,27 | 49,59 | 49,39 | 19,00% | 18,92% |
| 2009 | 59,99 | 59.26 | 56,02 | 54,97 | 48,41 | 48,20 | 19,76% | 19,42% |
| 2010 | 57,73 | 57,96 | 53,44 | 53,70 | 47,42 | 47,04 | 19,49% | 19.93% |
| 2011 | 56,25 | 56,69 | 51,87 | 52,46 | 46,02 | 45,90 | 20,63% | 20,45% |
| 2012 | 55,26 | 55,45 | 50,83 | 51,24 | 44.96 | 44,80 | 19,98% | 21,41% |
| 2013 | 54,11 | 54,23 | 49,53 | 50,06 | 43,47 | 43,72 | – | 22,39% |
| 2014 | 53,20 | 53.04 | 48,93 | 48,90 | 42,24 | 42,66 | – | 23,39% |
| 2015 | 51,86 | 51,88 | 48,04 | 47,77 | 40,68 | 40,55 | – | 24.40% |
| 2016 | 51,14 | 50,75 | 47,04 | 46,67 | 38,51 | 38,54 | – | 25,42% |
| 2017 | 49,45 | 49,63 | 45,60 | 45,59 | 36.69 | 36,63 | – | 26,45% |
| 2018 | – | – | – | – | 34,75 | 34,81 | – | 27,50% |
Новые дела также упоминаются как инциденты в других публикациях.Показатели новых случаев также называют показателями заболеваемости.
Просмотр таблицы данных
Уровень новых случаев и смертей на 100 000: Показатель новых случаев рака легких и бронхов составил 54,2 на 100 000 мужчин и женщин в год. Смертность составила 38,5 на 100 000 мужчин и женщин в год. Эти показатели скорректированы по возрасту и основаны на случаях 2013–2017 годов и смертей в 2014–2018 годах.
Пожизненный риск развития рака : примерно 6.Согласно данным за 2015–2017 годы, у 3 процентов мужчин и женщин в какой-то момент в течение жизни будет диагностирован рак легких и бронхов.
Распространенность этого рака : По оценкам, в 2017 году в США было 558 250 человек, живущих с раком легких и бронхов.
Знаете ли вы? Видео серии
Насколько распространен этот рак?
По сравнению с другими видами рака рак легких и бронхов встречается довольно часто.
| Рейтинг | Распространенные типы рака | Предполагаемый новый Чемоданов 2020 | Предположительно Смертей 2020 |
|---|---|---|---|
| 1. | Рак молочной железы (женский) | 276 480 | 42,170 |
| 2. | Рак легких и бронхов | 228 820 | 135,720 |
| 3. | Рак простаты | 191 930 | 33,330 |
| 4. | Колоректальный рак | 147 950 | 53 200 |
| 5. | Меланома кожи | 100,350 | 6,850 |
| 6. | Рак мочевого пузыря | 81 400 | 17 980 |
| 7. | Неходжкинская лимфома | 77 240 | 19 940 |
| 8. | Рак почек и почечного таза | 73,750 | 14 830 |
| 9. | Рак матки | 65 620 | 12 590 |
| 10. | Лейкемия | 60 530 | 23,100 |
Рак легких и бронхов представляет 12.7% всех новых случаев рака в США
12,7%
По оценкам, в 2020 году будет 228 820 новых случаев рака легких и бронхов, и примерно 135 720 человек умрут от этого заболевания.
Кто заболевает раком?
Рак легких чаще встречается у мужчин, чем у женщин, особенно у афроамериканцев. Курение широко признано основной причиной рака легких.Уровень новых случаев рака легких и бронхов составил 54,2 на 100 000 мужчин и женщин в год на основе случаев 2013–2017 гг. С поправкой на возраст.
Коэффициент новых случаев заболевания на 100000 человек по расе / этнической принадлежности и полу: рак легких и бронхов
Мужчины
| Все гонки | 61,7 |
|---|---|
| Белый | 62.2 |
| Черный | 71,2 |
| Житель островов Азиатско-Тихоокеанского региона | 46,2 |
| Американские индейцы / коренные жители Аляски | 43,5 |
| Латиноамериканцы | 35,1 |
| Не латиноамериканцы | 65,3 |
Женщины
| Все гонки | 48.6 |
|---|---|
| Белый | 51,5 |
| Черный | 43,8 |
| Житель островов Азиатско-Тихоокеанского региона | 28,6 |
| Американские индейцы / коренные жители Аляски | 34,3 |
| Латиноамериканцы | 24,8 |
| Не латиноамериканцы | 51.9 |
- Все гонки
- Белый
- Черный
- Азиат /
Житель островов Тихого океана - Американские индейцы /
Коренные жители Аляски - Латиноамериканцы
- неиспаноязычное население
Процент новых случаев по возрастным группам: рак легких и бронхов
| Возраст | Процент новых случаев |
|---|---|
| <20 | 0.0% |
| 20–34 | 0,2% |
| 35–44 | 0,9% |
| 45–54 | 6,6% |
| 55–64 | 21,8% |
| 65–74 | 34,1% |
| 75–84 | 26,6% |
| > 84 | 9.7% |
Рак легких и бронхов чаще всего диагностируется у людей в возрасте 65–74 лет.
Средний возраст
На момент постановки диагноза
71
Кто умирает от рака?
Смертность от рака легких выше среди населения среднего и старшего возраста. Рак легких и бронхов — первая ведущая причина смерти от рака в Соединенных Штатах.Коэффициент смертности составил 38,5 на 100 000 мужчин и женщин в год на основе данных о смертях в 2014–2018 годах с поправкой на возраст.
Коэффициент смертности на 100000 человек по расе / этнической принадлежности и полу: рак легких и бронхов
Мужчины
| Все гонки | 46,9 |
|---|---|
| Белый | 47,1 |
| Черный | 55.4 |
| Житель островов Азиатско-Тихоокеанского региона | 28,0 |
| Американские индейцы / коренные жители Аляски | 38,4 |
| Латиноамериканцы | 23,0 |
| Не латиноамериканцы | 49,3 |
Женщины
| Все гонки | 32.0 |
|---|---|
| Белый | 33,3 |
| Черный | 29,7 |
| Житель островов Азиатско-Тихоокеанского региона | 16,3 |
| Американские индейцы / коренные жители Аляски | 27,4 |
| Латиноамериканцы | 12,3 |
| Не латиноамериканцы | 34.0 |
- Все гонки
- Белый
- Черный
- Азиат /
Житель островов Тихого океана - Американские индейцы /
Коренные жители Аляски - Латиноамериканцы
- неиспаноязычное население
Процент смертей по возрастным группам: рак легких и бронхов
| Возраст | Процент смертей |
|---|---|
| <20 | 0.0% |
| 20–34 | 0,1% |
| 35–44 | 0,6% |
| 45–54 | 5,3% |
| 55–64 | 20,3% |
| 65–74 | 32,4% |
| 75–84 | 28,3% |
| > 84 | 12.9% |
Процент смертей от рака легких и бронхов наиболее высок среди людей в возрасте 65–74 лет.
Изменения со временем
Отслеживание новых случаев, смертей и выживаемости с течением времени (тенденции) может помочь ученым понять, наблюдается ли прогресс и где необходимы дополнительные исследования для решения проблем, таких как улучшение скрининга или поиск более эффективных методов лечения.
Используя статистические модели для анализа, скорректированные по возрасту показатели новых случаев рака легких и бронхов падали в среднем на 2,2% каждый год в период с 2008 по 2017 год. Смертность с поправкой на возраст снижалась в среднем на 3,6% ежегодно в 2009–2018 гг. Тенденции 5-летней относительной выживаемости показаны ниже.
Новые случаи, смерти и 5-летнее относительное выживание
Рак и легкие
Рисунок: Респираторная анатомия
Рисунок: Респираторная анатомия; на рисунке показано правое легкое с верхней, средней и нижней долями; левое легкое с верхней и нижней долями; а также трахею, бронхи, лимфатические узлы и диафрагму.На вставке показаны бронхиолы, альвеолы, артерия и вена.
Существует две основные категории рака легких: немелкоклеточный рак легкого и мелкоклеточный рак легкого. Каждый тип немелкоклеточного рака легкого имеет разные раковые клетки, которые растут и распространяются по-разному:
- Плоскоклеточный рак (также называемый эпидермоидной карциномой).
- Крупноклеточная карцинома: рак, который может начаться в нескольких типах крупных клеток.
- Аденокарцинома: рак, который начинается в клетках, выстилающих альвеолы и вырабатывающих такие вещества, как слизь.
Другими менее распространенными типами немелкоклеточного рака легкого являются: плеоморфная, карциноидная опухоль, карцинома слюнной железы и неклассифицированная карцинома.
Существует два основных типа мелкоклеточного рака легкого, опять же в зависимости от типа клеток: мелкоклеточная карцинома (рак овса) и комбинированная мелкоклеточная карцинома.
Дополнительная информация
Дополнительная информация
Вот несколько ресурсов, чтобы узнать больше о раке легких.
Список литературы
Вся статистика в этом отчете основана на статистике SEER и Национального центра статистики здравоохранения Центров по контролю и профилактике заболеваний.Большинство из них можно найти в SEER * Explorer.
Предлагаемое цитирование
Все материалы в этом отчете находятся в открытом доступе и могут воспроизводиться или копироваться без разрешения; цитирование источника, однако, приветствуется.
SEER по статистике рака: рак легких и бронхов. Национальный институт рака. Bethesda, MD, https://seer.cancer.gov/statfacts/html/lungb.html
Эти статистические данные касаются статистики населения, основанной на U.С. население. Поскольку эти статистические данные основаны на больших группах людей, их нельзя использовать для точного прогнозирования того, что произойдет с отдельным пациентом. Чтобы увидеть индивидуальную статистику, просмотрите SEER * Explorer. Чтобы просмотреть статистику для определенного состояния, перейдите в Профили рака штата.
Статистика, представленная в этих статистических фактах, основана на самых последних доступных данных, большинство из которых можно найти в SEER * Explorer. В некоторых случаях могут использоваться разные периоды года.
Оценки новых случаев заболевания и смерти на 2020 год являются прогнозами Американского онкологического общества (ACS) на основе ранее опубликованных данных.
Рак — сложная тема. Доступен широкий спектр информации. Эти статистические данные не касаются причин, симптомов, диагноза, лечения, последующего ухода или принятия решений, хотя во многих из этих областей есть ссылки на информацию.
Факторы риска рака легких
Существующие критерии высокого риска
В настоящее время скрининг на рак легких рекомендуется (и покрывается большинством планов страхования и Medicare) для определенных групп высокого риска.Лица, отвечающие следующим критериям, подвергаются наибольшему риску, но продолжаются исследования, чтобы определить, у кого еще может быть повышенный риск развития рака легких.
- Вам от 55 до 80 лет
- У вас есть история курения за 30 упаковок в год (см. График справа, чтобы рассчитать историю за упаковку за год)
- Вы курили в настоящее время или бросили курить в течение последних 15 лет
* Вышеуказанные критерии рекомендованы Целевой группой профилактических служб США (USPSTF).Если вы не соответствуете критериям высокого риска, но опасаетесь, что подвержены риску рака легких, поговорите со своим врачом о том, подходит ли вам скрининг.
Употребление табака — основной фактор риска
Курение вызывает 80-85% рака легких в США. Риск возрастает с увеличением количества лет и пачек в день, которые человек курил. В отчете Главного хирурга 2010 года «Как табачный дым вызывает заболевание: биология и поведенческие основы заболевания, связанного с курением» говорится: «Не существует безопасного уровня табачного дыма.«Табачный дым вызывает изменения в клетках, которые могут привести к раку.
Чтобы снизить риск, не курите. Если вы курите, бросьте. Отказ от курения во многом улучшает вашу жизнь, и мы призываем нынешних курильщиков найти лучший способ бросить курить. Если вам (или близкому человеку) поставили диагноз рак легких и дым, продолжение курения может, среди прочего, повлиять на эффективность лечения и усугубить побочные эффекты. Узнайте больше о курении после диагностики рака легких.
Другие риски, связанные с курением
Курение трубки
Курение трубки связано с раком легких, но риск, по-видимому, ниже у людей, которые также не курят сигареты.По данным Национального института рака, риск рака легких у курильщиков сигар может быть таким же, как и у курильщиков сигарет, если учитывать различия в уровне вдыхания и количества выкуриваемых сигарет в день.
Марихуана
Однако не все исследования обнаружили связь между употреблением марихуаны и раком легких. марихуана.”
Электронные сигареты
Некоторые считают, что электронные сигареты являются более здоровой альтернативой и могут даже помочь людям бросить курить традиционные сигареты. Вот что мы знаем:
- Недостаточно доказательств того, что электронные сигареты являются эффективным инструментом для отказа от курения.
- Более 2000 нерегулируемых компаний производят электронные сигареты, и мы точно не знаем, какие ингредиенты они содержат и насколько они опасны.
- В некоторых электронных сигаретах используются растворы никотина, которые потенциально токсичны.
- Влияние электронных сигарет на курение среди молодежи также неизвестно, одна проблема заключается в том, что их использование может привести к курению традиционных сигарет. Мы знаем, что из-за использования ароматизированных электронных сигарет и маркетинговых методов дети и молодые люди становятся мишенью некоторых производителей электронных сигарет.
- Также неизвестно влияние вдыхания паров на пользователя или окружающих.
- Наконец, есть опасения, что электронные сигареты мешают бросить курить, потому что они приукрашивают и нормализуют курение.
Дополнительные факторы риска
Радон
Радон — это невидимый радиоактивный газ без запаха и вкуса, который естественным образом встречается в почве и камнях. Воздействие радона является второй по значимости причиной рака легких в США, но Агентство по охране окружающей среды считает, что радон является основной причиной рака легких у никогда не куривших. Узнайте больше на сайте радона Агентства по охране окружающей среды.
Асбест
Асбест — это минеральное волокно, которое десятилетиями использовалось в производстве многих продуктов, включая изоляцию и плитку.Безопасный уровень воздействия асбеста не установлен. Большая часть подвержена профессиональному воздействию (связанному с работой) и в значительной степени сосредоточена в машиностроительной, строительной и судостроительной отраслях. Однако сегодня во многих зданиях и школах все еще есть изделия из асбеста. Воздействие асбеста увеличивает риск рака легких, а также развития мезотелиомы — рака слизистой оболочки органов, который может начаться в легких, а также в брюшной полости, сердце и груди. Узнайте больше об асбесте и мезотелиоме в Фонде прикладных исследований мезотелиомы.
Регулярное воздействие вторичного табачного дыма (пассивное курение)
Регулярное воздействие дыма от употребления табака другими людьми может увеличить риск рака легких на 20-30% по сравнению с теми, кто не подвергается воздействию табака. По оценкам, пассивное курение вызывает более 3000 смертей от рака легких в год. Дополнительную информацию можно найти в информационном бюллетене «Пассивное курение и рак» Национального института рака.
Военная служба
Уровень курения среди военнослужащих выше, чем среди населения в целом, но прошлая и настоящая военная служба также увеличивает риск развития рака легких.По оценкам, уровень заболеваемости раком легких среди ветеранов может быть в два раза выше, чем среди населения в целом. Военные, находящиеся на действительной военной службе, продолжают сталкиваться с агентами, которые также могут увеличивать их будущий риск. Узнайте больше об усилиях Министерства обороны по исследованию рака легких.
Воздействия, характерные только для ветеранов, которые увеличивают риск рака легких, включают: дефолианты и гербициды, содержащие диоксин, такие как Agent Orange и другие, используемые для дефолиации демилитаризованной зоны, а также воздействие асбеста на борту судов, на верфях и на подводных лодках; выхлопные газы, дым от горящих нефтяных скважин, керосиновые плиты и обогреватели в закрытых палатках и другие выбросы с поля боя.Исследования продолжаются по этим темам, а также по влиянию обедненного урана на риск рака легких.
Возраст
Возраст является фактором риска многих видов рака, включая рак легких. Средний возраст в США для диагностики рака легких составляет около 70 лет. Около 10% случаев рака легких возникает у людей моложе 50 лет.
Воздействие на окружающую среду, промышленные химикаты
Экологические химические вещества, включая мышьяк, бериллий, загрязнение воздуха выхлопными газами автомобилей и дизельных двигателей, промышленными и бытовыми выбросами, а также выбросами электростанций.
Имеются свидетельства того, что воздействие промышленных химикатов в определенных профессиях или отраслях увеличивает риск рака легких. К ним относятся: производство алюминия и кокса; парикмахер и парикмахеры; подземная добыча гематита с облучением радоном; литье из чугуна и стали; художники; производство художественного стекла, стеклотары и прессованной посуды; резиновая промышленность. Узнайте о профессиональных канцерогенных веществах, прочитав Перечень профессиональных канцерогенов, опубликованный в выпуске журнала Environmental Health Perspectives за ноябрь 2004 года.
Бета-каротин
Исследование, изучающее, может ли использование добавок бета-каротина снизить риск рака легких у лиц с высоким риском (нынешние курильщики и работники, подвергающиеся воздействию асбеста), вместо этого показало обратное. Использование добавок бета-каротина фактически увеличило количество диагнозов рака легких (и смертей от рака легких) у тех, кто уже находится в группе высокого риска. Важно отметить, что считается, что продукты, содержащие бета-каротин, снижают риск развития рака легких, как и увеличение потребления фруктов.
Проблемы, связанные со здоровьем
Даже среди никогда не куривших эмфизема, хронический бронхит и астма могут увеличить риск рака легких на 50–100%. Кроме того, поскольку все больше людей переживают рак, мы узнаем больше о долгосрочных эффектах лучевой терапии грудной клетки. У выживших после рака груди риск рака легких был выше у тех, кто получил лучевую терапию после мастэктомии, поскольку легкое находилось на той же стороне, что и исходный рак груди. Риск увеличивается с полученной дозой облучения.Похоже, что такой же риск не наблюдается при более новом лечении лучевой терапии молочной железы после лампэктомии. Курение, по-видимому, увеличивает риск рака легких, связанный с радиацией. При болезни Ходжкина повышенный риск рака легких у выживших в значительной степени связан с дозами радиации, используемыми при лечении. Как и при раке груди, риск увеличивается с полученной дозой облучения.
Семейный анамнез
Исследования показывают, что взрослые, у которых был или был полностью родственный родитель или брат или сестра с раком легких, особенно те, кому был поставлен диагноз до 50 лет или у которых диагностировано несколько родственников, подвергаются повышенному риску рака легких.
В настоящее время проводятся исследования, чтобы лучше понять связь семьи с раком легких. Если у вас есть хотя бы один биологически связанный родственник, у которого диагностирован рак легких, рассмотрите возможность присоединения к исследованию семейного рака легких Медицинского колледжа Университета Цинциннати.


 НМКРЛ имеет подкатегории, наиболее распространенными среди которых являются аденокарцинома и плоскоклеточный рак. Этот вид рака легких нередко является показанием к хирургическому лечению, особенно на ранних стадиях заболевания.
НМКРЛ имеет подкатегории, наиболее распространенными среди которых являются аденокарцинома и плоскоклеточный рак. Этот вид рака легких нередко является показанием к хирургическому лечению, особенно на ранних стадиях заболевания.
 Наиболее распространенными хирургическими процедурами являются медиастиноскопия, которая используется для биопсии лимфатических узлов в центральной части грудной полости; видео-ассистированная торакоскопическая операция (VATS) — менее инвазивный метод для биопсии легочной ткани; и торакотомия, которая представляет собой полостную операцию по удалению крупных частей легочной ткани или опухолей.
Наиболее распространенными хирургическими процедурами являются медиастиноскопия, которая используется для биопсии лимфатических узлов в центральной части грудной полости; видео-ассистированная торакоскопическая операция (VATS) — менее инвазивный метод для биопсии легочной ткани; и торакотомия, которая представляет собой полостную операцию по удалению крупных частей легочной ткани или опухолей.


 N Engl J Med . 2018; 378 (21): 1999-2009. DOI: 10.1056 / NEJMoa1715907
N Engl J Med . 2018; 378 (21): 1999-2009. DOI: 10.1056 / NEJMoa1715907