Бронхообструктивный синдром (бронхообструкция): причины, диагностика, лечение
Бронхообструктивный синдром — понятие, обозначающее совокупность клинических признаков, обусловленных нарушением прохождения воздушного потока по бронхиальному дереву. Под воздействием неблагоприятных эндогенных или экзогенных факторов слизистая оболочка бронхов воспаляется, отекает, образуется избыток слизи, которая скапливается в их просвете и сгущается. Крупные и мелкие бронхи сужаются, спазмируются и становятся непроходимыми.
Синдром бронхообструкции распространен в педиатрии. У детей он протекает намного тяжелее, чем у взрослых. Патологическое состояние чаще всего диагностируется у малышей, в наибольшей степени подверженных респираторным инфекциям. У аллергиков признаки бронхообструкции выявляются в 50% всех случаев.
Факторы, влияющие на развитие синдрома:
- ОРВИ,
- анатомо-физиологические особенности организма,
- возраст,
- экология,
- социально-бытовые условия,
- отягощенный семейный аллергический анамнез.

Бронхообструктивный синдром проявляется экспираторной или смешанной одышкой, приступами удушья по утрам после ночного сна, шумным дыханием, втяжение межреберных промежутков, мучительным кашлем с трудноотделяемой мокротой, тахипноэ, болью в груди,усиливающейся во время кашля. Бронхообструктивный синдром в англоязычных странах называют синдромом свистящего дыхания. Длительность приступа бронхообструкции колеблется от нескольких минут до нескольких часов.
Лечение синдрома бронхообструкции направлено на устранение причин, вызвавших его. Специалистам необходимо определить, чем вызван синдром, а затем назначать лечение. У одних больных полностью исчезает симптоматика патологии на фоне этиотропной терапии, а у других происходит прогрессирование или хронизация процесса, наступает инвалидность и даже летальный исход.
Классификация
Согласно этиологической классификации бронхообструктивный синдром бывает:
- Инфекционным — при наличии бактериальной или вирусной инфекции в организме,
- Аллергическим — на фоне бронхиальной астмы, поллиноза и аллергических бронхитов,
- Обтурационным — закупорка бронхов вязким секретом или инородными телами, бронхолитиаз,
- Гемодинамическим — нарушение легочного кровотока,
- Наследственным — генетически обусловленным,
- Ирритативным — термические и химические ожоги бронхов,
- Неврогенным — энцефалит, истерия, постконтузионный синдром,
- Токсико-химическим — отравление медикаментами и химическими веществами,
- Вегетативным — активация блуждающего нерва.

По степени повреждения:
- легкая степень — наличие свистящих хрипов,
- среднетяжелая степень — смешанная одышка в покое, акроцианоз, втяжение межреберных промежутков,
- тяжелая степень — нарушается общее самочувствие больного, цианоз, шумное дыхание,
- скрытая обструкция — отсутствие клинических признаков патологии, положительная проба с бронхолитиком.
Этиология
Бронхообструктивный синдром – проявление различных заболеваний дыхательной, нервной, пищеварительной и других систем организма.
- Вирусная инфекция — аденовирусная, гриппозная, парагриппозная, респираторно-синцитиальная.
- Бактериальная инфекция — микоплазменная, туберкулезная, сифилитическая.
- Патология бронхо-легочной системы — воспаление бронхов, бронхиол, легких, аномалии развития органов дыхания, бронхиальная астма, эмфизема легких, ателектазы, ХОБЛ.
- Болезни ЖКТ — недостаточность нижнего сфинктера пищевода, рефлюкс-эзофагит, язвенная болезнь, диафрагмальная грыжа.

- Врожденные патологии — детский церебральный паралич, атрезия бронхов, бронхомаляция, бронхобилиарный свищ, врожденные бронхоэктазы.
- Инфицирование различными паразитами – круглыми гельминтами.
- Недуги нервной системы, полученные в результате родовой травмы.
- Заболевания сердца и сосудов – врожденные пороки сердца, тромбоэмболия легочной артерии, аномалии развития.
- Эндокринные, системные и иммунные расстройства — васкулиты, иммунодефициты, гиперплазия региональных лимфатических узлов.
- Онкопатология.
- Травматическое повреждение, ожоги, отравления, побочное действие медикаментов.
Бронхообструкция может быть обусловлена отрицательным воздействием факторов окружающей среды, к которым относится некачественная вода, солнечная радиация, пыль, загрязненная атмосфера промышленными газами. К неспецифическим факторам относятся: переохлаждение, физическое перенапряжение, резкие запахи.
Пассивное курение в семье также способствует бронхообструкции у детей. Табачный дым вызывает дистрофию бронхиальных желез и разрушение эпителиального покрова бронхов, подавляет направленную миграцию нейтрофилов, замедляет продвижение слизи, снижает активность местного и общего иммунитета.
Табачный дым вызывает дистрофию бронхиальных желез и разрушение эпителиального покрова бронхов, подавляет направленную миграцию нейтрофилов, замедляет продвижение слизи, снижает активность местного и общего иммунитета.
Сложные или преждевременные роды, невозможность грудного кормления, злоупотребление алкогольными напитками беременной женщиной, выраженная реакция бронхов на внешние раздражители, недостаточная масса тела новорожденного, внутриутробное поражение ЦНС, дефицит витамина Д, частый плач, ОРВИ на первом году жизни – факторы, предрасполагающие к обструкции бронхов у малышей.
Анатомо-физиологические особенности детского организма способствуют развитию бронхообструктивного синдрома. У детей до 3 лет дыхательные пути отличаются определенной узостью, железистая ткань легко поддается гиперплазии, образуется более вязкая мокрота, недостаточный объем гладкой мускулатуры, ослабленный местный и общий иммунитет, особенное положение диафрагмы, податливые хрящи бронхиального тракта, эластичные костные структуры грудной клетки.
Патогенез
Воспаление слизистой оболочки бронхов вызвано действием патогенных биологических агентов, аллергенов, токсинов. Под их влиянием макрофаги синтезируют медиаторы воспаления, активируется каскад иммунных реакций, происходит выброс в системный ток крови гистамина, серотонина. Следующая стадия воспаления характеризуется синтезом простогландинов, тромбоксана, простациклина и лейкотриенов. Под их воздействием повышается проницаемость сосудов, возникает местное воспаление слизистой, она отекает, образуется вязкая слизь, развивается бронхоспазм, формируются клинические признаки болезни.
развитие брохнообструкции при астме
Звенья патогенеза синдрома бронхообструкции:
- Воспалительная инфильтрация слизистой бронхов,
- Нарушение проходимости бронхов,
- Спазматическое сокращения мышц,
- Сгущение слизи,
- Разрушение эпителиального покрова,
- Изменение нормальной структуры бронхиального дерева,
- Нарушение иммунной защиты, дисфункция макрофагальной системы,
- Нарушение легочной вентиляции,
- Дыхательная недостаточность.

Симптоматика
Клинические симптомы патологии:
- Одышка с удлинением выдоха,
- Громкое дыхание со свистом, хрипом и шумом,
- Приступообразный кашель, не приносящий облегчения,
- Ртхождение вязкой мокроты в конце приступа,
- Оральная крепитация,
- Хрипы разного калибра, слышимые на расстоянии,
- Втяжение межреберных промежутков при дыхании,
- Дефицит веса,
- Горизонтальное расположение ребер,
- Непропорциональная грудная клетка,
- Рвота,
- Головная боль,
- Бессонница,
- Гипергидроз,
- Спутанность сознания,
- Вынужденное положение больных,
- Акроцианоз.
Общее состояние больных оценивается как удовлетворительное. Дети становятся слабыми, капризными, плохо спят и едят, мало играют и много лежат, шумно и громко дышат. Хрипы и свист слышны на расстоянии. В тяжелых случаях возникают приступы остановки дыхания, одышка, мучительный кашель. Со временем у таких детей расширяются и выпячиваются межреберные промежутки, ход ребер становится горизонтальным.
Со временем у таких детей расширяются и выпячиваются межреберные промежутки, ход ребер становится горизонтальным.
Диагностика
Диагностика заболеваний, проявляющихся бронхообструктивным синдромом, начинается с изучения анамнеза жизни и болезни, клинических признаков, данных визуального осмотра. Для подтверждения или опровержения предполагаемого диагноза переходят к лабораторным и инструментальным методам исследования.
Методы, позволяющие обнаружить патологию:
- в периферической крови — неспецифические признаки воспаления, эозинофилия при аллергии,
- иммунограмма — определение титра иммуноглобулинов G, M и IgA,
- аллергопроба – скарификационные пробы,
- анализ крови на патогенные вирусы, гельминты и бактерии,
- бактериологическое исследование отделяемого носоглотки,
- в мокроте – эозинофилы, спирали Куршмана и кристаллы Шарко-Лейдена,
- бронхография,
- рентгенографическое исследование выявляет расширение корней легких, признаки поражения отдельных участков, наличие новообразований,
- спирография позволяет получить ряд показателей, которые описывают вентиляцию легких,
- пневмотахометрия – уменьшение объемной скорости форсированного выдоха,
- ангиопульмонография,
- ЭКГ,
- ПЦР,
- КТ и МРТ.

Дифференциальную диагностику бронхообструктивного синдрома проводят с пневмонией, раком легких, коклюшем, бронхиальной астмой, ХОБЛ, туберкулезом легких, рефлюксной болезнью.
Лечение
Если ребенку стало плохо, необходимо вызвать скорую помощь, расстегнуть ворот одежды, успокоить малыша и не показывать волнения, обеспечить приток свежего воздуха, придать удобное положение. Облегчить состояние поможет антигистаминный препарат и горячие ножные ванны.
Прежде чем преступить к лечению бронхообструктивного синдрома, необходимо определить первопричину и поставить правильный диагноз. Больных детей госпитализируют в стационар, где и оказывают неотложную бронхолитическую терапию. Первая помощь при патологии заключается в ингаляционном введении бронхолитиков – «Беродуала», «Атровента», «Беротека». Больному ребенку достаточно 2 ингаляционные дозы через спейсер или небулайзер 3-4 раза в день. При неэффективности ингаляционной терапии вводят внутривенно струйно «Эуфиллин» или капельно физиологический раствор.
После оказания неотложной помощи больным назначают следующие группы препаратов:
- Бронхолитики – «Эуфиллин», «Аминофиллин», симпатомиметики – «Фенотерол», «Сальбутамол».
- Антигистаминные средства при аллергической этиологии синдрома – «Зодак», «Кларитин», «Зиртек».
- Противовоспалительным и муколитическим действием обладает «Эреспал».
- Глюкокортикостероиды – «Пульмикорт», а также «Преднизолон» при тяжелом течении патологии.
- Муколитики – «Амбробене», «Лазолван», «Ацетилцистеин».
- Противокашлевые препараты – «Бронхолитин», «Мукопронт».
- Иммуностимуляторы – «Бронхомунал», «Ликопид».
- Противовирусные препараты – «Вартекс», «Циклоферон».
- Оксигенотерапию проводят с помощью носовых катетеров и специальной маски.
Для коррекции дренажной функции бронхов в домашних условиях необходимо соблюдать клинические рекомендации специалистов: увлажнять воздух в помещении, массировать грудную клетку, заниматься лечебной дыхательной гимнастикой, пройти курс кислородотерапии с применением кислородных коктейлей. Если у ребенка нет лихорадки, его следует выводить на прогулку. Насыщение организма кислородом и осуществление вентиляции легких помогут остановить дальнейшее развитие синдрома. Здоровое питание, регулярное проветривание помещения, влажная уборка — мероприятия, необходимые для скорейшего выздоровления.
Если у ребенка нет лихорадки, его следует выводить на прогулку. Насыщение организма кислородом и осуществление вентиляции легких помогут остановить дальнейшее развитие синдрома. Здоровое питание, регулярное проветривание помещения, влажная уборка — мероприятия, необходимые для скорейшего выздоровления.
Необходимость проведения антибактериальной терапия решается строго индивидуально. Обычно больным назначают антибиотики из группы бета-лактамов, макролидов и фторхинолонов – «Амоксиклав», «Азитромицин», «Офлоксацин». Показания для их применения: лихорадка более 3 дней, отсутствие эффекта от бронхолитиков, нарастание явлений интоксикации.
Бронхообструктивный синдром у детей имеет серьезный прогноз. Острые бронхиты и бронхиолиты обычно заканчиваются выздоровлением. При наличии бронхолегочной дисплазии синдром часто переходит в бронхиальную астму. Тяжелая форма патологии на фоне несвоевременной и неправильной терапии ухудшает качество жизни больных и в особо запущенных случаях заканчивается смертельным исходом.
Видео: лекция о бронхообструктивном синдроме
Видео: дифдиагностика и лечение бронхообструктивного синдрома у детей
Видео: ТВ-передача о бронхообструктивном синдроме
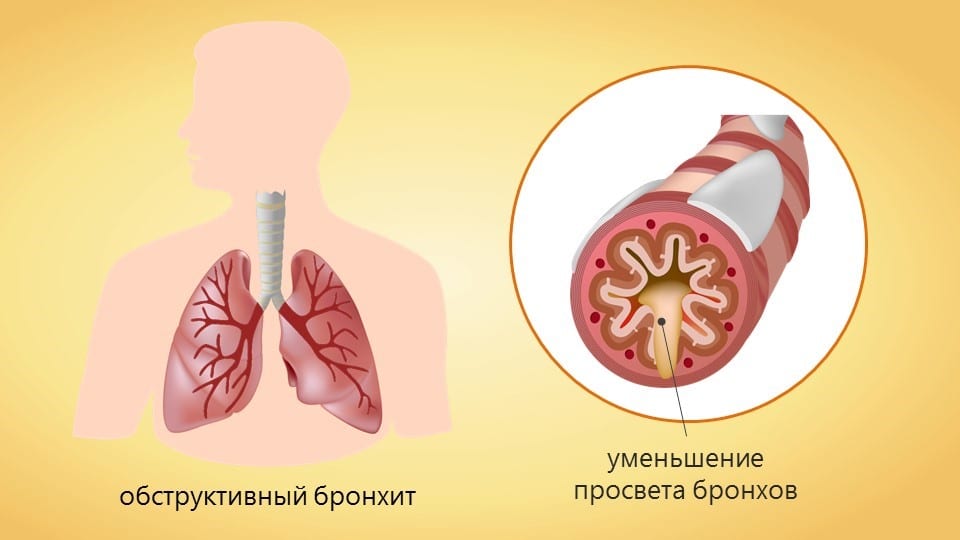
Обструктивный бронхит у детей: 6 основных способов лечения
Воспаление бронхов — нередкое явление в детском возрасте. Простые формы заболевания при соблюдении схемы лечения, назначенной врачом, успешно лечатся и в домашних условиях. Но это не относится к такому виду недуга, как обструктивный бронхит у детей, поскольку большинство малышей с подобным диагнозом нуждаются в госпитализации.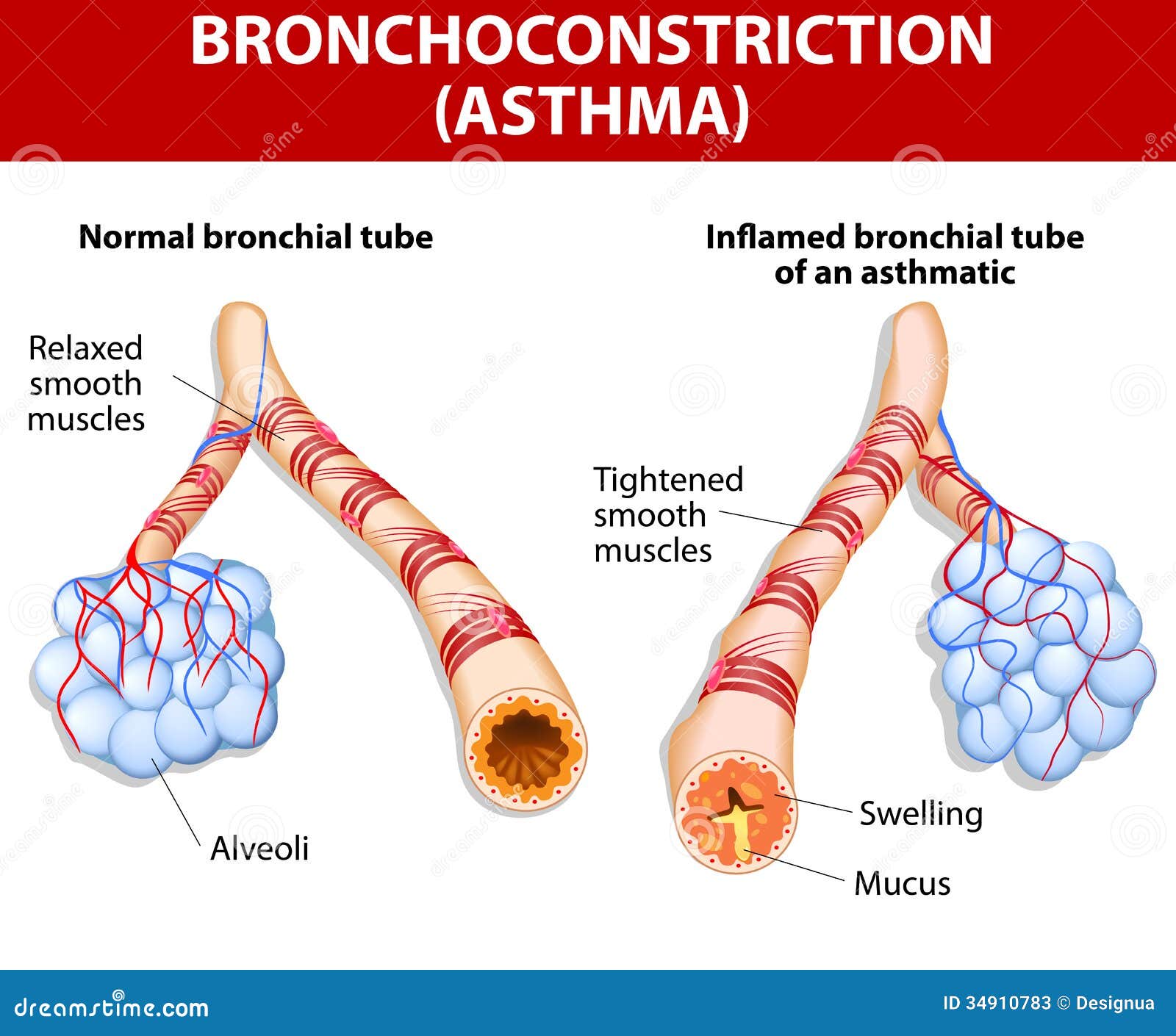
Задача родителей — вовремя обратить внимание на признаки обструкции и вызвать врача. При обструктивном бронхите риск развития серьезных осложнений достаточно высок, и только своевременная терапия помогает избежать опасных для жизни последствий болезни.
Что такое обструктивный бронхит у детей?
Термином «обструктивный бронхит» в медицине обозначается воспаление всех элементов бронхиального дерева, протекающее с нарушением нормальной проходимости бронхов (обструкцией). В результате затрудняется отхождение вырабатываемой слизи, в свою очередь это связано со следующими изменениями:
- бронхиальные мышцы спазмируются, и, как следствие, просвет бронхиального дерева сужается;
- повышается вязкость мокроты, она становится плотной, трудноотделимой. Одновременно слизи начинает вырабатываться больше;
- нарастает отечность слизистых оболочек, что еще больше сужает дыхательные пути.
Частое развитие обструктивного бронхита в дошкольном возрасте связано с анатомо-физиологическими особенностями дыхательной системы, с несовершенством иммунной системы и с особым функционированием бронхов.
Обструктивный бронхит у детей чаще всего возникает в первые три года их жизни. Согласно статистике, в этом возрасте более 20 % малышей переносят бронхит с явлениями обструкции. В группу риска входят часто болеющие респираторными инфекциями (более 6 раз в год) дети и дошкольники с аллергозаболеваниями в анамнезе. В большинстве случаев обструктивный бронхит возникает в холодные месяца года.
Рецидивирующая форм обструктивного бронхита повышает вероятность развития бронхиальной астмы, облитерирующего бронхиолита, эмфиземы, хронического бронхита.
Основные причины заболевания
В большей половине случаев причиной обструктивного бронхита в возрасте до трех лет является заражение дыхательной системы вирусами. Чаще всего это:
- вирусы гриппа и парагриппа;
- энтеровирус;
- аденовирусы;
- респираторно-синцитиальный вирусный микроорганизм.
Среди бактериальных возбудителей болезни выделяют Strеptococcuspneumoniae, Haemophilusinfluenza. Moraxellacatarrhalis.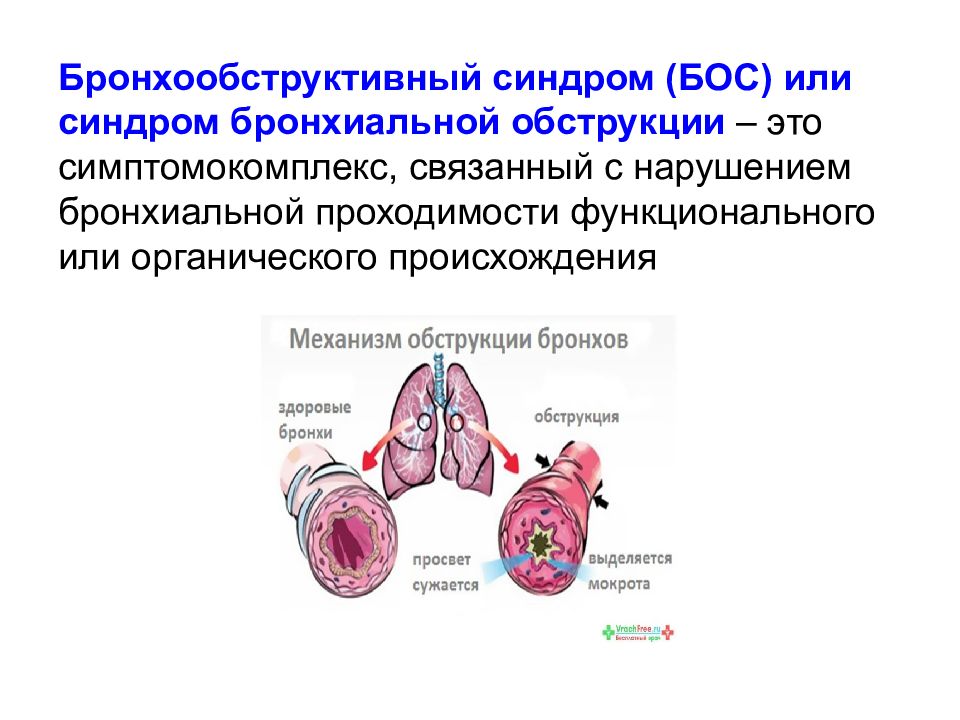 Обструкция может развиться на фоне вирусно-бактериального заражения, привыявлении рецидивирующих форм патологии необходимо исключить наличие в организме микоплазм, хламидий, цитомегаловируса, герпесной инфекции. Чаще всего первые признаки обструкции бронхов у детей младшего возраста появляются на фоне ОРВИ.
Обструкция может развиться на фоне вирусно-бактериального заражения, привыявлении рецидивирующих форм патологии необходимо исключить наличие в организме микоплазм, хламидий, цитомегаловируса, герпесной инфекции. Чаще всего первые признаки обструкции бронхов у детей младшего возраста появляются на фоне ОРВИ.
Выделяют несколько провоцирующих факторов заболевания, объясняющих частое возникновение обструкции в детском возрасте, это:
- особенности строения и функций дыхательной системы:
- узость просвета всех дыхательных путей;
- недостаточное функционирование органов местного иммунитета;
- недостаточная эластичность каркаса бронхиального дерева;
- слабость мышц дыхательной системы;
- повышенная вязкость вырабатываемой слизи;
- у детей раннего возраста — преобладание сна над активным периодом, длительное пребывание в положении на спине, что ухудшает дренажные свойства бронхов;
- патологии матери в период вынашивания ребенка — угроза выкидыша, гестоз и токсикоз, инфекции;
- вредные привычки беременной женщины — з
Причины бронхиальной обструкции у детей и направления терапии
Опубликовано в журнале:
РМЖ ПЕДИАТРИЯ »» № 22 2011
Н. А. Геппе, Н.А. Селиверстова, В.С. Малышев*, Н.Г. Машукова, Н.Г. Колосова
А. Геппе, Н.А. Селиверстова, В.С. Малышев*, Н.Г. Машукова, Н.Г. Колосова
1 МГМУ имени И.М. Сеченова, *Московский энергетический институт
Нарушение бронхиальной проходимости является одной их наиболее частых проблем в педиатрической практике. Причины разнообразны, но наиболее часто бронхиальная обструкция возникает при острых респираторных вирусных инфекциях. При этом необходимо учитывать факторы, предрасполагающие к возникновению нарушений бронхиальной проходимости.
Описано несколько фенотипов бронхиальной обструкции, возникающей у детей, имеющих как клиническое, так и прогностическое значение. Выделяют фенотип транзиторной обструкции (обструкция только в первые три года жизни), персистирующей обструкции (обструкция в течение первых 6 лет жизни) и обструкции с поздним началом (после 3 лет). Также у детей с обструкцией после 3 лет выделяют атопический и неатопический фенотип, сочетающийся с атопий и без атопии. Представляет интерес длительное наблюдение за детьми, в котором показано, что у детей с транзиторной обструкцией есть изменения легочной функции с рождения, еще до первого эпизода обструкции [1]. Дети с персистирующей обструкцией (высокий риск развития бронхиальной астмы) имеют нормальную функцию легких при рождении, но к 4-6 годам у них формируются обструктивные нарушения. Таким образом, один из существенных факторов, предрасполагающий к вирус-индуцированным симптомам в первые годы жизни — это уменьшение просвета дыхательных путей вследствие антенатальных проблем.
Представляет интерес длительное наблюдение за детьми, в котором показано, что у детей с транзиторной обструкцией есть изменения легочной функции с рождения, еще до первого эпизода обструкции [1]. Дети с персистирующей обструкцией (высокий риск развития бронхиальной астмы) имеют нормальную функцию легких при рождении, но к 4-6 годам у них формируются обструктивные нарушения. Таким образом, один из существенных факторов, предрасполагающий к вирус-индуцированным симптомам в первые годы жизни — это уменьшение просвета дыхательных путей вследствие антенатальных проблем.
Обструктивные заболевания легких у недоношенных детей обычно связывают с комбинацией незрелости легких, оксигенотерапией и вентиляторной поддержкой. Особенно это касается детей с низкой массой при рождении и тяжелым неонатальным респираторным заболеванием. Однако недоношенные дети с изначальным отсутствием неонатального заболевания также имеют сниженную респираторную функцию при обследовании в более позднем возрасте. Предполагается, что у недоношенных детей может быть склонность к «обструктивному паттерну». Тестирование на втором году здоровых недоношенных показывает, что у этих детей не нормализуется функция легких в раннем возрасте, в период наибольшего роста легких. Механизм персистирующего снижения функции дыхательных путей детей, родившихся недоношенными, не детерминирован, и может быть результатом более мелкого размера дыхательных путей и снижения эластичности легочной ткани, вторично к изменению альвеоляризации легочной паренхимы.
Предполагается, что у недоношенных детей может быть склонность к «обструктивному паттерну». Тестирование на втором году здоровых недоношенных показывает, что у этих детей не нормализуется функция легких в раннем возрасте, в период наибольшего роста легких. Механизм персистирующего снижения функции дыхательных путей детей, родившихся недоношенными, не детерминирован, и может быть результатом более мелкого размера дыхательных путей и снижения эластичности легочной ткани, вторично к изменению альвеоляризации легочной паренхимы.
Респираторные вирусные инфекции в раннем возрасте могут быть значительно более важным фактором риска бронхиальной обструкции, чем атопия. Тяжелые случаи бронхиолита в первые годы жизни нередко вызываются респираторно-синцитиальным вирусом (РСВ) в зимние месяцы и имеет типичный сезонный характер. Тяжелый бронхиолит сочетается в 30-40% случаев с вероятностью астмы. Риновирус (РВ) — следующий по частоте вызывающий бронхиолит. С клиникой бронхиолита протекают и другие вирусы, такие как человеческий метапневмовирус, человеческий бокавирус, энтеровирус, аденовирус, вирус гриппа, человеческий коронавирус и вирус парагриппа.
Новые технологии определения респираторных вирусов показали, что вирусы (особенно риновирусы) сочетаются с большим процентом обструктивных нарушений. Риновирус, как и РСВ, у детей повышает риск развития астмы, когда протекает с умеренной или тяжелой инфекцией нижних дыхательных путей. РСВ вызывает более тяжелые заболевания, особенно при сочетании РСВ и человеческого бокавируса [2,3]. Бронхиолит при РВ инфекции протекает в более легкой форме, чем при РСВ.
У новорожденных с риском атопии показано, что умеренные/тяжелые обструкции при РВ заболевании — более значимый фактор риска не только для развития повторных эпизодов обструкции к 3 годам, но также к развитию астмы к 6 годам [4,5]. Главным фактором риска рецидивирующей бронхиальной обструкции после острого бронхиолита была РВ инфекция и положительная наследственность по астме. У детей с РВ инфекцией, которые получали оральную КС терапию, вероятность развития рецидивирующей обструкции, в последующем была существенно меньше [6]. Исследование баланса между Th2 и 2 типами иммунного ответа показало, что у детей с атопией периферические мононуклеарные клетки, инкубированные с РВ вирусом, продуцируют IL-10, тогда как у неатопических субъектов IFN-с и IL-12 [7]. Сниженая способность мононуклеарных клеток крови к продукции гамма-интерферона (INF-α) и IL-12 уменьшает вирусный клиренс и может приводить к развитию обострения астмы путем поддержки Th3 типа воспаления и недостаточности 1 типа антивирусного иммунного ответа. На сегодняшний день обсуждаются два важных механизма: ведет ли рецидивирующая инфекция дыхательных путей к повреждению и таким образом к астме или дети предрасположены к астме, так как у них измененный уровень INF или другой цитокиновый ответ.
Исследование баланса между Th2 и 2 типами иммунного ответа показало, что у детей с атопией периферические мононуклеарные клетки, инкубированные с РВ вирусом, продуцируют IL-10, тогда как у неатопических субъектов IFN-с и IL-12 [7]. Сниженая способность мононуклеарных клеток крови к продукции гамма-интерферона (INF-α) и IL-12 уменьшает вирусный клиренс и может приводить к развитию обострения астмы путем поддержки Th3 типа воспаления и недостаточности 1 типа антивирусного иммунного ответа. На сегодняшний день обсуждаются два важных механизма: ведет ли рецидивирующая инфекция дыхательных путей к повреждению и таким образом к астме или дети предрасположены к астме, так как у них измененный уровень INF или другой цитокиновый ответ.
За последние 20 лет увеличилось количество генетических вариаций, которые сочетаются с астмой. Эти исследования показывают, что фенотип астмы тесно связан с атопией. Полиморфизм в генах относящихся к Th-2 ответу сочетается с ухудшением продукции специфических антител и цитокиновым ответом.
Для лучшего понимания постнатальных событий имеет важное значение информация об антенатальном периоде развития. Ветвление дыхательных путей происходит в первой половине беременности, и поэтому особенности течения антенатального периода могут влиять на калибр дыхательных путей. Наиболее хорошо изучен ген ADAM33, который важен для антенатального развития легких и особенно в морфогенезе разветвления и калибра дыхательных путей в 3- и 5-летнем возрасте [8,9].
Курение матери оказывает прямое действие на калибр дыхательных путей, развивающихся у плода, что сказывается на легких (особенно в уменьшении развития альвеол) [10]. Таким образом, важны взаимодействия генетической составляющей и окружающих факторов. Атопия у матери также сочетается с ухудшением легочной функции у новорожденных, хотя точный механизм пока не известен. У детей от матерей с преэклампсией и гипертензией, а также с диабетом повышен риск транзиторной ранней обструкции, персистирующей обструкции и более поздней обструкции [11]. Назначение антибиотиков во время родов сочетается как с ранней транзиторной обструкцией, так и с персистирующей обструкцией [11].
Назначение антибиотиков во время родов сочетается как с ранней транзиторной обструкцией, так и с персистирующей обструкцией [11].
Курение матери ведет к снижению IL-4 и INF-γ в пуповинной крови и повышает пролиферацию мононуклеарных клеток в пуповинной крови на домашнюю пыль. Другие исследования клеток пуповиной крови показывают, что курение матери сочетается с увеличением IL-13 и уменьшением INF-γ mRNA-ответа после стимуляции, а также продукцией TNF-α. Эпидемиологические исследования показывают, что материнское курение и атопия сочетаются с последующим бронхиолитом у детей первого года жизни. Фетальная иммунология показывает, что в пуповинной крови IL-12 и sCD30 ниже у детей, у которых развивается бронхиолит, что, возможно, обусловлено предшествующей бронхиолиту бронхиальной обструкцией. Таким образом, курение матери оказывает большое влияние на иммунный ответ у новорожденных, как и на анатомические особенности.
РСВ бронхиолит сочетается с увеличением экспрессии цитокинов Th3 паттерна или, что также возможно, снижением Th2, что делает привлекательной гипотезу, что РСВ вызывает астму. Бронхиальная гиперреактивность после бронхиолита сохраняется длительно и может объяснить предрасположенность к бронхиальной обструкции в более позднем возрасте. С другой стороны, специфические РСВ IgE, найденные у детей с бронхиолитом, показывает, что результатом ранней РСВ инфекции у отдельных пациентов может быть Th3 иммунный ответ, таким образом предрасполагая к развитию у этих детей бронхиальной астмы [12,13].
Бронхиальная гиперреактивность после бронхиолита сохраняется длительно и может объяснить предрасположенность к бронхиальной обструкции в более позднем возрасте. С другой стороны, специфические РСВ IgE, найденные у детей с бронхиолитом, показывает, что результатом ранней РСВ инфекции у отдельных пациентов может быть Th3 иммунный ответ, таким образом предрасполагая к развитию у этих детей бронхиальной астмы [12,13].
Генетические исследования показывают, что полиморфизм, например, IL-8, IL-10, и TLR генов сочетается с тяжестью РСВ инфекции. Предполагается, что не сама РСВ ведет к астме у ребенка, не имеющего отклонений. Возможное влияние РСВ бронхиолита на развитие астмы обусловлено предшествующими генетическими факторами и антенатальными воздействиями. Это позволяет рассматривать бронхиолит, как маркер данных проблем, а не причину последующих нарушений, и присоединение вирусных инфекций у таких детей будет протекать с большим числом проблем и более тяжелыми появлениями обструкции дыхательный путей, которые требуют быстрого и адекватного терапевтического вмешательства.
С другой стороны, есть точка зрения, что ранняя экспозиция вирусных инфекций может защищать против возникновения астмы в более позднем возрасте. Начало посещения ребенком организованного учреждения в раннем возрасте сочетается с более частой обструкцией, но реже формированием астмы к 6 годам.
Хорошо известно, что большинство обострений астмы сочетаются с вирусными инфекциями. В раннем возрасте диагноз астмы представляет большие трудности в связи с вариабельностью и неспецифичностью клинических проявлений, а также трудностями функциональной диагностики. У детей дошкольного возраста и школьников отмечается взаимодействие между экспозицией аллергенов, сенсибилизацией к аллергенам и вирусными инфекциями.
Неатопический фенотип бронхиальной обструкции создает наибольшие трудности для диагностики и понимания. Известно, что тяжелая аденовирусная инфекция может вести к длительной бронхиальной обструкции у ранее здорового ребенка. Респираторные вирусы, включая риновирус, РСВ, метапневмовирус, грипп, влияют на респираторный эпителий нижних дыхательных путей и провоцируют местную иммунологическую реакцию, как и протективный противовирусный ответ с продукцией интерферонов, хемотаксисом и активацией NK-клеток. Эпителий дыхательных путей является ключевым компонентом в респираторных нарушениях. Респираторные вирусы повреждают мерцательный эпителий слизистой оболочки дыхательного тракта, увеличивают ее проницаемость для аллергенов, токсических веществ и чувствительность рецепторов подслизистого слоя бронхов, что вызывает повышение бронхиальной гиперреактивности и возникновение обструктивных проявлений у детей. Бронхиальный эпителий может продуцировать и отвечать на сигналы иммунных клеток, которые вовлечены в инициацию и созревание врожденного и адаптивного иммунного ответа, включая воспалительный ответ к патогенам, Th3 ответ, структурные изменения дыхательных путей и ангиогенез.
Эпителий дыхательных путей является ключевым компонентом в респираторных нарушениях. Респираторные вирусы повреждают мерцательный эпителий слизистой оболочки дыхательного тракта, увеличивают ее проницаемость для аллергенов, токсических веществ и чувствительность рецепторов подслизистого слоя бронхов, что вызывает повышение бронхиальной гиперреактивности и возникновение обструктивных проявлений у детей. Бронхиальный эпителий может продуцировать и отвечать на сигналы иммунных клеток, которые вовлечены в инициацию и созревание врожденного и адаптивного иммунного ответа, включая воспалительный ответ к патогенам, Th3 ответ, структурные изменения дыхательных путей и ангиогенез.
С учетом разнообразия клинических симптомов и их выраженности при лечении детей с острыми респираторными заболеваниями используются препараты, воздействующие на различные компоненты патологического процесса. При наличии бронхиальной обструкции независимо от причин возникновения основными симптоматическими препаратами для лечения являются ß2-агонисты короткого действия, которые могут назначаться в ингаляционной форме или внутрь.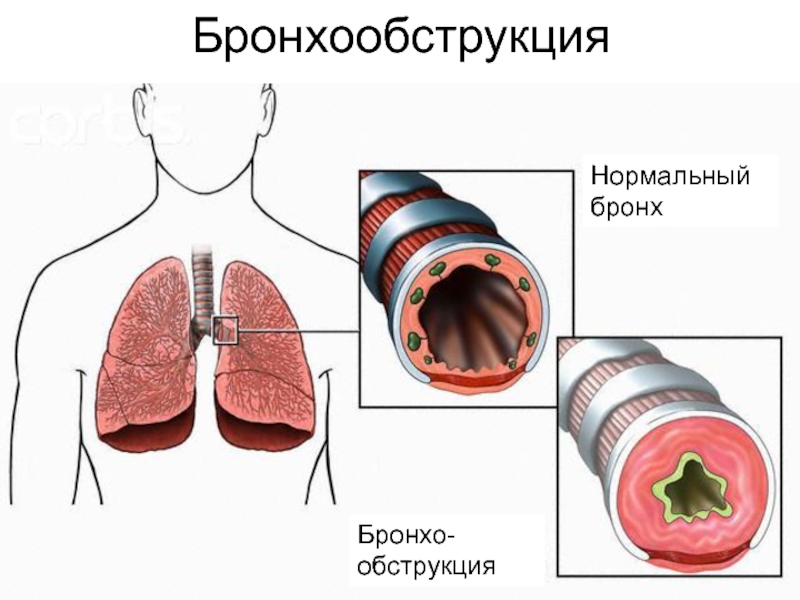 К современным тенденциям относится применение комбинированных препаратов разнонаправленного, но взаимодополняющего действия. У детей раннего возраста при тяжелой и среднетяжелой обструкции показана эффективность ингаляционного применения комбинации бронхолитика и муколитика [14]. Возможно добавление к этой комбинации ингаляционного глюкокортикостероида. Сходный принцип использован при нетяжелых проявлениях бронхиальной обструкции во время ОРВИ, при появлении кашля. Для эффективного отхождения мокроты и улучшения бронхиальной проходимости при острых респираторных вирусных инфекциях положительный эффект может быть достигнут при сочетанном назначении муколитиков и бронхолитиков.
К современным тенденциям относится применение комбинированных препаратов разнонаправленного, но взаимодополняющего действия. У детей раннего возраста при тяжелой и среднетяжелой обструкции показана эффективность ингаляционного применения комбинации бронхолитика и муколитика [14]. Возможно добавление к этой комбинации ингаляционного глюкокортикостероида. Сходный принцип использован при нетяжелых проявлениях бронхиальной обструкции во время ОРВИ, при появлении кашля. Для эффективного отхождения мокроты и улучшения бронхиальной проходимости при острых респираторных вирусных инфекциях положительный эффект может быть достигнут при сочетанном назначении муколитиков и бронхолитиков.
Аскорил экспекторант является комбинированным препаратом, в состав которого входят сальбутамол, бромгексин гидрохлорид, гвайфенезин, рацементол. Компоненты препарата оказывают бронхолитическое и отхаркивающее действие. Сальбутамол — селективный ß2-агонист короткого действия с выраженным быстрым бронхолитическим действием. Он также влияет на мукоцилиарный клиренс (стимулирует секрецию слизи и активность реснитчатого эпителия) [15].
Он также влияет на мукоцилиарный клиренс (стимулирует секрецию слизи и активность реснитчатого эпителия) [15].
Сальбутамол традиционно используется для ингаляционной терапии, имеется ограниченное количество этого препарата для энтерального применения. Бромгексин гидрохлорид с его активным метаболитом амброксолом обладает выраженным муколитическим и отхаркивающим действием посредством деполимеризации и разрушения мукопротеинов и мукополисахаридов, входящих в состав мокроты. Он также стимулирует деятельность секреторных клеток слизистых оболочек бронхов, продуцирующих сурфактант. Гвайфенезин стимулирует секрецию жидкой части бронхиальной слизи, уменьшает поверхностное натяжение и адгезивные свойства мокроты [16]. Ментол (рацементол) оказывает мягкое спазмолитическое действие, обладает слабыми антисептическими свойствами. По нашим данным, применение Аскорила экспекторанта у детей в возрасте от 2 до 10 лет с легким или среднетяжелым течением ОРЗ, оказывает выраженное положительное влияние на течение заболевания у детей по оценке врачей, а также по результатам анкетирования родителей. Острые респираторные заболевания у детей протекали с кашлем вследствие вовлечения в воспалительный процесс различных отделов респираторного тракта (ларингит, фарингит, трахеит, бронхит). У детей до 6 лет Аскорил экспекторант назначали по 5 мл (1 чайная ложка) 3 раза в сутки, детям от 6 до 10 лет — по 5-10 мл (1-2 чайные ложки) 3 раза в сутки. Результаты улучшаются при раннем начале лечения (с первых суток от начала заболевания). Продолжительность лечения составила 7-10 дней в зависимости от динамики состояния пациентов. Клинические симптомы (симптомы ОРЗ, затруднения при откашливании мокроты, выраженность одышки) оценивались в баллах (0 — не выражены, 1 — слабо выражены, 2 — умеренно выражены, 3 — сильно выражены).
Острые респираторные заболевания у детей протекали с кашлем вследствие вовлечения в воспалительный процесс различных отделов респираторного тракта (ларингит, фарингит, трахеит, бронхит). У детей до 6 лет Аскорил экспекторант назначали по 5 мл (1 чайная ложка) 3 раза в сутки, детям от 6 до 10 лет — по 5-10 мл (1-2 чайные ложки) 3 раза в сутки. Результаты улучшаются при раннем начале лечения (с первых суток от начала заболевания). Продолжительность лечения составила 7-10 дней в зависимости от динамики состояния пациентов. Клинические симптомы (симптомы ОРЗ, затруднения при откашливании мокроты, выраженность одышки) оценивались в баллах (0 — не выражены, 1 — слабо выражены, 2 — умеренно выражены, 3 — сильно выражены).
У детей старше 6 лет оценивались функция внешнего дыхания по данным спирографии (ФЖЕЛ, ОФВ1, ПСВ, минимальную объемную скорость на уровне 25%, 50%, 75% ЖЕЛ). У всех детей, в том числе раннего возраста, для исследования функции вешнего дыхания проводилась бронхофонография [17]. Метод бронхофонографии позволяет зафиксировать звуковые характеристики паттерна дыхания в частотном диапазоне от 200 Гц до 12 600 Гц. Мы анализировали акустический компонент работы дыхания (АКРД), который вычисляется, как площадь под кривыми (4 блока по 25 кривых) в определенном частотном диапазоне в единицу времени и выражается в мкдж. Изменения в диапазонах, превышающих 1200 Гц, отражают наличие бронхиальной обструкции.
Метод бронхофонографии позволяет зафиксировать звуковые характеристики паттерна дыхания в частотном диапазоне от 200 Гц до 12 600 Гц. Мы анализировали акустический компонент работы дыхания (АКРД), который вычисляется, как площадь под кривыми (4 блока по 25 кривых) в определенном частотном диапазоне в единицу времени и выражается в мкдж. Изменения в диапазонах, превышающих 1200 Гц, отражают наличие бронхиальной обструкции.
В течение всего периода наблюдения проводился мониторинг нежелательных эффектов, связанных с использованием препарата, измерялись также частота сердечных сокращений, систолическое и диастолическое давление до приема препарата, через 20 и 60 минут после приема в первый день лечения и на 7-10-й день терапии, у детей 2-5 лет одновременно оценивались показатели ЭКГ.
Из клинических проявлений наиболее выражен был кашель. Клинические признаки бронхиальной обструкции характеризовались кратковременными эпизодами одышки, приступами малопродуктивного кашля, небольшим количеством хрипов в легких у 15% детей. По данным функциональных исследований отклонения на спирограмме отмечались из общего числа обследованных у 57% детей в виде легких и умеренных проявлений бронхиальной обструкции. Наиболее информативные данные получены по данным бронхофонографии, которая проводилась у всех детей. Отклонения в высокочастотной части спектра (более 5000 Гц) отмечены у 62% детей, что свидетельствовало о нарушении бронхиальной проходимости, при отсутствии клинических симптомов. По сравнению с детьми с бронхиальной астмой [14] эти изменения при респираторных вирусных инфекциях были существенно меньше, но превышали возрастную норму в несколько раз.
По данным функциональных исследований отклонения на спирограмме отмечались из общего числа обследованных у 57% детей в виде легких и умеренных проявлений бронхиальной обструкции. Наиболее информативные данные получены по данным бронхофонографии, которая проводилась у всех детей. Отклонения в высокочастотной части спектра (более 5000 Гц) отмечены у 62% детей, что свидетельствовало о нарушении бронхиальной проходимости, при отсутствии клинических симптомов. По сравнению с детьми с бронхиальной астмой [14] эти изменения при респираторных вирусных инфекциях были существенно меньше, но превышали возрастную норму в несколько раз.
У детей, получавших комбинированный препарат (сальбутамол + муколитики), по сравнению с контрольной группой детей, получавших только муколитик (бромгексин), наблюдалась более быстрая положительная динамика. Ко 2-3-му дню лечения кашель становился влажным, наблюдалось облегчение отхождения мокроты, к 6-7-му дню терапии у большинства детей симптомы исчезли (p<0,05). В группе сравнения выздоровление у большинства детей отмечалось к 9-10-му дню терапии. У детей, получавших Аскорил экспекторант, исчезновение симптомов кашля отмечалось на 3-4 дня раньше, чем у больных в группе сравнения (p<0,05). Важным является факт исчезновения симптомов ночного кашля на 1-2 дня быстрее (к 5-6-му дню лечения, в группе сравнения — к 8-10-му дню (p<0,05), чем симптомов дневного кашля (к 6-7-му дню наблюдения, в группе сравнения — к 9-10-му дню (p<0,05). Снижение выраженности симптомов кашля сопровождалось улучшением сна, увеличением активности детей, улучшением их эмоционального состояния. Суммарная балльная оценка клинических симптомов на фоне лечения показала более быстрый эффект Аскорила экспекторанта по сравнению с группой сравнения.
В группе сравнения выздоровление у большинства детей отмечалось к 9-10-му дню терапии. У детей, получавших Аскорил экспекторант, исчезновение симптомов кашля отмечалось на 3-4 дня раньше, чем у больных в группе сравнения (p<0,05). Важным является факт исчезновения симптомов ночного кашля на 1-2 дня быстрее (к 5-6-му дню лечения, в группе сравнения — к 8-10-му дню (p<0,05), чем симптомов дневного кашля (к 6-7-му дню наблюдения, в группе сравнения — к 9-10-му дню (p<0,05). Снижение выраженности симптомов кашля сопровождалось улучшением сна, увеличением активности детей, улучшением их эмоционального состояния. Суммарная балльная оценка клинических симптомов на фоне лечения показала более быстрый эффект Аскорила экспекторанта по сравнению с группой сравнения.
Положительная динамика клинических симптомов сопровождалось достоверным улучшением показателей бронхофонографии и спирографии, свидетельствующих о нормализации бронхиальной проходимости. Бронхофонография, проведенная у детей через 20-30 минут после приема комбинированного препарата, показала улучшение бронхиальной проходимости. Это связано с наличием в препарате бронхолитика короткого действия, с взаимодополняющим действием с муколитиком (амброксол), а также седативным и противовоспалительным действием других компонентов. Переносимость комбинированного препарата была хорошей. У 1 ребенка наблюдалась аллергическая реакция на препарат в виде сыпи. У остальных детей побочных эффектов и нежелательных реакций не отмечено. 4% детей, получавших комбинированный препарат, и 10% детей, получавших только муколитик (p<0,05), в связи с недостаточной эффективностью лечения была добавлена антибактериальная терапия.
Это связано с наличием в препарате бронхолитика короткого действия, с взаимодополняющим действием с муколитиком (амброксол), а также седативным и противовоспалительным действием других компонентов. Переносимость комбинированного препарата была хорошей. У 1 ребенка наблюдалась аллергическая реакция на препарат в виде сыпи. У остальных детей побочных эффектов и нежелательных реакций не отмечено. 4% детей, получавших комбинированный препарат, и 10% детей, получавших только муколитик (p<0,05), в связи с недостаточной эффективностью лечения была добавлена антибактериальная терапия.
Таким образом, назначение Аскорила экспекторанта у детей снижает длительность респираторных вирусных заболеваний, уменьшает проявления бронхиальной обструкции, способствует более быстрому клиническому выздоровлению.
Список использованной литературы
- Martiner F. D. What have we learned from Tucson Children,s Respiratory Study. Paediatr. Respir Rev 2002, v3, №3, 193-197.

- Papadopoulos NG, Gourgiotis D, Javadyan A, et al. Does respiratory syncytial virus subtype influences the severity of acute bronchiolitis in hospitalized infants? Respir Med 2004; 98: 879-882.
- Midulla F, Scagnolari C, Bonci E, et al. Respiratory syncytial virus, human bocavirus and rhinovirus bronchiolitis in infants. Arch Dis Child 2010; 95: 35-41.
- Jackson DJ, Gangnon RE, Evans MD, et al. Wheezing rhinovirus illnesses in early life predict asthma development in high-risk children. Am J Respir Crit Care Med 2008; 178: 667-672.
- Kotaniemi-Syrja nen A, Vainionpa a R, Reijonen TM, et al. Rhinovirus-induced wheezing in infancy- the first sign of childhood asthma? J Allergy Clin Immunol 2003; 111: 66-71.
- Lehtinen P, Ruohola A, Vanto T, et al. Prednisolone reduces recurrent wheezing after a first wheezing episode associated with rhinovirus infection or eczema. J Allergy Clin Immunol 2007; 119: 570-575.

- Papadopoulos NG, Stanciu LA, Papi A, et al. A defective type 1 response to rhinovirus in a asthma. Thorax 2002; 57: 328-332.
- Haitchi HM, Powell RM, Shaw TJ, et al. ADAM33 expression in human lungs and asthmatic airways. Am Rev Respir Dis 2005; 171: 958-65
- Simpson A, Maniatis M, Jury F, et al. Polymorphisms in a disintegrin and metalloproteinase 33 (ADAM33) predict impaired early lung function. Am Rev Respir Crit Care Med 2005, 172: 55-60
- Elliot J, Carroll N, Bosco M, McCrohan M, Robinson P. Increased airway responsiveness,and decreased alveolar attachment! points following in utero smoke exposure in the guinea pig. Am J Respir Crit Care Med. 2001;|l63: 140-4.
- Rusconi F, Galassi C, Forastiere F, et al. Maternal complications and procedures iH-gregnancy and at birth and wheezing phenotypes in children. Am J Respir Crit Care Med. 2007, pl75: 16-21.
- Pala P, Bjarnason R, Sigurbergsson F, et al.
 Enhanced IL-4 responses in children with a history of respiratory syncytial virus bronchiolitis in infancy. Eur Respir J 2002; 20: 376-382.
Enhanced IL-4 responses in children with a history of respiratory syncytial virus bronchiolitis in infancy. Eur Respir J 2002; 20: 376-382. - Smyth RL, Fletcher JN, Thomas HM, et al. Respiratory syncytial virus and wheeze. Lancet 1999; 354: 1997-1998.
- Геппе Н.А., Старостина Л.С., Малышев В.С., Бераиа Т.Т. Возможности комбинированной бронхолитической терапии у детей с бронхиальной астмой. 2010, том 8, № 1-2, 27-31.
- Baker J.G. The selectivity of beta-adrenoceptor agonists at human beta1-, beta2- and beta3- adrenoceptors. Br. J. Pharmacol. 2010 Jul;160(5):1048-61.
- Dicpinigaitis P.V., Gayle Y.E. Sensitivity Effect of Guaifenesin on Cough Reflex. Chest 2003; 124: 2178-2181.
- Геппе Н.А., Селиверстова Н.А., Малышев В.С., Утюшева М.Г., Старостина Л.С., Озерская И.В. Бронхофонографическое исследование легких у больных бронхиальной астмой раннего возраста. Пульмонология 2008; 3: 38-41.
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Бронхообструктивный синдром у детей — причины, симптомы и лечение
Бронхообструктивный синдром у детей — комплекс симптомов, который характеризуется нарушением проходимости бронхиального дерева функционального или органического происхождения. Клинически это проявляется продолжительным и шумным выдохом, приступами удушья, активацией вспомогательных дыхательных мышц, сухим или непродуктивным кашлем. Основная диагностика бронхообструктивного синдрома у детей включает сбор анамнестических данных, объективный осмотр, рентгенографию, бронхоскопию и спирометрию.Лечение — бронхолитическая фармакотерапия β2-, устранение ведущего этиологического фактора.
Клинически это проявляется продолжительным и шумным выдохом, приступами удушья, активацией вспомогательных дыхательных мышц, сухим или непродуктивным кашлем. Основная диагностика бронхообструктивного синдрома у детей включает сбор анамнестических данных, объективный осмотр, рентгенографию, бронхоскопию и спирометрию.Лечение — бронхолитическая фармакотерапия β2-, устранение ведущего этиологического фактора.
Бронхообструктивный синдром (BAREFOOT) — клинический симптомокомплекс, характеризующийся сужением или закупоркой бронхов различного калибра вследствие скопления бронхиального секрета, утолщения стенки, спазма гладкомышечных мышц, уменьшения подвижности. легкого или сдавливания окружающими структурами. БЕЗОПАСНОСТЬ — широко распространенное патологическое состояние в педиатрии, особенно среди детей до 3 лет.По разным статистическим данным, на фоне острых заболеваний дыхательной системы БЕЗОПАСНОСТЬ встречается в 5-45% случаев. При отягощенном анамнезе этот показатель составляет 35-55%. Прогноз при БЕЗОПАСНОСТИ варьируется и напрямую зависит от этиологии. В одних случаях наблюдается полное исчезновение клинических проявлений на фоне адекватного этиотропного лечения, в других наблюдается синхронизация процессов, инвалидность или даже летальный исход.
Прогноз при БЕЗОПАСНОСТИ варьируется и напрямую зависит от этиологии. В одних случаях наблюдается полное исчезновение клинических проявлений на фоне адекватного этиотропного лечения, в других наблюдается синхронизация процессов, инвалидность или даже летальный исход.
Причины
Основная причина развития бронхообструктивного синдрома у детей — инфекционные заболевания и аллергические реакции.Среди ОРВИ бронхиальную обструкцию чаще всего провоцируют вирусы парагриппа (тип III) и RS-инфекция. Другие возможные причины: врожденные пороки сердца и бронхолегочной системы, РДС, генетические заболевания, иммунодефицит, бронхолегочная дисплазия, аспирация инородных тел, ГЭРГ, круглые гельминты, гиперплазия регионарных лимфатических узлов, новообразования бронхов и прилегающих тканей, побочное влияние лекарственных препаратов. .
Помимо основных причин бронхообструктивного синдрома у детей выделяют стимулирующие факторы, которые существенно повышают риск развития заболевания и ухудшают его течение. В педиатрии генетическая склонность к атопическим реакциям, пассивное курение, повышенная реактивность бронхиального дерева и его анатомо-физиологические особенности в младенческом возрасте, гиперплазия тимуса, дефицит витамина D, кормление искусственными смесями, дефицит массы тела, внутриутробный период. болезни относятся к тех. Все они способны усиливать влияние друг друга на организм ребенка и усугублять течение бронхообструктивного синдрома у детей.
В педиатрии генетическая склонность к атопическим реакциям, пассивное курение, повышенная реактивность бронхиального дерева и его анатомо-физиологические особенности в младенческом возрасте, гиперплазия тимуса, дефицит витамина D, кормление искусственными смесями, дефицит массы тела, внутриутробный период. болезни относятся к тех. Все они способны усиливать влияние друг друга на организм ребенка и усугублять течение бронхообструктивного синдрома у детей.
Патогенетически бронхообструктивный синдром у детей может быть вызван воспалительной реакцией бронхиальной стенки, спазмом гладкомышечных мышц, окклюзией или компрессией бронха.Вышеуказанные механизмы способны вызывать сужение бронхиального просвета, нарушение мукоцилиарного клиренса и уплотнение секрета, отек слизистой оболочки, разрушение эпителия в крупных бронхах и его гиперплазию в мелких. Как следствие — ухудшение проходимости, нарушение функции легких и дыхательная недостаточность.
Классификация
В зависимости от патогенеза бронхообструктивного синдрома у детей выделяют следующие формы патологии:
- БЕЗОПАСНЫЙ аллергический генез .
 Возникает на фоне бронхиальной астмы, реакций гиперчувствительности, поллиноза и аллергического бронхита, синдрома Леффлера.
Возникает на фоне бронхиальной астмы, реакций гиперчувствительности, поллиноза и аллергического бронхита, синдрома Леффлера. - БЕЗОПАСНОСТЬ, вызванная инфекционными заболеваниями . Основные причины: острый и хронический вирусный бронхит, ОРВИ, пневмония, бронхиолиты, бронхоэктатические изменения.
- БЕЗОПАСНЫЙ, развился на фоне наследственных или врожденных заболеваний . Чаще всего это, недостаточность α-анти-трипсина, синдромы Картагенера и Вильямса-Кэмпбелла, ГЭРГ, иммунодефицит, миопатия, эмфизема и аномалии развития бронхов.
- БЕЗОПАСНОСТЬ, возникшая в результате патологии новорожденных. Часто образуется на фоне СДР, аспирационного синдрома, стридора, грыжи диафрагмы, трахеоэзофагеального свища и др.
- БЕЗОПАСНЫЙ как проявление другой нозологии. Бронхообструктивный синдром у детей также может быть спровоцирован инородными телами в бронхиальном дереве, тимомегалией, гиперплазием регионарных лимфатических узлов, доброкачественными или злокачественными новообразованиями бронхов или прилегающих тканей.

По текущей продолжительности бронхообструктивный синдром у детей делится на:
- Sharp. Клиническая картина наблюдается не более 10 дней.
- Длинный. Признаки бронхиальной обструкции выявляются в течение 10 дней и дольше.
- Рецидив. Sharp Босиком бывает 3-6 раз в год.
- Постоянно рецидивирующий. Характеризуется короткими ремиссиями между эпизодами длительного БЕЗОПАСНОСТИ или их полным отсутствием.
Симптомы Босиком у детей
Клиническая картина бронхообструктивного синдрома у детей во многом зависит от основного заболевания или фактора, провоцирующего данную патологию. Общее состояние ребенка в большинстве случаев средневзвешенное, наблюдается общая слабость, капризность, нарушение сна, потеря аппетита, симптомы интоксикации и т. Д. Непосредственно БЕЗОПАСНОСТЬ независимо от этиологии имеет характерные симптомы: шумное громкое дыхание, хрипы, которые выслушиваются на расстоянии, специфический свист при выдохе.
Также наблюдается участие вспомогательных мышц в акте дыхания, приступах, одышке выдохе (чаще) или смешанного характера, сухом или непродуктивном кашле. При длительном течении бронхообструктивного синдрома у детей может формироваться бочкообразная грудная клетка — расширение и выпячивание межреберных промежутков, горизонтальный ход ребер. В зависимости от фоновой патологии также может быть повышение температуры тела, дефицит массы тела, слизистые или гнойные выделения из носа, частая рвота, рвота и др.
Диагностика
Диагностика бронхообструктивного синдрома у детей основана на сборе анамнестических данных, объективном исследовании, лабораторных и инструментальных методах. При опросе матери педиатр или неонатолог акцентирует внимание на возможных этиологических факторах: хронических заболеваниях, пороках развития, наличии аллергии, эпизодах БЕЗОПАСНОСТИ в прошлом и т. Д. При бронхообструктивном синдроме у детей очень информативно физикальное обследование ребенка.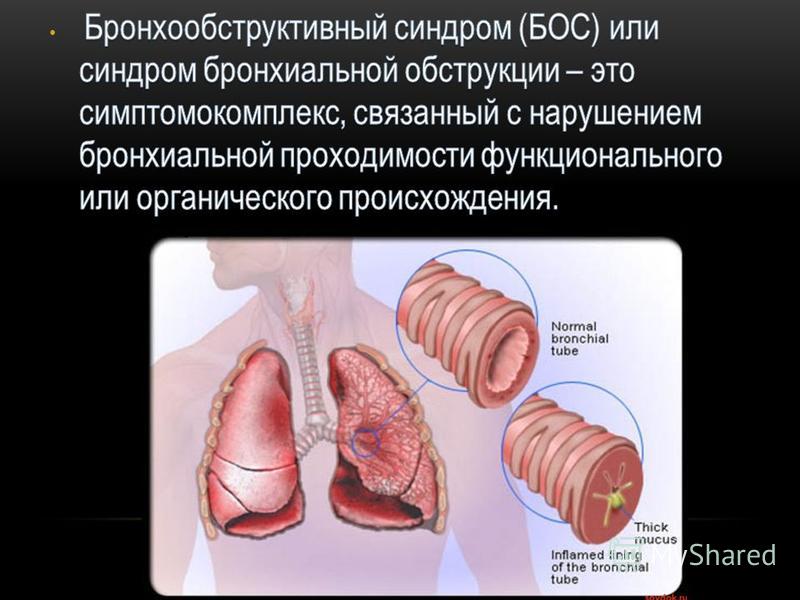 Перкуторно определяется усиление легочного звука до тимпанита. Аускультативная картина характеризуется жестким или ослабленным дыханием, сухим, свистящим, в младенчестве — мелкокапальными влажными хрипами.
Перкуторно определяется усиление легочного звука до тимпанита. Аускультативная картина характеризуется жестким или ослабленным дыханием, сухим, свистящим, в младенчестве — мелкокапальными влажными хрипами.
Лабораторная диагностика при бронхообструктивном синдроме у детей включает общие анализы и дополнительные тесты. В ОАК, как правило, определяют неспецифические изменения, указывающие на наличие очага воспаления:, смещение лейкоцитарной формулы влево, увеличение СОЭ, при наличии аллергического компонента — эозинофилии.При невозможности установить точную этиологию показаны дополнительные анализы: ИФА с определением IgM и IgG к вероятным инфекционным агентам, серологические тесты, тест с определением уровня хлоридов в поту при подозрении на т. Д.
Среди инструментальных методов, которые могут применяться при бронхообструктивном синдроме у детей, чаще всего используют рентгенографию ОГК, бронхоскопию, спирометрию, реже — КТ и МПТ. Рентгенография дает возможность увидеть расширенные корни легких, признаки сопутствующего поражения паренхимы, наличие новообразований или расширенных лимфатических узлов. Бронхоскопия позволяет выявить и удалить инородное тело из бронхов, оценить проходимость и состояние слизистых оболочек. Спирометрию проводят при длительном течении бронхообструктивного синдрома у детей с целью оценки функции внешнего дыхания, КТ и МРТ — при низкой информативности рентгенографии и бронхоскопии.
Бронхоскопия позволяет выявить и удалить инородное тело из бронхов, оценить проходимость и состояние слизистых оболочек. Спирометрию проводят при длительном течении бронхообструктивного синдрома у детей с целью оценки функции внешнего дыхания, КТ и МРТ — при низкой информативности рентгенографии и бронхоскопии.
Лечение, прогноз и профилактика
Лечение бронхообструктивного синдрома у детей направлено на исключение факторов, вызывающих обструкцию.Независимо от этиологии во всех случаях показана госпитализация ребенка и неотложная бронхолитическая терапия с использованием β2-. В дальнейшем могут использоваться антихолинергические препараты, ингаляционные кортикостероиды, системные глюкокортикостероиды. В качестве вспомогательных лекарственных средств применяются также муколитические антигистаминные препараты, метилксантины, инфузионная терапия. После определения происхождения бронхообструктивного синдрома у детей назначается этиотропная терапия: антибактериальные, противовирусные, противотуберкулезные средства, химиотерапия. В некоторых случаях может потребоваться операция. При наличии анамнестических данных, указывающих на возможное попадание инородного тела в дыхательные пути, проводится экстренная бронхоскопия.
В некоторых случаях может потребоваться операция. При наличии анамнестических данных, указывающих на возможное попадание инородного тела в дыхательные пути, проводится экстренная бронхоскопия.
Прогноз при бронхообструктивном синдроме у детей всегда тяжелый. Чем младше ребенок — тем тяжелее его состояние. И исход БЕЗОПАСНОСТИ во многом зависит от фонового заболевания. При остром обструктивном бронхите и бронхиолите, как правило, наблюдается выздоровление, редко сохраняется гиперреактивность бронхиального дерева.БЕЗОПАСНОСТЬ при бронхолегочной дисплазии сопровождается частыми ОРВИ, но часто стабилизируется к двухлетнему возрасту. У 15-25% таких детей трансформируется в бронхиальную астму. Непосредственно БГ может иметь различное течение: легкая форма переходит в ремиссию уже в младшем школьном возрасте, тяжелая, особенно на фоне неадекватной терапии, характеризуется ухудшением жизни, регулярными обострениями с летальным исходом в 1-6% случаев. БЕЗОПАСНОСТЬ на фоне облитерирующего бронхиолита часто приводит к эмфиземе и прогрессирующей сердечной недостаточности.
Профилактика бронхообструктивного синдрома у детей означает исключение всех потенциальных этиологических факторов или минимизацию их воздействия на детский организм. Сюда относится антенатальная охрана плода, планирование семьи, медико-генетическое консультирование, рациональное применение лекарственных препаратов, ранняя диагностика и адекватное лечение острых и хронических заболеваний дыхательной системы и др.
Детская врожденная обструкция лоханочно-мочеточникового перехода
Обструкция лоханочно-мочеточникового перехода — это закупорка в области, которая соединяет почечную лоханку (часть почки) с одной из трубок (мочеточников), по которым моча поступает в мочевой пузырь.Обструкция лоханочно-мочеточникового перехода обычно возникает, когда ребенок все еще растет в утробе матери. Это называется врожденным заболеванием (присутствует с рождения).
Что вызывает обструкцию лоханочно-мочеточникового перехода?
В большинстве случаев закупорка возникает, когда соединение между мочеточником и почечной лоханкой не развивается нормально и вызывает скопление мочи, что может повредить почку. Состояние также может быть вызвано расположением кровеносного сосуда в неправильное положение над мочеточником, вызывающее перегиб мочеточника.У детей старшего возраста и взрослых обструкция лоханочно-мочеточникового перехода может быть связана с рубцовой тканью, инфекцией, предшествующим лечением закупорки или камнями в почках. Обструкция лоханочно-мочеточникового перехода является наиболее часто диагностируемой причиной обструкции мочевыводящих путей у детей. В настоящее время его обычно диагностируют во время пренатальных ультразвуковых исследований. В некоторых случаях заболевание проявляется только после рождения. У детей может быть образование в брюшной полости, инфекция мочевыводящих путей или боль в животе или боку.
Состояние также может быть вызвано расположением кровеносного сосуда в неправильное положение над мочеточником, вызывающее перегиб мочеточника.У детей старшего возраста и взрослых обструкция лоханочно-мочеточникового перехода может быть связана с рубцовой тканью, инфекцией, предшествующим лечением закупорки или камнями в почках. Обструкция лоханочно-мочеточникового перехода является наиболее часто диагностируемой причиной обструкции мочевыводящих путей у детей. В настоящее время его обычно диагностируют во время пренатальных ультразвуковых исследований. В некоторых случаях заболевание проявляется только после рождения. У детей может быть образование в брюшной полости, инфекция мочевыводящих путей или боль в животе или боку.
Симптомы обструкции лоханочно-мочеточникового перехода
Симптомов может не быть.При появлении симптомов они могут включать:
- Боль в животе, спине или боку (боль в боку)
- Кровавая моча (гематурия)
- Шишка в брюшной полости (образование в брюшной полости)
- Инфекция мочевыводящих путей (может включать Инфекция почек, при которой наблюдается лихорадка)
- Плохой рост у младенцев (задержка развития)
- Рвота
Обследования и анализы
Ультразвук во время беременности может выявить проблемы с почками у будущего ребенка. Обследования после рождения могут включать:
Обследования после рождения могут включать:
- Ультразвуковое исследование почек — почти всегда проводится для определения степени расширения или растяжения почки.
- Ядерное сканирование почек
- Цистоуретрограмма при мочеиспускании
- Электролиты
- BUN
- Креатинин
Лечение обструкции лоханочно-мочеточникового перехода
В наиболее тяжелых случаях обструкции лоханочно-мочеточникового перехода может потребоваться операция в раннем возрасте, в то время как многие не требуют раннего вмешательства операция. В большинстве случаев хирургическое вмешательство не требуется, но необходимо периодически проверять, пока непроходимость не исчезнет.
Регулярные анализы необходимы, чтобы убедиться, что почка все еще функционирует должным образом.Если функция почек ухудшается или обструкция ухудшается, может быть рекомендовано хирургическое вмешательство.
Операция по устранению закупорки обеспечивает нормальный отток мочи и может выполняться открытыми методами (разрез) или лапароскопическими методами.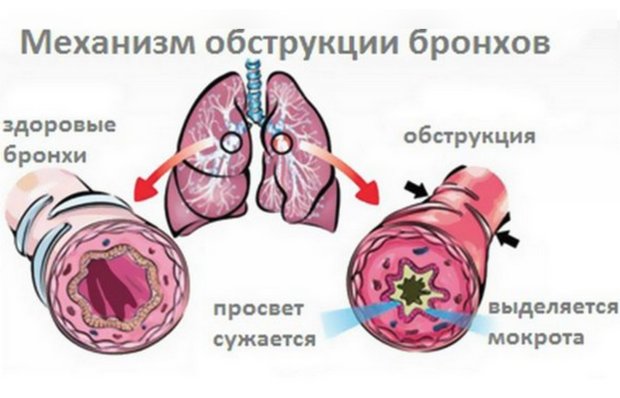 Оба метода называются пиелопластикой и включают удаление аномальной части мочеточника и его повторное соединение с почкой, чтобы обеспечить нормальный отток мочи.
Оба метода называются пиелопластикой и включают удаление аномальной части мочеточника и его повторное соединение с почкой, чтобы обеспечить нормальный отток мочи.
Открытая операция проводится в любом возрасте и включает разрез сбоку или сзади, чтобы добраться до почки и удалить закупорку, а затем восстановить мочеточник.
Лапароскопическая хирургия, минимально инвазивный метод, теперь может использоваться в любом возрасте и обычно включает в себя помощь роботизированной хирургии, чтобы помочь с деликатным ремонтом. Показатели успеха у обоих схожи, но дети, перенесшие лапароскопическую процедуру, обычно могут вернуться домой раньше (на один день) и быстрее вернуться к нормальной жизнедеятельности.
Для слива мочи из почки до выздоровления пациента можно установить трубку, называемую стентом. Нефростомическая трубка, которая вводится в бок пациента для слива мочи, также может понадобиться в течение короткого времени после операции.Этот тип трубки также можно использовать для лечения тяжелых инфекций перед операцией.
Перспективы (Прогноз)
Ранняя диагностика и лечение обструкции лоханочно-мочеточникового перехода может помочь сохранить функцию почек в будущем. Обструкция лоханочно-мочеточникового перехода, диагностированная до рождения или сразу после рождения, может улучшиться сама по себе.
Большинство пациентов чувствуют себя хорошо, без долгосрочных последствий. У тех, кому поставлен диагноз в более позднем возрасте, может произойти значительное повреждение почек. Текущие варианты лечения обеспечивают хорошие долгосрочные результаты.Пиелопластика обеспечивает максимальный долгосрочный успех в тяжелых случаях непроходимости.
В тяжелых случаях быстрое снятие давления на почки (декомпрессия почек) сразу после родов может значительно улучшить функцию почек.
Педиатры разработают план ухода, который наилучшим образом отвечает потребностям каждого ребенка.
Возможные осложнения
Необратимая потеря функции почек — возможное осложнение нелеченой обструкции лоханочно-мочеточникового перехода. Даже после лечения пораженная почка может подвергаться повышенному риску инфицирования или образования камней в почках.
Даже после лечения пораженная почка может подвергаться повышенному риску инфицирования или образования камней в почках.
Источник : http://www.nlm.nih.gov/medlineplus/ency/article/001267.htm
Бронхиальная астма у детей
Бронхиальная астма у детей — заболевание аллергическое. Больные дети часто имеют определенные свойства организма, часто наследственные. Неинфектино-аллергическая астма обычно возникает у детей с перенесенной пищевой аллергией, а разрешающим фактором могут быть заболевания органов дыхания.Инфекционно-аллергическая астма вызвала повторные воспалительные процессы в органах дыхания.
Клиническая картина бронхиальной астмы у детей, особенно у детей младшего возраста, отличается от таковой у взрослых, поскольку у детей сужение просвета бронхов при приступе было в первую очередь связано с отеком слизистой оболочки бронхов и повышением секреции слизи и в меньшей степени. при спазме еще слабо развиты мышцы бронхов. Приступу обычно предшествует катар верхних дыхательных путей, часто вазомоторный ринит.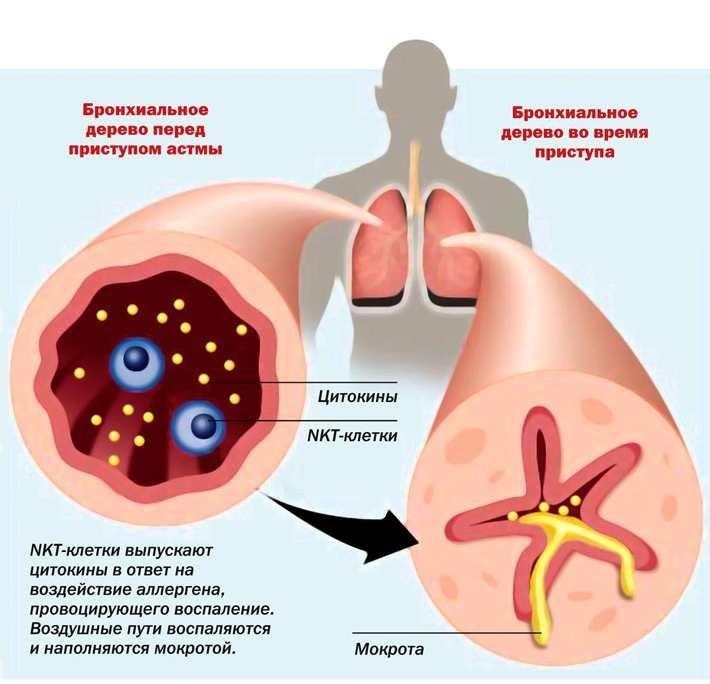 Чем младше ребенок, тем легче возникает кислородное голодание; может наступить асфиксия, а при полной непроходимости бронхов вязкой слизью — смерть. Для аускультации бронхиальной астмы характерны сухие свистящие хрипы на фазе выдоха; У детей раннего возраста при хронической пневмонии в фазе дыхания одновременно выслушиваются и смешанные влажные хрипы. У многих пациентов с самого начала приступа появляется навязчивый сухой кашель. Симптомы астмы могут наблюдаться у детей при острой вирусной и бактериальной пневмонии, но исчезают при выздоровлении.Заболевание определяется частотой и продолжительностью приступов; осложняет течение сочетание бронхиальной астмы, хронической пневмонии. При начале раннего и систематического лечения бронхиальной астмы возможно наступление периода полового созревания, если на свету не будет необратимых изменений.
Чем младше ребенок, тем легче возникает кислородное голодание; может наступить асфиксия, а при полной непроходимости бронхов вязкой слизью — смерть. Для аускультации бронхиальной астмы характерны сухие свистящие хрипы на фазе выдоха; У детей раннего возраста при хронической пневмонии в фазе дыхания одновременно выслушиваются и смешанные влажные хрипы. У многих пациентов с самого начала приступа появляется навязчивый сухой кашель. Симптомы астмы могут наблюдаться у детей при острой вирусной и бактериальной пневмонии, но исчезают при выздоровлении.Заболевание определяется частотой и продолжительностью приступов; осложняет течение сочетание бронхиальной астмы, хронической пневмонии. При начале раннего и систематического лечения бронхиальной астмы возможно наступление периода полового созревания, если на свету не будет необратимых изменений.
При дифференциальной диагностике бронхиальной астмы у детей следует иметь в виду острую пневмонию, инородное тело дыхательных путей и туманские (гранулемы) бронхогенные.
Лечение бронхиальной астмы у детей следует строго разделить на легкий приступ и лечение больного в межприступном периоде.Позднее и неправильное лечение приступа может помочь перенести его в тяжелое или длительное астматическое состояние. Обычно начинают с подкожных инъекций 0,3 мл раствора адреналина 1: 1000, независимо от возраста. Эффект наступает через 5-10 минут, но непродолжительный — 2 — 3 часа. При легких и умеренных приступах лечение можно продолжить приемом эфедрина (0,002-0,02 г), таблеток антельмана или теофедрина (1 / 4-1 / табл.). Детям старше 2 лет можно давать тройной порошок из эфедрина, эуфиллина, димедрола (или другого антигистаминного препарата — пипольфена, супрастина и других).При тяжелых приступах эти препараты назначают парентерально. Некоторым детям эффективны ингаляции (ручной ингалятор) 0,5 — 1 мл 0,5% раствора изадрина и 1 мл 0,5% раствора новокаина. При приступах некупеероотеса пациента необходимо госпитализировать; В стационаре вводят водорастворимый преднизон или гидрокортизон 0,5-1 мл (от 12,5 до 25 мг) в 5-10% растворе глюкозы. Улучшение состояния переходят на внутримышечное введение гормонов, а затем на прием внутрь утром, постепенно снижая дозу в течение 3-7 дней.Одновременно вводят и антигистаминные препараты. Если приступ переходит в длительное астматическое состояние, которое часто возникает при обострении хронической пневмонии, одновременно применяемых антибиотиков следует избегать пенициллина, поскольку он обладает наиболее аллергическим действием. Строго запрещены препараты морфин.
Улучшение состояния переходят на внутримышечное введение гормонов, а затем на прием внутрь утром, постепенно снижая дозу в течение 3-7 дней.Одновременно вводят и антигистаминные препараты. Если приступ переходит в длительное астматическое состояние, которое часто возникает при обострении хронической пневмонии, одновременно применяемых антибиотиков следует избегать пенициллина, поскольку он обладает наиболее аллергическим действием. Строго запрещены препараты морфин.
План лечения в межприступный период различается в зависимости от формы бронхиальной астмы. При неинфекционной форме аллергии исключают выявленные при специфическом обследовании аллергены, а в противном случае проводят специфическую гипосенсибилизацию.Назначают строгий режим, большие дозы аскорбиновой кислоты до 1 г / сут, витамины группы В, тщательное закаливание, массаж, гимнастику. Если аллерген не выявлен, проводят 1-2 курса лечения гистаглобином по 1,0 мл подкожно 2 раза в неделю, 6-8 раз на курс. При инфекционной форме аллергической астмы выявляют инфекционные очаги и проводят их реорганизацию до оперативного удаления (по показаниям).








 Enhanced IL-4 responses in children with a history of respiratory syncytial virus bronchiolitis in infancy. Eur Respir J 2002; 20: 376-382.
Enhanced IL-4 responses in children with a history of respiratory syncytial virus bronchiolitis in infancy. Eur Respir J 2002; 20: 376-382. Возникает на фоне бронхиальной астмы, реакций гиперчувствительности, поллиноза и аллергического бронхита, синдрома Леффлера.
Возникает на фоне бронхиальной астмы, реакций гиперчувствительности, поллиноза и аллергического бронхита, синдрома Леффлера.