Симптомы и лечение парапроктита — Medside.ru
Закрыть
- Болезни
- Инфекционные и паразитарные болезни
- Новообразования
- Болезни крови и кроветворных органов
- Болезни эндокринной системы
- Психические расстройства
- Болезни нервной системы
- Болезни глаза
- Болезни уха
- Болезни системы кровообращения
- Болезни органов дыхания
- Болезни органов пищеварения
- Болезни кожи
- Болезни костно-мышечной системы
- Болезни мочеполовой системы
- Беременность и роды
- Болезни плода и новорожденного
- Врожденные аномалии (пороки развития)
- Травмы и отравления
- Симптомы
- Системы кровообращения и дыхания
- Система пищеварения и брюшная полость
- Кожа и подкожная клетчатка
- Нервная и костно-мышечная системы
- Мочевая система
- Восприятие и поведение
- Речь и голос
- Общие симптомы и признаки
- Отклонения от нормы
- Диеты
- Снижение веса
- Лечебные
- Быстрые
- Для красоты и здоровья
- Разгрузочные дни
- От профессионалов
- Монодиеты
- Звездные
- На кашах
- Овощные
- Детокс-диеты
- Фруктовые
- Модные
- Для мужчин
- Набор веса
- Вегетарианство
- Национальные
- Лекарства
- Пищеварительный тракт и обмен веществ
- Кровь и система кроветворения
- Сердечно-сосудистая система
- Дерматологические препараты
- Mочеполовая система и половые гормоны
- Гормональные препараты
- Противомикробные препараты
- Противоопухолевые препараты и иммуномодуляторы
- Костно-мышечная система
- Нервная система
- Противопаразитарные препараты, инсектициды и репелленты
- Дыхательная система
- Органы чувств
- Прочие препараты
- БАДы и ТАА
ДЕЙСТВУЮЩИЕ ВЕЩЕСТВА
- Врачи
- Клиники
- Справочник
- Аллергология
- Анализы и диагностика
- Беременность
- Витамины
- Вредные привычки
- Геронтология (Старение)
- Дерматология
- Дети
- Женское здоровье
- Инфекция
- Контрацепция
- Косметология
- Народная медицина
- Обзоры заболеваний
- Обзоры лекарств
- Ортопедия и травматология
- Питание
- Пластическая хирургия
- Процедуры и операции
- Психология
- Роды и послеродовый период
- Сексол
Ишиоректальный парапроктит: диагностика, методы лечения(операция)
Патологии прямой кишки причиняют человеку массу дискомфорта и неудобств. Наиболее распространенным заболеванием органов ЖКТ является ишиоректальный парапроктит. Это сравнительно легкий вид недуга. Виновником его развития становятся патогенные микроорганизмы, приводящие к воспалению параректальной ткани. Также существует пельвиоректальный, подкожный, подслизистый вид парапроктита.
Наиболее распространенным заболеванием органов ЖКТ является ишиоректальный парапроктит. Это сравнительно легкий вид недуга. Виновником его развития становятся патогенные микроорганизмы, приводящие к воспалению параректальной ткани. Также существует пельвиоректальный, подкожный, подслизистый вид парапроктита.
О заболевании
Ишиоректальный парапроктит размещается в районе тазового дна, сведенного костями, его мышечной тканью, кожей ягодиц. Находится на 2 месте среди других видов патологии. Обнаруживается в 35% случаев у больных острым проктитом.
Парапроктит по своему течению имеет 2 формы воспалительного процесса:
- Острая. Гнойный парапроктит отличается моментальным образованием симптоматики.
- Хроническая. Классифицируется наличием своеобразного свища, локализующегося на поверхности кожи либо внутри. Образование причиняет сильную боль, а из отверстия просачивается гной.
Чтобы облегчить болевые ощущения и ускорить процесс выздоровления, следует внимательно отнестись к диетическому питанию и лечению ишиоректального проктита.
Гнойник, локализованный в пресакральной клетчатке, характеризуется ретроректальным либо позади-прямокишечным расположением. Данная форма требует срочной госпитализации, оперативного вмешательства. Заболевание опасно переходом острого парапроктита в хронический.
Симптомы
Симптомы парапроктита разнообразные, зависят от этапа развития патологии, продолжительности.
В самом начале появления парапроктита у человека:
- ухудшается общее состояние, появляется недомогание, слабость, потеря аппетита, болевые ощущения в костях, мышечных тканях;
- частое сердцебиение, дыхание затрудненное;
- температура тела увеличивается, бывает более 38°С;
- в районе прямой кишки и заднего прохода отмечается дискомфорт; в момент дефекации возникает резкая и сильная боль. Установить место расположения его очень сложно.
По истечении нескольких дней после образования начальных признаков ишиоректального проктита, клиническая картина дополняется и другими симптомами:
- в районе ягодицы появляется плотное скопление; найти его нетрудно – там, где гнойник расположен, кожный покров горячий, красный;
- в ягодичной области заметна отечность;
- пораженное место (где образовался гнойник) увеличивается в объеме, вследствие этого происходит асимметрия ягодиц;
- складки ануса видоизменяются, однако там, где расположено уплотнение они расплавляются;
- в поврежденном месте под самой кожей можно заметить своеобразный инфильтрат (скопление гноя), довольно уплотненный и при ощупывании болезненный.

С виду заметно, что одна ягодица больше другой, это обусловливается внутренним отеком. При воспалении ректальной полости отмечается отечность, покраснение анальной крипты.
Причины
Выражается острый ишиоректальный парапроктит в форме очага, содержащего гной, в седалищно-прямокишечной ямке, появившейся вследствие воздействия болезнетворной микрофлоры на пораженные области тканей кишечника. Часто патогенные бактерии проникают в середину клетчатки сквозь нарушенную слизистую заднего прохода, геморроидальную шишку либо воспалительную промежность.
Основные причины парапроктита следующие:
- нарушение пищеварительной системы, запоры;
- слабая иммунная система;
- анальный секс;
- сопрягающиеся патологии прямой кишки;
- несоблюдение гигиенических процедур;
- воспаленный процесс в мочеполовой системе (наблюдается изредка).
Такие же причины приводят к образованию пельвиоректального парапроктита.
Однако здесь гнойные образования размещаются в районе тазовой кости. Такой вид абсцесса установить поверхностно почти никогда не удается. Внешних симптомов, боли нет. Но патология препровождается такими же проявлениями, как при воспалении.
Диагностические мероприятия
Первым делом специалист опрашивает пациента о его жалобах. При диагностике определяются сопутствующие недуги: это может быть геморрой, различные острые, хронические инфекции, трещины ануса, болезнь Крона, постоянная диарея или запоры, повреждения прямой кишки.
Кроме этого, определить отечность при ишиоректальном парапроктите помогут следующие мероприятия:
- Пальпационное исследование прямой кишки – обнаруживается боль при легком надавливании на стенку кишки, опухлость, способен прощупаться инфильтрат.
- УЗИ устанавливает локализацию и размер прямокишечного абсцесса.
- Анализ крови определит присутствие гнойника, увеличено ли число лейкоцитов.
- Фистулография также указывает на область, где абсцессы располагаются, какого они размера, длительность течения болезни.

- Бактериологический посев, соскоб поможет выявить состав спровоцировавшей процесс флоры (зачастую это кишечная палочка наряду с иными бактериями).
Только после проведения тщательной диагностики врач подбирает действенный метод борьбы для устранения патологического образования в области анального отверстия.
Хронический парапроктит
Признаки хронической формы ишиоректального парапроктита в стадии обострения напоминают острую воспаленную патологию. Главной характеристикой становится свищ, который может образоваться внутри, снаружи либо быть полным.
Свищ заметить очень просто, например, при пальпации, проведении компьютерной томограммы, УЗИ либо МРТ. Фистулография помогает указать ход свища, если присутствуют полости и ответвления.
Лечение
При начальном остром гнойном ишиоректальном парапроктите используется внешняя терапия. Производятся сидячие ванночки с добавлением раствора Перманганата калия, а также употребление таблеток с антибактериальным действием. Лечебные мероприятия гнойного острого парапроктита со зрелой фистулой выполняется исключительно при помощи операции.
Лечебные мероприятия гнойного острого парапроктита со зрелой фистулой выполняется исключительно при помощи операции.
Оперативное вмешательство
Операция при парапроктите заключается в произведении надреза, дренирования, устранения гнойного содержимого. Манипуляцию назначают в экстренном (момент усугубления парапроктита) режиме или плановом (при снижении воспаления).
Острая форма патологии выполняется 2 видами оперативного лечения ишиоректального парапроктита:
- Одномоментное – в данной ситуации происходит вскрытие гнойника, очищение его содержимого, делается резекция поврежденных ректальных желез, анальной крипты. Такую процедуру применяют, если точно определены размеры и месторасположение гнойника, а близко размещенные ткани не задеты или совсем чуть-чуть.
- Многомоментное – производятся такие же манипуляции, что и в прежнем случае, но они делятся на 2 этапа, промежуток между ними может быть 5-7 дней. Первым действием вскрывают гнойник, дренируют.
 Вторая операция подразумевает удаление ректальной пазухи, железы, которые воспалены.
Вторая операция подразумевает удаление ректальной пазухи, железы, которые воспалены.
Раннее оперативное вмешательство позволяет благоприятно справиться с недугом, без каких-либо негативных последствий.
Послеоперационное лечение
Терапия после операции является главным этапом восстановления тканей прооперированной области. Чтобы болезнь не возобновилась, следует внимательно наблюдать за состоянием обработанной зоны. Ежедневно производить перевязку. Рану следует дезинфицировать антисептическим средством, после чего обработать мазью с противобактериальным эффектом, наложить марлевую повязку.
Также очень важным является диетическое питание. После удаления гнойника разрешается употреблять пищу не сразу. Вначале можно одну воду. Последующие пару дней меню должно быть щадящим. Не стоит кушать сладости, мучные изделия, фрукты, овощи, жирную, жареную еду.
Информация на нашем сайте предоставлена квалифицированными врачами и носит исключительно ознакомительный характер. Не занимайтесь самолечением! Обязательно обратитесь к специалисту!
Не занимайтесь самолечением! Обязательно обратитесь к специалисту!
Автор: Румянцев В. Г. Стаж 34 года.
Гастроэнтеролог, профессор, доктор медицинских наук. Назначает диагностику и проводит лечение. Эксперт группы по изучению воспалительных заболеваний. Автор более 300 научных работ.
Парапроктит — симптомы, причины, лечение профилактика
Часто встречающаяся патология прямой кишки гнойно-воспалительной природы, характеризующаяся довольно ярко-выраженной и к тому же неприятной симптоматикой называется парапроктитом. При этом недуге поражаются преимущественно ткани, окружающие прямую кишку.
Данное заболевание является одним из самых распространенных среди всех недугов прямой кишки. Столкнуться с парапроктитом может каждый, однако больше всего развитию болезни подвержены представители сильной половины общества.
Содержание статьи:
Причины
Причин и факторов, способствующих возникновению гнойно-воспалительного процесса в окружающих прямую кишку тканях на самом деле не так уж и много. Развиться paraproctitis может вследствие:
Развиться paraproctitis может вследствие:
- понижения защитных сил организма;
- истощения;
- наличия хронических патологий;
- инфекционных и проктологических заболеваний: геморроя, крипты;
- частых запоров;
- геморроя, трещин в заднем проходе;
- травмирования;
- заселения в организм патогенной микрофлоры.
Основная причина возникновения заболевания — проникновение в околопрямокишечную клетчатку разного рода микроорганизмов. Спровоцировать развитие гнойно-воспалительного процесса могут, как правило, несколько возбудителей, однако основа для развития патологического процесса – микробы, которые могут жить и размножаться в условиях полного отсутствия кислорода. Самые агрессивные микробы из всех существующих – анаэробы, которые в самые кротчайшие сроки провоцируют не только поражение клетчатки, но и прямой кишки.
Проникнуть в организм микрофлора может несколькими способами: гематогенным (с током крови) и контактным.
Через протоки желез, которые располагаются в области ануса, патогенная микрофлора из просвета прямой кишки попадает в окружающие ткани. И как результат – развитие воспалительного процесса и формирование гнойника.
Течение заболевания стремительное, и начинается, как правило, внезапно. Появление недомогания, озноба, болезненных ощущений в области заднего прохода, увеличение температуры тела – первые проявления парапроктита. В таком случае, первое, что вам необходимо сделать – обратиться за помощью специалиста.
Симптомы
Парапроктит может быть острым или истинным и хроническим. Острый paraproctitis — это не простое нагноение, которое образуется в околопрямокишечной клетчатке. Проявления острой формы недуга в большинстве случаев сводятся к формированию гнойных свищей. Устья свищевых ходов сосредотачиваются либо вблизи ануса, либо ближе к ягодицам.
Диагноз острого парапроктита – показание к хирургическому вмешательству. Начало патологии острое, течение стремительное и симптоматика ярко-выраженная. Гной, который образуется а параректальной клетчатке не находит выхода, вследствие чего гнойный процесс распространяется дальше. Острая форма недуга сопровождается появлением интенсивных болезненных ощущений в области анального отверстия и прямой кишки, увеличением температуры тела, тошнотой, недомоганием, понижением работоспособности, лихорадкой, головными болями, понижением аппетита, появлением болевых ощущений при мочеиспускании.
Гной, который образуется а параректальной клетчатке не находит выхода, вследствие чего гнойный процесс распространяется дальше. Острая форма недуга сопровождается появлением интенсивных болезненных ощущений в области анального отверстия и прямой кишки, увеличением температуры тела, тошнотой, недомоганием, понижением работоспособности, лихорадкой, головными болями, понижением аппетита, появлением болевых ощущений при мочеиспускании.
По расположению острый paraproctitis бывает:
- Подкожным. Данная форма сопровождается покраснением кожных покровов, образованием отека и уплотнения, сосредоточенных вблизи анального отверстия.
- Ретроректальным. Эта форма весьма коварна, поскольку патологический процесс возникает в самой глубине малого таза и сопровождается болевыми ощущениями в животе. На диагностирование патологии может уйти много времени. Но самое страшное, что процесс продолжает распространяться, а это сопутствует постепенному ухудшению состояния пациента. Основная причина ретроректального парапроктита – прорыв гнойника в прямую кишку вследствие расплавления ее стенки.

- Ишиоректальным. В диагностике данной формы также могут возникнуть определенные трудности. И обусловлено это неспецифичностью симптоматики. Гнойно-воспалительный процесс сосредотачивается в подвздошно-прямокишечной ямке. Симптоматика патологии начинает проявляться, как правило, по истечении недели. Характеризуется эта форма покраснением кожных покровов над очагом воспаления. Помимо этого отмечается некая асимметричность ягодиц.
- Подслизистым. Патологический процесс сосредоточен под слизистой. Эта форма характеризуется покраснением кожи, уплотнением и отеком в области ануса.
- Пельвиоректальным. Эта форма считается самой тяжелой, поскольку очаг располагается несколько выше мышц, образующих тазовое дно. Пельвиоректальный парапроктит сопровождается ознобом и выраженной лихорадкой, болезненными ощущениями внизу живота, задержкой мочи и стула.
- Некротическим. При этой форме отмечается стремительное распространение инфекции вследствие обширных некрозов мягких тканей.

Что касается хронического течения, то данная патология развивается вследствие некачественной, неправильной или неполной терапии острой формы. Характеризуется хроническая форма формированием свищей. Если говорить о течении недуга, то оно волнообразное. Единственная жалоба больных – гнойные или сукровичные выделения из свищевого канала.
При закупорке свищевого хода гнойным содержимым или при возникновении каких-либо препятствий к полному опорожнению гнойника патологический процесс, как правило, обостряется и становится сходным по клиническим проявлениям с острой формой.
Диагностика
После опроса и первичного осмотра с целью выявления изменений воспалительного характера: повышения скорости оседания эритроцитов, увеличения содержания лейкоцитов в крови, назначается проведение общего анализа крови.
Помимо этого назначается проведение: фистулографии – рентгенологического исследования свищевого хода; ультразвукового исследования; аноскопии; ректороманоскопии; зондирования свища; ультрасонографии.
Лечение
Терапия как острого, так и хронического парапроктита заключается в проведении операции: вскрытия гнойника или его дренирования. До и после хирургического вмешательства назначается прием болеутоляющих препаратов и антибиотиков, а также применение физиотерапевтических процедур: микроволновой и ультравысокочастотной терапии.
При игнорировании проблемы вы рискуете развитием осложнений: прорывом гнойника, образованием флегмоны, пельвиоперитонита, распространением воспалительного процесса на мошонку и мочеиспускательный канал.
Отзыв доктора
Парапроктит-это гнойное воспаление тканей, окружающих прямую кишку.
Часто протекает с образованием гнойных свищей. Причиной такого состояния являются микробные агенты. Повышает вероятность заболевания наличие любой патологии прямой кишки: трещины, геморроидальные узлы, воспаления слизистой, запоры, опухоли.
Исключить патологии опухолевой природы поможет обращение к врачу-проктологу.
В острых случаях показано хирургическое лечение. Повышает риск сидячий образ жизни, наличие заболеваний воспалительной природы, снижение иммунитета. Профилактикой является ежедневное опорожнение кишечника, гигиена анальной области, лечение воспалительных заболеваний.
Повышает риск сидячий образ жизни, наличие заболеваний воспалительной природы, снижение иммунитета. Профилактикой является ежедневное опорожнение кишечника, гигиена анальной области, лечение воспалительных заболеваний.
При наличии заболеваний кишечника обязательно ежегодное посещение врача-проктолога.
Профилактика
С целью предотвращения развития данной патологии рекомендуется соблюдать правила личной гигиены, своевременно лечить недуги прямой кишки, правильно и сбалансировано питаться, укреплять иммунную систему.
При появлении дискомфорта, болезненных ощущений, выделений и зуда в области анального отверстия незамедлительно обратитесь за помощью проктолога.
Диагностика острого парапроктита |
Первая и главная задача диагностики острого парапроктита — на основании жалоб пациента, клиники и осмотра распознать наличие и локализацию гнойника в клетчаточном пространстве, окружающем прямую кишку.
Достаточно проста диагностика подкожного парапроктита. Гнойник, локализующийся в подкожной клетчатке перианальной зоны, проявляется быстро и ярко: боль, гиперемия кожи на стороне поражения, сглаженность складок перианальной кожи. При расположении гнойника вблизи заднепроходного отверстия оно может приобретать щелевидную форму. Пальпация в области воспаления резко болезненна, но флюктуации вначале может и не быть — это поздний симптом. Несмотря на то что диагноз кажется несомненным уже при наружном осмотре и пальпации, необходимо выполнять пальцевое исследование прямой кишки и анального канала. При этом нужно не только установить связь гнойника с кишкой, найти пораженную крипту, но и помнить, что гной в подкожной клетчатке может появиться вследствие прорыва его из других клетчаточных пространств, чаще всего из ишиоректального. Введение пальца в кишку следует делать осторожно по стенке анального канала, противоположной расположению гнойника. При подкожном парапроктите верхняя граница абсцесса определяется ниже аноректальной линии. Выше этой зоны стенка кишки эластична.
Выше этой зоны стенка кишки эластична.
Таким образом, диагноз острого подкожного парапроктита можно поставить на основании клинической картины, наружного осмотра, пальпации и пальцевого исследования прямой кишки. Ано-, ректороманоскопия, сфинктерометрия и другие исследования обычно не проводятся в связи с тем, что инструментальные исследования при остром парапроктите очень болезненны.
Ишиоректальный парапроктит может давать изменения, видимые глазом, в поздней стадии, когда появляются выраженная асимметрия ягодиц, сглаживание перианальных складок. Поэтому, если больной обратился по поводу познабливания, ухудшения самочувствия, сна и тупой постоянной боли в прямой кишке и тазу, усиливающейся при дефекации, но без видимых на глаз изменений в области заднего прохода, следует выполнить пальцевое исследование прямой кишки. Уже в самые ранние сроки заболевания можно выявить уплощение стенки кишки выше анального канала, сглаженность складок слизистой оболочки на стороне поражения. К концу 1-й недели заболевания инфильтрат выбухает в просвет прямой кишки, местно отмечается повышение температуры. Воспалительный инфильтрат может распространиться на предстательную железу и уретру, в этом случае пальпация их вызывает болезненный позыв к мочеиспусканию.
К концу 1-й недели заболевания инфильтрат выбухает в просвет прямой кишки, местно отмечается повышение температуры. Воспалительный инфильтрат может распространиться на предстательную железу и уретру, в этом случае пальпация их вызывает болезненный позыв к мочеиспусканию.
Характерные признаки острого ишиоректального парапроктита — наличие инфильтрата в анальном канале на уровне и выше аноректальной линии (при этом пальцем удается достичь верхнюю границу этого инфильтрата), усиление боли при толчкообразном исследовании со стороны промежности. Если диагноз ясен, инструментальные методы исследования так же, как и при подкожном парапроктите, не применяются.
Подслизистый парапроктит диагностируется при пальцевом исследовании прямой кишки. Обычно выбухание гнойника в просвет кишки бывает выраженным, гной может распространяться вниз в подкожное клетчаточное пространство или идти вверх, отслаивая слизистую нижнеампулярного отдела прямой кишки. Подслизистый парапроктит часто вскрывается самостоятельно в просвет кишки, и если дренаж достаточный, может наступить выздоровление.
Тазово-прямокишечный (пельвиоректальный) парапроктит протекает наиболее тяжело и зачастую диагностируется поздно. Воспалительный процесс локализуется глубоко в тазу. Верхняя граница пельвиоректального пространства — тазовая брюшина, нижняя граница — мышцы, поднимающие задний проход. От кожи промежности до пельвиоректальной клетчатки два клетчаточных пространства — подкожное и ишиоректальное, поэтому наружный осмотр промежности обычно не позволяет диагностировать пельвиоректальный парапроктит. Признаки пельвиоректального парапроктита, видимые при наружном осмотре пациента, появляются только в том случае, если гнойный процесс распространяется на ишиоректальную область и на подкожную клетчатку, т. е. в поздней стадии.
Уже в начальной стадии пельвиоректального парапроктита при пальцевом исследовании можно определить болезненность одной из стенок средне- или верхнеампулярного отдела прямой кишки, можно обнаружить тестоватость кишечной стенки или инфильтрат за ее пределами.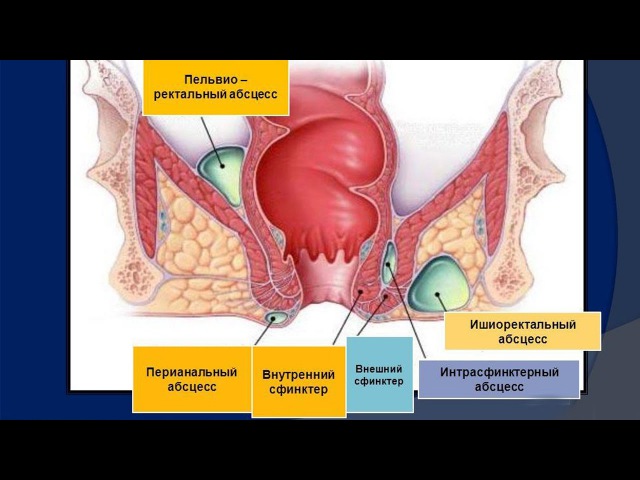 В более поздней стадии стенка кишки утолщается, отмечается сдавление ее извне, а еще позднее — выбухание в просвет кишки эластичного опухолевидного образования, иногда определяется флюктуация. Следует отметить, что при пельвиоректальном парапроктите верхний полюс гнойника пальцем обычно не достигается даже при положении больного на корточках. Пельвиоректальный гнойник, как правило, можно распознать, применив только пальцевое исследование прямой кишки. Зачастую необходимости в применении инструментальных методов диагностики нет. Но если диагноз неясен, нужно использовать ректороманоскопию и ультрасонографию.
В более поздней стадии стенка кишки утолщается, отмечается сдавление ее извне, а еще позднее — выбухание в просвет кишки эластичного опухолевидного образования, иногда определяется флюктуация. Следует отметить, что при пельвиоректальном парапроктите верхний полюс гнойника пальцем обычно не достигается даже при положении больного на корточках. Пельвиоректальный гнойник, как правило, можно распознать, применив только пальцевое исследование прямой кишки. Зачастую необходимости в применении инструментальных методов диагностики нет. Но если диагноз неясен, нужно использовать ректороманоскопию и ультрасонографию.
Эндоскопическая картина при тазово-прямокишечном парапроктите имеет особенности: слизистая оболочка ампулярного отдела кишки над областью инфильтрации гиперемирована, сосудистый рисунок усилен, сетчатый. В поздней стадии, когда инфильтрат выбухает в просвет кишки, слизистая оболочка над ним гладкая, ярко-красного цвета, контактно кровоточит. Если произошел прорыв гноя в просвет кишки, при надавливании тубусом ректоскопа на стенку кишки в месте инфильтрации выделяется гной.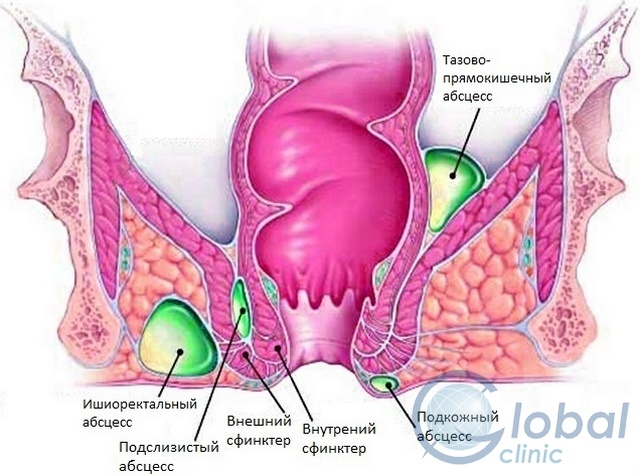 Увидеть отверстие в кишке при этом удается не всегда.
Увидеть отверстие в кишке при этом удается не всегда.
Ультрасонография открыла большие возможности в диагностике парапроктита. Исследование позволяет установить локализацию, размер гнойника, характер изменений в окружающих тканях, применение ректального датчика помогает в топической диагностике гнойного хода и пораженной крипты.
И все-таки основными в диагностике острого пельвиоректального парапроктита на сегодняшний день остаются оценка клинической картины и данные пальцевого исследования прямой кишки.
Разновидностью пельвиоректального парапроктита считается позадипрямокишечный, или ретроректальный. Особенностью клинической картины при локализации воспаления в ретроректальном пространстве является выраженный болевой синдром с самого начала заболевания. И при этой форме парапроктита важнейшим диагностическим методом является пальцевое исследование прямой кишки. Гнойник располагается позади прямой кишки выше заднепроходно-копчиковой связки, исследование обычно очень болезненно. Нередко при этой форме парапроктита четко определяется пораженная задняя крипта.
Нередко при этой форме парапроктита четко определяется пораженная задняя крипта.
Межмышечный парапроктит возникает при распространении гноя в пространство между внутренним и наружным сфинктером. Диагностируется он не так часто. Дело в том, что при наружном осмотре видимых изменений не бывает, процесс локализуется в стенке анального канала. Локализацию и границы инфильтрата можно определить с помощью пальпации большим пальцем со стороны перианальной кожи и указательным пальцем, введенным в кишку. Плотный и очень болезненный инфильтрат указывает на наличие межмышечного парапроктита. Зачастую в такой ситуации ставится диагноз инфильтративного парапроктита и начинается консервативная терапия. Как правило, через сутки гной распространяется на другие клетчаточные пространства и больной оперируется уже по поводу абсцесса.
Конечно, бывает так, что консервативная терапия оказывается эффективной и инфильтративный парапроктит разрешается. Но опыт показывает, что если в воспалительный процесс было вовлечено межсфинктерное пространство, вскоре болезнь вновь заявит о себе.
Итак, мы обсудили вопросы диагностики гнойного процесса в параректальных клетчаточных пространствах: в подкожном, подслизистом, ишиоректальном, пельвиоректальном и ретроректальном, межмышечном. Установили, что зачастую правильно проведенное пальцевое исследование позволяет своевременно поставить диагноз. Лишь в отдельных случаях, особенно при запущенных и осложненных воспалительных процессах, приходится прибегать к инструментальным методам исследования.
Уже упоминалось о том, что гнойник — это только часть патологического процесса при остром парапроктите. Есть еще пораженная крипта, куда открываются протоки воспаленных анальных желез, и есть гнойный ход, по которому гной распространился на клетчаточные пространства. Иногда уже во время первого осмотра при пальцевом исследовании прямой кишки удается пропальпировать пораженную крипту. Но более достоверные сведения получают в операционной, когда можно не только пропальпировать область всех крипт, но и, введя красящий раствор (метиленовый синий с добавлением перекиси водорода) в полость абсцесса, увидеть окрашивание заинтересованной крипты. Гнойный ход тоже чаще выявляется уже при операции. Если процесс острый, нет рубцов, свидетельствующих о предшествующем воспалении, пропальпировать даже поверхностный ход удается не всегда. Чаще всего гнойный ход проходит через подкожную порцию наружного сфинктера, и можно иногда через перианальную кожу пропальпировать тяж, идущий от подкожного абсцесса к прямой кишке. Очень редко гнойный ход располагается строго кнутри от наружного жома.
Гнойный ход тоже чаще выявляется уже при операции. Если процесс острый, нет рубцов, свидетельствующих о предшествующем воспалении, пропальпировать даже поверхностный ход удается не всегда. Чаще всего гнойный ход проходит через подкожную порцию наружного сфинктера, и можно иногда через перианальную кожу пропальпировать тяж, идущий от подкожного абсцесса к прямой кишке. Очень редко гнойный ход располагается строго кнутри от наружного жома.
Если же гнойный ход проходит через поверхностную, а тем более глубокую, порцию анального сфинктера, пропальпировать его, как правило, невозможно. При остром парапроктите ход еще не окружен рубцовой тканью, диаметр его невелик — 1—2 мм, зондом удается пройти по нему, если ход располагается достаточно поверхностно. При высоком расположении хода зондом можно сделать ложный ход.
После проведенного первичного осмотра мы можем сформулировать диагноз острого парапроктита с указанием локализации гнойника в клетчаточном пространстве, ориентировочно в ряде случаев предположить локализацию пораженной крипты и гнойного хода по отношению к наружному сфинктеру: интрасфинктерный, транссфинктерный и экстрасфинктерный. Интрасфинктерный гнойный ход бывает очень редко, чаще всего мы имеем дело с транссфинктерным ходом, он может пронизывать сфинктер на разных уровнях. По клинической картине мы можем судить о возбудителе парапроктита. Как правило, процесс вызывается ассоциацией микроорганизмов и налицо классические симптомы воспаления: боль, отек, гиперемия, гной.
Интрасфинктерный гнойный ход бывает очень редко, чаще всего мы имеем дело с транссфинктерным ходом, он может пронизывать сфинктер на разных уровнях. По клинической картине мы можем судить о возбудителе парапроктита. Как правило, процесс вызывается ассоциацией микроорганизмов и налицо классические симптомы воспаления: боль, отек, гиперемия, гной.
Сведения, получаемые нами при первом осмотре пациента, дополняются в дальнейшем при проведении операции. Но здесь могут быть затруднения. Так, если локализацию гнойника и распространенность воспаления по параректальным клетчаточным пространствам действительно можно установить описанными выше методами, то локализацию гнойного хода определить бывает очень трудно. Использование допплеро-, контрастной абсцессографии не дало желаемого эффекта. Наиболее перспективным для обнаружения гнойного хода зарекомендовало себя ультразвуковое исследование с использованием ректального датчика.
Дифференциальная диагностика.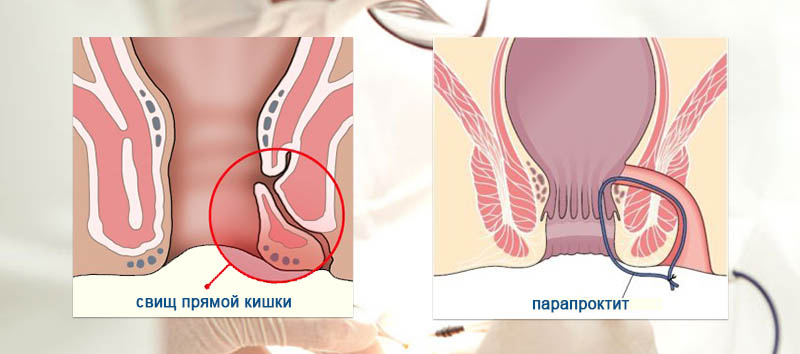
Острый парапроктит в основном приходится дифференцировать от нагноившейся тератомы параректальной клетчатки, абсцесса дугласова пространства, опухоли прямой кишки и параректальной области. Как правило, такая необходимость возникает при ишио-, пельвиоректальном парапроктите, т. е. при высоком расположении гнойника. При подкожном парапроктите иногда возникает сомнение: не является ли этот гнойник абсцедирующим фурункулом, нагноившейся атеромой? Если это парапроктит, то в подкожной клетчатке определяется тяж, идущий к заднепроходному отверстию, поскольку инфицирование идет из просвета кишки.
Отличить банальный парапроктит от нагноившейся тератомы (дермоидные и эпидермоидные кисты, солидные тератомы с наличием кистозных полостей) непросто. Следует иметь в виду, что нагноившаяся, но не вскрывшаяся киста не имеет связи с просветом прямой кишки, кисты часто имеют хорошо выраженную оболочку, четкие границы. Содержимое кист (кроме гноя) необычно для банальных гнойников — оно студнеобразное, творожистое или замазкообразное. Если киста опорожнилась в просвет кишки, то это отверстие, как правило, выше уровня крипт, в то время как при парапроктите имеется пораженная крипта, являющаяся входными воротами для инфекции из просвета кишки.
Если киста опорожнилась в просвет кишки, то это отверстие, как правило, выше уровня крипт, в то время как при парапроктите имеется пораженная крипта, являющаяся входными воротами для инфекции из просвета кишки.
Дифференциально-диагностические различия между пелъвиоректальным парапроктитом и абсцессом дугласова пространства выявляются при сборе анамнеза. Абсцесс дугласова пространства возникает как осложнение заболеваний органов брюшной полости или после оперативных вмешательств по поводу них. Помогает в правильной постановке диагноза бимануальное и бидигитальное исследования через прямую кишку и влагалище. По наблюдениям профессора А. М. Аминева, «при бимануальном исследовании через прямую кишку и брюшную стенку у больных с абсцессом малого таза свести-сопоставить концы пальцев через толщу тканей никогда не удается. Если при бимануальном исследовании через прямую кишку у мужчин и через влагалище у женщин удается свести-сопоставить концы пальцев хотя бы не по средней линии, а в боковых отделах таза, то нужно считать, что у больного не абсцесс дугласова пространства, а тазово-прямокишечный парапроктит». В современных условиях чаще всего применяется ультразвуковое исследование, позволяющее достаточно точно определить локализацию гнойника. Топическая диагностика крайне важна, поскольку оперативный доступ для дренирования абсцесса при парапроктите отличается от такового при абсцессе дугласова кармана.
В современных условиях чаще всего применяется ультразвуковое исследование, позволяющее достаточно точно определить локализацию гнойника. Топическая диагностика крайне важна, поскольку оперативный доступ для дренирования абсцесса при парапроктите отличается от такового при абсцессе дугласова кармана.
Острый парапроктит встречается как осложнение распадающейся злокачественной опухоли прямой кишки. Распознать это удается, применив пальцевое исследование прямой кишки.
Если воспалительный процесс в параректальной клетчатке носит индуративный характер, нужно исключить злокачественный процесс. При этом уместно применить все необходимые методы исследования: проктографию и рентгенографию крестца и копчика, ультрасонографию, биопсию.
Статьи по теме
ЗАПИСАТЬСЯ НА КОНСУЛЬТАЦИЮ
Парапроктит — Диагностика | Грамотно о здоровье на iLive
Диагностика острого парапроктита
Наибольшее значение при распознавании острого парапроктита имеет исследование анальной зоны и пальцевое исследование прямой кишки.
При осмотре обращает на себя внимание гиперемия кожи в области промежности на стороне поражения. При расположении абсцесса в непосредственной близости от анального отверстия анус деформируется. Пальпация промежности болезненна.Колебание можно определить. Пальцевое обследование прямой кишки также во многих случаях является болезненным, и его следует проводить с осторожностью. Этой методикой нельзя пренебрегать, так как информация, полученная с ее помощью, может быть очень ценной для распознавания практически всех форм острого парапроктита. При подкожном парапроктите, на который приходится примерно 50% всех случаев острого парапроктита, пальцевое исследование позволяет определить инфильтрат, в том числе его верхнюю границу. При подслизистом парапроктите, возникающем в 1.У 9-6,3% больных острым парапроктитом и относящимся к легким формам заболевания пальцевой осмотр может выявить круглое жесткое подслизистое образование, выступающее в просвет прямой кишки над линией гребня. Чаще встречается ишиоректальный парапроктит (35-40% от общего числа больных острым парапроктитом).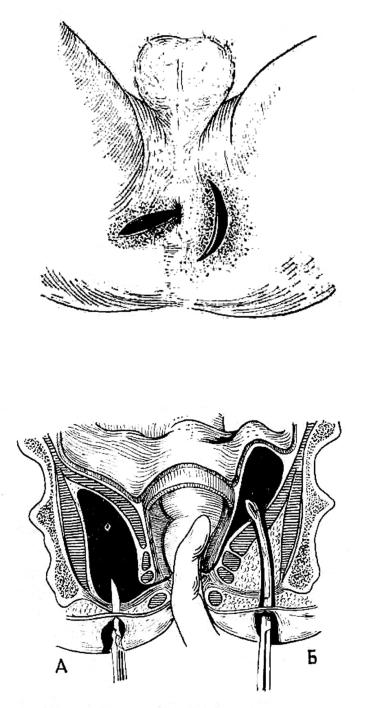 Для парапроктита этой локализации характерна также инфильтрация стенки нижней ампулярной части прямой кишки и анального канала выше линии гребня. Инфильтрацию невозможно определить только в тех случаях, когда гной быстро распространяется на подкожную клетчатку и прорывается на кожу промежности.При редко встречающейся тяжелой форме острого парапроктита — тазовом ректальном (пельвио-ректальном) — пальцевое обследование выявляет начальные признаки этого поражения: болезненность при пальпации одной из стенок средней или верхней ампулярной прямой мышцы, ее тестообразной консистенции или плотного инфильтрата. . Верхний полюс пельвиоректального инфильтрата пальцем обычно не определяется. Ректороманоскопия выявляет гиперемию и бархатистость слизистой оболочки в области, прилегающей к инфильтрату. Когда инфильтрат набухает в просвет кишечника, слизистая оболочка над ним лишается складок, и на момент ректороманоскопии он диффузно кровоточит (контактное кровотечение).
Для парапроктита этой локализации характерна также инфильтрация стенки нижней ампулярной части прямой кишки и анального канала выше линии гребня. Инфильтрацию невозможно определить только в тех случаях, когда гной быстро распространяется на подкожную клетчатку и прорывается на кожу промежности.При редко встречающейся тяжелой форме острого парапроктита — тазовом ректальном (пельвио-ректальном) — пальцевое обследование выявляет начальные признаки этого поражения: болезненность при пальпации одной из стенок средней или верхней ампулярной прямой мышцы, ее тестообразной консистенции или плотного инфильтрата. . Верхний полюс пельвиоректального инфильтрата пальцем обычно не определяется. Ректороманоскопия выявляет гиперемию и бархатистость слизистой оболочки в области, прилегающей к инфильтрату. Когда инфильтрат набухает в просвет кишечника, слизистая оболочка над ним лишается складок, и на момент ректороманоскопии он диффузно кровоточит (контактное кровотечение).
[1], [2], [3], [4], [5], [6], [7], [8]
Диагностика хронического парапроктита
При опросе пациента уточняется длительность заболевания, частота обострений и используемые методы лечения.
При обследовании обращают внимание на состояние кожи промежности. Пальпация перианальной области и промежности позволяет определить наличие рубцового процесса и степень его развития.
Пальцевое исследование прямой кишки позволяет судить о тонусе сфинктера и в некоторых случаях обнаружить внутреннее отверстие свища.
Обязательно используйте металлический триггерный зонд, который вводят в свищевой проход через его внешнее отверстие. С помощью зонда определяют направление свища, его отношение к мышце сфинктера.
Проба с красящим веществом служит для определения проходимости свищевого хода, расположения внутреннего отверстия и гнойных полостей в целлюлозе.
Фистулография — это обязательное рентгенологическое исследование свищей прямой кишки, особенно важное для выявления транс- и экстрарикнарных свищей.
Ректороманоскопия проводится для выявления сопутствующих воспалительных заболеваний, опухолей и высоких внутренних свищей.
[9], [10], [11]
Диагностика перипротезной инфекции | Скелетно-мышечный ключ
Серология: помимо скорости оседания эритроцитов и С-реактивного белка
Недавно было проведено исследование по оценке других сывороточных маркеров, которые можно использовать в диагностике ППИ. Прокальцитонин (ПКТ) — это сывороточный маркер, уровень которого повышается в присутствии раздражителей, таких как бактерии, которые являются провоспалительными.Боттнер и его коллеги измерили сывороточные уровни интерлейкина (ИЛ) -6, ПКТ, фактора некроза опухоли (TNF) -α, СРБ и СОЭ у 78 субъектов, перенесших ревизионную замену коленного или тазобедренного суставов по поводу PJI. CRP и IL-6 имели самую высокую чувствительность (95%) для выявления PJI, когда уровни были выше 3,2 мг / дл и 12 пг / мл, соответственно, и исследователи рекомендовали комбинировать CRP и IL-6 в качестве скринингового теста. Уровни ПКТ (> 0,3 нг / мл) были очень специфичными (98%), но имели низкую чувствительность (33%). С другой стороны, Хюгле и его коллеги сообщили, что ПКТ имеет более высокую чувствительность и специфичность для диагностики септического артрита, чем СРБ, с чувствительностью 93% и специфичностью 75% при пороговом значении ПКТ, равном 0.25 нг / мл. Теоретически это возможно, потому что ПКТ секретируется системой мононуклеарных фагоцитов при стимуляции липополисахаридом.
Прокальцитонин (ПКТ) — это сывороточный маркер, уровень которого повышается в присутствии раздражителей, таких как бактерии, которые являются провоспалительными.Боттнер и его коллеги измерили сывороточные уровни интерлейкина (ИЛ) -6, ПКТ, фактора некроза опухоли (TNF) -α, СРБ и СОЭ у 78 субъектов, перенесших ревизионную замену коленного или тазобедренного суставов по поводу PJI. CRP и IL-6 имели самую высокую чувствительность (95%) для выявления PJI, когда уровни были выше 3,2 мг / дл и 12 пг / мл, соответственно, и исследователи рекомендовали комбинировать CRP и IL-6 в качестве скринингового теста. Уровни ПКТ (> 0,3 нг / мл) были очень специфичными (98%), но имели низкую чувствительность (33%). С другой стороны, Хюгле и его коллеги сообщили, что ПКТ имеет более высокую чувствительность и специфичность для диагностики септического артрита, чем СРБ, с чувствительностью 93% и специфичностью 75% при пороговом значении ПКТ, равном 0.25 нг / мл. Теоретически это возможно, потому что ПКТ секретируется системой мононуклеарных фагоцитов при стимуляции липополисахаридом. Основываясь на этих исследованиях, ПКТ может быть полезен для различения бактериальных инфекций суставов и других причин воспаления. Использование этого маркера также может помочь определить, может ли быть эффективна противомикробная терапия, которая может сократить продолжительность приема лекарств и минимизировать устойчивость к противомикробным препаратам.
Основываясь на этих исследованиях, ПКТ может быть полезен для различения бактериальных инфекций суставов и других причин воспаления. Использование этого маркера также может помочь определить, может ли быть эффективна противомикробная терапия, которая может сократить продолжительность приема лекарств и минимизировать устойчивость к противомикробным препаратам.
Glehr и его коллеги сравнили ПКТ, ИЛ-6 и интерферон (ИФН) -α в качестве биомаркеров сыворотки с уровнями лейкоцитов и СРБ для диагностики ППИ у пациентов с повторной артропластикой.Образцы крови брали до операции, а также в первые, третьи и седьмые дни после операции. Результаты показали, что PCT, IL-6, CRP и WBC коррелировали с диагнозом PJI, тогда как IFN-α не коррелировали. IFN-α играет важную роль в противовирусном иммунитете, но не в противомикробном иммунитете и может не обнаруживаться при бактериальных инфекциях. В сывороточных измерениях ПКТ более 0,35 нг / мл имел чувствительность 80% и специфичность 37%, тогда как уровень ИЛ-6 более 2,55 пг / мл имел чувствительность 92% и специфичность 59%. Другие исследования показали аналогичные результаты в сыворотке пациентов с диагнозом PJI. С другой стороны, Уортингтон и его коллеги, а также Драго и его коллеги обнаружили, что уровень ПКТ не был повышен в сыворотке пациентов с ППИ. Однако СОЭ, СРБ, лейкоциты, ИЛ-6, растворимая молекула межклеточной адгезии-1 и сывороточный IgG к короткоцепочечной внеклеточной липотейхоевой кислоте были повышены у субъектов с септическим разрыхлением. IL-6 секретируется различными иммунными клетками, такими как моноциты, макрофаги, фибробласты и Т2-лимфоциты после травмы.Поскольку IL-6 запускает высвобождение CRP в клетках печени, он может гораздо быстрее реагировать на инфекцию, чем CRP, и, как сообщается, является чувствительным маркером бактериальной инфекции после TJA. Виртц и его коллеги продемонстрировали, что повышенный уровень IL-6 коррелирует с повышенной воспалительной активностью, и предположили, что IL-6 является лучшим индикатором послеоперационной воспалительной реакции, чем измерения CRP после TJA.
Другие исследования показали аналогичные результаты в сыворотке пациентов с диагнозом PJI. С другой стороны, Уортингтон и его коллеги, а также Драго и его коллеги обнаружили, что уровень ПКТ не был повышен в сыворотке пациентов с ППИ. Однако СОЭ, СРБ, лейкоциты, ИЛ-6, растворимая молекула межклеточной адгезии-1 и сывороточный IgG к короткоцепочечной внеклеточной липотейхоевой кислоте были повышены у субъектов с септическим разрыхлением. IL-6 секретируется различными иммунными клетками, такими как моноциты, макрофаги, фибробласты и Т2-лимфоциты после травмы.Поскольку IL-6 запускает высвобождение CRP в клетках печени, он может гораздо быстрее реагировать на инфекцию, чем CRP, и, как сообщается, является чувствительным маркером бактериальной инфекции после TJA. Виртц и его коллеги продемонстрировали, что повышенный уровень IL-6 коррелирует с повышенной воспалительной активностью, и предположили, что IL-6 является лучшим индикатором послеоперационной воспалительной реакции, чем измерения CRP после TJA. Это открытие противоречиво, поскольку моноциты реагируют на частицы полиэтилена, секретируя ИЛ-6, а высокие концентрации ИЛ-6 были обнаружены в межфазной мембране, окружающей свободные имплантаты.Даже если уровни IL-6 в периферической крови после TJA повышались, не проводилось никаких клинических исследований, которые бы показали корреляцию между несостоятельностью асептического имплантата и повышенными уровнями IL-6. Таким образом, IL-6 может быть полезен для раннего выявления септического процесса и для мониторинга эффективности антибактериальной терапии.
Это открытие противоречиво, поскольку моноциты реагируют на частицы полиэтилена, секретируя ИЛ-6, а высокие концентрации ИЛ-6 были обнаружены в межфазной мембране, окружающей свободные имплантаты.Даже если уровни IL-6 в периферической крови после TJA повышались, не проводилось никаких клинических исследований, которые бы показали корреляцию между несостоятельностью асептического имплантата и повышенными уровнями IL-6. Таким образом, IL-6 может быть полезен для раннего выявления септического процесса и для мониторинга эффективности антибактериальной терапии.
Shah и его коллеги измерили сывороточные уровни 25 различных цитокинов до и после TJA и определили цитокины, связанные с хирургической травмой. Три из 25 цитокинов, включая IL-6, хемоаттрактантный белок моноцитов (MCP) -1 и IL-2R, были связаны с послеоперационной травмой, в том числе с 1 глубокой инфекцией.Изменения в IL-6 и MCP-1, по-видимому, отражают усиление воспаления у субъекта с глубокой инфекцией, а уровни IL-2R у того же субъекта были ниже, чем в среднем, но заметно не снизились. Исследователи предположили, что комбинация повышенного уровня IL-6 через 6 часов и снижения уровней MCP-1 через 48 часов может быть связана с инфекцией.
Исследователи предположили, что комбинация повышенного уровня IL-6 через 6 часов и снижения уровней MCP-1 через 48 часов может быть связана с инфекцией.
Диагностика панкреатита | NIDDK
Как врачи диагностируют панкреатит?
Для диагностики панкреатита и поиска его причин врачи используют
- ваша история болезни
- медосмотр
- лабораторные и визуальные тесты
Медицинский работник спросит
Во время медицинского осмотра медицинский работник
- осмотрите свое тело
- проверьте живот на предмет боли, отека или нежности
Медицинский работник спросит вас о ваших симптомах и истории вашего здоровья, включая лекарства, которые вы принимаете.
Какие тесты используют специалисты здравоохранения для диагностики панкреатита?
Медицинские работники могут использовать лабораторные анализы или методы визуализации для диагностики панкреатита и выявления его причин. Диагностика хронического панкреатита на ранних стадиях может быть сложной задачей. Ваш врач также проверит вас на наличие других состояний с похожими симптомами, таких как язвенная болезнь или рак поджелудочной железы.
Диагностика хронического панкреатита на ранних стадиях может быть сложной задачей. Ваш врач также проверит вас на наличие других состояний с похожими симптомами, таких как язвенная болезнь или рак поджелудочной железы.
Лабораторные испытания
Лабораторные тесты, помогающие диагностировать панкреатит, включают следующее:
Анализы крови. Медицинский работник может взять у вас образец крови и отправить его в лабораторию для проверки на
Тесты стула. Ваш врач может проверить образец стула, чтобы выяснить, есть ли у человека мальабсорбция жира.
Визуальные тесты
Медицинские работники также используют методы визуализации для диагностики панкреатита. Техник выполняет большинство тестов в амбулаторном центре, больнице или кабинете врача. Для большинства этих анализов вам не нужна анестезия — лекарство, которое успокаивает вас.
УЗИ. Ультразвук использует устройство, называемое преобразователем, которое безопасно и безболезненно отражает звуковые волны от ваших органов, чтобы создать картину их структуры. Ультразвук может обнаружить камни в желчном пузыре.
Ультразвук может обнаружить камни в желчном пузыре.
Компьютерная томография (КТ). КТ позволяет получить изображения поджелудочной железы, желчного пузыря и желчных протоков. КТ может показать панкреатит или рак поджелудочной железы.
Магнитно-резонансная холангиопанкреатография (MRCP). MRCP использует аппарат магнитно-резонансной томографии (МРТ), который создает изображения ваших органов и мягких тканей без рентгеновских лучей.Ваш врач или специалист могут использовать MRCP для проверки вашей поджелудочной железы, желчного пузыря и желчных протоков на предмет наличия панкреатита.
Медицинские работники используют MRCP, чтобы исследовать поджелудочную железу, желчный пузырь и желчные протоки для выявления причин панкреатита.
Эндоскопическое ультразвуковое исследование (EUS). Ваш врач вводит эндоскоп — тонкую гибкую трубку — вам в горло, через желудок и в тонкий кишечник. Врач включает ультразвуковую насадку, чтобы сделать снимки поджелудочной железы и желчных протоков. Ваш врач может направить вас к гастроэнтерологу для проведения этого теста.
Ваш врач может направить вас к гастроэнтерологу для проведения этого теста.
Функциональный тест поджелудочной железы (PFT). Ваш врач может использовать этот тест для измерения реакции поджелудочной железы на секретин — гормон, вырабатываемый тонкой кишкой. Этот тест проводится только в некоторых центрах США.
Перитонит — Диагностика и лечение
Диагноз
Чтобы диагностировать перитонит, ваш врач обсудит с вами вашу историю болезни и проведет медицинский осмотр.Когда перитонит связан с перитонеальным диализом, ваших признаков и симптомов, особенно мутности диализирующего раствора, может быть достаточно, чтобы врач смог диагностировать это состояние.
В случаях перитонита, при котором инфекция может быть результатом других заболеваний (вторичный перитонит) или инфекция возникает в результате скопления жидкости в брюшной полости (спонтанный бактериальный перитонит), ваш врач может порекомендовать следующие тесты для подтверждения диагноз:
- Анализы крови.
 Образец вашей крови может быть взят и отправлен в лабораторию для проверки высокого количества лейкоцитов. Также может быть выполнен посев крови, чтобы определить, есть ли в вашей крови бактерии.
Образец вашей крови может быть взят и отправлен в лабораторию для проверки высокого количества лейкоцитов. Также может быть выполнен посев крови, чтобы определить, есть ли в вашей крови бактерии. - Визуальные тесты. Ваш врач может захотеть использовать рентген, чтобы проверить наличие отверстий или других перфораций в желудочно-кишечном тракте. Также можно использовать ультразвук. В некоторых случаях ваш врач может использовать компьютерную томографию (КТ) вместо рентгена.
- Анализ перитонеальной жидкости. С помощью тонкой иглы врач может взять образец жидкости из брюшины (парацентез), особенно если вы проходите перитонеальный диализ или у вас в брюшной полости имеется жидкость из-за заболевания печени. Если у вас перитонит, исследование этой жидкости может показать повышенное количество лейкоцитов, что обычно указывает на инфекцию или воспаление. Посев жидкости также может выявить присутствие бактерий.
Вышеупомянутые тесты могут также потребоваться, если вы получаете перитонеальный диализ и после медицинского осмотра и исследования диализирующего раствора диагноз перитонита не определен.
Лечение
Спонтанный бактериальный перитонит может быть опасным для жизни. Тебе нужно остаться в больнице. Лечение включает антибиотики и поддерживающую терапию.
Вам также нужно будет остаться в больнице из-за перитонита, вызванного инфекцией, вызванной другими заболеваниями (вторичный перитонит). Лечение может включать:
- Антибиотики. Скорее всего, вам дадут курс лечения антибиотиками для борьбы с инфекцией и предотвращения ее распространения.Тип и продолжительность антибактериальной терапии будут зависеть от тяжести вашего состояния и типа перитонита. Вам могут назначить антибиотик, который лечит широкий спектр бактерий, пока врачи не получат больше информации о конкретных бактериях, вызывающих вашу инфекцию. Тогда они смогут более точно нацелить ваш антибиотик.
- Хирургия. Хирургическое вмешательство часто требуется для удаления инфицированной ткани, лечения основной причины инфекции и предотвращения распространения инфекции, особенно если перитонит вызван разрывом аппендикса, желудка или толстой кишки.

- Другие виды лечения. В зависимости от ваших признаков и симптомов ваше лечение в больнице, вероятно, будет включать обезболивающие, введение жидкости через зонд (внутривенные жидкости), кислород и, в некоторых случаях, переливание крови.
Если вы проходите перитонеальный диализ
Если у вас перитонит, ваш врач может порекомендовать вам пройти диализ другим способом в течение нескольких дней, пока ваше тело не излечится от инфекции. Если перитонит сохраняется или рецидивирует, возможно, вам придется полностью прекратить перитонеальный диализ и перейти на другую форму диализа.
Клинические испытания
Изучите исследования клиники Мэйо, в которых тестируются новые методы лечения, вмешательства и тесты как средства предотвращения, обнаружения, лечения или контроля этого заболевания.
18 июня 2020 г.
Показать ссылки
- Yu ASL, et al.
 , Eds. Перитонеальный диализ. В: Brenner & Rector’s The Kidney. 11 изд. Эльзевир; 2020. https: //www.clinicalkey.com. По состоянию на 20 марта 2020 г.
, Eds. Перитонеальный диализ. В: Brenner & Rector’s The Kidney. 11 изд. Эльзевир; 2020. https: //www.clinicalkey.com. По состоянию на 20 марта 2020 г. - Ferri FF. Перитонит вторичный. В: Клинический советник Ферри 2020. Elsevier; 2020. https://www.clinicalkey.com. По состоянию на 17 марта 2020 г.
- Методы лечения почечной недостаточности: перитонеальный диализ. Национальный информационный центр по почечным и урологическим заболеваниям (NKUDIC). http://kidney.niddk.nih.gov/KUDiseases/pubs/peritoneal/index.aspx. По состоянию на 20 марта 2020 г.
- Runyon BA. Спонтанный бактериальный перитонит у взрослых: лечение и профилактика.https://www.uptodate.com/contents/search. По состоянию на 13 марта 2020 г.
- Острая боль в животе. Руководство Merck Professional Edition. http://www.merckmanuals.com/professional/gastrointestinal_disorders/acute_abdomen_and_surgical_gastroenterology/acute_abdominal_pain.html?qt=&sc=&alt=. По состоянию на 13 марта 2020 г.

- Picco MF (экспертное заключение). Клиника Майо. 24 марта 2015 года.
- Доэрти GM, изд. Брюшная полость. В: Текущая диагностика и лечение: хирургия.14-е изд. McGraw-Hill Education; 2015. https://accessmedicine.mhmedical.com. По состоянию на 13 марта 2020 г.
- AskMayoExpert. Спонтанный бактериальный перитонит (взрослый). Клиника Майо; 2019.
- Runyon BA. Спонтанный бактериальный перитонит у взрослых: диагноз. https://www.uptodate.com/contents/search. По состоянию на 13 марта 2020 г.
- Feehally J, et al., Eds. Осложнения перитонеального диализа. В кн .: Комплексная клиническая нефрология. 6-е изд. Эльзевир; 2019. https: // www.Clinicalkey.com. По состоянию на 20 марта 2020 г.
- Salzer, WL. Перитонит, связанный с перитонеальным диализом: проблемы и решения. Международный журнал нефрологии и реноваскулярных заболеваний. 2018; DOI: 10.2147 / IJNRD.S123618.
- Спонтанный бактериальный перитонит (САБ).
 Руководство Merck Professional Edition. https://www.merckmanuals.com/professional/hepatic-and-biler-disorders/approach-to-the-patient-with-liver-disease/spontaneous-bacterial-peritonitis-sbp. Доступ 13 марта 2020 г.
Руководство Merck Professional Edition. https://www.merckmanuals.com/professional/hepatic-and-biler-disorders/approach-to-the-patient-with-liver-disease/spontaneous-bacterial-peritonitis-sbp. Доступ 13 марта 2020 г. - Greenberger NJ, et al., Eds. Асцит и спонтанный бактериальный перитонит. В: Текущая диагностика и лечение: гастроэнтерология, гепатология и эндоскопия. 3-е изд. McGraw-Hill Education; 2016. https://accessmedicine.mhmedical.com. По состоянию на 17 марта 2020 г.
- Burkart JM. Клинические проявления и диагностика перитонита при перитонеальном диализе. https://www.uptodate.com/contents/search. По состоянию на 13 марта 2020 г.
- Burkart JM. Факторы риска и профилактика перитонита при перитонеальном диализе.https://www.uptodate.com/contents/search. По состоянию на 13 марта 2020 г.
- Li PK и др. Рекомендации ISPD по перитониту: обновленная информация о профилактике и лечении 2016 г. Международный перитонеальный диализ. 2016; DOI: 10.
 3747 / pdi.2016.00078.
3747 / pdi.2016.00078. - Раджан Э. (экспертное заключение). Клиника Майо. 1 июня 2020 г.
Связанные
Связанные процедуры
Показать другие связанные процедуры
Продукты и услуги
Показать больше продуктов и услуг Mayo Clinic
Перипротезная инфекция коленного сустава низкой степени: диагностика и лечение
1 J Orthopaed Traumatol (2015) 16: 1 7 DOI / sy СТАТЬЯ ОБЗОРА Перипротезная инфекция коленного сустава низкой степени: диагностика и лечение Микеле Вассо Альфредо Скьявоне Панни Поступила: 27 декабря 2013 г. / Принята к публикации: 29 марта 2014 г. / Опубликовано онлайн: 14 мая 2014 г. Ó Автор (ы) Эта статья опубликована в открытом доступе на Springerlink.com Abstract Диагностика и лечение перипротезной инфекции коленного сустава низкой степени злокачественности остаются спорными и спорными. Диагноз слабой степени инфекции после тотального эндопротезирования коленного сустава часто бывает сложным, поскольку клиническая симптоматика и диагностические исследования очень противоречивы, а коленные суставы часто имеют хорошо закрепленные компоненты. Хотя стандартным критерием для поэтапной реимплантации является временное размещение спейсера, содержащего антибиотики, для лечения инфекций, вызванных бактериями с низкой вирулентностью, рекомендуются менее инвазивные хирургические процедуры.Удаление раны с заменой полиэтилена и одноступенчатая реимплантация могут дать такие преимущества, как меньшее количество операций, снижение вероятности интраоперационных осложнений и снижение прямых социальных затрат.
/ Принята к публикации: 29 марта 2014 г. / Опубликовано онлайн: 14 мая 2014 г. Ó Автор (ы) Эта статья опубликована в открытом доступе на Springerlink.com Abstract Диагностика и лечение перипротезной инфекции коленного сустава низкой степени злокачественности остаются спорными и спорными. Диагноз слабой степени инфекции после тотального эндопротезирования коленного сустава часто бывает сложным, поскольку клиническая симптоматика и диагностические исследования очень противоречивы, а коленные суставы часто имеют хорошо закрепленные компоненты. Хотя стандартным критерием для поэтапной реимплантации является временное размещение спейсера, содержащего антибиотики, для лечения инфекций, вызванных бактериями с низкой вирулентностью, рекомендуются менее инвазивные хирургические процедуры.Удаление раны с заменой полиэтилена и одноступенчатая реимплантация могут дать такие преимущества, как меньшее количество операций, снижение вероятности интраоперационных осложнений и снижение прямых социальных затрат.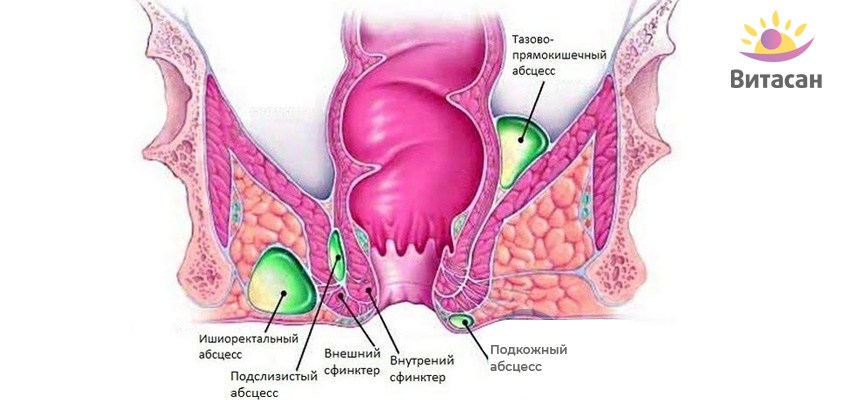 Целью этого описательного обзора был анализ литературы для оценки эффективности различных хирургических процедур при лечении перипротезных инфекций коленного сустава низкой степени злокачественности. Кроме того, были рассмотрены наиболее надежные исследования для диагностики тотальной инфекции коленного сустава, вызванной маловирулентными бактериями.Уровень доказательности Уровень V. Ключевые слова Тотальное эндопротезирование коленного сустава Низкая степень инфекции Диагностика Удаление раны Реимплантация Введение Инфекция продолжает оставаться редким, но разрушительным осложнением тотального эндопротезирования коленного сустава (ТКА), встречающимся в 13% случаев [1 5]. Несмотря на низкую заболеваемость, инфекция связана с заболеваемостью пациентов, повышенными расходами на здравоохранение и рецидивами M. Vasso (&) A. Schiavone Panni Департамент медицины и науки здравоохранения, Университет Молизе, Via Francesco De Sanctis, Кампобассо, Италия, и также сложно контролировать [6].Инфекции TKA часто связаны со стафилококками и стрептококками, тогда как аэробные грамотрицательные бактерии вызывают% всех инфекций, а анаэробные бактерии — еще 10% [7].
Целью этого описательного обзора был анализ литературы для оценки эффективности различных хирургических процедур при лечении перипротезных инфекций коленного сустава низкой степени злокачественности. Кроме того, были рассмотрены наиболее надежные исследования для диагностики тотальной инфекции коленного сустава, вызванной маловирулентными бактериями.Уровень доказательности Уровень V. Ключевые слова Тотальное эндопротезирование коленного сустава Низкая степень инфекции Диагностика Удаление раны Реимплантация Введение Инфекция продолжает оставаться редким, но разрушительным осложнением тотального эндопротезирования коленного сустава (ТКА), встречающимся в 13% случаев [1 5]. Несмотря на низкую заболеваемость, инфекция связана с заболеваемостью пациентов, повышенными расходами на здравоохранение и рецидивами M. Vasso (&) A. Schiavone Panni Департамент медицины и науки здравоохранения, Университет Молизе, Via Francesco De Sanctis, Кампобассо, Италия, и также сложно контролировать [6].Инфекции TKA часто связаны со стафилококками и стрептококками, тогда как аэробные грамотрицательные бактерии вызывают% всех инфекций, а анаэробные бактерии — еще 10% [7]. Метициллин-чувствительные стафилококки, стрептококки и анаэробные кокки обычно считаются бактериями с низкой вирулентностью, вызывающими перипротезные инфекции низкой степени злокачественности; метициллин-резистентные стафилококки, энтерококки и грамотрицательные организмы, безусловно, считаются бактериями с высокой вирулентностью из-за их внутренней устойчивости к антимикробным агентам и антибиотикам [8].Диагностика инфекции TKA, которая сама по себе очень сложна, становится очень сложной в присутствии микроорганизмов с низкой вирулентностью, поскольку клинические признаки и диагностические тесты могут противоречить друг другу. Общие клинические признаки инфекции часто отсутствуют, и золотого стандарта предоперационной диагностики не существует. В то время как двухэтапная реимплантация считается во всем мире наиболее успешной процедурой при лечении инфекций TKA, независимо от этиологии инфекционного организма (ов) (и времени заражения) [2, 4, 6, 9 12], лечение низкосортный протез коленного сустава инфекция остается спорным и дискуссионным.
Метициллин-чувствительные стафилококки, стрептококки и анаэробные кокки обычно считаются бактериями с низкой вирулентностью, вызывающими перипротезные инфекции низкой степени злокачественности; метициллин-резистентные стафилококки, энтерококки и грамотрицательные организмы, безусловно, считаются бактериями с высокой вирулентностью из-за их внутренней устойчивости к антимикробным агентам и антибиотикам [8].Диагностика инфекции TKA, которая сама по себе очень сложна, становится очень сложной в присутствии микроорганизмов с низкой вирулентностью, поскольку клинические признаки и диагностические тесты могут противоречить друг другу. Общие клинические признаки инфекции часто отсутствуют, и золотого стандарта предоперационной диагностики не существует. В то время как двухэтапная реимплантация считается во всем мире наиболее успешной процедурой при лечении инфекций TKA, независимо от этиологии инфекционного организма (ов) (и времени заражения) [2, 4, 6, 9 12], лечение низкосортный протез коленного сустава инфекция остается спорным и дискуссионным. Для лечения ТКА-инфекций низкой степени злокачественности (особенно на ранней стадии) рекомендуются менее инвазивные и более жизнеспособные хирургические процедуры: обработка раны с заменой вставки и одноэтапной реимплантацией имеет преимущество в меньшем количестве операций, способности поддерживать движение и здоровье мягких тканей, а также в меньшем количестве. расходы. Кроме того, эти процедуры означают, что пациент никогда не остается без компонентов протеза, что значительно повышает комфорт [1, 12 14]. Независимо от вирулентности инфекционных организмов, хирургическая обработка раны и удержание компонентов приводит к несогласованным показателям инфекционного контроля в% [15], в то время как одностадийная ревизия, при которой новые, стерильные компоненты имплантируются и закрепляются с помощью костного цемента, содержащего антибиотики, имеет большую вариабельность. в успешном инфекционном контроле
Для лечения ТКА-инфекций низкой степени злокачественности (особенно на ранней стадии) рекомендуются менее инвазивные и более жизнеспособные хирургические процедуры: обработка раны с заменой вставки и одноэтапной реимплантацией имеет преимущество в меньшем количестве операций, способности поддерживать движение и здоровье мягких тканей, а также в меньшем количестве. расходы. Кроме того, эти процедуры означают, что пациент никогда не остается без компонентов протеза, что значительно повышает комфорт [1, 12 14]. Независимо от вирулентности инфекционных организмов, хирургическая обработка раны и удержание компонентов приводит к несогласованным показателям инфекционного контроля в% [15], в то время как одностадийная ревизия, при которой новые, стерильные компоненты имплантируются и закрепляются с помощью костного цемента, содержащего антибиотики, имеет большую вариабельность. в успешном инфекционном контроле
2 2 J Orthopaed Traumatol (2015) 16:% [6, 15]. Однако существует мало данных об эффективности этих различных стратегий лечения при инфекциях TKA, вызванных низковирулентными бактериями. Таким образом, целью этого обзора был анализ литературы для определения наиболее эффективного хирургического лечения для лечения перипротезной инфекции коленного сустава низкой степени. Мы также рассмотрели наиболее надежные исследования по диагностике инфекции TKA, вызванной низковирулентными бактериями. Диагностика перипротезной инфекции коленного сустава низкой степени. Диагностика инфекции низкой степени злокачественности после ТКА часто является очень сложной задачей, поскольку клиническая симптоматика и диагностические исследования могут противоречить друг другу.Более того, пациенты часто обращаются с хорошо закрепленными компонентами даже при острых инфекциях. Мы считаем, что диагностический процесс следует развивать, используя следующие шаги. История и клинические особенности Ранние послеоперационные инфекции ТКА низкой степени злокачественности обычно проявляются только умеренной болью и ригидностью в коленях и / или трудной и отсроченной реабилитацией; стойкая лихорадка, сильная боль, местное тепло, эритема и отек часто отсутствуют.
Однако существует мало данных об эффективности этих различных стратегий лечения при инфекциях TKA, вызванных низковирулентными бактериями. Таким образом, целью этого обзора был анализ литературы для определения наиболее эффективного хирургического лечения для лечения перипротезной инфекции коленного сустава низкой степени. Мы также рассмотрели наиболее надежные исследования по диагностике инфекции TKA, вызванной низковирулентными бактериями. Диагностика перипротезной инфекции коленного сустава низкой степени. Диагностика инфекции низкой степени злокачественности после ТКА часто является очень сложной задачей, поскольку клиническая симптоматика и диагностические исследования могут противоречить друг другу.Более того, пациенты часто обращаются с хорошо закрепленными компонентами даже при острых инфекциях. Мы считаем, что диагностический процесс следует развивать, используя следующие шаги. История и клинические особенности Ранние послеоперационные инфекции ТКА низкой степени злокачественности обычно проявляются только умеренной болью и ригидностью в коленях и / или трудной и отсроченной реабилитацией; стойкая лихорадка, сильная боль, местное тепло, эритема и отек часто отсутствуют. Гематогенная инфекция низкой степени злокачественности встречается довольно редко и характеризуется внезапным и неожиданным ухудшением состояния ранее хорошо функционирующего сустава.Также в анамнезе может быть острое заболевание, за которым следует внезапное ухудшение функции колена с лихорадкой и ознобом [14, 16]. Хронические инфекции ТКА низкой степени злокачественности не имеют явного начала. Классическое проявление с болью, лихорадкой и местными признаками, такими как пазухи носовых пазух, покраснение и отек, встречается редко. Чаще пациенты жалуются на умеренную боль и скованность, которые существуют после замены коленного сустава [14, 16]. Рентгенограммы Стандартные рентгеновские снимки не очень полезны при диагностике низкосортной инфекции после ТКА, особенно при острых инфекциях, при которых рентгеновские лучи всегда нормальны.Рентгенограммы, показывающие образование новой надкостницы, рассеянные очаги остеолиза и субхондральную резорбцию кости, с большой вероятностью указывают на инфекцию, но обычно могут быть обнаружены позже.
Гематогенная инфекция низкой степени злокачественности встречается довольно редко и характеризуется внезапным и неожиданным ухудшением состояния ранее хорошо функционирующего сустава.Также в анамнезе может быть острое заболевание, за которым следует внезапное ухудшение функции колена с лихорадкой и ознобом [14, 16]. Хронические инфекции ТКА низкой степени злокачественности не имеют явного начала. Классическое проявление с болью, лихорадкой и местными признаками, такими как пазухи носовых пазух, покраснение и отек, встречается редко. Чаще пациенты жалуются на умеренную боль и скованность, которые существуют после замены коленного сустава [14, 16]. Рентгенограммы Стандартные рентгеновские снимки не очень полезны при диагностике низкосортной инфекции после ТКА, особенно при острых инфекциях, при которых рентгеновские лучи всегда нормальны.Рентгенограммы, показывающие образование новой надкостницы, рассеянные очаги остеолиза и субхондральную резорбцию кости, с большой вероятностью указывают на инфекцию, но обычно могут быть обнаружены позже. Радиопрозрачность перипротеза может не быть связана с септическим процессом, а серийные рентгенограммы помогают исключить другие состояния, такие как износ, остеолиз или перелом [16]. Лабораторные данные Количество периферических лейкоцитов (лейкоцитов) часто является нормальным при низкосортных инфекциях ТКА и мало помогает в диагностике [17]. Скорость оседания эритроцитов (СОЭ) и С-реактивный белок (СРБ) остаются наиболее полезными лабораторными исследованиями, даже несмотря на то, что их чувствительность может быть снижена [19].СОЭ [30 мм / ч или СРБ [10 мг / л] следует рассматривать как отклонение от нормы [7, 18]. Из-за этой более низкой чувствительности сывороточный интерлейкин-6 (IL-6) может представлять собой более надежный маркер перипротезной инфекции низкой степени [17, 19]. С порогом \ 10 пг / мл тест на IL-6 в сыворотке показывает чувствительность, специфичность, прогностическую ценность положительного результата (PPV), прогностическую ценность отрицательного результата (NPV) и точность 1,0, 0,95, 0,89, 1,0 и 97% соответственно.
Радиопрозрачность перипротеза может не быть связана с септическим процессом, а серийные рентгенограммы помогают исключить другие состояния, такие как износ, остеолиз или перелом [16]. Лабораторные данные Количество периферических лейкоцитов (лейкоцитов) часто является нормальным при низкосортных инфекциях ТКА и мало помогает в диагностике [17]. Скорость оседания эритроцитов (СОЭ) и С-реактивный белок (СРБ) остаются наиболее полезными лабораторными исследованиями, даже несмотря на то, что их чувствительность может быть снижена [19].СОЭ [30 мм / ч или СРБ [10 мг / л] следует рассматривать как отклонение от нормы [7, 18]. Из-за этой более низкой чувствительности сывороточный интерлейкин-6 (IL-6) может представлять собой более надежный маркер перипротезной инфекции низкой степени [17, 19]. С порогом \ 10 пг / мл тест на IL-6 в сыворотке показывает чувствительность, специфичность, прогностическую ценность положительного результата (PPV), прогностическую ценность отрицательного результата (NPV) и точность 1,0, 0,95, 0,89, 1,0 и 97% соответственно. , таким образом, являясь более точным маркером, чем СОЭ и СРБ [17, 19]. Благодаря своей превосходной чувствительности IL-6 может быть оптимальным инструментом для диагностики ТКА-инфекции низкой степени злокачественности [16, 19].Радионуклеотидное сканирование Сканирование бисфосфоната технеция-99 в сочетании со сканированием лейкоцитов, меченных индием-111, может способствовать диагностике ТКА-инфекции низкой степени злокачественности. Сканирование с использованием технеция достаточно надежно для обнаружения изменений, связанных с ремоделированием костей вокруг компонентов протеза; однако в случае положительного результата он не может отличить асептическое расшатывание от инфекции [22]. У него низкий NPV при инфекциях низкой степени злокачественности: нормальное сканирование предполагает, что расшатывание не является вероятной причиной боли, но не исключает возможности инфицирования [16].Сканирование лейкоцитов более чувствительно, но имеет низкую специфичность. Сочетание лейкоцитов с сканированием технеция повышает точность выявления инфекции низкой степени [16].
, таким образом, являясь более точным маркером, чем СОЭ и СРБ [17, 19]. Благодаря своей превосходной чувствительности IL-6 может быть оптимальным инструментом для диагностики ТКА-инфекции низкой степени злокачественности [16, 19].Радионуклеотидное сканирование Сканирование бисфосфоната технеция-99 в сочетании со сканированием лейкоцитов, меченных индием-111, может способствовать диагностике ТКА-инфекции низкой степени злокачественности. Сканирование с использованием технеция достаточно надежно для обнаружения изменений, связанных с ремоделированием костей вокруг компонентов протеза; однако в случае положительного результата он не может отличить асептическое расшатывание от инфекции [22]. У него низкий NPV при инфекциях низкой степени злокачественности: нормальное сканирование предполагает, что расшатывание не является вероятной причиной боли, но не исключает возможности инфицирования [16].Сканирование лейкоцитов более чувствительно, но имеет низкую специфичность. Сочетание лейкоцитов с сканированием технеция повышает точность выявления инфекции низкой степени [16]. В частности, если поглощение при сканировании лейкоцитов более интенсивное, чем при сканировании технеция, вероятно, что TKA инфицирован. Изотопное сканирование может давать ложноположительные результаты: в течение первого послеоперационного года повышенная активность сканирования может присутствовать примерно в% большеберцовых и% бедренных компонентов в бессимптомных коленях [23]. Аспирация При инфекции легкой степени тяжести аспирация колена может иметь низкую чувствительность из-за низкой бактериальной нагрузки.Антибактериальную терапию следует приостановить как минимум за 2 недели до аспирации, чтобы избежать ложноотрицательных результатов [18]. Аспират следует отправлять на аэробные, анаэробные и грибковые культуры. Если первая аспирация отрицательна, то следует выполнить как минимум две дополнительных аспирации [23]. Образцы, полученные из сустава, должны быть разделены на два или три образца: если все образцы положительны на один и тот же организм, аспирация считается положительной; если только один образец дает положительный результат или дает неожиданный положительный результат, аспирацию необходимо повторить, учитывая высокое подозрение на контаминацию [24].
В частности, если поглощение при сканировании лейкоцитов более интенсивное, чем при сканировании технеция, вероятно, что TKA инфицирован. Изотопное сканирование может давать ложноположительные результаты: в течение первого послеоперационного года повышенная активность сканирования может присутствовать примерно в% большеберцовых и% бедренных компонентов в бессимптомных коленях [23]. Аспирация При инфекции легкой степени тяжести аспирация колена может иметь низкую чувствительность из-за низкой бактериальной нагрузки.Антибактериальную терапию следует приостановить как минимум за 2 недели до аспирации, чтобы избежать ложноотрицательных результатов [18]. Аспират следует отправлять на аэробные, анаэробные и грибковые культуры. Если первая аспирация отрицательна, то следует выполнить как минимум две дополнительных аспирации [23]. Образцы, полученные из сустава, должны быть разделены на два или три образца: если все образцы положительны на один и тот же организм, аспирация считается положительной; если только один образец дает положительный результат или дает неожиданный положительный результат, аспирацию необходимо повторить, учитывая высокое подозрение на контаминацию [24]. Подсчет лейкоцитов в синовиальной жидкости и дифференциал — два полезных параметра: пороговые значения для оптимальной точности: [1100 клеток / мм 3 для подсчета лейкоцитов в жидкости и [64% для дифференциала нейтрофилов [25]).
Подсчет лейкоцитов в синовиальной жидкости и дифференциал — два полезных параметра: пороговые значения для оптимальной точности: [1100 клеток / мм 3 для подсчета лейкоцитов в жидкости и [64% для дифференциала нейтрофилов [25]).
3 J Orthopaed Traumatol (2015) 16: 1 7 3 Молекулярные тесты Обнаружение бактериальной ДНК или РНК в синовиальной жидкости с помощью исследований полимеразной цепной реакции (ПЦР) может быть полезным при низкосортных инфекциях ТКА с низкой бактериальной нагрузкой.ПЦР усиливает штаммы бактериальной (дезокси) РНК и может обнаруживать нежизнеспособные бактерии, которые не растут на культуре, а также бактерии, лизированные ультразвуком, обеспечивая результаты в течение часа. На результаты ПЦР не влияет прием антибиотиков [16]. Однако молекулярные методы не позволяют различать живые и мертвые организмы, генерируя ложноположительные результаты (низкая специфичность) и, следовательно, не имеют большого клинического применения [26].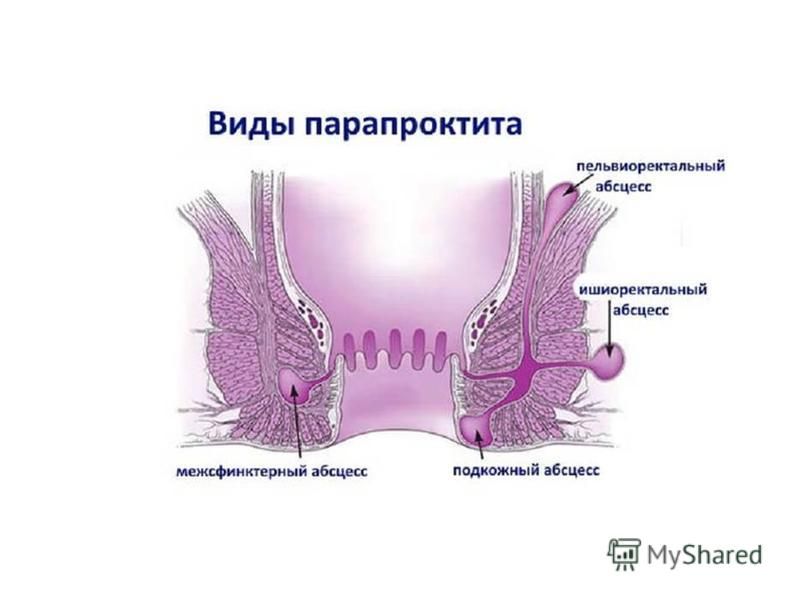 Интраоперационная гистопатология. Окрашивание по Граму интраоперационных образцов, полученных из суставной капсулы или перипротезной мембраны, не помогает в диагностике ТКА-инфекции низкой степени [27].Интраоперационная замороженная секция для определения нейтрофилов в перипротезных тканях используется для помощи в принятии интраоперационных решений. Точные гистологические критерии, используемые для диагностики инфекции, неоднородны. Однако считается, что от пяти до десяти полиморфноядерных лейкоцитов на поле высокого увеличения (9400) (PMN / HPF) по крайней мере в пяти областях соответствует инфекции [7, 16]. Этот метод сильно зависит от выбранной ткани и интерпретации патологоанатома. Низкая чувствительность этого метода при инфекции низкой степени, вероятно, связана с низким воспалительным ответом, вызываемым коагулазонегативными стафилококками, микроорганизмами, наиболее часто заражающими ТКА [7].Обработка ультразвуком Во время удаления протеза обработка ультразвуком может улучшить чувствительность микробиологических исследований, которая, как упоминалось выше, значительно снижается при инфекциях низкой степени злокачественности [28].
Интраоперационная гистопатология. Окрашивание по Граму интраоперационных образцов, полученных из суставной капсулы или перипротезной мембраны, не помогает в диагностике ТКА-инфекции низкой степени [27].Интраоперационная замороженная секция для определения нейтрофилов в перипротезных тканях используется для помощи в принятии интраоперационных решений. Точные гистологические критерии, используемые для диагностики инфекции, неоднородны. Однако считается, что от пяти до десяти полиморфноядерных лейкоцитов на поле высокого увеличения (9400) (PMN / HPF) по крайней мере в пяти областях соответствует инфекции [7, 16]. Этот метод сильно зависит от выбранной ткани и интерпретации патологоанатома. Низкая чувствительность этого метода при инфекции низкой степени, вероятно, связана с низким воспалительным ответом, вызываемым коагулазонегативными стафилококками, микроорганизмами, наиболее часто заражающими ТКА [7].Обработка ультразвуком Во время удаления протеза обработка ультразвуком может улучшить чувствительность микробиологических исследований, которая, как упоминалось выше, значительно снижается при инфекциях низкой степени злокачественности [28]. Обработка ультразвуком использует энергию ультразвука (УЗИ) для механического разрушения биопленки на удаленных имплантатах после ревизионной операции. Это увеличивает количество бактерий, выделенных при культивировании, или молекулярные методы, позволяющие обнаруживать бактерии, которые не были бы пропущены традиционной культурой тканей [28]. Улучшение чувствительности особенно заметно у ТКА, инфицированных маловирулентными организмами, и у пациентов, принимающих антибиотики в течение 2 недель до операции [21].Хирургическое лечение перипротезной инфекции коленного сустава низкой степени. Целью лечения является устранение инфекции и поддержание безболезненного и функционального сустава. Были предложены различные варианты лечения: супрессивная антибактериальная терапия, орошение и хирургическая обработка раны, одномоментная реимплантация, двухэтапная реимплантация, процедуры спасения и ампутация выше колена. В то время как двухэтапный обмен считается лучшим подходом независимо от вирулентности инфицирующего организма и времени заражения [2, 4, 6, 9 12], оптимальное лечение низкосортной инфекции TKA остается спорным, поскольку открытая обработка раны с заменой вставки и однократная -этапная реимплантация была предложена как допустимая хирургическая альтернатива с наименьшим воздействием.
Обработка ультразвуком использует энергию ультразвука (УЗИ) для механического разрушения биопленки на удаленных имплантатах после ревизионной операции. Это увеличивает количество бактерий, выделенных при культивировании, или молекулярные методы, позволяющие обнаруживать бактерии, которые не были бы пропущены традиционной культурой тканей [28]. Улучшение чувствительности особенно заметно у ТКА, инфицированных маловирулентными организмами, и у пациентов, принимающих антибиотики в течение 2 недель до операции [21].Хирургическое лечение перипротезной инфекции коленного сустава низкой степени. Целью лечения является устранение инфекции и поддержание безболезненного и функционального сустава. Были предложены различные варианты лечения: супрессивная антибактериальная терапия, орошение и хирургическая обработка раны, одномоментная реимплантация, двухэтапная реимплантация, процедуры спасения и ампутация выше колена. В то время как двухэтапный обмен считается лучшим подходом независимо от вирулентности инфицирующего организма и времени заражения [2, 4, 6, 9 12], оптимальное лечение низкосортной инфекции TKA остается спорным, поскольку открытая обработка раны с заменой вставки и однократная -этапная реимплантация была предложена как допустимая хирургическая альтернатива с наименьшим воздействием. Супрессивная антибактериальная терапия предназначена для пациентов, которые по медицинским показаниям не могут перенести операцию, с ограниченными шансами на успех при легком течении инфекции [11, 16]. Спасательные процедуры, такие как резекционная артропластика или артродез, и ампутация никогда не были необходимы при TKA, инфицированных чувствительными бактериями [14]. Следовательно, открытая обработка раны, а также одно- и двухэтапная реимплантация — единственные процедуры, рассматриваемые в этой статье. Ирригация и хирургическая обработка раны В условиях низкосортной инфекции TKA хирургическая обработка раны с сохранением компонентов, а также местное и системное применение антибиотиков могут быть показаны здоровым пациентам, пострадавшим от острой (ранней послеоперационной и гематогенной) грамположительной инфекции со стабильным и здоровым функционирующий протез и хорошая оболочка из мягких тканей без свища [8, 28].При попытке удержания компонентов, тщательная обработка раны и быстрое лечение антибиотиками до накопления биопленки имеют первостепенное значение для успешного результата [16, 29, 30].
Супрессивная антибактериальная терапия предназначена для пациентов, которые по медицинским показаниям не могут перенести операцию, с ограниченными шансами на успех при легком течении инфекции [11, 16]. Спасательные процедуры, такие как резекционная артропластика или артродез, и ампутация никогда не были необходимы при TKA, инфицированных чувствительными бактериями [14]. Следовательно, открытая обработка раны, а также одно- и двухэтапная реимплантация — единственные процедуры, рассматриваемые в этой статье. Ирригация и хирургическая обработка раны В условиях низкосортной инфекции TKA хирургическая обработка раны с сохранением компонентов, а также местное и системное применение антибиотиков могут быть показаны здоровым пациентам, пострадавшим от острой (ранней послеоперационной и гематогенной) грамположительной инфекции со стабильным и здоровым функционирующий протез и хорошая оболочка из мягких тканей без свища [8, 28].При попытке удержания компонентов, тщательная обработка раны и быстрое лечение антибиотиками до накопления биопленки имеют первостепенное значение для успешного результата [16, 29, 30]. Противопоказаниями являются хроническая инфекция, расшатывание имплантата, плохая оболочка мягких тканей и пациенты с другими артропластиками или дефектом сердечного клапана [16, 28]. Всегда предпочтительна замена полиэтилена, так как она позволяет выполнить полную синовэктомию и лучшую очистку задней синовиальной оболочки, а также исключает образование биопленки на полиэтилене [29, 31].Одна из причин неудачи артроскопической обработки раны, вероятно, связана с неспособностью удалить биопленку на границе полиэтиленового протеза и обработать заднюю поверхность колена [28, 29]. Интраоперационные посевы выполняются на синовиальной жидкости и мембране, инфицированных тканях и границе раздела полиэтиленовых имплантатов. Организм-специфическое внутривенное введение антибиотиков начинается в течение 4-6 недель с последующим длительным пероральным введением антибиотиков. Одноступенчатая реимплантация Инфекция низкой степени злокачественности после ТКА считается потенциально восприимчивой к одноэтапной реимплантации из-за низкой вирулентности инфекционных бактерий [5, 32, 33].
Противопоказаниями являются хроническая инфекция, расшатывание имплантата, плохая оболочка мягких тканей и пациенты с другими артропластиками или дефектом сердечного клапана [16, 28]. Всегда предпочтительна замена полиэтилена, так как она позволяет выполнить полную синовэктомию и лучшую очистку задней синовиальной оболочки, а также исключает образование биопленки на полиэтилене [29, 31].Одна из причин неудачи артроскопической обработки раны, вероятно, связана с неспособностью удалить биопленку на границе полиэтиленового протеза и обработать заднюю поверхность колена [28, 29]. Интраоперационные посевы выполняются на синовиальной жидкости и мембране, инфицированных тканях и границе раздела полиэтиленовых имплантатов. Организм-специфическое внутривенное введение антибиотиков начинается в течение 4-6 недель с последующим длительным пероральным введением антибиотиков. Одноступенчатая реимплантация Инфекция низкой степени злокачественности после ТКА считается потенциально восприимчивой к одноэтапной реимплантации из-за низкой вирулентности инфекционных бактерий [5, 32, 33].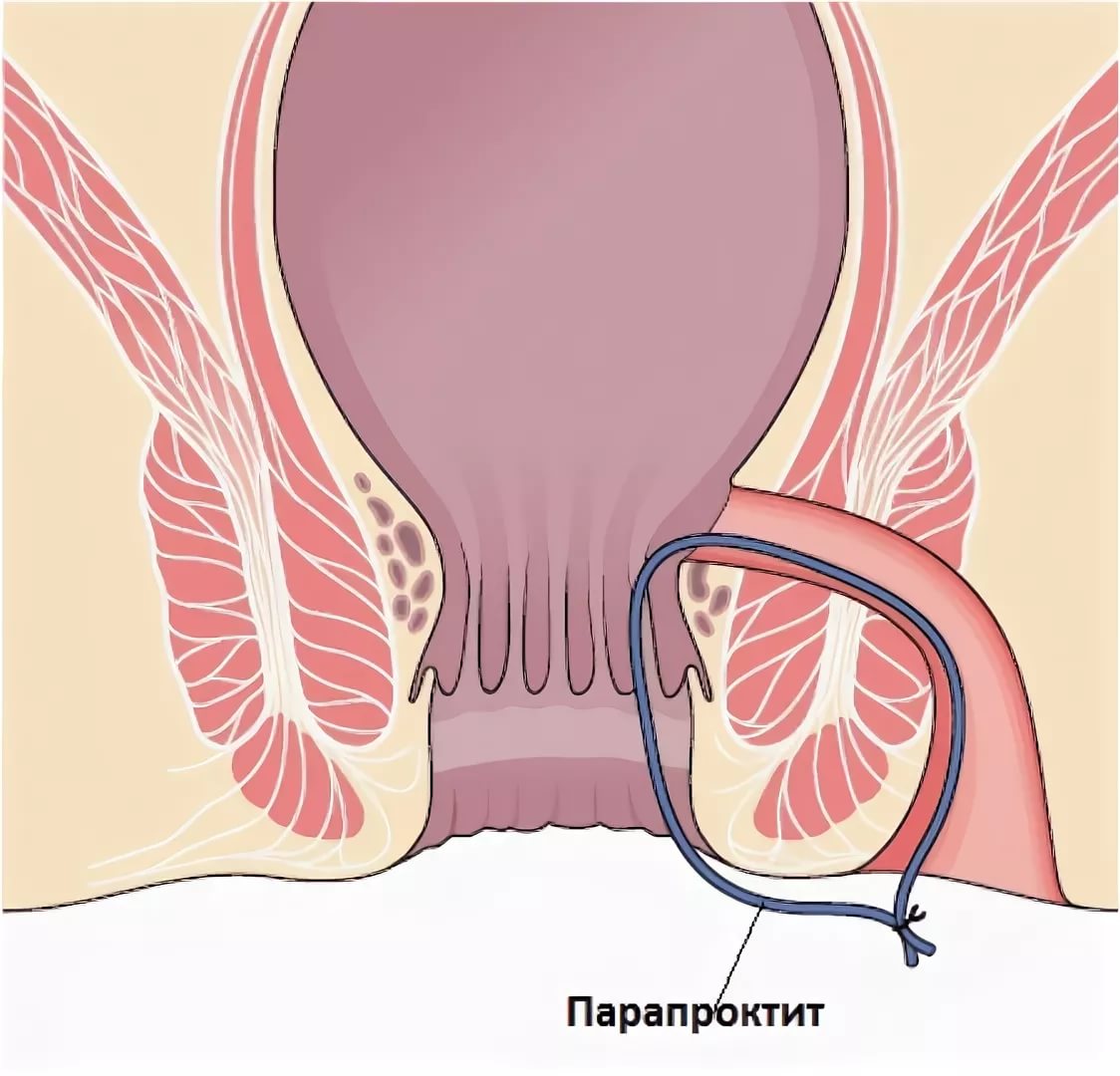 Факторы, связанные с успешной одноэтапной реимплантацией, включают идентификацию возбудителя перед ревизией, инфекции
Факторы, связанные с успешной одноэтапной реимплантацией, включают идентификацию возбудителя перед ревизией, инфекции
4 4 J Orthopaed Traumatol (2015) 16: 17, вызванные грамположительными бактериями, отсутствием синусового тракта и использованием костного цемента, содержащего антибиотики, для фиксации нового компонента [34]. Одноступенчатая реимплантация включает эксплантацию всех компонентов и цемента, тщательную обработку раны, обильную ирригацию и повторную имплантацию новых и подходящих компонентов протеза с цементом, пропитанным антибиотиками, с последующими 6–12 неделями системной терапии антибиотиками.Затем следует рассмотреть вопрос о пероральной антибактериальной терапии еще в течение 3–6 месяцев в соответствии с рекомендациями [32]. При слабой инфекции одноступенчатая ревизия может быть предпочтительной, поскольку сокращает время и стоимость восстановления и позволяет избежать некоторых проблем, связанных с двухэтапными процедурами, таких как жесткость и артрофиброз, возникающие в результате периода с использованием спейсера на месте.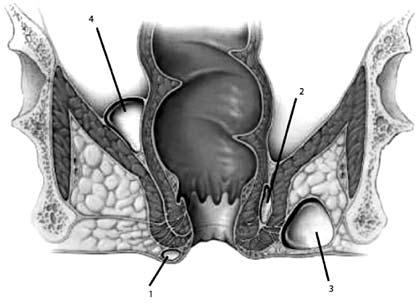 Кроме того, хирургическая обработка раны и одноэтапная стратегия позволяют пациенту сохранить свои протезные компоненты [13]. Двухэтапная реимплантация Двухэтапная реимплантация на самом деле считается современным методом лечения как острых, так и хронических инфекций ТКА, с зарегистрированными показателями успешности% независимо от этиологии инфекционного организма [2, 4, 6, 9 12].На первом этапе выполняется удаление всех компонентов и цемента, полная синовэктомия и обработка всех некротизированных и инфицированных тканей. Множественные образцы берут из глубокой синовиальной биопсии и отправляют на аэробные, анаэробные и грибковые культуры. Концы иссеченных костей и суставная щель тщательно промывают пульсирующим лаважем. Последовательно в шов вводят пропитанный антибиотиком цементный спейсер [6, 12, 35, 36]. При слабой инфекции 2 г ванкомицина на 40-граммовый пакет костного цемента может быть достаточно [18, 37], так как большинство предварительно сформированных спейсеров содержат гентамицин.
Кроме того, хирургическая обработка раны и одноэтапная стратегия позволяют пациенту сохранить свои протезные компоненты [13]. Двухэтапная реимплантация Двухэтапная реимплантация на самом деле считается современным методом лечения как острых, так и хронических инфекций ТКА, с зарегистрированными показателями успешности% независимо от этиологии инфекционного организма [2, 4, 6, 9 12].На первом этапе выполняется удаление всех компонентов и цемента, полная синовэктомия и обработка всех некротизированных и инфицированных тканей. Множественные образцы берут из глубокой синовиальной биопсии и отправляют на аэробные, анаэробные и грибковые культуры. Концы иссеченных костей и суставная щель тщательно промывают пульсирующим лаважем. Последовательно в шов вводят пропитанный антибиотиком цементный спейсер [6, 12, 35, 36]. При слабой инфекции 2 г ванкомицина на 40-граммовый пакет костного цемента может быть достаточно [18, 37], так как большинство предварительно сформированных спейсеров содержат гентамицин. Выбор антибиотика должен зависеть от антибиотикограммы: на самом деле, даже при низкой вирулентности, чувствительность к антибиотикам также может быть низкой [38]. Между этапами целевые внутривенные и пероральные антибиотики обычно используются в течение 6–12 недель на основании рекомендаций консультанта по инфекционным заболеваниям [1, 10]. Решение о повторной имплантации на втором этапе принимается после минимального двухнедельного перерыва в приеме антибиотиков, когда клинические признаки инфекции уменьшились, а уровни СОЭ и СРБ неуклонно приближались к норме [18, 37].При низкосортной инфекции лабораторные маркеры также могут нормализоваться у пациентов с персистирующей инфекцией, поэтому аспирацию коленного сустава перед повторной имплантацией следует выполнять у пациентов с подозрением на персистирующую инфекцию [18, 20, 39]. Второй этап включает эксплантацию цементного спейсера, удаление всех фрагментов цемента, тщательную обработку сустава и интрамедуллярных каналов, обильную ирригацию и установку соответствующих новых протезных компонентов, фиксируемых костным цементом, пропитанным ванкомицином [18, 40, 41] .
Выбор антибиотика должен зависеть от антибиотикограммы: на самом деле, даже при низкой вирулентности, чувствительность к антибиотикам также может быть низкой [38]. Между этапами целевые внутривенные и пероральные антибиотики обычно используются в течение 6–12 недель на основании рекомендаций консультанта по инфекционным заболеваниям [1, 10]. Решение о повторной имплантации на втором этапе принимается после минимального двухнедельного перерыва в приеме антибиотиков, когда клинические признаки инфекции уменьшились, а уровни СОЭ и СРБ неуклонно приближались к норме [18, 37].При низкосортной инфекции лабораторные маркеры также могут нормализоваться у пациентов с персистирующей инфекцией, поэтому аспирацию коленного сустава перед повторной имплантацией следует выполнять у пациентов с подозрением на персистирующую инфекцию [18, 20, 39]. Второй этап включает эксплантацию цементного спейсера, удаление всех фрагментов цемента, тщательную обработку сустава и интрамедуллярных каналов, обильную ирригацию и установку соответствующих новых протезных компонентов, фиксируемых костным цементом, пропитанным ванкомицином [18, 40, 41] . После реимплантации пациенты получают антибиотики внутривенно до тех пор, пока интраоперационные культуры не вернутся к норме. Результаты. В условиях низкосортных инфекций TKA ирригация и обработка раны показали неудовлетворительные показатели успеха, в среднем от 16% до 70% [8, 14]. При острых (ранних послеоперационных или гематогенных) инфекциях первичная открытая обработка раны считается успешной у 56% пациентов, инфицированных низковирулентными организмами, такими как Staphylococcus epidermidis или Streptococcal разновидности, но только у 8% пациентов, инфицированных S.aureus [42]. Оценив 247 колен, Buller et al. [31] сообщили о 45% неудачных операциях санации раны; более высокая частота неудач была обнаружена при инфекциях, вызванных резистентными организмами, и у пациентов с симптомами C21 день. Также сообщалось о 34% -ной частоте неудач при инфекциях легкой степени тяжести. Barberan et al. [43] сообщили об общей частоте неудач хирургической обработки раны у 35% пациентов с инфекциями низкой степени злокачественности, которые варьировались от 17% у пациентов с продолжительностью симптомов менее 1 месяца до 69% у пациентов с продолжительностью симптомов [6 недель].
После реимплантации пациенты получают антибиотики внутривенно до тех пор, пока интраоперационные культуры не вернутся к норме. Результаты. В условиях низкосортных инфекций TKA ирригация и обработка раны показали неудовлетворительные показатели успеха, в среднем от 16% до 70% [8, 14]. При острых (ранних послеоперационных или гематогенных) инфекциях первичная открытая обработка раны считается успешной у 56% пациентов, инфицированных низковирулентными организмами, такими как Staphylococcus epidermidis или Streptococcal разновидности, но только у 8% пациентов, инфицированных S.aureus [42]. Оценив 247 колен, Buller et al. [31] сообщили о 45% неудачных операциях санации раны; более высокая частота неудач была обнаружена при инфекциях, вызванных резистентными организмами, и у пациентов с симптомами C21 день. Также сообщалось о 34% -ной частоте неудач при инфекциях легкой степени тяжести. Barberan et al. [43] сообщили об общей частоте неудач хирургической обработки раны у 35% пациентов с инфекциями низкой степени злокачественности, которые варьировались от 17% у пациентов с продолжительностью симптомов менее 1 месяца до 69% у пациентов с продолжительностью симптомов [6 недель]. О лучших результатах сообщалось при рассмотрении только ранних послеоперационных (а не гематогенных) инфекций: Kim et al.[44] сообщили, что 27 из 32 колен (84%) были успешно вылечены периоперационной обработкой раны. Безусловно, хирургическая обработка раны, как сообщается, неэффективна для лечения хронических инфекций низкой степени злокачественности, с конечной частотой неудач 100% [8, 29, 45]. Наиболее убедительным доказательством отказа от использования хирургической обработки раны при инфекциях низкой степени злокачественности является частота неудач двухэтапной реимплантации после неудачной ирригации и хирургической обработки в 34% [8]. Fehring et al. [8] предложили ограничить его использование ранними послеоперационными инфекциями, при которых дата инокуляции четко определена, а периоперационная обработка раны должна улучшить инфекционный контроль, потому что вмешательство может происходить до образования лекарственно-устойчивой биопленки на имплантате или до того, как остеомиелит закрепится в перипротезных тканях.
О лучших результатах сообщалось при рассмотрении только ранних послеоперационных (а не гематогенных) инфекций: Kim et al.[44] сообщили, что 27 из 32 колен (84%) были успешно вылечены периоперационной обработкой раны. Безусловно, хирургическая обработка раны, как сообщается, неэффективна для лечения хронических инфекций низкой степени злокачественности, с конечной частотой неудач 100% [8, 29, 45]. Наиболее убедительным доказательством отказа от использования хирургической обработки раны при инфекциях низкой степени злокачественности является частота неудач двухэтапной реимплантации после неудачной ирригации и хирургической обработки в 34% [8]. Fehring et al. [8] предложили ограничить его использование ранними послеоперационными инфекциями, при которых дата инокуляции четко определена, а периоперационная обработка раны должна улучшить инфекционный контроль, потому что вмешательство может происходить до образования лекарственно-устойчивой биопленки на имплантате или до того, как остеомиелит закрепится в перипротезных тканях.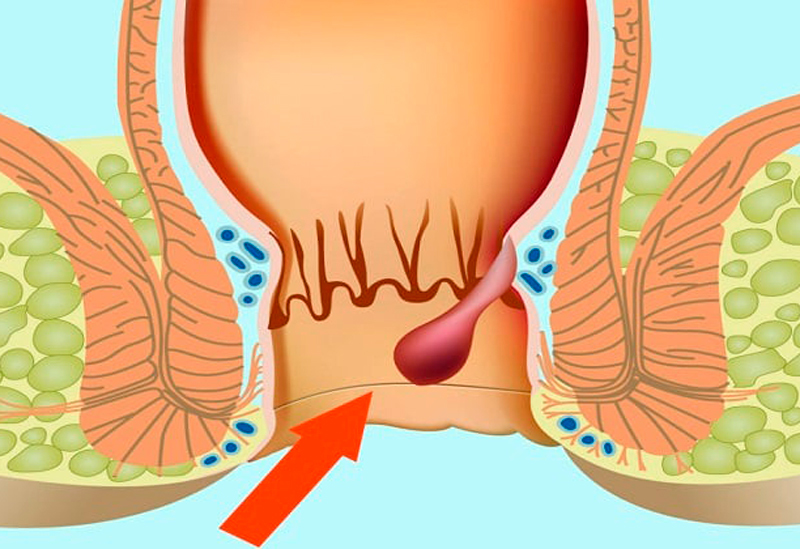 кость.Отчеты, относящиеся к одноэтапной ревизии, как правило, немногочисленны и низкого качества [5]. Одноэтапная реимплантация была успешной в тщательно отобранных случаях или в небольших сериях со средней степенью успеха 81% [5, 12, 15]. При инфекциях низкой степени злокачественности частота повторного заражения колеблется от 5% до 11, хотя в исследованиях с небольшими сериями случаев и короткими периодами наблюдения [5, 11, 13, 34]. Silva et al. [34] сообщили об успехе в 89% и обнаружили, что факторами, связанными с успехом, являются отсутствие образования пазух, грамположительная инфекция, использование пропитанного антибиотиком костного цемента при реимплантации и 12 недель антибактериальной терапии.Бейкер и др. [13] не сообщили о существенных различиях между одноэтапной и двухэтапной ревизией с точки зрения послеоперационной оценки коленного сустава, общего восприятия состояния здоровья или
кость.Отчеты, относящиеся к одноэтапной ревизии, как правило, немногочисленны и низкого качества [5]. Одноэтапная реимплантация была успешной в тщательно отобранных случаях или в небольших сериях со средней степенью успеха 81% [5, 12, 15]. При инфекциях низкой степени злокачественности частота повторного заражения колеблется от 5% до 11, хотя в исследованиях с небольшими сериями случаев и короткими периодами наблюдения [5, 11, 13, 34]. Silva et al. [34] сообщили об успехе в 89% и обнаружили, что факторами, связанными с успехом, являются отсутствие образования пазух, грамположительная инфекция, использование пропитанного антибиотиком костного цемента при реимплантации и 12 недель антибактериальной терапии.Бейкер и др. [13] не сообщили о существенных различиях между одноэтапной и двухэтапной ревизией с точки зрения послеоперационной оценки коленного сустава, общего восприятия состояния здоровья или
5 J Orthopaed Traumatol (2015) 16: 1 7 5 удовлетворенность пациентов с ТКА-инфекцией низкой степени. Они пришли к выводу, что одноэтапное лечение может быть функционально лучше в тех случаях, когда инфекция успешно ликвидирована, но может быть подвержено более высокому уровню повторного заражения, что связано с худшими результатами.Сингер и др. [5] сообщили, что одноэтапная ревизия позволила достичь уровня контроля 95% в случаях TKA-инфекций низкой степени злокачественности, у которых были пациенты с метициллин-резистентным S. aureus (MRSA), метициллин-устойчивым S. epidermidis (MRSE) или неизвестными микроорганизмами. исключен из исследования. Более высокая частота рецидивов инфекции оказалась связана с длительными хроническими инфекциями шарнирных протезов. Учитывая очень ограниченное количество надежных исследований, оценивающих эффективность одноэтапной реимплантации в искоренении инфекции низкой степени после ТКА, необходимы дальнейшие исследования [12].Почти постоянно сообщается, что успешность двухэтапной реимплантации в искоренении инфекции и восстановлении функции составляет [90%, независимо от этиологии инфекционных организмов и времени инфицирования [2, 4, 6, 9 12], так что это В настоящее время процедура считается наиболее надежным вариантом лечения инфицированных ТКА.
Они пришли к выводу, что одноэтапное лечение может быть функционально лучше в тех случаях, когда инфекция успешно ликвидирована, но может быть подвержено более высокому уровню повторного заражения, что связано с худшими результатами.Сингер и др. [5] сообщили, что одноэтапная ревизия позволила достичь уровня контроля 95% в случаях TKA-инфекций низкой степени злокачественности, у которых были пациенты с метициллин-резистентным S. aureus (MRSA), метициллин-устойчивым S. epidermidis (MRSE) или неизвестными микроорганизмами. исключен из исследования. Более высокая частота рецидивов инфекции оказалась связана с длительными хроническими инфекциями шарнирных протезов. Учитывая очень ограниченное количество надежных исследований, оценивающих эффективность одноэтапной реимплантации в искоренении инфекции низкой степени после ТКА, необходимы дальнейшие исследования [12].Почти постоянно сообщается, что успешность двухэтапной реимплантации в искоренении инфекции и восстановлении функции составляет [90%, независимо от этиологии инфекционных организмов и времени инфицирования [2, 4, 6, 9 12], так что это В настоящее время процедура считается наиболее надежным вариантом лечения инфицированных ТКА. Кроме того, сообщается, что двухэтапная реимплантация является еще более успешной при использовании при TKA-инфекциях низкой степени злокачественности [2, 4, 9, 39, 46 48]. Волин и др. [48] сообщили о 94,6% успешности у метициллин-чувствительных S.aureus инфекции. Salgado et al. [47] сообщили о 17% -ной частоте неудач при лечении инфекций MRSA, тогда как при инфекциях, вызванных чувствительным к метициллину S. aureus, неудач не было. Cordero-Ampuero et al. [9] сообщили, что инфекция была ликвидирована у 22 из 25 (88%) пациентов, инфицированных метициллин-резистентными стафилококками, и у 14 из 14 (100%) пациентов, инфицированных метициллинчувствительными стафилококками. Выводы. Диагностика инфекции TKA, которая сама по себе очень сложна, может быть чрезвычайно сложной в присутствии микроорганизмов с низкой вирулентностью.Клинические признаки часто противоречат друг другу, тогда как классические проявления боли, лихорадки и местных признаков, таких как синусовый тракт, покраснение и отек, встречаются редко. Уровни СОЭ и СРБ остаются первоочередным исследованием, даже несмотря на то, что чувствительность их результатов часто снижается при инфекциях низкой степени злокачественности. В этих случаях уровни IL-6 должны поддерживать оценку СОЭ и СРБ, чтобы значительно повысить чувствительность лабораторных результатов. Следует использовать сканирование с технецием и лейкоцитами, а ультразвуковая обработка протезов может помочь обнаружить бактерии, пропущенные традиционной культурой тканей.У пациентов с острой послеоперационной инфекцией легкой степени тяжести стратегия орошения и хирургической обработки с заменой вставки сохраняется, учитывая эмоциональные затраты на лечение этого осложнения как пациентом, так и хирургом. Таким образом, попытка спасти имплант посредством открытой хирургической обработки раны выглядит хорошо, несмотря на высокую частоту неудач. В случае неудачной обработки раны или хронических инфекций требуется резекция всех компонентов. Одноэтапный обмен может снизить количество операций и, как следствие, снизить затраты.Однако показатели эрадикации инфекции при прямом обмене показывают, что этот метод менее безопасен и предсказуем, чем двухэтапный пересмотр. Это говорит о том, что двухэтапная реимплантация с размещением внутриэтапного спейсера, содержащего антибиотик, должна представлять собой золотой стандарт для лечения инфекций низкой степени злокачественности. Конфликт интересов. Авторы заявляют, что у них нет конфликта. Открытый доступ. Эта статья распространяется на условиях лицензии Creative Commons Attribution License, которая разрешает любое использование, распространение и воспроизведение на любом носителе при условии указания автора (авторов) и источника.Ссылки 1. Johnson AJ, Sayeed SA, Naziri Q, Khanuja HS, Mont MA (2012) Сведение к минимуму осложнений с использованием динамических коленных спейсеров при инфицированной ревизионной артропластике. Clin Orthop Relat Res 470: Курд М.Ф., Ганем Э., Штайнбрехер Дж., Парвизи Дж. (2010) Двухэтапная обменная артропластика коленного сустава: влияет ли сопротивление инфекционного организма на результат? Clin Orthop Relat Res 468: Laudermilch DJ, Fedorka CJ, Heyl A, Rao N, McGough RL (2010) Результаты ревизионной тотальной артропластики коленного сустава после инфекции, вызванной метициллин-резистентным Staphylococcus aureus.Clin Orthop Relat Res 468: Сиддики М.М., Ло Н.Н., Аб Рахман С., Чин П.Л., Чиа С.Л., Йео С.Дж. (2013) Двухлетний исход ранних глубоких инфекций MRSA после первичной тотальной артропластики коленного сустава: обзор совместного реестра. J Arthroplast 28: Singer J, Merz A, Frommelt L, Fink B (2012) Высокий уровень инфекционного контроля с одноэтапной ревизией септических протезов коленного сустава, исключая MRSA и MRSE. Clin Orthop Relat Res 470: Jaekel DJ, Day JS, Klein GR, Levine H, Parvizi J, Kurtz SM (2012) Обеспечивают ли динамические цементно-цементные коленные спейсеры лучшую функцию и активность во время двухэтапной замены? Clin Orthop Relat Res 470: Bori G, Soriano A, Garcia S, Mallofrè C, Riba J, Mensa J (2007) Полезность гистологического анализа для прогнозирования присутствия микроорганизмов во время реимплантации после артропластики с резекцией бедра для лечения инфекции .J Bone Joint Surg Am A 89: Fehring TK, Odum SM, Berend KR, Jiranek WA, Parvizi J, Bozic KJ, Della Valle CJ, Gioe TJ (2013) Отказ ирригации и дебридмента из-за ранней послеоперационной перипротезной инфекции. Clin Orthop Relat Res 471: Cordero-Ampuero J, Esteban J, Garcia-Rey E (2010) Результаты после поздних полимикробных, грамотрицательных и метициллин-резистентных инфекций при артропластике коленного сустава. Clin Orthop Relat Res 468: 1229 6
Кроме того, сообщается, что двухэтапная реимплантация является еще более успешной при использовании при TKA-инфекциях низкой степени злокачественности [2, 4, 9, 39, 46 48]. Волин и др. [48] сообщили о 94,6% успешности у метициллин-чувствительных S.aureus инфекции. Salgado et al. [47] сообщили о 17% -ной частоте неудач при лечении инфекций MRSA, тогда как при инфекциях, вызванных чувствительным к метициллину S. aureus, неудач не было. Cordero-Ampuero et al. [9] сообщили, что инфекция была ликвидирована у 22 из 25 (88%) пациентов, инфицированных метициллин-резистентными стафилококками, и у 14 из 14 (100%) пациентов, инфицированных метициллинчувствительными стафилококками. Выводы. Диагностика инфекции TKA, которая сама по себе очень сложна, может быть чрезвычайно сложной в присутствии микроорганизмов с низкой вирулентностью.Клинические признаки часто противоречат друг другу, тогда как классические проявления боли, лихорадки и местных признаков, таких как синусовый тракт, покраснение и отек, встречаются редко. Уровни СОЭ и СРБ остаются первоочередным исследованием, даже несмотря на то, что чувствительность их результатов часто снижается при инфекциях низкой степени злокачественности. В этих случаях уровни IL-6 должны поддерживать оценку СОЭ и СРБ, чтобы значительно повысить чувствительность лабораторных результатов. Следует использовать сканирование с технецием и лейкоцитами, а ультразвуковая обработка протезов может помочь обнаружить бактерии, пропущенные традиционной культурой тканей.У пациентов с острой послеоперационной инфекцией легкой степени тяжести стратегия орошения и хирургической обработки с заменой вставки сохраняется, учитывая эмоциональные затраты на лечение этого осложнения как пациентом, так и хирургом. Таким образом, попытка спасти имплант посредством открытой хирургической обработки раны выглядит хорошо, несмотря на высокую частоту неудач. В случае неудачной обработки раны или хронических инфекций требуется резекция всех компонентов. Одноэтапный обмен может снизить количество операций и, как следствие, снизить затраты.Однако показатели эрадикации инфекции при прямом обмене показывают, что этот метод менее безопасен и предсказуем, чем двухэтапный пересмотр. Это говорит о том, что двухэтапная реимплантация с размещением внутриэтапного спейсера, содержащего антибиотик, должна представлять собой золотой стандарт для лечения инфекций низкой степени злокачественности. Конфликт интересов. Авторы заявляют, что у них нет конфликта. Открытый доступ. Эта статья распространяется на условиях лицензии Creative Commons Attribution License, которая разрешает любое использование, распространение и воспроизведение на любом носителе при условии указания автора (авторов) и источника.Ссылки 1. Johnson AJ, Sayeed SA, Naziri Q, Khanuja HS, Mont MA (2012) Сведение к минимуму осложнений с использованием динамических коленных спейсеров при инфицированной ревизионной артропластике. Clin Orthop Relat Res 470: Курд М.Ф., Ганем Э., Штайнбрехер Дж., Парвизи Дж. (2010) Двухэтапная обменная артропластика коленного сустава: влияет ли сопротивление инфекционного организма на результат? Clin Orthop Relat Res 468: Laudermilch DJ, Fedorka CJ, Heyl A, Rao N, McGough RL (2010) Результаты ревизионной тотальной артропластики коленного сустава после инфекции, вызванной метициллин-резистентным Staphylococcus aureus.Clin Orthop Relat Res 468: Сиддики М.М., Ло Н.Н., Аб Рахман С., Чин П.Л., Чиа С.Л., Йео С.Дж. (2013) Двухлетний исход ранних глубоких инфекций MRSA после первичной тотальной артропластики коленного сустава: обзор совместного реестра. J Arthroplast 28: Singer J, Merz A, Frommelt L, Fink B (2012) Высокий уровень инфекционного контроля с одноэтапной ревизией септических протезов коленного сустава, исключая MRSA и MRSE. Clin Orthop Relat Res 470: Jaekel DJ, Day JS, Klein GR, Levine H, Parvizi J, Kurtz SM (2012) Обеспечивают ли динамические цементно-цементные коленные спейсеры лучшую функцию и активность во время двухэтапной замены? Clin Orthop Relat Res 470: Bori G, Soriano A, Garcia S, Mallofrè C, Riba J, Mensa J (2007) Полезность гистологического анализа для прогнозирования присутствия микроорганизмов во время реимплантации после артропластики с резекцией бедра для лечения инфекции .J Bone Joint Surg Am A 89: Fehring TK, Odum SM, Berend KR, Jiranek WA, Parvizi J, Bozic KJ, Della Valle CJ, Gioe TJ (2013) Отказ ирригации и дебридмента из-за ранней послеоперационной перипротезной инфекции. Clin Orthop Relat Res 471: Cordero-Ampuero J, Esteban J, Garcia-Rey E (2010) Результаты после поздних полимикробных, грамотрицательных и метициллин-резистентных инфекций при артропластике коленного сустава. Clin Orthop Relat Res 468: 1229 6
6 6 J Orthopaed Traumatol (2015) 16: Kalore NV, Maheshwari A, Sharma A, Cheng E, Gioe TJ (2012) Есть ли предпочтительная техника артикуляционного спейсера для артропластики инфицированного колена? Предварительное исследование.Clin Orthop Relat Res 470: Masters JP, Smith NA, Foguet P, Reed M, Parsons H, Sprowson AP (2013) Систематический обзор доказательств одноэтапной и двухэтапной ревизии замены инфицированного коленного сустава. BMC Musculoskelet Disord 14: Romanò CL, Gala L, Logoluso N, Romanò D, Drago L (2012) Двухэтапная ревизия септического коленного протеза с шарнирно-сочлененными коленными спейсерами дает более высокую скорость искоренения инфекции, чем одноэтапная или двухэтапная ревизия со статическими спейсерами. Хирургия коленного сустава Sports Traumatol Arthrosc 20: Baker P, Petheram TG, Kurtz S, Konttinen YT, Gregg P, Deehan D (2013) Пациент сообщил о показателях исхода после ревизии инфицированного TKR: сравнение одноэтапного и двухэтапного ревизий.Коленная хирургия Sports Traumatol Arthrosc 21: Chun KC, Kim KM, Chun CH (2013) Инфекция после тотального эндопротезирования коленного сустава. Knee Surg Relat Res 25: Parvizi J, Zmistowski B, Adeli B (2010) Инфекция перипротезного сустава: варианты лечения. Ортопедия 33: Kalore NV, Gioe TJ, Singh JA (2011) Диагностика и лечение инфицированного тотального артропластика коленного сустава. Open Orthop J 5: Berbari E, Mabry T, Tsaras G, Spangehl M, Erwin PJ, Murad MH, Steckelberg J, Osmon D (2010) Лабораторные уровни воспалительных явлений в крови как маркеры инфекции протезных суставов: систематический обзор и метаанализ.J Bone Joint Surg Am 92: Kusuma SK, Ward J, Jacofsky M, Sporer SM, Della Valle CJ (2011) Какова роль серологического тестирования между этапами двухэтапной реконструкции инфицированного протеза коленного сустава? Clin Orthop Relat Res 469: Гарвин К.Л., Кенигсберг Б.С. (2012) Инфекция после тотального эндопротезирования коленного сустава: профилактика и лечение. Лекция 61 курса Instr: Ганем Э., Аззам К., Сили М., Джоши А., Парвизи Дж. (2009) Поэтапная ревизия при инфекции артропластики коленного сустава: какова роль серологических тестов перед повторной имплантацией? Clin Orthop Relat Res 467: Саварино Л., Тигани Д., Балдини Н., Бочиччио В., Джунти А. (2009). Предоперационная диагностика инфекции при тотальной артропластике коленного сустава: алгоритм.Knee Surg Sports Traumatol Arthrosc 17: Love C, Marwin SE, Palestro CJ (2009) Ядерная медицина и замена инфицированного сустава. Semin Nucl Med 39: Tsukayama DT, Goldberg VM, Kyle R (2003) Диагностика и лечение инфекции после тотального эндопротезирования коленного сустава. J Bone Joint Surg Am 85A (Дополнение 1): S75 S Neut D, Van Horn JR, Van Kooten TG, Van Der Mei HC, Busscher HJ (2003) Выявление инфекций, связанных с биоматериалом, в ортопедических суставных имплантатах. Clin Orthop Relat Res 413: Ghanem E, Parvizi J, Burnett RS, Sharkey PF, Keshavarzi N, Aggarwal A, Barrack RL (2008) Подсчет клеток и дифференциал аспирированной жидкости при диагностике инфекции в месте тотальной артропластики коленного сустава.J Bone Joint Surg Am 90: Bergin PF, Doppelt JD, Hamilton WG, Mirick GE, Jones AE, Sritulanondha S, Helm JM, Tuan RS (2010) Выявление перипротезных инфекций с использованием полимеразной цепной реакции на основе рибосомной РНК. J Bone Joint Surg Am 92: Portillo ME, Salvadó M, Trampuz A, Plasencia V, Rodriguez-Villasante M, Sorli L, Puig L, Horcajada JP (2013) Обработка ультразвуком по сравнению с вортексированием имплантатов для диагностики инфекции протезов суставов. J Clin Microbiol 51: Choi HR, von Knoch F, Zurakowski D, Nelson SB, Malchau H (2011) Можно ли рекомендовать ретенцию имплантата для лечения инфицированных TKA? Clin Orthop Relat Res 469: Gardner J, Gioe TJ, Tatman P (2011) Можно ли спасти этот протез ?: попытки восстановления имплантата при инфицированных первичных TKA.Clin Orthop Relat Res 469: Kuiper JW, Vos SJ, Saouti R, Vergroesen DA, Graat HC, Debets-Ossenkopp YJ, Peters EJ, Nolte PA (2013) Инфекции, связанные с протезированием суставов, леченные с помощью DAIR (санация, антибиотики, орошение и удержание) : анализ факторов риска и местных носителей антибиотиков у 91 пациента. Acta Orthop 84: Buller LT, Sabry FY, Easton RW, Klika AK, Barsoum WK (2012) Предоперационное прогнозирование успеха после орошения и санации с заменой полиэтилена при инфекциях протезных суставов тазобедренного и коленного суставов.J Arthroplast 27: Gulhane S, Vanhegan IS, Haddad FS (2012) Одностадийная ревизия: восстановление темпов. J Bone Joint Surg Br 94 (11 Suppl A): Whiteside LA, Peppers M, Nayfeh TA, Roy ME (2011) Метициллин-резистентный золотистый стафилококк у TKA, получавших ревизию и прямую внутрисуставную инфузию антибиотиков. Clin Orthop Relat Res 469: Silva M, Tharani R, Schmalzried TP (2002) Результаты прямого обмена или хирургической обработки инфицированного тотального артропластика коленного сустава. Clin Orthop Relat Res 404: Nettrour JF, Polikandriotis JA, Bernasek TL, Gustke KA, Lyons ST (2013) Шарнирные спейсеры для лечения инфицированного тотального артропластика коленного сустава: эффект комбинаций и концентраций антибиотиков.Ортопедия 36: Silvestre A, Almeida F, Renovell P, Morante E, López R (2013) Ревизия инфицированного тотального артропластика коленного сустава: двухэтапная реимплантация с использованием пропитанного антибиотиком статического спейсера. Clin Orthop Surg 5: Hsu YC, Cheng HC, Ng TP, Chiu KY (2007) Цементный артикулирующий спейсер, содержащий антибиотики, для двухэтапной реимплантации при эндопротезировании инфицированного тотального коленного сустава: простой и экономичный метод. J Arthroplast 22: Martínez JL, Baquero F (2002) Взаимодействие между стратегиями, связанными с бактериальной инфекцией: патогенность, эпидемичность и устойчивость к антибиотикам.Clin Microbiol Rev 15: Mittal Y, Fehring TK, Hanssen A, Marculescu C, Odum SM, Osmon D (2007) Двухэтапная реимплантация при перипротезной инфекции коленного сустава с участием резистентных организмов. J Bone Joint Surg Am 89A: Panni AS, Vasso M, Cerciello S (2013) Модульная аугментация при ревизионной тотальной артропластике коленного сустава. Хирургия коленного сустава Sports Traumatol Arthrosc 21: Вассо М., Бофилс П., Скьявоне Панни А. (2013) Выбор ограничения при ревизионной артропластике коленного сустава. Int Orthop 37: Deirmengian C, Greenbaum J, Stern J, Braffamn M, Lotke PA, Booth RE Jr, Lonner JH (2003) Открытая санация острых грамположительных инфекций после тотальной артропластики коленного сустава.Clin Orthop Relat Res 416: Barberan J, Aguilar L, Carroquino G, Gimenez MJ, Sanchez B, Martinez D, Prieto J (2006) Консервативное лечение стафилококковых инфекций протезов суставов у пожилых пациентов. Am J Med 119: 993.e Kim YH, Choi Y, Kim JS (2011) Лечение, основанное на типе инфицированных TKA, улучшает инфекционный контроль. Clin Orthop Relat Res 469: Аззам К.А., Сили М., Ганем Э., Остин М.С., Пуртилль Дж. Дж., Парвизи Дж. (2010) Ирригация и обработка раны в лечении инфекций протезных суставов: пересмотр традиционных показаний.J Arthroplast 25: Mortazavi SM, Vegari D, Ho A, Zmistowski B, Parvizi J (2011) Двухэтапная обменная артропластика при инфицированном тотальном артропластике коленного сустава: предикторы неудачи. Clin Orthop Relat Res 469:
7 J Orthopaed Traumatol (2015) 16: Salgado CD, Dash S, Cantey JR, Marculescu CE (2007) Более высокий риск неэффективности метициллин-резистентных инфекций протезных суставов Staphylococcus aureus.

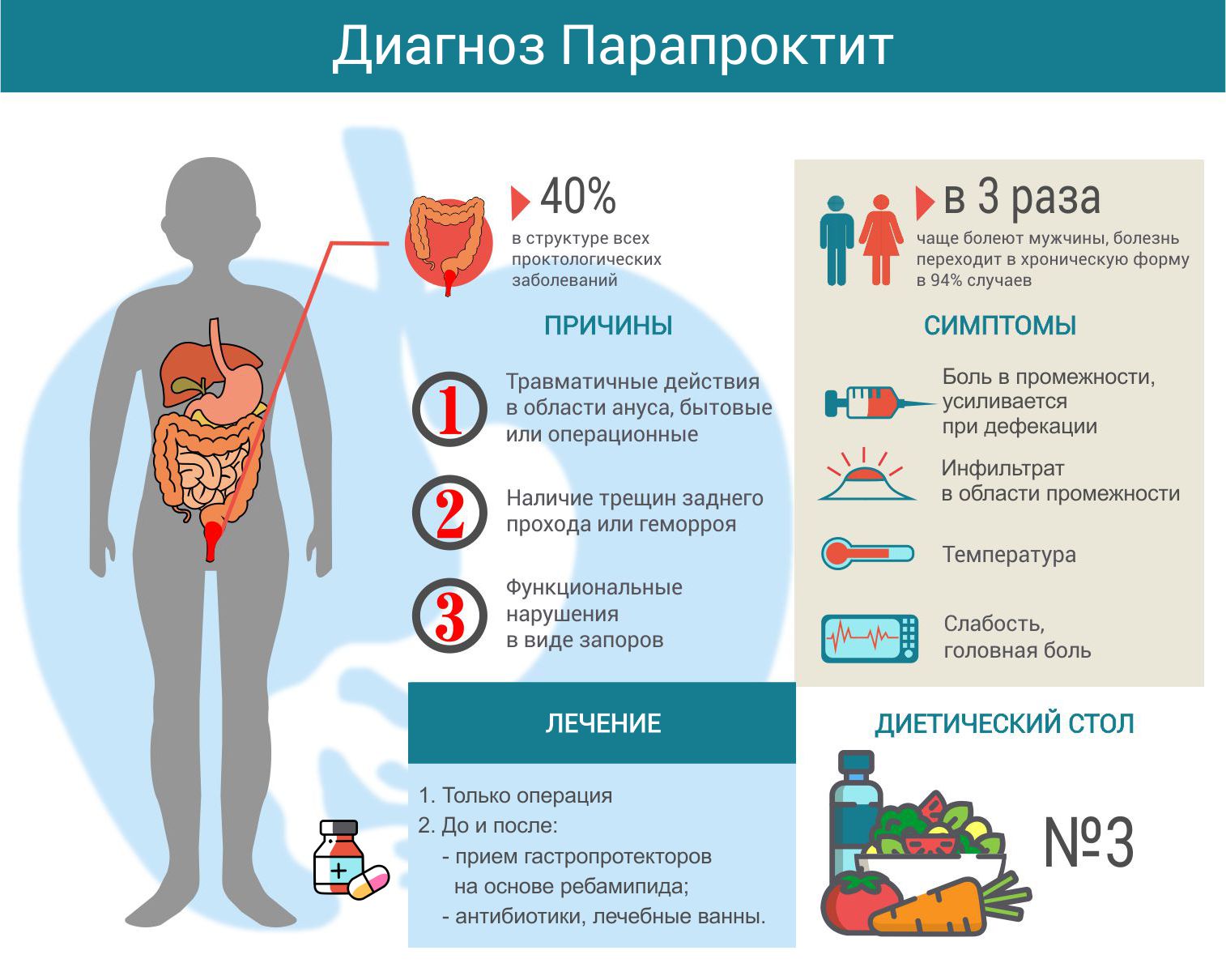

 Однако здесь гнойные образования размещаются в районе тазовой кости. Такой вид абсцесса установить поверхностно почти никогда не удается. Внешних симптомов, боли нет. Но патология препровождается такими же проявлениями, как при воспалении.
Однако здесь гнойные образования размещаются в районе тазовой кости. Такой вид абсцесса установить поверхностно почти никогда не удается. Внешних симптомов, боли нет. Но патология препровождается такими же проявлениями, как при воспалении.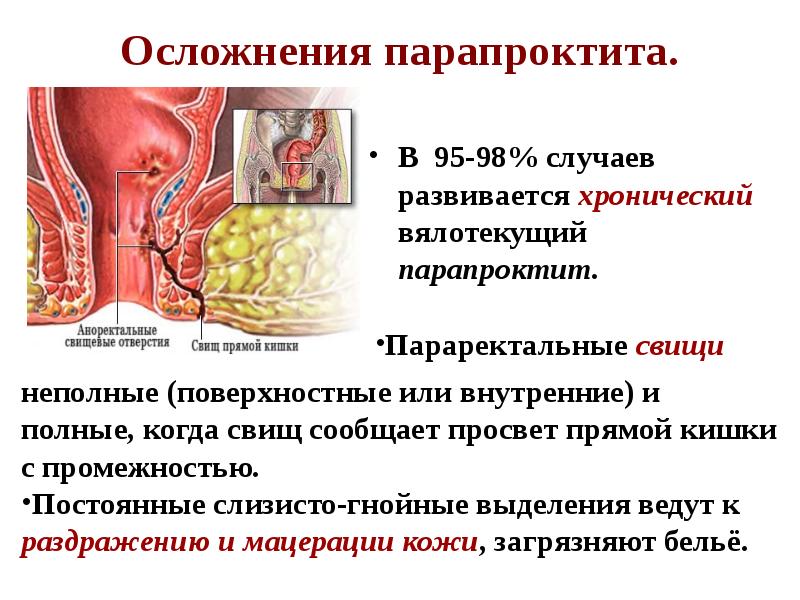
 Вторая операция подразумевает удаление ректальной пазухи, железы, которые воспалены.
Вторая операция подразумевает удаление ректальной пазухи, железы, которые воспалены.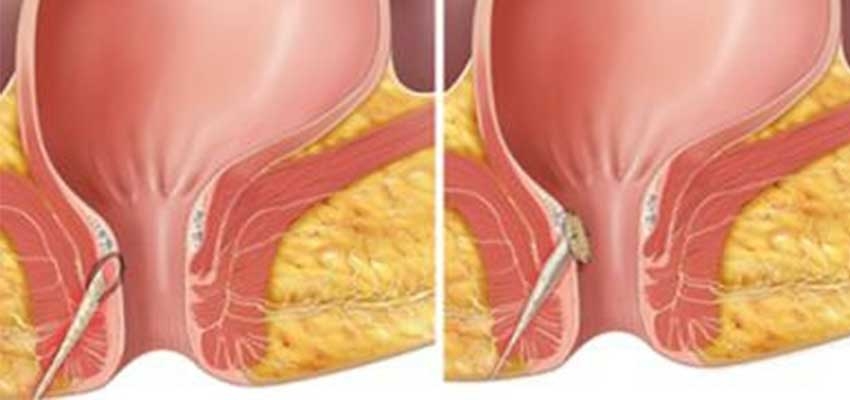

 Образец вашей крови может быть взят и отправлен в лабораторию для проверки высокого количества лейкоцитов. Также может быть выполнен посев крови, чтобы определить, есть ли в вашей крови бактерии.
Образец вашей крови может быть взят и отправлен в лабораторию для проверки высокого количества лейкоцитов. Также может быть выполнен посев крови, чтобы определить, есть ли в вашей крови бактерии.
 , Eds. Перитонеальный диализ. В: Brenner & Rector’s The Kidney. 11 изд. Эльзевир; 2020. https: //www.clinicalkey.com. По состоянию на 20 марта 2020 г.
, Eds. Перитонеальный диализ. В: Brenner & Rector’s The Kidney. 11 изд. Эльзевир; 2020. https: //www.clinicalkey.com. По состоянию на 20 марта 2020 г.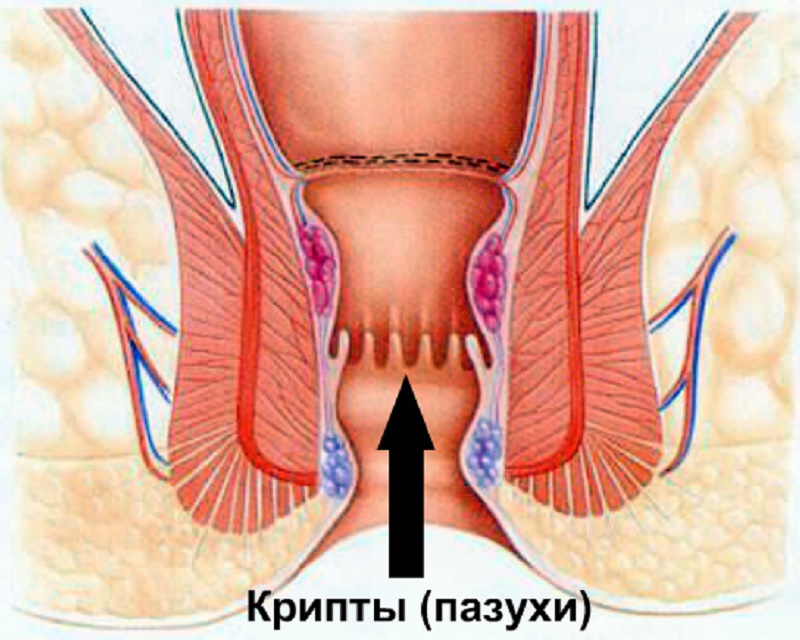
 Руководство Merck Professional Edition. https://www.merckmanuals.com/professional/hepatic-and-biler-disorders/approach-to-the-patient-with-liver-disease/spontaneous-bacterial-peritonitis-sbp. Доступ 13 марта 2020 г.
Руководство Merck Professional Edition. https://www.merckmanuals.com/professional/hepatic-and-biler-disorders/approach-to-the-patient-with-liver-disease/spontaneous-bacterial-peritonitis-sbp. Доступ 13 марта 2020 г. 3747 / pdi.2016.00078.
3747 / pdi.2016.00078.