Ультразвуковое исследование печени — Медицинский центр Медина (Электросталь)
- Главная
- Направления
- УЗ исследования
- Ультразвуковое исследование печени
Ультразвуковое исследование печени
Метод ультразвуковой диагностики состояний печени является на сегодняшний день одним из основных среди других диагностических средств и первым среди скрининговых методов. Это положение объясняется относительной простотой исследования, моментальным получением информации, отсутствие каких – либо противопоказаний к исследованию. Немаловажное значение имеет и экономическая доступность применения. Показаниями для исследования печени являются многие клинические симптомы и жалобы больного. Ультразвуковое сканирование проводится при гепато и спленомегалия, болях в животе, хронические заболевания печени, подозрении на объемное поражение печени, нарушение пигментного обмена, при синдроме желудочно – кишечного кровотечении, при острых болях в животе, при пальпируемом образовании в правом верхнем квандранте брюшной полости, инфантильный или ювенильный поликистоз почек и т. д.
д.
Аномалии развития печени.
Аномалии развития печени встречаются весьма редко. Большого клинического интереса не представляют из — за своей бессимптомности. Различают аномалии положения, формы и смешанные аномалии. К аномалиям положения относится крайне редко встречаемое расположение печени под левым куполом диафрагмы при обычном положении других органов. В других ситуациях расположение печени обусловлено патологическими процессами. К таким же редким аномалиям развития печеночной ткани относится аномалия формы, называемая «долей Риделя»,- удлиненный «язык» печеночной ткани, исходящий из правой, левой или квадратной доли печени. Ткань ее не изменена. Каких-либо клинических проявлений она не вызывает. Чаще встречается аномалия в виде «добавочной печени». Эти дольки различных размеров обычно распологаются рядом с основной печенью и соединяется с нею паранхиматозной или сосудистой ножкой.
Гепатомегалия
Гепатомегалия, которая является признаком некоторых наследственных синдромов. Определяется при врожденном токсоплазмозе, фетальных синдромах краснухи и цитомегаловируса, сопровождает наследственную непереносимость фруктозы. А также сопровождает галактоземии, гликогенозы, рецессивный остеопороз. Паренхиматозные диффузные изменения печени. Перечислим основные причины диффузных изменений печени:
Определяется при врожденном токсоплазмозе, фетальных синдромах краснухи и цитомегаловируса, сопровождает наследственную непереносимость фруктозы. А также сопровождает галактоземии, гликогенозы, рецессивный остеопороз. Паренхиматозные диффузные изменения печени. Перечислим основные причины диффузных изменений печени:
- Общие заболевания: острая дегидратация, тяжелая инфекция, голодание, интоксикации, недостаточность поджелудочной железы, муковисцидоз.
- Ферментопатии: гликогенозы, гиперлипидемия, наследственная непереносимость фруктозы, болезнь Вильсона, синдром Рея и т.д.
- Обменные заболевания: сахарный диабет, ожирение, гиперкортицизм (болезнь Кушинга, лечение стероидами), нефротический синдром.
Очаговые изменения печени
Очаговые изменения паренхимы печени диагностируются значительно проще, чем диффузные. К очаговым изменениям относятся кистозные поражения печени. Форма их может быть разнообразной, единичные или множественные . При любых кистозных образованиях печени необходимо исключать эхинококковое поражение. Еще одной причиной образования кист в печени являются травматические поражения печени. В последнее время участились случаи очаговых поражений печени инфекционного порядка, после которых также возможно отложение солей кальция в зоне некроза. К ним относятся иерсинеоз, хламидиоз, орнитоз, описторхоз, бактериальная инфекция с образованием абсцессов.
При любых кистозных образованиях печени необходимо исключать эхинококковое поражение. Еще одной причиной образования кист в печени являются травматические поражения печени. В последнее время участились случаи очаговых поражений печени инфекционного порядка, после которых также возможно отложение солей кальция в зоне некроза. К ним относятся иерсинеоз, хламидиоз, орнитоз, описторхоз, бактериальная инфекция с образованием абсцессов.
Опухолевидные поражения печени
Очаговые опухолевидные изменения печени носят самый разнообразный характер, зависящий от клеточного строения опухоли и стадии его развития.
Диффузные изменения печени и поджелудочной(Гепатомегалия) — что это такое? | Нетгастриту
Ставим лайки и подписываемся на канал. Новые материалы публикуются ежедневно!
Если хотите поддержать проект, в конце страницы есть форма для доната. Спасибо за внимание!
Спасибо за внимание!
При развитии гепатомегалии наблюдаются диффузные изменения печени и поджелудочной железы.
Симптомы бывают ярко-выраженные или смазанные. Диагностировать болезнь может только врач, который и назначает необходимое комплексное лечение.
Гепатомегалия: код по МКБ
Гепатомегалия Всемирной Организацией Здравоохранения внесена в нормативный документ МКБ 10. Болезнь приписана к группе R 16.
Причины
Причины гепатомегалии самые разнообразные. При обследовании выявляют увеличение печени и диффузные изменения паренхимы.
Спровоцировать такие диффузные изменения могут следующие факторы:
- гепатит;
- цирроз;
- сбой в обмене веществ;
- вирусные и инфекционные болезни;
- функциональные нарушения в сердечно-сосудистой системе;
- паразиты;
- жировой гепатоз;
- алкоголизм и наркомания;
- злоупотребление некоторыми видами лекарственных препаратов;
- болезни почек;
- болезни поджелудочной железы;
- лейкемия;
- фиброз;
- злокачественные образования;
- перикардит;
- закупорка в желчных протоках;
- амилоидоз;
- генетические патологии;
- спленомегалия;
- кисты.

Болезнь наблюдается у взрослых людей и даже у новорожденных детей. При гепатомегалии печень бугристая, так как происходит разрастание фиброзной ткани. Она перестает правильно функционировать и по мере развития патологии увеличивается в размере.
Симптомы гепатомегалии
Симптомы гепатомегалии связаны с причинами, которые вызвали это заболевание.
Главный признак — возможность легко ощутить при пальпации ее увеличение.
Во время проведения осмотра больной жалуется на болезненные ощущения.
Гепатомегалия также имеет такие признаки:
- отечность;
- увеличение почек;
- тошноту или рвоту;
- искажение вкуса;
- отвращение к некоторым продуктам питания;
- изжогу;
- желтушность кожи;
- повышенную утомляемость;
- запах из полости рта;
- зуд;
- дискомфорт в животе;
- диарею или запор;
- появление пигментных пятен на лице.
Виды
Болезнь подразделяется на виды с характерными для каждого особенностями:
- Невыраженная гепатомегалия выражается в незначительном увеличении в размерах печени.
 Болезнь диагностируют у маленьких детей. Если у ребенка нет негативной симптоматики и самочувствие не вызывает у него дискомфорта, врач не назначает лечение. Чаще всего этот вид гепатомегалии со временем проходит самостоятельно. Если же со временем будет наблюдаться увеличение органа, врач подбирает комплексную терапию.
Болезнь диагностируют у маленьких детей. Если у ребенка нет негативной симптоматики и самочувствие не вызывает у него дискомфорта, врач не назначает лечение. Чаще всего этот вид гепатомегалии со временем проходит самостоятельно. Если же со временем будет наблюдаться увеличение органа, врач подбирает комплексную терапию. - Выраженная гепатомегалия диагностируется, если орган увеличился до 5 см и более. Из-за этого происходит увеличение объема брюшной полости, что можно наблюдать при визуальном осмотре. По мере развития болезни у человека появляется лейкоз или гемобластоз.
- Умеренно выраженный вид характеризуется незначительным увеличением размера, который превышает норму до 2-5 см. При этом у больного редко наблюдается негативная симптоматика. Если соблюдать диету и не употреблять алкоголь, орган может самостоятельно восстановиться и со временем принять нормальные размеры. Если умеренно увеличена печень, назначение лекарственной терапии назначается только, когда со временем начинают появляться негативные симптомы.

Формы гепатомегалии
Гепатомегалия левой доли
Гепатомегалия за счет левой доли встречается редко. Увеличение органа могут спровоцировать инфекции или проблемы с сердцем, селезенкой, почками. Из-за расположения левой доли вблизи от поджелудочной железы, развитие болезни может начаться из-за панкреатита или из-за диффузных изменений.
Гепатомегалия правой доли
Эта форма заболевания диагностируется часто. Увеличение происходит из-за генетических особенностей. Воспалительные болезни, токсины, злоупотребление некоторыми видами продуктов могут спровоцировать гепатомегалию. Гепатомегалия правой доли негативно отражается на всем организме, так как она на 60% выполняет все необходимые функции печени.
Диффузная
При данной форме орган увеличивает от 12 см и выше. Диффузные изменения затрагивают любую часть. Это повреждает нервные окончания, негативно отразжается на кровообращении и желчевыведении. Изменения возникают из-за инфекционных процессов.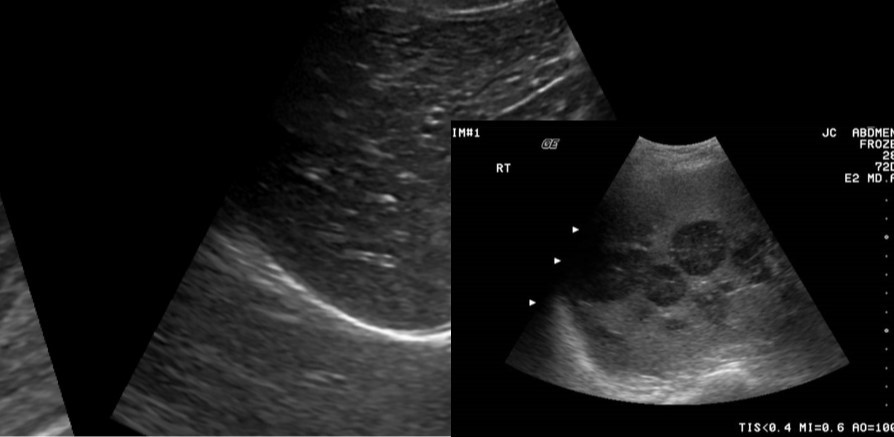 Для этой формы характерна следующая негативная симптоматика:
Для этой формы характерна следующая негативная симптоматика:
- усиленное сердцебиение;
- ощущаются ноющие боли;
- боль иррадиирует в руку или лопатку;
- если болезнь спровоцировал алкоголизм, наблюдается увеличение в размерах селезенки;
- появляется сильный озноб.
Медикаментозное лечение при такой форме не помогает. Больным назначают хирургическую операцию.
Парциальная
Увеличение органа происходит неравномерно. Одна из долей может быть больше, а другая меньше. Могут наблюдаться неровности по нижнему краю печени. Во время пальпации чувствуется бугристость и неровность поверхности.
Гепатомегалия и спленомегалия
Болезни могут возникнуть одновременно. И если гепатомегалия характеризуется увеличение размера печени, то спленомегалия — увеличением размера селезенки. Эту форму болезни вызывают:
- болезнь Гоше;
- нарушение кровообращения вен этих органов;
- паразиты и инфекции;
- болезни желчного пузыря;
- порок сердца;
- перикардит;
- туберкулез;
- малярия.

Из-за жирового гепатоза
Заболевание, развившееся на фоне жирового гепатоза появляется, когда начинается перерождение здоровых клеток в жировые. Провоцируют болезнь алкоголизм, частый прием лекарств, регулярная диета или частое голодание, злоупотребление пробиотиками и жирной пищей. Жиры не перерабатываются, а накапливаются в клетках, что и провоцирует развитие гепатомегалии из-за жирового гепатоза.
Гепатомегалия у плода
У плода болезнь связана с сильным увеличением органа. Задача врача при диагностике — выявить фактор, спровоцировавший болезнь. Чаще всего это связано:
- с внутриутробной инфекцией;
- из-за сбоя метаболизма;
- если женщина переболела сифилисом.
У новорожденных
Гепатомегалия у новорожденных слабо выражена.
Увеличение составляет максимум 2 см. Вызвать заболевание может очень много факторов:
- неправильное питание;
- вакцинация;
- аутоиммунные болезни;
- инфекции;
- злокачественные образования;
- закупорка или протоков;
- синдром Дебре;
- болезнь Гирке;
- синдром Мориака;
- эхинококкоз;
- синдром Ворингера.

Определить гепатомегалию можно по следующим симптомам:
- рвота или тошнота;
- желтушность кожи;
- появление пигментных пятен;
- набухание пупка;
- диарея;
- анемия;
- вялость.
Все симптомы характерны и для детей более старшего возраста.
Гепатомегалии при беременности
У женщин во время вынашивания ребенка диагностируется болезнь довольно часто. Из-за увеличения при беременности матки происходит смещение печени вверх. Она наполняется кровью, происходит ее увеличение в объеме. Оказывая давление на диафрагму, она затрудняет выведение желчи.
Гепатомегалия появляется если:
- орган поражается из-за длительного токсикоза;
- есть внутрипеченочный холестаз;
- если произошло резкое смещение.
_____________________________________________________________________________________
Проект НетГастриту создавался с целью предоставления людям точной и актуальной информации медицинской тематики. Статьи пишутся профессионалами и, к сожалению, затраты на развитие тормозят развитие проекта. Если Вы хотите нас поддержать воспользуйтесь формой ниже.
Статьи пишутся профессионалами и, к сожалению, затраты на развитие тормозят развитие проекта. Если Вы хотите нас поддержать воспользуйтесь формой ниже.
Сделаем мир лучше вместе. Спасибо за внимание.
_____________________________________________________________________________________
ДИФФУЗНЫЕ ИЗМЕНЕНИЯ ПЕЧЕНИ: ОЦЕНКА ЭФФЕКТИВНОСТИ ДИАГНОСТИКИ МЕТОДОМ СТАНДАРТИЗОВАННОЙ ARFI-ЭЛАСТОМЕТРИИ | Степанян
1. Феоктистова Е.В., Амосова А.А., Изотова О.Ю. и др. Возможности ARFI-эластографии в диагностике фиброза печени у детей с перегрузкой железом // Ультразвуковая и функциональная диагностика. 2015. № 5. С. 100. [Feoktistova E.V., Amosova A.A., Izotova O.Yu. i dr. Vozmozhnosti ARFI-ehlastografii v diagnostike fibroza pecheni u detej s peregruzkoj zhelezom. Ul’trazvukovaya i funkcional’naya diagnostika, 2015, No. 5, р. 100 (In Russ.)].
2. Феоктистова Е.В., Пыков М.И., Амосова А.А. и др. Применение ARFI-эластографии печени для оценки жесткости у детей различных возрастных групп // Ультразвуковая и функциональная диагностика. 2013. № 6. С. 46–55. [Feoktistova E.V., Pykov M.I., Amosova A.A. i dr. Primenenie ARFI-ehlastografii pecheni dlya ocenki zhestkosti u detej razlichnyh vozrastnyh grupp. Ul’trazvukovaya i funkcional’naya diagnostika, 2013, No. 6, рр. 46–55 (In Russ.)].
Феоктистова Е.В., Пыков М.И., Амосова А.А. и др. Применение ARFI-эластографии печени для оценки жесткости у детей различных возрастных групп // Ультразвуковая и функциональная диагностика. 2013. № 6. С. 46–55. [Feoktistova E.V., Pykov M.I., Amosova A.A. i dr. Primenenie ARFI-ehlastografii pecheni dlya ocenki zhestkosti u detej razlichnyh vozrastnyh grupp. Ul’trazvukovaya i funkcional’naya diagnostika, 2013, No. 6, рр. 46–55 (In Russ.)].
3. Маянский Д.Н. Цирроз печени глазами патофизиолога // Практическая медицина. 2012. № 6 (61). С. 83–85. [Mayanskij D.N. Cirroz pecheni glazami patofiziologa. Prakticheskaya medicina, 2012, No. 6 (61), рр. 83–85 (In Russ.)].
4. Петров В.Н., Лапотникова В.А. Цирроз печени // Российский семейный врач. 2011. № 3. С. 46–51. [Petrov V.N., Lapotnikova V.A. Cirroz pecheni. Rossijskij semejnyj vrach, 2011, No.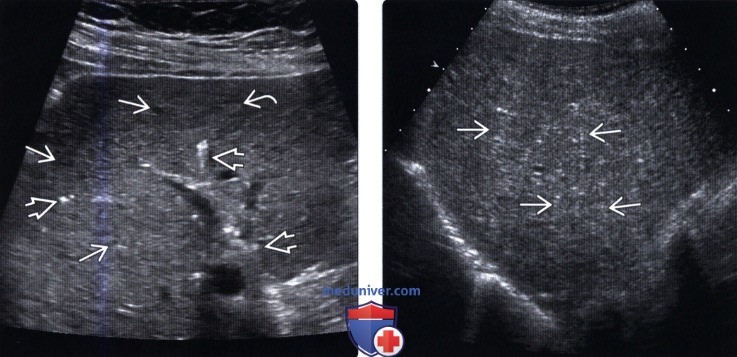 3, рр. 46–51 (In Russ.)].
3, рр. 46–51 (In Russ.)].
5. URL http://www.who.int/healthinfo/global_burden_disease/en/ (data obrashcheniya: 17.09.2017).
6. Морозова Т.Г., Борсуков А.В. Компрессионная эластография в диагностике стадий фиброзного процесса печени // Клиническая медицина. 2014. Т. 6, № 3. С. 80–84. [Morozova T.G., Borsukov A.V. Kompressionnaya ehlastografiya v diagnostike stadij fibroznogo processa pecheni. Klinicheskaya medicina, 2014, Vol. 6, No.3, рр. 80–84 (In Russ.)].
7. Koizumi Y., Hirooka M., Kisaka Y. et al. Liver fibrosis in patients with chronic hepatitis C: noninvasive diagnosis by means of real-time tissue elastography — establishment of the method for measurement. Radiol., 2011, Vol. 258, No. 2, рр. 610–617.
8. Проекты глобальных стратегий сектора здравоохранения. Вирусный гепатит, 2016–2021. Доклад секретариата. Шестьдесят девятая сессия Всемирной Ассамблеи Здравоохранения. Пункт 15.1 предварительной повестки дня. 22 апреля 2016 г. [Proekty global’nyh strategij sektora zdravoohraneniya. Virusnyj gepatit, 2016–2021. Doklad sekretariata. SHest’desyat devyataya sessiya Vsemirnoj Assamblei Zdravoohraneniya. Punkt 15.1 predvaritel’noj povestki dnya. 22 aprelya 2016 g. (In Russ.)].
Проекты глобальных стратегий сектора здравоохранения. Вирусный гепатит, 2016–2021. Доклад секретариата. Шестьдесят девятая сессия Всемирной Ассамблеи Здравоохранения. Пункт 15.1 предварительной повестки дня. 22 апреля 2016 г. [Proekty global’nyh strategij sektora zdravoohraneniya. Virusnyj gepatit, 2016–2021. Doklad sekretariata. SHest’desyat devyataya sessiya Vsemirnoj Assamblei Zdravoohraneniya. Punkt 15.1 predvaritel’noj povestki dnya. 22 aprelya 2016 g. (In Russ.)].
9. Аришева О.С., Гармаш И.В., Кобалава Ж.Д., Моисеев В.С. Методы диагностики фиброза печени // Экспериментальная и клиническая гастроэнтерология. 2013. № 7. С. 49–55. [Arisheva O.S., Garmash I.V., Kobalava Zh.D., Moiseev V.S. Metody diagnostiki fibroza pecheni. Ehksperimental’naya i klinicheskaya gastroehnterologiya, 2013, No. 7, рр. 49–55 (In Russ.)].
10. Goertz R. S., Zopf Y., Jugl V. et al. Measurement of liver elasticity with acoustic radiation force impulse (ARFI) technology: An alternative noninvasive method for staging liver fibrosis in viral hepatitis. Ultraschall in der Medizin, 2010, Vol. 31 (2), рр. 151–155.
S., Zopf Y., Jugl V. et al. Measurement of liver elasticity with acoustic radiation force impulse (ARFI) technology: An alternative noninvasive method for staging liver fibrosis in viral hepatitis. Ultraschall in der Medizin, 2010, Vol. 31 (2), рр. 151–155.
11. Lupsor M., Badea R., Stefanescu H. et al. Performance of a new elastographic method (ARFI technology) compared to unidimensional transient elastography in the noninvasive assessment of chronic hepatitis C. Preliminary results. Journal of Gastrointestinal and Liver Diseases, 2009, Vol. 18 (3), рр. 303–310.
12. Митьков В.В., Хуако С.А., Ампигилова Э.Р. и др. Оценка воспроизводимости результатов количественной ультразвуковой эластографии // Ультразвуковая и функциональная диагностика. 2011. № 2. С. 115–119. [Mit’kov V.V., Huako S.A., Ampigilova EH.R. i dr. Ocenka vosproizvodimosti rezul’tatov kolichestvennoj ul’trazvukovoj ehlastografii. Ul’trazvukovaya i funkcional’naya diagnostika, 2011, No. 2, рр. 115–119 (In Russ.)].
Ul’trazvukovaya i funkcional’naya diagnostika, 2011, No. 2, рр. 115–119 (In Russ.)].
13. Диомидова В.Н., Петрова О.В. Сравнительный анализ результатов эластографии сдвиговой волной и транзиентной эластографии в диагностике диффузных заболеваний печени // Ультразвуковая и функциональная диагностика. 2013. № 5. С. 17–23. [Diomidova V.N., Petrova O.V. Sravnitel’nyj analiz rezul’tatov ehlastografii sdvigovoj volnoj i tranzientnoj ehlastografii v diagnostike diffuznyh zabolevanij pecheni. Ul’trazvukovaya i funkcional’naya diagnostika. 2013, No. 5, рр. 17–23 (In Russ.)].
14. Кляритская И.Л., Шелихова Е.О., Мошко Ю.А. Транзиентная эластография в оценке фиброза печени // Крымский терапевтический журнал. 2015. Т. 3, № 26. С. 18–30. [Klyaritskaya I.L., Shelihova E.O., Moshko Yu.A. Tranzientnaya ehlastografiya v ocenke fibroza pecheni. Krymskij terapevticheskij zhurnal. 2015, Vol. 3, No. 26, рр. 18–30 (In Russ.)].
2015, Vol. 3, No. 26, рр. 18–30 (In Russ.)].
15. Nightingale K. Acoustic radiation force impulse (ARFI) imaging: A review. Current Medical Imaging Reviews, 2011, Vol. 7 (4), рр. 328–339.
16. Борсуков А.В., Морозова Т.Г. Диагностические возможности соноэластографии печени и селезенки при диффузных заболеваниях печени // Лучевая диагностика: Радиология — практика. 2014. № 4 (46). С. 6–17. [Borsukov A.V., Morozova T.G. Diagnosticheskie vozmozhnosti sonoehlastografii pecheni i selezenki pri diffuznyh zabolevaniyah pecheni. Luchevaya diagnostika: Radiologiya — praktika. 2014, No. 4 (46), рр. 6–17 (In Russ.)].
17. Зыкин Б.И., Постнова Н.А., Медведев М.Е. Эластография: анатомия метода // Променева діагностика, променева терапія. 2012. № 2–3. С. 107–113. [Zykin B. I., Postnova N.A., Medvedev M.E. Elastografiya: anatomiya metoda. Promeneva dіagnostika, promeneva terapіya, 2012, No. 2–3, рр. 107–113 (In Russ.)].
I., Postnova N.A., Medvedev M.E. Elastografiya: anatomiya metoda. Promeneva dіagnostika, promeneva terapіya, 2012, No. 2–3, рр. 107–113 (In Russ.)].
18. Cassinotto C., Boursier J., de L_edinghen V. et al. Liver stiffness in nonalcoholic fatty liver disease: A comparison of supersonic shear imaging, FibroScan, and ARFI with liver biopsy. Hepatology, 2016, Vol. 63 (6), рр. 1817–1827.
19. Eiler J., Kleinholdermann U., Albers D. et al. Standard value of ultrasound elastography using acoustic radiation force impulse imaging (ARFI) in healthy liver tissue of children and adolescents. Ultraschall. Med., 2012, Vol. 33, No. 5, рр. 474–479.
20. Fink M., Tanter M. A multiwave imaging approach for elastography. Current Medical Imaging Reviews, 2011, Vol. 7 (4). рр. 340–349.
340–349.
21. Friedrich-Rust M., Wunder K., Kriener S. et al. Liver fibrosis in viral hepatitis: Noninvasive assessment with acoustic radiation force impulse imaging versus transient elastography. Radiology, 2009, Vol. 252 (2), рр. 595–604.
22. Goertz R.S., Sturm J., Pfeifer L. et al. ARFI cut-off values and significance of standard deviation for liver fibrosis staging in patients with chronic liver disease. Annals of Hepatology, 2013, Vol. 12 (6), рр. 935–941.
23. Balakrishnan M., Souza F., Muñoz C. et al. Liver and spleen stiffness measurements by point shear wave elastography via acoustic radiation force impulse: Intraobserver and interobserver variability and predictors of variability in a US population. Journal of Ultrasound in Medicine, 2016, vol. 35 (11), рр. 2373–2380.
24. Изранов В.А., Степанян И.А., Мартинович М.В. ARFI-эластометрия печени у здоровых добровольцев: стандартизация методики // Вестник Балтийского Федерального Университета им. И. Канта. Естественные и медицинские науки. 2016. № 2. С. 77–85 [Izranov V.A., Stepanyan I.A., Martinovich M.V. ARFI-ehlastometriya pecheni u zdorovyh dobrovol’cev: standartizaciya metodiki. Vestnik Baltijskogo Federal’nogo Universiteta im. I. Kanta. Estestvennye i medicinskie nauki, 2016, No. 2, рр. 77–85 (In Russ.)].
25. Изранов В.А, Казанцева Н.В., Белецкая М.А. Проблемы методических подходов к измерению и оценке размеров печени при УЗИ // Вестник Балтийского федерального университета им. И. Канта. Сер.: Естественные и медицинские науки. 2017. № 1. С. 73–91. [Izranov V.A, Kazanceva N.V., Beleckaya M.A. Problemy metodicheskih podhodov k izmereniyu i ocenke razmerov pecheni pri UZI. Vestnik Baltijskogo federal’nogo universiteta im. I. Kanta. Ser.: Estestvennye i medicinskie nauki, 2017, No. 1, рр. 73–91 (In Russ.)].
26. Изранов В.А., Степанян И.А., Мартинович М.В. Выбор оптимального сегмента для оценки скорости сдвиговой волны при проведении ARFI-эластометрии печени // Тезисы VII Съезда Российской ассоциации специалистов ультразвуковой диагностики в медицине (10–13 ноября 2015 года, Москва) // Ультразвуковая и функциональная диагностика. 2015. № 4. Приложение. С. 68. [Izranov V.A., Stepanyan I.A., Martinovich M.V. Vybor optimal’nogo segmenta dlya ocenki skorosti sdvigovoj volny pri provedenii ARFI-ehlastometrii pecheni // Tezisy VII S’ezda Rossijskoj associacii specialistov ul’trazvukovoj diagnostiki v medicine (10–13 noyabrya 2015 goda, Moskva). Ul’trazvukovaya i funkcional’naya diagnostika, 2015, No. 4, Prilozhenie, р. 68 (In Russ.)].
Диффузные поражения паренхимы печени | Ветеринарная клиника доктора Шубина
Для определения диффузных изменений эхогенности печени происходит ее сравнение с эхогенностью коркового вещества правой почки и селезенки на той же глубине и на тех же настройках аппарата УЗИ. Эхогенность печени при этом может быть повышена, снижена или находиться в пределах нормы. Эхогенность паренхимы, у здоровых собак и у кошек, сходна с таковой коры правой почки, но могут наблюдаться некоторые вариации (чуть выше или чуть ниже). У нормальных собак печень обычно менее эхогенна, чем селезенка; это не всегда отмечается у нормальных кошек.
При УЗИ печени следует соблюдать некоторые предосторожности. При ультразвуковой оценки эхогенности печени всегда должна браться в учет вероятность комбинированного поражения печени, почек и селезенки. Поэтому относительное сравнение эхогенности может подозревать наличие отклонений (при наличии отклонений в одном или более органе), но это должно быть подтверждено другими клиническими данными и результатами биопсии. Оператор аппарата УЗИ всегда должен помнить, что установки машины могут значительно изменять эхогенность паренхимы печени.
Диффузные заболевания печени кроме изменения эхогенности могут вести к изменению размера и формы органа, при УЗИ всегда следует учитывать эти параметры. При дифференциации диффузных изменений эхогенности печени и плохо определяемых многочаговых заболеваний могут возникнуть некоторые трудности (обычно эти поражения вовлекают все доли печени, но не всегда однородно).
Ультразвуковая оценка диффузных изменений эхогенности печени во многом носит субъективный характер, особенно это касается случаев умеренно выраженных изменений. Диагностика различных типов диффузных заболеваний печени на основании ультразвукового вида должна быть проведена с большими предосторожностями. Как результат, УЗИ печени имеет ограниченную ценность в распознавании или дифференциации диффузных заболеваний паренхимы, и для постановки окончательного диагноза почти всегда требуется биопсия печени.
Ниже приведены таблицы, при каких заболеваниях наиболее часто происходит изменения эхогенности и размеров печени.
Таблица. Дифференциальные диагнозы при диффузных изменениях эхогенности паренхимы печени. Источник: Atlas of Small Animal Ultrasonography (2nd Edition).
Диффузная гиперэхогенность | Диффузная гипоэхогенность | Смешанная эхогенность |
Стероидная гепатопатия | Пассивный застой | Стероидная гепатопатия, связанная с |
Таблица. Дифференциальные диагнозы при изменениях объема печени. Источник: Atlas of Small Animal Ultrasonography (2nd Edition).
Диффузная гепатомегалия | Очаговая или ассиметричная | Уменьшение размера |
Стероидная гепатопатия | Первичные или метастатические новообразования | Врожденный портосистемный шунт |
Снижение эхогенности
Некоторые диффузные заболевания печени могут вести к общему снижению эхогенности паренхимы печени (по отношению к паренхиме коры правой почки), при этом портальная вена выделяется более отчетливо. Данные изменения у собак и кошек встречаются достаточно редко, наиболее вероятным диагнозом при этом будет гепатит. В случаях острого гнойного гепатита, эхогенность паренхимы печени обычно остается в пределах нормы, но субъективно может быть несколько снижена при улучшении перипортального эхо-сигнала. Также, снижение общей эхогенности печени может наблюдаться у собак и кошек при диффузных инфильтративных процессах, таких как лимфома, лейкемия и амилоидоз. Следует учитывать, что в большинстве случаев лимфомы печени с ее диффузным вовлечением, общая эхогенность остается в пределах нормы или чуть повышена. Пассивный застой в печени также может вести к снижению эхогенности, сопровождаемому гепатомегалией и увеличением печеночных вен, это указывает на сердечные, нежели чем на печеночные отклонения.
Повышение эхогенности
Повышение общей эхогенности паренхимы печени оценивается как окончательное, при ультразвуковом сравнении с корковым веществом правой почки. При этом края портальных вен выступают несколько меньше. При повышении общей эхогенности печени часто отмечается выраженное истощение ультразвука в паренхиме, что ведет к трудностям в визуализации более глубоких зон печени. В таких случаях, оператору аппарата УЗИ может помочь применение датчика с более низкой частотой, чем выбрано исходя из размера пациента. Неопытный оператор может провести настройку компенсации времени/усиления (TGC) и пропустить данные изменения.
Однородное повышение эхогенности паренхимы печени может отмечаться при таких патологиях как: жировая инфильтрация печени, стероидная гепатопатия, хронический гепатит, цирроз печени, мастоцитома печени и лимфосаркома (последнее достаточно редко). При хроническом гепатите или циррозе, в дополнение к повышению эхогенности, может отмечаться снижение размера печени, изменения ее краев, формирование регенеративных узлов и асцит.
Липидоз печени кошек – часто встречаемое поражение печени кошек, к нему предрасположены ожиревшие животные после эпизода голодания. При липидозе печени кошек обычно наблюдается гепатомегалия. При тяжелом течении липидоза печени кошек эхогенность печени может быть повышена, по сравнению с серповидным жиром и изоэхогенна или гиперэхогенна относительно жира сальника. Однако в норме у ожиревших животных может отмечаться повышенная, по отношению к серповидному жиру, эхогенность печени, что также отмечается при липидозе печени кошек. Также, при липидозе печени кошек, ее эхогенность может меняться неспецифически. В одном отчете аккуратность ультразвукового исследования для идентификации липидоза печени кошек составляла порядка 70%. Сахарный диабет также может вести к диффузной жировой инфильтрации печени.
Вакуолярная гепатопатия (vacuolar hepatopathy) собак – одна из частых форм с диффузным гиперэхогенным паттерном, не специфичным для гиперадренокортицизма и других эндокринопатий. Вакуолярная гепатопатия часто отмечается как вторичное поражение печени на фоне различных первичных заболеваний. При данном заболевании, кроме диффузного повышения эхогенности печени часто отмечается также гепатомегалия. Дифференциация между типами вакуолярной гепатопатии может потребовать специальной гистологической окраски (для гликогена и жира). Хотя липидоз печени почти всегда диффузный нормоэхогенный или гиперэхогенный с гомогенной эхотекстурой, вакуолярная гепатопатия часто характеризуются крапчатой (пятнистой) структурой (см. далее, негомогенная эхогенность).
Хронический гепатит или цирроз в классическом проявлении ведут к уменьшению размеров печени, повышению ее эхогенности и изменению контуров. Однако внешний ультразвуковой вид печени при данных заболеваниях может значительно варьировать и вызывать подозрение о новообразовании. Однако хронический гепатит и его окончательный исход в виде цирроза обычно не вызывают увеличение печени, как происходит при массивной инфильтрации печени клетками новообразований. Кроме уменьшения размера печени, повышения ее эхогенности изменения краев, у животного может отмечаться асцит. У собак с циррозом печени в паренхиме могут определяться регенеративные узлы, они выглядят как круглые контуры на фоне малой, эхогенной печени. Также возможно очаговое повышение эхогенности паренхимы печени по причине фиброза или дистрофической кальцификации.
Негомогенная эхогенность
При негомогенных (гетерогенных или пятнистых) изменениях эхогенности паренхимы печени часто наблюдается гиперэхогенность паренхимы с вкраплениями множественных плохо определяемых эхогенных узлов (вероятна также гиперэхогенность узлов). Дискретные границы узлов в большинстве случаев не определяются, и могут возникнуть трудности в идентификации аномальных зон.
Негомогенная эхогенность паренхимы печени встречается очень часто, можно сказать, что несколько чаще, чем нормальная гомогенная печень. Это может происходить в результате постепенного ввода более современного и чувствительного оборудования.
При дифференциальной диагностике негомогенной эхогенности учитываются такие патологии как: вакуолярная гепатопатия (включая стероидную гепатопатию и реже липидоз печени), узловая гиперплазия, экстрамедуллярный гематопоэз, хронический гепатит, фиброз, токсическая гепатопатия и болезни накопления. Зачастую, могут быть представлены два или несколько заболеваний одновременно (пр. хронический активный гепатит + узловая гиперплазия). У собак при вакуолярной гепатопатии часто отмечают наличие аномальной желчи, включая патологический осадок и мукоцеле.
Также, при обнаружении гетерогенных изменений эхогенности печени, в список дифференциальных диагнозов включаются новообразования (пр. лимфосаркома), но это редкая причина, при которой паренхима может выглядеть идеальной. Размеры печени могут быть нормальными или увеличенными.
Комплекс холангита/холангиогепатита кошек обычно связан со снижением эхогенности паренхимы и повышением видимости портальных сосудов. Печень при данном заболевании может выглядеть как нормальной, так гиперэхогенной и гипоэхогенной. Размеры печени при этом нормальные или повышенные. Также, при ультразвуковом исследовании могут быть выявлены некоторые желчные отклонения: утолщение стенки желчного пузыря; утолщение, расширение или извилистость желчных протоков.
У кошек при системном амилоидозе может быть отмечена гепатомегалия с неправильными краями печени и спонтанные разрывы. Паренхима печени имеет гетерогенную эхогенность с зонами высокой эхогенности (искры).
Гепатокожный синдром (поверхностный некролитический дерматит или метаболический эпидермальный некролиз) – уникальное заболевание животных, имеющих хроническое заболевание печени или глюкагон секретирующую опухоль поджелудочной железы. Заболевание чаще отмечается у пожилых собак и сопровождается формированием уникального ультразвукового паттерна в виде сот или Швейцарского сыра, а также формированием характерных кожных поражений. Сходные находки описаны также для кошек, но значимость этого не определена. Паттерн поражения печени характеризуется формированием множественных зон размером порядка 0.5-1.5 см в диаметре, гипоэхогенными по природе, они окружены высоко эхогенными границами (в виде сот). Поражения печени сопровождает паракератоз, поверхностный некролиз и базилярная гиперплазия эпидермиса. Причины заболевания не известны, но кожные поражения были связаны с сахарным диабетом, атрофией поджелудочной железы и фиброзом, панкретитом и глюкагономой поджелудочной железы. Постоянной находкой при гепатокожном синдроме была гипоаминоацидемия (hypoaminoacidemia).
Кожные поражения, уникальный ультразвуковой паттерн в печени (в виде сот) и нормальные или повышенные размеры печени помогают дифференцировать данный синдром от хронического цирроза. Цирроз обычно характеризуется нормальными или малыми размерами печени неправильной формы и не имеет характерных кожных поражений или уникального ультразвукового паттерна печени, наблюдаемого при поверхностном некролитическом дерматите.
Что такое Ультразвуковое исследование (УЗИ)?
Ультразвуковое исследование играет важную роль в постановке диагноза заболеваний внутренних органов, таких как:
- брюшная полость и забрюшинное пространство
- печень
- жёлчный пузырь и желчевыводящие пути
- поджелудочная железа
- селезёнка
- почки
- органы малого таза
- мочеточники
- мочевой пузырь
- предстательная железа
- мускуло-скелетные исследования
Ввиду относительно невысокой стоимости и высокой доступности ультразвуковое исследование является широко используемым методом обследования пациента и позволяет диагностировать достаточно большое количество заболеваний, таких как онкологические заболевания, хронические диффузные изменения в органах (диффузные изменения в печени и поджелудочной железе, почках и паренхиме почек, предстательной железе, наличие конкрементов в желчном пузыре, почках, наличие аномалий внутренних органов, жидкостных образований в органах и т. д.
Печень
Ультразвуковое исследование печени является достаточно высокоинформативным. Врачом оцениваются размеры печени, её структура и однородность, наличие очаговых изменений а также состояние кровотока. УЗИ позволяет с достаточно высокой чувствительностью и специфичностью выявить как диффузные изменения печени (жировой гепатоз, хронический гепатит и цирроз), так и очаговые (жидкостные и опухолевые образования).
Жёлчный пузырь и желчные протоки
Кроме самой печени оценивается состояние желчного пузыря и желчных протоков — исследуются их размеры, толщина стенок, проходимость, наличие конкрементов, состояние окружающих тканей. УЗИ позволяет в большинстве случаев определить наличие конкрементов в полости желчного пузыря.
Поджелудочная железа
При исследовании поджелудочной железы оцениваются её размеры, форма, контуры, однородность паренхимы, наличие образований.
Почки и наподчечники, забрюшинное пространство
При исследовании почек оценивается их количество, расположение, размер, форма, контуры, структура паренхимы и чашечно-лоханочной системы. УЗИ позволяет выявить аномалии почек, наличие конкрементов, жидкостных и опухолевых образований, также изменения вследствие хронических и острых патологических процессов почек.
Ультразвуковая диагностика может применяться для определения признаков кишечной непроходимости и косвенных признаков спаечного процесса. При помощи ультразвукового исследования можно обнаружить наличие свободной жидкости в брюшной полости, если её достаточно много, что может играть решающую роль в лечебной тактике ряда терапевтических и хирургических заболеваний и травм.
Щитовидная железа
В исследовании щитовидной железы ультразвуковое исследование является ведущим и позволяет определить наличие узлов, кист, изменения размера и структуры железы.
Кардиология, сосудистая и кардиохирургия
Эхокардиография (ЭхоКГ) — это ультразвуковая диагностика заболеваний сердца. В этом исследовании оцениваются размеры сердца и его отдельных структур (желудочки, предсердия, межжелудочковая перегородка, толщина миокарда желудочков, предсердий и т. д.), наличие и объем жидкости в перикарде — «сердечной сорочке», состояние клапанов сердца. С помощью специальных расчетов и измерений. Эхокардиография позволяет определить массу сердца, сократительную способность сердца — фракцию выброса и т. д. Существуют зонды, которые помогают во время операций на сердце следить за работой митрального клапана, расположенного между желудочком и предсердием.
Акушерство, гинекология и пренатальная диагностика
Ультразвуковое исследование используется для изучения внутренних половых органов женщины, состояния беременной матки, анатомии и мониторинга внутриутробного развития плода.
Этот эффект широко применяется в акушерстве, так как звуки, идущие от матки, легко регистрируются. На ранней стадии беременности звук проходит через мочевой пузырь. Когда матка наполняется жидкостью, она сама начинает проводить звук. Положение плаценты определяется по звукам протекающей через нее крови, а через 9 — 10 недель с момента образования плода прослушивается биение его сердца. С помощью ультразвукового исследования можно также определять количество зародышей или констатировать смерть плода
Мускуло-скелетные исследования
Ультразвуковое исследование используется для диагностики травматических повреждений и воспалительных заболеваний суставов (плечевых, коленных и т.д.), мышц, связок, менисков, сухожилий, выявление проявлений артроза.
Диффузные изменения печени
Cazador
Что это за ерунда такая? В заключении УЗИ написали «Диффузные изменения печени и поджелудочной железы». Врач сказал, что может быть гепатит 🙁 Сдал анализы крови. Что правда так все серьезно?
Wasya
Дождитесь анализов. «…Диффузные изменения паренхимы печени …» — это не диагноз, подобная формулировка присутствует в результатах подавляющего большинства УЗИ-исследований.
Gladiator
+1
Cazador
Сдал биохимию крови-АЛТ, АСТ всякие, вроде все в норме. Врач говорит, что изменение печени видимо от питания.
paramon
В России у каждого второго на секции диффузные изменения печени и поджелудочной железы
Гуманоид
Кстати, вопросик возник. У меня было Боткина (гепатит Б вроде по научному 😊) где-то под 4-ре года возраста. Слышал, что это оставляет последствия на печень на всю жизнь. А вот в чём собственно выражаются эти последствия — не знаю. Никто случайно не просветит незнайку, а? 😊
Cazador
Гуманоид
Кстати, вопросик возник. У меня было Боткина (гепатит Б вроде по научному 😊)
Разве болезньБоткина — это не гепатит А (желтуха)?
Wasya
Тут разъясняют разницу между несколькими формами этого воспаления (заболевания) печени:
http://hepatitis.aptekaonline.ru/
Некоммерческий сайт для общения людей, инфицированных вирусным гепатитом. Честно и без коммерции о диагностике, лечении и поддержании качества жизни. Мнения и опыт.
http://www.hcv.communityhost.ru/
Гуманоид
Cazador
Разве болезньБоткина — это не гепатит А (желтуха)?
Вполне может и так, я ж не врач, могу и перепутать букву. 😊
Диффузные изменения паренхимы печени
Печень отвечает за множество процессов, протекающих в организме. В ее функции входит контроль жиров и глюкозы, насыщение крови полезными ферментами, нейтрализация поступающих извне токсинов. При воздействии внешних неблагоприятных факторов, а также вследствие внутренних нарушений в организме, в тканях печени могут происходить различные изменения.
Что такое диффузные изменения печени?
В норме паренхима печени (основная функциональная ткань, состоящая из гепатоцитов) представляет собой однородную слабоэхогенную структуру, среди которой достаточно хорошо выделяются желчные протоки и кровеносные сосуды.
Диффузные изменения структуры печени свидетельствуют о том, что паренхима полностью видоизменена. Причем это может характеризовать как незначительные функциональные изменения (умеренные диффузные изменения паренхимы печени), так и очень серьезные поражения (паренхима повышенной эхогенности печени).
Диффузное изменение может иметь различный характер. Так, выделяют следующие типы изменений:
- фиброзное;
- склеротическое;
- гипертрофическое;
- дистрофическое;
- набухание.
Диффузный стеатоз печени – это заболевание, связанное с нарушением обмена веществ в гепатоцитах. Вследствие этого наблюдаются дистрофические изменения печени, в печеночных клетках происходит накопление жира.
При ультразвуковой диагностике наблюдается равномерное увеличение печени, диффузное повышение ее эхогенности (интенсивности отраженного ультразвукового сигнала) с сохранением однородности ее структуры. При дальнейшем прогрессировании процесса появляется «зернистость» паренхимы, что свидетельствует о начале развития стеатогепатита и гепатита.
Причины диффузных изменений печени
Изменения тканей печени может произойти по разным причинам, так как существует множество факторов, оказывающих негативное влияние на этот орган. К ним относятся:
- злоупотребление спиртными напитками;
- прием лекарственных средств;
- расстройства обмена веществ;
- употребление некачественных продуктов питания;
- наследственные патологии и др.
Не всегда диффузные изменения паренхимы печени говорят о каком-то заболевании. Но в некоторых случаях они могут являться следствием следующих патологий:
Признаки диффузных изменений печени
Диффузные изменения в тканях печени могут начинаться без каких-либо клинических симптомов, не беспокоя человека. Часто изменения фиксируются при профилактическом осмотре, предполагающем ультразвуковую диагностику.
Печень, благодаря своим размерам и плотности, довольно хорошо отражает ультразвуковые волны, поэтому хорошо сканируется при УЗИ. Эхографическими признаками (эхо-признаками) диффузных изменений печени являются следующие проявления, обнаруживаемые во время исследования:
- неоднородная структура ткани;
- повышенная эхоплотность паренхимы;
- наличие участков пониженной и повышенной эхогенности;
- увеличенные размеры печени;
- изменение рисунка кровеносных сосудов.
Лечение диффузных изменений печени
Лечение диффузных изменений проводится после выяснения точной причины, которая привела к этим явлениям. Для этого требуется проведение некоторых дополнительных исследований, к которым относятся:
- анализ крови;
- магнитно-резонансная томография;
- ангиография;
- гистологическое исследование ткани печени и др.
Помимо исследования состояния печени, может потребоваться диагностика всех органов пищеварения.
Методы лечения зависят от результатов диагностических мероприятий. В некоторых случаях потребуется лишь соблюдение диеты и отказ от вредных привычек, в других – прием медикаментов и даже оперативные вмешательства.
Жирная печень вызывает боль в животе и нарушение функции печени.
Ультразвук — это неинвазивное решение для исследования тканей в режиме реального времени. Мы недавно были упомянуты в пресс-релизе по поводу скелетно-мышечной ультрасонографии, что случается, один из наших специальностей. Просмотрите пресс-релиз здесь https://www.infonews.co.nz/news.cfm?id=115381 или прочтите его ниже.
Неалкогольная жировая болезнь печени (НАЖБП) является одной из наиболее частых причин хронических заболеваний печени и встречается примерно у 15% населения мира.Он включает в себя спектр состояний, связанных с отложением липидов в гепатоцитах, и варьируется от гепатостеатоза (простая жировая дистрофия печени) до неалкогольного стеатогепатита (НАСГ — жировые изменения с воспалением и гепатоцеллюлярным повреждением или фиброзом), которые могут привести к выраженному фиброзу и циррозу. Хотя обычно НАЖБП является доброкачественной и обратимой при обнаружении на ранней стадии, она может прогрессировать до необратимого прогрессирующего заболевания печени, такого как фиброз, цирроз, рак печени и печеночная недостаточность.
Печень расположена в верхней правой части живота и играет центральную роль во всех метаболических процессах в организме. Это помогает поддерживать нормальный уровень глюкозы в крови. Когда уровень сахара в крови низкий, печень расщепляет накопленный гликоген и триглицериды до глюкозы и попадает в кровоток. Печень также помогает использовать белки, жиры и углеводы, поступающие с пищей. Он производит желчь, которая расщепляет жиры и превращает их в АТФ (источник энергии), а также накапливает такие вещества, как гликоген, железо и витамины, необходимые для обмена веществ.Печень вырабатывает почти все белки плазмы, используемые в иммунной и коагуляционной системах, и одна из ее основных функций — детоксикация. Печень перерабатывает почти все вещества, попадающие в организм, расщепляя ее и выводя токсины.
Будучи вторым по величине органом в организме, печень играет жизненно важную роль в поддержании здоровья человека, поэтому ожирение может вызвать серьезные проблемы. Печень считается жирной, если жир составляет более 5-10% от массы тела печени. Накопленные в гепатоцитах жировые капли сжимают внутренние структуры клеток и затрудняют выполнение ими своих функций.Симптомы ожирения печени могут включать постоянную тупую боль в правом подреберье или диффузный дискомфорт в животе, диспепсию, проблемы с пищеварением, недостаток энергии и хроническую усталость.
Общие причины неалкогольной жировой дистрофии печени включают ожирение, гиперлипидемию или высокий уровень жиров в крови, диабет и длительный прием некоторых лекарств. Практикующие врачи обычно используют анализ крови на функцию печени (LFT), который измеряет уровни в крови ферментов, вырабатываемых клетками печени, и ультразвуковое сканирование печени в качестве первой линии оценки печени.Ультразвуковое исследование печени — надежный тест для подтверждения стеатоза. Жировая инфильтрация печени вызывает диффузное повышение эхогенности (яркая печень) и нечеткость сосудов из-за ослабления ультразвукового луча.
На УЗИ это может привести к:
- кора почек выглядит относительно гипоэхогенной по сравнению с паренхимой печени (обычно печень и кора почек имеют почти одинаковую эхогенность),
- повышенная эхогенность по сравнению с селезенкой при паренхиматозном поражении почек,
- отсутствие нормальных эхогенных стенок воротных вен и печеночных вен (важно не оценивать сосуды, идущие перпендикулярно лучу, поскольку они производят прямое отражение и могут казаться эхогенными даже в жировой печени),
- плохая визуализация глубоких отделов печени
- и плохая визуализация диафрагмы.
Классификация диффузного стеатоза печени на УЗИ используется для описания степени жировых изменений в печени.
- Степень I: диффузно повышенная эхогенность печени, но перипортальная и диафрагмальная эхогенность все еще заметна.
- Степень II: диффузно повышенная эхогенность печени, затемняющая перипортальную эхогенность, но диафрагмальная эхогенность все еще заметна.
- Степень III: диффузно повышенная эхогенность печени, затемняющая перипортальную, а также диафрагмальную эхогенность.
Эластография — это новый метод, в котором используется тот факт, что патологический процесс изменяет эластические свойства пораженной ткани. Это изменение эластичности и степени сопутствующего фиброза определяется путем измерения жесткости ткани. Основная идея заключается в том, что независимо от того, твердая или мягкая ткань, дает диагностическую информацию о наличии или статусе заболевания. Например, злокачественные опухоли часто бывают более твердыми, чем окружающие ткани, а печень с фиброзными изменениями жестче, чем здоровая.
Существует несколько видов соноэластографии:
- Деформационная эластография (также известная как статическая или компрессионная эластография). В этом методе к ткани применяется внешнее сжатие, и сравниваются ультразвуковые изображения до и после сжатия.
- Силовая импульсная визуализация акустического излучения (ARFI) использует ультразвук для создания качественной двухмерной карты жесткости тканей. Это достигается путем создания «толчка» внутри ткани с использованием силы акустического излучения сфокусированного ультразвукового луча.То, насколько ткань толкает вниз вдоль оси луча, отражает ее жесткость — более мягкую ткань толкать легче, чем более жесткую.
- Эластография сдвиговой волной (также известная как переходная эластография). Этот метод основан на использовании силы акустического излучения сфокусированного ультразвука для создания долевых волн в мягких тканях. Путем измерения параметров распространения поперечной волны с помощью ультразвука можно создать карту эластичности ткани.
- Supersonic Shear Imaging (SSI) дает количественную двумерную карту жесткости ткани в реальном времени.
Eastmed Radiology предлагает широкий спектр ультразвуковых и рентгеновских исследований, включая УЗИ брюшной полости для проверки состояния печени с использованием самого современного оборудования. Чтобы записаться на УЗИ в Окленде или рентген в Окленде, обратитесь в EastMed Radiology.
Паренхима печени — обзор
Развитие эхинококковой кисты
Когда паразит достигает паренхимы печени, он перерастает в кистозную личиночную фазу, которая в течение нескольких месяцев или лет перерастает в эхинококковую кисту (Bourée, 2001).
Эхинококковые кисты становятся видимыми в течение 3 недель и могут достигать 3 см в диаметре через 3 месяца.
Размер зависит от возраста и может достигать 20 см и более в диаметре. Он содержит прозрачную стерильную эхинококковую жидкость с многочисленными протосколексами (протосколисами) (среднее значение 400 000 / мм 3 ) (Bourée, 2001).
Зрелая киста E. granulosus состоит из трех слоев: зародышевого слоя , ламинированного слоя , и адвенциального слоя . Внутренний, зародышевый слой окружает заполненную жидкостью центральную эхинококковую полость и, в свою очередь, окружен ламинированным слоем . Эти два слоя вместе образуют эндоцисту . При сжатии ткани хозяина вокруг эндоцисты образуется фиброзный слой, известный как эктоциста или перициста (рис. 74.3).
Зародышевый слой , также называемый зародышевой оболочкой , является живым компонентом паразита.Он производит протосколики, которые выделяются непосредственно в жидкости кисты или в эндогенной дочерней кисте. Протосколекс обеспечивает будущую головку тении (сколекс). Недифференцированные клетки в зародышевом слое производят инвагинации в полость кисты, образуя капсулы расплода, содержащие многочисленные протосколики, которые выделяются в жидкость кисты. Герминальная мембрана выделяет жидкость в кисту и является источником эндогенных дочерних кист (рис. 74.4). Наличие дочерних кист создает мультивезикулярные кисты, которые чаще встречаются у взрослых, чем у детей.
Дочерние кисты имеют структуру, аналогичную материнским кистам, включая ламинированную и зародышевую мембрану , жидкость цисты, капсулы расплода и протосколексы. Единственное отличие — отсутствие адвентициального слоя (Krige & Beckingham, 2001). Тонкий зародышевый слой поддерживается снаружи характерным структурным компонентом паразита, слоистым слоем , который является бесклеточным, всегда отделяется от перицисты и обычно имеет толщину от 1 до 2 мм.Хотя ламинированный слой проницаем для воды, калия, хлоридов, кальция и мочевины, он защищает кисту от ферментов хозяина, желчи и бактерий. Дочерние кисты бывают двух видов в зависимости от способа их образования: эндогенные или экзогенные. Подавляющее большинство из них образованы, как описано ранее, эндогенной везикуляцией. Эктогенная везикуляция происходит, когда есть небольшая утечка или дефект в ламинированной мембране . : Зародышевый слой проходит через , создавая экзогенную дочернюю кисту («сателлитную» эхинококковую кисту).Их частота колеблется от 16% до 65% (Kalovidouris et al, 1992; Stamm et al, 2008).
Эктоциста или перициста представляет собой фиброзную капсулу, которая развивается из ткани хозяина в результате воспалительной реакции на E. granulosus . Этот толстый фиброзный слой присутствует в эхинококковых кистах печени и селезенки, но отсутствует в эхинококковых кистах легких и головного мозга. Сосудистые структуры и желчные протоки адвентициального слоя остаются неповрежденными и проходимыми, несмотря на увеличение кисты, и могут привести к послеоперационному кровотечению или утечке желчи после частичной перикистозной резекции.Кровоснабжение адвентициального слоя является обильным и приводит к появлению гиперваскулярного края или ореола вокруг кистозной полости на снимках компьютерной томографии (КТ) после инъекции контраста. Между адвентициальным слоем и окружающей нормальной тканью хозяина не наблюдается четких плоскостей расщепления, и киста не может быть легко отделена от окружающей паренхимы. Со временем адвентициальный слой может кальцифицироваться, частично или полностью (Krige & Beckingham, 2001).
Неосложненная эхинококковая киста обычно содержит прозрачную бесцветную жидкость без запаха, выделяемую зародышевой оболочкой. Концентрации натрия, хлорида и бикарбоната в жидкости такие же, как и в плазме пациента, тогда как уровни калия и кальция ниже. При неосложненных кистах эхинококковая жидкость стерильна. Кистовая жидкость, окрашенная желчью, указывает на цистобилиарную коммуникацию. Когда присутствует суперадрессированная инфекция, жидкость кисты выглядит откровенно гнойной; в дегенерированных кистах жидкость становится мутной.Вытекание содержимого эхинококкоза в результате травматического или ятрогенного разрыва вызывает имплантацию протосколексов и вторичных кист на окружающие внутренние органы, известную как вторичный эхинококкоз (Krige & Beckingham, 2001). Хотя может быть задействован любой сегмент печени, расположение эхинококковых кист печени, по-видимому, связано с соответствующим объемом каждой доли печени; таким образом, наблюдается более сильное вовлечение правой доли, особенно в сегменты VII и VIII (Kayaalp etal, 2003a).
Ультразвуковое исследование печени: диффузные и очаговые заболевания (Материалы)
Общие соображения
Стрижка волос на последних 2-3 межреберных промежутках и расширение дорсальной области важно для полной визуализации печени, особенно у собак с глубокой грудью. или собак с маленькой печенью. Датчик с небольшой площадью основания рекомендуется для межреберной визуализации и визуализации подреберья, когда необходимо наклонить зонд краниально. Обычно достаточно преобразователя на 5–10 МГц.Сканирование выполняется в спинном или боковом положении лежа. Газ в желудке, а иногда и в толстой кишке может затруднять визуализацию, поэтому желательно, чтобы пациент не голодал до УЗИ. Общий размер печени лучше всего оценивается на рентгенограммах и очень субъективен на УЗИ. Полное сканирование печени в сагиттальной и поперечной плоскостях важно, чтобы не пропустить поражения.
Ультразвук нормальной печени и желчного пузыря
Различные доли печени не могут быть определены на УЗИ, если нет перитонеального выпота.Левая доля (с латеральным и медиальным отделами) охватывает от трети до половины паренхимы. Хвостатая доля доходит до правой почки. Левая медиальная, квадратная и правая медиальная доли окружают желчный пузырь. Расположение отделов воротной и печеночной вен иногда может быть полезно для определения пораженной доли у собаки.
Паренхима печени однородна (по сравнению с селезенкой) в эхотекстуре с прерыванием от трубчатых до круглых безэхогенных участков, которые представляют печеночную и воротную вены.У воротных вен эхогенные стенки, а у печеночных — нет. Эхогенность печени аналогична эхогенности правой коры почек (печень может быть менее эхогенной по сравнению с почкой у кошек) и менее эхогенной по сравнению с селезенкой.
Край печени гладкий, а каудовентральный край левой доли (виден около дна желудка) у нормальных животных резко сужен. Распространение печени за пределы реберной дуги может быть различным (собаки с глубокой грудью могут не доходить до реберной дуги, а более мелкие породы могут выходить за ее пределы).
Ложковидный жир, расположенный вентральнее от печени, обычно по эхогенности аналогичен паренхиме, и иногда его можно принять за печень. Артефакт зеркального отображения, который выглядит как печень с обеих сторон диафрагмы, является обычным явлением.
Желчный пузырь очень разнообразен по размеру и содержит безэховую жидкость с тонкой гладкой стенкой. У собак часто можно увидеть эхогенный материал, зависящий от силы тяжести (называемый «илом»). Поскольку желчный пузырь не так сильно ослабляет ультразвуковой луч, эхогенность печени глубоко в желчном пузыре будет увеличиваться (дистальное акустическое усиление).Внутрипеченочная билиарная система не наблюдается у нормальных животных. Общий желчный проток может иметь диаметр до 3 мм у собаки и до 4 мм у кошки.
УЗИ диффузного поражения печени
Диффузное заболевание печени может вызывать изменения размера, контура, эхогенности печени и ослабления ультразвукового луча. Диффузное заболевание и плохо определяемое мультифокальное заболевание могут частично совпадать при ультразвуковом исследовании. Множественные патологические процессы, такие как вакуолярная гепатопатия и узловая регенерация, могут происходить одновременно, приводя как к диффузному, так и к мультифокальному заболеванию.
Ниже приведены обобщения общих патологических процессов и результаты их ультразвукового исследования:
• Диффузное увеличение размера с повышенной эхогенностью: стероидные и другие вакуолярные гепатопатии, липидоз, лимфома (чаще гипоэхогенная) и опухоль тучных клеток.
• Диффузное увеличение размера со снижением эхогенности: пассивная гиперемия, гепатит, лимфома и другие круглоклеточные неоплазии, амилоидоз
• Диффузное увеличение размера со смешанной эхогенностью: сочетание болезни, гепатита, лимфомы и других новообразований
• амилоидоз
Уменьшение размера печени с повышенной или смешанной эхогенностью и неправильным контуром: фиброз, цирроз
• Липидоз печени у кошек обычно имеет заметно гиперэхогенную печень по сравнению с серповидным жиром.Аспирацию по-прежнему можно выполнить, чтобы выявить гепатит или диффузную неоплазию как первопричину.
• Вакуолярные гепатопатии часто встречаются у собак, принимающих стероиды, и собак с гиперадренокортицизмом или сахарным диабетом. В дополнение к тому, что печень большая и гиперэхогенная, она обычно гиператенулирует, что приводит к снижению способности видеть глубокие участки печени.
• Воспалительное заболевание (гепатит / холангиогепатит) в значительной степени совпадает с указанными выше категориями, но чаще всего острое заболевание имеет пониженную эхогенность печени (это приводит к улучшенной визуализации портальных сосудов).
• Цирроз не только приводит к уменьшению размеров печени, но и вызывает неправильный край печени, что часто наблюдается при одновременном перитонеальном выпоте.
• Диффузная лимфома может иметь различный вид, но чаще всего вызывает диффузное снижение эхогенности. Это открытие в сочетании с характерными изменениями селезенки и лимфаденопатией делает лимфому очень подозрительной.
УЗИ очагового поражения печени
Очаговые массовые поражения или асимметричные различия в гепатомегалии включают неоплазию, абсцесс, гранулему, гематому, кисту, тромбоз или перекрут доли.Ультразвук полезен для характеристики твердых и заполненных жидкостью поражений (киста-анэхогенная; абсцесс, гранулема, некротическая неоплазия — различное содержание жидкости).
• Небольшой (менее 1,5 см), одиночный, гипоэхогенный (может варьироваться по эхогенности) узелок также может быть доброкачественной гиперплазией.
• Оценка взаимосвязи новообразования с воротами печени (сосудами и общим желчным протоком) важна в случаях, когда предполагается хирургическое вмешательство.
• Лимфома и гистиоцитарная неоплазия могут быть очаговыми.
• Маленькие кисты (безэховые с дистальным акустическим усилением) обычно являются случайными находками, если они не связаны с опухолями.
УЗИ мультифокального поражения печени
• Лимфома и гистиоцитарная неоплазия могут быть мультифокальными.
• Целевые поражения, которые представляют собой гипоэхогенные узелки с гиперэхогенными центрами, наиболее часто встречаются при метастатическом поражении.
• Доброкачественное заболевание (узловая гиперплазия) может иметь различный вид: изо-, гипо- или гиперэхогенные узелки.
• У собак с кожно-гепатическим синдромом печень увеличена, гиперэхогена, с множеством гипоэхогенных участков, создающих вид соты.
Ультразвуковые аномалии желчного пузыря
Холелиты будут гиперэхогенными с дистальным акустическим затемнением. Как правило, это случайные находки, хотя иногда они могут вызывать обструкцию или быть связаны с воспалением. Мукоцеле желчного пузыря имеют центрально расположенный эхогенный материал, часто имеющий «звездчатый» или «киви» рисунок (гиперэхогенные радиальные полосы).Если произошел некроз и разрыв стенки, возможно возникновение перитонеального выпота и повышение эхогенности окружающего жира.
Дополнительные данные
Увеличение воротных лимфатических узлов можно обнаружить в воротах печени, лучше всего просматриваемых через правое межреберное окно.
Иногда газ может присутствовать в билиарной системе, сосудах или паренхиме. Газ гиперэхогенный, с артефактом реверберации. Минерализация гиперэхогенная с сильной дистальной акустической тенью.Расположение минерализации может быть в паренхиме или желчевыводящей системе. Минерализация может быть связана как с доброкачественными, так и со злокачественными процессами.
Методы вмешательства
Важно помнить, что заболевание печени может присутствовать даже при обычном ультразвуковом исследовании. При подозрении на заболевание печени может быть показана аспирация или биопсия. Обычно выполняется пункция тонкой иглой под ультразвуковым контролем или биопсия диффузного заболевания печени и узелков / новообразований.Для аспирации используется игла калибра 22, от 1 до 1 ½ дюйма. Иногда может использоваться более длинная спинная игла. Обычно используются иглы для биопсии калибра от 14 до 18 с переменной длиной выброса. Аспирация выполняется с седацией или без нее, в зависимости от режима пациента, а биопсия проводится под общим наркозом. Обследование на кровотечение следует проводить сразу (а при необходимости через несколько часов) после процедуры.
Диагностическая визуализация гепатобилиарных поражений собак: обзор
Заболевания печени часто поддаются лечению и имеют предсказуемый прогноз после постановки окончательного диагноза.Целью клинико-патологической оценки гепатобилиарных поражений является выявление и характеристика поражения и дисфункции печени, выявление возможных основных причин вторичного заболевания печени, дифференциация причин желтухи, оценка потенциальных анестезиологических рисков, оценка прогноза и реакции на ксенобиотики и мониторинг ответа на терапию. В этой статье описаны различные методы диагностики и методы визуализации, используемые для диагностики гепатобилиарных поражений у собак. Помимо обзора значимых клинических проявлений и визуализации структурных аномалий в диагностическом подходе к различным заболеваниям печени, он также отображает рентгенографические, ультразвуковые и, где это возможно, лапароскопические характеристики различных поражений печени и целевых поражений, встречающихся в клинических случаях, представленных в Учебном ветеринарном клиническом комплексе , COVAS, Palampur в 2007-2008 гг.
1. Введение
Поражения печени у собак связаны с различными и часто расплывчатыми клиническими признаками и поэтому часто представляют собой диагностическую проблему для практикующих ветеринаров. Поскольку печень обладает большим функциональным резервом, выявление нарушения функции печени обычными методами возможно только при наличии значительного нарушения функции печени (≥55%) [1]. Кроме того, системные заболевания и различные лекарственные препараты могут вызывать вводящее в заблуждение повышение активности в сыворотке крови (вторичные или реактивные гепатопатии), и может оказаться клинической дилеммой решить, является ли повышение уровня ферментов печени значительным и представляют ли они первичное или вторичное заболевание печени [2].Несмотря на доступность ряда диагностических тестов как для повреждения, так и для дисфункции печени, редко существует единственный тест, который адекватно идентифицирует заболевание печени или его основную причину.
Широко подчеркивалась роль обзорной рентгенографии в обнаружении изменения размера печени. Но со временем ультразвуковое исследование превратилось в важнейший метод диагностической визуализации. Желаемые преимущества, заключающиеся в меньших затратах времени и неинвазивной оценке детального внутреннего строения печени и прилегающих структур, включая воротную вену, сделали УЗИ наиболее предпочтительной технологией для выявления различных форм заболеваний печени у собак [2].В настоящее время лапароскопия также становится плодотворным методом визуализации. Он предлагает огромное преимущество прямого висцерального визуального осмотра печени и позволяет его описательную или фотографическую документацию. Этот метод обеспечивает трехмерную оценку печени, а также является минимально инвазивным методом для получения цитологических, биопсийных и культуральных образцов очаговых поражений или генерализованного патологического состояния / карциноматозного роста печени [3].
Важно интерпретировать все результаты в свете других аспектов диагностического исследования, в частности анамнеза и физического осмотра.В большинстве случаев предварительный диагноз первичного заболевания печени может быть установлен путем сопоставления ультразвуковых отклонений с анамнезом, результатами физикального обследования, результатами клинических лабораторных исследований и рентгенографическими / лапароскопическими наблюдениями. Однако для выявления конкретных гепатопатий и, таким образом, постановки окончательного диагноза первичного заболевания печени обычно требуется гистопатологическое исследование образцов биопсии печени.
2. Диагностические тесты и методы визуализации при гепатобилиарных поражениях
Используя комбинацию анамнеза, результатов физикального обследования, результатов скрининга и лабораторных тестов, специфичных для гепатобилиарной системы, врач обычно склонен описывать заболевание как активное или неподвижное. .Кроме того, ему / ей становится легко охарактеризовать паттерн гепатобилиарной болезни (в первую очередь, гепатоцеллюлярную, первичную или смешанную гепатобилиарную систему) и дополнительно оценить степень гепатобилиарной дисфункции [2]. Таким образом, в свете всех этих аспектов, необходимо провести полную оценку, состоящую из следующих тестов.
2.1. Лабораторные оценочные испытания
2.1.1. Полный анализ крови
Полный анализ крови (ОАК) является неотъемлемой частью диагностического исследования любого системного патологического процесса или, в этом отношении, поражений печени.Он состоит из количественной и качественной экспертизы. Количественное исследование включает объем упакованных клеток (PCV), общее количество красных кровяных телец (RBC), концентрацию гемоглобина (Hb), общее количество лейкоцитов (WBC), дифференциальное количество лейкоцитов и количество тромбоцитов. Кроме того, также оцениваются средний корпускулярный объем эритроцитов (MCV), средний корпускулярный гемоглобин (MCH) и средняя концентрация корпускулярного гемоглобина (MCHC). Качественное обследование включает исследование мазков крови на предмет изменений клеточной морфологии.
2.1.2. Биохимия сыворотки
Биохимические результаты часто оказываются наиболее полезным подспорьем в диагностике гепатобилиарных поражений. Активность печеночно-специфических ферментов сыворотки обычно включается в скрининговые панели биохимии сыворотки и рассматривается как маркеры гепатоцеллюлярного и желчного повреждения и реактивности [2]. В дополнение к этому, многие биохимические тесты не являются специфическими индикаторами заболевания печени, но предлагают грубую оценку состояния печени или помогают распознать заболевания, которые либо имитируют клинические признаки заболевания печени, либо фактически вызывают вторичное заболевание печени.Минимальная биохимическая база данных сыворотки включает АЛТ, АСТ, ЩФ, ГГТ, АМК, креатинин, общий билирубин, общий белок, глюкозу, альбумин, глобулин и холестерин при подозрении на поражение печени [1].
2.1.3. Общий анализ мочи и фекалий
Анализ мочи дает быструю и ценную информацию о мочевыводящих путях и других системах организма, включая печень. Часто требуется полный анализ мочи (включая индикаторную полоску, удельный вес (SG) и исследование осадка), даже если одна из частей не показывает отклонений от нормы [2].Однако для получения максимальной пользы от анализа мочи часто требуется сопутствующий биохимический анализ сыворотки. Определенное изменение внешнего вида кала при гепатобилиарных поражениях. Таким образом, необходимо провести анализ образца фекалий, хотя он редко дает полезную информацию при оценке собаки с подозрением на поражение гепатобилиарной системы.
2.1.4. Абдоминоцентез
Анализ выделений из брюшной полости — важный компонент диагностики. Это может помочь либо в своевременном выявлении патологического процесса, ответственного за накопление жидкости, либо в указании дальнейших исследовательских процедур, которые могут быть полезны при диагностике поражения [4].Абдоминоцентез может выполняться в положении пациента стоя или в положении лежа на левом боку либо с помощью слепого чрескожного абдоминоцентеза, либо с помощью абдоминоцентеза под контролем УЗИ (Рисунки 1 и 2). Полученный таким образом абдоминальный выпот анализируют путем макроскопического исследования, цитологического исследования и микробиологического исследования. Кроме того, также оценивается общая концентрация белка и общее количество ядерных клеток [2]. Затем анализируемый выпот классифицируется как транссудат, модифицированный транссудат или экссудат (рис. 3).
2.1.5. Тесты на коагуляцию
Печень играет центральную роль в свертывающей и фибринолитической системах, и незначительные отклонения могут быть обнаружены путем анализа активности отдельных факторов. Хотя кровоточащий диатез можно ожидать, если в анамнезе имеется желудочно-кишечное кровотечение, всегда следует подозревать скрытую тенденцию, и перед выполнением биопсии печени необходимо определить профиль свертывания крови [3]. Профиль коагуляции должен включать оценку времени кровотечения из слизистой оболочки рта, времени свертывания цельной крови, одноэтапного протромбинового времени (OSPT или PT) и активированного частичного тромбопластинового времени (aPTT).В связи с этим следует также провести оценку продуктов деградации фибрина (FDP), D-димеров и витамина K [2].
2.1.6. Тесты динамической функции печени
Эти тесты могут быть очень полезны при диагностике поражений печени, за исключением пациентов с желтухой. Эти тесты основаны на анализе парных образцов крови для оценки способности печени выводить из кровотока эндогенные (желчные кислоты и аммиак) или экзогенные (бромсульфалеин и индоцианиновый зеленый) вещества [2].Нарушение клиренса предполагает гепатоцеллюлярную дисфункцию и / или портосистемное шунтирование, но не определяет причину. Поэтому требуются дополнительные исследования, включая портовенографию, ультрасонографию и биопсию печени [2].
2.2. Рентгенография
Обзорные рентгенограммы брюшной полости (боковой и вентродорсальный вид) полезны для оценки морфологических аномалий размера, формы, положения и плотности (минерализация / рентгенопрозрачность) печени и наличия абдоминального выпота.Однако отсутствие контраста брюшной полости и нечувствительность к обнаружению незначительных изменений ограничивают точность рентгенографии брюшной полости. Трудно оценить всю печень, поскольку большая часть печени вырисовывается в виде диафрагмы, желудка и правой почки [5]. Капноперитонеография, специальная рентгенографическая процедура с контрастированием, улучшает визуализацию внутренних органов брюшной полости в целом и очень полезна при оценке долей печени и ее границ, особенно диафрагмальной границы [6, 7] (Рисунки 4 и 5).При подозрении на неоплазию печени также желательны снимки грудной клетки для оценки легочных метастазов.
В дополнение к этим процедурам для оценки кровотока в печени легко выполняются интраоперационная брыжеечная портография под лапароскопическим контролем (рисунки 6, 7 и 8) и / или чрескожная спленопортография под контролем УЗИ (рисунки 9 и 10). в клинических условиях.
2.3. Ультрасонография
Ультрасонография — отличный неинвазивный способ оценки паренхимы печени. Это особенно полезно для дифференциации очагового заболевания от диффузного, кистозного от твердого образования и обструктивной желтухи от необструктивной [5]. Показания к ультразвуковому исследованию печени обычно включают повышенный уровень ферментов печени и наличие свободного абдоминального выпота. Эта процедура также показана для определения степени абдоминальных метастазов в случае неоплазии печени и для визуализации врожденных или приобретенных портокавальных или портосистемных шунтов.Допплеровская визуализация подтверждает расположение подозрительных сосудов и направление кровотока внутри, а также может предоставить подтверждающие доказательства внутрипеченочной портальной гипертензии, позволяя оценить скорость и направление портального кровотока [2]. Кроме того, чрескожная биопсия печени под контролем ультразвука позволяет точно направить иглу для биопсии в область брюшной ткани, избегая при этом крупных сосудов, желчного пузыря и желудочно-кишечного тракта [5].
2.4. Лапароскопия
Лапароскопия предлагает огромное преимущество прямой висцеральной визуализации (трехмерной) печени и прилегающих структур, таких как поджелудочная железа и внепеченочные желчные пути.Лапароскопия может выявить очень маленькие (0,5 см или меньше) метастатические поражения, которые нелегко обнаружить с помощью других диагностических методов. Лапароскопия также может предоставить точную, окончательную и стадийную информацию, которая в противном случае была бы получена только с помощью хирургической лапаротомии. Он также обеспечивает минимально инвазивный метод получения цитологических, биопсийных и культуральных образцов из очаговых поражений печени или генерализованного патологического состояния / карциноматозного роста [3]. Видно, что лапароскопия обеспечивает лучшую биопсию тканей печени, чем любые другие традиционные чрескожные методы, особенно при малых размерах печени [1].Это также дает преимущество получения биопсии из областей, визуально менее сосудистых, а также для отслеживания степени кровотечения после биопсии [3]. Предпочтительно чрескожные методы, когда ожидается обильное кровотечение, и лапаротомия, когда ожидается замедленное заживление ран (гипоальбуминемия). Минимальная инвазивность процедуры, быстрое восстановление пациента и точность диагностики делают лапароскопию идеальной техникой по сравнению с более инвазивными процедурами. Несмотря на появление новых лабораторных тестов, методов визуализации и тонкоигольной биопсии или аспирации под контролем ультразвука, лапароскопия остается ценным инструментом при надлежащем применении в диагностическом плане.Асцит, ненормальное время свертывания крови, небольшой размер тела (<2 кг массы тела) и плохое состояние пациента - единственные относительные противопоказания к лапароскопии. Этот метод требует сильной седации или анестезии и зависит от наличия оборудования и опыта врача.
2,5. Сцинтиграфия, магнитно-резонансная томография (МРТ) и компьютерная томография
Сцинтиграфия (ядерная томография), магнитно-резонансная томография (МРТ) и компьютерная томография в последнее время используются для диагностики гепатобилиарных поражений, но потребность в радиоизотопах и дорогостоящем оборудовании осталась ограничили их использование учебными заведениями развитых стран.Из этих трех методов визуализации сцинтиграфия была тщательно изучена для диагностики гепатобилиарных поражений у собак [2]. В нем используется изотоп технеций 99 m (), который включен в специальный радиофармацевтический препарат для запланированного исследования. После внутривенной инъекции радиофармпрепарата последовательно в течение 3 часов делают сцинтиграфические изображения, чтобы определить, был ли изотоп поглощен печенью, выведен ли он в желчные пути и выведен в кишечник.У собак с обструкцией внепеченочных желчных протоков радиофармпрепараты не обнаруживаются в желчном пузыре или кишечнике. Еще одно применение сцинтиграфии используется для диагностики ПСС у собак.
2.6. Биопсия печени и гистопатологическое исследование
Биопсия печени часто требуется для точной характеристики характера и степени тяжести заболевания печени. Его также можно использовать для дифференциации острых и хронических заболеваний, для определения стадии опухолевого заболевания и оценки ответа на терапию.Выбор наилучшей процедуры для получения биопсии печени зависит от множества факторов, включая размер печени, наличие коагулопатии, любое очаговое или диффузное поражение, наличие обструкции желчных путей или любые другие внутрибрюшные аномалии. Выбор метода биопсии также зависит от вероятности хирургического удаления новообразования, переносимости общей анестезии, доступного оборудования и опыта клинициста [2]. Различные методы биопсии включают тонкоигольную аспирацию, слепую чрескожную игольную биопсию с использованием биопсийной иглы Tru-Cut, игольную биопсию под контролем ультразвука, биопсию иглой с замочной скважиной и биопсию под лапароскопическим контролем [8] (рисунки 11, 12, 13 и 14). .Полученные таким образом образцы биопсии подвергаются стандартной обработке и гистопатологическому исследованию для установления окончательного диагноза поражения печени.
3. Диагностические особенности / изменения при различных гепатобилиарных поражениях
Следующие собачьи гепатопатии были рассмотрены в соответствии с их распространенностью в клинической практике.
3.1. Хронический гепатит
3.1.1. Этиология
При идиопатическом хроническом гепатите вполне вероятно, что после первоначального провоцирующего повреждения гепатоцита иммунные механизмы участвуют в сохранении воспаления [8].Семейный хронический гепатит у бедлингтон-терьеров, доберманов-пинчеров, вест-хайленд-уайт-терьеров и скай-терьеров имеет наследственную (аутосомно-рецессивную) неспособность выводить медь с желчью, что связано с прогрессирующим накоплением меди в печени и хроническим заболеванием печени [9]. Хронический прием лекарств (средства для профилактики сердечных гельминтов, противосудорожные препараты, глюкокортикоиды и химиотерапевтические препараты) является частой причиной хронического гепатита у собак [8]. Предполагается, что латентная вирусная инфекция печени, вызванная аденовирусом собак типа I, который вызывает инфекционный гепатит собак (ICH), вызывает стойкое воспаление и, следовательно, хронический гепатит [9].Цирроз — это необратимая конечная стадия хронического поражения печени, вызванная инфекцией, гепатотоксинами (медь и противосудорожные препараты), иммунологическим поражением (хронический гепатит), хроническим холестазом и гипоксией [9]. Воспаление, регенерация и фиброз печени приводят к развитию портальной гипертензии и образованию множественных внепеченочных портосистемных шунтов, которые, в свою очередь, способствуют развитию асцита [1, 8], в то время как перигепатические изменения, такие как асцит, расширение воротной и селезеночной вены и спленомегалия, могут возникают при циррозе печени из-за портальной гипертензии [10].
3.1.2. Клинические проявления
Собаки, пораженные этим заболеванием, — это в основном взрослые люди молодого или среднего возраста любого пола с признаками гепатита разной степени тяжести. Симптомы включали летаргию, депрессию, потерю веса, рвоту и желтуху. Однако идиопатический хронический гепатит, по-видимому, наиболее высок у сук с признаками анорексии, депрессии, слабости, полиурии / полидипсии, асцита, желтухи, потери веса и рвоты [9]. Результаты физикального обследования при остром гепатите, связанном с медью, могут включать депрессию, летаргию, обезвоживание, желтуху и гепатомегалию.При терминальной стадии заболевания печени признаки включали обезвоживание, исхудание / мышечное истощение, асцит и аномальное мышление (печеночная энцефалопатия) с желтухой и непальпируемой маленькой печенью [9] (Рисунок 15).
3.1.3. Лабораторная оценка
Морфологические изменения эритроцитов, которые включают различные формы эритроцитов (пойкилоциты) с нерегулярно спекулятивными эритроцитами (акантоциты или шпоры) и клетки-мишени, считаются соответствующими хроническому гепатобилиарному заболеванию [9].Воспалительная лейкограмма также иногда наблюдается при тяжелых хронических воспалительных гепатопатиях [8]. Согласованные результаты химического анализа сыворотки включают повышенную активность ALT и ALP, отражающую продолжающееся повреждение печени и внутрипеченочный холестаз, соответственно, тогда как менее согласованные данные включают гипоальбуминемию, гиперглобулинемию и аномальный гемостаз [9]. Асцитическая жидкость, если она присутствует, обычно представляет собой транссудат или модифицированный транссудат [1].
3.1.4. Рентгенологические особенности
Рентгенологические проявления цирроза печени зависят от стадии и тяжести заболевания, и чаще всего при циррозе можно идентифицировать небольшую плотную печень с неровной узловатой поверхностью (с пневмоперитонеографом или без него) [7].Однако рентгенологически оценить уменьшенный размер печени (микропеченку) сложнее, чем гепатомегалию [11] (Рисунок 16). Выпот в брюшной полости у асцитических собак не позволяет рентгенологически исследовать печень и другие органы брюшной полости благодаря классическому виду «матового стекла» (рис. 17).
3.1.5. Ультрасонографические особенности
Ультрасонографические особенности в случаях цирроза варьируют от множественных узлов в печени (от макронодулярной регенерации), помимо гиперэхогенной паренхимы печени и уменьшения размера доли печени [12], до диффузной гиперэхогенной (яркой), но маленькой печени с расширенным желчным пузырем и неправильным контуром [13 , 14].Цирроз может быть визуализирован сонографически как повышенная эхогенность печени, сопровождающаяся менее отчетливым появлением эхогенных краев воротной вены и сниженной дистальной визуализацией. Это конкретное ультразвуковое исследование связано с повышенным ослаблением луча. На перипортальный фиброз при цирротической печени указывает аномально гетерогенная эхогенность печени, придающая ей пятнистый вид и аномально выраженные краевые эхосигналы внутрипеченочных ветвей воротной вены [15]. Повышение эхогенности печени может наблюдаться при таких болезненных состояниях, как цирроз, липидоз печени, стероидная гепатопатия, лимфосаркома, длительный холангиогепатит и некоторые токсические гепатопатии [16, 17] (Рисунки 18 и 19).
3.1.6. Гистопатологические особенности
Первичным поражением является портальное воспаление, состоящее в основном из лимфоцитов и плазматических клеток; случайные нейтрофилы и макрофаги [8]. При идиопатическом хроническом гепатите воспаление распространяется на печеночную дольку, вызывая частичный некроз гепатоцитов [9]. При семейном хроническом гепатите окрашенная H и E ткань печени обнаруживает темные гранулы в цитоплазме гепатоцитов в центрилобулярных гепатоцитах на ранних стадиях и генерализованные на более поздних стадиях [9].Микроскопические признаки включают фиброз, регенеративные узелки и нарушение нормальной архитектуры печени.
3.2. Нецирротическая портальная гипертензия
Три необычных заболевания преимущественно молодых собак, а именно фиброз печени, идиопатический фиброз печени и первичная гипоплазия воротной вены, могут быть сгруппированы под этим названием.
3.2.1. Этиология
Портальная гипертензия может иметь предпеченочные причины, такие как тромбоз воротной вены, стеноз или сдавление увеличенными воротными лимфатическими узлами / новообразованиями.Постпеченочные причины включают сдавление печеночных вен, каудальной полой вены или поражение правых отделов сердца [18]. Портальная гипертензия может быть вторичным проявлением правосторонней застойной сердечной недостаточности, обструкции каудальной полой вены и внутрипеченочной обструкции [19].
3.2.2. Клинические проявления
Большинство пораженных собак представлены собаками молодого или среднего возраста (≤2,5 лет) любого пола с признаками печеночной недостаточности, включая летаргию, депрессию, потерю веса, желтуху и асцит [9].Аномальное мышление из-за печеночной энцефалопатии может быть менее стойким признаком этого расстройства [8].
3.2.3. Лабораторная оценка
Микроцитоз — общая черта этого заболевания. Нецирротические нарушения портальной гипертензии парадоксальным образом характеризуются аномальной активностью ферментов печени и гипербилирубинемией примерно в 50% случаев [9].
3.2.4. Рентгенологические особенности
Абдоминальный выпот препятствует рентгенологическому исследованию печени и других органов брюшной полости, поскольку асцит всегда является признаком нецирротической гипертензии [9].
3.2.5. Сонографические особенности
Портальную гипертензию трудно диагностировать с помощью стандартного ультразвукового исследования. Помимо наличия множественных портосистемных коллатеральных сосудов, асцита, спленомегалии и аномальной эхогенности печени, расширенные основные портальные и внепеченочные воротные вены являются ассоциированными признаками портальной гипертензии [20]. Ультрасонография — эффективный инструмент для оценки наличия портальной гипертензии и оценки ее эффектов [18] (рисунки 20 и 21).
3.2.6. Гистопатологические особенности
Результаты биопсии печени и гистопатологические исследования могут варьироваться от незначительных до минимальных воспалительных изменений при нарушениях нецирротической портальной гипертензии [9].
3.3. Врожденные портоваскулярные аномалии
3.3.1. Этиология
Наиболее частыми паттернами портоваскулярной аномалии являются одинарные внепеченочные коммуникации между воротной веной или одной из брыжеечных вен и каудальной полой веной или непарной веной у собак мелких пород и открытым венозным протоком у собак крупных пород [9] .Гипоплазия или аплазия внутрипеченочной портальной сосудистой сети может осложнить любую из этих аномалий, но это случается редко.
3.3.2. Клинические проявления
Возраст заболевших собак любого пола составляет от 2 месяцев до 8 лет; большинство из них появляются в возрасте до 1 года. Общие клинические признаки у собак с единичным внутрипеченочным или внепеченочным PSS — это признаки печеночной энцефалопатии, не всегда связанные с приемом пищи и / или желудочно-кишечными расстройствами, такими как рвота, диарея или пика [9].Жалобы на полиурию и полидипсию, уратный уролитиаз и непереносимость анестетиков или седативных средств. Результаты физикального обследования включают малый размер, плохую шерсть и иногда увеличение почек [8]. Асцит наблюдается у собак с внутрипеченочной артериовенозной фистулой. Клинические данные при неосложненных врожденных или приобретенных портосистемных шунтах ничем не примечательны, за исключением небольшого размера тела или потери веса, тогда как асцит и непрерывный шум в области печени являются постоянным признаком печеночных артериовенозных свищей / вторичных портосистемных шунтов [9].
3.3.3. Лабораторная оценка
Клинико-патологические находки у более чем 50% пораженных собак, независимо от типа сосудистой аномалии, включают микроцитоз, гипоальбуминемию, умеренное повышение активности АЛТ и ЩФ в сыворотке, гипохолестеринемию, низкое содержание АМК, гипераммониемию после заражения и нормальную или высокий уровень постпрандиального уровня SBA [9].
3.3.4. Рентгенологические особенности
Печень небольшого размера является частым рентгенологическим признаком любого типа сосудистой аномалии [8].Для подтверждения местоположения аномального сосуда могут потребоваться комбинации ультразвукового исследования, трансколонической сцинтиграфии или контрастной портальной венографии [9].
3.3.5. Ультрасонографические характеристики
Обычное УЗИ брюшной полости собак с портоваскулярными аномалиями может выявить внутрипеченочные и внепеченочные шунты с уменьшенным объемом печени и мочевыми камнями [8]. Заметно увеличенная и аномально изменяющаяся скорость портального кровотока с ослабленными внутрипеченочными воротными сосудами и локализованное расширение внутрипеченочной воротной вены (ПВ) в месте сообщения с каудальной полой веной (CVC) могут быть обнаружены при врожденных внутрипеченочных портосистемных шунтах.В то время как при врожденном внепеченочном шунте портозигот шунтирующий сосуд проходит примерно параллельно и слева от брюшной каудальной полой вены и может прослеживаться до диафрагмы, не сообщаясь с каудальной полой веной [21].
3.3.6. Гистопатологические особенности
Биопсия печени наиболее часто выявляет атрофию гепатоцитов с небольшими воротными венами или их отсутствием. Могут наблюдаться разной степени застоя синусоид, гиперплазия желчных путей, пролиферация артериол, липогранулемы и увеличение перипортальной соединительной ткани [8, 9].
3.4. Острая печеночная недостаточность
3.4.1. Этиология
Причины острой печеночной недостаточности у собак включают гепатотоксины, инфекционные и паразитарные агенты, а также различные заболевания [8]. Определенным токсинам окружающей среды (пестицидам, гербицидам, чистящим средствам и токсинам растений) присуща способность вызывать повреждение печени либо прямым гепатоцеллюлярным повреждением, либо нарушением гепатоцеллюлярного гомеостаза, что приводит к гибели клеток [9]. В дополнение к этому, некоторые противомикробные препараты (кетоконазол и триметоприм-сульфамид), антигельминты (мебендазол, диэтилкарбамазин-оксибендазол и тиацетарсамид), ингаляционные анестетики (галотан и метоксифлуран), а также анальгетики (ацетилсалициловая кислота), нафилапенон быть гепатотоксичным у собак [8, 9].Различные инфекционные причины острой печеночной недостаточности включают лептоспироз, токсоплазмоз, гистоплазмоз и инфекционный гепатит собак. Кроме того, другие системные состояния, такие как иммуноопосредованная гемолитическая анемия, хирургическая гипотензия, гипоксия, шок, острый панкреатит и внепеченочные бактериальные инфекции (пневмония, пиометра, перитонит и абсцессы) также могут вызывать тяжелое повреждение печени [8].
3.4.2. Клинические проявления
Пищевой статус и пол являются важными факторами хозяина, при этом самки более подвержены токсическому поражению печени, чем самцы [9].Доза, продолжительность воздействия и химический состав агента влияют на то, как токсичность выражается хозяином. Клинические признаки и клинико-патологические особенности острой токсической гепатопатии не отличаются от других гепатопатий, за исключением начала и, возможно, степени тяжести. Рвота — постоянный признак острой токсической гепатопатии. Гепатодиния является признаком любого острого повреждения печени, тогда как лихорадка и острая боль в животе являются признаками острого панкреатита, холангиогепатита и абсцесса печени [8, 9].Лихорадка может быть связана с инфекционными причинами поражения печени, такими как лептоспироз, ВЧГ, бактериальный холангиогепатит, абсцесс печени, системные микозы и внепеченочные инфекции [8].
3.4.3. Лабораторное исследование
Воспалительный общий анализ крови при острой печеночной недостаточности может указывать на острый панкреатит или основное инфекционное заболевание. Результаты клинико-патологических тестов типичны для легкого, умеренного или тяжелого гепатоцеллюлярного повреждения, о чем свидетельствует высокая активность АЛТ в сыворотке и переменное повышение активности ЩФ [8].Другие возможные находки включают гипербилирубинемию, повышенную концентрацию SBA, гипогликемию, гипераммониемию и коагулопатию. Биохимические признаки сопутствующей почечной недостаточности могут присутствовать при острой печеночной недостаточности как следствие воздействия гепатотоксинов (например, тиацетарсамида и ингаляционных анестетиков) и инфекционных агентов (например, лептоспироза) [9].
3.4.4. Рентгенологические особенности
Рентгенологическое исследование может быть без особенностей или может выявить гепатомегалию. Массивный некроз печени, вызывающий коллапс паренхимы печени и рентгенологическое выявление микропеченки, хотя и возможно, менее согласуется с острым повреждением печени [9].
3.4.5. Ультрасонографические особенности
Острая печеночная недостаточность может характеризоваться гепатомегалией с нормальной, повышенной или пониженной паренхиматозной эхогенностью наряду с диффузными паренхиматозными аномалиями, при которых дискретные границы печени не визуализируются [22]. Эхогенность паренхимы печени у собак с острой печеночной недостаточностью может варьироваться от нормальной до диффузно-пятнистой и до пониженной эхогенности [23]. Пассивный застой, наблюдаемый при остром поражении печени, является наиболее частой доброкачественной причиной диффузного снижения эхогенности печени, которое возникает в результате расширения синусоидов печени и гепатита из-за набухания гепатоцитов [24] (рис. 22).Симметричные изменения объема печени при гепатомегалии можно оценить, измерив максимальное расстояние от каудального конца печени по вентральной средней линии до диафрагмы. На сагиттальном изображении наблюдается приблизительно линейная зависимость между этим размером и массой тела [25]. Большие доли печени при гепатомегалии при остром поражении печени часто имеют закругленные края, тогда как нормальные доли печени имеют острые края [26]. Диффузная гипоэхогенная паренхима печени и округлые края печени с гепатомегалией были задокументированы при острой печеночной недостаточности как различные ультразвуковые данные, варьирующие от нормальной до диффузно пятнистой или пониженной эхогенности [23, 26] (Рисунок 23).
3.4.6. Гистопатологические особенности
Диффузный некроз печени является первичным гистологическим поражением, наиболее часто связанным с острой печеночной недостаточностью [8]. Гистопатологические поражения, описанные до сих пор при острой и подострой лекарственной гепатопатии у собак, представляют собой центрилобулярный некроз или перипортальное воспаление, каждое из которых может быть признаком других гепатопатий [9].
3.5. Заболевания желчевыводящих путей
Заболевания желчевыводящих путей включают заболевания самих желчных путей (например,g., бактериальный холецистит, холангит, холангиогепатит и некротический холецистит) и непроходимость внепеченочных желчных протоков (EBDO) у собак.
3.5.1. Этиология
Бактериальный холецистит чаще всего вызывается аэробными грамотрицательными бактериями (особенно E. coli, Klebsiella, Pseudomonas и Salmonella spp) или анаэробами ( Clostridium spp). Холелитиаз может предрасполагать к холециститу, закупоривая пузырный проток, вызывая чрезмерное растяжение желчного пузыря и застой, что способствует размножению анаэробных организмов [8].Причина спонтанного холелитиаза, хотя и не может быть определена, требует начального образования очага, удержания частиц в желчном пузыре, а затем устойчивого роста холелита [9]. Обструкция внепеченочных желчных протоков может быть результатом внепросветных компрессионных причин (например, неоплазия, стриктура, диафрагмальная грыжа и врожденные аномалии внепеченочных желчных путей) и внутрипросветных обструктивных причин (например, холелитиаз, сгущение желчи и печеночные сосальщики) [27 ].Холангиогепатит и холецистит чаще всего связаны с восходящей инфекцией [1]. Холецистит как генерализованное утолщение стенки желчного пузыря ассоциируется с острым пиелонефритом, портальной гипертензией, хроническими заболеваниями почек и гепатитом [24]. Ил желчных путей, который считается предшественником холецистолитиаза у людей, часто обнаруживается случайно у собак, и его причина и клиническое значение до конца не изучены [28, 29].
3.5.2. Клинические проявления
Клинические признаки холецистита включают анорексию, летаргию, лихорадку, боль в животе, рвоту, диарею и септический шок вследствие септического желчного перитонита после острого разрыва желчного пузыря.У собак с желчекаменной болезнью часто отсутствуют симптомы, а клинические признаки (желтуха, анорексия, потеря веса, рвота и обезвоживание) наиболее вероятны, когда желчекаменная болезнь осложняется бактериальной инфекцией, EBDO, перфорацией желчного пузыря или желчных протоков [8]. Независимо от основного заболевания, типичными клиническими признаками непроходимости желчных путей являются желтуха, острая или хроническая рвота, анорексия, депрессия, потеря веса, диарея, ахолический кал, чрезмерное кровотечение и иногда неопределенная боль в области черепа в животе [9].Результаты физикального обследования могут выявить лихорадку, дискомфорт в области черепа в животе, желтуху, гепатомегалию из-за нагрубания желчи, вздутие живота и шок. Чрезмерное кровотечение и ахолический кал указывают на хроническую и полную непроходимость общего желчного протока [9].
3.5.3. Лабораторное исследование
При общем анализе крови часто встречаются легкая нейтрофилия и легкая нерегенеративная анемия. Нейтрофилия со смещением влево предполагает возможность острого панкреатита или абсцесса, бактериального холангита / холецистита или разрыва желчевыводящих путей [8, 9].Результаты химического анализа сыворотки показывают заметно повышенную активность ALP и GGT, холестерина, желчных кислот и билирубина. Анализ мочи показывает билирубинурию и отсутствие уробилиногена. При мальабсорбции витамина К обнаруживается увеличение ПВ, АЧТВ и активированного времени свертывания.
3.5.4. Рентгенологические особенности
Рентгенологические результаты зависят от первопричины обструкции и могут включать холелитиаз с рентгеноконтрастной плотностью в области желчного пузыря или желчного протока, эмфизематозный холецистит, панкреатит и массовые поражения [8].Микропеченку можно оценить рентгенологически, если хроническая обструкция желчных путей у собак приводит к билиарному циррозу [8, 9]. При септическом желчном перитоните может наблюдаться полная потеря деталей живота [9]. Рентгенологически холелиты можно распознать как дискретные округлые рентгеноконтрастные образования в правой вентральной тени черепа.
3.5.5. Ультрасонографические особенности
Стенка желчного пузыря из-за холецистита выглядит утолщенной из-за визуализации как внутренней, так и внешней стенок и воспринимается как эффект двойного ободка [30].Сообщалось также об эффекте двойного ободка стенки желчного пузыря при холецистите [26]. Гиперэхогенная утолщенная стенка ГБ с эхогенной желчью и желчным илом были признаками, связанными с холециститом [31]. Сонографически холецистит характеризуется гиперэхогенной стенкой желчного пузыря толщиной более или равной 3 мм [32] и может иметь толщину более 4 мм в случае неоплазии [33] (рисунки 24 и 25). При холецистите воспалительного происхождения утолщенная стенка желчного пузыря может быть изоэхогенной паренхиме печени [33].
Холелиты наблюдались как эхогенные / гиперэхогенные очаги в зависимом просвете желчного пузыря с некоторой степенью акустического затенения [16, 34] (Рисунок 26).
3.5.6. Гистопатологические особенности
Гистопатологические изменения желчного пузыря, желчных протоков и печени могут отсутствовать при неосложненном холелитиазе. Однако нередки легкие холангиты и холециститы [8].
3.6. Гепатобилиарная неоплазия
3.6.1. Этиология
Причина естественных первичных новообразований печени у собак неизвестна. Возможные причины очагового увеличения печени включают кисты, гранулемы, абсцессы, новообразования, регенеративные узелки, гематомы и, в редких случаях, перекрут доли печени [7]. Некистозные полостные поражения описываются как смешанные области анэхогенного, гипоэхогенного и гиперэхогенного характера, возникающие в результате неоплазии [35]. Эти некистозные полостные поражения могут также возникать в результате накопления крови, некротической жидкости или клеточного дебриса, содержащегося в гематомах, узловой гиперплазии или больших неопластических массах [36].Сообщалось об инвазивности гепатоцеллюлярной карциномы и холангиоцеллюлярной карциномы с их рентгенографической оценкой как гепатомегалия [7], тогда как воспалительные заболевания или неоплазия, венозный застой в печени, жировая инфильтрация, холестаз, цирроз, инфильтративные заболевания (амилоидоз или липидоз) и болезни накопления описаны как потенциальные причины диффузной гепатомегалии [11]. Неоплазия печени может привести к симметричной гепатомегалии у 25% больных собак [37].
3.6.2. Клинические проявления
Наиболее стойкими признаками являются анорексия, летаргия, потеря веса, рвота, вздутие живота, полиурия / полидипсия, желтуха, диарея и чрезмерное кровотечение. Возможные находки при гепатобилиарной неоплазии могут включать образование в черепе брюшной полости и гепатомегалию с гепатодинией, бледностью, желтухой и кахексией [8, 9] (Рисунок 27).
3.6.3. Лабораторная оценка
Возможные гематологические находки при неоплазии печени включают анемию (нерегенеративную / регенеративную) и лейкоцитоз, тогда как биохимические показатели могут быть вариабельными и неспецифическими для заболевания печени [9].Повышение АЛТ и ЩФ обычно бывает от слабого до заметного, но может быть нормальным, особенно при метастатических опухолях [8]. Другие данные включают гипербилирубинемию, гипоальбуминемию, гиперглобулинемию, повышенную концентрацию SBA, длительную задержку красителя BSP и аномальные тесты коагуляции [9].
3.6.4. Рентгенологические особенности
Неравномерный силуэт печени был задокументирован как рентгенологический признак узловой гиперплазии [7], тогда как очаговое увеличение печени может быть обнаружено по выпуклости или изменению края печени или локализованному смещению глазного дна, тела желудка, привратника и пр. правая почка, дуоденальный изгиб черепа, поперечная ободочная кишка и головка селезенки или диафрагмы [16].Увеличение доли печени смещает тело и пилорические области желудка дорсально и влево [38] (Рисунок 28).
Тяжелая диффузная гепатомегалия может быть легко продемонстрирована на боковых рентгенографических проекциях как значительная часть каудального края печени, выступающая за реберную дугу, вместе с закруглением каудальных краев печени. Об этом также может свидетельствовать каудодорсальное смещение желудка в боковой проекции и каудально влево в вентродорсальной проекции [7].Гепатомегалия может быть рентгенологически подтверждена увеличением расстояния между желудком и диафрагмой или каудальным смещением и вентральным покрытием правой почки печенью [39]. Гепатомегалия является надежным рентгенологическим признаком заболевания печени, которое может быть диффузным, с равномерным увеличением всех долей или очаговым, с увеличением только одной доли [11] (Рисунок 29).
3.6.5. Сонографические особенности
Фокальные узелковые поражения гиперплазии были задокументированы как четко определенные твердые образования, имеющие переменную, часто более высокую эхогенность, чем нормальная паренхима печени, и центральная высокоэхогенная область.Лимфосаркома печени может быть сонографически охарактеризована как диффузная, пониженная или повышенная эхогенность в нормальной или увеличенной печени [40]. Лимфосаркома печени может также наблюдаться в виде мультифокальных плохо очерченных гипоэхогенных участков или хорошо очерченных гипоэхогенных узелков, окруженных гиперэхогенными участками (целевые поражения) [41]. Лимфома печени сонографически характеризуется снижением эхогенности печени у собак [22], тогда как единичная гиперэхогенная масса описывается как наиболее частое проявление гепатоцеллюлярной карциномы собак [42].Первичная неоплазия печени имеет вариабельный сонографический вид, варьирующийся от очень большой, умеренно ограниченной, инфильтрирующей массы, выступающей за пределы нормальных границ печени, с эхогенностью, немного более смешанной, чем у нормальной печени [43]. Ультрасонография чувствительна при обнаружении небольших очаговых поражений, хотя поражения менее 2 см трудно идентифицировать с помощью этого метода визуализации. Это также не так полезно, если поражение меньше 2 см в диаметре и изоэхогенно с нормальной тканью [24] (рисунки 30, 31 и 32).
Некистозные полостные поражения (например, абсцессы, гематомы, узловая гиперплазия печени и кавитированные новообразования) задокументированы как смешанные или сложные эхогенные структуры с хорошо или плохо очерченными границами [36]. Неровные, плохо очерченные границы в таких поражениях приводят к затемнению краев, которое менее очевидно, чем при четко очерченных кистах (Рисунки 33, 34 и 35).
3,6.6. Лапароскопические особенности
Лапароскопия обеспечивает прямую визуализацию и извлечение ценной информации относительно состояния тканей и степени распространения поражений при визуализации опухолей печени, некроза печени, атрофии селезенки и поджелудочной железы, адгезии гепатофренов, неоплазии кишечника и пиометрита [ 44]. Диагностическая точность лапароскопии огромна, и она позволяет легко визуализировать метастатические образования / образования размером от 0,5 см или меньше, которые нелегко обнаружить другими диагностическими методами [3] (рис. 36).
3.6.7. Гистопатологические особенности
Наиболее распространенными типами первичного рака печени, о которых сообщают у кобелей, являются гепатоцеллюлярная карцинома и внутрипеченочная холангиоцеллюлярная карцинома (желчные протоки) у сук. Гепатоцеллюлярная аденома реже встречается у представителей обоих полов [9]. Метастазы в печень гематогенным путем из отдаленных мест гораздо чаще возникают из-за аденокарциномы желудочно-кишечного тракта, поджелудочной железы и молочной железы, а также из гемангиосаркомы [9].Поражение печени также часто встречается у собак с лимфомой.
4. Заключение
Поскольку печень физиологически и анатомически разнообразна, не существует единого теста, который адекватно идентифицирует заболевание печени или его основную причину. По этой причине для диагностики гепатобилиарных поражений необходимо использовать серию тестов. Разумный пакет скрининговых тестов, рекомендуемых для животного с подозрением на гепатобилиарную болезнь, включает полный анализ крови (CBC), биохимический профиль сыворотки, общий анализ мочи, фекальный анализ, обзорную рентгенографию и ультразвуковое исследование.Полученное таким образом первичное показание может свидетельствовать о наличии гепатобилиарной болезни, что может быть подтверждено другими, более специфическими тестами, включая расширенные процедуры диагностической визуализации. Потребность в других лабораторных исследованиях, то есть абдоминоцентезе, профиле коагуляции, оценке концентрации аммиака в плазме натощак и т. Д., Определяется анамнезом каждого животного и результатами физикального обследования. Окончательный диагноз гепатобилиарного поражения должен быть подтвержден биопсией печени и гистопатологическим исследованием.
Визуализация печени Артикул
Введение
Поражения печени имеют широкий спектр патологий, начиная от доброкачественных поражений печени, таких как гемангиомы, до злокачественных поражений, таких как первичная гепатоцеллюлярная карцинома и метастазы. Визуализация является решающим шагом в диагностике этих состояний, поскольку уровень ферментов печени может повышаться у 8% людей в США. В большинстве этих случаев диагноз может быть поставлен с помощью комбинации анамнеза, серологического и радиологического исследований.[1] Поражения печени можно разделить на очаговые и диффузные.
Очаговые поражения печени можно подразделить на три основные клинические категории.
- Доброкачественные образования, не требующие лечения, если они бессимптомны, включая гемангиому печени, очаговую узловую гиперплазию и доброкачественные кисты печени
- Доброкачественные образования, требующие лечения, включая аденому печени, абсцесс печени и аденоматоз
- Злокачественные образования, включая гепатоцеллюлярную карциному, холангиокарциному, ангиосаркому печени и метастазы в печени
Диффузные поражения печени можно разделить на сосудистые, воспалительные и накопительные заболевания.
Доброкачественные поражения печени можно разделить на 3 категории в зависимости от их происхождения:
Холангиоцеллярные: киста печени, билиарная цистаденома, внутрипротоковое папиллярное новообразование желчных протоков, перибилиарная киста, внутрипеченочная узловатая желчная аденома
гиперплазия, аденома печени
Мезенхимальная: гемангиома, липома
Ультразвуковое исследование печени (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ) являются основными методами визуализации для диагностики поражений печени.Пост-внутривенная (IV) контрастная визуализация имеет уникальные особенности в печени, потому что печень имеет три различных фазы: артериальную фазу, портальную венозную фазу и венозную фазу. УЗИ может быть методом выбора в качестве метода скрининга, а мультидетекторная КТ с контрастным усилением (МДКТ) — в качестве метода выбора в большинстве визуализаций печени.
Анатомия
Наиболее широко используемой анатомической классификацией сегментов печени является классификация Куино, которая описывает восемь функционально независимых сегментов печени на основе васкуляризации, распределения желчных протоков и лимфодренажа.Каждый сегмент клиновидный, вершина направлена к воротам печени. Единственная ветвь печеночной артерии, воротной вены и желчного протока входит через верхушку в сегменты печени. Печеночная вена проходит между двумя соседними сегментами и впадает в нижнюю полую вену (НПВ). Средняя печеночная вена, которая проходит от нижней полой вены до ямки желчного пузыря, разделяет печень на правую и левую доли. Правая печеночная вена разделяет правую долю на передний и задний сегменты, а серповидная связка разделяет левую долю на медиальный и латеральный сегменты.Портальная вена делила каждую I по горизонтали на верхний и нижний сегменты. Сегмент I — это хвостатая доля, которая имеет специфические особенности, включая возможность получать двойное кровоснабжение из правой и левой воротной вены и дренировать непосредственно в НПВ. Сегменты II, III и IV — это левые секции. Сегменты V, VI, VII и VIII составляют правую часть печени.
Печеночное кровоснабжение осуществляется из воротной вены (около двух третей), а остальное — из печеночной артерии; таким образом, максимальное улучшение функции печени достигается во время фазы воротной вены, которая составляет от 60 до 120 секунд после усиления артериальной фазы.Опухоли, которые получают питание из печеночной артерии, будут усиливаться во время артериальной фазы, что было принципом при разработке трансартериальной химиоэмболизации и химиоэмболизации. Артериальная эмболизация и лечение нацелены на опухоли, а не на нормальные клетки печени [2].
Печеночные вены входят в нижнюю полую вену и могут быть видны как эхопрозрачные трубки с тонкими стенками. Портальная триада, включающая воротные вены, печеночные артерии и желчные протоки, окружена фибро-жировой тканью и может рассматриваться как эхогенные очаги по всей печени.
Воротная вена образуется от соединения верхней брыжеечной артерии и селезеночной вены за шейкой поджелудочной железы. Нижняя брыжеечная вена, желудочные и кистозные вены впадают в воротную вену. Он делится на правую печеночную вену и hepatis. Хотя воротная вена обеспечивает 75% кровоснабжения печени, она обеспечивает 50% снабжения печени кислородом. Портальная гипертензия или градиент печеночного венозного давления определяется как градиент портосистемного давления. Портальную гипертензию могут вызывать различные патологии, включая тромбоз воротной вены, цирроз, вирусный гепатит, синдром Бадда-Киари и застойную сердечную недостаточность.Проявления портальной гипертензии на УЗИ включают расширение воротной вены (> 13 мм), расширение селезеночной и верхней брыжеечных вен, наличие коллатеральных сосудов между воротными и системными путями, спленомегалию, асцит и наличие двухфазного или обратного кровотока (гепатофугальный) в Допплер-УЗИ, который является диагностическим и патогномоничным для портальной гипертензии. Портальную гипертензию можно оценить на КТ и МРТ с аналогичными проявлениями в США и наличием контраста в околопупочной вене, что является патогномоничным.
Гепатомегалия и цирроз печени — две основные патологии, искажающие анатомию печени. Заболевания сердца, включая застойную сердечную недостаточность, рестриктивную кардиомиопатию и заболевание правого клапана, могут вызывать гепатомегалию и расширение печеночных вен, что называется пассивным застоем в печени. Это происходит из-за нарушения оттока печеночных вен и застоя крови в паренхиме печени. УЗИ-проявлениями пассивного застоя печени являются увеличение правой доли печени, нижняя полая вена и увеличение печеночной вены.Изменения в печеночной вене и скорости движения НПВ можно оценить по цветному допплеровскому УЗИ с потерей нормального трехфазного кровотока и сглаживанием формы волны в печеночных венах. Застойная правосторонняя сердечная недостаточность также может вызвать безболезненное диффузное утолщение стенок желчного пузыря. Наиболее распространенной этиологией цирроза печени является алкоголь, за которым следуют вирусный гепатит, криптогенная инфекция, патологии сосудов и нарушения обмена веществ. Наиболее частыми изменениями при УЗИ при циррозе печени являются появление узловатости на поверхности, неоднородная эхотекстура, относительное увеличение хвостатой доли по сравнению с правой долей и атрофия медиального сегмента левой доли.Наличие изменений изображения портальной гипертензии увеличивает чувствительность и специфичность цирроза на основе изменений УЗИ, но обычно это происходит на поздних и поздних стадиях цирроза [1].
Обычные пленки
Обычные снимки редко используются при оценке патологии печени, за исключением гепатомегалии, когда тень печени выходит за пределы тени правой почки.
Компьютерная томография
КТ печени может выполняться с помощью различных протоколов, включая неусиленный, однофазный, двухфазный и трехфазный с усиленным контрастом.Каждый из этих протоколов КТ печени важен для оценки различных патологий печени. Однофазная КТ с усиленным контрастом обычно является методом выбора в фазе воротной вены при КТ, которая обычно длится 70 секунд после внутривенной (IV) инъекции контрастного вещества, и печень имеет максимальное усиление. Он может предоставить информацию в основном о диффузных патологиях печени, например, о циррозе печени и гиповаскулярных метастатических заболеваниях печени. Двухфазная КТ с усилением контраста является основным методом визуализации, проводимым в фазе воротной вены и поздней артериальной фазе, которая может быть получена примерно через 35 секунд после внутривенной инъекции и может предоставить более точную информацию о гиперваскулярных поражениях.[3] Этот протокол может быть полезен при гиперваскулярных метастатических поражениях, таких как почечно-клеточная карцинома, рак груди, меланома и эндокринные опухоли, а также для предоперационной оценки частичной резекции печени. Он может предоставить хирургу информацию об анатомии печени и ее сосудистой сети. Трехфазная КТ с контрастным усилением — это неусиленная артериальная и портальная венозная фазы или артериальная, венозная и отсроченная фаза. Усиление артериальной фазы начинается примерно через 20-25 секунд после внутривенного введения контрастного вещества.На этой стадии можно оценить гиперсосудистые патологии, как и большинство доброкачественных и злокачественных поражений печени. Трехфазные протоколы обычно используются у пациентов с возможным циррозом и гепатоцеллюлярной карциномой (ГЦК). ГЦК — это гиперваскулярное поражение, которое усиливается во время артериальной фазы и быстро вымывается во время портальной венозной фазы. Холангиокарцинома — одна из патологий печени, которую можно лучше оценить при трехфазной КТ, с неусиленной, портальной венозной фазой и отсроченной фазой (от 10 до 15 минут) за счет гиперусиления на отсроченной фазе из-за наличия большого количества фиброзной ткани.
Жировая болезнь печени — распространенное заболевание, которое может проявляться по-разному. Из-за его серьезных и серьезных последствий в течение длительного времени, подробное описание жировых изменений рентгенологами важно. Шесть основных важных паттернов жировой инфильтрации печени: диффузная, очаговая, географическая, субкапсулярная, мультифокальная и периваскулярная. Жировые изменения печени — это гиперэхогенные поражения по сравнению с селезенкой и корой почек. Стеатоз печени, диффузный или очаговый, лучше всего оценивать на неконтрастной компьютерной томографии брюшной полости.При стеатозе печени при неконтрастном исследовании печень измеряет как минимум на 10 единиц Хаунсфилда (HU) меньше, чем селезенка. На КТ с контрастированием печень и селезенка имеют разные скорости поглощения контраста. В портальной венозной фазе снижение плотности в печени на 25 HU меньше, чем в селезенке, свидетельствует о стеатозе. Жировую болезнь печени на МРТ можно определить по падению сигнала в сдвинутых по фазе Т1-взвешенных изображениях с градиентным эхом по сравнению с синфазными.
Диффузная жировая дистрофия печени — наиболее частая форма стеатоза печени.Тяжесть поражения может быть описана в США как легкая, умеренная, тяжелая и измеряется количественно с помощью МРТ, как наиболее точного неинвазивного метода. Диффузный стеатоз с гепатомегалией и повышенное соотношение хвостовой и правой долей увеличивают вероятность неалкогольного стеатогепатита (НАСГ). Очаговый стеатоз печени может иметь такие же визуальные характеристики, что и некоторые доброкачественные и злокачественные поражения печени, при дифференцировании которых может помочь МРТ. Области в печени, которые более подвержены фокальному стеатозу печени, — это перивезикулярные и субкапсулярные области, прилегающие к воротам печени или серповидной связке, которые являются теми же областями для очаговой защиты печени при диффузной жировой инфильтрации в результате изменения внутрипеченочного кровотока с аберрантным венозная система и отсутствие портального притока.Географическая жировая болезнь печени может быть вторичной по отношению к паренхиматозной болезни, такой как холангит, или поражение правой доли печени может быть связано с питанием этой части печени верхней брыжеечной веной, которая имеет липогенные материалы из желудочно-кишечного тракта. Субкапсулярное отложение жира может наблюдаться у пациентов с инсулинозависимым диабетом из-за накопления жира в субкапсулярной области, вторичного по отношению к более высокой концентрации инсулина. Мультифокальное отложение жира может напоминать метастазы, абсцессы, лимфому, саркоидоз и гемангиоматоз в США и КТ, но МРТ может дифференцировать присутствие жира с падением сигнала на несфазовых изображениях.Отложение жира вокруг воротной вены и / или печеночной вены может иметь такие же характерные особенности при УЗИ и КТ, что и синдром Бадда-Киари, перипортальный отек, а МРТ может отличать отложение жира от других патологий.
КТ без контрастирования может быть полезен для оценки и обнаружения отложений железа и кальция в печени. Амилоидоз и болезнь Вильсона в основном имеют неспецифические особенности визуализации печени. Амилоидоз, аномальное отложение амилоидных фибрилл, может иметь неспецифические визуальные проявления печени, такие как диффузная гепатомегалия или диффузные или очаговые области гипоаттенуации, гетерогенного внешнего вида или перипортального поражения.[4] Болезнь Вильсона — аутосомно-рецессивное заболевание, которое вызывает накопление меди в различных органах, таких как базальные ганглии, роговица и печень. КТ-проявлением болезни Вильсона в печени могут быть узелковые области гипертонусения в результате жировой инфильтрации и накопления меди в печени [5].
Наличие газа в воротной вене может иметь различную этиологию, и его следует дифференцировать от пневмобилии, которая является периферической в газе воротной вены по сравнению с пневмобилией, которая является центральной.Это проявляется в виде эхогенных очагов в просвете воротной вены в США и очагов низкой плотности в печени, воротной вене и ее ветвях при КТ. Пневмобилия — это наличие газа в желчном дереве, которое находится более центрально. Газ в воротной вене может быть вызван катетеризацией пупочной вены, некротическим энтероколитом, послеоперационными находками при коррекционной хирургии кишечника у детей, а также может быть связан с ишемией кишечника, воспалительным заболеванием кишечника, после эндоскопической процедуры верхних и нижних отделов брюшной полости, внутрибрюшного сепсиса у взрослых.Пневмобиллии могут наблюдаться на фоне недавно проведенного билиарного инструментария, несостоятельности сфинктера Одди, билиарно-кишечного хирургического анастомоза, спонтанной желчно-кишечной фистулы.
Абсцесс печени — это одно из кистозных поражений печени, обычно возникающее в результате инфекционного процесса в желудочно-кишечной системе, который перенес инфекцию в печень через систему воротной вены. Наиболее распространенным микроорганизмом является Escherichia coli. Визуализирующая характеристика абсцесса печени — это двойной целевой признак, представляющий собой центральную область низкого ослабления, окруженную двумя слоями колец.Внутренний слой может выглядеть как ободок с сильным затуханием с ранним и постоянным усилением контраста с задержкой, а внешний слой усиливается только в задержанной фазе. Абсцесс печени на Т2-взвешенной МРТ диагностируется по неровной стенке с поздним усилением и центральной областью гиперинтенсивности. [6] Кандидозная фунгемия — еще один инфекционный процесс, который может возникать у пациентов с ослабленным иммунитетом в результате диссеминированного кандидоза. Поражение печени и селезенки видно на КТ как множественные небольшие гипоаттенуирующие поражения, которые могут иметь усиление кольца и могут выглядеть как микроабсцессы.Хотя МРТ имеет лучшую чувствительность и специфичность, КТ используется чаще, потому что она менее дорогая и более доступная [7].
Магнитный резонанс
Магнитно-резонансная (МРТ) визуализация имеет некоторые преимущества и недостатки по сравнению с УЗИ и КТ. Отсутствие ионизирующего излучения, более высокое разрешение поперечного сечения, наличие внеклеточных и специфичных для гепатоцитов контрастных агентов, а также способность предоставлять более точную и точную информацию о диффузном поражении печени и характеристике очаговых поражений печени делают МРТ лучшим методом визуализации в визуализация печени.Но это стоит дороже, требует больше времени для получения изображений и требует терпеливого сотрудничества, такого как задержка дыхания, чтобы иметь лучше и меньше артефактов движения.
Протокол МРТ печени состоит из нескольких последовательностей до и после контрастирования. Постконтрастные фазы включают артериальную фазу, фазу воротной вены, фазу равновесия, гепатобилиарную отложенную фазу и более позднюю отложенную фазу. Контрастные вещества, специфичные для гепатобилиарной системы, которые используются при МРТ печени, — это тринатрий мангафодипира (Mn-DPDP), гадобенат димеглумин (Gd-BOPTA) и гадоксетовая кислота (Gd-EOB-DTPA).Эти контрастные вещества имеют специфические характеристики, такие как специфические рецепторы и переносчики для поглощения, различный процент выведения через желчные и почечные каналы, способ введения и побочные эффекты. Эти специфичные для гепатоцитов контрасты могут помочь идентифицировать и лучше охарактеризовать небольшое поражение печени, особенно хорошо дифференцированный ГЦК. Его можно использовать для отличия ФНГ от аденомы печени. Аденома печени видна в гепатобилиарной фазе как гипоинтенсивное поражение по сравнению с изо или гиперинтенсивным FNH, при оценке метастазов в печени, наблюдении за ГЦК и оценке после трансплантации печени.Он также может отличать опухоли гепатоцеллюлярного происхождения от опухолей негепатоцеллюлярного [8]. Контрастные вещества, которые выделяются с желчью, можно использовать для дифференциации гепатоцеллюлярной аденомы (ГКА) путем раннего гетерогенного усиления на Т1-взвешенной МРТ в артериальной фазе с подавлением жира и затем смыванием контраста в портальной венозной фазе. Поскольку ГКА не имеет желчных протоков, поглощение специфического контраста желчных путей минимально в отсроченной фазе. [9]
Самым чувствительным методом визуализации для оценки наличия и степени стеатоза печени является МРТ с градиентным повторным эхо (GRE).Однако золотым стандартом оценки наличия воспалительных и ранних фиброзных изменений является биопсия печени. [9] МР-эластография — это новый метод, первоначально представленный как эластография УЗИ, который может измерять жесткость печени и степень фиброза. МР-эластография не имеет возможной предвзятости при взятии проб, которая присутствует при биопсии печени, и имеет лучшую чувствительность и специфичность по сравнению с УЗ-эластографией, которая имеет ограничения у пациентов с ожирением и при наличии асцита.Перегрузка и накопление железа в клетках печени и клетках Купфера при гемохроматозе и гемосидерозе соответственно. Печень является основным органом отложения и может проявляться как гепатомегалия как первый признак. Его можно увидеть гипоинтенсивным по сравнению с сигналом параспинальных мышц на МРТ с взвешиванием T1 и T2 и с взвешиванием GRE T2.
Гемангиома печени является наиболее частым доброкачественным поражением печени, которое можно разделить на типичные и атипичные. Типичная гемангиома печени может быть оценена на неконтрастной КТ как гипоаттенуирующее поражение большую часть времени, на КТ с усиленным контрастом артериальной фазы как область с узловым усилением на периферии, в фазе воротной вены и замедленной фазе с непрерывным усилением периферии с заполнением центральной части контрастом.Гемангиома гипоинтенсивна при визуализации Т1 и гиперинтенсивна при визуализации Т2. Контрастное изображение Т1 с усилением гадолиния часто показывает узловое усиление периферии с прогрессирующим усилением центральной части и сохранением контраста при отложенной визуализации. Визуализация гепатобилиарного контраста Т1 неспецифична и может быть бесполезной. Две основные категории атипичной гемангиомы — это гигантская гемангиома печени и гемангиома печени с мгновенным заполнением. Гигантские гемангиомы — это поразительно большие, но неопухолевые сосудистые поражения, которые имеют радиологические проявления, аналогичные типичной гемангиоме печени.Гемангиомы печени / венозные мальформации со вспышкой наполнения имеют меньший размер (обычно менее 2 см) и гиперэхогенный вид в США. Они являются гипо- или изоплотными при неконтрактной визуализации и имеют быстрое, быстрое и однородное усиление в артериальной фазе с сохранением контраста в поздней фазе. Гемангиома с мгновенным заполнением имеет сходные визуальные проявления при CEUS и контрастной МРТ с усилением гадолиния с быстрым, однородным усилением и отсутствием вымывания на поздней стадии.
Фокальная узловая гиперплазия (ФНГ) — вторая по распространенности доброкачественная опухоль печени после гемангиомы гепатоцеллюлярного происхождения с центральным рубцом с содержанием жировой и фиброзной ткани и повышенной плотностью гепатоцитов примерно в 80% ФНГ.МРТ имеет лучшую чувствительность и специфичность в диагностике ФНГ по сравнению с КТ и УЗИ. FNH состоит из гепатоцитов, желчных протоков и клеток Купфера в аномальном расположении, ультразвуковое изображение при FNH — это очень тонкие изменения контура печени или изменение эхогенности паренхимы. FNH изо или гипоинтенсивен при визуализации без усиления T1 и имеет гомогенное усиление в артериальной фазе. FNH можно оценить на многофазной МРТ с гиперинтенсивным и отсроченным усилением на T2-взвешенных изображениях из-за сохранения контраста в гепатоцитах из-за наличия центрального рубца.[10]
Аденомы печени — это редкие доброкачественные опухоли печени гепатоцеллюлярного происхождения, чаще всего связанные с длительным использованием оральных контрацептивов. Другими факторами, которые могут вызвать аденомы печени, являются анаболические стероиды, болезни накопления гликогена, ожирение, метаболический синдром. Хотя аденомы печени являются доброкачественными опухолями печени, они имеют потенциальный риск кровотечения и злокачественного перерождения. Хирургическая резекция — это рекомендуемый метод лечения аденом печени. У пациентов, у которых резекция невозможна или нежелательна, изменение факторов риска, если таковые имеются, наблюдение с помощью визуализации и уровня альфа-фетопротеина или эмболизация печеночной артерии являются другими подходами к аденоме печени.
Киста печени — распространенное поражение печени холангиоцеллюлярного происхождения. Доброкачественные кисты печени встречаются у 5% населения. Его размер может варьироваться от микроскопического до 20 см. УЗИ может охарактеризовать кисту печени как анэхогенное поражение с тонкими стенками и наличием заднего акустического усиления, которое подтверждает жидкое содержание кисты, и очень тонкие перегородки в некоторых кистах. В КТ это можно оценить как область низкого внутреннего затухания с тонкой стенкой и возможным наличием тонких перегородок.Кисты можно оценить на МРТ как область гомогенного низкого сигнала на T1-взвешенном изображении и однородного высокого внутреннего сигнала на T2-взвешенном изображении и отсутствие контрастного усиления.
Гепатоцеллюлярная карцинома (ГЦК) — наиболее распространенная первичная опухоль печени. Цирроз и хронический гепатит являются основными факторами риска развития ГЦК. Уровень альфа-фетопротеина повышается у двух третей ГЦК. Повышенный уровень альфа-фетопротеина при циррозе указывает на ГЦК и может наблюдаться у 90% пациентов с ГЦК.В США ГЦК может проявляться иначе, чем очаговые гипоэхогенные, гиперэхогенные и гетерогенные поражения. Большинство ГЦК имеют гиперваскулярный цветовой допплерографический эффект. При УЗИ с контрастированием ГЦК можно оценить по усилению в артериальной фазе и смыванию в портальной венозной фазе. МРТ и КТ имеют чувствительность 81% и 68% при обнаружении ГЦК соответственно. При КТ картина усиления аналогична УЗИ с усилением контраста. Из-за возможного артериопортального шунта при ГЦК очаговые жировые изменения можно рассматривать как очаговое отложение жира в нормальной печени или как очаговое отложение жира вокруг ГЦК при диффузном стеатозе печени.ГЦК является следствием прогрессирования регенеративных узелков в диспластические узелки, а диспластические узелки высокой степени — в ГЦК низкой степени. Регенеративные и диспластические узелки питаются воротной веной; таким образом, они неотличимы друг от друга при визуализации, хотя диспластические узелки являются предраковыми, а регенеративные — нет. Большинство регенеративных и диспластических узелков гипоинтенсивны на T2-взвешенных изображениях и имеют переменную интенсивность на T1-взвешенных изображениях. Регенеративные узелки и диспластические узелки низкой степени выраженности одинаково интенсивны на МРТ с контрастным усилением.[11] Гепатоцеллюлярная карцинома (ГЦК) получает кровь из печеночной артерии по сравнению со здоровой печеночной тканью, которая получает кровоснабжение из воротной вены. Благодаря этой характеристике, HCC можно оценить в многофазной МРТ с контрастным усилением за счет увеличения усиления контраста в артериальной фазе и вымывания контраста в портальной фазе с усилением периферического края. ГЦК проявляется слегка гиперинтенсивной Т2-взвешенной МРТ без усиления. И печеночная артерия, и воротная вена питают холангиокарциному, поэтому усиление контрастности увеличивается как в артериальной, так и в венозной фазах.[9] [11]
Фиброламеллярная карцинома является подтипом ГЦК, но имеет лучший прогноз, более молодой возраст пациента на момент постановки диагноза и отсутствие повышения уровня альфа-фетопротеинов. Фиброламеллярный ГЦР на изображениях обычно имеет большие размеры на момент постановки диагноза и не имеет капсулы. Фиброламеллярная карцинома проявляется на Т1- и Т2-взвешенных МРТ как большая неоднородная масса с центральной гипоинтенсивностью из-за центрального фиброзного рубца. [12]
Метастатические поражения печени обычно гипоинтенсивны на Т1-взвешенных изображениях и гиперинтенсивны на Т2-взвешенных изображениях.Большинство метастатических опухолей печени являются гиповаскулярными, и фаза портальной вены — лучший временной интервал для визуализации. Некоторые метастатические опухоли, включая почечно-клеточную карциному, меланому и саркому, являются гиперваскулярными. Эти метастазы в печень лучше всего выявляются в артериальной фазе. [13]
УЗИ
Ультрасонография по-прежнему является первым методом визуализации для описания очаговых и диффузных поражений печени из-за его доступности, низкой стоимости и неинвазивности.Он может проявляться по-разному при различных патологиях печени, таких как генерализованная гипоэхогенность при остром гепатите и диффузных злокачественных образованиях, генерализованная гиперэхогенность при диффузном стеатозе печени и гиперэхогенные поражения при различных доброкачественных и злокачественных образованиях. Доброкачественные гиперэхогенные поражения включают гемангиому, аденому печени, очаговую узловую гиперплазию и любые очаговые жировые изменения. Злокачественные гиперэхогенные поражения включают метастазы в печень из колоректального, почечно-клеточного рака, меланомы и холангиокарциномы, а также ГЦК.Ультрасонография имеет некоторые ограничения из-за близости диафрагмы к печени, что затрудняет получение изображений всей печени, вариабельность между наблюдателями и меньшую точность у пациентов с габитусом большого тела [8].
Ультрасонография в сочетании с методами и инструментами играет важную роль в диагностике и лечении различных патологий печени, например:
- Ультразвук с цветным допплером может предоставить информацию о сосудистой сети печени; например, он может предоставить информацию о потоке и направлении воротной вены.Обычно направление потока в воротной вене — от центральной части печени к периферической части. Ретроградный кровоток от периферии к центру может указывать на цирроз печени с портальной гипертензией. Допплер-УЗИ можно использовать для оценки проходимости воротной вены перед трансплантацией, а также для оценки тромбоза печеночной артерии после трансплантации.
- Использование контрастно-усиленного УЗИ (CEUS) расширилось за последние несколько лет. CEUS требует значительного обучения, и оно очень зависит от навыков оператора.Он может иметь чувствительность 95,8% и специфичность 83,1% при диагностике очаговых поражений печени в здоровой печени. CEUS может предоставить информацию об архитектуре сосудов, наличии микроциркуляции в очаговых поражениях печени, а также злокачественной или доброкачественной природе опухолей. [14]
- Возможна чрескожная биопсия печени под контролем УЗИ или КТ. США являются методом выбора как для нефокальной биопсии печени, так и для фокальной, прицельной биопсии. Использование биопсии под контролем КТ в основном предназначено для поражений, которые не видны в США.Показаниями к очаговой биопсии печени являются неизвестные очаговые поражения печени и наличие метастазов в печени без конкретного источника. Показаниями к нефокальной биопсии печени являются стадия паренхиматозного заболевания, такого как цирроз, первичный билиарный цирроз и неалкогольная жировая болезнь печени, определение наличия отторжения после трансплантации печени, оценка болезни накопления печени и наличие аномального функционального теста печени без находка любой специфической этиологии. При коагулопатии и тяжелом асците трансъюгулярная биопсия печени является альтернативным вариантом чрескожной биопсии.
- Чрескожный дренаж под контролем УЗИ может быть полезен для дренирования любых аномальных скоплений жидкости, таких как абсцессы различной этиологии. Есть некоторые преимущества и недостатки по сравнению с чрескожным дренированием под КТ. Преимущества — отсутствие воздействия ионизирующего излучения, гибкое исследование с большим контролем над введением иглы и меньшее количество персонала, необходимого для выполнения процедуры. У него есть ограничения при глубоких поражениях, которые не видны в США, а газы кишечника могут ограничивать поле зрения.
- Эндоскопическое ультразвуковое исследование (EUS) стало диагностическим и терапевтическим методом при различных желудочно-кишечных и панкреатобилиарных заболеваниях, включая диагностику и терапевтическое применение при портальных гипертензивных заболеваниях, таких как варикоз пищевода, биопсия очаговых поражений печени под контролем EUS, доступ к воротной вене под контролем EUS, EUS- управляемая эмболизация воротной вены для индукции долевой атрофии печени и инъекция химиотерапии в воротную вену под контролем EUS. EUS имеет большую чувствительность по сравнению с визуализацией поперечного сечения при выявлении небольших поражений менее 10 мм.[15]
- Эластография на основе ультразвука — это неинвазивный метод оценки фиброза печени вместо биопсии печени и прогнозирования осложнений у пациентов с циррозом печени. Наиболее распространенными методами являются метод эластографии сдвиговой волной (SWE) и методы акустической радиационной импульсной силы. Эластография сдвиговой волной может быть выполнена несколькими методами, включая переходную эластографию, точечный SWE, двумерный (2D) -SWE. [16]
Цирротическая печень может оказаться гиперэхогенной в США.Чувствительность диагностики цирроза печени по США может варьироваться от 13% до 88%. Наличие признаков и симптомов портальной гипертензии, таких как увеличение диаметра селезенки или воротной вены на более поздних стадиях цирроза, может повысить чувствительность УЗИ. [1] Наличие гиперваскулярного узелка в CEUS имеет более высокую специфичность для небольших HCC, менее 2 см, по сравнению с исследованиями КТ и МРТ. Появление метастазов в печени во многом зависит от первичного источника опухоли. Он может проявляться в виде гипоэхогенных поражений почти в 65% метастазов или гиперэхогенных поражений.Наличие гиперэхогенного ореола указывает на злокачественное поражение. При CEUS метастазы имеют различную эхогенность в артериальной фазе, но появление вымывания в портальной фазе может быть полезно для выявления злокачественных новообразований.
Одно из важных применений УЗИ Допплера — у пациентов после трансплантации. Тромбоз печеночной артерии является наиболее частым сосудистым осложнением после трансплантации печени, и резистивный индекс (RI) является доплеровским параметром для его оценки, который измеряется путем вычитания максимальной систолической скорости из конечной диастолической скорости, деленной на максимальную систолическую скорость.Нормальный диапазон RI составляет от 0,55 до 0,8. Низкий RI более специфичен у пациентов с трансплантатом печени, что может быть связано с частичной артериальной обструкцией в проксимальной части артерии, периферическими сосудистыми шунтами и портальной гипертензией. В то время как высокий RI может быть связан с компрессией микрососудов, заболеванием или физиологией.
Гемангиома — наиболее частое доброкачественное поражение печени. Обычно это случайная находка у бессимптомных пациентов как наиболее частое гиперэхогенное поражение печени.В США это можно увидеть как гиперэхогенное поражение с четкой границей и периферическим питающим сосудом в цветном допплеровском режиме. Гемангиома появляется в артериальной фазе CEUS с усилением периферических узлов и портальной венозной фазой и поздней фазой с постоянным контрастным наполнением и переходом в гиперэхогенное поражение. У бессимптомных пациентов, не имеющих в анамнезе злокачественных новообразований, диагноз гемангиомы может быть поставлен исключительно на основании визуализации одного четко определенного, гомогенно гиперэхогенного поражения в США, и дальнейшее обследование не требуется.
Визуализирующие проявления вирусного гепатита в США могут варьироваться от нормальных до неспецифических проявлений гепатомегалии, утолщения стенки желчного пузыря, скопления жидкости вокруг воротной вены или генерализованной гипоэхогенности. Диагноз в основном ставится на основании клинических признаков и серологических тестов.
Ядерная медицина
Позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (ОФЭКТ) — это методы ядерной визуализации, которые в последнее время все чаще используются для диагностики злокачественных новообразований печени и оценки реакции на лечение, метастазов, рецидивов и прогнозов.F-фтордезоксиглюкоза (FDG) -PET и C-ацетатная ПЭТ являются более распространенными методами ядерной визуализации при диагностике злокачественных новообразований печени. Несмотря на высокую чувствительность, частота ложных срабатываний высока из-за обнаружения любой очаговой области гиперметаболизма, а чувствительность при обнаружении поражений размером менее 1 см низкая.
Трансартериальная радиоэмболизация и селективная внутренняя лучевая терапия — это методы диагностики в области ядерной медицины с прямым использованием ПЭТ или ОФЭКТ для диагностики и лечения одновременно.[17]
Ангиография
Многодетекторная компьютерная томографическая ангиография (МДКТ) — это метод визуализации для оценки новообразования печени с целью определения стадии и хирургического планирования путем предоставления информации об анатомии сосудов печени и патологии паренхимы. Двухфазная КТ печени с артериальной и портальной венозной фазой позволяет выявить гиперваскулярные опухоли с повышенной чувствительностью, чем только портальная фаза. Ангиография МДКТ является методом выбора при трансплантации печени от живого донора, а также для оценки артериальных осложнений после трансплантации.[18]
Трансартериальная химиоэмболизационная терапия (ТАХЭ) — это метод, при котором химиотерапия вводится непосредственно в печеночную артерию, питающую опухоль, что приводит к некрозу. Его основное применение при лечении HCC и специфических метастазов в печени, таких как колоректальные метастазы и холангиокарцинома. Это также может быть полезно при неоперабельной ГЦК.
Расположение пациента
Ультразвук — это основной метод визуализации печени, поэтому расположение пациента и опыт оператора являются важными факторами при оптимизации исследования.[19]
Клиническая значимость
Первый метод визуализации, который следует выбрать для оценки патологии печени, зависит от клинической ситуации пациента, наличия различных методов, знакомства техника и врача с тестом. УЗИ и КТ остаются первым методом визуализации для оценки диффузного и очагового поражения печени для скрининга и характеристики. Дальнейшие исследования и изображения могут быть выполнены на основе данных, полученных в США и КТ.
Стеатоз печени или ожирение печени — наиболее частая аномалия, обнаруживаемая при визуализации печени, которая может быть связана не только с алкогольной болезнью печени и неалкогольной болезнью печени, включая ожирение, инсулинорезистентность, диабет, гиперлипидемию и гипертензию. Неалкогольная жировая болезнь печени может прогрессировать от простой жировой болезни печени до неалкогольного стеатогепатита (НАСГ) и цирроза. Результаты УЗИ жировой болезни печени, независимо от этиологии, включают повышение эхогенности печени по сравнению с почечной корой, потерю нормальной эхогенности портальной триады на периферии печени, плохую визуализацию диафрагмы.Транзиторная эластография — наиболее проверенный метод, который имеет большую чувствительность и специфичность (87% и 91% соответственно) при диагностике цирроза печени по сравнению с диагностикой значительного фиброза (70% и 84% соответственно).
Стратификация риска необходима пациентам с циррозом печени для оценки риска таких осложнений, как последствия портальной гипертензии и рак печени. Серология печени и эластография — неинвазивные методы определения пациентов с циррозом печени на поздней стадии.Биопсия печени может предоставить информацию об стадиях фиброза. Эластография — это метод, который может показать повышенную жесткость паренхимы. Среди различных подходов к использованию эластографии наиболее распространенным во всем мире является переходная эластография с контролем вибрации [1].
Система отчетов и данных визуализации печени (LI-RADS) — это комплексная и стандартизированная система отчетности и классификации поражений печени, которые подвержены повышенному риску развития ГЦК. LIRAD классифицирует поражения на определенно доброкачественные, вероятно доброкачественные, вероятно или определенно злокачественные, но не специфичные для ГЦК, промежуточную вероятность злокачественных новообразований, возможно ГЦК и ГЦК.Он представляет собой руководство для радиологов, клиницистов и хирургов по вопросам наблюдения и рекомендаций в случае необходимости биопсии.
% PDF-1.7
%
225 0 объект
>
endobj
xref
225 91
0000000016 00000 н.
0000002633 00000 н.
0000002874 00000 н.
0000003003 00000 п.
0000003080 00000 н.
0000003102 00000 п.
0000003741 00000 н.
0000003910 00000 н.
0000004062 00000 н.
0000004218 00000 н.
0000004339 00000 п.
0000004460 00000 н.
0000004581 00000 п.
0000004702 00000 н.
0000004823 00000 н.
0000004944 00000 н.
0000005063 00000 н.
0000005184 00000 п.
0000005305 00000 н.
0000005426 00000 н.
0000005545 00000 н.
0000005666 00000 н.
0000005787 00000 н.
0000005908 00000 н.
0000006063 00000 н.
0000006209 00000 н.
0000006344 00000 п.
0000006824 00000 н.
0000007172 00000 н.
0000007344 00000 п.
0000007530 00000 н.
0000007588 00000 н.
0000007666 00000 н.
0000008128 00000 н.
0000008213 00000 н.
0000008780 00000 н.
0000008999 00000 н.
0000009303 00000 п.
0000010312 00000 п.
0000010714 00000 п.
0000010890 00000 п.
0000011196 00000 п.
0000012231 00000 п.
0000012411 00000 п.
0000012787 00000 п.
0000013026 00000 п.
0000013311 00000 п.
0000014303 00000 п.
0000015362 00000 п.
0000016480 00000 п.
0000017589 00000 п.
0000017723 00000 п.
0000017785 00000 п.
0000017812 00000 п.
0000018343 00000 п.
0000019436 00000 п.
0000020190 00000 п.
0000020903 00000 п.
0000020973 00000 п.
0000021072 00000 п.
0000026123 00000 п.
0000026393 00000 п.
0000026758 00000 п.
0000031626 00000 п.
0000032052 00000 п.
0000034551 00000 п.
0000038024 00000 п.
0000039551 00000 п.
0000039798 00000 п.
0000039857 00000 п.
0000040492 00000 п.
0000040694 00000 п.
0000040979 00000 п.
0000041365 00000 п.
0000041599 00000 п.
0000088522 00000 п.
0000110388 00000 п.
0000110464 00000 н.
0000110522 00000 н.
0000110836 00000 н.
0000110978 00000 п.
0000111083 00000 н.
0000111217 00000 н.
0000111353 00000 н.
0000111481 00000 н.
0000111609 00000 н.
0000111719 00000 н.
0000111835 00000 н.
0000111951 00000 н.
0000112046 00000 н.
0000002116 00000 н.
трейлер
] / Назад 912217 >>
startxref
0
%% EOF
315 0 объект
> поток
hb«a`4e`c`Icf @
Безалкогольная жировая болезнь печени (НАЖБП)
Обзор
Неалкогольная жировая болезнь печени (НАЖБП) является очень распространенным заболеванием и относится к группе состояний, при которых происходит накопление избыточного жира в печени у людей, которые мало пьют алкоголь или не употребляют его вообще.Самая распространенная форма НАЖБП — это легкое заболевание, называемое ожирением печени. При ожирении печени жир накапливается в клетках печени. Хотя наличие жира в печени — это ненормально, само по себе оно, вероятно, не повреждает печень. Небольшая группа людей с НАЖБП может иметь более серьезное заболевание, называемое неалкогольным стеатогепатитом (НАСГ). При НАСГ накопление жира связано с воспалением клеток печени и различной степенью рубцевания. НАСГ — потенциально серьезное заболевание, которое может привести к тяжелому рубцеванию печени и циррозу.Цирроз возникает, когда печень получает значительные повреждения, и клетки печени постепенно замещаются рубцовой тканью (см. Рисунок), что приводит к неспособности печени работать должным образом. Некоторым пациентам, у которых развивается цирроз, в конечном итоге может потребоваться пересадка печени (операция по удалению поврежденной печени и замене ее «новой» печенью).
Симптомы
Большинство людей с НАЖБП не имеют симптомов и проходят нормальный осмотр. У детей могут наблюдаться такие симптомы, как боль в животе, которая может проявляться в центре или в правой верхней части живота, а иногда и утомляемость.Однако следует учитывать и другие причины боли в животе и усталости. При физикальном обследовании печень может быть немного увеличена, и у некоторых детей может наблюдаться пятнистое темное изменение цвета кожи (черный акантоз), чаще всего на шее и в области подмышек.
Причины НАЖБП / НАСГ
НАЖБП является частью метаболического синдрома, характеризующегося диабетом или преддиабетом (инсулинорезистентностью), избыточным весом или ожирением, повышенным уровнем липидов крови, таких как холестерин и триглицериды, а также высоким кровяным давлением.Не у всех пациентов наблюдаются все проявления метаболического синдрома. Меньше известно о причинах развития НАСГ. Исследователи сосредотачиваются на нескольких факторах, которые могут способствовать развитию НАСГ. К ним относятся:
- Окислительный стресс (дисбаланс между прооксидантами и антиоксидантами, которые приводят к повреждению клеток печени)
- Производство и высвобождение токсичных воспалительных белков (цитокинов) собственными воспалительными клетками пациента, клетками печени или жировыми клетками
- Некроз или смерть клеток печени, называемый апоптозом
- Воспаление и инфильтрация жировой ткани (жировой ткани) лейкоцитами
- Микробиота кишечника (кишечные бактерии), которая может играть роль в воспалении печени
Факторы риска
НАЖБП — очень распространенное заболевание, которым страдает от одного из трех до одного из пяти взрослых и примерно у каждого десятого ребенка в Соединенных Штатах.Ожирение считается наиболее частой причиной жировой инфильтрации печени. По оценкам некоторых экспертов, около двух третей взрослых с ожирением и половина детей с ожирением могут иметь ожирение печени. Примерно от 2 до 5 процентов взрослых американцев и до 20 процентов страдающих ожирением могут страдать от более тяжелого состояния НАСГ. Число детей с НАСГ неизвестно. Наличие диабета 2 типа и других состояний, связанных с инсулинорезистентностью, таких как синдром поликистозных яичников, являются известными факторами риска развития ожирения печени и НАСГ.
Скрининг / диагностика
Диагноз НАЖБП обычно сначала подозревается у человека с избыточным весом или ожирения, у которого обнаруживается небольшое повышение показателей печени во время обычного анализа крови или случайно обнаруживается при радиологических исследованиях, таких как УЗИ брюшной полости или компьютерная томография. Некоторые эксперты теперь рекомендуют проверять эти печеночные ферменты у каждого ребенка или подростка с ожирением. Однако НАЖБП может присутствовать при нормальных анализах крови печени.Диагноз НАЖБП подтверждается визуализирующими исследованиями, чаще всего УЗИ печени, показывающими накопление жира в печени. Накопление жира в печени также может быть вызвано чрезмерным употреблением алкоголя, некоторыми лекарствами, вирусным гепатитом, аутоиммунным заболеванием печени и метаболическим или наследственным заболеванием печени. Их необходимо исключить как причины жировой болезни печени, чтобы подтвердить диагноз НАЖБП. В настоящее время единственный надежный способ определить, есть ли у человека НАСГ или простой жировой гепатоз, — это биопсия печени.В этой процедуре небольшая игла вводится через кожу после местной анестезии, чтобы получить небольшой кусочек печени для микроскопического исследования. НАСГ диагностируется, когда исследование этого участка печени под микроскопом показывает жировую инфильтрацию печени в дополнение к воспалению и различной степени рубцевания. Если присутствует только жир, то ставится диагноз простой жировой ткани печени. Биопсия печени дает важную информацию о степени рубцевания в печени, которая не будет очевидна только при анализе крови, ультразвуке или рентгене.Биопсия печени редко может быть связана с серьезным риском, включая кровотечение, и пациенты должны обсудить риски и преимущества процедуры со своим врачом.
Лечение НАЖБП / НАСГ
Несколько исследований показали, что потеря веса может быть связана с регрессией жира в печени. Поэтому наиболее важные рекомендации для людей с ожирением печени — это похудеть, если они страдают избыточным весом или ожирением, увеличить физическую активность, соблюдать сбалансированную диету и избегать употребления алкоголя и ненужных лекарств.Новые данные свидетельствуют о том, что средиземноморская диета (богатая мононенасыщенными жирными кислотами) может быть более полезной, чем диета с низким содержанием жиров. По данным крупных когортных исследований, употребление кофе снижает риск ожирения печени. Для пациентов с НАСГ, более тяжелой формой НАЖБП, эти же рекомендации могут быть полезны. Также важно контролировать диабет и при необходимости лечить повышенный уровень холестерина. Разработка лекарств, которые могут лечить НАФБ и НАСГ, является областью интенсивных исследований.Недавние исследования у взрослых и детей показали, что витамин Е (антиоксидант) может помочь улучшить НАСГ у пациентов, не страдающих диабетом. В настоящее время врачи и ученые изучают следующие стратегии уменьшения количества жира / воспаления в печени:
- Снижение веса (диета + упражнения, лекарства, операция)
- Лекарства для снижения уровня липидов
- Сенсибилизаторы инсулина (лекарства)
- Уменьшить степень воспаления печени путем приема антиоксидантных, антиапоптотических и антицитокиновых препаратов
Автор (ы) и дата (ы) публикации
Наим Альхури, доктор медицины, и Марша Х.Кей, доктор медицины, FACG, Клиника Кливленда, Кливленд, Огайо — Обновлено в декабре 2012 г.
Ариэль Э. Фельдштейн, доктор медицины, и Марша Х.


 Болезнь диагностируют у маленьких детей. Если у ребенка нет негативной симптоматики и самочувствие не вызывает у него дискомфорта, врач не назначает лечение. Чаще всего этот вид гепатомегалии со временем проходит самостоятельно. Если же со временем будет наблюдаться увеличение органа, врач подбирает комплексную терапию.
Болезнь диагностируют у маленьких детей. Если у ребенка нет негативной симптоматики и самочувствие не вызывает у него дискомфорта, врач не назначает лечение. Чаще всего этот вид гепатомегалии со временем проходит самостоятельно. Если же со временем будет наблюдаться увеличение органа, врач подбирает комплексную терапию..jpg)

