Лекарства, доказавшие свою эффективность » Медвестник
Парадоксальная ситуация: вводя в поисковую систему запрос «Лекарства, доказавшие свою эффективность», пользователь получает ссылки на сотни сайтов и тысячи статей, предлагающих списки лекарств, которые «не имеют доказанной эффективности», «не лечат», «являются пустышками».
Среди этих публикаций есть серьезные материалы с анализом важных проблем. И действительно, даже эксперты фармацевтического рынка из DSM Group указывают, что из десяти наиболее продаваемых препаратов (обезболивающих, сердечно-сосудистых, противовирусных) пять не проходили международные клинические испытания (подтверждение соответствия международным стандартам стоит дорого, а сами требования к исследованиям несколько десятков лет назад, когда появились некоторые из этих препаратов, были иными).
Однако многие тексты, выданные поисковиком и посвященные эффективности или неэффективности лекарственных средств, к сожалению, являются откровенными спекуляциями. Оставив на совести их авторов преследуемые цели, мы попробуем внести некоторую ясность в вопросы эффективности ряда групп лекарственных средств, чаще других подвергающихся критике «диванных экспертов», не утруждающих себя отслеживанием работ по этим темам и данных клинических исследований.
Оставив на совести их авторов преследуемые цели, мы попробуем внести некоторую ясность в вопросы эффективности ряда групп лекарственных средств, чаще других подвергающихся критике «диванных экспертов», не утруждающих себя отслеживанием работ по этим темам и данных клинических исследований.
Эссенциальные фосфолипиды
Эссенциальные фосфолипиды (ЭФЛ), например, долгое время в средствах массовой информации подвергались нападкам, высказывались сомнения в их эффективности. При этом зачастую авторы не уточняют конкретное заболевание, лечение которого рассматривается. А согласно сегодняшним представлениям о медицине, препарат не может «работать вообще», он может работать при конкретном показании, конкретном заболевании, и его эффективность должна измеряться конкретными показателями. Из статьи в статью в качестве мощного аргумента один автор за другим приводили данные исследования ветеранских медицинских центров США (2003 г.), не обнаружившего «положительных влияний данных препаратов на функцию печени», забывая упомянуть, что в этом исследовании изучалась их возможность обратить вспять фиброз печени при алкогольной болезни печени.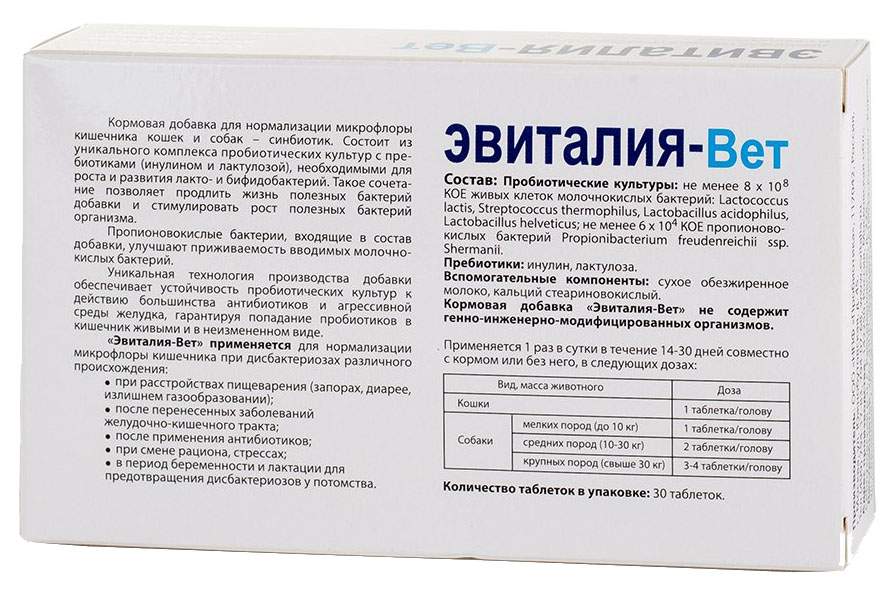 Интересно, что до сих пор ни один препарат не продемонстрировал возможности обратить вспять фиброз при данном заболевании. Более того, по данным того же исследования, его участники продолжали употреблять алкогольные напитки в повреждающих дозах, что делает неэффективной любую терапию. Кроме того, существует и другая разновидность жирового гепатоза – неалкогольная жировая болезнь печени (НАЖБП), при которой в клетках печени появляются жировые капли. И в отношении этого заболевания результаты целого ряда рандомизированных клинических исследований (не менее пяти) доказали, что эссенциальные фосфолипиды (ЭФЛ) снижают уровень стеатоза в печени, то есть жир в клетках печени, грубо говоря, «сжигается». Эффективность ЭФЛ в этих исследованиях оценивалась по результатам биопсии печени, МРТ и КТ. Еще одним свидетельством эффективности ЭФЛ при этом заболевании является представленный в 2020 году на тихоокеанском съезде Сообщества по изучению печени (APASL) метаанализ, в котором снова подтверждается эффект эссенциальных фосфолипидов на стеатоз.
Интересно, что до сих пор ни один препарат не продемонстрировал возможности обратить вспять фиброз при данном заболевании. Более того, по данным того же исследования, его участники продолжали употреблять алкогольные напитки в повреждающих дозах, что делает неэффективной любую терапию. Кроме того, существует и другая разновидность жирового гепатоза – неалкогольная жировая болезнь печени (НАЖБП), при которой в клетках печени появляются жировые капли. И в отношении этого заболевания результаты целого ряда рандомизированных клинических исследований (не менее пяти) доказали, что эссенциальные фосфолипиды (ЭФЛ) снижают уровень стеатоза в печени, то есть жир в клетках печени, грубо говоря, «сжигается». Эффективность ЭФЛ в этих исследованиях оценивалась по результатам биопсии печени, МРТ и КТ. Еще одним свидетельством эффективности ЭФЛ при этом заболевании является представленный в 2020 году на тихоокеанском съезде Сообщества по изучению печени (APASL) метаанализ, в котором снова подтверждается эффект эссенциальных фосфолипидов на стеатоз. В связи с этим неудивительно, что ЭФЛ включены в российские клинические рекомендации по лечению стеатоза. К этому следует также добавить 3 статьи, опубликованные совсем недавно в британском медицинском журнале «Open Gastroenterology» по результатам масштабного наблюдательного исследования, подтвердившего клиническую эффективность ЭФЛ у 2843 больных с НАЖБП и различными сопутствующими заболеваниями.
В связи с этим неудивительно, что ЭФЛ включены в российские клинические рекомендации по лечению стеатоза. К этому следует также добавить 3 статьи, опубликованные совсем недавно в британском медицинском журнале «Open Gastroenterology» по результатам масштабного наблюдательного исследования, подтвердившего клиническую эффективность ЭФЛ у 2843 больных с НАЖБП и различными сопутствующими заболеваниями.
Интерес врачей к неалкогольной жировой болезни печени и подходам к ее терапии сегодня объясняется не только стремительным распространением этой патологии, но и пониманием явной недооценки ее опасности ранее.
В структуре всех заболеваний печени НАЖБП находится на первом месте. Около 20 –30% взрослого населения в западных странах страдает ею. В РФ, по данным исследования DIREG2, у 37% амбулаторных пациентов выявлена данная патология.
Накопление избытка жира в виде капель внутри клеток печени – ключевой патологический феномен НАЖБП. В общей стратегии лечения этих пациентов, по мнению гепатологов, важно прежде всего снизить массу тела (назначаются диета, физические нагрузки), скорректировав таким образом инсулинорезистентность и жировой обмен. Основная задача терапии НАЖБП – избавить печень от избытка жировых молекул, которые могут рано или поздно стать причиной начала воспаления – стеатогепатита, следующей стадии заболевания. Помогают решить эту терапевтическую задачу и препараты эссенциальных фосфолипидов (например, Эссенциале Форте Н). И в рандомизированных контролируемых исследованиях, и в масштабном наблюдательном исследовании было отмечено снижение степени жировой перегрузки печени на фоне терапии ЭФЛ.
Основная задача терапии НАЖБП – избавить печень от избытка жировых молекул, которые могут рано или поздно стать причиной начала воспаления – стеатогепатита, следующей стадии заболевания. Помогают решить эту терапевтическую задачу и препараты эссенциальных фосфолипидов (например, Эссенциале Форте Н). И в рандомизированных контролируемых исследованиях, и в масштабном наблюдательном исследовании было отмечено снижение степени жировой перегрузки печени на фоне терапии ЭФЛ.
К этому остается добавить, что не все препараты группы гепатопротекторов, продающиеся в наших аптеках, могут представить столь же убедительные доказательства своей эффективности.
Список литературы по теме
Основы доказательной медицины: Учебное пособие для системы послевузовского и дополнительного профессионального образования врачей / Под общ. ред. Р.Г. Оганова. М.: Силицея-Полиграф, 2010, 136 с.
Ивашкин В.Т. и соавт. Клинические рекомендации по диагностике и лечению неалкогольной жировой болезни печени Российского общества по изучению печени и Российской гастроэнтерологической ассоциации // РЖГГК, № 2, 2016, с. 24‒42.
24‒42.
Gundermann et al. Essential phospholipids in fatty liver: a scientific update. Clin Exp Gastroenterol 2016, № 9, p. 105 –117.
Perumpail, Brandon J et al. “Clinical epidemiology and disease burden of nonalcoholic fatty liver disease.” World journal of gastroenterology vol. 23,47 (2017): 8263-8276. doi:10.3748/wjg.v23.i47.8263. Benedict 2017.
Gonciarz Z. et al. Randomized placebo-controlled double blind trial on essential‒phospholipoids in the treatment of fatty liver assosiated with diabetes. Med. Chr. Digest. 1998, 17,p.61‒65.
Li J.H., Chen X.Y., Zhong C.F., Min J. A randomized controlled study of essential phospholipids (Essentiale capsules) in the treatment of fatty liver. Infect Dis Info. 2000, 13 (4), p. 180–181.
Yin D., Kong L. Observation for curative effect of Essentiale in treatment of fatty liver caused by diabetes mellitus. Med J Q Ilu. 2000, vol.15, p.277, 278.
Sas E, Grinevich V, Efimov O, Shcherbina N. Beneficial influence of polyunsaturated phosphatidylcholine enhances functional liver condition and liver structure in patients with nonalcoholic steatohepatitis accompanied by diabetes type 2. Results of prolonged randomized blinded prospective clinical study. J. Hepatol. 2013, 58, S549.
Results of prolonged randomized blinded prospective clinical study. J. Hepatol. 2013, 58, S549.
Sun C., Zheng X., Tan Z., Cui F., Zhang R., Zhang H. Clinical observation on polyene phosphatidyl choline and metformin in the treatment of type 2 diabetes and non-alcoholic fatty liver disease. Clin Focus. 2008, 23 (17), p. 1272–1273.
Schüller Pérez A., Gonzáles San Martin F. Placebo-controlled study with polyunsaturated phosphatidylcholine in alcoholic steatosis of the liver. Med. Welt. 1985, vol. 36, № 16, p. 517‒ 521.
Dajani 2020, APASL. https://bmjopengastro.bmj.com/content/6/1/e000307
https://bmjopengastro.bmj.com/content/bmjgast/7/1/e000368.full.pdf
https://bmjopengastro.bmj.com/content/7/1/e000341.info
Пробиотики/пребиотики
Несмотря на «модность» приема продуктов с пробиотиками, «к назначению пробиотиков в развитых странах относятся с осторожностью», пишут интернетовские «знатоки». Действительно, тема симбиотической микрофлоры, дисбиозов и способов их коррекции вызывали большой скепсис у врачей, в том числе гастроэнтерологов. Вот только было это несколько десятков лет назад.
Вот только было это несколько десятков лет назад.
В последние же пару десятилетий концепция активного участия симбиотической микрофлоры человека в поддержании его здоровья и микроэкологические аспекты этиопатогенеза ряда современных заболеваний привлекают внимание ученых и врачей разных специальностей. Опубликовано множество новых данных, касающихся становления, состава, сукцессии симбионтной микрофлоры человека и животных, биохимических реакций, физиологических функций и патологических состояний, связанных с нею, принципов и конкретных приемов коррекции экологической системы хозяин/микрофлора, нашедших практическую реализацию.
Среди современных приемов сохранения и коррекции микробной экологии человека (назначение пробиотиков, пребиотиков, синбиотиков, метаболитов бактерий-симбионтов, аутопробиотиков) наиболее распространенным стало использование специально подобранных пробиотических микроорганизмов (преимущественно представителей нормальной микрофлоры пищеварительного тракта) в виде пробиотических лекарственных препаратов (пробиотики), биологически активных пищевых добавок или продуктов питания, также содержащих пре- или пробиотики. Кстати, термин «пробиотики» был предложен еще в 1954 году, причем «врачом развитых стран» F. Vergio. А сегодня уже эксперты Всемирной организации здравоохранения и Международной научной ассоциации пробиотиков и пребиотиков (International Scientific Association for Probiotics and Prebiotics, ISAPP) уточняют, что термин «пробиотик» (живые микроорганизмы, которые при введении в адекватном количестве оказывают положительный эффект на здоровье организма-хозяина) может быть применено только к тем препаратам, которые отвечают следующим требованиям: есть точная информация о входящих в их состав микроорганизмах с указанием штаммов; сохраняется достаточное число жизнеспособных бактерий к концу срока годности; проведены исследования, подтвердившие безопасность и эффективность включенных штаммов.
Кстати, термин «пробиотики» был предложен еще в 1954 году, причем «врачом развитых стран» F. Vergio. А сегодня уже эксперты Всемирной организации здравоохранения и Международной научной ассоциации пробиотиков и пребиотиков (International Scientific Association for Probiotics and Prebiotics, ISAPP) уточняют, что термин «пробиотик» (живые микроорганизмы, которые при введении в адекватном количестве оказывают положительный эффект на здоровье организма-хозяина) может быть применено только к тем препаратам, которые отвечают следующим требованиям: есть точная информация о входящих в их состав микроорганизмах с указанием штаммов; сохраняется достаточное число жизнеспособных бактерий к концу срока годности; проведены исследования, подтвердившие безопасность и эффективность включенных штаммов.
Применение пробиотиков год от года растет колоссальными темпами. Только в США доход от продажи пробиотиков составляет около 35 млрд долларов ежегодно. Неуклонно растет и число исследований, публикаций, посвященных проблеме использования пробиотиков при различных заболеваниях и для их профилактики. В их числе многочисленные метаанализы и систематические обзоры, оценивающие эффективность пробиотических штаммов с позиций доказательной медицины при заболеваниях и состояниях, связанных с нарушениями обмена веществ (сахарный диабет, дислипидемия, ожирение), заболеваниях желудочно-кишечного тракта (воспалительные заболевания кишки, запор, антибиотико-ассоциированная диарея, Clostridium difficile-ассоциированное заболевание, синдром раздраженной кишки), атопических заболеваниях (пищевая аллергия, ринит), заболеваниях печени (цирроз, неалкогольная жировая болезнь печени, печеночная энцефалопатия), заболеваниях поджелудочной железы (острый панкреатит) и др.
В их числе многочисленные метаанализы и систематические обзоры, оценивающие эффективность пробиотических штаммов с позиций доказательной медицины при заболеваниях и состояниях, связанных с нарушениями обмена веществ (сахарный диабет, дислипидемия, ожирение), заболеваниях желудочно-кишечного тракта (воспалительные заболевания кишки, запор, антибиотико-ассоциированная диарея, Clostridium difficile-ассоциированное заболевание, синдром раздраженной кишки), атопических заболеваниях (пищевая аллергия, ринит), заболеваниях печени (цирроз, неалкогольная жировая болезнь печени, печеночная энцефалопатия), заболеваниях поджелудочной железы (острый панкреатит) и др.
Учеными и врачами многих стран мира за последние годы выполнено огромное количество наблюдений, исследований по этой сложной и еще мало изученной теме. Но у практикующих врачей остается еще очень много вопросов, да и причин неэффективного назначения пробиотиков также немало. Среди последних могут быть: чужеродность для человека входящих в их состав микроорганизмов (производители зачастую указывают только род и вид микроорганизмов, без указания штаммов), недостаточный учет высокой видовой, индивидуальной и анатомической специфичности автохтонной микрофлоры лиц, которым назначают эти средства коррекции микроэкологических нарушений, неправильная дозировка и пр. Назначая пробиотик, следует помнить: нет универсального штамма бактерий, эффективного для лечения и профилактики всех заболеваний, связанных с нарушением состава микробиоты, поэтому очень важно дифференцированно подходить к выбору пробиотического штамма в зависимости от нозологии.
Назначая пробиотик, следует помнить: нет универсального штамма бактерий, эффективного для лечения и профилактики всех заболеваний, связанных с нарушением состава микробиоты, поэтому очень важно дифференцированно подходить к выбору пробиотического штамма в зависимости от нозологии.
С позиций доказательной медицины на сегодняшний день оправдано применение пробиотиков для лечения и профилактики следующих нозологий: антибиотико-ассоциированной диареи у взрослых и детей, диареи, ассоциированной с Clostridium difficile, острой инфекционной диареи у детей и взрослых, эрадикационной терапии, язвенного колита, синдрома раздраженной кишки. Выбор пробиотического средства должен базироваться на нозологии, в связи с этим в его состав должны входить штаммы с доказанной эффективностью при данном заболевании. Кроме этого, иногда приходится учитывать и другие факторы: например, после применения антибиотиков прием пробиотических микроорганизмов, активно колонизирующих кишечник, может подавлять восстановление многообразия микробиоты кишечника человека. Также следует обратить внимание на выживаемость пробиотических микроорганизмов в ЖКТ в зависимости от активной формы (споры/лиофилизат живых бактерий) и видовой принадлежности, в том числе при использовании внекишечно-растворимых капсул с экспозицией желудочному соку, что часто практикуется.
Также следует обратить внимание на выживаемость пробиотических микроорганизмов в ЖКТ в зависимости от активной формы (споры/лиофилизат живых бактерий) и видовой принадлежности, в том числе при использовании внекишечно-растворимых капсул с экспозицией желудочному соку, что часто практикуется.
Кроме того, необходимо учитывать правильное оформление упаковки, которая обязательно должна содержать информацию о роде, виде, штамме бактерий, входящих в состав пробиотика, адекватной дозировке.
Список литературы по теме
Suez, J., Zmora, N., Segal, E. et al. The pros, cons, and many unknowns of probiotics. Nat Med 25, 716–729 (2019).
Основы доказательной медицины: Учебное пособие для системы послевузовского и дополнительного профессионального образования врачей / Под общ. ред. Р.Г. Оганова. М.: Силицея-Полиграф, 2010, 136 с.
Hill C., Guarner F., Reid G, Gibson G.R. et al. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nature Reviews Gastroenterology and Hepatology. 2014, 11 (8), p. 506 –514.
Nature Reviews Gastroenterology and Hepatology. 2014, 11 (8), p. 506 –514.
Probiotics and prebiotics. World Gastroenterology Organisation Global Guidelines, 2017. Accessed October 10, 2019.
Кайбышева В.О., Никонов Е.Л. Пробиотики с позиции доказательной // Доказательная гастроэнтерология. Т. 8, № 3, 2019, с. 45‒54.
Parker E.A., Roy T., D’Adamo C.R., Wieland L.S. Probiotics and gastrointestinal conditions: An overview of evidence from the Cochrane Collaboration. Nutrition. 2018, 45, p. 125‒134.
Ардатская М.Д., Бельмер С.В., Добрица В.П., Захаренко С.М., Лазебник Л.Б., Минушкин О.Н. и соавт. Дисбиоз (дисбактериоз) кишечника: современное состояние проблемы, комплексная диагностика и лечебная коррекция // Экспериментальная и клиническая гастроэнтерология. № 117 (5), 2015, с. 13‒50.
Ардатская М.Д. Пробиотики, пребиотики и метабиотики в коррекции микроэкологических нарушений кишечника // Медицинский совет, № 13, 2015, с. 94‒99.
Guarner F., Khan A. G., Garisch J. et al. Всемирная гастроэнтерологическая организация. Практические рекомендации. Пробиотики и пребиотики. 2017, 37 с.
G., Garisch J. et al. Всемирная гастроэнтерологическая организация. Практические рекомендации. Пробиотики и пребиотики. 2017, 37 с.
Микробиота / Под ред. Е.Л.Никонова, Е.Л.Поповой. М.: Медиа Сфера, 2019.
Плотникова Е.Ю., Захарова Ю.В. Место пробиотиков в современной клинической практике // Consilium Medicum. № 1, 2018, с. 95‒99.
Sniffen J.C., McFarland L.V., Evans C.T., Goldstein E.J.C. Choosing an appropriate probiotic product for your patient: An evidence-based practical guide. PLoS ONE. 2018, 13 (12), e0209205.
McFarland L.V., Surawicz C.M., Greenberg R.N. et al. A randomized placebo-controlled trial of Saccharomyces boulardii in combination with standard antibiotics for Clostridium difficile disease. Journal of the American Medical Association. 1994, 271 (24), p. 1913‒1918.
Surawicz C.M., McFarland L.V., Greenberg R.N., Rubin M. et al. The search for a better treatment for recurrent Clostridium difficile disease: the use of high dose vancomycin combined with Saccharomyces boulardii. Clinical Infectious Diseases. 2000, 31 (4), p. 1012‒1017.
Clinical Infectious Diseases. 2000, 31 (4), p. 1012‒1017.
Pochapin M. The effect of probiotics on Clostridium difficile diarrhea. American Journal of Gastroenterology. 2000, 95 (S1), p. 11‒13.
Lawrence S.J., Korzenik J.R., Mundy L.M. Probiotics for recurrent Clostridium difficile disease. Journal of Medical Microbiology. 2005, 54, p. 905‒906.
Vecchione A, Celandroni F, Mazzantini D, Senesi S, Lupetti A, Ghelardi E. Compositional Quality and Potential Gastrointestinal Behavior of Probiotic Products Commercialized in Italy. Front Med (Lausanne). 2018; 5:59. Published 2018 Mar 7. doi:10.3389/fmed.2018.00059.
Millette, Mathieu & Nguyen, A. & Amine, K.M. & Lacroix, Monique. (2013). Gastrointestinal survival of bacteria in commercial probiotic products. International Journal of Probiotics and Prebiotics. 8. 149‒156.
Elshaghabee FMF, Rokana N, Gulhane RD, Sharma C, Panwar H. Bacillus As Potential Probiotics: Status, Concerns, and Future Perspectives. Front Microbiol. 2017;8:1490. Published 2017 Aug 10. doi:10.3389/fmicb.2017.01490.
Front Microbiol. 2017;8:1490. Published 2017 Aug 10. doi:10.3389/fmicb.2017.01490.
Витамин Д
Еще одна группа препаратов, чье назначение часто подвергается критике на бескрайних просторах околонаучного интернета, – витамины вообще и витамин Д в частности: «Витамины из аптеки не могут заменить здорового питания». Так ведь и медицинские специалисты ратуют за сбалансированное, рациональное питание. Вот только почему же врачи во всем мире бьют тревогу по поводу дефицита витамина Д, принявшего характер пандемии, затрагивающей преобладающую часть человеческой популяции, включая детей и подростков, взрослых, беременных и кормящих женщин, женщин в менопаузе, лиц с рядом хронических заболеваний, пожилых людей. К примеру, его недостаточность (определяемая уровнями 25(OH)D менее 30 нг/мл и менее 20 нг/мл) у женщин в постменопаузе составляет 50% в Таиланде и Малайзии, 75% – в США, 74 –83,2% – в России, 90% – в Японии и Южной Корее. Д-дефицит зафиксирован в исследованиях у значительного числа молодых людей, спортсменов (до 73%). Даже население стран экваториальной области (с высоким уровнем природной инсоляции), хотя и имеют более высокие показатели уровня витамина Д, все же испытывают недостаточность «солнечного» витамина. Экстраполируя результаты многочисленных исследований, можно говорить о том, что около 1 млрд жителей планеты в настоящее время имеют недостаточность витамина Д.
Даже население стран экваториальной области (с высоким уровнем природной инсоляции), хотя и имеют более высокие показатели уровня витамина Д, все же испытывают недостаточность «солнечного» витамина. Экстраполируя результаты многочисленных исследований, можно говорить о том, что около 1 млрд жителей планеты в настоящее время имеют недостаточность витамина Д.
А дело в том, что витамин Д естественным образом присутствует лишь в очень ограниченном количестве продуктов питания (для сравнения: рекордсмен по содержанию Д2 ‒ дикий лосось (необезжиренный!) – содержит 600 – 1000 МЕ на 100 г, лосось, который выращен на ферме – 100 – 250 МЕ на 100 г, говяжья печень – 45 –15 МЕ на 100 г). Синтез же Д3 в организме человека возможен лишь в строго определенных условиях, когда ультрафиолетовые (УФ) лучи (определенной длины и под определенным углом) попадают на кожу. Очевидно, что россияне из-за географического положения большей части страны (северная широта, выше 35 параллели; более острый угол падения солнечных лучей) остаются в очень невыгодном положении – практически с ноября по март организм сам не вырабатывает витамин Д.
И это еще не все. Дело в том, что обе формы витамина (Д2 и Д3,), получаемые из продуктов питания и образующиеся при пребывании на солнце, биологически инертны. Лишь попадая в печень, они подвергаются гидроксилированию и становятся кальцидолом (неактивной транспортной формой витамина Д). Окончательная же активация протекает преимущественно в почках (при участии фермента 1a-гидроксилазы) и контролируется паратгормоном (ПТГ), эстрогенами. Результат этой реакции – образование кальцитриола – Д-гормона, с функциями стероидных гормонов. Именно при его взаимодействии с ядерными рецепторами (РВД) происходит синтез более 200 белков. Гидроксилирование витамина Д и ядерные рецепторы к Д-гормону объединяются в так называемую Д – гормональную систему.
И задачи, и функции этой системы очень обширны и важны. В первую очередь, говоря о ней, принято упоминать ее роль в регуляции кальциевого и фосфорного обмена, установленную почти век назад: без присутствия в организме кальциферола нормальное усвоение кальция невозможно. Но накануне следующего столетия представления о роли витамина Д в функционировании организма человека претерпели значительную трансформацию (один из исследователей назвал ее: «Старое вино в новой бутылке»). И его исключительно антирахитический эффект (важнейшее звено кальциевого гомеостаза) оказался лишь одной из более чем трех десятков его функций, включающих модуляцию клеточного роста, нервно-мышечную проводимость, иммунитет и воспаление. Сегодня доказано, что экспрессия большого числа генов, кодирующих белки, участвующие в пролиферации, дифференцировке и апоптозе клеток, регулируется витамином Д. Рецепторы к витамину Д обнаружены не только в костной системе, но еще более чем в 35 органах и тканях. Причем в некоторых тканях присутствует собственная 1α-гидроксилаза, чтобы образовывать активные формы Д –гормона и локально генерировать высокие внутриклеточные концентрации 1,25(OH)2D для своих собственных целей функционирования (не увеличивая его концентрации в общем кровотоке).
Но накануне следующего столетия представления о роли витамина Д в функционировании организма человека претерпели значительную трансформацию (один из исследователей назвал ее: «Старое вино в новой бутылке»). И его исключительно антирахитический эффект (важнейшее звено кальциевого гомеостаза) оказался лишь одной из более чем трех десятков его функций, включающих модуляцию клеточного роста, нервно-мышечную проводимость, иммунитет и воспаление. Сегодня доказано, что экспрессия большого числа генов, кодирующих белки, участвующие в пролиферации, дифференцировке и апоптозе клеток, регулируется витамином Д. Рецепторы к витамину Д обнаружены не только в костной системе, но еще более чем в 35 органах и тканях. Причем в некоторых тканях присутствует собственная 1α-гидроксилаза, чтобы образовывать активные формы Д –гормона и локально генерировать высокие внутриклеточные концентрации 1,25(OH)2D для своих собственных целей функционирования (не увеличивая его концентрации в общем кровотоке).
Детский рахит и остеопороз пожилых с осложненными переломами и таким грозным, как перелом шейки бедра, – эти проблемы специалисты давно связали с дефицитом витамина Д.
А вот в последние 10‒15 лет их прежде всего интересует роль этого биологически активного вещества в деятельности иммунной системы, причем всех ее звеньев. Например, по ключевым словам «vitamin D», «immune», «immunity», «inflamma*» в базе данных Pubmed1 можно найти более 5000 ссылок. Особый интерес для экспертов представляет потенцирование витамином Д антиинфекционного (и антибактериального, и антивирусного) иммунитета. Изучены роль витамина Д в противотуберкулезном иммунитете и взаимосвязь между дефицитом этого витамина и угнетением противотуберкулезного иммунитета (у пациентов с туберкулезом прием витамина Д заметно усиливает TLR2/1L-индуцированные ответы макрофагов). Фундаментальные исследования указывают на важную роль активного метаболита витамина (1,25-дигидроксивитамина D, кальцитриола) в усилении иммунного ответа на микобактерии. Кальцитриол в дозах 10-9‒10-7 моль/л существенно ограничивал внутриклеточный рост микобактерий в моноцитах человека, в то время как гамма-интерферон, колониестимулирующий фактор-1, интерлейкины-1, -3, -6 и вовсе утрачивали антимикобактериальный эффект без этого витамина.
При этом ученые уверены (на основании исследований), что витамин Д может применяться для профилактики и лечения не только туберкулеза, но и других инфекционных заболеваний – хронического ринита и риносинусита, гриппа A (h2N1), RSV-инфекции, вирусного гепатита и др.
Было установлено, что витамин Д повышает врожденный антимикробный иммунный ответ (путем индукции эндогенного антимикробного пептида кателидицина (пептид LL-37), синтезируемого в макрофагах и нейтрофилах). В клиническом исследовании пациентов в отделениях интенсивной терапии была установлена корреляция между концентрацией 25-гидроксивитамина D в плазме крови с уровнями кателидицина.
На способность витамина Д снижать общую инфекционную заболеваемость одними из первых обратили внимание врачи-педиатры. Еще в 1960-х годах советскими исследователями было отмечено, что его назначение детям, страдающим рахитом, снижало риск заболеваемости и смертности от бронхопневмонии.
В многоцентровом всероссийском исследовании «РОДНИЧОК» отмечено, что низкие уровни гидроксивитамина D в плазме крови чаще встречаются у часто и длительно болеющих детей. Метаанализ 5 рандомизированных клинических испытаний подтвердил целесообразность использования «солнечного» витамина для профилактики инфекций дыхательных путей (грипп, пневмония, ОРЗ). Число случаев инфекций дыхательных путей было на 42% ниже в группах пациентов, принимавших витамин Д, по сравнению с контролем (ОР 0,58, 95% ДИ 0,42 – 0,81, р = 0,001). Анализ данных клинических исследований по подгруппам детей и взрослых по отдельности также подтвердил положительный эффект приема витамина Д на заболеваемость (взрослые – ОР 0,58, 95% ДИ 0,42 – 0,81, р = 0,001; дети – 0,65, 95% ДИ 0,47 – 0,90, р = 0,01).
Метаанализ 5 рандомизированных клинических испытаний подтвердил целесообразность использования «солнечного» витамина для профилактики инфекций дыхательных путей (грипп, пневмония, ОРЗ). Число случаев инфекций дыхательных путей было на 42% ниже в группах пациентов, принимавших витамин Д, по сравнению с контролем (ОР 0,58, 95% ДИ 0,42 – 0,81, р = 0,001). Анализ данных клинических исследований по подгруппам детей и взрослых по отдельности также подтвердил положительный эффект приема витамина Д на заболеваемость (взрослые – ОР 0,58, 95% ДИ 0,42 – 0,81, р = 0,001; дети – 0,65, 95% ДИ 0,47 – 0,90, р = 0,01).
Метаанализ 11 клинических исследований с участием пациентов с вирусным гепатитом С (n = 1575, 1117 случаев гепатита) показал наличие у пациентов достоверно более низких уровней гидроксивитамина D в сыворотке по сравнению с контролем. А прием витамина улучшает ответ на противовирусное лечение рецидивирующего гепатита C рибавирином и интерфероном-альфа. Прием витамина Д в составе комплексной терапии приводил к полной элиминации вирусных частиц более чем у 50% пациентов.
Профилактика и лечение инфекционных заболеваний справедливо считаются актуальными проблемами здравоохранения. Возможным вариантом программы повышения резистентности населения к их возбудителям должно стать использование витамина Д.
Иммунная система – это защита не только от инфекционных агентов, токсинов, но и от злокачественных клеток. Большое эпидемиологическое исследование (более 4 млн человек из 13 стран) показало, что прием витамина Д в дозе 1100 МЕ приводит к снижению риска рака до 60%. Наиболее мощная доказательная база накоплена в отношении рака легких, колоректального рака, рака простаты и молочной железы.
Теперь об оптимальном уровне витамина D. В основу клинических рекомендаций положены существующие консенсусы и рекомендации:
- рекомендации по витамину D Международного фонда остеопороза 2010 года,
- нормы потребления кальция и витамина D Института медицины США 2010 года,
- клинические рекомендации по диагностике, лечению и профилактике дефицита витамина D Международного эндокринологического общества (The Endocrine Society) 2011 года,
- рекомендации для швейцарской популяции Федеральной комиссии по питанию 2011 года,
- рекомендации Общества исследования костей и минерального обмена Испании 2011 года,
- рекомендации для женщин в постменопаузе и пожилых лиц Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита 2013 года,
- рекомендации Национального общества по остеопорозу Великобритании 2014 года,
- эпидемиологические данные и научные работы по данной проблематике, опубликованные в Российской Федерации.
Большинство экспертов определяют дефицит витамина Д концентрацией 25(ОН)D – 25(ОН)D от 20 до 30 нг/мл (от 50 до 75 нмоль/л). Об адекватных уровнях можно говорить при >30 нг/мл (75 нмоль/л). Рекомендуемые целевые значения 25(ОН)D при коррекции дефицита витамина Д – 30 – 60 нг/мл (75 –150 нмоль/л).
Список литературы по теме
Основы доказательной медицины: Учебное пособие для системы послевузовского и дополнительного профессионального образования врачей / Под общ. ред. Р.Г. Оганова. М.: Силицея-Полиграф, 2010, 136 с.
Национальная программа «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции»/ Союз педиатров России [и др.]. М.: ПедиатрЪ, 2018, 96 с.
Громова О.А., Торшин И.Ю. Витамин D – смена парадигмы. М.: ГЭОТАР-Медиа. 2017, 576 с.
Iftikhar R., Kamran S.M. Vitamin D deficiency in patients with tuberculosis. J Coll Physicians Surg Pak. 2013, 23 (10), p. 780‒783.
Rook G.A. The role of vitamin D in tuberculosis. Am Rev Respir Dis. 1988, oct., 138 (4), p. 768‒770.
Davies P.D. A possible link between vitamin D deficiency and impaired host defence to Mycobacterium tuberculosis. Tubercle. 1985, 66 (4), p. 301‒306.
Larcombe L., Orr P., Turner-Brannen E., Slivinski C.R., Nickerson P.W., Mookherjee N. Effect of vitamin D supplementation on Mycobacterium tuberculosis-induced innate immune responses in a Canadian Dené First Nations cohort. PLoS One, 2012, 7 (7), e40692.
Dini C, Bianchi A. The potential role of vitamin D for prevention and treatment of tuberculosis and infectious diseases. Ann Ist Super Sanita. 2012, 48 (3), p. 319 – 327.
Abuzeid W.M., Akbar N.A., Zacharek M.A. Vitamin D and chronic rhinitis. Curr Opin Allergy Clin Immunol. 2012, 12(1), p. 13 –17.
Sundaram M.E., Coleman L.A. Vitamin D and influenza. Adv Nutr. 2012, 3 (4), p. 517‒525.
Khoo A.L., Chai L.Y. Vitamin D (3) down-regulates proinflammatory cytokine response to Mycobacterium tuberculosis through pattern recognition receptors while inducing protective cathelicidin production. Cytokine. 2011, 55 (2), p. 294 – 300.
Lang P.O., Samaras D. Aging adults and seasonal influenza: does the vitamin d status (h)arm the body? J Aging Res. 2012, 806198.
Liu P.T. Cutting edge: vitamin D-mediated human antimicrobial activity against Mycobacterium tuberculosis is dependent on the induction of cathelicidin. J Immunol. 2007, 179 (4), p. 2060‒2063.
Stagi S., Bertini F. Vitamin D levels and effects of vitamin D replacement in children with periodic fever, aphthous stomatitis, pharyngitis, and cervical adenitis (PFAPA) syndrome. Int J Pediatr Otorhinolaryngol. 2014, 78 (6), p. 964 – 968.
Amaya-Mejia A.S., O’Farrill-Romanillos P.M., Galindo-Pacheco L.V. et al. Vitamin D deficiency in patients with common variable immunodeficiency, with autoimmune diseases and bronchiectasis. Rev Alerg Mex. 2013, 60 (3), p. 110 – 116.
Jeng L., Yamshchikov A.V., Judd S.E. Alterations in vitamin D status and anti-microbial peptide levels in patients in the intensive care unit with sepsis. J Transl Med. 2009, 7, 28.
Martineau A.R. Old wine in new bottles: vitamin D in the treatment and prevention of tuberculosis. Proc. Nutr Soc. 2012, 71 (1), p. 84 – 89.
Selvaraj P. Vitamin D, vitamin D receptor, and cathelicidin in the treatment of tuberculosis. Vitam Horm. 20.11, 86, p. 307‒325.
Denis M. Killing of Mycobacterium tuberculosis within human monocytes: activation by cytokines and calcitriol. Clin Exp Immunol. 1991, 84 (2), p. 200‒206.
Verway M. Vitamin D induces interleukin-1beta expression: paracrine macrophage epithelial signaling controls M. tuberculosis infection. PLoS Pathog. 2013, 9 (6), e1003407.
Leandro A.C., Rocha M.A. Genetic polymorphisms in vitamin D receptor, vitamin D-binding protein, Toll-like receptor 2, nitric oxide synthase 2, and interferon-gamma genes and its association with susceptibility to tuberculosis. Braz J Med Biol Res. 2009, 42 (4), p. 312‒322.
Esteve Palau E, Sanchez Martinez F. Tuberculosis: Plasma levels of vitamin D and its relation with infection and disease. Med Clin (Barc). 2013, S0025-7753(13)0075.
Kibirige D., Mutebi E. Vitamin D deficiency among adult patients with tuberculosis: a cross sectional study from a national referral hospital in Uganda. BMC Res Notes. 2013, 6 (1), 293.
Desai N.S., Tukvadze N. Effects of sunlight and diet on vitamin D status of pulmonary tuberculosis patients in Tbilisi, Georgia. Nutrition. 2012, 28 (4), p. 362 – 386.
Nnoaham K.E., Clarke A. Low serum vitamin D levels and tuberculosis: a systematic review and meta-analysis. Int J Epidemiol. 2008, 37 (1), p. 113–119.
Salahuddin N., Ali F., Hasan Z. Vitamin D accelerates clinical recovery from tuberculosis: results of the SUCCINCT Study [Supplementary Cholecalciferol in recovery from tuberculosis]. A randomized, placebo-controlled, clinical trial of vitamin D supplementation in patients with pulmonar BMC Infect Dis. 2013, 13, 22.
Hasan Z., Salahuddin N., Rao N., Aqeel M. et al. Change in serum CXCL10 levels during anti-tuberculosis treatment depends on vitamin D status [Short Communication]. Int J Tuberc Lung Dis. 2014, 18 (4), p. 466‒469.
Coussens A.K., Wilkinson R.J., Hanifa Y., Nikolayevskyy V et al. Vitamin D accelerates resolution of inflammatory responses during tuberculosis treatment. Proc Natl Acad Sci U S A. 2012, 109(38), p. 15449 –15454.
Ganmaa D., Giovannucci E., Bloom B.R., Fawzi W., Burr W. et al. Vitamin D, tuberculin skin test conversion, and latent tuberculosis in Mongolian school-age children: a randomized, double-blind, placebo-controlled feasibility trial. Am J Clin Nutr. 2012, 96(2), p. 391‒396.
Villar L.M. Association between vitamin D and hepatitis C virus infection: a meta-analysis. World J Gastroenterol. 2013, 19(35), p. 5917‒5924.
Lange C.M., Bojunga J., Ramos-Lopez E. Vitamin D deficiency and a CYP27B1-1260 promoter polymorphism are associated with chronic hepatitis C and poor response to interferon-alfa based therapy. J Hepatol. 2011, 54 (5), p. 887‒889.
Petta S., Camma C. Low vitamin D serum level is related to severe fibrosis and low responsiveness to interferon-based therapy in genotype 1 chronic hepatitis C. Hepatology. 2010, 51 (4), p. 1158‒1167.
Bitetto D., Fabris C. Vitamin D supplementation improves response to antiviral treatment for recurrent hepatitis C. Transpl Int. 2011, 24 (1), p. 43‒50.
Zhuravskaia E.L. Effect of rickets prevention on bronchopneumonia morbidity and mortality in children during the 1st vear of life in rural areas. Pediatr Akus Ginekol. 1962, 5, p. 32‒33.
Salimpour R. Rickets in Tehran. Study of 200 cases. Arch Dis Child. 1975, Jan, 50 (1), p. 63‒66.
Muhe L., Lulseged S. Case-control study of the role of nutritional rickets in the risk of developing pneumonia in Ethiopian children. Lancet. 1997, Jun 21, 349 (9068), p. 1801‒1804.
Захарова И.Н., Мальцев С.В., Боровик Т.Э., Яцык Г.В. и соавт. Недостаточность витамина D у детей раннего возраста в России (результаты многоцентрового исследования – зима 2013–2014 гг.) // Вопросы фармакоэпидемиологии, 2014, с. 75‒80.
Charan J., Goyal J.P., Saxena D., Yadav P. Vitamin D for prevention of respiratory tract infections: A systematic review and meta-analysis. J Pharmacol Pharmacother. 2012, 3 (4), p. 300‒303.
Khare D., Godbole N.M., Pawar S.D. [1, 25[OH]2 D3] pre- and post-treatment suppresses inflammatory response to influenza A (h2N1) infection in human lung A549 epithelial cells. Eur J Nutr. 2013, 52 (4), p. 1405‒1415.
Hansdottir S., Monick M.M., Lovan N. Vitamin D decreases respiratory syncytial virus induction of NF-kappaB-linked chemokines and cytokines in airway epithelium while maintaining the antiviral state. J Immunol. 2010, 184 (2), p. 965‒974.
Bergman P., Lindh A.U. Vitamin D and Respiratory Tract Infections: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. PLoS One, 2013, 8 (6), e65835.
Zhao G., Ford E.S., Tsai J., Li C., Croft J.B. Low concentrations of serum 25-hydroxyvitamin D associated with increased risk for chronic bronchitis among US adults. Br J Nutr. 2012, 107 (9), p. 1386‒1392.
Herscovitch K., Dauletbaev N., Lands L.C. Vitamin D as an anti-microbial and anti-inflammatory therapy for Cystic Fibrosis. Paediatr Respir Rev. 2014, 15(2), p. 154‒162.
Holick M.F., Tuohimaa P. et al., 2006; Gissel T. et al, 2008; S. Pilzetal., 2013.
Клинические рекомендации «Дефицит витамина D у взрослых: диагностика, лечение и профилактика». Российская ассоциация эндокринологов. 2015. 75 с.
Как восстановить микрофлору кишечника • Причины, симптомы и признаки нарушения микрофлоры
Миллиарды полезных бактерий, живущих в ЖКТ человека, делают незаметную, но нужную работу. От чего возникает дисбактериоз и можно ли восстановить микрофлору кишечника?
«Миллиарды» – это не преувеличение, а преуменьшение. Биологи подсчитали, что в кишечнике здорового человека проживает примерно 50 триллионов микроорганизмов. Хотя человек может жить с нарушениями микрофлоры ЖКТ или даже при полном ее отсутствии, это считается отклонением от нормы. Также нежелателен дисбаланс между разными микроорганизмами или преобладание патогенных видов. Поэтому важно поддерживать здоровье кишечника и его обитателей – и речь здесь не столько о лечении, сколько о правильном питании и образе жизни.
Что такое микрофлора кишечника
Микрофлора кишечника – это совокупность всех микроорганизмов, которые живут в ЖКТ здорового человека. При этом в желудке их намного меньше, поскольку кислая среда неблагоприятна для большинства бактерий. Большая часть микрофлоры сосредоточена в тонком и толстом кишечнике. В основном это – лактобациллы, бифидобактерии и бактероиды. Полезные бактерии в кишечнике помогают организму усвоить питательные вещества, которые не переварились в желудке. Кроме этого, микрофлора кишечника тренирует иммунную систему человека
Причины нарушения микрофлоры кишечника
В очень редких случаях микрофлора кишечника исчезает полностью. Гораздо чаще врачи сталкиваются с уменьшением количества нужных видов микроорганизмов и ростом патогенной флоры. Произойти это может по нескольким причинам:
- пищевое или химическое отравление;
- хронические заболевания ЖКТ;
- инфекционное заболевание;
- лечение антибиотиками или иными подавляющими микрофлору препаратами.
Это состояние врачи называют дисбактериозом или дисбиозом кишечника. Важно понимать, что это не самостоятельная болезнь, а синдром. Поэтому правильнее лечить первопричину, а не сам дисбактериоз.
Симптомы и признаки нарушения микрофлоры кишечника
Даже сегодня микрофлора кишечника изучена недостаточно. Например, ученые до сих пор не могут ответить на вопрос: почему нарушение ее состава у одних людей протекает тяжело, а у других – бессимптомно и без ухудшения самочувствия. Так или иначе, предположить нарушение микрофлоры ЖКТ можно по следующим клиническим проявлениям:
- боль или чувство распирания в животе;
- диарея и/или метеоризм;
- ухудшение аппетита.
Диагностировать нарушение микрофлоры кишечника сложно, поскольку у каждого человека она уникальна. Поэтому врач будет в первую очередь искать причину дисбактериоза, а именно – заболевание, которое могло к этому привести.
Как восстановить микрофлору кишечника народными средствами
К сожалению, достоверных исследований, которые бы показали действенность альтернативной медицины в данном случае, нет. Нормализовать микрофлору кишечника можно лишь опосредованно: улучшая качество жизни. Речь идет не только о правильном питании, но и о физических активностях, отказе от вредных привычек и др. В частности, рацион с высоким содержанием растительных волокон (фрукты, овощи, злаки) благоприятно влияет на микрофлору кишечника, поскольку некоторые бактерии питаются клетчаткой.
Восстановление микрофлоры после антибиотиков
После приема некоторых лекарств (в частности, антибиотиков) в микрофлоре кишечника может наблюдаться дисбаланс. Например, место убитых лекарствами лактобактерий могут занять грибковые культуры или протеи, на которых антибиотики не действуют. Непосредственного лечения, позволяющего быстро восстановить микрофлору кишечника, современная медицина предложить не может. Чаще всего микрофлора приходит в норму самостоятельно, через некоторое время после отмены антибиотиков. Как долго придется ждать? Как правило, несколько недель. По результатам анализов врач дополнительно может назначить средства, подавляющие патогенную флору (например, противогрибковые препараты).
К сожалению, широко рекламируемые пробиотики и препараты с лакто– и бифидобактериями не имеют доказанной эффективности. Проблема в том, что полезные микроорганизмы невозможно доставить туда, где они нужны, живыми. Так, двенадцатиперстная кишка человека содержит агрессивные пищеварительные ферменты, которые убивают большинство микроорганизмов. Поэтому до кишечника «полезные бактерии в капсулах» просто не доходят.
Какие продукты восстанавливают микрофлору кишечника
Важно понимать, что какими бы полезными не были продукты, в кишечник они попадают в полностью переваренном состоянии. И однозначно говорить, например, что кефир улучшает микрофлору за счет содержания полезных бактерий, не совсем верно. Поэтому после отравления, диареи или иного расстройства ЖКТ необходимо, в первую очередь, снизить нагрузку на организм, придерживаясь определенной диеты.
Вот пример лечебного питания, назначаемого при заболеваниях кишечника:
| Можно | Нельзя |
|---|---|
| Сухари из белого хлеба (без добавления сахара, соли и специй) | Сдобные мучные изделия, черный хлеб, пирожные |
| Супы на обезжиренном бульоне или овощном отваре | Наваристые мясные бульоны, грибные супы |
| Нежирные сорта мяса и птицы в виде отварных и паровых блюд | Жирное мясо и рыбу, жареные блюда, колбасы, соленая рыба и икра |
| Каши на воде (рис, греча, овсянка, манка) | Перловка, макароны, бобовые |
| Творог и кисломолочные продукты | Цельное молоко и сливки |
| Свежие или печеные фрукты без кожуры (в том числе в виде пюре) | Фрукты и овощи, содержащие много грубой клетчатки (капуста, морковь, груши, абрикосы) |
| Кисели, желе, отвар шиповника, разбавленные ягодные соки | Газированные напитки, алкоголь, кофе |
Несмотря на то, что сырые фрукты и овощи надо вводить в меню аккуратно, полностью отказываться от них нельзя. Помимо содержания необходимых витаминов, клетчатка стимулирует перистальтику, что может уберечь от запора. А вот отвары лечебных трав без рекомендации врача принимать не стоит.
Как защитить микрофлору при беременности и подготовиться к родам без медикаментов?
Беременность это не только радостное ожидание, бабочки в животе и первые фото малыша на УЗИ. Это еще и испытание для организма будущей матери. Гормональный фон меняется, донимают странные вкусовые предпочтения, преследуют запахи, часто обостряются хронические заболевания и возникают новые проблемы со здоровьем. И среди них нередок вагинальный дисбактериоз: появляются зуд, жжение, выделения, боль в моменты интимной близости. Но дисбактериоз — коварная штука и часто протекает бессимптомно, между тем, он может быть очень опасен.
Чем опасен дисбактериоз?
Гормональная перестройка не лучшим образом влияет на микрофлору влагалища и кишечника беременной. Но сохранить нормальную микрофлору во время беременности – это очень важно! Именно эту микрофлору получает ребенок при рождении. И она должна быть здоровой!
В нашем организме миллиарды разных бактерий. Часть из них полезны и необходимы человеку, а часть, наоборот, приводят к болезням. Противостояние полезных и болезнетворных бактерий идет постоянно. И в наших интересах помочь полезным бактериям занять свое место под солнцем. Окружающая среда просто кишит болезнетворными бактериями, а значит они постоянно получают «новых бойцов» из загрязненного воздуха, несвежих продуктов или водопроводной воды.
При беременности организму приходится работать за двоих, иммунитет снижается, и болезнетворные бактерии могут взять верх, изменить нормальную микрофлору. Вместе с будущей матерью страдает и плод – еще не рожденный ребенок. Дисбактериоз может привести к вагинозу, запорам, инфицированию влагалища и даже к раку шейки матки.
Микрофлора кишечника и родовых путей связаны между собой!
Мало кто знает о транслокации бактерий. Оказывается, жизнеспособные микроорганизмы способны проходить через слизистую оболочку желудочно-кишечного тракта и мигрировать в другие органы: печень, лимфоузлы, селезенку. Мигрируют они и во влагалище, и в родовые пути.
Транслокация полезных бактерий способствует быстрому заживлению ран, снижению риска послеоперационных осложнений. А миграция патогенных, наоборот, способна вызвать неприятности в любом месте.
Нарушение же нормофлоры влагалища способно лишить здоровья и будущего ребенка, ведь свою первую микрофлору он получает именно от матери. Поэтому так важно в период беременности и подготовки к родам поддерживать микроэкологический баланс женского организма.
| фото с сайта mamalubit.ru |
Как защититься от дисбактериоза во время беременности, если львиная доля лекарств противопоказана?
Защититься от дисбактериоза и поддерживать микрофлору в норме помогут кисломолочные продукты с пробиотиками.
Не все кисломолочные продукты, стоящие на полках магазинов, помогут в восстановлении микрофлоры: сколько бы вы не съели магазинных йогуртов и биойогуртов, толку будет мало. Концентрация пробиотических бактерий в промышленных биойогуртах слишком мала, а классические йогурты вообще не содержат пробиотических культур.
Помочь быстро восстановить и защитить микрофлору способны только специальные пробиотические продукты, в которых пробиотики являются не вспомогательной добавкой, а основой заквасочной микрофлоры и непосредственно участвуют в процессе ферментации молока. Но такие продукты редко продаются в обычных супермаркетах: у них часто специфический вкус, и цены на них кусаются.
Что делать?
Пробиотические кисломолочные продукты можно приготовить дома, на собственной кухне! Потребуется йогуртница или термос, пакет молока и специальная сухая закваска, в состав которой входят полезные молочнокислые бактерии. Такой пробиотический продукт принесет реальную пользу организму: устранит запоры, которые так часто донимают во время беременнности, защитит от дисбактериоза и нормализует микрофлору. Приготовленный дома пробиотик всегда свежий, без каких-либо посторонних добавок, способных вызвать аллергию, имеет высокую (10 в 9 степени) концентрацию полезных бактерий и отличается приятным нежным вкусом и ароматом.
Это просто находка для беременных, желающих выносить и родить здорового ребенка, сохранив свое собственное здоровье! Замечательно он подходит и детям.
Какие сухие закваски для приготовления пробиотиков дома выбрать?
В России продают импортные и отечественные закваски. Но разработки отечественных микробиологов гораздо глубже и обширнее, чем у зарубежных коллег. А пробиотические закваски и вовсе являются исключительной компетенцией отечественной микробиологии.
В России самое авторитетное биотехнологическое предприятие — ФГУП «Экспериментальная биофабрика». Здесь десятилетиями накапливался опыт в селекции молочнокислых и пробиотических микроорганизмов и в производстве заквасочных культур. Здесь же производятся и закваски «Йогуртель», имеющие самый широкий (18 видов продукции) ассортимент на рынке. И особое внимание заслуживает не имеющая аналогов пробиотическая серия «Йогуртель ProBio Complex».
Серия заквасок «Йогуртель ProBio Complex» насчитывает 6 видов: Биолакт, Бифилакт, Нормофлор, Наринэль, Нормолакт, Виталактон. Закваски расфасованы в небольшие пакетики, которые удобно использовать в домашних условиях.
Эта серия разработана специально для будущих мам и их деток, которые нуждаются в повышенной защите микрофлоры. Именно закваски «Йогуртель ProBio Complex» помогут защититься от дисбактериоза и сохранить нормальную микрофлору без применения лекарств.
Смешайте молоко с одной из этих заквасок, разлейте его по баночкам и оставьте в йогуртнице сквашиваться на 8-10 часов. Продукты на основе заквасок этой серии, в отличие от сухих форм пробиотиков, не только более полезны, но и имеют приятный кисломолочный вкус. А благоприятное влияние на организм вы почувствуете уже через несколько дней.
В будущем у вас уже не возникнет вопрос, какие закваски выбрать для приготовления кисломолочного прикорма своему малышу.
Чем отличаются друг от друга пробиотические закваски «Йогуртель»?
Состав каждой закваски «Йогуртель» строго подобран по соотношению различных культур, чтобы получить продукт с нужными характеристиками. Из 1 пакетика закваски Йогуртель можно сделать 3 литра полезного пробиотического продукта!
Кисломолочный Биолакт атакует патогенные и условно-патогенные бактерии. В закваске Биолакт специально подобранные ацидофильные бактерии усилены многовидовым комплексом лактобацилл и бифидобактериями трех видов, которые присущи нормальной микрофлоре кишечника детского организма. Биолакт очень эффективен при дисбактериозах и детских кишечных инфекциях.
Бактериальный состав: Lactobacillus acidophilus, L. fermentum, L. plantarum, L. casei, Streptococcus thermophilus, Bifidobacterium bifidum, B. Breve, B. infantis.
Закваска Бифилакт – это многовидовая смесь бифидобактерий и молочнокислых бактерий, подобранных в оптимальных пропорциях. Готовый продукт обладает нежным приятным вкусом, содержит пробиотические культуры в высокой концентрации, насыщен витаминами, ферментами и незаменимыми аминокислотами. Он очень нравится детям.
Бактериальный состав: Lactococcus lactis subsp. diacetilactis, Streptococcus thermophilus, Lactobacillus plantarum, Bifidobacterium bifidum, B. Longum.
В результате сквашивания молока закваской Нормофлор получается пробиотический кисломолочный продукт с высокой концентрацией полезных бактерий, с нежным приятным вкусом и низкой кислотностью, что важно при использовании его в качестве первого прикорма (продукты с повышенной кислотностью противопоказаны детям первых лет жизни). В этой закваске бифидо- и лактобактерии, так необходимые женскому организму, дополнены пропионовокислыми бактериями. Они обладают выраженными антистрессовым и антимутагенным свойствами.
Бактериальный состав: Lactococcus lactis subsp. cremoris, Bifidobacterium bifidum, B. infantis, Lactobacillus acidophilus, L. casei, Propionibacterium shermanii.
Ацидофильная палочка хорошо известна своей способностью эффективно подавлять развитие нежелательной микрофлоры. Она лучше, чем другие молочнокислые бактерии, переносит высокую кислотность желудочного сока и легко достигает кишечника, где и проявляет в полной мере все свои целебные свойства, превосходя по своим показателям болгарскую палочку.
В закваске Наринэль сразу 5 различных штаммов ацидофильной палочки и два вида лактококков. Продукт, полученный с помощью закваски «Наринэль» превосходит хорошо известный классический Наринэ по органолептическим показателям и по комплексу синтезируемых витаминов, аминокислот, ферментов.
Бактериальный состав: Lactococcus lactis subsp. cremoris, Lactococcus lactis subsp. lactis, Lactobacillus acidophilus штаммы № 5е, № 3е, № 20Т, № 336, № 22п5.
Пробиотический кисломолочный продукт, полученный на основе закваски Нормолакт, быстро нормализует уровень лактобактерий при дисбактериозе и различных нарушениях биоценоза кишечника. Пропионовокислые бактерии, содержащиеся в закваске, активно продуцируют витамины группы В (особенно В12), стимулируют развитие собственных кишечных бифидобактерий и подавляют развитие гнилостных бактерий и грибов.
Бактериальный состав: Lactococcus lactis subsp. cremoris, Lactobacillus plantarum, L. casei, Propionibacterium shermanii.
Пробиотические культуры, входящие в состав закваски Виталактон, быстро устраняют дисбиотические нарушения кишечной микрофлоры и поддерживают ее в нормальном состоянии. Ароматобразующие лактококки придают продукту мягкий кисломолочный вкус и аромат, который оценят и полюбят не только опытные знатоки, но самые маленькие дегустаторы.
Бактериальный состав: Lactococcus lactis subsp. diacetilactis, Lactobacillus acidophilus, Streptococcus thermophilus, Bifidobacterium bifidum, B. Longum.
Где купить пробиотические закваски «Йогуртель»?
Внимание! В настоящее время закваски пробиотической серии «Йогуртель» уже можно приобрести в аптечной сети «Фармленд».
Любая хорошая мать отдаст что угодно, чтобы родить здорового малыша. Но вам не придется тратиться на дорогостоящие лекарства, чтобы сохранить здоровую микрофлору.
Если вы намерены благополучно выносить и родить малыша, не отказывайте себе в удовольствии полакомиться кисломолочными продуктами на основе заквасок «Йогуртель». Это и вкусно и полезно для вас и вашего будущего ребенка.
Микрофлора кишечника: значение для человека
Оглавление
Многие факторы оказывают своё влияние на организм человека и микрофлору в частности. Среди них — лечение антибиотиками, во время которого для кишечника могут назначаться специальные препараты, например пробиотики или метабиотики. Почему важно поддерживать баланс кишечной микрофлоры — выясним в статье.
Желудочно-кишечный тракт (ЖКТ) человека – это огромная территория площадью 250-400 кв.м, на которой происходит взаимодействие между организмом человека и окружающей его средой. В среднем за всю жизнь через ЖКТ человека проходит около 60 тонн пищи и множество микроорганизмов, которые потенциально могут нанести вред здоровью [1].
Интересен тот факт, что сам по себе человеческий организм заселен более чем триллионом микробов, при этом более 60% этих микробов находятся в кишечнике [2]. Совокупность микроорганизмов, населяющих кишечник, называют кишечной микрофлорой или кишечной микробиотой [3]. Кишечная микрофлора сопровождает человека всю жизнь и имеет огромное значение в поддержании здоровья человека. Она обладает защитной, пищеварительной, метаболической и иммуномодулирующей функцией [4].
Влияние микрофлоры на организм
Защитная функция. Микробы, населяющие кишечник в норме, препятствуют размножению болезнетворных микроорганизмов. Микрофлора образует вещества, препятствующие размножению патогенных микробов. Например, вещество бактериоцин. Также она конкурирует за питательные вещества с патогенными микроорганизмами.
Пищеварительная функция. Микрофлора участвует в пищеварении. Происходит образование микроорганизмами ферментов, расщепляющих компоненты пищи (жиры, углеводы и др.).
Метаболическая функция. Происходит пополнение полезных веществ в организме. Нормальная микрофлора кишечника участвует в образовании витаминов группы B, K, некоторых аминокислот.
Иммуно-модулирующая функция. Микрофлора кишечника участвует в активации работы иммунной системы, синтезе иммунных факторов защиты организма человека от патогенов.
Препараты для микрофлоры
Нарушение баланса нормальной кишечной микрофлоры, или дисбиоз, ассоциировано с нарушением работы желудочного-тракта и других органов и систем [2]. Восстановление микрофлоры кишечника могут взять на себя метабиотики. Например, метабиотик нового поколения «Актофлор-С». Он представляет собой комплекс аминокислот и органических кислот, синергичное действие которых повышает физиологическую активность и стимулирует рост собственной полезной микрофлоры человека. Препарат способствует устранению симптомов кишечных расстройств, таких как диарея, запор, вздутие живота, боль, способствует улучшению обмена веществ, а также положительно влияет на иммунитет [5]. Подробнее о компонентах препарата и их действии можно узнать здесь.
Список литературы:
1. Thursby E., Juge N. Introduction to the human gut microbiota //Biochemical Journal. – 2017. – Т. 474. – №. 11. – С. 1823-1836.
2. Ардатская М. Д. Пробиотики, пребиотики и метабиотики в коррекции микроэкологических нарушений кишечника //Медицинский совет. – 2015. – №. 13.
3. Backhed, F. (2005) Host-bacterial mutualism in the human intestine. Science 307, 1915–1920
4. Булатова Е. М. и др. Кишечная микробиота: современные представления //Педиатрия. Журнал им. ГН Сперанского. – 2009. – Т. 87. – №. 3.
5. Согласно инструкции по применению препарата «Актофлор-С».
Производство пробиотической продукции | Инновационная компания
Способствуют восстановлению микрофлоры кишечника «ЖИВАЯ ЗАЩИТА ЖИВЫМИ БАКТЕРИЯМИ»
Пробиотики – это живые микроорганизмы, которые при попадании в желудочно-кишечный тракт человека в достаточном количестве, сохраняют свою активность, жизнеспособность и оказывают положительное влияние на здоровье человека.
ООО «Инновационная компания «Экобиос» в Медико-экологическом центре представляет препараты, полученные с помощью уникальной технологии производства жидких концентратов живых бифидо- и лактобактерий. На сегодняшний день разработана следующая оздоровительная продукция:
- — «Соя-лактум» — комплексный биопродукт – жидкий препарат лактобактерий на основе гидролизатно-соевой среды;
- — «Соя-бифидум» — комплексный биопродукт – жидкий препарат бифидобактерий на основе гидролизатно-соевой среды;
- — «Эуфлорин®-L» — комплексный биопродукт – жидкий препарат лактобактерий на основе гидролизатно-молочной среды;
- — «Эуфлорин-B»® — комплексный биопродукт – жидкий препарат бифидобактерий на основе гидролизатно-молочной среды;
- — «Пробиотик на основе гидролизатно-соевой среды (ГСС)» — жидкий концентрат бифидобактерий;
- — Закваска «Йогуртовая» — функциональные компоненты, необходимые для производства продуктов переработки молока: закваска с маркировкой «Инновационная компания «Экобиос» — жидкий препарат лактобактерий на основе гидролизатно-соевой среды;
- — Квас «Пользишка» — Напиток обладает приятным освежающим вкусом, улучшает обмен веществ. Он утоляет жажду, бодрит и нормализует обменные процессы в организме. Обладает высокой энергетической ценностью, способствует пищеварению благодаря содержащимся в нем бифидобактериям, которые облегчают переваривание пищи, её всасывание и повышают аппетит. В «ПОЛЬЗИШКЕ»® содержатся витамины B1 и E, кальций, магний, фосфор, что объясняет его полезные свойства, а также — ценные ферменты и незаменимые аминокислоты, которые играют огромную роль в организме по разложению и выведению мертвых, больных и патологических клеток. Пейте «Пользишку» на здоровье!
ООО «Инновационная компания «Экобиос» — единственный в Оренбургской области производитель физиологичных для организма, биологически активных препаратов, основанных на использовании штаммов Bifidobacterium и Lactobacillus. Технологии производства и наименования пробиотиков защищены патентами на изобретение и товарными знаками России.
Уникальность пробиотиков, изготовленных ООО «Инновационная компания «Экобиос»:
- в состав входят живые бактерии и продукты их жизнедеятельности: витамины, незаменимые аминокислоты и иммуномодулирующие вещества;
- жидкие пробиотические препараты – это источник микроорганизмов для нормализации микрофлоры кишечника;
- в их состав входят 5 миллиардов живых бифидо- и лактобактерий, и продукты их жизнедеятельности;
- препараты разрешены для приема детям, начиная с раннего возраста, и взрослым;
- не имеют противопоказаний, нетоксичны, не вызывают привыкания;
- при изготовлении препаратов не используются генно-модифицированные компоненты и пищевые добавки.
Более высокий эффект достигается в сочетании препаратов лактобактерий и бифидобактерий.
Оздоровительная продукция соответствует Техническим регламентам Таможенного союза ТР ТС 021/2011; ТР ТС 022/2011; ТР ТС 029/2012, ТР ТС 033/2013. и производится в соответствии с документами:
- СГР № RU.77.99.88.003.E.003978.10.18 от 12.09.2018 на основании Экспертного Заключения ФГБУН «ФИЦ питания и биотехнологии» № 529/Э-475/б-18 от 19.07.2018 г.;
- СГР № RU.77.99.88.003.E.004460.10.18 от 10.10.2018 на основании Экспертного Заключения ФГБУН «ФИЦ питания и биотехнологии» № 529/Э-631/б-18 от 27.09.2018 г.;
- СГР № RU.77.99.88.003.E.001036.03.19 от 22.03.2019 на основании Экспертного Заключения ФБУЗ ФЦГ и Э Роспотребнадзора № 10 ФЦ/612 от 14.03.2019 г.;
- СГР № RU.77.99.88.003.E.001255.04.19 от 04.04.2019 на основании Экспертного Заключения ФБУЗ ФЦГ и Э Роспотребнадзора № 10 ФЦ/672 от 21.03.2019 г.;
- Декларации о соответствии ЕАЭС № RU Д-RU/АГ81.В.20053 до 02.05.2023 г. на основании Протокола № 04706-314-1-18/БМ от 28.04.2018 г. Испытательной лаборатории ООО «Инновационные решения» ;
- Декларация о соответствии ЕАЭС № RU Д-RU.АД53.В.02518 до 02.05.2023 г. на основании Протокола испытаний № 4145 от 19.11.2018 г. Испытательного лабораторного центра Федерального бюджетного учреждения здравоохранения «Федерального центра гигиены и эпидемиологии» Роспотребнадзора.
Технические условия (ТУ) 10.89.19-012-14498222-2018;
Технические условия (ТУ) 10.89.19-003-95665535-2019;
Технические условия (ТУ) 10.89.19-003-11908694-2018;
Технические условия (ТУ) 10.89.19-004-11908694-2018.
Препараты используются:
— для нормализации микрофлоры кишечника при синдроме дисбактериоза в гастроэнтерологии, колонопроктологии, педиатрии, оториноларингология, дерматологии, акушерстве и гинекологии, урологии, аллергических и иммунодефицитных состояниях;
— для уменьшения дисбиотического, токсического действия антибиотиков, цитостатиков, противотуберкулёзных препаратов, анальгетиков, стероидных гормонов и антидепрессантов;
— для восстановления микрофлоры кишечника онкологических больных, получающих химио- и лучевую терапию;
— при влиянии загрязнений окружающей среды , включая экозависимые заболевания;
— при эмоциональном и физическом стрессе.
Бифидо- и лактобактерии синтезируют достаточное количество важных для организма человека витаминов: витамины группы В, РР, витамин Н, иммуностимулирующие вещества, незаменимые аминокислоты.
Если Вам или Вашему ребёнку необходимо пройти курс лечения антибиотиками, биопрепараты, выпускаемые МЭЦ ООО «Инновационная компания «Экобиос» помогут перенести это лечение без тяжёлых последствий для желудочно-кишечного тракта.
Получить консультации и приобрести препараты можно по адресу: г. Оренбург, ул. Карагандинская , 48А, Торговый отдел «Будьте здоровы», тел. (3532) 70-31-84 и ул. Новая, 4/1 , 2-ой этаж, тел. (3532) 52-84-80.
➤ Лактофильтрум® 325 мг + 120 мг инструкция по применению
Торговое название препарата: Лактофильтрум®
Международное непатентованное название или химическое (группировочное) наименование лекарственного препарата: лактулоза + лигнин гидролизный
Лекарственная форма: таблетки
Состав на одну таблетку
Лигнин гидролизный (в пересчете на сухое вещество) 355 мг, Лактулоза (в пересчете на 100 % вещество) 120 мг
Вспомогательные вещества: натрия кроскармеллоза 20мг, магния стеарат 5мг, целлюлоза микрокристаллическая до получения таблетки массой 550 мг
Описание:
Капсуловидные двояковыпуклые таблетки темно-коричневого цвета с бело-серыми вкраплениями с риской.
Фармакотерапевтическая группа: энтеросорбирующее средство
Код ATX: A07BC
Фармакологические свойства:
Фармакологическое действие препарата обусловлено свойствами, входящих в состав активных компонентов — лигнина и лактулозы.
Лигнин гидролизный — природный энтеросорбент, состоящий из продуктов гидролиза компонентов древесины, обладает высокой сорбирующей активностью и неспецифическим дезинтоксикационным действием. Связывает в кишечнике и выводит из организма патогенные бактерии и бактериальные токсины, лекарственные препараты, соли тяжелых металлов, алкоголь, аллергены а также избыток некоторых продуктов обмена веществ, в том числе билирубин, холестерин, гистамин, серотонин, мочевину, иные метаболиты, ответственные за развитие эндогенного токсикоза.
Не токсичен, не всасывается, полностью выводится из кишечника в течение 24 ч.
Лактулоза — синтетический дисахарид, молекула которого состоит из остатков галактозы и фруктозы. Лактулоза в желудке и верхних отделах кишечника не; всасывается и не гидролизуется. Высвобождающаяся из таблеток лактулоза в толстом кишечнике в качестве субстрата ферментируется нормальной микрофлорой кишечника, стимулируя рост бифидобактерий и лактобацилл. В результате гидролиза лактулозы в толстом кишечнике образуются органические кислоты — молочная, уксусная и муравьиная подавляющие рост патогенных микроорганизмов и уменьшающие вследствие этого продукцию азотсодержащих токсических веществ. Описанный процесс приводит к увеличению осмотического давления в просвете толстого кишечника и стимулированию перистальтики.
Комплексное действие препарата направлено на нормализацию микробиоценоза толстого кишечника и снижение интенсивности эндогенных токсических состояний.
Применение препарата в комплексной терапии бактериального вагиноза (дисбиоза влагалища) приводит к повышению эффективности терапии, в том числе, увеличению количества лактобацилл во влагалище, а также эффективному подавлению роста условно-патогенной флоры.
Показания к применению:
Нарушения микрофлоры кишечника (дисбактериоз кишечника), в том числе в результате антибиотикотерапии; в комплексной терапии синдрома раздраженного кишечника, гепатитов и цирроза печени; аллергических заболеваний (атопический дерматит, крапивница), бактериального вагиноза (дисбиоза влагалища).
Противопоказания
Индивидуальная непереносимость препарата, непроходимость кишечника, желудочно-кишечные кровотечения, галактоземия. Нежелательно использовать препарат при обострении язвенной болезни желудка и 12- перстной кишки, атонии кишечника.
Способ применения и дозы:
Внутрь, при необходимости после предварительного измельчения, запивая водой, за час до еды и приема других лекарственных средств.
При дисбактериозе кишечника:
- взрослым и детям старше 12 лет – по 2-3 таблетки 3 раза в день,
- детям от 8 до 12 лет – по 1-2 таблетки, 3 раза в день,
- детям от 3 до 7 лет – по 1 таблетке, 3 раза в день,
- детям от 1 года до 3 лет – по ½ таблетки, 3 раза в день.
При бактериальном вагинозе (дисбиозе влагалища):
По 2 таблетки 3 раза в день.
Средняя продолжительность курса лечения – 2-3 недели.
Длительное использование препарата и повторные курсы лечения должны проводится только по рекомендации врача.
Побочное действие
Возможны аллергические реакции на компоненты препарата, редко — метеоризм, диарея.
Передозировка:
Симптомы: запор, боли в животе. Лечение: прекращение приема препарата.
Взаимодействие с другими лекарственными средствами
Возможно, снижение лечебного эффекта некоторых одновременно принимаемых внутрь препаратов.
Особые указания
Препарат может использоваться в комплексной терапии совместно с другими лекарственными препаратами при соблюдении правила раздельного приема.
Форма выпуска
Таблетки.
По 10 или 15 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной. По 30 или 60 таблеток во флакон из пластика с навинчиваемой крышкой или в банку полимерную с навинчиваемой крышкой.
По 1, 2, 3 или 6 контурных ячейковых упаковок по 10 таблеток, 2 или 4 контурных ячейковых упаковки по 15 таблеток или 1 флакон или 1 банку вместе с инструкцией по применению помещают в пачку из картона.
Условия хранения
В защищенном от влаги и света месте при температуре не выше 30 ̊С. Хранить в недоступном для детей месте.
Условия отпуска из аптек:
Без рецепта.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение/организация, принимающая претензии:
АО «АВВА РУС», Россия,
121614, г. Москва, ул. Крылатские Холмы, д.30, корп.9.
Тел/факс: +7 (495) 956-75-54
avva.com.ru
Производитель:
АО «АВВА РУС», Россия,
610044, Кировская обл., г. Киров, ул. Луганская, д. 53а.
Тел.: +7 (8332)25-12-29, +7 (495)956-75-54
Как восстановить микрофлору кишечника | Городской медицинский центр GormedC
Чтобы привести микрофлору в норму, необходим комплексный подход к лечению. В него будут входить некоторые народные средства, правильное питание и медикаменты.
Противостоять бактериям и предотвращать их проникновение в желудочно-кишечный тракт должна микрофлора. Именно поэтому для постоянной правильной работы кишечника необходимо постоянное поступление определенных микроорганизмов. Они, прежде всего, необходимы для борьбы с патогенами. Всем известный дисбактериоз — нарушение баланса, связанного с их недостаточностью. Чащу всего подобное случается после принятия курса антибиотиков.
Восстановление микрофлоры кишечника
Чтобы привести микрофлору в норму, необходим комплексный подход к лечению. В него будут входить некоторые народные средства, правильное питание и медикаменты. Прежде чем начать лечение, необходимо проконсультироваться с гастроэнтерологом.
В зависимости от симптомов, выделяют 5 типов препаратов. В любом случае, можно предоставить проблему до ее появления. Употребляйте пробиотики вместе с антибиотиками. Стоит помнить, что последние назначают только при большом количестве патогенов. Перед их назначением следует сдать анализы, чтобы определить, восприимчивы они к подобному лечению. В инструкции к каждому препарату указывается правильная дозировка, частота применения. Не нужно превышать дозировку, так как это может оказать негативный эффект. К детским препаратам относят Хилак Форте и Линекс. Не стоит полагаться на отзывы на форумах, так как решающую роль при выборе лекарства всегда будет играть специалист-медик.
Можно сочетать медикаменты и народные средства. К ним можно отнести специальную брагу. Для ее изготовления нам потребуется пол-литра теплой воды, сахар и мед по одной столовой ложке и 2 грамма дрожжей. Достаточно просто все смешать и поставить в теплое место. Пить ее стоит между приемами пищи. Полезным может оказаться настрой из эвкалипта, укропа и мяты. Необходимо смешать три части перечной мяты, одну часть семян укропа и пять эвкалипта. Все это литром теплой воды и дать настояться час. Пейте по стакану смеси перед приемом пищи. Перед использованием этих народных рецептов стоит получить консультацию врача.
Диетический рацион
Придерживайтесь правильного рациона, так как это поможет снизить нагрузку на ваше пищеварение. Вся кисломолочная продукция помогает заполнить желудок нужными бактериями. Лучшим другом должны стать каши из круп, так как они не только помогают нормализовать обмен веществ, но и выведут токсины.
Влияние лечения антимикробными препаратами на микрофлору толстой кишки человека
Ther Clin Risk Manag. 2008 Dec; 4 (6): 1343–1358.
Отдел микробиологии, Национальный центр токсикологических исследований, FDA, Джефферсон, АР, США
Для корреспонденции: Фатеме Рафии, Отдел микробиологии, Национальный центр токсикологических исследований, FDA, Джефферсон, АР 71602, США, тел. + 1870 543 7342 , Факс +1870 543 7307, электронная почта
Авторские права © 2008 Dove Medical Press Limited.Все права защищеныЭта статья цитировалась в других статьях в PMC.
Реферат
Противомикробные препараты являются наиболее ценным средством лечения бактериальных инфекций. Однако назначение пациентам терапевтических доз противомикробных средств является основной причиной нарушения нормальной микрофлоры желудочно-кишечного тракта. Это нарушение приводит к ослаблению естественных защитных механизмов, обеспечиваемых микробной экосистемой толстой кишки, что делает хозяина уязвимым для заражения комменсальными микроорганизмами или внутрибольничными патогенами.В этом мини-обзоре обсуждается влияние противомикробных препаратов по отдельности и в комбинации на микрофлору толстой кишки человека.
Ключевые слова: антибиотики, кишечные бактерии
Введение
Экосистема микрофлоры толстой кишки человека, ее метаболические функции и ее устойчивость к колонизации жизненно важны для благополучия хозяина, производства жизненно важных метаболитов и предотвращения инфекций ( Эдлунд и Норд 1999b; Салливан и др. 2001a, 2001b). Различные ферменты в микробной экосистеме участвуют в деконъюгации, восстановлении и других биохимических действиях, что приводит к изменению биодоступности, активации или детоксикации различных молекул, включая метаболиты лекарств, высвобождаемые печенью через желчные протоки (Rowland 1995). Модели in vitro показали, что изменение популяционного состава микрофлоры кишечника человека сопровождается снижением устойчивости к колонизации (Wagner et al 2008). Кроме того, микробное сообщество может оказывать неизвестное влияние на иммунную систему (van der Waaij and Nord 2000). Микрофлора толстой кишки, по-видимому, стимулирует иммунную систему хозяина быстро реагировать на патогенные воздействия (Berg 1996). Хотя клетки кишечного тракта сосуществуют с нормальной комменсальной микрофлорой, они распознают и уничтожают вторгшиеся патогены, прежде чем вернуться к гомеостазу с комменсальными бактериями.Роли и влияние разных комменсальных бактерий различаются. Ответы хозяина на действие комменсальных бактерий генетически детерминированы (Prantera et al 1997). У пациентов с синдромом воспалительного кишечника иммунная система слизистых оболочек проявляет ненормальную реакцию на комменсальные бактерии у генетически предрасположенных лиц. Использование терапевтических агентов для воздействия на бактериальную популяцию может привести к микробному дисбалансу, который влияет на здоровье и вызывает заболевание. На основании клинических и эпидемиологических исследований было выдвинуто предположение, что как терапевтическое использование антибиотиков, так и типичные диеты в промышленно развитых странах могут нарушить нормальные опосредованные микробиотой механизмы иммунологической толерантности в слизистой оболочке, что также может привести к увеличению аллергических заболеваний дыхательных путей. (Новерр и Хаффнагл, 2005 г.).В следующих разделах будут обсуждаться другие эффекты клинического использования противомикробных препаратов на микрофлору кишечника.
Нарушение экосистемы
Хотя экосистема толстой кишки в целом стабильна, ее можно нарушить введением противомикробных препаратов для лечения или профилактики (Peck et al 1984). Бактерии толстой кишки подвергаются действию антимикробных агентов независимо от того, вводятся ли они перорально или путем инъекции через кровоток (Edlund and Nord 1999b).Это воздействие может происходить из-за неполного всасывания антимикробных агентов, вводимых перорально, из-за воздействия противомикробных агентов в секретах слюнных желез или слизистой оболочки кишечника или с желчью из печени (Nord et al 1984a, 1984b; Arvidsson et al 1988).
Степень изменений, происходящих в сообществе кишечной микрофлоры в результате введения противомикробных агентов, зависит от антибактериального спектра и их концентрации в содержимом просвета (Nord et al 1984a, 1984b).Антибиотики, принимаемые перорально, которые всасываются в верхней части тонкого кишечника, отличаются по своему действию от тех, которые плохо всасываются. Парентеральные противомикробные агенты, секретируемые с желчью или слизистой оболочкой, также влияют на восприимчивые популяции бактерий (Nord and Edlund 1990; Edlund and Nord 1999b). Воздействие антимикробных агентов на экосистему толстой кишки может привести к изменению популяции различных компонентов в результате подавления или уничтожения некоторых микроорганизмов, чрезмерного роста микроорганизмов, не восприимчивых к этим агентам, и создания устойчивых к противомикробным препаратам членов, которые обычно исключаются ( Норд 1993).
Влияние комменсальных микроорганизмов на колонизацию
Несколько факторов способствуют предотвращению колонизации некомменсальными микроорганизмами, среди которых конкуренция за питательные вещества, конкуренция за прикрепление и производство летучих жирных кислот (Nord et al 1984b). Летучие жирные кислоты, продуцируемые анаэробными бактериями, токсичны для некоторых других видов, особенно для энтеробактерий. Производство бактериоцинов энтеробактериями, стрептококками и анаэробными бактериями также ограничивает бактериальный рост.
Развитие устойчивых к противомикробным препаратам бактерий
Еще одним последствием воздействия антибиотиков, которое может иметь длительный эффект, является появление устойчивых к противомикробным препаратам бактерий, которые могут вызвать проблемы в долгосрочной перспективе (Nord and Edlund 1990). Эти организмы могут передаваться в разные места внутри хозяина, где они могут вызывать инфекцию, и другим хозяевам (Nord et al 1984b; Edlund and Nord 2000). Примером является инфекция мочевыводящих путей, вызванная устойчивым к противомикробным препаратам Escherichia coli (Winberg et al 1993; Edlund and Nord 2000).
Многоцентровое исследование восприимчивости (Aldridge et al 2001) показало изменения в структуре устойчивости анаэробных бактерий к различным антибиотикам. Устойчивость анаэробных бактерий к антибиотикам теперь известна для β-лактамов, клиндамицина, макролидов, тетрациклинов, фторхинолонов и нитроимидазола (Nord 2008). Метициллин-резистентные штаммы Staphylococcus aureus (MRSA) были выделены в амбулаторных условиях у детей с микробным дисбалансом толстой кишки в результате применения антибиотиков (Николаева и др., 2001).
Индукция ферментов в бактериях толстой кишки, которые делают противомикробные средства неэффективными, является еще одним побочным эффектом антимикробных средств (Finegold 1986). Введение β-лактамов привело к повышению уровня β-лактамаз в нормальной микрофлоре кишечника (Edlund et al, 1994). Сообщалось об индукции β-лактамаз у некоторых аэробных и анаэробных бактерий цефокситином. Однако, поскольку кал, по-видимому, ингибирует индукцию β-лактамаз, Stark и коллеги (1995) приписывают увеличение β-лактамаз отбору «стабильно дерепрессированных мутантов», а не индукции β-лактамаз.
Грибковые инфекции
Другая проблема, которая может возникнуть в результате лечения антибиотиками, — это заражение грибами (Louie et al 1985). Наблюдается чрезмерный рост грибков, особенно после лечения антибиотиками, снижающими популяцию анаэробных бактерий, у экспериментальных животных, здоровых людей и пациентов с нейтропенией (Kennedy and Voltz 1985; Louie et al 1985; Pletz et al 2004). Луи и его коллеги (1985) заключают: «Сохранение анаэробной флоры имеет решающее значение для предотвращения заражения грибами у пациентов с нейтропенией.«Грибковые инфекции могут вызывать серьезные проблемы у пациентов с ослабленным иммунитетом, вызывая диссеминированные инфекции в различных местах, которые могут привести к серьезным осложнениям (Gauthier and Klein 2008).
Кеннеди и его коллеги (1987) использовали Candida albicans для заражения мышей, леченных и не леченных антибиотиками, и обнаружили связь грибка с кишечным эпителием мышей, леченных антибиотиками, но не с таковыми у контрольных мышей, у которых была местная бактериальная флора. . У обработанных мышей часть грибковых клеток проникла глубоко в слизистую оболочку кишечного тракта, но большинство из них были связаны со слизистой оболочкой слепой кишки.
Влияние на патогенность бактерий
Противомикробные средства, помимо ограничения эффективности колонизационного барьера за счет нарушения нормальной кишечной микробиоты, могут также влиять на патогенность некоторых бактерий. Было показано, что фторхинолоны индуцируют бактериофаги и увеличивают продукцию токсина Шига в E. coli O157: H7, что может увеличивать вирулентность этого штамма (Zhang et al 2000). В нашей лаборатории один из пяти устойчивых к гатифлоксацину штаммов Clostridium perfringens также имел повышенную продукцию фосфолипазы C и перфринголизина O (Rafii et al, 2008).Субингибирующие концентрации ампициллина и клиндамицина могут напрямую влиять на приверженность Clostridium difficile , увеличивая экспрессию генов, необходимых для колонизации (Deneve et al 2008). В исследовании in vitro на животных было показано, что подкожное введение антибиотиков, нарушающих анаэробную флору, способствовало росту и продукции токсинов C. difficile в содержимом слепой кишки мыши. Антибиотики, не оказавшие значительного воздействия на анаэробные популяции, не влияли на рост или выработку токсинов (Pultz and Donskey 2005).Эти результаты подтверждают обеспокоенность государственных регулирующих органов, Всемирной организации здравоохранения и специалистов здравоохранения по поводу использования противомикробных препаратов для сельскохозяйственных животных (Cerniglia and Kotarski 1999).
Другие побочные эффекты
Использование противомикробных препаратов обычно сопровождается желудочно-кишечными расстройствами, особенно диареей, связанной с приемом антибиотиков, которая часто проходит вскоре после прекращения приема противомикробных препаратов и восстановления баланса в экосистеме (Nord and Edlund 1990) .Это происходит у 15–25% пациентов, получающих антибиотики, и частота его возникновения различается при приеме различных антибиотиков. Это вызвано нарушением микрофлоры кишечника от легкого до тяжелого; легкие случаи могут быть результатом нарушения обмена углеводов или желчных кислот. Распространение патогенов в результате этого нарушения может вызвать тяжелые случаи диареи, связанной с приемом антибиотиков (Schröder et al 2006).
У хозяев с ослабленным иммунитетом, ослабленных хирургическим вмешательством или пожилым возрастом, могут возникать тяжелые инфекции, вызванные условно-патогенными микроорганизмами.Потенциальные патогены, такие как C. difficile , проживающие в толстой кишке, могут вызывать C. difficile -связанную антибиотико-ассоциированную диарею и / или псевдомембранозный колит (Aronsson et al 1981, 1985; Ambrose et al 1985; Finegold 1986; Edlund and Норд 2000). Finegold (1986) отметил, что, за исключением ванкомицина и парентерально вводимых аминогликозидов, большинство других противомикробных агентов были причастны к инфекциям C. difficile .
Системные инфекции у пациентов с ослабленным иммунитетом, вызванные обычно безвредными микроорганизмами, также наблюдались после лечения антибиотиками.Суперинфекция, в которую вовлечены все основные типы анаэробов, также связана с использованием противомикробных препаратов. В общем, осложнения, связанные с противомикробными препаратами, являются результатом подавления местной флоры, которая предотвращает колонизацию и разрастание потенциальных патогенов, находящихся в толстой кишке, которые могут вызывать диарею, колит или другие септические состояния (Finegold 1986).
Оценка действия противомикробных препаратов на микрофлору кишечника
Очевидные последствия воздействия противомикробных препаратов на микрофлору толстой кишки были измерены путем подсчета видов бактерий после клинического лечения пациента или экспериментального воздействия на добровольцев различных антимикробных препаратов. агентов (Норд и Эдлунд, 1990).Оценка паттернов устойчивости анаэробных бактерий в слюне и кале амбулаторных и госпитализированных пациентов, независимо от лечения антибиотиками, показала связь между относительным количеством устойчивых к антибиотикам анаэробных бактерий, госпитализацией и лечением антибиотиками. Количество устойчивых штаммов коррелирует с продолжительностью лечения антибиотиками (Stark et al 1993).
В многочисленных исследованиях ученые оценивали действие противомикробных агентов на бактерии толстой кишки, вводя антибиотики своим испытуемым и измеряя их влияние на популяции различных бактериальных родов.Изучены все основные классы противомикробных средств. Большая часть этой работы была выполнена лабораторией Карла Норда в больнице Каролинского университета в Стокгольме, Швеция, и было написано несколько обзоров (Nord et al 1984a, 1984b, 1988; Nord and Edlund 1990; Nord 1993; Edlund and Nord 1999b; Sullivan et al 2001a). Образцы фекалий, которые обычно считаются репрезентативными для микробиоты толстой кишки, культивировали на неселективных и селективных средах. Были подсчитаны различные типы колоний, выделены в чистой культуре и идентифицированы до уровня рода.Их количество сравнивали с количеством бактерий, присутствующих от каждого рода до лечения, чтобы измерить эффект антибиотика в уменьшении количества бактерий или обеспечении увеличения, разрастания или размножения других. Все новые колонизирующие бактерии были проверены на чувствительность к введенным антибиотикам (Nord et al 2006a, 2006b). Сообщалось о бактериях, которые были уничтожены, и о тех, которые переросли другие виды. Также было обнаружено развитие устойчивости среди бактерий в нормальной флоре и чрезмерный рост таких микроорганизмов, как дрожжи, которые контролируются нормальной микрофлорой.В большинстве случаев популяции одних родов бактерий уменьшались, а численность бактерий других родов увеличивалась. Это увеличение сопровождалось либо увеличением резистентных штаммов бактерий, либо чрезмерным ростом грибов (Louie et al 1985; Nilsson-Ehle et al 1985).
Экспресс-методы с использованием анализа ДНК также использовались для демонстрации воздействия противомикробных препаратов на микрофлору кишечника человека. De La Cochetiere и его коллеги (2005) выделили фекальную ДНК добровольцев после лечения антибиотиками и амплифицировали бактериальные гены 16S рРНК с помощью ПЦР с общими праймерами, которые были проанализированы с помощью гель-электрофореза в градиенте температуры.Сравнивая модели доминирующих видов с образцами, полученными до лечения, они определили влияние лечения на изменение микробиоты.
Поскольку повсеместное появление различных устойчивых к противомикробным препаратам бактерий было проблематичным, а смертельные случаи стали результатом чрезмерного роста в остальном безобидных комменсальных микроорганизмов, которые не реагируют на доступные противомикробные средства, представляется своевременным рассмотреть влияние этих соединений на микроорганизмы толстой кишки , с акцентом на те, которые не были рассмотрены в предыдущих обзорах.
β-лактамы
β-лактамы — это старейший и наиболее широко назначаемый класс антибиотиков; этот класс включает пенициллины, цефалоспорины, монобактамы, карбапенемы и ингибиторы β-лактамаз.
Пенициллины
К членам этой группы относятся феноксиметилпенициллин, ампициллин, амоксициллин, пиперациллин, азлоциллин, темоциллин, тикарциллин, пивампициллин, талампициллин и баампициллин.
Цефалоспорины
Большинство из них являются полусинтетическими соединениями и не подвержены расщеплению β-лактамного кольца многими β-лактамазами.Они включают цефалоридин, цефазолин, цефаклор, цефроцил, цефбуперазон, цефуроксим, цефокситин, цефотиам, цефотаксим, цефоперазон, цефтриаксон, цефтазидим, цефтиазоксим, цефменоксим, цефотетан и цефрадин.
Монобактамы
β-лактамное кольцо в монобактамах находится отдельно и не слито с другим кольцом. Азтреонам является примером; обычно используется в сочетании с другими лекарствами.
Карбапенемы
По мере того, как все больше и больше бактерий развивают устойчивость к β-лактамным антимикробным агентам, продуцируя различные β-лактамазы, были предприняты усилия по поиску лекарств, на которые не действуют β-лактамазы.Карбапенемы включают имипенем, меропенем, эртапенем, фаропенем, дорипенем, панипенем и бетамипрон. Имипенем инактивируется в почках дегидропептидазой; чтобы предотвратить это, он используется в сочетании с циластатином, ингибитором почечной дегидропептидазы (Birnbaum et al 1985; Nord et al 1985). Помимо устойчивости к β-лактамазам, карбапенемы обладают широкой антибактериальной активностью.
Ингибиторы β-лактамаз
Эти соединения содержат β-лактамное кольцо, но обладают незначительной антимикробной активностью.Поскольку они связываются с β-лактамазами и предотвращают их атаку на другие β-лактамы, их вводят совместно с антимикробными β-лактамами.
Влияние лечения β-лактамами на микрофлору кишечника человека
Воздействие различных β-лактамных антибиотиков оценивалось как на людях-добровольцах, так и на пациентах, проходящих лечение. Различные исследования рассматривали эффекты группы пенициллина: ампициллин (Leigh, 1979), ампициллин плюс сульбактам (Kager et al, 1982), пиперациллин (Kager et al, 1983), азлоциллин (Nord et al, 1986a), темоциллин (van der Waaij 1985), тикарциллин и клавулановая кислота (Nord et al 1989) ().Все они уменьшили количество энтеробактерий, энтерококков и анаэробных бактерий. Лечение амоксициллином (Leigh and Nash 1979; Gipponi et al 1985) привело к подавлению количества энтеробактерий в одних испытаниях, но увеличило их количество в других (Brismar et al 1993b). В некоторых исследованиях после лечения амоксициллином, с клавулановой кислотой или без нее наблюдался избыточный рост C. difficile (Brismar et al 1993b; Lode et al 2001). В некоторых испытаниях наблюдали избыточный рост бактериями или Candida после приема вышеуказанных препаратов.Введение тикарциллина / клавулановой кислоты привело к увеличению количества энтерококков. Феноксиметилпенициллин не имел большого эффекта (Adamsson et al 1997).
Таблица 1
Влияние пенициллинов, отдельно или в сочетании с другими лекарствами, на микрофлору кишечника
Поскольку β-лактамы были первыми открытыми антибиотиками, их часто назначают для лечения различных инфекций, и в результате появилось много бактерий. сопротивление им. Присутствие β-лактамаз в различных бактериях часто приводит к неэффективности этих препаратов.Чтобы избежать развития резистентности и повысить эффективность лекарств, были разработаны другие β-лактамы, которые используются в комбинациях с ингибиторами β-лактамаз или другими лекарственными средствами ().
Таблица 2
Влияние выбранных β-лактамов, отличных от цефалоспоринов, в том числе в комбинации с другими лекарственными средствами, на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней и количество курсов лечения в день | Количество субъектов | Подавление бактерий | Размножение бактерий | Появились устойчивые штаммы или другие результаты | Дни до нормы после прекращения лечения | Ссылка | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Пиперациллин | 90/ тазобакт 4–8 | 20 | Энтеробактерии Энтерококки Бифидобактерии Эубактерии Лактобациллы Clostridia грамположительные кокки | Nord et al. (1993) | ||||||||
| Омепразол / амоксициллин | 20/1000 | 14/2 | 14 | внутримышечные изменения продукция -лактамазы | Stark et al. (1996) | |||||||
| Амоксициллин / клавулановая кислота | 1000 | 7 | 12 | Бифидобактерии Лактобациллы Клостридии | Энтерококки Escherichia coli | Clostridium difficile , выделенная от трех добровольцев | Lode et al. (2001) | |||||
| Амоксициллин | 500 | 7/3 | Brismar et al. (1993a, 1993b) | |||||||||
| Омепразол / амоксициллин / метронидазол | 20/1000/40 | Общая анаэробная микрофлора | Streptococcus spp. Enterococcus spp. Энтеробактерии Колонизация дрожжевыми грибами у девяти субъектов | 35 дней | Адамссон и его коллеги (1999) | |||||||
| Имипенем (хирургическая профилактика) | 500/1000 | 2/4 | 20 | Стафилококки Стрептококки Энтерококки Энтеробактерии Анаэробные кокки Бифидобактерии Эубактерии Лактобациллы Clostridia Fusobacteria Bacteroides | Без колонизации; в норме через 14 дней | Kager et al. (1988) | ||||||
| Pivmecillinam | 400 | 14–41 | 15 | E.coli | Sullivan et al. (2001b) | |||||||
| Ertapenem | 1000 | 7 | 10 | Lactobacilli Бифидобактерии Clostridia Bacteroides E. coli | Enterococci | Разрастание дрожжей | 21–35 дней | Плетц и его коллеги (2004) | ||||
| Азтреонам | пациенты с фебрамицином | Кишечные грамотрицательные бациллы Фекальные анаэробы | Грибковое заражение | Луи и его коллеги (1985) | ||||||||
| Азтреонам плюс клоксациллин | Гриб-отрицательная бактерия анаэробы | Грибковое заражение | Луи и его коллеги (1985) | |||||||||
| Моксалактам плюс тобрамицин | 9015 Фекальные грамотрицательные бактерии 9015 Луи и его коллеги (1985) | |||||||||||
| Имипенем | 500–1000 | 4–11 / 4 | 10 | Энтеробактерии Анаэробные кокки Бактероиды | ||||||||
| Меропенем | 500 | 7/3 | 10 | Энтеробактерии Стрептококки Clostridia Bacteroides грамотрицательные кокки | Enterococci | 14 дней | Bergan et al. (1991) |
Pivmecillinam
Sullivme et al. микрофлора 15 особей.Их лечили в течение 7 дней 400 мг пивмециллинама два раза в день, а затем снова через 14 и 21 день после начала приема. Число E. coli уменьшилось, но изменений в анаэробной микрофлоре не произошло.
Пиперациллин / тазобактам
Рассмотрено влияние пиперациллина на бактерии толстой кишки (Nord and Edlund 1990). Также изучалось влияние на экологию толстой кишки его использования в сочетании с ингибитором β-лактамазы, тазобактамом (Nord et al 1992, 1993; Nord and Lahnborg 1994).Оценивали влияние комбинации пиперациллин / тазобактам (4 / 0,5 г) на пациентов с внутрибрюшными инфекциями, которых лечили три раза в день в течение 8 дней; снизилось среднее количество энтеробактерий, энтерококков и анаэробов (бифидобактерий, эубактерий, лактобактерий, клостридий и грамположительных кокков). Анаэробные грамотрицательные кокки и Bacteroides spp. не были затронуты (). Количество бактерий нормализовалось после прекращения лечения (Nord et al 1992, 1993).
Омепразол и амоксициллин
Комбинация омепразола (20 мг, ингибитор протонной помпы для эрадикации Helicobacter pylori ) и амоксициллина (1000 мг) два раза в день в течение 14 дней приводила к изменениям микрофлоры кишечного тракта, увеличивает в количестве устойчивых энтеробактерий и увеличение продукции β-лактамаз, обнаруженное в образцах фекалий (Stark et al 1995; Adamsson et al 1999).
Комбинации омепразол / амоксициллин / метронидазол
Также изучались эффекты амоксициллина в сочетании с противомикробными средствами, эффективными против анаэробов.Метронидазол, который используется для лечения анаэробных и паразитарных инфекций, также используется для лечения H. pylori в сочетании с другими лекарствами. Лечение пациентов комбинацией омепразола 20 мг, амоксициллина 1 г и метронидазола 40 мг в течение 7 дней привело к изменению нормальной микрофлоры и выраженному подавлению анаэробной микрофлоры. Во время лечения некоторые пациенты также были заражены дрожжами. Значения МИК этих препаратов для Enterococcus spp.и Enterobacteriaceae увеличились (Adamsson et al 1999).
Амоксициллин / клавулановая кислота
Введение 1000 мг амоксициллина / клавулановой кислоты в течение 7 дней 12 здоровым людям (те же люди, которые лечились линезолидом 600 мг в течение 7 дней, с периодом вымывания 4 недели между курсами лечения) привело к увеличению количества энтерококков и E. coli и значительному снижению количества анаэробов, включая бифидобактерии, лактобациллы и клостридии. C. difficile был выделен у трех добровольцев (Lode et al 2001). Авторы пришли к выводу, что в отличие от линезолида, амоксициллин / клавулановая кислота не уничтожает грамположительные бактерии.
Десять добровольцев, получавших амоксициллин по 500 мг три раза в день в течение 7 дней, были колонизированы устойчивыми к амоксициллину бактериями, в основном E. coli , Klebsiella и Enterobacter (Brismar et al 1993b). Активность β-лактамазы была обнаружена в микрофлоре шести человек.
Имипенем
Кагер и его коллеги (1988) оценили влияние имипенема как при лечении, так и в профилактических целях на микрофлору кишечника. Использование 0,5 или 1 г имипенема четыре раза в день в течение 4–11 дней привело к снижению количества энтеробактерий, анаэробных кокков и Bacteroides spp. во время лечения. В дальнейшем микрофлора нормализовалась. Пациенты, получавшие 0,5 или 1 г имипенема для хирургической профилактики каждые 6 часов в течение 48 часов, имели подавленные уровни стафилококков, стрептококков, энтерококков, энтеробактерий, анаэробных бактерий, кокков, бифидобактерий, эубактерий, лактобацилл, клостридий, фузобактерий и Bacteroides spp.во время лечения; после этого уровни были нормальными. Колонизации устойчивыми к имипенему бактериями не происходило (Kager et al 1988, 1989).
Азтреонам с тобрамицином или клоксациллином
Луи и его коллеги (1985) использовали различные комбинации препаратов для лечения пациентов с фебрильной нейтропенией и сравнили их влияние на микробную экологию. Комбинации азтреонама либо с тобрамицином (15 человек), либо с клоксациллином (14 пациентов) привели к уничтожению кишечных грамотрицательных бацилл.Эти комбинации также вызвали уменьшение количества фекальных анаэробов, сопровождаемое пониженной концентрацией короткоцепочечных жирных кислот в фекальных супернатантах (Louie et al 1985). Разрастание грибков произошло у 27% субъектов, получавших азтреонам / тобрамицин, и у 43% субъектов, получавших азтреонам / клоксациллин. Комбинированная терапия моксалактамом / тобрамицином у 15 пациентов оказала аналогичное влияние на снижение анаэробов и грибковых заболеваний (81%), как и две предыдущие комбинации. Все пациенты были пациентами с фебрильной нейтропенией, поэтому авторы пришли к выводу, что поддержание анаэробной флоры было важным для предотвращения заражения грибами у пациентов с фебрильной нейтропенией.
Меропенем
Внутривенное введение 500 мг меропенема три раза в день в течение 7 дней у 10 пациентов привело к снижению количества энтеробактерий и стрептококков и увеличению количества энтерококков, клостридий, Bacteroides spp. И грамотрицательных кокки. Другие грамположительные кокки и палочки не пострадали. Через две недели после прекращения терапии микрофлора кишечника вернулась к норме (Bergan et al, 1991).
Эртапенем и цефтриаксон
Введение эртапенема (1 г в день) или цефтриаксона (2 г в день) 10 здоровым людям в течение 7 дней посредством инъекции привело к 4-логарифмическому снижению E.coli , а также уменьшение анаэробной микрофлоры, включая лактобациллы, бифидобактерии, клостридии и Bacteroides spp. Количество энтерококков увеличилось на 4 логарифма. В обоих случаях наблюдался избыточный рост дрожжей, но в обоих случаях микрофлора нормализовалась в течение 21–35 дней после завершения лечения (Pletz et al 2004).
Цефалоспорины
Различные цефалоспорины оказывают большое влияние на микрофлору толстой кишки (Nord and Edlund, 1990).Цефбуперазон (Kager et al 1986), цефокситин (Kager et al 1982), цефотаксим (Lambert-Zechovsky et al 1985), цефоперазон (Alestig et al 1983), цефтриаксон (Arvidsson et al 1982), цефаклор (Nord et al 1987), и цефотетан (Амброуз и др., 1985) снижали количество анаэробных бактерий и энтеробактерий. Все эти препараты, за исключением цефоперазона и цефтриаксона, также снижали количество энтерококков при большинстве курсов лечения. Цефотаксим уменьшал количество энтеробактерий и энтерококков в одном испытании. Цефалоридин (Амброуз и др., 1985) и цефрадин (Брамфитт и др., 1986) оказали незначительное влияние.Однако в результате применения всех этих препаратов, за исключением цефрадина, цефтазидима и цеф-буперазона, развились устойчивые бактериальные штаммы. C. difficile появился в некоторых испытаниях с цефепимом, цефтриаксоном и цефиксимом. Количество анаэробных грамположительных кокков увеличивалось после лечения цефтриаксоном и цефиксимом (Nilsson-Ehle et al 1985, Sullivan et al 2001a). Влияние других цефалоспоринов (цефпрозила, цефподоксима проксетила, цефтибутена и цефадроксила) на кишечную флору показано в.
Таблица 3
Влияние цефалоспоринов на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней и количество сеансов лечения в день | Количество субъектов | Подавление бактерий | Появление устойчивых штаммов или другие побочные эффекты | Дни до нормального состояния после прекращения лечения | Ссылка | |
|---|---|---|---|---|---|---|---|---|
| Cefprozil | 500 | 8/2 | 8 | Enterobacteria 9015occi | Мягкие стулья | 4 дня | Lode et al. (1992) | |
| Cefadroxil | 500 | 10 | 20 | Не сильно изменились Адамссон и его коллеги (1997) | ||||
| Цефподоксим проксетил | 200 | 7/2 | 10 | Стрептококки Энтеробактерии Clostridia | Enterococci Clostridium difficile | Активность β-лактамазы во флоре некоторых субъектов | Brismar et al. (1993b) | |
| Цефтриаксон | Бифидобактерии Clostridia Bacteroides E.coli | Энтерококки | Разрастание дрожжей | от 1 до 35 дней | Плетц и его коллеги (2004) | |||
| Цефтибутан | 400 | 10 | 14 9015occi | E. cocci | Повышенная колонизация β-лактамазой C. difficile у шести человек | Brismar et al. (1993a) |
Cefprozil
Введение цефпрозила привело к изменениям в популяциях определенных родов.Lode et al. (1992) изучали эффекты цефпрозила у восьми человек. Они вводили 500 мг цефпрозила два раза в день в течение 8 дней и обнаружили, что это привело к умеренному снижению количества энтеробактерий и небольшому увеличению количества энтерококков, стафилококков и Bacteroi-des spp. Популяции микробов были нормальными через 4 дня после обработки. Основным микробиологически связанным последствием был мягкий стул. В некоторых случаях наблюдался избыточный рост C. difficile после лечения цефпрозилом (Lode et al 1992).
Цефподоксим проксетил
Цефподоксим проксетил оказывает сильное воздействие на бактерии толстой кишки. Брисмар и его коллеги (1993b) оценили эффекты этого соединения на добровольцах, получавших 200 мг два раза в день в течение 7 дней. Количество стрептококков, энтеробактерий и клостридий существенно снизилось в фекальной флоре, и наблюдался чрезмерный рост энтерококков, дрожжей и Clostridium difficile (Brismar et al 1993b).
Цефадроксил
Назначение цефадроксила здоровым людям не вызывает заметных нарушений экологии толстой кишки.Adamsson и его коллеги (1997) оценили эффект от приема 500 мг цефадроксила в течение 10 дней 20 здоровыми добровольцами. Воздействие на микрофлору кишечника было незначительным, и микрофлора была нормальной через две недели после отмены препарата.
Цефтибутен
Брисмар и его коллеги (1993a) вводили цефтибутен 14 здоровым людям. Каждый получал ежедневную дозу 400 мг цефтибутена перорально, но только у двух человек обнаруживались уровни цефтибутена в кале. За период введения увеличилось количество энтерококков и E.coli и анаэробных кокков. У восьми добровольцев были повышенные уровни β-лактамаз, и шесть были колонизированы C. difficile.
Фторхинолоны
Фторхинолоны представляют собой класс синтетических противомикробных агентов, влияние которых на экологию микрофлоры толстой кишки интенсивно изучалось (Edlund and Nord 1988b; Edlund and Nord 1999b; Sullivan et al 2001a). Путем введения различных фторхинолонов и подсчета бактерий из разных родов до и после воздействия было показано, что фторхинолоны обладают избирательным действием на нормальные бактерии толстой кишки.Эффекты ципрофлоксацина (Brismar et al 1990), норфлоксацина (Edlund et al 1987a, 1987b; Edlund and Nord 1988a), офлоксацина (Pecquet et al 1987; Edlund et al 1988), пефлоксацина (Vollaard et al 1992), ломефлоксацина (Edlund et al 1990), левофлоксацин (Edlund et al 1997b), спарфлоксацин (Ritz et al 1994), руфлоксацин (D’Antonio et al 1996), ситафлоксацин (Inagaki and Yamamoto et al 1995), гатифлоксацин (Edlund and Nord 1999a), тровафлоксацин (Edlund and Nord 1999b) и моксифлоксацин (Edlund and Nord 1999b; Edlund et al 2000b) на микрофлору кишечника.Все протестированные фторхинолоны уменьшали популяции энтеробактерий, а пефлоксацин уменьшал количество аэробных грамположительных кокков. В целом ни один из фторохинолонов не влиял на популяцию анаэробных бактерий. Разрастания бактерий под действием фторхинолонов не наблюдалось, но иногда наблюдалось разрастание Candida . Хотя инфекция C. difficile не наблюдалась, использование новых фторхинолонов было связано с появлением C.difficile диарея, связанная с антибиотиками, в некоторых больницах. In vitro , мы показали, что некоторые штаммы C. perfringens легко становятся устойчивыми к фторхинолонам, даже к тем, которые обычно эффективны против анаэробов (Rafii et al 2005). Устойчивые штаммы также демонстрируют физиологические изменения, отличные от штаммов дикого типа. Точно так же мы показали in vitro , что один из пяти штаммов C. perfringens продуцировал большее количество токсина в ответ на воздействие гатифлоксацина (Rafii et al 2008).Также оценивалось влияние некоторых из последних разработанных фторхинолонов (гареноксацина, гемифлоксацина и клинафлоксацина) на экологию толстой кишки ().
Таблица 4
Влияние фторхинолонов на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней | Количество субъектов | Подавление бактерий | Развивающиеся штаммы | Резистентные бактерии | Дней до нормы после прекращения лечения | Ссылка | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Гареноксацин | 600 | 6 | 16 | Энтерококки Бациллы Коринебактерии Энтеробактерии Бифидобактерии Лактобациллы Clostridia Bacteroides | Eubacteria | Устойчивость к гареноксацину Eubacterium lentum | 14 дней | Nord et al. (2003) | |||
| Гемифлоксацин | 320 | 7 | 10 | Энтеробактерии Энтерококки Стрептококки Анаэробные кокки Lactobacilli | 49 дней | Баркер и его коллеги (2001) | |||||
| Клинафлоксацин | 200 | 7 | 12 | Аэробные бактерии. | Oh et al. (2000) |
Garenoxacin
Nord et al. (2003) оценили влияние перорального приема гареноксацина на фекальную микрофлору 16 человек. Прием 600 мг гареноксацина ежедневно в течение 6 дней снизил количество энтерококков, бацилл, коринебактерий, энтеробактерий, бифидобактерий, лактобацилл, клостридий и Bacteroides spp. в микрофлоре кишечника, и это увеличило количество эубактерий.Микрофлора нормализовалась через 2 недели после прекращения приема фторхинолона широкого спектра действия. Концентрация гареноксацина в образцах фекалий составляла 14–31 мг / кг. Устойчивый к Garenoxa-cin Eubacterium lentum (MIC = 64 мг / мл) был изолирован от субъектов; популяции вернулись к нормальному состоянию через 14 дней после отмены (Nord et al, 2003).
Гемифлоксацин
Селективный эффект гемифлоксацина на микрофлору кишечника был аналогичен таковому у других фторхинолонов (Barker et al 2001).Введение 320 мг гемифлоксацина перорально в течение 7 дней 10 здоровым субъектам привело к подавлению энтеробактерий, энтерококков и стрептококков. Также уменьшились анаэробные кокки и лактобациллы. Разрастания или отбора устойчивых бактерий не обнаружено; популяции бактерий вернулись к норме через 49 дней после прекращения лечения (Barker et al 2001).
Клинафлоксацин
Ох и коллеги (2000) оценили влияние клина-флоксацина на экологию кишечника у 12 здоровых людей и обнаружили серьезные экологические нарушения.Пероральное введение 200 мг клинафлоксацина в течение 7 дней привело к высокому уровню препарата в кале (среднее значение 176 мг / кг на 7 день). Он уничтожил аэробные бактерии у 11 испытуемых и подавил анаэробную микрофлору. Клинафлоксацин-устойчивый Bacteroides sp. (MIC> 4) также появились; Ох и коллеги (2000) рекомендовали ограничить использование этого препарата.
Макролиды
Макролиды имеют макроциклическое 14-16-членное лактоновое кольцо, присоединенное к дезоксисахара. Они включают кларитромицин, диритромицин, эритромицин и рокситромицин, которые обладают бактерицидным или бактериостатическим действием.Их влияние на микрофлору кишечника кратко излагается в.
Таблица 5
Влияние диритромицина, кларитромицина, тигециклина и эритромицина на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней и количество процедур | в день | Подавление бактерий | Размножение бактерий и дрожжей | Появление устойчивых штаммов | Дней до нормы после прекращения лечения | Ссылка | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Диритромицин | 500 | 7 | Стрептококки Стафилококки Анаэробы Clostridia Lactobacilli | Диритромицин-устойчивые энтеробактерии | Eckernas et al. (1991) | |||||
| Кларитромицин | 500 | 7/2 | 12 | Escherichia coli | 12 | Клостридии | Энтерококки Enterobacter Citrobacter Klebsiella Pseudomonas | Отсутствует | 35 дней | Эдлунд и соавторы (2000a) |
| /7/50/156 | 16 | Анаэробные бактерии | Общая анаэробная микрофлора | Streptococcus spp. Enterococcus spp. Энтеробактерии устойчивый к кларитромицину Bacteroides spp. | Adamsson et al. (1999) | |||||
| Тигециклин | 100 / затем 50/2 | 10 | 13 | Энтерококки Escherichia Лактобациллы Bifidobacteria | Nord et al. (2006b) | |||||
| Эритромицин | 1000/500 | 7/2 | 10 | Streptococci Энтерококки Энтеробактерии Анаэробные бактерии также были поражено | Staphylococcus spp. | Устойчивые к эритромицину энтеробактерии, клостридии или дрожжи | Brismar et al. (1991) |
Диритромицин
Eckernas и его коллеги (1991) оценили влияние лечения диритромицином 20 здоровых людей на популяции диритромицина. . При ежедневном приеме 500 мг диритромицина в течение 7 дней в кале было обнаружено 12 мг / кг диритромицина.
Количество энтеробактерий и анаэробов (грамположительные кокки, бифидобактерии, эубактерии и Bacteroides spp.) уменьшилась кишечная флора и увеличилось количество стрептококков, стафилококков и других анаэробов (клостридий и лактобацилл). Кроме того, кишечник колонизировали устойчивые к диритромицину энтеробактерии. Eckernas и его коллеги (1991) пришли к выводу, что диритромицин оказывает значительное экологическое воздействие на бактерии толстой кишки.
Кларитромицин
Эдлунд и его коллеги (2000a, 2000b) оценили экологическое воздействие кларитромицина на 12 добровольцах. Введение кларитромицина (500 мг два раза в день в течение 7 дней) вызвало значительное снижение E.coli , а количество энтерококков, энтеробактерий, цитробактеров, клебсиелл и псевдомонад заметно увеличилось. Никаких существенных изменений в количестве стафилококков, стрептококков, бацилл или Candida замечено не было. В анаэробной микрофлоре бифидобактерии, лактобациллы и клостридии были подавлены, в то время как никаких изменений в пептострептококках, Veillonella , Bacteroide spp. Или фузобактериях не обнаружено. Через 35 дней микрофлора у всех добровольцев была нормальной.Эдлунд и его коллеги (2000a, 2000b) также обнаружили появление Bacteroides spp. изоляты, устойчивые к кларитромицину после введения 500 мг кларитромицина в течение 10 дней 10 пациентам. Эти бактерии сохранялись в течение 2 недель после отмены препарата. В том же исследовании авторы также обнаружили α-гемолитические стрептококки, кишечные энтерококки и энтеробактерии с устойчивостью к кларитромицину, но без чрезмерного роста дрожжей или C. difficile .
Комбинация 20 мг омепразола, 250 мг кларитромицина и 400 мг метронидазола приводила к изменению нормальной микрофлоры, подобно комбинации омепразола, амоксициллина и метронидазола (Adamsson et al 1999).Подавление анаэробной микрофлоры было более выраженным, чем в группе амоксициллина. Во время лечения наблюдалось значительное увеличение количества устойчивых к кларитромицину штаммов Bacteroides с 2% до 76%. Обе комбинации изменяли фекальную микрофлору, но комбинированная терапия кларитромицином оказывала более нежелательное воздействие на экосистему толстой кишки (Adamsson et al 1999).
Эритромицин
Брисмар и его коллеги (1991) вводили 1 г этилсукцината эритромицина перорально в течение 7 дней 10 добровольцам и оценивали его действие на бактерии толстой кишки.Они обнаружили уменьшение количества стрептококков, энтерококков и энтеробактерий во время приема, увеличение количества стафилококков и изменение анаэробных бактерий. В более раннем исследовании (Heimdahl and Nord 1982) было показано, что введение 500 мг эритромицина два раза в день в течение 7 дней 10 добровольцам привело к снижению количества энтеробактерий и большинства анаэробов. Кроме того, всех субъектов колонизировали потенциально патогенные устойчивые к эритромицину энтеробактерии, клостридии или дрожжи (Heimdahl and Nord 1982).
Кетолиды
Это новый класс соединений, родственных макролидам, и включает телитромицин (Nord et al 2004), который отличается от эритромицина наличием большой ароматической боковой цепи и заменой сахара кетогруппой. Кетолиды могут связываться с двумя участками бактериальной рибосомы; поэтому они эффективны даже против макролидно-устойчивых бактерий. У них также снижен потенциал индукции устойчивых к кетолидам бактерий. Эдлунд и его коллеги (2000a) изучали действие телитромицина у десяти субъектов и обнаружили увеличение МПК телитромицина для резистентных видов Bacteroides spp.изолятов, которые сохранялись в течение 2 недель после отмены препарата. Однако разрастания дрожжей и C. difficile не наблюдалось.
Аминогликозиды
Примерами аминогликозидов являются амикацин, гентамицин, канамицин, неомицин, нетилмицин, паромомицин, родострептомицин, стрептомицин, тобрамицин и апрамицин. Finegold (1986) отметил связь между приемом «кишечных антисептиков», таких как пероральный неомицин, и суперинфекцией анаэробами.
Глицилциклины
Глицилциклины, новый класс антибиотиков, представляют собой аналоги тетрациклинов, разработанные с особенностями предотвращения их оттока из клеток или образования белков защиты рибосом, которые приводят к устойчивости к тетрациклинам.
Тигециклин
Тигециклин — это глицилциклин, который обладает мощным действием широкого спектра действия против большинства грамположительных и грамотрицательных аэробных и анаэробных бактерий. Введение 50 мг тигециклина 20 пациентам каждые 12 часов в течение 10 дней (Nord et al 2006b) привело к снижению количества энтерококков, E. coli , лактобацилл и бифидобактерий, а также к увеличению количества других энтеробактерий и дрожжей. Разработаны два устойчивых к тигециклину штамма Klebsiella pneumoniae и пять устойчивых к тигециклину штаммов Enterobacter cloacae (Nord et al 2006b).
Линкозамиды
Линкомицин и клиндамицин представляют собой линкозамиды, которые ингибируют реакции транспептидазы, связываясь с 23 S и 50 S субъединицами бактериальных рибосом и ингибируя раннее удлинение пептидных цепей.
Клиндамицин
Клиндамицин используется для лечения не только анаэробных инфекций, но и паразитарных инфекций, включая малярию. Введение клиндамицина 10 пациентам в течение 7 дней приводило к нарушению экологии толстой кишки (Kager et al, 1981).Клиндамицин также связан с диареей, связанной с антибиотиками C. difficile . Кагер и его коллеги (1981) оценили эффект 600 мг клиндамицина внутривенно с 8-часовыми интервалами в течение 48 часов, что привело к уменьшению количества энтерококков, стрептококков и анаэробных бактерий. После лечения размножались стрептококки и анаэробные бактерии; у части пациентов возникла послеоперационная инфекция, вызванная Enterococcus faecalis .
Оксазолидоны
Линезолид относится к классу антимикробных агентов, называемых оксазолидонами.Это синтетический антибиотик, который редко используется из-за своей высокой цены, но он эффективен для лечения бактериальных инфекций с множественной лекарственной устойчивостью, в том числе вызванных Streptococcus spp. и MRSA. Введение 600 мг линезолида в течение 7 дней здоровым добровольцам привело к подавлению энтерококков и увеличению количества Klebsiella spp. Это также уменьшило количество следующих анаэробов: бифидобактерии, лактобациллы, клостридии и Bacte-roides spp.Через тридцать пять дней после прекращения лечения микрофлора была нормальной (Lode et al 2001).
Гликопептиды
Этот класс состоит из гликозилированных циклических нерибосомных пептидов и включает ванкомицин, тейкопланин, телаванцин, трампланин, декапланин и далбаванцин, который является липогликопептидом. Они подавляют синтез пептидогликана.
Ванкомицин
Этот препарат использовался в качестве последнего средства для лечения инфекций, вызванных грамположительными бактериями. Эдлунд и его коллеги (1997a) оценили эффекты ванкомицина у 10 человек после лечения 250 мг цефуроксима аксетила два раза в день в течение 7 дней.Затем субъекты получали 125 мг ванкомицина четыре раза в день в течение 7 дней. Авторы пришли к выводу, что ванкомицин вызывает экологические нарушения микрофлоры кишечника. Лечение ванкомицином привело к снижению количества Enterococcus faecium , E. faecalis и E. durans и анаэробов, включая бифидобактерии и Bacteroides spp. Это также привело к появлению подвижных энтерококков, в том числе E. gallinarum, и E.casseliflavus со сниженной чувствительностью к ванкомицину (МПК = 4–16 мг / мл). Некоторые из этих штаммов имели ген van C2 (C3). Кроме того, появились устойчивые к ванкомицину штаммы видов Pediococcus , Lactobacillus , Klebsiella , Citrobacter и Enterobacter . Недавно другие исследователи показали, что пероральный ванкомицин способствует чрезмерному росту устойчивых к ванкомицину энтерококков (Al-Nassir et al, 2008).
Далбаванцин
Это новый липогликопептид, родственный ванкомицину, и аналогично этому препарату он используется для лечения MRSA и S. epidermidis . Норд и его коллеги (2006a) оценили действие этого препарата у 12 человек. При введении 1 г далбаванцина шести мужчинам и шести женщинам произошли некоторые изменения в количестве энтерококков и E. coli , но не изменилось количество лактобацилл, клостридий и Bacteroides spp. № C.difficile были выделены. Новых колонизирующих аэробных или анаэробных бактерий с устойчивостью к далбаванцину обнаружено не было. Далбаванцин, по-видимому, не оказывает серьезного экологического воздействия на нормальную микрофлору кишечника человека (Barker et al 2001, Nord et al 2006a).
Метронидазол
Метронидазол используется для лечения анаэробных бактериальных инфекций, а также в комбинации с другими лекарствами для лечения язвенного колита. Было показано, что он устраняет метаногенные археи (Ansorg et al 2003).Использование перорального метронидазола для лечения заболевания, ассоциированного с C. difficile-, привело к чрезмерному росту энтерококков, включая устойчивые к ванкомицину штаммы (Al-Nassir et al, 2008).
Выводы
Микрофлора толстой кишки обеспечивает ряд преимуществ, включая участие в питании хозяина и защиту хозяина от инфекции. В большинстве случаев противомикробной терапии численность бактериальных популяций одних родов сокращается, а популяций других родов — увеличивается.В некоторых случаях увеличение количества определенных бактерий сопровождается появлением устойчивых штаммов бактерий или чрезмерным ростом грибков. Лечение комбинациями противомикробных препаратов не обязательно предотвращает развитие резистентности. Это может даже привести к чрезмерному росту грибков и появлению бактерий, устойчивых ко всем лекарствам в комбинации. Примерами являются комбинация амоксициллина и метронидазола и комбинация азтреонама с тобрамицином или клоксациллином, все из которых приводят не только к подавлению анаэробов, но и к чрезмерному росту грибков.Некоторые анаэробные бактерии могут сдерживать рост грибков. Обзор воздействия антимикробных препаратов на экологию толстой кишки также показывает различия между людьми в ответ на лечение этими препаратами и различия в эффектах этих препаратов на разные штаммы одной и той же бактерии. Штаммы, продуцирующие токсин C. difficile , были обнаружены в некоторых больницах после терапии фторхинолоном, а некоторые штаммы C. perfringens вырабатывают токсин после воздействия гатифлоксацина.Невозможно переоценить важность разумного использования этих важных лекарств.
Благодарности
Мы выражаем особую благодарность доктору Карлу Э. Норду и доктору Кидон Сунгу за рецензирование этой рукописи. Взгляды, представленные в этой статье, не обязательно отражают точку зрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Ссылки
- Adamsson I, Edlund C, Sjostedt S, et al. Сравнительные эффекты цефадроксила и феноксиметилпенициллина на нормальную микрофлору ротоглотки и кишечника.Инфекционное заболевание. 1997. 25: 154–8. [PubMed] [Google Scholar]
- Adamsson I, Nord CE, Lundquist P, et al. Сравнительные эффекты омепразола, амоксициллина и метронидазола по сравнению с омепразолом, кларитромицином и метронидазолом на микрофлору полости рта, желудка и кишечника у пациентов, инфицированных Helicobacter pylori, . J Antimicrob Chemother. 1999; 44: 629–40. [PubMed] [Google Scholar]
- Аль-Нассир В.Н., Сетхи А.К., Ли Й. и др. Как пероральный метронидазол, так и пероральный ванкомицин способствуют стойкому избыточному росту устойчивых к ванкомицину энтерококков во время лечения заболевания, ассоциированного с Clostridium difficile .Противомикробные агенты Chemother. 2008. 52: 2403–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Олдридж К.Э., Эшкрафт Д., Камбре К. и др. Многоцентровое исследование изменения чувствительности in vitro к противомикробным препаратам клинических изолятов видов Bacteroides fragilis , Prevotella , Fusobacterium , Porphyromonas и Peptostreptococcus . Противомикробные агенты Chemother. 2001; 45: 1238–43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Алестиг К., Карлберг Х., Норд CE и др.Влияние цефоперазона на фекальную флору. J Antimicrob Chemother. 1983; 12: 163–7. [PubMed] [Google Scholar]
- Амброуз Н.С., Джонсон М., Бердон Д.В. и др. Влияние однократных внутривенных антибиотиков на фекальную флору и появление Clostridium difficile . J Antimicrob Chemother. 1985; 15: 319–26. [PubMed] [Google Scholar]
- Ансорг Р., Рат П.М., Рунде В. и др. Влияние деконтаминации кишечника с использованием метронидазола на обнаружение метаногенных архей у реципиентов трансплантата костного мозга.Пересадка костного мозга. 2003; 31: 117–9. [PubMed] [Google Scholar]
- Aronsson B, Möllby R, Nord CE. Возникновение токсин-продуцирующего вещества Clostridium difficile при диарее, связанной с антибиотиками, в Швеции. Med Microbiol Immunol. 1981; 170: 27–35. [PubMed] [Google Scholar]
- Aronsson B, Möllby R, Nord CE. Противомикробные агенты и Clostridium difficile при остром кишечном заболевании: эпидемиологические данные из Швеции, 1980–1982 гг. J Infect Dis. 1985; 151: 476–81. [PubMed] [Google Scholar]
- Arvidsson A, Alvan G, Angelin B и др.Цефтриаксон: почечная и желчная экскреция и влияние на микрофлору толстой кишки. J Antimicrob Chemother. 1982; 10: 207–15. [PubMed] [Google Scholar]
- Arvidsson A, Leijd B, Nord CE, et al. Индивидуальная вариабельность экскреции цефтриаксона с желчью: влияние на метаболизм липидов желчных путей и микрофлору кишечника. Eur J Clin Invest. 1988. 18: 261–6. [PubMed] [Google Scholar]
- Баркер П.Дж., Шихан Р., Тейлол-Фу М. и др. Влияние гемифлоксацина на нормальную микрофлору кишечника человека.J Chemother. 2001; 13: 47–51. [PubMed] [Google Scholar]
- Berg RD. Аборигенная микрофлора желудочно-кишечного тракта. Trends Microbiol. 1996; 4: 430–5. [PubMed] [Google Scholar]
- Bergan T, Nord CE, Thorsteinsson SB. Влияние меропенема на микрофлору кишечника. Eur J Clin Microbiol Infect Dis. 1991; 10: 524–7. [PubMed] [Google Scholar]
- Бирнбаум Дж., Кахан Ф.М., Кропп Х. и др. Карбапенемы, новый класс бета-лактамных антибиотиков. Открытие и разработка имипенема / циластатина.Am J Med. 1985; 78: 3–21. [PubMed] [Google Scholar]
- Брисмар Б., Эдлунд С., Мальмборг А.С. и др. Концентрации ципрофлоксацина и влияние микрофлоры толстой кишки у пациентов, перенесших колоректальную операцию. Противомикробные агенты Chemother. 1990; 34: 481–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Brismar B, Edlund C, Nord CE. Сравнительное действие кларитромицина и эритромицина на нормальную микрофлору кишечника. Scand J Infect Dis. 1991; 23: 635–42. [PubMed] [Google Scholar]
- Brismar B, Edlund C, Nord CE.Влияние цефтибутена на нормальную микрофлору кишечника. Инфекционное заболевание. 1993a; 21: 373–5. [PubMed] [Google Scholar]
- Brismar B, Edlund C, Nord CE. Влияние цефподоксима проксетила и амоксициллина на нормальную микрофлору полости рта и кишечника. Eur J Clin Microbiol Infect Dis. 1993b; 12: 714–9. [PubMed] [Google Scholar]
- Брамфитт В., Франклин И., Грейди Д. и др. Влияние амоксициллин-клавуланата и цефрадина на фекальную флору здоровых добровольцев, не контактировавших с больничной средой.Противомикробные агенты Chemother. 1986; 30: 335–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cerniglia CE, Котарски С. Оценка остатков ветеринарных лекарств в пище на предмет их потенциального воздействия на микрофлору кишечника человека. J Regulatory Toxicol Pharmacol. 1999; 29: 238–61. [PubMed] [Google Scholar]
- D’Antonio D, Pizzigallo E, Lacone A и др. Влияние руфлоксацина, назначаемого в качестве профилактики онкологическим больным, на их микрофлору полости рта и фекалий. J Antimicrob Chemother. 1996; 38: 839–47.[PubMed] [Google Scholar]
- Де ла Кошетьер М.Ф., Дюран Т., Лепаж П. и др. Устойчивость доминирующей микробиоты фекалий человека при кратковременном введении антибиотиков. J Clin Microbiol. 2005; 43: 5588–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Денев С., Деломени С., Барк М.С. и др. Антибиотики, участвующие в заболевании, ассоциированном с Clostridium difficile , увеличивают экспрессию гена фактора колонизации. J Med Microbiol. 2008; 57: 732–8. [PubMed] [Google Scholar]
- Eckernas SA, Grahnen A, Nord CE.Влияние диритромицина на нормальную микрофлору полости рта и кишечника. Eur J Clin Microbiol Infect Dis. 1991; 10: 688–92. [PubMed] [Google Scholar]
- Эдлунд К., Алван Г., Баркхольт Л. и др. Фармакокинетика и сравнительные эффекты телитромицина (HMR 3647) и кларитромицина на микрофлору ротоглотки и кишечника. J Antimicrob Chemother. 2000a; 46: 741–9. [PubMed] [Google Scholar]
- Эдлунд К., Баркхольт Л., Олссон-Лильеквист Б. и др. Влияние ванкомицина на кишечную флору пациентов, ранее получавших антимикробную терапию.Clin Infect Dis. 1997a; 25: 729–32. [PubMed] [Google Scholar]
- Эдлунд К., Берган Т., Йозефссон К. и др. Влияние норфлоксацина на микрофлору ротоглотки и толстой кишки и фармакокинетика многократных доз. Scand J Infect Dis. 1987a; 19: 113–21. [PubMed] [Google Scholar]
- Эдлунд К., Бейер Г., Химер-Бау М. и др. Сравнительное действие моксифлоксацина и кларитромицина на нормальную микрофлору кишечника. Scand J Infect Dis. 2000b; 32: 81–5. [PubMed] [Google Scholar]
- Edlund C, Brismar B, Nord CE.Влияние ломефлоксацина на нормальную микрофлору полости рта и кишечника. Eur J Clin Microbiol Infect Dis. 1990; 9: 35–9. [PubMed] [Google Scholar]
- Эдлунд К., Кагер Л., Мальмборг А.С. и др. Влияние офлоксацина на микрофлору полости рта и желудочно-кишечного тракта у пациентов, перенесших операции на желудке. Eur J Clin Microbiol Infect Dis. 1988; 7: 135–43. [PubMed] [Google Scholar]
- Эдлунд К., Лидбек А., Кагер Л. и др. Сравнительное действие эноксацина и норфлоксацина на микрофлору толстой кишки человека. Противомикробные агенты Chemother.1987b; 31: 1846–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Edlund C, Nord CE. Манипуляции с микрофлорой ротоглотки и кишечника норфлоксацином: микробиологические и клинические аспекты. Scand J Infect Dis Suppl. 1988a; 56: 14–21. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Обзор влияния 4-хинолонов на нормальную микрофлору ротоглотки и кишечника человека. Инфекционное заболевание. 1988b; 16: 8–12. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Экологическое действие гатифлоксацина на нормальную микрофлору кишечника человека.J Chemother. 1999a; 11: 50–3. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Влияние хинолонов на экологию кишечника. Наркотики. 1999b; 58 (Дополнение 2): 65–70. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Влияние пероральных антибиотиков для лечения инфекций мочевыводящих путей на нормальную микрофлору человека. J Antimicrob Chemother. 2000; 46 (Приложение A): 41–8. [PubMed] [Google Scholar]
- Edlund C, Sjöstedt S, Nord CE. Сравнительное действие левофлоксацина и офлоксацина на нормальную микрофлору полости рта и кишечника.Scand J Infect Dis. 1997b; 29: 383–6. [PubMed] [Google Scholar]
- Эдлунд К., Старк К., Север СЕ. Связь между повышением активности бета-лактамаз после перорального приема трех новых цефалоспоринов и защитой от кишечных экологических нарушений. J Antimicrob Chemother. 1994; 34: 127–38. [PubMed] [Google Scholar]
- Finegold SM. Анаэробные инфекции и колит Clostridium difficile , возникшие при антибактериальной терапии. Scand J Infect Dis Suppl.1986; 49: 160–4. [PubMed] [Google Scholar]
- Gauthier G, Klein BS. Понимание морфогенеза грибков и уклонения от иммунитета. Микроб. 2008; 3: 416–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Gipponi M, Sciutto C, Accornero L, et al. Оценка модификаций кишечной бактериальной флоры у пациентов, длительно принимающих пероральный прием бакампициллина или амоксициллина: случайное исследование. Химиотерапия. 1985; 4: 214–7. [PubMed] [Google Scholar]
- Heimdahl A, Nord CE. Влияние эритромицина и клиндамицина на местную анаэробную флору человека и новую колонизацию желудочно-кишечного тракта.Eur J Clin Microbiol. 1982; 1: 38–48. [PubMed] [Google Scholar]
- Инагаки Ю., Ямамото Н., Чида Т. и др. Влияние DU-6859a, нового сильнодействующего фторхинолона на фекальную микрофлору добровольцев. Jpn J Antibiot. 1995; 48: 368–79. [PubMed] [Google Scholar]
- Кагер Л., Брисмар Б., Мальмборг А.С. и др. Влияние цефбуперазона на микрофлору толстой кишки у пациентов, перенесших колоректальные операции. Препараты Exp Clin Res. 1986; 12: 983–6. [PubMed] [Google Scholar]
- Кагер Л., Брисмар Б., Мальмборг А.С. и др.Эффект лечения имипенемом по сравнению с хирургической профилактикой имипенемом на микрофлору кишечника. Int J Clin Pharmacol Res. 1988; 8: 441–7. [PubMed] [Google Scholar]
- Кагер Л., Брисмар Б., Мальмборг А.С. и др. Концентрации имипенема в колоректальной хирургии и влияние на микрофлору толстой кишки. Противомикробные агенты Chemother. 1989; 33: 204–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кагер Л., Лильеквист Л., Мальмборг А.С. и др. Влияние профилактики клиндамицином на микрофлору толстой кишки у пациентов, перенесших колоректальную операцию.Противомикробные агенты Chemother. 1981; 20: 736–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kager L, Malmborg AS, Nord CE, et al. Влияние краткосрочной профилактики цефокситином на микрофлору толстой кишки у пациентов, перенесших колоректальную операцию. Инфекционное заболевание. 1982; 10: 338–40. [PubMed] [Google Scholar]
- Kager L, Malmborg AS, Nord CE, et al. Влияние профилактики пиперациллина на микрофлору толстой кишки у пациентов, перенесших колоректальную операцию. Инфекционное заболевание. 1983; 11: 251–4. [PubMed] [Google Scholar]
- Кеннеди MJ, Volz PA.Влияние различных антибиотиков на колонизацию и распространение в желудочно-кишечном тракте Candida albicans. Sabouraudia. 1985; 23: 265–73. [PubMed] [Google Scholar]
- Кеннеди MJ, Volz PA, Edwards CA, et al. Механизмы ассоциации Candida albicans со слизистой оболочкой кишечника. J Med Microbiol. 1987. 24: 333–41. [PubMed] [Google Scholar]
- Lambert-Zechovsky N, Bingen E, Aujard Y, et al. Влияние цефотаксима на фекальную флору у детей. Инфекционное заболевание. 1985; (13 Приложение 1): S140 – S144.[PubMed] [Google Scholar]
- Ли Д.А. Фармакологические и токсикологические исследования амоксициллина, талампициллина и ампициллина, а также клинические испытания парентерального амоксициллина при серьезных госпитальных инфекциях. Препараты Exptl Clin Res. 1979; 5: 29–139. [Google Scholar]
- Leigh DA, Nash JG. Парентеральное лечение амоксициллином тяжелых инфекций у госпитализированных пациентов. J Antimicrob Chemother. 1979; 5: 109–12. [PubMed] [Google Scholar]
- Lode H, Müller C, Borner K и др. Фармакокинетика многократного введения цефпрозила и его влияние на кишечную флору добровольцев.Противомикробные агенты Chemother. 1992; 36: 144–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lode H, Von der Höh N, Ziege S, et al. Экологические эффекты линезолида по сравнению с амоксициллином / клавулановой кислотой на нормальную микрофлору кишечника. Scand J Infect Dis. 2001; 33: 899–903. [PubMed] [Google Scholar]
- Луи Т.Дж., Чабб Х., Боу Э.Дж. и др. Сохранение параметров устойчивости к колонизации во время эмпирической терапии азтреонамом у пациентов с фебрильной нейтропенией. Rev Infect Dis. 1985; 7 (Приложение 4): S747 – S761.[PubMed] [Google Scholar]
- Николаева И.В., Анохин В.А., Бондаренко В.М. и др. [Лекарственная устойчивость штаммов Staphylococcus aureus , выделенных от детей с дисбактериозом кишечника] Ж. Микробиол Эпидемиол Иммунобиол. 2001; 1: 9–13. [PubMed] [Google Scholar]
- Nilsson-Ehle I, Nord CE, Ursing B. Цефтриаксон: фармакокинетика и влияние на микрофлору кишечника у пациентов с острыми бактериальными инфекциями. Scand J Infect Dis. 1985; 17: 77–82. [PubMed] [Google Scholar]
- Nord CE.Влияние противомикробных средств на экологию микрофлоры кишечника человека. Vet Microbiol. 1993; 35: 193–7. [PubMed] [Google Scholar]
- Nord CE. Паттерны чувствительности к антимикробным препаратам анаэробных бактерий в Европе (аннотация). 9-й раз в два года Конгресс Американского общества анаэробов; Лонг-Бич, Калифорния. 2008. с. 137. [Google Scholar]
- Nord CE, Bergan T, Aase S. Влияние азлоциллина на микрофлору толстой кишки. Scand J Infect Dis. 1986a; 18: 163–6. [PubMed] [Google Scholar]
- Nord CE, Bergan T, Thorsteinsson SB.Влияние тикарциллина / клавуланата на микрофлору кишечника. J Antimicrob Chemother. 1989; 24 (Дополнение B): 221–6. [PubMed] [Google Scholar]
- Nord CE, Brismar B, Kasholm-Tengve B, et al. Влияние терапии пиперациллином / тазобактамом на микрофлору кишечника. Scand J Infect Dis. 1992; 24: 209–13. [PubMed] [Google Scholar]
- Nord CE, Brismar B, Kasholm-Tengve B, et al. Влияние лечения пиперациллином / тазобактамом на микрофлору кишечника человека. J Antimicrob Chemother. 1993; 31 (Приложение A): 61–5.[PubMed] [Google Scholar]
- Nord CE, Edlund C. Влияние противомикробных препаратов на микрофлору кишечника человека. J Chemother. 1990; 2: 218–37. [PubMed] [Google Scholar]
- Nord CE, Фаррелл Д. Д., Леклерк Р. Влияние кетолидов на селекцию резистентности и экологические эффекты во время лечения инфекций дыхательных путей. Microb Drug Resist. 2004. 10: 255–63. [PubMed] [Google Scholar]
- Nord CE, Heimdahl A, Kager L, et al. Влияние различных антимикробных препаратов на нормальную микрофлору желудочно-кишечного тракта человека.Rev Infect Dis. 1984a; 6 (Приложение 1): S270 – S275. [PubMed] [Google Scholar]
- Nord CE, Heimdahl A, Lundberg C, et al. Влияние цефаклора на нормальную микрофлору ротоглотки и кишечника человека. Scand J Infect Dis. 1987; 19: 681–5. [PubMed] [Google Scholar]
- Nord CE, Kager L, Heimdahl A. Влияние противомикробных препаратов на микрофлору желудочно-кишечного тракта и риск инфекций. Am J Med. 1984b; 76: 99–106. [PubMed] [Google Scholar]
- Nord CE, Kager L, Malmborg AS. Влияние антимикробной профилактики на устойчивость к колонизации.J Hosp Infect. 1988; 11 (Приложение A): 259–64. [PubMed] [Google Scholar]
- Nord CE, Kager L, Philipson A, et al. Влияние имипенема / циластатина на микрофлору толстой кишки. Rev Infect Dis. 1985; 7 (Дополнение 3): S432 – S434. [PubMed] [Google Scholar]
- Nord CE, Lahnborg G. Эффективность пиперациллина / тазобактама при лечении экспериментальных внутрибрюшных инфекций. Eur J Surg Suppl. 1994; (573): 45–9. [PubMed] [Google Scholar]
- Nord CE, Meurling L, Russo RL, et al. Влияние гареноксацина на эубактерии нормальной микрофлоры кишечника при одновременном применении с дигоксином.J Chemother. 2003; 15: 244–7. [PubMed] [Google Scholar]
- Nord CE, Rasmanis G, Wahlund E. Влияние далбаванцина на нормальную микрофлору кишечника. J Antimicrob Chemother. 2006a; 58: 627–31. [PubMed] [Google Scholar]
- Nord CE, Sillerstrom E, Wahlund E. Влияние тигециклина на нормальную микрофлору ротоглотки и кишечника. Противомикробные агенты Chemother. 2006b; 50: 3375–80. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Noverr MC, Huffnagle GB. «Гипотеза микрофлоры» аллергических заболеваний.Clin Exp Allergy. 2005; 35: 1511–20. [PubMed] [Google Scholar]
- Oh H, Nord CE, Barkholt L, et al. Экологические нарушения микрофлоры кишечника, вызванные клинафлоксацином, хинолоном расширенного спектра действия. Инфекционное заболевание. 2000; 28: 272–7. [PubMed] [Google Scholar]
- Пек Дж. Дж., Fuchs PC, Gustafson ME. Антимикробная профилактика при плановой хирургии толстой кишки. Опыт 1035 операций в городской больнице. Am J Surg. 1984; 147: 633–7. [PubMed] [Google Scholar]
- Pecquet S, Andremont A, Tancrede C.Влияние перорального офлоксацина на фекальные бактерии у людей-добровольцев. Противомикробные агенты Chemother. 1987. 31: 124–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Pletz MW, Rau M, Bulitta J, et al. Фармакокинетика и влияние эртапенема на микрофлору кишечника по сравнению с цефтриаксоном после многократного введения добровольцам мужского и женского пола. Противомикробные агенты Chemother. 2004. 48: 3765–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Prantera C, Scribano ML, Berto E, et al.Использование антибиотиков при болезни Крона: почему и как? BioDrugs. 1997. 8: 293–306. [PubMed] [Google Scholar]
- Пульц, штат Нью-Джерси, Донски CJ. Влияние лечения антибиотиками на рост и продукцию токсина Clostridium difficile в содержимом слепой кишки мышей. Противомикробные агенты Chemother. 2005; 49: 3529–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rafii F, Park M, Bryant AE, et al. Повышенная продукция фосфолипазы C и перфринголизина O (альфа- и тета-токсины) в устойчивом к гатифлоксацину штамме Clostridium perfringens. Противомикробные агенты Chemother. 2008. 52: 895–900. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rafii F, Park M, Novak JS. Изменения ДНК-гиразы и топоизомеразы IV в устойчивых мутантах Clostridium perfringens , обнаруженных после обработки in vitro фторхинолонами. Противомикробные агенты Chemother. 2005; 49: 488–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ritz M, Lode H, Fassbender M и др. Фармакокинетика многократного приема спарфлоксацина и его влияние на фекальную флору.Противомикробные агенты Chemother. 1994; 38: 455–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rowland IR. Токсикология толстой кишки. Роль кишечной микрофлоры. В: Gibson GR, Macfarlane GT, редакторы. Бактерии толстой кишки человека. Бока-Ратон, Флорида: CRC Press; 1995. С. 155–74. [Google Scholar]
- Шредер О., Герхард Р., Штейн Дж. [Диарея, связанная с антибиотиками] Z Гастроэнтерол. 2006; 44: 193–204. [PubMed] [Google Scholar]
- Старк К., Эдлунд С., Хедберг М. и др. Индукция бета-лактамазы цефокситином в анаэробной микрофлоре кишечника.Eur J Clin Microbiol Infect Dis. 1995; 14: 18–24. [PubMed] [Google Scholar]
- Stark CA, Adamsson I, Edlund C, et al. Влияние омепразола и амоксициллина на микрофлору полости рта и желудочно-кишечного тракта у пациентов с инфекцией Helicobacter pylori . J Antimicrob Chemother. 1996; 38: 927–39. [PubMed] [Google Scholar]
- Stark CA, Edlund C, Sjöstedt S, et al. Устойчивость к противомикробным препаратам анаэробной микрофлоры ротовой полости и кишечника человека. Противомикробные агенты Chemother.1993; 37: 1665–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sullivan A, Edlund C, Nord CE. Влияние антимикробных препаратов на экологический баланс микрофлоры человека. Lancet Infect Dis. 2001а; 1: 101–14. [PubMed] [Google Scholar]
- Салливан А., Эдлунд С., Свенунгссон Б. и др. Влияние перорально вводимого пивмециллинама на нормальную микрофлору ротоглотки, кишечника и кожи. J Chemother. 2001b; 13: 299–308. [PubMed] [Google Scholar]
- ван дер Ваай Д. Селективная дезактивация пищеварительного тракта пероральным азтреонамом и темоциллином.Rev Infect Dis. 1985; 7 (Дополнение 4): S628 – S634. [PubMed] [Google Scholar]
- van der Waaij D, Nord CE. Развитие и сохранение у бактерий множественной устойчивости к антибиотикам; анализ и новый подход к этой актуальной проблеме. Int J Antimicrob Agents. 2000; 16: 191–7. [PubMed] [Google Scholar]
- Воллаард Э. Дж., Клазенер HA, Янссен AJ. Влияние пефлоксацина на устойчивость к микробной колонизации у здоровых добровольцев. Eur J Clin Microbiol Infect Dis. 1992; 11: 257–60. [PubMed] [Google Scholar]
- Wagner RD, Johnson SJ, Cerniglia CE.Модель in vitro устойчивости к колонизации кишечной микробиотой: эффекты противомикробных агентов, используемых у сельскохозяйственных животных. Противомикробные агенты Chemother. 2008; 52: 1230–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Winberg J, Herthelius-Elman M, Möllby R, et al. Патогенез инфекции мочевыводящих путей — экспериментальные исследования устойчивости влагалища к колонизации. Педиатр Нефрол. 1993; 7: 509–14. [PubMed] [Google Scholar]
- Zhang X, McDaniel AD, Wolf LE, et al.Хинолоновые антибиотики вызывают бактериофаги, кодирующие токсин Шига, выработку токсинов и гибель мышей. J Infect Dis. 2000; 181: 664–70. [PubMed] [Google Scholar]
Влияние лечения антимикробными препаратами на микрофлору толстой кишки человека
Ther Clin Risk Manag. 2008 Dec; 4 (6): 1343–1358.
Отдел микробиологии, Национальный центр токсикологических исследований, FDA, Джефферсон, АР, США
Для корреспонденции: Фатеме Рафии, Отдел микробиологии, Национальный центр токсикологических исследований, FDA, Джефферсон, АР 71602, США, тел. + 1870 543 7342 , Факс +1870 543 7307, электронная почта
vog.Авторские права © 2008 Dove Medical Press Limited. Все права защищеныЭта статья цитировалась в других статьях в PMC.
Реферат
Противомикробные препараты являются наиболее ценным средством лечения бактериальных инфекций. Однако назначение пациентам терапевтических доз противомикробных средств является основной причиной нарушения нормальной микрофлоры желудочно-кишечного тракта. Это нарушение приводит к ослаблению естественных защитных механизмов, обеспечиваемых микробной экосистемой толстой кишки, что делает хозяина уязвимым для заражения комменсальными микроорганизмами или внутрибольничными патогенами.В этом мини-обзоре обсуждается влияние противомикробных препаратов по отдельности и в комбинации на микрофлору толстой кишки человека.
Ключевые слова: антибиотики, кишечные бактерии
Введение
Экосистема микрофлоры толстой кишки человека, ее метаболические функции и ее устойчивость к колонизации жизненно важны для благополучия хозяина, производства жизненно важных метаболитов и предотвращения инфекций ( Эдлунд и Норд 1999b; Салливан и др. 2001a, 2001b). Различные ферменты в микробной экосистеме участвуют в деконъюгации, восстановлении и других биохимических действиях, что приводит к изменению биодоступности, активации или детоксикации различных молекул, включая метаболиты лекарств, высвобождаемые печенью через желчные протоки (Rowland 1995). Модели in vitro показали, что изменение популяционного состава микрофлоры кишечника человека сопровождается снижением устойчивости к колонизации (Wagner et al 2008). Кроме того, микробное сообщество может оказывать неизвестное влияние на иммунную систему (van der Waaij and Nord 2000). Микрофлора толстой кишки, по-видимому, стимулирует иммунную систему хозяина быстро реагировать на патогенные воздействия (Berg 1996). Хотя клетки кишечного тракта сосуществуют с нормальной комменсальной микрофлорой, они распознают и уничтожают вторгшиеся патогены, прежде чем вернуться к гомеостазу с комменсальными бактериями.Роли и влияние разных комменсальных бактерий различаются. Ответы хозяина на действие комменсальных бактерий генетически детерминированы (Prantera et al 1997). У пациентов с синдромом воспалительного кишечника иммунная система слизистых оболочек проявляет ненормальную реакцию на комменсальные бактерии у генетически предрасположенных лиц. Использование терапевтических агентов для воздействия на бактериальную популяцию может привести к микробному дисбалансу, который влияет на здоровье и вызывает заболевание. На основании клинических и эпидемиологических исследований было выдвинуто предположение, что как терапевтическое использование антибиотиков, так и типичные диеты в промышленно развитых странах могут нарушить нормальные опосредованные микробиотой механизмы иммунологической толерантности в слизистой оболочке, что также может привести к увеличению аллергических заболеваний дыхательных путей. (Новерр и Хаффнагл, 2005 г.).В следующих разделах будут обсуждаться другие эффекты клинического использования противомикробных препаратов на микрофлору кишечника.
Нарушение экосистемы
Хотя экосистема толстой кишки в целом стабильна, ее можно нарушить введением противомикробных препаратов для лечения или профилактики (Peck et al 1984). Бактерии толстой кишки подвергаются действию антимикробных агентов независимо от того, вводятся ли они перорально или путем инъекции через кровоток (Edlund and Nord 1999b).Это воздействие может происходить из-за неполного всасывания антимикробных агентов, вводимых перорально, из-за воздействия противомикробных агентов в секретах слюнных желез или слизистой оболочки кишечника или с желчью из печени (Nord et al 1984a, 1984b; Arvidsson et al 1988).
Степень изменений, происходящих в сообществе кишечной микрофлоры в результате введения противомикробных агентов, зависит от антибактериального спектра и их концентрации в содержимом просвета (Nord et al 1984a, 1984b).Антибиотики, принимаемые перорально, которые всасываются в верхней части тонкого кишечника, отличаются по своему действию от тех, которые плохо всасываются. Парентеральные противомикробные агенты, секретируемые с желчью или слизистой оболочкой, также влияют на восприимчивые популяции бактерий (Nord and Edlund 1990; Edlund and Nord 1999b). Воздействие антимикробных агентов на экосистему толстой кишки может привести к изменению популяции различных компонентов в результате подавления или уничтожения некоторых микроорганизмов, чрезмерного роста микроорганизмов, не восприимчивых к этим агентам, и создания устойчивых к противомикробным препаратам членов, которые обычно исключаются ( Норд 1993).
Влияние комменсальных микроорганизмов на колонизацию
Несколько факторов способствуют предотвращению колонизации некомменсальными микроорганизмами, среди которых конкуренция за питательные вещества, конкуренция за прикрепление и производство летучих жирных кислот (Nord et al 1984b). Летучие жирные кислоты, продуцируемые анаэробными бактериями, токсичны для некоторых других видов, особенно для энтеробактерий. Производство бактериоцинов энтеробактериями, стрептококками и анаэробными бактериями также ограничивает бактериальный рост.
Развитие устойчивых к противомикробным препаратам бактерий
Еще одним последствием воздействия антибиотиков, которое может иметь длительный эффект, является появление устойчивых к противомикробным препаратам бактерий, которые могут вызвать проблемы в долгосрочной перспективе (Nord and Edlund 1990). Эти организмы могут передаваться в разные места внутри хозяина, где они могут вызывать инфекцию, и другим хозяевам (Nord et al 1984b; Edlund and Nord 2000). Примером является инфекция мочевыводящих путей, вызванная устойчивым к противомикробным препаратам Escherichia coli (Winberg et al 1993; Edlund and Nord 2000).
Многоцентровое исследование восприимчивости (Aldridge et al 2001) показало изменения в структуре устойчивости анаэробных бактерий к различным антибиотикам. Устойчивость анаэробных бактерий к антибиотикам теперь известна для β-лактамов, клиндамицина, макролидов, тетрациклинов, фторхинолонов и нитроимидазола (Nord 2008). Метициллин-резистентные штаммы Staphylococcus aureus (MRSA) были выделены в амбулаторных условиях у детей с микробным дисбалансом толстой кишки в результате применения антибиотиков (Николаева и др., 2001).
Индукция ферментов в бактериях толстой кишки, которые делают противомикробные средства неэффективными, является еще одним побочным эффектом антимикробных средств (Finegold 1986). Введение β-лактамов привело к повышению уровня β-лактамаз в нормальной микрофлоре кишечника (Edlund et al, 1994). Сообщалось об индукции β-лактамаз у некоторых аэробных и анаэробных бактерий цефокситином. Однако, поскольку кал, по-видимому, ингибирует индукцию β-лактамаз, Stark и коллеги (1995) приписывают увеличение β-лактамаз отбору «стабильно дерепрессированных мутантов», а не индукции β-лактамаз.
Грибковые инфекции
Другая проблема, которая может возникнуть в результате лечения антибиотиками, — это заражение грибами (Louie et al 1985). Наблюдается чрезмерный рост грибков, особенно после лечения антибиотиками, снижающими популяцию анаэробных бактерий, у экспериментальных животных, здоровых людей и пациентов с нейтропенией (Kennedy and Voltz 1985; Louie et al 1985; Pletz et al 2004). Луи и его коллеги (1985) заключают: «Сохранение анаэробной флоры имеет решающее значение для предотвращения заражения грибами у пациентов с нейтропенией.«Грибковые инфекции могут вызывать серьезные проблемы у пациентов с ослабленным иммунитетом, вызывая диссеминированные инфекции в различных местах, которые могут привести к серьезным осложнениям (Gauthier and Klein 2008).
Кеннеди и его коллеги (1987) использовали Candida albicans для заражения мышей, леченных и не леченных антибиотиками, и обнаружили связь грибка с кишечным эпителием мышей, леченных антибиотиками, но не с таковыми у контрольных мышей, у которых была местная бактериальная флора. . У обработанных мышей часть грибковых клеток проникла глубоко в слизистую оболочку кишечного тракта, но большинство из них были связаны со слизистой оболочкой слепой кишки.
Влияние на патогенность бактерий
Противомикробные средства, помимо ограничения эффективности колонизационного барьера за счет нарушения нормальной кишечной микробиоты, могут также влиять на патогенность некоторых бактерий. Было показано, что фторхинолоны индуцируют бактериофаги и увеличивают продукцию токсина Шига в E. coli O157: H7, что может увеличивать вирулентность этого штамма (Zhang et al 2000). В нашей лаборатории один из пяти устойчивых к гатифлоксацину штаммов Clostridium perfringens также имел повышенную продукцию фосфолипазы C и перфринголизина O (Rafii et al, 2008).Субингибирующие концентрации ампициллина и клиндамицина могут напрямую влиять на приверженность Clostridium difficile , увеличивая экспрессию генов, необходимых для колонизации (Deneve et al 2008). В исследовании in vitro на животных было показано, что подкожное введение антибиотиков, нарушающих анаэробную флору, способствовало росту и продукции токсинов C. difficile в содержимом слепой кишки мыши. Антибиотики, не оказавшие значительного воздействия на анаэробные популяции, не влияли на рост или выработку токсинов (Pultz and Donskey 2005).Эти результаты подтверждают обеспокоенность государственных регулирующих органов, Всемирной организации здравоохранения и специалистов здравоохранения по поводу использования противомикробных препаратов для сельскохозяйственных животных (Cerniglia and Kotarski 1999).
Другие побочные эффекты
Использование противомикробных препаратов обычно сопровождается желудочно-кишечными расстройствами, особенно диареей, связанной с приемом антибиотиков, которая часто проходит вскоре после прекращения приема противомикробных препаратов и восстановления баланса в экосистеме (Nord and Edlund 1990) .Это происходит у 15–25% пациентов, получающих антибиотики, и частота его возникновения различается при приеме различных антибиотиков. Это вызвано нарушением микрофлоры кишечника от легкого до тяжелого; легкие случаи могут быть результатом нарушения обмена углеводов или желчных кислот. Распространение патогенов в результате этого нарушения может вызвать тяжелые случаи диареи, связанной с приемом антибиотиков (Schröder et al 2006).
У хозяев с ослабленным иммунитетом, ослабленных хирургическим вмешательством или пожилым возрастом, могут возникать тяжелые инфекции, вызванные условно-патогенными микроорганизмами.Потенциальные патогены, такие как C. difficile , проживающие в толстой кишке, могут вызывать C. difficile -связанную антибиотико-ассоциированную диарею и / или псевдомембранозный колит (Aronsson et al 1981, 1985; Ambrose et al 1985; Finegold 1986; Edlund and Норд 2000). Finegold (1986) отметил, что, за исключением ванкомицина и парентерально вводимых аминогликозидов, большинство других противомикробных агентов были причастны к инфекциям C. difficile .
Системные инфекции у пациентов с ослабленным иммунитетом, вызванные обычно безвредными микроорганизмами, также наблюдались после лечения антибиотиками.Суперинфекция, в которую вовлечены все основные типы анаэробов, также связана с использованием противомикробных препаратов. В общем, осложнения, связанные с противомикробными препаратами, являются результатом подавления местной флоры, которая предотвращает колонизацию и разрастание потенциальных патогенов, находящихся в толстой кишке, которые могут вызывать диарею, колит или другие септические состояния (Finegold 1986).
Оценка действия противомикробных препаратов на микрофлору кишечника
Очевидные последствия воздействия противомикробных препаратов на микрофлору толстой кишки были измерены путем подсчета видов бактерий после клинического лечения пациента или экспериментального воздействия на добровольцев различных антимикробных препаратов. агентов (Норд и Эдлунд, 1990).Оценка паттернов устойчивости анаэробных бактерий в слюне и кале амбулаторных и госпитализированных пациентов, независимо от лечения антибиотиками, показала связь между относительным количеством устойчивых к антибиотикам анаэробных бактерий, госпитализацией и лечением антибиотиками. Количество устойчивых штаммов коррелирует с продолжительностью лечения антибиотиками (Stark et al 1993).
В многочисленных исследованиях ученые оценивали действие противомикробных агентов на бактерии толстой кишки, вводя антибиотики своим испытуемым и измеряя их влияние на популяции различных бактериальных родов.Изучены все основные классы противомикробных средств. Большая часть этой работы была выполнена лабораторией Карла Норда в больнице Каролинского университета в Стокгольме, Швеция, и было написано несколько обзоров (Nord et al 1984a, 1984b, 1988; Nord and Edlund 1990; Nord 1993; Edlund and Nord 1999b; Sullivan et al 2001a). Образцы фекалий, которые обычно считаются репрезентативными для микробиоты толстой кишки, культивировали на неселективных и селективных средах. Были подсчитаны различные типы колоний, выделены в чистой культуре и идентифицированы до уровня рода.Их количество сравнивали с количеством бактерий, присутствующих от каждого рода до лечения, чтобы измерить эффект антибиотика в уменьшении количества бактерий или обеспечении увеличения, разрастания или размножения других. Все новые колонизирующие бактерии были проверены на чувствительность к введенным антибиотикам (Nord et al 2006a, 2006b). Сообщалось о бактериях, которые были уничтожены, и о тех, которые переросли другие виды. Также было обнаружено развитие устойчивости среди бактерий в нормальной флоре и чрезмерный рост таких микроорганизмов, как дрожжи, которые контролируются нормальной микрофлорой.В большинстве случаев популяции одних родов бактерий уменьшались, а численность бактерий других родов увеличивалась. Это увеличение сопровождалось либо увеличением резистентных штаммов бактерий, либо чрезмерным ростом грибов (Louie et al 1985; Nilsson-Ehle et al 1985).
Экспресс-методы с использованием анализа ДНК также использовались для демонстрации воздействия противомикробных препаратов на микрофлору кишечника человека. De La Cochetiere и его коллеги (2005) выделили фекальную ДНК добровольцев после лечения антибиотиками и амплифицировали бактериальные гены 16S рРНК с помощью ПЦР с общими праймерами, которые были проанализированы с помощью гель-электрофореза в градиенте температуры.Сравнивая модели доминирующих видов с образцами, полученными до лечения, они определили влияние лечения на изменение микробиоты.
Поскольку повсеместное появление различных устойчивых к противомикробным препаратам бактерий было проблематичным, а смертельные случаи стали результатом чрезмерного роста в остальном безобидных комменсальных микроорганизмов, которые не реагируют на доступные противомикробные средства, представляется своевременным рассмотреть влияние этих соединений на микроорганизмы толстой кишки , с акцентом на те, которые не были рассмотрены в предыдущих обзорах.
β-лактамы
β-лактамы — это старейший и наиболее широко назначаемый класс антибиотиков; этот класс включает пенициллины, цефалоспорины, монобактамы, карбапенемы и ингибиторы β-лактамаз.
Пенициллины
К членам этой группы относятся феноксиметилпенициллин, ампициллин, амоксициллин, пиперациллин, азлоциллин, темоциллин, тикарциллин, пивампициллин, талампициллин и баампициллин.
Цефалоспорины
Большинство из них являются полусинтетическими соединениями и не подвержены расщеплению β-лактамного кольца многими β-лактамазами.Они включают цефалоридин, цефазолин, цефаклор, цефроцил, цефбуперазон, цефуроксим, цефокситин, цефотиам, цефотаксим, цефоперазон, цефтриаксон, цефтазидим, цефтиазоксим, цефменоксим, цефотетан и цефрадин.
Монобактамы
β-лактамное кольцо в монобактамах находится отдельно и не слито с другим кольцом. Азтреонам является примером; обычно используется в сочетании с другими лекарствами.
Карбапенемы
По мере того, как все больше и больше бактерий развивают устойчивость к β-лактамным антимикробным агентам, продуцируя различные β-лактамазы, были предприняты усилия по поиску лекарств, на которые не действуют β-лактамазы.Карбапенемы включают имипенем, меропенем, эртапенем, фаропенем, дорипенем, панипенем и бетамипрон. Имипенем инактивируется в почках дегидропептидазой; чтобы предотвратить это, он используется в сочетании с циластатином, ингибитором почечной дегидропептидазы (Birnbaum et al 1985; Nord et al 1985). Помимо устойчивости к β-лактамазам, карбапенемы обладают широкой антибактериальной активностью.
Ингибиторы β-лактамаз
Эти соединения содержат β-лактамное кольцо, но обладают незначительной антимикробной активностью.Поскольку они связываются с β-лактамазами и предотвращают их атаку на другие β-лактамы, их вводят совместно с антимикробными β-лактамами.
Влияние лечения β-лактамами на микрофлору кишечника человека
Воздействие различных β-лактамных антибиотиков оценивалось как на людях-добровольцах, так и на пациентах, проходящих лечение. Различные исследования рассматривали эффекты группы пенициллина: ампициллин (Leigh, 1979), ампициллин плюс сульбактам (Kager et al, 1982), пиперациллин (Kager et al, 1983), азлоциллин (Nord et al, 1986a), темоциллин (van der Waaij 1985), тикарциллин и клавулановая кислота (Nord et al 1989) ().Все они уменьшили количество энтеробактерий, энтерококков и анаэробных бактерий. Лечение амоксициллином (Leigh and Nash 1979; Gipponi et al 1985) привело к подавлению количества энтеробактерий в одних испытаниях, но увеличило их количество в других (Brismar et al 1993b). В некоторых исследованиях после лечения амоксициллином, с клавулановой кислотой или без нее наблюдался избыточный рост C. difficile (Brismar et al 1993b; Lode et al 2001). В некоторых испытаниях наблюдали избыточный рост бактериями или Candida после приема вышеуказанных препаратов.Введение тикарциллина / клавулановой кислоты привело к увеличению количества энтерококков. Феноксиметилпенициллин не имел большого эффекта (Adamsson et al 1997).
Таблица 1
Влияние пенициллинов, отдельно или в сочетании с другими лекарствами, на микрофлору кишечника
Поскольку β-лактамы были первыми открытыми антибиотиками, их часто назначают для лечения различных инфекций, и в результате появилось много бактерий. сопротивление им. Присутствие β-лактамаз в различных бактериях часто приводит к неэффективности этих препаратов.Чтобы избежать развития резистентности и повысить эффективность лекарств, были разработаны другие β-лактамы, которые используются в комбинациях с ингибиторами β-лактамаз или другими лекарственными средствами ().
Таблица 2
Влияние выбранных β-лактамов, отличных от цефалоспоринов, в том числе в комбинации с другими лекарственными средствами, на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней и количество курсов лечения в день | Количество субъектов | Подавление бактерий | Размножение бактерий | Появились устойчивые штаммы или другие результаты | Дни до нормы после прекращения лечения | Ссылка | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Пиперациллин | 90/ тазобакт 4–8 | 20 | Энтеробактерии Энтерококки Бифидобактерии Эубактерии Лактобациллы Clostridia грамположительные кокки | Nord et al. (1993) | ||||||||
| Омепразол / амоксициллин | 20/1000 | 14/2 | 14 | внутримышечные изменения продукция -лактамазы | Stark et al. (1996) | |||||||
| Амоксициллин / клавулановая кислота | 1000 | 7 | 12 | Бифидобактерии Лактобациллы Клостридии | Энтерококки Escherichia coli | Clostridium difficile , выделенная от трех добровольцев | Lode et al. (2001) | |||||
| Амоксициллин | 500 | 7/3 | Brismar et al. (1993a, 1993b) | |||||||||
| Омепразол / амоксициллин / метронидазол | 20/1000/40 | Общая анаэробная микрофлора | Streptococcus spp. Enterococcus spp. Энтеробактерии Колонизация дрожжевыми грибами у девяти субъектов | 35 дней | Адамссон и его коллеги (1999) | |||||||
| Имипенем (хирургическая профилактика) | 500/1000 | 2/4 | 20 | Стафилококки Стрептококки Энтерококки Энтеробактерии Анаэробные кокки Бифидобактерии Эубактерии Лактобациллы Clostridia Fusobacteria Bacteroides | Без колонизации; в норме через 14 дней | Kager et al. (1988) | ||||||
| Pivmecillinam | 400 | 14–41 | 15 | E.coli | Sullivan et al. (2001b) | |||||||
| Ertapenem | 1000 | 7 | 10 | Lactobacilli Бифидобактерии Clostridia Bacteroides E. coli | Enterococci | Разрастание дрожжей | 21–35 дней | Плетц и его коллеги (2004) | ||||
| Азтреонам | пациенты с фебрамицином | Кишечные грамотрицательные бациллы Фекальные анаэробы | Грибковое заражение | Луи и его коллеги (1985) | ||||||||
| Азтреонам плюс клоксациллин | Гриб-отрицательная бактерия анаэробы | Грибковое заражение | Луи и его коллеги (1985) | |||||||||
| Моксалактам плюс тобрамицин | 9015 Фекальные грамотрицательные бактерии 9015 Луи и его коллеги (1985) | |||||||||||
| Имипенем | 500–1000 | 4–11 / 4 | 10 | Энтеробактерии Анаэробные кокки Бактероиды | ||||||||
| Меропенем | 500 | 7/3 | 10 | Энтеробактерии Стрептококки Clostridia Bacteroides грамотрицательные кокки | Enterococci | 14 дней | Bergan et al. (1991) |
Pivmecillinam
Sullivme et al. микрофлора 15 особей.Их лечили в течение 7 дней 400 мг пивмециллинама два раза в день, а затем снова через 14 и 21 день после начала приема. Число E. coli уменьшилось, но изменений в анаэробной микрофлоре не произошло.
Пиперациллин / тазобактам
Рассмотрено влияние пиперациллина на бактерии толстой кишки (Nord and Edlund 1990). Также изучалось влияние на экологию толстой кишки его использования в сочетании с ингибитором β-лактамазы, тазобактамом (Nord et al 1992, 1993; Nord and Lahnborg 1994).Оценивали влияние комбинации пиперациллин / тазобактам (4 / 0,5 г) на пациентов с внутрибрюшными инфекциями, которых лечили три раза в день в течение 8 дней; снизилось среднее количество энтеробактерий, энтерококков и анаэробов (бифидобактерий, эубактерий, лактобактерий, клостридий и грамположительных кокков). Анаэробные грамотрицательные кокки и Bacteroides spp. не были затронуты (). Количество бактерий нормализовалось после прекращения лечения (Nord et al 1992, 1993).
Омепразол и амоксициллин
Комбинация омепразола (20 мг, ингибитор протонной помпы для эрадикации Helicobacter pylori ) и амоксициллина (1000 мг) два раза в день в течение 14 дней приводила к изменениям микрофлоры кишечного тракта, увеличивает в количестве устойчивых энтеробактерий и увеличение продукции β-лактамаз, обнаруженное в образцах фекалий (Stark et al 1995; Adamsson et al 1999).
Комбинации омепразол / амоксициллин / метронидазол
Также изучались эффекты амоксициллина в сочетании с противомикробными средствами, эффективными против анаэробов.Метронидазол, который используется для лечения анаэробных и паразитарных инфекций, также используется для лечения H. pylori в сочетании с другими лекарствами. Лечение пациентов комбинацией омепразола 20 мг, амоксициллина 1 г и метронидазола 40 мг в течение 7 дней привело к изменению нормальной микрофлоры и выраженному подавлению анаэробной микрофлоры. Во время лечения некоторые пациенты также были заражены дрожжами. Значения МИК этих препаратов для Enterococcus spp.и Enterobacteriaceae увеличились (Adamsson et al 1999).
Амоксициллин / клавулановая кислота
Введение 1000 мг амоксициллина / клавулановой кислоты в течение 7 дней 12 здоровым людям (те же люди, которые лечились линезолидом 600 мг в течение 7 дней, с периодом вымывания 4 недели между курсами лечения) привело к увеличению количества энтерококков и E. coli и значительному снижению количества анаэробов, включая бифидобактерии, лактобациллы и клостридии. C. difficile был выделен у трех добровольцев (Lode et al 2001). Авторы пришли к выводу, что в отличие от линезолида, амоксициллин / клавулановая кислота не уничтожает грамположительные бактерии.
Десять добровольцев, получавших амоксициллин по 500 мг три раза в день в течение 7 дней, были колонизированы устойчивыми к амоксициллину бактериями, в основном E. coli , Klebsiella и Enterobacter (Brismar et al 1993b). Активность β-лактамазы была обнаружена в микрофлоре шести человек.
Имипенем
Кагер и его коллеги (1988) оценили влияние имипенема как при лечении, так и в профилактических целях на микрофлору кишечника. Использование 0,5 или 1 г имипенема четыре раза в день в течение 4–11 дней привело к снижению количества энтеробактерий, анаэробных кокков и Bacteroides spp. во время лечения. В дальнейшем микрофлора нормализовалась. Пациенты, получавшие 0,5 или 1 г имипенема для хирургической профилактики каждые 6 часов в течение 48 часов, имели подавленные уровни стафилококков, стрептококков, энтерококков, энтеробактерий, анаэробных бактерий, кокков, бифидобактерий, эубактерий, лактобацилл, клостридий, фузобактерий и Bacteroides spp.во время лечения; после этого уровни были нормальными. Колонизации устойчивыми к имипенему бактериями не происходило (Kager et al 1988, 1989).
Азтреонам с тобрамицином или клоксациллином
Луи и его коллеги (1985) использовали различные комбинации препаратов для лечения пациентов с фебрильной нейтропенией и сравнили их влияние на микробную экологию. Комбинации азтреонама либо с тобрамицином (15 человек), либо с клоксациллином (14 пациентов) привели к уничтожению кишечных грамотрицательных бацилл.Эти комбинации также вызвали уменьшение количества фекальных анаэробов, сопровождаемое пониженной концентрацией короткоцепочечных жирных кислот в фекальных супернатантах (Louie et al 1985). Разрастание грибков произошло у 27% субъектов, получавших азтреонам / тобрамицин, и у 43% субъектов, получавших азтреонам / клоксациллин. Комбинированная терапия моксалактамом / тобрамицином у 15 пациентов оказала аналогичное влияние на снижение анаэробов и грибковых заболеваний (81%), как и две предыдущие комбинации. Все пациенты были пациентами с фебрильной нейтропенией, поэтому авторы пришли к выводу, что поддержание анаэробной флоры было важным для предотвращения заражения грибами у пациентов с фебрильной нейтропенией.
Меропенем
Внутривенное введение 500 мг меропенема три раза в день в течение 7 дней у 10 пациентов привело к снижению количества энтеробактерий и стрептококков и увеличению количества энтерококков, клостридий, Bacteroides spp. И грамотрицательных кокки. Другие грамположительные кокки и палочки не пострадали. Через две недели после прекращения терапии микрофлора кишечника вернулась к норме (Bergan et al, 1991).
Эртапенем и цефтриаксон
Введение эртапенема (1 г в день) или цефтриаксона (2 г в день) 10 здоровым людям в течение 7 дней посредством инъекции привело к 4-логарифмическому снижению E.coli , а также уменьшение анаэробной микрофлоры, включая лактобациллы, бифидобактерии, клостридии и Bacteroides spp. Количество энтерококков увеличилось на 4 логарифма. В обоих случаях наблюдался избыточный рост дрожжей, но в обоих случаях микрофлора нормализовалась в течение 21–35 дней после завершения лечения (Pletz et al 2004).
Цефалоспорины
Различные цефалоспорины оказывают большое влияние на микрофлору толстой кишки (Nord and Edlund, 1990).Цефбуперазон (Kager et al 1986), цефокситин (Kager et al 1982), цефотаксим (Lambert-Zechovsky et al 1985), цефоперазон (Alestig et al 1983), цефтриаксон (Arvidsson et al 1982), цефаклор (Nord et al 1987), и цефотетан (Амброуз и др., 1985) снижали количество анаэробных бактерий и энтеробактерий. Все эти препараты, за исключением цефоперазона и цефтриаксона, также снижали количество энтерококков при большинстве курсов лечения. Цефотаксим уменьшал количество энтеробактерий и энтерококков в одном испытании. Цефалоридин (Амброуз и др., 1985) и цефрадин (Брамфитт и др., 1986) оказали незначительное влияние.Однако в результате применения всех этих препаратов, за исключением цефрадина, цефтазидима и цеф-буперазона, развились устойчивые бактериальные штаммы. C. difficile появился в некоторых испытаниях с цефепимом, цефтриаксоном и цефиксимом. Количество анаэробных грамположительных кокков увеличивалось после лечения цефтриаксоном и цефиксимом (Nilsson-Ehle et al 1985, Sullivan et al 2001a). Влияние других цефалоспоринов (цефпрозила, цефподоксима проксетила, цефтибутена и цефадроксила) на кишечную флору показано в.
Таблица 3
Влияние цефалоспоринов на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней и количество сеансов лечения в день | Количество субъектов | Подавление бактерий | Появление устойчивых штаммов или другие побочные эффекты | Дни до нормального состояния после прекращения лечения | Ссылка | |
|---|---|---|---|---|---|---|---|---|
| Cefprozil | 500 | 8/2 | 8 | Enterobacteria 9015occi | Мягкие стулья | 4 дня | Lode et al. (1992) | |
| Cefadroxil | 500 | 10 | 20 | Не сильно изменились Адамссон и его коллеги (1997) | ||||
| Цефподоксим проксетил | 200 | 7/2 | 10 | Стрептококки Энтеробактерии Clostridia | Enterococci Clostridium difficile | Активность β-лактамазы во флоре некоторых субъектов | Brismar et al. (1993b) | |
| Цефтриаксон | Бифидобактерии Clostridia Bacteroides E.coli | Энтерококки | Разрастание дрожжей | от 1 до 35 дней | Плетц и его коллеги (2004) | |||
| Цефтибутан | 400 | 10 | 14 9015occi | E. cocci | Повышенная колонизация β-лактамазой C. difficile у шести человек | Brismar et al. (1993a) |
Cefprozil
Введение цефпрозила привело к изменениям в популяциях определенных родов.Lode et al. (1992) изучали эффекты цефпрозила у восьми человек. Они вводили 500 мг цефпрозила два раза в день в течение 8 дней и обнаружили, что это привело к умеренному снижению количества энтеробактерий и небольшому увеличению количества энтерококков, стафилококков и Bacteroi-des spp. Популяции микробов были нормальными через 4 дня после обработки. Основным микробиологически связанным последствием был мягкий стул. В некоторых случаях наблюдался избыточный рост C. difficile после лечения цефпрозилом (Lode et al 1992).
Цефподоксим проксетил
Цефподоксим проксетил оказывает сильное воздействие на бактерии толстой кишки. Брисмар и его коллеги (1993b) оценили эффекты этого соединения на добровольцах, получавших 200 мг два раза в день в течение 7 дней. Количество стрептококков, энтеробактерий и клостридий существенно снизилось в фекальной флоре, и наблюдался чрезмерный рост энтерококков, дрожжей и Clostridium difficile (Brismar et al 1993b).
Цефадроксил
Назначение цефадроксила здоровым людям не вызывает заметных нарушений экологии толстой кишки.Adamsson и его коллеги (1997) оценили эффект от приема 500 мг цефадроксила в течение 10 дней 20 здоровыми добровольцами. Воздействие на микрофлору кишечника было незначительным, и микрофлора была нормальной через две недели после отмены препарата.
Цефтибутен
Брисмар и его коллеги (1993a) вводили цефтибутен 14 здоровым людям. Каждый получал ежедневную дозу 400 мг цефтибутена перорально, но только у двух человек обнаруживались уровни цефтибутена в кале. За период введения увеличилось количество энтерококков и E.coli и анаэробных кокков. У восьми добровольцев были повышенные уровни β-лактамаз, и шесть были колонизированы C. difficile.
Фторхинолоны
Фторхинолоны представляют собой класс синтетических противомикробных агентов, влияние которых на экологию микрофлоры толстой кишки интенсивно изучалось (Edlund and Nord 1988b; Edlund and Nord 1999b; Sullivan et al 2001a). Путем введения различных фторхинолонов и подсчета бактерий из разных родов до и после воздействия было показано, что фторхинолоны обладают избирательным действием на нормальные бактерии толстой кишки.Эффекты ципрофлоксацина (Brismar et al 1990), норфлоксацина (Edlund et al 1987a, 1987b; Edlund and Nord 1988a), офлоксацина (Pecquet et al 1987; Edlund et al 1988), пефлоксацина (Vollaard et al 1992), ломефлоксацина (Edlund et al 1990), левофлоксацин (Edlund et al 1997b), спарфлоксацин (Ritz et al 1994), руфлоксацин (D’Antonio et al 1996), ситафлоксацин (Inagaki and Yamamoto et al 1995), гатифлоксацин (Edlund and Nord 1999a), тровафлоксацин (Edlund and Nord 1999b) и моксифлоксацин (Edlund and Nord 1999b; Edlund et al 2000b) на микрофлору кишечника.Все протестированные фторхинолоны уменьшали популяции энтеробактерий, а пефлоксацин уменьшал количество аэробных грамположительных кокков. В целом ни один из фторохинолонов не влиял на популяцию анаэробных бактерий. Разрастания бактерий под действием фторхинолонов не наблюдалось, но иногда наблюдалось разрастание Candida . Хотя инфекция C. difficile не наблюдалась, использование новых фторхинолонов было связано с появлением C.difficile диарея, связанная с антибиотиками, в некоторых больницах. In vitro , мы показали, что некоторые штаммы C. perfringens легко становятся устойчивыми к фторхинолонам, даже к тем, которые обычно эффективны против анаэробов (Rafii et al 2005). Устойчивые штаммы также демонстрируют физиологические изменения, отличные от штаммов дикого типа. Точно так же мы показали in vitro , что один из пяти штаммов C. perfringens продуцировал большее количество токсина в ответ на воздействие гатифлоксацина (Rafii et al 2008).Также оценивалось влияние некоторых из последних разработанных фторхинолонов (гареноксацина, гемифлоксацина и клинафлоксацина) на экологию толстой кишки ().
Таблица 4
Влияние фторхинолонов на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней | Количество субъектов | Подавление бактерий | Развивающиеся штаммы | Резистентные бактерии | Дней до нормы после прекращения лечения | Ссылка | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Гареноксацин | 600 | 6 | 16 | Энтерококки Бациллы Коринебактерии Энтеробактерии Бифидобактерии Лактобациллы Clostridia Bacteroides | Eubacteria | Устойчивость к гареноксацину Eubacterium lentum | 14 дней | Nord et al. (2003) | |||
| Гемифлоксацин | 320 | 7 | 10 | Энтеробактерии Энтерококки Стрептококки Анаэробные кокки Lactobacilli | 49 дней | Баркер и его коллеги (2001) | |||||
| Клинафлоксацин | 200 | 7 | 12 | Аэробные бактерии. | Oh et al. (2000) |
Garenoxacin
Nord et al. (2003) оценили влияние перорального приема гареноксацина на фекальную микрофлору 16 человек. Прием 600 мг гареноксацина ежедневно в течение 6 дней снизил количество энтерококков, бацилл, коринебактерий, энтеробактерий, бифидобактерий, лактобацилл, клостридий и Bacteroides spp. в микрофлоре кишечника, и это увеличило количество эубактерий.Микрофлора нормализовалась через 2 недели после прекращения приема фторхинолона широкого спектра действия. Концентрация гареноксацина в образцах фекалий составляла 14–31 мг / кг. Устойчивый к Garenoxa-cin Eubacterium lentum (MIC = 64 мг / мл) был изолирован от субъектов; популяции вернулись к нормальному состоянию через 14 дней после отмены (Nord et al, 2003).
Гемифлоксацин
Селективный эффект гемифлоксацина на микрофлору кишечника был аналогичен таковому у других фторхинолонов (Barker et al 2001).Введение 320 мг гемифлоксацина перорально в течение 7 дней 10 здоровым субъектам привело к подавлению энтеробактерий, энтерококков и стрептококков. Также уменьшились анаэробные кокки и лактобациллы. Разрастания или отбора устойчивых бактерий не обнаружено; популяции бактерий вернулись к норме через 49 дней после прекращения лечения (Barker et al 2001).
Клинафлоксацин
Ох и коллеги (2000) оценили влияние клина-флоксацина на экологию кишечника у 12 здоровых людей и обнаружили серьезные экологические нарушения.Пероральное введение 200 мг клинафлоксацина в течение 7 дней привело к высокому уровню препарата в кале (среднее значение 176 мг / кг на 7 день). Он уничтожил аэробные бактерии у 11 испытуемых и подавил анаэробную микрофлору. Клинафлоксацин-устойчивый Bacteroides sp. (MIC> 4) также появились; Ох и коллеги (2000) рекомендовали ограничить использование этого препарата.
Макролиды
Макролиды имеют макроциклическое 14-16-членное лактоновое кольцо, присоединенное к дезоксисахара. Они включают кларитромицин, диритромицин, эритромицин и рокситромицин, которые обладают бактерицидным или бактериостатическим действием.Их влияние на микрофлору кишечника кратко излагается в.
Таблица 5
Влияние диритромицина, кларитромицина, тигециклина и эритромицина на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней и количество процедур | в день | Подавление бактерий | Размножение бактерий и дрожжей | Появление устойчивых штаммов | Дней до нормы после прекращения лечения | Ссылка | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Диритромицин | 500 | 7 | Стрептококки Стафилококки Анаэробы Clostridia Lactobacilli | Диритромицин-устойчивые энтеробактерии | Eckernas et al. (1991) | |||||
| Кларитромицин | 500 | 7/2 | 12 | Escherichia coli | 12 | Клостридии | Энтерококки Enterobacter Citrobacter Klebsiella Pseudomonas | Отсутствует | 35 дней | Эдлунд и соавторы (2000a) |
| /7/50/156 | 16 | Анаэробные бактерии | Общая анаэробная микрофлора | Streptococcus spp. Enterococcus spp. Энтеробактерии устойчивый к кларитромицину Bacteroides spp. | Adamsson et al. (1999) | |||||
| Тигециклин | 100 / затем 50/2 | 10 | 13 | Энтерококки Escherichia Лактобациллы Bifidobacteria | Nord et al. (2006b) | |||||
| Эритромицин | 1000/500 | 7/2 | 10 | Streptococci Энтерококки Энтеробактерии Анаэробные бактерии также были поражено | Staphylococcus spp. | Устойчивые к эритромицину энтеробактерии, клостридии или дрожжи | Brismar et al. (1991) |
Диритромицин
Eckernas и его коллеги (1991) оценили влияние лечения диритромицином 20 здоровых людей на популяции диритромицина. . При ежедневном приеме 500 мг диритромицина в течение 7 дней в кале было обнаружено 12 мг / кг диритромицина.
Количество энтеробактерий и анаэробов (грамположительные кокки, бифидобактерии, эубактерии и Bacteroides spp.) уменьшилась кишечная флора и увеличилось количество стрептококков, стафилококков и других анаэробов (клостридий и лактобацилл). Кроме того, кишечник колонизировали устойчивые к диритромицину энтеробактерии. Eckernas и его коллеги (1991) пришли к выводу, что диритромицин оказывает значительное экологическое воздействие на бактерии толстой кишки.
Кларитромицин
Эдлунд и его коллеги (2000a, 2000b) оценили экологическое воздействие кларитромицина на 12 добровольцах. Введение кларитромицина (500 мг два раза в день в течение 7 дней) вызвало значительное снижение E.coli , а количество энтерококков, энтеробактерий, цитробактеров, клебсиелл и псевдомонад заметно увеличилось. Никаких существенных изменений в количестве стафилококков, стрептококков, бацилл или Candida замечено не было. В анаэробной микрофлоре бифидобактерии, лактобациллы и клостридии были подавлены, в то время как никаких изменений в пептострептококках, Veillonella , Bacteroide spp. Или фузобактериях не обнаружено. Через 35 дней микрофлора у всех добровольцев была нормальной.Эдлунд и его коллеги (2000a, 2000b) также обнаружили появление Bacteroides spp. изоляты, устойчивые к кларитромицину после введения 500 мг кларитромицина в течение 10 дней 10 пациентам. Эти бактерии сохранялись в течение 2 недель после отмены препарата. В том же исследовании авторы также обнаружили α-гемолитические стрептококки, кишечные энтерококки и энтеробактерии с устойчивостью к кларитромицину, но без чрезмерного роста дрожжей или C. difficile .
Комбинация 20 мг омепразола, 250 мг кларитромицина и 400 мг метронидазола приводила к изменению нормальной микрофлоры, подобно комбинации омепразола, амоксициллина и метронидазола (Adamsson et al 1999).Подавление анаэробной микрофлоры было более выраженным, чем в группе амоксициллина. Во время лечения наблюдалось значительное увеличение количества устойчивых к кларитромицину штаммов Bacteroides с 2% до 76%. Обе комбинации изменяли фекальную микрофлору, но комбинированная терапия кларитромицином оказывала более нежелательное воздействие на экосистему толстой кишки (Adamsson et al 1999).
Эритромицин
Брисмар и его коллеги (1991) вводили 1 г этилсукцината эритромицина перорально в течение 7 дней 10 добровольцам и оценивали его действие на бактерии толстой кишки.Они обнаружили уменьшение количества стрептококков, энтерококков и энтеробактерий во время приема, увеличение количества стафилококков и изменение анаэробных бактерий. В более раннем исследовании (Heimdahl and Nord 1982) было показано, что введение 500 мг эритромицина два раза в день в течение 7 дней 10 добровольцам привело к снижению количества энтеробактерий и большинства анаэробов. Кроме того, всех субъектов колонизировали потенциально патогенные устойчивые к эритромицину энтеробактерии, клостридии или дрожжи (Heimdahl and Nord 1982).
Кетолиды
Это новый класс соединений, родственных макролидам, и включает телитромицин (Nord et al 2004), который отличается от эритромицина наличием большой ароматической боковой цепи и заменой сахара кетогруппой. Кетолиды могут связываться с двумя участками бактериальной рибосомы; поэтому они эффективны даже против макролидно-устойчивых бактерий. У них также снижен потенциал индукции устойчивых к кетолидам бактерий. Эдлунд и его коллеги (2000a) изучали действие телитромицина у десяти субъектов и обнаружили увеличение МПК телитромицина для резистентных видов Bacteroides spp.изолятов, которые сохранялись в течение 2 недель после отмены препарата. Однако разрастания дрожжей и C. difficile не наблюдалось.
Аминогликозиды
Примерами аминогликозидов являются амикацин, гентамицин, канамицин, неомицин, нетилмицин, паромомицин, родострептомицин, стрептомицин, тобрамицин и апрамицин. Finegold (1986) отметил связь между приемом «кишечных антисептиков», таких как пероральный неомицин, и суперинфекцией анаэробами.
Глицилциклины
Глицилциклины, новый класс антибиотиков, представляют собой аналоги тетрациклинов, разработанные с особенностями предотвращения их оттока из клеток или образования белков защиты рибосом, которые приводят к устойчивости к тетрациклинам.
Тигециклин
Тигециклин — это глицилциклин, который обладает мощным действием широкого спектра действия против большинства грамположительных и грамотрицательных аэробных и анаэробных бактерий. Введение 50 мг тигециклина 20 пациентам каждые 12 часов в течение 10 дней (Nord et al 2006b) привело к снижению количества энтерококков, E. coli , лактобацилл и бифидобактерий, а также к увеличению количества других энтеробактерий и дрожжей. Разработаны два устойчивых к тигециклину штамма Klebsiella pneumoniae и пять устойчивых к тигециклину штаммов Enterobacter cloacae (Nord et al 2006b).
Линкозамиды
Линкомицин и клиндамицин представляют собой линкозамиды, которые ингибируют реакции транспептидазы, связываясь с 23 S и 50 S субъединицами бактериальных рибосом и ингибируя раннее удлинение пептидных цепей.
Клиндамицин
Клиндамицин используется для лечения не только анаэробных инфекций, но и паразитарных инфекций, включая малярию. Введение клиндамицина 10 пациентам в течение 7 дней приводило к нарушению экологии толстой кишки (Kager et al, 1981).Клиндамицин также связан с диареей, связанной с антибиотиками C. difficile . Кагер и его коллеги (1981) оценили эффект 600 мг клиндамицина внутривенно с 8-часовыми интервалами в течение 48 часов, что привело к уменьшению количества энтерококков, стрептококков и анаэробных бактерий. После лечения размножались стрептококки и анаэробные бактерии; у части пациентов возникла послеоперационная инфекция, вызванная Enterococcus faecalis .
Оксазолидоны
Линезолид относится к классу антимикробных агентов, называемых оксазолидонами.Это синтетический антибиотик, который редко используется из-за своей высокой цены, но он эффективен для лечения бактериальных инфекций с множественной лекарственной устойчивостью, в том числе вызванных Streptococcus spp. и MRSA. Введение 600 мг линезолида в течение 7 дней здоровым добровольцам привело к подавлению энтерококков и увеличению количества Klebsiella spp. Это также уменьшило количество следующих анаэробов: бифидобактерии, лактобациллы, клостридии и Bacte-roides spp.Через тридцать пять дней после прекращения лечения микрофлора была нормальной (Lode et al 2001).
Гликопептиды
Этот класс состоит из гликозилированных циклических нерибосомных пептидов и включает ванкомицин, тейкопланин, телаванцин, трампланин, декапланин и далбаванцин, который является липогликопептидом. Они подавляют синтез пептидогликана.
Ванкомицин
Этот препарат использовался в качестве последнего средства для лечения инфекций, вызванных грамположительными бактериями. Эдлунд и его коллеги (1997a) оценили эффекты ванкомицина у 10 человек после лечения 250 мг цефуроксима аксетила два раза в день в течение 7 дней.Затем субъекты получали 125 мг ванкомицина четыре раза в день в течение 7 дней. Авторы пришли к выводу, что ванкомицин вызывает экологические нарушения микрофлоры кишечника. Лечение ванкомицином привело к снижению количества Enterococcus faecium , E. faecalis и E. durans и анаэробов, включая бифидобактерии и Bacteroides spp. Это также привело к появлению подвижных энтерококков, в том числе E. gallinarum, и E.casseliflavus со сниженной чувствительностью к ванкомицину (МПК = 4–16 мг / мл). Некоторые из этих штаммов имели ген van C2 (C3). Кроме того, появились устойчивые к ванкомицину штаммы видов Pediococcus , Lactobacillus , Klebsiella , Citrobacter и Enterobacter . Недавно другие исследователи показали, что пероральный ванкомицин способствует чрезмерному росту устойчивых к ванкомицину энтерококков (Al-Nassir et al, 2008).
Далбаванцин
Это новый липогликопептид, родственный ванкомицину, и аналогично этому препарату он используется для лечения MRSA и S. epidermidis . Норд и его коллеги (2006a) оценили действие этого препарата у 12 человек. При введении 1 г далбаванцина шести мужчинам и шести женщинам произошли некоторые изменения в количестве энтерококков и E. coli , но не изменилось количество лактобацилл, клостридий и Bacteroides spp. № C.difficile были выделены. Новых колонизирующих аэробных или анаэробных бактерий с устойчивостью к далбаванцину обнаружено не было. Далбаванцин, по-видимому, не оказывает серьезного экологического воздействия на нормальную микрофлору кишечника человека (Barker et al 2001, Nord et al 2006a).
Метронидазол
Метронидазол используется для лечения анаэробных бактериальных инфекций, а также в комбинации с другими лекарствами для лечения язвенного колита. Было показано, что он устраняет метаногенные археи (Ansorg et al 2003).Использование перорального метронидазола для лечения заболевания, ассоциированного с C. difficile-, привело к чрезмерному росту энтерококков, включая устойчивые к ванкомицину штаммы (Al-Nassir et al, 2008).
Выводы
Микрофлора толстой кишки обеспечивает ряд преимуществ, включая участие в питании хозяина и защиту хозяина от инфекции. В большинстве случаев противомикробной терапии численность бактериальных популяций одних родов сокращается, а популяций других родов — увеличивается.В некоторых случаях увеличение количества определенных бактерий сопровождается появлением устойчивых штаммов бактерий или чрезмерным ростом грибков. Лечение комбинациями противомикробных препаратов не обязательно предотвращает развитие резистентности. Это может даже привести к чрезмерному росту грибков и появлению бактерий, устойчивых ко всем лекарствам в комбинации. Примерами являются комбинация амоксициллина и метронидазола и комбинация азтреонама с тобрамицином или клоксациллином, все из которых приводят не только к подавлению анаэробов, но и к чрезмерному росту грибков.Некоторые анаэробные бактерии могут сдерживать рост грибков. Обзор воздействия антимикробных препаратов на экологию толстой кишки также показывает различия между людьми в ответ на лечение этими препаратами и различия в эффектах этих препаратов на разные штаммы одной и той же бактерии. Штаммы, продуцирующие токсин C. difficile , были обнаружены в некоторых больницах после терапии фторхинолоном, а некоторые штаммы C. perfringens вырабатывают токсин после воздействия гатифлоксацина.Невозможно переоценить важность разумного использования этих важных лекарств.
Благодарности
Мы выражаем особую благодарность доктору Карлу Э. Норду и доктору Кидон Сунгу за рецензирование этой рукописи. Взгляды, представленные в этой статье, не обязательно отражают точку зрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Ссылки
- Adamsson I, Edlund C, Sjostedt S, et al. Сравнительные эффекты цефадроксила и феноксиметилпенициллина на нормальную микрофлору ротоглотки и кишечника.Инфекционное заболевание. 1997. 25: 154–8. [PubMed] [Google Scholar]
- Adamsson I, Nord CE, Lundquist P, et al. Сравнительные эффекты омепразола, амоксициллина и метронидазола по сравнению с омепразолом, кларитромицином и метронидазолом на микрофлору полости рта, желудка и кишечника у пациентов, инфицированных Helicobacter pylori, . J Antimicrob Chemother. 1999; 44: 629–40. [PubMed] [Google Scholar]
- Аль-Нассир В.Н., Сетхи А.К., Ли Й. и др. Как пероральный метронидазол, так и пероральный ванкомицин способствуют стойкому избыточному росту устойчивых к ванкомицину энтерококков во время лечения заболевания, ассоциированного с Clostridium difficile .Противомикробные агенты Chemother. 2008. 52: 2403–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Олдридж К.Э., Эшкрафт Д., Камбре К. и др. Многоцентровое исследование изменения чувствительности in vitro к противомикробным препаратам клинических изолятов видов Bacteroides fragilis , Prevotella , Fusobacterium , Porphyromonas и Peptostreptococcus . Противомикробные агенты Chemother. 2001; 45: 1238–43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Алестиг К., Карлберг Х., Норд CE и др.Влияние цефоперазона на фекальную флору. J Antimicrob Chemother. 1983; 12: 163–7. [PubMed] [Google Scholar]
- Амброуз Н.С., Джонсон М., Бердон Д.В. и др. Влияние однократных внутривенных антибиотиков на фекальную флору и появление Clostridium difficile . J Antimicrob Chemother. 1985; 15: 319–26. [PubMed] [Google Scholar]
- Ансорг Р., Рат П.М., Рунде В. и др. Влияние деконтаминации кишечника с использованием метронидазола на обнаружение метаногенных архей у реципиентов трансплантата костного мозга.Пересадка костного мозга. 2003; 31: 117–9. [PubMed] [Google Scholar]
- Aronsson B, Möllby R, Nord CE. Возникновение токсин-продуцирующего вещества Clostridium difficile при диарее, связанной с антибиотиками, в Швеции. Med Microbiol Immunol. 1981; 170: 27–35. [PubMed] [Google Scholar]
- Aronsson B, Möllby R, Nord CE. Противомикробные агенты и Clostridium difficile при остром кишечном заболевании: эпидемиологические данные из Швеции, 1980–1982 гг. J Infect Dis. 1985; 151: 476–81. [PubMed] [Google Scholar]
- Arvidsson A, Alvan G, Angelin B и др.Цефтриаксон: почечная и желчная экскреция и влияние на микрофлору толстой кишки. J Antimicrob Chemother. 1982; 10: 207–15. [PubMed] [Google Scholar]
- Arvidsson A, Leijd B, Nord CE, et al. Индивидуальная вариабельность экскреции цефтриаксона с желчью: влияние на метаболизм липидов желчных путей и микрофлору кишечника. Eur J Clin Invest. 1988. 18: 261–6. [PubMed] [Google Scholar]
- Баркер П.Дж., Шихан Р., Тейлол-Фу М. и др. Влияние гемифлоксацина на нормальную микрофлору кишечника человека.J Chemother. 2001; 13: 47–51. [PubMed] [Google Scholar]
- Berg RD. Аборигенная микрофлора желудочно-кишечного тракта. Trends Microbiol. 1996; 4: 430–5. [PubMed] [Google Scholar]
- Bergan T, Nord CE, Thorsteinsson SB. Влияние меропенема на микрофлору кишечника. Eur J Clin Microbiol Infect Dis. 1991; 10: 524–7. [PubMed] [Google Scholar]
- Бирнбаум Дж., Кахан Ф.М., Кропп Х. и др. Карбапенемы, новый класс бета-лактамных антибиотиков. Открытие и разработка имипенема / циластатина.Am J Med. 1985; 78: 3–21. [PubMed] [Google Scholar]
- Брисмар Б., Эдлунд С., Мальмборг А.С. и др. Концентрации ципрофлоксацина и влияние микрофлоры толстой кишки у пациентов, перенесших колоректальную операцию. Противомикробные агенты Chemother. 1990; 34: 481–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Brismar B, Edlund C, Nord CE. Сравнительное действие кларитромицина и эритромицина на нормальную микрофлору кишечника. Scand J Infect Dis. 1991; 23: 635–42. [PubMed] [Google Scholar]
- Brismar B, Edlund C, Nord CE.Влияние цефтибутена на нормальную микрофлору кишечника. Инфекционное заболевание. 1993a; 21: 373–5. [PubMed] [Google Scholar]
- Brismar B, Edlund C, Nord CE. Влияние цефподоксима проксетила и амоксициллина на нормальную микрофлору полости рта и кишечника. Eur J Clin Microbiol Infect Dis. 1993b; 12: 714–9. [PubMed] [Google Scholar]
- Брамфитт В., Франклин И., Грейди Д. и др. Влияние амоксициллин-клавуланата и цефрадина на фекальную флору здоровых добровольцев, не контактировавших с больничной средой.Противомикробные агенты Chemother. 1986; 30: 335–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cerniglia CE, Котарски С. Оценка остатков ветеринарных лекарств в пище на предмет их потенциального воздействия на микрофлору кишечника человека. J Regulatory Toxicol Pharmacol. 1999; 29: 238–61. [PubMed] [Google Scholar]
- D’Antonio D, Pizzigallo E, Lacone A и др. Влияние руфлоксацина, назначаемого в качестве профилактики онкологическим больным, на их микрофлору полости рта и фекалий. J Antimicrob Chemother. 1996; 38: 839–47.[PubMed] [Google Scholar]
- Де ла Кошетьер М.Ф., Дюран Т., Лепаж П. и др. Устойчивость доминирующей микробиоты фекалий человека при кратковременном введении антибиотиков. J Clin Microbiol. 2005; 43: 5588–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Денев С., Деломени С., Барк М.С. и др. Антибиотики, участвующие в заболевании, ассоциированном с Clostridium difficile , увеличивают экспрессию гена фактора колонизации. J Med Microbiol. 2008; 57: 732–8. [PubMed] [Google Scholar]
- Eckernas SA, Grahnen A, Nord CE.Влияние диритромицина на нормальную микрофлору полости рта и кишечника. Eur J Clin Microbiol Infect Dis. 1991; 10: 688–92. [PubMed] [Google Scholar]
- Эдлунд К., Алван Г., Баркхольт Л. и др. Фармакокинетика и сравнительные эффекты телитромицина (HMR 3647) и кларитромицина на микрофлору ротоглотки и кишечника. J Antimicrob Chemother. 2000a; 46: 741–9. [PubMed] [Google Scholar]
- Эдлунд К., Баркхольт Л., Олссон-Лильеквист Б. и др. Влияние ванкомицина на кишечную флору пациентов, ранее получавших антимикробную терапию.Clin Infect Dis. 1997a; 25: 729–32. [PubMed] [Google Scholar]
- Эдлунд К., Берган Т., Йозефссон К. и др. Влияние норфлоксацина на микрофлору ротоглотки и толстой кишки и фармакокинетика многократных доз. Scand J Infect Dis. 1987a; 19: 113–21. [PubMed] [Google Scholar]
- Эдлунд К., Бейер Г., Химер-Бау М. и др. Сравнительное действие моксифлоксацина и кларитромицина на нормальную микрофлору кишечника. Scand J Infect Dis. 2000b; 32: 81–5. [PubMed] [Google Scholar]
- Edlund C, Brismar B, Nord CE.Влияние ломефлоксацина на нормальную микрофлору полости рта и кишечника. Eur J Clin Microbiol Infect Dis. 1990; 9: 35–9. [PubMed] [Google Scholar]
- Эдлунд К., Кагер Л., Мальмборг А.С. и др. Влияние офлоксацина на микрофлору полости рта и желудочно-кишечного тракта у пациентов, перенесших операции на желудке. Eur J Clin Microbiol Infect Dis. 1988; 7: 135–43. [PubMed] [Google Scholar]
- Эдлунд К., Лидбек А., Кагер Л. и др. Сравнительное действие эноксацина и норфлоксацина на микрофлору толстой кишки человека. Противомикробные агенты Chemother.1987b; 31: 1846–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Edlund C, Nord CE. Манипуляции с микрофлорой ротоглотки и кишечника норфлоксацином: микробиологические и клинические аспекты. Scand J Infect Dis Suppl. 1988a; 56: 14–21. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Обзор влияния 4-хинолонов на нормальную микрофлору ротоглотки и кишечника человека. Инфекционное заболевание. 1988b; 16: 8–12. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Экологическое действие гатифлоксацина на нормальную микрофлору кишечника человека.J Chemother. 1999a; 11: 50–3. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Влияние хинолонов на экологию кишечника. Наркотики. 1999b; 58 (Дополнение 2): 65–70. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Влияние пероральных антибиотиков для лечения инфекций мочевыводящих путей на нормальную микрофлору человека. J Antimicrob Chemother. 2000; 46 (Приложение A): 41–8. [PubMed] [Google Scholar]
- Edlund C, Sjöstedt S, Nord CE. Сравнительное действие левофлоксацина и офлоксацина на нормальную микрофлору полости рта и кишечника.Scand J Infect Dis. 1997b; 29: 383–6. [PubMed] [Google Scholar]
- Эдлунд К., Старк К., Север СЕ. Связь между повышением активности бета-лактамаз после перорального приема трех новых цефалоспоринов и защитой от кишечных экологических нарушений. J Antimicrob Chemother. 1994; 34: 127–38. [PubMed] [Google Scholar]
- Finegold SM. Анаэробные инфекции и колит Clostridium difficile , возникшие при антибактериальной терапии. Scand J Infect Dis Suppl.1986; 49: 160–4. [PubMed] [Google Scholar]
- Gauthier G, Klein BS. Понимание морфогенеза грибков и уклонения от иммунитета. Микроб. 2008; 3: 416–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Gipponi M, Sciutto C, Accornero L, et al. Оценка модификаций кишечной бактериальной флоры у пациентов, длительно принимающих пероральный прием бакампициллина или амоксициллина: случайное исследование. Химиотерапия. 1985; 4: 214–7. [PubMed] [Google Scholar]
- Heimdahl A, Nord CE. Влияние эритромицина и клиндамицина на местную анаэробную флору человека и новую колонизацию желудочно-кишечного тракта.Eur J Clin Microbiol. 1982; 1: 38–48. [PubMed] [Google Scholar]
- Инагаки Ю., Ямамото Н., Чида Т. и др. Влияние DU-6859a, нового сильнодействующего фторхинолона на фекальную микрофлору добровольцев. Jpn J Antibiot. 1995; 48: 368–79. [PubMed] [Google Scholar]
- Кагер Л., Брисмар Б., Мальмборг А.С. и др. Влияние цефбуперазона на микрофлору толстой кишки у пациентов, перенесших колоректальные операции. Препараты Exp Clin Res. 1986; 12: 983–6. [PubMed] [Google Scholar]
- Кагер Л., Брисмар Б., Мальмборг А.С. и др.Эффект лечения имипенемом по сравнению с хирургической профилактикой имипенемом на микрофлору кишечника. Int J Clin Pharmacol Res. 1988; 8: 441–7. [PubMed] [Google Scholar]
- Кагер Л., Брисмар Б., Мальмборг А.С. и др. Концентрации имипенема в колоректальной хирургии и влияние на микрофлору толстой кишки. Противомикробные агенты Chemother. 1989; 33: 204–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кагер Л., Лильеквист Л., Мальмборг А.С. и др. Влияние профилактики клиндамицином на микрофлору толстой кишки у пациентов, перенесших колоректальную операцию.Противомикробные агенты Chemother. 1981; 20: 736–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kager L, Malmborg AS, Nord CE, et al. Влияние краткосрочной профилактики цефокситином на микрофлору толстой кишки у пациентов, перенесших колоректальную операцию. Инфекционное заболевание. 1982; 10: 338–40. [PubMed] [Google Scholar]
- Kager L, Malmborg AS, Nord CE, et al. Влияние профилактики пиперациллина на микрофлору толстой кишки у пациентов, перенесших колоректальную операцию. Инфекционное заболевание. 1983; 11: 251–4. [PubMed] [Google Scholar]
- Кеннеди MJ, Volz PA.Влияние различных антибиотиков на колонизацию и распространение в желудочно-кишечном тракте Candida albicans. Sabouraudia. 1985; 23: 265–73. [PubMed] [Google Scholar]
- Кеннеди MJ, Volz PA, Edwards CA, et al. Механизмы ассоциации Candida albicans со слизистой оболочкой кишечника. J Med Microbiol. 1987. 24: 333–41. [PubMed] [Google Scholar]
- Lambert-Zechovsky N, Bingen E, Aujard Y, et al. Влияние цефотаксима на фекальную флору у детей. Инфекционное заболевание. 1985; (13 Приложение 1): S140 – S144.[PubMed] [Google Scholar]
- Ли Д.А. Фармакологические и токсикологические исследования амоксициллина, талампициллина и ампициллина, а также клинические испытания парентерального амоксициллина при серьезных госпитальных инфекциях. Препараты Exptl Clin Res. 1979; 5: 29–139. [Google Scholar]
- Leigh DA, Nash JG. Парентеральное лечение амоксициллином тяжелых инфекций у госпитализированных пациентов. J Antimicrob Chemother. 1979; 5: 109–12. [PubMed] [Google Scholar]
- Lode H, Müller C, Borner K и др. Фармакокинетика многократного введения цефпрозила и его влияние на кишечную флору добровольцев.Противомикробные агенты Chemother. 1992; 36: 144–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lode H, Von der Höh N, Ziege S, et al. Экологические эффекты линезолида по сравнению с амоксициллином / клавулановой кислотой на нормальную микрофлору кишечника. Scand J Infect Dis. 2001; 33: 899–903. [PubMed] [Google Scholar]
- Луи Т.Дж., Чабб Х., Боу Э.Дж. и др. Сохранение параметров устойчивости к колонизации во время эмпирической терапии азтреонамом у пациентов с фебрильной нейтропенией. Rev Infect Dis. 1985; 7 (Приложение 4): S747 – S761.[PubMed] [Google Scholar]
- Николаева И.В., Анохин В.А., Бондаренко В.М. и др. [Лекарственная устойчивость штаммов Staphylococcus aureus , выделенных от детей с дисбактериозом кишечника] Ж. Микробиол Эпидемиол Иммунобиол. 2001; 1: 9–13. [PubMed] [Google Scholar]
- Nilsson-Ehle I, Nord CE, Ursing B. Цефтриаксон: фармакокинетика и влияние на микрофлору кишечника у пациентов с острыми бактериальными инфекциями. Scand J Infect Dis. 1985; 17: 77–82. [PubMed] [Google Scholar]
- Nord CE.Влияние противомикробных средств на экологию микрофлоры кишечника человека. Vet Microbiol. 1993; 35: 193–7. [PubMed] [Google Scholar]
- Nord CE. Паттерны чувствительности к антимикробным препаратам анаэробных бактерий в Европе (аннотация). 9-й раз в два года Конгресс Американского общества анаэробов; Лонг-Бич, Калифорния. 2008. с. 137. [Google Scholar]
- Nord CE, Bergan T, Aase S. Влияние азлоциллина на микрофлору толстой кишки. Scand J Infect Dis. 1986a; 18: 163–6. [PubMed] [Google Scholar]
- Nord CE, Bergan T, Thorsteinsson SB.Влияние тикарциллина / клавуланата на микрофлору кишечника. J Antimicrob Chemother. 1989; 24 (Дополнение B): 221–6. [PubMed] [Google Scholar]
- Nord CE, Brismar B, Kasholm-Tengve B, et al. Влияние терапии пиперациллином / тазобактамом на микрофлору кишечника. Scand J Infect Dis. 1992; 24: 209–13. [PubMed] [Google Scholar]
- Nord CE, Brismar B, Kasholm-Tengve B, et al. Влияние лечения пиперациллином / тазобактамом на микрофлору кишечника человека. J Antimicrob Chemother. 1993; 31 (Приложение A): 61–5.[PubMed] [Google Scholar]
- Nord CE, Edlund C. Влияние противомикробных препаратов на микрофлору кишечника человека. J Chemother. 1990; 2: 218–37. [PubMed] [Google Scholar]
- Nord CE, Фаррелл Д. Д., Леклерк Р. Влияние кетолидов на селекцию резистентности и экологические эффекты во время лечения инфекций дыхательных путей. Microb Drug Resist. 2004. 10: 255–63. [PubMed] [Google Scholar]
- Nord CE, Heimdahl A, Kager L, et al. Влияние различных антимикробных препаратов на нормальную микрофлору желудочно-кишечного тракта человека.Rev Infect Dis. 1984a; 6 (Приложение 1): S270 – S275. [PubMed] [Google Scholar]
- Nord CE, Heimdahl A, Lundberg C, et al. Влияние цефаклора на нормальную микрофлору ротоглотки и кишечника человека. Scand J Infect Dis. 1987; 19: 681–5. [PubMed] [Google Scholar]
- Nord CE, Kager L, Heimdahl A. Влияние противомикробных препаратов на микрофлору желудочно-кишечного тракта и риск инфекций. Am J Med. 1984b; 76: 99–106. [PubMed] [Google Scholar]
- Nord CE, Kager L, Malmborg AS. Влияние антимикробной профилактики на устойчивость к колонизации.J Hosp Infect. 1988; 11 (Приложение A): 259–64. [PubMed] [Google Scholar]
- Nord CE, Kager L, Philipson A, et al. Влияние имипенема / циластатина на микрофлору толстой кишки. Rev Infect Dis. 1985; 7 (Дополнение 3): S432 – S434. [PubMed] [Google Scholar]
- Nord CE, Lahnborg G. Эффективность пиперациллина / тазобактама при лечении экспериментальных внутрибрюшных инфекций. Eur J Surg Suppl. 1994; (573): 45–9. [PubMed] [Google Scholar]
- Nord CE, Meurling L, Russo RL, et al. Влияние гареноксацина на эубактерии нормальной микрофлоры кишечника при одновременном применении с дигоксином.J Chemother. 2003; 15: 244–7. [PubMed] [Google Scholar]
- Nord CE, Rasmanis G, Wahlund E. Влияние далбаванцина на нормальную микрофлору кишечника. J Antimicrob Chemother. 2006a; 58: 627–31. [PubMed] [Google Scholar]
- Nord CE, Sillerstrom E, Wahlund E. Влияние тигециклина на нормальную микрофлору ротоглотки и кишечника. Противомикробные агенты Chemother. 2006b; 50: 3375–80. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Noverr MC, Huffnagle GB. «Гипотеза микрофлоры» аллергических заболеваний.Clin Exp Allergy. 2005; 35: 1511–20. [PubMed] [Google Scholar]
- Oh H, Nord CE, Barkholt L, et al. Экологические нарушения микрофлоры кишечника, вызванные клинафлоксацином, хинолоном расширенного спектра действия. Инфекционное заболевание. 2000; 28: 272–7. [PubMed] [Google Scholar]
- Пек Дж. Дж., Fuchs PC, Gustafson ME. Антимикробная профилактика при плановой хирургии толстой кишки. Опыт 1035 операций в городской больнице. Am J Surg. 1984; 147: 633–7. [PubMed] [Google Scholar]
- Pecquet S, Andremont A, Tancrede C.Влияние перорального офлоксацина на фекальные бактерии у людей-добровольцев. Противомикробные агенты Chemother. 1987. 31: 124–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Pletz MW, Rau M, Bulitta J, et al. Фармакокинетика и влияние эртапенема на микрофлору кишечника по сравнению с цефтриаксоном после многократного введения добровольцам мужского и женского пола. Противомикробные агенты Chemother. 2004. 48: 3765–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Prantera C, Scribano ML, Berto E, et al.Использование антибиотиков при болезни Крона: почему и как? BioDrugs. 1997. 8: 293–306. [PubMed] [Google Scholar]
- Пульц, штат Нью-Джерси, Донски CJ. Влияние лечения антибиотиками на рост и продукцию токсина Clostridium difficile в содержимом слепой кишки мышей. Противомикробные агенты Chemother. 2005; 49: 3529–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rafii F, Park M, Bryant AE, et al. Повышенная продукция фосфолипазы C и перфринголизина O (альфа- и тета-токсины) в устойчивом к гатифлоксацину штамме Clostridium perfringens. Противомикробные агенты Chemother. 2008. 52: 895–900. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rafii F, Park M, Novak JS. Изменения ДНК-гиразы и топоизомеразы IV в устойчивых мутантах Clostridium perfringens , обнаруженных после обработки in vitro фторхинолонами. Противомикробные агенты Chemother. 2005; 49: 488–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ritz M, Lode H, Fassbender M и др. Фармакокинетика многократного приема спарфлоксацина и его влияние на фекальную флору.Противомикробные агенты Chemother. 1994; 38: 455–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rowland IR. Токсикология толстой кишки. Роль кишечной микрофлоры. В: Gibson GR, Macfarlane GT, редакторы. Бактерии толстой кишки человека. Бока-Ратон, Флорида: CRC Press; 1995. С. 155–74. [Google Scholar]
- Шредер О., Герхард Р., Штейн Дж. [Диарея, связанная с антибиотиками] Z Гастроэнтерол. 2006; 44: 193–204. [PubMed] [Google Scholar]
- Старк К., Эдлунд С., Хедберг М. и др. Индукция бета-лактамазы цефокситином в анаэробной микрофлоре кишечника.Eur J Clin Microbiol Infect Dis. 1995; 14: 18–24. [PubMed] [Google Scholar]
- Stark CA, Adamsson I, Edlund C, et al. Влияние омепразола и амоксициллина на микрофлору полости рта и желудочно-кишечного тракта у пациентов с инфекцией Helicobacter pylori . J Antimicrob Chemother. 1996; 38: 927–39. [PubMed] [Google Scholar]
- Stark CA, Edlund C, Sjöstedt S, et al. Устойчивость к противомикробным препаратам анаэробной микрофлоры ротовой полости и кишечника человека. Противомикробные агенты Chemother.1993; 37: 1665–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sullivan A, Edlund C, Nord CE. Влияние антимикробных препаратов на экологический баланс микрофлоры человека. Lancet Infect Dis. 2001а; 1: 101–14. [PubMed] [Google Scholar]
- Салливан А., Эдлунд С., Свенунгссон Б. и др. Влияние перорально вводимого пивмециллинама на нормальную микрофлору ротоглотки, кишечника и кожи. J Chemother. 2001b; 13: 299–308. [PubMed] [Google Scholar]
- ван дер Ваай Д. Селективная дезактивация пищеварительного тракта пероральным азтреонамом и темоциллином.Rev Infect Dis. 1985; 7 (Дополнение 4): S628 – S634. [PubMed] [Google Scholar]
- van der Waaij D, Nord CE. Развитие и сохранение у бактерий множественной устойчивости к антибиотикам; анализ и новый подход к этой актуальной проблеме. Int J Antimicrob Agents. 2000; 16: 191–7. [PubMed] [Google Scholar]
- Воллаард Э. Дж., Клазенер HA, Янссен AJ. Влияние пефлоксацина на устойчивость к микробной колонизации у здоровых добровольцев. Eur J Clin Microbiol Infect Dis. 1992; 11: 257–60. [PubMed] [Google Scholar]
- Wagner RD, Johnson SJ, Cerniglia CE.Модель in vitro устойчивости к колонизации кишечной микробиотой: эффекты противомикробных агентов, используемых у сельскохозяйственных животных. Противомикробные агенты Chemother. 2008; 52: 1230–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Winberg J, Herthelius-Elman M, Möllby R, et al. Патогенез инфекции мочевыводящих путей — экспериментальные исследования устойчивости влагалища к колонизации. Педиатр Нефрол. 1993; 7: 509–14. [PubMed] [Google Scholar]
- Zhang X, McDaniel AD, Wolf LE, et al.Хинолоновые антибиотики вызывают бактериофаги, кодирующие токсин Шига, выработку токсинов и гибель мышей. J Infect Dis. 2000; 181: 664–70. [PubMed] [Google Scholar]
Влияние лечения антимикробными препаратами на микрофлору толстой кишки человека
Ther Clin Risk Manag. 2008 Dec; 4 (6): 1343–1358.
Отдел микробиологии, Национальный центр токсикологических исследований, FDA, Джефферсон, АР, США
Для корреспонденции: Фатеме Рафии, Отдел микробиологии, Национальный центр токсикологических исследований, FDA, Джефферсон, АР 71602, США, тел. + 1870 543 7342 , Факс +1870 543 7307, электронная почта
vog.Авторские права © 2008 Dove Medical Press Limited. Все права защищеныЭта статья цитировалась в других статьях в PMC.
Реферат
Противомикробные препараты являются наиболее ценным средством лечения бактериальных инфекций. Однако назначение пациентам терапевтических доз противомикробных средств является основной причиной нарушения нормальной микрофлоры желудочно-кишечного тракта. Это нарушение приводит к ослаблению естественных защитных механизмов, обеспечиваемых микробной экосистемой толстой кишки, что делает хозяина уязвимым для заражения комменсальными микроорганизмами или внутрибольничными патогенами.В этом мини-обзоре обсуждается влияние противомикробных препаратов по отдельности и в комбинации на микрофлору толстой кишки человека.
Ключевые слова: антибиотики, кишечные бактерии
Введение
Экосистема микрофлоры толстой кишки человека, ее метаболические функции и ее устойчивость к колонизации жизненно важны для благополучия хозяина, производства жизненно важных метаболитов и предотвращения инфекций ( Эдлунд и Норд 1999b; Салливан и др. 2001a, 2001b). Различные ферменты в микробной экосистеме участвуют в деконъюгации, восстановлении и других биохимических действиях, что приводит к изменению биодоступности, активации или детоксикации различных молекул, включая метаболиты лекарств, высвобождаемые печенью через желчные протоки (Rowland 1995). Модели in vitro показали, что изменение популяционного состава микрофлоры кишечника человека сопровождается снижением устойчивости к колонизации (Wagner et al 2008). Кроме того, микробное сообщество может оказывать неизвестное влияние на иммунную систему (van der Waaij and Nord 2000). Микрофлора толстой кишки, по-видимому, стимулирует иммунную систему хозяина быстро реагировать на патогенные воздействия (Berg 1996). Хотя клетки кишечного тракта сосуществуют с нормальной комменсальной микрофлорой, они распознают и уничтожают вторгшиеся патогены, прежде чем вернуться к гомеостазу с комменсальными бактериями.Роли и влияние разных комменсальных бактерий различаются. Ответы хозяина на действие комменсальных бактерий генетически детерминированы (Prantera et al 1997). У пациентов с синдромом воспалительного кишечника иммунная система слизистых оболочек проявляет ненормальную реакцию на комменсальные бактерии у генетически предрасположенных лиц. Использование терапевтических агентов для воздействия на бактериальную популяцию может привести к микробному дисбалансу, который влияет на здоровье и вызывает заболевание. На основании клинических и эпидемиологических исследований было выдвинуто предположение, что как терапевтическое использование антибиотиков, так и типичные диеты в промышленно развитых странах могут нарушить нормальные опосредованные микробиотой механизмы иммунологической толерантности в слизистой оболочке, что также может привести к увеличению аллергических заболеваний дыхательных путей. (Новерр и Хаффнагл, 2005 г.).В следующих разделах будут обсуждаться другие эффекты клинического использования противомикробных препаратов на микрофлору кишечника.
Нарушение экосистемы
Хотя экосистема толстой кишки в целом стабильна, ее можно нарушить введением противомикробных препаратов для лечения или профилактики (Peck et al 1984). Бактерии толстой кишки подвергаются действию антимикробных агентов независимо от того, вводятся ли они перорально или путем инъекции через кровоток (Edlund and Nord 1999b).Это воздействие может происходить из-за неполного всасывания антимикробных агентов, вводимых перорально, из-за воздействия противомикробных агентов в секретах слюнных желез или слизистой оболочки кишечника или с желчью из печени (Nord et al 1984a, 1984b; Arvidsson et al 1988).
Степень изменений, происходящих в сообществе кишечной микрофлоры в результате введения противомикробных агентов, зависит от антибактериального спектра и их концентрации в содержимом просвета (Nord et al 1984a, 1984b).Антибиотики, принимаемые перорально, которые всасываются в верхней части тонкого кишечника, отличаются по своему действию от тех, которые плохо всасываются. Парентеральные противомикробные агенты, секретируемые с желчью или слизистой оболочкой, также влияют на восприимчивые популяции бактерий (Nord and Edlund 1990; Edlund and Nord 1999b). Воздействие антимикробных агентов на экосистему толстой кишки может привести к изменению популяции различных компонентов в результате подавления или уничтожения некоторых микроорганизмов, чрезмерного роста микроорганизмов, не восприимчивых к этим агентам, и создания устойчивых к противомикробным препаратам членов, которые обычно исключаются ( Норд 1993).
Влияние комменсальных микроорганизмов на колонизацию
Несколько факторов способствуют предотвращению колонизации некомменсальными микроорганизмами, среди которых конкуренция за питательные вещества, конкуренция за прикрепление и производство летучих жирных кислот (Nord et al 1984b). Летучие жирные кислоты, продуцируемые анаэробными бактериями, токсичны для некоторых других видов, особенно для энтеробактерий. Производство бактериоцинов энтеробактериями, стрептококками и анаэробными бактериями также ограничивает бактериальный рост.
Развитие устойчивых к противомикробным препаратам бактерий
Еще одним последствием воздействия антибиотиков, которое может иметь длительный эффект, является появление устойчивых к противомикробным препаратам бактерий, которые могут вызвать проблемы в долгосрочной перспективе (Nord and Edlund 1990). Эти организмы могут передаваться в разные места внутри хозяина, где они могут вызывать инфекцию, и другим хозяевам (Nord et al 1984b; Edlund and Nord 2000). Примером является инфекция мочевыводящих путей, вызванная устойчивым к противомикробным препаратам Escherichia coli (Winberg et al 1993; Edlund and Nord 2000).
Многоцентровое исследование восприимчивости (Aldridge et al 2001) показало изменения в структуре устойчивости анаэробных бактерий к различным антибиотикам. Устойчивость анаэробных бактерий к антибиотикам теперь известна для β-лактамов, клиндамицина, макролидов, тетрациклинов, фторхинолонов и нитроимидазола (Nord 2008). Метициллин-резистентные штаммы Staphylococcus aureus (MRSA) были выделены в амбулаторных условиях у детей с микробным дисбалансом толстой кишки в результате применения антибиотиков (Николаева и др., 2001).
Индукция ферментов в бактериях толстой кишки, которые делают противомикробные средства неэффективными, является еще одним побочным эффектом антимикробных средств (Finegold 1986). Введение β-лактамов привело к повышению уровня β-лактамаз в нормальной микрофлоре кишечника (Edlund et al, 1994). Сообщалось об индукции β-лактамаз у некоторых аэробных и анаэробных бактерий цефокситином. Однако, поскольку кал, по-видимому, ингибирует индукцию β-лактамаз, Stark и коллеги (1995) приписывают увеличение β-лактамаз отбору «стабильно дерепрессированных мутантов», а не индукции β-лактамаз.
Грибковые инфекции
Другая проблема, которая может возникнуть в результате лечения антибиотиками, — это заражение грибами (Louie et al 1985). Наблюдается чрезмерный рост грибков, особенно после лечения антибиотиками, снижающими популяцию анаэробных бактерий, у экспериментальных животных, здоровых людей и пациентов с нейтропенией (Kennedy and Voltz 1985; Louie et al 1985; Pletz et al 2004). Луи и его коллеги (1985) заключают: «Сохранение анаэробной флоры имеет решающее значение для предотвращения заражения грибами у пациентов с нейтропенией.«Грибковые инфекции могут вызывать серьезные проблемы у пациентов с ослабленным иммунитетом, вызывая диссеминированные инфекции в различных местах, которые могут привести к серьезным осложнениям (Gauthier and Klein 2008).
Кеннеди и его коллеги (1987) использовали Candida albicans для заражения мышей, леченных и не леченных антибиотиками, и обнаружили связь грибка с кишечным эпителием мышей, леченных антибиотиками, но не с таковыми у контрольных мышей, у которых была местная бактериальная флора. . У обработанных мышей часть грибковых клеток проникла глубоко в слизистую оболочку кишечного тракта, но большинство из них были связаны со слизистой оболочкой слепой кишки.
Влияние на патогенность бактерий
Противомикробные средства, помимо ограничения эффективности колонизационного барьера за счет нарушения нормальной кишечной микробиоты, могут также влиять на патогенность некоторых бактерий. Было показано, что фторхинолоны индуцируют бактериофаги и увеличивают продукцию токсина Шига в E. coli O157: H7, что может увеличивать вирулентность этого штамма (Zhang et al 2000). В нашей лаборатории один из пяти устойчивых к гатифлоксацину штаммов Clostridium perfringens также имел повышенную продукцию фосфолипазы C и перфринголизина O (Rafii et al, 2008).Субингибирующие концентрации ампициллина и клиндамицина могут напрямую влиять на приверженность Clostridium difficile , увеличивая экспрессию генов, необходимых для колонизации (Deneve et al 2008). В исследовании in vitro на животных было показано, что подкожное введение антибиотиков, нарушающих анаэробную флору, способствовало росту и продукции токсинов C. difficile в содержимом слепой кишки мыши. Антибиотики, не оказавшие значительного воздействия на анаэробные популяции, не влияли на рост или выработку токсинов (Pultz and Donskey 2005).Эти результаты подтверждают обеспокоенность государственных регулирующих органов, Всемирной организации здравоохранения и специалистов здравоохранения по поводу использования противомикробных препаратов для сельскохозяйственных животных (Cerniglia and Kotarski 1999).
Другие побочные эффекты
Использование противомикробных препаратов обычно сопровождается желудочно-кишечными расстройствами, особенно диареей, связанной с приемом антибиотиков, которая часто проходит вскоре после прекращения приема противомикробных препаратов и восстановления баланса в экосистеме (Nord and Edlund 1990) .Это происходит у 15–25% пациентов, получающих антибиотики, и частота его возникновения различается при приеме различных антибиотиков. Это вызвано нарушением микрофлоры кишечника от легкого до тяжелого; легкие случаи могут быть результатом нарушения обмена углеводов или желчных кислот. Распространение патогенов в результате этого нарушения может вызвать тяжелые случаи диареи, связанной с приемом антибиотиков (Schröder et al 2006).
У хозяев с ослабленным иммунитетом, ослабленных хирургическим вмешательством или пожилым возрастом, могут возникать тяжелые инфекции, вызванные условно-патогенными микроорганизмами.Потенциальные патогены, такие как C. difficile , проживающие в толстой кишке, могут вызывать C. difficile -связанную антибиотико-ассоциированную диарею и / или псевдомембранозный колит (Aronsson et al 1981, 1985; Ambrose et al 1985; Finegold 1986; Edlund and Норд 2000). Finegold (1986) отметил, что, за исключением ванкомицина и парентерально вводимых аминогликозидов, большинство других противомикробных агентов были причастны к инфекциям C. difficile .
Системные инфекции у пациентов с ослабленным иммунитетом, вызванные обычно безвредными микроорганизмами, также наблюдались после лечения антибиотиками.Суперинфекция, в которую вовлечены все основные типы анаэробов, также связана с использованием противомикробных препаратов. В общем, осложнения, связанные с противомикробными препаратами, являются результатом подавления местной флоры, которая предотвращает колонизацию и разрастание потенциальных патогенов, находящихся в толстой кишке, которые могут вызывать диарею, колит или другие септические состояния (Finegold 1986).
Оценка действия противомикробных препаратов на микрофлору кишечника
Очевидные последствия воздействия противомикробных препаратов на микрофлору толстой кишки были измерены путем подсчета видов бактерий после клинического лечения пациента или экспериментального воздействия на добровольцев различных антимикробных препаратов. агентов (Норд и Эдлунд, 1990).Оценка паттернов устойчивости анаэробных бактерий в слюне и кале амбулаторных и госпитализированных пациентов, независимо от лечения антибиотиками, показала связь между относительным количеством устойчивых к антибиотикам анаэробных бактерий, госпитализацией и лечением антибиотиками. Количество устойчивых штаммов коррелирует с продолжительностью лечения антибиотиками (Stark et al 1993).
В многочисленных исследованиях ученые оценивали действие противомикробных агентов на бактерии толстой кишки, вводя антибиотики своим испытуемым и измеряя их влияние на популяции различных бактериальных родов.Изучены все основные классы противомикробных средств. Большая часть этой работы была выполнена лабораторией Карла Норда в больнице Каролинского университета в Стокгольме, Швеция, и было написано несколько обзоров (Nord et al 1984a, 1984b, 1988; Nord and Edlund 1990; Nord 1993; Edlund and Nord 1999b; Sullivan et al 2001a). Образцы фекалий, которые обычно считаются репрезентативными для микробиоты толстой кишки, культивировали на неселективных и селективных средах. Были подсчитаны различные типы колоний, выделены в чистой культуре и идентифицированы до уровня рода.Их количество сравнивали с количеством бактерий, присутствующих от каждого рода до лечения, чтобы измерить эффект антибиотика в уменьшении количества бактерий или обеспечении увеличения, разрастания или размножения других. Все новые колонизирующие бактерии были проверены на чувствительность к введенным антибиотикам (Nord et al 2006a, 2006b). Сообщалось о бактериях, которые были уничтожены, и о тех, которые переросли другие виды. Также было обнаружено развитие устойчивости среди бактерий в нормальной флоре и чрезмерный рост таких микроорганизмов, как дрожжи, которые контролируются нормальной микрофлорой.В большинстве случаев популяции одних родов бактерий уменьшались, а численность бактерий других родов увеличивалась. Это увеличение сопровождалось либо увеличением резистентных штаммов бактерий, либо чрезмерным ростом грибов (Louie et al 1985; Nilsson-Ehle et al 1985).
Экспресс-методы с использованием анализа ДНК также использовались для демонстрации воздействия противомикробных препаратов на микрофлору кишечника человека. De La Cochetiere и его коллеги (2005) выделили фекальную ДНК добровольцев после лечения антибиотиками и амплифицировали бактериальные гены 16S рРНК с помощью ПЦР с общими праймерами, которые были проанализированы с помощью гель-электрофореза в градиенте температуры.Сравнивая модели доминирующих видов с образцами, полученными до лечения, они определили влияние лечения на изменение микробиоты.
Поскольку повсеместное появление различных устойчивых к противомикробным препаратам бактерий было проблематичным, а смертельные случаи стали результатом чрезмерного роста в остальном безобидных комменсальных микроорганизмов, которые не реагируют на доступные противомикробные средства, представляется своевременным рассмотреть влияние этих соединений на микроорганизмы толстой кишки , с акцентом на те, которые не были рассмотрены в предыдущих обзорах.
β-лактамы
β-лактамы — это старейший и наиболее широко назначаемый класс антибиотиков; этот класс включает пенициллины, цефалоспорины, монобактамы, карбапенемы и ингибиторы β-лактамаз.
Пенициллины
К членам этой группы относятся феноксиметилпенициллин, ампициллин, амоксициллин, пиперациллин, азлоциллин, темоциллин, тикарциллин, пивампициллин, талампициллин и баампициллин.
Цефалоспорины
Большинство из них являются полусинтетическими соединениями и не подвержены расщеплению β-лактамного кольца многими β-лактамазами.Они включают цефалоридин, цефазолин, цефаклор, цефроцил, цефбуперазон, цефуроксим, цефокситин, цефотиам, цефотаксим, цефоперазон, цефтриаксон, цефтазидим, цефтиазоксим, цефменоксим, цефотетан и цефрадин.
Монобактамы
β-лактамное кольцо в монобактамах находится отдельно и не слито с другим кольцом. Азтреонам является примером; обычно используется в сочетании с другими лекарствами.
Карбапенемы
По мере того, как все больше и больше бактерий развивают устойчивость к β-лактамным антимикробным агентам, продуцируя различные β-лактамазы, были предприняты усилия по поиску лекарств, на которые не действуют β-лактамазы.Карбапенемы включают имипенем, меропенем, эртапенем, фаропенем, дорипенем, панипенем и бетамипрон. Имипенем инактивируется в почках дегидропептидазой; чтобы предотвратить это, он используется в сочетании с циластатином, ингибитором почечной дегидропептидазы (Birnbaum et al 1985; Nord et al 1985). Помимо устойчивости к β-лактамазам, карбапенемы обладают широкой антибактериальной активностью.
Ингибиторы β-лактамаз
Эти соединения содержат β-лактамное кольцо, но обладают незначительной антимикробной активностью.Поскольку они связываются с β-лактамазами и предотвращают их атаку на другие β-лактамы, их вводят совместно с антимикробными β-лактамами.
Влияние лечения β-лактамами на микрофлору кишечника человека
Воздействие различных β-лактамных антибиотиков оценивалось как на людях-добровольцах, так и на пациентах, проходящих лечение. Различные исследования рассматривали эффекты группы пенициллина: ампициллин (Leigh, 1979), ампициллин плюс сульбактам (Kager et al, 1982), пиперациллин (Kager et al, 1983), азлоциллин (Nord et al, 1986a), темоциллин (van der Waaij 1985), тикарциллин и клавулановая кислота (Nord et al 1989) ().Все они уменьшили количество энтеробактерий, энтерококков и анаэробных бактерий. Лечение амоксициллином (Leigh and Nash 1979; Gipponi et al 1985) привело к подавлению количества энтеробактерий в одних испытаниях, но увеличило их количество в других (Brismar et al 1993b). В некоторых исследованиях после лечения амоксициллином, с клавулановой кислотой или без нее наблюдался избыточный рост C. difficile (Brismar et al 1993b; Lode et al 2001). В некоторых испытаниях наблюдали избыточный рост бактериями или Candida после приема вышеуказанных препаратов.Введение тикарциллина / клавулановой кислоты привело к увеличению количества энтерококков. Феноксиметилпенициллин не имел большого эффекта (Adamsson et al 1997).
Таблица 1
Влияние пенициллинов, отдельно или в сочетании с другими лекарствами, на микрофлору кишечника
Поскольку β-лактамы были первыми открытыми антибиотиками, их часто назначают для лечения различных инфекций, и в результате появилось много бактерий. сопротивление им. Присутствие β-лактамаз в различных бактериях часто приводит к неэффективности этих препаратов.Чтобы избежать развития резистентности и повысить эффективность лекарств, были разработаны другие β-лактамы, которые используются в комбинациях с ингибиторами β-лактамаз или другими лекарственными средствами ().
Таблица 2
Влияние выбранных β-лактамов, отличных от цефалоспоринов, в том числе в комбинации с другими лекарственными средствами, на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней и количество курсов лечения в день | Количество субъектов | Подавление бактерий | Размножение бактерий | Появились устойчивые штаммы или другие результаты | Дни до нормы после прекращения лечения | Ссылка | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Пиперациллин | 90/ тазобакт 4–8 | 20 | Энтеробактерии Энтерококки Бифидобактерии Эубактерии Лактобациллы Clostridia грамположительные кокки | Nord et al. (1993) | ||||||||
| Омепразол / амоксициллин | 20/1000 | 14/2 | 14 | внутримышечные изменения продукция -лактамазы | Stark et al. (1996) | |||||||
| Амоксициллин / клавулановая кислота | 1000 | 7 | 12 | Бифидобактерии Лактобациллы Клостридии | Энтерококки Escherichia coli | Clostridium difficile , выделенная от трех добровольцев | Lode et al. (2001) | |||||
| Амоксициллин | 500 | 7/3 | Brismar et al. (1993a, 1993b) | |||||||||
| Омепразол / амоксициллин / метронидазол | 20/1000/40 | Общая анаэробная микрофлора | Streptococcus spp. Enterococcus spp. Энтеробактерии Колонизация дрожжевыми грибами у девяти субъектов | 35 дней | Адамссон и его коллеги (1999) | |||||||
| Имипенем (хирургическая профилактика) | 500/1000 | 2/4 | 20 | Стафилококки Стрептококки Энтерококки Энтеробактерии Анаэробные кокки Бифидобактерии Эубактерии Лактобациллы Clostridia Fusobacteria Bacteroides | Без колонизации; в норме через 14 дней | Kager et al. (1988) | ||||||
| Pivmecillinam | 400 | 14–41 | 15 | E.coli | Sullivan et al. (2001b) | |||||||
| Ertapenem | 1000 | 7 | 10 | Lactobacilli Бифидобактерии Clostridia Bacteroides E. coli | Enterococci | Разрастание дрожжей | 21–35 дней | Плетц и его коллеги (2004) | ||||
| Азтреонам | пациенты с фебрамицином | Кишечные грамотрицательные бациллы Фекальные анаэробы | Грибковое заражение | Луи и его коллеги (1985) | ||||||||
| Азтреонам плюс клоксациллин | Гриб-отрицательная бактерия анаэробы | Грибковое заражение | Луи и его коллеги (1985) | |||||||||
| Моксалактам плюс тобрамицин | 9015 Фекальные грамотрицательные бактерии 9015 Луи и его коллеги (1985) | |||||||||||
| Имипенем | 500–1000 | 4–11 / 4 | 10 | Энтеробактерии Анаэробные кокки Бактероиды | ||||||||
| Меропенем | 500 | 7/3 | 10 | Энтеробактерии Стрептококки Clostridia Bacteroides грамотрицательные кокки | Enterococci | 14 дней | Bergan et al. (1991) |
Pivmecillinam
Sullivme et al. микрофлора 15 особей.Их лечили в течение 7 дней 400 мг пивмециллинама два раза в день, а затем снова через 14 и 21 день после начала приема. Число E. coli уменьшилось, но изменений в анаэробной микрофлоре не произошло.
Пиперациллин / тазобактам
Рассмотрено влияние пиперациллина на бактерии толстой кишки (Nord and Edlund 1990). Также изучалось влияние на экологию толстой кишки его использования в сочетании с ингибитором β-лактамазы, тазобактамом (Nord et al 1992, 1993; Nord and Lahnborg 1994).Оценивали влияние комбинации пиперациллин / тазобактам (4 / 0,5 г) на пациентов с внутрибрюшными инфекциями, которых лечили три раза в день в течение 8 дней; снизилось среднее количество энтеробактерий, энтерококков и анаэробов (бифидобактерий, эубактерий, лактобактерий, клостридий и грамположительных кокков). Анаэробные грамотрицательные кокки и Bacteroides spp. не были затронуты (). Количество бактерий нормализовалось после прекращения лечения (Nord et al 1992, 1993).
Омепразол и амоксициллин
Комбинация омепразола (20 мг, ингибитор протонной помпы для эрадикации Helicobacter pylori ) и амоксициллина (1000 мг) два раза в день в течение 14 дней приводила к изменениям микрофлоры кишечного тракта, увеличивает в количестве устойчивых энтеробактерий и увеличение продукции β-лактамаз, обнаруженное в образцах фекалий (Stark et al 1995; Adamsson et al 1999).
Комбинации омепразол / амоксициллин / метронидазол
Также изучались эффекты амоксициллина в сочетании с противомикробными средствами, эффективными против анаэробов.Метронидазол, который используется для лечения анаэробных и паразитарных инфекций, также используется для лечения H. pylori в сочетании с другими лекарствами. Лечение пациентов комбинацией омепразола 20 мг, амоксициллина 1 г и метронидазола 40 мг в течение 7 дней привело к изменению нормальной микрофлоры и выраженному подавлению анаэробной микрофлоры. Во время лечения некоторые пациенты также были заражены дрожжами. Значения МИК этих препаратов для Enterococcus spp.и Enterobacteriaceae увеличились (Adamsson et al 1999).
Амоксициллин / клавулановая кислота
Введение 1000 мг амоксициллина / клавулановой кислоты в течение 7 дней 12 здоровым людям (те же люди, которые лечились линезолидом 600 мг в течение 7 дней, с периодом вымывания 4 недели между курсами лечения) привело к увеличению количества энтерококков и E. coli и значительному снижению количества анаэробов, включая бифидобактерии, лактобациллы и клостридии. C. difficile был выделен у трех добровольцев (Lode et al 2001). Авторы пришли к выводу, что в отличие от линезолида, амоксициллин / клавулановая кислота не уничтожает грамположительные бактерии.
Десять добровольцев, получавших амоксициллин по 500 мг три раза в день в течение 7 дней, были колонизированы устойчивыми к амоксициллину бактериями, в основном E. coli , Klebsiella и Enterobacter (Brismar et al 1993b). Активность β-лактамазы была обнаружена в микрофлоре шести человек.
Имипенем
Кагер и его коллеги (1988) оценили влияние имипенема как при лечении, так и в профилактических целях на микрофлору кишечника. Использование 0,5 или 1 г имипенема четыре раза в день в течение 4–11 дней привело к снижению количества энтеробактерий, анаэробных кокков и Bacteroides spp. во время лечения. В дальнейшем микрофлора нормализовалась. Пациенты, получавшие 0,5 или 1 г имипенема для хирургической профилактики каждые 6 часов в течение 48 часов, имели подавленные уровни стафилококков, стрептококков, энтерококков, энтеробактерий, анаэробных бактерий, кокков, бифидобактерий, эубактерий, лактобацилл, клостридий, фузобактерий и Bacteroides spp.во время лечения; после этого уровни были нормальными. Колонизации устойчивыми к имипенему бактериями не происходило (Kager et al 1988, 1989).
Азтреонам с тобрамицином или клоксациллином
Луи и его коллеги (1985) использовали различные комбинации препаратов для лечения пациентов с фебрильной нейтропенией и сравнили их влияние на микробную экологию. Комбинации азтреонама либо с тобрамицином (15 человек), либо с клоксациллином (14 пациентов) привели к уничтожению кишечных грамотрицательных бацилл.Эти комбинации также вызвали уменьшение количества фекальных анаэробов, сопровождаемое пониженной концентрацией короткоцепочечных жирных кислот в фекальных супернатантах (Louie et al 1985). Разрастание грибков произошло у 27% субъектов, получавших азтреонам / тобрамицин, и у 43% субъектов, получавших азтреонам / клоксациллин. Комбинированная терапия моксалактамом / тобрамицином у 15 пациентов оказала аналогичное влияние на снижение анаэробов и грибковых заболеваний (81%), как и две предыдущие комбинации. Все пациенты были пациентами с фебрильной нейтропенией, поэтому авторы пришли к выводу, что поддержание анаэробной флоры было важным для предотвращения заражения грибами у пациентов с фебрильной нейтропенией.
Меропенем
Внутривенное введение 500 мг меропенема три раза в день в течение 7 дней у 10 пациентов привело к снижению количества энтеробактерий и стрептококков и увеличению количества энтерококков, клостридий, Bacteroides spp. И грамотрицательных кокки. Другие грамположительные кокки и палочки не пострадали. Через две недели после прекращения терапии микрофлора кишечника вернулась к норме (Bergan et al, 1991).
Эртапенем и цефтриаксон
Введение эртапенема (1 г в день) или цефтриаксона (2 г в день) 10 здоровым людям в течение 7 дней посредством инъекции привело к 4-логарифмическому снижению E.coli , а также уменьшение анаэробной микрофлоры, включая лактобациллы, бифидобактерии, клостридии и Bacteroides spp. Количество энтерококков увеличилось на 4 логарифма. В обоих случаях наблюдался избыточный рост дрожжей, но в обоих случаях микрофлора нормализовалась в течение 21–35 дней после завершения лечения (Pletz et al 2004).
Цефалоспорины
Различные цефалоспорины оказывают большое влияние на микрофлору толстой кишки (Nord and Edlund, 1990).Цефбуперазон (Kager et al 1986), цефокситин (Kager et al 1982), цефотаксим (Lambert-Zechovsky et al 1985), цефоперазон (Alestig et al 1983), цефтриаксон (Arvidsson et al 1982), цефаклор (Nord et al 1987), и цефотетан (Амброуз и др., 1985) снижали количество анаэробных бактерий и энтеробактерий. Все эти препараты, за исключением цефоперазона и цефтриаксона, также снижали количество энтерококков при большинстве курсов лечения. Цефотаксим уменьшал количество энтеробактерий и энтерококков в одном испытании. Цефалоридин (Амброуз и др., 1985) и цефрадин (Брамфитт и др., 1986) оказали незначительное влияние.Однако в результате применения всех этих препаратов, за исключением цефрадина, цефтазидима и цеф-буперазона, развились устойчивые бактериальные штаммы. C. difficile появился в некоторых испытаниях с цефепимом, цефтриаксоном и цефиксимом. Количество анаэробных грамположительных кокков увеличивалось после лечения цефтриаксоном и цефиксимом (Nilsson-Ehle et al 1985, Sullivan et al 2001a). Влияние других цефалоспоринов (цефпрозила, цефподоксима проксетила, цефтибутена и цефадроксила) на кишечную флору показано в.
Таблица 3
Влияние цефалоспоринов на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней и количество сеансов лечения в день | Количество субъектов | Подавление бактерий | Появление устойчивых штаммов или другие побочные эффекты | Дни до нормального состояния после прекращения лечения | Ссылка | |
|---|---|---|---|---|---|---|---|---|
| Cefprozil | 500 | 8/2 | 8 | Enterobacteria 9015occi | Мягкие стулья | 4 дня | Lode et al. (1992) | |
| Cefadroxil | 500 | 10 | 20 | Не сильно изменились Адамссон и его коллеги (1997) | ||||
| Цефподоксим проксетил | 200 | 7/2 | 10 | Стрептококки Энтеробактерии Clostridia | Enterococci Clostridium difficile | Активность β-лактамазы во флоре некоторых субъектов | Brismar et al. (1993b) | |
| Цефтриаксон | Бифидобактерии Clostridia Bacteroides E.coli | Энтерококки | Разрастание дрожжей | от 1 до 35 дней | Плетц и его коллеги (2004) | |||
| Цефтибутан | 400 | 10 | 14 9015occi | E. cocci | Повышенная колонизация β-лактамазой C. difficile у шести человек | Brismar et al. (1993a) |
Cefprozil
Введение цефпрозила привело к изменениям в популяциях определенных родов.Lode et al. (1992) изучали эффекты цефпрозила у восьми человек. Они вводили 500 мг цефпрозила два раза в день в течение 8 дней и обнаружили, что это привело к умеренному снижению количества энтеробактерий и небольшому увеличению количества энтерококков, стафилококков и Bacteroi-des spp. Популяции микробов были нормальными через 4 дня после обработки. Основным микробиологически связанным последствием был мягкий стул. В некоторых случаях наблюдался избыточный рост C. difficile после лечения цефпрозилом (Lode et al 1992).
Цефподоксим проксетил
Цефподоксим проксетил оказывает сильное воздействие на бактерии толстой кишки. Брисмар и его коллеги (1993b) оценили эффекты этого соединения на добровольцах, получавших 200 мг два раза в день в течение 7 дней. Количество стрептококков, энтеробактерий и клостридий существенно снизилось в фекальной флоре, и наблюдался чрезмерный рост энтерококков, дрожжей и Clostridium difficile (Brismar et al 1993b).
Цефадроксил
Назначение цефадроксила здоровым людям не вызывает заметных нарушений экологии толстой кишки.Adamsson и его коллеги (1997) оценили эффект от приема 500 мг цефадроксила в течение 10 дней 20 здоровыми добровольцами. Воздействие на микрофлору кишечника было незначительным, и микрофлора была нормальной через две недели после отмены препарата.
Цефтибутен
Брисмар и его коллеги (1993a) вводили цефтибутен 14 здоровым людям. Каждый получал ежедневную дозу 400 мг цефтибутена перорально, но только у двух человек обнаруживались уровни цефтибутена в кале. За период введения увеличилось количество энтерококков и E.coli и анаэробных кокков. У восьми добровольцев были повышенные уровни β-лактамаз, и шесть были колонизированы C. difficile.
Фторхинолоны
Фторхинолоны представляют собой класс синтетических противомикробных агентов, влияние которых на экологию микрофлоры толстой кишки интенсивно изучалось (Edlund and Nord 1988b; Edlund and Nord 1999b; Sullivan et al 2001a). Путем введения различных фторхинолонов и подсчета бактерий из разных родов до и после воздействия было показано, что фторхинолоны обладают избирательным действием на нормальные бактерии толстой кишки.Эффекты ципрофлоксацина (Brismar et al 1990), норфлоксацина (Edlund et al 1987a, 1987b; Edlund and Nord 1988a), офлоксацина (Pecquet et al 1987; Edlund et al 1988), пефлоксацина (Vollaard et al 1992), ломефлоксацина (Edlund et al 1990), левофлоксацин (Edlund et al 1997b), спарфлоксацин (Ritz et al 1994), руфлоксацин (D’Antonio et al 1996), ситафлоксацин (Inagaki and Yamamoto et al 1995), гатифлоксацин (Edlund and Nord 1999a), тровафлоксацин (Edlund and Nord 1999b) и моксифлоксацин (Edlund and Nord 1999b; Edlund et al 2000b) на микрофлору кишечника.Все протестированные фторхинолоны уменьшали популяции энтеробактерий, а пефлоксацин уменьшал количество аэробных грамположительных кокков. В целом ни один из фторохинолонов не влиял на популяцию анаэробных бактерий. Разрастания бактерий под действием фторхинолонов не наблюдалось, но иногда наблюдалось разрастание Candida . Хотя инфекция C. difficile не наблюдалась, использование новых фторхинолонов было связано с появлением C.difficile диарея, связанная с антибиотиками, в некоторых больницах. In vitro , мы показали, что некоторые штаммы C. perfringens легко становятся устойчивыми к фторхинолонам, даже к тем, которые обычно эффективны против анаэробов (Rafii et al 2005). Устойчивые штаммы также демонстрируют физиологические изменения, отличные от штаммов дикого типа. Точно так же мы показали in vitro , что один из пяти штаммов C. perfringens продуцировал большее количество токсина в ответ на воздействие гатифлоксацина (Rafii et al 2008).Также оценивалось влияние некоторых из последних разработанных фторхинолонов (гареноксацина, гемифлоксацина и клинафлоксацина) на экологию толстой кишки ().
Таблица 4
Влияние фторхинолонов на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней | Количество субъектов | Подавление бактерий | Развивающиеся штаммы | Резистентные бактерии | Дней до нормы после прекращения лечения | Ссылка | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Гареноксацин | 600 | 6 | 16 | Энтерококки Бациллы Коринебактерии Энтеробактерии Бифидобактерии Лактобациллы Clostridia Bacteroides | Eubacteria | Устойчивость к гареноксацину Eubacterium lentum | 14 дней | Nord et al. (2003) | |||
| Гемифлоксацин | 320 | 7 | 10 | Энтеробактерии Энтерококки Стрептококки Анаэробные кокки Lactobacilli | 49 дней | Баркер и его коллеги (2001) | |||||
| Клинафлоксацин | 200 | 7 | 12 | Аэробные бактерии. | Oh et al. (2000) |
Garenoxacin
Nord et al. (2003) оценили влияние перорального приема гареноксацина на фекальную микрофлору 16 человек. Прием 600 мг гареноксацина ежедневно в течение 6 дней снизил количество энтерококков, бацилл, коринебактерий, энтеробактерий, бифидобактерий, лактобацилл, клостридий и Bacteroides spp. в микрофлоре кишечника, и это увеличило количество эубактерий.Микрофлора нормализовалась через 2 недели после прекращения приема фторхинолона широкого спектра действия. Концентрация гареноксацина в образцах фекалий составляла 14–31 мг / кг. Устойчивый к Garenoxa-cin Eubacterium lentum (MIC = 64 мг / мл) был изолирован от субъектов; популяции вернулись к нормальному состоянию через 14 дней после отмены (Nord et al, 2003).
Гемифлоксацин
Селективный эффект гемифлоксацина на микрофлору кишечника был аналогичен таковому у других фторхинолонов (Barker et al 2001).Введение 320 мг гемифлоксацина перорально в течение 7 дней 10 здоровым субъектам привело к подавлению энтеробактерий, энтерококков и стрептококков. Также уменьшились анаэробные кокки и лактобациллы. Разрастания или отбора устойчивых бактерий не обнаружено; популяции бактерий вернулись к норме через 49 дней после прекращения лечения (Barker et al 2001).
Клинафлоксацин
Ох и коллеги (2000) оценили влияние клина-флоксацина на экологию кишечника у 12 здоровых людей и обнаружили серьезные экологические нарушения.Пероральное введение 200 мг клинафлоксацина в течение 7 дней привело к высокому уровню препарата в кале (среднее значение 176 мг / кг на 7 день). Он уничтожил аэробные бактерии у 11 испытуемых и подавил анаэробную микрофлору. Клинафлоксацин-устойчивый Bacteroides sp. (MIC> 4) также появились; Ох и коллеги (2000) рекомендовали ограничить использование этого препарата.
Макролиды
Макролиды имеют макроциклическое 14-16-членное лактоновое кольцо, присоединенное к дезоксисахара. Они включают кларитромицин, диритромицин, эритромицин и рокситромицин, которые обладают бактерицидным или бактериостатическим действием.Их влияние на микрофлору кишечника кратко излагается в.
Таблица 5
Влияние диритромицина, кларитромицина, тигециклина и эритромицина на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней и количество процедур | в день | Подавление бактерий | Размножение бактерий и дрожжей | Появление устойчивых штаммов | Дней до нормы после прекращения лечения | Ссылка | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Диритромицин | 500 | 7 | Стрептококки Стафилококки Анаэробы Clostridia Lactobacilli | Диритромицин-устойчивые энтеробактерии | Eckernas et al. (1991) | |||||
| Кларитромицин | 500 | 7/2 | 12 | Escherichia coli | 12 | Клостридии | Энтерококки Enterobacter Citrobacter Klebsiella Pseudomonas | Отсутствует | 35 дней | Эдлунд и соавторы (2000a) |
| /7/50/156 | 16 | Анаэробные бактерии | Общая анаэробная микрофлора | Streptococcus spp. Enterococcus spp. Энтеробактерии устойчивый к кларитромицину Bacteroides spp. | Adamsson et al. (1999) | |||||
| Тигециклин | 100 / затем 50/2 | 10 | 13 | Энтерококки Escherichia Лактобациллы Bifidobacteria | Nord et al. (2006b) | |||||
| Эритромицин | 1000/500 | 7/2 | 10 | Streptococci Энтерококки Энтеробактерии Анаэробные бактерии также были поражено | Staphylococcus spp. | Устойчивые к эритромицину энтеробактерии, клостридии или дрожжи | Brismar et al. (1991) |
Диритромицин
Eckernas и его коллеги (1991) оценили влияние лечения диритромицином 20 здоровых людей на популяции диритромицина. . При ежедневном приеме 500 мг диритромицина в течение 7 дней в кале было обнаружено 12 мг / кг диритромицина.
Количество энтеробактерий и анаэробов (грамположительные кокки, бифидобактерии, эубактерии и Bacteroides spp.) уменьшилась кишечная флора и увеличилось количество стрептококков, стафилококков и других анаэробов (клостридий и лактобацилл). Кроме того, кишечник колонизировали устойчивые к диритромицину энтеробактерии. Eckernas и его коллеги (1991) пришли к выводу, что диритромицин оказывает значительное экологическое воздействие на бактерии толстой кишки.
Кларитромицин
Эдлунд и его коллеги (2000a, 2000b) оценили экологическое воздействие кларитромицина на 12 добровольцах. Введение кларитромицина (500 мг два раза в день в течение 7 дней) вызвало значительное снижение E.coli , а количество энтерококков, энтеробактерий, цитробактеров, клебсиелл и псевдомонад заметно увеличилось. Никаких существенных изменений в количестве стафилококков, стрептококков, бацилл или Candida замечено не было. В анаэробной микрофлоре бифидобактерии, лактобациллы и клостридии были подавлены, в то время как никаких изменений в пептострептококках, Veillonella , Bacteroide spp. Или фузобактериях не обнаружено. Через 35 дней микрофлора у всех добровольцев была нормальной.Эдлунд и его коллеги (2000a, 2000b) также обнаружили появление Bacteroides spp. изоляты, устойчивые к кларитромицину после введения 500 мг кларитромицина в течение 10 дней 10 пациентам. Эти бактерии сохранялись в течение 2 недель после отмены препарата. В том же исследовании авторы также обнаружили α-гемолитические стрептококки, кишечные энтерококки и энтеробактерии с устойчивостью к кларитромицину, но без чрезмерного роста дрожжей или C. difficile .
Комбинация 20 мг омепразола, 250 мг кларитромицина и 400 мг метронидазола приводила к изменению нормальной микрофлоры, подобно комбинации омепразола, амоксициллина и метронидазола (Adamsson et al 1999).Подавление анаэробной микрофлоры было более выраженным, чем в группе амоксициллина. Во время лечения наблюдалось значительное увеличение количества устойчивых к кларитромицину штаммов Bacteroides с 2% до 76%. Обе комбинации изменяли фекальную микрофлору, но комбинированная терапия кларитромицином оказывала более нежелательное воздействие на экосистему толстой кишки (Adamsson et al 1999).
Эритромицин
Брисмар и его коллеги (1991) вводили 1 г этилсукцината эритромицина перорально в течение 7 дней 10 добровольцам и оценивали его действие на бактерии толстой кишки.Они обнаружили уменьшение количества стрептококков, энтерококков и энтеробактерий во время приема, увеличение количества стафилококков и изменение анаэробных бактерий. В более раннем исследовании (Heimdahl and Nord 1982) было показано, что введение 500 мг эритромицина два раза в день в течение 7 дней 10 добровольцам привело к снижению количества энтеробактерий и большинства анаэробов. Кроме того, всех субъектов колонизировали потенциально патогенные устойчивые к эритромицину энтеробактерии, клостридии или дрожжи (Heimdahl and Nord 1982).
Кетолиды
Это новый класс соединений, родственных макролидам, и включает телитромицин (Nord et al 2004), который отличается от эритромицина наличием большой ароматической боковой цепи и заменой сахара кетогруппой. Кетолиды могут связываться с двумя участками бактериальной рибосомы; поэтому они эффективны даже против макролидно-устойчивых бактерий. У них также снижен потенциал индукции устойчивых к кетолидам бактерий. Эдлунд и его коллеги (2000a) изучали действие телитромицина у десяти субъектов и обнаружили увеличение МПК телитромицина для резистентных видов Bacteroides spp.изолятов, которые сохранялись в течение 2 недель после отмены препарата. Однако разрастания дрожжей и C. difficile не наблюдалось.
Аминогликозиды
Примерами аминогликозидов являются амикацин, гентамицин, канамицин, неомицин, нетилмицин, паромомицин, родострептомицин, стрептомицин, тобрамицин и апрамицин. Finegold (1986) отметил связь между приемом «кишечных антисептиков», таких как пероральный неомицин, и суперинфекцией анаэробами.
Глицилциклины
Глицилциклины, новый класс антибиотиков, представляют собой аналоги тетрациклинов, разработанные с особенностями предотвращения их оттока из клеток или образования белков защиты рибосом, которые приводят к устойчивости к тетрациклинам.
Тигециклин
Тигециклин — это глицилциклин, который обладает мощным действием широкого спектра действия против большинства грамположительных и грамотрицательных аэробных и анаэробных бактерий. Введение 50 мг тигециклина 20 пациентам каждые 12 часов в течение 10 дней (Nord et al 2006b) привело к снижению количества энтерококков, E. coli , лактобацилл и бифидобактерий, а также к увеличению количества других энтеробактерий и дрожжей. Разработаны два устойчивых к тигециклину штамма Klebsiella pneumoniae и пять устойчивых к тигециклину штаммов Enterobacter cloacae (Nord et al 2006b).
Линкозамиды
Линкомицин и клиндамицин представляют собой линкозамиды, которые ингибируют реакции транспептидазы, связываясь с 23 S и 50 S субъединицами бактериальных рибосом и ингибируя раннее удлинение пептидных цепей.
Клиндамицин
Клиндамицин используется для лечения не только анаэробных инфекций, но и паразитарных инфекций, включая малярию. Введение клиндамицина 10 пациентам в течение 7 дней приводило к нарушению экологии толстой кишки (Kager et al, 1981).Клиндамицин также связан с диареей, связанной с антибиотиками C. difficile . Кагер и его коллеги (1981) оценили эффект 600 мг клиндамицина внутривенно с 8-часовыми интервалами в течение 48 часов, что привело к уменьшению количества энтерококков, стрептококков и анаэробных бактерий. После лечения размножались стрептококки и анаэробные бактерии; у части пациентов возникла послеоперационная инфекция, вызванная Enterococcus faecalis .
Оксазолидоны
Линезолид относится к классу антимикробных агентов, называемых оксазолидонами.Это синтетический антибиотик, который редко используется из-за своей высокой цены, но он эффективен для лечения бактериальных инфекций с множественной лекарственной устойчивостью, в том числе вызванных Streptococcus spp. и MRSA. Введение 600 мг линезолида в течение 7 дней здоровым добровольцам привело к подавлению энтерококков и увеличению количества Klebsiella spp. Это также уменьшило количество следующих анаэробов: бифидобактерии, лактобациллы, клостридии и Bacte-roides spp.Через тридцать пять дней после прекращения лечения микрофлора была нормальной (Lode et al 2001).
Гликопептиды
Этот класс состоит из гликозилированных циклических нерибосомных пептидов и включает ванкомицин, тейкопланин, телаванцин, трампланин, декапланин и далбаванцин, который является липогликопептидом. Они подавляют синтез пептидогликана.
Ванкомицин
Этот препарат использовался в качестве последнего средства для лечения инфекций, вызванных грамположительными бактериями. Эдлунд и его коллеги (1997a) оценили эффекты ванкомицина у 10 человек после лечения 250 мг цефуроксима аксетила два раза в день в течение 7 дней.Затем субъекты получали 125 мг ванкомицина четыре раза в день в течение 7 дней. Авторы пришли к выводу, что ванкомицин вызывает экологические нарушения микрофлоры кишечника. Лечение ванкомицином привело к снижению количества Enterococcus faecium , E. faecalis и E. durans и анаэробов, включая бифидобактерии и Bacteroides spp. Это также привело к появлению подвижных энтерококков, в том числе E. gallinarum, и E.casseliflavus со сниженной чувствительностью к ванкомицину (МПК = 4–16 мг / мл). Некоторые из этих штаммов имели ген van C2 (C3). Кроме того, появились устойчивые к ванкомицину штаммы видов Pediococcus , Lactobacillus , Klebsiella , Citrobacter и Enterobacter . Недавно другие исследователи показали, что пероральный ванкомицин способствует чрезмерному росту устойчивых к ванкомицину энтерококков (Al-Nassir et al, 2008).
Далбаванцин
Это новый липогликопептид, родственный ванкомицину, и аналогично этому препарату он используется для лечения MRSA и S. epidermidis . Норд и его коллеги (2006a) оценили действие этого препарата у 12 человек. При введении 1 г далбаванцина шести мужчинам и шести женщинам произошли некоторые изменения в количестве энтерококков и E. coli , но не изменилось количество лактобацилл, клостридий и Bacteroides spp. № C.difficile были выделены. Новых колонизирующих аэробных или анаэробных бактерий с устойчивостью к далбаванцину обнаружено не было. Далбаванцин, по-видимому, не оказывает серьезного экологического воздействия на нормальную микрофлору кишечника человека (Barker et al 2001, Nord et al 2006a).
Метронидазол
Метронидазол используется для лечения анаэробных бактериальных инфекций, а также в комбинации с другими лекарствами для лечения язвенного колита. Было показано, что он устраняет метаногенные археи (Ansorg et al 2003).Использование перорального метронидазола для лечения заболевания, ассоциированного с C. difficile-, привело к чрезмерному росту энтерококков, включая устойчивые к ванкомицину штаммы (Al-Nassir et al, 2008).
Выводы
Микрофлора толстой кишки обеспечивает ряд преимуществ, включая участие в питании хозяина и защиту хозяина от инфекции. В большинстве случаев противомикробной терапии численность бактериальных популяций одних родов сокращается, а популяций других родов — увеличивается.В некоторых случаях увеличение количества определенных бактерий сопровождается появлением устойчивых штаммов бактерий или чрезмерным ростом грибков. Лечение комбинациями противомикробных препаратов не обязательно предотвращает развитие резистентности. Это может даже привести к чрезмерному росту грибков и появлению бактерий, устойчивых ко всем лекарствам в комбинации. Примерами являются комбинация амоксициллина и метронидазола и комбинация азтреонама с тобрамицином или клоксациллином, все из которых приводят не только к подавлению анаэробов, но и к чрезмерному росту грибков.Некоторые анаэробные бактерии могут сдерживать рост грибков. Обзор воздействия антимикробных препаратов на экологию толстой кишки также показывает различия между людьми в ответ на лечение этими препаратами и различия в эффектах этих препаратов на разные штаммы одной и той же бактерии. Штаммы, продуцирующие токсин C. difficile , были обнаружены в некоторых больницах после терапии фторхинолоном, а некоторые штаммы C. perfringens вырабатывают токсин после воздействия гатифлоксацина.Невозможно переоценить важность разумного использования этих важных лекарств.
Благодарности
Мы выражаем особую благодарность доктору Карлу Э. Норду и доктору Кидон Сунгу за рецензирование этой рукописи. Взгляды, представленные в этой статье, не обязательно отражают точку зрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Ссылки
- Adamsson I, Edlund C, Sjostedt S, et al. Сравнительные эффекты цефадроксила и феноксиметилпенициллина на нормальную микрофлору ротоглотки и кишечника.Инфекционное заболевание. 1997. 25: 154–8. [PubMed] [Google Scholar]
- Adamsson I, Nord CE, Lundquist P, et al. Сравнительные эффекты омепразола, амоксициллина и метронидазола по сравнению с омепразолом, кларитромицином и метронидазолом на микрофлору полости рта, желудка и кишечника у пациентов, инфицированных Helicobacter pylori, . J Antimicrob Chemother. 1999; 44: 629–40. [PubMed] [Google Scholar]
- Аль-Нассир В.Н., Сетхи А.К., Ли Й. и др. Как пероральный метронидазол, так и пероральный ванкомицин способствуют стойкому избыточному росту устойчивых к ванкомицину энтерококков во время лечения заболевания, ассоциированного с Clostridium difficile .Противомикробные агенты Chemother. 2008. 52: 2403–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Олдридж К.Э., Эшкрафт Д., Камбре К. и др. Многоцентровое исследование изменения чувствительности in vitro к противомикробным препаратам клинических изолятов видов Bacteroides fragilis , Prevotella , Fusobacterium , Porphyromonas и Peptostreptococcus . Противомикробные агенты Chemother. 2001; 45: 1238–43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Алестиг К., Карлберг Х., Норд CE и др.Влияние цефоперазона на фекальную флору. J Antimicrob Chemother. 1983; 12: 163–7. [PubMed] [Google Scholar]
- Амброуз Н.С., Джонсон М., Бердон Д.В. и др. Влияние однократных внутривенных антибиотиков на фекальную флору и появление Clostridium difficile . J Antimicrob Chemother. 1985; 15: 319–26. [PubMed] [Google Scholar]
- Ансорг Р., Рат П.М., Рунде В. и др. Влияние деконтаминации кишечника с использованием метронидазола на обнаружение метаногенных архей у реципиентов трансплантата костного мозга.Пересадка костного мозга. 2003; 31: 117–9. [PubMed] [Google Scholar]
- Aronsson B, Möllby R, Nord CE. Возникновение токсин-продуцирующего вещества Clostridium difficile при диарее, связанной с антибиотиками, в Швеции. Med Microbiol Immunol. 1981; 170: 27–35. [PubMed] [Google Scholar]
- Aronsson B, Möllby R, Nord CE. Противомикробные агенты и Clostridium difficile при остром кишечном заболевании: эпидемиологические данные из Швеции, 1980–1982 гг. J Infect Dis. 1985; 151: 476–81. [PubMed] [Google Scholar]
- Arvidsson A, Alvan G, Angelin B и др.Цефтриаксон: почечная и желчная экскреция и влияние на микрофлору толстой кишки. J Antimicrob Chemother. 1982; 10: 207–15. [PubMed] [Google Scholar]
- Arvidsson A, Leijd B, Nord CE, et al. Индивидуальная вариабельность экскреции цефтриаксона с желчью: влияние на метаболизм липидов желчных путей и микрофлору кишечника. Eur J Clin Invest. 1988. 18: 261–6. [PubMed] [Google Scholar]
- Баркер П.Дж., Шихан Р., Тейлол-Фу М. и др. Влияние гемифлоксацина на нормальную микрофлору кишечника человека.J Chemother. 2001; 13: 47–51. [PubMed] [Google Scholar]
- Berg RD. Аборигенная микрофлора желудочно-кишечного тракта. Trends Microbiol. 1996; 4: 430–5. [PubMed] [Google Scholar]
- Bergan T, Nord CE, Thorsteinsson SB. Влияние меропенема на микрофлору кишечника. Eur J Clin Microbiol Infect Dis. 1991; 10: 524–7. [PubMed] [Google Scholar]
- Бирнбаум Дж., Кахан Ф.М., Кропп Х. и др. Карбапенемы, новый класс бета-лактамных антибиотиков. Открытие и разработка имипенема / циластатина.Am J Med. 1985; 78: 3–21. [PubMed] [Google Scholar]
- Брисмар Б., Эдлунд С., Мальмборг А.С. и др. Концентрации ципрофлоксацина и влияние микрофлоры толстой кишки у пациентов, перенесших колоректальную операцию. Противомикробные агенты Chemother. 1990; 34: 481–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Brismar B, Edlund C, Nord CE. Сравнительное действие кларитромицина и эритромицина на нормальную микрофлору кишечника. Scand J Infect Dis. 1991; 23: 635–42. [PubMed] [Google Scholar]
- Brismar B, Edlund C, Nord CE.Влияние цефтибутена на нормальную микрофлору кишечника. Инфекционное заболевание. 1993a; 21: 373–5. [PubMed] [Google Scholar]
- Brismar B, Edlund C, Nord CE. Влияние цефподоксима проксетила и амоксициллина на нормальную микрофлору полости рта и кишечника. Eur J Clin Microbiol Infect Dis. 1993b; 12: 714–9. [PubMed] [Google Scholar]
- Брамфитт В., Франклин И., Грейди Д. и др. Влияние амоксициллин-клавуланата и цефрадина на фекальную флору здоровых добровольцев, не контактировавших с больничной средой.Противомикробные агенты Chemother. 1986; 30: 335–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cerniglia CE, Котарски С. Оценка остатков ветеринарных лекарств в пище на предмет их потенциального воздействия на микрофлору кишечника человека. J Regulatory Toxicol Pharmacol. 1999; 29: 238–61. [PubMed] [Google Scholar]
- D’Antonio D, Pizzigallo E, Lacone A и др. Влияние руфлоксацина, назначаемого в качестве профилактики онкологическим больным, на их микрофлору полости рта и фекалий. J Antimicrob Chemother. 1996; 38: 839–47.[PubMed] [Google Scholar]
- Де ла Кошетьер М.Ф., Дюран Т., Лепаж П. и др. Устойчивость доминирующей микробиоты фекалий человека при кратковременном введении антибиотиков. J Clin Microbiol. 2005; 43: 5588–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Денев С., Деломени С., Барк М.С. и др. Антибиотики, участвующие в заболевании, ассоциированном с Clostridium difficile , увеличивают экспрессию гена фактора колонизации. J Med Microbiol. 2008; 57: 732–8. [PubMed] [Google Scholar]
- Eckernas SA, Grahnen A, Nord CE.Влияние диритромицина на нормальную микрофлору полости рта и кишечника. Eur J Clin Microbiol Infect Dis. 1991; 10: 688–92. [PubMed] [Google Scholar]
- Эдлунд К., Алван Г., Баркхольт Л. и др. Фармакокинетика и сравнительные эффекты телитромицина (HMR 3647) и кларитромицина на микрофлору ротоглотки и кишечника. J Antimicrob Chemother. 2000a; 46: 741–9. [PubMed] [Google Scholar]
- Эдлунд К., Баркхольт Л., Олссон-Лильеквист Б. и др. Влияние ванкомицина на кишечную флору пациентов, ранее получавших антимикробную терапию.Clin Infect Dis. 1997a; 25: 729–32. [PubMed] [Google Scholar]
- Эдлунд К., Берган Т., Йозефссон К. и др. Влияние норфлоксацина на микрофлору ротоглотки и толстой кишки и фармакокинетика многократных доз. Scand J Infect Dis. 1987a; 19: 113–21. [PubMed] [Google Scholar]
- Эдлунд К., Бейер Г., Химер-Бау М. и др. Сравнительное действие моксифлоксацина и кларитромицина на нормальную микрофлору кишечника. Scand J Infect Dis. 2000b; 32: 81–5. [PubMed] [Google Scholar]
- Edlund C, Brismar B, Nord CE.Влияние ломефлоксацина на нормальную микрофлору полости рта и кишечника. Eur J Clin Microbiol Infect Dis. 1990; 9: 35–9. [PubMed] [Google Scholar]
- Эдлунд К., Кагер Л., Мальмборг А.С. и др. Влияние офлоксацина на микрофлору полости рта и желудочно-кишечного тракта у пациентов, перенесших операции на желудке. Eur J Clin Microbiol Infect Dis. 1988; 7: 135–43. [PubMed] [Google Scholar]
- Эдлунд К., Лидбек А., Кагер Л. и др. Сравнительное действие эноксацина и норфлоксацина на микрофлору толстой кишки человека. Противомикробные агенты Chemother.1987b; 31: 1846–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Edlund C, Nord CE. Манипуляции с микрофлорой ротоглотки и кишечника норфлоксацином: микробиологические и клинические аспекты. Scand J Infect Dis Suppl. 1988a; 56: 14–21. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Обзор влияния 4-хинолонов на нормальную микрофлору ротоглотки и кишечника человека. Инфекционное заболевание. 1988b; 16: 8–12. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Экологическое действие гатифлоксацина на нормальную микрофлору кишечника человека.J Chemother. 1999a; 11: 50–3. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Влияние хинолонов на экологию кишечника. Наркотики. 1999b; 58 (Дополнение 2): 65–70. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Влияние пероральных антибиотиков для лечения инфекций мочевыводящих путей на нормальную микрофлору человека. J Antimicrob Chemother. 2000; 46 (Приложение A): 41–8. [PubMed] [Google Scholar]
- Edlund C, Sjöstedt S, Nord CE. Сравнительное действие левофлоксацина и офлоксацина на нормальную микрофлору полости рта и кишечника.Scand J Infect Dis. 1997b; 29: 383–6. [PubMed] [Google Scholar]
- Эдлунд К., Старк К., Север СЕ. Связь между повышением активности бета-лактамаз после перорального приема трех новых цефалоспоринов и защитой от кишечных экологических нарушений. J Antimicrob Chemother. 1994; 34: 127–38. [PubMed] [Google Scholar]
- Finegold SM. Анаэробные инфекции и колит Clostridium difficile , возникшие при антибактериальной терапии. Scand J Infect Dis Suppl.1986; 49: 160–4. [PubMed] [Google Scholar]
- Gauthier G, Klein BS. Понимание морфогенеза грибков и уклонения от иммунитета. Микроб. 2008; 3: 416–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Gipponi M, Sciutto C, Accornero L, et al. Оценка модификаций кишечной бактериальной флоры у пациентов, длительно принимающих пероральный прием бакампициллина или амоксициллина: случайное исследование. Химиотерапия. 1985; 4: 214–7. [PubMed] [Google Scholar]
- Heimdahl A, Nord CE. Влияние эритромицина и клиндамицина на местную анаэробную флору человека и новую колонизацию желудочно-кишечного тракта.Eur J Clin Microbiol. 1982; 1: 38–48. [PubMed] [Google Scholar]
- Инагаки Ю., Ямамото Н., Чида Т. и др. Влияние DU-6859a, нового сильнодействующего фторхинолона на фекальную микрофлору добровольцев. Jpn J Antibiot. 1995; 48: 368–79. [PubMed] [Google Scholar]
- Кагер Л., Брисмар Б., Мальмборг А.С. и др. Влияние цефбуперазона на микрофлору толстой кишки у пациентов, перенесших колоректальные операции. Препараты Exp Clin Res. 1986; 12: 983–6. [PubMed] [Google Scholar]
- Кагер Л., Брисмар Б., Мальмборг А.С. и др.Эффект лечения имипенемом по сравнению с хирургической профилактикой имипенемом на микрофлору кишечника. Int J Clin Pharmacol Res. 1988; 8: 441–7. [PubMed] [Google Scholar]
- Кагер Л., Брисмар Б., Мальмборг А.С. и др. Концентрации имипенема в колоректальной хирургии и влияние на микрофлору толстой кишки. Противомикробные агенты Chemother. 1989; 33: 204–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кагер Л., Лильеквист Л., Мальмборг А.С. и др. Влияние профилактики клиндамицином на микрофлору толстой кишки у пациентов, перенесших колоректальную операцию.Противомикробные агенты Chemother. 1981; 20: 736–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kager L, Malmborg AS, Nord CE, et al. Влияние краткосрочной профилактики цефокситином на микрофлору толстой кишки у пациентов, перенесших колоректальную операцию. Инфекционное заболевание. 1982; 10: 338–40. [PubMed] [Google Scholar]
- Kager L, Malmborg AS, Nord CE, et al. Влияние профилактики пиперациллина на микрофлору толстой кишки у пациентов, перенесших колоректальную операцию. Инфекционное заболевание. 1983; 11: 251–4. [PubMed] [Google Scholar]
- Кеннеди MJ, Volz PA.Влияние различных антибиотиков на колонизацию и распространение в желудочно-кишечном тракте Candida albicans. Sabouraudia. 1985; 23: 265–73. [PubMed] [Google Scholar]
- Кеннеди MJ, Volz PA, Edwards CA, et al. Механизмы ассоциации Candida albicans со слизистой оболочкой кишечника. J Med Microbiol. 1987. 24: 333–41. [PubMed] [Google Scholar]
- Lambert-Zechovsky N, Bingen E, Aujard Y, et al. Влияние цефотаксима на фекальную флору у детей. Инфекционное заболевание. 1985; (13 Приложение 1): S140 – S144.[PubMed] [Google Scholar]
- Ли Д.А. Фармакологические и токсикологические исследования амоксициллина, талампициллина и ампициллина, а также клинические испытания парентерального амоксициллина при серьезных госпитальных инфекциях. Препараты Exptl Clin Res. 1979; 5: 29–139. [Google Scholar]
- Leigh DA, Nash JG. Парентеральное лечение амоксициллином тяжелых инфекций у госпитализированных пациентов. J Antimicrob Chemother. 1979; 5: 109–12. [PubMed] [Google Scholar]
- Lode H, Müller C, Borner K и др. Фармакокинетика многократного введения цефпрозила и его влияние на кишечную флору добровольцев.Противомикробные агенты Chemother. 1992; 36: 144–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lode H, Von der Höh N, Ziege S, et al. Экологические эффекты линезолида по сравнению с амоксициллином / клавулановой кислотой на нормальную микрофлору кишечника. Scand J Infect Dis. 2001; 33: 899–903. [PubMed] [Google Scholar]
- Луи Т.Дж., Чабб Х., Боу Э.Дж. и др. Сохранение параметров устойчивости к колонизации во время эмпирической терапии азтреонамом у пациентов с фебрильной нейтропенией. Rev Infect Dis. 1985; 7 (Приложение 4): S747 – S761.[PubMed] [Google Scholar]
- Николаева И.В., Анохин В.А., Бондаренко В.М. и др. [Лекарственная устойчивость штаммов Staphylococcus aureus , выделенных от детей с дисбактериозом кишечника] Ж. Микробиол Эпидемиол Иммунобиол. 2001; 1: 9–13. [PubMed] [Google Scholar]
- Nilsson-Ehle I, Nord CE, Ursing B. Цефтриаксон: фармакокинетика и влияние на микрофлору кишечника у пациентов с острыми бактериальными инфекциями. Scand J Infect Dis. 1985; 17: 77–82. [PubMed] [Google Scholar]
- Nord CE.Влияние противомикробных средств на экологию микрофлоры кишечника человека. Vet Microbiol. 1993; 35: 193–7. [PubMed] [Google Scholar]
- Nord CE. Паттерны чувствительности к антимикробным препаратам анаэробных бактерий в Европе (аннотация). 9-й раз в два года Конгресс Американского общества анаэробов; Лонг-Бич, Калифорния. 2008. с. 137. [Google Scholar]
- Nord CE, Bergan T, Aase S. Влияние азлоциллина на микрофлору толстой кишки. Scand J Infect Dis. 1986a; 18: 163–6. [PubMed] [Google Scholar]
- Nord CE, Bergan T, Thorsteinsson SB.Влияние тикарциллина / клавуланата на микрофлору кишечника. J Antimicrob Chemother. 1989; 24 (Дополнение B): 221–6. [PubMed] [Google Scholar]
- Nord CE, Brismar B, Kasholm-Tengve B, et al. Влияние терапии пиперациллином / тазобактамом на микрофлору кишечника. Scand J Infect Dis. 1992; 24: 209–13. [PubMed] [Google Scholar]
- Nord CE, Brismar B, Kasholm-Tengve B, et al. Влияние лечения пиперациллином / тазобактамом на микрофлору кишечника человека. J Antimicrob Chemother. 1993; 31 (Приложение A): 61–5.[PubMed] [Google Scholar]
- Nord CE, Edlund C. Влияние противомикробных препаратов на микрофлору кишечника человека. J Chemother. 1990; 2: 218–37. [PubMed] [Google Scholar]
- Nord CE, Фаррелл Д. Д., Леклерк Р. Влияние кетолидов на селекцию резистентности и экологические эффекты во время лечения инфекций дыхательных путей. Microb Drug Resist. 2004. 10: 255–63. [PubMed] [Google Scholar]
- Nord CE, Heimdahl A, Kager L, et al. Влияние различных антимикробных препаратов на нормальную микрофлору желудочно-кишечного тракта человека.Rev Infect Dis. 1984a; 6 (Приложение 1): S270 – S275. [PubMed] [Google Scholar]
- Nord CE, Heimdahl A, Lundberg C, et al. Влияние цефаклора на нормальную микрофлору ротоглотки и кишечника человека. Scand J Infect Dis. 1987; 19: 681–5. [PubMed] [Google Scholar]
- Nord CE, Kager L, Heimdahl A. Влияние противомикробных препаратов на микрофлору желудочно-кишечного тракта и риск инфекций. Am J Med. 1984b; 76: 99–106. [PubMed] [Google Scholar]
- Nord CE, Kager L, Malmborg AS. Влияние антимикробной профилактики на устойчивость к колонизации.J Hosp Infect. 1988; 11 (Приложение A): 259–64. [PubMed] [Google Scholar]
- Nord CE, Kager L, Philipson A, et al. Влияние имипенема / циластатина на микрофлору толстой кишки. Rev Infect Dis. 1985; 7 (Дополнение 3): S432 – S434. [PubMed] [Google Scholar]
- Nord CE, Lahnborg G. Эффективность пиперациллина / тазобактама при лечении экспериментальных внутрибрюшных инфекций. Eur J Surg Suppl. 1994; (573): 45–9. [PubMed] [Google Scholar]
- Nord CE, Meurling L, Russo RL, et al. Влияние гареноксацина на эубактерии нормальной микрофлоры кишечника при одновременном применении с дигоксином.J Chemother. 2003; 15: 244–7. [PubMed] [Google Scholar]
- Nord CE, Rasmanis G, Wahlund E. Влияние далбаванцина на нормальную микрофлору кишечника. J Antimicrob Chemother. 2006a; 58: 627–31. [PubMed] [Google Scholar]
- Nord CE, Sillerstrom E, Wahlund E. Влияние тигециклина на нормальную микрофлору ротоглотки и кишечника. Противомикробные агенты Chemother. 2006b; 50: 3375–80. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Noverr MC, Huffnagle GB. «Гипотеза микрофлоры» аллергических заболеваний.Clin Exp Allergy. 2005; 35: 1511–20. [PubMed] [Google Scholar]
- Oh H, Nord CE, Barkholt L, et al. Экологические нарушения микрофлоры кишечника, вызванные клинафлоксацином, хинолоном расширенного спектра действия. Инфекционное заболевание. 2000; 28: 272–7. [PubMed] [Google Scholar]
- Пек Дж. Дж., Fuchs PC, Gustafson ME. Антимикробная профилактика при плановой хирургии толстой кишки. Опыт 1035 операций в городской больнице. Am J Surg. 1984; 147: 633–7. [PubMed] [Google Scholar]
- Pecquet S, Andremont A, Tancrede C.Влияние перорального офлоксацина на фекальные бактерии у людей-добровольцев. Противомикробные агенты Chemother. 1987. 31: 124–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Pletz MW, Rau M, Bulitta J, et al. Фармакокинетика и влияние эртапенема на микрофлору кишечника по сравнению с цефтриаксоном после многократного введения добровольцам мужского и женского пола. Противомикробные агенты Chemother. 2004. 48: 3765–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Prantera C, Scribano ML, Berto E, et al.Использование антибиотиков при болезни Крона: почему и как? BioDrugs. 1997. 8: 293–306. [PubMed] [Google Scholar]
- Пульц, штат Нью-Джерси, Донски CJ. Влияние лечения антибиотиками на рост и продукцию токсина Clostridium difficile в содержимом слепой кишки мышей. Противомикробные агенты Chemother. 2005; 49: 3529–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rafii F, Park M, Bryant AE, et al. Повышенная продукция фосфолипазы C и перфринголизина O (альфа- и тета-токсины) в устойчивом к гатифлоксацину штамме Clostridium perfringens. Противомикробные агенты Chemother. 2008. 52: 895–900. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rafii F, Park M, Novak JS. Изменения ДНК-гиразы и топоизомеразы IV в устойчивых мутантах Clostridium perfringens , обнаруженных после обработки in vitro фторхинолонами. Противомикробные агенты Chemother. 2005; 49: 488–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ritz M, Lode H, Fassbender M и др. Фармакокинетика многократного приема спарфлоксацина и его влияние на фекальную флору.Противомикробные агенты Chemother. 1994; 38: 455–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rowland IR. Токсикология толстой кишки. Роль кишечной микрофлоры. В: Gibson GR, Macfarlane GT, редакторы. Бактерии толстой кишки человека. Бока-Ратон, Флорида: CRC Press; 1995. С. 155–74. [Google Scholar]
- Шредер О., Герхард Р., Штейн Дж. [Диарея, связанная с антибиотиками] Z Гастроэнтерол. 2006; 44: 193–204. [PubMed] [Google Scholar]
- Старк К., Эдлунд С., Хедберг М. и др. Индукция бета-лактамазы цефокситином в анаэробной микрофлоре кишечника.Eur J Clin Microbiol Infect Dis. 1995; 14: 18–24. [PubMed] [Google Scholar]
- Stark CA, Adamsson I, Edlund C, et al. Влияние омепразола и амоксициллина на микрофлору полости рта и желудочно-кишечного тракта у пациентов с инфекцией Helicobacter pylori . J Antimicrob Chemother. 1996; 38: 927–39. [PubMed] [Google Scholar]
- Stark CA, Edlund C, Sjöstedt S, et al. Устойчивость к противомикробным препаратам анаэробной микрофлоры ротовой полости и кишечника человека. Противомикробные агенты Chemother.1993; 37: 1665–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sullivan A, Edlund C, Nord CE. Влияние антимикробных препаратов на экологический баланс микрофлоры человека. Lancet Infect Dis. 2001а; 1: 101–14. [PubMed] [Google Scholar]
- Салливан А., Эдлунд С., Свенунгссон Б. и др. Влияние перорально вводимого пивмециллинама на нормальную микрофлору ротоглотки, кишечника и кожи. J Chemother. 2001b; 13: 299–308. [PubMed] [Google Scholar]
- ван дер Ваай Д. Селективная дезактивация пищеварительного тракта пероральным азтреонамом и темоциллином.Rev Infect Dis. 1985; 7 (Дополнение 4): S628 – S634. [PubMed] [Google Scholar]
- van der Waaij D, Nord CE. Развитие и сохранение у бактерий множественной устойчивости к антибиотикам; анализ и новый подход к этой актуальной проблеме. Int J Antimicrob Agents. 2000; 16: 191–7. [PubMed] [Google Scholar]
- Воллаард Э. Дж., Клазенер HA, Янссен AJ. Влияние пефлоксацина на устойчивость к микробной колонизации у здоровых добровольцев. Eur J Clin Microbiol Infect Dis. 1992; 11: 257–60. [PubMed] [Google Scholar]
- Wagner RD, Johnson SJ, Cerniglia CE.Модель in vitro устойчивости к колонизации кишечной микробиотой: эффекты противомикробных агентов, используемых у сельскохозяйственных животных. Противомикробные агенты Chemother. 2008; 52: 1230–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Winberg J, Herthelius-Elman M, Möllby R, et al. Патогенез инфекции мочевыводящих путей — экспериментальные исследования устойчивости влагалища к колонизации. Педиатр Нефрол. 1993; 7: 509–14. [PubMed] [Google Scholar]
- Zhang X, McDaniel AD, Wolf LE, et al.Хинолоновые антибиотики вызывают бактериофаги, кодирующие токсин Шига, выработку токсинов и гибель мышей. J Infect Dis. 2000; 181: 664–70. [PubMed] [Google Scholar]
Влияние лечения антимикробными препаратами на микрофлору толстой кишки человека
Ther Clin Risk Manag. 2008 Dec; 4 (6): 1343–1358.
Отдел микробиологии, Национальный центр токсикологических исследований, FDA, Джефферсон, АР, США
Для корреспонденции: Фатеме Рафии, Отдел микробиологии, Национальный центр токсикологических исследований, FDA, Джефферсон, АР 71602, США, тел. + 1870 543 7342 , Факс +1870 543 7307, электронная почта
vog.Авторские права © 2008 Dove Medical Press Limited. Все права защищеныЭта статья цитировалась в других статьях в PMC.
Реферат
Противомикробные препараты являются наиболее ценным средством лечения бактериальных инфекций. Однако назначение пациентам терапевтических доз противомикробных средств является основной причиной нарушения нормальной микрофлоры желудочно-кишечного тракта. Это нарушение приводит к ослаблению естественных защитных механизмов, обеспечиваемых микробной экосистемой толстой кишки, что делает хозяина уязвимым для заражения комменсальными микроорганизмами или внутрибольничными патогенами.В этом мини-обзоре обсуждается влияние противомикробных препаратов по отдельности и в комбинации на микрофлору толстой кишки человека.
Ключевые слова: антибиотики, кишечные бактерии
Введение
Экосистема микрофлоры толстой кишки человека, ее метаболические функции и ее устойчивость к колонизации жизненно важны для благополучия хозяина, производства жизненно важных метаболитов и предотвращения инфекций ( Эдлунд и Норд 1999b; Салливан и др. 2001a, 2001b). Различные ферменты в микробной экосистеме участвуют в деконъюгации, восстановлении и других биохимических действиях, что приводит к изменению биодоступности, активации или детоксикации различных молекул, включая метаболиты лекарств, высвобождаемые печенью через желчные протоки (Rowland 1995). Модели in vitro показали, что изменение популяционного состава микрофлоры кишечника человека сопровождается снижением устойчивости к колонизации (Wagner et al 2008). Кроме того, микробное сообщество может оказывать неизвестное влияние на иммунную систему (van der Waaij and Nord 2000). Микрофлора толстой кишки, по-видимому, стимулирует иммунную систему хозяина быстро реагировать на патогенные воздействия (Berg 1996). Хотя клетки кишечного тракта сосуществуют с нормальной комменсальной микрофлорой, они распознают и уничтожают вторгшиеся патогены, прежде чем вернуться к гомеостазу с комменсальными бактериями.Роли и влияние разных комменсальных бактерий различаются. Ответы хозяина на действие комменсальных бактерий генетически детерминированы (Prantera et al 1997). У пациентов с синдромом воспалительного кишечника иммунная система слизистых оболочек проявляет ненормальную реакцию на комменсальные бактерии у генетически предрасположенных лиц. Использование терапевтических агентов для воздействия на бактериальную популяцию может привести к микробному дисбалансу, который влияет на здоровье и вызывает заболевание. На основании клинических и эпидемиологических исследований было выдвинуто предположение, что как терапевтическое использование антибиотиков, так и типичные диеты в промышленно развитых странах могут нарушить нормальные опосредованные микробиотой механизмы иммунологической толерантности в слизистой оболочке, что также может привести к увеличению аллергических заболеваний дыхательных путей. (Новерр и Хаффнагл, 2005 г.).В следующих разделах будут обсуждаться другие эффекты клинического использования противомикробных препаратов на микрофлору кишечника.
Нарушение экосистемы
Хотя экосистема толстой кишки в целом стабильна, ее можно нарушить введением противомикробных препаратов для лечения или профилактики (Peck et al 1984). Бактерии толстой кишки подвергаются действию антимикробных агентов независимо от того, вводятся ли они перорально или путем инъекции через кровоток (Edlund and Nord 1999b).Это воздействие может происходить из-за неполного всасывания антимикробных агентов, вводимых перорально, из-за воздействия противомикробных агентов в секретах слюнных желез или слизистой оболочки кишечника или с желчью из печени (Nord et al 1984a, 1984b; Arvidsson et al 1988).
Степень изменений, происходящих в сообществе кишечной микрофлоры в результате введения противомикробных агентов, зависит от антибактериального спектра и их концентрации в содержимом просвета (Nord et al 1984a, 1984b).Антибиотики, принимаемые перорально, которые всасываются в верхней части тонкого кишечника, отличаются по своему действию от тех, которые плохо всасываются. Парентеральные противомикробные агенты, секретируемые с желчью или слизистой оболочкой, также влияют на восприимчивые популяции бактерий (Nord and Edlund 1990; Edlund and Nord 1999b). Воздействие антимикробных агентов на экосистему толстой кишки может привести к изменению популяции различных компонентов в результате подавления или уничтожения некоторых микроорганизмов, чрезмерного роста микроорганизмов, не восприимчивых к этим агентам, и создания устойчивых к противомикробным препаратам членов, которые обычно исключаются ( Норд 1993).
Влияние комменсальных микроорганизмов на колонизацию
Несколько факторов способствуют предотвращению колонизации некомменсальными микроорганизмами, среди которых конкуренция за питательные вещества, конкуренция за прикрепление и производство летучих жирных кислот (Nord et al 1984b). Летучие жирные кислоты, продуцируемые анаэробными бактериями, токсичны для некоторых других видов, особенно для энтеробактерий. Производство бактериоцинов энтеробактериями, стрептококками и анаэробными бактериями также ограничивает бактериальный рост.
Развитие устойчивых к противомикробным препаратам бактерий
Еще одним последствием воздействия антибиотиков, которое может иметь длительный эффект, является появление устойчивых к противомикробным препаратам бактерий, которые могут вызвать проблемы в долгосрочной перспективе (Nord and Edlund 1990). Эти организмы могут передаваться в разные места внутри хозяина, где они могут вызывать инфекцию, и другим хозяевам (Nord et al 1984b; Edlund and Nord 2000). Примером является инфекция мочевыводящих путей, вызванная устойчивым к противомикробным препаратам Escherichia coli (Winberg et al 1993; Edlund and Nord 2000).
Многоцентровое исследование восприимчивости (Aldridge et al 2001) показало изменения в структуре устойчивости анаэробных бактерий к различным антибиотикам. Устойчивость анаэробных бактерий к антибиотикам теперь известна для β-лактамов, клиндамицина, макролидов, тетрациклинов, фторхинолонов и нитроимидазола (Nord 2008). Метициллин-резистентные штаммы Staphylococcus aureus (MRSA) были выделены в амбулаторных условиях у детей с микробным дисбалансом толстой кишки в результате применения антибиотиков (Николаева и др., 2001).
Индукция ферментов в бактериях толстой кишки, которые делают противомикробные средства неэффективными, является еще одним побочным эффектом антимикробных средств (Finegold 1986). Введение β-лактамов привело к повышению уровня β-лактамаз в нормальной микрофлоре кишечника (Edlund et al, 1994). Сообщалось об индукции β-лактамаз у некоторых аэробных и анаэробных бактерий цефокситином. Однако, поскольку кал, по-видимому, ингибирует индукцию β-лактамаз, Stark и коллеги (1995) приписывают увеличение β-лактамаз отбору «стабильно дерепрессированных мутантов», а не индукции β-лактамаз.
Грибковые инфекции
Другая проблема, которая может возникнуть в результате лечения антибиотиками, — это заражение грибами (Louie et al 1985). Наблюдается чрезмерный рост грибков, особенно после лечения антибиотиками, снижающими популяцию анаэробных бактерий, у экспериментальных животных, здоровых людей и пациентов с нейтропенией (Kennedy and Voltz 1985; Louie et al 1985; Pletz et al 2004). Луи и его коллеги (1985) заключают: «Сохранение анаэробной флоры имеет решающее значение для предотвращения заражения грибами у пациентов с нейтропенией.«Грибковые инфекции могут вызывать серьезные проблемы у пациентов с ослабленным иммунитетом, вызывая диссеминированные инфекции в различных местах, которые могут привести к серьезным осложнениям (Gauthier and Klein 2008).
Кеннеди и его коллеги (1987) использовали Candida albicans для заражения мышей, леченных и не леченных антибиотиками, и обнаружили связь грибка с кишечным эпителием мышей, леченных антибиотиками, но не с таковыми у контрольных мышей, у которых была местная бактериальная флора. . У обработанных мышей часть грибковых клеток проникла глубоко в слизистую оболочку кишечного тракта, но большинство из них были связаны со слизистой оболочкой слепой кишки.
Влияние на патогенность бактерий
Противомикробные средства, помимо ограничения эффективности колонизационного барьера за счет нарушения нормальной кишечной микробиоты, могут также влиять на патогенность некоторых бактерий. Было показано, что фторхинолоны индуцируют бактериофаги и увеличивают продукцию токсина Шига в E. coli O157: H7, что может увеличивать вирулентность этого штамма (Zhang et al 2000). В нашей лаборатории один из пяти устойчивых к гатифлоксацину штаммов Clostridium perfringens также имел повышенную продукцию фосфолипазы C и перфринголизина O (Rafii et al, 2008).Субингибирующие концентрации ампициллина и клиндамицина могут напрямую влиять на приверженность Clostridium difficile , увеличивая экспрессию генов, необходимых для колонизации (Deneve et al 2008). В исследовании in vitro на животных было показано, что подкожное введение антибиотиков, нарушающих анаэробную флору, способствовало росту и продукции токсинов C. difficile в содержимом слепой кишки мыши. Антибиотики, не оказавшие значительного воздействия на анаэробные популяции, не влияли на рост или выработку токсинов (Pultz and Donskey 2005).Эти результаты подтверждают обеспокоенность государственных регулирующих органов, Всемирной организации здравоохранения и специалистов здравоохранения по поводу использования противомикробных препаратов для сельскохозяйственных животных (Cerniglia and Kotarski 1999).
Другие побочные эффекты
Использование противомикробных препаратов обычно сопровождается желудочно-кишечными расстройствами, особенно диареей, связанной с приемом антибиотиков, которая часто проходит вскоре после прекращения приема противомикробных препаратов и восстановления баланса в экосистеме (Nord and Edlund 1990) .Это происходит у 15–25% пациентов, получающих антибиотики, и частота его возникновения различается при приеме различных антибиотиков. Это вызвано нарушением микрофлоры кишечника от легкого до тяжелого; легкие случаи могут быть результатом нарушения обмена углеводов или желчных кислот. Распространение патогенов в результате этого нарушения может вызвать тяжелые случаи диареи, связанной с приемом антибиотиков (Schröder et al 2006).
У хозяев с ослабленным иммунитетом, ослабленных хирургическим вмешательством или пожилым возрастом, могут возникать тяжелые инфекции, вызванные условно-патогенными микроорганизмами.Потенциальные патогены, такие как C. difficile , проживающие в толстой кишке, могут вызывать C. difficile -связанную антибиотико-ассоциированную диарею и / или псевдомембранозный колит (Aronsson et al 1981, 1985; Ambrose et al 1985; Finegold 1986; Edlund and Норд 2000). Finegold (1986) отметил, что, за исключением ванкомицина и парентерально вводимых аминогликозидов, большинство других противомикробных агентов были причастны к инфекциям C. difficile .
Системные инфекции у пациентов с ослабленным иммунитетом, вызванные обычно безвредными микроорганизмами, также наблюдались после лечения антибиотиками.Суперинфекция, в которую вовлечены все основные типы анаэробов, также связана с использованием противомикробных препаратов. В общем, осложнения, связанные с противомикробными препаратами, являются результатом подавления местной флоры, которая предотвращает колонизацию и разрастание потенциальных патогенов, находящихся в толстой кишке, которые могут вызывать диарею, колит или другие септические состояния (Finegold 1986).
Оценка действия противомикробных препаратов на микрофлору кишечника
Очевидные последствия воздействия противомикробных препаратов на микрофлору толстой кишки были измерены путем подсчета видов бактерий после клинического лечения пациента или экспериментального воздействия на добровольцев различных антимикробных препаратов. агентов (Норд и Эдлунд, 1990).Оценка паттернов устойчивости анаэробных бактерий в слюне и кале амбулаторных и госпитализированных пациентов, независимо от лечения антибиотиками, показала связь между относительным количеством устойчивых к антибиотикам анаэробных бактерий, госпитализацией и лечением антибиотиками. Количество устойчивых штаммов коррелирует с продолжительностью лечения антибиотиками (Stark et al 1993).
В многочисленных исследованиях ученые оценивали действие противомикробных агентов на бактерии толстой кишки, вводя антибиотики своим испытуемым и измеряя их влияние на популяции различных бактериальных родов.Изучены все основные классы противомикробных средств. Большая часть этой работы была выполнена лабораторией Карла Норда в больнице Каролинского университета в Стокгольме, Швеция, и было написано несколько обзоров (Nord et al 1984a, 1984b, 1988; Nord and Edlund 1990; Nord 1993; Edlund and Nord 1999b; Sullivan et al 2001a). Образцы фекалий, которые обычно считаются репрезентативными для микробиоты толстой кишки, культивировали на неселективных и селективных средах. Были подсчитаны различные типы колоний, выделены в чистой культуре и идентифицированы до уровня рода.Их количество сравнивали с количеством бактерий, присутствующих от каждого рода до лечения, чтобы измерить эффект антибиотика в уменьшении количества бактерий или обеспечении увеличения, разрастания или размножения других. Все новые колонизирующие бактерии были проверены на чувствительность к введенным антибиотикам (Nord et al 2006a, 2006b). Сообщалось о бактериях, которые были уничтожены, и о тех, которые переросли другие виды. Также было обнаружено развитие устойчивости среди бактерий в нормальной флоре и чрезмерный рост таких микроорганизмов, как дрожжи, которые контролируются нормальной микрофлорой.В большинстве случаев популяции одних родов бактерий уменьшались, а численность бактерий других родов увеличивалась. Это увеличение сопровождалось либо увеличением резистентных штаммов бактерий, либо чрезмерным ростом грибов (Louie et al 1985; Nilsson-Ehle et al 1985).
Экспресс-методы с использованием анализа ДНК также использовались для демонстрации воздействия противомикробных препаратов на микрофлору кишечника человека. De La Cochetiere и его коллеги (2005) выделили фекальную ДНК добровольцев после лечения антибиотиками и амплифицировали бактериальные гены 16S рРНК с помощью ПЦР с общими праймерами, которые были проанализированы с помощью гель-электрофореза в градиенте температуры.Сравнивая модели доминирующих видов с образцами, полученными до лечения, они определили влияние лечения на изменение микробиоты.
Поскольку повсеместное появление различных устойчивых к противомикробным препаратам бактерий было проблематичным, а смертельные случаи стали результатом чрезмерного роста в остальном безобидных комменсальных микроорганизмов, которые не реагируют на доступные противомикробные средства, представляется своевременным рассмотреть влияние этих соединений на микроорганизмы толстой кишки , с акцентом на те, которые не были рассмотрены в предыдущих обзорах.
β-лактамы
β-лактамы — это старейший и наиболее широко назначаемый класс антибиотиков; этот класс включает пенициллины, цефалоспорины, монобактамы, карбапенемы и ингибиторы β-лактамаз.
Пенициллины
К членам этой группы относятся феноксиметилпенициллин, ампициллин, амоксициллин, пиперациллин, азлоциллин, темоциллин, тикарциллин, пивампициллин, талампициллин и баампициллин.
Цефалоспорины
Большинство из них являются полусинтетическими соединениями и не подвержены расщеплению β-лактамного кольца многими β-лактамазами.Они включают цефалоридин, цефазолин, цефаклор, цефроцил, цефбуперазон, цефуроксим, цефокситин, цефотиам, цефотаксим, цефоперазон, цефтриаксон, цефтазидим, цефтиазоксим, цефменоксим, цефотетан и цефрадин.
Монобактамы
β-лактамное кольцо в монобактамах находится отдельно и не слито с другим кольцом. Азтреонам является примером; обычно используется в сочетании с другими лекарствами.
Карбапенемы
По мере того, как все больше и больше бактерий развивают устойчивость к β-лактамным антимикробным агентам, продуцируя различные β-лактамазы, были предприняты усилия по поиску лекарств, на которые не действуют β-лактамазы.Карбапенемы включают имипенем, меропенем, эртапенем, фаропенем, дорипенем, панипенем и бетамипрон. Имипенем инактивируется в почках дегидропептидазой; чтобы предотвратить это, он используется в сочетании с циластатином, ингибитором почечной дегидропептидазы (Birnbaum et al 1985; Nord et al 1985). Помимо устойчивости к β-лактамазам, карбапенемы обладают широкой антибактериальной активностью.
Ингибиторы β-лактамаз
Эти соединения содержат β-лактамное кольцо, но обладают незначительной антимикробной активностью.Поскольку они связываются с β-лактамазами и предотвращают их атаку на другие β-лактамы, их вводят совместно с антимикробными β-лактамами.
Влияние лечения β-лактамами на микрофлору кишечника человека
Воздействие различных β-лактамных антибиотиков оценивалось как на людях-добровольцах, так и на пациентах, проходящих лечение. Различные исследования рассматривали эффекты группы пенициллина: ампициллин (Leigh, 1979), ампициллин плюс сульбактам (Kager et al, 1982), пиперациллин (Kager et al, 1983), азлоциллин (Nord et al, 1986a), темоциллин (van der Waaij 1985), тикарциллин и клавулановая кислота (Nord et al 1989) ().Все они уменьшили количество энтеробактерий, энтерококков и анаэробных бактерий. Лечение амоксициллином (Leigh and Nash 1979; Gipponi et al 1985) привело к подавлению количества энтеробактерий в одних испытаниях, но увеличило их количество в других (Brismar et al 1993b). В некоторых исследованиях после лечения амоксициллином, с клавулановой кислотой или без нее наблюдался избыточный рост C. difficile (Brismar et al 1993b; Lode et al 2001). В некоторых испытаниях наблюдали избыточный рост бактериями или Candida после приема вышеуказанных препаратов.Введение тикарциллина / клавулановой кислоты привело к увеличению количества энтерококков. Феноксиметилпенициллин не имел большого эффекта (Adamsson et al 1997).
Таблица 1
Влияние пенициллинов, отдельно или в сочетании с другими лекарствами, на микрофлору кишечника
Поскольку β-лактамы были первыми открытыми антибиотиками, их часто назначают для лечения различных инфекций, и в результате появилось много бактерий. сопротивление им. Присутствие β-лактамаз в различных бактериях часто приводит к неэффективности этих препаратов.Чтобы избежать развития резистентности и повысить эффективность лекарств, были разработаны другие β-лактамы, которые используются в комбинациях с ингибиторами β-лактамаз или другими лекарственными средствами ().
Таблица 2
Влияние выбранных β-лактамов, отличных от цефалоспоринов, в том числе в комбинации с другими лекарственными средствами, на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней и количество курсов лечения в день | Количество субъектов | Подавление бактерий | Размножение бактерий | Появились устойчивые штаммы или другие результаты | Дни до нормы после прекращения лечения | Ссылка | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Пиперациллин | 90/ тазобакт 4–8 | 20 | Энтеробактерии Энтерококки Бифидобактерии Эубактерии Лактобациллы Clostridia грамположительные кокки | Nord et al. (1993) | ||||||||
| Омепразол / амоксициллин | 20/1000 | 14/2 | 14 | внутримышечные изменения продукция -лактамазы | Stark et al. (1996) | |||||||
| Амоксициллин / клавулановая кислота | 1000 | 7 | 12 | Бифидобактерии Лактобациллы Клостридии | Энтерококки Escherichia coli | Clostridium difficile , выделенная от трех добровольцев | Lode et al. (2001) | |||||
| Амоксициллин | 500 | 7/3 | Brismar et al. (1993a, 1993b) | |||||||||
| Омепразол / амоксициллин / метронидазол | 20/1000/40 | Общая анаэробная микрофлора | Streptococcus spp. Enterococcus spp. Энтеробактерии Колонизация дрожжевыми грибами у девяти субъектов | 35 дней | Адамссон и его коллеги (1999) | |||||||
| Имипенем (хирургическая профилактика) | 500/1000 | 2/4 | 20 | Стафилококки Стрептококки Энтерококки Энтеробактерии Анаэробные кокки Бифидобактерии Эубактерии Лактобациллы Clostridia Fusobacteria Bacteroides | Без колонизации; в норме через 14 дней | Kager et al. (1988) | ||||||
| Pivmecillinam | 400 | 14–41 | 15 | E.coli | Sullivan et al. (2001b) | |||||||
| Ertapenem | 1000 | 7 | 10 | Lactobacilli Бифидобактерии Clostridia Bacteroides E. coli | Enterococci | Разрастание дрожжей | 21–35 дней | Плетц и его коллеги (2004) | ||||
| Азтреонам | пациенты с фебрамицином | Кишечные грамотрицательные бациллы Фекальные анаэробы | Грибковое заражение | Луи и его коллеги (1985) | ||||||||
| Азтреонам плюс клоксациллин | Гриб-отрицательная бактерия анаэробы | Грибковое заражение | Луи и его коллеги (1985) | |||||||||
| Моксалактам плюс тобрамицин | 9015 Фекальные грамотрицательные бактерии 9015 Луи и его коллеги (1985) | |||||||||||
| Имипенем | 500–1000 | 4–11 / 4 | 10 | Энтеробактерии Анаэробные кокки Бактероиды | ||||||||
| Меропенем | 500 | 7/3 | 10 | Энтеробактерии Стрептококки Clostridia Bacteroides грамотрицательные кокки | Enterococci | 14 дней | Bergan et al. (1991) |
Pivmecillinam
Sullivme et al. микрофлора 15 особей.Их лечили в течение 7 дней 400 мг пивмециллинама два раза в день, а затем снова через 14 и 21 день после начала приема. Число E. coli уменьшилось, но изменений в анаэробной микрофлоре не произошло.
Пиперациллин / тазобактам
Рассмотрено влияние пиперациллина на бактерии толстой кишки (Nord and Edlund 1990). Также изучалось влияние на экологию толстой кишки его использования в сочетании с ингибитором β-лактамазы, тазобактамом (Nord et al 1992, 1993; Nord and Lahnborg 1994).Оценивали влияние комбинации пиперациллин / тазобактам (4 / 0,5 г) на пациентов с внутрибрюшными инфекциями, которых лечили три раза в день в течение 8 дней; снизилось среднее количество энтеробактерий, энтерококков и анаэробов (бифидобактерий, эубактерий, лактобактерий, клостридий и грамположительных кокков). Анаэробные грамотрицательные кокки и Bacteroides spp. не были затронуты (). Количество бактерий нормализовалось после прекращения лечения (Nord et al 1992, 1993).
Омепразол и амоксициллин
Комбинация омепразола (20 мг, ингибитор протонной помпы для эрадикации Helicobacter pylori ) и амоксициллина (1000 мг) два раза в день в течение 14 дней приводила к изменениям микрофлоры кишечного тракта, увеличивает в количестве устойчивых энтеробактерий и увеличение продукции β-лактамаз, обнаруженное в образцах фекалий (Stark et al 1995; Adamsson et al 1999).
Комбинации омепразол / амоксициллин / метронидазол
Также изучались эффекты амоксициллина в сочетании с противомикробными средствами, эффективными против анаэробов.Метронидазол, который используется для лечения анаэробных и паразитарных инфекций, также используется для лечения H. pylori в сочетании с другими лекарствами. Лечение пациентов комбинацией омепразола 20 мг, амоксициллина 1 г и метронидазола 40 мг в течение 7 дней привело к изменению нормальной микрофлоры и выраженному подавлению анаэробной микрофлоры. Во время лечения некоторые пациенты также были заражены дрожжами. Значения МИК этих препаратов для Enterococcus spp.и Enterobacteriaceae увеличились (Adamsson et al 1999).
Амоксициллин / клавулановая кислота
Введение 1000 мг амоксициллина / клавулановой кислоты в течение 7 дней 12 здоровым людям (те же люди, которые лечились линезолидом 600 мг в течение 7 дней, с периодом вымывания 4 недели между курсами лечения) привело к увеличению количества энтерококков и E. coli и значительному снижению количества анаэробов, включая бифидобактерии, лактобациллы и клостридии. C. difficile был выделен у трех добровольцев (Lode et al 2001). Авторы пришли к выводу, что в отличие от линезолида, амоксициллин / клавулановая кислота не уничтожает грамположительные бактерии.
Десять добровольцев, получавших амоксициллин по 500 мг три раза в день в течение 7 дней, были колонизированы устойчивыми к амоксициллину бактериями, в основном E. coli , Klebsiella и Enterobacter (Brismar et al 1993b). Активность β-лактамазы была обнаружена в микрофлоре шести человек.
Имипенем
Кагер и его коллеги (1988) оценили влияние имипенема как при лечении, так и в профилактических целях на микрофлору кишечника. Использование 0,5 или 1 г имипенема четыре раза в день в течение 4–11 дней привело к снижению количества энтеробактерий, анаэробных кокков и Bacteroides spp. во время лечения. В дальнейшем микрофлора нормализовалась. Пациенты, получавшие 0,5 или 1 г имипенема для хирургической профилактики каждые 6 часов в течение 48 часов, имели подавленные уровни стафилококков, стрептококков, энтерококков, энтеробактерий, анаэробных бактерий, кокков, бифидобактерий, эубактерий, лактобацилл, клостридий, фузобактерий и Bacteroides spp.во время лечения; после этого уровни были нормальными. Колонизации устойчивыми к имипенему бактериями не происходило (Kager et al 1988, 1989).
Азтреонам с тобрамицином или клоксациллином
Луи и его коллеги (1985) использовали различные комбинации препаратов для лечения пациентов с фебрильной нейтропенией и сравнили их влияние на микробную экологию. Комбинации азтреонама либо с тобрамицином (15 человек), либо с клоксациллином (14 пациентов) привели к уничтожению кишечных грамотрицательных бацилл.Эти комбинации также вызвали уменьшение количества фекальных анаэробов, сопровождаемое пониженной концентрацией короткоцепочечных жирных кислот в фекальных супернатантах (Louie et al 1985). Разрастание грибков произошло у 27% субъектов, получавших азтреонам / тобрамицин, и у 43% субъектов, получавших азтреонам / клоксациллин. Комбинированная терапия моксалактамом / тобрамицином у 15 пациентов оказала аналогичное влияние на снижение анаэробов и грибковых заболеваний (81%), как и две предыдущие комбинации. Все пациенты были пациентами с фебрильной нейтропенией, поэтому авторы пришли к выводу, что поддержание анаэробной флоры было важным для предотвращения заражения грибами у пациентов с фебрильной нейтропенией.
Меропенем
Внутривенное введение 500 мг меропенема три раза в день в течение 7 дней у 10 пациентов привело к снижению количества энтеробактерий и стрептококков и увеличению количества энтерококков, клостридий, Bacteroides spp. И грамотрицательных кокки. Другие грамположительные кокки и палочки не пострадали. Через две недели после прекращения терапии микрофлора кишечника вернулась к норме (Bergan et al, 1991).
Эртапенем и цефтриаксон
Введение эртапенема (1 г в день) или цефтриаксона (2 г в день) 10 здоровым людям в течение 7 дней посредством инъекции привело к 4-логарифмическому снижению E.coli , а также уменьшение анаэробной микрофлоры, включая лактобациллы, бифидобактерии, клостридии и Bacteroides spp. Количество энтерококков увеличилось на 4 логарифма. В обоих случаях наблюдался избыточный рост дрожжей, но в обоих случаях микрофлора нормализовалась в течение 21–35 дней после завершения лечения (Pletz et al 2004).
Цефалоспорины
Различные цефалоспорины оказывают большое влияние на микрофлору толстой кишки (Nord and Edlund, 1990).Цефбуперазон (Kager et al 1986), цефокситин (Kager et al 1982), цефотаксим (Lambert-Zechovsky et al 1985), цефоперазон (Alestig et al 1983), цефтриаксон (Arvidsson et al 1982), цефаклор (Nord et al 1987), и цефотетан (Амброуз и др., 1985) снижали количество анаэробных бактерий и энтеробактерий. Все эти препараты, за исключением цефоперазона и цефтриаксона, также снижали количество энтерококков при большинстве курсов лечения. Цефотаксим уменьшал количество энтеробактерий и энтерококков в одном испытании. Цефалоридин (Амброуз и др., 1985) и цефрадин (Брамфитт и др., 1986) оказали незначительное влияние.Однако в результате применения всех этих препаратов, за исключением цефрадина, цефтазидима и цеф-буперазона, развились устойчивые бактериальные штаммы. C. difficile появился в некоторых испытаниях с цефепимом, цефтриаксоном и цефиксимом. Количество анаэробных грамположительных кокков увеличивалось после лечения цефтриаксоном и цефиксимом (Nilsson-Ehle et al 1985, Sullivan et al 2001a). Влияние других цефалоспоринов (цефпрозила, цефподоксима проксетила, цефтибутена и цефадроксила) на кишечную флору показано в.
Таблица 3
Влияние цефалоспоринов на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней и количество сеансов лечения в день | Количество субъектов | Подавление бактерий | Появление устойчивых штаммов или другие побочные эффекты | Дни до нормального состояния после прекращения лечения | Ссылка | |
|---|---|---|---|---|---|---|---|---|
| Cefprozil | 500 | 8/2 | 8 | Enterobacteria 9015occi | Мягкие стулья | 4 дня | Lode et al. (1992) | |
| Cefadroxil | 500 | 10 | 20 | Не сильно изменились Адамссон и его коллеги (1997) | ||||
| Цефподоксим проксетил | 200 | 7/2 | 10 | Стрептококки Энтеробактерии Clostridia | Enterococci Clostridium difficile | Активность β-лактамазы во флоре некоторых субъектов | Brismar et al. (1993b) | |
| Цефтриаксон | Бифидобактерии Clostridia Bacteroides E.coli | Энтерококки | Разрастание дрожжей | от 1 до 35 дней | Плетц и его коллеги (2004) | |||
| Цефтибутан | 400 | 10 | 14 9015occi | E. cocci | Повышенная колонизация β-лактамазой C. difficile у шести человек | Brismar et al. (1993a) |
Cefprozil
Введение цефпрозила привело к изменениям в популяциях определенных родов.Lode et al. (1992) изучали эффекты цефпрозила у восьми человек. Они вводили 500 мг цефпрозила два раза в день в течение 8 дней и обнаружили, что это привело к умеренному снижению количества энтеробактерий и небольшому увеличению количества энтерококков, стафилококков и Bacteroi-des spp. Популяции микробов были нормальными через 4 дня после обработки. Основным микробиологически связанным последствием был мягкий стул. В некоторых случаях наблюдался избыточный рост C. difficile после лечения цефпрозилом (Lode et al 1992).
Цефподоксим проксетил
Цефподоксим проксетил оказывает сильное воздействие на бактерии толстой кишки. Брисмар и его коллеги (1993b) оценили эффекты этого соединения на добровольцах, получавших 200 мг два раза в день в течение 7 дней. Количество стрептококков, энтеробактерий и клостридий существенно снизилось в фекальной флоре, и наблюдался чрезмерный рост энтерококков, дрожжей и Clostridium difficile (Brismar et al 1993b).
Цефадроксил
Назначение цефадроксила здоровым людям не вызывает заметных нарушений экологии толстой кишки.Adamsson и его коллеги (1997) оценили эффект от приема 500 мг цефадроксила в течение 10 дней 20 здоровыми добровольцами. Воздействие на микрофлору кишечника было незначительным, и микрофлора была нормальной через две недели после отмены препарата.
Цефтибутен
Брисмар и его коллеги (1993a) вводили цефтибутен 14 здоровым людям. Каждый получал ежедневную дозу 400 мг цефтибутена перорально, но только у двух человек обнаруживались уровни цефтибутена в кале. За период введения увеличилось количество энтерококков и E.coli и анаэробных кокков. У восьми добровольцев были повышенные уровни β-лактамаз, и шесть были колонизированы C. difficile.
Фторхинолоны
Фторхинолоны представляют собой класс синтетических противомикробных агентов, влияние которых на экологию микрофлоры толстой кишки интенсивно изучалось (Edlund and Nord 1988b; Edlund and Nord 1999b; Sullivan et al 2001a). Путем введения различных фторхинолонов и подсчета бактерий из разных родов до и после воздействия было показано, что фторхинолоны обладают избирательным действием на нормальные бактерии толстой кишки.Эффекты ципрофлоксацина (Brismar et al 1990), норфлоксацина (Edlund et al 1987a, 1987b; Edlund and Nord 1988a), офлоксацина (Pecquet et al 1987; Edlund et al 1988), пефлоксацина (Vollaard et al 1992), ломефлоксацина (Edlund et al 1990), левофлоксацин (Edlund et al 1997b), спарфлоксацин (Ritz et al 1994), руфлоксацин (D’Antonio et al 1996), ситафлоксацин (Inagaki and Yamamoto et al 1995), гатифлоксацин (Edlund and Nord 1999a), тровафлоксацин (Edlund and Nord 1999b) и моксифлоксацин (Edlund and Nord 1999b; Edlund et al 2000b) на микрофлору кишечника.Все протестированные фторхинолоны уменьшали популяции энтеробактерий, а пефлоксацин уменьшал количество аэробных грамположительных кокков. В целом ни один из фторохинолонов не влиял на популяцию анаэробных бактерий. Разрастания бактерий под действием фторхинолонов не наблюдалось, но иногда наблюдалось разрастание Candida . Хотя инфекция C. difficile не наблюдалась, использование новых фторхинолонов было связано с появлением C.difficile диарея, связанная с антибиотиками, в некоторых больницах. In vitro , мы показали, что некоторые штаммы C. perfringens легко становятся устойчивыми к фторхинолонам, даже к тем, которые обычно эффективны против анаэробов (Rafii et al 2005). Устойчивые штаммы также демонстрируют физиологические изменения, отличные от штаммов дикого типа. Точно так же мы показали in vitro , что один из пяти штаммов C. perfringens продуцировал большее количество токсина в ответ на воздействие гатифлоксацина (Rafii et al 2008).Также оценивалось влияние некоторых из последних разработанных фторхинолонов (гареноксацина, гемифлоксацина и клинафлоксацина) на экологию толстой кишки ().
Таблица 4
Влияние фторхинолонов на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней | Количество субъектов | Подавление бактерий | Развивающиеся штаммы | Резистентные бактерии | Дней до нормы после прекращения лечения | Ссылка | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Гареноксацин | 600 | 6 | 16 | Энтерококки Бациллы Коринебактерии Энтеробактерии Бифидобактерии Лактобациллы Clostridia Bacteroides | Eubacteria | Устойчивость к гареноксацину Eubacterium lentum | 14 дней | Nord et al. (2003) | |||
| Гемифлоксацин | 320 | 7 | 10 | Энтеробактерии Энтерококки Стрептококки Анаэробные кокки Lactobacilli | 49 дней | Баркер и его коллеги (2001) | |||||
| Клинафлоксацин | 200 | 7 | 12 | Аэробные бактерии. | Oh et al. (2000) |
Garenoxacin
Nord et al. (2003) оценили влияние перорального приема гареноксацина на фекальную микрофлору 16 человек. Прием 600 мг гареноксацина ежедневно в течение 6 дней снизил количество энтерококков, бацилл, коринебактерий, энтеробактерий, бифидобактерий, лактобацилл, клостридий и Bacteroides spp. в микрофлоре кишечника, и это увеличило количество эубактерий.Микрофлора нормализовалась через 2 недели после прекращения приема фторхинолона широкого спектра действия. Концентрация гареноксацина в образцах фекалий составляла 14–31 мг / кг. Устойчивый к Garenoxa-cin Eubacterium lentum (MIC = 64 мг / мл) был изолирован от субъектов; популяции вернулись к нормальному состоянию через 14 дней после отмены (Nord et al, 2003).
Гемифлоксацин
Селективный эффект гемифлоксацина на микрофлору кишечника был аналогичен таковому у других фторхинолонов (Barker et al 2001).Введение 320 мг гемифлоксацина перорально в течение 7 дней 10 здоровым субъектам привело к подавлению энтеробактерий, энтерококков и стрептококков. Также уменьшились анаэробные кокки и лактобациллы. Разрастания или отбора устойчивых бактерий не обнаружено; популяции бактерий вернулись к норме через 49 дней после прекращения лечения (Barker et al 2001).
Клинафлоксацин
Ох и коллеги (2000) оценили влияние клина-флоксацина на экологию кишечника у 12 здоровых людей и обнаружили серьезные экологические нарушения.Пероральное введение 200 мг клинафлоксацина в течение 7 дней привело к высокому уровню препарата в кале (среднее значение 176 мг / кг на 7 день). Он уничтожил аэробные бактерии у 11 испытуемых и подавил анаэробную микрофлору. Клинафлоксацин-устойчивый Bacteroides sp. (MIC> 4) также появились; Ох и коллеги (2000) рекомендовали ограничить использование этого препарата.
Макролиды
Макролиды имеют макроциклическое 14-16-членное лактоновое кольцо, присоединенное к дезоксисахара. Они включают кларитромицин, диритромицин, эритромицин и рокситромицин, которые обладают бактерицидным или бактериостатическим действием.Их влияние на микрофлору кишечника кратко излагается в.
Таблица 5
Влияние диритромицина, кларитромицина, тигециклина и эритромицина на микрофлору кишечника
| Соединение | Лечение (мг в день) | Количество дней и количество процедур | в день | Подавление бактерий | Размножение бактерий и дрожжей | Появление устойчивых штаммов | Дней до нормы после прекращения лечения | Ссылка | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Диритромицин | 500 | 7 | Стрептококки Стафилококки Анаэробы Clostridia Lactobacilli | Диритромицин-устойчивые энтеробактерии | Eckernas et al. (1991) | |||||
| Кларитромицин | 500 | 7/2 | 12 | Escherichia coli | 12 | Клостридии | Энтерококки Enterobacter Citrobacter Klebsiella Pseudomonas | Отсутствует | 35 дней | Эдлунд и соавторы (2000a) |
| /7/50/156 | 16 | Анаэробные бактерии | Общая анаэробная микрофлора | Streptococcus spp. Enterococcus spp. Энтеробактерии устойчивый к кларитромицину Bacteroides spp. | Adamsson et al. (1999) | |||||
| Тигециклин | 100 / затем 50/2 | 10 | 13 | Энтерококки Escherichia Лактобациллы Bifidobacteria | Nord et al. (2006b) | |||||
| Эритромицин | 1000/500 | 7/2 | 10 | Streptococci Энтерококки Энтеробактерии Анаэробные бактерии также были поражено | Staphylococcus spp. | Устойчивые к эритромицину энтеробактерии, клостридии или дрожжи | Brismar et al. (1991) |
Диритромицин
Eckernas и его коллеги (1991) оценили влияние лечения диритромицином 20 здоровых людей на популяции диритромицина. . При ежедневном приеме 500 мг диритромицина в течение 7 дней в кале было обнаружено 12 мг / кг диритромицина.
Количество энтеробактерий и анаэробов (грамположительные кокки, бифидобактерии, эубактерии и Bacteroides spp.) уменьшилась кишечная флора и увеличилось количество стрептококков, стафилококков и других анаэробов (клостридий и лактобацилл). Кроме того, кишечник колонизировали устойчивые к диритромицину энтеробактерии. Eckernas и его коллеги (1991) пришли к выводу, что диритромицин оказывает значительное экологическое воздействие на бактерии толстой кишки.
Кларитромицин
Эдлунд и его коллеги (2000a, 2000b) оценили экологическое воздействие кларитромицина на 12 добровольцах. Введение кларитромицина (500 мг два раза в день в течение 7 дней) вызвало значительное снижение E.coli , а количество энтерококков, энтеробактерий, цитробактеров, клебсиелл и псевдомонад заметно увеличилось. Никаких существенных изменений в количестве стафилококков, стрептококков, бацилл или Candida замечено не было. В анаэробной микрофлоре бифидобактерии, лактобациллы и клостридии были подавлены, в то время как никаких изменений в пептострептококках, Veillonella , Bacteroide spp. Или фузобактериях не обнаружено. Через 35 дней микрофлора у всех добровольцев была нормальной.Эдлунд и его коллеги (2000a, 2000b) также обнаружили появление Bacteroides spp. изоляты, устойчивые к кларитромицину после введения 500 мг кларитромицина в течение 10 дней 10 пациентам. Эти бактерии сохранялись в течение 2 недель после отмены препарата. В том же исследовании авторы также обнаружили α-гемолитические стрептококки, кишечные энтерококки и энтеробактерии с устойчивостью к кларитромицину, но без чрезмерного роста дрожжей или C. difficile .
Комбинация 20 мг омепразола, 250 мг кларитромицина и 400 мг метронидазола приводила к изменению нормальной микрофлоры, подобно комбинации омепразола, амоксициллина и метронидазола (Adamsson et al 1999).Подавление анаэробной микрофлоры было более выраженным, чем в группе амоксициллина. Во время лечения наблюдалось значительное увеличение количества устойчивых к кларитромицину штаммов Bacteroides с 2% до 76%. Обе комбинации изменяли фекальную микрофлору, но комбинированная терапия кларитромицином оказывала более нежелательное воздействие на экосистему толстой кишки (Adamsson et al 1999).
Эритромицин
Брисмар и его коллеги (1991) вводили 1 г этилсукцината эритромицина перорально в течение 7 дней 10 добровольцам и оценивали его действие на бактерии толстой кишки.Они обнаружили уменьшение количества стрептококков, энтерококков и энтеробактерий во время приема, увеличение количества стафилококков и изменение анаэробных бактерий. В более раннем исследовании (Heimdahl and Nord 1982) было показано, что введение 500 мг эритромицина два раза в день в течение 7 дней 10 добровольцам привело к снижению количества энтеробактерий и большинства анаэробов. Кроме того, всех субъектов колонизировали потенциально патогенные устойчивые к эритромицину энтеробактерии, клостридии или дрожжи (Heimdahl and Nord 1982).
Кетолиды
Это новый класс соединений, родственных макролидам, и включает телитромицин (Nord et al 2004), который отличается от эритромицина наличием большой ароматической боковой цепи и заменой сахара кетогруппой. Кетолиды могут связываться с двумя участками бактериальной рибосомы; поэтому они эффективны даже против макролидно-устойчивых бактерий. У них также снижен потенциал индукции устойчивых к кетолидам бактерий. Эдлунд и его коллеги (2000a) изучали действие телитромицина у десяти субъектов и обнаружили увеличение МПК телитромицина для резистентных видов Bacteroides spp.изолятов, которые сохранялись в течение 2 недель после отмены препарата. Однако разрастания дрожжей и C. difficile не наблюдалось.
Аминогликозиды
Примерами аминогликозидов являются амикацин, гентамицин, канамицин, неомицин, нетилмицин, паромомицин, родострептомицин, стрептомицин, тобрамицин и апрамицин. Finegold (1986) отметил связь между приемом «кишечных антисептиков», таких как пероральный неомицин, и суперинфекцией анаэробами.
Глицилциклины
Глицилциклины, новый класс антибиотиков, представляют собой аналоги тетрациклинов, разработанные с особенностями предотвращения их оттока из клеток или образования белков защиты рибосом, которые приводят к устойчивости к тетрациклинам.
Тигециклин
Тигециклин — это глицилциклин, который обладает мощным действием широкого спектра действия против большинства грамположительных и грамотрицательных аэробных и анаэробных бактерий. Введение 50 мг тигециклина 20 пациентам каждые 12 часов в течение 10 дней (Nord et al 2006b) привело к снижению количества энтерококков, E. coli , лактобацилл и бифидобактерий, а также к увеличению количества других энтеробактерий и дрожжей. Разработаны два устойчивых к тигециклину штамма Klebsiella pneumoniae и пять устойчивых к тигециклину штаммов Enterobacter cloacae (Nord et al 2006b).
Линкозамиды
Линкомицин и клиндамицин представляют собой линкозамиды, которые ингибируют реакции транспептидазы, связываясь с 23 S и 50 S субъединицами бактериальных рибосом и ингибируя раннее удлинение пептидных цепей.
Клиндамицин
Клиндамицин используется для лечения не только анаэробных инфекций, но и паразитарных инфекций, включая малярию. Введение клиндамицина 10 пациентам в течение 7 дней приводило к нарушению экологии толстой кишки (Kager et al, 1981).Клиндамицин также связан с диареей, связанной с антибиотиками C. difficile . Кагер и его коллеги (1981) оценили эффект 600 мг клиндамицина внутривенно с 8-часовыми интервалами в течение 48 часов, что привело к уменьшению количества энтерококков, стрептококков и анаэробных бактерий. После лечения размножались стрептококки и анаэробные бактерии; у части пациентов возникла послеоперационная инфекция, вызванная Enterococcus faecalis .
Оксазолидоны
Линезолид относится к классу антимикробных агентов, называемых оксазолидонами.Это синтетический антибиотик, который редко используется из-за своей высокой цены, но он эффективен для лечения бактериальных инфекций с множественной лекарственной устойчивостью, в том числе вызванных Streptococcus spp. и MRSA. Введение 600 мг линезолида в течение 7 дней здоровым добровольцам привело к подавлению энтерококков и увеличению количества Klebsiella spp. Это также уменьшило количество следующих анаэробов: бифидобактерии, лактобациллы, клостридии и Bacte-roides spp.Через тридцать пять дней после прекращения лечения микрофлора была нормальной (Lode et al 2001).
Гликопептиды
Этот класс состоит из гликозилированных циклических нерибосомных пептидов и включает ванкомицин, тейкопланин, телаванцин, трампланин, декапланин и далбаванцин, который является липогликопептидом. Они подавляют синтез пептидогликана.
Ванкомицин
Этот препарат использовался в качестве последнего средства для лечения инфекций, вызванных грамположительными бактериями. Эдлунд и его коллеги (1997a) оценили эффекты ванкомицина у 10 человек после лечения 250 мг цефуроксима аксетила два раза в день в течение 7 дней.Затем субъекты получали 125 мг ванкомицина четыре раза в день в течение 7 дней. Авторы пришли к выводу, что ванкомицин вызывает экологические нарушения микрофлоры кишечника. Лечение ванкомицином привело к снижению количества Enterococcus faecium , E. faecalis и E. durans и анаэробов, включая бифидобактерии и Bacteroides spp. Это также привело к появлению подвижных энтерококков, в том числе E. gallinarum, и E.casseliflavus со сниженной чувствительностью к ванкомицину (МПК = 4–16 мг / мл). Некоторые из этих штаммов имели ген van C2 (C3). Кроме того, появились устойчивые к ванкомицину штаммы видов Pediococcus , Lactobacillus , Klebsiella , Citrobacter и Enterobacter . Недавно другие исследователи показали, что пероральный ванкомицин способствует чрезмерному росту устойчивых к ванкомицину энтерококков (Al-Nassir et al, 2008).
Далбаванцин
Это новый липогликопептид, родственный ванкомицину, и аналогично этому препарату он используется для лечения MRSA и S. epidermidis . Норд и его коллеги (2006a) оценили действие этого препарата у 12 человек. При введении 1 г далбаванцина шести мужчинам и шести женщинам произошли некоторые изменения в количестве энтерококков и E. coli , но не изменилось количество лактобацилл, клостридий и Bacteroides spp. № C.difficile были выделены. Новых колонизирующих аэробных или анаэробных бактерий с устойчивостью к далбаванцину обнаружено не было. Далбаванцин, по-видимому, не оказывает серьезного экологического воздействия на нормальную микрофлору кишечника человека (Barker et al 2001, Nord et al 2006a).
Метронидазол
Метронидазол используется для лечения анаэробных бактериальных инфекций, а также в комбинации с другими лекарствами для лечения язвенного колита. Было показано, что он устраняет метаногенные археи (Ansorg et al 2003).Использование перорального метронидазола для лечения заболевания, ассоциированного с C. difficile-, привело к чрезмерному росту энтерококков, включая устойчивые к ванкомицину штаммы (Al-Nassir et al, 2008).
Выводы
Микрофлора толстой кишки обеспечивает ряд преимуществ, включая участие в питании хозяина и защиту хозяина от инфекции. В большинстве случаев противомикробной терапии численность бактериальных популяций одних родов сокращается, а популяций других родов — увеличивается.В некоторых случаях увеличение количества определенных бактерий сопровождается появлением устойчивых штаммов бактерий или чрезмерным ростом грибков. Лечение комбинациями противомикробных препаратов не обязательно предотвращает развитие резистентности. Это может даже привести к чрезмерному росту грибков и появлению бактерий, устойчивых ко всем лекарствам в комбинации. Примерами являются комбинация амоксициллина и метронидазола и комбинация азтреонама с тобрамицином или клоксациллином, все из которых приводят не только к подавлению анаэробов, но и к чрезмерному росту грибков.Некоторые анаэробные бактерии могут сдерживать рост грибков. Обзор воздействия антимикробных препаратов на экологию толстой кишки также показывает различия между людьми в ответ на лечение этими препаратами и различия в эффектах этих препаратов на разные штаммы одной и той же бактерии. Штаммы, продуцирующие токсин C. difficile , были обнаружены в некоторых больницах после терапии фторхинолоном, а некоторые штаммы C. perfringens вырабатывают токсин после воздействия гатифлоксацина.Невозможно переоценить важность разумного использования этих важных лекарств.
Благодарности
Мы выражаем особую благодарность доктору Карлу Э. Норду и доктору Кидон Сунгу за рецензирование этой рукописи. Взгляды, представленные в этой статье, не обязательно отражают точку зрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Ссылки
- Adamsson I, Edlund C, Sjostedt S, et al. Сравнительные эффекты цефадроксила и феноксиметилпенициллина на нормальную микрофлору ротоглотки и кишечника.Инфекционное заболевание. 1997. 25: 154–8. [PubMed] [Google Scholar]
- Adamsson I, Nord CE, Lundquist P, et al. Сравнительные эффекты омепразола, амоксициллина и метронидазола по сравнению с омепразолом, кларитромицином и метронидазолом на микрофлору полости рта, желудка и кишечника у пациентов, инфицированных Helicobacter pylori, . J Antimicrob Chemother. 1999; 44: 629–40. [PubMed] [Google Scholar]
- Аль-Нассир В.Н., Сетхи А.К., Ли Й. и др. Как пероральный метронидазол, так и пероральный ванкомицин способствуют стойкому избыточному росту устойчивых к ванкомицину энтерококков во время лечения заболевания, ассоциированного с Clostridium difficile .Противомикробные агенты Chemother. 2008. 52: 2403–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Олдридж К.Э., Эшкрафт Д., Камбре К. и др. Многоцентровое исследование изменения чувствительности in vitro к противомикробным препаратам клинических изолятов видов Bacteroides fragilis , Prevotella , Fusobacterium , Porphyromonas и Peptostreptococcus . Противомикробные агенты Chemother. 2001; 45: 1238–43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Алестиг К., Карлберг Х., Норд CE и др.Влияние цефоперазона на фекальную флору. J Antimicrob Chemother. 1983; 12: 163–7. [PubMed] [Google Scholar]
- Амброуз Н.С., Джонсон М., Бердон Д.В. и др. Влияние однократных внутривенных антибиотиков на фекальную флору и появление Clostridium difficile . J Antimicrob Chemother. 1985; 15: 319–26. [PubMed] [Google Scholar]
- Ансорг Р., Рат П.М., Рунде В. и др. Влияние деконтаминации кишечника с использованием метронидазола на обнаружение метаногенных архей у реципиентов трансплантата костного мозга.Пересадка костного мозга. 2003; 31: 117–9. [PubMed] [Google Scholar]
- Aronsson B, Möllby R, Nord CE. Возникновение токсин-продуцирующего вещества Clostridium difficile при диарее, связанной с антибиотиками, в Швеции. Med Microbiol Immunol. 1981; 170: 27–35. [PubMed] [Google Scholar]
- Aronsson B, Möllby R, Nord CE. Противомикробные агенты и Clostridium difficile при остром кишечном заболевании: эпидемиологические данные из Швеции, 1980–1982 гг. J Infect Dis. 1985; 151: 476–81. [PubMed] [Google Scholar]
- Arvidsson A, Alvan G, Angelin B и др.Цефтриаксон: почечная и желчная экскреция и влияние на микрофлору толстой кишки. J Antimicrob Chemother. 1982; 10: 207–15. [PubMed] [Google Scholar]
- Arvidsson A, Leijd B, Nord CE, et al. Индивидуальная вариабельность экскреции цефтриаксона с желчью: влияние на метаболизм липидов желчных путей и микрофлору кишечника. Eur J Clin Invest. 1988. 18: 261–6. [PubMed] [Google Scholar]
- Баркер П.Дж., Шихан Р., Тейлол-Фу М. и др. Влияние гемифлоксацина на нормальную микрофлору кишечника человека.J Chemother. 2001; 13: 47–51. [PubMed] [Google Scholar]
- Berg RD. Аборигенная микрофлора желудочно-кишечного тракта. Trends Microbiol. 1996; 4: 430–5. [PubMed] [Google Scholar]
- Bergan T, Nord CE, Thorsteinsson SB. Влияние меропенема на микрофлору кишечника. Eur J Clin Microbiol Infect Dis. 1991; 10: 524–7. [PubMed] [Google Scholar]
- Бирнбаум Дж., Кахан Ф.М., Кропп Х. и др. Карбапенемы, новый класс бета-лактамных антибиотиков. Открытие и разработка имипенема / циластатина.Am J Med. 1985; 78: 3–21. [PubMed] [Google Scholar]
- Брисмар Б., Эдлунд С., Мальмборг А.С. и др. Концентрации ципрофлоксацина и влияние микрофлоры толстой кишки у пациентов, перенесших колоректальную операцию. Противомикробные агенты Chemother. 1990; 34: 481–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Brismar B, Edlund C, Nord CE. Сравнительное действие кларитромицина и эритромицина на нормальную микрофлору кишечника. Scand J Infect Dis. 1991; 23: 635–42. [PubMed] [Google Scholar]
- Brismar B, Edlund C, Nord CE.Влияние цефтибутена на нормальную микрофлору кишечника. Инфекционное заболевание. 1993a; 21: 373–5. [PubMed] [Google Scholar]
- Brismar B, Edlund C, Nord CE. Влияние цефподоксима проксетила и амоксициллина на нормальную микрофлору полости рта и кишечника. Eur J Clin Microbiol Infect Dis. 1993b; 12: 714–9. [PubMed] [Google Scholar]
- Брамфитт В., Франклин И., Грейди Д. и др. Влияние амоксициллин-клавуланата и цефрадина на фекальную флору здоровых добровольцев, не контактировавших с больничной средой.Противомикробные агенты Chemother. 1986; 30: 335–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cerniglia CE, Котарски С. Оценка остатков ветеринарных лекарств в пище на предмет их потенциального воздействия на микрофлору кишечника человека. J Regulatory Toxicol Pharmacol. 1999; 29: 238–61. [PubMed] [Google Scholar]
- D’Antonio D, Pizzigallo E, Lacone A и др. Влияние руфлоксацина, назначаемого в качестве профилактики онкологическим больным, на их микрофлору полости рта и фекалий. J Antimicrob Chemother. 1996; 38: 839–47.[PubMed] [Google Scholar]
- Де ла Кошетьер М.Ф., Дюран Т., Лепаж П. и др. Устойчивость доминирующей микробиоты фекалий человека при кратковременном введении антибиотиков. J Clin Microbiol. 2005; 43: 5588–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Денев С., Деломени С., Барк М.С. и др. Антибиотики, участвующие в заболевании, ассоциированном с Clostridium difficile , увеличивают экспрессию гена фактора колонизации. J Med Microbiol. 2008; 57: 732–8. [PubMed] [Google Scholar]
- Eckernas SA, Grahnen A, Nord CE.Влияние диритромицина на нормальную микрофлору полости рта и кишечника. Eur J Clin Microbiol Infect Dis. 1991; 10: 688–92. [PubMed] [Google Scholar]
- Эдлунд К., Алван Г., Баркхольт Л. и др. Фармакокинетика и сравнительные эффекты телитромицина (HMR 3647) и кларитромицина на микрофлору ротоглотки и кишечника. J Antimicrob Chemother. 2000a; 46: 741–9. [PubMed] [Google Scholar]
- Эдлунд К., Баркхольт Л., Олссон-Лильеквист Б. и др. Влияние ванкомицина на кишечную флору пациентов, ранее получавших антимикробную терапию.Clin Infect Dis. 1997a; 25: 729–32. [PubMed] [Google Scholar]
- Эдлунд К., Берган Т., Йозефссон К. и др. Влияние норфлоксацина на микрофлору ротоглотки и толстой кишки и фармакокинетика многократных доз. Scand J Infect Dis. 1987a; 19: 113–21. [PubMed] [Google Scholar]
- Эдлунд К., Бейер Г., Химер-Бау М. и др. Сравнительное действие моксифлоксацина и кларитромицина на нормальную микрофлору кишечника. Scand J Infect Dis. 2000b; 32: 81–5. [PubMed] [Google Scholar]
- Edlund C, Brismar B, Nord CE.Влияние ломефлоксацина на нормальную микрофлору полости рта и кишечника. Eur J Clin Microbiol Infect Dis. 1990; 9: 35–9. [PubMed] [Google Scholar]
- Эдлунд К., Кагер Л., Мальмборг А.С. и др. Влияние офлоксацина на микрофлору полости рта и желудочно-кишечного тракта у пациентов, перенесших операции на желудке. Eur J Clin Microbiol Infect Dis. 1988; 7: 135–43. [PubMed] [Google Scholar]
- Эдлунд К., Лидбек А., Кагер Л. и др. Сравнительное действие эноксацина и норфлоксацина на микрофлору толстой кишки человека. Противомикробные агенты Chemother.1987b; 31: 1846–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Edlund C, Nord CE. Манипуляции с микрофлорой ротоглотки и кишечника норфлоксацином: микробиологические и клинические аспекты. Scand J Infect Dis Suppl. 1988a; 56: 14–21. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Обзор влияния 4-хинолонов на нормальную микрофлору ротоглотки и кишечника человека. Инфекционное заболевание. 1988b; 16: 8–12. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Экологическое действие гатифлоксацина на нормальную микрофлору кишечника человека.J Chemother. 1999a; 11: 50–3. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Влияние хинолонов на экологию кишечника. Наркотики. 1999b; 58 (Дополнение 2): 65–70. [PubMed] [Google Scholar]
- Edlund C, Nord CE. Влияние пероральных антибиотиков для лечения инфекций мочевыводящих путей на нормальную микрофлору человека. J Antimicrob Chemother. 2000; 46 (Приложение A): 41–8. [PubMed] [Google Scholar]
- Edlund C, Sjöstedt S, Nord CE. Сравнительное действие левофлоксацина и офлоксацина на нормальную микрофлору полости рта и кишечника.Scand J Infect Dis. 1997b; 29: 383–6. [PubMed] [Google Scholar]
- Эдлунд К., Старк К., Север СЕ. Связь между повышением активности бета-лактамаз после перорального приема трех новых цефалоспоринов и защитой от кишечных экологических нарушений. J Antimicrob Chemother. 1994; 34: 127–38. [PubMed] [Google Scholar]
- Finegold SM. Анаэробные инфекции и колит Clostridium difficile , возникшие при антибактериальной терапии. Scand J Infect Dis Suppl.1986; 49: 160–4. [PubMed] [Google Scholar]
- Gauthier G, Klein BS. Понимание морфогенеза грибков и уклонения от иммунитета. Микроб. 2008; 3: 416–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Gipponi M, Sciutto C, Accornero L, et al. Оценка модификаций кишечной бактериальной флоры у пациентов, длительно принимающих пероральный прием бакампициллина или амоксициллина: случайное исследование. Химиотерапия. 1985; 4: 214–7. [PubMed] [Google Scholar]
- Heimdahl A, Nord CE. Влияние эритромицина и клиндамицина на местную анаэробную флору человека и новую колонизацию желудочно-кишечного тракта.Eur J Clin Microbiol. 1982; 1: 38–48. [PubMed] [Google Scholar]
- Инагаки Ю., Ямамото Н., Чида Т. и др. Влияние DU-6859a, нового сильнодействующего фторхинолона на фекальную микрофлору добровольцев. Jpn J Antibiot. 1995; 48: 368–79. [PubMed] [Google Scholar]
- Кагер Л., Брисмар Б., Мальмборг А.С. и др. Влияние цефбуперазона на микрофлору толстой кишки у пациентов, перенесших колоректальные операции. Препараты Exp Clin Res. 1986; 12: 983–6. [PubMed] [Google Scholar]
- Кагер Л., Брисмар Б., Мальмборг А.С. и др.Эффект лечения имипенемом по сравнению с хирургической профилактикой имипенемом на микрофлору кишечника. Int J Clin Pharmacol Res. 1988; 8: 441–7. [PubMed] [Google Scholar]
- Кагер Л., Брисмар Б., Мальмборг А.С. и др. Концентрации имипенема в колоректальной хирургии и влияние на микрофлору толстой кишки. Противомикробные агенты Chemother. 1989; 33: 204–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кагер Л., Лильеквист Л., Мальмборг А.С. и др. Влияние профилактики клиндамицином на микрофлору толстой кишки у пациентов, перенесших колоректальную операцию.Противомикробные агенты Chemother. 1981; 20: 736–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kager L, Malmborg AS, Nord CE, et al. Влияние краткосрочной профилактики цефокситином на микрофлору толстой кишки у пациентов, перенесших колоректальную операцию. Инфекционное заболевание. 1982; 10: 338–40. [PubMed] [Google Scholar]
- Kager L, Malmborg AS, Nord CE, et al. Влияние профилактики пиперациллина на микрофлору толстой кишки у пациентов, перенесших колоректальную операцию. Инфекционное заболевание. 1983; 11: 251–4. [PubMed] [Google Scholar]
- Кеннеди MJ, Volz PA.Влияние различных антибиотиков на колонизацию и распространение в желудочно-кишечном тракте Candida albicans. Sabouraudia. 1985; 23: 265–73. [PubMed] [Google Scholar]
- Кеннеди MJ, Volz PA, Edwards CA, et al. Механизмы ассоциации Candida albicans со слизистой оболочкой кишечника. J Med Microbiol. 1987. 24: 333–41. [PubMed] [Google Scholar]
- Lambert-Zechovsky N, Bingen E, Aujard Y, et al. Влияние цефотаксима на фекальную флору у детей. Инфекционное заболевание. 1985; (13 Приложение 1): S140 – S144.[PubMed] [Google Scholar]
- Ли Д.А. Фармакологические и токсикологические исследования амоксициллина, талампициллина и ампициллина, а также клинические испытания парентерального амоксициллина при серьезных госпитальных инфекциях. Препараты Exptl Clin Res. 1979; 5: 29–139. [Google Scholar]
- Leigh DA, Nash JG. Парентеральное лечение амоксициллином тяжелых инфекций у госпитализированных пациентов. J Antimicrob Chemother. 1979; 5: 109–12. [PubMed] [Google Scholar]
- Lode H, Müller C, Borner K и др. Фармакокинетика многократного введения цефпрозила и его влияние на кишечную флору добровольцев.Противомикробные агенты Chemother. 1992; 36: 144–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lode H, Von der Höh N, Ziege S, et al. Экологические эффекты линезолида по сравнению с амоксициллином / клавулановой кислотой на нормальную микрофлору кишечника. Scand J Infect Dis. 2001; 33: 899–903. [PubMed] [Google Scholar]
- Луи Т.Дж., Чабб Х., Боу Э.Дж. и др. Сохранение параметров устойчивости к колонизации во время эмпирической терапии азтреонамом у пациентов с фебрильной нейтропенией. Rev Infect Dis. 1985; 7 (Приложение 4): S747 – S761.[PubMed] [Google Scholar]
- Николаева И.В., Анохин В.А., Бондаренко В.М. и др. [Лекарственная устойчивость штаммов Staphylococcus aureus , выделенных от детей с дисбактериозом кишечника] Ж. Микробиол Эпидемиол Иммунобиол. 2001; 1: 9–13. [PubMed] [Google Scholar]
- Nilsson-Ehle I, Nord CE, Ursing B. Цефтриаксон: фармакокинетика и влияние на микрофлору кишечника у пациентов с острыми бактериальными инфекциями. Scand J Infect Dis. 1985; 17: 77–82. [PubMed] [Google Scholar]
- Nord CE.Влияние противомикробных средств на экологию микрофлоры кишечника человека. Vet Microbiol. 1993; 35: 193–7. [PubMed] [Google Scholar]
- Nord CE. Паттерны чувствительности к антимикробным препаратам анаэробных бактерий в Европе (аннотация). 9-й раз в два года Конгресс Американского общества анаэробов; Лонг-Бич, Калифорния. 2008. с. 137. [Google Scholar]
- Nord CE, Bergan T, Aase S. Влияние азлоциллина на микрофлору толстой кишки. Scand J Infect Dis. 1986a; 18: 163–6. [PubMed] [Google Scholar]
- Nord CE, Bergan T, Thorsteinsson SB.Влияние тикарциллина / клавуланата на микрофлору кишечника. J Antimicrob Chemother. 1989; 24 (Дополнение B): 221–6. [PubMed] [Google Scholar]
- Nord CE, Brismar B, Kasholm-Tengve B, et al. Влияние терапии пиперациллином / тазобактамом на микрофлору кишечника. Scand J Infect Dis. 1992; 24: 209–13. [PubMed] [Google Scholar]
- Nord CE, Brismar B, Kasholm-Tengve B, et al. Влияние лечения пиперациллином / тазобактамом на микрофлору кишечника человека. J Antimicrob Chemother. 1993; 31 (Приложение A): 61–5.[PubMed] [Google Scholar]
- Nord CE, Edlund C. Влияние противомикробных препаратов на микрофлору кишечника человека. J Chemother. 1990; 2: 218–37. [PubMed] [Google Scholar]
- Nord CE, Фаррелл Д. Д., Леклерк Р. Влияние кетолидов на селекцию резистентности и экологические эффекты во время лечения инфекций дыхательных путей. Microb Drug Resist. 2004. 10: 255–63. [PubMed] [Google Scholar]
- Nord CE, Heimdahl A, Kager L, et al. Влияние различных антимикробных препаратов на нормальную микрофлору желудочно-кишечного тракта человека.Rev Infect Dis. 1984a; 6 (Приложение 1): S270 – S275. [PubMed] [Google Scholar]
- Nord CE, Heimdahl A, Lundberg C, et al. Влияние цефаклора на нормальную микрофлору ротоглотки и кишечника человека. Scand J Infect Dis. 1987; 19: 681–5. [PubMed] [Google Scholar]
- Nord CE, Kager L, Heimdahl A. Влияние противомикробных препаратов на микрофлору желудочно-кишечного тракта и риск инфекций. Am J Med. 1984b; 76: 99–106. [PubMed] [Google Scholar]
- Nord CE, Kager L, Malmborg AS. Влияние антимикробной профилактики на устойчивость к колонизации.J Hosp Infect. 1988; 11 (Приложение A): 259–64. [PubMed] [Google Scholar]
- Nord CE, Kager L, Philipson A, et al. Влияние имипенема / циластатина на микрофлору толстой кишки. Rev Infect Dis. 1985; 7 (Дополнение 3): S432 – S434. [PubMed] [Google Scholar]
- Nord CE, Lahnborg G. Эффективность пиперациллина / тазобактама при лечении экспериментальных внутрибрюшных инфекций. Eur J Surg Suppl. 1994; (573): 45–9. [PubMed] [Google Scholar]
- Nord CE, Meurling L, Russo RL, et al. Влияние гареноксацина на эубактерии нормальной микрофлоры кишечника при одновременном применении с дигоксином.J Chemother. 2003; 15: 244–7. [PubMed] [Google Scholar]
- Nord CE, Rasmanis G, Wahlund E. Влияние далбаванцина на нормальную микрофлору кишечника. J Antimicrob Chemother. 2006a; 58: 627–31. [PubMed] [Google Scholar]
- Nord CE, Sillerstrom E, Wahlund E. Влияние тигециклина на нормальную микрофлору ротоглотки и кишечника. Противомикробные агенты Chemother. 2006b; 50: 3375–80. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Noverr MC, Huffnagle GB. «Гипотеза микрофлоры» аллергических заболеваний.Clin Exp Allergy. 2005; 35: 1511–20. [PubMed] [Google Scholar]
- Oh H, Nord CE, Barkholt L, et al. Экологические нарушения микрофлоры кишечника, вызванные клинафлоксацином, хинолоном расширенного спектра действия. Инфекционное заболевание. 2000; 28: 272–7. [PubMed] [Google Scholar]
- Пек Дж. Дж., Fuchs PC, Gustafson ME. Антимикробная профилактика при плановой хирургии толстой кишки. Опыт 1035 операций в городской больнице. Am J Surg. 1984; 147: 633–7. [PubMed] [Google Scholar]
- Pecquet S, Andremont A, Tancrede C.Влияние перорального офлоксацина на фекальные бактерии у людей-добровольцев. Противомикробные агенты Chemother. 1987. 31: 124–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Pletz MW, Rau M, Bulitta J, et al. Фармакокинетика и влияние эртапенема на микрофлору кишечника по сравнению с цефтриаксоном после многократного введения добровольцам мужского и женского пола. Противомикробные агенты Chemother. 2004. 48: 3765–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Prantera C, Scribano ML, Berto E, et al.Использование антибиотиков при болезни Крона: почему и как? BioDrugs. 1997. 8: 293–306. [PubMed] [Google Scholar]
- Пульц, штат Нью-Джерси, Донски CJ. Влияние лечения антибиотиками на рост и продукцию токсина Clostridium difficile в содержимом слепой кишки мышей. Противомикробные агенты Chemother. 2005; 49: 3529–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rafii F, Park M, Bryant AE, et al. Повышенная продукция фосфолипазы C и перфринголизина O (альфа- и тета-токсины) в устойчивом к гатифлоксацину штамме Clostridium perfringens. Противомикробные агенты Chemother. 2008. 52: 895–900. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rafii F, Park M, Novak JS. Изменения ДНК-гиразы и топоизомеразы IV в устойчивых мутантах Clostridium perfringens , обнаруженных после обработки in vitro фторхинолонами. Противомикробные агенты Chemother. 2005; 49: 488–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ritz M, Lode H, Fassbender M и др. Фармакокинетика многократного приема спарфлоксацина и его влияние на фекальную флору.Противомикробные агенты Chemother. 1994; 38: 455–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rowland IR. Токсикология толстой кишки. Роль кишечной микрофлоры. В: Gibson GR, Macfarlane GT, редакторы. Бактерии толстой кишки человека. Бока-Ратон, Флорида: CRC Press; 1995. С. 155–74. [Google Scholar]
- Шредер О., Герхард Р., Штейн Дж. [Диарея, связанная с антибиотиками] Z Гастроэнтерол. 2006; 44: 193–204. [PubMed] [Google Scholar]
- Старк К., Эдлунд С., Хедберг М. и др. Индукция бета-лактамазы цефокситином в анаэробной микрофлоре кишечника.Eur J Clin Microbiol Infect Dis. 1995; 14: 18–24. [PubMed] [Google Scholar]
- Stark CA, Adamsson I, Edlund C, et al. Влияние омепразола и амоксициллина на микрофлору полости рта и желудочно-кишечного тракта у пациентов с инфекцией Helicobacter pylori . J Antimicrob Chemother. 1996; 38: 927–39. [PubMed] [Google Scholar]
- Stark CA, Edlund C, Sjöstedt S, et al. Устойчивость к противомикробным препаратам анаэробной микрофлоры ротовой полости и кишечника человека. Противомикробные агенты Chemother.1993; 37: 1665–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sullivan A, Edlund C, Nord CE. Влияние антимикробных препаратов на экологический баланс микрофлоры человека. Lancet Infect Dis. 2001а; 1: 101–14. [PubMed] [Google Scholar]
- Салливан А., Эдлунд С., Свенунгссон Б. и др. Влияние перорально вводимого пивмециллинама на нормальную микрофлору ротоглотки, кишечника и кожи. J Chemother. 2001b; 13: 299–308. [PubMed] [Google Scholar]
- ван дер Ваай Д. Селективная дезактивация пищеварительного тракта пероральным азтреонамом и темоциллином.Rev Infect Dis. 1985; 7 (Дополнение 4): S628 – S634. [PubMed] [Google Scholar]
- van der Waaij D, Nord CE. Развитие и сохранение у бактерий множественной устойчивости к антибиотикам; анализ и новый подход к этой актуальной проблеме. Int J Antimicrob Agents. 2000; 16: 191–7. [PubMed] [Google Scholar]
- Воллаард Э. Дж., Клазенер HA, Янссен AJ. Влияние пефлоксацина на устойчивость к микробной колонизации у здоровых добровольцев. Eur J Clin Microbiol Infect Dis. 1992; 11: 257–60. [PubMed] [Google Scholar]
- Wagner RD, Johnson SJ, Cerniglia CE.Модель in vitro устойчивости к колонизации кишечной микробиотой: эффекты противомикробных агентов, используемых у сельскохозяйственных животных. Противомикробные агенты Chemother. 2008; 52: 1230–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Winberg J, Herthelius-Elman M, Möllby R, et al. Патогенез инфекции мочевыводящих путей — экспериментальные исследования устойчивости влагалища к колонизации. Педиатр Нефрол. 1993; 7: 509–14. [PubMed] [Google Scholar]
- Zhang X, McDaniel AD, Wolf LE, et al.Хинолоновые антибиотики вызывают бактериофаги, кодирующие токсин Шига, выработку токсинов и гибель мышей. J Infect Dis. 2000; 181: 664–70. [PubMed] [Google Scholar]
18 распространенных лекарств, связанных с измененным микробиомом кишечника
По данным голландских исследователей, почти половина из 41 распространенного класса лекарств связана с изменениями микробиоты кишечника человека.
Значительные изменения в таксономической структуре, метаболической активности и резистоме (гены устойчивости к антибиотикам) были замечены в образцах фекалий человека после использования 18 из 41 распространенной категории лекарств, при этом четырьмя наиболее частыми виновниками были ингибиторы протонной помпы (ИПП), метформин, об антибиотиках и слабительных, сообщил Арнау Вич Вила, магистр медицинских наук из Университетского медицинского центра Гронингена на Объединенной европейской неделе гастроэнтерологии в Барселоне.
Вич Вила и его коллеги выполнили секвенирование метагеномики на 1883 свежезамороженных образцах кала из трех независимых когорт: популяционная группа, пациенты с воспалительным заболеванием кишечника и пациенты с синдромом раздраженного кишечника, смешанные со здоровыми контрольными группами.
Различия между потребителями наркотиков и лицами, не употребляющими наркотики, оценивались путем изучения эффекта от приема одного лекарства, а также с учетом использования нескольких наркотиков каждым участником. Когортные результаты были объединены в метаанализ с использованием обратной дисперсии.
«Наша работа подчеркивает важность учета роли кишечной микробиоты при разработке методов лечения, а также указывает на новые гипотезы, которые могут объяснить определенные побочные эффекты, связанные с использованием лекарств», — сказал Вич Вила. Эти ассоциации должны быть функционально исследованы в свете важности микробиоты кишечника для здоровья и широкого использования многих лекарств.
Изменения микробиоты кишечника, вызванные лекарственными препаратами, могут увеличить риск кишечных инфекций и ожирения, отмечает Вич Вила.
После внесения поправки на полипрагмазию, семь категорий лекарств остались достоверно связанными с изменениями в 46 кишечных таксонах и путях.
Микробиота кишечника пользователей ИПП, например, показала большее количество стрептококковых бактерий верхних отделов желудочно-кишечного тракта и повышенный биосинтез жирных кислот, в то время как у пользователей метформина были более высокие уровни потенциально инфекционной кишечной палочки Escherichia coli.
В других ассоциациях:
- Увеличение механизмов устойчивости к антибиотикам было связано с восемью различными категориями лекарств: антиандрогенными пероральными контрацептивами, бета-симпатомиметическими ингаляторами, слабительными средствами, метформином, другими пероральными противодиабетическими средствами, ИПП, нестероидными противовоспалительными препаратами и triptans
- Селективные депрессанты-ингибиторы обратного захвата серотонина были связаны с обилием Eubacterium ramulus , обычно считающихся полезным разрушителем пищевых флавоноидов
- Пероральные стероиды были связаны с обогащением метаногенными бактериями, которые были связаны с повышенным индексом массы тела
«Мы уже знаем, что на эффективность и токсичность некоторых лекарств влияет бактериальный состав желудочно-кишечного тракта и что микробиота кишечника связана с множеством заболеваний», — сказал Вич Вила в пресс-релизе UEGW.«Поэтому очень важно понять, каковы последствия использования лекарств для микробиома кишечника».
Исследователи указали на увеличение количества сообщений об изменениях микробиоты кишечника, связанных с ожирением, диабетом, заболеваниями печени и нейродегенеративными заболеваниями, а также раком.
Гейл Креши, доктор медицинских наук из клиники Кливленда в Огайо, которая не принимала участия в исследовании, отметила, что хорошо известно, что лекарства могут изменять состав и разнообразие кишечных микробов, в частности тех, которые изменяют pH желудочного сока (например, ИПП), уничтожают бактерии (антибиотики) или изменяют моторику (слабительные).
«Секвенирование метагеномики в настоящее время продвигает вперед область, касающуюся функции микробиома кишечника и медицинских методов лечения», — сказала она MedPage Today. «Это было замечено с иммунотерапевтическими агентами, использующими состав и функцию микробиома в качестве средства для измерения ответа и токсичности иммунной терапии рака, а также с использованием пребиотиков, пробиотиков, постбиотиков и трансплантации фекальной микробиоты для модуляции иммунной терапии», — сказал Креши, который не принимал участия в голландских исследованиях.
Точно так же Дэвид Т.Рубин, доктор медицины из Чикагского университета, сказал, что это исследование способствует развитию понимания того, насколько изменчивой может быть кишечная микробиота. «Конечно, понятно, что диета и воспаление влияют на состав кишечной микробиоты, но оценка воздействия многих медицинских методов лечения ранее не описывалась», — сказал он MedPage Today.
«Открытие того, что большинство этих методов лечения действительно влияет на состав микробиоты кишечника прямым или косвенным образом, имеет значение для того, как эти лекарства могут влиять на другие биологические функции, включая метаболизм», — сказал Рубин, не участвовавший в исследовании.«Будет интересно глубже понять продольные изменения с течением времени, а также то, возвращается ли микробиом к своему исходному уровню или компенсируется другими способами».
Охарактеризовав исследование как ассоциативное, Джек Гилберт, доктор философии из Калифорнийского университета в Сан-Диего, сказал, что оно, тем не менее, выявило потенциально важные изменения, связанные с лекарствами. «Это предварительная информация, но она дает некоторые проверяемые гипотезы для будущей работы», — сказал он MedPage Today.
Раскрытие информации
Это исследование было поддержано Исследовательским советом Нидерландов и Университетом Гронингена.Авторы не сообщили о конфликте интересов. Креши, Рубин и Гилберт сообщили об отсутствии конкурирующих интересов в отношении своих комментариев.
Обычные лекарства могут изменять кишечные бактерии и увеличивать риски для здоровья
Новое исследование показало, что многие распространенные лекарства, в том числе те, которые лечат диабет, проблемы с пищеварением, бактериальные инфекции и даже депрессию, могут фактически предрасполагать людей к определенным типам инфекций, воздействуя на баланс их кишечного микробиома.
Лекарства, отпускаемые по рецепту, помогают лечить болезни, облегчать инфекции и управлять симптомами определенных хронических заболеваний.
Однако иногда они могут вызывать побочные эффекты различной степени тяжести. Врачи и исследователи не всегда осведомлены обо всех возможных неблагоприятных исходах.
Новое исследование, проведенное Университетским медицинским центром Гронингена и Медицинским центром Маастрихтского университета в Нидерландах, обнаружило доказательства того, что многие распространенные лекарства — от антибиотиков до антидепрессантов — оказывают значительное влияние на микробиом кишечника.Они могут даже нарушить хрупкое равновесие бактериальных популяций.
По словам исследователей, это может увеличить риск развития кишечных инфекций и других проблем со здоровьем, включая ожирение и устойчивость к противомикробным препаратам.
В исследовании, которое команда представила вчера на Единой европейской гастроэнтерологической неделе в Барселоне, Испания, изучалось влияние 41 распространенного типа рецептурных лекарств.
Для этого они собрали и проанализировали 1883 образца фекалий людей, страдающих воспалительным заболеванием кишечника или синдромом раздраженного кишечника (СРК), а также группы здоровых участников контрольной группы.
Исследователи сравнили результаты людей, принимавших лекарства по рецепту, с результатами людей, которые этого не делали. Они также изучили эффекты отдельных лекарств по сравнению с комбинациями лекарств.
Они обнаружили, что 18 распространенных категорий лекарств оказывают важное влияние на бактериальный состав микробиома кишечника, что может привести к нежелательным последствиям для здоровья. Такие последствия могут включать кишечные инфекции, ожирение и различные состояния, связанные со здоровьем кишечника.
Восемь из этих категорий, по-видимому, увеличивают устойчивость к противомикробным препаратам.
Кроме того, четыре категории лекарств оказали сильнейшее влияние на баланс бактерий в кишечнике. Это были:
- ингибиторы протонной помпы (ИПП), снижающие выработку желудочной кислоты
- метформин, помогающий людям справляться с симптомами диабета 2 типа
- антибиотики, которые борются с бактериальными инфекциями
- слабительные, которые помогают лечить запоры
Анализы показали, что у людей, принимавших ИПП, было больше бактерий верхних отделов желудочно-кишечного тракта и что их тела производили больше жирных кислот.Между тем, у тех, кто принимал метформин, был более высокий уровень Escherichia coli , бактерии, которая может вызывать диарею и инфекции мочевыводящих путей.
Кроме того, класс антидепрессантов, называемых селективными ингибиторами обратного захвата серотонина, был связан с повышенным уровнем Eubacterium ramulus — другой потенциально опасной бактерии — у людей с СРК.
Между тем, пероральные стероиды были связаны с более высоким уровнем метан-продуцирующих бактерий, которые могли способствовать увеличению веса и ожирению.
«Мы уже знаем, что на эффективность и токсичность некоторых лекарств влияет бактериальный состав желудочно-кишечного тракта, и что микробиота кишечника связана с множеством заболеваний», — говорит ведущий исследователь Арнау Вич Вила.
«[T] поэтому очень важно понять, каковы последствия использования лекарств для микробиома кишечника», — добавляет он.
«Наша работа подчеркивает важность учета роли кишечной микробиоты при разработке методов лечения, а также указывает на новые гипотезы, которые могут объяснить определенные побочные эффекты, связанные с использованием лекарств.”
Arnau Vich Vila
Внутреннее действие: микробиота поглощает лекарства, оказывая сильное влияние на их активность
Миллионы пациентов с болезнью Паркинсона полагаются на препарат Леводопа для облегчения тремора, замедления движений и других двигательных симптомов. Но многие пациенты испытывают такие побочные эффекты, как сердечная аритмия, тошнота и желудочно-кишечные проблемы. Побочные эффекты и преимущества леводопы у разных пациентов сильно различаются. Оказывается, эти загадочные различия во многом связаны с микробами в их кишечнике.
Исследователи обнаружили, что многие побочные эффекты препарата Леводопа от болезни Паркинсона были результатом действия бактериального фермента декарбоксилазы, продуцируемого комменсальным кишечным микробом E. faecalis (изображение на цветной электронной микрофотографии). Изображение предоставлено: ScienceSource / Dennis Kunkel Microscopy.
Ранее в этом году химик Эмили Бальскус и ее коллеги из Гарвардского университета в Кембридже, Массачусетс, обнаружили, что многие побочные эффекты были результатом действия бактериального фермента декарбоксилазы, продуцируемого кишечным микробом Enterococcus faecalis .Леводопа — это неактивная форма нейромедиатора дофамина, и для работы она должна быть активирована ферментом декарбоксилазы человека. Активизируйте лекарство слишком рано — до того, как оно пересечет гематоэнцефалический барьер — и возникнут побочные эффекты. Чтобы заблокировать эту преждевременную активацию, производители лекарств уже давно добавляют к леводопе ингибитор фермента, известный как карбодопа. Но Бальскус и ее коллеги обнаружили, что, хотя карбодопа воздействует на человеческие ферменты, она не ингибирует бактериальную декарбоксилазу. Фактически, бактериальный фермент воздействует на лекарство в кишечнике до того, как оно пересекает гематоэнцефалический барьер, вызывая проблемные симптомы (1).
Бальскус и другие узнают, что взаимодействия между нашими микробами и лекарствами намного сложнее, чем предполагалось ранее, что потенциально может вызывать токсические побочные эффекты или изменять активность лекарств. Лекарства, которые не всасываются в организме, обычно помечаются для удаления в печени, а затем транспортируются в кишечник. Хотя человеческие клетки больше не распознают эти продукты выделения, кишечные бактерии могут действовать на инактивированные молекулы лекарств. Этот этап можно назвать «четвертой фазой метаболизма лекарств», — говорит химик Мэтью Рединбо из Университета Северной Каролины в Чапел-Хилл.«Бактерии совершают невероятно сложные химические реакции, которые не в состоянии осуществить ни одна человеческая система».
Используя комбинацию химии и геномики, исследователи теперь начинают идентифицировать эти механизмы. По мере того, как они это делают, они открывают способы подавления микробных ферментов, вызывающих неприятные побочные эффекты. Конечным результатом могут быть менее токсичные препараты, а также более точные прогнозы реакции пациентов на лекарства.
Potent Pathways
Способность микробов изменять лекарственные препараты была известна уже почти столетие.В доантибиотическую эру немецкие исследователи обнаружили, что противомикробный препарат пронтозил — после того, как он был переварен ферментами в печени и почках, а также кишечными бактериями, — стал сильнодействующим сульфаниламидом, эффективным против многих грамположительных бактерий (2).
Затем рассмотрим противовирусный препарат соривудин. Препарат оказался смертельным для 18 больных раком, и его сняли всего через два месяца после утверждения FDA в 1990-х годах. Позже исследования на мышах показали, что кишечные микробы, вероятно, переваривали соривудин в продукт, который блокировал ферменты печени, необходимые для метаболизма распространенного противоракового препарата 5-фторурацила (5-FU), что приводило к летальному накоплению 5-FU (3).
Только недавно исследователи начали систематически анализировать пути, участвующие в таких неожиданных взаимодействиях. Микробиолог Эндрю Гудман из Йельской школы медицины изучал связи между пищевыми химическими веществами и кишечными бактериями, когда он обнаружил, что выживание некоторых видов зависит от определенных витаминов. Удалите химическое вещество, и комменсальные бактерии вымрут. «На самом деле, пытаясь понять этот разговор между комменсалами и диетой хозяина, мы начали думать о других небольших молекулах, которые кишечные микробы могут распознавать и затем преобразовывать для своих собственных целей», — говорит Гудман.«Это то, что заставило нас задуматься о медицинских препаратах».
В недавнем исследовании Гудман и его коллеги измерили, как 76 различных видов кишечных бактерий человека переваривают 271 распространенное лекарство, принимаемое перорально. Они обнаружили, что даже когда 80% дозы лекарства быстро попадает в кровоток, микробные ферменты могут воздействовать на оставшиеся 20% с образованием токсичных метаболитов. Хотя команда выбрала препараты, которые химически сильно отличались друг от друга, они обнаружили, что по крайней мере две трети молекул метаболизируются по крайней мере одним исследованным кишечным микробом (4).«Способность этих микробов метаболизировать эти лекарства была намного шире, чем мы ожидали», — говорит Гудман.
Трудно было точно предсказать, какие лекарства будут метаболизироваться. «Наркотики с химической структурой, которые выглядят как идеальная приманка для микробов, по какой-то причине остались нетронутыми», — говорит Гудман. «И лекарства, в которых не было ничего похожего на микроб, могли бы распознать это очень эффективно».
В экспериментах с образцами микробиоты человека исследователи начали обнаруживать ферменты, которые могут помочь предсказать, какие бактериальные сообщества могут метаболизировать лекарства.Работа — это «только начало понимания того, в какой степени почти все в нашем теле подвержено трансформации микробами», — говорит Рединбо.
Рединбо и другие хотят понять микробные ферменты, которые действуют на молекулы лекарств. Как правило, неабсорбированные остатки перорально потребляемых лекарств транспортируются в печень, где ферменты инактивируют их и добавляют метки, такие как глюкуроновая кислота, чтобы маркировать молекулы для выделения. Затем они попадают в кишечник через желчные кислоты.Химические метки делают инактивированные лекарства непригодными для использования клетками человека.
Но кишечные бактерии рассматривают молекулы как источники пищи, и они несут ферменты, известные как β-глюкуронидазы, которые могут пережевывать глюкуроновую кислоту для получения энергии и отбрасывать молекулу лекарства — теперь реактивированную — обратно в кишечник. Исследования Redinbo начались с противоопухолевого препарата иринотекан, который может вызывать сильную, отсроченную диарею в результате этой бактериальной активности. Они также обнаружили, что молекула, которую они назвали SBX-1, ингибирует эти микробные ферменты и, таким образом, может блокировать эти токсические эффекты (5).«Это была действительно первая демонстрация того, что микробиота содержит мишени, поддающиеся воздействию лекарств, и что они могут быть нацелены на достижение клинического результата», — говорит Рединбо.
Микробиом человека может определить, ощутят ли он преимущества препарата, побочные эффекты, токсичность или какую-либо комбинацию. Изображение предоставлено: от исх. 7. Перепечатано с разрешения AAAS.
Нацелены на бактериальные ферменты
Команда также работает над выявлением аналогов SBX-1, которые могут оказаться эффективными против других бактериальных ферментов.Примерно 25% клинических лекарств, включая несколько нестероидных противовоспалительных средств, нацелены на бактериальные глюкуронидазы. Таким образом, ингибиторы ферментов, которые блокируют эту активность, потенциально могут снизить токсические побочные эффекты различных других лекарств.
Аналогичным образом Стэнли Хейзен из клиники Кливленда в Огайо и его команда работают над лекарствами, которые могут блокировать синтез кишечных микробов триметиламина N -оксида (ТМАО), потенциально нежелательной молекулы, производимой из жирных продуктов, таких как яичные желтки, мясо и молочные продукты.ТМАО ускоряет образование бляшек на стенках артерий и может привести к сердечно-сосудистым заболеваниям. В исследованиях на животных исследователи обнаружили, что блокирование микробного синтеза ТМАО снижает жировые отложения и может служить средством лечения сердечных и метаболических нарушений (6).
Благодаря последним достижениям в области геномики разработчики лекарств находят способы адаптировать молекулы к конкретным вариантам в геноме человека. Эти так называемые фармакогеномные подходы позволяют пациентам выбирать из нескольких различных препаратов в зависимости от генетического профиля человека.Но если хороших вариантов не существует, вскоре станет возможным изменить микробиом пациента, говорит Гудман. «У нас есть возможность изменить микробиом человека таким образом, чтобы мы действительно не думали об изменении его генома, чтобы улучшить его реакцию на лекарство».
Подходящие лекарства и микробы
Чтобы усовершенствовать лекарственно-модулирующие микробиомные вмешательства, исследователи должны будут лучше охарактеризовать функцию лекарств и лучше измерить влияние диеты и кишечного сообщества на микробные ферменты, говорит микробиолог Питер Тернбо из Калифорнийского университета в Сан-Франциско. .
«Идея о том, что микробиом будет использоваться в доклинической разработке лекарств, все еще в некотором роде спорна и определенно не является стандартом для лекарств на рынке».
–Питер Тернбо
«У нас нет простого правила, согласно которому этот препарат не метаболизируется, а этот — будет», — говорит Тернбо. «И даже если предположить, что в вашем микробиоме есть какой-то фермент, который влияет на соединение, мы действительно не понимаем, что определяет, активны ли эти ферменты».
Выявление этих данных может также ускорить процесс разработки лекарств.Многие потенциальные лекарства отбрасываются на ранней стадии разработки из-за токсических побочных эффектов. Но если эти эффекты являются результатом вмешательства микробов — и если исследователи смогут определить источники такого вмешательства, — награды могут быть значительными: возродились старые лекарства и, возможно, новые, адаптированные для пациентов на основе их кишечной микробиоты. «Идея о том, что микробиом будет использоваться в доклинической разработке лекарств, все еще вызывает споры и определенно не является стандартом для лекарств на рынке», — говорит Тернбо.
Тем не менее, учитывая растущее количество доказательств регулирующего действия микробиоты на лекарства, он предлагает учитывать микробную активность при разработке лекарств и клинических испытаниях. «Я не пытаюсь утверждать, что микробиом важнее генома человека», — говорит Тернбо. «Но так же, как люди смотрят на конкретные человеческие гены или мутации, которые могут иметь значение для действия лекарства, мы должны находиться в одной точке с микробиомом».
