Комплексный ПЦР тест нового поколения для определения вируса папилломы человека (ВПЧ)
Лаборатория «Овум» проводит комплексный ПЦР тест нового поколения для определения
Вируса папилломы человека (ВПЧ)
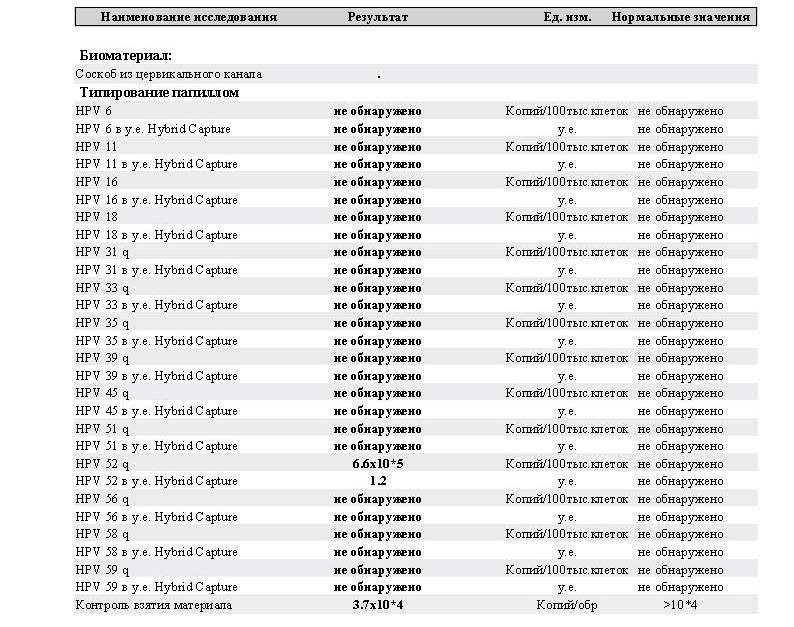
- ВПЧ СКРИН-ТИТР – тест суммарного определения количества ДНК 14-высокоонкогенных типов ВПЧ с дифференцированным определением индивидуальных концентраций наиболее онкогенных 16,18 и 45 генотипов и определением возможной интеграции вируса
Исследование позволяет методом ПЦР в режиме «реального времени» в количественном формате определять:
— суммарное количество ДНК 14-ти высокоонкогенных генотипов ВПЧ (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68),
— количество ДНК ВПЧ 16 типа,
— количество ДНК ВПЧ 18 типа,
— количество ДНК ВПЧ 45 типа,
— оценить возможность интеграции ДНК ВПЧ 16,18,45 типов в геном клеток человека.
В настоящее время доказана и не подвергается сомнению роль ВПЧ как основной причины в возникновении и развитии рака шейки матки (РШМ) у женщин.
К генотипам ВПЧ высокого онкогенного риска на сегодняшний день относят 14 типов вируса: 16,18,31,33,35,39,45,51,52,56,58,59,66,68; они способны оказывать трансформирующее воздействие на клетки эпителия и приводить к развитию предраковых изменений – тяжелых дисплазий и рака шейки матки.
ВПЧ обнаруживается в 95% случаев РШМ, из них 16, 18, 45 генотипы в совокупности являются причиной 75% плоскоклеточных раков и 94% аденокарцином шейки матки.
Средний возраст возникновения раков при ВПЧ 16, 18, 45 типов – 47 лет, при всех остальных высокоонкогенных типах – 56 лет.
Тест ВПЧ СКРИН-ТИТР определяет только значимые для риска развития рака шейки матки генотипы ВПЧ (тест не определяет генотипы ВПЧ низкого и неопределенного риска).
Количественное исследование ВПЧ отражает степень активности процесса и позволяет оценить клиническую значимость. Тест ВПЧ-СКРИН-ТИТР позволяет определять точное количество вирусной ДНК в единицах измерения — lg ДНК ВПЧ на 100 тыс. клеток эпителия.
клеток эпителия.
Интерпретация результатов для исследуемых образцов:
| Концентрация ВПЧ | Клиническая значимость |
| менее 3 lg ДНК ВПЧ | Малозначимая |
| от 3 до 5 lg ДНК ВПЧ | Значимая |
| более 5 lg ДНК ВПЧ | Повышенная |
Развитие РШМ часто ассоциировано с длительным присутствием (персистенцией) в организме и встраиванием ДНК вируса (интеграцией) в геном клеток эпителия человека, наиболее часто интегрируют ВПЧ 16, 18 и 45 генотипы. Определяя различные участки онкогенов вируса методом ПЦР можно косвенно судить о возможности интеграции вируса в геном человека. Интеграция вируса в геном человека — наиболее опасный и прогностически неблагоприятный фактор.
Носительство вируса может возникнуть практически у каждой женщины. Длительная персистенция ВПЧ с большей вероятностью приведет к злокачественной трансформации клетки. В случае получения неудовлетворительных результатов обследования необходима консультация у врача-гинеколога, который выберет оптимальную тактику дальнейшего обследования, наблюдения и лечения.
Тактика регулярного обследования снижает риск развития рака шейки матки в 1000 раз, а раннее начало терапии предотвращает до 80% наблюдений цервикального рака.
Выявление ВПЧ – не приговор, а повод для регулярного наблюдения. Доказано, что при проведении адекватного противовоспалительного лечения, дисплазия шейки матки любой степени способна регрессировать и исчезать совсем.
Исследуемый материал для ПЦР анализа на ВПЧ СКРИН-ТИТР:
- мазки со слизистой оболочки влагалища;
- соскобы эпителия со слизистой оболочки цервикального канала.
Показания к исследованию:
- Скрининг заболеваний шейки матки (цервикальный скрининг) совместно с цитологическим исследованием
- Подозрение на инфицирование ВПЧ
- Неопределенные результаты цитологического исследования
- Различия в результатах цитологического исследования и кольпоскопии
- Контроль эффективности проведенного лечения
Стоимость исследования: 800р.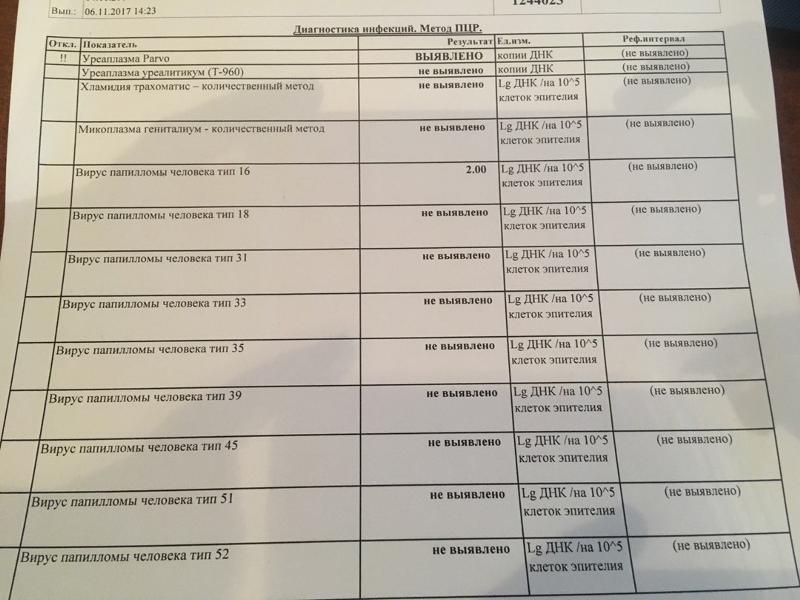
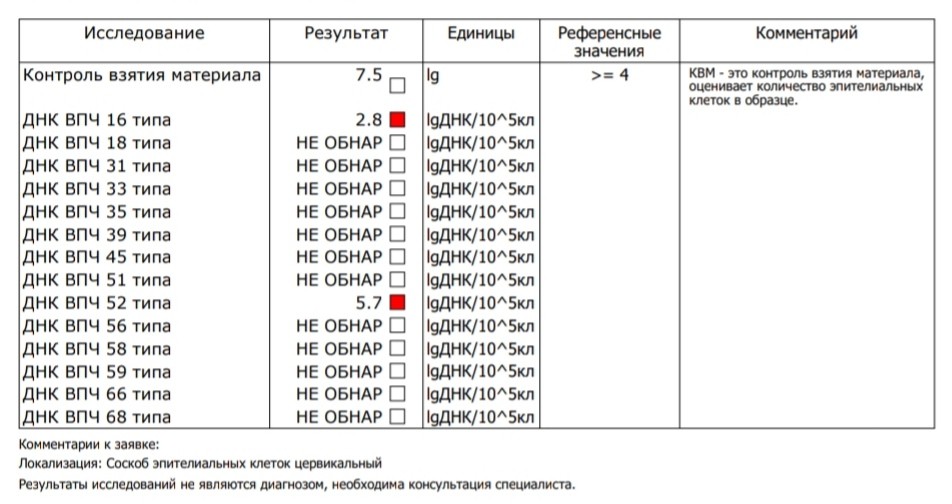
Определение ДНК ВПЧ (Вирус папилломы человека, Human papillomavirus, HPV) высокого онкогенного риска, скрининг 14 типов (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68) + КВМ в соскобе эпителиальных клеток урогенитального тракта
Исследуемый материал
Соскоб эпителиальных клеток урогенитального тракта
Метод определения
ПЦР с детекцией в режиме «реального времени»
Суммарное выявление ДНК вируса папилломы человека 14 типов высокого онкогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68) в соскобе эпителиальных клеток урогенитального тракта методом ПЦР с детекцией в режиме «реального времени».
Вирус папилломы человека (ВПЧ, Human papillomavirus, HPV) относится к малым ДНК-содержащим вирусам, которые инфицируют эпителиальные клетки и индуцируют пролиферативные поражения кожи и слизистых оболочек. В настоящее время известно около ста типов ВПЧ с различным онкогенным потенциалом, которые условно объединяют в группы высокого и низкого онкогенного риска. Более 90% всех цервикальных карцином позитивны к присутствию ВПЧ. Наиболее часто в биоматериале из опухолей шейки матки обнаруживают 16-й и 18-й типы. Выявление ДНК ВПЧ не подтверждает наличие злокачественного процесса, в большинстве (до 90%) случаев в течение 12-36 месяцев происходит элиминация вируса и самоизлечение. При длительной хронической персистенции вируса и в зависимости от его типа повышается риск развития онкологического процесса. Диагностика заболевания требует дополнительного цитологического, гистологического исследования и динамического наблюдения.
Поскольку ВПЧ инфицирует эпителиальные клетки, необходимым условием получения достоверного результата является соблюдение техники взятия соскоба. В состав тестов по диагностике и мониторингу ВПЧ введен специальный параметр – контроль взятия материала (КВМ). КВМ – это тест по определению количества геномной ДНК человека в биоматериале, источником которой служат эпителиальные клетки, попавшие в пробу.
Аналитические показатели:
- определяемый фрагмент – специфичные участки ДНК ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 типов;
- специфичность определения – 100%;
- чувствительность определения – 100 копий ДНК ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 типов в образце.
Литература
- Профилактика рака шейки матки: Руководство для врачей. — М.: Изд. «МЕДпресс-информ». 2008:41.
- Заболевания шейки матки и генитальные инфекции. Под ред. проф. В.Н. Прилепской. — М.: Изд. «ГЭОТАР-Медиа». 2016:384.
- Папилломавирусная инфекция. Пособие для врачей. Под ред. проф. д.б.н. В.М. Говоруна. 2009:55.
- Bekkers R., Meijer C., et al. Effects of HPV detection in population-based screening programmers for cervical cancer: a Dutch moment. Gynecologic oncology. 2006;100(3):451-454.
- Khan M. et al. The elevated 10-year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type specific HPV testing in clinical practice. Journal of the National Cancer Institute. 2005; 97:1072-1079.
- Snijders J., Meijer C. The value of viral load in HPV detection in screening. HPVtoday. 2006;8:8-9.
Определение ДНК ВПЧ (Вирус папилломы человека, Human papillomavirus, HPV) высокого онкогенного риска, скрининг 14 типов (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68) + КВМ в соскобе эпителиальных клеток урогенитального тракта
Исследуемый материал
Соскоб эпителиальных клеток урогенитальный
Метод определения
ПЦР.
Тест, направленный на качественное обнаружение ДНК вируса папилломы человека 14 типов высокого онкогенного риска: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 в соскобе эпителиальных клеток урогенитального тракта.
Вирус папилломы человека (ВПЧ) может быть причиной возникновения рака гениталий у женщин и плоскоклеточного рака у мужчин и женщин. Доказано, что этот вирус является причиной возникновения остроконечных кондилом, кондилом и новообразований шейки матки. Различные виды ВПЧ являются причиной различных поражений. Некоторые из них являются факторами высокого онкогенного риска.
Необходимым условием получения достоверного результата исследования является соблюдение техники взятия соскоба эпителиальных клеток. В состав тестов по диагностике и мониторингу ВПЧ введен специальный параметр — контроль взятия материала (КВМ). КВМ представляет собой тест по определению количества геномной ДНК человека в биоматериале, источником которой являются эпителиальные клетки, попадающие в пробу при правильной технике взятия биоматериала.
Аналитические показатели:
- определяемый фрагмент — специфичные участки ДНК ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 типов;
- специфичность определения — 100%;
- чувствительность определения 100 копий ДНК ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 типов в образце.
Определение ДНК ВПЧ (Вирус папилломы человека, Human papillomavirus, HPV) высокого онкогенного риска, скрининг 14 типов (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68) + КВМ в соскобе эпителиальных клеток урогенитального тракта
Тест, направленный на качественное обнаружение ДНК вируса папилломы человека 14 типов высокого онкогенного риска: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 в соскобе эпителиальных клеток урогенитального тракта.
Вирус папилломы человека (ВПЧ) может быть причиной возникновения рака гениталий у женщин и плоскоклеточного рака у мужчин и женщин. Доказано, что этот вирус является причиной возникновения остроконечных кондилом, кондилом и новообразований шейки матки. Различные виды ВПЧ являются причиной различных поражений. Некоторые из них являются факторами высокого онкогенного риска.
Аналитические показатели:
- определяемый фрагмент — специфичные участки ДНК ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 типов;
- специфичность определения — 100%;
- чувствительность определения 100 копий ДНК ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 типов в образце.
Формат выдачи результата включает суммарный ответ по всем указанным типам ВПЧ-обнаружено/не обнаружено. Результат ОБНАРУЖЕНО следует интерпретировать как наличие в образце специфических участков ДНК одного или нескольких типов ВПЧ без указания конкретного типа. Результат НЕ ОБНАРУЖЕНО следует интерпретировать как отсутствие в образце специфических участков ДНК ВПЧ всех указанных типов.
Обследование женщин целесообразно проводить в первую половину менструального цикла, не ранее 5 –ого дня. Допустимо обследование во второй половине цикла, не позднее, чем за 5 дней до предполагаемого начала менструации. При наличии патологических изменений, взятие материала проводится в день обращения. Накануне и в день обследования пациентке не рекомендуется выполнять спринцевание влагалища. Не рекомендуется взятие биоматериала на фоне проведения антибактериальной терапии ( общей / местной) и во время menses, ранее 24- 48 часов после полового контакта, интравагинального УЗИ и кольпоскопии. Рекомендуется брать материал не ранее, чем через 14 дней после применения антибактериальных препаратов и местных антисептиков, и не ранее, чем через 1 месяц после применения антибиотиков перорально. Если для исследования берут соскоб из уретры, сбор материала проводят до или не ранее 2 — 3 часов после мочеиспускания.
Если для исследования берут соскоб из уретры, сбор материала проводят до или не ранее 2 — 3 часов после мочеиспускания.
Для мужчин: За 1–2 суток до взятия мазка (соскоба) необходимо исключить половые контакты. Не рекомендуется взятие биоматериала на фоне проведения антибактериальной терапии ( общей / местной). Нельзя мочиться в течение 1,5-2 часов до процедуры.
С общими рекомендациями для подготовки к исследованиям можно ознакомиться здесь >>
Проявления трансформирующей дисплазии в различной степени.
Ослабление иммунитета.
Профилактические скрининговые исследования.
Вирус папилломы человека Digene-тест (ВПЧ Digene-тест, метод «гибридного захвата»; Digene HPV Test, Hybrid Capture Technology) — определение ДНК-типов высокого онкогенного риска (16/18/31/33/35/39/45/51/52/56/58/59/68 типы)
Скрининговый тест, использующийся в целях диагностики предраковых состояний и рака шейки матки.
Существует более 100 генотипов вируса папилломы человека. Инфицирование этим вирусом — достаточно распространённое явление. Передаётся инфекция обычно половым путём, в редких случаях возможна вертикальная передача вируса от матери к ребёнку во время родов.
Инфицирование вирусом папилломы может не иметь клинических проявлений, часто наблюдается естественное очищение организма от вируса, особенно в молодом возрасте. Но персистенция вируса в эпителии шейки матки в течение длительного времени может вызывать его патологические изменения.
Рак шейки матки – один из немногих видов злокачественных новообразований, для которых установлена основная причина возникновения заболевания. Многочисленными исследованиями показано, что ДНК вируса папилломы человека обнаруживается практически при всех случаях предраковых состояний и при раке шейки матки. Инфицирование вирусом папилломы предшествует последующей сквамозной (чешуйчатой) интраэпителиальной дисплазии шейки матки. Третья стадия интраэпителиального новообразования шейки матки возникает только при наличии персистирующей инфекции генотипами папилломавируса высокого онкогенного риска. Доказано, что длительная персистенция (5 — 10 лет) папилломавируса генотипов высокого онкогенного риска у женщин старше 30 лет связана со значительным ростом риска развития злокачественных изменений шейки матки. Инфицирование вирусом папилломы генотипов низкого онкогенного риска может клинически проявляться в виде появления остроконечных кондилом.
Доказано, что длительная персистенция (5 — 10 лет) папилломавируса генотипов высокого онкогенного риска у женщин старше 30 лет связана со значительным ростом риска развития злокачественных изменений шейки матки. Инфицирование вирусом папилломы генотипов низкого онкогенного риска может клинически проявляться в виде появления остроконечных кондилом.
Digene HPV тест – защищённая международным патентным законодательством молекулярная технология фирмы Digene, направленная на выявление специфических фрагментов ДНК вируса папилломы человека (метод «гибридного захвата»).
Digene HPV тест дает возможность дифференцировать между 2 группами генотипов вируса — высокого и низкого онкориска. В тесте № 394 выявляется наличие ДНК HPV группы генотипов высокого риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68). В тесте № 395 выявляется наличие ДНК HPV группы генотипов низкого риска (6/11/42/43/44).
Digene HPV тест получил широкое распространение благодаря своей надежности и простоте применения. Чувствительность теста в комбинации с цитологическим исследованием (PAP-тест, в лаборатории ИНВИТРО тест № 517) в обнаружении предраковых изменений шейки матки и рака шейки матки намного выше, чем проведение только цитологического исследования. Считается целесообразным проведение Digene HPV теста при неопределённых результатах PAP-теста. В настоящее время комбинация Digene HPV теста и цитологического PAP-теста становится «золотым стандартом» в этой области диагностики и предлагается для скринингового обследования женщин старше 30 лет. Метод стандартизован. Это единственный тест выявления HPV высокого онкогенного риска, одобренный FDA (Федеральное Управление США по контролю за пищевыми продуктами и лекарствами). Тест получил одобрение ФСНСЗСР (Федеральная служба РФ по надзору в сфере здравоохранения и социального развития).
Digene-тест выявляет клинически значимый уровень инфицирования вирусом папилломы человека, приводящий к развитию неоплазии шейки матки (в отличие от обычных ПЦР-методов, направленных на максимальную чувствительность выявления вирусной ДНК, что не всегда имеет прямые клинические корреляции).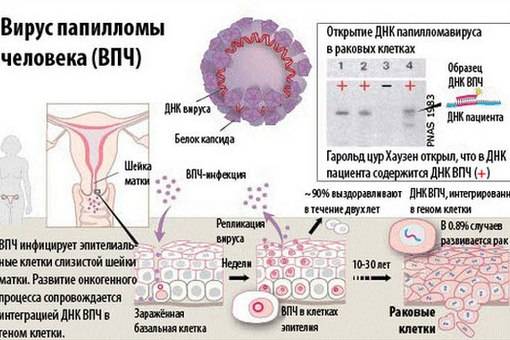 Положительный Digene HPV тест у женщин моложе 30 лет служит показанием к повторному тестированию через 9 месяцев, поскольку у молодых женщин инфекция ВПЧ может носить транзиторный характер.
Положительный Digene HPV тест у женщин моложе 30 лет служит показанием к повторному тестированию через 9 месяцев, поскольку у молодых женщин инфекция ВПЧ может носить транзиторный характер.
Положительный Digene HPV тест у женщин старше 30 лет может свидетельствовать о персистенции вируса. При соответствующем результате цитологического исследования это означает, что женщина имеет высокий риск развития онкопатологии шейки матки и ей требуется специальная профилактика или лечение. Современные методы лечения позволяют в случае раннего выявления резко снизить заболеваемость раком шейки матки и особенно его инкурабельных случаев. Тестирование на присутствие вируса после проведённого лечения позволяет убедиться в его эффективности.
Вирус папилломы человека: вопросы и ответы
Что такое папилломавирусная инфекция?
Папилломавирусная инфекция — группа вирусных инфекционных заболеваний, характеризующихся развитием папилломатозных (бородавчатых) образований на коже и слизистых оболочках, хроническим рецидивирующим течением, широким распространением, высокой контагиозностью, т.е. способностью легко передаваться от человека к человеку.
Проявления папилломавирусной инфекции (ПВИ, ВПЧ) медикам известны давно. Они описаны еще врачами Древней Греции под названием «кондиломы». Гиппократ называл их также «половыми бородавками».
Вирус папилломы человека (ВПЧ) – это достаточно распространенный вирус, который может вызвать серьезные заболевания вплоть до возникновения онкологических заболеваний.
По эпидемиологическим оценкам в мире инфицировано 10-13% населения или приблизительно 630 млн. человек. При проведении массовых скрининговых исследований ВПЧ обнаруживается у 40-50% сексуально активных мужчин и женщин, но у большинства из них, особенно в молодом возрасте, может исчезнуть без какого- либо лечения.
Как можно заразиться вирусом папилломы человека?
ВПЧ поражает всех – мужчин и женщин — и передается при половых контактах, а также при любых прямых контактах с кожей заражённого человека, однако очень редко метастазирует в отдельные органы и ткани человека.
Не случайно вирус папилломы человека — наиболее сексуально трансмиссивная инфекция. По данным некоторых исследователей, вероятность заражения ВПЧ при половом контакте составляет до 60-70%, частота инфицирования вирусом прямо пропорциональна числу половых партнёров: при наличии одного партнера ВПЧ выявляется у 17-20% женщин, при наличии 5 и более партнёров — у 70-80%.
Клинические формы папилломавирусной инфекции обнаруживают у 40-60% мужчин, являющихся половыми партнёрами инфицированных женщин. Поражения у них вызываются теми же типами ВПЧ, что и у женщин, а примерно в 2/3 случаев возникают характерные высыпания на коже и слизистых оболочках половых органов.
Несмотря на то, что вирус папилломы человека обнаружен в амниотической жидкости, риск заражения плода от матери оценивается как низкий и составляет – до 3%.
К каким заболеваниям может привести наличие у человека вируса папилломы?
На сегодняшний день известно более 300 различных типов вируса папилломы человека. Среди них различают типы ВПЧ высокого, среднего и низкого онкогенного риска. При этом человек может быть инфицирован как одним, так и несколькими типами вируса одновременно.
Различные типы ВПЧ вызывают или принимают участие в развитии:
цервикальной, вульвальной, влагалищной дисплазии шейки матки;
преинвазивного и инвазивного рака шейки матки, рака влагалища и перианальной области;
остроконечных кондилом половых органов, мочевых путей;
генитальных кондилом.
Согласно данным эпидемиологических исследований, частота ПВИ гениталий значительно варьирует в различных этнических и географических регионах. Распространённость вируса папилломы обусловлена многочисленными факторами, а также во многом определяется социально-экономическими, поведенческими и медико-гигиеническими условиями. Так, например, минимальная частота инфицирования ВПЧ (5%) наблюдается в Испании. Эта страна принадлежит к странам с «низким» риском заболевания раком шейки матки. Традиционно «высоким» риском инфицирования ВПЧ считаются страны – Аргентина, Мексика, Бразилия, Марокко. С другой стороны, в США и Канаде, несмотря на высокий социально- экономический уровень, частота выявления ВПЧ составляет от 22 до 26%.
Так, например, минимальная частота инфицирования ВПЧ (5%) наблюдается в Испании. Эта страна принадлежит к странам с «низким» риском заболевания раком шейки матки. Традиционно «высоким» риском инфицирования ВПЧ считаются страны – Аргентина, Мексика, Бразилия, Марокко. С другой стороны, в США и Канаде, несмотря на высокий социально- экономический уровень, частота выявления ВПЧ составляет от 22 до 26%.
Несмотря на очевидную медико-социальную значимость проблемы, системные исследования по оценке распространенности ПВИ в Российской Федерации практически не проводились. В настоящее время выполняются отдельные, нескоординированные исследования, согласно которым невозможно объективно оценить состояние проблемы в целом и осуществить даже приближённое прогнозирование эпидемиологической ситуации распространенности ВПЧ среди населения.
Как развивается и проявляется папилломавирусная инфекция?
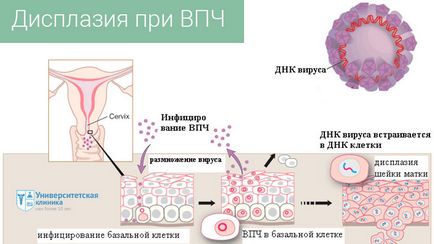
Вирус папилломы человека обитает в коже и слизистых оболочках половых органов. Как показывают медицинские и лабораторные исследования, количество вируса зависит от состояния иммунитета кожи и слизистых — чем выше активность иммунной системы, тем меньшее количество вируса содержится в них. Для того, чтобы вирус мог проявить себя какими-либо симптомами, должно накопиться определенное его количество. А это возможно только при условии снижения иммунитета: после перенесённых инфекций, во время (после) приёма антибиотиков, при беременности, во время сильных стрессов и т. д. Накопившись в достаточной мере на участке кожи или слизистой, вирус папилломы изменяет функцию эпителиальных клеток. В результате они начинают бесконтрольно делиться, что приводит к разрастанию участка кожи и появлению разного рода образований — папиллом и кондилом.
В зависимости от проявлений ПВИ на гениталиях выделяют клиническую, субклиническую и латентную формы.
Клиническая форма инфекции – это в основном генитальные бородавки в виде остроконечных (экзофитных) образований.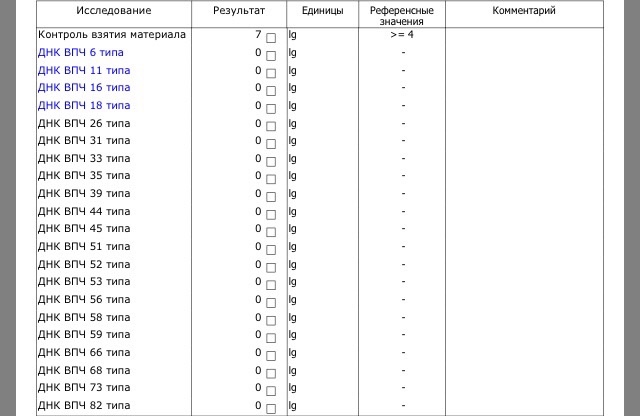 В редких случаях кондиломы наружных половых органов быстро разрастаются, превращаясь в полузлокачественное гигантское образование – опухоль Бушке — Левеншштейна, с экзо- и эндофитным ростом и способностью к проникновению в соседние ткани.
В редких случаях кондиломы наружных половых органов быстро разрастаются, превращаясь в полузлокачественное гигантское образование – опухоль Бушке — Левеншштейна, с экзо- и эндофитным ростом и способностью к проникновению в соседние ткани.
Субклиническая форма ПВИ проявляется в виде плоских кондилом. Они чаще локализуются на шейке матки, реже во влагалище, и в большинстве случаев не заметны при осмотре.
Латентная форма ПВИ не сопровождается морфологическими изменениями в инфицированной ткани, а ДНК вируса часто определяют, где нет заметных клинических признаков инфекции.
Как диагностировать наличие вируса папилломы человека?
Доказательством наличия вируса папилломы служат:
проявления инфекции ВПЧ;
результаты цитологического исследования (изучения характера клеток под микроскопом), свидетельствующего о дисплазии шейки матки;
выявление ВПЧ методом ПЦР;
выявление в крови антител к ВПЧ (используется только в научных целях).
В лабораторной практике для диагностики ВПЧ используются две методики: ПЦР и гибридизационный анализ (Дайджин — тест). В Независимой лаборатории ИНВИТРО для диагностики вируса папилломы человека используют оба метода.
Наиболее распространенным, доступным и достаточно чувствительным является метод ПЦР. Он позволяет диагностировать субклиническую и латентную формы инфекции и обнаружить от 10 до 100 копий генома ВПЧ и идентифицировать, по крайней мере, 43 различных типа.
Несмотря на высокую чувствительность ПЦР, при бессимптомной инфекции ВПЧ выявить вирус удается далеко не всегда. Это связано с особенностями этой инфекции:
инфекция ВПЧ может неопределенное время находиться в латентном (спящем) состоянии. При этом вирус находится в глубине кожи и слизистых, но на поверхность не выделяется.
 В таком состоянии его сложно выявить методом ПЦР.
В таком состоянии его сложно выявить методом ПЦР.инфекция ВПЧ в большинстве случаев поражает обширные участки кожи. При отсутствии симптомов не совсем ясно, исследование какого участка кожи будет более достоверным.
Дайджин — тест — позволяет выявлять не только 13 типов вируса высокоонкогенного риска и 5 типов низкого онкогенного риска ВПЧ, но и определять клинически значимую концентрацию вируса в ткани. Это помогает выработать дальнейшую тактику врача при ведении пациента. Чувствительность теста в сочетании с цитологическим исследованием в обнаружении дисплазий и рака шейки матки намного выше, чем проведение только цитологического анализа.
При цитологическом исследовании, которое также можно провести в Независимой лаборатории ИНВИТРО, часто используется окрашивание мазков по Папаниколау (PAP – тест).
В настоящее время комбинация Дайджин – теста и PAP –теста является «золотым стандартом» в области диагностики патологии шейки матки и предлагается для скринингового обследования женщин старше 30 лет. Положительный тест у женщин моложе 30 лет служит показанием к повторному тестированию через 9 месяцев, поскольку у молодых инфекция может носить транзиторный характер.
Положительный Дайджин — тест у женщин, старше 30 лет может свидетельствовать о персистенции вируса. При соответствующем результате цитологического исследования это означает, что имеется высокий риск развития онкопатологии шейки матки и это требует специальной профилактики и лечения.
Следует помнить, что диагностика ВПЧ инфекции – является одним из важных методов профилактики рака шейки матки и играет значительную роль в успешном лечении данного заболевания.
Однако выявление папилломавирусных инфекций требует современной технологической базы и высококачественных исследований. Именно это может предложить своим клиентам Независимая лаборатория ИНВИТРО.
| 22. Клиническая лабораторная диагностика | ||
|---|---|---|
| 22.01 | Общий (клинический) анализ крови | 400 |
| 22.02 | Общий (клинический) анализ крови развернутый (5-diff) | 500 |
| 22.02.1 | Общий (клинический) анализ крови развернутый + микроскопия (5-diff) | 700 |
| 22.03 | Определение основных групп крови (А,В,0) и резус
-принадлежности | 400 |
| 22.04 | Аллоиммунные антитела (включая антитела к
Rh-антигену) | 400 |
| 22.05 | Общий (клинический анализ крови развернутый (5-diff) + подсчет числа тромбоцитов (по Фонио) | 600 |
| 22.06 | Длительность кровотечения по Дьюку | 100 |
| 22.07 | Свертываемость крови по Сухареву | 100 |
| 22.08 | Общий (клинический) анализ мочи | 300 |
| 22.09 | Общий анализ мочи (без микроскопии осадка) | 250 |
| 22.09.1 | Анализ мочи по Зимницкому | 700 |
| 22.09.2 | Трехстаканная проба мочи | 600 |
| 22.10 | Анализ мочи по Нечипоренко | 200 |
| 22.11 | Анализ эякулята с фоторегистрацией и MAR-тестом
(Спермограмма) | 1 800 |
| 22.13 | Антиспермальные антитела IgG в сперме (прямой
MAR-тест) | 800 |
| 22.14 | Определение фрагментации ДНК сперматозоидов | 5 400 |
22. 15 15 | Посткоитальный тест | 500 |
| 22.16 | Микроскопическое исследование осадка секрета простаты | 300 |
| 22.17 | Микроскопическое исследование синовиальной жидкости | 550 |
| 22.18 | Микроскопическое исследование на грибковые заболевания (кожа, ногти, волосы) | 300 |
| 22.19 | Микроскопическое исследование на демодекоз | 300 |
| 22.20 | Соскоб урогенитальный на флору | 350 |
| 22.21 | Микроскопическое исследование на трихомонады (Trichomonas vaginalis) | 300 |
| 22.22 | Системная красная волчанка. Определение LE-клеток (микроскопия) | 400 |
| 22.23 | Цитологическое исследование биоматериала | 500 |
| 22.24 | Цитологическое исследование соскоба шейки матки и
цервикального канала | 500 |
| 22.25 | Цитологическое исследование пунктата молочной железы (1
образование) | 1 000 |
| 22.26 | Цитологическое исследование отделяемого молочных желез
(мазок-отпечаток) | 500 |
| 22.27 | Цитологическое исследование пунктата молочной железы (2 и
более образований) | 3 000 |
| 22.28 | Гистологическое исследование (1 элемент) | 1 400 |
| 22.29 | Исследование на уреамикоплазмы с определением чувствительности к антибиотикам | 1 550 |
| 22.29.1 | Исследование на уреаплазму (Ureaplasma urealyticum) с определением чувствительности к антибиотикам | 750 |
22. 29.2 29.2 | Исследование на микоплазму (Mycoplasma hominis) с определением чувствительности к антибиотикам | 750 |
| 22.30 | Бактериологическое исследование на микрофлору | 1 150 |
| 22.31 | Бактериологическое исследование отделяемого половых органов | 1 150 |
| 22.32 | Бактериологическое исследование мочи | 1 150 |
| 22.33 | Соскоб со слизистой носа на эозинофилы (нозограмма) | 200 |
| 22.34 | Соскоб на яйца гельминтов/энтеробиоз | 300 |
| 22.35 | Исследование кала на яйца гельминтов и простейшие | 350 |
| 22.36 | Копрологическое исследование | 1 000 |
| 22.37 | Бактериологическое исследование секрета простаты/эякулята с определением чувствительности к антимикробным препаратам | 2 560 |
| 22.38 | Посев отделяемого из уха на микрофлору, определение чувствительности к антимикробным препаратам и бактериофагам (Eye Culture, Routine. Bacteria Identification. Antibiotic Susceptibility and Bacteriophage Efficiency testing) | 1 600 |
| 22.39 | Исследование уровня ретикулоцитов в крови | 195 |
| 22.40 | Исследование уровня эозинофильного катионного белка в крови | 675 |
| 23. ПЦР-диагностика показать | ||
| 23.01 | ПЦР-диагностика хламидии трахоматис (в соскобе) | 265 |
| 23.02 | ПЦР-диагностика хламидии трахоматис (в синовиальной
жидкости) | 380 |
23. 03 03 | ПЦР-диагностика уреаплазмы уреалитикум + парвум (в
соскобе) | 265 |
| 23.04 | ПЦР-диагностика микоплазмы хоминис (в соскобе) | 265 |
| 23.05 | ПЦР-диагностика микоплазмы гениталиум (в соскобе) | 265 |
| 23.06 | ПЦР-диагностика гонококка (в соскобе) | 265 |
| 23.07 | ПЦР-диагностика гонококка (в синовиальной жидкости) | 380 |
| 23.08 | ПЦР-диагностика вируса герпеса 1,2 типа (в соскобе) | 265 |
| 23.09 | ПЦР-диагностика вируса герпеса 6 типа в крови | 500 |
| 23.10 | ПЦР-диагностика вируса герпеса 6 типа в крови
(количественно) | 980 |
| 23.11 | ПЦР-диагностика цитомегаловируса (в соскобе) | 265 |
| 23.12 | ПЦР-диагностика трихомонады (в соскобе) | 265 |
| 23.13 | ПЦР-диагностика гарднереллы (в соскобе) | 265 |
| 23.14 | ПЦР-диагностика кандиды (в соскобе) | 265 |
| 23.15 | ПЦР-диагностика кандиды (в синовиальной жидкости) | 380 |
| 23.16 | ПЦР-диагностика кандиды — типирование (Candida
albicans/glabrata/krusei) | 610 |
23. 17 17 | ПЦР-диагностика папилломавируса 16 тип (в соскобе) | 300 |
| 23.18 | ПЦР-диагностика папилломавируса 18 тип (в соскобе) | 300 |
| 23.19 | ПЦР-диагностика папилломавирусной инфекции 16,18 тип
(количественно) | 700 |
| 23.20 | ПЦР-диагностика папилломавируса 6, 11 типы (в
соскобе) | 350 |
| 23.21 | ПЦР-диагностика папилломавирусов (КВАНТ-21) | 1 500 |
| 23.21.1 | ПЦР-диагностика ВПЧ (вирус папилломы человека,HPV) скрининг 15 типов:
16,18,31,33,35,39,45,51,52,56,58,59,6,11,68) | 650 |
| 23.21.2 | ПЦР-диагностика ВПЧ (вирус папилломы человека, НРV) скрининг 14 + определение интегрированных форм вируса | 900 |
| 23.22 | ПЦР-диагностика 1 инфекции в крови | 500 |
| 23.23 | ПЦР-диагностика 1 инфекции в эякуляте | 500 |
| 23.24 | ПЦР-диагностика биоценоза урогенитального тракта
(ФЕМОФЛОР 16) | 2 500 |
| 23.24.1 | Исследование микрофолоры урогенитального тракта женщин (ФЕМОФЛОР Скрин) | 1 800 |
| 23.25 | ПЦР-диагностика биоценоза урогенитального тракта
(Андрофлор) | 3 000 |
23. 25.1 25.1 | Исследование микрофлоры урогенитального тракта мужчин (Андрофлор Скрин) | 1 800 |
| 23.25.2 | Исследование микрофлоры урогенитального тракта мужчин — Вирафлор-А (АФ скрин +Квант 15) | 2 500 |
| 23.25.3 | Исследование микрофолоры урогенитального тракта женщин — Вирафлор-Ф (ФФ скрин +Квант 15) | 2 500 |
| 23.26 | Определение ДНК вируса гепатита B (Hepatitis B virus) в
крови методом ПЦР, качественное исследование | 700 |
| 23.27 | ПЦР-диагностика гепатита В (количественно) | 3 000 |
| 23.28 | Определение РНК вируса гепатита C (Hepatitis C virus) в
крови методом ПЦР, качественное исследование | 700 |
| 23.29 | Определение генотипа вируса гепатита C (Hepatitis C
virus) | 800 |
| 23.30 | ПЦР-диагностика гепатита С (количественно ) | 3 000 |
| 23.31 | ПЦР-диагностика гепатита D (качественно) | 550 |
| 23.32 | ПЦР-диагностика гепатита D+В (качественно) | 1 000 |
| 23.33 | ПЦР-диагностика ротавируса,норовируса, астровируса
(качественно) | 1 000 |
| 23.33.1 | ПЦР-диагностика норовирусов 1,2 геногруппы (кал) | 800 |
23. 33.2 33.2 | ПЦР-диагностика ротавируса, норовируса, астровируса, энтеровируса (качественно) | 1 200 |
| 23.34 | ПЦР-диагностика хеликобактера пилори (кал) | 600 |
| 23.35 | ПЦР-диагностика энтеровируса (кал) | 439 |
| 23.36 | ПЦР-диагностика энтеровируса (зев, нос) | 1 000 |
| 23.37 | ПЦР-диагностика ОКИ (острые кишечные инфекции)
Аденовирусы группы F, Ротавирусы группы А, Норовирусы 2 генотипа, Астровирусы, Энтеровирус, - Шигелла, Энтероинвазивные E. coli, Сальмонелла, Термофильные Кампилобактерии (кал) | 1 500 |
| 23.38 | ПЦР-диагностика вируса герпеса 4 типа (Эпштейна -Барр) | 350 |
| 23.39 | ПЦР-диагностика вируса герпеса 4 типа (Эпштейна -Барр) в
крови, качественное исследование | 500 |
| 23.40 | ПЦР-диагностика вируса герпеса 4 типа (Эпштейна -Барр) в
крови (количественно) | 980 |
| 23.41 | ПЦР-диагностика мононуклеоза (Вирус Эпштейна-Барр/
Цитомегаловирус/ Вирус герпеса 6 типа) (качественно) | 740 |
| 23.42 | ПЦР-диагностика мононуклеоза (Вирус Эпштейна-Барр/
Цитомегаловирус/ Вирус герпеса 6 типа) (количественно) | 1 330 |
| 23.43 | ПЦР-диагностика токсоплазмы (кровь) | 500 |
23. 44 44 | ПЦР-диагностика вируса краснухи (кровь) | 500 |
| 23.46 | ПЦР-диагностика вирусов гриппа А+В (Influenza А-В) | 1500 |
| 23.47 | ПЦР-диагностика ОРВИ-скрин (респираторно-синцитиальный вирус, метапневмовирус, вирус парагриппа 1,2,3,4, коронавирусы, риновирусы, аденовирусы В,С,Е, бокавирусы) | 1600 |
| 23.48 | ПЦР-диагностика вируса гриппа A h2N1 (свиной), h4N2 (Гонконг) | 1000 |
| 23.49 | ПЦР-диагностика хламидия пневмония (Chlamydophila pneumoniae) | 480 |
| 23.50 | ПЦР-диагностика вируса герпеса 3 типа (ветряная оспы и опоясывающий лишай) (Varicella-Zoster Virus) | 350 |
| 23.51 | Генетика тромбофилии (8 генов) с описанием | 3 600 |
| 23.52 | Генетика тромбофилии (2 гена) (для контрацепции) с
описанием | 2 300 |
| 23.53 | ПЦР-диагностика микоплазма пневмония (Mycoplasma pneumoniae) | 480 |
| 23.55 | Генетика нарушения обмена фолатов с описанием | 3 100 |
| 23.57 | Генетика тромбофилии, обмен фолатов с описанием | 5 600 |
| 23.59 | Генетическая предрасположенность к развитию рака молочной
железы и яичников (BRCA-1, BRCA-2) с описанием | 3 980 |
23. 61 61 | Генетический фактор мужского бесплодия (AZF) с
описанием | 3 980 |
| 23.62 | Типирование генов системы HLAII класса (DQB1 -
репродуктивные проблемы) 12 показателей | 3 080 |
| 23.62.1 | Типирование генов системы HLA II класса. Полная панель. Локусы DRB1, DQA1, DQB1. | 4 300 |
| 23.62.2 | Типирование генов системы HLA II класса. (DRB1 — трансплантация органов и тканей) 13 показателей. | 2 000 |
| 23.62.3 | Типирование генов системы HLA II класса. (DQA1 — риск развития сахарного диабета I типа) 8 показателей. | 2 000 |
| 23.64 | Кардиогенетика гипертонии (полная панель) с описанием | 3 960 |
| 23.65 | Описание результатов генетических исследований врачом-генетиком | 600 |
| 23.66 | ПЦР-диагностика золотистого стафилококка. Качественно, количественно и выявление метициллин-чувствительного Staphylococcus aureus. | 600 |
| 23.67 | ПЦР-диагностика возбудителей коклюша (Bordetella pertussis), паракоклюша (Bordetella parapertussis) и бронхисептикоза (Bordetella bronchiseptica) | 600 |
| 23.68 | ПЦР-диагностика коронавируса (SAR.S-CoV-2) (качественное определение) | 2 000 |
| 23.69 | ПЦР-диагностика коронавируса (SARS-CoV-2) (качественное определение) с выездом для забора биоматериала | 2 250 |
23. 70 70 | ПЦР-диагностика коронавируса (SARS-CoV-2) (качественное определение) (результат на английском языке) | 2 200 |
| 24. ИФА-диагностика показать | ||
| 24.01 | Экспресс-анализ крови на ВИЧ | 330 |
| 24.02 | Антитела к ВИЧ 1 и 2 и антиген ВИЧ 1 и 2 (HIV-Аг/Ат) | 260 |
| 24.03 | Экспресс-анализ крови на сифилис | 330 |
| 24.04 | Суммарные антитела к антигенам Treponema pallidum
(Сифилис IgG и IgM качественно) | 350 |
| 24.04.1 | Сифилис РПГА (реакция пассивной гемагглютинации), качественно | 330 |
| 24.04.2 | Сифилис РПГА (реакция пассивной гемагглютинации), количественно (титр) | 660 |
| 24.05 | Экспресс-анализ крови на гепатит В | 330 |
| 24.06 | Определение поверхностного антигена вируса гепатита В
(HBsAg, качественный тест) | 330 |
| 24.07 | Определение поверхностного антигена вируса гепатита В
(HBsAg, количественный тест) | 600 |
| 24.08 | Экспресс-анализ крови на гепатит С | 330 |
| 24.09 | Суммарные антитела к антигенам вируса гепатита C (Ig M и
Ig G качественно) | 330 |
24. 10 10 | Исследование уровня 25-OH витамина Д в крови | 2 000 |
| 24.10.1 | Исследование уровня фолиевой кислоты (Folic Acid) в крови | 770 |
| 24.10.2 | Исследование уровня витамина В12 (цианокобаламин) в крови | 615 |
| 24.11 | Исследование уровня тиреотропного гормона (ТТГ) в
крови | 450 |
| 24.12 | Исследование уровня свободного тироксина (Т4) сыворотки
крови | 450 |
| 24.13 | Исследование уровня общего трийодтиронина (Т3) в
крови | 300 |
| 24.14 | Исследование уровня антител к тиреоидной пероксидазе
(АТ-ТПО) в крови | 450 |
| 24.15 | Исследование уровня антител к рецептору тиреотропного
гормона (ТТГ) в крови | 1 200 |
| 24.16 | Исследование уровня антител к тиреоглобулину (АТ-ТГ) в
крови | 360 |
| 24.16.1 | Исследование уровня Тиреоглубина (Тиреоглобулин; Thyroglobulin, TG) | 550 |
| 24.17 | Исследование уровня адренокортикотропного (АКТГ) гормона
в крови | 570 |
| 24.17.1 | Исследование уровня соматотропного гормона в крови (соматотропин, СТГ) | 350 |
| 24.18 | Исследование уровня лютеинизирующего гормона (ЛГ) в
сыворотке крови | 450 |
24. 19 19 | Исследование уровня фолликулостимулирующего гормона (ФСГ)
в сыворотке крови | 450 |
| 24.20 | Исследование уровня пролактина в крови | 450 |
| 24.21 | Исследование уровня общего кортизола в крови | 450 |
| 24.22 | Исследование уровня прогестерона в крови | 450 |
| 24.23 | Исследование уровня эстрадиола в крови | 650 |
| 24.24 | Исследование уровня хорионического гонадотропина
(бета-ХГЧ) в крови | 500 |
| 24.25 | Исследование уровня хорионического гонадотропина
(бета-ХГЧ) в крови (срок выполнения 1 день) | 1 000 |
| 24.26 | Исследование уровня паратиреоидного гормона в крови | 750 |
| 24.27 | Исследование уровня ферритина в крови | 500 |
| 24.28 | Исследование уровня общего тестостерона в крови | 450 |
| 24.28.1 | Исследование уровня свободного тестостерона в крови | 1 250 |
| 24.28.2 | Исследование уровня дигидротестостерона (Dihydrotestosterone) в крови | 1 100 |
| 24.29 | Исследование уровня глобулина, связывающего половые
гормоны (ССГ), в крови | 650 |
24. 30 30 | Исследование уровня гормона
ДГЭА-С(дегидроэпиандростерон-сульфат) | 450 |
| 24.31 | Исследование уровня 17-гидроксипрогестерона (17-OH
прогестерон) в крови | 500 |
| 24.32 | Определение уровня антимюллерова гормона в крови | 1 200 |
| 24.33 | Исследование уровня Ингибина В, в крови | 1 000 |
| 24.34 | Исследование уровня C-пептида в крови | 600 |
| 24.35 | Исследование уровня инсулина крови | 600 |
| 24.36 | Определение антител класса M (IgM) к вирусу краснухи
(Rubella virus) в крови | 400 |
| 24.37 | Определение антител класса G (IgG) к вирусу краснухи
(Rubella virus) в крови | 400 |
| 24.38 | Определение антител класса M (IgM) к токсоплазме
(Toxoplasma gondii) в крови | 400 |
| 24.39 | Определение антител класса G (IgG) к токсоплазме
(Toxoplasma gondii) в крови | 400 |
| 24.40 | Определение антител класса M (IgM) к вирусу простого
герпеса в крови | 400 |
| 24.41 | Определение антител класса G (IgG) к вирусу простого
герпеса в крови | 400 |
| 24.42 | Определение антител класса M (IgM) к цитомегаловирусу
(Cytomegalovirus) в крови | 400 |
| 24.43 | Определение антител класса G (IgG) к цитомегаловирусу
(Cytomegalovirus) в крови | 400 |
| 24.44 | Определение антител класса G (IgG) к возбудителю
описторхоза (Opisthorchis felineus) в крови | 400 |
| 24.45 | Определение норовирусов (1,2 геногруппа) | 450 |
| 24.46 | Определение антигена ротавируса в крови | 450 |
| 24.47 | Определение антител класса G (Ig G) к антигенам
лямблий | 450 |
| 24.48 | Определение антител класса G (Ig G) к антигенам
токсокар | 410 |
| 24.49 | Определение антител класса G (Ig G) к аскаридам | 760 |
| 24.50 | Определение антител к возбудителю брюшного тифа
Salmonella typhi (РПГА) | 470 |
| 24.51 | Определение суммарных антител (IgА, IgМ, Ig G) к антигену
CagA Helicobacter pilori | 580 |
| 24.52 | Определение суммарных антител ( IgА, IgM, IgG) к антигену лямблий | 490 |
| 24.53 | Системная красная волчанка. Антитела ( IgG) к
двуспиральной (нативной) ДНК | 470 |
| 24.54 | Исследование уровня общего иммуноглобулина E в крови | 450 |
| 24.55 | Аллергопанель №1 – Смешанная (IgE к 20 респираторным и
пищевым аллергенам) | 4 000 |
| 24.56 | Аллергопанель №2 — Респираторная (IgE к 20 респираторным
аллергенам) | 4 000 |
| 24.57 | Аллергопанель №3 — Пищевая (IgE к 20 пищевым
аллергенам) | 4 000 |
| 24.58 | Аллергопанель №4 — Педиатрическая (IgE к 20
«педиатрическим» аллергенам) | 4 000 |
| 24.59 | Экспресс-анализ кала на скрытую кровь | 300 |
| 24.60 | Исследование уровня простатспецифического (ПСА) антигена
общего в крови | 450 |
| 24.61 | Экспресс-анализ крови на общий ПСА (простат-специфический
антиген) | 330 |
| 24.62 | Исследование уровня антигена плоскоклеточной карциномы (SCC) | 1 900 |
| 24.63 | Исследование уровня РЭА (раково-эмбриональный
антиген) | 510 |
| 24.64 | Исследование уровня опухолеассоциированного маркера CA
15-3 в крови (углеводный антиген рака молочной железы) | 560 |
| 24.65 | Исследование уровня антигена аденогенных раков CA 19-9 в
крови | 510 |
| 24.66 | Исследование уровня антигена аденогенных раков CA 125 в
крови | 550 |
| 24.67 | Определение антифосфолипидного синдрома
(Бета-2-гликопротеин, Суммарная фракция фосфолипидов, ХГЧ, Ревматоидный фактор, Двуспиральная ДНК, Коллаген), полуколичественно | 3 500 |
| 24.69 | Исследование уровня Кальцитонина (Calcitonin) | 850 |
| 24.70 | Определение антител к циклическому цитруллинированному пептиду (АЦЦП) | 1 000 |
| 24.71 | Исследование уровня АФП (Альфа-фетопротеин) | 310 |
| 24.72 | Диагностика целиакии (Антитела к тканевой трансглутаминазе IgG: IgA) | 1 500 |
| 24.73 | Определение антител класса М (IgM) к коронавирусу (SARS-CoV, IgM) в крови | 750 |
| 24.74 | Определение антител класса G (IgG) к коронавирусу (SARS-CoV, IgG) в крови | 750 |
| 24.75 | Определение суммарных антител (IgM+IgG) к коронавирусу (SARS-CoV-2, IgM+IgG) в крови | 1 350 |
| 25. Биохимические исследования показать | ||
| 25.01 | Исследование уровня глюкозы в крови | 150 |
| 25.02 | Глюкозотолерантный тест с определением глюкозы натощак и после нагрузки через 2 часа (включая взятие
биоматериала) | 600 |
| 25.03 | Глюкозотолерантный тест при беременности (включая взятие
биоматериала) | 750 |
| 25.04 | Исследование уровня гликированного гемоглобина в
крови | 450 |
| 25.05 | НОМА Оценка инсулинорезистентности: глюкоза (натощак),
инсулин (натощак), расчет индекса HOMA-IR | 700 |
| 25.06 | Проба Реберга (клиренс эндогенного креатинина, скорость
клубочковой фильтрации) (кровь,моча) | 300 |
| 25.07 | Исследование уровня общего билирубина в крови | 150 |
| 25.08 | Исследование уровня билирубина связанного
(конъюгированного) в крови | 150 |
| 25.09 | Определение активности аспартатаминотрансферазы (АСТ) в
крови | 150 |
| 25.10 | Определение активности аланинаминотрансферазы (АЛТ) в
крови | 150 |
| 25.11 | Определение активности гамма-глютамилтрансферазы (ГГТ) в
крови | 150 |
| 25.12 | Исследование уровня лактатдегидрогеназы (ЛДГ) в крови | 150 |
| 25.13 | Исследование уровня С-реактивного белка (СРБ) | 300 |
| 25.14 | Исследование уровня гомоцистеина в крови | 1 100 |
| 25.15 | Исследование уровня общего белка в крови | 150 |
| 25.16 | Суточная потеря белка в моче | 160 |
| 25.17 | Исследование уровня альбумина в крови | 150 |
| 25.18 | Исследование уровня микроальбумина в моче | 250 |
| 25.19 | Исследование уровня мочевины в крови | 150 |
| 25.20 | Исследование уровня креатинина в крови | 150 |
| 25.21 | Исследование уровня холестерина в крови | 150 |
| 25.22 | Исследование уровня холестерина липопротеинов низкой
плотности (ЛПНП) | 250 |
| 25.23 | Исследование уровня холестерина липопротеинов высокой
плотности в крови (ЛПВП) | 250 |
| 25.24 | Исследование уровня липопротеинов в крови
(триглицериды) | 200 |
| 25.25 | Липидограмма (холестерин, ЛПВП, ЛПНП, триглицериды,
коэффициент атерогенности) | 800 |
| 25.26 | Исследование уровня общего магния в крови | 180 |
| 25.27 | Исследование уровня неорганического фосфора в крови | 150 |
| 25.28 | Исследование уровня общего кальция в крови | 150 |
| 25.29 | Исследование уровня кальция в суточной моче | 160 |
| 25.30 | Исследование уровня железа сыворотки крови | 200 |
| 25.30.1 | Исследование уровня меди (Cu) сыворотки крови | 240 |
| 25.30.2 | Исследование уровня цинка (Zn) сыворотки крови | 240 |
| 25.31 | Исследование железосвязывающей способности в крови | 350 |
| 25.32 | Исследование уровня трансферрина в крови | 400 |
| 25.33 | Электролиты (К, Na,Ca, Cl) | 500 |
| 25.34 | Исследование уровня амилазы в крови | 150 |
| 25.35 | Исследование уровня мочевой кислоты в крови | 150 |
| 25.36 | Исследование уровня мочевой кислоты в моче | 150 |
| 25.37 | Исследование уровня АСЛО в крови (антистрептолизин О,
полуколичественно) | 250 |
| 25.38 | Исследование уровня ревматоидного фактора
(полуколичественно) | 250 |
| 25.39 | Исследование уровня изоферментов креатинкиназы в
крови(Креатинфосфокиназа КФК) | 190 |
| 25.40 | Исследование уровня изоферментов креатинкиназы в крови
(Креатинфосфокиназа КФК -МВ) | 250 |
| 25.40.1 | Исследование уровня маркеров: Миоглобин/Креатинкиназа МВ/Тропонин-I | 850 |
| 25.41 | Исследование уровня иммуноглобулина G в крови | 200 |
| 25.42 | Исследование уровня щелочной фосфатазы в крови | 150 |
| 25.43 | Исследование уровня простатической кислой фосфатазы в
крови | 160 |
| 26. Коагулологические исследования(оценка системы гемостаза)показать | ||
| 26.01 | Активированное частичное тромбопластиновое время | 200 |
| 26.02 | Протромбиновый комплекс по Квику(протромбиновое время,
ПТИ, МНО) | 200 |
| 26.03 | Исследование уровня фибриногена в крови (по Клауссу) | 200 |
| 26.04 | Определение тромбинового времени в крови | 200 |
| 26.05 | Определение концентрации Д-димера в крови | 860 |
| 26.06 | Определение активности антитромбина III в крови | 300 |
Особенности клинических проявлений вируса папилломы человека у мужчин, практикующих секс с мужчинами | Стоянов
1. Редди Б.Ю., Ламберт В.К. Остроконечные кондиломы. В кн.: Мрочковски Т.Ф., Милликан Л.Э., Париш Л.Ч. Генитальные и перианальные заболевания. Пер. с англ. под ред. В.А. Молочкова. М.: Гэотар-Медиа, 2019. С. 91–100.
2. Молочков В.А., Семенова Т.Б., Киселев В.И., Молочков А.В. Генитальные вирусные инфекции. М.: Бином, 2009. 208 с.
3. Mayeaux E.J. Jr, Dauton C. Modern management of external genital warts. J Low Genit Tract Dis 2008;12(3):185–92. DOI: 10.1097/LGT.0b013e31815dd4b4.
4. Давыдов М., Демидов Л., Поляков Б. Современное состояние и проблемы онкологии. Врач 2006;(13):3–7.
5. Молочкова Ю.В. Генитальная папилломавирусная инфекция. М.: Бином, 2017. 234 с.
6. Forcier M., Musacchio N. An overview of human papillomavirus infection for the dermatologist: disease, diagnosis, management, and prevention. Dermatol Ther 2010;23(5):458–76. DOI: 10.1111/j.1529-8019.2010.01350.x.
7. Баткаев Э.А., Баткаева Н.В. Папилломавирусная инфекция человека. М.: Изд-во РГМУ, 2013. 24 c.
8. Молочков А.В. Иммунотерапия генитальной папилломавирусной инфекции. Лечащий врач 2009;(5):35–9.
9. Молочков А.В., Киселев В.И., Рудых И.В. и др. Папилломавирусная инфекция: клиника, диагностика, лечение. М.: Изд-во РГМУ, 2004. 43 с.
10. Скидан Н.И., Орехов Д.В., Горбунов А.П. и др. Дифференцированный подход к выбору тактики лечения пациентов с вирусно-бактериальными уретритами, ассоциированными с ВПЧ-инфекцией. Международный журнал прикладных и фундаментальных исследований 2014;(10):149–53.
11. Breeze P.L., Judson F.N., Penley К.A., Douglas J.M. Jr. Anal human papillomavirus infection among homosexual and bisexual men: prevalence of type-specific infection and association with human immunodeficiency virus. Sex Transm Dis 1995;22(1):7–14. DOI: 10.1097/00007435-199501000-00002.
12. Dunne E.F., Nielsen C.M., Stone K.M. et al. Prevalence of HPV infection among men: a systematic review of the literature. J Infect Dis 2006;194(8):1044–57. DOI: 10.1086/507432.
13. Rosenblat A., Gustavo H. Human papillomavirus. A practical guide for urologists. Berlin: Heidelberg Springer Verlag, 2009.
14. Willey D.J., Douglas J., Beutner K. et al. External genital warts diagnosis: treatment and prevention. Clin Infect Dis 2002;35(Suppl 2):210–24. DOI: 10.1086/342109.
15. Laprise C., Trottier H., Monnier P. et al. Prevalence of human papillomaviruses in semen: a systematic review and metaanalysis. Hum Reprod 2014;29(4):640–51. DOI: 10.1093/humrep/det453.
16. Mullhall B.P., Fieldhouse S., Clark S. et al. Anti-sperm antibodies in homosexual men: prevalenсе and correlation with sexual behaviour. Genitourin Med 1990;66(1):5–7. DOI: 10.1136/sti.66.1.5.
17. Bell A., Weinberg M. Homosexualities: a study of diversity among men and women. NY: Simon and Shuster, 1978. 505 р.
18. Neiman R. Sexuelle minder sexuelle orientierungim volker und europarecht. Berlin: Berliner Wissenschaftsverlag, 2013. 321 s. (In German).
19. Poynten V., Grulich F. Gay men and anal cancer. Natl AIDS Bull 2013;11(2):33–5.
20. Стоянов В.Б., Фоминых С.Ю., Семенова Т.Б. Генитальная папилломавирусная инфекция у мужчин: особенности клиники, диагностики и перспективы лечения. В сб.: IV Всероссийская научно-практическая конференция с международным участием «Рациональная фармакотерапия в урологии – 2010». Тезисы. М., 2010. С. 126–128.
21. Palevsky J.M., Gulliano A.R., Goldstone S. et al. HPV vaccine against anal HPV infection and anal intraepithelial neoplasia. N Engl J Med 2011;365(17):1576–85. DOI: 10.1056/NEJMoa1010971.
Генотипы вируса папилломы человека 68 и 58 являются наиболее распространенными генотипами у женщин из общин киломбо в штате Мараньян, Бразилия
Основные моменты
- •
В Бразилии бежавшие или освобожденные рабы начали жить в изолированных общинах, называемых киломбо.
- •
Частота вируса папилломы человека (ВПЧ) была определена у женщин из квиломбос в штате Мараньян, Бразилия.
- •
Общая частота ВПЧ была низкой (13%), а наиболее частыми генотипами были ВПЧ 68 и ВПЧ 58.
- •
ВПЧ-положительные женщины в 6,5 раз чаще имели цитологические аномалии.
- •
Распределение типов ВПЧ значительно отличалось от мировых.
Резюме
Цели
Определить частоту типов вируса папилломы человека (ВПЧ) и поведенческие характеристики, связанные с цитологическими аномалиями, у женщин, потомков рабов, которые живут в изолированных общинах, известных как киломбос в штате Мараньян, Бразилия.
Методы
Цервиковагинальные образцы 353 женщин были проанализированы с помощью стандартной цитологии и генотипирования. Обнаружение и генотипирование ВПЧ проводили с использованием набора для тестирования генотипирования ВПЧ с линейным набором. Были проанализированы поведенческие факторы и их связь с цитологическими отклонениями, а также связь между цитологическими отклонениями и инфекцией ВПЧ.
Результаты
Частота инфицирования ВПЧ составила 13%, при этом инфицирование типами ВПЧ высокого риска было более частым, чем типами низкого риска (10.2% против 2,8%). Наиболее распространенными генотипами были ВПЧ 68 (3,1%) и ВПЧ 58 (2,6%). У ВПЧ-положительных женщин в 6,5 раз чаще, чем у ВПЧ-отрицательных женщин, диагностировались цитологические аномалии. Обнаружена значимая связь между инфекцией ВПЧ и наличием цитологических аномалий у женщин в возрасте 31–40 лет и женщин в возрасте 51–60 лет.
Выводы
Обнаружен отчетливый профиль генотипов ВПЧ высокого риска с преобладанием типов 68 и 58. Возможно, что результаты настоящего исследования обусловлены специфическими характеристиками популяции, которая географически изолирована и сохраняется консервативные сексуальные привычки.
Ключевые слова
Типы ВПЧ
Инфекция половых путей
Мазок из шейки матки
Эпидемиология
Изолированные сообщества
Рекомендуемые статьиЦитирующие статьи (0)
Посмотреть аннотацию
© 2017 Авторы. Опубликовано Elsevier Ltd от имени Международного общества инфекционных болезней.
Рекомендуемые статьи
Цитирующие статьи
Тест мРНК ВПЧ 14 типа при сортировке ДНК-ВПЧ-положительных женщин в постменопаузе с нормальной цитологией | BMC Cancer
В период с 2013 по 2016 год женщины в возрасте 60–65 лет, с нормальной цитологией и проживающие в южном регионе Швеции (Сконе) ( n = 5925) были проверены на наличие HR-HPV.
Когда в 2013 году был введен тест на выход, лаборатория имела доступ только к тесту ДНК ВПЧ MGP-PCR Luminex, и поэтому он использовался в качестве основного теста на ВПЧ на протяжении всего исследования.
Цервикальный ДНК-ВПЧ был обнаружен у 286 (4,8%) человек со средним возрастом 61,9 года (SD +/- 1,7).
Критериями исключения из дальнейшего наблюдения были неоплазия шейки матки в анамнезе и / или лечение заболеваний шейки матки, такое как процедура электрического иссечения петли (LEEP), гистерэктомия или трахелэктомия, а также текущее онкологическое лечение на момент проведения двойного теста.В общей сложности 271 женщина с положительной реакцией на HR-HPV с нормальной цитологией шейки матки соответствовала критериям включения в это проспективное исследование.
Рис. 1
Процесс включения и данные последующего наблюдения, включая результаты ДНК ВПЧ и мРНК ВПЧ
Двойной тест состоял из образца LBC (Thinprep, Hologic, Inc.), который был проанализирован на ДНК HR-HPV с использованием Тест MGP-PCR-Luminex [6, 7]. У женщин с положительным результатом теста на ДНК HR-HPV, сопутствующий анализ мРНК E6 / E7 HPV (APTIMA, Hologic, Inc.) был выполнен. Женщинам с нормальной цитологией и положительным результатом на ДНК ВПЧ-ВПЧ было назначено новое контрольное обследование через 12 месяцев, включая новый образец ББК и процедуру совместного тестирования ДНК / мРНК ВПЧ. Всем женщинам, у которых была диагностирована патология шейки матки и / или положительный результат на ДНК и / или мРНК HR-HPV, была назначена дальнейшая клиническая оценка с кольпоскопической оценкой. Та же процедура была выполнена у женщин с положительным результатом на ДНК и / или мРНК HR-HPV в двух последующих контрольных группах. Следующая рутинная процедура совместного тестирования была назначена через 12 месяцев, включая даже тех женщин, которые прошли клиническое обследование.
На всех последующих контрольных мероприятиях, которые проводились с интервалами от 12 до 18 месяцев, применялись те же критерии отбора, чтобы определить, какие женщины нуждались в дальнейшем клиническом исследовании. В течение периода наблюдения удалось зарегистрировать не менее трех последовательных последующих наблюдений.
Женщины с нормальным цитологическим исследованием и отрицательными результатами ДНК ВПЧ-ВПЧ отказались от услуг стандартного скрининга.
Классификация результатов LBC и гистологии
Результаты LBC были определены как нормальные, атипичные плоскоклеточные клетки неопределенной значимости (ASCUS), атипичные железистые клетки (AGC), плоскоклеточные интраэпителиальные поражения низкой степени (LSIL) и интраэпителиальные поражения высокой степени ( HSIL) по классификации Bethesda [8].Гистопатологические результаты были определены как поражения LSIL и HSIL с использованием двухуровневой системы классификации [9]. Гистологически подтвержденный HSIL или хуже использовался в качестве первичной конечной точки исследования. Поражения низкой степени злокачественности, основанные на цитологических или гистологических данных, представлены отдельно. Рецидивирующие цитологические аномалии той же степени тяжести рассматривались как единый случай.
У женщин с поражениями HSIL на LBC и соответствующими результатами кольпоскопии для терапевтического лечения выполнялась LEEP.Кроме того, пациентам с цитологическим ASCUS или LSIL, но кольпоскопической картиной, указывающей на лежащее в основе предраковое поражение, была назначена процедура LEEP.
В случае недоступной зоны трансформации, расположенной внутри цервикального канала, для диагностики брали биопсию шейки матки или образец конизации.
Анализ HR-HPV
Анализ ДНК HPV MGP-PCR Luminex позволяет одновременно обнаруживать несколько типов HPV [6, 7].
Из каждого флакона LBC (Thinprep) центрифугировали 2 мл при 3500 x g в течение пяти минут, а затем удалили жидкость, так что осталось 500 мкл.Из каждого образца ДНК очищали общим набором NA (200 мкл на входе и 100 мкл на выходе) с использованием Magna Pure LC (Roche), а затем ДНК ВПЧ амплифицировали с помощью ПЦР с модифицированными праймерами GP5 + / 6 + (MGP) [7].
После амплификации генотипирование HPV на основе Luminex позволяет идентифицировать следующие типы HR-HPV: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и вероятный высокий — тип риска 68 (A и B), а также типы риска 26, 53, 66, 67, 69, 73 и 82, согласно классификации IARC 2012 года [10].В настоящем исследовании вероятные и возможные типы HR-HPV были классифицированы как типы HR-HPV.
Анализ мРНК E6 / E7 HPV (APTIMA) качественно определяет мРНК E6 / E7 14 типов HR-HPV: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 и 68.
Из каждого флакона LBC (Thinprep) 1 мл автоматически переносили в 2,9 мл раствора для переноса APTIMA (ATS, Hologic, Inc.) с помощью прибора Tomcat (Hologic, Inc.). После этого аликвоту 400 мкл дополнительно обрабатывали для анализа мРНК HPV E6 / E7 (APTIMA) с помощью системы Panther (Hologic, Inc.)
Мы рассчитали долю положительности мРНК E6 / E7 HPV для каждого из этих 14 типов HR-HPV, а также для HPV67 (известно, что APTIMA перекрестно реагирует с HPV67, вкладыш набора, APTIMA HPV Assay, номер 503 744), как определено анализом ДНК ВПЧ MGP-PCR Luminex.
Наличие одного и того же генотипа HR-HPV при включении и при последующем наблюдении было определено как персистирующая инфекция. При последующем наблюдении у женщин с доброкачественной цитологией, у которых тест на ДНК HR-HPV был отрицательным, но был положительным на ДНК HPV низкого риска (LR) в соответствии с анализом Luminex, статус HR-HPV считался отрицательным или очищенной инфекцией.
Конечные точки
Конечной точкой было развитие гистологически подтвержденного HSIL или хуже в течение четырехлетнего периода наблюдения.
Статистическая оценка
Статистические сравнения были основаны на двусторонних критериях хи-квадрат. Все сравнения были двусторонними, применялся уровень значимости 5%. Абсолютный риск развития патологий шейки матки среди женщин с положительной реакцией на мРНК ВПЧ был представлен с соответствующими 95% доверительными интервалами (ДИ).
Совокупная частота инцидентов (CIR) в течение периода наблюдения была рассчитана в соответствии с анализом выживаемости Каплана-Мейера и представлена в виде процентов с соответствующим 95% доверительным интервалом.
Статистический анализ проводился с использованием SPSS версии 19.0 или выше (IBM Corp., Амонк, Нью-Йорк, США) и Omnistat (SBU, Треллеборг, Швеция).
Часто задаваемые вопросы о раке шейки матки | Государственная лаборатория гигиены штата Висконсин
Что такое рак шейки матки?
Рак шейки матки — медленно прогрессирующее заболевание.Обычно это начинается с небольшого поражения или роста на шейке матки. Аномальные клетки приобрели способность покидать свое нормальное положение на поверхности и первоначально проникают в более глубокие ткани. Они также приобретают способность распространяться в отдаленные места, путешествуя по кровеносным сосудам или лимфатическим каналам. Местные инвазии и отдаленное распространение опасны для жизни. Существует два основных типа рака шейки матки:
Плоскоклеточный рак (наиболее распространенный рак шейки матки) возникает из плоскоклеточных клеток, покрывающих эктоцервикс и на границе плоских железистых клеток в эндоцервиксе.
Эндоцервикальная аденокарцинома (около 5-10% всех случаев рака шейки матки) возникает из железистых клеток, обнаруженных в эндоцервикальном канале.
Оба типа карциномы шейки матки следуют одним и тем же медицинским рекомендациям.
Каковы факторы риска рака шейки матки?
Врачи пока не могут определить, почему один человек заболевает раком, а другой — нет, но существует ряд факторов риска, которые предрасполагают женщин к этому заболеванию. Основные факторы риска:
- Инфекция, вызванная вирусом папилломы человека (ВПЧ) (см. Часто задаваемые вопросы о ВПЧ)
- Отсутствие регулярных Пап-тестов
Пап-тест позволяет выявить аномальные клеточные изменения, которые могут быть предраковыми.Если изменение обнаружено на ранней стадии, высока вероятность того, что отклонения можно вылечить и вылечить. - Ослабленная иммунная система
Неспособность организма бороться с инфекциями (такими как ВПЧ) может привести к более высокой заболеваемости раком шейки матки. - Возраст
Рак шейки матки обычно встречается у женщин старше 40 лет. Статистика развития естественного канцерогенеза показывает, что женщины подвергаются воздействию вируса (ов) ВПЧ в начале половой жизни и в возрасте от двадцати лет.У большинства иммунная система работает, чтобы избавиться от вируса (ов) в течение двух лет. По какой-то еще не полностью изученной причине некоторые женщины не могут избавиться от вируса (ов) ВПЧ, что приводит к стойкой инфекции ВПЧ, которая приводит к изменениям в ДНК, вызывая предраковые или раковые поражения шейки матки. - Раннее начало половой жизни
Начало половой жизни в возрасте до 16 лет подвергает женщину большему риску развития рака шейки матки, вероятно, из-за повышенного риска заражения ВПЧ. - Многие сексуальные партнеры
Женщина, у которой было много сексуальных партнеров или у которой было много других партнеров, подвержена более высокому риску развития рака шейки матки. Имейте в виду, что половые партнеры половых партнеров увеличивают риск в геометрической прогрессии. - Курение сигарет
Было обнаружено, что курящие женщины имеют повышенный риск рака шейки матки по сравнению с женщинами, которые не курят. - Использование противозачаточных таблеток в течение длительного времени
Этот фактор риска до конца не изучен, но исследования показали, что длительное использование противозачаточных таблеток является фактором риска рака шейки матки.Кроме того, исследования также показали, что противозачаточные таблетки могут снизить риск рака яичников. - Повторнородящие женщины
Некоторые исследования показывают, что женщины, у которых много родов, имеют повышенный риск рака шейки матки.
Что такое предраковые поражения и что их вызывает?
Предраковые поражения частично являются результатом инфекции ВПЧ. Под этим заголовком попадают аномальные клеточные изменения, отмеченные при мазке Папаниколау.Предраковые поражения более конкретно определяются как плоскоклеточные интраэпителиальные поражения высокой степени злокачественности (HSIL). Небольшой процент этих поражений, если их не лечить, может стать злокачественным.
Что такое плоскоклеточные интраэпителиальные поражения?
Эти плоскоклеточные интраэпителиальные поражения (SIL) имеют диагноз низкой (LSIL) или высокой (HSIL) степени:
Низкий уровень SIL представляет микроскопические изменения в клетках, которые отражают инфекцию ВПЧ низкого риска. Эти изменения часто проходят без лечения и никогда не перерастают в серьезное поражение.Эти изменения также могут быть обнаружены в связи с поражениями высокой степени злокачественности (HSIL) из-за воздействия ВПЧ высокого риска. Следовательно, важно следить за LSIL дополнительными мазками Папаниколау и / или кольпоскопией и биопсией. Некоторые лабораторные отчеты и врачи называют эти изменения легкой дисплазией, легкой дисплазией с ВПЧ или CIN 1 (цервикальная интраэпителиальная неоплазия). Соответствующий диагностический результат биопсии — CIN1 (цервикальная интрапителиальная неоплазия, легкая дисплазия).
High-grade SIL представляет клетки с более серьезными аномалиями и имеют больше шансов перерасти в рак.Если не лечить, HSIL обычно перерастает в рак. Поэтому обязательно следовать указаниям врача о вариантах лечения. В некоторых отчетах о патологии и врачи называют эти изменения умеренной или тяжелой дисплазией или карциномой in situ. Соответствующие результаты биопсии ткани — CIN2 или CIN3 соответственно.
Каковы симптомы рака шейки матки?
- Аномальное вагинальное кровотечение — наиболее частый симптом
- Кровотечение между регулярными менструациями
- Кровотечение после полового акта
- Кровотечение после спринцевания
- Менструальный цикл, который стал обильнее и продолжительнее, чем раньше
- Кровотечение после менопаузы
- Обильные выделения из влагалища
- Тазовая боль
- Боль во время полового акта
Можно ли предотвратить рак шейки матки?
Рак шейки матки можно предотвратить с помощью скрининга и вакцинации.Вакцина представляет собой серию из трех прививок, наиболее эффективную при введении до начала половой жизни. Вакцина одобрена как для девочек, так и для мальчиков в возрасте от 9 до 26 лет.
На рынке представлены две вакцины. Гардасил (Merck and Company) — квадравалентная вакцина, обеспечивающая иммунитет к двум типам генотипов ВПЧ высокого риска (16 и 18) и двум типам генотипов ВПЧ низкого риска (6 и 11, которые связаны с остроконечными кондиломами). Церварикс (GSK) защищает от двух типов вируса папилломы человека высокого риска (16 и 18).
Национальный институт здоровья сообщает, что лучший способ предотвратить рак шейки матки — это его раннее выявление. Регулярное ежегодное обследование органов малого таза и мазок Папаниколау позволяют врачам обнаружить аномальные изменения шейки матки.
Скрининг мазка Папаниколау для выявления предраковых изменений шейки матки до появления симптомов очень важен. Когда эти аномальные клетки обнаруживаются, можно начинать лечение и, таким образом, предотвращать большинство случаев рака шейки матки. Кроме того, скрининг может выявить рак на ранних стадиях, когда лечение с большей вероятностью вылечит рак.
Скрининг женщин с помощью мазка Папаниколау оказался очень эффективным. С каждым годом количество женщин, у которых диагностирован рак шейки матки, падает. Врачи считают, что это во многом связано с успехом теста Папаниколау.
Излечим ли рак шейки матки?
Рак шейки матки когда-то был ведущей причиной смерти от рака, но сегодня рак шейки матки почти полностью излечим, если его выявить на ранней (предраковой) стадии.
Если рак шейки матки обнаружен на запущенной стадии, его труднее лечить.Если болезнь не метастазировала (не распространилась) в окружающие органы, то показатель излечения составляет 90%. Если метастаз произошел, скорость излечения будет зависеть от того, насколько далеко распространился рак, то есть от стадии рака.
Существуют ли новые технологии для скрининга рака шейки матки?
Мазок Папаниколау в руках опытных, преданных своему делу технологов очень точен и очень эффективен при обнаружении отклонений. Внедряемые новые технологии призваны улучшить методику сбора и оценки мазков Папаниколау, а не заменить их.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило использование жидких версий мазка Папаниколау: ThinPrep® и Surepath ™. Тест на жидкой основе удаляет избыточные воспалительные клетки, слизь крови и бактерии из клеточного образца и улучшает клеточную обработку. Удаление закупоривающего материала помогает цитотехнологам идентифицировать больший процент клеток с тонкими ядерными аномалиями. Существуют два устройства для автоматизированного скрининга, одобренные FDA: Hologic ThinPrep® Imaging Systems и BD Focal Point GS.Оба используют компьютерную алгоритмическую разработку, чтобы помочь цитотехнологам в оценке Пап-тестов.
Тестирование на ВПЧ
— это относительно новая технология молекулярного анализа, которая помогает выявлять женщин с высоким риском развития рака шейки матки. К ним относятся:
- Qiagen HC2 —Использование гибридного захвата для выявления 13 вирусных типов ВПЧ высокого риска (16,18,31,33,35,39,45,51,52,56,58,59). Результаты могут быть положительными, отрицательными или неубедительными.
- Hologic Cervista —Использует технологию захватчиков для определения 15 вирусных типов ВПЧ высокого риска (16,18,31,33,35,39,45,51,52,56,58).Этот метод также имеет ген домашнего хозяйства для оценки адекватности.
- Roche cobas® 4800 — Тесты на вирусные типы ВПЧ высокого риска (16,18,31,33,35,39,45,51,52,56,58,59,66,68). Из этих типов 12 делятся на положительные или отрицательные. Типы вирусов 16 и 18 тестируются как индивидуально положительные или отрицательные.
- Hologic / GenProbe Aptima HPV Assay — Этот метод второго поколения нацелен на MRNA E61E7 для 14 типов ВПЧ высокого риска (16,18,31,33,35,39,45,51,52,56,58,59, 66,68).
- ПЦР — может конкретно идентифицировать любые типы вирусов ВПЧ с высоким риском, но он не одобрен FDA, стоит дорого и плохо возмещается.
Не забывайте ВПЧ-45 при скрининге рака шейки матки | Американский журнал клинической патологии
В редакцию
Испытание ATHENA сосредоточено только на вирусе папилломы человека (ВПЧ) -16 и ВПЧ-18 для выявления женщин с высоким риском заболевания шейки матки высокой степени или хуже. 1
Типовые скрининговые тесты должны быть ориентированы не только на ВПЧ-16 и ВПЧ-18, но и на ВПЧ-45. Типы ВПЧ 16, 18 и 45 являются тремя наиболее распространенными типами рака шейки матки.Вместе они составляют 75% плоскоклеточного рака и 94% аденокарциномы. 2,3 ВПЧ-18 и ВПЧ-45 вместе значительно чаще встречаются в случаях аденокарциномы, чем в случаях плоскоклеточного рака (44% против 14%; P <0,0001). 3 У женщин моложе 30 лет в два раза (4%) больше инвазивного рака шейки матки, связанного с ВПЧ-45, чем с типами ВПЧ, отличными от 16, 18 или 45 (2%). 3
Средний возраст пациентов с раком шейки матки самый низкий для ВПЧ-45 (46.8 лет), затем идут HPV-18 (48,2 года) и HPV-16 (50,0 лет). Средний возраст пациентов с инвазивным раком, вызванным ВПЧ-16, ВПЧ-18 и ВПЧ-45, составляет 47 лет, а средний возраст женщин с этим раком, связанным с любым другим типом ВПЧ, составляет 56 лет. 2,3
Возможное объяснение этого более молодого возраста — интеграция вирусной ДНК в геном человека. Процент интеграции увеличивается от прогрессирования поражения низкой степени к инвазивной карциноме. Пациенты с инвазивным раком с интегрированной ДНК ВПЧ имеют статистически значимый средний возраст на момент постановки диагноза (43 года) по сравнению с пациентами без интеграции (52.5 лет; P = 0,017). 4 Частота интеграции при инвазивном раке самая высокая для HPV-18, которая колеблется от 100% до 92%, за ней следуют HPV-45 (83%) и HPV-16 (которая колеблется от 55% до 80%). 4–6 Другие типы, такие как HPV-33 (интеграция 37%) и HPV-31 (интеграция 14%), с меньшей вероятностью интегрируются. ВПЧ-45 и ВПЧ-18 редки у женщин с нормальной цитологией и поражениями высокой степени (0,4% и 2,3% и 0,9% и 6,9% соответственно) по сравнению с ВПЧ-16 (2,6% и 45%).4% соответственно). 7 Более раннее возникновение инвазивного рака шейки матки, положительного на ВПЧ-45 и ВПЧ-18, указывает на короткое время прогрессирования до инвазивного рака, связанное с более высокой скоростью ранней интеграции. 3
Младший возраст женщин с инвазивным раком шейки матки, положительным по типам ВПЧ 16, 18 и 45, важен для программ первичной и вторичной профилактики рака шейки матки. Таким образом, протоколы скрининга генотипа, специфичного для типа, должны включать как минимум ВПЧ-16, ВПЧ-18 и ВПЧ-45.Вакцинация рекомбинантной вакциной против вируса папилломы человека бивалентной (типы 16 и 18) (Церварикс) высокоэффективна (> 98%) против ВПЧ высокого риска (ВР) типов 16, 18 и 45, а также частично также против типов 31 и 35. , в то время как вакцинация четырехвалентной вакциной против вируса папилломы человека (типы 6, 11, 16 и 18), рекомбинантная вакцина (Гардасил) является высокоэффективной (> 98%) только против HR-HPV типов 16 и 18 и частично против типа 31. Можно было бы рассмотреть возможность отсрочки скрининга шейки матки в когортах, вакцинированных против ВПЧ, из-за позднего возникновения рака с типами ВПЧ, не связанными с типами ВПЧ 16, 18 или 45.
В исследовании ATHENA используется только генотипирование для ВПЧ-16 и ВПЧ-18. 1 Исходя из опубликованных результатов, генотип целесообразно проводить только на ВПЧ-16. 1 Абсолютный риск цервикальной интраэпителиальной неоплазии (CIN) 2 или хуже и CIN 3 или хуже у женщин с ВПЧ-16 + составляет 31,5% и 20,0% соответственно. Для женщин с ВПЧ-18 + эти показатели составляют 4,3% и 4,3% соответственно, а для женщин с положительным результатом на не-ВПЧ-16 / ВПЧ-18 HR-HPV (12 других генотипов HR-HPV) — 8.6% и 4,4% соответственно. Относительные риски CIN 2 или хуже и CIN 3 или хуже для женщин с ВПЧ-16 + по сравнению с женщинами, положительными по HR-HPV без ВПЧ-16 / ВПЧ-18, составляют 3,7 и 4,5, соответственно. Только исходная положительность HPV-18 не привела к значительному увеличению относительного риска CIN 2 или хуже или CIN 3 или хуже по сравнению с комбинацией всех 12 других генотипов HR-HPV.
В проспективных исследованиях, таких как исследование ATHENA или ALTS, недооценка предраковых поражений шейки матки, вызванных ВПЧ 18 и / или 45 типов, по сравнению с долей раковых заболеваний шейки матки, относимых к этим типам ВПЧ.Это, по крайней мере, странно для проспективных исследований, учитывая тот факт, что эти виды рака возникают раньше, чем те, которые связаны с ВПЧ-16.
Возможные объяснения могут заключаться в быстром прогрессировании или в том, что эти поражения отсутствуют. Последнее может быть связано с тем, что они часто находятся выше в эндоцервикальном канале, особенно в поражениях желез. Это подтверждается тем фактом, что скрининг оказывает большое влияние на плоскоклеточные поражения, но не на аденокарциномы. Другое объяснение может заключаться в том, что тест на ВПЧ или генотипирование ВПЧ неадекватны для обнаружения интегрированного ВПЧ-18 или ВПЧ-45.Тестирование на ВПЧ можно проводить с праймерами в областях L1 или E6 / E7. Во время интеграции никогда не происходит потери E6 / E7, но выражение L1 может быть потеряно. Следовательно, последнее может привести к ложноотрицательному результату, если используется только тест L1. Сравнение праймеров для разных областей выявило 10% различие в обнаружении HR-HPV. 8 В испытании ATHENA для обнаружения ВПЧ использовался тест cobas 4800 HPV DNA (Roche Molecular Systems, Плезантон, Калифорния), и это исключительно тест L1.
Скрининг рака шейки матки должен основываться на тестировании на ВПЧ из-за большей чувствительности по сравнению с цитологией.Текущие тесты на ВПЧ должны быть сосредоточены на трех основных типах ВПЧ: 16, 18 и 45. В будущем типоспецифическое генотипирование для всех типов ВПЧ-ВПЧ необходимо для определения того, происходит ли замена типа после вакцинации. Следует избегать использования праймеров, расположенных в областях, которые могут отсутствовать в опухолях, интегрированных с ВПЧ (например, L1 и E2). Праймеры, обнаруживающие онкогенные области E6 / E7, которые всегда присутствуют, даже при интегрированном раке шейки матки (15%), следует учитывать, чтобы не пропустить интегрированные инфекции HPV.
Список литературы
1.
и другие.
the ATHENA (Обращение к потребности в расширенной диагностике HPV) Исследовательская группа HPV
.
Тестирование на вирус папилломы человека высокого риска у женщин с цитологией ASC-US: результаты исследования ATHENA HPV
.
Ам Дж. Клин Патол
.
2011
;
135
:
468
—
475
.2.
для исследовательской группы HERACLES / SCALE
.
Распространение вируса папилломы человека при неоплазии шейки матки: результаты двух параллельных эпидемиологических исследований у женщин с интраэпителиальной неоплазией шейки матки высокой степени и инвазивным раком шейки матки в Европе
.
Представлено в виде тезисов на Международной конференции по вирусу папилломы
;
3–8 июля 2010 г.
;
Монреаль, Канада
. Аннотация 766.3.
и другие.
для ретроспективного международного опроса и группы исследования временных тенденций ВПЧ
.
Определение генотипа вируса папилломы человека при инвазивном раке шейки матки: ретроспективное перекрестное всемирное исследование
.
Ланцет Онкол
.
2010
;
11
:
1048
—
1056
.4.
и другие.
Типозависимая частота интеграции геномов вируса папилломы человека в цервикальные поражения
.
Cancer Res
.
2008
;
68
:
307
—
313
.5.
и другие.
HPV16 и HPV18 в опухолях половых органов: значительно различаются уровни интеграции вируса и корреляция с инвазивностью опухоли
.
J Med Virol
.
2002
;
67
:
574
—
582
.6.
.
Интеграция вируса папилломы человека высокого риска: ключевое событие в канцерогенезе шейки матки?
Дж. Патол
.
2007
;
212
:
356
—
367
.7.
и другие.
Эпидемиология и естественное течение инфекций, вызванных вирусом папилломы человека, и типоспецифические последствия неоплазии шейки матки
.
Вакцина
.
2008
;
26
:
K1
—
K16
.8.
и другие.
Сравнение консенсусной ПЦР MY09 / 11 и типоспецифичных ПЦР при обнаружении онкогенных типов ВПЧ
.
Дж. Cell Mol Med
.
2007
;
11
:
881
—
891
.
Ответ авторов
Тереза Л. Райт, доктор медицины
Тереза Л. Райт, Мэриленд
Система здравоохранения Университета Вирджинии, Шарлоттсвилль
Genentech, Южный Сан-Франциско, Калифорния
2012
Мы благодарим докторов Tjalma и Depuydt за их интерес к нашему исследованию и тесту cobas HPV и хотели бы заверить их, что мы не забыли HPV-45 при скрининге на рак шейки матки.Наш анализ был разработан для выявления присутствия онкогенных генотипов ВПЧ HR, включая ВПЧ-45, в совокупности, при этом сообщая о ВПЧ-16 и ВПЧ-18 отдельно. Хотя многие исследования продемонстрировали преобладание рака шейки матки, ассоциированного с ВПЧ-16 и ВПЧ-18, 1,2 , по-видимому, нет четкого консенсуса в отношении ранжирования следующих наиболее онкогенных генотипов, о чем свидетельствуют данные нескольких исследователей. . Например, по данным de Sanjose et al., 1 , ВПЧ-45 был назван третьим наиболее онкогенным типом в мире, но после длительного наблюдения занял 11-е место по CIN 3 или хуже. 3 Более того, в исследовании ARTISTIC инфекция HPV-16 / HPV-18 вызвала в 3 раза большую частоту CIN 3 или хуже на исходном уровне по сравнению с типами HPV 31, 33, 45, 52 и 58 вместе взятыми. 4 На начальном этапе нашего исследования ATHENA ВПЧ-45 (обнаруженный с помощью теста генотипирования ВПЧ с высоким риском Roche LINEAR ARRAY) занял девятое место по риску CIN 3 или хуже и 10 место по распространенности, тогда как ВПЧ-16 занял первое место риск CIN 3 или хуже и распространенность, а ВПЧ-18 занимает пятое место по риску и второе по распространенности.Более подробный анализ распространенности и рисков, связанных с различными генотипами HR-HPV в исследовании ATHENA, будет предметом будущей рукописи.
Тьялма и Депюйдт также справедливо указывают, что ВПЧ-18 не давал абсолютного риска для CIN 2 / CIN 3 или хуже, который был выше, чем для 12 других генотипов HR-HPV в испытании ATHENA. К этому моменту следует отметить, что в отличие от абсолютных рисков CIN 2 или хуже и CIN 3 или хуже, наблюдаемых у женщин, положительных по 12 другим HR-HPV (8.6% и 4,4% соответственно), абсолютный риск у женщин с положительным результатом на ВПЧ-18 идентичен для CIN 2 или хуже и CIN 3 или хуже (4,3% и 4,3% соответственно), что указывает на то, что заболевание, вызванное ВПЧ-18, связано с гистология более высокого уровня и часто имеет железистую форму. Кроме того, следует отметить, что риски, указанные в этом анализе, относятся только к исходной фазе исследования ATHENA. Это актуально, потому что широко распространено мнение о том, что заболевание, связанное с ВПЧ-18, выявляется во время длительного наблюдения, тогда как ВПЧ-16 более очевиден при первоначальной оценке. 5,6 Объяснения этой разницы включают в себя внутренние трудности в обнаружении и / или идентификации заболевания, связанного с ВПЧ-18 (поскольку поражения желез возникают выше в цервикальном канале, чем поражения плоскоклеточных клеток) или необходимость более длительных периодов стойкости перед Развивается заболевание, связанное с ВПЧ-18. По этим причинам последующая фаза исследования ATHENA будет иметь решающее значение для полного понимания риска тяжелого заболевания шейки матки, связанного с инфекцией HPV генотипа 18.Фаза последующего наблюдения также позволит оценить риск ВПЧ-45 с течением времени на исходном уровне.
Мы также хотели бы обратиться к другой проблеме Тьялмы и Депюйдта по поводу возможности пропуска болезни при использовании теста на ВПЧ с праймерами, направленными против области L1. Широко признано, что в болезненном состоянии присутствует достаточное количество полноразмерных эписомальных копий HR-HPV, что позволяет его обнаруживать с помощью L1-направленных праймеров. 7,8 Фактически, в исследовании de Sanjose et al, 1 , которое Тьялма и Депюйдт много цитировали, использовался анализ SPF-10, L1-тест на основе полимеразной цепной реакции.Кроме того, данные ATHENA, представленные в нашей статье, включают сравнение производительности теста cobas HPV Test с тестом Hybrid Capture 2 (QIAGEN, Gaithersburg, MD) (который использует зонды РНК HPV, не направленные против области L1 ДНК HPV, для создания гибрид РНК-ДНК), и мы демонстрируем отсутствие значительных различий в чувствительности или специфичности для выявления тяжелой степени заболевания шейки матки между двумя тестами. 9
Еще раз благодарим Тьялму и Депюйдта за их интерес и понимание.Мы представили первый набор данных для теста cobas HPV Test, который был разработан для выявления всех онкогенных генотипов HPV (включая HPV-45) в качестве объединенного результата и дополнительно для идентификации отдельно HPV-16 и HPV-18, которые ответственны за 70% рак шейки матки во всем мире. Мы продемонстрировали сопоставимую чувствительность и специфичность для выявления тяжелой степени заболевания (CIN 2 или хуже и CIN 3 или хуже) с Hybrid Capture 2, который был стандартом тестирования на ВПЧ в течение последнего десятилетия. Мы надеемся, что предоставили дополнительную информацию, чтобы убедить Тьялму и Депюйдт в том, что мы провели хорошо спланированное исследование для поддержки клинической валидации нового объединенного теста HR-HPV, который включает интегрированную идентификацию HPV-16 и HPV-18.
Список литературы
1.
и другие.
Определение генотипа вируса папилломы человека при инвазивном раке шейки матки: ретроспективное перекрестное всемирное исследование
.
Ланцет Онкол
.
2010
;
11
:
1048
—
1056
.2.
.
Глава 1: Вирус папилломы человека и рак шейки матки: бремя и оценка причинно-следственной связи
.
J Natl Cancer Inst Monogr
.
2003
;
31
:
3
—
13
. 3.
и другие.
Долгосрочный абсолютный риск цервикальной интраэпителиальной неоплазии 3 степени или выше в результате инфицирования вирусом папилломы человека: роль устойчивости
.
J Национальный онкологический институт
.
2010
;
102
:
1478
—
1488
.4.
и другие.
Сравнение тестирования ДНК ВПЧ и жидкостной цитологии в течение трех раундов первичного скрининга шейки матки: расширенное наблюдение в исследовании ARTISTIC [опубликовано в Интернете перед печатью 18 февраля 2011 г.]
.
евро J Рак
.
2011
;
47
:
864
—
871
. DOI: .5.
и другие.
Повышенный 10-летний риск предрака и рака шейки матки у женщин с вирусом папилломы человека (ВПЧ) типа 16 или 18 и возможная полезность тестирования на тип-специфический ВПЧ в клинической практике
.
J Национальный онкологический институт
.
2005
;
97
:
1072
—
1079
.6.
и другие.
Выявление предраковых поражений шейки матки дифференцируется по вирусу папилломы человека типа
.
Cancer Res
.
2009
;
69
:
3262
—
3266
.7.
и другие.
Интеграция вируса папилломы человека типа 16 в карциному шейки матки in situ и при инвазивном раке шейки матки
.
Дж. Клин Микробиол
.
2006
;
44
:
1755
—
1762
.8.
и другие.
Вирусная нагрузка эписомальных и интегрированных форм вируса папилломы человека 33 типа при плоскоклеточных интраэпителиальных поражениях шейки матки
.
Инт Дж. Рак
.
2007
;
121
:
2674
—
2681
.9.
и другие.
the ATHENA (Обращение к потребности в расширенной диагностике HPV) Исследовательская группа HPV
.
Тестирование на вирус папилломы человека высокого риска у женщин с цитологией ASC-US: результаты исследования ATHENA HPV
.
Ам Дж. Клин Патол
.
2011
;
135
:
468
—
475
.
© Американское общество клинической патологии
Распространенность ВПЧ и выявление редких генотипов ВПЧ у женщин из Гонконга из Южного Китая с цитологическими аномалиями
Вирус папилломы человека (ВПЧ) был определен как основная причина плоскоклеточного интраэпителиального поражения шейки матки и инвазивного рака шейки матки. Появление различных коммерческих наборов для генотипирования ВПЧ с различными характеристиками облегчает выявление генотипов ВПЧ с наибольшим и низким риском, но редкие типы ВПЧ обычно не диагностируются.В настоящем исследовании обнаружение ВПЧ выполнялось с использованием набора GenoFlow HPV Array Test (DiagCor Bioscience), который может идентифицировать 33 подтипа ВПЧ с помощью определенных зондов. Кроме того, был разработан консенсусный зонд HPV (универсальный зонд) для захвата не только 33 генотипов, но и редких подтипов. Из 1643 южнокитайских женщин, прошедших тестирование в период с 2012 по 2013 год, распространенность ВПЧ составила 42,3%, с ВПЧ 52 (139/1643, 8,5%), ВПЧ 81 (89/1643, 5,4%) и ВПЧ 16 (63/1643, 3,8%) являются наиболее часто обнаруживаемыми подтипами.Из всех 695 HPV-положительных случаев 56 (8,1%) случаев были обнаружены только универсальным зондом, из которых 5 были случаями ASCUS или LSIL. Результаты секвенирования подтвердили, что типы ВПЧ 30, 91 и 74, а интратипические варианты ВПЧ 72 и 82 присутствовали в 5 случаях. Результат предполагает, что некоторые редкие подтипы ВПЧ могут быть вовлечены в поражения шейки матки.
1. Введение
Инфекция, вызванная вирусом папилломы человека (ВПЧ), является наиболее распространенной инфекцией, передаваемой половым путем. На сегодняшний день полностью секвенировано 170 типов ВПЧ [1].Филогенетический анализ, основанный на последовательностях ORF L1, выявил пять эволюционных групп с различными эпителиальными тропизмами и ассоциациями болезней: альфа-, бета-, гамма-, Nu- и Mu-папилломавирусы (PV). Альфа-ЛВ включают кожные типы с низким риском, которые обычно вызывают кожные бородавки, типы слизистых оболочек с низким риском, связанные с доброкачественными поражениями и остроконечными кондиломами, и типы слизистых оболочек с высоким риском, которые могут вызвать рак шейки матки [2]. Стойкая инфекция альфа-ЛВ высокого риска является предпосылкой для развития рака шейки матки и его гистологического предшественника — цервикальных интраэпителиальных поражений.Двенадцать ВПЧ (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 и 59) классифицируются Международным агентством по изучению рака как канцерогенные для человека, при этом ВПЧ 68 признан вероятно канцерогенный. Некоторые другие типы ВПЧ (26, 30, 34, 53, 66, 67, 69, 70, 73, 82, 85 и 97), возможно, являются канцерогенными на основании эволюционного сходства с известными типами, вызывающими рак [3]. ВПЧ 16 и ВПЧ 18 обычно считаются наиболее важными онкогенными вирусами, на которые приходится> 70% всех диагностированных во всем мире рака шейки матки [4].Однако несколько исследований показали участие редких типов ВПЧ в злокачественных новообразованиях шейки матки. HPV 61 и HPV 62 были обнаружены в 2,3% LSIL и 3,5% HSIL [5]. Ретроспективное поперечное исследование также выявило редкие типы ВПЧ (включая 42, 61, 74 и 91) в 1% из 8977 случаев инвазивного рака шейки матки [6]. Недавнее исследование с использованием ПЦР с вырожденными праймерами MY09 / 11 с последующим прямым секвенированием показало распространенность редких типов ВПЧ в поражениях шейки матки на уровне 9,47%. В частности, HPV 54 и HPV 81 были обнаружены в образцах с гистопатологическими данными CIN I, HPV 61 в образцах с CIN II и HPV 81 в образцах с CIN III [7].Новые исследования предполагают потенциальную роль некоторых редких типов ВПЧ в поражениях шейки матки и раке шейки матки.
В настоящее время генотипирование ВПЧ играет важную роль в четырех основных клинических применениях: первичный скрининг шейки матки, сортировка ВПЧ по цитологическим аномалиям низкой степени, тест на излечение после лечения и разрешение неопределенностей [8, 9]. Молекулярные методы обнаружения ДНК ВПЧ в целом подразделяются на анализы амплификации сигналов и мишеней. Система Hybrid Capture 2 (HC2) (Digene Corporation, Гейтерсбург, Мэриленд, США) и тест Cervista HPV HR (Hologic, WI, США), одобренные FDA тесты ДНК ВПЧ, которые выявляют 13 и 14 типов ВПЧ высокого риска, соответственно, методами усиления сигнала.Генотипирование HPV с помощью линейного массива (Roche Molecular Diagnostics, Branchburg, Нью-Джерси, США) и InnoLiPA HPV Genotyping (Innogenetics, Бельгия) основаны на амплификации гена L1 HPV с последующей гибридизацией с обратной линией-блоттингом для обнаружения 37 и 28 типов HPV, соответственно. Все эти анализы предназначены для выявления только наиболее частых и определенных подтипов ВПЧ высокого и низкого риска. Другие подтипы, выходящие за рамки их определенных областей, вряд ли будут обнаружены. Для выявления более редких подтипов ВПЧ в наборе для тестирования массива ВПЧ GeneFlow использовался набор вырожденных праймеров PGMY для амплификации гена L1 ВПЧ с последующей проточной гибридизацией и захватом с помощью универсального зонда с консенсусной последовательностью ВПЧ.Универсальный зонд был разработан для выявления не только определенной панели из 33 подтипов ВПЧ высокого и низкого риска, но также внепанельных редких подтипов и вариантных форм конкретных типов ВПЧ. В этом отчете мы использовали тесты GenoFlow HPV для оценки распространенности и распределения генотипов HPV у женщин из Гонконга, Южный Китай. Мы также исследовали, связаны ли выявленные внепанельные подтипы ВПЧ с результатами их цитологического исследования.
2. Материалы и методы
2.1. Популяция исследования
Жидкостные цитологические образцы от 1648 южнокитайских женщин были протестированы, когда они посещали частные медицинские клиники с октября 2012 года по сентябрь 2013 года с согласия пациента.Все образцы были подвергнуты скринингу с помощью стандартной цитологии, а тестирование на ВПЧ было проведено с использованием набора GenoFlow HPV Array Test (DiagCor Bioscience, Гонконг, ЮАР). Пять случаев были исключены из исследования из-за отсутствия данных цитологии или возраста.
2.2. Генотипирование ВПЧ
Набор для анализа массива вирусов папилломы человека GenoFlow использовали для генотипирования ВПЧ. Этот набор был разработан для идентификации 33 наиболее распространенных генотипов ВПЧ. Анализ охватывает 18 известных в настоящее время генотипов ВПЧ высокого риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73 и 82) и 15 генотипов низкого риска. генотипы ВПЧ высокого риска (6, 11, 26, 40, 42, 43, 44, 54, 55, 57, 61, 70, 71, 72, 81 и 84).Также включен универсальный зонд (U) для обнаружения редких подтипов ВПЧ, выходящих за пределы панели 33-генотипов. Образцы шейки матки, сохраненные в жидкой цитологической среде (Thin-Prep; Cytyc Corp., Мальборо, Массачусетс, США или Surepath; BD Diagnostics-Tripath BD Biosciences, Оксфорд, Великобритания), один раз промывали физиологическим раствором с фосфатным буфером и подвергали экстракции ДНК. с помощью мини-набора QIAamp DNA Blood Mini (Qiagen) в соответствии с инструкциями производителя. Экстрагированную ДНК смешивали со смесью праймеров, меченных биотином, и полимеразой ДНК Taq , поставляемой с тестовым набором GenoFlow; с последующим этапом ПЦР-амплификации с использованием указанных условий термоциклирования.Затем амплифицированные продукты генотипировали с использованием системы массивов GenoFlow HPV. Вкратце, ампликоны денатурировали и гибридизовали со специфическими зондами, улавливающими ДНК ВПЧ, посредством проточной гибридизации. Гибридизованную ДНК подвергали тщательной промывке и детектировали колориметрическим методом. Результат действителен только при наличии сигналов в контроле гибридизации (HC) и контроле амплификации (AC) [10].
2.3. Подтверждение внепанельного генотипа ВПЧ
Для образцов с положительным сигналом универсального зонда, но отрицательным для специфических типов ВПЧ (внепанельные образцы ВПЧ), экстрагированная ДНК образца была амплифицирована с системами праймеров MY09 / 11 и GP5 + / 6 + с использованием стандартных эталонов. протокол [11, 12].Целевые ампликоны очищали и секвенировали с использованием соответствующих наборов праймеров. Затем результаты секвенирования были проанализированы с помощью программы BLAST для подтверждения генотипа HPV.
3. Результаты и обсуждения
Среди 1643 подходящих китайских женщин возраст варьировался от 15 до 83 лет, а средний возраст составлял 29 лет. Характеристики пациентов представлены в таблице 1. На основании цитологических результатов 1505 (91,6%, 1505/1643) образцов были нормальными без интраэпителиального поражения или злокачественных новообразований, 91 (5.5%) были атипичными плоскоклеточными клетками неопределенной значимости (ASCUS), 41 (2,5%) были плоскими интраэпителиальными поражениями низкой степени (LSIL) и 6 (0,36%) были плоскоклеточными интраэпителиальными поражениями высокой степени (HSIL). Используя тест GenoFlow HPV Array Test, тест на генотипирование показал, что 695 случаев были положительными на ДНК ВПЧ, а общая распространенность ВПЧ составила 42,3% (695/1643). Тремя наиболее распространенными типами были ВПЧ 52 (139/1643, 8,5%), ВПЧ 81 (89/1643, 5,4%) и ВПЧ 16 (63/1643, 3,8%) независимо от их гистологических результатов шейки матки (Рисунок 1).Наши результаты согласуются с опубликованными метааналитическими исследованиями, показывающими, что наиболее часто обнаруживаемым типом ВПЧ в Южном Китае был ВПЧ 52 [13–15]. Лю и др. сообщили, что ВПЧ 52 был наиболее часто встречающимся генотипом в регионе Гуанчжоу в Китае, в то время как его распространенность была сопоставима с распространенностью ВПЧ 16 в Гонконге [16]. Ли и др. и Ye et al. также показали, что ВПЧ 52 имел самую высокую распространенность в Гуандуне и Чжэцзяне в Китае соответственно [14, 17]. В этом исследовании ВПЧ 16 занял третье место по распространенности (3.8%) было сопоставимо с мировым показателем. Распространенность ВПЧ 16 в зависимости от типа населения колеблется от 2% до 4% во всех регионах [6]; однако инфекция ВПЧ 16 тесно связана с риском неоплазии шейки матки и вызывает более 50% случаев рака шейки матки [4]. Сообщается также, что ВПЧ 81 (эквивалент CP8304) связан с предраковыми или раковыми поражениями [18, 19]. Распространенность ВПЧ 81 в мировых популяционных исследованиях не очень высока, но ВПЧ 81 является одним из наиболее часто наблюдаемых типов ВПЧ у ВИЧ-положительных пациентов [20, 21].Вывод о том, что в нашем исследовании распространенность ВПЧ 81 была выше, чем ВПЧ 16, может быть связано с географическими и биологическими вариациями в распределении типов ВПЧ и чувствительностью различных методов генотипирования к конкретным типам ВПЧ.
| |||||||||||||||||||||||||||||||||
| ASCUS: атипичные плоскоклеточные клетки неопределенного значения; LSIL: плоские интраэпителиальные поражения низкой степени злокачественности; HSIL: плоскоклеточные интраэпителиальные поражения высокой степени. | |||||||||||||||||||||||||||||||||
В тесте GenoFlow использовался новый универсальный зонд для обнаружения генотипов ВПЧ, выходящих за пределы панели 33 генотипов, что может расширить охват обнаружения генотипов. В настоящем исследовании 56 случаев были положительными на ДНК ВПЧ только при обнаружении «универсальным зондом», но не в отношении специфических типов ВПЧ на панели. Было высказано предположение, что в выборках присутствовали один или несколько внепанельных генотипов ВПЧ, а распространенность составила 3,4% (56/1643), что лишь немного ниже, чем у ВПЧ 16 (рис. 1).Из 56 случаев, положительных на неизвестные типы ВПЧ, 91,1% (51/56) образцов показали нормальные цитологические результаты при Пап-тесте, 3,6% (2/56) образцов были диагностированы как ASCUS, а 5,4% (3/56) образцов были LSIL. Эти пять случаев с клеточными аномалиями были секвенированы для подтверждения типов ВПЧ. Генотипы были успешно идентифицированы и перечислены в таблице 2. Редкие типы ВПЧ 30, 91 и 74, а также вариантные формы ВПЧ 72 и 82 были обнаружены у женщин с ASCUS или LSIL.
| |||||||||||||||||||||||
группа частей 9, часть группы HPV типы 53, 56 и 66 классифицируются как возможно канцерогенные из-за его тесной филогенетической связи с HPV 56, который является хорошо известным канцерогенным типом HPV [3].ВПЧ 30 обычно не обнаруживается в половых путях, поэтому его обычно исключают из коммерческих наборов для генотипирования ВПЧ. Однако методом микрочипов ДНК Rahman et al. показали, что распространенность ВПЧ 30 у 342 ВИЧ-отрицательных японских женщин составила 3,8% и была обнаружена в 1 случае ASCUA, 7 случаях LSIL и 1 случае HSIL [22].
ВПЧ 91 и ВПЧ 74 относятся к видам альфа 8 и альфа 10, соответственно, и оба классифицируются как неканцерогенные [3]. Для изучения их распространенности были проведены лишь ограниченные исследования.Впервые ВПЧ 74 был идентифицирован из стойких вагинальных поражений интраэпителиальной неоплазии низкой степени у женщины с ослабленным иммунитетом [23]. Choi et al. выполнили секвенирование ДНК на 209 образцах HPV-other (положительных на HPV-PCR, но отрицательных при использовании специфических зондов HPV-гибридизации) для определения типа HPV. У пациента LSIL был выявлен случай инфицирования HPV 74 [19]. В когорте из 310 сексуально активных женщин на Тринидаде ВПЧ 91 был обнаружен в 1 случае путем секвенирования ДНК, но его роль в развитии рака все еще не ясна [24].
Внутритипные варианты
HPV широко описаны, особенно в HPV 16. Онкогенные белки E6 и E7 обычно мутируют, тогда как синонимичные и несинонимичные мутации также описаны в гене L1 в HPV 16 [25–27]. В нескольких исследованиях изучалась генетическая изменчивость генов L1, E6 и E7 в HPV 18, 38, 52 и 53 и было показано, что интратипические варианты обнаруживаются часто [28–31]. Некоторые из этих мутаций увеличивают онкогенный потенциал и эффективность заражения вирусов.Неудивительно, что если мутации расположены в месте обнаружения зондов, генотипирование даст ложноотрицательный результат. В этом исследовании, хотя в набор были включены зонды, специфичные для ВПЧ 72 и ВПЧ 82, были получены отрицательные результаты. Однако положительность инфекции HPV была обнаружена универсальным зондом, а идентификация вариантных форм HPV 72 и 82 была подтверждена секвенированием ДНК.
В настоящее время большинство анализов генотипирования ВПЧ позволяют обнаруживать только наиболее распространенные типы высокого и низкого риска, но не типы неизвестного риска, новые типы или даже внутритиповые варианты.Чтобы улучшить качество генотипирования ВПЧ, было разработано секвенирование следующего поколения для секвенирования цервикальной ДНК. Meiring et al. с помощью секвенирования нового поколения идентифицировали в общей сложности 16 генотипов ВПЧ из 109 образцов шейки матки от ВИЧ-инфицированных женщин из Южной Африки, при этом четыре генотипа (ВПЧ-30, 74, 86 и 90) не включены в коммерческий набор [32]. Тем не менее, эта платформа относительно дорога, требует много времени и дорогостоящего оборудования. Для теста GenoFlow, использованного в настоящем исследовании, использование ПЦР с модифицированными праймерами PGMY, нацеленными на область L1 ВПЧ, с последующей гибридизацией с универсальным зондом, позволяет обнаруживать редкие виды или варианты ВПЧ за пределами панели генотипирования.Система гибридизации Flow-through также позволяет выполнить генотипирование ВПЧ в течение 3 часов. Этот экспресс-тест с максимальным охватом HPV будет хорошей альтернативой в клинических применениях HPV.
4. Выводы
В настоящем исследовании с помощью универсального зонда, доступного в GenoFlow, у китайских женщин с цитологическими аномалиями низкой степени были успешно обнаружены редкие типы ВПЧ 30, 91 и 74, а также вариантные формы ВПЧ 72 и 82. Тест на массив ВПЧ. Данные о распространенности редких типов ВПЧ и интратипических вариантов ВПЧ помогут прояснить роль этих вирусов в интраэпителиальных поражениях шейки матки и инвазивном раке шейки матки.
Конфликт интересов
Нгаи На Хлоя Ко, Лай-Он Чу, Джозеф К.Ф. Чоу и Джозеф В.О. Там — сотрудники DiagCor Bioscience Inc. Ltd. Эндерс Ко Нг занимает должность почетного доцента в Университете Гонконга. а также является старшим научным сотрудником DiagCor Bioscience Inc. Ltd.
Специфическое для генотипа удаление генитального вируса папилломы человека (ВПЧ) среди матерей в финской семье Исследование ВПЧ
РЕЗЮМЕ
Большинство случаев инфицирования вирусом папилломы человека (ВПЧ) шейки матки молодые женщины преходящи, но отчасти неизвестно, различается ли клиренс между разными генотипами ВПЧ и различные факторы, предсказывающие генотип-специфический клиренс.В исследовании Finnish Family HPV Study 131 из 252 женщин (средний возраст 25,5 лет) избавились от инфекции в течение проспективного 6-летнего наблюдения (медиана 62,4 месяца; диапазон от 1,6 до 94,5 месяцев). Соскобы шейки матки, собранные при каждом посещении, тестировались на 24 типа ВПЧ низкого и высокого риска (ВПЧ) с помощью множественного генотипирования ВПЧ. Регрессия отравления (панельные данные) была использована для оценки предикторов клиренса генотипов ВПЧ 7 и 9 видов. Из всех генотипов ВПЧ, выявленных у этих женщин, инфекции множественного типа и ВПЧ 16 (ВПЧ16) выздоравливали реже всего (46.1% и 50,5% соответственно). Актуарное и приблизительное среднее время до первого клиренса варьировали для разных генотипов. Уровень актуарного клиренса (количество событий / человеко-время в группе риска) был самым высоким для HPV16 и множественных инфекций, тогда как HPV66 и -82 имели самый высокий общий уровень клиренса. Независимыми предикторами, увеличивающими типоспецифический клиренс генотипов ВПЧ видов 7/9, был пожилой возраст (коэффициент заболеваемости [IRR] = 1,1; 95% доверительный интервал [95% ДИ], 1,03–1,18; P = 0,002) и исходный уровень перорально. HR HPV DNA-негативный статус (IRR = 2.94; 95% ДИ от 1,03 до 8,36; P = 0,042), в то время как большее количество половых партнеров во время последующего наблюдения уменьшало вероятность выздоровления (IIR = 0,35; 95% ДИ от 0,15 до 0,83; P = 0,018). В заключение, ВПЧ16 и множественные инфекции показали самый низкий уровень выведения среди молодых матерей. Увеличение возраста и отрицательный исходный статус ДНК ВПЧ в полости рта были связаны с увеличением клиренса, тогда как большее количество текущих половых партнеров снижало вероятность клиренса генотипа ВПЧ 7/9 вида.
Генитальные инфекции, вызванные вирусом папилломы человека (ВПЧ), в большинстве случаев носят временный характер (3, 7). В большинстве исследований по клиренсу ВПЧ рассматривались все типы ВПЧ высокого риска (HR) и / или сравнивались клиренс между типами ВПЧ HR и низкого риска (LR) (3, 4, 12, 13, 17, 18, 21, 23, 24). Более ранние данные показывают, что инфекции HR HPV обычно проходят медленнее, чем инфекции LR HPV (4, 25), и что вероятность того, что инфекция не исчезнет, увеличивается параллельно с ее продолжительностью (7, 13).
До недавнего времени не было данных о клиренсе ВПЧ на уровне генотипа (5, 9, 19, 25).Результаты показывают, что инфекция ВПЧ типа 16 (ВПЧ16) имеет самую низкую тенденцию к клиренсу. Чтобы понять естественную историю инфекций ВПЧ, необходимы точные данные о фактическом и приблизительном времени клиренса и степени клиренса (CR) для отдельных генотипов.
Настоящее исследование является одним из первых, в котором оценивается частота клиренса, специфичного для типа ВПЧ, а также актуарное и приблизительное время клиренса и скорость клиренса для 24 наиболее распространенных генотипов LR и HR HPV. Исследование проводилось среди недавно родивших матерей, которые в течение 6 лет находились под наблюдением в рамках исследования финских семей по ВПЧ.Кроме того, предикторы клиренса генотипа ВПЧ видов 7/9 были проанализированы в панельной модели регрессии Пуассона.
МАТЕРИАЛЫ И МЕТОДЫ
Субъекты. Исследование финской семьи на ВПЧ — проспективное когортное исследование, проводимое совместно отделением акушерства и гинекологии Университетской больницы Турку (TUH) и Институтом стоматологии медицинского факультета Университета Турку. Субъектами в этой когорте являются беременные женщины, которые были набраны как минимум на 36 неделе их основной (исходной) беременности (16) и наблюдались в течение 6 лет (в среднем 54.9 месяцев; стандартное отклонение [SD], 27,3 месяца; медиана 62,4 месяца; от 1,6 до 94,5 месяцев) после родов (10). Совместная комиссия по этике Университета Турку и TUH одобрила протокол исследования и поправки к нему (№ 2/1998 и 2/2006). В общей сложности 329 матерей были включены в когорту (средний возраст 25,5 лет), из которых 252 дали положительный результат на ВПЧ хотя бы один раз в течение периода последующего наблюдения (FU) и соответствовали критериям для этого анализа, т.е. Очистка от ВПЧ. Еще 52 женщины, которые были исключены из этого исследования, оставались отрицательными на ВПЧ в течение периода FU, в то время как у оставшейся 31 женщины пробы были взяты только один раз во время FU.Женщины в этом исследовании имеют кавказское происхождение, одно этническое происхождение и представляют финское население. Блок-схема условий исследования представлена на рис. 1. Некоторые женщины были потеряны из-за ФУ, в основном из-за трудностей с посещением или по семейным причинам. Структурированная анкета для регистрации демографических данных и потенциальных факторов риска регистрировалась на исходном уровне и повторялась при посещениях ФУ через 36 месяцев и 6 лет. Выбранные данные из этих записей были использованы для оценки риска в настоящем регрессионном анализе Пуассона.
РИС. 1.
Блок-схема матерей, включенных в исследование финских семей по ВПЧ. Контрольные визиты проводились в период с 1998 по 2008 гг.
образцов. Соскоб соскоба шейки матки для тестирования на ВПЧ был взят на исходном уровне и при посещениях через 2, 12, 24, 36 месяцев и 6 лет запись исследования). Отбор образцов производился с помощью цитощетки (MedScand, Мальме, Швеция) из шейки матки с использованием среды для отбора образцов 0,05 М фосфатно-солевого буфера с 100 мкг гентамицина. Образцы немедленно замораживали при -20 ° C и хранили при -70 ° C.Соскобы со слизистой оболочки полости рта собирали, как описано ранее (15), и в статистических анализах использовали только исходные данные ДНК.
Мазки Папаниколау. Стандартный мазок Папаниколау был взят у всех женщин на исходном уровне, а также в 12, 24, 36 месяцев и 6 лет с использованием стандартной методики взятия трех образцов с деревянным шпателем и цитощеткой (MedScand, Мальмё, Швеция). описано ранее (16).
Генотипирование ВПЧ. Генотипирование ВПЧ проводили с помощью набора для множественного генотипирования ВПЧ (Multimetrix; Progen Biotechnik GmbH, Гейдельберг, Германия), как показано на рис.2. Набор определяет следующие 24 генотипа LR и HR HPV: LR HPV6, -11, -42, -43, -44 и -70 и HR HPV16, -18, -26, -31, -33, -35. , -39, -45, -51, -52, -53, -56, -58, -59, -66, -68, -73 и -82 (20). С помощью анализатора Luminex LX-100 (система Bio-Plex 200; Bio-Rad Laboratories, Геркулес, Калифорния) вычисляли среднюю интенсивность флуоресценции (MFI) по меньшей мере 100 шариков для каждой шарики, установленной в образце. Значение отсечения для каждого цикла и типа HPV было в 1,5 раза больше фонового MFI (отрицательный контроль) плюс 5 единиц MFI.
РИС. 2.
Алгоритм генотипирования ВПЧ мультиплексным методом.
Генотипирование
HPV было выполнено с использованием более раннего продукта ПЦР, который теперь был повторно усилен праймерами GP05 + и bio-GP06 + (22). Первоначально ДНК выделяли из соскобов высокосолевым методом (11). Затем продукты ПЦР гибридизовали с меченным дигоксигенином коктейлем олигозондов HR HPV (HPV16, -18, -31, -33, -35, -39, -45, -51, -52, -54, -56 и — 58) для выявления любых ВПЧ высокого риска (1).
Поскольку HPV16 является наиболее распространенным генотипом, мы стремились избежать ложноположительных результатов из-за контаминации путем повторного тестирования всех HPV16-положительных образцов, как описано Шмиттом и соавторами (20).
Статистический анализ. Все статистические анализы выполнялись с использованием пакетов программного обеспечения SPSS (SPSS, Inc., Чикаго, Иллинойс) и STATA (Stata Corp., College Station, TX) (PASW Statistics для Windows, версия 18.0.1 и STATA / SE 11.0). Таблицы частот были проанализированы с использованием критерия χ 2 с отношением правдоподобия или точным критерием Фишера для категориальных переменных. Различия в средних значениях непрерывных переменных анализировали с использованием непараметрических критериев (Манна-Уитни или Крускала-Уоллиса) для двух и нескольких независимых выборок, соответственно.Для сравнения индивидуальных показателей клиренса использовалась статистика отношения скоростей (RR) (STATA) с 95% доверительными интервалами для конкретных тестов (95% ДИ).
Предикторы типоспецифичного клиренса ВПЧ. Чтобы проанализировать предикторы клиренса ВПЧ, мы использовали видоспецифический подход к клиренсу путем объединения отдельных генотипов в их соответствующие виды. Кроме того, нас интересовало очищение от ВПЧ только ключевыми типами ВПЧ ВПЧ, т. Е. Видов 7 (HPV18, -39, -45, -59, -68, -70 и -85) и видов 9 (HPV16, -31, -33, -35, -52, -58 и -67).
Регрессионный анализ Пуассона был использован для панельных данных, сгруппированных по матери и пробам (в одномерном и многомерном режимах), с использованием модели усредненной по популяции (PA) модели (2, 6). Посещение FU было временной переменной в настройках панели, а клиренс HPV (переменная подсчета) был зависимой переменной с функцией связи журнала Пуассона. Структура независимой внутригрупповой корреляции для модели PA с надежной оценкой дисперсии (95% доверительный интервал) для учета внутрисубъектной корреляции была наиболее подходящим шаблоном ковариации, определяемым информационным критерием квазивероятности (QIC) (6).С этими вариантами регрессия Пуассона для панельных данных аналогична модели обобщенного оценочного уравнения (GEE) PA, причем обе модели дают идентичные результаты.
В одномерном пуассоновском анализе мы сначала протестировали все ковариаты, записанные в базовом вопроснике, а также некоторые выбранные переменные из опросника FU (например, запись новых партнеров), которые ранее были задействованы как потенциальные факторы риска ВПЧ в этой когорте (16 ). В окончательной многомерной модели были введены только переменные, которые были значимыми (или погранично значимыми) в одномерном пуассоновском анализе, и были скорректированы с учетом возраста на момент включения в исследование.Все статистические тесты были двусторонними и были объявлены значимыми при значении P <0,05.
РЕЗУЛЬТАТЫ
Исходы инфекции ВПЧ и клиренс ВПЧ по конкретному типу. Исходы инфекции ВПЧ представлены на рис. 3. Сначала были определены следующие шесть различных моделей исходов: (i) всегда отрицательный, (ii) случайный ВПЧ ( женщин, которые были HPV-отрицательными на исходном уровне и приобрели случайную HPV-инфекцию во время FU), (iii) типоспецифическая персистенция, (iv) неспецифическая персистенция, (v) колебания и (vi) клиренс (временный).В этом исследовании мы сосредоточились на тех 252 женщинах, у которых хотя бы один тест на ВПЧ был положительным во время ФУ и, таким образом, накопилось время, подверженное риску выведения из ВПЧ. Из этих 252 женщин 131 избавилась от инфекции во время ФУ. Клиренс определялся как когда у женщины с предыдущим положительным тестом на ВПЧ был отрицательный тест (при любом посещении ФУ), и она оставалась отрицательной на ВПЧ до конца последнего посещения. Результат для тех женщин, у которых был еще один положительный тест на ВПЧ после отрицательного результата, был классифицирован как колебание и был исключен из этого анализа.
РИС. 3.
Исход инфекции ВПЧ во время наблюдения. Генотип-специфический исход инфекции HPV у каждой женщины оценивался путем сравнения вирусных событий при каждом посещении FU с исходным статусом HPV, и были идентифицированы шесть различных основных исходов. В этом исследовании оценивалось избавление от генотип-специфичных инфекций ВПЧ, включая всех женщин, которые вылечили свою инфекцию среди тех, кто находится в категориях исходов от 2 до 6.
Типоспецифическое избавление от инфекций ВПЧ. Из 329 женщин, включенных в это исследование, 252 прошли тестирование на ВПЧ. в какой-то момент был положительным, и из них 131 пережил разминирование во время FU.Среднее время наблюдения за этими 252 женщинами составило 58,8 ± 25,1 (стандартное отклонение) месяцев (медиана 65,0; диапазон от 6 до 95). К концу FU излечилось 100% инфекций HPV11, -43 и -51, равно как и 83,3% инфекций HPV6 ( n = 5/6) (Таблица 1). Для большинства других генотипов клиренс был менее частым и выявлялся примерно в 50% случаев. Это относится к инфекциям HPV16, из которых 50,5% ( n = 54/107) вылечены, а также к инфекциям множественного типа, среди которых частота выведения была еще меньше, т.е.е., 46,1% ( n = 35/76) случаев.
ТАБЛИЦА 1.
Процент вылеченных инфекций, время до выведения и скорость выведения для различных генотипов и видов ВПЧ
Интервалы времени (в месяцах) до первого события выведения были рассчитаны с первого посещения с положительным результатом на ВПЧ (исходный уровень или любой FU). визит) к первому событию очистки, отдельно как для актуарного, так и для приблизительного времени. Чтобы рассчитать актуарное время клиренса, в анализ Каплана-Мейера были включены как женщины, у которых произошло событие, так и те, у которых его не было ( n = 252).Наибольшее актуарное время для клиренса было обнаружено для единичных случаев HPV33 и HPV44, которые не показали клиренса (Таблица 1). Затем последовали HPV66, -35 и -31 с актуарным временем 48,1, 45,6 и 45,5 месяцев соответственно. С другой стороны, самые короткие актуарные времена были зарегистрированы для HPV73, -11 и -59, то есть 11,8, 12,4 и 12,8 месяцев соответственно. Большинство оставшихся типов (HPV16, -18, -52, -58 и -70) имели актуарное время в диапазоне от 30,7 до 36,9 месяцев, тогда как у множественных инфекций время выведения было несколько более длительным и составляло 41.1 мес. Для расчета приблизительного времени клиренса были включены только те 131 женщина, у которых произошел клиренс, и поэтому они короче актуарного времени. Самый продолжительный период (49,5 месяцев) был зарегистрирован для HPV52. Затем последовали HPV16, -31, -43, -51, -56 и -70 с приблизительным временем от 22,1 до 28,5 месяцев. Самый короткий приблизительный период времени — 10,4 месяца — показал HPV73, который был несколько короче, чем у остальных генотипов, в диапазоне от 11,9 до 14,8 месяцев. Для инфекций множественного типа приблизительное время до выведения было 21.7 месяцев.
Из отдельных видов ВПЧ вид 8 был ликвидирован в 100% случаев инфекции ( n = 2), причем как актуарное, так и приблизительное время до выведения составило 24,8 месяца. Виды 5, 10 и 7 показали клиренс в 80% ( n = 4/5), 77,8% ( n = 7/9) и 67,9% ( n = 19/28) случаев. соответственно. Для вида 9 клиренс составил всего 49,2% ( n = 61/124), что аналогично таковому для редких видов 6 и 11, т. Е. 40% ( n = 2/5) и 50% ( n = 1/2) соответственно.Актуарные сроки очистки были самыми продолжительными для видов 6 (46,2 месяца), за которыми следовали виды 9, время очистки которых составило 37,4 месяца (Таблица 1). Как актуарное, так и приблизительное время очистки были самыми короткими для видов 11 и составили всего 11,7 и 10,4 месяца соответственно. Наибольшее приблизительное время очистки было зарегистрировано для видов 9 и 8, то есть 37,4 и 24,3 месяца соответственно.
Совокупный клиренс видов 7 и 9 сравнивали с клиренсом видов 10 при одномерном анализе выживаемости (Каплана-Мейера) (рис.4). Вид 10 (доброкачественные типы) показал значительно более быстрое и полное удаление, чем виды 7 и 9, которые также заметно отклонялись друг от друга, при этом вид 9 показал наименьшее кумулятивное удаление (тест логарифмического ранга, P = 0,013). Когда один HPV16 сравнивался со всеми другими генотипами в аналогичном анализе Каплана-Мейера, разница также была значительной ( P = 0,015), при этом клиренс HPV16 был почти на 20% меньше, чем у всех других генотипов (данные не показаны).
РИС.4.
Кумулятивное избавление от инфекций ВПЧ 7, 9 и 10 видов по анализу Каплана-Мейера.
CR. Также были рассчитаны как актуарные, так и общие коэффициенты клиренса (CR), которые были выражены как количество событий на 1000 женщин-месяцев в группе риска (WMR). Для получения актуарных показателей клиренса, специфичных для генотипа, количество событий клиренса для каждого отдельного генотипа и вида было разделено на общий WMR (т.е. 9,146 месяцев, накопленных всеми 252 ВПЧ-положительными женщинами), таким образом, включая женщин без события клиренса. .Из одиночных генотипов наиболее частый генотип, HPV16, также показал самый высокий CR, 5,9 / 1000 WMR (95% ДИ, 4,3-7,4), за ним следовали комбинации нескольких типов, которые исчезли со скоростью 3,8 / 1000. WMR (95% ДИ, от 2,5 до 5,1). Актуарный CR для HPV18 был заметно ниже — 0,65 / 1000 WMR (95% ДИ, от 0,1 до 1,2). Из-за доминирующей роли HPV16, вид 9 показал самый высокий CR 6,7 / 1000 WMR (95% CI, от 5,0 до 8,3), что намного превышает CR (2,0 / 1000 WMR) у вида 7 (Таблица 1). Это логично, поскольку CR, вероятно, коррелирует со скоростью обнаружения конкретного типа HPV.
Для расчета приблизительных показателей выведения были включены только женщины с событиями клиренса, а количество событий клиренса для каждого отдельного генотипа (или вида) было разделено на WMR, накопленный только этими женщинами, и поэтому является надежным показателем для сравнения различных ВПЧ. генотипы и виды ВПЧ. Из всех генотипов HPV66 и -82 очищались наиболее быстро, оба накапливали события клиренса со скоростью 83,2 / 1000 WMR, что намного превышает скорость HPV6 и HPV59 с общим CR 67.4 / 1,000 WMR и 76,9 / 1,000 WMR соответственно. Общий CR HPV16 был намного медленнее, 45,2 / 1000 WMR. Из-за этой относительно широкой вариации среди отдельных генотипов, включенных в разные виды, грубые CR между видами HPV показали гораздо меньшую вариативность, при этом виды 10 и 11 имели самые высокие общие CR (70,9 / 1000 WMR и 96,1 / 1000 WMR, соответственно). в то время как остальные виды очищались медленнее (с CR в диапазоне от 40,8 / 1000 WMR до 59,3 / 1000 WMR) (Таблица 1).
Предикторы выведения видов.Предикторы генотип-специфического клиренса видов 7 и видов 9 во время FU анализировали с использованием модели PA регрессии Пуассона, при этом событие клиренса при любом посещении FU использовалось в качестве зависимой переменной. Результаты представлены в Таблице 2. В одномерном анализе Пуассона две переменные были значимыми предикторами этих событий выведения: возраст (выздоровление чаще происходило с увеличением возраста) и количество половых партнеров во время FU (все женщины без партнеров вылечены).
ТАБЛИЦА 2.
Предикторы видоспецифичного клиренса инфекций ВПЧ для видов 7 и 9 в регрессии Пуассона (для панельных данных) в одномерном режиме и с поправкой на значимые ковариаты
Когда все значимые и пограничные значимые переменные одномерного анализа Пуассона были введены в В многомерной модели Пуассона вместе с возрастом пациента три переменные сохранили свое значение в качестве независимых предикторов клиренса вида 7/9: (i) возраст (клиренс чаще встречался с увеличением возраста [ P = 0.002], (ii) исходный пероральный статус ДНК HPV HR (отрицательный HR HPV увеличивал вероятность выздоровления) (коэффициент заболеваемости [IRR] = 2,94; P = 0,042), и (iii) количество половых партнеров во время FU. (все женщины с более чем 2 партнерами не смогли очиститься) (IRR = 0,35; 95% ДИ, 0,15–0,83; P = 0,018).
ОБСУЖДЕНИЕ
Настоящее исследование является первым, в котором представлена подробная информация как об актуарном, так и о приблизительном времени клиренса и скорости клиренса на уровне генотипа ВПЧ и видов.Неудивительно, что самая низкая частота выведения была зарегистрирована для HPV16 и множественных инфекций, из которых вылечились только 51,6% и 50,5% соответственно. В анализе Каплана-Мейера клиренс HPV16 был почти на 20% меньше, чем у всех других генотипов. В других исследованиях 80,7%, 69% и 51,9% ВПЧ-инфекций вылечились в период между 14 и 19 месяцами ФУ (5, 18, 21). Было показано, что из типов LR HPV 81% избавился от FU в течение 12 месяцев (5), а большая часть типоспецифического выведения произошла через 2 года (14).При стратификации по видам ВПЧ вид 10 (доброкачественные типы) показывает значительно более быстрое очищение, чем виды 7 и 9. Это согласуется с результатами, показывающими, что вид 9 имеет самый низкий уровень выведения и самую большую продолжительность заболевания (5, 25). .
Актуарное время включает в себя также женщин без выздоровления, но показывает, сколько времени требуется у ВПЧ-положительных женщин, чтобы избавиться от инфекции определенного генотипа. Насколько нам известно, об актуарном клиренсе различных типов ВПЧ ранее не сообщалось.Примерное время для каждого генотипа указывает время, необходимое для выведения из организма у женщин, которые пережили такое событие, обеспечивая надежную меру для сравнения различных генотипов ВПЧ (Таблица 1). В настоящей серии наши данные по HPV16 удивительно похожи на недавно опубликованные данные, показывающие среднее время выведения от 17,1 до 22 месяцев в течение 19 месяцев и 48 месяцев времени FU, соответственно (8, 18). Для HPV6 и -11 наше приблизительное время составило 14,8 и 12,4 месяца соответственно, что также очень похоже на данные, о которых сообщалось ранее (9.3 и 8,4 месяца соответственно [8], а также 9,5 месяцев для HPV6 / 11 [25]). Эти данные подтверждают, что общее время клиренса для типов ВПЧ HR почти вдвое больше, чем для ВПЧ LR (от 22,1 до 28,1 месяцев по сравнению с 10,4 до 14,8 месяцев).
Актуарные и грубые CR заметно различаются из-за значительных различий в знаменателях. Сравнение между отдельными исследованиями затруднено, особенно когда время FU и размер когорт существенно различаются. В нашей когорте HPV16 показал значительно более низкий общий CR — 45.2/1000 WMR, чем в недавнем исследовании, в котором сообщается, что общий CR составляет 72,0 / 1000 WMR для HPV16 в течение 15 месяцев FU (5). При анализе по видам CR 44,9 / 1000 WMR и 59,3 / 1000 WMR были зарегистрированы для видов 9 и 7, соответственно. Это несколько ниже, чем ранее сообщалось для видов 9 (143,1 / 1000 WMR и 76,5 / 1000 WMR) и для вида 7 (110,7 / 1000 WMR и 94,1 / 1000 WMR) (5, 25). Эти различия объясняются разными условиями исследования, в том числе размером когорты, и более коротким периодом ФЕ от 15 до 48 месяцев в этих исследованиях (5, 19, 25).Дополнительным фактором является различный возрастной профиль. Сильной стороной нашего результата CR является долгое время проведения FU и молодой возраст этих женщин. Однако из-за этого дизайна исследования количество субъектов ограничено, а из-за абсолютной редкости некоторых генотипов ВПЧ требуется гораздо большая когорта, чтобы повысить эффективность исследования для отдельных генотипов.
Только два значимых предиктора исключения вида 7/9 были обнаружены в однофакторной модели, а один дополнительный предиктор оказался значимым в многомерной модели.Выздоровление чаще происходило с возрастом, что согласуется с недавними данными других исследований (3, 5, 19). Однако эта связь не была обнаружена в исследовании Trottier с соавторами (25). Наше предыдущее исследование, в котором оценивалась совокупная возрастная клиренс для 13 типов ВПЧ, показало, что общая скорость клиренса была относительно постоянной во всех возрастных группах (24). Эти данные соответствуют известной динамике ВПЧ-инфекций. Среди молодых женщин побочные инфекции являются доминирующим типом с определенным периодом времени, после которого преобладающим типом является выздоровление.Действительно, частота выздоровления превышает показатель заболеваемости с 25 лет и старше (24), что объясняет, почему события излечения с увеличением возраста также в этой когорте более распространены с возрастом (Таблица 2).
Вторым значимым предиктором выздоровления было количество текущих половых партнеров, зарегистрированное в середине 36-месячного периода во время FU. Соответственно, те женщины, у которых не было партнера во время FU, все избавились от инфекции, в отличие от тех, у которых было два или более, ни одна из которых не прошла. Предыдущие исследования не обнаружили связи между количеством текущих половых партнеров и клиренсом (19, 25).Наше наблюдение правдоподобно объясняется вероятностью более высокого воздействия типов ВПЧ ВС с несколькими партнерами.
Наконец, мы также смогли оценить оральный статус ВПЧ ВПЧ как предиктор клиренса видов 7/9. HR ВПЧ-ДНК-отрицательный оральный статус на исходном уровне увеличивал вероятность выздоровления. Это наблюдение является совершенно новым и даже не оценивалось в предыдущих исследованиях из-за отсутствия образцов ротовой полости. Этот вопрос будет подробно рассмотрен во время анализа генотип-специфичных оральных данных о ВПЧ из исследования ВПЧ в финской семье.Интересно, что из 12 женщин, у которых в анамнезе были бородавки в полости рта, ни одна не избавилась от инфекций генитального ВПЧ, что согласуется с наблюдением, что исходный положительный статус ДНК ВПЧ при пероральном приеме ВС снижает вероятность излечения.
В заключение, ВПЧ16 и множественные инфекции показали самый низкий уровень выведения из числа только что родивших матерей. Это первое исследование, в котором и (i) актуарное, и приблизительное время до первого клиренса и (ii) актуарные и приблизительные CR были оценены на уровне генотипа и видов ВПЧ.Важные независимые предикторы клиренса вида 7/9 включают (i) возраст, (ii) наличие более 2-х текущих сексуальных партнеров и (iii) исходный оральный статус ДНК ВПЧ для HR; пожилой возраст и оральный HR-отрицательный ДНК-отрицательный статус HPV увеличивают клиренс, в то время как наличие нескольких половых партнеров снижает вероятность избавления от инфекций вида 7/9.
БЛАГОДАРНОСТИ
Это исследование было поддержано Академией Финляндии, Финским фондом рака, Специальным государственным фондом (EVO) университетской больницы Турку и Национальной высшей школой клинических исследований (CLIGS).
Выражаем признательность за квалифицированную техническую помощь Татьяне Песковой, Марии Хенттинен и Кетлин Адель.
СНОСКИ
- Получено 17 апреля 2010 г.
- Возвращено для модификации 27 мая 2010 г.
- Принято 4 июня 2010 г.
- Авторское право © Американское общество микробиологии, 2010 г.
Анттила М., С. Сирьянен, Х. Джи, С. Саарикоски и К.Syrjänen.
1999. Неспособность продемонстрировать ДНК вируса папилломы человека в эпителиальном раке яичников с помощью ПЦР с общим праймером. Gynecol Oncol.
72
:
337-341. - 2.↵
Diggle, P.J., K.-Y. Лян и С.Л. Зегер.
1994. Анализ продольных данных, 1-е изд. Издательство Оксфордского университета, Оксфорд, Соединенное Королевство. - 3.↵
Franco, E. L., L. L. Villa, J. P. Sobrinho, J. M. Prado, M. C. Rousseau, M. Désy, and T.Э. Рохан.
1999. Эпидемиология заражения и избавления от цервикальной папилломавирусной инфекции у женщин из зоны повышенного риска рака шейки матки. J. Infect. Дис.
180
:
1415-1423. - 4.↵
Джулиано А. Р., Р. Харрис, Р. Л. Седжо, С. Болдуин, Д. Роу, М. Р. Папенфус, М. Абрахамсен, П. Инсерра, С. Ольвера и К. Хэтч.
2002. Заболеваемость, распространенность и устранение инфекций, вызванных вирусом папилломы человека, специфическими для каждого типа: Исследование здоровья молодых женщин.J. Infect. Дис.
186
:
462-469. - 5.↵
Гудман, М. Т., Ю. Б. Швецов, К. Макдаффи, Л. Р. Уилкенс, Х. Чжу, П. Дж. Томпсон, Л. Нинг, Дж. Киллин, Л. Камемото и Б. И. Эрнандес.
2008. Распространенность, приобретение и устранение инфекции вируса папилломы человека шейки матки среди женщин с нормальной цитологией: Когортное исследование вируса папилломы человека на Гавайях. Cancer Res.
68
:
8813-8824. - 6.↵
Хардин, Дж.и J.M. Hilbe.
2003. Обобщенные оценочные уравнения. Чапман и Холл, Бока-Ратон, Флорида. - 7.↵
Хо, Г. Й., Р. Бирман, Л. Бердсли, К. Дж. Чанг и Р. Д. Бурк.
1998. Естественная история цервиковагинальной папилломавирусной инфекции у молодых женщин. N. Engl. J. Med.
338
:
423-428. - 8.↵
Insinga, R. P., E. J. Dasbach, E. H. Elbasha, K. L. Liaw, and E. Barr.
2007. Заболеваемость и продолжительность инфицирования вирусом папилломы человека 6, 11, 16 и 18 шейки матки у молодых женщин: оценка с различных аналитических точек зрения.Cancer Epidemiol. Биомаркеры Пред.
16
:
709-715. - 9.↵
Lai, CH, A. Chao, CJ Chang, FY Chao, HJ Huang, S. Hsueh, CT Lin, HH Cheng, CC Huang, JE Yang, TI Wu, HH Chou и ТК Чанг.
2008. Хозяин и вирусные факторы в отношении избавления от инфекции вируса папилломы человека: когортное исследование на Тайване. Int. J. Рак
123
:
1685–1692. - 10.↵
Louvanto, K., М. Ринтала, К. Сюрьянен, С. Гренман и С. Сюрьянен. Генотип-специфическая персистенция инфекций генитального вируса папилломы человека (ВПЧ) у женщин, за которыми в течение 6 лет наблюдали в рамках исследования Finnish Family HPV Study. J. Infect. Дис., В печати.
- 11.↵
Миллер С.А., Дайкс Д.Д., Полесский Х.Ф.
1988. Простая процедура высаливания для извлечения ДНК из ядерных клеток человека. Nucleic Acids Res.
16
:
1215. - 12.↵
Муньос, Н., Ф. Мендес, Х. Поссо, М. Молано, А. Дж. Ван ден Брюле, М. Рондерос, К. Мейер, А. Муньос и группа по изучению ВПЧ Института национального рака.
2004. Заболеваемость, продолжительность и детерминанты цервикальной папилломавирусной инфекции в когорте колумбийских женщин с нормальными цитологическими результатами. J. Infect. Дис.
190
:
2077-2087. - 13.↵
Пламмер, М., М. Шиффман, П. Э. Кастл, Д. Мокорт-Боулч, К. М. Уиллер и группа ALTS.
2007 г.2-летнее проспективное исследование персистенции вируса папилломы человека среди женщин с цитологическим диагнозом атипичных плоскоклеточных клеток неопределенного значения или плоскоклеточного интраэпителиального поражения низкой степени. J. Infect. Дис.
195
:
1582–1589. - 14.↵
Ричардсон, Х., Г. Келсалл, П. Теллье, Х. Войер, М. Абрахамович, А. Ференци, Ф. Кутле и Э. Л. Франко.
2003. Естественная история типоспецифических инфекций вируса папилломы человека у студенток университетов.Cancer Epidemiol. Биомаркеры Пред.
12
:
485-490. - 15.↵
Ринтала, М. А., С. Э. Гренман, М. Э. Ярвенкюля, К. Й. Сюрьянен и С. М. Сюрьянен.
2005. Типы ДНК вируса папилломы человека (ВПЧ) высокого риска в слизистой оболочке полости рта и половых органов младенцев в течение первых 3 лет жизни: опыт финского семейного исследования ВПЧ. Clin. Заразить. Дис.
41 год
:
1728-1733. - 16.↵
Ринтала, М.А., С.Э. Гренман, М. Х. Пуранен, Э. Исолаури, У. Экблад, П. О. Керо и С. М. Сырьянен.
2005. Передача вируса папилломы человека высокого риска (ВПЧ) от родителей к младенцу: проспективное исследование ВПЧ в семьях в Финляндии. J. Clin. Microbiol.
43 год
:
376-381. - 17.↵
Родригес, А. К., М. Шиффман, Р. Эрреро, С. Вахолдер, А. Хильдесхайм, П. Е. Кастл, Д. Соломон, Р. Бурк и группа Proyecto Epidemiológico Guanacaste.
2008. Быстрое очищение от вируса папилломы человека и его значение для клинической практики стойких инфекций.J. Natl. Cancer Inst.
100
:
513-517. - 18.↵
Роза, М. И., Дж. М. Фачел, Д. Д. Роза, Л. Р. Медейрос, К. Н. Иганси и М. К. Бозцетти.
2008. Персистенция и устранение инфекции вируса папилломы человека: проспективное когортное исследование. Являюсь. J. Obstet. Гинеколь.
199
:
617.e1-e7. - 19.↵
Safaeian, M., M. Kiddugavu, P.E. Gravitt, S.J. Gange, J. Ssekasanvu, D. Murokora, M. Sklar, D. Serwadda, M.Дж. Вавер, К. В. Шах и Р. Грей.
2008. Детерминанты заболеваемости и избавления от инфекций, вызываемых вирусом папилломы человека высокого риска, в сельских районах Ракаи, Уганда. Cancer Epidemiol. Биомаркеры Пред.
17
:
1300-1307. - 20.↵
Schmitt, M., I. G. Bravo, P. J. Snijders, L. Gissmann, M. Pawlita, and T. Waterboer.
2006. Мультиплексное генотипирование вирусов папилломы человека на основе гранул. J. Clin. Microbiol.
44 год
:
504-512. - 21.№
Sellors, J. W., T. L. Karwalajtys, J. Kaczorowski, J. B. Mahony, A. Lytwyn, S. Chong, J. Sparrow, and A. Lorincz.
2003. Исследование ВПЧ в женской группе Онтарио. Заболеваемость, клиренс и предикторы инфекции вируса папилломы человека у женщин. CMAJ
168
:
421-425. - 22.↵
Снайдерс, П. Дж. Ф., А. Дж. К. ван ден Брюле, Х. Ф. Дж. Шрайнемакерс, Г. Сноу, К. Дж. Л. М. Мейер и Дж. М. М. Вальбумерс.
1990. Использование общих праймеров в полимеразной цепной реакции позволяет обнаруживать широкий спектр генотипов вируса папилломы человека.J. Gen. Virol.
71
:
173-181. - 23.↵
Сырьянен, С., Шабалова И.П, Петровичев Н., Козаченко В.П., Захарова Т., Паяниди А., Подистов Ю.И., Чемерис Г., Созаева Л.Г., Липова Е.В., Цидаева И. О. Г. Иванченко, А. А. Пшепурко, С. Захаренко, Р. Неровина, Л. Б. Клюкина, О. А. Ерохина, М. Ф. Брановская, М. Никитина, В. Грюнберга, А. Грюнберг, А. Ющенко, П. Тоси, М. Чинторино, Р. Сантопьетро , и KJ Syrjänen.
2005. Удаление ДНК из группы высокого риска вируса папилломы человека (ВПЧ) и аномалий мазка ПАП в когорте женщин, прошедших скрининг на ВПЧ в Новых Независимых Государствах бывшего Советского Союза (когортное исследование ННГ).Евро. J. Obstet. Гинеколь. Репродукция. Биол.
119
:
219-227. - 24.↵
Сырянен С., Шабалова И.П., Петровичев Н., Подистов Ю., Иванченко О., Захаренко С., Неровина Р., Клюкина Л. Б., Брановская М. Ф., Ющенко А., Тоси А. П. , К. Сырьянен и Группа когортных исследований ННГ.
2005. Повозрастная заболеваемость и уровень выздоровления от инфекций папилломавируса человека высокого риска у женщин в бывшем Советском Союзе. Int. J. ЗППП, СПИД
16
:
217-223. - 25.↵
Троттье, Х., С. Махмуд, Дж. К. Прадо, Дж. С. Собриньо, М. К. Коста, Т. Э. Рохан, Л. Л. Вилла и Э. Л. Франко.
2008. Типовая продолжительность инфекции вируса папилломы человека: значение для скрининга вируса папилломы человека и вакцинации. J. Infect. Дис.
197
:
1436-1447. - 1.
Саслоу Д., Рунович С.Д., Соломон Д., Москицки А.Б., Смит Р.А. и др. (2002) Руководство Американского онкологического общества по раннему выявлению неоплазии и рака шейки матки. CA Cancer J Clin 52: 342–362. - 2.
Шерман М.Э., Шиффман М., Эрреро Р., Келли Д., Братти С. и др. (1998) Эффективность полуавтоматической системы скрининга мазка Папаниколау: результаты популяционного исследования, проведенного в Гуанакасте, Коста-Рика. Рак 84: 273–280. - 3.
Ронко Дж., Джорджи-Росси П., Кароцци Ф., Конфортини М., Далла Пальма П. и др. (2010) Эффективность тестирования вируса папилломы человека для выявления инвазивного рака шейки матки и интраэпителиальной неоплазии шейки матки: рандомизированное контролируемое исследование.Ланцет Онкол 11: 249–257. - 4.
Саслоу Д., Соломон Д., Лоусон Х.В., Киллаки М., Куласингам С.Л. и др. (2012) Американское онкологическое общество, Американское общество кольпоскопии и патологии шейки матки и Руководство по скринингу Американского общества клинической патологии по профилактике и раннему выявлению рака шейки матки. CA Cancer J Clin 62: 147–172. - 5.
Maucort-Boulch D, Plummer M, Castle PE, Demuth F, Safaeian M и др. (2010) Предикторы персистенции вируса папилломы человека среди женщин с сомнительной или слегка ненормальной цитологией.Int J Cancer 126: 684–691. - 6.
Родригес А.С., Шиффман М., Эрреро Р., Вахолдер С., Хильдесхайм А. и др. (2008) Быстрое избавление от вируса папилломы человека и значение для клинической направленности стойких инфекций. J Natl Cancer Inst 100: 513–517. - 7.
Райт Т.К.-младший, Массад Л.С., Дантон С.Дж., Спитцер М., Уилкинсон Э.Дж. и др. (2007) Консенсусное руководство 2006 г. по ведению женщин с отклонениями от нормы скрининговых тестов шейки матки. Дж. Низкие мочеполовые тракты Dis 11: 201–222. - 8.
Тралл М.Дж., Рассел Д.К., Фасик М.С., Яо Д.Л., Уорнер Дж. Н. и др. (2010) Тестирование на ВПЧ высокого риска у женщин 30 лет и старше с отрицательными тестами Папаниколау: первоначальный клинический опыт с 18-месячным периодом наблюдения. Am J Clin Pathol 133: 894–898. - 9.
Чан П.К. (2012) Вирус папилломы человека 58 типа: уникальная роль в раке шейки матки в Восточной Азии. Cell Biosci 2: 17. - 10.
Bao YP, Li N, Smith JS, Qiao YL (2008) Распространение типа вируса папилломы человека у женщин из Азии: метаанализ.Int J Gynecol Cancer 18: 71–79. - 11.
Смит Дж. С., Линдси Л., Хутс Б., Киз Дж., Франчески С. и др. (2007) Распределение типа вируса папилломы человека при инвазивном раке шейки матки и поражениях шейки матки высокой степени: обновление метаанализа. Int J Cancer 121: 621–632. - 12.
Хонг С.Р., Ким И.С., Ким Д.В., Ким М.Дж., Ким А.Р. и др. (2009) Распространенность и распределение генотипов ДНК цервикального вируса папилломы человека у корейских женщин: многоцентровое исследование. Корейский журнал патологии 43: 342–350. - 13.
Райт Т. К. мл., Столер М. Х., Шарма А., Чжан Г., Беренс С. и др. (2011) Оценка генотипирования ВПЧ-16 и ВПЧ-18 для сортировки женщин с отрицательными результатами цитологического исследования ВПЧ + высокого риска. Am J Clin Pathol 136: 578–586. - 14.
Хан MJ, Castle PE, Lorincz AT, Wacholder S, Sherman M, et al. (2005) Повышенный 10-летний риск развития предрака и рака шейки матки у женщин с вирусом папилломы человека (ВПЧ) типа 16 или 18 и возможная полезность тестирования на тип-специфический ВПЧ в клинической практике.J Natl Cancer Inst 97: 1072–1079. - 15.
Kjaer SK, Frederiksen K, Munk C, Iftner T (2010) Долгосрочный абсолютный риск цервикальной интраэпителиальной неоплазии 3 степени или хуже после инфекции вируса папилломы человека: роль стойкости. J Natl Cancer Inst 102: 1478–1488. - 16.
Cogliano VJ, Baan R, Straif K, Grosse Y, Lauby-Secretan B и др. (2011) Предотвращаемые воздействия, связанные с раком человека. J Natl Cancer Inst 103: 1827–1839. - 17.Асато Т., Маэхама Т., Нагаи Ю., Канадзава К., Уэзато Х. и др. (2004) Крупное исследование риска рака шейки матки, связанного с инфекцией вируса папилломы человека в Японии, методом случай-контроль путем генотипирования на основе нуклеотидного секвенирования. J Infect Dis 189: 1829–1832.
- 18.
Hwang T (1999) Обнаружение и типирование ДНК вируса папилломы человека с помощью ПЦР с использованием консенсусных праймеров в различных поражениях шейки матки у корейских женщин. J Korean Med Sci 14: 593–599. - 19.
Чан П.К., Лам Ч.В., Чунг Т.Х., Ли У.В., Ло К.В. и др.(2002) Ассоциация варианта вируса папилломы человека 58 типа с риском рака шейки матки. J Natl Cancer Inst 94: 1249–1253. - 20.
Чан П.К., Чунг Т.Х., Там А.О., Ло К.В., Йим С.Ф. и др. (2006) Ошибки в оценке распространенности генотипа вируса папилломы человека, связанные с обычно используемыми консенсусными праймерами. Int J Cancer 118: 243–245. - 21.
Значение инфекции ВПЧ-58 у женщин, инфицированных ВПЧ, цитологически отрицательных и проживающих в стране с высокой распространенностью инфекции ВПЧ-58
Аннотация
Назначение
Цитология шейки матки и совместное тестирование ДНК вируса папилломы человека (ВПЧ) рекомендуется в качестве метода скрининга для выявления поражений шейки матки.Однако для женщин с ВПЧ-положительной реакцией, но с отрицательной цитологией, надлежащее лечение и значение инфекции ВПЧ-58 остаются неизвестными.
Методы
В этом исследовании распространенного ВПЧ, выявленного на исходном уровне со средним периодом наблюдения 3,2 года, оценивались факторы риска, связанные с аномалиями шейки матки, и оценивалась значимость инфекции ВПЧ-58. Всего было набрано 265 женщин. Все плоскоклеточные интраэпителиальные поражения высокой степени злокачественности (HSIL), обнаруженные цитологически, были подтверждены гистологией.Гистологические диагнозы цервикальной интраэпителиальной неоплазии 2/3 были классифицированы как HSIL. Женщины были разделены на четыре группы в соответствии с генотипом HPV, который был обнаружен при их первом посещении: HPV-58 (n = 27), HPV-16 (n = 52; 3 женщины имели коинфекцию HPV-58), десять других высоких типы риска (HR) (n = 79) или типы низкого / неопределенного риска (n = 107).
Результаты
Из 265 женщин 20 (7,5%) имели HSIL при последующем осмотре. Наблюдались значительные различия в совокупной частоте HSIL между четырьмя группами ( p <0.001). Кумулятивные показатели заболеваемости HSIL за 5 лет составили 34,0% (95% ДИ: 17,3–59,8%) в случаях с ВПЧ-58, 28,0% (ДИ 95%: 13,8–51,6) в случаях с положительным результатом ВПЧ-16, 5,5% ( 95% ДИ: 2,1–14,0%) в одном из десяти других типов случаев ВПЧ-ВПЧ и 0% у женщин с ВПЧ низкого / неопределенного риска. При наблюдении у женщин с ВПЧ-ВПЧ (n = 158) стойкая инфекция ВПЧ была значимым фактором, связанным с развитием ВПЧ (отношение рисков = 15,459, 95% ДИ: 2,042–117,045). Женщины с ВПЧ-58 имели более высокий риск (отношение рисков = 5.260, 95% ДИ: 1,538–17,987) для развития HSIL, чем женщины с ВПЧ-16 (отношение рисков = 3,822, 95% ДИ: 1,176–12,424) по сравнению с женщинами с другими типами ВПЧ-ВПЧ.
Заключение
HPV-58 имеет высокую связь с развитием HSIL у женщин, которые являются HPV-положительными и цитологически отрицательными.
Образец цитирования: Song JS, Kim EJ, Choi J, Gong G, Sung CO (2013) Значение инфекции HPV-58 у женщин, которые являются HPV-положительными, цитологически отрицательными и проживают в стране с высокой распространенностью HPV -58 Инфекция.PLoS ONE 8 (3):
e58678.
https://doi.org/10.1371/journal.pone.0058678
Редактор: Роберт Д. Бурк,
Медицинский колледж Альберта Эйнштейна, Нью-Йорк
Поступила: 10.10.2012; Одобрена: 5 февраля 2013 г .; Опубликовано: 7 марта 2013 г.
Авторские права: © 2013 Song et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: У авторов нет поддержки или финансирования, чтобы сообщить.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Использование мазка Папаниколау (Пап) в качестве скрининга на рак шейки матки значительно снизило заболеваемость раком шейки матки и связанную с ним смертность в последние годы. Однако мазок Папаниколау имеет низкую чувствительность (<70%) для выявления плоскоклеточных интраэпителиальных поражений высокой степени злокачественности (HSIL), что вызывает ряд вопросов, касающихся необходимости дополнительных методов для улучшения обнаружения [1], [2].Таким образом, включение теста ДНК вируса папилломы человека (ВПЧ) рекомендуется в сочетании с тестом Папаниколау для улучшения выявления предраковых поражений шейки матки [1]. Использование тестирования ДНК ВПЧ в сочетании с тестом Папаниколау значительно повысило чувствительность скрининга на HSIL [3]. Однако сочетание тестирования ДНК ВПЧ и цитологии подняло новую проблему, касающуюся ведения женщин с положительным результатом на ВПЧ, но отрицательным по цитологическому анализу. В этих случаях текущие рекомендации включают два варианта: 1) повторное совместное тестирование через 12 месяцев; или 2) немедленное тестирование генотипа HPV только на HPV-16 или на HPV-16 и / или -18 [4].Из этих вариантов повторное совместное тестирование является предпочтительным вариантом для большинства женщин, поскольку большинство преходящих инфекций ВПЧ излечиваются в течение 12 месяцев иммунной системой хозяина [4], [5], [6], [7]. Кроме того, краткосрочный риск развития HSIL в этой популяции низок [4], [8]. Расчетный 12-месячный риск развития HSIL + у ВПЧ-положительных и цитологических отрицательных женщин колеблется в пределах 0,8–4,1% [4]. Однако существует ограниченное количество исследований, которые выявили факторы риска развития HSIL у женщин, положительных по ВПЧ, но отрицательных при цитологическом исследовании при последующих обследованиях.
Тестирование
генотипа ВПЧ на ВПЧ-16 и / или -18 (вариант 2) у ВПЧ-положительных и цитологически отрицательных женщин может быть неэффективной стратегией скрининга для женщин в Восточной Азии, поскольку существуют значительные различия в распределении генотипов ВПЧ. между западным и восточным населением. В частности, ВПЧ-58, связанный с высоким риском развития дисплазии шейки матки и рака шейки матки, редко встречается во всем мире, но обычно встречается в Восточной Азии [9]. В целом ВПЧ-58 является третьим по распространенности онкогенным типом в Азии, но вызывает только 3.3% всех случаев рака шейки матки в мире [9], [10], [11]. В Корее ВПЧ-58 является вторым по распространенности типом, диагностируемым у женщин с аномальными цитологическими образцами (10,8% от всех аномальных цитологических образцов) [12].
Положительность
на ВПЧ-16 и / или -18 связана со значительным риском развития HSIL у ВПЧ-положительных и цитологических отрицательных женщин [13], [14], [15]. Однако значение обнаружения HPV-58 у женщин, которые являются HPV-положительными и цитологически отрицательными, широко не изучались.
В этом исследовании мы оценили факторы риска, связанные с аномалиями шейки матки у женщин с ВПЧ-положительными, но отрицательными результатами цитологического исследования, и оценили значимость инфекции ВПЧ-58 у женщин, живущих в стране с высокой распространенностью инфекции ВПЧ-58.
Материалы и методы
Пациенты
Это исследование было одобрено институциональным наблюдательным советом (IRB) медицинского центра Асан, Сеул, Корея. Учитывая, что это было ретроспективное исследование, в котором использовались данные реестра, собранные Медицинским центром Асан, IRB отказался от необходимости получать письменное информированное согласие.Данные были проанализированы анонимно. Наш институт обрабатывал около 50 000 мазков Папаниколау в год, из которых> 95% составляли препараты на жидкой основе SurePath. В общей сложности 3246 женщин, которые прошли совместное тестирование с использованием цитологии и генотипирования ВПЧ в период с декабря 2005 г. по сентябрь 2010 г. в Медицинском центре Асан, были отобраны после поиска в нашей электронной базе данных патологий. Из этих 3246 пациентов, прошедших совместное тестирование, 377 (11,6%) были признаны отрицательными по цитологии, но положительными по ВПЧ. Среди этих 377 пациентов 94 были исключены из-за потери для последующего наблюдения или неадекватного периода наблюдения (т.е., эти женщины прошли краткосрочные контрольные обследования в течение <1 года без гистологического подтверждения). Однако исключенные женщины не отличались по определенным характеристикам, таким как распределение HR-HPV, по сравнению с женщинами, включенными в это исследование. Из оставшихся 283 женщин 18 женщин моложе 30 лет также были исключены из исследования. Наконец, в исследование были включены в общей сложности 265 женщин, которые были HPV-положительными, но цитологически отрицательными при первоначальной оценке и не имели предыдущих цитологических аномалий.Женщины, которым не проводилась кольпоскопия, конизация или гистерэктомия, наблюдались с использованием цитологических мазков каждые 6–12 месяцев в течение> 1 года. Все мазки из шейки матки были приготовлены с использованием препаратов на жидкой основе SurePath (TriPath Imaging, Берлингтон, Северная Каролина, США). Сбор данных был остановлен, когда была обнаружена положительная реакция на HSIL или когда пациенту была сделана биопсия, конизация или гистерэктомия в течение периода наблюдения. Средний период наблюдения составил 3,2 года (диапазон: 0,04–6,26 года). Возникновение плоскоклеточных интраэпителиальных поражений низкой степени злокачественности (LSIL) и HSIL в течение периода последующего наблюдения считалось показателем аномалий шейки матки.Из общего числа 265 женщин все 20 женщин с HSIL, 30 из 62 женщин с LSIL и 8 из 187 женщин без аномалий шейки матки при контрольной цитологии прошли дополнительное гистологическое исследование, такое как кольпоскопическая биопсия, конизация или гистерэктомия. Для этого исследования гистологические диагнозы цервикальной интраэпителиальной неоплазии (CIN) 1 были классифицированы как LSIL, а диагнозы CIN 2 и 3 были классифицированы как HSIL. Из 265 женщин, включенных в это исследование, 193 последовательно оценивались с помощью повторного тестирования на ВПЧ в течение> 1 года, а также цитологического исследования.Остальные 72 женщины были оценены цитологически только в течение периода наблюдения после первоначального совместного тестирования. Стойкая инфекция ВПЧ оценивалась у 193 женщин, которые проходили повторные тесты на ВПЧ в течение> 1 года, и это было определено как выявление того же генотипа ВПЧ, который наблюдался на исходном уровне в ≥ 2 последовательных тестах на ВПЧ, выполненных в течение более 1 года. Наличие множественных инфекций определялось как наличие нескольких типов ВПЧ (≥ 2 генотипов) в первоначальном тесте на ВПЧ. Для определения онкогенности ВПЧ-58 генотипы ВПЧ, обнаруженные при первом посещении, были сгруппированы в четыре категории: положительные по ВПЧ-16, положительные по ВПЧ-58 (отдельно или в комбинации с другими типами, но исключая ВПЧ-16), остальные десять. другие типы ЧСС (исключая любые ВПЧ-16 и -58) и типы низкого / неопределенного риска.Было три женщины, которым был поставлен диагноз ВПЧ-16 и ВПЧ-58, которые были классифицированы как положительные на ВПЧ-16, чтобы определить риск развития HSIL у женщин, инфицированных ВПЧ-58. Характеристики женщин с ВПЧ-положительными и цитологическими отрицательными результатами приведены в Таблице 1.
Обнаружение ВПЧ
Тестирование на ВПЧ
проводили с использованием микрочипа ДНК MyHPV (Mygene Co., Сеул, Корея) в соответствии с протоколами производителя. Вкратце, образцы для тестирования на ВПЧ были отдельно собраны из мазков Папаниколау с использованием эндоцервикальных щеток, которые поставлялись с набором MyHPV Chip.ДНК выделяли с использованием набора для выделения (MyGene) и проводили вложенную ПЦР для амплификации гена. Для первой ПЦР смесь двух наборов праймеров — MY09 (5′-CGT CCM ARR GGA WAC TGA TC-3 ‘; 20 пмоль) и MY11 (5′-GCM CAG GGW CAT AAY AAT GG-3′; 20 pmol) — использовался. Для второй ПЦР использовали праймеры HPV GP5 + (5’-TTT GTT ACT GTG GTA GAT ACT AC-3 ‘; 20 пмоль) и GP6 + (5′-GAA AAA TAA ACT GTA AAT CAT ATT C-3’; 20 пмоль) были использованы. ПЦР-амплификацию β-глобина выполняли в качестве внутреннего контроля. Продукты ПЦР подвергали электрофорезу в 3% агарозном геле.Продукты первой ПЦР имели длину 450 п.о., а продукты второй ПЦР — 150 п.о. ПЦР-продукты с β-глобином имели размер 250 п.н. После 1 -й ПЦР 2 мкл продуктов ПЦР использовали для 2 -й ПЦР. Десять микролитров второго продукта ПЦР денатурировали в течение 5 минут при 95 ° C и оставляли в ледяной воде на 5 минут. Затем продукт смешивали с буфером для гибридизации (MyGene). Эту смесь наносили на ДНК-чип и подвергали реакции гибридизации в течение одного часа в камере для гибридизации (Vision Scientific, Сеул, Корея) при 43 ° C.После гибридизации продукт дважды промывали буфером I (2 × стандартный цитрат физиологического раствора [SSC], 0,1% додецилсульфат натрия [SDS]), дважды — буфером II (0,2 × SSC) и один раз — буфером III (0,1 × SSC. ) по 5 минут каждое. Гибридизированную ДНК ВПЧ идентифицировали с помощью сканера модели G4000 (GSI Lumonics, Billerica, MA, USA). К каждому чипу ДНК прикрепляли пару олигонуклеотидных зондов для каждого из 24 типов HPV. Когда пара конкретных зондов вызывала флуоресцентный ответ, тест считался положительным для этого типа HPV.Используемый микрочип ДНК способен идентифицировать определенные генотипы ВПЧ и множественные инфекции ВПЧ. Микрочип ДНК ВПЧ включал 43 генотипа, в том числе ВПЧ-16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 82, 26, 53, 66, 67, 69, 70. , 73, 6, 11, 34, 40, 42, 43, 44, 54, 55, 61, 62, 72, 81, 7, 10, 27, 30, 32, 57, 83, 84 и 91. Все 43 подтипы ВПЧ обнаруживаются на чипе. Мы рассматривали HPV-16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 и 59 как типы HR-HPV [16], а остальные типы — как низкий / неопределенный риск.
Статистический анализ
Кривые кумулятивных показателей заболеваемости LSIL и HSIL были построены с использованием метода Каплана-Мейера и сравнивались с использованием критерия логарифмического ранга. Регрессионный анализ Кокса был проведен для оценки факторов риска, связанных с HSIL, включая возраст, персистирующую инфекцию, множественную инфекцию и генотип ВПЧ. Для каждого фактора оценивались отношения рисков и 95% доверительный интервал (ДИ). Все тесты были двусторонними, и значения p- <0.05 считались статистически значимыми. Статистический анализ выполняли с использованием статистического программного обеспечения Stata / IC версии 12 (StataCorp Ltd., College Station, TX, USA).
Результаты
Характеристика исследуемой популяции
Всего в анализ были включены 265 женщин со средним возрастом 46 лет (диапазон: 30–71 год), которые были HPV-положительными, но цитологически отрицательными на исходном уровне. Инфекция HR-HPV была обнаружена у 158 (59,6%) женщин, а инфекция HPV низкого / неопределенного риска — у 107 (40.4%) женщин на начальных тестах на ВПЧ. Из 265 проанализированных женщин один тип ВПЧ был обнаружен у 190 (71,7%) женщин и ≥ 2 типов ВПЧ выявлен у 79 (29,8%) женщин. Из них 60 женщин имели 2 типа, 16 женщин 3 типа, 1 женщина 4 типа и 2 женщины 5 типов ВПЧ. ВПЧ-16 был наиболее часто обнаруживаемым генотипом (19,6%; 52 из 265 женщин), отдельно или в сочетании с другими типами, за которым следовали ВПЧ-70 (16,6%; 44/265) и ВПЧ-53 (13,6%; 36). / 265). Распространенность ВПЧ-18 составила 7,5% (20/265).Распространенность ВПЧ-58, который, как известно, является генотипом с высокой распространенностью в Восточной Азии, присутствовала у 11,3% (30/265) исследуемой популяции. Распространенность остальных типов ВПЧ включала ВПЧ-52 (11,7%; 31/265), ВПЧ-66 (9,1%; 24/265) и ВПЧ-54 (7,5%; 20/265). Распространенность ВПЧ-31, 33, 35, 39, 45, 51, 56, 59, 6, 11, 40, 42, 43, 44, 68, 69, 72 и 84 была менее 5%. Распространенность каждого генотипа показана на Рисунке 1А.
Рисунок 1. Показатели распространенности генотипов ВПЧ и аномалий шейки матки у женщин с положительными и отрицательными результатами цитологического исследования.
Показатели распространенности различных генотипов ВПЧ у 265 женщин с положительными и отрицательными результатами цитологического исследования (А). Кумулятивные показатели заболеваемости плоскоклеточными интраэпителиальными поражениями низкой степени (LSIL) и плоскоклеточными интраэпителиальными поражениями высокой степени (HSIL) на основе 265 женщин с ВПЧ-положительными реакциями, включая типы высокого и низкого риска (B).
https://doi.org/10.1371/journal.pone.0058678.g001
Частота аномалий шейки матки при контрольных осмотрах
В течение периода наблюдения LSIL был обнаружен у 23.4% женщин (62 из 265) и HSIL был обнаружен у 7,5% женщин (20 из 265). Совокупные показатели заболеваемости LSIL и HSIL среди включенных в исследование 265 женщин показаны на Рисунке 1B. Для LSIL кумулятивные показатели заболеваемости за 1, 2 и 5 лет составили 12,0% (95% ДИ: 8,6–16,7), 19,5% (95% ДИ: 15,0–25,0) и 31,7% (95% ДИ: 24,1–25,0). 40.9) соответственно. Для HSIL совокупные коэффициенты заболеваемости за 1, 2 и 5 лет составили 1,9% (95% ДИ: 0,8–4,6%), 5,0% (95% ДИ: 2,8–8,6%) и 11,1% (95% ДИ: 6,8–17,8%) соответственно. Все HSIL были обнаружены в течение 5 лет после контрольных обследований.При ограничении только женщинами с инфекцией HR-HPV (n = 158) кумулятивные показатели заболеваемости HSIL за 1, 2 и 5 лет составили 3,3% (95% ДИ: 1,4–7,7%), 8,4% (95% ДИ: 4,8–14,3%) и 18,1% (95% ДИ: 11,4–28,2%) соответственно.
Оценка риска LSIL у ВПЧ-положительных и цитологических отрицательных случаев
Из оцененных факторов риска развитие LSIL во время последующего наблюдения было связано с персистирующей инфекцией LR-HPV (отношение рисков = 2,280, 95% ДИ: 1,003–5,184, p = 0.049). Персистирующая инфекция HR-HPV также имела тенденцию показывать повышенный риск развития LSIL, но не была статистически значимой (отношение рисков = 1,343, 95% ДИ: 0,985–1,831, p = 0,062). Хроническая инфекция присутствовала у 84 (43,5%) из 193 женщин. Из них 63 имели стойкую инфекцию HR-HPV, а оставшиеся 21 имели инфекцию HPV низкого / неопределенного риска. Остальные факторы риска, включая возраст (≤ 45 против> 45 лет; p = 0,658), тип ВПЧ (HR против низкого / неопределенного; p = 0.997) и множественные инфекции ( p = 0,759) существенно не различались с точки зрения частоты LSIL.
Оценка риска HSIL у ВПЧ-положительных и цитологических отрицательных женщин
Из оцененных факторов риска HR-HPV (отношение рисков = 47,979, 95% ДИ: 1,209–1904,472, p = 0,039) и стойкая инфекция HR-HPV (отношение рисков = 5,153, 95% ДИ: 1,872– 14,179, p = 0,002) были достоверно связаны с развитием HSIL.HSIL также не был обнаружен у женщин с ВПЧ низкого / неопределенного риска, даже у женщин с устойчивой инфекцией ВПЧ низкого / неопределенного риска, и все случаи HSIL развились у женщин с инфекцией ВПЧ-HR. Пожилой возраст (> 45 лет) (отношение рисков = 1,574, 95% ДИ: 0,627–3,947, p = 0,334) и множественные инфекции ВПЧ (отношение рисков = 2,051, 95% ДИ: 0,849–4,951, p = 0,110), как правило, были связаны с более высокой частотой HSIL, но эти отношения не были статистически значимыми.
При наблюдении у женщин с инфекцией HR-HPV стойкая инфекция HPV все еще была значимым фактором, связанным с развитием HSIL (отношение рисков = 15,459, 95% ДИ: 2,042–117,045, p = 0,008) (Таблица 2). Пятилетний кумулятивный уровень заболеваемости HSIL составил 32,3% (95% ДИ: 19,7–50,2%) среди женщин с персистирующей инфекцией ВПЧ, но был только 1,8% (95% ДИ: 0,3–11,9%) среди женщин с транзиторной инфекцией ВПЧ. . Интересно, что при использовании классических классификаций онкогенных групп HR-HPV (HPV-16 и / или -18 vs.десять других типов HR), частота HSIL не различалась между ними (отношение рисков = 1,103, 95% ДИ: 0,457–2,662, p = 0,828), что позволяет предположить, что один из других десяти типов HR-HPV является основной онкогенный тип ВПЧ. Пятилетний кумулятивный уровень заболеваемости HSIL составил 21,2% (95% ДИ: 10,2–40,9%) для случаев ВПЧ-16 и / или -18, но 15,8% (95% ДИ: 8,9–27,2%) у женщин с другие десять типов HR-HPV.
HPV-58 является основным фактором риска развития HSIL у HPV-положительных и цитологических отрицательных женщин
Когда все женщины были разделены на 4 группы в зависимости от генотипа ВПЧ на исходном уровне, между группами были обнаружены значительные различия в частоте HSIL ( p <0.001, рисунок 2). Кумулятивные показатели заболеваемости HSIL за 5 лет составили 34,0% (95% ДИ: 17,3–59,8%) среди положительных случаев ВПЧ-58, 28,0% (ДИ 95%: 13,8–51,6) среди положительных случаев ВПЧ-16, 5,5% ( 95% ДИ: 2,1–14,0%) среди женщин, положительных по десяти другим типам ВПЧ-ВПЧ, и 0% среди женщин с типами ВПЧ низкого / неопределенного риска. Женщины с ВПЧ-58 продемонстрировали более высокий коэффициент риска (отношение рисков = 5,260, 95% ДИ: 1,538–17,987, p = 0,008) для развития HSIL, чем женщины с ВПЧ-16 (отношение рисков = 3.822, 95% ДИ: 1,176–12,424, p = 0,026) по сравнению с женщинами с другими десятью типами HR-HPV (таблица 2). В многофакторном анализе персистирующая инфекция (отношение рисков = 14,248, 95% ДИ: 1,861–109,115, p = 0,011) и HPV-58 (отношение рисков = 4,244, 95% ДИ: 1,013-17,780, p = 0,048 ) были независимо связаны с развитием HSIL у женщин с инфекцией HR-HPV (Таблица 2).
Рис. 2. Совокупная частота плоскоклеточных интраэпителиальных поражений высокой степени злокачественности (HSIL) в соответствии с генотипами ВПЧ.
Женщины с ВПЧ-положительными и цитологическими отрицательными результатами были разделены на 4 группы в зависимости от генотипа ВПЧ, выявленного при первом обследовании. Значительные различия в частоте HSIL были обнаружены между 4 группами. Обратите внимание, что существует более высокий риск развития HSIL у женщин с инфекцией HPV-58.
https://doi.org/10.1371/journal.pone.0058678.g002
Обсуждение
Ведение женщин с инфекциями HR-HPV и отрицательными цитологическими результатами является важным вопросом.Текущая рекомендация для этих случаев — совместное тестирование на ВПЧ и цитологию каждые 12 месяцев или немедленное тестирование на генотип ВПЧ только на ВПЧ-16 или на ВПЧ-16 и / или -18. Настоящие результаты предполагают, что обнаружение стойкой инфекции ВПЧ имеет решающее значение для прогнозирования ЦИН 2/3 у ВПЧ-положительных и цитологических отрицательных женщин. Наши результаты ясно демонстрируют, что повторное тестирование ДНК ВПЧ для выявления стойкой инфекции является практическим методом, который можно использовать для независимого прогнозирования ВПЧ у женщин с отрицательными цитологическими результатами, несмотря на тот факт, что текущие тесты ДНК ВПЧ не могут отличить истинную персистирующую инфекцию от преобладающей. ВПЧ и случайное инфицирование одним и тем же типом ВПЧ (повторное определение одного и того же генотипа).Таким образом, персистирующая инфекция в этом исследовании эквивалентна либо невылеченной инфекции ВПЧ, либо повторной инфекции с тем же генотипом. Из 63 женщин с персистирующей инфекцией HR-HPV, описанной в настоящем исследовании, у 15 (23,8%) развился HSIL в течение периода последующего наблюдения. Однако из 63 случаев HR-HPV без стойкой инфекции только у 1 (1,6%) развился HSIL во время последующего наблюдения. Женщины с персистирующей инфекцией, но без HSIL, могут иметь повторные инфекции, которые не являются персистирующими, или ВПЧ элиминируется через ≥ 1 года, или эти пациенты могут проходить только краткосрочные контрольные обследования.
Статус
HR-HPV, особенно HPV-16 и / или -18, является важным предиктором HSIL + у женщин с отрицательной цитологией [13], [14], [15]. 10-летний кумулятивный уровень заболеваемости HSIL + у женщин ≥ 30 лет с отрицательной цитологией составил 20,7% (95% ДИ: 8,6–32,8%) и 17,7% (95% ДИ: 0,0–36,0%) для положительных по ВПЧ-16. и женщины, инфицированные ВПЧ-18, соответственно [14]. Исследование Kjaer et al. [15] сообщили, что оценочная вероятность развития HSIL + у женщин с отрицательным цитологическим исследованием и положительным результатом на ВПЧ-16 и -18 составляет 26.7% (95% ДИ: 21,1–31,8%) и 19,1% (95% ДИ: 10,4–27,3%), соответственно, после изучения популяции в течение 12 лет. В этом исследовании 5-летняя кумулятивная частота HSIL у женщин в возрасте ≥ 30 лет с отрицательными цитологическими результатами, положительными на ВПЧ-16 и / или -18, составила 21,2% (95% ДИ: 10,2–40,9%), но среди женщин с другими типами ВПЧ-HR этот показатель составлял 15,8% (95% ДИ: 8,9–27,2%). Существует несоответствие между совокупными показателями заболеваемости HSIL у женщин с другими типами HR-HPV (не-HPV-16 и / или -18), поскольку 10-летний совокупный уровень заболеваемости HSIL + был только 1.5% (95% ДИ: 0,3–2,7%) среди HR-HPV-положительных женщин, которые были отрицательными на HPV-16 и / или -18, согласно исследованию Khan et al. [14]. Это несоответствие можно объяснить высокой распространенностью ВПЧ-58 и его значительной ассоциацией с HSIL в этом исследовании.
О высокой распространенности ВПЧ-58 сообщалось в Восточной Азии, включая Китай (28% в Шанхае, 10% в Гонконге и 10% в Тайване), Корее (16%) и Японии (8%) [9] , [17], [18]. Хотя более высокая распространенность ВПЧ-58 в Восточной Азии до конца не изучена, предполагается, что генетические характеристики и варианты ВПЧ-58 с различной онкогенностью играют определенную роль [9], [19].Сообщалось об относительно высоком вкладе HPV-58 в развитие плоскоклеточного рака в Восточной Азии [17], [18], [20], [21], [22], [23], [24]. Кроме того, ВПЧ-58 был обнаружен у относительно высокой доли пациентов с дисплазией шейки матки высокой степени в Китае [25]. У корейских женщин ВПЧ-58 является вторым по распространенности типом ВПЧ у женщин с аномальной цитологией шейки матки [12]. В этом исследовании мы показываем, что инфекция HPV-58 связана с высоким риском развития HSIL среди женщин с отрицательными цитологическими результатами.Мы также демонстрируем, что одного обнаружения HPV-16 и / или -18 недостаточно для прогнозирования развития HSIL у HPV-положительных, цитологических отрицательных женщин и включения обнаружения HPV-58 в сочетании с HPV-16 и / или -18. имеет важное значение для улучшения прогнозирования HSIL в стране с высокой распространенностью HPV-58. В этом исследовании все случаи HSIL были обнаружены в течение 5 лет. Это может быть частично связано с прекращением сбора данных, когда женщины получили отрицательные результаты биопсии, потому что HSIL развивается из нормальной шейки матки в течение длительного периода времени.Однако раннее выявление HSIL может иметь значение для разработки руководящих принципов, рекомендующих немедленное тестирование на генотип HPV (только для HPV-16 или для HPV-16 и / или -18) для женщин с HR-HPV-положительными, но отрицательными по цитологическому анализу. результаты [4]. В этом исследовании мы подчеркиваем высокую онкогенность HPV-58 для развития HSIL. Кроме того, эти результаты важны в эпоху вакцинации против ВПЧ для профилактики рака шейки матки. Наши результаты также предполагают, что ВПЧ-58 следует включать в схемы вакцинации против ВПЧ, особенно в странах с высокой распространенностью.
В заключение, настоящие результаты предполагают, что обнаружение преобладающей и стойкой инфекции ВПЧ может быть многообещающей стратегией для лечения пациентов, у которых положительный тест на ВПЧ-ВПЧ, но отрицательный цитологический результат. Кроме того, высокая связь между ВПЧ-58 и развивающимся HSIL указывает на то, что идентификация генотипа ВПЧ-58 важна для ведения женщин, которые являются ВПЧ-положительными и цитологически отрицательными в стране с высокой распространенностью инфекции ВПЧ-58. .
Вклад авторов
Задумал и спроектировал эксперименты: COS EJK JC GG. Проведены эксперименты: COS JC GG. Проанализированы данные: COS JSS. Предоставленные реагенты / материалы / инструменты анализа: COS JSS EJK JC GG. Написал статью: COS JSS JC.

 В таком состоянии его сложно выявить методом ПЦР.
В таком состоянии его сложно выявить методом ПЦР.