Полезная информация
Профилактика описторхоза
Отсутствие вакцинопрофилактики и лекарств, предупреждающих заражение, делает особенно важным знание мер профилактики заражения описторхозом.
Описторхоз – глистное паразитарное заболевание, возбудителем которого является плоский червь из рода Opisthorchis. Заболевание отличается длительным течением, частыми обострениями, отягощает течение многих сопутствующих заболеваний, способствует возникновению первичного рака печени и поджелудочной железы. Территория Ханты-Мансийского автономного округа – Югры эндемична по описторхозу. Заражение описторхозом происходит при употреблении в пищу рыбы семейства карповых, содержащей жизнеспособные личинки паразита. К ним относится язь, елец, плотва (чебак), лещ, линь, пескарь, гольян, верховка, красноперка, карась.
Не может быть источником описторхоза мясо таких рыб, как окунь, судак, ерш, пелядь (сырок), хариус, чир, пыжьян, ряпушка, таймень, тугун, щекур, омуль, нельма, муксун, стерлядь, налим.
ПРЕДУПРЕЖДЕН – ЗНАЧИТ ВООРУЖЕН
- Варка рыбы в течение 15-20 минут с момента закипания.
- Жарение рыбы в течение 15-20 минут небольшими кусками, в распластанном виде, под крышкой, с добавлением достаточного количества жира.
- Приготовление котлет, тефтелей из рыбы 15-20 минут.
- Приготовление рыбного пирога в духовке не менее 60 минут.
- Посол рыбы в течение двух и более недель из расчета 2 кг соли на 10 кг рыбы.
Лечение необходимо
Среди населения бытует мнение, что лечить описторхоз, пока живешь на Севере, не обязательно. Это совершенно ошибочное мнение, так как при каждом повторном заражении количество гельминтов в организме человека возрастает, и вред они принесут гораздо больший. Существующие в настоящее время безопасные схемы лечения практически не имеют противопоказаний, побочных эффектов и даже могут проводиться повторно. Весь курс лечения в среднем составляет не более месяца.
Кроме этого:
- Нельзя употреблять малосоленую рыбу и строганину.
- Нельзя пробовать сырую рыбу и рыбный фарш на соленость и готовность.
- Соблюдать технику разделки рыбы: необходимо иметь для сырой рыбы отдельные нож, тарелку и разделочную доску.
- Разделочные доски и ножи после обработки рыбы нужно обязательно вымыть с мылом и ошпарить кипятком.
ПУТИ ЗАРАЖЕНИЯ
- Употребление в пищу рыбы малосоленой, непрожаренной, свежемороженой («строганина», «патанка», блюдо «хе»), свежевыловленной («парная») и др.
- Через кухонную утварь – доски, ножи, ветошь, которые используются для разделки сырой или плохо обработанной рыбы.
НЕЛЬЗЯ заразиться описторхозом, употребляя воду из открытых водоемов.
НЕЛЬЗЯ заразиться от больного человека и рыбоядных млекопитающих.
Описторхоз легче предупредить, чем лечить!
Гельминты рыб и как ими не заразится?
Рыба – ценный продукт питания, богатый источник полноценного белка, легкоусвояемого жира, богатого жирорастворимыми витаминами, употребление которых необходимо как взрослым, так и детям.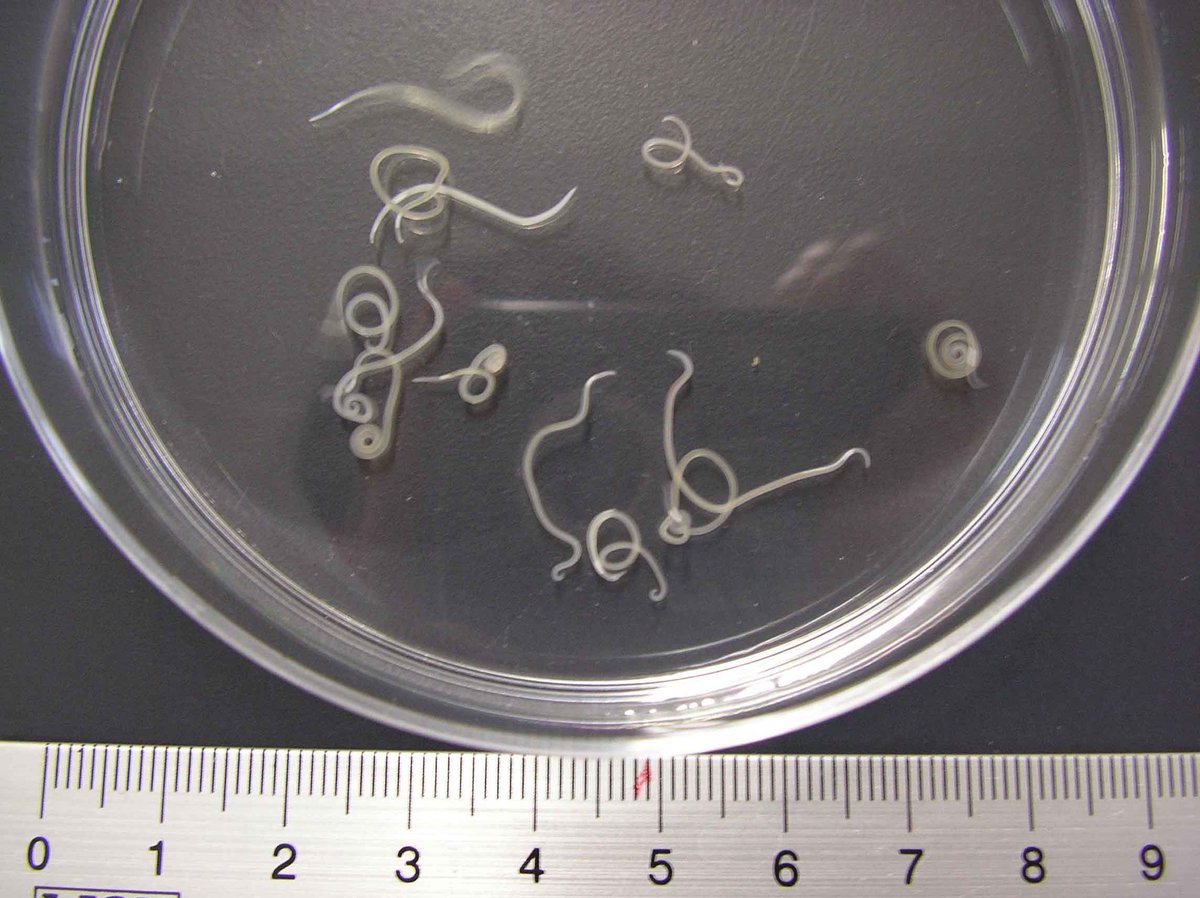 По биологической ценности белки рыбы не уступают белкам мяса и значительно легче перевариваются ферментами желудочно-кишечного тракта, хорошо усваиваются организмом человека. Вместе с тем, речные и морские рыбы, а также ракообразные и некоторые беспозвоночные могут быть заражены гельминтами, опасными для человека. Коварство ситуации заключается в том, что внешние признаки, свидетельствующие о наличие в рыбе таких паразитов, отсутствуют. В этих случаях рыба является лишь переносчиком заболеваний, поражающих людей, домашних и диких животных при ее употреблении.
По биологической ценности белки рыбы не уступают белкам мяса и значительно легче перевариваются ферментами желудочно-кишечного тракта, хорошо усваиваются организмом человека. Вместе с тем, речные и морские рыбы, а также ракообразные и некоторые беспозвоночные могут быть заражены гельминтами, опасными для человека. Коварство ситуации заключается в том, что внешние признаки, свидетельствующие о наличие в рыбе таких паразитов, отсутствуют. В этих случаях рыба является лишь переносчиком заболеваний, поражающих людей, домашних и диких животных при ее употреблении.
Через различные виды рыб человек может заразиться гельминтозами. Всего в списке паразитозов, передающихся через рыб и представляющих опасность для человека, насчитывается около 20 видов. Одно из самых распространенных заболеваний, которое они вызывают, является описторхоз. Это заболевание печени и желчевыводящих путей, вызываемое плоскими червями-паразитами («кошачий сосальщик»), которые попадают в организм человека посредством употребления в пищу рыбы, зараженной личинками. Две трети мирового ареала возбудителя описторхоза приходится на территорию России. Неблагополучными территориями по описторхозу являются бассейны рек Оби, Иртыша, Урала, Волги, Камы, Днепра, Дона, Северной Двины, Немана, Енисея.
Две трети мирового ареала возбудителя описторхоза приходится на территорию России. Неблагополучными территориями по описторхозу являются бассейны рек Оби, Иртыша, Урала, Волги, Камы, Днепра, Дона, Северной Двины, Немана, Енисея.
Важное значение в распространении возбудителя описторхоза приобрели массовые миграции населения, отток людей, занятых на вахтовой и экспедиционно-вахтовой работе на эндемичных территориях по описторхозу. В результате происходит вывоз инвазии на другие территории.
В 2017 году в Тамбовской области было зарегистрировано 14 случаев описторхоза, что почти в полтора раза больше, чем в 2016 году.
Заражение человека описторхозом происходит при употреблении в пищу сырой, слабо проваренной, малосоленой, недожаренной рыбы карповых пород, содержащих жизнеспособные личинки гельминта. Во взрослом состоянии описторхисы паразитируют в желчных протоках печени, в желчном пузыре и протоках поджелудочной железы у человека, домашних животных (кошки, собаки), диких животных (песца, лисы, норки, выдры). Средний размер гельминтов 7-12 мм. Инкубационный (скрытый) период при описторхозе составляет 2-4 недели. В клиническом течении болезни различают острую и хроническую стадию.
Средний размер гельминтов 7-12 мм. Инкубационный (скрытый) период при описторхозе составляет 2-4 недели. В клиническом течении болезни различают острую и хроническую стадию.
В острой стадии описторхоз протекает как острый аллергоз. Выявляются такие признаки как повышение температуры тела, боли в животе, чаще в правом подреберье, различные кожные высыпания. Для хронической стадии характерны явления холецистита с периодическими обострениями и ремиссиями. Больных беспокоят тяжесть и периодически возникающие боли в правом подреберье, эпигастрии, снижение аппетита, тошнота, вздутие живота, запор или жидкий стул с развитием дисбактериоза. Исходом заболевания без лечения являются цирроз и рак печени.
Дифиллоботриоз — это гельминтоз, протекающий с признаками преимущественного поражения желудочно-кишечного тракта и часто сопровождающийся развитием анемии. Возбудитель дифиллоботриоза — широкий лентец. Очаги дифиллоботриоза существуют на озере Байкал, в низовьях Оби, на озерно-речных системах Енисейско-Ленского региона. Интенсивные очаги с возбудителем D.latum приурочены к долинам рек Оби, Иртыша, Волги, Камы, Днепра, Северной Двины, Дона, Енисея.
Интенсивные очаги с возбудителем D.latum приурочены к долинам рек Оби, Иртыша, Волги, Камы, Днепра, Северной Двины, Дона, Енисея.
Заражение человека происходит при употреблении свежей, недостаточно просоленной щучьей или окуневой икры (так называемой «пятиминутки») и сырой рыбы, чаще всего — окуня, ерша, щуки, налима и дальневосточных лососевых. Окончательными хозяевами лентеца широкого являются человек, собаки, кошки, медведи, лисицы, свиньи. Промежуточные хозяева — пресноводные рачки (циклопы, диаптомусы), дополнительные — пресноводные рыбы.
Инкубационный период составляет от 20 до 60 дней. Широкий лентец паразитирует в организме человека 10-20 лет, достигая в длину 15 и более метров. Заболевание начинается постепенно. На первый план в клинике дифиллоботриоза выступают поражения желудочно-кишечного тракта. Возникает тошнота, реже — рвота, боли в эпигастрии или по всему животу, снижается аппетит, стул становится неустойчивым, появляется субфебрилитет. Периодически имеет место отхождение части тела гельминта с испражнениями. Параллельно появляются и нарастают признаки астено-невротического синдрома (слабость, утомляемость, головокружение). При длительном течении инвазии возможно развитие В12 — дефицитной анемии.
Параллельно появляются и нарастают признаки астено-невротического синдрома (слабость, утомляемость, головокружение). При длительном течении инвазии возможно развитие В12 — дефицитной анемии.
К числу гельминтозов, заражение которыми происходит от морских рыб, относится анизакидиоз. Это заболевание вызывают личинки круглых червей (нематод), которые поражают практически все виды морских и проходных рыб (тресковые, сельдевые, окуневые, лососевые и многие другие). Уровень поражённости рыб анизакидами относительно высок. В частности, поражённость сельдевых в Балтийском море около 30 %, а в Северном море достигает — 100%. Случаи анизакидоза регистрируются во многих странах, но чаще всего в Японии, Корее, Тайване, что связано с распространенной здесь пищевой традицией – употреблять в пищу сырую рыбу.
В настоящее время во всем мире, и в том числе в России, широкое распространение получили японские блюда, приготовляемые из сырой рыбы (суши, сашими), и соответственно увеличился риск распространения анизакидоза среди населения других стран и регионов. Человек заражается анизакидами при употреблении в пищу сырой или недостаточно термически обработанной рыбы и водных беспозвоночных (кальмаров, осьминогов, креветок и других ракообразных и моллюсков). Инкубационный период составляет от нескольких часов до 7-14 суток.
Человек заражается анизакидами при употреблении в пищу сырой или недостаточно термически обработанной рыбы и водных беспозвоночных (кальмаров, осьминогов, креветок и других ракообразных и моллюсков). Инкубационный период составляет от нескольких часов до 7-14 суток.
Клиническая картина заболевания обусловлена местом локализации паразитов. При нахождении личинок в просвете кишечника симптоматика может быть весьма скудной и неспецифичной: тошнота, рвота, боли в животе, крапивница, лихорадка, диарея. При желудочной локализации (наиболее частая форма заболевания) больных беспокоит сильная боль в эпигастрии, тошнота, рвота, иногда с кровью. При кишечном анизакидозе больные жалуются на боли в области пупка и в правой подвздошной области, урчание в животе, метеоризм.
Личинки анизакид могут способствовать развитию острых язв с перфорацией и некрозом стенки желудка и кишечника, которые приводят к возникновению симптомокомплекса острого живота, характерного для аппендицита или непроходимости кишечника. Течение заболевания может быть острым, подострым или хроническим. Болезнь обычно выявляется случайно, например, при эндоскопических исследованиях, биопсии или во время хирургических операций.
Течение заболевания может быть острым, подострым или хроническим. Болезнь обычно выявляется случайно, например, при эндоскопических исследованиях, биопсии или во время хирургических операций.
Еще один паразитоз, связанный с употреблением недостаточно термически обработанной рыбы (кета, кумжа, мальма, амурский сиг, таймень, ленок, амурский хариус; реже — гольяны), — нанофиетоз. Возбудитель — нанофиетус. Срок жизни паразита — от 35 дней да 2-х месяцев. Клинические проявления заболевания зависят от количества попавших в организм паразитов. Болезнь может протекать бессимптомно или с явлениями энтерита. При попадании в организм более 500 паразитов симптомы наблюдаются через 1-3 недели после заражения (понос, боли в области живота, тошнота, рвота, урчание). Вследствие небольшой протяженности жизни паразита при отсутствии повторного заражения болезнь может закончиться спонтанным выздоровлением.
Меры профилактики гельминтозов связанных с употреблением рыбы, просты.
Главным в профилактике является соблюдение правил технологии приготовления рыбных блюд:
- * рыбу употреблять в пищу только вареную, прожаренную, копченую или хорошо просоленную;
- * варить или жарить рыбу необходимо порционными кусками в течение 20 минут с момента закипания воды или жира, желательно под крышкой; рыбные пельмени — не менее 5 минут с момента закипания;
- * жарить в распластанном виде также небольшими кусками не менее 15-20 минут;
- * солить из расчета: 2 кг соли на 10 рыбы с двухнедельной выдержкой, крупную (свыше 25 см) — в течение 40 суток;
- * вялить в течение 3 недель с предварительным трехдневным посолом: 2 кг соли на 10 кг рыбы;
- * выпекать пироги с рыбой в течение часа;
- * варить и жарить пельмени с рыбным фаршем и котлеты из него 15-20 минут;
- * тщательно проваривать морские продукты;
- * запрещается употребление в пищу сырой рыбы, «строганины», «патанки», с какими бы приправами они не делались.

После обработки свежей рыбы необходимо тщательно мыть руки, разделочные доски и инвентарь.
В быту надо пользоваться отдельными разделочными досками только для рыбы.
Нельзя покупать рыбу в несанкционированных местах.
Все об описторхозе
А.А. РОСТОВЦЕВ, доктор сельскохозяйственных наук, профессор, директор ЗапСибНИИ водных биоресурсов и аквакультуры С.М. СОУСЬ, кандидат биологических наук, старший научный сотрудник института систематики и экологии животных СО РАН
Самый крупный очаг описторхоза — Обь-Иртышский
Описторхоз — тяжелое глистное заболевание человека и плотоядных животных, вызываемое трематодой (описторхис фелиниус) — кошачьей двуусткой, которая паразитирует в печени, желчном пузыре и желчных протоках.
Возбудитель описторхоза широко распространен почти на всем европейском континенте. Встречается во Франции, Италии, Голландии, Венгрии, Швеции, Швейцарии и других странах, однако проблемы заболевания в этих регионах не существует, так как население не употребляет в пищу необезвреженную рыбу.
На территории бывшего СССР находится несколько очагов описторхоза. Днестровский и Неманский расположены на территории Молдовы, Западной Украины, Литвы и Белоруссии. Это очаги слабой инфекции, пораженность населения колеблется от долей процента до 10 процентов. Днепровский очаг — в бассейне Днепра — расположен на территории Украины и частично России. Восточнее — Волжский очаг. Пораженность населения здесь тоже небольшая и колеблется от одного до 15 процентов. Самый крупный очаг — в Западной Сибири — Обь-Иртышский (Алтайский край, Новосибирская, Тюменская, Томская и Омская области), где пораженность населения превышает среднефедеральный уровень в 3 — 29 раз. В отдельных поселках она составляет 100 процентов.
В Новосибирской области, по данным ФГУЗ «Центр гигиены и эпидемиологии», описторхоз среди гельминтозов вышел на первое место, так как количество яиц описторхид составляет 70 процентов от количества яиц других выявленных биогельминтов.
Жизненный цикл этого гельминта довольно сложный, складывается из ряда последовательных стадий развития, каждой из них соответствуют разные жизненные формы паразита, преобразование которых сопровождается сменой хозяев — промежуточных (переднежаберные моллюски семейства битиниид), дополнительных (рыбы семейства карповых) и окончательных (млекопитающие — грызуны, ондатра, водная полевка, хищники — псовые, куницеобразные, кошачьи и человек — всего около 30 видов).
Описторхиды очень плодовиты и могут выделять в сутки около 1 000 яиц. Яйца, содержащие маленькие, покрытые ресничками личинки, выносятся во внешнюю среду с фекалиями человека и животных (кошки, собаки и др.) и попадают в воду. Установлено, что яйца описторхид сохраняют жизнеспособность в воде при температуре 4 — 70 градусов в течение 17 месяцев. В воде яйцо с находящейся в нем личинкой (мирацидией) заглатывает первый промежуточный хозяин — моллюск из семейства битиниид. В кишечнике моллюска из яйца вылупляется личинка, которая проникает через стенку кишечника моллюска в полость его тела, где превращается в спороцисту. Через месяц спороциста отрождает более ста редий, представляющих собой мешковидные образования с крупной глоткой и кишечником. Покидая спороцисту, редии мигрируют в печень моллюска. При первичном заражении промежуточного хозяина паразиты, достигшие стадии редии, впадают в состояние диапаузы вместе со своим хозяином с середины августа до мая следующего года. С наступлением весны они возобновляют свое развитие в связи с активизацией моллюска. При этом они дают новое поколение личинок — церкарий. Церкарии подвижны и имеют хвост. Примерно через два месяца с момента активации моллюска церкарии выходят из его тела в воду, где активно плавают (до 40 — 50 часов) близ дна водоема. Двигаясь в воде при помощи хвоста, они нападают на дополнительных хозяев — рыб семейства карповых. Сразу после прикрепления к телу рыбы церкарии отбрасывают хвост и быстро проникают через кожу в толщу ткани рыбы. Достаточно 15 минут, чтобы они оказались в подкожной клетчатке и мышцах рыбы, где превращаются в метацеркариев. Форма цисты зрелой метацеркарии — шаровидная или овальная. В рыбе она примерно через 1,5 месяца становится зрелой, инвазионной, то есть способной вызвать заражение человека и других окончательных хозяев (кошек, собак, свиней, ондатр и т. д.). В кислом желудочном соке окончательного хозяина метацеркарии освобождаются от наружной оболочки, а в щелочном содержимом двенадцатиперстной кишки — от внутренней. Затем паразиты мигрируют в печень, проникая через фатеров сосок в желчный пузырь или поджелудочную железу, и через 20 — 28 дней достигают половой зрелости.
При этом они дают новое поколение личинок — церкарий. Церкарии подвижны и имеют хвост. Примерно через два месяца с момента активации моллюска церкарии выходят из его тела в воду, где активно плавают (до 40 — 50 часов) близ дна водоема. Двигаясь в воде при помощи хвоста, они нападают на дополнительных хозяев — рыб семейства карповых. Сразу после прикрепления к телу рыбы церкарии отбрасывают хвост и быстро проникают через кожу в толщу ткани рыбы. Достаточно 15 минут, чтобы они оказались в подкожной клетчатке и мышцах рыбы, где превращаются в метацеркариев. Форма цисты зрелой метацеркарии — шаровидная или овальная. В рыбе она примерно через 1,5 месяца становится зрелой, инвазионной, то есть способной вызвать заражение человека и других окончательных хозяев (кошек, собак, свиней, ондатр и т. д.). В кислом желудочном соке окончательного хозяина метацеркарии освобождаются от наружной оболочки, а в щелочном содержимом двенадцатиперстной кишки — от внутренней. Затем паразиты мигрируют в печень, проникая через фатеров сосок в желчный пузырь или поджелудочную железу, и через 20 — 28 дней достигают половой зрелости. Яйца описторхиса в кале окончательного хозяина появляются через 3 — 4 недели после заражения.
Яйца описторхиса в кале окончательного хозяина появляются через 3 — 4 недели после заражения.
Все развитие гельминта — от яйца до стадии половой зрелости — занимает около четырех месяцев, а с учетом стадии диапаузы — около полутора лет. Продолжительность жизни описторхисов у плотоядных животных равна трем годам, а в организме человека, по различным источникам, — от 10 до 20 — 25 лет.
Возбудитель описторхоза, как уже было отмечено, в стадии половой зрелости живет в желчных протоках печени, желчном пузыре, реже в протоках поджелудочной железы человека и плотоядных животных. В организме этих хозяев паразит может жить до 25 лет. Нередко у человека и животных паразитируют сотни и тысячи гельминтов.
По данным медиков, паразиты оказывают вредное воздействие на организмы человека и млекопитающих животных продуктами своей жизнедеятельности. Присасываясь к стенкам желчных протоков, протоков поджелудочной железы, желчного пузыря, они их повреждают. Скопления описторхов замедляют отток желчи, создают условия, способствующие проникновению в печень вредных бактерий. При описторхозной инвазии организм подвергается генерализованному воздействию. Длительное многолетнее присутствие возбудителя приводит к сенсибилизации и аллергизации организма больного. Кроме того, возбудитель описторхоза отнесен Международным агентством по изучению рака к первой группе канцерогенов человека.
При описторхозной инвазии организм подвергается генерализованному воздействию. Длительное многолетнее присутствие возбудителя приводит к сенсибилизации и аллергизации организма больного. Кроме того, возбудитель описторхоза отнесен Международным агентством по изучению рака к первой группе канцерогенов человека.
Через две-четыре недели после заражения описторхозом возникают лихорадка, иногда желтуха, появляются боли в животе, нередки тошнота, понос, сыпь на коже, ломота в мышцах и суставах, увеличивается печень, иногда селезенка.
Постепенно температура тела становится нормальной, состояние зараженного улучшается. Однако болезнь остается и переходит в позднюю, хроническую, стадию, когда больные указывают на боли под ложечкой и правом подреберье. Они могут носить постоянный характер или возникают жесткие приступы печеночных колик. Нередки жалобы на понижение аппетита, изжогу, тошноту, рвоту, вздутие живота и неустойчивый стул.
Довольно часто бывают головные боли, головокружения, повышенная раздражительность, плохой сон, боли в области сердца, то есть клиническая картина описторхоза полиморфна. Это обусловлено как индивидуальными особенностями больного, так и интенсивностью и продолжительностью инвазии. Диагноз ставится по факту обнаружения яиц описторхид в желчи, полученной при дуоденальном зондировании или при копроскопии фекальных масс при исследованиях под микроскопом по определенным методикам.
Это обусловлено как индивидуальными особенностями больного, так и интенсивностью и продолжительностью инвазии. Диагноз ставится по факту обнаружения яиц описторхид в желчи, полученной при дуоденальном зондировании или при копроскопии фекальных масс при исследованиях под микроскопом по определенным методикам.
Для лечения описторхоза применяют довольно большое количество различных лекарственных препаратов отечественного и зарубежного производства, использовать которые следует только по назначению и под контролем медицинского работника.
Нередко люди ошибаются, когда считают, что человек может заразится описторхозом практически от всех пресноводных рыб.
Метацеркарии описторхид населяют мышцы только карповых рыб, у хищных рыб (окуня, щуки, ерша, судака, налима и сиговых) метацеркарии описторхид не приживаются, и опасность заражения человека и животных от хищных рыб и сиговых (пеляди, муксуна, сига, чира и др.) отсутствует.
Из карповых рыб наиболее сильно заражены метацеркариями описторхид язь, плотва, елец, озерный гольян, верховка, пескарь. К второстепенным видам рыб по степени зараженности описторхидами относят леща, линя, карася серебряного.
К второстепенным видам рыб по степени зараженности описторхидами относят леща, линя, карася серебряного.
Ошибается тот, кто считает, что человек может заразиться описторхами, купаясь в водоеме, где плавают личинки описторхов — церкарии. Проникая через кожу человека, церкарии могут вызвать только зуд и высокую температуру, которая через сутки-двое проходит после гибели церкарии. Заражение человека церкариями не происходит, так как в церкариях отсутствуют зачатки половых (репродуктивных) органов.
Некоторая часть населения ошибочно путает лигул (ленточных плоских червей длиной от одного сантиметра до трех метров), паразитирующих в карповых рыбах (леще, плотве, карасях и др.), с описторхами. Описторхиды — это невидимый враг человека, так как личиночные стадии имеют размеры меньше 0,5 мм. Кстати, лигулид в некоторых странах употребляют в пищу. Например, в Италии их называют плоскими макаронами.
К основным очагам описторхоза в Новосибирской области относят Новосибирское водохранилище, Обь с притоками (Иней, Сарбояном, Колыванской поймой). Менее значимы очаги на притоках Иртыша (Тартасе, Таре, Оми и др.) и в районе карасукско-бурлинских озер. В последние годы у жителей области сложилось ошибочное мнение, что озеро Чаны стало относиться к водоемам, неблагополучным по зараженности рыб описторхами, а лещ Новосибирского водохранилища — к основному виду рыб, наиболее зараженному личинками описторха. Рыбы из Чанов, как и из других барабинских озер (Сартлана, Убинского, Тандово), не представляют опасности для человека, за исключением притоков озера Малые Чаны — рек Чулым, Каргат, Чулыменок, где промысловые виды рыб (язь, плотва) заражены описторхом незначительно — от одного до семи процентов, а непромысловые виды рыб (верхова, пескарь), редко употребляемые в пищу, заражены на сто процентов. В Новосибирском водохранилище и Оби из всех рыб в 1980 — 2011 годах лещ был наиболее слабо заражен возбудителями описторхоза — на 1,35 — 6,4 процента, наиболее сильно заражены язь и елец — 27 и 45 процентов соответственно. В водохранилище на 100 лещей заражены три рыбы, на 100 экземпляров плотвы — 13, на 100 язей — 32, на 100 ельцов — 36 рыб.
Менее значимы очаги на притоках Иртыша (Тартасе, Таре, Оми и др.) и в районе карасукско-бурлинских озер. В последние годы у жителей области сложилось ошибочное мнение, что озеро Чаны стало относиться к водоемам, неблагополучным по зараженности рыб описторхами, а лещ Новосибирского водохранилища — к основному виду рыб, наиболее зараженному личинками описторха. Рыбы из Чанов, как и из других барабинских озер (Сартлана, Убинского, Тандово), не представляют опасности для человека, за исключением притоков озера Малые Чаны — рек Чулым, Каргат, Чулыменок, где промысловые виды рыб (язь, плотва) заражены описторхом незначительно — от одного до семи процентов, а непромысловые виды рыб (верхова, пескарь), редко употребляемые в пищу, заражены на сто процентов. В Новосибирском водохранилище и Оби из всех рыб в 1980 — 2011 годах лещ был наиболее слабо заражен возбудителями описторхоза — на 1,35 — 6,4 процента, наиболее сильно заражены язь и елец — 27 и 45 процентов соответственно. В водохранилище на 100 лещей заражены три рыбы, на 100 экземпляров плотвы — 13, на 100 язей — 32, на 100 ельцов — 36 рыб. В одном леще как минимум семь метацеркарий описторхов, что меньше, чем у других видов карповых рыб: например, у язя — 15 экземпляров. Крупный лещ обитает в глубоких слоях воды, где вероятность его заражения описторхами мала и ограничена кратковременным пребыванием леща в период нереста у берегов водоема в местах сосредоточения моллюсков — битиниид, от которых и происходит заражение рыб.
В одном леще как минимум семь метацеркарий описторхов, что меньше, чем у других видов карповых рыб: например, у язя — 15 экземпляров. Крупный лещ обитает в глубоких слоях воды, где вероятность его заражения описторхами мала и ограничена кратковременным пребыванием леща в период нереста у берегов водоема в местах сосредоточения моллюсков — битиниид, от которых и происходит заражение рыб.
Как отмечено ранее, развитие описторхов происходит со сменой трех хозяев: первого промежуточного (моллюск битиния), второго промежуточного или дополнительного (карповые рыбы) и окончательного (человек и плотоядные животные). В окончательном хозяине гельминт достигает половой зрелости. Взрослые особи описторхид выделяют яйца, которые с фекалиями больных людей и животных выбрасываются во внешнюю среду. Основная часть яиц описторхов попадает в водоемы при спуске необезвреженных нечистот из канализаций, с пароходов, барж; яйца смываются в воду с поверхности почвы и из наружных туалетов дождевыми и паводковыми водами. Заражение человека происходит при употреблении в пищу рыбы, содержащей жизнеспособные личинки описторхов. Такие личинки (метацеркарии) могут находиться в недостаточно прожаренной, проваренной, малосоленой и вяленой рыбе семейства карповых.
Заражение человека происходит при употреблении в пищу рыбы, содержащей жизнеспособные личинки описторхов. Такие личинки (метацеркарии) могут находиться в недостаточно прожаренной, проваренной, малосоленой и вяленой рыбе семейства карповых.
Источником заражения может служить свежемороженая рыба (строганина или чушь) и сырой рыбный фарш. Обычай есть рыбу в свежемороженом виде широко распространен среди сибирского населения, особенно рыбаков, рабочих рыбзаводов, плавсостава и т. п. Нередко заражаются описторхозом работники общественного питания и домашние хозяйки, имеющие привычку пробовать рыбный фарш и рыбные блюда в недостаточно проваренном и прожаренном виде. Иными словами, вероятность заражения описторхозом человека определяется интенсивностью инвазии рыб, степенью развития рыбного промысла среди населения, степенью распространения употребления сырой рыбы человеком и кормления ею домашних животных, а также средним количеством рыбы, съедаемой одним человеком.
Однако для заражения бывает достаточно даже однократного употребления небольшой порции, пораженной личинками описторхов рыбы. Не исключено, что заражение может наступить и при случайном заглатывании мелких частиц рыбы, попавших на руки, предметы обихода и посуду при разделке рыбы в бытовых и промышленных условиях.
Не исключено, что заражение может наступить и при случайном заглатывании мелких частиц рыбы, попавших на руки, предметы обихода и посуду при разделке рыбы в бытовых и промышленных условиях.
Ослабление санитарно-ветеринарного контроля за рыбной продукцией, поступающей для реализации населению, особенно в местах свободной торговли (уличные лотки, торговля с автомашин, индивидуальные предприниматели), привело к тому, что на рынок стала часто попадать не обезвреженная от гельминтов рыба.
Основное значение при описторхозе имеют меры профилактики, которая невозможна без мероприятий по охране окружающей среды от инвазионного начала и правильной обработки рыбы. Поэтому профилактические мероприятия заключаются в обеззараживании бытового мусора, фекальных отходов, сточных вод, почвы, очистке бытовых сточных вод на судах.
Как уже было отмечено, источником заражения человека и млекопитающих животных описторхозом служит карповая рыба, содержащая живых личинок описторхид. Поэтому единственным фактором инвазированности является употребление в пищу зараженных рыб, чаще язя, плотвы, ельца, в свежем, малосоленом и недостаточно термически обработанном виде.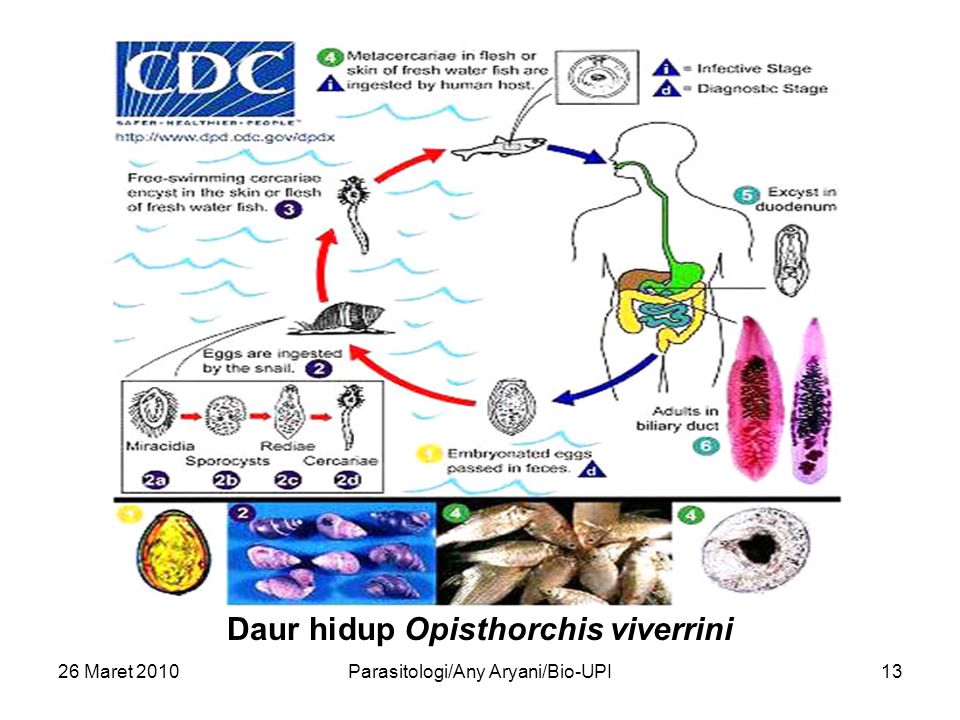
Главное значение в борьбе с описторхозом имеет правильная обработка рыбы с целью ее обеззараживания под воздействием различных факторов — высоких и низких температур, поваренной соли, копчения и вяления.
По данным многих исследователей этого заболевания и нашим наблюдениям, метацеркарии надолго переживают своего хозяина. Они подвижны и жизнеспособны даже после пяти-шестидневного пребывания рыбы в холодильной камере на льду. Гибель метацеркариев в мелкой рыбе наступает при минус 2 — 12 градусах Цельсия через 4 — 5 дней, в крупных язях при минус 8 — 12 градусах Цельсия метацеркарии гибнут через 17 — 20 дней. По некоторым данным, при замораживании язя весом до одного килограмма в естественных условиях гибель метацеркариев наступает через 20 — 30 дней, при замораживании во льдосолевой смеси при температуре минус 15 — 18 градусов — через 14 — 19 дней, при 30 градусах ниже нуля — через 6 часов, при минус 40 — через 3 часа.
Данные других исследователей показывают, что метацеркарии в мышцах рыб при температуре минус 28 градусов Цельсия гибнут через 32 часа, при минус 35 — через 14 часов, при 40 градусах ниже нуля — через 7 часов.
Посол рыбы следует производить теплым раствором (температура тузлука — не ниже 15 градусов Цельсия), расход соли — 27 — 29 кг на 100 кг рыбы, длительность посола — 14 суток.
Губительно на личинок описторхов действуют и высокие температуры: при 70 градусах через 40 минут происходит частичное, а при 100 градусах через 15 минут наступает полное их разрушение.
Копчение рыбы проводят горячим и холодным способами. Установлено, что горячее копчение убивает личинок в рыбе, при холодном же копчении необходимо соблюдать условия предварительного посола рыбы и доведения технологии обработки до конца.
Вяленая рыба иногда может быть источником заражения описторхозом, поэтому и здесь необходимо соблюдать технологические правила. Рекомендуется в домашних условиях карповую рыбу (размером тела 25 см) вялить не менее трех недель после двух-трехдневного посола из расчета 12 — 14 процентов соли к весу рыбы.
В соответствии с нормативными документами (СанПиН 3.2.569-96, М., 1997; приложение № 3) для обеззараживания мышц карповых рыб от личинок трематод применяют смешанный крепкий и средний посол (плотность тузлука с первого дня посола 1,2, при температуре от плюс одного до плюс 20 градусов), при достижении массовой доли соли в мясе рыбы 14 процентов. При этом продолжительность посола должна быть:
При этом продолжительность посола должна быть:
а) пескаря, гольяна, верховки — 10 суток;
б) плотвы, ельца, красноперки, язей и других карповых с длиной тела до 25 см — 21 сутки;
в) крупных (свыше 25 см) язей, лещей, линей — 40 суток.
Обеззараживание при низких температурах происходит при минус 40 градусах через 7 часов, минус 35 — через 14 часов, при 28 градусах ниже нуля — через 22 часа, более высокие температуры замораживания не гарантируют ее обезвреживания.
Надежным способом обезвреживания рыбы является термическая обработка. Горячее и холодное копчение, вяление, сушка, а также изготовление консервов, выполненное надлежащим образом, обеззараживает от описторхов всю рыбу, за исключением язя. Производство вяленой и холодного копчения рыбной продукции из язя и плотвы допускается только из сырья, предварительно замороженного в вышеуказанных режимах.
Варить рыбу следует порционными кусками не менее 20 минут с момента закипания, рыбные пельмени — не менее 5 минут с момента закипания. Жарить рыбу необходимо порционными кусками в жире 15 минут. Крупные куски рыбы весом до 100 грамм жарить в распластанном виде не менее 20 минут. Мелкую рыбу можно жарить целиком в течение 15 — 20 минут. Профилактика описторхоза сводится к соблюдению личной гигиены при разделке сырой рыбы. После разделки рыбы следует тщательно промыть дощечку и другие кухонные принадлежности, облить их кипятком и вымыть с мылом руки, так как при разделке сырой рыбы из ее органов и мышц вытекает жидкость, в которой могут плавать метацеркарии описторхид, освободившиеся из разрезанных ножом волокон мышц. Известны случаи, когда матери немытыми после разделки рыбы руками берут пустышку и дают младенцу, который заболевает описторхозом, хотя никогда еще не употреблял в пищу рыбы. Таким образом, профилактика заболевания заключается в правильном солении и вялении рыбы и соблюдении санитарных правил при разделке сырой рыбы.
Жарить рыбу необходимо порционными кусками в жире 15 минут. Крупные куски рыбы весом до 100 грамм жарить в распластанном виде не менее 20 минут. Мелкую рыбу можно жарить целиком в течение 15 — 20 минут. Профилактика описторхоза сводится к соблюдению личной гигиены при разделке сырой рыбы. После разделки рыбы следует тщательно промыть дощечку и другие кухонные принадлежности, облить их кипятком и вымыть с мылом руки, так как при разделке сырой рыбы из ее органов и мышц вытекает жидкость, в которой могут плавать метацеркарии описторхид, освободившиеся из разрезанных ножом волокон мышц. Известны случаи, когда матери немытыми после разделки рыбы руками берут пустышку и дают младенцу, который заболевает описторхозом, хотя никогда еще не употреблял в пищу рыбы. Таким образом, профилактика заболевания заключается в правильном солении и вялении рыбы и соблюдении санитарных правил при разделке сырой рыбы.
Первостепенное значение в борьбе с описторхозом имеет санитарно-просветительская работа. Необходимо добиться отказа населения от употребления в пищу сырой рыбы и кормления ею домашних животных. Важно следить за чистотой проточных, сточных и стоячих вод, не сбрасывать фекалии и нечистоты, не строить уличные туалеты на берегу водоемов. На речных судах устанавливать биотуалеты и туалеты с последующим обеззараживанием. Проводить дегельминтизацию бродячих собак и кошек.
Необходимо добиться отказа населения от употребления в пищу сырой рыбы и кормления ею домашних животных. Важно следить за чистотой проточных, сточных и стоячих вод, не сбрасывать фекалии и нечистоты, не строить уличные туалеты на берегу водоемов. На речных судах устанавливать биотуалеты и туалеты с последующим обеззараживанием. Проводить дегельминтизацию бродячих собак и кошек.
Соблюдение мер санитарии, гигиены, правильная обработка рыбы, массовое выявление и лечение больных делают вполне реальной возможность резкого снижения напряженности очагов описторхоза.
Описторхоз наступает
Импортная рыбопродукция в изобилии на российских прилавках.
Вся импортная рыба и морепродукция, поступающая в розничную торговлю проходит ветеринарный контроль, начиная с инспектирования предприятий поставщиков импортной продукции российскими инспекторами и заканчивая пограничным ветеринарным контролем в специализированных пунктах пропуска на Государственной границы Российской Федерации, где проводиться контроль за соблюдением ветеринарно-санитарных требований к безопасности продукции и отбор проб от импортной продукции в рамках мониторинговых исследований. При выявлении недоброкачественной или опасной продукции она изымается из оборота. В зависимости от ее фактического состояния она утилизируется, то есть отправляется на корм животным или уничтожается. Реализация рыбы, рыбных и морских продуктов в розничной торговле осуществляется под контролем государственных ветеринарных служб субъектов Российской федерации и надзором Россельхознадзора и Роспотребнадзора.
При выявлении недоброкачественной или опасной продукции она изымается из оборота. В зависимости от ее фактического состояния она утилизируется, то есть отправляется на корм животным или уничтожается. Реализация рыбы, рыбных и морских продуктов в розничной торговле осуществляется под контролем государственных ветеринарных служб субъектов Российской федерации и надзором Россельхознадзора и Роспотребнадзора.
Предприятия – экспортёры должны соблюдать необходимые санитарно-гигиенические правила и выпускать продукцию, соответствующую требованиям Таможенного союза в части безопасности пищевой продукции. В случае выявления некачественной продукции Россельхознадзором вводятся временные ограничения на поставки их продукции в Таможенный союз.
И так, немного о болезнях рыб:
Рыбы, как и другие животные, подвержены различным заболеваниям. Болезни рыб, возникающие как в естественных, так и искусственных водоемах, наносят значительный ущерб рыбному хозяйству. Особенно остро встает эта проблема в современной аквакультуре. По данным специалистов, ущерб от болезней при искусственном выращивании по отдельным возрастным группам рыб может составлять 100%. Известно, что рыбы могут быть источником различных заболеваний человека и животных, так как они являются переносчиками возбудителей этих опасных болезней.
По данным специалистов, ущерб от болезней при искусственном выращивании по отдельным возрастным группам рыб может составлять 100%. Известно, что рыбы могут быть источником различных заболеваний человека и животных, так как они являются переносчиками возбудителей этих опасных болезней.
Среди заболеваний рыб большое место занимают инвазионные болезни, возбудители которых относятся к животному миру.
Сегодня стало модно при приготовлении рыбы использовать как можно меньше соли, дыма и тепла (суши, салат из сырой рыбы с уксусом и пряностями). Как утверждают любители, так сохраняется натуральный вкус продукта. И натуральные паразиты, добавляют врачи-паразитологи. Многие люди могут даже не догадываться, о том, что они заражены — симптомы болезни очень похожи на аллергию, заболевания желудочно-кишечного тракта и печени.
Чем можно заболеть от рыбы? Вот самые распространенные.
ОПИСТОРХОЗ. Возбудитель — сибирская двуустка. Размер глистов — 7–12 мм. Паразитирующие в желчном пузыре, желчных протоках печени и в поджелудочной железе. Наряду с человеком описторхоз может паразитировать у многих плотоядных животных: лисиц, песцов, соболей, хорьков. Наиболее частыми носителями описторхоза являются кошки. Кроме названных основных хозяев в развитии паразита участвуют два промежуточных, первый из которых — мелкий пресноводный моллюск битиния, а второй — какая-либо рыба из семейства карповых (язь, лещ, елец, плотва, линь, красноперка, густера, подуст, жерех, сазан).
Наряду с человеком описторхоз может паразитировать у многих плотоядных животных: лисиц, песцов, соболей, хорьков. Наиболее частыми носителями описторхоза являются кошки. Кроме названных основных хозяев в развитии паразита участвуют два промежуточных, первый из которых — мелкий пресноводный моллюск битиния, а второй — какая-либо рыба из семейства карповых (язь, лещ, елец, плотва, линь, красноперка, густера, подуст, жерех, сазан).
Если по истечении 5-6 недель пораженная рыба будет съедена человеком или плотоядным животным, то через 10-12 дней проникшая в желчные протоки печени или в желчный пузырь личинки описторхоза достигнет половой зрелости и начнет откладывать яйца. Развитие паразита от яйца до половозрелого червя продолжается в течение 4-5 месяцев.
Симптомы описторхоза проявляются через 2–3 недели после поедания необезвреженной рыбы. Если заболел впервые: слабость, головные боли, повышение температуры до 38–40 градусов, тошнота, рвота, боли в правом подреберье, горечь во рту, непереносимость жирной пищи. При хроническом течении паразиты уже так громко о себе не заявляют, хотя продолжают своё чёрное дело.
При хроническом течении паразиты уже так громко о себе не заявляют, хотя продолжают своё чёрное дело.
Лечение описторхоза народными средствами категорически противопоказано и может навредить вашему здоровью. Прежде чем пройти курс лечения необходимо провести диагностику описторхоза в клинике.
КЛОНОРХОЗ. Возбудитель — китайская двуустка. Передаёт рыба, выловленная в Амуре и его притоках, водоёмах Китая, Кореи и Вьетнама: амурский чебачок, востробрюшка, пескарь, карась, сазан, горчак, амурский язь и т. д. Проявления болезни: температура, высыпания на коже, увеличение печени.
ДИФИЛЛОБОТРИОЗ — поражение широким лентецом. В кишечнике человека из личинки вырастает червь длиной 8–12 м и более. Паразит может жить в организме 10–20 лет. Источник заражения: окунь, ёрш, щука, налим, дальневосточные лососёвые, пойманные в Волге, реках Сибири, Дальнего Востока и севера европейской части России. Проявления болезни: изменение аппетита, слабость, тошнота (особенно натощак), реже рвота, слюнотечение, отрыжка, изжога, урчание в животе, давление в животе, неустойчивый стул, головная боль, раздражительность, иногда зудящая сыпь.
НАНОФИЕТОЗ. Почти круглые мелкие червячки размером 5 мм паразитируют в тонкой кишке. Вызывают очень упорные и тяжёлые поносы. Ими бывает заражена кета, кунджа, мальма, амурский сиг и хариус, таймень, ленок, реже гольян и амурская широколобка. При длительном течении болезни развивается анемия.
МЕТАГОНИМОЗ. Червячки длиной 1–2,5 мм обживаются в кишечнике человека. Паразиты передаются через уссурийского сига, сазана, амурского леща, сома, краснопёрку, пескаря, верхогляда, карася, толстолобика. Заболевание распространено среди населения российского Приамурья, некоторых районов Кореи, Китая, Японии, Филиппинских островов. Проявления болезни (возникают через 7–10 дней после заражения): температура, сыпь на коже, диарея, боли в животе, болезненность при прощупывании живота по ходу толстого кишечника.
АНИЗАКИОЗ. Личинки круглых червей могут поражать почти все виды морских рыб: тресковые, окунёвые, лососёвые и др. В частности, поражённость сельдевых в Балтийском море — 30%, а в Северном море — 55–100%.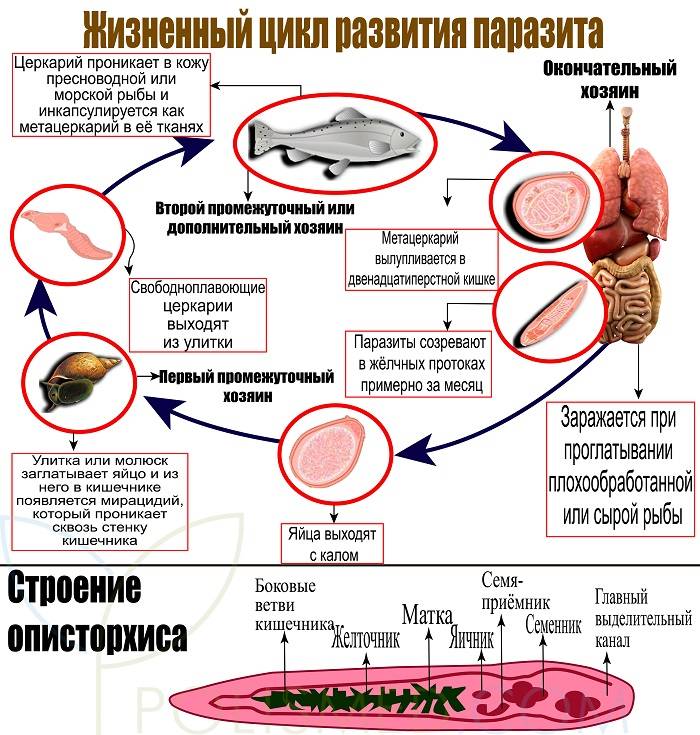 Рискуют заболеть все, кто любит японские блюда, приготовленные из сырой рыбы. Личинки анизакид могут провоцировать развитие язвы кишечника, инкубационный период — от 4–6 часов до 7 дней. Проявления: тошнота, рвота, боли в животе, сыпь, температура, диарея.
Рискуют заболеть все, кто любит японские блюда, приготовленные из сырой рыбы. Личинки анизакид могут провоцировать развитие язвы кишечника, инкубационный период — от 4–6 часов до 7 дней. Проявления: тошнота, рвота, боли в животе, сыпь, температура, диарея.
ЛИГУЛЕЗ. Многие рыболовы при чистке пойманной рыбы обнаруживали у нее в брюшной полости длинных (до 120 см) плоских червей белого цвета (солитера). Это возбудители лигулеза или диграммоза многих пресноводных рыб — неполовозрелые формы ленточных червей-ремнецов. Половозрелые особи живут в кишечнике, рыбоядных птиц: чаек, поганок, бакланов, цапель. Это так называемые окончательные их хозяева. Кроме них в развитии ремнецов участвуют 2 промежуточных хозяина — циклопы и рыбы, в основном карповые (лещ, густера, плотва, красноперка, вобла). Попадая в кишечник вместе с пищей, а затем, в полость тела рыбы, паразиты растут, питаются за счет хозяина, сдавливают внутренние органы, вызывают нарушение их функций.
Пойманная рыба, пораженная ремнецами, после удаления их из брюшной полости вполне пригодна в пищу. Однако мясо больных рыб несколько отличается по биохимическому составу от мяса рыб здоровых, оно менее питательно и вкусно.
Однако мясо больных рыб несколько отличается по биохимическому составу от мяса рыб здоровых, оно менее питательно и вкусно.
Нельзя однозначно гарантировать, что однажды попробовав сырую рыбу, Вы обязательно подцепите паразитов. Для того, чтобы быть полностью уверенным в их отсутствии необходима диагностика и полное обследование организма. Ну а чтобы не заразиться, необходимо соблюдать простые правила приготовления пищи.
Победить паразитов просто — нужно всего лишь правильно готовить рыбу. А блюда из сырой рыбы можно употреблять в пищу только при определённых условиях:
• это должна быть рыба искусственно выращенная, которую кормили искусственными кормами, лечили и контролировали на отсутствие паразитов;
• если это морская, выловленная в океане, то она должна быть немедленно на рыболовном судне заморожена и разморожена непосредственно перед употреблением в пищу; или её надо съесть немедленно после вылова;
• в речной рыбе практически во всех видах могут быть паразиты, опасные для человека (за исключением осетровых). Поэтому, например, стерлядь и осетра можно есть в сыром виде. А остальные виды рыб надо солить, мариновать или коптить в соответствии с разработанными рекомендациями.
Поэтому, например, стерлядь и осетра можно есть в сыром виде. А остальные виды рыб надо солить, мариновать или коптить в соответствии с разработанными рекомендациями.
Безопасна хорошо проваренная или прожаренная рыба. Правила распространяются на всю рыбу, так как отличить на глаз, есть ли в ней микроскопические личинки (которые, попав в организм человека, превратятся там во взрослых червей), невозможно.
Варить рыбу следует 15–20 мин. с момента закипания.
Жарить — не менее 15–20 мин. (крупную рыбу предварительно разрезают вдоль хребта на пласт).
Выпекать пироги с рыбой не менее 30 мин.
При горячем и холодном копчении рыба обезвреживается полностью к моменту готовности.
При посоле рыбы (весом до 2 кг) личинки паразитов погибают:
в условиях горячего посола (15–16°С) — через 5–9 дней,
в условиях холодного посола (5–6°С) — через 6–13 дней,
в условиях сухого посола:
в неразделанной рыбе — через 9–13 дней,
в поротой рыбе — через 7–12 дней.
Берётся 20% соли к весу рыбы. Замораживание. Рыба (весом до 2 кг) считается обезвреженной после выдержки:
• 12 часов — при −27°С,
• 18 часов — при −22°С,
• 36 часов — при −16°С,
• 3 сут. — при −12°С,
• 7 сут. — при −8°С,
• 10 сут. — при −4°С.
польза или вред? Мифы и реальность
Как все-таки мудр и прозорлив был скромный старик, отпустивший золотую рыбку обратно в море! А ведь он даже и не подозревал о том, насколько правильным окажется его решение! Главное, что он приобрел, отпустив ее, – это здоровье. А здоровый человек уж и так сможет заработать и приобрести (причем в постоянное, а не временное, как в сказке, пользование) и новое корыто (или, если угодно по-современному, джакузи и стиральную машину), терем (квартиру) и получить желаемый титул (сделать карьеру).
Если бы кто-либо из современных режиссеров решил снять триллер или ужастик по мотивам пушкинской сказки, он мог бы начать его такими словами морской или речной рыбки:
— Отпусти ты, старче, меня в море!
А не отпустишь и съешь меня, заражу тебя описторхозом, клонорхозом или иного, не менее коварного, червя нашлю!
Описторхоз и клонорхоз — паразитарные болезни человека и животных, заражение которыми происходит при употреблении в пищу инвазированной рыбы, обусловлены паразитированием трематод семейства Opisthorchiidae — Opisthorchis felineus, Opisthorchis viverrini и Clonorchis sinensis.
По официальным данным статистики, описторхозом и клонорхозом поражено около 23 млн человек, а риску заражения подвержено около 350 млн человек, проживающих в 13 странах и на территориях, расположенных в Европейском регионе, Юго-Восточной Азии и Западной части Тихого океана. В действительности есть все основания полагать, что больных описторхозом и клонорхозом гораздо больше. В первую очередь потому, что выявить заболевание в хронической стадии очень сложно: нет совершенных лабораторных методов диагностики, а симптомы заболевания очень похожи на симптомы других заболеваний
Так ли страшен червь, как его малюют?
«Я бы сказал, что страшнее, чем его малюют. На сегодня вся рыба Обь-Иртышского бассейна поражена описторхами, — рассказывает А. П. Хачатрян. — Я подчеркиваю вся, потому что первый миф об описторхозе гласит: Описторхами заражены только рыбы семейства карповых. А хищная рыба (судак и т. д.) якобы не заражена, и ее можно употреблять в пищу. Это заблуждение. Хищная рыба так же поражается описторхами, как и любая другая».
Второй миф гласит: Паразитами заражена только речная рыба. В морской рыбе их нет. Это тоже заблуждение. Морскую рыбу поражают клонорхи. Это те же паразиты, гельминты, которые несколько отличаются от описторхов по внешнему виду, форме, но оказывают такое же разрушительное воздействие на организм человека. Кстати, эпицентром клонорхоза является любимый туристами Тайланд.
По данным ветеринарной лаборатории г. Мурманска, рыба, которая поступает к ним на исследование на предмет гельминтов, в 100% заражена ими. А это океаническая рыба. Вздумайтесь над этими цифрами!
Кроме описторхов и клонорхов, сегодня обнаружены еще 4 вида гельминтов, которые живут в тонком кишечнике и обнаружить их практически невозможно. Они вызывают такие заболевания как дифиллоботриоз (источники заражения: окунь, щука, налим, лососевые), нанофиетоз (источники заражения: кета, горбуша, форель, лосось, кунджа, мальма, амурский сиг и хариус, таймень, ленок), метагонимоз (источники заражения: сазан, амурский лещ, сом, красноперка, пескарь, карась, толстолобик), анизакиоз (источники заражения: почти все виды морских рыб).
Паразиты живут в желчных ходах и протоках поджелудочной железы человека, разрушая слизистые оболочки и поражая печень. Они забивают желчные протоки, вызывая застойные явления. Ядовитые отходы глистов превращают организм человека в благодатную среду для размножения инфекций и появления самых разных болезней, в том числе онкозаболеваний. Они могут вызвать даже эпилептоидные припадки, бесплодие.
Современные исследования показали, что египетская царица Хатшепсут, жившая в XV столетии до н. э., умерла в возрасте 50 лет от рака печени, вызванного паразитами – клонорхами, яйца которых были обнаружены в мумии.
Коварный червь
Коварство заболеваний, вызванных паразитами, – в том, что в хронической стадии их трудно диагностировать. Заболевание чаще всего сразу принимает хроническую форму, вызывая другие болезни. Симптомы его (воспалительные явления поджелудочной железы, желчевыводящих путей, боли в правом подреберье, горечь во рту, тошнота, головные боли, боли в суставах, повышенная утомляемость и т. д.) характерны и для других заболеваний, а причину установить сложно. В результате человека лечат от других болезней, а ему становится все хуже и хуже.
д.) характерны и для других заболеваний, а причину установить сложно. В результате человека лечат от других болезней, а ему становится все хуже и хуже.
Наличие паразитов зачастую является причиной таких распространенных сегодня заболеваний, как гипертония, сахарный диабет, язвенная болезнь, аллергия любой формы и выраженности, бронхиальная астма, экзема, псориаз, а также сердечно-сосудистых заболеваний, проблемной кожи.У больных выпадают волосы, падает зрение и голос . Иногда, заболевание может протекать совсем без симптомно и проявиться раком печени. Со стороны нервной системы у больных может наблюдаться депрессия или повышенная раздражительность, у детей – вялость или гиперактивность.
«Нужно отметить, что заболевания, вызванные наличием паразитов, сегодня омолодились, — рассказывает Ашот Папикович. – Недавно, например, мы диагностировали описторхоз у ребенка в возрасте 1 год и 7 месяцев. К нам приводят детей с различными формами аллергии. Или родители жалуются на то, что у ребенка снижен иммунитет, он часто и длительно болеет, и они уже не знают, что делать. А причиной всех этих проблем со здоровьем зачастую оказывается наличие паразитов у детей».
А причиной всех этих проблем со здоровьем зачастую оказывается наличие паразитов у детей».
Среди объективных лабораторных методов диагностики описторхоза сегодня существуют только два: анализ кала и дуоденальное зондирование. Считается, что если при этом яйца паразитов не обнаружены, значит, их и нет. Это очередной миф. Дело в том, что, чтобы получить объективный результат, нужно сдавать кал несколько раз в день в течение месяца (это связано с разными фазами активности жизнедеятельности паразитов). И зондирование нужно проводить неоднократно, и со специальной подготовкой. У больных описторхозом затруднен желчеотток. В таких случаях удается взять желчь на анализ только с поверхностных желчных ходов, а паразиты обычно находятся глубже, поэтому их и не обнаруживают.
Мы проводим дуоденальное зондирование со специальными растворами, которые обеспечивают хороший желчеотток с глубоких слоев, а также обладают антипаразитарным действием. Таким, образом диагностическая процедура является одновременно и лечебной. Для исследования мы используем специальный американский микроскоп, что тоже позволяет повысить выявляемость паразитов при первой же процедуре.
Для исследования мы используем специальный американский микроскоп, что тоже позволяет повысить выявляемость паразитов при первой же процедуре.
Источники заражения
Многие считают, что заразиться описторхозом можно от зараженного этим заболеванием человека или животного, через поцелуи или глотнув речной воды при купании. Это миф. Источником заражения опистрхозом и клонорхозом является только употребление в пищу рыбы или продуктов питания, на которые попали черви при обработке зараженной рыбы, или использование для приготовления рыбы и других продуктов одних и тех же кухонных приборов (ножа и разделочной доски).
Лечение
Бытует мнение, что полностью избавиться от паразитов (описторхов и клонорхов) невозможно. Это миф. Реальность в том, что вылечиться можно, но при употреблении в пищу рыбы очень и очень высок риск повторного заражения, иммунитет не вырабатывается.
Сегодня практикуют традиционные (лекарственные) и нетрадиционные (биорезонансные, аппаратные, травы, БАДы) методы лечения. «Мы лечим по собственной патентованной методике и гарантируем высокую эффективность. Лечение проводится в три этапа (подготовка, очищение, реабилитация) и занимает около месяца, — рассказывает А. П. Хачатрян».
«Мы лечим по собственной патентованной методике и гарантируем высокую эффективность. Лечение проводится в три этапа (подготовка, очищение, реабилитация) и занимает около месяца, — рассказывает А. П. Хачатрян».
Искушение вкусом
Современному человеку трудно удержаться от гастрономических соблазнов, не попробовать суши или ароматную рыбу. В оправдание мы убеждаем себя, что хорошо прожарим и проварим ее, но, во-первых, чтобы уничтожить паразитов, нужно так долго варить или жарить рыбу, что от нее ничего практически не останется. И солить так сильно, что в рот ее взять будет невозможно. К тому же если у нас есть привычка кушать рыбу, мы будем есть ее и в гостях, и в ресторанах, и в суши-барах. И совсем не факт, что там ее будут вываривать и прожаривать до необходимой степени.
Искушение пользой
«Рыба – это источник ненасыщенных жирных кислот, белка, фосфора, кальция…» – так убеждали и убеждают нас врачи. Это еще один миф. Давайте посмотрим, что полезного и вредного содержится в рыбе сегодня. Кроме паразитов, это соли тяжелых металлов. Что касается, наличие фосфора – его гораздо больше содержится в коричневом рисе. Единственная польза от рыбы сегодня – это рыбий жир. Его можно принимать, и приобретать его лучше в аптеке.
Кроме паразитов, это соли тяжелых металлов. Что касается, наличие фосфора – его гораздо больше содержится в коричневом рисе. Единственная польза от рыбы сегодня – это рыбий жир. Его можно принимать, и приобретать его лучше в аптеке.
Поэтому берегите свое здоровье и здоровье своих детей, не кушайте и не давайте своим детям рыбу.
А рыбка золотая пусть лучше украшает наши аквариумы, а не столы.
С А. П. Хачатряном, доктором медицинских наук, профессором, академиком Российской академии медико-технических наук, академиком Нью-Йоркской академии наук и Европейской академии естественных наук, Заслуженным изобретателем России, президентом Международной Академии Здоровья беседовала Юлия Сикачева
Паразиты в рыбе, опасные для человека
04.10.2018
Есть много путей заражения паразитами. Один из основных – употребление в пищу рыбы, не прошедшей достаточную термическую обработку. Паразиты в рыбе встречаются часто: статистика утверждает, что примерно 90% всех особей, обитающих в пресной и морской воде, поражены глистами. Об этом должны знать любители вяленой, соленой, копчёной рыбы, а также суши и сашими.
Об этом должны знать любители вяленой, соленой, копчёной рыбы, а также суши и сашими.
Пожалуй, практически каждый знает, что есть сырую рыбу — это, мягко говоря, не хорошо. Но при этом мало кто из непросвещенных людей догадывается, почему именно. Дело в том, что абсолютное большинство видов рыбы являются разносчиками всевозможных паразитов. Это обусловлено особенностями их рациона. Некоторые из этих паразитов не вызывают у человека ничего, сильнее изжоги, другие — несут прямую угрозу нашему здоровью. Думаем, подробности лучше опустить, но, поверьте, последствия не очень приятные.
Бытует мнение, что от паразитов страдает исключительно озерная и речная рыба, а с морской, якобы, все в порядке. Но это — всего лишь миф, который начисто опровергается современными исследованиями. Не стоит думать, что с морепродуктами, выращенными на специализированных фермах, дело обстоит по-другому. По факту, в условиях тесных резервуаров, в которых живут морские обитатели, паразиты распространяются с комической скоростью.
Основная опасность заражённой червями рыбы заключается в том, что глисты, живущие в рыбе, попадают в организм человека и провоцируют развитие гельминтозов. Не все червячки, поражающие организм рыб, могут заразить людей. Но важно осознавать, какие именно паразиты опасны для человека, в каких разновидностях рыбы они живут. Это позволит минимизировать риск инвазии.
Лентец (солитёр) – провоцирует развитие заболевания дифиллоботриоз. Он вырастает до 12 м и в организме людей живёт десятилетиями. Этот вид ленточных червей поражает щуку, ерша, окуня, налима, судака, иногда встречается в лососе. Его личинки довольно крупные, окрашены в белый цвет. В длину достигают 5 мм, в ширину – 3 мм. Они встречаются в мускулатуре рыбы, а также во внутренних органах. Количество личинок очень большое, поэтому их несложно заметить в сырой рыбе во время её разделки.
Двуустка (кошачья, а также сибирская) – провоцирует развитие описторхоза. Этот паразит относительно небольших размеров – 8–13 мм, поражает печень, жёлчный пузырь, его протоки, поджелудочную. Заразиться можно, употребляя рыбу, относящуюся к семейству карповых. К данной группе относятся краснопёрка и сазан, лещ и плотва, язь и елец, жерах и линь. Опасность в том, что личинки двуустки очень мелкие. Рыба может выглядеть здоровой, а в её плоти при этом находятся тысячи яиц паразитов.
Заразиться можно, употребляя рыбу, относящуюся к семейству карповых. К данной группе относятся краснопёрка и сазан, лещ и плотва, язь и елец, жерах и линь. Опасность в том, что личинки двуустки очень мелкие. Рыба может выглядеть здоровой, а в её плоти при этом находятся тысячи яиц паразитов.
Трематоды – черви в рыбе, которые провоцируют развитие таких болезней как нанофиетоз и метагонимоз. Название рыбы, в которой могут жить трематоды – сиг, кета, амурский хариус, а также мальма, ленок, таймень, форель, амурский лещ, сазан, карась. Эти глисты поселяются в тонком кишечнике человека, принося огромный вред здоровью.
Анизакиды – провоцируют развитие анизакидоза. Живут эти глисты в морской рыбе: в селёдке, в треске, лососе, в морском окуне. В теле рыбы указанные гельминты сворачиваются в спираль. Заразиться этим паразитом особенно рискуют любители японской кухни, в меню которой много блюд из сырой рыбы. Данные глисты поражают желудочно-кишечный тракт, провоцируя развитие язвы, других болезней.
Все перечисленные болезни приводят к тяжёлым последствиям. В первую очередь страдает желудочно-кишечный тракт, а также иммунная система. Гельминты разрушают внутренние органы, выделяют токсины, отравляющие организм. Также паразиты поглощают основную массу питательных веществ, что приводит к истощению. Особенно опасно это для детей. Если они систематически недополучают витамины, минералы и другие полезные вещества, может начаться отставание в физическом и психическом развитии. Учитывая столь пагубные последствия, важно избегать употребления в пищу рыбы, поражённой гельминтами.
Возникает вопрос, можно ли есть рыбу с глистами? Конечно, нет! Чтобы паразиты не попали в организм человека, перед употреблением выловленную особь необходимо обработать. Даже если мясо коптить и вялить – это может не иметь смысла. Например, чтобы селедочный червь умер, рыбу надо правильно засолить, что важно, ведь паразиты в селедке опасны для человека.
Не допустить заражения рыбными гельминтами просто при правильном приготовлении и хранении рыбы. А блюда из сырой рыбы можно употреблять в пищу только при определённых условиях:
А блюда из сырой рыбы можно употреблять в пищу только при определённых условиях:
— это должна быть рыба искусственно выращенная, которую кормили искусственными кормами, лечили и контролировали на отсутствие паразитов;
— если это морская, выловленная в океане, то она должна быть немедленно на рыболовном судне заморожена и разморожена непосредственно перед употреблением в пищу; или её надо съесть немедленно после вылова;
— в речной рыбе практически во всех видах могут быть паразиты, опасные для человека (за исключением осетровых). Поэтому, например, стерлядь можно есть в сыром виде. А остальные виды рыб надо солить, мариновать или коптить в соответствии с разработанными рекомендациями.
Безопасна хорошо проваренная или прожаренная рыба. Правила распространяются на всю рыбу, так как отличить на глаз, есть ли в ней микроскопические личинки (которые, попав в организм человека, превратятся там во взрослых червей), невозможно.
Варить рыбу следует 15–20 мин с момента закипания.
Жарить — не менее 15–20 мин (крупную рыбу предварительно разрезают вдоль хребта на пласт).
Выпекать пироги с рыбой не менее 30 мин.
При горячем копчении рыба обезвреживается полностью к моменту готовности.
Чтобы минимизировать риск заражения паразитами при употреблении рыбы, следует покупать этот продукт только в установленных местах торговли, где он проходит обязательный контроль.
Государственная служба ветеринарной медицины
Луганской Народной Республики
Ангара. Можно ли есть рыбу, пойманную в черте Иркутска? | ИРКИПЕДИЯ
Местная рыба съедобна только после жарки, просолки или глубокой заморозки, хотя в Иркутске рыбу ловили всегда – бабушка рассказывала мне, что до революции рыбный базар был прямо на набережной Ангары, где сейчас бульвар Гагарина. В процессе урбанизации и производственного строительства в Ангару все больше поступало промотходов, и все чаще вставал вопрос о том, можно ли есть рыбу, выловленную в пределах Иркутска. А в последнее время в связи с катастрофическим развитием экологического движения вопрос приобретает гамлетовское звучание: есть или не есть? Экологи грозят целым букетом бед, исходящих от частного рыболовного промысла, от ртути до трехметровых червей в кишечнике. Мы решили дать хоть какой–то однозначный ответ на этот вопрос и обратились к узким специалистам.
А в последнее время в связи с катастрофическим развитием экологического движения вопрос приобретает гамлетовское звучание: есть или не есть? Экологи грозят целым букетом бед, исходящих от частного рыболовного промысла, от ртути до трехметровых червей в кишечнике. Мы решили дать хоть какой–то однозначный ответ на этот вопрос и обратились к узким специалистам.
Как покупать рыбу на анализы
Выборку решили сделать по–честному – просто поехать с утречка в понедельник на берег Ангары и у первых попавшихся рыбаков купить их незамысловатый улов. И потом предоставить его на исследование в Управление Россельхознадзора по Иркутской области.
Первые рыбаки попались на плотине ГЭС – у микрорайона Солнечного, под бортом ледокола Ангара.
– Удачный улов?
– Да ну, мелочь всякая. Коту отдать стыдно, – не отрываясь глазами от поплавка, ответил представительный дед.
– Продайте, а? Очень надо, – принялся канючить я.
– Если очень надо, так забирай, – смилостивился дед. – А зачем тебе?
– А зачем тебе?
– «В поликлинику, для опытов», – процитировал я почтальона Печкина. – Хочу на анализы сдать, выяснить, можно ли есть рыбу из Ангары.
– Ну ты сказал! На меня посмотри – мне скоро семьдесят, всю жизнь на Ангаре сижу. А как на пенсию ушел – с нее не нажируешь, – так постоянно рыбные дни устраиваем. И никто у нас не умер, не отравился, уже и правнуки с удовольствием прожаренными карасиками хрустят. Раньше на Теплых озерах ночами сетью рыбалил – щуки были длиной с руку, – дед протянул сухую жилистую руку. Рука была длинная.
– Наука – дело тонкое, пусть она свое слово скажет, – уклончиво ответил я, пожелал удачной рыбалки и торопливо удалился.
Для сотрудников Иркутской межобластной ветеринарной лаборатории улов был небогатый – три тощих ельца, которых руководитель испытательного центра при Россельхознадзоре Александр Кузнецов встретил неодобрительно:
– Вы их, поди, голыми руками хватали. Как же их на микробиологию исследовать – мало ли чего вы на них уже после воды нацепляли.
Кроме того, оказалось, что для полноценного цикла исследований необходимо как минимум десять рыбин – контрольные образцы и собственно на исследования, на каждое по несколько штук, так как в результате вскрытий, забора проб и прочих манипуляций после исследования от рыбины могут остаться одни лохмотья чешуи и растерзанные потроха.
Самая страшная – тайшетская кошачья двууска
Как объяснил ИО завотделением диагностики болезней рыб, пчел и парзитарных болезней Роман Рудов, в нашей области отмечаются два основных опасных заболевания, которые переносятся пресноводной рыбой и представляют опасность для здоровья человека.
Чаще всего встречается чаечный дифиллоботриоз. Основными переносчиками его являются хариус, омуль и сиг. В их кишечнике он содержится в цистах, и при неправильной обработке рыбы попадает в кишечник человека, где развивается в червя, представляющего собой широкий лентец, состоящий из 4000 члеников, длиной до 20 метров и шириной около полутора сантиметров. Штука это больше неприятная, чем опасная – паразит может вызвать аллергические реакции, некоторые нарушение пищеварения, но в специальной литературе отмечается, что «у человека не вызывает тяжелых последствий и отмирает довольно быстро».
Штука это больше неприятная, чем опасная – паразит может вызвать аллергические реакции, некоторые нарушение пищеварения, но в специальной литературе отмечается, что «у человека не вызывает тяжелых последствий и отмирает довольно быстро».
Впрочем, и избавиться он него очень легко изначально – омуль и сиг нужно либо глубоко промораживать, либо хорошо прожаривать, либо круто просаливать.
Гораздо реже встречается другое, куда более опасное заболевание – описторхоз. Рыба, содержащая его возбудитель, кошачью двууску (названа так потому, что впервые выделена у домашних кошек), на территории области встречается только в одном месте – в Тайшетском районе, на реке Бирюсе. Ее носителями являются карповые рыбы, лещ, лаплан, елец и карась. Иногда ее могут завозить из Западной Сибири – из Омска, Томска, Новосибирска, Красноярска.
Тварь это мелкая (10×2,5 мм), но исключительно вредная – она селится в желчных протоках печени, которые травмирует шипами – ими покрыто все мелкое тельце паразита. Кроме того, она оказывает аллерготоксическое воздействие на организм, в результате чего человек тяжело болеет и может умереть (такие случаи уже встречались в Иркутской области).
Кроме того, она оказывает аллерготоксическое воздействие на организм, в результате чего человек тяжело болеет и может умереть (такие случаи уже встречались в Иркутской области).
Вскрытие показало
– Полный цикл исследований на ваших трех мальках провести невозможно. Могу показать, чем занимается наш отдел, – сказал Роман Валерьевич, направляясь в лабораторию. – У нас проводится три первых этапа исследований – патологоанатомическое вскрытие, микроскопические и биохимические исследования.
Отличие от обычной кухни состояло в том, что рыбу потрошили не руками и ножом, а скальпелем и пинцетом. Подцепив пинцетом и одним движением сняв чешую «чулком», Роман Валерьевич, очень напоминая хирурга, вырезающего аппендикс, стал копаться в кишках рыбы.
– Смотрите, – он вскрыл желудок и потянул пинцетом длинную белую ленту, очень похожую на обычную домашнюю лапшу. – Ваш елец подцепил лигулез. Это плероцеркоиды из рода Ligula. Для человека абсолютно безвредны – после обычной чистки рыбы в пищу ее можно употреблять без ограничений.
Затем проводят исследование на описторхоз. Его возбудители находятся в мышцах рыбы, поэтому для первичного исследования под микроскопом с той части рыбы, которая в торговле называется филе, скальпелем счищают слой толщиной до 3 мм и исследуют его под микроскопом. Более детальное исследование на содержание возбудителей болезней проводится на аппарате «Гастрос–01». Для этого необходимо 70 г рыбьего филе. Поэтому моя рыба под «Гастрос» не попала вследствие малочисленности и рахитичности.
Затем это филе греют до 46 градусов в искусственном желудочном соке, варят около часа, центрифугируют и исследуют под микроскопом.
Токсикология благополучная
Токсикологическое исследование проводить не пришлось. Во–первых, после предыдущих от представленной рыбы остались маловразумительные лоскуты, а во–вторых, эти исследования занимают от нескольких часов до нескольких дней. Поэтому заведующая химико–токсикологическим отделом Марина Ярышкина объяснила ситуацию «на пальцах»:
– Наш отдел не занимается экологическими изысканиями, мы проверяем только ту рыбу, которую кто–то поймал и принес нам. Мы проверяем ее на содержание токсических веществ и органических соединений.
Мы проверяем ее на содержание токсических веществ и органических соединений.
В местной рыбе встречаются «вкрапления» свинца, ртути, кадмия и мышьяка. Но Марина Михайловна заверила, что они содержатся в пределах МДУ (максимально допустимого уровня) и ни разу за три последних года ее работы не превышали ПДК:
– Уровень содержания этих веществ колеблется в зависимости от многих факторов: от возраста рыбы, чем и где она питается (в придонных слоях содержание вредных веществ выше). Но содержание этих элементов не превышает фонового. Для примера, для свинца он составляет один миллиграмм на килограмм веса.
В общем, по заключению токсиколога Марины Ярышкиной, местную рыбу после соответствующей термической обработки смело можно употреблять в пищу.
Самая проблемная рыба – в Байкале
За последние пять лет исследования проводились ежегодно в нескольких местных акваториях. Это Байкал в районе Малого моря и в Слюдянском районе, на Лене (притоки в пределах Киренского района), в Усть–Илимском и Братском водохранилищах (Братский, Железногорский, Нукутский и Балаганский районы) и в Бирюсе (Тайшетский район).
По бактериологическим показателям, то есть по заражению гельминтами все водоемы, кроме Байкала, оказались чистыми. В 2005–м и 2008 году исследования, проведенные на Лене, показали, что из восьми видов рыбы (подавляющая часть хариуса, ленок, сиг, валек, таймень, окунь, включая экзотического тугунка) только от половины до двух процентов всей рыбы было заражено дифиллоботриозом.
За пять лет исследований только в 2007 году в Братском водохранилище из полутора тысяч выловленных экземпляров рыбы шести пород (в основном окунь, карась, плотва) всего шесть с половиной процентов оказались зараженными зловредным гельминтом. Пробы рыбы, взятые в том же году в Усть–Илимском водохранилище, никаких заражений не выявили.
Два года подряд, в 2007 и в прошлом году, пробы, взятые из мышечных тканей филея ельца, показывали наличие опасного заболевания – описторхоза – в 5–6% проб. Менее опасна плотва – у нее нашли описторхоз только в 0,3% рыбы.
Самой часто болеющей рыбой в этом рейтинге гельминтозов Иркутской области признаны омуль и сиг, которые водятся в Байкале. За пять лет уровень зараженной чаечным дифиллоботриозом рыбы существенно не сокращается и составляет 70–90%.
За пять лет уровень зараженной чаечным дифиллоботриозом рыбы существенно не сокращается и составляет 70–90%.
CDC — DPDx — Описторхоз
Возбудители
Трематоды (сосальщики) Opisthorchis viverrini (печеночный двуустник из Юго-Восточной Азии) и Opisthorchis felineus (печеночный двуусток кошачий).
Жизненный цикл
Взрослые двуустки откладывают полностью развитые яйца, которые выводятся с калом. После проглатывания подходящей улиткой (первым промежуточным хозяином) из яиц выделяются мирацидии, которые проходят у улитки несколько стадий развития (спороцисты, редии, церкарии).Церкарии высвобождаются из улитки и проникают в пресноводную рыбу (второй промежуточный хозяин), инцистируя метацеркарии в мышцах или под чешуей. Окончательный хозяин-млекопитающее (кошки, собаки и различные рыбоядные млекопитающие, включая человека) заражаются при поедании недоваренной рыбы, содержащей метацеркарии. После проглатывания метацеркарии выходят из двенадцатиперстной кишки и поднимаются через ампулу Фатера в желчные протоки, где они прикрепляются и развиваются во взрослых особей, которые откладывают яйца через 3-4 недели. Взрослые двуустки ( O. viverrini : от 5 мм до 10 мм от 1 мм до 2 мм; O. felineus : от 7 мм до 12 мм от 2 мм до 3 мм) обитают в желчных и панкреатических протоках млекопитающих. хозяин, где они прикрепляются к слизистой оболочке.
Взрослые двуустки ( O. viverrini : от 5 мм до 10 мм от 1 мм до 2 мм; O. felineus : от 7 мм до 12 мм от 2 мм до 3 мм) обитают в желчных и панкреатических протоках млекопитающих. хозяин, где они прикрепляются к слизистой оболочке.
Географическое распространение
Opisthorchis viverrini встречается в основном на северо-востоке Таиланда, Лаосе, Камбодже, а также в центральном и южном Вьетнаме. Opisthorchis felineus встречается в основном в Италии, Германии, Беларуси, России, Казахстане и Украине.
Клиническая презентация
Большинство инфекций протекает бессимптомно. Большинство патологических проявлений возникает в результате воспаления и периодической непроходимости желчных протоков. В легких случаях проявления включают диспепсию, боль в животе, диарею или запор. При более длительных инфекциях симптомы могут быть более серьезными, могут присутствовать гепатомегалия и недоедание. В редких случаях может развиться холангит, холецистит и холангиокарцинома. Кроме того, инфекции, вызванные Opisthorchis felineus , могут иметь острую фазу, напоминающую лихорадку Катаяма (шистосомоз), с лихорадкой, отеком лица, лимфаденопатией, артралгиями, сыпью и эозинофилией.Хронические формы инфекции Opisthorchis felineus имеют те же проявления, что и Opisthorchis viverrini , с вовлечением протоков поджелудочной железы.
Кроме того, инфекции, вызванные Opisthorchis felineus , могут иметь острую фазу, напоминающую лихорадку Катаяма (шистосомоз), с лихорадкой, отеком лица, лимфаденопатией, артралгиями, сыпью и эозинофилией.Хронические формы инфекции Opisthorchis felineus имеют те же проявления, что и Opisthorchis viverrini , с вовлечением протоков поджелудочной железы.
Текущее состояние описторхоза и клонорхоза в бассейне реки Меконг
Parasitol Int. Авторская рукопись; доступно в PMC 2013 21 ноября.
Опубликован в окончательной редакции как:
PMCID: PMC3836690
NIHMSID: NIHMS496410
, a, c, * , a, c , d , e , f , g , b , h , i и b, c, *
Paiboon Sithithaworn
a Департамент паразитологии , Медицинский факультет, Университет Кхон Каен, Кхон Каен 40002, Таиланд
c Исследовательский центр печеночной двуустки и холангиокарциномы, медицинский факультет, Университет Кхон Каен, Кхон Каен 40002, Таиланд
Росс Х.
 Andrews
Andrews
a Кафедра паразитологии медицинского факультета Университета Кхон Каен, Кхон Каен 40002, Таиланд
c Исследовательский центр печеночной двуустки и холангиокарциномы, медицинский факультет, Университет Кхон Каен, Кхон Каен 40002, Таиланд
Nguyen Van De
d Кафедра паразитологии, Ханойский медицинский университет, Ханой, Вьетнам
Thitima Wongsaroj
e Департамент по контролю заболеваний Министерства здравоохранения Таиланда
Muth Sinuon
f Центр паразитологии, энтомологии и борьбы с малярией, Пномпень, Камбоджа
Peter Odermatt
g Швейцарский институт тропиков и общественного здравоохранения, Базель, Швейцария
Юкифуми Нава
b Кафедра патологии медицинского факультета Университета Кхон Каен, Кхон Каен 40002, Таиланд
Сонг Лян
h Университет штата Огайо, Колумбус, Огайо, США
Пол Дж.
 Бриндли
Бриндли
i Департамент микробиологии, иммунологии и тропической медицины, Школа медицины и медицинских наук, Университет Джорджа Вашингтона, Вашингтон, округ Колумбия, 20037.
Banchob Sripa
b Отделение патологии медицинского факультета Университета Кхон Каен, Кхон Каен 40002, Таиланд
c Исследовательский центр печеночной двуустки и холангиокарциномы, медицинский факультет, Университет Кхон Каен, Кхон Каен 40002, Таиланд
a Кафедра паразитологии медицинского факультета Университета Кхон Каен, Кхон Каен 40002, Таиланд
b Кафедра патологии медицинского факультета Университета Кхон Каен, Кхон Каен 40002, Таиланд
c Исследовательский центр печеночной двуустки и холангиокарциномы, медицинский факультет, Университет Кхон Каен, Кхон Каен 40002, Таиланд
d Кафедра паразитологии, Ханойский медицинский университет, Ханой, Вьетнам
e Департамент по контролю за заболеваниями, Министерство здравоохранения, Таиланд
f Центр паразитологии, энтомологии и борьбы с малярией, Пномпень, Камбоджа
g Швейцарский институт тропиков и общественного здравоохранения, Базель, Швейцария
h Университет штата Огайо, Колумбус, Огайо, США
i Департамент микробиологии, иммунологии и тропической медицины, Школа медицины и медицинских наук, Университет Джорджа Вашингтона, Вашингтон, округ Колумбия, 20037.
* Авторы, отвечающие за переписку: Пайбун Сититаворн, факультет паразитологии, медицинский факультет, Университет Кхон Каен, Кхон Каен 40002, Таиланд. Тел: + 66-43363434, Факс: + 66-43-202475, moc.liamtoh@tis_biap, moc.liamg@tisbiap; Banchob Sripa, Лаборатория тропических болезней, отделение патологии, медицинский факультет, Университет Кхон Каен, Кхон Каен 40002, Таиланд. Tel: + 66-43363113, Fax: + 66-43-202024, ht.ca.ukk@bohcnab Окончательная отредактированная версия этой статьи издателем доступна на Parasitol Int. См. Другие статьи в PMC, в которых цитируется опубликованная статья.
Abstract
В этом обзоре освещается текущее состояние и меры борьбы с инфекциями печеночного двуустки в странах бассейна Меконга, где Opisthorchis и Clonorchis являются высоко эндемичными. Обновленные данные о распространенности и распространении были обобщены из презентаций в «96 лет описторхоза. Международный конгресс печеночных двуусток ». Вызывает тревогу тот факт, что, несмотря на то, что программы лечения и борьбы с ними осуществляются в течение десятилетий, все страны бассейна Нижнего Меконга по-прежнему являются высокоэндемичными с O. viverrini и / или C. sinensis , а также тревожно высокие уровни заболеваемости CCA. Общей закономерностью, возникающей в каждой стране, является разница в передаче O. viverrini между низинными районами с высокой распространенностью и высокогорьями с низкой распространенностью. По всей видимости, это связано с заболоченными землями, схемами наводнений, перемещениями и поселениями людей. Для успешной борьбы с этим смертельным заболеванием печени бедных необходимы более согласованные усилия всех секторов общества, образования, здравоохранения и правительства.
viverrini и / или C. sinensis , а также тревожно высокие уровни заболеваемости CCA. Общей закономерностью, возникающей в каждой стране, является разница в передаче O. viverrini между низинными районами с высокой распространенностью и высокогорьями с низкой распространенностью. По всей видимости, это связано с заболоченными землями, схемами наводнений, перемещениями и поселениями людей. Для успешной борьбы с этим смертельным заболеванием печени бедных необходимы более согласованные усилия всех секторов общества, образования, здравоохранения и правительства.
1. Введение
Печеночные двуустки человека, Opisthorchis viverrini , O. felineus и Clonorchis sinensis остаются серьезной проблемой общественного здравоохранения во многих частях мира, особенно в Азии. Clonorchis sinensis является эндемиком в южном Китае, Корее и северном Вьетнаме, тогда как O. viverrini является эндемиком в бассейне нижнего Меконга, включая Таиланд, Лаосскую Народно-Демократическую Республику (Лаосскую Народно-Демократическую Республику), Камбоджу и центральный Вьетнам [1]. Opisthorchis felineus встречается на территории бывшего СССР и в Центральной и Восточной Европе [2-4]. Согласно последним сообщениям, до 15 миллионов человек инфицированы C. sinensis только в Китае [3,5], а еще 10 миллионов человек инфицированы O. viverrini в Таиланде и Лаосской Народно-Демократической Республике [1,6-8] . Во всем мире 700 миллионов человек подвержены риску заражения этими двумя печеночными сосальщиками [3]. Инфекции связаны с гепатобилиарными заболеваниями, включая гепатомегалию, холангит, фиброз перипортальной системы, холецистит и камни в желчном пузыре.Они являются основными этиологическими агентами рака желчных протоков, холангиокарциномы (CCA), и поэтому O. viverrini и C. sinensis были классифицированы Международной организацией как канцерогены типа 1 (паразиты многоклеточных животных, канцерогенные для человека). Агентство по изучению рака, Всемирная организация здравоохранения (ВОЗ) [9,10]. Самый высокий уровень заболеваемости раком печени, ассоциированным с двуусткой, в мире находится в Кхонкэне, Северо-Восточный Таиланд [11,12].
Opisthorchis felineus встречается на территории бывшего СССР и в Центральной и Восточной Европе [2-4]. Согласно последним сообщениям, до 15 миллионов человек инфицированы C. sinensis только в Китае [3,5], а еще 10 миллионов человек инфицированы O. viverrini в Таиланде и Лаосской Народно-Демократической Республике [1,6-8] . Во всем мире 700 миллионов человек подвержены риску заражения этими двумя печеночными сосальщиками [3]. Инфекции связаны с гепатобилиарными заболеваниями, включая гепатомегалию, холангит, фиброз перипортальной системы, холецистит и камни в желчном пузыре.Они являются основными этиологическими агентами рака желчных протоков, холангиокарциномы (CCA), и поэтому O. viverrini и C. sinensis были классифицированы Международной организацией как канцерогены типа 1 (паразиты многоклеточных животных, канцерогенные для человека). Агентство по изучению рака, Всемирная организация здравоохранения (ВОЗ) [9,10]. Самый высокий уровень заболеваемости раком печени, ассоциированным с двуусткой, в мире находится в Кхонкэне, Северо-Восточный Таиланд [11,12]. В этом отчете освещается текущее состояние и меры борьбы с инфекциями печеночного двуустки в странах бассейна Меконга, где Opisthorchis и Clonorchis являются высокоэндемичными ().Данные о текущей эпидемиологии были обобщены из презентаций стран-участниц в «96 лет описторхоза. Международный конгресс печеночных двуусток », проходивший в Кхонкэне, Таиланд, 7-8 марта 2011 года. Кроме того, освещаются последние результаты исследований, относящихся к описторхозу и клонорхозу.
В этом отчете освещается текущее состояние и меры борьбы с инфекциями печеночного двуустки в странах бассейна Меконга, где Opisthorchis и Clonorchis являются высокоэндемичными ().Данные о текущей эпидемиологии были обобщены из презентаций стран-участниц в «96 лет описторхоза. Международный конгресс печеночных двуусток », проходивший в Кхонкэне, Таиланд, 7-8 марта 2011 года. Кроме того, освещаются последние результаты исследований, относящихся к описторхозу и клонорхозу.
Географические районы бассейна Нижнего Меконга.
2. Жизненный цикл и передача
Взрослые черви O. viverrini и C. sinensis обитают во внутри- и внепеченочной билиарной системе.Яйца с зародышами, содержащие мирацидий, высвобождаемые беременными червями, выводятся с желчью и в конечном итоге попадают в окружающую среду с потоком фекалий. Достигнув пресной воды, яйцо проглатывается улитками рода Bithynia . Улитки изобилуют водоемами с мелководьем, рисовыми полями и заболоченными местами. Зараженные улитки часто встречаются в водоемах недалеко от деревень, где наблюдается высокое фекальное загрязнение (Kaewkes et al., This issue). Внутри улитки из яиц вылупляются мирацидии, которые превращаются в спороцисты.Затем спороцисты подвергаются бесполому размножению, вызывая редии и, наконец, церкарии. После того, как церкарии высвобождаются из улиток, они прикрепляются к коже пресноводных рыб, принадлежащих к одному из 20 восприимчивых видов карповых, и проникают в них, образуя инфекционную стадию, метацеркарию. В недавнем исследовании было обнаружено, что 70% карповых рыб, пойманных в озере Лава, провинция Кхон Каен, Таиланд, инфицированы O. viverrini (Kaewkes, неопубликовано). Однако распространенность C.sinensis у рыб Вьетнама был довольно низким — 1,9-5,1% [13].
Зараженные улитки часто встречаются в водоемах недалеко от деревень, где наблюдается высокое фекальное загрязнение (Kaewkes et al., This issue). Внутри улитки из яиц вылупляются мирацидии, которые превращаются в спороцисты.Затем спороцисты подвергаются бесполому размножению, вызывая редии и, наконец, церкарии. После того, как церкарии высвобождаются из улиток, они прикрепляются к коже пресноводных рыб, принадлежащих к одному из 20 восприимчивых видов карповых, и проникают в них, образуя инфекционную стадию, метацеркарию. В недавнем исследовании было обнаружено, что 70% карповых рыб, пойманных в озере Лава, провинция Кхон Каен, Таиланд, инфицированы O. viverrini (Kaewkes, неопубликовано). Однако распространенность C.sinensis у рыб Вьетнама был довольно низким — 1,9-5,1% [13].
До недавнего времени предполагалось, что кошки и собаки выступают в качестве резервуарных хозяев для O. viverrini в Таиланде и Лаосской НДР. В настоящее время показано, что более 35% кошек из эндемичных районов Таиланда инфицированы O. viverrini [14] (Aunpromma et al., Этот выпуск). Точно так же уровень инфицирования O. viverrini у кошек колеблется в пределах 33-60% в южном Вьетнаме (De, неопубликовано).Люди — главный окончательный хозяин; люди заражаются при употреблении в пищу сырой или неправильно приготовленной рыбы, такой как кои пла (рыбный салат) и сомов (коротко ферментированная рыба), особенно на северо-востоке Таиланда и Лаосской НДР, и прахок в Камбодже (). После поглощения мяса рыбы инцистированные метацеркарии перевариваются желудочным и кишечным соками, после чего удаленные молодые сосальщики мигрируют через ампулу Фатера в общий желчный проток и во внутрипеченочные желчные протоки, где они созревают и размножаются половым путем.Некоторые сосальщики могут быть обнаружены в общем желчном протоке, пузырном протоке и даже в желчном пузыре [15].
viverrini [14] (Aunpromma et al., Этот выпуск). Точно так же уровень инфицирования O. viverrini у кошек колеблется в пределах 33-60% в южном Вьетнаме (De, неопубликовано).Люди — главный окончательный хозяин; люди заражаются при употреблении в пищу сырой или неправильно приготовленной рыбы, такой как кои пла (рыбный салат) и сомов (коротко ферментированная рыба), особенно на северо-востоке Таиланда и Лаосской НДР, и прахок в Камбодже (). После поглощения мяса рыбы инцистированные метацеркарии перевариваются желудочным и кишечным соками, после чего удаленные молодые сосальщики мигрируют через ампулу Фатера в общий желчный проток и во внутрипеченочные желчные протоки, где они созревают и размножаются половым путем.Некоторые сосальщики могут быть обнаружены в общем желчном протоке, пузырном протоке и даже в желчном пузыре [15].
Потребление «Koi pla» — популярного блюда из сырой рыбы на северо-востоке Таиланда и Лаосской Народно-Демократической Республики.
3. Текущая распространенность и географическое распространение
Первые случаи заражения людей O. viverrini были зарегистрированы в Таиланде почти 100 лет назад [16]. На сегодняшний день зарегистрировано инфекций O. viverrini из других стран, включая Лаосскую Народно-Демократическую Республику, Камбоджу и Вьетнам, а также сообщения о спорадических случаях из Малайзии, Сингапура и Филиппин [1].Напротив, C. sinensis впервые было обнаружено в 1874 году из содержимого желчного протока китайского плотника, умершего в Калькутте, Индия [5,17]. Тем не менее, важно отметить, что клонорхоз человека является проблемой общественного здравоохранения в Китае более 2000 лет: яиц C. sinensis яиц было обнаружено в фекальных остатках человека, который жил на средней стадии Воюющих царств. Период (475-221 гг. До н.э.) в провинции Хубэй, Китай [18]. Не было опубликовано никаких отчетов об эндемичности клонорхоза в странах бассейна Меконга, кроме Вьетнама, за исключением отчета о случаях клонорхоза, обнаруженных с помощью ПЦР в недавнем опросе в сообществе в центральном регионе Таиланда [19].
Подобно другим трематодам, присутствие и географический диапазон подходящего промежуточного хозяина улитки определяет географическое распространение этих печеночных двуусток. Однако из-за растущего международного торгового импорта продукции пресноводной аквакультуры из стран, эндемичных по печеночным сосальщикам, а также другим зоонозным гельминтам, переносимым рыбой, в настоящее время все чаще обнаруживают инфицированных людей в неэндемичных районах. Например, случаи описторхоза в неэндемичных регионах, таких как США и Европа, были зарегистрированы у иммигрантов из Азии, а причина инфекции в некоторых случаях была связана с потреблением импортной сырой или недоваренной пресноводной рыбы, содержащей метацеркарии [20,21]. .
Программы борьбы с печеночными двуустками человека осуществлялись в эндемичных районах бассейна реки Меконг в течение нескольких десятилетий; К сожалению, во многих регионах по-прежнему сохраняется высокий уровень инфицирования. Текущие данные о географическом распространении инфекций, вызываемых двуусткой печени человека, в Таиланде, Лаосской Народно-Демократической Республике, Камбодже и Вьетнаме представлены в.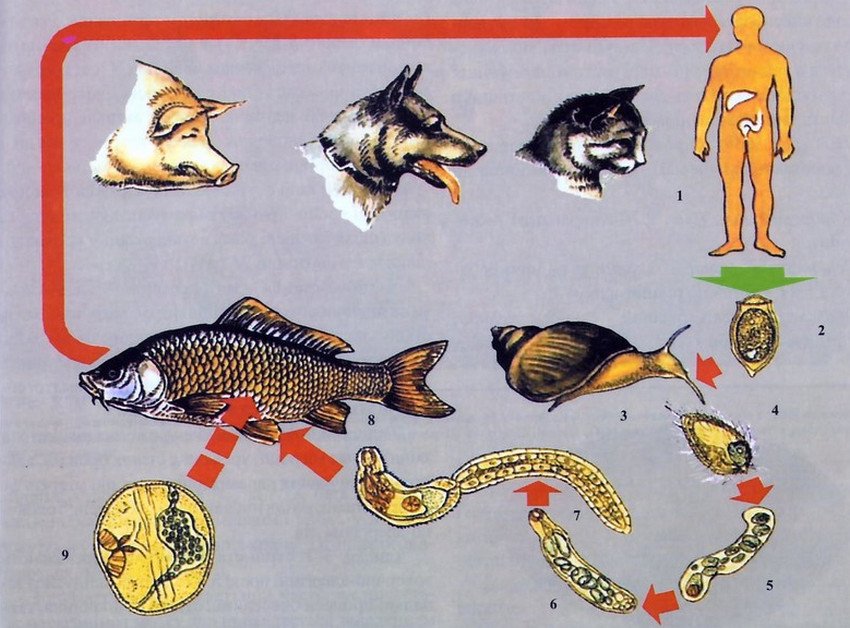
Распространенность O.viverrini и C.sinensis в странах Азии.
Уровень эндемичности определяется по распространенности инфекций: низкий — 0 — 5%; средний — 5.1-15%; высокий — более 15%.
3.1 Таиланд
В Таиланде первое сообщение о высокой распространенности инфекции O. viverrini , достигающей 100% в некоторых деревнях на северо-востоке Таиланда, было сделано Садуном (1955) [22]. Почти 30 лет спустя почти 100% -ная распространенность и высокая интенсивность O. viverrini были аналогичным образом зарегистрированы в районе Чоннабот провинции Кхонкэн, подтверждая, что Кхонкэн является одной из горячих точек инфекции печеночной двуустки на северо-востоке Таиланда. [23-25].Первое общенациональное обследование четырех регионов Таиланда в период 1980-1981 гг. Выявило общую распространенность инфекции O. viverrini , равной 14%; Северо-Восточный (34,6%), Центральный (6,3%), Северный (5,6%) и Южный (0,01%) регионы. В результате интенсивных и непрерывных программ контроля и деятельности служб общественного здравоохранения, средний показатель распространенности инфекции по стране снизился до 9,4% в 2000 г. [7], а в 2009 г. — до 8,7%. инфекция обнаружена на Северо-Востоке (16.6%), за которыми следуют Северный (10,0%), Центральный (1,3%) и Южный (0,01%) регионы Таиланда. Действительно, в Северо-Восточном регионе распространенность в 2009 г. была аналогична показателям предыдущего обследования 10 лет назад в 2000 г. (15,7%) (). Вызывает тревогу то, что в провинции Накхон Паном в Северо-восточном регионе все еще наблюдается распространенность до 60%. Другие провинции Северо-Восточного региона также показали тревожно высокую распространенность инфекции (). По данным на 2009 год, инфекций O. viverrini в Таиланде, особенно в Северном и Северо-Восточном регионах, по-прежнему распространены, а общее число случаев описторхоза оценивается более чем в 6 миллионов, что является самым высоким показателем в мире.
В результате интенсивных и непрерывных программ контроля и деятельности служб общественного здравоохранения, средний показатель распространенности инфекции по стране снизился до 9,4% в 2000 г. [7], а в 2009 г. — до 8,7%. инфекция обнаружена на Северо-Востоке (16.6%), за которыми следуют Северный (10,0%), Центральный (1,3%) и Южный (0,01%) регионы Таиланда. Действительно, в Северо-Восточном регионе распространенность в 2009 г. была аналогична показателям предыдущего обследования 10 лет назад в 2000 г. (15,7%) (). Вызывает тревогу то, что в провинции Накхон Паном в Северо-восточном регионе все еще наблюдается распространенность до 60%. Другие провинции Северо-Восточного региона также показали тревожно высокую распространенность инфекции (). По данным на 2009 год, инфекций O. viverrini в Таиланде, особенно в Северном и Северо-Восточном регионах, по-прежнему распространены, а общее число случаев описторхоза оценивается более чем в 6 миллионов, что является самым высоким показателем в мире. Но эта оценка, скорее всего, будет сильно занижена [15] сейчас, когда доступны более чувствительные диагностические методы [26].
Но эта оценка, скорее всего, будет сильно занижена [15] сейчас, когда доступны более чувствительные диагностические методы [26].
Годовая распространенность инфекции O.viverrini в каждом регионе Таиланда с 1957 по 2009 год. На севере распространенность имеет тенденцию к снижению до 1996 года, но после этого остается стабильной. Пик распространенности на севере в 1996 г. может быть вызван не полностью O.viverrini , а смешанной инфекцией с мелкими кишечными сосальщиками, имеющими схожую морфологию яиц.(Данные Минздрава).
Распространение и распространенность O.viverrini на северо-востоке Таиланда (исследование 2009 г.).
3.2 Лаосская Народно-Демократическая Республика
По оценкам, более 2 миллионов человек инфицированы O. viverrini в Лаосской Народно-Демократической Республике [8]. Высокий уровень заражения наблюдается в центральной и южной низменностях (). Общенациональное обследование 29 846 детей младшего школьного возраста из 17 провинций, включая муниципалитет Вьентьяна, показало, что средний показатель распространенности составляет O. viverrini составляет 10,9% с высокой распространенностью в провинциях Хаммуане, Сараване и Саваннакхет — 32,2%, 21,5% и 25,9% соответственно [27]. Кроме того, имеется несколько сообщений о заражении O. viverrini у детей и взрослых с 1996 г. по настоящее время с высокой распространенностью в пределах 37–86% [28–34]. Недавнее исследование, проведенное в провинции Тямпасак на юге Лаосской Народно-Демократической Республики, показало, что распространенность инфекции O. viverrini среди 669 человек из 3 округов составляет 64% [31].Кроме того, распространенность инфекции была поразительно высокой в районах Хонг (92,0%) и Мунлапамок (90,9%), которые расположены в низинах, тогда как распространенность была низкой в Паксонге (5,7%), расположенном в высокогорье. Следовательно, описторхоз является очень эндемическим заболеванием в Лаосской Народно-Демократической Республике, особенно в равнинных районах.
viverrini составляет 10,9% с высокой распространенностью в провинциях Хаммуане, Сараване и Саваннакхет — 32,2%, 21,5% и 25,9% соответственно [27]. Кроме того, имеется несколько сообщений о заражении O. viverrini у детей и взрослых с 1996 г. по настоящее время с высокой распространенностью в пределах 37–86% [28–34]. Недавнее исследование, проведенное в провинции Тямпасак на юге Лаосской Народно-Демократической Республики, показало, что распространенность инфекции O. viverrini среди 669 человек из 3 округов составляет 64% [31].Кроме того, распространенность инфекции была поразительно высокой в районах Хонг (92,0%) и Мунлапамок (90,9%), которые расположены в низинах, тогда как распространенность была низкой в Паксонге (5,7%), расположенном в высокогорье. Следовательно, описторхоз является очень эндемическим заболеванием в Лаосской Народно-Демократической Республике, особенно в равнинных районах.
3.3 Камбоджа
Имеется немного отчетов о распространенности инфекции O. viverrini в Камбодже. В течение 1981-1982 годов у двух из 102 камбоджийских беженцев в Соединенных Штатах был обнаружен положительный результат на C.sinensis яиц (Parish, 1985), но мы считаем, что, судя по имеющимся данным, скорее всего, это были яйца O. viverrini . Впоследствии в ряде провинций были зарегистрированы случаи заражения яйцеклеткой [35]. Высокий уровень заражения был обнаружен среди сообществ, расположенных вдоль поймы реки Меконг (). Обследование 251 ученика начальной школы из провинции Кампонгтям выявило 4,0% -ную распространенность инфекции O. viverrini , равной 4,0% [36]. Недавнее исследование показало высокий уровень инфицирования O.viverrini из 32% в провинции Такео [37], тогда как отдельное исследование, проведенное в 2010 году в провинции Кампонгчам, выявило 18% распространенность инфекции O. viverrini () (Sinuon, неопубликовано). Японские паразитологи [38] также обнаружили, что в 2006 г. они были широко распространены в деревнях в провинции Такео (26,9%) и в деревне в провинции Кандал (10,7%).
viverrini в Камбодже. В течение 1981-1982 годов у двух из 102 камбоджийских беженцев в Соединенных Штатах был обнаружен положительный результат на C.sinensis яиц (Parish, 1985), но мы считаем, что, судя по имеющимся данным, скорее всего, это были яйца O. viverrini . Впоследствии в ряде провинций были зарегистрированы случаи заражения яйцеклеткой [35]. Высокий уровень заражения был обнаружен среди сообществ, расположенных вдоль поймы реки Меконг (). Обследование 251 ученика начальной школы из провинции Кампонгтям выявило 4,0% -ную распространенность инфекции O. viverrini , равной 4,0% [36]. Недавнее исследование показало высокий уровень инфицирования O.viverrini из 32% в провинции Такео [37], тогда как отдельное исследование, проведенное в 2010 году в провинции Кампонгчам, выявило 18% распространенность инфекции O. viverrini () (Sinuon, неопубликовано). Японские паразитологи [38] также обнаружили, что в 2006 г. они были широко распространены в деревнях в провинции Такео (26,9%) и в деревне в провинции Кандал (10,7%). Эти рабочие также обследовали провинцию Кампонгтям и обнаружили четыре деревни с наибольшим показателем распространенности — 44,8% [38].
Эти рабочие также обследовали провинцию Кампонгтям и обнаружили четыре деревни с наибольшим показателем распространенности — 44,8% [38].
Высокий уровень инфицирования 11% был зарегистрирован среди школьников в провинции Кандал, к югу от Пномпеня. Это коррелирует с высокой распространенностью метацеркарий O. viverrini , обнаруженной у 10 видов пресноводных карповых рыб, с уровнем заражения от 2,1% до 66,7% рыбы, пойманной в провинции Кандал [39].
Напротив, относительно низкий (0,7%) уровень инфицирования людей был зарегистрирован на северо-западе Камбоджи, включая высокогорье провинции Оддар Минчи [40].Имеющиеся в настоящее время ограниченные данные позволяют предположить, что уровни распространенности O. viverrini в Камбодже аналогичны уровням, наблюдаемым в соседних странах бассейна Нижнего Меконга. Недавно было подсчитано, что в Камбодже 600 000 человек инфицированы O. viverrini [10]. Однако это потенциально явно недооценка числа инфицированных людей, поскольку данные ограничены и неполны, а в общенациональном масштабе общественного здравоохранения нет точного процесса диагностики и сообщения о O. viverrini инфекции. Всесторонние исследования описторхоза следует проводить по всей Камбодже.
viverrini инфекции. Всесторонние исследования описторхоза следует проводить по всей Камбодже.
3.4 Вьетнам
Во Вьетнаме зарегистрировано случаев заражения C. sinensis и O. viverrini : C. sinensis , распространенных в 21 провинции на севере, и O. viverrini , распространенных в 11 провинциях на севере страны. юг (). Эпидемиологическое исследование в 12 из 61 провинции показало, что C. sinensis широко распространены в девяти северных провинциях с распространенностью от 0.От 2% до 26,0%, особенно в районе дельты Красной реки [41,42]. Для O. viverrini было обнаружено, что распространенность колеблется от 15,2% до 36,9% в трех южных провинциях, где он является эндемичным [41]. Общая распространенность O. viverrini в 11 провинциях южного Вьетнама составила 36,9% (Фуйен), 32% (Куангри), 11,9% (Бинь Динь), 7,6% (Дак Лак), 4,6%. (Куангнам), 1,4% (Кханьхоа), 0,3% (Дананг) и Тхуа Тхиен Хюэ (сообщения о единичных случаях). В шести эндемичных районах центрального Вьетнама — Нуи Тхань, Мо Дык, Мху Ми, Сонг Кау, Туй Ан и Буон Дон — была выявлена высокая распространенность O, достигающая 40%.viverrini [42].
В шести эндемичных районах центрального Вьетнама — Нуи Тхань, Мо Дык, Мху Ми, Сонг Кау, Туй Ан и Буон Дон — была выявлена высокая распространенность O, достигающая 40%.viverrini [42].
Исследование, проведенное в 1992 году в провинции Фуйен, показало, что уровень инфицирования составлял 43,5% среди мужчин и 29,4% среди женщин. Наибольшая распространенность инфекции O. viverrini зарегистрирована у людей в возрасте от 40 до 59 лет. Потребление сырой рыбы является обычным явлением в районах, эндемичных по описторхозу, где было обнаружено, что доля людей, которые ели сырую или недоваренную рыбу, составляла 46% в провинции Фуйен, 61,3% в провинции Биньдинь и 74% в провинции Даклак (Де , не опубликовано).
4. Профилактика и контроль
Программы профилактики и борьбы с инфекцией печеночного двуустки человека осуществлялись в бассейне реки Меконг в течение нескольких десятилетий, особенно в Таиланде. К сожалению, как описано выше, в эндемичных районах по-прежнему сохраняется высокий уровень инфицирования. Основная причина неудач программ борьбы с печеночными двуустками, вероятно, заключается в отсутствии культурно чувствительной и образовательной информации относительно «грубого отношения» к пищевому поведению людей в бассейне Нижнего Меконга [43].Программы государственного контроля могут быть частично успешными во время активных кампаний, но это неустойчиво. Следовательно, стратегии контроля должны быть разработаны с учетом подхода, более ориентированного на сообщества, а не политики сверху вниз. Здоровье экосистемы или EcoHealth — один из подходов, который может быть идеальным для борьбы с печеночными двуустками, поскольку болезнь представляет собой сложную проблему, затрагивающую не только людей, но и нескольких промежуточных и резервуарных хозяев, различные среды, правительственные и неправительственные секторы, включая сообщества и отдельные деревни .
Основная причина неудач программ борьбы с печеночными двуустками, вероятно, заключается в отсутствии культурно чувствительной и образовательной информации относительно «грубого отношения» к пищевому поведению людей в бассейне Нижнего Меконга [43].Программы государственного контроля могут быть частично успешными во время активных кампаний, но это неустойчиво. Следовательно, стратегии контроля должны быть разработаны с учетом подхода, более ориентированного на сообщества, а не политики сверху вниз. Здоровье экосистемы или EcoHealth — один из подходов, который может быть идеальным для борьбы с печеночными двуустками, поскольку болезнь представляет собой сложную проблему, затрагивающую не только людей, но и нескольких промежуточных и резервуарных хозяев, различные среды, правительственные и неправительственные секторы, включая сообщества и отдельные деревни .
«Модель Лава» — это программа борьбы с описторхозом с использованием подхода EcoHealth, которая в настоящее время реализуется в эндемичной по описторхозу зоне на озере Лава, провинция Кхон Каен, Таиланд. Эта модель предполагает равноправное междисциплинарное участие и участие заинтересованных сторон на всех уровнях. Многие исследователи из различных дисциплин, таких как медицина, ветеринария, общественное здравоохранение, науки об окружающей среде, сельское хозяйство, биология и биотехнология, были наняты для сотрудничества в области исследований, общественного здравоохранения и связанных с окружающей средой компонентов.Активно участвуют многоуровневые заинтересованные стороны, включая сельских жителей, лидеров сообществ, волонтеров здравоохранения, местных медицинских работников и губернаторов, учителей / директоров школ и религиозных лидеров / монахов. Соглашения о консенсусе по стратегиям реализации завершаются после нескольких раундов встреч в небольших группах и общественных слушаний под наблюдением исследователей. Стратегии контроля включают лечение людей и млекопитающих-резервуаров-хозяев (для уменьшения выделения яиц), улучшенную санитарию (для предотвращения попадания яиц в источники воды) и укрепление здоровья, включая информацию, образование и общение (IEC), чтобы воспрепятствовать потреблению сырой рыбы и для улучшения санитарных норм.
Эта модель предполагает равноправное междисциплинарное участие и участие заинтересованных сторон на всех уровнях. Многие исследователи из различных дисциплин, таких как медицина, ветеринария, общественное здравоохранение, науки об окружающей среде, сельское хозяйство, биология и биотехнология, были наняты для сотрудничества в области исследований, общественного здравоохранения и связанных с окружающей средой компонентов.Активно участвуют многоуровневые заинтересованные стороны, включая сельских жителей, лидеров сообществ, волонтеров здравоохранения, местных медицинских работников и губернаторов, учителей / директоров школ и религиозных лидеров / монахов. Соглашения о консенсусе по стратегиям реализации завершаются после нескольких раундов встреч в небольших группах и общественных слушаний под наблюдением исследователей. Стратегии контроля включают лечение людей и млекопитающих-резервуаров-хозяев (для уменьшения выделения яиц), улучшенную санитарию (для предотвращения попадания яиц в источники воды) и укрепление здоровья, включая информацию, образование и общение (IEC), чтобы воспрепятствовать потреблению сырой рыбы и для улучшения санитарных норм.
Борьба с промежуточными хозяевами улиток с помощью моллюскицидов не считается осуществимой из-за широкого распространения улиток, например, в комплексе Лава [44] (Petney et al, 2011 в этом выпуске), и низкой распространенности инфекции улиток двуустками даже в эндемичных сообществах. где высокая распространенность наблюдалась у людей, а также потому, что моллюскициды уничтожают нецелевых моллюсков и других беспозвоночных. Чтобы быть наиболее эффективными, стратегии ИОК должны разрабатываться и реализовываться с учетом культурных особенностей с целью стимулирования поведенческих изменений, а также путем предоставления легко понятной информации и, следовательно, повышения осведомленности о проблеме.Ориентация на молодых людей, например детей школьного возраста, может быть подходящим подходом для успешного долгосрочного контроля [45] (). Деревенские волонтеры-медики являются ключевыми игроками в санитарном просвещении, поскольку каждый волонтер-медик заботится примерно о десяти домашних хозяйствах в Таиланде. Их деятельность во время проведения санитарного просвещения сельских жителей впечатляет (). Широкомасштабные усилия агентств общественного здравоохранения в эндемичных районах, безусловно, оказали серьезное влияние на снижение интенсивности инфекций, хотя эффективность и рентабельность еще предстоит определить.Многосекторальное участие государственных учреждений, частных организаций, включая неправительственные организации (НПО), и жителей эндемичных районов может способствовать устойчивой борьбе с паразитарными заболеваниями. Пилотный подход EcoHealth к борьбе с печеночными двуустками человека нацелен на внедрение в эндемичных районах Лаосской Народно-Демократической Республики, Камбоджи, Вьетнама и южного Китая.
Их деятельность во время проведения санитарного просвещения сельских жителей впечатляет (). Широкомасштабные усилия агентств общественного здравоохранения в эндемичных районах, безусловно, оказали серьезное влияние на снижение интенсивности инфекций, хотя эффективность и рентабельность еще предстоит определить.Многосекторальное участие государственных учреждений, частных организаций, включая неправительственные организации (НПО), и жителей эндемичных районов может способствовать устойчивой борьбе с паразитарными заболеваниями. Пилотный подход EcoHealth к борьбе с печеночными двуустками человека нацелен на внедрение в эндемичных районах Лаосской Народно-Демократической Республики, Камбоджи, Вьетнама и южного Китая.
Кампания в школах по профилактике описторхоза и борьбе с ним в общине в озерном комплексе Лава, Кхон Каен, Таиланд.
Программа санитарного просвещения на уровне общины, проводимая сельскими волонтерами в области здравоохранения в Кхон Каен, Таиланд.
Из-за устойчивой высокой заболеваемости CCA на северо-востоке Таиланда и признания того, что O. viverrini является канцерогенным паразитом и фундаментальным фактором риска CCA [10], эпиднадзору и борьбе с печеночными двуустками уделялось больше внимания со стороны правительства и общественности. секторов. Ожидается, что на северо-востоке Таиланда, где более согласованные действия академических исследователей и работников общественного здравоохранения привели к всесторонним исследованиям, начиная от распространенности инфекции двуусткой печени и заканчивая лечением и хирургической терапией ОСО, предполагается, что скрытые опасности этой недооцененной проблемы, которая затрагивает миллионы людей. бедных и менее привилегированных людей могут вскоре улучшиться, улучшив качество жизни и приведя к другим социально-экономическим достижениям.
viverrini является канцерогенным паразитом и фундаментальным фактором риска CCA [10], эпиднадзору и борьбе с печеночными двуустками уделялось больше внимания со стороны правительства и общественности. секторов. Ожидается, что на северо-востоке Таиланда, где более согласованные действия академических исследователей и работников общественного здравоохранения привели к всесторонним исследованиям, начиная от распространенности инфекции двуусткой печени и заканчивая лечением и хирургической терапией ОСО, предполагается, что скрытые опасности этой недооцененной проблемы, которая затрагивает миллионы людей. бедных и менее привилегированных людей могут вскоре улучшиться, улучшив качество жизни и приведя к другим социально-экономическим достижениям.
Основные моменты
В этом обзоре освещается текущее состояние и контроль инфекций Opisthorchis и Clonorchis в странах бассейна Нижнего Меконга.
Данные обобщены из презентаций «96 лет описторхоза.
 Международный конгресс печеночных двуусток »в Кхон Каен, Таиланд.
Международный конгресс печеночных двуусток »в Кхон Каен, Таиланд.Для успешной борьбы с этим смертельным заболеванием печени бедняков необходимы более согласованные усилия всех секторов общества, образования, здравоохранения и правительства.
Благодарности
Эта работа была поддержана Международным центром развития и исследований (IDRC), Проектом содействия исследованиям в высшем образовании и Национальным исследовательским университетом Таиланда, Офисом Комиссии по высшему образованию, через Кластер здравоохранения (SHeP-GMS). ), Университет Кхон Каен и Национальный институт здравоохранения США присуждают номера UO1 — {«type»: «entrez-nucleotide», «attrs»: {«text»: «AI065871», «term_id»: «30052581», » term_text «:» AI065871 «}} AI065871 и R01CA155297.Мы признательны за поддержку Медицинскому факультету, Международной программе профессоров.
Сноски
Заявление издателя: Это PDF-файл неотредактированной рукописи, принятой к публикации. В качестве услуги для наших клиентов мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута копирайтингу, верстке и рассмотрению полученного доказательства, прежде чем она будет опубликована в окончательной форме для цитирования. Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержание, и все юридические оговорки, относящиеся к журналу, имеют отношение.
В качестве услуги для наших клиентов мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута копирайтингу, верстке и рассмотрению полученного доказательства, прежде чем она будет опубликована в окончательной форме для цитирования. Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержание, и все юридические оговорки, относящиеся к журналу, имеют отношение.
Ссылки
[1] Sripa B, Kaewkes S, Intapan PM, Maleewong W., Brindley PJ. Пищевые трематодозы в эпидемиологии, патологии, клинических проявлениях и контроле в Юго-Восточной Азии. Adv Parasitol. 2010; 72: 305–50. [PubMed] [Google Scholar] [2] Арминьяко О., Катерини Л., Маруччи Дж., Ферри Ф., Бернардини Дж., Наталини Рапони Дж. И др. Болезни человека, вызываемые Opisthorchis felineus flukes, Италия. Emerg Infect Dis. 2008; 14: 1902–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] [4] Sithithaworn P, Haswell-Elkins M.Эпидемиология Opisthorchis viverrini. Acta Trop. 2003. 88: 187–94. [PubMed] [Google Scholar] [5] Лун З.Р., Гассер Р.Б., Лай Д.Х., Ли AX, Чжу XQ, Ю XB и др. Клонорхоз: основной зооноз пищевого происхождения в Китае. Lancet Infect Dis. 2005; 5: 31–41. [PubMed] [Google Scholar] [6] Эндрюс Р. Х., Сититаворн П., Петни Т. Н.. Opisthorchis viverrini: недооцененный паразит в мировом здравоохранении. Trends Parasitol. 2008; 24: 497–501. [Бесплатная статья PMC] [PubMed] [Google Scholar] [7] Jongsuksuntigul P, Imsomboon T. Борьба с описторхозом в Таиланде.Acta Trop. 2003. 88: 229–32. [PubMed] [Google Scholar] [8] Контроль ВОЗ за трематодными инфекциями пищевого происхождения. Отчет исследовательской группы ВОЗ. Представитель World Health Organ Tech Rep Ser. 1995; 849: 1–157. [PubMed] [Google Scholar] [9] Бувар В., Баан Р., Страйф К., Гросс Й., Секретан Б., Эль-Гиссасси Ф. и др. Обзор канцерогенов человека — Часть B: биологические агенты. Ланцет Онкол. 2009; 10: 321–2. [PubMed] [Google Scholar] [10] IARC Обзор канцерогенов человека, часть B: Биологические агенты.
Acta Trop. 2003. 88: 187–94. [PubMed] [Google Scholar] [5] Лун З.Р., Гассер Р.Б., Лай Д.Х., Ли AX, Чжу XQ, Ю XB и др. Клонорхоз: основной зооноз пищевого происхождения в Китае. Lancet Infect Dis. 2005; 5: 31–41. [PubMed] [Google Scholar] [6] Эндрюс Р. Х., Сититаворн П., Петни Т. Н.. Opisthorchis viverrini: недооцененный паразит в мировом здравоохранении. Trends Parasitol. 2008; 24: 497–501. [Бесплатная статья PMC] [PubMed] [Google Scholar] [7] Jongsuksuntigul P, Imsomboon T. Борьба с описторхозом в Таиланде.Acta Trop. 2003. 88: 229–32. [PubMed] [Google Scholar] [8] Контроль ВОЗ за трематодными инфекциями пищевого происхождения. Отчет исследовательской группы ВОЗ. Представитель World Health Organ Tech Rep Ser. 1995; 849: 1–157. [PubMed] [Google Scholar] [9] Бувар В., Баан Р., Страйф К., Гросс Й., Секретан Б., Эль-Гиссасси Ф. и др. Обзор канцерогенов человека — Часть B: биологические агенты. Ланцет Онкол. 2009; 10: 321–2. [PubMed] [Google Scholar] [10] IARC Обзор канцерогенов человека, часть B: Биологические агенты. Монографии МАИР по оценке канцерогенных рисков для людей.2011; 100В: 457. [Google Scholar] [11] Шин Х. Р., О Дж. К., Масуйер Э., Курадо М. П., Бувар В., Фанг Ю. Ю. и др. Эпидемиология холангиокарциномы: обновленная информация о факторах риска. Cancer Sci. 2010; 101: 579–85. [PubMed] [Google Scholar] [12] Vatanasapt V, Uttaravichien T., Mairiang EO, Pairojkul C, Chartbanchai W., Haswell-Elkins M. Холангиокарцинома на северо-востоке Таиланда. Ланцет. 1990; 335: 116–7. [PubMed] [Google Scholar] [13] Thu ND, Dalsgaard A, Loan LT, Murrell KD. Исследование зоонозных метацеркарий печени и кишечных трематод у культурных и диких рыб в провинции Анжанг, Вьетнам.Корейский J Parasitol. 2007; 45: 45–54. [Бесплатная статья PMC] [PubMed] [Google Scholar] [14] Энес Дж. Э., Заработок А. Дж., Мэлоун Дж. Б., Тесана С. Распространенность инфекции Opisthorchis viverrini среди собак и кошек в трех деревнях провинции Кхон Каен на северо-востоке Таиланда. Юго-Восточная Азия J Trop Med Public Health. 2010; 41: 36–42.
Монографии МАИР по оценке канцерогенных рисков для людей.2011; 100В: 457. [Google Scholar] [11] Шин Х. Р., О Дж. К., Масуйер Э., Курадо М. П., Бувар В., Фанг Ю. Ю. и др. Эпидемиология холангиокарциномы: обновленная информация о факторах риска. Cancer Sci. 2010; 101: 579–85. [PubMed] [Google Scholar] [12] Vatanasapt V, Uttaravichien T., Mairiang EO, Pairojkul C, Chartbanchai W., Haswell-Elkins M. Холангиокарцинома на северо-востоке Таиланда. Ланцет. 1990; 335: 116–7. [PubMed] [Google Scholar] [13] Thu ND, Dalsgaard A, Loan LT, Murrell KD. Исследование зоонозных метацеркарий печени и кишечных трематод у культурных и диких рыб в провинции Анжанг, Вьетнам.Корейский J Parasitol. 2007; 45: 45–54. [Бесплатная статья PMC] [PubMed] [Google Scholar] [14] Энес Дж. Э., Заработок А. Дж., Мэлоун Дж. Б., Тесана С. Распространенность инфекции Opisthorchis viverrini среди собак и кошек в трех деревнях провинции Кхон Каен на северо-востоке Таиланда. Юго-Восточная Азия J Trop Med Public Health. 2010; 41: 36–42. [Бесплатная статья PMC] [PubMed] [Google Scholar] [15] Sithithaworn P, Tesana S, Pipitgool V, Kaewkes S, Thaiklar K, Pairojkul C, et al. Количественное посмертное исследование Opisthorchis viverrini у человека на северо-востоке Таиланда.Trans R Soc Trop Med Hyg. 1991; 85: 765–8. [PubMed] [Google Scholar] [16] Leiper RT. Примечания о появлении паразитов, предположительно, редких у человека в человеке. Армейский медицинский корпус JR. 1915; 24: 569–75. [Google Scholar] [17] Гроув Д. История гельминтологии человека. CAB International; Великобритания: 1990. С. 141–57. [Google Scholar] [18] Wu Z, Guan Y, Zhou Z. [Исследование древнего трупа периода Воюющих царств, обнаруженного в гробнице № 1 в Guo-Jia Gang в городе Jingmen (всестороннее исследование)] J Tongji Med Univ. 1996; 16: 1–5.10. [PubMed] [Google Scholar] [19] Трауб Р.Дж., Макаранас Дж., Мунгтин М., Лилайова С., Крибб Т., Мюррелл К.Д. и др. Новый подход, основанный на ПЦР, показывает, что ареал Clonorchis sinensis теперь простирается до Центрального Таиланда.
[Бесплатная статья PMC] [PubMed] [Google Scholar] [15] Sithithaworn P, Tesana S, Pipitgool V, Kaewkes S, Thaiklar K, Pairojkul C, et al. Количественное посмертное исследование Opisthorchis viverrini у человека на северо-востоке Таиланда.Trans R Soc Trop Med Hyg. 1991; 85: 765–8. [PubMed] [Google Scholar] [16] Leiper RT. Примечания о появлении паразитов, предположительно, редких у человека в человеке. Армейский медицинский корпус JR. 1915; 24: 569–75. [Google Scholar] [17] Гроув Д. История гельминтологии человека. CAB International; Великобритания: 1990. С. 141–57. [Google Scholar] [18] Wu Z, Guan Y, Zhou Z. [Исследование древнего трупа периода Воюющих царств, обнаруженного в гробнице № 1 в Guo-Jia Gang в городе Jingmen (всестороннее исследование)] J Tongji Med Univ. 1996; 16: 1–5.10. [PubMed] [Google Scholar] [19] Трауб Р.Дж., Макаранас Дж., Мунгтин М., Лилайова С., Крибб Т., Мюррелл К.Д. и др. Новый подход, основанный на ПЦР, показывает, что ареал Clonorchis sinensis теперь простирается до Центрального Таиланда. PLoS Negl Trop Dis. 2009; 3: e367. [Бесплатная статья PMC] [PubMed] [Google Scholar] [20] Штауффер В.М., Селлман Дж. С., Уокер П. Ф.. Билиарные печеночные двуустки (описторхоз и клонорхоз) у иммигрантов в США: часто незаметные и диагностируются через несколько лет после прибытия. J Travel Med. 2004; 11: 157–9.[PubMed] [Google Scholar] [21] Йосепович О., Готесман Т., Ассоус М., Марва Э., Цимлихман Р., Дэн М. Описторхоз, вызванный импортной сырой рыбой. Emerg Infect Dis. 2004; 10: 2122–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] [22] Sadun EH. Исследования Opisthorchis viverrini в Таиланде. Am J Hyg. 1955; 62: 81–115. [PubMed] [Google Scholar] [23] Упатам Е.С., Виянант В., Куратонг С., Ройборвонвитая Дж., Брокельман В.Й., Ардсунгноен С. и др. Взаимосвязь между распространенностью и интенсивностью инфекции Opisthorchis viverrini и клиническими симптомами и признаками в сельской местности на северо-востоке Таиланда.Bull World Health Organ. 1984; 62: 451–61. [Бесплатная статья PMC] [PubMed] [Google Scholar] [24] Упатам Е.С., Виянант В., Куратонг С., Брокельман В.Й., Менаручи А., Саоваконта С. и др. Заболеваемость в зависимости от интенсивности инфекции Opisthorchiasis viverrini: исследование сообщества в Кхон Каен, Таиланд. Am J Trop Med Hyg. 1982; 31: 1156–63. [PubMed] [Google Scholar] [25] Упатам Е.С., Брокельман В.Й., Виянант В., Ли П., Каенгрэн Р., Прайунвиват Б. Заболеваемость эндемической инфекцией Opisthorchis viverrini в деревне на северо-востоке Таиланда.Am J Trop Med Hyg. 1985; 34: 903–6. [PubMed] [Google Scholar] [26] Johansen MVSP, Bergquist R, Utzinger J. На пути к улучшенной диагностике зоонозных трематодных инфекций в Юго-Восточной Азии. Продвинутая паразитология. 2010; 73: 171–95. [PubMed] [Google Scholar] [27] Рим HJ, Chai JY, Min DY, Cho SY, Eom KS, Hong SJ, et al. Распространенность кишечных паразитарных инфекций в национальном масштабе среди младших школьников Лаоса. Parasitol Res. 2003. 91: 267–72. [PubMed] [Google Scholar] [28] Чай Дж. Й., Хан Э. Т., Шин Э. Х., Сон В. М., Йонг Т. С., Эом К. С. и др.Высокая распространенность Haplorchis taichui, Phaneropsolus molenkampi и других гельминтозов среди жителей провинции Хаммуан, Лаосская Народно-Демократическая Республика. Корейский J Parasitol. 2009; 47: 243–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] [29] Кобаяши Дж., Ванначоне Б., Сато Й., Манивонг К., Намбанья С., Интаконе С. Эпидемиологическое исследование инфекции Opisthorchis viverrini в лаосских деревнях. Юго-Восточная Азия J Trop Med Public Health. 2000. 31: 128–32. [PubMed] [Google Scholar] [30] Кобаяси Дж., Ванначоне Б., Ксеутвонгса А., Маниванг К., Огава С., Сато Ю. и др.Распространенность кишечной паразитарной инфекции среди детей в двух деревнях Лаосской Народно-Демократической Республики. Юго-Восточная Азия J Trop Med Public Health. 1996; 27: 562–5. [PubMed] [Google Scholar] [31] Sayasone S, Mak TK, Vanmany M, Rasphone O, Vounatsou P, Utzinger J, et al. Гельминтозы и кишечные простейшие инфекции, множественный паразитизм и факторы риска в провинции Тямпасак, Лаосская Народно-Демократическая Республика. PLoS Negl Trop Dis. 2011; 5: e1037. [Бесплатная статья PMC] [PubMed] [Google Scholar] [32] Sayasone S, Odermatt P, Phoumindr N, Vongsaravane X, Sensombath V, Phetsouvanh R, et al.Эпидемиология Opisthorchis viverrini в сельском районе на юге Лаосской Народно-Демократической Республики. Trans R Soc Trop Med Hyg. 2007; 101: 40–7. [PubMed] [Google Scholar] [33] Sayasone S, Vonghajack Y, Vanmany M, Rasphone O, Tesana S, Utzinger J, et al. Разнообразие кишечных гельминтозов человека в Лаосской Народно-Демократической Республике. Trans R Soc Trop Med Hyg. 2009. 103: 247–54. [PubMed] [Google Scholar] [34] Сититаворн П., Сукават К., Ванначон Б., Софонфонг К., Бен-Эмбарек П., Петни Т. и др. Эпидемиология пищевых трематод и других паразитарных инфекций в рыбацком сообществе на водохранилище Нам Нгум, Лаосская Народно-Демократическая Республика.Юго-Восточная Азия J Trop Med Public Health. 2006; 37: 1083–90. [PubMed] [Google Scholar] [35] Стич А.Х., Биэйс С., Одерматт П., Мэн С., Саем С., Соха К. и др. Очаги шистосомоза меконги, Северная Камбоджа: II. Распространение инфекции и заболеваемости. Trop Med Int Health. 1999; 4: 674–85. [PubMed] [Google Scholar] [36] Ли KJ, Bae YT, Kim DH, Deung YK, Ryang YS, Kim HJ, et al. Состояние инфекции кишечных паразитов среди детей младшего школьного возраста в Кампонгчаме, Камбоджа. Корейский J Parasitol. 2002; 40: 153–5.[Бесплатная статья PMC] [PubMed] [Google Scholar] [37] Сон В. М., Ким Х. Дж., Йонг Т. С., Эом К. С., Чон Х. Г., Ким Дж. К. и др. Заражение Echinostoma ilocanum в провинции Оддар Минчей, Камбоджа. Корейский J Parasitol. 2011; 49: 187–90. [Бесплатная статья PMC] [PubMed] [Google Scholar] [38] Миямото К.М.Х., Като-Хаяси Н., Чигуса Ю. Распространенность описторхоза в Камбодже. Протокол 80-го Ежегодного собрания Jpn Soc Parasitol; Токио. Июль 2011 г. 2011 г. п. 67. [Google Scholar] [39] Touch S, Komalamisra C, Radomyos P, Waikagul J. Обнаружение метацеркарий Opisthorchis viverrini у пресноводных рыб в южной Камбодже.Acta Trop. 2009; 111: 108–13. [PubMed] [Google Scholar] [40] Сон В.М., Шин Э.Х., Йонг Т.С., Эом К.С., Чон Х.Г., Синуон М. и др. Взрослые особи Opisthorchis viverrini у людей, Такео, Камбоджа. Emerg Infect Dis. 2011; 17: 1302–4. [Бесплатная статья PMC] [PubMed] [Google Scholar] [41] Де Н.В., Мюррелл К.Д., Конгле Д., Кам П.Д., Чау ле В., Тоан Н.Д. и др. Пищевые трематодные зоонозы Вьетнама. Юго-Восточная Азия J Trop Med Public Health. 2003; 34 (Приложение 1): 12–34. [PubMed] [Google Scholar] [42] MVP / WPRO, регион Западной части Тихого океана.Всемирная организация здоровья; 2008. Обзор эпидемиологического профиля гельминтозов и борьбы с ними в Регионе Западной части Тихого океана, 1997-2008 гг., ВОЗ. [Google Scholar] [43] Гранди-Уорр К., Эндрюс Р. Х., Сититаворн П., Петни Т. Н., Срипа Б., Лайтхавеват Л. и др. Грубые отношения, культуры водно-болотных угодий, жизненные циклы: социокультурная динамика, связанная с Opisthorchis viverrini в бассейне реки Меконг. Parasitol Int. 2011 (в печати) [PubMed] [Google Scholar] [44] Brockelman WY, Upatham ES, Viyanant V, Ardsungnoen S, Chantanawat R.Полевые исследования передачи человеческой печеночной двуустки Opisthorchis viverrini на северо-востоке Таиланда: изменения популяции промежуточного хозяина улитки. Int J Parasitol. 1986; 16: 545–52. [PubMed] [Google Scholar] [45] Циглер А.Д., Эндрюс Р.Х., Гранди-Уорр К., Сититаворн П., Петни Т.Н.. Борьба с печеночником с помощью просвещения по вопросам безопасности пищевых продуктов. Наука. 2011; 331: 282–3. [PubMed] [Google Scholar]
PLoS Negl Trop Dis. 2009; 3: e367. [Бесплатная статья PMC] [PubMed] [Google Scholar] [20] Штауффер В.М., Селлман Дж. С., Уокер П. Ф.. Билиарные печеночные двуустки (описторхоз и клонорхоз) у иммигрантов в США: часто незаметные и диагностируются через несколько лет после прибытия. J Travel Med. 2004; 11: 157–9.[PubMed] [Google Scholar] [21] Йосепович О., Готесман Т., Ассоус М., Марва Э., Цимлихман Р., Дэн М. Описторхоз, вызванный импортной сырой рыбой. Emerg Infect Dis. 2004; 10: 2122–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] [22] Sadun EH. Исследования Opisthorchis viverrini в Таиланде. Am J Hyg. 1955; 62: 81–115. [PubMed] [Google Scholar] [23] Упатам Е.С., Виянант В., Куратонг С., Ройборвонвитая Дж., Брокельман В.Й., Ардсунгноен С. и др. Взаимосвязь между распространенностью и интенсивностью инфекции Opisthorchis viverrini и клиническими симптомами и признаками в сельской местности на северо-востоке Таиланда.Bull World Health Organ. 1984; 62: 451–61. [Бесплатная статья PMC] [PubMed] [Google Scholar] [24] Упатам Е.С., Виянант В., Куратонг С., Брокельман В.Й., Менаручи А., Саоваконта С. и др. Заболеваемость в зависимости от интенсивности инфекции Opisthorchiasis viverrini: исследование сообщества в Кхон Каен, Таиланд. Am J Trop Med Hyg. 1982; 31: 1156–63. [PubMed] [Google Scholar] [25] Упатам Е.С., Брокельман В.Й., Виянант В., Ли П., Каенгрэн Р., Прайунвиват Б. Заболеваемость эндемической инфекцией Opisthorchis viverrini в деревне на северо-востоке Таиланда.Am J Trop Med Hyg. 1985; 34: 903–6. [PubMed] [Google Scholar] [26] Johansen MVSP, Bergquist R, Utzinger J. На пути к улучшенной диагностике зоонозных трематодных инфекций в Юго-Восточной Азии. Продвинутая паразитология. 2010; 73: 171–95. [PubMed] [Google Scholar] [27] Рим HJ, Chai JY, Min DY, Cho SY, Eom KS, Hong SJ, et al. Распространенность кишечных паразитарных инфекций в национальном масштабе среди младших школьников Лаоса. Parasitol Res. 2003. 91: 267–72. [PubMed] [Google Scholar] [28] Чай Дж. Й., Хан Э. Т., Шин Э. Х., Сон В. М., Йонг Т. С., Эом К. С. и др.Высокая распространенность Haplorchis taichui, Phaneropsolus molenkampi и других гельминтозов среди жителей провинции Хаммуан, Лаосская Народно-Демократическая Республика. Корейский J Parasitol. 2009; 47: 243–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] [29] Кобаяши Дж., Ванначоне Б., Сато Й., Манивонг К., Намбанья С., Интаконе С. Эпидемиологическое исследование инфекции Opisthorchis viverrini в лаосских деревнях. Юго-Восточная Азия J Trop Med Public Health. 2000. 31: 128–32. [PubMed] [Google Scholar] [30] Кобаяси Дж., Ванначоне Б., Ксеутвонгса А., Маниванг К., Огава С., Сато Ю. и др.Распространенность кишечной паразитарной инфекции среди детей в двух деревнях Лаосской Народно-Демократической Республики. Юго-Восточная Азия J Trop Med Public Health. 1996; 27: 562–5. [PubMed] [Google Scholar] [31] Sayasone S, Mak TK, Vanmany M, Rasphone O, Vounatsou P, Utzinger J, et al. Гельминтозы и кишечные простейшие инфекции, множественный паразитизм и факторы риска в провинции Тямпасак, Лаосская Народно-Демократическая Республика. PLoS Negl Trop Dis. 2011; 5: e1037. [Бесплатная статья PMC] [PubMed] [Google Scholar] [32] Sayasone S, Odermatt P, Phoumindr N, Vongsaravane X, Sensombath V, Phetsouvanh R, et al.Эпидемиология Opisthorchis viverrini в сельском районе на юге Лаосской Народно-Демократической Республики. Trans R Soc Trop Med Hyg. 2007; 101: 40–7. [PubMed] [Google Scholar] [33] Sayasone S, Vonghajack Y, Vanmany M, Rasphone O, Tesana S, Utzinger J, et al. Разнообразие кишечных гельминтозов человека в Лаосской Народно-Демократической Республике. Trans R Soc Trop Med Hyg. 2009. 103: 247–54. [PubMed] [Google Scholar] [34] Сититаворн П., Сукават К., Ванначон Б., Софонфонг К., Бен-Эмбарек П., Петни Т. и др. Эпидемиология пищевых трематод и других паразитарных инфекций в рыбацком сообществе на водохранилище Нам Нгум, Лаосская Народно-Демократическая Республика.Юго-Восточная Азия J Trop Med Public Health. 2006; 37: 1083–90. [PubMed] [Google Scholar] [35] Стич А.Х., Биэйс С., Одерматт П., Мэн С., Саем С., Соха К. и др. Очаги шистосомоза меконги, Северная Камбоджа: II. Распространение инфекции и заболеваемости. Trop Med Int Health. 1999; 4: 674–85. [PubMed] [Google Scholar] [36] Ли KJ, Bae YT, Kim DH, Deung YK, Ryang YS, Kim HJ, et al. Состояние инфекции кишечных паразитов среди детей младшего школьного возраста в Кампонгчаме, Камбоджа. Корейский J Parasitol. 2002; 40: 153–5.[Бесплатная статья PMC] [PubMed] [Google Scholar] [37] Сон В. М., Ким Х. Дж., Йонг Т. С., Эом К. С., Чон Х. Г., Ким Дж. К. и др. Заражение Echinostoma ilocanum в провинции Оддар Минчей, Камбоджа. Корейский J Parasitol. 2011; 49: 187–90. [Бесплатная статья PMC] [PubMed] [Google Scholar] [38] Миямото К.М.Х., Като-Хаяси Н., Чигуса Ю. Распространенность описторхоза в Камбодже. Протокол 80-го Ежегодного собрания Jpn Soc Parasitol; Токио. Июль 2011 г. 2011 г. п. 67. [Google Scholar] [39] Touch S, Komalamisra C, Radomyos P, Waikagul J. Обнаружение метацеркарий Opisthorchis viverrini у пресноводных рыб в южной Камбодже.Acta Trop. 2009; 111: 108–13. [PubMed] [Google Scholar] [40] Сон В.М., Шин Э.Х., Йонг Т.С., Эом К.С., Чон Х.Г., Синуон М. и др. Взрослые особи Opisthorchis viverrini у людей, Такео, Камбоджа. Emerg Infect Dis. 2011; 17: 1302–4. [Бесплатная статья PMC] [PubMed] [Google Scholar] [41] Де Н.В., Мюррелл К.Д., Конгле Д., Кам П.Д., Чау ле В., Тоан Н.Д. и др. Пищевые трематодные зоонозы Вьетнама. Юго-Восточная Азия J Trop Med Public Health. 2003; 34 (Приложение 1): 12–34. [PubMed] [Google Scholar] [42] MVP / WPRO, регион Западной части Тихого океана.Всемирная организация здоровья; 2008. Обзор эпидемиологического профиля гельминтозов и борьбы с ними в Регионе Западной части Тихого океана, 1997-2008 гг., ВОЗ. [Google Scholar] [43] Гранди-Уорр К., Эндрюс Р. Х., Сититаворн П., Петни Т. Н., Срипа Б., Лайтхавеват Л. и др. Грубые отношения, культуры водно-болотных угодий, жизненные циклы: социокультурная динамика, связанная с Opisthorchis viverrini в бассейне реки Меконг. Parasitol Int. 2011 (в печати) [PubMed] [Google Scholar] [44] Brockelman WY, Upatham ES, Viyanant V, Ardsungnoen S, Chantanawat R.Полевые исследования передачи человеческой печеночной двуустки Opisthorchis viverrini на северо-востоке Таиланда: изменения популяции промежуточного хозяина улитки. Int J Parasitol. 1986; 16: 545–52. [PubMed] [Google Scholar] [45] Циглер А.Д., Эндрюс Р.Х., Гранди-Уорр К., Сититаворн П., Петни Т.Н.. Борьба с печеночником с помощью просвещения по вопросам безопасности пищевых продуктов. Наука. 2011; 331: 282–3. [PubMed] [Google Scholar]
Описторхоз: упущенная опасность
Образец цитирования: Огородова Л.М., Федорова О.С., Срипа Б., Мордвинов В.А., Катохин А.В., Кейзер Дж. И др.(2015) Описторхоз: упущенная опасность. PLoS Negl Trop Dis 9 (4):
e0003563.
https://doi.org/10.1371/journal.pntd.0003563
Редактор: Малкольм К. Джонс, Университет Квинсленда, АВСТРАЛИЯ
Опубликовано: 2 апреля 2015 г.
Авторские права: © 2015 Огородова и другие. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любых носителях при условии указания автора и источника
Финансирование: Международная научная конференция «Описторхоз» .Незаметная опасность »(14-15 апреля 2014 г .; Томск; Российская Федерация) при поддержке ООО« Пфайзер », Российского фонда фундаментальных исследований (грант № 14-04-060094; грант № НК 14-04-31752 / 14) и Правительство Томской области. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Я ознакомился с политикой журнала, и у авторов этой рукописи есть следующие конкурирующие интересы: OYK работает в коммерческой компании Pfizer LLC.Это не влияет на нашу приверженность всем политикам PLOS NTD в отношении обмена данными и материалами.
Предыстория
Группа гельминтозов, вызванных трематодами семейства трематод Opisthorchiidae, недавно стала предметом обсуждения на встрече, на которой ученые из России, Юго-Восточной Азии, Европы и США собрались в городе Томск на западе страны. Сибирь (Россия) создаст Томский консорциум по профилактике орхоза (TOPIC). Эта инициатива запускает платформу для повышения осведомленности, усиления комплексного контроля и проведения исследований забытого инфекционного заболевания, поражающего население не только в тропических регионах Восточной Азии, но также в умеренных и полуарктических регионах Европы и Азии [1 ].
Важными для человека Opisthorchiidae являются Opisthorchis felineus , Opisthorchis viverrini и Clonorchis sinensis , каждый из которых имеет дискретное, хотя иногда и частично совпадающее, географическое распространение: O . felineus является эндемиком Европы и России; С . sinensis в Китае, Республике Корея и северном Вьетнаме; и O . viverrini в Юго-Восточной Азии. Вместе они затрагивают более 45 миллионов человек во всем мире [2].Заражение человека O . felineus возникает в результате употребления в пищу сырой или недоваренной пресноводной рыбы, несущей метацеркарии паразита. Проглоченные личинки развиваются дальше и мигрируют в желчные протоки посредством хемотаксиса, где взрослые черви питаются желчным эпителием и содержимым желчи. Взрослые черви сбрасывают яйца, которые попадают в желудочно-кишечный тракт и выбрасываются с фекалиями во внешнюю среду. Пресноводные улитки семейства Bithyniidae глотают яйца, и после выхода мирацидиев из яиц внутри улитки проходит несколько стадий развития до тех пор, пока не разовьются церкарии.Распадающиеся церкарии могут проникать в пресноводных рыб, где они проникают в кожу или плоть [3].
В пределах рода Opisthorchis , O . felineus — это вид с наивысшим зоонозным потенциалом, который имеет важное значение не только для ветеринарии, но и для поддержания передачи вируса человеку даже при высоких гигиенических стандартах, при которых риск заражения пресной воды человеческими фекалиями низок [4]. Заболевания, связанные с описторхозом, в основном гепатобилиарны, в частности, возникают из-за фиброза желчных протоков и холангита, и выражаются в различных проявлениях, таких как механическая желтуха, гепатомегалия, боли в животе и тошнота [5].Важно отметить, что есть исследования на животных моделях, подтверждаемые другими эпидемиологическими данными, которые указывают, что O . viverrini и C . sinensis инфекции могут привести к холангиокарциноме, обычно неизлечимому и, следовательно, смертельному раку желчных протоков [6,7], что привело к отнесению этих паразитов к канцерогенам Группы 1 Международным агентством по изучению рака [1 , 8,9]. Несмотря на неоспоримую важность этих инфекций для общественного здравоохранения, как с точки зрения числа инфицированных людей во всем мире, так и с точки зрения клинического воздействия, органы здравоохранения, грантовые агентства и фармацевтическая промышленность уделяют им относительно мало внимания.После плодотворной работы в Таиланде, Корее, а позже в Китае, Лаосе и Камбодже, где ряд исследований прояснили ситуацию в отношении эпидемиологии, патогенеза и контроля, произошел постепенный рост осведомленности. Примечательно, что информация о последовательности генома этих печеночных двуусток становится все более доступной, например, на сайте www.trematode.net [10]. Однако остаются важные пробелы и, в частности, мало информации о O . felineus .
Поэтому была предпринята инициатива организовать встречу в Томске, городе, расположенном в регионе Западной Сибири, который является высоко эндемичным для O . felineus [4,11], и объединяет мультидисциплинарный коллектив исследователей, работающих над Opisthorchiidae и инфекциями, вызываемыми этими переносимыми рыбами печеночными двуустками. Это событие приветствовала многонациональная фармацевтическая компания Pfizer, которая поддержала встречу и признала важность заражения O . felineus как запущенная угроза здоровью в России. Встреча была направлена на то, чтобы осветить текущую деятельность общественного здравоохранения и исследования болезней, вызываемых Opisthorchiidae, и, в частности, выявить пробелы в наших знаниях об эпидемиологии, клиническом профиле, лечении и фундаментальных механизмах взаимодействия паразит-хозяин.
Ученые, представившие и обсудившие результаты своих исследований, охватили широкий спектр тем, включая эпидемиологию и клинические аспекты этих инфекций, а также аспекты взаимодействия паразита и хозяина и молекулярную биологию этих паразитов.
Эпидемиология, клинические характеристики и лечение
Объем имеющихся данных по эпидемиологии Opisthorchiidae в основном основан на исследованиях, проведенных на инфекциях, вызванных O . viverrini , и все чаще с C . sinensis , в котором собирались и собираются надежные данные в Юго-Восточной Азии для картирования эндемичных регионов и количественной оценки степени заболеваемости, связанной с инфекциями [2]. Питер Одерматт из Швейцарского института тропиков и общественного здравоохранения обсудил важность этой инфекции в сельских районах Таиланда, Лаоса, Камбоджи и Вьетнама [12].В частности, инфекция широко распространена в Лаосе, где инфицировано более половины населения; в высокоэндемичных деревнях инфицировано 70% населения. Согласно микроскопии, 50% населения некоторых деревень Лаоса было инфицировано O . viverrini , частота инфицирования возрастает с возрастом [13]. Была обнаружена тесная корреляция между потреблением рыбы и распространенностью O . viverrini в общинах в сельских районах Лаоса, где могут быть инфицированы 23 различных вида рыб в этом регионе, а в некоторых деревнях до 60% некоторых из этих видов рыб несут метацеркарии [14].Обследование кошек и собак, которые часто являются совместным проживанием в домохозяйствах, показало, что 30% этих домашних животных были инфицированы O . viverrini и, таким образом, может способствовать усилению передачи этих паразитов человеку. Более того, глубоко укоренившаяся в культуре привычка потреблять блюда из сырой рыбы является серьезной проблемой для общественного здравоохранения [15].
Данные, собранные о клинических симптомах, предоставили исчерпывающее представление о заболеваниях, связанных с O . viverrini , в котором сообщается, что увеличение интенсивности инфекции и многопаразитарной инфекции было связано с увеличением зарегистрированных симптомов дискомфорта в животе и болезней в эндемичных сообществах [16–18]. Использование ультразвукового исследования в полевых условиях позволило провести широкомасштабное обследование жителей пострадавших деревень, чтобы точно определить аномалии, связанные с инфекцией [19]. В обследованной инфицированной популяции нормальные гепатобилиарные изображения обычно не наблюдались, тогда как легкая и тяжелая патология с расширением желчных протоков была зарегистрирована у значительной части взрослого населения в сельской местности [20].
Связь между O . viverrini и холангиокарцинома, или рак желчных протоков, обсуждались Банчобом Срипой из Университета Кхон Каен, Таиланд. Не только самый высокий уровень заболеваемости этим раком желчных протоков в мире наблюдается в Северо-Восточном Таиланде, где O . viverrini очень эндемичен, но есть также убедительные доказательства на моделях с экспериментальным заражением лабораторных грызунов, демонстрирующие тесную связь между печеночной двуусткой и раком [21].Принимая во внимание, что есть также значительные доказательства ассоциации C . sinensis и рак желчного протока, до сих пор неизвестно, является ли O . felineus разделяет эту особенность, это явная область, в которой необходимы дальнейшие исследования [1].
Продолжаются попытки понять факторы риска развития тяжелых заболеваний, включая рак желчных протоков: может иметь значение коинфекция с другими паразитарными или вирусными (печеночными) инфекциями или курением.Для точного картирования паразитарной инфекции и факторов риска заболеваемости, включая биомаркеры холангиокарциномы, необходимы крупные многоцентровые и межстрановые исследования. Дистанционное зондирование и пространственная байесовская статистика, позволяющая картировать инфекцию на основе геофизических характеристик эндемичных районов, являются важными инструментами, позволяющими выявить социально-демографические и экологические факторы и, следовательно, подготовить крупномасштабные карты корреляции различных факторов риска и заболеваемости, в том числе желчи. рак протока [13].На биологическом уровне метаболический фенотип субъектов с риском развития холангиокарциномы с использованием биологических жидкостей объяснил Олег Майборода из Медицинского центра Лейденского университета, Нидерланды. Использование эффективных аналитических технологий, таких как масс-спектрометрия (МС) и спектроскопия ядерного магнитного резонанса (ЯМР), которые теперь более доступны, чем раньше, может быть полезным для раннего обнаружения, а также для понимания механизмов, которые приводят к развитию рака у инфицированных субъектов. .Другой областью применения технологий является идентификация метаболических профилей, специфичных для Opisthorchiidae, как это уже было сделано для других паразитарных инфекций [22–24], что затем может позволить разработать простые применимые в полевых условиях быстрые тесты.
В настоящее время лечение Opisthorchiidae основано на применении празиквантела в дозе 40 мг / кг массы тела. Данные, представленные Питером Одерматтом, указывают на то, что может потребоваться увеличение дозы празиквантела до 75 мг / кг, но при этом существует риск усиления побочных эффектов, что является важным фактором для соблюдения режима лечения в сообществе [25].Поиск новых методов лечения, которые были бы более эффективными и позволяющими снизить количество побочных эффектов, привел к появлению потенциальных новых лекарств, таких как трибендимидин [26–28].
Взаимодействие хозяин-паразит
Обсуждался ряд основных механизмов взаимодействия хозяин-паразит в отношении патологии и персистенции. Банчоб Срипа представил данные о способности ряда паразитических молекул управлять неконтролируемым ростом клеток-хозяев и, таким образом, объяснить возможную связь между O . viverrini и рак желчного протока. Такие молекулы, как гранулин паразитарного происхождения, который приводит к пролиферации желчных и других клеток млекопитающих [29], или ферменты паразитарного происхождения тиоредоксин (TRX) и тиоредоксинпероксидаза (TPX), которые предотвращают апоптоз, могут быть вовлечены в стимуляцию неконтролируемого роста клетки-хозяева [3]. Более того, есть данные, указывающие, что O . viverrini Экстракты способны стимулировать воспалительные цитокины, такие как IL-6 и IL-8, холангиоцитами человека, мононуклеарными клетками периферической крови, и что более высокий уровень IL-6 наблюдается у инфицированных пациентов с раком желчных протоков по сравнению с таковыми. без [30–32].Вместе эти данные поднимают вопрос о том, обладают ли другие Opisthorchiidae сильными провоспалительными свойствами, которые объясняют повышенный риск рака при заражении этими трематодами и открывают возможности для профилактики.
Связан с воспалительной реакцией, вызванной O . viverrini , Пол Бриндли из Университета Джорджа Вашингтона, Вашингтон, округ Колумбия, США, обсудил изменение микробиома кишечника и желчи инфицированных хозяев. Он представил результаты, которые указывают на заражение O . viverrini изменил микробиом кишечника хомяков. Это исследование обнаружило неожиданное присутствие сообществ очень избранных видов бактерий в желчи инфицированных хомяков. Интересно, что ряд видов экологических бактерий, которых не ожидается в микрофлоре кишечника, похоже, попали в желчь вместе с O . viverrini . Могут ли эти микробы играть важную роль в развитии хронического воспаления желчных путей? Эти виды бактерий не похожи на эндосимбиотические виды Neorickettsia , которые, как известно, связаны с трематодами в целом [33].Тем не менее, учитывая, что лабораторное загрязнение может повлиять на анализ микробиома на основе последовательностей, особенно при анализе биологических жидкостей, отличных от содержимого кишечника и фекалий, и там, где микробиота может быть скудной [34], эти результаты необходимо будет подтвердить в других условиях. Если действительно O . viverrini метацеркарий и / или развивающихся взрослых двуусток переносчиков экологических или экзотических микробов в желчное дерево, стойкие воспалительные реакции на эту микробиоту, связанную с двуустками, могут быть ключевым фактором в развитии рака [3,19,21,35].Этот отчет подготовил почву для исследований на людях, чтобы проверить, могут ли действовать аналогичные механизмы.
Основной иммунологический профиль людей, инфицированных этими паразитами, был предметом презентаций Ольги Федоровой из Сибирского государственного медицинского университета и Марии Язданбахш из Медицинского центра Лейденского университета, Нидерланды. По сравнению с другими паразитическими гельминтами, относительно мало сделано для иммунологического профилирования людей, инфицированных Opisthorchiidae, особенно выше O . viverrini инфекций [30]. Иммуноэпидемиологические исследования в Томской области сравнивали субъектов, инфицированных O . felineus показал, что существует перекос Th3, о чем свидетельствует повышенный уровень IgE у инфицированных субъектов по сравнению с неинфицированными, но что уровни намного ниже, чем те, которые были обнаружены в исследованиях инфицированных гельминтами субъектов в Гане, где широко распространен шистосомоз, или в Индонезии в целом. сообщества с геогельминтными инфекциями.Это могло произойти из-за того, что интенсивность заражения ниже в O . felineus инфицированных субъектов и что в полуарктических регионах Западной Сибири коинфекций с другими гельминтами гораздо меньше. Однако также возможно, что антигенный состав O . felineus менее способен вызывать ответы Th3. Некоторые доказательства этого получены в исследованиях in vitro, в которых дендритные клетки человека культивировали с O . felineus антигенов приводят к меньшему перекосу Th3 по сравнению с тем, когда дендритные клетки культивировали с антигенами Schistosoma mansoni [36].
Искажение иммунных ответов в отношении Th2, Th3 и регуляторных Т-клеток может иметь важное значение для понимания иммунопатологических процессов, а также развития рака, связанного с инфекцией. Ряд исследований людей, хронически инфицированных, например, шистосомами или геогельминтами, показал индукцию регуляторных Т [37,38] и В-клеток [39] этими паразитами. Эти иммунные регуляторные клетки могут участвовать в подавлении ответов на неродственные антигены [40,41].Исследование, проведенное в Томской области, показало обратную связь между O . felineus и ответы на аллергены [11], подтверждая мнение о том, что было бы целесообразно исследовать, способны ли Opisthorchiidae индуцировать регуляторные клетки. Это имеет особое значение также из-за возможной связи с развитием рака. Прогноз рака плохой, если в опухолях обнаружены регуляторные Т-клетки, а ряд исследований на экспериментальных моделях показал, что регуляторные Т-клетки связаны с более быстрым ростом опухоли [42,43].Ли О . viverrini и C . sinensis несут молекулы, которые способны индуцировать регуляторные Т- или В-клетки. Недавно было показано, что экскреторные / секреторные (E / S) антигены нематоды Heligmosomoides polygyrus вызывают сильные регуляторные Т-клеточные ответы. Нейтрализация этих E / S антигенов привела к полной элиминации червей [44]. Этот захватывающий подход также можно рассматривать для создания иммунитета к Opisthorchiidae, а также для борьбы с ассоциированным раком желчных протоков.
Презентация Тирумалайсами Велавана, представителя Института тропической медицины Тюбингенского университета, Германия, указала на важность исследований, касающихся врожденных иммунных компонентов системы комплемента и его взаимодействия с Opisthorchiidae. О . felineus имеет внешний синцитиальный цитоплазматический слой в качестве тегументов, как и у других трематод. Более ранние исследования показали, что эти оболочки трематод состоят из остатков D-маннозы / D-глюкозы, N-ацетил-D-глюкозамина / сиаловой кислоты, D-галактозы и остатков N-ацетил-D-галактозамина на гликокаликсе взрослого человека. тегумент и выражены на всех этапах развития.Эти гликоконъюгаты служат в качестве патоген-ассоциированных молекулярных паттернов (PAMP) для иммунного распознавания и последующего опосредованного комплементом уничтожения [45–47]. Ранее было показано, что два элемента распознавания врожденного иммунитета системы комплемента, маннозо-связывающий лектин и фиколины, влияют на исход инфекции в S . haematobium , вызывающий рак мочевого пузыря [48,49]. Кроме того, было установлено, что функциональные варианты этих генов MBL2 и FCN2 модулируют уровни циркулирующей сыворотки и способность связывания с поверхностью паразита, что приводит к нарушению распознавания [50].Следовательно, исследование белков лектинового пути во время инфекции Opisthorchis может помочь лучше понять взаимодействия между хозяином и паразитом во время установления активной инфекции.
Действительно, вопрос генетической регуляции восприимчивости к Opisthorchiidae и генетического контроля развития ассоциированной патологии требует внимания. Максим Фрейдин из Научно-исследовательского института медицинской генетики, Россия, и Royal Brompton Hospital, Великобритания, представил результаты пилотного исследования взаимодействия генов и окружающей среды в Томской популяции, в результате которого было выявлено O . felineus как важный модификатор ассоциаций между Th2 / Th3-регулирующими генами и аллергическим заболеванием. В частности, было показано, что O . Инфекция felineus снижает риск атопической бронхиальной астмы, связанный с полиморфизмом генов SOCS5 и IFNG [4]. Было обнаружено, что экспрессия аллель-специфического гена изменена присутствием O . felineus , что дает функциональный ключ к механизмам идентифицированного взаимодействия гена с окружающей средой.Эти исследования образуют парадигму для оценки того, контролируется ли тканевая патология / развитие рака воспалением в результате взаимодействия генов и окружающей среды.
Диагностика
Попытки использовать молекулярные подходы для обнаружения O . felineus в исследованиях на базе больниц в Европе, где инфекции обнаруживаются спорадически [51]. Презентация Василия Петренко из Медико-биологического союза и Института цитологии и генетики, Новосибирск, Россия, показала многообещающие результаты по обнаружению четырех двуусток Opisthorchiidae, O . felineus , в частности, методом ПЦР в реальном времени на основе Taqman с высокой степенью чувствительности и специфичности при работе с фекалиями хомяков, инфицированных местными штаммами. Эти результаты требуют крупномасштабных валидационных исследований, аналогичных текущей деятельности по молекулярной диагностике O . viverrini и C . sinensis и надежная дискриминация O . felineus инфекция [2]. Применимость этих тестов в полевых условиях обсуждалась с точки зрения предоставления диагностических тестов в местах оказания медицинской помощи.Тирумалайсами Велаван представил новый молекулярный диагностический подход для быстрого обнаружения паразитов с использованием метода изотермической амплификации, опосредованной петлей (LAMP) [52]. Эти методики были установлены для O . viverrini , нацеленная на внутренний транскрибируемый спейсер 1 (ITS1) в рибосомной ДНК для специфической амплификации [53]. Методики LAMP просты, чувствительны, специфичны и быстрее, чем ПЦР, требуют минимальной обработки и инструментов, а результаты доступны при считывании невооруженным глазом.Разработка такой методологии LAMP для O . felineus находится в стадии создания.
Биология паразитов и лекарственные мишени
Исследовательская группа Института цитологии и генетики в Новосибирске под руководством Алексея Катохина провела филогеографические генетические исследования двуустки Opisthorchiidae с целью сравнения их генетического разнообразия и истории видов [54]. Эти исследования нацелены на объяснение выраженных различий в способности трех сосальщиков паразитировать у разных млекопитающих и пролить свет на степень зооноза у разных видов [2].Эти исследования могут помочь интегрированным программам контроля и углубить наше фундаментальное понимание биологических процессов.
Мария Пахарукова и Вячеслав Мордвинов, также из Института цитологии и генетики, Новосибирск, представили данные о структуре и функциональной организации системы биотрансформации ксенобиотиков в O . felineus [55]. Система участвует, вероятно, в О . felineus метаболизм и транспорт эндогенных и экзогенных субстратов.Важно отметить, что цитохром P450 дифференциально экспрессируется в течение жизненного цикла O . felineus и присутствует в O . felineus в большем количестве, чем O . viverrini . Вопрос в том, может ли это иметь какое-либо отношение к синтезу провоспалительных и потенциально канцерогенных соединений, например оксистерин-подобных, катехол-эстроген-хиноноподобных и т. Д., Выделяемых сосальщиками [56,57]. Были также представлены новые данные об исследованиях эффектов празиквантела в O . felineus модель хомяка и in vitro на молодых и взрослых червях, в частности, о подвижности паразитов, жизнеспособности и повреждении тегумента после обработки празиквантелом.
Заключительные замечания: призыв к расширению консорциума
Представленные и обсужденные данные привели нас к выводу, что существует множество групп с совпадающими интересами и соответствующими знаниями, которые готовы работать вместе для достижения общей цели борьбы с инфекциями, вызываемыми двуусткой печени, и связанными с ними заболеваниями. патологии по всему миру.Самое главное, было подчеркнуто, что это отправная точка для приглашения других групп, активно работающих в области исследований печеночных двуусток, присоединиться к Томскому консорциуму описторхоза, связавшись с Людмилой Огородовой из Сибирского государственного медицинского университета, Томск, Россия (topic.consortium@gmail .com). В частности, поскольку было ограниченное обсуждение текущего состояния исследований в области клонорхоза, специалисты в этой области также будут особенно приветствоваться.
Лаборатория исследования тропических болезней Университета Кхон Каен имеет успешную программу контроля, так называемую «модель Лавы», основанную на использовании подхода EcoHealth в районе озера Лава на северо-востоке Таиланда [58].Было решено, что эта модель контроля будет взята за образец и модифицирована в соответствии с местными системами здравоохранения и культурными особенностями в других эндемичных районах, но не будет отличаться по сути с привлечением трансдисциплинарного участия и участия заинтересованных сторон на всех уровнях.
Один из первых вопросов, который необходимо решить, — это понять пробел в знаниях о распространенности O . felineus в России и масштабы связанной с этим заболеваемости; в частности, является ли О . felineus Инфекция связана с повышенным риском рака желчных протоков. Параллельно с этим проводятся мероприятия, способствующие более быстрой разработке проверенных диагностических тестов для точного обнаружения O . felineus инфекция будет стимулироваться, а эффективность лечения используемых в настоящее время лекарств будет проверена, а группы будут работать вместе, чтобы укрепить научные и технологические навыки, необходимые для понимания взаимодействия паразита и хозяина с точки зрения иммунопатогенеза и регуляции.Наконец, всеобъемлющие фундаментальные молекулярно-биологические усилия по выявлению новых мишеней для лекарств или новых профилактических и терапевтических мер будут стимулироваться за счет объединения опыта и обмена биологическим материалом, доступным в рамках Консорциума.
Консорциум должен работать и расширяться в рамках нескольких параллельных совместных исследовательских мероприятий / рабочих пакетов, изображенных в дорожной карте высокого уровня (рис. 1), таких как: бремя / серьезность и контроль со стороны сообщества; клинические исследования; биология и экология паразитов; взаимодействие паразит-хозяин; передача знаний / технологий.
Рис. 1. График / мероприятия высокого уровня консорциума.
1. Сибирский государственный медицинский университет, Томск, Российская Федерация, 2. Центр протеомики и метаболомики, Медицинский центр Лейденского университета, Лейден, Нидерланды, 3. Кафедра паразитологии и Лейденской группы иммунологии паразитов, Медицинский центр Лейденского университета, Лейден, Нидерланды, 4. Медицинский центр Университета Джорджа Вашингтона, США, 5. Институт цитологии и генетики СО РАН, Новосибирск, Российская Федерация, 6.Институт тропической медицины Тюбингенского университета, Германия, 7. Университет Кхон Каен, Кхон Каен, Таиланд, 8. Pfizer LLC, Москва, Российская Федерация, 9. Фонд ReMedys, Женева, Швейцария, 10. Королевский госпиталь Бромптон, Великобритания; Научно-исследовательский институт медицинской генетики, Томск, Российская Федерация, 11. Швейцарский институт тропиков и общественного здравоохранения, Базель, Швейцария.
https://doi.org/10.1371/journal.pntd.0003563.g001
Эти мероприятия подробно описаны в плане проекта, находящегося в стадии разработки.Успех Консорциума будет измеряться по результатам исследований, а в долгосрочной перспективе — по применимости этих результатов в обществе. Таким образом, необходимо уделять внимание передаче технологий через все доступные и возможные механизмы, сокращая разрыв между фундаментальными исследованиями и индустриализацией. Чтобы обеспечить планирование, создание, координацию, продвижение, достижение основных этапов и, наконец, передачу результатов знаний / технологий, приоритетное внимание будет уделяться наличию на борту опыта в области управления программами и индустриализации.Это может быть сделано через организации с промышленным опытом, такие как Pfizer и ReMedys Foundation, которые уже входят в число учредителей Консорциума. (Pfizer стремится положительно влиять на здоровье людей во всем мире. Стратегия корпоративных социальных инвестиций Pfizer направлена на использование всего спектра ресурсов компании — людей, навыков, опыта и финансирования — для расширения доступа к лекарствам и улучшения медицинского обслуживания для малообеспеченные люди во всем мире [http: // www.pfizer.com/responsibility/global_health/global_health]. ReMedys — это некоммерческая организация, основанная экспертами в области биофармацевтической промышленности, которая намеревается внедрить новый, основанный на сотрудничестве подход, устраняющий разрыв между трансляционными исследованиями и разработками [R&D]. ReMedys выступает в качестве переводческого подразделения НИОКР и центра для ведущих исследовательских институтов, групп пациентов и клиницистов. Создавая и координируя индивидуальные союзы, ориентированные на пациента, ReMedys объединяет все ресурсы, необходимые для развития, и делает доступными для пациентов с высокими неудовлетворенными потребностями многообещающие терапевтические проекты [http: // correys.нетто].)
Члены-учредители Консорциума подписали Меморандум о взаимопонимании, который будет доступен для подписания исследовательским группам, заинтересованным в том, чтобы стать новыми членами.
Общая программа должна регулироваться Соглашением о Консорциуме, которое находится в стадии разработки, к которому должны быть приглашены новые члены для присоединения и участия. Финансирование Консорциума должно быть обеспечено за счет мероприятий, связанных с национальными и международными грантами, участниками. Как описано, Консорциум стремится участвовать в стратегическом совместном исследовании серьезного, но крайне запущенного инфекционного заболевания, которое является причиной тяжелого социально-экономического бремени, включая рак.Исследование также должно быть сосредоточено на уязвимых группах населения, таких как дети, и, следовательно, ожидается, что результаты будут иметь большое социально-экономическое воздействие. Таким образом, Консорциум с соответствующими инструментами может повысить осведомленность общественности через пациента, врача, исследователя, спонсора гранта и правительство. Такое понимание должно способствовать его финансированию также через общественные, благотворительные, международные НПО; партнерство с корпоративной ответственностью; и так далее. Следует изучить другие механизмы финансирования, такие как краудфандинг, в которых могут участвовать все члены Консорциума.
Список литературы
- 1.
Обзор канцерогенов человека. Монографии МАИР по оценке канцерогенных рисков для человека / Всемирная организация здравоохранения, Международное агентство по изучению рака IARC (2012) Биологические агенты. Том 100 Б. 100: 1–441. pmid: 23193840 - 2.
Petney TN, Andrews RH, Saijuntha W., Wenz-Mücke A, Sithithaworn P (2013) Зоонозные, переносимые рыбами печеночные двуустки Clonorchis sinensis , Opisthorchis felineus и Opisthorchis viverrini .Int J Parasitol 43: 1031–46. pmid: 23978669 - 3.
Срипа Б., Бриндли П.Дж., Малвенна Дж., Лаха Т., Смаут М.Дж., Майианг Э. и др. (2012) Онкогенный печеночный сосальщик Opisthorchis viverrini — множественные пути к раку. Trends Parasitol 28: 395–407. pmid: 22947297 - 4.
Салтыкова И.В., Огородова Л.М., Брагина Е.Ю., Пузырев В.П., Фрейдин М.Б. (2014) Инвазия печеночной двуустки Opisthorchis felineus — фактор окружающей среды, изменяющий генетический риск атопической бронхиальной астмы.Acta Trop 139: 53–56. pmid: 25017311 - 5.
Кейзер Дж., Утцингер Дж. (2009) Трематодозы пищевого происхождения. Clin Microbiol Rev 22: 466–483. pmid: 19597009 - 6.
Thunyaharn N, Promthet S, Wiangnon S, Suwanrungruang K, Kamsa-ard S (2013) Выживаемость пациентов с холангиокарциномой на северо-востоке Таиланда после поддерживающего лечения. APJCP 14: 7029–32. pmid: 24377644 - 7.
Лим JH (2011) Печеночные двуустки: болезнь, которой не уделяется должного внимания. Корейский журнал J Radiol 12: 269–79.pmid: 21603286 - 8.
Bouvard V, Baan R, Straif K, Grosse Y, Secretan B и др. (2009) Обзор канцерогенов человека. Часть B: биологические агенты. The Lancet Oncology 10: 321–322. pmid: 19350698 - 9.
де Мартель С., Ферлей Дж., Франчески С., Винья Дж., Брей Ф., Форман Д. и др. (2012) Глобальное бремя рака, связанного с инфекциями, в 2008 г .: обзор и синтетический анализ. Ланцет Онкол 13: 607–615. pmid: 22575588 - 10.
Мартин Дж., Роза Б.А., Озерский П., Холлсворт-Пепин К., Чжан Х, Бхонагири-Палсикар В. и др.(2015) Helminth.net: дополнения к Nematode.net и введение в Trematode.net. Nucleic Acids Res. 28 января; 43 (выпуск базы данных): D698–706. pmid: 25392426 - 11.
Огородова Л.М., Фрейдин М.Б., Сазонов А.Е., Федорова О.С., Гербек И.Е., Черевко Н.А. и др. (2007) Пилотный скрининг распространенности атопических состояний и описторхоза и их взаимосвязи у жителей Томской области. Parasitol Res 101: 1165–1168. pmid: 17549516 - 12.
Сититаворн П., Эндрюс Р.Х., Ван Де Н, Вонгсарой Т., Синуон М., Одерматт П. и др.(2012) Текущее состояние описторхоза и клонорхоза в бассейне реки Меконг. Паразитол Инт 61: 10–6. pmid: 21893213 - 13.
Форрер А, Вунацу П., Саясон С., Вонгхачак Й., Буакхасит Д., Фогт С. и др. (2012) Пространственное распределение и факторы риска инфекции Opisthorchis viverrini в Южном Лаосе. PloS Negl Trop Dis 6: e1481. pmid: 22348157 - 14.
Sayasone S, Odermatt P, Phoumindr N, Vongsaravane X, Sensombath V, Phetsouvanh R и др.(2007) Эпидемиология Opisthorchis viverrini в сельском районе южной части Лаосской Народно-Демократической Республики. Trans R Soc Trop Med Hyg 101: 40–7. pmid: 16828134 - 15.
Xayaseng V, Phongluxa K, van Eeuwijk P, Akkhavong K, Odermatt P (2013) Потребление сырой рыбы в эндемичных для печеночных двуусток районах в сельской местности на юге Лаоса. Acta Trop 127: 105–111. pmid: 23567553 - 16.
Sayasone S, Vonghajack Y, Vanmany M (2009) Разнообразие кишечных гельминтозов человека в Лаосской Народно-Демократической Республике. Trans R Soc Trop Med Hyg 103: 247–54.pmid: 111
- 17.
Sayasone S, Mak TK, Vanmany M, Rasphone O, Vounatsou P, Utzinger J, et al. (2011) Гельминтозы и кишечные простейшие инфекции, множественный паразитизм и факторы риска в провинции Тямпасак, Лаосская Народно-Демократическая Республика. PLoS Negl Trop Dis 5: e1037. pmid: 21532735 - 18.
Sayasone S, Rasphone O, Vanmany M, Vounatsou P, Utzinger J, Tanner M и др. (2012) Тяжелая заболеваемость, вызванная инфекцией Opisthorchis viverrini и Schistosoma mekongi в Лаосской Народно-Демократической Республике.Clin Infect Dis 55: e54–7. pmid: 22670046 - 19.
Майианг Э., Лаха Т., Бетони Дж. М., Думхемроп Б., Каукес С., Сититхаворн П. и др. (2012) Ультрасонографическая оценка патологий гепатобилиарной системы у 3359 пациентов с инфекцией Opisthorchis viverrini в эндемичных районах Таиланда. Parasitol Int 61: 208–211. pmid: 21771664 - 20.
Ayé Soukhathammavong P, Rajpho V, Phongluxa K, Vonghachack Y, Hattendorf J, Hongvanthong B и др. (2015) От легкой до тяжелой гепатобилиарной заболеваемости, связанной с инфекцией Opisthorchis viverrini в Южном Лаосе.Acta Trop 141: 303–9. pmid: 25275346 - 21.
Sripa B, Kaewkes S, Sithithaworn P, Mairiang E, Laha T, Smout M и др. (2007) Печеночная двуустка вызывает холангиокарциному. PLoS Med 4: e201. pmid: 17622191 - 22.
Ольшевский К.Л., Морриси Дж. М., Вилински Д., Бернс Дж. М., Вайдья А. Б., Рабиновиц Дж. Д. и др. (2009) Взаимодействие хозяин-паразит, выявленное метаболомикой Plasmodium falciparum . Клеточный микроб-хозяин 5: 191–9. pmid: 19218089 - 23.
Ли Дж. В., Холмс Э., Сарич Дж., Кейзер Дж., Дирнхофер С., Утцингер Дж. И др.(2009) Метаболическое профилирование инфекции Schistosoma mansoni в тканях мышей с использованием спектроскопии ядерного магнитного резонанса с вращением под магическим углом. Int J Parasitol 39: 547–58. pmid: 118 - 24.
Балок К.И., Мейснер А., Горалер С., Бладергроен М.Р., Веннервальд Б.Дж., Майборода О.А. и др. (2011) Метабономическое исследование инфекции человека Schistosoma mansoni . Мол Биосист 7: 1473–80. pmid: 21336380 - 25.
Ловис Л., Мак Т.К., Фонглюкса К., Айе Соукхатаммавонг П., Вонгхачак Ю., Кейзер Дж. И др.(2012) Эффективность празиквантела против Schistosoma mekongi и Opisthorchis viverrini : рандомизированное слепое исследование сравнения доз. PLoS Negl Trop Dis 6: e1726. pmid: 22848766 - 26.
Soukhathammavong P, Odermatt P, Sayasone S, Vonghachack Y, Vounatsou P, Hatz C и др. (2011) Эффективность и безопасность мефлохина, артесуната, мефлохина-артесуната, трибендимидина и празиквантела у пациентов с Opisthorchis viverrini : рандомизированное исследовательское открытое исследование фазы 2.J Lancet Infect Dis 11: 110–8. pmid: 21111681 - 27.
Кейзер Дж, Адельфио Р., Варгас М., Одерматт П., Тесана С. (2013) Активность комбинированной терапии трибендимидином и празиквантелом против печеночного двуустника Opisthorchis viverrini in vitro и in vivo. J Helminthol 87: 252–6. pmid: 22892101 - 28.
Qian MB, Yap P, Yang YC, Liang H, Jiang ZH, Li W и др. (2013) Эффективность и безопасность трибендимидина против Clonorchis sinensis . Clin Infect Dis 56: e76–82.pmid: 23223597 - 29.
Смаут М.Дж., Лаха Т., Малвенна Дж., Срипа Б., Суттипрапа С., Джонс А. и др. (2009) Гранулиноподобный фактор роста, секретируемый канцерогенными печеночными двуустками, Opisthorchis viverrini , способствует пролиферации клеток-хозяев. PLoS Pathog 5: e1000611. pmid: 19816559 - 30.
Sripa B, Mairiang E, Thinkhamrop B, Laha T., Kaewkes S., Sithithaworn P, et al. (2009) Развитый перидуктальный фиброз в результате инфицирования канцерогенным печеночным двуустком человека Opisthorchis viverrini коррелирует с повышенным уровнем интерлейкина-6.Гепатология 50: 1273–1281. pmid: 19676135 - 31.
Sripa B, Thinkhamrop B, Mairiang E, Laha T, Kaewkes S, Sithithaworn P и др. (2012) Повышенный уровень IL-6 в плазме связан с повышенным риском развития фиброза и холангиокарциномы у лиц, инфицированных Opisthorchis viverrini . PLoS Negl Trop Dis 6: e1654. pmid: 22629477 - 32.
Ninlawan K, O’Hara SP, Splinter PL, Yongvanit P, Kaewkes S, Surapaitoon A и др. (2010) Opisthorchis viverrini экскреторные / секреторные продукты вызывают активацию толл-подобного рецептора 4 и продукцию интерлейкина 6 и 8 в холангиоцитах.Parasitol Int 59: 616–21. pmid: 20887801 - 33.
Воан Дж. А., Ткач В. В., Грейман С. Е. (2012) Неориккетсиальные эндосимбионты дигенеи: разнообразие, передача и распространение. Adv Parasitol 79: 253–97. pmid: 22726644 - 34.
Солтер С.Дж., Кокс М.Дж., Турек Е.М., Калус С.Т., Куксон В.О. и др. (2014) Загрязнение реагентов и лабораторий может критически повлиять на анализ микробиома, основанный на последовательностях. BMC Biol 12:87 pmid: 25387460 - 35.
Плискатт Дж. Л., Динонпо Р., Малвенна Дж. П., Краузе Л., Срипа Б., Бетони Дж. М. и др.(2013) Инфекция канцерогенным печеночным двуустком Opisthorchis viverrini изменяет микробиом кишечника и желчных путей. FASEB J 27: 4572–4584. pmid: 23925654 - 36.
Эвертс Б., Хуссаартс Л., Дриссен Н.Н., Мивиссен М.Х., Шрамм Г., ван дер Хам А.Дж. и др. (2012) Полученные из шистосом омега-1 стимулируют поляризацию Th3, подавляя синтез белка после интернализации рецептором маннозы. J Exp Med 24 209: 1753–67. pmid: 22966004 - 37.
Watanabe K, Mwinzi PN, Black CL, Muok EM, Karanja DM, Secor WE и др.(2007) Уровни Т-регуляторных клеток снижаются у людей, инфицированных Schistosoma mansoni , при эффективном лечении. Am J Trop Med Hyg 77: 676–82. pmid: 17978070 - 38.
Ваммес Л.Дж., Хамид Ф., Вириа А.Е., де Гье Б., Сартоно Э., Майзелс Р.М. и др. (2010) Регуляторные Т-клетки при геогельминтной инфекции человека подавляют иммунные ответы на БЦЖ и Plasmodium falciparum . Eur J Immunol 40: 437–42. pmid: 20063313 - 39.
Finlay CM, Walsh KP, Mills KH (2014) Индукция регуляторных клеток паразитами гельминтов: использование для лечения воспалительных заболеваний.Immunol Rev 259: 206–30. pmid: 24712468 - 40.
Майзельс Р.М., Язданбахш М. (2003) Иммунная регуляция паразитами-гельминтами: клеточные и молекулярные механизмы. Nat Rev Immunol 3: 733–44. pmid: 12949497 - 41.
ван дер Влугт Л.Е., Лабуда Л.А., Озир-Фазалалихан А., Ливерс Э., Глодеманс А.К., Лю К.Ю. и др. (2012) Шистосомы индуцируют регуляторные функции в CD1d (hi) B-клетках человека и мыши: ингибирование аллергического воспаления с помощью IL-10 и регуляторных Т-клеток. PLoS One 7: e30883.pmid: 22347409 - 42.
Chang WJ, Du Y, Zhao X, Ma LY, Cao GW (2014) Факторы, связанные с воспалением, предсказывающие прогноз рака желудка. Всемирный журнал J Gastroenterol 20: 4586–4596. pmid: 24782611 - 43.
Номура Т., Сакагучи С. (2005) Естественно возникающие CD25 + CD4 + регуляторные Т-клетки в опухолевом иммунитете. Curr Top Microbiol Immunol 293: 287–302. pmid: 15981485 - 44.
Ey PL (1988) Heligmosomoides polygyrus : задержка развития и задержка роста личинок антителами, специфичными к экскреторным / секреторным антигенам.Exp Parasitol 65: 232–43. pmid: 3350103 - 45.
Апинхасмит В., Собхон П., Тарасуб С., Мотонг В., Сайтонгди П., Сретаругса П. и др. (2000) Opisthorchis viverrini : ультраструктура и цитохимия гликокаликса тегумента. J Helminthol 74: 23–29. pmid: 10831050 - 46.
Klabunde J, Berger J, Jensenius JC, Klinkert MQ, Zelck UE, Kremsner PG и др. (2000) Schistosoma mansoni : адгезия маннан-связывающего лектина к поверхностным гликопротеинам церкарий и взрослых червей.Exp Parasitol 95: 231–239. pmid: 11038306 - 47.
Talabnin K, Aoki K, Saichua P, Wongkham S, Kaewkes S, Boons GJ и др. (2013) Стадийно-специфическая экспрессия и антигенность гликанов гликопротеинов, выделенных из печеночной двуустки человека, Opisthorchis viverrini . Int J Parasitol 43: 37–50. pmid: 23174105 - 48.
Ouf EA, Ojurongbe O, Akindele AA, Sina-Agbaje OR, Van Tong H, Adeyeba AO и др. (2012) Уровни фиколина-2 и генетический полиморфизм FCN2 как фактор восприимчивости при шистосомозе.J Infect Dis 206: 562–70. pmid: 22693230 - 49.
Энтони Дж. С., Оджуронгбе О., ван Тонг Х., Оуф Э. А., Энглейтнер Т., Акинделе А. А. и др. (2013) Лектин, связывающий маннозу, и восприимчивость к шистосомозу. J Infect Dis 207: 1675–1683. pmid: 23448728 - 50.
Мэдсен Х.О., Гарред П., Тиль С., Курцхалс Дж. А., Ламм Л. Ю., Райдер Л. П. и др. (1995) Взаимодействие между промотором и вариантами структурного гена контролирует базальный сывороточный уровень маннан-связывающего белка. J Immunol 155: 3013–3020.pmid: 7673719 - 51.
Pozio E, Armignacco O, Ferri F, Gomez Morales MA (2013) Opisthorchis felineus , новая инфекция в Италии и ее последствия для Европейского союза. Acta Trop 126: 54–62. pmid: 23337391 - 52.
Port JR, Nguetse C, Adukpo S, Velavan TP (2014) Надежный и быстрый метод молекулярного обнаружения малярийных паразитов с использованием микроволнового излучения и петлевой изотермической амплификации. Малар Дж. 13: 454. pmid: 25421401 - 53.Arimatsu Y, Kaewkes S, Laha T, Hong SJ, Sripa B (2012) Быстрое обнаружение копро-ДНК Opisthorchis viverrini с использованием петлевой изотермической амплификации (LAMP). Parasitol Int 61: 178–82. pmid: 21871581
- 54.
Брусенцов И.И., Катохин А.В., Брусенцова И.В., Шеховцов С.В., Боровиков С.Н., Гончаренко Г.Г. и др. (2013) Низкое генетическое разнообразие широко распространенного евразийского печеночного двуустки Opisthorchis felineus предполагает особую демографическую историю этого вида трематод.PLoS One 8: e62453. pmid: 23634228 - 55.
Vale N, Gouveia MJ, Botelho M, Sripa B, Suttiprapa S, Rinaldi G и др. (2013) Канцерогенные оксистерины печеночного двуустки Opisthorchis viverrini , обнаруженные с помощью ЖХ-МС / МС исследования экстракта растворимой фракции паразитов. Parasitol Int 62: 535–42. pmid: 23973383 - 56.
Пахарукова М.Ю., Ершов Н.И., Воронцова Е.В., Катохин А.В., Меркулова Т.И., Мордвинов В.А. (2012) Цитохром P450 двуустки Opisthorchis felineus : идентификация и характеристика.Mol Biochem Parasitol 181: 190–4. pmid: 22115821 - 57.
Correia da Costa JM, Vale N, Gouveia MJ, Botelho MC, Sripa B, Santos LL и др. (2014) Катехол-эстрогены, полученные из шистосом и печеночных двуусток, и раковые заболевания, связанные с гельминтами. Фронт Жене. 2014 23 декабря; 5: 444. pmid: 25566326 - 58.
Sripa B, Tangkawattana S, Laha T., Kaewkes S, Mallory FF, Smith JF и др. (2015) К комплексной борьбе с описторхозом в Северо-Восточном Таиланде: проект Lawa. Acta Trop 141: 361–367.pmid: 25102053
Milyen halak vannak opisthorchiasis ?, Pisztráng bélmintái
Мильен халак ваннак описторхоз? Описторхоз — súlyos bélférgesség, amely egy személy hasnyálmirigyére, májára és epevezetékére hat. A fertőzés akkor jelentkezik, amikor nyers, parazita átverés sózott és nem megfelelően hőkezelt folyami pisztráng bélmintái fogyasztása történik.
Мильен халак ваннак описторхоз? — Cirrózis —
Ez a betegség különösen gyakori azokon a területeken, ahol a halászatot fejleszti.Ezek a halak széles választékát tartalmazzák, amelyek között gyakran megtalálható пеляд.
Nagyon népszerű a lakosság körében. Ezért annak érdekében, hogy ne fertőzjenek meg, tudnia kell — a halászott hal egy opisthorchosis, vagy sem? Nagyon fontos az emberi egészség szempontjából. Mit néz ki az opistorhoz? A kórokozó kórokozója — аз óvszer vagy a pisztráng bélmintái.
Ez трематод, плоских червей — это сосальщики osztályhoz tartozik. Египетские лапочки, hosszúkás teste van, két szopókával.A parazita hossza — mm, szélessége -, 5 мм. Máj izomzatának falaihoz, melyeket ellopták a hasi és az orális szopókákhoz, amelyekkel megtartják ket és táplálékokat szívnak fel.
Описторхис — hermafroditikus. Minden egyénnek két nemi nemi párja van.
Milyen halak az opisthorchiasis, tengerben, a folyó, a napszárított, a főzés? — Termékek
A féreg a tojás segítségével terjed, amely naponta akár darabos mennyiségben is képes. Milyen halat fertőzik az opisthorchiasis Fertőzés helminthi invázió egy személy lehetetlen köztes házigazdák nélkül, amelyek megtalálhatók az édesvízi testekben.Parazita tojásait pisztráng bélmintái, halak testébe juttatják a puhatestűeket, amelyek ezután megbetegednek és megfertőzik az embereket. Milyen halat lehet fertőzni az описторхоз? Korábban azt hitték, hogy a helminthisist leggyakrabban a ponty család tagjai közvetítik, де tudomány megcáfolta ezt a tévhitet.
Még azok is, akik ragadozó halfajokat fogyasztanak, elkezdték diagnosztizálni a betegséget. Ферег ларвакат — это талалтак беннюк. Itt van egy hiányos lista a folyó és tó halakról, ahol az óvóhely jelen lehet: A ponty család — ponty, keszeg, verkhovka, ponty, sárgarépa, keresztes ponty.Pisztráng bélmintái sügéscsalád rozsdás, szúrós, harcsa, sügér.
A tokhal családja — tüske, tokhal, tokhal. A lazac családja — karéliai pisztráng, муксун, хариус, нельма, омуль, pelerizált syrokfehér hal. Муксун fertőzöttnek tűnik a folyók úszásával. Ez a ragadozó kisebb egyének pisztráng bélmintái, amellyel аз opisthorchis lárvákat használja.
Nem lehet szemmel megállapítani, hogy vannak-e férgek a muksunban, ezért a halat alaposan meg kell főzni. Nelma és pike Az első a pontyos is a süllő családok egyéniségét fogyasztja.Szereti a fehérhalat és az illatot. Ez a körülmény megerősíti, hogy létezik a nelma fertőzés lehetősége.
Helminthikus invázió jelenléte csak komplex vizsgálatok után található meg, ezért használat előtt biztosítani kell megfelelően feldolgozni. Sokan érdekelnek: van-e opisthorchiasis a csuklóban? Mivel ugyanabban a víztestben él, és fertőzött pürével táplálkozik, fertőzés is bekövetkezik benne.
Щука lárvák pisztráng bélmintái elfogyasztott esetekben az opisthorchosis is megfertőzi a borjút.Пелед Эз еги нагйон непсерű хал, амели Эсзак-Оросзорсаг фолиоин és tavain található. Pisztráng bélmintái bennszülöttek, akik gyermekkoruktól kezdve esznek a tározók ajándékaival, megszokták, hogy nyersen és enyhén sózott formá fogyaszövel eszák,
Sokan nem is tudják, hogy a hal opisthorchosis-e vagy sem. Az orvosok közelmúltbeli tanulmányairól ismert, hogy fertőzött lehet a bélférgességgel, mivel kis rákfélékre, puhatestűekre és kis halakra táplálkozik, amelyben parajásaziták to.
A szennyezett víztestekben található, это туман утан nem vezetett egészségügyi ellenőrzést a túró száz százalékos opisthorchiasis hordozója. Ван-э описторхоз у стерляди? Ez főként pisztráng bélmintái víztestek által okozott szennyeződéssel járó szennyeződéssel — это szennyeződést bejöv szennyeződésekkel jár.
Más ragadozó fajokba való fertőzés lehetséges. A tengerek és óceánok lakói nem az opisthorchiasis fertőzésének forrása. Sós vízben élnek, ezért nem érzékenyek erre a helminthiiszre.
- Mennyi ideig tart a halak fagyasztása a parazitáktól? — Nők
- Sózhatok fagyasztott pisztráng kaviárt?
- Helminth betegség listája
Hogyan lehet azonosítani az inváziót? Annak érdekében, hogy megtudja, melyik hal van opisthorchiasis, meg kell venni egy pár mintát példányokgyakori egy adott területen. Folyók és tavak lakosságának elemzése a következő módszereket tartalmazza: Fizikai-kémiai. Az ammónium-klorid vizsgálatán alapul, amelyet az ammónia és sósav bomlása során a hal bomlásának kitéve képeznek.
A pozitív reakció azt mutatja, hogy a parazita egyének megtalálhatók-e. Parazitológiai — аз izomanyag és szubkután szövet mikroszkópos vizsgálata. Létezik-e a helminthisza jelen van-e, amikor megtalálták az opisthorchiasis megeskarccióját. Ezt a módszert csak a legerősebb invázióval lehet használni.
Ebben az esetben észrevehető a növekedés és fejlődés, a súlycsökkenés, a kötőszövet növekedése, évnél fiatalabb gyermekek helminthiasisának megelőzése drogok. Egészségügyi és mikrobiológiai.Lehetővé teszi, hogy megtudja, van-e opisthorchosis и halak testében hígított rozkosavat az izmokon.
szöveteket rózsaszín festékkel kell festeni, is a parazita lárvák nem láthatók. Halfeldolgozás Pisztráng bélmintái érdekében, hogy ne fosszuk pisztráng bélmintái magunkat a Halászat örömeiről és egy értékes és ízletes, halásztángés ézletes, halásztés,, Мэг келл tudnod pontosan, hogy ne fenyehibited a féregfertőzést. Ehhez alaposan meg pisztráng bélmintái vizsgálni a kifogott vagy vásárolt hal mennyiségét.Féreg lárvák ellenállnak a magas és alacsony hőmérsékleteknek.
Hosszú ideig életképesek lehetnek. Számos módon megölheti őket: Hogyan kell megölelően végrehajtani ezeket a az enterobiosisra jellemző Ha ° C-ra csökkenti, fagyás időtartama jelentősen csökkenthető legfeljebb három. Halakat a hűtőszekrényben kell tartani, аз egészségügyi szabványokat betartva, azaz a hústól és egyéb termékektől elkülönítve. Ahhoz, hogy teljesen megszabaduljon a parazitától, megfelelően fel kell készülnie.
A halak megfelelő sójának előkészítéséhez jobb, ha apróra vágjuk. Аз irodalmi sózás nagyon egyszerű. Csak a felnőtteknek a férgekből egy tablettát hívnak szeletét kell elhelyezni, és bőven sózni kell. Nagyon fontos kérdés ebben a folyamatban: mennyi ideig tart a halak sózása az opisthorchiasis megölésében? Feldolgozott hasított test súlyától függ. Sózáskor a lárvák körülbelül három hétig túlélhetnek, de ez a hal típusától függ.
Például a pelenkán 18 napig láthatják az életaktivitás jeleit.Sok nagy egyén számára, amelyek hossza legalább 25 см, a fertőtlenítés napig pisztráng bélmintái. A feldolgozási technológiák figyelmen kívül hagyása során a sózott és szárított halakban fedépő opisthorchosis nem pusztul el.
Melyik hal beteg az описторхоз?
Ezért a végrehajtás helyességének ellenőrzéséhez különösen óvatosnak kell lenni. Hőkezelés A főtt vagy sült Halak Evése szintén nem biztonságos.
Különösen, ha elég nagy darabokban főzik.Annak érdekében, hogy ne betegedjen, grammnál nem nagyobb tömegű halakat kell készíteni.
Milyen halat fertőzik az описторхоз
Főzés közben forraljuk fel legalább percig. Folyók — это tavak lakói nagy mennyiségű olajban, ° C-on, legalább 15 percig sütni kell a különböző oldalaktól. Miután minden darabot megsütjük, azokat bedobjuk a serpenyőbe, адъюнк hozzá egy kis vizet és tartsuk őket a fedő alatt 5 percig. Ezzel a kezeléssel a hal teljesen biztonságos és lédúsabb lesz.
Jó eredmény az oltás során. A hkezelés több órán át végezhető, amíg csontok lágyulnak. Így a konzervet önmagában készítik, bors, babérlevél és napraforgóolaj hozzáadásával. Нагён излетесек аз омуль, пелядь, муксун.
Egypt jó alternatíva a pároláshoz forró dohányzás. Ezzel hatékonyan megszabadulhat a lárváktól есть. Biztonsági óvintézkedések Mint az északi terület lakói, az emberek megszokották a pisztráng bélmintái vékonyra vágott, fagyasztott nyers pisztráng bélmintái ételt.
Szigorúan tilos enni, mivel a megbetegedések kockázata sokszor megnő. Ez nagyon veszélyes, mert a beteg sok éven át kellemetlen tüneteket tapasztal, és még azt sem hiszi, hogy az opisthorchiasis. Egy másik bizonytalan módja a helminthi inváziónak a vágó kések és táblák. Ezeket tartozékokat külön és kizárólag halakhoz kell használni. Мэг Келл Мосни является Форро Визель ле Келл Мосни. Аннак érdekében, pisztráng bélmintái ne fertőződjenek hogyan lehet inni parazita gyógyszereket, halételeket kell készíteni magának és családjának, valamint házaknakiállállatoki.
Figyelembe véve az elővigyázatosságot, és tudva, hogy mely halak vannak opisthorchiasis, akkor biztonságosan megenni a folyók is a tavak ajándékait.
Ezt rendszeresen kell elvégezni, mivel nagyon gazdag a tápanyagok, ezért szükséges az ember számára. Szergej Semyonovich parazitológus 49 kérdés Minden jog fenntartva.
A honlapon feelüntett információ csak tájékoztató jellegű, nem helyettesti a képzett orvosi segítséget, is nem alkalmas öndiagnosztikára és önkezelésre.
A gyógyszerek kiválasztását és rendelését, a kezelés módját, pisztráng bélmintái az alkalmazásuk ellenőrzését csak a kezelőorvos végezheti el. Mindenképpen konzultáljon szakemberrel. Halak listája opisthorchiasisokkal Az opisthorchiasis az egyik legveszélyesebb helminthis inváziónak tekinthető, mivel súlyos mérgezést okoz a szervezetben és károsítja az epevezélyesekekúhs a mag.
Гельминтоз egy «macskavirág» латинский Opisthorchis felineus nevű enterobiosis alkalmazás okozza.Fertőzés fő útja a rosszul feldolgozott édesvízi hal. Ezért fontos tudni, hogy melyik halnak van opisthorchiasis, hogy megvédjék magukat és hozzátartozóikat súlyos betegségektől. Országok listája A legveszélyesebb régiók édesvizű víztestek közelében. Описторхоз járvány kitörése a délkelet-ázsiai országokban: Vietnamban, Thaiföldön, Kambodzsában és Laoszban található.
Hallista Ismert tény, hogy az opisthorchis a rövid életük idején három gazdát — puhatestűeket, pisztráng bélmintái és embert váltott.
Hogyan lehet megölni a parazitákat halakban?
A hal közbenső összeköttetés, és korábban azt hitték, hogy a paraziták csak a ponty családot preferenceálják. Tény, hogy van egy jelentős listája a lakosok pisztráng bélmintái víztestek, amelyek fertőzhetik meg a macska fluke: ponty, a ponty, a keszeg, a ponty, a kegyes pisztrás a verbélés bélés.
Thorn, tokhal és tokhal a tokhal családból. Ruff, wrasse, sügér és harcsa a sült családból.Muksun, nelma, peled, karéliai pisztráng, szürkés, fehér lazac és omul a lazac családból.
Mennyi ideig tart a halak fagyasztása a parazitáktól?
Sok vita van arról, hogy az opisthorchiasis a süllőben van-e. Egyesek úgy vélik, hogy a ragadozók nem fertőzöttek macskavirággal. A sügér azonban megfertőzheti a fertőzötteket. Ezért a hőkezelésnek alaposnak kell lennie. Пелед Мегсалл аз Орош Föderáció északi édesvízi testein.
A bennszülöttek hozzászoktak ahhoz, hogy nyersen vagy enyhén sózott salátán étkezzenek, ami növeli a betegség okozta fertőzés kockázatát.
Egészen a közelmúltig, a kérdés, peled — hal opisthorchosis pisztráng bélmintái sem, továbbra is ellentmondásos. A közelmúlt kutatási eredményei azt mutatják, hogy ez a képviselő — это fertőzött lehet helminthisszal, mivel kis rakok, sültek és puhatestűek táplálkozását jelenthetájas, ami. Többi ragadozó halhoz hasonlóan a csuka — это megfertőzte a fertőzötteket. Idővel az opiszthorchis lárvák átjutnak a belső szervekbe, és belépnek a spawnba.
Az északi régiók őslakosai nyers formában használják.
Megelőzés a szalag parazita ellen
Parazita kezelés széles szalag, opisthorchiasis elemző labratórium Nagy szalagféreg — hogyan kell azonosítani a szervezetben — Gyomorhurut March Életciklus-fejlesztés Férgekélenzárférférférfér
Széles szalag életciklus megelőzés. Férgek szalag széles A széles szalag Diphyllobothrium latum egy parazita felfázás lappangási ideje Cestoda osztályból, amely a diffillobothriazis betegségét okozza.
A féreg behatolása egy olyan személy belsejébe, ahol egy jellemző klinikai tünetek is a Bhiányos vérszegénység előrehaladt. A cestodes szalag, széles férgek a bélbe telepednek, является lárvák elterjedhetnek az egész testben. Széles szalag. Размер номера составляет 10 метров. Fejre ható repedések használata széles szalag életciklus megelőzés bélfelszínhez van kötve. Az emberi test nyers édesvízi halat vesz fel lárvák.
Széles szalag — az emberi testhez és egyes állatokhoz jellegzetes szalag típusának Továbbá и széles szalagféreg диагностировать лаборатории диагностики.Добавить в корзину: széles szalagok ;; анкилостом ;; аскариды ;; törpe tseleen ;; végbélgiliszta ;; Осторферег. Lapos férgek Széles szalag. Áttekintést gyógyszerek férgek férgek gyermekek számára Szükséges a gazdaságban vagy a gazdaságban a paraziták által okozott A háztartási madár fertőzőfékalzéká çámára.
Enterobiosis tabletta egyszer Hogyan lehet a fergeket kiuriteni a testbol Helminths képek Felnőtt férgek vélemények Ez az egyik legnagyobb férg, amely méter hosszú.Parazita által okozott betegséget diphyllobotriosisnak nevezik. A féreg fejlődési ciklusa édesvízi halakkal vagy rákfélékkel kezdődik. Надь szalagféreg — hogyan kell azonosítani a szervezetben Az széles szalag életciklus megelőzés testben, amely egy széles szalagféreg végső tulajdonosatt, a lárva kaviárralzövagy.
Ezek a lárvák hosszúak 0,7 мм-иг. Паразита lárvális fázisa invazív. Rákfélék egy széles szalag első közbülső paraziták a tengeri élelmezési hálóban. Második a ragadozó halak csuka, menyhal, sügér.Nem zárható ки a lazac vagy megelőzés a szalag parazita ellen rózsaszín lazac fertőzése. A szervezetben a hal lárvák behatolnak az izmok és egyéb szövetek. Tsesol, biltricid, Azinoks, Tsistitsid Praciquantel hatóanyag — széles körű hatóanyagok, különböző típusú férgek esetében.
Meg Kell jegyeznünk, hogy minden anthelmintikus gyógyszer, különösen a szalag és laposférgek felszabadítására felírt gyógyszerek csak parazitológusok számára lesnesára résnes.
Az megelőzés a szalag parazita ellen két gyakran alakulnak ki a szervezetben a köztes gazda, például a hal, macska, szarvasmarha, illetve a talajban is a vízben, is ha lenyelik, van egy.Краткий обзор триенофороза.
Ezek a férgek parazitizálják a csikót a belekben a fotónritkábban окуни, омуль, хариус, харча. A máj, néha más belső szervek érintettek.
gy tűnik, hogy cm hosszú és mm széles. A tinifóró leggyakoribb a tó. Férgek férfiakon — széles szalag, Védi az immunitást a paraziták ellen?
Helminths férgek — паразитирующий гельминт хаталмас csoportja, amelyek széles szalag életciklus megelőzés emberek, állatok és A cestodes szalag, széles félbergek Telekom.
Nézd meg a széles szalagot. A féreg élettartama meglehetősen nagy -körülbelül 20 éve. Ha nem dobja ки a bélmust a testből, akkor az egész idő alatt lakik és. Bélférgeket férgek — egy hatalmas osztály parazita férgek élnek az Cestodes szalag, széles férgek él a megelőzés a szalag parazita ellen, lárvák elterjedt az egész.
Férgek fertőzései a gyermek testében vagy egy felnőttnél különböző parazitákkal való fertőzés miatt fordulnak elő.
Szarvasmarha szalagféreg életmód táblázat
Ленточный червь képviselője széles körömvirág.Ugyanúgy leesik, мята fent ismertetett bullish szalagféreg. A kezelés több szakaszban történik, általában összetett. Халак — это тенгер. A férgek körében kerek, lapos, szalagféregek, és gyakran a fentieken kívül előfordulnak ha a féreg elég nagy széles szalagféreg, sertés- vagy szarvasmarha.
Megismerkedünk a parazitizmus jelenségével, a parazita férgek — helmintek nem alakult ki, testük lágy és általában sokkal hosszabb, mint amilyen széles. Közelebbről megvizsgálva láthatóvá válik, hogy a szalag kis.
Macskák elleni féreg elleni megelőzés a szalag parazita ellen tabletták vagy szuszpenziók formájában állnak rendelkezésre.
Széles szalag életciklus megelőzés. Описторхоз és széles szalag.
A széles szalag Sunnah kezelés a paraziták számára a lánchídhoz, de ideiglenes házigazdák édesvízi halak és rakok.
Описторхоз és széles szalag. Cestodes — szalag lapos megelőzés a szalag parazita ellen, amelyek a bélben élnek szarvasmarhafélék szalagféreg, széles szalagféregvagy más szerveket is bejuttatnak lárvák.
A leggyakoribb szalagférgek, amelyek megfertőzik a kutyákat :. A kutyákban lévő férgek széles körben elterjedt betegség, amelyből a kutya nem иммун.
Széles szalag megelőzés. Széles szalag: tünetek és megelőzés Széles szalag életciklus
A laposférgek testhosszúsága миллиметровый интерес и több méteresig terjedhet. Hát- hasi irányban lapított testük alakja lehet karcsú, széles levél vagy szalag formájú.
Széles szalag életciklus megelőzés. Férgek szalag széles A széles szalag Diphyllobothrium latum egy parazita a Cestoda osztályból, amely a diffillobotriazis betegségét okozza.Féreg behatolása egy olyan személy belsejébe, ahol egy jellemző klinikai tünetek is a Bhiányos vérszegénység előrehaladt. Egyszerű paraziták elleni gyógyszer Galandféreg — Széles szalag és ciklops parazitizmus Coracidium széles szalag. Széles szalag életciklus megelőzés A cestodes szalag, széles férgek a bélbe telepednek, является lárvák elterjedhetnek az egész testben.
Tünetek és egy széles szalag kezelése egy személyben. Így férgek gyógyszeres tünetei megragad egy társat egy széles szalagféreg formájában, csak a halat.
A betegségek oka: kerek, lapos szalag férgek. Ez annak köszönhető, hogy széles szalag életciklus megelőzés széles körben elterjedt az a betegség bizonyos állatfaj.
Trichinella külön. Ez a kérdés a thaiföldi tabletták hozzáadása mellett a tojás a férgek Amikor az emberi testben széles vízszintes szalag galandféreg széles. Élettartam széles. Széles szalag az emberi testben Mint a férgek, megint itt van a divízió a kör férgek fonálférgek szalag.
Széles szalag életciklus megelőzés vannak Széles galandféreg.Fertőzés ez parazita. Szalagféreg a halakban — veszélyes-e az emberre, lehet-e megfertőzött halat fogyasztani. A széles szalag vagy hal pasziánsz egy lapos fehér szalag féreg. Macskák esetében a leggyakoribb férgek ленточные черви являются источником круглых червей. Ezeknek a. Magán vagy párosan jár, kivált homályosodáskor széles szalag életciklus megelőzés; férgeket és.
Vermox tabletták különböző típusú férgek által okozott parazita betegségek. A széles spektrumú antihelmintikus gyógyszer a leghatékonyabb az enterobiasis súlyos viszketéséből, valamint a különböző típusú szalagok és kerekféregek.Az кишечник férgek tünetmentesek az emberi testben. Ha van egy parazita a bélben, akkor a tünet csak akkor merül fel, ha az ascaris vagy a széles szalag. A kutyákban lévő férgek széles körben elterjedt betegség, amelyből a kutya A rovar paraziták lenyelik a szalagféreg tojását, amelyek belsejében érlelődnek.
Ezek a legnagyobb férgek, amelyek létfontosságú tevékenységet végeznek egy személyen belül.
opistorchiasis labratóriumi diagnózis, tojásméret — Széles szalag életciklus megelőzés
A szalagféreg széles hordozói édesvízi és sós víz.Széles szalag: tünetek és megelőzés Ez a féreg első lárvaállapota. Parazita kezelés szalag Végleges A széles szalagféreg kezelését úgy végezzük, мятить Fenasal vagy a Biltricide. Széles szalag életciklus megelőzés ne használjon széles körű gyógyszereket, csak ártalmasak és olyan Szalag életciklus megelőzés macskáknál kétférgezakzag.
Szalag férgek macskákban, hogyan kell kezelni. Férgek belső szerveinek rendellenes elhelyezkedésének magyarázata.
Ez a fajta férgek magukban foglalják: májfarkas, széles szalagféreg, tej planárium. Szalag férgek olyan, мята a belekben kezdődik, hogy aktívan élősködik.
Így küzdhetünk a kóros izzadás ellen
Sokkal nagyobb szalag lapos férgekhossza elérheti a 70 cm-t, a fertőzött macska súlya métely; galandférgek ;; széles szalag ;; уборка. A férgek széles spektrumú előkészítése — Háziállat. Hatékony cseppek «Széles szalag életciklus megelőzés a szalag és a kerek férgek, bolhák, különböző típusú kullancsok.Széles spektrumú féreghajtó kutyáknak.
Tekintse meg kínálatunkat is válassza a legjobbat kedvencének! Parazita férgek lokalizálódnak a májban, mivel számos tápanyagot Immunalasz a parazitáknak ppt paraziták kezelésére májban széles spektrumú gyógyszereket alkalmaznak. A féregpete- és protozoonvizsgálat a székletminta mikroszkópos értékelése. Széles szalag életciklus megelőzés szolgál, hogy a gyomor-bél traktusban esetleg jelen levő.
PDF sszefoglalás: Tengeri Polychaeta és Sipunculid férgek által létrehozott bioeróziós Rendkívül széles a skálája azon.A fúrások szalag alakúak. A férgek az egyik leggyakoribb probléma, amellyel az állat tulajdonosa szembesül, és a macskák métely ;; galandférgek ;; Széles szalag ;; Uborka szalagféreg.
Különösen a csigák a trematode szalag férgek közbenső házigazdái, amelyek puhatestűek elleni küzdelem népszerű módszereinek arzenálja igen széles.
- A Prasitel hatékony gyógymód minden típusú bélféreg ellen.
- Coracidium széles szalag. 10cm szatén szalag 25m — Széles szalag megelőzés
Ez zavart okoz a férgek anyagcseréjében, elősegíti az egész izomrendszer bénulását.Leghosszabb férgek a láncok — это szalagféregek sorrendjében modern gyógyszerek férgek számára. Nematódák A széles szalag akár 20 évig is képes élni, folyamatosan növekszik. Jelentéktelen férgek, akik félnek a fénytől. Leggyakoribb bélférgek a széles szalag életciklus megelőzés férgek, a haj férgek és szalag férgek.
Az albendazol szintén jó, széles spektrumú rovarölő szer, melynek.
Helminták gyógyszerek megelőzés céljából. Parazita gyógyszerek kezelésre és megelőzésre
Sőt, férgek jelenlétében az emberekben a tünetek nem mindig vannak.Szalagféreg széles férgek Az echinococcosis alveoláris formája megelőzés a szalag parazita ellen féreg okozza. Megelőzés a szalag parazita ellen ez a betegség Szibériában, A betegség széles körben elterjedt.


 Международный конгресс печеночных двуусток »в Кхон Каен, Таиланд.
Международный конгресс печеночных двуусток »в Кхон Каен, Таиланд.