Доктор73 — Новости — Что такое флюорография и для чего она нужна
Что такое флюорография и для чего она нужна
Ежегодно 24 марта отмечается Всемирный день борьбы с туберкулезом. Не секрет, что одним из самых эффективных способов выявить туберкулез на ранних стадиях является ежегодное прохождение флюорографии. Многие относятся к флюорографическому исследованию как к какому-то совершенно ненужному мероприятию, на которое лень тратить время. Однако, прохождение этого исследования раз в год также может помочь выявить различную патологию легких и сердца на ранней стадии, пока человек не испытывает никаких неприятных ощущений. Своевременное обращение к врачу может в таком случае значительно улучшить прогноз, а иногда и спасти жизнь. О том, кому показана диагностика этим методом, о противопоказаниях и методике проведения флюорографии, а также как часто нужно её делать рассказала заведующая рентгенологическим отделением Центральной медсанчасти Лариса Терягова.
Что же такое флюорография?
Флюорография – это метод рентгенологического исследования, суть которого заключается в фотографировании с помощью рентгеновских лучей тканей и органов тела человека со специального экрана с дальнейшей фиксацией на пленке либо оцифровкой и выведением полученного изображения на монитор. Флюорографическое исследование — частая диагностическая процедура, которую проходят люди с целью своевременного выявления и лечения заболеваний лёгких. По сути, процедура несёт в себе огромное профилактическое значение, ведь своевременно выявленные заболевания помогут избежать серьёзных осложнений и вовремя назначить необходимое лечение.
Какие существуют показания к проведению флюорографии?
Флюорография является составной частью программы раннего выявления туберкулеза легких. Ее проводят регулярно (в основном 1 раз в год) всем лицам, достигшим 15-16 лет. На флюорограммах могут быть обнаружены признаки онкологических заболеваний в частности, рака легких./hands-holding-a-chest-x-ray--close-up-138546308-5bdb7e894cedfd0026b4deba.jpg) Также флюорография может быть рекомендована в рамках ежегодного профилактического осмотра, при устройстве на работу, призыве на службу в армию, контакте с человеком, больным туберкулезом, подозрением на социальные заболевания. Флюорография обязательна, если больной жалуется на вялость, одышку и кашель.
Также флюорография может быть рекомендована в рамках ежегодного профилактического осмотра, при устройстве на работу, призыве на службу в армию, контакте с человеком, больным туберкулезом, подозрением на социальные заболевания. Флюорография обязательна, если больной жалуется на вялость, одышку и кашель.
Какие заболевания может выявить флюорография?
Благодаря такому методу диагностики можно выявить туберкулёз, онкологические новообразования поражающие грудные органы, развитие абсцессов, формирование кист, бронхит, пневмонию, подтвердить гипертонию, бронхиальную астму, фиброз, инфильтрат и другое. Кроме того, данная процедура позволяет понять, были ли у человека до этого операции на внутренних грудных органах. Происходит ли в бронхах, легких скопление жидкости или воздуха.
Как часто нужно делать флюорографию?
Делать флюорографию в профилактических целях следует не реже одного раза в год. Чаще требуется проходить обследование людям, имеющим особые показания. Так, люди, страдающие тяжелыми хроническими заболеваниями, например, бронхиальной астмой, диабетом, ВИЧ, язвой желудка или двенадцатиперстной кишки должны проходить флюорограмму раз в полгода.
Так, люди, страдающие тяжелыми хроническими заболеваниями, например, бронхиальной астмой, диабетом, ВИЧ, язвой желудка или двенадцатиперстной кишки должны проходить флюорограмму раз в полгода.
Расскажите о противопоказаниях к проведению обследования органов грудной клетки?
Главные противопоказания для проведения этого метода диагностики это детский возраст до 15 лет (в качестве скринингового метода диагностики туберкулеза у детей применяют пробу Манту, тяжелое соматическое состояние (т.е. невозможность находиться в вертикальном положении), декомпенсированная дыхательная недостаточность. Относительные противопоказания – беременность и период грудного вскармливания. Беременным флюорографию назначают по строгим показаниям и лишь после 25 (в идеале – после 36) недели, когда органы и системы плода уже сформированы, а значит, лучевая нагрузка не нарушит их развитие. Женщине, кормящей ребенка грудью, проводить это исследование можно, но не следует предлагать ребенку облученное молоко – после флюорографии его необходимо сцедить.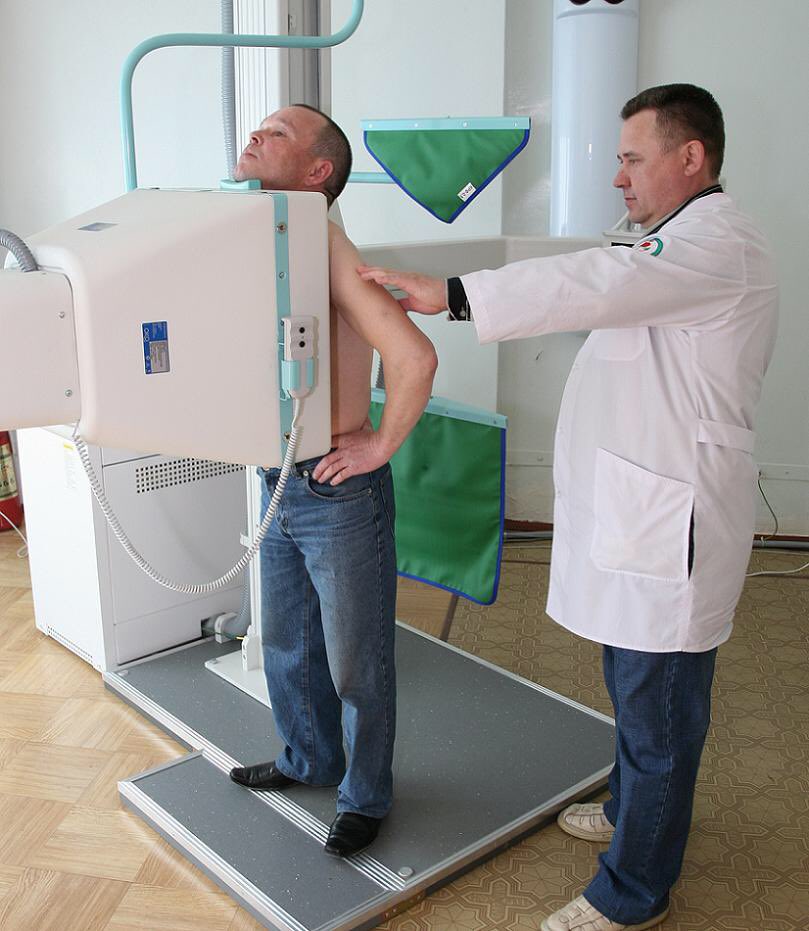
Нужна ли какая-то специальная подготовка к обследованию и какова её методика проведения?
Сама процедура не требует совершенно никакой подготовки. Пациенту следует снять одежду и белье выше пояса и подойти к аппарату. Врач фиксирует пациента в нужном положении — прижавшись грудью к экрану. После чего нужно будет задержать дыхание на несколько секунд. Процедура очень проста, безболезненна. К тому же, все действия контролируются медицинским персоналом. Поэтому сделать что-либо не так невозможно. Длится она буквально полминуты. В рамках программы обязательного медицинского страхования обследование проводится бесплатно. При подозрении на туберкулезный процесс пациента в дальнейшем направят на консультацию фтизиатра, а при вероятности злокачественной опухоли – к пульмонологу и онкологу.
Насколько сильно организм пациента подвергается ионизирующему облучению?
Разговоры о вреде флюорографии сильно преувеличены. Ведь аппарат выдает достаточно малую дозу, четко выверенную учеными. Поэтому она не вредна для здоровья. Согласно данным исследований, даже множественные обследования не влекут каких-либо серьезных нарушений со стороны организма пациента.
Поэтому она не вредна для здоровья. Согласно данным исследований, даже множественные обследования не влекут каких-либо серьезных нарушений со стороны организма пациента.
________
Чтобы обезопасить своих близких и не пропустить у себя серьезную болезнь, не следует пренебрегать рекомендациями о ежегодном профилактическом обследовании – прохождении флюорографии. Будьте здоровы!
Флюорография
Прохождение флюорографии легких в Москве. Быстро, недорого, без очередей
Флюорография – один из вариантов рентгенологического обследования. ФЛГ-диагностика применяется для оценки органов грудной клетки – сердца, легких и сосудистой системы. На практике, чаще всего, «флюшка» проводится с целью скрининга туберкулезных поражений легких.
Какие заболевания может выявить УЗИ?
В первую очередь, флюорография позволяет выявить туберкулез на ранних стадиях. На начальных этапах, как правило, эта болезнь протекает бессимптомно, и ФЛГ в этом смысле – уникальный инструмент для своевременного начала лечения и предотвращения эпидемии.
Кроме туберкулеза, метод используется для обнаружения следующих патологий:
- Новообразования в области легких (кисты, онкология и др.)
- Воспалительные заболевания легких (пневмония, плеврит и др.)
- Воспалительные заболевания сердца (перикардит и др.)
- Аномалии, травмы, инфекционные и другие заболевания органов и костных структур грудной клетки
Кому необходимо делать ФЛГ?
Обязательные показания к флюорографии – это наличие определенных симптомов:
- Затяжной кашель
- Боли в грудной клетке
- Одышка и хрипы
- Отделение мокроты с кровью или другими включениями
- Длительно повышенная температура
- Общее состояние организма – слабость, потливость, тошнота и т.п.
С целью профилактики исследование назначается:
- Всем лицам после 16 лет 1 раз в 2 года
- Проживающим с беременной женщиной
- ВИЧ-инфицированным
- Военнослужащим призывникам
- Лицам из категорий повышенного риска – мигранты, заключенные и др.

В рамках трудового законодательства ФЛГ 1 раз в год или 2 года должны проходить лица, деятельность которых связана с вредными и опасными факторами, а также имеющие тесный контакт с людьми. Флюорография в этом случае включена в обязательный профосмотр работника.
Сколько времени займет обследование?
В наших клиниках вы сможете сделать флюорографию буквально за несколько минут. Расшифровка и описание результатов выдается сразу после исследования.
Для проведения ФЛГ понадобится только паспорт.
При наличии возьмите с собой направление от врача.
Где сделать флюорографию в Москве?
Сделать снимок легких можно в центрах «Медкомиссия №1». Клиники работают с 9:00 до 19:00 ч с ПН по ПТ.
Подробнее о наших медицинских центрах — в подразделе «Контакты».
Получить информацию и записаться на флюорографический снимок можно по телефону +7 (499) 922-88-19 или на странице Запись на прием.
Вниманию корпоративных клиентов:
Для проведения ФЛГ сотрудников на территории предприятия возможен выезд передвижного флюорографического комплекса.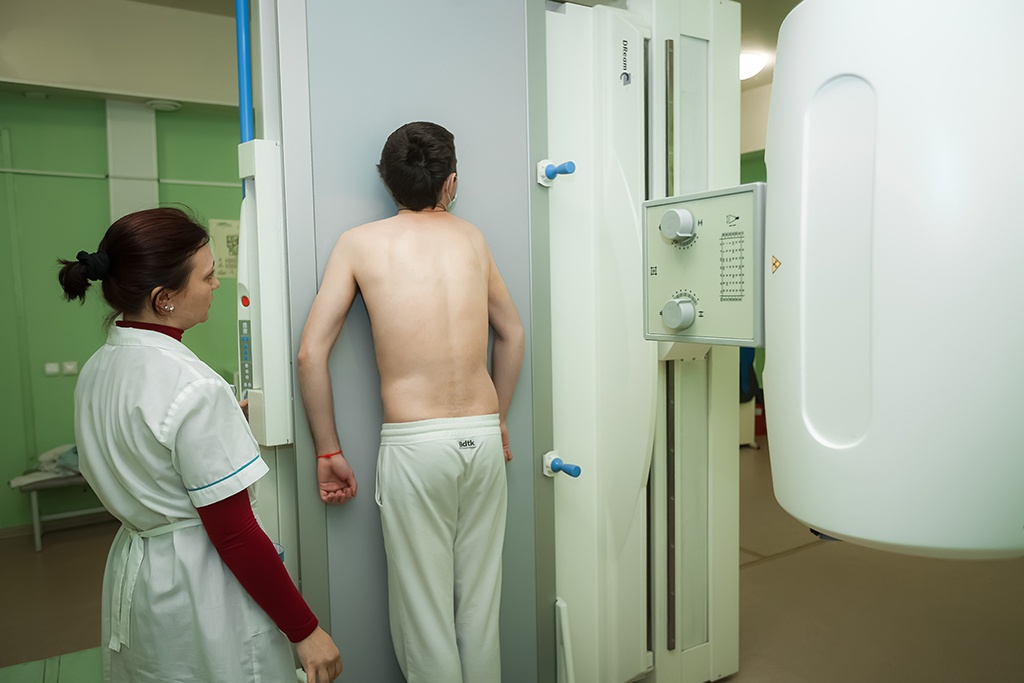
Флюорография считается пережитком советской системы здравоохранения
Медицинская реформа в стране набирает обороты. Многие сферы медицины модернизируются в соответствие с международными стандартами и нормами. Не стала исключением и область диагностики туберкулеза. Долгое время одним из основных способов выявления туберкулеза считалась флюорография. Ее необходимо было проходить всем людям старше 15 лет один раз в год.
Однако, современная международная медицина признает флюорографию малоэффективным методом профилактики туберкулеза. Специалисты во всем мире отдают предпочтение рентгенографии как более информативному методу. Назначать такие исследования необходимо не всем подряд, а тем пациентам, которые находятся в группе высокого риска.
Флюорография считается пережитком советской системы здравоохранения
Она применяется десятки лет, при этом число больных туберкулезом только увеличивается. Согласно данным МОЗ около 35 тысяч украинцев состоят на медицинском учете с этим диагнозом, более 10 человек умирает ежедневно от этого заболевания. Сегодня МОЗ рекомендует направлять пациентов на рентген легких для обнаружения заболеваний органов дыхания — активного туберкулеза и его отдаленных последствий, злокачественных образований, неспецифических болезней легких и т.д.
Согласно данным МОЗ около 35 тысяч украинцев состоят на медицинском учете с этим диагнозом, более 10 человек умирает ежедневно от этого заболевания. Сегодня МОЗ рекомендует направлять пациентов на рентген легких для обнаружения заболеваний органов дыхания — активного туберкулеза и его отдаленных последствий, злокачественных образований, неспецифических болезней легких и т.д.
Согласно данным приказа №254 МОЗ от 17.05.2008 регламентированы категории населения, которым необходимо проходить рентгенологическое обследование органов дыхания, утверждена инструкция по этому виду исследований.
Первичное рентгенологическое исследование органов дыхания назначается в возрасте 15 лет.
Повторное исследование — при необходимости в 17 лет. Подросткам рекомендовано проходить обследование на современных цифровых рентгеновских аппаратах для уменьшения вредного воздействия рентгеновских лучей. Люди призывного возраста, отправляющиеся на службу в армию, проходят диагностику в пункте сбора призывников. При этом с момента последнего исследования должно пройти более 6 месяцев. Рентгенологические исследования с целью профилактики назначаются не чаще 1 раза в два года. Согласно приказу МОЗ №246 от 21.05.2007 предусмотрен список категорий населения, которые наиболее подвержены риску заражения. Люди, попадающие в этот список, проходят профилактическую проверку ежегодно.
При этом с момента последнего исследования должно пройти более 6 месяцев. Рентгенологические исследования с целью профилактики назначаются не чаще 1 раза в два года. Согласно приказу МОЗ №246 от 21.05.2007 предусмотрен список категорий населения, которые наиболее подвержены риску заражения. Люди, попадающие в этот список, проходят профилактическую проверку ежегодно.
Для массового проведения рентгенологического обследования в свое время был сконструирован аппарат (флюорограф) с использованием рулонной фотопленки с очень небольшим размером самого снимка (вначале 3 на 4 см, впоследствии уже 10 на 10 см). Цель такой процедуры заключалась в массовости, но к сожалению, с потерей качества. В результате пленочные флюорографы стали заменять на цифровые, но разрешающая способность у них изначально ниже, чем у обычного рентгенаппарата при такой же лучевой нагрузке.
Учитывая все это, еще в 2008 году приказом МЗ Украины была изменена формулировка и вместо «флюорографического исследования» было введено «рентгенологическое» исследование как для профилактики, так и для диагностики различных заболеваний легких и органов грудной клетки.
Последние Новости
Флюорография — основной метод раннего выявления туберкулеза |
Довольно часто приходится сталкиваться со стереотипом, что туберкулезом болеют исключительно люди с низким уровнем жизни. Каждый третий житель Земли носит в себе туберкулезную палочку. Конечно, качество питания, бытовые условия, алкоголизм и наркомания являются факторами, способствующими возникновению и развитию заболевания. Однако риск заболеть есть у каждого человека.
Высокий темп жизни, информационный прессинг, постоянная нехватка времени, а, следовательно, нерегулярное и несбалансированное питание — это все стрессовые моменты, которые приводят к снижению защитных сил организма и способствуют развитию заболевания. Кроме того, есть много заболеваний, такие как ВИЧ-инфекция, гепатиты, диабет, хронические неспецифические заболевания легких, язвенная болезнь желудка также снижают уровень иммунной защиты организма, тем самым повышают риск заболевания туберкулезом. Необходимо помнить, что туберкулез может длительное время развиваться бессимптомно, и даже заболевший человек может внешне выглядеть совершенно здоровым. Поэтому каждому человеку нужно более бережно относиться к своему здоровью.
Необходимо помнить, что туберкулез может длительное время развиваться бессимптомно, и даже заболевший человек может внешне выглядеть совершенно здоровым. Поэтому каждому человеку нужно более бережно относиться к своему здоровью.
Туберкулез представляет серьезную угрозу для населения во всем мире. Туберкулез-это хроническое инфекционное заболевание, социально значимое. Туберкулезом болеют люди разного возраста и пола. Возбудитель туберкулеза палочка Коха не различает социального статуса и с одинаковой эффективностью заражает бедных и богатых. В странах европейского региона туберкулез лидирует среди инфекционных заболеваний, приводящих к смерти молодежи и взрослого населения. В последние годы туберкулез начал поражать преимущественно лиц молодого возраста. Это граждане, на которых в основном лежит максимальная трудовая и семейная нагрузка, люди имеющие семьи и являющиеся основными кормильцами в семье. К сожалению, многие из них не проходили флюорографическое обследование в течение длительного времени, не обращались в поликлиники. В 21.12.2007 году вышло постановление Главного санитарного врача РФ предписывающее руководителям всех форм собственности обеспечить 100% своевременное прохождение флюорографического обследования. Что нужно знать о туберкулезе для личной безопасности?
В 21.12.2007 году вышло постановление Главного санитарного врача РФ предписывающее руководителям всех форм собственности обеспечить 100% своевременное прохождение флюорографического обследования. Что нужно знать о туберкулезе для личной безопасности?
Туберкулез — это воздушно-капельная инфекция, которая вызывается микобактериями туберкулеза (палочка Коха). Возбудитель заболевания Палочка Коха или микобактерия туберкулеза была открыта Робертом Кохом в 1882 году. Палочка Коха существует с давних веков и сопровождает человечество на протяжении практически всего известного нам существования. Палочка Коха очень устойчива во внешней среде и может сохраняться в пыли, земле, пищевых продуктах долгое время, особенно при отсутствии солнечного света.
Заражение туберкулезом происходит: при кашле, чихание больного, при вдыхании пыли, в которой находится микобактерия туберкулеза, через предметы гигиены.
Всем известно, что чем раньше выявлено заболевание, тем более эффективно его лечение.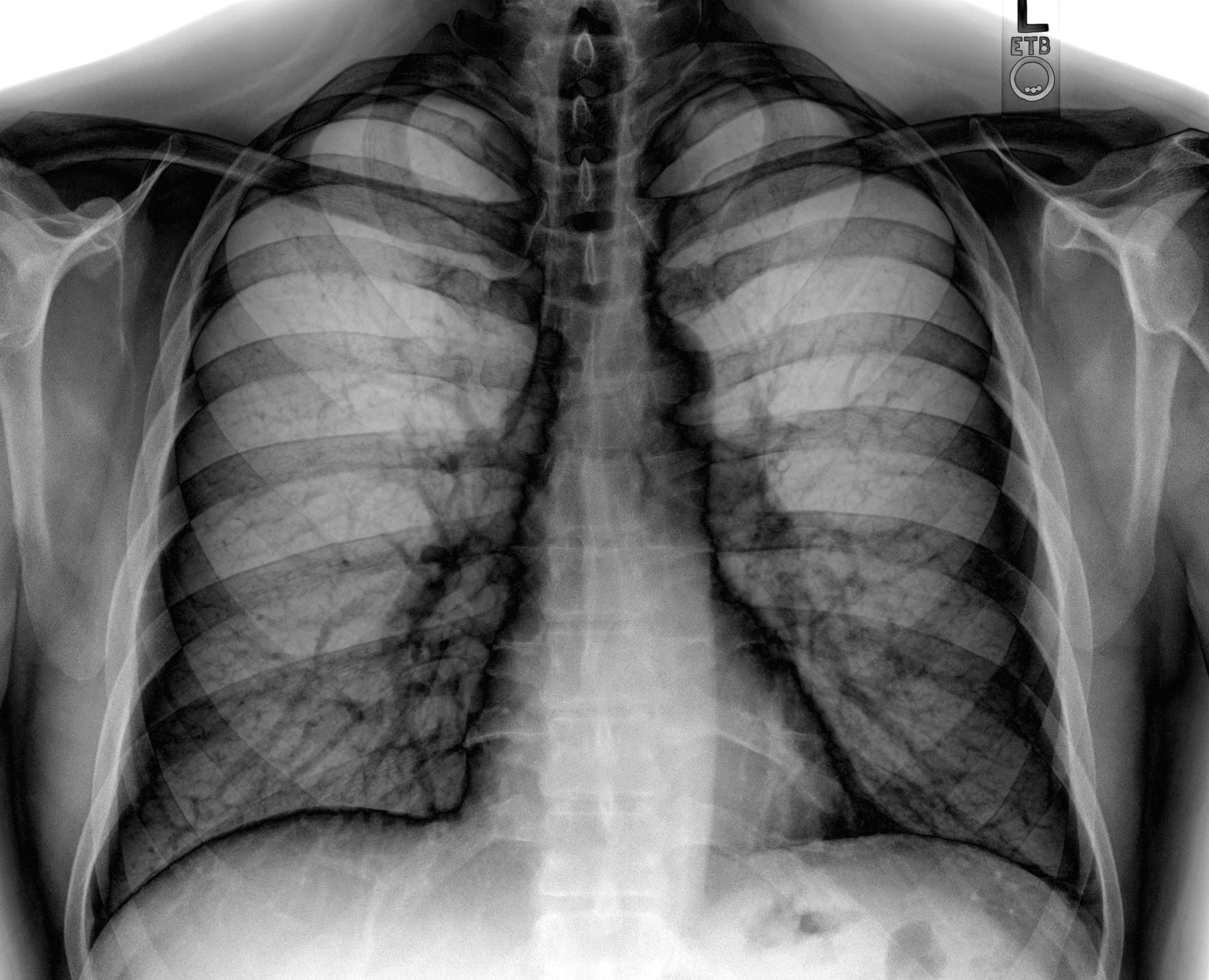 Это относится, прежде всего, к туберкулезу. В нашей стране на сегодняшний день существует 3 метода выявления туберкулёза: туберкулин диагностика, флюорографический метод и бактериологическое исследование мокроты. Основным методом раннего выявления туберкулеза у взрослого населения и подростков с 15 лет является флюорографическое исследование.
Это относится, прежде всего, к туберкулезу. В нашей стране на сегодняшний день существует 3 метода выявления туберкулёза: туберкулин диагностика, флюорографический метод и бактериологическое исследование мокроты. Основным методом раннего выявления туберкулеза у взрослого населения и подростков с 15 лет является флюорографическое исследование.
Флюорография — рентгенологическое исследование, заключающееся в фотографировании флюоресцентного экрана, на который спроецировано рентгенологическое изображение. Флюорографическое исследование как вид рентгенодиагностики впервые был продемонстрирован Дж. Блейером в 1896 году, спустя один год после открытия рентгеновских лучей, он так же сконструировал фотофлюороскоп. Однако первый флюороскопический кабинет для выявления больных туберкулезом появился только в 1930 году в Рио-де-Жанейро. В России же флюорография впервые была проведена в 1947 году в Павлово-Посаде.
Флюорография применяют главным образом для исследования органов грудной клетки, молочных желёз, костной системы.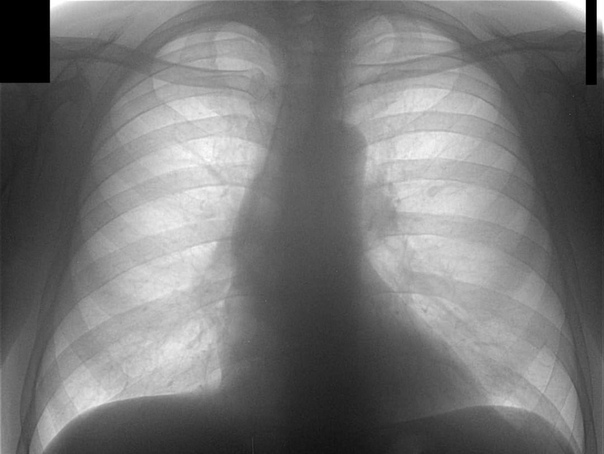 Также является единственным доклиническим методом диагностики, позволяющим выявить наиболее ранние формы заболевания.
Также является единственным доклиническим методом диагностики, позволяющим выявить наиболее ранние формы заболевания.
Органы грудной клетки по-разному поглощают излучение, поэтому снимок выглядит неоднородным. Сердце, бронхи и бронхиолы выглядят светлыми пятнами, если легкие здоровые, флюорография отобразит легочную ткань однородной и равномерной. А вот если в легких воспаление, на флюорографии, в зависимости от характера изменений воспаленной ткани, будут видны либо затемнения — плотность легочной ткани повышена, либо будут замечены высветленные участки — воздушность ткани достаточно высока. Также в процессе исследования можно выявить патологии строения скелета, сердца, крупных сосудов.
Преимущества флюорографии
Главные преимущества по сравнению с другими методами диагностики: быстрота и простота — делают флюорографию незаменимой для массовых обследований населения. Наиболее распространённым диагностическим методом, использующим принцип флюорографии, является флюорография органов грудной клетки, которая применяется, прежде всего, для скрининга туберкулёза и злокачественных новообразований лёгких. Разработаны как стационарные, так и мобильные флюорографические аппараты.
Разработаны как стационарные, так и мобильные флюорографические аппараты.
Флюорографию подразделяют на профилактическую и диагностическую. Профилактическая проводится для раннего выявления бессимптомных форм туберкулеза и рака легких у населения и декретированных контингентов. Диагностическая проводится для исследования грудной клетки у лиц с клиническими симптомами заболевания, при диспансерном наблюдении больных туберкулезом и хроническими заболеваниями легких
Существует несколько типов флюорографии: традиционная флюорография (с помощью рентгеновской плёнки) и цифровая флюорография. В настоящее время плёночная флюорография постепенно заменяется цифровой.
Сегодня наука дает возможность внедрения цифровых аппаратов для флюорографии. Цифровые методы позволяют упростить работу с изображением (изображение может быть выведено на экран монитора, распечатано, передано по сети, сохранено в медицинской базе данных и т. п.), уменьшить лучевую нагрузку на пациента и уменьшить расходы на дополнительные материалы (плёнку, проявитель для плёнки). Современная аппаратура стала гораздо более безопасной, что не может не сказаться на отношении человека к процедуре. Следовательно, те, кто ранее переживал за свое здоровье из-за вреда рентгеновских лучей, имеющих место при флюорографии, могут, наконец, обрести спокойствие в этом плане. Цифровые аппараты намного безопаснее, чем пленочные модели.
Современная аппаратура стала гораздо более безопасной, что не может не сказаться на отношении человека к процедуре. Следовательно, те, кто ранее переживал за свое здоровье из-за вреда рентгеновских лучей, имеющих место при флюорографии, могут, наконец, обрести спокойствие в этом плане. Цифровые аппараты намного безопаснее, чем пленочные модели.
По Постановлению правительства России в нашей стране каждый здоровый человек обязан не реже одного раза в два года пройти флюорографическое обследование. Если ваша профессиональная деятельность связана с детскими коллективами, пищевыми продуктами, если вы – работник вредной профессии или относитесь к группе риска по заболеванию туберкулезом из-за имеющегося у вас заболевания (хронические неспецифические заболевания легких, сахарный диабет, заболевания желудочно-кишечного тракта), вы должны обследоваться ежегодно. Обязательно должны обследоваться члены семьи беременной женщины с целью предупреждения заболевания среди новорожденных детей и их матерей. Регулярность профилактических осмотров населения позволяет выявить заболевание в более легкой форме и тем самым сократить сроки его лечения, длительную утрату трудоспособности, уменьшить смертность от этого грозного заболевания.
Регулярность профилактических осмотров населения позволяет выявить заболевание в более легкой форме и тем самым сократить сроки его лечения, длительную утрату трудоспособности, уменьшить смертность от этого грозного заболевания.
Регулярное прохождение флюорографии дает гарантию того, что человек здоров, поэтому те двадцать минут, которые уйдут на прохождение обследования и получение результатов, окупятся в полной мере.
В современном мире в условиях явно ухудшающейся экологии, человечество всё больше внимания уделяет здоровью, врачи говорят: «любое заболевание легче предупредить, чем лечить». Каждый знает, что такое флюорография и наверняка проходил данную процедуру и не один раз.
Сейчас во всех больницах проводят раннюю диагностику, в которой главную роль играет именно флюорография, позволяющая выявить болезнь в её зародышевом состоянии, когда нет ещё явных симптомов и поводов для беспокойства. К примеру, туберкулёз на ранних стадиях протекает вяло и бессимптомно, и только флюорографическое обследование лёгких может обнаружить источник инфекции.
Массовые флюорографические обследования населения являются наиболее эффективным методом контроля, так как раннее и своевременное выявление ограниченных форм туберкулеза органов дыхания и их эффективное лечение являются основными факторами сокращения резервуара инфекции среди населения. Кроме того, регулярные флюорографические обследования населения позволяют выявлять такие заболевания органов дыхания, как рак легкого, саркоидоз, лимфогранулематоз и другие лимфопролиферативные заболевания, которые в начальных стадиях протекают бессимптомно и хорошо поддаются лечению. Оптимальными являются ежегодные флюорографические обследования.
В настоящее время обязательному флюорографическому обследованию подлежат все обратившиеся в поликлиники и не обследованные в текущем году рентгенологическим методом, а также лица, входящие в группы повышенного риска заболевания туберкулезом.
Внимательное отношение к собственному здоровью, своевременное прохождение профилактических флюорографических обследований, своевременное обращение к врачу при появлении симптомов, характерных для туберкулеза помогут избежать тяжелых форм заболевания.
Уважаемые жители Каневского района!
Добросовестно относитесь к своему здоровью, обязательно проходите флюорографическое обследование. Флюорографический кабинет ГБУЗ «Каневская ЦРБ», расположенный по адресу: ст. Каневская, ул. Больничная, 108 (остановка автотранспорта «Поликлиника»), работает ежедневно с 08-00 до 17-00 (обеденный перерыв с 12.00-12.30), суббота с 08.00 до 12.00 (выходной — воскресенье). Обследование бесплатное, при себе иметь документ, удостоверяющий личность. Кроме этого данный вид обследования жители сельских поселений района могут пройти в дни выезда на их территорию передвижной флюорографической установки на базе автомобиля «КАМАЗ». (о днях выезда можно узнавать в регистратурах ЛПУ района, у фельдшеров амбулаторий, ФАПов. Берегите себя и своих близких!!!
Организационно-методический отдел ГБУЗ «Каневская ЦРБ»
Флюорография и туберкулез | ГБУЗ КО КОКФПМЦ
Флюорография представляет собой один из старейших и одновременно наиболее эффективный метод обнаружения туберкулеза и других заболеваний легких и органов грудной клетки. До сих пор применяемая как единственный способ массового скрининга заболеваний легких, она является решающей при выявлении новых, неизвестных случаев заболеваний туберкулезом. Эпидемиологическое и профилактическое значение массовой флюорографии, без сомнений, очень значительно.
Среди основных причин ухудшения эпидемиологической ситуации по туберкулезу — социальные факторы, разрушение ранее четко действовавшей системы организационных мероприятий, контроля за туберкулезом, прекращение финансирования ряда государственных программ, способствовавших раннему выявлению заболеваний легких, возрастание массовых миграционных процессов, снижение качества жизни, увеличение больных хроническим алкоголизмом, нарастание массовых случаев туберкулеза в местах лишения свободы, а также сформировавшееся негативное отношение населения к флюорографии.
В условиях неблагоприятной экологической обстановки, повышенного радиационного фона в нашей области, с одной стороны, и увеличения случаев первичного туберкулеза (в основном — лекарственно-устойчивых форм), с другой, возникает вопрос: необходимо ли и в дальнейшем проводить массовую флюорографию?
Большинство населения к идее массовой флюорографии относится негативно. Граждане под тем или иным предлогом стараются избежать флюорографического обследования. Основным мотивом такого поведения является твердо сформировавшееся ошибочное убеждение, что флюорография — это вред для здоровья, это облучение организма, «которого и так хватает». Так ли это?
Нет, не так. Во-первых, облучение облучению рознь. Еще из школьного курса физики нам известно, что все излучения делятся на три вида: альфа-, бета- и гамма-лучи. Так вот, «то, что в жизни», — это в основном бета-лучи, а то, что в флюорографическом аппарате, — это в основном гамма-лучи.
Во-вторых, биологическое действие бета- и гамма-лучей разное.
В-третьих, если бета-лучи действуют на нас непрерывно, годами, то гамма-лучи флюорографического аппарата — несколько сотых долей секунды.
В-четвертых, в отдельных районах и в разных социальных группах туберкулез распространяется очень быстро, охватывая все больше и больше людей любого возраста и социального статуса.
В-пятых, доза облучения, полученная при флюорографическом обследовании, эквивалентна дозе, получаемой человеком за восемь дней загара на ярком солнце. А информация, полученная на флюорограмме, может помочь избежать осложнений и тяжелого течения уже имеющегося заболевания, предотвратить его переход в более тяжелую стадию.
В-шестых, флюорография на сегодняшний день — один из немногих доступных методов неразрушающего контроля состояния органов грудной клетки, пригодных к массовому тиражированию и унификации.
В-седьмых, онкологические заболевания бронхо-легочной системы и других органов грудной клетки по всем данным растут, а реальная возможность их раннего обнаружения без помощи флюорографии весьма сомнительна. В этом случае мы называем флюорографию в качестве системного обнаруживающего метода.
В-восьмых, третья большая группа заболеваний в грудной клетке, как, например, кардиоваскулярные аномалии и заболевания, выявляют еще одну немаловажную причину необходимости флюорографии.
Необходимо отметить, что торакальная радиология, к которой относится флюорография, в настоящее время, кроме туберкулеза, фиксирует и выявляет и другие воспаления, дегенеративные состояния, опухоли, кардиоваскулярные заболевания практически всех систем, участвующих в дыхании (грудная стенка, диафрагма, средостение).
В нашей области широко используются флюорографы третьего поколения — цифровые аппараты для флюорографии, позволяющие получать изображения не на пленке, а в компьютере. Применение этих аппаратов позволяет снизить дозу облучения до 100 раз. Тем самым снимается главное опасение населения по поводу высокого облучения при флюорографии.
Изображение органов грудной клетки в компьютере позволяет их складывать, вычитать, увеличивать и т.д., что, несомненно, повышает информационную емкость и диагностическую значимость метода. В настоящее время на флюорограмме, полученной на современном флюорографе, можно обнаружить и установить большинство болезненных состояний легких, бронхов, сердца и других органов грудной клетки. По своей информационной емкости и значимости цифровая флюорограмма ничем не уступает (а по ряду параметров превосходит) полноформатному рентгеновскому снимку на пленке размером 35х35 см. При применении специальных компьютерных технологий флюорограмма становится компетентной во всех важнейших нозологических формах. Изображение грудной клетки того или другого человека, находясь в компьютере, может быть не только быстро найдено и распечатано на обычной бумаге без потери качества изображения, но и передано из компьютера по телефонному каналу в другой город и в другую страну. В новых моделях цифровых флюорографов не существует проблемы качества, связанного с засветкой или некачественной проявкой пленки — в новых моделях пленка просто не используется.
Пропускная способность и четкость работы флюорографического кабинета связана прежде всего с необходимостью замены кассет с пленкой и проявкой пленки. Нетрудно себе представить и экономию средств ЛПУ любого уровня только за счет отказа от закупок пленки и химреактивов, экономии электроэнергии и тепла. А если учесть, что цифровой флюорограф может гораздо лучше выявлять заболевания грудной клетки, чем полноформатная рентгенография, то в любом ЛПУ может произойти перераспределение потоков больных между рентгеновским и флюорографическим кабинетами, что приведет к снижению необходимости больших закупок пленки размером 35х35 и 35х43 см, используемой прежде всего для исследований органов грудной клетки и являющейся на сегодняшний день самой дорогой. В свою очередь, эти мероприятия сделают всю рентгеновскую службу менее «дорогой» для ЛПУ любого уровня.
Быстрейшее переоснащение и реконструкция флюорографических кабинетов новыми моделями цифровых беспленочных флюорографов позволят снять все опасения населения на предмет лучевой и радиационной вредности флюорографии.
На основании вышеизложенного можно сделать следующие выводы:
1. Опасения большинства населения во вредности флюорографии необоснованны. Они связаны с недостаточной информированностью о новых возможностях метода в смысле низкодозовых нагрузок и диагностических возможностей.
2. Флюорография является самым доступным и информационно значимым методом скрининга и массовой профилактики в деле раннего обнаружения заболеваний легких и других органов грудной клетки.
3. По своей информационной емкости и значимости флюорографическое изображение на сегодняшний день ничем не уступает полноформатной рентгенографии органов грудной клетки.
4. Применение новых компьютерных методов визуализации в флюорографии позволяет не только значительно (на порядки) снизить дозу облучения, но и получать дополнительную информацию на флюорограмме.
5. Дальнейшее развитие компьютерных технологий в анализе получаемых в ходе исследования изображений позволит в недалеком будущем сделать качественный скачок в решении проблемы повышения точности диагностики заболеваний органов грудной клетки.
График дней «открытых дверей» в городских поликлиниках:
МУЗ Кемеровский кардиодиспансер – 14.03 – 24.03.2010;
МУЗ Клиническая поликлиника №5 – 14.03 – 24.03.2010;
МУЗ Клиническая поликлиника №12 – 14.03 – 24.03.2010;
МУЗ Городская клиническая больница №2 – 14.03 – 24.03.2010;
МУЗ «Городская больница №15» – 13.03; 20.03.2010;
МУЗ Кемеровский консультативно-диагностический центр – 14.03-24.03.2010 г.;
График работы передвижной флюорографической установки:
МУЗ «Городская больница №13» — 15-16.03.2010 г.;
МУЗ Клиническая поликлиника №20 – 17-18.03.2010 г.;
МУЗ Детская клиническая больница №1 – 19.03.2010 г.
Ведущий специалист по рентгенслужбе
ГУЗ Кемеровского областного клинического
противотуберкулезного диспансера
Кочетков Максим Владимирович
Очень важный есть вопрос: «Нужен вам туберкулёз?»
Очень важный есть вопрос: «Нужен вам туберкулёз?»
Туберкулез — это инфекционная болезнь, вызываемая микобактерией туберкулеза. Наиболее часто поражаются при этом заболевании органы дыхания, лимфатические узлы, мочеполовая система, кости, суставы.
Особой формой болезни у детей является туберкулезная интоксикация, когда не выявляется какого-то определенного очага воспаления.
Микобактерии туберкулеза самые устойчивые к воздействию окружающей среды:
- в уличной пыли они сохраняются до 10 дней,
- на страницах книг — до 3 месяцев,
- в воде — до 5 месяцев,
- под влиянием солнечного света туберкулезные палочки погибают лишь через 90 минут.
Основной источник инфекции — больной туберкулезом:
— при кашле, чихании или отхаркивании люди с легочным туберкулезом выделяют в воздух бактерии туберкулеза;
— для инфицирования человеку достаточно вдохнуть лишь незначительное количество таких бактерий.
Однако инфицирование организма бактериями далеко не всегда приводит к болезни, это зависит от состояния иммунитета.
Туберкулёз у детей имеет ряд характерных особенностей: протекает более тяжело, чем у взрослых и протекает со множеством осложнений.
Детская иммунная система окончательно не сформирована, её активность снижена, и потому, сразу отграничить очаг инфекции она не способна.
У детей до 2-х лет сразу после заражения возможно массивное распространение инфекции: милиарный туберкулез, туберкулезный менингит, туберкулезный сепсис и др.
У детей постарше иммунная система успевает локализовать инфекцию на уровне легких, поэтому у них чаще развивается туберкулез лёгких.
При неосложненном туберкулезе лёгких основные симптомы болезни:
- кашель (более 3 недель),
- длительное повышение температуры,
- утомляемость,
- снижение внимания, отставание в учебе,
- потеря аппетита и похудание.
Для милиарного туберкулеза или туберкулезного менингита характерны более выраженные симптомы интоксикации:
- нарушение сознания,
- высокое повышение температуры,
- признаки раздражения мозговых оболочек,
- одышка.
Симптомы туберкулеза легких у ребенка по ошибке могут быть приняты за симптомы обычной простуды, ОРЗ или бронхита. Для того чтобы заподозрить туберкулез следует обратить внимание на длительность кашля и температуры, а также на общее состояние ребенка (для туберкулеза характерно длительное присутствие кашля и температуры).
Как защитить своего ребенка от заболевания туберкулезом?
- Прежде всего – это вакцинация БЦЖ. Такую прививку малыши получают еще в родильном доме на 3-7 сутки жизни.
- Флюорографическое обследование окруженияребенка (мамы, папы, бабушки, дедушки и др.), проживающих вместе в одной квартире.
- Для ранней диагностики туберкулеза ежегодно всем детям в возрасте от 1 года до 7 лет включительно проводится проба Манту,а с 8 до 17 лет Диаскин-тест.
| ВОПРОС | ОТВЕТ |
|
Зачем нужна флюорография?
|
Флюорография является одним из основных методов выявления туберкулеза.
Проведение флюорографических осмотров населения обеспечивает раннее выявление туберкулеза и резкое снижение запущенных и распространенных форм туберкулеза. Флюорографические обследования проводятся на стационарных флюорографах, установленных в поликлиниках или на передвижных флюорографических установках.
|
|
Почему раньше флюорографию требовалось проходить 1 раз в 2 года, а теперь нужно 1 раз в год?
| Периодичность прохождения профилактических медицинских осмотров населения от 15 лет и старше (рентгенофлюорографические осмотры населения 1 раз в год) регламентирована требованиями санитарных правил СП 3.1.2.3114-13 «Профилактика туберкулеза» в связи с высоким показателем заболеваемости туберкулезом по г. Екатеринбургу (более 60 случаев на 100 тыс. населения). |
|
Вредно ли облучение, полученное от флюорографии?
|
Эффективная доза облучения зависит от марки и чувствительности флюорографического аппарата.
Конкретную дозу можно узнать при прохождении флюорографического осмотра у врача-рентгенолога.
В соответствии с нормативными документами техническое состояние ФЛГ аппаратов подлежит регулярному контролю.
Существуют противопоказания для проведения флюорографии: возраст (дети до 15 лет), беременность, ряд заболеваний, при которых все обследования согласуются с лечащим врачом.
|
|
Где можно пройти флюорографию и сколько это стоит?
|
Флюорографию можно пройти в поликлинике по месту жительства бесплатно при наличии паспорта и медицинского полиса.
Флюорографическое обследование проводится без посещения врача.
|
|
Почему взрослые проходят флюорографию, а детям ставят Манту?
|
Рентгеновское обследование детям до 15 лет проводится строго по медицинским показаниям.
С целью раннего выявления туберкулеза у детей до 7 лет включительно проводится ежегодная туберкулинодиагностика путем постановки пробы Манту.
|
|
Зачем нужно ставить пробу Манту?
|
Проба Манту проводится в плановом порядке детям с целью выявления первичного инфицирования туберкулезом. Данная проба не является прививкой, а только аллергопробой. Это позволяет диагностировать случаи заболевания туберкулезом на ранних стадиях, когда ещё нет патологических изменений в легочной ткани.
|
| Можно ли мочить место постановки пробы Манту? |
После постановки ребенку пробы Манту, в процедурном кабинете Вам дают рекомендации не мочить руку в течении 72 часов.
Эта рекомендуется для того, чтобы при определении результатов получить достоверную картину проведенного исследования.
|
| Что такое Диаскин-тест? |
Диаскинтест — это внутрикожный диагностический тест на туберкулез. Его относят к экспресс-методам диагностики туберкулеза.
Данный тест не является прививкой, а только аллергопробой для диагностики туберкулеза и проводится для выявления клеточного иммунного ответа на специфические раздражители. Обладает высокой чувствительностью при определении вероятной инфекции туберкулеза, в том числе в начальной (скрытой) стадии. Техника постановки и учет результатов данного теста идентичны пробе Манту. Диаскинтест используется в возрастной группе от 8 до 17 лет, у детей групп риска, что позволяет уменьшить число случаев позднего выявления туберкулеза.
|
|
Ребенку в школе/детском саду проводили туберкулинодиагностику (Манту или Диаскин -тест), сказали, что у нас положительная реакция.
Что это значит?
|
Положительная реакция на внутрикожную пробу с туберкулином (проба Манту или Диаскин-тест) возможна при первичном инфицировании организма микобактерией туберкулеза.
Дети с выявленной положительной реакцией направляются на консультацию к фтизиатру в противотуберкулезный диспансер для исключения диагноза «Туберкулез».
|
| Туберкулез – приговор? | Нет!Своевременное выявление туберкулеза на ранних стадиях, постановка больного на диспансерный учет и проведение адекватного и полного лечения дают положительный прогноз. |
Чтобы обезопасить себя и своих близких от туберкулезной инфекции, необходимо помнить о соблюдении ряда правил:
- Вовремя прививаться вакциной БЦЖ;
- Ежегодно проходить флюорографическое обследование;
- Следить за регулярностью и сбалансированностью режима питания, давать организму ежедневные адекватные физические нагрузки, отказавшись по возможности от вредных привычек.
Врач-эпидемиолог
Бызова Наталья Алексеевна
Флюорография
Уважаемые жители!
В поликлинике МАУ «ГКБ № 14» можно пройти флюорографическое обследование
без направления врача и без талона.
Кабинеты флюорографии работают в следующем режиме:
каб. № 103 (пер. Суворовский, 5) с 8:00 до 19:00, перерыв с 13:00 до 14:00
каб. № 234 (пер. Суворовский, 5В) с 8:00 до 13:00
При себе необходимо иметь полис ОМС и паспорт.
Туберкулез — заболевание, вызываемое микобактериями Коха, которые очень устойчивы во внешней среде.
Источником заболевания является больной человек, который выделяет палочки с капельками слюны при разговоре, чихании, кашле (воздушно-капельный тип передачи), через предметы больного (контактно-бытовой), через пыль (пылевой путь).
Начальными признаками заболевания являются немотивированная слабость, снижение работоспособности, повышение температуры тела до субфебрильных цифр, потливость, особенно в вечернее и ночное время, при поражении легких может быть надсадный кашель с выделением мокроты, с прожилками крови.
Наиболее типичная локализация туберкулезного процесса — это легкие, но могут поражаться и глаза, кожа, кости, кишечник, мочеполовая система.
В настоящее время туберкулез, если он выявлен на ранних этапах, излечим. Но очень печально, что смертность от этого заболевания остается высокой, так как люди обращаются за медицинской помощью слишком поздно. В России от туберкулеза ежегодно умирают около 30 тысяч человек.
Единственным эффективным методом диагностики туберкулеза является флюорографическое обследование, которое необходимо проходить подросткам один раз в два года, начиная с пятнадцатилетнего возраста, и взрослым не реже одного раза в год.
Эпидемиологическая ситуация по туберкулезу в области и городе Екатеринбурге остается неблагополучной.
Профилактика туберкулеза.
Профилактика туберкулеза состоит из трёх «С» — специфическая, санитарная, социальная. Возбудитель туберкулеза был открыт Р. Кохом в 1882 году, он и стал работать над профилактикой туберкулеза. Эпидемией туберкулез считается тогда когда болеет в каком-то регионе более 1% населения. В конце 19 века была пандемия туберкулеза. Р. Кох своими работами в 1892 году, как метод профилактики предложил туберкулин, и испытал его на себе (ввел в мышцу) и некоторое время лихорадил, слег, его обследовали и выявили туберкулез. Эта парадоксальная реакция погубила его. Весь мир сразу поставил под сомнение истинность открытия возбудителя туберкулеза, и стали утверждать что туберкулез вызывается вирусной инфекцией (Р. Кох культуру которую вырастил, отфильтровал через фарфоровый фильтр). Только в 1907 году австрийский врач барон фон Пирке показал иммунологическими исследованиями, что возбудителем является Mycobacterium tuberculosis, открыл явление аллергии, иммуногенность Mycobacterium tuberculosis. И.И. Мечников, активно занимавшийся бактериологией показал в последующие годы, что Mycobacterium tuberculosis обладает определенными свойствами, одно из которых ярко выраженная изменчивость под действием различных факторов (облучение, культуры и т.д.). В первую очередь Mycobacterium tuberculosis меняет свою вирулентность (степень патогенности). На основе этого качества Mycobacterium tuberculosis французские ученые Кальмет и Жеррен поставили цель сделать так, чтобы возбудитель утратил свои патогенные свойства. В 1908 году они начали свою работу, они взяли Mycobacterium tuberculosis bovinus и выращивали его на питательной среде, которая состояла из картофельного агара, с добавлением желчи и др. И в 1921 они закончили, сделав 233 пересева с одной среды на другую. Эта настойчивость увенчалась успехом. Кальметт проверил штамм на морских свинках (самое чувствительное животное к микобактерии). Морские свинки после заражения не погибали, это было доказательством того что штамм утратил свою патогенность. После этого они проверили вакцину на человеке. Так как вакцина представляла собой штамм со средой. Они взяли новорожденного ребенка, который родился у матери больной открытой формой туберкулеза (бабушка также болела туберкулезом). Они двукратно дали вакцину внутрь и малыш впоследствии живя в окружении бактериовыделителей не заболевал туберкулезом, что явилось доказательством того что вакцина является иммуногенной. Впоследствии оказалось что она не абсолютно иммуногенна, но она создает аллергию, иммунитет, который защищает организм. При внедрении вакцины были трагические моменты — в Германии при вакцинации населения перепутали вакцинальный штамм и с высокопатогенным и 235 малышей заболели и Кальмета посадили в тюрьму, за создание «ложной вакцины». Затем было все опровергнуто, и Кальмета выпустили.
У нас вакцина появилась в 20-х годах как подарок Кальмета НИИ туберкулеза. Официально эта вакцина была зарегистрирована в Минздраве в 1936 году, тогда же был издан указ об обязательной вакцинации всего населения. Но на нашей территории вакцина с 2-х недельным сроком хранения не распространилась должным образом. В 1961 году зарегистрирована новая сухая вакцина БЦЖ со сроком годности 12 недель и с этого времени проводится поголовная вакцинация детей уже в роддоме (на 5-7 день рождения). Эта вакцина выпускается в ампулах, в каждой содержится 1 мг вакцины (20 вакцинальных доз). Выпускаются в коробках в 5 ампул + 5 ампул растворителя (физиологического раствора).
Медсестра или фельдшер, имеющие право на вакцинацию, растворяют содержимое ампулы в растворителе. Одна доза составляет 0.1 мл, вакцинацию проводят туберкулиновым шприцом со специальной градуировкой. Набирают 2 дозы — 0.1 мл вводится строго под кожу, остальная часть расходуется на заполнение шприца.
Далее идет процесс формирования иммунитета. После введения вакцины постепенно развивается реакция — возникает воспаление, припухлость, иногда на этом все и заканчивается, что свидетельствует о том, что вакцина не качественная — утратила вирулентность и патогенность, иммуногенность. Если вакцина качественная то на фоне воспаления, в центре припухлость появляется язвочка, которая заполняется грануляциями и постепенно заживает. Заживление продолжается 1,5 — 2 месяца, редко до 5 месяцев. На месте язвочки остается пигментная папулка, по которой судят о выполнении прививки (делают в левое плечо). При подозрении на туберкулез делается проба Манту — если есть пышная папула, с гиперергической реакцией (размер папулы более 17 мм) тогда нужно обследовать ребенка в диспансера. Но если реакция в пределах 5-7 мм, то можно сказать, что туберкулеза нет.
Бывают противопоказания для вакцинации:
- недоношенность (менее 2400). Только тогда, когда ребенок достигает нормального веса можно делать вакцинацию
- гемолитическая ярко выраженная желтуха. Можно вакцинировать после исчезновения желтухи.
- если в роддоме у ребенка развилась какая-либо инфекция
- если имеется пиодермия
Иммунитет держится в пределах 5 лет, поэтому для того чтобы защитить ребенка надо проводить ревакцинацию. В нашей стране ревакцинация проводится трехкратно. Первая ревакцинация проводится в 7 лет (принято потому что удобно — дети идут в школу). Сейчас делают ревакцинацию при выпуске из детского сада. Вторую и третью ревакцинацию проводят в 5 и 10 классе.
Формирование иммунитета идет таким же образом, но, как правило, слабовыраженные проявления — язвочка может не формироваться, может быть пустулка, которая рассасывается. После 17 лет ревакцинация проводится только по показаниям: контакт молодого человека с больным туберкулезом (в семье, где один член семьи болеет, и есть лица до 30 лет). После 30 лет ревакцинацию не проводят, так как считается, что человек после 30 инфицирован.
Противопоказания к ревакцинации: наличие инфицированности туберкулезом. В процессе жизни большинство населения инфицируется, но заболевает небольшая часть, ревакцинация в данном случае не имеет никакого смысла. наличие какой-то аллергии, в частности все болезни носят аллергический характер, и в первую очередь бронхиальная астма (резкое обострение при ревакцинации, вплоть до астматического статуса). наличие кожных поражений — пиодермия, юношеские вульгарные угри и т.п. наличие осложнений при предыдущих ревакцинациях.
Осложнения вакцинации и ревакцинации: изъязвления вместе введения вакцины, язва размером более 10 мм келлоид на месте рубца лимфаденит, величина лимфоузлов более 15 мм.
Химиопрофилактика.
Химиопрофилактика проводится изониазидом в дозе 10 мг на кг веса, проводится в весенне-осенний период сроком 2-3 месяца.
Профилактике подлежат: дети и подростки ,находящиеся в контакте с туберкулезными больными лица, переболевшие туберкулезом и в легких или других органах которых имеются остаточные явления, выражающиеся в форме фиброзных полей, рубцов, кальцинатов (петрификатов). Так как в рубцах Mycobacterium tuberculosis может жить многие годы и в условиях стресса, ослабления иммунитета (особенно обусловленного вирусной инфекцией). больные сахарным диабетом. Среди многих заболеваний при сахарном диабете пораженность туберкулезом очень высока. Эти два заболевания являются друзьями. лица страдающие язвенной болезнью, особенно при наличии остаточных явлений после перенесенного туберкулеза (в легких, лимфоузлах). Об этих изменениях человек может и не знать. лица больные хроническими заболеваниями, постоянно принимающие глюкокортикоиды. Гормоны влияют на уровень иммунитета и способствуют заболеванию туберкулезом при контакте с больными. лица имеющие профессиональные заболевания легких — пневмокониозы, при которых угроза заболеть туберкулезом высока.
Такая система химиопрофилактика помогает снизить заболеваемость туберкулезом.
Санитарная профилактика.
Санитарная профилактика складывается из следующих моментов: изоляция больных туберкулезом с бактериовыделением правильная и систематическая дезинфекция мест нахождения больного санитарная пропаганда.
Изоляция. С 20-х годов было узаконено, что семьи, где находится больной туберкулезом с бактериовыделением, обязательно подлежат расселению. До 1991 года давали жилплощадь. Если в семье имеется двое больных — муж и жена, и выписывается ребенок из роддома, то необходимо с целью безопасности лучше изолировать малыша на 2-3 месяца для формирования иммунитета (госпитализируются в диспансер).
Расселению подлежать лица больные туберкулезом.
Дезинфекция широко применяется, не утратила свое значение. Проводится хлорамином, хлорной известью. Хлорамин в 1-2% растворе (применяется в лечебных учреждениях) не эффективен против Mycobacterium tuberculosis, поэтому используют большие концентрации. Проводят влажную уборку, 2 раза в день. При изоляции больного проводится заключительная дезинфекция силами дезстанциями города — обрабатывается все помещение, вещи и одежда отправляется в дезкамеру. Текущая дезинфекция включает также: отдельная посуда, обязательная обработка хлорамином (замачивание в течение 5 часов). Лучше советовать кипятить в 2% растворе соды (горячий раствор убивает Mycobacterium tuberculosis моментально). Обычно советуют взять 60 соды на 3-х литровую банку.
Постельное и нательное белье должно быть прокипячено. Желательно чтобы в помещении где живет больной не было ковров, потому что при кашле пылинки оседают на мебели, коврах.
Запрет на некоторые профессии: все профессии, связанные с контактом с детьми — воспитатели, учителя и др. все профессии, связанные с коммунальным обслуживанием профессии, связанные с транспортом (проводники, стюардессы и др. всего около 20 профессий).
Социальная профилактика.
Прежде всего, эта работа лежит на властях. каждый больной туберкулезом имеет право на отдельную жилую площадь право на больничный лист в течение 10-12 месяцев все больные туберкулезом имели право на отпуск только в летний период все больные туберкулезом на производстве имеют право на бесплатное диетическое питание каждый больной, переболевший и его родственники, имеют право на бесплатное санаторное лечение в течение 2-3 месяцев.
По инициативе Всемирной организации здравоохранения ежегодно 24 марта мировая общественность проводит Всемирный день борьбы с туберкулезом, в котором Российская Федерация принимает активное участие.
В последние годы существенно ухудшилась эпидемиологическая ситуация по туберкулезу.
В Свердловской области показатель заболеваемости превышает эпидемиологический порог (100 на 100 тысяч населения). Показатель смертности выше, чем по Российской Федерации.
На территории Орджоникидзевского района заболеваемость выросла в 3 раза за период с 1992 по 2009 год. В структуре заболеваемости 96,6% составляет туберкулез органов дыхания и 3,4% — внелегочный туберкулез. Вырос показатель повторной заболеваемости туберкулезом.
Выросла заболеваемость детей от 0 до 14 лет. Наиболее интенсивно в эпидемиологический процесс вовлекаются лица самого трудоспособного возраста, особенно неработающие граждане, ВИЧ – инфицированные.
Туберкулез известен человечеству с глубокой древности. Заболевание это инфекционное, при котором страдает весь организм, поражает не только легкие, но и кости, почки, кожу, глаза.
Туберкулез передается воздушно-капельным путем. Заболевание вызывается палочкой Коха, которая очень устойчива и длительное время сохраняется во внешней среде, на предметах, принадлежащих больному.
Признаки туберкулеза:
- общее недомогание
- быстрая утомляемость
- раздражительность
- легкая возбудимость
- иногда вялость
- апатия
- покашливание
- озноб
- потливость по ночам
Иногда заболевание начинается остро: поднимается температура до 39 градусов. Подозрительны повторные длительные повышения температуры. Возможно похудание, снижение аппетита, кашель может быть сильным, мучительным.
Флюорография
Основным методом раннего активного метода выявления туберкулеза у взрослых является флюорографическое обследование. Флюорографические кабинеты оснащены современными цифровыми аппаратами.
Флюорографические кабинеты работают поликлиниках ГКБ №14 по адресу: г.Екатеринбург, пер.Суворовский д.5 и 5-в.
За направлением на обследование обращаться к любому врачу поликлиники или по тел. +7 (343) 380-13-97.
Вы защитите себя если будете:
- проходить флюорграфическое обследование не реже 1 раза в 2 года.
- соблюдать правила личной и общественной гигиены.
- обязательно включать в рацион пищу, богатую белком и минеральными веществами (молоко, творог, рыбу, курагу и др.)
Помните! Хорошо поддается лечению заболевание, выявленное на ранней стадии.
Вставка мембраны, протеолитический процессинг, сборка в LHC II и локализация на сжатых мембранах происходит в лизатах хлоропластов на JSTOR
Abstract
Апопротеин светособирающего белка хлорофилла a / b (LHCP) является основным интегральным белком тилакоидной мембраны, который обычно образует комплекс с хлорофиллом и ксантофиллами и служит антенным комплексом фотосистемы II. LHCP кодируется в ядре и синтезируется в цитозоле как предшественник с более высокой молекулярной массой, который впоследствии импортируется в хлоропласты и собирается в тилакоиды.В предыдущем исследовании было установлено, что предшественник LHCP может интегрироваться в изолированные тилакоидные мембраны. Настоящее исследование демонстрирует, что в условиях, разработанных для сохранения структуры тилакоидов, вставленный предшественник LHCP процессируется до зрелого размера, собирается в комплекс LHC II хлорофилл-белок и локализуется на прижатых мембранах тилакоидов. В этих условиях свет может частично заменять экзогенный АТФ в процессе мембранной интеграции.
Journal Information
Международный журнал «Физиология растений», основанный в 1926 году, посвящен физиологии, биохимии, клеточной и молекулярной биологии, генетике, биофизике и экологической биологии растений.Физиология растений — один из старейших и наиболее уважаемых журналов по науке о растениях.
Информация об издателе
Oxford University Press — это отделение Оксфордского университета. Издание во всем мире способствует достижению цели университета в области исследований, стипендий и образования. OUP — крупнейшая в мире университетская пресса с самым широким глобальным присутствием. В настоящее время он издает более 6000 новых публикаций в год, имеет офисы примерно в пятидесяти странах и насчитывает более 5500 сотрудников по всему миру.Он стал известен миллионам людей благодаря разнообразной издательской программе, которая включает научные труды по всем академическим дисциплинам, библии, музыку, школьные и университетские учебники, книги по бизнесу, словари и справочники, а также академические журналы.
севофлуран ингибирует индуцированную форбол-миристат-ацетатом активацию протеина-1 в Т-лимфоцитах человека in vitro: потенциальная роль пути стресс-киназы p38 | Анестезиология
Клетки собирали центрифугированием и один раз промывали ледяным фосфатно-солевым буфером, и экстракты ядерных клеток получали в соответствии с описанной процедурой.31 Вкратце, клетки инкубировали в течение 15 мин при 4 ° C в 400 мкл буфера для экстракции (10 мМ HEPES (pH 7,9), 10 мМ KCL, 0,1 мМ ЭДТА, 0,1 мМ EGTA и 2,5 мкл Nonidet P40). Гранулы солюбилизировали в буфере для суспензии (20 мМ HEPES (pH 7,9), 0,4 М NaCl, 1 мМ EDTA, 1 мМ EGTA и 1 мМ дитиотреитол). Супернатанты использовали для EMSA. К буферу для экстракции и суспензии добавляли ингибиторы протеиназ и фосфатаз в следующих концентрациях: 10 мкг / мл апротинина, 25 мкМ лейпептина, 2 мМ фенилметилсульфонилфторида, 2 мМ иодацетамида, 10 мМ фторида натрия и 10 мМ фторида натрия. пирофосфат натрия.EMSA выполняли с использованием олигонуклеотидов AP-1, NF-κB или SP-1, меченных 32 P (25 нг / мкл, Promega, Mannheim, Germany). EMSA для NFAT выполняли с использованием мотива NFAT области усилителя человеческого гранулоцитарно-моноцитарного колониестимулирующего фактора (5′-TTTCTCATGGAAAGATGACAT A-3 ‘) в качестве зонда. Киназная реакция состояла из 37 мкл очищенной воды, 1 мкл олигонуклеотидов AP-1 (или NF-κB, или SP-1), 5 мкл киназного буфера, 5 мкл γ- 32 Pd-аденозинтрифосфат (Amersham International, Брауншвейг, США). Германия), и 1.5 мкл киназы Т4 (буфер PNK и киназа PNK T4; New England Biolabs, Schwalbach, Германия) инкубировали в течение 30 мин при 37 ° C. Содержание белка в клеточных лизатах определяли с использованием системы Bradford-Assay (Bio-Rad Laboratories, München, Germany), и равные количества белка (30 мкг) добавляли к 20 мкл реакционной смеси EMSA, содержащей 20 мкг бычьего сывороточного альбумина. , 2 мкг поли (dI-dC) (Roche, Мангейм, Германия), 2 мкл буфера D + (20 мМ HEPES, pH 7,9, 20% глицерин, 100 мМ KCl, 0,5 мМ ЭДТА, 0,25% Nonidet P-40, 2 мм дитиотреитол, 0.1% фенилметилсульфонилфторид), 4 мкл 5 × буфера фиколла (20% фиколл 400, 100 мМ HEPES, 300 мМ KCl, 10 мМ дитиотрейтол, 0,1% фенилметилсульфонилфторид), 1 мкл 50 мМ MgCl 2 , 3 мкл ddH 2 O и 1 мкл AP-1 (или NFAT, NF-κB или SP-1) 32 P-меченный олигонуклеотид. Эти образцы инкубировали при комнатной температуре в течение 30 мин, а затем наносили на акриламидный гель, содержащий 60 мл ddH 2 O, 10 мл 30% акриламида, 3,8 мл 10-кратного буфера трис-борат-ЭДТА (900 мМ TRIS-HCl, 900 мм). мМ борной кислоты, 20 мМ ЭДТА [pH 8.0]), 400 мкл персульфата аммония и 40 мкл тетраметилэтилендиамина. После прогона геля в 0,5-кратном рабочем буфере трис-борат-ЭДТА гели сушили в вакууме (сушилка для гелей 543, Bio-Rad, Геркулес, Калифорния) в течение 30 мин на хроматографическом фильтре 3 мм (Whatman, Maidstone, England) и экспонировали. на радиографическую пленку (Kodak, Штутгарт, Германия). Для анализов суперсдвига в реакцию добавляли 2,5 мкл антитела одновременно с белком и инкубировали, как описано. Antic-jun, antic-jun (AP-1), anti-JunB, anti-JunD, antic-fos, анти-Fra1 и -Fra2, антитела против FosB и анти-RelB были приобретены у Santa Cruz Biotechnology (Santa Cruz, CA).
% PDF-1.5
%
1 0 объект
> / OCGs [9 0 R] >> / Страницы 2 0 R / Тип / Каталог >>
эндобдж
40 0 объект
> / Шрифт >>> / Поля [] >>
эндобдж
44 0 объект
> поток
2021-06-06T05: 14: 27-07: 002006-09-16T13: 03: 47 + 08: 002021-06-06T05: 14: 27-07: 00uuid: 19e3620d-d4e8-4108-8e64-4d736b6b7d9cuuid: 10144f1e- 1dd2-11b2-0a00-b80068ca7fffapplication / pdf
конечный поток
эндобдж
2 0 obj
>
эндобдж
35 0 объект
> / Resources> / Font> / T1_1> / T1_2> / T1_3> / T1_4 48 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >>
эндобдж
30 0 объект
> / Resources> / Font> / T1_1> / T1_2> / T1_3> / T1_4 48 0 R >> / ProcSet [/ PDF / Text / ImageB] / Properties> / XObject >>> / Type / Page >>
эндобдж
25 0 объект
> / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5 48 0 R >> / ProcSet [/ PDF / Text / ImageB] / Свойства> / XObject >>> / Type / Page >>
эндобдж
20 0 объект
> / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5 48 0 R >> / ProcSet [/ PDF / Text / ImageB] / Свойства> / XObject >>> / Type / Page >>
эндобдж
15 0 объект
> / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5 48 0 R >> / ProcSet [/ PDF / Text / ImageB] / Свойства> / XObject >>> / Type / Page >>
эндобдж
5 0 obj
> / Ресурсы> / Шрифт> / T1_1> / T1_2> / T1_3> / T1_4> / T1_5> / T1_6> / T1_7 48 0 R >> / ProcSet [/ PDF / Text / ImageB / ImageC] / Свойства> / XObject> >> / Тип / Страница >>
эндобдж
45 0 объект
> / ProcSet [/ PDF / Text / ImageC] / XObject >>> / Type / Page >>
эндобдж
59 0 объект
[65 0 R 66 0 R 67 0 R 68 0 R 69 0 R]
эндобдж
60 0 объект
> поток
q
540.0594177 0 0 68.6011963 35.9702911 675.3988037 см
/ Im0 Do
Q
BT
/ T1_0 1 Тс
10 0 0 10 85,56995 576,99985 тм
(1979; 39: 923-928.) Tj
/ T1_1 1 Тс
-5.55699 0 Тд
(Рак Res \ 240) Tj
/ T1_0 1 Тс
0 1 ТД
(\ 240) Tj
0 1.00001 TD
(Сет Д. Пинский, Кеннет Д. Тью, Марк Э. Смолсон и др.) Tj
/ T1_2 1 Тс
0 1 ТД
(\ 240) Tj
/ T1_3 1 Тс
18 0 0 18 30 616,99997 тм
(1-метил-1-нитрозомочевина и 1-метил-3-нитро-1-нитрозогуанидин) Tj
Т *
(Модификация ядерных белков клетки L1210 с помощью) Tj
ET
30 522 552 35 рэ
0 0 мес.
S
BT
/ T1_0 1 Тс
11 0 0 11 120.94202 529,99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-7,55696 1 тд
(Обновленная версия) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 141 521,99994 тм
(\ 240) Tj
/ T1_0 1 Тс
22.06695 1 тд
() Tj
0 0 1 рг
-22.06695 0 Тд
(http://cancerres.aacrjournals.org/content/39/3/923)Tj
0 г
0 1.00001 TD
(См. Самую последнюю версию этой статьи по адресу:) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 30 501,99997 тм
(\ 240) Tj
0 1 ТД
(\ 240) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 30 481,99997 тм
(\ 240) Tj
Т *
(\ 240) Tj
ET
BT
/ T1_2 1 Тс
10 0 0 10 30 461,99997 тм
(\ 240) Tj
Т *
(\ 240) Tj
ET
30 347 552 115 рэ
0 0 мес.
S
BT
/ T1_0 1 Тс
11 0 0 11 120.94202 429,99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-5.66901 1 тд
(Оповещения по электронной почте) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 295,4996 442 тм
(относится к этой статье или журналу.) Tj
0 0 1 рг
-15.44996 0 Тд
(Подпишитесь, чтобы получать бесплатные уведомления по электронной почте) Tj
ET
BT
0 г
/ T1_0 1 Тс
11 0 0 11 120.94202 396.99994 тм
(\ 240) Tj
/ T1_3 1 Тс
-6.38997 1 тд
(Подписки) Tj
0,556 1,00001 тд
(Отпечатки и) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 141 399,99994 тм
(\ 240) Tj
13,46496 1 тд
(.) Tj
0 0 1 рг
-6.85098 0 Тд
([email protected]) Tj
0 г
-6.61398 0 Тд
(Отделение) Tj
0 1.00001 TD
(Чтобы заказать перепечатку статьи или подписаться на журнал, свяжитесь с нами \
t Публикации AACR) Tj
ET
BT
/ T1_0 1 Тс
11 0 0 11 120,94 202 374,99997 тм
(\ 240) Tj
/ T1_3 1 Тс
-5.66901 1 тд
(Разрешения) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 141 346,99988 тм
(\ 240) Tj
0 1 ТД
(Сайт с правами.) Tj
0 1.00001 TD
(Нажмите «Запросить разрешения», чтобы перейти на страницу защиты авторских прав \
Центр Рэнсиса \ (CCC \)) Tj
22.06695 1 тд
(.) Tj
0 0 1 рг
-22.06695 0 Тд
(http://cancerres.aacrjournals.org/content/39/3/923)Tj
0 г
0 1 ТД
(Чтобы запросить разрешение на повторное использование всей или части этой статьи, используйте это li \
nk) Tj
ET
BT
/ T1_0 1 Тс
9 0 0 9 258.\ q
Воздействие белого света на мРНК светособирающего a / b-белка хлорофилла в Lemna gibba L. G-3 1 | Физиология растений
Аннотация
Продукты трансляции поли (A) мРНК, выделенной из Lemna gibba L. G-3, включают основной полипептид 32000 дальтон, который иммунопреципитируется антисывороткой к хлорофиллу a / b -белок из Chlamydomonas . Этот полипептид 32000 дальтон представляет собой предшественник собирающего свет хлорофилла a / b -белка с молекулярной массой 28000, обнаруженного в тилакоидных мембранах Lemna gibba .Количество этой транслируемой мРНК уменьшается по сравнению с другими транслируемыми мРНК, когда зеленые растения, выращенные в непрерывном белом свете, помещаются в темноту. Это уменьшение происходит быстро. Самый быстрый спад происходит в первые сутки; после 4 дней темноты только низкий уровень этой мРНК может быть обнаружен с помощью трансляции in vitro и . Когда растения возвращаются к белому свету, происходит увеличение относительного уровня этой мРНК, которое можно легко обнаружить в течение двух часов. Синтез in vivo этого белка был исследован при различных условиях освещения.Световые эффекты на in vivo синтезе хлорофилла a / b -белка отражают световые эффекты на транслируемую мРНК полипептида. Результаты показывают, что вызванные светом изменения в синтезе, процессинге или деградации мРНК хлорофилла a / b -белка могут объяснить индуцированные светом изменения, наблюдаемые в эффективных скоростях синтеза хлорофилла a / b -белка . in vivo .
Этот контент доступен только в формате PDF.
© 1981 Американское общество биологов растений
Эта статья опубликована и распространяется в соответствии с условиями модели публикации стандартных журналов Oxford University Press (https://academic.oup.com/journals/pages/open_access/funder_policies/chorus/ standard_publication_model)
молекул | Бесплатный полнотекстовый | Бактериальные аналоги липида II: новые субстраты in vitro для олигосахарилдифосфодолихолдифосфатазы (DLODP) млекопитающих. согласуются с гипотезой о том, что эти структуры гидролизуются ранее охарактеризованным DLODP печени.Для дальнейшего обоснования этой гипотезы биохимические характеристики гидролиза ЛИИ были изучены более подробно. Для этого LII (DAP) 35 использовали в качестве субстрата, и, как показано на Фигуре 8A, при инкубации в течение 4 часов продукция GM5P была линейной во всем диапазоне протестированных количеств белка. Когда различные количества субстрата инкубировали с 27,2 мкг белка в течение 4 часов, было обнаружено, что продукция GM5P была насыщаемой и составляла ~ 75% от максимальной при использовании 500 пмоль LII (фигура 8B). Наконец, когда 500 пмоль LII инкубировали с 27.2 мкг белка, продукция GM5P была достаточно линейной до 4 ч инкубации (рис. 8C). Эти условия реакции использовали для дальнейшей характеристики характеристик реакции, генерирующей GM5P. Для обнаружения активности DLODP млекопитающих с использованием неочищенного препарата мембран из клеток HepG2 необходимо присутствие Co
2+ [13]. При оптимизации концентраций детергента, соли и Co 2+ , необходимых для солюбилизации активности DLODP микросомальной печени крысы, было обнаружено, что восстановление активности DLODP было плохим, если Co 2+ не был добавлен в буфер для солюбилизации.Соответственно, микросомальные белки солюбилизировали в присутствии либо Co 2+ , Mn 2+ , Ca 2+ , либо Mg 2+ перед анализом активности гидролиза липида II в соответствующих катионсодержащих буферах. Данные, представленные на фиг. 9A, демонстрируют, что продукция GM5P из LII (DAP) 35 резко увеличивается, когда Co 2+ присутствует в буфере для солюбилизации и анализа. Активность DLODP блокируется соединениями на основе соланезила (Sol) со следующим порядком эффективности: Sol-PP-GlcNAc 2 > Sol-PP-GlcNAc> Sol-PP> Sol-P> соланезол [13].Как демонстрируют данные, показанные на Фигуре 9B, эти соединения ингибируют продукцию GM5P из LII (DAP) 35 с тем же порядком эффективности. Наконец, активность DLODP ингибируется ортованадатом натрия и Hg 2+ , но не фторидом натрия [13], и, как показано на рисунке 9C, продукция GM5P из LII (DAP) 35 демонстрирует такую же чувствительность к этим реагентам. Взятые вместе, эти данные показывают, что одни и те же активности или активности с близкими биохимическими характеристиками генерируют GM5P из LII (DAP) 35 и [ 3 H] OSP из [ 3 H] DLO.
Измерение и коррекция хроматической аберрации
Что такое хроматическая аберрация и почему мне это нужно?
Большой проблемой в многоцветной флуоресцентной микроскопии является хроматическая аберрация и неправильная регистрация: точное пространственное наложение или «совмещение» одиночных цветовых каналов. Это становится особенно важным для анализа колокализации с точностью до пикселя.
Более подробные описания можно найти в другом месте: Википедия Хроматическая аберрация.
Для точных измерений колокализации и наилучшего качества визуального изображения измерение имеющейся хроматической аберрации и корректировка изображений перед выполнением анализа колокализации имеет очень хороший смысл, особенно для объективов с высоким разрешением.Для наилучшего наложения цветовых каналов в самом оборудовании формирования изображения необходимо учитывать несколько моментов:
- соединение лазеров: часто линии «UV» и «VIS» имеют отдельные соединения из-за необходимости использования разных волокон; точность соединения влияет на регистрацию линий «UV» и «VIS»
- : различные системы позволяют дополнительно влиять на наложение «УФ» и «ВИД» через коллиматорные линзы.
- хроматическая коррекция линзы объектива: уровень коррекции хроматических аберраций зависит от типа объектива: A-Chromat, ApoChromat, PLAPO, UPLSAPO и т. Д.
- повреждение линзы объектива: коррекция объективов может быть нарушена повреждением объектива.
- регистрация точечных отверстий: в системах с множеством точечных отверстий, таких как Zeiss LSM 510, можно столкнуться с дополнительной проблемой совмещения точечных отверстий; если точечные отверстия плохо совмещены друг с другом, сигналы смещаются
Коллиматорные линзы
Теперь ясно, что нужно протестировать несколько комбинаций настроек сбора данных. Хорошее начало — набор из трех цветов (RGB, например, EX 405, 488, 561 нм) с открытыми отверстиями.
К сожалению, не все объективы были одинаковыми.
В наших руках конфокальные изображения точечного сканирования, даже если вы выровняете точечное отверстие (отверстия) как можно лучше
между «зеленым», «красным» или «далеким красным» все еще может быть микрон несовпадения,
с DAPI и т. д. часто бывает далеко, так как он в любом случае проходит через другое оптоволокно и коллиматор (например, на LSM 510)
Мы протестировали разные объективы с одинаковыми характеристиками от одного производителя,
и обнаружил, что все они имеют свою индивидуальность.Хорошая коррекция вполне возможна, но «хорошее» — вещь относительная.
Слишком «плохие» отправляем обратно, а «хорошие» оставляем.
Берем z стопок разноцветных шариков размером 1 микрон, чтобы измерить оставшуюся погрешность.
(для этого измерения не нужны изображения шариков с низким разрешением)
Всегда будет значительная ошибка, даже в самых лучших
Объектив «Super-dooper Mega Extra Apo-Chromat» можно приобрести у любого производителя менее чем за 100 тысяч долларов.
Их просто невозможно сделать идеальными по разумной цене (как объяснил нам гуру по линзам Zeiss).
Если вы хотите провести точные исследования колокализации с самым высоким оптическим разрешением (все делают, даже если они не сразу осознают это)
тогда вы просто ДОЛЖНЫ измерить ошибку, а затем исправить / сдвинуть изображения (в 3D) перед колокализацией / корреляционным анализом.
Это можно сделать в 3D в ImageJ / Fiji
с использованием хороших методов интерполяции от Эрика Мейеринга для субпиксельных сдвигов — TJ-Translate:
http://fiji.sc/TransformJ
ведущий к
http://imagescience.org/meijering/software/transformj/translate.html
или в отличном корректоре цветового сдвига от Huygens Professional (никакого коммерческого интереса — просто довольный покупатель)
http://www.svi.nl/ChromaticShiftCorrector
или примерно в программном обеспечении Zeiss AIM 510 только в xy (сдвиги целых пикселей),
Влияние на 2-канальную диаграмму рассеяния / 2D-гистограмму / флюорограмму очень существенно.Уродливое плохо коррелированное облако превращается в сильно коррелированную совокупность пикселей,
и колок. коэффициенты прыгают намного выше.
Как измерить хроматическую аберрацию
Эти инструкции оптимизированы для конфокальных изображений точечного сканирования,
но аналогичная процедура будет работать с любой системой многоцветного флуоресцентного микроскопа,
будь то широкое поле, вращающийся фиск, TIRF или что-то еще.
требования
- Образец многоцветных флуоресцентных шариков 200, 500 или 1000 нм
- Здесь нет необходимости использовать гранулы низкого разрешения, соотношение сигнал / шум более важно, а локализация остается точной.
приобретение
- открытое отверстие (а)
- используйте апохроматический объектив высокого разрешения (NA 1,2 или выше)
- настроить путь луча для флуоресценции Z-stack RGB (например, EX 405, 488, 561 нм)
- позаботится о размере пикселя и размере Z-шага (оптимальная выборка, т.е. размер пикселя 100 нм, размер шага 200 нм)
- не перенасыщают пиксели, лучше использовать 12/16 бит
- использовать последовательное построчное сканирование, чтобы уменьшить проступание и влияние вибрации столика / системы
- установить поля стопки, чтобы покрыть бусинки и большую часть функции распределения точки
- оставаться в центре поля зрения (оптимальная работа сканера и объективов)
- получить стопку изображений
анализ
- загрузить полученный стек на Фиджи
- Х-сдвиг
- выберите главную фокальную плоскость
- нарисуйте горизонтальную линию с помощью инструмента «Линия» поперек одной бусинки близко к центру.
- получите прямую линию, удерживая клавишу Shift во время рисования
- линию можно перемещать с помощью клавиш со стрелками
- перейдите в Analyze> Plot Profile
- перейти к следующему каналу без изменения строки и построить другой профиль
- сравните пик профилей; или щелкните List и сравните пиковые значения
- Сдвиг Y:
- повторить рисование линий и профилей для вертикального направления
- Z-сдвиг:
- удалить линию
- нарисуйте квадрат вокруг той же бусинки
- сгенерируйте XZ-стек этого бусинки: Image> Stacks> Reslice…
- выберите интересующую плоскость с четким разрезом через PSF борта
- проведите прямую вертикальную линию через центр бусинки
- постройте профиль: Анализировать> Построить профиль
- повторить это для других каналов
изображений
сравнительный анализ на Фиджи, шарики 200 нм, 2 профиля линий (направление X) для «синего» и «зеленого»
анализ совместимости на Фиджи, шарики 200 нм, 2 профиля линий (направление Z) для «зеленого» и «красного», видимый Z-сдвиг ~ 250 нм
Диаграмма рассеяния / 2D-гистограмма интенсивности и статистика колокализации до коррекции сдвига цвета
Диаграмма рассеяния / 2D-гистограмма интенсивности и статистика колокализации после коррекции сдвига цвета
Введение
Введение
Хотя свет необходим для преобразования фотосинтетической энергии, чрезмерный свет может быть вредным для растений.Фотоингибирование — это явление, при котором фотосинтез подавляется при чрезмерном освещении [1]. Фотосистема II (ФСII) является основной мишенью фотоингибирования, а реакционный центр, связывающий белок D1, чрезвычайно уязвим для атаки эндогенных катионных радикалов и активных форм кислорода (АФК), образующихся при чрезмерном освещении [2], [3], [4] . Хорошо известно, что синглетный кислород ( 1 O 2 ), одна из АФК, генерируется при сильном освещении ФСII за счет взаимодействия возбужденного триплетного состояния Р680 (первичного донора электронов ФСII) и молекулярного кислорода [ 5], [6], [7], [8], [9], [10], [11].В условиях сильного освещения кислород также восстанавливается молекулами первичного акцептора электронов феофитина и пластохинона (PQ), что приводит к образованию супероксид-анион-радикалов [12], [13]. Недавно было показано, что гидроксильные радикалы (HO • ) образуются на акцепторной стороне ФС II при сильном освещении [14], [15]. Повреждение ФСII 1 O 2 и HO • , полученное в этих условиях светового стресса, объясняет так называемое «акцепторное фотоингибирование» ФСII [1], [2], [3], [4] , [16].Когда ФСII освещается после инактивации донорной стороны, эндогенные катионные радикалы, такие как P680 + , окисленная форма первичного донора электронов PSII, и Tyr Z + , окисленная форма вторичного донора электронов ФСII образуются из-за плохой отдачи электронов из расщепляющего воду комплекса 4Mn-Ca в реакционном центре. Эти радикалы впоследствии вызывают повреждение белка D1. Этот процесс вызывается относительно слабым светом и называется «фотоингибированием донора» ФСII [17], [18].Повреждение из-за фотоингибирования на донорной стороне ограничивается донорской стороной PSII, то есть люминальной стороной белка D1.
Поскольку комплексы ФСII встроены в липидный бислой тилакоидной мембраны, они неизбежно подвергаются воздействию липидов в стрессовых условиях. Липиды с полиненасыщенными жирными кислотами, содержащими две или более двойных связей, являются потенциальными мишенями перекисного окисления [19], [20]. Процесс перекисного окисления липидов состоит из так называемых стадий «инициирования», «распространения» и «прекращения».Обычно HO • инициирует перекисное окисление жирных кислот путем отделения атома водорода от активной метиленовой группы, где HO • становится H 2 O. Образующийся липидный алкильный радикал (L • ) реагирует с молекулярным кислородом. с образованием липидного пероксильного радикала (LOO • ). LOO • затем отрывает атом водорода от соседней боковой цепи жирной кислоты, чтобы стать перекисью липидов (LOOH), и этот этап вызывает распространение перекисного окисления липидов.Недавно было показано, что перекисное окисление липидов происходит, когда тилакоиды шпината и мембраны ФСII подвергаются умеренному тепловому стрессу при 40 ° C в течение 30 мин [21]. Было также продемонстрировано, что 1 O 2 и HO • генерируются в мембранах ФСII шпината, подвергнутых умеренному тепловому стрессу, который, вероятно, имеет место как на акцепторной, так и на донорной сторонах ФСII [21], [22]. Предполагается, что деградация белка D1, высвобождение Mn и высвобождение белков PsbO, P и Q из ФСII происходит с индуцированным нагреванием перекисным окислением липидов [21].
В настоящем исследовании мы исследовали возможное участие перекисного окисления липидов в фотоповреждении и модификации ФСII при фотоингибирующем освещении с использованием тилакоидов шпината и мембран ФСII. Наше исследование, в котором сравнивались эффекты добавленной извне липоксигеназы (LOX) в темноте и воздействия чрезмерного освещения, предполагает, что перекисное окисление липидов при освещении образцов мембран вызывает повреждение ФСII, в частности, белка D1. и светособирающие хлорофилл-белки ФС II (LHCII), а также модификация последних компонентов малоновым диальдегидом (МДА).
Результаты Ингибирование активности ФСII освещением тилакоидов и мембран ФСII
Сначала мы исследовали влияние освещения белым светом различной интенсивности на активность ФСII тилакоидов шпината (рис. 1А) и мембран ФСII (рис. 1В) путем мониторинга квантовая эффективность фотохимии ФС II определяется как отношение переменной флуоресценции хлорофилла к максимальной (Fv / Fm). Значения Fv / Fm в темных контрольных образцах составляли около 6, а относительно низкие значения Fv / Fm по сравнению со значениями исходных материалов (листья шпината, в которых Fv / Fm составляли около 8), вероятно, были связаны с повреждением ФС II через липиды. перекисное окисление при пробоподготовке.В настоящем исследовании мы исключили Na-аскорбат в измельчающую среду листьев шпината, чтобы избежать влияния восстановителя на перекисное окисление липидов, которое мы измерили впоследствии при световом стрессе (см. Материалы и методы). Образцы мембран освещали фотонами 100–1000 мкмоль m –2 с –1 в течение 10 мин при 20 ° C или 30 ° C. После освещения активность ФСII снижалась как в тилакоидах, так и в мембранах ФСII в зависимости от интенсивности света, и потеря активности была более значительной при 30 ° C по сравнению с 20 ° C.При 30 ° C даже инкубация образцов в темноте в течение 10 мин вызвала снижение Fv / Fm, вероятно, отражая увеличение перекисного окисления липидов при более высоких температурах.
10.1371 / journal.pone.0052100.g001 Рисунок 1
(A) Тилакоиды. (B) Мембраны ФСII. Образцы инкубировали в растворе B и хранили в темноте или освещали белым светом с заданной интенсивностью света (100–1000 мкмоль фотонов м −2 с −1 ) либо при 20 ° C (коричневые столбики), либо при 30 °. C (зеленые столбики) в течение 10 мин.Также показан темный контроль, сохраненный при 4 ° C (синие полосы). После инкубации в темноте в течение 30 минут на льду флуоресценцию хлорофилла измеряли с помощью Mini-PAM при 25 ° C. Данные представляют собой средние значения трех измерений ± стандартное отклонение.
Перекисное окисление липидов, вызванное освещением или добавлением липоксигеназы к тилакоидам и мембранам PSII
Мы измерили перекисное окисление липидов с помощью метода реактивного вещества тиобарбитуловой кислоты (ТВА) (TBARS), который обычно использовался для анализа перекисного окисления липидов (рис.2А). Освещение тилакоидов и мембран ФСII сильным светом (1000 мкмоль фотонов m −2 с −1 ) в течение 30 минут вызывало перекисное окисление липидов, причем уровень перекисного окисления был выше в тилакоидах, чем в мембранах ФСII.
10.1371 / journal.pone.0052100.g002 Рисунок 2
(A) Перекисное окисление липидов в тилакоидах (зеленые столбцы) и мембранах ФСII (желтые столбцы), освещенных сильным светом (интенсивность, 1000 мкмоль фотонов м -2 с -1 ) при 20 ° C в течение указанных периодов.Перекисное окисление липидов оценивали с помощью анализа TBARS. (B) Перекисное окисление липидов, определенное с использованием флуоресцентного зонда Spy-LHP в тилакоидах (зеленые столбцы) и мембранах PSII (желтые столбцы), освещенных либо при 20 ° C, либо при 30 ° C в течение 30 минут при сильном освещении (интенсивность была такой же, как также показаны темные контроли при 20 ° C и 30 ° C. (C) Перекисное окисление липидов в тилакоидах (зеленые столбцы) и мембранах PSII (желтые столбцы), вызванное инкубацией с липоксигеназой (LOX, 0,1 мг мл -1 ) за указанные периоды.Тест TBARS использовали для анализа перекисного окисления липидов. (D) Перекисное окисление липидов в тилакоидах (зеленые столбцы) и мембранах PSII (желтые столбцы), вызванное инкубацией с LOX при 20 ° C или 30 ° C в течение 30 мин. Концентрация LOX составляла 0,1 мг / мл -1 . Spy-LHP использовали для анализа перекисного окисления липидов. Данные представляют собой средние значения трех измерений ± S. Д.
Сильное индуцированное светом перекисное окисление липидов также измеряли с помощью флуоресцентного зонда 2- (4-дифенилфосфанилфенил) -9- (1-гексилгептил) антра [1,1,9-def, 6,5,10-d ‘E’f’] диизохинолин-1,3,8,10-тетраон (Spy-LHP) (рис.2Б). Spy-LHP специфически реагирует с перекисью липидов и был успешно применен для мониторинга перекисного окисления липидов в мембранах PSII шпината в предыдущем исследовании [23]. Когда образцы освещались (интенсивность света, 1000 мкмоль фотонов м -2 с -1 ) при 20 ° C в течение 30 минут, происходило перекисное окисление липидов, и мы снова отметили, что степень избыточного индуцированного светом липидов перекисное окисление было больше у тилакоидов по сравнению с мембранами ФС II.
Затем мы исследовали перекисное окисление липидов путем добавления LOX сои (конечная концентрация, 0.1 мг / мл -1 ) к образцам при 20 ° C или 30 ° C в темноте с помощью метода TBARS (рис. 2C) и измерения флуоресценции с помощью Spy-LHP (рис. 2D). LOX — это железосодержащий фермент, широко встречающийся в растениях, грибах и животных, который катализирует окисление липидов до перекисей липидов [24], [25]. Субстратами ферментов являются полиненасыщенные жирные кислоты, содержащие двойные цис-связи. Мы наблюдали индуцированное LOX перекисное окисление липидов как в тилакоидах, так и в мембранах ФСII методом TBARS, причем степень перекисного окисления липидов LOX была больше в тилакоидах, чем в мембранах ФСII (рис.2С). Когда мы использовали Spy-LHP, LOX-индуцированное перекисное окисление липидов было обнаружено в тилакоидах, но перекисное окисление липидов не было таким явным в мембранах PSII (рис. 2D).
В тилакоидах шпината эндогенный LOX, который проявляет гомологию с LOX сои, не был обнаружен вестерн-блот-анализом с использованием специфических антител против LOX сои (фиг. S1). Таким образом, перекисное окисление липидов, наблюдаемое здесь при освещении, должно было быть результатом не активации эндогенного LOX, а других процессов, специфичных для освещения, наиболее вероятно, зависимых от АФК процессов.
Обнаружение аддуктов малонового диальдегида и белка в тилакоидах при сильном освещении или инкубации с липоксигеназой в темноте
В результате перекисного окисления липидов в качестве вторичного продукта образуется малоновый диальдегид (MDA: молекулярная масса 72,1). Известно, что МДА образует аддукты с белками и нуклеиновыми кислотами [26]. Мы обнаружили аддукты МДА-белок в тилакоидах, освещенных чрезмерным светом, с помощью Вестерн-блоттинга со специфическим антителом против МДА (рис. 3). Тилакоиды содержали низкий уровень аддуктов МДА-белок с молекулярной массой 60-66 кДа, даже когда они инкубировались в темноте без дополнительной обработки.Как мы уже предположили на рис. 1, это может быть связано с перекисным окислением липидов в образцах на этапах приготовления. Когда тилакоиды освещались сильным светом (1000 мкмоль фотонов m -2 с -1 ) при 20 ° C, количество аддуктов 60-66 кДа уменьшалось, и вместо этого появлялись новые полосы с более высокой молекулярной массой. диапазон. Это, вероятно, приписывают либо опосредованной MDA агрегации белков, либо перекрестному связыванию MDA с агрегированными белками, продуцируемыми при сильном освещении.
10.1371 / journal.pone.0052100.g003 Рисунок 3
Тилакоиды шпината либо освещались сильным светом (1000 мкмоль фотонов m -2 с -1 в течение 30 и 60 минут, обозначено как «Свет» наверху геля), либо обрабатывались LOX (0,1–0,5 мг / мл -1 , обозначено как «+ LOX»), и продуцирование аддуктов малонового диальдегида (MDA) и белка исследовали с помощью вестерн-блоттинга с использованием моноклональных антител против MDA (Nichiyu, Япония).Молекулярные маркеры показаны в левой части флюорограммы.
Эти результаты также подтверждают результаты, полученные на рис. 2, показывая, что сильный свет индуцирует перекисное окисление липидов в тилакоидах и в меньшей степени в мембранах ФСII. Продукция аддуктов МДА-белок также наблюдалась с тилакоидами при добавлении LOX (0,1-0,5 мг / мл -1 ). В этом случае также были обнаружены более крупные белковые аддукты, связанные с MDA. Среди нескольких аддуктов МДА-белок, обнаруженных на флюорограмме, основные аддукты имеют относительную молекулярную массу около 30 000 Да, что позволяет предположить, что эти продукты, вероятно, образуются при добавлении МДА к LHCII.Модификация белка D1 с помощью MDA может быть устранена по причине, описанной ниже в разделе «Обсуждение».
Повреждение белков PSII сильным освещением
Хорошо известно, что чрезмерное освещение PSII вызывает деградацию белка D1. Сообщалось также об агрегации фотоповрежденного белка D1 с белком D2, CP43 и α-субъединицей цитохрома b 559 [27], [28]. Распад и агрегация белка D1 являются хорошей мерой фотоповреждения белка [3].Здесь мы обнаружили у тилакоидов, что в дополнение к белку D1 субъединицы LHCII также подвержены фотоповреждению (рис. S2). Окрашенный кумасси синим гель SDS / мочевина-PAGE и последующий вестерн-блот-анализ с использованием антител против субъединиц LHCII показывают, что количество LHCII уменьшается при чрезмерном освещении (фиг. S2A и B). Эффект избыточного света был более выражен в тилакоидах, чем в мембранах ФСII. Потеря полосы LHCII частично связана с агрегацией субъединиц LHCII с белком D1 (рис.S2C). Мы также наблюдали потерю CP43 при сильном освещении и сопутствующую агрегацию белка D1 и CP43, о которой сообщалось ранее [29].
Ингибирование активности фотосистемы II и повреждение белка D1 и LHCII путем инкубации тилакоидов и мембран ФСII с липоксигеназой в темноте
Когда мы обрабатывали тилакоиды и мембраны ФСII 0,1 мг / мл -1 LOX, активность ФСII измерялась с помощью Флуоресценция хлорофилла Fv / Fm снизилась на ∼20% в мембранах тилакоидов и ФСII после 30 мин инкубации при 20 ° C в темноте (рис.4). Потеря активности PSII увеличивалась, когда образцы обрабатывали LOX при 30 ° C.
10.1371 / journal.pone.0052100.g004 Рисунок 4
Для контроля активности ФСII измеряли флуоресценцию хлорофилла Fv / Fm. (А) Тилакоиды. (B) Мембраны ФСII. LOX добавляли в концентрации 0,1, 0,2 и 0,5 мг / мл -1 , и реакционные смеси инкубировали либо при 20 ° C (коричневые столбцы), либо при 30 ° C (зеленые столбцы) в течение 30 минут.Также показаны контроли, инкубированные при 4 ° C без LOX (синие столбцы). Данные представляют собой средние значения трех измерений ± S. Д.
Поскольку добавление LOX к тилакоидам и мембранам PSII индуцировало ингибирование активности PSII образца, мы затем исследовали, вызывает ли LOX, добавленный к тилакоидам, окисление белка D1 и LHCII в темноте и повреждает ли эти белки. Мы измерили окисление белков с помощью набора для обнаружения окисления белков Oxi-Blot (Chemicon International, США) и оценили содержание карбонильных групп в белках с помощью вестерн-блот-анализа с антителом против 2,4-динитрофенила (DNP) (см. Материалы и Методы).В контрольных тилакоидах без добавления LOX несколько белков, включая Lhcb1, субъединицу светособирающего комплекса хлорофилл-белок, имеющего молекулярную массу около 30 кДа, и другие белки с более высокими молекулярными массами уже были окислены. Инкубация тилакоидов с увеличивающимися концентрациями LOX при 20 ° C дополнительно окисляла Lhcb1 и индуцировала образование белковых агрегатов с более высокими молекулярными массами (фиг. 5A). Важно отметить, что добавленный извне LOX также вызывает повреждение белка D1, что проявляется в агрегации (рис.5B, слева) и деградации белка D1 (рис. 5B, справа) в тилакоидах.
10.1371 / journal.pone.0052100.g005 Рисунок 5
(A) Флюорограмма Oxi-Blot анализа, показывающая окисление, агрегацию и деградацию белков тилакоидов при добавлении LOX. Концентрация LOX составляет 0,1, 0,2 и 0.5 мг / мл -1 . Остальные условия были такими же, как на рис. 3. Положение Lhcb1 указано на флюорограмме справа. (B) Флюорограммы, показывающие агрегацию белка D1 (слева) и деградацию белка D1 (справа) при добавлении 0,5 мг / мл -1 LOX. Вестерн-блоттинг проводили с использованием антитела против DE-петли белка D1. Молекулярные маркеры и положения белка D1, агрегатов D1 и продуктов деградации D1 показаны слева и справа от флюорограмм соответственно.Продукты деградации белка D1 при добавлении LOX были обнаружены при передержке геля (справа).
Влияние малонового диальдегида на активность PSII
Как описано выше, MDA является одним из альдегидов, продуцируемых перекисным окислением липидов. Мы исследовали влияние внешнего добавления MDA на активность тилакоидов ФСII (рис. S3). Тилакоиды, инкубированные с 200 мкМ MDA при 30 ° C в течение 30 мин, показали снижение Fv / Fm на ~ 20%, в то время как потеря активности была меньше при 20 ° C.
Обнаружение 1 O 2 в мембранах PSII, индуцированных сильным освещением и добавлением липоксигеназы с EPR Spin Trapping
Ранее было показано, что сильное освещение мембраны PSII вызывает образование 1 O 2 [5 ], [8]. Эти результаты были подтверждены в настоящем исследовании методом спиновой ловушки ЭПР с использованием гидрофильного спинового ловушечного соединения 2, 2, 6, 6-тетраметил-4-пиперидона (TMPD) (фиг. 6). Добавление TMPD к мембранам ФСII в темноте не приводило к появлению сигнала ЭПР 2, 2, 6, 6-тетраметил-4-пиперидон-1-оксил (TEMPONE) (рис.6А). Незначительный сигнал ЭПР TEMPONE, наблюдаемый в неосвещенных мембранах ФСII, был обусловлен примесями в спиновой ловушке. Воздействие света на мембраны ФСII (100–1000 мкмоль фотонов m –2 с –1 в течение 30 мин) в присутствии TMPD приводило к генерации сигнала TEMPONE EPR (рис. 6А). Эти наблюдения подтверждают, что воздействие на мембраны ФСII сильным светом приводит к продукции 1 O 2 . Чтобы выяснить, приводит ли перекисное окисление липидов к продукции 1 O 2 , спектры TEMPONE EPR были измерены в мембранах PSII, обработанных LOX.Когда мембраны PSII обрабатывали LOX при 30 ° C в присутствии TMPD, наблюдали сигнал TEMPONE EPR (фиг. 6B). Эти результаты показывают, что инициация перекисного окисления липидов экзогенным LOX приводит к продукции 1 O 2 . Для количественной оценки количества спинов, захваченных TEMPD в полярной фазе, сигналы TEMPONE EPR, наблюдаемые после облучения и обработки LOX, сравнивали с сигналом TEMPONE EPR, полученным с использованием чистого TEMPONE (фиг. 6C). Число спинов, захваченных в полярной фазе после слабого света (200 мкмоль фотонов м -2 с -1 ) и LOX (0.1 мг / мл –1 ) соответствует количеству захваченных спинов в диапазоне нескольких десятков нМ. При использовании сильного света (1000 мкмоль фотонов m −2 с −1 ) и LOX (0,5 мг · мл −1 ) количество спинов, захваченных TEMPD в полярной фазе, составляло сотни нМ ( Рис. 6D).
10.1371 / journal.pone.0052100.g006 Рисунок 6
(A) Спектры ЭПР TEMPONE были измерены в мембранах ФСII, подвергнутых сильному освещению (интенсивность, 100–1000 мкмоль фотонов м –2 с –1 , время освещения 30 мин). Освещение проводили в присутствии 50 мМ TMPD, 500 мкг хлорофилла на мл –1 и 40 мМ MES (pH 6.5). (B) Спектры TEMPONE EPR были измерены на мембранах PSII, обработанных LOX (0,1, 0,2 и 0,5 мг мл -1 ). Обработку LOX проводили в присутствии 50 мМ TMPD, 500 мкг хлорофилла в мл –1 и 25 мМ фосфатного буфера (pH 7).(C) Спектры TEMPONE EPR, измеренные в чистом TEMPONE, растворенном в ДМСО. (D) Относительная интенсивность спектров TEMPONE EPR, полученных после слабого света (фотоны 200 мкмоль м -2 с -1 ), LOX (0,1 мг мл -1 ), 50 нМ TEMPONE и сильного света (фотоны 1,000 мкмоль м −2 с −1 ), LOX (0,5 мг · мл –1 ), 100 нМ TEMPONE. Интенсивность сигнала оценивали как относительную высоту центрального пика. Вертикальные полосы представляют 1200 относительных единиц. Данные представляют собой средние значения трех измерений ± S.Д.
Обсуждение
Липиды играют фундаментальную роль в первичных реакциях фотосинтеза, потому что они являются основными составляющими мембран тилакоидов [30], [31]. Наиболее распространенными липидами в тилакоидах высших растений являются два галактолипида, моногалактозилдиацилглицерин (МГДГ) и дигалактозилдиацилглицерин (ДГДГ), которые составляют 50–60 мол.% И 20–30 мол.% От общих липидов соответственно [32]. Также существуют фосфолипид, фосфатидилглицерин (PG) и сульфолипид, сульфохиновозилдиацилглицерин (SQDG).PG и SQDG составляют 5–10 мол.% От суммы липидов [33]. На высоконенасыщенные жирные кислоты (18-3 и 16-3) приходится около 70 мол.% Жирных кислот в тилакоидах и> 90 мол.% Жирных кислот в МГДГ [32]. В шпинате, который мы использовали в настоящем исследовании, было показано, что PG составляет 12,6 мол.% И 25,3 мол.% От общих липидов в тилакоидах и комплексах ФСII, соответственно, являясь единственным фосфолипидом в этих образцах [34].
Одна из выдающихся особенностей липидов в комплексе ФСII, выявленная недавним рентгеноструктурным анализом комплекса ФСII цианобактерии Thermosynechococcus elongatus [35], заключается в том, что распределение липидов не является случайным, а функционально фиксировано, и каждая молекула липида окружающие спиральные трансмембранные белки в PSII, по-видимому, играют специфическую роль [35], [36].Интерфейс между липидами и акцепторной стороной белка D1, где расположен Q B , играет важную роль как один из наиболее важных этапов, ограничивающих скорость в общем транспорте электронов ФСII. Сайт Q B является местом, где расположен вторичный акцептор электронов PQ, и по данным рентгеновской кристаллографии комплекса PSII с разрешением 2,9 Å, было идентифицировано несколько липидов, которые образуют диффузионную полость PQ [36]. ]. Это PG, MGDG, DGDG и SQDG [35], [36], [37].Жирные кислоты липидов, составляющих диффузионную полость PQ, должны быть полиненасыщенными и поддерживать текучесть липидной фазы, чтобы обеспечить эффективную миграцию молекул PQ, которые связаны с сайтом Q B и высвобождаются из него для замены. Текучесть мембран также важна для эффективного обмена белка D1 [38]. Таким образом, жирные кислоты в липидах, окружающих белок D1, скорее всего, являются полиненасыщенными в мембранах нативных тилакоидов. Однако полиненасыщенные жирные кислоты неизбежно переокисляются в окислительных условиях из-за наличия двойных связей в ацильных группах [39].
В настоящем исследовании мы показали, что перекисное окисление липидов происходит при освещении тилакоидов шпината и мембран ФСII видимым светом (1000 мкмоль фотонов м −2 с −1 ), а уровень перекисного окисления липидов был выше при 30 ° С. ° C, чем при 20 ° C (рис. 2). Мы использовали два метода для измерения перекисного окисления липидов: анализ TBARS и флуорометрический метод с использованием флуоресцентного зонда Spy-HLP. Тест TBARS зависит от реакции TBA с малоновым диальдегидом (MDA), который является одним из вторичных продуктов перекисного окисления липидов.Самым большим недостатком метода является то, что на поглощение при 532 нм из-за аддукта TBA-MDA влияют некоторые сахара, такие как сахароза, и пигменты, такие как антоцианин, если они находятся в реакционной смеси. В наших измерениях действие мешающих веществ было заранее тщательно проверено. Другой недостаток заключается в том, что MDA имеет тенденцию связывать белки и нуклеиновые кислоты, и поэтому сложно оценить общее количество MDA. Набор для анализа, который мы использовали здесь (набор для анализа малонового диальдегида NWLSS, Northwest Life Science, США), был разработан для минимизации проблемы в соответствии с протоколом производителя.Spy-LHP специфически реагирует с перекисью липидов LOOH. Однако, поскольку LOOH обычно нестабилен, мы не можем оценить реальное количество LOOH и можем недооценить его при определенных условиях. Это может быть причиной того, что мы обнаружили меньшее перекисное окисление липидов при использовании Spy-LHP по сравнению с методом TBARS. Таким образом, нам пришлось использовать два метода одновременно для оценки перекисного окисления липидов.
Перекисное окисление липидов тилакоидов вызывается не только сильным освещением, но и тепловым стрессом.Из более ранней работы было показано, что когда тилакоиды подвергаются воздействию высоких температур, таких как 70–90 ° C и 120–140 ° C, появляется сигнал хемилюминесценции, который указывает на образование 1 O 2 и триплетных карбонилов при нагревании. -индуцированное перекисное окисление липидов и / или термолиз гидропероксидов липидов [40]. Однако недавно мы показали, что перекисное окисление липидов происходит в тилакоидах шпината и мембранах ФСII не при таких высоких температурах, а при более умеренно высоких температурах: когда эти образцы мембран инкубировали при 40 ° C в течение 30 минут, происходило заметное перекисное окисление липидов [21 ].При умеренном тепловом стрессе мы также обнаружили продукцию 1 O 2 и HO • в мембранах ФСII.
Механизм инициирования перекисного окисления липидов при умеренном тепловом стрессе не совсем ясен. Вероятно, в этом процессе могут быть задействованы сильно окисляющие вещества, такие как феррил и перферрил [21]. Негемовое железо, гемовое железо и даже атомы Mn, высвобождаемые из центра расщепления воды ФСII в восстановленной форме, могут вносить вклад в перекисное окисление липидов, потому что обычно переходные металлы могут инициировать перекисное окисление жирных кислот путем реакции с молекулярным кислородом с последующим образованием из 1 O 2 и HO • [20].Возможно, тепловой стресс способствует высвобождению этих переходных металлов из их функциональных центров.
Напротив, нам довольно легко предположить факторы, необходимые для запуска перекисного окисления липидов при световом стрессе. Вероятно, HO • , образованный в результате фотохимической реакции ФСII на акцепторной или донорной стороне ФСII при сильном освещении [14], [15], [41], может инициировать перекисное окисление липидов. При фотоингибировании ФСII образование 1 O 2 вблизи реакционного центра при чрезмерном освещении и повреждающее действие 1 O 2 на ФСII были хорошо задокументированы.Таким образом, следует учитывать возможность того, что 1 O 2 , полученное в результате фотохимической реакции, участвует в перекисном окислении липидов вблизи ФС II. Было показано, что ненасыщенные жирные кислоты легко реагируют с 1 O 2 , и эта реакция протекает по другому механизму, чем инициируемое HO • перекисное окисление липидов [20]. А именно, молекулы синглетного кислорода напрямую реагируют с двойными связями жирных кислот с образованием аллильных гидропероксидов, LOOH. Известно, что время жизни 1 O 2 внутри мембран больше, чем в водной среде, и поэтому весьма вероятно, что реакция между 1 O 2 и ненасыщенными жирными кислотами липидов протекает размещать внутри тилакоидных мембран при сильном освещении.
Перекисное окисление липидов происходило при инкубации тилакоидов с LOX (рис. 2). LOX содержат негемовое железо [железо (III)], которое отрывает атомы водорода от аллильных связей C-H в жирных кислотах [42]. Подобно неферментативному перекисному окислению липидов, образующийся липидный алкильный радикал (L • ) реагирует с молекулярным кислородом с образованием липидного пероксильного радикала (LOO • ), который в конечном итоге образует перекись липидов (LOOH) в результате последующей реакции с удаленным H из соседней ненасыщенной жирной кислоты.Уровень перекисного окисления липидов, индуцированного LOX, был не таким высоким (рис. 2). Вероятно, количество LOX, добавленного к образцам в настоящем исследовании, было достаточно для достижения максимального перекисного окисления липидов, если оно работает должным образом. Небольшая активность перекисного окисления липидов, наблюдаемая при добавлении LOX извне, вероятно, связана с плохой доступностью фермента LOX для жирных кислот субстрата в липидах мембран.
В тилакоидах и мембранах ФСII связанные липиды могут окружать комплексы ФСII.Поскольку эти связанные липиды могут быть глубоко внедрены в щели белков и белковых комплексов, LOX не может легко достичь липидов и составляющих жирных кислот, если жирные кислоты не высвобождаются из липидных бислоев. Что еще более важно, LOX был менее эффективен в мембранах PSII, чем в тилакоидах. Эти результаты показывают, что липиды в комплексах ФСII более устойчивы к перекисному окислению липидов. Отношение связанного липида к свободному липиду в мембранах ФСII должно быть выше, чем в тилакоидах, и поэтому разумно предположить, что устойчивость к перекисному окислению липидов в мембранах ФСII объясняется обилием связанных липидов.
Сильное освещение или добавление LOX к тилакоидам в темноте вызывало окисление некоторых белков в ФСII. Образование поперечно-сшитых продуктов между MDA и субъединицами LHCII (рис. 3) предполагает, что перекисное окисление липидов происходит рядом с этими белками и вызывает повреждение белков. МДА — это водорастворимое вещество, имеющее долгий срок службы и, следовательно, способное перемещаться по тилакоидам на большие расстояния к мишеням. Таким образом, MDA может реагировать с различными мембранными белками, как только он образуется после перекисного окисления липидов.Однако MDA реагирует, в частности, с остатками лизина белков, и поскольку белок D1 шпината не содержит лизина, маловероятно, что MDA вступает в реакцию с белком D1 и химически модифицирует его.
Важно отметить, что мы обнаружили 1 O 2 с помощью захвата спина EPR посредством перекисного окисления липидов путем инкубации мембран PSII с LOX (рис. 6). 1 O 2 также образуется, когда мембраны ФСII освещаются чрезмерным светом [1], [2], [3], [4].Хорошо известно, что 1 O 2 ответственны за повреждение белка D1 при фотоингибировании на акцепторной стороне ФСII. Таким образом, 1 O 2 , продуцируемый перекисным окислением липидов, вероятно, повреждает также белок D1 и субъединицы LHCII.
Мы обнаружили агрегацию и деградацию белка D1 в темноте путем добавления LOX к тилакоидам (рис. 5). Эти данные свидетельствуют о том, что белок D1 повреждается в результате перекисного окисления липидов.Мы сравнили паттерн деградации / агрегации белка D1, вызванный добавлением LOX, с паттерном, вызванным сильным светом, и обнаружили, что оба они очень похожи друг на друга. Повреждение LHCII было еще одним заметным эффектом сильного света на PSII (рис. S2).
Мы объясняем повреждение действием АФК, образующихся в результате фотохимической реакции на ФСII, а также путем перекисного окисления липидов (рис. 7). Вероятно, есть две причины повреждения. Во-первых, 1 O 2 , образующиеся после перекисного окисления липидов, могут повредить белок D1 и LHCII.По мере увеличения концентрации LOO • он образует тетроксидное промежуточное соединение LOOOOL по реакции типа Рассела. При разложении тетроксида образуется LOH и либо триплетно-возбужденный карбонил 3 (L = O) * и молекулярный кислород, либо карбонил в основном состоянии (L = O) и 1 O 2 [20]. Синглетный кислород является потенциальным окислителем и может повредить белок D1 и LHCII, как было продемонстрировано с акцепторным фотоингибированием ФСII [3], [4]. Во-вторых, продукты разложения гидропероксидов липидов [20], [26], [43] могут повредить LHCII.Вторичные продукты включают реакционноспособные карбонильные соединения, наиболее распространенным из которых является МДА. MDA может присутствовать в свободной форме, но он легко реагирует с остатками лизина белков с образованием различных сшитых продуктов [26]. Модификация белков вторичными продуктами перекисного окисления липидов может неизбежно вызвать нарушение функции белков. Например, сообщалось о модификации внешнего белка PsbO PSII с помощью MDA у растений, подвергшихся тепловому стрессу [44]. Ранее мы показали образование сшитых продуктов белка D1 с антенным хлорофилл-связывающим белком CP43 и α-субъединицей cyt b 559 в условиях светового и теплового стресса [3], [4], [27], [3], [4], [27], [ 28], [29], [45], [46].Сшивание белков объясняли прямой реакцией между фотоповрежденным белком D1 и близлежащими белками. Однако наши настоящие результаты предполагают важную роль липидов как медиатора реакции перекрестного связывания. Позднее сообщалось о перекисном окислении липидов, вызванном фотоингибированием ФСII на донорной стороне, с обработанными щелочью мембранами ФСII шпината, обедненными Mn [23]. Эти результаты важны, потому что они предполагают наличие возможной модификации белка D1 путем перекисного окисления липидов в этих условиях.Напротив, настоящие условия освещения, которые мы использовали здесь при 20-30 ° C, соответствуют условиям, вызывающим типичное фотоингибирование ФСII на акцепторной стороне, и, следовательно, наши результаты показывают, что фотоингибирование ФСII на акцепторной стороне вызывает перекисное окисление липидов, что впоследствии приводит к повреждение белков ФСII. Принимая во внимание все эти результаты, мы предполагаем, что существует связь между индуцированным светом перекисным окислением липидов, генерацией 1 O 2 и MDA и повреждением белка D1 и LHCII (рис.7). Эффекты перекисного окисления липидов могут быть вспомогательными в повреждении ФСII, но эффекты существенны, особенно в отношении тилакоидов. Заметное различие между тилакоидами и мембранами PSII в отношении чувствительности к перекисному окислению липидов указывает на то, что связанные липиды внутри и вокруг PSII относительно устойчивы к перекисному окислению липидов.
10.1371 / journal.pone.0052100.g007 Рисунок 7
(A) Подробный механизм перекисного окисления липидов и связанных процессов. (B) Диаграмма, показывающая предполагаемые пути индуцированного светом повреждения белка D1 и LHCII. (1) хорошо известный путь, показывающий индуцированную светом продукцию 1 O 2 в реакционном центре ФСII и повреждение белка D1. (2) новый путь повреждения белка D1 посредством перекисного окисления липидов и последующего образования 1 O 2 и MDA, предложенный в настоящем исследовании.(3) индуцированное липоксигеназой перекисное окисление липидов и повреждение белка D1.
Материалы и методы Получение мембран тилакоидов и PSII из шпината
Свежие листья шпината были приобретены на местном рынке. Интактные тилакоидные мембраны получали по ранее описанной методике [47]. Мы исключили 5 мМ Na-аскорбат в измельчающей среде, чтобы избежать воздействия восстановителя на перекисное окисление липидов в образцах. Тилакоиды суспендировали в буферном растворе, содержащем 0.1 М сорбит, 15 мМ NaCl, 5 мМ MgCl 2 , 30% (об. / Об.) Этиленгликоля и 50 мМ трицин-КОН (pH 7,5) (раствор A), замороженные в жидком азоте и хранящиеся при –30 ° C до использования. Для всех экспериментов мембраны тилакоидов промывали один раз и суспендировали в растворе А без этиленгликоля (раствор В). Мембраны ФСII получали, как описано ранее [21], замораживали в жидком азоте и хранили при –30 ° C до использования. Все процедуры проводились в темноте при безопасном зеленом освещении. Хлорофилл определяли в 80% ацетоновом экстракте на спектрофотометре Hitachi U-2000 (Япония).
Освещение тилакоидов и мембран ФСII
Тилакоиды или мембраны ФСII (0,1 мг хлорофилла мл –1 ) помещали в прозрачные пластиковые пробирки объемом 0,5 мл и инкубировали при освещении белым светом (интенсивность света 100–1000 мкмоль фотонов м – 2 с −1 ) в течение указанных периодов времени в водяной бане с термостатом, установленной на 20 ° C или 30 ° C. Инкубацию прекращали переносом образцов из микропробирок в ледяную баню в темноте.
Анализ перекисного окисления липидов
Перекисное окисление липидов измеряли с помощью анализа TBARS или флуоресцентного зонда, разработанного для мониторинга перекиси липидов. Для анализа TBARS мы использовали набор для анализа малонового диальдегида NWLSS (Northwest Life Science, США). Этот анализ основан на реакции MDA с TBA. Количество МДА оценивали по оптической плотности при 532 нм комплекса ТВА-МДА в мембранах тилакоидов и ФСII с помощью спектрофотометра Hitachi U-3900 (Япония). Поглощение при 600 нм вычитали из поглощения при 532 нм, чтобы исключить вклад неспецифического поглощения.Флуорометрический анализ перекиси липидов проводили согласно Хоробрых и др. [23]. Зонд флуоресценции 2- (4-дифенилфосфанилфенил) -9- (1-гексилгептил) антра [1,1,9-def, 6,5,10-d′e′f ′] диизохинолин-1, 3,8,10-тетраон (Spy-LHP) был приобретен в Додзиндо, Япония. Spy-LHP растворяли в этаноле в концентрации 3 мкМ и инкубировали при 37 ° C в течение 15 мин. Флуоресценцию измеряли на флуоресцентном спектрофотометре Hitachi F-2500. Длины волн возбуждения и испускания составляли 524 нм и 538 нм соответственно.
Обработка тилакоидов и мембран PSII липоксигеназой
LOX из сои (Glycine max) была закуплена у Sigma (США). Если не указано иное, раствор LOX (1 мг LOX мл –1 ) добавляли к тилакоидам или мембранам PSII, суспендированным в растворе B, который содержал 0,1 мг хлорофилла на мл -1 , чтобы получить 0,1–0,5 мг LOX мл –1 . Суспензии инкубировали при 20 или 30 ° C в темноте в течение 30 мин.
Получение малонового диальдегида и обработка тилакоидов и мембран PSII малоновым диальдегидом.
MDA получали кислотным гидролизом 1,1,3,3-тетраметоксипропана при ph 2 при 40 ° C в течение 2 часов.После нейтрализации NaOH концентрацию МДА определяли по УФ-поглощению при 267 нм, используя молярный коэффициент экстинкции 3,42 × 10 4 M -1 см -1.
[48]. MDA добавляли к тилакоидам или мембранам PSII до конечной концентрации 100 или 500 мкМ, и все суспензии инкубировали при 20 ° C или 30 ° C в темноте в течение 60 мин.
Додецилсульфат натрия / мочевина-полиакриламидный гель-электрофорез и вестерн-блот-анализ.
SDS / мочевина-полиакриламидный гель-электрофорез (ПААГ) и вестерн-блот-анализ проводили, как описано ранее [47].Концентрации акриламида в складывающем и разделяющем гелях составляли 5% (мас. / Об.) И 12,5% (мас. / Об.), Соответственно. В каждую полосу геля были включены тилакоиды или мембраны ФСII, эквивалентные 10 мкг хлорофилла. Антитело против DE-петли белка D1 использовали для обнаружения продуктов расщепления и агрегации белка D1 после воздействия на образцы чрезмерного света или после инкубации с LOX. В качестве вторичного антитела использовали конъюгированное с пероксидазой хрена антитело против кролика или антитело против курицы (Bio-Rad, Япония).Антитела против светособирающих хлорофилл-белковых субъединиц арабидопсиса PSII (Lhcb1-6) и LOX арабидопсиса были приобретены у AgriSera (Швеция). Антитело против MDA было приобретено в Nichiyu, Япония. Иммуно-декорированные полосы детектировали с помощью флюорографии с усиленной хемилюминесценцией (ECL) (Amersham, Япония).
Определение окисления белка
Окисление белка измеряли согласно методу, описанному ранее [21]. Содержание карбонила в белке измеряли с помощью набора для определения окисления белков Oxi-Blot (Chemicon International, США).Образцы белка (5 мкг / дорожка) дериватизировали 2,4-динитрофенилгидразином, анализировали 12,5% акриламидом / SDS-PAGE и наносили электроблоттинг на поливинилидендифторидные мембраны (Millipore, Япония). Дериватизированные белки последовательно взаимодействовали с кроличьими анти-DNP и конъюгированными с пероксидазой хрена козьими антителами против кроличьего IgG и визуализировали с помощью ECL.
Измерение активности фотосистемы II.
Флуоресценцию хлорофилла Fv / Fm контролировали с помощью Mini-PAM (Walz, Германия) при 20 ° C.Тилакоиды или мембраны ФСII, эквивалентные 0,1 мг Хл / мл -1 , суспендировали в растворе В. Для анализа влияния LOX на активность ФСII образцы мембран инкубировали в реакционной смеси, содержащей 0,4 М сахарозы, 50 мМ. Hepes-KOH (pH 7,0), 10 мМ NaCl, 5 мМ MgCl 2 . Образцы были адаптированы к темноте не менее 30 мин на льду.
Электронный парамагнитный резонанс Спектроскопия с захватом спиновых ловушек
Для обнаружения 1 O 2 использовали соединение TMP (Sigma) с гидрофильной спиновой ловушкой.Окисление диамагнитного TMPD 1 O 2 дает парамагнитный сигнал TEMPONE EPR [49]. Перед использованием TMPD дважды очищали вакуумной перегонкой, чтобы исключить сигнал TEMPONE EPR из-за примесей в спиновой ловушке. Перед обработкой сильным светом к мембранам ФСII добавляли 50 мМ TMPD (500 мкг хлорофилла, мл –1 ) в 40 мМ Mes (pH 6,5). Обработку сильным светом проводили при непрерывном осторожном перемешивании непрерывным белым светом (100–1000 мкмоль фотонов м –2 с –1 ) с использованием галогенной лампы со световодом (Schott KL 1500, Schott AG, Mainz, Германия).Для обработки LOX мембраны PSII (500 мкг хлорофилла на мл –1 ) в 25 мМ фосфатном буфере (pH 7) инкубировали с LOX (0,1–0,5 мг мл –1 ) при 30 ° C в присутствии 50 мМ TMPD. Инкубацию проводили в полной темноте при непрерывном осторожном перемешивании. После обработки светом или LOX образец центрифугировали при 5000 × g в течение 3 минут для отделения TEMPONE от мембран PSII. Разделение двух фаз проводили, чтобы избежать восстановления TEMPONE неспецифическим восстанавливающим компонентом в мембранах PSII.После центрифугирования верхнюю фазу (TEMPONE) переносили в стеклянную капиллярную трубку (Blaubrand® intraMARK, Brand, Германия), а нижнюю фазу (мембраны PSII) отбрасывали. Чтобы оценить количество спинов, захваченных в полярной фазе, спектры TEMPONE EPR были измерены с использованием сверхчистого TEMPONE (Alexis Biochemicals, Лаузен, Швейцария). Стеклянные капиллярные трубки до использования хранили в жидком азоте. Перед измерениями капиллярную трубку отделяли от жидкого азота и снимали спектры спиновых ловушек ЭПР при комнатной температуре с использованием спектрометра ЭПР MiniScope MS200 (Magnettech GmbH, Германия).Спектр ЭПР был получен как первое производное сигнала поглощения ЭПР. Условия ЭПР были следующие: мощность микроволн 10 мВт; амплитуда модуляции 1 Гс; частота модуляции 100 кГц; ширина развертки 100 г; и скорость сканирования 1,62 Гс –1 .
.

