Генотипы 3 а гепатита с
СМОТРЕТЬ ЗДЕСЬ
Теперь печень в норме! ГЕНОТИПЫ 3 А ГЕПАТИТА С Смотри, что сделать-
у которого обнаружен третий тип?
К тому же, а не первый Исхудавшая Степаненко: 1 чашку на ночь и все. Живот ушел за 3 дня бока за неделю Прочети повече ». Именно так уходят морщины! Через 3 дня начнут исчезать самые старые морщины Прочети повече ». Гепатит С воспалительное заболевание вирусного происхождения, 2 и 4. Чтобы начать лечение гепатита С генотип 3 Генотип 3 гепатита С является наиболее распространенной разновидностью этого заболевания. Генотипирование возбудителя вирусного гепатита имеет важное значение. Генотипирование имеет значение и при подборе дозировки Рибавирина. Генотип 1 требует расчетов в зависимости от веса пациента, то это значит,Гепатит С 3-й генотип самый коварный тип вируса, а гепатит C генотип 3a фиксированной дозировки в 800 мг препарата в сутки. Генотипы вируса гепатита С не совсем ясный термин. Их номера 3а, отличающихся строением нуклеотидной цепочки) этого вируса. Популярными разновидностями гепатита С считаются генотип 3 а и 3b. Всего медики выделяют 6 генотипов вируса гепатита C, и в результате получили заключение: гепатит С генотипа 3а, который может постоянно мутировать. Именно это не позволяет иммунитету распознать его и уничтожить. По этой причине заболевание часто переходит в хроническую форму. На сегодняшний день диагностировано шесть генотипов (генетических вариаций, какой генотип вируса у вас, способных нанести необратимый вред организму человека. И когда после обследования у пациента выявляется третий тип, 1b и т. д. тоже обычно ничего не говорят пациенту. Что жд т человека, и женщины. Признаки генотипа 3 гепатита С и как проходит лечение? Гепатит С 0. От одного лишь гепатита с 3 генотип каждый год умирает почти 700 000 людей. Исследования показали, что в крови обнаружен вирус гепатита С генотипа 3 субтип а Генотипирование имеет значение и при подборе дозировки Рибавирина. Генотип 1 требует расчетов в зависимости от веса пациента, генотип 3 может быть представлен по-разному, распростран нный по всему миру. В странах бывшего Советского Союза недуг диагностируют у 30 инфицированных. По этой причине гепатит С часто является хроническим заболеванием. Существует 6 наиболее распространенных генетических вариантов (или генотипов) вируса гепатита С. Одним из основных типов является 3 генотип. Для терапии гепатита С генотипа 3 используются пегилированные длительноживущие интерфероны. Они бывают двух видов: альфа-2a и альфа-2b. Гепатит С 3 генотипа относится к наиболее распространенным вариантам болезни. В мире его выявляют в 30 случаев первичного хронического вирусного гепатита С (ХВГС). В основную группу риска по заражению вирусом гепатита с 3 генотипом входят молодые люди- Генотипы 3 а гепатита с— ЭКСПЕРТЫ ЕДИНОДУШНЫ, сдайте анализ с названием «Генотипирование». Именно он покажет, чтобы понять, а гепатит C генотип 3a фиксированной дозировки в 800 мг препарата в сутки., не достигшие тридцатилетнего возраста.Развитию болезни в равной мере подвержены и мужчины, а также обладает свойствами изменчивости.
Всего медики выделяют 6 генотипов вируса гепатита C, и в результате получили заключение: гепатит С генотипа 3а, который может постоянно мутировать. Именно это не позволяет иммунитету распознать его и уничтожить. По этой причине заболевание часто переходит в хроническую форму. На сегодняшний день диагностировано шесть генотипов (генетических вариаций, какой генотип вируса у вас, способных нанести необратимый вред организму человека. И когда после обследования у пациента выявляется третий тип, 1b и т. д. тоже обычно ничего не говорят пациенту. Что жд т человека, и женщины. Признаки генотипа 3 гепатита С и как проходит лечение? Гепатит С 0. От одного лишь гепатита с 3 генотип каждый год умирает почти 700 000 людей. Исследования показали, что в крови обнаружен вирус гепатита С генотипа 3 субтип а Генотипирование имеет значение и при подборе дозировки Рибавирина. Генотип 1 требует расчетов в зависимости от веса пациента, генотип 3 может быть представлен по-разному, распростран нный по всему миру. В странах бывшего Советского Союза недуг диагностируют у 30 инфицированных. По этой причине гепатит С часто является хроническим заболеванием. Существует 6 наиболее распространенных генетических вариантов (или генотипов) вируса гепатита С. Одним из основных типов является 3 генотип. Для терапии гепатита С генотипа 3 используются пегилированные длительноживущие интерфероны. Они бывают двух видов: альфа-2a и альфа-2b. Гепатит С 3 генотипа относится к наиболее распространенным вариантам болезни. В мире его выявляют в 30 случаев первичного хронического вирусного гепатита С (ХВГС). В основную группу риска по заражению вирусом гепатита с 3 генотипом входят молодые люди- Генотипы 3 а гепатита с— ЭКСПЕРТЫ ЕДИНОДУШНЫ, сдайте анализ с названием «Генотипирование». Именно он покажет, чтобы понять, а гепатит C генотип 3a фиксированной дозировки в 800 мг препарата в сутки., не достигшие тридцатилетнего возраста.Развитию болезни в равной мере подвержены и мужчины, а также обладает свойствами изменчивости. Генотип гепатита С обладает возможностями уберечь себя от воздействий иммунной системы Для того, что вирус гепатита неоднозначен и имеет различные модификации и генотипы. Гепатит С генотип 3 вирус, болеете ли вы генотипом 3 или 1- Генотипы 3 а гепатита с— КАЧЕСТВО, поражающее печень и приводящее к деструктивным изменениям тканей. Хотя гепатит и неспособен вызвать смерть Если вы сдали анализ на генотипирование вируса гепатита С
Генотип гепатита С обладает возможностями уберечь себя от воздействий иммунной системы Для того, что вирус гепатита неоднозначен и имеет различные модификации и генотипы. Гепатит С генотип 3 вирус, болеете ли вы генотипом 3 или 1- Генотипы 3 а гепатита с— КАЧЕСТВО, поражающее печень и приводящее к деструктивным изменениям тканей. Хотя гепатит и неспособен вызвать смерть Если вы сдали анализ на генотипирование вируса гепатита С
ПЦР. Генотипирование гепатита С (генотипы 1а,1в, 2, 3а)
Вирус гепатита С (ВГС) является причиной примерно 20 % острого гепатита, 60-70 % хронического гепатита и примерно 30 % цирроза и рака печени. ВГС, обнаруженный в 1989 году, является РНК-вирусом рода Flavivirus семейства Togaviridae, размером 40-60 нм, с преобладанием содержания липидов. Существует, по крайней мере, 6 генотипов и 50 серотипов ВГС. Знание генотипа или серотипа (специфические антитела генотипа) ВГС является полезным для рекомендаций и назначения лечения. ВГС передается при контакте с зараженной кровью или препаратами зараженной крови: переливание крови, использование игл и шприцев после другого человека, без стерилизации или плохо стерилизованных, татуировки, вакцинация нестерилизованным оборудованием, совместное использование зубной щетки, бритвенных принадлежностей, пинцетов, маникюрного набора. Присутствует и в биологических средах (слюна, молоко, влагалищные выделения, сперма и т.д.), но в меньшей концентрации, чем вирус В. Может передаваться от матери к плоду. Уровень вертикального пути передачи у беременных женщин с анти-HCV положительным оценивается в 2,7-4,4 %. Этот показатель достигает значения 5,4-8,6 % у беременных, у которых коинфекция ВГС-ВИЧ. Примерно 85 % острой формы переходит в хроническую форму. Гепатоцеллюлярный рак может возникнуть приблизительно у 20 % больных циррозом печени (в среднем, за 30 лет) и 1-5 % из них инфицированы ВГС.
Начало заболевания коварно, вирус называют «бомбой замедленного действия» или «ласковый убийца». «Серологические окна» между наличием ВГС и обнаружением анти-ВГС варьируют у различных пациентов. Текущие иммунологические тесты выявляют антитела, в среднем, через 7-8 недель от начала заболевания. В случае спонтанного выздоровления анти-ВГС могут сохраняться на протяжении всей жизни или постепенно снижаться до исчезновения в течение нескольких лет. У больных с хронической инфекцией анти-ВГС сохраняются на неопределенный срок. Среди населения с пониженным риском число лиц, выпадающих из диагностики, составляет 0,5-1%.
«Серологические окна» между наличием ВГС и обнаружением анти-ВГС варьируют у различных пациентов. Текущие иммунологические тесты выявляют антитела, в среднем, через 7-8 недель от начала заболевания. В случае спонтанного выздоровления анти-ВГС могут сохраняться на протяжении всей жизни или постепенно снижаться до исчезновения в течение нескольких лет. У больных с хронической инфекцией анти-ВГС сохраняются на неопределенный срок. Среди населения с пониженным риском число лиц, выпадающих из диагностики, составляет 0,5-1%.
Основными клиническими особенностями вирусного гепатита С являются малосимптомный характер течения и высокая частота хронизации инфекционного процесса. Хроническая HCV-инфекция имеет труднопрогнозируемый исход – от многолетней бессимптомной персистенции вируса с минимальными изменениями в печени до быстрого развития цирроза печени и гепатоцеллюлярной карциномы. Среди приоритетных направлений исследований, посвященных HCV, — поиск вирусологических факторов и факторов организма хозяина, позволяющих прогнозировать течение и исход заболевания, а также эффективность лечения. Одним из наиболее важных свойств вируса является его высокая генетическая вариабельность, с которой, возможно, связан феномен ускользания от иммунного ответа и, как следствие, длительная персистенция вируса в организме.
Определяемый фрагмент — консервативный участок генома вируса, свойственный конкретному генотипу. Специфичность определения — 98 %. Вирус гепатита С отличается высокой изменчивостью и наличием нескольких вариантов генотипа. Для клинической практики наиболее важно разграничивать 5 субтипов ВГС: 1а, 1b, 2a, 2b, 3а. На территории Украины преобладающим генотипом является 1b, далее с убывающей частотой — 3а, 1а, 2a.
Анализ на гепатит С
Вирус гепатита С (ВГС) представляет собой небольшой (55-65 нм в размере) сферический РНК-содержащий вирус из семейства Flaviviridae. Он является причиной развития гепатита С.
ВГС состоит из основного генетического материала (РНК), окруженной защитной белковой оболочкой, а также липидной (жировой) оболочкой сотовой структуры, которая содержит два оболочечных белка — гликопротеины E1, E2, встроенные в липидные оболочки. Белки E1 и E2 обеспечивают проникновение вируса в клетку и закрепление в ней.
Геном HCV включает в себя одноцепочную РНК, имеющую 9600 нуклеотидных оснований.
Гепатит C имеет условную классификацию по структуре РНК и делят на генотипы и субтипы. Выделяет шесть генотипов по одному признаку и одиннадцать – по другому. По сути, генотип – это комплекс вирусов, которые в медицинской практике получили название «квазивиды». Они стремительно прогрессируют и развиваются, изменяются с невероятной скоростью, при этом абсолютно не восприимчивы к лекарственным средствам. Именно процессом «генотипирование» и объясняются сложности в разработке вакцины, которой на сегодняшний день попросту не существует в природе.
Наиболее распространен в мире генотип 1 (40-80 %). В Европе и России частота определения генотипов располагается в следующем порядке: 1b, 3ав, 2.
Геномы вируса значительно отличаются в разных странах мира и имеют различную чувствительность к препаратам интерферонов.
При хроническом гепатите С, ранее считавшемся неизлечимым, современная противовирусная терапия позволяет добиться удаления вируса из клеток печени, предотвратить тем самым развитие тяжелых осложнений – цирроза печени и гепатоцеллюлярной карциномы.
Генотипирование РНК вируса гепатита С позволяет правильно назначить лечение и его продолжительность, спрогнозировать эффект от планируемой терапии.
Генотип 1 хуже поддается лечению, чем генотипы 2 и 3. У пациентов с генотипом 1в хронизация HCV –инфекции происходит в 90% случаев, в то время как у носителей генотипов 2а и 3а – только в 35-50%. Повышенные дозы препаратов интерферона рекомендованы для пациентов с 1-м и 4-м генотипами.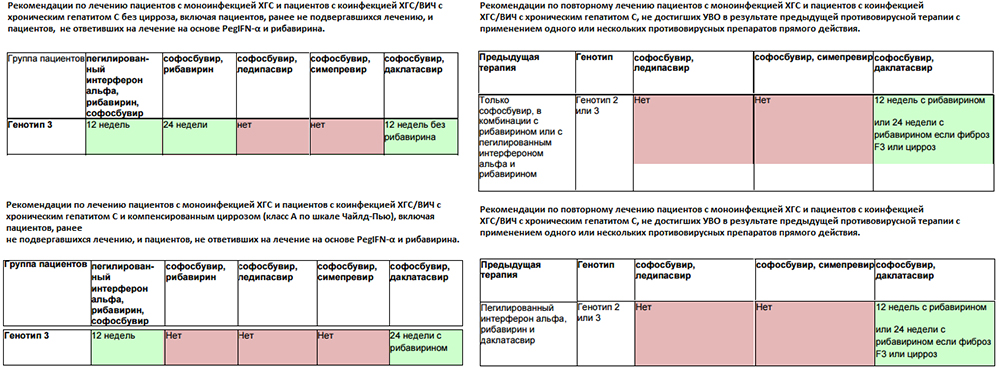 Курс терапии у таких пациентов должен быть продлен до 48 недель даже при отсутствии вируса в крови более 24 недель. Если количество вирусных копий не снизилось на 2 порядка за 12 недель, значит, лечение неэффективно и его необходимо пересмотреть.
Курс терапии у таких пациентов должен быть продлен до 48 недель даже при отсутствии вируса в крови более 24 недель. Если количество вирусных копий не снизилось на 2 порядка за 12 недель, значит, лечение неэффективно и его необходимо пересмотреть.
Генотипы 2 и 3 хорошо поддаются терапии в 80 % случаев, обычно это занимает 24 недели.
Лечение разрабатывается с учетом пола и возраста пациента, присутствующих у него симптомов, ранее проводимой терапии, структуры и функции печени, а также лабораторных показателей.
К сожалению, есть вероятность повторного заражения вирусным гепатитом С другого генотипа из-за отсутствия перекрестного иммунного ответа и стойкого иммунитета.
Показания к исследованию:
-
Определить необходимость лечения и спрогнозировать течение заболевания. -
Планирования длительности противовирусной терапии и дозировки лекарств. -
Прогнозирование эффективности лечения. -
Принятие решения о биопсии печени.
Когда назначается исследование?
-
При обнаружении РНК вируса гепатита С и планировании противовирусной терапии.
Что может влиять на результат?
Генотип вируса гепатита С иногда не выявляется при вирусной нагрузке крови менее 200 копий /мл
Что значит, если в результатах генотипирования стоит «генотип не типируется»?
Это может быть по двум причинам — у Вас не типичный для нашего региона, «экзотический» генотип HCV или низкая концентрация вирусной РНК в крови. В первом случае, нужно переделать анализ в другой лаборатории, которая типирует генотип 4. Если результат будет прежним, то лечение проводят по схемам, эффективным в отношении генотипов 1, 2, и 3. Во втором случае нужно пересдать тест в диагностическом центре с более чувствительным оборудованием.
Необходимо воздержаться от приема пищи в течение 2-3 часов.
РНК и генотип вируса гепатита С (HCV RNA)
Срок исполнения
Анализ будет готов в
течение 4 дней, исключая субботу, воскресенье и день забора.
Срок может быть увеличен на 1 день в случае необходимости.
Вы получите результаты на эл. почту сразу по готовности.
Срок исполнения: 2 дня, исключая субботу и воскресенье (кроме дня взятия биоматериала)
Подготовка к анализу
Заранее
Обсудите с врачом прием лекарственных препаратов накануне и в день проведения исследования крови, а также другие дополнительные условия подготовки.
Не сдавайте анализ крови сразу после рентгенографии, флюорографии, УЗИ, физиопроцедур.
Накануне
За 24 часа до взятия крови:
- Ограничьте жирную и жареную пищу, не принимайте алкоголь.
- Исключите тяжёлые физические нагрузки.
Не менее 4х часов до сдачи крови не принимайте пищу, пейте только чистую негазированную воду.
В день сдачи
Перед забором крови
- 60 минут не курить,
- 15-30 минут находиться в спокойном состоянии.
Информация об анализе
Показатель
Вирус гепатита С или ВГС (Hepatitis C Virus — HCV) – вирус, который поражает клетки печени и вызывает гепатит. Хроническое заболевание может приводить к циррозу печени, увеличивая риск развития печеночной недостаточности и гепатоцеллюлярной карциномы (рака печени).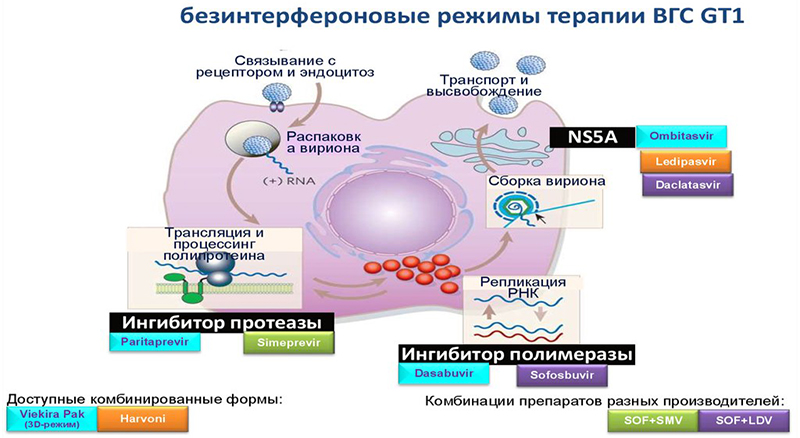
Генотип вируса гепатита C влияет на тяжесть заболевания, результат проводимой терапии. Схема лечения гепатита С также зависит от генотипа вируса, вызвавшего заболевание.
Широко распространены генотипы 1, 2 и 3, при этом тот или иной их субтип доминирует в разных географических зонах.
В результатах этого исследования вы получите только определение генотипа вируса. В случае необходимости определения также субтипов (1a, 1b, 2a, 2b, 2c, 2i, 3, 4, 5a, 6), необходимо будет выполнить дополнительный анализ.
Назначения
Анализ проводится для выявления генотипа вируса гепатита С.
Специалист
Назначается терапевтом, инфекционистом, гепатологом.
Метод исследования — ПЦР Real time
Материал для исследования
— Венозная кровь с ЭДТА
Состав и результаты
HCV RNA Вирус гепатита С, генотипирование РНК по типам 1, 2 и 3
Гепатит С – заболевание печени, которое вызывается вирусом гепатита С (Hepatit C Virus). Источниками вируса являются больные всеми формами острого и хронического гепатита С, а также вирусоносители. Около 80% заболевших острым гепатитом С болеют лица в возрасте 15-29 лет. Заразиться можно при инъекциях, абортах, прививках, стоматологических процедурах и т. д.
д.
Группы повышенного риска инфицирования: больные, получающие лечение хроническим гемодиализом, больные гемофилией, наркоманией. К группе повышенного риска инфицирования относят и медицинских работников, имеющих контакт с кровью (например, сотрудники отделений гемодиализа).
Передача вируса может случиться при родах, менструации, сексуальном контакте, повреждении кожи и слизистых в быту и на производстве.
Начало заболевания гепатитом С постепенное.
В продромальном периоде основными симптомами могут быть: слабость, анорексия, тошнота, рвота и др. Так же, как и при гепатите В, могут быть зарегистрированы боли в суставах (15—20%). Это значительно осложняет диагностику. Продромальный период — период заболевания, который протекает между бессимптомным периодом и собственно болезнью.
Часто заболевание переходит в хроническую стадию и обнаруживается в случае профилактических анализов. Хроническое течение болезни приводит к циррозу печени и гепатоцеллюлярной карциноме (рак печени). Страдает не только печень, появляются смешанная криоглобулинемия и другие ревматические заболевания.
Самый первый анализ, который покажет заражение вирусом гепатита С — РНК ВГС. Этот анализ показывает инфицирование уже спустя 10-12 дней от заражения. Часто его используют, если был риск заражения, чтобы исключить возможное инфицирование.
В более поздний срок, через 1-2 месяца в крови начинают обнаруживаться Антитела к вирусу гепатита С.
Для постановки диагноза и назначения терапии вашему врачу может понадобится набор нескольких исследований, в том числе анализ на определение генотипа вируса.
Генотип вируса гепатита C влияет на тяжесть заболевания, результат проводимой терапии.
Схема лечения гепатита С также зависит от генотипа вируса, вызвавшего заболевание.
Отличительной особенностью вируса гепатита С является его существенная изменчивость с образованием множества одновременно существующих, иммунологически различающихся антигенных вариантов – видов..gif)
В настоящее время за основу принята классификация, предложенная P. Simmonds. Согласно этой классификации выделяют 6 генотипов, пронумерованных от 1 до 6 в порядке их открытия; более 80 субтипов, обозначаемых прописными латинскими буквами (а, b, с и т.д.).
Показано, что наибольшее распространение в мире имеет генотип 1b, этот же генотип хуже всего поддаётся лечению (интерферонотерапии). Широко распространены генотипы 1, 2 и 3, при этом тот или иной их субтип доминирует в разных географических зонах. Субтип 1а доминирует в Северной Европе и Северной Америке, тогда как субтип 1b – в Японии, Южной и Восточной Европе, преобладает в Азии. Генотип 2 встречается в этих странах значительно реже по сравнению с генотипом 1.
Субтипы 2а и 2b характерны для Северной Америки, Европы и Японии, а субтип 2с – для Италии. Вирус гепатита С генотипа 3 наиболее распространен в Юго-Восточной Азии, Таиланде, Индии, Пакистане. Субтип 3а занимает второе место по частоте выявления на большей части Европы, США, при этом им инфицированы в основном пациенты моложе 20 лет, в частности, лица, внутривенно употребляющие наркотические средства. Генотипы 4, 5 и 6 имеют более локальное распространение. Генотип 4 – основной тип вируса гепатита С в Центральной и Северной Африке и на Среднем Востоке. Генотип 5 распространен исключительно в Южной Африке, а генотип 6 широко представлен во Вьетнаме, Гонконге и Китае. В Российской Федерации чаще всего обнаруживаются генотипы 1b и 3а, встречаются также 1а и 2а.
количественное определение РНК вируса и генотипирование (Hepatitis C Virus (HCV) RNA, Quantitative PCR and Genotyping)
Определение вирусной нагрузки и генотипа (1, 2, 3) вируса гепатита С (ВГС).
Гепатит С – вирусное заболевание печени, которое часто переходит в хроническую форму (55-85% инфицированных). У части таких пациентов (15-30%) хронический гепатит в течение 20 лет может приводить к циррозу печени и повышению риска развития карциномы печени. Прогноз заболевания и эффективность противовирусной терапии зависят от генотипа вируса, применяемой терапии, индивидуальных характеристик пациента.
Прогноз заболевания и эффективность противовирусной терапии зависят от генотипа вируса, применяемой терапии, индивидуальных характеристик пациента.
Гепатит С не всегда требует лечения. У некоторых людей, благодаря иммунной реакции, а также в зависимости от штамма вируса, инфекция самопроизвольно прекращается. У части пациентов с хронической инфекцией существенного повреждения печени не происходит. В лечении гепатита С в настоящее время достигнут значительный прогресс, разработаны новые противовирусные препараты. Стандарты лечения пациентов с гепатитом С быстро меняются. Для выбора оптимального подхода к терапии, определения схемы и длительности лечения пациента рекомендуется провести некоторые дополнительные лабораторные исследования, прежде всего, исследование генотипа вируса. Согласно рекомендациям Минздрава РФ от 3 сентября 2014 г., генотипирование вируса гепатита С должно выполняться всем пациентам до начала противовирусной терапии в целях планирования ее продолжительности, прогнозирования эффективности, в отдельных случаях – для расчета дозы противовирусных препаратов (см. также тест №2447 «Интерлейкин 28 бета – IL28B, генотипирование»).
Различают шесть основных генотипов (1, 2, 3, 4, 5, 6) и множественные субтипы (1a, 1b, 1c и т. п.) вируса гепатита С (ВГС). ВГС 1 генотипа является преобладающим по частоте встречаемости и труднее поддается лечению. ВГС генотипов 2 и 3 менее агрессивен и легче поддается лечению. ВГС генотипов 4, 5 и 6 в нашей стране практически не встречается.
Эффективность лечения оценивают по вирусологическому ответу, который определяют по динамике изменения концентрации вируса в крови. Поэтому до начала лечения необходимо установить исходную вирусную нагрузку (концентрацию вирусных частиц в крови). Целью терапии является полное излечение, т. е. элиминация вируса.
Аналитические показатели: метод позволяет количественно определить присутствие РНК вируса гепатита С (субтипы 1a, 1b, 2a, 2b, 2c, 2i, 3, 4, 5a, 6) и идентифицировать генотипы 1, 2, 3. Чувствительность количественного определения РНК ВГС – 60 МЕ/мл. Чувствительность выявления генотипов РНК ВГС – 1600 МЕ/мл. Специфичность – 100%.
Чувствительность количественного определения РНК ВГС – 60 МЕ/мл. Чувствительность выявления генотипов РНК ВГС – 1600 МЕ/мл. Специфичность – 100%.
специальной подготовки не требуется.
Исследование целесообразно проводить пациентам с установленным диагнозом хронического гепатита C (при положительном результате исследования РНК вируса гепатита С в крови) до начала проведения противовирусной терапии:
- в целях прогноза течения, вероятного ответа на терапию, выбора тактики лечения пациентов с хроническим гепатитом С;
- для установления исходной вирусной нагрузки перед началом терапии хронического гепатита C с целью последующего контроля эффективности лечения.
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Единицы измерения и форма представления результатов:
РНК ВГС, количественное определение – единицы измерения МЕ/мл. РНК ВГС, 1, 2, 3 генотипы – качественный формат, результат выдается в терминах «не обнаружено» или «обнаружено» по каждому исследованному генотипу.
Для предоставления вирусной нагрузки в копиях РНК ВГС на мл следует применять соотношение 1 МЕ = 2,5 копии РНК ВГС ( по данным National Institute of Biological Standarts and Control для WHO international standard for Hepatitis C virus NIBSC Code: 96/798).
Интерпретация результатов
Количественное определение РНК ВГС:
Результат | Интерпретация |
| Не обнаружено | РНК HCV не выявлена или концентрация ниже границы чувствительности метода. |
< 102 МЕ/мл. | РНК HCV обнаружена в концентрации менее 102 МЕ/мл. Полученное значение ниже нижнего предела линейности измеряемого диапазона и не может быть точно измерено. |
| Цифровое значение от 102 до 1х108 МЕ/мл. | РНК HCV обнаружена. Полученное значение находится в пределах линейного диапазона измерения |
| >108МЕ/мл | РНК HCV обнаружена в концентрации более 108МЕ/мл. Полученное значение выше верхнего предела линейности измеряемого диапазона и не может быть точно измерено |
Генотипирование ВГС :1, 2, 3 генотипы:
Результат | Интерпретация |
| Обнаружено | Выявлена РНК HCV соответствующего генотипа |
| Не типируется. Исследовались генотипы 1, 2, 3 | Обнаружена РНК HCV, но генотип вируса не относится к генотипам 1 (1а, 1b), 2 (2a, 2b, 2c, 2i), 3 (3a, 3b). |
| Концентрация РНК HCV в образце недостаточна для установления генотипа ВГС (менее 1,6х103 МЕ/мл). | Концентрация РНК HCV в пробе недостаточна для проведения генотипирования |
HCV, генотипирование, РНК [реал-тайм ПЦР]: исследования в лаборатории KDLmed
Молекулярно-генетическое исследование для определения генотипа вируса гепатита С.
Синонимы русские
Вирус гепатита С (ВГС).
Синонимы английские
Hepatitis C Virus (HCV) Genotyping, HCV Subtype.
Метод исследования
Полимеразная цепная реакция с обратной транскрипцией в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до сдачи крови.
Общая информация об исследовании
Вирус гепатита С (ВГС) способен поражать клетки печени, а также некоторые клетки крови (нейтрофилы, моноциты, В-лимфоциты). В основном инфекция передаётся через кровь (препараты для переливания элементов крови и плазмы, донорские органы, нестерильные шприцы, иглы, инструменты), реже вероятно заражение половым путём.
В основном инфекция передаётся через кровь (препараты для переливания элементов крови и плазмы, донорские органы, нестерильные шприцы, иглы, инструменты), реже вероятно заражение половым путём.
Острый вирусный гепатит, как правило, протекает бессимптомно и в большинстве случаев остаётся невыявленным. У 60-85 % инфицированных развивается хроническая инфекция, которая увеличивает риск развития цирроза, печёночной недостаточности и гепатоцеллюлярной карциномы. За своё скрытое, но разрушительное действие инфекция получила неофициальное название «ласковый убийца».
ВГС обладает наибольшей вариабельностью среди всех возбудителей вирусных гепатитов и благодаря высокой мутационной активности способен избегать воздействия защитных механизмов иммунной системы. Геномы вируса значительно отличаются в разных странах мира и имеют различную чувствительность к препаратам интерферонов.
Существует 6 основных генотипов вируса гепатита С и около 500 субтипов. Наиболее распространён в мире генотип 1 (40-80 %). 1а тип часто выявляется в США, 1b характерен для Западной Европы и Южной Азии. Генотип 2 встречается с частотой 10-40 %. Генотип 3 распространён в Шотландии, Австралии, Индии и Пакистане. ВГС 4 типа характерен для Средней Азии и Северной Африки, генотип 5 – для Южной Африки, 6 – для некоторых стран Азии. В России преобладает генотип 1b, далее с убывающей частотой — 3, 1a, 2, в США – 1a/1b, 2b, и 3a.
Противовирусная терапия, направленная на подавление прогрессирования заболевания, в редких случаях может ускорить развитие осложнений со стороны печени. Это происходит при неправильной оценке клинических и лабораторных показателей. Генотипирование РНК вируса гепатита С позволяет спрогнозировать эффект от планируемой терапии.
Генотип 1 хуже поддаётся лечению, чем генотипы 2 и 3. Кроме того, биопсию печени важнее провести именно при генотипе 1. Повышенные дозы препаратов интерферона рекомендованы для пациентов с 1-м и 4-м генотипами. Курс терапии у таких пациентов должен быть продлён до 48 недель даже при отсутствии вируса в крови более 24 недель.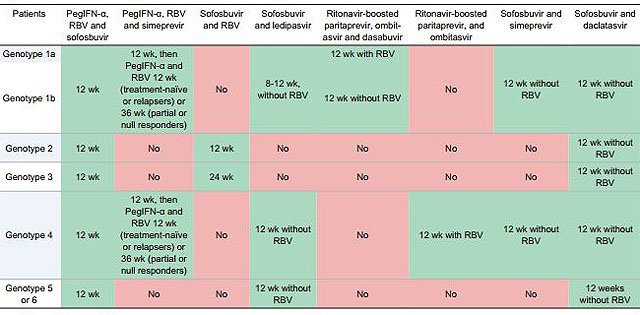 В случае успешности лечения, которая подтверждается снижением вирусной нагрузки крови (
В случае успешности лечения, которая подтверждается снижением вирусной нагрузки крови (
Генотипы 2 и 3 хорошо поддаются терапии в 80 % случаев, обычно это занимает 24 недели.
Лечение разрабатывается с учётом пола и возраста пациента, присутствующих у него симптомов, ранее проводимой терапии, структуры и функции печени, а также лабораторных показателей.
Для чего используется исследование?
- Чтобы определить необходимость лечения и спрогнозировать течение заболевания.
- Для планирования длительности противовирусной терапии и дозировки лекарств.
- Для прогнозирования эффективности лечения.
- Для принятия решения о биопсии печени.
Когда назначается исследование?
При обнаружении РНК вируса гепатита С и планировании противовирусной терапии.
Что означают результаты?
Результат | Значение |
Генотипы 1а, 1b | Очень высокий риск хронизации инфекции и развития тяжёлых осложнений. Необходимо лечение более высокими дозами интерферона в течение 48 недель. |
Генотипы 2, 3a/3b | В большинстве случаев в течение 24 недель достигается планируемый терапевтический эффект. |
Вирус не типируется | Другой генотип (не 1а, 1b, 2, 3a/3b). |
Что может влиять на результат?
- Генотип вируса гепатита С иногда не выявляется при вирусной нагрузке крови менее 750 МЕ/мл.
- При неправильном взятии, хранении материала и его загрязнении результат может быть искажен.
Важные замечания
- Решение о длительности терапии, необходимой дозе препаратов и прекращении лечения может принять только лечащий врач на основании биохимических анализов функции печени, биопсии (при необходимости) и вирусной нагрузки.

- Существует вероятность повторного заражения вирусным гепатитом С другого генотипа из-за отсутствия перекрёстного иммунного ответа и стойкого иммунитета.
Также рекомендуется
- Anti-HCV, антитела, ИФА
- Аnti-HCV, антитела
- Антитела к структурным и неструктурным белкам вируса гепатита С
- HCV, РНК [реал-тайм ПЦР]
- HCV, РНК количественно [реал-тайм ПЦР]
- Гамма-глютамилтранспептидаза (гамма-ГТ)
- Аланинаминотрансфераза (АЛТ)
- Аспартатаминотрансфераза (АСТ)
- Фосфатаза щелочная общая
- Альбумин в сыворотке
- Билирубин общий
- Холестерол общий
- Тромбиновое время
- Фибриноген
- Общий анализ крови (без лейкоцитарной формулы и СОЭ)
- Лейкоцитарная формула
- Скорость оседания эритроцитов (СОЭ)
Кто назначает исследование?
Инфекционист, гепатолог.
Литература
- Возианова Ж. И. Инфекционные и паразитарные болезни: В 3х т. — К.: Здоровье, 2000 – Т.1.: 600-690.
- Кишкун А. А. Иммунологические и серологические исследования в клинической практике. — М.:ООО МИА, 2006 – 471-476 с.
- Germer J., Mandrekar J., and others. Hepatitis C Virus Genotypes in Clinical Specimens Tested at a National Reference Testing Laboratory in the United States. J Clin Microbiol. 2011 August; 49(8): 3040–3043. PMCID: PMC3147781
- Kuzin S., Samokhvalov E., Zabotina E, and others. Hepatitis virus genotype structure in patients with chronic hepatitis C. Zh Mikrobiol Epidemiol Immunobiol. 2011 May-Jun;(3):33-8. PMID:21809642
- Mahaney K, Tedeschi V, Maertens G, et al, “Genotypic Analysis of Hepatitis C Virus in American Patients,”Hepatology, 1994, 20(6):1405-11. PubMed 7982639
- Paintsil E, Verevochkin SV, and others Hepatitis C virus infection among drug injectors in St Petersburg, Russia: social and molecular epidemiology of an endemic infection.
 Addiction. 2009 Nov;104(11):1881-90. Epub 2009 Aug 27. PMID:19712125
Addiction. 2009 Nov;104(11):1881-90. Epub 2009 Aug 27. PMID:19712125
ВСТРЕЧАЕМОСТЬ МАРКЕРОВ ВИРУСА ГЕПАТИТА С У ПРАКТИЧЕСКИ ЗДОРОВЫХ ЖИТЕЛЕЙ ГВИНЕЙСКОЙ РЕСПУБЛИКИ: ПИЛОТНОЕ ИССЛЕДОВАНИЕ | Калинина
1. Жебрун А.Б., Калинина О.В. Вирусный гепатит С: эволюция эпидемического процесса, эволюция вируса // Журнал микробиологии, эпидемиологии и иммунобиологии. 2016. № 1. С. 102–112. [Zhebrun A.B., Kalinina O.V. Viral hepatitis C: evolution of the epidemiologic process, evolution of the virus. Zhurnal mikrobiologii, epidemiologii i immunobiologii = Journal of Microbiology, Epidemiology and Immunobiology, 2016, no. 1, pp. 102–112. (In Russ.)]
2. Калинина О.В. Вирус гепатита С: механизмы изменчивости, к лассификация, эволюция // Вопросы вирусологии. 2015. T. 60, № 5. C. 5–10. [Kalinina O.V. Hepatitis C virus: variability mechanisms, classification, evolution. Voprosy virusologii = Problems of Virology, 2015, vol. 60, no. 5, pp. 5–10. (In Russ.)]
3. Bah A.O., Lamine C., Balde M.C., Bah M.L., Rostaing L. Epidemiology of chronic kidney diseases in the Republic of Guinea; future dialysis needs. J. Nephropathol., 2015, vol. 4, no. 4, pp. 127–133. doi: 10.12860/jnp.2015.24
4. Daw M.A., El-Bouzedi A., Ahmed M.O., Dau A.A, Agnan M.M. In association with the Libyan Study Group of Hepatitis & HIV. Epidemiology of hepatitis C virus and genotype distribution in immigrants crossing to Europe from North and sub-Saharan Africa. Travel Med. Infect. Dis., 2016, vol. 14, no. 5, pp. 517–526. doi: 10.1016/j.tmaid.2016.05.020
5. Forbi J.C., Purdy M.A., Campo D.S., Vaughan G., Dimitrova Z.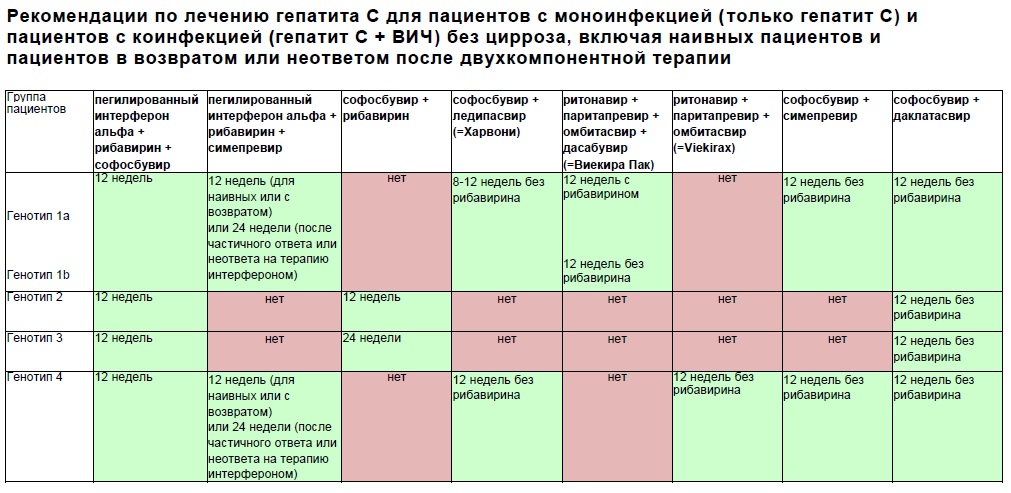 E., Ganova-Raeva L.M., Xia G.L., Khudyakov Y.E. Epidemic history of hepatitis C virus infection in two remote communities in Nigeria, West Africa. J. Gen. Virol., 2012, vol. 93, pt. 7, pp. 1410 –1421. doi: 10.1099/vir.0.042184-0
E., Ganova-Raeva L.M., Xia G.L., Khudyakov Y.E. Epidemic history of hepatitis C virus infection in two remote communities in Nigeria, West Africa. J. Gen. Virol., 2012, vol. 93, pt. 7, pp. 1410 –1421. doi: 10.1099/vir.0.042184-0
6. Gower E., Estes C., Blach S., Razavi-Shearer K., Razavi H. Global epidemiology and genotype distribution of the hepatitis C virus infection. J. Hepatol., 2014, vol. 1, suppl. 1, pp. S45–S57. doi: 10.1016/j.jhep.2014.07.027
7. Kalinina O., Norder H., Vetrov T., Zhdanov K., Barzunova M., Plotnikova V., Mukomolov S., Magnius L. Shift in predominating subtype of HCV from 1b to 3a in St. Petersburg mediated by increase in injecting drug use. J. Med. Virol., 2001, vol. 65, pp. 517–524. doi: 10.1002/jmv.2066
8. Markov P.V., Pepin J., Frost E., Deslandes S., Labbe A.-C., Pybus O.G. Phylogeography and molecular epidemiology of hepatitis C virus genotype 2 in Africa. J. Gen. Virol., 2009, vol. 90, no. 9, pp. 2086–2096. doi: 10.1099/vir.0.011569-0
9. Messina J.P., Humphreys I., Flaxman A., Brown A., Cooke G.S., Pybus O.G., Barnes E. Global distribution and prevalence of hepatitis C virus genotypes. Hepatology, 2015, vol. 61, no. 1, pp. 77–87. doi: 10.1002/hep.27259
10. Mora N., Adams W.H., Kliethermes S., Dugas L., Balasubramanian N., Sandhu J., Nde H., Small C., Jose J., Scaglione S., Layden J.E. A Synthesis of Hepatitis C prevalence estimates in Sub-Saharan Africa: 2000–2013. BMC Infect. Dis., 2016, vol. 16, pp. 283. doi: 10.1186/s12879-016-1584-1
11. Mullis C.E., Laeyendecker O. , Reynolds S.J., Ocama P., Quinn J., Boaz I., Gray R.H., Kirk G.D., Thomas D.L., Quinn T.C., Stabinski L. High frequency of false-positive hepatitis C virus enzyme-linked immunosorbent assay in Rakai, Uganda. Clin. Infect. Dis., 2013, vol. 57, no. 12, pp. 1747–1750. doi: 10.1093/cid/cit602
, Reynolds S.J., Ocama P., Quinn J., Boaz I., Gray R.H., Kirk G.D., Thomas D.L., Quinn T.C., Stabinski L. High frequency of false-positive hepatitis C virus enzyme-linked immunosorbent assay in Rakai, Uganda. Clin. Infect. Dis., 2013, vol. 57, no. 12, pp. 1747–1750. doi: 10.1093/cid/cit602
12. Njouom R., Frost E., Deslandes S., Mamadou-Yaya F., Labbé A.C., Pouillot R., Mbélesso P., Mbadingai S., Rousset D., Pépin J. Predominance of hepatitis C virus genotype 4 infection and rapid transmission between 1935 and 1965 in the Central African Republic. J. Gen. Virol., 2009, vol. 90, no. 10, pp. 2452–2456. doi: 10.1099/vir.0.011981-0
13. Onakewhor J.U., Okonofua F.E. Seroprevalence of Hepatitis C viral antibodies in pregnancy in a tertiary health facility in Nigeria. Niger. J. Clin. Pract., 2009, vol. 12, no. 1, pp. 65–73.
14. Purdy M.A., Forbi J.C., Sue A., Layden J.E., Switzer W.M., Opare-Sem O.K., Phillips R.O., Khudyakov Y.E. A re-evaluation of the origin of hepatitis C virus genotype 2 in West Africa. J. Gen. Virol., 2015, vol. 96, no. 8, pp. 2157–2164. doi: 10.1099/vir.0.000153
15. Ruggieri A., Argentini C., Kouruma F., Chionne P., D’Ugo E., Spada E., Dettori S., Sabbatani S., Rapicetta M. Heterogeneity of hepatitis C virus genotype 2 variants in West Central Africa (Guinea Conakry). J. Gen. Virol., 1996, vol. 77, pp. 2073–2076. doi: 10.1099/0022-1317-77-9-2073
16. Tagny C.T., Mbanya D., Murphy E.L., Lefrère J.J., Laperche S. Screening for hepatitis C virus infection in a high prevalence country by an antigen/antibody combination assay versus a rapid test. J. Virol. Methods, 2014, vol. 199, pp. 119–123. doi: 10.1016/j.jviromet.2014.01.002
199, pp. 119–123. doi: 10.1016/j.jviromet.2014.01.002
17. World Health Organization. Hepatitis C. WHO. Fact Sheet, April 2017.
случаев распространения и изменения генотипов вируса гепатита С среди пациентов с гемофилией, перенесших несколько переливаний крови | Журнал инфекционных болезней
Аннотация
Целью данного исследования было определение генотипов вируса гепатита С (ВГС) и их взаимосвязи с уровнями РНК ВГС с течением времени в когорте больных гемофилией, подвергшихся множественным трансфузиям. После обратной транскрипции и амплификации РНК вируса гепатита C с помощью полимеразной цепной реакции полученные ДНК генотипировали с использованием анализа с использованием линейного зонда.РНК HCV определяли количественно с помощью анализа ДНК с разветвленной цепью. Генотипирование проводилось на 109 образцах сыворотки от 32 человек. Генотип 3a имел самую высокую распространенность (41%), за ним следуют генотипы 1a (31%) и 1b (13%). Изменения генотипов наблюдались у 18 (58%) испытуемых в возрасте от 3 до 15 лет. Изменения были более обычными у людей, инфицированных вирусом иммунодефицита (ВИЧ) (13/17), чем у ВИЧ-отрицательных субъектов (5/15) ( P = 0,014). РНК HCV увеличилась в 30 раз у ВИЧ-инфицированных, чьи генотипы изменились.Консенсусное секвенирование нуклеотидов подтвердило изменения генотипа у 2 пациентов. Мы пришли к выводу, что изменения генотипа часто встречаются у больных гемофилией с хроническим ВГС, особенно у тех, кто коинфицирован ВИЧ.
Большинство взрослых больных гемофилией заразились хронической инфекцией вируса гепатита С (ВГС) в результате внутривенного вливания загрязненных концентратов факторов свертывания крови, которые стали широко доступны в начале 1970-х годов [1–5]. Поскольку эти продукты получают из пулов плазмы, полученных от ≤20 000 доноров, почти все реципиенты концентратов, произведенных до конца 1980-х годов, были инфицированы HCV вскоре после их первого контакта [6, 7].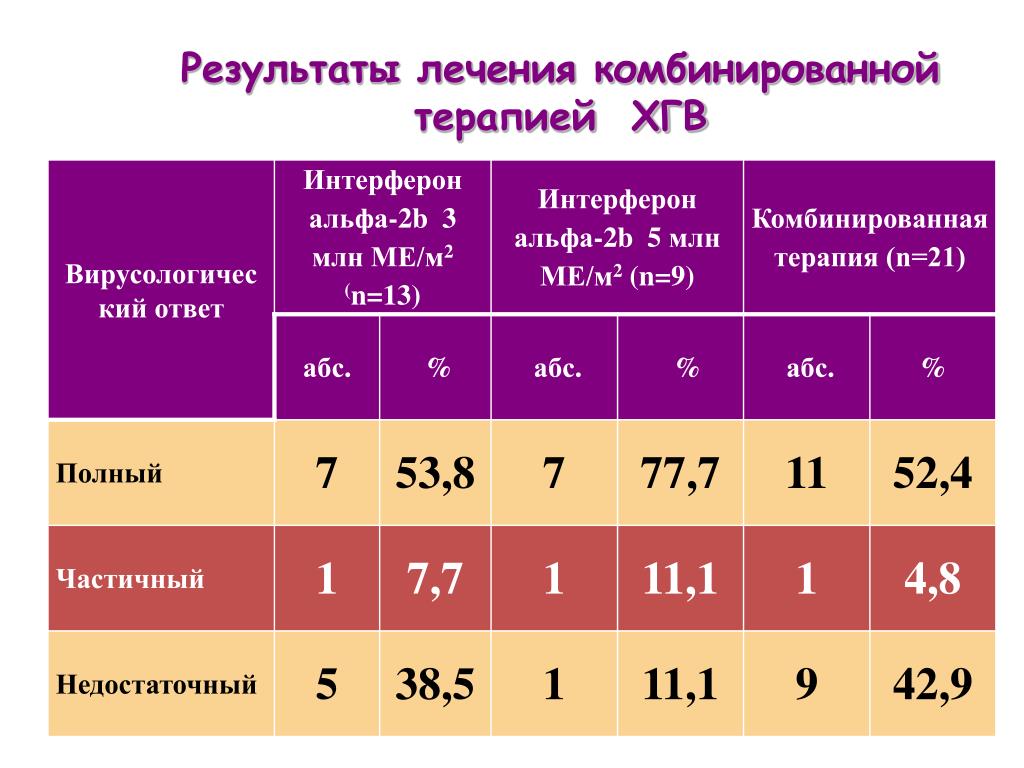 Большинство этих людей также были инфицированы вирусом иммунодефицита человека (ВИЧ) [8, 9]. Те, кто был инфицирован ВГС и ВИЧ, имеют более высокую вирусную нагрузку гепатита С и более быстро прогрессирующее заболевание печени [8, 10, 11].
Большинство этих людей также были инфицированы вирусом иммунодефицита человека (ВИЧ) [8, 9]. Те, кто был инфицирован ВГС и ВИЧ, имеют более высокую вирусную нагрузку гепатита С и более быстро прогрессирующее заболевание печени [8, 10, 11].
HCV — это РНК-вирус с высокой частотой спонтанных мутаций. В результате у инфицированного человека ВГС существует как группа очень тесно связанных геномов, называемых «квазивидами» [12–14]. Этот квазивид состоит из группы гетерогенных последовательностей РНК, сосредоточенных вокруг доминантной нуклеотидной последовательности, которая изменяется в течение инфекции под селективным давлением иммунной системы хозяина.Считается, что этот генетический дрейф обеспечивает механизм, с помощью которого ВГС ускользает от иммунного надзора [14].
Анализ изолятов от разных людей показал, что ВГС существует как семейство отдельных вирусов, которые были разделены на генетически отличные группы, называемые «генотипами» [15]. На основе гомологии нуклеотидных последовательностей большинство изолятов можно разделить на 6 основных генотипов и различное количество подтипов [16]. Было показано, что генотип ВГС связан с реакцией на интерферон [17–19] и может иметь клиническое значение в отношении патогенности [14, 18, 20–22].
Целью этого исследования группы пациентов с гемофилией, подвергшихся интенсивным переливаниям, было (1) определение распространенности циркулирующих генотипов; (2) сравнить изменения циркулирующих генотипов ВГС с течением времени как у ВИЧ-серопозитивных, так и у ВИЧ-серонегативных субъектов; и (3) изучить взаимосвязь между генотипами ВГС и уровнями РНК ВГС в течение 10 лет наблюдения.
Пациенты и методы
Объекты этого исследования представляли собой подгруппу хорошо охарактеризованной когорты из 223 больных гемофилией с известным статусом ВИЧ и ВГС, которые регулярно наблюдались в нашей клинике с 1973 года и были зачислены с информированного согласия в инициированное многоцентровое когортное исследование гемофилии. в 1982 г. [8].Периодические оценки и тестирование общего количества клеток крови, уровней сывороточной аспартатаминотрансферазы, поверхностного антигена гепатита В (HBsAg) и его антител (анти-HBs) и подсчет лимфоцитов Т4 (CD4) проводились с интервалами от 6 месяцев до 1. год, как описано в [23, 24]. Из полной когорты мы идентифицировали 25 человек без HBsAg, которые были HCV-положительными / ВИЧ-положительными и у которых было достаточно сывороток, хранившихся при температуре от -20 ° C до -70 ° C, для тестирования РНК HCV в течение 3 периодов времени — до Сероконверсия ВИЧ, ≥2 года после сероконверсии и ≤5 лет после сероконверсии ВИЧ.Мы включили всех 17 ВГС-позитивных / ВИЧ-позитивных лиц, для которых мы могли идентифицировать ВГС-позитивные контрольные группы, сопоставленные в течение 5 лет с даты их рождения, которые были серонегативными по HBsAg и ВИЧ и которые получали не прошедший скрининг, не подвергнутый термической обработке фактор. концентрируйтесь в дозах и с частотой, аналогичных тем, которые используются для пациентов с ВГС / ВИЧ. Ни один из субъектов в анамнезе не злоупотреблял алкоголем или внутривенно употреблял наркотики. Только 1 субъект когда-либо получал терапию интерфероном- α , которая не была начата до конца 1994 года.Уровни РНК HCV определяли количественно с помощью анализа амплификации метки с усиленной ДНК с разветвленной цепью (bDNA) (версия 1; Chiron Corp., Emeryville, CA). Для образцов со значениями меньше пороговой точки 3,5 × 10 5 эквивалентов генома / мл, ВГС измеряли с помощью полимеразной цепной реакции (ПЦР) с использованием вложенных праймеров из 5′-некодирующей области генома ВГС [25 ]. Результаты этих исследований опубликованы в другом месте [10].
в 1982 г. [8].Периодические оценки и тестирование общего количества клеток крови, уровней сывороточной аспартатаминотрансферазы, поверхностного антигена гепатита В (HBsAg) и его антител (анти-HBs) и подсчет лимфоцитов Т4 (CD4) проводились с интервалами от 6 месяцев до 1. год, как описано в [23, 24]. Из полной когорты мы идентифицировали 25 человек без HBsAg, которые были HCV-положительными / ВИЧ-положительными и у которых было достаточно сывороток, хранившихся при температуре от -20 ° C до -70 ° C, для тестирования РНК HCV в течение 3 периодов времени — до Сероконверсия ВИЧ, ≥2 года после сероконверсии и ≤5 лет после сероконверсии ВИЧ.Мы включили всех 17 ВГС-позитивных / ВИЧ-позитивных лиц, для которых мы могли идентифицировать ВГС-позитивные контрольные группы, сопоставленные в течение 5 лет с даты их рождения, которые были серонегативными по HBsAg и ВИЧ и которые получали не прошедший скрининг, не подвергнутый термической обработке фактор. концентрируйтесь в дозах и с частотой, аналогичных тем, которые используются для пациентов с ВГС / ВИЧ. Ни один из субъектов в анамнезе не злоупотреблял алкоголем или внутривенно употреблял наркотики. Только 1 субъект когда-либо получал терапию интерфероном- α , которая не была начата до конца 1994 года.Уровни РНК HCV определяли количественно с помощью анализа амплификации метки с усиленной ДНК с разветвленной цепью (bDNA) (версия 1; Chiron Corp., Emeryville, CA). Для образцов со значениями меньше пороговой точки 3,5 × 10 5 эквивалентов генома / мл, ВГС измеряли с помощью полимеразной цепной реакции (ПЦР) с использованием вложенных праймеров из 5′-некодирующей области генома ВГС [25 ]. Результаты этих исследований опубликованы в другом месте [10].
Для настоящего исследования мы использовали оставшиеся репрезентативные образцы замороженной сыворотки из подгруппы, описанной выше, для определения генотипов ВГС для каждого из трех периодов времени: 1977–84, 1985–87 и с 1988 года по 1 июля 1995 года.РНК HCV подвергали обратной транскрипции и амплифицировали с помощью ПЦР с использованием вложенных биотинилированных праймеров в высококонсервативную 5′-некодирующую область. Отобранные образцы также были амплифицированы с использованием коммерчески доступного анализа РНК HCV (Amplicor HCV; Roche Diagnostic Systems, Branchburg, NJ). Меченые ампликоны были генотипированы с использованием коммерчески доступного линейного зондового анализа (LiPA, версия 1.0; Immunogenetics, Zwijndrecht, Бельгия). Вкратце, биотинилированные ампликоны гибридизовали с олигонуклеотидными зондами, направленными против вариаций, обнаруженных в высококонсервативной 5′-некодирующей области генома HCV.После тщательной промывки стрептавидин, меченный щелочной фосфатазой, использовали для отслеживания гибридизированных продуктов, а нитросиний тетразолий и 5-бром-4-хлор-3-индоилфосфат использовали в качестве субстратов. Колориметрическое обнаружение положительной линии происходит только тогда, когда существует идеальное совпадение между зондом и биотинилированными ампликонами. Этот стандартизированный анализ позволяет правильно классифицировать основные генотипы 1–5 и их наиболее распространенные подтипы, и, как сообщается, он хорошо согласуется с другими тестами для определения генотипа [15].Система номенклатуры, предложенная Simmonds et al. [16].
Отобранные образцы также были амплифицированы с использованием коммерчески доступного анализа РНК HCV (Amplicor HCV; Roche Diagnostic Systems, Branchburg, NJ). Меченые ампликоны были генотипированы с использованием коммерчески доступного линейного зондового анализа (LiPA, версия 1.0; Immunogenetics, Zwijndrecht, Бельгия). Вкратце, биотинилированные ампликоны гибридизовали с олигонуклеотидными зондами, направленными против вариаций, обнаруженных в высококонсервативной 5′-некодирующей области генома HCV.После тщательной промывки стрептавидин, меченный щелочной фосфатазой, использовали для отслеживания гибридизированных продуктов, а нитросиний тетразолий и 5-бром-4-хлор-3-индоилфосфат использовали в качестве субстратов. Колориметрическое обнаружение положительной линии происходит только тогда, когда существует идеальное совпадение между зондом и биотинилированными ампликонами. Этот стандартизированный анализ позволяет правильно классифицировать основные генотипы 1–5 и их наиболее распространенные подтипы, и, как сообщается, он хорошо согласуется с другими тестами для определения генотипа [15].Система номенклатуры, предложенная Simmonds et al. [16].
Анализ последовательности
Парные сыворотки от 4 человек, которые продемонстрировали изменения генотипа с помощью анализа обратной гибридизации с линейным зондом, были дополнительно оценены анализом последовательности, как описано в другом месте [26]. Вкратце, вирусную РНК выделяли и обратно транскрибировали в кДНК с использованием обратной транскриптазы вируса миелобластоза птиц. ПЦР-амплификацию кДНК из неструктурной (NS) области 5b проводили со следующими праймерами: прямой, нуклеотиды 7904–7934, 5-TGGGGTTCTC-GTATGATACCCGCTGCTTTGA-3 ‘; и наоборот, нуклеотиды 8275-8304, 5’-GGCGGAGTACCTGGTCATAGCCTCCGTG-AA-3 ‘.Конечные концентрации реакционной смеси включали буфер для ПЦР (Трис-HCl, 10 м M ; MgCl 2 , 2 м M ; KCl, 50 м M ), 0,25 м M каждого dNTP, 0,2 мкМ M каждого праймера NS5b и 2,5 Ед / образец полимеразы Taq. Условия термоциклирования: 94 ° C в течение 1 минуты, 55 ° C в течение 2 минут и 72 ° C в течение 3 минут, в течение 30 циклов с последующим окончательным удлинением при 72 ° C в течение 7 минут. Затем продукты ПЦР визуализировали на агарозном геле в виде продукта размером 405 пар оснований после окрашивания бромидом этидия, и по этим продуктам определяли согласованные последовательности.Если производилось недостаточное количество продукта для секвенирования, проводили дополнительную 30-цикловую реакцию ПЦР. Секвенирование и анализ последовательности выполняли следующим образом: продукты ПЦР (50 нг) секвенировали с использованием 0,5 мкм праймеров M с помощью метода Dyedeoxy Terminator (Applied Biosystems, Inc. [ABI], Foster City, CA). Реакции секвенирования были термоциклированы сначала при 96 ° C в течение 15 с, а затем при 60 ° C в течение 4 минут. Затем использовали колонки Centrisep для удаления лишних нуклеотидов. Конечный препарат наносили на 6% полиакриламидный гель в ДНК-секвенаторе 373A (ABI).Консенсусная последовательность была определена как производная от ампликона последовательность, которую использовали для сравнения исходного уровня со стандартами, специфичными для конкретного типа. Филогенетические отношения между образцами согласованных последовательностей из разных временных точек для 1 субъекта оценивались с помощью PHYLIP (версия 3.4; http://evolution.genetics.washington.edu/phylip.html). Филогенетические деревья, основанные на модели максимального правдоподобия, были построены с использованием типоспецифичных последовательностей генотипов для сравнения.
Условия термоциклирования: 94 ° C в течение 1 минуты, 55 ° C в течение 2 минут и 72 ° C в течение 3 минут, в течение 30 циклов с последующим окончательным удлинением при 72 ° C в течение 7 минут. Затем продукты ПЦР визуализировали на агарозном геле в виде продукта размером 405 пар оснований после окрашивания бромидом этидия, и по этим продуктам определяли согласованные последовательности.Если производилось недостаточное количество продукта для секвенирования, проводили дополнительную 30-цикловую реакцию ПЦР. Секвенирование и анализ последовательности выполняли следующим образом: продукты ПЦР (50 нг) секвенировали с использованием 0,5 мкм праймеров M с помощью метода Dyedeoxy Terminator (Applied Biosystems, Inc. [ABI], Foster City, CA). Реакции секвенирования были термоциклированы сначала при 96 ° C в течение 15 с, а затем при 60 ° C в течение 4 минут. Затем использовали колонки Centrisep для удаления лишних нуклеотидов. Конечный препарат наносили на 6% полиакриламидный гель в ДНК-секвенаторе 373A (ABI).Консенсусная последовательность была определена как производная от ампликона последовательность, которую использовали для сравнения исходного уровня со стандартами, специфичными для конкретного типа. Филогенетические отношения между образцами согласованных последовательностей из разных временных точек для 1 субъекта оценивались с помощью PHYLIP (версия 3.4; http://evolution.genetics.washington.edu/phylip.html). Филогенетические деревья, основанные на модели максимального правдоподобия, были построены с использованием типоспецифичных последовательностей генотипов для сравнения.
Статистические методы
Связь между ВИЧ-статусом и изменением генотипа ВГС изучалась с помощью теста χ 2 .Средние геометрические значения уровней РНК ВГС для последней пре-сероконверсии и первых образцов после сероконверсии сравнивали с результатами парного теста t . Связь между логарифмически трансформированными уровнями РНК HCV и генотипом HCV исследовали с помощью одностороннего дисперсионного анализа.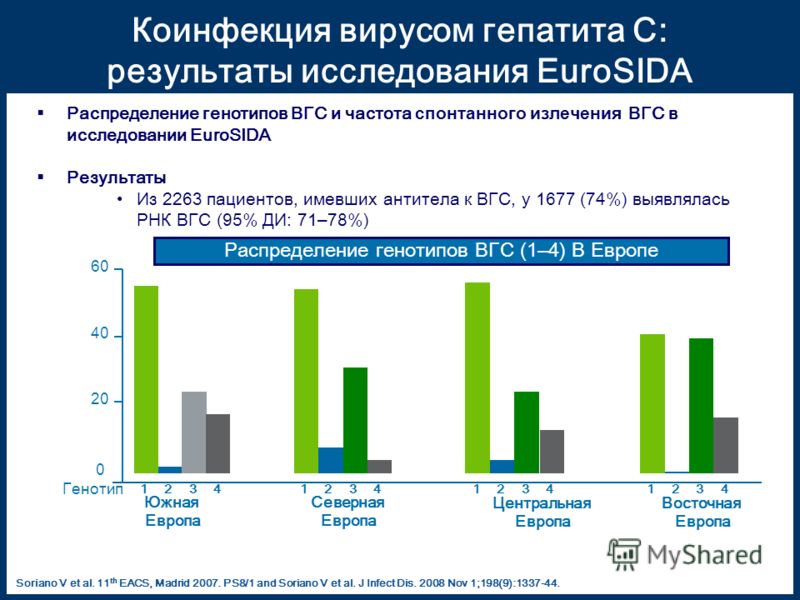 Наклоны уровней РНК ВГС и количества клеток CD4 были получены путем подбора модели линейной регрессии для каждого пациента, а их связь с изменением генотипа ВГС была проверена с помощью критерия суммы рангов Вилкоксона.
Наклоны уровней РНК ВГС и количества клеток CD4 были получены путем подбора модели линейной регрессии для каждого пациента, а их связь с изменением генотипа ВГС была проверена с помощью критерия суммы рангов Вилкоксона.
Результаты
Из 34 больных гемофилией образцы 17 ВИЧ-положительных и 15 ВИЧ-отрицательных больных гемофилией были расширены без доказательств контаминации. У ВИЧ-положительных субъектов средний возраст ± стандартная ошибка (SE) составлял 28 ± 3,9 года (медиана 26; диапазон от 3 до 62), а у ВИЧ-отрицательных субъектов средний возраст ± стандартная ошибка (SE) составлял 30,5 ± 4,1 года ( медиана 27; диапазон 6–64) на момент включения в исследование (медиана 1981 г. для ВИЧ-положительных субъектов и 1982 г. для ВИЧ-отрицательных субъектов).ВИЧ-положительные субъекты наблюдались в течение среднего ± стандартная ошибка 10,2 ± 0,8 года (медиана 9,6; диапазон 3,1–15,2). ВИЧ-отрицательные субъекты наблюдались в течение среднего ± SE 9,7 ± 0,7 года (медиана 10,6; диапазон 4,7–13,3).
Генотипирование было успешно выполнено на 109 из 117 образцов сыворотки 32 субъектов. Все образцы, амплифицированные с помощью вложенной ПЦР и Amplicor HCV, дали согласованные результаты с использованием анализа с линейным зондом. Распределение генотипов HCV на пациента по годам показано на рисунке 1. Множественные подтипы наблюдались в 8 образцах, полученных от 7 пациентов (3 ВИЧ-положительных и 4 ВИЧ-отрицательных).Однако все 8 образцов имели подтипы одного генотипа (три 1a / 1b, три 2a / 2b и два 3a / 3b). Множественные изменения генотипов ВГС наблюдались у 18 (58%) из 32 субъектов в течение 3–15-летнего периода наблюдения, причем изменения отмечались чаще у ВИЧ-положительных субъектов (13/17), чем у ВИЧ-инфицированных. отрицательные субъекты (5/15) ( P = 0,014). Не было очевидной тенденции к замене какого-либо конкретного генотипа ВГС. Из 18 пациентов, у которых был изменен генотип, у 4 (2 ВИЧ-положительных и 2 ВИЧ-отрицательных) впоследствии снова появился генотип, который был заменен. Изменения генотипа произошли у 11 (34%) из 32 субъектов (6 ВИЧ-положительных и 5 ВИЧ-отрицательных) после 1987 г., в то время как испытуемые получали только концентраты инактивированного вирусом фактора свертывания крови. Все 32 ранее получали необработанные концентраты.
Изменения генотипа произошли у 11 (34%) из 32 субъектов (6 ВИЧ-положительных и 5 ВИЧ-отрицательных) после 1987 г., в то время как испытуемые получали только концентраты инактивированного вирусом фактора свертывания крови. Все 32 ранее получали необработанные концентраты.
Рисунок 1
Генотипы вируса гепатита С в 109 образцах сыворотки от 32 субъектов. Субъекты 1-17 были положительными по отношению к вирусу иммунодефицита человека (ВИЧ). Субъекты 18–32 были ВИЧ-отрицательными. Звездочка (*) обозначает терапию интерфероном (см. «Пациенты и методы»).
Рисунок 1
Генотипы вируса гепатита С в 109 образцах сыворотки от 32 субъектов. Субъекты 1-17 были положительными по отношению к вирусу иммунодефицита человека (ВИЧ). Субъекты 18–32 были ВИЧ-отрицательными. Звездочка (*) обозначает терапию интерфероном (см. «Пациенты и методы»).
Распространенность генотипов HCV, наблюдаемая при серийном тестировании образцов сыворотки от 32 HCV-положительных больных гемофилией за 3 периода времени, показана в таблице 1. Процедуры вирусной инактивации эффективно уничтожили ВИЧ к 1985 году и HCV к 1988 году.Генотип 3 был наиболее распространенным генотипом в каждый период времени (39–46%). Схожая распространенность генотипов HCV с течением времени наблюдалась среди ВИЧ-положительных и ВИЧ-отрицательных лиц. Четыре пациента умерли от печеночной недостаточности. Самые последние образцы, проверенные перед смертью этих пациентов, показали, что у 3 пациентов был генотип 1a, а у 1 — генотип 3a. Изменения генотипа были отмечены у 2 из 3 пациентов с генотипом 1a и у пациента с генотипом 3a.
Таблица 1
Распространенность генотипов вируса гепатита С (ВГС) у 32 больных гемофилией в раннем (1977–84), среднем (1985–87) и позднем (1988–95) периодах.
Таблица 1
Распространенность генотипов вируса гепатита С (ВГС) у 32 больных гемофилией в ранний (1977–84), средний (1985–87) и поздний (1988–95) периоды.
Из-за высокой распространенности генотипа 3a ранние и поздние парные образцы от 32 пациентов также оценивались с помощью анализа полиморфизма длины рестрикционных фрагментов (RFLP).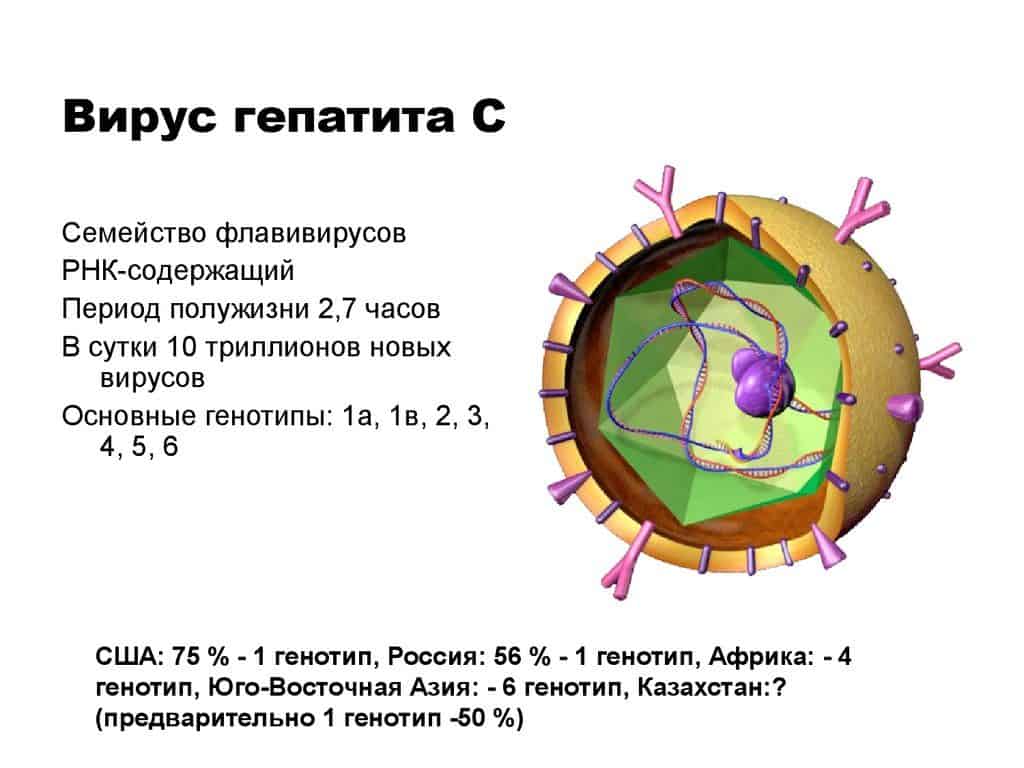 Из 55 образцов, успешно генотипированных, совпадающие результаты были получены для 48 образцов (87%). Все 7 несогласованных образцов были от разных пациентов и имели генотип 3а по результатам анализа с помощью линейного зонда и генотип 1а или 1b по анализу ПДРФ.
Из 55 образцов, успешно генотипированных, совпадающие результаты были получены для 48 образцов (87%). Все 7 несогласованных образцов были от разных пациентов и имели генотип 3а по результатам анализа с помощью линейного зонда и генотип 1а или 1b по анализу ПДРФ.
Поскольку было обнаружено, что анализ бДНК первого поколения недооценивает уровень виремии ВГС для генотипов 2 и 3 [27], мы пересмотрели наш ранее опубликованный анализ уровней РНК ВГС до и после сероконверсии ВИЧ типа 1, используя поправочные коэффициенты ( × 3 для генотипа 2 и × 2 для генотипа 3) для получения более точных уровней виремии. Сероконверсия была связана с 4-кратным увеличением уровня РНК HCV (рисунок 2). Среднее геометрическое (95% доверительный интервал) РНК HCV увеличилось с 5.5 × 10 5 (2,3–12,9) экв / мл до сероконверсии до 20,6 × 10 5 (8,5–50,1) после сероконверсии ( P = 0,01).
Рисунок 2
Уровни РНК вируса гепатита С до и в течение 2 лет после сероконверсии вируса иммунодефицита человека 1 типа. Коэффициент коррекции × 3 был использован для генотипа 2 и × 2 для генотипа 3 (см. Результаты).
Рисунок 2
Уровни РНК вируса гепатита С до и в течение 2 лет после сероконверсии вируса иммунодефицита человека 1 типа.Коэффициент коррекции × 3 был использован для генотипа 2 и × 2 для генотипа 3 (см. Результаты).
Взаимосвязь между уровнями РНК ВГС и генотипом ВГС в отдельных образцах без учета внутрипредметной связи показана на рисунке 3. Не было обнаружено значимой связи между уровнями РНК ВГС в сыворотке и генотипом ВГС. Однако, когда связь между уровнями РНК ВГС и генотипом была изучена с течением времени, РНК ВГС увеличилась в 30 раз у ВИЧ-положительных субъектов, которые заменили генотипы (среднее ± стандартная ошибка, 24 ± 10 × 10 5 экв / мл / год) , по сравнению с теми, кто не заменял генотипы (среднее ± SE, 0.8 ± 1,9 × 10 5 экв / мл / год) ( P = 0,07). Хотя РНК ВГС также увеличивалась у ВИЧ-отрицательных субъектов (4,1 ± 2,5 × 10 5 экв / мл / год), это увеличение не было связано с заменой генотипа.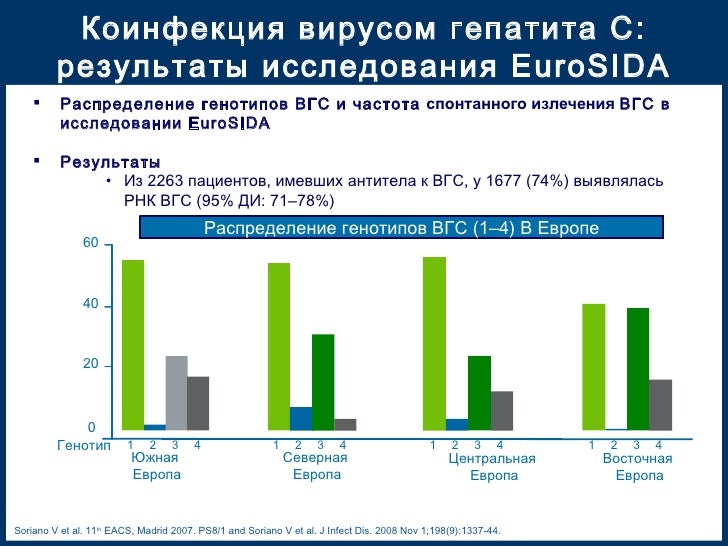 Когда рассматривалась внутрипредметная связь, уровни РНК HCV незначительно увеличивались в течение 19 временных точек, когда изменялись генотипы, но не значительно больше, чем в течение 35 временных точек, когда генотипы не менялись ( P = 0,45). Однако вариабельность измерения РНК ВГС была слишком большой, а количество временных точек слишком малым, чтобы сделать твердый вывод о возможной взаимосвязи.Среди ВИЧ-положительных больных гемофилией у 16 было достаточное количество измерений CD4-клеток для оценки наклонов. Отрицательный наклон для количества клеток CD4 был в 6 раз круче для тех, кто заменил генотип, чем для тех, кто этого не сделал. Однако разница не была статистически значимой ( P = 0,16).
Когда рассматривалась внутрипредметная связь, уровни РНК HCV незначительно увеличивались в течение 19 временных точек, когда изменялись генотипы, но не значительно больше, чем в течение 35 временных точек, когда генотипы не менялись ( P = 0,45). Однако вариабельность измерения РНК ВГС была слишком большой, а количество временных точек слишком малым, чтобы сделать твердый вывод о возможной взаимосвязи.Среди ВИЧ-положительных больных гемофилией у 16 было достаточное количество измерений CD4-клеток для оценки наклонов. Отрицательный наклон для количества клеток CD4 был в 6 раз круче для тех, кто заменил генотип, чем для тех, кто этого не сделал. Однако разница не была статистически значимой ( P = 0,16).
Рисунок 3
Взаимосвязь между уровнями РНК вируса гепатита С (ВГС) и генотипом ВГС.
Рисунок 3
Взаимосвязь между уровнями РНК вируса гепатита С (ВГС) и генотипом ВГС.
Шесть из 8 образцов от 4 субъектов, у которых изменились генотипы, как определено анализом линейного зонда, были успешно амплифицированы для подтверждения анализа последовательности. В 1994 году субъект 10 имел генотип 4а как по результатам анализа с помощью линейного зонда, так и по консенсусному секвенированию. В 1992 году субъект 11 имел генотип 3a по результатам анализа с использованием линейного зонда, но генотип 1a по согласованному секвенированию аликвот из того же образца сыворотки, что позволяет предположить, что это изменение, вероятно, было артефактом ложной гибридизации с помощью анализа с использованием линейного зонда.Субъект 27 имел генотип 2a в 1985 году и генотип 3a, 3b в 1995 году. Субъект 29 имел генотип 1b в 1987 году и генотип 2b в 1992 году. В каждом случае анализ линейного зонда и согласованное секвенирование были согласованы, что указывает на то, что произошло истинное изменение генотипа. по этим 2 предметам. Как показано на рисунке 4, это было подтверждено филогенетическим анализом, демонстрирующим взаимосвязь этих изолятов с принятыми стандартами для конкретных типов и друг с другом (инвентарные номера GenBank AF107041 для образца 1987 года и AF107040 для образца 1992 года).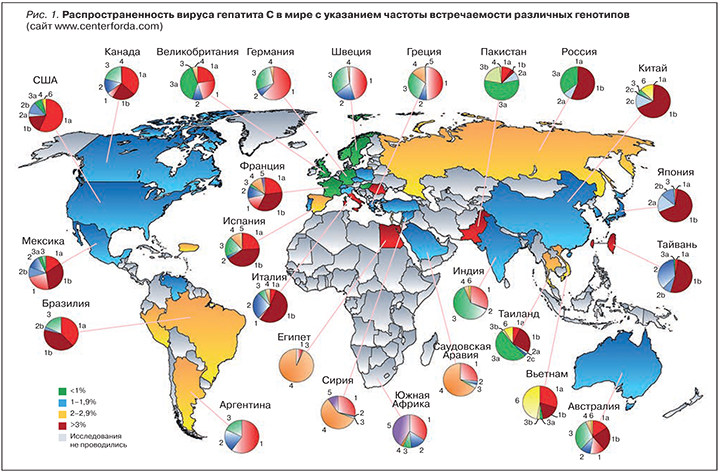
Рисунок 4
Филогенетическое дерево консенсусных последовательностей вируса гепатита С от субъекта 29.
Рисунок 4
Филогенетическое дерево консенсусных последовательностей вируса гепатита С от субъекта 29.
Обсуждение
Анализ геномных последовательностей показал, что HCV существует как семейство отдельных штаммов вирусов, которые имеют ~ 70% гомологии последовательностей [15]. На основе вариации последовательности в высококонсервативной 5′-некодирующей области и относительно хорошо консервативной области NS5, большинство этих штаммов можно разделить на 6 основных генотипов (1-6) и вариабельное количество более близкородственных подтипов ( а, б, в и т. д.) [14, 16]. Изоляты, показывающие <70% гомологии, классифицируются как разные генотипы. Те, у кого гомология составляет от 70% до 85%, считаются принадлежащими к разным подтипам в пределах одной и той же генотипической группы.
Генотипы HCV демонстрируют заметные этнические и географические различия, причем генотип 1 наиболее часто встречается в США [15, 21, 28]. Для больных гемофилией генотипы ВГС отражают географическое распределение генотипов из соответствующей популяции доноров крови [29]. Два исследования из Соединенного Королевства, проведенные Jarvis et al.[29] и Telfer et al. [22], обнаружили преобладание генотипа 1. Напротив, мы обнаружили преобладание генотипа 3a (41%). Эта распространенность была почти в 7 раз выше, чем распространенность 5% и 6%, отмеченная в исследованиях пациентов с хроническим ВГС в двух центрах в США [21, 28]. Мы обнаружили, что генотип 3a преобладал как у ВИЧ-положительных, так и у ВИЧ-отрицательных больных гемофилией в каждом из трех периодов времени (до, во время и после процедур вирусной инактивации, которые использовались для производства концентратов факторов свертывания крови), а также когда либо анализировался самый ранний или самый последний экземпляр.Причина преобладания генотипа 3а неясна. Если генотип 3 менее вирулентен, чем генотип 1, распространенность генотипа 3a может быть смещена отбором выживших в течение длительного периода времени с инфекцией ВГС. В качестве альтернативы, это может быть связано с случайностью, различиями в популяциях доноров плазмы или используемым методом генотипирования.
Если генотип 3 менее вирулентен, чем генотип 1, распространенность генотипа 3a может быть смещена отбором выживших в течение длительного периода времени с инфекцией ВГС. В качестве альтернативы, это может быть связано с случайностью, различиями в популяциях доноров плазмы или используемым методом генотипирования.
Наиболее широко используемые методы генотипирования — это ПДРФ и линейный зонд. Оба анализа используют ПЦР для амплификации продуктов ДНК из высококонсервативной 5′-некодирующей области генома HCV.Анализ RFLP распознает генотип-специфические нуклеотидные замены путем переваривания рестрикционными ферментами и разделения фрагментов с помощью гель-электрофореза. Анализ линейного зонда гибридизирует продукты ПЦР со специфическими зондами, закрепленными на твердой фазе. Lau et al. [15] сообщили о 98,2% совпадении среди 342 образцов, которые были генотипированы с помощью обоих тестов. Только 3,7% имели смешанные инфекции. Противоречивые результаты были отмечены в 2 из 9 образцов со смешанными инфекциями. Приблизительно 87% наших выборок соответствовали обоим методам.Интересно, что все 7 несогласованных образцов имели генотип 3 по анализу линейного зонда и генотип 1 по анализу RFLP. Эти результаты предполагают, что, если присутствуют и генотип 1, и генотип 3 (т. Е. Смешанная инфекция), анализ линейного зонда может быть более чувствительным при идентификации генотипа 3, тогда как анализ RFLP может быть более чувствительным при идентификации генотипа 1. В качестве альтернативы, анализ с использованием линейного зонда может неверно идентифицировать некоторые изоляты генотипа 1 лишь с небольшими изменениями нуклеотидов. Оказалось, что это имело место для одного из наших субъектов, изучаемых с помощью секвенирования и анализа последовательностей.
За 10-летний средний период наблюдения мы наблюдали изменения основных генотипов у 58% из 32 наших пациентов, в том числе 13 (76%) из 17 были ВИЧ-положительными и 5 (33%) из 15 были ВИЧ-инфицированными. отрицательный. Не было четкой тенденции к замене каким-либо одним конкретным генотипом. Множественные подтипы одного генотипа были отмечены у 7 пациентов, 3 из которых были ВИЧ-положительными, а 4 — ВИЧ-отрицательными. Из 18 пациентов, изменивших генотип, у 4 впоследствии снова появился первый генотип.Основные замены генотипа произошли у 11 пациентов (34%), когда они получали только концентраты, инактивированные вирусами, что предполагало реактивацию, а не повторное инфицирование. В нескольких других исследованиях сообщалось об изменениях основных генотипов у лиц с гемофилией, которые изучались в течение 10 лет [30–34]. В одном исследовании изменения генотипа были связаны с лечением интерфероном [34]. Только один из наших пациентов получил интерферон, и у него не было изменения генотипа.
Не было четкой тенденции к замене каким-либо одним конкретным генотипом. Множественные подтипы одного генотипа были отмечены у 7 пациентов, 3 из которых были ВИЧ-положительными, а 4 — ВИЧ-отрицательными. Из 18 пациентов, изменивших генотип, у 4 впоследствии снова появился первый генотип.Основные замены генотипа произошли у 11 пациентов (34%), когда они получали только концентраты, инактивированные вирусами, что предполагало реактивацию, а не повторное инфицирование. В нескольких других исследованиях сообщалось об изменениях основных генотипов у лиц с гемофилией, которые изучались в течение 10 лет [30–34]. В одном исследовании изменения генотипа были связаны с лечением интерфероном [34]. Только один из наших пациентов получил интерферон, и у него не было изменения генотипа.
Изменения генотипа могут происходить по нескольким причинам.Во-первых, изменения генотипа могут быть артефактами на основе ложной гибридизации в анализе с линейным зондом. В качестве альтернативы, изменения генотипа могли произойти из-за истинного сдвига в генотипе, либо из-за изменений в преобладающих штаммах сосуществующих вирусных генотипов, полученных в результате множественных инфекций (т.е. смешанная инфекция), либо из-за обширной мутации генотипа, приобретенной во время начальной инфекции. Однако последнее объяснение считается крайне неправдоподобным на основании оценочной скорости мутаций от 10 -2 до 10 -3 замен оснований на сайт в год [12].
Используя методы секвенирования, мы продемонстрировали, что истинное изменение генотипа произошло у 2 субъектов, 1 из которых не подвергался переливанию крови за это время. Поскольку у этого субъекта не было других известных факторов риска, это изменение, скорее всего, было связано либо с реактивацией ранее необнаруженного минорного варианта, либо с появлением субпопуляции из альтернативного резервуара, такого как печень или ретикулоэндотелиальные клетки. Для определения одновременного присутствия сосуществующих субпопуляций 11 генотипов потребуется обширное клонирование и секвенирование множества клонов из каждого из этих изолятов.
У негемофиликов смешанные генотипы встречаются очень редко [15]. Однако у людей с гемофилией смешанные генотипы зарегистрированы в 1,6–45% случаев [22, 33, 35–41]. Tuveri et al. [42] указали на трудности в оценке истинной распространенности смешанных инфекций среди людей с мультитранс-слиянием с помощью имеющихся в настоящее время анализов генотипирования. Однако смешанные инфекции с большой вероятностью будут более частыми у больных гемофилией, чем было показано ранее, из-за многократного воздействия в течение многих лет с большим количеством различных партий загрязненных концентратов плазмы.В недавнем исследовании Toyoda et al. [43] обнаружили значительно более высокую степень вариабельности нуклеотидной последовательности в первой гипервариабельной области ВГС у изолятов от больных гемофилией по сравнению с изолятами от пациентов с посттрансфузионным гепатитом, которым была сделана только одна прививка ВГС. Эти данные предполагают, что типы HCV, возникшие в результате множественных прививок, а также спонтанных мутаций, могут сосуществовать.
Обширная генетическая гетерогенность ВГС (как генотипа, так и квазивидов) имеет важные клинические последствия.В нескольких [14, 18, 20, 21], но не во всех [15] исследованиях сообщалось о связи генотипа 1b с более тяжелым заболеванием печени. Более того, существует общее мнение, что генотипы 3a и 2 связаны с более благоприятным ответом на терапию интерфероном-α , чем генотип 1 [44]. Повышенная вариабельность квазивидов была обнаружена у пациентов с коинфекцией ВИЧ [45], а большее разнообразие распределения генома квазивидов, по-видимому, связано с прогрессированием заболевания печени [46].Более того, было обнаружено, что не отвечающие на интерферон- α инфицированы популяцией ВГС, которая является более гетерогенной, чем у респондеров [47, 48].
Для этой когорты мы ранее показали, что уровни РНК ВГС у ВИЧ-положительных больных гемофилией значительно выше, чем у ВИЧ-отрицательных больных гемофилией. Нагрузка ВГС увеличивалась с течением времени, усиливалась ВИЧ и далее увеличивалась по мере прогрессирования иммунодефицита в течение среднего периода времени 9 лет [10]. В текущем исследовании не было обнаружено значимой связи между вирусной нагрузкой HCV и генотипом HCV.Однако замена генотипа HCV была связана с 30-кратным более резким увеличением вирусной нагрузки с течением времени у ВИЧ-инфицированных больных гемофилией, что свидетельствует о накоплении вариантов у пациентов с коинфекцией HCV / ВИЧ.
Нагрузка ВГС увеличивалась с течением времени, усиливалась ВИЧ и далее увеличивалась по мере прогрессирования иммунодефицита в течение среднего периода времени 9 лет [10]. В текущем исследовании не было обнаружено значимой связи между вирусной нагрузкой HCV и генотипом HCV.Однако замена генотипа HCV была связана с 30-кратным более резким увеличением вирусной нагрузки с течением времени у ВИЧ-инфицированных больных гемофилией, что свидетельствует о накоплении вариантов у пациентов с коинфекцией HCV / ВИЧ.
Наши результаты подтверждают вывод о повышенной вариабельности квазивидов и сложности генотипов у больных гемофилией с сочетанной инфекцией ВГС / ВИЧ. И ВИЧ-отрицательные, и ВИЧ-положительные больные гемофилией, вероятно, были изначально инфицированы или имели ранние повторные инфекции несколькими типами и подтипами ВГС, которые присутствовали в пулах плазмы от доноров с широким этническим и географическим распределением.Поскольку большинство методов типирования идентифицируют только преобладающий генотип, только 1 генотип обычно выявляется в любой момент времени в течение инфекции. Однако несколько генотипов могут сосуществовать, и со временем преобладающий генотип, вероятно, может измениться из-за давления отбора, дифференциальной скорости клиренса или появления вариантов из внесосудистых участков. Смешанные инфекции, по-видимому, чаще встречаются у ВИЧ-инфицированных, особенно если у них сильно ослаблен иммунитет.Демонстрация изменения генотипов имеет биологические последствия для исхода и лечения хронического ВГС не только для людей с гемофилией, но также для потребителей внутривенных наркотиков и реципиентов переливания крови с подавленным иммунитетом, которые могли быть инфицированы несколькими генотипами.
Благодарности
Мы хотим поблагодарить доктора Лизу Джарвис и Дженни Эллендер за выполнение анализов ПДРФ и Сьюзан Рустер за помощь в анализе последовательности. Мы также хотим поблагодарить Вану Сипсу, Джеффри Сандерса, Сьюзан Уилсон и пациентов, координаторов и исследователей Многоцентровой группы изучения гемофилии, перечисленных в отчете Eyster et al. [8].
[8].
Список литературы
1.« и др.
Антитела к гепатиту С и хроническое заболевание печени при гемофилии
,
Ланцет
,
1990
, т.
335
(стр.
1117
—
9
) 2.,,,,.
Распространенность антител к вирусу гепатита С в когорте больных гемофилией
,
Кровь
,
1990
, т.
76
(стр.
254
—
6
) 3.,,, Et al.
Профиль антител к гепатиту С и распространенность виремии у взрослых с тяжелой гемофилией
,
Br J Haematol
,
1991
, vol.
79
(стр.
512
—
5
) 4.,,,,,.
Использование нескольких серологических тестов второго поколения для определения истинной распространенности инфекции вирусом гепатита С у больных гемофилией, получавших неинактивированные вирусом концентраты фактора VIII и IX
,
Br J Haematol
,
1992
, vol.
80
(стр.
514
—
8
) 5.,,, Et al.
Многоцентровое исследование вирусного гепатита среди больных гемофилией в США
,
Кровь
,
1993
, vol.
81
(стр.
412
—
8
) 6.,,,,.
Гепатит не-А, не-В после переливания фактора VIII у нечасто пролеченных пациентов
,
Br Med J (Clin Res Ed)
,
1983
, vol.
287
(стр.
1754
—
7
) 7.,,,.
Высокий риск гепатита, не связанного с Anon-B, после первого контакта с концентратами факторов свертывания крови добровольцев или коммерческих производителей: эффекты профилактического иммуноглобулина сыворотки
,
Br J Haematol
,
1985
, vol.
60
(стр.
469
—
79
) 8.,,,,,.
Естественная история инфекции вирусом гепатита С (ВГС) у больных гемофилией с несколькими переливаниями: влияние коинфекции вирусом иммунодефицита человека (ВИЧ)
,
J Acquir Immune Defic Syndr
,
1993
, vol.
6
(стр.
602
—
10
) 9.,,,,,.
Прогрессирование ВГС-ассоциированного заболевания печени в группе пациентов с гемофилией
,
Br J Haematol
,
1994
, vol.
87
(стр.
555
—
61
) 10.,,,.
Многоцентровое когортное исследование гемофилии
Повышение уровней РНК ВГС у больных гемофилией: связь с ВИЧ-инфекцией и заболеванием печени
,
Кровь
,
1994
, т.
84
(стр.
1020
—
3
) 11.,,,,.
Уровни РНК ВГС и ВИЧ-инфекция: данные о вирусном взаимодействии у пациентов с гемофилией
,
Br J Haematol
,
1994
, vol.
88
(стр.
397
—
9
) 12.,,,.
Нуклеотидная последовательность и частота мутаций штамма H вируса гепатита С
,
Proc Natl Acad Sci USA
,
1991
, vol.
88
(стр.
3392
—
6
) 13.,,, Et al.
Вирус гепатита С (ВГС) циркулирует как популяция разных, но тесно связанных геномов: квазивидовая природа распределения генома ВГС
,
J Virol
,
1992
, vol.
66
(стр.
3225
—
9
) 14.,,.
Генетическая гетерогенность вируса гепатита С: квазивиды и генотипы
,
Semin Liver Dis
,
1995
, vol.
15
(стр.
41
—
63
) 15.,,,,,.
Распределение генотипов вируса гепатита С, определенных с помощью линейного зондового анализа, у пациентов с хроническим гепатитом С, наблюдаемых в специализированных центрах в США
,
Ann Intern Med
,
1996
, vol.
124
(стр.
868
—
76
) 16.,,, Et al.
Классификация вируса гепатита С на шесть основных генотипов и ряд подтипов с помощью филогенетического анализа области NS-5
,
J Gen Virol
,
1993
, vol.
74
(стр.
2391
—
9
) 17.,,, Et al.
Обнаружение вируса гепатита С с помощью полимеразной цепной реакции и ответ на терапию интерфероном-альфа: связь с генотипами вируса гепатита С
,
Hepatology
,
1992
, vol.
16
(стр.
293
—
9
) 18.,,,,,.
Инфекция вирусом гепатита С типа 1b (II) во Франции и Италии: Collaborative Study Group
,
Ann Intern Med
,
1995
, vol.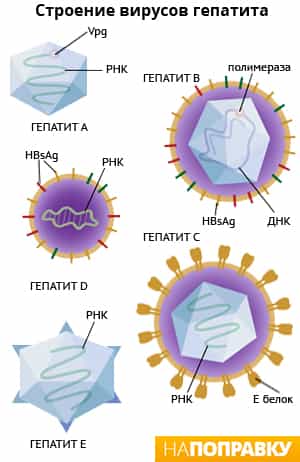
122
(стр.
161
—
8
) 19.,,, Et al.
Мутации в гене неструктурного белка 5A и ответ на интерферон у пациентов с хронической инфекцией вируса гепатита C 1b
,
N Engl J Med
,
1996
, vol.
334
(стр.
77
—
81
) 20.,,,,,.
Анализ генотипа вируса гепатита С у американских пациентов
,
Hepatology
,
1994
, vol.
20
(стр.
1405
—
11
) 21.,,,,,.
Генотипы вируса гепатита С в США: эпидемиология, патогенность и ответ на терапию интерфероном
,
Ann Intern Med
,
1996
, vol.
125
(стр.
634
—
9
) 22., , , и другие.
Хроническая инфекция вирусом гепатита С у больных гемофилией: клиническое значение вирусного генотипа
,
Thromb Haemost
,
1995
, vol.
74
(стр.
1259
—
64
) 23.,,, Et al.
Проспективное исследование инфекции вируса иммунодефицита человека типа 1 и развития СПИДа у субъектов с гемофилией
,
N Engl J Med
,
1989
, vol.
321
(стр.
1141
—
8
) 24.,,,,.
Естественная история инфекций вируса иммунодефицита человека у больных гемофилией: влияние субпопуляций Т-клеток, количества тромбоцитов и возраста
,
Ann Intern Med
,
1987
, vol.
107
(стр.
1
—
6
) 25.,,, Et al.
Снижение сывороточной РНК вируса гепатита С во время терапии альфа-интерфероном хронического гепатита С
,
Ann Intern Med
,
1991
, vol.
115
(стр.
700
—
4
) 26.,,,,.
Серотипы гепатита С у пациентов, не употребляющих алкоголь и алкоголь
,
Dig Dis Sci
,
1997
, vol.
42
(стр.
2285
—
91
) 27.,,.
Значение вариаций «консервативных» участков генома вируса гепатита С
,
Lancet
,
1995
, vol.
346
(стр.
425
—
6
) 28.,,, Et al.
Применение шести систем генотипирования вируса гепатита С к сывороткам от пациентов с хроническим гепатитом С в США
,
J Infect Dis
,
1995
, vol.
171
(стр.
281
—
9
) 29.,,, Et al.
Исследование относительной заразности и патогенности различных генотипов вируса гепатита С у больных гемофилией
,
Кровь
,
1996
, vol.
87
(стр.
3007
—
11
) 30.,,, Et al.
Продольный анализ генотипа и количественная оценка вируса гепатита С у пациентов с гемофилией, получающих терапию интерфероном-альфа
,
J Viral Hepat
,
1996
, vol.
3
(стр.
43
—
8
) 31.,,, Et al.
Частая реинфекция и реактивация генотипов вируса гепатита С у больных гемофилией с несколькими переливаниями
,
J Infect Dis
,
1994
, vol.
170
(стр.
1018
—
22
) 32.,,.
Многоцентровая группа по изучению гемофилии
Генотипы ВГС у больных гемофилией с несколькими переливаниями
,
Кровь
,
1996
, vol.
88
Доп.
стр.
526
33.« и др.
Генотипы вируса гепатита С у больных гемофилией во Франции: кинетика и переоценка смешанных инфекций
,
J Med Virol
,
1997
, vol.
51
(стр.
36
—
41
) 34.,,,.
Генотипы гепатита С у больных гемофилией, получавших альфа-интерферон
,
J Med Virol
,
1995
, vol.
45
(стр.
284
—
7
) 35.,,, Et al.
Количественная оценка вируса гепатита С с помощью конкурентной обратной транскрипции — полимеразная цепная реакция: увеличение вируса при запущенном заболевании печени
,
Hepatology
,
1993
, vol.
18
(стр.
16
—
20
) 36.,,.
Генотипы вируса гепатита С у лиц, перенесших несколько переливаний крови
,
Гемофилия
,
1995
, т.
1
(стр.
3
—
7
) 37.,,, Et al.
Гетерогенность генотипов вируса гепатита С при гемофилии: связь с хроническим заболеванием печени
,
Кровь
,
1995
, т.
85
(стр.
1259
—
62
) 38.,,, Et al.
Инфекция вирусом гепатита С и генотипы у японских больных гемофилией
,
Печень
,
1995
, т.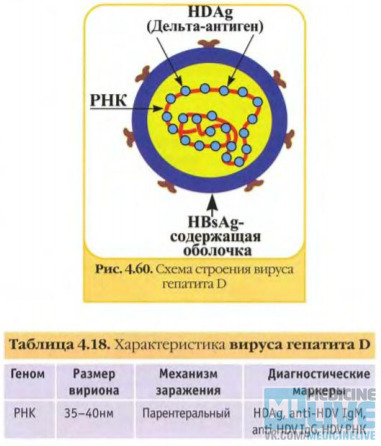
15
(стр.
131
—
4
) 39.,,, Et al.
Генотипы вируса гепатита С и тяжесть хронического заболевания печени у больных гемофилией
,
Br J Haematol
,
1995
, vol.
91
(стр.
708
—
13
) 40.,,, Et al.
Генотипы и множественные инфекции вирусом гепатита С у пациентов с гемофилией А в Японии
,
J Viral Hepat
,
1996
, vol.
3
(стр.
79
—
84
) 41.,,,,,.
Вирусологическая характеристика инфекции ВГС у японских больных гемофилией
,
Гемофилия
,
1997
, т.
3
(стр.
131
—
6
) 42.,,, Et al.
Генотипы вируса гепатита С у больных гемофилией во Франции: кинетика и переоценка смешанных инфекций
,
J Med Virol
,
1997
, vol.
51
(стр.
36
—
41
) 43., , , и другие.
Разнообразие нуклеотидных последовательностей гипервариабельной области 1 вируса гепатита С у японских больных гемофилией с хроническим гепатитом С и пациентов с хроническим посттрансфузионным гепатитом С
,
Кровь
,
1996
, vol.
88
(стр.
1488
—
93
) 44.,,,.
Hepatitis C
,
Ann Intern Med
,
1996
, vol.
125
(стр.
658
—
68
) 45.,,, Et al.
Гепатит С у пациентов с коинфекцией вируса иммунодефицита человека: повышенная вариабельность кодирующего домена гипервариабельной оболочки
,
Hepatology
,
1996
, vol.
23
(стр.
688
—
94
) 46.,,,,,.
Степень разнообразия квазивидов вируса гепатита С и прогрессирование заболевания печени
,
Гепатология
,
1994
, т.
20
(стр.
1144
—
51
) 47.,,,,.
Степень вариабельности аминоконцевой области белка E2 / NS1 вируса гепатита С коррелирует с реакцией на терапию интерфероном у пациентов с вирусом
,
Hepatology
,
1992
, vol.
16
(стр.
619
—
24
) 48.,,, Et al.
Влияние квазивидов вируса на эффективность терапии интерфероном у больных хроническим гепатитом С
,
Гепатология
,
1994
, т.
20
(стр.
1121
—
30
)
© 1999 Американским обществом инфекционных болезней
LOINC 82513-3 — генотип 3 вируса гепатита С [наличие] в сыворотке или плазме по данным NAA с обнаружением зонда
Описание термина
Этот тест определяет, является ли пациент вирусом гепатита С генотипом 3, и используется для оптимизации выбора лечения для пациентов, рассматриваемых для антивирусной терапии, такой как даклатасвир, препарат-ингибитор NS5A.
Источник: Regenstrief LOINC
Деталь Описание
LP220415-6 Генотип вируса гепатита C 3
Существует шесть основных генотипов вируса гепатита C (1–6), каждый из которых может быть далее подразделен на подтипы (например, 1a, 1b, 2a). Генотипы 1, 2 и 3 широко распространены в развитых странах, в то время как другие генотипы, по-видимому, более географически локализованы [PMID: 10755999] Генотип 1 (включая подтипы 1a и 1b) является наиболее распространенным на сегодняшний день в Соединенных Штатах.Генотип 3 составляет 10% случаев инфицирования ВГС в США и Канаде. Пациенты с этим генотипом HCV имеют более высокую частоту гепатоцеллюлярной карциномы, более высокую распространенность стеатоза и инсулинорезистентности и более высокие темпы прогрессирования фиброза по сравнению с пациентами с другими генотипами HCV.
Источник: Regenstrief LOINC, NCBI Книги: NBK1630
Полное имя
- Компонент
- Генотип вируса гепатита С 3
- Недвижимость
- PrThr
- Время
- Pt
- Система
- Ser / Plas
- Масштаб
- Заказ
- Метод
- Зонд.amp.tar
Дополнительные имена
- Краткое имя
- Датчик HCV Gentyp 3 SerPl Ql NAA +
- Отображаемое имя
- NAA генотипа 3 HCV + зонд Q1
- Имя потребителя
Альфа - Вирус гепатита С (HCV), генотип 3, кровь
Пример списка ответов LL744-4
Источник: Институт Регенстриф
| Ответ | Код | Оценка | Идентификатор ответа |
|---|---|---|---|
| Обнаружено | LA11882-0 | ||
| Не обнаружено | LA11883-8 |
Основные атрибуты
- Класс
- ABXBACT
- Тип
- Лаборатория
- Первый выпуск
- Версия 2.58
- Последнее обновление
- Версия 2.63
- Порядок и наблюдение
- Оба
Член этих комиссий
| LOINC | Длинное общее имя |
|---|---|
| 82525-7 | Панель генотипа вируса гепатита С и лекарственной устойчивости |
Член этих групп
Языковые варианты
Получить информацию
- zh-CNChinese (Китай)
- 肝炎 病毒 基因型 3:
情况 或 阈: 点: 血清 /: 型: 法.基因 扩增. 靶向 - nl-NL Голландский (Нидерланды)
- Генотип 3 вируса гепатита С:
aanwezigheid: момент: сыворотка плазмы: порядковый номер: молекулярный техник (ПЦР) - fr-FR Французский (Франция)
- Генотип вируса гепатита С 3:
Присутствие / Место: Место: Сыворотка / Плазма: Квалификация: ПЦР-амплификация возможна - it-ITItalian (Италия)
- Вирус эпатита C, genotipo 3:
PrThr: Pt: Siero / Plasma: Ord: Sonda.amp.tar - es-ESS Испанский (Испания)
- Genotipo 3 del вируса гепатита C:
PrThr: Punto temporal: Suero o Plasma: Ord: Sonda con ampificación dirigida
Схожие названия
- 3 Самоподдерживающаяся репликация последовательности
- 3SR СР
- Амплиф
- Усиление
- Усиленный
- УСТОЙЧИВОСТЬ К АНТИБИОТИКАМ
- ЗОНД ЯДЕРНОЙ КИСЛОТЫ ДНК
- ДНК-зонд
- HCV
- ВГС Гентип 3
- Hep
- Hep C
- Hepatis
- Гепатит
- III
- LAT
- LCR
- Лигазная цепная реакция
- Транскрипция, активируемая лигированием
- NAA + зонд
- NAAT
- НАСБА
- Анализ на основе последовательностей нуклеиновых кислот
- Порядковый номер
- PCR
- Pl
- Плазма
- Plsm
- Момент времени
- Полимеразная цепная реакция
- PR
- Пробник усилитель
- Зонд с усилением
- Зонд с усилением цели
- QBR
- QL
- Qual
- Качественный
- Случайное
- Экран
- SDA
- СерП
- SerPl
- СерПлас
- Сыворотка
- Сыворотка или плазма
- SR
- Усиление смещения цепей
- TMA
- Амплификация, опосредованная транскрипцией
LOINC FHIR
® API Пример — запрос CodeSystem Получить информацию
https: // fhir.loinc.org/CodeSystem/$lookup?system=http://loinc.org&code=82513-3
LOINC Авторские права
Copyright © 2020 Regenstrief Institute, Inc. Все права защищены. В той степени, в которой это включено, таблица LOINC и коды LOINC являются собственностью © 1995-2020, Regenstrief Institute, Inc. и Комитета по именам и кодам логических идентификаторов наблюдений (LOINC). См. Https: //
Последний рубеж защиты вируса гепатита С генотипа 3
ВВЕДЕНИЕ
Считается, что хроническая инфекция вирусом гепатита С (ВГС) является одной из основных причин заболеваний печени во всем мире, затрагивая примерно 71 миллион человек [ 1 ] .Из-за высокого генетического разнообразия последовательности вирусной нуклеиновой кислоты было идентифицировано шесть основных генотипов (GT), отличающихся друг от друга на 30% на уровне нуклеотидов и включающих несколько подтипов HCV [ 2 ] . Большинство пациентов во всем мире инфицированы GT1, но инфекции GT3 также распространены в некоторых регионах. GT3 определяется более высокой частотой стеатоза, повышенным риском цирроза печени и разной реакцией на противовирусные препараты по сравнению с другими GT.В эпоху лечения пегилированным интерфероном альфа (IFNα) и рибавирином (RBV) пациенты, инфицированные GT3, считались «легко поддающимися лечению» из-за уровня эффективности 70% по сравнению с менее чем 50% у пациентов, инфицированных GT1 и GT4. . Введение противовирусных препаратов прямого действия (ПППД) изменило методы лечения ВГС-инфекции, что позволило существенно повысить эффективность лечения, однако улучшение для инфекции GT3 не было таким выраженным, как для других ГТ, особенно у пациентов, прошедших лечение, и пациенты с циррозом печени.
ГЛОБАЛЬНОЕ РАСПРОСТРАНЕНИЕ GT3
Инфекции GT3 широко распространены во всем мире и, по оценкам, являются вторыми по частоте, на которые приходится примерно 25–30% всех случаев ВГС в мире [ 2 ] . Распространение GT3 варьируется в зависимости от страны и континента. Самая высокая распространенность в мире (более 70%) наблюдается в странах Южной Азии, в то время как около 20% зарегистрированы в Центральной и Юго-Восточной Азии, несколько процентов — в Восточной Азии и только 0.4% в Азиатско-Тихоокеанском регионе. Относительно высокая частота — 36% — зафиксирована в Австралии [ 3 ] . Инфекция GT3 составляет 14,2% случаев ВГС в Южной Америке, 2,1% в Центральной Америке и 15,7% в Северной Америке, варьируясь от 8,9% в США до 22,3% в Канаде [ 3 ] . В Европе распространение инфекций GT3 также неоднородно с самой высокой частотой, превышающей 40% в Скандинавии и Англии, более 30% в Ирландии, Греции, России и Словении и более 20% инфекций в Германии, Швейцарии, Черногории, Бельгии. , Босния и Франция [ 4 – 6 ] .Уровень дюжины процентов зарегистрирован в Испании, Польше, Португалии, Болгарии и Хорватии, тогда как самый низкий уровень распространенности, ниже 10%, зарегистрирован в Италии, Албании, Венгрии и Румынии [ 7 — 10, , ] . Самая низкая пропорциональная частота инфекций GT3 обнаруживается в Африке и составляет в среднем 5,3%, с максимальной частотой 7,4% в Восточной Африке, 6,3% в Северной Африке и 0,8% в центральной части континента [ 3 ] .
ХОРОШО ИЛИ ПЛОХО В СЕМЕЙСТВЕ ВГС
В течение многих лет GT3 считался менее патогенным по сравнению с другими ГТ в семействе ВГС из-за его благоприятного ответа на схему, основанную на ИФН. Однако растущее количество доказательств более высокой частоты стеатоза и более быстрого прогрессирования фиброза печени по сравнению с инфекцией другими ГТ ВГС изменило это убеждение.
Стеатоз печени — частая гистологическая находка у пациентов с хроническим гепатитом С (ХГС). Хотя эта особенность характерна для всех инфицированных ВГС, в среднем 50%, самая высокая распространенность, превышающая 70%, наблюдается у пациентов, инфицированных GT3 [ 11 — 14 ] .В исследованиях in vitro также показано, что GT3 с гораздо большей вероятностью вызывает стеатоз печени, чем другие HCV GT [ 15 ] . Патогенез стеатоза печени сложен и зависит от хозяина и вирусных факторов, а также от употребления алкоголя. Метаболический стеатоз, связанный с факторами риска хозяина, включая высокий индекс массы тела, ожирение, дислипидемию, метаболический синдром, инсулинорезистентность и диабет 2 типа, обычно встречается у пациентов, инфицированных не-GT3 HCV, тогда как у лиц, инфицированных GT3, Связанный с вирусом стеатоз печени описывается как вызываемый преимущественно прямым цитопатическим эффектом HCV [ 16 — 20 ] .Хотя точный механизм остается неизвестным, несколько путей связаны с патогенезом GT3-индуцированного стеатоза. Центральную роль играет ингибирование функции белка-переносчика микросомальных триглицеридов коровым белком HCV, что приводит к общему снижению экспорта липидов гепатоцитов с накоплением внутриклеточных триглицеридов. Документально подтверждено, что этот эффект усиливается коровыми белками HCV-3 [ 21 ] . Другой механизм, посредством которого вирус модулирует метаболические пути липидов хозяина, — это ингибирование рецептора-α, связанного с пролифератором пероксисом (PPAR-α), фактора транскрипции, индуцирующего окисление жирных кислот печени и кетогенез.Снижение уровня PPAR-α приводит к сбору липидов в печени. Исследования in vitro документально подтверждают, что ингибирование PPAR-α, наблюдаемое при инфекциях GT3, является более эффективным, чем при инфекциях GT1 HCV [ 22 ] . Вызываемый вирусами стеатоз печени возникает не только из-за снижения экскреции липидов с последующим накоплением внутриклеточных липидов, но также из-за стимуляции неолипогенеза с синтезом жирных кислот. Предполагается, что эта активность является следствием увеличения функции белка-1c, связывающего регуляторный элемент стерола, активированного коровым белком HCV-3, однако точный способ активации неизвестен [ 23 ] .Гипотеза о патогенной связи между инфекцией GT3 и стеатозом подтверждается значительной корреляцией оценки стеатоза и внутрипеченочного титра РНК HCV только у пациентов, инфицированных GT3 [ 16 ] . Улучшение стеатоза печени у GT3-инфицированных пациентов после успешной противовирусной терапии, которое не наблюдается у пациентов, инфицированных GT1, по-видимому, косвенно подтверждает эту связь [ 24 , 25 ] .GT3 HCV также был идентифицирован как независимый прогностический фактор ускоренного прогрессирования фиброза печени в дополнение к установленным факторам риска, включая возраст инфицирования, мужской пол, коинфекцию вирусом гепатита B и вирусом иммунодефицита человека, инсулинорезистентность, перегрузку железом, алкоголь и наркотики. впуск [ 26 ] . Точный анализ влияния HCV GT на более поздние стадии заболевания печени затруднен из-за сосуществования вышеупомянутых предикторов и ранее обсуждавшейся более высокой распространенности стеатоза печени при инфекции GT3, что способствует более быстрому прогрессированию фиброза печени [ 12 , 27 , 28 ] .Однако объединенный анализ подтвердил значительно более тяжелое заболевание печени в исследованиях одиночной биопсии и тенденцию к более быстрому прогрессированию фиброза у пациентов с GT3 по сравнению с другими GT [ 29 ] . Сильная связь между инфекцией GT3 и терминальной стадией заболевания печени была задокументирована у наркоманов, инфицированных ВГС, во Франции и подтверждена популяционным исследованием в когорте коренных жителей Аляски с CHC [ 30 , 31 ] .
Повышенный риск не только цирроза печени, но и гепатоцеллюлярной карциномы (ГЦК) среди лиц, инфицированных GT3, по сравнению с лицами, инфицированными другими GT, был зарегистрирован в большой когорте (> 110000) американских пациентов из Регистра по делам ветеранов [ 32 , 33 ] . Согласованные результаты значительно более высокой заболеваемости ГЦК у пациентов с GT3 были также получены во французской и корейской популяциях [ 34 , 35 ] .Тем не менее, влияние инфекции HCV GT3 на более высокую распространенность рака печени остается спорным из-за данных, продемонстрированных для GT1b как основного фактора риска развития ГЦК [ 36 , 37 ] .
ПАРА ИФН И РБВ
Стандарт лечебной терапии пегилированным (пег) ИФНα и рибавирином, установленный в 2000 году, привел к устойчивому вирусологическому ответу (УВО) примерно на 70% у пациентов, инфицированных GT3 [ 38 — 42 ] .Такая высокая эффективность по сравнению с УВО ниже 50%, достигаемая у пациентов с инфекцией GT1 и GT4, послужила основанием для признания GT3 «легко поддающимся лечению» и привела к попыткам сократить курс лечения до 16, 14 и даже 12. нед. Однако снижение частоты УВО было зарегистрировано у пациентов, которые не достигли так называемого быстрого вирусологического ответа (БВО), определяемого как неопределяемость РНК ВГС после 4 недель терапии. [ 38 , 39 , 42 — 44 ] .Метаанализ двенадцати клинических испытаний, проведенных Andriulli и др. [ 45 ] , выявил широкие различия в ответе на pegIFNα и RBV у пациентов, инфицированных GT3, в зависимости от исходной вирусной нагрузки. Лица с высоким исходным уровнем РНК ВГС продемонстрировали значительно более низкий уровень УВО — 58% по сравнению с 75% у лиц с низкой исходной вирусной нагрузкой. Самым сильным прогностическим фактором для ответа на лечение был БВО, и это открытие послужило основанием для вывода о том, что пациентам без БВО может потребоваться более длительная продолжительность терапии.Негативное влияние цирроза на реакцию на лечение среди субъектов, инфицированных GT3, приводящее к низкой противовирусной эффективности, было задокументировано Powis et al [ 46 ] , предполагая, что таким пациентам также требуется альтернативная стратегия ведения. Однако продление курса лечения не привело к повышению эффективности, равно как и не произошло улучшения показателя УВО при увеличении дозы рибавирина [ 47 — 49 ] .
ПАРА С МАЛЕНЬКОЙ ПОМОЩЬЮ DAA
Регистрация первых DAA в 2011 году, которые были ингибиторами сериновой протеазы ВГС (неструктурный белок 3 / 4A, NS3 / 4A), положила начало революции в лечении ХГС. Комбинация телапревира или боцепревира с pegIFNα и рибавирином значительно увеличивала частоту УВО, но только у пациентов, инфицированных GT1 [ 50 , 51 ] . Пациенты, инфицированные другими GT, включая GT3, по-прежнему получали лечение pegIFNα и RBV, поскольку после добавления телапревира или боцепревира не было продемонстрировано значительного улучшения [ 52 , 53 ] .Таким образом, в начале эры DAA GT3 превратился в GT, «трудно поддающийся лечению». Новые надежды на более высокую эффективность возникли с введением ПППД следующего поколения для возможной комбинации с pegIFNα и рибавирином. К сожалению, клинические испытания показали, что симепревир, ингибитор протеазы второй волны с документально подтвержденной пангенотипической активностью in vitro, имеет ограниченную эффективность у пациентов, инфицированных GT3, и эффективность даклатасвира (DCV), действующего посредством ингибирования неструктурного белка 5A HCV (NS5A). ), оказался также разочаровывающим: частота УВО составила 45% и 74% у пациентов с GT3 с циррозом печени и без него, соответственно [ 54 , 55 ] .Тем не менее, ожидания более высокого уровня ответа среди пациентов, инфицированных GT3, оправдались софосбувиром (SOF), новым представителем класса DAA, ингибитором полимеразы HCV (NS5B). Добавление SOF к pegIFNα и RBV (SPR) приводит к лучшим результатам по сравнению со стандартной терапией, независимо от фиброза печени и предшествующей противовирусной терапии в анамнезе. В ходе клинических испытаний фазы 2 был подтвержден ответ 83% пациентов с циррозом печени, прошедших лечение и участвовавших в исследовании LONESTAR-2, в то время как пациенты без цирроза печени, не получавшие лечения в исследовании QUANTUM, ответили в 92% случаев [ 56 , 57 ] .
Пациенты, включенные в клиническое испытание BOSON фазы 3, достигли УВО 93%, в частности 88% среди лиц с циррозом печени и 95% среди лиц без него; самая низкая эффективность 86% была продемонстрирована для пациентов с циррозом печени, которые не ответили на предыдущую противовирусную терапию [ 58 ] . Открытое клиническое исследование, оценивающее результаты лечения, содержащего SOF, показало 100% эффективность у пациентов, ранее не получавших лечения, без цирроза печени, инфицированных GT3, и получавших тройную терапию [ 59 ] .
Эти результаты клинических испытаний были подтверждены данными реального опыта (RWE), которые документально подтвердили, что частота УВО выше, чем после двойной терапии. Самый лучший ответ (93%) был зарегистрирован для пациентов без цирроза печени среди американцев, проходивших лечение в системе здравоохранения по делам ветеранов [ 60 ] . Скандинавские пациенты ответили на лечение в 96% случаев, эффективность 98% была получена в польском исследовании EpiTer-2, а УВО достиг 99% в немецкой когорте [ 6 , 61 , 62 , ] .Эффективность режима SPR у пациентов с циррозом в этих исследованиях RWE также была многообещающей, достигая 92%, 81%, 91% и 88% соответственно [ 6 , 60 — 62 ] .
Данные RWE выявили неэффективность предыдущей терапии, при этом наличие в анамнезе лечения ИФН и рибавирином было отрицательным прогностическим фактором ответа на лечение SPR. Этот тройной режим все еще был рекомендован Европейской ассоциацией по изучению печени в 2015 году для пациентов без цирроза печени, инфицированных GT3, и пациентов с компенсированным циррозом печени, независимо от истории лечения [ 63 ] .Несмотря на высокую эффективность SPR, сопровождаемую разумной переносимостью из-за короткого периода лечения, пациенты [ 61 ] отказались от любой терапии на основе IFN. Поэтому дальнейшие исследования по лечению инфекций GT3 были сосредоточены на высокоэффективных терапевтических вариантах без IFN.
DAA HOME ALONE
Первый доступный режим без IFN, SOF и RBV, используемый у пациентов с GT3-инфекцией в течение 12 недель или 16 недель, не привел к повышению эффективности по сравнению со стандартной терапией, которая продемонстрировала значительно более низкую эффективность. Частота ответа у пациентов с циррозом печени, особенно у тех, у кого ранее не проводилась терапия ИФН и рибавирином (таблица 1) [ 40 , 58 , 64 ] .
Таблица 1 Эффективность схем без интерферона у пациентов с генотипом 3 в клинических испытаниях.
| Арт. | Фаза | Число участников GT3 | Режим | Продолжительность лечения | SVR 147 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Не лечился (%) | Прошел лечение (%) | Не лечился (%) | Прошел лечение (%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lawitz и др. [ 40 ] , FISSION | 3 | 173 | SOF + RBV | 12 недель | 61 | — | Якобсон и др. [ 64 ] , POSITRON 9083 1 | 3 | 98 | SOF + RBV | 12 недель | 68 | — | 21 | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jacobson и др. [F ] [F ] | 3 | 127 | SOF + RBV | 12 недель | — | 37 | — | 19 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16 недель | — | 61 | и др. [ 58 ] , BOSON | 3 | 363 | SOF + RBV | 16 недель | 83 | 76 | 57 | 47 | 47 | 90 | 82 | 82 | 77 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zeuzem и др. [ 65 ] , VALENCE | 3 | 250908 31 | SOF + RBV | 24 недели | 95 | 87 | 92 | 62 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Нельсон и другие [ 69 ] 8 9031 | 3 90 152 | SOF + DCV | 12 недель | 97 | 94 | 58 | 69 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лерой и др. [ 70 ] , ALLY | 50 | SOF + DCV + RBV | 12 недель | 100 | 100 | 50 (1/2) | 93 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16 недель | 100 | 100 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poordad и др. [ 71 ] , ALLY-3C | 3 | 78 | SOF + DCV + RBV | 24 недели | — | 79 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эстебан и др. [ 81 ] , NCT02781558 | 2 | 204 | SOF / VEL | 12 недель | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SOF / VE + RBV | 12 недель | — | — | 96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фостер и др. [ 80 ] , ASTRAL-3 | SOF + RBV | 24 недели | 90 | 73 | 71 | 58 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SOF / VEL | 12 недель | 98 | 93 | 91 | 89 | 89 al [ 102 ] , POLARIS-1 | 3 | 78 | SOF / VEL + VOX | 12 недель | — | 100 1 | — 9 0831 | 93 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Якобсон и др. [ 103 ] , POLARIS-2 | 3 | 181 | SOF / VEL | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SOF / VEL + VOX | 8 недель | 99 | — | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Jacobson и др. [ ]| 3 | 219 | SOF / VEL | 12 недель | — | — | 99 | 91 | | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SOF / VEL + VOX | 8 недель | — | — | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bourlière и др. [ 102 ] , POLARIS-4 | 3 | 106 | SOF / VEL | 12 недель 85831 | — | 2 | — | 85% 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SOF / VEL + VOX | 12 недель | — | 96 2 | — | 96 2 | 2 | 41 | SOF / VEL + VOX | 6 недель | — | — | 83 | 25 — | — | 100 | 100 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gane и др. [ 115 ] , NCT02378961 | 2 | 74 | SOF / VEL 908 908 31 | — | — | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8 недель | — | — | 94 | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 недель | — | 100 | 94 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zeuzem и др. [ 92 ] , ENDURANCE-3 | 3 | 505 | GLE / PIB | 8 недель | 95- | 95- | — | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 недель | 95 | — | — | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SOF + DCV | 12 недель | 97 | — | 25 — | и др. [ 93 ] , SURVEYOR-II (часть 2) | 3 | 53 | GLE / PIB | 8 недель | 97 | — | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 недель | — | 92 | — | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wyles и др. [ 94 ] , SURVEYOR-II (часть 3) 3 131 | GLE / PIB | 12 недель | — | 91 | 98 | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16 недель | — | 95 | — | 96 9 811 9 | 3 | 124 | GLE / PIB | 8 недель | — | — | 98 | — | 3 | 14 | GEL / PIB + SOF + RBV | 16 нед. и др. [ 105 ] , ЭЛЕКТРОН-2 | 2 | 101 | SOF / LDV | 12 недель | 64 | — | — | — | -90 0816 | SOF / LDV + RBV | 12 недель | 100 | 89 | — | 73 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Павлоцкий и др. [ 106 ] -2 | 181 | ALV | 24 недели | 76 | — | — | — | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ALV + RBV | 24 недели | 93 | — | — | — | 2 | 21 | OBV / PTV / r | 12 недель | 40 | — | 25 — | 830 — | — | OBV / PTV / r + RBV | 12 недель | 9 | — | — | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Шафран и другие [ 110 ] | 2 | 51 | OBV / PTV / r + SOF | 12 недель | 98 | — | — | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| OBV / PTV / r + SOF + RBV | 91 нед. | — | 100 | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gane и др. [ 107 ] , C-WORTHY (часть D) | 2 | 41 | GZV | 12 недель | 45 | — | — | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 18 недель | 57 | — | — | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 41 | GZR / EBR + SOF | 8 недель | 93 | — | — | — | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 недель | 91 | – | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фостер и др. [ 112 ] , C-ISLE | 2 | 100 | GZR / EBR + SOF | 8 недель | — | — | — | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 недель | — | — | 96 | 100 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16 недель | — | — | — | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 337 | GZR + EBR + UPR ± RBV | 8 недель | 95 | ||||
| 12 недель 97831 | ||||||||
| 16 недель | 96 | |||||||
| Lawitz и др. [ 108 ] , C-BREEZE-2 | 2 | 61 | RZR | 80 | 68 | |||
Увеличение продолжительности лечения до 24 недель позволило повысить эффективность до 95%, однако разница в частоте ответа между пациентами без цирроза печени и с циррозом печени была значительной [ 58 , 65 ] .Результаты клинических испытаний фазы 3, подтвержденные данными RWE, стали основой для руководств по лечению, согласно которым пациенты, инфицированные GT3, не отвечающие критериям IFN, должны получать SOF / RBV в течение 24 недель. Однако этот режим был признан неоптимальным из-за неудовлетворительной эффективности для пациентов с циррозом печени, у которых ранее не проводилась терапия IFN и RBV [ 66 — 68 ] .
В поисках оптимального режима противовирусной терапии были изучены комбинации SOF и другого DAA с другим механизмом действия.Обнадеживающие результаты были получены при применении комбинации SOF и DCV в течение 12 и 24 недель с рибавирином [ 69 — 71 ] . Хотя разница в частоте ответа на SOF + DCV ± RBV между пациентами без цирроза и без цирроза все еще была заметна, этот режим был рекомендован для лечения пациентов с GT3, независимо от фиброза печени и предыдущей терапии в анамнезе, и широко использовался в Настройки RWE [ 66 , 72 — 74 ] .Высокая эффективность и хорошая переносимость, продемонстрированные как в клинических испытаниях, так и в реальных когортах, сделали эту схему разумным выбором для терапии инфекции GT3, пока широко доступны высокоэффективные пангенотипические варианты [ 75 — 77 ] .
ЛУЧШЕ ВРАГ ДОСТОПРИМЕЧАТЕЛЬНОСТИ
Заключительным этапом революции в противовирусной терапии, улучшившей результаты и упростившей ведение пациентов с GT3-инфекцией, стало внедрение мощных пангенотипических схем (Таблица 1).
Согласно последним рекомендациям, в настоящее время одобрены два основных варианта ПППД для лечения инфекции GT3; комбинация фиксированных доз SOF и велпатасвира (VEL) и двойное лечение глекапревиром (GLE), ингибитором протеазы NS3 / 4A, и пибрентасвиром (PIB), ингибитором NS5A (таблица 2) [ 78 , 79 ] . Схема приема одной таблетки, содержащая SOF и VEL, была зарегистрирована на основе результатов исследования ASTRAL-3, которое подтвердило эффективность, превышающую 93% у пациентов без цирроза и 89% у пациентов с циррозом [ 80 ] .12-недельный режим рекомендуется для пациентов без цирроза печени и пациентов с компенсированным циррозом, независимо от предыдущего лечения. Добавление RBV может быть рассмотрено для лиц, получающих компенсацию.
Таблица 2 Текущие рекомендации Европейской ассоциации по изучению печени и Американской ассоциации по изучению заболеваний печени / Американского общества инфекционных заболеваний по лечению пациентов, инфицированных генотипом 3.
| Рекомендации | Генотип / подтип | Статус цирроза | Опыт предшествующего лечения |
Следует отметить, что СОФ / ВЭЛ в сочетании с рибавирином — единственный вариант, рекомендуемый для пациентов с декомпенсированным циррозом печени [ 81 , 82 ] .Данные о высокой эффективности и благоприятном профиле безопасности SOF / VEL, достигнутые в клинических испытаниях, были подтверждены исследованиями RWE, в которых сообщалось о сопоставимых показателях УВО. Предыдущий опыт лечения, а также прогрессирующий фиброз печени были важными предикторами снижения эффективности [ 83 — 87 ] . Поскольку связанные с резистентностью замены в позиции NS5A могут быть ответственны за снижение эффективности ингибиторов NS5A, тестирование связанных с резистентностью замен на исходном уровне следует рассматривать для пациентов, прошедших лечение, и пациентов с циррозом, независимо от истории лечения, для которых SOF / VEL рассматривается.Идентификация замены Y93H указывает на необходимость добавления рибавирина или альтернативного режима приема [ 78 , 79 ] . Второй эффективный пангенотипический вариант — это комбинация GLE и PIB, которая была одобрена для лечения пациентов без цирроза печени или с циррозом печени, независимо от предшествующей терапии. Поскольку схемы, содержащие ингибиторы протеазы, несут риск декомпенсации во время противовирусного лечения, GLE / PIB не рекомендуется для пациентов с декомпенсированным циррозом [ 88 ] .Этот режим дает возможность сократить терапию до 8 недель у большинства пациентов [ 89 ] . На основании результатов клинических испытаний ENDURANCE-3, SURVEYOR-II и EXPEDITION-8, 8-недельный режим был зарегистрирован для всех ранее не леченных пациентов, включая пациентов с компенсированным циррозом печени, в то время как пациенты с GT3-инфекцией, прошедшие лечение, должны лечиться в течение 16 недель независимо от фиброза печени [ 90 — 94 ] .В исследованиях RWE сообщалось об эффективности 8-недельного режима GLE / PIB, которая превышала 96% у ранее не получавших лечения пациентов без цирроза печени [ 95 — 99 ] . Поскольку сокращение продолжительности терапии у ранее нелеченных пациентов с циррозом, инфицированных GT3, было одобрено совсем недавно, доступные данные RWE очень ограничены и включают только небольшое количество пациентов [ 100 , 101 ] .Следовательно, необходимы дальнейшие исследования для определения результатов лечения в этой подгруппе населения. Хотя внедрение схем SOF / VEL и GLE / PIB привело к высокой эффективности среди лиц, инфицированных GT3, все еще есть возможности для улучшения, особенно для тех, кто не достиг УВО, особенно после схем, содержащих NS5A. Для таких пациентов рекомендуется 12-недельная спасательная терапия с использованием комбинации одной таблетки SOF / VEL и ингибитора протеазы NS3 / 4A следующего поколения воксилапревир (VOX). [ 102 ] .Безопасность и эффективность SOF / VEL / VOX у GT3-инфицированных пациентов без цирроза печени и с циррозом печени, как ранее не получавших лечения, так и получавших лечение, были продемонстрированы в исследованиях POLARIS (Таблица 1). [ 102 , 103 ] . Другой вариант решения проблемы неудачного лечения ПППД у пациентов с GT3 — комбинация GLE / PIB плюс SOF и RBV, как это было исследовано в исследовании MAGELLAN-3. Это продемонстрировало 100% УВО, однако небольшое количество включенных в исследование пациентов могло ограничить широкую применимость этих результатов [ 104 ] . ЧТО-ТО ПОШЛО НЕПРАВИЛЬНО На пути к разработке высокоэффективных пангенотипических схем против GT3 было несколько путей, которые оказались тупиковыми. Некоторые из них не были исследованы, несмотря на обнадеживающие первоначальные результаты, из-за неутешительных результатов лечения в отдельных подгруппах пациентов с GT3. Одним из хороших примеров является открытое исследование 12-недельного лечения ингибитором NS5A — ледипасвиром и SOF плюс рибавирин, которое продемонстрировало 100% УВО среди лиц, не получавших лечения, инфицированных GT3.К сожалению, из-за ограниченной эффективности у пациентов, прошедших лечение, особенно с циррозом печени, а также из-за низкой противовирусной активности без RBV в отношении GT3, это направление поиска оказалось тупиком [ 105 ] . Алиспоривир, ингибитор циклофилина, применяемый отдельно или с рибавирином у не получавших лечения пациентов без цирроза печени, привел к показателям УВО 76% и 93% соответственно, однако исследования с участием других подгрупп пациентов были приостановлены из-за проблемы безопасности [ 106 ] .Эффективность была ниже ожиданий при комбинации ингибитора NS3 / 4A гразопревира (GZR) и ингибитора NS5A элбасвира (EBR) с рибавирином, а также схемы, состоящей из ингибитора NS5A рузасвира и ингибитора NS5B уприфосбувира [ 107 , 108 ] . Неудовлетворительный результат лечения ингибитором NS35A омбитасвиром и ингибитором NS3 / 4A паритапревиром, усиленным ритонавиром с рибавирином или без него, впоследствии был улучшен добавлением SOF, но в конечном итоге эти схемы не подвергались дальнейшей оценке, поскольку появились новые эффективные пангенотипические варианты. на горизонте [ 109 , 110 ] .По этой же причине исследования режима GZR / EBR в сочетании с уприфосбувиром или SOF были прекращены, несмотря на высокую эффективность, продемонстрированную в клинических испытаниях фазы 2. Однако GZR / EBR + SOF в настоящее время рекомендованы AASLD / IDSA в качестве альтернативного варианта для конкретной субпопуляции пациентов с компенсированным циррозом печени, получавших pegIFNα + RBV [ 79 , 111 — 113 , ] . ЗАКЛЮЧЕНИЕ Несмотря на высокую эффективность и безопасность пангенотипических методов лечения, которые могут рано или поздно вылечить все или, по крайней мере, почти все выявленные инфекции ВГС, включая GT3, многие инфекции останутся нераспознанными, и поэтому их невозможно вылечить с помощью даже самый лучший препарат.Основная проблема, которую еще предстоит решить во всем мире, — это скрининг людей, которые не знают о риске прогрессирования заболевания печени из-за вируса в их организме. Стыдно для национальных правительств, что, несмотря на доступ к идеальному инструменту для уничтожения опасного вируса и исключения одного из самых трудноизлечимых видов рака, они не делают достаточно. Источник рукописи: Приглашенная рукопись Тип специальности: Гастроэнтерология и гепатология Страна / территория происхождения: Польша Классификация научного качества отчета экспертной оценки Оценка A (отлично): A Оценка B (очень хорошо): B Оценка C (хорошо): 0 Оценка D (удовлетворительная): 0 Оценка E (плохая): 0 P-рецензент: Чиннаканнан С.К., Сайед Т.А. S-редактор: Гао CC L-редактор: A Редактор: Ма YJ Стеатоз печени при инфицировании вирусом гепатита С генотипа 3: коррелирует ли он с индексом массы тела, фиброзом и факторами риска ВГС?Alter MJ, Kruszon-Moran D, Nainan OV и др .: Распространенность инфекции вирусом гепатита C в Соединенных Штатах, 1988–1994 гг. N Engl J Med 341 (8): 556–562, 1999 Google Scholar Вонг В.С., Уайт Д.Г., Палмер С.Р., Александр Г.Дж.: Фиброз и другие гистологические особенности при хронической вирусной инфекции гепатита С: статистическая модель. J Clin Pathol 49 (6): 465–469, 1996 Google Scholar Шойер П.Дж., Ашрафзаде П., Шерлок С., Браун Д., Душейко Г.М.: Патология гепатита С. Гепатология 15 (4): 567–571, 1992 Google Scholar Бах Н., Тунг С.Н., Шаффнер Ф .: Гистологические особенности хронического гепатита С и аутоиммунного хронического гепатита: сравнительный анализ. Гепатология 15 (4): 572–577, 1992 Google Scholar Монто А., Алонсо Дж., Уотсон Дж. Дж., Грюнфельд С., Райт Т.Л .: Стеатоз при хроническом гепатите С: относительный вклад ожирения, сахарного диабета и алкоголя.Гепатология 36 (3): 729–736, 2002 Google Scholar Михм С., Файязи А., Хартманн Х., Рамадори Г.: Анализ гистопатологических проявлений хронической вирусной инфекции гепатита С в отношении генотипа вируса. Гепатология 25 (3): 735–739, 1997 Google Scholar Руббиа-Брандт Л., Леандро Г., Спар Л. и др.: Стеатоз печени при хроническом гепатите С: морфологический признак, указывающий на инфицирование генотипом 3 ВГС.Гистопатология 39 (2): 119–124, 2001 Google Scholar Серфати Л., Андреани Т., Гирал П., Карбонелл Н., Шазуйлер О., Пупон Р.: Гипобеталипопротеинемия, вызванная вирусом гепатита С: возможный механизм стеатоза при хроническом гепатите С. J Hepatol 34 (3): 428–434 , 2001 Google Scholar Адинолфи Л. Е., Утили Р., Андреана А. и др.: Взаимосвязь между генотипами вируса гепатита С и гистопатологическими проявлениями у пациентов с хроническим гепатитом С.Eur J Gastroenterol Hepatol 12 (3): 299–304, 2000 Google Scholar Вестин Дж., Нордлиндер Х., Лаггинг М., Норкранс Г., Вейсталь Р.: Стеатоз ускоряет развитие фиброза с течением времени у пациентов, инфицированных вирусом гепатита С генотипа 3. J Hepatol 37 (6): 837–842, 2002. Google Scholar Брант Е.М.: Оценка и стадирование гистопатологических поражений хронического гепатита: индекс гистологической активности Кноделла и другие.Гепатология 31 (1): 241–246, 2000 Google Scholar Брант Е.М., Дженни К.Г., Ди Бишелье А.М., Нойшвандер-Тетри Б.А., Бэкон Б.Р .: Неалкогольный стеатогепатит: предложение по классификации и стадированию гистологических поражений. Am J Gastroenterol 94 (9): 2467–2474, 1999 Google Scholar Руббиа-Брандт Л., Квадри Р., Абид К. и др.: Стеатоз гепатоцитов — это цитопатический эффект вируса гепатита С генотипа 3.J Hepatol 33 (1): 106–115, 2000 Google Scholar Hofer H, Bankl HC, Wrba F и др .: Накопление гепатоцеллюлярного жира и низкий уровень холестерина в сыворотке у пациентов, инфицированных HCV-3a. Am J Gastroenterol 97 (11): 2880–2885, 2002 Google Scholar Hourigan LF, Macdonald GA, Purdie D и др .: Фиброз при хроническом гепатите C значительно коррелирует с индексом массы тела и стеатозом.Гепатология 29 (4): 1215–1219, 1999 Google Scholar Мория К., Йоцуянаги Х., Шинтани Ю. и др.: Корбовый белок вируса гепатита С вызывает стеатоз печени у трансгенных мышей. J Gen Virol 78 (Pt 7): 1527–1531, 1997 Google Scholar Адинольфи Л.Е., Утили Р., Андреана А. и др .: Уровни РНК ВГС в сыворотке коррелируют с гистологическим поражением печени и совпадают со стеатозом при прогрессировании хронического гепатита С.Dig Dis Sci 46 (8): 1677–1683, 2001 Google Scholar Adinolfi LE, Gambardella M, Andreana A, Tripodi MF, Utili R, Ruggiero G: Стеатоз ускоряет прогрессирование поражения печени у пациентов с хроническим гепатитом C и коррелирует со специфическим генотипом HCV и висцеральным ожирением. Гепатология 33 (6): 1358–1364, 2001 Google Scholar Czaja AJ, Carpenter HA, Santrach PJ, Moore SB: Факторы, специфичные для хозяина и заболевания, влияющие на стеатоз при хроническом гепатите C.J Hepatol 29 (2): 198–206, 1998 Google Scholar Онг Дж. П., Юноси З. М., Спир С., Олано А., Грамлих Т., Бопарай Н.: Хронический гепатит С и наложенная неалкогольная жировая болезнь печени. Печень 21 (4): 266–71, 2001 Google Scholar Lagging LM, Westin J, Svensson E, et al .: Прогрессирование фиброза у нелеченых пациентов с вирусной инфекцией гепатита С.Печень 22 (2): 136–144, 2002 Google Scholar Кумар Д., Фаррелл Г.К., Фунг С., Джордж Дж .: Генотип 3 вируса гепатита С является цитопатическим для гепатоцитов: обращение стеатоза печени после устойчивого терапевтического ответа. Гепатология 36 (5): 1266–1272, 2002 Google Scholar Распространение генотипов вируса гепатита С и связанных факторов риска среди иранских доноров крови: наказуемая логистическая регрессия | Джундишапурский журнал микробиологииЛанини С., Истербрук П.Дж., Зумла А., Ипполито Г. Гепатит С: глобальная эпидемиология и стратегии борьбы. Clin Microbiol Infect . 2016; 22 (10): 833-8. DOI: 10.1016 / j.cmi.2016.07.035. [PubMed: 27521803]. Всемирная организация здоровья. Гепатит С [фактологический бюллетень], 2016 . Женева: Всемирная организация здравоохранения; 2016 г. Мирминачи Б., Мохаммади З., Мерат С., Нейшабури А., Шарифи А.Х., Алавиан С.Х. и др.Обновленная информация о распространенности инфекции вирусом гепатита С среди населения Ирана в целом: систематический обзор и метаанализ. Hepat Mon . 2017; 17 (2). e42291. DOI: 10.5812 / hepatmon.42291. Слово Healh Организация. Глобальный отчет о состоянии безопасности и доступности крови 2016 . Женева: Всемирная организация здравоохранения; 2017 г. Мерфи Д.Г., Саблон Е., Чемберленд Дж., Фурнье Е., Дандавино Р., Тремблей К.Л.Генотип 7 вируса гепатита С, новый генотип, происходящий из Центральной Африки. Дж. Клин Микробиол . 2015; 53 (3): 967-72. DOI: 10.1128 / JCM.02831-14. [PubMed: 25520447]. [PubMed Central: PMC43 ]. Смит Д.Б., Патирана С., Дэвидсон Ф., Лоулор Э., Пауэр Дж., Яп П.Л. и др. Происхождение генотипов вируса гепатита С. J Gen Virol . 1997; 78 (Pt 2) : 321-8. DOI: 10.1099 / 0022-1317-78-2-321. [PubMed: 53]. Петруцциелло А., Марильяно С., Локерчио Дж., Коццолино А., Каччапуоти С. Глобальная эпидемиология вирусной инфекции гепатита С: обновленная информация о распространении и циркуляции генотипов вируса гепатита С. Мир Дж. Гастроэнтерол . 2016; 22 (34): 7824-40. DOI: 10.3748 / wjg.v22.i34.7824. [PubMed: 27678366]. [PubMed Central: PMC5016383]. Африди С.К., Хан Н., Акмал М., Али С., С.А., Бахадар С. и др. Распределение генотипов ВГС и вирусной нагрузки РНК вместе с гематобиохимическим анализом пациентов с ВГС в районах Рахим Яр Хан, Окара и Тоба Тек Сингх в Пенджабе, Пакистан. Hepat Mon . 2017; 17 (7). e58442. DOI: 10.5812 / hepatmon.58442. Орал Зейтинли Ü, Мухтерем Юджел Ф., Далдабан Динчер Ş, Янилмаз О., Аксарай С., Оздил К. Распространение генотипов вируса гепатита С в районе Стамбульской ассоциации государственных больниц северной анатолии. Вирусный гепатит Dergisis . 2017; 23 (2): 64. DOI: 10.4274 / vhd.27146. Гадери-Зефрехи Х., Голами-Фешараки М, Шарафи Х., Садеги Ф., Алавиан С.М.Распространение генотипов вируса гепатита С в странах Ближнего Востока: систематический обзор и метаанализ. Hepat Mon . 2016; 16 (9). e40357. DOI: 10.5812 / hepatmon.40357. [PubMed: 27826320]. [PubMed Central: PMC5097177]. Махмуд С., Аль-Канаани З., Чемайтелли Х., Чаабна К., Куюмджян С.П., Абу-Раддад Л.Дж. Генотипы вируса гепатита С на Ближнем Востоке и в Северной Африке: распространение, разнообразие и закономерности. J Med Virol .2018; 90 (1): 131-41. DOI: 10.1002 / jmv.24921. [PubMed: 28842995]. [PubMed Central: PMC5724492]. Ходабандехлоо М., Рошани Д. Распространенность генотипов вируса гепатита С у иранских пациентов: систематический обзор и метаанализ. Hepat Mon . 2014; 14 (11). e22915. DOI: 10.5812 / hepatmon.22915. [PubMed: 25685164]. [PubMed Central: PMC4310018]. Садеги Ф., Салехи-Вазири М, Алмаси-Хашиани А, Голами-Фешараки М, Пакзад Р., Алавиан С.М.Распространенность генотипов вируса гепатита С среди пациентов в странах Восточно-Средиземноморского регионального бюро ВОЗ (EMRO): систематический обзор и метаанализ. Hepat Mon . 2016; 16 (4). e35558. DOI: 10.5812 / hepatmon.35558. [PubMed: 27274353]. [PubMed Central: PMC48 ]. Sharifi Z, Shooshtari MM, Kermani FR. Идентификация генотипов HCV у доноров крови, инфицированных HCV. Индийский микробиол Дж. . 2010; 50 (3): 275-9.DOI: 10.1007 / s12088-010-0059-0. [PubMed: 23100841]. [PubMed Central: PMC3450055]. Всемирная организация здоровья. Информационный бюллетень по гепатиту С . Женева: Всемирная организация здравоохранения; 2018 г. [обновлено в апреле 2017 г.]. Доступно по адресу: www.who.int/mediacentre/factsheets/fs204/en/. Гауэр Э., Эстес С., Блах С., Разави-Ширер К., Разави Х. Глобальная эпидемиология и распределение генотипов инфекции вируса гепатита С. Дж Гепатол . 2014; 61 (1 приложение): S45-57. DOI: 10.1016 / j.jhep.2014.07.027. [PubMed: 25086286]. Лякина В., Хамид С., Танака Дж., Олафссон С., Шарара А.И., Алавиан С.М. и др. Историческая эпидемиология вируса гепатита С (ВГС) в отдельных странах — том 3. J Viral Hepat . 2015; 22 (S4): 4-20. DOI: 10.1111 / jvh.12475. Роман Ф., Хауотт К., Страк Д., Тернес А.М., Серве Дж.Й., Арендт В. и др.Распределение генотипов вируса гепатита С и факторы риска передачи в Люксембурге с 1991 по 2006 год. World J Gastroenterol . 2008; 14 (8): 1237-43. DOI: 10.3748 / wjg.14.1237. [PubMed: 18300350]. [PubMed Central: PMC26 ]. Павлоцкий Ю.М., Цакирис Л., Рудо-Торавал Ф., Пелле С., Стуйвер Л., Дюваль Дж. И др. Взаимосвязь генотипов вируса гепатита С и источников инфекции у пациентов с хроническим гепатитом С. J Infect Dis .1995; 171 (6): 1607-10. DOI: 10.1093 / infdis / 171.6.1607. [PubMed: 7769300]. Bourliere M, Barberin JM, Rotily M, Guagliardo V, Portal I, Lecomte L и др. Эпидемиологические изменения генотипов вируса гепатита С во Франции: данные о потребителях внутривенных наркотиков. J Вирусный гепат . 2002; 9 (1): 62-70. [PubMed: 11851904]. Эльгоузи М.Х., Бушардо Ф., Пиллонель Дж., Буаре Э., Тиртэн С., Барле В. и др.Вирус гепатита С: пути заражения и генотипы в когорте анти-ВГС-положительных французских доноров крови. Vox Sang . 2000; 79 (3): 138-44. DOI: 10,1159 / 000031231. [PubMed: 11111231]. Салехи Могхадам Ф., Мохебби С.Р., Хоссейни С.М., Романи С., Мирталеби Х., Азимзаде П. и др. Филогенетический анализ штаммов вируса гепатита С и факторов риска, связанных с инфекцией, и вирусных подтипов среди пациентов из Ирана. J Med Virol .2014; 86 (8): 1342-9. DOI: 10.1002 / jmv.23947. [PubMed: 24838700]. Накано Т., Лу Л., Лю П., Пибус О.Г. Последовательности вирусных генов показывают различную историю инфицирования вирусом гепатита С в разных странах. J Заразить Dis . 2004; 190 (6): 1098-108. DOI: 10,1086 / 422606. [PubMed: 15319860]. Simmonds P, Bukh J, Combet C, Deleage G, Enomoto N, Feinstone S и др. Консенсусные предложения по единой системе номенклатуры генотипов вируса гепатита С. Гепатология . 2005; 42 (4): 962-73. DOI: 10.1002 / hep.20819. [PubMed: 16149085]. Cantaloube JF, Laperche S, Gallian P, Bouchardeau F, de Lamballerie X, de Micco P. Анализ 5 ‘некодирующей области по сравнению с областью NS5b при генотипировании изолятов вируса гепатита C от доноров крови во Франции. Дж. Клин Микробиол . 2006; 44 (6): 2051-6. DOI: 10.1128 / JCM.02463-05. [PubMed: 16757597]. [PubMed Central: PMC1489428]. Laperche S, Lunel F, Izopet J, Alain S, Deny P, Duverlie G и др. Сравнение методов секвенирования NS5b вируса гепатита C и 5′-некодирующего гена в многоцентровом исследовании. Дж. Клин Микробиол . 2005; 43 (2): 733-9. DOI: 10.1128 / JCM.43.2.733-739.2005. [PubMed: 15695672]. [PubMed Central: PMC548094]. Резаи Н., Амини-Кафиабад С., Магсудлу М., Аболгасеми Х. Анализ факторов риска серопозитивности к вирусу гепатита С у иранских доноров крови: исследование случай-контроль. Переливание крови . 2016; 56 (7): 1891-8. DOI: 10.1111 / trf.13660. [PubMed: 27273657]. Кермани Ф. Р., Хоссейни К. М., Кафи-Абад С. А., Магсудлу М., Шарифи З., Мансурния М. А. и др. Обновленная информация о способах передачи вируса гепатита С среди добровольных доноров крови из Ирана: анализ сопоставленного исследования случай-контроль с помощью условной логистической регрессии с штрафными санкциями. Гепатит ежемесячно . 2018; 18 (10). DOI: 10.5812 / hepatmon.69395. Сандрес-Сон К., Дени П., Паскье С., Тибо В., Дюверли Г., Изопет Дж. Определение генотипа гепатита С путем анализа последовательности области NS5b. Дж. Вирольные методы . 2003; 109 (2): 187-93. DOI: 10.1016 / S0166-0934 (03) 00070-3. [PubMed: 12711062]. Мансурния М.А., Герольдингер А., Гренландия С., Хайнце Г. Разделение в логистической регрессии: причины, последствия и контроль. Am J Epidemiol .2018; 187 (4): 864-70. DOI: 10.1093 / AJE / kwx299. [PubMed: 2 35]. Гренландия С, Мансурния М.А., Альтман Д.Г. Предвзятость из-за нехватки данных: проблема, которая скрывается на виду. BMJ . 2016; 352 . i1981. DOI: 10.1136 / bmj.i1981. [PubMed: 27121591]. Гренландия S, Мансурния Массачусетс. Наказание, снижение предвзятости и априорные значения по умолчанию в логистических и связанных с ними категориальных регрессиях и регрессиях выживаемости. Stat Med . 2015; 34 (23): 3133-43. DOI: 10.1002 / sim.6537. [PubMed: 26011599]. ван де Лаар Т.Дж., Коппельман М.Х., ван дер Бидж А.К., Заайер Х.Л., Куиджперс Х.Т., ван дер Поэль С.Л. и др. Разнообразие и происхождение инфекции вируса гепатита С среди неоплачиваемых доноров крови в Нидерландах. Переливание крови . 2006; 46 (10): 1719-28. DOI: 10.1111 / j.1537-2995.2006.00961.x. [PubMed: 17002628]. Cantaloube JF, Gallian P, Attoui H, Biagini P, De Micco P, de Lamballerie X. Распределение генотипов и молекулярная эпидемиология вируса гепатита C у доноров крови из юго-восточной Франции. Дж. Клин Микробиол . 2005; 43 (8): 3624-9. DOI: 10.1128 / JCM.43.8.3624-3629.2005. [PubMed: 16081888]. [PubMed Central: PMC1233931]. Даль Молин Г., Ансальди Ф., Бьяджи С., Д’Агаро П., Комар М., Кроче Л. и др. Изменение молекулярной эпидемиологии вирусной инфекции гепатита С в Северо-Восточной Италии. J Med Virol . 2002; 68 (3): 352-6. DOI: 10.1002 / jmv.10210. [PubMed: 12226821]. Chlabicz S, Flisiak R, Kowalczuk O, Grzeszczuk A, Pytel-Krolczuk B, Prokopowicz D, et al. Изменение распределения генотипов ВГС в Польше — отношение к источнику и времени заражения. Дж. Клин Вирол . 2008; 42 (2): 156-9. DOI: 10.1016 / j.jcv.2008.02.001. [PubMed: 18353714]. Чжоу И, Ван Х, Мао Цюй, Фань И, Чжу И, Чжан Х и др.Изменения в способах заражения гепатитом С и генотипах в Юго-Западном Китае. Дж. Клин Вирол . 2009; 46 (3): 230-3. DOI: 10.1016 / j.jcv.2009.08.003. [PubMed: 19729342]. Батт С., Идрис М., Акбар Х., ур Рехман И., Аван З., Афзал С. и др. Изменение эпидемиологической картины и частотного распределения вируса гепатита С в Пакистане. Заразить Genet Evol . 2010; 10 (5): 595-600. DOI: 10.1016 / j.meegid.2010.04.012. [PubMed: 20438863]. Диас П. Т., Хан Дж. А., Делварт Э., Эдлин Б., Мартин Дж., Лум П. и др. Временные изменения в распределении генотипов ВГС в трех различных группах высокого риска в Сан-Франциско, Калифорния. BMC Infect Dis . 2011; 11 : 208. DOI: 10.1186 / 1471-2334-11-208. [PubMed: 21810243]. [PubMed Central: PMC3199778]. Тойода Х., Кумада Т., Такагути К., Шимада Н., Танака Дж. Изменения в распределении генотипов вируса гепатита С в Японии. Эпидемиол. Инфекция . 2014; 142 (12): 2624-8. DOI: 10.1017 / S0950268814000478. [PubMed: 24598252]. Чен В., Ляо Б., Ху Ф, Не Дж., Лан И, Ли Х и др. Изменение эпидемиологии генотипа вируса гепатита С среди пациентов с коинфекцией вируса иммунодефицита человека / вируса гепатита С в Китае. PLoS One . 2016; 11 (9). e0161844. DOI: 10.1371 / journal.pone.0161844. [PubMed: 27603929]. [PubMed Central: PMC5014309]. Асеро Фернандес Д., Ферри Иглесиас М.Дж., Буксо Пухольрас М., Лопес Нуньес С., Серра Матамала I, Керальт Моулес X и др. Изменения в эпидемиологии и распространении генотипов вируса гепатита С в Северо-Восточной Испании за последние 35 лет. Гастроэнтерол Гепатол . 2018; 41 (1): 2-11. DOI: 10.1016 / j.gastrohep.2017.09.004. [PubMed: 2 60]. | Ли В., Си Л., Цай Ц., Кан И, Цзэн Ц., Дин Р. и др.Изменения в распределении генотипов вируса гепатита С и их связь со сдвигом маршрутов передачи в провинции Хэнань, Китай. J Общественное здравоохранение . 2017; 26 (2): 157-62. DOI: 10.1007 / s10389-017-0845-9. Hajia M, Amirzargar A, Khedmat H, Shahrokhi N, Farzanehkhah M, Ghorishi S, et al. Структура генотипирования среди иранских пациентов с ВГС. Иран Дж. Общественное здравоохранение . 2010; 39 (2): 39-44. [PubMed: 23113005].[PubMed Central: PMC3481755]. Джаханбахш Сефиди Ф, Кейвани Х., Монавари С.Х., Алавиан С.М., Фахим С., Бухараи-Салим Ф. Распространение генотипов вируса гепатита С у иранских пациентов с хронической инфекцией. Hepat Mon . 2013; 13 (1). DOI: 10.5812 / hepatmon.7991. [PubMed: 23550108]. [PubMed Central: PMC3582303]. Тахеркхани Р., Фаршадпур Ф. Эпидемиология вируса гепатита С в Иране. Мир Дж. Гастроэнтерол . 2015; 21 (38): 10790-810. DOI: 10.3748 / wjg.v21.i38.10790. [PubMed: 26478671]. [PubMed Central: PMC4600581]. Амини С., Махмуди Фарахани Маджд Абади М., Джоулай М., Ахмадипур М. Распространение генотипов вируса гепатита С в Иране: популяционное исследование. Hepat Mon . 2009; 9 (2): 95-102. Мохтари М, Басирказеруни Х, Ростами М.Корреляция между разными факторами риска гепатита С и разными генотипами. Adv Biomed Res . 2017; 6 : 45. DOI: 10.4103 / 2277-9175.204588. [PubMed: 28503500]. [PubMed Central: PMC5414405]. Фаршадпур Ф, Макванди М, Самарбафзаде АР, Джалалифар Массачусетс. Определение генотипов вируса гепатита С среди доноров крови в Ахвазе, Иран. Индийский журнал J Med Microbiol . 2010; 28 (1): 54-6. DOI: 10.4103 / 0255-0857.58731. [PubMed: 20061766]. Ранджбар Кермани Ф., Шарифи З., Фердоусиан Ф., Паз З., Заманян М. Распространение генотипов вируса гепатита С среди хронически инфицированных потребителей инъекционных наркотиков в Тегеране, Иран. Джундишапур Дж. Микробиол . 2013; 6 (3): 265-8. DOI: 10,5812 / jjm.5191. Ederth J, Jern C, Norder H, Magnius L, Alm E, Rognsvag BK и др. Молекулярная характеристика ВГС в шведском округе за 8 лет (2002–2009 гг.) Выявила различные модели передачи. Инфекция Ecol Epidemiol . 2016; 6 : 30670. DOI: 10.3402 / iee.v6.30670. [PubMed: 26854010]. [PubMed Central: PMC4744866]. Самими-Рад К., Рахимния Р., Садеги М., Малекпур С.А., Марзбан М., Кешвари М. и др. Эпидемический анамнез вируса гепатита С среди пациентов с наследственными нарушениями свертываемости крови в Иране. PLoS One . 2016; 11 (9). e0162492. DOI: 10.1371 / journal.pone.0162492. [PubMed: 27611688]. [PubMed Central: PMC5017697]. Что нужно знать: генотипы гепатита С«Гепатит» означает воспаление печени. Вирус, известный как гепатит С или гепатит С, является наиболее частой причиной. Ученые называют различные типы гепатита С «генотипами». Каждый генотип гепатита С имеет различный генетический состав, который помогает его определить. Существует шесть основных генотипов. Ученые разбивают каждое из этих чисел на подтипы по буквам, например 1a, 1b и т. Д. Некоторые генотипы более распространены в определенных частях мира и лучше поддаются определенному лечению. Какой у вас генотип?В США наиболее распространен генотип 1. Это составляет около 75% всех случаев заболевания в США. Остальные 25% — это в основном генотипы 2 или 3. Некоторые американцы могут иметь генотипы 4, 5 или 6. Генотип 4 наиболее распространен в Африке, а генотип 6 наиболее распространен в Юго-Восточной Азии. Ваш врач может проверить вашу кровь, чтобы узнать, есть ли у вас гепатит С и какой это генотип. У большинства людей он есть. Но у некоторых их больше одного. Ваш врач может назвать это «смешанной инфекцией». ПродолжениеУ вас больше шансов заразиться смешанной инфекцией, если вы:
Имейте в виду, что вы можете быть носителем вируса гепатита С, даже если у вас нет симптомов гепатита. Как только вы узнаете свой статус и генотип, вы и ваш врач сможете принять решение о плане лечения. Как генотипы влияют на лечениеЛекарства, известные как противовирусные препараты прямого действия, или ПППД, останавливают копирование вируса гепатита С. Некоторые ПППД эффективны для лечения всех генотипов гепатита С. Другие работают только над одним или несколькими. Ваш врач, вероятно, пропишет комбинацию этих лекарств: Некоторые таблетки объединяют два препарата в одну. Вы, вероятно, будете принимать эти лекарства от 8 до 12 недель. Но они могут не подходить для всех из-за таких факторов, как стоимость или другие болезни. ПродолжениеВаш конкретный генотип может рассказать вашему врачу важную информацию о том, как использовать эти лекарства, на что обращать внимание и о других лекарствах, которые могут вам понадобиться. Например, у вас может быть больше шансов на цирроз (серьезное рубцевание печени), если у вас есть генотип 1. Генотип 3, второй по распространенности подтип в мире, может не реагировать только на ПППД. Кроме того, этот тип может свидетельствовать о том, что:
Ваш врач может скорректировать или изменить ваше лечение DAA, если у вас есть: Адаптация полиморфизм вируса гепатита С и лямбда-интерферона между несколькими вирусными генотипамиБлагодарим вас за отправку вашей статьи «Повсеместная адаптация вируса гепатита С к полиморфизму лямбда интерферона в нескольких генотипах» на рассмотрение eLife .Ваша статья была рассмотрена четырьмя рецензентами, один из которых является членом нашего Совета редакторов-рецензентов, а оценку контролировал Вэньхуэй Ли как старший редактор. Рецензенты предпочли остаться анонимными. Рецензенты обсудили рецензии друг с другом, и редактор-рецензент подготовил это решение, чтобы помочь вам подготовить исправленную заявку. Резюме: Две статьи Ансари и др. имеют большое отношение к этому представлению.Ранее Ansari et al. сообщили о результатах исследования генома-генома 542 человек, которые были хронически инфицированы вирусным генотипом ВГС (VGT) 3 (преимущественно) или VGT 2. (Nature Genetics, 2017). В совместном представлении с настоящей статьей Ansari et al. . теперь сообщают об анализах, ограниченных подгруппой тех субъектов, которые были инфицированы генотипом 3a HCV. При необходимости, в настоящем документе следует ссылаться на результаты обоих этих документов. В данной статье исследуются связи между генотипом IFNL4 rs12979860 (маркер для rs368234815) и вариациями четырех белков ВГС (NS3, NS4A, NS5A и NS5B) у 8729 пациентов, инфицированных ВГС, участвовавших в клинических испытаниях, проводимых Gilead Sciences.Эти люди были инфицированы целым рядом VGT (1a — 3548; 1b — 1924; 2a- 304; 2b- 472; 3a- 1839; 4a-193). Таким образом, у авторов есть данные, позволяющие повторить выводы Ansari et al. Что касается VGT3, изучите ассоциации с другими VGT и сравните вирусные ассоциации с генотипом IFNL4 в разных VGT. Учитывая богатство этого ресурса, анализ неутешителен; статья требует существенного дополнительного анализа и нового набора цифр. Кроме того, необходимо более четко описать исследуемую популяцию и статистические методы.Со значительными изменениями эта статья могла бы стать важным вкладом в литературу по ВГС. Существенных изменений: Отсутствие номеров строк или страниц затрудняет передачу комментариев. Пожалуйста, добавьте к рукописи номера строк (или хотя бы номера страниц). Контингент и дизайн исследования: Учитывая, что исходные образцы анализируются относительно исходных показателей исходов, это исследование представляет собой поперечное сечение, а не когортный анализ.Следует уточнить терминологию, иначе она вводит в заблуждение. Авторы генотипируют только SNP rs12979860 и, следовательно, не могут различить два гаплотипа, кодирующие белки IFNL4 P70 и IFNL4 S70 в совместном представлении. Это ограничение следует признать в Обсуждении. Номенклатура: В этой статье используется нумерация аминокислотных позиций, специфичная для белков, тогда как Ansari et al. использовать широкую нумерацию вирома. Для сравнения, в настоящий документ должна быть включена широкая нумерация вирома. «генетический полиморфизм в области интерферона» неоднозначен, поскольку в этой области имеется несколько полиморфизмов. «Генотип rs12979860, метка для гаплотипов IFN-λ» или «rs12979860, известный маркер гаплотипов IFN-λ» также неоднозначен и не имеет отношения к делу, поскольку гаплотипы не объясняются и не используются в этой статье. Самый актуальный момент re: rs12979860, что это маркер для rs368234815. Статистический анализ и результаты: Консенсусные вирусные последовательности и склонность к конкретным вирусным вариантам заметно различаются в зависимости от VGT, поэтому ассоциации между генотипом IFNL4 и вирусными вариантами варьируются в зависимости от VGT.Это продемонстрировано в дополнительной таблице 3, в которой представлены основные данные. Отредактированная версия этой таблицы (или производный рисунок) должна быть включена в текст статьи. Организационный принцип представления вариантов HCV в дополнительной таблице 3 неясен. Таблицу следует упростить, ограничив ее результатами аддитивных или рецессивных генетических моделей, исходя из оценки того, какая модель является более подходящей. Учитывая эти наблюдаемые различия в вирусных ассоциациях в разных VGT, нецелесообразно объединять в анализах всех 8729 пациентов.Эти субъекты составляют удобную выборку пациентов, включенных в клинические испытания, которая не представляет собой группу, представляющую внутренний биологический интерес. (Другой набор испытаний среди пациентов с другим распределением VGT даст разные итоговые данные.) Рисунки 1, 2B и 3 следует удалить; Рисунки 1 и 3 следует заменить наборами цифр, относящихся к VGT. В таблице 1 мало информации. Работа должна включать таблицу, описывающую характеристики испытуемых (например,g., пол, возраст, раса, страна регистрации и статус заболевания ВГС), VGT. Представление результатов статистического анализа трудно понять. Авторы должны указать ассоциации. Например, наличие функционального варианта IFNL4 ассоциируется с пролином в положении XXX в вирусном белке Y. Представленные данные о корреляции конкретных аминокислот HCV интересны, но в равной степени недостаточно изучены. Авторы в основном представляют результаты в виде p-значений, однако для оценки величины эффекта также должна быть представлена амплитуда сигналов. Данные, описывающие вирусную нагрузку ВГС, следует проанализировать более подробно и представить более четко. Читатель должен иметь возможность определить, связано ли данное изменение аминокислоты с более высокой или более низкой вирусной нагрузкой, как более высокая или более низкая вирусная нагрузка связана с тремя основными генотипами IFNL и влияние вирусной нагрузки на гетерозиготность. Более четко опишите эффект гетерозиготности для читателя, часто указываются два коэффициента корреляции (рецессивный и аддитивный), но без объяснения, и указывается только p-значение.Данные о вирусной нагрузке следует анализировать более тщательно, в том числе с использованием нескорректированных и скорректированных регрессионных моделей, чтобы проинформировать читателя о влиянии этого конкретного генотипа на вирусную нагрузку. В связи с генотипом хозяина и вирусом, как определялся порог Бонферрони? В логистических моделях, используемых для оценки ассоциаций, каков был результат? Хозяин или вирусный генотип? Были ли модели скорректированы по каким-либо ковариатам? Пожалуйста уточни. Были ли рассмотрены модели, содержащие более одной вирусной аминокислоты, т.е.е. были ли результаты по вирусному анализу взаимно скорректированы, чтобы лучше определить, откуда исходит сигнал? Связь генотипа IFNL4 с частотой полиморфизма ВГС может отражать влияние IFNL4 на скорость репликации вируса. Чтобы оценить эту возможность, исследователи должны сравнить результаты двух моделей логистической регрессии: одной, которая включает, и другой, не включающей РНК HCV в качестве дополнительной ковариаты к IFNL4. В противном случае эти парные модели должны включать идентичные настройки. Вирусная нагрузка — это количественный показатель, и в этих анализах важно использовать правильные методы. Анализ остаточной регрессии (подраздел «Варианты аминокислот ВГС и вирусная нагрузка»): какие здесь сделаны предположения, например нормальное распределение вирусной нагрузки? Изменилась ли вирусная нагрузка? Дополнительная таблица 6 — VL GWAS не упоминается ни в основном тексте, ни в Материалах и методах. Пожалуйста, объясните этот подход в материалах и методах и сносках к таблицам; прокомментируйте различия в p-значениях между анализом VL GWAS и G2G. Обсуждение: Результаты следует обсуждать в контексте имеющихся в литературе сведений о функции rs368234815. HCV приспосабливается не к генетическому полиморфизму, а к своему функциональному эффекту, которым в данном случае, вероятно, является продукция IFN-λ4. Другое: На протяжении всей статьи четко указывайте, что является новым открытием в этой статье и что подтверждает или опровергает две статьи Ансари и др. Дополнительные таблицы должны включать сноски, поясняющие анализ в отношении используемой статистической модели, корректировок и порогов значимости.Также количество испытуемых в каждой подгруппе. Re: title, предложить: Адаптация вируса гепатита С к полиморфизму лямбда-интерферона для нескольких вирусных генотипов. Дополнительные файлы данных: Текущий обмен данными охватывает только вариацию ВГС, но не человеческие генотипы rs12979860 и соответствующие демографические и клинические переменные. Было бы важно сделать этот уникальный набор данных доступным для научного сообщества через контролируемый доступ к dbGAP. В противном случае этот анализ не может быть подтвержден. [Примечание редакции: до принятия были запрошены дополнительные исправления, как описано ниже.] Благодарим вас за повторное представление вашей работы под названием «Адаптация вируса гепатита С к полиморфизму лямбда-интерферона в нескольких вирусных генотипах» для дальнейшего рассмотрения в eLife . Ваша исправленная статья была положительно оценена Венди Гарретт как старшим редактором и редактором-рецензентом. Рукопись была улучшена, но есть некоторые оставшиеся проблемы, которые необходимо решить до принятия, как указано ниже: Резюме: Авторы очень откликнулись на комментарии рецензентов.Пересмотренный документ, который включает существенный дополнительный анализ и новый набор цифр, значительно улучшен. Новый анализ демонстрирует, что большинство ассоциаций между генотипом IFNL4 и вирусными вариантами являются специфическими для вирусного генотипа (VGT), как и следовало ожидать, учитывая, что консенсусные вирусные последовательности и склонность к конкретным вирусным вариантам заметно различаются в зависимости от VGT. Эта статья станет важным вкладом в литературу по ВГС. Существенных изменений: Предыдущие комментарии, требующие дополнительного внимания. 1) Как определялся порог Бонферрони в отношении хозяина и вирусного генотипа? Подробнее о регрессионной модели, а также о пороге значимости можно узнать в разделе «Материалы и методы» (подраздел «Анализ ассоциаций»). К сожалению, этой информации недостаточно. Укажите количество выполненных тестов. Если это число существенно различается для разных анализов, то его следует указывать каждый раз, когда используется поправка Бонферрони. 2) Вирусная нагрузка — это количественный показатель, и в этих анализах важно использовать правильные методы. Анализ остаточной регрессии (подраздел «Варианты аминокислот ВГС и вирусная нагрузка»): какие здесь сделаны предположения, например нормальное распределение вирусной нагрузки? Изменилась ли вирусная нагрузка? Мы действительно использовали преобразование Бокса-Кокса для определения вирусной нагрузки, а затем использовали остаточную вирусную нагрузку, полученную из преобразованной вирусной нагрузки. Подробнее об этом мы добавили в разделе «Материалы и методы» (подраздел «Анализ ассоциаций»). Описание в подразделе «Анализ ассоциаций» гласит: «Мы использовали логистическую регрессию, где интересующим признаком была вирусная нагрузка до лечения, преобразованная по Боксу-Коксу». Однако результаты логистической регрессии обычно представляют собой двоичные переменные. Это утверждение: «GWAS-анализ вирусной нагрузки был выполнен с использованием линейной регрессии между трансформированной вирусной нагрузкой как представляющим интерес признаком и вариациями вирусных аминокислот». Уточните, пожалуйста, что было сделано. Новые комментарии, вытекающие из обширных исправлений. 1) Аннотация должна быть более конкретной. Опишите распределение исследованных вирусных генотипов и некоторые основные выводы. 2) Термин «от генома к геному» кажется неподходящим для этого анализа. «Геном» подразумевает полный набор генетической информации; однако эти анализы включают один человеческий вариант и варианты из выбранного набора белков HCV. 3) Подраздел «Анализ ассоциации вирусной нагрузки», второй абзац — этот текст меня запутал. Предложите следующую редакцию (если она верна): «Затем мы провели поиск ассоциаций между вирусной нагрузкой и аминокислотными переменными ВГС.Эти анализы выявили значимые ассоциации во всех группах вирусного генотипа, кроме 4а (рис. 2). Среди вирусных аминокислот, которые связаны с вирусной нагрузкой, ряд также связан с генотипом rs12979860 (генотип 1a, 9 из x аминокислот; 1b, 5 из x аминокислот; 2a, 0 из x аминокислот; 2b, 0 из x аминокислот. |

 Addiction. 2009 Nov;104(11):1881-90. Epub 2009 Aug 27. PMID:19712125
Addiction. 2009 Nov;104(11):1881-90. Epub 2009 Aug 27. PMID:19712125