Генотипирование и количественное определение РНК гепатита С
Генопирование вируса гепатита С
Вирус гепатита С отличается высокой изменчивостью — способностью к мутациям (изменениям в генетическом строении). Способность к изменению позволяют вирусу ускользать от иммунной системы и затрудняет лечение гепатита С. В действительности, вирус гепатита С — это целый спектр подобных вирусов, которые можно выделить в отдельные подгруппы, которые классифицируют по генотипам и субтипам.
Насчитывают 11 генотипов ВГС, однако в России распространены 3 основных генотипа — 1, 2 и 3, поэтому большинство диагностических центров определяют генотипы (генотипируют) 1, 2 и 3.
Генотипирование (определение генотипа вируса) — один из самых важных анализов. Он позволит предсказать шансы на успешное лечение и поможет врачу определить необходимые дозы препаратов и длительность терапии.
Зачем нужно определять генотип?
Это очень важный анализ.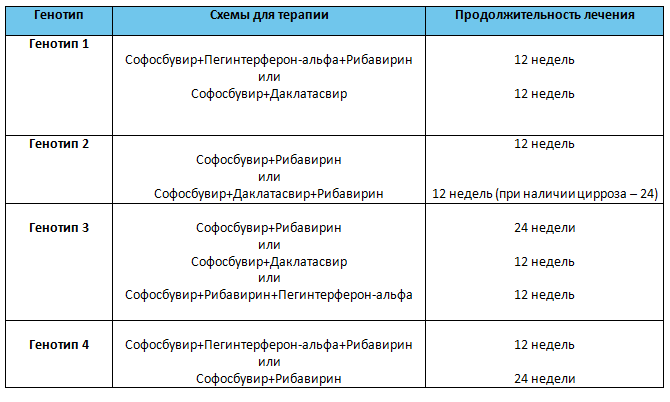 Разные генотипы имеют различную резистентность (устойчивость) к лечению. Так, например, генотипы 2 и 3 лечатся стандартной терапией в течение 24 недель с эффективностью до 85%, а генотип 1 и 4 — 48 недель с эффективностью до 60%.
Разные генотипы имеют различную резистентность (устойчивость) к лечению. Так, например, генотипы 2 и 3 лечатся стандартной терапией в течение 24 недель с эффективностью до 85%, а генотип 1 и 4 — 48 недель с эффективностью до 60%.
Имеет ли значение субтип генотипа, например 1a?
Нет, клинического значения субтип не имеет. Главное·— определить цифру (сам генотип).
Что значит, если в результатах генотипирования стоит
«генотип не типируется»?
Это может быть по двум причинам — у Вас не типичный для нашего региона, «экзотический» генотип HCV или низкая концентрация вирусной РНК в крови.
Может ли генотип измениться с течением времени?
Нет, для этого требуется тысячи лет. У некоторых пациентов имеется 2 и более генотипов, но преобладает один. В таком случае анализом может обнаружиться только один генотип. Бывают случаи, когда у пациентов определяли, к примеру, генотип 3a, а после лечения выявляли генотип 1b.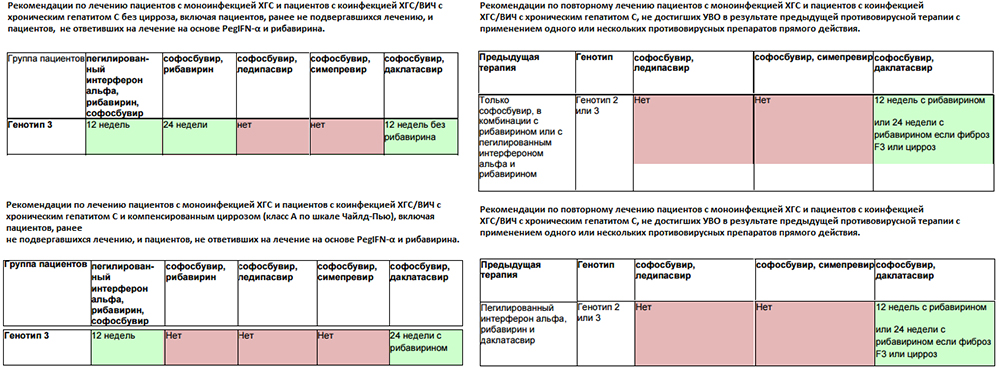 Причиной тому было одновременное присутствие генотипов 3 и 1b. От первого типа удалось избавиться в результате терапии, а второй из-за устойчивости к препаратам оставался в организме.
Причиной тому было одновременное присутствие генотипов 3 и 1b. От первого типа удалось избавиться в результате терапии, а второй из-за устойчивости к препаратам оставался в организме.
Количественное определение РНК гепатита С
Почему важно делать количественное определение РНК вируса гепатита С?
Количественная характеристика содержания РНК вируса гепатита С в клинических образцах важна для оценки эффективности противовирусной терапии и имеет прогностическое значение для определения хронизации этого гепатита. Если концентрация вируса меньше 8х105 МЕ/мл (2х106 копий/мл), то прогноз курса лечения благоприятный, если выше — то рекомендуют использовать другие схемы лечения. Вирусная нагрузка ниже 8х105 МЕ/мл (2х106 копий/мл) наряду с определением генотипа вируса является независимым и самым точным параметром эффективности лечения. Снижение концентрации РНК вируса гепатита С к третьему дню от начала терапии на 85% является быстрым и точным параметром для предсказания эффективности терапии, приводящей к раннему вирусологическому ответу.
Показания к назначению анализа:
Положительный качественный тест на наличие РНК вируса гепатита С в сыворотке крови.
Определение тактики лечения пациентов.
Точная оценка эффективности лечения.
Консультативно-диагностическая поликлиника НПО «ВИРИОН» предлагает широкий спектр современной лабораторной диагностики гепатита С и других заболеваний печени.
| < Предыдущая | Следующая > |
|---|
Лечение гепатита С. Информация о лечении гепатита C
Есть много вещей, которые вы можете сделать, чтобы улучшить свое здоровье и почувствовать себя лучше во время лечения от гепатита С. А если вы хорошо позаботитесь о себе, вы увеличите свои шансы на то, что сможете принимать лекарства в соответствии с предписаниями.
ВАЖНОСТЬ ДИЕТЫ И ПИТАНИЯ
Вопреки некоторым утверждениям, которые вы можете прочитать в Интернете, специальной «диеты против гепатита С» не существует.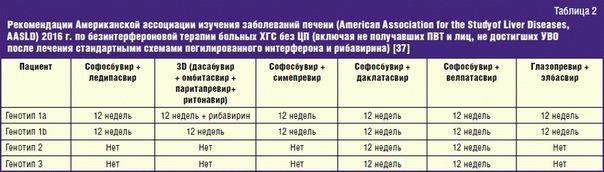 Однако здоровая диета может улучшить здоровье печени у человека с гепатитом С.
Однако здоровая диета может улучшить здоровье печени у человека с гепатитом С.
Хорошо сбалансированная диета может улучшить работу печени и снизить риск цирроза (выраженного рубцевания) печени. Это также может помочь вашей иммунной системе бороться с болезнями. Люди с гепатитом C, как правило, чаще страдают диабетом, но хорошая диета может помочь контролировать уровень сахара в крови и уменьшить жировые отложения, тем самым снижая риск развития диабета.
Многочисленные исследования продемонстрировали пользу употребления кофе для улучшения здоровья печени при гепатите С. Исследования показывают, что для достижения этой пользы вам нужно пить более двух чашек в день. Однако исследования недостаточно сильны, чтобы дать рекомендацию начать пить кофе, и некоторые люди плохо его переносят. А вот тем, кто в настоящее время все же пьет кофе — наслаждайтесь!
Важно правильно питаться, не иметь лишнего веса и избегать употребления алкоголя во время лечения. Напротив, плохая диета иногда может привести к проблемам с печенью. Избыточный вес, употребление слишком большого количества алкоголя, диабет или высокий уровень холестерина или жиров в крови связаны с накоплением жира в печени, что называется «жирная печень»(Или стеатоз). Со временем наличие ожирения печени в дополнение к гепатиту С увеличит вероятность развития цирроза. Самый эффективный способ похудеть — сочетать снижение калорийности с повышенной физической активностью.
Избыточный вес, употребление слишком большого количества алкоголя, диабет или высокий уровень холестерина или жиров в крови связаны с накоплением жира в печени, что называется «жирная печень»(Или стеатоз). Со временем наличие ожирения печени в дополнение к гепатиту С увеличит вероятность развития цирроза. Самый эффективный способ похудеть — сочетать снижение калорийности с повышенной физической активностью.
Хотя соблюдение в целом здоровой диеты и поддержание нормальной массы тела может показаться нецелесообразным лечением гепатита С, это хороший способ защитить вашу печень. Все, что необходимо, — это следовать рекомендациям по питанию, основанным на «Диетических рекомендациях для американцев», если только у вас нет цирроза или другого заболевания, например диабета или заболевания почек, которое может служить основанием для определенных диетических ограничений.
Общие диетические рекомендации включают следующее:
- Поддерживайте здоровое потребление калорий
- Ешьте цельнозерновой хлеб и крупы
- Получайте достаточно белка (при необходимости добавляйте протеиновые напитки)
- Ешьте не менее 5 порций фруктов и овощей в день; употребление в пищу продуктов разного цвета может обеспечить ряд питательных веществ.

- Ограничьте потребление соленой, сладкой и жирной пищи.
- Пейте достаточно жидкости (обычно 6-8 стаканов в день). В дополнение к воде вы можете добавить сок, чай, молоко, суп и замороженные фруктовые батончики.
БУДЬТЕ ОСТОРОЖНЫ ОТНОСИТЕЛЬНО ПИЩЕВЫХ ДОБАВОК
Некоторые витамины и минералы, такие как витамины A и D, железо и ниацин, в больших дозах могут нанести вред вашей печени. Прежде чем принимать витамин или добавку, лучше всего проконсультироваться с врачом, диетологом или диетологом.
СПИРТ
Это токсин для печени даже у людей без гепатита С. Чрезмерное употребление алкоголя может привести к циррозу и серьезным заболеваниям печени. Лучше всего полностью отказаться от алкоголя.
ВАЖНОСТЬ УПРАЖНЕНИЯ
Упражнения важны по многим причинам: они помогают контролировать вес, укрепляют вашу иммунную систему, улучшают аппетит и снимают стресс и депрессию. Хотя идея тренироваться, когда вы чувствуете усталость, может показаться нелогичной, она может улучшить ваше общее чувство благополучия.
Физические упражнения не означают, что вам нужно ходить в тренажерный зал — важны прогулки, садоводство и даже работа по дому. Делайте вещи умеренно. Постарайтесь делать 10-минутные блоки упражнений в течение дня. Лучше всего подходят упражнения с малой нагрузкой, такие как ходьба или плавание. Вы можете начать с 10-минутной прогулки в удобном темпе, при необходимости делать перерывы для отдыха и постепенно повышать уровень активности. Перед тем, как начать диету и программу упражнений, рекомендуется поговорить с врачом.
ВАЖНОСТЬ СНИЖЕНИЯ СТРЕССА И УПРАВЛЕНИЯ ГНЕВОМ
Каждый человек в тот или иной момент испытывает стресс в жизни — работа, финансы, дети, семейные проблемы — все это примеры общих факторов стресса. Наше тело создано для того, чтобы справляться со стрессом, чтобы уберечь нас от опасности или вынести трудный день. Однако стресс может стать проблемой, если он постоянный или интенсивный.
Хронический стресс отрицательно влияет на иммунную систему и способствует возникновению других проблем, таких как высокое кровяное давление, болезни сердца, проблемы со сном и злоупотребление психоактивными веществами.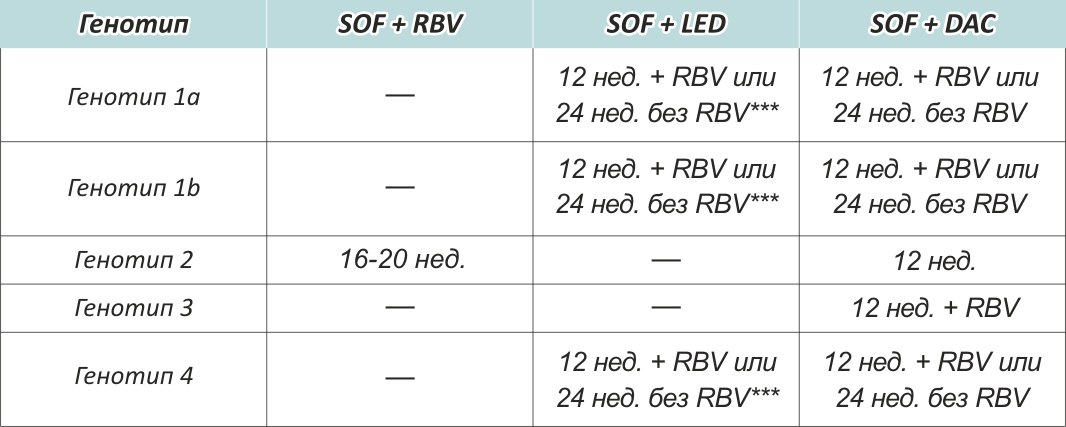 Хроническое заболевание, такое как гепатит С, может вызывать физический и эмоциональный стресс. Лечение гепатита С может добавить дополнительные факторы стресса в зависимости от уровня побочных эффектов, которые вы испытываете. Когда люди находятся в хроническом стрессе, также часто бывает злость.
Хроническое заболевание, такое как гепатит С, может вызывать физический и эмоциональный стресс. Лечение гепатита С может добавить дополнительные факторы стресса в зависимости от уровня побочных эффектов, которые вы испытываете. Когда люди находятся в хроническом стрессе, также часто бывает злость.
Чувство гнева при первом диагнозе болезни — обычная реакция. У вас могли быть мысли вроде «Я этого не заслуживаю!» и «Почему это случилось со мной?» Хотя эти реакции вполне нормальны, гнев, который становится хроническим и / или переходит в ярость, — нет. Проще говоря, это может разрушить ваши отношения и лишить вас энергии, необходимой для хорошей жизни.
Умение справляться со стрессом и гневом является неотъемлемой частью борьбы с инфекцией гепатита С и его лечения. Ниже приведены некоторые стратегии, которые могут вам помочь:
- Найдите способы расслабить и успокоить свой разум. Некоторые люди находят полезными медитацию, молитву, визуализацию или массаж.
- Сделайте что-нибудь физическое в качестве освобождения.
 Танцы, езда на велосипеде, прогулки, йога или любые упражнения могут сохранить ваше здоровье и уменьшить стресс и гнев.
Танцы, езда на велосипеде, прогулки, йога или любые упражнения могут сохранить ваше здоровье и уменьшить стресс и гнев. - Примите участие в группе поддержки гепатита С.
- Помочь другим; иногда помощь другим — лучший способ забыть о собственных проблемах.
- Ставьте перед собой разумные ожидания. Решайте проблемы по одной задаче за раз. Что я должен сделать сегодня? Если это не так важно, вычеркните это из списка.
- Научитесь позволять другим помогать вам, когда вам это нужно.
- Проводите время с людьми, которые позитивно относятся к жизни, и ограничьте свое общение с людьми и местами, которые вызывают негатив.
- Посещайте занятия по управлению стрессом и / или гневом. Их часто предлагают работодатели, медицинские страховые компании или общественные центры.
- Найдите способ посмеяться. Неважно, смотрите ли вы веселый фильм или проводите время с хорошим другом, помните, что смех оказывает лечебное воздействие как на тело, так и на ум.
- Постарайтесь придать положительный оттенок вещам и не переживайте по мелочам.
 Практикуйте позитивное мышление, заменяя негативные мысли посланиями надежды и утверждения.
Практикуйте позитивное мышление, заменяя негативные мысли посланиями надежды и утверждения. - Обсудите свои чувства с людьми, которым доверяете. Иногда другие могут предложить другую точку зрения или решение того, что у вас на уме. Или подумайте о том, чтобы обратиться за помощью к специалисту по психическому здоровью.
Для пациентов с 3 генотипом вируса гепатита C появилось эффективное лекарство
Препарат глекапревир/пибрентасвир доказал свою эффективность и переносимость у пациентов с 3 генотипом вируса гепатита C, независимо от наличия цирроза или предыдущего опыта лечения.
В исследование, результаты которого были опубликованы в научном журнале Journal of Viral Hepatology, были включены данные, полученные в ходе пяти клинических испытаний 2 или 3 фазы. Общее количество участников составило 693 человека.
95% наивных пациентов без цирроза достигли устойчивого вирусологического ответа в течение 12 недель после окончания курса терапии (УВО12). В группе пациентов, принимавших препарат в течение 8 недель, УВО12 достигли 198 пациентов из 208, в группе, получавшей 12-недельный курс, — 280 из 294.
В группе пациентов, принимавших препарат в течение 8 недель, УВО12 достигли 198 пациентов из 208, в группе, получавшей 12-недельный курс, — 280 из 294.
В группе наивных пациентов с циррозом, получавших препарат в течение 12 недель, УВО12 достигли 97% (67 человек из 69). Об этом сообщает портал Infectious Disease Advisor.
Среди людей, ранее проходивших лечение интерферон- или софосбувир-содержащей терапией, 90% пациентов без цирроза, получавших глекапревир/пибрентасвир в течение 12 недель, достигли УВО12 (44 человека из 49). В аналогичной группе, получавшей препарат в течение 16 недель, УВО12 достигли 95% пациентов (21 из 22).
Среди пациентов с циррозом, получавших препарат в течение 16 недель, УВО12 достигли 94% (48 из 51).
Согласно выводам исследователей, применение глекапревира/пибрентасвира рекомендовано в течение 8 и 12 недель наивным пациентам как с циррозом, так и без него, и в течение 16 недель пациентам, имеющим опыт лечения, независимо от наличия или отсутствия цирроза.
3 генотип вируса гепатита C является вторым по распространенности (после 1 генотипа) на территории России. Препарат глекапревир/пибрентасвир, выпускаемый фармацевтической компанией AbbVie, зарегистрирован в нашей стране под торговым наименованием «Мавирет». В список Жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) в настоящее время не входит.
причины, симптомы и лечение в Москве
Гепатит С с генотипом 1 считается самым агрессивным типом заболевания, который очень быстро перетекает в хроническую форму. Болезнь чрезмерно устойчива к терапии противовирусными и интерферонными препаратами, поэтому такой тип гепатита С сложно поддается лечению и склонен к частым рецидивам. Лечение гепатита С с генотипом 1 осуществляется под строгим контролем врача.
Генотип 1 гепатита С: особенности и субтипы
У первого генотипа выделяют три субтипа:
Вирус гепатита С с генотипом 1 стремительно мутирует и видоизменяется, обладает повышенной устойчивостью к иммунным функциям организма и проводимой противовирусной терапии. Лечение гепатита с генотипом 1в самое сложное и непредсказуемое. Дело в том, что этот субтип в большинстве случаев стремительно перетекает в хроническую форму, приводя к серьезным осложнениям, таким как:
Лечение гепатита с генотипом 1в самое сложное и непредсказуемое. Дело в том, что этот субтип в большинстве случаев стремительно перетекает в хроническую форму, приводя к серьезным осложнениям, таким как:
- фиброз;
- цирроз;
- онкология.
В 80% случаев субтип 1в диагностируется у пациентов, которым проводили переливание крови. Даже после успешного окончания лечения 1b, не исключены риски скорого рецидива.
Болезнь протекает в несколько стадий, каждая из которых проявляется специфической и неспецифической симптоматикой:
- Острая. Характеризуется стремительным прогрессированием воспалительного процесса в тканях органа и может длиться около шести месяцев. Симптоматическая картина может быть смазанной или острой, проявляющейся такими симптомами: увеличение температуры, тошнота, желтуха, боли в подреберье справа.
- Носительство. Случается и так, что после проникновения вируса РНК в организм заражение на происходит. В таких ситуациях вирус в крови идентифицируется, однако инфицирование не происходит и патологическая симптоматика полностью отсутствует.
 Носитель не болеет сам, но может заражать других людей.
Носитель не болеет сам, но может заражать других людей. - Латентная. Разрушительные процессы в тканях печени прогрессируют, однако ярковыраженная симптоматика отсутствует.
- Клиническая. Самый тяжелый период болезни, при котором вирус максимально активно себя проявляет, провоцируя резкое ухудшение состояния и развитие такой патологической симптоматики, как: тошнота с частыми приступами рвоты, стремительная потеря веса, быстрая утомляемость, слабость.
Больные с клинической фазой нуждаются в экстренной госпитализации, так как требуют специфического лечения под строгим наблюдением специалиста.
Лечение гепатита с 1 генотипом
Гепатит С с 1 генотипом сложно поддается консервативной терапии. Эффективность лечения зависит от разных факторов:
- степень запущенности патологии;
- уровень вирусной нагрузки;
- адекватность подобранной терапии;
- соблюдение требований врача.
Схема лечения такой формы гепатита предполагает применение таких комбинаций медпрепаратов:
- «Софосбувир»-«Рибавирин»-«Пегинтерферон».
 Длительность лечения составляет в среднем 3 месяца.
Длительность лечения составляет в среднем 3 месяца. - «Софосбувир»-«Ледипасвир» («Даклатавир» или «Велпатасвир»). Продолжительность лечения более двенадцати недель.
1а, 1b, 2, 3a, 4 — ОВУМ – медицинская лаборатория в Кемерοво
Вирус гепатита С является РНК — содержащим вирусом семейства флавивирусов. Вирус поражает клетки печени, приводит к развитию острых и хронических гепатитов.
Вирус гепатита С генетически неоднороден, выделяют 6 генотипов и множество субтипов вируса. Наиболее распространенными в России являются 1,2 и 3 генотипы.
Генотипирование вируса гепатита С — это определение генотипа вируса, исследование проводится методом ПЦР в режиме реального времени, дифференцируются основные наиболее распространенные генотипы 1а, 1b, 2, 3a,4.
Кому показано проведение генотипирования вируса гепатита С
Генотипирование должно выполняться всем пациентам с вирусным гепатитом С, имеющим положительный результат анализа на РНК вируса гепатита С в крови. Исследование проводится до начала лечения противовирусными препаратами, чтобы определить тактику лечения.
Исследование проводится до начала лечения противовирусными препаратами, чтобы определить тактику лечения.
Генотип определяет:
- особенности течения заболевания,
- эффективность и продолжительность противовирусной терапии,
- частоту перехода инфекции в хроническую форму и исход инфекции.
Считается, что генотип 1b является более устойчивым к противовирусной терапии и вызывает развитие заболевания с более высоким риском перехода заболевания в хроническую форму.
Результата анализа
В результате анализа указывается выявленный генотип или генотипы вируса.
Генотип может не определиться в случае низкой концентрации вируса в крови.
Генотип может не определиться при инфицировании редкими генотипами, выявление которых не включено в данный тест.
Полученный результат исследования обязательно должен интерпретировать лечащий врач с учетом всех данных о состоянии здоровья пациента, комплекса проведенных лабораторных анализов, принимаемых лекарственных средствах.
Фосфоглив® при гепатите С: лечение гепатита
Хронический вирусный гепатит С – это хроническое заболевание печени, обусловленное инфицированием вирусом гепатита С. Процесс продолжается более 6 месяцев. При этом в ткани этого органа развивается воспаление и фиброз (разрастание соединительной ткани).
По данным официальной статистики, в Российской Федерации насчитывается около 5 миллионов больных хроническим вирусным гепатитом С. По неофициальным данным эта цифра может быть в 3–6 раз выше. Ежегодно регистрируется более 40 тысяч новых больных хроническим вирусным гепатитом С. При отсутствии эффективного лечения в 10–20 % случаев инфицирования в течение 20–30 лет развивается цирроз печени.
Вирус гепатита С (HCV) является РНК-вирусом из семейства Flaviviridae, представленным семью генотипами. Наиболее распространенным в мире является 1-ый генотип, в Европе и в России –1b. Кроме того, достаточно высокую распространенность в нашей стране имеют 2-й и 3-й генотипы вируса гепатита С.
Основные факторы риска заражения вирусом
- Внутривенное введение наркотических средств;
- сексуальные контакты с лицами, применяющими внутривенные наркотики;
- гемодиализ;
- мужской гомосексуализм;
- переливание крови;
- беспорядочные половые связи;
- медицинские манипуляции.
Заражение происходит парентерально, то есть через кровь. Попадая в кровоток, вирус гепатита С достигает печени, проникает в ее клетки – гепатоциты – и размножается. После выхода из гепатоцитов новые вирусные частицы заражают здоровые клетки печени.
Поражение вирусом гепатита С осуществляется неколькими механизмами. Во-первых, активированные присутствием в организме вируса гепатита С клетки иммунной системы (Т-лимфоциты), направленные на его уничтожение, повреждают и инфицрованные гепатоциты. Во-вторых, клетки печени, в которые проник вирус гепатита С, воспринимаются иммунной системой, как чужеродные и она стремится от них избавиться. В-тертьих, белки вируса гепатита С обладают прямым повреждающим действием на гепатоциты, стимулируя воспаление и фиброз.
В-тертьих, белки вируса гепатита С обладают прямым повреждающим действием на гепатоциты, стимулируя воспаление и фиброз.
Для вирусного гепатита С характерна высокая частота хронизации. Острый инфекционный процесс, начавшийся после проникновения вируса гепатита С в кровь, переходит в хронический в 50-90 % случаев. Это связано с двумя особенностями возбудителя инфекции. Первая из них – высокая способность вируса гепатита С к размножению; вторая – не менее высокая способность к мутациям. То есть, постоянно мутируя, вирус гепатита С «ускользает» от иммунной системы, не позволяя организму избавится от себя.
Симптомы вирусного гепатита
Симптомы вирусного гепатита С неспецифичны, что серьезно затрудняет раннюю диагностику и своевременное начало лечения. Возможно появление слабости, тошноты, болей в мышцах и суставах, повышенной утомляемости, снижения массы тела. При наличии подобных проявлений, которые могут быть симптомами вирусного гепатита С, следует как можно раньше обратиться к врачу.
Не стоит забывать о том, что чаще всего вирусный гепатит С протекает без каких-либо симптомов. Несмотря на это, воспаление и фиброз продолжают прогрессировать, что в итоге может привести к циррозу печени. Поэтому хронический вирусный гепатит С часто называют «ласковым убийцей». Проблемой является и то, что течение болезни и темпы ее прогрессирования крайне изменчивы и непредсказуемы. В одном случае до развития цирроза на фоне вирусного гепатита С проходит несколько десятков лет, в другом, цирроз может сформироваться в течение года.
Диагностика хронического вирусного гепатита С
Основными методами диагностики являются лабораторное определение антител к вирусу гепатита С (anti-HCV) при помощи иммуноферментативного анализа (ИФА) и определение РНК вируса гепатита С в крови (HCV RNA) с помощью полимеразной цепной реакции (ПЦР). Первый метод предназначен, прежде всего, для скрининга; второй позволяет определить количество вируса гепатита С в крови – вирусную нагрузку и его генотип, что имеет прогностическое значение и определяет выбор тактики лечения. Оценка выраженности фиброза осуществляется при помощи биопсии или неинвазивных тестов (эластометрия, «фибротест», «фиброметр»).
Оценка выраженности фиброза осуществляется при помощи биопсии или неинвазивных тестов (эластометрия, «фибротест», «фиброметр»).
Что касается уровня аланинаминотрансферазы – фермента, считающегося универсальным маркером неблагополучия печени – при хроническом вирусном гепатите С его диагностическая ценность невелика. Уровень аланинаминотрансферазы имеет волнообразную динамику, то есть, на том или ином этапе течения болезни показатель в пределах нормальных значений может быть обманчивым.
Лечение заболевания
Лечение вирусного гепатита С – нелегкая задача. Необходимо отметить, что терапией данного заболевания должен заниматься только опытный специалист – врач-инфекционист или гепатолог.
В качестве основных средств, используемых при лечении вирусного гепатита С выступают противовирусные препараты. До недавнего времени были доступны только препараты интерферона – стандартного и пегилированного (длительного действия). За последние годы в лечении гепатита был достигнут значительный прогресс – появились более эффективные лекарства, влияющие непосредственно на размножение вируса.
Вместе с тем нельзя забывать о том, что лечение гепатита С не всегда бывает эффективным, даже при использовании современных лекарственных средств. Могут быть противопоказания для назначения лечения или его непереносимость. В некоторых случаях терапия гепатита С не назначается сразу, так как требуется ожидание, которое может составлять месяцы или даже годы. Иногда боязнь возможных побочных эффектов и длительность лечения заставляют необоснованно отказаться от противовирусных препаратов.
Но, к сожалению, пациентов с гепатитом С, которым не требуется лечение, нет. Это связано с тем, что заболевание прогрессирует, независимо от наличия симптомов и их выраженности. Во избежание развития цирроза, при невозможности по тем или иным причинам принимать препараты, действие которых направлено на уничтожение вируса гепатита С, следует принимать лекарства, способные защитить печень от неблагоприятных последствий инфекции.
Фосфоглив* – это не только средство для восстановления клеток печени, но и борьба с причиной их разрушения!
Одним из препаратов, показанных для патогенетического лечения вирусного гепатита С, является Фосфоглив*. Его активный компонент, обуславливающий целесообразность назначения при гепатите С, – это глицирризиновая кислота, обладающая противовоспалительным и антифиброзным действием. Клинический эффект, а также благоприятный профиль безопасности препарата доказаны исследованиями. *Помните, что диагностировать вирусный гепатит и назначить соответствующее лечение может только врач!
Его активный компонент, обуславливающий целесообразность назначения при гепатите С, – это глицирризиновая кислота, обладающая противовоспалительным и антифиброзным действием. Клинический эффект, а также благоприятный профиль безопасности препарата доказаны исследованиями. *Помните, что диагностировать вирусный гепатит и назначить соответствующее лечение может только врач!
ХГС: Буеверов А.О. Глицирризиновая кислота: патогенетическая терапия хронического гепатита С у особых групп пациентов // Клинические перспективы гастроэнтерологии, гепатологии – 2014. — № 4. – С. 3-9.1
Схема равидасвир + софосбувир демонстрирует эффективность в лечении всех генотипов гепатита С
Эффективность и безопасность равидасвира и софосбувира у пациентов с хронической инфекцией гепатита С (ВГС) без цирроза или с компенсированным циррозом изучалась в двухэтапном открытом многоцентровом несравнительном исследовании фазы 2/3 STORM-C-1[1]. Результаты были опубликованы в апреле 2021 года в журнале The Lancet.
Результаты были опубликованы в апреле 2021 года в журнале The Lancet.
В исследовании принимали участие пациенты с ВГС с компенсированным циррозом (F4 по шкале Metavir и класс А по Чайлд-Пью) или без цирроза (F0-3 по шкале Metavir) в возрасте 18-69 лет, независимо от генотипа ВГС, наличия ВИЧ-инфекции и предыдущего опыта лечения схемами на основе интерферона или пути инфицирования ВГС.
Пациенты без цирроза и пациенты с циррозом получали схему равидасвир (200 мг) и софосбувир (400 мг) с режимом приема один раз в день в течение 12 недель и 24 недель соответственно. Первичной конечной точкой исследования был устойчивый вирусологический ответ через 12 недель после начала лечения (УВО12; РНК ВГС <12 МЕ/мл в Таиланде и РНК ВГС <15 МЕ/мл в Малайзии через 12 недель после окончания лечения).
В период с 14 сентября 2016 года по 5 июня 2017 года 301 пациент был включен в первый этап исследования. У 98 пациентов (33%) был генотип 1a, у 27 (9%) – 1b, у 2 (1%) пациентов – генотип 2, у 158 (52%) – генотип 3, у 16 (5%) – генотип 6. У 81 пациента (27%) был компенсированный цирроз печени, у 90 (30%) была ко-инфекция ВИЧ и 99 (33%) ранее получали лечение на основе интерферона.
У 81 пациента (27%) был компенсированный цирроз печени, у 90 (30%) была ко-инфекция ВИЧ и 99 (33%) ранее получали лечение на основе интерферона.
Из 300 пациентов, данные которых использовались для анализа, 291 (97%) человек достиг УВО12. УВО12 был зарегистрирован у 78 (96%) из 81 пациента с циррозом печени и у 153 (97%) из 158 пациентов с генотипом 3, в том числе у 51 (96%) из 53 пациентов с циррозом. Показатели УВО12 у пациентов с сопутствующей ВИЧ-инфекцией и у тех, кто проходил в прошлом лечение интерфероном, не отличались от остальных групп.
Полученные результаты: Комбинация равидасвир + софосбувир показала очень высокую эффективность и хорошую переносимость у этой достаточно разнородной взрослой популяции пациентов с хроническим ВГС. Схема равидасвир + софосбувир может стать дополнительным доступным, простым и эффективным инструментом для широкомасштабных программ лечения, направленных на элиминацию вирусного гепатита С.
Исследование проводилось в клинических центрах Таиланда и Малайзии. Малайзия находится в числе стран, которые планируют полностью искоренить эпидемию вирусного гепатита С к 2025 году. Это стало возможным в том числе благодаря резкому снижению цены на пангенотипные пероральные схемы лечения за счет выдачи принудительной лицензии на софосбувир[2].
Малайзия находится в числе стран, которые планируют полностью искоренить эпидемию вирусного гепатита С к 2025 году. Это стало возможным в том числе благодаря резкому снижению цены на пангенотипные пероральные схемы лечения за счет выдачи принудительной лицензии на софосбувир[2].
Россия получила право на использование аналогов равидасвира в 2017 году – в рамках лицензионного соглашения между Патентным пулом лекарственных средств и египетской компанией «Фарко»[3]. Если исследования равидасвира завершатся успешно, то пациенты России смогут получить доступ к еще одной пангенотипной схеме, потенциально более дешевой, чем уже имеющиеся на рынке. Это будет важным фактором для успешной реализации плана элиминации ВГС в России, о котором недавно говорил президент России В. Путин в послании Федеральному собранию[4].
[1] Исследование зарегистрировано на сайте ClinicalTrials.gov, номер NCT02961426, и в Национальном реестре медицинских исследований Малайзии, NMRR-16-747-29183.
[2] https://myhepcservices.com/wp-content/uploads/2021/03/Report-On-Access-To-HCV-Treatment-Barriers.pdf, стр. 2
[3] https://itpcru.org/2017/04/21/patentnyj-pul-i-farko-zaklyuchili-soglashenie-po-novomu-preparatu-dlya-lecheniya-gepatita/
[4] https://itpcru.org/2021/04/22/gepatit-s-v-rossii-nuzhna-naczionalnaya-strategiya/
клинических характеристик, текущие и новые вирусные ингибиторы, проблемы будущего
Реферат
Вирус гепатита С (ВГС) представляет собой глобальное бремя для здравоохранения, от которого страдают более 150 миллионов человек во всем мире. В прошлом генотип 3 HCV считался трудным для лечения по сравнению с другими генотипами. Генотип 3 связан с более высоким уровнем осложнений, включая жировую болезнь печени, фиброз, гепатоцеллюлярную карциному и смертность. Однако с появлением противовирусных препаратов прямого действия первого и второго поколений генотип 3 можно эффективно лечить.Кроме того, эти новые препараты хорошо переносятся пациентами и имеют значительно меньше побочных эффектов по сравнению со схемами на основе рибавирина и интерферона. Однако, несмотря на то, что были достигнуты большие успехи в преодолении биологических барьеров, наша следующая задача заключается в преодолении экономических и финансовых препятствий, если мы хотим искоренить генотип 3 ВГС. Здесь мы рассматриваем клинические особенности, связанные с генотипом 3 ВГС, текущие и новые схемы лечения. , и проблемы, связанные с лечением.
Однако, несмотря на то, что были достигнуты большие успехи в преодолении биологических барьеров, наша следующая задача заключается в преодолении экономических и финансовых препятствий, если мы хотим искоренить генотип 3 ВГС. Здесь мы рассматриваем клинические особенности, связанные с генотипом 3 ВГС, текущие и новые схемы лечения. , и проблемы, связанные с лечением.
Ключевые слова: Гепатит С, генотип 3, устойчивый вирусный ответ, противовирусные препараты прямого действия, лечение
Введение
Вирусный гепатит С (ВГС) поражает примерно 71 миллион человек во всем мире [1].Одноцепочечный РНК-вирус семейства Flaviviridae , HCV является основной причиной хронических заболеваний печени во всем мире [2-6]. Как растущая угроза общественному здоровью, ВГС является одной из основных причин инвалидности, заболеваемости и смертности во всем мире [7]. Ежегодно около 700 000 человек умирают от связанных с ВГС осложнений, включая цирроз, гепатоцеллюлярную карциному (ГЦК) и печеночную недостаточность [8].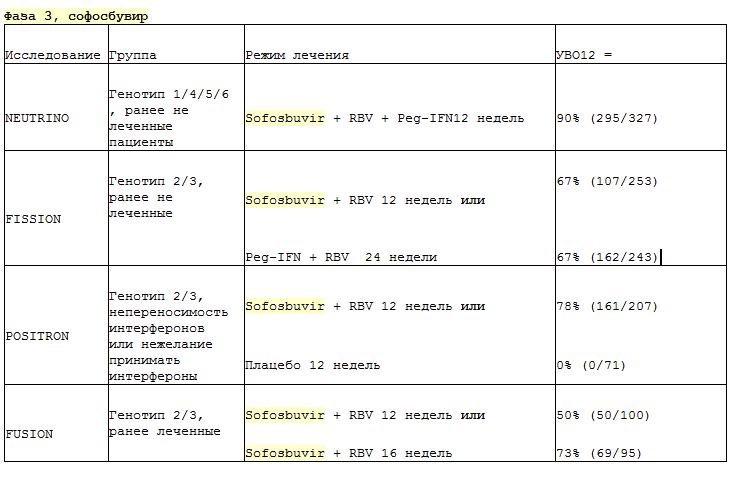 К сожалению, многие люди с ВГС узнают о своей инфекции только тогда, когда у них развиваются симптомы цирроза или рака печени.По оценкам, 21% остро инфицированных пациентов остаются недиагностированными, а 75–85% становятся хронически инфицированными [9]. В результате были возобновлены международные усилия, направленные на снижение глобального бремени вирусного гепатита, в том числе глобальная стратегия сектора здравоохранения Всемирной организации здравоохранения (ВОЗ) по вирусному гепатиту на 2016–2021 годы [10].
К сожалению, многие люди с ВГС узнают о своей инфекции только тогда, когда у них развиваются симптомы цирроза или рака печени.По оценкам, 21% остро инфицированных пациентов остаются недиагностированными, а 75–85% становятся хронически инфицированными [9]. В результате были возобновлены международные усилия, направленные на снижение глобального бремени вирусного гепатита, в том числе глобальная стратегия сектора здравоохранения Всемирной организации здравоохранения (ВОЗ) по вирусному гепатиту на 2016–2021 годы [10].
На основании анализа геномной последовательности существует семь основных генотипов (HCV 1-7), включая 67 подтвержденных и 20 предварительных подтипов [11]. Генотип важен не только для прогнозирования ответа на терапию, но и для прогнозирования риска прогрессирования заболевания [12].Генотип 3 считается наиболее плохо изученным генотипом и имеет самый низкий уровень устойчивого вирусологического ответа (УВО) в эпоху пегилированного интерферона [13]. Генотип 3, который считается одним из наиболее трудных для лечения подтипов, имеет более высокую скорость прогрессирования заболевания и смертности по сравнению с другими генотипами [13,14]. Согласно метаанализу, ускоренное прогрессирование фиброза печени, связанное с генотипом 3, имело отношение шансов 1,52 в исследованиях с одной биопсией по сравнению с другими генотипами, что свидетельствует об ускоренном фиброзе [15].Более того, инфекция генотипа 3 связана с более высокой частотой ГЦК [16]. Таким образом, за последние 20 лет появились более эффективные методы лечения для борьбы с вирулентностью генотипа 3.
Методология
Исследования, опубликованные в период с января 2000 года по январь 2018 года, искали в электронных базах данных в соответствии с названиями статей, содержанием аннотаций и актуальностью в область вирусного гепатита C генотипа 3. Базы данных, использованные в этом обзоре, включали PubMed, MEDLINE, Embase, Google Scholar, Scopus, ClinicalTrials.gov и Кокрановские базы данных. Основными используемыми поисковыми запросами были генотип 3 гепатита С, эпидемиология, частота инфицирования, стеатоз, фиброз, коинфекция ВИЧ, ГЦК, инсулинорезистентность (ИР), метаболизм липидов, лечение и клинические испытания. Мы также вручную провели поиск ссылок, чтобы найти дополнительные релевантные исследования. Статьи, опубликованные на языках, отличных от английского, были исключены.
Клинические особенности
Эпидемиология
Генотип 3 составляет 20% всех инфекций ВГС во всем мире [17].Это второй по распространенности генотип в мире, поражающий примерно 54,3 миллиона человек, причем примерно 75% случаев приходится на Восточную Азию [18]. Генотип 3 отвечает за 54-80% всех инфекций ВГС в Индии и 79% всех инфекций ВГС в Пакистане, причем более высокие показатели зарегистрированы среди потребителей наркотиков [17,19]. Он также распространен в Европе, где на него приходится 30% всех случаев инфицирования ВГС в Греции, Польше, Дании, Финляндии и Великобритании [19]. В США генотип 3 является вторым по распространенности генотипом и составляет 8–13% всех инфекций ВГС [20].В Африке генотип 3 гораздо менее распространен и составляет примерно 9% всех инфекций ВГС [21].
Стеатоз
Стеатоз возникает в результате чрезмерного накопления триглицеридов в гепатоцитах. Исследование гистопатологии печени показало, что генотип 3 имел самую высокую распространенность стеатоза по сравнению с другими подтипами [22]. Вероятно, это связано с цитопатическим эффектом генотипа, который избирательно препятствует позднему пути холестерина и усиливает экспрессию синтазы жирных кислот; однако стеатоз имеет тенденцию улучшаться при достижении УВО [23,24].Также было отмечено, что стеатоз быстрее прогрессирует в фиброз печени у пациентов, инфицированных генотипом 3, а не другими генотипами [25]. Однако Chan et al сообщили, что хотя генотип 3 связан с более высокой частотой стеатоза, текущие данные не показывают какого-либо усиленного прямого вирусно-опосредованного фиброгенеза печени [21]. Большинство исследований, в которых сообщалось о потенциальной связи с генотипом 3 и тяжестью фиброза печени, были ограничены небольшими когортами, вариабельностью характеристик пациентов, таких как инсулинорезистентность (ИР), индекс массы тела или распределение генотипов, а также расхождения в методологии, особенно в отношении к классификации стеатоза [26,27].
Большой метаанализ 3068 пациентов с хроническим гепатитом С из Северной Америки, Европы и Австралии показал, что генотип 3 был связан со стеатозом, а не с фиброзом; Многофакторный анализ выявил стеатоз и уровень воспалительной активности по гистопатологии как независимые предикторы заболевания [28]. Хотя прямая вирусная связь кажется отсутствующей или неясной, некоторые исследования выявили связь между более высокой степенью стеатоза и более высокой частотой фиброза [27].
Хотя точные патогенетические механизмы стеатоза, опосредованного генотипом 3, все еще неясны, генотип 3, по-видимому, модулирует метаболизм и транспорт липидов хозяина внутри гепатоцитов посредством трех механизмов: микросомальный белок-переносчик триглицеридов; белок 1с, связывающий регуляторный элемент стерола; и рецептор-α, связанный с пролифератором пероксисом [29].Считается, что благодаря этим путям секвестрация внутрипеченочного жира или стеатоз ухудшает ответ на лечение у пациентов с ожирением печени [25]. В крупном национальном исследовании с участием 7248 подходящих субъектов использование статинов (n = 3334) было достоверно связано с лучшими показателями УВО после противовирусной терапии и меньшим прогрессированием фиброза печени и частотой ГЦК [30].
Коинфекция ВГС / вируса иммунодефицита человека (ВИЧ)
Коинфекция ВИЧ и ВГС-3 является относительно распространенным явлением.Согласно метаанализу более 780 исследований, глобальная распространенность коинфекции ВГС / ВИЧ оценивается примерно в 6% [31]. В США и Западной Европе распространенность коинфекции составляет примерно 10-30% [32,33]. Коинфекция с HCV-3 увеличивает риск хронической болезни, вызывая более высокую вирусную нагрузку и неспособность вызвать CD4 / CD8-опосредованный Т-клеточный иммунный ответ [34]. Коинфекция также была связана с ускоренным прогрессированием фиброза печени и снижением УВО при переходе на режимы на основе интерферона [35–37].Однако было показано, что антиретровирусная терапия облегчает прогрессирование связанного с ВГС поражения печени и фиброза за счет уменьшения воспаления и иммунной дисфункции, связанных с ВИЧ, и ограничения инфекционности [38–41]. Кроме того, лечение гепатита С у пациентов с коинфекцией было связано со снижением частоты смерти, прогрессирования ВИЧ, явлений, связанных с печенью, и снижения риска сахарного диабета и, возможно, хронической почечной недостаточности [42,43]. Поскольку ВИЧ ускоряет естественное течение ВГС и осложнений, связанных с печенью, рекомендуется, чтобы все пациенты с коинфекцией проходили лечение хронического ВГС, за исключением тех, чья ожидаемая продолжительность жизни составляет менее нескольких лет и которые не будут излечены лечением [44].
Гиперлипидемия, сахарный диабет или IR
Метаболизм липидов тесно связан с молекулярными механизмами инфекционного цикла ВГС. Репликация ВГС влияет и зависит от поглощения и оттока холестерина через различные рецепторы липопротеинов во время его проникновения в клетки хозяина [45]. Было показано, что белки, связанные с липопротеинами очень низкой плотности, включая аполипопротеин (апо) B, апоЕ и микросомальные белки-переносчики триглицеридов, играют решающую роль в образовании инфекционных частиц HCV, особенно относящихся к генотипу 3 [46].ВГС может связывать рецепторы липопротеинов низкой плотности (ЛПНП) и вызывать внутриклеточное отложение липидов [47]. Пациенты, инфицированные генотипом 3, как правило, имеют гипохолестеринемию и гипобеталипопротеинемию, что может объяснить прямое влияние вируса на метаболизм липидов [48]. Похоже, что HCV-3 также избирательно вмешивается в поздний путь холестерина, явление, которое, по-видимому, исчезает с УВО [23]. Интересно, что высокие уровни ЛПНП имеют тенденцию прогнозировать УВО у пациентов, получавших интерферон и рибавирин (РБВ) [49].Поскольку рецепторы ЛПНП участвуют в проникновении ВГС в гепатоциты, более высокие уровни ЛПНП могут уменьшать количество рецепторов ЛПНП на клеточной мембране, тем самым снижая клеточную инфекционность [49].
Коровой белок HCV может индуцировать ИР, нарушая внутриклеточный сигнальный путь инсулина [50]. При генотипе 3 наличие ИР может снизить вероятность достижения УВО при использовании схем лечения интерфероном и рибавирином, особенно при стеатозе, поражающем более 33% печени [51-54]. Однако эрадикация HCV, по-видимому, улучшает чувствительность к инсулину без изменения жировых отложений, уровней адипокина или глюкагона, что указывает на прямую связь между вирусной активностью и ИР [55].У пациентов с нормальной чувствительностью к инсулину вероятность достижения УВО была почти в три раза выше, чем у пациентов с ИР [56]. К сожалению, проспективное когортное исследование не смогло обнаружить связи между показателями ИР и УВО у пациентов с генотипом 1, 2 или 3 [57]. Кроме того, Patel и др. изучили специфические для генотипа ассоциации с ИР и фиброзом печени. Хотя в исследовании действительно сообщалось об ассоциации у пациентов с генотипом 1, в когорте с генотипом 3 не было обнаружено значительной ассоциации [58]. Механизмы HCV-опосредованного IR, SVR и генотип-специфичных ассоциаций остаются неясными.К счастью, новые схемы противовирусного лечения прямого действия (ПППД) не подвержены ИР [54].
HCC
Заболеваемость HCC растет в США и во всем мире [59,60]. Генотип 3 был связан со значительно более высокой частотой ГЦК по сравнению с другими генотипами [61]. McMahon и соавт. изучали 1080 участников на протяжении 11 171 человеко-лет и сообщили, что люди, инфицированные генотипом 3, имеют повышенный риск ГЦК и смерти, связанной с печенью [62].Другое исследование показало, что риск ГЦК после поправки на демографические и клинические характеристики был на 80% выше у пациентов с генотипом 3 по сравнению с генотипом 1 [63]. Аналогичным образом, McCombs и др. показали в исследовании Veteran Affairs (VA), что риск развития ГЦК был на 63% выше с генотипом 3 (HR 1,63, 95% ДИ 1,47–1,79; P <0,001) по сравнению с генотипом 1 [14 ]. Кроме того, Ioannou et al (2018) сообщили, что у 62 354 пациентов с VA лечение гепатита С с помощью ПППД снизило риск рака печени на 71% [64].Это открытие подчеркивает необходимость проявлять бдительность при диагностике и раннем лечении ВГС даже при циррозе печени.
Текущие ПППД
Генетический ландшафт вируса гепатита С создал серьезную проблему для разработки вакцин и эффективных пангенотипических методов лечения [65]. До появления ПППД схемы лечения пегилированным интерфероном и рибавирином были стандартом лечения. Однако основным ограничением этих режимов были их побочные эффекты, среди которых преобладали усталость, гриппоподобные симптомы, гематологические отклонения и нейропсихиатрические симптомы [66].Эти побочные эффекты были устранены с помощью ПППД, которые лечат пациентов, сталкивающихся с серьезными проблемами, включая генетическое разнообразие ВГС, вирусную резистентность, влияние генетики хозяина, прогрессирующее заболевание печени и другие сопутствующие заболевания [67–69].
Основные достижения в выяснении и характеристике жизненного цикла ВГС привели к определению ключевых этапов репликации вируса [70,71] (). DAA нацелены на неструктурные (NS) вирусные белки, важные для репликации вирусной РНК, процессинга полипротеинов и сборки инфекционных вирионов [72].В настоящее время ПППД, одобренные FDA для лечения генотипа 3, включают (в комбинации): софосбувир, пангенотипический аналог нуклеотидов, ингибитор полимеразы NS5B HCV; даклатасвир, ингибитор металлопротеина NS5A HCV; велпатасвир, пангенотипический ингибитор NS5A нового поколения; и глекапревир и пибрентасвир, ингибитор протеазы NS3 / 4A и ингибитор NS5A, соответственно [73,74].
Иллюстрация стадий, на которых действуют ингибиторы NS5A и NS5B
Испытания ASTRAL-3 были нацелены на оценку безопасности и эффективности софосбувира и велпатасвира при лечении пациентов, инфицированных генотипом 3, в том числе не получавших лечения и ранее проходивших лечение , и пациенты с компенсированным циррозом печени [75].После 12-недельного лечения в группе софосбувир-велпатасвир достиг УВО 95% (95% ДИ 92-98%), что превосходит показатель 80% (95% ДИ 75-85%) в группе софосбувир-рибавирин ( P <0,001). Наиболее частыми побочными эффектами были утомляемость, головная боль, тошнота и бессонница.
Комбинация глекапревира и пибрентасвира была протестирована в исследованиях SURVEYOR-2 и ENDURANCE-3 [76]. В фазе II SURVEYOR-2 комбинация была протестирована с рибавирином или без него. В исследовании сообщалось о достижении УВО 97% для не получавших лечения пациентов с генотипом 3 без цирроза после 8 недель лечения (без рибавирина).Через 12 недель терапии (с рибавирином или без него) пациенты с генотипом 3, не получавшие лечения, показали УВО 100%. В фазе III SURVEYOR-2 пациенты, прошедшие лечение, получали глекапревир / пибрентасвир в течение 12 или 16 недель; у пациентов с циррозом, ранее не получавших лечения, курс терапии составлял 12 недель, а у пациентов, прошедших лечение — 16 недель [77]. У проходивших лечение пациентов без цирроза печени показатели излечения 91% и 96% были зарегистрированы в 12- и 16-недельных группах соответственно. В группах с циррозом печени пациенты, не получавшие лечения, имели УВО 98% после 12-недельного режима, в то время как пациенты, прошедшие лечение, имели УВО 96% после 16 недель.В исследованиях, сравнивающих эффективность глекапревира / пибрентасвира (в течение 8 недель) и софосбувира / даклатасвира при лечении нецирротических препаратов, не получавших лечения, сообщалось о сходных профилях безопасности и УВО [78]. Исследование показало, что 8-недельное лечение глекапревиром / пибрентасвиром может оказаться очень эффективным. В дополнение к руководящим принципам, выпущенным Европейской ассоциацией по изучению печени (EASL), Американская ассоциация по изучению заболеваний печени и Американское общество инфекционных заболеваний рекомендуют использовать глекапревир / пибрентасвир в течение 8 недель у лиц без цирроза ( ) [79].
Таблица 1
Американская ассоциация по изучению заболеваний печени: рекомендации по лечению генотипа 3
В исследовании PROTON в течение 12 недель вводили комбинацию софосбувира, интерферона и рибавирина. Он показал УВО 96% у не получавших лечения пациентов с генотипом 3, у некоторых из которых был цирроз [80]. В исследовании BOSON, фазе 3, оценивалась та же комбинация с УВО 93% у пациентов, не получавших лечения (96% у пациентов без цирроза и 91% у пациентов с циррозом) [78].Когорты без интерферона, получавшие софосбувир и рибавир, имели более низкий УВО на 71% и 84% после лечения в течение 16 и 24 недель соответственно.
В исследовании FISSION софосбувир и рибавирин в течение 12 недель сравнивали с интерфероном и рибавирином в течение 24 недель у пациентов, не получавших лечения [81]. Однако УВО составило только 56% и 63% соответственно. В обеих группах у пациентов с циррозом был более низкий УВО, чем у пациентов без цирроза (34% против 61% и 30% против 71% соответственно). Исследование ПОЗИТРОН проводилось для пациентов, которым интерферон не подходил [82].Субъекты получали софосбувир и рибавирин или плацебо в течение 12 недель и сообщили о достижении УВО 61% и 0% соответственно. У пациентов с циррозом УВО составил 21%, а у пациентов без цирроза — 68%. Аналогичным образом, исследование VALENCE продлило ту же комбинацию софосбувира и рибавирина до 24 недель у пациентов, не получавших лечения. Однако гораздо более высокий УВО наблюдался у пролеченных пациентов без цирроза (94%) и у пациентов с циррозом (92%) [83].
В исследование ALLY-3 были включены пациенты, ранее не получавшие лечения, которые получали комбинацию софосбувира и даклатасвира в течение 12 недель.Комбинация достигла УВО 90% и хорошо переносилась; УВО составил 58% у пациентов с циррозом печени и 97% у пациентов без цирроза [84,85]. ALLY-3 также тестировал опытных пациентов с тем же режимом и сообщил об УВО 86% в целом (69% при циррозе и 94% при отсутствии цирроза) ().
Таблица 2
Текущие варианты лечения противовирусными препаратами прямого действия
Велпатасвир (GS-5816) — мощный ингибитор NS5A с активностью против генотипов 1-6 [86]. В исследовании ЭЛЕКТРОН-2 его оценивали в различных дозах в сочетании с различными лекарствами: софосбувир с 25 мг велпатасвира, софосбувир с 25 мг велпатасвира и рибавирином, софосбувир с 100 мг велпатасвира и софосбувир с 10 мг велпатасвира и RBV, все пациенты, не получавшие лечения [87].В исследовании сообщалось о 100%, 88%, 96% и 100%, соответственно. Он также был протестирован на опытных пациентах в тех же четырех группах, где УВО составляли 85%, 95%, 100% и 100% у пациентов без цирроза печени и 58%, 85%, 88% и 96% у пациентов с циррозом. , соответственно. Наиболее частыми побочными эффектами были утомляемость, головная боль и тошнота, все они были связаны с рибавирином.
Недавний метаанализ, проведенный Берденом и соавторами , показал, что схемы, содержащие софосбувир и велпатасвир, достигли наивысшей эффективности лечения с рибавирином (УВО 99%; 95% ДИ 98-100%) и без рибавирины (УВО 97%; 95%). ДИ 95–99%) [88].Анализ показал, что рибавирин значительно увеличивает частоту УВО у пациентов с циррозом печени или без него. Этот же режим также продемонстрировал высокую эффективность лечения (УВО 94%) у пациентов с коинфекцией ВИЧ-1 и ВГС [89]. В результате, согласно рекомендациям EASL для лечения ВГС, пациенты с моноинфекцией генотипа 3 или коинфекцией ВИЧ должны получать софосбувир и даклатасвир или софосбувир и велпатасвир (в течение 12 недель у лиц, не получавших лечения) [90] . Лицам, имеющим опыт лечения, рекомендуются либо комбинации на длительный срок (24 недели), либо добавление рибавирина в течение 12 недель.
Сегодня многие из этих методов лечения очень дороги по сравнению с предыдущими схемами лечения интерфероном и рибавирином. Схема лечения софосбувиром, ледипасвиром и рибавирином стоит примерно 73 000 долларов за год жизни с поправкой на качество (QALY), тогда как комбинация софосбувира и даклатасвира стоит более 396 000 долларов за QALY [19]. Однако с социальной точки зрения лечение новыми методами лечения ВГС представляется более экономичным по сравнению с лечением на основе рибавирина и пегилированного интерферона [91,92]. Использование ПППД привело к значительно более высокому уровню УВО наряду с меньшим количеством побочных эффектов.Текущие рекомендации по лечению хронического ВГС-генотипа 3 кратко изложены в.
Новые противовирусные препараты нового поколения
Будущие разработки включают ПППД следующего поколения, способные преодолевать барьеры резистентности и предлагающие более широкий спектр активности против всех генотипов, включая глекапревир, пибрентасвир, воксилапревир, уприфосбувир, гразопревир, рузасвир, AL-335 симепревир и одаласвир [93]. В исследовании C-SWIFT комбинировали гразопревир, элбасвир и софосбувир в лечении ранее не получавших лечения пациентов с циррозом и без него [94].Пациенты без цирроза печени получали терапию в течение 8 или 12 недель и достигли УВО 93% и 100% соответственно. Пациенты с циррозом достигли УВО 91% после 12-недельного курса. Аналогичным образом в исследовании C-ISLE оценивалась эффективность и безопасность элбасвира и гразопревира плюс софосбувир с рибавирином и без него, хотя и у пациентов с компенсированным циррозом печени [95]. Среди участников, ранее не получавших лечения, УВО через 8 недель составил 91% (21/23) у тех, кто лечился рибавирином. После лечения в течение 12 недель без рибавирина УВО составил 96% (23/24).Среди опытных участников с рибавирином и без него, УВО составил 94% (17/18) и 100% (17/17) в группе 12 недель, соответственно, и 94% (17/18) в группе 16 недель. рука. Пять человек сообщили о серьезных побочных эффектах, включая пневмонию, боль в груди, передозировку опиатами, целлюлит и снижение креатинина. Паритапревир (ABT-450), ингибитор NS3 / 4, вводится с ритонавиром (ABT-450 / r) [96]. Как фармакоусилитель ритонавир не имеет активности против ВГС; вместо этого он подавляет метаболизм паритапревира, тем самым увеличивая пиковое и минимальное воздействие препарата и позволяя принимать один раз в день дозу ABT-450 [97].В исследовании NAVIGATOR ABT-450 / r комбинируется с омбитасвиром (ABT-267), ингибитором NS5A, в течение 12 недель у пациентов без цирроза печени, не получавших лечения с генотипом 3, при этом частота УВО составила 50% без RBV и всего 9% с RBV [ 98]. Хотя препарат хорошо переносился, низкие УВО побудили к прекращению исследования. Аналогичным образом, у пациентов с циррозом или без цирроза в испытании QUARTZ II-III комбинации омбитасвир / паритапревир / ритонавир плюс софосбувир с рибавирином или без него общий УВО составил 98% через 12 недель [98].В исследовании отмечено, что сочетание ПППД с дополнительными механизмами действия и вирусологическими мишенями может быть эффективной терапевтической стратегией.
Изучаются и другие новые ингибиторы, включая уприфосбувир (MK-3682; ингибитор NS5B), рузасвир (MK8408; ингибитор NS5A), гразопревир (ингибитор NS3) и воксилапревир (ингибитор NS3 / 4A) [99]. В исследовании C-BREEZE-2 изучалась эффективность рузасвира и уприфосбувира при лечении генотипов 1–6 в течение 12 недель [100]. Однако из-за субоптимальных УВО генотипа 3 (80% у пациентов без цирроза по сравнению с68% у пациентов с циррозом печени), а также при вирусологическом рецидиве комбинация была признана терапевтически неэффективной ().
Таблица 3
Лечение следующего поколения
В фазе II C-CREST-2 была протестирована тройная комбинация уприфосбувира, рузасвира и гразопревира [101]. Общий УВО у пациентов с генотипом 3, не получавших лечения и не страдающих циррозом печени, варьировал от 86 до 95%, что позволяет предположить, что 8-недельная продолжительность лечения была неоптимальной [102]. В фазе III исследования C-CREST 2 та же тройная комбинация с рибавирином и без него изучалась на 8, 12 и 16 неделях [102].Общий УВО для пациентов с генотипом 3 составил 96%. В 8-недельной группе УВО составил 94% и 98%, без и с рибавирином соответственно. В подгруппе с циррозом только у 1 пациента из 74 рецидивов, и этот пациент находился в группе 16-недельного лечения (с рибавирином).
На этапе II исследования LEPTON оценивалась тройная комбинация софосбувира, велпатасвира и GS-9857, ингибитора протеазы нового поколения NS3 / 4A [100]. Лечение было протестировано на ранее не получавших лечения пациентах с компенсированным циррозом, неэффективностью интерферона / рибавирина с циррозом и неэффективностью ПППД с циррозом и без него.Продолжительность исходной группы составляла 6 недель, а опытной группы — 8 недель. У исходной группы был УВО 83%, в то время как опытная группа имела УВО 100%, в которую входили четыре ранее не ответивших на ПППД. Однако исследование было недостаточно мощным, и поэтому к этим результатам следует относиться осторожно.
В исследовании POLARIS-3 ранее не получавшие лечения пациенты с циррозом получали софосбувир и велпатасвир в течение 12 недель или софосбувир, велпатасвир и воксилапревир в течение 8 недель [103].В исследование были включены пациенты, которые ранее не получали лечение ПППД. В целом, обе группы достигли УВО 96% через 12 недель, что включало одно отозванное согласие и несвязанную смерть. Пациенты с циррозом, не получавшие лечения, имели УВО 96% при тройной терапии, в то время как пациенты с циррозом, прошедшие лечение, имели УВО 97%. Около 2% участников исследования испытали побочные эффекты.
Наконец, MIV-802, ингибитор NS5B, был протестирован для оценки его противовирусной активности против генотипа 3 in vitro [104].Доклинические исследования показали, что MIV-802 обладает большей противовирусной активностью против генотипа 3, чем софосбувир, что подтверждает его рассмотрение для дальнейшей разработки [105]. В целом, ПППД нового поколения для лечения гепатита С оказались клинически эффективными при лечении большого числа пациентов. Показатели УВО для ПППД следующего поколения равны или выше, чем у ПППД первого поколения. Этот новый класс терапевтических средств обещает быть простым в использовании, высокоэффективным, пан-генотипическим, одноразовым, полностью пероральным, без интерферона и рибавирина [93].
Проблемы будущего
При разработке лекарств от ВГС за последнее десятилетие было решено множество проблем и устранены пробелы в уходе, такие как охват всех генотипов, неблагоприятные побочные эффекты и охват лиц с коинфекцией ВИЧ и пациентов с циррозом печени. Достижение клинического УВО стало менее важной проблемой для пациентов, инфицированных генотипом 3, которые когда-то считались трудно поддающимися лечению [106]. Исследования на определенных группах пациентов, таких как дети, беременные женщины и кормящие матери, отсутствуют и представляют собой неудовлетворенную потребность [107].Кроме того, хотя большинство лекарств от гепатита С метаболизируются в печени, возможности применения ПППД для людей с тяжелым хроническим заболеванием почек остаются ограниченными или противопоказаны [108]. Кроме того, размер выборки из анализа подгрупп, полученный в результате клинических испытаний ПППД следующего поколения, следует интерпретировать с осторожностью. В результате необходимы более крупные выборки для оценки клинической эффективности в определенных когортах.
Более того, учитывая, что стоимость играет роль в распределении и использовании лечения, еще предстоит увидеть, как стоимость повлияет на общественное здоровье.Наша следующая задача заключается в преодолении ценовых барьеров, если мы действительно хотим искоренить генотип 3 ВГС [109]. Мы должны снизить цены на лекарства, чтобы обеспечить всеобщий доступ. Мы также должны объединить эти усилия со снижением вреда, направленным на повторное внедрение новых и устойчивых штаммов ВГС. Что еще более важно, для достижения стратегической цели, поставленной ВОЗ, которая направлена на ликвидацию гепатита С, исследователям, поставщикам медицинских услуг, политикам, затронутым сообществам, защитникам, фармацевтическим и диагностическим предприятиям и правительствам во всем мире придется работать вместе [ 110].Falade-Nwulia и др. отметили, что снижение повторного инфицирования и достижение целей по элиминации ВГС требует сочетания лечения ВГС со снижением вреда и целенаправленными поведенческими вмешательствами; Частоту повторного инфицирования следует рассматривать как показатель обращения за лечением от ВГС [111].
Более того, хотя ПППД успешно лечили ВГС, их финансовое бремя не исключает возможности использования и разработки вакцины, которая может сыграть решающую профилактическую роль [112].Несмотря на то, что существуют вакцины для предотвращения гепатита А и В, цель разработки вакцины против ВГС — защита от персистирования ВГС. Несколько вакцин-кандидатов прошли клинические испытания после многообещающих результатов на шимпанзе [113]. В настоящее время исследуются два механизма вакцинации: иммунитет, опосредованный Т-клетками, и выработка антител [114]. Однако сложный транскрипционный профиль гепатита С продолжает оставаться проблемой при разработке вакцины.
Повторное инфицирование ВГС следует свести к минимуму, но не опасаться, поскольку мы работаем над устранением ВГС.Скорее, реинфекцию следует рассматривать как показатель того, что лечение гепатита С распространяется среди групп населения, которые, скорее всего, будут поддерживать продолжающуюся эпидемию ВГС. Повторные инфекции ВГС следует сводить к минимуму, сочетая лечение ВГС со снижением вреда и хорошо продуманными целевыми поведенческими вмешательствами.
клинических особенностей, текущие и новые вирусные ингибиторы, проблемы будущего
Реферат
Вирус гепатита С (ВГС) представляет собой глобальное бремя для здравоохранения, от которого страдают более 150 миллионов человек во всем мире.В прошлом генотип 3 HCV считался трудным для лечения по сравнению с другими генотипами. Генотип 3 связан с более высоким уровнем осложнений, включая жировую болезнь печени, фиброз, гепатоцеллюлярную карциному и смертность. Однако с появлением противовирусных препаратов прямого действия первого и второго поколений генотип 3 можно эффективно лечить. Кроме того, эти новые препараты хорошо переносятся пациентами и имеют значительно меньше побочных эффектов по сравнению со схемами на основе рибавирина и интерферона.Однако, несмотря на то, что были достигнуты большие успехи в преодолении биологических барьеров, наша следующая задача заключается в преодолении экономических и финансовых препятствий, если мы хотим искоренить генотип 3 ВГС. Здесь мы рассматриваем клинические особенности, связанные с генотипом 3 ВГС, текущие и новые схемы лечения. , и проблемы, связанные с лечением.
Ключевые слова: Гепатит С, генотип 3, устойчивый вирусный ответ, противовирусные препараты прямого действия, лечение
Введение
Вирусный гепатит С (ВГС) поражает примерно 71 миллион человек во всем мире [1].Одноцепочечный РНК-вирус семейства Flaviviridae , HCV является основной причиной хронических заболеваний печени во всем мире [2-6]. Как растущая угроза общественному здоровью, ВГС является одной из основных причин инвалидности, заболеваемости и смертности во всем мире [7]. Ежегодно около 700 000 человек умирают от связанных с ВГС осложнений, включая цирроз, гепатоцеллюлярную карциному (ГЦК) и печеночную недостаточность [8]. К сожалению, многие люди с ВГС узнают о своей инфекции только тогда, когда у них развиваются симптомы цирроза или рака печени.По оценкам, 21% остро инфицированных пациентов остаются недиагностированными, а 75–85% становятся хронически инфицированными [9]. В результате были возобновлены международные усилия, направленные на снижение глобального бремени вирусного гепатита, в том числе глобальная стратегия сектора здравоохранения Всемирной организации здравоохранения (ВОЗ) по вирусному гепатиту на 2016–2021 годы [10].
На основании анализа геномной последовательности существует семь основных генотипов (HCV 1-7), включая 67 подтвержденных и 20 предварительных подтипов [11]. Генотип важен не только для прогнозирования ответа на терапию, но и для прогнозирования риска прогрессирования заболевания [12].Генотип 3 считается наиболее плохо изученным генотипом и имеет самый низкий уровень устойчивого вирусологического ответа (УВО) в эпоху пегилированного интерферона [13]. Генотип 3, который считается одним из наиболее трудных для лечения подтипов, имеет более высокую скорость прогрессирования заболевания и смертности по сравнению с другими генотипами [13,14]. Согласно метаанализу, ускоренное прогрессирование фиброза печени, связанное с генотипом 3, имело отношение шансов 1,52 в исследованиях с одной биопсией по сравнению с другими генотипами, что свидетельствует об ускоренном фиброзе [15].Более того, инфекция генотипа 3 связана с более высокой частотой ГЦК [16]. Таким образом, за последние 20 лет появились более эффективные методы лечения для борьбы с вирулентностью генотипа 3.
Методология
Исследования, опубликованные в период с января 2000 года по январь 2018 года, искали в электронных базах данных в соответствии с названиями статей, содержанием аннотаций и актуальностью в область вирусного гепатита C генотипа 3. Базы данных, использованные в этом обзоре, включали PubMed, MEDLINE, Embase, Google Scholar, Scopus, ClinicalTrials.gov и Кокрановские базы данных. Основными используемыми поисковыми запросами были генотип 3 гепатита С, эпидемиология, частота инфицирования, стеатоз, фиброз, коинфекция ВИЧ, ГЦК, инсулинорезистентность (ИР), метаболизм липидов, лечение и клинические испытания. Мы также вручную провели поиск ссылок, чтобы найти дополнительные релевантные исследования. Статьи, опубликованные на языках, отличных от английского, были исключены.
Клинические особенности
Эпидемиология
Генотип 3 составляет 20% всех инфекций ВГС во всем мире [17].Это второй по распространенности генотип в мире, поражающий примерно 54,3 миллиона человек, причем примерно 75% случаев приходится на Восточную Азию [18]. Генотип 3 отвечает за 54-80% всех инфекций ВГС в Индии и 79% всех инфекций ВГС в Пакистане, причем более высокие показатели зарегистрированы среди потребителей наркотиков [17,19]. Он также распространен в Европе, где на него приходится 30% всех случаев инфицирования ВГС в Греции, Польше, Дании, Финляндии и Великобритании [19]. В США генотип 3 является вторым по распространенности генотипом и составляет 8–13% всех инфекций ВГС [20].В Африке генотип 3 гораздо менее распространен и составляет примерно 9% всех инфекций ВГС [21].
Стеатоз
Стеатоз возникает в результате чрезмерного накопления триглицеридов в гепатоцитах. Исследование гистопатологии печени показало, что генотип 3 имел самую высокую распространенность стеатоза по сравнению с другими подтипами [22]. Вероятно, это связано с цитопатическим эффектом генотипа, который избирательно препятствует позднему пути холестерина и усиливает экспрессию синтазы жирных кислот; однако стеатоз имеет тенденцию улучшаться при достижении УВО [23,24].Также было отмечено, что стеатоз быстрее прогрессирует в фиброз печени у пациентов, инфицированных генотипом 3, а не другими генотипами [25]. Однако Chan et al сообщили, что хотя генотип 3 связан с более высокой частотой стеатоза, текущие данные не показывают какого-либо усиленного прямого вирусно-опосредованного фиброгенеза печени [21]. Большинство исследований, в которых сообщалось о потенциальной связи с генотипом 3 и тяжестью фиброза печени, были ограничены небольшими когортами, вариабельностью характеристик пациентов, таких как инсулинорезистентность (ИР), индекс массы тела или распределение генотипов, а также расхождения в методологии, особенно в отношении к классификации стеатоза [26,27].
Большой метаанализ 3068 пациентов с хроническим гепатитом С из Северной Америки, Европы и Австралии показал, что генотип 3 был связан со стеатозом, а не с фиброзом; Многофакторный анализ выявил стеатоз и уровень воспалительной активности по гистопатологии как независимые предикторы заболевания [28]. Хотя прямая вирусная связь кажется отсутствующей или неясной, некоторые исследования выявили связь между более высокой степенью стеатоза и более высокой частотой фиброза [27].
Хотя точные патогенетические механизмы стеатоза, опосредованного генотипом 3, все еще неясны, генотип 3, по-видимому, модулирует метаболизм и транспорт липидов хозяина внутри гепатоцитов посредством трех механизмов: микросомальный белок-переносчик триглицеридов; белок 1с, связывающий регуляторный элемент стерола; и рецептор-α, связанный с пролифератором пероксисом [29].Считается, что благодаря этим путям секвестрация внутрипеченочного жира или стеатоз ухудшает ответ на лечение у пациентов с ожирением печени [25]. В крупном национальном исследовании с участием 7248 подходящих субъектов использование статинов (n = 3334) было достоверно связано с лучшими показателями УВО после противовирусной терапии и меньшим прогрессированием фиброза печени и частотой ГЦК [30].
Коинфекция ВГС / вируса иммунодефицита человека (ВИЧ)
Коинфекция ВИЧ и ВГС-3 является относительно распространенным явлением.Согласно метаанализу более 780 исследований, глобальная распространенность коинфекции ВГС / ВИЧ оценивается примерно в 6% [31]. В США и Западной Европе распространенность коинфекции составляет примерно 10-30% [32,33]. Коинфекция с HCV-3 увеличивает риск хронической болезни, вызывая более высокую вирусную нагрузку и неспособность вызвать CD4 / CD8-опосредованный Т-клеточный иммунный ответ [34]. Коинфекция также была связана с ускоренным прогрессированием фиброза печени и снижением УВО при переходе на режимы на основе интерферона [35–37].Однако было показано, что антиретровирусная терапия облегчает прогрессирование связанного с ВГС поражения печени и фиброза за счет уменьшения воспаления и иммунной дисфункции, связанных с ВИЧ, и ограничения инфекционности [38–41]. Кроме того, лечение гепатита С у пациентов с коинфекцией было связано со снижением частоты смерти, прогрессирования ВИЧ, явлений, связанных с печенью, и снижения риска сахарного диабета и, возможно, хронической почечной недостаточности [42,43]. Поскольку ВИЧ ускоряет естественное течение ВГС и осложнений, связанных с печенью, рекомендуется, чтобы все пациенты с коинфекцией проходили лечение хронического ВГС, за исключением тех, чья ожидаемая продолжительность жизни составляет менее нескольких лет и которые не будут излечены лечением [44].
Гиперлипидемия, сахарный диабет или IR
Метаболизм липидов тесно связан с молекулярными механизмами инфекционного цикла ВГС. Репликация ВГС влияет и зависит от поглощения и оттока холестерина через различные рецепторы липопротеинов во время его проникновения в клетки хозяина [45]. Было показано, что белки, связанные с липопротеинами очень низкой плотности, включая аполипопротеин (апо) B, апоЕ и микросомальные белки-переносчики триглицеридов, играют решающую роль в образовании инфекционных частиц HCV, особенно относящихся к генотипу 3 [46].ВГС может связывать рецепторы липопротеинов низкой плотности (ЛПНП) и вызывать внутриклеточное отложение липидов [47]. Пациенты, инфицированные генотипом 3, как правило, имеют гипохолестеринемию и гипобеталипопротеинемию, что может объяснить прямое влияние вируса на метаболизм липидов [48]. Похоже, что HCV-3 также избирательно вмешивается в поздний путь холестерина, явление, которое, по-видимому, исчезает с УВО [23]. Интересно, что высокие уровни ЛПНП имеют тенденцию прогнозировать УВО у пациентов, получавших интерферон и рибавирин (РБВ) [49].Поскольку рецепторы ЛПНП участвуют в проникновении ВГС в гепатоциты, более высокие уровни ЛПНП могут уменьшать количество рецепторов ЛПНП на клеточной мембране, тем самым снижая клеточную инфекционность [49].
Коровой белок HCV может индуцировать ИР, нарушая внутриклеточный сигнальный путь инсулина [50]. При генотипе 3 наличие ИР может снизить вероятность достижения УВО при использовании схем лечения интерфероном и рибавирином, особенно при стеатозе, поражающем более 33% печени [51-54]. Однако эрадикация HCV, по-видимому, улучшает чувствительность к инсулину без изменения жировых отложений, уровней адипокина или глюкагона, что указывает на прямую связь между вирусной активностью и ИР [55].У пациентов с нормальной чувствительностью к инсулину вероятность достижения УВО была почти в три раза выше, чем у пациентов с ИР [56]. К сожалению, проспективное когортное исследование не смогло обнаружить связи между показателями ИР и УВО у пациентов с генотипом 1, 2 или 3 [57]. Кроме того, Patel и др. изучили специфические для генотипа ассоциации с ИР и фиброзом печени. Хотя в исследовании действительно сообщалось об ассоциации у пациентов с генотипом 1, в когорте с генотипом 3 не было обнаружено значительной ассоциации [58]. Механизмы HCV-опосредованного IR, SVR и генотип-специфичных ассоциаций остаются неясными.К счастью, новые схемы противовирусного лечения прямого действия (ПППД) не подвержены ИР [54].
HCC
Заболеваемость HCC растет в США и во всем мире [59,60]. Генотип 3 был связан со значительно более высокой частотой ГЦК по сравнению с другими генотипами [61]. McMahon и соавт. изучали 1080 участников на протяжении 11 171 человеко-лет и сообщили, что люди, инфицированные генотипом 3, имеют повышенный риск ГЦК и смерти, связанной с печенью [62].Другое исследование показало, что риск ГЦК после поправки на демографические и клинические характеристики был на 80% выше у пациентов с генотипом 3 по сравнению с генотипом 1 [63]. Аналогичным образом, McCombs и др. показали в исследовании Veteran Affairs (VA), что риск развития ГЦК был на 63% выше с генотипом 3 (HR 1,63, 95% ДИ 1,47–1,79; P <0,001) по сравнению с генотипом 1 [14 ]. Кроме того, Ioannou et al (2018) сообщили, что у 62 354 пациентов с VA лечение гепатита С с помощью ПППД снизило риск рака печени на 71% [64].Это открытие подчеркивает необходимость проявлять бдительность при диагностике и раннем лечении ВГС даже при циррозе печени.
Текущие ПППД
Генетический ландшафт вируса гепатита С создал серьезную проблему для разработки вакцин и эффективных пангенотипических методов лечения [65]. До появления ПППД схемы лечения пегилированным интерфероном и рибавирином были стандартом лечения. Однако основным ограничением этих режимов были их побочные эффекты, среди которых преобладали усталость, гриппоподобные симптомы, гематологические отклонения и нейропсихиатрические симптомы [66].Эти побочные эффекты были устранены с помощью ПППД, которые лечат пациентов, сталкивающихся с серьезными проблемами, включая генетическое разнообразие ВГС, вирусную резистентность, влияние генетики хозяина, прогрессирующее заболевание печени и другие сопутствующие заболевания [67–69].
Основные достижения в выяснении и характеристике жизненного цикла ВГС привели к определению ключевых этапов репликации вируса [70,71] (). DAA нацелены на неструктурные (NS) вирусные белки, важные для репликации вирусной РНК, процессинга полипротеинов и сборки инфекционных вирионов [72].В настоящее время ПППД, одобренные FDA для лечения генотипа 3, включают (в комбинации): софосбувир, пангенотипический аналог нуклеотидов, ингибитор полимеразы NS5B HCV; даклатасвир, ингибитор металлопротеина NS5A HCV; велпатасвир, пангенотипический ингибитор NS5A нового поколения; и глекапревир и пибрентасвир, ингибитор протеазы NS3 / 4A и ингибитор NS5A, соответственно [73,74].
Иллюстрация стадий, на которых действуют ингибиторы NS5A и NS5B
Испытания ASTRAL-3 были нацелены на оценку безопасности и эффективности софосбувира и велпатасвира при лечении пациентов, инфицированных генотипом 3, в том числе не получавших лечения и ранее проходивших лечение , и пациенты с компенсированным циррозом печени [75].После 12-недельного лечения в группе софосбувир-велпатасвир достиг УВО 95% (95% ДИ 92-98%), что превосходит показатель 80% (95% ДИ 75-85%) в группе софосбувир-рибавирин ( P <0,001). Наиболее частыми побочными эффектами были утомляемость, головная боль, тошнота и бессонница.
Комбинация глекапревира и пибрентасвира была протестирована в исследованиях SURVEYOR-2 и ENDURANCE-3 [76]. В фазе II SURVEYOR-2 комбинация была протестирована с рибавирином или без него. В исследовании сообщалось о достижении УВО 97% для не получавших лечения пациентов с генотипом 3 без цирроза после 8 недель лечения (без рибавирина).Через 12 недель терапии (с рибавирином или без него) пациенты с генотипом 3, не получавшие лечения, показали УВО 100%. В фазе III SURVEYOR-2 пациенты, прошедшие лечение, получали глекапревир / пибрентасвир в течение 12 или 16 недель; у пациентов с циррозом, ранее не получавших лечения, курс терапии составлял 12 недель, а у пациентов, прошедших лечение — 16 недель [77]. У проходивших лечение пациентов без цирроза печени показатели излечения 91% и 96% были зарегистрированы в 12- и 16-недельных группах соответственно. В группах с циррозом печени пациенты, не получавшие лечения, имели УВО 98% после 12-недельного режима, в то время как пациенты, прошедшие лечение, имели УВО 96% после 16 недель.В исследованиях, сравнивающих эффективность глекапревира / пибрентасвира (в течение 8 недель) и софосбувира / даклатасвира при лечении нецирротических препаратов, не получавших лечения, сообщалось о сходных профилях безопасности и УВО [78]. Исследование показало, что 8-недельное лечение глекапревиром / пибрентасвиром может оказаться очень эффективным. В дополнение к руководящим принципам, выпущенным Европейской ассоциацией по изучению печени (EASL), Американская ассоциация по изучению заболеваний печени и Американское общество инфекционных заболеваний рекомендуют использовать глекапревир / пибрентасвир в течение 8 недель у лиц без цирроза ( ) [79].
Таблица 1
Американская ассоциация по изучению заболеваний печени: рекомендации по лечению генотипа 3
В исследовании PROTON в течение 12 недель вводили комбинацию софосбувира, интерферона и рибавирина. Он показал УВО 96% у не получавших лечения пациентов с генотипом 3, у некоторых из которых был цирроз [80]. В исследовании BOSON, фазе 3, оценивалась та же комбинация с УВО 93% у пациентов, не получавших лечения (96% у пациентов без цирроза и 91% у пациентов с циррозом) [78].Когорты без интерферона, получавшие софосбувир и рибавир, имели более низкий УВО на 71% и 84% после лечения в течение 16 и 24 недель соответственно.
В исследовании FISSION софосбувир и рибавирин в течение 12 недель сравнивали с интерфероном и рибавирином в течение 24 недель у пациентов, не получавших лечения [81]. Однако УВО составило только 56% и 63% соответственно. В обеих группах у пациентов с циррозом был более низкий УВО, чем у пациентов без цирроза (34% против 61% и 30% против 71% соответственно). Исследование ПОЗИТРОН проводилось для пациентов, которым интерферон не подходил [82].Субъекты получали софосбувир и рибавирин или плацебо в течение 12 недель и сообщили о достижении УВО 61% и 0% соответственно. У пациентов с циррозом УВО составил 21%, а у пациентов без цирроза — 68%. Аналогичным образом, исследование VALENCE продлило ту же комбинацию софосбувира и рибавирина до 24 недель у пациентов, не получавших лечения. Однако гораздо более высокий УВО наблюдался у пролеченных пациентов без цирроза (94%) и у пациентов с циррозом (92%) [83].
В исследование ALLY-3 были включены пациенты, ранее не получавшие лечения, которые получали комбинацию софосбувира и даклатасвира в течение 12 недель.Комбинация достигла УВО 90% и хорошо переносилась; УВО составил 58% у пациентов с циррозом печени и 97% у пациентов без цирроза [84,85]. ALLY-3 также тестировал опытных пациентов с тем же режимом и сообщил об УВО 86% в целом (69% при циррозе и 94% при отсутствии цирроза) ().
Таблица 2
Текущие варианты лечения противовирусными препаратами прямого действия
Велпатасвир (GS-5816) — мощный ингибитор NS5A с активностью против генотипов 1-6 [86]. В исследовании ЭЛЕКТРОН-2 его оценивали в различных дозах в сочетании с различными лекарствами: софосбувир с 25 мг велпатасвира, софосбувир с 25 мг велпатасвира и рибавирином, софосбувир с 100 мг велпатасвира и софосбувир с 10 мг велпатасвира и RBV, все пациенты, не получавшие лечения [87].В исследовании сообщалось о 100%, 88%, 96% и 100%, соответственно. Он также был протестирован на опытных пациентах в тех же четырех группах, где УВО составляли 85%, 95%, 100% и 100% у пациентов без цирроза печени и 58%, 85%, 88% и 96% у пациентов с циррозом. , соответственно. Наиболее частыми побочными эффектами были утомляемость, головная боль и тошнота, все они были связаны с рибавирином.
Недавний метаанализ, проведенный Берденом и соавторами , показал, что схемы, содержащие софосбувир и велпатасвир, достигли наивысшей эффективности лечения с рибавирином (УВО 99%; 95% ДИ 98-100%) и без рибавирины (УВО 97%; 95%). ДИ 95–99%) [88].Анализ показал, что рибавирин значительно увеличивает частоту УВО у пациентов с циррозом печени или без него. Этот же режим также продемонстрировал высокую эффективность лечения (УВО 94%) у пациентов с коинфекцией ВИЧ-1 и ВГС [89]. В результате, согласно рекомендациям EASL для лечения ВГС, пациенты с моноинфекцией генотипа 3 или коинфекцией ВИЧ должны получать софосбувир и даклатасвир или софосбувир и велпатасвир (в течение 12 недель у лиц, не получавших лечения) [90] . Лицам, имеющим опыт лечения, рекомендуются либо комбинации на длительный срок (24 недели), либо добавление рибавирина в течение 12 недель.
Сегодня многие из этих методов лечения очень дороги по сравнению с предыдущими схемами лечения интерфероном и рибавирином. Схема лечения софосбувиром, ледипасвиром и рибавирином стоит примерно 73 000 долларов за год жизни с поправкой на качество (QALY), тогда как комбинация софосбувира и даклатасвира стоит более 396 000 долларов за QALY [19]. Однако с социальной точки зрения лечение новыми методами лечения ВГС представляется более экономичным по сравнению с лечением на основе рибавирина и пегилированного интерферона [91,92]. Использование ПППД привело к значительно более высокому уровню УВО наряду с меньшим количеством побочных эффектов.Текущие рекомендации по лечению хронического ВГС-генотипа 3 кратко изложены в.
Новые противовирусные препараты нового поколения
Будущие разработки включают ПППД следующего поколения, способные преодолевать барьеры резистентности и предлагающие более широкий спектр активности против всех генотипов, включая глекапревир, пибрентасвир, воксилапревир, уприфосбувир, гразопревир, рузасвир, AL-335 симепревир и одаласвир [93]. В исследовании C-SWIFT комбинировали гразопревир, элбасвир и софосбувир в лечении ранее не получавших лечения пациентов с циррозом и без него [94].Пациенты без цирроза печени получали терапию в течение 8 или 12 недель и достигли УВО 93% и 100% соответственно. Пациенты с циррозом достигли УВО 91% после 12-недельного курса. Аналогичным образом в исследовании C-ISLE оценивалась эффективность и безопасность элбасвира и гразопревира плюс софосбувир с рибавирином и без него, хотя и у пациентов с компенсированным циррозом печени [95]. Среди участников, ранее не получавших лечения, УВО через 8 недель составил 91% (21/23) у тех, кто лечился рибавирином. После лечения в течение 12 недель без рибавирина УВО составил 96% (23/24).Среди опытных участников с рибавирином и без него, УВО составил 94% (17/18) и 100% (17/17) в группе 12 недель, соответственно, и 94% (17/18) в группе 16 недель. рука. Пять человек сообщили о серьезных побочных эффектах, включая пневмонию, боль в груди, передозировку опиатами, целлюлит и снижение креатинина. Паритапревир (ABT-450), ингибитор NS3 / 4, вводится с ритонавиром (ABT-450 / r) [96]. Как фармакоусилитель ритонавир не имеет активности против ВГС; вместо этого он подавляет метаболизм паритапревира, тем самым увеличивая пиковое и минимальное воздействие препарата и позволяя принимать один раз в день дозу ABT-450 [97].В исследовании NAVIGATOR ABT-450 / r комбинируется с омбитасвиром (ABT-267), ингибитором NS5A, в течение 12 недель у пациентов без цирроза печени, не получавших лечения с генотипом 3, при этом частота УВО составила 50% без RBV и всего 9% с RBV [ 98]. Хотя препарат хорошо переносился, низкие УВО побудили к прекращению исследования. Аналогичным образом, у пациентов с циррозом или без цирроза в испытании QUARTZ II-III комбинации омбитасвир / паритапревир / ритонавир плюс софосбувир с рибавирином или без него общий УВО составил 98% через 12 недель [98].В исследовании отмечено, что сочетание ПППД с дополнительными механизмами действия и вирусологическими мишенями может быть эффективной терапевтической стратегией.
Изучаются и другие новые ингибиторы, включая уприфосбувир (MK-3682; ингибитор NS5B), рузасвир (MK8408; ингибитор NS5A), гразопревир (ингибитор NS3) и воксилапревир (ингибитор NS3 / 4A) [99]. В исследовании C-BREEZE-2 изучалась эффективность рузасвира и уприфосбувира при лечении генотипов 1–6 в течение 12 недель [100]. Однако из-за субоптимальных УВО генотипа 3 (80% у пациентов без цирроза по сравнению с68% у пациентов с циррозом печени), а также при вирусологическом рецидиве комбинация была признана терапевтически неэффективной ().
Таблица 3
Лечение следующего поколения
В фазе II C-CREST-2 была протестирована тройная комбинация уприфосбувира, рузасвира и гразопревира [101]. Общий УВО у пациентов с генотипом 3, не получавших лечения и не страдающих циррозом печени, варьировал от 86 до 95%, что позволяет предположить, что 8-недельная продолжительность лечения была неоптимальной [102]. В фазе III исследования C-CREST 2 та же тройная комбинация с рибавирином и без него изучалась на 8, 12 и 16 неделях [102].Общий УВО для пациентов с генотипом 3 составил 96%. В 8-недельной группе УВО составил 94% и 98%, без и с рибавирином соответственно. В подгруппе с циррозом только у 1 пациента из 74 рецидивов, и этот пациент находился в группе 16-недельного лечения (с рибавирином).
На этапе II исследования LEPTON оценивалась тройная комбинация софосбувира, велпатасвира и GS-9857, ингибитора протеазы нового поколения NS3 / 4A [100]. Лечение было протестировано на ранее не получавших лечения пациентах с компенсированным циррозом, неэффективностью интерферона / рибавирина с циррозом и неэффективностью ПППД с циррозом и без него.Продолжительность исходной группы составляла 6 недель, а опытной группы — 8 недель. У исходной группы был УВО 83%, в то время как опытная группа имела УВО 100%, в которую входили четыре ранее не ответивших на ПППД. Однако исследование было недостаточно мощным, и поэтому к этим результатам следует относиться осторожно.
В исследовании POLARIS-3 ранее не получавшие лечения пациенты с циррозом получали софосбувир и велпатасвир в течение 12 недель или софосбувир, велпатасвир и воксилапревир в течение 8 недель [103].В исследование были включены пациенты, которые ранее не получали лечение ПППД. В целом, обе группы достигли УВО 96% через 12 недель, что включало одно отозванное согласие и несвязанную смерть. Пациенты с циррозом, не получавшие лечения, имели УВО 96% при тройной терапии, в то время как пациенты с циррозом, прошедшие лечение, имели УВО 97%. Около 2% участников исследования испытали побочные эффекты.
Наконец, MIV-802, ингибитор NS5B, был протестирован для оценки его противовирусной активности против генотипа 3 in vitro [104].Доклинические исследования показали, что MIV-802 обладает большей противовирусной активностью против генотипа 3, чем софосбувир, что подтверждает его рассмотрение для дальнейшей разработки [105]. В целом, ПППД нового поколения для лечения гепатита С оказались клинически эффективными при лечении большого числа пациентов. Показатели УВО для ПППД следующего поколения равны или выше, чем у ПППД первого поколения. Этот новый класс терапевтических средств обещает быть простым в использовании, высокоэффективным, пан-генотипическим, одноразовым, полностью пероральным, без интерферона и рибавирина [93].
Проблемы будущего
При разработке лекарств от ВГС за последнее десятилетие было решено множество проблем и устранены пробелы в уходе, такие как охват всех генотипов, неблагоприятные побочные эффекты и охват лиц с коинфекцией ВИЧ и пациентов с циррозом печени. Достижение клинического УВО стало менее важной проблемой для пациентов, инфицированных генотипом 3, которые когда-то считались трудно поддающимися лечению [106]. Исследования на определенных группах пациентов, таких как дети, беременные женщины и кормящие матери, отсутствуют и представляют собой неудовлетворенную потребность [107].Кроме того, хотя большинство лекарств от гепатита С метаболизируются в печени, возможности применения ПППД для людей с тяжелым хроническим заболеванием почек остаются ограниченными или противопоказаны [108]. Кроме того, размер выборки из анализа подгрупп, полученный в результате клинических испытаний ПППД следующего поколения, следует интерпретировать с осторожностью. В результате необходимы более крупные выборки для оценки клинической эффективности в определенных когортах.
Более того, учитывая, что стоимость играет роль в распределении и использовании лечения, еще предстоит увидеть, как стоимость повлияет на общественное здоровье.Наша следующая задача заключается в преодолении ценовых барьеров, если мы действительно хотим искоренить генотип 3 ВГС [109]. Мы должны снизить цены на лекарства, чтобы обеспечить всеобщий доступ. Мы также должны объединить эти усилия со снижением вреда, направленным на повторное внедрение новых и устойчивых штаммов ВГС. Что еще более важно, для достижения стратегической цели, поставленной ВОЗ, которая направлена на ликвидацию гепатита С, исследователям, поставщикам медицинских услуг, политикам, затронутым сообществам, защитникам, фармацевтическим и диагностическим предприятиям и правительствам во всем мире придется работать вместе [ 110].Falade-Nwulia и др. отметили, что снижение повторного инфицирования и достижение целей по элиминации ВГС требует сочетания лечения ВГС со снижением вреда и целенаправленными поведенческими вмешательствами; Частоту повторного инфицирования следует рассматривать как показатель обращения за лечением от ВГС [111].
Более того, хотя ПППД успешно лечили ВГС, их финансовое бремя не исключает возможности использования и разработки вакцины, которая может сыграть решающую профилактическую роль [112].Несмотря на то, что существуют вакцины для предотвращения гепатита А и В, цель разработки вакцины против ВГС — защита от персистирования ВГС. Несколько вакцин-кандидатов прошли клинические испытания после многообещающих результатов на шимпанзе [113]. В настоящее время исследуются два механизма вакцинации: иммунитет, опосредованный Т-клетками, и выработка антител [114]. Однако сложный транскрипционный профиль гепатита С продолжает оставаться проблемой при разработке вакцины.
Повторное инфицирование ВГС следует свести к минимуму, но не опасаться, поскольку мы работаем над устранением ВГС.Скорее, реинфекцию следует рассматривать как показатель того, что лечение гепатита С распространяется среди групп населения, которые, скорее всего, будут поддерживать продолжающуюся эпидемию ВГС. Повторные инфекции ВГС следует сводить к минимуму, сочетая лечение ВГС со снижением вреда и хорошо продуманными целевыми поведенческими вмешательствами.
Гепатит C Генотип 3: трудно иметь, трудно лечить
Когда стало доступно генотипирование вируса гепатита С (ВГС), я узнал, что у меня генотип 1а. До недавнего времени тяжелее всего лечили гепатит С генотипа 1.Однако генотип 1 теперь довольно легко лечить с помощью новейших одобренных препаратов против гепатита С. Генотип 2 всегда легко лечить. Генотип 3 вызывает проблемы. В этом блоге я обсуждаю генотип 3, рассматриваю текущие рекомендации по лечению гепатита С генотипа 3 и смотрю на то, что нас ждет впереди.
Генотип 3 не только наиболее устойчив к лечению, но и является наиболее агрессивным типом гепатита С. По сравнению с другими генотипами люди с генотипом 3 имеют тенденцию быстрее прогрессировать до фиброза и цирроза.Генотип 3 имеет более высокую распространенность тяжелого стеатоза (ожирение печени) и более высокую частоту гепатоцеллюлярной карциномы (рак печени).
Текущие рекомендации по лечению ВГС для генотипа 3
Пациенты, ранее не прошедшие курс лечения пегинтерфероном и рибавирином, не прошли курс лечения
- Совальди (софосбувир) + рибавирин в течение 24 недель
70
частота вирусологического ответа через 12 недель (УВО12) для пациентов, ранее не получавших лечения: 93% для пациентов без цирроза; 92 процента для пациентов с циррозом печени.(Исследование VALENCE) В этом небольшом европейском исследовании было всего 13 пациентов с циррозом печени, ранее не получавших лечения. Показатели УВО12 среди пациентов, прошедших лечение: 87 процентов среди пациентов без цирроза; 60 процентов для пациентов с циррозом печени. (Исследование VALENCE)
- Sovaldi (софосбувир) + рибавирин + пегинтерферон (ПЭГ) в течение 12 недель
Частота УВО12: 87% (исследования LONESTAR и VALENCE были очень небольшими, и данные по циррозу печени по сравнению с циррозом печени не наблюдались. при условии)
Обсуждение : Показатели излечения при повторном лечении низкие, но хорошие для новичков.Все, что превышает 90% УВО, — это повод для радости, но прием рибавирина — повод для сочувствия. Рибавирин и побочные эффекты идут рука об руку, как арахисовое масло и желе. Общие побочные эффекты включают: усталость, нарушение концентрации внимания, учащенное сердцебиение, бессонницу, потерю аппетита, проблемы с настроением (беспокойство, депрессию, раздражительность, капризность), тошноту, сыпь / зуд / сухость кожи, одышку, извращение вкуса, расстройство желудка. слабость, гемолитическая анемия (низкий уровень эритроцитов), головокружение / дурноту.
Двадцать четыре недели этого не весело.Более того, реальное использование софосбувира и рибавирина может не дать таких высоких показателей излечения. Однако это выполнимо — сотни тысяч людей перенесли 48 недель приема ПЭГ плюс рибавирин; некоторые прошли тройную терапию Инсивеком или Виктрелисом. Итак, если вы лечитесь, получите поддержку. Форумы Hep — хорошее место для начала. (Бесстыдная самореклама, мои книги, особенно Гепатит С, шаг за шагом , также могут быть полезны.)
Что впереди
- Харвони (софосбувир / ледипасвир) + рибавирин в течение 12 недель: испытание ELECTRON-2 был очень маленьким — 51 пациент с гепатитом C с генотипом 3, ранее не получавший лечения, из которых только у трех был цирроз.В группе лечения, которая использовала рибавирин, 100% достигли УВО12 по сравнению с 64% в группе без рибавирина. Среди пациентов, прошедших лечение, 89% пациентов без цирроза имели УВО; пациенты с циррозом печени имели УВО 73%. Harvoni не одобрен FDA для лечения пациентов с генотипом 3.
- Даклатасвир + софосбувир в течение 12 недель: в испытании ALLY-3 фазы 3 приняли участие 152 пациента с генотипом 3 (101 не лечился / 51 проходил лечение). Из не получавших лечения субъектов 97% без цирроза имели УВО12; 58 процентов УВО пациентов с циррозом печени.Среди пациентов, прошедших лечение, 94% УВО12 у пациентов без цирроза; 69 процентов с циррозом). Даклатасвир не одобрен FDA в США.
- GS-5816 + софосбувир с рибавирином или без него: это комбинация, на которую стоит обратить внимание. GS-5816 — это ингибитор NS5A нового поколения компании Gilead Sciences (того же класса, что и ледипасвир). ELECTRON-2 сообщил о 96-100 процентах УВО при комбинации софосбувира и GS-5816, с рибавирином или без него в течение 8 недель у не получавших лечения пациентов с генотипом 3 без цирроза печени.Аналогичное исследование с использованием GS-5816 + софосбувир без рибавирина в течение 12 недель показало 93% УВО.
Генотип вируса гепатита C 3 — обзор
Эпидемиология генотипов вируса гепатита C и генотипические вариации во всем мире
ВГС разделен на шесть отдельных генотипов по всему миру с множеством подтипов в каждом классе генотипов. Генотип — это классификация вируса ВГС на основе генетического материала в цепях РНК (рис.1.1.3).
Рисунок 1.1.3. Генотипы вируса гепатита С.
Генотипы 1, 2 и 3 (HCV G1, G2 и G3) распространены во всем мире [5,6]. Типы ВГС G1a и G1b преобладают в Европе, Северной и Южной Америке и Японии, на них приходится около 60% глобальных инфекций. ВГС G2 распространен в Японии и Китае и встречается в Соединенных Штатах, а также в северной, западной и южной Европе [6,7]. ВГС G3 широко распространен в Юго-Восточной Азии, Индии и Австралии и неодинаково распространен в Европе и США [5,6].ВГС G4 в основном встречается на Ближнем Востоке, в Египте и Центральной Африке [8,9]. ВГС G5 почти ограничен Южной Африкой [10], а ВГС G6 обнаружен в определенных регионах Азии [11,12] (рис. 1.1.4).
Рисунок 1.1.4. Географическое распространение генотипов вируса гепатита С.
Происхождение и эволюция генотипов ВГС у людей до сих пор не ясны. Считается, что вирус эволюционировал в течение нескольких тысяч лет [1]. Огромное генетическое разнообразие генотипов ВГС G1, G2 и G4 в Западной и Центральной Африке [12-17] и генотипов ВГС G3 и G6 на Индийском субконтиненте и в Юго-Восточной Азии [11,12] предполагает, что ВГС является эндемическим заболеванием в эти популяции давно.Появление новых групп риска и путей передачи, таких как переливание крови, медицинское использование нестерилизованных игл и (особенно в промышленно развитых странах) употребление инъекционных наркотиков и совместное использование инъекционного оборудования, позволило быстро распространить и распространить по всему миру генотипы HCV G1, G2 и G3 в западные и другие нетропические страны за последние 30–70 лет [15]. Однако наблюдается тесная связь между конкретными генотипами и конкретными географическими регионами, такими как распространенность ВГС G4a в Египте [13–15] и ВГС G5a в Южной Африке [10].В западных странах определенные генотипы циркулируют в различных группах риска, включая ВГС G1a и G3a у потребителей инъекционных наркотиков (ПИН) и ВГС G1b, G2a, G2b, G2c и G4a по всему Средиземноморью [13,15].
За последнее десятилетие эпидемиология и распространение генотипов ВГС продемонстрировали заметные различия в одних географических регионах и были относительно стабильными в других. Большая часть вариабельности генотипа ВГС, обнаруженная между географическими регионами, может быть объяснена разной историей эпидемии ВГС в этих регионах, частотой и степенью, в которой различные факторы риска способствовали передаче ВГС, а также динамикой популяции, которая прямо или косвенно вносила специфический вклад в передачу вируса гепатита С. генотипы и их хозяева в новую среду и способствовали циркуляции генотипов, отличных от HCV G1, G2 и G3 [18].
Лечение хронического гепатита С генотипа 3 на основе софосбувира — Скандинавское исследование в реальной жизни
Аннотация
Предпосылки и цели
Инфекция, вызванная вирусом хронического гепатита С (ВГС) генотипа 3, на поздней стадии заболевания печени оказалась наиболее сложной для лечения. Мы ретроспективно оценили результаты лечения схемами на основе софосбувира (SOF) для лечения инфекций HCV генотипа 3 в реальных условиях в Скандинавии.
Методы
последовательных пациентов с хронической инфекцией ВГС генотипа 3 были включены в 16 лечебных центров в Дании, Швеции, Норвегии и Финляндии.Были включены пациенты, которые получали схему, содержащую SOF. Стадия фиброза оценивалась с помощью биопсии печени или транзиторной эластографии печени. Следующие виды лечения были назначены в зависимости от наличия и местных рекомендаций: 1) SOF + рибавирин (RBV) в течение 24 недель, 2) SOF + даклатасвир (DCV) +/- RBV в течение 12-24 недель, 3) SOF + пегилированный интерферон альфа (peg -IFN-α) + RBV в течение 12 недель или 4) SOF / ледипасвир (LDV) + RBV в течение 12–16 недель. Первичной конечной точкой был устойчивый вирусологический ответ (УВО), оцененный на 12-й неделе (УВО12) после окончания лечения.
Результаты
Мы включили 316 пациентов со средним возрастом 55 лет (диапазон 24-79), 70% мужчин, 49% прошли лечение, 58% с компенсированным циррозом и 12% с декомпенсированным циррозом. В популяцию с модифицированным намерением лечить (mITT) УВО12 был достигнут у 284/311 (91%) пациентов. Из 26 неудачных попыток лечения у пяти не было ответа, у 3 наблюдался прорыв, а у 18 — рецидив. Пять пациентов не были включены в популяцию mITT. Три пациента умерли по причинам, не связанным с лечением, а двое были потеряны для последующего наблюдения.Частота УВО12 была одинаковой для всех схем лечения, но ниже у мужчин (p = 0,042) и у пациентов с декомпенсированным заболеванием печени (p = 0,004).
Заключение
Мы обнаружили, что лечение на основе софосбувира в реальных условиях может обеспечить частоту УВО, превышающую 90%, у пациентов с инфекцией генотипа 3 ВГС и прогрессирующим заболеванием печени.
Образец цитирования: Dalgard O, Weiland O, Noraberg G, Karlsen L, Heggelund L, Färkkilâ M, et al. (2017) Лечение хронического гепатита C генотипа 3 на основе софосбувира — скандинавское исследование в реальной жизни.PLoS ONE 12 (7):
e0179764.https://doi.org/10.1371/journal.pone.0179764
Редактор: Мин-Лунг Ю, Мемориальная больница Чун Хо Медицинского университета Гаосюн, Тайвань
Поступила: 14 марта 2017 г .; Принято к печати: 2 июня 2017 г .; Опубликовано: 13 июля 2017 г.
Авторские права: © 2017 Dalgard et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Некоторые участвующие больницы не позволяют делать данные общедоступными. Реальные данные, на которых основан анализ, извлекаются из местных реестров качества, некоторые из которых имеют временные ограничения, требующие удаления данных через определенное количество лет. Данные доступны по запросу. Пожалуйста, свяжитесь с Ингунн Мелкерааен, отделение инфекционных заболеваний, университетская больница Акерсхуса, 1478 Лоренског. Норвегия, электронная почта: [email protected] или Далгард О. ([email protected]).
Финансирование: Автор (ы) не получил специального финансирования для этой работы.
Конкурирующие интересы: Олав Далгард: исследовательские гранты Gilead, Abbvie и Merck. Платные лекции Abbvie, Merck и Gilead. Председатель комитета, пишущего норвежское национальное руководство по лечению ВГС в Норвегии. Нина Вайс: клинический исследователь, спикер и член консультативного совета Abbvie, Bristol Myers Squibb и Merck Sharp & Dohme; спикер и член консультативного совета Gilead.Ларс Карлсен: Консультативные советы: Merck, Abbvie, Gilead, Bristol-Myers Squibb. Член комитета, который составляет национальные руководства по лечению ВГС в Норвегии. Клинический эксперт по ВГС для Норвежского агентства по лекарственным средствам Марти Фарккила: Грант на исследование: Gilead. Стоимость спикера и консультации, MSD Finland, Janssen, BMS, Takeda, Pfizer, Cook Ireland, Intercept Ola Weiland: Консультации: AbbVie, BMS, Gilead, Janssen, Medivir, Roche и MSD / Merck. Спикерское бюро: AbbVie, BMS, Gilead, Janssen, Medivir, Roche и MSD / Merck Lone Madsen: Стоимость лекций от: BMS и Medivir.Член консультативного совета: AbbVie и BMS. Метте Кьер: Гонорары от Abbvie. Это не влияет на нашу приверженность политике PLOS ONE в отношении обмена данными и материалами.
Введение
Около 100 000 человек инфицированы вирусом гепатита С (ВГС) в Скандинавии (Дания, Финляндия, Норвегия, Швеция), из которых 50% имеют генотип 3 [1, 2]. Пациенты с генотипом 3 HCV, по-видимому, имеют более быстрое развитие цирроза и его осложнений, чем пациенты, инфицированные другими генотипами [3].
С 2011 года стали доступны новые противовирусные препараты прямого действия (ПППД) против ВГС [4]. Ингибиторы протеаз первого поколения не обладали эффектом против генотипа 3, тогда как нуклеотидный аналог ингибитора полимеразы NS5B софосбувир (SOF) обладал пангенотипической активностью, включая влияние на генотип 3 [5] [6]. SOF, введенный в течение 24 недель в сочетании с рибавирином (RBV) при инфекциях генотипа 3, обеспечил устойчивый вирусологический ответ (SVR) через 12 недель после окончания лечения (SVR12) у 90% пациентов без цирроза печени и только у 60% пациентов с циррозом [7 ].
Исследования in vitro с ингибитором NS5A даклатасвиром (DCV) также показали высокую эффективность против всех генотипов, включая генотип 3 [8]. В исследовании ALLY-3 SOF + DCV без RBV назначали в течение 12 недель и дали УВО12 у 94% пациентов с генотипом 3 без цирроза печени, но только у 63% пациентов с циррозом [9]. В исследовании ALLY-3 + SOF + DCV + RBV назначали в течение 12 или 16 недель не получавшим лечения и опытным пациентам с фиброзом стадии F3-F4, и УВО был достигнут у 31/36 (86%) пациентов с F4 с нет улучшения при продлении лечения до 16 недель [10].
Второй ингибитор NS5A, ледипасвир (LDV), был объединен с SOF в таблетке с фиксированной дозой (FDC), вводимой один раз в день. Эта терапия очень эффективна против инфекций HCV генотипа 1, а также у пациентов с циррозом [11]. Для инфекций с генотипом 3 опубликовано мало данных, но исследования in vitro и исследования фазы 2 показывают, что LDV менее эффективен, чем DCV при инфекциях с генотипом 3 [12, 13].
Целью этого исследования было документальное подтверждение эффективности схем на основе софосбувира у пациентов, получавших лечение от инфекции HCV генотипа 3, в реальных условиях в Скандинавии.
Материалы и методы
В это ретроспективное многоцентровое когортное исследование были включены пациенты, инфицированные HCV генотипа 3 в возрасте ≥18 лет, получившие хотя бы одну дозу SOF в Дании, Норвегии, Финляндии или Швеции. Пациенты с трансплантированным органом и пациенты с коинфекцией ВИЧ или HBV были исключены. Если пациенты получали лечение с помощью режима, содержащего SOF, более одного раза, в настоящий анализ включали только первое лечение. В Швеции Региональный совет по этике, Стокгольм, Швеция (Regionala etikprövningsnämnden i Stockholm), и Региональный совет по этике, Гётеборг, Швеция (Regionala etikprövningsnämnden i Göteborg), рассмотрели исследование и дали разрешение.В Дании Датское агентство по защите данных одобрило сбор данных (jnr. 1-16-02-453-12).
Институциональные наблюдательные советы (IRB) в каждом из участвующих исследовательских центров в Норвегии и Финляндии (Университетская больница Акерсхус; Sørlandet sykehus, Арендал; Университетская больница Ставангера и Вестре Викен, HF, Драммен, Норвегия и Университетская больница Хельсинки, Финляндия) одобрили изучение.
Лечение
Следующие схемы лечения использовались в соответствии с национальными руководящими принципами и / или доступностью препаратов ПППД: 1) СОФ + рибавирин в течение 24 недель, 2) СОФ + ДКВ +/- рибавирин в течение 12–24 недель, 3) СОФ / ЛДВ + рибавирин в течение 12–24 недель или 43) SOF + RBV + пегилированный интерферон альфа (peg-IFN-α) в течение 12 недель.
Вирусология
Вирусологические анализы были выполнены в местных лабораториях. РНК ВГС в плазме определяли с помощью теста Cobas AmpliPrep / COBAS TaqMan HCV (Roche Diagnostics, Бранчбург, Нью-Джерси), который количественно определяет РНК ВГС с пределом обнаружения (LOD) 15 МЕ / мл или Abbott RealTime HCV с LOD 12 МЕ / мл (Abbott GmbH, Висбаден, Германия).
Генотип вируса определяли с помощью метода гибридизации (VERSANT HCV Genotype Assay (LiPA, Bayer HealthCare LLC, Tarrytown, NY, USA)) или с помощью праймер-специфичного метода RT-PCR TaqMan [14] или секвенирования C-E1 по Сэнгеру. область ВГС [15].
Оценки
Первичной конечной точкой эффективности был УВО, определяемый как неопределяемая РНК ВГС через 12 недель после окончания лечения (УВО12). Вирусологический прорыв во время лечения был определен как два последовательных результата РНК ВГС более чем на 1 log 10 МЕ на миллилитр выше надирного уровня РНК ВГС. Вирусологический рецидив определялся как определяемый уровень РНК ВГС после окончания лечения у пациента, у которого во время лечения не определялась РНК ВГС. Отсутствие ответа определялось как обнаружение РНК HCV в конце лечения у пациента, у которого не было вирусологического прорыва.
Фиброз печени оценивали с помощью транзиторной эластографии печени (TE) или биопсии печени [16]. Стадия фиброза при биопсии печени оценивалась по шкале METAVIR [17], а средний уровень TE> 12,5 кПа определялся как цирроз.
Статистика
Анализ проводился с использованием программного пакета SPSS v.14.0. УВО12 оценивали в модифицированной популяции намеренных лечиться (mITT), которая включала пациентов, получивших ≥1 дозу схемы, содержащей SOF, но не включала пациентов без вирусологической неудачи, которые были потеряны для последующего наблюдения или умерли от расстройств, не связанных с лечением. лечение.
Описательная статистика выполнялась с помощью критерия хи-квадрат, парного t-критерия или, в зависимости от случая,
Был проведен логистический регрессионный анализ с SVR12 в качестве зависимой переменной и пола, возраста, режима лечения и стадии заболевания (компенсированное или декомпенсированное заболевание печени) в качестве независимых переменных. Двустороннее значение P <0,05 считалось значимым.
Результаты
Всего пролечено 316 пациентов с инфекцией HCV генотипа 3; 129 в Дании, пять в Финляндии, 74 в Норвегии и 108 в Швеции.Характеристики пациентов в зависимости от схемы лечения представлены в таблице 1.
В популяции mITT УВО12 был достигнут у 285/311 (92%) пациентов (у 4 пациентов, включенных в популяцию mITT, данные последующего наблюдения были доступны только через 4 недели после прекращения лечения). Из 26 неудачных попыток лечения у пяти не было ответа, у трех — прорыв, а у 18 — рецидив. Пять пациентов не были включены в популяцию mITT, из которых двое были потеряны для последующего наблюдения, трое умерли по причинам, не связанным с лечением (один умер от метастатического рака толстой кишки, один умер от печеночной недостаточности и один умер от перитонита, который был осложнением колоскопии). .
Предикторы SVR
Частота УВО12 была одинаковой при всех режимах лечения (рис. 1). Однако частота УВО12 была ниже у мужчин, чем у женщин (194/217 (89%) и 90/93 (97%) соответственно; p = 0,042). Кроме того, у пациентов с циррозом печени была отмечена тенденция к более низкому уровню ответа по сравнению с пациентами без цирроза (190/212 (90%) и 95/99 (96%) соответственно; p = 0,060). У пациентов с декомпенсированным циррозом (B или C по шкале Чайлд-Пью) частота УВО12 была ниже, чем у пациентов с компенсированным заболеванием печени (31/38 (82%) и 238/252 (94%) соответственно; (p = 0.004)) (рис.1). Точно так же увеличение жесткости печени было связано со снижением шансов достижения SVR12 (p = 0,030) (рис. 2).
Рис. 1. Устойчивый вирусологический ответ (УВО) через 12 недель после окончания лечения в соответствии с различными схемами лечения на основе софосбувира и стадией заболевания печени у пациентов с хронической инфекцией HCV генотипа 3 (n = 311).
* Данные о 24 пациентах с циррозом печени не включены из-за отсутствия оценки CP.
https: // doi.org / 10.1371 / journal.pone.0179764.g001
В многомерном пошаговом логистическом регрессионном анализе, который не включал результаты жесткости печени, SVR12 в группе mITT был связан с женским полом (p = 0,032) и отсутствием декомпенсированное заболевание печени (р = 0,04).
Лечение SOF + DCV
SOF + DCV было введено 193/316 (61%) пациентам, из которых 123 (64%) также получали RBV. Продолжительность лечения была короткой (12-16 недель) у 119/193 (62%) (12 недель у 71 пациента) и длинной (17-26 недель) у 74/193 (38%) пациентов (24 недели у 66 пациентов).
В группе mITT SVR12 был получен у 177/193 (92%) пациентов, получавших SOF + DCV +/- RBV. Частота УВО12 не различалась между теми, кто получал более короткую и более длительную продолжительность лечения (111/119 (93%) и 66/74 (89%), соответственно). Также не различались между теми, кто получал и не получал рибавирин (115/123 ( 93,5%) по сравнению с 62/70 (88,6%) соответственно). Однако среди тех, кто получал непродолжительное лечение, наблюдалась тенденция к более высокому уровню УВО12 у пациентов, получавших рибавирин, по сравнению с теми, кто этого не делал (78/81 (96%) и 33/38 (87%) соответственно; p = 0.055). В дальнейших двумерных анализах SVR12 не зависел от возраста, пола, опыта лечения, наличия цирроза, наличия декомпенсированного заболевания печени и эластичности печени.
SOF + DCV вводили 20 пациентам с Чайлд-Пью B или C, и УВО был достигнут у 17 (85%) из них. Продолжительность лечения составила 24 недели у 15 (75%) и 12–16 недель у 5 (25%) пациентов. РБВ вводили 12 (60%) пациентам.
Обсуждение
В этом реальном скандинавском исследовании лечения ВГС на основе SOF у пациентов с инфекцией ВГС генотипа 3, у многих из которых наблюдается прогрессирующее заболевание печени, УВО12 был достигнут в 92% случаев.Таким образом, 96% пациентов без цирроза достигли УВО12, что согласуется с более ранними исследованиями, в которых частота УВО12 составляла от 87% до 97% [7, 9, 18]. Более того, 89% пациентов с циррозом достигли УВО12, что является впечатляющим показателем излечения, поскольку у многих пациентов с циррозом наблюдалась декомпенсация. Частота УВО12 у пациентов с циррозом печени выше, чем в клинических испытаниях фаз 2 и 3 [9, 10].
Хотя соблюдение режима лечения систематически не отслеживалось, мы предполагаем, что высокий показатель УВО12, достигнутый в нашем исследовании, был достигнут за счет высокого очень высокого показателя приверженности, достигнутого при тщательном наблюдении за опытными медсестрами.
Лишь в нескольких исследованиях сообщалось о влиянии лечения на основе SOF на пациентов, инфицированных HCV генотипа 3 с декомпенсированным заболеванием печени, в реальных условиях [19, 20]. В соответствии с нашими данными, проведенное в Германии исследование в реальных условиях показало, что SVR12 был достигнут у 83% из 41 пациента с генотипом 3 и декомпенсированным заболеванием печени, получавших SOF + DCV +/- RBV [19]. Хотя ответ лучше, чем тот, который был достигнут в Программе расширенного доступа NHS England Expanded Access Program (EAP), которая сообщила о достижении УВО у 68% из 192 декомпенсированных пациентов с генотипом 3 HCV, получавших SOF / LDV или SOF + DCV [21].Недавно Velpatasvir (VEL), ингибитор NS5A 2 -го поколения с пангенотипической эффективностью, был одобрен в Европе и Северной Америке в таблетках FDC с SOF [22]. Среди пациентов с компенсированным циррозом печени и инфекцией HCV генотипа 3 93% достигли УВО12 после 12 недель лечения SOF / VEL. Однако среди пациентов с декомпенсированным заболеванием печени только 50% достигли УВО12 после 12 или 24 недель лечения SOF / VEL [23]. При добавлении рибавирина частота УВО12 увеличилась до 85%, но только 13 пациентов получили это лечение.
Европейская ассоциация изучения печени (EASL) не рекомендует лечить инфекцию HCV генотипа 3 с помощью SOF / LDV, поскольку активность LDV в отношении генотипа 3 in vitro значительно ниже, чем DCV [13]. DCV не был доступен для всех наших пациентов в течение начального периода исследования, и, таким образом, 32 пациента получали SOF / LDV + RBV в течение 12–16 недель, из которых 28 (94%) достигли УВО. Среди пациентов с циррозом печени, получавших SOF / LDV + RBV, 91% достигли УВО. Можно предположить, что наблюдаемая нами высокая частота УВО была вызвана SOF + RBV и что LDV вносил лишь незначительный вклад.Это, однако, маловероятно с учетом того факта, что частота УВО после 12 недель лечения SOF + RBV пациентам с генотипом 3 HCV и циррозом печени составила только 34% в исследовании фазы 3 [6].
Мужской пол был связан с неэффективностью лечения, в том числе при контроле стадии заболевания печени. В исследовании ALLY-3, в котором все пациенты получали SOF + DCV в течение 12 недель, была выявлена аналогичная тенденция [9]. Мы предполагаем, что это может отражать иммунологическую уязвимость мужчин, которая также была отмечена при острых инфекциях ВГС, когда мужчины реже спонтанно излечивают инфекцию, чем женщины [24].
Поскольку это исследование представляет собой многоцентровое, реальное, нерандомизированное когортное исследование, результаты следует интерпретировать с осторожностью. Примечательно, что внешний мониторинг данных не проводился. Несмотря на эти недостатки, данные, полученные в реальных условиях, являются дополнением к рандомизированным клиническим испытаниям и предоставляют важные данные об исходах для более широкого круга пациентов, включая пациентов с более поздними стадиями заболевания печени, которые часто исключаются из основных регистрационных испытаний.
Заключение
Мы обнаружили, что лечение на основе софосбувира в реальных условиях может обеспечить частоту УВО, превышающую 90%, у пациентов с инфекцией HCV генотипа 3 и прогрессирующим заболеванием печени.
Вклад авторов
- Концептуализация: OD GN NW OW.
- Обработка данных: OD.
- Формальный анализ: OD.
- Получение финансирования: OD.
- Расследование: OD OW GN LK LH MF UB EB AØ MSK HK BTR SH LGM ALL ML NW.
- Методология: OD GN NW OW.
- Администрация проекта: OD NW.
- Программное обеспечение: OD.
- Надзор: OD.
- Подтверждение: OD.
- Визуализация: OD.
- Написание — черновик: ОД.
- Написание — просмотр и редактирование: OD ML NW OW.
Ссылки
- 1.
Корнберг М., Разави Х.А., Альберти А., Бернаскони Э., Бути М., Купер С. и др. Систематический обзор эпидемиологии вируса гепатита С в Европе, Канаде и Израиле. Liver Int.2011; 31 Приложение 2: 30–60. Epub 18.06.2011. pmid: 21651702. - 2.
Bruggmann P, Berg T, Ovrehus AL, Moreno C, Brandao Mello CE, Roudot-Thoraval F, et al. Историческая эпидемиология вируса гепатита С (ВГС) в отдельных странах. J Viral Hepat. 2014; 21 Приложение 1: 5–33. pmid: 24713004. - 3.
Канвал Ф., Крамер Дж. Р., Ильяс Дж., Дуан З., Эль-Сераг HB. Генотип 3 HCV связан с повышенным риском цирроза и гепатоцеллюлярного рака в национальной выборке ветеранов США с HCV.Гепатология. 2014; 60 (1): 98–105. pmid: 24615981; - 4.
Пурдад Ф., Маккоун мл., Бэкон Б.Р., Бруно С., Маннс М.П., Сулковски М.С. и др. Боцепревир для нелеченой хронической инфекции HCV генотипа 1. N Engl J Med. 364 (13): 1195–206. Epub 2011/04/01. pmid: 21449783. - 5.
Пурдад Ф., Маккоун-младший, Бэкон Б.Р., Бруно С., Маннс М.П., Сулковски М.С. и др. Боцепревир для нелеченой хронической инфекции HCV генотипа 1. N Engl J Med. 2011. 364 (13): 1195–206. Epub 2011/04/01. pmid: 21449783. - 6.
Лавиц Э., Мангиа А., Уайлс Д., Родригес-Торрес М., Хассанейн Т., Гордон С.К. и др. Софосбувир для лечения хронического гепатита С. N Engl J Med. 2013. 368 (20): 1878–87. Epub 2013/04/24. pmid: 23607594. - 7.
Zeuzem S, Dusheiko GM, Salupere R, Mangia A, Flisiak R, Hyland RH и др. Софосбувир и рибавирин при генотипах 2 и 3 ВГС. N Engl J Med. 2014; 370 (21): 1993–2001. pmid: 24795201. - 8.
Ван С., Валера Л., Цзя Л., Кирк М.Дж., Гао М., Фриделл Р.А.Активность даклатасвира in vitro в отношении NS5A вируса гепатита С генотипа 3. Противомикробные средства и химиотерапия. 2013; 57 (1): 611–3. pmid: 23089758; - 9.
Нельсон Д.Р., Купер Дж. Н., Лалезари Дж. П., Лавиц Э., Покрос П. Дж., Гитлин Н. и др. Полностью пероральное 12-недельное лечение даклатасвиром и софосбувиром у пациентов с инфекцией вируса гепатита С генотипа 3: исследование III фазы ALLY-3. Гепатология. 2015; 61 (4): 1127–35. pmid: 25614962; - 10.
Leroy V, Angus P, Bronowicki JP, Dore GJ, Hezode C, Pianko S и др.Даклатасвир, софосбувир и рибавирин для лечения генотипа 3 вируса гепатита С и прогрессирующего заболевания печени: рандомизированное исследование III фазы (ALLY-3 +). Гепатология. 2016; 63 (5): 1430–41. pmid: 26822022; - 11.
Afdhal N, Zeuzem S, Kwo P, Chojkier M, Gitlin N, Puoti M, et al. Ледипасвир и софосбувир при нелеченой инфекции HCV генотипа 1. N Engl J Med. 2014; 370 (20): 1889–98. pmid: 24725239. - 12.
Gane EJ, Hyland RH, An D, Svarovskaia E, Pang PS, Brainard D, et al. Эффективность ледипасвира и софосбувира с рибавирином или без него в течение 12 недель у пациентов с инфекцией HCV генотипа 3 или 6.Гастроэнтерология. 2015; 149 (6): 1454–61 e1. pmid: 26261007. - 13.
Гао М. Противовирусная активность и устойчивость ингибиторов комплекса репликации NS5A ВГС. Curr Opin Virol. 2013. 3 (5): 514–20. pmid: 23896281. - 14.
Линд М., Ханнун С. Генотипирование вируса гепатита С с помощью ПЦР в реальном времени Такмана. J Clin Virol. 2005. 34 (2): 108–14. pmid: 16157261. - 15.
Корбет С., Бух Дж., Хейнсен А., Фомсгаард А. Подтипирование вируса гепатита С с помощью анализа обратной транскриптазы на основе ядра-оболочки 1 с секвенированием и его использование для определения распределения подтипов среди датских пациентов.J Clin Microbiol. 2003. 41 (3): 1091–100. pmid: 12624035; - 16.
Castera L, Vergniol J, Foucher J, Le Bail B, Chanteloup E, Haaser M и др. Проспективное сравнение транзиторной эластографии, фибротеста, APRI и биопсии печени для оценки фиброза при хроническом гепатите С. Гастроэнтерология. 2005. 128 (2): 343–50. Epub 2005/02/03. pmid: 15685546. - 17.
Бедосса П., Пойнард Т. Алгоритм оценки активности при хроническом гепатите С. Гепатология. 1996. 24 (2): 289–93.pmid: 86 - 18.
Лавиц Э., Пурдад Ф., Брейнард Д.М., Хайланд Р.Х., Ан Д., Дворы-Соболь Х. и др. Софосбувир с пегинтерфероном-рибавирином в течение 12 недель у ранее леченных пациентов с генотипом 2 или 3 гепатита С и циррозом печени. Гепатология. 2015; 61 (3): 769–75. pmid: 25322962; - 19.
Welzel TM, Petersen J, Herzer K, Ferenci P, Gschwantler M, Wedemeyer H, et al. Даклатасвир плюс софосбувир, с рибавирином или без него, обеспечили высокий устойчивый вирусологический ответ у пациентов с инфекцией ВГС и прогрессирующим заболеванием печени в реальной когорте.Кишечник. 2016. pmid: 27605539. - 20.
Янг Дж., Вайс Н., Хофер Х., Ирвинг В., Вейланд О., Джиостра Е. и др. Эффективность терапии на основе даклатасвира у европейских пациентов с хроническим гепатитом С и прогрессирующим заболеванием печени. BMC Infect Dis. 2017; 17 (1): 45. pmid: 28061762; - 21.
Фостер Г.Р., Ирвинг В.Л., Чунг М.К., Уокер А.Дж., Хадсон Б.Э., Верма С. и др. Влияние противовирусной терапии прямого действия на пациентов с хроническим гепатитом С и декомпенсированным циррозом печени. J Hepatol.2016; 64 (6): 1224–31. pmid: 26829205. - 22.
Фостер Г.Р., Афдал Н., Робертс С.К., Брау Н., Гане Э.Дж., Пианко С. и др. Софосбувир и Велпатасвир для инфекции генотипа 2 и 3 ВГС. N Engl J Med. 2015; 373 (27): 2608–17. pmid: 26575258. - 23.
Карри М. П., О’Лири Дж. Г., Бзовей Н., Мьюир А. Дж., Коренблат К. М., Фенкель Дж. М. и др. Софосбувир и Велпатасвир для лечения гепатита С у пациентов с декомпенсированным циррозом печени. N Engl J Med. 2015; 373 (27): 2618–28. pmid: 26569658. - 24.
Blackard JT, Shata MT, Shire NJ, Sherman KE.Острая вирусная инфекция гепатита С: проблема хроническая. Гепатология. 2008. 47 (1): 321–31. pmid: 18161707;
Расширенная терапия у пациентов с гепатитом C, инфицированных генотипом 3 — Просмотр полного текста
В этом исследовании планируется рассмотреть вопрос о том, следует ли увеличивать продолжительность терапии PegIFNα2b 1,5 мг / кг / неделю с 24 до 48 недель и использовать рибавирин в зависимости от веса (15 мг / кг) может снизить частоту рецидивов и, таким образом, увеличить частоту УВО у пациентов, инфицированных генотипом 3, которые не смогли достичь RVR, но достигли полного cEVR, определяемого как неопределяемая РНК HCV (т. Е.<50 или <15 МЕ / мл к 12 неделям). Это исследование необходимо, потому что, хотя у большинства пациентов с генотипом 3 в конечном итоге РНК HCV становится неопределяемой во время лечения, рецидив после прекращения терапии остается основной причиной неспособности достичь УВО. Это очень важный вопрос, учитывая, что на сегодняшний день ни один из новых низкомолекулярных препаратов не является эффективным против генотипа 3, а это означает, что в настоящее время у пациентов с инфекцией генотипа 3 нет других вариантов. Рецидивы особенно распространены у пациентов с запущенным заболеванием печени, но было показано, что если УВО может быть достигнут у пациентов с запущенным заболеванием, риск печеночной недостаточности значительно снижается, как и риск гепатоцеллюлярной карциномы (ГЦК).Как следствие, потребность в трансплантации печени уменьшается, а выживаемость повышается. Поэтому очень важно определить стратегии уменьшения рецидивов и повышения показателей УВО.
Некоторые люди подвержены большему риску заражения генотипом 3. В западном мире основными группами риска являются нынешние или бывшие потребители наркотиков (ПИН) и иммигранты, выросшие в Южной Азии (Индия и Пакистан), где заражение, вероятно, происходит в раннем детстве из-за воздействию загрязненных инструментов, игл и т. д.
Вторым потенциальным преимуществом достижения УВО является снижение заболеваемости диабетом. Было продемонстрировано, что диабет чаще встречается у инфицированных гепатитом С, чем среди населения в целом — это наблюдение было сделано при изучении базы данных населения NHANES. Прелюдией к развитию диабета 2 типа является инсулинорезистентность. Инсулинорезистентность (ИР) присутствует примерно у одной трети пациентов, хронически инфицированных ВГС, причем этот показатель наиболее высок у пациентов с циррозом печени и у тех, кто страдает избыточным весом или ожирением.Ранние данные показывают, что, хотя наличие инсулинорезистентности снижает чувствительность к интерферону, если может быть достигнут УВО, резистентность к инсулину теряется. Исследования ИР у лиц, инфицированных вирусом гепатита С генотипа 3, отсутствуют. Независимо от инфекции ВГС, рождение в Южной Азии является фактором риска диабета 2 типа.
Проблема инсулинорезистентности и эффективности противовирусной терапии при хроническом гепатите С решалась исключительно среди кавказцев, инфицированных генотипом 1.Последние данные из Японии показывают, что у пациентов с диабетом и гепатитом C успешная эрадикация РНК HCV может одновременно предотвратить последующий диабет и, предположительно, системные осложнения этого заболевания.
Имеется мало данных о частоте БВО среди населения Южной Азии, поскольку из Пакистана и Индии было сообщено о нескольких терапевтических испытаниях у пациентов с инфекциями генотипа 3. Оценки могут быть получены только из исследований, проведенных на кавказцах из Северной Европы и Северной Америки.В исследовании Шиффмана частота БВО у лиц с инфекцией генотипа 3 составляла 62%, а предварительный отчет об испытании Альбуферона у пациентов с генотипами 2 и 3 показывает, что частота БВО у азиатов колебалась от 44 до 60% — эта цифра включала всех азиатов. .
Есть несколько причин, по которым нужно специально рассматривать способы улучшения результатов противовирусной терапии у пациентов, инфицированных ХГС генотипа 3. Во-первых, практически во всех исследованиях лечения сообщается об объединенной частоте УВО, достигнутой для генотипов 2 и 3, даже несмотря на то, что данные свидетельствуют о том, что ответ на терапию отличается между этими двумя генотипами.Внутри популяций пациентов с инфекцией генотипа 3 также могут быть различия. Жители Южной Азии преимущественно инфицированы генотипом 3a, в то время как потребители инъекционных наркотиков, как правило, имеют инфекцию генотипа 3b. В английской литературе не опубликованы официальные испытания противовирусной терапии у жителей Южной Азии или сравнения подтипов генотипа 3.
У пациентов, инфицированных генотипом 1, медленная реакция на противовирусную терапию, т.е. отсутствие БВО, связана со значительно более высокой частотой рецидивов у тех, у кого РНК ВГС не определяется через 12 недель, а не через 4 недели после начала лечения.Продление лечения еще на шесть месяцев значительно снижает частоту рецидивов. Продление лечения пациентов, инфицированных генотипом 3, у которых ранее случился рецидив всего через 14 недель терапии до 24 недель, снизило частоту рецидивов. Таким образом, ожидается, что, увеличив продолжительность лечения с 24 до 48 недель у тех, у кого не удалось достичь БВО (т. Е. У пациентов с медленным ответом), но которые действительно достигли полного РВО, мы надеемся предотвратить рецидив от лечения. Потенциальным дополнительным преимуществом достижения УВО в этой популяции пациентов, многие из которых уже имеют высокий риск СД2, является то, что это может снизить вирусно-опосредованный компонент ИР.
Что нужно знать: генотипы гепатита С
«Гепатит» означает воспаление печени. Вирус, известный как гепатит С или гепатит С, является наиболее частой причиной.
Ученые называют различные типы гепатита С «генотипами». Каждый генотип гепатита С имеет различный генетический состав, который помогает его определить.
Существует шесть основных генотипов. Ученые разбивают каждое из этих чисел на подтипы по буквам, например 1a, 1b и т. Д. Некоторые генотипы более распространены в определенных частях мира и лучше поддаются определенному лечению.
Какой у вас генотип?
В США наиболее распространен генотип 1. Это составляет около 75% всех случаев заболевания в США. Остальные 25% — это в основном генотипы 2 или 3. Некоторые американцы могут иметь генотипы 4, 5 или 6. Генотип 4 наиболее распространен в Африке, тогда как генотип 6 наиболее распространен в Юго-Восточной Азии.
Ваш врач может проверить вашу кровь, чтобы узнать, есть ли у вас гепатит C и какой это генотип. У большинства людей он есть. Но у некоторых их больше одного. Ваш врач может назвать это «смешанной инфекцией».
У вас больше шансов заразиться смешанной инфекцией, если вы:
- Много лет назад получили продукты крови, такие как тромбоциты, плазма, эритроциты или цельная кровь
- Получили продукты крови в месте, где не проверяют кровь для гепатита C
- Находятся на диализе почек
- Инъекционные наркотики с использованием общих или нестерилизованных игл
Имейте в виду, что вы можете быть носителем вируса гепатита C, даже если у вас нет симптомов гепатита. Как только вы узнаете свой статус и генотип, вы и ваш врач сможете принять решение о плане лечения.
Как генотипы влияют на лечение
Лекарства, известные как противовирусные препараты прямого действия, или ПППД, останавливают копирование вируса гепатита С. Некоторые ПППД эффективны для лечения всех генотипов гепатита С. Другие работают только над одним или несколькими.
Ваш врач, вероятно, пропишет вам комбинацию этих лекарств:
Некоторые таблетки объединяют два лекарства в одну.
Вы, вероятно, будете принимать эти лекарства от 8 до 12 недель. Но они могут не подходить для всех из-за таких факторов, как стоимость или другие болезни.
Ваш конкретный генотип может рассказать вашему врачу важные вещи о том, как использовать эти лекарства, на что обращать внимание и о других лекарствах, которые могут вам понадобиться.
Например, у вас может быть больше шансов на цирроз (серьезное рубцевание печени), если у вас генотип 1.
Генотип 3, второй по распространенности подтип в мире, может не реагировать на одни только ПППД.


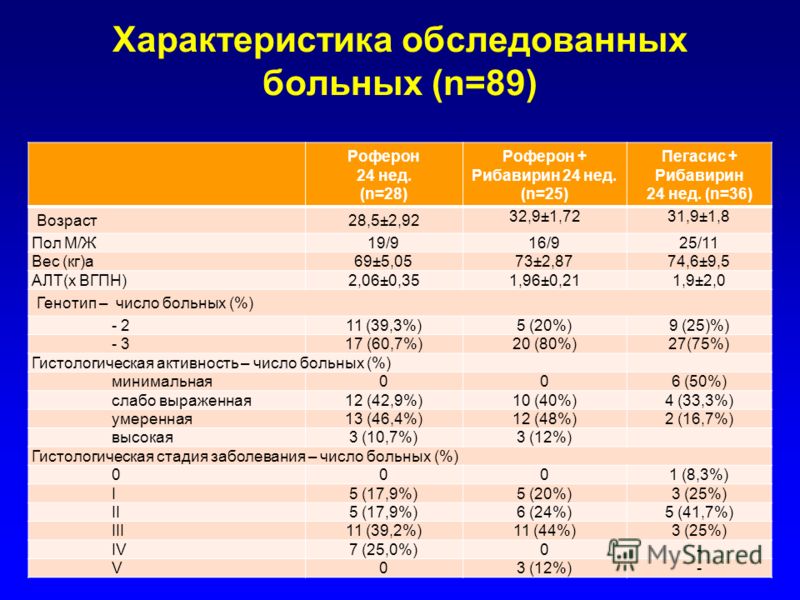 Танцы, езда на велосипеде, прогулки, йога или любые упражнения могут сохранить ваше здоровье и уменьшить стресс и гнев.
Танцы, езда на велосипеде, прогулки, йога или любые упражнения могут сохранить ваше здоровье и уменьшить стресс и гнев.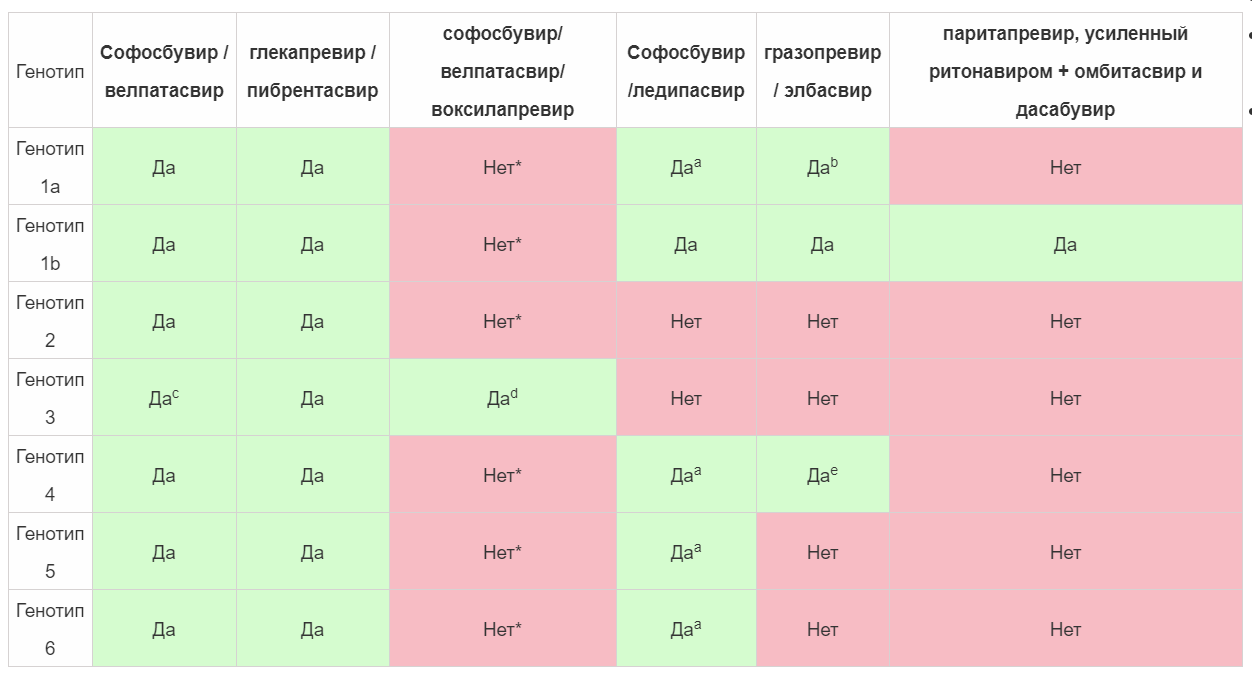 Практикуйте позитивное мышление, заменяя негативные мысли посланиями надежды и утверждения.
Практикуйте позитивное мышление, заменяя негативные мысли посланиями надежды и утверждения. Носитель не болеет сам, но может заражать других людей.
Носитель не болеет сам, но может заражать других людей. Длительность лечения составляет в среднем 3 месяца.
Длительность лечения составляет в среднем 3 месяца.