DNA HBV(кач.)
Исследование для выявления возбудителя гепатита В (HBV), в ходе которого с помощью метода полимеразной цепной реакции (ПЦР) в «реальном времени» определяется наличие генетического материала (ДНК) вируса в крови. Чувствительность метода составляет 45 копий/мл (или 10МЕ/мл).
Вирусный гепатит В (ВГВ) – инфекционное заболевание печени, вызванное ДНК-содержащим вирусом гепатита В (HBV). Среди всех причин развития острого гепатита и хронической вирусной инфекции вирус гепатита В считается одной из самых распространенных в мире.
Источник инфекции – больной вирусным гепатитов В или бессимптомный вирусоноситель. Гепатит В передаётся с кровью и биологическими жидкостями парентеральным, трансплацентарным, половым путями. Проникая в организм, вирус гепатита попадает в макрофаги крови и разносится по организму. Репликация вируса происходит в лимфатических узлах, костном мозге, фолликулах селезёнки, макрофагах, гепатоцитах. Повреждение печени обусловлено, в основном, за счёт иммунного лизиса; также вирус оказывает прямое цитопатическое действие.
Инкубационный период заболевания – от 4 недель до 6 месяцев. Вирусный гепатит В может протекать как в виде легких форм, длящихся несколько недель, так и в виде многолетней хронической инфекции. Основные признаки гепатита: желтушность кожных покровов, лихорадка, тошнота, утомляемость, в лабораторных анализах – нарушения функции печени и специфические антигены вируса гепатита В. Острое заболевание может быстро приводить к летальному исходу, переходить в хроническую инфекцию или заканчиваться полным выздоровлением. Считается, что после перенесенного ВГВ формируется стойкий иммунитет. Частота формирования хронических форм инфекции у детей составляет 30-90%, у взрослых -5-10%. Хронический вирусный гепатит В связан с развитием цирроза и рака печени.
Существует несколько специфических тестов для выявления существующего или перенесенного вирусного гепатита В. Для подтверждения наличия инфекции и уточнения периода заболевания используют определение антигенов вируса, антител к ним и ДНК вируса. ПЦР отличается высокой чувствительностью и специфичностью. Методом ПЦР можно определить ДНК вируса качественно или количественно. Благодаря качественному методу подтверждается присутствие вируса гепатита В в организме и его активное размножение. Это особенно важно в сложных диагностических случаях. При инфицировании мутантными штаммами вируса специфические антигены HBsAg и HBeAg могут быть отрицательными. Качественное определение ДНК вируса играет важную роль в раннем выявлении гепатита В. Генетический материал вируса обнаруживается в крови на несколько недель раньше, чем HBsAg. Положительный результат ПЦР за период более 6 месяцев указывает на хроническую инфекцию.Во время лечения вирусного гепатита В исчезновение ДНК вируса свидетельствует о его эффективности.
ПЦР отличается высокой чувствительностью и специфичностью. Методом ПЦР можно определить ДНК вируса качественно или количественно. Благодаря качественному методу подтверждается присутствие вируса гепатита В в организме и его активное размножение. Это особенно важно в сложных диагностических случаях. При инфицировании мутантными штаммами вируса специфические антигены HBsAg и HBeAg могут быть отрицательными. Качественное определение ДНК вируса играет важную роль в раннем выявлении гепатита В. Генетический материал вируса обнаруживается в крови на несколько недель раньше, чем HBsAg. Положительный результат ПЦР за период более 6 месяцев указывает на хроническую инфекцию.Во время лечения вирусного гепатита В исчезновение ДНК вируса свидетельствует о его эффективности.
Кровь рекомендуется сдавать не ранее чем через 4часа после последнего приема пищи (воду пить можно).
Материал для исследования: сыворотка крови.
Интерпретация результатов содержит аналитическую информацию для лечащего врача. Лабораторные данные входят в комплекс всестороннего обследования пациента, проводимого врачом и не могут быть использованы для самодиагностики и самолечения.
Лабораторные данные входят в комплекс всестороннего обследования пациента, проводимого врачом и не могут быть использованы для самодиагностики и самолечения.
Тест является качественным. При отсутствии ДНК HBV выдается ответ — «не обнаружено». В случае обнаружения фрагмента ДНК, специфичного для вируса гепатита выдается результат «обнаружено».
Отрицательный результат:
§ отсутствие вируса гепатита В в крови.
Положительный результат:
§ вирусный гепатит В.
Анализ hbv-днк (количественно) – сдать по цене 2240 руб. в Москве
Стоимость забора биоматериала
Настоящим уведомляем Вас о том, что с 01 марта 2016 года Лаборатория «Литех» изменяет порядок и стоимость забора биоматериала.
Прейскурант
*Цены у Партнеров могут отличаться.
Анализ мочи и кала принимается в специальных контейнерах, бесплатно получить которые можно в медицинских офисах «Литех» или приобрести в аптеке.
Внимание! Скидки и специальные предложения не распространяются на забор биологического материала и генетические исследования |
Анализ на гепатит В:
- 22 ПЦР (прямое выявление возбудителя)
- 23 ИФА (определение антигенов и антител)
Гепатит B (ВГВ, HВV) – острое системное вирусное заболевание. Характеризуется поражением печени и различными внепеченочными проявлениями, Протекает остро или хронически, в желтушной (35%) или безжелтушной (65%) формах. Вирус гепатита В содержит ДНК и чрезвычайно устойчив во внешней среде (к УФ-лучам, температуре, детергентам). Гепатит В передается с кровью и биологическими жидкостями парентеральным, трансплацентарным, половым и бытовым путями. Группу повышенного риска составляют лица, практикующие внутривенную наркоманию, беспорядочные половые связи, а также медицинские работники, пациенты, нуждающиеся в гемодиализе или переливаниях крови, заключенные, члены семей HBs-положительных лиц, новорожденные от HBs-положительных матерей.
Проникая в организм, вирус гепатита попадает в макрофаги крови и разносится по организму. Репликация вируса происходит в лимфатических узлах, костном мозге, фолликулах селезенки, макрофагах, гепатоцитах. Повреждение печени обусловлено, в основном, за счет иммунного лизиса; также вирус оказывает прямое цитопатическое действие.
Инкубационный период – в среднем составляет 4-12 дней, но может растягиваться до 12 месяцев. В конце инкубационного периода повышаются уровни печеночных трансаминаз, увеличиваются печень и селезенка. Возможно повышение концентрации билирубина до 2-2,5 нормальных значений, хотя это не приводит к потемнению мочи. Встречаются гриппоподобный, артралгический, диспептический или смешанный варианты клинического течения продромы. Наиболее неблагоприятным является течение продромы по типу сывороточной болезни (зуд, мигрирующие околосуставные высыпания).
Острый период (2-12 дней) протекает с интоксикационным синдромом: снижением аппетита, диспепсией, инверсией сна. В трети случаев возникает желтуха: резко повышается уровень билирубина, слизистые оболочки и кожа окрашиваются в различные оттенки желтого цвета, появляется зуд. Наиболее тревожным симптомом является снижение протромбинового индекса и альбумина крови, свидетельствующие о печеночно-клеточной недостаточности. Осложнение заболевания печеночной энцефалопатией свидетельствует об острой гепатодистрофии. Бурный гуморальный иммунный ответ зачастую приводит к появлению иммунных комплексов, оседающих на эндотелии сосудов почек, щитовидной железы, половых органов и др. Возникают васкулиты. В программе системных проявлений HBV-инфекции могут возникать аутоиммунный тиреоидит, хронический гастрит, синдром Шегрена, идеопатическая тромбоцитопеническая пурпура, узелковый периартериит, гломерулонефрит, синдром Гийена – Барре, ревматоидный артрит, и др.
В трети случаев возникает желтуха: резко повышается уровень билирубина, слизистые оболочки и кожа окрашиваются в различные оттенки желтого цвета, появляется зуд. Наиболее тревожным симптомом является снижение протромбинового индекса и альбумина крови, свидетельствующие о печеночно-клеточной недостаточности. Осложнение заболевания печеночной энцефалопатией свидетельствует об острой гепатодистрофии. Бурный гуморальный иммунный ответ зачастую приводит к появлению иммунных комплексов, оседающих на эндотелии сосудов почек, щитовидной железы, половых органов и др. Возникают васкулиты. В программе системных проявлений HBV-инфекции могут возникать аутоиммунный тиреоидит, хронический гастрит, синдром Шегрена, идеопатическая тромбоцитопеническая пурпура, узелковый периартериит, гломерулонефрит, синдром Гийена – Барре, ревматоидный артрит, и др.
Фаза выздоровления характеризуется исчезновением признаков холестаза, нормализацией процессов обмена веществ, восстановлением функции печени, на первый план выходят системные проявления заболевания.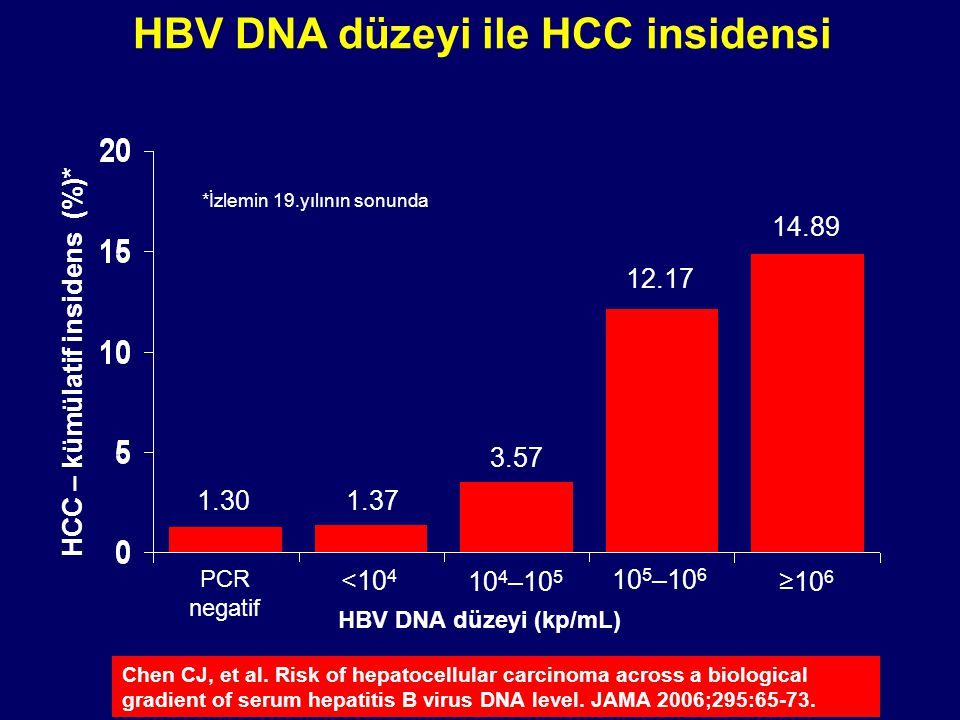 По сравнению с другими вирусными гепатитами, гепатит В имеет более системный характер, менее благоприятно протекает у детей. Хроническое течение возникает в 5% случаев. «Здоровые носители» HBsAg, также как и больные хроническим гепатитом В, подвержены высокому риску развития цирроза печени и гепатоцеллюлярной карциномы. Системные проявления не всегда исчезают вместе с излечением гепатита В.
По сравнению с другими вирусными гепатитами, гепатит В имеет более системный характер, менее благоприятно протекает у детей. Хроническое течение возникает в 5% случаев. «Здоровые носители» HBsAg, также как и больные хроническим гепатитом В, подвержены высокому риску развития цирроза печени и гепатоцеллюлярной карциномы. Системные проявления не всегда исчезают вместе с излечением гепатита В.
Разработанные на сегодняшний день вакцины не вызывают вакцино-обусловленного гепатита В, т.к. представляют собой генно-инженерный HBs-антиген. Однако вакцинопрофилактика обеспечивает защиту от гепатита В только на 5-7 лет. До вакцинации, по итогам вакцинации и по прошествии 5 лет после вакцинации необходимо исследовать уровень anti-HBs-антител.
В современной лабораторной диагностике вирусного гепатита В основная роль отводится выявлению в анализах серологических маркеров инфицирования вирусом: HBsAg, HВeAg, анти-НВс класса IgM и IgG, анти-НВе и анти-HBs и геномной ДНК вируса.
Выявление ДНК HBV
Качественное обнаружение в крови HBV ДНК является основным арбитражным критерием, характеризующим активность вирусного процесса, который можно использовать при заражении мутантными формами вируса, при иммуносупрессии (больные онкологическими заболеваниями, наркоманы и т. д.) и для количественной оценки присутствующего в организме возбудителя.
д.) и для количественной оценки присутствующего в организме возбудителя.
Количественная характеристика содержания ДНК HВV в клинических образцах важна для оценки эффективности противовирусной терапии. Если концентрация вируса меньше 105 копий/мл, то прогноз курса лечения благоприятный, если выше, то необходимо применить другие схемы лечения.
Снижение концентрации ДНК вируса гепатита В в течение недели после начала курса лечения не менее чем на треть является быстрым и точным параметром для предсказания эффективности терапии, приводящей к раннему вирусологическому ответу.
В целом, показанием к анализу на наличие HBV ДНК служит выявление ранней HBV-инфекции, поскольку ПЦР дает положительный результат уже на первых неделях инфекции при отсутствии других серологических маркеров.
Серологическая диагностика
Анализ крови на выявление HBs Ag (поверхностный антиген вируса гепатита В, «австралийский антиген»)
HBsAg — поверхностный антиген вируса гепатита В, основной маркер при анализе острого и хронического гепатита В — представляет собой белковую молекулу (липопротеин), ответственную за адсорбцию вируса на поверхности гепатоцитов (клеток печени). После встраивания вируса в геном печеночных клеток они начинают продуцировать вирусную ДНК и белки, и новые молекулы HBsAg поступают в кровь.
После встраивания вируса в геном печеночных клеток они начинают продуцировать вирусную ДНК и белки, и новые молекулы HBsAg поступают в кровь.
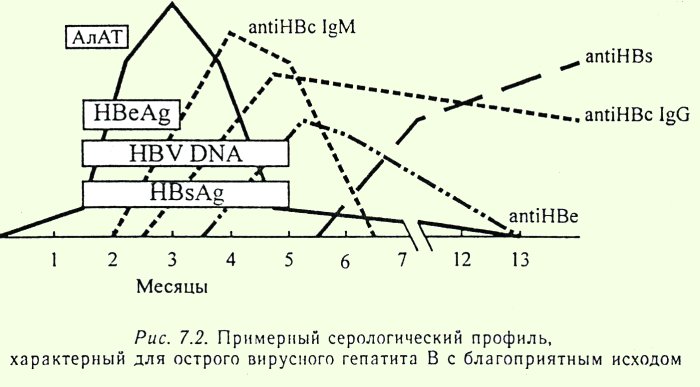
HBsAg — основной маркер инфицирования HBV. При остром вирусном В в большинстве случаев (90-80 %) HBsAg удается выявить в инкубационном периоде, начиная с 3-5-й недели заражения. Средняя продолжительность циркуляции антигена — 70-80 дней. Быстрое исчезновение HBsAg (в первые дни желтухи) с появлением антиНВs — плохой прогностический признак. При хроническом гепатите В HBsAg может циркулировать в крови больного на протяжении многих лет. Возможно пожизненное носительство HBsAg.
HBsAg способен активизировать клеточные протоонкогены. Через достаточно длительный срок (более 20 лет) возможно развитие гепатокарциномы.
Выявление HBeAg (сердцевинный антиген вируса гепатита В)
HBеAg (антиген инфекционности) представляет собой сердцевинный белок, кодируется тем же геном, что и НBсore Ag. Обнаруживается в крови в период вирусемии, параллельно с HBsAg, начиная с конца инкубационного периода. В этом периоде с высокой вероятностью методом ПЦР обнаруживается HBV-DNA(ДНК ВГВ). Вероятность заражения здорового человека при попадании HBеAg «+» крови в десятки раз выше, чем в том случае, если сероконверсия наступила, HBeAg исчез и заменился anti-HBe. В крови циркулирует недолго, меньше, чем HBsAg, исчезает к концу желтушного периода (примерно к 9 неделе с начала болезни). Циркуляция антигена инфекционности в течение 2 мес и более является признаком хронизации гепатита В. Т.о. этот показатель может служить маркером контагиозности хронических НВsAg — носителей. При хроническом ВГВ с высокой репликативной активностью возможно обнаружение его в течение нескольких лет. Этот антиген циркулирует только в присутствии HBsAg, поэтому целесообразно обследовать именно HBsAg-позитивные сыворотки.
В этом периоде с высокой вероятностью методом ПЦР обнаруживается HBV-DNA(ДНК ВГВ). Вероятность заражения здорового человека при попадании HBеAg «+» крови в десятки раз выше, чем в том случае, если сероконверсия наступила, HBeAg исчез и заменился anti-HBe. В крови циркулирует недолго, меньше, чем HBsAg, исчезает к концу желтушного периода (примерно к 9 неделе с начала болезни). Циркуляция антигена инфекционности в течение 2 мес и более является признаком хронизации гепатита В. Т.о. этот показатель может служить маркером контагиозности хронических НВsAg — носителей. При хроническом ВГВ с высокой репликативной активностью возможно обнаружение его в течение нескольких лет. Этот антиген циркулирует только в присутствии HBsAg, поэтому целесообразно обследовать именно HBsAg-позитивные сыворотки.
Выявление Anti-HBс (суммарные антитела к HBcore-антигену вируса гепатита В)
Антитела к HB-core антигену появляются в анализе при остром гепатите В в крови вскоре после появления HBsAg, персистируют после исчезновения HBs-антигена перед появлением анти-HBs-антител и сохраняются длительное время после выздоровления (при HBV-инфекции они самые «долгоживущие» и могут обнаруживаться пожизненно). В отсутствие информации о других маркерах в анализе гепатита В, наличие анти-HBcore позволяет предположить, что человек может быть активно инфицирован или переносил гепатит В в прошлом и имеет иммунитет. Анти-HBcore-антитела могут быть единственным серологическим маркером перенесенного гепатита В и потенциально инфицированной крови.
В отсутствие информации о других маркерах в анализе гепатита В, наличие анти-HBcore позволяет предположить, что человек может быть активно инфицирован или переносил гепатит В в прошлом и имеет иммунитет. Анти-HBcore-антитела могут быть единственным серологическим маркером перенесенного гепатита В и потенциально инфицированной крови.
Определение суммарных антител anti-НBcore применяют в целях диагностики текущего или перенесенного в прошлом гепатита В. Присутствие общих антител anti-НBcore не дает возможности дифференцировать острую, хроническую или перенесенную в прошлом инфекцию.
Выявление Anti-HBс IgM (антитела класса М к HBcore-антигену вируса гепатита В)
Антитела к HBсore антигену класса М начинают вырабатываться в период первого появления клинических симптомов гепатита В и сохраняются до периода выздоровления.
Выявление Anti-HBe (антитела к HBe-антигену вируса гепатита В в анализе)
Синтез антител к HBeAg в организме начинается после элиминации антигена инфекционности, они свидетельствуют о прекращении репликации (размножения) вируса в организме. К концу 9-й недели эти антитела можно обнаружить у 90% больных. В период выздоровления эти антитела могут исчезать. Однако обнаружение anti-HBe не всегда является показателем отсутствия инфекционности данной конкретной сыворотки. Иногда возможно появление мутантной, дефектной HBeAg-отрицательной формы вируса, т.е. вирус данный антиген синтезировать не способен. Но при этом хотя в крови обнаруживаются anti-HBe, высокая репликативная активность вируса сохраняется.
К концу 9-й недели эти антитела можно обнаружить у 90% больных. В период выздоровления эти антитела могут исчезать. Однако обнаружение anti-HBe не всегда является показателем отсутствия инфекционности данной конкретной сыворотки. Иногда возможно появление мутантной, дефектной HBeAg-отрицательной формы вируса, т.е. вирус данный антиген синтезировать не способен. Но при этом хотя в крови обнаруживаются anti-HBe, высокая репликативная активность вируса сохраняется.
Выявление Anti-HBs (анализ на антитела к HBs-антигену вируса гепатита В)
Anti-HBs-антитела появляются в фазе выздоровления после острого гепатита В, обычно через 3-4 месяца после элиминации HBsAg (так называемая фаза «окна»). Продолжительность фазы окна может варьировать от 1 мес до 1 года, в зависимости от состояния иммунной системы больного.В этот период «окна» важно обследовать пациента на anti-HBc IgM.
Anti-HBs-антитела особенно важны в обеспечении иммунной защиты против данного вируса, поэтому количественное определение анти-HBs-антител обычно используют в контроле эффективности иммунитета при вакцинации против гепатита В. Со временем, титр антител снижается вплоть до необнаружения.Иногда возможно пожизненная циркуляция anti-HBs антител. Появление в анализах анти-HBs на фоне клинического улучшения у больного гепатитом В и исчезновение HBsAg является хорошим прогностическим признаком,и показателем выздоровления.
Со временем, титр антител снижается вплоть до необнаружения.Иногда возможно пожизненная циркуляция anti-HBs антител. Появление в анализах анти-HBs на фоне клинического улучшения у больного гепатитом В и исчезновение HBsAg является хорошим прогностическим признаком,и показателем выздоровления.
При хроническом течении гепатита В возможно параллельное определение поверхностного антигена и антител к нему. Обнаружение в анализе анти-HBs в острой фазе гепатита В параллельно с HBsAg свидетельствует о неблагоприятном прогнозе заболевания.
Различные сочетания серологических маркеров инфицирования вирусом гепатита В и их интерпретация
| HBsAg | anti-HBs | anti-HBc | HBeAg | anti-HBe |
ВГВ/ДНК | Трактовка результатов | |
| IgM | общ. | ||||||
|
+ |
— |
+ |
+ |
+ |
— |
+ | Активная репликация ВГВ (дикий штамм) |
|
+ |
— |
+ |
+ |
— |
+/- |
+ | Активная репликация ВГВ (мутантный штамм) |
|
+ |
— |
+ |
+ |
— |
+/- |
— | Разрешившийся острый гепатит |
|
+ |
— |
— |
+ |
— |
+/- |
— | “Здоровый” носитель -HBsAg |
|
— |
— |
+ |
+ |
— |
— |
— | Фаза “окна” острого гепатита В |
|
— |
+ |
— |
+ |
— |
+/- |
— | Иммунитет после перенесенного гепатита В |
|
— |
+ |
— |
— |
— |
— |
— | Иммунитет после вакцинации |
Анализы при гепатите B в лаборатории «ЛИТЕХ»:
Прямое выявление наличия вируса в организме:
- Метод исследования: Полимераная цепная реакция (ПЦР) (выявление специфического фрагмента ДНК вируса)
- Качественное определение HBV ДНК.

- Количественное определение HBV ДНК. Анализ на гепатит проводится после положительного качественного исследования.
- Материал для исследования: сыворотка крови. Только в одноразовой пластиковой пробирке с плотно завинчивающейся крышкой.
Серологические исследования:
- Определение антигенов и специфических антител к антигенам вируса гепатита В: HBsAg, HBeAg, Anti-HBc, Anti HBc IgM, Anti-HBe, Anti-HBs.
- Метод исследования: иммуноферментный анализ на гепатит (ИФА)
- Материал для исследования: сыворотка крови. Только в одноразовой пластиковой пробирке с плотно завинчивающейся крышкой
Анализ на ДНК вируса гепатита В качественный со скидкой до 50% в лаборатории Lab4U
Срок исполнения
Анализ будет готов в
течение 4 дней, исключая субботу, воскресенье и день забора.
Срок может быть увеличен на 1 день в случае необходимости.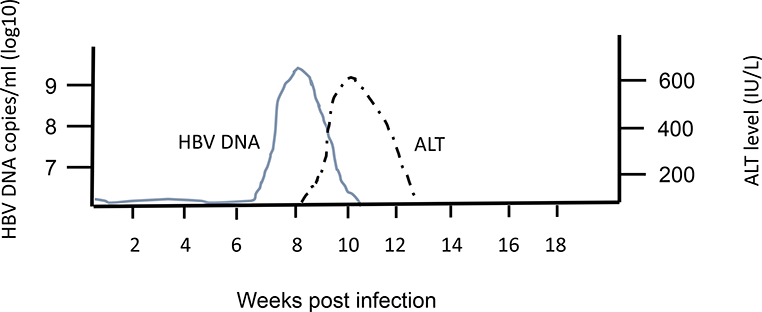
Вы получите результаты на эл. почту сразу по готовности.
Срок исполнения: 2 дня, исключая субботу и воскресенье (кроме дня взятия биоматериала)
Подготовка к анализу
Заранее
Обсудите с врачом прием лекарственных препаратов накануне и в день проведения исследования крови, а также другие дополнительные условия подготовки.
Не сдавайте анализ крови сразу после рентгенографии, флюорографии, УЗИ, физиопроцедур.
Накануне
За 24 часа до взятия крови:
- Ограничьте жирную и жареную пищу, не принимайте алкоголь.
- Исключите тяжёлые физические нагрузки.
Не менее 4х часов до сдачи крови не принимайте пищу, пейте только чистую негазированную воду.
В день сдачи
Перед забором крови
- 60 минут не курить,
- 15-30 минут находиться в спокойном состоянии.

Информация об анализе
Показатель
Вирусный гепатит В (HBV — hepatit b virus) – инфекционное заболевание печени, вызванное вирусом гепатита В.
Гепатит В может долго протекать бессимптомно, переходя в хроническую форму. Хронический вирусный гепатит В может приводить к циррозу и раку печени. Пока человек не знает о том, что болен, это опасно для него и окружающих.
Ранее всего, после заражения можно выявить гепатит В по анализу крови на ДНК вируса гепатита В. Он покажет инфицирование уже спустя 10-12 дней. Этот анализ поможет проверить возможное инфицирование человека, попавшего в группу риска.
Кроме того, в случае хронического течения заболевания, анализ на ДНК используется для выявления обострений.
Качественный анализ имеет высокую чувствительность, поэтому положительный результата анализа требует подтверждения с помощью других анализов, которые назначит врач.
В целях профилактики анализ на гепатит В можно сдать в комплексе Группа риска.
Чувствительность метода — 1000 копий ДНК/мл.
Назначения
Качественный метод определения содержания ДНК вируса гепатита B в крови дает возможность определить инфицирование гепатитом В, в том числе при отрицательном результате анализа на HBsAg. Также рекомендуется сдать этот анализ лицам, имевшим контакт с инфицированным человеком.
Специалист
Назначается терапевтом, эндокринологом, инфекционистом, гепатологом.
Метод исследования — ПЦР Real time
Материал для исследования
— Венозная кровь с ЭДТА
Состав и результаты
HBV DNA Вирус гепатита В, определение ДНК
Вирусный гепатит В (HBV — hepatit b virus) – инфекционное заболевание печени, вызванное вирусом гепатита В.
Гепатит В
Самая распространенная разновидность гепатита на планете. В России им болеет около 5 млн человек и немалое количество людей не подозревают о том, что больны. Гепатит В может протекать бессимптомно длительное время, переходя в хроническую форму. Поэтому пока человек не знает о том, что болен, это опасно и для его здоровья, и для здоровья окружающих. По этой причине сдавать анализ для выявления гепатита B рекомендуется регулярно, раз в полгода. Защитить себя от заражения гепатитом В можно с помощью вакцинации. Вакцинация обеспечивает защиту от гепатита В на 5 — 7 лет. До вакцинации, по итогам вакцинации и по прошествии 5 лет после вакцинации необходимо исследовать уровень антител с помощью анализа — anti-HBs-антител.
Гепатит В передается с биологическими жидкостями: спермой, кровью, плазмой. Если был вероятный случай заражения (незащищенный половой акт, многоразовой использование шприца, контакт с зараженной кровью и т. д.), сдать анализ на гепатит B нужно через месяц для более достоверного результата.
д.), сдать анализ на гепатит B нужно через месяц для более достоверного результата.
Инкубационный период от 4 недель до 6 месяцев.
Инкубационный период — отрезок времени от момента попадания вируса в организм до проявления симптомов болезни.
В конце инкубационного периода повышаются уровни печёночных показателей (АЛТ, АСТ), увеличиваются печень и селезёнка, повышается концентрации билирубина до 2 — 2,5 раз от нормы, хотя это не приводит к потемнению мочи. Он может протекать как в виде легких форм, длящихся несколько недель, так и в виде хронической инфекции с многолетним течением.
Симптомы острого гепатита: желтушность кожи, повышенная температура, тошнота, быстрая утомляемость. В лабораторных анализах – признаки нарушения функции печени и специфические антигены вируса гепатита В. Острый гепатит это период первых 3 месяцев от момента заражения. Острый гепатит может протекать как с яркими симптомами гепатита (желтушность, белесый стул), так и без них.
Острое заболевание может протекать быстро, с летальным исходом, перейти в хроническую инфекцию или окончиться полным выздоровлением. Считается, что после перенесенного гепатита формируется стойкий иммунитет. Хронический вирусный гепатит В может приводить к циррозу и раку печени. В процессе борьбы организма с гепатитом могут формироваться аутоимунные заболевания: тиреоидит, хронический гастрит, синдром Шегрена, идеопатическая тромбоцитопеническая пурпура, узелковый периартериит, гломерулонефрит, синдром Гийена Барре, ревматоидный артрит и др.
Диагностика острого гепатита B
Ранее всего, после заражения можно выявить гепатит В по анализу крови на ДНК вируса гепатита В.
В этот период инфицированный является заразным, хотя симптомы гепатита могут не наблюдаться. Однако и этот анализ может быть отрицательным в некоторый период (диагностическое или серологическое окно) течения болезни.
Спустя некоторое время (3-5 недель) с момента заражения организм начинает вырабатывать антитела класса M (IgM) к антигену HBcor к вирусу гепатита В (IgM HBcorAg).
Диагноз гепатита В ставится на основании определения нескольких анализов, характерных для различных стадий болезни – инкубационного периода, острой фазы и реконвалесценции.
Качественный метод определения ДНК вируса гепатита B в крови дает возможность оценить интенсивность развития заболевания, эффективность лечения.
Определение ДНК вируса безусловно необходимо для установления фазы развития вируса. Очень важно определение ДНК вируса для прогноза течения острого гепатита B.
Установлено, что неизменный ДНК вируса в крови более 8 недель после начала заболевания говорит о хронизации процесса, тогда как выявление и начало лечения ДНК вируса в течение первых 2 недель болезни коррелирует с полным выздоровлением.
Следовательно, определение ДНК вируса гепатита B в крови является важнейшим анализом, который в совокупности с другими лабораторными анализами позволяет диагностировать инфекцию, определить характер инфекционного процесса, оценить необходимость проведения терапии и её эффективность.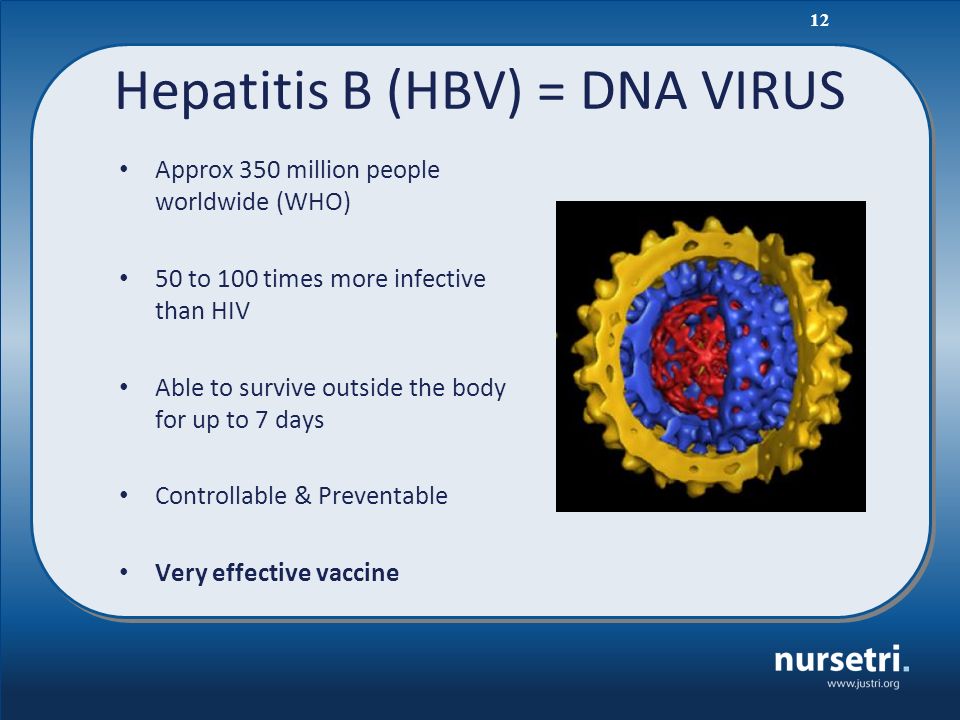
Чувствительность метода — 1000 копий ДНК/мл.
ДНК вируса гепатита B в крови – самый ранний показатель гепатита B,;показатель фазы активного размножения вируса при остром и хроническом гепатите B.
Качественное определение ДНК вируса гепатита В в крови подтверждает диагноз гепатита B.
По результатам положительного качественного анализа на ДНК вируса гепатита В обычно назначается анализ количественным методом. Это позволяет следить за динамикой развития вируса и контролировать результаты терапии.
В конце курса терапии так же сдают анализ качественным методом, поскольку он имеет более высокую чувствительность.
Вирус гепатита B, определение ДНК (HBV-DNA) кол. в сыворотке крови
Определение ДНК вируса гепатита В (Hepatitis В virus, HBV) в сыворотке крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени».
Аналитические показатели
Определяемый фрагмент – специфичный участок ДНК вируса гепатита В. 8 МЕ/мл.
8 МЕ/мл.
Специальной подготовки к исследованию не требуется.С общими рекомендациями для подготовки к исследованиям можно ознакомиться здесь >>
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Интерпретация результата
Единицы измерения: количество ДНК вируса гепатита В, выраженное в МЕ/мл. Для пересчета в копии/мл следует применять соотношение 1 МЕ=4,5 копии ДНК вируса гепатита В.
Интерпретация результатов:
«не обнаружено»:ДНК вируса гепатита В не выявлена или значение ниже предела чувствительности метода (20 МЕ/мл). Результат интерпретируют как «ДНК вируса гепатита В не выявлена»;
< 10^2 МЕ/мл: результат положительный с концентрацией ДНК вируса гепатита В менее 10^2 МЕ/мл;
от 10^2 до 1х10^8 МЕ/мл: результат положительный. 8 МЕ/мл.
8 МЕ/мл.
Обращаем внимание, что сроки выполнения ПЦР-исследований могут быть увеличены при проведении подтверждающих тестов.
Опыт использования метода ПЦР для выявления РНК (ДНК) возбудителей вирусных гепатитов В и С у серонегативных доноров
О.А. Тарасенко, И.А. Гукасян, Л.В.Соболевская, Т.В. Черненко
Станция переливания крови Департамента Здравоохранения г. Москвы
В настоящее время исследование образцов донорской крови на маркеры вирусных гепатитов В (ВГВ) и С (ВГС) проводят серологическими методами: иммуноферментным (ИФА) или иммунохемилюминисцентным (ИХЛА) анализом, позволяющими определять наличие в них поверхностного антигена ВГВ (HBsAg) и антител к белкам ВГС (анти HCV). Введение в лабораторную практику службы крови обязательного тестирования донорской крови на указанные серологические маркеры ВГВ и ВГС позволило значительно снизить риск посттрансфузионной передачи ВГС и ВГВ.
Известно, однако, что при ВГС специфические антитела появляются в среднем через 10-12 недель от момента заражения, а в некоторых случаях сроки их появления могут отодвигаться до 30-50 недель [2,6]. Поэтому при исследовании методами ИФА или ИХЛА образцов крови, взятой от донора с ранней стадией ВГС, когда антитела еще не выявляются (период, так называемого, серонегативного окна), получают, как правило, ложноотрицательный результат. В то же время именно в этот период ВГС наблюдается, выраженная виремия и связанная с ней высокая « инфекционная способность» инфицированной крови [3 ]. В связи с этим компоненты крови, заготовленные от донора, находящегося в периоде «серонегативного окна», являются основным источником заражения реципиента ВГС при гемотрансфузии.
Использование NAT-технологий, в частности метода ПЦР, позволяет выявить РНК HCV в крови уже через 1-2 недели после заражения, т.е. приблизительно за 60 дней до выявления в ней антител к HCV серологическими тестами.
HBsAg в большинстве случаев является наиболее значимым серологическим маркером острого и хронического ВГВ, выявление которого в крови свидетельствует с высокой степенью вероятности о присутствии в ней вируса . Однако, зарегистрированы случаи заражения ВГВ при переливании HBsAg-негативной крови. В настоящее время известно о существовании по крайней мере двух «ускользающих (escape)» мутантов HBsAg [9,13], которые могут возникать как естественным путем в ходе инфекционного процесса, так и после противовирусной терапии. Эти штаммы HBV способны передаваться горизонтальным путем и обусловливать ложно негативный результат при скрининге донорской крови на HBsAg. Описана, так называемая, «молчащая» форма ВГВ, характеризующаяся наличием низких концентраций вируса в крови при не детектируемом уровне HBsAg [2, 11]. Она может наблюдаться у некоторых больных после острого ВГВ с самостоятельным разрешением и даже после успешно проведенного противовирусного лечения, а также при хроническом ВГВ. Установлено, что «молчащая» инфекция представляет клиническую форму ВГВ, способную передаваться через компоненты крови, а диагностика ее основывается на тщательном сборе анамнеза и применении высокочувствительного метода ПЦР для определения вирусной ДНК [1].
Однако, зарегистрированы случаи заражения ВГВ при переливании HBsAg-негативной крови. В настоящее время известно о существовании по крайней мере двух «ускользающих (escape)» мутантов HBsAg [9,13], которые могут возникать как естественным путем в ходе инфекционного процесса, так и после противовирусной терапии. Эти штаммы HBV способны передаваться горизонтальным путем и обусловливать ложно негативный результат при скрининге донорской крови на HBsAg. Описана, так называемая, «молчащая» форма ВГВ, характеризующаяся наличием низких концентраций вируса в крови при не детектируемом уровне HBsAg [2, 11]. Она может наблюдаться у некоторых больных после острого ВГВ с самостоятельным разрешением и даже после успешно проведенного противовирусного лечения, а также при хроническом ВГВ. Установлено, что «молчащая» инфекция представляет клиническую форму ВГВ, способную передаваться через компоненты крови, а диагностика ее основывается на тщательном сборе анамнеза и применении высокочувствительного метода ПЦР для определения вирусной ДНК [1].
Задачей настоящей работы было оценить целесообразность использования метода ПЦР для скрининга донорской крови на маркеры ВГС ВГВ.
Пробы крови от каждого донора забирали в 2 пробирки: одну пробирку с разделительным гелем для получения сыворотки для серологических исследований и вторую пробирку с ЭДТА для получения плазмы для ПЦР.
Скрининг донорских сывороток на серологические маркеры ВИЧ 1,2, ВГВ и ВГС проводили методом ИФА на аппарате Evolis (компания Biorad, США) или методом ИХЛА на аппарате Architect (компания Abott, США).
Для определения антител к HCV методами ИФА и ИХЛА использовали, соответственно, тест-системы Murex anti HCV (Abbott, США) и тест-системы Architect anti HCV (компания Abbott, США).
Для выявления HBsAg методом ИФА использовали тест-системы Monolisa HBsAg Ultra (Bio-Rad, США) и тест-системы Architect HBsAg (компания Abbott, США).
Образцы, показавшие при первичном исследовании в ИФА или ИХЛА положительный результат на анти ВИЧ 1,2, анти HCV или HBsAg, отбирали для повторного исследования в тех же тест-системах и подтверждающих тестах.
Все серонегативные образцы исследовали методом ПЦР на наличие РНК HIV, HCV и ДНК HBV.
В течение 2008 года ПЦР-исследования проводили на аппаратах Cobas Ampliprep/ Cobas Amplicor ( компания Roch, Швейцария) с использованием тест-систем: Cobas Ampliprep/Cobas Amplicor HIV 1 Monitor Test , Cobas Ampliprep/ Cobas Amplicor HCV Test и Cobas Amplicor HBV Monitor Test.
С января 2009 года исследования выполняли методом ПЦР в режиме реального времени на инструментальном комплексе Cobas 201 (Roche. Швейцария), включающем пипетирующую рабочую станцию, аппарат для автоматического выделения нуклеиновых кислот Cobas Ampliprep и анализатор Cobas Taqman для автоматического проведения амплификации и детектирования нуклеиновых кислот с использованием 5 нуклеазной технологии. Многоканальные оптические системы прибора позволяют регистрировать флуоресцентный сигнал от исследуемого образца в каждом цикле ПЦР. Для ПЦР-анализа серонегативных образцов использовали мультиплексные тест-системы CobasTaqScreen MPX Test, разработанные компанией Roche специально для скрининга донорской крови [10].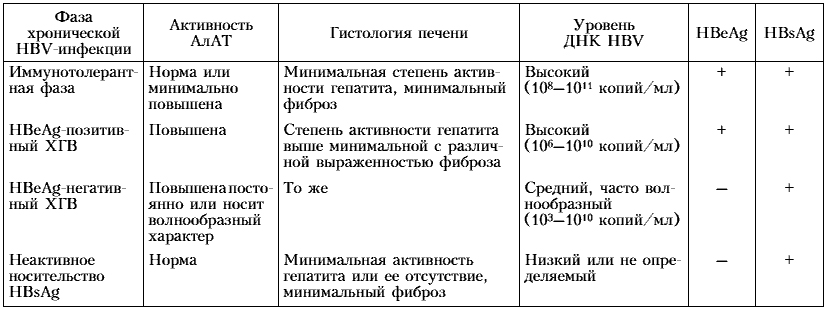 За счет включения в реакционную смесь различных пар специфических праймеров и зондов эти системы позволяют выявлять одновременно в одной пробирке РНК HIV-1 rpyппы М и группы О, HIV-2, HCV и ДНК HBV. Образцы, при исследовании которых регистрировали нарастание флуоресцентного сигнала, считали положительными, т.е. содержащими вирусную РНК (ДНК). Такие образцы исследовали повторно в той же тест-системе. При получении повторно положительного результата проводили идентификацию выявленной нуклеиновой кислоты с помощью указанных выше ПЦР-диагностикумов на отдельные инфекции.
За счет включения в реакционную смесь различных пар специфических праймеров и зондов эти системы позволяют выявлять одновременно в одной пробирке РНК HIV-1 rpyппы М и группы О, HIV-2, HCV и ДНК HBV. Образцы, при исследовании которых регистрировали нарастание флуоресцентного сигнала, считали положительными, т.е. содержащими вирусную РНК (ДНК). Такие образцы исследовали повторно в той же тест-системе. При получении повторно положительного результата проводили идентификацию выявленной нуклеиновой кислоты с помощью указанных выше ПЦР-диагностикумов на отдельные инфекции.
Результаты исследования представлены в таблицах 1 и 2.
Таблица 1 — Результаты исследования серонегативных образцов донорской крови методом ПЦР на комплексе Cobas Ampliprep/Cobas Amplicor
Количество исследований | Количество образцов, содержащих: | ||
| PHKHCV | РНК HIV | ДНК HBV |
56 983 | 8 | 0 | 0 |
Таблица 2 — Результаты исследования серонегативных образцов донорской крови методом ПЦР на комплексе Cobas S 201
Количество исследований | Количество положительных результатов в тесте МРХ | Количество положительных результатов в дискриминаторном тесте на: | ||
РНК HCV | РНК HIV | ДНК HBV | ||
62 438 | 31 | 16 | 0 | 4 |
При исследовании 56983 серонегативных образцов донорской плазмы на наличие вирусной РНК (ДНК) на аппаратах Cobas Ampliprep/Cobas Amplicor с помощью диагностических тест-систем на отдельные иифекции (табл. 1) было выявлено 8 образцов, содержащих РНК HCV. При этом РНК HIV-1 и ДНК HBV ни в одном из исследованных образцов выявлено не было.
1) было выявлено 8 образцов, содержащих РНК HCV. При этом РНК HIV-1 и ДНК HBV ни в одном из исследованных образцов выявлено не было.
При исследовании 62438 серонегативных образцов на аппаратном комплексе Cobas 201 с помощью тест-систем CobasTagScreen МРХ в 31 случае было зарегистрировано нарастание флуоресцентного сигнала, свидетельствующее о наличии в образце вирусной РНК (ДНК) (табл.2). Дискриминаторный анализ этих образцов с помощью тест- систем на отдельные инфекции выявил в 16-и из них РНК HCV, в 4-х. других- ДНК HBV в низкой концентрации (менее 60 IU./ml). Остальные 11 образцов, положительные в тесте CobasTagScreen МРХ, показали отрицательный результат в индивидуальных тестах на РНК HIV-1, РНК HCV и ДНК HBV. Однако при исследовании образцов, содержащих ДНК HBV и образцов с не идентифицированной нуклеиновой кислотой на наличие антиНВсоr во всех случаях выявили выраженную серологическую реакцию (коэффициент позитивности колебался от 7,8 до 8,6) (табл.3).
Таблица 3 — Выявление ДНК HBV у серонегативных доноров
№ п/п | Результат скринингового теста | Результат ПЦР-теста на ДНК HBV | Наличие Anti НВсог | Наличие Anti HBs |
1 | + | — | + | — |
2 | + | + | + | — |
3 | + | — | + | — |
4 | + | — | + | + |
5 | + | + | + | — |
6 | + | — | + |
|
7 | + | — | + | — |
8 | + | + | + | — |
9 | + | — | + | + |
10 | + | — | + | — |
11 | + | + | + | _ |
12 | + | — | + | + |
13 | + | — | + | — |
14 | + | — | + | + |
15 | + | — | — | — |
В 4-х образцах были также обнаружены антитела к HBsAg . Наличие в образцах с не идентифицированной нуклеиновой кислотой серологических маркеров HBV инфекции позволяет считать, что в них присутствует ДНК HBV в концентрации ниже предела чувствительности теста Cobas Amplicor HBV Monitor (40 IU/ml), выявляемая, однако, более чувствительной тест-системой CobasTagScreen MPX (3,3-4,4 IU/ml).
Наличие в образцах с не идентифицированной нуклеиновой кислотой серологических маркеров HBV инфекции позволяет считать, что в них присутствует ДНК HBV в концентрации ниже предела чувствительности теста Cobas Amplicor HBV Monitor (40 IU/ml), выявляемая, однако, более чувствительной тест-системой CobasTagScreen MPX (3,3-4,4 IU/ml).
Обобщая полученные результаты, мы установили, что методом ПЦР из 119421 образцов донорской плазмы, показавших отрицательный результат в серологических тестах, выявлено 24 образца (0,02%), содержащих РНК HCV. 16 HCV -позитивных образцов имели нормальный уровень трансаминаз, в то время как в 8-и других был зарегистрирован повышенный уровень активности АЛТ. Подобная картина может наблюдаться как при ранней инфекции (период серонегативного окна), так и при хроническом ВГС у лиц с подавленным иммунитетом. Данные литературы, свидетельствующие об отсутствии прямой зависимости между уровнем АЛТ и наличием РНК HCV в сыворотке крови [4] позволяют считать, что обнаружение РНК HCV в крови является наиболее информативным показателем HCV-инфекции в период серонегативного окна.
Также нами было выявлено 11 случаев ВГВ у HBsAg негативных доноров. В 4-х из них низкий уровень виремии сохранялся несмотря на наличие анти- HBS. Известно, что подобное состояние иногда может наблюдаться длительное время после клинического выздоровления от острого ВГВ. Предполагают, что персистенция вируса в этом: случае может осуществляться в форме иммунного комплекса с анти-HBs [11]. В остальных случаях сочетание низкого уровня виремии с наличием только анти-НВсог скорее укладывается в картину «молчащей» формы хронического ГВ. Считают, что отрицательные результаты при детекции HBsAg у больных ВГВ могут быть вызваны низким уровнем HBsAg, образованием иммунных комплексов, а также мутациями вируса в S-регионе [11,17]. Механизмы, поддерживающие низкий уровень репликации вируса при «молчащей» форме ГВ нуждаются в дальнейшем изучении. В настоящее время к факторам, способным поддерживать персистенцию вируса в крови при «молчащей» HBV- инфекции относят инфицирование вирусом моноцитов крови, формирование иммунных комплексов с антителами, ослабленный иммунитет и коинфекцию [11,17].
Таким образом, на основании полученных результатов можно заключить, что скрининг образцов донорской крови с применением ПЦР-тестирования для выявления вирусной РНК (ДНК) позволит снизить риск посттрансфузионной передачи вирусных гепатитов В и С, за счет выявления инфицированных доноров, находящихся в периоде серонегативного окна и доноров с молчащей формой инфекции. Алгоритм апробации донорской крови, при котором скрининг образцов методом ПЦР проводят одновременно с исследованием их в серологических тестах, позволит не только повысить инфекционную безопасность гемопродукции, но и сократить промежуток времени от момента забора крови до выдачи ее в лечебные учреждения, что особенно важно для сохранения компонентов с ограниченным сроком годности.
ЛИТЕРАТУРА
1. Амосов А.Д. Гепатит В (издание 2). Кольцов, 2001.- 128 с.
2. Голосова Т..В., Никитин И.К. Гемотрансмиссивные инфекции.- М.., 2003.- 191 с.
3. Карякин А. В., Скоцеляс Е.Д., Терентьева Л.А. Мониторинг безопасности донорского контингента России//Трансфузиология, 2007.- №1-2.- с.21.
В., Скоцеляс Е.Д., Терентьева Л.А. Мониторинг безопасности донорского контингента России//Трансфузиология, 2007.- №1-2.- с.21.
4. Майер К.П. Острый вирусный гепатит С.// В кн.: Гепатит и последствия гепатита. /Пер. с нем.- М.: ГЭОТАР Медицина,. 1999.- с.91-98.
5. Малышев B.C., Федорова В.Д., Потехин О.Е. Маркеры вирусного гепатита В у доноров крови и в группах сравнения // Иммунопатология, аллергология, инфектология.-1999.- №1.- с.103-105.
6. Рагимов А.А., Дашкова Н.Г. Основы трансфузионной иммунологии. — М., 2004.-280 с.
7. Allain J.P. Occult hepatitis В virus infection: implication in transfusion. // Vox Sang., 2004, Vol.86, N.2, p.83-91.
8. Busch M.P., Glynn S.A.. Strainer S.L. et al. A new strategy for estimating risk of transfusion-transmitted viral infections based on rates of detection of resently infected donors.// Transfusion, 2004, vol. 45, p.254-264.
9. Gutierrez C, Devesa M., Loureiro C.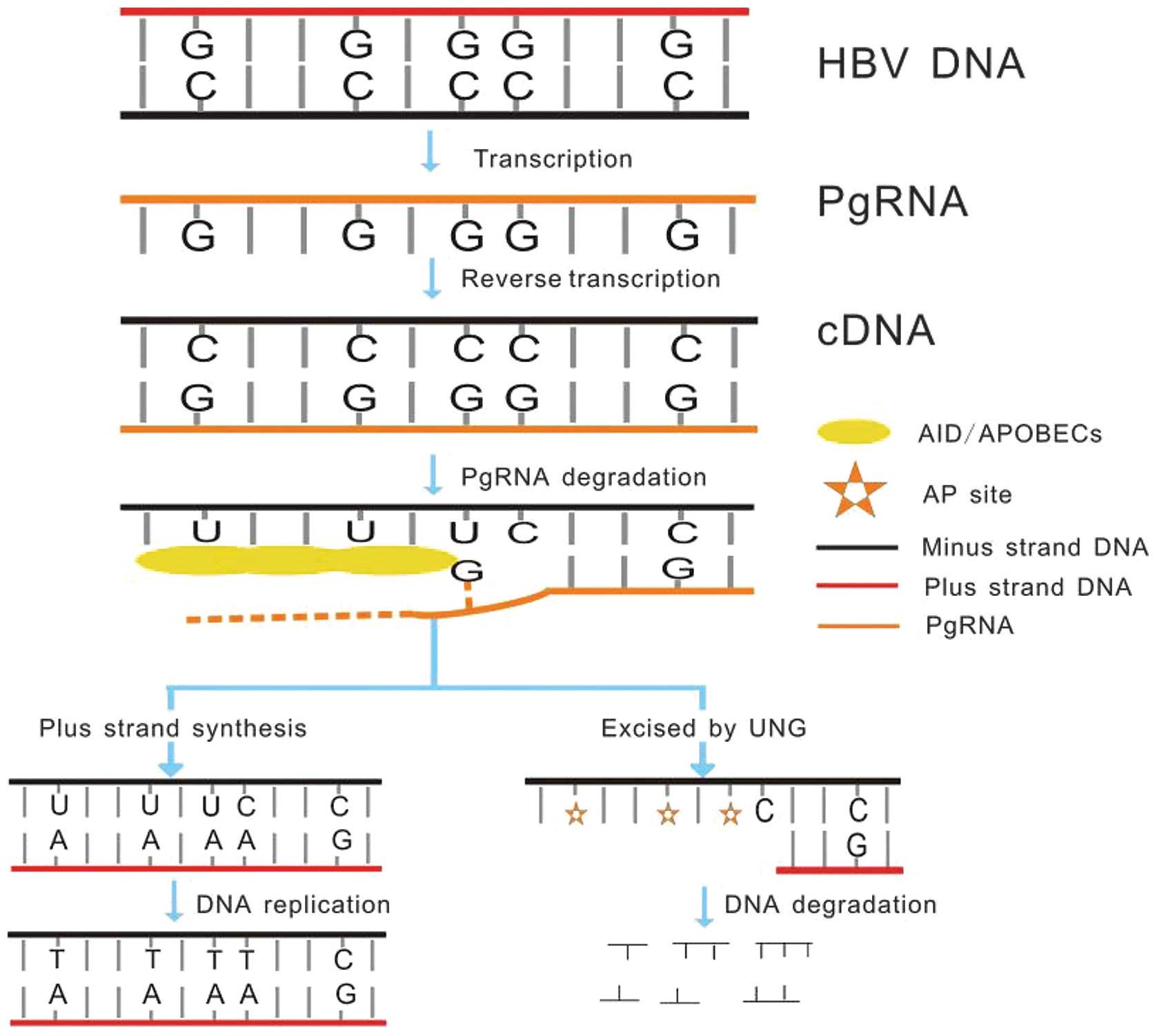 L. et al. Molecular and serological evaluation of surface antigen negative hepatitis В virus infection in blood from Venezuela. // J.Med.Virol., 2004, Vol. 3, N.2 p.200-207.
L. et al. Molecular and serological evaluation of surface antigen negative hepatitis В virus infection in blood from Venezuela. // J.Med.Virol., 2004, Vol. 3, N.2 p.200-207.
10. Herman S., Ohhashi Y., Kyger E. et al. Performance characteristics of a new multiplex NAT screening test for HBV, HCV and HIV. The Cobas TagScreen MRX Test on the COBAS S 201 system.// Vox Sang., 2007, Vol.91, Suppl.3:81.
11. Ke-Qin Hu. Occult hepatitis В virus infection and its clinical implications. // Journal of viral hepatitis, 2002, Vol.9, p.243-257.
12. Kleinman SH., Strong DM., Tegtmeier GE. Et.al. Hepatitis В virus (DBV) DNA screening of blood donation in minipools with the Cobas AnipliScreen HBV test. // Transfusion, 2005.VoI.45, p.1247-1257.
13. Levicnik.-Stezinar S. Hepatitis В surface antigen escape mutant in a first blood donor potentially missed by a routine screening assay. // Clin.Lab.< 2004, Vol.50, N.l-2, p.49-51.
14. Minegishi K., Yoshikawa A., Kishimoto S.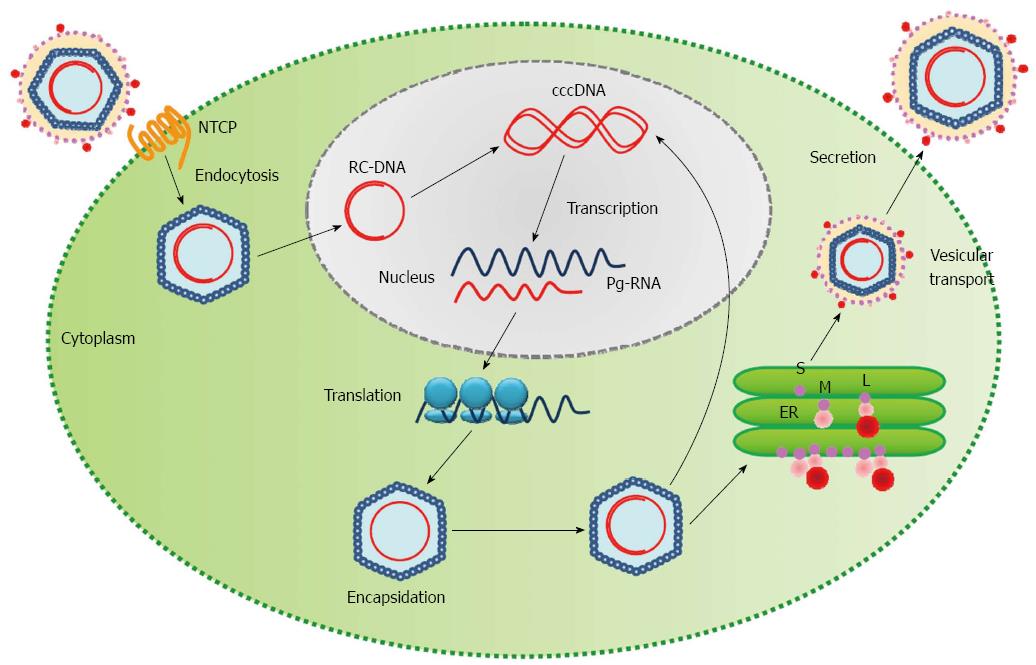 et al. Superiority of minipool nucleic acid amplifycation technology for hepatitis В virus over chemiluminescence immimoassay for hepatitis В surface antigen screening. Vox Sang., 2003, Vol.84, p.287-291.
et al. Superiority of minipool nucleic acid amplifycation technology for hepatitis В virus over chemiluminescence immimoassay for hepatitis В surface antigen screening. Vox Sang., 2003, Vol.84, p.287-291.
15. Roth W.K., Weber M., Petersen D. et al. NAT for HBV and anti HBc testing increase blood safety. // Transition, 2002, Vol.42, p.869-875.
16. Stramer S.L., Glynn S.A., Kleinman S.H. et al. Detection of HTV-1 and HCV infections among antibody-negative blood donors by nucleic acid- amplification testing.// N Engl Med, 2004, vol.351, p.760-768.
17. Weber В., Melchior W., Gehrke R. et al. Hepatitis В virus markers in anti-ITBc only positive individuals. III. Med. Virol., 2001, Vol.64, N.3, p.312-3 19.
18. Yoshikawa A, Gotanda Y., Itabashi M. et al. Hepatitis В NAT virus-poselive blood donors in the esrly and late stages of HBV infection: analyses of the window period and kmetics of HBV DNA. Vox Sang.,2005, Vol.88, p.77-86.
19. Голосова Т.В., Никитин И. К. Гемотрансмиссивные инфекции. — М.,2003.
К. Гемотрансмиссивные инфекции. — М.,2003.
Все статьи в разделе «Лабораторная диагностика»
Hepatitis B virus (HBV, гепатит B), ДНК (ПЦР), количественный, кровь
Количественное определение ДНК вируса гепатита В методом ПЦР
Hepatitis B Virus DNA Quantitative, Real-Time PCR
Hepatitis B virus, иллюстрация с сайта innermostsecrets.com.
Анализ определяет количество частиц вируса гепатита В (hepatitis В virus) методом полимеразной цепной реакции (ПЦР) в плазме крови. Определяемый фрагмент — уникальная последовательность ДНК гена структурного белка вируса гепатита В. Специфичность определения — 98%. Чувствительность определения — от 2×105 МЕ (5×103 тысяч копий) вирусных частиц в одном миллилитре сыворотке крови.
Гепатит B — одна из самых распространенных и опасных вирусных инфекций, передающихся через кровь и половым путем. Инкубационный период 50-180 дней. Острый гепатит B сначала напоминает грипп, затем развивается желтуха. У 90 % больных острый гепатит B излечивается через 4-8 недель, в остальных случаях переходит в хроническую форму.
Инкубационный период 50-180 дней. Острый гепатит B сначала напоминает грипп, затем развивается желтуха. У 90 % больных острый гепатит B излечивается через 4-8 недель, в остальных случаях переходит в хроническую форму.
Хронический гепатит В зачастую развивается, минуя острую форму. Болезнь прогрессирует годами и проявляется постепенно нарастающим общим недомоганием. Наибольшую опасность представляют типичные последствия этой инфекции: цирроз и рак печени.
ПЦР — полимеразная цепная реакция. Этот метод, изобретатель которого был награжден Нобелевской премией, умножает количество генетического материала, содержащегося в биологическом образце. Благодаря этому можно напрямую измерить число частиц конкретного вируса в сыворотке в очень широком диапазоне — от миллионов до считаных единиц.
Метод ПЦР – полимеразная цепная реакция, позволяющая идентифицировать наличие в биологическом материале искомый участок генетического материала.
Подробнее о методе ПЦР — его разновидностях, преимуществах и области применения в медицинской диагностике.
Количественная характеристика содержания ДНК вируса гепатита важна для оценки эффективности противовирусной терапии и имеет прогностическое значение для определения его хронизации.
При исходно низком уровне виремии (ДНК HBV менее 2×103 копий/мл (2×105 МЕ/мл) процент хронизации острого гепатита В близок к нулю.
При концентрации HBV ДНК от 2×103 до 2×106 хронизация процесса наблюдается у 25–30 % больных, а при высоком уровне виремии у пациента (более 2×106 (8×105МЕ/мл)) острый гепатит В чаще всего переходит в хронический.
Снижение концентрации ДНК вируса гепатита В к третьему дню от начала терапии на 85% является быстро определяемым и точным параметром для предсказания эффективности терапии.
Hepatitis C can be cured: will hepatitis B become next? | Chulanov
Chronic hepatitis B (CHB) and C (CHC) are one of the leading causes of cirrhosis and liver cancer with over a million of people dying annually from their consequences. In Russia CHB and CHC morbidity and related mortality show an upward trend. As a result of recent breakthroughs in antiviral therapeutics CHC became a curable disease. Modern therapeutics effectively suppress viral replication in CHB patients, but withdrawal of antivirals usually results in disease relapse. Loss of HBsAg required for the so called «functional cure» is a very rare event. Moreover, «complete cure» when the virus is entirely eliminated from the body is not possible due to a persistent form of covalently closed circular DNA (cccDNA) of hepatitis B virus (HBV) in hepatocytes refractory to modern antivirals. Today, there is a plethora of new promising medications being at different stages of development that target different steps of viral life cycle, including inhibitors of interaction between HBV and its entry receptor NTCP, inhibitors of HBV cccDNA, inhibitors of nucleocapsid assembly, technologies of genome editing (TALENs, CRISPR/Cas etc) and RNA-interference. In addition to direct acting antivirals, there is a number of approaches aimed at enhancement of the innate and adaptive immune responses.
In Russia CHB and CHC morbidity and related mortality show an upward trend. As a result of recent breakthroughs in antiviral therapeutics CHC became a curable disease. Modern therapeutics effectively suppress viral replication in CHB patients, but withdrawal of antivirals usually results in disease relapse. Loss of HBsAg required for the so called «functional cure» is a very rare event. Moreover, «complete cure» when the virus is entirely eliminated from the body is not possible due to a persistent form of covalently closed circular DNA (cccDNA) of hepatitis B virus (HBV) in hepatocytes refractory to modern antivirals. Today, there is a plethora of new promising medications being at different stages of development that target different steps of viral life cycle, including inhibitors of interaction between HBV and its entry receptor NTCP, inhibitors of HBV cccDNA, inhibitors of nucleocapsid assembly, technologies of genome editing (TALENs, CRISPR/Cas etc) and RNA-interference. In addition to direct acting antivirals, there is a number of approaches aimed at enhancement of the innate and adaptive immune responses.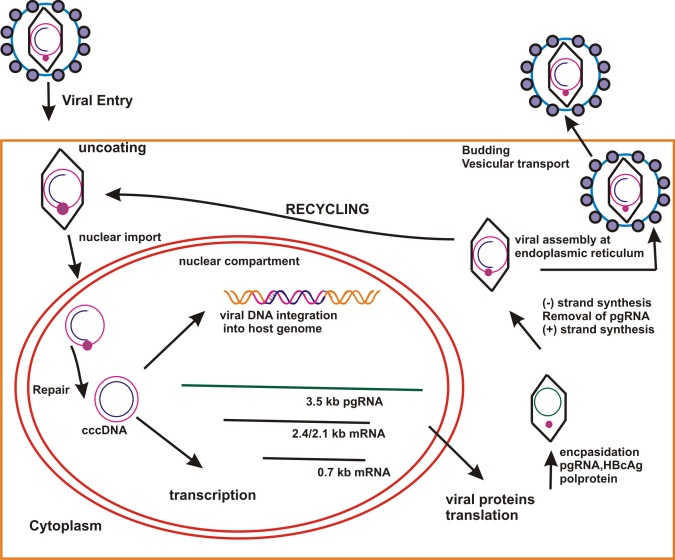 In experimental conditions, some of these approaches or their combinations help to achieve functional cure. However, complete elimination of the virus is possible only using technologies of genome editing, capable of specific cccDNA degradation. Nuclease systems are currently at their early stages of development, and there is a long way to prove their efficacy and safety. Nevertheless, highly promising results of the recent years leave no doubt that CRISPR/Cas systems and similar technologies can become the basis of CHB therapy.
In experimental conditions, some of these approaches or their combinations help to achieve functional cure. However, complete elimination of the virus is possible only using technologies of genome editing, capable of specific cccDNA degradation. Nuclease systems are currently at their early stages of development, and there is a long way to prove their efficacy and safety. Nevertheless, highly promising results of the recent years leave no doubt that CRISPR/Cas systems and similar technologies can become the basis of CHB therapy.
АН — аналоги нуклеозидов/нуклеотидов APС — апуриновые/апиримидиновые сайты ИКТ — иммунные контрольные точки ИФН — интерферон КИ — клинические исследования ккзДНК — кольцевая ковалентно замкнутая ДНК кчдДНК — кольцевая частично двуцепочечная ДНК миРНК — малые интерферирующие РНК мРНК — матричные РНК пгРНК — прегеномная РНК ХГВ — хронический гепатит В ХГС — хронический гепатит С ЦП — цирроз печени HBcAg — сore-белок (ядерный антиген HBV) HBsAg — поверхностные белки HBV HBV — вирус гепатита В NTCP — рецептор для проникновения HBV в клетку TLR — Toll-подобные рецепторы По оценкам ВОЗ, смертность от вирусных гепатитов в мире с 2000 г. увеличилась на 22% и превысила таковую от ВИЧ-инфекции. В 2015 г. от вирусных гепатитов умерли 1,34 млн человек, причем 96% из них от цирроза печени (ЦП) и рака печени вследствие хронического гепатита В (ХГВ) и хронического гепатита С (ХГС) [1]. Согласно данным государственного статистического наблюдения в России заболеваемость ХГВ и ХГС по-прежнему очень высока: в 2016 г. 22 и 36 случаев на 100 тыс. населения соответственно, что в абсолютных цифрах приближается к 85 тыс. новых случаев. При этом заболеваемость ЦП за предыдущие 5 лет выросла более чем на 40%, а смертность от ЦП, исключая алкогольный, в 2015 г. составляла 29,4 на 100 тыс. населения, или 34 651 случай. Из приведенных цифр видно, что актуальность проблемы хронических вирусных гепатитов не только не снижается, а стремительно возрастает. За последние 5 лет новые препараты прямого противовирусного действия совершили переворот в области лечения ХГС. Используя комбинацию из двух или трех препаратов, в течение 12—24 нед можно добиться полной элиминации вируса гепатита С из организма более чем у 90% пациентов [2].
увеличилась на 22% и превысила таковую от ВИЧ-инфекции. В 2015 г. от вирусных гепатитов умерли 1,34 млн человек, причем 96% из них от цирроза печени (ЦП) и рака печени вследствие хронического гепатита В (ХГВ) и хронического гепатита С (ХГС) [1]. Согласно данным государственного статистического наблюдения в России заболеваемость ХГВ и ХГС по-прежнему очень высока: в 2016 г. 22 и 36 случаев на 100 тыс. населения соответственно, что в абсолютных цифрах приближается к 85 тыс. новых случаев. При этом заболеваемость ЦП за предыдущие 5 лет выросла более чем на 40%, а смертность от ЦП, исключая алкогольный, в 2015 г. составляла 29,4 на 100 тыс. населения, или 34 651 случай. Из приведенных цифр видно, что актуальность проблемы хронических вирусных гепатитов не только не снижается, а стремительно возрастает. За последние 5 лет новые препараты прямого противовирусного действия совершили переворот в области лечения ХГС. Используя комбинацию из двух или трех препаратов, в течение 12—24 нед можно добиться полной элиминации вируса гепатита С из организма более чем у 90% пациентов [2]. При этом современное лечение ХГС не только высокоэффективно, но и безопасно — легко переносится, не сопряжено со значительными побочными эффектами. Несмотря на пока еще невысокую доступность таких препаратов в нашей стране, мы можем с уверенностью констатировать, что ХГС перешел из разряда трудно поддающихся лечению болезней в категорию полностью излечимых. Современные подходы к лечению ХГВ основываются на применении препаратов интерферона (ИФН) или аналогов нуклеозидов/нуклеотидов (АН). В первом случае эффективность лечения в целом невысока. Во втором случае лечение АН позволяет подавить репликацию вируса практически у всех пациентов, однако для большинства срок лечения может быть неопределенно долгим, возможно пожизненным. И в том, и в другом случае после завершения лечения репликация вируса, как правило, возобновляется. Элиминации HBsAg удается достичь лишь у небольшого числа пациентов. В последние десятилетия мир переживает невероятный подъем во многих областях науки, включая молекулярную биологию, что обусловлено прежде всего созданием и развитием новых методов и технологий.
При этом современное лечение ХГС не только высокоэффективно, но и безопасно — легко переносится, не сопряжено со значительными побочными эффектами. Несмотря на пока еще невысокую доступность таких препаратов в нашей стране, мы можем с уверенностью констатировать, что ХГС перешел из разряда трудно поддающихся лечению болезней в категорию полностью излечимых. Современные подходы к лечению ХГВ основываются на применении препаратов интерферона (ИФН) или аналогов нуклеозидов/нуклеотидов (АН). В первом случае эффективность лечения в целом невысока. Во втором случае лечение АН позволяет подавить репликацию вируса практически у всех пациентов, однако для большинства срок лечения может быть неопределенно долгим, возможно пожизненным. И в том, и в другом случае после завершения лечения репликация вируса, как правило, возобновляется. Элиминации HBsAg удается достичь лишь у небольшого числа пациентов. В последние десятилетия мир переживает невероятный подъем во многих областях науки, включая молекулярную биологию, что обусловлено прежде всего созданием и развитием новых методов и технологий.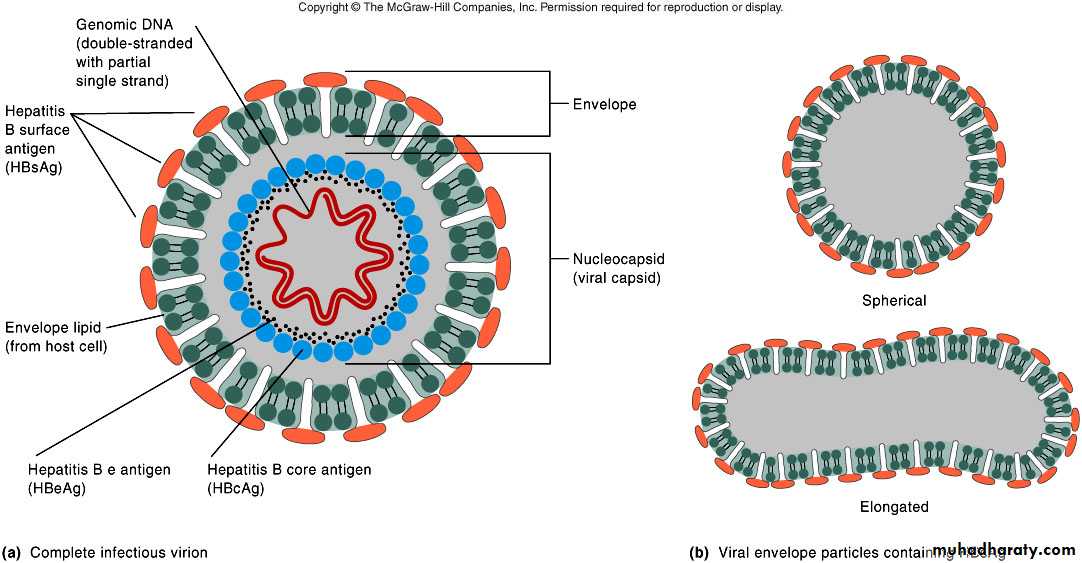 Высокопроизводительное секвенирование и обработка больших массивов данных заполнили множество пробелов в изучении природы вирусов. Технологии сайт-специфичного редактирования генома открывают широкие возможности для развития генотерапии. Системы синтеза, прогнозирования свойств и анализа действия химических соединений позволяют получать сотни потенциальных лекарственных веществ в короткие сроки. Можно ли в этих условиях рассчитывать, что ХГВ аналогично гепатиту С будет вычеркнут из списка неизлечимых заболеваний? Поиску ответа на этот вопрос посвящена данная публикация. Биология вируса гепатита В. Вирус гепатита В (HBV) относится к семейству Hepadnaviridae. Вирионы HBV, которые также называют частицами Дейна, содержат липидную оболочку клеточного происхождения, декорированную поверхностными белками вируса (HBsAg), и нуклеокапсид, состоящий из сore-белков (HBcAg). Внутри нуклеокапсида находится геном вируса — кольцевая частично двуцепочечная ДНК (кчдДНК) [3]. После проникновения HBV в гепатоцит кчдДНК вируса попадает в цитоплазму клети и транспортируется в ядро, где достраивается до другой формы генома — кольцевой ковалентно замкнутой ДНК (ккзДНК).
Высокопроизводительное секвенирование и обработка больших массивов данных заполнили множество пробелов в изучении природы вирусов. Технологии сайт-специфичного редактирования генома открывают широкие возможности для развития генотерапии. Системы синтеза, прогнозирования свойств и анализа действия химических соединений позволяют получать сотни потенциальных лекарственных веществ в короткие сроки. Можно ли в этих условиях рассчитывать, что ХГВ аналогично гепатиту С будет вычеркнут из списка неизлечимых заболеваний? Поиску ответа на этот вопрос посвящена данная публикация. Биология вируса гепатита В. Вирус гепатита В (HBV) относится к семейству Hepadnaviridae. Вирионы HBV, которые также называют частицами Дейна, содержат липидную оболочку клеточного происхождения, декорированную поверхностными белками вируса (HBsAg), и нуклеокапсид, состоящий из сore-белков (HBcAg). Внутри нуклеокапсида находится геном вируса — кольцевая частично двуцепочечная ДНК (кчдДНК) [3]. После проникновения HBV в гепатоцит кчдДНК вируса попадает в цитоплазму клети и транспортируется в ядро, где достраивается до другой формы генома — кольцевой ковалентно замкнутой ДНК (ккзДНК). ккзДНК служит матрицей для вирусных РНК: матричных РНК (мРНК), с которых синтезируются белки вируса, и прегеномной РНК (пгРНК). пгРНК в комплексе с вирусной полимеразой и рядом клеточных белов попадает в de novo синтезированный нуклеокапсид. Внутри нуклеокапсида происходит обратная транскрипция, в результате которой снова образуется геномная кчдДНК, в то время как пгРНК деградирует [4]. Почему ХГВ в настоящее время неизлечим? Основная причина перехода инфекции в хроническую форму — персистенция ккзДНК в ядре гепатоцита. Данная форма генома HBV характеризуется высокой стабильностью, сохраняется в клетках печени независимо от характера и длительности терапии и обнаруживается даже у пациентов с разрешившейся инфекцией, когда ДНК HBV и HBsAg в крови не выявляется [5, 6]. Поскольку ккзДНК может запустить весь вирусный цикл, только полная ее элиминация может быть условием выздоровления без риска реактивации инфекции [7]. Однако, несмотря на многолетнее изучение и большой арсенал перспективных лекарственных препаратов, еще не удается добиться деградации всех ккзДНК в гепатоцитах.
ккзДНК служит матрицей для вирусных РНК: матричных РНК (мРНК), с которых синтезируются белки вируса, и прегеномной РНК (пгРНК). пгРНК в комплексе с вирусной полимеразой и рядом клеточных белов попадает в de novo синтезированный нуклеокапсид. Внутри нуклеокапсида происходит обратная транскрипция, в результате которой снова образуется геномная кчдДНК, в то время как пгРНК деградирует [4]. Почему ХГВ в настоящее время неизлечим? Основная причина перехода инфекции в хроническую форму — персистенция ккзДНК в ядре гепатоцита. Данная форма генома HBV характеризуется высокой стабильностью, сохраняется в клетках печени независимо от характера и длительности терапии и обнаруживается даже у пациентов с разрешившейся инфекцией, когда ДНК HBV и HBsAg в крови не выявляется [5, 6]. Поскольку ккзДНК может запустить весь вирусный цикл, только полная ее элиминация может быть условием выздоровления без риска реактивации инфекции [7]. Однако, несмотря на многолетнее изучение и большой арсенал перспективных лекарственных препаратов, еще не удается добиться деградации всех ккзДНК в гепатоцитах.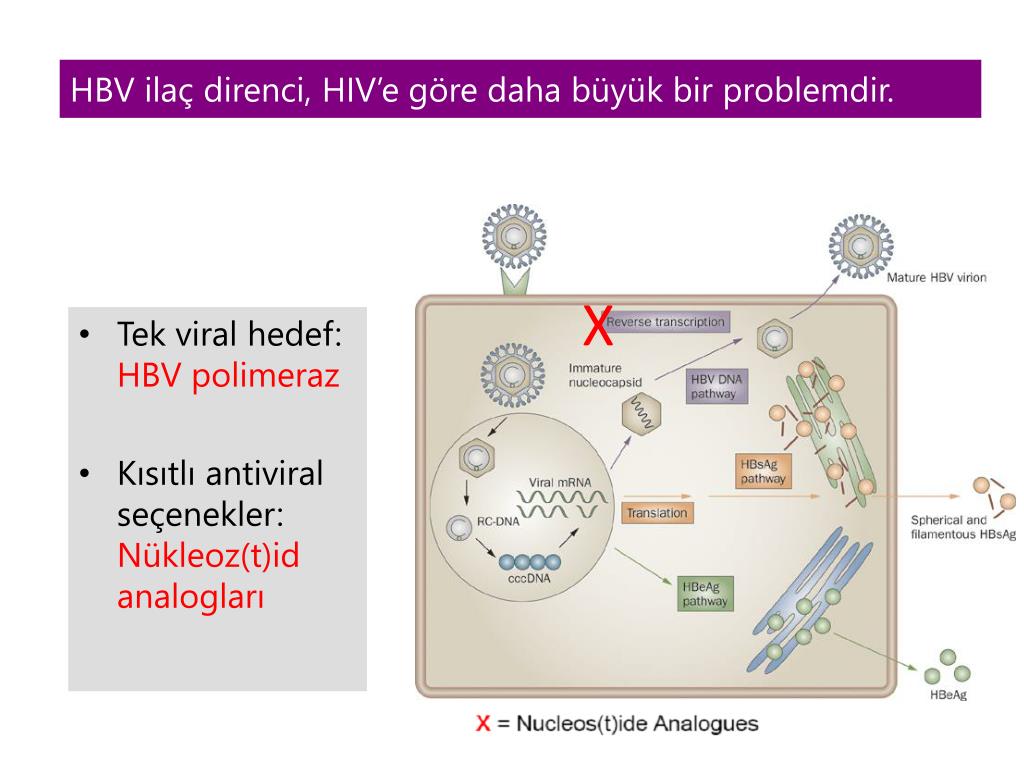 Стабильность ккзДНК обусловлена тем, что она существует в ядре в виде мини-хромосомы в комплексе с гистоновыми и негистоновыми белками клетки, а также вирусными белками HBxAg и HBcAg. Вследствие такой особенности в структуре ккзДНК подвержена эпигенетической регуляции клеточными белками, которые изменяют ее транскрипционную активность. Основная роль в этом процессе принадлежит метилированию островков CpG ДНК, метилированию и ацетилированию гистонов [8]. Таким образом, транскрипционный статус ккзДНК, степень компактизации и соответственно доступность ДНК вируса для внешних воздействий во многом зависят от эпигеномной модификации белков, которые привлекаются к мини-хромосоме [9]. Еще одна причина хронизации инфекции — способность HBV «избегать» иммунного ответа [10, 11]. Причиной нарушения интерферонового ответа в острой фазе инфекции является нарушение работы различных сигнальных путей, которые в норме индуцируют продукцию интерферона при других вирусных инфекциях. Механизм этого феномена до конца остается не изученным.
Стабильность ккзДНК обусловлена тем, что она существует в ядре в виде мини-хромосомы в комплексе с гистоновыми и негистоновыми белками клетки, а также вирусными белками HBxAg и HBcAg. Вследствие такой особенности в структуре ккзДНК подвержена эпигенетической регуляции клеточными белками, которые изменяют ее транскрипционную активность. Основная роль в этом процессе принадлежит метилированию островков CpG ДНК, метилированию и ацетилированию гистонов [8]. Таким образом, транскрипционный статус ккзДНК, степень компактизации и соответственно доступность ДНК вируса для внешних воздействий во многом зависят от эпигеномной модификации белков, которые привлекаются к мини-хромосоме [9]. Еще одна причина хронизации инфекции — способность HBV «избегать» иммунного ответа [10, 11]. Причиной нарушения интерферонового ответа в острой фазе инфекции является нарушение работы различных сигнальных путей, которые в норме индуцируют продукцию интерферона при других вирусных инфекциях. Механизм этого феномена до конца остается не изученным.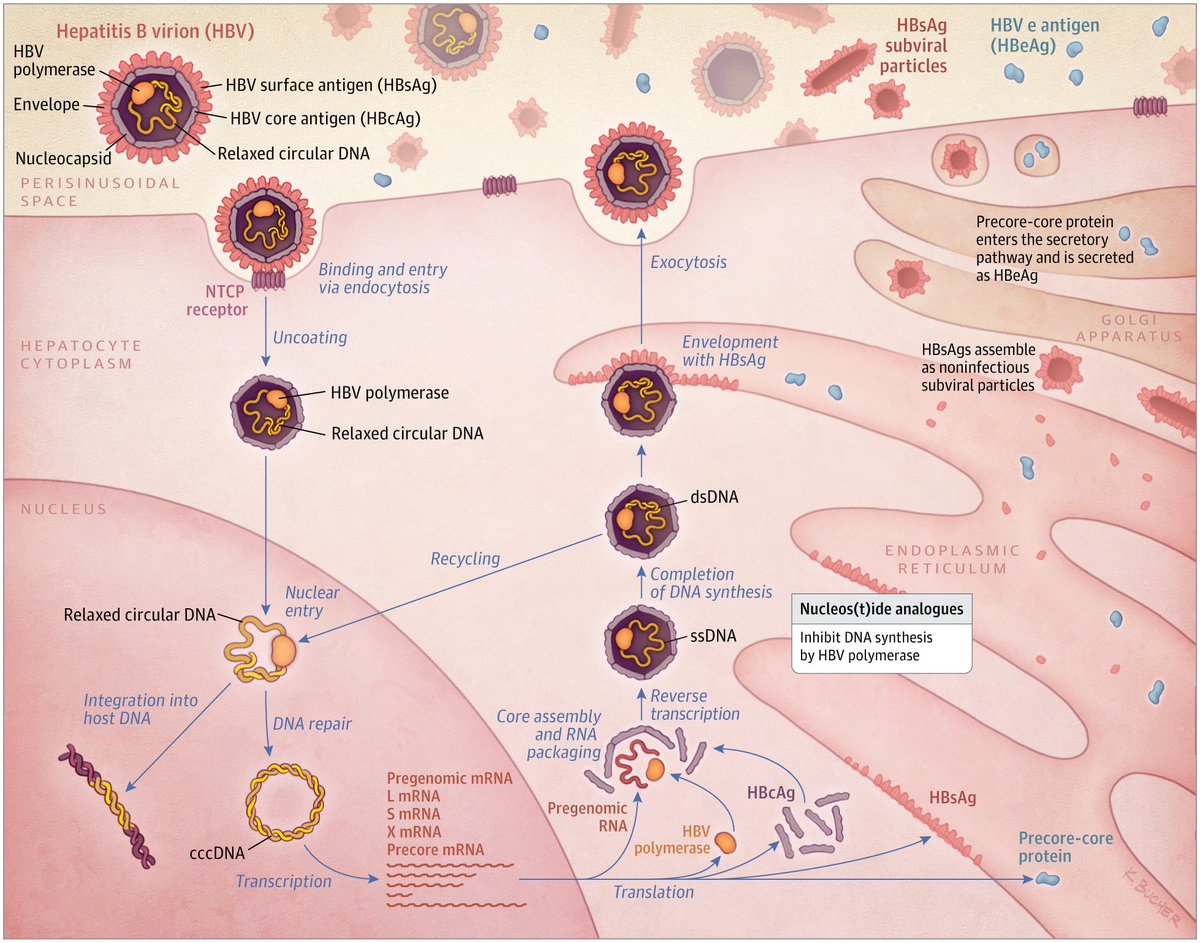 Кроме того, HBV создает условия устойчивой иммуносупрессии, снижая абсолютные количества и подавляя функцию специфичных для HBV Т-лимфоцитов, дендритных клеток и естественных киллеров [12, 13]. Ответ на лечение ХГВ: желаемый и достижимый. Очевидно, что на вопрос, что является желаемым, идеальным ответом на противовирусную терапию, напрашивается ответ — излечение. Однако что считать излечением ХГВ и к каким конечным точкам в терапии следует стремиться в настоящее время — предмет активных дискуссий. Мы обсуждаем вопрос с позиций воздействия на этиологический фактор — HBV. В идеальном случае необходимо добиться полного излечения, т. е. полной элиминации вируса из организма, при котором не детектируется ни один интермедиат вирусного цикла, а в гепатоцитах не сохраняется ни одной копии ккзДНК. Только в этом случае риск развития гепатоцеллюлятной карциномы и вероятность реактивации инфекции после прекращения терапии будут сведены к нулю. Усилия многих разработок, о которых пойдет речь далее, направлены на элиминацию ккзДНК, однако эта цель пока недостижима.
Кроме того, HBV создает условия устойчивой иммуносупрессии, снижая абсолютные количества и подавляя функцию специфичных для HBV Т-лимфоцитов, дендритных клеток и естественных киллеров [12, 13]. Ответ на лечение ХГВ: желаемый и достижимый. Очевидно, что на вопрос, что является желаемым, идеальным ответом на противовирусную терапию, напрашивается ответ — излечение. Однако что считать излечением ХГВ и к каким конечным точкам в терапии следует стремиться в настоящее время — предмет активных дискуссий. Мы обсуждаем вопрос с позиций воздействия на этиологический фактор — HBV. В идеальном случае необходимо добиться полного излечения, т. е. полной элиминации вируса из организма, при котором не детектируется ни один интермедиат вирусного цикла, а в гепатоцитах не сохраняется ни одной копии ккзДНК. Только в этом случае риск развития гепатоцеллюлятной карциномы и вероятность реактивации инфекции после прекращения терапии будут сведены к нулю. Усилия многих разработок, о которых пойдет речь далее, направлены на элиминацию ккзДНК, однако эта цель пока недостижима. Более вероятным считается достижение так называемого функционального излечения, которое характеризуется элиминацией HBsAg с сероконверсией или без нее. В ряде исследований доказано, что при спонтанной или индуцированной лечением элиминации HBsAg риск неблагоприятных исходов заболевания значительно снижается. Это связывают с функциональной, транскрипционной неактивностью ккзДНК. Однако даже такой цели с помощью противовирусных препаратов, имеющихся в арсенале, достичь удается довольно редко. Частота элиминации HBsAg при современных подходах к лечению ХГВ не превышает 5—10%. Большой оптимизм вселяют результаты исследований по возможности блокирования различных этапов жизненного цикла вируса. Комбинирование нескольких препаратов, воздействующих на разные мишени, очевидно, будет гораздо более эффективным. Наконец, под частичным излечением понимают стойкое подавление репликации HBV, при котором HBsAg продолжает обнаруживаться. Такой результат лечения является вполне достижимым и считается приемлемым, так как снижение вирусной нагрузки коррелирует со снижением риска развития неблагоприятных исходов.
Более вероятным считается достижение так называемого функционального излечения, которое характеризуется элиминацией HBsAg с сероконверсией или без нее. В ряде исследований доказано, что при спонтанной или индуцированной лечением элиминации HBsAg риск неблагоприятных исходов заболевания значительно снижается. Это связывают с функциональной, транскрипционной неактивностью ккзДНК. Однако даже такой цели с помощью противовирусных препаратов, имеющихся в арсенале, достичь удается довольно редко. Частота элиминации HBsAg при современных подходах к лечению ХГВ не превышает 5—10%. Большой оптимизм вселяют результаты исследований по возможности блокирования различных этапов жизненного цикла вируса. Комбинирование нескольких препаратов, воздействующих на разные мишени, очевидно, будет гораздо более эффективным. Наконец, под частичным излечением понимают стойкое подавление репликации HBV, при котором HBsAg продолжает обнаруживаться. Такой результат лечения является вполне достижимым и считается приемлемым, так как снижение вирусной нагрузки коррелирует со снижением риска развития неблагоприятных исходов. Однако он не может рассматриваться как окончательная цель противовирусной терапии, а лишь как промежуточный положительный результат. Основные критерии описанных выше вариантов излечения представлены в табл. 1. Таблица 1. Основные критерии вариантов излечения ХГВ В клинической практике выделяют вирусологический, серологический, биохимический и гистологический ответ на лечение. Наиболее важен вирусологический ответ, который определяется по-разному в зависимости от характера лечения (препараты ИФН или АН) и периода оценки. При лечении АН вирусологическим ответом считается отрицательный результат на ДНК HBV после 3 мес лечения (при аналитической чувствительности метода 10 МЕ/мл и выше). При лечении препаратами ИФН вирусологический ответ определяется как уровень ДНК HBV в плазме крови менее 2000 МЕ/мл через 6 и 12 мес лечения. По завершении любого варианта лечения устойчивым вирусологическим ответом считается уровень ДНК HBV< 2000 МЕ/мл на протяжении не менее 12 мес [14]. Таким образом, клиническое определение устойчивого вирусологического ответа соответствует критериям частичного излечения, описанным ранее.
Однако он не может рассматриваться как окончательная цель противовирусной терапии, а лишь как промежуточный положительный результат. Основные критерии описанных выше вариантов излечения представлены в табл. 1. Таблица 1. Основные критерии вариантов излечения ХГВ В клинической практике выделяют вирусологический, серологический, биохимический и гистологический ответ на лечение. Наиболее важен вирусологический ответ, который определяется по-разному в зависимости от характера лечения (препараты ИФН или АН) и периода оценки. При лечении АН вирусологическим ответом считается отрицательный результат на ДНК HBV после 3 мес лечения (при аналитической чувствительности метода 10 МЕ/мл и выше). При лечении препаратами ИФН вирусологический ответ определяется как уровень ДНК HBV в плазме крови менее 2000 МЕ/мл через 6 и 12 мес лечения. По завершении любого варианта лечения устойчивым вирусологическим ответом считается уровень ДНК HBV< 2000 МЕ/мл на протяжении не менее 12 мес [14]. Таким образом, клиническое определение устойчивого вирусологического ответа соответствует критериям частичного излечения, описанным ранее. Открытие пгРНК в составе вирионов HBV, секретируемых в кровь из инфицированных гепатоцитов, не только во многом изменило представления о биологии вируса, но и породило идею об использовании пгРНК в качестве маркера для оценки эффективности лечения ХГВ [15]. Переход ккзДНК в транскрипционно-неактивную форму в результате воздействия лекарственных препаратов влечет за собой прекращение секреции пгРНК в составе вирионов. Таким образом, отрицательный результат на пгРНК в плазме крови косвенно свидетельствует о функциональной неактивности ккзДНК в гепатоцитах и может рассматриваться как ранний признак скорого достижения функционального излечения. Терапия ХГВ. Современные подходы к лечению ХГВ основываются на использовании двух групп препаратов: прямого противовирусного действия и иммуноопосредованного действия. К препаратам прямого противовирусного действия относятся аналоги нуклеозидов (ламивудин, телбивудин, энтекавир) и нуклеотидов (адефовир, тенофовир), которые являются ингибиторами вирусной полимеразы (см.
Открытие пгРНК в составе вирионов HBV, секретируемых в кровь из инфицированных гепатоцитов, не только во многом изменило представления о биологии вируса, но и породило идею об использовании пгРНК в качестве маркера для оценки эффективности лечения ХГВ [15]. Переход ккзДНК в транскрипционно-неактивную форму в результате воздействия лекарственных препаратов влечет за собой прекращение секреции пгРНК в составе вирионов. Таким образом, отрицательный результат на пгРНК в плазме крови косвенно свидетельствует о функциональной неактивности ккзДНК в гепатоцитах и может рассматриваться как ранний признак скорого достижения функционального излечения. Терапия ХГВ. Современные подходы к лечению ХГВ основываются на использовании двух групп препаратов: прямого противовирусного действия и иммуноопосредованного действия. К препаратам прямого противовирусного действия относятся аналоги нуклеозидов (ламивудин, телбивудин, энтекавир) и нуклеотидов (адефовир, тенофовир), которые являются ингибиторами вирусной полимеразы (см. рисунок). Жизненный цикл HBV и ключевые мишени для противовирусной терапии. ЭР — эндоплазматическая сеть (эндоплазматический ретикулум). Предпочтение отдается препаратам энтекавир и тенофовир, оказывающим выраженное противовирусное действие и обладающим высоким генетическим барьером (низкий риск развития лекарственной устойчивости) [16]. К препаратам иммуноопосредованного действия относятся различные формы ИФН-α (короткого или пролонгированного действия). Их назначение оправдано пациентам, у которых мы вправе ожидать относительно более высокую эффективность такого лечения (HBeAg-положительный ХГВ, низкая вирусная нагрузка, низкий уровень HBsAg, повышенная активность трансаминаз, генотип, А HBV) [17]. Несмотря на то что современные противовирусные препараты могут подавлять активную репликацию вируса, ккзДНК HBV не является мишенью такого рода терапии и служит причиной реактивации вирусной инфекции при ее завершении. По мере изучения молекулярной биологии HBV и его взаимодействий с клеткой появляются новые подходы к лечению ХГВ, направленные на различные стадии жизненного цикла вируса (см.
рисунок). Жизненный цикл HBV и ключевые мишени для противовирусной терапии. ЭР — эндоплазматическая сеть (эндоплазматический ретикулум). Предпочтение отдается препаратам энтекавир и тенофовир, оказывающим выраженное противовирусное действие и обладающим высоким генетическим барьером (низкий риск развития лекарственной устойчивости) [16]. К препаратам иммуноопосредованного действия относятся различные формы ИФН-α (короткого или пролонгированного действия). Их назначение оправдано пациентам, у которых мы вправе ожидать относительно более высокую эффективность такого лечения (HBeAg-положительный ХГВ, низкая вирусная нагрузка, низкий уровень HBsAg, повышенная активность трансаминаз, генотип, А HBV) [17]. Несмотря на то что современные противовирусные препараты могут подавлять активную репликацию вируса, ккзДНК HBV не является мишенью такого рода терапии и служит причиной реактивации вирусной инфекции при ее завершении. По мере изучения молекулярной биологии HBV и его взаимодействий с клеткой появляются новые подходы к лечению ХГВ, направленные на различные стадии жизненного цикла вируса (см. рисунок). Некоторые, наиболее перспективные, экспериментальные методы лечения описаны далее. Препараты для лечения ХГВ, находящиеся в разработке приведены табл. 2. Таблица 2. Препараты для лечения ХГВ, находящиеся в разработке Примечание. FDA — Управление по контролю за качеством лекарственных препаратов и пищевых продуктов США. Экспериментальные методы лечения ХГВ: препараты прямого противовирусного действия Ингибиторы связывания HBV с рецептором. Главным рецептором, посредством которого HBV проникает в гепатоцит, является NTCP (sodium taurocholate co-transporting polypeptide). Мирклюдекс-B представляет синтетический липопептид, полученный на основе pre-S1-домена белка оболочки HBV. Данный препарат эффективно ингибирует проникновение HBV в клетку, поскольку конкурирует с ним за возможность связывания с рецептором NTCP [18]. В эксперименте у иммунодефицитных гуманизированных мышей, инфицированных HBV, наблюдалось снижение вирусной нагрузки в сыворотке крови. Мирклюдекс-В не только ингибировал увеличение количества ккзДНК в инфицированных клетках, но и предотвращал дальнейшее распространение вируса в неинфицированные гепатоциты [19].
рисунок). Некоторые, наиболее перспективные, экспериментальные методы лечения описаны далее. Препараты для лечения ХГВ, находящиеся в разработке приведены табл. 2. Таблица 2. Препараты для лечения ХГВ, находящиеся в разработке Примечание. FDA — Управление по контролю за качеством лекарственных препаратов и пищевых продуктов США. Экспериментальные методы лечения ХГВ: препараты прямого противовирусного действия Ингибиторы связывания HBV с рецептором. Главным рецептором, посредством которого HBV проникает в гепатоцит, является NTCP (sodium taurocholate co-transporting polypeptide). Мирклюдекс-B представляет синтетический липопептид, полученный на основе pre-S1-домена белка оболочки HBV. Данный препарат эффективно ингибирует проникновение HBV в клетку, поскольку конкурирует с ним за возможность связывания с рецептором NTCP [18]. В эксперименте у иммунодефицитных гуманизированных мышей, инфицированных HBV, наблюдалось снижение вирусной нагрузки в сыворотке крови. Мирклюдекс-В не только ингибировал увеличение количества ккзДНК в инфицированных клетках, но и предотвращал дальнейшее распространение вируса в неинфицированные гепатоциты [19].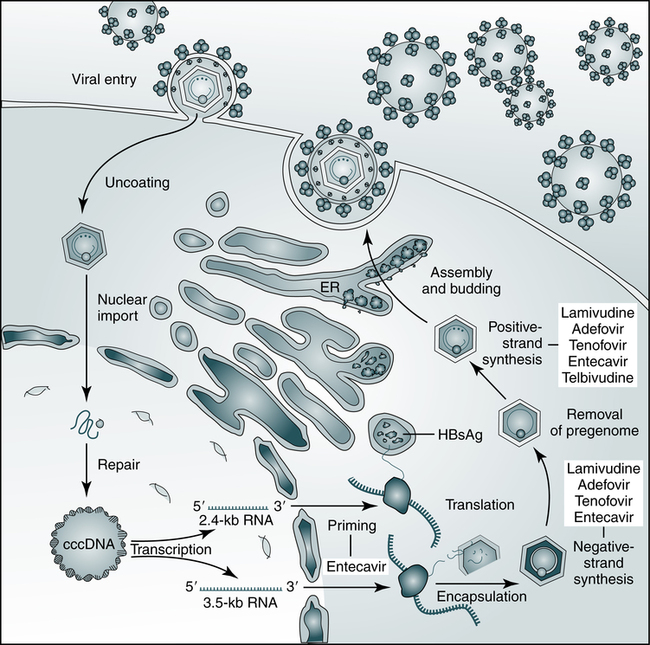 В настоящее время препарат находится во II фазе клинических исследований (КИ). Показаны его безопасность, хорошая переносимость и эффективность в широком диапазоне доз (0,5—10 мг). Значительное снижение уровня ДНК HBV (более 1 log10) к 12-й неделе лечения наблюдалось у 75% пациентов, получающих 10 мг препарата [20]. В будущем препарат может стать важным компонентом комбинированных схем лечения ХГВ. Ингибиторы ккзДНК HBV. Одним из этапов жизненного цикла вируса, на который может быть направлено воздействие с целью предотвращения образования ккзДНК, является конверсия кчдДНК в ккзДНК. К ингибиторам этого процесса относятся два двузамещенных сульфонамида ССС-0975 и ССС-0346 [21]. Показано, что данные молекулы снижают количества ккзДНК в культуре клеток гепатоцитов утки в 2 раза. Однако эти соединения не стимулировали деградацию ккзДНК, т. е. эффект снижения связан только с нарушением образования ккзДНК de novo. Данная работа хорошо демонстрирует возможности современных технологий. Авторам за 5 мес удалось оценить влияние на вирусный цикл 85 тыс.
В настоящее время препарат находится во II фазе клинических исследований (КИ). Показаны его безопасность, хорошая переносимость и эффективность в широком диапазоне доз (0,5—10 мг). Значительное снижение уровня ДНК HBV (более 1 log10) к 12-й неделе лечения наблюдалось у 75% пациентов, получающих 10 мг препарата [20]. В будущем препарат может стать важным компонентом комбинированных схем лечения ХГВ. Ингибиторы ккзДНК HBV. Одним из этапов жизненного цикла вируса, на который может быть направлено воздействие с целью предотвращения образования ккзДНК, является конверсия кчдДНК в ккзДНК. К ингибиторам этого процесса относятся два двузамещенных сульфонамида ССС-0975 и ССС-0346 [21]. Показано, что данные молекулы снижают количества ккзДНК в культуре клеток гепатоцитов утки в 2 раза. Однако эти соединения не стимулировали деградацию ккзДНК, т. е. эффект снижения связан только с нарушением образования ккзДНК de novo. Данная работа хорошо демонстрирует возможности современных технологий. Авторам за 5 мес удалось оценить влияние на вирусный цикл 85 тыс. низкомолекулярных соединений и отобрать из их 2, давших эффект, для дальнейших исследований. Технологии «редактирования» генома. Большой интерес представляют технологии «редактирования» генома, основанные на использовании нуклеаз — ферментов, способных избирательно связываться с определенными нуклеотидными последовательностями в составе целевой молекулы ДНК и катализировать ее расщепление. К ним относятся нуклеазы с «цинковыми пальцами» (zinc-finger nucleases — ZFN), TALEN (transcription activator-like effector nucleases) и CRISPR/Cas9 (clustered regularly interspaced short palindromic repeats/Cas nucleases) — системы, которые могут «разрезать» заданный участок последовательности ДНК, но при этом не оказывать цитотоксического действия, связанного с внецелевым воздействием на геном клетки [22]. Наиболее перспективной в настоящее время является технология «редактирования» генома на основе сайт-специфических нуклеаз CRISPR/Cas9. Сайтспецифичесные нуклеазы вызывают двуцепочечные разрывы ДНК и могут использоваться как ингибиторы репликации HBV.
низкомолекулярных соединений и отобрать из их 2, давших эффект, для дальнейших исследований. Технологии «редактирования» генома. Большой интерес представляют технологии «редактирования» генома, основанные на использовании нуклеаз — ферментов, способных избирательно связываться с определенными нуклеотидными последовательностями в составе целевой молекулы ДНК и катализировать ее расщепление. К ним относятся нуклеазы с «цинковыми пальцами» (zinc-finger nucleases — ZFN), TALEN (transcription activator-like effector nucleases) и CRISPR/Cas9 (clustered regularly interspaced short palindromic repeats/Cas nucleases) — системы, которые могут «разрезать» заданный участок последовательности ДНК, но при этом не оказывать цитотоксического действия, связанного с внецелевым воздействием на геном клетки [22]. Наиболее перспективной в настоящее время является технология «редактирования» генома на основе сайт-специфических нуклеаз CRISPR/Cas9. Сайтспецифичесные нуклеазы вызывают двуцепочечные разрывы ДНК и могут использоваться как ингибиторы репликации HBV. Элементами CRISPR-систем являются проводники РНК (guide RNAs) и белки Cas. Узнавание осуществляется за счет взаимодействия РНК с комплементарным участком ДНК. Система представляет собой комплекс из РНК и белков Cas, обладающих нуклеазной активностью. Опубликовано несколько успешных работ с использованием этой системы для HBV. В клетках HepAD38, экспрессирующих геном HBV, наблюдалось значительное снижение уровня ДНК вируса при трансдукции клеток плазмидой, кодирующей Cas9, и кассетой из трех проводников РНК, комплементарных последовательностям HBV. В клетках HepaRG также отмечено понижение уровня ккзДНК. Таким образом, показано эффективное снижение числа копий ДНК и ккзДНК как на модели хронической инфекции (HepAD38-клетки), так и при инфекции de novo (HepaRG-клетки) [23]. В других работах целевой последовательностью в геноме HBV выбрана рамка считывания, кодирующая белок X. При этом подтверждена эффективность модели in vivo с использованием системы, экспрессирующей ккзДНК в клетках печени мыши.
Элементами CRISPR-систем являются проводники РНК (guide RNAs) и белки Cas. Узнавание осуществляется за счет взаимодействия РНК с комплементарным участком ДНК. Система представляет собой комплекс из РНК и белков Cas, обладающих нуклеазной активностью. Опубликовано несколько успешных работ с использованием этой системы для HBV. В клетках HepAD38, экспрессирующих геном HBV, наблюдалось значительное снижение уровня ДНК вируса при трансдукции клеток плазмидой, кодирующей Cas9, и кассетой из трех проводников РНК, комплементарных последовательностям HBV. В клетках HepaRG также отмечено понижение уровня ккзДНК. Таким образом, показано эффективное снижение числа копий ДНК и ккзДНК как на модели хронической инфекции (HepAD38-клетки), так и при инфекции de novo (HepaRG-клетки) [23]. В других работах целевой последовательностью в геноме HBV выбрана рамка считывания, кодирующая белок X. При этом подтверждена эффективность модели in vivo с использованием системы, экспрессирующей ккзДНК в клетках печени мыши. C. Dong и соавт. [24] продемонстрировали, что система может сокращать количество ккзДНК и подавлять репликацию вируса как в клетках, трансфицированных ккзДНК, так и на модели гуманизированных мышей in vivo. С. Seeger и J. Sohn [23] показали, что при двуцепочечных разрывах ДНК, вносимых системами CRISPR/Cas9 на модели клеток HepG2-NTCP, инфицированных HBV, репарация разрывов преимущественно происходит по пути негомологичного соединения концов, т. е. системы CRISPR/Cas9 вносят многочисленные мутации в геном HBV [25]. Опубликованные данные по действию систем CRISPR/Cas9 на цикл HBV приведены в табл. 3. Таблица 3. Основные результаты исследований противовирусных свойств CRISPR/Cas9 при HBV-инфекции на модельных системах Таким образом, во многих исследованиях продемонстрирована высокая эффективность системы CRISPR/Cas9 при разрушении различных форм ДНК HBV, что позволяет считать данный подход одним из наиболее перспективных направлений разработки противовирусных препаратов для лечения ХГВ.
C. Dong и соавт. [24] продемонстрировали, что система может сокращать количество ккзДНК и подавлять репликацию вируса как в клетках, трансфицированных ккзДНК, так и на модели гуманизированных мышей in vivo. С. Seeger и J. Sohn [23] показали, что при двуцепочечных разрывах ДНК, вносимых системами CRISPR/Cas9 на модели клеток HepG2-NTCP, инфицированных HBV, репарация разрывов преимущественно происходит по пути негомологичного соединения концов, т. е. системы CRISPR/Cas9 вносят многочисленные мутации в геном HBV [25]. Опубликованные данные по действию систем CRISPR/Cas9 на цикл HBV приведены в табл. 3. Таблица 3. Основные результаты исследований противовирусных свойств CRISPR/Cas9 при HBV-инфекции на модельных системах Таким образом, во многих исследованиях продемонстрирована высокая эффективность системы CRISPR/Cas9 при разрушении различных форм ДНК HBV, что позволяет считать данный подход одним из наиболее перспективных направлений разработки противовирусных препаратов для лечения ХГВ.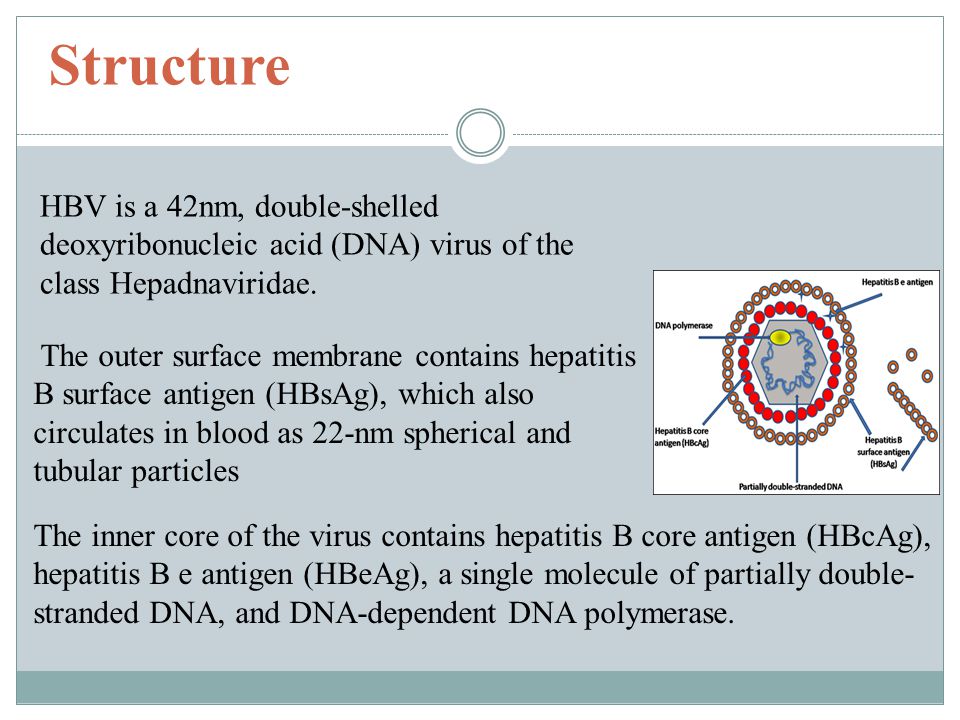 Ингибиторы сборки нуклеокапсида HBV. Белок нуклеокапсида HBV (HBcAg) играет центральную роль в жизненном цикле вируса, обеспечивая упаковку генома, участвуя в обратной транскрипции и множестве других ключевых процессов, необходимых для поддержания стабильной инфекции. Сборка нуклеокапсида — сложный многокомпонентный процесс, ингибирование которого может остановить репликацию вируса и восполнение пула ккзДНК, а потому является привлекательной мишенью для противовирусного воздействия. Два препарата находятся в разработке у компании «Janssen»: NVR 3—778 (II фаза КИ) и JNJ56136379 (I фаза КИ). Наиболее хорошо изучен препарат NVR 3—778, который ингибирует сборку нуклеокапсида и ряд других функций HBcAg в микромолярных концентрациях in vitro и in vivo. Он продемонстрировал активность в отношении HBV разных генотипов, хорошую переносимость, биодоступность и фармакокинетику при дозировании 1 раз в день. Эффективность данного препарата показана также в комбинации с аналогами нуклеоз (т)идов [32].
Ингибиторы сборки нуклеокапсида HBV. Белок нуклеокапсида HBV (HBcAg) играет центральную роль в жизненном цикле вируса, обеспечивая упаковку генома, участвуя в обратной транскрипции и множестве других ключевых процессов, необходимых для поддержания стабильной инфекции. Сборка нуклеокапсида — сложный многокомпонентный процесс, ингибирование которого может остановить репликацию вируса и восполнение пула ккзДНК, а потому является привлекательной мишенью для противовирусного воздействия. Два препарата находятся в разработке у компании «Janssen»: NVR 3—778 (II фаза КИ) и JNJ56136379 (I фаза КИ). Наиболее хорошо изучен препарат NVR 3—778, который ингибирует сборку нуклеокапсида и ряд других функций HBcAg в микромолярных концентрациях in vitro и in vivo. Он продемонстрировал активность в отношении HBV разных генотипов, хорошую переносимость, биодоступность и фармакокинетику при дозировании 1 раз в день. Эффективность данного препарата показана также в комбинации с аналогами нуклеоз (т)идов [32]. Препарат морфотиадин (GLS4) компании «HEC Pharma» относится к группе гетероарилдигидропиримидинов, является селективным ингибитором сборки нуклеокапсида HBV и также находится во II фазе КИ. GLS4 продемонстрировал выраженную ингибирующую активность в культуре клеток HBV HepG2.2.15, в том числе в отношении резистентных к АН штаммов HBV. Препарат имеет благоприятный фармакокинетический профиль и достаточно безопасен для проведения дальнейших исследований [33]. Недавно открыта еще одна группа веществ, ингибирующих сборку нуклеокапсида, которая получила название факторов аллостерической модификации core-белка (сore protein allosteric modifiers— CpAMs), одним из которых является ABI-H0731 («Assembly Biosciences», I фаза КИ). На моделях in vitro показано, что CpAM снижают репликацию HBV, уровень ккзДНК, HBeAg, HBsAg и пгРНК [34]. Для ингибитора AB-423 («Arbutus Biopharma», I фаза КИ) показана активность на двух разных стадиях жизненного цикла HBV: инкапсидации пгРНК и формирования ккзДНК. В культуре клеток HepAD38 и гепатомы человека показан аддитивный и синергетический эффект при комбинированном использовании АН и препаратов из группы малых интерферирующих РНК (миРНК), о которых пойдет речь далее [35].
Препарат морфотиадин (GLS4) компании «HEC Pharma» относится к группе гетероарилдигидропиримидинов, является селективным ингибитором сборки нуклеокапсида HBV и также находится во II фазе КИ. GLS4 продемонстрировал выраженную ингибирующую активность в культуре клеток HBV HepG2.2.15, в том числе в отношении резистентных к АН штаммов HBV. Препарат имеет благоприятный фармакокинетический профиль и достаточно безопасен для проведения дальнейших исследований [33]. Недавно открыта еще одна группа веществ, ингибирующих сборку нуклеокапсида, которая получила название факторов аллостерической модификации core-белка (сore protein allosteric modifiers— CpAMs), одним из которых является ABI-H0731 («Assembly Biosciences», I фаза КИ). На моделях in vitro показано, что CpAM снижают репликацию HBV, уровень ккзДНК, HBeAg, HBsAg и пгРНК [34]. Для ингибитора AB-423 («Arbutus Biopharma», I фаза КИ) показана активность на двух разных стадиях жизненного цикла HBV: инкапсидации пгРНК и формирования ккзДНК. В культуре клеток HepAD38 и гепатомы человека показан аддитивный и синергетический эффект при комбинированном использовании АН и препаратов из группы малых интерферирующих РНК (миРНК), о которых пойдет речь далее [35]. РНК-интерференция. Одной из перспективных мишеней для противовирусных препаратов является транскрипция вирусных мРНК. При хронической инфекции, вызванной HBV, как правило, наблюдается избыточный синтез HBsAg и других вирусных белков, постоянное воздействие которых на Т-лимфоциты приводит к истощению Т-клеточного звена иммунитета. Подавление или полная блокировка экспрессии вирусных мРНК может привести к значительному снижению уровня антигенов HBV и как следствие восстановлению иммунитета [36]. Механизм РНК-интерференции — подавления экспрессии целевых генов с помощью малых молекул РНК — в настоящее время широко используется как один из инструментов для создания лекарственных препаратов. Опубликовано более десятка перспективных экспериментальных разработок препаратов против HBV на основе малых некодирующих РНК. Интерес представляет препарат ARC-520 («Arrowhead», II фаза КИ), содержащий 2 малые интерферирующие РНК (миРНК), конъюгированные с молекулой холестерина, которые комплементарны 2 регионам в геноме HBV.
РНК-интерференция. Одной из перспективных мишеней для противовирусных препаратов является транскрипция вирусных мРНК. При хронической инфекции, вызванной HBV, как правило, наблюдается избыточный синтез HBsAg и других вирусных белков, постоянное воздействие которых на Т-лимфоциты приводит к истощению Т-клеточного звена иммунитета. Подавление или полная блокировка экспрессии вирусных мРНК может привести к значительному снижению уровня антигенов HBV и как следствие восстановлению иммунитета [36]. Механизм РНК-интерференции — подавления экспрессии целевых генов с помощью малых молекул РНК — в настоящее время широко используется как один из инструментов для создания лекарственных препаратов. Опубликовано более десятка перспективных экспериментальных разработок препаратов против HBV на основе малых некодирующих РНК. Интерес представляет препарат ARC-520 («Arrowhead», II фаза КИ), содержащий 2 малые интерферирующие РНК (миРНК), конъюгированные с молекулой холестерина, которые комплементарны 2 регионам в геноме HBV.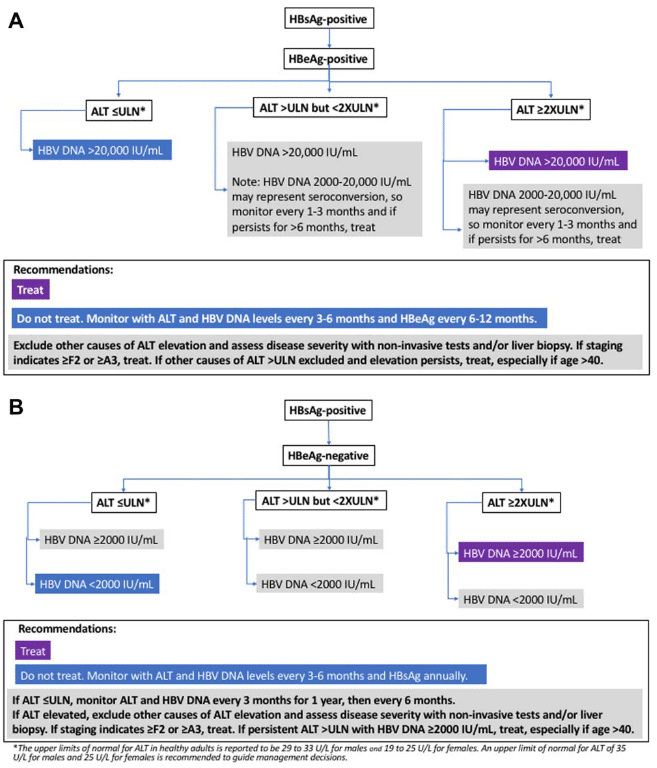 Препарат демонстрировал дозозависимое подавление экспрессии HBsAg. После однократного введения 2 мг/кг ARC-520 наблюдалось снижение уровня HBsAg до 50% на протяжении 43—57 дней. При этом частота нежелательных явлений не отличалась от таковой при применении плацебо [37]. Препарат ARB-1467 («Arbutus Biopharma», II фаза КИ) включает 3 миРНК, комплементарные фрагментам S и X генов HBV, которые заключены в липидные наночастицы. При внутривенном введении 1 раз в неделю в исследованиях дает синергетический эффект при комбинации с энтекавиром или AB-423. Эта же компания выводит во II фазу КИ свой препарат второго поколения ARB-1740, демонстрирующий в 10 раз более высокую активность по сравнению с ARB-1467 [38]. На I/II стадии КИ находится препарат компании «Alnylam ALN-HBV», который представляет собой миРНК, конъюгированную с N-ацетилгалактозамином и нацеленную на высококонсервативный фрагмент X гена HBV. Особая форма конъюгата с повышенной стабильностью позволяет вводить препарат подкожно 1 раз в месяц и добиваться высокой терапевтической эффективности [39].
Препарат демонстрировал дозозависимое подавление экспрессии HBsAg. После однократного введения 2 мг/кг ARC-520 наблюдалось снижение уровня HBsAg до 50% на протяжении 43—57 дней. При этом частота нежелательных явлений не отличалась от таковой при применении плацебо [37]. Препарат ARB-1467 («Arbutus Biopharma», II фаза КИ) включает 3 миРНК, комплементарные фрагментам S и X генов HBV, которые заключены в липидные наночастицы. При внутривенном введении 1 раз в неделю в исследованиях дает синергетический эффект при комбинации с энтекавиром или AB-423. Эта же компания выводит во II фазу КИ свой препарат второго поколения ARB-1740, демонстрирующий в 10 раз более высокую активность по сравнению с ARB-1467 [38]. На I/II стадии КИ находится препарат компании «Alnylam ALN-HBV», который представляет собой миРНК, конъюгированную с N-ацетилгалактозамином и нацеленную на высококонсервативный фрагмент X гена HBV. Особая форма конъюгата с повышенной стабильностью позволяет вводить препарат подкожно 1 раз в месяц и добиваться высокой терапевтической эффективности [39].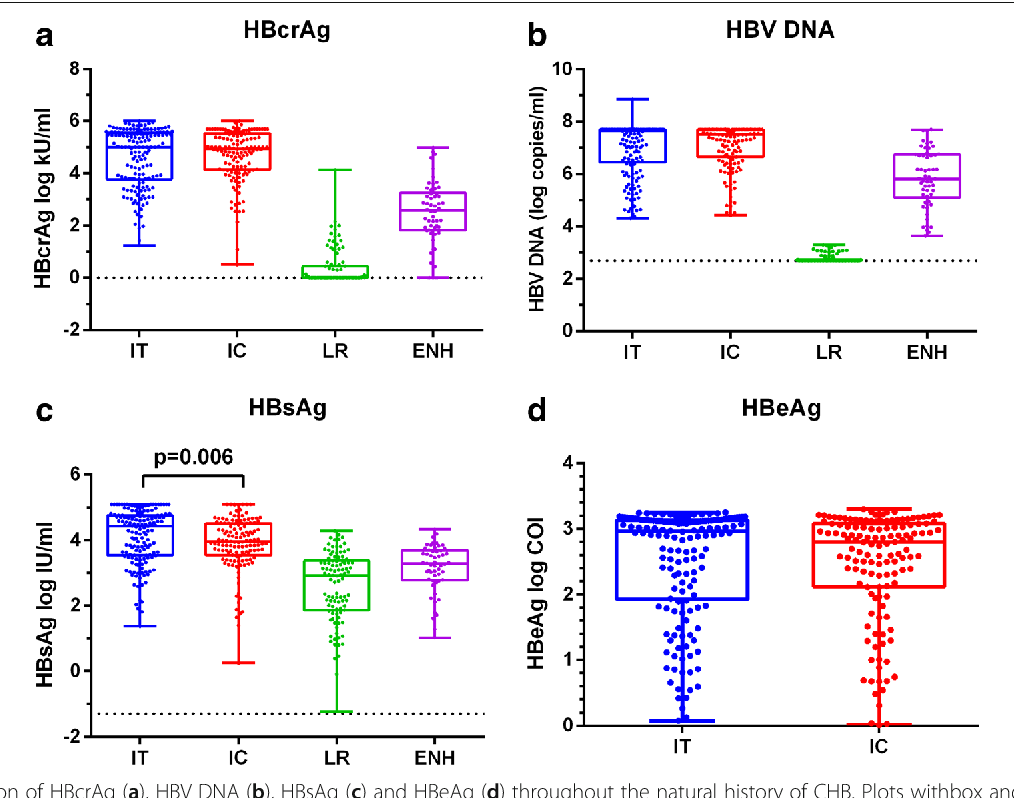 Несомненными достоинствами подхода на основе миРНК являются его универсальность, возможность быстрой адаптации к новым вариантам вируса, разработки препаратов пролонгированного действия, а также механизм действия, основанный на подавлении экспрессии генов. Из недостатков следует упомянуть инъекционный способ введения и чувствительность к мутациям в геноме вируса. Кроме того, в ряде работ показано, что при использовании миРНК возможны такие нежелательные эффекты, как неспецифическая активация иммунной системы, связывание с нецелевой мРНК, нарушение процессинга микроРНК в клетке и нарушение посттранскрипционной регуляции генов. Поэтому вопрос безопасности использования технологии РНК-интерференции остается весьма актуальным. Экспериментальные методы лечения ХГВ: иммуномодулирующая терапия.Усиление иммунного ответа. Хорошо известно, что патогенез ХГВ определяется иммунными механизмами. Слабовыраженный Т-клеточный ответ на этапе острой инфекции играет решающую роль в развитии хронического процесса.
Несомненными достоинствами подхода на основе миРНК являются его универсальность, возможность быстрой адаптации к новым вариантам вируса, разработки препаратов пролонгированного действия, а также механизм действия, основанный на подавлении экспрессии генов. Из недостатков следует упомянуть инъекционный способ введения и чувствительность к мутациям в геноме вируса. Кроме того, в ряде работ показано, что при использовании миРНК возможны такие нежелательные эффекты, как неспецифическая активация иммунной системы, связывание с нецелевой мРНК, нарушение процессинга микроРНК в клетке и нарушение посттранскрипционной регуляции генов. Поэтому вопрос безопасности использования технологии РНК-интерференции остается весьма актуальным. Экспериментальные методы лечения ХГВ: иммуномодулирующая терапия.Усиление иммунного ответа. Хорошо известно, что патогенез ХГВ определяется иммунными механизмами. Слабовыраженный Т-клеточный ответ на этапе острой инфекции играет решающую роль в развитии хронического процесса. Повреждение гепатоцитов при ХГВ опосредовано иммунными реакциями. HBV обладает способностью подавлять врожденный и адаптивный иммунный ответ, используя различные тактики. По этим причинам иммуномодулирующие методы терапии играют важную роль в лечении ХГВ. Иммунный механизм разрушения ккзДНК HBV описан J. Lucifora и соавт. [40], которые в эксперименте показали, что индукция внутрипеченочного противовирусного иммунного ответа может вызывать стимуляцию нецитолитического расщепления ккзДНК в инфицированных гепатоцитах. Под воздействием высоких доз ИФН-α и агонистов LTβR происходило повышение уровня дезаминаз APOBEC3A и APOBEC3B, которые вызывали образование апуриновых/апиримидиновых сайтов (APС) в ккзДНК без повреждения ДНК генома клетки. APOBEC3A и APOBEC3B — одни из немногих факторов, которые могут напрямую действовать на ккзДНК. Они локализуются вместе с белком HBc и транспортируются в ядро, где дезаминируют матрицы ккзДНК. Дезаминазы способны взаимодействовать с одноцепочечной ДНК, таким образом, ккзДНК может быть подвержена действию дезаминаз только в транскрипционно активном состоянии.
Повреждение гепатоцитов при ХГВ опосредовано иммунными реакциями. HBV обладает способностью подавлять врожденный и адаптивный иммунный ответ, используя различные тактики. По этим причинам иммуномодулирующие методы терапии играют важную роль в лечении ХГВ. Иммунный механизм разрушения ккзДНК HBV описан J. Lucifora и соавт. [40], которые в эксперименте показали, что индукция внутрипеченочного противовирусного иммунного ответа может вызывать стимуляцию нецитолитического расщепления ккзДНК в инфицированных гепатоцитах. Под воздействием высоких доз ИФН-α и агонистов LTβR происходило повышение уровня дезаминаз APOBEC3A и APOBEC3B, которые вызывали образование апуриновых/апиримидиновых сайтов (APС) в ккзДНК без повреждения ДНК генома клетки. APOBEC3A и APOBEC3B — одни из немногих факторов, которые могут напрямую действовать на ккзДНК. Они локализуются вместе с белком HBc и транспортируются в ядро, где дезаминируют матрицы ккзДНК. Дезаминазы способны взаимодействовать с одноцепочечной ДНК, таким образом, ккзДНК может быть подвержена действию дезаминаз только в транскрипционно активном состоянии.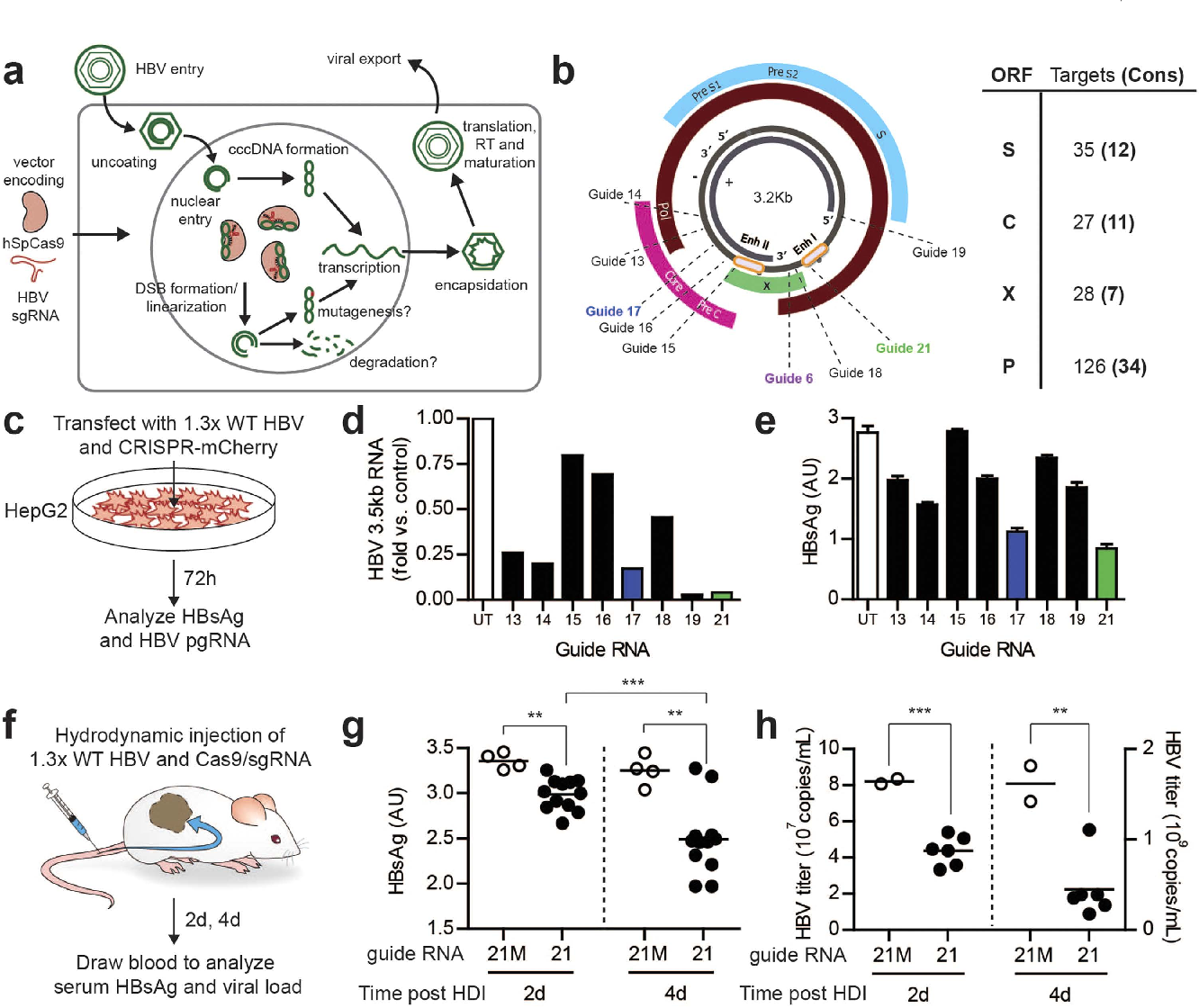 При действии дезаминаз происходит замена гуанина на урацил, который распознается гликозилазами клетки и отщепляется с образованием APС. Они в свою очередь расщепляются эндонуклеазами, что приводит к деградации молекул ккзДНК. Почему происходит расщепление ккзДНК, а не ее репарация, пока неясно, однако авторы высказали предположение, что количество APС оказывается слишком велико, и репарационные механизмы не способны справиться с таким количеством повреждений. Использование препаратов, индуцирующих действие дезаминаз APOBEC, в комбинации с другими антивирусными агентами может стать эффективным терапевтическим подходом для лечения ХГВ. Агонисты LTβR активны даже при использовании в низких дозах в отличие от ИФН-α и не оказывают токсического действия на клетки in vivo и in vitro [40]. Семейство Toll-подобных рецепторов (TLR) — важнейший регулятор обеих ветвей иммунитета, который активируется в ответ на внедрение широкого спектра патогенов [41]. Стимуляция TLR патогеном приводит к экспрессии многих генов, таких как ко-стимулирующие молекулы и провоспалительные цитокины [42].
При действии дезаминаз происходит замена гуанина на урацил, который распознается гликозилазами клетки и отщепляется с образованием APС. Они в свою очередь расщепляются эндонуклеазами, что приводит к деградации молекул ккзДНК. Почему происходит расщепление ккзДНК, а не ее репарация, пока неясно, однако авторы высказали предположение, что количество APС оказывается слишком велико, и репарационные механизмы не способны справиться с таким количеством повреждений. Использование препаратов, индуцирующих действие дезаминаз APOBEC, в комбинации с другими антивирусными агентами может стать эффективным терапевтическим подходом для лечения ХГВ. Агонисты LTβR активны даже при использовании в низких дозах в отличие от ИФН-α и не оказывают токсического действия на клетки in vivo и in vitro [40]. Семейство Toll-подобных рецепторов (TLR) — важнейший регулятор обеих ветвей иммунитета, который активируется в ответ на внедрение широкого спектра патогенов [41]. Стимуляция TLR патогеном приводит к экспрессии многих генов, таких как ко-стимулирующие молекулы и провоспалительные цитокины [42].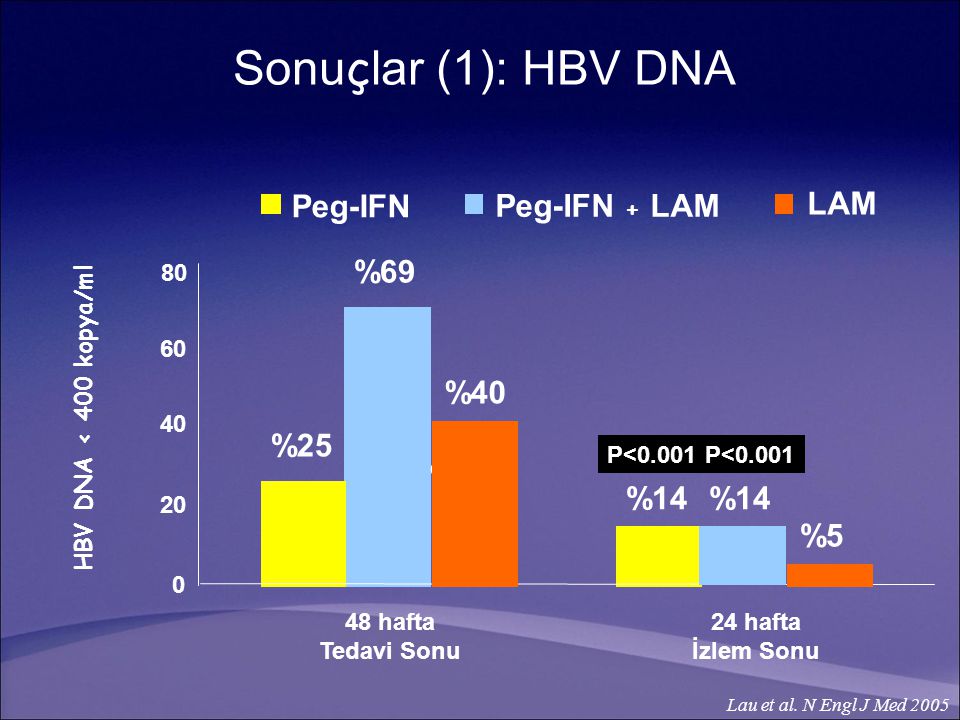 Выяснилось, что экспрессия TLR на гепатоцитах понижает уровень продукции HBV [43]. Это свидетельствует, что активация иммунного ответа, опосредованная TLR, может контролировать инфекцию HBV. Препарат GS-9620 («Gilead Sciences», II фаза КИ), селективный агонист TLR7, снижает уровень ДНК HBV у шимпанзе с хронической инфекцией HBV [44]. В I фазе КИ показана безопасность препарата у 75 здоровых волонтеров, а также его способность активировать экспрессию генов, стимулированных ИФН, у пациентов с ХГВ [45]. Ингибиторы контрольных точек иммунного ответа. Контрольные точки иммунного ответа, или иммунные контрольные точки (ИКТ, англ.: immune checkpoints) — семейство молекул, которые стимулируют или подавляют реакции клеточного иммунитета. Они играют ключевую роль в поддержании гомеостаза иммунной системы и предотвращении аутоиммунного ответа. Одной из ингибирующих ИКТ является рецептор программированной смерти клеток PD-1, который способен инактивировать клетки иммунной системы при взаимодействии со своими лигандами PD-L.
Выяснилось, что экспрессия TLR на гепатоцитах понижает уровень продукции HBV [43]. Это свидетельствует, что активация иммунного ответа, опосредованная TLR, может контролировать инфекцию HBV. Препарат GS-9620 («Gilead Sciences», II фаза КИ), селективный агонист TLR7, снижает уровень ДНК HBV у шимпанзе с хронической инфекцией HBV [44]. В I фазе КИ показана безопасность препарата у 75 здоровых волонтеров, а также его способность активировать экспрессию генов, стимулированных ИФН, у пациентов с ХГВ [45]. Ингибиторы контрольных точек иммунного ответа. Контрольные точки иммунного ответа, или иммунные контрольные точки (ИКТ, англ.: immune checkpoints) — семейство молекул, которые стимулируют или подавляют реакции клеточного иммунитета. Они играют ключевую роль в поддержании гомеостаза иммунной системы и предотвращении аутоиммунного ответа. Одной из ингибирующих ИКТ является рецептор программированной смерти клеток PD-1, который способен инактивировать клетки иммунной системы при взаимодействии со своими лигандами PD-L. У пациентов с ХГВ наблюдали повышение экспрессии PD-1 на T-клетках CD8 (+) [46]. Блокирование PD-1 увеличивает пролиферацию Т-клеток CD8 (+) и продукцию ИФН-γ в лимфоцитах [47]. Таким образом, блокирование ингибирующих ИКТ может усилить противовирусный иммунный ответ. Эффективность подобного подхода уже доказана, и он используется в практике при лечении ряда онкологических заболеваний. Комбинация новых иммуномодулирующих агентов с прямыми противовирусными препаратами может стать перспективным подходом к лечению больных ХГВ. Заключение Хронические гепатиты В и С как в мире, так и в России являются главными причинами цирроза и рака печени, смертность от которых ежегодно возрастает. Благодаря бурному развитию биомедицинской науки и новых технологий разработки лекарственных средств, всего за несколько лет создано более десятка высокоэффективных противовирусных препаратов, которые не оставили шанса вирусному гепатиту С — в настоящее время это заболевание полностью излечимо. Излечение от гепатита В — значительно более трудная задача, однако результаты современных исследований позволяют надеяться на успех.
У пациентов с ХГВ наблюдали повышение экспрессии PD-1 на T-клетках CD8 (+) [46]. Блокирование PD-1 увеличивает пролиферацию Т-клеток CD8 (+) и продукцию ИФН-γ в лимфоцитах [47]. Таким образом, блокирование ингибирующих ИКТ может усилить противовирусный иммунный ответ. Эффективность подобного подхода уже доказана, и он используется в практике при лечении ряда онкологических заболеваний. Комбинация новых иммуномодулирующих агентов с прямыми противовирусными препаратами может стать перспективным подходом к лечению больных ХГВ. Заключение Хронические гепатиты В и С как в мире, так и в России являются главными причинами цирроза и рака печени, смертность от которых ежегодно возрастает. Благодаря бурному развитию биомедицинской науки и новых технологий разработки лекарственных средств, всего за несколько лет создано более десятка высокоэффективных противовирусных препаратов, которые не оставили шанса вирусному гепатиту С — в настоящее время это заболевание полностью излечимо. Излечение от гепатита В — значительно более трудная задача, однако результаты современных исследований позволяют надеяться на успех. Ключевой мишенью в жизненном цикле HBV является ккзДНК, элиминация которой будет означать полное излечение от инфекции. Среди новых групп лекарственных препаратов, находящихся на разных стадиях разработки, каждая обладает рядом достоинств и недостатков. Показавшие высокую эффективность и хорошую переносимость ингибиторы связывания HBV с рецептором NTCP позволяют предотвращать проникновение вируса в неинфицированные клетки, но не воздействуют на ккзДНК. При прекращении приема этих препаратов происходит реактивация ХГС. Ингибиторы синтеза ккзДНК снижают образование ккзДНК de novo, однако ранее накопленные матрицы продолжают персистировать в клетках печени. Ингибиторы сборки нуклеокапсида не только подавляют сборку вирионов, но и действуют на неканонические функции сore-белка HBV. Тем самым негативное влияние HBV на организм снижается в большей степени. Технология РНК-интерференции не просто прерывает цикл HBV, но полностью останавливает образование вирусных белков — НВх, НВs и НВс, с которыми связана трансформация клеток и развитие гепатоцеллюлярной карциномы.
Ключевой мишенью в жизненном цикле HBV является ккзДНК, элиминация которой будет означать полное излечение от инфекции. Среди новых групп лекарственных препаратов, находящихся на разных стадиях разработки, каждая обладает рядом достоинств и недостатков. Показавшие высокую эффективность и хорошую переносимость ингибиторы связывания HBV с рецептором NTCP позволяют предотвращать проникновение вируса в неинфицированные клетки, но не воздействуют на ккзДНК. При прекращении приема этих препаратов происходит реактивация ХГС. Ингибиторы синтеза ккзДНК снижают образование ккзДНК de novo, однако ранее накопленные матрицы продолжают персистировать в клетках печени. Ингибиторы сборки нуклеокапсида не только подавляют сборку вирионов, но и действуют на неканонические функции сore-белка HBV. Тем самым негативное влияние HBV на организм снижается в большей степени. Технология РНК-интерференции не просто прерывает цикл HBV, но полностью останавливает образование вирусных белков — НВх, НВs и НВс, с которыми связана трансформация клеток и развитие гепатоцеллюлярной карциномы. Препараты, усиливающие иммунный ответ, и ингибиторы ИКТ в целом эффективны, однако как терапевтический подход могут быть использованы только в комбинации с препаратами прямого действия. Одна общая особенность каждой из перечисленных групп состоит в том, что они не действуют на ккзДНК HBV и позволяют достичь в лучшем случае «функционального» излечения. Персистирующие ккзДНК сохраняются в клетке, и прекращение приема препаратов почти всегда приводит к реактивации инфекции. По мнению авторов, технологии сайт-специфичес-кого расщепления ккзДНК — наиболее перспективная в настоящее время стратегия, на основе которой могут быть созданы подходы, позволяющие добиться полного излечения от ХГВ. Системы нуклеаз пока находятся на ранних этапах разработки и еще многое предстоит сделать для доказательства их эффективности и безопасности, но обнадеживающие результаты последних исследований не оставляют сомнений в том, что уже в недалеком будущем CRISPR/Cas и аналогичные технологии могут стать основой терапии ХГВ.
Препараты, усиливающие иммунный ответ, и ингибиторы ИКТ в целом эффективны, однако как терапевтический подход могут быть использованы только в комбинации с препаратами прямого действия. Одна общая особенность каждой из перечисленных групп состоит в том, что они не действуют на ккзДНК HBV и позволяют достичь в лучшем случае «функционального» излечения. Персистирующие ккзДНК сохраняются в клетке, и прекращение приема препаратов почти всегда приводит к реактивации инфекции. По мнению авторов, технологии сайт-специфичес-кого расщепления ккзДНК — наиболее перспективная в настоящее время стратегия, на основе которой могут быть созданы подходы, позволяющие добиться полного излечения от ХГВ. Системы нуклеаз пока находятся на ранних этапах разработки и еще многое предстоит сделать для доказательства их эффективности и безопасности, но обнадеживающие результаты последних исследований не оставляют сомнений в том, что уже в недалеком будущем CRISPR/Cas и аналогичные технологии могут стать основой терапии ХГВ.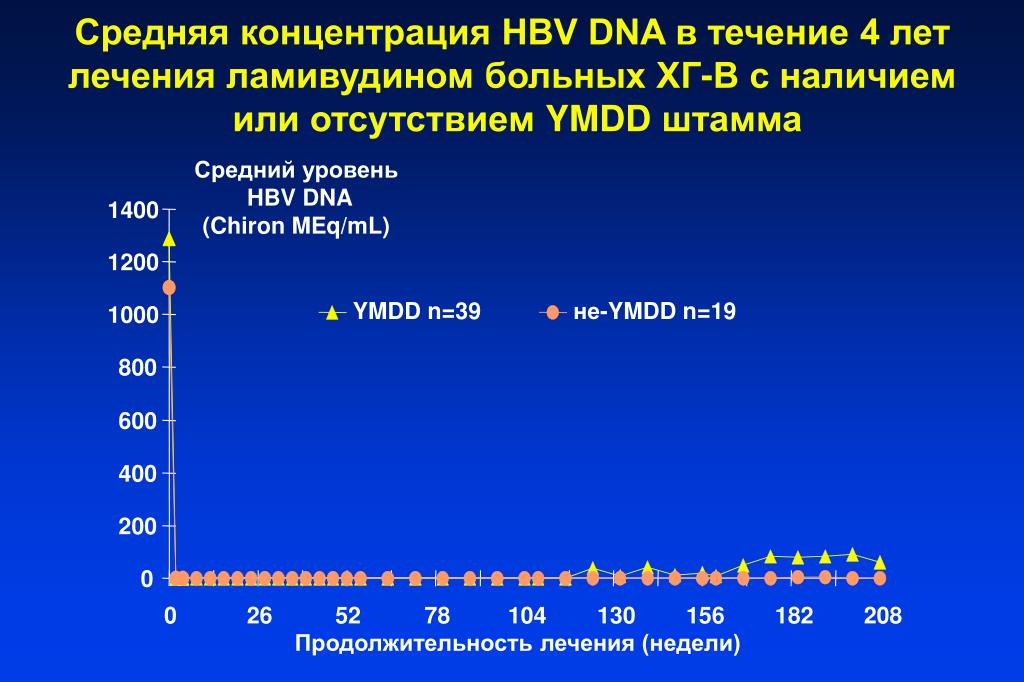 Авторы заявляют об отсутствии конфликта интересов. Работа выполнена при поддержке гранта РНФ № 16−15−10426.
Авторы заявляют об отсутствии конфликта интересов. Работа выполнена при поддержке гранта РНФ № 16−15−10426.
- Global Hepatitis Report 2017. Geneva: World Health Organization; 2017.
- Falade-Nwulia O, Suarez-Cuervo C, Nelson DR, Fried MW, Segal JB, Sulkowski MS. Oral Direct-Acting Agent Therapy for Hepatitis C Virus Infection: A Systematic Review. Ann Intern Med. 2017;166(9):637-648. https://doi.org/10.7326/M16-2575
- Bremer C, Glebe D. The Molecular Virology of Hepatitis B Virus. Seminars in Liver Disease. 2013;33(02):103-112. https://doi.org/10.1055/s-0033-1345717
- Habig J, Loeb D. Template Switches during Plus-Strand DNA Synthesis of Duck Hepatitis B Virus Are Influenced by the Base Composition of the Minus-Strand Terminal Redundancy. Journal of Virology. 2003;77(23):12412-12420. https://doi.org/10.1128/jvi.
 77.23.12412-12420.2003
77.23.12412-12420.2003 - Yang H, Kao J. Persistence of hepatitis B virus covalently closed circular DNA in hepatocytes: molecular mechanisms and clinical significance. Emerging Microbes & Infections. 2014;3(9):e64. https://doi.org/10.1038/emi.2014.64
- Zoulim F. New insight on hepatitis B virus persistence from the study of intrahepatic viral cccDNA. Journal of Hepatology. 2005;42(3):302-308. https://doi.org/10.1016/j.jhep.2004.12.015
- Block T, Guo J. The Covalently Closed Circular Form of Hepatitis B Virus Genome: Is There Now an End in «Site»? Gastroenterology. 2016;150(1):34-36. https://doi.org/10.1053/j.gastro.2015.11.032
- Pollicino T, Belloni L, Raffa G et al. Hepatitis B Virus Replication Is Regulated by the Acetylation Status of Hepatitis B Virus cccDNA-Bound h4 and h5 Histones. Gastroenterology. 2006;130(3):823-837. https://doi.org/10.1053/j.gastro.2006.01.001
- Bock C, Schwinn S, Locarnini S et al.
 Structural organization of the hepatitis B virus minichromosome. Journal of Molecular Biology. 2001;307(1):183-196. https://doi.org/10.1006/jmbi.2000.4481
Structural organization of the hepatitis B virus minichromosome. Journal of Molecular Biology. 2001;307(1):183-196. https://doi.org/10.1006/jmbi.2000.4481 - Nassal M. HBV cccDNA: viral persistence reservoir and key obstacle for a cure of chronic hepatitis B. Gut. 2015;64(12):1972-1984. https://doi.org/10.1136/gutjnl-2015-309809
- Vierling J. The Immunology of Hepatitis B. Clinics in Liver Disease. 2007;11(4):727-759. https://doi.org/10.1016/j.cld.2007.08.001
- Busca A, Kumar A. Innate immune responses in hepatitis B virus (HBV) infection. Virology Journal. 2014;11(1):22. https://doi.org/10.1186/1743-422x-11-22
- Chisari F, Isogawa M, Wieland. S. Pathogenesis of hepatitis B virus infection. Pathologie Biologie. 2010;58(4):258-266. https://doi.org/10.1016/j.patbio.2009.11.001
- European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection.
 J Hepatol. 2017;67(2):370-398. https://doi.org/10.1016/j.jhep.2017.03.021
J Hepatol. 2017;67(2):370-398. https://doi.org/10.1016/j.jhep.2017.03.021 - Wang J, Shen T, Huang X et al. Serum hepatitis B virus RNA is encapsidated pregenome RNA that may be associated with persistence of viral infection and rebound. Journal of Hepatology. 2016;65(4):700-710. https://doi.org/10.1016/j.jhep.2016.05.029
- Liu S, Seto W, Lai C, Yuen M. Hepatitis B: treatment choice and monitoring for response and resistance. Expert Review of Gastroenterology & Hepatology. 2016;10(6):697-707. https://doi.org/10.1586/17474124.2016.1145547
- Wang Y-C, Yang S-S, Su C-W, et al. Predictors of response to pegylated interferon in chronic hepatitis B: a real-world hospital-based analysis. Scientific Reports. 2016;6:29605. https://doi.org/10.1038/srep29605
- Yan H, Li W. Sodium Taurocholate Cotransporting Polypeptide Acts as a Receptor for Hepatitis B and D Virus. Digestive Diseases. 2015;33(3):388-396.
 https://doi.org/10.1159/000371692
https://doi.org/10.1159/000371692 - Volz T, Allweiss L, ḾBarek M et al. The entry inhibitor Myrcludex-B efficiently blocks intrahepatic virus spreading in humanized mice previously infected with hepatitis B virus. Journal of Hepatology. 2013;58(5):861-867. https://doi.org/10.1016/j.jhep.2012.12.008
- Rizzo T, Urban S. Myrcludex B Therapy Reduced HBV DNA and HDV RNA in Phase 2a Clinical Trial. MD Conference Express. 2014;14(48):19-20. https://doi.org/10.1177/155989771448014
- Cai D, Mills C, Yu W et al. Identification of Disubstituted Sulfonamide Compounds as Specific Inhibitors of Hepatitis B Virus Covalently Closed Circular DNA Formation. Antimicrobial Agents and Chemotherapy. 2012;56(8):4277-4288. https://doi.org/10.1128/aac.00473-12
- Allweiss L, Dandri M. The Role of cccDNA in HBV Maintenance. Viruses. 2017;9(6):156. https://doi.org/10.3390/v9060156
- Kennedy E, Bassit L, Mueller H et al.
 Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease. Virology. 2015;476: 196-205. https://doi.org/10.1016/j.virol.2014.12.001
Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease. Virology. 2015;476: 196-205. https://doi.org/10.1016/j.virol.2014.12.001 - Dong C, Qu L, Wang H, Wei L, Dong Y, Xiong S. Targeting hepatitis B virus cccDNA by CRISPR/Cas9 nuclease efficiently inhibits viral replication. Antiviral Research. 2015;118:110-117. https://doi.org/10.1016/j.antiviral.2015.03.015
- Seeger C, Sohn J. Targeting Hepatitis B Virus With CRISPR/Cas9. Molecular Therapy — Nucleic Acids. 2014;3:e216. https://doi.org/10.1038/mtna.2014.68
- Lin S, Yang H, Kuo Y et al. The CRISPR/Cas9 System Facilitates Clearance of the Intrahepatic HBV Templates In Vivo. Molecular Therapy — Nucleic Acids. 2014;3:e186. https://doi.org/10.1038/mtna.2014.38
- Wang J. Dual gRNAs guided CRISPR/Cas9 system inhibits hepatitis B virus replication. World Journal of Gastroenterology.
 2015;21(32):9554. https://doi.org/10.3748/wjg.v21.i32.9554
2015;21(32):9554. https://doi.org/10.3748/wjg.v21.i32.9554 - Zhen S, Hua L, Liu Y et al. Harnessing the clustered regularly interspaced short palindromic repeat (CRISPR)/CRISPR-associated Cas9 system to disrupt the hepatitis B virus. Gene Therapy. 2015;22(5):404-412. https://doi.org/10.1038/gt.2015.2
- Liu X, Chen Y, Guo D, Chen S, Hao R. Inhibition of hepatitis B virus by the CRISPR/Cas9 system via targeting the conserved regions of the viral genome. Journal of General Virology. 2015;96(8):2252-2261. https://doi.org/10.1099/vir.0.000159
- Ramanan V, Shlomai A, Cox D et al. CRISPR/Cas9 cleavage of viral DNA efficiently suppresses hepatitis B virus. Scientific Reports. 2015;5(1). https://doi.org/10.1038/srep10833
- Karimova M, Beschorner N, Dammermann W et al. CRISPR/Cas9 nickase-mediated disruption of hepatitis B virus open reading frame S and X. Scientific Reports. 2015;5(1). https://doi.
 org/10.1038/srep13734
org/10.1038/srep13734 - Yuen M.-F., Kim D.J., Weilert F. et al. NVR 3-778, a First-in-Class HBV Core Inhibitor, Alone and in Combination with Peg-Interferon (PegIFN), in Treatment-Naive HBeAg-Positive Patients: Early Reductions in HBV DNA and HBeAg. Journal of Hepatology. 2016;64(2):S210-S211. https://doi.org/10.1016/S0168-8278(16)00175-6
- Ren Q, Liu X, Luo Z, Li J, Wang C, Goldmann S, Zhang J, Zhang Y. Discovery of hepatitis B virus capsid assembly inhibitors leading to a heteroaryldihydropyrimidine based clinical candidate (GLS4). Bioorg Med Chem. 2017;25(3):1042-1056. https://doi.org/10.1016/j.bmc.2016.12.017
- Huang Q, Mercier A, Zong Y et al. Preclinical Characterization of Potent Core Protein Assembly Modulators for the Treatment of Chronic Hepatitis B. Journal of Hepatology. 2017;64(2):S584. https://doi.org/10.1016/S0168-8278(16)01072-2
- Mani N, Cole AG, Ardzinski A et al. The HBV capsid inhibitor AB-423 exhibits a dual mode of action and displays additive/synergistic effects in in vitro combination studies.
 Hepatology. 2016; 64(1 Suppl):123A-124A. https://doi.org/10.1002/hep.28796
Hepatology. 2016; 64(1 Suppl):123A-124A. https://doi.org/10.1002/hep.28796 - Yang H, Kao J. Viral hepatitis: HBV cure — can we pin our hopes on immunotherapy? Nature Reviews Gastroenterology & Hepatology. 2015;12(3):129-131. https://doi.org/10.1038/nrgastro.2015.8
- Gish R, Yuen M, Chan H et al. Synthetic RNAi triggers and their use in chronic hepatitis B therapies with curative intent. Antiviral Research. 2015;121:97-108. https://doi.org/10.1016/j.antiviral.2015.06.019
- Thi EP, Ye X, Dhillon AP et al. Development of Second Generation RNA Interference Therapy for Hepatitis B Virus Infection. Hepatology. 2016;64(1,Suppl):922A. https://doi.org/10.1002/hep.28800
- Sepp-Lorenzino L, Sprague AG, Mayo T et al. GalNAc-siRNA conjugate ALN-HBV targets a highly conserved, pan-genotypic X-orf viral site and mediates profound and durable HBsAg silencing in vitro and in vivo. Hepatology. 2015;6(1?Suppl):224A-225A.
 https://doi.org/10.1002/hep.28171
https://doi.org/10.1002/hep.28171 - Lucifora J, Xia Y, Reisinger F. et al. Specific and nonhepatotoxic degradation of nuclear hepatitis B virus cccDNA. Science. 2014;343:1221-1228. https://doi.org/10.1126/science.1243462
- Aderem A, Ulevitch R. Toll-like receptors in the induction of the innate immune response. Nature. 2000;406(6797):782-787. https://doi.org/10.1038/35021228
- Takeda K. Toll-like receptors in innate immunity. International Immunology. 2004;17(1):1-14. https://doi.org/10.1093/intimm/dxh286
- Funk E, Kottilil S, Gilliam B, Talwani R. Tickling the TLR7 to cure viral hepatitis. Journal of Translational Medicine. 2014;12(1):129. https://doi.org/10.1186/1479-5876-12-129
- Lanford R, Guerra B, Chavez D et al. GS-9620, an Oral Agonist of Toll-Like Receptor-7, Induces Prolonged Suppression of Hepatitis B Virus in Chronically Infected Chimpanzees. Gastroenterology.
 2013;144(7):1508-1517.e10. https://doi.org/10.1053/j.gastro.2013.02.003
2013;144(7):1508-1517.e10. https://doi.org/10.1053/j.gastro.2013.02.003 - Gane E, Lim Y, Gordon S et al. The oral toll-like receptor-7 agonist GS-9620 in patients with chronic hepatitis B virus infection. Journal of Hepatology. 2015;63(2):320-328. https://doi.org/10.1016/j.jhep.2015.02.037.
- Peng G, Luo B, Li J et al. Hepatitis B e-antigen Persistency is Associated with the Properties of HBV-Specific CD8 T Cells in CHB Patients. Journal of Clinical Immunology. 2010;31(2):195-204. https://doi.org/10.1007/s10875-010-9483-5
- Bengsch B, Martin B, Thimme R. Restoration of HBV-specific CD8+ T cell function by PD-1 blockade in inactive carrier patients is linked to T cell differentiation. Journal of Hepatology. 2014;61(6):1212-1219. https://doi.org/10.1016/j.jhep.2014.07.005
Views
Abstract — 309
PDF (Russian) — 21
Cited-By
Article Metrics
PlumX
Dimensions
Refbacks
- There are currently no refbacks.

уровень ДНК HBV может предсказать значительный фиброз печени у HBeAg-отрицательных пациентов с хроническим гепатитом B с показанием для биопсии | BMC Gastroenterology
Lok AS, McMahon BJ: Хронический гепатит B: обновление 2009 г. Гепатология. 2009, 50 (3): 661-662. 10.1002 / hep.23190.
Артикул
PubMed
Google ученый
Европейская ассоциация по изучению печени: Руководство EASL по клинической практике: ведение хронической инфекции вируса гепатита В.J Hepatol. 2012, 57: 167-185.
Артикул
Google ученый
Liaw YF, Kao JH, Piratvisuth T, Chan HL, Chien RN, Liu CJ, Gane E, Locarnini S, Lim SG, Han KH, Amarapurkar D, Cooksley G, Jafri W, Mohamed R, Hou JL , Chuang WL, Lesmana LA, Sollano JD, Suh DJ, Omata M: Азиатско-Тихоокеанский консенсус по ведению хронического гепатита B: обновление 2012 года. Hepatol Int. 2012, 6: 531-561. 10.1007 / s12072-012-9365-4.
Hepatol Int. 2012, 6: 531-561. 10.1007 / s12072-012-9365-4.
Артикул
PubMed
Google ученый
Rockey DC, Caldwell SH, Goodman ZD, Nelson RC, Smith AD: Американская ассоциация по изучению заболеваний печени: биопсия печени. Гепатология. 2009, 49 (3): 1017-1044. 10.1002 / hep.22742.
Артикул
PubMed
Google ученый
Castera L: Гепатит B: надежны ли неинвазивные маркеры фиброза печени ?. Liver Int. 2014, 34 ((Дополнение 1)): 91-96. 10.1111 / liv.12393.
CAS
Статья
PubMed
Google ученый
Тайская ассоциация по изучению печени: Практическое руководство Таиланда по лечению хронического гепатита B .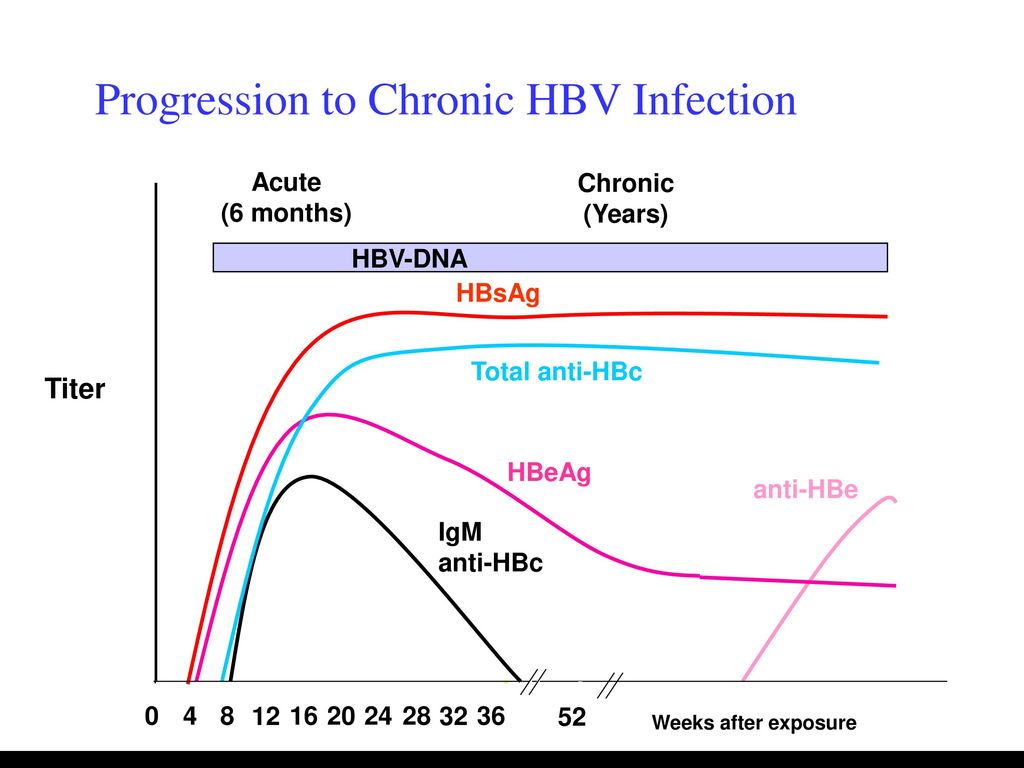 2012. http://www.thasl.org/files/24.HBV_and_HCV_Guideline_2012(update).pdf.
2012. http://www.thasl.org/files/24.HBV_and_HCV_Guideline_2012(update).pdf.
Su TH, Hsu CS, Chen CL, Liu CH, Huang YW, Tseng TC, Liu CJ, Chen PJ, Lai MY, Chen DS, Kao JH: концентрация поверхностного антигена гепатита B в сыворотке коррелирует с уровнем ДНК HBV у пациентов с хроническим гепатитом B. Antivir Ther. 2010, 15: 1133-1139. 10.3851 / IMP1696.
CAS
Статья
PubMed
Google ученый
Tseng TC, Liu CJ, Su TH, Wang CC, Chen CL, Chen PJ, Chen DS, Kao JH: Уровни поверхностного антигена гепатита B в сыворотке позволяют прогнозировать потерю поверхностного антигена сероконвертерами е-антигена гепатита B. Гастроэнтерология. 2011, 141: 517-525. 10.1053 / j.gastro.2011.04.046. 525.e1-2
CAS
Статья
PubMed
Google ученый
Sandrin L, Fourquet B, Hasquenoph JM, Yon S, Fournier C, Mal F, Christidis C, Ziol M, Poulet B, Kazemi F, Beaugrand M, Palau R: переходная эластография: новый неинвазивный метод для оценка фиброза печени.Ультразвук Med Biol. 2003, 29: 1705-1713. 10.1016 / j.ultrasmedbio.2003.07.001.
Артикул
PubMed
Google ученый
Guido M, Rugge M: Отбор образцов биопсии печени при хроническом вирусном гепатите. Semin Liver Dis. 2004, 24 (1): 89-97. 10.1055 / с-2004-823103.
Артикул
PubMed
Google ученый
Knodell RG, Ishak KG, Black WC, Chen TS, Craig R, Kaplowitz N, Kiernan TW, Wollman J: Формулировка и применение числовой балльной системы для оценки гистологической активности при бессимптомном хроническом активном гепатите.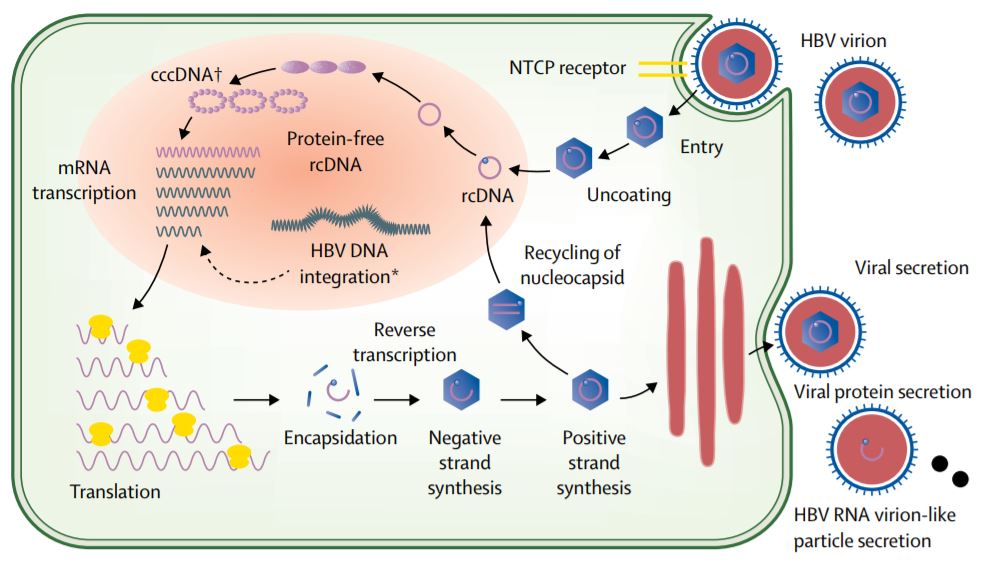 Гепатология. 1981, 1 (5): 431-435. 10.1002 / hep.1840010511.
Гепатология. 1981, 1 (5): 431-435. 10.1002 / hep.1840010511.
CAS
Статья
PubMed
Google ученый
Бедосса П., Пойнард Т.: Алгоритм оценки активности хронического гепатита С. Группа совместных исследований METAVIR. Гепатология. 1996, 24: 289-293. 10.1002 / hep.510240201.
CAS
Статья
PubMed
Google ученый
Croagh CM, Bell SJ, Slavin J, Kong YX, Chen RY, Locarnini S, Desmond PV: Увеличение вирусной нагрузки гепатита B связано с риском значительного фиброза печени у HBeAg-отрицательных, но не HBeAg-положительных хронических гепатит Б.Liver Int. 2010, 30 (8): 1115-1122. 10.1111 / j.1478-3231.2010.02267.x.
CAS
Статья
PubMed
Google ученый
Mohamadnejad M, Montazeri G, Fazlollahi A, Zamani F, Nasiri J, Nobakht H, Forouzanfar MH, Abedian S, Tavangar SM, Mohamadkhani A, Ghoujeghi F, Estakhri A, Farjadari N, Estakhri A, Nouri Zouri, , Малекзаде Р: Неинвазивные маркеры фиброза и воспаления печени при хроническом заболевании печени, вызванном вирусом гепатита В.Am J Gastroenterol. 2006, 101 (11): 2537-2545. 10.1111 / j.1572-0241.2006.00788.x.
Артикул
PubMed
Google ученый
Xiao L, Xian J, Li Y, Geng A, Yang X, Han L, Xu H: параметры, связанные со значительными гистологическими изменениями печени у пациентов с хроническим гепатитом B. ISRN Gastroenterol 2014, 2014:
Seto WK, Wnog DKH, Fung J, Ip PP, Yuen JC, Hung IF, Lai CL, Yuen MF: Высокие уровни поверхностного антигена b гепатита B предсказывают незначительный фиброз при хроническом гепатите B с положительным антигеном e. Б.PLoS One. 2012, 7 (8): e43087-10.1371 / journal.pone.0043087.
Б.PLoS One. 2012, 7 (8): e43087-10.1371 / journal.pone.0043087.
CAS
Статья
PubMed
PubMed Central
Google ученый
Фридрих-Руст М., Онг М.Ф., Мартенс С., Сарразин С., Боджунга Дж., Цеузем С., Херрманн Э.: Проведение временной эластографии для определения стадии фиброза печени: метаанализ. Гастроэнтерология. 2008, 134 (4): 960-974. 10.1053 / j.gastro.2008.01.034.
Артикул
PubMed
Google ученый
Tsochatzis EA, Gurusamy KS, Ntaoula S, Cholongitas E, Davidson BR, Burroughs AK: Эластография для диагностики тяжести фиброза при хроническом заболевании печени: метаанализ диагностической точности. J Hepatol. 2011, 54 (4): 650-659. 10.1016 / j.jhep.2010.07.033.
CAS
Статья
PubMed
Google ученый
Chon YE, Choi EH, Song KJ, Park JY, Kim Do Y, Han KH, Chon CY, Ahn SH, Kim SU: Проведение временной эластографии для определения стадии фиброза печени у пациентов с хроническим гепатитом B : метаанализ.PLoS One. 2012, 7 (9): e44930-10.1371 / journal.pone.0044930.
CAS
Статья
PubMed
PubMed Central
Google ученый
Degos F, Perez P, Roche B., Mahmoudi A, Asselineau J, Voitot H, Bedossa P: Диагностическая точность FibroScan и сравнение с биомаркерами фиброза печени при хроническом вирусном гепатите: многоцентровое проспективное исследование (исследование FIBROSTIC ). J Hepatol. 2010, 53 (6): 1013-1021. 10.1016 / j.jhep.2010.05.035.
Артикул
PubMed
Google ученый
Arena U, Vizzutti F, Corti G, Ambu S, Stasi C, Bresci S, Moscarella S, Boddi V, Petrarca A, Laffi G, Marra F, Pinzani M: измеренные показатели жесткости печени при остром вирусном гепатите методом транзиторной эластографии. Гепатология. 2008, 47 (2): 380-384. 10.1002 / hep.22007.
CAS
Статья
PubMed
Google ученый
Sagir A, Erhardt A, Schmitt M, Häussinger D: Транзиторная эластография ненадежна для выявления цирроза у пациентов с острым повреждением печени. Гепатология. 2008, 47 (2): 592-595. 10.1002 / hep.22056.
CAS
Статья
PubMed
Google ученый
Brunetto MR, Oliveri F, Colombatto P, Moriconi F, Ciccorossi P, Coco B, Romagnoli V, Cherubini B, Moscato G, Maina AM, Cavallone D, Bonino F: уровни поверхностного антигена гепатита B в сыворотке помогают отличить активных носителей вируса гепатита B генотипа D от неактивных.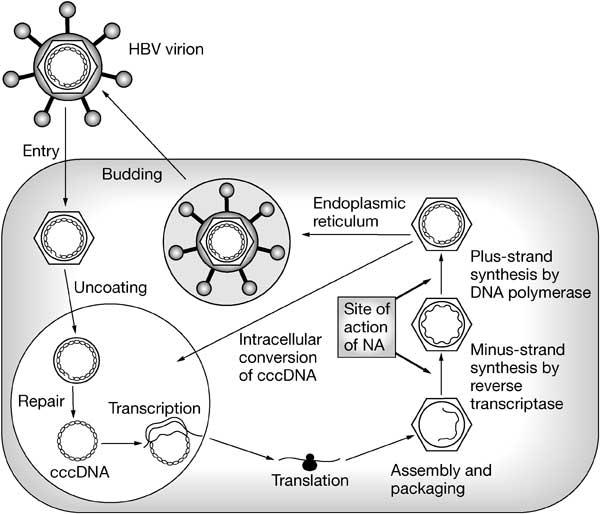 Гастроэнтерология. 2010, 139 (2): 483-490. 10.1053 / j.gastro.2010.04.052.
Гастроэнтерология. 2010, 139 (2): 483-490. 10.1053 / j.gastro.2010.04.052.
CAS
Статья
PubMed
Google ученый
Tseng TC, Liv CJ, Yang HC, Su TH, Wang CC, Chen CL, Kuo SF, Liu CH, Chen PJ, Chen DS, Kao JH: Высокий уровень поверхностного антигена гепатита B увеличивает риск гепатоцеллюлярной карцинома у пациентов с низкой нагрузкой HBV. Гастроэнтерология. 2012, 142 (5): 1140-1149. 10.1053 / j.gastro.2012.02.007.
CAS
Статья
PubMed
Google ученый
Tseng TC, Liu CJ, Yang HC, Su TH, Wang CC, Chen CL, Kuo SF, Liu CH, Chen PJ, Chen DS, Kao JH: детерминанты спонтанной потери поверхностного антигена у антиген-отрицательных пациентов с гепатитом B e с низкая вирусная нагрузка.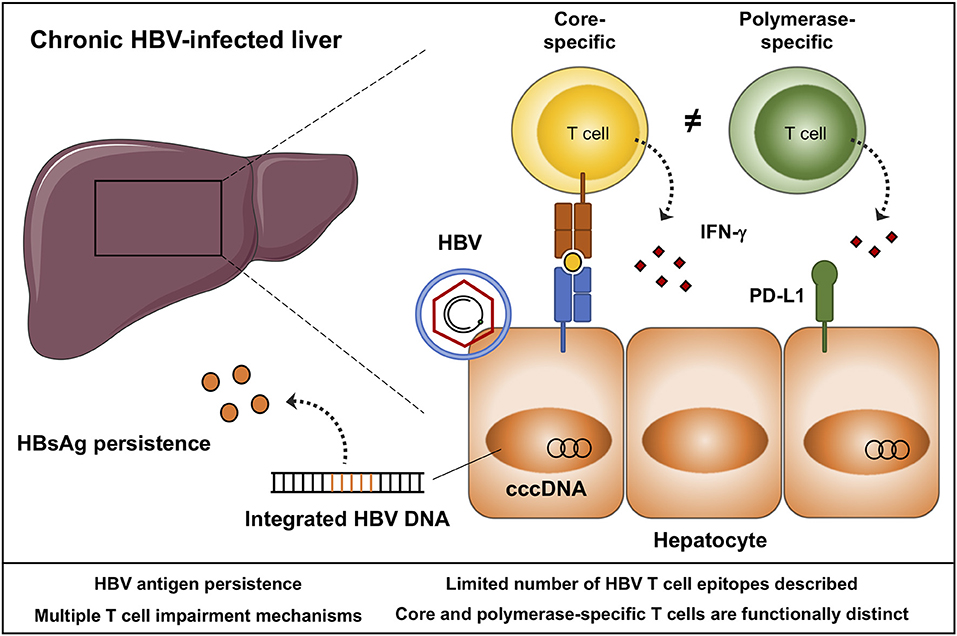 Гепатология. 2012, 55 (1): 68-76. 10.1002 / hep.24615.
Гепатология. 2012, 55 (1): 68-76. 10.1002 / hep.24615.
Артикул
PubMed
Google ученый
Guner R, Karahocagil M, Buyukberber M, Kandemir O, Ural O, Usluer G, Inan D, Koksal I, Baykam N, Hizel K, Yamazhan T., Esen S, Tasyaran MA: Корреляция между внутрипеченочным гепатитом B уровни cccDNA вируса и другие маркеры активности у пациентов с HBeAg-отрицательной хронической инфекцией гепатита B.Eur J Gastroenterol Hepatol. 2011, 23 (12): 1185-1191. 10.1097 / MEG.0b013e32834ba13a.
Артикул
PubMed
Google ученый
Martinot-Peignoux M, Carvalho RJ, Cardoso AC, Lapalus M, Lada O, Asselah T, Krause F, Marcellin P: значимая генотип-специфическая ассоциация уровня поверхностного антигена гепатита B и тяжести заболевания печени у пациентов при хроническом гепатите Б.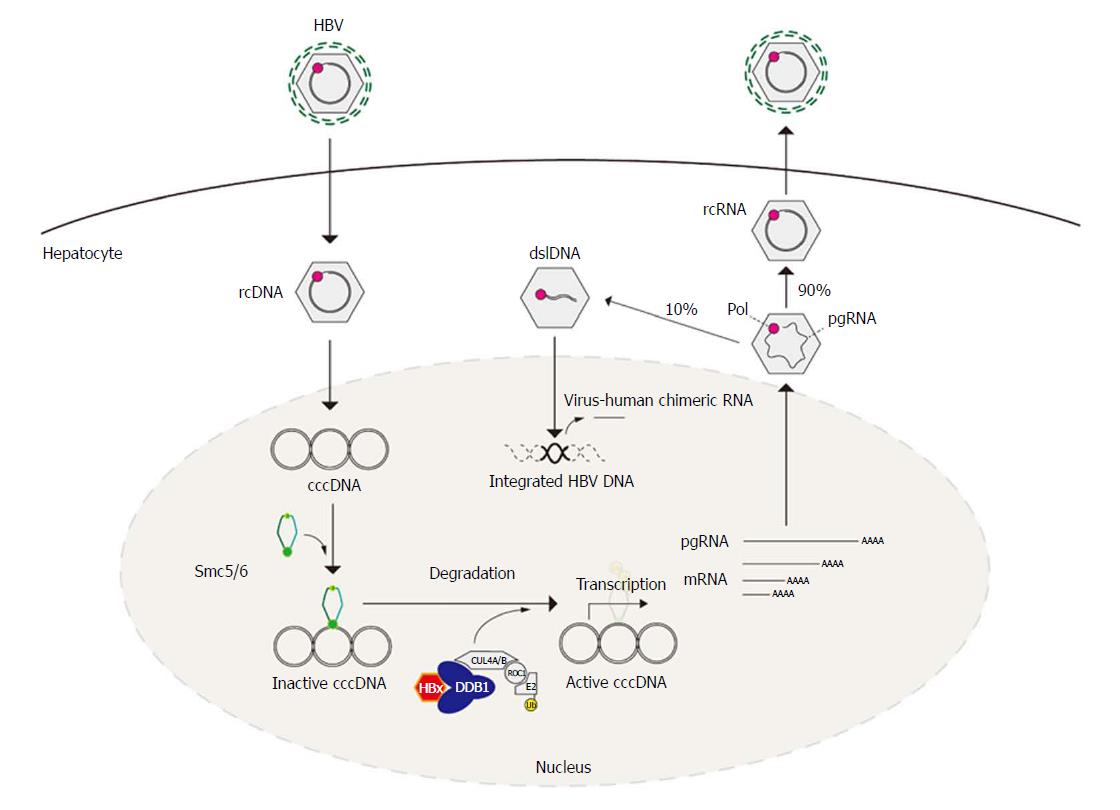 Гепатология. 2011, 54 (доп.): 1078A-
Гепатология. 2011, 54 (доп.): 1078A-
Google ученый
Количественное тестирование ДНК вируса гепатита B для раннего прогнозирования поддержания ответа во время терапии ламивудином у пациентов с хроническим гепатитом B | Журнал инфекционных болезней
Абстрактные
Чтобы определить, может ли резкое снижение уровней ДНК вируса гепатита B (HBV) в течение первых месяцев терапии ламивудином предсказать появление вариантов YMDD у пациентов с хроническим гепатитом B, каждые 3 месяца проводилось количественное тестирование образцов сыворотки от 35 пациентов. которые лечились ламивудином более 1 года.Снижение уровней ДНК HBV от исходного уровня до 3-го месяца было выше у 22 респондентов, чем у 13 неответчиков (среднее ± стандартное отклонение, 4,16 ± 1,06 против 2,88 ± 1,77 log 10 копий; P = 0,002), при этом никаких различий не наблюдалось. у пациентов с вариантами YMDD и без них через 1 год терапии. Через 3 месяца ДНК HBV не определялась у 77% респондентов, тогда как через 1 год она не определялась у 23% пациентов, не ответивших, 40% пациентов с вариантами YMDD и 74% пациентов без вариантов. Следовательно, количественный анализ ДНК ВГВ очень полезен при принятии решения о продолжении терапии из-за низкой вероятности ответа у пациентов, которые остаются положительными на ДНК ВГВ на 3-м месяце лечения
Через 3 месяца ДНК HBV не определялась у 77% респондентов, тогда как через 1 год она не определялась у 23% пациентов, не ответивших, 40% пациентов с вариантами YMDD и 74% пациентов без вариантов. Следовательно, количественный анализ ДНК ВГВ очень полезен при принятии решения о продолжении терапии из-за низкой вероятности ответа у пациентов, которые остаются положительными на ДНК ВГВ на 3-м месяце лечения
Ламивудин, первая специфическая пероральная противовирусная терапия хронического гепатита B, доказала свою безопасность и эффективность в контролируемых исследованиях, но соответствующая продолжительность терапии ламивудином не была определена, особенно у пациентов с положительной реакцией на гепатит B e (HBe) [ 1–4].При хроническом гепатите с положительным результатом на антиген HBe (HBeAg) установленным параметром прекращения терапии является клиренс HBeAg и сероконверсия к анти-HBe, поскольку это указывает на устойчивый ответ. Исследования с использованием ламивудина в течение 1 года продемонстрировали 20% -ный уровень отрицательности HBeAg, а продление терапии до 3 лет увеличивало потерю HBeAg до 40% (и даже выше у пациентов с повышенным уровнем аланинаминотрансферазы [АЛТ]) [2, 4-6].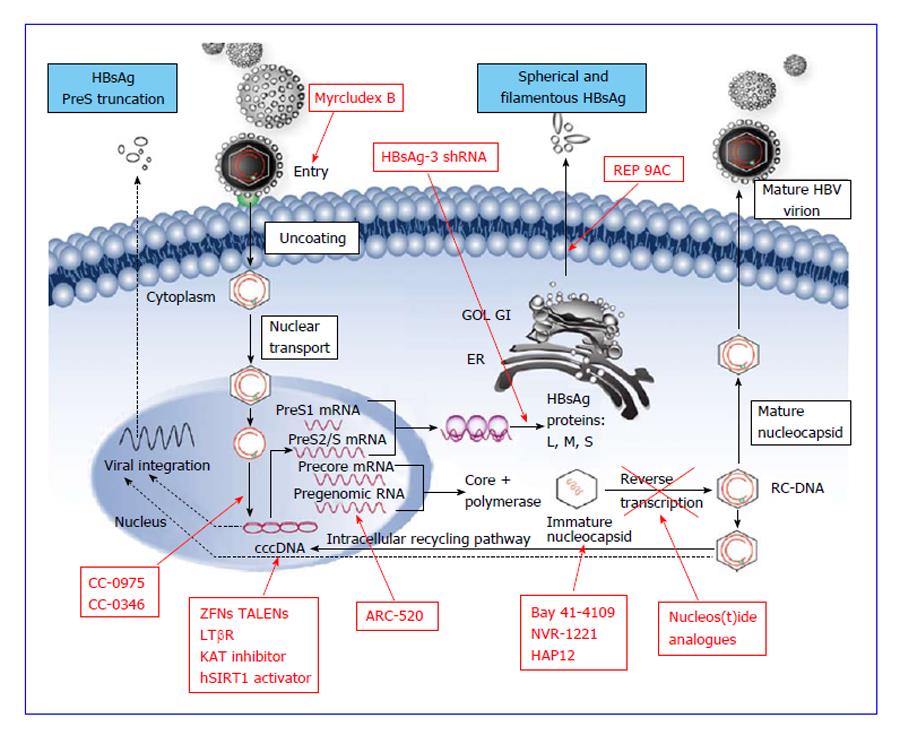 Длительная терапия ламивудином связана с появлением вариантов в высококонсервативном мотиве YMDD полимеразы вируса гепатита B (HBV) [7, 8].Возникновение этих вариантов увеличилось с 14% при 1 годе терапии ламивудином до 49% при 3-летнем лечении [9]. Эти варианты были связаны с более низкой чувствительностью к ламивудину, на что указывают аномальные уровни АЛТ и положительность сывороточной ДНК HBV
Длительная терапия ламивудином связана с появлением вариантов в высококонсервативном мотиве YMDD полимеразы вируса гепатита B (HBV) [7, 8].Возникновение этих вариантов увеличилось с 14% при 1 годе терапии ламивудином до 49% при 3-летнем лечении [9]. Эти варианты были связаны с более низкой чувствительностью к ламивудину, на что указывают аномальные уровни АЛТ и положительность сывороточной ДНК HBV
Более 90% пациентов, получающих терапию ламивудином, достигают быстрого и значительного подавления вирусемии [1–3]. Сообщений о кинетике ВГВ во время терапии ламивудином немного, а роль позднего клиренса ДНК ВГВ в ответ недостаточно широко оценивалась [10, 11].Это может быть важным вопросом при выявлении пациентов, для которых длительная терапия может быть связана с увеличением стойкого подавления ДНК HBV
Целью этого исследования было определить, можно ли количественно измерить ДНК HBV на ранней стадии (например, на 3-м месяце) во время терапии ламивудином. у пациентов с хроническим гепатитом B полезен для прогнозирования сохранения ответа на терапию и появления YMDD-варианта HBV
Пациенты и методы
Пациенты Тридцать пять пациентов (25 мужчин и 10 женщин; средний возраст 46 лет.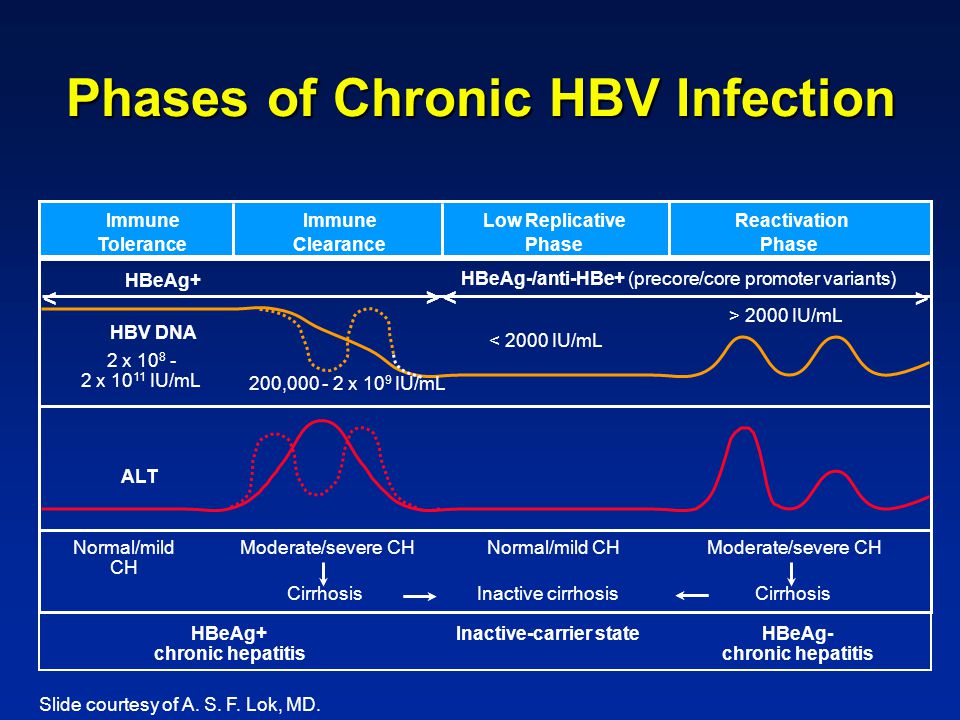 1 год; диапазон, 24–62 года) с HBV DNA-позитивным хроническим гепатитом B (15 HBeAg-позитивных и 20 анти-HBe-позитивных) и повышенным уровнем АЛТ (в среднем 133 U / L; диапазон 49–364 U / L) лечились перорально. с 100 мг ламивудина (Zeffix; Glaxo Wellcome) один раз в день в течение> 1 года (диапазон 12–24 месяцев) в открытом исследовании. Биопсия печени перед лечением, проведенная у 31 пациента, выявила хронический активный гепатит у 22 и цирроз печени у 9. Пациентов обследовали каждые 3 месяца во время терапии ламивудином, и образец крови брали при каждом посещении.Ответы пациентов на терапию ламивудином были классифицированы как «начальные», «поддерживаемые» или «нет». Первоначальный ответ определяли как клиренс сывороточной ДНК HBV в двух последовательных определениях гибридизационного анализа (ДНК разветвления [bDNA]). Поддерживаемый ответ определялся как неопределяемая сывороточная ДНК HBV в течение всего периода терапии (≤1 год). Отсутствие ответа определялось как сохранение ДНК HBV в сыворотке крови или ее повторное появление после первоначального удаления.
1 год; диапазон, 24–62 года) с HBV DNA-позитивным хроническим гепатитом B (15 HBeAg-позитивных и 20 анти-HBe-позитивных) и повышенным уровнем АЛТ (в среднем 133 U / L; диапазон 49–364 U / L) лечились перорально. с 100 мг ламивудина (Zeffix; Glaxo Wellcome) один раз в день в течение> 1 года (диапазон 12–24 месяцев) в открытом исследовании. Биопсия печени перед лечением, проведенная у 31 пациента, выявила хронический активный гепатит у 22 и цирроз печени у 9. Пациентов обследовали каждые 3 месяца во время терапии ламивудином, и образец крови брали при каждом посещении.Ответы пациентов на терапию ламивудином были классифицированы как «начальные», «поддерживаемые» или «нет». Первоначальный ответ определяли как клиренс сывороточной ДНК HBV в двух последовательных определениях гибридизационного анализа (ДНК разветвления [bDNA]). Поддерживаемый ответ определялся как неопределяемая сывороточная ДНК HBV в течение всего периода терапии (≤1 год). Отсутствие ответа определялось как сохранение ДНК HBV в сыворотке крови или ее повторное появление после первоначального удаления.
Серологические маркеры HBsAg анализировали с помощью коммерческого иммуноанализа (Abbott-Auszyme Mc; Abbott Laboratories).HBeAg и анти-HBe были обнаружены с помощью RIA (DiaSorin)
Количественное определение уровня ДНК HBV в сыворотке Для определения уровня ДНК HBV в сыворотке использовали два метода. Первый метод, обычный хемилюминесцентный анализ олигонуклеотидов бДНК (Quantiplex; Chiron), имеет нижний предел обнаружения 7,0 × 10 5 генома / мл. ДНК HBV была протестирована с использованием этого метода при поступлении и позже, для оценки ответа на терапию.
Второй метод, используемый для определения уровня ДНК HBV, представлял собой анализ полимеразной цепной реакции (ПЦР) в реальном времени, при котором выделялась ДНК HBV. из сыворотки с помощью спин-колонок (мини-колонки QIAamp DNA; Qiagen), и их концентрации определяли с помощью программируемого высокоскоростного термоциклера ДНК (LightCycler; Roche Diagnostics).Олигонуклеотидные последовательности праймеров, соответствующих коровому гену HBV, были следующими: HBVF, 5′-GACCACCAAATGCCCCTAT-3 ‘(2299–2316) и HBVR, 5′-CGAGATTGAGATCTTCTGCGAC-3’ (2442–2421). Гибридизацию проводили с использованием 2 различных коротких олигонуклеотидов, которые гибридизуются с 2 соседними внутренними последовательностями амплифицированного фрагмента ПЦР. Один зонд, HBVLC, 5′-TCCCTCGCCTGCCAGACG (A / C) AG (A / G) TCTC-3 ‘(2386–2411), мечен на 5′-конце и фосфорилируется на 3′-конце; Реакции секвенирования анализировали в секвенаторе ДНК (ABI PRISM 310; Perkin-Elmer Cetus) и с красным флуорофором (LightCycler 640; Roche Diagnostics).Другой зонд, HBVFL, 5’-GA (G / C) GCAGGTCCCCTAGAAGAAGAA-3 ‘(2361–2384), был помечен флуоресцеином на 3’-конце. Нуклеотидные последовательности пронумерованы в соответствии с генотипом C (номер доступа GenBank V00867). Условиями ПЦР были 4 мкл M MgCl 2 , 3 пмоль каждого зонда гибридизации, 20 пмоль 2 праймеров ПЦР, 2 мл смеси зондов гибридизации (смесь зондов LightCycler Fast Start DNA Master; Roche Diagnostics) и 10 мл образцов ДНК HBV в общем объеме 20 мл
Гибридизацию проводили с использованием 2 различных коротких олигонуклеотидов, которые гибридизуются с 2 соседними внутренними последовательностями амплифицированного фрагмента ПЦР. Один зонд, HBVLC, 5′-TCCCTCGCCTGCCAGACG (A / C) AG (A / G) TCTC-3 ‘(2386–2411), мечен на 5′-конце и фосфорилируется на 3′-конце; Реакции секвенирования анализировали в секвенаторе ДНК (ABI PRISM 310; Perkin-Elmer Cetus) и с красным флуорофором (LightCycler 640; Roche Diagnostics).Другой зонд, HBVFL, 5’-GA (G / C) GCAGGTCCCCTAGAAGAAGAA-3 ‘(2361–2384), был помечен флуоресцеином на 3’-конце. Нуклеотидные последовательности пронумерованы в соответствии с генотипом C (номер доступа GenBank V00867). Условиями ПЦР были 4 мкл M MgCl 2 , 3 пмоль каждого зонда гибридизации, 20 пмоль 2 праймеров ПЦР, 2 мл смеси зондов гибридизации (смесь зондов LightCycler Fast Start DNA Master; Roche Diagnostics) и 10 мл образцов ДНК HBV в общем объеме 20 мл
В качестве стандарта для количественного определения мы использовали стандарт плазмы ДНК HBV, содержащий ∼4.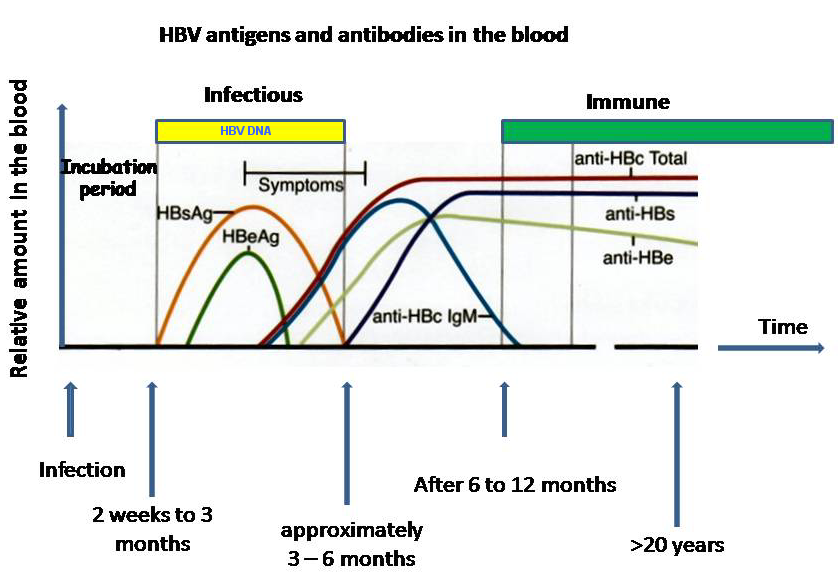 4 × 10 9 копий генома ДНК HBV / мл (квантиплекс ДНК HBV; Chiron). Из стандарта плазмы мы приготовили 6 серийных разведений в отрицательной плазме для получения концентраций от 10 3 до 10 7 копий генома ДНК HBV / мл. Предел обнаружения этого анализа составлял ~ 1 × 10 3 генома / мл. Этот метод использовался для количественного определения ДНК HBV на 3-м месяце лечения. Результаты выражены в виде среднего логарифма 10 значений (копий ДНК HBV / мл)
4 × 10 9 копий генома ДНК HBV / мл (квантиплекс ДНК HBV; Chiron). Из стандарта плазмы мы приготовили 6 серийных разведений в отрицательной плазме для получения концентраций от 10 3 до 10 7 копий генома ДНК HBV / мл. Предел обнаружения этого анализа составлял ~ 1 × 10 3 генома / мл. Этот метод использовался для количественного определения ДНК HBV на 3-м месяце лечения. Результаты выражены в виде среднего логарифма 10 значений (копий ДНК HBV / мл)
Обнаружение вариантов HBV Фрагмент гена ДНК-полимеразы HBV длиной 779 п.н., включая мотив YMDD, амплифицировали с помощью ПЦР Амплифицированные продукты были очищены и секвенированные, как описано в другом месте [12]
Статистический анализ Тест Стьюдента t , критерий Манна-Уитни U & amp; сумма рангов и точный двусторонний тест Фишера использовались для анализа количественных и качественных различий между группами. .P <0,05 считалось статистически значимым.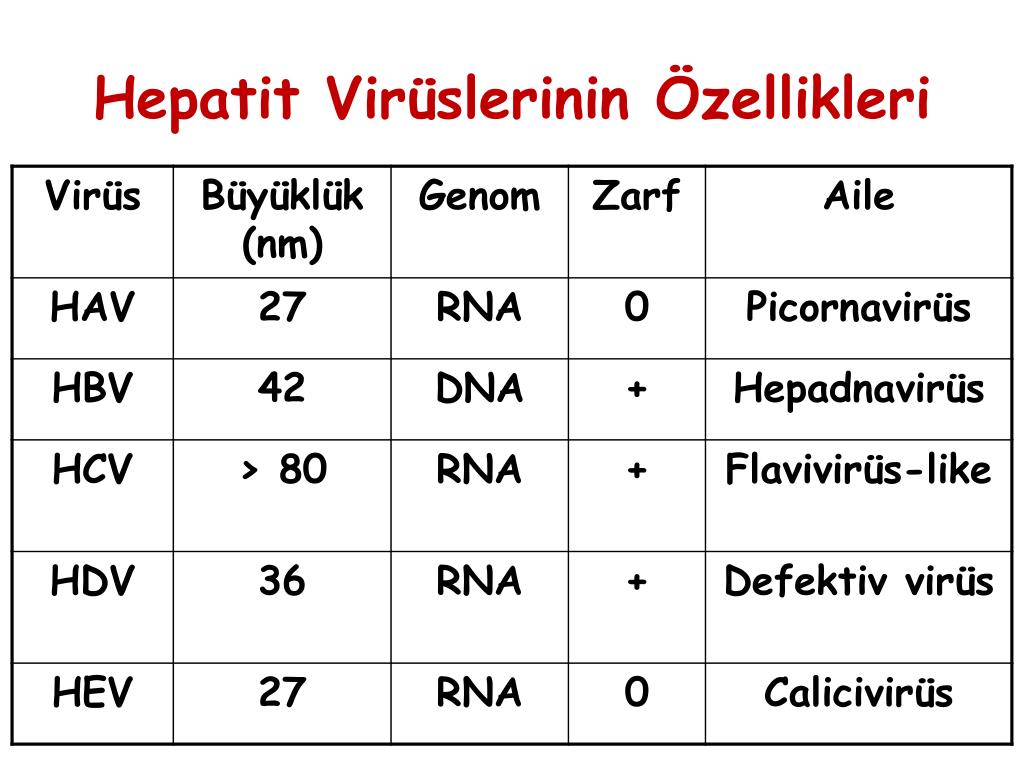 Все анализы данных проводились с использованием SPSS для Windows (версия 9.0; SPSS)
Все анализы данных проводились с использованием SPSS для Windows (версия 9.0; SPSS)
Результаты
ДНК HBV стала отрицательной у 26 пациентов (74%) и была связана с нормальным уровнем АЛТ у 22 (63%) в конце 1 года терапии ламивудином. Трое из 4 пациентов с отрицательной реакцией на ДНК HBV в сыворотке и с аномальными уровнями ALT после 1 года лечения стали положительными по ДНК HBV и у них развились варианты YMDD во время длительной терапии (2 пациента к 15 месяцу и 1 к 18 месяцу).Три пациента (20%) потеряли HBeAg, а у 2 (13%) пациентов произошла сероконверсия к анти-HBe. Ни один из пациентов не потерял HBsAg
Варианты ДНК-полимеразы HBV были обнаружены у 15 (44%) из 34 пациентов, обследованных на 1 год. Из них 9 были положительными по ДНК HBV, как определено с помощью bDNA, и 11 имели повышенный уровень АЛТ через 1 год (3 с уровнем АЛТ выше, чем исходный уровень). Таким образом, варианты YMDD были обнаружены у 9 (69%) из 13 неответчиков и у 6 (27%) из 22 респондентов (P = 0,020).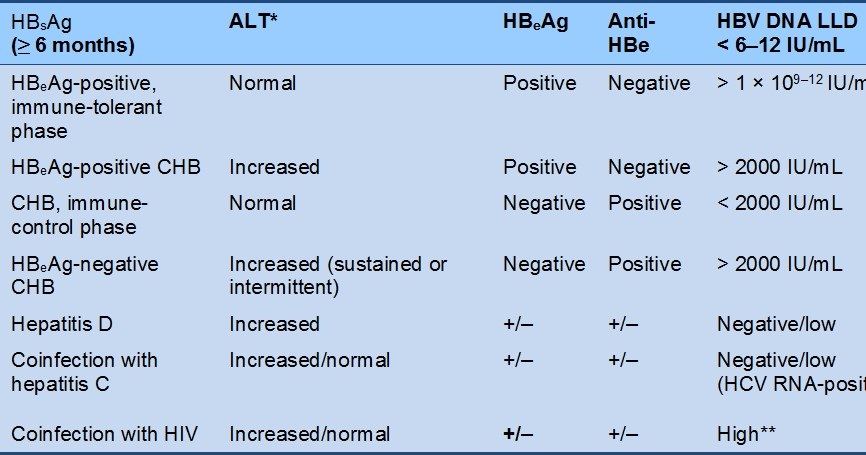
На 3-м месяце терапии уровни ДНК HBV в сыворотке стали неопределяемыми в 20 случаях (57 %) со средним уменьшением на 3.95 ± 1,16 (диапазон 6,43–0,22). Уровни ДНК HBV на 3-м месяце были ниже среди респондентов, чем среди неответчиков (3,55 ± 0,97 против 5,69 ± 2,05; P = 0,003), со средним снижением на 4,16 ± 1,06 у респондеров вирусологического ответа и 2,88 ± 1,77 у неответчиков (P =. 04; рисунок 1). Поддержание ответа на терапию было связано с отсутствием ДНК HBV на 3-м месяце, что не было обнаружено у 17 (77%) из 22 респондентов и у 3 (23%) из 13 не ответивших (P = 0,002)
Рисунок 1
Профиль ДНК вируса гепатита B (HBV) 35 пациентов с хроническим гепатитом B, как определено их вирусологической реакцией на терапию ламивудином.Данные представляют собой средние уровни ДНК HBV (log 10 копий / мл) 9 неответчиков () и 26 респондентов (•) после 1 года терапии
Рисунок 1
Профиль ДНК вируса гепатита B (HBV) 35 пациентов с хронический гепатит B, что определяется их вирусологической реакцией на терапию ламивудином. Данные представляют собой средние уровни ДНК HBV (log 10 копий / мл) у 9 неответчиков () и 26 респондентов (•) после 1 года терапии
Данные представляют собой средние уровни ДНК HBV (log 10 копий / мл) у 9 неответчиков () и 26 респондентов (•) после 1 года терапии
Количественное тестирование ДНК HBV через 3 месяца терапии, которое показывает отрицательный результат, чувствительность 73% и специфичность 88% для раннего прогнозирования устойчивого ответа на ламивудин.Прогнозирующая ценность положительного результата теста составляет 95% с точностью 74%
Исходные уровни ДНК HBV были выше у 15 пациентов с вариантами YMDD после 1 года лечения, чем у 19 пациентов без вариантов (8,42 ± 1,16 vs . 7,58 ± 1,01; P = 0,033). Уровни ДНК HBV на 3-м месяце также были выше у пациентов с вариантами YMDD, чем у пациентов без (4,55 ± 1,69 против 3,70 ± 1,5, соответственно; P не был значимым). Однако не было обнаружено различий в снижении ДНК HBV (3.86 ± 1,52 против 3,80 ± 1,32; P не было значимым) в течение первых 3 месяцев терапии между пациентами с вариантами YMDD или без них в 1 год (рисунок 2)
Рисунок 2
ДНК-профиль вируса гепатита B (HBV) 34 пациентов с хроническим гепатитом B, согласно появлению вариантов HBV после 1 года терапии ламивудином. Данные представляют собой средние уровни ДНК HBV (log 10 копий / мл) для 15 пациентов с () и 19 пациентов без (•) вариантов YMMD через 1 год
Данные представляют собой средние уровни ДНК HBV (log 10 копий / мл) для 15 пациентов с () и 19 пациентов без (•) вариантов YMMD через 1 год
Рисунок 2
Профиль ДНК вируса гепатита B (HBV) 34 пациенты с хроническим гепатитом В по появлению вариантов HBV через 1 год терапии ламивудином.Данные представляют собой средние уровни ДНК HBV (log 10 копий / мл) для 15 пациентов с () и 19 пациентов без (•) вариантов YMMD через 1 год
В целом, количественная ДНК HBV стала отрицательной на 3-м месяце лечения из 6 (40%) из 15 пациентов с вариантами YMDD и у 14 (74%) из 19 пациентов без вариантов на 1 год (P = 0,041). Несмотря на появление вариантов YMDD, 6 пациентов считались поддерживающими ответчиками, из которых 4 (67%) имели неопределяемый уровень ДНК HBV на 3-м месяце лечения.У пациентов без вариантов YMDD ДНК HBV была отрицательной на 3-м месяце у 87% респондеров и у 25% не ответивших (P = 0,03)
Отрицательная ДНК HBV при количественном тестировании на 3-м месяце терапии имеет чувствительность 60 % и специфичность 73% для раннего предсказания появления вариантов YMDD. Точность теста составляет 42%, с положительной прогностической ценностью 64%
Точность теста составляет 42%, с положительной прогностической ценностью 64%
Обсуждение
Два исследования показали, что мониторинг вирусной нагрузки может предсказать более позднее появление ламивудин-резистентных штаммов HBV во время терапии [10, 11].Вирусные нагрузки> 4,0 log 10 копий ДНК HBV / мл были обнаружены через 3 месяца у всех пациентов, у которых произошла сероконверсия на HBeAg, тогда как уровни ДНК HBV стали неопределяемыми у пациентов, у которых не произошло сероконверсии в течение 18 месяцев терапии [10]. В нашем исследовании мы обнаружили корреляцию между уровнями ДНК HBV на 3-м месяце терапии ламивудином и сохранением ответа на терапию. Кроме того, были небольшие различия в нагрузках ДНК HBV на 3-м месяце между пациентами с вариантами YMDD и без них, но мы смогли определить конкретный уровень ДНК HBV (<1000 копий / мл) в качестве предиктора появления вариантов YMDD.Уровни ДНК HBV> 1 × 10 3 копий / мл в это время указали на отсутствие ответа на ламивудин, несмотря на непрерывную терапию. Это будет одно из наиболее полезных применений количественного тестирования ДНК HBV, поскольку оно позволяет отобрать пациентов, которым будет полезна пролонгированная терапия ламивудином, особенно для пациентов с положительными анти-HBe
Это будет одно из наиболее полезных применений количественного тестирования ДНК HBV, поскольку оно позволяет отобрать пациентов, которым будет полезна пролонгированная терапия ламивудином, особенно для пациентов с положительными анти-HBe
Наши результаты показывают, что раннее количественное тестирование ДНК HBV может выявить различные вирусологические исходы у пациентов, получающих терапию ламивудином.Пациенты, у которых к 3 месяцу ДНК HBV становилась отрицательной, с большей вероятностью сохраняли ответ на длительную терапию ламивудином, чем пациенты, у которых ДНК HBV была положительной через 3 месяца. Пациенты, у которых к 3 месяцам была положительная ДНК HBV, имели более низкий шанс достижения вирусологического ответа, несмотря на длительную терапию, и имели риск появления вариантов YMDD
Это исследование также сделало интересное наблюдение о пациентах с неопределяемой ДНК HBV и повышенным Уровни АЛТ через 1 год лечения и кто продолжал терапию ламивудином.Большинство таких пациентов (75%) стали ВИЧ-положительными, несмотря на терапию, что позволяет предположить, что повышенный уровень АЛТ после 1 года лечения ламивудином связан с потерей ответа в будущем. Если эти результаты будут подтверждены дополнительными исследованиями, эти пациенты могут получить пользу от добавления других противовирусных препаратов для поддержания ответа
Если эти результаты будут подтверждены дополнительными исследованиями, эти пациенты могут получить пользу от добавления других противовирусных препаратов для поддержания ответа
Наши результаты также продемонстрировали, что количественное тестирование ДНК HBV дает 95% вероятность положительного прогноза поддержания ответа на ламивудин и 64% вероятность положительного предсказания появления вариантов YMDD.Следовательно, количественное тестирование ДНК HBV очень полезно для раннего прогнозирования поддержания вирусологического ответа.
ПЦР в реальном времени обеспечивает быстрое и точное средство изучения уровней ДНК HBV и появления вариантов YMDD, 2 важных фактора в определении терапевтического эффекта. стратегии для пациентов с хроническим HBV, получающих терапию ламивудином [13, 14]. Появление новых лекарств, эффективных против ВГВ, таких как адефовир и энтекавир, может быть особенно полезным для пациентов, не отвечающих на ламивудин, а количественное тестирование ДНК ВГВ будет очень полезным в различных терапевтических подходах для оптимизации лечения гепатита В [15]
Ссылки
1« и др.
Терапия ламивудином хронического гепатита B: шестимесячное рандомизированное исследование с диапазоном доз
,
Гастроэнтерология
,
1997
, vol.
113
(стр.
1258
—
63
) 2« и др.
Продленное повторное лечение ламивудином хронического гепатита B: поддержание вирусной супрессии после прекращения терапии
,
Hepatology
,
1999
, vol.
30
(стр.
1082
—
7
) 3« и др.
Эффективность ламивудина у пациентов с отрицательным антигеном гепатита В / положительным по ДНК вируса гепатита В (преко-мутантным) хроническим гепатитом В
,
Hepatology
,
1999
, vol.
29
(стр.
889
—
96
) 4« и др.
Годовое испытание ламивудина при хроническом гепатите B
,
N Engl J Med
,
1998
, vol.
339
(стр.
61
—
8
) 5« и др.
Эффекты расширенной терапии ламивудином у азиатских пациентов с хроническим гепатитом B
,
Гастроэнтерология
,
2000
, vol.
119
(стр.
172
—
80
) 6.
Сероконверсия е-антигена гепатита В: эффекты ламивудина отдельно или в комбинации с интерфероном альфа
,
J Med Virol
,
2000
, vol.
61
(стр.
374
—
9
) 7« и др.
Селекция мутаций полимеразы вируса гепатита В при терапии реципиентов трансплантата ламивудином
,
Hepatology
,
1996
, vol.
24
(стр.
711
—
3
) 8,.
Медикаментозная терапия хронического гепатита В: противовирусная эффективность и влияние мутаций полимеразы вируса гепатита В на исход терапии
,
J Hepatol
,
1998
, vol.
29
(стр.
151
—
68
) 9« и др.
Клиническое значение мутантного вируса гепатита B (HBV) YMDD в большой когорте пациентов с гепатитом B, леченным ламивудином
,
Hepatology
,
1998
, vol.
28
стр.
319
10« и др.
Количественная оценка виремии гепатита В и появления вариантов YMDD у пациентов с хроническим гепатитом В, получавших ламивудин
,
J Infect Dis
,
1999
, vol.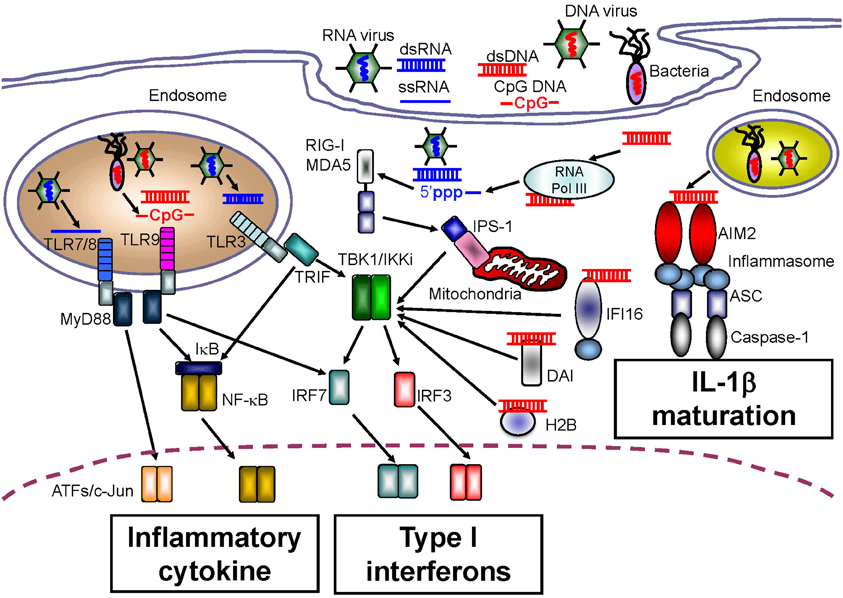
180
(стр.
1757
—
62
) 11« и др.
Мониторинг вирусной нагрузки может прогнозировать появление лекарственно-устойчивых штаммов вируса гепатита В у пациентов с трансплантацией почки во время терапии ламивудином
,
J Infect Dis
,
2000
, vol.
181
(стр.
2063
—
6
) 12«
Родригес-Фриас
,
F
.
Преходящее появление вариантов гепатита В у пациента с хроническим гепатитом В, резистентным к ламивудину
,
J Hepatol
,
1998
, vol.
28
(стр.
510
—
8
) 13,,,.
Частота, характеристики и клиническое влияние устойчивости к ламивудину при хроническом гепатите B
,
J Hepatol
,
1998
, vol.
28
стр.
48
14,,,,.
Использование ПЦР в реальном времени и флуориметрии для выявления мутаций, связанных с устойчивостью к ламивудину, в вирусе гепатита В
,
Антимикробные агенты Chemother
,
1999
, vol.
43
(стр.
1600
—
8
) 15« и др.
Мутанты гепатита B, устойчивые к адефовиру дипивоксилу
,
Hepatology
,
2000
, vol.
32
(стр.
129
—
34
)
© 2001 Американским обществом инфекционных болезней
Клиническая значимость анализа in situ на ДНК HBV: перекрестное исследование у пациентов с хроническим гепатитом B
Введение
Инфекция, вызванная вирусом гепатита B (HBV), остается глобальной проблемой общественного здравоохранения, от которой страдают более 240 миллионов человек, страдающих хроническим гепатитом B (CHB) физическим лицам по всему миру.1 Хроническое заболевание печени, вызванное вирусом, приводит к фиброзу печени и, в конечном итоге, к гепатоцеллюлярной карциноме. 2 Тщательному пониманию естественной истории ХГВ способствует постоянная разработка тестов для основных вирусологических (ДНК HBV и РНК HBV) и иммунологических ( Антигены и антитела HBV) 3. Среди них недавно разработанный базовый антиген HBV (HBcrAg) 4–6 и количественный титр HBcAb показали значительную прогностическую ценность7.
Хотя сывороточные биомаркеры широко используются для оценки хронического заболевания печени, гистопатологическое исследование биопсии печени остается золотым стандартом для оценки патологий печени при ХГВ.8 Кроме того, иммуногистохимия (ИГХ) HBsAg и HBcAg помогает клиницистам оценить вирусологическую активность HBV.9 Однако ИГХ HBsAg показал ограниченную связь с энергией репликации вируса, тогда как положительный уровень HBcAg ниже.
Недавно мы разработали чувствительный анализ гибридизации in situ (ISH) для ДНК HBV и обнаружили, что его распределение отличается от распределения HBsAg.10 Эти результаты позволяют предположить, что внутрипеченочная ДНК HBV может представлять собой новый гистологический маркер, дополняющий текущие исследования IHC.В этом исследовании мы стремились дополнительно оценить его чувствительность и специфичность в большой группе пациентов с ХГВ и гепатитом без ВГВ. Кроме того, была исследована взаимосвязь между анализом ISH ДНК HBV и существующими вирусологическими / патологическими маркерами
Материалы и методы
Пациенты и образцы
В этом исследовании участвовали 313 пациентов, не получавших лечения ХГВ, которые были госпитализированы в отделение гепатобилиарной медицины. Шанхайский клинический центр общественного здравоохранения, и с марта 2015 года по декабрь 2018 года ему была сделана биопсия печени.Среди них 163 пациента были HBeAg-положительными, а 150 пациентов — HBeAg-отрицательными. Пациентам был поставлен диагноз в соответствии со стандартом, разработанным в Руководстве по клинической практике EASL (Европейская ассоциация по изучению печени) 2017 г. по ведению инфекции HBV2. Критерии исключения были следующими: коинфицированы другими вирусными гепатитами, ВИЧ, значительное потребление алкоголя (> 20 г в день для мужчин,> 10 г в день для женщин), патология печени указали на лекарственное поражение печени или жировую болезнь печени и получение противовирусной терапии в течение предшествующих 6 месяцев.
Шанхайский клинический центр общественного здравоохранения, и с марта 2015 года по декабрь 2018 года ему была сделана биопсия печени.Среди них 163 пациента были HBeAg-положительными, а 150 пациентов — HBeAg-отрицательными. Пациентам был поставлен диагноз в соответствии со стандартом, разработанным в Руководстве по клинической практике EASL (Европейская ассоциация по изучению печени) 2017 г. по ведению инфекции HBV2. Критерии исключения были следующими: коинфицированы другими вирусными гепатитами, ВИЧ, значительное потребление алкоголя (> 20 г в день для мужчин,> 10 г в день для женщин), патология печени указали на лекарственное поражение печени или жировую болезнь печени и получение противовирусной терапии в течение предшествующих 6 месяцев.
Патологическая оценка
Биопсию печени с ультразвуковым контролем выполняли с использованием односекундной иглы для биопсии печени (16G). Полученные образцы печени обычно фиксировали формалином и заливали парафином. Парафиновые срезы тканей окрашивали H&E, трихромом Массона и ретикулином. Патологическая оценка печени была независимо оценена двумя опытными патологами, которые не знали клинической информации и использовали стандарт Scheuer.
Патологическая оценка печени была независимо оценена двумя опытными патологами, которые не знали клинической информации и использовали стандарт Scheuer.
ИГХ HBsAg и HBcAg были выполнены с использованием автоматического красителя Leical BOND, проверены патологами и оценены как 0, 1, 2 и 3, что соответствует доле иммуномеченых клеток 0%, <5%, 5% –20% и> 20% соответственно.
Клинические и серологические параметры
Образцы сыворотки крови были получены в течение 1 дня до или после биопсии печени. Уровень HBsAg, HBeAg и анти-HBe в сыворотке измеряли с помощью хемилюминесцентного иммуноанализа на микрочастицах (CMIA) (Abbott, США). Диапазон обнаружения сывороточного HBsAg составляет 0,05–250 МЕ / мл, и его повторно тестировали с разведением 1: 500, если исходное значение теста превышало верхний предел обнаружения. Уровень HBcAb в сыворотке измеряли с помощью CMIA (иммуноанализ микрочастиц Chemiluminesence, Wantai, Китай), и диапазон обнаружения составлял от 10 2 МЕ / мл до 10 5 МЕ / мл. HBcrAg в сыворотке крови измеряли с помощью хемилюминесцентного иммуноферментного анализа (Fujirebio, Япония) с диапазоном обнаружения от 10 3 МЕ / мл до 10 7 МЕ / мл, и его повторно тестировали с разведением 1: 1000, если исходное значение теста превышен верхний предел обнаружения. ДНК HBV в сыворотке крови определяли количественно с помощью анализа ПЦР-флуоресценции (Sansure, Китай) с диапазоном обнаружения от 5 × 10 2 до 2 × 10 9 МЕ / мл. Уровень аланинтрансферазы (АЛТ) в сыворотке крови определяли на полностью автоматическом биохимическом анализаторе Abbott Accelerator a3600 (Abbott, США).
HBcrAg в сыворотке крови измеряли с помощью хемилюминесцентного иммуноферментного анализа (Fujirebio, Япония) с диапазоном обнаружения от 10 3 МЕ / мл до 10 7 МЕ / мл, и его повторно тестировали с разведением 1: 1000, если исходное значение теста превышен верхний предел обнаружения. ДНК HBV в сыворотке крови определяли количественно с помощью анализа ПЦР-флуоресценции (Sansure, Китай) с диапазоном обнаружения от 5 × 10 2 до 2 × 10 9 МЕ / мл. Уровень аланинтрансферазы (АЛТ) в сыворотке крови определяли на полностью автоматическом биохимическом анализаторе Abbott Accelerator a3600 (Abbott, США).
ISH ДНК HBV
Процедуры гибридизации и амплификации были основаны на нашем предыдущем исследовании10 и выполнялись с использованием ViewRNA ISH Tissue Assay (Thermo Fisher, Fremont, California, USA). Срезы тканей обычно депарафинизировали и регидратировали с последующим извлечением антигена, расщеплением протеазой и повторной фиксацией 4% формальдегидом в течение 5 минут.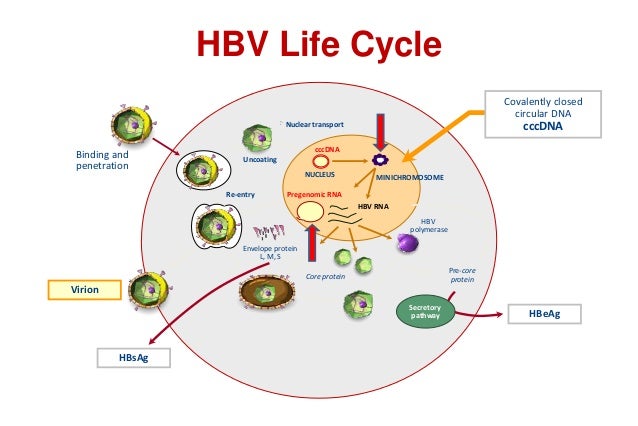 Зонд ДНК HBV (VF6-20095) был разработан для нацеливания на последовательность минус-цепи (nt2959-837), консервативную от генотипа A до генотипа D.После гибридизации зонда и усиления сигнала срезы окрашивали NBT / BCIP (Roche) в проявляющем растворе при 37 ° C в течение 2 часов. Затем срезы инкубировали с антителом к гистону h4 (Cell Signaling Cat No. 14269), а затем с антителом, конъюгированным с HRP, и сигнал проявляли с помощью AEC. Результаты ISH были исследованы патологами, и им был присвоен балл 0–4 (0–4, что соответствует примерно 0%, <5%, 5% –10%, 10–20% и> 20%). Для тройного окрашивания ДНК HBV-HBsAg-Sirius Red после развития сигнала ДНК на срез наносили анти-HBs-антитело (клон: OTI1D3, ZM-0122, ZSBio, Пекин, Китай), за которым следовало антитело против IgG-HRP мыши / кролика. (Leica) инкубация и разработка DAB.Наконец, предметные стекла окрашивали сириусом красным в течение 30 минут и промывали дистиллированной водой перед сушкой на воздухе и установкой. Слайды сканировали с помощью панорамного цифрового сканера слайдов (3DHISTECH).
Зонд ДНК HBV (VF6-20095) был разработан для нацеливания на последовательность минус-цепи (nt2959-837), консервативную от генотипа A до генотипа D.После гибридизации зонда и усиления сигнала срезы окрашивали NBT / BCIP (Roche) в проявляющем растворе при 37 ° C в течение 2 часов. Затем срезы инкубировали с антителом к гистону h4 (Cell Signaling Cat No. 14269), а затем с антителом, конъюгированным с HRP, и сигнал проявляли с помощью AEC. Результаты ISH были исследованы патологами, и им был присвоен балл 0–4 (0–4, что соответствует примерно 0%, <5%, 5% –10%, 10–20% и> 20%). Для тройного окрашивания ДНК HBV-HBsAg-Sirius Red после развития сигнала ДНК на срез наносили анти-HBs-антитело (клон: OTI1D3, ZM-0122, ZSBio, Пекин, Китай), за которым следовало антитело против IgG-HRP мыши / кролика. (Leica) инкубация и разработка DAB.Наконец, предметные стекла окрашивали сириусом красным в течение 30 минут и промывали дистиллированной водой перед сушкой на воздухе и установкой. Слайды сканировали с помощью панорамного цифрового сканера слайдов (3DHISTECH). Полные изображения срезов были экспортированы и обработаны с помощью ImageJ для расчета площади поверхности ISH-положительных клеток относительно общей площади ткани. Полностью оцифрованные изображения всего сечения с указанием основных клинических параметров были собраны и загружены на http://www.hepb-atlas.com.
Полные изображения срезов были экспортированы и обработаны с помощью ImageJ для расчета площади поверхности ISH-положительных клеток относительно общей площади ткани. Полностью оцифрованные изображения всего сечения с указанием основных клинических параметров были собраны и загружены на http://www.hepb-atlas.com.
Заявление об этике
Все пациенты дали письменное согласие перед их включением в исследование и сбором клинических образцов.
Статистический анализ
Статистический анализ проводился с использованием Medcalc версии 15.8 (Broekstraat, Mariakerke, Бельгия) и пакета R (corrplot). Для непрерывных переменных использовались медиана и IQR. Для категориальных переменных использовались частоты и пропорции. Сравнение HBeAg-положительных и HBeAg-отрицательных пациентов проводилось с помощью U-теста Манна-Уитни для непрерывных данных и теста Пирсона χ 2 для категориальных данных. Коэффициент корреляции рассчитывали по методу Спирмена.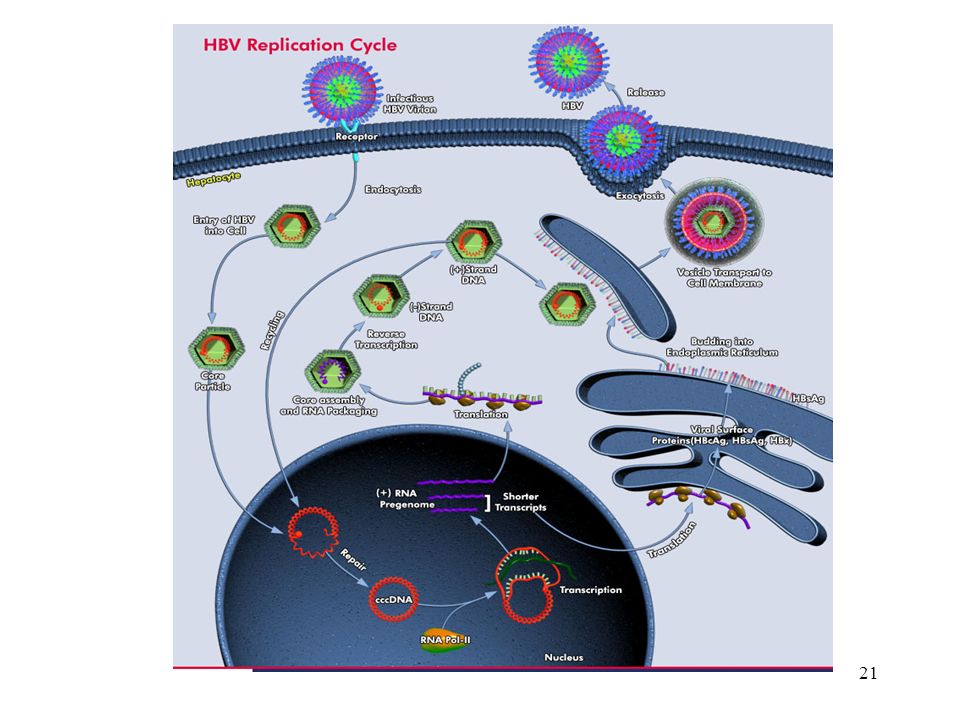 Для всех тестов значимость была принята при p <0,05.
Для всех тестов значимость была принята при p <0,05.
Результаты
Демографические, клинические и патологические характеристики исследуемой популяции
В это исследование было включено 313 пациентов с ХГВ. Они были разделены на HBeAg-положительных (n = 163) и HBeAg-отрицательных (n = 150) пациентов. Демографические, клинические и патологические характеристики исследуемой популяции представлены в таблице 1. Соотношение мужчин и женщин в этих двух группах было сопоставимым (p> 0,05). Средний возраст HBeAg-отрицательных пациентов был выше, чем HBeAg-положительных пациентов (p <0.001), что соответствует клиническому течению заболевания. Медиана титра HBsAg у HBeAg-положительных пациентов составила 4,117 log10 МЕ / мл, что значительно выше, чем у HBeAg-отрицательных пациентов (3,296 log10 МЕ / мл, p <0,0001). Точно так же уровень ДНК HBV в сыворотке был значительно выше у HBeAg-положительных пациентов (медиана, 7,314 log10 МЕ / мл), чем у HBeAg-отрицательных (медиана, 3,588 log10 МЕ / мл, p <0,0001).
Таблица 1
Демографические и клинические характеристики исследуемой популяции
Характер окрашивания ISH ДНК HBV и его взаимосвязь с биомаркерами сыворотки
В целом 298 случаев показали положительный сигнал ДНК HBV (положительный показатель 95.2%), что аналогично ИГХ HBsAg (97,1%) и значительно выше, чем HBcAg (42,8%). Сигнал ISH в основном распределялся в цитоплазме гепатоцитов, хотя также наблюдалась ядерная локализация. Кроме того, мы также провели анализ на срезах шести пациентов с гепатитом, отличным от HBV (гепатит С и лекарственный гепатит), и ни один из них не показал положительного окрашивания. Анализ ISH ДНК HBV показал 98,7% положительных результатов в случаях с положительным e-антигеном по сравнению с 91,3% в случаях с отрицательным e-антигеном.Аналогичным образом, HBsAg IHC показал 98,1% положительных результатов в е-положительных случаях, тогда как 93,3% е-отрицательных случаев показали положительное окрашивание. Наиболее разительная разница наблюдалась при окрашивании ядра ИГХ.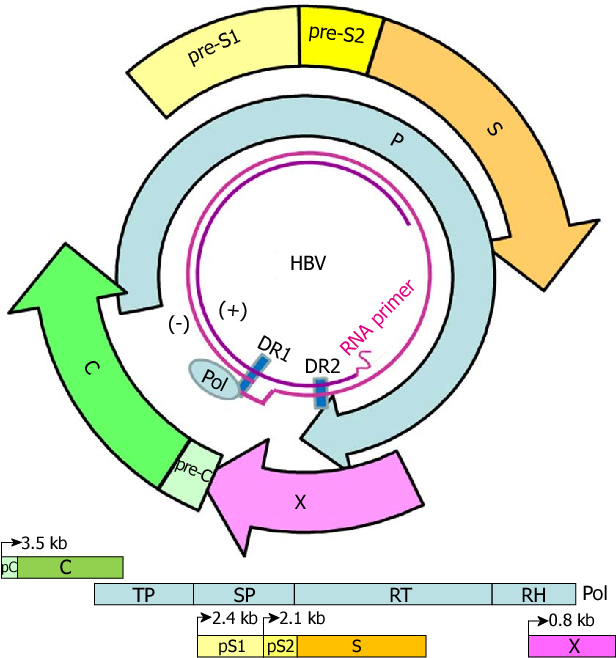 64,4% положительных по е-антигену случаев показали положительное окрашивание на HBcAg, тогда как этот показатель составлял только 19,3% для отрицательных по е-антигену.
64,4% положительных по е-антигену случаев показали положительное окрашивание на HBcAg, тогда как этот показатель составлял только 19,3% для отрицательных по е-антигену.
Тщательное изучение ISH совместно с IHC на тех же образцах дало некоторые интересные результаты. Хотя HBsAg и ДНК HBV показали высокую скорость обнаружения на этих участках, в большинстве случаев распределение ДНК HBV разительно отличалось от распределения HBsAg.На рисунке 1 показаны типичные результаты окрашивания срезов печени HBeAg-положительного пациента с вирусной нагрузкой 5,89 × 10 6 МЕ / мл. Поверхностный антиген накапливался в некоторых долях, тогда как ДНК HBV была обогащена в отдельных областях. Однако при обнаружении цитоплазматического HBcAg он обычно распределялся в аналогичных зонах положительности ДНК HBV. Тем не менее, мы обнаружили, что HBcAg может отсутствовать, когда ДНК HBV очень распространена (дополнительный рисунок 1 в Интернете), что указывает на ограниченную чувствительность текущего анализа HBcAg IHC.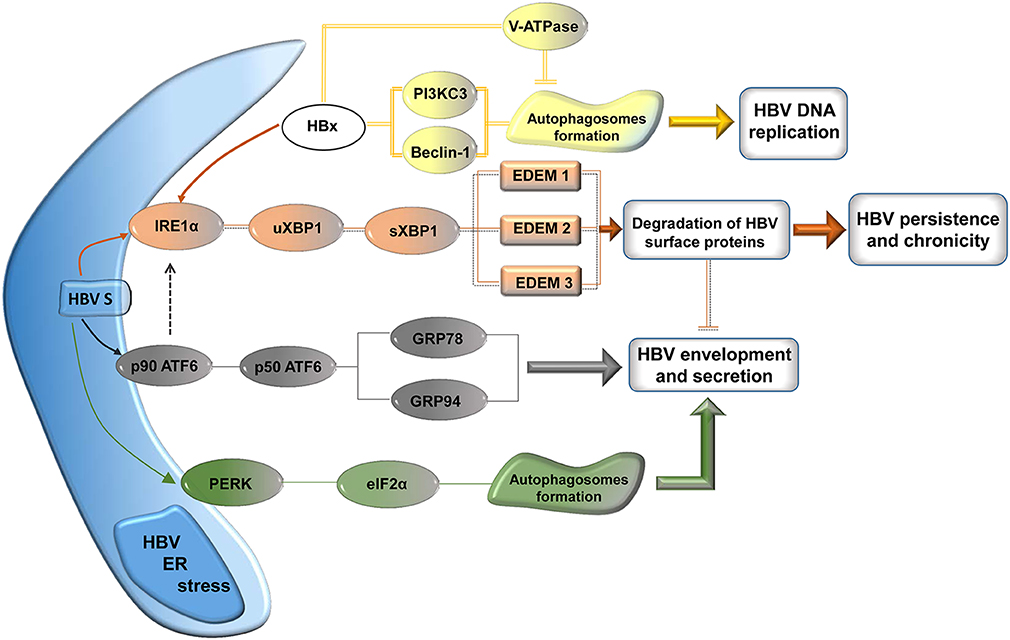 Есть также случаи, когда результаты ИГХ были отрицательными как для S-, так и для Core-антигена, но обнаруживалась ДНК HBV, как показано в одном примере (дополнительный рисунок 2 онлайн). Хотя и HBsAg, и внутрипеченочная ДНК HBV показали высокую скорость обнаружения, в случаях с неопределяемой ДНК S или HBV только два случая показали двойной отрицательный результат, тогда как в других случаях была обнаружена либо S (11 случаев), либо ДНК HBV (13 случаев). Результаты таблицы кросс-табуляции показали, что эти два теста не зависят друг от друга (p = 0.1232, точный тест Фишера, онлайн-дополнительная таблица 1). Напротив, ни один из ISH-отрицательных образцов ДНК HBV не был положительным по коровому антигену, тогда как в случае с ISH-положительными образцами ДНК HBV (n = 298) 134 из них показали положительную IHC-положительность (44,6%). Статистический анализ показал, что положительный ISH ДНК HBV значительно увеличивает вероятность положительного основного результата ИГХ (p = 0,0002, точный тест Фишера, онлайн-дополнительная таблица 2).
Есть также случаи, когда результаты ИГХ были отрицательными как для S-, так и для Core-антигена, но обнаруживалась ДНК HBV, как показано в одном примере (дополнительный рисунок 2 онлайн). Хотя и HBsAg, и внутрипеченочная ДНК HBV показали высокую скорость обнаружения, в случаях с неопределяемой ДНК S или HBV только два случая показали двойной отрицательный результат, тогда как в других случаях была обнаружена либо S (11 случаев), либо ДНК HBV (13 случаев). Результаты таблицы кросс-табуляции показали, что эти два теста не зависят друг от друга (p = 0.1232, точный тест Фишера, онлайн-дополнительная таблица 1). Напротив, ни один из ISH-отрицательных образцов ДНК HBV не был положительным по коровому антигену, тогда как в случае с ISH-положительными образцами ДНК HBV (n = 298) 134 из них показали положительную IHC-положительность (44,6%). Статистический анализ показал, что положительный ISH ДНК HBV значительно увеличивает вероятность положительного основного результата ИГХ (p = 0,0002, точный тест Фишера, онлайн-дополнительная таблица 2).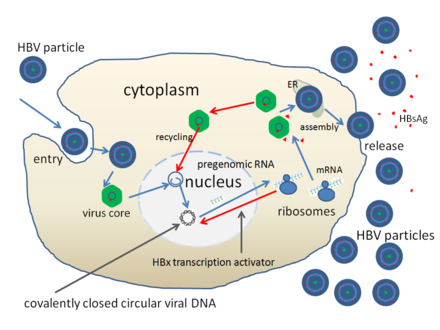 Эти результаты предполагают, что HBcAg IHC был частично связан с ISH ДНК HBV.
Эти результаты предполагают, что HBcAg IHC был частично связан с ISH ДНК HBV.
Рисунок 1
Прямое сравнение иммуногистохимии поверхностного антигена (A), корового антигена (B) и гибридизации ДНК HBV (C) in situ у HBeAg-положительного пациента с ХГВ с ДНК HBV 5.89 × 10 6 МЕ / мл, HBsAg 2180 МЕ / мл и АЛТ 45 Ед / л. Изображение сканирования всего участка и соответствующие области (отмеченные прямоугольниками) были увеличены и показаны. АЛТ, аланинтрансфераза; ХГВ, хронический гепатит В; ВГВ, вирус гепатита В.
Затем мы оценили корреляцию между внутрипеченочной ДНК и другими ключевыми параметрами, такими как сывороточная ДНК HBV, HBcrAg и титр HBsAg. Как показано на рисунке 2A, наблюдалась сильная корреляционная картина между внутрипеченочной и циркулирующей ДНК HBV (r s = 0.678, p <0,0001, фигура 2A). Аналогичным образом, сигнал ISH ДНК HBV значительно коррелирует с уровнем HBcrAg (r s = 0,645, p <0,0001, рисунок 2B) и титром HBsAg в сыворотке (r s = 0,531, p <0,0001, рисунок 2C).
Рисунок 2
Графики корреляции между уровнем положительных результатов ISH ДНК HBV и сывороткой HBV DNA (A), сывороточным HBcrAg (B) и сывороточным HBsAg (C). Ранговая корреляция Спирмена. Значения P были показаны на каждом графике. HBcrAg, антиген, связанный с ядром HBV; ВГВ, вирус гепатита В; ISH, гибридизация in situ.
Мы также сравнили эффективность ISH ДНК HBV с показателями обычных IHC-исследований. Частота положительных результатов ДНК HBV была преобразована в градуированные баллы для прямого сравнения с баллами IHC. Во-первых, хотя HBcAg IHC показал значительную положительную корреляцию с сывороточными вирусными маркерами (с вирусной нагрузкой: r s = 0,621, с HBsAg в сыворотке: r s = 0,580, с HBcrAg: r s = 0,666, p <0,0001, рисунок 3C), его низкая общая положительная частота (42,8%) ограничивала его полезность у пациентов с ограниченной вирусной репликацией.Однако ИГХ HBsAg показал высокий положительный результат (97,1%). Его отношения с циркулирующими вирусными маркерами показали значительно более низкие корреляции (с вирусной нагрузкой: r s = 0,437, с HBsAg в сыворотке: r s = 0,454, с HBcrAg: r s = 0,397, p <0,0001, рисунок 3B) по сравнению с сигналом ISH ДНК HBV (с вирусной нагрузкой: r s = 0,678, с сывороткой HBsAg: r s = 0,521, с HBcrAg: r s = 0,641, p <0,0001, рис.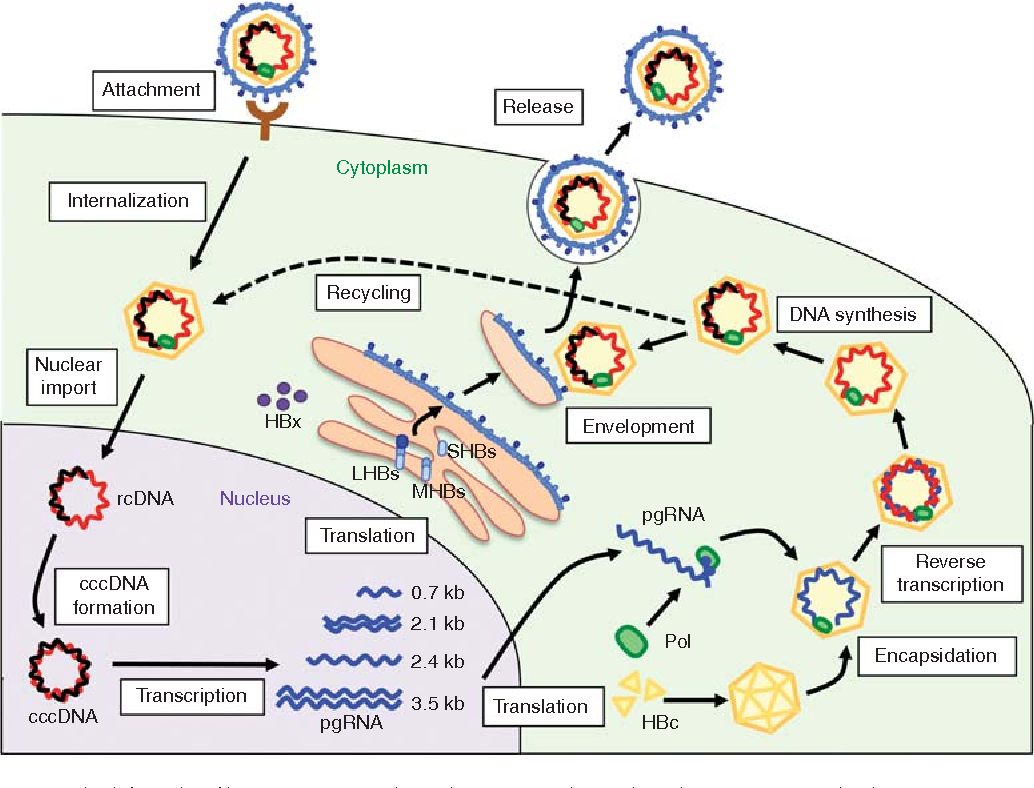 3A).
3A).
Рисунок 3
Связь между внутрипеченочными вирусологическими маркерами и маркерами сыворотки.Уровни ДНК HBV в сыворотке, HBsAg и HBcrAg в сыворотке были сгруппированы в соответствии с оценкой ISH для ДНК HBV (A), оценкой IHC для поверхностного антигена (B) или корового антигена (C) и сравнивали. HBcrAg, антиген, связанный с ядром HBV; ВГВ, вирус гепатита В; ИГХ, иммуногистохимия; ISH, гибридизация in situ.
Взаимосвязь между сывороточными и внутрипеченочными параметрами
Мы создали матрицу корреляции между биомаркерами сыворотки и печени, стратифицированными по статусу HBeAg (рис. 4). Были отмечены некоторые существенные тенденции.Связанный с ядром антиген показал сильную взаимосвязь с вирусной нагрузкой (e-положительные пациенты, r = 0,838, p <0,0001; e-отрицательные пациенты, r = 0,545, p <0,0001) и вирусным поверхностным антигеном (e-положительные пациенты, r = 0,619, p <0,0001; е отрицательные пациенты, r = 0,462, p <0,0001) независимо от статуса HBeAg (рисунок 4).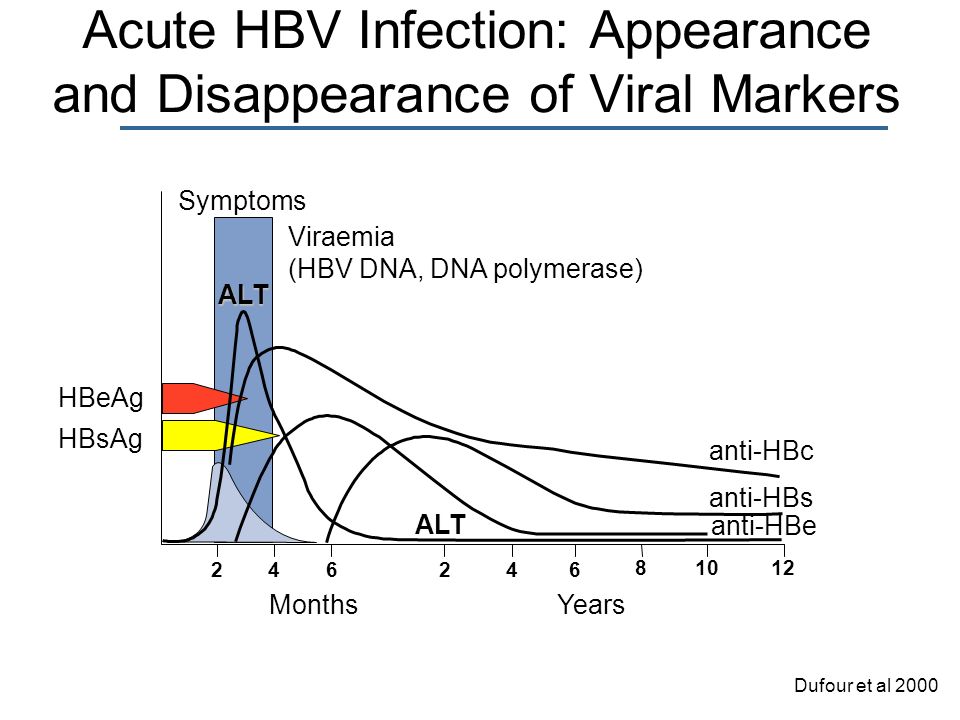 Напротив, титр HBcAb демонстрировал четкую взаимосвязь с сигналом ISH ДНК HBV в положительных по е-антигену (r = -0,31, p <0,0001) и отрицательных группах (r = 0,28, p <0,0001). Аналогичные тенденции наблюдались также между HBcAb и сывороткой ДНК HBV (e-положительные пациенты, r = -0.34, р <0,0001; e отрицательные пациенты, r = 0,58, p <0,0001) или HBcrAg (e положительные пациенты, r = -0,32, p <0,0001; e отрицательные пациенты, r = 0,44, p <0,0001) (рисунок 4). Также была проанализирована взаимосвязь между сывороточной АЛТ и внутрипеченочной ДНК. В группе с положительным антигеном не было обнаружено статистической значимости между этими маркерами (r = -0,014, p = 0,85), в то время как в группе с отрицательным антигеном была обнаружена положительная корреляция (r = 0,35, p <0,0001).
Напротив, титр HBcAb демонстрировал четкую взаимосвязь с сигналом ISH ДНК HBV в положительных по е-антигену (r = -0,31, p <0,0001) и отрицательных группах (r = 0,28, p <0,0001). Аналогичные тенденции наблюдались также между HBcAb и сывороткой ДНК HBV (e-положительные пациенты, r = -0.34, р <0,0001; e отрицательные пациенты, r = 0,58, p <0,0001) или HBcrAg (e положительные пациенты, r = -0,32, p <0,0001; e отрицательные пациенты, r = 0,44, p <0,0001) (рисунок 4). Также была проанализирована взаимосвязь между сывороточной АЛТ и внутрипеченочной ДНК. В группе с положительным антигеном не было обнаружено статистической значимости между этими маркерами (r = -0,014, p = 0,85), в то время как в группе с отрицательным антигеном была обнаружена положительная корреляция (r = 0,35, p <0,0001).
Рисунок 4
Матрица корреляции между серологическими и внутрипеченочными переменными общей популяции (A), HBeAg-популяции (B) и HBeAg-отрицательной полупации (C).Цвет круга указывает значение коэффициентов корреляции Спирмена.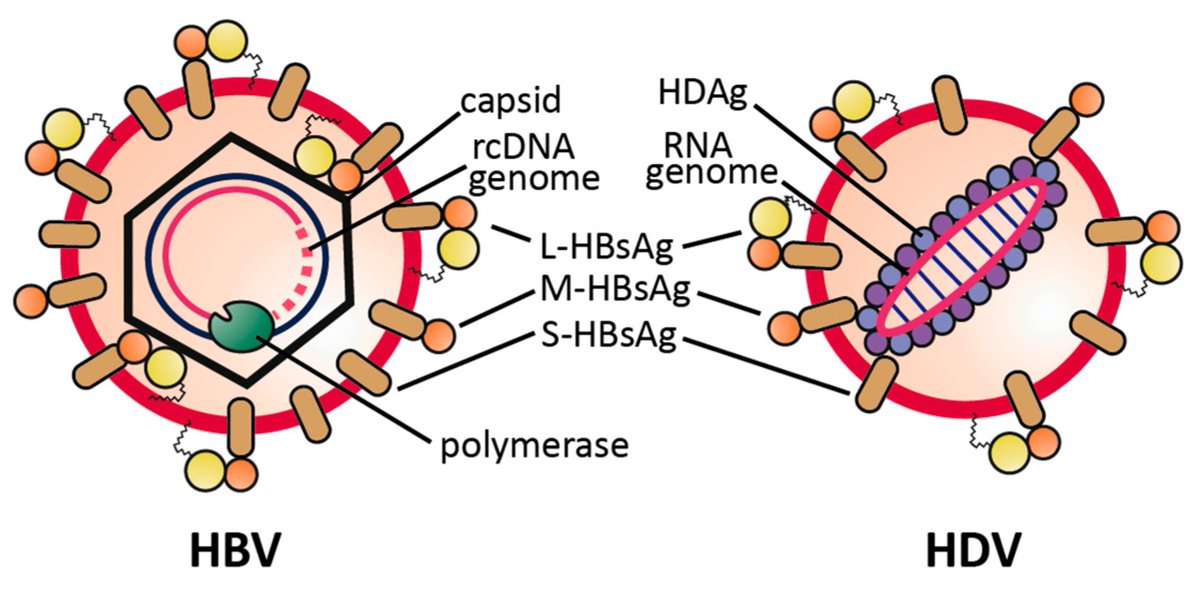 Синий указывает на положительную корреляцию; красный означает положительную корреляцию. АЛТ, аланинтрансфераза; ВГВ, вирус гепатита В; HBcrAg, основной антиген HBV.
Синий указывает на положительную корреляцию; красный означает положительную корреляцию. АЛТ, аланинтрансфераза; ВГВ, вирус гепатита В; HBcrAg, основной антиген HBV.
Паттерны внутрипеченочной ДНК HBV при различных уровнях воспаления и фиброза печени
Мы также отметили в корреляционной матрице, что сигнал ISH ДНК HBV имел разные паттерны корреляции с гистологией печени, если разделить на статус HBeAg.У HBeAg-положительных пациентов, хотя воспаление печени не связано с внутрипеченочной ДНК, уровень фиброза отрицательно связан с ISH ДНК HBV (r s = -0,166, p <0,05, рисунок 5A). Однако у HBeAg-отрицательных пациентов наблюдалась значимая положительная взаимосвязь между внутрипеченочной ДНК HBV и степенью поражения печени (r = 0,362, p <0,0001) и стадией (r = 0,277, p = 0,0006, рисунок 5B). Эти результаты свидетельствуют о модулирующей роли HBeAg в развитии патологий печени при ХГВ.
Рисунок 5
Связь между сигналом ISH ДНК HBV и воспалением и фиброзом печени. Когорта была разделена на HBeAg-положительную (A) и отрицательную (B) группу, а уровни положительных ISH ДНК HBV были сгруппированы в соответствии с классификацией печени и оценкой стадии. ВГВ, вирус гепатита В; ISH, гибридизация in situ.
Когорта была разделена на HBeAg-положительную (A) и отрицательную (B) группу, а уровни положительных ISH ДНК HBV были сгруппированы в соответствии с классификацией печени и оценкой стадии. ВГВ, вирус гепатита В; ISH, гибридизация in situ.
Тройное окрашивание ДНК HBV, HBsAg и Sirius red в качестве удобного молекулярного патологического исследования вирусологического и гистологического статуса CHB
Поскольку предыдущие результаты предполагали пространственно различное распределение ДНК HBV и HBsAg в соответствии с нашим предыдущим отчетом, мы попытались объединить эти два маркера на одном срезе путем последовательного окрашивания ДНК HBV и HBsAg.Кроме того, мы провели контрастное окрашивание сириусом красным, чтобы получить гистологический фон коллагеновых волокон. Комбинация сине-фиолетового (ДНК HBV), коричневого (HBsAg) и красного цвета привела к высококонтрастному цветному контрасту, легко интерпретируемым изображениям (рис. 6). Важно отметить, что это тройное окрашивание выявило некоторые интересные явления.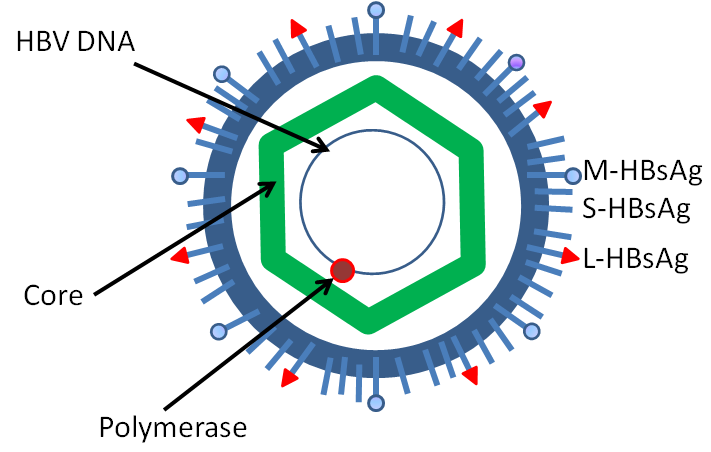 ДНК HBV и HBsAg в основном демонстрировали паттерн взаимного исключения, как мы сообщали.10 Кроме того, было обнаружено, что S-богатые клетки в основном располагались в минимально фиброзной области (рис. 6A), тогда как ДНК-положительные клетки HBV часто наблюдались окруженными. коллагеновыми волокнами (рис. 6B – D).На некоторых участках переходы между богатыми S и богатыми ДНК клетками можно было легко наблюдать около фиброзной области (рис. 6E – F, обратите внимание на клетки с ДНК и S-сигналом). В совокупности метод тройного окрашивания дает патологам более полное представление о вирусологической активности в отношении гистологического прогрессирования заболевания.
ДНК HBV и HBsAg в основном демонстрировали паттерн взаимного исключения, как мы сообщали.10 Кроме того, было обнаружено, что S-богатые клетки в основном располагались в минимально фиброзной области (рис. 6A), тогда как ДНК-положительные клетки HBV часто наблюдались окруженными. коллагеновыми волокнами (рис. 6B – D).На некоторых участках переходы между богатыми S и богатыми ДНК клетками можно было легко наблюдать около фиброзной области (рис. 6E – F, обратите внимание на клетки с ДНК и S-сигналом). В совокупности метод тройного окрашивания дает патологам более полное представление о вирусологической активности в отношении гистологического прогрессирования заболевания.
Рисунок 6
Типичные изображения тройного окрашивания ДНК HBV-HBsAg и сириуса красным. Для каждой панели была показана шкала масштаба. Были перечислены основные клинические параметры, такие как статус HBeAg, АЛТ (Ед / л), сывороточная ДНК HBV (МЕ / мл) и шкала Шойера.АЛТ, аланинтрансфераза; ВГВ, вирус гепатита В.
Обсуждение
Хотя было несколько широко доступных биомаркеров крови (вирусная нагрузка, количественный HBsAg, HBeAg, биохимические параметры сыворотки и т. Д.) Для оценки хронического заболевания печени, вызванного HBV, гистопатология печени предлагает более прямой взгляд на это заболевание. внутрипеченочный воспалительный фиброз. Кроме того, иммуноокрашивание вирусных антигенов может выявить более подробную информацию о статусе репликации вируса и продукции вирионов / субвирусных частиц.К сожалению, интерпретация этих результатов оказалась непростой. Предыдущие исследования показали, что ИГХ-окрашивание поверхностного антигена в основном генерировало цитоплазматический сигнал, расположенный в кластерных гепатоцитах. При наблюдении с помощью окрашивания H&E эти клетки демонстрировали эозинофильную, мелкозернистую, довольно плотную цитоплазму, что приводило к появлению матового стекла. Эта картина в основном наблюдается у иммунотолерантных пациентов и носителей. Однако окрашивание корового антигена методом ИГХ может показывать как ядерный, так и цитоплазматический паттерн и показало гораздо более сильную связь с острым лобулярным гепатитом и хроническим активным гепатитом.
Д.) Для оценки хронического заболевания печени, вызванного HBV, гистопатология печени предлагает более прямой взгляд на это заболевание. внутрипеченочный воспалительный фиброз. Кроме того, иммуноокрашивание вирусных антигенов может выявить более подробную информацию о статусе репликации вируса и продукции вирионов / субвирусных частиц.К сожалению, интерпретация этих результатов оказалась непростой. Предыдущие исследования показали, что ИГХ-окрашивание поверхностного антигена в основном генерировало цитоплазматический сигнал, расположенный в кластерных гепатоцитах. При наблюдении с помощью окрашивания H&E эти клетки демонстрировали эозинофильную, мелкозернистую, довольно плотную цитоплазму, что приводило к появлению матового стекла. Эта картина в основном наблюдается у иммунотолерантных пациентов и носителей. Однако окрашивание корового антигена методом ИГХ может показывать как ядерный, так и цитоплазматический паттерн и показало гораздо более сильную связь с острым лобулярным гепатитом и хроническим активным гепатитом.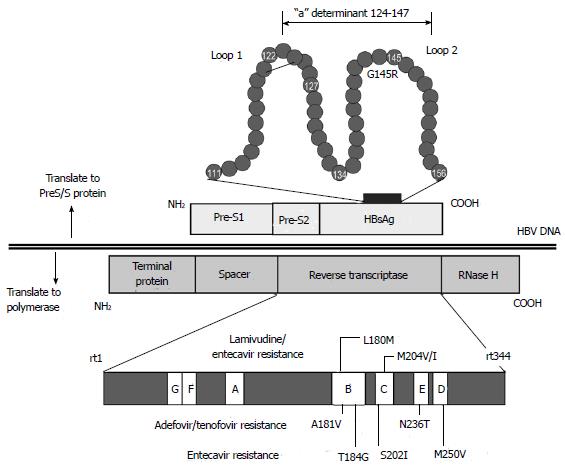 12–14 Действительно, мы ранее обнаружили мозаичное распределение вирусного поверхностного и корового антигена вместе с ДНК HBV, что позволило предположить более сложную картину образа жизни HBV на одноклеточном уровне.10 В этом исследовании мы применили недавно установленную ДНК HBV в Анализ ISH в большой когорте пациентов с ХГВ и сравнение его эффективности с хорошо зарекомендовавшими себя анализами IHC.
12–14 Действительно, мы ранее обнаружили мозаичное распределение вирусного поверхностного и корового антигена вместе с ДНК HBV, что позволило предположить более сложную картину образа жизни HBV на одноклеточном уровне.10 В этом исследовании мы применили недавно установленную ДНК HBV в Анализ ISH в большой когорте пациентов с ХГВ и сравнение его эффективности с хорошо зарекомендовавшими себя анализами IHC.
Благодаря обширной оптимизации анализа, наш анализ ISH ДНК HBV обеспечил высокий уровень обнаружения в образцах CHB, который сравним с таковым для HBsAg IHC, при сохранении высокой специфичности.В соответствии с предыдущей публикацией, распределение ДНК HBV и поверхностного антигена в значительной степени отличается, как показано при прямом сравнении сканирований всего сечения. Однако цитоплазматическое окрашивание корового антигена показало гораздо более сильную пространственную связь с ДНК HBV. Однако ИГХ корового антигена менее чувствительна, поскольку только 42,8% срезов показали положительный результат.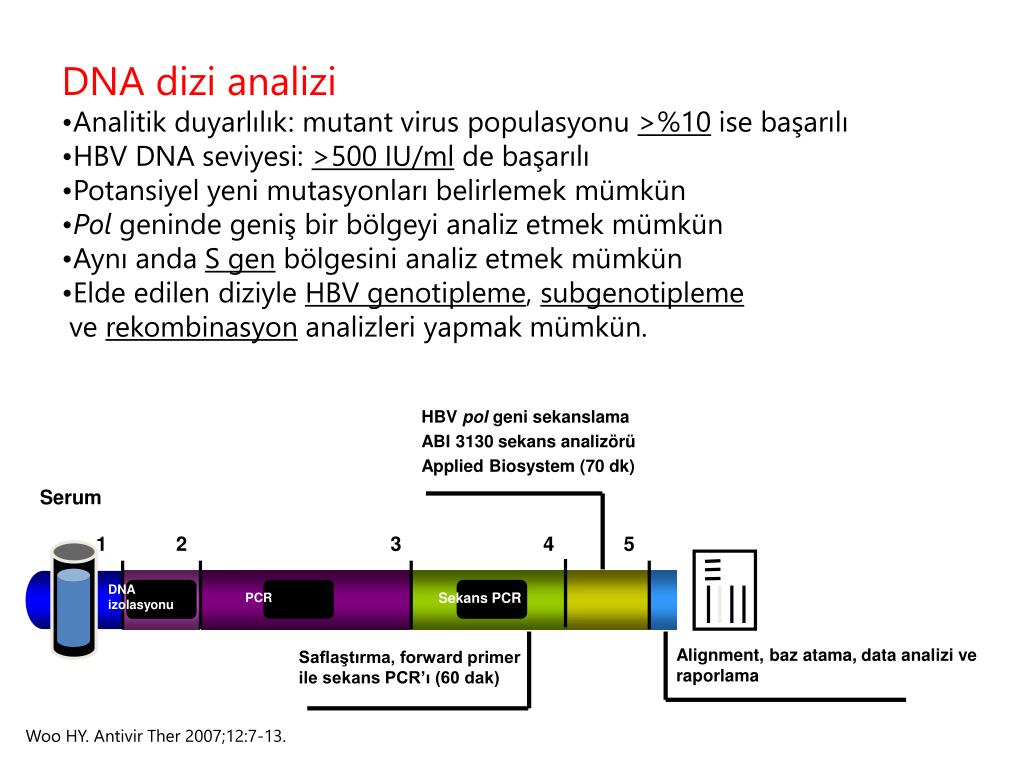
Затем мы оценили клиническую значимость анализа ISH ДНК HBV в контексте клинически доступных и новых биомаркеров, таких как HBcrAg и HBcAb.Мы обнаружили, что сигнал ISH ДНК HBV сильно коррелирует с вирусной нагрузкой в сыворотке, HBcrAg и, в меньшей степени, титром HBsAg. Эту закономерность разделяет ИГХ корового антигена, хотя она имеет гораздо более низкий процент положительных результатов. Интересно, что сигнал ISH ДНК HBV обнаруживает HBeAg-зависимую связь с титром HBcAb. Эта тенденция была также обнаружена между вирусной нагрузкой и HBcAb. Действительно, количественные уровни основных антител, как сообщается, тесно связаны с активностью гепатита 15, процесс, в значительной степени зависящий от статуса HBeAg.
Помимо ISH ДНК HBV, мы также разработали метод тройного окрашивания, при котором на одном и том же срезе можно наблюдать репликацию вируса, экспрессию поверхностного вирусного антигена и коллагеновые волокна. Это дает нам уникальное комплексное представление о прогрессировании заболевания и обеспечивает важную пространственную взаимосвязь между вирусологическими и гистологическими событиями, что является информативным как для фундаментальных клинических исследований, так и для точной патологической диагностики.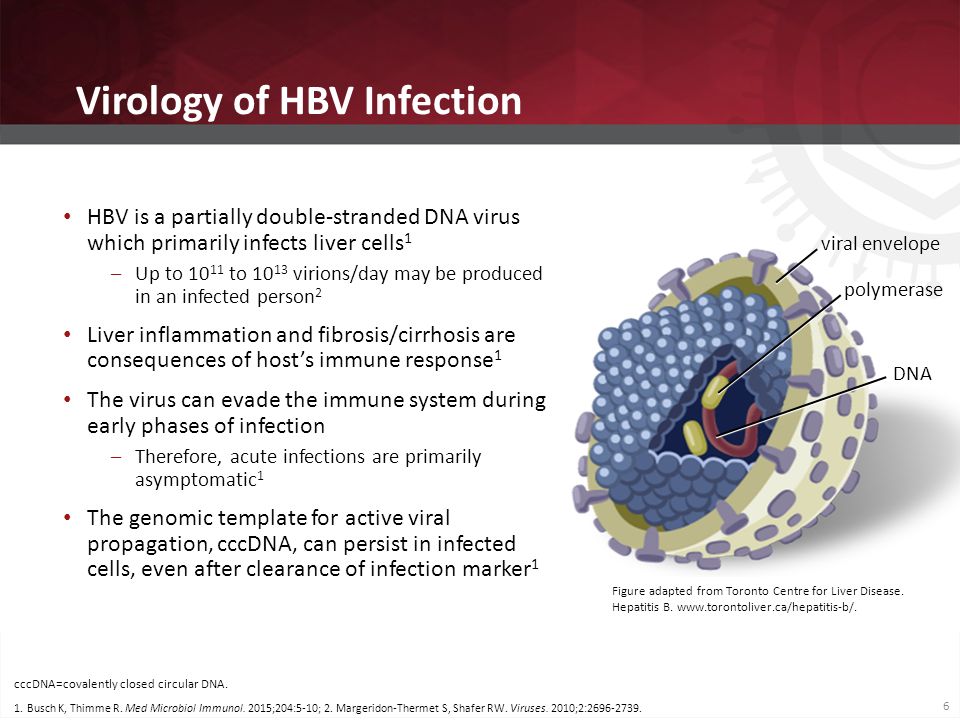
Взятые вместе, основанные на клинической группе из 313 случаев ХГВ, ISH ДНК HBV проявляет чувствительность и специфичность, сходную с таковой HBsAg IHC, но с отчетливым гистологическим распределением.Он информирует о внутрипеченочной вирусологической активности и коррелирует с существующими биомаркерами. Таким образом, он является многообещающим новым исследованием молекулярной патологии для точной диагностики заболеваний печени, вызванных HBV.
Take home messages
Разработанный in situ анализ гибридизации ДНК вируса гепатита B (HBV) показал высокий уровень чувствительности и специфичности в когорте из 313 пациентов с хроническим гепатитом B.
Новый протокол тройного окрашивания, который сочетает в себе определение ДНК HBV, HBsAg и коллагеновых волокон, позволяет лучше оценить репликацию вируса и экспрессию антигена в контексте фиброза печени.
Обнаруживаемая ДНК HBV в сравнении с аналогами нуклеоз (т) идов стратифицирует прогнозируемую оценку риска гепатоцеллюлярной карциномы
Исходные характеристики пациентов
Все пациенты с ХГВ постоянно получали терапию НА.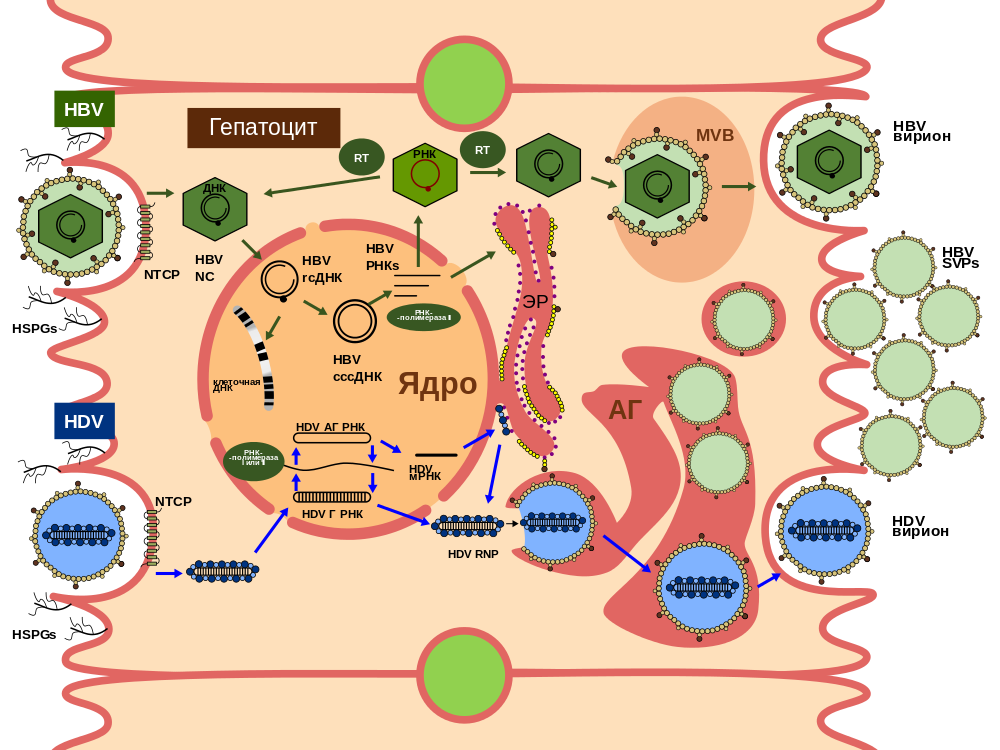 С октября 2006 г. по август 2018 г. 1652 пациента начали получать терапию NA (ETV / TDF / TAF = 1010/270/372). Пациенты, которые наблюдались менее 1 года, имели в анамнезе ГЦК или демонстрировали развитие ГЦК в течение первого года лечения, не были включены в эту когорту.Всего в анализ были включены 1183 пациента, получавших терапию НА. Было 700 пациентов, ранее не получавших лечения, и 483 пациента ранее лечились. Общее кумулятивное число пациентов, ранее леченных NA, кроме ETV / TDF / TAF, составляло 381, а терапию на основе интерферона — 169. Среди них 703 (59,4%) пациента были мужчинами; средний возраст составил 52,9 ± 12,9 года; У 177 (14,9%) пациентов диагностирован цирроз печени; и 401 (33,8%) пациент были положительными по антигену гепатита В (HBeAg). Исходные данные сыворотки (тромбоциты, альбумин, билирубин, аланинаминотрансфераза, альфа-фетопротеин, креатинин и уровни ДНК HBV в сыворотке) описаны в таблице 1.Средняя продолжительность наблюдения составила 4,9 (1,0–12,9) года.
С октября 2006 г. по август 2018 г. 1652 пациента начали получать терапию NA (ETV / TDF / TAF = 1010/270/372). Пациенты, которые наблюдались менее 1 года, имели в анамнезе ГЦК или демонстрировали развитие ГЦК в течение первого года лечения, не были включены в эту когорту.Всего в анализ были включены 1183 пациента, получавших терапию НА. Было 700 пациентов, ранее не получавших лечения, и 483 пациента ранее лечились. Общее кумулятивное число пациентов, ранее леченных NA, кроме ETV / TDF / TAF, составляло 381, а терапию на основе интерферона — 169. Среди них 703 (59,4%) пациента были мужчинами; средний возраст составил 52,9 ± 12,9 года; У 177 (14,9%) пациентов диагностирован цирроз печени; и 401 (33,8%) пациент были положительными по антигену гепатита В (HBeAg). Исходные данные сыворотки (тромбоциты, альбумин, билирубин, аланинаминотрансфераза, альфа-фетопротеин, креатинин и уровни ДНК HBV в сыворотке) описаны в таблице 1.Средняя продолжительность наблюдения составила 4,9 (1,0–12,9) года. Наконец, 780 (65,9%), 206 (17,4%) и 197 (16,7%) пациентов получали терапию ETV, TDF и TAF соответственно.
Наконец, 780 (65,9%), 206 (17,4%) и 197 (16,7%) пациентов получали терапию ETV, TDF и TAF соответственно.
Таблица 1 Клинические характеристики пациентов, получавших NA, в начале исследования.
Кумулятивная частота ГЦК
В ходе последующего наблюдения у 52 (4,39%) пациентов развился ГЦК, как показано в таблице 2 клинических характеристик на момент постановки диагноза. Кумулятивная частота ГЦК через 3, 5, 7 и 10 лет после ETV / TDF / TAF было 2.03%, 4,61%, 5,74% и 7,34% соответственно (рис. 1А). Было 27 пациентов, которые умерли почти не по причинам, связанным с печенью (другой рак 15, внутричерепное кровоизлияние 1, пневмония 2, сердечная недостаточность 1, почечная недостаточность 1, смерть, связанная с печенью 3, неизвестно 4).
Таблица 2 Клинические характеристики пациентов с ГЦК при постановке диагноза.
Рисунок 1
Совокупная заболеваемость гепатоцеллюлярной карциномой. ( A ) Все пациенты с ХГВ получали терапию НА. ( B ) Статус ДНК HBV; 732 (61.8%) и 451 (38,2%) пациент достигли непрерывно неопределяемого статуса ДНК HBV и детектируемого статуса ДНК HBV соответственно. Пациенты, которые достигли или не достигли постоянно неопределяемого статуса ДНК HBV (лог-ранговый тест, P <0,001).
( A ) Все пациенты с ХГВ получали терапию НА. ( B ) Статус ДНК HBV; 732 (61.8%) и 451 (38,2%) пациент достигли непрерывно неопределяемого статуса ДНК HBV и детектируемого статуса ДНК HBV соответственно. Пациенты, которые достигли или не достигли постоянно неопределяемого статуса ДНК HBV (лог-ранговый тест, P <0,001).
Факторы, связанные с развитием HCC во время терапии NA
В дополнение к исходным характеристикам, которые использовались для анализа факторов, связанных с HCC, мы также сосредоточили внимание на статусе ДНК HBV во время терапии NA. Мы исследовали влияние этого статуса ДНК HBV у пациентов с ХГВ на канцерогенез в печени.Мы обнаружили, что 732 (61,8%) и 451 (38,2%) пациента постоянно достигли неопределяемого и определяемого статуса ДНК HBV соответственно. Выявляемая ДНК HBV была значительно связана с более высоким риском развития HCC по сравнению с постоянно не определяемой ДНК HBV (HR 2,442; 95% ДИ 1,366–4,367; лог-ранговый тест, P <0,001; рис.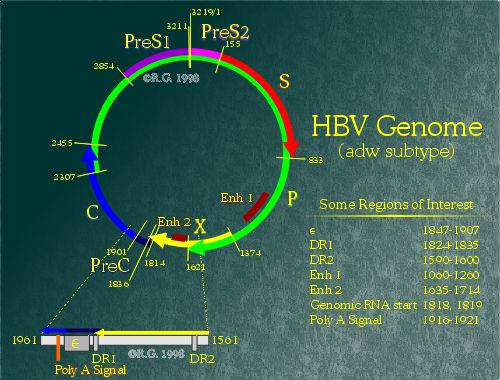 1B). Для подробностей, средний уровень ДНК HBV в сыворотке у пациентов с детектируемой ДНК составлял 2,5 (1,88, 3,25) Log МЕ / мл. Вирусологический прорыв был отмечен у 2 пациентов, у которых были обнаружены устойчивые мутанты HBV.Все они были спасены, добавив TDF к ETV. Было 36 пациентов, у которых никогда не было неопределяемой ДНК HBV, и у 141 пациента был вирусологический рецидив после полного подавления, соответственно. Однако эти факторы существенно не различались по риску развития ГЦК.
1B). Для подробностей, средний уровень ДНК HBV в сыворотке у пациентов с детектируемой ДНК составлял 2,5 (1,88, 3,25) Log МЕ / мл. Вирусологический прорыв был отмечен у 2 пациентов, у которых были обнаружены устойчивые мутанты HBV.Все они были спасены, добавив TDF к ETV. Было 36 пациентов, у которых никогда не было неопределяемой ДНК HBV, и у 141 пациента был вирусологический рецидив после полного подавления, соответственно. Однако эти факторы существенно не различались по риску развития ГЦК.
27 пациентов достигли сероклинирования поверхностного антигена гепатита B (HBsAg), и ни у одного пациента не развился ГЦК.
Затем мы исследовали прогностические факторы ГЦК, используя одномерный и многомерный анализ.В однофакторном анализе мужской пол, пожилой возраст, цирроз, более низкое количество тромбоцитов (<150 × 10 9 / л), более низкий уровень альбумина, более высокий уровень билирубина, оценка ALBI 27 (которая состоит из альбумина и билирубина и полезны для оценки функции печени), употребление алкоголя и определяемая ДНК HBV были важными прогностическими факторами ГЦК.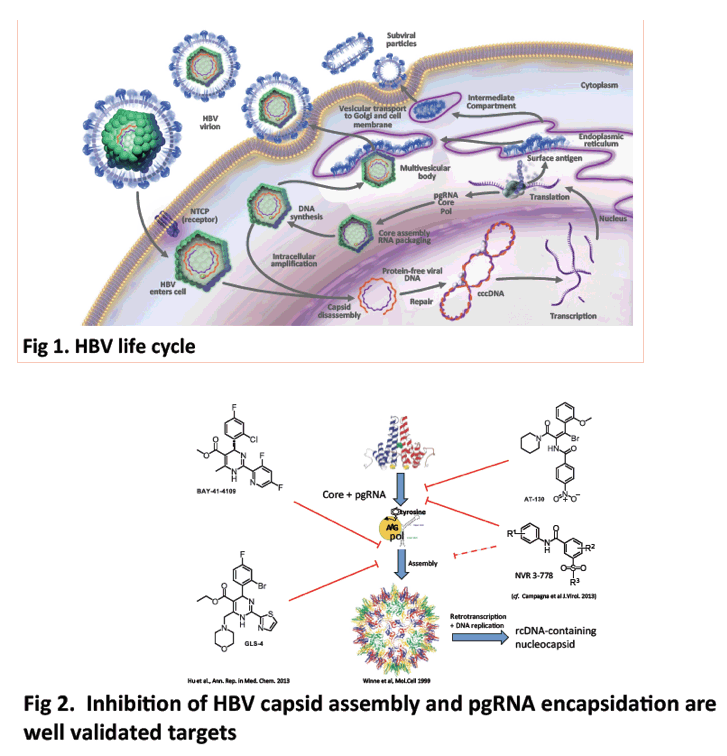 В многомерном анализе мужской пол (ОР 3,731; 95% ДИ 1,669–8,340; P = 0,001), пожилой возраст (ОР 1,06; 95% ДИ 1.033–1.088; P <0,001), цирроз (HR 2,59; 95% ДИ 1,288–5,205; P = 0,007), более низкое количество тромбоцитов (HR 2,763; 95% ДИ 1,231-6,203; P = 0,013) и обнаруживаемый HBV. ДНК (ОР 3,234; 95% ДИ 1,732–6,035; P <0,001) были независимыми прогностическими факторами развития ГЦК во время терапии НА (Таблица 3).
В многомерном анализе мужской пол (ОР 3,731; 95% ДИ 1,669–8,340; P = 0,001), пожилой возраст (ОР 1,06; 95% ДИ 1.033–1.088; P <0,001), цирроз (HR 2,59; 95% ДИ 1,288–5,205; P = 0,007), более низкое количество тромбоцитов (HR 2,763; 95% ДИ 1,231-6,203; P = 0,013) и обнаруживаемый HBV. ДНК (ОР 3,234; 95% ДИ 1,732–6,035; P <0,001) были независимыми прогностическими факторами развития ГЦК во время терапии НА (Таблица 3).
Таблица 3 Регрессионный анализ пропорциональных рисков Кокса для факторов, связанных с ГЦК.
Кроме того, мы выполнили анализ подгруппы с анализом статуса ДНК HBV, цирроза и HBeAg.Статус ДНК HBV при использовании аналогов нуклеоз (т) идов может значительно разделить риск развития ГЦК в этих подгруппах (дополнительный рисунок 1).
В частности, у пациентов, ранее не получавших лечения (n = 700), совокупная частота ГЦК у пациентов с более высокими уровнями ДНК HBV до лечения (> 4,0 log МЕ / мл) была значительно выше (HR 5,446; 95% ДИ 2,111–14,05; логранговый тест, P = 0,0413) (дополнительный рисунок 2A). В качестве прогнозирующего фактора для достижения постоянно неопределяемой ДНК HBV, сывороточная ДНК HBV через 1 год после начала NA существенно связана с достижением постоянно неопределяемой ДНК HBV ( P <0.0001, логистическая регрессия). Статус ДНК HBV через 1 год после начала NA также был значимым фактором риска развития HCC (HR 2,279; 95% CI 1,214–4,278; лог-ранговый тест, P = 0,0303) (дополнительный рисунок 2B).
В качестве прогнозирующего фактора для достижения постоянно неопределяемой ДНК HBV, сывороточная ДНК HBV через 1 год после начала NA существенно связана с достижением постоянно неопределяемой ДНК HBV ( P <0.0001, логистическая регрессия). Статус ДНК HBV через 1 год после начала NA также был значимым фактором риска развития HCC (HR 2,279; 95% CI 1,214–4,278; лог-ранговый тест, P = 0,0303) (дополнительный рисунок 2B).
Статус ДНК HBV стратифицирует прогностическую оценку PAGE-B HCC
Как описано выше, мужской пол, пожилой возраст и более низкое количество тромбоцитов были независимыми прогностическими факторами развития HCC во время терапии NA. Оценка PAGE-B была разработана с использованием этих факторов у пациентов с ХГВ, получающих противовирусную терапию, и продемонстрировала высокое значение индекса согласованности для прогнозирования развития ГЦК 21,22 .Мы проверили оценку PAGE-B в нашей когорте (рис. 2A) и обнаружили, что она была достаточно полезной.
Рисунок 2
Кумулятивная частота гепатоцеллюлярной карциномы с оценкой PAGE-B, подразделенной в соответствии со статусом ДНК HBV при терапии NA. ( A ) Совокупные показатели заболеваемости ГЦК на основе PAGE-B. По шкале PAGE-B 240 (20,3%), 661 (55,9%) и 282 (23,8%) пациентов были отнесены к группам низкого, среднего и высокого риска соответственно. ( B ) Пациенты, которые достигли или не достигли постоянно неопределяемого статуса ДНК HBV в группах среднего и высокого риска PAGE-B.Статус ДНК HBV классифицировал пациентов среднего и высокого риска (на основе PAGE-B) на подгруппы (лог-ранговый тест, P = 0,0238, P <0,001). ( C ) Оценка PAGE-B была стратифицирована с использованием статуса ДНК HBV.
Мы классифицировали 240 (20,3%), 661 (55,9%) и 282 (23,8%) пациентов на группы низкого, среднего и высокого риска соответственно. Однако большинство пациентов относились к группе промежуточного риска. Поэтому мы исследовали, может ли статус ДНК HBV при терапии NA подразделить PAGE-B группу промежуточного риска.
Мы наблюдали, что 404 (61,1%) и 257 (38,9%) пациентов достигли постоянно неопределяемой и детектируемой ДНК HBV соответственно. В группе промежуточного риска PAGE-B обнаруживаемая ДНК HBV была значительно связана с более высоким риском развития HCC по сравнению с постоянно необнаруживаемой ДНК HBV (HR 3,338; 95% CI 1,045–10,66; лог-ранговый тест, P = 0,0238; рис. 2Б, левая панель). Кроме того, в группе высокого риска PAGE-B обнаруживаемая ДНК HBV также была значительно связана с более высоким риском развития HCC (HR 3.191; 95% ДИ 1,543–6,597; логранговый тест, P <0,001; Рис. 2Б, правая панель). Кумулятивная частота ГЦК в группе высокого риска PAGE-B с постоянно отрицательной ДНК HBV была значительно выше по сравнению с таковой, наблюдаемой в группе PAGE-B промежуточного риска с детектируемым статусом ДНК HBV (HR 2.369; 95% CI 1.098). –5,111; логарифмический критерий P = 0,0352). В группе низкого риска PAGE-B выявлен единичный случай развития ГЦК. Таким образом, группа низкого риска могла показать свою функциональность как есть.
На основании этих результатов, PAGE-B был значительно расслоен при разделении на пять групп на основе статуса ДНК HBV (рис. 2C). Статус ДНК HBV при терапии NA дополнял оценку PAGE-B.
Эта модель прогнозирования PAGE-B – ДНК полезна для строгой оценки совокупного уровня заболеваемости ГЦК через 3, 5, 7 и 10 лет у пациентов с ХГВ, получающих противовирусную терапию (Таблица 4). Различительная способность наших моделей сравнивалась с помощью информационного критерия Акаике (AIC).Значения AIC были настолько малы, что лучшая различительная способность прогнозирования развития HCC была показана в PAGE-B-ДНК (дополнительная таблица 1).
Таблица 4 Совокупный уровень заболеваемости ГЦК с расслоениями модели прогнозирования PAGE-B-ДНК через 3,5,7 и 10 лет.
Оценка гепатита В без количественной оценки ДНК вируса гепатита В: проспективное когортное исследование в Уганде | Труды Королевского общества тропической медицины и гигиены
Абстрактные
Общие сведения
Хроническая инфекция гепатита B поражает 240 миллионов человек, с наибольшей распространенностью в Африке и Азии, и ежегодно приводит к 700 000 смертей.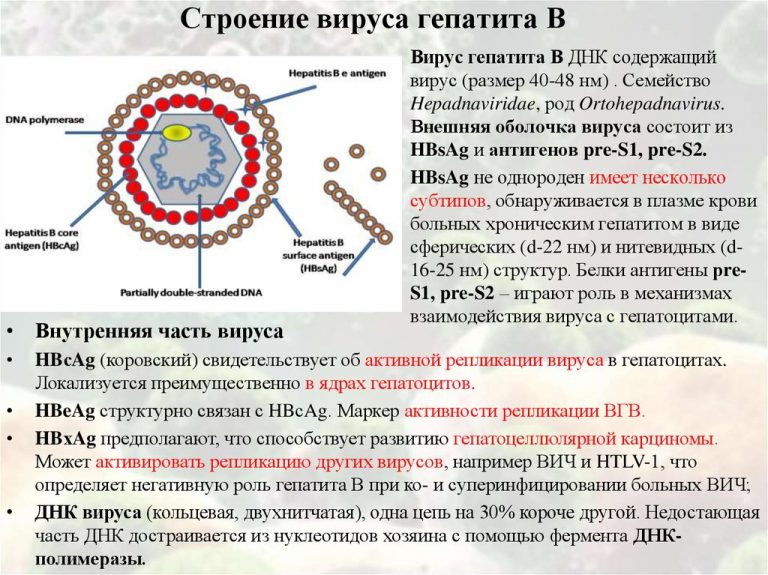 Доступ к диагностическим средствам, особенно для количественной оценки вирусной нагрузки вируса гепатита B (ДНК HBV), является серьезным препятствием для лечения. Мы стремились протестировать рекомендации Всемирной организации здравоохранения по ведению гепатита В в условиях ограниченных ресурсов.
Доступ к диагностическим средствам, особенно для количественной оценки вирусной нагрузки вируса гепатита B (ДНК HBV), является серьезным препятствием для лечения. Мы стремились протестировать рекомендации Всемирной организации здравоохранения по ведению гепатита В в условиях ограниченных ресурсов.
Методы
Мы сравнили распределение лечения с использованием и без использования ДНК HBV в когорте в Уганде. Перспективно набирали взрослых, не получавших лечения, — положительный тест на поверхностный антиген гепатита В, отрицательный на вирус иммунодефицита человека. По результатам ультразвукового исследования печени и рутинных гематологических и биохимических исследований были произведены предварительные распределения на группы лечения и наблюдения.Для каждого участника был проведен анализ ДНК HBV, и были приняты окончательные решения о лечении, которые сравнили с предварительными распределениями.
Результаты
Полная оценка была проведена для 100 участников; лечение было показано в 20.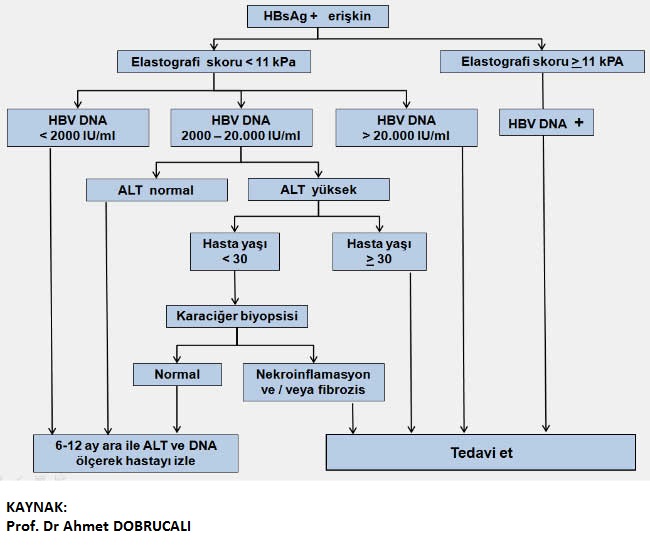 Оценка без ДНК HBV выявила пациентов для лечения с положительной прогностической ценностью 88,2% и отрицательной прогностической ценностью 94% по сравнению с оценкой с использованием ДНК HBV.
Оценка без ДНК HBV выявила пациентов для лечения с положительной прогностической ценностью 88,2% и отрицательной прогностической ценностью 94% по сравнению с оценкой с использованием ДНК HBV.
Выводы
Если ДНК HBV недоступна, пациентов с гепатитом B можно обследовать с помощью УЗИ печени и стандартных лабораторных тестов.Эти результаты позволят врачам в условиях ограниченных ресурсов с большей готовностью начинать лечение и информировать политику в отношении элиминации вирусного гепатита.
Введение
Хронический гепатит В (ХГВ) поражает 240 миллионов человек во всем мире 1 и ежегодно уносит жизни около 700 000 человек из-за осложнений гепатоцеллюлярной карциномы (ГЦК) и цирроза, преимущественно в странах с низким и средним уровнем дохода (СНСД). 2,3 После длительного периода забвения 4 гепатит В стал в центре внимания глобальной политики здравоохранения.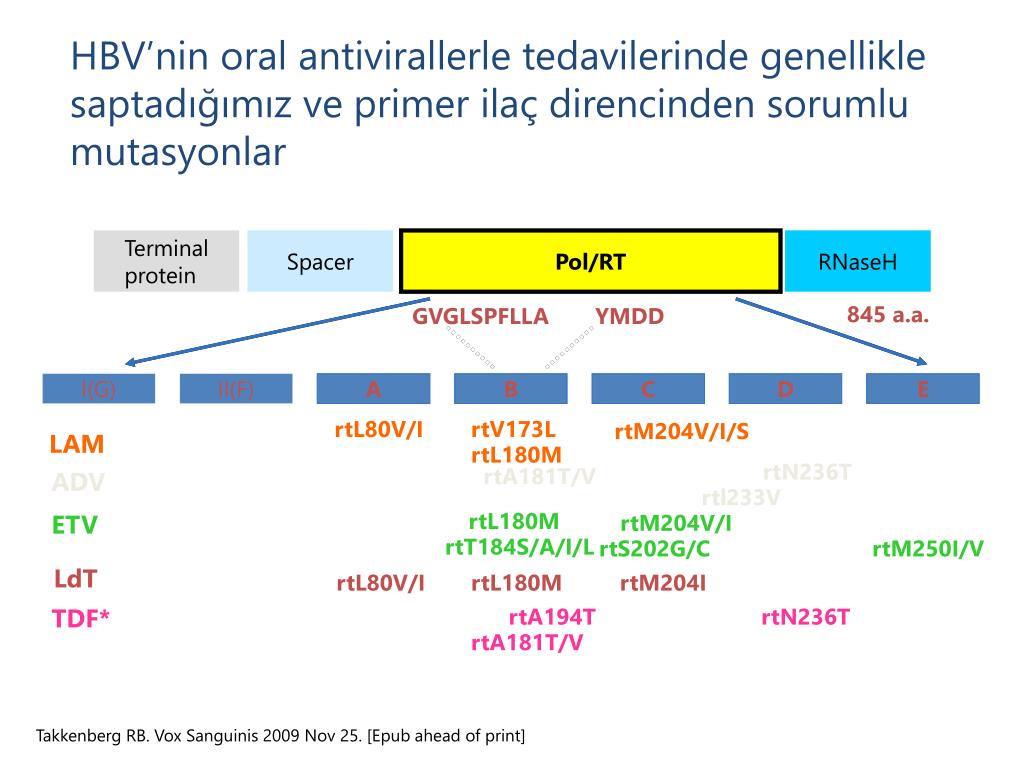 В соответствии с резолюцией Всемирной ассамблеи здравоохранения о вирусном гепатите в 2014 г. Всемирная организация здравоохранения (ВОЗ) опубликовала руководящие принципы для ХГВ в марте 2015 г. 5 и Глобальную стратегию сектора здравоохранения по вирусному гепатиту в июне 2016 г. 6 В этих документах описывается цель ликвидировать вирусный гепатит как угрозу общественному здоровью к 2030 году, в том числе снизить смертность от вирусного гепатита на 65% по сравнению с исходной точкой в 2016 году, когда в настоящее время лечение получают менее 1% людей с вирусным гепатитом.В отсутствие крупномасштабного международного финансирования ответственность за разработку национальных руководств и обеспечение лечения лежит на странах-членах. Терапия нуклеозидными ингибиторами обратной транскриптазы, такими как тенофовир, контролирует репликацию вируса, 7 обращает вспять фиброз 8 и снижает риск ГЦК. 9 Эти препараты безопасны и хорошо переносятся при ХГВ.
В соответствии с резолюцией Всемирной ассамблеи здравоохранения о вирусном гепатите в 2014 г. Всемирная организация здравоохранения (ВОЗ) опубликовала руководящие принципы для ХГВ в марте 2015 г. 5 и Глобальную стратегию сектора здравоохранения по вирусному гепатиту в июне 2016 г. 6 В этих документах описывается цель ликвидировать вирусный гепатит как угрозу общественному здоровью к 2030 году, в том числе снизить смертность от вирусного гепатита на 65% по сравнению с исходной точкой в 2016 году, когда в настоящее время лечение получают менее 1% людей с вирусным гепатитом.В отсутствие крупномасштабного международного финансирования ответственность за разработку национальных руководств и обеспечение лечения лежит на странах-членах. Терапия нуклеозидными ингибиторами обратной транскриптазы, такими как тенофовир, контролирует репликацию вируса, 7 обращает вспять фиброз 8 и снижает риск ГЦК. 9 Эти препараты безопасны и хорошо переносятся при ХГВ. 10
10
Одним из основных препятствий на пути медикаментозного лечения гепатита B является стоимость и доступность исследований, которые в настоящее время считаются ключевыми для оценки состояния пациентов.Количественная оценка вирусной нагрузки ДНК вируса гепатита В (HBV) выполняется с помощью полимеразной цепной реакции (ПЦР) в реальном времени, а неинвазивные измерения фиброза печени (например, транзиторная эластография) количественно оцениваются с помощью таких устройств, как FibroScan (транзиторная эластография). Вместе с сывороточной аланинтрансаминазой (АЛТ) эти исследования рекомендуются для обоснования решений по лечению в европейских, 11 американских 12 и азиатских 13 руководящих принципах лечения гепатита B, но они слишком дороги для многих систем здравоохранения СНСД.Одно описательное исследование отношения гепатологов на конференции в Западной Африке показало, что стоимость и доступность исследований были основными причинами, по которым они не проводились. 14 Другое качественное исследование, основанное на интервью с пациентами, их родственниками и медицинскими работниками в Буркина-Фасо, выявило доступ и платежеспособность в качестве основных препятствий для получения медицинской помощи. 15 Нет надежных альтернатив для развивающихся стран и нет руководств по лечению гепатита B в Африке.Индекс соотношения аспартатаминотрансфераза: тромбоциты (APRI) был разработан для использования при инфекции гепатита C, где он работает хорошо, но имеет низкую чувствительность и специфичность при гепатите B. 16 Руководящие принципы ВОЗ 5 2015 года включают рекомендации по ведению пациентов в условиях Количественный анализ ДНК HBV недоступен, включая использование APRI, но следует признать пробелы в исследованиях в показаниях для начала или отсрочки лечения в странах Африки к югу от Сахары. В отсутствие финансирования широкомасштабных подходов к обследованию и лечению, 17 , существует потребность в упрощенной клинической оценке гепатита B, подходящей для СНСД, чтобы добиться расширения масштабов лечения, необходимого для снижения смертности.
14 Другое качественное исследование, основанное на интервью с пациентами, их родственниками и медицинскими работниками в Буркина-Фасо, выявило доступ и платежеспособность в качестве основных препятствий для получения медицинской помощи. 15 Нет надежных альтернатив для развивающихся стран и нет руководств по лечению гепатита B в Африке.Индекс соотношения аспартатаминотрансфераза: тромбоциты (APRI) был разработан для использования при инфекции гепатита C, где он работает хорошо, но имеет низкую чувствительность и специфичность при гепатите B. 16 Руководящие принципы ВОЗ 5 2015 года включают рекомендации по ведению пациентов в условиях Количественный анализ ДНК HBV недоступен, включая использование APRI, но следует признать пробелы в исследованиях в показаниях для начала или отсрочки лечения в странах Африки к югу от Сахары. В отсутствие финансирования широкомасштабных подходов к обследованию и лечению, 17 , существует потребность в упрощенной клинической оценке гепатита B, подходящей для СНСД, чтобы добиться расширения масштабов лечения, необходимого для снижения смертности. 18
18
В Уганде распространенность носительства поверхностного антигена гепатита B (HBsAg) колеблется от 5% в столице Кампале до 20% в сельской местности на севере. 19 Недавнее обследование распространенности среди населения в провинции Гулу продемонстрировало распространенность 17%. 20 В ответ на такую высокую распространенность мы хотели установить эффективность замены использования ДНК ВГВ и АЛТ на использование только АЛТ, основываясь на рекомендациях ВОЗ, в качестве доступного подхода к оценке ХГВ.Соответственно, мы разработали прагматическое исследование, основанное на местной инфраструктуре здравоохранения, как реальную проверку этого подхода.
Методы
Дизайн исследования и участники
Для сравнения алгоритмов начала лечения использовалось проспективное когортное исследование с одной группой.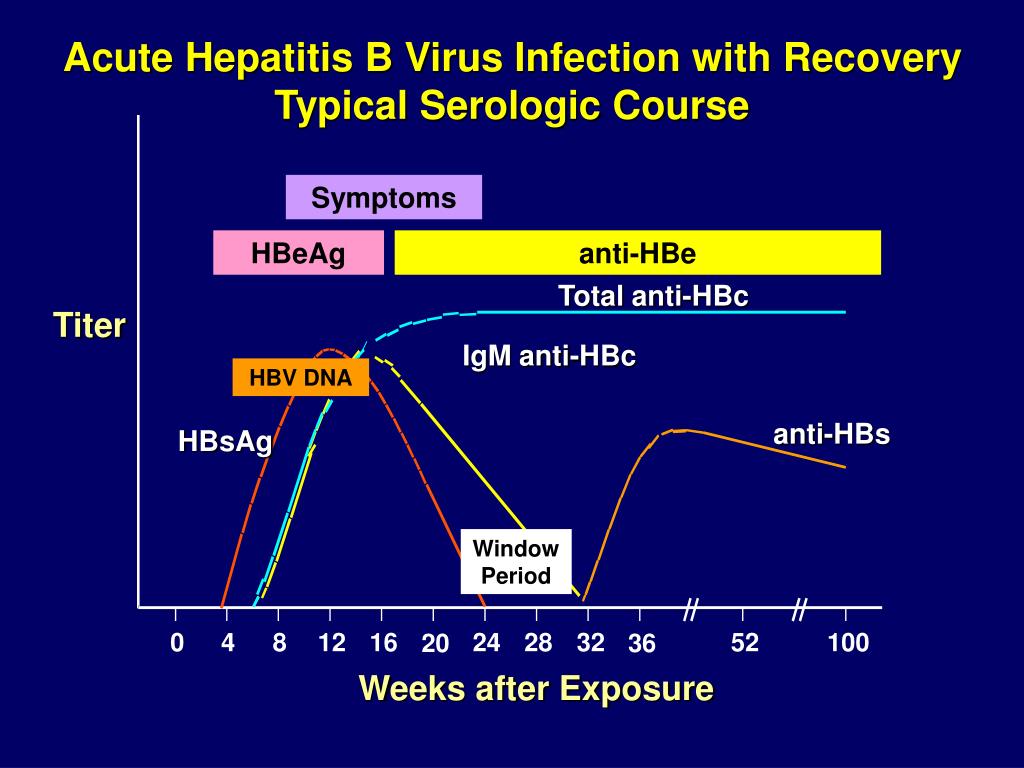 Пациенты были направлены на исследование клиническими сотрудниками и врачами больницы Святой Марии Lacor из амбулаторных или стационарных служб, если у них был положительный тест на HBsAg и отрицательный тест на вирус иммунодефицита человека (ВИЧ).Направления были проверены на соответствие критериям приема. Лицам, чей ВИЧ-статус был неизвестен, предлагалось пройти тестирование. Пациенты включались в исследование только в случае отрицательного результата на ВИЧ. ВИЧ-позитивные люди были направлены в местную программу лечения ВИЧ для лечения сочетанной инфекции ВИЧ / ВГВ. Объяснение исследования и согласие получено на местном языке. Размер выборки 103 был рассчитан так, чтобы дать 80% мощности для обнаружения 15% разницы между оценками «на основе АЛТ» и «с ДНК ВГВ» с помощью теста Макнемара.
Пациенты были направлены на исследование клиническими сотрудниками и врачами больницы Святой Марии Lacor из амбулаторных или стационарных служб, если у них был положительный тест на HBsAg и отрицательный тест на вирус иммунодефицита человека (ВИЧ).Направления были проверены на соответствие критериям приема. Лицам, чей ВИЧ-статус был неизвестен, предлагалось пройти тестирование. Пациенты включались в исследование только в случае отрицательного результата на ВИЧ. ВИЧ-позитивные люди были направлены в местную программу лечения ВИЧ для лечения сочетанной инфекции ВИЧ / ВГВ. Объяснение исследования и согласие получено на местном языке. Размер выборки 103 был рассчитан так, чтобы дать 80% мощности для обнаружения 15% разницы между оценками «на основе АЛТ» и «с ДНК ВГВ» с помощью теста Макнемара.
Лабораторные процедуры
Клинические оценки были выполнены клиническим руководителем исследования и рассмотрены врачом-исследователем. У всех пациентов полный анализ крови (FBC), функциональные пробы печени (LFT) и креатинин сыворотки (SCr) были измерены в клинической лаборатории Lacor больницы Святой Марии с использованием автоматического анализатора Human Diagnostics 5L (Висбаден, Германия) и клинического анализа Humastar 600. химическая платформа (Висбаден, Германия). Гамма-глутамилтрансфераза не является частью локальной функциональной панели печени и не измерялась.Ультразвуковое исследование печени было проведено специалистами по ультразвуковой диагностике в больнице Святой Марии Лакор. На этом этапе, до получения результатов по вирусной нагрузке, было выполнено моделирование распределения пациентов по лечению с помощью алгоритма «на основе ALT» (рис. 3). Вирусную нагрузку ДНК гепатита B измеряли у каждого пациента с помощью ПЦР в реальном времени с использованием теста COBAS AmpliPrep / COBAS TaqMan HBV (Roche, Базель, Швейцария).
У всех пациентов полный анализ крови (FBC), функциональные пробы печени (LFT) и креатинин сыворотки (SCr) были измерены в клинической лаборатории Lacor больницы Святой Марии с использованием автоматического анализатора Human Diagnostics 5L (Висбаден, Германия) и клинического анализа Humastar 600. химическая платформа (Висбаден, Германия). Гамма-глутамилтрансфераза не является частью локальной функциональной панели печени и не измерялась.Ультразвуковое исследование печени было проведено специалистами по ультразвуковой диагностике в больнице Святой Марии Лакор. На этом этапе, до получения результатов по вирусной нагрузке, было выполнено моделирование распределения пациентов по лечению с помощью алгоритма «на основе ALT» (рис. 3). Вирусную нагрузку ДНК гепатита B измеряли у каждого пациента с помощью ПЦР в реальном времени с использованием теста COBAS AmpliPrep / COBAS TaqMan HBV (Roche, Базель, Швейцария).
Лечение
Решения о лечении были приняты независимо двумя авторами с использованием оценки «с ДНК ВГВ» (рис.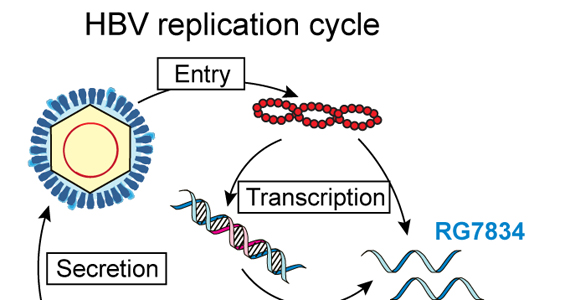 2), расхождения были обсуждены, и был согласован окончательный план лечения.Пациенты соответствовали критериям лечения, если имелись признаки цирроза (APRI> 2 или ультразвуковое исследование, подтверждающее цирроз) или активного гепатита, связанного с HBV (ALT> 50 МЕ / л и ДНК HBV> 20 000 МЕ / мл). Пациентам, назначенным на лечение, предлагали тенофовир дизопроксил фумарат 300 мг один раз в день, скорректированный в соответствии с клиренсом креатинина 21 , и наблюдали в соответствии с рекомендациями ВОЗ. 5 Пациентам, отнесенным к группе наблюдения, было предложено наблюдение в поликлинике стационара.Тенофовир был подарен Gilead Sciences (Фостер-Сити, Калифорния, США). Gilead Sciences не принимала участия в планировании исследования или анализе данных.
2), расхождения были обсуждены, и был согласован окончательный план лечения.Пациенты соответствовали критериям лечения, если имелись признаки цирроза (APRI> 2 или ультразвуковое исследование, подтверждающее цирроз) или активного гепатита, связанного с HBV (ALT> 50 МЕ / л и ДНК HBV> 20 000 МЕ / мл). Пациентам, назначенным на лечение, предлагали тенофовир дизопроксил фумарат 300 мг один раз в день, скорректированный в соответствии с клиренсом креатинина 21 , и наблюдали в соответствии с рекомендациями ВОЗ. 5 Пациентам, отнесенным к группе наблюдения, было предложено наблюдение в поликлинике стационара.Тенофовир был подарен Gilead Sciences (Фостер-Сити, Калифорния, США). Gilead Sciences не принимала участия в планировании исследования или анализе данных.
Статистический анализ
оценок «на основе АЛТ» сравнивали с оценкой «с ДНК HBV» в качестве эталонного стандарта. Статистический анализ выполняли в GraphPad Prism 7 (GraphPad Software, La Jolla, CA, USA). Доверительные интервалы для пропорций рассчитывались с использованием метода Уилсона – Брауна.
Заявление об этике
Протокол исследования был одобрен Комитетом по институциональным исследованиям и этике больницы Лакор и Комитетом по этике исследований Лондонского университетского колледжа и зарегистрирован Национальным советом Уганды по науке и технологиям.Все субъекты дали информированное согласие. В исследование не были включены дети. Информация об исследовании и формы согласия были доступны на английском и ло. Все участники должны были дать письменное согласие на включение в исследование.
Результаты
Поток пациентов в исследовании показан на рисунке 1. Всего 103 пациента с положительным HBsAg и отрицательным тестом на ВИЧ были направлены в исследование как из стационарных, так и амбулаторных служб. Два человека отказались от участия.Образец ДНК HBV не был получен от другого участника, который был исключен из анализа. Все остальные пациенты прошли полную клиническую оценку и следующие исследования: FBC, LFT, SCr, ультразвуковое сканирование печени и ПЦР вирусной нагрузки ДНК HBV. Демографические и клинические данные сведены в Таблицу 1.
Рисунок 1. Диаграмма стандартов
для отчетности по исследованиям диагностической точности (STARD), показывающая сравнение алгоритмов «на основе ALT» и «с ДНК HBV».
Рис. 1. Диаграмма стандартов
для отчетности по исследованиям диагностической точности (STARD), показывающая сравнение алгоритмов «на основе ALT» и «с ДНК HBV».
Таблица 1.
Сводка демографических и клинических данных
| Женщина: мужчина, n | 54:46 |
| Возраст (лет), медиана (диапазон) | 27 (18–77) |
| Амбулаторно: стационарно, n | 96: 4 |
| АЛТ (МЕ / л), медиана (диапазон) | 31 (11–394) |
| AST (МЕ / л), медиана (диапазон) | 37 (8–368) |
| Количество тромбоцитов (× 10 9 / л), медиана (диапазон) | 212 (56–598) |
| Креатинин (мг / дл), медиана (диапазон) | 1.0 (0,1–2,7) |
| Вирусная нагрузка ДНК HBV (МЕ / мл), медиана (диапазон) | 652 (не обнаружено–> 3,4 × 10 8 ) |
| Пациенты с ДНК HBV ниже предела количественное определение,% | 20 |
| Пациенты с ДНК HBV> 2000 МЕ / мл,% | 42 |
| Пациенты с ДНК HBV> 20000 МЕ / мл,% | 28 |
| Женщина: мужчина, n | 54:46 |
| Возраст (лет), медиана (диапазон) | 27 (18–77) |
| Амбулаторно: стационарно, n | 96: 4 |
| АЛТ (МЕ / л), медиана (диапазон) | 31 (11–394) |
| AST (МЕ / л), медиана (диапазон) | 37 (8–368) |
| Количество тромбоцитов (× 10 9 / л), медиана (диапазон) | 212 (56–598) |
| Креатинин (мг / дл), медиана (диапазон) | 1.0 (0,1–2,7) |
| Вирусная нагрузка ДНК HBV (МЕ / мл), медиана (диапазон) | 652 (не обнаружено–> 3,4 × 10 8 ) |
| Пациенты с ДНК HBV ниже предела количественное определение,% | 20 |
| Пациенты с ДНК HBV> 2000 МЕ / мл,% | 42 |
| Пациенты с ДНК HBV> 20000 МЕ / мл,% | 28 |
Таблица 1.
Сводка демографических и клинических данных
| Женщина: мужчина, n | 54:46 |
| Возраст (лет), медиана (диапазон) | 27 (18–77) |
| Амбулаторно: стационарно , n | 96: 4 |
| ALT (МЕ / л), медиана (диапазон) | 31 (11–394) |
| AST (МЕ / л), медиана (диапазон) | 37 (8 –368) |
| Количество тромбоцитов (× 10 9 / л), медиана (диапазон) | 212 (56–598) |
| 1.0 (0,1–2,7) | |
| Вирусная нагрузка ДНК HBV (МЕ / мл), медиана (диапазон) | 652 (не обнаружено–> 3,4 × 10 8 ) |
| Пациенты с ДНК HBV ниже предела количественное определение,% | 20 |
| Пациенты с ДНК HBV> 2000 МЕ / мл,% | 42 |
| Пациенты с ДНК HBV> 20000 МЕ / мл,% | 28 |
| Женщина: мужчина, n | 54:46 |
| Возраст (лет), медиана (диапазон) | 27 (18–77) |
| Амбулаторно: стационарно, n | 96: 4 |
| АЛТ (МЕ / л), медиана (диапазон) | 31 (11–394) |
| AST (МЕ / л), медиана (диапазон) | 37 (8–368) |
| Количество тромбоцитов (× 10 9 / л), медиана (диапазон) | 212 (56–598) |
| Креатинин (мг / дл), медиана (диапазон) | 1.0 (0,1–2,7) |
| Вирусная нагрузка ДНК HBV (МЕ / мл), медиана (диапазон) | 652 (не обнаружено–> 3,4 × 10 8 ) |
| Пациенты с ДНК HBV ниже предела количественное определение,% | 20 |
| Пациенты с ДНК HBV> 2000 МЕ / мл,% | 42 |
| Пациенты с ДНК HBV> 20000 МЕ / мл,% | 28 |
Всего из 20 пациентов соответствовали критериям лечения согласно стандартной оценке с ДНК HBV.Четырнадцать участников были распределены на лечение из-за цирроза, 12 с результатами УЗИ печени, соответствующими хроническому заболеванию печени, и 2 пациента с нормальным ультразвуковым сканированием имели APRI> 2. Еще шесть человек имели активный гепатит как показание к лечению (рис. 2). Всего только восемь человек имели APRI> 2. При использовании критериев лечения APRI> 2 или обоих ALT> 50 МЕ / л и ДНК HBV> 20 000 МЕ / мл (то есть без использования УЗИ печени) только 14 пациентов соответствовали бы критериям.
Рисунок 2.
Алгоритм оценки гепатита B «с ДНК HBV». Основано на рекомендациях ВОЗ по профилактике, уходу и ведению пациентов с хроническим гепатитом B 2015. 5 Поток пациентов в исследовании выделен курсивом. УЗИ: ультразвуковое исследование.
Рисунок 2.
Алгоритм оценки гепатита B «с ДНК HBV». Основано на рекомендациях ВОЗ по профилактике, уходу и ведению людей с хроническим гепатитом B 2015 г. 5 Последовательность пациентов в исследовании выделена курсивом. УЗИ: ультразвуковое исследование.
Мы использовали однократную оценку повышенного уровня АЛТ как упрощенный метод выявления активного гепатита. В соответствии с нашей оценкой «на основе АЛТ» пациенты с циррозом печени и лица старше 30 лет с АЛТ> 50 МЕ / л (верхний предел нормы в местной лаборатории) были назначены на лечение. Используя алгоритм «на основе АЛТ» без оценки репликации вируса, 14 участников с признаками цирроза все еще были распределены для лечения, как и 1 из 6 человек с активным гепатитом.Двое из 81 пациента, назначенного для наблюдения, были назначены на лечение по этому алгоритму (рис. 3). По сравнению с подходом «с ДНК HBV» это дает чувствительность 75% (95% доверительный интервал [ДИ] от 53,1 до 88,8%) и специфичность 97,5% (95% ДИ от 91,3 до 99,6%), что является положительной прогностической ценностью. (PPV) 88,2% (95% ДИ от 65,7 до 97,9%) и отрицательная прогностическая ценность (NPV) 94% (95% ДИ от 86,7 до 97,4%) (Таблица 2). В апостериорном анализе с использованием любого из цирроза на УЗИ, APRI> 2 или ALT> 50 (в любом возрасте) в качестве показания для лечения был идентифицирован 31 пациент (14 с циррозом, как указано выше, 17 с повышенным уровнем ALT). .Это дает 100% (95% ДИ от 83,9 до 100%) чувствительность, но 86,3% (95% ДИ от 77,0 до 92,2%) специфичность, с NPV 100% (95% ДИ от 94,7 до 100%) и низким PPV 64,5%. (95% ДИ от 47,0 до 78,9%).
Рисунок 3.
Алгоритм «на основе АЛТ» для оценки гепатита B. Основан на рекомендациях ВОЗ по профилактике, лечению и ведению лиц с хроническим гепатитом B 2015. 5 Моделирование потока пациентов с помощью этого подхода показано в курсив. УЗИ, ультразвуковое исследование.
Рис. 3.
Алгоритм «на основе АЛТ» для оценки гепатита B. На основе руководящих принципов ВОЗ по профилактике, уходу и лечению лиц с хроническим гепатитом В 2015 г. 5 Показан имитационный поток пациентов с помощью этого подхода курсивом. УЗИ, ультразвуковое исследование.
Таблица 2.
Сводка сравнительных оценок
| . | Показано лечение (n = 100) . | Чувствительность,% (95% ДИ) . | Специфичность,% (95% ДИ) . | PPV,% (95% ДИ) . | NPV,% (95% ДИ) . |
|---|---|---|---|---|---|
| С ДНК HBV | 20 | — | — | — | — |
| Только ALT | 17 | 75 (от 53,1 до 88,825) | 88,2 (от 65,7 до 97,9) | 94 (от 86,7 до 97,4) |
| . | Показано лечение (n = 100) . | Чувствительность,% (95% ДИ) . | Специфичность,% (95% ДИ) . | PPV,% (95% ДИ) . | NPV,% (95% ДИ) . |
|---|---|---|---|---|---|
| С ДНК HBV | 20 | — | — | — | — |
| Только ALT | 17 | 75 (от 53,1 до 88,825) | 88,2 (65,7–97,9) | 94 (86,7–97,4) |
Таблица 2.
Резюме сравнения оценок
| . | Показано лечение (n = 100) . | Чувствительность,% (95% ДИ) . | Специфичность,% (95% ДИ) . | PPV,% (95% ДИ) . | NPV,% (95% ДИ) . |
|---|---|---|---|---|---|
| С ДНК HBV | 20 | — | — | — | — |
| Только ALT | 17 | 75 (53.От 1 до 88,8) | 97,5 (от 91,3 до 99,6) | 88,2 (от 65,7 до 97,9) | 94 (от 86,7 до 97,4) |
| . | Показано лечение (n = 100) . | Чувствительность,% (95% ДИ) . | Специфичность,% (95% ДИ) . | PPV,% (95% ДИ) . | NPV,% (95% ДИ) . |
|---|---|---|---|---|---|
| С ДНК HBV | 20 | — | — | — | — |
| Только ALT | 17 | 75 (53.От 1 до 88,8) | 97,5 (от 91,3 до 99,6) | 88,2 (от 65,7 до 97,9) | 94 (от 86,7 до 97,4) |
Показаны результаты семи участников с несоответствующим назначением лечения по разным алгоритмам в Таблице 3. Существует тенденция для стратегии лечения «на основе АЛТ» к чрезмерному лечению трансаминита у лиц старше 30 лет и к недостаточному лечению молодых пациентов с активным гепатитом по сравнению с оценкой тех же пациентов с использованием АЛТ и ДНК HBV.
Таблица 3.
Результаты обследования семи пациентов с разными схемами лечения
| Возраст (лет) . | АЛТ (мг / дл) . | APRI . | ДНК HBV (МЕ / мл) . | С ДНК HBV . | только ALT . | |
|---|---|---|---|---|---|---|
| 18 | 94 | 1.06 | 10 | 9 | Лечить | Наблюдать |
| 18 | 99 | 1.29 | > 170 000 000 | Лечить | Наблюдать | |
| 22 | 67 | 0,62 | > 170 000 000 | Лечить | Наблюдать | |
| 26 | 128258 | Лечить | Наблюдать | |||
| 28 | 135 | 1,39 | 198 297 | Лечить | Наблюдать | |
| 32 | 61 | 0.37 | 2910 | Наблюдать | Лечить | |
| 36 | 51 | 0,16 | 310 | Наблюдать | Лечить |
| АЛТ (мг / дл) . | APRI . | ДНК HBV (МЕ / мл) . | С ДНК HBV . | только ALT . | |
|---|---|---|---|---|---|
| 18 | 94 | 1.06 | 109132 019 | Лечить | Наблюдать |
| 18 | 99 | 1,29 | > 170 000 000 | Лечить | Наблюдать |
| 22 | Лечить | Наблюдать | |||
| 26 | 128 | 1,77 | 2973114 | Лечить | Наблюдать |
| 28 | 135 | 39 | 198297 | Лечить | Наблюдать |
| 32 | 61 | 0,37 | 2910 | Наблюдать | Лечить |
| 36 | Лечить |
Таблица 3.
Результаты обследования семи пациентов с разными схемами лечения
| Возраст (лет) . | АЛТ (мг / дл) . | APRI . | ДНК HBV (МЕ / мл) . | С ДНК HBV . | только ALT . | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 18 | 94 | 1.06 | 10 | 9 | Лечить | Наблюдать | ||||
| Лечить 18 | 99 | 1.29 | 9026 908 1708 000 | 22 | 67 | 0.62 | > 170 000 000 | Лечить | Наблюдать | |
| 26 | 128 | 1,77 | 2973114 | Лечить | Наблюдать | |||||
| 28 | Лечить | Лечить | ||||||||
| 32 | 61 | 0,37 | 2910 | Лечить | Лечить | |||||
| 36 | 51 | 0.16 | 310 | Наблюдать | Лечить |
| Возраст (лет) . | АЛТ (мг / дл) . | APRI . | ДНК HBV (МЕ / мл) . | С ДНК HBV . | только ALT . | |
|---|---|---|---|---|---|---|
| 18 | 94 | 1.06 | 10 | 9 | Лечить | Наблюдать |
| 18 | 99 | 1.29 | > 170 000 000 | Лечить | Наблюдать | |
| 22 | 67 | 0,62 | > 170 000 000 | Лечить | Наблюдать | |
| 26 | 128258 | Лечить | Наблюдать | |||
| 28 | 135 | 1,39 | 198 297 | Лечить | Наблюдать | |
| 32 | 61 | 0.37 | 2910 | Наблюдать | Лечить | |
| 36 | 51 | 0,16 | 310 | Наблюдать | Лечить |
В вирусной группе показаны целые нагрузки ALT и HBV. Большинство участников имели АЛТ <50 МЕ / л и ДНК HBV <20 000 МЕ / мл (59/100). Группа пациентов моложе 30 лет (кружки) имела высокую вирусную нагрузку и АЛТ от 30 до 50 МЕ / л, что свидетельствует об «иммунной толерантности».У трех из 29 пациентов старше 30 лет (треугольники) и без признаков цирроза АЛТ> 50 МЕ / л по сравнению с 14/57 пациентами в возрасте <30 лет (p = 0,12).
Рисунок 4.
График зависимости ДНК HBV от ALT. График, показывающий log HBV ДНК против ALT для лиц с признаками цирроза (APRI> 2 или признаки цирроза на УЗИ, крестики) и лиц без него в возрасте> 30 и <30 лет (треугольники и круги, соответственно). Горизонтальная пунктирная линия указывает на ALT> 50 МЕ / мл, а вертикальная пунктирная линия указывает на ДНК HBV> 20 000 МЕ / мл.
Рисунок 4.
График зависимости ДНК HBV от ALT. График, показывающий log HBV ДНК против ALT для лиц с признаками цирроза (APRI> 2 или признаки цирроза на УЗИ, крестики) и лиц без него в возрасте> 30 и <30 лет (треугольники и круги, соответственно). Горизонтальная пунктирная линия указывает на ALT> 50 МЕ / мл, а вертикальная пунктирная линия указывает на ДНК HBV> 20 000 МЕ / мл.
Обсуждение
Принятие решений о лечении является серьезным препятствием для развертывания программ лечения гепатита В в развивающихся странах.Установленные руководства по лечению, такие как Европейская ассоциация по изучению печени и Американская ассоциация по изучению заболеваний печени 11–13 , требуют проведения исследований, которые для большинства людей являются дорогостоящими. Тест на вирусную нагрузку гепатита В в Уганде стоит около 80 долларов США, где валовой внутренний продукт на душу населения составляет 675 долларов США. В результате как плохой доступ к оценке, так и недоступность терапии означает, что миллионы людей с ХГВ в развивающихся странах не могут получить доступ к жизненно важному лечению.Упрощенные стратегии лечения, основанные на недорогих, широко доступных тестах, являются важным шагом на пути к мобилизации крупномасштабных программ лечения наркозависимости. В ответ на выявленные пробелы в исследованиях 5 мы исследовали упрощенную оценку лиц, инфицированных ВГВ, на основе рекомендаций ВОЗ, которая может предоставить доступную альтернативу установленным руководствам по лечению. На нашем испытательном полигоне St Mary’s Hospital Lacor стоимость всех тестов для пациентов с использованием алгоритма «на основе ALT» составляет всего 8 долларов США.Стоимость добавления количественного определения ДНК HBV к этим тестам составила более 1140 долларов за каждое измененное решение о лечении.
Наше исследование демонстрирует выявление значительной части пациентов с ХГВ, нуждающихся в лечении, с использованием только недорогих исследований, которые широко доступны для врачей по всей Африке. Это открытие усиливает необходимость улучшить доступ к эффективному лечению ВГВ. Сильной стороной нашего подхода является использование широко доступных клинических параметров, измеряемых в реальных условиях здравоохранения в Уганде.Оценка на основе ALT доступна врачам в условиях ограниченных ресурсов, которые хотят надлежащим образом оценить своих пациентов без доступа к специализированным тестам. NPV подхода «на основе АЛТ» была высокой, что позволяло уверенно успокоить большое количество пациентов. PPV был высоким, но CI были широкими, что отражало как небольшое количество результатов, так и возможность избыточного лечения трансаминита, не связанного с HBV. Это может быть особенно актуально в Уганде, где уровень потребления алкоголя высок.Мы исключили пациентов с ранее существовавшим алкогольным заболеванием печени, но не исключили пациентов на основании употребления алкоголя, поскольку это важный кофактор для HBV-ассоциированного заболевания печени. Употребление алкоголя трудно контролировать, особенно если содержание алкоголя в напитках местного производства может быть непостоянным или неизвестным. Анамнез может быть недостоверным, и этанол в сыворотке вряд ли окажется полезным или выполнимым. Людям со значительным заболеванием печени и одновременно ХГВ и значительным потреблением алкоголя рекомендуется уменьшить потребление алкоголя в рамках лечения ХГВ. 5 Коинфекция вирусом гепатита С (ВГС) могла быть источником трансаминита, не связанного с ВГВ, в нашей когорте, хотя распространенность ВГС в Уганде низкая. 22
Остаются важные клинические вопросы. Во-первых, оценка «с ДНК вируса гепатита B» не является истинным золотым стандартом для сравнения недорогих альтернатив. Клинические оценки, включая проверенные неинвазивные методы измерения фиброза, такие как FibroScan, позволили бы более чувствительно определять раннее заболевание печени и обеспечить более строгий тест для любого предлагаемого недорогого подхода.Во-вторых, критически важны последующие данные, чтобы продемонстрировать, способен ли недорогой подход предотвратить исход болезни. Может случиться так, что недорогой алгоритм, который не может определить долю пациентов, которым показано лечение (в соответствии с руководящими принципами богатых стран), все равно будет эффективным, если он сможет выявить пациентов с самым высоким риском прогрессирования декомпенсированного цирроза или ГЦК и предотвратить эти результаты. Такие исследования потребуют больших когорт с длительным периодом наблюдения. В-третьих, нельзя пренебречь частотой ложных срабатываний алгоритма «на основе ALT» (2/17).Небольшое избыточное лечение может быть приемлемым, учитывая незначительную устойчивость HBV к тенофовиру и благоприятный профиль безопасности как при HBV, так и при отсутствии заболевания. 23,24 Лица с коинфекцией ВИЧ-ВГВ были исключены из этого исследования и направлены в местную программу лечения ВИЧ. В соответствии с национальными руководящими принципами Уганды по ВИЧ (и руководящими принципами ВОЗ) они должны лечиться от обеих инфекций с помощью схемы на основе тенофовира, не требуя дополнительной оценки заболевания печени. В эндемичных по ВИЧ районах можно использовать тенофовир в качестве комбинированного лечения ВГВ и доконтактной профилактики ВИЧ, но это еще не исследовано.В отличие от ВИЧ, где клинические эпизоды могут быть использованы в качестве спускового механизма лечения, первое проявление болезни ХГВ обычно сопровождается летальными осложнениями ГЦК или декомпенсированного цирроза печени. В результате лечение необходимо начинать у бессимптомных лиц. Уход за нуждающимися при минимизации чрезмерного лечения будет сложной задачей для любого подхода к оценке. По мере того, как мы узнаем больше о последствиях ранней инфекции HBV, 25 , мы можем увидеть более широкие показания к лечению, упрощающие оценку, как мы наблюдали в случае с ВИЧ в последние годы. 26
Наши результаты также подчеркивают необходимость в улучшенных тестах на фиброз и активный гепатит, подходящих для условий с ограниченными ресурсами. Оценка цирроза с помощью УЗИ печени была важна, так как 12 из 20 пациентов были назначены на лечение на основе этого теста. Чтобы внедрить стратегию, аналогичную той, которую мы использовали в этом исследовании, необходимо улучшить предоставление ультразвуковых услуг в сельских районах Африки. В соответствии с предыдущими когортами, APRI имел низкую чувствительность к циррозу, у 6 из 12 пациентов с циррозом на УЗИ также APRI> 2. 27 Если полагаться только на АЛТ, APRI и ДНК HBV без ультразвука, шести пациентам с серьезным заболеванием печени не было бы предложено лечение. Соотношение гамма-глутамилтранспептидаза (GGT): тромбоциты (GPR), разработанное Lemoine et al. 28 и показано, что он превосходит APRI в двух когортах в Африке к югу от Сахары, может быть включен в аналогичные подходы, хотя измерение GGT как части панели функции печени не является универсальным. У нас не было доступа к GGT на местном уровне, поэтому мы не могли оценить его полезность, но это должно стать предметом будущих проспективных исследований.Также примечательно, что доля пациентов, которым было назначено лечение в нашей когорте на базе больниц в Уганде, была выше, чем в когорте пациентов, прошедших скрининг в Гамбии, по данным исследователей из отдела профилактики фиброза и рака печени в Африке (20% против 4,4%). 17 Доля, наблюдаемая в нашей когорте, была более похожа на 32%, наблюдаемых в амбулаторных условиях в США, 29 , что свидетельствует о том, что подходы к скринингу на уровне сообщества могут потребовать оценки с более высокой специфичностью, чем требуется в условиях больницы.Даже в нашей относительно молодой когорте многие пациенты были неактивными носителями (44/100), что может поддерживать относительно низкую стоимость программного лечения даже в регионах с высокой распространенностью. Тем не менее, 24 из 57 участников моложе 30 лет имели АЛТ> 50 МЕ / мл (14/57) или ДНК HBV> 20 000 МЕ / мл (15/57). Текущие рекомендации делают упор на лечении пациентов старше 30 лет, но у более молодых людей ХГВ может уже вызывать предраковые поражения. 25 Дальнейшие исследования последствий гепатита B для молодежи имеют большое значение, особенно в странах Африки к югу от Сахары, где средний возраст составляет 18 лет.
Выводы
Недорогая и доступная оценка, такая как наш подход «на основе АЛТ», должна использоваться в исследованиях, сообщающих о долгосрочных результатах в качестве основы для расширения масштабов программ лечения ХГВ в развивающихся странах. По-прежнему существует необходимость в оптимизации лечения хронического гепатита в странах Африки к югу от Сахары на основе показателей результатов, в том числе для молодых людей. Эти вопросы необходимо решить, если мы хотим достичь цели ВОЗ по сокращению смертности от вирусного гепатита на 65% к 2030 году.В то время как ожидаются исчерпывающие данные о результатах и улучшенные диагностические инструменты, наш прагматический подход демонстрирует, что оценка «на основе АЛТ» — это простой и достижимый способ выявления большинства пациентов с ХГВ, которым требуется лечение.
Вклад авторов: NE, NL и MM внесли свой вклад в дизайн исследования. NL, HT, EO и OGP выполняли сбор данных. NE, NL и HT выполнили распределение лечения и анализ данных. NE и NL составили рукопись. MKM, HT и EO критически оценили рукопись.Все авторы одобрили окончательную рукопись.
Благодарности: Авторы хотели бы поблагодарить доктора Мартина Огванга и персонал больницы Святой Марии Лакор за их поддержку во время этого исследования, а также Питера Хьюза, руководителя клинических лабораторий Совета медицинских исследований / Исследовательского подразделения Института вирусов Уганды по СПИД для проведения тестирования вирусной нагрузки ДНК HBV. Мы также благодарим Восточноафриканский диплом тропической медицины и гигиены за представление исследователей.
Финансирование: Эта работа была поддержана грантом Королевского общества тропической медицины и гигиены (000478) и стипендией доктора философии Wellcome Trust, присужденной NE (102772 / Z / 13 / Z).
Конкурирующие интересы: MKM сообщает о грантах от Gilead Sciences, грантах и личных гонорарах от Roche, личных гонорарах от Bristol-Myers Squibb, личных гонорарах от CN Bio Innovations и личных гонорарах от Galapagos NV, помимо представленных работ. NL, HT, EO, OGP и NE не имеют конфликтов интересов, о которых следует раскрывать.
Этическое разрешение: Не требуется.
Список литературы
1
Ott
JJ
,
Stevens
GA
,
Groeger
J
et al.
Глобальная эпидемиология инфекции, вызванной вирусом гепатита B: новые оценки возрастной распространенности и эндемичности HBsAg
.
Вакцина
.
2012
;
30
(
12
):
2212
—
9
,2
ГББ 2013 Смертность и причины смерти Соавторы
.
Глобальная, региональная и национальная возрастная и половая смертность от всех причин и причин смерти от 240 причин смерти, 1990–2013 гг.
.
Ланцет
.
2015
;
385
(
9963
):
117
—
71
.3
Stanaway
JD
,
Flaxman
AD
,
Naghavi
M
et al.
Глобальное бремя вирусного гепатита с 1990 по 2013 год: результаты исследования глобального бремени болезней, 2013 год
.
Ланцет
.
2016
;
388
(
10049
):
1081
—
8
,4
О’Хара
GA
,
McNaughton
AL
,
Maponga
T
и др.
Инфекция вирусом гепатита B как забытая тропическая болезнь
.
PLoS Negl Trop Dis
.
2017
;
11
(
10
):
e0005842
,5
Всемирная организация здравоохранения
. Руководство по профилактике, уходу и лечению лиц с хронической инфекцией гепатита В. Женева: Всемирная организация здравоохранения;
2015
,6
Всемирная организация здравоохранения
. Глобальная стратегия сектора здравоохранения по вирусному гепатиту на 2016–2021 гг.К искоренению вирусного гепатита. Женева: Всемирная организация здравоохранения;
2016
.7
Gordon
SC
,
Krastev
Z
,
Horban
A
et al.
Эффективность тенофовира дизопроксил фумарата через 240 недель у пациентов с хроническим гепатитом В с высокой исходной вирусной нагрузкой
.
Гепатология
.
2013
;
58
(
2
):
505
—
13
,8
Марселлин
P
,
Gane
E
,
Buti
M
et al.
Регресс цирроза печени во время лечения хроническим гепатитом В тенофовир дизопроксил фумаратом: 5-летнее открытое катамнестическое исследование
.
Ланцет
.
2013
;
381
(
9865
):
468
—
75
,9
Хосака
T
,
Suzuki
F
,
Кобаяши
M
и др.
Длительное лечение энтекавиром снижает заболеваемость гепатоцеллюлярной карциномой у пациентов с вирусной инфекцией гепатита B
.
Гепатология
.
2013
;
58
(
1
):
98
—
107
.10
Idilman
R
,
Gunsar
F
,
Koruk
M
et al.
Долгосрочная терапия энтекавиром или тенофовиром дизопроксилфумаратом у не получавших лечения пациентов с хроническим гепатитом В в реальных условиях
.
J Вирусный гепат
.
2015
;
22
(
5
):
504
—
10
.11
Европейская ассоциация изучения печени
.
Руководство по клинической практике EASL 2017 по лечению вирусной инфекции гепатита В
.
Дж Гепатол
.
2017
;
67
(
2
):
370
—
98
.12
Terrault
NA
,
Bzowej
NH
,
Chang
K-M
et al.
Рекомендации AASLD по лечению хронического гепатита B
.
Гепатология
.
2016
;
63
(
1
):
261
—
83
,13
Зарин
SK
,
Кумар
M
,
Lau
GK
et al.
Азиатско-Тихоокеанское клиническое руководство по ведению гепатита B: обновление 2015 г.
.
Гепатол Инт
.
2015
;
10
(
1
):
1
—
98
.14
Okonkwo
UC
,
Onyekwere
CA
.
Проблемы ведения хронической инфекции HBV в Западной Африке: взгляд клинициста
.
Троп Докт
.
2016
;
46
(
1
):
16
—
20
,15
Джилс-Верник
T
,
Hejoaka
F
,
Sanou
A
et al.
Препятствия на пути к оказанию помощи при инфицировании вирусом гепатита В: качественный анализ в Буркина-Фасо, Западная Африка
.
Ам Дж. Троп Мед Хиг
.
2016
;
95
(
6
):
1368
—
75
,16
Kim
WR
,
Berg
T
,
Asselah
T
et al.
Оценка систем баллов APRI и FIB-4 для неинвазивной оценки фиброза печени у пациентов с хроническим гепатитом B
.
Дж Гепатол
.
2016
;
64
(
4
):
773
—
80
.17
Lemoine
M
,
Shimakawa
Y
,
Njie
R
et al.
Приемлемость и осуществимость программы скрининга и лечения вирусной инфекции гепатита В в Гамбии: исследование «Профилактика фиброза и рака печени в Африке» (PROLIFICA)
.
Ланцетный шар Здоровье
.
2016
;
4
(
8
):
e559
—
67
. 18
Spearman
CW
,
Afihene
M
,
Ally
R
et al.
Гепатит B в странах Африки к югу от Сахары: стратегии по достижению целей ликвидации до 2030 года
.
Ланцет Гастроэнтерол Гепатол
.
2017
;
2
(
12
):
900
—
9
,19
Бвоги
J
,
Брака
F
,
Макумби
I
и др.
Инфекция гепатита B в Уганде очень эндемична: результаты национального серологического исследования
.
Afr Health Sci
.
2009
;
9
(
2
):
98
—
108
,20
Ochola
E
,
Ocama
P
,
Orach
CG
et al.
Высокое бремя инфекции гепатита В в северной Уганде: результаты обследования населения
.
BMC Public Health
.
2013
;
13
:
727
,21
Eastwood
JB
,
Kerry
SM
,
Plange-Rhule
J
et al.
Оценка СКФ четырьмя методами у взрослых в Ашанти, Гана: необходимость уравнения СКФ для бедных африканских популяций
.
Циферблат нефрола
.
2010
;
25
(
7
):
2178
—
87
.22
Hladik
W
,
Kataaha
P
,
Mermin
J
et al.
Распространенность и стоимость скрининга вируса гепатита С среди доноров крови из Уганды
.
Троп Мед Инт Здоровье
.
2006
;
11
(
6
):
951
—
4
,23
Бути
M
,
Цай
N
,
Петерсен
J
и др.
Семилетняя эффективность и безопасность лечения хронической вирусной инфекцией гепатита В тенофовир дизопроксилфумаратом
.
Dig Dis Sci
.
2015
;
60
(
5
):
1457
—
64
.24
Fonner
VA
,
Dalglish
SL
,
Kennedy
CE
et al.
Эффективность и безопасность пероральной предконтактной профилактики ВИЧ для всех групп населения
.
СПИД
.
2016
;
30
(
12
):
1973
—
83
,25
Mason
WS
,
Gill
US
,
Litwin
S
et al.
Интеграция ДНК HBV и увеличение клональных гепатоцитов у пациентов с хроническим гепатитом B, считающихся иммунными
.
Гастроэнтерология
.
2016
;
151
(
5
):
986
—
998.e4
.26
INSIGHT START Study Group
.
Начало антиретровирусной терапии при раннем бессимптомном течении ВИЧ-инфекции
.
N Engl J Med
.
2015
;
373
(
9
):
795
—
807
,27
Bonnard
P
,
Sombie
R
,
Lescure
FX
и др.
Сравнение эластографии, показателей сывороточных маркеров и гистологии для оценки фиброза печени у пациентов, инфицированных вирусом гепатита B (HBV), в Буркина-Фасо
.
Ам Дж. Троп Мед Хиг
.
2010
;
82
(
3
):
454
—
8
,28
Lemoine
M
,
Shimakawa
Y
,
Nayagam
S
et al.
Отношение гамма-глутамилтранспептидазы к тромбоцитам (GPR) прогнозирует значительный фиброз и цирроз печени у пациентов с хронической инфекцией HBV в Западной Африке
.
Кишечник
.
2016
;
65
(
8
):
1369
—
76
,29
Spradling
PR
,
J
,
Rupp
LB
et al.
Нечастая клиническая оценка пациентов с хроническим гепатитом В в общих медицинских учреждениях США
.
Clin Infect Dis
.
2016
;
63
(
9
):
1205
—
8
.
© Автор (ы) 2018.Опубликовано Oxford University Press от имени Королевского общества тропической медицины и гигиены.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии, что оригинал работа правильно процитирована.
ACCURUN® 325 Series 700 Положительный контроль на ДНК HBV 5 x 4,0 мл
Контрольные и стандартные образцы
Номер материала
2020-0098
Размер
5 х 4.0 мл
Статус инвентаря
В наличии
Единица измерения
EA
Положительный контроль
ACCURUN 325 Series 700 на ДНК HBV разработан для использования с процедурами анализа in vitro , которые определяют и количественно определяют ДНК HBV.ACCURUN 325 Series 700 изготовлен из человеческой сыворотки или плазмы, реактивен в отношении ДНК HBV и нереактивен в отношении антител к ВИЧ 1, ВИЧ 2, HCV и HTLV. ACCURUN 325 может помочь вам избежать дорогостоящих повторений и, что еще более важно, ложноотрицательных или положительных результатов, позволяя контролировать анализ ДНК HBV с помощью надежного источника положительного материала.
ACCURUN 325 Series 700
- Готовый к использованию контроль, разработанный специально для вашего анализа, обеспечивает дополнительную уверенность в результатах лабораторных анализов.
- Можно комбинировать с другими контролями ACCURUN в индивидуальной комбинации;
- Изготовлено из плазмы или сыворотки природного происхождения; очень похож на образец реального пациента
- Неактивен в отношении антител к ВИЧ 1/2, HCV и HTLV;
- Постоянный и надежный источник материалов для контроля качества; способствует соблюдению нормативных требований
- Включенные аналиты: ДНК HBV
- Нормативный статус: IVD, CE
ACCURUN Молекулярные средства контроля используются во многих лабораториях мирового класса для обеспечения эффективности анализа.ACCURUN 325 Series 700 может помочь повысить уверенность в результатах ваших тестов и помочь в соблюдении нормативных требований, когда они являются частью программы обеспечения качества вашей лаборатории.
Справочный номер: A325-5732
ACCURUN SDS-ACRN-04
Тип документа
Паспорт безопасности
ACCURUN 325 СЕРИЯ 700 Положительный контроль ДНК вируса гепатита В
ACCURUN 325 СЕРИЯ 700 Положительный контроль ДНК вируса гепатита В
ACCURUN 325 СЕРИЯ 700 Положительный контроль ДНК вируса гепатита В
D01007004.TIF
% PDF-1.4
%
448 0 объект
>
endobj
444 0 объект
[/ CalGray>]
endobj
443 0 объект
[/ CalRGB>]
endobj
445 0 объект
> поток
Сб 20 янв, 10:44:16 2007PageGenie PDFGeneratorapplication / pdf
D01007004.TIF2021-02-06T15: 24: 21-08: 002021-02-06T15: 24: 21-08: 00uuid: e8e887f7-90ea-438d-af42-56d0d4717c49uuid: 998f6fd9-1dd1-11b2-0a00-3800685982ff
конечный поток
endobj
449 0 объект
>
endobj
442 0 объект
>
endobj
468 0 объект
>
endobj
469 0 объект
>
endobj
201 0 объект
> / ProcSet [/ PDF / Text / ImageB] / XObject >>> / Rotate 0 / Thumb 437 0 R / Type / Page >>
endobj
248 0 объект
> / ProcSet [/ PDF / Text / ImageB] / XObject >>> / Rotate 0 / Thumb 438 0 R / Type / Page >>
endobj
271 0 объект
> / ProcSet [/ PDF / Text / ImageB] / XObject >>> / Rotate 0 / Thumb 439 0 R / Type / Page >>
endobj
338 0 объект
> / ProcSet [/ PDF / Text / ImageB] / XObject >>> / Rotate 0 / Thumb 440 0 R / Type / Page >>
endobj
359 0 объект
> / ProcSet [/ PDF / Text / ImageB] / XObject >>> / Rotate 0 / Thumb 441 0 R / Type / Page >>
endobj
470 0 объект
> / ProcSet [/ PDF / Text / ImageC] / XObject >>> / Type / Page >>
endobj
482 0 объект
[488 0 R 489 0 R 490 0 R 491 0 R 492 0 R 493 0 R]
endobj
483 0 объект
> поток
q
287.5 0 0 75 160,75 681 см
/ Im0 Do
Q
BT
/ T1_0 1 Тс
10 0 0 10 312,69977 582,99982 тм
() Tj
0 0 1 рг
-9,174 0 Тд
(10.1101 / gad.1.8.773) Tj
0 г
-16.89598 0 Тд
(Доступ к самой последней версии на сайте doi 🙂 Tj
9.22699 1 тд
() Tj
/ T1_1 1 Тс
-0,88899 0 Тд
(1:) Tj
/ T1_0 1 Тс
-2,78 0 тд
(1987,) Tj
/ T1_2 1 Тс
-5.558 0 Тд
(Genes Dev. \ 240) Tj
/ T1_0 1 Тс
0 1.00001 TD
(\ 240) Tj
0 1 TD
(Т. Нагая, Т. Накамура, Т. Токино и др.) Т.Дж.
Т *
(\ 240) Tj
/ T1_1 1 Тс
15 0 0 15 52 632,99997 тм
(гепатоцеллюлярная карцинома человека) Tj
Т *
(Способ интеграции ДНК вируса гепатита В в хромосомы) Tj
ET
52 571 метр
557 571 л
0 0 мес.
S
BT
ET
BT
/ T1_0 1 Тс
11 0 0 11 136.942 539.99997 тм
(\ 240) Tj
/ T1_1 1 Тс
-5.11299 1 Td
(Ссылки) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 157 531,99994 тм
(\ 240) Tj
28.33983 1 тд
() Tj
0 0 1 рг
/ T1_1 1 Тс
-28.33983 0 Тд
(http://genesdev.cshlp.org/content/1/8/773.full.html#ref-list-1)Tj
0 г
/ T1_0 1 Тс
0 1.00001 TD
(Эта статья цитирует 33 статьи, 16 из которых доступны бесплатно по адресу:) Tj
ET
BT
/ T1_0 1 Тс
11 0 0 11 136,942 509,99997 тм
(\ 240) Tj
/ T1_1 1 Тс
-3,44598 1 тд
(Лицензия) Tj
ET
BT
/ T1_1 1 Тс
11 0 0 11 100,86 185 483,99997 тм
(Сервис) Tj
-3.16599 1 тд
(Оповещение по электронной почте) Tj
ET
BT
/ T1_0 1 Тс
10 0 0 10 157 475,99994 тм
(\ 240) Tj
17.39696 1 Td
() Tj
0 0 1 рг
/ T1_1 1 Тс
-4,892 0 Тд
(нажмите здесь) Tj
0 г
/ T1_0 1 Тс
-12.50496 0 Тд
(правый угол статьи или) Tj
Т *
(Получайте бесплатные уведомления по электронной почте, когда новые статьи цитируют эту статью — зарегистрируйтесь \
в рамке вверху) Tj
ET
52 463 кв.м.
557 463 л
0 0 мес.
S
BT
ET
q
468 0 0 60 70,5 108 см
-1.00001 TL / Im1 Do
Q
52 68 кв.м.
557 68 л
0 0 мес.
S
BT
ET
BT
/ T1_0 1 Тс
10 0 0 10 54 42 тм
(Copyright \ 251 Лабораторный пресс Колд-Спринг-Харбор) Tj
ET
BT
/ T1_0 1 Тс
8 0 0 8 503.63965 779 тм
() Tj
0 0 1 рг
-16.44997 0 Тд
(Пресса лаборатории Колд-Спринг-Харбор) Tj
0 г
-16.17497 0 Тд
(6 февраля 2021 г. — Опубликовано) Tj
0 0 1 рг
-8.67099 0 Тд
(genesdev.cshlp.org) Tj
0 г
-8.11398 0 Td
(Загружено с) Tj
ET
конечный поток
endobj
486 0 объект
> / Filter / FlateDecode / Height 300 / Length 73148 / Name / X / Subtype / Image / Type / XObject / Width 1150 >> stream
Hypq lJjBa
80 @ bA
«pRHB) CSJP (M` * jQC`Ӻ \ =} Oaq ‘ٍ3 ~? ly |` #
.

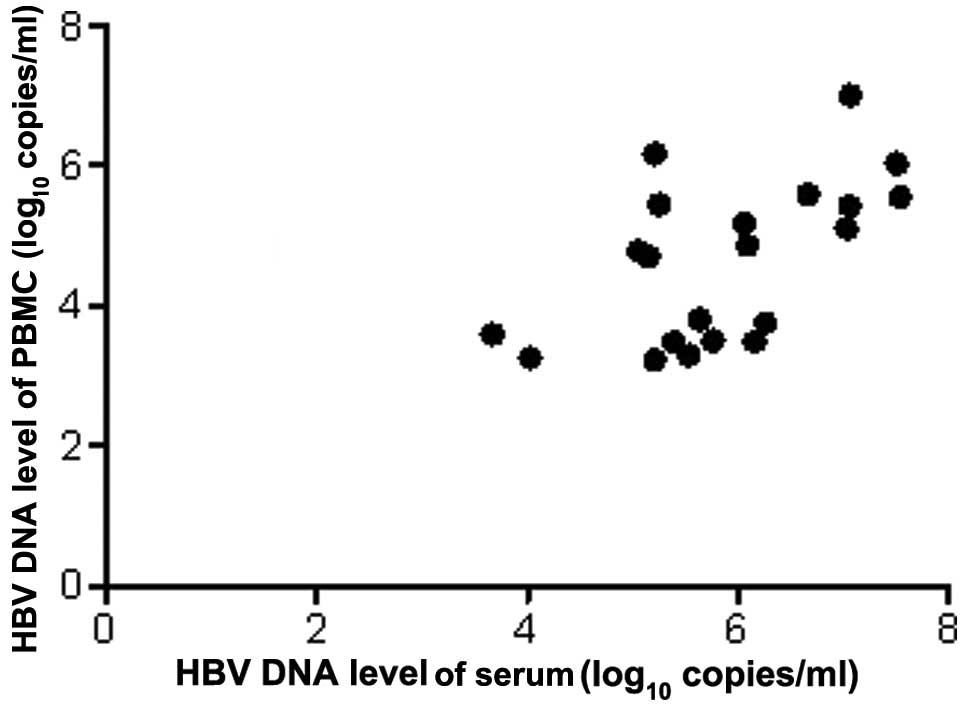
 8 МЕ/мл.
8 МЕ/мл.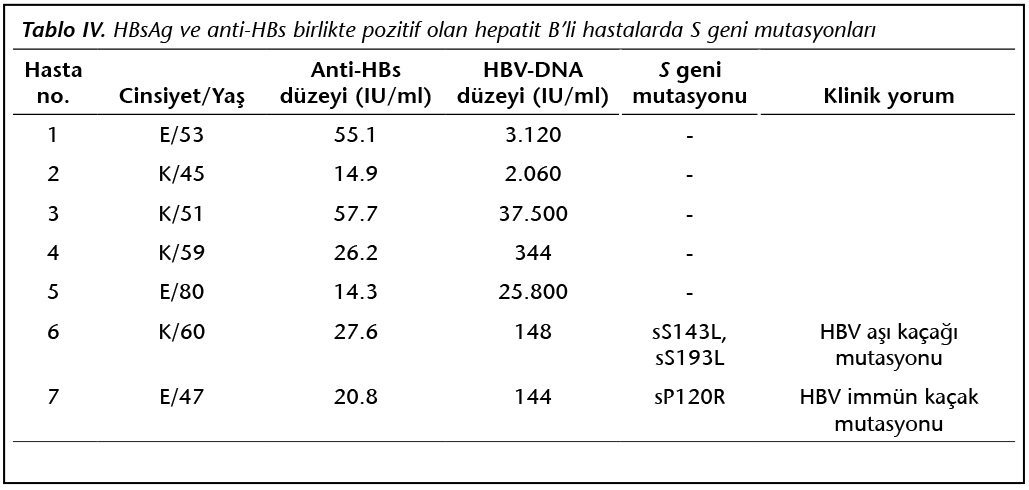 77.23.12412-12420.2003
77.23.12412-12420.2003 Structural organization of the hepatitis B virus minichromosome. Journal of Molecular Biology. 2001;307(1):183-196. https://doi.org/10.1006/jmbi.2000.4481
Structural organization of the hepatitis B virus minichromosome. Journal of Molecular Biology. 2001;307(1):183-196. https://doi.org/10.1006/jmbi.2000.4481 J Hepatol. 2017;67(2):370-398. https://doi.org/10.1016/j.jhep.2017.03.021
J Hepatol. 2017;67(2):370-398. https://doi.org/10.1016/j.jhep.2017.03.021 https://doi.org/10.1159/000371692
https://doi.org/10.1159/000371692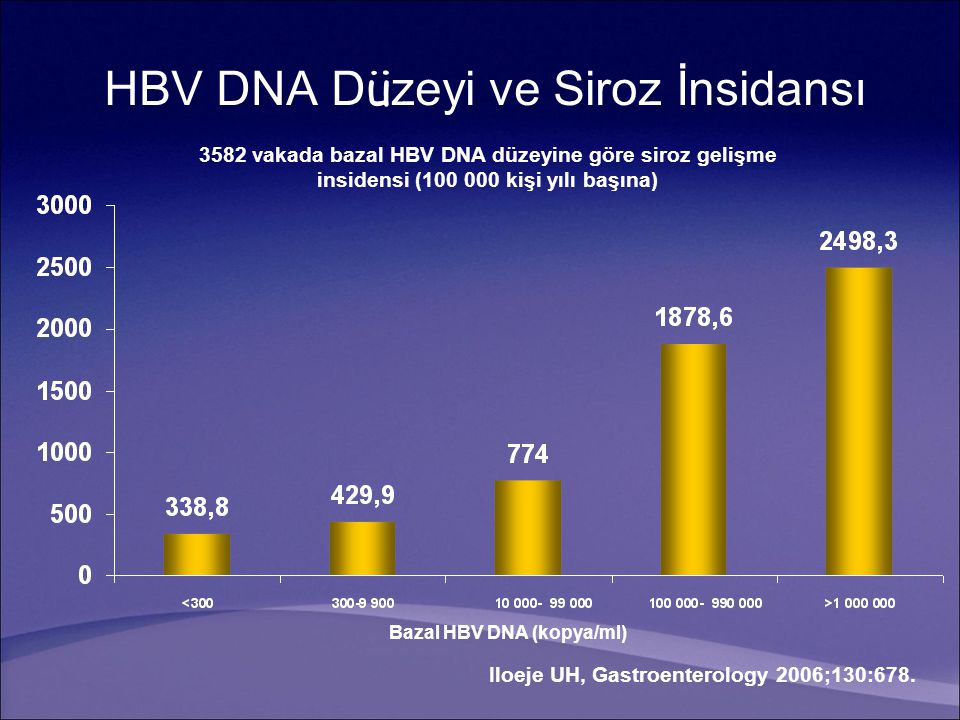 Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease. Virology. 2015;476: 196-205. https://doi.org/10.1016/j.virol.2014.12.001
Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease. Virology. 2015;476: 196-205. https://doi.org/10.1016/j.virol.2014.12.001 2015;21(32):9554. https://doi.org/10.3748/wjg.v21.i32.9554
2015;21(32):9554. https://doi.org/10.3748/wjg.v21.i32.9554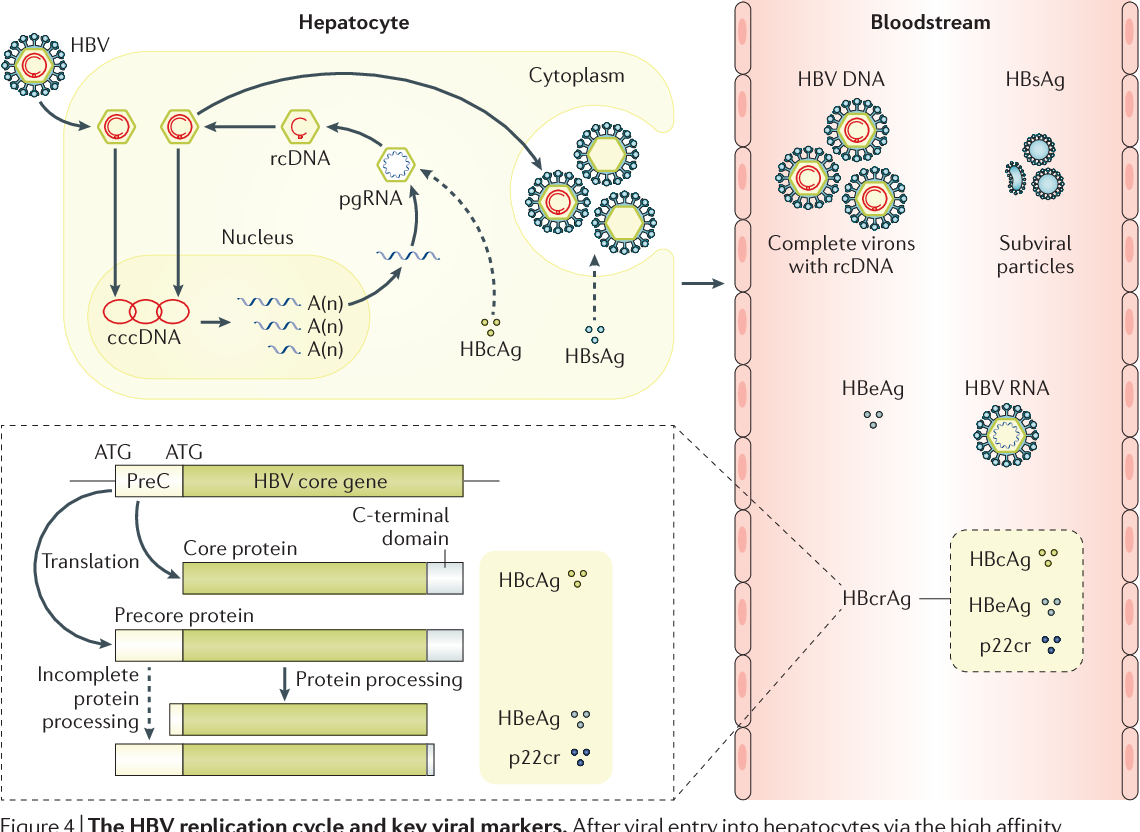 org/10.1038/srep13734
org/10.1038/srep13734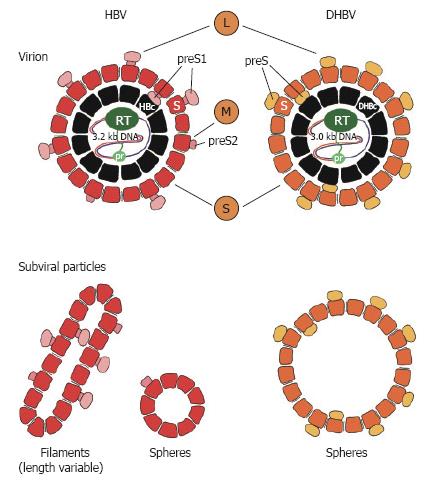 Hepatology. 2016; 64(1 Suppl):123A-124A. https://doi.org/10.1002/hep.28796
Hepatology. 2016; 64(1 Suppl):123A-124A. https://doi.org/10.1002/hep.28796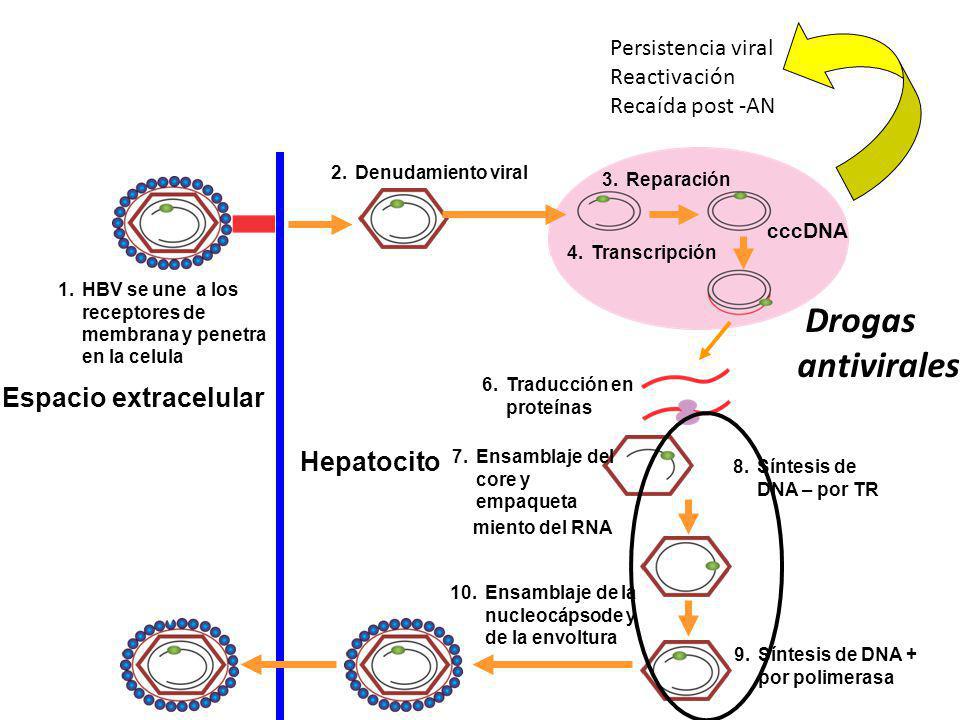 https://doi.org/10.1002/hep.28171
https://doi.org/10.1002/hep.28171:max_bytes(150000):strip_icc()/hepatitis-b-viruses-and-dna--illustration-758308151-5c2ed680c9e77c000138ddb7.jpg) 2013;144(7):1508-1517.e10. https://doi.org/10.1053/j.gastro.2013.02.003
2013;144(7):1508-1517.e10. https://doi.org/10.1053/j.gastro.2013.02.003