Микоплазменная пневмония у детей — ОГБУЗ «СМОЛЕНСКИЙ КОЖНО-ВЕНЕРОЛОГИЧЕСКИЙ ДИСПАНСЕР»
Чем опасна для ребенка микоплазма: пневмония у детей
Нередко в педиатрической практике встречается вызванная таким возбудителем, как микоплазма, пневмония у детей. Пневмонией называется инфекционное заболевание, при котором воспаляется легочная ткань. Любая пневмония является серьезной патологией. Особенно она опасна для детского организма, который менее устойчив к микробам. В большинстве случаев заболевание протекает в легкой форме, но при отсутствии лечебных мер могут развиться осложнения (менингоэнцефалит, поражение сосудов глаз, плеврит). Каковы причины, симптомы и лечение этой патологии легких?
Характеристика микоплазменной пневмонии
Микоплазменная пневмония относится к атипичным формам воспаления легких.Возбудителями болезни являются Mycoplasma pneumoniae. Микоплазмоз начинается с катаральных явлений, что зачастую становится причиной неправильной диагностики и несвоевременного обращения к врачу. Микоплазменная пневмония чаще всего развивается вне стен лечебного учреждения. Такие пневмонии называются внебольничными. На ее долю приходится до 50% случаев воспаления легких. Болезнь поражает преимущественно детей и подростков. Часто дети заражаются в стенах детских учреждений (школ, детских садов, школ-интернатов, средних и высших учебных заведений).
В некоторых случаях болезнь развивается сразу после рождения малыша. В данной ситуации речь идет о врожденной форме микоплазменной пневмонии. У новорожденных она протекает наиболее тяжело. Возможно развитие генерализованной формы болезни с поражением внутренних органов. Микоплазменная пневмония бывает очаговой и долевой. В первом случае воспаление затрагивает незначительный участок легкого в пределах нескольких легочных долек. При долевой пневмонии в процесс вовлекается целая доля легкого. В большинстве случаев воспаление является односторонним.
Свойства возбудителя
Возбудителями заболевания являются микоплазмы. Это мелкие одноклеточные микроорганизмы. Они относятся к типу простейших организмов. Эти микроорганизмы имеют следующие отличительные черты:
Это мелкие одноклеточные микроорганизмы. Они относятся к типу простейших организмов. Эти микроорганизмы имеют следующие отличительные черты:
- не имеют клеточной стенки и ядра;
- величиной от 100 до 600 нм;
- способны менять свою форму;
- чувствительны к высокой температуре, дезинфицирующим средствам и ультрафиолетовому излучению;
- содержат ДНК и РНК;
- неспособны долго жить во внешней среде.
Ребенок заражается через воздух. Микоплазмы с током воздуха проникают в верхние дыхательные пути, а оттуда в бронхи и легочную ткань. Источником инфекции является больной или бессимптомный носитель. Размножение микоплазм происходит в альвеолах. На фоне это формируется интерстициальный тип воспаления легких, при котором происходит утолщение перегородок между альвеолами. После перенесенного ребенком заболевания у него формируется иммунитет продолжительностью до 10 лет.
Способствуют развитию болезни следующие факторы:
- курение;
- иммунодефицит;
- тяжелые хронические заболевания;
- переохлаждение;
- несбалансированное питание.
В группу риска входят дети в возрасте от 3 до 15 лет.
Клинические проявления
Симптомы микоплазменной пневмонии имеют свои особенности. Вначале наблюдаются симптомы поражения верхних дыхательных путей (насморк, боль в горле, снижение аппетита, сухой кашель). Постепенно повышается температура тела.
Воспаление легких проявляется следующими симптомами у детей:
- лихорадкой;
- болью в груди, усиливающейся при вдохе и выдохе;
- приступообразным кашлем с отделением небольшого количества мокроты.
При обструкции бронхов кашель может беспокоить ребенка на протяжении нескольких недель. Симптомы интоксикации могут быть выражены слабо. Микоплазменная пневмония отличается тем, что часто присутствуют внелегочные симптомы. К ним относится кожная сыпь, боль в животе, мышцах и суставах, парестезия. Сыпь выявляется у 12-15% больных детей. Она пятнисто-папулезная или уртикарная. У маленьких детей симптомы выражены слабо.
Сыпь выявляется у 12-15% больных детей. Она пятнисто-папулезная или уртикарная. У маленьких детей симптомы выражены слабо.
У некоторых больных заболевание имеет смешанную этиологию. В данной ситуации присоединяется вторичная бактериальная инфекция. Наиболее тяжело протекает сливная пневмония, когда мелкие очаги сливаются между собой, затрагивая несколько легочных сегментов или целую долю. У половины больных детей при пневмонии наблюдается увеличение печени. Функция органа при этом не нарушена. Реже увеличивается селезенка. У детей дошкольного возраста часто увеличиваются лимфатические узлы.
Обследование и лечение
Лечение больных детей проводится после постановки диагноза и исключения других заболеваний легких. Диагностика включает в себя рентгенографию грудной клетки или компьютерную томографию, физикальное исследование (выслушивание и перкуссию легких), исследование мокроты для уточнения типа возбудителя, осмотр зева, общий анализ крови и мочи. На рентгенограмме при сегментарной пневмонии обнаруживается наличие очаговых инфильтратов в нижних сегментах с нечеткими контурами, интерстициальные изменения. При микроскопическом исследовании мокроты микоплазмы не обнаруживаются. Проводится полимеразная цепная реакция или серологические методы исследования (ИФА).
Основу лечения больных микоплазменной пневмонией детей составляет антибиотикотерапия.
Назначаются тетрациклины (Доксициклин) или макролиды (Азитромицин, Эритромицин). При этом во внимание берется возраст ребенка. Доксициклином нельзя лечить детей младше 12 лет и детей более старшего возраста с массой тела менее 45 кг. Лечение также включает обильное питье, дезинтоксикацию организма, физиопроцедуры, массаж, применение отхаркивающих средств в виде сиропов или микстур. Таким образом, микоплазменная пневмония у детей редко протекает в тяжелой форме и практически всегда заканчивается выздоровлением.
МИКОПЛАЗМЕННАЯ ПНЕВМОНИЯ
В настоящее время заболеваемость микоплазменной пневмонией приобрела характер эпидемии в детских учреждениях городов России. За сентябрь—октябрь 2017 года в городе Радужный Владимирской области микоплазменной пневмонией заболели около 40 человек, 34 из них дети. В Нижнем Новгороде за это время микоплазменная пневмония зарегистрирована у 2,5 тыс. нижегородцев, в основном у детей до 2-х лет и посещающих детские дошкольные учреждения. В Хабаровске случаи пневмонии зарегистрированы в 8 школах и детских садах (всего заболели 23 ребёнка). В Москве с 13.10.2017 г. были введены внеочередные каникулы в лицеях Северо-Западного административного округа в связи с регистрацией 21 случая внебольничной микоплазменной пневмонии среди учащихся.
За сентябрь—октябрь 2017 года в городе Радужный Владимирской области микоплазменной пневмонией заболели около 40 человек, 34 из них дети. В Нижнем Новгороде за это время микоплазменная пневмония зарегистрирована у 2,5 тыс. нижегородцев, в основном у детей до 2-х лет и посещающих детские дошкольные учреждения. В Хабаровске случаи пневмонии зарегистрированы в 8 школах и детских садах (всего заболели 23 ребёнка). В Москве с 13.10.2017 г. были введены внеочередные каникулы в лицеях Северо-Западного административного округа в связи с регистрацией 21 случая внебольничной микоплазменной пневмонии среди учащихся.
Пневмония, вызванная микоплазмой, составляет до 20% от всех болеющих воспалением лёгких. Наибольшую опасность эта болезнь представляет для детей от 5 до 14 лет, молодых людей работоспособного возраста — 30—37 лет и для лиц пожилого возраста.
Микоплазмы способны вызывать вспышки как в закрытых коллективах (новобранцы, дети в летних лагерях, интернатах), так и эпидемии среди совместно проживающих сообществ. Характерны сезонные колебания заболеваемости микоплазменной пневмонией с пиком в осенне-зимний период.
Передаётся инфекция воздушно-капельным путём. Патогенные бактерии при кашле и чихании больного человека распространяются по воздушному пространству, оседая на мебели и бытовых предметах. Здоровому человеку достаточно вдохнуть заражённый воздух или перед принятием пищи прикоснуться к поражённой инфекцией вещи, чтобы заболеть.
Микоплазменная пневмония начинает развиваться примерно через три недели после контакта с заражённым лицом и начинается как обычная острая респираторно-вирусная инфекция. Чаще всего микоплазма вызывает бронхоневмонию. Появляется субфебрильная температура, головные боли, болезненные ощущении в суставах и мышцах. Позднее присоединяются признаки поражения дыхательных путей, включая охриплость и кашель. Кашель в большинстве случаев сухой, иногда может отходить пенистая беловатая мокрота. Вышеперечисленные симптомы постепенно усиливаются, достигая максимальной интенсивности к пятому или седьмому дню болезни. Температура тела подскакивает до 39—40 градусов, держится на такой отметке примерно неделю, появляются свистящие влажные хрипы, похожие на хрипы при бронхиальной астме или бронхиолите, кашель становится более выраженным и может появиться одышка. Затем жар медленно спадает до 37—38 градусов и держится около 10—12 суток, в редких случаях дольше.
Температура тела подскакивает до 39—40 градусов, держится на такой отметке примерно неделю, появляются свистящие влажные хрипы, похожие на хрипы при бронхиальной астме или бронхиолите, кашель становится более выраженным и может появиться одышка. Затем жар медленно спадает до 37—38 градусов и держится около 10—12 суток, в редких случаях дольше.
Быстро поставить диагноз атипичной пневмонии, вызванной микоплазмами, удаётся не всегда. Наиболее точными и показательными методами диагностики болезни у взрослых и детей являются серологические методы исследования крови пациента (иммуноферментный анализ крови (ИФА) и полимеразная цепная реакция (ПЦР).
Кроме микоплазменной пневмонии, микроорганизмы также могут стать причиной острого воспаления верхних дыхательных путей (фарингита), бронхиальной астмы, обострений хронического обструктивного бронхита и развития нераспираторной патологии (перикардита, отита, энцефалита, менингита, гемолитической анемии) у практически здоровых людей.
Лечение микоплазменной пневмонии должен проводить только лечащий врач в условиях стационара. Самостоятельное лечение народными средствами, а также самовольная отмена или замена назначенного врачом лечения может не только усугубить течение заболевания, но и привести к летальному исходу.
Н. ГЛАЗКОВА, врач-эпидемиолог ФКУЗ «МСЧ МВД России по г. Москве», рисунок Николая РАЧКОВА
Респираторные инфекции, вызванные микоплазмой пневмонии
Микоплазма пневмонии является «атипичной» бактерией, которая вызывает респираторные инфекции верхних и нижних дыхательных путей. Наиболее распространённой формой заболевания, особенно у детей, является трахеобронхит, который часто наблюдается вместе с другими симптомами поражения верхних дыхательных путей. Реже встречаются фарингиты, ринофарингиты, ларингофарингиты, бронхиты. Данный возбудитель также может приводить к развитию более серьезного заболевания – воспалению легких (пневмонии).
Распространение инфекции происходит воздушно – капельным путем: при кашле и чихании бактерии попадают в окружающую среду в виде инфекционного аэрозоля. Для передачи инфекции нужен длительный тесный контакт. Непродолжительное нахождение с больным человеком, как правило, не приводит к заражению. Чаще данное заболевание распространяется между членами одной семьи, которые живут вместе. Микоплазменной инфекцией можно заболеть в любое время года.
Для передачи инфекции нужен длительный тесный контакт. Непродолжительное нахождение с больным человеком, как правило, не приводит к заражению. Чаще данное заболевание распространяется между членами одной семьи, которые живут вместе. Микоплазменной инфекцией можно заболеть в любое время года.
По сравнению с другими респираторными инфекциями для инфекций, вызванных микоплазмой пневмонии, характерен более длительный инкубационный период, первые симптомы заболевания появляются через 2 – 3 недели после инфицирования.
Среди наиболее частых симптомов пневмонии наблюдаются: боли в горле, усталость, лихорадка, головные боли, приступообразный кашель, который может длиться неделями или месяцами. При развитии пневмонии к данным симптомам присоединяются затрудненное дыхание и, в некоторых случаях, боли в области грудной клетки при дыхании или кашле.
В любом возрасте существует риск заражения микоплазменной инфекцией, но чаще болеют школьники и лица молодого возраста (до 25 лет). Люди с ослабленным иммунитетом, недавно перенесшие другие респираторные инфекции, имеющие хронические бронхиты и астму также имеют более высокий риск развития данного заболевания.
В ответ на микоплазменную инфекцию в нашем организме вырабатываются антитела двух классов IgM и IgG.
Первыми в крови обнаруживаются IgM, их уровень повышается в течение короткого периода времени и определяется, как правило, в течение нескольких месяцев. Вслед за образованием IgM начинают вырабатываться IgG, со временем их уровень повышается и достигает определенного предела. После перенесенного заболевания в течение длительного времени в крови обнаруживаются IgG. Определение иммуноглобулинов М и G помогает врачу – инфекционисту в диагностике респираторной инфекции, вызванной микоплазмой пневмонии. В дополнение к данным исследованиям может быть проведено ПЦР- исследование, позволяющее выявить ДНК возбудителя в отделяемом из носоглотки.
В большинстве случаев микоплазменная инфекция имеет умеренное течение, необходимость назначения антибактериальных препаратов определяется только лечащим врачом. При правильном лечении заболевания наступает полное выздоровление.
При правильном лечении заболевания наступает полное выздоровление.
В медицинском центре «Биомедика» Вы можете записаться на прием к врачу-инфекционисту и выполнить необходимые лабораторные исследования.
причины появления, симптомы заболевания, диагностика и способы лечения
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Синонимы: микоплазменная инфекция, микоплазма, Mycoplasma
Микоплазмоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Микоплазменная инфекция — острое заболевание, вызываемое грамм-отрицательными бактериями, сопровождающееся различными воспалительными поражениями респираторного, урогенитального трактов, суставов, кроветворной и нервной систем. Возбудителями являются микоплазмы из рода Mycoplasma семейства Mycoplasmataceae.
Микоплазмы неустойчивы во внешней среде, разрушаются под действием температуры, замораживания, ультрафиолета, ультразвука, а также современных моющих и дезинфицирующих средств.
Микоплазмы могут существовать не только вне, но и внутри клеток, что позволяет им ускользать от механизмов иммунной защиты организма. В отличие от бактерий, они не имеют клеточной стенки, но могут расти на специальных бесклеточных средах. Подобно вирусам, проходят через бактериальные фильтры. Самостоятельно существовать микоплазмы не могут, так как паразитируют на клетках организма-хозяина, получая из них питательные вещества.
Причины появления микоплазмоза
Источником инфекции является больной человек или носитель микоплазм. Как правило, микоплазмоз протекает скрыто — примерно 40% больных не чувствуют каких-либо явных симптомов, пока стрессовая ситуация или ослабленный иммунитет не спровоцируют активизацию инфекционного процесса, часто приводя к серьезным осложнениям.
Заражение происходит воздушно-капельным путем, половым путем, вертикальным путем (от матери плоду через плаценту) или во время родов.
Респираторный микоплазмоз, вызываемый Mycoplasma pneumoniae и передающийся воздушно-капельным путем, составляет от 7% до 21% в структуре острых респираторных заболеваний, занимая 5-е место среди болезней органов дыхания.
Для передачи возбудителя требуется довольно тесный и длительный контакт, поэтому респираторный микоплазмоз особенно распространен в закрытых коллективах.
Возбудители респираторного микоплазмоза проникают в организм через дыхательные пути, фиксируются на поверхности эпителия слизистой оболочки трахеи и бронхов. Они вырабатывают токсины, которые вызывают стойкий кашель. Иммунологический ответ на этот возбудитель может провоцировать внебольничную пневмонию, тяжелые заболевания верхних дыхательных путей, острый приступ астмы.
Многочисленные исследования показали, что бактерии респираторного микоплазмоза можно выявить практически во всех органах и тканях – печени, почках, сердечной мышце, веществе мозга, перикардиальной и внутрисуставной жидкостях, крови.
Это дает возможность рассматривать микоплазменную инфекцию как генерализованный процесс с диссеминацией возбудителя и развитием полиорганных поражений.
Mycoplasma genitalium – патогенный микроорганизм, способный вызывать уретрит у лиц обоего пола, цервицит и воспалительные заболевания органов малого таза у женщин. Урогенитальный микоплазмоз распространен среди взрослых и передается половым путем.
Классификация заболевания
Выделяют три основные формы заболевания: респираторный микоплазмоз, урогенитальный микоплазмоз, врожденный микоплазмоз.
Классификация по МКБ 10
А63.8 Другие уточненные заболевания, передаваемые преимущественно половым путем:
-
А63.8 + N34.1 Уретрит, вызванный M. genitalium - А63.
 8 + N72 Цервицит, вызванный M. genitalium
8 + N72 Цервицит, вызванный M. genitalium - А63.8 + N70 Сальпингоофорит, вызванный M. genitalium
- А63.8 + N71 Эндометрит, вызванный M. genitalium
- А63.8 + N45 Орхит и эпидидимит, вызванный M. genitalium
- А63.8 + N48.1 Баланопостит, вызванный M. genitalium
J15.7 Пневмония, вызванная M. pneumoniae
J20.0 Острый бронхит, вызванный M. pneumoniae
B96.0 M. рneumoniae как причина болезней, классифицированных в других рубриках.
Симптомы микоплазмоза
Для урогенитального микоплазмоза характерные клинические особенности не выявлены. Описаны микоплазменные уретриты, простатиты, вагиниты, кольпиты, цервициты, острые и хронические пиелонефриты. Чаще всего микоплазмоз протекает в виде обычной мочеполовой инфекции. Появляется зуд и жжение при мочеиспускании, болезненность в нижней части живота, а также необильные слизистые выделения с неприятным запахом.
Более тяжелым случаем является респираторный микоплазмоз, так как возможно поражение абсолютно любого отдела дыхательного тракта.
Заболевание может протекать в двух клинических формах:
- микоплазмоз верхних дыхательных путей (неосложненный респираторный микоплазмоз),
- микоплазменная пневмония.
К легкой форме относится микоплазмоз верхних дыхательных путей (фарингит, трахеит). Среднетяжелая форма характеризуется наличием микоплазмоза верхних дыхательных путей с клинической картиной обструктивного бронхита или микоплазменной пневмонии (интерстициальной, очаговой).
Тяжелая форма заболевания протекает с выраженной и длительной лихорадкой; типичной для крупноочаговой, или «тотальной» пневмонии.
Начало заболевания чаще постепенное, реже острое. У пациентов выявляют першение в горле, ринит, непродуктивный постоянный кашель, субфебрильную лихорадку, недомогание, чувство ломоты, головную боль, охриплость, сыпь и редко буллезное воспаление барабанной перепонки. Катаральный синдром характеризуется явлениями фарингита, трахеита или бронхита (часто с обструктивным компонентом). Нередко у детей отмечается коклюшеподобный кашель, сопровождающийся болями в груди, животе, нередко заканчивающийся рвотой.
Катаральный синдром характеризуется явлениями фарингита, трахеита или бронхита (часто с обструктивным компонентом). Нередко у детей отмечается коклюшеподобный кашель, сопровождающийся болями в груди, животе, нередко заканчивающийся рвотой.
Диагностика микоплазмоза
Основным направлением в диагностике микоплазмоза является выделение возбудителя, так как клиническая картина заболевания не позволяет достоверно установить диагноз.
Лабораторная диагностика респираторного микоплазмоза основана на прямых методах выявления микоплазм и серологических реакциях определения специфических антител.
Проводят серологическое исследование на M. pneumoniae (на специфические антитела IgM, IgG и IgA). Антитела класса IgM являются индикатором первичного инфицирования.
Особенности клиники, диагностики, лечения микоплазменной пневмонии у детей Текст научной статьи по специальности «Клиническая медицина»
о
IÜ
Л
УДК 616.24-002:579.887]-053.2-07-085
ЮЛИШ Е.И., ЧЕРНЫШЕВА O.E., КОНЮШЕВСКАЯ A.A., ТАЛАЛАЕНКО А.К. Донецкий национальный медицинский университет им. М. Горького
ОСОБЕННОСТИ КЛИНИКИ, ДИАГНОСТИКИ, ЛЕЧЕНИЯ МИКОПЛАЗМЕННОЙ ПНЕВМОНИИ У ДЕТЕЙ
Резюме. В работе представлены особенности клиники, методы диагностики, принципы рационального лечения микоплазменной пневмонии в детском возрасте. Ключевые слова: микоплазменная пневмония, дети.
С конца 1980-х годов наблюдается тенденция к росту заболеваемости детей пневмонией, количества случаев ее осложненного течения [10]. В экономически благополучных странах частота регистрации пневмонии у детей первых 5 лет жизни составляет 5—10 случаев на 1000 детей, в возрасте младше 5 лет — 34—40 случаев в год [1, 5, 7]. Ежегодно в мире регистрируется около 155 миллионов случаев заболевания пневмонией у детей, из них примерно 1,8 миллиона в возрасте до 5 лет погибает [6].
Ежегодно в мире регистрируется около 155 миллионов случаев заболевания пневмонией у детей, из них примерно 1,8 миллиона в возрасте до 5 лет погибает [6].
В последние годы появились многочисленные данные об изменении этиологии пневмоний и их течения. В частности, результаты исследований, проведенных в 2003—2013 гг. среди детей в Финляндии (8851 чел.), показали, что заболеваемость хламидо-фильными пневмониями составила 2,3 на 1000 детей, а микоплазменными — 5,0 на 1000 детей в год [8].
Несмотря на достижения современной педиатрии, пневмония по-прежнему является важнейшей отдельно взятой причиной смерти детей во всем мире — 20 % всех случаев смерти детей в возрасте до пяти лет [9]. В развивающихся странах внебольнич-ная пневмония остается частой причиной смертельных исходов среди детского населения [6], в то время как в развитых странах наблюдается уменьшение частоты смертельных исходов [9].
Экономические потери, связанные с лечением данного заболевания в США, составляют 8,4— 10 миллиардов долларов США в год, из них 92 % приходится на госпитализированных больных. Лечение одного пациента в условиях стационара обходится в 2430-8970, а на дому — 300 долларов США [11]. А стоимость лечения детей, страдающих пневмонией, во всем мире составляет около 600 миллионов долларов США [6].
Согласно данным многочисленных исследований, этиология заболеваний верхних и нижних дыха-
тельных путей у детей, в том числе и внебольничной пневмонии, связана с микрофлорой, колонизующей верхние отделы дыхательных путей — пневмококками — S.pneumoniae (от 50 до 80 % случаев), гемо-фильной палочкой (10—15 %), гемолитическими стрептококками группы А, чаще S.pyogenis и Viridans [12—15]. В последние годы среди причин заболеваний респираторного тракта называют Chlamydophila pneumoniae и Mycoplasma pneumoniae, выявляемые в 20—25 % случаев [16—19]. В результате исследований, проведенных в Италии, была выявлена роль M.pneumoniae и C.pneumoniae в развитии внебольничной пневмонии у детей от 2 до 14 лет. Микоплазменная инфекция была диагностирована у 21 % детей в возрасте 2—4 лет, у 41 % детей в возрасте 5—7 лет и у 60 % детей старше 7 лет. Хламидофильная пневмония была диагностирована у 10 % детей в возрасте 2—4 лет, у 19 % — 5—7 лет и у 21 % детей старше 7 лет [20]. Из 145 исследованных детей (средний возраст — 2,5 года) в Турции доля микоплазменных пневмоний составила 27 %, а хламидофильных — 5 % [21]. R. Samransamruajkit с соавторами показали лидирующую роль хламидий и микоплазм в развитии пневмоний, вызываемых у детей в Таиланде (из 58 пациентов у 25 % наблюдалась микоплазменная пневмония и у 15 % — хламидийная). Согласно данным российских авторов, при внебольничной пневмонии у пациентов молодого возраста S.pneumoniae выделялась у 29 % пациентов, C.pneumoniae — у 27 %, M.pneumoniae — у 9 %, ассоциация S.pneumoniae с M.pneumoniae и C.pneumoniae — у 24 % больных, а ассоциация M.pneumoniae и C.pneumoniae — у 11 %.
В результате исследований, проведенных в Италии, была выявлена роль M.pneumoniae и C.pneumoniae в развитии внебольничной пневмонии у детей от 2 до 14 лет. Микоплазменная инфекция была диагностирована у 21 % детей в возрасте 2—4 лет, у 41 % детей в возрасте 5—7 лет и у 60 % детей старше 7 лет. Хламидофильная пневмония была диагностирована у 10 % детей в возрасте 2—4 лет, у 19 % — 5—7 лет и у 21 % детей старше 7 лет [20]. Из 145 исследованных детей (средний возраст — 2,5 года) в Турции доля микоплазменных пневмоний составила 27 %, а хламидофильных — 5 % [21]. R. Samransamruajkit с соавторами показали лидирующую роль хламидий и микоплазм в развитии пневмоний, вызываемых у детей в Таиланде (из 58 пациентов у 25 % наблюдалась микоплазменная пневмония и у 15 % — хламидийная). Согласно данным российских авторов, при внебольничной пневмонии у пациентов молодого возраста S.pneumoniae выделялась у 29 % пациентов, C.pneumoniae — у 27 %, M.pneumoniae — у 9 %, ассоциация S.pneumoniae с M.pneumoniae и C.pneumoniae — у 24 % больных, а ассоциация M.pneumoniae и C.pneumoniae — у 11 %.
© Юлиш Е.И., Чернышева О.Е., Конюшевская А.А.,
Талалаенко А.К., 2014 © «Здоровье ребенка», 2014 © Заславский А.Ю., 2014
Причем в 30—40 % случаев микоплазменная пневмония наблюдалась у детей старше 5 лет и подростков, особенно среди детей, посещающих детские коллективы, в то время как среди людей зрелого возраста — всего лишь в 2—3 %. Кроме того, микоплазменная инфекция наблюдалась и у детей раннего возраста, в том числе умерших в первые дни после рождения и у мертворожденных, что свидетельствует о возможности передачи микоплазм от матери плоду [5].
Этиологическая структура внебольничных пневмоний различается в зависимости от возраста больных. Так, микоплазменная пневмония встречается у 15 % больных детей в возрасте от 6 месяцев до 5 лет, старше 5 лет — уже в 23—44 % случаев [39].
Согласно статистическим исследованиям, каждые 3—8 лет наблюдаются эпидемиологические подъемы заболеваемости микоплазменной пневмонией, которые длятся несколько месяцев. При этом заболеваемость может достигать 20 % от общего числа внебольничных пневмоний, что является самым высоким показателем среди небактериальных поражений легочной паренхимы [22, 28].
Согласно принятой в настоящее время классификации, все микоплазмы объединены в одно семейство Mycoplasmataceae, которое имеет два рода: Mycoplasma и Ureaplasma urealyticum. M.pneumoniae относится к роду Mycoplasma, семейству Mycoplasmataceae, порядку Mycoplasmatales, классу Mollicutes. Первый представитель рода микоплазм был открыт еще в 1898 г. французскими исследователями Е. Nocard и Е. Rous, но только в течение последних десятилетий было установлено, что люди страдают от инфекций, вызываемых микоплазмами. Впервые микоплазма была выделена от больного пневмонией М. Eaton в 1944 г. и отнесена к вирусам, получив название «агент Итона». Лишь в 1962 г. R. Chanock доказал, что этот микроорганизм является микоплазмой [2, 26].
Являясь мембраноассоциированным микроорганизмом, M.pneumoniae занимает промежуточное положение между вирусами, бактериями и простейшими. Это мелкий полиморфный, грамотрицательный, факультативно-анаэробный, прокариотический микроорганизм, содержащий РНК и ДНК, лишенный внешней мембраны и имеющий вместо клеточной стенки трехслойную цитоплазматическую мембрану. Данная особенность строения обусловливает резистентность к различным агентам, подавляющим синтез клеточной стенки, прежде всего — резистентность к пенициллину и остальным, без исключения, ß-лактамам. За счет особой выпуклой терминальной структуры микоплазма обладает уникальной скользящей подвижностью и адсорбцией к поверхностным структурам клеток хозяина, в частности эритроцитам, клеткам реснитчатого эпителия трахеи, бронхов, в которых под действием токсического фактора M. pneumoniae нарушается биосинтез РНК, белка, что приводит к гибели клеток. Структурное сходство мембран клеток человека и мембран микоплазм ведет к «маскировке» антигенов микоплазм, слабому распознаванию их как чужеродных агентов. В связи
pneumoniae нарушается биосинтез РНК, белка, что приводит к гибели клеток. Структурное сходство мембран клеток человека и мембран микоплазм ведет к «маскировке» антигенов микоплазм, слабому распознаванию их как чужеродных агентов. В связи
с этим существует возможность аутоиммунизации организма. Прикрепляясь к клеткам респираторного эпителия, М.рпвитотав вызывает дисфункцию ресничек, вплоть до цитолиза, после чего происходит цитоадсорбция микроорганизма и встраивание участков мембраны возбудителя в мембрану клеток. Это приводит к тому, что микоплазма обеспечивает себя всеми необходимыми питательными веществами [23-25].
Одним из первых признаков поражения клеток является потеря подвижности ресничек эпителия. Микоплазмы, разрушая терминальные перемычки между клетками эпителия, дезорганизуют тканевую архитектонику и, интраканаликулярно распространяясь, поражают альвеолоциты. Обнаружить возбудителя в альвеолоцитах можно как при имму-нолюминесцентном анализе, так и при гисторадио-автографическом. Микроколонии микоплазмы обнаруживаются в цитоплазме альвеолоцитов, претерпевающих в результате этого ряд характерных морфологических изменений, приводящих их к гибели. В дальнейшем из легких М.рпвитотав попадает в регионарные лимфатические узлы, далее — в кровеносное русло, в результате чего развивается генерализованная инфекция с поражением внутренних органов и ЦНС. Подобные формы заболевания чаще отмечаются у детей раннего возраста. Помимо поражения альвеолоцитов и бронхиального эпителия, в легких наблюдается выраженная иммуноморфоло-гическая реакция, характеризующаяся утолщением и инфильтрацией межальвеолярных перегородок лимфоидными и гистиоцитарными элементами, появлением в них клеток плазматического ряда, гиперплазией и плазмоклеточной реакцией в перибронхи-альных лимфатических фолликулах и узлах. Кроме того, М.рпвитотав способна к саморепликации и, как следствие, к длительной персистенции.
Основным фактором, способствующим циркуляции и распространению возбудителя, является скопление людей внутри одного коллектива, плохая циркуляция воздуха в непроветриваемых помещениях, что чаще встречается в осенне-зимний период. Источником микоплазменной инфекции являются больные и носители. Инфицированный человек выделяет вирус при разговоре, чихании или кашле. Возбудитель относительно неустойчив во внешней среде, разрушается при нагревании до 40 °С в течение 20 минут. Механизм передачи инфекции — аэрогенный. Инкубационный период длится от 1 до 4 недель (в среднем 2-3 недели) [25-27]. Вирулентность инфекции в отношении мальчиков выше, чем девочек, но меньше по сравнению с такими инфекционными заболеваниями, как корь, коклюш, ветряная оспа, краснуха и грипп [30].
После внедрения М.рпвитотав в организм ребенка заболевание может протекать по нескольким сценариям. С одной стороны, возбудитель, длительно находясь внутри организма и не вызывая болезнь, делает ребенка здоровым носителем инфекции. С другой — возбудитель может вызывать типичный мико-
плазменный бронхолегочный процесс или инфекцию верхних дыхательных путей. В случае неблагоприятного течения развивается генерализация инфекции с развитием артрита, энцефалита, менингита. Разнообразие клинических проявлений зависит от патогенеза микоплазменной инфекции. Так, возможно прямое действие возбудителя на различные органы и системы за счет выработки токсинов, ферментов. Воздействие иммунных комплексов на мембраны клеток обусловливает генерализованные и местные иммунные реакции. Кроме того, микоплазмы, прикрепляясь к эритроцитам, вызывают их гемолиз.
Вследствие того, что входными воротами для M.pneumoniae является слизистая оболочка респираторного тракта, одним из самых ранних симптомов респираторного микоплазмоза, протекающего по типу острой респираторной инфекции, является сухость и першение в горле, заложенность или сухость в носовых ходах, сухой длительный кашель [29].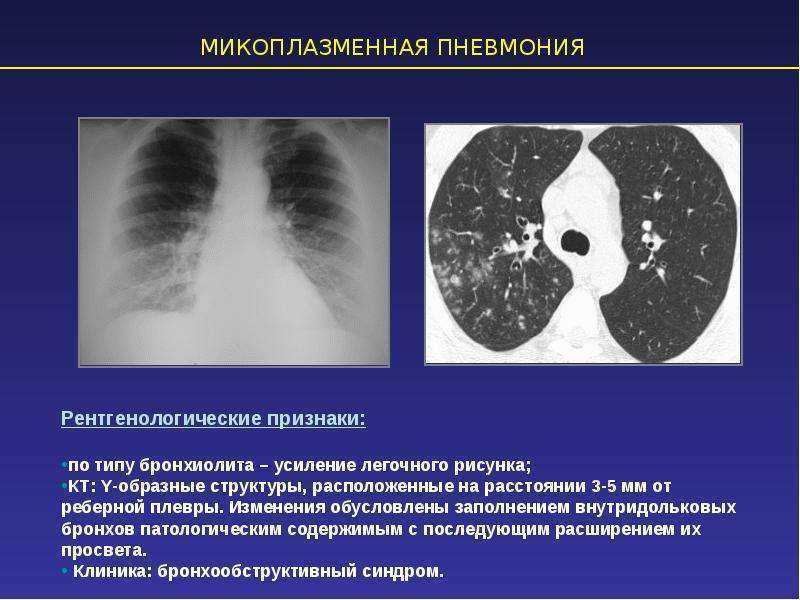 При остром развитии заболевания у ребенка отмечается лихорадка до 39,0—40,0 °С, сохраняющаяся до 10 дней. В дальнейшем, при неблагоприятном течении инфекционного процесса, появляются выраженные признаки интоксикации, появляется сухой интенсивный кашель, заложенность носа, першение в горле. Происходит снижение температуры, и яркие симптомы заболевания постепенно исчезают.
При остром развитии заболевания у ребенка отмечается лихорадка до 39,0—40,0 °С, сохраняющаяся до 10 дней. В дальнейшем, при неблагоприятном течении инфекционного процесса, появляются выраженные признаки интоксикации, появляется сухой интенсивный кашель, заложенность носа, першение в горле. Происходит снижение температуры, и яркие симптомы заболевания постепенно исчезают.
В случае постепенного начала заболевания, что наблюдается чаще, в первые дни заболевания отмечается вялость, сонливость ребенка при нормальных цифрах температуры тела. У него появляются нарушение носового дыхания с незначительным слизистым отделяемым, боль при глотании, сухой интенсивный кашель, возможно с болью за грудиной, рвотой в конце приступа кашля, болезненные ощущения в мышцах и в области поясницы. При осмотре могут определяться гиперемия слизистой оболочки глотки, небных миндалин, незначительное их увеличение. Такое проявление респираторного микоплаз-моза, по типу острой респираторной инфекции, может продолжаться 2—4 недели, а иногда и более.
Нередко инфекционный процесс распространяется на терминальные отделы респираторного тракта, что приводит к развитию микоплазменной пневмонии. В 20—30 % случаев воспалительный процесс охватывает сразу оба легких. Обычно заболевание начинается постепенно, с умеренной головной и мышечной боли, повышения температуры тела. Основными и наиболее постоянными симптомами мико-плазменной пневмонии являются непродуктивный обильный кашель, возникающий через 3—5 дней после начала инфекции, сохраняющийся в течение 3—4 недель, лихорадка, головные боли, выраженное недомогание, боли во всем теле [30].
Температура тела в течение всего периода болезни может оставаться субфебрильной, но может и достигать 38,5—39 °С, держаться на этом уровне до 7, а иногда и до 10—12 дней. Снижается температура литически, а затем длительно (иногда до месяца) может сохраняться субфебрилитет. Длительность и высота лихорадки
Длительность и высота лихорадки
зависят от тяжести процесса в легких. Так, при интер-стициальной пневмонии лихорадка менее выражена, а при очаговой и субдолевой — более выражена.
Если у больного отсутствует кашель, то диагноз микоплазменной пневмонии практически можно исключить. При данной патологии кашель обычно сухой, иногда сопровождается отделением небольшого количества слизистой мокроты, в тяжелых случаях — с прожилками крови. Как правило, кашель длится от нескольких недель до нескольких месяцев и сопровождается болью за грудиной, болью в грудной клетке при дыхании, усиливающейся при глубоком вдохе. У детей раннего возраста может развиться бронхообструктивный синдром. У детей старшего возраста и подростков кашель постепенно становится продуктивным. В легких при этом могут выслушиваться рассеянные сухие и разнокалиберные влажные хрипы. Примерно у 10 % детей с ми-коплазменной пневмонией отмечают преходящую макулопапулезную сыпь.
При исследовании крови отсутствует нейтро-фильный лейкоцитоз, характерен моноцитоз и незначительное увеличение СОЭ.
При рентгенологическом исследовании органов грудной клетки отмечается неоднородная негомогенная инфильтрация легких без четких границ, в виде небольших пятнистых или сливных затемнений, чаще в виде тумана, облака. Также характерным является выраженное усиление и сгущение легочного рисунка. Обычно процесс носит односторонний характер и локализуется в нижних отделах. Усиление бронхососудистого рисунка остается длительное время и после клинического выздоровления.
Наиболее специфичным и чувствительным методом лабораторной диагностики микоплазменной пневмонии является микробиологическое исследование. Однако выделение культуры M.pneumoniae не всегда представляется возможным. Это обусловлено тем, что, как правило, у большинства пациентов отмечается сухой кашель, особенно в начале заболевания, что затрудняет получение мокроты. С другой стороны, для выделения M.pneumoniae из клинического материала — мокроты, плевральной жидкости, легочной ткани, смывов с задней стенки глотки — требуются специфические среды, которые способны обеспечить микоплазмы источниками энергии, сте-ролами, фосфолипидами с определенным осмотическим давлением. К тому же даже при наличии богатой питательной среды рост M.pneumoniae происходит крайне медленно, в среднем 7—14 суток, а часто требует и гораздо более длительных, в течение нескольких недель, сроков инкубации, что нередко приводит к контаминации посева другими, менее прихотливыми микроорганизмами [33]. Чувствительность куль-турального исследования даже при четко выполненных требованиях не превышает 60 % [33, 34].
Это обусловлено тем, что, как правило, у большинства пациентов отмечается сухой кашель, особенно в начале заболевания, что затрудняет получение мокроты. С другой стороны, для выделения M.pneumoniae из клинического материала — мокроты, плевральной жидкости, легочной ткани, смывов с задней стенки глотки — требуются специфические среды, которые способны обеспечить микоплазмы источниками энергии, сте-ролами, фосфолипидами с определенным осмотическим давлением. К тому же даже при наличии богатой питательной среды рост M.pneumoniae происходит крайне медленно, в среднем 7—14 суток, а часто требует и гораздо более длительных, в течение нескольких недель, сроков инкубации, что нередко приводит к контаминации посева другими, менее прихотливыми микроорганизмами [33]. Чувствительность куль-турального исследования даже при четко выполненных требованиях не превышает 60 % [33, 34].
В то же время специфичность при использовании дополнительных тестов для видовой идентификации M.pneumoniae достигает 100 %. Поэтому вследствие трудности диагностики микоплазменной инфекции
путем культурального исследования этиологическая расшифровка основывается на серотипировании. Для этого используется реакция связывания комплемента (РСК), реакция непрямой иммунофлюо-ресценции (РНИФ), латекс-агглютинации, ИФА, позволяющие обнаружить специфические антитела к M.pneumoniae — иммуноглобулины классов А, M, G [31, 32, 39]. Наличие специфического инфекционного процесса подтверждается нарастанием концентрации IgG- и IgM-антител к M.pneumoniae при исследовании парных сывороток пациента с интервалом в 2 недели. Свидетельством острой или недавно перенесенной инфекции может считаться как минимум 4-кратное нарастание титра антител. При интерпретации результатов серологических методов исследования следует учитывать то, что достаточно высокий уровень антител класса IgG к M.pneumoniae может сохраняться длительное время после перенесенной инфекции либо нарастание титра IgG может быть отсроченным во времени [35].
В последнее время для диагностики микоплаз-менной инфекции все большее значение приобретает полимеразная цепная реакция (ПЦР) для определения ДНК возбудителя [33]. Метод ПЦР актуален в диагностике пневмонии, вызванной M.рneumoniae, так как характеризуется чувствительностью 85—95 % и специфичностью более 90 % [39]. Разрабатываются методики детекции микоплазм при помощи «гнездной» ПЦР, которая отличается более высокой чувствительностью, ПЦР в реальном времени [34]. Последняя, в отличие от классической ПЦР, по аналитическим характеристикам позволяет определять уровень микробной нагрузки. По мнению исследователей, это может использоваться для дифференциации инфекции c носительством M.pneumoniae и оценки степени тяжести инфекционного процесса [36].
Исследования по оценке приемлемости различного клинического материала для выявления M.pneumoniae определили более высокую диагностическую ценность мокроты по сравнению с оро-фарингеальными, назофарингеальными мазками или назофарингеальным аспиратом, что объясняется большей концентрацией возбудителя в нижних дыхательных путях [37]. Поэтому у пациентов с внебольничной пневмонией для культурального исследования и ПЦР следует использовать мокроту, и только при невозможности ее получения — образцы из верхних дыхательных путей [33].
Обследование на микоплазмоз следует проводить в случаях длительно протекающего заболевания с кашлем, а также при длительном субфебрилитете.
Терапия микоплазменной пневмонии включает назначение постельного режима на лихорадочный период, оксигенотерапию в случае насыщения крови кислородом менее 92 %, антипиретики только при повышении температуры тела до фебрильных цифр, исключая плановое назначение, что может создать иллюзию благополучия и затруднить оценку эффективности антибактериальной терапии. Кроме того,
Кроме того,
назначаются муколитические и отхаркивающие препараты. Бронхоспазмолитическая терапия в виде бета-2-агонистов короткого действия монотерапией или в составе комбинированных лекарственных препаратов (беродуал) назначается в случае сопутствующего бронхообструктивного синдрома, что часто может наблюдаться при микоплазменной пневмонии, а также при возникновении пневмонии у больных бронхиальной астмой [39].
При микоплазменной пневмонии возбудитель находится внутри нейтрофилов, альвеолярных макрофагов, и это защищает его от действия таких антибиотиков, как пенициллины, цефалоспорины, аминогликозиды. Поэтому антибиотиками первого ряда в лечении больных являются макролиды: ази-тромицин, спиромицин, кларитромицин. Механизм действия макролидов связан с нарушением синтеза белка в клетках чувствительных микроорганизмов. Для большинства этих препаратов характерен постантибиотический эффект, в основе которого лежат необратимые изменения в рибосомах микроорганизма, благодаря чему антибактериальное действие усиливается и пролонгируется, сохраняясь в течение срока, необходимого для ресинтеза новых функциональных белков микробной клетки [22, 38]. Кроме того, макролиды обладают противовоспалительными и иммуномодулирующими свойствами, которые обусловлены модулирующим влиянием на такие функции нейтрофилов, как фагоцитоз, хемотаксис, киллинг. Под влиянием 14-членных макролидов происходит ингибирование окислительного «взрыва», в результате чего уменьшается образование высокоактивных окисляющих соединений, способных повреждать не только бактериальные клетки, но и собственные ткани. Взаимодействуя с клетками иммунной системы, макролиды могут ингибировать синтез и/или секрецию таких провоспалительных цитокинов, как интерлейкины — IL-1, IL-6, IL-8, фактор некроза опухоли а, и, наоборот, усиливать секрецию противовоспалительных интерлейки-нов — IL-2, IL-4, IL-10 [22]. Наиболее активными в отношении M. pneumoniae является азитромицин, джозамицин, спирамицин.
pneumoniae является азитромицин, джозамицин, спирамицин.
Фармакокинетические параметры азитромицина выгодно отличают препарат от других макролидов. Так, азитромицин более устойчив к действию соляной кислоты желудочного сока, не оказывает ин-гибирующего влияния на микросомальную систему цитохрома Р-450 (что характерно для 14-членных макролидов) и, следовательно, характеризуется низкой вероятностью лекарственных взаимодействий.
Кроме того, азитромицин максимально накапливается в легочной ткани, в слизистых оболочках бронхов и альвеол, среднего уха, синусов, бронхиальном секрете, слюне, миндалинах. Активный захват антибиотика фибробластами, альвеолярными макрофагами и полиморфноядерными лейкоцитами создает в них концентрации, многократно превышающие таковые в сыворотке крови. Мигрируя в очаг воспаления, фагоциты выполняют транспортную функцию, достав-
Таблица 2. Способ применения Азитро САНДОЗ® в суспензии у детей при концентрации азитромицина
200 мг/5 мл
Таблица 1. Способ применения Азитро САНДОЗ® в суспензии у детей при концентрации азитромицина
100 мг/5 мл
Масса тела, кг 3-дневная терапия, мл 5-дневная терапия, мл
1-3-й день 10 мг/кг/сутки 1-й день 10 мг/кг/сутки 2-5-й день 5 мг/кг/сутки
10 5 5 2,5
12 6 6 3
Масса тела, кг 3-дневная терапия, мл 5-дневная терапия, мл
1-3-й день 10 мг/кг/сутки 1-й день 10 мг/кг/сутки 2-5-й день 5 мг/кг/сутки
10 2,5 2,5 1,25
12 3 3 1,5
14 3,5 3,5 1,75
16 4 4 2
17-25 5 5 2,5
26-35 7,5 7,5 3,75
36-45 10 10 5
Более 45 кг 12,5 12,5 6,25
ляя антибиотик непосредственно к месту локализации бактерий. Под влиянием микробных стимулов происходит выделение препарата из клеток в пораженные ткани и создание его более высокой и длительно сохраняющейся концентрации в очаге инфекции.
Под влиянием микробных стимулов происходит выделение препарата из клеток в пораженные ткани и создание его более высокой и длительно сохраняющейся концентрации в очаге инфекции.
Согласно данным метаанализа, включившего 45 клинических исследований, общая частота нежелательных явлений при приеме азитромицина составила не более 9 %, наиболее типичными из которых являлись нарушения со стороны ЖКТ — боли и дискомфорт в животе, тошнота, диарея. В другом мета-анализе показано, что частота отмены азитромицина из-за нежелательных явлений при лечении инфекций нижних и верхних отделов дыхательных путей составляет 0,7 и 0,8 % соответственно. В отличие от эритромицина и кларитромицина азитромицин не приводит к повышению уровня трансаминаз и развитию холестаза, также при его применении не отмечается удлинение интервала QT.
В последние годы при изучении влияния ази-тромицина на белки, образующие межклеточные соединения в респираторном эпителии, были получены новые данные о неантибактериальных свойствах азитромицина, которые носят обратимый и дозозависимый характер. Установлено, что азитро-мицин увеличивает электрическое сопротивление респираторного эпителия за счет влияния на регуляцию транспорта ионов и растворов через межклеточное пространство и регулирует локализацию белков межклеточных контактов эпителия (клаудин-1, клаудин-4, адгезивная молекула), обеспечивающих целостность эпителиальной ткани и являющихся ключевым компонентом структурной и функциональной защиты эпителия дыхательных путей. Этими свойствами не обладают другие антибиотики. Важным является отсутствие отрицательного влияния азитромицина на жизнеспособность респираторного эпителия [40].
В настоящее время среди макролидов широко используется Азитро САНДОЗ® (Sandoz), как в педиатрии, так и во взрослой практике. Азитро САНДОЗ® — это единственная на украинском рынке суспензия, содержащая азитромицина моногидрат. В соответствии с информацией, содержащейся в краткой характеристике продукта (SmPC), суспензия азитромицина моногидрата может приниматься вместе с едой. Формы выпуска — таблетки по 250 и 500 мг и суспензия по 100 и 200 мг азитромицина в 5 мл раствора. Важным преимуществом Азитро САНДОЗ® являются европейское качество и доступная цена.
В соответствии с информацией, содержащейся в краткой характеристике продукта (SmPC), суспензия азитромицина моногидрата может приниматься вместе с едой. Формы выпуска — таблетки по 250 и 500 мг и суспензия по 100 и 200 мг азитромицина в 5 мл раствора. Важным преимуществом Азитро САНДОЗ® являются европейское качество и доступная цена.
Способ применения и дозирование Азитро САНДОЗ®. Взрослым по 500 мг в сутки в течение 3 дней или 500 мг в первый день и в последующие 4 дня по 250 мг. Детям — из расчета 10 мг/кг 1 раз в сутки на протяжении 3 дней или 10 мг/кг в сутки в первый день с переходом на 5 мг/кг в последующие 4 дня.
Методика применения Азитро САНДОЗ® в зависимости от концентрации суспензии представлена в табл. 1 и 2.
Список литературы
1. Заплатников А.Л. Внебольничные пневмонии у детей раннего возраста: принципы антимикробной терапии // Лечащий врач. — 2007. — № 7. — С. 3-9.
2. Таточенко В.К. Практическая пульмонология детского возраста. — М, 2001. — 268 с.
3. Острые респираторные заболевания у детей: лечение и профилактика /Научно-практическая программа Союза педиатров России. — М.: Международный фонд охраны здоровья матери и ребенка, 2002. — 69 с.
4. Самсыгина Г.А. Пневмонии у детей // http://medvuz.com/ med1808/t5/7.php
5. Горбич О.А, Чистенко Т.Н. Эпидемиологические аспекты пневмоний // http://www.bsmu.by/index.php?option=com_content &view=article&id=4478:2011-03-10-10-18-17&catid=297:42010-&Itemid=196
6. Пневмония / Информационный бюллетень ВОЗ. — 2009. — № 331. — 3 с.
7. Mcintosh K. Community-acquired pneumonia in children / K. Mcintosh //New England Journal of Medicine. — 2002. — Vol. 346, № 6. — P. 429-437.
8. Heiskanen-Kosma T. Chlamydia pneumoniae is an important cause of community-acquired pneumonia in school-aged children: serological results of a prospective, population-based study / T. Heiskanen-Kosma [et al.] // Scandinavian journal of infectious diseases. — 1999. — Vol. 31, № 3. — P. 255-259.
9. Dowell S.F. Mortality from pneumonia in children in the United States, 1939 through 1996/ S.F. Dowell // New England Journal of Medicine. — 2000. — Vol. 342, № 19. — P. 1399-1407.
10. Tan T. Clinical characteristics of children with complicated pneumonia caused by Streptococcus pneumoniae / T. Tan [et al.] // Pediatrics. — 2002. — Vol. 110, № 1. — P. 1-6.
11. Гучев И.А. Современные руководства по ведению внеболь-ничной пневмонии у взрослых: путь к единому стандарту/И.А. Гучев, А.И. Синопальников // Клиническая микробиология и антимикробная химиотерапия. — 2008. — Т. 10, № 4. — С. 305-321.
12. Волосовець О.П., Юлш 6.1. Рацюнальна антибютикоте-рапы рестраторних захворювань у дтей. — Тернопшь: Укрмед-книга, 2003. — 399 с.
13. Таточенко В.К. Клинические рекомендации. Педиатрия (Пневмония у детей) / Под ред. А.А. Баранова. — М.: ГЭОТАР-Медиа, 2005. — 28 с.
14. Community Acquired Pneumonia Guideline Team, Cincinnati Children’s Hospital Medical Center: Evidence-based care guideline for medical management ofCommunity Acquired Pneumonia in children 60 days to 17 years ofage. http://www.cincinnatichildrens.org/svc/alpha/h/ healthpolicy/based/pneumonia. htm. Guideline 14, pages 1—16, 2005.
htm. Guideline 14, pages 1—16, 2005.
15. Малахов А.Б., Дронов И.А., Волков И.К., Геппе НА., Кир-даков Ф.И. Оптимальный выбор терапии при внебольничной пневмонии у детей//Лечащий врач. — 2011. — № 1. — С. 28-34.
16. Юлиш Е.И., Кривущев Б.И. Подходы к направленной эти-отропной терапии при бактериальных респираторных заболеваниях у детей //Здоровье ребенка. — 2010. — № 6 (33). — С. 82-87.
17. Mcintosh K Community-Acquired pneumonia in children // N. Engl. J. Med. — 2002. — Vol. 346, № 6. — P. 429-437.
18. Crawford S.E., Daum R.S. Bacterial pneumonia, lung abscess and empyema / Pediatric respiratory medicine// Ed. by Taussig L.M., Landau L.I. — Mosby Inc. — 2008. — P. 501-553.
19. Niederman M.S., Mandell L.A., Anzueto A. et al. Guidelines for the management of adults with community-acquired pneumonia. Diagnosis, assessment of severity, antimicrobial therapy, and prevention // Am. J. Respir. Crit. Care Med. — 2001. — Vol. 163. — P. 1730-1754.
20. Principi N.M. Pneumoniae and Chlamydia pneumoniae cause not only atypical pneumonias/ N. Principi [et al.] // Clinical Infectious Diseases. — 2001. — Vol. 32, № 9. — P. 1281-1289.
21. Somer A. Chlamydia pneumoniae in children with community-acquired pneumonia in Istanbul, Turkey/ A. Somer[et al.] // Journal of tropical pediatrics. — 2006. — Vol. 52, № 3. — P. 173-178.
22. Мусалимова Г.Г., Саперов В.Н., Никонорова Т.А. Диагностика и лечение микоплазменной и хламидийной пневмоний // Лечащий врач. — 2004. — № 8. — С. 21-25.
23. Mandell L.A., Marrie T.J, Grossman R.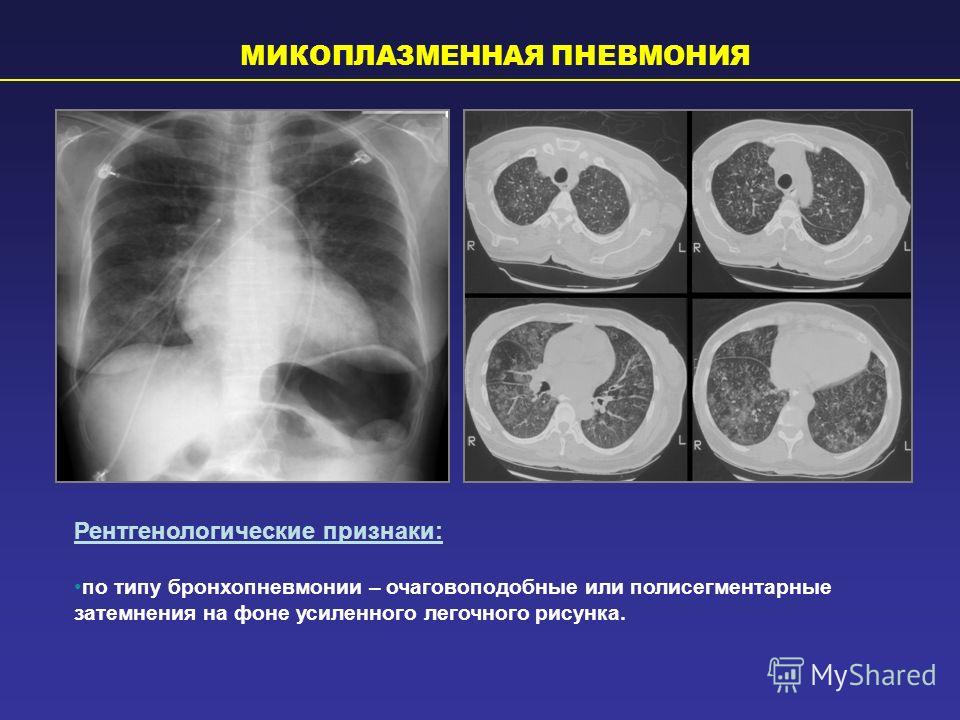 вання мь коплазмено1 пневмони в дитячому вщ.
вання мь коплазмено1 пневмони в дитячому вщ.
Kro40Bi слова: мшоплазмена пневмон1я, дии.
25. British Thoracic Society Guidelines for the management of community-acquired pneumonia in adults // Thorax. — 2001. — Vol. 56, № 4. — Р. 1-64.
26. Российский терапевтический справочник / Под ред. А.Г. Чучалина. — М, 2005. — 308 с.
27. Simberkoff M.S., Cross A.P., Al-Ibrahim M. et al. Etlicacy of pnevmococcal vaccine in hiqh- risk patients: results of a Veterans Administration cooperative study//N. Engl. J. Med. —1986. — Р. 43-45.
28. Сторожаков Г.И., Утешев Д.Б. Некоторые аспекты диагностики и лечения внебольничных пневмоний, вызванных атипичными возбудителями //Лечащий врач. — 2005. — № 8. — С. 34-39.
29. Лебедева М.В. Особенности кашля у детей дошкольного возраста, посещающих детский сад и находящихся на дому, и его лечение//Лечащий врач. — 2013. — № 8. — С. 25-31.
30. Reither M. Mykoplasmenpneumonie im Kindes- und Jugendalter // Padiat. prax. — 55. — 619-627.
31. Marrie T.J, Peeling R.W., Fane M.J. et al. Ambulatory patients with community — acquired pneumonia the freguency of atypical agents and clinical course //Am. J. Med. — 1996. — Vol. 5. — P. 67-90.
32. Ноников В.Е. Диагностика и лечение атипичных пневмоний // Consilium medicum. — 2001. — T. 3, № 12. — C. 569-574.
33. Рачина С.А., Козлов Р.С. Современные подходы к микробиологической диагностике при внебольничной пневмонии//Пульмонология. — 2010. — № 5. — С. 5-14.
34. Waites K.B., Talkington D.F. M. pneumoniae and its role as a human pathogen // Clin. Microbiol. Rev. — 2004. — 17. — 697-728.
Waites K.B., Talkington D.F. M. pneumoniae and its role as a human pathogen // Clin. Microbiol. Rev. — 2004. — 17. — 697-728.
35. Razin S. Diagnosis of mycoplasmal infections// Ed. by Razin S., Herrmann R. Molecular biology and pathogenicity of mycoplasmas. — New York: Kluwer Academic/ Plenum Publishers; 2002. — 531-544.
36. Dorigo-Zetsma J.W., Zaat S.A., Vriesema A.J. et al. Demonstration by a nested PCRfor M. pneumoniae that M. pneumoniae load in the throat is higher in patients hospitalized for M. pneumoniae infection than in non-hospitalised subjects // J. Med. Microbiol. —
1999. — 48. — 1115-1122.
37. Loens K., Beck T., Ursi D. et al. Evaluation of different nucleic acid amplification techniques for the detection of M. pneumoniae, C. pneumoniae and Legionella spp. in respiratory specimens from patients with community-acquired pneumonia // J. Microbiol. Meth. — 2008. — 73. — 257-262.
38. Макаревич А.Э. Болезни органов дыхания. — Минск,
2000. — 369 с.
39. Внебольничная пневмония у детей: распространенность, диагностика, лечение, профилактика. Научно-практическая программа / Под ред. Чучалина А.Г. — М, 2011. — 63 с.
40. Применение антибиотиков у детей в амбулаторной практике /Подред. А.А. Баранова, Л.С. Страчунского//Клин. микро-биол. антимикроб. химиотер. — 2007. — 9 (3). — 200-10.
41. Охотникова Е.Н., Поночевная Е.В., Усова Е.И. и др. Ази-тро Сандоз в лечении заболеваний респираторной системы у детей // Здоровье Украины. — 2010. — № 1. — С. 41.
42. Summary of Product Characteristics (SmPC) Azithromycin 200 mg/ 5ml Powder for Oral Suspension HYPERLINK (https://www. medicines.org.uk/emc/medicine/22608/SPC/Az,ithromycin+200mg+ 5ml+Powder+for+Oral+Suspension)
Summary of Product Characteristics (SmPC) Azithromycin 200 mg/ 5ml Powder for Oral Suspension HYPERLINK (https://www. medicines.org.uk/emc/medicine/22608/SPC/Az,ithromycin+200mg+ 5ml+Powder+for+Oral+Suspension)
43. Инструкция по медицинскому применению препарата.
44. Електронна база Морюн. Програмний комплекс «Аптека». Оптовi та роздрiбнi пропозици, ачень 2014 (http://pharmabase. com.ua/poisk/)
Получено 07.02.14 4-03-АЗД-РЕЦ-0114 □
Yulish Ye.!., Chernyshova O.Ye., Konyushevskaya A.A., Talalayenko A.K.
Donetsk National Medical University named after M. Gorky, Donetsk, Ukraine
FEATURES OF CLINICAL PRESENTATION, DIAGNOSIS AND TREATMENT OF MYCOPLASMAL PNEUMONIA IN CHILDREN
Summary. This paper presents the features of clinical presentation, diagnostic methods, principles of rational treatment of mycoplasmal pneumonia in childhood.
Key words: mycoplasmal pneumonia, children.
запись к врачу — ДокДок СПб
Пульмонологи Санкт-Петербурга — последние отзывы
Внимательный и опытный доктор. Она сделала мне бронхометрию и назначила препарат, от которого у меня появились побочные эффекты. Поэтому мне надо будет еще раз прийти к ней на консультацию.
Надежда,
19 ноября 2020
Хороший доктор. Она выслушала пациента и прописала лечение. Нам понравилось!
Она выслушала пациента и прописала лечение. Нам понравилось!
На модерации,
22 марта 2021
Я рассказала доктору, что меня беспокоит. Она меня послушала, посмотрела мои документы и сделала все, что нужно. Приятный и красивый врач.
На модерации,
22 марта 2021
Доктор внимательный. Она ничего нового не рассказала нам о проблеме. Врач минуты 3 разговаривала по телефону во время приема.
Анна,
17 марта 2021
Доктор очень приятный и обходительный. Он меня расспросил, послушал, провел обследование и направил на анализы. Я приду к врачу на повторный приём.
Надежда,
16 марта 2021
Владимир Николаевич внимательный, спокойный, располагающий к себе и профессиональный врач. Он подробно просмотрел результаты анализов, осмотрел меня, проконсультировал, всё объяснил и дал рекомендации. Доктор так же ответил на все мои вопросы.
Он подробно просмотрел результаты анализов, осмотрел меня, проконсультировал, всё объяснил и дал рекомендации. Доктор так же ответил на все мои вопросы.
Наталья,
14 марта 2021
Доктор внимательный и профессиональный. Она выслушала меня, всё записала, осмотрела и дала рекомендации. Я доволен!
Михаил,
14 марта 2021
Ирина Викторовна осмотрела меня, прописала рекомендации и назначения. Она профессиональный, внимательный и приятный врач. Я пойду к ней повторно!
Галина,
14 марта 2021
Хороший и внимательный доктор. На приеме он нам все доступно объяснил, рассказал, сделал правильные назначения и прописал лечение.
Светлана,
10 марта 2021
Хороший, грамотный, отзывчивый и внимательный специалист. Он нам всё объяснил и назначил лечение.
Он нам всё объяснил и назначил лечение.
Елена,
10 марта 2021
Показать 10 отзывов из 730
Микоплазма пневмонии (Мycoplasma pneumoniae)
Микоплазма пневмонии — вид бактерий, вызывающих у человека заболевания респираторного тракта, источником инфекции является больной человек или носитель.
Микоплазма пневмонии служит причиной 10 – 20% всех случаев пневмонии. Кроме того, микоплазма часто вызывает трахеобронхит, бронхиолит, фарингит. Вызванные микоплазмами инфекции отличаются затяжным течением (недели и более).
В крупных городах инфекции, вызванные Mycoplasma pneumoniae постоянно встречаются на протяжении всего года. Каждые 3 – 7 лет возникают эпидемии микоплазменной инфекции. Инфекции, вызванные Mycoplasma pneumoniae передаются воздушно-пылевым путем, но, в отличие от других респираторных инфекций, распространяются медленно, даже в пределах одной семьи.
Внедрение микоплазмы внутрь клетки человека превращает последнюю в иммунологически инородную, что провоцирует развитие реакции организма, направленной против собственных клеток (аутоиммунные реакции). Микоплазма поражает ткань бронхов, трахеи и легких. При благоприятных условиях микроб легко атакует клетку-мишень, а затем паразитирует внутри клетки-хозяина или на ее клеточной мембране.
Инкубационный период длится, как правило, 12-14 дней, но может достигать и 4 недель. В это время человек еще даже не подозревает, что он болен. В первую очередь под удар попадают верхние дыхательные пути, у больного наблюдается сухость и заложенность носа. Постепенно добавляется дискомфорт в горле, садится голос. Общее самочувствие начинает ухудшаться. Температура
Температура
поднимается все выше и выше, пока не достигнет критической отметки. Все это сопровождается слабостью и обильным потоотделением. Эти симптомы проявляются в течении 1-2 недель. Характерным признаком является кашель, длительностью до двух недель. Обычно кашель наступает приступами. Во время этих приступов выделяется немного густой мокроты. Заболевшие отмечают боль в мышцах (31,3%), головную боль (63,6%), а также явления, не характерные для ОРВИ — высыпания на кожном покрове (22,7%), барабанных перепонках, расстройства кишечника (25%) и парестезии (покалывание, жжение кожи и т. п.). При поражении центральной нервной системы (ЦНС) микоплазмозом — выздоровление обычно идет медленно, а в некоторых случаях наблюдаются остаточные дефекты. Возможны смертельные исходы.
Прогноз и профилактика
Прогноз благоприятный. В большинстве случаев болезнь заканчивается полным выздоровлением. После заболевания образуется иммунитет, но он нестойкий.
Профилактика микоплазменной пневмонии аналогична профилактике других сезонных респираторных заболеваний. Во время вспышек эпидемии рекомендуется избегать людных средств или пользоваться масками. Также очень важно для профилактики заболевания укреплять иммунитет, так как микоплазменная инфекция чаще развивается на фоне ослабленной иммунной системы.
Диагностика
В отличие от бактериальных пневмоний, микоплазменная и хламидийная не имеют отчетливых физикальных и рентгенологических признаков инфильтрации, а культуральная диагностика их невозможна, так как микоплазмы и хламидии являются внутриклеточными возбудителями. Поэтому диагностика микоплазменной и хламидийной пневмоний основывается в первую очередь на выявлении особенностей клинико-рентгенологических данных и подтверждается с помощью полимеразно-цепной реакции (ПЦР).
ФБУЗ «Центр гигиены и эпидемиологии в ЯНАО» приглашает Вас сдать анализ «Возбудители респираторных инфекций (Mycoplasma pneumoniae / Chlamydophila pneumoniae), качественное определение ДНК.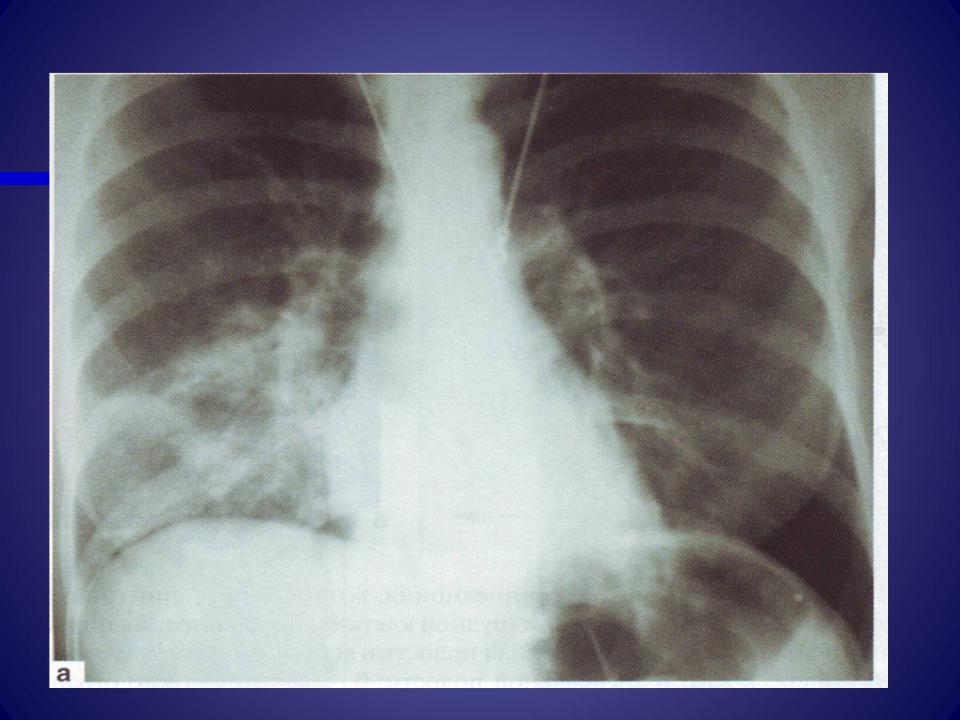
|
ВАЖНО! Для получения достоверных результатов, анализы на выявление возбудителей инфекций должны проводиться не менее чем через 2 недели после последнего приема антибактериальных препаратов. |
|
Мазок из ротоглотки. Натощак или через 4 часа после еды, (не полоскать рот, не пить) |
|
Мокрота. После предварительного полоскания полости рта водой. Рекомендуется собирать с утра, после санации ротовой полости, в стерильный пластиковый контейнер с закручивающейся крышкой (контейнер можно получить бесплатно), в количестве не менее 5,0 мл. |
Лекарства от микоплазменной пневмонии: лечение антибиотиками
McCormack WM. Инфекции, вызванные микоплазмами. Каспер Д.Л., Браунвальд Э., Фаучи А.С. и др., Ред. Принципы внутренней медицины Харрисона . Нью-Йорк: Макгроу-Хилл; 2005. 16-е изд .: 1008-11, 159.
.
Reimann HA. Острая инфекция дыхательных путей с атипичной пневмонией: заболевание, вероятно, вызванное фильтруемым вирусом. JAMA . 1938. 111: 2377-84.
Eaton MD, Meiklejohn G, VanHerick W.Исследования этиологии первичной атипичной пневмонии: фильтруемый агент, передающийся хлопковым крысам, хомякам и куриным эмбрионам. J Exp Med . 1944. 79: 649-67.
Камизоно С., Охя Х., Хигучи С., Окадзаки Н., Нарита М. Три семейных случая лекарственно-устойчивой инфекции Mycoplasma pneumoniae. Eur J Pediatr . 2010 июн. 169 (6): 721-6. [Медлайн].
Исодзуми Р., Йошимин Х., Морозуми М., Убуката К., Ариёши К. Внебольничная пневмония взрослых, вызванная устойчивой к макролидам Mycoplasma pneumoniae. Респирология . 2009 14 ноября (8): 1206-8. [Медлайн].
Респирология . 2009 14 ноября (8): 1206-8. [Медлайн].
Мацубара К., Морозуми М., Окада Т., Мацусима Т., Комияма О, Сёдзи М. и др. Сравнительное клиническое исследование чувствительных к макролидам и устойчивых к макролидам инфекций Mycoplasma pneumoniae у педиатрических пациентов. J Заразить Chemother . 2009 15 декабря (6): 380-3. [Медлайн].
Ли Х, Юн К.В., Ли ХД, Чхве Э. Антимикробная терапия макролид-резистентной пневмонии Mycoplasma pneumoniae у детей. Expert Rev Anti Infect Ther . 2017 г. 11. 1–12. [Медлайн].
Copete AR, Aguilar YA, Rueda ZV, Vélez LA. Генотипирование и устойчивость к макролидам Mycoplasma pneumoniae, выявленная у детей с внебольничной пневмонией в Медельине, Колумбия. Int J Заразить Dis . 2017 15 ноября. 66: 113-120. [Медлайн].
Blyth CC, Gerber JS. Макролиды у детей с внебольничной пневмонией: панацея или плацебо ?. J Pediatric Infect Dis Soc .2017 31 октября. [Medline].
Таширо М., Фусими К., Кавано К., Таказоно Т., Сайджо Т., Ямамото К. и др. Сравнение эффективности противомикробных препаратов среди госпитализированных пациентов с Mycoplasma pneumoniae Pneumoniae в Японии во время крупных эпидемий устойчивых к макролидам инфекций M. pneumoniae: общенациональное обсервационное исследование. Clin Infect Dis . 2017 13 ноября. 65 (11): 1837-1842. [Медлайн].
Ли СВ, Ян СС, Чанг С.С., Йе Х.Дж., Чоу В.К.Острый гепатит, связанный с микоплазменной пневмонией, у взрослого пациента без легочной инфекции. Дж. Чин Мед Ассо . 2009 Апрель 72 (4): 204-6. [Медлайн].
Quioc JJ, Trabut JB, Drouhin F, Malbrunot C, Vallet-Pichard A, Pol S, et al. Острый холестатический гепатит, выявляющий инфекцию Mycoplasma pneumoniae без поражения легких у взрослого пациента. евро J Гастроэнтерол Hepatol . 2009 21 февраля (2): 220-1. [Медлайн].
Острый холестатический гепатит, выявляющий инфекцию Mycoplasma pneumoniae без поражения легких у взрослого пациента. евро J Гастроэнтерол Hepatol . 2009 21 февраля (2): 220-1. [Медлайн].
Okoli K, Gupta A, Irani F, Kasmani R.Иммунная тромбоцитопения, связанная с инфекцией Mycoplasma pneumoniae: отчет о болезни и обзор литературы. Фибринолиз свертывания крови . 2009 20 октября (7): 595-8. [Медлайн].
Хан Ф.Ю., Аяссин М. Mycoplasma pneumoniae, ассоциированная с тяжелой аутоиммунной гемолитической анемией: отчет о болезни и обзор литературы. Braz J Infect Dis . 2009 Февраль 13 (1): 77-9. [Медлайн].
Веттер Д.А., Камиллери MJ. Клинические, этиологические и гистопатологические особенности синдрома Стивенса-Джонсона в течение 8-летнего периода в клинике Мэйо. Mayo Clin Proc . 2010 Февраль 85 (2): 131-8. [Медлайн]. [Полный текст].
Yachoui R, Kolasinski SL, Feinstein DE. Mycoplasma pneumoniae с атипичным синдромом Стивенса-Джонсона: диагностическая проблема. Case Rep Infect Dis . 2013. 2013: 457161. [Медлайн]. [Полный текст].
Адзумагава К., Камбара Ю., Мурата Т., Тамай Х. Четыре случая артрита, связанного с инфекцией Mycoplasma pneumoniae. Педиатр Инт . 2008 Август.50 (4): 511-3. [Медлайн].
Csábi G, Komáromy H, Hollódy K. Поперечный миелит как редкое серьезное осложнение инфекции Mycoplasma pneumoniae. Педиатр Нейрол . 2009 Октябрь 41 (4): 312-3. [Медлайн].
Нарита М. Патогенез неврологических проявлений инфекции Mycoplasma pneumoniae. Педиатр Нейрол . 2009 Сентябрь 41 (3): 159-66. [Медлайн].
[Медлайн].
Ноймайр Л., Леннетт Э., Келли Д., Эрлз А., Эмбури С., Гронси П. и др.Микоплазменная болезнь и острый грудной синдром при серповидно-клеточной анемии. Педиатрия . 2003 июл.112 (1, часть 1): 87-95. [Медлайн].
Ван К., Гилл П., Перера Р., Томсон А., Мант Д., Харден А. Клинические симптомы и признаки для диагностики Mycoplasma pneumoniae у детей и подростков с внебольничной пневмонией. Кокрановская база данных Syst Rev . 17 октября 2012 г. 10: CD009175. [Медлайн].
Рахимиан М., Хоссейни Б. М. Серологическое исследование Bordetella Pertussis, Mycoplasma Pneumonia и Chlamydia Pneumonia у иранских паломников хаджа с длительными кашлевыми заболеваниями: последующее исследование. Респир Мед . 2017 Ноябрь 132: 122-131. [Медлайн].
Крамер Л., Эмара Д.М., Гадре А.К. Микоплазма — маловероятная причина буллезного мирингита. Ухо-носовое горло J . 2012 июн.91 (6): E30-1. [Медлайн].
Меллик Л.Б., Верма Н. Миф о Mycoplasma pneumoniae и буллезном мирингите. Скорая педиатрическая помощь . 2010 26 декабря (12): 966-8. [Медлайн].
Меллик Л.Б., Верма Н. Миф о Mycoplasma pneumoniae и буллезном мирингите. Скорая педиатрическая помощь . 2010 26 декабря (12): 966-8. [Медлайн].
Котикоски MJ, Kleemola M, Palmu AA. Нет данных о Mycoplasma pneumoniae при остром мирингите. Pediatr Infect Dis J . 2004 Май. 23 (5): 465-6. [Медлайн].
Palmu AA, Kotikoski MJ, Kaijalainen TH, Puhakka HJ. Бактериальная этиология острого мирингита у детей младше двух лет. Pediatr Infect Dis J . 2001 июн.20 (6): 607-11. [Медлайн].
Робертс ДБ. Этиология буллезного мирингита и роль микоплазм в заболевании ушей: обзор. Педиатрия . 1980 апр. 65 (4): 761-6. [Медлайн].
Reittner P, Müller NL, Heyneman L, Johkoh T, Park JS, Lee KS, et al. Mycoplasma pneumoniae pneumonia: рентгенографические и КТ с высоким разрешением у 28 пациентов. AJR Am J Roentgenol . 2000, январь, 174 (1): 37-41. [Медлайн].
Ma LD, Chen B, Dong Y, Fan J, Xia L, Wang SZ, et al.Экспресс посев на микоплазмы для ранней диагностики инфекции Mycoplasma pneumoniae. J Clin Lab Анал . 2010. 24 (4): 224-9. [Медлайн].
Онари С., Окада Т., Окада Т., Окано С., Какута О, Куцума Х. и др. Иммунохроматографический тест для быстрой диагностики инфекции Mycoplasma pneumoniae. Педиатр Инт . 2017 Октябрь 59 (10): 1123-1125. [Медлайн].
Song M, Zhang Y, Li S, Zhang C, Tao M, Tang Y, et al. Чувствительный и быстрый иммуноферментный анализ на Mycoplasma pneumoniae у детей с пневмонией на основе однослойных углеродных нанотрубок. Научный сотрудник . 2017 27 ноября. 7 (1): 16442. [Медлайн].
Dumke R, Strubel A, Cyncynatus C, Nuyttens H, Herrmann R, Lück C и др. Оптимизированная серодиагностика инфекций Mycoplasma pneumoniae. Диагностика Microbiol Infect Dis . 2012 июн.73 (2): 200-3. [Медлайн].
Чжао Ф., Цао Б., Хе ЛХ и др. Оценка нового анализа ПЦР в реальном времени для обнаружения Mycoplasma pneumoniae в клинических образцах. Биомедицинская среда Sci .2012 25 февраля (1): 77-81. [Медлайн].
Mustafa MI, Al-Marzooq F, How SH, Kuan YC, Ng TH. Использование мультиплексной ПЦР в реальном времени улучшает выявление бактериальной этиологии внебольничной пневмонии. Троп Биомед . 2011 Декабрь 28 (3): 531-44. [Медлайн].
Ди Марко Э., Канджеми Дж., Филиппетти М., Мелиоли Дж., Биассони Р. Разработка и клиническая проверка ПЦР в реальном времени с использованием одномолекулярного зонда на основе скорпиона для обнаружения Mycoplasma pneumoniae в клинических изолятах. Новый микробиол . 2007 октября 30 (4): 415-21. [Медлайн].
Галлсби К., Сторм М., Бондесон К. Одновременное обнаружение Chlamydophila pneumoniae и Mycoplasma pneumoniae с помощью молекулярных маяков в дуплексной ПЦР в реальном времени. Дж. Клин Микробиол . 2008 Февраль 46 (2): 727-31. [Медлайн]. [Полный текст].
Chen CJ, Hung MC, Kuo KL, Chung JL, Wu KG, Hwang BT и др. Роль катионного белка эозинофилов у пациентов с инфекцией Mycoplasma pneumoniae. Дж. Чин Мед Ассо . 2008, январь 71 (1): 37-9. [Медлайн].
Llibre JM, Urban A, Garcia E, Carrasco MA, Murcia C. Облитерирующий бронхиолит, организующий пневмонию, связанную с острой инфекцией Mycoplasma pneumoniae. Clin Infect Dis . 1997 25 декабря (6): 1340-2. [Медлайн].
Нагашима М., Хигаки Т., Сато Х., Накано Т. Сердечный тромб, связанный с инфекцией Mycoplasma pneumoniae. Interact Cardiovasc Thorac Surg .2010 декабря 11 (6): 849-51. [Медлайн].
Li CM, Gu L, Yin SJ, et al. Возрастное поражение миокарда, связанное с пневмонией Mycoplasma pneumoniae, у детей. J Int Med Res . 2013 Октябрь 41 (5): 1716-23. [Медлайн].
Daxboeck F. Инфекции центральной нервной системы Mycoplasma pneumoniae. Curr Opin Neurol . 2006 августа 19 (4): 374-8. [Медлайн].
Смит Р., Эвиатар Л. Неврологические проявления инфекций Mycoplasma pneumoniae: разнообразный спектр заболеваний.Отчет о шести случаях и обзор литературы. Clin Pediatr (Phila) . 2000 апр. 39 (4): 195-201. [Медлайн].
Koskiniemi M. Проявления ЦНС, связанные с инфекциями Mycoplasma pneumoniae: краткое изложение случаев в Университете Хельсинки и обзор. Clin Infect Dis . 1993, 17 августа, приложение 1: S52-7. [Медлайн].
Luby JP. Пневмония, вызванная инфекцией Mycoplasma pneumoniae. Clin Chest Med . 1991 июн.12 (2): 237-44. [Медлайн].
Kurata M, Kano Y, Sato Y, Hirahara K, Shiohara T. Синергетические эффекты инфекции Mycoplasma pneumoniae и лекарственной реакции на развитие атипичного синдрома Стивенса-Джонсона у взрослых. Acta Derm Venereol . 2016 Январь 96 (1): 111-3. [Медлайн]. [Полный текст].
Калер Дж., Мухтар О, Хан Б., Шреста Б., Калер Р., Тинг Б. и др. Рабдомиолиз: необычное представление инфекции Mycoplasma pneumoniae в отчете о случае для взрослых и обзоре литературы. Кейс Реп Мед . 2018. 2018: 6897975. [Медлайн].
Хан Ф.Ю., Сайед Х. Рабдомиолиз, связанный с пневмонией Mycoplasma pneumoniae. Гонконгская медицина J . 2012 июн. 18 (3): 247-9. [Медлайн].
Оиши Т., Нарита М., Охя Х. и др. Рабдомиолиз, связанный с устойчивой к противомикробным препаратам Mycoplasma pneumoniae. Emerg Infect Dis . 2012 май. 18 (5): 849-51. [Медлайн]. [Полный текст].
Moon HJ, Yang JK, In DH, Kwun DH, Jo HH, Chang SH.Случай 14-летней девочки, у которой развился дерматомиозит, связанный с инфекцией микоплазменной пневмонии. Soonchunhyang Med Sci . Декабрь 2015. 21: 130-33. [Полный текст].
Лю Е.М., Джаниджан Р.Х. Mycoplasma pneumoniae: другой маскарад. JAMA Офтальмол . 2013 Февраль 131 (2): 251-3. [Медлайн].
Смит LG. Микоплазменная пневмония и ее осложнения. Инфекция Dis Clin North Am . 2010 24 марта (1): 57-60.[Медлайн].
Biondi E, McCulloh R, Alverson B, Klein A, Dixon A. Лечение микоплазменной пневмонии: систематический обзор. Педиатрия . 2014 июнь 133 (6): 1081-90. [Медлайн].
Колин А.А., Юсеф С., Форно Э, Корппи М. Лечение Mycoplasma pneumoniae при инфекциях нижних дыхательных путей у детей. Педиатрия . 2014 июн.133 (6): 1124-5. [Медлайн].
Cardinale F, Chironna M, Chinellato I, Principi N, Esposito S.Клиническая значимость устойчивости к макролидам Mycoplasma pneumoniae у детей. Дж. Клин Микробиол . 2013 Февраль 51 (2): 723-4. [Медлайн]. [Полный текст].
Кавай Ю., Мияшита Н., Кубо М. и др. Терапевтическая эффективность макролидов, миноциклина и тосуфлоксацина против макролид-резистентной пневмонии Mycoplasma pneumoniae у детей. Противомикробные агенты Chemother . 2013 май. 57 (5): 2252-8. [Медлайн]. [Полный текст].
Uh Y, Hong JH, Oh KJ, et al.Устойчивость Mycoplasma pneumoniae к макролидам и частота ее выявления с помощью ПЦР в реальном времени в больницах первичной и третичной медицинской помощи. Энн Лаб Мед . 2013 ноябрь 33 (6): 410-4. [Медлайн]. [Полный текст].
Центры по контролю и профилактике заболеваний. Лечение антибиотиками и резистентность. Доступно по адресу https://www.cdc.gov/pneumonia/atypical/mycoplasma/hcp/antibiotic-treatment-resistance.html. 13 апреля 2018 г .; Доступ: 28 декабря 2018 г.
Pereyre S, Goret J, Bébéar C.Mycoplasma pneumoniae: современные знания о резистентности к макролидам и лечении. Передний микробиол . 2016. 7: 974. [Медлайн].
Todd SR, Dahlgren FS, Traeger MS, Beltrán-Aguilar ED, Marianos DW, Hamilton C, et al. Отсутствие видимого окрашивания зубов у детей, получавших доксициклин при подозрении на пятнистую лихорадку Скалистых гор. J Педиатр . 2015 май. 166 (5): 1246-51. [Медлайн]. [Полный текст].
Случай взрослого человека с тяжелой опасной для жизни пневмонией Mycoplasma pneumoniae, вызванной устойчивым к макролидам штаммом, Япония: отчет о болезни | BMC Infectious Diseases
В этом отчете мы описываем тяжелый опасный для жизни случай MPP, вызванный устойчивым к макролидам штаммом.В нашем случае начальная терапия, включающая введение высоких доз AZM и кортикостероидов, была неэффективной, и LVFX и MINO были необходимы для улучшения клинических симптомов и уменьшения поражений легких. Возможность бактериальной коинфекции осталась; таким образом, был введен другой антибиотик (MEPM). Однако клиническое течение и проявления КТ не были совместимы с общей бактериальной инфекцией, а повторяющиеся отрицательные бактериальные культуры из образцов дыхательных путей не могли полностью объяснить наличие обширных поражений легких.Следовательно, мы сочли, что крайнее ухудшение, отмеченное до 14 клинического дня, в значительной степени было связано с устойчивым к макролидам MPP.
В последнее время во всем мире увеличилась распространенность изолятов МП, устойчивых к макролидам. Наиболее частым механизмом, лежащим в основе устойчивости, является мутация A-to-G в положении 2063 домена V гена MP 23S рРНК (A2063G), за которым следуют A2063T, A2064G и A2063C [12]. Как сообщалось ранее, неэффективность начального лечения макролидами против макролидорезистентного MPP часто приводит к продолжительному повышению температуры и кашлю; однако дыхательная недостаточность или смертельное течение редки [12,13,14].Устойчивый к макролидам MPP, вероятно, не прогрессировал до тяжелой инфекции из-за его менее эффективного синтеза белка, вызванного точечной мутацией в его рРНК [15]. Поскольку MP имеет только один оперон рРНК для конструирования рибосом, точечная мутация в штамме, устойчивом к макролидам, может исключительно влиять на активность рибосом.
Некоторые случаи MPP могут быть опасными для жизни, включая тяжелую дыхательную недостаточность или летальный исход, и иногда определяются как молниеносные MPP [2,3,4]. Сообщается, что в этих угрожающих жизни случаях МПП средняя продолжительность от начала инфекции до развития дыхательной недостаточности составляет 9–15 дней [2]; К этим случаям относятся те, которые связаны с ухудшением состояния после введения определенных методов лечения, таких как терапия макролидами или стероидами.Поскольку развитие дыхательной недостаточности в нашем случае отмечалось до 14-го дня клинической практики, мы сочли, что этот случай, вероятно, относится к тяжелому угрожающему жизни / молниеносному типу.
Считается, что клеточный гипериммунный ответ хозяина на MPP, являющийся механизмом и этиологией тяжелого / фульминантного MPP, играет центральную роль в прогрессировании заболевания [2]. Поскольку у MP нет бактериальной клеточной стенки, для лечения инфекции MP обычно используются антибиотики, ингибирующие синтез ДНК, такие как макролиды, тетрациклин и фторхинолон.Кроме того, кортикостероиды широко рекомендуются для тяжелых / фульминантных случаев МПП, которые сопровождаются гиперактивным иммунным ответом [2,3,4]. Идзумикава и др. сообщили, что относительно высокая доза метилпреднизолона (> 500 мг / день) в сочетании с соответствующими антимикоплазменными агентами эффективно улучшала симптомы в большинстве случаев молниеносной МПП в течение 3-5 дней [16]. Miyashita et al. рекомендовал начало терапии кортикостероидами в тяжелых случаях MPP с уровнем ЛДГ в сыворотке выше 364 МЕ / л [17].Однако окончательного лечения молниеносного MPP, в частности, вызванного устойчивым к макролидам штаммом, не установлено.
На сегодняшний день существует лишь несколько сообщений, описывающих фульминантные случаи MPP, резистентные к терапии макролидами и стероидами. В педиатрическом случае Shen et al. описали молниеносный MPP из-за штамма, устойчивого к макролидам, у которого лекарственная чувствительность была подтверждена культурами [18]. В этом случае MPP обострился после введения AZM и стандартной дозы метилпреднизолона (2 мг / кг / день), и, наконец, улучшение было отмечено после перехода на лечение антибиотиками моксифлоксацином с внутривенным иммуноглобулином.В случае взрослого пациента Kawakami et al. сообщили, что фульминантный MPP обострился, несмотря на прием АЗМ и преднизолона 30 мг / день, но это улучшение было отмечено после приема миноциклина [19]. Подобно этим случаям, наш случай MPP также показал быстрое улучшение после добавления фторхинолона и миноциклина. В целом, мы предполагаем, что не только гипериммунная активность, но и пролиферация MP могут играть критическую роль в тяжелой / фульминантной MPP из-за штамма, устойчивого к макролидам. Таким образом, лечение с использованием фторхинолона или тетрациклина для подавления пролиферации MP может быть незаменимым в этих случаях.
В нашем случае экспресс-тест на антигены не был доступен в соответствующей больнице, и точный диагноз был подтвержден на 14-й день клинической практики. Хотя серологический тест на антитела обычно считается стандартным методом диагностики MPP, он не подходит для MPP. -диагностика в острой фазе, поскольку для этого требуются парные пробы сыворотки с интервалом 2–4 недели [20]. В этой ситуации с 2013 года в Японии стал доступен экспресс-тест на антиген микоплазмы на основе иммунохроматографии, Ribotest ™ Mycoplasma [21].Этот тест выявляет рибосомный белок M. pnuemoniae L7 / 12, компонент рибосомы 50S, и его диагностическая чувствительность для MPP, как сообщается, составляет примерно 60% от чувствительности ПЦР в реальном времени [21]. До сих пор клинический опыт и данные по Риботесту ограничены только Японией, и его полезность при лечении МПП у взрослых остается неясной. В нашем случае Риботест на ЖБАЛ, проведенный на 14 клинический день, дал положительный результат, что доказало существование более длительной легочной инфекции, вызванной МП.Поскольку было обнаружено, что MP больше в мокроте, чем в образцах из верхних дыхательных путей [22, 23], может быть более полезным исследовать BALF, который является наиболее непосредственно отбираемым образцом из нижних дыхательных путей, с помощью Ribotest. По крайней мере, если бы нашему пациенту был поставлен немедленный диагноз, мы могли бы выбрать соответствующие антибиотики на более ранней стадии, что могло бы привести к более быстрому улучшению. Учитывая сложность диагностики MPP, в особых случаях из-за штаммов, устойчивых к макролидам, мы предполагаем, что могут потребоваться дальнейшие исследования, которые исследуют полезность экспресс-теста на антиген.
Насколько нам известно, настоящий отчет является первым задокументированным случаем тяжелого опасного для жизни MPP, вызванного устойчивым к макролидам штаммом, устойчивость которого к макролидам была подтверждена генетическим анализом. Основываясь на опыте, полученном в нашем настоящем случае, мы предлагаем, чтобы тяжелая форма MPP, вызванная устойчивым к макролидам штаммом, должна рассматриваться как дифференциальный диагноз, когда встречаются случаи ухудшения внебольничной пневмонии. Это особенно важно при назначении антибиотиков, отличных от фторхинолона или тетрациклина.Следует также признать высокую распространенность устойчивых к макролидам ЛП во всем мире, поскольку подобные случаи угрожающих жизни МПП могут быть существенно недооценены.
В заключение мы сообщаем о редком случае серьезного опасного для жизни MPP, вызванного устойчивым к макролидам штаммом у взрослого человека. Это подчеркивает важность правильного выбора противомикоплазменных препаратов при лечении этого состояния. Кроме того, необходимо повышать осведомленность о возникновении устойчивой к макролидам инфекции MPP, особенно в случаях, когда тяжелая инфекция развивается после первоначальной неудачи лечения.
Инфекция Mycoplasma pneumoniae | DermNet NZ
Автор: д-р Кэролайн Махон, регистратор дерматологии и педиатрии, Окленд, Новая Зеландия. 2013.
Что такое
Mycoplasma pneumoniae ?
Mycoplasma pneumoniae — это бактериальный организм, у которого, в отличие от других бактерий, отсутствует клеточная стенка. Это вызывает инфекции дыхательных путей.
Как микоплазма вызывает инфекцию?
Инфекция распространяется при контакте с каплями, выделяющимися из верхних и нижних дыхательных путей инфицированных людей.Инкубационный период от 1 до 3 недель. M. pneumoniae — частая причина внебольничной пневмонии во всем мире. Иммунитет после заражения микоплазмой недолговечный, и возможно развитие рецидивов инфекции.
Каковы симптомы микоплазменной инфекции?
Во многих случаях инфекция, вызванная M. pneumoniae , протекает бессимптомно или приводит к неспецифическим симптомам, таким как головная боль, субфебрильная температура, сухой кашель и недомогание. Респираторное обследование часто бывает нормальным, хотя при прослушивании грудной клетки с помощью стетоскопа можно обнаружить рассеянные хрипы (потрескивания) и хрипы.Однако это может привести к пневмонии, серьезной инфекции легких.
M. pneumoniae также может вызывать осложнения в других системах органов в результате прямого вторжения бактерий или иммунного ответа на инфекцию. Осложнения иногда бывают более серьезными, чем при первичной респираторной инфекции.
Некоторые заболевания, связанные с микоплазмами, перечислены в таблице ниже.
| Органная система | Симптомы и заболевания, вызываемые микоплазмой |
|---|---|
| Дыхательная система |
|
| Нервная система |
|
| Печень |
|
| Сердце |
|
| Система крови |
|
В некоторых случаях из суставной жидкости выделяется | |
| Желудочно-кишечный тракт |
|
Сыпь, связанная с инфекцией
M. pneumoniae
Сыпь поражает до одной трети пациентов с M.pneumoniae Инфекция дыхательных путей.
Наиболее частая сыпь — это неспецифическая экзантема, при которой на туловище и конечностях появляются кратковременные красные пятна. Эти участки эритемы проходят сами по себе и не требуют специального лечения.
Везикулы и пузыри, петехии (маленькие пурпурные пятна из-за кровотечения на коже) и крапивница (похожие на ульи) также были описаны в связи с инфекцией M. pneumoniae .
Волдыри, вызванные микоплазмой
Многоформная эритема
M.pneumoniae может иногда вызывать многоформную буллезную эритему (EM; EM major). Обычно присутствует несколько специфических особенностей.
- Выпуклые красные пораженные участки, похожие на мишени, имеют три отдельные зоны, включая центральную буллу (волдырь).
- Сыпь обычно начинается на конечностях, а затем распространяется на туловище.
- Мукозит: конъюнктивит и изъязвления губ, рта (стоматит) и половых органов являются обычными явлениями.
Большая многоформная атипичная эритема, вызванная микоплазмой
Синдром Стивенса-Джонсона / токсический эпидермальный некролиз
Синдром Стивенса-Джонсона (SJS) / токсический эпидермальный некролиз (TEN) теперь считаются проявлением той же редкой, острой, серьезной кожной реакции, при которой наблюдается пластовидная кожа и потеря слизистой оболочки .Традиционная терминология описывает SJS, имеющий отслоение кожи <10% площади поверхности тела (BSA), TEN, когда оно составляет> 30% BSA, и перекрытие, когда отслоение составляет от 10% до 30%. Большинство случаев вызвано приемом лекарств.
M. pneumoniae — наиболее часто определяемая инфекционная причина SJS, особенно у детей и подростков. В недавнем ретроспективном обзоре всех случаев SJS, наблюдаемых в клинике Mayo в США за период 8 лет, было обнаружено, что 22% случаев связаны с M.pneumoniae инфекция. Средний возраст этой группы составлял 14 лет с диапазоном от 10 до 36 лет.
Редко, M. pneumoniae было связано с токсическим эпидермальным некролизом.
Мукозит, связанный с микоплазмой
M. pneumoniae редко был связан с оральным мукозитом (стоматитом), конъюнктивитом и изъязвлением слизистой оболочки половых органов без сопутствующей кожной сыпи. Это проявление было по-разному названо «атипичным» или «неполным» SJS (синдром Фукса), хотя было высказано предположение, что более подходящим термином для этого синдрома является «микоплазменный мукозит».Обычно поражает детей и молодых людей.
Мукозит, вызванный микоплазмой
Менее распространенные кожные признаки
Инфекция M. pneumoniae также была зарегистрирована в связи с рядом других кожных проблем, включая:
Диагноз
инфекции M. pneumoniae
Клиническое подозрение на инфекцию M. pneumoniae возникает в Пациент с респираторным заболеванием и любым типом сыпи, особенно с многоформной эритемой.
Самый быстрый диагностический тест — это M. pneumoniae полимеразной цепной реакции (ПЦР) мазка из зева, чувствительность и специфичность которого составляет 78–100%.
Серологический анализ на Mycoplasma (анализ крови) выявляет антитела IgM и IgG через 7–10 дней и 3 недели соответственно. Чувствительность и специфичность серологических тестов ниже, чем у ПЦР (50–66%), но их можно повысить, назначив второй тест в фазе выздоровления. Положительный результат теста подтверждается, если единичный титр> 1:32 или четырехкратное увеличение титра IgG или IgM по сравнению с исходным уровнем обнаружено при повторном тестировании.Титры IgM остаются повышенными в течение нескольких недель, а уровни IgG остаются повышенными в течение многих месяцев после заражения микоплазмой.
Рентгенограмма грудной клетки при инфекции M. pneumoniae неспецифична. Чаще всего наблюдается очаговое уплотнение в одном или обоих легких. Небольшие плевральные выпоты (жидкость в слизистой оболочке легких) наблюдаются в 20% случаев.
Результаты стандартного анализа крови также неспецифичны. Общее количество лейкоцитов и дифференциальные подсчеты могут быть в пределах нормы.Тестирование маркеров воспаления может выявить нормальные или повышенные уровни СРБ и СОЭ. В результатах теста функции печени могут быть легкие неспецифические отклонения.
Полный анализ крови может выявить:
- Гемолиз с легкой нормоцитарной нормохромной анемией, повышенным количеством ретикулоцитов и пониженным уровнем гаптоглобина и / или положительным результатом теста Комбса
- Холодные агглютинины, т. Е. Высокие уровни антител IgM в крови, которые связывают красные кровяные тельца при более низких температурах, чем температура тела (21–28 градусов)
- Повышенное количество тромбоцитов (тромбоцитоз)
- Панцитопения (снижение количества эритроцитов, лейкоцитов и тромбоцитов), но это очень редко.
Лечение микоплазменной инфекции
Микоплазменную инфекцию обычно лечат макролидными антибиотиками, обычно эритромицином или рокситромицином. Они снижают заразность других и могут улучшить респираторные симптомы, а также связанную с ними кожную сыпь.
Кларитромицин и азитромицин более дороги, и для их использования в Новой Зеландии может потребоваться разрешение врача-инфекциониста. Они требуют менее частого приема, чем эритромицин или рокситромицин, и с меньшей вероятностью вызывают побочные эффекты со стороны желудочно-кишечного тракта.
Альтернативами для пациентов с аллергией на макролиды или непереносимостью макролидов, или для которых существует потенциальное лекарственное взаимодействие, являются доксицилин или моксифлоксацин.
Вакцины против M. pneumoniae нет.
Лечение кожных проявлений
инфекции M. pneumoniae
Неспецифические высыпания, вызванные микоплазменной инфекцией, можно лечить мягкими смягчающими средствами для уменьшения дискомфорта.
Устные антигистаминные препараты могут быть полезны при крапивнице.
При наличии волдырей или поражения слизистой оболочки следует обратиться за советом к специалисту. Пациентам с многоформной эритемой необходима поддерживающая терапия и тщательное наблюдение.
- Уход за кожей рта, глаз и половых органов
- Увлажнение и внимание к потребностям в питании
- Консультация офтальмолога при красных или болезненных глазах или при нарушении зрения
- Регулярное применение кортикостероидов при высыпаниях, связанных с M. pneumoniae , и SJS не подтверждено имеющимися медицинскими данными
- Результат, особенно у здоровых детей и молодых людей, обычно отличный.
Устойчивые к макролидам Mycoplasma pneumoniae Пневмония у подростков и взрослых: клинические данные, лекарственная чувствительность и терапевтическая эффективность
ТЕКСТ
Mycoplasma pneumoniae является основной причиной внебольничной пневмонии (ВП) у детей школьного возраста и молодых людей ( 1, 2). Конкретный диагноз инфекции M. pneumoniae важен, потому что лечение обычно используемыми β-лактамными антибиотиками неэффективно против этих организмов, поскольку у них отсутствует клеточная стенка.Таким образом, рекомендации CAP Японского респираторного общества (JRS) были рекомендованы в качестве быстрой и простой системы оценки, основанной на клинических и лабораторных данных для предположительного диагноза пневмонии M. pneumoniae (1, 3, 4). Наше недавнее исследование показало, что система баллов JRS была наиболее полезным инструментом для начала назначения адекватной антибактериальной терапии вероятной пневмонии, вызванной M. pneumoniae, среди протестированных методов быстрой диагностики (5).
Хотя пневмония, вызванная M. pneumoniae, обычно имеет легкую степень тяжести, устойчивые к макролидам (MR) M.pneumoniae с мутациями в гене 23S рРНК появилась у детей с ВП (6, 7). Более 60% штаммов M. pneumoniae у педиатрических пациентов показали высокую устойчивость к 14- и 15-членным кольцевым макролидам с МИК ≥64 мг / л (8–10). Клиническая и бактериологическая эффективность макролидов для лечения случаев MR M. pneumoniae pneumonia была ниже, чем в случаях чувствительной к макролидам (MS) M. pneumoniae pneumonia у педиатрических пациентов (9–13). В отличие от пациентов детского возраста, имеющиеся данные по MR M.pneumoniae у подростков и взрослых ограничены (8, 14). Целью настоящего исследования было определение средств быстрого отличия MR M. pneumoniae pneumonia от MS M. pneumoniae pneumonia в повседневной клинической практике, не дожидаясь результатов генетического анализа. Мы сравнили основные состояния, тяжесть пневмонии, клинические симптомы, лабораторные данные, прогностические факторы и рентгенографические данные у пациентов с пневмонией MR M. pneumoniae и пациентов с MS M.pneumoniae pneumonia (пациенты с MR и пациенты с рассеянным склерозом соответственно) у подростков и взрослых. Основываясь на клинической картине, мы оценили полезность быстрых и простых методов клинической диагностики (5), балльной системы JRS (1, 3, 4) и компьютерной томографии высокого разрешения (HRCT) (15, 16) для ранней диагностики. предполагаемый диагноз пневмонии, вызванной M. pneumoniae. Дополнительной целью этого исследования было изучение лекарственной чувствительности изолятов MR и различий в терапевтической эффективности против MR M.pneumoniae среди макролидов, хинолонов и миноциклина.
Подростки и взрослые пациенты с ВП, посетившие 12 учреждений, участвовавших в группе исследования атипичных патогенов с января 2008 по сентябрь 2012 года, были включены в это исследование. Диагноз основывался на клинических признаках и симптомах (кашель, лихорадка, мокрота, одышка, боль в груди или ненормальные звуки дыхания) и рентгенологических аномалиях легких, которые были, по крайней мере, сегментарными и были вызваны ранее существовавшими или другими известными причинами.Критерии исключения включали следующее: иммунодепрессивное заболевание (например, ВИЧ-положительный статус, нейтропения после химиотерапии, использование преднизона> 20 мг / день или других иммунодепрессантов, а также трансплантация органов в анамнезе), госпитализация в предшествующие 30 дней, проживание в медперсонале. дома или в учреждении длительного ухода, а также при активной форме туберкулеза. Все случаи пневмонии, возникшие более чем через 3 дня после госпитализации, считались нозокомиальными и исключались. В течение периода исследования 844 случая ВП были оценены с помощью посева и ПЦР на M.пневмония. Наконец, мы зарегистрировали и проанализировали 73 случая инфекции M. pneumoniae, которые были положительными на M. pneumoniae в культуре и / или методом ПЦР. Из них все случаи были положительными на ПЦР, а 29 случаев — положительными на посев. Информированное согласие было получено от всех пациентов, а протокол исследования был одобрен Комитетом по этике Медицинской школы Кавасаки.
Мы использовали стандартизированный опросник для сбора клинической информации. Информация о пациенте и собранных клинических признаках и симптомах включала кашель, выделение мокроты, боль в горле, одышку, боль в груди, головную боль, тошноту и рвоту.При первом посещении были выполнены анализы крови на количество лейкоцитов в периферической крови, С-реактивный белок, парциальное давление кислорода артериальной крови и рентгенограмма грудной клетки. Тяжесть пневмонии оценивалась с использованием шкалы клинической тяжести, индекса тяжести пневмонии (PSI), опубликованного Американским обществом инфекционных заболеваний, который рассчитывался на основе данных, касающихся возраста, осложнений, результатов физикального обследования и лабораторных данных ( 17).
Микробиологические тесты, посев, ПЦР в реальном времени и серологические тесты выполнялись, как описано ранее (2, 4, 5).Культивирование M. pneumoniae проводили в бульоне с плевропневмоноподобными организмами (PPLO) (Difco, Детройт, Мичиган, США). Образцы мокроты или образцы мазков из носоглотки культивировали с использованием 2 мл бульона PPLO в течение 4 недель при 37 ° C. В бульоне PPLO, цвет которого изменился с красного на желтый с потреблением глюкозы, колонии M. pneumoniae очищали с использованием чашки с агаром PPLO. Наконец, M. pneumoniae была идентифицирована путем гемадсорбции колоний 5% суспензией эритроцитов морских свинок. Затем ДНК экстрагировали с помощью мини-набора QIAamp DNA (Qiagen K.K., Tokyo, Japan) в соответствии с инструкциями производителя. ДНК M. pneumoniae была обнаружена с помощью ПЦР в реальном времени, нацеленной на консервативную часть гена, кодирующего адгезин P1. Антитела к M. pneumoniae измеряли с помощью теста агглютинации частиц (набор Serodia-Myco II; Fujirebio, Токио, Япония). Как сообщалось ранее, микробная этиология была классифицирована как окончательная, предполагаемая или неизвестная (5).
Поиск мутаций в положениях 2063, 2064 и 2617 в области гена V домена 23S рРНК M. pneumoniae был выполнен с использованием метода прямого секвенирования в образцах с положительным результатом посева или ПЦР, как сообщалось ранее (7–9) .МИК 11 противомикробных препаратов для изолятов M. pneumoniae определяли методами микродилюции (18). Контрольный штамм FH использовали в качестве чувствительного к лекарству контроля. Для определения МИК использовались следующие противомикробные средства: эритромицин, кларитромицин, азитромицин, рокитамицин, клиндамицин, миноциклин, тетрациклин, тосуфлоксацин, гареноксацин, левофлоксацин и моксифлоксацин. МИК против изолятов M. pneumoniae, собранных в этом исследовании, сравнивали с таковыми против изолятов MR от педиатрических пациентов, которые были собраны в другом исследовании (9).
HRCT исследования были выполнены, как сообщалось ранее (15). Три рентгенолога грудной клетки (18, 14 и 12 лет соответственно), которые не знали диагнозов, ретроспективно и независимо оценили наличие консолидации, аттенюации матового стекла, центрилобулярных узелков, утолщения бронхиальной стенки, ретикулярного или линейного помутнение, плевральный выпот и лимфаденопатия (15). Окончательные решения относительно наличия каждой находки и модели непрозрачности для каждого случая были приняты на основе консенсуса между тремя радиологами.Мы проанализировали пациентов, изображения КТ которых были получены до лечения антибиотиками, поскольку антибиотики могут влиять на результаты КТ. Наконец, мы проанализировали результаты КТГ грудной клетки у 36 пациентов с РС и 25 пациентов с МРТ.
Терапевтическая эффективность антибиотиков против РС и МР M. pneumoniae pneumonia оценивалась среди макролидов (кларитромицин и азитромицин), миноциклина и хинолонов (гареноксацин, левофлоксацин, тозуфлоксацин и моксифлоксацин). Первичный подбор антибиотиков производил лечащий врач.Всем 20 госпитализированным пациентам вводили миноциклин в дозе 200 мг / сут внутривенно. Одному пациенту с тяжелой формой ВП вводили β-лактам плюс миноциклин, а остальным 53 пациентам вводили макролиды или хинолоны перорально. Дозы азитромицина, гареноксацина, левофлоксацина и моксифлоксацина составляли 500 мг, 400 мг, 500 мг и 400 мг один раз в сутки, соответственно, а кларитромицин и тозуфлоксацин вводились два раза в сутки в дозах 400 мг и 600 мг соответственно, в соответствии с с вкладышем в упаковке, прилагаемым к каждому лекарству.Если клинические симптомы и признаки не улучшились ко второму визиту, лечащий педиатр изменил лечение антибиотиками на миноциклин или хинолоны.
Одним из критериев оценки клинического исхода у пациентов с ВП является снижение температуры тела (1). В этом исследовании мы оценивали клинический результат с использованием лихорадки, поскольку в предыдущих исследованиях также оценивались только лихорадочные дни для оценки клинического исхода у пациентов с МРТ (9–13). Кроме того, мы оценили терапевтическую эффективность лечения антибиотиками через 48 часов, поскольку предыдущие отчеты продемонстрировали, что среднее количество лихорадочных дней у пациентов с РС во время введения макролидов составляло 1.4 и 1,5 суток (11, 12).
Статистический анализ выполняли с использованием программы Stat View версии 5.0 (SAS Institute Inc., Кэри, Северная Каролина, США). Частота основных состояний, клинические данные и рентгенологические данные были проанализированы с использованием точного критерия Фишера. Средний возраст пациентов и лабораторные данные сравнивали с помощью критерия Стьюдента t . Для каждого радиологического открытия считывались значения каппа.
Тридцать из 73 пациентов (41%) с пневмонией M. pneumoniae были инфицированы MR M.пневмония. Среди этих 30 пациентов с MR 27 имели переход A-to-G в положении 2063 в домене V гена 23S рРНК (A2063G), а у трех был переход A-to-G в положении 2064 (A2064G). Мутаций в сайте 2617 в домене V гена 23S рРНК не наблюдалось.
Основные состояния, тяжесть пневмонии, клинические симптомы, лабораторные данные и прогностические факторы пациентов с МР и РС представлены в таблице 1. Никаких существенных различий между пациентами с МР и пациентами с РС не наблюдалось.При использовании балльной системы JRS, которая представляет собой быстрый клинический диагностический метод для предположительной диагностики пневмонии M. pneumoniae, диагностическая чувствительность составила 80% у пациентов с МР и 81% у пациентов с РС.
Таблица 1
Основные условия и клинические данные у пациентов с РС и МР Пневмония M. pneumoniae при первом осмотре
В таблице 2 приведены результаты ВРКТ грудной клетки для пациентов с РС и МРТ. Значение каппа между читателями составило 0,624 для консолидации. , 0,581 для затухания в матовом стекле, 0.771 для центрилобулярных узелков, 0,572 для утолщения стенки бронхов, 0,591 для ретикулярного или линейного помутнения, 0,8901 для плеврального выпота и 0,632 для лимфаденопатии. Из 25 пациентов с МРТ утолщение бронхиальной стенки и центрилобулярные узелки наблюдались наиболее часто (по 84% каждый), затем следовало ослабление матового стекла (60%) и уплотнение воздушного пространства (52%). Также наблюдались ретикулярные или линейные помутнения, плевральный выпот и лимфаденопатия, но с низкой частотой. Никаких существенных различий между пациентами с РС и пациентами с МР не наблюдалось.Когда мы оценили пневмонию M. pneumoniae как показывающие рентгенографические признаки с сочетанием утолщения бронхиальной стенки и центрилобулярных узелков и / или ослабления матового стекла с долевым распределением (15, 16), диагностически значимые результаты для подозрения на пневмонию M. pneumoniae были обнаружены в 69% пациентов с РС и 70% пациентов с МР.
Таблица 2
Результаты КТ грудной клетки пациентов с РС и МР M. pneumoniae pneumoniae при первом осмотре
Среди 13 изолятов MR M.pneumoniae, значения MIC , 90, для 14- и 15-членных макролидов, таких как эритромицин, кларитромицин и азитромицин, составляли> 128 мкг / мл,> 128 мкг / мл и 128 мкг / мл соответственно; Значения MIC в эталонном штамме MS составляли 0,0039 мкг / мл, 0,002 мкг / мл и 0,00025 мкг / мл соответственно (таблица 3). Напротив, тетрациклин, миноциклин и все четыре хинолона показали хорошую антимикоплазменную активность со значениями MIC 90 0,5 мкг / мл, 2,0 мкг / мл и 0,5-0,0625 мкг / мл соответственно против MR M.pneumoniae, которые были эквивалентны таковым для эталонного штамма MS. Никаких различий в лекарственной чувствительности изолятов MR M. pneumoniae не наблюдалось между педиатрическими пациентами, подростками и взрослыми пациентами.
Таблица 3
Антимикоплазменная активность in vitro в отношении эталонного штамма и клинических изолятов MR M. pneumoniae
Терапевтическая эффективность анти-M. pneumoniae против MS и MR M. pneumoniae показана в таблице 4. У всех включенных в исследование пациентов исходная температура была выше 38 ° C.Среди пациентов с РС макролиды (8 пациентов на азитромицине и 6 пациентов на кларитромицине), хинолоны (7 пациентов на гареноксацине, 3 пациента на левофлоксацине, 4 пациента на тосуфлоксацине и 2 пациента на моксифлоксацине) и миноциклин показали хорошую клиническую эффективность при дефервезии. в течение 48 ч после начала приема антибиотиков наблюдались у 71%, 81% и 91% пациентов соответственно (статистически значимой разницы между тремя группами нет). Среди пациентов с МР снижение температуры тела в течение 48 часов после начала приема антибиотиков наблюдалось у 28% пациентов в группе макролидов (7 пациентов на азитромицине и 7 пациентов на кларитромицине), 77% пациентов в группе хинолонов (3 пациента на гареноксацине, 3 пациента на тосуфлоксацин и 3 пациента, получавшие левофлоксацин) и 85% группы миноциклина.Лечение было более эффективным в группах хинолона и миноциклина, чем в группах макролидов ( P = 0,0361 и P = 0,0237, соответственно). Среди 14 пациентов с МР, получавших макролидные антибиотики (7 пациентов на азитромицине и 7 пациентов на кларитромицине), лечение было изменено на другие антимикоплазменные антибиотики у 10 пациентов (6 пациентов на миноциклин, 3 пациента на гареноксацин и 1 пациент на моксифлоксацин), но не изменения антибиотиков были зарегистрированы для пациентов в группах хинолона и миноциклина.
Таблица 4
Клиническая эффективность макролидов, хинолонов и миноциклина против РС и МР M. pneumoniae pneumonia
Клинические проявления, такие как основные состояния, тяжесть пневмонии, клинические симптомы, лабораторные данные, прогностические факторы и рентгенографические данные для M y пневмония пневмонии четко отличается от нетипичной пневмонии (1–5, 15, 16). Таким образом, рекомендации JRS проходят испытания, чтобы различать пневмонию, вызванную M. pneumoniae, и нетипичную пневмонию, используя уникальную и простую систему оценок (1).В этом исследовании мы исследовали, можем ли мы быстро отличить пневмонию MR M. pneumoniae от пневмонии MS M. pneumoniae, не дожидаясь результатов генетического анализа. Никаких различий в клинической картине между пациентами с РС и МР не наблюдалось. Те же клинические особенности продемонстрировали, что диагностическая чувствительность системы оценки JRS и HRCT грудной клетки была идентична между пациентами с РС и пациентами с МРТ.
A2063G в домене V 23S рРНК является наиболее частой мутацией, связанной с MR M.pneumoniae у педиатрических пациентов, за которыми следуют A2063T, A2064G и A2063C (9). В этом исследовании было показано, что изоляты MR у подростков и взрослых пациентов имеют такую же распространенность мутаций, как и у детей, при этом 90% изолятов имеют мутацию A2063G. Значения MIC 90 11 антимикробных агентов против изолятов M. pneumoniae от этих подростков и взрослых пациентов были очень похожи на таковые для изолятов от педиатрических пациентов. Значения МПК хорошо коррелировали с клиническим улучшением, при котором снижение температуры тела в течение 48 часов после начала приема антибиотиков наблюдалось у 28% пациентов в группе макролидов, 77% пациентов в группе хинолонов и 85% пациентов в группе миноциклина. .
У нашего исследования было несколько ограничений. Во-первых, количество пациентов в каждой группе лечения было небольшим, а тип используемого хинолона варьировал. Другим ограничением было то, что настоящее исследование не было рандомизированным испытанием для сравнения эффективности нескольких антибиотиков против штаммов MR. Необходимы крупномасштабные рандомизированные терапевтические испытания для разработки клинических руководств в отношении наиболее подходящих антимикробных средств для использования против этих штаммов MR.
В заключение пациенты с МР М.pneumoniae pneumonia нельзя было отличить клинически от пациентов с пневмонией M. pneumoniae. Клиническая эффективность макролидов для лечения MR M. pneumoniae была низкой. Врачи могут использовать миноциклин вместо макролидов, если подозревается пневмония MR M. pneumoniae и наблюдается отсутствие дефектообразования в течение 48 часов после начала лечения макролидами.
Инфекция микоплазмой — NYC Health
Что такое микоплазменная инфекция?
Инфекция Mycoplasma — это респираторное заболевание, вызываемое Mycoplasma pneumoniae, микроскопическим организмом, связанным с бактериями.Для города Нью-Йорка нет точной оценки частоты заболевания, поскольку микоплазма не подлежит регистрации.
Кто заражается микоплазмой?
Заболеть этим заболеванием может любой человек, но чаще всего оно поражает детей старшего возраста и молодых людей.
Когда возникают микоплазменные инфекции?
Инфекции микоплазмы возникают спорадически в течение года. Широко распространенные вспышки среди населения могут происходить с интервалом от 4 до 8 лет. Инфекции микоплазмы чаще всего возникают в конце лета и осенью.
Как распространяется микоплазма?
Микоплазма передается при контакте с каплями из носа и горла инфицированных людей, когда они кашляют или чихают. Считается, что передача инфекции требует длительного тесного контакта с инфицированным человеком. Распространение в семьях, школах и учреждениях происходит медленно. Зараженный человек обычно заразен менее 20 дней.
Каковы симптомы микоплазменной инфекции?
Типичные симптомы включают жар, кашель, бронхит, боль в горле, головную боль и недомогание.Распространенным результатом микоплазменной инфекции является пневмония (иногда называемая «ходячей пневмонией», потому что она обычно легкая и редко требует госпитализации). Также могут возникнуть инфекции среднего уха (отит). Симптомы могут сохраняться от нескольких дней до более месяца.
Как скоро после заражения появляются симптомы?
Симптомы обычно появляются через 6–32 дня после заражения. Обычно симптомы развиваются медленно, в течение 2–4 дней.
Как диагностируется микоплазменная инфекция?
Инфекция микоплазмы обычно диагностируется на основании типичных симптомов.Неспецифический анализ крови (холодовые агглютинины) помогает в диагностике, но не всегда дает положительный результат. Использование более конкретных лабораторных тестов часто ограничивается специальными расследованиями вспышек.
Делает ли перенесенное инфицирование микоплазмой человека иммунитетом?
Иммунитет после заражения микоплазмой действительно возникает, но не сохраняется на всю жизнь. Известно, что случаются вторичные инфекции, хотя они могут быть более легкими. Продолжительность иммунитета неизвестна.
Как лечить микоплазменную инфекцию?
Антибиотики, такие как эритромицин и тетрациклин, являются эффективным лечением.Однако, поскольку микоплазменная инфекция обычно проходит сама по себе, лечение антибиотиками легких симптомов не является необходимым.
Как можно предотвратить заражение микоплазмой?
В настоящее время нет вакцин для предотвращения инфекции Mycoplasma и нет надежно эффективных мер борьбы. Как и при любом респираторном заболевании, всем людям следует прикрывать лицо при кашле или чихании.
Для получения дополнительной информации о микоплазменной инфекции позвоните по телефону 311 .
Mycoplasma Pneumonia — Консультант по терапии рака
ОБЗОР: Что нужно знать каждому практикующему врачу
Вы уверены, что у вашего пациента инфекция Mycoplasma pneumoniae? Каковы типичные признаки этого заболевания?
Mycoplasma pneumoniae — частая причина инфекции верхних дыхательных путей и остается самой частой причиной бактериальной пневмонии. Термин «ходячая пневмония» использовался для описания обычного случая инфекции нижних дыхательных путей, поскольку болезнь обычно не изнуряет.Внелегочные проявления и осложнения микоплазменной инфекции встречаются регулярно и включают сыпь, артрит, гемолитическую анемию, расстройства центральной нервной системы, перикардит, почечную дисфункцию и жалобы со стороны желудочно-кишечного тракта.
Типичная респираторная инфекция, вызываемая M. pneumoniae, представляет собой медленно развивающийся синдром фарингита, заложенности носовых пазух и сухого кашля. На этом этапе кашель вторичен по отношению к трахеобронхиту. Когда инфекция прогрессирует и поражает нижние дыхательные пути, чаще всего встречается атипичная пневмония с двусторонними диффузными легочными инфильтратами.
Внелегочные проявления инфекции
Примерно у 20% пациентов, госпитализированных с инфекцией M. pneumoniae, развиваются внелегочные осложнения. Дерматологические заболевания, включая эритематозную пятнисто-папулезную сыпь, являются одними из наиболее частых внелегочных проявлений болезни. Сыпь обычно проходит самостоятельно; тем не менее, тяжелые формы многоформной эритемы, конъюнктивита, язвенного стоматита и буллезных экзантем действительно встречаются.
Большая многоформная эритема и микоплазменная инфекция
Большая многоформная эритема, или синдром Стивена Джонсона, может быть вызвана несколькими известными возбудителями инфекции.Одним из наиболее распространенных факторов, вызывающих это мультисистемное воспалительное заболевание, является M. pneumoniae. Пациенты, у которых развивается эта проблема, должны быть обследованы на предмет возможности заражения микоплазмой.
Какое другое заболевание / состояние имеет некоторые из этих симптомов?
Другие бактериальные причины атипичной пневмонии включают Chlamydophila pneumoniae, C. psittaci и Legionella pneumophila. По клиническим признакам вирусную пневмонию нелегко отличить от атипичной бактериальной пневмонии.Причины внебольничной вирусной пневмонии включают грипп, парагрипп, аденовирус, энтеровирус, метапневмовирус человека и респираторно-синцитиальный вирус.
Что послужило причиной развития этой болезни в это время?
Инфекции Mycoplasma pneumoniae могут возникать в виде кластеров и вспышек во всех возрастных группах. Климат, сезонность и география, по-видимому, не способствуют распространению возбудителя, хотя большинство вспышек, описанных в Соединенных Штатах, происходит в конце лета и начале осени.
Дети с серповидно-клеточной анемией, синдромом Дауна и иммуносупрессией подвержены более высокому риску тяжелой микоплазменной болезни, включая фульминантную пневмонию. Дети с синдромами дефицита антител подвержены большему риску заболевания легких и имеют предрасположенность к развитию артрита, вызванного M. pneumoniae.
Какие лабораторные исследования следует запросить для подтверждения диагноза? Как следует интерпретировать результаты?
Серологический диагноз считается золотым стандартом для подтверждения заболевания, когда обнаруживается четырехкратное повышение уровня антител в сыворотке крови между образцами в острой стадии и в период выздоровления.Посев на микоплазмы и ПЦР также используются, но поскольку организм может сохраняться в течение различного времени, значимость положительного результата посева или ПЦР может быть поставлена под сомнение без подтверждающих доказательств сероконверсии.
Серологические исследования
Титры острых и выздоравливающих должны быть получены с интервалом примерно 4-6 недель. Клинический диагноз подтверждается четырехкратным или более высоким увеличением титра антител против микоплазмы. Серологический диагноз остается «золотым стандартом», используемым для подтверждения микробиологической этиологии заболевания, хотя другие результаты тестов, такие как титры холодовых агглютининов и ПЦР микоплазмы, могут предоставить подтверждающие доказательства во время острой фазы инфекции.
Титры холодных агглютининов
Холодовые агглютинины — это антитела класса IgM, которые вырабатываются примерно у половины пациентов с инфекцией Mycoplasma pneumoniae через 7-10 дней после начала болезни. Считается, что эти антитела представляют собой перекрестно-реактивные антитела, вырабатываемые против I-антигена эритроцитов. Так называемое «прикроватное» тестирование холодного агглютинина включает в себя сбор крови в пробирку с антикоагулянтом и помещение пробирки в ледяную воду на 30 секунд. Затем пробирку проверяют на макроагглютинацию в холодном состоянии, затем медленно нагревают для наблюдения за отделением эритроцитов.При повторном воздействии холода макроагглютинация возобновляется.
Более точный тест включает серийное разведение сывороток и реакцию сывороток с эритроцитами группы крови O для определения титра, до которого все еще происходит агглютинация. Этот тест обычно проводится в лабораториях банка крови. Было показано, что реакция холодовых агглютининов напрямую коррелирует с тяжестью респираторного заболевания; однако этот тест нечувствителен и крайне неспецифичен. По мере того, как серологическая диагностика и диагностика с помощью ПЦР стали более рутинными, популярность и полезность этого теста снизились.Однако положительный прикроватный тест на холодовой агглютинин, проведенный на крови, взятой у пациента с атипичной пневмонией или мультиформной эритемой, может быть клинически удовлетворительным, поскольку он предлагает убедительные подтверждающие доказательства причины болезни пациента.
Посев на микоплазмы
Лабораторная культура Mycoplasma pneumoniae технически сложна и доступна только в специализированных справочных лабораториях. Для поддержки его роста требуется селективная и дифференциальная культуральная среда, организм растет очень медленно (3 недели и более), и бактериальные колонии должны визуализироваться под микроскопом опытным микробиологом, чтобы подтвердить рост и идентифицировать вид микоплазмы как пневмония.Таким образом, посев непрактичен и имеет мало клинического применения, потому что пациент, скорее всего, выздоровеет от болезни до того, как станет известен результат посева.
ПЦР на микоплазму
Полимеразная цепная реакция — это быстрый, высокочувствительный и специфический анализ, используемый для обнаружения присутствия специфичных для микробов нуклеотидов. Посев является нечувствительным и медленным, а серологический анализ требует получения образцов в острой фазе и выздоравливающих с интервалом не менее месяца, поэтому понятно, что ПЦР-анализы были разработаны для помощи в диагностике микоплазменных инфекций.
Необходимо признать ограничения на тестирование ПЦР. Во-первых, положительные образцы ПЦР могут быть обнаружены у лиц без клинических проявлений. Микоплазменные организмы и / или специфическая ДНК микоплазм могут присутствовать в течение недель или месяцев после заражения, поэтому обнаружение ампликонов ПЦР у пациента может не отражать активную инфекцию. Чтобы преодолеть это ограничение, у детей было предложено комбинированное использование тестирования IgM микоплазмы с тестированием ПЦР. Клинические образцы, подходящие для ПЦР, включают респираторные выделения, полученные из ротоглотки, носоглотки, мокроты или жидкости бронхоальвеолярного лаважа.Прямая ПЦР из легочной ткани также оказалась успешной.
Роль для тестирования IgA
Поскольку M. pneumoniae представляет собой инфекцию слизистых оболочек, была предложена возможность использования специфичных для организма IgA-ответов для постановки диагноза. В настоящее время очень немногие анализы включают реагенты для тестирования IgA, и в настоящее время IgA-специфические тесты недоступны в Соединенных Штатах.
Могут ли быть полезны визуализирующие исследования? Если да, то какие?
Рентгенограмма грудной клетки должна быть сделана у пациентов с респираторными симптомами от умеренной до тяжелой, чтобы задокументировать степень поражения легких, определить наличие плеврального выпота и оценить редкое осложнение абсцесса легкого.
Рентгенографические данные при инфекции Mycoplasma pneumoniae чрезвычайно разнообразны и, следовательно, могут имитировать множество других состояний. Наиболее вероятны рентгенологические находки при бронхопневмонии перихилярных областей. Реже встречаются крупозная пневмония и наличие плеврального выпота. Рентгенологические признаки абсцесса легкого были описаны во время микоплазменной инфекции, но их наличие всегда должно повышать вероятность альтернативного диагноза.
Если вы можете подтвердить, что у пациента инфекция Mycoplasma pneumoniae, какое лечение следует начать?
Надлежащее лечение микоплазменной инфекции антибиотиками сокращает течение болезни и ускоряет облегчение симптомов.Антибиотики группы макролидов являются препаратами выбора, но также эффективны тетрациклины и фторхинолоны.
Mycoplasma не имеет клеточной стенки и, следовательно, по своей природе устойчива к активным агентам клеточной стенки, таким как бета-лактамные антибиотики. Сульфаниламиды, триметоприн и рифампицин также неэффективны. Линкозамины (клиндамицин), по-видимому, имеют низкие минимальные ингибирующие концентрации in vitro, но не являются клинически эффективными. Оксазолидиноны (препараты, нацеленные на 30S-рибосомы) in vitro не имеют перспектив, и их следует избегать.Кетолиды (такие как телитромицин) перспективны против M. pneumoniae in vitro, но клинические данные у детей отсутствуют, а возможность токсического действия на печень привела к осторожности при использовании этого антибиотика.
Сообщается, что высокие дозы глюкокортикоидов полезны в качестве дополнительной терапии у пациентов с микоплазменным энцефалитом. Плазмаферез и внутривенная терапия иммуноглобулинами также использовались в таких условиях, но неясно, приносят ли эти стратегии существенную клиническую пользу.
Макролиды и устойчивость к макролидам
Исследования у детей с внебольничной пневмонией, вызванной микоплазмой, показали, что азитромицин и кларитромицин столь же эффективны, как и эритромицин. Азитромицин и кларитромицин обычно предпочтительнее эритромицина из-за их большей переносимости, дозирования один или два раза в день и более короткой продолжительности лечения азитромицином, хотя их стоимость выше.
Устойчивые к макролидам M. pneumoniae были впервые описаны в 2000 году и, как полагают, являются результатом селективного давления, вторичного по отношению к повсеместному увеличению использования азитромицина.В глобальном масштабе Китай и Япония сообщают о показателях устойчивости к макролидам на уровне 90% и выше. В 2011 году в отчете из Израиля отмечена 30% -ная резистентность организмов, изолированных от госпитализированных пациентов. В некоторых регионах Европы сопротивление достигает 26%. Напротив, уровень сопротивления в западном полушарии остается ниже на уровне 13% по состоянию на 2015 год.
Тесты на чувствительность обычно не доступны и проводятся редко, но появление устойчивых к макролидам M. pneumoniae вызывает опасения по поводу обычных эмпирических вариантов охвата в некоторых частях мира.Встречающиеся в природе штаммы, устойчивые к тетрациклину или фторхинолонам, еще не описаны.
Хинолоны
Левофлоксацин, моксифлоксацин, гатифлоксацин и спарфлоксацин обладают большей in vitro активностью против микоплазмы, чем хинолоны старшего поколения (ципрофлоксацин, офлоксацин), хотя минимальные ингибирующие концентрации для всех хинолонов выше (и, таким образом, для агентов теоретически менее эффективны) группа макролидов.
Какие побочные эффекты связаны с каждым вариантом лечения?
Эритромицин часто вызывает спазмы в животе, потерю аппетита и тошноту.Рвота или диарея — частые жалобы во время лечения. Редко возникают аллергические реакции. Описаны сердечные аритмии, в том числе torsades de pointes.
Терапия азитромицином и кларитромицином реже связана с желудочно-кишечными жалобами. Головные боли возникают у ~ 1% пациентов. Редко эти макролиды связаны с клинически значимой гепатотоксичностью или синдромами гиперчувствительности к лекарствам.
Антибиотики группы хинолонов связаны с повышенным риском тендинита и разрыва сухожилий во всех возрастных группах.Риск еще больше возрастает при одновременном применении глюкокортикоидов и у пациентов с трансплантацией солидных органов.
Каковы возможные исходы инфекции Mycoplasma pneumoniae?
Почти все инфекции Mycoplasma pneumoniae имеют отличный прогноз; однако описаны редкие случаи летального исхода в результате дыхательной недостаточности, острой гемолитической анемии, осложнений многоформной эритемы и энцефалита.
Что вызывает это заболевание и как часто оно встречается?
Эпиднадзор в США показывает, что микоплазма ответственна за 15-20% всех внебольничных пневмоний (ВП).В Скандинавии M. pneumoniae была обнаружена в 30% всех педиатрических ВП и более чем в 50% среди детей старше 5 лет. Заболеваемость наиболее высока среди детей школьного возраста и снижается после подросткового возраста.
Серологические исследования показали, что передача болезни происходит циклическими эпидемиями каждые 3-5 лет. Длительный инкубационный период, относительно низкая скорость передачи и сохранение организма в дыхательных путях в течение различных периодов после заражения могут объяснить, почему эпидемии длятся в течение длительного периода времени.
Инкубационный период может длиться до 3 недель.
Как эти патогены / гены / воздействия вызывают болезнь?
Инфекция приводит к изъязвлению и разрушению мерцательного эпителия дыхательных путей с инфильтрацией макрофагов, нейтрофилов, лимфоцитов и плазматических клеток. В самых тяжелых случаях может развиться диффузное альвеолярное повреждение. Плевральный выпот, бронхоэктазы, абсцессы и фиброз легких — редкие, но серьезные последствия.
Другие клинические проявления, которые могут помочь в диагностике и лечении
Заражение M.pneumoniae подозревают, что они играют роль в нескольких хронических воспалительных заболеваниях. Доказательства роли астмы более убедительны, чем для других заболеваний, и инфекция была связана с искаженным Th3-доминантным воспалительным ответом во время длительной или хронической инфекции.
Какие осложнения вы можете ожидать от болезни или лечения болезни?
Осложнения пневмонии включают развитие плеврального выпота или развитие дыхательной недостаточности, редкую, но опасную для жизни проблему.Также описано образование абсцесса легкого.
У пациентов с дерматологическими проявлениями инфекции необходимо сохранять бдительность в отношении развития большой многоформной эритемы. Таким пациентам может потребоваться агрессивная жидкостная и электролитная поддержка, а в серьезных случаях требуется помощь дыхательных путей с помощью механической вентиляции, позволяющей заживить язвенный процесс в верхних дыхательных путях.
Как можно предотвратить Mycoplasma pneumoniae?
Антибиотикопрофилактика не рекомендуется после заражения.Вакцины нет.
Какие доказательства?
Гардинер, С.Дж., Гавранич, Дж.Б., Чанг, А.Б. «Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к детям». Кокрановская база данных Syst Rev .. vol. 1. 2015. pp. CD004875 (Это традиционный Кокрановский обзор по теме, специфической для детей.)
Zheng, X, Lee, S, Selvarangan, R. «Устойчивые к макролидам, США». Emerg Infect Dis. т. 21.2015. С. 1470-1472. (В этом отчете оценивался 91 образец из 6 участков в США, и было обнаружено, что высокий уровень устойчивости к макролидам впервые в этой области мира превышает 10%.)
Waites, KB, Talkington, DF. «И его роль в качестве патогена для человека». Clin Micro Rev. vol. 17. 2004. С. 697-728. (Самый последний полный и авторитетный обзор, доступный по этой теме. Обзор заканчивается сводной таблицей всех клинических испытаний, проведенных у детей и взрослых для оценки вариантов лечения.Краткое обсуждение проблем в разработке вакцины является основным моментом.)
Аткинсон, Т.П., Уэйтс, КБ. «Инфекции в детстве». Pediatr Infect Dis J. vol. 33. 2014. С. 92-94. (Предлагает отличный обзор современных знаний в области эпидемиологии и лечения детей.)
Аткинсон, Т.П., Балиш, М.Ф., Уэйтс, КБ. «Эпидемиология, клинические проявления, патогенез и лабораторное определение инфекций». FEMS Microbiol Rev. vol. 32.2008. С. 956-973. (Отличный обзор для тех, кто хочет узнать больше о патогенезе и базовой биологии микоплазм. Раздел, посвященный лабораторным исследованиям, является сильной стороной этого обзора, так как в нем представлена сбалансированная критика методов серологического, посевного и ПЦР-анализа.)
Аль-Заиди, С.А., МакГрегор, Д., Махант, С. «Неврологические осложнения инфекций, подтвержденных методом ПЦР, у детей: продолжительность продромального заболевания может отражать патогенетический механизм». Clin Infect Dis. т.61. 2015. С. 1092-1098. (Обсуждаются предлагаемые механизмы патогенеза неврологических проявлений у детей после обобщения опыта большой педиатрической когорты.)
Продолжающиеся споры относительно этиологии, диагностики и лечения
Клинические данные указывают на потенциальную связь между аутоиммунными нарушениями периферической нервной системы и образованием патологических антител против углеводных групп ганглиозидов, в основном GM1. От 5 до 15% случаев синдрома Гийена-Барре (СГБ) были связаны с предшествующей инфекцией микоплазмы, но окончательное доказательство причинно-следственной связи остается неуловимым.
Недавнее инфицирование M. pneumoniae было связано с развитием острого демиелинизирующего энцефаломиелита (ADEM) и неврита зрительного нерва. Доказательства, связывающие такие случаи с производством аутоантител, вызванных микоплазмами, не так надежны, как для GBS.
Считается, что аутоиммунные явления, наблюдаемые после заражения микоплазмой, возникают в результате молекулярной мимекрии. Белки Mycoplasma adhesin и некоторые ткани человека имеют гомологию аминокислотных последовательностей. В частности, аутоиммунные антитела могут развиваться против антигена I на эритроцитах, активности CD4 рецептора Т-клеток и антигенов главного комплекса гистосовместимости класса II, обнаруженных на лимфоцитах.
M. pneumoniae очень редко культивировали из спинномозговой жидкости пациентов с менингоэнцефалитом, но при проведении более чувствительного тестирования полимеразной цепной реакции чаще обнаруживается специфическая для организма ДНК. Эта неспособность идентифицировать организмы в культуре поддерживает утверждение о том, что большинство проявлений микоплазменной инфекции в центральной нервной системе являются вторичными по отношению к аутоиммунным явлениям, а не к активной инфекции ЦНС.
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине».Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
Mycoplasma Pneumoniae | Intermountain Healthcare
Профиль зародыша
Также известен как: Ходячая пневмония, атипичная пневмония, M. Pneumoniae
Тип зародыша: Бактерии
Сезон: Весна, лето, осень, зима
Mycoplasma pneumoniae — частая причина респираторных инфекций у детей школьного возраста и молодых людей.(Инфекция Mycoplasma pneumoniae редко встречается у детей младше 5 лет.) Распространенными симптомами являются кашель, боль в горле, лихорадка и усталость. У многих людей инфекция протекает в легкой форме, и они выздоравливают самостоятельно. Однако около 10% детей школьного возраста заболевают пневмонией и могут нуждаться в лечении антибиотиками.
Сезонность
Инфекции Mycoplasma pneumoniae наблюдаются круглый год во всем мире.
Признаки и симптомы
Кашель и боль в горле — наиболее частые симптомы инфекции Mycoplasma pneumoniae.Часто кашель начинается с «сухого» (непродуктивного) кашля, но позже может перейти в «мокроту» (продуктивный). Инфекция также может вызывать жар, слабость, головную боль и сыпь, а также может вызвать обострение астмы у человека, страдающего астмой. Пневмония — частое осложнение. Фактически, инфекция Mycoplasma pneumoniae является основной причиной пневмонии у детей школьного возраста и молодых людей.
Иногда у людей, инфицированных Mycoplasma, появляется необычная сыпь в форме мишени, которая называется мультиформной эритемой.
Как это распространяется
Mycoplasma pneumoniae передается при тесном личном контакте.Инфекция легко распространяется внутри семьи, а вспышки болезни обычны в школах, летних лагерях и общежитиях.
Диагностика и лечение
Медицинские работники обычно диагностируют инфекцию Mycoplasma pneumoniae, изучая историю болезни и проводя медицинский осмотр. Врач также может подтвердить диагноз, проверив образец слизи изо рта или носа или заказав анализ крови.
Лечение Mycoplasma pneumoniae зависит от симптомов и осложнений.Если симптомы легкие, лечение может означать устранение симптомов до тех пор, пока инфекция не пройдет сама по себе. Однако пневмония может потребовать лечения антибиотиками.
Что я могу сделать сегодня?
1) Практикуйте профилактику и остановите распространение:
- Мойте руки часто и хорошо и пусть дети делают то же самое.
- Избегайте тесного контакта с больными людьми, а если вы заболели, не ходите дома и не ходите на работу.
- Прикрывайте чихание и кашель.
- Используйте салфетку один раз, затем выбросьте и вымойте руки.
2) Обратите внимание:
- При распространении микоплазменной пневмонии обращайте внимание на любые симптомы, которые могут быть у вашего ребенка.

 8 + N72 Цервицит, вызванный M. genitalium
8 + N72 Цервицит, вызванный M. genitalium