прогноз срока жизни, симптомы и лечение
Для любого вида рака характерно определённое направление метастазов. Но где бы ни оказался первичный очаг заболевания, метастазы обязательно отправятся в лёгкие, за редким исключением. Лёгочная ткань – излюбленное место метастазов всех типов злокачественных образований.
Ткань лёгких имеет развитую систему кровотока, через неё прокачивается кровь. Метастазы в лёгких – это миграция клеток рака по крови и лимфе, которую инициирует почти любой первичный очаг злокачественной опухоли.
Поток лимфы направляется в крупные сосуды, те впадают в полую верхнюю вену. С помощью сердца смесь крови и лимфы проходит через лёгкие. Поэтому раковый процесс в лёгких – это, как правило, вторичный рак: первичный очаг находится в другом месте. Сто пятьдесят полнокровных, в прямом смысле слова, квадратных метров (такова площадь альвеол лёгких) – полигон идеальных условий для развития раковых клеток.
Прогноз
Ещё недавно наличие метастазов звучало как приговор. Возможности выжить после изнуряющего курса химиотерапии практически не отмечалось. Цитостатики, препараты для торможения клеточного деления, открывали второй фронт, добивая измождённый организм побочными эффектами. Основные: губительное действие на костный мозг, необратимые процессы в печени и, как вариант, летальные изменения состава крови.
Возможности выжить после изнуряющего курса химиотерапии практически не отмечалось. Цитостатики, препараты для торможения клеточного деления, открывали второй фронт, добивая измождённый организм побочными эффектами. Основные: губительное действие на костный мозг, необратимые процессы в печени и, как вариант, летальные изменения состава крови.
Операции не давали ожидаемого результата: после радикального удаления поражённой ткани часто оставался нежизнеспособный орган.
«Доктор, сколько мне ещё осталось?» – на известный печальный вопрос онкологам приходится отвечать чуть ли не ежедневно, иногда многократно. Дать прогноз срока жизни затруднительно. Как долго осталось жить пациенту, зависит от ряда факторов:
- где находится первичное злокачественное новообразование;
- физическое состояние больного человека;
- число прожитых лет пациента;
- наличие метастазов в другие органы, помимо лёгкого, и проч.
Определяющий фактор ещё не назван: в какой момент развития опухоли пациент забил тревогу и обратился к врачу.
Метастазы в лёгких
Метастазы в лёгких – печальное свидетельство того, что силы сопротивления организма исчерпаны, и клетка рака беспрепятственно понеслась по кровотоку. Медицина сегодня не всегда способна вылечить больного – полностью справиться с метастазами. Прогноз при подобном диагнозе нередко малоприятный из-за отсутствия явной симптоматики в начале процесса.
Положительные прогнозы даёт своевременное лечение первичного новообразования. Люди иногда относительно долго живут и после операций, связанных с метастазами, повторившимися через год.
Хорошие результаты получены при нахождении первичных очагов опухолей в теле матки, молочной железы, в костях, в печени и в области мягких тканей.
Существенно не влияет на выживаемость локализация вторичного рака: центральный либо периферийный. Не зависит время жизни от стороны поражения органа раком, от наличия метастазов в плевру.
Оптимистическими прогнозами радует новообразование, квалифицирующееся как высокодифференцированное.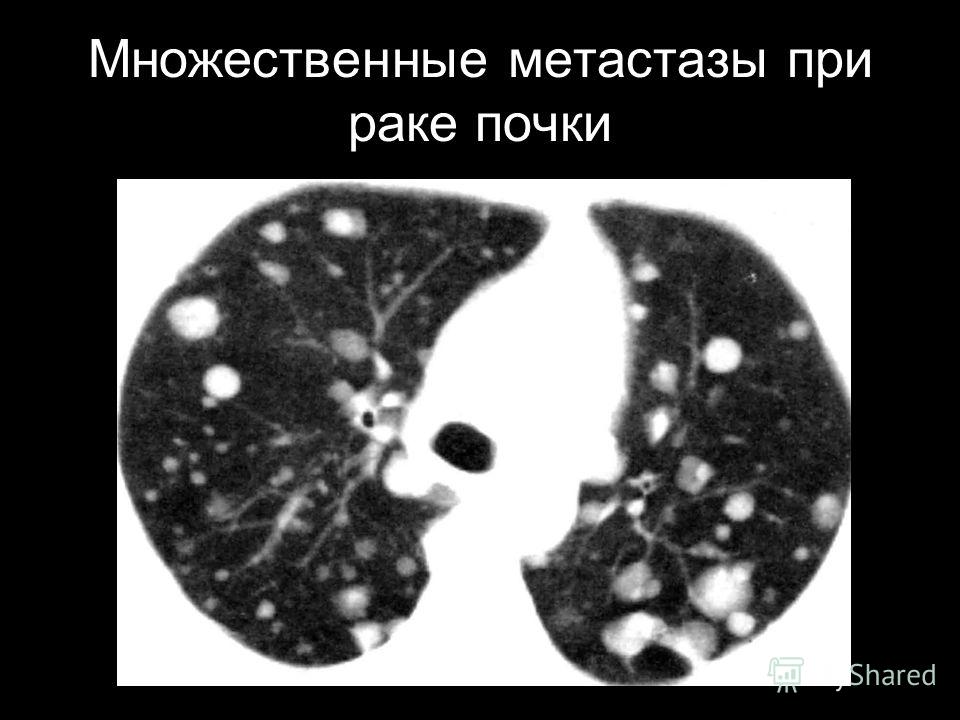 Подобные раковые клетки напоминают здоровые и медленно распространяются. Опухоль в последнем случае поддаётся терапии. Рано выявленная патология продлевает жизнь до 5 лет.
Подобные раковые клетки напоминают здоровые и медленно распространяются. Опухоль в последнем случае поддаётся терапии. Рано выявленная патология продлевает жизнь до 5 лет.
Если не лечить низкодифференцированную опухоль, пациент сможет прожить 100 дней. Клетки указанного вида опухоли крайне агрессивные, но чувствительны к химиотерапии, ионизированному облучению. Семьдесят процентов больных продолжают жить, если терапия проводится своевременно, злокачественный процесс выявлен максимум на второй степени развития.
Помимо того, что определяющим фактором метастазирования опухолей различных органов именно в лёгкое являются множественные кровеносные сосуды лёгочной ткани, в отдельных случаях ситуации способствует и близкое взаиморасположение ряда органов.
Рак лёгких
Классификация метастазов в лёгких
По способам метастазирования:
- Лимфогенные метастазы. Раковые клетки с потоком лимфы направл
Метастазы в легких — симптоматика, причины, методика лечение
Высокий уровень развития современной медицины дает возможность диагностировать рак на самых ранних стадиях. Большинство своевременно выявленных новообразований успешно поддаются лечению, но, тем не менее, раковые образования коварны. Зачастую злокачественные новообразования вызывают вторичные очаги роста, так называемые метастазы. Наиболее частые места локализации метастазов – печень, лимфоузлы, кости, головной мозг и легочная ткань.
Большинство своевременно выявленных новообразований успешно поддаются лечению, но, тем не менее, раковые образования коварны. Зачастую злокачественные новообразования вызывают вторичные очаги роста, так называемые метастазы. Наиболее частые места локализации метастазов – печень, лимфоузлы, кости, головной мозг и легочная ткань.
Причины метастазов в легких
Статистика показывает, что метастазы в легких стоят на втором месте по количеству диагностирования вторичных онкологических заболеваний. Легкие являются самым большим по площади органом, через который движется весь кровяной поток. Механизм возникновения метастаз выглядит следующим образом. В процессе роста первичной раковой опухоли часть ее клеток попадает в кровь и лимфу. Кровоток и лимфоток переносит раковые клетки на новое место, где они начинают рост, образуя множественные метастазы. Такой рак называют метастатическим, а сам процесс переноса раковых клеток в организме – метастазированием.
Локализация метастазов в легких – серьезный и опасный процесс, протекающий иногда бессимптомно. Выявляются они в подавляющем количестве случаев на последних стадиях онкологического заболевания.
Выявляются они в подавляющем количестве случаев на последних стадиях онкологического заболевания.
Наиболее вероятно метастазирование в легочные ткани рака следующих органов:
- Шейки матки;
- Прямой кишки;
- Головного мозга;
- Поджелудочной железы;
- Мочевого пузыря;
- Молочной железы;
- Толстой кишки;
- Позвоночника;
- Кожных покровов;
- Печени;
- Почек.
Не исключают поражения легких метастазами и другие виды рака.
Виды и классификация поражения легочной ткани метастазами
Все вторичные очаги медики классифицируют по следующим признакам:
- По размеру;
- По месту локализации;
- По количественному признаку;
- по гистологическому типу первичной опухоли
- по способу метастазирования
Симптоматика метастазов в легких
Метастазы легочной ткани в течение долгого времени практически не проявляют себя, затрудняя диагностику. Характерные признаки метастаз проявляются на поздних стадиях рака. Основными симптомами являются:
Характерные признаки метастаз проявляются на поздних стадиях рака. Основными симптомами являются:
- Одышка;
- Ноющая боль в грудной и брюшной полости;
- Кровь в мокроте;
- Отказ от пищи;
- Резкое снижение веса;
- Гипертермия;
- Отеки;
- Систематические головные боли;
- Кашель.
Вышеназванные признаки довольно легко спутать с проявлениями других болезней. Если выявлен хотя бы один симптом, специалисты рекомендуют пройти полную диагностику с целью исключить патологию.
Методы диагностики метастазов в легких
Метод рентгенографии (флюорографии) способен выявить изменения в легочной ткани. На рентгенограмме виден характер поражения, его размеры и расположение. Метастазирование в область плевры напоминает плеврит, поэтому рекомендуется провести КТ и МРТ диагностику, которые дополнят картину болезни.
Компьютерная томография показывает области, где находятся образования, и их характер.
Цитологический анализ мокроты или материалов биопсии является подтверждающим методом.
Способы лечения вторичных очагов
- Хирургическое вмешательство заключается в резекции одиночных очагов вторичной онкологии.
- Курсовая химиотерапия назначается дополнительно к медикаментозному лечению. Схема химиотерапии определяется по результатам лечения. Схема химиотерапии зависит от стадии, формы и гистологического типа опухоли:
- Лучевая терапия снижает болевые симптомы и замедляет рост злокачественных клеток.
- Гормональная терапия.
- Радиохирургия.
Продолжительность жизни пациентов с диагнозом метастазы в легких
Множественные метастазы в легких не дают однозначных прогнозов. В зависимости от характера образования, его расположения, характера и иных характеристик, а также стадии, на которой начато лечение, в результате успешного лечения пациент может выздороветь.
Второе мнение экспертов
Специалисты нашей Национальной телерадиологической сети имеют высокий уровень квалификации, большой опыт работы и помогут составить грамотное заключение по результатам имеющихся анализов и снимков, а также подтвердят или опровергнут поставленный диагноз.
Метастазы в легких, в позвоночнике — Онкология
Доброго времени суток.
Учитывая проведенное оперативное лечение в 2011г. — на основании индексов TNM- ,была выставлена 3 стадия заболевания. При 3 стадии заболевания полного изменения от онкологического процесса не происходит и опухоль , ранее удаленная, начинает метастазировать. Что , к сожалению, в вашей ситуации и произошло. Легкие и кости — это » первая инстанция» метастазирования злокачественных опухолей почки.
При наличии распространенного метастатического поражения свидетельствует о прогрессии процесса, поэтому вас перевели на симптоматическое лечение, потому что специфического лечения распространенного опухолевого процесса не существует и все лечение направлено на купирование симптомов онкологического заболевания. Вы были на консультации у онколога ( г. Барнаул), следовательно вас должны были перевести в 4 клиническую группу и это должно быть отражено во врачебной справке.
Согласно приказам по оказанию помощи онкологическим больным вы можете. ….
….
1. Оформить инвалидность по месту жительства. Учитывая распространенный опухолевый процесс вам положена 1 группа инвалидности . Этим занимается терапевт по месту жительства.
2. Получение обезболивающей терапии ( онкологическим больным обезболивающие препараты даются бесплатно). Для это необходимо запись онколога о назначение сильнодействующих не наркотических и наркотических обезболивающих. Таких препаратов как трамадол, промел, морфин. Данные препараты выдаются только по рецепту врача, в свободной продаже из нет. Данные препараты назначаются по схеме: от однократного укола в день до 4- х кратного применения ( максимально) Главное употреблять в равные промежутки времени : 6-12-18-24 часа.
В онкологии есть специальные врач ( паллиативные терапевты) которые способны расписать обезболивающее лечение , и это будет официально.
Все обезболивающие препараты должны применятьмя по » прикрытием » желудка. Данные препараты очень сильно действуют на желудок. Поэтому необходимо применение препаратов » для желудка» Омез или и нольпаза. 40 мг * 1 р/ день
40 мг * 1 р/ день
Так же если вы применяете препараты для снижения температуря на основе парацетомола, необходимо » защищать» желудок.
Слабые обезболивающие,( нестероидные противовспалительне средства) , такие как кетонал, баралгин и их аналоги- находятся в свободной продаже) максимальная дозировка таких препаратов 1 таб или 1 ампула * 3 раза в день- это максимально.
Из противорвотных препаратов- церукал — достаточно слабый. Вопрос в причине рвоты.. какая она??? центрального генеза или связана с воспалительными проблемами в желудке. Более сильный противорвотный препарат ондансетрон, продается без рецепта врача, стоит прилично.
Но по поводу применения лекарственных препаратов необходимо проконсультироваться с леч. доктором.
С уважением Елена Сергеевна
Варианты лечения метастазов рака толстой кишки в легкие
Колоректальный рак, который распространяется на легкие, также называемый метастазами в легкие, лечится иначе, чем рак, возникший в легких. Колоректальный рак, который распространяется на легкие, часто лечится хирургическим вмешательством — обычно минимально инвазивными методами — а иногда в сочетании с химиотерапией.
Индивидуальное лечение метастазов в легких
Во всех случаях метастазов в легкие протокол лечения должен быть адаптирован к индивидуальному пациенту.Есть много разных способов комбинировать подходы к лечению в зависимости от того, где находится рак, какие другие органы вовлечены, общее состояние здоровья пациента и другие факторы. Также есть роль для индивидуальных предпочтений каждого пациента.
Новые варианты лечения метастатических узелков в легких могут также включать радиочастотную абляцию (лечение с помощью электрически нагретой проволоки), криотерапию (лечение замораживанием) или стереотаксическое (сфокусированное) излучение в дополнение к традиционным вариантам.
Изучаемые в будущем варианты лечения включают подход, аналогичный тому, который используется при опухолях печени, когда химиотерапия вводится непосредственно в опухоль. Такой подход может быть полезным для пациентов с множественными метастазами в легких.
Лечение узелков в легком
При метастазах в легкие лечение может зависеть от того, что делает рак. Если узелки появляются в легких у пациента с колоректальным раком, они должны быть удалены хирургическим путем, если это возможно, как способ диагностировать проблему и, возможно, вылечить ее в целом.
Если узелки появляются в легких у пациента с колоректальным раком, они должны быть удалены хирургическим путем, если это возможно, как способ диагностировать проблему и, возможно, вылечить ее в целом.
Лечение также будет зависеть от количества появившихся узелков. Если их всего несколько — четыре или пять, то удаление их хирургическим путем поможет выжить пациенту в будущем. Если их 10, 15 или более, то системная химиотерапия может принести пациенту больше пользы, чем хирургическое вмешательство.
Лечение заблокированного дыхательного горла
Колоректальный рак, который распространился на легкие и блокирует дыхательное горло, можно лечить больше как первичный рак легкого, путем хирургического удаления самого узла или доли, в которой он находится.Если опухоль вызывает более серьезные проблемы, лечение может включать хирургический подход в сочетании с химиотерапией. Радиация, хотя и менее распространена, также может использоваться для лечения рака.
Обработка скоплений жидкости вокруг легких
У пациентов также могут образовываться скопления жидкости вокруг легких. Их лечат, прежде всего, назначая пациентам химиотерапию и затем дренируя эти выделения. Один из способов слить их — использовать плевральный катетер, при котором небольшая пластиковая трубка вставляется в грудную клетку и может быть прикреплена к небольшой одноразовой вакуумной бутылке.
Их лечат, прежде всего, назначая пациентам химиотерапию и затем дренируя эти выделения. Один из способов слить их — использовать плевральный катетер, при котором небольшая пластиковая трубка вставляется в грудную клетку и может быть прикреплена к небольшой одноразовой вакуумной бутылке.
Жидкость можно удалять каждый день, чтобы легкие оставались расширенными. Это делается дома и позволяет пациентам сразу же начать химиотерапию.
Узнать больше
Пациенты с раком, распространившимся на легкие, также могут узнать о передовых методах лечения в рамках нашей программы лечения рака грудной клетки.
Метастазы в кости — Симптомы и причины
Обзор
Метастазирование в кости происходит, когда раковые клетки распространяются с исходного участка на кость.
Почти все виды рака могут распространяться (метастазировать) в кости. Но некоторые виды рака особенно подвержены распространению на кости, включая рак груди и рак простаты.
Метастазы в кости могут возникать в любой кости, но чаще встречаются в позвоночнике, тазу и бедре. Метастазы в кости могут быть первым признаком того, что у вас рак, или метастазы в кости могут возникать через годы после лечения рака.
Метастазы в кости могут вызывать боль и переломы. За редким исключением рак, распространившийся на кости, невозможно вылечить.Лечение может помочь уменьшить боль и другие симптомы метастазов в кости.
Продукты и услуги
Показать больше продуктов от Mayo Clinic
Симптомы
Иногда метастазы в кости не вызывают никаких признаков и симптомов.
Когда это происходит, признаки и симптомы метастазов в кости включают:
- Боль в костях
- Сломанные кости
- Недержание мочи
- Недержание кишечника
- Слабость в ногах или руках
- Высокий уровень кальция в крови (гиперкальциемия), который может вызывать тошноту, рвоту, запор и спутанность сознания
Когда обращаться к врачу
Если вы испытываете стойкие признаки и симптомы, которые вас беспокоят, запишитесь на прием к врачу.
Если в прошлом вы лечились от рака, расскажите врачу о своей истории болезни и о том, что вас беспокоят свои признаки и симптомы.
Причины
Метастазы в кости возникают, когда раковые клетки отделяются от исходной опухоли и распространяются на кости, где они начинают размножаться.
Врачи не уверены, что вызывает распространение некоторых видов рака. И непонятно, почему некоторые виды рака попадают в кости, а не в другие распространенные места метастазирования, такие как печень.
Факторы риска
Практически любой тип рака может распространяться на кости, но рак, наиболее вероятно вызывающий метастазы в кости, включает:
- Рак груди
- Рак почки
- Рак легкого
- Лимфома
- Множественная миелома
- Рак простаты
- Рак щитовидной железы
Лептоменингеальных метастазов | Мемориальный онкологический центр им. Слоуна Кеттеринга
Слоуна Кеттеринга
Перейти к основному содержанию
Мемориальный онкологический центр им. Слоуна Кеттеринга
Институт Слоана Кеттеринга
Давать
Локации
Врачи
Назначения
Связаться с нами
Поиск
Закрыть поиск
Меню
Закрыть меню
- Взрослые пациенты
▼- Обзор взрослых пациентов
- Лечение рака
- Типы рака
- Оценка рисков и скрининг
- Диагностика и лечение
- Клинические испытания
- Ваш опыт
- Становление пациента
- Поддержка пациентов
- Поддержка попечителей
- Наши офисы
- Нью-Джерси
- Нью-Йорк
- Штат Нью-Йорк
- Страхование и помощь
- Информация о страховании
- Финансовая помощь
- Найти врачаЗаписаться на приемИнформация для посетителейMyMSK
- Пациенты-дети и подростки
▼- Обзор пациентов-детей и подростков
- Детское онкологическое лечение
- Наше лечение в MSK Kids
- Детское онкологическое лечение
- Лечение
- Педиатрические клинические испытания
- Ваш опыт
- Наши пациенты
- Становление пациента
- Жизнь в MSK Дети
- Поступающие в MSK Kids
- Стационарное лечение
- Амбулаторное лечение
- Размещение
- Страхование и помощь
- Информация о страховании
- Финансовая помощь
Гистопатологические и молекулярный подход к стадированию множественных узелков в легких — Schneider
Introduction
Сообщаемая частота пациентов с карциномой легких с множественными узелками колеблется от 0. От 2% до 20% (1-3). Заболеваемость растет благодаря улучшенным методам визуализации, программам скрининга рака легких и наблюдению за пациентами с ранее леченными раками. Классификация множественных легочных узелков как множественных первичных опухолей или внутрилегочных метастазов может быть сложной задачей. Мартини и Меламед предложили наиболее часто используемые клинические и патологические критерии в 1975 г. (1). Основная идея, лежащая в основе их классификации, заключалась в том, что морфология метастазов должна соответствовать морфологии первичной опухоли, в то время как различная морфология поддерживает классификацию опухолей как не связанных между собой отдельных первичных опухолей.Хотя эти критерии кажутся простыми и понятными, их применение врачами и патологами различается. В результате неадекватная классификация опухолей не позволила предсказать клиническое течение или исход. Различие между множественными первичными опухолями и внутрилегочными метастазами важно, потому что лечение и результаты различны.
От 2% до 20% (1-3). Заболеваемость растет благодаря улучшенным методам визуализации, программам скрининга рака легких и наблюдению за пациентами с ранее леченными раками. Классификация множественных легочных узелков как множественных первичных опухолей или внутрилегочных метастазов может быть сложной задачей. Мартини и Меламед предложили наиболее часто используемые клинические и патологические критерии в 1975 г. (1). Основная идея, лежащая в основе их классификации, заключалась в том, что морфология метастазов должна соответствовать морфологии первичной опухоли, в то время как различная морфология поддерживает классификацию опухолей как не связанных между собой отдельных первичных опухолей.Хотя эти критерии кажутся простыми и понятными, их применение врачами и патологами различается. В результате неадекватная классификация опухолей не позволила предсказать клиническое течение или исход. Различие между множественными первичными опухолями и внутрилегочными метастазами важно, потому что лечение и результаты различны.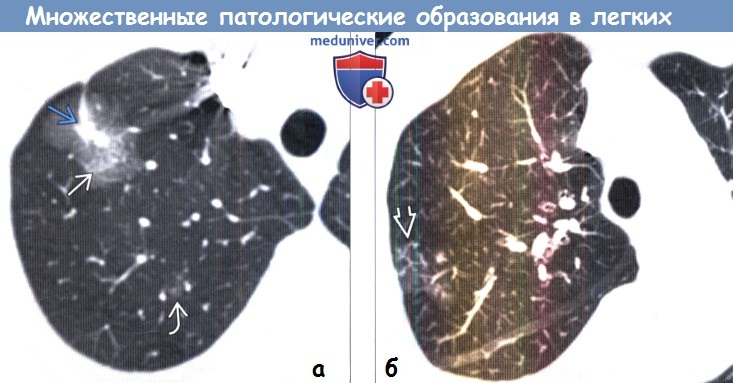 Таким образом, в 7-м и, тем более, в текущем 8-м издании Руководства по стадированию рака Американского объединенного комитета (AJCC) делается попытка более точно классифицировать множественные опухоли не только с использованием критериев локализации, но и путем включения самых последних гистологических данных. критерии классификации и молекулярные характеристики опухолей (4,5).В этом обзоре обобщены клинические, патологические и молекулярные подходы к классификации и определению стадии множественных узелков в легких.
Таким образом, в 7-м и, тем более, в текущем 8-м издании Руководства по стадированию рака Американского объединенного комитета (AJCC) делается попытка более точно классифицировать множественные опухоли не только с использованием критериев локализации, но и путем включения самых последних гистологических данных. критерии классификации и молекулярные характеристики опухолей (4,5).В этом обзоре обобщены клинические, патологические и молекулярные подходы к классификации и определению стадии множественных узелков в легких.
Стадия мультифокального рака легкого
Определение стадии множественных узелков опухоли легких было сложной задачей и претерпело значительные изменения в последних двух изданиях руководства AJCC по стадированию. Определение стадии мультифокального рака легкого в 7-м издании руководства AJCC по стадированию в основном основывалось на критериях Мартини и Меламеда, установленных в 1975 году (1,5).Руководство по стадированию AJCC с тех пор признало, что эти критерии могут быть неоптимальными с клинической точки зрения; были выдвинуты некоторые новые предложения, но без подробного руководства по их реализации. Например, патологам была предоставлена возможность включить свои морфологические отпечатки, результаты иммуногистохимии и любые доступные молекулярные исследования в определение стадии патологии. Однако не было дано подробных рекомендаций относительно того, какие гистологические критерии или молекулярные исследования следует использовать. Кроме того, не было определено, как включить молекулярные исследования в определение стадии мультифокального рака легких.
Например, патологам была предоставлена возможность включить свои морфологические отпечатки, результаты иммуногистохимии и любые доступные молекулярные исследования в определение стадии патологии. Однако не было дано подробных рекомендаций относительно того, какие гистологические критерии или молекулярные исследования следует использовать. Кроме того, не было определено, как включить молекулярные исследования в определение стадии мультифокального рака легких.
В 8-м издании руководства AJCC по стадированию мультифокальный рак легкого был разделен на четыре типа заболеваний (, таблица 1, ) (4,6). Эти паттерны основаны на клинической картине (включая рентгенологический слепок и распределение заболевания), гистологической оценке и исходах.
Таблица 1 Паттерны мультифокального рака легких, признанные 8-м изданием руководства Американского объединенного комитета по стадированию рака (4,6)
Полная таблица
Первый образец определяется множественными первичными опухолями. Клинические характеристики каждого отдельного опухолевого узла аналогичны таковым для отдельного индивидуального рака легкого в зависимости от его стадии и гистологии. Каждой опухоли следует назначить отдельную стадию T, N и M, как если бы это была одна опухоль.
Клинические характеристики каждого отдельного опухолевого узла аналогичны таковым для отдельного индивидуального рака легкого в зависимости от его стадии и гистологии. Каждой опухоли следует назначить отдельную стадию T, N и M, как если бы это была одна опухоль.
Второй паттерн определяется как отдельные опухолевые узелки одного происхождения (внутрилегочные метастазы), обычно представленные множественными опухолевыми узелками одного гистологического типа и / или молекулярного профиля. Общая выживаемость этих пациентов в первую очередь определяется лечением.Определение стадии этих опухолей осуществляется по тем же правилам, что и в 7-м издании руководства AJCC по стадированию. Отдельный узелок опухоли в той же доле находится на стадии Т3, в ипсилатеральной доле — как Т4, а в контралатеральной доле — как M1a.
Третий образец определяется мультифокальной аденокарциномой легкого с признаками матового стекла радиологически или лепидными признаками гистологически. У пациентов с мультифокальной лепидной аденокарциномой крайне маловероятно развитие узловых или отдаленных метастазов, но у них действительно повышенный риск развития дополнительных маточных / субтвердых раковых опухолей легких.В целом, эта модель рака легких часто проявляет более ленивое поведение. Наибольшее поражение, к которому добавляется буква «m» в скобках для обозначения множественности, определяет патологическую стадию T.
Четвертая форма — аденокарцинома легкого так называемого «легочного типа». Он характеризуется диффузным консолидированным рисунком при визуализации грудной клетки без четко обозначенных узелков. Гистологически эта картина обычно коррелирует с инвазивной муцинозной аденокарциномой. Эти опухоли обычно развиваются медленно, но общая выживаемость хуже, чем у матовых / лепидных опухолей.Т-стадия патологии аналогична таковой для внутрилегочных метастазов.
Морфологический подход к мультифокальному раку легкого
Патологическая оценка множественных узелков в легких играет важную роль в различении множественных первичных опухолей от внутрилегочных метастазов. Полезность патологических критериев Мартини и Меламеда ограничена, поскольку они рассматривают только основной гистологический тип опухоли (аденокарцинома против плоскоклеточного рака).Они не учитывают огромную морфологическую неоднородность, наблюдаемую в аденокарциномах легких, наиболее распространенном гистологическом типе немелкоклеточной карциномы у пациентов с изолированными, а также множественными узелками. Исчерпывающий гистологический подтип этой гетерогенной морфологии был официально описан в классификации аденокарциномы легких Международной ассоциации по изучению рака легких / Американского торакального общества / Европейского респираторного общества (IASLC / ATS / ERS) и впоследствии принят Всемирной организацией здравоохранения (ВОЗ). классификация опухолей легких 2015 г. (7,8).Вкратце, существует пять основных морфологически различных подтипов инвазивной аденокарциномы легких, включая ацинарный, папиллярный, микропапиллярный, солидный и лепидный. Вариантами аденокарциномы легких считается целый спектр муцинозных опухолей. Напротив, плоскоклеточная карцинома морфологически менее гетерогенная и в настоящее время распознается тремя подтипами (ороговевающий, некератинизирующий и базалоидный).
Прогностическое значение гистологического подтипа аденокарциномы легкого было продемонстрировано в нескольких исследованиях (9-11).Солидные и микропапиллярные подтипы связаны с плохим прогнозом, тогда как лепидный подтип обычно указывает на благоприятные исходы (12,13). Из-за прогностической значимости различных гистологических подтипов комплексная гистологическая оценка хирургически резецированной аденокарциномы легкого с шагом 5% была рекомендована классификацией аденокарциномы легкого IASLC / ATS / ERS и классификацией опухолей легких ВОЗ 2015 года. Также было показано, что комплексная гистологическая оценка чрезвычайно важна для классификации и определения стадии множественных узелков опухоли легких (14-16).Алгоритмический подход к хирургической резекции образцов с множественными опухолевыми узлами был предложен Girard et al. ( Рисунок 1 ) (14). Патологи должны решить, являются ли две опухоли морфологически похожими или нет. Легче установить, что два рака являются отдельными первичными опухолями, чем то, что они являются внутрилегочными метастазами, но, поскольку основные различия в гистологических подтипах могут быть связаны с более агрессивными подтипами, которые чрезмерно представлены в метастатических очагах, этот метод не идеален.Гистологическая оценка должна включать относительный процент каждого гистологического подтипа. Аденокарциномы также могут быть оценены на предмет вариантов (муцинозный, кишечный, коллоидный, внутриутробный) и цитологических изменений, таких как светлоклеточные или перстневые признаки. Помимо гистологических подтипов, полезными отличительными признаками могут быть другие опухолевые элементы, такие как внешний вид стромы и наличие воспаления или некроза. Гораздо сложнее отличить множественные первичные плоскоклеточные карциномы от внутрилегочных метастазов.В случае плоскоклеточного рака при первичной гистологической оценке следует учитывать степень ороговения, наличие базалоидной цитологии, внешний вид стромы (например, миксоид, гиалинизированный) и некроз. Также может оказаться полезным наличие дополнительных признаков, таких как изменение светлых клеток или саркоматоидная морфология. Хотя не существует общепринятой схемы классификации немелкоклеточной карциномы, в сложных случаях может потребоваться оценка подробных цитологических характеристик, таких как размер клеток, контуры ядер и наличие или отсутствие ядрышек.Исследование воспроизводимости IASLC низкодифференцированной немелкоклеточной карциномы продемонстрировало большое согласие среди легочных патологов в распознавании таких особенностей плоскоклеточного рака, как ороговение, образование кератинового жемчуга и межклеточные мосты (17). Это предполагает потенциальную роль этого простого подхода в определении стадии мультифокальной плоскоклеточной карциномы. Напротив, последовательное комплексное гистологическое определение подтипов аденокарциномы является более сложной задачей. Исследование воспроизводимости аденокарциномы IASLC показало, что согласие между легочными патологами от справедливого до умеренного (2).В этом исследовании папиллярный, микропапиллярный и лепидный подтипы были причиной большинства разногласий среди патологов. Причина расхождений в интерпретации может заключаться в непоследовательном применении существующих диагностических критериев.
Рисунок 1 Алгоритмический подход к множественным узелкам в легких с использованием комплексного гистологического подтипа (14).
Noguchi et al. продемонстрировал, что обучение патологоанатомов диагностическим критериям должно в конечном итоге привести к значительному улучшению диагностической воспроизводимости (3).Можно утверждать, что это исследование не отражало повседневную практику, потому что интерпретация была основана на обзоре репрезентативного статического изображения определенного гистологического подтипа, а не на обзоре всего сечения опухоли. Другое исследование, проведенное той же группой торакальных патологов по оценке морфологии синхронных узелков в легких, дополнительно подтверждает эту гипотезу (18). Патологи рассмотрели полные слайды 126 опухолей 48 пациентов и оценили многочисленные гистологические и цитологические особенности.Общее согласие в отношении классификации опухоли как первичной опухоли или внутрилегочного метастаза достигло 0,60 балла по шкале Каппа, что указывает на то, что патолог в большинстве случаев может очень хорошо провести общую морфологическую характеристику множественных узелков в легких и последующую стадию. Наиболее полезными морфологическими признаками для различения множественных первичных опухолей и метастазов были основной тип опухоли, преобладающие гистологические паттерны, образование ацинусов, ядерный плеоморфизм, размер клеток и ядрышек и скорость митоза (18).
Запросы для оценки во время интраоперационных консультаций с замороженными срезами, остаются ли две опухоли отдельными первичными или внутрилегочные метастазы. Замороженные срезы обычно имеют много артефактов обработки, которые могут затруднить надежную всестороннюю гистологическую оценку. В нескольких исследованиях сообщалось об умеренном согласии по гистологическому подтипу аденокарциномы легкого на замороженных срезах (19,20). Подобно исследованиям постоянных срезов, микропапиллярные и лепидные подтипы были наиболее сложными, в то время как ацинарные и сплошные узоры, скорее всего, были правильно идентифицированы.В дополнение к низкому качеству замороженных срезов, ошибка выборки может существенно повлиять на неоптимальную гистологическую оценку, потому что только небольшая часть, а не вся опухоль может быть оценена во время операции.
Дилемма представляет собой морфологическую оценку множественных узелков на небольших биоптатах и цитологических образцах, которые часто являются единственными образцами тканей, доступными у пациентов с карциномой легких. Точная классификация на определенные основные типы, такие как аденокарцинома и плоскоклеточный рак, возможна в большинстве случаев на основе морфологии или с помощью иммуногистохимии.Следовательно, в случаях отдельных первичных опухолей другого гистологического типа может быть достаточно небольших биопсийных и цитологических образцов (21-25). Однако морфологическая подклассификация аденокарциномы легкого на цитологическом образце затруднена и во многом зависит от типа процедуры и клеточности опухоли в образце (26,27). Ацинарный узор, по-видимому, легче классифицировать на цитологических образцах, в то время как распознавание микропапиллярных и твердых структур может быть чрезвычайно трудным и ненадежным (28).
В классификации опухолей легких ВОЗ 2015 г. был введен термин и понятие аденокарцинома in situ (AIS), заменив им термин бронхиолоальвеолярная карцинома (BAC) (8). Нередко выявляются множественные узелки в легких, которые классифицируются как AIS. По данным ВОЗ, эти опухоли имеют общий размер до 3 см и характеризуются ростом злокачественных клеток, обычно демонстрирующих дифференцировку пневмоцитов II типа или клеток Клары, вдоль альвеолярных перегородок без признаков инвазии в строму, сосуды, воздушное пространство или плевральную полость. .При визуализации эти опухоли выглядят как множественные помутнения матового стекла. Считается, что они представляют собой отдельные первичные аденокарциномы, а не внутрилегочные метастазы. Точно так же минимально инвазивная аденокарцинома (MIA) и инвазивная аденокарцинома с преимущественно лепидным типом роста считаются отдельными первичными опухолями. Это различие важно, потому что весь спектр аденокарциномы с лепидным компонентом (AIS, MIA или аденокарцинома с преобладанием лепидных) имеет хорошие клинические исходы (29-31).Это правило применимо только к немуцинозным аденокарциномам. Муцинозные аденокарциномы встречаются редко. При адекватном отборе образцов в подавляющем большинстве муцинозных опухолей можно обнаружить инвазивные очаги, демонстрирующие лепидный характер роста. Отдельные очаги чистой муцинозной АИС можно рассматривать как отдельные первичные опухоли. Однако инвазивные муцинозные аденокарциномы имеют тенденцию к внутрилегочному метастатическому распространению, и поэтому множественные муцинозные опухоли часто лучше всего рассматривать как метастатические очаги (8).Более того, инвазивная муцинозная аденокарцинома обычно имеет худший исход, чем ее немуцинозные аналоги (32).
Таким образом, опубликованные исследования демонстрируют возможность морфологического подтипа карциномы легкого, который предсказывает стадию и исход болезни лучше, чем критерии Мартини и Меламеда.
Молекулярный подход к мультифокальному раку легкого
За последнее десятилетие появилось множество исследований с использованием различных молекулярных подходов к анализу синхронных узелков опухоли легких, включая микросателлитный анализ ДНК, сравнительную геномную гибридизацию (CGH), массив CGH и, совсем недавно, секвенирование следующего поколения (NGS) (15,33- 39).В целом опухоли с в значительной степени согласованными молекулярными результатами считались клональными по происхождению (метастазы), а опухоли с противоречивыми результатами считались независимыми первичными опухолями. Расхождение между клинической и молекулярной классификацией первоначально предполагаемых случаев множественного первичного рака легких составляло от 18% до 30% в разных сериях (14,15).
В самых ранних молекулярных исследованиях использовались анализы клональности, такие как панель переменного числа полиморфных микросателлитных маркеров и анализ инактивации Х-хромосомы (37,38,40).Данные, полученные с помощью этих анализов, следует интерпретировать с осторожностью, поскольку аналогичные модели аллельных потерь могут присутствовать в респираторном эпителии курильщиков с раком легких или без него. Основными недостатками первых молекулярных исследований были небольшое количество проанализированных случаев и отсутствие стандартизированной методологии и критериев интерпретации. Данные из опубликованных отчетов указывают на очень вариабельный процент мультифокальных опухолей, идентифицированных как клонально связанные (до 70%), и все отчеты согласны с тем, что мультифокальные опухоли могут возникать либо как метастазы из одной опухоли, либо как независимые опухоли (16,33-35 , 41).
Достижения в области молекулярных методов привели к более комплексным подходам к анализу геномных изменений, таких как генные мутации, амплификации, делеции и реаранжировки. Многие исследования оценивали определенные мутации, исходя из предположения, что соответствующие мутации драйвера определяют опухоли как клонально связанные (16,33,42). Однако следует быть очень осторожным с интерпретацией, потому что одни и те же мутации могут возникать в морфологически разных опухолях. Кроме того, драйверные мутации также могут быть обнаружены в нормальном легком у пациентов с раком легких и могут представлять собой наиболее распространенную мутацию (43).Возможность мутации зародышевой линии EGFR может также дополнительно усложнить интерпретацию клональной связи множественной аденокарциномы легких (44,45). Следовательно, идентификация одной и той же мутации в двух опухолях не обязательно указывает на клональную связь. Такой результат всегда должен коррелировать с морфологией опухоли и результатами визуализации. Другой проблемой, о которой широко сообщалось в литературе, является гетерогенность мутаций, особенно для EGFR и KRAS , между первичными опухолями и метастатическими участками с частотой диссонанса от 0 до 45% (46-50).Однако вариации в этих более ранних исследованиях, вероятно, связаны с техническими факторами, такими как низкая чувствительность анализа, количество опухоли в образце и качество ДНК / РНК. Самые последние исследования с использованием секвенирования следующего поколения продемонстрировали высокую степень согласованности (94%) для основных соматических изменений между первичными опухолями легких и соответствующими метастазами (51). Yatabe et al. показали, что факторы, лежащие в основе интерпретации целевых анализов мутаций на основе ПЦР, связаны с сосуществованием амплификации генов, загрязнением нормальной тканью, содержанием опухолевых клеток и чувствительностью анализа, а не с гетерогенностью соматических мутаций (52).
В целом, молекулярное тестирование онкогенных мутаций при аденокарциноме легких на поздней стадии стало стандартом лечения. Таким образом, информация о статусе генной мутации часто может быть включена вместе с гистологической оценкой опухоли в стадию множественных опухолей легких. В 8-м издании руководства по стадированию AJCC подобный паттерн биомаркеров (обычно геномные изменения) рассматривается только как относительный аргумент в пользу единственного источника опухоли, и вместо этого одобряются точно совпадающие точки останова, определенные CGH, как единственное свидетельство клональности.Количество исследований с использованием CGH очень ограничено (15,39). Интересно, что в дополнение к CGH в этих исследованиях также использовались исследования мутаций и морфологические критерии для классификации опухолей как отдельных первичных опухолей или метастазов. У рутинного использования CGH есть несколько ограничений. Во-первых, CGH не является стандартным методом, используемым для генотипирования солидных опухолей в клинической практике, в основном потому, что необходимы большие количества ДНК и не предоставляется информация о потенциально действенных мишенях. Во-вторых, платформы NGS были внедрены во многих клинических лабораториях, которые обеспечивают одновременное обнаружение генных мутаций, изменений числа копий и реаранжировок генов, что делает CGH еще менее желательным методом анализа для повседневной клинической практики.Мерфи и др. предположил, что оценка перестроек ДНК с помощью секвенирования ДНК следующего поколения может быть лучшим подходом в качестве идентификатора клонов, чем однонуклеотидные мутации (53).
В отличие от аденокарциномы легких, молекулярное профилирование плоскоклеточного рака обычно не проводится. Опубликованные исследования, в которых использовались ограниченные генетические панели, в большинстве случаев не продемонстрировали значительного улучшения стадии мультифокальной плоскоклеточной карциномы (16).
Клиническое лечение и исходы мультифокального рака легкого
Клинические рекомендации Американского колледжа грудных врачей рекомендуют визуализацию и методы минимально инвазивной иглы в качестве первого выбора для обнаружения скрытых метастазов средостения и отдаленных метастазов у пациентов с синхронным раздельным первичным раком легкого, а также дополнительных опухолевых узлов (внутрилегочных метастазов) (54,55 ).Лечение определяется на основании гистологической классификации опухолей и стадии (, фиг. 2, ). Пациенты с синхронными независимыми первичными карциномами легких без признаков метастатического поражения, скорее всего, будут рассматриваться для хирургической резекции. База данных IASLC по множественным опухолевым узелкам показала, что почти все узелки с одной долей были удалены хирургическим путем, тогда как контралатеральные узелки — нет (57). Хирургическое лечение пациентов с синхронной первичной карциномой легкого может привести к выживаемости, сравнимой с выживаемостью пациентов с подобранной стадией единичного рака легкого.5-летняя общая выживаемость для хирургически резецированных опухолей в той же доле и без метастазов в лимфатические узлы составляет около 50% (56,58). В целом кажется, что количество опухолевых узлов не влияет на выживаемость, хотя Rao et al. сообщил о тенденции к лучшей выживаемости у пациентов с одиночными дополнительными узелками (59). Меньше данных о выживаемости для хирургически резецированных синхронных узелков, возникающих в различных ипсилатеральных или контралатеральных долях. Nagai et al. сообщил об отсутствии разницы в выживаемости пациентов с множественными узелками, возникающими в одной или в разных долях (60).Совокупные данные опубликованных исследований показывают, что 5-летняя общая выживаемость пациентов на стадии N0 с опухолевыми узелками в другой ипсилатеральной доле составляет около 40% (57). Данные о выживаемости пациентов с узелками контралатеральной опухоли следует интерпретировать с осторожностью, поскольку не все контралатеральные опухоли удаляются. В одном исследовании ограниченная резекция второго контралатерального узла первичного рака легкого не оказала значительного влияния на 5-летнюю выживаемость (61). Обычно считается, что у этих пациентов низкая выживаемость, но их часто не лечат с целью лечения, и, следовательно, влияние операции на выживаемость остается неопределенным.Анализ хирургически резецированного синхронного рака легкого, встречающегося в нескольких долях, показал, что пожилой возраст, мужской пол, метастазы в лимфатические узлы и одностороннее расположение опухоли являются неблагоприятными прогностическими факторами (62). Другой сообщаемый прогностический фактор включает размер опухоли, при этом меньшие опухоли связаны с лучшей выживаемостью (63-65). Следует отметить, что для того, чтобы все эти данные считались надежными, необходимо исходить из того, что классификация множественных первичных раковых заболеваний или внутрилегочных метастазов была точной.
Рисунок 2 Алгоритмический подход к лечению множественных узелков в легких (56).
Выводы
Отличие нескольких биологически несвязанных опухолей первичного рака легких от внутрилегочного метастатического заболевания из одного источника может помочь предсказать исход и направить терапию. Патологоанатомы находятся в авангарде проведения этого различия. Мультифокальный рак легких должен сначала пройти гистологическое исследование на подтипы, чтобы собрать относительные аргументы в пользу или против одного источника опухоли.Другой набор биомаркеров и отсутствие узловых или системных метастазов благоприятствуют биологически не связанным опухолям (отдельные первичные опухоли). И наоборот, тот же паттерн биомаркеров или наличие значительных узловых или системных метастазов дает относительные аргументы в пользу биологически связанных опухолей (внутрилегочные метастазы). Практикующим врачам необходимо тщательно взвесить важность каждой из этих характеристик для каждого отдельного пациента. Абсолютной уверенности относительно того, представляют ли две опухоли отдельные первичные раковые образования или внутрилегочные метастазы, зачастую невозможно.Классификация сложных случаев часто требует многопрофильного обсуждения между радиологами, онкологами, хирургами и патологами.
Благодарности
Нет.
Конфликт интересов: Авторы не заявляют о конфликте интересов.
Список литературы
- Мартини Н, Меламед MR. Множественный первичный рак легких. J. Thorac Cardiovasc Surg 1975; 70: 606-12.[PubMed]
- Thunnissen E, Beasley MB, Borczuk AC, et al. Воспроизводимость гистопатологических подтипов и инвазии при аденокарциноме легких. Международное исследование между наблюдателями. Мод Pathol 2012; 25: 1574-83. [Crossref] [PubMed]
- Ногучи М., Минами Ю., Иидзима Т. и др. Воспроизводимость диагноза малой аденокарциномы легкого и полезность образовательной программы для диагностических критериев. Патол Инт 2005; 55: 8-13. [Crossref] [PubMed]
- AJCC Руководство по стадированию рака.8-е изд. Нью-Йорк: Springer, 2017.
- AJCC Руководство по стадированию рака. 7 изд. Нью-Йорк: Springer, 2010.
- Деттербек ФК, Николсон АГ, Франклин В.А. и др. Проект IASLC по стадированию рака легкого: краткое изложение предложений по пересмотру классификации рака легких с множественными легочными участками поражения в предстоящем восьмом издании классификации TNM. J Thorac Oncol 2016; 11: 639-50.
- Трэвис В.Д., Брамбилла Э., Ногучи М. и др.Международная ассоциация по изучению рака легких / Американское торакальное общество / Европейское респираторное общество: международная мультидисциплинарная классификация аденокарциномы легких: резюме. Proc Am Thorac Soc 2011; 8: 381-5. [Crossref] [PubMed]
- Трэвис В.Д., Брамбилла Э., Берк А.П. и др. редакторы. Классификация опухолей Всемирной организации здравоохранения. Лион: Международное агентство по изучению рака, 2015.
- Варт А., Мули Т., Мейстер М. и др. Новая гистологическая система классификации аденокарциномы легких, созданная Международной ассоциацией по изучению рака легких / Американским торакальным обществом / Европейским респираторным обществом, является независимым от стадии предиктором выживаемости.Дж. Клин Онкол 2012; 30: 1438-46. [Crossref] [PubMed]
- Окада М. Подтипирование аденокарциномы легкого в соответствии с новой классификацией 2011 IASLC / ATS / ERS: корреляция с прогнозом пациента. Клиника торакальной хирургии 2013; 23: 179-86. [Crossref] [PubMed]
- Yoshizawa A, Motoi N, Riely GJ, et al. Влияние предложенной классификации аденокарциномы легкого IASLC / ATS / ERS: прогностические подгруппы и значение для дальнейшего пересмотра стадирования на основе анализа 514 случаев стадии I.Мод Pathol 2011; 24: 653-64. [Crossref] [PubMed]
- Ohtaki Y, Yoshida J, Ishii G, et al. Прогностическое значение твердого компонента при аденокарциноме легких. Ann Thorac Surg 2011; 91: 1051-7. [Crossref] [PubMed]
- Санчес-Мора Н., Пресманес М.С., Монрой В. и др. Микропапиллярная аденокарцинома легкого: особый гистологический подтип с прогностическим значением. Серия кейсов. Хум Патол 2008; 39: 324-30. [Crossref] [PubMed]
- Girard N, Deshpande C, Lau C и др.Комплексная гистологическая оценка помогает отличить множественные первичные немелкоклеточные карциномы легких от метастазов. Am J Surg Pathol 2009; 33: 1752-64. [Crossref] [PubMed]
- Жирар Н., Островная I, Лау С. и др. Геномное и мутационное профилирование для оценки клональных взаимоотношений между множественными немелкоклеточными формами рака легких. Clin Cancer Res 2009; 15: 5184-90. [Crossref] [PubMed]
- Шнайдер Ф., Деррик В., Дэвисон Дж. М. и др. Морфологический и молекулярный подход к синхронным немелкоклеточным карциномам легких: влияние на стадию.Мод Pathol 2016; 29: 735-42. [Crossref] [PubMed]
- Thunnissen E, Noguchi M, Aisner S и др. Воспроизводимость гистопатологического диагноза при низкодифференцированном НМРЛ: международное исследование с участием многих наблюдателей. Дж. Торак Онкол 2014; 9: 1354-62. [Crossref] [PubMed]
- Николсон А., Виола П., Торкко К. и др. Воспроизводимость комплексной гистологической оценки и уточнения гистологических критериев при определении P-стадии множественных опухолевых узлов. J Thorac Oncol 2017; 12: S1131-2.[Crossref]
- Trejo Bittar HE, Incharoen P, Althouse AD и др. Точность гистологического подтипа IASLC / ATS / ERS аденокарциномы легкого I стадии на интраоперационных замороженных срезах. Мод Pathol 2015; 28: 1058-63. [Crossref] [PubMed]
- Yeh YC, Nitadori J, Kadota K и др. Использование замороженного среза для определения гистологических паттернов аденокарциномы легких I стадии
.
.
.

 Слоуна Кеттеринга
Слоуна Кеттеринга