Эхоструктура печени неоднородна — Онлайн медик
Неоднородная структура печени на УЗИ
Такое заключение УЗД исследования, как диффузно-неоднородная структура печени довольно распространенное явление.
Спровоцировать изменения в паренхиме органа способно множество факторов, и не всегда они связаны с развитием какого-то заболевания.
Для проведения полноценной терапии по устранению структурных изменений печени необходимо точно установить, что именно поспособствовало образованию патологии.
Что это представляет собой?
Правильное анатомическое строение железы подразумевает деление органа на правую и левую доли. Помимо этого, правая подразделяется еще на две части.
Тело печени состоит с 8 сегментов, которые имеют обособленное кровоснабжение, иннервацию и отток желчи. Паренхима печени в нормальном анатомическом виде зернистая.
Степень выраженности этой так называемой зернистости и является главным критерием определения состояния железы. Любые изменения структуры печени считаются патологическими отклонениями.
Любые изменения структуры печени считаются патологическими отклонениями.
В норме кровеносные сосуды и желчные протоки во время УЗД исследования не показывают завышенную эхогенность.
Изменения диффузного характера
Исследование поможет вовремя диагностировать структурные изменения тканей.
Если зерна паренхимы увеличены, то это состояние называется диффузная неоднородность. Изменения такого характера без соответствующих мер терапии ведут к полной трансформации ткани.
Патология может возникать вследствие неправильного питания. Паренхима также может видоизменяться при любом негативном влиянии. Если зерна увеличились от внешнего воздействия, то лечение не займет много времени. Печень с неоднородной диффузной структурой часто провоцирует отклонения в работе поджелудочной железы.
Состояние проявляется такими симптомами, как:
- периодический дискомфорт в правом подреберье;
- незначительные быстро проходящие болевые ощущения;
- желтизна белков (редко наблюдается).

Почему возникает неоднородная печень?
Нарушения структуры паренхимы могут быть спровоцированными разными причинами. Очень часто, если повышена эхоструктура печени, то это является последствием развития таких заболеваний, как:
- гепатиты разной этиологии;
- цирроз печени;
- жировой гепатоз;
- тромбоз печеночных вен.
Вредные привычки разрушают печень.
Если исследования показали, что печень умеренно неоднородная, то выделяют такие провоцирующие факторы:
- интоксикация вредными веществами, например, алкоголем;
- воспаление железы;
- неправильное питание, постоянные диеты;
- длительное лечение некоторыми медикаментами;
- нарушение обменных процессов в организме;
- ожирение;
- сахарный диабет.
Мелкозернистая эхоструктура
Здоровая печень имеет выраженную сосудистую сетку и хорошо просматриваемые желчные протоки. Очертание органа четкое, края острые. Железа в нормальном состоянии однородная, гомогенная, мелкозернистая с диаметром воротной вены 8—12 мм.
При отклонении от этого диаметра в большую сторону на 2 мм в комплексе с изменением эхогенности органа, подозревают портальную гипертензию. Причинами формирования высокого давления крови в портальной вене могут быть вирусные поражения, злоупотребление вредными веществами, неправильный рацион.
В случаях когда печень мелкозернистая, но с небольшими изменениями, соответствующее лечение способно все исправить.
Среднезернистая
Неоднородность печени может быть началом серьезной патологии.
Такая патология считается промежуточной фазой между нормальным состоянием железы и началом формирования болезни, когда видоизменения невозможно будет обратить.
Среднезернистая печень образовывается, как следствие неправильного обмена веществ. Железа может быть увеличена в объеме и не иметь четких краев. Для постановки верного диагноза необходимо провести ряд дополнительных исслед
что это значит, симптомы и лечение
Ультразвуковое исследование – один из самых эффективных методов диагностики заболеваний печени.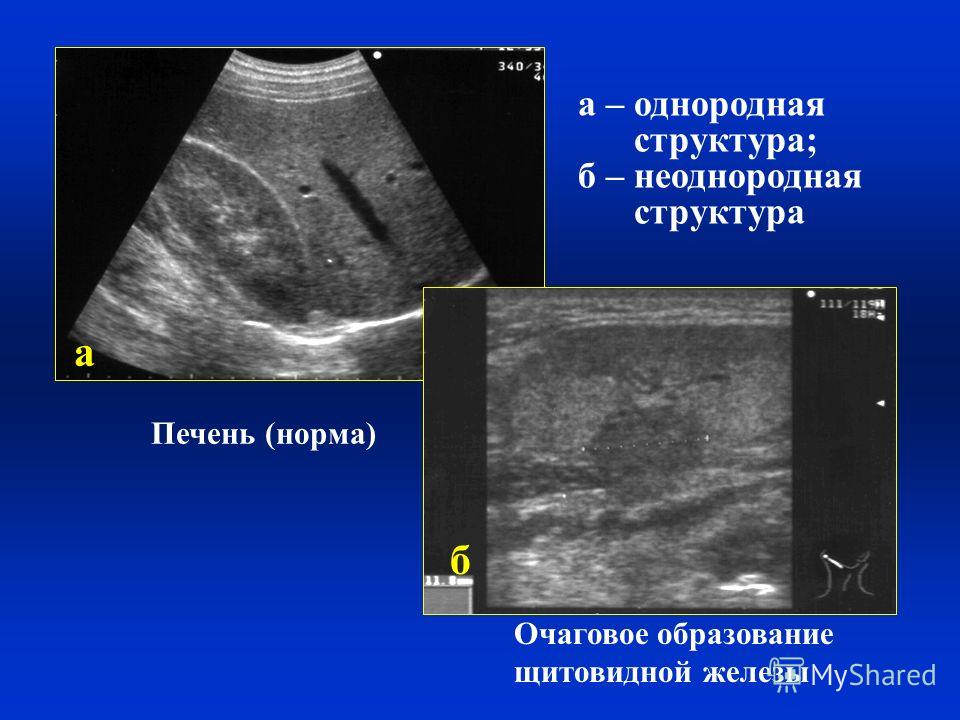 Его информативность позволяет изучить состояние железы и ее кровотока. И если по результатам УЗИ будет обнаружено, что повышенная эхогенность печени, то это серьезный повод для дополнительного обследования и лечения органа.
Его информативность позволяет изучить состояние железы и ее кровотока. И если по результатам УЗИ будет обнаружено, что повышенная эхогенность печени, то это серьезный повод для дополнительного обследования и лечения органа.
Эхогенность – что это такое?
Высокая эффективность УЗИ основана на природных свойствах ультразвуковых волн. С легкостью распространяясь в различных средах, они могут поглощаться или отражаться тканями организма. Поглощение характерно для тканей, содержащих жидкость – чем ее больше, тем более темными они выглядят на экране монитора аппарата УЗИ.
Отражение возможно в том случае, когда на траектории движения волны возникает участок с высоким акустическим сопротивлением. Это может быть какое-нибудь уплотнение с низким содержанием жидкости — конкремент (камень), отложение жира, рубец, опухоль или абсцесс. В этом случае на экране аппарата, изображение исследуемого органа будет иметь светлые участки с повышенной эхогенностью, что указывает на их патологическую природу.
Кроме того, отражение ультразвуковых волн возможно в том случае, когда они достигают границы, разделяющей ткани с разным акустическим сопротивлением. Чем больше эта разница – тем сильнее ответный сигнал, выше эхогенность, а значит светлее участок на экране.
Совершенно черными на экране монитора будут выглядеть ткани с повышенным содержанием жидкости, что указывает на развитие воспалительного процесса, который сопровождается скоплением (застоем) крови, гноя и жидкости.
Таким образом, понятие «эхогенность» означает способность тканей организма поглощать или отражать ультразвуковые волны. Благодаря этой характеристике специалисты могут оценить состояние органа.
Что значит эхогенность печени повышена?
Визуально, на экране аппарата УЗИ, состояние и эхогенность печени может выглядеть следующим образом.
- Светлые участки – патология с повышенной эхогенностью.
- Серые участки (различной интенсивности) – умеренная эхогенность, что свидетельствует о нормальном состоянии органа.

- Очень темные и черные участки – патология с пониженной эхогенностью.
Повышенная эхогенность печени – это не болезнь. Это своеобразный симптом, указывающий на наличие проблем с железой. Причины их возникновения могут быть различны.
Причины повышения эхогенности
В большей части клинических случаев эхогенность печени повышается из-за накопления жира в ее клетках – развивается жировая дистрофия железы. Жир имеет плотную структуру и хорошо отражает звуковые волны. Поэтому на мониторе его накопления сразу заметны, а сама железа выглядит неоднородно.
Среди других причин, вызывающих повышение эхогенности, можно выделить следующие патологии.
- Цирроз печени – структура и цвет органа неоднородны и напоминают мозаику.
- Новообразования – имеют однородную, плотную структуру и будут отчетливо видны на изображении.
- Киста – за счет скопления гноя (жидкость), эхогенность печени будет умерено повышена.
- Холангит – воспаленные и расширенные желчные протоки выглядят светлыми и хорошо заметны.

- Глистные инвазии – изображение будет расплывчатым, с участками здоровой и поврежденной ткани светлого цвета.
При возникновении абсцесса будет наблюдаться пониженная эхогенность печени. Но по мере развития воспалительного процесса, ткань становится неоднородной и степень отражения ультразвука возрастает.
Нередко повышение эхогенности паренхимы печени связано с нарушением обмена веществ или токсическим поражением органа — при злоупотреблении алкоголем или неконтролируемом приеме лекарственных средств. В этом случае структура железы будет неоднородной, с вкраплением светлых участков.
Не стоит забывать и о тесной взаимосвязи поджелудочной железы с печенью. Липоматоз, панкреатит и любые нарушение функций поджелудочной, негативно влияют на состояние печени. Поэтому в ходе проведения УЗИ будет наблюдаться повышенная эхогенность и поджелудочной, и печени.
Симптомы патологии
Наличие и характер симптомов напрямую зависит от основного заболевания, вызвавшего повышение характеристики отражения. Как правило, это типичные для заболеваний печени признаки.
Как правило, это типичные для заболеваний печени признаки.
- Неприятные ощущения в правом подреберье – дискомфорт, боль, распирание, тяжесть.
- Желтушность склер и кожных покровов.
- Горечь во рту.
- Нарушение функций ЖКТ – тошнота, рвота, понос, метеоризм.
- Высыпания и кожный зуд.
- Общее недомогание, беспричинное повышение температуры, слабость.
- Снижение иммунитета.
Печень человека – очень «терпеливый» орган. Долгое время она «может скрывать» свое неудовлетворительное состояние, не болеть и не беспокоить. Поэтому не стоит ждать появления симптомов. Нужно заботиться о своей печени заблаговременно, особенно, когда человек ведет малоподвижный образ жизни, переедает, выпивает спиртные напитки, работает на вредном производстве. Чтобы нейтрализовать влияние негативных факторов, следует чистить свой организм и печень. Для этого необходимо выбирать натуральные средства, с полезными для железы свойствами. Прием натуральных комплексов поможет нормализовать функции печени и защитит ее от поражения.
Диагностика
Ультразвуковое исследование демонстрирует состояние печени в общем. Для полной расшифровки его результатов, пациенту назначают дополнительное обследование — биохимический анализ крови и мочи, МРТ, компьютерная томография и изучают все показатели печени — уровень трасиминазы, билирубина и др. Чтобы исключить или подтвердить онкологию проводят биопсию.
Большое внимание опытные специалисты уделяют сбору анамнеза пациента. Зачастую информация о его пищевых привычках, образе жизни, ранее перенесенных заболеваниях помогает установить точный диагноз и определить причину повышенной эхогенности.
Лечение
Если эхогенность печени повышена, то лечение должно проводиться комплексно и решать следующие задачи.
- Устранение первопричины – для лечения основного заболевания используют медикаментозные препараты.
- Нормализация функций печени – проводят гепапротекторную терапию, в рамках которой ведут прием натуральных средств для оздоровления и улучшения состояния железы.

- Нормализация общего самочувствия пациента – упор делается на очищение и укрепление организма, с целью повышения его защитных функций и работоспособности.
Важно знать! Если лечение было успешным и степень эхогенности в рамках нормы, то это не означает, что печень абсолютно здорова. Скорее всего, структурные изменения ее паренхимы останутся пожизненно, и печень будет нуждаться в поддерживающей терапии.
Методики по очищению печени от токсинов
И здоровая, и перенесшая заболевание печень, нуждается в регулярном очищении. Для его проведения интернет-сообщество предлагает массу методов, большая часть из которых имеет сомнительную эффективность и может навредить организму. Будьте бдительны!
Исключением из множества предложений является нелекарственное средство на натуральной основе Leviron Duo. Входящие в его состав компоненты, обладают гепапротекторным и стабилизирующим действием. Регулярный прием средства помогает нейтрализовать негативное влияние токсических веществ на клетки печени и нормализовать ее функции.
Натуральное средство Leviron Duo принимают согласно инструкции и только после предварительной консультации с лечащим врачом. Прием средства не отменяет основной терапии, а дополняет ее, помогая закрепить полученный в ходе лечения результат.
Диета при повышенной эхогенности печени
Качество и количество употребляемой человеком пищи, напрямую влияет на состояние железы. Поэтому соблюдение диеты – это обязательное условие успешного лечения и последующего поддержания функций печени. Как правило, пациентам назначают диету №5 по Певзнеру и они должны придерживаться следующих рекомендаций питания.
- Дробный прием пищи – маленькие порции, через каждые 2,5 – 3 часа.
- Под запретом жирная, жареная, копченая, консервированная, сладкая, соленая, острая и пряная пища.
- Для термической обработки продуктов питания необходимо использовать варку, запекание или приготовление на пару.
- Допустимое количество жиров в сутки – не более 60 – 70 г, жиры животного происхождения нужно заменить на растительные.

В ежедневном рационе следует отдать предпочтение нежирным сортам мяса и рыбы, крупам, молочным продуктам, овощам, фруктам и сухофруктам. Последний прием пищи – не позднее 19.00.
Видео по теме:
Предыдущая статьяДиффузные изменения печени — признаки и лечениеСледующая статьяЛечение печени — эффективные методики
Диффузно однородная структура печени – Всё о болезнях печени
Печень в организме человека выполняет множество очень важных функций. Это не только участие во всех видах обмена, но и синтез ферментов, белков крови, гормонов. Кроме этого, печеночная ткань является мощной системой детоксикации. При выполнении ультразвуковой диагностики врачи-функционалисты часто пишут в заключении о том, что имеют место диффузные изменения паренхимы печени. Важно понимать, что это не является диагнозом. Эхографическая неодородность, диффузные изменения – состояния, которые являются поводом для углубленного диагностического поиска. Ведь эти ультразвуковые проявления могут быть вызваны как гепатопатиями (заболеваниями описываемого органа), так и проявлениями других системных болезней.
Эхографическая неодородность, диффузные изменения – состояния, которые являются поводом для углубленного диагностического поиска. Ведь эти ультразвуковые проявления могут быть вызваны как гепатопатиями (заболеваниями описываемого органа), так и проявлениями других системных болезней.
Варианты эхо-симптомов при исследовании печени
Для того чтобы понять, какие бывают изменения эхоструктуры печени, нужно определить нормальную ультразвуковую картину при исследовании органа. В первую очередь оценивается показатель эхогенности. Печеночная паренхима имеет пониженную эхогенность. Она обычно сопоставима с показателем почечной ткани. В сравнении с этим показателем врачи визуализирующих методик выставляют степени повышения или понижения эхогенности. Чаще выявляется снижение показателя. Повышенная эхогенность – проявление заболеваний, при которых плотность печени становится больше, чем в норме.
При отсутствии заболеваний самого органа или других систем организма печень сохраняет однородность. Структура может быть мелкозернистой. Неоднородность строения говорит о том, что имеется патология. Чаще всего это заболевания пищеварительного тракта (хронический панкреатит, например).
Структура может быть мелкозернистой. Неоднородность строения говорит о том, что имеется патология. Чаще всего это заболевания пищеварительного тракта (хронический панкреатит, например).
Нередко возможна ситуация, когда диффузно измененная паренхима и очаговые формы изменения структуры печени существуют параллельно. Это могут быть кисты, доброкачественные и злокачественные новообразования печеночной ткани. В печени могут быть выявлены метастатические очаги опухолей.
Что все-таки означает заключение: диффузные неоднородные изменения структуры печени? Для пациента эта фраза ничего не говорит. Однако доктор, к которому с этими данными обратился больной, должен начать диагностический поиск. Ведь диффузные изменения паренхимы печени клинически себя практически ничем не проявляют.
Стеатогепатоз
Этот термин дословно означает «ожирение» печеночной ткани. Эта патология типична при следующих заболеваниях:
- алиментарное и алиментарно-конституциональное ожирение;
- гипоталамический синдром;
- диффузные диабетические изменения ткани печени;
- дислипидемии – патологические состояния с нарушением обмена липидного обмена.

При этих ситуациях орган увеличивается в размерах со временем, а сначала формируются умеренные диффузные изменения печени. Стеатоз органа – необратимая патология. Ее можно контролировать, препятствуя прогрессированию процесса. Это важно, так как жировая дистрофия печеночной ткани приводит к более серьезной проблеме – циррозу.
Какие эхопризнаки диффузных изменений печени типичны при описываемом заболевании?
- Повышенная эхогенность сигнала от органа.
- Печеночный рисунок неоднородный.
- Край органа несколько сглажен, иногда закруглен.
- Воротная вена интактна.
- Печень сама по себе увеличена в размерах (гепатомегалия).
- Регистрируются в большинстве случаев еще и незначительные эхографические признаки диффузных изменений поджелудочной железы.
Рекомендуется определить липидный спектр крови, показатели печеночных функций. Учитывая, что признаки диффузных изменений печени при стеатогепатозе часто вызваны диабетическим поражением, следует проверить уровень сахара, гликозилированного гемоглобина. При необходимости понадобится консультация эндокринолога.
При необходимости понадобится консультация эндокринолога.
Цирроз
При развитии этого синдрома признаки диффузных изменений паренхимы печени носят особенный характер. Структура органа еще более неоднородная, чем при стеатогепатозе. Эхогенность значительно повышается, ведь плотность печеночной ткани становится выраженной.
Стоит отметить, что цирроз – это замещение нормальных функционирующих гепатоцитов соединительнотканными клетками, или фиброз. Это состояние всегда сопровождается уменьшением размеров органа (по типу «сморщивания»).
Судить о сохранности или нарушении печеночной функции по результатам ультразвукового исследования сложно. Ведь эхокартина органа и его резервы не всегда находятся в прямой зависимости. То, насколько сохранены функции печени, зависит от числа оставшихся гепатоцитов. Поэтому даже такие выраженные диффузные заболевания печени, как цирроз, могут протекать в стадии компенсации.
При цирротических изменениях оценивать необходимо прежде всего состояние сосудов. Это касается не только портального кровотока, но и вен кавальной системы.
Это касается не только портального кровотока, но и вен кавальной системы.
- ширина просвета воротной вены при циррозе превышает 15 мм;
- радиус просвета селезеночной вены – 5мм.
Выявление этих признаков говорит о выраженном застое в системе воротной вены. Этот синдром называется портальная гипертензия. При этой ситуации возникает опасность развития кровотечения из вен пищевода, геморроидальных кавернозных сосудов. Печень на начальных этапах увеличена, четко контурируются вены, их диаметр превышает нормативные показатели. Также имеют место диффузные изменения структуры печени.
Для диагностики цирроза необходимо исключить инфекционный генез заболевания. Чаще всего цирроз вызван вирусным гепатитом С, поэтому прежде всего назначается анализ крови на антигены всех вирусных гепатитов. Следующий этап диагностического поиска – исследование функции печени. О ее сохранности свидетельствуют нормальные показатели билирубина, холестерина, печеночных трансаминаз, альбумина, уровня общего белка, а также коагулологических показателей.
Финальный этап – проведение биопсии для оценки степени фиброза. Это важно в прогностическом плане и для определения тактики лечения.
Гепатиты
Гепатитом считается воспалительное заболевание печени. Чаще он может быть вызван инфекционными агентами. Это вирусные гепатиты А,В,С, D. Возможно развитие этого заболевания из-за употребления токсических соединений.
Наиболее распространенный вариант – алкоголизм. Поэтому врачу при получении заключения о признаках диффузного поражения печени нужно обращать пристальное внимание на признаки хронической алкогольной интоксикации:
- Гиперемированное лицо.
- На коже туловище расположены «сосудистые» звездочки или телеангиэктазии, которые представляют собой расширенные капиллярные сосуды.
- Ладони имеют ярко-красный цвет.
- От пациента исходит запах перегара.
- В позе Ромберга пациент неустойчив, походка шаткая.
- Руками больному сложно выполнять сложные и мелкие движения из-за тремора.

Токсический гепатит может быть вызван приемом медикаментов. В этом случае имеет место ятрогенное заболевание (которое вызвано действиями доктора) либо самолечение.
При выполнении ультразвукового исследования эхогенность печени повышена. Ее структура может сохранять однородность. Размеры могут быть увеличенными, но чаще они остаются неизменными.
Патология печени у детей
Дети также подвержены развитию диффузных изменений описываемого органа. Последние связаны с большим количеством причин. Большая их часть связана с заболеваниями других органов и систем.
- Сердечные пороки.
- Функциональная незрелость пищеварительной системы.
- Глистные инвазии и другие протозоозы с нарушением функции печени.
- Прием медикаментов.
- Инфекции различно локализации.
- Нарушение оттока желчи, связанное с атрезией или спазмом сфинктерного аппарата.
- Опухоли первичные или метастатические очаги.
Диффузные изменения печени у ребенка сопровождаются теми же признаками на УЗИ, что и у взрослых пациентов. Но подход к диагностике должен осуществляться с учетом этиологических факторов.
Но подход к диагностике должен осуществляться с учетом этиологических факторов.
Подходы к терапии
При диффузных нарушениях структуры печени лечение во многом зависит от того заболевания, которое их вызвало. Здесь имеется в виду этиотропная терапия. Симптоматическое лечение этого состояния подразумевает устранение беспокоящих жалоб.
Как лечить диффузные изменения печени при стеатогепатозе? Патогенетический подход подразумевает назначение гепатопротекторных средств. Их выбор сегодня очень широк. Предпочтение гастроэнтерологи при назначении отдают гепатопротекторам, включающим в свой состав эссенциальные фосфолипиды. Курс приема должен составлять не менее 3 месяцев. В течение года терапия этими препаратами должна проводиться как минимум дважды.
Лечение гепатитов вирусной этиологии подразумевает использование противовирусной специфической терапии. Гепатопротекторы также необходимы для комплексного лечения.
Важный аспект – соблюдение диетических рекомендаций. Запрещены к приему острые и жареные продукты. Разрешается пища, предусмотренная столом 5 по Певзнеру. Можно есть мясо, особенно нежирные сорта, овощи, фрукты.
Запрещены к приему острые и жареные продукты. Разрешается пища, предусмотренная столом 5 по Певзнеру. Можно есть мясо, особенно нежирные сорта, овощи, фрукты.
Диффузные нарушения структуры печени не являются самостоятельным заболеванием. Поэтому появление этой записи в карточке – не повод пугаться и начинать бесконтрольное лечение. Это означает, что нужно искать причину и корректировать ее.
zpmed.ru
Что такое диффузные изменения паренхимы печени
Этот орган состоит из ткани, которая называется паренхимой. Она образуется преимущественно из печеночных клеток – гепатоцитов, обновляющих старые или погибшие участки ткани. Печень полностью регенерируется примерно за год-полтора. Если в ней обнаруживаются диффузные (то есть затрагивающие весь орган) изменения, то чаще это означает увеличение паренхимной ткани, реже – ее уменьшение. Такие нарушения могут быть как незначительными, так и масштабными.
Такие нарушения могут быть как незначительными, так и масштабными.
Даже банальный грипп не проходит для печени бесследно, но она, как правило, отделывается минимальными изменениями в паренхиме. Другое дело – тяжелые диффузные поражения после гепатита любого вида, хронического алкогольного отравления или лямблиоза. Если в органе начнет расти рубцовая (фиброзная) ткань, он значительно увеличится в объеме и подвергнется необратимым структурным изменениям.
Признаки и симптомы гепатомегалии
Печень долго не сетует на тяжкие условия своего существования. Несчастья органа обнаруживаются лишь случайно во время УЗИ по совсем другим жалобам пациента. Часто наблюдается увеличение печени – гепатомегалия, вследствие которой структура органа начинает деградировать. Плотность паренхимы становится повышенной, а ее эхогенность многократно превышает норму, то есть ультразвук отражается от паренхимы с гораздо большей скоростью.
При диффузных изменениях увеличенный орган легко обнаруживается пальпацией, причем эта диагностическая процедура доставляет пациенту боль. Если же такие изменения протекают не в острой форме, человек может ее не испытывать. Но по мере прогрессирования патологии симптомы гепатомегалии становятся все очевиднее. Появляются:
- изжога;
- дурной запах изо рта;
- тошнота;
- желтый оттенок, зуд кожи;
- асцит (жидкость в брюшной полости).
Злоупотребление алкоголем, жирной пищей вызывает уплотнение паренхимы печени. Вирусные инфекции, паразиты тоже влекут за собой частичные, диффузно-очаговые изменения в ней. Однако они могут спровоцировать развитие опухолей. При гепатитах эхографические признаки диффузных изменений печени нередко выражены слабо, хотя орган уже существенно увеличен. Дальше – больше. При циррозе происходят тотальные диффузные изменения ткани печени. Неоднородных участков – масса, и эхогенность паренхимы печени повышена максимально.
Умеренной
Признаки незначительной деградации печени встречаются часто. Если они появились в ней, то имеются и в поджелудочной железе. Наличие умеренных диффузных поражений в печени УЗИ-диагност определяет по повышенной плотности ткани, неоднородности ее структуры, искажению рисунка сосудов. Уплотнение паренхимы и другие эхопризнаки патологии могут проявляться через ощущение дискомфорта после жирной еды, привкус горечи во рту, головные боли, быструю утомляемость, раздражительность.
По типу жирового гепатоза
На нарушения обмена веществ, интоксикацию организма печень реагирует весьма своеобразно: ее клетки накапливают жир. Со временем развивается стеатоз или жировая инфильтрация, попросту – ожирение органа. Болезнь коварна тем, что лишена симптоматики и зачастую выявляется случайно при ультразвуковом исследовании брюшной полости. Иногда человек ощущает подташнивание, слабость, усталость, сонливость. Потом в его движениях может появиться заторможенность, а в речи – монотонность. Еще позже человека настигают желтуха, асцит, головокружения, судороги.
Потом в его движениях может появиться заторможенность, а в речи – монотонность. Еще позже человека настигают желтуха, асцит, головокружения, судороги.
Реактивных изменений паренхимы печени у ребенка
Функциональная незрелость желудка и кишечника у детей, токсическое воздействие глистов нередко приводят к развитию реактивного гепатита, то есть вызванного не патологиями печени. Этот недуг или не имеет симптомов, или проявляется слабым недомоганием, расстройствами пищеварения, субфебрильной температурой, эмоциональным спадом. При адекватном лечении диффузных отклонений можно восстановить деятельность печени полностью.
Выраженных диффузных изменений
Когда отравление печени различными ядами настолько сильно, что она уже не способна их нейтрализовать, начинается ее распад – цирроз. Если на ранних этапах диффузно-очагового перерождения орган увеличивается в объеме, то на поздней стадии он уменьшается и сморщивается. Эхоструктура его диффузно-неоднородна, а эхогенность очень высока. Пациента неотступно преследуют боли в правом подреберье и правом плече, язык, склеры и кожа под глазами у него – желтушного цвета.
Эхоструктура его диффузно-неоднородна, а эхогенность очень высока. Пациента неотступно преследуют боли в правом подреберье и правом плече, язык, склеры и кожа под глазами у него – желтушного цвета.
Методы лечения
Основное лечение диффузных поражений в печени состоит прежде всего в ликвидации их причин: ожирения, злоупотребления алкоголем, приема токсичных для этого органа лекарств и т.п. Улучшают состояние органа аминокислоты, витамины Е и группы В. Чтобы печеночные клетки восстанавливались, гепатологи (или терапевты) назначают препараты:
- Эссенциале форте Н;
- Фосфоглив;
- ФанДетокс;
- Гептрал;
- Резалют Про;
- Гепабене.
По показаниям проводят курсы лечения антибиотиками, противовирусными, противоглистными и желчегонными препаратами. Оперативные методы лечения применяют при необходимости удаления камней, опухолей в печени. Больным назначается диетический стол №5 с запретом жирных, острых и копченых продуктов. Соленая, сладкая, кислая пища, алкоголь и газировка тоже запрещены. Приоритет отдается постным сортам мяса и рыбы в отварном виде, молочным блюдам и супам, кашам и овощам.
Больным назначается диетический стол №5 с запретом жирных, острых и копченых продуктов. Соленая, сладкая, кислая пища, алкоголь и газировка тоже запрещены. Приоритет отдается постным сортам мяса и рыбы в отварном виде, молочным блюдам и супам, кашам и овощам.
sovets.net
Структура печени – это строение ее внутренней соединительной ткани, из которой образована строма (скелет). Она делит основу печени на сотни тысяч мельчайших долек. Каждая долька, по своей форме напоминает призму с шестью гранями. Между ними расположено множество кровеносных сосудов – капилляров, а также желчные протоки.
Длина каждой дольки от 1,5 до 2 мм, а ширина – от 1 до 1,2 мм. Их заполняют гепатоциты – клетки печени, окружающие центральную вену. Гепатоциты собраны в пластинки, толщина которых равна размеру одной клетки. Они образуют ветвистые соединения, которые от центральной вены радиально расходятся к периферии. Между ними остаются небольшие щели, которые называются синусоидами. Они наполнены кровью, которая поступает к ним из печеночной артерии и разветвленной воротной вены. В самих дольках происходит образование желчи, которая через систему канальцев поступает в желчный проток.
Они наполнены кровью, которая поступает к ним из печеночной артерии и разветвленной воротной вены. В самих дольках происходит образование желчи, которая через систему канальцев поступает в желчный проток.
Желчный проток, печеночная артерия и все ветви воротной вены находятся вблизи наружной границы печеночной дольки, неподалеку друг от друга. Поэтому их называют портальной (входной) триадой. Часть соединительной ткани, расположенной вокруг портальной триады, состоит из примыкающих к ней секторов нескольких долек, в состав которых входят волокна нервных окончаний и лимфа сосуды. Эта часть называется ацинусом. В одном ацинусе находится до двадцати гепатоцитов. Поэтому, на снимках при ультразвуковом обследовании, можно увидеть, что структура печени – зернистая.
У здорового человека, при нормальном функционировании, на фоне соединительной ткани можно визуально увидеть желчевыводящие протоки и сеть сосудов в виде трубочек, диаметр самых мелких ветвей которых – всего 1 мм. При этом если печень находится в нормальном состоянии, воротная вена имеет диаметр ствола от 8 до 12 мм, а структура печени – мелкозернистая. Если же он увеличен в диаметре и превышает 14 мм, это означает начало гипертензии портальной.
При этом если печень находится в нормальном состоянии, воротная вена имеет диаметр ствола от 8 до 12 мм, а структура печени – мелкозернистая. Если же он увеличен в диаметре и превышает 14 мм, это означает начало гипертензии портальной.
Она характеризуется набухшей, дряблой консистенцией соединительной ткани, более бледной ее окраской, появлением большого количества капель белкового происхождения или увеличением количества зерен в цитоплазме. Обычно это свидетельствует о заболеваниях инвазионного или инфекционного характера, интоксикации организма и прочих факторах. Нередко к этому приводит неполноценное питание. Надо отметить, что изменение структуры печени – процесс обратимый. Как только будут устранены причины, вызывающие нарушение нормального функционирования такого жизненно важного органа, и приводящие к изменениям в строении его тканей, таким как неоднородная структура печени, все опять придет в норму.
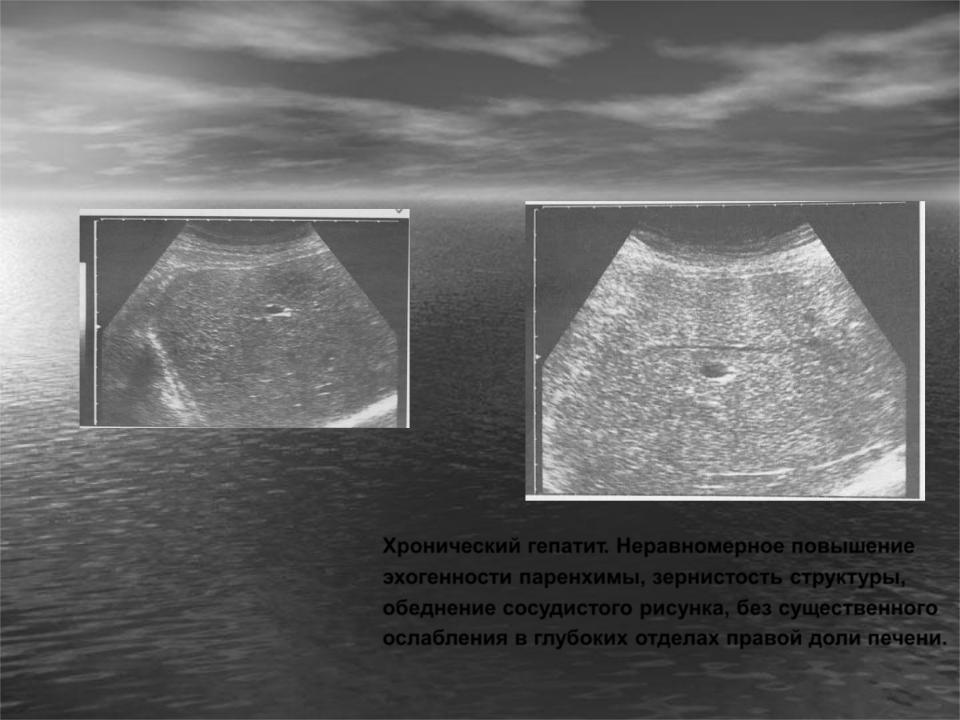
Очень часто гепатиты различного происхождения (вирусные, алкогольные), а также нарушения обменных процессов, такие как ожирение, сахарный диабет приводят к тому, что печень увеличивается в размерах, а ее ткань изменяет свою структуру, например, увеличиваются лимфатические узлы. При этом во время УЗИ хорошо видна среднезернистая структура печени. Но на основании только одних этих изменений трудно поставить правильный диагноз и выявить причину их возникновения. Поэтому, в большинстве случаев, проводятся дополнительные исследования.
При этом во время УЗИ хорошо видна среднезернистая структура печени. Но на основании только одних этих изменений трудно поставить правильный диагноз и выявить причину их возникновения. Поэтому, в большинстве случаев, проводятся дополнительные исследования.
Более четкое перерождение ткани печени, приводящее к снижению ее основных функций, прослеживается во время ультразвукового исследования при циррозе печени. При этом отчетливо видны все неровности ее контура. На них появляются бугорки разных размеров. Хорошо заметно, что структура печени – диффузно-неоднородная. Это может быть вызвано непроходимостью желчных протоков, дистрофией или инфильтрацией печеночных клеток, уменьшением или увеличением соединительной ткани.
Существует ряд и других признаков, указывающих на происхождение того или иного заболевания, вызывающего перерождение соединительной ткани печени, и вызывающее изменение ее структуры. По состоянию структуры печени можно судить о характере и причинах той или иной болезни, на какой стадии развития она находиться, а также выбрать оптимальные методы лечения. Но для этого должно быть проведено полное обследование, с использованием различных методов исследования.
Но для этого должно быть проведено полное обследование, с использованием различных методов исследования.
gepaten.ru
Диффузные изменения паренхимы печени
Ткань печени имеет однородную структуру со слабой плотностью. При диффузных изменениях паренхимы в печени во время ультразвукового исследования в тканях печени просматриваются кровеносные сосуды с желчными протоками, плотность которых повышена.
Диффузные изменения печени указывают на полное изменение ткани печени, которые могут быть связаны как с серьезными патологиями, так и с незначительными функциональными нарушениями в работе органа.
Степень отека паренхимы печени зависит от выраженности воспалительного процесса. При диффузных изменениях могут наблюдаться следующие заболевания: ожирение, цирроз печени, сахарный диабет, алкоголизм, опухоли, хронический гепатит, кистозные образования.
Также не исключаются паразиты или вирусная инфекция, неправильное питание.
Начавшиеся диффузные изменения печени могут спровоцировать головную боль, тошноту, слабость, горечь во рту, частую смену настроения, раздражительность.
Диффузные изменения структуры печени
Диффузные изменения печени выявляются на УЗИ. Изменение структуры может начаться не только в результате первичных заболеваний печени, но и при патологиях, не связанных с органом. К примеру, при сахарном диабете может возникнуть нарушение белкового обмена и появится отложения в печени.
В этом случае доли печени увеличиваются в размере, также повышается плотность органа, в более глубоких слоях структура органа теряет однородность.
Неоднородная структура может просматриваться как небольшие или крупные участки разной плотности с патологическими продуктами обмена (белки, углеводы).
Диффузные изменения тканей печени
При любых негативных влияниях на печень происходят изменения в диффузной ткани органа. Такие изменения могут спровоцировать алкогольная зависимость, курение, лекарства, наследственные аномалии, а также вирусы и бактерии.
Нередко диффузные изменения печени выявляются в сочетании с заболеваниями поджелудочной, поскольку у этих органов связаны протоки.
Диффузно неоднородные изменения структуры печени
Диффузные изменения печени, при которых появляется неоднородность ткани, могут быть связаны с непроходимостью протоков желчного пузыря, разрастанием либо уменьшением соединительной ткани, скоплением в клетках печени каких-либо веществ.
При неоднородности печени, как правило, диагностируют цирроз, кальцинаты, обструкцию вен печени, гепатит, нарушение метаболизма (при ожирении или сахарном диабете).
Довольно часто при неоднородной структуре тканей возникают бугорки, уменьшается или увеличивается соединительная ткань, не исключается дистрофия клеток печени, протоков желчи.
Причины изменения ткани могут быть связаны, как уже говорилось, с неполноценным, нездоровым питанием, злоупотреблением спиртным и пр.
Большинство патологических состояний печени выявляются на ультразвуковом исследовании.
Для назначения лечения требуется установление основного диагноза, который стал причиной диффузных изменений печени.
Печень является уникальным органом человека, имеющим способность самовосстанавливаться, но необратимые последствия приводят к серьезным нарушениям в работе органа.
Диффузно дистрофические изменения печени
Диффузные изменения печени происходят в результате отрицательного воздействия на организм из-за неправильного питания, заболеваний или других нарушений нормальной работы органов и систем.
Дистрофические изменения приводят к сильному подавлению печеночной функции. Причиной таких изменений становятся острые или хронические заболевания органа.
В большинстве случаев дистрофические изменения диффузной ткани происходят из-за вируса гепатита. В некоторых случаях к таким поражениям приводят отравления (грибами, нитратами и т.д.), применение галотана, атофана.
Также к такому рода изменениям может привести цирроз печени, нецелесообразное применение диуретиков, снотворных или успокоительных средств.
Диффузные изменения стенок протоков печени
Печень состоит из долек, в центре которых проходят вены и желчные протоки. Протоки необходимы для сбора выработанной желчи, они проходят через всю печень и имеют замкнутые концы.
Протоки необходимы для сбора выработанной желчи, они проходят через всю печень и имеют замкнутые концы.
Диффузные изменения печени затрагивают весь орган, включая стенки протоков печени. Изменения стенок протоков происходят в основном по тем же причинам, что и в остальной ткани органа (вирусы, бактерии, нездоровая пища и пр.).
Диффузные изменения печени при хроническом холецистите
Диффузные изменения печени при хроническом холецистите возникают довольно часто.
При хроническом холецистите в желчном пузыре наблюдается длительный воспалительный процесс, временами с обострениями. Заболевание всегда является вторичным, которое развивается в результате дискинезии желчевыводящих путей или врожденных патологий. От холецистита чаще страдают женщины (в пять раз), особенно со светлыми волосами и склонные к полноте.
Диффузные изменения печени при гепатомегалии
Гепатомегалия – это патологическое увеличение печени. Самой распространенной причиной данного состояния является отравление токсинами или ядовитыми веществами.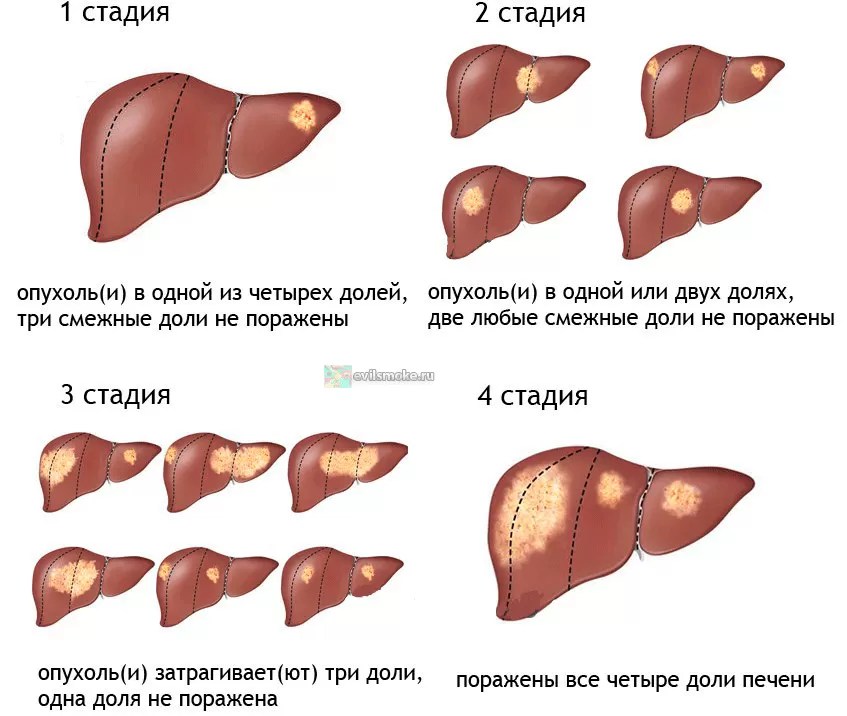 Диффузные изменения печени в этом случае поражают полностью все ткани, при этом орган легко прощупывается под ребрами (при здоровой печени прощупать орган крайне тяжело).
Диффузные изменения печени в этом случае поражают полностью все ткани, при этом орган легко прощупывается под ребрами (при здоровой печени прощупать орган крайне тяжело).
Кроме того, при надавливании чувствуется боль, что также указывает на нарушение работы печени. Гепатомегалию не считают самостоятельным заболеванием, специалисты относят данное состояние к симптому, который указывает на необходимость срочно лечить печень.
Печень осуществляет разрушение и обезвреживание токсических и ядовитых веществ, который попадают в организм. Проходя сквозь печень, токсины выводятся из организма нейтрализованными.
Диффузные реактивные изменения печени
Диффузные изменения печени иногда носят реактивный характер, другими словами, при нарушении работы печени наблюдается реакция поджелудочной, которая выражается реактивным панкреатитом.
Такое заключение при ультразвуковом исследовании позволяет с большой долей вероятности исключить новообразования, опухоли, камни и пр. Также ультразвук показывает очаговые поражения плотности ткани.
Также ультразвук показывает очаговые поражения плотности ткани.
Диффузные изменения не являются диагнозом, они указывают только на необходимость дополнительного обследования.
Диффузно очаговые изменения печени
Диффузные изменения печени поражают весь орган. Во время УЗИ врач диагностирует изменение ткани по всей поверхности печени.При очаговых поражениях органа изменения затрагивают отдельные участки печени, другими словами, УЗИ выявляет на нормальной ткани печени очаги изменения.
При диффузно-очаговых изменениях врач выявляет на пораженной ткани печени отдельные очаги, которые имеют отличие от диффузных. Такого рода изменения встречаются при гепатите сопровождающегося метастазированием или абсцессом.
Диффузные изменения печени у ребенка
Диффузные изменения печени могут произойти в результате врожденных патологий (недоразвитости). Также причиной может стать заболевание гепатитом во время беременности (обычно в таких случаях назначается прерывание беременности).
Изменения в печени у ребенка могут начаться на фоне лечения антибиотиками, которые являются крайне токсичными препаратами, а организм малыша недостаточно крепкий и сформировавшийся.
Диффузные изменения печени у новорожденного
Диффузные изменения печени у новорожденных часто возникают в результате врожденных аномалий.
Также на печень новорожденного могут повлиять заболевания матери во время беременности, лекарственные препараты (особенно антибиотики).
При обнаружении диффузных изменений печени у новорожденного, в первую очередь, следует провести дополнительное обследование (анализ крови, мочи), при необходимости назначается биохимический анализ крови, биопсия, лапароскопия.
ilive.com.ua
Диффузные изменения печени
Слабоэхогенная однородная структура печёночной ткани – это норма. В данном случае должны быть заметны кровеносные сосуды и желчные протоки, которые имеют повышенную эхогенность. Если произошли диффузные изменения паренхимы печени, то это ведёт к полному изменению ткани печени. Подобные изменения могут свидетельствовать как о незначительных функциональных изменениях, так и об очень тяжёлых поражениях, при которых печёночная ткань будет представлять собой высокую эхогенную структуру. Чтобы определить степень изменений, необходимы дополнительные лабораторные исследования печени, желчевыводящих путей, двенадцатиперстной кишки, поджелудочной железы. Может возникнуть необходимость обследовать и остальные органы пищеварения.
Изменениям в паренхиме печени могут способствовать некоторые заболевания, среди которых жировая дистрофия, алкогольный гепатит любого типа, разные обменные болезни печени. Жировое перерождение печени ведёт к увеличению её размеров и повышению эхогенности структур. Если изменения незначительные, то это похоже на хронический гепатит, возникающий по многочисленным причинам, включая вирусные инфекции и алкоголизм. Чтобы установить истинную причину заболевания, необходимы тщательные дополнительные исследования.
Диффузные изменения паренхимы печени возможно обнаружить ультразвуковым методом исследования. Они возникают не только при первичной болезни печени, но и при некоторых патологических внепечёночных изменениях. Например, сахарный диабет может привести к амилоидозу печени. В данном случае при эхографии размеры всех долей печени будут увеличены, эхогенность ткани печени также увеличена, но в глубоких отделах будет наблюдается затухание, проявляться неоднородность структуры в виде увеличения зернистости изображения, будет происходить незначительное сглаживание рисунка сосудов. Также при таких патологических изменениях, как гемосидероз, галактоземия, болезнь Виллибранта, метаболические нарушения и т. д. имеют место неспецифические изменения в эхографической картине. Это прежде всего формирование неоднородной структуры паренхимы. Неоднородность проявляется в виде крупных или мелких участков пониженной и повышенной эхогенности. На таких участках можно обнаружить скопления патологических продуктов обмена, к которым относятся углеводы, гликогеноиды, белки и т. д. В некоторых случаях обязательно проводится дифференциальная диагностика с множеством мелкоочаговых поражений печени. Тем не менее наиболее успешно решить этот вопрос позволяет пункционная биопсия. Ультразвуковое исследование — это кропотливый и глубокий процесс, требующий больших знаний в области физиологии, анатомии и ультразвукового исследования печени. В последнее время возможности дифференциальной диагностики расширены и углублены, благодаря совершенствованию ультразвуковой аппаратуры. Тем не менее уровень ультразвукового оборудования не всегда является достаточным для постановки точного диагноза. В таком случае необходимы дальнейшие исследования диффузных заболеваний паренхимы.
Рекомендуем: Лечебное питание, диетические столы. Калькулятор калорий
Полезная информация о печени
3.7 / 6
Новые (1)
Роман Ильич Бураховский30.07 02:18
Всем хорошего здоровья! Довольно таки грамотно описана тема заболевания печени! Но хочу добавить также что нужно ввести предмет здорового способа жизни во всех социальных сферах. И конечно же все прежде всего зависит от культуры человека! Хочу дать всем совет не злоупотреблять жареной и жирной пищей! И у кого есть дети, обязательно отведите их на консультацию к думающему!!! мануальному терапевту !!!Всем удачи и крепкого здоровья !
otvet.mail.ru
Важно знать!
Гепатит лечится простым народным средством, просто утром натощак… Читать далее »
Source: gepasoft.ru
Эхоструктура печени: виды и лечение
Содержание материала
Печень – важный орган, который, в человеческом организме, взял на себя роль защитника. Это фильтр, пропускающий через себя «врагов», тем самым защищая здоровье человека.
Именно печень берет на себя функцию обезвреживания токсинов. Она участвует в процессе синтеза, процессе обмена и соединения плазмы, холестерина, гормонов и желчи. Вместе с этим – это самый уязвимый орган.
Причины диффузных изменений
Диффузия представляет собой цепочку, с помощью которой происходит обмен между молекулами и атомами. Этот процесс позволяет выровнять количество тел в той или иной области. При этом если существует вероятность какого-либо негативного влияния, то такая цепочка нарушается, и конечно в соответствии с таким изменениями нарушается скорость, равновесие и плотность частиц и веществ.
Диффузный процесс это не только процесс в природе, но и в человеческом организме. Выражается он в слаженной работе между органами. При этом если происходит сбой или в процесс вмешивается негативный фактор, то соответственно изменяется и диффузия, в сторону отклонения от нормы, как в структуре, так и в слаженной работе между всеми органами системы ЖКТ. Такие изменения могут иметь разный характер – от незначительных изменений до развития патологии.
Важно! Изменение могут наблюдаться при отклонении от нормы размера паренхимы, от и ровности краев органа и равномерности распределения паренхимы по нему
Диффузное изменение может быть не только у людей преклонного возраста, но и у младенцев. При этом если речь идет о младенцах, то признаки диффузии у них расцениваются при врожденных аномалиях. У детей, более старших – исключительно при перенесении желтухи, или после отравления.
Причинами изменения печени могут быть:
- Ведение нездорового образа жизни, в том числе – плохое питание, пренебрежение советами диетологов, употребление пива и крепких спиртных напитков, курение и т.д.
- При внутриутробном формировании.
- Прием наркотиков.
- Отравления.
- Наличие паразитов, вирусов и бактерий.
Виды структурных изменений печени
Орган имеет особое строение соединительной ткани. Она выстилает орган по всей его поверхности, тем самым визуально, разделяет его на части – дольки. При этом, такие дольки-грани между собой выстилают желчные протоки и сосуды.
Если у человека нет проблем с печенью, размеры его печени будут в норме, вместе с ее параметрами – ровными краями, и т.д. Другими словами ее структура будет иметь мелкозернистость.
Мелкозернистая эхоструктура
Так как в организме человека печень – наиболее большой из органов, на него и возложена функция содействовать и обеспечивать непрерывность жизненно-важных процессов. В частности – участие в метаболическом процессе, в процессе пищеварения, кроветворения, фильтрации и т.д. Вес печени – 1,5 кг (у взрослых). Формирование печени закладывается во внутриутробный период. В нормальном состоянии, то есть без развития патологи и иных процессов, печень имеет стандартные показатели краев, контура и т.д. Такое состояние принято считать мелкозернистой структурой органа.
Такой вид изменений как мелкозернистость, может наблюдаться исключительно у здорового человека. При этом эхограмма показывает сосуды и систему протоков желчи. При помощи современной аппаратуры, при мелкозернистой структуре просматриваются капилляры около 0,1 см.
К сведению! Структура печени здорового человека имеет ровный и четкий контур, строение органа – гомогенное, располагается портальная вена, которая пересекает ее по периферии, наблюдается мелкозернистая структура.
Среднезернистая
Среднезернистая структура касается изменения – увеличения лимфатического узла. Это последствие развития диабета, при нарушенном обмене веществ, при вирусных болезнях или алкогольном гепатите.
Крупнозернистая
Если структура крупнозернистая, то присутствует разной этиологии гепатит. При этом может быть нарушен метаболизм, развиваться диабет или ожирение. Также крупнозернистость наблюдается на фоне алкогольного поражения органа. Обнаружить данную патологию можно посредством УЗИ, при этом может быть изменен размер лимфатических узлов, негативная трансформация структуры в органе. Как правило, такая картина – это еще не диагноз, а только предпосылки к нему.
Неоднородная
Такое изменение развивается при трансформации ткани. Это ведет к циррозу. Параллельно могут быть непроходимы желчные протоки и развиваться дистрофия гепатоцитов, которые замещаются фиброзной тканью. Возникает она на фоне нерационального приема препаратов, при различных диетах или ожирении, часто – при развитии гепатита.
Интересный факт! Неоднородная структуру возникает из-за нарушения в организме. В частности – плохое кровообращение, которое влияет на структуру и размер печени.
В чем опасность?
Любое изменение в органе влечет за собой серьезные последствия. Если все в начальной стадии, то просто может быть накопление жиров в органе, перерождаются ткани и нарушается стабильная работа печени. Конечно, такие последствия не вызывают опасений.
С другой стороны, на первоначальном этапе, может повышать давление в воротниковой вене. А это ведет к развитию цирроза, варикоза в других венах, что становиться катализатором кровотечений и летальных исходов. Как показывают статистические данные, около 30 % летальных исходов, имели свое начало именно с повышенного давления, на которое никто не обращал внимание.
Не менее страшный из осложнений – асцит. Он представляет собой скопление жидкости в отделе живота, который перерастает в перитонит. Как следствие – кровь не очищается от токсинов, а они негативно воздействуют на нервную систему. Все это дает толчок к развитию энцефалопатии, а она – кому.
Развенчиваем мифы! Печень очень важный и чувствительный орган, который фильтрует кровь и выполняет ряд процессов в организме человека. Однако часто, люди заблуждаются, считая, что проблемы с печенью, могут быть только у лиц, любящих алкоголь. Действительно, алкоголь негативно влияет на организм, особенно если его прием неконтролируем и чрезмерен. Однако орган подвержен негативному влиянию и, казалось бы, у здоровых людей. Речь идет о неалкогольных жировых болезнях.
Как проводится диагностика?
Диффузные изменения в органе возникают как аномалии развития в утробном периоде. Диагностировать их можно при проведении УЗИ. При этом исследовании специалист может обратить внимание на размер органа, который говорит о развитии недугов или перерождении жировых клеток.
Благодаря УЗИ, врач может предположить о развитии болезней в органе, в частности измерить эхогенность, структуру, проницаемость и т.д. Только на основании показателей УЗИ ставиться вердикт – диффузное изменение печени. Под этим термином кроется множество недугов. Чтобы исключить или подтвердить необходимо провести дополнительные исследования – рентгенографию, почечные пробы, биохимические исследования и т.д. При этом, биохимический анализ определяет уровень повреждения органа, а также симптоматику цитолиза или холестаза.
Лечение
В зависимости от того, что будет обнаружено при проведении клинических исследований, будет подбираться схема лечения. Так, при незначительных изменениях назначают терапию, направленную на восстановление печеночной системы (препараты гепатохилин, гепар эссенциале).
При умеренных изменениях к терапии присоединят антибактериальные препараты, антибиотики и витамины в компоненте с десенсебилизирующими средствами.
При изменениях вирусной этиологии назначают противовирусные средства, в тяжелом случае подключают гормональную «артиллерию» с аминогликозидными средствами.
При паразитарной форме изменений включают в терапию противоглистовые препараты, витаминные комплексы и гепатопротекторы.
Профилактика
Профилактические мероприятия предполагают искоренение негативных факторов, то есть:
- Ведение правильного образа жизни, с сохранением физической активности и правильной системы питания.
- Минимизация и полный отказ от вредных привычек.
- Соблюдение правил личной гигиены.
- Соблюдение половой гигиены.
К сожалению, не все меры безопасности могут защитить от повреждений печени, так как существует высокий риск влияния иных негативных факторов с внешней среды.
История, биологические системы и отрасли
Физиология — это изучение нормального функционирования живых существ. Это подраздел биологии, охватывающий ряд тем, включая органы, анатомию, клетки, биологические соединения и то, как все они взаимодействуют, чтобы сделать жизнь возможной.
От древних теорий до молекулярных лабораторных методов физиологические исследования сформировали наше понимание компонентов нашего тела, того, как они общаются и как они поддерживают нашу жизнь.
Мерриан-Вебстер определяет физиологию как:
«[A] раздел биологии, который имеет дело с функциями и деятельностью жизни или живого вещества (например, органов, тканей или клеток), а также с соответствующими физическими и химическими явлениями. ”
Быстрые факты по физиологии
Вот несколько ключевых моментов о физиологии. Более подробная и вспомогательная информация находится в основной статье.
- Физиологию можно рассматривать как исследование функций и процессов, которые создают жизнь.
- Изучение физиологии восходит к 420 г. до н.э.
- Изучение физиологии разделено на множество дисциплин, охватывающих такие разные темы, как упражнения, эволюция и защита.
Поделиться на PinterestФизиология охватывает множество дисциплин в биологии человека и за ее пределами.
Изучение физиологии — это в некотором смысле изучение жизни. Он задает вопросы о внутреннем устройстве организмов и о том, как они взаимодействуют с окружающим миром.
Физиология проверяет, как работают органы и системы в организме, как они общаются и как они объединяют свои усилия для создания условий, благоприятных для выживания.
В частности, физиология человека часто разделяется на подкатегории; эти темы охватывают огромное количество информации.
Исследователи в этой области могут сосредоточиться на чем угодно, от микроскопических органелл в клеточной физиологии до более широких тем, таких как экофизиология, изучающая целые организмы и то, как они адаптируются к окружающей среде.
Наиболее актуальное направление физиологических исследований для Медицинские новости Сегодня — это прикладная физиология человека; в этой области исследуются биологические системы на уровне клетки, органа, системы, анатомии, организма и повсюду между ними.
В этой статье мы посетим некоторые разделы физиологии, разработав краткий обзор этой огромной темы. Сначала мы рассмотрим краткую историю физиологии.
Изучение физиологии уходит корнями в древнюю Индию и Египет.
Как медицинская дисциплина, она восходит к временам Гиппократа, знаменитого «отца медицины» — около 420 г. до н.э.
Гиппократ придумал теорию четырех жидкостей, утверждая, что тело содержит четыре различных телесных жидкости: черную желчь, мокроту, кровь и желтую желчь.Согласно теории, любое нарушение их соотношения ведет к ухудшению здоровья.
Клавдий Гален (около 130-200 гг. Н.э.), также известный как Гален, модифицировал теорию Гиппократа и был первым, кто использовал эксперименты для получения информации о системах организма. Его широко называют основоположником экспериментальной физиологии.
Жан Фернель (1497-1558), французский врач, первым ввел термин «физиология» из древнегреческого, означающего «изучение природы, происхождения».
Фернел был также первым, кто описал позвоночный канал (пространство в позвоночнике, через которое проходит спинной мозг).У него есть кратер на Луне, названный в его честь за его усилия — он называется Фернелиус.
Еще один скачок в физиологических знаниях произошел с публикацией книги Уильяма Харви под названием Анатомическая диссертация о движении сердца и крови у животных в 1628 году.
Харви был первым, кто описал системное кровообращение и путь крови через мозг и тело, движимые сердцем.
Возможно, удивительно, но большая часть медицинской практики была основана на использовании четырех жидкостей вплоть до 1800-х годов (например, кровопускание).В 1838 году произошел сдвиг в мышлении, когда на сцену вышла клеточная теория Матиаса Шлейдена и Теодора Шванна, предполагавшая, что тело состоит из крошечных отдельных клеток.
С этого момента область физиологии открылась, и прогресс был быстрым:
- Джозеф Листер, 1858 — первоначально изучал коагуляцию и воспаление после травмы, затем он открыл и начал использовать спасающие жизнь антисептики.
- Иван Павлов, 1891 — условные физиологические реакции у собак.
- Август Крог, 1910 г. — получил Нобелевскую премию за открытие, как регулируется кровоток в капиллярах.
- Эндрю Хаксли и Алан Ходжкин, 1952 — открыли ионный механизм, с помощью которого передаются нервные импульсы.
- Эндрю Хаксли и Хью Хаксли, 1954 — добились успехов в изучении мускулов, открыв скользящие нити в скелетных мышцах.
Основные системы, охваченные изучением физиологии человека, следующие:
- Система кровообращения — включая сердце, кровеносные сосуды, свойства крови и то, как работает кровообращение при болезни и здоровье.
- Пищеварительная / выделительная система — отображение движения твердых тел изо рта в задний проход; это включает исследование селезенки, печени и поджелудочной железы, превращение пищи в топливо и ее окончательный выход из организма.
- Эндокринная система — исследование эндокринных гормонов, передающих сигналы по всему организму, помогая ему согласованно реагировать. Основные эндокринные железы — гипофиз, щитовидная железа, надпочечники, поджелудочная железа, паращитовидные железы и гонады — находятся в центре внимания, но почти все органы вырабатывают эндокринные гормоны.
- Иммунная система — естественная система защиты организма состоит из лейкоцитов, тимуса и лимфатической системы. Сложный набор рецепторов и молекул объединяется, чтобы защитить хозяина от атак патогенов. Молекулы, такие как антитела и цитокины, сильно отличаются.
- Покровная система — кожа, волосы, ногти, потовые и сальные железы (выделяющие маслянистое или восковое вещество).
- Костно-мышечная система — скелет и мышцы, сухожилия, связки и хрящи.Костный мозг — место, где образуются красные кровяные тельца — и то, как кости хранят кальций и фосфат, также включены.
- Нервная система — центральная нервная система (головной и спинной мозг) и периферическая нервная система. Изучение нервной системы включает исследование органов чувств, памяти, эмоций, движений и мыслей.
- Почечная / мочевая система — включая почки, мочеточники, мочевой пузырь и уретру, эта система удаляет воду из крови, производит мочу и уносит отходы.
- Репродуктивная система — состоит из гонад и половых органов. Изучение этой системы также включает изучение того, как плод создается и воспитывается в течение 9 месяцев.
- Дыхательная система — состоит из носа, носоглотки, трахеи и легких. Эта система вводит кислород и удаляет углекислый газ и воду.
Существует множество дисциплин, в названии которых используется слово физиология. Ниже приведены некоторые примеры:
- Физиология клетки — изучение того, как клетки работают и взаимодействуют; физиология клетки в основном сосредоточена на мембранном транспорте и передаче нейронов.
- Системная физиология — основное внимание уделяется вычислительному и математическому моделированию сложных биологических систем. Он пытается описать способ, которым отдельные ячейки или компоненты системы сходятся, чтобы реагировать в целом. Они часто исследуют метаболические сети и передачу сигналов клеток.
- Эволюционная физиология — изучение того, как системы или части систем адаптировались и изменялись на протяжении нескольких поколений. Темы исследований охватывают множество вопросов, включая роль поведения в эволюции, половой отбор и физиологические изменения в зависимости от географических особенностей.
- Физиология защиты — изменения, происходящие в ответ на потенциальную угрозу, например, подготовка к ответной реакции «бей или беги».
- Физиология упражнений — как следует из названия, это исследование физиологии физических упражнений. Это включает исследования в области биоэнергетики, биохимии, сердечно-легочной функции, биомеханики, гематологии, физиологии скелетных мышц, нейроэндокринной функции и функции нервной системы.
Упомянутые выше темы — это лишь небольшая часть доступных физиологий.Область физиологии столь же важна, сколь и обширна.
Анатомия тесно связана с физиологией. Анатомия относится к изучению структуры частей тела, но физиология фокусируется на том, как эти части работают и связаны друг с другом.
Определение, где это происходит, процесс и типы
Гематопоэз — это производство всех клеточных компонентов крови и плазмы крови. Это происходит в кроветворной системе, которая включает органы и ткани, такие как костный мозг, печень и селезенку.
Проще говоря, гемопоэз — это процесс, посредством которого организм производит клетки крови. Он начинается на ранней стадии развития эмбриона, задолго до рождения, и продолжается на протяжении всей жизни человека.
Краткие сведения о гемопоэзе:
Кровь состоит из более чем 10 различных типов клеток. Каждый из этих типов клеток попадает в одну из трех широких категорий:
1. Красные кровяные тельца (эритроциты) : они переносят кислород и гемоглобин по всему телу.
2. Лейкоциты (лейкоциты) : Они поддерживают иммунную систему. Существует несколько различных типов лейкоцитов:
- Лимфоциты : включая Т-клетки и В-клетки, которые помогают бороться с некоторыми вирусами и опухолями.
- Нейтрофилы : Помогают бороться с бактериальными и грибковыми инфекциями.
- Эозинофилы : они играют роль в воспалительной реакции и помогают бороться с некоторыми паразитами.
- Базофилы : они высвобождают гистамины, необходимые для воспалительной реакции.
- Макрофаги : они поглощают и переваривают мусор, включая бактерии.
3. Тромбоциты (тромбоциты) : помогают крови свертываться.
Текущие исследования подтверждают теорию гемопоэза, называемую монофилетической теорией. Эта теория утверждает, что один тип стволовых клеток производит все типы клеток крови.
Кроветворение происходит во многих местах:
Кроветворение в эмбрионе
Кроветворение в эмбрионе, которое иногда называют примитивным кроветворением, продуцирует только красные кровяные тельца, которые могут обеспечивать развивающиеся органы кислородом.На этой стадии развития желточный мешок, который питает эмбрион до полного развития плаценты, контролирует кроветворение.
По мере того, как эмбрион продолжает развиваться, процесс кроветворения перемещается в печень, селезенку и костный мозг и начинает продуцировать другие типы клеток крови.
У взрослых кроветворение эритроцитов и тромбоцитов происходит главным образом в костном мозге. У младенцев и детей он также может продолжаться в селезенке и печени.
Лимфатическая система, в частности селезенка, лимфатические узлы и тимус, вырабатывает белые кровяные тельца, называемые лимфоцитами.Ткани печени, селезенки, лимфатических узлов и некоторых других органов производят другой тип белых кровяных телец, называемых моноцитами.
Процесс гемопоэза
Скорость кроветворения зависит от потребностей организма. Организм постоянно производит новые клетки крови, чтобы заменить старые. Ежедневно необходимо заменять около 1 процента кровяных телец.
Белые кровяные тельца имеют самую короткую продолжительность жизни, иногда от нескольких часов до нескольких дней, в то время как эритроциты могут длиться до 120 дней или около того.
Процесс гемопоэза начинается с неспециализированных стволовых клеток. Эта стволовая клетка размножается, и некоторые из этих новых клеток трансформируются в клетки-предшественники. Это клетки, которым суждено стать определенным типом клеток крови, но они еще не полностью развиты. Однако эти незрелые клетки вскоре делятся и созревают на компоненты крови, такие как красные и белые кровяные тельца или тромбоциты.
Хотя исследователи понимают основы гематопоэза, продолжаются научные дебаты о том, как образуются стволовые клетки, которые играют роль в гематопоэзе.
Каждый тип кровяных клеток проходит несколько разный путь кроветворения. Все начинаются со стволовых клеток, называемых мультипотентными гемопоэтическими стволовыми клетками (HSC). Отсюда гемопоэз следует двумя разными путями.
Трехлинейный гемопоэз относится к производству трех типов клеток крови: тромбоцитов, эритроцитов и лейкоцитов. Каждая из этих клеток начинается с трансформации HSC в клетки, называемые общими миелоидными предшественниками (CMP).
После этого процесс немного меняется.На каждой стадии процесса клетки-предшественники становятся более организованными:
Эритроциты и тромбоциты
- Эритроциты : клетки CMP изменяются пять раз, прежде чем окончательно превратиться в эритроциты, также известные как эритроциты.
- Тромбоциты : клетки CMP трансформируются в три различных типа клеток, прежде чем стать тромбоцитами.
Белые кровяные тельца
Существует несколько типов белых кровяных телец, каждый из которых следует своим путем в процессе кроветворения.Все белые кровяные тельца первоначально трансформируются из клеток CMP в миобласты. После этого процесс выглядит следующим образом:
- Прежде чем стать нейтрофилом, эозинофилом или базофилом, миобласт проходит еще четыре стадии развития.
- Чтобы стать макрофагом, миобласт должен трансформироваться еще три раза.
Второй путь гемопоэза продуцирует Т- и В-клетки.
Т-клетки и В-клетки
Для производства лимфоцитов МНС трансформируются в клетки, называемые обычными лимфоидными предшественниками, которые затем становятся лимфобластами.Лимфобласты дифференцируются в борющиеся с инфекцией Т-клетки и В-клетки. Некоторые В-клетки дифференцируются в плазматические клетки после контакта с инфекцией.
Некоторые заболевания крови могут влиять на здоровые клетки крови в крови, даже если происходит кроветворение.
Например, рак белых кровяных телец, такой как лейкемия и лимфома, может изменять количество белых кровяных телец в кровотоке. Опухоли в кроветворной ткани, которая производит клетки крови, например в костном мозге, могут влиять на количество клеток крови.
В процессе старения увеличивается количество жира в костном мозге. Это увеличение жира может затруднить выработку костным мозгом клеток крови. Если организм нуждается в дополнительных клетках крови из-за болезни, костный мозг не может опередить эту потребность. Это может вызвать анемию, которая возникает, когда в крови не хватает гемоглобина из красных кровяных телец.
Гематопоэз — это постоянный процесс, который производит огромное количество клеток. Оценки различаются, и точное количество ячеек зависит от индивидуальных потребностей.Но в обычный день организм может производить 200 миллиардов эритроцитов, 10 миллионов лейкоцитов и 400 миллиардов тромбоцитов.
Границы | Медицина печени нового поколения с использованием моделей органоидов
Введение
Распространенность заболеваний печени растет, и на них ежегодно приходится около 2 миллионов смертей во всем мире (Asrani et al., 2019). Этиология хронических заболеваний печени многофакторна и варьируется в зависимости от географического положения (Zhou et al., 2014). Основные причины включают хронические вирусные инфекции (гепатиты B и C), чрезмерное употребление алкоголя, ожирение, жировую болезнь печени и стеатогепатит, наследственные заболевания (болезнь Вильсона, нарушения накопления, гепаторенальная тирозинемия и т. Д.), Аутоиммунные заболевания печени, лекарственные препараты. заболевания печени, а также злокачественные новообразования и идиопатические причины (Zhou et al., 2014).
На сегодняшний день для расшифровки молекулярных механизмов развития и патогенеза печени используются различные культуры клеток и животные.Среди них обычные двумерные (2D) культуры клеток имеют несколько ограничений, особенно для длительного и стабильного размножения. Кроме того, двумерные первичные культуры гепатоцитов не могут воспроизводить ключевые аспекты ткани печени человека, в частности, сложную архитектуру и клеточную гетерогенность (Duval et al., 2017; Rowe and Daley, 2019). Более того, в этих клетках часто отсутствуют взаимодействия клетка-клетка и клетка-внеклеточный матрикс (ВКМ), которые необходимы для поддержания фенотипов in situ, и биологических функций, а также тканеспецифических клеточных процессов (Baxter et al., 2015; Duval et al., 2017). Кроме того, первичные гепатоциты имеют ограниченную способность к делению при выращивании в 2D-культурах и быстро теряют характерные для печени паттерны и функции экспрессии генов, такие как синтез ингибиторов свертывания (Boost et al., 2007), поддержание стабильного цитохрома P450 (Darnell et al. ., 2012; Костадинова и др., 2013) и лигирование интегринов (Meli et al., 2012) через несколько недель после посева (Clayton, Darnell, 1983; Bissell et al., 1987; Mitaka, Ooe, 2010). .
С тех пор, как была разработана технология индуцированных плюрипотентных стволовых клеток (ИПСК), создание гепатоцитов с помощью протоколов ступенчатой дифференцировки, имитирующих органогенез in vivo , стало легко осуществимым в 2D-культурах (Takahashi et al., 2007; Си-Тайеб и др., 2010b; Чен и др., 2012; Hannan et al., 2013). В этих протоколах обычно используются комбинации факторов роста / цитокинов, чтобы повторить развитие эмбриональной печени в условиях культивирования in vitro . Тем не менее гепатоциты, полученные с помощью этих протоколов дифференцировки, значительно различаются по уровню своего созревания и в большинстве случаев представляют собой незрелые гепатоциты. Кроме того, они не обладают способностью расширяться в течение длительного времени в монослойной культуре, отчасти из-за отсутствия тканеспецифической архитектуры, механических и биохимических сигналов и межклеточной коммуникации в 2D-условиях (Pampaloni et al., 2007; Луо и др., 2018).
Животные модели также могут быть использованы при изучении патологий печени. Подавляющее большинство этих моделей имеют функциональные сосудистые, стромальные и иммунные компоненты, предлагая многочисленные преимущества по сравнению с 2D-культурами. Однако для разработки моделей животных требуются ресурсоемкие и трудоемкие процессы. Кроме того, физиологические и геномные межвидовые различия в моделях на животных создают ограничения в представлении фенотипов заболеваний и прогнозировании результатов исследований, таких как лекарственный ответ (Mariotti et al., 2018).
Органоиды просто определяются как системы трехмерных культур клеток, которые имитируют структурные и функциональные характеристики представляемого органа. Это определение относится к сборке органоспецифических типов клеток, которые развиваются из плюрипотентных стволовых клеток / органных стволовых клеток / клеток-предшественников, и их самоорганизации посредством сортировки клеток и пространственно ограниченного клонирования, подобно процессу развития in vivo (Lancaster, Knoblich, 2014; Clevers, 2016; Fatehullah et al., 2016). Органоидные структуры могут стабильно поддерживаться в долгосрочных культурах in vitro , продолжая отражать, даже после многих поколений, in vivo характеристики ткани происхождения без каких-либо значительных генетических или физиологических изменений (Huch et al., 2015 ; Акбари и др., 2019). В процессе культивирования органоидов, часто тканеспецифичным образом, используется ряд факторов роста и небольших молекул для регулирования сигнальных путей, которые необходимы для самообновления, дифференциации и пролиферации органоидов.В настоящее время широко используются два основных подхода к успешному формированию органоидов с использованием определенных биохимических факторов в надлежащей трехмерной матрице. Первый подход основан на дифференцировке плюрипотентных стволовых клеток (ПСК), которые затем самоорганизуются с образованием тканеспецифичных органоидов, таких как глазной стакан (Eiraku et al., 2011; Nakano et al., 2012; Kuwahara et al. ., 2015; Eldred et al., 2018), мозг (Lancaster et al., 2013; Pas̨ca et al., 2015), кишечник (Spence et al., 2011), поджелудочная железа (Greggio et al., 2013), печень (Takebe et al., 2013; Sampaziotis et al., 2015; Guan et al., 2017; Lee et al., 2018; Akbari et al., 2019; Koike et al., 2019), легкое (Dye et al., 2015), предстательная железа (Drost et al., 2016), почка (Takasato et al., 2015) и кровеносный сосуд (Wimmer et al., 2019). Второй подход основан на получении функциональных органоидов из тканеспецифических стволовых клеток или клеток-предшественников взрослых / плода / детей, которые сохраняют в нормальных и поврежденных условиях регенеративную способность определенных тканей.Эти типы органоидов также были установлены из различных тканей, включая кишечник (Ootani et al., 2009; Sato et al., 2009), желудок (Barker et al., 2010), печень (Huch et al., 2015; Hu et al., al., 2018), почки (Schutgens et al., 2019), кожи (Boonekamp et al., 2019) и поджелудочной железы (Huch et al., 2013a; Boj et al., 2015).
Печень
Структура и функции
Печень, самый большой орган в организме, выполняет жизненно важные метаболические, экзокринные и эндокринные функции. Помимо производства желчи и регуляции метаболизма гликолита, мочевины и холестерина, печень способствует детоксикации крови и регулирует гомеостаз крови, в частности, путем секреции факторов свертывания и белков сыворотки, таких как альбумин (Gordillo et al., 2015; Стангер, 2015). Доля печени, состоящая из разнородных типов клеток, является наименьшей структурной единицей печени. Метаболически он делится на разные структурные зоны и функциональные организации (Kietzmann, 2017). Гепатоциты являются основным типом паренхиматозных клеток долек печени, составляя около 70% от общей массы взрослого органа. Гепатоциты и холангиоциты (другой тип эпителиальных клеток печени) происходят из эмбриональной энтодермы, тогда как непаренхимные клетки печени, такие как стромальные клетки, звездчатые клетки, клетки Купфера и кровеносные сосуды, имеют мезодермальное происхождение (Gordillo и другие., 2015; Стангер, 2015). Последние передовые технологии, в частности секвенирование одноклеточной РНК, позволили идентифицировать существование резидентных эпителиальных предшественников печени взрослого человека и картировать гетерогенность стволовых / предшественников в печени. Эти новые идеи послужили убедительными ориентирами для углубления понимания биологии и физиологии печени (Aizarani et al., 2019).
Органогенез печени
Главный принцип технологии органоидов печени — повторение основных фаз органогенеза в блюде.Поэтому понимание последовательных событий и регуляторных факторов в развитии печени имеет решающее значение (Tremblay and Zaret, 2005; Si-Tayeb et al., 2010a; Fiorotto et al., 2018). Во время гаструляции бластула сначала дает энтодерму (один из трех первичных зародышевых листков), которая в дальнейшем формируется в дискретные домены органов в передней, средней и задней кишках. Затем зачаток печени формируется из энтодермы передней кишки путем индукции сигналов Activin / Nodal, WNT, FGF и BMP (Douarin, 1975; Gualdi et al., 1996; Юнг и др., 1999; Камия и др., 1999; Росси и др., 2001; Зарет, 2002; D’Amour et al., 2005; Han et al., 2011). После образования этой структуры гепатобласты подвергаются расширению и дифференцировке, давая как гепатоциты, так и желчный эпителий, в то время как соседняя мезодермальная мезенхима способствует образованию фибробластов и звездчатых клеток печени. Затем нормальная структура ткани печени завершается дальнейшим созреванием гепатоцитов и холангиоцитов и клеточной интеграцией мезенхимы и эндотелия (Tremblay and Zaret, 2005).
Органоидные модели
3D-модели органоидов печени, полученные на основе ИПСК
Органоиды печени
Генерация органоидов печени из iPCS была впервые предложена Takebe и его коллегами с использованием элегантной модели совместного культивирования. В этой модели печеночные предшественники получали путем ступенчатой дифференцировки от ИПСК в условиях 2D-культивирования клеток и затем совместно культивировали с мезенхимальными стволовыми клетками человека (МСК) и эндотелиальными клетками пупочной вены человека (HUVEC). Впоследствии макроскопически видимые трехмерные агрегаты, называемые iPSC-зачатками печени (LB), были спонтанно продуцированы в культуре, залитой матригелем.Более того, структуры сосудистой сети человека в iPSC-LB стали функциональными, подключившись к сосудам хозяина после трансплантации. В частности, клетки печени в приживленных зачатках печени начали секретировать альбумин в кровоток мыши-реципиента с 10 по 45 день после трансплантации. Что еще более важно, эти структуры зачатков органов продемонстрировали способность регенерировать и восстанавливать вызванную лекарствами летальную печеночную недостаточность (Takebe et al., 2013). В последующем исследовании секвенирование одноклеточной РНК выявило паттерны экспрессии генов, уникальные для идентичности клонов, и облегчило идентификацию гетерогенных и динамических популяций клеток во время дифференцировки от плюрипотентности до зачатка печени (Camp et al., 2017; Поттер, 2018). После этих усилий по созданию функционального зачатка печени человека многие исследовательские группы разработали различные протоколы для получения различных типов органоидов печени, полученных из плюрипотентных стволовых клеток. Некоторые из важных протоколов в этой области представлены на Рисунке 1.
Рис. 1. Ключевые протоколы для создания трехмерных культур органоидов печени на основе ИПСК. FCS, плодная телячья сыворотка; 3D, трехмерный; FGF, фактор роста фибробластов; TGF, трансформирующий фактор роста; Р-СПО, Р-Спондин; EGF, эпидермальный фактор роста; HGF, фактор роста гепатоцитов; CM, условия среднего; FACS, Сортировка клеток по флуоресценции; EpCAM, молекула адгезии эпителиальных клеток; ИПСК, индуцированная плюрипотентная стволовая клетка; BMP, костный морфогенетический белок; ME, мезоэндодерма; HP, Печеночный прародитель; KGF, фактор роста кератиноцитов; HB, гепатобласт; HCM, среда для культивирования гепатоцитов; OSM, Онкостатин М; H / C, гепатоцит / холангиоцит; Декс, Дексаметазон; ИТС, инсулин-трансферрин-селен; DE, Definitive Endoderm; FG, передняя кишка; FP, прародитель передней кишки; CP, предшественник холангиоцитов.
Guan et al. (2017) недавно установили производные ИПСК печеночные органоиды (Hep-org), окруженные структурами протоков холангиоцитов, в течение примерно 50–60 дней. К сожалению, когда эти органоиды достигли критического размера, что затруднило получение достаточного количества питательных веществ и кислорода, их способность к размножению и регенерации значительно снизилась. Этот недостаток был преодолен путем диссоциации органоидов на отдельные клетки, а затем их репликации и преобразования в матригеле (Guan et al., 2017). Недавно был описан новый протокол для создания органоидов на основе плюрипотентных стволовых клеток человека (hPSC) с гепатобилиарной структурой. Органоиды демонстрируют сигнатуры экспрессии печеночных генов и ключевые функциональные характеристики холангиоцитов in vitro и выживают более 8 недель после трансплантации иммунодефицитным мышам (Wu et al., 2019).
Недавно мы описали быстрый и высокоэффективный протокол для производства органоидов печени человека, полученных из ИПСК.Наше исследование показало, что обогащение клеток адгезии эпителиальных клеток (EpCAM) -положительных клеток приводит к гомогенной популяции энтодермальных клеток и разрешает дифференцировку функциональных гепатоцитов. Кроме того, R-Spondin улучшил спецификацию EpCAM-положительных промежуточных клеток энтодермы в этой культуральной системе (Akbari et al., 2019). Более того, только EpCAM-положительные энтодермальные клетки, а не EpCAM-отрицательные клетки, обладали способностью образовывать органоиды печени. Наши результаты полностью согласуются с предыдущими исследованиями, показывающими, что EpCAM демонстрирует динамический паттерн экспрессии генов во время развития печени и что EpCAM-положительные клетки способны давать начало компартментам печени (Schmelzer et al., 2007; Танака и др., 2009; Лу и др., 2013). Кроме того, наше исследование показало, что эти производные из энтодермы печеночные органоиды (получившие название eHEPO) могут быть продуцированы за 14 дней и размножены более чем на 1 год без какой-либо значительной потери эффективности культивирования (Akbari et al., 2019). Аналогичным образом, анализ характеристик in vitro и показал, что eHEPO могут иметь морфологию эпителия и псевдостратифицированную структуру. Одним из ключевых аспектов этого метода было сохранение клеточного состава и морфологической структуры eHEPO как в молодых, так и в старых органоидах.Более того, анализ профилей экспрессии генов выявил переход от плюрипотентности к зрелым гепатоцитам. Наконец, eHEPO демонстрируют функциональные характеристики зрелых гепатоцитов in vitro , эффективно прививаются в печень мыши и экспрессируют человеческий ALB на 32 день после внутриселезеночной инъекции (Akbari et al., 2019). Совсем недавно был разработан революционный метод установления целостной многоорганной структуры. Во-первых, передний и задний сфероиды кишечника были отдельно дифференцированы от ИПСК.После этого передний сфероид был перенесен на соседний задний сфероид. Со временем эти сферы слились и инвагинировали как взаимосвязанный мультиорган. В целом, этот метод продемонстрировал, что переднезаднее взаимодействие воспроизводит границу передней и средней кишки in vitro , даже в отсутствие внешних факторов (Koike et al., 2019).
Органоиды холангиоцитов
Другой тип органоидов, которые демонстрируют характеристики и функции холангиоцитов, был разработан и использован несколькими исследовательскими группами для специального изучения физиологии желчных протоков и холангиопатий.Впервые Dianat et al. (2014) успешно создали холангиоцитоподобные клетки (CLC), полученные из ИПСК, в трехмерной культуре. Эти клетки обнаруживают структурное и функциональное сходство с первичными холангиоцитами, например образование ресничек и ответ на гормональную стимуляцию. Сходным образом, CLCs способны транспортировать Rhodamine 123 в просвет с помощью трансмембраны с множественной лекарственной устойчивостью 1 (MDR1), другого свойства физиологически функциональных холангиоцитов (Dianat et al., 2014). Затем, объединив двухмерные монослойные и трехмерные системы культивирования, Огава и его коллеги создали органоиды холангиоцитов (Chol-org) из hPSCs.В этом методе использовались сигналы развития холангиоцитов для создания самоорганизованной структуры, подобной желчным протокам. Судьба холангиоцитов была достигнута с помощью 3D совместного культивирования гепатобластов со стромальными клетками OP9 в присутствии гормонов роста. В данном случае белок NOTCH, секретируемый клетками OP9, использовали для имитации передачи сигналов JAG1 / Notch и стимулирования развития и спецификации холангиоцитов. Холангиоциты демонстрируют морфологию ветвления и профили экспрессии генов, связанных с холангиоцитами. Кроме того, эти клетки утратили экспрессию гепатобластов и маркеров гепатоцитов, таких как альфа-фетопротеин (AFP) и альбумин.Анализ транспортной активности и тест на опухоль кисты, вызванный форсколином, подтвердили функциональность этих холангиоцитов (Ogawa et al., 2015). Другой подход, разработанный Sampaziotis et al. (2015) продемонстрировали, что Chol-org может быть получен из холангиоцитов-предшественников, происходящих из гепатобластов, с использованием FGF10, активина A, ретиноевой кислоты и EGF. Эти Chol-org продемонстрировали функциональные свойства холангиоцитов, такие как активность щелочной фосфатазы и гамма-глутамил-транспептидазы, а также поглощение и экспорт желчных кислот (Sampaziotis et al., 2015, 2017). Кроме того, использование ламинина в качестве матрицы увеличивает количество и диаметр кист, а также экспрессию маркерных генов холангиоцитов, полученных из ИПСК (Takayama et al., 2016).
3D-модели органоидов печени, полученные из взрослых стволовых клеток
Печень демонстрирует замечательную регенеративную способность (Michalopoulos, 2010; Hindley et al., 2014; Stanger, 2015). Однако типы клеток, участвующих в гомеостазе и регенерации печени после повреждения, четко не определены. Ранее было показано, что Sox9-позитивные клетки (овальные клетки) вблизи желчного протока участвуют в регенеративной реакции печени после массивного повреждения (Furuyama et al., 2011). Такие результаты находятся в тесном согласии с другими исследованиями, которые подчеркнули вклад эпителиальных клеток желчных путей в регенеративный ответ печени (Dorrell et al., 2011; Espanol-Suner et al., 2012). Аналогичным образом, результаты этих исследований согласуются с другими выводами, демонстрирующими, что удаление печеночных предшественников нарушает регенерацию печени (Shin et al., 2015). В совокупности эти находки указывают на то, что стволовые клетки / клетки-предшественники печени сохраняют способность образовывать паренхиму печени in vivo и органоиды in vitro .
Имеющиеся данные свидетельствуют о том, что Lgr5-положительные клетки-предшественники не присутствуют в здоровой взрослой печени и поджелудочной железе (Huch et al., 2013b), но, скорее, они активируются при химическом повреждении и становятся обнаруживаемыми вблизи желчных протоков печени. . Было показано, что свежевыделенные фрагменты здоровых желчных протоков и, что более интересно, Lgr5-положительные одиночные клетки, выделенные из печени мышей, могут давать 3D органоиды. Эти бипотентные эпителиальные органоиды печени могут быть дифференцированы в зрелые и функциональные гепатоциты in vitro и могут спасать печеночную недостаточность у мутантной мыши по фумарилацетоацетатгидролазе ( Fah — / -), модели тирозинемии типа I заболевания печени, после трансплантации (Huch и другие., 2013b; Broutier et al., 2016). Кроме того, группа Clevers адаптировала протокол органоидов печени мышей для культивирования бипотентных стволовых клеток из печени взрослого человека (Huch et al., 2015). Они продемонстрировали, что EpCAM-положительные единичные клетки человека из области протока или даже из его фрагментов могут развиваться в органоиды клонального эпителия печени. Эти органоиды могут генерировать функциональные гепатоциты после дифференцировки in vitro и приживления в паренхиме печени-реципиента мыши in vivo .Исследование также показало, что органоиды были генетически стабильными в долгоживущих культурах, характеризуясь низким количеством единичных основных изменений, большинство из которых, вероятно, были включены до или во время образования органоидов, но не во время культивирования (Huch et al., 2015) . Хотя модель Хуча элегантно продемонстрировала, что протоковые предшественники обладают способностью генерировать гепатоциты в определенных условиях культивирования, а Рэйвен и его сотрудники недавно показали, что нарушение гепатоцеллюлярной регенерации во время повреждения печени может вызвать протоковую реакцию и образование гепатоцитов негепатоцитарного происхождения (Raven и другие., 2017), продолжаются споры в отношении исследований, которые продемонстрировали, что большая часть регенеративного ответа после повреждения печени зависит в первую очередь от гепатоцитов, а не стволовых клеток (Grompe, 2014). В частности, исследования по отслеживанию клонов на мышах предоставили подтверждающие доказательства того, что только гепатоциты участвовали в регенерации печени после повреждения (Schaub et al., 2014; Yanger et al., 2014). Передача сигналов Wnt от эндотелиальных клеток печени может влиять на гомеостатическое самообновление гепатоцитов.Специализированные Axin2-положительные клетки, локализованные в перицентральной доле печени, были ранее идентифицированы как источник предшественников этой гомеостатической реакции (Wang et al., 2015). Экспрессия раннего маркера-предшественника печени ТВХ3 в этих типах клеток подтвердила наличие популяции зрелых и предшественников клеток во взрослой печени. Сходным образом перипортальные и гибридные гепатоциты с низкими уровнями экспрессии SOX9 восполняли массу печени после хронического повреждения (Font-Burgada et al., 2015). Соответственно, группа Clevers недавно установила новую модель органоида, происходящую из одного зрелого Axin2-позитивного гепатоцита.Их исследование показало, что сигнальные пути Wnt / Rspo1 и HGF были основными регуляторами роста первичных гепатоцитов как в моделях органоидов у мышей, так и у людей. Такой подход способствовал росту органоидов печени из одного гепатоцита непосредственно после переваривания коллагеназы. Здесь как неповрежденные гепатоциты, так и гепатоциты из физически поврежденной печени (частичная гепатэктомия, PHx) были использованы для производства органоидов печени мышей. Эти органоиды отображают ключевые функциональные характеристики и профили экспрессии генов гепатоцитов.Кроме того, анализ обогащения набора генов (GSEA) органоидов, полученных из PHx, показал, что профили экспрессии генов органоидов печени мыши напоминают профили экспрессии генов пролиферирующих гепатоцитов после PHx. Соответственно, органоиды печени воспроизводили регенеративную реакцию печени взрослых на частичную гепатэктомию. Образцы печени плода и взрослого человека также использовались для образования органоидов в том же исследовании. По сравнению с органоидами печени взрослых доноров органоиды из печени плода показали более высокую способность к расширению.Одной из причин нарушения роста органоидов печени взрослых может быть ограниченная по своей природе активность фермента теломеразы (Hu et al., 2018). Более того, низкое количество холангиоцитов внутри органоидов печени и транс-дифференцировка Hep-org в Chol-org при культивировании в среде холангиоцитов (Huch et al., 2015) является признаком образования de novo желчных протоков после частичного образования желчных протоков. резекция. Органоиды печени в этом исследовании отличались от более ранних моделей Chol-org с точки зрения размера клеток, соотношения ядро / цитоплазма, субклеточной структуры и функции и профилей экспрессии генов.Это критическое различие можно объяснить клеткой происхождения органоидов. Органоиды печени произошли из гепатоцитов, Chol-org были разработаны из EpCAM-положительных клеток-предшественников. Более того, с точки зрения функциональности in vivo то же исследование показало, что органоиды способны приживаться и повторно заселяться в печени мышей с иммунодефицитом (Hu et al., 2018).
Сложное взаимодействие между гепатоцитами, плазмой и другими резидентными клетками печени играет ключевую роль в поддержании функций печени и регулировании регенеративных реакций.Аутокринные сигналы от гепатоцитов (VEGF, TGF-α), паракринные сигналы от звездчатых клеток (HGF) (Michalopoulos, 2007) и воспалительные цитокины от клеток Купфера (IL-6 и TNF-α) необходимы для запуска успешной регенеративной реакции печени. . Peng et al. (2018) недавно показали, что TNF-α будет способствовать размножению гепатоцитов мыши в условиях 3D-культивирования in vitro . Кроме того, эти клетки смогли прижиться и заселиться в печени мышей Fah — / -. На основании этих результатов можно сделать вывод, что этот подход потенциально может быть интегрирован с протоколом Ху для создания гепатоцитов человека с почти физиологическими характеристиками.Другая модель культуры органоидов печени была разработана Vyas et al. (2017). В данном случае децеллюляризованные каркасы печени хорька засевали эмбриональными клетками-предшественниками человека, содержащими стромальные и эндотелиальные клетки печени, а затем инкубировали в среде для дифференцировки в течение 3 недель для индукции гепатобилиарных органоидов в условиях культивирования in vitro . Хотя эта модель доказала, что спецификация и созревание печеночных и желчных клонов в каркасе было лучше, чем для клеток, выращенных в матригеле, способность самообновления органоидов и эффективность этого метода в восстановлении функций печени взрослых были сравнительно низкими (Рисунок 2).
Рисунок 2. Ключевые протоколы для разработки трехмерных культур органоидов печени на основе стволовых клеток печени взрослых. 3D, трехмерный, FGF, фактор роста фибробластов; TGF, трансформирующий фактор роста; Р-СПО, Р-Спондин; EGF, эпидермальный фактор роста; HGF, фактор роста гепатоцитов; CM, условия среднего; FACS, Сортировка клеток по флуоресценции; EpCAM, молекула адгезии эпителиальных клеток.
3D-модели органоидов для непаренхимных клеток печени
Звездчатые клетки печени (HSC) представляют собой печеночно-специфические мезенхимальные клетки, которые вносят вклад в физиологию и патофизиологию печени (Scholten et al., 2010; Mederacke et al., 2013; Уэллс, 2014). В здоровой печени HSC находятся в состоянии покоя на исходном уровне, и их функция заключается в хранении липидных капель витамина A. После повреждения, вызванного токсинами или вирусными инфекциями, HSC становятся метаболически активными, что приводит к накоплению ECM в печени (Friedman, 2008). HSC имеют ограниченную способность к пролиферации в 2D-культуре, не могут поддерживать покоящийся фенотип и спонтанно теряют ключевые функциональные характеристики in vitro (Mederacke et al., 2015; Perea et al., 2015). Koui et al. (2017) показали, что предшественники HSC, происходящие из ИПСК, могут быть размножены и созревают in vitro и могут приобретать клон-специфические характеристики. Недавнее исследование Coll et al. (2018) создали эффективную систему культивирования для дифференциации HSC от iPSC. В этой системе HSC генерировались с помощью протоколов, которые изначально были разработаны для создания HSC из ESC (Asahina et al., 2009; Onitsuka et al., 2010). Вкратце, ИПСК были дифференцированы в сторону мезодермальных предшественников с BMP4.Затем эти мезотелиальные клетки индуцировали ретинолом и пальмитиновой кислотой для их последующей дифференцировки в HSC. Через 12 дней полученные клетки напоминали первичные HSC с точки зрения морфологии, профиля транскриптома и функциональных характеристик. Кроме того, при выращивании в виде совместных культур трехмерных сфероидов вместе с клетками HepaRG, HSC сохраняли витамин A и, что более важно, они переходили из состояния покоя в состояние активации в ответ на токсичность для печени. В заключение, этот метод обеспечил надежную и надежную систему культивирования для исследования биологии и патобиологии печени с использованием органоидов печени и активированных HSC (Coll et al., 2018).
Возможные применения органоидов печени
Органоиды имеют много преимуществ по сравнению с традиционными методами культивирования клеток. Эти миниатюрные органы обеспечивают долгосрочное стабильное расширение почти физиологическим образом и имитируют функцию, структуру и патологию тканей в 3D. Таким образом, они обладают огромным потенциалом для превращения в отличные платформы для различных фундаментальных и трансляционных исследовательских приложений, включая моделирование заболеваний, скрининг лекарств, генную терапию, выяснение взаимодействий микробов с хозяевами и замену органов (рис. 3).
Рисунок 3. Возможные области применения органоидов печени.
Модели заболеваний через органоиды печени
За последние несколько лет, с открытием других мощных технологий, в частности редактирования генома CRISPR-Cas9, исследования органоидов открыли новые возможности для понимания молекулярной патофизиологии заболеваний. С этой целью введение специфичных для заболевания мутаций в органоиды печени, полученные от здоровых доноров, стало быстрым и беспроблемным, что позволяет исследователям легко исследовать механизмы, связанные с мутациями, и клинические фенотипы.В качестве альтернативы, тканевые эксплантаты или биопсии пациентов также могут быть использованы непосредственно для получения органоидов, специфичных для заболевания. В таблице 1 приведены модели заболеваний печени, опубликованные в литературе.
Таблица 1. Модели заболеваний печени на основе органоидов.
Редкие и генетические болезни
Дефицит альфа-1-антитрипсина (A1ATD) — редкое наследственное заболевание, которое вызывает заболевания легких и печени, проблемы с кожей и воспаление кровеносных сосудов.A1AT представляет собой ингибитор сериновой протеазы, который синтезируется в основном в печени и переносится с кровотоком в легкие. Его основная функция в легких — ингибировать фермент, называемый эластазой нейтрофилов, тем самым защищая ткань легких от протеолитической деградации. Наиболее распространенной генетической миссенс-мутацией в A1ATD является аллель PiZ (Glu 342 Lys) гена SERPINA1, который приводит к агломерации неправильно свернутых белков в гепатоцитах (Bals, 2010). Чтобы смоделировать это состояние, Huch et al.(2015) разработали органоиды, используя образцы биопсии печени, полученные от трех пациентов с болезнью A1ATD. Примечательно, что органоиды, полученные от пациентов (PDO), имитировали патологию заболевания, со снижением уровней белка и агрегацией белка A1AT в эндоплазматическом ретикулуме. Синдром Алажиля (ALGS), еще одно мультисистемное генетическое заболевание, также моделировали с использованием того же подхода (Huch et al., 2015). Следует отметить, что ALGS имеет аутосомно-доминантное наследование и преимущественно вызывается гетерозиготными мутациями в гене JAG1, который кодирует белок Jagged1, трансмембранный лиганд в пути передачи сигналов Notch.Мутации JAG1 приводят к дефициту в различных тканях, включая печень, сердце и мышцы (Turnpenny and Ellard, 2012). Согласно результатам этого исследования, органоиды у пациентов с ALGS не могли образовывать интактные структуры желчных протоков in vitro , а клетки в просвете органоидов подверглись апоптозу, имитируя патологию болезни in vivo (Huch et al., 2015) . В дополнение к органоидам, происходящим от стволовых клеток / предшественников печени, Гуан и его коллеги использовали индивидуальные ИПСК для моделирования этого генетического нарушения.В частности, ИПСК от двух пациентов с ALGS были дифференцированы на органоиды с помощью протокола, описанного на рисунке 1. В отличие от здоровых органоидов, образование желчных протоков и транспортная функция желчных протоков ALGS-специфических PDO были значительно нарушены. Кроме того, с использованием обратного подхода с использованием технологии CRISPR-Cas9, вызывающая ALGS мутация C829X JAG1 была введена в ИПСК, полученные из здоровых фибробластов человека. В результате способность генетически модифицированных органоидов, полученных из ИПСК, образовывать структуры, подобные протокам, была значительно снижена, повторяя патологию печени ALGS (Guan et al., 2017).
Цитруллинемия типа I (CTLN1) — это наследственное нарушение цикла мочевины в печени, возникающее из-за дефицита фермента аргининосукцинат-синтазы 1 (ASS1) (Kose et al., 2017). У новорожденных с тяжелой цитруллинемией I типа возникают опасные для жизни клинические проявления, такие как эпизоды гипераммониемии, которые могут быть фатальными или привести к необратимым неврологическим нарушениям. Текущие стратегии (лекарства и диета с низким содержанием белка) для лечения цитруллинемии типа I неэффективны, а в тяжелых случаях долговременная выживаемость низкая.Трансплантация клеток с функциональными гепатоцитами становится многообещающим терапевтическим подходом. Недавно ИПСК, полученные от пациентов с цитруллинемией I типа с гомозиготными мутациями G390R в гене ASS1, были использованы для разработки модели, специфичной для заболевания. В частности, ИПСК, специфичные для пациента, были созданы путем репрограммирования дермальных фибробластов с помощью эписомальных векторов и дифференцировки в направлении дефинитивной энтодермы в определенных условиях. Затем выделяли EpCAM-положительные энтодермальные клетки, полученные из ИПСК, и использовали их для создания функциональных культур печеночных органоидов.Эти органоиды демонстрируют экспрессию специфичных для гепатоцитов маркерных генов и повторяют ключевые метаболические функции зрелых гепатоцитов, включая поглощение ЛПНП, секрецию альбумина и накопление гликогена. Дальнейший анализ показал, что органоиды печени имитировали клинические фенотипы пациентов с цитруллинемией I типа, такие как повышенный уровень аммиака и пониженный уровень мочевины. Более того, эти фенотипы могут быть спасены эктопической экспрессией гена ASS1 дикого типа в органоидах, полученных от пациентов. В совокупности эта модель предлагает многообещающую основу для изучения стратегий коррекции / замены генов в клеточной терапии и проведения доклинических исследований по открытию и разработке лекарств при нарушениях цикла мочевины (Akbari et al., 2019).
Органоиды холангиоцитов, полученные из ИПСК, также использовались для моделирования заболеваний. Например, Огава и его коллеги, как показано на рисунке 1, использовали Chol-org для конкретного пациента для моделирования болезни кистозного фиброза (CF). МВ — это опасное для жизни редкое аутосомно-рецессивное заболевание, вызванное мутациями в гене регулятора трансмембранной проводимости при кистозном фиброзе (CFTR). Мутации в гене CFTR нарушают функцию хлорид-ионного канала, вызывая нарушение регуляции потока ионов и транспорта эпителиальной жидкости в легких, поджелудочной железе, толстой кишке и печени.В этом исследовании Chol-org, полученный из ИПСК, показал неправильно свернутые белки CFTR, нарушение образования кист и потерю функции хлоридных каналов, что отражает фенотип заболевания у пациентов. Кроме того, они показали, что воздействие на органоиды низкомолекулярного препарата-усилителя CFTR VX-770 (ивакафтор) вместе с форсколином и IBMX исправляет дефект неправильной укладки и приводит к функциональному восстановлению мутантного белка CFTR (Ogawa et al., 2015 ). Chol-org также использовался в другом исследовании для успешного моделирования ALGS, поликистоза печени и холангиопатии, связанной с CF (Sampaziotis et al., 2015). В частности, лечение полученного от пациента Chol-org лекарствами, связанными с МВ (верапамил и октреотид), спасло клинический фенотип холангиопатии CF in vitro . В поддержку этих результатов в текущем исследовательском проекте под названием HIT-CF Europe также используются системы клеточных культур нового поколения с целью оценки эффективности и безопасности редких лекарств-кандидатов, специфичных для мутации CF, в органоидах, полученных от пациентов. Проект подчеркивает захватывающие перспективы систем культивирования органоидов для улучшения жизни людей с МВ.Взятые вместе, технологии органоидов нового поколения обладают огромным потенциалом для точного моделирования заболеваний, связанных с желчными путями, и открывают путь для доклинических исследований на основе органоидов в точной медицине.
Рак и сложные заболевания
Рак печени является пятым по распространенности раком в мире и второй по значимости причиной смерти (Bray et al., 2018). Отсутствие мощных моделей рака печени, которые точно воспроизводят гистопатологию, гетерогенность, геном и профиль транскриптома опухолей, затрудняет разработку эффективных методов лечения.Хотя в прошлом были созданы различные модели рака печени, такие как линии раковых клеток и полученные от пациентов ксенотрансплантаты (PDX), недостатки каждой модели ограничивают их применение в исследованиях рака печени. Например, при длительном пассировании в 2D-культуре линии раковых клеток накапливают мутации и подвергаются клональной селекции, что приводит к потере исходной генетической и фенотипической гетерогенности (Kim, 2005). Более того, низкая скорость приживления, высокая стоимость, трудоемкость создания и непригодность для крупномасштабных испытаний лекарств ограничивают использование моделей PDX (Hidalgo et al., 2014; Gu et al., 2015; Каваллони и др., 2016).
Персонализированная медицина рака — это новый и инновационный подход, направленный на создание эффективных терапевтических стратегий для каждого пациента на основе специфических особенностей опухоли. В этом отношении многообещающей платформой становятся опухолевые органоиды, называемые опухолевыми моделями. Недавно Broutier et al. создали модель опухолевой культуры из трех различных подтипов первичного рака печени (PLC), а именно гепатоцеллюлярной карциномы (HCC), холангиокарциномы (CC) и комбинированной гепатоцеллюлярно-холангиокарциномы (CHC), используя образцы рака печени, полученные от пациентов, не имевших в анамнезе вирусных заболеваний. лечение.Установленные опухоли сохранили гистологические характеристики, а также профили транскриптомов и геномные подписи исходной ткани. Кроме того, исследований in vivo продемонстрировали канцерогенный и метастатический потенциал органоидов, полученных из PLC, при трансплантации под капсулу почки. Важно отметить, что комплексные данные омики органоидов, полученных из PLC, привели исследователей к выявлению новых биомаркеров и новых потенциальных терапевтических агентов для PLC, таких как ингибитор ERK (Broutier et al., 2017). В другом исследовании Nuciforo et al. (2018) разработали методологию, с помощью которой они генерировали опухолевые клетки из образцов биопсии иглы от разных пациентов с ГЦК с различными стадиями опухоли и этиологией. Эти опухоли успешно воспроизводили гистопатологические свойства наряду с профилями экспрессии генов и мутационными ландшафтами исходных тканей. Более того, они также сохранили особенности опухоли после трансплантации мышам с иммунодефицитом (Nuciforo et al., 2018).
Недавно Ли и др.(2019) разработали когорту из 27 линий опухолевидных клеток из нескольких областей образцов опухолей человека от пациентов с CC и HCC. Маркеры эпителия, желчных протоков, стволовости и муцина использовали для характеристики клеточной идентичности опухолевых клеток. Дальнейший анализ показал, что опухоли, полученные от пациентов, отражают гистологические особенности, профили транскриптомов и генетический фон исходных первичных опухолей печени. Интересно, что высокопроизводительный скрининг этих опухолей выявил гетерогенные лекарственные реакции, что свидетельствует о сильной внутри- и межопухолевой гетерогенности.В результате было обнаружено, что только небольшая группа лекарств эффективна в блокировании их распространения (Li et al., 2019).
Что касается исследования рака печени, новое исследование продемонстрировало, что органоидную технологию можно использовать для моделирования возникновения рака (Sun et al., 2019). В частности, Сан и его коллеги предположили, что прямое перепрограммирование фибробластов в трехмерные гепатоциты может осуществляться за счет эктопической экспрессии FOXA3, HNF1A и HNF4A. Интересно, что эти органоиды печени обладали ограниченной способностью к расширению и пролиферации, которую можно было преодолеть с помощью трансдукции SV40.В этой модели трансдукция c-MYC способствовала инициации HCC и образованию рака печени in vivo , частично за счет индукции избыточного связывания митохондрий с эндоплазматическим ретикулумом. Кроме того, при ортотопической трансплантации RAS-трансформированные органоиды образовывали внутрипеченочные холангиокарциномы гепатоцитарного происхождения (Sun et al., 2019).
Органоиды, полученные из нормальных тканей, также могут быть использованы для моделирования рака путем последовательного введения мутаций гена драйвера рака.Преимущество использования таких моделей состоит в том, что они позволяют исследовать эффекты мутаций драйверов на изогенном (идентичном) генетическом фоне. С этой целью в различных лабораториях независимо созданы мутантные органоиды толстой кишки путем включения мутаций по крайней мере четырех из наиболее часто изменяемых генов колоректальной карциномы, а именно KRAS, APC, TP53, SMAD4 и PIK3CA (Drost et al., 2015; Matano et al. др., 2015). У этих мутантных органоидов развиваются аденокарциномы при трансплантации в капсулу почек мышей-реципиентов, моделируя прогрессирование рака толстой кишки.Аналогичным образом, недавнее исследование показало, что потеря функции BAP1 с помощью CRISPR-Cas9 в органоидах печени в сочетании с распространенными мутациями холангиокарциномы (TP53, PTEN, SMAD4 и NF1) влияет на организацию эпителиальной ткани и межклеточные соединения. и приводит к приобретению злокачественных признаков (Artegiani et al., 2019).
Потенциал органоидов печени человека как модели для изучения хронических и сложных заболеваний печени также является многообещающим для открытия эффективных методов лечения.В связи с этим Ouchi et al. (2019) разработали метод создания многоклеточной органоидной системы печени для моделирования неалкогольного стеатогепатита. В частности, органоиды печени демонстрируют накопление липидов, фиброз и воспаление при воздействии свободных жирных кислот. Результаты этого исследования показывают, что эта система может воспроизводить прогрессивные аспекты стеатогепатита и модельной болезни Вольмана и, что более важно, что FGF19 можно использовать для облегчения патологий заболевания (Ouchi et al., 2019).
Взаимодействия хозяина и микробиома
Лаборатория
Randall’s изучала проникновение и локализацию вируса гепатита С в органоидах гепатомы. HCV локализуется в базолатеральной мембране, и его вирионы постепенно накапливаются в плотных контактах. Эта модель является многообещающим инструментом для исследования сложных транспортных процессов ВГС (Baktash et al., 2018). Недавно в лаборатории Танигучи были получены функциональные органоиды печени, полученные из ИПСК человека, и инфицированы их геномом вируса гепатита В (HBV).Здесь функциональные органоиды печени продемонстрировали более высокую восприимчивость к инфекции HBV, чем 2D-печеночные клетки, полученные из ИПСК человека, и могли поддерживать распространение HBV и продуцировать инфекционный вирус в течение более длительных периодов времени. Примечательно, что инфекция HBV привела к тяжелой печеночной дисфункции органоидов, характеризующейся повышенными маркерами повреждения печени и измененной ультраструктурой печени. Интересно, что это исследование также показало, что инфицированные HBV органоиды печени, генерируемые без иммунных клеток, имели нарушенную функцию печени, и, таким образом, выдвинули гипотезу о том, что HBV действительно может быть цитопатическим вирусом (Nie et al., 2018).
Таким образом, органоиды печени являются многообещающими моделями для изучения взаимодействия вируса гепатита с хозяином и могут легко стать персонализированными моделями инфекции для индивидуальных исследований и лечения гепатита.
Профилирование Omic
Вместо скрининга из установленных библиотек лекарств, данные omics могут использоваться для прогнозирования новых лекарств-кандидатов от болезней. С помощью органоидной технологии можно также усилить достаточное количество здоровых и больных тканей in vitro и проанализировать причинные мутации с помощью глубокого секвенирования или отслеживать схемы лечения с помощью фенотипического профилирования органоидов с использованием омических платформ.Недавно команда Хуха предсказала новые лекарственные мишени для пациентов с раком печени, изучив атомные профили опухолевых клеток, и показала, что ингибиторы ERK могут уменьшать образование опухолей в моделях ксенотрансплантатов, полученных от пациентов (Broutier et al., 2017). Эти результаты показывают, что омическое профилирование может предложить удобную стратегию для понимания молекулярного патогенеза заболеваний и определения новых терапевтических мишеней для лекарств.
Биоинженерные модели органоидов
Чтобы увеличить продолжительность жизни и воспроизводимость клеточных функций in vitro , исследовательское сообщество в настоящее время использует различные инструменты биоинженерии, такие как высокопроизводительные микрочипы, технологии лаборатории на кристалле (Polini et al., 2014; Bhise et al., 2016), микроструктуры белков, микрофлюидики, специализированных планшетов, биомиметических каркасов и биопринтинга для контроля клеточного микросреда (Zhang et al., 2017b). Андерхилл и Хетани (2018) недавно провели обзор достижений в биоинженерных моделях печени, которые можно использовать для скрининга лекарств, и детерминант дифференцировки / функции клеток печени в микросреде (Massa et al., 2017; Zhang et al., 2017a).
Jin et al. (2018) разработали васкуляризованную трехмерную модель органоида печени, полученную из индуцированных гепатоцитов (iHep), которые были напрямую дифференцированы от фибробластов.Они достигли этого путем совместного культивирования iHeps с эндотелиальными клетками в децеллюляризованном трехмерном гидрогеле внеклеточного матрикса печени (LEM) в микрожидкостном устройстве для культивирования клеток с непрерывным динамическим потоком среды. Используя преимущества этой платформы, трехмерные органоиды печени на основе iHep смогли создать многоорганную систему, состоящую из нескольких органоидов, полученных из разных внутренних органов, и продемонстрировали большую применимость для функционального и стандартизованного высокопроизводительного скрининга лекарственных средств (HTS) (Jin et al., 2018).
Микромасштабные технологии
могут имитировать in vivo -подобные клеточные микросреды, позволяя точно контролировать важнейшие физико-химические факторы, такие как поток жидкости, биохимические сигналы и т. Д. (Huh et al., 2010; Schepers et al., 2016; Chung и др., 2017). Недавно Wang et al. (2018) предложили простую и надежную стратегию, которая способствовала дифференцировке in situ , долгосрочному 3D-культивированию и созданию функциональных органоидов печени на основе hiPSC в системе перфузионных микропиллярных чипов.Органоиды печени показали благоприятные характеристики роста и клеточной гетерогенности, включая дифференцировку гепатоцитов и холангиоцитов, имитирующих ткань печени in vivo . В частности, органоиды печени в условиях перфузионного культивирования демонстрируют повышенную жизнеспособность клеток, а также экспрессию генов, специфичных для энтодермы и зрелых гепатоцитов. Более того, по сравнению со статическими культурами они показали улучшенные метаболические возможности и функции печени, включая производство альбумина и мочевины.Наконец, органоиды печени показали зависимый от дозы и времени гепатотоксический ответ на ацетаминофен, что снова является идеальной платформой для тестирования на наркотики (Wang et al., 2018).
Гепатотоксичность
Гепатотоксичность относится к токсическому действию лекарственных препаратов и их метаболитов на ткань печени и обычно подразумевает острое повреждение и недостаточность печени, вызванное химическими веществами. Анализ токсичности для всех видов лекарств важен до их одобрения для выпуска на рынок (Kaplowitz, 2005).До настоящего времени первичные двумерные гепатоциты использовались в качестве модели для скрининга метаболизма и токсичности лекарств. Однако гепатоциты нестабильны и функционально неэффективны в долгосрочных культурах из-за нарушения активности цитохрома P450 (CYP). С этой целью органоиды печени могут стать отличной платформой для прогнозирования химически индуцированной гепатотоксичности. Недавно Mun et al. (2019) обнаружили, что органоиды печени могут экспрессировать ферменты CYP фазы I метаболизма лекарств и ферменты детоксикации фазы II.В частности, CYP1A2 и CYP3A4 индуцировались после лечения омепразолом в культуре печеночных органоидов. Кроме того, CYP3A4- и CYP1A2 / 2E1-опосредованные гепатотоксические препараты (троглитазон и APAP, соответственно) были проанализированы в 2D-культурах гепатоцитов и органоидов. Основываясь на экспериментах по жизнеспособности клеток после воздействия гепатотоксических препаратов в клинически значимых концентрациях, органоиды печени показали более высокую чувствительность, чем 2D гепатоциты. В частности, токсическая концентрация тровафлоксацина (антибиотика широкого спектра действия) была примерно в 50 раз выше в 2D-гепатоцитах (Mun et al., 2019). В заключение, анализ гепатотоксичности на основе органоидов оказался полезным для скрининговых исследований лекарственных средств и раннего прогнозирования химического поражения печени. В качестве альтернативы, наши недавние результаты показывают, что полученные из ИПСК печеночные органоиды можно легко культивировать в течение многих поколений (по крайней мере, 48 пассажей) и продолжать сохранять печеночные функции, что делает эту модель подходящей для долгосрочных доклинических скрининговых исследований гепатотоксичности (Akbari et al., 2019).
Биобанки
Модели органоидов будут также служить возобновляемым ресурсом через криоконсервированные биобанки здоровых и больных органоидов человека (van de Wetering et al., 2015). Сегодня эти «живые биобанки» становятся все более привлекательными для исследователей в академических кругах и промышленности для различных целей, особенно тех, которые связаны с разработкой инновационных терапевтических стратегий, выявлением новых диагностических маркеров и разработкой индивидуальных планов лечения пациентов. Недавно была создана Инициатива по моделированию рака человека (HCMI) как международное сотрудничество между Национальным институтом рака США (NCI), UKR Research UK (CRUK), Институтом Wellcome Sanger (WSI) и Hubrecht Organoid Technology (HUB ).В рамках пилотного этапа с использованием передовых технологий, HCMI направлен на создание, клиническую аннотацию и генетическую характеристику около 1000 моделей раковых клеток / органоидов следующего поколения из опухолей пациентов. Общая цель HCMI состоит в том, чтобы продвигать исследования рака, предоставляя исследовательскому сообществу большую коллекцию легкодоступных моделей раковых клеток и все необходимые ресурсы, включая формы согласия и стандартизированные протоколы, используемые для разработки моделей. Эти модели рака затем могут быть использованы для выполнения фундаментальных и трансляционных исследований рака и внесения вклада в открытие мишеней для лекарств, идентификацию новых биомаркеров, специфичных для болезней, и разработку профилактических, а также терапевтических стратегий для персонализированной медицины.
Генная терапия
Таргетная генная терапия с большим успехом применялась для исправления или инактивации мутаций генетических заболеваний у животных или in vitro на моделях культур клеток . В ближайшем будущем многие усилия, вероятно, будут направлены на объединение современных инструментов редактирования генома с органоидными технологиями in vitro для создания здоровых изогенных органоидов путем исправления генетических дефектов в органоидах, полученных от пациентов. Будем надеяться, что эти технологии потенциально могут быть использованы для лечения пациентов с опасными для жизни и другими неизлечимыми заболеваниями, при условии, что трансплантаты принимаются тканью-реципиентом без какого-либо иммунного отторжения.Например, мутация, вызывающая заболевание, недавно была возвращена к мутации дикого типа с помощью CRISPR-Cas9 в органоидах, полученных от пациентов из синдрома Алажиля, и фенотип заболевания был успешно устранен in vitro (Guan et al., 2017 ). У нас есть основания полагать, что всякий раз, когда технологии редактирования генома станут полностью применимыми в клинической практике с точки зрения безопасности и эффективности, органоидные технологии также станут возможными для такой терапии.
Трансплантация
Функциональные органоиды являются многообещающей альтернативой трансплантации клеток и целых органов, поскольку они могут быть получены из изогенных собственных тканей.Используя технологии ИПСК, можно также получить HLA-согласованные тканеспецифичные органоиды из легко доступных биопсий тканей. Действительно, емкость in vitro
Frontiers | Модели in vitro и системы на кристалле: исследования взаимодействия биоматериалов с тканями, полученными с использованием линий метаболических клеток легкого и печени
Введение
Модели in vitro являются отправной точкой в биологических и медицинских исследованиях. С научным прогрессом и появлением различных моделей in vitro знания о поведении всего организма растут.Вместе с экспериментальными моделями in vitro разрабатываются компьютерные модели in silico . Разрабатываются разные типы моделей в разных масштабах — макро, мезо, микро, нано, в зависимости от того, объясняют ли они поведение всей системы (макро; модели конечных элементов), поведение на уровне молекулярных кластеров (мезо; диссипативные частицы. динамические модели) или поведения на молекулярном уровне (микро, нано; модели молекулярной динамики). Результаты, полученные на моделях in vitro и in silico , следует сравнить и проверить.Конечная цель — разработать адекватные модели in silico , которые сокращают стоимость и время экспериментальных измерений и обеспечивают удовлетворительные результаты. Однако для начала нам нужны результаты моделей in vitro. In vitro Модели использовались для многих сегментов человеческого организма — для гематоэнцефалического барьера (Ogunshola, 2011), исследования остеоартрита (Johnson et al., 2016), псориаза (Jean and Pouliot, 2010), ткани миокарда. (Vunjak Novakovic et al., 2014) и ишемическое повреждение миокарда (Tumiati et al., 1994) и пароксизмальной наджелудочковой тахикардии (Wit et al., 1971), эпителием среднего уха мыши (Mulay et al., 2016), болезнью Альцгеймера (Stoppelkamp et al., 2011), тромбозом (Zhang et al., 2017) и сосудистого воспаления (Ahluwalia et al., 2018), а также для различных моделей рака (Katt et al., 2016) и др.
Линия клеток
Calu-3 была создана в 1975 году из места метастазирования (плевральный выпот) у 25-летнего мужчины европеоидной расы с аденокарциномой легких (Memorial Sloan Kettering Cancer Center, 2018).Текущие исследования показывают, что эта клеточная линия обладает характеристиками, аналогичными первичным эпителиальным клеткам, и может использоваться для исследования эпителиального барьера дыхательных путей для оценки регулярности и нерегулярности барьерных функций. Образованный эпителиальный барьер можно использовать для исследования заболеваний и тестирования новых методов лечения и лекарств.
Хотя печень известна тем, что является частью пищеварительного тракта и участвует в метаболизме ксенобиотиков и питательных веществ (углеводов и липидов), она выполняет более 300 жизненно важных функций (Angier, 2017).Когда дело доходит до токсикологических исследований, представляющее интерес химическое вещество часто проверяется на печени. В последние годы новые технологии in vitro, и in silico, позволили понять механизмы токсичности, чтобы заменить или сократить использование животных в исследованиях тканей (Gubbels-van Hal et al., 2005; Jie et al., 2016; Comenges et al., 2017). Это делается на молекулярном уровне, чтобы понять, как изменения на более низких уровнях влияют на более высокие уровни биологической организации (например, ткани, органы и т. Д.); EPA, 2003). Одной из клеточных линий, которая в последнее время привлекла большое внимание, является клеточная линия гепатокарциномы человека HepG2, которая используется в исследованиях in vitro тканей печени (Gonzales et al., 2015). Он имеет одно ядро и имеет эпителиоподобную морфологию (Wilkening et al., 2003). Клеточная линия HepG2 первоначально была выделена у 15-летнего белого мальчика с формой гепатоцеллюлярной карциномы (Gonzales et al., 2015). Однако многие механизмы, связанные с нормальными человеческими гепатоцитами, можно обнаружить в клетках HepG2, некоторые из которых включают секрецию белков плазмы, выработку желчных кислот, а также процессы детоксикации.Также сообщается, что клетки гепатомы обладают рецепторами для инсулина, трансферрина, эстрогена и липопротеинов низкой плотности (Bouma et al., 1989; Gonzales et al., 2015), что означает, что у них есть механизмы детоксикации, осуществляемые путем превращения реакций биотрансформации (Dehn et al., 2004).
В следующем разделе представлены модели in vitro для линий клеток легких и печени. После этого обсуждается обработка данных и доступные модели линий клеток легких и печени. Четвертый раздел содержит обзор на кристалле, относящийся к ранее упомянутым клеточным линиям, и, наконец, в разделе заключения дается краткое изложение современного состояния и критически рассматриваются возможные будущие шаги в этой области.
Ретроспектива in vitro Модели клеток легких и печени
Моделирование легких с использованием линий эпителиальных клеток Calu-3
Несмотря на то, что клетки Calu-3 представляют собой иммортализованные клетки, они по-прежнему обладают многими характеристиками клеток первичных дыхательных путей и могут использоваться для наблюдения за транспортом, метаболизмом и тестирования нового подхода к лекарствам (Zhu et al., 2010).
Дифференцированные системы культур клеток бронхиального эпителия человека были оценены для исследования астмы — первичные клетки (клетки бронхиального эпителия человека, HBEC) и непервичные клетки, клеточные линии [Calu-3, BEAS-2B, BEAS-2B R1; (Стюарт и др., 2012)] (рис. 1). Больше физиологических моделей можно получить с HBEC, культивируемыми на границе раздела воздух-жидкость со специально определенной средой, которая дифференцирует соответствующий фенотип. Клетки обладают способностью дифференцироваться в бокалы (MUC5AC +), образовывать реснитчатый слой (β-тубулин IV +) и развивать высокое трансэпителиальное электрическое сопротивление (TEER), которое служит косвенным показателем возникновения плотных контактов (белок ZO-1) и как маркер нарушения эпителиального слоя. Клетки Calu-3 растут до слияния в течение 5 дней и образуют плотный эпителиальный монослой в течение 21 дня в культуре.Плотность клеточного слоя подтверждена измерениями TEER. Проницаемость можно наблюдать с помощью поглощения flu-Na, и текущие результаты показывают, что существует связь между параметром TEER и поглощением flu-Na и проницаемостью мембраны (Haghi et al., 2010). Экспрессия P-gp на клеточной поверхности на Calu-3 зависит от времени и не зависит от клеточных пассажей. Был сделан вывод, что слизистая секреция увеличивается со временем в культуре. Определение количества слизистой можно провести с помощью альцианового синего. Дифференцировку клеток можно оценить с помощью конфокальной визуализации и количественной ПЦР (Stewart et al., 2012). Клеткам Calu-3 требуется больше всего времени, чтобы стать полностью сливными, но они становятся более однородными с повышенной секрецией слизи. Grainger et al. (2006) в своем исследовании также пришли к выводу, что клеточная линия Calu-3 может быть использована для моделирования функции и поведения эпителиального барьера дыхательных путей. Они культивировали клетки как культуру с воздушным интерфейсом (AIC) и как культуру, покрытую жидкостью (LCC). По сравнению с условиями окружающей среды, AIC обеспечивал большее количество слизи, покрывающей поверхность клеток, псевдостратифицированный слой с большим количеством столбчатых клеток (LCC создает монослой) и более проницаемыми клетками.Сравнивая AIC и LCC, авторы пришли к выводу, что клеточная линия Calu-3, культивированная с AIC, продуцировала клеточный слой, более похожий на морфологию реального эпителия дыхательных путей и электрическое сопротивление in vivo , чем клетки, культивированные с использованием LCC (рис. 1). Kreft et al. пришли к аналогичному выводу (Kreft et al., 2015), исследуя клеточную линию Calu-3 в различных условиях культивирования, чтобы гарантировать оптимизированную модель in vitro для исследования функции бронхиального эпителия. Клетки Calu-3 были протестированы в среде A-MEM на границе раздела воздух-жидкость (A-L) и на границе раздела жидкость-жидкость (L-L).Интерфейс A-L оказался более естественным с физиологической точки зрения, образуя псевдостратифицированный столбчатый эпителий с большим количеством микроворсинок и секреторных пузырьков, демонстрируя более высокие значения TEER и более низкую проницаемость декстрана. Более длительное время в культуре значительно снижает проницаемость декстрана и увеличивает экспрессию переносчика лекарственного средства. Главный вывод из этого исследования заключался в том, что условия культивирования клеток, а также время культивирования влияют на дифференцировку клеток, барьерную функцию, значения проницаемости и экспрессию переносчиков лекарств.Все они должны быть стандартизированы для линии клеток Calu-3 как модель in vitro для системы доставки лекарств и заболеваний легких.
Рисунок 1 . Список часто используемых линий клеток легких. AIC, культура с радиоинтерфейсом; LCC, культура, покрытая жидкостью.
Zhu et al. дал обзор культивируемых человеком эпителиальных клеток дыхательных путей, Calu-3 (Zhu et al., 2010). Они использовали модель для оценки эффектов концентрации кислорода, положительного давления в дыхательных путях и некоторых фармакологических агентов.Эта линия клеток оказалась полезной для изучения респираторных заболеваний, повреждений дыхательных путей, связанных с кислородным отравлением, и оценки новых методов лечения (рис. 1). Изолированные клетки Calu-3 могут в основном имитировать эпителиальные клетки дыхательных путей, но при некоторых исследованиях нельзя пренебрегать отсутствием систематического воспаления. Еще одна важная характеристика при изучении заболеваний легких — поглощение наночастиц из окружающей среды, загрязненного воздуха и воды. Особенно опасны углеродные наночастицы (CNP, шарики).Поглощение CNP в организме может происходить при вдыхании наночастиц из воздуха и может вызывать заболевание легких или в дальнейшем попадать в систему кровообращения и даже в мозг (Banga et al., 2012). Углеродные наночастицы влияют на барьерную функцию монослоя эпителия дыхательных путей Calu-3, уменьшая его. Потеря жизнеспособности клеток снижает TEER, измеряемую на клеточном монослое, что связано с высвобождением цитокинов. Клеточную линию Calu-3 можно использовать для наблюдения за раздражением дыхательных путей и тестирования токсичности лекарств и их среды с помощью анализа МТТ (Ihekwereme et al., 2014). Линии эпителиальных клеток, такие как Calu-3, можно использовать для тестирования новых лекарств и новых методов лечения. Онг и др. сосредоточились на фармацевтических применениях клеточной линии Calu-3 (Ong et al., 2013), но проанализировали использование других клеточных линий, таких как линии бронхиальных клеток 16HBE14o-, BEAS-2B и альвеолярная клеточная линия A549. Их вывод, основанный на литературе, заключается в том, что AIC имеет преимущество перед окружающей средой LCC и что TEER может использоваться в качестве измерения целостности сформированного монослоя. Транспорт лекарств основан на проницаемости слоя.Клетки Calu-3 демонстрируют экспрессию и функциональную активность P-гликопротеина (P-gp), белков, связанных с множественной лекарственной устойчивостью (MRP), а также белка устойчивости к раку молочной железы (BCRP). Эти переносчики обнаруживаются в легких человека, in vivo, и в клеточной линии Calu-3. Лекарственное взаимодействие может привести к повышенной токсичности и побочным эффектам для различных терапевтических результатов. Например, Mamlouk et al. показали, что нестероидные противовоспалительные препараты (аспирин, ибупрофен и др.) снижают захват сальбутамола клетками Calu-3 (Mamlouk et al., 2013). Клеточная линия Calu-3 также используется в исследовании противоопухолевых терапевтических средств для ингибирования роста из-за своего злокачественного происхождения (Ong et al., 2013).
Моделирование печени с использованием линий метаболических клеток HepG2
Линии клеток печени человека, независимо от того, являются ли они раковыми или иммортализованными гепатоцитами, можно эффективно культивировать и использовать для различных целей. Некоторые из широко используемых линий печеночных клеток — это HepG2, Huh7, Hep3B и SK-Hep-1, которые происходят от гепатоцеллюлярной карциномы (HCC), и HepaRG, которая представляет собой линию клеток HCC, которая включает как гепатоциты, так и билиароподобные клетки. (Го и др., 2011; Gerets et al., 2012) (рисунок 2). Однако линии клеток печени человека имеют некоторые ограничения, такие как присутствие более низкой и вариабельной экспрессии ферментов цитохрома P450 (CYP450), чего нет в первичных гепатоцитах человека (Guo et al., 2011). В этом смысле результаты, полученные с индукцией ферментов CYP450, являются более многообещающими, а это означает, что переносчик лекарств MDR1 лучше в новой линии печеночных клеток Fa2N-4 (Mills et al., 2004). Другая линия клеток, линия клеток HepaRG, является многообещающим заменителем первичных гепатоцитов человека.Было замечено, что в случае посева с низкой плотностью клетки HepaRG пролиферируют и дифференцируются до слияния только с образованием колоний гепатоцитов. Эти колонии затем окружены билиарными эпителиальными клетками, которые обнаруживают уровни экспрессии CYP450, что является результатом, сопоставимым с первичными гепатоцитами человека (Guillouzo et al., 2007). Что касается доставки лекарств, то более интересным является способность клеток HepaRG выявлять лекарства, которые могут вызывать повреждение печени (Tomida et al., 2015). Кроме того, клетки HepaRG также демонстрируют более устойчивый ответ на воспалительные стимулы (например,g., IL-6, TNFα) по сравнению с первичными гепатоцитами человека, что может быть результатом генетической изменчивости (Klein et al., 2015) (рис. 2).
Рисунок 2 . Список часто используемых линий клеток печени.
В последние годы было сделано много достижений в области систем культивирования, которые улучшили функциональность и стабильность клеток печени in vitro (Zeilinger et al., 2016). Чтобы описать поведение нативного органа in vivo , типы клеток, используемые в исследованиях печени in vitro , должны выполнять некоторые из этих функций, в зависимости от цели исследования (Zeilinger et al., 2016). Было разработано множество различных моделей печени in vitro, , для точного описания химической обработки, которая может быть переведена на in vivo ответов. Из предложенных методов те, которые остаются применимыми для тестирования in vitro на токсичность для печени, — это срезы печени, клеточные линии и первичные гепатоциты (Soldatow et al., 2013). Срезы ткани печени используются, потому что они сохраняют структуру печени, имеют хорошую корреляцию in vitro / in vivo (поскольку они содержат типы клеток, найденные in vivo ) и поддерживают зонально-специфичную активность цитохрома и механизмы токсичности (Lerche-Langrand и Toutain, 2000).Исследования с использованием срезов ткани обычно проводятся при длине культивирования от 30 минут до 5 дней и следуют таким параметрам, как давление кислорода, среда и добавки, а также система культивирования (т. Е. Встряхиваемые колбы, многостенные планшеты, лунки с перемешиванием и т. Д.). Обычно их модифицируют для увеличения жизнеспособности клеток и уменьшения дегенеративных изменений, присутствующих в ткани во время исследования (Soldatow et al., 2013). Линии иммортализованных клеток, полученные из печени, в большинстве случаев не обладают фенотипическими характеристиками ткани печени (Yu et al., 2001). Наиболее часто используемые иммортализованные клеточные линии, полученные из печени, — это Fa2N-4, HepG2, Hep3B, PLc / PRFs Huh7, HBG и HepaRG (Guguen-Guillouzo and Guillouzo, 2010; Guguen-Guillouzo et al., 2010) (рис. 2). Первичные гепатоциты и гепатоцитоподобные клетки имеют ограниченное применение с использованием стандартных условий культивирования для некоторых типов испытаний на токсичность из-за проблем с долгосрочным поддержанием их функциональности, отсутствия надлежащих свойств абсорбции, распределения, метаболизма и экскреции (ADME) (Soldatow и другие., 2013). Суспензии первичных гепатоцитов также широко используются в исследованиях токсичности с умеренной интенсивностью (Soldatow et al., 2013). Предыдущие исследования продемонстрировали, что суспензии также сохраняют высокий уровень функциональности, что позволяет лучше коррелировать с исследованиями токсичности in vivo (O’Brien and Siraki, 2005; Hewitt et al., 2007). Например, Гриффин и Хьюстон (2005) пришли к выводу, что суспензии гепатоцитов позволяют лучше и точнее прогнозировать скорость внутреннего клиренса по сравнению с обычными однослойными культурами.Однако в тестировании in vitro в основном использовались первичные культуры гепатоцитов, так как они способны поддерживать функциональную активность в течение 24–72 часов. Поэтому они могут применяться не только в исследованиях индукции и ингибирования ферментов, что позволяет проводить мониторинг соединений со средней пропускной способностью, но также идеально подходят для изучения межвидовых и межличностных различий в метаболизме (LeCluyse, 2001; Hewitt et al., 2007). . Первичные культуры гепатоцитов часто сочетаются с медиаторами воспаления.Причина этого в том, что традиционные 2D-культуры гепатоцитов плохо подходят для высокопроизводительного скрининга (Soldatow et al., 2013). Комбинация in vitro — лекарственное средство / воспалительный цитокин / воспалительный медиатор была использована в исследовании Cosgrove et al. (2009) для воспроизведения клинической гепатотоксичности лекарств. Это было выполнено специально для идиосинкразических препаратов не только в культивируемых первичных гепатоцитах человека и крысы, но и в клетках HepG2.
Кроме того, исследований in vitro часто объединяют две клеточные линии.Например, в одном исследовании Scheers et al. (2014) объединили хорошо зарекомендовавшую себя линию клеток Caco-2 с клетками печени человека HepG2 для улучшения абсорбции железа. Результаты показывают, что этот подход является возможной альтернативой традиционной модели Caco-2 in vitro для абсорбции железа (Scheers et al., 2014).
Основные области применения клеточных линий печени, используемых в исследованиях in vitro , — это исследования развития рака и терапии (Zeilinger et al., 2016). Клеточная линия HepG2, как линия опухолевых клеток, была исследована с целью изучения конкретных метаболических путей, связанных с опухолями печени, или разработки лекарственных препаратов для лечения рака.Следует подчеркнуть, что обычно разная чувствительность в разных линиях опухолевых клеток разного происхождения исследуется параллельно, чтобы охватить разные типы рака. Например, клетки HepG2 использовались в исследовании, в котором анализировалась экспрессия и регуляция факторов транскрипции, связанных с раком (Samatiwat et al., 2016). Линия клеток HepG2 также может быть использована для изучения метаболизма лекарств и гепатотоксичности. Так обстоит дело в исследовании Palabiyik et al. (2016), которые исследовали метаболизм лекарств и гепатотоксичность, в частности токсичность и профилактику ацетаминофена.Клеточная линия HepaRG также представляет собой многообещающую альтернативу использованию первичных гепатоцитов человека (PHH) для исследований метаболизма, распределения и токсичности лекарств (Lübberstedt et al., 2011; Andersson et al., 2012). Они показали, что клетки HepaRG обладают способностью высоко дифференцировать и выражать типичные функции печени. Это означает, что их можно использовать в исследованиях, включая CYP-зависимый метаболизм, индукцию CYP и экспрессию переносчика лекарств (Andersson et al., 2012). Клетки HepaRG при использовании в тестах на токсичность лекарств демонстрируют такую же реакцию на эффекты ацетаминофена, как PHH, и более высокую активацию генов, связанных с повреждением печени, по сравнению с клетками HepG2.С другой стороны, они демонстрируют пониженную чувствительность к обнаружению гепатотоксических препаратов (Gerets et al., 2012). В результате можно сделать вывод, что клетки HepaRG могут быть альтернативой PHH в скрининговых исследованиях на индукцию CYP (Zeilinger et al., 2016).
Разработанные методы анализа клеток печени и легких — токсикологическая оценка, рост клеток и отделение
Компьютерные модели и математические модели легких встречаются редко. В литературе по этой теме не так много сообщений.Большинство разработанных моделей микрофлюидных устройств типа «легкое на чипе» включают методы визуализации для трехмерной клеточной биологии, такие как конфокальная лазерная сканирующая микроскопия, двухфотонная и многофотонная микроскопия, просвечивающая и сканирующая электронная микроскопия, покадровая визуализация (Konar et al. ., 2016). Konar et al. проанализировали применение органоида легких, что предполагает трехмерную тканевую культуральную систему, которая точно воспроизводит гистологические и функциональные аспекты ткани in vivo . Применение такой системы можно разделить на несколько областей: исследования рака, воспалений и инфекций легких, тестирование токсичности и разработка лекарств и, наконец, персонализированная медицина.
Модель легкого на кристалле была разработана Хэнкоком и Элаббаси (2018) с программным обеспечением COMSOL Multiphysics в соответствии с моделью, представленной Huh (2015). COMSOL предлагает методы моделирования взаимодействия жидкости и конструкции, нелинейных конструкционных материалов, ламинарного потока жидкости, переноса разбавленных частиц и возможности отслеживания частиц. Мембрана PDMS и стены могут быть смоделированы как нелинейные модели материалов в стиле нео-Гука, Муни-Ривлина или Огдена. Могут быть добавлены дополнительные функции, такие как моделирование транспорта лекарств и питательных веществ, поглощения клетками на пористой мембране и т. Д.Модель COMSOL дает представление о работе устройства в зависимости от изготовления и выбранного материала.
Savla et al. (2004) математически смоделировали закрытие эпителиальной раны дыхательных путей при механической нагрузке на велосипеде. Часть моделирования была основана на модели in vitro культивированных клеток эпителиальных клеток дыхательных путей человека и кошек (AEC), используемой для изучения механизмов восстановления монослоя эпителия поврежденных дыхательных путей, подвергнутого циклической нагрузке. Математическое представление модели включало расширенное уравнение диффузии, объединяющее такие параметры, как коэффициент диффузии, коэффициент распространения и коэффициент распространения.Эти параметры в значительной степени влияют на закрытие раны и концентрацию клеток.
Одной из целей в будущем будет усовершенствование математических и компьютерных моделей устройства «легкое на чипе», а также автоматизация методов визуализации.
С другой стороны, компьютерные модели печени были разработаны в основном с целью анализа токсичности метаболитов лекарств. В некоторых исследованиях использовались многомасштабные подходы, такие как физиологические кинетические / динамические (PBK / D) модели, которые описывают перенос химических веществ в организме (Sala Benito et al., 2017). Эти модели часто сочетались с некоторыми уточнениями (Gubbels-van Hal et al., 2005) для оценки биодоступности и распределения химического вещества в анализе, чтобы улучшить оценки концентраций in vivo , путем экстраполяции в vitro (Sala Benito et al., 2017). Такой подход к моделированию полезен при оценке химического риска, когда важна приоритезация химических испытаний (Kramer et al., 2015; Bell et al., 2017). По возможности исследований in vitro, исследований были объединены с исследованиями in vivo, , чтобы подтвердить предложенный подход (Comenges et al., 2017).
Хотя анализы in vitro удобны для оценки механизмов токсичности, все еще существуют некоторые ограничения на анализы in vitro , которые делают невозможным полностью заменить исследований in vivo (Comenges et al., 2017). Эти ограничения в основном касаются различий, обнаруженных между экспериментами in vitro, и in vivo, (ложноположительные и отрицательные результаты, большая вариабельность между анализами, низкая чувствительность и т. Д.)) (Höfer et al., 2004; Lilienblum et al., 2008). По этой причине разрабатываются математические модели, которые определяют судьбу соединения в клеточном анализе в сочетании с моделью роста клеток (Comenges et al., 2017). Виртуальный клеточный анализ (VCBA) был разработан на основе лабораторных данных HTS (Zaldívar et al., 2010; Zaldívar and Baraibar, 2011) с целью описания динамических эффектов, поскольку кинетика уже описана моделями PBK (Sala Benito et al. , 2017). VCBA можно описать как основанную на процессе модель или математическое представление анализа in vitro для моделирования эффектов и судьбы химического вещества (Comenges et al., 2017). Модель VCBA (Comenges et al., 2017; Sala Benito et al., 2017) состоит из многих параметров, зависящих от физико-химических, экспериментальных, а также характеристик клеточной линии, но может быть разделена на четыре подмодели, которые описывают:
1. Модель судьбы и транспорта,
2. Модель разделения ячеек,
3. Модель роста и деления клеток,
4. Динамика клеток, включая модель токсичности и эффектов (рис. 3).
Рисунок 3 .Схематическое изображение модели VCBA.
Подмодель Fate and Transport рассчитывает зависящую от времени химическую концентрацию в анализе с использованием уравнений динамического баланса массы. Это означает, что включены несколько явлений (испарение, абсорбция пластиком, дегенерация, разделение химических веществ и т. Д.). Кроме того, подмодель разделения ячеек включает экстраполяцию уравнения модели ячейки, предполагая, что общая концентрация соединения может быть разделены на концентрации отсеков.Подмодель роста и деления клеток исследует четыре стадии G1, S, G2, M клеточного цикла, в то время как динамика клеток, включая подмодель токсичности и эффектов, включает влияние влияния концентрации химического вещества на выживаемость (с учетом смертности рейтинг) (Sala Benito et al., 2017).
Первоначально VCBA был построен в Matlab с целью изучения токсикологического воздействия химических веществ на клетки (Zaldívar et al., 2010; Zaldívar and Baraibar, 2011; Comenges et al., 2012).Позже он был адаптирован к языку R, чтобы сделать его бесплатным для конечных пользователей. Comenges et al. интегрировал код в среду Knime через узел R-KNIME (Comenges et al., 2017). Платформа KNIME Analytics (Berthold et al., 2009) была разработана как удобная и бесплатная графическая рабочая среда, которая поддерживает аналитику данных, которая включает управление данными и преобразование, исследование, а также визуализацию и отчетность. В этом смысле Benito et al. использовали платформу KNIME Analytics в качестве удобного инструмента для автоматизации генерации ключевых входных параметров в биокинетических моделях (Sala Benito et al., 2017).
Следует отметить, что модели VCBA также использовались при исследовании клеточных линий HepG2. Paini et al. исследовали многократное воздействие клеточных линий печени человека HepG2 (а также HepaRG) с целью оптимизации VCBA (Paini et al., 2017). Основное преимущество этого исследования заключается в том, что токсичность повторной дозы не подходит для исследований in vivo, и модели VCBA могут помочь сократить и оптимизировать время, затрачиваемое на оценку безопасности человека, когда дело доходит до аналогичных исследований. Кроме того, следует подчеркнуть, что все проекты были посвящены разработке вычислительных инструментов и прогнозных моделей для оценки безопасности химических веществ.Проект ЕС КОСМОС был одним из них. В рамках этого проекта было разработано 11 химических моделей PBK (Bois et al., 2017; Sala Benito et al., 2017). Модели COSMOS были вставлены в ранее упомянутые версии KNIME с двумя вариантами выполнения — локально, на настольном компьютере или удаленно, с использованием веб-браузера и KNIME WebPortal.
Встроенные системы
Organ-on-a-chip — это микрофлюидное устройство, которое имитирует поведение определенного органа или системы на микрочипе.За последние несколько лет несколько различных органов были разработаны с использованием технологии на кристалле (рис. 4).
Рисунок 4 . Органы на кристалле.
Основным преимуществом технологии «орган на чипе» является ее способность отображать структурную и функциональную сложность живых тканей и органов, в отличие от методов культивирования клеток in vitro и , которые не воспроизводят динамическое механическое и биохимическое микроокружение. Микроустройство «орган на чипе» имитирует микросистемы и обладает огромным потенциалом в качестве инновационной платформы для прогнозирования.
Легкое на чипе
Lung-on-a-chip, первоначально разработанная в Институте биологической инженерии Висса при Гарвардском университете, представляет собой микрофлюидное устройство, которое имитирует дыхание легких человека на микрочипе. Конструкция включает два слоя клеток легких, разделенных пористой мембраной и покрытых двумя каналами — верхним и нижним. Верхний канал представляет собой дыхательные пути и пропускает воздух. Нижний канал представляет собой кровеносные сосуды и обеспечивает кровоток. Имитация дыхания достигается с помощью вакуума, подаваемого в камеры, который создает циклическое механическое растяжение.Конструкция легкого на чипе представлена на рисунке 5.
Рисунок 5 . Схематическое изображение легкого на чипе.
Основная цель создания «орган на чипе», включая легкое, — сократить количество экспериментов на животных и в конечном итоге заменить их.
Устройство Lung-on-a-chip можно использовать для моделирования дыхания здорового легкого и для анализа взаимодействия наночастиц, которые образуются в результате загрязнения воздуха и воды и могут вызывать воспалительные процессы.Кроме того, можно испытать новые лекарства и методы лечения некоторых заболеваний легких, измерить токсичность новых лекарств и смоделировать рак легких.
Ху — один из основателей технологии «легкое на кристалле» (Huh, 2015). Он также создал модель легкого, сосредоточив внимание на альвеолярно-капиллярном интерфейсе — микрофлюидном устройстве как единице живого легкого человека. Модель состоит из двух камер, разделенных пористой мембраной. Верхняя камера содержит альвеолярные эпителиальные клетки, а нижняя камера содержит легочные микрососудистые эндотелиальные клетки.Верхняя камера заполнена воздухом, а нижняя — кровью. Боковые камеры используются для циклического вакуумного всасывания, чтобы вызвать циклическое растяжение, чтобы имитировать дыхательные движения и деформацию альвеолярно-капиллярного барьера (рис. 5).
Микроустройство обладает способностью воспроизводить свойства легких. Его можно использовать для лучшего понимания функции легких и моделирования легочных заболеваний (Metzger, 2018). Важнейшие процессы дыхания легких — это газообмен между альвеолой и капилляром.После установления функции газообмена микроприбор можно использовать для анализа токсичности, а также для анализа некоторых заболеваний легких. Эта модель может быть использована для анализа абсорбции наночастиц диоксида кремния и острой токсической реакции на абсорбцию наночастиц из-за растяжения альвеолярно-капиллярного барьера. Это позволяет сделать вывод, что дыхание увеличивает поглощение наночастиц
В лаборатории Wyss была разработана модель альвеолы на чипе для воспроизведения тромбоза легких.Чтобы моделировать внутрисосудистый тромбоз, фактор некроза опухоли (TNF-α) добавляли в верхнюю камеру. Цель заключалась в том, чтобы спровоцировать воспаление с участием цитокинов, которые предупреждают лейкоциты и частицы крови тромбоцитов. Эти частицы крови дополнительно вызывают образование тромбов. В институте Wyss было подтверждено, что проницаемость легких связана с концентрацией TNF-α (Jain et al., 2018). Использование LPS (липополисахаридов) вызвало тромбоз и вызвало воспаление из-за взаимодействия между альвеолярными эпителиальными и эндотелиальными клетками сосудов.В заключение, препарат Пармодулин уменьшил воспаление сосудов без повреждения эндотелия. Таким образом, одним из потенциальных применений технологии «легкое на чипе» является анализ тромбоза. Другой может быть анализ физиологических реакций во время острого астматического криза (Benam et al., 2015). С помощью микроаппарата можно анализировать различные типы заболеваний легких. Новые испытания лекарств на наблюдаемое заболевание можно проводить без использования животных и с меньшими затратами. Также можно проанализировать отек легких.Это состояние, при котором сгустки крови и жидкость заполняют легкие, вызванное сердечной недостаточностью или побочными эффектами лекарств от рака. Huh (2015) протестировал модель, представленную на рисунке 5, на отеке легких, и для этой цели в нижнюю камеру было введено лекарство от рака. Была замечена миграция жидкости и белков плазмы в верхнюю воздушную камеру, аналогичная побочному эффекту препарата. Как считалось, иммунная система не участвует в побочных эффектах утечки. Фактически, дыхание увеличивает утечку (Rojahn, 2012).Было обнаружено, что использование различных лекарственных препаратов-кандидатов, таких как препарат GlaxoSmithKline, может предотвратить утечку в системе микросхем (Rojahn, 2012). Небольшие дыхательные пути-на-чипе были разработаны для анализа воспаления легких и лекарственной реакции (Benam et al., 2015). Дыхательные пути-на-чипе были созданы путем посева первичных эпителиальных клеток дыхательных путей человека (hAEC) и первичных эндотелиальных клеток микрососудов легких человека на противоположных сторонах пористой мембраны. Эпителиальные клетки образовывали барьер за счет создания плотных контактов, которые обнаруживались по экспрессии ZO1, в то время как соединения эндотелиальных клеток наблюдались по экспрессии PECAM-1.Измерения проходимости дыхательных путей на чипе сравнивали с измерениями in vivo , чтобы подтвердить использование микроустройства. Электронно-микроскопический анализ подтвердил, что реснички на апикальной стороне имели ту же структуру, что и здоровые реснички, обнаруженные в легком живого человека in vivo (организация 9 + 2 микротрубочек). Реснички активно бьются в диапазоне частот [9–20 Гц]. Был измерен мукоцилиарный транспорт, и было обнаружено, что скорость частиц была почти идентична скорости, наблюдаемой в дыхательных путях легких здорового человека.Вывод состоит в том, что «дыхательные пути на чипе» можно использовать как представление о живом здоровом легком человека, а также при астме и хронической обструктивной болезни легких (ХОБЛ). IL-13 играет важную роль в развитии астмы, и его достаточно и необходимо для индукции аллергической астмы на животных моделях. Он участвует в воспалении дыхательных путей, гиперплазии бокаловидных клеток и гиперсекреции слизи, а также в создании субэпителиального фиброза и гиперчувствительности дыхательных путей. Увеличение количества бокаловидных клеток было замечено через 8 дней, когда небольшие дыхательные пути на чипе обрабатывали IL-3, как и в других моделях in vitro .Также были отмечены более высокая продукция воспалительных цитокинов G-CSF и GM-CSF в сосудистом канале и снижение частоты биения ресничек. Патогенные инфекции являются основной причиной обострения ХОБЛ у пациентов. Эпителиальные клетки дыхательных путей на чипе выстраивались либо с нормальными эпителиальными клетками, либо с эпителиальными клетками ХОБЛ, и обрабатывались вирусным миметиком поли (I: C) или липополисахаридным эндотоксином (LPS). Компонент бактериальной стенки, который имитирует производство цитокинов и широко используется для этой цели.Секреция цитокинов M-CSF была проанализирована, поскольку она способствует дифференцировке и выживанию макрофагов. С другой стороны, контролировалось производство IL-8, потому что IL-8 привлекает нейтрофилы. Стимуляция поли (I: C) способствовала секреции цитокинов IP-10 и RANTES как в здоровых чипах, так и в чипах с ХОБЛ. Помимо IP-10, который является отличным клиническим маркером, уровень M-CSF был повышен в чипе дыхательных путей, обработанном поли (I: C). По этой причине его можно использовать в качестве нового биомаркера обострений ХОБЛ, вызванных респираторными вирусами.Разработанные микрофлюидные модели дыхательных путей человека, страдающего астмой и ХОБЛ, могут быть в дальнейшем использованы для тестирования эффективности новых экспериментальных препаратов, а также для анализа механизма действия лекарств на молекулярном уровне.
Клетки из микроустройства «легкое на чипе» можно контролировать с помощью системы микроимпедансной томографии, которая может предоставить полезную информацию о клетках и условиях культивирования (Mermoud et al., 2018). Новая микроимпедансная томография (MITO) может быть интегрирована в легкое на чипе и позволяет в реальном времени контролировать целостность эпителиального барьера, расположенного на расстоянии 1 мм от электродов.Эта система успешно отслеживала в режиме реального времени изменения сопротивления эпителиального барьера легких.
Yang et al. разработали опухоли на кристалле с мембраной из нановолокна для электропрядения PLGA, толщина которой составляет около 3 мкм, которая является пористой и проницаемой для молекул (Yang et al., 2018). Был оценен препарат гефитиниб, противоопухолевый препарат, нацеленный на EGFR, и проанализирована устойчивость клеток A549 в совместной культуре с HFL1. Одной из причин может быть секреция IGF-1 клетками HFL1, которые после ингибирования активируют сигнальный путь PI3K / Akt и приводят к слабому ответу опухолевых клеток на химиотерапевтические препараты.Кроме того, клетки A549 вызывают апоптоз и гибель эндотелиальных клеток, что может в дальнейшем привести к распространению опухоли. Конечная цель авторов (Yang et al., 2018) — применить модель в персонализированном лечении опухоли легкого, что может иметь важное значение в будущих клинических исследованиях.
Печень на чипе
Основной причиной неэффективности возможных методов лечения после тестирования на животных является гепатотоксичность (Ho et al., 2006; Lee et al., 2015). Возможность использования «печенки на чипах» позволяет избежать этого этапа.Концепция «орган на чипе» зародилась как способ имитации тканей и органов путем построения сетей, состоящих из нескольких функциональных единиц, соединенных многоканальными связями (Baker, 2011; Bhatia and Ingber, 2014; Esch et al., 2015). Однако считается, что клетки печени являются одними из самых сложных клеточных линий для поддержания жизни в чашке Петри (Domansky et al., 2013), и способ имитации их нормальной среды имеет решающее значение для увеличения продолжительности их жизни. Паркер и др. (2008) показали, что клетки печени размножаются и их метаболическая активность увеличивается, когда мезенхимальные клетки из плаценты человека помещают вместе с клетками печени.Самым важным параметром в этом процессе является соотношение между двумя вышеупомянутыми типами клеток. Микрожидкостным устройствам клеточной линии уделяется все внимание из-за преимущества небольшого размера и контроля потока (Sia and Whitesides, 2003). Некоторые начальные попытки практического применения встроенных систем в тканевой инженерии включали изучение измерений импеданса, чтобы определить, где находятся определенные клеточные агрегаты в биологически релевантной трехмерной среде (Canali et al., 2015). В нормальной биологической среде клетки окружены гидрогелеподобным внеклеточным матриксом (ЕСМ), состоящим из белков (Canali et al., 2015). Когда индуцируется переменное электрическое поле, клетки и ткани проявляют сложное поведение, которое в основном зависит от частоты (Yang et al., 1999). Это было основным предположением, лежащим в основе исследования Canali et al. (2015), которые выполнили моделирование методом конечных элементов (КЭ) для изучения измерения импеданса 4Т. Они представили высокую плотность человеческих клеток HepG2, инкапсулированных в желатин, с помощью искусственных трехмерных клеточных конструкций и хотели определить распределение поля чувствительности в зависимости от сочетания токоведущих (CC) и датчиков напряжения (PU) электродов.Моделирование проводилось в программном обеспечении COMSOL Multiphysics и показало, что этот метод подходит для зондирования на основе импеданса с применением при формировании биоискусственных органов (Canali et al., 2015).
Микро изготовленные устройства были исследованы с различными кремниевыми и полидиметилсилоксановыми (PDMS) субстратами, чтобы использовать их для культивирования гепатоцитов в мембранных биореакторах (De Bartolo et al., 2000; Ostrovidov et al., 2004), мульти- слоистые полимерные структуры (Leclerc et al., 2004), а также устройства, включающие системы доставки кислорода и питательных веществ, сопровождаемые онлайн-мониторингом (Powers et al., 2002; Lee et al., 2006). Ho et al. (2006) удалось воссоздать дольку печени (функциональная единица печени) на микрофлюидном чипе с помощью диэлектрофореза. Weng et al. (2017) удалось разработать устройство без каркаса, в первую очередь потому, что технологии на основе каркаса имеют серьезные ограничения (например, внутренняя стабильность каркаса или непредсказуемые эффекты на пути передачи сигналов).
Очень важным, уже упомянутым аспектом систем на чипе является соответствующее распределение питательных веществ, при котором неравномерное распределение и напряжения сдвига по всей области каркаса могут уменьшить колонизацию клеток и повлиять на качество регенерированной ткани (Podichetty et al., 2015) . С этой целью были исследованы биореакторы с осевым потоком (также называемые перфузионными биореакторами) для определения оптимальной скорости потока (Gardel et al., 2013), диаметров входа и выхода, а также поверхности каркаса для культивирования гепатоцитов (Leclerc et al., 2004). Утверждается, что цели вышеупомянутых исследований заключаются в регенерации кости (Azuaje, 2010), сердечной заплате (Dvir et al., 2006) и брюшной стенке (Pu et al., 2010). В некоторых исследованиях моделирования использовалась вычислительная гидродинамика (CFD), чтобы получить представление о гидродинамике и распределении питательных веществ в биореакторах (Cioffi et al., 2006; Wendt et al., 2008; Patrachari et al., 2012). Они использовали либо многомасштабный подход к моделированию континуума (Causin et al., 2013), либо модель Больцмана-решетки (Spencer et al., 2013). Их подход с использованием моделирования полезен, но основным недостатком исследования является отсутствие экспериментальной проверки (Podichetty et al., 2015). Они изучили характеристики распределения питательных веществ из-за влияния неидеального потока на регенерацию тканей (Podichetty et al., 2015). Результаты моделирования CFD и модели дисперсии были подтверждены экспериментами по потреблению питательных веществ (Podichetty et al., 2015). Метаболически очень активные клетки HepG2 были засеяны на хитозан-желатиновые (CG) каркасы, и результаты показали, что in vitro позволяет контролировать регенерацию ткани с помощью такого рода моделирования.Это представляет собой шаг вперед к пониманию влияния механических стимулов на трехмерную культуру клеток (Podichetty et al., 2015).
Исследовательская группа из Universitätsklinikum Jena, Германия, разработала печень на чипе. Они исследовали паттерны активации макрофагов при воспалительных реакциях, чтобы контролировать бактериальные инфекции. Модель «печень на чипе» с микрофлюидной перфузией была сделана для изучения инфекций печени. Со всеми основными типами клеток печени человека на этом чипе и имитацией микрофизиологической среды этот чип можно использовать для изучения связанных с воспалением молекулярных процессов нарушения функции печени и связанных с макрофагами процессов восстановления тканей, подверженных воспалительным состояниям. .В частности, эта исследовательская группа использовала описанную систему «печень на чипе» для изучения патогенеза инфекций Staphylococcus aureus и инфекций, вызываемых Candida albicans , а также для лечения заболеваний печени, связанных с сепсисом, с использованием функционализированных наночастиц. Схематическое изображение печени на чипе показано на рисунке 6.
Рисунок 6 . Схематическое изображение печени-на-чипе.
Многотипная модель клетки на бедре была изготовлена Jie et al.(2016) для реконструкции физиологической кинетики лекарств путем посева клеток Caco-2, HepG2 и U251 (они использовались для имитации кишечника, печени и глиобластомы соответственно). Полное описание микрожидкостного микрочипа было дано Jie et al. (2016), где клетки Caco-2 служили тканью кишечника для всасывания пероральных лекарств. Клетки HepG2, как эквивалент печени, помещали под линией клеток Caco-2. Клетки U251, как компартмент глиобластомы, были связаны с единицей клеток HepG2 с помощью массива узких каналов (Jie et al., 2016). Можно сказать, что все это имитирует in vivo 3D-микроокружение и исследует функции абсорбции, метаболизма и реакции лекарств в создаваемом микросреде с возможным применением в персонализированной терапии рака (Jie et al., 2016). Другие исследователи также изучали микрофлюидные чипы (Huh et al., 2012; Ramadan et al., 2013). Imura et al. (2013) моделировали распределение лекарств и процессы выведения в динамической микрофлюидной системе, а Maschmeyer et al. (2015) установили микрофизиологическую мультиорганную систему для длительного совместного культивирования.В исследовании Zhang et al. (2008) также необходимо упомянуть, так как это исследование специально посвящено микрофлюидной среде, разработанной для улучшенной культуры клеток гепатоцитов in vitro . Моделирование методом конечных элементов, смоделированное с помощью COMSOL, было выполнено для изучения влияния непрерывной перфузии на потребление глюкозы клеткой HepG2 (Zhang et al., 2008). Результаты показывают, что предлагаемый метод подходит для производства микрофлюидных устройств с условиями массопереноса, а также обсуждают влияние на поддержание биологической функции и дифференцированного фенотипа (Zhang et al., 2008).
Кроме того, конструкции, которые состоят из взаимосвязанных отсеков, позволяют исследовать, как различные типы клеток и органы общаются и взаимодействуют в смысле взаимозависимых клеточных ответов. Теобальд и др. исследовали упрощенную модель «печень-почка-на-чипе» и пришли к выводу, что комбинированная модель «печень-почка» подходит для начального определения токсических эффектов, опосредованных печенью. Они показали, что клетки печени, растущие в больших количествах в микрофлюидных условиях, экспрессируют биомаркеры, связанные с метаболизмом (Theobald et al., 2017). Исследование токсичности афлатоксина B1 (AFB1) и бензоальфапирена (BαP) показало важность изучения нескольких органов в микрофлюидных устройствах для целей тестирования in vitro на токсичность и скрининга лекарств (Theobald et al., 2017). Chang et al. разработали интегрированную микрофизиологическую систему печень-почка (MPS) для выявления нефротоксичных химических веществ, метаболизируемых печенью, с использованием связанных функций «печень на чипе» и «почка на чипе» (Chang et al., 2016). Их результаты показывают важную особую цель биотрансформации печени в исследованиях токсичности и валидации in vitro и in vivo сравнений моделей (Chang et al., 2016).
Выводы
Многие ученые скептически относятся к дальнейшему совершенствованию систем «орган на чипе» и замене экспериментов на животных, потому что человеческий организм очень сложен по структуре и функциям, и они не верят, что «орган на чипе» может включать все параметры окружающей среды. Это правда — «легкое на чипе» — это не настоящее легкое, но может быть определенная польза от нахождения более подробной информации о конкретных заболеваниях легких. Тестирование новых лекарств перед испытанием их на животных может принести пользу.Эксперименты на животных должны соответствовать этическим требованиям и не могут быть связаны с легкими человека во всех аспектах (Benam et al., 2015). Например, в легких мыши и крысы реже встречаются клетки, продуцирующие муцин, которые важны для развития астмы. Воспаление легких включает сложные тканево-тканевые взаимодействия между клетками эпителия дыхательных путей легких и клетками эндотелия микрососудов, которые активируют иммунную систему — задействуют иммунные клетки, такие как нейтрофилы. Эти процессы можно моделировать с помощью микрофлюидного устройства типа «легкое на чипе».Помимо регулярного поведения легких, эти микрофлюидные устройства можно использовать для сбора информации и новых знаний о заболеваниях легких, а также для тестирования новых подходов к лекарствам и лечения.
Что касается исследований клеточной линии печени, сообщалось, что вызванное лекарственным средством поражение печени (гепатотоксичность) является наиболее частой причиной задержки клинической фазы разработки лекарственного средства и даже отмены одобренного лекарственного препарата (Bies et al. др., 2006). В отличие от других органов человека, печень обладает замечательной способностью к регенерации.Наряду с физиологическим значением и пластичностью этого органа, исследование печени позволяет лучше понять физиологию человека, болезни и реакцию на экзогенные соединения. Кроме того, основной проблемой при создании микрофлюидных устройств для печени является сложность самой печени. Из-за своей сложности и множества функций в сочетании с различными типами клеток и определенной конструкции печень очень трудно моделировать. Таким образом, главное удобство печенки-на-чипе заключается в ее способности воспроизводить микроскопические детали, что важно для будущих исследований (Lee et al., 2015). Как только улучшат печень на чипсах, вылечить множество заболеваний (например, гепатит B, гепатоцеллюлярную карциному) станет проще.
Авторские взносы
Все перечисленные авторы внесли существенный, прямой и интеллектуальный вклад в работу и одобрили ее к публикации.
Финансирование
Это исследование финансировалось Европейским проектом h3020 PANBioRA [номер гранта 760921-2] и грантами Министерства образования, науки и технологического развития Сербии [номер гранта III41007 и номер гранта OI174028].
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Сноски
Список литературы
Ахлувалия, А., Мисто, А., Воцци, Ф., Мальяро, К., Маттеи, Г., Марескотти, М. К., и др. (2018). Системное и сосудистое воспаление в модели in vitro центрального ожирения. PLOS ONE .13: e0192824. DOI: 10.1371 / journal.pone.0192824
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Андерссон, Т. Б., Канебрат, К. П., и Кенна, Дж. Г. (2012). Клеточная линия HepaRG: уникальный инструмент in vitro для понимания метаболизма и токсикологии лекарств у человека. Мнение эксперта. Drug Metab. Toxicol. 8, 909–920. DOI: 10.1517 / 17425255.2012.685159
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Анжер, Н. (2017).Physiologie. Le foie, cet organe à tout faire. Courrier International (The New York Times).
Банга А., Вицманн Ф. А., Хориа И. П. и Блейзер-Йост Б. Л. (2012). Функциональные эффекты воздействия наночастиц на эпителиальные клетки дыхательных путей Calu-3. Cell. Physiol. Biochem. 29, 197–212. DOI: 10.1159 / 000337601
CrossRef Полный текст | Google Scholar
Белл, С. М., Чанг, X., Вамбо, Дж. Ф., Аллен, Д. Г., Бартельс, М., Брауэр, К. Л. и др.(2017). In vitro — in vivo экстраполяция для определения приоритетов и принятия решений с высокой пропускной способностью. Toxicol. In Vitro . 47, 213–227. DOI: 10.1016 / j.tiv.2017.11.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бенам К. Х., Вилленаве Р., Луччеси К., Вароне А., Хубо К., Ли, Х. Х. и др. (2015). Небольшие дыхательные пути-на-чипе позволяют анализировать воспалительные реакции легких и лекарственные препараты in vitro . Nat.Методы 13, 151–157. DOI: 10.1038 / nmeth.3697
CrossRef Полный текст | Google Scholar
Бертольд, М. Р., Себрон, Н., Дилл, Ф., Габриэль, Т. Р., Кёттер, Т., Мейнл, Т. и др. (2009). KNIME — майнер информации Konstanz: версия 2.0 и выше. AcM SIGKDD Explorations Newsletter 11, 26–31. DOI: 10.1145 / 1656274.1656280
CrossRef Полный текст | Google Scholar
Бис Р. Р., Наварро В. Дж. И Сеньор Дж. Р. (2006). Гепатотоксичность, связанная с лекарствами. J. Clin. Pharmacol. 46, 1052–1053. DOI: 10.1177 / 0091270006292979
CrossRef Полный текст
Bois, F. Y., Ochoa, J. G. D., Gajewska, M., Kovarich, S., Mauch, K., Paini, A., et al. (2017). Подходы к многомасштабному моделированию для оценки безопасности косметических ингредиентов. Токсикология 392, 130–139. DOI: 10.1016 / j.tox.2016.05.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баума, М. Э., Рожье, Э., Вертье, Н., Лабарр, К.и Фельдманн Г. (1989). Дальнейшее клеточное исследование клеточной линии HepG2, происходящей от гепатобластомы человека: морфология и иммуноцитохимические исследования белков, секретируемых печенью. Клетка in vitro. Devel. Биол. 25, 267–275. DOI: 10.1007 / BF02628465
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Канали, К., Маццони, К., Ларсен, Л. Б., Хейсканен, А., Мартинсен, Ø. Г., Вольф А. и др. (2015). Метод импеданса для пространственного восприятия трехмерных клеточных конструкций — применение в тканевой инженерии. Аналитик 140, 6079–6088. DOI: 10.1039 / C5AN00987A
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каузин П., Сакко Р. и Верри М. (2013). Многомасштабный подход к вычислительному моделированию биофизической среды при искусственной регенерации хрящевой ткани. Biomech. Модель. Механобиол. 12, 763–780. DOI: 10.1007 / s10237-012-0440-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чанг, С. Я., Вебер, Э. Дж., Несс, К. В., Итон, Д. Л., и Келли, Э. Дж. (2016). Печень и почки на чипах: микрофизиологические модели для понимания функции транспортера. Clin. Pharmacol. Терапия. 100, 464–478. DOI: 10.1002 / cpt.436
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чоффи М., Боскетти Ф., Раймонди М. Т. и Дубини Г. (2006). Оценка моделирования гидродинамической микросреды в тканевых конструкциях: модель на основе микро-компьютерной томографии. Biotechnol.Bioeng. 93, 500–510. DOI: 10.1002 / бит.20740
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Обучение в гетерогенных классах
Обучение в гетерогенных классах
ED284
Обучение в неоднородных классах
Winter Quarter, 2002
Понедельник 15:15 18:05
CERAS 300-302-204
Преподаватели:
Рэйчел А. Лотан | Джордж Банч Часы работы: по приб. Телефон: 723-3893 [email protected] | Джули Гейнсбург Часы работы: по апп. Телефон: 938-7593 [email protected] |
Обучение пониманию — сложное дело. Более того, обеспечение того, чтобы все учащиеся имели доступ к академически сложным учебным задачам и к участию с равным статусом, является особенно важной педагогической целью.В этом курсе мы узнаем, как организовать класс и как поддержать учащихся, когда они решают интеллектуально сложные и лингвистически насыщенные учебные задачи в разнородных классах. Для этого класса мы определяем разнородные классы как классы, в которых учащиеся имеют широкий диапазон предыдущих академических достижений и различные уровни устной и письменной речи на языке обучения.
Для таких классов групповая работа является настоятельно рекомендуемой и хорошо задокументированной стратегией обучения.Мы узнаем, как организовать класс и подготовить студентов к групповой работе; как уравнять участие членов группы; как разрабатывать учебные задания, поддерживающие концептуальное понимание, овладение содержанием и языковое развитие; и как оценивать групповые продукты, а также индивидуальный вклад. Мы обсудим взаимосвязь между обучением в малых группах и другими структурами участия в классе, а также оптимальный баланс различных учебных стратегий и учебных шагов.
Курс включает в себя самые разные виды деятельности: моделирование групповых заданий; использование специалистов по развитию навыков для выработки совместных норм в классах; ролевые игры; тематические обсуждения созданных учителем кейсов об их опыте групповой работы; анализ аудиторных видеофильмов; и «семинар» по разработке настоящего группового задания.
Вы проведете заключительный проект в собственном классе с коллегой по STEP. К этой программе прилагается описание финального проекта, а также критерии оценки.
Обязательная литература:
Элизабет Г. Коэн, 1994. Разработка групповой работы: стратегии для неоднородной классной комнаты , 2-е издание, Нью-Йорк: издательство Teachers College Press.
Shulman, Lotan, and Whitcomb (Eds.), 1998. Групповая работа в различных классах: справочник для преподавателей, New York: Teachers College Press
Valdés, Guadalupe, 2001. Изучение и не изучение английского языка: латиноамериканские студенты в американских школах, TC Press.
Кроме того, в программу для чтения курса включены избранные статьи и компакт-диск с совместными усилиями по развитию навыков и ролевыми играми для использования в классе.
1/14 Организация и управление классом для групповой работы:
Делегирование полномочий, совместные нормы и роли учащихся
Развитие навыков : много островов / много точек
Видео : Как заставить групповую работу работать
Привлечение к ответственности групп и отдельных лиц
Обсуждение случая : Инерция одной группы
Показаний:
Шульман, Лотан и Уиткомб (ред.), 1998. Groupwork in Diversity Classrooms: A casebook for Educators, New York: Teachers College Press, Introduction, pp 1-10
Коэн, Элизабет Г. 1994. Разработка групповой работы: стратегии для разнородных классных комнат , Нью-Йорк: издательство Teachers College Press. Главы 6 и 7.
(—) Инерция одной группы. 1998. в Shulman, JH, Lotan, R.A., and Whitcomb, J.A. (Ред.) Работа в группах в разных классах: справочник для педагогов . Нью-Йорк: Издательство педагогического колледжа.
Срок сдачи первого задания 1/25
Передача полномочий: я и мой класс
1/21 Без класса
1/28 Проблемы статуса в классе
Создатель навыков: Обсуждение космического корабля
Видео : Статус: Часть I
Чтений:
Коэн, Элизабет Г. 1994. Разработка групповой работы: стратегии для разнородных классов , Нью-Йорк: издательство Teachers College Press.Главы 3, 8 и 10.
Стил, Клод. Угроза в воздухе: как стереотипы формируют интеллектуальную идентичность и производительность, Американский психолог , июнь 1997 г., стр. 613-629
Valdés, Guadalupe, 2001. Изучение и не изучение английского языка: латиноамериканские студенты в американских школах, TC Press. стр 2-28, 127-143
Штернберг, Роберт. 1996. Мифы, контрмифы и правда об интеллекте, Исследователь в области образования , Vol. 25, No. 2, pp. 11-16.
Рекомендовано: Cohen, E.G. и Лотан, Р.А., 1995. Обеспечение равноправного взаимодействия в гетерогенном классе , American Educational Research Journal , 32, 99-120.
2/4 Обработка статуса: лечение множественных способностей и присвоение компетенции
Видео : Лечение статуса, части 2 и 3
Разработка ориентации на множественные способности
Обсуждение случая : «Шанс, который я ждал За;» «Тишина»
Показаний:
Гарднер, Ховард.Ноябрь 1995, Размышления о множественном интеллекте, Phi Delta Kappan, pp. 200-209
Штернберг, Роберт. 1998. Способности — это формы развития опыта. Исследователь в области образования, Vol. 27, № 3, с. 11-20
Valdés, Guadalupe, 2001. Изучение и не изучение английского языка: латиноамериканские студенты в американских школах, TC Press. стр 84-126
(—) Шанс, которого я ждал, и (—) Молчание,
1998. В Шульман, Дж.Х., Лотан Р.А., Уиткомб Дж. (Ред.) Работа в группах в разных классах: справочник для педагогов . Нью-Йорк: Издательство педагогического колледжа.
Срок сдачи второго задания — 25 февраля
Проблемы со статусом: как их распознать, когда я их увижу?
2/11 Конструктивные особенности продуктивных групповых задач
Анализ групповой работы с несколькими способностями (в тематических группах)
Практикум: Разработка неограниченных задач с несколькими возможностями
Показания :
Лотан, Рэйчел А.1997. Принципы принципиальной учебной программы, Коэн и Лотан (ред.) Работа за равенство в гетерогенных классах: социологическая теория в действии . Нью-Йорк: Издательство педагогического колледжа.
Коэн, Элизабет Г. 1994. Разработка групповой работы: стратегии для разнородных классов , Нью-Йорк. Teachers College Press, Глава 5,
2/18 Без класса
2/25 Условия для развития академического дискурса в лингвистическом
разнородные классы
Анализ возможностей овладения языком в условиях групповой работы
Чтений:
Бартоломе, Лилия I., Неправильное обучение академическим дискурсам. Политика
языка в классе, Westview Press. Понимание академического
Дискурсы стр. 1-15
Valdés, Guadalupe, 2001. Изучение и не изучение английского языка: латиноамериканец
Студенты в американских школах, TC Press. пп 144 159
TESOL, 1997. Стандарты ESL для дошкольников. (для текста стандартов
см. www.tesol.edu)
3/4 Развитие устной и письменной академической речи: вспомогательный предмет
овладение и рост и развитие английского языка.
Чтений :
Карраскильо, Анджела Л. и Вивиан Родригес, 1995. Учащиеся из числа меньшинств, принадлежащие к языковым меньшинствам, в общеобразовательной школе, Multilingual Matters Ltd., стр. 75-89
Маккей, Сандра Ли и Вонг, Сау-Линг Синтия, 1996. Множественные дискурсы, множественные идентичности: инвестиции и участие в изучении второго языка среди китайских студентов-иммигрантов-подростков, Harvard Educational Review , Vol. 66, № 3
Фрадд, Сандра Х.и Ли, Окхи, Роли учителей в продвижении научных исследований с учащимися из разных языков, Исследователь образования , август, сентябрь 1999 г., стр. 14-20
3/11 Как мы узнаем, что они знают? Оценка в групповой работе и оценивание
работы изучающих английский язык
Чтений:
Уэбб, Норин, лето 1995 г., Групповое сотрудничество в оценке: множественные цели, процессы и результаты, EEPA , vol.17, № 2, стр 239–261.
Де ла Лус Рейес, М. и Джон Дж. Халькон. 2001. Лучшее для наших детей: Критические перспективы грамотности для латиноамериканских студентов , TC Press: New York Chp. 11 и 12,
с. 185-212
Третье назначение — 15 марта
Описание ученика ELL
3/15 Оценка групповой работы в классе: сбор данных
Практика навыков наблюдения
Показаний :
Элизабет Г.Cohen, 1994, Разработка групповой работы: стратегии для разнородных
кабинеты, NY. Teachers College Press, Глава 9
(—) Дополнительная аудитория критиков, (1998) In Shulman, J.H., Lotan, R.A.,
и Whitcomb, J.A. (Ред.) Работа в группах в разных классах: справочник
для педагогов . Нью-Йорк: Издательство педагогического колледжа.
Модели кооперативного обучения: академическая полемика
Симуляция академической полемики: отслеживающая дискуссия
* * * * * * * *
Показаний:
Джонсон, Дэвид В.и Джонсон, Роджер Т. 1995. Структурирование академической полемики,
в С. Шаран (ред.) Справочник по методам совместного обучения, Вестпорт,
Коннектикут: Greenwood Press.
Модели кооперативного обучения: структурный подход и групповое исследование
Чтений:
Каган, Спенсер и Каган, Мигель. 1995. Структурный подход: шесть ключей к совместному обучению. В С. Шаран (ред.) Справочник по методам совместного обучения, Вестпорт, Коннектикут: Greenwood Press.
Шаран, Яэль и Шаран, Шломо. 1995. Групповое исследование в кооперативном классе, В С. Шаран (ред.) Справочник по методам кооперативного обучения, Вестпорт, Коннектикут: Greenwood Press .
3/18 Были все вместе: Имитация урока групповой работы
Чтений:
(—) Были все вместе, 1998. В Шульман, Дж. Х., Лотан, Р. А., и
Уиткомб, Дж. (Ред.) Работа в группах в разных классах: справочник для
Педагоги .Нью-Йорк: Издательство педагогического колледжа.
Окончательный проект до 25 марта 2002 г.
.