Линекс® экспертный подход к решению любых ситуаций для восстановления баланса микрофлоры
Москва. 30 июля 2015 г. Компания «Сандоз» расширяет линейку препаратов Линекс® — лидера безрецептурного портфеля компании и пробиотика №1 в России.*
Пробиотики являются одной из наиболее динамично развивающихся категорий на мировом фармацевтическом рынке. Связано это с тем, что характер питания населения развитых стран изменился: в рационе большинства современных горожан преобладают продукты, подвергшиеся рафинированию, термической обработке или замораживанию, генной модификации для улучшения вкусовых качеств и продления срока годности. Поэтому пробиотики – препараты, позволяющие поддерживать в норме состояние микрофлоры и здоровье желудочно-кишечного тракта – все чаще используются как в лечебных, так и в профилактических целях. Мировой рынок производства пробиотиков растет ежегодно на 7%. По данным Euromonitor, к 2017 году он составит 33,5 млрд евро1.
По данным Euromonitor, к 2017 году он составит 33,5 млрд евро1.
Линекс® хорошо известен российским врачам и потребителям благодаря высочайшему качеству и широкой линейке препаратов, в которой каждый сможет найти для себя оптимальный вариант пробиотика. В июле 2015 году, помимо всеми любимого Линекс® и Линекс для детей®, линейка пополнилась новинкой — Линекс® Форте. Новинка содержит комплекс из 2-х наиболее изученных бактерий BB-12 и LA-5 в высокой концентрации,что позволяет принимать от одной капсулы в день. что особенно удобно для проведения курсов лечения.Входящие в состав препарата пробиотические штаммы подавляют рост патогенных бактерий и оказывают благотворное влияние на состав кишечной микробиоты (микрофлоры).
Нормальная микрофлора снижая активность болезнетворных микроорганизмов, подавляет патогенные, гнилостные и газообразующие бактерии. Кроме того представители кишечной микробиоты принимают участие в жировом и пигментном обмене, стимулируют иммунную систему, принимают активное участие в переваривании пищи. Микробиоценоз желудочно-кишечного тракта – а это приблизительно 100 триллионов микроорганизмов (от 1013 до 1014) весом около 1,5 кг у взрослого человека – в значительной степени определяет состояние здоровья человека, являясь, по существу, органом, ответственным за ряд ключевых метаболических процессов в организме1-3. Но существует множество факторов, оказывающих негативное влияние на микробиоту кишечника и приводящих к дисбалансу. Это особенности питания, заболевания органов пищеварения, кишечные инфекции, применение антибактериальных препаратов4. Для коррекции состояния кишечной микробиоты при различных патологических состояниях: дисбиозах, диареях различного происхождения, Clostridium difficile ассоциированных инфекциях и др. – используются препараты-пробиотики.
Микробиоценоз желудочно-кишечного тракта – а это приблизительно 100 триллионов микроорганизмов (от 1013 до 1014) весом около 1,5 кг у взрослого человека – в значительной степени определяет состояние здоровья человека, являясь, по существу, органом, ответственным за ряд ключевых метаболических процессов в организме1-3. Но существует множество факторов, оказывающих негативное влияние на микробиоту кишечника и приводящих к дисбалансу. Это особенности питания, заболевания органов пищеварения, кишечные инфекции, применение антибактериальных препаратов4. Для коррекции состояния кишечной микробиоты при различных патологических состояниях: дисбиозах, диареях различного происхождения, Clostridium difficile ассоциированных инфекциях и др. – используются препараты-пробиотики.
По словам директора по корпоративным связям компании «Сандоз» Юрия Головатчика, новинка станет значимым подспорьем в лечении ряда болезней:
«В состав пробиотика Линекс® Форте в суточной дозировке входят 2 хорошо изученные бактерии, являющие представителями нормальной микрофлоры кишечника — лакто- и бифидобактерии. Бактерии, содержащиеся в капсулах Линекс® Форте, нормализуют и поддерживают физиологический баланс кишечной микрофлоры во всех отделах кишечника. Линекс® Форте показан для профилактики и лечения дисбактериоза кишечника, симптомами которого могут быть диарея, запоры, нарушение пищеварения, тошнота, метеоризм, отрыжка и кожные аллергические реакции».
Бактерии, содержащиеся в капсулах Линекс® Форте, нормализуют и поддерживают физиологический баланс кишечной микрофлоры во всех отделах кишечника. Линекс® Форте показан для профилактики и лечения дисбактериоза кишечника, симптомами которого могут быть диарея, запоры, нарушение пищеварения, тошнота, метеоризм, отрыжка и кожные аллергические реакции».
Д.м.н., профессор, заведующая кафедрой пропедевтики детских болезней Педиатрического факультета Первого Московского государственного медицинского университета (Первого МГМУ) им. И.М. Сеченова, Светлана Ильинична Эрдес отметила: «Кишечник не напрасно называют «вторым мозгом» человека. Наше здоровое состояние во многом зависит от микрофлоры кишечника, основы основ слаженной работы организма. Именно поэтому пробиотики препараты, дающие возможность поддерживать в норме бактериальный состав кишечника – так важны в жизни современного человека. Погрешности в питании, стресс, прием антибиотиков и множество других факторов могут привести к нарушению состава кишечной микробиоты. Широкая линейки Линекс® позволяет подобрать каждому пациенту подходящий для него робиотик в любой ситуации нарушения микрофлоры!
Широкая линейки Линекс® позволяет подобрать каждому пациенту подходящий для него робиотик в любой ситуации нарушения микрофлоры!
О компании «Сандоз»
Компания «Сандоз», дженериковое подразделение группы компаний «Новартис», является лидером в отрасли воспроизведенных лекарственных средств и постоянно стремится к повышению уровня доступности высококачественной медицинской помощи для пациентов. «Сандоз» располагает штатом свыше 26 000 сотрудников по всему миру. Компания поставляет широкий спектр доступных по цене лекарственных препаратов пациентам в разных странах мира.
Достигнув объема продаж в 9,6 млрд. долларов США в 2014 г. и обладая портфелем лекарственных средств, состоящим из более чем 1100 химических соединений, компания «Сандоз» занимает лидирующую позицию в мире как в области биоаналогов, так и на рынке противоинфекционных и офтальмологических дженериков, а также дженериков применяемых в трансплантологии. Кроме того, компания «Сандоз» является одним из мировых лидеров на рынке дженериков в таких ключевых терапевтических областях как: инъекционные и дерматологические препараты, препараты для лечения заболеваний дыхательной, центральной нервной, сердечно-сосудистой и пищеварительной систем, метаболических нарушений и болевых синдромов.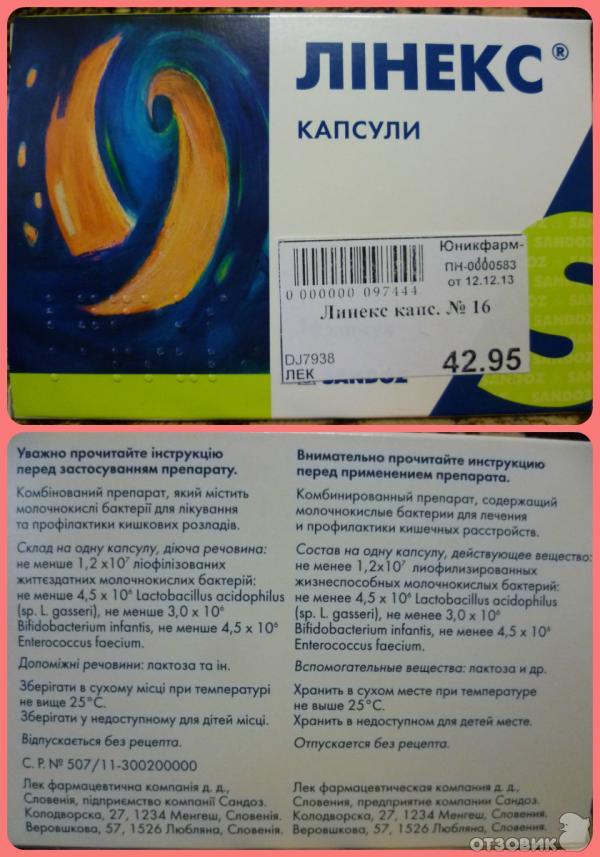
Компания «Сандоз» разрабатывает, производит и продает лекарственные средства, а также фармацевтические и биотехнологические активные субстанции действующих веществ. Около половины портфеля препаратов «Сандоз» состоит из различных категорий лекарственных средств, более сложных в разработке и производстве, чем стандартные дженерики.
Начиная с 2003 года, когда компания консолидировала различные направления производства дженериков под брендом «Сандоз», мы наблюдаем высокий естественный рост бизнеса за счет увеличения продаж. В дополнение к этому, рост обусловлен рядом целевых приобретений, которые компания «Сандоз» осуществила в различных регионах и направлениях бизнеса, в том числе «Гексал» (Германия), «Эбеве Фарма» (Австрия) и «Фуджера Фармасьютикалс» (США).
Компания «Сандоз» представлена в Twitter. Подписывайтесь на новости компании по ссылке http://twitter.com/Sandoz_Global.
**По продажам в упаковках по данным ООО “АЙ ЭМ ЭС Хэлс”, январь-декабрь 2014
Amann R, Fuchs BM.
 Nat Rev Microbiol 2008; 6:339.
Nat Rev Microbiol 2008; 6:339.Zhao L. Nature Review. Microbiology, Sept 2013; 11:639-47
O’Hara AM&Shanahan F. Best Practice / Research Clinical Gastroenterology 2014; 28:585-97
Приказ N 231 от 9 июня 2003 г. Об утверждении отраслевого стандарта «Протокол ведения больных. Дисбактериоз кишечника»
Чем нас лечат: Линекс. Препарат от несуществующей болезни
Авторы другого обзора, уже 2015 года, изучили, могут ли пробиотики предотвращать диарею у детей после приема антибиотиков. Ответ и здесь оказался положительным, причем для 22 из 23 исследований. Однако наилучших отзывов удостоились штаммы Lactobacillus rhamnosus и Saccharomyces boulardii (один из штаммов дрожжей), а не те штаммы, которые содержатся в Линексе.
Болезни «дисбактериоз» не существует. Лечит ли Линекс хоть что-то?
С профилактикой последствий приема антибиотиков более-менее разобрались. А вот помогут ли пробиотики (и йогурты с бифидобактериями) от уже начавшихся заболеваний?
Если речь идет о той же инфекционной диарее, еще один кохрейновский обзор подтверждает, что использование пробиотиков вместе с обильным питьем, чтобы снизить обезвоживание, сокращает течение заболевания в среднем на 25 часов, и риск, что оно не пройдет на четвертый день применения, также сократился. Авторы отмечают, что следует подробно разработать дозировку и назначения конкретных пребиотиков при разных состояниях пациентов.
Авторы отмечают, что следует подробно разработать дозировку и назначения конкретных пребиотиков при разных состояниях пациентов.
Что касается продолжительной (длительностью от 14 дней) диареи у детей, здесь ситуация намного более спорная. Научных доказательств того, что пробиотики как-то помогут, слишком мало, чтобы сделать выводы на их основе. Лучше прибегнуть к традиционному лечению и устранить инфекцию, тогда и диарея пройдет.
На вопрос, как прием пробиотиков влиял на течение псевдомембранозного колита, вызванного все той же злосчастной клостридией, правильный ответ прост: никак. По крайней мере, если не убивать самих Clostridium difficile антибиотиками, от бифидобактерий и прочих пробиотиков никакого толку точно не будет, да и доказательств эффективности комбинированного с антибиотиками приема тоже практически нет. То же касается и других типов колитов (например, язвенного).
Сомнительны и доказательства какой-либо пользы пробиотиков для лечения острых проявлений болезни Крона и поддержания состояния ремиссии.
Следует ли из этого, что все производители пробиотиков врут? Нет. Тот же Линекс честно признает, что является биологически активной добавкой, а не лекарственным средством. Правда, только в своем «детском» варианте, что вызывает некоторое удивление.
В линейке препаратов пробиотиков Линекс появился новый продукт Линекс Форте uMEDp
Сандоз расширила линейку продуктов Линекс, являющегося лидером безрецептурного портфеля компании, за счет вывода на рынок формулы усиленного действия — Линекс Форте.
В состав пробиотика Линекс Форте в суточной дозировке входят бактерии, являющиеся представителями нормальной микрофлоры кишечника, — лакто- и бифидобактерии (BB-12 и LA-5) в высокой концентрации, что позволяет назначать его для приема один раз в день.. Это особенно удобно для курсового лечения. Линекс Форте показан для профилактики и лечения дисбактериоза кишечника, симптомами которого могут быть диарея, запоры, нарушение пищеварения, тошнота, метеоризм, отрыжка и кожные аллергические реакции
Входящие в состав препарата пробиотические штаммы подавляют рост патогенных бактерий и оказывают благотворное влияние на состав кишечной микробиоты. Нормальная микрофлора, снижая активность болезнетворных микроорганизмов, подавляет патогенные, гнилостные и газообразующие бактерии. Кроме того, представители кишечной микробиоты принимают участие в жировом и пигментном обмене, стимулируют иммунную систему, принимают активное участие в переваривании пищи. Микробиоценоз желудочно-кишечного тракта – а это приблизительно 100 триллионов микроорганизмов весом около 1,5 кг у взрослого человека – в значительной степени определяет состояние здоровья. Но такие факторы, как особенности питания, заболевания органов пищеварения, кишечные инфекции, применение антибактериальных препаратов негативно влияют на микробиоту кишечника. Для коррекции ее состояния при дисбиозах, диареях различного происхождения, Clostridium difficile ассоциированных инфекция используются препараты-пробиотики.
Нормальная микрофлора, снижая активность болезнетворных микроорганизмов, подавляет патогенные, гнилостные и газообразующие бактерии. Кроме того, представители кишечной микробиоты принимают участие в жировом и пигментном обмене, стимулируют иммунную систему, принимают активное участие в переваривании пищи. Микробиоценоз желудочно-кишечного тракта – а это приблизительно 100 триллионов микроорганизмов весом около 1,5 кг у взрослого человека – в значительной степени определяет состояние здоровья. Но такие факторы, как особенности питания, заболевания органов пищеварения, кишечные инфекции, применение антибактериальных препаратов негативно влияют на микробиоту кишечника. Для коррекции ее состояния при дисбиозах, диареях различного происхождения, Clostridium difficile ассоциированных инфекция используются препараты-пробиотики.
Согласно оценкам Лорен Бэнди, аналитика рынка ингредиентов Euromonitor International, мировой рынок производства пробиотиков растет ежегодно на 7 и к 2017 году он составит 33,5 млрд евро. При этом в ближайшие пять лет продажи пробиотиков на европейском рынке несколько снизятся с 5,13 млрд евро в 2012 году до 5 млрд евро в 2017 году, а на рынках Китая, Бразилии, Аргентины, Южной Кореи и Японии будет наблюдаться двузначный рост рынка.
При этом в ближайшие пять лет продажи пробиотиков на европейском рынке несколько снизятся с 5,13 млрд евро в 2012 году до 5 млрд евро в 2017 году, а на рынках Китая, Бразилии, Аргентины, Южной Кореи и Японии будет наблюдаться двузначный рост рынка.
Настроение плохое, болит голова, постоянные простуды — при чем здесь боли в животе?: Люди: Из жизни: Lenta.ru
Когда мы предвидим опасность, часто говорим, что чуем ее нутром, а не головой. Любовь же рождается не только в сердце, но и в животе, в котором порхают бабочки. Эти фразы не оторваны от реальности — они связаны с физиологическими процессами в кишечнике, который часто называют «вторым мозгом». «Лента.ру» разобралась, какую роль кишечник играет в организме и как наладить его работу.
В кишечнике около 100 миллионов нейронов — это больше, чем в спинном мозге или периферической нервной системе. Пусть кишечник не играет роли в сочинении симфоний, но он достаточно умен для того, чтобы выполнять пищеварительную работу автономно, не подключая сознание.
Состояние кишечника влияет на эмоциональное состояние человека. Около 90 процентов серотонина — «гормона счастья» — вырабатывается в кишечнике. Ученые Калифорнийского технологического института уверены, что изменения в микробном составе кишечника влияют на выработку серотонина, а значит, и на настроение. Считается, что нарушения в работе «второго мозга» могут быть одной из причин депрессии, расстройства сна, тревожности, мигрени, ожирения.
В кишечнике трудится большое количество микроорганизмов, известных как кишечная микробиота, — это около 100 триллионов различных бактерий. Если в микробиоме происходит сбой, это может отразиться на всем организме. Поскольку в теле человека так много микроорганизмов, нужна система, которая будет защищать организм от вторжений болезнетворных микробов и вирусов. Эту роль выполняет иммунитет.
В кишечнике находится 70-80 процентов иммунных клеток. В нормальных условиях иммунная система и микробиота сотрудничают: первая помогает размножению полезных бактерий и поддерживает стабильное микробное сообщество, а вторая способствует развитию иммунных клеток и участвует в настройке иммунных реакций.
Кишечник населяет микрофлора — дружественная и патогенная. Если верх одерживают враждебные микроорганизмы, возникает дисбактериоз. Причины нарушения состояния кишечной микробиоты могут быть разными — непереносимость молочных продуктов, хронические заболевания, употребление некоторых лекарств, — но куда чаще это результат наших личных усилий. На состояние микрофлоры влияют однообразная диета, вредные привычки (алкоголь и курение), стрессы, недостаток сна и малоподвижный образ жизни.
Обычные простудные заболевания и грипп тоже влияют на расстановку сил в микробиоме. Как только мы становимся жертвами инфекции, активизируются лимфоциты (они находятся в лимфатической ткани кишечника) и начинают синтезировать защитные антитела. Параллельно с ними на стражу здоровья встают микроорганизмы, населяющие кишечник. Чаще всего наш организм справляется без посторонней помощи, но микрофлоре неизбежно наносится ущерб, поэтому поддерживать ее во время болезни — хорошая привычка.
Главное испытание для микрофлоры — прием антибиотиков. Многие россияне пьют их при первых признаках простуды. Казалось бы, ну и что? Особенно если завтра на работу или важную встречу. Но антибиотики не разбирают, патоген перед ними или нормальная микрофлора, а действуют на все бактерии. Это оправданно, иначе было бы не победить тяжелую болезнь, но у эффективности антибиотиков есть своя цена. После их приема снижается количество полезных бифидо- и лактобактерий.
Многие россияне пьют их при первых признаках простуды. Казалось бы, ну и что? Особенно если завтра на работу или важную встречу. Но антибиотики не разбирают, патоген перед ними или нормальная микрофлора, а действуют на все бактерии. Это оправданно, иначе было бы не победить тяжелую болезнь, но у эффективности антибиотиков есть своя цена. После их приема снижается количество полезных бифидо- и лактобактерий.
Дальше — замкнутый круг: чем хуже состояние микрофлоры кишечника, тем хуже иммунитет. Начинаются простуды, дисбактериоз, хроническая усталость, проблемы с кожей. Признаками слабого иммунитета (а значит, и нарушенной микрофлоры кишечника) считаются простуды, случающиеся у взрослых людей чаще пяти раз в год.
Чтобы антибиотики не нарушали тонкий баланс микрофлоры и не приводили к ослаблению иммунитета, важно правильно поддерживать кишечник во время и после болезни.
Обычно для восстановления микрофлоры врачи рекомендуют пробиотики и пребиотики.
Пробиотики — живые микроорганизмы и бактерии, содержащиеся в нормальной микрофлоре кишечника и выполняющие жизненно важные функции. Наиболее распространенные пробиотики — лакто- и бифидобактерии.
Наиболее распространенные пробиотики — лакто- и бифидобактерии.
Чаще всего пробиотики назначают одновременно с антибиотиками, чтобы остановить рост патогенной микрофлоры. Но, к сожалению, доктора не всегда объясняют, как принимать пробиотики, чтобы они приносили максимум пользы.
Начинать курс приема пробиотиков и антибиотиков в один день. Бытует мнение, что принимать оба препарата одновременно бесполезно. Но уже давно разработаны пробиотики, которые прикрепляются к стенкам кишечника и не боятся антибиотиков. Кишечник надо поддерживать сразу, а не ждать, пока антибиотики вместе с лечением инфекции нанесут ущерб микробиоте.
Пить пробиотик через три часа после антибиотика. Этого времени как раз достаточно для того, чтобы антибиотик не повредил пробиотику.
Принимать пробиотик не менее двух недель. Микрофлора восстанавливается долго, и если курс пробиотиков прервать, на место полезных бактерий может прийти условно-патогенная флора, а с ней — проблемы в кишечнике, вирусные инфекции и многое другое.
Хотя лактобактерии и бифидобактерии можно найти в кисломолочных продуктах, доказанная польза есть только у лекарственных препаратов. В том же кефире плотность нужных бактерий недостаточна, поэтому заменять им лечение не стоит.
Отсутствие пробиотической помощи или нарушение правил приема ведет к тому, что на фоне лечения антибиотиками возникает масса побочных эффектов — вплоть до диареи. Люди прерывают курс лечения, самостоятельно меняют препарат, и все это ведет к развитию у бактерий устойчивости к антибиотикам. Из-за этого многие болезни все сложнее лечить. Чтобы не наступили времена, когда простуда или грипп станут опасными болезнями, надо пить полный курс антибиотиков, а для комфорта кишечника поддерживать его пробиотиками.
После курса пробиотиков, которые подавят враждебную микрофлору, полезно увеличить в диете количество пребиотиков. Пребиотики — это сложные углеводы, основной источник питания микрофлоры. Они содержатся во фруктах, овощах и цельнозерновых продуктах, богатых клетчаткой. Это могут быть лук, отруби, бананы, брокколи, нут, чечевица, фасоль, хлебцы. Суточная норма для взрослого человека составляет от 30 до 50 граммов клетчатки. И пробиотики, и пребиотики важны для здоровья микрофлоры, поэтому отлично подходят для профилактики ЖКТ-проблем.
Это могут быть лук, отруби, бананы, брокколи, нут, чечевица, фасоль, хлебцы. Суточная норма для взрослого человека составляет от 30 до 50 граммов клетчатки. И пробиотики, и пребиотики важны для здоровья микрофлоры, поэтому отлично подходят для профилактики ЖКТ-проблем.
На восстановление микробиоты после приема антибиотиков организму нужно, по результатам разных исследований, от полутора месяцев до полугода. Важно помнить, что правильная и своевременная поддержка кишечника нужна для ускорения этого процесса. И тогда «второй мозг» перестанет недовольно ворчать, а вы — переживать.
Все о дисбактериозе | Медицинский центр «Новая медицина»
ВСЁ О ДИСБАКТЕРИОЗЕ
Дисбактериоз очень распространенное заболевание. По данным Минздрава дисбактериоз выявляют у 90% взрослого населения и свыше 25% детей в возрасте до года. Многие заболевания, в том числе и хронические, связаны с нарушением микробиоценоза кишечника и часто являются следствием дисбактериоза, а не его причиной.
Дисбактериоз считается основной социальной болезнью 21-го века. Актуальность проблемы требует постоянного поиска новых средств лечения дисбактериоза и его коррекции.
ДИСБАКТЕРИОЗ У ДЕТЕЙ
Дисбактериоз у детей, как и у взрослых, возникает вследствие нарушения баланса микрофлоры кишечника. Определить его наличие без анализа в лаборатории крайне сложно, поскольку это не является самостоятельным заболеванием, а возникает вследствие воспалительного процесса в организме или же в случае нарушения баланса витаминов. В медицинской терминологии также применяется определение «дисбиоз», которое является синонимом «дисбактериоза».
Чаще всего возникает дисбактериоз у детей грудного возраста. К основному фактору его появления относится искусственное вскармливание малыша и недостаток витаминов, получаемых с дополнительной пищей. Также дисбактериоз у детей может возникнуть при аллергических реакциях организма, приема антибиотиков, зоны повышенной радиации, острых и хронических заболеваний пищеварительной системы или нарушения нормального функционирования кишечника из-за недостатка бактерий, расщепляющих кислоты и питательные вещества. Источник, как правило, устанавливает врач.
Кишечно-желудочный тракт взрослого человека содержит примерно 1,5 кг бактерий, около 400—500 разных видов, а у детей до двух лет, вскармливаемых грудным молоком, преобладают в основной массе бифидобактерии, которые препятствуют развитию кишечно-желудочных заболеваний. У малышей, которых вскармливают искусственным путем, из-за невозможности кормить грудью, не формируется преобладание какой-то определенной группы бактерий — бифидо бактерий, такое питание не сможет предотвратить дисбактериоз у ребенка и защитить организм от других заболеваний. Поэтому врачи рекомендуют кормить теми кисломолочными смесями, которые способствуют их размножению. Информацию о свойствах смесей можно прочитать на упаковке и выбрать оптимальную для ребенка.
Преобладание бифидобактерий в детском организме важно тем, что они помогают регулировать обмен желчных кислот, а также принимают участие в формировании органических веществ и кислот, необходимых для работы кишечника. Способствуют усваиванию витаминов К, группы В, D, солей, никотиновой и фолиевой кислоты, получаемых с питанием. Имеют антиаллергическое, антирахитическое и антианемическое действие на организм, а кроме того формируют иммунитет.
Как мы уже говорили, симптомов, по которым можно однозначно сделать вывод, что это дисбактериоз — нет, поэтому нужно искать в первую очередь причину — то заболевание, которое может сопровождаться дисбактериозом.
Раньше дисбактериоз определяли с помощью анализа состава кала, но так как осуществить правильный сбор кала в стерильную посуду не возможно, результат такого анализа не до конца объективен. На сегодняшний день в современной медицине применяются более сложные и точные методы, такие как исследование с помощью биохимии; для гастроскопии — анализ соскоба слизистой 12-перстнойлибо тощей кишки, для колоноскопии — анализ соскоба прямой и толстой кишки. Но такие сложные исследования проводятся только по назначению лечащего врача.
Каким же образом происходит лечение?
Первостепенно необходимо лечить причину его возникновения — основное заболевание, которое устанавливает один из врачей, назначенных педиатром. Курс лечения будет состоять из лечения очага заболевания и специализированного питания смесями, способствующими либо образованию правильной (здоровой) микрофлоры кишечника либо смесями, которые уже содержат микроорганизмы.
Предотвращается возможный дисбактериоз у ребенка в первую очередь длительным грудным кормлением и своевременным введением дополнительного прикорма к молоку. Лучше всего все этапы вскармливания ребенка согласовывать с наблюдающим педиатром, собственная интуиция важна, но совет профессионала не менее важен, тем более в этом возрасте закладывается основа иммунитета на всю жизнь. Дополнять рацион питания рекомендуется специальными кисло-молочными смесями, которые содержат в себе бифидо и лактобактерии полезные деткам.
В том случае, если врач установил дисбактериоз у ребенка, к основному питанию добавляются кисло-молочные продукты, в зависимости от направления лечения. Наринэ-Форте, Биовестин, Биовестин-лакто содержат бифидо и лактобактерии в пропорциях и состояние, которые способны стимулировать развитие микроорганизмов нормальной флоры.
Но не забывайте — не только питанием лечится дисбактериоз у детей, а также предупреждением первоисточника его возникновения, который определяет врач. Лучше всего сразу применять смеси, которые способствуют образованию бифидобактерий, как прикорм к основному питанию, для того, чтобы поддерживать необходимую микрофлору кишечника и предотвратить дисбактериоз у ребенка, а именно лечение смесями уже осуществлять под руководством врача в сочетании с лечением очага воспаления.
ДИСБАКТЕРИОЗ — ВРАГ ЗДОРОВЬЯ
Каждый день наш организм нуждается в еде. Без пищи человек не может существовать. Прием пищи становится ритуалом, который человек должен соблюдать изо дня в день. Однако не всегда наш организм в силе переварить ее. Особенно, если мы позволяем себе лишнего.
Например, переедаем за ужином или перед сном, едим не совсем полезную и здоровую пищу. Полноценное пищеварение возможно только в случае наличия в желудке каждого человека самых разнообразных микробов. Причем эти микробы могут быть как положительными, так и, как это ни странно, отрицательными. Именно они помогают нашему желудку все это переварить.
Если говорить о дисбактериозе, то это состояние, во время которого все микробы нашего организма изменяют свой состав. Это изменение в свою очередь ведет к нарушению работы желудка и кишечника.
Вполне правильным будет вопрос — почему же все это происходит? Изменение состава Вашего кишечника происходит в результате каких-либо изменений в Вашем организме. Что это значит? Ваш организм чем-то заражен или в него попала какая-то инфекция. Все это приводит к появлению дисбактериоза.
Рассмотрим подробнее причины появления дисбактериоза. Этот сбой работы кишечника может произойти в результате неправильного применения различных антибиотиков. Если Вы страдаете заболеваниями пищеварительного тракта, у Вас также может появиться дисбактериоз. Слабый иммунитет, послеоперационное состояние или неправильное питание — еще три причины появления дисбактериоза.
Во время дисбактериоза кишечник перестает обладать полезными микробами. Он наполнен только вредными бактериями, которые приводят к болям в области кишечника. В этот момент организм человека практически не получает никаких витаминов, жиров и других важных для организма веществ. Все это приводит к сильному снижению веса больного. При дисбактериозе у больного болит и вздувается живот. У него обязательно меняется стул.
Чтобы выявить наличие этого заболевания, Вам необходимо обратиться к врачу-гастроэнтерологу. Он назначит Вам гастроскопию, то есть проверят Ваш кишечник при помощи специального аппарата. Вам также проверят кишку и возьмут анализы кала. Все эти процедуры помогут врачу назначить Вам правильный курс лечения.
При любом курсе лечения этого заболевания Вы должны будете соблюдать диету. Эта диета обязательно будет включать в свой состав различные продукты, которые богаты полезными бактериями. Чаще всего таковыми являются различные кисломолочные продукты. Также Вам пропишут антибиотики или бактериофаги. Это препараты, которые помогут Вам очистить кишечник от вредных бактерий. Также Ваше лечение не обойдется без лекарственных препаратов, которые помогут Вашему кишечнику нормализоваться. Это такие препараты как: Нарине-Форте, Бификол, Биовестин, Нарине Ф-баланс и др.
Чаще всего для полного выздоровления хватает двух месяцев. Однако есть одно но. Как правило, после лечения ни один врач не даст Вам стопроцентной гарантии, что Вы не заболеете дисбактериозом вновь. Микрофлора кишечника имеет один большой минус. Она очень быстро реагирует на любые изменения Вашего организма. Чтобы избежать всех этих неприятностей, Вам необходимо вовремя избавляться от любых неполадок Вашего органи. Например можно проводить профилактику — время от времени пропивать препараты, которые нормализуют микрофлору кишечника. Для этих целей отлично подойдет Нарине-Форте или Нарине Ф-баланс. При регулярном применение эти препараты не дадут развиться дисбактериозу, а так же нормализуют микрофлору пищеварительного тракта, что улучшит аппетит, стул и защитит Ваш кишечник от патогенных микробов. Также Вам не стоит принимать никакие антибиотики без консультации у врача.
Если говорить честно, то все в Ваших руках. Здоровье каждого человека в огромнейшей степени зависит исключительно от него самого. Если Вы будете себя беречь, Вы навсегда останетесь здоровыми и счастливыми.
БАД — ЭТО ТО, ЧТО НАМ НЕ ХВАТАЕТ В ПИЩЕ?
Относятся ли БАДы к разряду медикаментозных препаратов? Вызывают ли пищевые добавки привыкание? Могут ли добавки заменить обычное питание? Как правильно их применять? Что входит в их состав? Есть ли у БАДов противопоказания, и в каких случаях необходимо посоветоваться с врачом, прежде чем их принимать? На вопросы отвечает директор направления по улучшению качества пищевых продуктов канадского Института Здоровья Nutrilite.
Кто из нас не мечтает укрепить здоровье и продлить отпущенный природой срок жизни? Для этих целей вроде бы и выпускаются различные биологически активные добавки (БАДы). О них ходит множество мифов. Кто-то считает их панацеей от всего, кто-то убежден, что они не дают никакого эффекта, а их производители — шарлатаны…
Так что же такое БАДы и как правильно их принимать? С этим вопросом «Правда.ру» обратилась к Одре Дэвис — директору направления по улучшению качества пищевых продуктов канадского Института Здоровья Nutrilite.
— Относятся ли БАДы к разряду медикаментозных препаратов?
— Биологически активные добавки к пище — не лекарства. Но использовать их в комплексе с лекарственными средствами вполне разумно и оправданно. Они помогают оздоровить организм, сократить длительность болезни, снизить риск развития осложнений и обострений, позволяют увеличить продолжительность жизни. Лекарства хороши, когда человек уже заболел. А БАДы применяются как средства профилактики, предупреждения болезней. Ведь, за исключением травм и инфекций, болезнь никогда не возникает внезапно. Зачастую развитие заболевания являет собой длительный процесс, на протяжении которого организм пытается бороться с патологическими изменениями… Если в это время прибегнуть к БАДам, возможно, удастся восстановить нормальную работу органов еще до того, как нарушения станут очевидны.
— Вызывают ли пищевые добавки привыкание?
— Физиологического привыкания не вызывают. Но есть люди, «зацикленные» на приеме различных витаминов, добавок и лекарств. На самом деле в состав добавок входят вещества, которые должны присутствовать в нашем ежедневном рационе. Но мало кто из нас умеет питаться рационально. Вот и бежим покупать БАДы!
— Могут ли добавки заменить обычное питание? Как правильно их применять?
— БАДы являются именно добавками к пище, а не ее заменителями. С их помощью организм адаптируется к воздействию различных внешних и внутренних факторов. Биодобавки и витаминно-минеральные комплексы рекомендуется принимать регулярно в осенно-зимне-весенний период, когда организм ослаблен непогодой и гиповитоминозами. Кроме того, они могут оказать незаменимую помощь в восстановлении после стрессов и физических нагрузок.
— А что входит в их состав?
— БАДы включают в себя компоненты животного, растительного и минерального происхождения. В их состав могут входить как природные ингредиенты, так и соединения, полученные биотехнологическими или химическими методами. Могу с уверенностью сказать, что генетически модифицированные продукты при производстве биологически активных добавок не используются. В России утвержден и действует список из 190 разрешенных компонентов. Есть и перечень запрещенных: это, во-первых, сильнодействующие психотропные и ядовитые вещества, а также вещества, не являющиеся аналогами элементов нашего пищевого рациона, неприродные синтетические продукты, гормоны и ряд других…
— Есть ли у БАДов противопоказания, и в каких случаях необходимо посоветоваться с врачом, прежде чем их принимать?
— Предупреждения о возможных противопоказаниях потребитель может прочитать на этикетке к препарату. В России БАДы обязательно проходят государственную регистрацию. Но за консультацией к врачу не мешает обратиться, если вы беременны, кормите грудью, а также, если препарат предназначается для ребенка. Стоит помнить и о том, что у разных людей организм может по-разному реагировать на те или иные продукты и препараты, даже, на первый взгляд, безвредные. Поэтому совет грамотного специалиста никогда не помешает.
РОДИТЕЛЯМ ОБ АНТИБИОТИКАХ
Вторую половину ХХ века можно смело назвать антибактериальной эрой, и это не будет преувеличением: число жизней, спасенных с помощью антибиотиков, давно перешагнуло за миллиард! Об их чудотворной силе ходят легенды, но и хулы в их адрес приходится слышать не меньше. Виной тому поверхностное знание, провоцирующее неоправданные ожидания, а стало быть — и многочисленные обвинения антибиотиков в бедах, за которые они на самом деле ответственности вовсе не несут.
А хуже всего то, что антибиотики применяют гораздо чаще, чем это необходимо, нанося тем самым серьезнейший вред не только больным, но и обществу в целом. Я далек от мысли научить родителей самостоятельно использовать антибиотики — это дело врача. Но я убежден, что понимать логику назначения врача современные родители не только могут, но и обязаны.
О ПОЛЬЗЕ ГРЯЗНОЙ ПОСУДЫ
Слово «антибиотик» образовано из двух элементов греческого происхождения: anti- — «против» и bios — «жизнь». Антибиотиками называют образуемые микроорганизмами, высшими растениями или тканями животных организмов вещества, избирательно подавляющие развитие микроорганизмов (или клеток злокачественных опухолей).
Любопытна история открытия первого антибиотика — пенициллина — шотландским бактериологом Александером Флемингом в 1829 г.: будучи по природе человеком неряшливым, он очень не любил… мыть чашки с бактериологическими культурами. Каждые 2—3 недели на его рабочем столе вырастала целая груда грязных чашек, и он скрепя сердце приступал к очистке «авгиевых конюшен». Одна из таких акций дала неожиданный результат, масштаб последствий которого сам ученый оценить в тот момент не мог. В одной из чашек обнаружилась плесень, подавляющая рост высеянной культуры болезнетворной бактерии группы staphylococcus. Кроме того, «бульон», на котором разрослась плесень, приобрел отчетливо выраженные бактерицидные свойства по отношению ко многим распространенным патогенным бактериям. Плесень, которой была заражена культура, относилась к виду penicillium.
В очищенном виде пенициллин был получен лишь в 1940 г., т. е. спустя 11 лет после его открытия, в Великобритании. Сказать, что это произвело революцию в медицине, — значит не сказать ничего. Но у любой медали, увы, две стороны…
ОБОРОТНАЯ СТОРОНА МЕДАЛИ
Открыв столь мощное оружие в борьбе с болезнетворными микроорганизмами, человечество впало в эйфорию: к чему долго и кропотливо подбирать лекарственную терапию, если можно «шарахнуть» по зловредным микробам антибиотиком? Но и микробы «не лыком шиты» — они весьма эффективно защищаются от грозного оружия, вырабатывая устойчивость к нему. Если антибиотик, скажем, блокирует синтез необходимых микробу белков — микроб в ответ на это просто… меняет белок, обеспечивающий его жизнедеятельность. Некоторые микроорганизмы ухитряются научиться выработке ферментов, разрушающих сам антибиотик. Короче говоря, способов множество, и «хитроумные» микробы ни одним из них не пренебрегают. Но самое печальное заключается в том, что устойчивость микробов может передаваться от одного вида другому путем межвидового скрещивания! Чем чаще применяется антибиотик, тем быстрее и успешнее микробы приспосабливаются к нему. Возникает, как вы понимаете, порочный круг — чтобы разорвать его, ученые вынуждены вступить в навязанную микробами «гонку вооружений», создавая все новые и новые виды антибиотиков.
НОВОЕ ПОКОЛЕНИЕ ВЫБИРАЕТ…
К настоящему времени создано более 200 противомикробных препаратов, из них более 150 используются для лечения детей. Их мудреные названия нередко ставят в тупик людей, не имеющих отношения к медицине. Как же разобраться в обилии замысловатых терминов? На помощь, как всегда, приходит классификация. Все антибиотики делятся на группы — в зависимости от способа воздействия на микроорганизмы.
Пенициллины и цефалоспорины разрушают оболочку бактериальной клетки.
Аминогликозиды, макролиды, левомицетин, рифампицин и линкомицин убивают бактерии, подавляя синтез разных ферментов — каждый своего.
Фторхинолоны уничтожают микроорганизмы более «изощренно»: подавляемый ими фермент отвечает за размножение микробов.
В непрекращающемся состязании с микробами ученым приходится придумывать все новые и новые методы борьбы — каждый из них дает начало новому поколению соответствующей группы антибиотиков.
Теперь о названиях. Увы, здесь царит изрядная неразбериха. Дело в том, что помимо основных международных (так называемых генерических) названий многие антибиотики имеют и фирменные, запатентованные тем или иным конкретным производителем (в России их более 600). Так, например, один и тот же препарат может называться амоксициллином, Оспамоксом и Флемоксин Солютабом. Как же разобраться? По закону наряду с патентованным фирменным названием на упаковке лекарства обязательно указывается и его генерическое название — мелким шрифтом, нередко по-латыни (в данном случае — amoxycillinum).
При назначении антибиотика часто говорят о препаратепервого выбора и резервных препаратах. Препарат первого выбора — это тот препарат, назначение которого определяется диагнозом — если у больного нет устойчивости или аллергии к этому лекарственному средству. В последнем случае обычно назначаются резервные препараты.
ЧЕГО ЖДАТЬ И ЧЕГО НЕ ЖДАТЬ ОТ АНТИБИОТИКОВ?
Антибиотики способны излечить заболевание, вызванное бактериями, грибками и простейшими, но не вирусами. Именно поэтому бесполезно ожидать эффекта от антибиотика, назначенного при ОРВИ, точнее, эффект в таких случаях бывает негативным: температура держится несмотря на прием антибиотика — вот вам и «питательная среда» для распространения молвы о якобы потерянной эффективности антибиотиков или же о повальной устойчивости микробов.
Назначение антибиотика при вирусной инфекции не предотвращает бактериальных осложнений. Напротив, подавляя рост чувствительных к препарату микробов, например обитающих в дыхательных путях, антибиотик облегчает заселение дыхательных путей устойчивыми к нему патогенными бактериями, легко вызывающими осложнение.
Антибиотики не подавляют воспалительного процесса, обусловливающего подъем температуры, так что «сбить температуру» через полчаса, как парацетамол, антибиотик не может. При приеме антибиотика падение температуры наступает лишь через несколько часов или даже через 1—3 дня. Именно поэтому нельзя давать одновременно антибиотик и жаропонижающее: падение температуры от парацетамола может замаскировать отсутствие эффекта от антибиотика, а при отсутствии эффекта антибиотик, естественно, необходимо как можно скорее сменить.
Однако сохранение температуры нельзя считать признаком, однозначно свидетельствующим о неэффективности принимаемого антибиотика: порой выраженная воспалительная реакция, образование гноя требуют дополнительного к антибактериальному лечения (назначения противовоспалительных средств, вскрытия гнойника).
ВЫБОР ЗА ВРАЧОМ
Для лечения заболеваний, вызываемых чувствительными к антибиотикам микробами, обычно используются препараты первого выбора. Так, ангину, отит, пневмонию лечат амоксициллином или оспеном, микоплазменную инфекцию или хламидиоз эритромицином или другим антибиотиком из группы макролидов.
Возбудители кишечных инфекций зачастую быстро вырабатывают устойчивость к антибиотикам, поэтому при лечении кишечных инфекций антибиотики применяются лишь в тяжелых случаях — обычно цефалоспорины 2—3-го поколений или хинолоны.
Инфекции мочевых путей вызываются представителями кишечной флоры, их лечат амоксициллином или, при устойчивости возбудителей, резервными препаратами.
Как долго принимают антибиотик? При большинстве острых болезней его дают в течение 2—3 дней после падения температуры, однако есть много исключений. Так, отит обычно лечат амоксициллином не более 7—10 дней, а ангину — не менее 10 дней, иначе может быть рецидив.
ТАБЛЕТКИ, СИРОПЫ, МАЗИ, КАПЛИ…
Для детей особенно удобны препараты в детских формах. Так, препарат амоксициллина Флемоксин Солютаб выпускается в растворимых таблетках, их легко дать с молоком или чаем. Многие препараты, такие как джосамицин (Вильпрафен), азитромицин (Сумамед), цефуроксим (Зиннат), амоксициллин (Оспамокс) и др., выпускаются в сиропе или в гранулах для его приготовления.
Есть несколько форм антибиотиков для наружного применения — левомицетиновая, гентамициновая, эритромициновая мази, тобрамициновые глазные капли и др.
ОПАСНЫЕ ДРУЗЬЯ
Опасности, связанные с приемом антибиотиков, часто преувеличивают, но помнить о них необходимо всегда.
Поскольку антибиотики подавляют нормальную флору организма, они могут вызывать дисбактериоз, т. е. размножение бактерий или грибов, не свойственных тому или иному органу, прежде всего кишечнику. Однако лишь в редких случаях такой дисбактериоз опасен: при недлительном (1—3 недели) лечении антибиотиками проявления дисбактериоза фиксируются крайне редко, к тому же пенициллин, макролиды, цефалоспорины 1-го поколения не подавляют роста флоры кишечника. Так что противогрибковые (нистатин) и бактериальные (Бифидумбактерин, Лактобактерин) препараты применяются для предупреждения дисбактериоза лишь в случаях длительного лечения несколькими лекарственными препаратами широкого антибактериального спектра.
Термином «дисбактериоз», однако, в последнее время стали злоупотреблять — ставят его в качестве диагноза, списывая на него чуть ли не любые нарушения функционирования желудочно-кишечного тракта. Есть ли вред от такого злоупотребления? Да, поскольку это мешает постановке правильного диагноза. Так, например, у многих детей с пищевой непереносимостью диагностируют дисбактериоз, а потом «лечат» Бифидумбактерином, обычно без успеха. Да и стоят анализы кала на дисбактериоз немало.
Еще одна опасность, подстерегающая при приеме антибиотиков, — аллергия. У некоторых людей (в том числе и у грудных детей) имеется аллергия к пенициллинам и другим препаратам-антибиотикам: сыпи, шоковые реакции (последние, к счастью, встречаются очень редко). Если у вашего ребенка уже наблюдалась реакция на тот или иной антибиотик, об этом надо обязательно сообщить врачу, и он легко подберет замену. Особенно часты аллергические реакции в тех случаях, когда антибиотик дают больному, страдающему заболеванием небактериальной природы: дело в том, что многие бактериальные инфекции как бы снижают «аллергическую готовность» больного, что уменьшает риск реакции на антибиотик.
Аминогликозиды могут вызывать поражение почек и глухоту, их без большой надобности их не применяют. Тетрациклины окрашивают эмаль растущих зубов, их дают детям только после 8 лет. Препараты фторхинолонов детям не назначают из-за опасности нарушения роста, их дают лишь по жизненным показаниям.
Принимая во внимание все вышеперечисленные «факторы риска», врач обязательно оценивает вероятность осложнений и применяет препарат только тогда, когда отказ от лечения сопряжен с большой степенью риска.
В заключение остается лишь сказать несколько слов об экономических аспектах назначения антибиотиков. Новые антибиотики стоят очень дорого. Спору нет, бывают ситуации, когда их применение необходимо, однако я часто сталкиваюсь со случаями, когда эти препараты назначаются без надобности, при заболеваниях, которые можно легко вылечить дешевыми лекарствами «старого образца». Я согласен с тем, что не следует скупиться, если речь идет о лечении ребенка. Но траты должны быть разумными! (Можно, например, купить антибиотик в форме сиропа: сиропы довольно дороги, но дети их принимают охотно, да и дозировать сироп или капли очень удобно.) Однако это не означает, что при выборе препарата вовсе не следует принимать во внимание финансовую сторону дела. Не надо стесняться спросить у врача, во что обойдется вам выписанный рецепт, и если он вас не устраивает (слишком дорог или слишком дешев — это тоже нередко настораживает родителей), поищите вместе с врачом удовлетворяющую вас замену. Хочу еще раз повторить: десятки препаратов, имеющиеся сегодня в аптеках, почти всегда позволяют найти эффективное лекарство, соответствующее вашим возможностям.
ДИСБАКТЕРИОЗ — АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
Проблема сохранения здоровья, поиск путей снижения неблагоприятного воздействия на организм внешней среды являются в настоящее время крайне актуальными для нашей страны. По данным Российской академии наук, более 90% населения Российской Федерации в настоящее время имеют отклонения от физиологической нормы по тем или иным показателям, характеризующим здоровье человека.
Техногенные и экологические катастрофы, инфекционные болезни, экспансия некачественных лекарственных средств и продуктов питания, самоотравление алкоголем и наркотиками, психоэмоциональное напряжение и множество других вредоносных факторов истощают защитные силы организма, снижают его адаптационный потенциал.
Одной из важнейших систем поддержания и сохранения гомеостаза организма является его нормальная микрофлора, населяющая желудочно-кишечный тракт, мочеполовую систему, кожные покровы. Она оказывает многоплановое влияние на защитные, адаптационные и обменно-трофические механизмы организма, а ее нарушения под влиянием факторов эндогенной или экзогенной природы могут привести к утрате или искажению этих функций, которые влекут за собой проявления дисбактериоза — изменения качественного и количественного состава микрофлоры организма. Спектр клинических синдромов и патологических состояний, патогенез которых связан с дисбактериозом, в настоящее время очень широк и имеет тенденцию к увеличению.
Это возводит проблему разработки средств, повышающих адаптационный потенциал организма человека, в ранг первостепенных задач не только медицинского, но и экономического и политического характера.
В настоящее время одним из наиболее доступных и эффективных способов экологической реабилитации являются пробиотики — продукты, биологически активные добавки и фармацевтические препараты на основе полезных микроорганизмов, прежде всего, бифидобактерий и лактобацилл, оказывающих многофакторное регулирующее и стимулирующее воздействиие на организм человека, укрепляющих иммунную систему, защищающих от болезнетворных микробов. И не случайно, согласно данным российских маркетологов, занятых анализом объемов потребления фармпрепаратов и БАД, начиная с 2000 года только два сегмента этого рынка имеют тенденцию к росту — антиканцерогенные и пробиотические препараты. Им принадлежит ведущая роль в нормализации микробиоценоза кишечника, поддержании неспецифической резистентности организма, улучшении процессов всасывания и гидролиза жиров, белкового и минерального обмена, синтезе биологически активных веществ.
Представители нормофлоры синтезируют витамины группы В, никотиновую кислоту, биотин, витамин К. Большая роль принадлежит им в защите организма от токсических элементов экзогенного происхождения и эндогенных субстратов и метаболитов. Они принимают активное участие в метаболизации разнообразных веществ растительного, животного и микробного происхождения, рециркуляции желчных кислот, активно влияют на метаболизм билирубина и холестерина. Установлена их антиканцерогенная и антимутагенная активность. Известна способность инактивировать гистамин, играющий важную роль в проявлении аллергии.
Все эти положительные эффекты позволяют рассматривать представителей нормальной микрофлоры как эффективный биокорректор и основу для создания различных форм пробиотиков.
По материалам сайта www.disbakterioza.net
60 отзывов, инструкция по применению
Линекс принадлежит к группе эубиотиков. В кишечнике человека обитает масса микроорганизмов, имеющих довольно сложную историю взаимоотношений друг с другом и с окружающей средой, полную локальных конфликтов и даже полномасштабных боевых действий, приводящих к нарушению баланса кишечного биоценоза. Эубиотики являют собой препараты бактерий-представителей нормальной микрофлоры, препятствующих размножению патогенных микроорганизмов. В частности, в состав линекса входят высушенные в вакууме живые молочнокислые бактерии видов Bifidobacterium infantis, Lactobacillus acidophilus, Enterococcus faecium, играющие важную биохимическую роль в организме человека и присутствующие в его кишечнике с самого рождения.
Бактериальный триумвират линекса создает в кишечнике ту самую кислую среду, которая угнетает рост патогенной и условно патогенной микрофлоры и позволяет пищеварительным ферментам в полной мере проявлять свою активность. Помимо этого данные бактерии принимают деятельное участие в синтезе витаминов группы В, С, К, которые, в свою очередь, делают организм устойчивым к неблагоприятным факторам окружающей среды. Среди других важных «должностных обязанностей» бактерий, собранных под оболочкой капсулы линекса, видное место занимает синтез веществ с противомикробной активностью, участие в обменных процессах желчных кислот и желчных пигментов, оптимизация иммунного статуса организма.
Прием препарата целесообразно увязывать с режимом питания, принимая его вместе с небольшим количеством воды сразу после еды. Детям до 3-ех лет, а также лицам, для которых размер капсулы чрезмерен, можно вскрыть ее, высыпав содержимое в ложку и размешав в небольшом количестве жидкости. Линекс независимо от возраста пациента принимается 3 раза в день, отличается лишь количество капсул: 1 (дети до 2-ух лет), 1-2 (дети 2-12 лет) и 2 (подростки и взрослые). Срок лечения устанавливается в зависимости от индивидуальных особенностей организма пациента и этиологии дисбактериоза.
Прием линекса сопряжен с некоторыми ограничениями и мерами предосторожности. Так, нельзя запивать препарат горячими напитками и совмещать лечение с потреблением алкоголя. Перед началом лечения при наличии у пациента таких симптомов, как повышенная температура тела (свыше 38 °C), наличие слизи или крови в кале, непрекращающейся в течение 2-ух и более дней диарее и острых абдоминальных болей, потеря массы тела, а также при присутствии в анамнезе хронических заболеваний необходима врачебная консультация.
Анализ кала на дисбактериоз | Медицинский центр «Президент-Мед»
В кишечнике любого человека находятся бактерии, они перерабатывают пищу и помогают нашему организму усваивать питательные вещества. Когда таких микроорганизмов мало развиваются нарушения, приводящие к расстройству пищеварения.
Исследовать состав кишечной микрофлоры помогает анализ кала на дисбактериоз, он позволяет определить наличие бифидобактерий, а также лактобактерий (полезные бактерии), выявить энтеробактерии, энтерококки, бактероиды и другие патогенные микроорганизмы.
Анализ кала на дисбактериоз может назначаться пациентам всех возрастов, поскольку этот диагноз бывает даже у самых маленьких пациентов. Показан данный анализ и после применения антибиотиков, так как они пагубно влияют на микрофлору кишечника.
Что такое дисбактериоз, чем он опасен
Дисбактериоз – состояние, при котором в микрофлоре кишечника диагностируется преобладание патогенных и условно-патогенных микроорганизмов над полезными бактериями. Как следствие нарушается нормальное функционирование ЖКТ, появляется риск развития многих тяжелых заболеваний из-за того, что иммунная система человека очень сильно ослабевает.
Различают несколько стадий развития дисбактериоза:
1-ая стадия – патогенные бактерии имеются в кишечнике, но плохая микрофлора развивается не стремительно. Неприятные симптомы на этом этапе могут не проявляться.
2-ая стадия – полезных микроорганизмов мало, вредные бактерии активно развиваются. У пациента может быть понос, метеоризм.
3-я стадия – не обнаруживается полезная микрофлора. Развивается воспаление стенок кишечника, появляются хронические запоры или диарея, симптоматика болезненная.
4-ая стадия – патогенные организмы активны, они прогрессируют и истощают организм. Длительное преобладание вредной микрофлоры кишечника приводит к авитаминозу, анемии и другим неприятным состояниям.
Быстрое восстановление работы ЖКТ возможно только на ранних стадиях, запущенные же варианты тяжело лечатся, они могут стать катализатором для развития онкологических и других опасных недугов. Именно поэтому важно своевременно выявить дисбактериоз.
Признаки дисбактериоза
Особое проявление симптоматики дисбактериоза наблюдается в младенческом и детском возрасте. У взрослых пациентов симптомы также прослеживаются, но из-за постоянной загруженности, как правило, на недомогание вовремя никто внимания не обращает.
Симптомы дисбактериоза:
- Постоянная тошнота.
- Чрезмерное выделение слюны.
- Отсутствие аппетита.
- Неприятный запах изо рта.
- Повышенное газообразование.
- Диарея или запор.
- Во рту привкус металла.
- Боль в животе.
- Аллергическая реакция.
- Ухудшение состояния ногтей, кожи, а также волос.
- Частые простудные заболевания.
У взрослых больных появляются признаки интоксикации организма, могут ощущаться головные боли. При дисбактериозе повышается утомляемость, наблюдается постоянное состояние слабости.
Если человека мучают выше приведенные симптомы, врач в обязательном порядке назначит исследование кала на дисбактериоз. Сдавать анализ можно и в профилактических целях, чтобы предупредить развитие болезней ЖКТ.
Правила сбора анализа кала
Чтобы результаты анализа кала на дисбактериоз были достоверными, нужно заранее подготовиться и правильно собрать исследуемый материал. Примерно за четыре дня до сдачи кала перестают принимать медикаментозные средства, которые могут воздействовать на состав микрофлоры. Если необходима терапия антибиотиками, тогда пройти исследование рекомендуют до приема лекарств и после их отмены.
Перед сбором материала для диагностики дисбактериоза нельзя применять клизму, а за три дня до анализа следует перестать использовать свечи. Придется также посидеть несколько дней на диете, из рациона нужно исключить продукты, оказывающие воздействие на микрофлору: острые и кислые блюда, жирное мясо, а также алкогольные напитки.
Собирать анализ необходимо только в стерильную тару, поэтому утку или другую емкость нужно продезинфицировать. Удобнее всего кал транспортировать в специальном калоприемнике (продают в аптеке), он стерильный и не требует обработки. На анализ материал нужно принести не позднее трех часов после сбора. Замораживать или оставлять на ночь в холодильнике кал нельзя, результаты будут недостоверные.
Чтобы сдать анализ кала на дисбактериоз в Видном и в Москве (метро Коломенская и ВДНХ) обращайтесь в медцентры Президент-Мед
Автор: Лаврова Нина Авенировна
Заместитель генерального директора по медицинской части
Окончила Ярославский государственный медицинский институт по специальности «Лечебное дело»
Медицинский опыт работы — 25 лет
Записаться к врачу
ОТЗЫВЫ КЛИЕНТОВ
Елена
От души и с добрым чувством, выражаю благодарность ЧУДО-ВРАЧУ Семенову Артему Юрьевичу, за неоценимый вклад в возвращении красоты моих ножек! Даже и не думала, что можно буквально стереть с них (ножек) «карту мира», которая злостно ограничивала выбор моего гардероба, не заикаюсь уже об отсутствии эстетики… Что и говорить, склеротерапия — великая вещь в волшебных руках…[…]
Евгения
Хочу от всего сердца поблагодарить и выразить чувство глубочайшего уважения уникальному доктору Артему Юрьевичу Семенову за выполненную в марте 2014 года лазерную операцию с минифлебэктомией на обеих ножках. Варикозная болезнь у меня проявилась после рождения детей в 30 лет. А в последний год тяжесть и боли в ногах, особенно в жаркое время года, стали просто нестерпимыми….[…]
Мария
Я сдавала анализы, и была очень довольна. Медсестра Римма настолько легко берет анализы, я даже не поняла когда она меня уколола, очень обходительная, добрая и с чувством юмора! Потом мне пришлось еще и ребенка своего привезти, так он у меня не только дал взять кровь, но и даже не успел заплакать, хотя перед этим мы сдавали кровь в обычной поликлинике, да еще и конфету получил…[…]
Евгения
Была на приёме у гинеколога Ольги Александровны, была только один раз, но врач показался очень квалифицированный, далее судить буду в процессе лечения, и отпишусь. Клиника платная, но деньги не дерут! Профессионализм на высшем уровне, а цены ниже чем во многих псевдоклиниках. Девушка на телефоне очень приятная и уважительно относится к клиентам, старается помочь и выгодно для…[…]
Мария
Хочу поблагодарить врача-онколога Яннау Ирину Николаевну. Очень внимательный и душевный доктор, настоящий профессионал, выслушала все жалобы и страхи по поводу обнаруженного уплотнения в молочной железе. Уже после разговора с врачом почувствовала облегчение. При повторном приеме Ирина Николаевна очень подробно объяснила результаты анализов, УЗИ, назначила лечение. Я себя…[…]
Ксения Романенкова
Выражаю огромную благодарность Доктору с большой буквы Семенову Артему Юрьевичу!!! Своими ножками, благодаря ему, я сейчас очень довольна, от варикозного расширения вен 2 степени не осталось и следа! Хочу подписаться под каждым положительным отзывом в его адрес и советую всем,кто имеет проблемы с венами, не раздумывая и не откладывая обращаться к этому добродушному…[…]
Наталья
Прекрасный молодой доктор,внимательный прислушивается к жалобам больных, лечил ногу после неудавшейся операции у флеболога Семенова А. Ю.[…]
Матвеева Ольга
Хочу выразить свою благодарность Семенову Артему Юрьевичу за блестяще проведенную лазерную облитерацию большой подкожной вены в октябре 2015 года. Не было никаких сомнений в выборе врача и клиники. До этого, восемь лет назад Артем Юрьевич провел блестящую склеротерапию на вене. Вы -профессионал, знающий свое дело, о таких людях говорят : «на своем месте». Внимательный….[…]
Валентина
Хочу выразить свою благодарность Семенов Артему Игоревичу за блестяще проведенную лазерную облитерацию по технологии Biolitec на обеих голенях . Выбирая клинику я сомневалась и очень боялась так как 10 лет назад мне делали операцию и я помнила насколько это было болезненно и как тяжело я проходила реабилитационный период. А здесь все так быстро и совершенно…[…]
Елена
Хочу всем женщинам на свете порекомендовать высококвалифицированного специалиста, мастера своего дела Артема Юрьевича Семенова. У него просто золотые руки! Я делала склеротерапию обеих ног, после двух лечебных процедур ножки мои наконец то стали без сосудистых «звездочек». Очень рада что обратилась именно к этому врачу. Искренне желаю — здоровья, благополучия, успехов во всем…[…]
Наталья
Замечательный доктор Семенов А.Ю. помог с проблемой расширенных вен. Делала у него ЭВЛА в мае 2016г. Все прошло очень хорошо. Профессионально, качественно, безболезненно, с добрым веселым общением. Приехала из Воронежа просто по отзывам других людей в инете. Боялась, вдруг отзывы липовые!! Но теперь сама пишу хвалебную оду. Все получилось. Всем страждущим по вопросам…[…]
Галина
Артем Юрьевич спасибо Вам большое за Ваши золотые ручки. Артем Юрьевич делал мне склеротерапию обеих конечностей в 2015 году, в этом году была на профилактике. Очень благодарна, ножками можно любоваться. И мои друзья и знакомые лечились у него, очень благодарны. Спасибо Вам. Рекомендую !!!!![…]
Сергей Бусурин
Четыре года страдал варикозном. Были сильные боли. Большое спасибо Алексею Михайловичу, замечательно провел операцию. Доктор от Бога.[…]
Наталья
Выражаю большую благодарность Бадмаеве Тамаре Борисовна! Помогла в лечение, отличный врач![…]
Валерия
Много лет лечилась, обошла много врачей, но никак не удавалось найти подходящее лечение. Эти бесконечные неудобства в жизни стали ее неотъемлемой частью, я уже свыклась с таким состоянием.
Так вышло,что привела сына на консультацию в связи с подростковыми угрями и Тамара Борисовна сразу заметила и мою проблему.
Таким образом она помогла и сыну, и нашла источник моей…[…]
Елена
Были с ребёнком у этого педиатра уже несколько раз. Очень хороший врач! Внимательная, ответственная, компетентная, а главное, очень хорошо ладит с детьми! Рекомендую её всем своим подругам .[…]
Наталья
Хочу выразить благодарность врачу Озеровой М.С. В городскую поликлинику к кардиологу не попасть, долго собиралась и пошла в платную клинику. Очень боялась, что сейчас назначат кучу анализов, кучу лекарств выпишут, но была приятно удивлена. Врач провела осмотр, сделала ЭКГ, назначила только необходимые анализы. Очень благодарна Марии Сергеевне за чуткое, внимательное отношение…[…]
Анастасия
Спасибо огромнейшее за Вашу работу! Все четко, ясно, понятно и быстро! Без лишних разговоров «о судьбе отечества». Просто невероятно позитивные эмоции после общения![…]
Инна
Прекрасный врач, имеет огромный опыт, может правильно поставить диагноз, все объяснить клиенту. К каждому находит свой подход.[…]
Анна
Хочется сказать слава благодарности доктору Колонтарову А.Я. Ходила в поликлинику, сдавала несколько раз анализы и особо мне помочь не смогли. Пришла на приём к врачу по рекомендации знакомой, и правда такого врача можно советовать всем! Грамотный, опытный, помог мне. Назначил анализы, выявил причину и лечение подобрал индивидуально, т к не все препараты мне можно пить….[…]
Марина Степановна
Мария Сергеевна, профессионал своего дела. Большое ей спасибо! Пришла с высоким давлением, головной болью, провели полное обследование, назначили лечение. В поликлинике не дождёшься на записи к врачи, а про ЭКГ вообще нечего говорить. А в мед центре сразу сделали ЭКГ, УЗИ сердца, взяли анализы. Я теперь буду наблюдаться только тут. Давно не встречала такого специалиста![…]
Ольга
Спасибо Юлие Владимировне! Врач очень опытная, внимательная, а самое главное ее очень любят дети! Приходилось уже несколько раз с ребёнком обращаться и всегда каждый приём на высоте. Как хорошо, когда есть такие хорошие врачи[…]
Наталья
Спасибо от меня и всей моей семьи за профессионализм, поддержку, чуткое и внимательное отношение. Это – огромное счастье, что такие компетентные, умелые и талантливые, неравнодушные люди работают именно там, где они больше всего нужны. Ваши терпение, отзывчивость, чуткость, понимание, забота, доброжелательное и внимательное отношение, лечат и успокаивают. Желаю крепкого…[…]
Дмитрий
Хочу сказать огромное спасибо доктору Колонтарову Аркадию Яковлевичу за высочайший профессионализм и врачебную проницательность.Только после лечения у Аркадия Яковлевича появились ощутимые улучшения!Очень рекомендую этого доктора.[…]
Дмитрий
Низкий поклон, Аркадий Яковлевич! Несколько лет назад Вы диагностировали мне варикоцеле и сделали операцию. Сегодня я отмечаю первый месяц со дня рождения сына. Спасибо за Ваш профессионализм, чуткость и позитив![…]
Дмитрий
Низкий поклон, Аркадий Яковлевич! Несколько лет назад Вы диагностировали мне варикоцеле и сделали операцию. Сегодня я отмечаю первый месяц со дня рождения сына. Спасибо за Ваш профессионализм, чуткость и позитив![…]
ТАТЬЯНА
Замчательный доктор! Был варикоз на левой ноге.Убрали все лазером.Сечас ничего не заметно.После операции год наблюдали. Очень благодарна!!![…]
Ольга
Была на приёме у маммолога Яннау Ирины Николаевны. В середине приёма врач удалилась на 20 мин. ссылаясь на то, что ей самой нужно посетить врача, у которой заканчивается рабочий день.
Врач осмотрела, дала рекомендации.
Вопрос почему за первичный приём пришлось платить на 20% больше оплаты оговоренной с администратором, остался загадкой.
Задав данный вопрос, обрушился…[…]
Щетининой О.Н.
Большое спасибо всем работникам клиники за слаженную работу и хорошее настроение. Отдельное спасибо Ивановой Ю.А. за профессионализм, отзывчивость, индивидуальный подход.[…]
Ирина
Хочу рассказать свою историю. В 2015 году обращалась к доктору Семенову Артему Юрьевичу по поводу лечения варикозного расширения вен. Доктро провел обследование и предложил операцию по новой методике с использованием лазера. Я пребывала в нерешительности и думах в течение нескольких лет. А зря, болезнь прогрессировала. И вот наконец вчера 10 апреля 2019 года решилась на…[…]
Светлана
Хочу выразить огромную благодарность Чулак Ольге Александровне, за внимательность, инд. подход к пациенту, а так же профессионализм, доброжелательность и заботу! А ТАк же клинику Президент-мед и всему персоналу на ресепшн. Ольга Александровна- вы лучшая :)[…]
Светлана
Хочу выразить огромную благодарность Чулак Ольге Александровне, за внимательность, инд. подход к пациенту, а так же профессионализм, доброжелательность и заботу! А ТАк же клинику Президент-мед и всему персоналу на ресепшн. Ольга Александровна- вы лучшая :)[…]
Татьяна
Роман Евгеньевич хороший,грамотный специалист.Я разбираюсь в медицине и могу полностью доверять доктору.Спасибо.[…]
Наталья Ивановна
Была на приеме у доктора для получения справки на права. Внимательно провел осмотр с использованием всей офтальмологической аппаратуры. Очень серьезный молодой человек. Никаких лишних разговоров. Но работу свою знает на отлично. По сравнению с предыдущими осмотрами окулистов для получения справки, которые были чисто формальным осмотром, здесь я получила полноценный осмотр и…[…]
Марат Кудайкулов
Нас несет поток бесконечных событий, заданий, аттестаций… Цейтнот – естественное для нас состояние… И среди этого вечного движения островок простой человеческой доброты – Аркадий Яковлевич Колонтаров! После знакомства с ним автоматически попадаешь в некую систему абсолютной защищенности. Через некоторое время понимаешь – эта защищённость из нашего детства… Это когда медсестра…[…]
Татьяна
От души хочу поблагодарить флеболога Семенова А.Ю. На первичном приеме Артем Юрьевич сделал УЗИ, показал и прокомментировал состояние моих вен, затем на схеме нарисовал и объяснил суть операции лазерной коагуляции вен. Доктор очень доброжелательный и внимательный. Операцию я перенесла легко, в тот же день была уже дома. Много лет (больше 10) мучилась с тяжестью и болями в…[…]
наталья
Долго собиралась с духом на проведение процедуры гастроскопии и, как оказалось, совершенно зря. При первом общении с доктором сразу попадаешь в атмосферу спокойствия и доброжелательности. это достаточно неприятное исследование Владимир Израилевич сделал очень нежно и безболезненно. Огромное ему спасибо. Руки у него просто золотые. Теперь на контрольную гастроскопию через 6…[…]
Киселева Елена
Хочу выразить свою благодарность Медицинскому Инновационному Флебологическому Центру, в лице Семенова Артема Юрьевича и его команды профессионалов!
Мой путь в вашу клинику и профессиональные руки был целых 5 лет, за это время я перенесла 3 тромбоза на одной ноге, имея при этом сопутствующую болезнь, т.к. Бронхиальная астма, с аллергическим компонентом, непереносимость всех…[…]
Светлана
Выражаю благодарность Роману Евгеньевичу Бачурину. Доктор провел УЗИ брюшной полости на высшем уровне, проконсультировал по всем беспокоившим меня вопросам, показал на мониторе проблемные области и порекомендовал дальнейшие действия. Осталась очень довольна и отношением врача, и его работой. При необходимости буду вновь к нему обращаться.[…]
Екатерина
Добрый день, хочу выразить свое восхищение Екатериной Викторовной, врач высшей категории, с первой секунды располагает пациента, чувствуется высокий профессионализм, очень доброжелательная, внимательная, реально всегда на связи со своими пациентами, что очень важно, так как в наше время мало кто может брать на себя ответственность. Всем советую![…]
Максим Ерохин
Выражаю огромную признательность коллективу клиники «Президент-Мед». В особенности хирургу-флебологу Семенову Артёму Юрьевичу за высокий профессионализм, преданность своему делу, чуткое и внимательное отношение к пациентам. Буду рекомендовать Вашу клинику своим знакомым. Спасибо![…]
Ольга
Ходим к Педиатру Кобизской Н. В.. Внимательна, осторожна. Грамотно подходит к осмотру ребенка и назначению лечения.
Также, ходили к гастроэнтерологу, но честно сказать не могу с уверенностью сказать, что это «наш» врач.
Назначили УЗИ, при этом в кабинете уже другой пациент и приходиться ждать, пока с ним закончат… хотя мы как бы на приеме. Спасибо[…]
Алла
Вырожаю сердечную ость Артему[…]
Алла Саблина
Вырожаю сердечную благодарность Артему Семеновичу за его золотые руки! У меня был не легкий случай. Никто не брался,чтобЫ гарантировать хороший исход. Артем Семенрвич не только взялся,но и результат просто превосходный. Реабилитация прошла успешно. Доктор с большой буквы,по другому не скажешь!!!![…]
Наталья
Добрый день! Обычно ходила к врачам по рекомендациям моих друзей -врачей , моего папы-хирурга.. В этот раз решила помониторить сама и положиться на интуицию.. И она меня не подвела. Благодарю от чистого сердца Семенова Артема Юрьевича и моего оперирующего доктора Федорова Дмитрия Анатольевича за высокий профессионализм, чуткое отношение к пациенту и тонкое чувство юмора! И…[…]
границ | NLR и воспалительные заболевания, связанные с дисбактериозом кишечника: движущие силы или препятствия?
Введение
Здоровый кишечник человека заселен несколькими микроорганизмами, включая грибы, вирусы и бактерии, принадлежащие к разным семействам (1). Исследования микробиома кишечника показывают большое количество бактерий из семейств Bacteroidaceae, Prevotellaceae, Rikenellaceae и Ruminococcaceae в толстой кишке (2). С другой стороны, тонкий кишечник в основном заселен бактериями из семейств Lactobacillaceae и Enterobacteriaceae (3).В последние годы секвенирующий анализ гена 16S рРНК выявил связь между микробиотой кишечника и воспалительными заболеваниями (4). Изменения в составе кишечной микробиоты, процесс, называемый дисбактериозом, играют ключевую роль в патогенезе воспалительных заболеваний, таких как ревматоидный артрит (5), атеросклероз (6), язвенный колит, болезнь Крона (7) и сахарный диабет. типа 1 и 2 (8, 9). Соответственно, модуляция микробиоты кишечника пребиотиками и пробиотиками в качестве профилактических или терапевтических стратегий для смягчения патогенеза воспалительных заболеваний все чаще исследуется (10).
Рецепторы врожденного иммунитета, также называемые рецепторами распознавания образов (PRR), экспрессируются несколькими клетками и участвуют в распознавании микробных продуктов или эндогенных собственных молекул. PRR являются ключевыми компонентами патогенеза воспалительных и аутоиммунных заболеваний (11, 12). Толл-подобные рецепторы (TLR) и NOD-подобные рецепторы (NLR) относятся к основным семействам, составляющим суперсемейство PRR (13). В процессе дисбактериоза увеличенное количество патобионтических бактерий модулирует экспрессию и активацию TLR, что приводит к провоспалительной реакции в кишечнике и вне кишечника (14, 15).С другой стороны, NLR имеют либо положительные, либо вредные эффекты, которые зависят от антимикробных факторов и провоспалительного цитокинового профиля после активации микробиоты кишечника. В этом мини-обзоре подчеркивается различная роль NLR в метаболических и воспалительных заболеваниях, связанных с дисбактериозом кишечника.
Дисбактериоз кишечника при воспалительных заболеваниях
Микробиота кишечника в гомеостазе напрямую связана со здоровьем хозяина. Кишечная микробиота влияет на метаболизм хозяина (16), иммунную систему (17, 18), микробицидные механизмы кишечника (19) и поддерживает кишечный барьер (20).Многие исследования показывают, что факторы окружающей среды, такие как использование антибиотиков (21, 22), диета (23) и стресс (24), могут изменить микробиоту кишечника, увеличивая количество патобионтических бактерий за счет комменсальных бактерий, процесс, известный как дисбиоз ( 25). Дисбактериоз кишечника способствует развитию ряда аутоиммунных, воспалительных и метаболических заболеваний, таких как ревматоидный артрит (РА), воспалительные заболевания кишечника (ВЗК) и сахарный диабет (26, 27). Однако во многих случаях, например, при ВЗК, еще не известно, является ли дисбактериоз причиной или следствием заболевания (28, 29).Точная роль микробиоты кишечника в патогенезе РА также полностью не изучена. Однако у мышей без микробов (GF) наблюдается задержка развития RA по сравнению с контрольной группой (30). На ранних стадиях РА было зарегистрировано уменьшение количества некоторых комменсальных бактерий, например, принадлежащих к роду Bifidobacteria и Bacteroides , и увеличение количества Escherichia coli и Proteus mirabilis (31, 32). . Кроме того, у пациентов с РА наблюдается повышение уровня Prevotella copri , а также анти- P.copri IgA и IgG, что позволяет предположить, что эти бактерии могут вносить вклад в патогенез РА (33).
Воспалительные заболевания кишечника, такие как болезнь Крона (БК) и язвенный колит (ЯК), поражают около 3 миллионов человек в Европе и США, причем высокая и ускоренная заболеваемость наблюдается в развивающихся странах (34, 35). Хотя этиология все еще не ясна, генетическая предрасположенность и факторы окружающей среды, такие как диета и использование антибиотиков, являются триггерами этих заболеваний, которые в основном характеризуются хроническим воспалением кишечника (34, 36).Кроме того, нарушение эпителиального барьера и дисбактериоз кишечника широко сообщается у пациентов и в экспериментальных моделях желудочно-кишечных инфекций (37, 38), включая пациентов с ВЗК (39, 40). Метагеномный анализ 16S рРНК показал, что микробиота, присутствующая в кале мышей с ЯК, сильно отличается от микробиоты в кале здоровых мышей, в основном увеличением видов филума Verrucomicrobia и уменьшением Tenericutes у мышей с колитом, что коррелирует с с более высоким показателем заболевания (41, 42).Увеличение количества энтеробактерий наблюдается в образцах кала пациентов с CD (43). Численность Escherichia и Shigella также увеличивается в этом состоянии по сравнению со здоровыми людьми. Кроме того, сообщалось о сокращении количества родов Roseburia, Coprococcus и Ruminococcus , которые являются важными продуцентами бутирата (44, 45). Анализ биопсии толстой кишки у пациентов с ВЗК также показывает снижение Firmicutes и увеличение Bacteroidetes (46), а у пациентов с ВЗК наблюдается повышенное производство биопленок штаммами Enterococcus по сравнению со штаммами из контрольной группы (47).
Несбалансированная микробиота кишечника и изменения барьерной функции кишечника также тесно связаны с патогенезом сахарного диабета (СД) (48). СД включает группу метаболических заболеваний, характеризующихся в основном хронической гипергликемией, возникающей в результате нарушения секреции и / или функциональности инсулина (49). При диабете 1 типа (T1D), также называемом аутоиммунным диабетом, присутствуют аутоантитела, и аутореактивные лимфоциты опосредуют разрушение β-клеток поджелудочной железы, что приводит к полному дефициту инсулина (50).Влияние микробиоты на развитие T1D было продемонстрировано на мышах с дефицитом Myd88 и диабетом без ожирения (NOD), выращенных в условиях, свободных от патогенов (SPF) или микробов (GF). Принимая во внимание, что мыши SPF NOD.Myd88 — / — защищены от T1D, у мышей в условиях GF развивается T1D, показывая, что защитные эффекты Myd88 зависят от присутствия микробиоты кишечника (51). В этом контексте многие исследования показали различия в составе микробиоты между диабетиками и недиабетическими пациентами, предполагая, что эти изменения связаны с развитием и тяжестью СД1 (52, 53).Исследования бактериального протеома показывают высокое обогащение белками Clostridium и Bacteroides у детей с СД1, тогда как контрольная группа демонстрирует большее обогащение белками Bifidobacterium (54). Кроме того, снижение количества видов, продуцирующих лактат и бутират, таких как B. adolescentis , связано с аутоиммунитетом T1D (55).
В моделях диабета 2 типа (T2D) дисбиоз кишечника усугубляет воспалительный процесс, увеличивает проницаемость кишечника, а также изменяет метаболизм короткоцепочечных жирных кислот, которые важны для инсулинорезистентности (56), в дополнение к ускорению развития ожирение, ретинопатия и нефропатия (57).У пациентов с СД2 чрезмерное потребление углеводов и белков связано с дисбалансом микробиоты кишечника, с увеличением рода Clostridium и уменьшением количества Bifidobacterium spp. и Lactobacillus , помимо непереносимости глюкозы (58). Более того, в экспериментальных моделях СД2 введение бактерий рода Bifidobacterium улучшает толерантность к глюкозе и придает защитную роль в развитии СД2 (59, 60).Точно так же прием Bacteroides acidifaciens снижает инсулинорезистентность и даже предотвращает ожирение (61).
Рецепторы врожденного иммунитета, такие как NLR, играют решающую роль в защите кишечного барьера от различных микроорганизмов из окружающей среды. Эти рецепторы также модулируют микробный состав кишечника, что связано с развитием воспалительных заболеваний (62).
Защитная роль NLR в гомеостазе кишечной микробиоты и ВЗК
Компоненты врожденной иммунной системы являются первым барьером против инфекций и распознают гибель клеток, вызывая быстрый иммунный ответ за счет распознавания молекулярных паттернов, ассоциированных с патогенами (PAMP) и молекулярных паттернов, связанных с повреждениями (DAMP), соответственно (63).NLR являются частью множества рецепторов врожденного иммунитета, расположенных во внутриклеточной среде, и инициируют воспалительные процессы. NOD1 и NOD2, центральные члены NLR, в основном распознают бактериальный пептидогликан и, таким образом, индуцируют транскрипцию генов NF-kB и митоген-активируемых протеинкиназ (MAPK), активируя экспрессию провоспалительных факторов различными клетками (13).
Рецептор NOD1 обнаруживает гамма-D-глутамил-мезо-диаминопимелиновую кислоту (γ iE-DAP), пептид, обнаруживаемый в основном в грамотрицательных бактериях, но также и в группах грамположительных бактерий, таких как Listeria spp.и Bacillus spp (64–66). В отсутствие NOD1 происходит размножение некоторых кишечных бактерий, таких как Clostridiales , Bacteroides spp., Сегментированные нитчатые бактерии (SFB) и Enterobacteriaceae. Рецептор NOD2 обнаруживает мурамилдипептид (MDP), присутствующий в бактериальном пептидогликане, и является наиболее важным рецептором в кишечном гомеостатическом контроле (67). Этот рецептор контролирует комменсальную микробиоту и устранение патогенных бактерий в кишечных криптах, сводя к минимуму риск воспаления кишечника и колоректального рака (68–70).Интересно, что экспрессия NOD2 зависит от присутствия кишечных комменсальных бактерий, что указывает на положительную обратную связь. Дефицит NOD2 нарушает это гомеостатическое взаимодействие, что приводит к дисбактериозу кишечника и повышенной восприимчивости к ВЗК (69).
Другие NLR также играют важную роль в гомеостазе кишечника. Активация семейства NOD-подобных рецепторов — пиринового домена, содержащего 6 (NLRP6), посредством олигомеризации и сборки белков с комплексом инфламмасом — активирует каспазу-1 и приводит к синтезу IL-1β и IL-18 в эпителии кишечника (71 ).Дефицит NLRP6 в эпителиальных клетках толстой кишки мышей снижает уровень IL-18, способствует дисбактериозу кишечника и увеличивает риск колита (72, 73). IL-18, секретируемый эпителиальными клетками, стимулирует барьерную функцию и регенерацию эпителиальных клеток (73). Кроме того, сама комменсальная микробиота активирует инфламмасому NLRP6, что приводит к выработке слизи бокаловидными клетками и антимикробными пептидами, поддерживая здоровый состав кишечной микробиоты (74).
NLRP3, другой тип NLR, высоко экспрессируется в моноцитарной линии (75) и способствует большей продукции IL-1β по сравнению с IL-18, что приводит к изменениям в составе кишечной микробиоты (76).В нормальных условиях у мышей с дефицитом NLRP3 наблюдается дисбиоз кишечника, связанный с чрезмерным ростом Prevotellaceae и Bacteroidetes (77), тогда как соотношение между Firmicutes и Bacterioidetes уменьшается (78). В отличие от других NLR, NLRP12 обладает противовоспалительным действием, ингибируя канонический и неканонический NF-κB; снижение выработки воспалительных цитокинов, хемокинов и онкогенных факторов (79–82) и контроль инфекции грамотрицательными бактериями (83). Дефицит NLRP12 на модели колита, индуцированного декстрансульфатом натрия (DSS), способствует воспалению толстой кишки, снижает разнообразие кишечной микробиоты и увеличивает количество колитогенных бактерий, таких как семейство Erysipelotrichaceae, что свидетельствует о защитной роли NLRP12 при ВЗК (84).
Расходящиеся роли NLR и AIM2 в развитии T1D
В последние несколько лет несколько линий доказательств продемонстрировали, что члены семейства NLR участвуют в патогенезе T1D. Недавно мы сообщили, что мыши, лишенные NOD2, но не NOD1, устойчивы к индуцированному стрептозотоцином (STZ) T1D и неспособны вызывать иммунный ответ Th2 и Th27 в лимфатических узлах поджелудочной железы (PLN) и поджелудочной железе. Интересно, что у мышей с диабетом наблюдаются изменения в составе микробиоты кишечника, и это связано с транслокацией микробиоты кишечника в PLN (рис. 1).Когда эти мыши подвергаются лечению антибиотиками широкого спектра действия до инъекций STZ, у них не развиваются признаки СД1, такие как гипергликемия. Кроме того, введение лиганда NOD2, MDP, способствует развитию STZ-индуцированного T1D у мышей дикого типа (WT), которым вводили антибиотики и инъецировали STZ. Наши результаты демонстрируют, что распознавание микробиоты кишечника NOD2 в PLN запускает провоспалительный ответ, который индуцирует патогенный иммунный ответ клеток Th2 и Th27, тем самым внося вклад в патогенез STZ-индуцированного T1D (Таблица 1) (85).
Рисунок 1 . Экспрессия и дифференциальные функции NLR в развитии диабета 1 типа. Повышенная экспрессия AIM2 была обнаружена в слизистой оболочке кишечника мышей с предиабетом, и его активация вызывает высвобождение IL-18, что, в свою очередь, способствует продукции RegIIIγ. Этот механизм ослабляет дисбактериоз кишечника, усиливает барьер кишечника и ослабляет ответ лимфоцитов Th2 и Tc1 против продуцирующих инсулин β-клеток, что в конечном итоге защищает от T1D. С другой стороны, NOD2 распознает транслоцированный мурамилдипептид (MDP) из дисбиотической микробиоты и способствует активации лимфоцитов Th2 и Th27 при T1D.Наконец, у мышей с диабетом наблюдалась повышающая регуляция экспрессии NLRP3 в PLN, которая активируется в макрофагах путем распознавания митохондриальной ДНК (мДНК), приводит к продукции IL-1β и стимулирует образование патогенных лимфоцитов Th27 и Th2, что приводит к началу T1D.
Таблица 1 . Резюме экспериментальных исследований роли NLR в T1D.
STZ-инъецированные мыши WT демонстрируют увеличение различных групп бактерий в кишечной микробиоте, таких как семейство Bacteroidaceae и род Bacteroides , которые были связаны с повышенной восприимчивостью к T1D у людей (91, 92).Эти результаты повторяют то, что было обнаружено у пациентов с сахарным диабетом 1 типа, при этом тип Bacteroidetes, семейство Bacteroidaceae и род Bacteroides чаще встречаются у детей с положительной реакцией на антитела, чем у сверстников с отрицательной реакцией на антитела (55). Другое важное наблюдение, обнаруженное среди пациентов с диабетом 1 типа, — снижение разнообразия микробиоты, связанное со снижением относительной численности Bifidobacterium, Roseburia, Faecalibacterium и Lachnospira (91).Эти данные показывают, что дисбактериоз кишечника, наблюдаемый у пациентов с диабетом 1 типа, может действовать как триггер окружающей среды в развитии заболевания, и что стратегии, нацеленные на блокировку передачи сигналов NOD2, появляются в качестве потенциальных методов лечения СД1. Аналогичные результаты были получены на модели спонтанных мышей T1D. Мыши NOD.NOD2 — / — без совместного проживания демонстрируют снижение частоты СД1 и снижение CD4 + IFN-γ + / CD8 + IFN-γ + (Th2 / Tc1) и CD4 + IL-17 + / CD8 + IL-17 + (Th27 / Tc17) Т-клетки в PLN, что указывает на то, что активация NOD2 регулирует развитие T1D, изменяя состав микробиоты кишечника и модулируя адаптивный иммунный ответ ( 86).
Другие исследования также показали, что NLRP3 необходим для патогенеза СД1. Дефицит NLRP3 у мышей NOD защищает от T1D, подавляя экспрессию хемокинов и хемокиновых рецепторов, участвующих в миграции иммунных клеток к островкам поджелудочной железы. Дефицит NLRP3 у мышей NOD снижает экспрессию CCR5 и CXRC3 на Т-клетках, а также экспрессию генов CCL5 и CXCL10 в ткани поджелудочной железы, и эти процессы происходят зависимым от IRF1 образом (87). Кроме того, наша исследовательская группа продемонстрировала, что активация инфламмасомы NLRP3 митохондриальной ДНК (мДНК) способствует высвобождению IL-1β макрофагами, способствуя генерации патогенных клеток Th27 / Th2 в PLN и чувствительности к T1D в модели STZ-индуцированного T1D (рис. , Таблица 1) (88).Соответственно, ассоциативное исследование в северо-восточной части Бразилии выявило два однонуклеотидных полиморфизма (SNP) в NLRP3, rs10754558 и rs358294199, которые связаны с T1D у людей, что свидетельствует о том, что вариации NLRP3 могут быть предрасполагающим генетическим фактором для развитие аутоиммунного СД1 (89).
Другой рецептор врожденного иммунитета, который приводит к сборке инфламмасом при его активации, — это датчик ДНК, отсутствующий в меланоме 2 (AIM2) (93, 94). Активация AIM2 участвует в аутоиммунных и воспалительных заболеваниях (95).В модели STZ T1D AIM2 высоко экспрессируется в подвздошной кишке на ранних стадиях заболевания. Интересно, что AIM2 — / — STZ-инъецированные мыши обнаруживают повышенную частоту T1D, повышенную кишечную проницаемость и бактериальную транслокацию в PLN, что приводит к провоспалительному ответу, опосредованному клетками Th2 и Tc1. Когда микробиота кишечника истощается коктейлем антибиотиков широкого спектра действия перед инъекциями STZ, повышенная чувствительность к T1D, наблюдаемая у мышей AIM2 — / — , исчезает (Таблица 1).Эффекты, индуцируемые активацией AIM2 in vivo , опосредуются высвобождением IL-18, который способствует регенерации продукции III гамма (RegIIIγ) островкового происхождения, таким образом смягчая изменения микробиоты кишечника и усиливая барьерную функцию кишечника. Вместе наши данные показывают, что активация AIM2 ограничивает дисбактериоз кишечной микробиоты, кишечную проницаемость и транслокацию в PLN, уменьшая провоспалительный ответ и обеспечивая защиту от T1D (90).
Роль NLR в ожирении, СД2 и сопутствующих заболеваниях
Дисбактериоз кишечника может приводить к повышенной проницаемости кишечного барьера, что приводит к системному воспалению низкой степени и метаболическим нарушениям, таким как ожирение, СД2 и ишемический инсульт (96, 97).Рецепторы врожденного иммунитета играют роль в системном воспалении, вызванном ожирением. У мышей, получавших диету с высоким содержанием жиров (HFD), наблюдается усиление воспаления толстой кишки и эндотоксемии из-за повышенной кишечной проницаемости слизистой оболочки толстой кишки (98). Кроме того, наблюдается усиление передачи сигналов TLR4 в толстой кишке и активация NF-κB (98). Однако самки мышей, лишенные TLR4, демонстрируют более высокий риск развития ожирения, но также обладают большей защитой от инсулинорезистентности, возможно, из-за отсутствия передачи сигналов TLR4 в органах, важных для метаболического гомеостаза (99).Кроме того, другие исследования показали, что дисбактериоз кишечника способствует состоянию метаболической эндотоксемии при ожирении, что приводит к накоплению ЛПС в крови, мета воспламенению и инсулинорезистентности через путь CD14 / TLR4 (100–102).
T2D — это хроническое метаболическое воспалительное состояние и самый распространенный тип диабета у взрослых во всем мире (103). Это заболевание инициируется обострением дисфункции поджелудочной железы, когда выработка инсулина β-клетками поджелудочной железы не успевает за увеличением периферической инсулинорезистентности (104, 105).Системное воспаление слабой степени сопровождает диабет с высокими уровнями в сыворотке крови С-реактивного белка (CRP), фактора некроза опухоли (TNF-α), хемопривлекающего моноциты белка-1 (MCP-1) и IL-1β (106, 107 ). Кроме того, ожирение, старение и другие состояния, способствующие хроническому воспалению слабой степени, связаны с повышенным риском развития СД2 (108–110). Системно высокие сывороточные концентрации IL-6, IL-1β и TNF-α увеличивают инсулинорезистентность и вызывают эндотелиальную дисфункцию, стимулируя сосудистую систему к развитию заболеваний, связанных с диабетом, включая системную артериальную гипертензию (111).Между тем, повышение уровня IL-1β, IL-6 и IL-8 в поджелудочной железе снижает экспрессию гена инсулина в β-клетках поджелудочной железы, что способствует повышению инсулинорезистентности (112).
Точный баланс между активацией врожденных рецепторов NOD1 и NOD2 имеет решающее значение для поддержания периферической инсулинорезистентности. Прямая активация рецепторов NOD1 посредством внутрибрюшинного введения лиганда NOD1 у мышей WT приводит к увеличению периферической инсулинорезистентности в течение 6 часов (113). В этом же исследовании активация NOD1 вызывала небольшое увеличение циркулирующих провоспалительных цитокинов.Кроме того, более высокие концентрации медиаторов воспаления наблюдаются в культурах фибробластов 3T3-L1, дифференцированных в адипоциты и подвергнутых воздействию лигандов NOD1 в течение 18 часов (113). Воспаление периферических тканей, особенно жировой ткани (114), является отличительной чертой СД2 и напрямую способствует его патогенезу через дисфункцию жировой ткани и последующие осложнения энергетического гомеостаза и промежуточного метаболизма (115). В этом контексте мыши NOD1 / NOD2 с двойным нокаутом защищены от периферической инсулинорезистентности и периферического воспаления, наблюдаемых в модели T2D, вызванной ожирением (HFD) (113).
NOD2 — это рецептор врожденного иммунитета, который распознает пептидогликан в клеточной стенке бактерий и, следовательно, представляет собой важное звено между микробиотой кишечника и иммунитетом (116). Следовательно, профиль активации NOD2 может быть важным при метаболических заболеваниях с ответвлениями иммунной системы и, следовательно, может представлять собой связь между микробиотой кишечника и этими заболеваниями. Дефицит NOD2 у мышей способствует большему перемещению бактерий из кишечника (116). В модели HFD мыши с дефицитом NOD2 проявляют большую периферическую резистентность к инсулину, воспаление висцеральной жировой ткани и более высокое содержание бактериальной ДНК в печени (117).HFD увеличивает соотношение Firmicutes к Bacteriodetes, а у мышей NOD2 — / — , подвергнутых HFD, обнаруживается дисбактериоз, представленный увеличением количества бактерий Helicobacter и семейства Peptococcaceae и уменьшением количества бактерий рода Clostridium по сравнению с Мыши WT, получавшие HFD (117). Трансплантация фекалий от мышей с ожирением мышам с худым GF увеличивает общую массу тела и массу жировой ткани. В качестве альтернативы трансплантация фекалий от тощих мышей мышам GF с ожирением снижает массу жировой ткани (118).В этой последней экспериментальной установке наблюдается увеличение количества типов Bacteriodetes в кишечнике, что связано с производством метаболитов микробиоты с модулирующими свойствами хозяина, в частности: SCFAs (118). Интересно, что адекватное потребление пищевых волокон способствует секреции SCFAs кишечной микробиотой. Кроме того, активация рецептора GPR43 у мышей с помощью SCFAs в макрофагах M2 жировой ткани приводит к повышенной метаболической активности и способствует поддержанию и гомеостазу здоровой жировой ткани, улучшая метаболическое здоровье (119).
Заключительные замечания
Различные категории NLR модулируют вызванные дисбактериозом кишечника внекишечные и кишечные воспалительные заболевания. Эффекты NLR разнообразны и могут быть как защитными, так и вредными, в зависимости от иммунологического контекста. В кишечнике NLR регулируют состав и транслокацию кишечной микробиоты, влияя на секрецию слизи и продукцию антимикробных пептидов, тем самым играя ключевую роль в защите от воспалительных заболеваний кишечника, таких как язвенный колит и болезнь Крона.Альтернативно, NLR также активируются микробными PAMP (кишечная микробиота) или эндогенными DAMP (компонентами мертвых или умирающих клеток), которые действуют как отрицательные или положительные регуляторы врожденного и адаптивного иммунного ответа и способствуют восприимчивости или устойчивости к метаболическим заболеваниям, таким как как ожирение, диабет 1, 2 типа и их сопутствующие заболевания. Таким образом, фармакологическая модуляция этих рецепторов может представлять новые терапевтические стратегии для этих воспалительных и метаболических заболеваний.
Авторские взносы
JE-O, JL, ÍP, JG и GM в равной степени внесли свой вклад в написание рукописи. JS и RT оказали научную помощь и критически пересмотрели ее. DC координировал и рецензировал рукопись. Все авторы одобрили подачу и публикацию.
Финансирование
Это исследование было поддержано грантами Исследовательского фонда Сан-Паулу (FAPESP) (номера процессов: 2012 / 10395-0; 2018 / 14815-0).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
5. Чжан X, Чжан Д., Цзя Х., Фэн К., Ван Д., Лян Д. и др. Микробиомы полости рта и кишечника нарушаются при ревматоидном артрите и частично нормализуются после лечения. Nat Med. (2015) 21: 895–905. DOI: 10,1038 / нм.3914
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Карлссон Ф. Х., Фак Ф., Нукау И., Тремароли В., Фагерберг Б., Петранович Д. и др. Симптоматический атеросклероз связан с измененным метагеномом кишечника. Nat Commun. (2012) 3: 1245. DOI: 10.1038 / ncomms2266
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Tamboli CP, Neut C, Desreumaux P, Colombel JF. Дисбактериоз при воспалительном заболевании кишечника. Gut. (2004) 53: 1–4. DOI: 10.1136 / gut.53.1.1
CrossRef Полный текст | Google Scholar
8. Тай Н, Вонг Ф.С., Вэнь Л. Роль кишечной микробиоты в развитии сахарного диабета 1-го, 2-го типа и ожирения. Rev Endocr Metab Disord. (2015) 16: 55–65. DOI: 10.1007 / s11154-015-9309-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Ли Х, Ватанабе К., Кимура И. Дисбиоз кишечной микробиоты стимулирует и предполагает новые терапевтические стратегии для лечения сахарного диабета и связанных с ним метаболических заболеваний. Front Immunol. (2017) 8: 1882. DOI: 10.3389 / fimmu.2017.01882
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Frosali S, Pagliari D, Gambassi G, Landolfi R, Pandolfi F, Cianci R.Как сложное взаимодействие между толл-подобными рецепторами, микробиотой и кишечным иммунитетом может влиять на патологию желудочно-кишечного тракта. J Immunol Res. (2015) 2015: 489821. DOI: 10.1155 / 2015/489821
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Роуленд И., Гибсон Дж., Хейнкен А., Скотт К., Суонн Дж., Тиле И. и др. Функции кишечной микробиоты: метаболизм питательных веществ и других компонентов пищи. Eur J Nutr. (2018) 57: 1–24. DOI: 10.1007 / s00394-017-1445-8
CrossRef Полный текст | Google Scholar
18.Лазар В., Диту Л.М., Пиркалабиру Г.Г., Георге И., Курутиу С., Холбан А.М. и др. Аспекты взаимодействия микробиоты кишечника и иммунной системы при инфекционных заболеваниях, иммунопатологии и раке. Front Immunol. (2018) 9: 1–1830. DOI: 10.3389 / fimmu.2018.01830
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Зарринпар А., Шаикс А., Сюй З.З., Чанг М.В., Мароц, Калифорния, Сагательян А. и др. Вызванное антибиотиками истощение микробиома изменяет метаболический гомеостаз, влияя на передачу сигналов в кишечнике и метаболизм в толстой кишке. Nat Commun. (2018) 9: 2872. DOI: 10.1038 / s41467-018-05336-9
PubMed Аннотация | CrossRef Полный текст
22. Ким Х.Дж., Ли Ш., Хонг С.Дж. Вызванный антибиотиками дисбиоз кишечной микробиоты усугубляет атопический дерматит у мышей из-за измененных короткоцепочечных жирных кислот. Allergy Asthma Immunol Res. (2020) 12: 137–48. DOI: 10.4168 / aair.2020.12.1.137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Алоу М.Т., Лагье Дж., Рауль Д.Влияние диеты на микробиоту кишечника и дисбактериоз, связанный с нарушением питания. Hum Microbiome J. (2016) 1: 3–11. DOI: 10.1016 / j.humic.2016.09.001
CrossRef Полный текст | Google Scholar
24. Карл Дж. П., Хэтч А. М., Арчидиаконо С. М., Пирс С. К., Пантоха-Фелисиано И. Г., Доэрти Л. А. и др. Влияние психологических, экологических и физических стрессоров на микробиоту кишечника. Front Microbiol. (2018) 9: 2013. DOI: 10.3389 / fmicb.2018.02013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29.Бутто Л.Ф., Халлер Д. Дисбиоз при воспалении кишечника: причина или следствие. Int J Med Microbiol. (2016) 306: 302–9. DOI: 10.1016 / j.ijmm.2016.02.010
CrossRef Полный текст | Google Scholar
31. Ваахтовуо Дж., Мунукка Э., Коркеамаки М., Лууккайнен Р., Тойванен П. Фекальная микробиота при раннем ревматоидном артрите. J Rheumatol. (2008) 35: 1500–5.
Google Scholar
32. Ньюкирк М.М., Збар А., Барон М., Манжес АР. Отчетливые паттерны бактериальной колонизации подтипов Escherichia coli связаны со статусом ревматоидного фактора при раннем воспалительном артрите. Ревматология. (2010) 49: 1311–6. DOI: 10.1093 / ревматология / keq088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Пианта А., Арвикар С., Стрле К., Дроуин Е.Е., Ван К., Костелло С.Е. и др. Доказательства иммунной значимости кишечного микроба prevotella copri у пациентов с ревматоидным артритом. Arthritis Rheumatol. (2017) 69: 964–75. DOI: 10.1002 / art.40003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34.Ni J, Wu GD, Albenberg L, Tomov VT. Микробиота кишечника и ВЗК: причинная связь или корреляция? Nat Publ Gr. (2017) 14: 573–84. DOI: 10.1038 / nrgastro.2017.88
CrossRef Полный текст | Google Scholar
35. Соавторы G 2017 IBD. Глобальное, региональное и национальное бремя воспалительных заболеваний кишечника в 195 странах и территориях, 1990-2017 гг .: систематический анализ для исследования глобального бремени болезней, 2017 г. Lancet Gastroenterol Hepatol. (2020) 5: 17–30.DOI: 10.1016 / S2468-1253 (19) 30333-4
CrossRef Полный текст | Google Scholar
36. Маттос БРР, Гарсия М.П.Г., Ногейра Дж.Б., Пайатто Л.Н., Альбукерке К.Г., Соуза К.Л. и др. Воспалительное заболевание кишечника: обзор иммунных механизмов и биологических методов лечения. Медиаторы воспаления. (2015) 2015: 493012. DOI: 10.1155 / 2015/493012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Битти Дж. К., Акиерман С. В., Мотта Дж. П., Муиз С., Воркентин М. Л., Харрисон Дж. Дж. И др.Giardia duodenalis вызывает патогенный дисбиоз биопленок кишечной микробиоты человека. Int J Parasitol. (2017) 47: 311–26. DOI: 10.1016 / j.ijpara.2016.11.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Yu LCH, Shih YA, Wu LL, Lin YD, Kuo W.T., Peng WH, et al. Кишечный дисбактериоз способствует развитию устойчивых к антибиотикам бактериальных инфекций: системного распространения устойчивых и комменсальных бактерий через эпителиальный трансцитоз. Am J Physiol Gastrointest Liver Physiol. (2014) 307: G824–35. DOI: 10.1152 / ajpgi.00070.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Пророк-Хамон М., Фрисвелл М.К., Алсвид А., Робертс К.Л., Сонг Ф., Фланаган П.К. и др. Связанные со слизистой оболочкой толстой кишки диффузно адгезивные afaC + Escherichia coli , экспрессирующие lpfA и pks, увеличиваются при воспалительном заболевании кишечника и раке толстой кишки. Gut. (2014) 63: 761–70. DOI: 10.1136 / gutjnl-2013-304739
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41.Саманта А.К., Торок В.А., Перси Нью-Джерси, Абимослех С.М., Ховарт Г.С. Микробный дактилоскопический анализ позволяет выявить уникальные бактериальные сообщества в фекальной микробиоте крыс с экспериментально вызванным колитом. J Microbiol. (2012) 50: 218–25. DOI: 10.1007 / s12275-012-1362-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Нагалингам Н.А., Као Дж.Й., Янг В.Б. Микробная экология кишечника мышей, связанная с развитием колита, индуцированного декстран-сульфатом натрия. Воспаление кишечника. (2011) 17: 917–26. DOI: 10.1002 / ibd.21462
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Сексик П., Риготтье-Гойс Л., Грамет Г., Сутрен М., Почарт П., Марто П. и др. Изменения доминирующих фекальных бактериальных групп у пациентов с болезнью Крона толстой кишки. Gut. (2003) 52: 237–42. DOI: 10.1136 / gut.52.2.237
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Чен Л., Ван В., Чжоу Р., Нг С.К., Ли Дж., Хуанг М. и др.Характеристики фекальной и слизистой микробиоты у китайских пациентов с воспалительным заболеванием кишечника. Медицина. (2014) 93: e51. DOI: 10.1097 / MD.0000000000000051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Ковальска-Дуплага К., Госевски Т., Капуста П., Срока-Олексяк А., Ведрихович А., Печарковский С. и др. Различия в микробиоме кишечника здоровых детей и пациентов с впервые диагностированной болезнью Крона. Sci Rep. (2019) 9: 18880. DOI: 10.1038 / s41598-019-55290-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Уокер А. В., Сандерсон Дж. Д., Черчер С., Паркс Г. С., Хадспит Б. Н., Реймент Н. и др. Высокопроизводительный анализ библиотеки клонов микробиоты, связанной со слизистой оболочкой, выявляет дисбактериоз и различия между воспаленными и невоспаленными участками кишечника при воспалительном заболевании кишечника. BMC Microbiol. (2011) 11: 7. DOI: 10.1186 / 1471-2180-11-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47.Golinska E, Tomusiak A, Gosiewski T, Wiecek G, Machul A, Mikolajczyk D, et al. Факторы вирулентности штаммов Enterococcus , выделенных от пациентов с воспалительным заболеванием кишечника. World J Gastroenterol. (2013) 19: 3562–72. DOI: 10.3748 / wjg.v19.i23.3562
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Лу Дж., Ма К.Л., Руань XZ. Дисбиоз микробиоты кишечника способствует развитию сахарного диабета. Инфекционные микробы Dis. (2019) 1: 43–8.DOI: 10.1097 / IM9.0000000000000011
CrossRef Полный текст | Google Scholar
51. Вен Л., Лей Р. Е., Волчков П. Ю., Странджес П. Б., Аванесян Л., Стоунбрейкер А. С. и др. Врожденный иммунитет и микробиота кишечника в развитии диабета 1 типа. Природа. (2008) 455: 1109–13. DOI: 10.1038 / nature07336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Джамшиди П., Хасанзаде С., Тахвилдари А., Фарси Ю., Арбаби М., Мота Дж. Ф. и др. Есть ли связь между микробиотой кишечника и диабетом 1 типа? Систематический обзор. Gut Pathog. (2019) 11:49. DOI: 10.1186 / s13099-019-0332-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Пинто Э, Ансельмо М., Калха М., Боттрилл А., Дуарте И., Эндрю П. У. и др. Кишечный протеом детей с диабетом и контрольной группы обогащен различными микробными белками и белками хозяина. Микробиология. (2017) 163: 161–74. DOI: 10.1099 / mic.0.000412
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55.де Гоффау М.С., Луопаярви К., Книп М., Илонен Дж., Руохтула Т., Харконен Т. и др. Состав фекальной микробиоты у детей с бета-клеточным аутоиммунитетом и без него различается. Диабет. (2013) 62: 1238–44. DOI: 10.2337 / db12-0526
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Сиркана А., Фрамарин Л., Леоне Н., Беррутти М., Кастеллино Ф., Паренте Р. и др. Изменение микробиоты кишечника при диабете 2 типа: просто совпадение? Curr Diab Rep.9 (2018) 18:98.DOI: 10.1007 / s11892-018-1057-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Фернандес Р., Виана С.Д., Нунес С., Рейс Ф. Диабетический дисбактериоз кишечной микробиоты как воспаление и состояние иммунного старения, которое способствует прогрессированию ретинопатии и нефропатии. Biochim Biophys Acta Mol Basis Dis. (2019) 1865: 1876–97. DOI: 10.1016 / j.bbadis.2018.09.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Ямагути Ю., Адачи К., Сугияма Т., Симозато А., Эби М., Огасавара Н. и др.Связь кишечной микробиоты с метаболическими маркерами и диетическими привычками у пациентов с сахарным диабетом 2 типа. Пищеварение. (2016) 94: 66–72. DOI: 10.1159 / 000447690
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Ле ТКС, Хосака Т., Нгуен Т.Т., Кассу А., Данг Т.О., Тран HB и др. Виды Bifidobacterium снижают уровень глюкозы в сыворотке, увеличивают экспрессию сигнальных белков инсулина и улучшают профиль адипокина у мышей с диабетом. Biomed Res. (2015) 36: 63–70.DOI: 10.2220 / биомедры.36.63
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Кикучи К., Бен Отман М., Сакамото К. Стерилизованные бифидобактерии подавляли накопление жира и уровень глюкозы в крови. Biochem Biophys Res Commun. (2018) 501: 1041–7. DOI: 10.1016 / j.bbrc.2018.05.105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Ян Дж.Й., Ли Ю.С., Ким Й., Ли Ш., Рю С., Фукуда С. и др. Комменсал кишечника Bacteroides acidifaciens предотвращает ожирение и улучшает чувствительность к инсулину у мышей. Mucosal Immunol. (2017) 10: 104–16. DOI: 10,1038 / mi.2016.42
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Даолин Т., Руи К., Койн С.Б., Зе Х.Дж., Лотце М.Т. PAMP и DAMP: сигнальные 0, которые стимулируют аутофагию и иммунитет. Immunol Rev. (2012) 249: 158–75. DOI: 10.1111 / j.1600-065X.2012.01146.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Жирардин С.Е., Травассос Л.Х., Эрве М., Блано Д., Бонека И.Г., Филпотт Д.Д. и др.Требования к молекулам пептидогликана, позволяющие обнаруживать их с помощью Nod1 и Nod2. J Biol Chem. (2003) 278: 41702–8. DOI: 10.1074 / jbc.M307198200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Girardin SE, Boneca IG, Carneiro LAM, Antignac A, Jéhanno M, Viala J, et al. Nod1 обнаруживает уникальный муропептид из грамотрицательного бактериального пептидогликана. Наука. (2003) 300: 1584–7. DOI: 10.1126 / science.1084677
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66.Чамайлард М., Хашимото М., Хори Й., Масумото Дж., Цю С., Сааб Л. и др. Существенная роль NOD1 в распознавании хозяином бактериального пептидогликана, содержащего диаминопимелиновую кислоту. Nat Immunol. (2003) 4: 702–7. DOI: 10.1038 / ni945
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Инохара Н., Огура Ю., Фонтальба А., Гутьеррес О., Понс Ф., Креспо Дж. И др. Распознавание хозяином бактериального мурамилдипептида, опосредованного NOD2: последствия для болезни Крона. J Biol Chem. (2003) 278: 5509–12. DOI: 10.1074 / jbc.C200673200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Рехман А., Сина С., Гаврилова О., Хеслер Р., Отт С., Бейнс Дж. Ф. и др. Nod2 необходим для временного развития кишечных микробных сообществ. Gut. (2011) 60: 1354–62. DOI: 10.1136 / gut.2010.216259
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Петницки-Оквейя Т., Хрнцир Т., Лю Ю.Дж., Бисвас А., Худкович Т., Тласкалова-Хогенова Х. и др.Nod2 необходим для регуляции комменсальной микробиоты в кишечнике. Proc Natl Acad Sci USA. (2009) 106: 15813–8. DOI: 10.1073 / pnas.02106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Кутюрье-Майяр А., Секер Т., Рехман А., Норманд С., Де Арканджелис А., Хеслер Р. и др. NOD2-опосредованный дисбиоз предрасполагает мышей к трансмиссивному колиту и колоректальному раку. J Clin Invest. (2013) 123: 700–11. DOI: 10.1172 / JCI62236
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72.Леви М., Таисс К.А., Зееви Д., Дохналова Л., Зильберман-Шапира Г., Махди Дж. А. и др. Метаболиты, модулируемые микробиотой, формируют микроокружение кишечника, регулируя передачу сигналов воспаления NLRP6. Cell. (2015) 163: 1428–43. DOI: 10.1016 / j.cell.2015.10.048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Элинав Э., Стровиг Т., Кау А.Л., Энао-Мехиа Дж., Тайс, Калифорния, Бут CJ и др. Инфламмасома NLRP6 регулирует микробную экологию толстой кишки и риск колита. Cell. (2011) 145: 745–57. DOI: 10.1016 / j.cell.2011.04.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Wlodarska M, Thaiss CA, Nowarski R, Henao-Mejia J, Zhang JP, Brown EM, et al. Инфламмасома NLRP6 управляет интерфейсом кишечника хозяин-микроб, регулируя секрецию слизи бокаловидными клетками. Cell. (2014) 156: 1045–59. DOI: 10.1016 / j.cell.2014.01.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75.Awad F, Assrawi E, Jumeau C, Georgin-Lavialle S, Cobret L, Duquesnoy P и др. Влияние поляризации человеческих моноцитов и макрофагов на экспрессию NLR и активацию инфламмасомы NLRP3. PLoS ONE. (2017) 12: e0175336. DOI: 10.1371 / journal.pone.0175336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Яо Х, Чжан Ц., Син И, Сюэ Г, Чжан Ц., Пань Ф и др. Ремоделирование кишечной микробиоты гиперактивным NLRP3 побуждает регуляторные Т-клетки поддерживать гомеостаз. Nat Commun. (2017) 8: 1–17. DOI: 10.1038 / s41467-017-01917-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Хенао-Мейджиа Дж., Элинав Э., Джин С., Хао Л., Мехал В.З., Стровиг Т. и др. Инфламмасомный дисбиоз регулирует прогрессирование НАЖБП и ожирения. Природа. (2012) 482: 179–85. DOI: 10.1038 / nature10809
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Уильямс К.Л., Лич Дж. Д., Дункан Дж. А., Рид В., Раллабанди П., Мур С. и др.Белок CATERPILLER Monarch-1 является антагонистом toll-подобных рецепторов, фактора некроза опухоли α- и провоспалительных сигналов, индуцированных Mycobacterium tuberculosis. J Biol Chem. (2005) 280: 39914–24. DOI: 10.1074 / jbc.M502820200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Лич Дж. Д., Уильямс К. Л., Мур С. Б., Артур Дж. К., Дэвис Б. К., налоговый инспектор Д. Д. и др. Передний край: monarch-1 подавляет неканоническую активацию NF-κB и p52-зависимую экспрессию хемокинов в моноцитах. J Immunol. (2007) 178: 1256–60. DOI: 10.4049 / jimmunol.178.3.1256
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Аллен И.К., Уилсон Дж. Э., Шнайдер М., Лич Дж. Д., Робертс Р. А., Артур Дж. С. и др. NLRP12 подавляет воспаление толстой кишки и онкогенез за счет негативной регуляции неканонической передачи сигналов NF-κB. Иммунитет. (2012) 36: 742–54. DOI: 10.1016 / j.immuni.2012.03.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82.Заки М.Х., Фогель П., Малиредди Р.КС., Боди-Малапель М., Ананд П.К., Бертин Дж. И др. NOD-подобный рецептор NLRP12 ослабляет воспаление толстой кишки и онкогенез. Cancer Cell. (2011) 20: 649–60. DOI: 10.1016 / j.ccr.2011.10.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Владимер Г.И., Венг Д., Пакетт SWM, Ваная С.К., Ратинам ВАК, Ауне М.Х. и др. Инфламмасома NLRP12 распознает yersinia pestis. Иммунитет. (2012) 37: 96–107. DOI: 10.1016 / j.иммунитет.2012.07.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Chen L, Wilson JE, Koenigsknecht MJ, Chou WC, Montgomery SA, Truax AD, et al. NLRP12 ослабляет воспаление толстой кишки, поддерживая микробное разнообразие толстой кишки и способствуя защитному росту комменсальных бактерий. Nat Immunol. (2017) 18: 541–51. DOI: 10.1038 / ni.3690
CrossRef Полный текст | Google Scholar
85. Коста FRC, Francozo MCS, de Oliveira GG, Ignacio A, Castoldi A, Zamboni DS, et al.Транслокация кишечной микробиоты в лимфатические узлы поджелудочной железы запускает активацию NOD2 и способствует возникновению T1D. J Exp Med. (2016) 213: 1223–39. DOI: 10.1084 / jem.20150744
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Ли YY, Пирсон JA, Chao C, Peng J, Zhang X, Zhou Z и др. Нуклеотид-связывающий домен олигомеризации, содержащий белок 2 (Nod2), модулирует восприимчивость к TIDM микробиотой кишечника. J Аутоиммун. (2017) 82: 85–95. DOI: 10.1016 / j.jaut.2017.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Ху Ц., Дин Х, Ли Й, Пирсон Дж. А., Чжан Х, Флавелл Р. А. и др. Дефицит NLRP3 защищает от диабета 1 типа за счет регуляции хемотаксиса островков поджелудочной железы. Proc Natl Acad Sci USA. (2015) 112: 11318–23. DOI: 10.1073 / pnas.1513509112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Карлос Д., Коста, Франция, Перейра, Калифорния, Роча, Ф.А., Яочите, JNU, Оливейра, Г.Г. и др.Митохондриальная ДНК активирует инфламмасому NLRP3 и предрасполагает к диабету 1 типа на мышиной модели. Front Immunol. (2017) 8: 164. DOI: 10.3389 / fimmu.2017.00164
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Pontillo A, Brandao L, Guimaraes R, Segat L, Araujo J, Crovella S. Два SNP в гене NLRP3 вовлечены в предрасположенность к диабету 1 типа и целиакии в педиатрической популяции из северо-восточной Бразилии. Аутоиммунитет. (2010) 43: 583–9.DOI: 10.3109 / 080
0432
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90. Лейте Дж. А., Пессенда Дж., Герра-Гомес ИК, де Сантана АКМ, Андре Перейра С., Рибейро Кампос Коста Ф. и др. ДНК-сенсор AIM2 защищает от индуцированного стрептозотоцином диабета 1 типа, регулируя гомеостаз кишечника через путь IL-18. Ячейки. (2020) 9: 959. DOI: 10.3390 / Cell
59
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91.Murri M, Leiva I., Gomez-Zumaquero JM, Tinahones FJ, Cardona F, Soriguer F и др. Микробиота кишечника у детей с диабетом 1 типа отличается от таковой у здоровых детей: исследование случай-контроль. BMC Med. (2013) 11:46. DOI: 10.1186 / 1741-7015-11-46
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Паттерсон Е., Маркес Т.М., О’Салливан О., Фицджеральд П., Фицджеральд Г.Ф., Коттер П.Д. и др. Стрептозотоцин-индуцированный диабет типа 1 у крыс Sprague-Dawley связан с измененным составом кишечной микробиоты и уменьшением разнообразия. Микробиология. (2015) 161: 182–93. DOI: 10.1099 / mic.0.082610-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Хорнунг В., Аблассер А., Шаррел-Деннис М., Бауэрнфейнд Ф., Хорват Г., Кэффри Д. Р. и др. AIM2 распознает цитозольную дцДНК и формирует воспаление, активирующее каспазу-1, с ASC. Природа. (2009) 458: 514–8. DOI: 10.1038 / nature07725
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Ратинам ВАК, Цзян Цз., Ваггонер С.Н., Шарма С., Коул Л. Е., Ваггонер Л. и др.Инфламмасома AIM2 необходима для защиты хозяина от цитозольных бактерий и ДНК-вирусов. Nat Immunol. (2010) 11: 395–402. DOI: 10.1038 / ni.1864
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Ман С.М., Карки Р., Каннеганти Т-Д. Инфламмасома AIM2 при инфекции, раке и аутоиммунитете: роль в распознавании ДНК, воспалении и врожденном иммунитете. Eur J Immunol. (2016) 46: 269–80. DOI: 10.1002 / eji.201545839
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96.Ямасиро К., Танака Р., Урабе Т., Уэно Ю., Ямаширо Ю., Номото К. и др. Дисбактериоз кишечника связан с метаболизмом и системным воспалением у пациентов с ишемическим инсультом. PLoS ONE. (2017) 12: e0171521. DOI: 10.1371 / journal.pone.0171521
CrossRef Полный текст | Google Scholar
97. Pasini E, Corsetti G, Assanelli D, Testa C, Romano C, Dioguardi FS, et al. Влияние хронических упражнений на микробиоту кишечника и кишечный барьер у человека с диабетом 2 типа. Minerva Med. (2019) 110: 3–11. DOI: 10.23736 / S0026-4806.18.05589-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Ким К.А., Гу В, Ли И.А., Джон Э.Х., Ким Д.Х. Микробиота кишечника, вызванная диетой с высоким содержанием жиров, усугубляет воспаление и ожирение у мышей через сигнальный путь TLR4. PLoS ONE. (2012) 7: e47713. DOI: 10.1371 / journal.pone.0047713
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Ши Х., Кокоева М.В., Иноуэ К., Цамели И., Инь Х., Флиер Дж. С..TLR4 связывает врожденный иммунитет и инсулинорезистентность, вызванную жирными кислотами. J Clin Invest. (2006) 116: 3015–25. DOI: 10.1172 / JCI28898
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Кани П.Д., Амар Дж., Иглесиас М.А., Погги М., Кнауф С., Бастелика Д. и др. Метаболическая эндотоксемия вызывает ожирение и инсулинорезистентность. Диабет. (2007) 56: 1761–72. DOI: 10.2337 / db06-1491
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101.Поджи М., Бастелика Д., Гуаль П., Иглесиас М.А., Гремо Т., Кнауф С. и др. Мыши C3H / HeJ, несущие мутацию toll-подобного рецептора 4, защищены от развития инсулинорезистентности в белой жировой ткани в ответ на диету с высоким содержанием жиров. Diabetologia. (2007) 50: 1267–76. DOI: 10.1007 / s00125-007-0654-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Люче Э., Кузен Б., Гариду Л., Серино М., Вагет А., Барро С. и др. Метаболическая эндотоксемия напрямую увеличивает пролиферацию предшественников адипоцитов в начале метаболических заболеваний через CD14-зависимый механизм. Mol Metab. (2013) 2: 281–91. DOI: 10.1016 / j.molmet.2013.06.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Пайпер М.С., Саад Р.Дж. Сахарный диабет и Cclon. Curr Treat Options Гастроэнтерол. (2017) 15: 460–74. DOI: 10.1007 / s11938-017-0151-1
CrossRef Полный текст | Google Scholar
104. Аларкон С., Боланд Б. Б., Учизоно Ю., Мур П. С., Петерсон Б., Раджан С. и др. Адаптивная пластичность β-клеток поджелудочной железы при ожирении увеличивает выработку инсулина, но отрицательно влияет на секреторную функцию. Диабет. (2016) 65: 438–50. DOI: 10.2337 / db15-0792
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Рандерия С.Н., Томсон Г.Дж., Нелл Т.А., Робертс Т., Преториус Э. Воспалительные цитокины при сахарном диабете 2 типа как способствующие гиперкоагуляции и аномальное образование тромбов. Cardiovasc Diabetol. (2019) 18:72. DOI: 10.1186 / s12933-019-0870-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107.Hotamisligil GS, Arner P, Caro JF, Atkinson RL, Spiegelman BM. Повышенная экспрессия фактора некроза опухоли-α в жировой ткани при ожирении и инсулинорезистентности человека. J Clin Invest. (1995) 95: 2409–15. DOI: 10.1172 / JCI117936
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Ян С.Т., Цзя Дж.Х., Лв XF, Шао Ю.Х., Инь С.Н., Чжан XG и др. Гликемический контроль и комплексный контроль метаболических факторов риска у пожилых людей с диабетом 2 типа. Exp Gerontol. (2019) 127: 110713. DOI: 10.1016 / j.exger.2019.110713
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Маскаринек Г., Садакане А., Сугияма Х., Бреннер А., Тацукава Ю., Грант Е. Диабет 2 типа, ожирение и риск рака груди среди японских женщин из когорты выживших после атомной бомбы. Cancer Epidemiol. (2019) 60: 179–84. DOI: 10.1016 / j.canep.2019.04.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. Ли С., Лейси М.Э., Янкович М., Корреа А., Ву WC.Связь между фенотипами ожирения и инсулинорезистентностью и риском диабета 2 типа у афроамериканцев: исследование сердца Джексона. J Clin Transl Endocrinol. (2020) 19: 100210. DOI: 10.1016 / j.jcte.2019.100210
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112. Hotamisligil GkS, Peraldi P, Budavari A, Ellis R, White MF, Spiegelman BM. IRS-1-опосредованное ингибирование активности тирозинкиназы рецептора инсулина при резистентности к инсулину, индуцированной TNF-альфа и ожирением. Наука. (1996) 271: 665–70. DOI: 10.1126 / science.271.5249.665
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Шерцер Дж. Д., Тамракар А. К., Магальяйнс Дж. Г., Перейра С., Билан П. Дж., Фуллертон М. Д. и др. Активаторы NOD1 связывают врожденный иммунитет с инсулинорезистентностью. Диабет. (2011) 60: 2206–15. DOI: 10.2337 / db11-0004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Rakotoarivelo V, Lacraz G, Mayhue M, Brown C, Rottembourg D, Fradette J, et al.Профили воспалительных цитокинов во висцеральной и подкожной жировой ткани у пациентов с ожирением, перенесших бариатрическую операцию, показывают отсутствие корреляции с ожирением или диабетом. EBioMedicine. (2018) 30: 237–47. DOI: 10.1016 / j.ebiom.2018.03.004
CrossRef Полный текст | Google Scholar
116. de Souza PR, Guimarães FR, Sales-Campos H, Bonfá G, Nardini V, Chica JEL, et al. Отсутствие рецептора NOD2 предрасполагает к воспалению кишечника из-за нарушения регуляции иммунного ответа у хозяев, которые не могут контролировать дисбактериоз кишечника. Иммунобиология. (2018) 223: 577–85. DOI: 10.1016 / j.imbio.2018.07.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Дену Е., Лольмед К., Гариду Л., Поми С., Чабо С., Лау Т.С. и др. Нарушение восприятия пептидогликана NOD 2 способствует воспалению, дисбактериозу и инсулинорезистентности, вызванному диетой. EMBO Mol Med. (2015) 7: 259–74. DOI: 10.15252 / emmm.201404169
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118.Muegge BD, Kuczynski J, Knights D, Clemente JC, González A, Fontana L, et al. Диета способствует сближению функций микробиома кишечника в филогенезе млекопитающих и в организме человека. Наука. (2011) 332: 970–4. DOI: 10.1126 / science.1198719
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Накадзима А., Накатани А., Хасегава С., Ирие Дж., Одзава К., Цудзимото Г. и др. Рецептор короткоцепочечных жирных кислот GPR43 регулирует воспалительные сигналы в макрофагах М2-типа жировой ткани. PLoS ONE. (2017) 12: e0179696. DOI: 10.1371 / journal.pone.0179696
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Микробный дисбактериоз тонкого кишечника лежит в основе симптомов, связанных с функциональными желудочно-кишечными расстройствами
Этическое одобрение исследований на людях
Все исследования на людях были одобрены IRB клиники Мэйо [тестовые образцы (16–006388 и 15–003235), контрольная группа здоровых людей (14–002382) и 15–003603)], и мы соблюдаем все соответствующие этические нормы.Исследование диетического вмешательства было зарегистрировано на сайте ClinicalTrials.gov (NCT03266536). Все субъекты исследования питания дали информированное согласие, тогда как аспираты тонкой кишки были получены из лаборатории клинической микробиологии в соответствии с отказом от согласия IRB для протокола 15–003235. Биологические материалы, полученные от пациентов, не могут быть переданы на основании протокола, одобренного институциональным IRB.
Сбор аспиратов тонкой кишки
Последовательные пробы аспиратов тонкой кишки от пациентов с симптомами после диагностической ФГДС были получены непосредственно из микробиологической лаборатории с мая по декабрь 2016 года.Образцы дуоденального аспирата собирали во время EGD после прямого прохождения в двенадцатиперстную кишку с минимальным раздуванием в желудке с использованием стандартного однопросветного аспирационного катетера, пропущенного через всасывающий порт эндоскопа. Были включены образцы, связанные с пациентами, которые ранее давали согласие на просмотр электронных медицинских карт. Всего за этот промежуток времени было получено 143 аспирата от пациентов с симптомами. После исключения образцов из-за отсутствия согласия или низкой глубины считывания при секвенировании (<1000) было включено в общей сложности 126 пациентов с симптомами.Дуоденальные аспираты, полученные от 38 здоровых добровольцев, участвовавших в других исследованиях и собранные аналогичным образом, также были получены и обработаны аналогичным образом. Клинические метаданные были получены ретроспективным обзором электронной медицинской карты, включая демографическую информацию, ИМТ, клинические показания для тестирования SIBO, количественные результаты аэробных и анаэробных аспиратных культур, курс антибиотиков для лечения SIBO, клинический ответ на антибиотики, необходимость повторного приема антибиотиков, недавние лекарства включая использование антибиотиков и ИПП, операции на желудочно-кишечном тракте, сопутствующие заболевания и т. д.
Критерии диагностики SIBO на основе количественных культур
Аспираты тонкой кишки (10 мкл) наносили штрихами на RBAP (кровяной агар), REMB (грамотрицательная селекционная среда), RBAPA (предварительно восстановленный кровяной агар) и инкубировали в аэробных условиях при + грамположительный селективный) и инкубировали анаэробно либо в клинической лаборатории, либо в исследовательской лаборатории.Общее количество бактерий (анаэробное плюс аэробное количество) было меньше или больше 10 5 КОЕ / мл, а диагноз СИБР был основан на культуре дуоденального аспирата, демонстрирующей рост бактерий ≥ 10 5 КОЕ / мл (аэробный, анаэробный или оба) более 48 часов 15,16,17 .
Сравнение культур и секвенирование 16S рРНК
Бактериальная ДНК была извлечена из аспиратов и биопсий двенадцатиперстной кишки с использованием фенол-хлороформа и из стула с использованием набора для экстракции фекальной ДНК MoBio с последующей амплификацией 16 S рРНК с использованием праймеров, совместимых с библиотекой Nextera, фланкирующих V4 гипервариабельная область ([прямое выступание] + 515 F: [TCGTCGGCAGCGTCAGATGTGTATAAGAGACAG] GTGCCAGCMGCCGCGGTAA; и [обратный выступ] + 806 R: [GTCTCGTGGGCTCGGAGATGTGTATA протокол секвенирования 900 с использованием протокола и двойного секвенирования 900 с использованием GGACT-34).Все образцы секвенировали вместе в режиме парных концов 2 × 300 на приборе Illumina MiSeq с использованием реагентов v3, разработанных Центром геномики Университета Миннесоты.
Сырые последовательности с парными концами были отфильтрованы по качеству, обрезаны адаптером и сшиты с использованием конвейера контроля качества SHI7 35 , с порогом обрезки> 32 и средним показателем качества> 35. Предварительно обработанные считывания были проанализированы путем закрытого отбора ссылок с ускоренным механизмом оптимального выравнивания с зазором BURST 36,37 в режиме CAPITALIST против баз данных NCBI RefSeq Targeted Loci Project, посвященных бактериальным и архейным 16 S (https: // www.ncbi.nlm.nih.gov/refseq/targetedloci/) с 97-процентной идентичностью. После фильтрации образцов с низкой глубиной считывания мы приступили к анализу 126 пациентов с симптомами и 38 здоровых людей из контрольной группы. Анализ разнообразия был выполнен с использованием QIIME v1.9.1 38 , а другие анализы данных, статистические тесты и визуализации были выполнены в R. Для сравнения разнообразия различных типов образцов желудочно-кишечного тракта в исследовании диетического вмешательства последовательности были разрежены до средней глубины. сайта с наименьшим количеством чтений, CLR (центрированное логарифмическое соотношение) — преобразовано после мультипликативной замены и проанализировано с помощью пользовательских сценариев R и пакета «vegan ».
Дифференциальный анализ численности между здоровыми субъектами и субъектами с симптомами был выполнен на нормализованных данных обилия 39 для каждого таксономического ранга с использованием теста перестановки (1000 перестановок) с t-статистикой в качестве статистики критерия. Перед тестированием к нормированным данным о численности применялось преобразование квадратного корня. Таксоны с распространенностью <10% или максимальной долей <0,2% были исключены из тестирования. Контроль FDR (процедура Бенджамини-Хохберга) выполнялся для каждого таксономического ранга для корректировки множественного тестирования.SI был сгенерирован с использованием классификации случайных лесов на основе нормализованных данных уровня OTU (пакет randomForest в R). Шкала индекса была определена как вероятность отсутствия симптомов классификации пациентов на основе сгенерированной модели. Этот метод предотвращает перетренированность путем удержания выборки для классификации и прогнозирования на основе оставшегося набора данных n -1. Функция Boruta 40 Выбор (пакет Boruta в R) использовался для определения OTU, которые вносят значительный вклад в классификацию.Связи с семью демографическими или клиническими переменными были протестированы с использованием моделей линейной регрессии и скорректированы для множественного тестирования с использованием контроля FDR.
Мы сгенерировали DI с помощью метода CLOUD 24 . Вкратце, матрица расстояний Эйчисона здоровых образцов использовалась в качестве эталонного облака, и расстояние от каждого здорового образца до здорового облака было рассчитано для каждого образца в наборе данных. Затем этот расчет расстояния был повторен для каждой выборки пациентов с симптомами относительно здорового облака; расстояния, превышающие два стандартных отклонения (SD) от среднего значения расстояния до здорового человека, считаются «дисбиотическими»; те, кто находится в пределах 2 SD от среднего значения расстояния до здорового человека, считаются «подобными здоровью».Затем эта оценка дисбиоза в облаке была подтверждена с использованием ортогонального подхода, основанного на показателях SI: мы подгоняли показатели SI здоровых к распределению шкалы логит (значения SI здорового контроля приблизительно нормальны по шкале logit; p = 0,41, нормальность Шапиро-Уилка контрольная работа). Мы снова применили правило 2 SD, классифицируя образцы с более чем 2 SD от среднего значения распределения здоровых людей как «дисбиотические», а образцы в пределах 2 SD как «аналогичные здоровым». Чтобы сгенерировать DI здесь, мы затем повторно классифицировали выборки по случайному лесу с использованием новых групповых классификаций и использовали OOB вероятность «дисбиотической» классификации в качестве показателя индекса.Эти два независимых метода находятся в тесном согласии, что оценивается по высокой степени корреляции между оценками ОБЛАЧНОГО дисбиоза в выборках и их индексной оценкой, основанной на вероятности ( r = 0,7, p = 2 × 10 −16 , Корреляции Пирсона). Оценка расстояния в облаке использовалась во всех последующих анализах. Для сравнения мы также сгруппировали данные с помощью спектральной кластеризации, реализованной в пакете R «kernlab» v0.9.27, с использованием двух центров кластеров и настроек по умолчанию 41 .
Вмененные функции из состава микробиоты
Для прогнозирования микробных функций предварительно обработанные считывания ДНК были сопоставлены с версией 13_8 базы данных GreenGenes 16 S рРНК с использованием BURST с идентичностью 97%. Полученные таблицы OTU использовались для создания прогнозируемых аннотаций KEGG с использованием PICRUSt v1.1.3 42 . Размер эффекта линейного дискриминантного анализа (LDA) (LEfSe; Galaxy Version 1.0) 43 затем использовался для выявления предполагаемых функций, которые значительно различались (оценка LDA> 2.0) между группами.
Исследование диетических вмешательств на здоровых добровольцах
Это было пилотное проспективное одноцентровое исследование диетических вмешательств на здоровых добровольцах, изначально потреблявших диету с высоким содержанием клетчатки. Исследование было зарегистрировано на сайте clinictrials.gov под номером NCT03266536. Подходящими участниками были здоровые взрослые (≥ 18 лет) с исходным потреблением клетчатки ≥ 11 г / 1000 калорий / день; <10% дневных калорий из добавленного сахара; ≥ 5 порций фруктов и овощей в день; и ≤ 13% дневных калорий из насыщенных жиров на основе заполненного опросника по частоте приема пищи.Пациенты были исключены из исследования, если они не соответствовали вышеуказанным диетическим требованиям, имели известный диагноз воспалительного заболевания кишечника, микроскопический колит, целиакию или другие воспалительные состояния, наличие абдоминальных симптомов на основании исходного анкетного опроса, пероральное применение антибиотиков или пробиотиков последние 4 недели, беременность или планы забеременеть в рамках периода исследования, или любые другие заболевания, состояния или привычки, которые могут помешать завершению исследования. Диетические инструкции и выбор продуктов питания обсуждались на предварительном визите лицензированного диетолога.
Все субъекты прошли скрининг лично или по телефону и заполнили анкету по частоте приема пищи, чтобы убедиться, что они соответствуют критериям включения и исключения. При первичном и последующем посещении им была проведена ФГДС с седацией в сознании. Дуоденальный аспират получали через стандартный отсасывающий катетер, пропущенный через отсасывающий порт с минимальным надуванием в желудке; аликвота была отправлена в клиническую лабораторию для тестирования на SIBO, а оставшаяся часть хранилась для анализа микробиома при -80 ° C.Было получено восемь биопсий двенадцатиперстной кишки для исследований камеры Уссинга, анализа микробиома и последовательности РНК хозяина. При первоначальном и последующем посещении участники заполнили анкету по симптомам и демографию и предоставили образец стула. Симптомы, оцениваемые с помощью анкет, включали: частоту стула, натуживание, неполное опорожнение, твердый / комковатый стул, боль в животе, связанную с дефекацией, диарею / жидкий водянистый стул, вздутие живота, затруднения глотания, тошноту / рвоту, изжогу, усталость и аппетит.Ответы записывались в двоичном формате (да / нет). В рамках вмешательства все участники придерживались 7-дневной стандартизированной диеты с типичным для США распределением макроэлементов калорий: 50% из углеводов, 35% из жиров и 15% из белка. Диета была с низким содержанием клетчатки (<10 г / 1000 калорий в день) и высоким содержанием простого сахара (≥ 50% дневных углеводов).
Статистический анализ мощности
Мы выполнили апостериорный расчет мощности для сравнения микробиома между здоровыми и симптоматическими субъектами, сосредоточив внимание на силе дифференциального анализа численности, где у нас была гораздо более низкая статистическая мощность по сравнению с анализами альфа- и бета-разнообразия , из-за многократной коррекции тестирования.Мы использовали сетевой калькулятор мощности микробиома для проведения анализа мощности (http://fedematt.shinyapps.io/shinyMB/), который был основан на моделировании Монте-Карло и тесте Уилкоксона – Манна – Уитни 44 . Мы использовали коэффициент ложного обнаружения 5%, чтобы исправить множественное тестирование. Предполагая, что мы тестируем 65 родов, при этом численность 10 родов с умеренной численностью (6–15 ранги) снижается на 50% у пациентов с симптомами (по сравнению с 26 дифференциальными родами со средним снижением на 59% в наблюдаемых данных), мы имели средняя мощность 75% для обнаружения этих 10 дифференциальных родов и мощность 100% для обнаружения хотя бы одного значимого рода при текущем размере выборки.Таким образом, исследование было достаточно мощным, чтобы обнаружить умеренную разницу таксонов при сравнении здоровых субъектов и субъектов с симптомами.
Ex vivo функция эпителиального барьера
Исследования камеры Уссинга были выполнены для измерения барьерной функции слизистой оболочки двенадцатиперстной кишки и секреторных ответов, как было описано ранее 45 . Вкратце, биопсии двенадцатиперстной кишки помещали в камеры Уссинга объемом 4 мл (Physiologic Instruments, Сан-Диего, Калифорния), экспонируя 0,031 см области 2 в течение 45 минут после сбора.Камеры были заполнены Кребсом с 10 мм маннитом (сторона слизистой оболочки) и Кребсом с 10 мм глюкозы (подслизистая сторона). Базовое трансэпителиальное сопротивление и ток короткого замыкания каждой ткани измеряли с использованием пары электродов Ag / AgCl с агар-солевыми мостиками и пары токоподводящих платиновых электродов для поддержания условий фиксации напряжения. Параклеточный поток через биопсию измеряли с использованием 4 кДа FITC-декстрана, вводимого на слизистую (концентрация в камере 1 мг / мл). Отбор образцов производился со стороны подслизистой оболочки каждые 30 минут в течение всего 3 часов, а кумулятивная флуоресценция измерялась с помощью Multi-Mode Microplate Reader (BioTek, VT) и преобразовывалась в концентрацию с использованием стандартных кривых.Кумулятивный поток в конце 3 ч был рассчитан для FITC – декстрана. Корреляции Спирмена (непараметрические) использовались для проверки связи между разнообразием микробиома и потоком FITC – декстрана.
RNA seq
Образцы биопсии размораживали на льду, гомогенизировали и центрифугировали при 13000 об / мин, а супернатант переносили в новую пробирку. РНК получали с использованием набора RNeasy Mini Kit (QIAGEN, Hilden, Германия) и секвенировали на Illumina HiSeq 2500. Анализ данных выполняли с использованием Mayo Analysis Pipeline for RNA Sequencing (MAP-RSeq) с выравниванием по строению генома человека (GRCh48.78) 46 . Вкратце, конвейер MAP-RSeq выполняет оценку качества чтения последовательностей из файла FASTQ, выравнивает оставшиеся оставшиеся чтения с TopHat 47 , а количество генов агрегируется с библиотекой Python HTSeq 48 . Средняя общая глубина считывания составила 57 052 595 (стандартное отклонение 8,5 × 10 6 ) и в среднем 87,0% (стандартное отклонение 2,0%) от общего числа считываний, сопоставленных с моделями генов. Условная квантильная нормализация была выполнена для учета длины гена и ошибок содержания GC 49 .
1 Подготовка образцов метаболомики H-ЯМР
Образцы аспирата центрифугировали при 4 ° C при 12000 × g в течение 5 мин. 162 мкл супернатанта смешивали с 18 мкл буфера ЯМР (1,5 мкл KH 2 PO 4 , 1 г / л TSP и 0,13 г / л NaN 3 , Sigma-Aldrich) и переносили в Трубка для ЯМР 3 мм. Образцы фекалий предварительно взвешивали (~ 100 мг), рандомизировали и помещали в пробирку с завинчивающейся крышкой, содержащую 50 мг 1.Циркониевые шарики диаметром 0 мм, к которым было добавлено 400 мкл ACN: H 2 O (1: 3). Пробирку помещали в миксер Biospec на 30 с. Затем гомогенизированный образец центрифугировали в течение 20 мин при 16000 × g . Супернатант осторожно переносили в пробирки с центрифугированием и центрифугировали в течение 30 мин при 16000 × g . 80 мкл отфильтрованной фекальной воды вносили аликвотами в 96-луночный планшет и 10 мкл использовали для контроля качества. Отфильтрованную фекальную воду в 96-луночном планшете сушили в токе азота перед восстановлением 540 мкл D 2 O (Sigma-Aldrich) и 60 мкл буфера ЯМР.Восстановленную фекальную воду и буферную смесь переносили в 5-миллиметровые экспериментальные пробирки для ЯМР.
1 H-ЯМР эксперимент
Метаболические профили измеряли на спектрометре Bruker 600 МГц (Bruker Biospin, Райнштеттен, Германия), установленном на постоянную температуру 300 К для образцов мочи, аспирата и фекалий и 310 К для образцов плазмы. Стандартный одномерный эксперимент NOSY был выполнен для каждого образца мочи, аспирата и фекальной воды, а эксперимент CPMG — для образцов плазмы.Всего было выполнено 64 сканирования для каждого образца в 64 тыс. Точек данных для мочи, аспиратов и плазмы; Было собрано 128 сканирований на образец в 64 тыс. Точек данных для фекальной воды.
1 Предварительная обработка данных H-ЯМР
Данные спектров были импортированы в MATLAB (версия 8.3.0.532 R2014a, Mathworks Inc, Натик, Массачусетс, США). Для следующих исполнений использовалась серия сценариев собственной разработки. Фазирование, корректировка базовой линии и спектральная калибровка до TSP (0 ppm).Спектры выравнивались вручную. Чтобы учесть разницу в концентрации образцов, к образцам была применена нормализация вероятностного коэффициента. Собственные скрипты использовались для построения моделей PCA и OPLS-DA и интеграции интересующих пиков. Корреляции характеристик и тенденции были проанализированы в R.
Сводка отчетов
Дополнительная информация о дизайне исследования доступна в Сводке отчетов по исследованиям природы, связанной с этой статьей.
Дисбактериоз кишечника и пробиотики при COVID-19
Мини-обзор
— (2020) Том 10, Выпуск 4
Ясунари Кагеяма 1, 2 , Тецу Акияма 3 и Цутому Накамура 1, 3 *
* Переписка:
Цутому Накамура, Лаборатория молекулярной и генетической информации, Институт количественных биологических наук, Токийский университет,
Бункё-ку, Токио,
Япония, Электронная почта:
Информация об авторе »
Аннотация
Пандемия COVID-19 представляет собой новую угрозу для глобального общественного здравоохранения.Несколько линий доказательств предполагают, что причинный вирус SARS-CoV-2 инфицирует эпителиальные клетки кишечника человека, а также эпителиальные клетки дыхательных путей, предполагая, что кишечная инфекция SARS-CoV-2 оказывает деструктивное воздействие на микробиоту кишечника и, следовательно, на физиологию дыхательных путей и иммунитет по оси кишечник-легкие. Несмотря на важную роль оси кишечник-легкие в противовирусном иммунитете, в настоящее время доступна лишь ограниченная информация о специфических для COVID-19 изменениях в микробиоме кишечника.В этом обзоре обобщены недавние знания о дисбактериозе кишечника, связанном с пациентами с COVID-19, и его потенциальном влиянии на респираторные симптомы через ось кишечник-легкие. Мы также обсуждаем возможность профилактического и терапевтического использования пробиотиков при COVID-19, включая наше продолжающееся испытание с использованием Lactobacillus plantarum, который, как известно, обладает широким спектром иммуномодулирующей активности против респираторных вирусных инфекций.
Ключевые слова
COVID-19; Дисбактериоз; Ось кишечник-легкие; Микробиом; Микробиота; Пробиотики
Введение
Недавняя пандемия COVID-19 стала новой угрозой
к глобальному общественному здравоохранению.Пациенты с COVID-19 обращаются с
спектр тяжести заболевания, от бессимптомной до легкой
гриппоподобные для тяжелобольных с потенциально тяжелой пневмонией
сопровождается острым респираторным дистресс-синдромом (ОРДС) и
полиорганная недостаточность [1,2]. Возбудитель коронавируса SARSCoV-
2, в первую очередь поражает субпопуляцию эпителиальных клеток дыхательных путей.
клетки, коэкспрессирующие ангиотензинпревращающий фермент 2 (ACE2), a
вирусный рецептор клеточной поверхности и трансмембранная сериновая протеаза 2
(TMPRSS2), трансмембранная протеаза, которая способствует вирусному
проникновение в клетки-хозяева [3-5].
Примечательно, что несколько линий свидетельств предполагают, что человеческий
Кишечный тракт является дополнительной мишенью для инфекции SARS-CoV-2.
Многие клинические исследования показали, что значительный
процент пациентов с COVID-19 страдает одновременным
желудочно-кишечные проявления, чаще всего диарея и
боль в животе [6-8]. Обнаружена вирусная РНК SARS-CoV-2
в образцах стула и анальных / ректальных мазках пациентов даже после
клиренс вируса в носоглотке [9-11], и
кроме того, инфекционные вирусы были выделены из фекалий
Больной COVID-19 с диареей [12].ACE2 и TMPRSS2 являются
коэкспрессируется в нижних отделах желудочно-кишечного тракта, особенно
энтероциты и клетки-предшественники подвздошной и толстой кишки
[4,5,13-15]. Фактически, SARS-CoV-2 может инфицировать кишечник человека.
органоиды и активно реплицируются [12,15-17]. Эти результаты поднимают
возможность того, что кишечная инфекция SARS-CoV-2 имеет
отрицательное воздействие на кишечные комменсальные микробы и
впоследствии физиология дыхательных путей и иммунитет через кишечник
ось.
В этом обзоре мы обобщаем последние знания о кишечной
дисбактериоз у пациентов с COVID-19 и обсудить его потенциал
вклад в респираторные симптомы через кишечник-легкие
оси и возможности анти-COVID-19 терапии с использованием
пробиотические кишечные бактерии.
Дисбактериоз кишечника, связанный с Covid-19
Накопление доказательств выявило перекрестную связь между
кишечная микробиота и дыхательные пути, называемые кишечным
ось, по которой компоненты кишечного микроба и
метаболиты модулируют физиологию дыхательных путей и иммунитет [18–21].
Дисбиоз микробиоты кишечника приводит к нарушению иммунного тонуса в респираторном эпителии и слизистой оболочке, что может вызвать
нарушение иммунного ответа на респираторные вирусные инфекции.
Несмотря на важную роль оси кишечник-легкие в противовирусном
иммунитет, в настоящее время доступна лишь ограниченная информация
относительно изменений в микробиоме кишечника, связанных с COVID-19.
Кишечная микробиота и воспалительный тон хозяина
Shen et al. ранее проведенное протеомное профилирование сыворотки
Пациенты с COVID-19 и установили шкалу протеомного риска для крови
(PRS) для прогнозирования клинических исходов пациентов [22].
В недавнем препринте та же исследовательская группа
обнаружил основной набор кишечных бактериальных таксонов, которые
ассоциированный с PRS крови у неинфицированных лиц [23].
Основные таксоны включают род Bacteroides, род Streptococcus,
род Lactobacillus, семейство Ruminococcaceae, семейство
Lachnospiraceae и отряд Clostridiales.Кроме того,
авторы предполагают связь между составом определенного кишечника
бактерии и восприимчивость к тяжелой форме COVID-19. Интересно, что
подмножество основных таксонов коррелирует с сывороточными уровнями
провоспалительные цитокины, включая TNF-α, IFN-γ, IL-1β,
ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12p70, ИЛ-13. В общем,
Bacteroides, Streptococcus и Clostridiales отрицательно
коррелировали с сывороточными уровнями тестируемых цитокинов, тогда как
Ruminococcus, Blautia и Lactobacillus положительно коррелируют.Анализы фекального метаболома и метаболических путей выявили 45
метаболиты, связанные с основными таксонами, и показали, что
метаболиты участвуют в связанном с аминокислотами метаболическом
пути. Основные бактериальные таксоны и соответствующие метаболиты
может быть посредником между микробиотой кишечника и воспалительным процессом
тон.
В вышеупомянутом цитокиновом тесте Ruminococcus gnavus имеет
сильная положительная корреляция с большинством воспалительных
цитокины исследованы. R.gnavus обычно присутствует в кишечнике.
микробиом более 90% людей [24].Несколько
исследования микробиома связали R. gnavus с воспалительными
заболевание кишечника, два состояния [болезнь Крона (БК) и
язвенный колит (ЯК)], характеризующийся хроническим поражением слизистой оболочки.
воспаление желудочно-кишечного тракта [25-31], предполагающее
возможная роль R. gnavus в индукции аберрантного воспалительного процесса.
ответы в слизистой оболочке кишечника. Примечательно, что R. gnavus производит
провоспалительный полисахарид глюкорхамнана, который сильно
индуцирует зависимую от Toll-подобного рецептора 4 секрецию TNF-α
дендритными клетками [32].Кроме того, R. gnavus может разлагать муцин.
использовать в качестве источника углерода [29,33-35], что приводит к
разрушение слизистого слоя и его барьерная функция. Эти
метаболические свойства могут увеличить экспозицию кишечника
иммунная система к полисахариду глюкорхамнана для усиления
воспалительный тон хозяина. R. gnavus и / или другие муколитики
бактерии могут способствовать системному гипервоспалению
характерна для пациентов с COVID-19.
Covid-19-специфические изменения в кишечном микробиоме
Какие изменения кишечной микробиоты специфичны для
Пациенты с COVID-19 и как изменения способствуют
COVID-19 симптомы? В недавней статье в Gastroenterology,
Цзо и его коллеги ясно показали, что COVID-19 специфичен.
изменения в кишечном бактериальном сообществе [36].Они выполнили
метагеномное секвенирование с дробовиком для анализа образцов кала из
15 госпитализированных пациентов от легкой до критической и 15 неинфицированных
индивидуумов и обнаружил специфический для пациента дисбактериоз кишечника
микробиом. Наблюдаемый дисбактериоз характеризуется
увеличение условно-патогенных микроорганизмов и уменьшение полезных
симбионты. Интересно, что тяжесть COVID-19 положительно
коррелирует с относительной численностью рода Coprobacillus,
Clostridium ramosum и Clostridium hathewayi и обратно пропорционально
Faecalibacterium prausnitzii.Известно, что F. prausnitzii имеет
иммуномодулирующее свойство, производя противовоспалительное
белок и бутират, короткоцепочечные жирные кислоты, которые
необходимы для регулируемого кишечного иммунитета и эпителиальной
барьерная функция [37]. Исследования микробиома связали
снижение относительной численности F. prausnitzii с хроническим
воспалительные заболевания, такие как CD [38,39], астма [40,41] и
ожирение [42].
Zuo et al. также представили интересные данные о том, что SARS-CoV-2
вирусная нагрузка в образцах кала пациентов обратно коррелирует с
Bacteroides dorei, B.thetaiotaomicron, B. massiliensis и B. ovatus.
В этом контексте следует отметить, что эти виды Bacteroides
может подавлять экспрессию Ace2 в кишечнике, когда
моноколонизированы в толстой кишке стерильных мышей [43]. В
в частности, B. thetaiotaomicron, доминирующий комменсальный анаэроб
кишечника человека, как известно, обладает противовоспалительным
свойство и улучшают барьерную функцию слизистой оболочки у грызунов с
химически индуцированный колит, экспериментальные модели БК [44-46].
В совокупности снижение B.thetaiotaomicron может привести к
повышенная экспрессия Ace2 и снижение противовоспалительного
активность, которая может усилить инфекционность SARS-CoV-2 и
тонус кишечного / системного воспалительного процесса.
Есть еще одно свидетельство того, что микробиота кишечника может
модулировать экспрессию Ace2 в толстой кишке и системное воспаление в
его хозяин. Ян и др. продемонстрировали, что восстановление
кишечная микробиота у стерильных крыс значительно снизила
colonic Ace2expression [47]. Анализ метаболома сыворотки
выявили более высокий уровень метаболитов триптофана, кинуреновых
кислота и гидроксикинуренин, предполагая, что эти метаболиты
участвуют в регуляции Ace2.Согласование
также привело к усилению системного воспаления, о чем свидетельствует
повышенный уровень липокалина-2 в сыворотке, также известный как
липокалин, связанный с желатиназой нейтрофилов, который участвует в
врожденный иммунитет и повышенная доля CD11b +
гранулоциты. Это исследование показывает, что микробиота кишечника может
модулировать экспрессию Ace2 в кишечнике и вызывать иммунную
нарушение регуляции, характерное для COVID-19.
Два исследования на животных, проведенные Geva-Zatorsky et al. [43] и Янг и др.
al. [47] поднимают новые интригующие вопросы, и требуются дальнейшие исследования.
требуется для определения видов бактерий, выделяющих
метаболиты с регуляторной активностью для экспрессии Ace2 и
выяснить механизм подавления Ace2
бактериальные метаболиты.Что еще более важно, мы должны уточнить
регулируется ли кишечная экспрессия ACE2
схожие механизмы, опосредованные микробиотой, у человека и
может ли микробиота кишечника подавлять Ace2 в дыхательных путях
выражение.
Выявление специфических для пациента изменений микробиоты кишечника
может позволить нам поставить диагноз на основе микробиома
COVID-19. Gu et al. выявили различия в кишечнике
микробная сигнатура между 30 умеренным и тяжелым COVID-19
пациентов и 30 здоровых людей из контрольной группы с использованием гена рибосомной РНК 16S
секвенирование ампликонов [48].Отличия включают уменьшенное
бактериальное разнообразие, более высокая относительная численность условно-патогенных
патогены, такие как Streptococcus родов, Rothia, Veillonella и
Actinomyces и меньшее относительное количество полезных
комменсалы у пациентов. Кроме того, комбинация пяти
родов, Fusicatenibacter, Romboutsia, Intestinibacter,
Actinomyces и Erysipelato clostridium были идентифицированы как
биомаркер, который может отличить пациентов от здоровых
частные лица. Это открытие предполагает потенциальную диагностику и
терапевтическое значение специфической микробиоты кишечника при COVID-19
даже если требуются дальнейшие валидационные исследования.
Профилактическое и терапевтическое использование пробиотиков при Covid-19
Компоненты и метаболиты, полученные из кишечного комменсала
бактерии играют ключевую роль в опосредованной оси кишечник-легкие регуляции
физиология дыхательных путей и иммунитет [18-21]. Следовательно, есть
возможность нормализации дисбактериоза кишечника с помощью
пробиотики эффективны для борьбы с COVID-19. Предыдущий
Исследования на животных и клинические исследования показали, что пероральный прием
пробиотические штаммы обладают защитной и терапевтической эффективностью при
инфекции дыхательных путей, вызванные вирусами РНК, такими как
вирус гриппа и риновирус [49-53].Однако были
нет сообщений о клинических испытаниях, посвященных эффективности пробиотиков
в COVID-19 на сегодняшний день, и обоснование использования пробиотиков
против COVID-19 остается неясным. Опасные для жизни симптомы
и осложнения COVID-19 вызваны
гипервоспаление из-за сложной иммунной дисрегуляции
включая нейтрофилию, лимфоцитопению, снижение Т-лимфоцитов
иммунитет и чрезмерное производство медиаторов воспаления
[54-56]. Поэтому особенно примечательно, что конкретный пробиотик
штаммы обладают превосходными иммуномодулирующими свойствами.
способность против респираторных вирусных инфекций.
Существует множество доказательств того, что Lactobacillus plantarum имеет
широкий спектр иммуномодулирующей активности, особенно при
заражение сезонным и высокопатогенным гриппом
вирусы. Пероральное введение L. plantarum мышам облегчает
воспаление при вирусной инфекции [57], усиливает NK-клетки
активности [58], активирует Th2-опосредованные иммунные ответы и Th2
продукция цитокинов (IL-12 и IFN-γ) [57-59], и в частности,
способствует IgA-опосредованному иммунитету слизистой оболочки тонкого кишечника
и легкое [59,60].Аналогичным образом рандомизированные контролируемые испытания
продемонстрировали, что пероральный прием L. plantarum снижает риск
приобретение инфекций верхних / нижних дыхательных путей и облегчает
респираторные симптомы [61-63]. Показано, что эти эффекты
связано с иммуномодулирующей способностью L. plantarum,
включая активацию CD8 + Т-клеток, усиление
фагоцитарная активность гранулоцитов, снижение плазмы
провоспалительные цитокины IFN-γ и TNF-α и повышение
противовоспалительных цитокинов ИЛ-4 и ИЛ-10 [62,64].Эти
результаты показывают, что L. plantarum усиливает многие аспекты
механизм защиты хозяина от вирусной инфекции. На основании
Из этих результатов мы использовали L. plantarum как анти-
Пробиотики COVID-19 в нашем недавнем клиническом испытании для
иммунологическая эффективность пробиотических молочнокислых бактерий против
COVID-19. Продолжающееся испытание с упором на неинфицированных
физические лица зарегистрированы в Университетской больнице.
Информационная сеть — Реестр клинических исследований (UMIN-CTR,
https: //www.umin.ac.jp/ctr/index.htm) под пробным номером
UMIN000040479.
Перспективы на будущее
Состав кишечной микробиоты сильно варьируется
среди людей, что может привести к высокому межличностному
несоответствие восприимчивости к инфекции SARS-CoV-2 и
тяжесть симптомов, связанных с COVID-19. Чтобы проверить это
возможность, нам необходимо провести сравнительные исследования кишечника
профили микробиоты среди пациентов с COVID-19 с разными
выраженность и выявить композиционные изменения в конкретных
кишечные бактерии, определяющие несоответствие.Точно так же
было бы интересно исследовать различия в
состав микробиома кишечника пациентов с COVID-19
с экстра респираторными проявлениями или без них, такими как
тромбоз, повреждение миокарда, повреждение почек или неврологический
симптомы [65-67].
Разработать пробиотики для лечения COVID-19, подробнее
необходимы усилия для выделения и / или идентификации большего количества пробиотиков.
штаммы, обладающие способностью снижать вирусную нагрузку и подавлять
гипервоспаление через различные механизмы действия.Бактериальный
виды за пределами родов Lactobacillus и Bifidobacterium
следует изучить. Рандомизированные контролируемые испытания с большим
когорты, направленные на оценку профилактического и терапевтического использования
пробиотиков также важны. Как описано выше,
в дыхательных путях обитают комменсальные бактериальные
сообществ, и респираторная микробиота, как известно,
тесно связан с восприимчивостью и серьезностью
респираторные инфекции. Фактически, метатранскриптомические исследования
выявили, что у пациентов с COVID-19 больше нарушены дыхательные пути
микробиом.Интересно, что бактерии из рода, специфичного для кишечника,
Бактероиды обычно и в изобилии встречаются в
жидкость бронхоальвеолярного лаважа от пациентов с ОРДС. Косвенный
манипулирование респираторным микробиомом пероральными пробиотиками
может быть многообещающей дополнительной терапией для уменьшения опасности для жизни
гипервоспаление при COVID-19.
Ссылки
- Fu L, Wang B, Yuan T, Chen X, Ao Y, Fitzpatrick T, et al. Клинические характеристики коронавирусной болезни 2019 (COVID-19) в Китае: систематический обзор и метаанализ.J Infect. 2020; 80: 656-665.
- Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX и др. Клиническая характеристика коронавирусной болезни 2019 в Китае. N Engl J Med. 2020; 382: 1708-1720.
- Lukassen S, Chua RL, Trefzer T, Kahn NC, Schneider MA, Muley T. и др. Рецептор SARS-CoV-2 ACE2 и TMPRSS2 в основном экспрессируются в транзиторных секреторных клетках бронхов. EMBO J. 2020; 39: 105114.
- Сунгнак В., Хуанг Н., Бекавин С., Берг М., Куин Р. Факторы проникновения SARS-CoV-2 высоко экспрессируются в эпителиальных клетках носа вместе с генами врожденного иммунитета.Nat Med. 2020; 26: 681-687.
- Ziegler CGK, Allon SJ, Nyquist SK, Mbano IM, Miao VN. Рецептор SARS-CoV-2 ACE2 представляет собой стимулируемый интерфероном ген в эпителиальных клетках дыхательных путей человека и обнаруживается в определенных подмножествах клеток в тканях. Клетка. 2020; 181: 1016-1035.
- Гу Дж, Хан Б., Ван Дж. COVID-19: желудочно-кишечные проявления и потенциальная фекально-оральная передача. Гастроэнтерол. 2020; 158: 1518-1519.
- Вонг Ш., Луи Р. Н., Сун Дж. Дж. Covid-19 и пищеварительная система. J GastroenterolHepatol.2020; 35: 744-748.
- Ян Л., Ту Л. Последствия желудочно-кишечных проявлений COVID-19. Ланцет Гастроэнтерол Гепатол. 2020; 5: 629-630.
- Chen Y, Chen L, Deng Q, Zhang G, Wu K. Присутствие РНК SARS-CoV-2 в кале пациентов с COVID-19. J Med Virol. 2020; 92: 833-840.
- Кипкорир В., Черуйот И., Нгуре Б., Мизиани М., Мунгути Дж. Длительное обнаружение РНК SARS-Cov-2 в анальных / ректальных мазках и образцах стула у пациентов с COVID-19 после отрицательной конверсии в назофарингеальном тесте RT-PCR.J Med Virol. 2020.
- Wu Y, Guo C, Tang L, Hong Z, Zhou J. Продолжительное присутствие вирусной РНК SARS-CoV-2 в образцах фекалий. Ланцет Гастроэнтерол Гепатол. 2020; 5: 434-435.
- Zhou J, Li C, Liu X, Chiu MC, Zhao X. Инфекция органоидов кишечника летучих мышей и человека SARS-CoV-2. Nat Med. 2020.
- Lee JJ, Kopetz S, Vilar E, Shen JP, Chen K. Относительное количество генов входа SARS-CoV-2 в энтероцитах нижних отделов желудочно-кишечного тракта. Гены (Базель). 2020; 11: 645.
- Чжан Х, Кан З, Гонг Х, Сюй Д, Ван Дж.Пищеварительная система — потенциальный путь распространения COVID-19: анализ паттерна одноклеточной коэкспрессии ключевых белков в процессе проникновения вируса. Кишечник. 2020; 69: 1010–1018.
- Zang R, Gomez Castro MF, McCune BT, Zeng Q, Rothlauf PW.TMPRSS2 и TMPRSS4 способствуют инфицированию SARS-CoV-2 энтероцитов тонкого кишечника человека. SciImmunol. 2020; 5: 3582.
- Lamers MM, Beumer J, van derVaart J, Knoops K, Puschhof J. SARS-CoV-2 продуктивно инфицирует энтероциты кишечника человека. 2020.
- Сяо Ф, Тан М, Чжэн Х, Лю И, Ли Х.Доказательства желудочно-кишечной инфекции SARS-CoV-2. Гастроэнтерол. 2020; 158: 1831-1833.
- Бадден К.Ф., Геллатли С.Л., Вуд Д.Л., Купер М.А., Моррисон М. Возникающие патогенные связи между микробиотой и осью кишечник-легкие. Nat Rev Microbiol. 2017; 15: 55-63.
- Дюма А., Бернар Л., Поке И., Луго-Вилларино Г., Нейроллес О. Роль микробиоты легких и оси кишечник-легкие в респираторных инфекционных заболеваниях. Cell Microbiol. 2018; 20: 12966.
- Trompette A, Gollwitzer ES, Yadava K, Sichelstiel AK, Sprenger N.Метаболизм пищевых волокон кишечной микробиотой влияет на аллергические заболевания дыхательных путей и кроветворение. Nat Med. 2014; 20: 159-166.
- Zhang D, Li S, Wang N, Tan HY, Zhang Z. Перекрестная связь между кишечной микробиотой и легкими при распространенных заболеваниях легких. Front Microbiol. 2020; 11: 301.
- Shen B, Yi X, Sun Y, Bi X, Du J. Протеомная и метаболомная характеристика сывороток пациентов с COVID-19. Клетка. 2020.
- Gou W, Fu Y, Yue L, Chen GD, Cai X. Микробиота кишечника может лежать в основе предрасположенности здоровых людей к COVID-19.2020.
- Qin J, Li R, Raes J, Arumugam M, Burgdorf KS. Каталог микробных генов кишечника человека, созданный путем метагеномного секвенирования. Природа. 2010; 464: 59-65.
- Холл А.Б., Яссур М., Саук Дж., Гарнер А., Цзян X. Новая клада жвачных, обогащенная у пациентов с воспалительными заболеваниями кишечника. Genome Med. 2017; 9: 103.
- Joossens M, Huys G, Cnockaert M, De Preter V, Verbeke K. Дисбиоз фекальной микробиоты у пациентов с болезнью Крона и их здоровых родственников.Кишечник. 2011; 60: 631-637.
- Nishikawa J, Kudo T, Sakata S, Benno Y, Sugiyama T. Разнообразие микробиоты слизистой оболочки при активном и неактивном язвенном колите. Сканд Дж. Гастроэнтерол, 2009; 44: 180-186.
- Nishino K, Nishida A, Inoue R, Kawada Y, Ohno M. Анализ образцов эндоскопической щетки выявил дисбактериоз слизистой оболочки при воспалительном заболевании кишечника. J Gastroenterol. 2018; 53: 95-106.
- Png CW, Linden SK, Gilshenan KS, Zoetendal EG, McSweeney CS. Муколитические бактерии с повышенной распространенностью в слизистой оболочке IBD увеличивают использование муцина in vitro другими бактериями.Am J Gastroenterol. 2010; 105: 2420-2428.
- Prindiville T, Cantrell M, Wilson KH. Анализ последовательности рибосомной ДНК бактерий, ассоциированных со слизистой оболочкой, при болезни Крона. Воспаление кишечника. 2004; 10: 824-833.
- Willing BP, Dicksved J, Halfvarson J, Andersson AF, Lucio M. Исследование пиросеквенирования у близнецов показывает, что микробный профиль желудочно-кишечного тракта зависит от фенотипа воспалительного заболевания кишечника. Гастроэнтерол. 2010; 139: 1844–1854.
- Henke MT, Kenny DJ, Cassilly CD, Vlamakis H, Xavier RJ.Ruminococcusgnavus, член микробиома кишечника человека, связанный с болезнью Крона, продуцирует воспалительный полисахарид. ProcNatlAcad Sci. 2019; 116: 12672-12677.
- Bell A, Brunt J, Crost E, Vaux L, Nepravishta R. Выяснение пути метаболизма сиаловой кислоты у собирающего слизь Ruminococcusgnavus раскрывает механизмы адаптации бактерий к кишечнику. Nat Microbiol. 2019; 4: 2393-2404.
- Crost EH, Tailford LE, Le Gall G, Fons M, Henrissat B. Использование слизистых гликанов симбионтом кишечника человека Ruminococcusgnavus зависит от штамма.PLoS One. 2013; 8: 76341.
- Tailford LE, Owen CD, Walshaw J, Crost EH, Hardy-Goddard J. Открытие внутримолекулярных транс-сиалидаз в микробиоте кишечника человека предполагает новые механизмы адаптации слизистой оболочки. Nat Commun. 2015; 6: 7624.
- Цзо Т., Чжан Ф., Луи GCY, Йео Ю.К., Ли АЫЛ. Изменения микробиоты кишечника пациентов с COVID-19 во время госпитализации. Гастроэнтерол. 2020.
- Quevrain E, Maubert MA, Michon C, Chain F, Marquant R. Идентификация противовоспалительного белка из Faecalibacteriumprausnitzii, комменсальной бактерии, дефицитной при болезни Крона.Кишечник. 2016; 65: 415-425.
- Просберг М., Бендцен Ф., Винд I, Петерсен А.М., Глууд Л.Л. Связь между микробиотой кишечника и активностью воспалительного заболевания кишечника: систематический обзор и метаанализ. Сканд Дж Гастроэнтерол. 2016; 51: 1407-1415.
- Sokol H, Pigneur B, Watterlot L, Lakhdari O, Bermudez-Humaran LG. Facalibacteriumprausnitzii — противовоспалительная комменсальная бактерия, идентифицированная анализом кишечной микробиоты пациентов с болезнью Крона. ProcNatlAcad Sci. 2008; 105: 16731-16736.
- Arrieta MC, Stiemsma LT, Dimitriu PA, Thorson L, Russell S. Микробные и метаболические изменения в раннем младенчестве влияют на риск детской астмы. SciTransl Med. 2015; 7: 307.
- Wang Q, Li F, Liang B, Liang Y, Chen S. Исследование ассоциации кишечной микробиоты при астме у взрослых в Великобритании в масштабе всего метагенома. BMC Microbiol. 2015; 18: 114.
- Thingholm LB, Ruhlemann MC, Koch M, Fuqua B, Laucke G. Лица, страдающие ожирением, с диабетом 2 типа и без него, демонстрируют различные функциональные возможности и состав кишечных микробов.Клеточный микроб-хозяин. 2019; 26: 252-264.
- Гева-Заторский Н, Сефик Э, Куа Л, Пашман Л, Тан Т.Г. Изучение микробиоты кишечника человека на наличие иммуномодулирующих организмов. Клетка. 2017; 168: 928-943.
- Delday M, Mulder I, Logan ET, Grant G. Bacteroidesthetaiotaomicron уменьшает воспаление толстой кишки на доклинических моделях болезни Крона. Воспаление кишечника. 2019; 25: 85-96.
- Келли Д., Кэмпбелл Д.И., Кинг Т.П., Грант Дж., Янссон Е.А. Комменсальные анаэробные кишечные бактерии ослабляют воспаление, регулируя ядерно-цитоплазматическое перемещение PPAR-гамма и RelA.Nat Immunol. 2004; 5: 104-112.
- Wrzosek L, Miquel S, Noordine ML, Bouet S, Joncquel Chevalier-Curt M, et al. Bacteroidesthetaiotaomicron и faecalibacteriumprausnitzii влияют на выработку гликанов слизи и развитие бокаловидных клеток в эпителии толстой кишки модельного грызуна-гнотобиота. BMC Biol. 2013; 11: 61.
- Янг Т., Чакраборти С., Саха П., Мелл Б., Ченг X. Крысы-гнотобиоты показали, что микробиота кишечника регулирует мРНК толстой кишки Ace2, рецептора инфекционности SARS-CoV-2.Гипертония. 2020; 76: 1-3.
- Gu S, Chen Y, Wu Z, Chen Y, Gao H. Изменения микробиоты кишечника у пациентов с гриппом COVID-19 или h2N1. Clin Infect Dis. 2020; 709.
- Лехторанта Л., Питкаранта А., Корпела Р. Пробиотики при респираторных вирусных инфекциях. Eur J ClinMicrobiol Infect Dis. 2014; 33: 1289-1302.
- Lei WT, Shih PC, Лю SJ, Lin CY, Yeh TL. Влияние пробиотиков и пребиотиков на иммунный ответ на вакцинацию против гриппа у взрослых: систематический обзор и метаанализ рандомизированных контролируемых испытаний.Питательные вещества. 2017; 9: 1175.
- Луото Р., Руусканен О., Варис М., Каллиомаки М., Салминен С. Добавки с пребиотиками и пробиотиками предотвращают риновирусные инфекции у недоношенных детей: рандомизированное плацебо-контролируемое исследование. J Allergy ClinImmunol. 2014; 133: 405-413.
- Тернер Р. Б., Вудфолк Дж. А., Бориш Л., Стейнке Дж. В., Патри Дж. Т.. Влияние пробиотика на врожденный воспалительный ответ и выделение вируса в рандомизированном контролируемом исследовании экспериментальной риновирусной инфекции. Benef Microbes. 2017; 8: 207-215.
- Yeh TL, Shih PC, Liu SJ, Lin CH, Liu JM. Влияние добавок пребиотиков или пробиотиков на титры антител после вакцинации против гриппа: систематический обзор и метаанализ рандомизированных контролируемых испытаний. Drug Des DevelTher. 2018; 12: 217-230.
- Blanco-Melo D, Nilsson-Payant BE, Liu WC, Uhl S, Hoagland D. Несбалансированная реакция хозяина на SARS-CoV-2 способствует развитию COVID-19. Клетка. 2020; 181: 1036-1045.
- Cao X (2020) COVID-19: иммунопатология и ее значение для терапии.Nat Rev Immunol. 20: 269-270.
- Джамареллос-Бурбулис Э.Дж., Нетеа М.Г., Ровина Н., Акиносоглу К., Антониаду А. Комплексная иммунная дисрегуляция у пациентов с COVID-19 с тяжелой дыхательной недостаточностью. Клеточный микроб-хозяин. 2020; 27: 992-1000.
- Park MK, Ngo V, Kwon YM, Lee YT, Yoo S. Lactobacillus plantarum DK119 в качестве пробиотика обеспечивает защиту от вируса гриппа путем модуляции врожденного иммунитета. PLoS One. 2013; 8: 75368.
- Takeda S, Takeshita M, Kikuchi Y, Dashnyam B, Kawahara S.Эффективность перорального введения убитых нагреванием пробиотиков из монгольских молочных продуктов против инфекции гриппа у мышей: облегчение инфекции гриппа за счет его иммуномодулирующей активности через иммунитет кишечника. IntImmunopharmacol. 2011; 11: 1976-1983.
- Кавашима Т., Хаяси К., Косака А., Кавашима М., Игараси Т. Штамм YU Lactobacillus plantarum из ферментированных пищевых продуктов активирует Th2 и защитные иммунные реакции. IntImmunopharmacol. 2011; 11: 2017-2024.
- Кикучи Ю., Кунито-Асари А., Хаякава К., Имаи С., Касуя К.Пероральное введение штамма Lactobacillus plantarum AYA усиливает секрецию IgA и обеспечивает защиту выживания от инфицирования вирусом гриппа у мышей. PLoS One. 2014; 9: 86416.
- Берггрен А., ЛазуАрен И., Ларссон Н., Оннинг Г. Рандомизированное, двойное слепое и плацебо-контролируемое исследование с использованием новых пробиотических лактобацилл для усиления иммунной защиты организма от вирусных инфекций. Eur J Nutr. 2011; 50: 203-210.
- Chong HX, Yusoff NAA, Hor YY, Lew LC, Jaafar MH. Lactobacillus plantarum DR7 улучшил инфекции верхних дыхательных путей за счет усиления иммунных и воспалительных параметров: рандомизированное двойное слепое плацебо-контролируемое исследование.J Dairy Sci. 2019; 102: 4783-4797.
- Паниграхи П., Парида С., Нанда, Северная Каролина, Сатпатия Р., Прадхан Л. Рандомизированное испытание синбиотиков для предотвращения сепсиса среди младенцев в сельских районах Индии. Природа. 2017; 548: 407-412.
- Rask C, Adlerberth I, Berggren A, Ahren IL, Wold AE. Дифференциальный эффект на клеточный иммунитет у людей-добровольцев после приема различных лактобацилл. ClinExpImmunol. 2013; 172: 321-332.
- Man WH, de SteenhuijsenPiters WA, Bogaert D. Микробиота дыхательных путей: привратник для здоровья органов дыхания.Nat Rev Microbiol. 2017; 15: 259-270.
- Унгер С.А., Богерт Д. Респираторный микробиом и респираторные инфекции. J Infect. 2017; 74 (1): 84-88.
- Шен З, Сяо Й, Кан Л., Ма В., Ши Л. Геномное разнообразие SARS-CoV-2 у пациентов с коронавирусной болезнью 2019. Clin Infect Dis. 2020; 203.
- Zhang H, Ai JW, Yang W, Zhou X, He F. Метатранскриптомическая характеристика COVID-19 позволила идентифицировать классификатор транскрипции хозяина, связанный с передачей сигналов иммунной системы. Clin Infect Dis. 2020; 663.
- Диксон Р.П., Зингер Б.Х., Ньюстед М.В., Фальковски Н.Р., Эрб-Даунвард-младший. Обогащение микробиома легких кишечными бактериями при сепсисе и остром респираторном дистресс-синдроме. Nat Microbiol. 2016; 1: 16113.
.
Информация об авторе
Ясунари Кагеяма 1, 2 , Тецу Акияма 3 и Цутому Накамура 1, 3 *
1 Takanawa Clinic, Minato-ku, Tokyo, Japan
2 Tokai University Hospital, Isehara-shi, Kanagawa, Japan
3 Лаборатория молекулярной и генетической информации, Институт количественных биологических наук, Токийский университет, Бункё -ku, Токио, Япония
Образец цитирования: Кагеяма Ю., Акияма Т., Накамура Т. (2020) Дисбактериоз кишечника и пробиотики при COVID-19.J Clin Trials 10: 421. doi:
10.35248 / 2167-0870.20.10.421
Дата получения:
04 июля 2020/ Дата принятия в печать:
17 июля 2020 г./ Дата публикации:
24 июл.2020 г.
Авторские права: © 2020 Kageyama Y, et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License,
который разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Дисбиоз кишечника и обнаружение «живых кишечных бактерий» в крови японских пациентов с диабетом 2 типа
Реферат
ЦЕЛЬ Растущее количество данных указывает на то, что микробиота кишечника является важным модификатором ожирения и диабета. Однако до сих пор нет информации о кишечной микробиоте и «живых кишечных бактериях» в системном кровотоке японских пациентов с диабетом 2 типа.
ДИЗАЙН И МЕТОДЫ ИССЛЕДОВАНИЯ Используя чувствительный метод количественной ПЦР с обратной транскрипцией (RT-qPCR), мы определили состав микробиоты фекального кишечника у 50 японских пациентов с диабетом 2 типа и 50 контрольных субъектов, а также его связь с различными клиническими проявлениями. параметры, включая маркеры воспаления.Мы также проанализировали наличие кишечных бактерий в образцах крови.
РЕЗУЛЬТАТЫ Подсчет группы Clostridium coccoides , кластера Atopobium и Prevotella (облигатных анаэробов) был значительно ниже ( P <0,05), тогда как общее количество Lactobacillus ) были значительно выше ( P < 0,05) в образцах кала больных диабетом, чем в образцах контрольной группы.В частности, количество подгрупп Lactobacillus reuteri и Lactobacillus plantarum было значительно выше ( P <0,05). Кишечные бактерии были обнаружены в крови у пациентов с диабетом значительно чаще, чем у контрольных субъектов (28% против 4%, P < 0,01), и большинство этих бактерий были грамположительными.
ВЫВОДЫ Это первое сообщение о дисбактериозе кишечника у японских пациентов с диабетом 2 типа по оценке с помощью RT-qPCR.Большое количество кишечных бактерий в кровообращении предполагает перемещение бактерий из кишечника в кровоток.
Введение
Микробиота кишечника необходима для иммунной системы хозяина (1), пищеварения, включая расщепление сложных углеводов, таких как пищевые волокна, и производство органических кислот для поддержания соответствующей среды pH в кишечнике (2) . Изучение микробиоты кишечника быстро прогрессирует, и без преувеличения можно сказать, что внедрение культурально-независимых подходов, основанных на анализе 16S рРНК, привело к смене парадигмы в этой области (2,3).Помимо своего физиологического значения, дисбактериоз кишечника связан с ожирением из-за увеличения доступности богатых калориями продуктов, таких как западная диета (4–6). Вместе с предыдущими данными появилась новая информация о патофизиологической роли микробиоты кишечника и крови в развитии атеросклероза (7–9). Важная концепция роли кишечной микробиоты в инсулинорезистентности была впервые описана Кани и его коллегами (4,10–13). В серии исследований эти исследователи продемонстрировали, что кишечные грамотрицательные бактерии продуцируют липополисахарид (ЛПС), который является хорошо известной провоспалительной молекулой, может перемещаться в кровоток из дырявого кишечника и вызывать метаболическую эндотоксемию, которая связана с ожирением. (4).Более конкретно, диета с высоким содержанием жиров усиливает разрушение белков плотных контактов в кишечнике, таких как zonula occludens-1 и окклюдин, которые участвуют в барьерной функции кишечника на моделях мышей (13). Этот эффект напрямую зависит от микробиоты кишечника, поскольку лечение антибиотиками устраняет индуцированную диетой проницаемость кишечника (4). Вышеупомянутые исследования показывают, что дисбактериоз кишечника и связанная с ним повышенная проницаемость кишечника могут служить факторами окружающей среды для развития ожирения до развития диабета.Хотя данные, полученные на мышах, убедительны, функциональные связи между микробиотой кишечника человека и заболеванием менее понятны из-за различных смешивающих факторов, включая возраст, пол, диету, генетику и расу (14,15).
В Японии оценочное число пациентов с диабетом 2 типа увеличилось до 10,7 миллиона, что является шестым по величине таким населением в мире (16). Однако исследований состава кишечной микробиоты у японских пациентов с диабетом 2 типа на людях не проводилось. Японская диета сильно отличается от западной диеты, и известно, что на микробиоту кишечника влияет тип пищи (6), что позволяет предположить, что микробиота кишечника у японских пациентов с диабетом 2 типа может отличаться от таковой у западных людей.Поэтому важно исследовать состав микробиоты кишечника у японских пациентов с диабетом 2 типа.
Интересно, что Amar et al. (17) сообщили, что диета с высоким содержанием жиров индуцирует бактериальную транслокацию из кишечника в кровоток у людей путем обнаружения бактериальной геномной ДНК, кодирующей 16S рРНК. Однако пока нет доказательств того, что «живые бактерии» перемещаются из кишечника в системный кровоток.
В текущем исследовании мы проанализировали состав микробиоты фекального кишечника и уровни кишечных бактерий в плазме у 50 японских пациентов с диабетом 2 типа и 50 контрольных субъектов путем обнаружения 16S рРНК.Мы также исследовали взаимосвязь между различными клиническими параметрами, приемом пищи и микробиотой кишечника, чтобы определить клиническое значение микробиоты кишечника у японских пациентов с диабетом 2 типа.
Дизайн и методы исследования
Объекты исследования
Мы набрали японских пациентов с диабетом 2 типа, которые регулярно посещали амбулаторную клинику университетской больницы Дзюнтендо в период с 2011 по 2012 год, и 50 пациентов согласились принять участие в исследовании. Мы также набрали контрольных субъектов, которые регулярно посещали амбулаторную клинику университетской больницы Джунтендо для лечения гипертонии, дислипидемии или заболеваний щитовидной железы, состояние которых находилось под хорошим контролем, или которые посещали университетскую больницу Джунтендо для плановых медицинских осмотров в период с 2011 по 2012 год.Пятьдесят контрольных субъектов с уровнем HbA 1c <6,0% (42 ммоль / моль) согласились участвовать. Из исследования были исключены пациенты со следующими состояниями: 1 ) пролиферативная ретинопатия; 2 ) возраст ≥80 лет; 3 ) серьезное заболевание печени (уровень аспартатаминотрансферазы и / или аланинаминотрансферазы> 100 МЕ / л) или серьезное заболевание почек (уровень креатинина сыворотки> 2,0 мг / дл; 4 ) острая сердечная недостаточность; 5 ) злокачественная опухоль; 6 ) воспалительное заболевание кишечника; и 7 ) история лечения антибиотиками в течение 3 месяцев после участия в исследовании.Протокол исследования был одобрен Комитетом по этике Университета Джунтендо, и письменное информированное согласие было получено от каждого пациента перед включением в исследование.
Определение количества бактерий с помощью обратной транскрипции, направленной на 16S рРНК — количественная ПЦР
После включения в исследование участников попросили предоставить свежие образцы фекалий. Образцы фекалий помещали непосредственно в две пробирки (∼1,0 г / пробирка) участники или сотрудники больницы; одна пробирка содержала 2 мл РНК позже (раствор для стабилизации РНК; Ambion, Остин, Техас), а другая была пуста.Образцы помещали в холодильник при 4 ° C (для анализа фекальной микробиоты) или в морозильную камеру при -20 ° C (для анализа концентрации органических кислот в фекалиях и pH фекалий) в течение 30 минут после выделения. Образцы крови были взяты после ночного голодания в течение 5 дней после сдачи образцов кала. Один миллилитр крови добавляли к 2 мл бактериального реагента RNAprotect (Qiagen, Hilden, Германия) сразу после сбора. Образцы хранили при -80 ° C. Образцы кала и крови при температуре −20 ° C были доставлены в Центральный институт микробиологических исследований им. Якульта.
Для количественной оценки бактерий, присутствующих в образцах, мы экстрагировали фракции общей РНК из фекалий и крови ранее описанным методом (18–21) и исследовали состав кишечной микробиоты и уровни кишечных бактерий в плазме с использованием 16S рРНК- прицельная RT – количественная ПЦР (qPCR) с использованием Yakult Intestinal Flora-SCAN. Три серийных разведения образца экстрагированной РНК использовали для бактериальной рРНК-целевой ОТ-кПЦР (18–21), а значения порогового цикла в линейном диапазоне анализа применяли к стандартной кривой для получения соответствующего количества бактериальных клеток в каждый образец нуклеиновой кислоты.Затем эти данные были использованы для определения количества бактерий в образце. Специфичность анализа RT-qPCR с использованием праймеров, специфичных для группы, рода или вида, определяли, как описано ранее (18–21). Последовательности праймеров перечислены в дополнительной таблице 1.
Измерение органических кислот и pH
Концентрации органических кислот в кале и сыворотке определяли с использованием методов, описанных ранее (21) с небольшими изменениями. Вкратце, замороженный образец гомогенизировали в четырех объемах 0.15 моль / л хлорной кислоты и выдерживают при 4 ° C в течение 12 часов. Суспензию центрифугировали при 20400 × g при 4 ° C в течение 10 мин. Затем полученный супернатант пропускали через фильтр с размером пор 0,45 мкм (Millipore Japan, Токио, Япония). Образец анализировали на наличие органических кислот с помощью системы высокоэффективной жидкостной хроматографии (432 Conductivity Detector; Waters Co., Milford, MA), и pH в фекалиях анализировали с помощью pH / термометра IQ 150 (IQ Scientific Instruments, Inc., Карловы Вары, Калифорния).
Биохимические анализы
Образцы крови были получены после ночного голодания. Липиды сыворотки (общий холестерин [T-CHO], холестерин HDL [HDL-C], холестерин LDL и триглицерид [TG]), уровень глюкозы в крови натощак и HbA 1c измеряли стандартными методами. Уровни в плазме высокочувствительного С-реактивного белка (hs-CRP), интерлейкина-6 (IL-6) и фактора некроза опухоли (TNF) -α измеряли с помощью латексной нефелометрии, иммунохемилюминесцентного ферментного анализа и ELISA в частном порядке. лаборатории (SRL Laboratory, Токио, Япония) соответственно.Уровень в плазме LPS-связывающего белка (LBP) измеряли с помощью набора для ELISA LBP человека (Hycult Biotech, Нидерланды).
Опросник по диетическому питанию
Оригинальный опросник по анамнезу диеты (DHQ) был разработан Sasaki et al. (22) в 1998 г., и его справедливость была подтверждена. Однако на ответ требуется около 45–60 минут. В этом исследовании мы использовали краткий тип самоуправляемого DHQ (BDHQ) (23), потому что BDHQ требует всего ∼15–20 минут, чтобы ответить. Действительность BDHQ также подтверждается, как описано ранее (23).Анкета была заполнена, когда участники посетили больницу, чтобы сдать образцы крови. Это четырехстраничная структурированная анкета для самостоятельного заполнения, в которой оцениваются пищевые привычки за предыдущий месяц. Большинство продуктов питания и напитков были выбраны из списка продуктов, которые очень часто потребляются в Японии, с использованием списка продуктов, который с некоторыми изменениями использовался в Национальном обследовании здоровья и питания Японии. В дополнение к BDHQ участники предоставили дополнительную письменную информацию о частоте употребления определенных продуктов, которые, как известно, влияют на микробиоту кишечника, таких как йогурт и пищевые добавки.
Статистический анализ
Все статистические анализы проводились с использованием пакета статистического программного обеспечения JMP, версия 10.0.2 (Институт SAS, Кэри, Северная Каролина). Данные были выражены как среднее значение ± стандартное отклонение для данных с нормальным распределением и медиана (межквартильный размах) для данных с асимметричным распределением. Для анализа данных использовался тест Манна-Уитни U . Корреляционный анализ Спирмена использовался для определения связи между количеством фекальных бактерий / органических кислот, LBP и клиническими параметрами.Степень обнаружения анализировалась с помощью теста прямой вероятности Фишера. P <0,05 считалось статистически значимым.
Результаты
ИМТ, уровень глюкозы в крови натощак, HbA , 1c и TG были значительно выше в группе диабета 2 типа, чем в контрольной группе, в то время как уровни T-CHO и HDL-C были значительно ниже в группе 2. группу диабета по сравнению с контрольной группой. Кроме того, hs-CRP и IL-6 (представляющие маркеры воспаления) были значительно выше в группе диабета 2 типа, чем в контрольной группе.Не было значительных различий в возрасте и уровне TNF-α между двумя группами (Таблица 1).
Таблица 1
Характеристики субъектов исследования
Расчетное общее потребление энергии согласно опроснику BDHQ составило 1,662 ± 569 и 1749 ± 521 ккал / день в группе диабета 2 типа и контрольной группе, соответственно. Отношение потребления углеводов к общему потреблению энергии составило 56,1 ± 7,9% в группе диабета и 53,9 ± 6,6% в контрольной группе, тогда как соотношение потребления жиров составляло 26.8 ± 5,7% и 28,6 ± 5,1% соответственно, а соотношение потребления белка составило 17,1 ± 3,5% и 17,5 ± 3,0% соответственно. Не было значительных различий в потреблении общей энергии, углеводов, жиров и белков между двумя группами. Количество участников, употреблявших йогурт не реже одного раза в неделю, было одинаковым в двух группах (группа диабета 32 участника; контрольная группа 30 участников).
Количество фекальных бактерий существенно не различалось между двумя группами (таблица 2).Однако среди облигатных анаэробов количество группы Clostridium coccoides , кластера Atopobium и Prevotella было значительно ниже ( P < 0,05), а общее количество Lactobacillus среди факультативных анаэробов было значительно ниже. выше ( P < 0,05) в группе диабета по сравнению с контрольной группой. Подгруппы Lactobacillus reuteri и Lactobacillus plantarum были особенно значительно выше ( P <0.05).
Таблица 2
Сравнение количества бактерий, органических кислот и pH между контрольными субъектами и пациентами с диабетом 2 типа
Известно, что метформин и ингибиторы α-глюкозидазы влияют на желудочно-кишечную систему. Таким образом, мы исследовали разницу в микробиоте кишечника у пациентов с диабетом, принимавших и не принимавших метформин и ингибиторы α-глюкозидазы. Уровни Enterobacteriaceae (7,5 ± 0,9 [ n = 18] против 6,7 ± 1,1 log 10 клеток / г [ n = 31], P <0.05) и Staphylococcus (4,9 ± 0,9 [ n = 17] против 4,4 ± 0,9 log 10 клеток / г [ n = 30], P <0,05) были значительно выше у пациентов, получавших метформин. Уровень Bifidobacterium (9,7 ± 0,6 [ n = 9] против 9,1 ± 0,8 log 10 клеток / г [ n = 41], P <0,05), всего Lactobacillus (8,3 ± 1,1 [ n = 9] против 6,7 ± 1,4 log 10 клеток / г [ n = 41], P <0.01), Lactobacillus gasseri (7,7 ± 1,1 [ n = 9] по сравнению с 5,8 ± 1,6 log 10 клеток / г [ n = 39], P <0,01) и Enterococcus ( 7,8 ± 1,2 [ n = 9] по сравнению с 6,3 ± 1,2 log 10 клеток / г [ n = 41], P <0,01) были значительно выше у пациентов, получавших ингибиторы α-глюкозидазы.
Концентрации в кале общих органических кислот ( P < 0,05), уксусной кислоты ( P < 0.01) и пропионовой кислоты ( P < 0,05) были значительно ниже в группе диабета, чем в контрольной группе (таблица 2). Концентрация изовалериановой кислоты в кале была значительно выше ( P < 0,05) в группе диабета, чем в контрольной группе, но концентрации других органических кислот в кале и значения pH существенно не различались между двумя группами. С другой стороны, не наблюдалось разницы между концентрацией органических кислот в крови в группе диабета и в контрольной группе.
Затем мы исследовали связи между различными клиническими параметрами (перечисленными в таблице 1), продуктами питания в BDHQ и фекальными бактериями с низким содержанием в группе диабета. Как показано в таблице 3, количество C. coccoides в кале отрицательно коррелировало с уровнями hs-CRP ( r = -0,387), потреблением энергии ( r = -0,332), потреблением насыщенных жирных кислот ( r = -0,313) и ИМТ ( r = -0,312). Кроме того, количество фекалий кластера Atopobium отрицательно коррелировало с уровнем hs-CRP ( r = -0.392) и ИМТ ( r = -0,321), и положительно с HDL-C ( r = 0,353). Напротив, количество Prevotella не коррелировало с клиническими параметрами или продуктами питания в BDHQ. Общее количество Lactobacillus , которое было выше в группе диабета, не коррелировало с клиническими параметрами или продуктами питания, перечисленными в BDHQ.
Таблица 3
Корреляция между количеством бактерий в кале, органическими кислотами и различными клиническими параметрами у пациентов с диабетом 2 типа
В таблице 3 также обобщены ассоциации между различными клиническими параметрами, продуктами питания, перечисленными в BDHQ, и органическими кислотами в фекалиях, измененными при типе 2 пациенты с диабетом.Общее количество органических кислот в фекалиях отрицательно коррелировало с потреблением насыщенных жирных кислот ( r = -0,325) и общим потреблением жиров ( r = -0,324) и положительно с потреблением углеводов ( r = 0,281) у пациентов с диабетом 2 типа. . Уровень уксусной кислоты в кале отрицательно коррелировал с потреблением насыщенных жирных кислот ( r = -0,364), общим потреблением жиров ( r = -0,327) и продолжительностью диабета ( r = -0,301) и положительно с потреблением углеводов. ( r = 0.356). Как и уксусная кислота, уровень пропионовой кислоты в кале отрицательно коррелировал с продолжительностью диабета ( r = -0,349) и потреблением насыщенных жирных кислот ( r = -0,311). Высокий уровень изовалериановой кислоты в кале у пациентов с диабетом 2 типа не коррелировал с клиническими параметрами или продуктами питания, перечисленными в BDHQ.
В таблице 4 показана скорость обнаружения рРНК кишечных бактерий в образцах крови. Бактерии были обнаружены у 14 из 50 субъектов в группе диабета, по сравнению только с 2 из 50 субъектов в контрольной группе (28% vs.4%, P < 0,01). Частота обнаружения каждой бактерии в группе диабета 2 типа составила 14% в группе C. coccoides , 14% в группе Atopobium , 4% в подгруппе Clostridium leptum , 2% в группе Streptococcus группе и 2% в группе Enterobacteriaceae , а уровень обнаружения в контрольной группе составил 2% в группе C. coccoides и 2% в группе Streptococcus . Количество видов бактерий, обнаруженных в образцах крови, было ограниченным, и большинство из них были грамположительными анаэробными бактериями, которые, как известно, являются частью комменсальной кишечной флоры, за исключением грамотрицательных Enterobacteriaceae .Уровни LBP в сыворотке, которые, как известно, играют роль в LPS-опосредованном воспалительном ответе (24), были значительно выше в группе диабета, чем в контрольной группе (12,1 ± 3,7 против 10,5 ± 3,0 мкг / мл, P < 0,05). Более того, в группе диабета уровень LBP показал положительную корреляцию с ИМТ ( r = 0,499, P <0,01), HbA 1c ( r = 0,356, P <0,05), hs- CRP ( r = 0,724, P <0.01), TNF- ( r = 0,313, P <0,05) и IL-6 ( r = 0,595, P <0,01).
Таблица 4
Количество бактерий в образцах крови и уровни LBP
Выводы
Основными результатами настоящего исследования были дисбактериоз кишечника и наличие живых бактерий в крови японских пациентов с диабетом 2 типа. Amar et al. (17) ранее сообщили, что концентрация бактериальных генов в крови (с использованием бактериальной 16S рДНК) может предсказать начало диабета, что впервые указывает на клиническое значение микробиоты крови в развитии диабета 2 типа.Однако анализ бактериальной рДНК 16S не может различить, живы или мертвы бактерии-мишени в кишечнике и крови. По этой причине в текущем исследовании мы использовали RT-qPCR, который может обнаруживать живые бактерии как в кишечнике, так и в крови, поскольку в этом методе используются специфические праймеры, нацеленные на молекулы бактериальной РНК (18). Используя эту технологию, мы определили наличие дисбактериоза кишечника и возможную бактериальную транслокацию из кишечника в кровь у японских пациентов с диабетом 2 типа.
Недавно Larsen et al.(25) идентифицировали наличие дисбактериоза кишечника у датских пациентов с диабетом 2 типа с помощью пиросеквенирования с использованием тегов и количественной ПЦР. Кроме того, Qin et al. (26) сообщили о дисбактериозе кишечника у китайских пациентов с диабетом 2 типа в исследовании ассоциации на уровне всего метагенома. Методы, использованные в двух вышеупомянутых исследованиях, отличались от методов, использованных в нашем исследовании, и, вероятно, объясняют различия в результатах трех исследований. Однако мы подтвердили некоторые аналогичные результаты у японских пациентов с диабетом 2 типа.Кроме того, количество фекалий в группе C. coccoides было значительно ниже у пациентов с диабетом 2 типа, что согласуется с результатами Qin et al. (26). Кроме того, общее количество Lactobacillus в кале было значительно выше у пациентов с диабетом 2 типа, что согласуется с данными, представленными Larsen et al. (25) Причина высокого количества Lactobacillus , пробиотика, в настоящее время не ясна. Поскольку наш метод не позволяет различить врожденные бактерии и бактерии, происходящие из таких продуктов, как йогурт, мы подсчитали количество участников, которые потребляли йогурт, но не обнаружили значительной разницы между двумя группами.Эти результаты предполагают, что высокое количество Lactobacillus в фекалиях отражает высокий уровень врожденных бактерий у пациентов с диабетом 2 типа. Необходимы дальнейшие исследования для изучения роли Lactobacillus при диабете 2 типа.
Сложные углеводы, такие как пищевые волокна, метаболизируются микробиотой толстой кишки до олигосахаридов и моносахаридов и ферментируются до короткоцепочечных жирных кислот, таких как масляная кислота, уксусная кислота и пропионовая кислота (2). Масляная кислота обеспечивает энергией эпителиальные клетки толстой кишки (27).Кроме того, сообщалось, что короткоцепочечные жирные кислоты стимулируют секрецию GLP-1 через рецептор, связанный с G-белком (FFAR2) (28). Таким образом, органические кислоты, продуцируемые кишечной флорой, тесно связаны с получением энергии из рациона и гомеостазом глюкозы инкретиновым гормоном. Интересно, что в нашем исследовании концентрации в кале общей органической кислоты, уксусной кислоты и пропионовой кислоты у пациентов с диабетом 2 типа были значительно ниже, чем у контрольных субъектов, а концентрации в кале уксусной кислоты и пропионовой кислоты отрицательно коррелировали с длительность диабета.Кроме того, органические кислоты в кале способствуют элиминации Escherichia coli O -157 (29). Принимая во внимание эту роль органических кислот в кале и наши результаты, низкий уровень органических кислот в кале может быть вредным, вызывая ухудшение гликемического контроля за счет снижения секреции инкретинового гормона после еды и повышения восприимчивости к инфекции у пациентов с диабетом 2 типа (28). , 30).
Наши данные показали, что уровень общих органических кислот в кале тесно коррелирует с потреблением углеводов и отрицательно с общим потреблением жиров и насыщенных жирных кислот.Кроме того, уровни LBP в плазме были значительно выше у пациентов с диабетом 2 типа. Известно, что LBP увеличивается при ожирении и отражает уровень LPS, части стенки грамотрицательных анаэробных бактерий и связывается с важными рецепторами распознавания структуры клеточной поверхности, называемыми Toll-подобным рецептором (TLR) -4 (31). В группе диабета уровень LBP показал положительную корреляцию с клиническими маркерами, такими как BMI, HbA 1c , hs-CRP, TNF-α и IL-6. Эти результаты частично согласуются с гипотезой Cani et al.(4,13), что диета с высоким содержанием жиров вызывает дисбактериоз кишечника и впоследствии приводит к инсулинорезистентности через LPS-зависимый механизм. В текущем исследовании, хотя высокий уровень бактерий был обнаружен в образцах крови пациентов с диабетом 2 типа, большинство обнаруженных бактерий были грамположительными анаэробными бактериями, которые, как известно, являются частью комменсальной флоры кишечника. В экспериментах на мышах пища с высоким содержанием жиров увеличивала транслокацию живых грамотрицательных бактерий через слизистую кишечника в кровь и брыжеечную жировую ткань, что, в свою очередь, было связано с воспалением слабой степени (32).В одном исследовании (17) среди бактерий, обнаруженных в крови пациентов с сахарным диабетом 2 типа,> 90% бактериальной ДНК принадлежали грамотрицательному типу Proteobacteria . Однако в этом исследовании мы обнаружили повышенный уровень LBP без повышенного уровня грамотрицательных бактерий из кишечника. Возможно, это связано с повышенным уровнем бактерий в других местах, например, в полости рта.
Клиническое значение грамположительной бактериальной транслокации у пациентов с диабетом 2 типа остается неизвестным.В этом отношении важно взаимодействие между липотейхоевой кислотой (LTA) и TLR-2 в продукции цитокинов. LTA, грамположительный компонент бактериальной стенки, связывается с TLR-2 (33). Недавние исследования (34,35) сообщили, что LTA усиливает экспрессию IL-6 в различных клетках, а наше исследование продемонстрировало наличие высоких уровней IL-6 у пациентов с диабетом 2 типа. Вместе взятые, необходимы дальнейшие исследования для определения значимости транслокации грамположительных бактерий в системном воспалении, выявленном у пациентов с ожирением и диабетом 2 типа.
Текущее исследование имеет определенные ограничения. Во-первых, у контрольных субъектов не проводился пероральный тест на толерантность к глюкозе, чтобы полностью исключить наличие диабета. Следовательно, контрольные субъекты в нашем исследовании нельзя с уверенностью отнести к контрольным субъектам, не страдающим диабетом. Однако уровни HbA 1c у всех испытуемых не превышали 6,0% (42 ммоль / моль). Во-вторых, мы не смогли подтвердить причинно-следственную связь между дисбиозом кишечника и бактериальной транслокацией, потому что наше исследование было кросс-секционным по дизайну.В-третьих, поскольку пациенты с диабетом 2 типа имели избыточный вес или страдали ожирением, нельзя исключать, что дисбактериоз кишечника и бактериальная транслокация были вызваны ожирением. В связи с этим мы разделили пациентов с диабетом на две группы: группу с ожирением (ИМТ ≥25 кг / м 2 ) и группу без ожирения (ИМТ <25 кг / м 2 ). Не было значительных различий в частоте обнаружения бактерий крови. Эти данные подтверждают идею о том, что ожирение не было основной причиной различий. В-четвертых, в нашем исследовании была небольшая выборка.
Хотя эти ограничения следует принимать во внимание, наши результаты могут дать новое понимание патофизиологических механизмов диабета 2 типа. Необходимы дальнейшие крупномасштабные исследования микробиоты кишечника и крови у японских пациентов с диабетом 2 типа.
В заключение, наши результаты продемонстрировали дисбактериоз кишечника и возможную бактериальную транслокацию крови у пациентов с диабетом 2 типа. Следующим шагом в этом протоколе исследования является проведение интервенционных исследований, чтобы выяснить, может ли улучшение дисбактериоза кишечника путем изменения образа жизни или введения пробиотиков снизить уровни маркеров кровообращения и скорость бактериальной транслокации с улучшением гликемического контроля.
Информация о статье
Благодарности. Авторы благодарят Норикацу Юки, Акиру Такахаши и Юкико Кадо из Центрального института микробиологических исследований Якульт, которые помогли с анализом собранных образцов. Авторы также благодарят Джо Мацуока, биостатиста из Центра клинических исследований Высшей школы медицины Университета Дзюнтендо, который дал рекомендации по статистическому анализу.
Двойственность интересов. А.К. получил гонорары за лекции от Kissei Pharma, Sanofi и Takeda Pharmaceutical Co.Ю.Т. получил гонорары за лекции от Takeda Pharmaceutical Co., MSD, Boehringer Ingelheim, Sanofi, Eli Lilly, Novartis Pharmaceuticals и Kissei Pharma. Т. получил гонорары за лекции от MSD, Takeda Pharmaceutical Co. и Eli Lilly. Ю.Ф. получил гонорары за лекции от Novartis Pharmaceuticals и Eli Lilly и исследовательские фонды от Novartis Pharmaceuticals, MSD и Takeda Pharmaceutical Co. T.H. получил гонорары за лекции от MSD, Eli Lilly, Takeda Pharmaceutical Co., Novartis Pharmaceuticals, Dainippon Sumitomo, Novo Nordisk Pharma, Sanofi и Daiichi Sankyo, а также получил средства на исследования от MSD, Eli Lilly, Takeda Pharmaceutical Co., Kowa, Mochida, Sanwakagaku, Novo Nordisk Pharma, Kissei Pharma, Novartis, Boehringer Ingelheim, Tanabe Mitsubishi, Dainippon Sumitomo, Telmo, Sanofi Aventis, Roche, Ono и Daiichi Sankyo. С.Н. и Ю.Ю. получили средства на исследования от Yakult Honsha Co. Ltd. H.W. получил гонорары за лекции от Boehringer Ingelheim, Sanofi, Ono Pharmaceutical Co., Novo Nordisk Pharma, Novartis Pharmaceuticals, Eli Lilly, Sanwakagaku Kenkyusho, Daiichi Sankyo Inc., Takeda Pharmaceutical Co., MSD, Dainippon Sumitomo Pharmaceuticals и Kowa Co.и фонды исследований от Boehringer Ingelheim, Pfizer, Mochida Pharmaceutical Co., Sanofi, Novo Nordisk Pharma, Novartis Pharmaceuticals, Sanwakagaku Kenkyusho, Terumo Corporation, Eli Lilly, Mitsubishi Tanabe Pharma, Daiichi Sankyo Inc., Takeda Pharmaceutical Co., MSD, Shionogi. , Dainippon Sumitomo Pharma, Kissei Pharma и AstraZeneca. О других потенциальных конфликтах интересов, относящихся к этой статье, не сообщалось.
Авторские взносы. J.S. и А.К. исследовал данные, участвовал в сборе данных, анализировал данные, участвовал в обсуждении, а также написал и отредактировал рукопись.F.I., T.Y., H.G., H.A., K.K., M.K., T.S., T.O., Y.T., Y.S., R.Y., T.M., Y.F. и H.F. участвовали в сборе данных и внесли свой вклад в обсуждение. К.Н., Т.Т. и Т.А. разработал исследование, проанализировал данные и отредактировал рукопись. T.H. разработал исследование и внес свой вклад в обсуждение. С.Н. участвовал в обсуждении. Ю.Ю. разработал исследование, участвовал в обсуждении и отредактировал рукопись. H.W. исследовал данные, участвовал в сборе данных, участвовал в обсуждении и редактировал рукопись.А.К. является гарантом этой работы и, как таковой, имеет полный доступ ко всем данным в исследовании и берет на себя ответственность за целостность данных и точность анализа данных.
Предварительная презентация. Части этого исследования были представлены в виде тезисов на 73-й научной сессии Американской диабетической ассоциации, Чикаго, штат Иллинойс, 21–25 июня 2013 г.
- Получено 2 декабря 2013 г.
- Принято 28 марта 2014 г.
- © 2014 Американская диабетическая ассоциация.Читатели могут использовать эту статью при условии, что произведение правильно процитировано, используется в образовательных целях, а не для получения прибыли, и если произведение не изменено.
Использование пробиотиков для коррекции дисбактериоза нормальной микробиоты после заболевания или разрушительных событий: систематический обзор
Введение
Популярность пробиотиков в последнее время выросла в геометрической прогрессии, но наряду с их возросшим использованием ведутся споры о том, как следует регулировать пробиотики и следует ли рассматривать пробиотики в качестве лечебного питания, лекарства или пищевой добавки.В США пробиотики обычно доступны в виде пищевых добавок и, таким образом, ограничены заявлением о «структуре или функции» для здоровья и, в отличие от лекарств, отпускаемых по рецепту, не имеют права заявлять, что «лечат» или «излечивают» болезнь. В Европе и Великобритании пробиотики имеют право заявлять о своей полезности или функциональности. Эти утверждения должны быть подтверждены хорошо проведенными испытаниями на людях в целевой популяции или на здоровых добровольцах, но Европейское управление по безопасности пищевых продуктов (EFSA) отклонило> 80% поданных им заявлений.1–3 Во многих случаях научное обоснование конкретного заявления о пользе для здоровья было сочтено недостаточным или основанным на косвенном эффекте4. Одно из таких функциональных заявлений, сделанных в отношении пробиотических продуктов, заключается в том, что они устраняют дисбактериоз (или нарушение жизнедеятельности бактерий и грибов после применения антибиотиков или других препаратов). разрушительное воздействие) и, таким образом, может быть полезным для поддержания здоровья. Пробиотики активны в течение этого чувствительного окна с момента разрушительного события до момента восстановления нормальной микробиоты. Для пробиотиков задокументировано множество механизмов действия (от блокирования участков прикрепления патогенов, разрушения патогена бактериоцинами или протеазами, разлагающими токсины до регуляции иммунной системы) 5, 6, и хотя клинические данные подтверждают Эффективность некоторых пробиотических штаммов, доказательства, связывающие эти механизмы действия с определенными заявлениями о здоровье или функции, не так однозначны.
Классическим примером последствий дисбактериоза является диарея, связанная с антибиотиками (AAD) .7, 8 Хотя антибиотики могут быть эффективными в уничтожении патогенных организмов, общим непреднамеренным эффектом является уничтожение или подавление полезных микробов из-за общей восприимчивости к антибиотику. Одна из многих функций нормальной микробиоты — это способность противостоять инфекции патогенными организмами, называемая «резистентностью к колонизации» 9, 10. Например, потеря субпопуляции нормальной микробиоты может привести к потере способности нарушать пуховые волокна и крахмалы превращаются в абсорбируемые короткоцепочечные жирные кислоты, что приводит к высокому уровню непереваренных углеводов, которые могут вызвать диарею.11 Было показано, что нарушение нормальной микробиоты приводит к более высокому уровню инфекций в других системах организма, кроме кишечного тракта, включая кожу, 12, 13 влагалище, 14, 15 дыхательные пути, 16, 17 и ротовую полость18. –20
Основной проблемой при установлении причины и следствия улучшения дисбактериоза пробиотиками является отсутствие стандартного определения «нормальной» микробиоты. Виды микробов, присутствующих в разных нишах тела, существенно различаются между индивидуумами, которые также зависят от возраста, географического района и состояния здоровья хозяина.Кроме того, полный учет микробиоты в настоящее время невозможен, поскольку нет анализов для обнаружения всех> 10 13 –10 14 организмов в кишечнике, а стандартные методы культивирования микробов пропускают 75–95% этих организмов. 21, 22 Развитие метагеномики (каталогизация профилей индивидуальных и специфических для болезней бактериальных генов) и создание международного проекта «Микробиом человека» открыли новую эру в нашем понимании сложности этих взаимодействий в организме.23, 24 Этот сдвиг парадигмы от культивирования к метагеномному анализу расширил наши возможности документировать изменения микробных популяций до беспрецедентной степени, но интерпретация этих сдвигов продолжает оставаться предметом дискуссий.25-28 С появлением этих новых метагеномных инструментов, пересматривается роль пробиотиков в восстановлении нормальной микробиоты.29
В свете новых руководящих документов и рекомендаций цель этого систематического обзора состоит в том, чтобы определить, как требования по восстановлению нормальной микробиоты и коррекции дисбактериоза изучались с помощью хорошо спланированных испытаний и какие штаммы пробиотиков имеют доказательные данные. чтобы поддержать эти утверждения.
Методы
Цель исследования
Систематический обзор литературы для анализа доказательств того, что пробиотики могут исправить дисбактериоз нормальной микробиоты по результатам рандомизированных контролируемых исследований.
Стратегия поиска
Поисковые запросы включали: пробиотики + заявления о здоровье, восстановление нормальной микробиоты, дисбиоз, нормальная микробиота, фармакокинетика, метагеномика, пробиотики, пищевые добавки, рандомизированные контролируемые испытания, AAD, Clostridium difficile инфекция (CDI), воспалительные заболевания кишечника (IBD) синдром раздраженного кишечника (IBS), диарея путешественника (TD), искоренение Heliobacter pylori, бактериального вагиноза (BV) или вагинита, лечение острой детской диареи и специфические штаммы или продукты пробиотиков.Первоначально стратегии поиска были широкими, а затем сузились до клинических испытаний пробиотиков.
Источники данных
PubMed (1985–2013), EMBASE (1985–2013), Кокрановская база данных систематических обзоров (1990–2013), CINAHL (1985–2013), AMED (1985–2013) и ISI Web of Science (2000–2013). Был проведен поиск по трем онлайновым регистрам клинических испытаний: Кокрановскому центральному регистру контролируемых испытаний (http://www.cochrane.org), метарегистру контролируемых испытаний (http://www.controlled-trials.com/mrct) и Национальным институтам здравоохранения. (http: // www.Clinicaltrials.gov).
Критерии отбора исследований и извлечения данных
Отрывки из всех цитат были рассмотрены одним автором и оценены для включения в рандомизированные контролируемые испытания пробиотических препаратов. Полные статьи были извлечены, если были упомянуты нормальные анализы микробиоты. Испытания на неанглийском языке переводились и включались, когда это было возможно. Критерии исключения включали доклинические исследования (модели на животных или анализы in vitro), исследования безопасности или фазы 2, обзоры, испытания эффективности без анализов для нормальных видов микробиоты, только метагеномные методы, механизм действия нормальной микробиоты или пробиотика, перекрестные исследования, отчеты о случаях или серии случаев, повторяющиеся отчеты или исследования неуказанных типов пробиотиков.Были рассмотрены все фармакокинетические исследования на людях, поскольку в их рефератах часто не содержались данные нормального анализа микробиоты. Процесс извлечения данных и обзора соответствовал руководящим принципам заявления о предпочтительных элементах отчетности для систематических обзоров и метаанализов (PRISMA) с использованием контрольного списка из 27 пунктов и блок-схемы.30 Для сбора данных о пробиотике (тип штамма) использовалась стандартизированная форма извлечения данных. , суточная доза, продолжительность), тип контроля (плацебо, активное лечение или отсутствие лечения), дизайн исследования (состояние микробиоты на исходном уровне и время последующего наблюдения), тип анализа микробиоты (микробное культивирование, молекулярные биомаркеры и т. д.), включенное исследование популяция (взрослые и дети, здоровые добровольцы, болезненное состояние), тип и время действия деструктивного агента (антибиотики, химиотерапия и т. д.), размер и отсев исследования, оценка результатов (эффективность и / или статус микробиоты в конце исследования, нежелательные явления) и вид заявления о состоянии здоровья.
Результаты и определения
Первичный результат — это степень коррекции или улучшения микробиоты с помощью определенного (ых) пробиотического штамма (ов). Вторичный результат — это связь между степенью коррекции дисбиоза и чистой эффективностью, обнаруженной в рандомизированных контролируемых испытаниях пробиотических вмешательств. Дисбиоз определяется как изменение или нарушение нормальной микробиоты (бактериальные или грибковые виды) из-за воздействия разрушающего фактора (например, антибиотиков, хронических заболеваний, стресса, медицинских процедур или лекарств и т. Д.).Поскольку в настоящее время не существует стандартного определения «нормальной» микробиоты, для этого обзора восстановление нормальной микробиоты определяется как возвращение к анализируемым видам или профилю микробов, полученным у здорового человека (до того, как произойдет разрушительное событие). Включенные исследования должны иметь по крайней мере анализ лечения препробиотиками и анализ лечения постпробиотиками. В течение периода поиска (1985–2013) было доступно множество микробных анализов, включая документирование микробиоты либо с помощью микробных культур, либо с помощью метагеномных методов (нацеленные на 16s рРНК зонды с использованием флуоресцентной гибридизации in situ (FISH) или другого метода ПЦР) 8, 21, 28, 31 или косвенными методами (по шкале Ньюджента).15 баллов по шкале Ньюджента (от 0 до 10) используются для диагностики бактериального вагиноза (баллы ≥7) или нормальной микробиоты влагалища (баллы 0–3) на основе количественных морфотипов малых грамотрицательных палочек ( Gardnerella vaginalis / bacteroides spp) и изогнутые грамотрицательные палочки ( Mobiluncus spp), полученные при окраске по Граму мазков из влагалищных выделений. Микробиологические анализы только штаммов, содержащихся в пробиотическом продукте, считаются фармакокинетическими исследованиями и не включаются в профили нормальной микробиоты.
Модели дисбактериоза
Для определения воздействия на нормальную микробиоту были включены только прямые доказательства изменения микробиоты (виды, профили, индексы разнообразия или диагностические критерии), а косвенные эффекты были исключены (изменения кишечных ферментов, параметров иммунной системы или симптомов заболевания). Степень улучшения дисбактериоза подразделяется на три уровня: (1) восстановление нормальной микробиоты до исходного уровня; (2) изменение или улучшение нормальной микробиоты; и (3) отсутствие изменений нормальной микробиоты.
Литература содержала три модели дисбиоза: модель A (восстановление нормальной микробиоты), в которой анализировали пациентов, зарегистрированных со здоровой, ненарушенной микробиотой, а затем снова анализировали после разрушительного события (такого как воздействие антибиотиков) и терапии пробиотиками; модель B (изменение микробиоты) оценивала пациентов с уже существующей нарушенной микробиотой (например, уже существующее хроническое заболевание или активное заболевание), а затем после пробиотической терапии; Модель C (без дисбактериоза) тестировала добровольцев без разрушительного события (до или во время клинического испытания) как в препробиотический, так и в постпробиотический периоды, как показано на рисунке 1.«Восстановление» нормальной микробиоты определяется как восстановление микробиоты до нормального здорового исходного уровня. Восстановление может быть полным (все проанализированные уровни микробов вернулись к исходному уровню) или неполным восстановлением (частичное восстановление некоторых штаммов микробов, но не все вернулись к исходным уровням). В исследованиях, в которых участвовали участники с дисбактериозом на исходном уровне (обычно из-за хронических заболеваний), невозможно показать восстановление нормального уровня микробиоты, поскольку нормальная, ненарушенная микробиота не присутствовала у этих типов участников исследования на момент включения в исследование.Таким образом, наиболее веские аргументы в пользу конструкции модели B — это «изменение или улучшение» микробиоты. В этой статье были проанализированы только данные участников, подвергшихся воздействию пробиотиков. Данные из контрольных групп использовались для подтверждения дисбактериоза у участников с хроническими заболеваниями или после разрушительного воздействия, такого как антибиотики или химиотерапия, не затронутых воздействием пробиотиков.32–34
Рис. 1
Временная последовательность событий и три модели дизайна исследований, определяющих три различные степени коррекции дисбиоза пробиотиками.
Оценка методологической силы и качества
Система GRADE (классификация рекомендаций, оценка, разработка и оценка) для оценки общего качества исследования будет использоваться для каждого пробиотического штамма или типа (отдельные штаммы и смеси штаммов) .35 Рекомендация для поддержки заявления о каждом пробиотическом штамме. или смесь могут быть оценены по общей силе доказательств («сильные», многие рандомизированные контролируемые испытания показывают значительное восстановление микробиоты, или «умеренные» — только одно рандомизированное контролируемое испытание; или «слабые», только серии случаев или отчеты, ограниченное количество малых испытаний и т. д.).
Качество доказательств основано на дизайне исследования и оценивается как «высокое качество» (четко определенный дизайн исследования для определения восстановления при нормальной микробиоте, модель A) или «среднее качество» (нарушение микробиоты на исходном уровне, модель B) или «низкое качество» (нарушение работы не произошло, модель C). Измерение систематической ошибки публикации в данном обзоре не оценивалось, поскольку объединенные оценки эффективности не проводились, как это обычно бывает в метаанализе, но все исследования с анализами микробиоты были включены для ограничения систематической ошибки.
Рейтинг чистой эффективности
Чтобы определить, связана ли способность корректировать дисбактериоз с клинической эффективностью, используйте опубликованную литературу для рандомизированных контролируемых исследований (РКИ) или мета-анализы пробиотиков для различных показаний заболевания, включая AAD, 5, 36, 37 CDI, 5, 38 IBD , 39 IBS, 40 TD, 41 эрадикация H. pylori , 36, 37 BV42 и лечение острой детской диареи были рассмотрены.43–45 Чистый рейтинг был рассчитан путем вычитания количества РКИ, показавших незначительную или эквивалентную эффективность из числа РКИ, показавших значительную эффективность.Ранги были разделены на следующие категории: ++, ≥2 чистых РКИ, показывающих значительную эффективность; +, чистых РКИ, показывающих значительную эффективность; 0, равное количество РКИ, показывающих значимые и незначимые результаты эффективности, и -, ≥1 чистое отрицательное или незначимое РКИ. Пробиотики, не прошедшие РКИ, не оценивались.
Результаты
Обзор литературы за 1985–2013 гг. Обнаружил 353 статьи, посвященные лечению пробиотиками и их потенциальному влиянию на нормальную микробиоту.
Исключенные исследования
Как показано на рисунке 2, в общей сложности 272 статьи были исключены по следующим причинам: обзоры (n = 116), исследования эффективности пробиотиков без данных о нормальных анализах микробиоты (n = 54), модели пробиотиков на животных и изменения микробиоты. (n = 38), только метагеномные методы или методы микробиоты (n = 17), исследования нормальной микробиоты, но без использования пробиотиков (n = 14), анализы микробиоты in vitro (n = 10), дублирующие отчеты (n = 2 ) или разные (n = 21), которые включали исследования механизма действия пробиотиков, исследования безопасности, дублирующие отчеты, перекрестные исследования и два с плохо описанными пробиотическими вмешательствами.46, 47 В общей сложности была рассмотрена 81 полная статья, в которой упоминались изменения в нормальной микробиоте или указывались на полезность пробиотиков и их влияние на нормальную микробиоту.
Рис. 2
Блок-схема результатов обзора литературы (1985–2013) включенных и исключенных исследований по восстановлению или улучшению нормальной микробиоты с помощью пробиотиков. РКИ — рандомизированные контролируемые испытания; МОА, механизм действия; НМ, нормальная микробиота.
Фармакокинетические исследования пробиотиков (n = 18), в которых сообщалось о концентрациях пробиотических штаммов до и после лечения, но не анализировались на другие виды нормальной микробиоты, были исключены.Хотя в нескольких исследованиях, использующих этот дизайн исследования, утверждается, что пробиотики оказали влияние на нормальную микробиоту, тип полученных данных — это фармакокинетическое поведение самих пробиотиков, а не нормальная микробиота. Несколько исследований заявили, что нормальная микробиота была изменена, потому что после введения пробиотиков наблюдалось увеличение количества различных видов бактерий, но проанализированные виды были теми, которые содержались в пробиотическом продукте, поэтому это увеличение не является неожиданным. Фармакокинетические исследования документально подтвердили, что пробиотические штаммы, принимаемые перорально, могут выжить при прохождении через кишечный тракт с уровнем выделения с фекалиями от <1% до 22%.48, 49 Эти фармакокинетические исследования были исключены из этого анализа, поскольку они не тестировали другие типы нормальной микробиоты, не обнаруженные в пробиотическом продукте.
Включенные исследования
Из 63 включенных клинических испытаний пять испытаний включали несколько групп лечения, в результате чего в общей сложности было проанализировано 69 групп лечения. Engelbrektson и др. 50 протестировали смесь из пяти штаммов пробиотиков на добровольцах, подвергшихся воздействию антибиотиков, а также протестировали смесь из четырех штаммов пробиотиков на здоровых добровольцах, не подвергавшихся воздействию антибиотиков.Zoppi и др. 51 использовали восемь различных групп лечения в своем исследовании, и в наш анализ были включены группы пробиотиков ( Saccharomyces boulardii отдельно и Lactobacillus rhamnosus GG отдельно), смесь двух пробиотиков ( L. acidophilus и Bifido bifidum ) и смесь трех пробиотических штаммов ( L. acidophilus, L. rhamnosus и B. bifidum ). Orrhage et al 52 использовали две группы лечения (только Bifido longum и смесь B.longum и L. acidophilus ). Ларсен и др. 53 протестировали два отдельных пробиотика ( B. lactis и L. acidophilus ) в разных группах лечения. Lidbeck et al. 54 давали либо эноксацин, либо клиндамицин и рандомизировали пациентов либо L. acidophilus , либо плацебо.
Нормальные методы анализа микробиоты
Из 69 лечебных групп, в которых проводились нормальные анализы микробиоты, для профилирования микробиоты использовались различные методы.Во многих исследованиях использовались только стандартные микробиологические анализы культур (37, 54%), в то время как в других (28, 40%) использовались методы обнаружения некультивируемых бактериальных штаммов, которые включали метагеномные анализы (FISH, TRFLP, секвенирование 16 s рРНК) или другие ПЦР. техники. В некоторых исследованиях (4,6%) использовалась косвенная оценка нормальной микробиоты с использованием шкалы Ньюджента для диагностики бактериального вагиноза, которая основывается на окрашивании по Граму вагинальных выделений, pH влагалища и симптомах для определения наличия или отсутствия нормальной микробиоты.15
Штаммы пробиотиков
В 69 группах лечения большинство (36, 52%) использовали один штамм пробиотика, в то время как 14 (20%) тестировали смесь двух пробиотических штаммов и 19 (28%) тестировали смесь трех или более пробиотических штаммов. Распределение пробиотиков с одним штаммом по сравнению с множественными пробиотиками незначительно варьировалось в зависимости от модели дизайна исследования (= 2,3, p = 0,32). Из 15 групп реставрационного исследования (модель A) 47% использовали один штамм пробиотика и 53% использовали несколько штаммов. Из 25 групп лечения с нарушенной микробиотой на исходном уровне (модель B) 44% использовали один штамм и 56% использовали несколько штаммов.Из 29 групп исследования с неповрежденной микробиотой (модель C) 62% использовали один штамм и 38% использовали несколько штаммов.
Модель восстановления нормальной микробиоты (модель A)
Было найдено только 10 исследований (с 15 группами лечения) с использованием модели А для определения восстановления микробиоты (таблица 1) 32, 34, 50–52, 54–58 Тип включенных участников варьировался от здоровых добровольцев до детей с нелеченными респираторные инфекции, педиатрическим онкологическим больным. Для участников с острыми инфекциями или раком базовые анализы проводились перед разрушающим агентом (антибиотиками или химиотерапией).Число участников, получавших пробиотики, составляло в среднем 20 на исследование и варьировалось от 5 до 83. В 93% разрушающим фактором было воздействие антибиотиков, а в одном исследовании химиотерапия вызвала нарушение микробиоты. Только 8 (53%) групп исследования выполнили анализ в течение периода наблюдения 1–8 недель после прекращения приема пробиотика.
Таблица 1
Доказательные данные о восстановлении нормальной микробиоты (НМ) для 12 пробиотиков из 10 исследований (15 групп лечения; модель A)
Анализ пробиотических штаммов по отдельности выявил только два пробиотических продукта в более чем одном рандомизированном контролируемом исследовании.Пробиотическая смесь L. acidophilus и B. bifidum показала полное восстановление в одном исследовании, но только частичное восстановление в другом (сила: сильная, качество: высокое). Пробиотическая смесь L. acidophilus (2 штамма) с B. bifidum и B. animalis показала полное восстановление в одном исследовании, но только частичное восстановление в другом (сила: сильная, качество: высокое). Пять других пробиотических продуктов только в одном подтверждающем клиническом исследовании показали восстановление микробиоты ( B.longum , Clost. butyricum , L. acidophilus , смесь L. acidophilus с L. paracasei и B. lactis и смесь L. acidophilus с L. paracasei и B. bifidum и два штамма B. lactis ; Прочность: умеренная, Качество: высокое). Три пробиотических продукта с одним подтверждающим клиническим испытанием показали частичное восстановление ( S. boulardii , L. rhamnosus GG, смесь L.rhamnosus с L. bifidus и L. acidophilus ; Прочность: умеренная, Качество: высокое). Только два пробиотических продукта с использованием модели A не показали изменений в микробиоте ( B. breve и смесь L. acidophilus и B. longum ; сила: умеренная, качество: высокое). Таким образом, 10 из 12 (83%) пробиотических продуктов показали полное или частичное восстановление нормальной микробиоты.
Из 11 пробиотических продуктов с заявлением о «восстановлении или улучшении нормальной микробиоты» 10 (91%) были поддержаны этим обзором, но только семь показали полное восстановление, а пять — частичное восстановление микробиоты (таблица 1).Смесь L. acidophilus и B. longum не показала никаких изменений в микробиоте. Wada и др. 32 заявили, что B. breve «усилены кишечными анаэробами», но это сравнивалось только с группой плацебо. Их данные показали, что химиотерапия является разрушительным событием, приводящим к увеличению количества энтеробактерий в кишечнике в группе плацебо, но к концу 8-недельного периода наблюдения в группе пробиотиков или плацебо не наблюдалось значительных различий по сравнению с исходной микробиотой. уровни.
Нарушение нормальной микробиоты при исходных исследованиях (модель B)
Двадцать четыре исследования (с 25 группами лечения) использовали модель B, в которую были включены участники с ранее существовавшей нарушенной микробиотой, связанной с текущим заболеванием или состояниями (таблица 2) .33, 53, 59–80 Среднее количество участников, получавших пробиотики, составляло 23 ± 16 / исследование и варьировались от 7 до 83 участников. Типы ранее существовавших факторов, нарушающих микробиоту, включали пациентов с атопическим дерматитом, аллергии, цирроз, бактериальный вагиноз, синдром раздраженного кишечника, воспалительные заболевания кишечника (язвенный колит и поучит), идиопатическую диарею, энтеральное питание, синдром короткой кишки и рак толстой кишки. .Только 10 (40%) исследуемых групп проводили анализ в течение периода последующего постпробиотического наблюдения.
Таблица 2
Доказательные данные по улучшению или изменению нормальной микробиоты (NM) в 18 пробиотиках из 24 исследований (25 групп лечения) с нарушенной микробиотой на исходном уровне (модель B)
Три пробиотика прошли несколько клинических испытаний, чтобы подтвердить утверждение об улучшении микробиоты за счет пробиотика. S. boulardii использовался в двух испытаниях либо с пациентами с энтеральным питанием, либо с пациентами с активной диареей и обнаружил улучшение привычной микробиоты у пациентов с активной диареей, 66 но продемонстрировал только косвенные доказательства изменений короткоцепочечных жирных кислот в другое исследование65 (Сила: сильная, Качество: умеренное).Смесь из четырех пробиотических штаммов (2 штамма L. rhamnosus , P. freudenreichii + B. breve ) показала улучшение микробиоты в двух клинических испытаниях74, 75 (сила: сильная, качество: умеренное). Из четырех клинических испытаний смеси семи пробиотических штаммов, два не показали значительных изменений микробиоты77, 78, одно показало, что постпробиотическое лечение больше анаэробами79, а одно обнаружило снижение количества видов бактероидов80 (сила: сильная, качество: умеренная). Три клинических испытания показали, что не было значительных изменений, связанных с Lactobacillus plantarum 299v62–64 (сила: сильная, качество: умеренное).Из этих пробиотиков только одно подтверждающее клиническое испытание (сила: умеренная, качество: умеренное), два отдельных штамма пробиотиков ( E. coli, Nissle и L. casei rhamnosus ) и пять различных смесей пробиотических штаммов подтверждают утверждение о том, что пробиотик изменяет микробиоту (таблица 2). Таким образом, 10 из 18 (56%) пробиотических продуктов изменили или улучшили микробиоту у людей с ранее существовавшим заболеванием.
Из 25 лечебных групп утверждение статьи было подтверждено в 14 (56%) исследованиях.Не было значительных изменений микробиоты из-за пробиотика в девяти группах лечения и только изменение микробиоты в пяти других (таблица 2). Наш обзор не согласился с заявленными результатами в 11 (46%) других группах лечения. В семи группах лечения было заявлено, что тестируемый пробиотик «восстановил нормальную микробиоту», но неясно, как был сделан этот вывод, поскольку не было времени, когда нормальная неповрежденная микробиота присутствовала. Из семи исследований, в которых утверждалось, что их пробиотики «восстановили» нормальную микробиоту, наш анализ показал, что ни одно из них не способно документально подтвердить восстановление, но подтверждено, что пробиотики улучшили или изменили микробиоту в этих исследованиях.В четырех исследованиях утверждалось, что пробиотик «изменил или улучшил» нормальную микробиоту, но в этом обзоре не было обнаружено значительных различий при сравнении постпробиотических и исходных анализов для групп пробиотиков. Girard-Pipau и др. 65 пришли к выводу, что S. boulardii «изменил нормальную флору», потому что в группе пробиотиков было обнаружено больше грамположительных анаэробов по сравнению с контрольной группой, а в группе наблюдалось увеличение содержания трех короткоцепочечных жирных кислот. S. boulardii группа.Однако, когда анализ ограничивается тенденциями, наблюдаемыми только в группе пробиотиков, не наблюдалось значительных различий в профилях микробиоты препробиотиков и постпробиотиков. Вентури и др. 77 пришли к выводу, что смесь из семи пробиотических штаммов увеличивает концентрацию некоторых полезных штаммов в кишечнике. Однако единственными штаммами, у которых наблюдалось значительное увеличение, были штаммы, содержащиеся в смеси пробиотиков, а не конкретно нормальная микробиота хозяина. Поскольку это исследование не имело исходного уровня микробиоты, увеличенное количество лактобацилл и бифидобактерий могло не отражать их нормальные уровни.Van der Aa и др. 59 утверждали, что B. breve «успешно модулирует кишечную флору», но при сравнении исходных уровней с постпробиотическими уровнями не наблюдалось значительных изменений в группе пробиотиков. Odamaki и др. 33 действительно показали увеличение Faecalibacterium spp и Bacteroides fragilis spp в конце лечения B. longum BB536, но такое же увеличение наблюдалось и в группе плацебо.
Непрерывные исследования нормальной микробиоты (модель C)
В 29 испытаний были включены здоровые взрослые люди, у которых во время исследования не присутствовал деструктивный фактор (отсутствие антибиотиков, отсутствие лекарств или наличие острого или хронического заболевания), которые могли бы повлиять на нормальную микробиоту, как показано в таблице 3.14, 49, 50, 81–106. Среднее количество участников, получавших пробиотики, составляло 23 человека в исследовании и варьировалось от 7 до 160 человек в исследовании. Из 29 групп исследования анализы проводились в течение периода наблюдения только в 52%. Fujiwara и др. 84 культивировали семь здоровых добровольцев и обнаружили энтеробактерии и клостридиальных видов после B. longum , снижение на 10 1 / г по сравнению с исходным уровнем (p <0,03), но никаких других изменений в микробиоте были обнаружены. Karlsson и др. 94 обнаружили значительное увеличение кишечного разнообразия у девяти добровольцев мужского пола с атеросклерозом, получавших L.plantarum 299v, но поскольку тесты полиморфизма длин концевых рестрикционных фрагментов использовались вместо культур для видов бактерий, специфические изменения в видах микробиоты не могли быть определены. Ян и Шеу культивировали 63 ребенка (55% с Helicobacter pylori ), получавших йогурт с L. acidophilus и B. lactis , но обнаружили только снижение количества E. coli в H.pylori отрицательных. в подгруппе детей, существенных изменений нормальной микробиоты у H.pylori — положительные дети. 100 Кубота и др. 103 проанализировали 29 участников с аллергией на пыльцу японского кедра и обнаружили, что молоко, ферментированное L. rhamnosus GG и L. gasseri TMC0356, подавляло изменения микробиоты (меньше изменений профиля кишечника), но не удалось определить изменения конкретных видов бактерий из-за типа используемого анализа (FISH и TRFLP) .103 Таким образом, только 4 из 19 (21%) пробиотических продуктов изменили микробиоту у здоровых людей, у которых не было разрушительного события.
Таблица 3
Модель C: Доказательные данные по улучшению или изменению нормальной микробиоты (NM) в 19 пробиотиках у здоровых добровольцев, включенных в 29 исследований (29 лечебных групп) в исследованиях без разрушительного воздействия
Из семи исследований, в которых утверждалось, что их пробиотики «восстанавливают или изменяют» нормальную микробиоту, только четыре утверждения были подтверждены. Сьерра и др. 96 заявили, что Lactobacillus salivarius дали 20 здоровым взрослым «улучшенная микробиота кишечника», но были обнаружены только повышенные уровни лактобацилл и никаких других изменений у нормальных видов микробиоты обнаружено не было.Единственное другое свидетельство было косвенным из наблюдаемых изменений иммунных параметров. He и др. 99 заявили о смеси B. longum и B. animalis «модифицированной» микробиоты, но изменения наблюдались только во время приема йогурта, а не после периода наблюдения в течение 1 недели. Витали и др. 14 утверждали, что смесь из четырех штаммов лактобактерий и трех штаммов бифидобактерий «модулировала вагинальную микробиоту», но единственные значительные изменения были связаны с увеличением видов бактерий, содержащихся в смеси пробиотиков.
из пробиотиков, подтвержденных многочисленными клиническими испытаниями ( B. animalis , B. longum , L. casei , L. plantarum 299v, смесь B. animalis и B. lactis ), 13 испытаний (87%) подтверждают отсутствие значительных изменений в нормальной микробиоте, если микробиота не нарушена (сила: сильная, качество: низкое).
Ассоциация клинической эффективности и восстановления нормальной микробиоты
В нескольких исследованиях одновременно сравнивалась клиническая эффективность и способность восстанавливать или улучшать нормальную микробиоту после дисбактериоза.Был проведен синтез литературы по РКИ по восьми распространенным показаниям болезни, и была оценена общая сила сети. Эффективность пробиотиков, способных восстанавливать нормальную микробиоту, часто подтверждалась РКИ, как показано в таблице 4. Из 10 пробиотиков с доказательствами восстановления 7 (70%) также прошли по крайней мере одно РКИ по крайней мере для одного из восьми. болезней, в то время как 30% не имели поддерживающих РКИ по эффективности. Из семи пробиотиков, включенных в ассоциированные РКИ, только два пробиотика ( S.boulardii и L. acidophilus ) имеют убедительные доказательства эффективности при большинстве показаний к болезни, в то время как пять пробиотиков, способных восстанавливать микробиоту, имели слабые доказательства эффективности или отсутствовали. Например, S. boulardii , у которого есть исследования, поддерживающие восстановление, имеет убедительные доказательства клинической эффективности для AAD (рейтинг ++: 11 РКИ имели значимые результаты, а 6 имели незначительные результаты), CDI (рейтинг ++: было проведено два РКИ со значительными результатами. ), IBD (с рейтингом ++: было два РКИ со значительными результатами), IBS (с рейтингом 0: было одно РКИ со значительной эффективностью и одно РКИ с незначительными результатами), TD (рейтинг +: 3 РКИ со значительной эффективностью и 2 с незначительными результатами. эффективность), H.pylori (ранжирование -: 2 РКИ со значительными результатами и 4 с незначительными результатами) и отсутствие исследований по BV. L. acidophilus , который частично восстановил микробиоту в исследовании, связан с клинической эффективностью при AAD, IBS и BV, но не для TD или ликвидации H. pylori и лечения острой детской диареи (рейтинг ++: имел 19 РКИ со значительной защитой и пять с незначительными результатами). Напротив, L. rhamnosus GG, , еще один пробиотик, способный восстанавливать микробиоту, часто упоминается в метаанализе как обладающий значительной эффективностью при ААД.Наши результаты обновленного обзора литературы указывают на чистую слабую оценку клинической эффективности по всем показаниям болезни: AAD (оценено -: 3 РКИ имели значимые результаты, а 6 — незначительные результаты), CDI (ранжировано -: два РКИ с несущественные результаты), IBD (ранг -: одно РКИ с незначительными результатами), IBS (оценка 0: 2 РКИ со значительной эффективностью и два РКИ с незначительными результатами), TD (оценка 0: одно РКИ со значительной эффективностью и один с незначительной эффективностью), H.pylori (рейтинг -: 3 РКИ с незначительными результатами), отсутствие РКИ по БВ и лечению острой детской диареи (рейтинг ++: 10 РКИ со значительной эффективностью и одно с незначительными результатами).
Таблица 4
Сравнение способности пробиотика восстанавливать или улучшать дисбактериоз с ранжированной клинической эффективностью при различных показаниях заболевания
Испытания эффективности не проводились так часто для пробиотиков, которые, как было показано, способны только изменять или улучшать, но не восстанавливать микробиоту после дисбактериоза.Из девяти пробиотиков, которые могут изменять микробиоту, 6 (67%) имели поддерживающие РКИ по крайней мере для одного заболевания, но разнообразие исследованных заболеваний было более ограниченным. L. casei имел умеренную чистую силу для AAD и бактериального вагиноза, но был нейтральным в отношении способности уничтожить H. pylori , а другие показания к болезни не тестировались в РКИ с L. casei . Смесь пробиотиков L. reuteri и L. fermentum имеет убедительные доказательства бактериального вагиноза, но не показаний для каких-либо других заболеваний, перечисленных в таблице 4.
Из восьми пробиотиков, не способных изменять или восстанавливать нормальную микробиоту, только L. plantarum 299v имели РКИ на ААД и СРК, оба с чистой отрицательной или слабой клинической эффективностью. B. lactis и смесь L. rhamnosus и L. reuteri имели чистую нейтральную оценку эффективности для лечения острой детской диареи. Для других четырех пробиотических продуктов, не влияющих на нормальную микробиоту, не было РКИ клинической эффективности.Исследования с использованием Bacillus clausii не оценивали нормальную микробиоту и не дали значимых результатов испытаний по искоренению H. pylori и лечению диареи у детей.
Из шести пробиотиков с данными только о фармакокинетике самого пробиотика и без других исследований других нормальных штаммов микробиоты, пять имели РКИ, показывающие различную чистую эффективность при различных показаниях, как показано в таблице 4.
Шесть популярных пробиотиков ( B.clausii , B. infantis , L. reuteri , L. acidophilus + L. helveticus , L. acidophilus + L. casei и L. acidophilus + B. animalis ) имеют только РКИ клинической эффективности, но не опубликовали исследования, посвященные их роли в восстановлении или улучшении нормальной микробиоты.
Обсуждение
Разработка и оценка заявлений о полезности или функциональности пробиотиков является важной проблемой и в настоящее время определена как приоритетная для исследований несколькими международными организациями, включая Всемирную гастроэнтерологическую организацию107 и Американское общество питания.2 Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США борется с обоснованными утверждениями о пользе для здоровья пробиотических продуктов и в настоящее время рекомендует использовать утверждения о структуре / функции, такие как «поддерживает регулярность кишечника», но утверждение о восстановлении нормальной микробиоты все еще обсуждается. 108 Европейское управление по безопасности пищевых продуктов (EFSA) предоставляет руководящие материалы, которые рекомендуют, чтобы заявления о здоровье или функциональности пробиотиков имели положительный физиологический эффект и имели соответствующие научные испытания для подтверждения заявлений о пользе для здоровья.3 Приемлемые утверждения о здоровье кишечника могут включать функциональные утверждения (улучшенное время прохождения, более мягкая консистенция стула, уменьшение желудочно-кишечного дискомфорта, защита от патогенов). Поскольку в настоящее время невозможно определить стандартный профиль нормальной микробиоты, EFSA рекомендует, чтобы функциональные заявления о восстановлении нормальной микробиоты документировали восстановление здоровой микробиоты и сопровождались благоприятным физиологическим или клиническим результатом. и механизмы зависят от штамма и могут варьироваться в зависимости от штамма пробиотика, доказательства должны быть проанализированы для каждого пробиотического продукта индивидуально.5, 6, 9, 109 — 112
Недооцененным открытием было влияние дизайна исследования и исследуемых групп на интерпретацию результатов исследования. В литературе обычно встречаются пять различных типов дизайна исследований, связанных с пробиотиками. Наиболее распространенным типом исследований является рандомизированное контролируемое испытание, в котором проверяются результаты эффективности и безопасности у пациентов, но эти испытания обычно не документируют влияние пробиотика на нормальную микробиоту. Вторым наиболее распространенным типом дизайна исследования являются фармакокинетические исследования (документирование восстановления пероральной дозы пробиотика или увеличения пробиотических штаммов после лечения по сравнению с предварительной обработкой или клиренсом пробиотика).Несмотря на то, что в этих кинетических исследованиях не проводился анализ на штаммы, не являющиеся пробиотиками, некоторые экстраполировали их результаты и пришли к выводу, что их пробиотики наблюдали некоторый эффект или улучшение нормальной микробиоты.19, 111 Эти два первых типа исследований не поддерживают доказательную базу. выводы о восстановлении или изменении нормальной микробиоты и были исключены из этого обзора.
Для изучения дисбактериоза подходят три типа исследований. В первом типе исследования нормальная микробиота анализировалась как минимум дважды (на исходном уровне, то есть до воздействия разрушительного события или пробиотиков, а затем еще раз во время или после лечения пробиотиками), чтобы показать фактическое восстановление исследуемой нормальной микробиоты до здоровых исходных уровней.Второй тип дизайна исследования начался с неподходящих исходных условий (исходные образцы, взятые после того, как нормальная микробиота была нарушена хроническим заболеванием). Для пациентов с установленными хроническими заболеваниями не существует исходного уровня «нормальной микробиоты» ни в группе пробиотиков, ни в контрольной группе. Даже если исходные данные взяты во время ремиссии, на микробиоту все еще могут влиять хронические заболевания или острая диарея. Исследования пробиотиков при хронических заболеваниях или острых заболеваниях обычно сообщают о «пре-пробиотическом лечении» и «пост-пробиотическом лечении» и могут показывать значительные изменения в микробных видах, но неясно, отражает ли это истинное восстановление нормальных профилей микробиоты. .В исследование третьего типа были включены здоровые добровольцы, которым не вводили антибиотики (так что нормального нарушения микробиоты не происходило) и которые демонстрируют только влияние пробиотиков на здоровую микробиоту (обычно слабое или нулевое воздействие). Контрольные группы не требовались для нашей оценки воздействия пробиотиков на микробиоту, но контрольные группы могут задокументировать степень нарушения нормальной микробиоты провоцирующими агентами (антибиотик, начало болезни и т. Д.).
Пять пробиотиков с одним штаммом ( B.longum , Clost. butyricum , L. acidophilus, L. rhamnosus и S. boulardii ) и пять пробиотических смесей (( L. acidophilus + B. bifidum) , ( L. rhamnosus +
42 L. bifidus + L. acidophilus) , ( L. acidophilus + L. paracasei + B. lactis), (L. acidophilus , 2 штамма, B. bifidum, B. animalis) и (L . acidophilus + L. paracasei + B. bifidum + 2 штамма B.lactis )) задокументировано полное или частичное восстановление нормальной микробиоты (модель A). Только две смеси пробиотиков ((смесь 2 штаммов: L. acidophilus + B. bifidum ) и (смесь 4 штаммов: L. acidophilus , 2 штамма, B. bifidum, B. animalis )) были поддержаны подтверждающее исследование. Доказательства того, что пробиотики могут изменять или улучшать нормальную микробиоту (модель B), были обнаружены для трех пробиотиков одного штамма ( E. coli Nissle, S. boulardii и L.casei rhamnosus ) и семь смесей из 2-7 пробиотических штаммов. Из этих 10 пробиотиков, обнаруживших изменение микробиоты, только три прошли несколько испытаний: S. boulardii , смесь из четырех штаммов (2 штамма L. rhamnosus + P. freudenreichii + B. breve ) и смесь из семи штаммов. (4 лактобациллы и 3 штамма бифидобактерий), но только у одного были стабильные результаты, показывающие улучшения микробиоты.74, 75 Очевидно, что для подтверждения воздействия пробиотика на нормальную микробиоту необходимо более одного исследования.Из 19 штаммов (или смесей) пробиотиков, изученных на здоровых добровольцах, которые не подвергались воздействию разрушающих факторов (модель C), никаких изменений нормальной микробиоты не наблюдалось для 79%, что указывает на устойчивость микробиоты.
Улучшение нормальной микробиоты за счет определенных штаммов пробиотиков, по-видимому, было связано с лучшими клиническими конечными точками. В рамках восьми распространенных заболеваний, обычно лечатся пробиотиками, большее количество испытаний со значительной эффективностью было связано с пробиотическими штаммами, восстанавливающими нормальную микробиоту, и только одно испытание со значительной эффективностью было обнаружено для пробиотиков, которые не влияли на микробиоту.Однако немногие пробиотики прошли испытания на эффективность при всех восьми заболеваниях, а многие не имели испытаний на эффективность.
Некоторые пробиотики, эффективность которых при различных заболеваниях опубликована, не имели исследований, изучающих влияние пробиотика на нормальную микробиоту: B. clausii , B. infantis , L. brevis , L. reuteri , смесь двух штаммов ( L. acidophilus + L. helveticus ), смесь двух штаммов ( L. acidophilus + L.casei ) или ( L. acidophilus + B. animalis ), смесь четырех штаммов ( L. rhamnosus (два штамма), P. freudenreichii + B. animalis )) и смесь семи штаммы ( L. sporogens, L. bifidum, L. bulgaricus, L. thermophilus, L. acidophilus, L. casei, L. rhamnosus) .
Сравнение результатов с другими исследованиями
Другие обзоры в литературе заявлений о пробиотиках, связанных с изменениями в нормальной микробиоте, были сосредоточены на широких вопросах нормативной стандартизации заявлений о здоровье или функциях, использовании надлежащего дизайна исследований и проблеме определения биомаркеров «здоровой микробиоты» .3, 29, 112 Донован и др. 2 рекомендует, чтобы заявления о пользе пробиотиков для здоровья подтверждались хорошо проведенными испытаниями на людях в целевой группе населения. Эти обзоры также рекомендуют коррелировать биомаркеры кишечника с клиническими конечными точками, однако ни один из этих обзоров не пытался этого сделать.29, 112 В предыдущих обзорах не предпринимались попытки проанализировать связь между штаммами пробиотиков и их влиянием на нормальную микробиоту путем стратификации по качество дизайна исследования111. В данном обзоре эти проблемы были устранены путем анализа штаммов пробиотиков по качеству дизайна исследования и включения только испытаний, в которых оценивалась нормальная микробиота (либо с помощью микробного культивирования, либо с помощью биомаркеров молекулярных штаммов) и оценивалась степень улучшения дисбактериоза с помощью клинических данных. результаты для каждого пробиотического штамма.
Возможности для будущих исследований
В большинстве исследований (80%) с использованием модели А для документирования восстановления нормальной микробиоты использовались только методы микробиологического культивирования, которые позволяют обнаруживать только те организмы, которые растут в культуре. Использование более совершенных молекулярных метагеномных методов показало, что одно культивирование пропускает до 95% этих организмов.21, 22 Использование метагеномных методов было более распространено в исследованиях с использованием модели B (48%) и модели C (45%). ) дизайн исследования, который касается только потенциального изменения микробиоты.Характеристика микробиоты — сложный вопрос, и всесторонний учет всех бактериальных и грибковых штаммов в организме выходит за рамки наших текущих возможностей. Следовательно, любые исследования изменений микробиоты в лучшем случае неполны, но общие тенденции в бактериальных филотипах могут быть задокументированы с помощью ДНК-зондов и метагеномных методов. Ошибка дифференциального обнаружения может присутствовать из-за разнообразия анализов, используемых в этих исследованиях, и должна быть учтена в будущих исследованиях.
Еще одно предложение для будущих исследований состоит в том, чтобы включить постпробиотический период в соответствующий период наблюдения.Менее половины рассмотренных исследований проводили анализы на нормальную микробиоту в течение соответствующего периода наблюдения. Как было показано, восстановление от разрушающего фактора может быть продлено (обычно 8 недель) 7, 8, и исследования, в которых не удалось обнаружить восстановление микробиоты, могли обнаружить возврат к нормальным исходным уровням, если для восстановления было уделено достаточно долгое время. произошло. Дальнейшие исследования должны быть направлены на то, чтобы дать время для восстановления нормальной микробиоты.
Поскольку действие пробиотиков зависит от штамма, и во многих исследованиях обычно указывается только род и вид тестируемого пробиотика, будущие отчеты должны включать полное описание пробиотика до уровня окрашивания.5, 112
Сильные и слабые стороны
Сильные стороны этого обзора включали полноту стратегии поиска, которая проверяла несколько баз данных цитирования, реестры клинических испытаний и поиск авторов, использование установленных протоколов PRISMA для обзоров и использование схемы классификации результатов для различных степеней оценки восстановления микробов. Этот анализ контролировал смешанные эффекты различных исследуемых популяций и дизайнов исследований, представленных в литературе.Фармакокинетические исследования только самого пробиотического штамма (ов) были исключены, и были включены только испытания, в которых анализировались другие виды, обнаруженные в микробиоте. Применяя стандартное определение для «восстановления» и «улучшения» нормальной микробиоты, можно различать существенные различия по типу используемых дизайнов исследований и различным эффектам различных штаммов пробиотиков. Ограничения этого обзора включают: один автор проанализировал и извлек литературу, объединил испытания, проведенные в разных популяциях (взрослые и дети), а также использовались разные дозы и схемы пробиотиков.Неполный поиск всех исследований, оценивающих влияние пробиотиков на микробиоту человека, также является потенциальным ограничением любого поиска в литературе. Еще одним ограничением является то, что улучшение дисбактериоза и клиническая эффективность пробиотических штаммов также косвенно связаны, прямая причинно-следственная связь с типами проведенных исследований невозможна. Еще одним ограничением является отсутствие в настоящее время стандартного определения того, что составляет «нормальную микробиоту». Состав микробиоты зависит от человека, возраста, географического положения и состояния здоровья хозяина.Современные микробиологические методы улучшаются, но не могут обнаружить все виды, присутствующие в организме хозяина.
✿ «Линекс»: инструкция по применению — 【Фармацевтика】
«Линекс» — препарат, содержащий пробиотические микроорганизмы, вырабатывающие молочную кислоту. Воздействуя на кишечную флору, они улучшают процессы пищеварения и устраняют такие неприятные симптомы, как тошнота, изжога, боли в животе.
Показания к применению «Линекс»
Основным показанием к назначению «Линекса» является дисбактериоз микрофлоры кишечника.Может проявляться такими симптомами, как:
— диарея;
— запор;
— метеоризм;
— расстройство желудка;
— тошнота;
— рвота;
— отрыжка;
— боль в животе;
— сухость кожи и сыпь, похожая на аллергическую (встречается преимущественно у детей).
Дисбактериоз кишечника может возникнуть в результате неправильного или неполноценного питания, изменения климата, снижения иммунитета, приема некоторых лекарств (антибиотиков, цитостатиков и т. Д.), А также после перенесенной кишечной инфекции.Согласно инструкции, «Линекс» можно принимать не только в активной фазе дисбактериоза, но и в профилактических целях.
Чем раньше начато профилактическое лечение Линексом, тем выше вероятность предотвращения дисбактериоза кишечника.
Режим и дозировка «Линекс»
«Линекс» выпускается в виде непрозрачных капсул, внутри которых находится белый порошок. При лечении дисбактериоза у новорожденных и у детей, которые не могут самостоятельно проглотить капсулу, порошок следует насыпать ложкой и смешать с водой, чаем или любой другой жидкостью.
Принимать «Линекс» лучше через 15-20 минут после еды. Капсулу запивать небольшим количеством жидкости.
Детям до двух лет необходимо принимать содержимое одной капсулы Линекса трижды в день. Детям в возрасте от 2 до 12 лет терапевтическая доза может быть увеличена вдвое. Если лекарство прописано для профилактики дисбактериоза, хватит одной капсулы трижды в день. Подростки, достигшие 12-летнего возраста, а также взрослые должны выпивать по 2 капсулы Линекса за раз. Кратность приема по-прежнему трехразовая.
Как правило, «Линекс» хорошо сочетается с другими препаратами и не имеет побочных эффектов даже при длительном применении. Именно поэтому его смело можно назначать при беременности и кормлении грудью.
Судя по отзывам, улучшение от применения «Линекса» наступает уже через 3-4 дня после начала приема препарата, но для закрепления эффекта лечение следует продолжить как минимум еще неделю.
Как и все препараты, покупать «Линекс» следует только в проверенных аптеках. Цена на препарат колеблется в пределах 200-300 рублей за 16 капсул.При необходимости длительного лечения выгоднее покупать большую упаковку, в которой содержится не 16, а 32 или 48 капсул.
Статья по теме
Как выбрать недорогой аналог «Линекс»
Дисбактериоз — MEpedia
Дисбиоз — это дисбаланс микробной экологии части тела, обычно кишечника.
Психологический стресс [править | править источник]
Психологический стресс может изменить микробиоту кишечника, уменьшая количество бифидобактерий и лактобацилл.
Инфекция [править | править источник]
Имеются убедительные доказательства того, что дисбактериоз или дисбаланс микробной экологии кишечника играет роль в симптомах ME / CFS. В среднем у пациентов с ME / CFS более низкие уровни Bifidobacteria , Escherichia coli и более высокие уровни аэробных бактерий [1] , в частности Enterococcus и Streptococcus видов. [2] Последние продуцируют D-лактат, форму молочной кислоты, вырабатываемой только нечеловеческими клетками, которая плохо метаболизируется у человека.D-лактат связан с широким спектром когнитивных и неврологических симптомов, например, у пациентов, страдающих D-лактоацидозом. Исследование показало, что более высокие уровни бактерий энтерококка у пациентов с CFS были связаны с более серьезной неврологической и когнитивной дисфункцией [3] .
Пациенты с CFS могут чаще страдать от избыточного бактериального роста в тонком кишечнике (SIBO). [необходима ссылка ]
Одним из предполагаемых последствий дизобиоза является избыточное производство сероводорода (h3S) патогенными бактериями.h3S может подавлять митохондриальное дыхание, блокируя цитохром с оксидазу. [необходима ссылка ]
Исследование норвежских и бельгийских пациентов обнаружило значительно уменьшенные пропорции Firmicutes родов Holdemania и увеличенные доли bacteroidetes родов Alistipes в норвежской, но не бельгийской выборке. У обоих было обнаружено значительно увеличенное количество Firmicutes родов Lactonifactor . [4]
- ↑ Синдром хронической усталости: молочнокислые бактерии могут иметь терапевтическое значение
- ↑ Шиди, Джон Р.; Веттенхолл, Ричард Э.Х .; Скэнлон, Денис; Гули, Пол Р; Льюис, Дональд П.; МакГрегор, Нил; Стэплтон, Дэвид I; Батт, Генри Л; Де Мейрлейр, Кенни Л. (июль 2009 г.), «Повышенное содержание d-молочнокислых кишечных бактерий у пациентов с синдромом хронической усталости», In Vivo , 23 (4): 621–628, PMID 19567398
- ↑ Ринг, Дженни, изд.(2002). Миалгическая энцефалопатия — синдром хронической усталости: практические врачи — проблема информированного точного диагноза: материалы международного клинического и научного совещания, Сидней, Австралия, 1-2 декабря 2001 г. . Боурал, Австралия: Мемориальный фонд Элисон Хантер. ISBN 9780958186506 . OCLC 52595685.
- ↑ Фремонт, Марк; Куманс, Дэнни; Массарт, Себастьян; Де Мейрлейр, Кенни (август 2013 г.). «Высокопроизводительное секвенирование гена 16S рРНК выявляет изменения кишечной микробиоты у пациентов с миалгическим энцефаломиелитом / синдромом хронической усталости». Анаэроб . 22 : 50–56. DOI: 10.1016 / j.anaerobe.2013.06.002.
Информация, представленная на этом сайте, не предназначена для диагностики или лечения каких-либо заболеваний.

 Nat Rev Microbiol 2008; 6:339.
Nat Rev Microbiol 2008; 6:339.