Влияние алкоголя на печень: можно ли употреблять алкоголь и не ухудшать состояние печени?
Каждый должен знать, что любой алкогольный напиток, независимо от его крепости, оказывает негативное влияние на печень. Но есть ли разница в последствиях употребления разных видов алкоголя? Полезны ли вино и коньяк? Все это и многое другое мы рассмотрим в этой статье.
Здоровая печень и прием алкоголя: совместимы ли эти понятия?
Печень человека выполняет свыше 500 различных функций в организме. Она синтезирует незаменимые вещества, жизненно важные для организма, и вырабатывает желчь, без которой пищеварение станет невозможным. Алкоголь действует разрушительно на клетки печени, нарушая выполнение ею своих функций, что негативно сказывается на всем организме. Поэтому алкоголь и здоровая печень несовместимы, это доказанный факт.
Механизм воздействия алкоголя на клетки печени
Этиловый спирт, являющийся в быту универсальным растворителем, для организма человека — токсическое вещество. Попадая в печень, которая ответственна за его переработку, этанол претерпевает ряд превращений и продукты его переработки бомбардируют клетки, разрушая их стенки, отвечающие за пропуск в здоровую клетку только полезных для нее веществ.2 В итоге, функция мембран нарушается и в здоровую клетку проникают яды и токсины, способные как повредить, так и полностью убить ее.
Попадая в печень, которая ответственна за его переработку, этанол претерпевает ряд превращений и продукты его переработки бомбардируют клетки, разрушая их стенки, отвечающие за пропуск в здоровую клетку только полезных для нее веществ.2 В итоге, функция мембран нарушается и в здоровую клетку проникают яды и токсины, способные как повредить, так и полностью убить ее.
Признаки заболеваний печени, вызванных алкоголем
Регулярное употребление алкоголя через некоторое время приводит к хронической алкогольной болезни печени, последней стадией которой является цирроз печени. Начальные стадии алкогольного гепатита проходят незаметно, и только при обследовании у врача можно зарегистрировать начинающееся повреждение клеток печени, которое ещё может быть обратимым. К первым признакам заболевания печени относятся:
– увеличение среднего объёма клеток крови;
– повышение уровня глутамилтранспептидазы в крови;
– повышение уровня глутаминовой оксалоуксусной трансаминазы;
– повышение глутаминовой пируваттрансаминазы;
– снижение уровня альбумина;
– удлинение протромбинового времени;
– увеличение уровня билирубина;
– тромбоцитопения (снижение количества тромбоцитов в крови).
Все эти симптомы будут проявляться на фоне быстрой утомляемости, сонливости и слабости.
Не откладывайте визит к врачу, потому что:
1. Воспалительное заболевание печени развивается около 3-5 лет.
2. Своевременная диагностика дает шанс на полное выздоровление.
3. Без лечения и смены образа жизни воспаление может перейти в стадию цирроза печени.
Откладывание визита к врачу приводит к печальным последствиям: у 3-10% лиц с алкогольной болезнью печени, постоянно употребляющих спиртное, развивается рак печени.
Симптомы цирроза печени:
– Живот увеличивается, а масса тела резко падает.
– Кожа теряет эластичность, становится сухой, могут появляться раздражения.
– Синяки на теле появляются даже от легкого нажатия.
– Кости становятся хрупкими, возможны частые переломы, при этом любые раны плохо заживают.
– Человек испытывает постоянные боли в мышцах.
– Человека преследует горькая отрыжка.
– Моча темнее, цвет и консистенция кала изменяются.
К таким последствиям могут привести любые дозы даже слабоалкогольных напитков.
Укоренившиеся мифы и их разоблачение
– Вино менее вредно для печени, чем водка или коньяк
Надо понимать, что безопасного для здоровья алкоголя не существует. Однако если говорить о спиртном, наносящем меньший вред здоровью печени, то вопрос не в типе напитка, а в его качестве. Например, дорогой коньяк может вызвать меньшие последствия, чем дешевое, плохо очищенное вино. Также стоит помнить и о количестве принятого спиртного в пересчёте на этанол.
– Пиво вредно только подросткам
Пиво содержит в себе не только этиловый спирт, но и фитоэстрогены — гормоны растительного происхождения, в огромном количестве содержащиеся в хмеле – неизменной составляющей пива, из-за чего в первую очередь может пострадать еще несформированная половая система. Поэтому, пиво особенно опасно подросткам, половая система которых находится в стадии формирования. Но вредно пиво для всех возрастов.
Но вредно пиво для всех возрастов.
– Польза коньяка превышает его вред для здоровья
Иногда можно услышать, что коньяк нормализует давление или лечит варикозное расширение вен, однако, из-за высокого содержания в нем этилового спирта, его негативное воздействие на печень уничтожает любую минимальную пользу от его приема.
Если, несмотря на все аргументы, полностью отказываться от спиртного Вы не собираетесь, постарайтесь уменьшить дозы принимаемого алкоголя и более тщательно подходить к его выбору. При употреблении спиртных напитков на регулярной основе, хотя бы 2-3 раза в месяц, необходимо не реже раза в год проходить обследование у врача для проверки функции печени.
Список литературы
1. Шифф, Ю. Р. Болезни печени по Шиффу. Алкогольные, лекарственные, генетические и метаболические заболевания / Юджин Р. Шифф, Майкл Ф. Соррел, Уиллис С. Мэддрей; пер. с англ. под ред. Н. А. Мухина [и др.]. – Москва : ГЭОТАР-Медиа, 2011. – 476 с.
– 476 с.
2. Костюкевич О. И. Алкогольное поражение печени: социальное звучание, клинические последствия и аспекты патогенетической терапии // Приложение РМЖ «Болезни Органов Пищеварения» №2 от 11.09.2007. – стр. 62.
3. Блум, С. Справочник по гастроэнтерологии и гепатологии / Стюарт Блум, Джорж Вебстер ; пер. с англ. под ред. В. Т. Ивашкина, И. В. Маева, А. С. Трухманова. – Москва : ГЭОТАР-Медиа, 2010. – 581 с.
4. Внутренние болезни по Дэвидсону. Гастроэнтерология. Гепатология / под ред. Николаса А.Буна, Ники Р. Колледжаи [и др.]; пер. с англ. под ред. В.Т. Ивашкина. – Москва : Рид Элсивер, 2009. – 192 с.
5. Наиболее распространенные заболевания желудочно-кишечного тракта и печени : справочник для практикующих врачей / В. Т. Ивашкин [и др.]; под общ. ред. В. Т. Ивашкина. – Москва : ГЭОТАР-Медиа, 2008. – 170 с.
Cоавтор, редактор и медицинский эксперт:
Шимбарецкий Георгий Алексеевич
Родился 23. 06.1984.
06.1984.
Образование:
2007 г. — Нижегородская государственная медицинская академия.
2009 г. — Закончил ординатуру по специальности «Организация здравоохранения» и «Общественное здоровье».
Лучевая диагностика болезней органов брюшной полости
В.Е. Синицын
МЕТОДЫ ДИАГНОСТИКИ
Современная лучевая диагностика болезней органов брюшной полости совершенно не похожа на рентгенологию пищеварительного канала 40-70-х годов ХХ века. На протяжении десятилетий для исследований этой анатомической зоны использовались лишь обзорные снимки, контрастирование барием желудка и кишки и холецистография. Возможности оценки печени, поджелудочной железы и желчных протоков, внеорганных опухолей были ограниченными и основывались, в основном, на косвенных признаках. По мере развития эндоскопии частота использования рентгеновских методов для исследований пищевода, желудка и толстой кишки стала уменьшаться. С другой стороны, рентгеноскопия и рентгенография органов пищеварительного канала остаются важнейшими методами комплексного исследования этих органов. Такие методы, как пероральная или внутривенная холецистография, а также диагностический ретроперитонеум, практически вышли из употребления.
С другой стороны, рентгеноскопия и рентгенография органов пищеварительного канала остаются важнейшими методами комплексного исследования этих органов. Такие методы, как пероральная или внутривенная холецистография, а также диагностический ретроперитонеум, практически вышли из употребления.
Неизбежный технический прогресс техники, изменения в организации медицины и быстрое накопление научных данных неузнаваемо изменили абдоминальную радиологию. В первую очередь, это касается исследования паренхиматозных органов брюшной полости, где ведущую роль на сегодняшний день занимают ультразвуковое исследование (УЗИ), компьютерная томография (КТ) и реже – магнитно-резонансная томография (МРТ).
УЗИ стал основным, стандартным методом исследования всех паренхиматозных органов брюшной полости. Фазированные датчики и ложные микропроцессорные системы предоставили возможность существенно улучшить качество изображений и уменьшить выраженность артефактов. Цветовое доплеровское исследование является стандартным методом изучения сосудов органов брюшной полости и исследования васкуляризации выявленных патологических образований и структур. Появились методики трехмерного УЗИ. Применение эндоскопических датчиков для внутриполостных исследований существенно расширяет возможности этого метода в сложных случаях. Исследуются контрастные средства для УЗИ, предназначенные для изучения перфузии и выявления очаговых поражений печени.
Цветовое доплеровское исследование является стандартным методом изучения сосудов органов брюшной полости и исследования васкуляризации выявленных патологических образований и структур. Появились методики трехмерного УЗИ. Применение эндоскопических датчиков для внутриполостных исследований существенно расширяет возможности этого метода в сложных случаях. Исследуются контрастные средства для УЗИ, предназначенные для изучения перфузии и выявления очаговых поражений печени.
Другой базовый метод исследований органов брюшной полости – КТ – также претерпел огромные изменения. До 1989 г. она была «шаговой» – стол перемещался ступенями, соответственно толщине среза, что ограничивало ее временное и пространственное разрешение и, соответственно, диагностическую информативность.
После появления спиральной КТ (СКТ) в 1989 г. метод стал объемным. При СКТ постоянно включенная рентгеновская трубка вращается вокруг непрерывно движущегося стола. Соответственно этому существенно возросло пространственное и временное разрешение метода, уменьшился риск пропустить мелкие патологические очаги. Метод стал стандартизованным. Следующим шагом (1999 г.) стало появление мультиспиральной КТ (МСКТ). Системы МСКТ первого поколения могли выполнять одновременно 4 среза толщиной от 0,5 мм за один оборот трубки (длительность его удалось сократить до 0,5 с). В настоящее время основной парк МСКТ составляют приборы с 16-64 рядами детекторов, у которых время оборота трубки составляет всего 320-350 мс, а толщина среза – 0,5 с. В 2008 г. появились приборы с 256 и 320 рядами детекторов. В настоящее время все новые системы КТ являются мультиспиральными. Благодаря техническому прогрессу, КТ стала применяться в областях, ранее недоступных для нее. Появилась КТ-ангиография, метод стал использоваться для визуализации полых органов. Были созданы методики КТ-колонографии и гастрографии. Было доказано, что диагностическая эффективность КТ-колоноскопии сопоставимо с таковой традиционной фиброволоконной колоноскопии. Учитывая быстроту выполнения и необременительность КТ-колонографии пациентов, обсуждается целесообразность применения этого метода для скрининга рака толстой кишки.
Метод стал стандартизованным. Следующим шагом (1999 г.) стало появление мультиспиральной КТ (МСКТ). Системы МСКТ первого поколения могли выполнять одновременно 4 среза толщиной от 0,5 мм за один оборот трубки (длительность его удалось сократить до 0,5 с). В настоящее время основной парк МСКТ составляют приборы с 16-64 рядами детекторов, у которых время оборота трубки составляет всего 320-350 мс, а толщина среза – 0,5 с. В 2008 г. появились приборы с 256 и 320 рядами детекторов. В настоящее время все новые системы КТ являются мультиспиральными. Благодаря техническому прогрессу, КТ стала применяться в областях, ранее недоступных для нее. Появилась КТ-ангиография, метод стал использоваться для визуализации полых органов. Были созданы методики КТ-колонографии и гастрографии. Было доказано, что диагностическая эффективность КТ-колоноскопии сопоставимо с таковой традиционной фиброволоконной колоноскопии. Учитывая быстроту выполнения и необременительность КТ-колонографии пациентов, обсуждается целесообразность применения этого метода для скрининга рака толстой кишки.
Однако наиболее распространенным является применение КТ для диагностики и дифференциальной диагностики очаговых поражений печени и поджелудочной железы. Стандартным является выполнение КТ с болюсным введением 100-140 мл контрастного средства. Многофазное исследование в различные фазы контрастирования (из которых важнейшими являются артериальная и портально-венозная) позволяет выявлять и характеризовать очаговые поражения печени и поджелудочной железы, планировать лечение и оценивать его результаты. С помощью МСКТ можно с высокой точностью визуализировать артерии и вены органов брюшной полости, а также желчные протоки.
Благодаря быстроте и надежности МСКТ все чаще используется при обследовании пациентов с диагнозом «острый живот» (выявление перфорации полых органов, кровотечений, кишечной непроходимости, мезентериальной ишемии, острого аппанедицита, панкреатита, холецистита и другой патологии).
МРТ реже используется в исследованиях органов брюшной полости, чем УЗИ и МСКТ, – в первую очередь, по экономическим соображениям. Тем не менее, при правильно выбранных показаниях она дает важную диагностическую информацию. Одной из важнейших областей применения МРТ являются исследования печени. Благодаря мультипараметрическому характеру МР-изображений, возможности получения серий срезов с варьирующими параметрами, подчеркивающих контрастность по параметрам магнитной релаксации (Т1, Т2), подавлению сигнала от жира, хорошей визуализации артерий и вен без контрастирования, МРТ стала важнейшим методом выявления очаговых поражений печени. Методика МР-холангиографии позволяет видеть вне- и внутрипеченочные желчные протоки неинвазивно, не прибегая к искусственному контрастированию. Эта методика основывается на усилении сигнала от неподвижной жидкости (желчь) и подавлению сигнала от плотных тканей и крови. При раздутии очищенных от внутрикишечного содержимого петель толстой кишки воздухом или специальными жидкостями возможно выполнение методики МР-энтерографии или колонографии. Использование контрастных препаратов на основе гадолиния («Магневист», «Гадовист», «Омнискан», «Оптимарк» и пр.
Тем не менее, при правильно выбранных показаниях она дает важную диагностическую информацию. Одной из важнейших областей применения МРТ являются исследования печени. Благодаря мультипараметрическому характеру МР-изображений, возможности получения серий срезов с варьирующими параметрами, подчеркивающих контрастность по параметрам магнитной релаксации (Т1, Т2), подавлению сигнала от жира, хорошей визуализации артерий и вен без контрастирования, МРТ стала важнейшим методом выявления очаговых поражений печени. Методика МР-холангиографии позволяет видеть вне- и внутрипеченочные желчные протоки неинвазивно, не прибегая к искусственному контрастированию. Эта методика основывается на усилении сигнала от неподвижной жидкости (желчь) и подавлению сигнала от плотных тканей и крови. При раздутии очищенных от внутрикишечного содержимого петель толстой кишки воздухом или специальными жидкостями возможно выполнение методики МР-энтерографии или колонографии. Использование контрастных препаратов на основе гадолиния («Магневист», «Гадовист», «Омнискан», «Оптимарк» и пр. ) еще более расширяет возможности метода. Относительно недавно появился новый класс контрастных средств для МРТ – гепатотропные (орган-специфические) агенты, такие как «Примовист», «Тесласкан» и ряд других. Эти препараты обладают двойным механизмом действия, позволяя характеризовать как васкуляризацию, так и клеточный состав изучаемых внутрипеченочных структур.
) еще более расширяет возможности метода. Относительно недавно появился новый класс контрастных средств для МРТ – гепатотропные (орган-специфические) агенты, такие как «Примовист», «Тесласкан» и ряд других. Эти препараты обладают двойным механизмом действия, позволяя характеризовать как васкуляризацию, так и клеточный состав изучаемых внутрипеченочных структур.
УЗИ, МСКТ и МРТ используются, как уже говорилось, и для изучения структур пищеварительного канала. В качестве примера следует упомянуть эндоскопическое УЗИ (исследования прямой кишки, пищевода, головки поджелудочной железы), КТ- и МРТ-колонографию, гастро- и энтерографию.
Область использования радионуклидных методов в абдоминальной радиологии существенно сократилась. Они утратили свое значение в качестве методик изучения анатомии внутренних органов. Основная роль радионуклидных методов (в первую очередь – позитрон-эмиссионной томографии /ПЭТ/) в абдоминальной радиологии – стадирование опухолей, выявление метастатических поражений (прежде всего – печени). Реже радионуклидные методы применяют для выявления скрытых (оккультных) кровотечений из ЖКТ и изучения функции печени.
Реже радионуклидные методы применяют для выявления скрытых (оккультных) кровотечений из ЖКТ и изучения функции печени.
Ангиографические методы, в связи с развитием УЗИ, МСКТ и МРТ, в значительной степени утратили свое диагностическое значение. Сейчас они преимущественно используются для планирования и проведения интервенционных вмешательств на полых и паренхиматозных органах (стентирование, остановка кровотечений, хемоэмболизация и пр.).
Основные области использования лучевых методов диагностики болезней органов брюшной полости представлены в таблице 1.
Таблица 1. Методы исследования органов брюшной полости
| Исследуемый орган | Метод | Цель исследования |
|---|---|---|
| Органы брюшной полости | Обзорный снимок брюшной полости | Обследование пациентов с «острым животом», диагностика кишечной непроходимости, перфорации полых органов, выявление рентгенопозитивных конкрементов |
| Пищевод | Рентгенография/рентгеноскопия пищевода | Выявление грыж пищеводного отверстия диафрагмы, дивертикулов, стриктур, обтураций, варикозного расширения вен, опухолей, инородных тел |
| Желудок и 12-перстная кишка | Рентгенография/рентгеноскопия по обычной методике Рентгенография/рентгеноскопия двойным контрастированием | Диагностика язв, опухолей, стриктур, обтураций, синдрома нарушенного всасывания, контроль результатов операции |
| 12-перстная кишка | Релаксационная дуоденография | Диагностика опухолей головки поджелудочной железы, Фатерова соска, болезней 12-перстной кишки |
| Тонкая кишка | Пассаж бария (пероральное контрастирование) Энтероклизма (чреззондовое введение контрастного вещества) | Диагностика проходимости кишки, выявление причин стриктур, обструкции, опухолей, воспалительных заболеваний |
| Толстая кишка | Ирриогоскопия (ретроградное контрастирование) Двойное контрастирование КТ-колоноскопия МР-колоноскопия Эндоскопическое УЗИ | Диагностика опухолей, воспалительных заболеваний, дивертикулов, выявление причин кишечной непроходимости |
| Желчный пузырь и протоки | Ретроградная панкреатохолангиография Прямая (пункционная) холангиография УЗИ, КТ, МРТ МР-холангиография | Оценка состояния внепеченочных и внутрипеченочных желчных протоков (конкременты, стриктуры, опухоли), диагностика опухолей головки поджелудочной железы, Фатерова соска, воспалительных и опухолевых заболеваний |
| Печень | УЗИ КТ МРТ ПЭТ | Диагностика и дифференциальная диагностика очаговых поражений печени, диффузных болезней, травм |
| Поджелудочная железа | УЗИ Эндоскопическое УЗИ КТ МРТ | Воспалительные заболевания, конкременты, опухоли, травмы, аномалии развития |
ЧАСТНАЯ ПАТОЛОГИЯ
Пищевод
Для исследования пищевода традиционно используется рентгенологическое исследование с барием (рис. 1). Процесс прохождения глотков бариевой взвеси (или специального бариевого препарата) регистрируют с помощью флюороскопии в реальном масштабе времени. Частое показание к рентгенологическому исследованию пищевода – диагностика желудочно-пищеводного рефлюкса. Он проявляется обратным забросом бариевой взвеси из желудка в пищевод при исследовании в горизонтальном положении или в положении Тренделенбурга. В случае обструкции пищевода инородным телом рентгенологическое исследование позволяет немедленно установить его уровень и выраженность. С помощью этого метода хорошо видны участки расширения и сужения пищевода при доброкачественных стриктурах (рубцовых, ахалазии). Для ахалазии характерно расширение проксимальной части пищевода и сужение его дистального отдела в форме «клюва». При опухолях пищевода (доброкачественных и злокачественных) виден дефект наполнения пищевода. Характерным признаком злокачественных образований (рака) является изъязвление слизистой и изменение ее рентгенологического рисунка, ригидность стенок пищевода, неровные контуры опухоли (рис.
1). Процесс прохождения глотков бариевой взвеси (или специального бариевого препарата) регистрируют с помощью флюороскопии в реальном масштабе времени. Частое показание к рентгенологическому исследованию пищевода – диагностика желудочно-пищеводного рефлюкса. Он проявляется обратным забросом бариевой взвеси из желудка в пищевод при исследовании в горизонтальном положении или в положении Тренделенбурга. В случае обструкции пищевода инородным телом рентгенологическое исследование позволяет немедленно установить его уровень и выраженность. С помощью этого метода хорошо видны участки расширения и сужения пищевода при доброкачественных стриктурах (рубцовых, ахалазии). Для ахалазии характерно расширение проксимальной части пищевода и сужение его дистального отдела в форме «клюва». При опухолях пищевода (доброкачественных и злокачественных) виден дефект наполнения пищевода. Характерным признаком злокачественных образований (рака) является изъязвление слизистой и изменение ее рентгенологического рисунка, ригидность стенок пищевода, неровные контуры опухоли (рис. 2). Различные виды патологии пищевода (грыжи пищеводного отверстия диафрагмы, опухоли, расширения) хорошо выявляются с помощью КТ или МРТ. КТ позволяет хорошо выявлять распространение опухолей за пределы пищевода. Для детальной оценки стенок пищевода иногда используют эндоскопическое УЗИ.
2). Различные виды патологии пищевода (грыжи пищеводного отверстия диафрагмы, опухоли, расширения) хорошо выявляются с помощью КТ или МРТ. КТ позволяет хорошо выявлять распространение опухолей за пределы пищевода. Для детальной оценки стенок пищевода иногда используют эндоскопическое УЗИ.
У пациентов с циррозом печени рентгенографию пищевода назначают для обнаружения варикозно-расширенных вен. С целью уточнения нарушения моторики пищевода иногда назначается манометрия нижнего пищеводного сфинктера с измерением силы и длительности перистальтических сокращений.
Желудок и 12-перстная кишка
Как уже говорилось, из-за более высокой информативности эндоскопические методы несколько потеснили рентгенологические при диагностике болезней желудка и 12-перстной кишки. В то же время существенно, что рентгеноскопия желудка дает цельную картину об анатомии и функции исследуемых органов (рис.3). Это особенно важно при выявлении диффузно растущих опухолей, оценке степени рубцовых поражений стенок, нарушений эвакуации содержимого.![]() По этой причине рентгеноскопия и рентгенография желудка и 12-перстной кишки входят в большинство стандартных схем обследования пациентов с болезнями этих органов.
По этой причине рентгеноскопия и рентгенография желудка и 12-перстной кишки входят в большинство стандартных схем обследования пациентов с болезнями этих органов.
При диагностике гастритов данные рентгенографии неспецифичны и лишь в случае гипертрофического или склерозирующего (ригидного) гастрита можно увидеть грубые изменения рисунка слизистой (гипертрофия или сглаживание, ригидность стенок).
Классическим показанием к рентгенологическому исследованию желудка является диагностика язв желудка и 12-перстной кишки. Язвы желудка чаще всего локализуются на малой кривизне, а 12-перстной кишки – в области ее луковицы. Однако возможна любая локализация язв. Наиболее надежными рентгенологическими симптомами язв являются симптомы «ниши» и «кратера», локальные изменения рисунка слизистой, отек и ригидность стенки в месте локализации язвы (рис.4, рис.5). Рентгенография хорошо выявляет последствия язвенной болезни – участки рубцовой деформации желудка и 12-перстной кишки. Иногда язвы могут осложняться пенетрацией в окружающие органы (поджелудочную железу, печеночно-дуоденальную связку, сальник, печень и желчные пути), а также в брюшную полость. В этом случае при обзорной рентгенографии или при выполнении снимка на правом боку (латерография) выявляется свободный воздух в брюшной полости, указывающий на перфорацию полого органа. Следует заметить, что при подозрении на перфорацию одного из органов пищеварительного канала противопоказан прием бария. Для контрастирования органов пищеварительного канала в этом случае используют водорастворимые йодсодержащие контрастные вещества. Диагностика перфораций и сопутствующих им осложнений возможна также с помощью УЗИ и КТ.
Иногда язвы могут осложняться пенетрацией в окружающие органы (поджелудочную железу, печеночно-дуоденальную связку, сальник, печень и желчные пути), а также в брюшную полость. В этом случае при обзорной рентгенографии или при выполнении снимка на правом боку (латерография) выявляется свободный воздух в брюшной полости, указывающий на перфорацию полого органа. Следует заметить, что при подозрении на перфорацию одного из органов пищеварительного канала противопоказан прием бария. Для контрастирования органов пищеварительного канала в этом случае используют водорастворимые йодсодержащие контрастные вещества. Диагностика перфораций и сопутствующих им осложнений возможна также с помощью УЗИ и КТ.
Рентгенография и рентгеноскопия остаются важными методами диагностики доброкачественных и злокачественных опухолей желудка. Их дифференциальная диагностика основывается на анализе контуров опухоли, характера изменений складок желудка и локальной ригидности его стенок (рис.6). Во всех случаях при выявлении опухоли при рентгенологическом исследовании желудка и 12-перстной кишки назначается эндоскопия с биопсией. В настоящее время все чаще и чаще опухоли желудка впервые выявляют при проведении КТ органов брюшной полости (рис.7) (чаще всего как случайную находку), после чего пациентов направляют на специализированное исследование. УЗИ и МСКТ широко используются для оценки локальной инвазии злокачественных опухолей (прорастание стенки желудка и окружающих структур) и выявления локальных и удаленных метастазов.
Во всех случаях при выявлении опухоли при рентгенологическом исследовании желудка и 12-перстной кишки назначается эндоскопия с биопсией. В настоящее время все чаще и чаще опухоли желудка впервые выявляют при проведении КТ органов брюшной полости (рис.7) (чаще всего как случайную находку), после чего пациентов направляют на специализированное исследование. УЗИ и МСКТ широко используются для оценки локальной инвазии злокачественных опухолей (прорастание стенки желудка и окружающих структур) и выявления локальных и удаленных метастазов.
Тонкая кишка
Как уже упоминалось, для исследований тонкой кишки используют оценку пассажа по ней бариевой взвеси или водорастворимого контрастного средства, а также чреззондовую энтерографию. В последнее время большое внимание привлекли такие методики, как КТ- или МР-энтерография, при которых возможно построение трехмерных изображений органа и построение изображений просвета кишки в эндоскопическом режиме. Опухоли тонкой кишки, по сравнению с выше- и нижележащими отделами пищеварительного канала, встречаются редко. При лучевом исследовании этого органа частым показанием к исследованию является диагностика тонкокишечной непроходимости и выяснение ее причины, выявление локальных воспалительных поражений (чаще всего – терминального отдела при болезни Крона), обследование пациентов с синдромом «острого живота». При подозрении на острую тонкокишечную непроходимость выполняют обзорный снимок брюшной полости (рис.9), еще более информативным в выявлении обструкции и диагностике ее причины назначают КТ или УЗИ. Использование МР- или КТ-энтерографии при болезни Крона позволяет получить информацию, зачастую недоступную для эндоскопического исследования. Так, эти методы дают возможность видеть не только утолщенные, изъязвленные участки стенки подвздошной кишки, но и инфильтрацию окружающей клетчатки, локальное расширение сосудов брыжейки, увеличение региональных лимфатических узлов.
При лучевом исследовании этого органа частым показанием к исследованию является диагностика тонкокишечной непроходимости и выяснение ее причины, выявление локальных воспалительных поражений (чаще всего – терминального отдела при болезни Крона), обследование пациентов с синдромом «острого живота». При подозрении на острую тонкокишечную непроходимость выполняют обзорный снимок брюшной полости (рис.9), еще более информативным в выявлении обструкции и диагностике ее причины назначают КТ или УЗИ. Использование МР- или КТ-энтерографии при болезни Крона позволяет получить информацию, зачастую недоступную для эндоскопического исследования. Так, эти методы дают возможность видеть не только утолщенные, изъязвленные участки стенки подвздошной кишки, но и инфильтрацию окружающей клетчатки, локальное расширение сосудов брыжейки, увеличение региональных лимфатических узлов.
Толстая кишка
Ирригоскопия по-прежнему является одним из важнейших методов исследования всех отделов толстой кишки. Она дополняет данные колоноскопии и позволяет получить более полную информацию о состоянии органа (рис.10). Одно из самых частых показаний к ирригоскопии – диагностика рака толстой кишки, полипов и дивертикулов. При ирригоскопии рак толстой кишки виден как дефект наполнения с четкой границей между неизмененной слизистой оболочкой и опухолью; выявляются признаки ригидности кишечной стенки. Нередко участок опухолевого поражения вызывает циркулярное сужение просвета кишки (симптом «яблочного огрызка»). Рентгенологические проявления рака толстой кишки зависят от гистологической формы опухоли, локализации и степени ее распространения. МСКТ и в особенности методика КТ-колонографии могут служить альтернативой ирригоскопии в скрининге и диагностике рака толстой кишки. КТ позволяет лучше видеть изменения кишечной стенки и стадировать заболевание (рис.12). Для диагностики ранних стадий рака прямой и сигмовидной кишки стало применяться и трансректальное УЗИ.
Она дополняет данные колоноскопии и позволяет получить более полную информацию о состоянии органа (рис.10). Одно из самых частых показаний к ирригоскопии – диагностика рака толстой кишки, полипов и дивертикулов. При ирригоскопии рак толстой кишки виден как дефект наполнения с четкой границей между неизмененной слизистой оболочкой и опухолью; выявляются признаки ригидности кишечной стенки. Нередко участок опухолевого поражения вызывает циркулярное сужение просвета кишки (симптом «яблочного огрызка»). Рентгенологические проявления рака толстой кишки зависят от гистологической формы опухоли, локализации и степени ее распространения. МСКТ и в особенности методика КТ-колонографии могут служить альтернативой ирригоскопии в скрининге и диагностике рака толстой кишки. КТ позволяет лучше видеть изменения кишечной стенки и стадировать заболевание (рис.12). Для диагностики ранних стадий рака прямой и сигмовидной кишки стало применяться и трансректальное УЗИ.
Помимо злокачественных опухолей, рентгенологические исследования толстой кишки позволяют выявить воспалительные заболевания толстой кишки (дивертикулит (рис. 13), язвенный или гранулематозный колит), врожденные аномалии развития (болезнь Гиршпрунга, мегаколон), нарушения мезентериального кровообращения.
13), язвенный или гранулематозный колит), врожденные аномалии развития (болезнь Гиршпрунга, мегаколон), нарушения мезентериального кровообращения.
Обзорный снимок брюшной полости, УЗИ и КТ позволяют выяснить причину острого живота и кишечной непроходимости. Одной из самых частых причин синдрома «острого живота» при локализации боли в правом нижнем квадранте является аппендицит. КТ и УЗИ (рис.14) обеспечивают визуализацию воспаленного и увеличенного червеобразного отростка, своевременную диагностику осложнений (развитие инфильтратов, абсцедирования, перфорации). Эти два метода незаменимы и для диагностики других причин «острого живота» (обструкция мочеточника камнем, острый панкреатит, острый холецистит, панкреатит, перфорация полого органа и другой патологии).
Та же тенденция прослеживается и в диагностике кишечной непроходимости. Чаще всего встречается механическая кишечная непроходимость, вызванная опухолями, спайками, инвагинациями, грыжами, желчными и каловыми камнями. При развитии кишечной непроходимости развивается пневматоз кишечника, по мере ее прогрессирования в петли кишечника жидкостью. Уровни жидкости со скоплениями газа над ними в расширенных петлях кишки («чаши Клойбера») являются классическим симптомом кишечной непроходимости. При тонкокишечной непроходимости вертикальные размеры «чаш Клойбера» преобладают над горизонтальными, видны характерные полулунные складки слизистой петель кишки; при толстокишечной горизонтальные размеры уровней жидкости превалируют над вертикальными, видны гаустры. КТ и УЗИ лучше выявляют кишечную непроходимость на ранних стадиях ее развития нежели обзорный снимок, кроме того, обычно с их помощью удается установить и ее причину (рис.15).
При развитии кишечной непроходимости развивается пневматоз кишечника, по мере ее прогрессирования в петли кишечника жидкостью. Уровни жидкости со скоплениями газа над ними в расширенных петлях кишки («чаши Клойбера») являются классическим симптомом кишечной непроходимости. При тонкокишечной непроходимости вертикальные размеры «чаш Клойбера» преобладают над горизонтальными, видны характерные полулунные складки слизистой петель кишки; при толстокишечной горизонтальные размеры уровней жидкости превалируют над вертикальными, видны гаустры. КТ и УЗИ лучше выявляют кишечную непроходимость на ранних стадиях ее развития нежели обзорный снимок, кроме того, обычно с их помощью удается установить и ее причину (рис.15).
Печень
Как уже упоминалось выше, лучевая диагностика заболеваний печени сегодня в основном основывается на использовании УЗИ, КТ и МРТ, реже – ПЭТ.
Применение методов лучевой диагностики при основных болезнях печени зависит от характеристик самого заболевания и возможностей метода.
При диффузных заболевания печени лучевые методы диагностики играют вспомогательную роль. Они используются для дифференциального диагноза (исключение опухолевых поражений), оценки размеров и структуры органа, динамического наблюдения.
Так, при гепатитах (вирусных, токсических, алкогольных) данные методов лучевой диагностики неспецифичны. Печень может быть увеличена или уменьшена в размерах, могут встречаться признаки неоднородности структуры печени при УЗИ. Может определяться диффузное увеличение органа.
Диагностика жировой инфильтрации печени с помощью лучевых методов вполне надежна. Как правило, области жировой инфильтрации чередуются с участками нормальной паренхимы печени. Жировая инфильтрация не приводит к нарушению архитектоники сосудов печени или масс-эффекту. Картина жировой инфильтрации может претерпевать быструю динамику, что имеет важное дифференциально-диагностическое и прогностическое значение. При УЗИ жировая дистрофия печени хорошо видна. Она выглядит как диффузные изменения печени с пониженной эхогенностью, перемежающиеся с участками неизмененной ткани. При КТ отмечается значительное снижение плотности паренхимы органа (до 20-30 единиц Хаунсфилда) (рис.16). Из-за понижения ее плотности пораженные сегменты становятся отчетливо видимыми на фоне неизмененных участков печеночной ткани и сосудов печени. В норме плотность печени несколько выше, чем плотность селезенки. Поэтому при жировой инфильтрации снижение плотности ткани печени видно даже без помощи денситометрии. МРТ редко применяется для подтверждения диагноза, т.к. УЗИ и КТ вполне достаточно для этой цели. Однако если у этих больных проводится МРТ, то применяют специальные программы исследования (импульсные последовательности с подавлением сигнала от жировой ткани).
Она выглядит как диффузные изменения печени с пониженной эхогенностью, перемежающиеся с участками неизмененной ткани. При КТ отмечается значительное снижение плотности паренхимы органа (до 20-30 единиц Хаунсфилда) (рис.16). Из-за понижения ее плотности пораженные сегменты становятся отчетливо видимыми на фоне неизмененных участков печеночной ткани и сосудов печени. В норме плотность печени несколько выше, чем плотность селезенки. Поэтому при жировой инфильтрации снижение плотности ткани печени видно даже без помощи денситометрии. МРТ редко применяется для подтверждения диагноза, т.к. УЗИ и КТ вполне достаточно для этой цели. Однако если у этих больных проводится МРТ, то применяют специальные программы исследования (импульсные последовательности с подавлением сигнала от жировой ткани).
При диагностике цирроза печени информативность методов лучевой диагностики существенно выше. Выделяют макроузловую, микроузловую и смешанную формы цирроза печени. При микроузловом циррозе печень уменьшена в размерах и значительно уплотнена, регенеративная активность выражена незначительно. При макроузловом циррозе выявляются множественных узлы регенерации, некоторые из них мультилобулярные, с перегородками. Основными критериями диагностики цирроза являются уменьшение размеров печени (на начальных этапах заболевания печень может быть увеличена в размерах), выявление множественных узлов регенерации, наличие признаков портальной гипертензии, спленомегалии, асцита. Наиболее информативными для диагностики являются КТ, УЗИ и МРТ (рис.17). Оценка характера кровотока в портальной вене и печеночных венах с помощью УЗ-допплерографии может оказывать помощь в оценке степени нарушения венозного кровотока в органе. Иногда возникает необходимость в дифференциальной диагностике очагов печеночно-клеточного рака и узлов регенерации при циррозе. В сложных для диагностики случаях прибегают к пункционной биопсии. Она может выполняться под контролем УЗИ или КТ, что повышает точность забора материала и уменьшает риск осложнений.
При макроузловом циррозе выявляются множественных узлы регенерации, некоторые из них мультилобулярные, с перегородками. Основными критериями диагностики цирроза являются уменьшение размеров печени (на начальных этапах заболевания печень может быть увеличена в размерах), выявление множественных узлов регенерации, наличие признаков портальной гипертензии, спленомегалии, асцита. Наиболее информативными для диагностики являются КТ, УЗИ и МРТ (рис.17). Оценка характера кровотока в портальной вене и печеночных венах с помощью УЗ-допплерографии может оказывать помощь в оценке степени нарушения венозного кровотока в органе. Иногда возникает необходимость в дифференциальной диагностике очагов печеночно-клеточного рака и узлов регенерации при циррозе. В сложных для диагностики случаях прибегают к пункционной биопсии. Она может выполняться под контролем УЗИ или КТ, что повышает точность забора материала и уменьшает риск осложнений.
При ряде заболеваний печени, связанных с метаболическими нарушениями, лучевые методы диагностики позволяют выявить специфические симптомы, облегчающие их диагностику. В качестве примера можно привести болезнь Коновалова-Вильсона и гемохроматоз.
В качестве примера можно привести болезнь Коновалова-Вильсона и гемохроматоз.
Гепатоцеребральная дистрофия (болезнь Коновалова-Вильсона) обусловлена нарушениями обмена меди, которая откладывается в печени, почках, головном мозге. При обследованиях печени обнаруживают явления гепатита или цирроза различной степени выраженности. Однако самым важным является характерное увеличение плотности паренхимы печени при КТ (или повышение интенсивности сигнала при МРТ). Это связано с повышенным содержанием в органе ионов меди. При гемохроматозе (первичном или вторичном) происходит повышенное накопление железа в клетках ретикуло-эндотелиальной системы. Соответственно этому меняется характер изображения печени на компьютерных томограммах (повышение плотности) и изменение сигнала при МРТ (низкая интенсивность сигнала от паренхимы печени как на Т1, так и на Т2-взвешенных изображениях – рис.18). Последнее объясняется особенностями магнитных свойств оксидов железа в клетках ретикуло-эндотелиальной системы.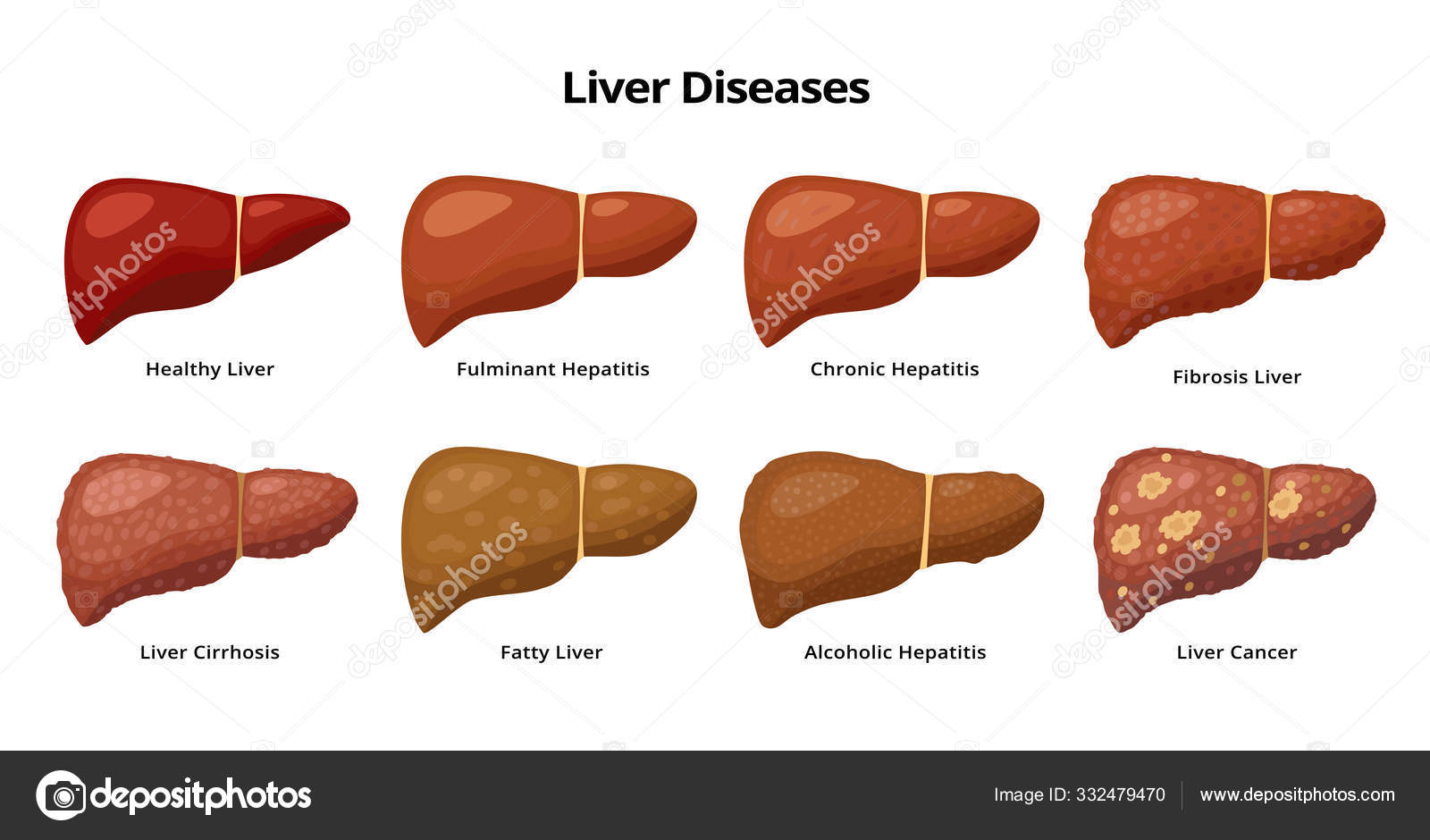
Исключительно важным является диагностика и дифференциальная диагностика объемных образований печени. К ним относятся простые кисты печени, паразитарные болезни, абсцессы, эхинококкоз и альвеококкоз, метастазы органных опухолей и первичные опухоли печени.
Простые кисты печени встречаются достаточно часто. На ультразвуковых и томо- графических изображениях они имеют различные размеры, тонкие стенки, однородное содержимое с характеристиками, характерными для жидкости, по плотности близкой к воде. Внутри кист отсутствуют сосуды. Содержимое простых кист не усиливается при введении контрастного препарата. Кисты печени встречаются у 20-40% пациентов с поликистозом почек.
Все методы лучевой диагностики – УЗИ, КТ, МРТ – позволяют с высокой точностью выявлять кисты печени (рис.19).
Абсцессы печени могут иметь различное происхождение. Чаще всего встречаются микробные (кишечная палочка, стрептококк, анаэробная инфекция) и паразитарные (амебные) абсцессы печени.
Инфекционные абсцессы могут возникать после травм печени, хирургических вмешательств, при холангите, сепсисе, флебите портальной вены. При допплеровском ультразвуковом исследовании видна повышенная васкуляризация капсулы, отсутствие сигнала от кровотока внутри полости абсцесса. При УЗИ абсцесс печени проявляется как округлая структура с плотной, неровной капсулой, имеющая толстые стенки и неровную внутреннюю поверхность. Внутри лоцируется плотное жидкое содержимое, возможно наличие газа. Для амебных абсцессов характерна толстая капсула с множественным внутренними перегородками, отсутствие скоплений газа в абсцессе, нередки множественные поражения. Схожая картина получается при использовании КТ и МРТ. В сомнительных случаях прибегают к внутривенному контрастированию. Повышение контрастности капсулы абсцесса и выявление пузырьков газа в его полости позволяет поставить правильный диагноз (рис.20).
С помощью методов лучевой диагностики (чаще всего КТ и УЗИ) выполняют различные виды манипуляций для лечения абсцессов, такие как пункция и дренирование.
Печень, селезенка и легкие являются основными органами диссеминации личинок эхинококка и альвеококка. Поражения других органов (почки, мог, сердце и пр.) встречаются гораздо реже. Первоначально, после заражения, кисты имеют небольшой размер (2-3 мм), и выявление их бывает крайне затруднительным. По мере их роста диагноз облегчается. Для всех методов наиболее характерными признаками эхинококкоза являются наличие в печени кист различного размера с четкими, тонкими и ровными стенками. Диагноз эхинококкоза облегчается при обнаружении внутри или снаружи образования дочерних кист (рис.21). При эхинококкозе в 30% случаев стенки кисты кальцинированы. В случае гибели паразита часто наблюдается частичное или полное отслоение внутренней оболочки, которая становится хорошо видимой внутри кистозной полости. При альвеококкозе кисты множественные, контуры их нечеткие из-за инфильтративного роста с воспалительными и некротическими реакциями по периферии кист. Плотность внутри кисты выше, чем при эхинококкозе. Поэтому образование может напоминать растущую опухоль.
Поэтому образование может напоминать растущую опухоль.
К очаговым поражениям печени относятся доброкачественные и злокачественные опухоли печени и метастазы органных опухолей в печень.
Среди доброкачественных опухолей наиболее часто встречаются гемангиомы, фокальная узловая гиперплазия и аденома печени.
Гемангиома – наиболее часто встречающаяся доброкачественная опухоль печени. Она встречается у 1-5% взрослого населения. В подавляющем большинстве случаев гемангиомы обнаруживают случайно при УЗИ или томографии печени. Очень редко гигантские (>10 см) гемангиомы могут сопровождаться клинической симптоматикой из-за сдавления окружающих структур, тромбоза, геморрагий. При УЗИ гемангиома выглядит как округлое образование с множественными сигналами внутри опухоли от мелких сосудов. На КТ-изображениях гемангиомы в типичных случаях выглядят как округлые образования с низкой плотностью и четкими контурами. При выявлении образования, похожего на гемангиому, обязательно проводить внутривенное контрастирование. Характерным для гемангиом является центропетальная (от периферии к центру) последовательность заполнения гемангиомы контрастным препаратом (рис.22).
Характерным для гемангиом является центропетальная (от периферии к центру) последовательность заполнения гемангиомы контрастным препаратом (рис.22).
При МРТ, из-за длительного времени релаксации на Т2-взвешенных изображениях, характерно очень яркое изображение опухоли на фоне темной паренхимы печени. При динамическом контрастном МР-исследовании с гадолинием характер заполнения опухоли контрастом тот же, что и при КТ. Большие гемангиомы могут иметь нетипичный вид – протяженные центральные зоны, плохо, или не накапливающие контрастный препарат (рубцы, участки гиалиноза). В редких случаях для диагностик гемангиом используют сцинтиграфию печени с меченными эритроцитами или ангиографию.
Фокальная узловая гиперплазия – редкая доброкачественная опухоль печени, обычно встречающаяся у молодых женщин (до 75% случаев). Она состоит из гепатоцитов, купферовских клеток и желчных протоков. В ее центральной части обычно располагается рубец, от которого расходятся перегородки (септы). Она может быть множественной. На изображениях эта опухоль характеризуется отсутствием капсулы, гомогенностью структуры и гиперваскулярностью. Без контрастного усиления опухоль обычно имеет такие же характеристики сигнала, что и паренхима печени. Большая опухоль может вызывать нарушение хода сосудов печени. Эта опухоль гиперваскулярна, поэтому она хорошо выявляется при динамической КТ или МРТ с контрастным усилением в артериальную фазу (рис.23). Обычно хорошо виден гипоинтенсивный центральный рубец, который в отстроченную фазу накапливает контрастный препарат, в то время как паренхима опухоли становится мало отличимой от нормальной печени.
Она может быть множественной. На изображениях эта опухоль характеризуется отсутствием капсулы, гомогенностью структуры и гиперваскулярностью. Без контрастного усиления опухоль обычно имеет такие же характеристики сигнала, что и паренхима печени. Большая опухоль может вызывать нарушение хода сосудов печени. Эта опухоль гиперваскулярна, поэтому она хорошо выявляется при динамической КТ или МРТ с контрастным усилением в артериальную фазу (рис.23). Обычно хорошо виден гипоинтенсивный центральный рубец, который в отстроченную фазу накапливает контрастный препарат, в то время как паренхима опухоли становится мало отличимой от нормальной печени.
Аденома – редкая доброкачественная опухоль печени, состоящая из гепатоцитов. Кровоснабжается она одной или несколькими дополнительными веточками почечной артерии. При выполнении УЗИ, КТ или МРТ выглядит как объемное образование, нередко окруженное тонкой псевдокапсулой (зоной фиброза). В ткани опухоли могут выявляться участки кровоизлияний, центральный рубец отсутствует. При проведении КТ и МРТ с контрастным усилением аденома контрастируется преимущественно в артериальную фазу. При этом отмечается негомогенное повышение плотности. Иногда аденому трудно дифференцировать от гепатоцеллюлярного рака.
При проведении КТ и МРТ с контрастным усилением аденома контрастируется преимущественно в артериальную фазу. При этом отмечается негомогенное повышение плотности. Иногда аденому трудно дифференцировать от гепатоцеллюлярного рака.
Злокачественные опухоли печени делятся на первичные и вторичные (метастазы). Из злокачественных опухолей часто встречается гепатома (гепатоцеллюлярный рак), реже – холангиокарцинома (холангиоклеточный рак).
Гепатоцеллюлярный рак (гепатома) – наиболее часто встречающаяся первичная опухоль печени. Риск развития гепатомы повышен у пациентов с циррозом печени, гепатитами В и С, гемохроматозом. Выделяют узловую (солитарную), многоузловую и диффузную формы заболевания. Характерна инвазия опухоли в портальную и печеночные вены (до 30% случаев). Гепатома может метастазировать в другие органы (легкие, кости, лимфатические узлы).
Изображения гепатомы, получаемые при лучевых методах диагностики, достаточно разнообразны. Для опухоли характерна негомогенность внутреннего строения, внутриопухолевые перегородки, может выявляться центральный рубец, некротические или кистозные участки, капсула, наличие дочерних узлов. Опухоль может проникать в сосуды, иметь включения кальция и сопровождаться асцитом. Гепатомы, как правило, характеризуются повышенной васкуляризацией и наличием артерио-венозных шунтов. По этой причине при выполнении УЗ-допплерографии, ангиографии или КТ и МРТ с контрастированием они лучше всего видны в артериальную фазу (рис.24).
Для опухоли характерна негомогенность внутреннего строения, внутриопухолевые перегородки, может выявляться центральный рубец, некротические или кистозные участки, капсула, наличие дочерних узлов. Опухоль может проникать в сосуды, иметь включения кальция и сопровождаться асцитом. Гепатомы, как правило, характеризуются повышенной васкуляризацией и наличием артерио-венозных шунтов. По этой причине при выполнении УЗ-допплерографии, ангиографии или КТ и МРТ с контрастированием они лучше всего видны в артериальную фазу (рис.24).
При диагностике гепатом лучевые методы позволяют определить размеры и расположение опухоли и выявить наличие локальных внутрипеченочных метастазов, инвазии в вены печени. Эти данные очень важны для выбора метода лечения и определения прогноза.
Холангиоклеточный рак (холангиокарцинома) – злокачественная опухоль, растущая из внутрипеченочных желчных протоков. При УЗИ или КТ может иметь вид гиподенсного (гипоинтенсивного при МРТ) очага или мультифокального образования с инфильтративным ростом по ходу желчных протоков (рис. 25). Наиболее яркое проявление заболевания – выраженное расширение внутрипеченочных желчных протоков выше места их обструкции опухолью и контрастирование ткани самого образования. КТ, МРТ и особенно МР-холангиография облегчают диагностику опухолевого поражения желчных протоков. Холангиокарцинома, поражающая область слияния внутрипеченочных желчных протоков и вызывающая их обструкцию, получила название опухоли Клацкина. Заболевание следует дифференцировать со случаями доброкачественного врожденного кистозного расширения желчных протоков (болезнь Кароли).
25). Наиболее яркое проявление заболевания – выраженное расширение внутрипеченочных желчных протоков выше места их обструкции опухолью и контрастирование ткани самого образования. КТ, МРТ и особенно МР-холангиография облегчают диагностику опухолевого поражения желчных протоков. Холангиокарцинома, поражающая область слияния внутрипеченочных желчных протоков и вызывающая их обструкцию, получила название опухоли Клацкина. Заболевание следует дифференцировать со случаями доброкачественного врожденного кистозного расширения желчных протоков (болезнь Кароли).
Среди всех очаговых поражений печени важное значение придается выявлению метастазов злокачественных опухолей в печень. Выявление даже единичного небольшого по размеру метастаза в печень меняет стадию процесса и, соответственно, выбор лечебной тактики и прогноз заболевания. Все методы современной лучевой диагностики позволяют визуализировать метастазы в печень. Их чувствительность и специфичность колеблются в пределах 75-90% и зависят от характеристик самого метода, методики исследования, гистологического строения, васкуляризации и размеров очагов. Чаще всего в качестве начального метода исследования назначают УЗИ. В сложных ситуациях диагностический алгоритм расширяется. Выполняют КТ с многофазным контрастированием и/или МРТ (также с контрастированием).
Чаще всего в качестве начального метода исследования назначают УЗИ. В сложных ситуациях диагностический алгоритм расширяется. Выполняют КТ с многофазным контрастированием и/или МРТ (также с контрастированием).
Метастазы в печень обнаруживают примерно у 30-40% пациентов, умерших от злокачественных заболеваний. Чаще всего источником метастатического поражения печени являются опухоли кишечника и желудка, поджелудочной железы, рак легкого и молочной железы. В печень метастазируют и опухоли других органов.
При УЗИ и томографии метастазы в печень видны как множественные мягкотканые очаги (симптом «монеток») (рис.26). В зависимости от гистологии первичного очага, они могут быть гиперваскулярными или гиповаскулярными (чаще всего). От вакуляризации во многом зависит вид метастатических очагов на томограммах и изменение их плотности (интенсивности при МРТ) во время контрастирования. Иногда встречаются метастазы с кальцинатами или с выраженным кистозным компонентом. В сомнительных случаях помощь в диагностике метастатических поражений может оказать ПЭТ или ПЭТ/КТ с 18-ФДГ.
В сомнительных случаях помощь в диагностике метастатических поражений может оказать ПЭТ или ПЭТ/КТ с 18-ФДГ.
Лучевые методы важны для диагностики портальной гипертензии. Синдром портальной гипертензии встречается при целом ряде заболеваний: тромбозе и компрессии портальной вены и ее ветвей, циррозе печени, холангите, застойной сердечной недостаточности и других заболеваниях. Поэтому при исследовании органов брюшной полости в обязательном порядке положено изучить и описать состояние сосудов печени и селезенки. Портальную гипертензию диагностируют на основании расширения воротной вены, выявления варикозного расширения коллатеральных вен, спленомегалии, асцита. При диагностике тромбоза воротной вены или синдрома Бадда-Киари (тромбоз печеночных вен) большую роль играют КТ или МРТ, выполненные в ангиографическом режиме. Методом УЗ-допплерографии можно определить скорость и направления кровотока в воротной и селезеночной венах.
Заболевания селезенки встречаются значительно реже, чем болезни печени. Диагностика осуществляется с помощью УЗИ и КТ, реже методом МРТ. В селезенке могут встречаться доброкачественные опухоли: гамартомы и гемангиомы. Из злокачественных опухолей чаще всего диагностируются метастазы и поражение селезенки лимфопролиферативными заболеваниями (лимфогранулематоз, лимфомы). Первичные злокачественные опухоли селезенки очень редки. Принципы диагностики поражений селезенки такие же, как и печени.
Диагностика осуществляется с помощью УЗИ и КТ, реже методом МРТ. В селезенке могут встречаться доброкачественные опухоли: гамартомы и гемангиомы. Из злокачественных опухолей чаще всего диагностируются метастазы и поражение селезенки лимфопролиферативными заболеваниями (лимфогранулематоз, лимфомы). Первичные злокачественные опухоли селезенки очень редки. Принципы диагностики поражений селезенки такие же, как и печени.
Травмы селезенки ведут к образованию гематом и разрыву органа. Точная информация о состоянии селезенки влияет на выбор тактики лечения. Диагностика при этом, как правило, проводится в срочном порядке. Поэтому на первый план выходят УЗ- и КТ-исследования. И при УЗИ, и при КТ можно быстро получить исчерпывающую информацию. Инфаркты селезенки эмбологенного происхождения в острой стадии хорошо выявляются при КТ или МРТ с контрастным усилением. В хронической стадии в местах инфарктов КТ можно выявлять кальцинаты.
Поджелудочная железа
Заболевания поджелудочной железы являются частыми показаниями к направлению пациента на лучевое исследование.
Острый панкреатит в начальной стадии своего развития проявляется увеличением органа, диффузным изменением структуры железы из-за ее отека. По мере прогрессирования заболевания появляются перипанкреатические скопления жидкости, инфильтрация окружающей жировой клетчатки. Важно выявление некротических очагов в железе при тяжелом течении заболевания. Для обнаружения очагов панкреонекроза требуется проведение КТ с контрастным усилением (рис.27). В отдаленном периоде с помощью методов лучевой диагностики могут выявляться псевдокисты, кальцинаты, аневризмы артерий (чаще всего – ветвей селезеночной артерии). Панкреатит головки поджелудочной железы, приводящий к обструкции холедоха, иногда приходится дифференцировать с опухолью. Для этой цели прибегают к выполнению КТ или МРТ с контрастированием.
На хронический панкреатит указывает атрофия железы (иногда в сочетании с участками локальной гипертрофии), жировая дистрофия, фиброз или кальциноз ее паренхимы (рис. 28), камни в панкреатическом протоке и его расширение.
28), камни в панкреатическом протоке и его расширение.
Наиболее серьезные требования к методам лучевой диагностики предъявляются при подозрении на опухоль поджелудочной железы. К основным типам опухолей железы относятся рак железы (аденокарцинома и цистаденокарцинома), эндокринные опухоли, лимфома и метастазы.
Рак поджелудочной железы – самая частая злокачественная опухоль органа. Более половины случаев заболевания возникают в головке поджелудочной железы. В этой связи первыми признаками заболевания является желтуха. При диагностике приходится проводить дифференциацию между опухолью, отечной формой панкреатита и некальцинированным конкрементом желчного протока. Опухоли тела и хвоста железы долгое время не проявляются и поэтому часто диагностируются, достигнув большого размера (4-5 см).
Диагноз опухоли поджелудочной железы по данным УЗИ, КТ или МРТ преимущественно основывается на выявлении локального утолщения железы и очагового изменения характеристик сигнала в месте поражения. При уточнении причины желтухи и выявлении изменений в головке железы большую помощь оказывает эндоскопическое УЗИ и ретроградная панкреатохолангиография. Для уточнения диагноза часто выполняется Кт с динамическим контрастированием с тонкими срезами. Опухоль обычно выявляется в виде гиподенсного образования на фоне лучше контрастированной паренхимы железы (рис.29). МРТ с использованием болюсного усиления гадолинием увеличивает чувствительность и специфичность метода в выявлении образований.
При уточнении причины желтухи и выявлении изменений в головке железы большую помощь оказывает эндоскопическое УЗИ и ретроградная панкреатохолангиография. Для уточнения диагноза часто выполняется Кт с динамическим контрастированием с тонкими срезами. Опухоль обычно выявляется в виде гиподенсного образования на фоне лучше контрастированной паренхимы железы (рис.29). МРТ с использованием болюсного усиления гадолинием увеличивает чувствительность и специфичность метода в выявлении образований.
Для определения возможности выполнения резекции опухоли необходимо выявить распространенность опухоли. Методика КТ-ангиографии позволяет определить наличие инвазии опухоли в верхнебрыжеечную артерию и вену, чревный ствол или воротную вену или в прилежащие к железе органы (желудок, кишечник, сальник).
Большие трудности в диагностике представляют кистозные опухоли поджелудочной железы (цистаденокарцинома). Это злокачественная кистозного строения опухоль, содержащая муцин. Опухоль обычно локализуется в теле или хвосте поджелудочной железы. При УЗИ, КТ или МРТ опухоль выглядит как гиповаскулярная структура, ее перегородки и узлы накапливают контрастный препарат. Схожим образом может выглядеть доброкачественная опухоль – цистаденома или же многокамерная псевдокиста.
Опухоль обычно локализуется в теле или хвосте поджелудочной железы. При УЗИ, КТ или МРТ опухоль выглядит как гиповаскулярная структура, ее перегородки и узлы накапливают контрастный препарат. Схожим образом может выглядеть доброкачественная опухоль – цистаденома или же многокамерная псевдокиста.
Относительно редко в поджелудочной железе встречаются эндокринные опухоли (инсулиномы, гастриномы, випомы, соматостиномы, глюкагеномы и нефункционирующие опухоли). В большинстве случаев эти опухоли являются гиперваскулярными, поэтому они хорошо видны в артериальную фазу контрастирования при выполнении КТ или МРТ (рис.30). Селективная ангиография также позволяет выявить патологические сосуды опухоли. Большое значение для диагноза имеют признаки гормональной активности опухоли (гипогликемия в случае инсулиномы, синдром Золлингера-Эллисона при гастриномах и пр.). Метастазы в печень опухолей APUD системы также обычно бывают гиперваскулярными.
Желчный пузырь и желчные протоки
Частым показанием к лучевому исследованию является подозрение на желчекаменную болезнь и холециститы (калькулезный и безкалькулезный).
Ведущим методом диагностики заболеваний желчного пузыря и желчевыводящих путей является УЗИ. С помощью этого метода можно видеть конкременты в полости желчного пузыря и симптом «акустической тени» за конкрементом (рис.31). Конкременты в желчном пузыре и протоках хорошо видны при КТ (рис.32), а также при МР-холангиографии (как дефекты наполнения на фоне яркого сигнала от желчи). На современных мультиспиральных компьютерных томографах удается визуализировать даже «рентгенонегативные» (холестериновые) конкременты в пузыре, так как они обычно отличаются по плотности от желчи.
Для диагностики острого и хронического холецистита предпочтение отдают УЗИ. С его помощью можно выявить утолщение и инфильтрацию стенок пузыря (рис.33), расширение его полости, неоднородность желчи. При осложненном холецистите (абсцедирование или гангренозные изменения пузыря) можно выявить скопления газа и гноя. Часто выявляется скопление экссудата в ложе пузыря.
Применение ультразвукового исследования также предпочтительно при подозрении на холангиты. С помощью метода визуализируют расширение внутрипеченочных желчных протоков, перипротоковую инфильтрацию паренхимы печени, изменение плотности желчи внутри протоков. При хронических холангитах характерно выявление чередующихся участков сужения (стриктур) и расширения желчных протоков, фибротических и воспалительных изменений по их периферии, которые можно диагностировать с помощью РХПГ, МР-холангиографии или УЗИ. Могут выявляться камни во внутрипеченочных желчных протоках. При осложненных холангитах УЗИ, КТ и МРТ используют для диагностики таких осложнений заболевания, как внутрипеченочные абсцессы.
С помощью метода визуализируют расширение внутрипеченочных желчных протоков, перипротоковую инфильтрацию паренхимы печени, изменение плотности желчи внутри протоков. При хронических холангитах характерно выявление чередующихся участков сужения (стриктур) и расширения желчных протоков, фибротических и воспалительных изменений по их периферии, которые можно диагностировать с помощью РХПГ, МР-холангиографии или УЗИ. Могут выявляться камни во внутрипеченочных желчных протоках. При осложненных холангитах УЗИ, КТ и МРТ используют для диагностики таких осложнений заболевания, как внутрипеченочные абсцессы.
Лимфатические узлы и внеорганные опухоли
В забрюшинном пространстве расположены лимфатические протоки и несколько групп лимфатических узлов. Выявление их поражения при злокачественных заболеваниях имеет важное диагностическое значение. Даже при условно нормальных размерах узлов их количественное увеличение должно восприниматься с настороженностью. Чаще всего причиной увеличения забрюшинных лимфатических узлов являются метастазы злокачественных опухолей органов брюшной полости или таза. При лимфомах (лимфогранулематоз, неходжкинские лимфомы) пораженные лимфатические узлы отличаются от пораженных метастатическим процессом. Они сливаются в полициклические массы, которые могут вызывать смещение внутренних органов, обструкцию мочеточников, сосудов. Мезентериальная, забрюшинная или тазовая лимфоаденопатия могут быть проявлением СПИДа.
Чаще всего причиной увеличения забрюшинных лимфатических узлов являются метастазы злокачественных опухолей органов брюшной полости или таза. При лимфомах (лимфогранулематоз, неходжкинские лимфомы) пораженные лимфатические узлы отличаются от пораженных метастатическим процессом. Они сливаются в полициклические массы, которые могут вызывать смещение внутренних органов, обструкцию мочеточников, сосудов. Мезентериальная, забрюшинная или тазовая лимфоаденопатия могут быть проявлением СПИДа.
Выраженное увеличение лимфатических узлов может быть обнаружено при выполнении УЗИ. Однако оптимальным методом оценки всех групп лимфатических узлов брюшной полости является КТ. В сомнительных случаях прибегают к радионуклидным методам диагностики (ПЭТ).
В брюшной полости могут быть расположены внеорганные опухоли. Эти опухоли долгое время могут не проявлять себя клинически и обнаруживаться при диспансеризации либо при обследовании по другому поводу. В зависимости от гистологического типа (липомы, липосаркомы, мезотелиомы, тератомы и т.д.) они могут иметь различную плотность и отношение к контрастному веществу.
ЗАКЛЮЧЕНИЕ
Несмотря на прогресс лучевой диагностики, до сих пор нет единого универсального метода диагностики болезней органов брюшной полости. Их выбор и методика выполнения исследования во многом зависят от характера предполагаемого заболевания, остроты процесса и ведущего клинического синдрома. Тем не менее, очевидно, что продолжает увеличиваться роль УЗИ и КТ. Эти методики все чаще используются в острых, неотложных ситуациях, а также начали применяться и для обследования полых органов (кишка, желудок). МРТ и ПЭТ имеют большое значение в диагностике и дифференциальной диагностике опухолей печени.
Медь в крови
Медь – это жизненно важный микроэлемент, играющий существенную роль в синтезе гемоглобина и активации ферментов дыхательной цепи. Он входит в состав костей, хряща, соединительной ткани и миелиновых оболочек.
Синонимы русские
Общая медь в крови.
Синонимы английские
Cu, Total copper, Hepatic copper.
Метод исследования
Колориметрический метод (IFCC).
Единицы измерения
Мкг/л (микрограмм на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу 2-3 часа до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Медь – важный катион, входящий в состав многих ферментов. Они принимают активное участие в метаболизме железа, формировании соединительной ткани, выработке энергии на клеточном уровне, продукции меланина (пигмента, отвечающего за цвет кожи) и в нормальном функционировании нервной системы.
Основными источниками меди для человека являются такие продукты питания как орехи, шоколад, грибы, печень, злаки и сухофрукты. Также медь может поступать в организм с водой, в случае, если она контактировала с медьсодержащими предметами (например с медьсодержащей посудой). После поступления в желудочно-кишечный тракт медь всасывается в тонкой кишке и соединяясь с белками крови, транспортируется в печень. Большая часть меди в крови находится в связанном с церрулоплазмином состоянии (около 95 %), меньшая часть связана с альбуминами сыворотки или находится в свободном состоянии. При избыточном поступлении меди с пищей печень выделяет ее излишки с желчью и она удаляется из организма с калом и мочой.
Недостаточность меди, как и ее избыток — редкие патологичсекие состояния. Чаща встречается перенасыщеие организма медью, связанное с нарушением ее обмена, либо хроническим отравлением. Наследственное заболевание, приводящее к повышенному отложению меди в тканях организма называется болезнь Вильсона-Коновалова (Уильсона-Коновалова). Основными его симптомами являются:
- анемия
- тошнота
- рвота
- боли в животе
- желтуха
- повышенная утомляемость
- резкие перемены настроения
- дрожание конечностей
- нарушение глотания
- неустойчивая походка
- дистония
- появление специфической окраски радужки глаз
При вовлечении в патологический процесс почек может нарушиться образование мочи вплоть до анурии. Некоторые из этих симптомов иногда также проявляются при остром или хроническом отравлении медью, возникающем из-за загрязнения окружающей среды, а также вследствие заболеваний печени, которые препятствуют обмену микроэлемента.
Дефицит меди может внезапно возникнуть у людей, страдающих заболеваниями, вызывающими тяжелую мальабсорбцию (муковисцидозом, целиакией). Эти болезни сопровождаются нейтропенией, остеопорозом и микроцитарной анемией.
Редкая генетическая патология, связанная с X-хромосомой, болезнь Менкеса («болезнь курчавых волос») ведет к дефициту меди у болеющих детей. Это заболевание, поражающее преимущественно мужчин, проявляется судорожными приступами, задержкой развития, дисплазией артерий головного мозга и необычно ломкими курчавыми волосами.
Недостаточное количество меди в крови грозит производством дефектных эритроцитов с низкой продолжительностью жизни, а также уменьшением активности ферментов, содержащих в своем составе этот микроэлемент.
Для чего используется исследование?
- Для диагностики болезни Вильсона-Коновалова (как правило совместно с тестом на церулоплазмин).
- Для оценки состояния пациента при подозрении на отравление медью, а также при ее недостатке или при нарушениях, влияющих на обмен меди (вместе с тестом на церулоплазмин).
- Для контроля за эффективностью лечения болезни Вильсона-Коновалова и патологического состояния, вызванного избытком меди или ее излишней потерей.
Когда назначается исследование?
Анализ назначается совместно с другими тестами (церулоплазмин), при наличии симптомов болезни Вильсона-Коновалова, подозрении на острое отравление медью, а также для оценки обеспеченности организма данным микроэлементом.
Что означают результаты?
Референсные значения
Для мужчин: 700 — 1400 мкг/л.
Для женщин: 800 — 1550 мкг/л.
Причины повышения уровня меди:
- внутривенное введение медьсодержащих растворов,
- применение оральных контрацептивов,
- первичный билиарный цирроз,
- хронические воспалительные заболевания (ревматоидный артрит, системная красная волчанка),
- гемохроматоз,
- гипертиреоз,
- гипотиреоз,
- лейкоз,
- лимфома,
- анемия (пернициозная, железодефицитная, апластическая).
Причины снижения уровня меди:
- болезнь Менкеса («болезнь курчавых волос»),
- болезнь Вильсона – Коновалова (гепатолентикулярная дегенерация),
- заболевания желудочно-кишечного тракта (спру, целиакия, поражения тонкого кишечника),
- заболевания почек и печени,
- долгий период энтерального питания,
- квашиоркор,
- муковисцидоз,
- нарушения обмена коллагена,
- первичный остеопороз,
- саркоидоз.
Результаты исследования должны оцениваться в комплексе с анализом на церулоплазмин и клиническими данными. Изолированное повышение концентрации меди в крови не является подтверждением наличия заболевания, а лишь указывает на необходимость дальнейшего клинического поиска.
Характерными лабораторными признаками болезни Вильсона – Коновалова являются снижение концентрации меди в крови, повышение ее концентрации в моче в сочетании с пониженным уровнем церулоплазмина.
При некоторых патологических состояниях, таких как хронические заболевания печени, почек, остром гепатите, наблюдается повышенное выделение меди с мочой и ее высокий уровень в крови, при этом уровень церулоплазмина будет нормальный или повышенный.
Уменьшение содержания меди в крови и в моче, а также уменьшение концентрации церулоплазмина иногда свидетельствуют о дефиците меди.
Повышение концентрации меди во время лечения состояния, связанного с ее дефицитом и снижением концентрации церулоплазмина, говорит об эффективности проводимой терапии.
Ситуации, вызывающие сильное изменение уровня меди, чаще всего связаны с нарушением питания и/или всасывания меди, а также с какими-либо генетическими нарушениями ее утилизации и включения в процессы обмена.
Что может влиять на результат?
- Интерпретация результатов может быть осложнена тем, что церулоплазмин является белком острой фазы воспаления, поэтому его уровень повышен при любом воспалительном или инфекционном заболевании. Оба эти показателя возрастают во время беременности, в период приема эстрогенов и оральных контрацептивов.
- Лекарственные препараты карбамазепин, фенобарбитал, эстрогены, оральные контрацептивы, фенитоин повышают уровень меди в крови, нифедипин снижает его.
Скачать пример результата
Важные замечания
- Общий уровень меди снижен у новорождённых, поднимается в течение следующих нескольких лет, достигает пика, затем постепенно снижается до нормы.
- Скрининговые проверки уровня меди не рекомендованы в связи с тем, что у многих людей без нарушений обмена меди на результаты анализа могут влиять патологии воспалительного или инфекционного характера.
Также рекомендуется
Кто назначает исследование?
Терапевт, ревматолог, гематолог, педиатр.
Патология почек при циррозе печени uMEDp
Поражение почек у больных циррозом печени значительно ухудшает прогноз заболевания. В статье представлены диагностические критерии хронической болезни почек, острой болезни почек, острого повреждения почек и методы их лечения.
Таблица 1. Дефиниции заболеваний почек у пациентов с циррозом печени
Таблица 2. Стадии острого повреждения почек у больных циррозом печени
Алгоритм наблюдения и лечения больных циррозом печени с острым почечным повреждением
В среднем у 5–7% больных циррозом печени различной этиологии ежегодно наблюдается декомпенсация заболевания [1–3]. Декомпенсированный цирроз печени – заболевание с мультиорганной (системной) дисфункцией. Декомпенсированной стадии заболевания предшествует стадия компенсации (асимптомная стадия), когда клинические симптомы заболевания отсутствуют. Средняя продолжительность жизни пациентов с компенсированной стадией заболевания – 12 лет.
Существуют три стадии компенсированного цирроза печени:
- стадия 0: отсутствуют признаки портальной гипертензии и варикозно расширенные вены пищевода (ВРВП), измерение жесткости печени (liver stiffness measurement, LSM) > 15, но 5, но
- стадия 1: ВРВП отсутствуют, определяется значимая портальная гипертензия – LSM ≥ 20 или давление в воротной вене ≥ 10 мм рт. ст.;
- стадия 2: имеют место ВРВП и значимая портальная гипертензия.
Декомпенсация цирроза печени (симптомная стадия) характеризуется наличием клинических признаков заболевания, средняя продолжительность жизни не превышает двух лет. Манифестация декомпенсированного заболевания часто сопровождается кровотечением из ВРВП. Конечная стадия декомпенсации цирроза печени характеризуется развитием рефрактерного асцита, печеночной энцефалопатии или желтухи, почечной недостаточности, присоединением инфекции [1, 3, 4].
О функциональном состоянии почек судят по уровню креатинина крови и снижению скорости клубочковой фильтрации (СКФ).
Критерии почечной недостаточности у пациентов с циррозом печени были определены более 30 лет назад и базировались на уровне креатинина ≥ 1,5 мг/дл, что соответствовало показателю СКФ ≤ 40 мл/мин/1,73 м2. Важно, что у пациентов с заболеваниями печени даже незначительное увеличение уровня креатинина крови может вызывать заметное снижение СКФ. Тем не менее диагноз почечной дисфункции при заболеваниях печени все еще основан на показателях креатинина крови [5, 6]. В случае повышения уровня креатинина крови и снижения СКФ у пациентов с заболеванием печени необходимо исключить хроническую болезнь почек (ХБП), острую болезнь почек (ОБП), острое повреждение почек (ОПП) или их сочетание (табл. 1).
Цирроз печени может сопровождаться ХБП, обусловленной сопутствующими заболеваниями, например сахарным диабетом, артериальной гипертензией и/или такими заболеваниями почек, как IgA-нефропатия, вирусная гломерулопатия.
Распространенность ХБП у пациентов с циррозом печени до сих пор не изучена. Диагноз ХБП основывается на снижении СКФ на протяжении трех и более лет (СКФ 2). СКФ рассчитывается по формулам, учитывающим уровень креатинина, наличие (отсутствие) признаков повреждения почечной паренхимы (протеинурия, гематурия, анормальные значения ультрасонографии). Стадия ХБП определяется исходя из уровня снижения СКФ [7–9].
Критерием ОБП служит повреждение почек, зафиксированное в течение менее трех месяцев: СКФ снижается менее 60 мл/мин/1,73 м2, или на 35% и более, либо уровень креатинина увеличивается на 50% и более за указанный промежуток времени.
В настоящее время вместо термина «острая почечная недостаточность» используется термин «острое повреждение почек», предложенный экспертами Международной организации по улучшению глобальных результатов лечения заболеваний почек KDIGO (Kidney Disease: Improving Global Outcomes) [10, 11]. При ОПП не отмечается каких-либо структурных изменений почек. Диагноз основан на увеличении уровня креатинина сыворотки крови в 1,5 раза по сравнению с исходным (если это известно или предполагается, что увеличение уровня произошло в течение предшествующих семи дней, или абсолютное увеличение уровня креатинина на 0,3 мг/дл (≥ 26,5 мкмоль/л) и более – на протяжении двух дней).
Следует подчеркнуть, что диагностика ОПП, согласно критериям KDIGO, может базироваться как на уровне креатинина сыворотки крови, так и на объеме выделяемой мочи. То есть, исходя из данных критериев, диагноз ОПП правомерен и при объеме мочи менее 0,5 мл/кг/ч за шесть часов [11–13]. Однако, согласно новому консенсусу Международного асцитического клуба (International Ascites Club), объем мочи не учитывается при диагностике ОПП у больных циррозом печени. Это объясняется тем, что больные циррозом печени с асцитическим синдромом часто страдают олигурией с выраженной задержкой натрия, несмотря на относительно нормальную СКФ, объем мочи у них может повышаться на фоне применения диуретиков [14].
Новая система разделения ОПП на стадии основана на процентном увеличении уровня креатинина сыворотки крови у больных циррозом печени по сравнению с базовым уровнем (начальная стадия) либо при пиковом значении креатинина во время госпитализации в случае прогрессирующего ОПП (пиковая стадия). У пациентов с циррозом печени значение креатинина в течение последних трех месяцев, до его повышения, следует рассматривать как базовое. Согласно критериям KDIGO, стадия 1 соответствует увеличению креатинина на 0,3 мг/дл (≥ 26,5 мкмоль/л) и более, или в 1,5–2 раза от базового. Стадия 2 ОПП соответствует увеличению уровня креатинина сыворотки крови более чем в два раза, но менее чем в три раза. Стадия 3 верифицируется при увеличении уровня креатинина более чем в три раза (табл. 2) [11].
Как показали результаты недавних исследований, у пациентов с циррозом печени со стадией 1 ОПП эффективность терапии зависит от уровня креатинина сыворотки крови. Его увеличение более чем на 1,5 мг/дл (132,6 мкмоль/л) ассоциируется с худшим прогнозом [15–17]. В отличие от системы KDIGO эксперты Международного асцитического клуба предложили разделять стадию 1 на подстадии 1а (креатинин
С учетом системы стадирования и результатов нескольких проспективных исследований был предложен новый алгоритм лечения ОПП у пациентов с циррозом печени (рисунок) [14]. При подстадии 1а (увеличение уровня креатинина до значений менее чем 1,5 мг/дл (132,6 мкмоль/л)) в некоторых случаях достаточно устранить провоцирующие факторы: отменить гепатотоксические препараты, нестероидные противовоспалительные препараты, уменьшить дозу или отменить диуретики и бета-блокаторы, увеличить объем плазмы, пролечить диагностированные инфекции. Но уже с подстадии 1b кроме полной отмены диуретических препаратов рекомендовано вводить альбумин из расчета 1 г на 1 кг веса больного на протяжении двух дней. Если после двухдневного лечения признаки ОПП сохраняются, необходимо исключить наличие у пациента гепаторенального синдрома (ГРС) или других видов ОПП.
У больных циррозом печени могут наблюдаться все виды ОПП – преренальное, ГРС, ренальное, острое тубулярное, постренальное повреждение [8]. Необходимо дифференцировать ГРС от острого тубулярного некроза. Конечно, возможно разграничение различных вариантов повреждения с помощью пункционной биопсии почек. В отличие от острого тубулярного некроза при ГРС отсутствуют морфологические изменения в почках. Поскольку биопсия почки редко проводится при ОПП, в настоящее время предлагают использовать биомаркеры. Для дифференциальной диагностики между острым тубулярным некрозом и ГРС целесообразно определять в моче липокалин, ассоциированный с желатиназой нейтрофилов. Концентрация этого белка в моче и крови значительно повышается в первые часы после развития ОПП. Подобный анализ позволяет быстро установить диагноз и назначить адекватную терапию. Скорее всего этот тест в будущем получит широкое распространение в клинической практике [18–22].
Экспертами Международного асцитического клуба классификация ГРС была пересмотрена. Сегодня выделяют два типа ГРС. Тип 1 соответствует ГРС-ОПП, тип 2 подразумевает нарушение функции почек, соответствие критериям ГРС, но не ОПП (не-ОПП-ГРС).
Согласно критериям Международного асцитического клуба, ГРС-ОПП возникает только при наличии у больных декомпенсированным циррозом печени асцита и признаков ОПП (увеличение уровня креатинина на 0,3 мг/дл (≥ 26,5 мкмоль/л) и выше на протяжении 48 часов, или на 50% и более на протяжении семи дней). При диагностике ГРС-ОПП необходимо исключить шок, органическое поражение почек (отсутствие протеинурии и микрогематурии и структурных изменений почек по данным ультрасонографии), доказать отсутствие в анамнезе приема в ближайшее время нефро- и гепатотоксических препаратов, улучшение в течение двух дней после отмены диуретических средств и назначения альбумина в дозе 1 г на 1 кг веса пациента [14, 23].
Всем пациентам c ГРС-ОПП со стадией выше 1а необходимо незамедлительно назначить вазоконстрикторы и альбумин с госпитализацией в палату интенсивной терапии. Препаратом выбора из вазопрессоров является терлипрессин (Реместип). Препарат повышает тонус гладких мышц сосудистой стенки, вызывает сужение артериол, вен и венул в большей степени в брюшной полости, уменьшает кровоток в гладкомышечных органах и печени, снижает давление в портальной системе. Препарат можно вводить внутривенно болюсно (1 мг каждые 4–6 часов) или непрерывно внутривенно, 2 мг/сут. Если через два дня лечения уровень креатинина снижается менее чем на 25% пикового, дозу терлипрессина следует увеличить до максимальной – 12 мг/сут. При недоступности терлипрессина его можно заменить норадреналином. Если недоступны оба препарата, можно использовать мидодрин и октреотид, хотя их эффективность ниже. Одновременно с вазопрессорами вводится 20%-ный раствор альбумина, его суточная доза – 20–40 г. Для предупреждения перегрузки кровообращения целесообразно измерять центральный объем крови с титрованием дозы альбумина [24–29].
Профилактика ГРС основана на введении раствора альбумина пациентам с асцитическим синдромом, у которых не исключен риск развития спонтанного бактериального перитонита. В случае его верификации альбумин вводят из расчета 1,5 мг на 1 кг веса, на третий день от постановки диагноза – в дозе 1 мг на 1 кг веса пациента [30, 31].
Кроме того, в качестве профилактики спонтанного бактериального перитонита и развития на его фоне ГРС-ОПП используют норфлоксацин 400 мг/сут.
Киста печени — симптомы, лечение, причины болезни, первые признаки
Описание
Киста печени представляет собой доброкачественное новообразование, локализующееся внутри или на поверхности печени. Это серьезное заболевание, которое может быть чревато сложными последствиями для организма. Самой большой опасностью является то, что зачастую, при небольших новообразованиях оно протекает совершенно бессимптомно и может оставаться без внимания и лечения долгие годы. Часто киста на печени обнаруживается случайно: в результате УЗИ брюшной области, проведенного по совсем другому поводу. Нередки случаи, когда доброкачественные новообразования на печени могут быть выявлены в результате вскрытия только после смерти человека, так как при жизни она не проявляла никаких симптомов. При этом киста чаще всего не является причиной смерти.
Киста представляется собой полое образование, состоящее из мягких тканей снаружи, а внутри заполнена жидкостью или желеобразной густой массой. Цвет содержимого может варьироваться от прозрачного до темно-зеленого. Интенсивность цвета обычно прямо пропорциональна плотности содержимого.
Размер образования может варьироваться от нескольких миллиметров до 20 сантиметров в диаметре. Размер кисты зависит от ряда причин. Во-первых, очень важен возраст кисты. Когда она только образовалась, ее размер может быть крошечным. Но прогрессируя под воздействием различных факторов, со временем она может вырасти до очень больших размеров. Во-вторых, огромную роль играет механизм образования, так как некоторые виды кист могут сразу развиться до довольно больших размеров буквально за несколько недель. Третьим, но не менее важным фактором развития кисты на печени человека является ее локализация. Дело в том, что разные части печени в большей или меньшей степени способствуют росту и развитию кисты. Так, например, киста, которая образовалась на поверхности печени, будет расти быстрее и интенсивней, чем внутренняя киста.
Сама по себе киста небольшого размера не представляет большой опасности в процессе обычной своей жизнедеятельности. Человек может всю жизнь прожить с печёночной кистой, не подозревая о ее наличии, так как симптомы себя никак не проявили. Однако своевременная диагностика кисты крайне важна, так как может помочь избежать неблагоприятных последствий и осложнений. Если кисту обнаружить своевременно, при наличии определенных положительных факторов, избавиться от нее можно путем медикаментозной терапии. Киста печени у детей также чаще лечится медикаментозно. В остальных случаях имеет место хирургическое вмешательство и полное удаление кисты. Операция обычно проводится, когда киста находится на поверхности печени, если киста внутри, то преимущественно назначается лекарственная терапия.
Виды печеночных кист
Кисты печени имеют сложную классификацию. Самым главным способом разделения является выделение ложных и истинных кист. Истинные кисты имеют врожденный характер, а также отличаются наличием выстилки внутри эпителия. В свою очередь, кисты истинные подразделяются на несколько разновидностей в зависимости от морфологических особенностей строения: ретенционные, простые, дермоидные, многокамерные.
Ложные кисты могут быть приобретены человеком в процессе жизнедеятельности. Причинами появления таких кист могут быть перенесенные ранее операции, а также травмы и воспаления. Они приводят к изменениям в тканях печени и способствуют образованию жидкостных кист.
Кисты могут иметь разное количество полостей. В зависимости от этого выделяют одиночные и многокамерные кисты печени. Существует также такое заболевание как поликистоз. Он диагностируется при наличии кист в различных сегментах печени.
По способу взаимодействия с печенью кисты делятся на паразитарные и непаразитарные кисты печени. Возникновение паразитарных кист называют в медицинской практике эхинококкоз печени, так как он вызван эхинококковыми кистами печени. Встречается также разновидность альвеококковых кист. Они образуются в результате поражения кист гельминтами. Различают также билиарные кисты печени и холангиогенную кисту печени.
Причины появления печеночных кист
Врачи не имеют однозначного варианта, от чего появляется киста печени в человеческом организме. Также однозначно не известно, почему именно женщины в большинстве своем страдают от кист. Причины, которые чаще всего приводят к образованию печеночных кист, могут быть разными: в зависимости от того, какая разновидность кисты возникла.
Воспалительная гиперплазия желчных путей, сопровождаемая обструкцией, часто приводит к истинной кисте. При этом развитие эмбриона не сопровождается подключением внутридольковых потоков к общей системе путей желчевыделения, и возникает желчная киста печени. Эпителий продолжает секретировать жидкость непрерывно, однако, в связи с тем, что полость получается замкнутой, жидкость в ней скапливается. Таким образом, при нарушении этого процесса может образоваться гидратная киста печени. Эта теория имеет высокую вероятность истинности, так как в составе кисты не встречается содержание желчи. Соответственно ее пути не имеют точек соприкосновения с каналами желчевыделения, которые нормально функционируют. Солитарная киста печени может содержать прозрачную жидкость, если она образовалась совсем недавно, а зеленая слизь образуется чаще в застарелых кистах, которые локализируются в области печени на протяжении нескольких лет.
Кроме того, прием гормональных препаратов часто влечет такую побочную реакцию как возникновение печеночной кисты. Однако не все производители синтетических гормонов говорят об этом, так как прямая связь не установлена. Также имеет место ряд случаев возникновения ложных кист на фоне приема оральных контрацептивов. Таким образом, киста на печени причины возникновения может иметь различные.
Последствия возникновения кисты
Маленькая субкапсулярная киста может находится на поверхности или внутри печени и даже не проявлять себя и не причинять никакого дискомфорта ее владельцу. Однако при достижении ею более крупных размеров человек может испытывать болезненность в области печени, а также чувство давления, тошноту и рвоту, запоры или диарею. Киста печени может привести к потере человеком трудоспособности на определённый период. Вызывает киста холецистит. Она приводит к постоянной слабости, потере аппетита, сонливости и одышке. При лечении кисты нужно обязательно соблюдать диету и следовать рекомендациям врача.
Киста печени чем опасна? Она может повлечь за собой и серьезные осложнения:
- Воспаление;
- Разрыв кисты печени;
- Распространение гельминтов.
Воспалительный процесс обычно сопровождается резкими, но терпимыми болями и высокой температурой. Он может привести к гепатомегалии. Киста печени также увеличивается в этом случае. Обычно при госпитализации и проведении первичного осмотра врач может методом тактильного анализа почувствовать наличие уплотнения в пораженной области и направит на УЗИ, которое и выявит воспаленную кисту. Ее нужно срочным образом удалять, а до операции провести курс противовоспалительной терапии. Если воспаленную доброкачественную кисту печени не лечить, то она может привести к заражению крови, абсцессу и некрозу тканей, что ведет к летальному исходу.
Разрыв кисты происходит чаще всего вследствие травмы или иного резкого физического воздействия на кисту. Также киста ворот печени может лопнуть из-за утончения стенок вследствие чрезмерного наполнения жидкостью, что встречается крайне редко. При разрыве содержимое кисты изливается непосредственно в брюшную полость, и чтобы спасти жизнь пациента, нужно проводить экстренную полостную операции по удалению остатков кисты и ее содержимого из брюшной полости.
Распространение гельминтов может возникнуть, если киста паренхимы печени была вызвана паразитарным путем и имеет ложную специфику. При отсутствии лечения гельминты продолжают свое размножение и локализуются на других органах. Гельминты могут послужить причиной возникновения различных опасных заболеваний. Заражение организма гельминтами приводит к гельминтозу. При распространении в нескольких внутренних органах оно очень сложно поддается лечению и требует длительной медикаментозной терапии. Гельминты истощают организм и могут привести к летальному исходу. Такие последствия кисты печени очень опасны.
Опасной является киста печени у плода во время беременности. Так как ее лечение проблематично, и в случае возникновения осложнений придётся вызывать искусственные роды, иначе есть риск смерти плода. Часто у них возникают паренхиматозные кисты печени.
Таким образом, сама по себе киста печени может находиться в организме человека долгие годы и никак себя не проявлять. Если киста со временем или сразу после возникновения, увеличивается в размерах, возникает определенная клиническая картина, которая позволяет вовремя диагностировать заболевание и избавиться от кисты хирургическим путём или медикаментозно, благодаря чему рассасывается киста печени. Противопоказания при этом обязательно должны быть учтены при назначении лечения. Например, киста и аллергия могут представлять ряд противопоказаний к приему тех или иных лекарств. Однако в случае несвоевременного или неэффективного лечения киста может привести к неблагоприятным последствиям: таким как воспаление, разрыв или распространение возбудителей. Несвоевременное оказание помощи может закончиться летальным исходом для пациента, и в ряде случаев так и происходит.
Симптомы
Фото: sprosivracha.com
Признаками кисты печени являются следующие проявления в организме человека:
- длительная тошнота;
- частая отрыжка;
- продолжительная диарея;
- тупая боль, которая локализуется в правом подреберье, но может отдавать в область пупка, левую руку и лопатку;
- выраженная одышка при незначительной физической нагрузке;
- мышечная слабость;
- повышенная утомляемость;
- усиление болевого синдрома во время физической нагрузки;
- появление большого дискомфорта в правом подреберье во время поездки в транспорте, особенно, если происходит сильная тряска;
- некоторое снижение аппетита;
- повышенная потливость;
- асимметричная деформация живота. В этом случае четко видно, что печень сильно увеличена в размере;
- резкое похудение без видимых причин;
- повышение температуры тела.
Причины развития кисты печени до конца не определены. Это может быть вызвано пороками развития в процессе эмбриогенеза или другими факторами, которые появились на протяжении жизни человека. Лечение данного заболевания подразумевает применение консервативных и радикальных методов в зависимости от степени разрастания новообразования и его типа. Народные средства также широко используются против кисты печени, если она еще не представляет серьезной опасности для жизни и здоровья человека.
Киста в печени – первые симптомы заболевания
В большинстве случаях киста в печени может никак не проявляться. Особенно это касается случаев, когда наблюдается лишь одно новообразование или несколько небольших. Также редко жалуется на наличие неприятных симптомов человек, у которого кисты образовались на разных частях печени. Поэтому часто данное заболевание удается выявить только во время УЗД-диагностики, которая была назначена во время профилактического осмотра. Также киста печени может сочетаться с другими проблемами, которые проявляются более выраженно. На дальнейшее развитие первых симптомов влияет характер новообразований, их размещение, форма, размер и общее состояние здоровья человека.
Боли при кисте печени – один из первых симптомов заболевания. Они локализуются в области правого подреберья, иногда могут отдавать на центральную часть живота, в левый бок, руку или даже лопатку. В большинстве случаев боль имеет тупой характер и проявляется после значительной физической нагрузки или после приема пищи. По мере течения заболевания значительный дискомфорт в области размещения печени наблюдается уже и в спокойном состоянии. Также боль проявляется во время поездки на транспорте, когда человека начинает трясти.
Когда киста достигает диаметра 70 мм, или появляется несколько новообразований, которые поразили больше 20% печени, развиваются другие симптомы. К ним относят:
- отрыжка, которая проявляется очень часто;
- человек чувствует насыщение после приема небольшого количества пищи;
- при пальпации или обычном визуальном осмотре наблюдается значительное увеличение печени;
- человек постоянно чувствует тошноту;
- появляется метеоризм;
- больного мучает диарея, которая продолжается длительное время.
Неспецифические симптомы кисты печени
У некоторых больных наблюдаются неспецифические признаки данного заболевания, которые только при комплексном подходе к диагностике могут указать на развитие кист печени. К таким симптомам относят:
- повышенное потоотделение;
- появление субфебрильной температуры: особенно в вечернее время;
- появление одышки;
- постоянная усталость и быстрая утомляемость;
- потеря аппетита.
Осложнения при появлении кисты
Данное новообразование очень опасно для жизни и здоровья человека, потому что оно может вызывать большое количество осложнений, которые сопровождаются ярко выраженными симптомами.
В случае развития воспалительного процесса в первую очередь при кисте печени болит живот в области правого подреберья. При этом данные ощущения могут распространяться на соседние участки тела, что приносит еще больше страданий больному. Параллельно с этим симптомом появляется повышенная температура, озноб, мышечная слабость. Человек чувствует усталость, снижается его работоспособность, он плохо спит и отказывается от пищи. На фоне такого состояния больной может похудеть.
Если киста расположена недалеко от желчевыводящих путей, она может вызвать механическую желтуху, которая проявляется следующими симптомами:
- выраженная тупая боль в правом боку, которая постепенно нарастает;
- моча окрашивается в темный цвет;
- кал становится почти белым;
- кожа, склеры и слизистые глаз приобретают желтый оттенок. По мере развития болезни кожные покровы окрашиваются в землистый оттенок;
- тошнота и рвота;
- человек чувствует нестерпимый зуд на коже;
- значительное снижение аппетита, которое приводит к похудению;
- повышение температуры тела;
- увеличение печени.
Если человек не обращается к врачу и не предпринимает никаких мер, боли приобретают спазматический характер. Они становятся резкими и доставляют много страданий для больного человека. При этом внешние признаки данной проблемы проявляются только спустя 24-48 часов после развития болевого синдрома.
Симптомы эхинококковой кисты печени
При появлении эхинококковой кисты человек не чувствует никакого дискомфорта и неприятных ощущений. Данное заболевание развивается без выраженных симптомов на протяжении нескольких лет. На первом этапе развития эхинококковой кисты возможны такие ее проявления:
- быстрая утомляемость;
- потеря работоспособности;
- мышечная слабость;
- появление аллергической реакции разного проявления;
- повышение температуры, которое имеет скачкообразный характер.
По мере увеличения размера кисты появляются другие симптомы. В первую очередь человек чувствует выраженную тупую боль в правом боку, которая увеличивается при физической нагрузке или после приема пищи. При осмотре наблюдается увеличение размера живота с правой стороны. При пальпации ощущается, что печень стала больше, уплотнена. При надавливании на живот человек не ощущает боли.
Также больного беспокоит расстройство пищеварения, которое выражается следующими симптомами – тошнотой, рвотой, изменением нормального стула (он становится слишком жидким, дефекация проходит очень редко).
При значительном увеличении размеров кист наблюдается выраженный болевой синдром, который сопровождается высокой температурой. При этом у больного появляется озноб, он чувствует слабость и усталость.
Разрыв кисты печени – симптомы
Если происходит значительное увеличение размеров кисты печени при механическом воздействии, она может разорваться, что очень опасно для жизни человека. При этом происходит следующее:
- больной чувствует резкую нестерпимую боль;
- через несколько секунд человек ощущает облегчение, которое сопровождается мышечной слабостью;
- у человека выступает холодный пот;
- появляется шум в ушах и «мушки» перед глазами;
- больной человек теряет сознание.
Если вы наблюдаете развитие таких симптомов у своего близкого, нужно вызывать скорую помощь. Очень важно произвести неотложное лечение, поскольку данное состояние очень опасно для больного человека. В некоторых случаях оно может приводить даже к смерти.
Диагностика
Фото: infopechen.ru
Киста печени очень часто возникает без проявления каких-либо серьезных симптомов. Поэтому в медицинской практике зачастую встречается ситуация, когда кисту обнаруживают при диспансерном осмотре пациента или узи брюшной полости совсем по другому поводу, например, при диагностировании какого-либо заболевания желудочно-кишечного тракта, так как признаки кисты печени можно спутать и с другими заболеваниями какого-либо из органов, располагающегося в этой части брюшной полости.
При диагностировании кисты печени очень важно определить, какой тип кисты у пациента, и в каком количестве они находятся в печени. То есть: существуют ли еще кисты помимо обнаруженной. Кроме того, нужно замерить размеры кисты, наличие воспалительных процессов и зафиксировать местоположение кисты печени. Диагностика предполагает следующие виды исследований:
- МРТ;
- КТ;
- УЗИ;
- Пункция кисты печени.
При помощи таких исследований как МРТ и КТ киста печени дифференцируется от других похожих заболеваний. Например, гемангиома или различные опухоли органов брюшной полости. МРТ является наиболее полезным с информативной точки зрения исследованием. По его результатам будет видна общая картина заболевания. Проводится оно в условиях стационара при помощи специального аппарат – томографа. В ее результате можно получить 3D изображение любого органа и изучить все отклонения.
Компьютерная томография же помогает изучить орган изнутри, благодаря этому исследование носит уникальный характер. Компьютерная томография позволяет получить послойные изображения, которые говорят о структуре пораженного органа и новообразования. Это исследование предназначено для идентификации самых маленьких кист на поверхности и внутри печени. При помощи КТ можно выявить кисты на самых ранних стадиях их возникновения и обнаружить поликистоз. В случае обнаружения большого числа кист при помощи КТ можно обнаружить их конечное количество на момент исследования. КТ брюшной полости на предмет наличия кист печени проводится посредством введения контрастного препарата внутривенно. В то время как КТ, исследующее другие органы брюшной полости, проводится методом орального введения препарата.
Для всех классических морфологических исследований кисты проводится УЗИ печени. Киста в этом случае рассматривается с точки зрения размера и типа образования. УЗИ наиболее простой и распространённый способ исследования органов брюшной полости. Это обусловлено наличием аппаратов для проведения УЗИ практически в любой клинке: как частной, так и государственной. Это нужно для того, чтобы принять решение, каким будет лечение: медикаментозным или радикальным.
Кроме того, нужно взять пункцию для определения наличия онкомаркеров при кисте печени. Онкомаркеры помогут определить, является ли новообразование доброкачественным. При отрицательном результате имеет место возникновение раковых клеток в области печени, и ставится совсем другой диагноз. Соответственно, анализ на онкомаркеры используется при дифференциальной диагностике кисты печени от рака.
Если выявлено, что киста имеет паразитарный характер возникновения, нужно обязательно провести исследования крови и определить локализацию паразитов в других органов. В таком случае лечение будет проводиться не только с целью устранения кисты, но и для избавления от вызвавших ее гельминтов, чтобы предотвратить рецидив заболевания и неблагоприятные последствия гельминтоза.
Своевременная и правильная диагностика заболевания помогает предотвратить его негативные последствия. Это очень важно, так как в ряде случаев возникновения кисты печени, это заболевание лечится медикаментозным способом.
Если диагностика проведена своевременно, но киста не может быт вылечена при помощи лекарств, то может быть проведена лапароскопия кисты печени, и она будет удалена самым простым способом. Однако, если довести состояние пациента до возникновения осложнений, и киста внезапно разорвется, или возникнет кровоизлияние в брюшную полость, то потребуется полостная операция для удаления остатков кисты и вычищения брюшной полости от ее содержимого.
Итак, важно не только вовремя установить наличие новообразований в области печени. Диагностика кисты включает в себя установления количества, размера и характера кист. Нужно определить, по какой причине возникло это новообразование, чтобы предотвратить рецидивы заболевания, а также провести полное исследование обнаруженных кист для определения корректной схемы лечения. Своевременно и правильно поставленный диагноз может не только помочь пациенту пережить более легкий и консервативный способ лечения, но и спасти ему жизнь, так как внезапное наступление осложнений чревато очень серьезными последствиями.
Лечение
Фото: liverandpancreassurgeon.com
Диета
При кисте необходимо придерживаться диеты, которая поможет улучшить состояние больного, а в некоторых случаях – предотвратить оперативное вмешательство. Определенные ограничения нужно соблюдать и после хирургического удаления образований. Это позволяет предупредить повторное развитие кисты и восстановить ткани печени. Следует исключить из рациона:
- жареную пищу;
- блюда, приготовленные с большим количеством жира;
- копчености;
- консервированные и маринованные продукты;
- пищу с высоким содержанием соли;
- сладкие и газированные напитки;
- кондитерские и хлебобулочные изделия;
- кофе и крепкий чай;
- острые соусы, приправы, пряности.
Правильное питание предполагает ежедневный прием продуктов, богатых витаминами, минералами и другими полезными веществами. К таковым относят овощи и фрукты в сыром, тушенном, вареном или запеченном виде. Рекомендуется чаще употреблять капусту, морковь, топинамбур, болгарский перец, клубнику, пастернак, петрушку. Необходимо включать в свой рацион рыбу, нежирные сорта мяса, молоко, кефир, творог, йогурт.
Нужна ли операция
Если в процессе диагностики была обнаружена киста, диаметр которой не превышает 3 см, хирургическое вмешательство не требуется. Следует периодически проходить обследование у гастроэнтеролога для своевременного выявления изменений. В качестве показаний к удалению рассматриваются:
- Выявление образования размером 3 см. Абсолютным показанием являются кисты более 10 см.
- Рецидив после пункционных методов лечения.
- Наличие осложнений: нагноения, разрыва, кровотечения.
- Сдавление желчевыводящих путей и нарушение оттока желчи.
- Ярко выраженные симптомы, негативно влияющие на качество жизни.
Хирургическое лечение
Операции при кисте печени могут быть радикальными (резекция, трансплантация), условно радикальными (энуклеация), паллиативными (аспирация, вскрытие и дренирование, марсупиализация, фенестрация). Суть методов заключается в следующем:
- Фенестрация. Лапароскопическая методика. Делаются небольшие разрезы для введения оборудования. Через прокол в кисте происходит ее опорожнение. Стенки образования иссекают. Осуществляют коагуляцию ложа.
- Энуклеация (вылущивание). Показана при средних и небольших кистах. Предполагает полное удаление новообразования, при этом здоровые ткани органа остаются незатронутыми. Операция может проводиться чрез несколько небольших отверстий (лапароскопический метод) или через широкий разрез в брюшной полости (лапаротомный метод).
- Дренирование. Вмешательство происходит под ультразвуковым или рентгеновским контролем. Врач устанавливает иглу в межреберное пространство точно внутрь образования. Через иглу вводится специальная струна для дренирования кисты. Осуществляется промывание полости антисептическими растворами.
- Марсупиализация. Применяется, когда образование нельзя полностью удалить из-за особенностей локализации или спаек с соседними органами.
- Резекция печени. Кисту удаляют вместе с окружающими измененными тканями. В зависимости от расположения патологического очага резекция может быть клиновидной, краевой, сегментарной и пр.
Лекарства
Фото: moveria.de
При выборе комплекса лекарственных препаратов для лечения кисты и реабилитации после ее резекции необходимо учитывать особенности организма пациента, индивидуальную переносимость тех или иных средств. Классическая схема лечения преследует такие цели, как:
- Восстановление печени. Производится с использованием средств на основе натуральных фосфолипидов.
- Обезболивание. Анальгетики показаны в раннем послеоперационном периоде.
- Стимуляция иммунитета. Препараты на растительной основе рекомендованы при наличии иммунных нарушений и в фазе восстановления после операции.
- Коррекция гормонального сбоя. Необходима женщинам с кистами на фоне гормональных расстройств. Обычно осуществляется с использованием прогестагенов.
Народные средства
Фото: mostlynoodles.com
Народные средства являются вспомогательным методом, не заменяют прием фармпрепаратов или операцию. Прежде чем применять какие-либо методы лечения, необходимо проконсультироваться со специалистом для исключения противопоказаний.
Одним из наиболее эффективных лекарственных растений является лопух. Рекомендуется взять листья молодого лопуха и отжать в соковыжималке. Далее нужно поставить получившийся сок в холодильник и пить по 2-3 столовых ложки в день в течение 30 дней.
Также для лечения кисты народными средствами можно использовать чистотел. Следует выжать сок растения и смешать его с водкой или со спиртом в одинаковых пропорциях. Средство принимают утром натощак, за час до завтрака, предварительно разбавив молоком. Начинать можно с десяти капель на стакан и последовательно довести до двадцати капель. Затем дозу постепенно снижают и снова доводят до десяти капель на стакан.
Помимо трав в лечении кисты на печени советуют использовать кедровые орехи, а точнее – их скорлупу. Нужно взять 100 г. кедровой лузги и залить их прохладной водой. В течение получаса кипятить на среднем огне и выпить получившийся отвар в течение одного дня. Использовать скорлупу можно 2-3 раза, потом необходимо брать новую.
Средства нетрадиционной медицины успешно используются при разных заболеваниях, но необходимо помнить, что самолечение может еще больше навредить здоровью. Любой шаг должен обговариваться со специалистами.
Информация носит справочный характер и не является руководством к действию. Не занимайтесь самолечением. При первых симптомах заболевания обратитесь к врачу.
Источники
- Непаразитарные кисты печени в терапевтической практике. Автореферат диссертации/ Турко Т.В. – 2004.
- Хирургия печени/ Альперович Б.И. – 2013.
- Клиническая хирургия/ Альперович Б.И., Цхай Т.В. – 2008.
- Руководство по хирургии печени и желчевыводящих путей/ Борисов А.Е. – 2002.
Ваши комментарии о симптомах и лечении
Рак печени у детей и подростков
Гепатоцеллюлярная карцинома у детей встречается редко. Она обычно диагностируется у детей в возрасте 12–14 лет, редко — у детей младше 5 лет.
Факторы риска и причины возникновения гепатоцеллюлярной карциномы
Гепатоцеллюлярная карцинома обычно встречается у взрослых с заболеванием или повреждением печени (цирроз печени) из-за инфекции, определенных состояний здоровья или повреждения вследствие употребления наркотических веществ и алкоголя. У детей старшего возраста и подростков может развиться этот вид рака, но у большинства из них нет известных факторов риска. Только у трети детей с гепатоцеллюлярной карциномой существуют факторы риска, которые делают их более подверженными развитию рака. К ним относятся:
- Гепатит В или С
- Воздействие этанола (алкоголя)
- Воздействие винилхлорида
- Воздействие афлатоксина В1
- Применение андрогенных анаболических стероидов
- Сахарный диабет
- Некоторые наследственные или врожденные заболевания:
- Метаболические состояния, включая тирозинемию и гликогеновую болезнь
- Семейные холестатические синдромы, включая синдром Алажиля и билиарную атрезию
- Нейрофиброматоз
- Атаксия-телеангиэктазия
- Анемия Фанкони
Прогноз при лечении гепатоцеллюлярной карциномы
Гепатоцеллюлярная карцинома хуже поддается лечению, потому что она редко реагирует на химиотерапию. Полное удаление опухоли путем операции или пересадки печени дает наилучшие шансы на выздоровление. Общая выживаемость составляет менее 30%. Факторы, влияющие на вероятность выздоровления:
- Распространение опухоли на другие части тела.
- Возможность полного удаления опухоли путем хирургической операции.
Лечение гепатоцеллюлярной карциномы
Хирургическая операция — единственный способ лечения гепатоцеллюлярной карциномы. Химиотерапия используется для уменьшения размера опухоли до такой степени, чтобы ее можно было полностью удалить. Однако этот тип рака не очень чувствителен к химиотерапии.
Если при диагностике выявлено, что опухоль уже распространилась за пределы печени, можно попробовать химиотерапию или локальную терапию.
Препарат сорафениб может помочь замедлить развитие рака. Регорафениб был одобрен для пациентов, которые ранее лечились сорафенибом. Некоторые препараты, такие как цисплатин, для детей могут действовать лучше, чем для взрослых.
Локальная терапия может помочь пациентам, которые ждут пересадки печени. Основная цель этих методов лечения — замедлить рост опухоли и продлить жизнь, а не обеспечить излечение.
Чем опасны заболевания почек у детей?
Любое недомогание малыша, даже самое, на первый взгляд, незначительное вселяет в родителей первобытный ужас и панику, заставляя мучиться вопросом: чем можно помочь? Что уж говорить о сложных и достаточно тяжелых заболеваниях.
К великому сожалению, количество детей с различной патологией почек за последние несколько лет значительно увеличилось. Дают о себе знать и неблагополучная экологическая ситуация и осложнения инфекционных болезней. Врачи говорят о том, что практически каждый шестой ребенок, страдает какой-либо нефроурологической патологией. И такие данные не могут не пугать, ведь почки – это один из тех органов, которые обуславливают «чистоту» организма, отвечая за выведение из него токсических веществ и продуктов распада, являясь как бы природным фильтром. Что должны знать родители, чтобы уберечь почки ребенка, и что рекомендуют специалисты? Слово детскому нефрологу ОКДЦ Алексею Кожину
Наблюдаться с рождения
– С первых дней жизни нередко проявляются наследственные и генетически обусловленные заболевания. Среди инфекционных факторов доминирует внутриутробная инфекция, проникающая в организм крохи во время родов. Это случается в том случае, если мама была носителем хламидийной или микоплазменной инфекции. Малыш автоматически получает ее „в подарок», и под удар попадают уязвимые почки.
Дело в том, что к моменту рождения их развитие еще не завершено. Фильтрующая поверхность почек новорожденного в 5 раз меньше, чем у взрослого, однако уже к полугоду у большинства детей она достигает значений, близких к таковым у взрослых. По мере взросления процессы выделения становятся все совершеннее. Однако адаптационные способности детского организма хуже, чем взрослого, особенно в так называемые критические периоды созревания. Их три: от новорожденности до 2-3 лет, от 4-5 до 7-8 лет и подростковый, в котором происходит резкое изменение обмена веществ под влиянием гормонов.
Риск развития заболеваний почек высок у тех детей, чьи родители страдают пиелонефритом, обменными заболеваниями (мочекаменная болезнь,артрозы, ферментопатии), эндокринными, расстройствами (ожирение, заболевания щитовидной железы). Около 50% детей, прошедших реанимацию новорожденных, к сожалению, имеют патологии почек.
У младенцев обменную нефропатию мама может заподозрить сама — по слишком ярким пятнам на пеленках — мочекислый диатез проявляется необычно интенсивным окрашиванием мочи. Сориентироваться в дальнейшем обследовании и лечении поможет анализ мочи.
У мальчиков внимательная мама заметит ослабление струи мочи. Причиной этого считают наличие врожденных клапанов мочеиспускательного канала или нарушение его нервной регуляции. Благодаря появлению новых эффективных лекарств, совершенствованию хирургической техники, установке стентов — устройств, препятствующих неправильному току мочи, такие дети ведут активный образ жизни, выполняя рекомендации лечащего доктора.
Насторожить в плане врожденной патологии почек может также отсутствие мочеиспускания у новорожденного более 24-48 часов после рождения, отеки, повышение артериального давления. При врожденной аномалии почечных сосудов требуется своевременное хирургическое вмешательство.
Боли в животе у детей младшего возраста даже без изменений в моче часто могут быть связаны с аномалиями органов мочевой системы. Дизурия — боль или резь при мочеиспускании, учащение или урежение мочеиспусканий, недержание или неудержание мочи указывают на возможность инфекции мочевых путей. Врожденные изменения в мочевыделительной системе, сопровождающиеся обратным забросом мочи из мочевого пузыря, часто предрасполагают к инфекции мочевых путей, в том числе пиелонефриту.
Во всем виновата инфекция?
Одно из самых распространённых заболеваний, которое выявляет педиатр при обследовании в поликлинике – инфекция мочевых путей. Постановка этого диагноза осуществляется после сдачи анализов мочи (общий анализ мочи и посев мочи на стерильность). При этом доктор, как правило, назначает антибактериальную терапию, она должна нормализовать анализы мочи. После такого лечения ваш ребенок ,как правило, забывает о заболевании почек на достаточно продолжительное время. Но так случается не всегда, и вот почему.
Причиной заболевания у девочек очень часто становится воспаление в вагине, которое проявляется вульвовагинитом. Ребенок жалуется на болезненность больших и малых половых губ, на странные выделения. Эти выделения из вагины попадают в мочевой пузырь и у ребенка возникает цистит , появляются жалобы на боли внизу живота, учащенное или редкое иногда болезненное мочеиспускание, потом восходящая мочевая инфекция попадает из мочевого пузыря в почки.
Если не провести все необходимые лабораторные исследования, не пройти консультацию детского гинеколога, не выполнить УЗИ почек, с полным мочевым пузырем и замером толщины стенки мочевого пузыря, установить причины, которые привели к данному заболеванию, будет сложно.
Мамы девочек часто спрашивают, что приводит к вульвовагиниту. Самая распространенная причина — неправильный туалет наружных половых органов , когда не выполняется ежедневная обработка с лактоцидом, или другим аналогичным мылом, больших и малых половых губ до входа во влагалище.
Второй причиной вульвовагинита может стать инфицирование от взрослых посредством постельного белья, на котором находятся выделения взрослой женщины или мужчины, пластмассовая мебель в аквапарках и бассейнах, на которых посидел больной взрослый; а так же при посещении туалетов в школах и детских садах через унитаз.
Диагноз поставлен – как лечить?
Практически все часто встречающиеся заболевания почек лечатся комбинированно: антибактериальная терапия в инъекциях или таблетках сочетается с использованием гинекологических свечей и промыванием вагины.
Для лечения цистита также необходима комбинированная терапия: антибактериальные препараты в сочетании с внутрипузырными промываниями антисептиками мочевого пузыря через уретральный катетер, а также физиотерапия на область мочевого пузыря. При неправильной тактике диагностики и лечения инфекции мочевых путей, дети годами получают по несколько курсов антибактериальной терапии в год с кратковременным эффектом.
Поэтому при выборе индивидуальной схемы лечения так важно посоветоваться не только с детским нефрологом, и с детским гинекологом, но и с урологом для проведения цистоскопии – это инструментальное обследование мочевого пузыря.
Одна из проблем у мальчиков — физиологический фимоз, который родители ребенка должны обнаружить приблизительно к 3 годам. Многие папы и мамы не занимаются этим вопросом вплоть до старших классов школы, пока сам ребенок не озаботится данной проблемой. При обследовании таких мальчиков анализы мочи будут собраны неправильно и окажутся неинформативными.
Сколько пьет ваш ребенок?
Одним из важнейших критериев в диагностике работы мочевого пузыря является определение ритмов мочеиспускания , вы должны следить за тем сколько раз ваш ребенок помочился за сутки и какими порциями. Чтобы правильно провести данное исследование, нужно также учитывать ежедневную водную нагрузку, знать с каким интервалом ребенок пил жидкость. Есть мнение, что в среднем он должен пить не меньше литра жидкости в день, а в летний период от 1.5 до 2.0 литров жидкости в день. При нормальной водной нагрузке моча ребенка будет светло-желтого цвета, становясь иногда прозрачной, как вода. При неудовлетворительной водной нагрузке моча становится ярко желтой, иногда мутной и непрозрачной.
Если мы начнем обсуждать, какими порциями должен мочиться ребенок, то существуют возрастные критерии. У грудного малыша объем мочевого пузыря составляет около 90 мл, поэтому он мочится порциями от 30-50 мл и до 90 мл, в 2 года объем мочевого пузыря 120 мл, в 3 года — 130 мл, в 4 года — 140 мл и в 5 лет — 150 мл. Бывает, что ваш 5-летний ребенок с утра мочится по 200 и 300 мл, что соответствует порции практически взрослого человека. Как же это происходит?
Оказывается, мочевой пузырь, как и желудок, при желании можно растянуть до невероятных размеров. Есть дети, которые привыкли перед сном пить воду в объеме 250-300 мл. Эта вода находится в мочевом пузыре всю ночь, растягивая его (кстати, иногда, на фоне этой привычки появляется ночное недержание мочи). Есть ряд детей, которые не добегают до туалета днем, не удерживая мочу. В основе этой проблемы также стоит переполненный мочевой пузырь. Когда мочевой пузырь привычно становится растянутым, он не может полностью эвакуировать мочу. В дальнейшем в нём легко возникают вирусно — бактериальные инфекции, приводящие к появлению циститов и восходящей инфекции мочевых путей.
Иногда на фоне переполненности возникает ситуация, при которой моча из мочевого пузыря возвращается обратно в лоханку почки, деформируя и растягивая её. Такой процесс нередко приводит к необходимости оперативного лечения. Для предотвращения заболеваний почек важно знать, сколько жидкости пьет ваш ребенок — достаточно ли промываются почки, и каков объём порции при мочеиспускании.
О чем нам расскажет УЗИ?
Родители часто приходят на прием к нефрологу за разъяснением данных УЗИ почек. Этот метод очень нужен каждому врачу : он описывает, как выглядят почки, дает представление об анатомии органа. Однако на основании УЗИ далеко не всегда удается сразу поставить окончательный диагноз. Этот метод требует уточнения другими более точными рентгеноурологическими исследованиями. При этом очень важно, на каком аппарате выполнено УЗИ, и насколько был опытен специалист, выдавший заключение.
Иногда приходится перепроверять данные УЗИ почек и проводить более углубленное специализированное обследование. Главное — не надо оставлять за спиной нерасшифрованные диагнозы, поставленные на УЗИ, чтобы в дальнейшем не опоздать с назначением необходимого лечения. В первую очередь стоит обратить внимание на различные деформации анатомии почек, нарушение уродинамики, и на нарушение оттока мочи из почек или мочевого пузыря.
Вот мы и подошли ещё к одному достаточно распространенному заболеванию – пиелонефриту. Часто, опрашивая родителей о наличии болезней почек в семье, можно услышать — у меня был хронический пиелонефрит. А в чем он проявлялся? – «Болела спина, живот, повышалась температура и были изменения в анализах мочи. Эта ситуация повторялась 1 или 2 раза в году».
Почему же пиелонефрит возвращался вновь и вновь? Хронический пиелонефрит часто называют вторичным пиелонефритом, так как в основе этого заболевания лежит сочетание инфекции мочевых путей и нарушение уродинамики, или оттока мочи из почек или мочевого пузыря. Если вам назначили антибактериальную терапию без выяснения причин пиелонефрита, то настоящей ремиссии болезни вы не получите. Пиелонефрит будет возвращаться. И в этой ситуации вам нужен грамотный нефролог, а, возможно, и уролог, который проведет все необходимые обследования и установит истинную причину нарушений.
Всегда надо помнить о главном
Мой опыт практического врача показывает, что в последние годы возникает много различных заболеваний на фоне токсических и химических поражений органов , ведущих к тяжелым заболеваниям почек. Неоднократно отмечалось, что после употребления в пищу арбуза, выращенного на азотистых удобрениях, или клубники из теплицы в мае; у ребёнка появлялась моча с примесью крови, или начинался тяжелый аллергический процесс, который иногда приводил к отечному синдрому.
Такие заболевания почек лечились длительно, в нефрологических клиниках, с применением гормональной терапии. Поэтому не забывайте о том, что лучше дать ребёнку овощи и фрукты, соответствующие сезону и выращенные в собственном огороде, чем недоброкачественный продукт неизвестного происхождения.
На фоне герпес-вирусной инфекции возникают нефриты и циститы, которые невозможно вылечить без полной ликвидации основной вирусной инфекции. Дети с таким диагнозом нуждаются в консультации иммунолога и нефролога с проведением ИФА-диагностики для определения активности вирусной инфекции.
Лечение заболеваний почек невозможно без современной диагностической базы. Это хорошо знают специалисты Областного консультативно-диагностического центра, где сосредоточена новейшая аппаратура экспертного класса и внедрены европейские стандарты обследования.
Недаром, в последнее врем, в ОКДЦ вырос и поток маленьких пациентов. В этом ведущем лечебном учреждении ЮФО теперь принимают не только педиатры, но и детские врачи практически всех узких специальностей.
Заболеваний почек великое множество и их можно описывать очень долго. Я остановился на отдельных, самых распространённых случаях. Важно помнить о главном: если у вашего ребенка есть изменения в анализах мочи и крови, или обнаружились какие-либо проблемы на УЗИ — не затягивайте свой приход к опытному нефрологу. В противном случае, лечиться придется гораздо дольше, а возникшие осложнения могут привести даже к необратимым последствиям.
Что это такое, причины, профилактика и лечение
Обзор
Печень и другие органы брюшной полости
Что означает повышенный уровень ферментов печени?
Если у вас высокий уровень ферментов печени в крови, у вас повышенный уровень ферментов печени. Высокий уровень ферментов печени может быть временным или быть признаком такого заболевания, как гепатит или заболевание печени. Некоторые лекарства также могут вызывать повышение уровня печеночных ферментов.
Что такое ферменты печени?
Ферменты печени — это белки, которые ускоряют химические реакции в организме.Эти химические реакции включают образование желчи и веществ, которые способствуют свертыванию крови, расщеплению пищи и токсинов и борьбе с инфекциями. Общие ферменты печени включают:
- Щелочная фосфатаза (ЩФ).
- Аланинтрансаминаза (АЛТ).
- Аспартаттрансаминаза (AST).
- Гамма-глутамилтрансфераза (GGT).
Если ваша печень повреждена, она выделяет ферменты в кровоток (чаще всего АЛТ или АСТ).
Почему врач проверяет ферменты печени?
Ваш лечащий врач может проверить уровень ферментов в печени с помощью функционального теста печени (LFT) или панели печени.Тест функции печени — это разновидность анализа крови. Ваш врач может назначить LFT во время регулярного осмотра, если вы подвержены риску повреждения или заболевания печени или если у вас есть симптомы поражения печени.
Возможные причины
Что вызывает повышение ферментов печени?
Заболевания печени, медицинские состояния, лекарства и инфекции могут вызывать повышение уровня ферментов печени.
Общие причины повышенного уровня печеночных ферментов включают:
Другие причины повышенного уровня печеночных ферментов включают:
Каковы факторы риска повышенного уровня ферментов печени?
Факторы, повышающие уровень ферментов печени, включают:
- Злоупотребление алкоголем.
- Некоторые лекарства, травы и витаминные добавки.
- Диабет.
- Семейный анамнез заболевания печени.
- Гепатит или подверженность гепатиту.
Каковы симптомы повышенного уровня ферментов печени?
У большинства людей с повышенным уровнем ферментов печени симптомы отсутствуют. Если повреждение печени является причиной повышения ферментов печени, у вас могут быть такие симптомы, как:
Уход и лечение
Как лечат повышенные ферменты печени?
Около одной трети людей с повышенным уровнем ферментов печени будут иметь нормальный уровень ферментов печени через две-четыре недели.Если уровень ферментов печени остается высоким, ваш врач может заказать дополнительные анализы крови или визуализационные тесты, такие как УЗИ, компьютерная томография или МРТ. Они также могут направить вас к специалисту по печени (гепатологу). Лечение будет зависеть от того, что вызывает повышение уровня ферментов печени.
Можно ли предотвратить повышение ферментов печени?
Некоторые заболевания, повышающие активность печеночных ферментов, невозможно предотвратить. Но есть шаги, которые вы можете предпринять, чтобы сохранить свою печень здоровой:
- Избегайте употребления алкоголя или употребления алкогольных напитков в умеренных количествах, в зависимости от совета врача.
- Не передавайте иглы или предметы, загрязненные кровью.
- Придерживайтесь здоровой диеты.
- Сделайте вакцину против гепатита A и B.
- Следите за уровнем сахара в крови, если у вас диабет.
- Сообщите своему врачу обо всех принимаемых вами лекарствах, травах и добавках.
- Следите за своим весом.
- Регулярно делайте физические упражнения.
Записка из клиники Кливленда
Повышение уровня ферментов печени может быть вызвано различными причинами, в том числе заболеваниями печени и приемом лекарств.Повышенные ферменты печени также могут быть временными. Если ваш анализ крови показывает высокий уровень ферментов печени, поговорите со своим врачом. Они постараются выяснить причину.
Виноват ли запой? > Новости> Yale Medicine
Для молодого человека, который любит активную социальную жизнь, пандемия COVID-19 изменила многое. Но одна вещь, которая, похоже, не сильно изменилась, — это привлекательность алкоголя, которая — во всяком случае, — кажется, усилилась. Бары и вечеринки, возможно, больше не подходят, но есть «счастливые часы Zoom», встречи вдали от общества, коктейли для пары или даже выпивка в одиночестве, все из которых может привести к серьезным последствиям, включая заболевание печени, которое, по словам врачей, растет. молодые люди.
Альберт До, доктор медицины, клинический директор Йельской медицинской программы по борьбе с ожирением печени, сообщает, что он регулярно принимает молодых пациентов с циррозом, который является медицинским диагнозом поздней стадии рубцевания печени, вызванных чрезмерным употреблением алкоголя. «Страшно то, что им всего 30-40 лет», — говорит он, отмечая, что шансы на развитие заболевания печени тем выше, чем дольше человек пьет, и чаще всего встречается в возрасте от 40 до 50 лет. Другое Доктора Йельской медицины диагностировали у людей заболевание печени, когда им еще было 20 лет.
Это не только тревожное событие, но и, возможно, удивительное, учитывая, что последняя информация показывает, что миллениалы (родившиеся с 1981 по 1996 год) и представители поколения Z (родившиеся с 1997 года по настоящее время) пьют меньше, чем предыдущие поколения — на самом деле, Опросы показывают, что употребление алкоголя в этих группах резко снизилось с 1990-х годов. Но другие исследования показывают, что смертность от заболеваний печени, вызванных алкоголем, является самой высокой среди миллениалов: исследование, опубликованное в 2018 году, показало, что смертность от болезней печени увеличивается на 10% в год среди людей в возрасте от 25 до 35 лет, в то время как смертность от рака печени удвоилась в этой группе.
«Общее снижение употребления алкоголя — это большой плюс, но это не говорит всей картины, потому что употребление алкоголя среди молодых людей все еще может быть довольно проблематичным», — говорит Федерико Вака, доктор медицины, магистр здравоохранения, врач скорой медицинской помощи Йельской больницы Нью-Хейвен и Исследователь.
Часто доктор Вака видит, как молодые люди прибывают в отделение неотложной помощи (ED) в тяжелом состоянии алкогольного опьянения — некоторые из них настолько пьяны, что едва могут ходить или говорить, говорит он. По его словам, эти молодые пациенты могут иметь или не иметь хроническое расстройство, связанное с употреблением алкоголя [широко известное как алкоголизм].
Его беспокоит то, что они часто обращаются за неотложной помощью в отделение неотложной помощи после эпизода «запоя» или, что еще хуже, «чрезмерного запоя», который несет в себе значительный риск опасного для жизни отравления алкоголем. По данным Центров по контролю и профилактике заболеваний (CDC), пьянство наиболее распространено среди молодых людей в возрасте 18–34 лет, и большинство пьяных людей моложе 21 года также сообщают о пьянстве.
Жировая болезнь печени — Здоровье детей округа Ориндж
Каковы симптомы жировой болезни печени?
Жировая болезнь печени иногда называют тихой болезнью печени, потому что она может протекать без каких-либо симптомов.Большинство людей с НАЖБП живут с жиром в печени, не вызывая поражения печени. У некоторых людей с жиром в печени развивается НАСГ.
Дети, подростки и молодые люди с НАСГ могут иметь симптомы. Если повреждение печени в результате НАСГ приводит к необратимому рубцеванию и затвердеванию печени, это называется циррозом.
Симптомы НАСГ могут включать:
- Сильная усталость
- Слабость
- Похудание
- Пожелтение кожи или глаз
- Паукообразные кровеносные сосуды на коже
- Продолжительный зуд.
НАСГ, переходящий в цирроз, может вызывать такие симптомы, как задержка жидкости, внутреннее кровотечение, мышечное истощение и спутанность сознания. У людей с циррозом может развиться печеночная недостаточность, и им потребуется пересадка печени. Узнайте больше о циррозе печени.
Кто подвержен риску жировой болезни печени?
Точная причина ожирения печени неизвестна, но ожирение, по-видимому, является наиболее частой причиной. За последнее десятилетие ожирение в США удвоилось, и поставщики медицинских услуг наблюдают неуклонный рост жировой болезни печени.Хотя дети и молодые люди могут заболеть жировой болезнью печени, чаще всего она встречается в среднем возрасте.
К факторам риска относятся:
- Избыточный вес
- Наличие высокого уровня жира в крови, либо триглицеридов, либо ЛПНП («плохой») холестерина
- Болеют диабетом или преддиабетом
- Повышенное кровяное давление.
Как диагностируется жировая болезнь печени?
Жировая болезнь печени может протекать без каких-либо симптомов. Обычно это диагностируется во время обычных анализов крови, чтобы проверить здоровье и функцию печени.Врач вашего ребенка может заподозрить жировую болезнь печени с отклонениями в результатах анализов, особенно если ребенок страдает ожирением. Чрезмерное употребление алкоголя и инфекция, а также другие причины могут привести к отклонениям в тестах печени.
Визуализирующие исследования печени могут показать жировые отложения, но единственный способ диагностировать жировую болезнь печени — это биопсия печени. Биопсия печени заключается в введении длинной иглы через кожу ребенка в печень. Игла удаляет небольшой кусочек ткани печени, который можно рассмотреть под микроскопом.
- Если в ткани есть жир, но нет воспаления или повреждений, диагноз — НАЖБП.
- Если в ткани есть жир, воспаление и повреждение печени, диагноз — НАСГ.
- Если ткань имеет вид рубцовой ткани, называемый фиброзом, у ребенка может развиваться цирроз.
Подробнее о биопсии печени.
Как лечить жировую болезнь печени?
Дети, подростки и молодые люди с НАЖБП без каких-либо других медицинских проблем могут не нуждаться в специальном лечении.Внесение изменений в образ жизни может контролировать или обращать вспять накопление жира в печени ребенка. Сюда могут входить:
- Похудение
- Снижение холестерина и триглицеридов
- Борьба с диабетом
- Употребление лекарств, например безрецептурных лекарств
- Отказ от алкоголя.
Если у вашего ребенка НАСГ, нет лекарств, которые могли бы обратить вспять накопление жира в его печени. В некоторых случаях повреждение печени прекращается или даже прекращается.Но у других болезнь продолжает прогрессировать. Если у вашего ребенка НАСГ, важно контролировать любые состояния, которые могут способствовать развитию жировой болезни печени. Лечение и изменение образа жизни могут включать:
- Похудение
- Лекарство для снижения холестерина или триглицеридов
- Лекарство для снижения артериального давления
- Лекарства от диабета
- Ограничение безрецептурных препаратов
- Отказ от алкоголя
- На приеме к печеночнику.
Некоторые лекарства изучаются как возможные методы лечения НАСГ, включая антиоксиданты, такие как витамин Е. Ученые также изучают некоторые новые лекарства от диабета от НАСГ, которые можно давать, даже если у ребенка нет диабета.
Почему ожирение печени вызывает беспокойство?
Основным осложнением жировой болезни печени является прогрессирование НАСГ в цирроз. Цирроз означает постоянное рубцевание и уплотнение печени.
Если у вашего ребенка была диагностирована жировая болезнь печени, важно
- Обратитесь к врачу вашего ребенка, если его симптомы ухудшатся. Эти симптомы включают усталость, потерю аппетита, потерю веса, слабость, задержку жидкости или кровотечение.
- Узнайте как можно больше об этом заболевании и работайте в тесном сотрудничестве с медицинской бригадой вашего ребенка.
- Всегда сообщайте всем лечащим врачам вашего ребенка о любых лекарствах, которые они принимают. Сюда входят безрецептурные препараты, пищевые добавки и витамины.
- Следуйте инструкциям по лечению болезни. Жировая болезнь печени можно лечить, поддерживая здоровый вес, придерживаясь сбалансированной диеты, регулярно делая физические упражнения и продолжая избегать алкоголя.
Проявления печени при гематологических заболеваниях
Abstract
Поражение печени часто наблюдается при нескольких гематологических заболеваниях, что приводит к аномальным функциональным тестам печени, аномалиям визуализирующих исследований печени или клиническим симптомам, проявляющимся в печени. При гемолитической анемии желтуха и гепатоспленомегалия часто напоминают заболевания печени. При гематологических злокачественных новообразованиях злокачественные клетки часто инфильтрируют печень и могут демонстрировать аномальные результаты тестов функции печени, сопровождающиеся гепатоспленомегалией или образованием множественных узелков в печени и / или селезенке.В дальнейшем эти случаи могут перерасти в фульминантную печеночную недостаточность.
1. Введение
Гепатологи или терапевты иногда сталкиваются с печеночными проявлениями различных гематологических нарушений в повседневной практике, включая различные отклонения в тестах функции печени или визуализирующих исследованиях печени. Некоторые гематологические нарушения также имитируют заболевания печени. Хотя обзорные статьи о гематологических нарушениях и заболеваниях печени публиковались ранее [1–3], мы также рассматриваем более свежие темы в этой статье.
2. Нарушения эритроцитов (эритроцитов)
2.1. Гемолитическая анемия (ГА)
2.1.1. Классификация по сайту разрушения эритроцитов
При серьезном повреждении мембраны эритроцитов в кровотоке происходит немедленный лизис (внутрисосудистый гемолиз). В случаях менее серьезного повреждения клетки могут разрушаться внутри моноцитарно-макрофагальной системы в селезенке, печени, костном мозге и лимфатических узлах (внесосудистый гемолиз) [4–6].
2.1.2. Клиническая картина
Пациенты с ГК обычно обращаются со следующими признаками: быстрое начало анемии, желтуха, пигментные (билирубиновые) желчные камни в анамнезе и спленомегалия.Также может возникнуть легкая гепатомегалия [4].
2.1.3. Функциональные тесты печени на HA
При гемолизе уровни сывороточной лактатдегидрогеназы (ЛДГ) (особенно изоформ LDh2 и LDh3) повышаются из-за лизированных эритроцитов [4]. Уровни аспартаттрансаминазы сыворотки (AST) также слегка повышаются при гемолизе, с Отношение ЛДГ / АСТ чаще всего превышает 30 [7]. Уровень общего билирубина редко может превышать 5 мг / дл, если функция печени в норме, за исключением случаев острого гемолиза, вызванного серповидно-клеточным кризом.Дисфункция печени также может быть вызвана переливанием крови при анемии при серповидно-клеточной анемии (ВСС) и талассемии [1, 3].
2.1.4. Гемолиз при заболеваниях печени
Гемолиз может быть вызван либо аномалиями мембран эритроцитов (внутренними), либо факторами окружающей среды (внешними). Большинство внутренних причин являются наследственными, за исключением пароксизмальной ночной гемоглобинурии (ПНГ) или редких состояний приобретенной альфа-талассемии [4].
Внешний HA вызывается иммунными или неиммунными механизмами.Внешний неиммунный HA вызывается системными заболеваниями, включая некоторые инфекционные заболевания и заболевания печени или почек. Различные заболевания печени могут индуцировать HA, и двумя основными причинами внешнего HA у пациентов с заболеванием печени являются разрушение эритроцитов в увеличенной селезенке (гиперспленизм) и приобретенные изменения в мембране красных клеток (например, клетки-мишени, акантоциты, эхиноциты и стоматоциты). Заболевания печени, особенно вызванные алкогольной интоксикацией, вызывают тяжелую гипофосфатемию [8–10], которая, предположительно, приводит к снижению уровня аденозинтрифосфата в эритроцитах, что приводит к хрупкости и сфероидности мембран эритроцитов.Эти эритроциты легко захватываются селезенкой из-за их пониженной деформируемости. Когда преобладающей причиной является чрезмерное употребление алкоголя, состояние быстро улучшается после прекращения употребления алкоголя.
Синдром Зиве — плохо изученное заболевание, характеризующееся ожирением печени / циррозом, сильной болью в верхней части живота и правом подреберье, желтухой, гиперлипидемией и HA [11–13].
2.2. Аутоиммунный HA (AIHA)
AIHA характеризуется повышенным разрушением эритроцитов за счет аутоантител с активацией комплемента или без нее.Диагностика АИГА включает сочетание клинических и лабораторных признаков гемолиза эритроцитов вместе с обнаружением аутоантител и / или отложением комплемента на эритроцитах, обнаруживаемых с помощью прямого антиглобулинового теста, также известного как прямой тест Кумбса [14]. Более чем у половины пораженных пациентов АМСЗ связан с основным заболеванием, включая какой-либо тип инфекционного заболевания, иммунного расстройства или лимфопролиферативного расстройства (вторичный АИГА), тогда как у других пациентов нет никаких признаков основного заболевания (идиопатического или первичного АИГА). [15].
2.2.1. Тесты функции печени при АИГА
Лабораторные данные АИГА не отличаются от результатов других причин гемолиза, то есть снижения уровня гаптоглобина в сыворотке, непрямой билирубинемии и повышенных уровней ЛДГ в сыворотке (преобладание I> II) и АСТ (в основном ЛДГ). / AST> 30). Общий билирубин в сыворотке редко превышает 5 мг / дл, часто наблюдается поликлональная гипергаммаглобулинемия.
2.2.2. Печеночная недостаточность в AIHA
Иммуноглобулин (Ig) G-антитела (редко IgM-антитела) обычно реагируют с антигенами на поверхности эритроцитов при температуре тела и поэтому называются «теплыми агглютининами», тогда как IgM-антитела (редко типа IgG) реагируют с антигенами. на поверхности эритроцитов ниже температуры тела и поэтому называются «холодовыми агглютининами».«Тепло реагирующие антитела IgM могут привести к печеночной недостаточности in vivo аутоагглютинации [16]. Сообщалось о летальном случае, когда первичный АИГА проявлялся острой печеночной недостаточностью [16]. У пациента наблюдались повторяющиеся эпизоды внутрисосудистого гемолиза. Несмотря на терапию кортикостероидами, спленэктомию и многократные переливания крови, пациент в конечном итоге скончался от печеночной недостаточности.
2.3. PNH
PNH — это необычный тип приобретенного гемолиза, который встречается у взрослых среднего возраста [17, 18].Пациенты обращаются с темной мочой (гемоглобинурия), обычно это утренние пробы. Было доказано, что ПНГ является приобретенным клональным генетическим заболеванием, вызванным соматической мутацией X-сцепленного гена PIG-A в гемопоэтических стволовых клетках [19].
2.3.1. Клиническая картина
Клинические проявления ПНГ в первую очередь связаны с нарушениями функции кроветворения, ГК, состоянием гиперкоагуляции, гипоплазией или аплазией костного мозга и прогрессированием до миелодиспластического синдрома или острого лейкоза [18].
2.3.2. Диагноз ПНГ
ПНГ ранее ставился косвенно на основании чувствительности эритроцитов ПНГ к лизированию комплементом. Тест на лизис сахарозы используется в качестве скринингового теста, а диагноз подтверждается тестом на кислотный гемолиз Хэма [20–22]. Однако обнаружение дефицита гликозилинозитолфосфолипидного белка при ПНГ с помощью проточного цитометрического анализа было разработано для диагностики [23].
2.3.3. ПНГ-ассоциированное заболевание печени
Одним из серьезных осложнений ПНГ является развитие состояния гиперкоагуляции и образование тромбов.Тромбоз при ПНГ обычно возникает во внутричерепных, печеночных или воротных сосудах. ПНГ является одной из наиболее частых причин появления тромбоза воротной вены de novo и редкой причиной синдрома Бадда-Киари [24].
2.4. Серповидноклеточная болезнь (SCD)
SCD — это аутосомно-рецессивное генетическое заболевание, возникающее в результате наследования варианта гемоглобина S (Hb S) цепи β -глобина. Наиболее тяжелая форма с гомозиготностью по Hb S (Hb SS) называется серповидноклеточной анемией (SCA).Менее тяжелые формы обладают гетерозиготностью по Hb S и C (Hb SC) или Hb β -талассемия (Hb β -thal). Эритроциты деформируются до серповидной формы, склонны к гемолизу, часто образуя скопления в сосудистой сети (вазоокклюзионный криз), вызывая повреждение органов [25].
2.4.1. Проявление печени при SCD
Печень может быть поражена заболеванием с сосудистыми осложнениями от серповидного процесса. Более того, многократные переливания крови, необходимые для лечения, могут увеличить риск вирусного гепатита, перегрузки железом и развития пигментированных желчных камней, все из которых может способствовать развитию заболевания печени, называемого «серповидноклеточная гепатопатия» [26–28].Острая боль в животе и отклонения в тестах функции печени, а также желтуха могут быть вызваны острым серповидно-печеночным кризом, серповидноклеточным внутрипеченочным холестазом, холециститом и холедохолитиазом с обструкцией общего желчного протока.
2.4.2. Функциональные пробы печени при SCD
Нарушения функциональных проб печени часто встречаются у пациентов с SCD. Повышение непрямого билирубина, ЛДГ и АСТ без других признаков заболевания печени обнаруживается у 72% пациентов с ВКА, что связано с гемолизом и / или неэффективным эритропоэзом [29].Концентрации общего билирубина обычно <6 мг / дл, но могут удвоиться (<15 мг / л) во время серповидно-печеночного криза [30]. Уровни АЛТ в сыворотке могут более точно отражать повреждение гепатоцитов [29]. Щелочная фосфатаза (ЩФ) в сыворотке крови, преимущественно костного происхождения, обычно повышена [31].
Острое повышение сывороточной аминотрансферазы может наблюдаться при ишемии печени при вазоокклюзионном кризе, тогда как хронические нарушения функции печени обнаруживаются у 9–25% пациентов [29, 32], обычно вызванные сопутствующими заболеваниями печени, такими как хронические гепатит B или C, непроходимость общего желчного протока или употребление алкоголя.
2.4.3. Гипераммониемия из-за дефицита цинка при SCD
Низкие уровни цинка в плазме наблюдаются у 44% пациентов с SCD [33], что может привести к развитию энцефалопатии из-за гипераммонемии у пациентов с циррозом и SCA, которую можно исправить введением цинка [34] .
2.4.4. Визуализирующие исследования печени при SCD
Результаты компьютерной томографии пациентов с гомозиготной SCA выявляют диффузную гепатомегалию. Селезенка обычно небольшая, атрофическая и может иметь плотные кальцификаты из-за повторного инфаркта селезенки.Двойные гетерозиготы (Hb SC и Hb S β -thal) обычно имеют спленомегалию и могут проявлять инфаркт, разрыв, кровотечение или абсцесс селезенки.
МРТ может показывать снижение интенсивности сигнала в печени и поджелудочной железе [35] из-за отложений железа у пациентов с ВСС, получающих хронические переливания крови [36–39]. УЗИ брюшной полости может выявить камни в желчном пузыре или повышенную эхогенность печени и поджелудочной железы из-за отложений железа [37].
3. Нарушения свертывания крови
3.1. Диссеминированная внутрисосудистая коагуляция (ДВС)
ДВС — системный процесс, вызывающий как тромбоз, так и кровотечение. Патогенез ДВС-синдрома обусловлен, прежде всего, чрезмерным производством тромбина, что приводит к широко распространенному и системному внутрисосудистому образованию тромбов. Основными инициирующими факторами являются высвобождение или экспрессия тканевого фактора, вторичного по отношению к обширному повреждению эндотелия сосудов или усиленная экспрессия моноцитами в ответ на эндотоксин и различные цитокины. Наиболее частыми причинами ДВС-синдрома являются сепсис, травмы и разрушение тканей, рак и акушерские осложнения.
3.1.1. Диагностика ДВС-синдрома
Диагноз ДВС-синдрома предполагает наличие анамнеза и симптомов, тромбоцитопении и наличия микроангиопатических изменений в мазке крови. Диагноз подтверждается лабораторными тестами, которые демонстрируют доказательства как увеличения образования тромбов (например, снижение фибриногена), так и увеличения фибринолиза (например, повышение количества продуктов распада фибрина или D-димера).
3.1.2. Печеночные проявления при ДВС-синдроме
Желтуха часто встречается у пациентов с ДВС-синдромом и может быть вызвана повреждением печени и повышенным продуцированием билирубина вследствие гемолиза.Кроме того, гепатоцеллюлярное повреждение может быть вызвано сепсисом и гипотонией. Общие проявления острого ДВС-синдрома, помимо кровотечения, включают тромбоэмболию и дисфункцию почек, печени, легких и центральной нервной системы. В серии из 118 пациентов с острым ДВС-синдромом нарушение функции печени было обнаружено у 19% [38]. Тяжелое заболевание печени включает снижение синтеза факторов и ингибиторов свертывания крови [39], фибринолиз, фибриногенолиз и повышенный уровень продуктов распада фибрина.Тромбоцитопения может быть вызвана гиперспленизмом, вторичным по отношению к портальной гипертензии.
3.2. Синдром антифосфолипидных антител (APS)
Синдром антифосфолипидных антител (APS) или синдром APLA характеризуется присутствием одного из антифосфолипидных антител (aPL) в плазме и возникновением любых клинических проявлений, включая венозные или артериальные тромбозы или заболеваемость беременностью. .
3.2.1. Клиническая картина
APS возникает как первичный или вторичный из основных заболеваний, таких как системная красная волчанка (СКВ).В серии первичных или вторичных АФС, тромбоз глубоких вен (ТГВ) (32%), тромбоцитопения (22%), ретикулярная ливедо (20%), инсульт (13%), поверхностный тромбофлебит (9%), тромбоэмболия легочной артерии (9%) , потеря плода (8%), транзиторная ишемическая атака (7%) и гемолитическая анемия (7%) часто наблюдаются [40], а венозные тромбозы встречаются чаще, чем артериальные тромбозы [41, 42]. Хотя наиболее частыми участками, где возникает ТГВ, являются икры и почечные вены, также могут быть поражены печеночные, подмышечные, подключичные и сетчатые вены, пазухи головного мозга и полая вена.
3.2.2. Проявление печени в APS
Поражение печени может включать тромбоз печени или воротной вены, который может привести к синдрому Бадда-Киари, веноокклюзионной болезни печени, инфаркту печени, портальной гипертензии и циррозу. [40, 43].
3.3. Синдром HELLP
Синдром HELLP определяется гемолизом с микроангиопатическим мазком крови, повышенными ферментами печени и низким количеством тромбоцитов [44]. Синдром HELLP встречается примерно у 1-2 на 1000 беременностей и у 10-20 процентов женщин с тяжелой преэклампсией / эклампсией.
3.3.1. Клиническая картина
Наиболее частыми клиническими проявлениями являются боль в животе [45], тошнота, рвота и недомогание, которые могут напоминать вирусный гепатит, особенно если уровни АСТ и ЛДГ в сыворотке заметно повышены [46]. Гипертония и протеинурия присутствуют примерно в 85 процентах случаев. Дифференциальный диагноз включает острую жировую болезнь печени при беременности (ОЖП). Увеличение протромбинового времени, активируемое частичным тромбопластиновым временем (АЧТВ), низкие концентрации глюкозы и повышенные концентрации креатинина чаще встречаются у женщин с AFLP, чем у женщин с HELLP.
3.3.2. Проявление печени при синдроме HELLP
Синдром HELLP и тяжелая преэклампсия могут быть связаны с печеночными проявлениями, включая инфаркт, кровотечение и разрыв.
4. Криоглобулинемия
4.1. Определение и классификация
Осадки в сыворотке крови при температуре ниже 37 ° C относятся к криоглобулину (CG). ХГ состоит из иммуноглобулина (Ig) и компонентов комплемента [47], а криоглобулинемия относится к наличию ХГ в сыворотке крови пациента.Согласно классификации Бруэ, основанной на клональности Ig [48], существует три типа ХГ. Тип I CG (моноклональный Ig) обычно связан с гематологическими злокачественными новообразованиями, такими как макроглобулинемия Вальденстрема или множественная миелома. CG типа II (поликлональные и моноклональные Ig) часто является вторичным по отношению к хроническим инфекциям, таким как гепатит C или инфекция вируса иммунодефицита человека. CG типа III (поликлональный Ig) часто является вторичным по отношению к системным ревматическим заболеваниям.
4.2. Клиническая презентация
Клинические признаки ХГ типа I (моноклональные Ig) включают синдром повышенной вязкости из-за гематологических злокачественных новообразований.В то время как CG типа II и III (смешанный и поликлональный Ig, соответственно) присутствуют с «триадой Мельцера» пальпируемой пурпуры, артралгии и миалгии, вызванной васкулитом в сосудах малого и среднего размера [49].
Вторичные лимфопролиферативные расстройства встречаются менее чем у 5–10 процентов пациентов с ХГ типа II через 5–10 лет после постановки диагноза [50–52]. Первичные злокачественные новообразования включают В-клеточную неходжкинскую лимфому, лимфому средней и высокой степени злокачественности и лимфому низкой степени злокачественности, такую как иммуноцитома, лимфоидные опухоли, связанные со слизистой оболочкой, и центроцитарную фолликулярную лимфому.Среди пациентов с криоглобулинемией II типа, связанной с гепатитом С, частота неходжкинской лимфомы оценивается в 35 раз выше, чем в общей популяции.
4.3. Криоглобулинемия при инфекции ВГС
Патогенез ХГ наиболее изучен при хронической инфекции ВГС. Гиперактивация В-клеток может быть результатом инфицирования В-клеток ВГС через белок клеточной поверхности CD81 [53], хронической антиген-неспецифической стимуляции макромолекулярными комплексами сыворотки, содержащими ВГС, включая ВГС-IgG и ВГС-липопротеин [54, 55], или от антиген-специфический механизм HCV [56], приводящий к размножению специфических клонов B-клеток, экспрессирующих идиотип WA [57] или V (H) 1-69 [58].Частицы HCV часто обнаруживаются в комплексах CG, но развитие CG при инфекции гепатита C не обязательно требует вириона HCV или его компонентов [59].
Среди пациентов с инфекцией ВГС количество циркулирующих регуляторных Т-клеток сравнивалось между пациентами с симптоматической и бессимптомной ХГ [60], и было обнаружено, что средние уровни регуляторных Т-клеток были значительно ниже у пациентов с симптоматической ХГС-ассоциированной ХГ. чем бессимптомные предметы.
4.4. Печеночная манифестация криоглобулинемии
Сообщалось о печеночных проявлениях в виде гепатомегалии, аномальных функциональных тестов печени или аномальной биопсии печени, причем до 90 процентов, возможно, из-за самого хронического гепатита [61].
5. Гематологические новообразования
5.1. Классификация новообразований кроветворного происхождения
Новообразования, происходящие из кроветворных и лимфоидных тканей, классифицируются в соответствии с их морфологическими, иммунофенотипическими, генетическими и клиническими особенностями, а также по типу происхождения клеток и стадии дифференцировки в соответствии с широко применяемой и принятой Всемирной организацией здравоохранения система классификации 2001 г., обновленная в 2008 г. [62].
Миелоидные новообразования включают хронические миелопролиферативные новообразования (МПН), МДС или острые лейкозы миелоидного происхождения.Лимфоидные новообразования подразделяются на острый лимфобластный лейкоз / лимфому, происходящие от предшественников В- или Т-лимфоидных клеток, или на опухоли, происходящие из зрелых Т- или В-лимфоцитов, включая плазматические клетки. Новообразования гистиоцитарных / дендритных клеток происходят из антигенпрезентирующих клеток или тканевых макрофагов. Редкие случаи не поддаются классификации по миелоидной или лимфоидной линии [62].
6. Миелоидные новообразования
Хронические MPN, также называемые миелопролиферативными нарушениями, классически включают хронический миелоидный лейкоз (CML), истинную полицитемию (PV), эссенциальную тромбоцитемию и первичный идиопатический миелофиброз.
6.1. CML
CML — это MPN, характеризующийся нарушением регуляции продукции и неконтролируемой пролиферацией зрелых и незрелых гранулоцитов с нормальной морфологией. Опухолевые клетки происходят из плюрипотентных гемопоэтических стволовых клеток, имеющих приобретенный гибридный ген BCR-ABL1 , обычно в результате транслокации между хромосомами 9 и 22, t (9; 22) (q34; q11), именуемой филадельфийской (Ph ) хромосома. BCR-ABL1 индуцирует лейкемогенез через киназозависимые и независимые пути передачи сигналов.Естественное течение ХМЛ варьируется от хронической фазы до ускоренной фазы или взрывного кризиса, но процесс прогрессирования полностью не изучен [62].
6.1.1. Клинические симптомы и проявление ХМЛ со стороны печени
На момент обращения у 20–50% пациентов симптомы отсутствуют. Лабораторные данные включают лейкоцитоз с незрелыми клетками гранулоцитарного ряда и базофилию, легкую анемию и тромбоцитоз. Симптомы включают усталость, недомогание, потливость и потерю веса.Боль в животе и дискомфорт могут возникать в левом верхнем квадранте (иногда относящемся к левому плечу), а также может присутствовать раннее насыщение из-за спленомегалии с периспленитом и / или инфарктом селезенки или без него. Также наблюдаются различные степени гепатомегалии. Болезненность в нижней части грудины иногда возникает из-за разрастания костного мозга, и часто встречаются эпизоды кровотечения из-за дисфункции тромбоцитов [63, 64].
В хронической фазе примерно у 50% пациентов с ХМЛ при поступлении наблюдается гепатомегалия от легкой до умеренной степени без нарушений функции печени [65].Однако во время бластного криза инфильтрация синусоид печени незрелыми клетками может привести к увеличению печени и повышению уровня ЩФ в сыворотке [66].
6.2. PV
PV является одним из хронических MPN, и клинические признаки включают повышенное количество эритроцитов, спленомегалию, тромбоцитоз и / или лейкоцитоз, тромботические осложнения, эритромелалгию или зуд. При физикальном обследовании спленомегалия, полнокровие лица (красный цианоз) и гепатомегалия выявляются у 70%, 67% и 40% пациентов соответственно [67].Непальпируемая спленомегалия распознается у большинства пациентов при визуализирующих исследованиях [68, 69].
Жалобы со стороны желудочно-кишечного тракта часто встречаются при ПВ, с высокой частотой эпигастрального дистресса, пептических язв и гастродуоденальных эрозий при эндоскопии верхних отделов желудка [70]. Они были приписаны изменениям кровотока в слизистой оболочке желудка из-за изменения вязкости крови и / или повышенного высвобождения гистамина из тканевых базофилов, хотя одно исследование показало высокую частоту положительного ответа на инфекцию Helicobacter pylori [70].Хотя прямое поражение печени встречается редко, у некоторых пациентов может развиваться острый или хронический синдром Бадда-Киари [71].
6.3. Первичный миелофиброз (PMF)
Первичный миелофиброз (PMF) — хроническое злокачественное гематологическое заболевание, характеризующееся спленомегалией, лейкоэритробластозом, фиброзом костного мозга и экстрамедуллярным гематопоэзом.
6.3.1. Проявление PMF в печени
На момент постановки диагноза PMF гепатомегалия наблюдается у 40–70% пациентов, а спленомегалия — как минимум у 90% [72–74].Гепатоспленомегалия вызывается выраженным экстрамедуллярным кроветворением, которое может развиться после спленэктомии, особенно в печени [75, 76]. В сообщении о 10 пациентах с PMF, значительное увеличение размера печени и сывороточных концентраций ALP, билирубина и / или γ -GTP наблюдалось у всех пациентов, у которых впоследствии развилась острая печеночная недостаточность, что привело к смерти 3. -4 недели после спленэктомии [76].
6.3.2. Аномальные функциональные тесты печени в PMF
Пациенты с PMF могут иметь неспецифические отклонения лабораторных тестов, включая повышение сывороточных концентраций ALP, LDH, мочевой кислоты, лейкоцитарной ALP и витамина B12 [77, 78].Повышение ЩФ может быть связано с поражением печени или костей, в то время как повышение ЛДГ может быть результатом неэффективного кроветворения.
6.4. MPN и тромбоз воротной вены
MPN могут быть нечастой причиной тромбоза тирозинкиназы воротной вены (V617F) неясной этиологии [79–81]. В таких случаях может быть обнаружена мутация JAK2 [82, 83].
6.5. MPN и синдром Бадда-Киари
Мутация JAK2 может быть обнаружена почти у всех пациентов с PV и примерно у 50 процентов пациентов с эссенциальной тромбоцитемией (ET) или PMF. JAK2 Мутации (V617F) были описаны у 26-59 процентов пациентов с синдромом Бадда-Киари без явных обнаружений MPN [84–87]. Эти данные предполагают наличие скрытых MPN у некоторых пациентов с так называемым «идиопатическим» синдромом Бадда-Киари.
7. Лимфоидные новообразования
7.1. Лимфома Ходжкина (HL)
HL, ранее называвшаяся болезнью Ходжкина, является первой выявленной лимфоидной опухолью, которая обычно возникает в лимфатических узлах и распространяется непрерывно через лимфатическую систему.HL гистологически характеризуется гигантскими клетками, называемыми клетками Ходжкина / Рида-Штернберга (H / RS), большинство из которых представляют собой трансформированные вирус-положительные В-клетки Эпштейна-Барра, присутствующие в реактивном клеточном фоне, состоящем из гранулоцитов, плазматических клеток и лимфоцитов.
7.1.1. Печеночные проявления HL
Инфильтрация злокачественных клеток в печени наблюдалась у 14% пациентов с HL. Гепатомегалия обнаруживается у 9% пациентов с I-II стадиями заболевания и у 45% пациентов с III-IV стадиями [88].Легкое повышение аминотрансферазы и умеренное повышение ЩФ может происходить из-за инфильтрации опухолью или непроходимости внепеченочных желчных протоков [88]. Холестаз может быть вызван прямой инфильтрацией клеток лимфомы, обструкцией внепеченочных желчных путей, вирусным гепатитом, гепатотоксичностью лекарств или синдромом исчезающих желчных протоков [89–91]. Приблизительно у 3–13% пациентов с HL наблюдается желтуха [90]. Острая печеночная недостаточность может быть вызвана ишемией, вторичной по отношению к сдавлению синусоидов печени инфильтрирующими клетками лимфомы [92, 93].
7.2. Неходжкинская лимфома (НХЛ)
НХЛ классифицируется по клеточной морфологии от мелкоклеточного до крупноклеточного, а в соответствии с естественным течением клинической агрессивности заболевания — как низкая, средняя или высокая степень.
7.2.1. Печеночная манифестация NHL
Лимфомная клеточная инфильтрация печени с гепатомегалией чаще встречается в НХЛ, чем в HL, при этом в 16–43% случаев наблюдается поражение печени [88]. Внепеченочная обструкция также чаще встречается при НХЛ, чем при HL, а инфильтрация печени чаще встречается при B-клеточных лимфомах низкой степени, чем при лимфомах высокой степени [94].Острая печеночная недостаточность может возникать при НХЛ, как видно из HL [95], что вызвано внезапной ишемией, связанной с массивной инфильтрацией синусоидов или замещением паренхимы печени злокачественными клетками [95]. Хотя вовлечение печени в HL и NHL может проявляться как острая печеночная недостаточность [96–101], трансплантации печени следует избегать [102].
Острая печеночная недостаточность, вызванная лимфомой, может быть заподозрена в случаях острого начала увеличения печени и лактоацидоза, отличных от других причин печеночной недостаточности [2, 103].
7.2.2. Тесты на аномальные функции печени в NHL
Тесты функции печени у пациентов с NHL показывают повышение уровня ЩФ в сыворотке от легкого до умеренного [88]. Повышенный уровень ЛДГ в сыворотке также часто наблюдается у пациентов с НХЛ, особенно при высокоагрессивном типе, таком как лимфома Беркитта или лимфобластная лимфома, что отражает высокую опухолевую нагрузку, обширную инфильтрацию печени и сопутствующую иммуноопосредованную ГК, которые связаны с плохим прогнозом. .
7.2.3. Визуализирующие исследования печени в НХЛ
Хотя диффузная гепатоспленомегалия обычно наблюдается у пациентов с вялотекущими лимфомами, функция печени при НХЛ обычно сохраняется.С другой стороны, дискретные образования печени чаще встречаются у высокоагрессивных подтипов [104, 105]. Однако не все очаговые поражения печени у пациентов с НХЛ связаны с лимфомой. В отчете о 414 последовательных пациентах с НХЛ только 39% очаговых поражений печени, обнаруженных в начале заболевания, были вызваны НХЛ, а 58% были доброкачественными [106], тогда как 74% поражений, обнаруженных во время наблюдения, были вызваны НХЛ и 15% были связаны с НХЛ. из-за злокачественного новообразования, отличного от НХЛ (например, гепатоцеллюлярная карцинома, метастатическая опухоль из другого вторичного злокачественного образования).Асцит может присутствовать и может быть хилезным в случае лимфатической обструкции.
7.3. Первичная НХЛ печени
Первичная НХЛ печени — редкое заболевание, составляющее <1% всех экстранодальных лимфом. Две трети случаев возникают у мужчин в возрасте примерно 50 лет. Симптомы включают боль в животе, лихорадку, гепатомегалию и аномальные тесты функции печени с повышением уровня ЛДГ выше, чем у АЛТ [107, 108]. Наиболее распространенным гистологическим подтипом первичной НХЛ печени является диффузная В-крупноклеточная лимфома, составляющая 80–90% случаев.Это заболевание может проявляться узелками в печени или диффузной портальной инфильтрацией и синусоидальным распространением [109].
Острая печеночная недостаточность, вызванная первичной лимфомой печени, лечилась с помощью трансплантации печени и последующей химиотерапии [110]. Хотя первичная лимфома печени встречается редко, стойкие воспалительные процессы, связанные с инфекцией ВГС или аутоиммунным заболеванием, могут играть роль в лимфомагенезе В-клеток печени [111].
7.4. Первичная гепатоспленочная NHL
Сообщалось о первичной гепатоспленочной крупноклеточной В-клеточной лимфоме, ассоциированной с ВГС [112], также может развиться острая печеночная недостаточность плода [113].Хотя этиологическая роль ВГС в лимфоме неизвестна, ВГС-положительные лимфомы, как правило, возникают в экстранодальных участках, особенно в печени, селезенке или слюнных железах, где находится ВГС и происходит хроническая инфильтрация лимфоцитов.
7,5. Внутрисосудистая диффузная крупноклеточная лимфома
Внутрисосудистая диффузная крупноклеточная лимфома или внутрисосудистая лимфома — редкое, но важное заболевание у пациентов с быстро проявляющейся лихорадкой, сыпью или ишемическими, неврологическими или респираторными симптомами.При этом состоянии опухолевые клетки обычно развиваются исключительно в мелких сосудах кожи, головного мозга, печени или легких. Биопсия из этих органов необходима для гистологического диагноза.
Симптомы лихорадки, ночного потоотделения и потери веса наблюдаются у 55–85% пациентов с В-клеточной лимфомой [114, 115]. Пораженные органы различаются в зависимости от области. В западных странах чаще всего встречаются симптомы, связанные с центральной нервной системой (39%) и кожей (39%) [114, 116, 117], тогда как симптомы, связанные с костным мозгом (32%), печенью (26%), и селезенка (26%) встречаются реже.В Азии чаще встречаются симптомы, связанные с поражением костного мозга (75%), селезенки (67%) и печени (55%) [118–121], тогда как симптомы, связанные с поражением центральной нервной системы (27%) и кожи. поражения (15%) встречаются реже [122]. Гемофагоцитарный синдром также описан в японской серии (азиатский вариант) [120].
Диагноз внутрисосудистой крупноклеточной лимфомы может быть установлен путем случайной биопсии кожи [123] или биопсии органов, предположительно пораженных; например, биопсия печени, если наблюдаются необъяснимые аномальные функциональные тесты печени, легкого, если присутствуют необъяснимые легочные симптомы, и мозга, если существуют необъяснимые неврологические симптомы [124–127].
7.6. Гепатоспленочная Т-клеточная лимфома
7.6.1. Клиническая презентация
Гепатоспленочная Т-клеточная лимфома — это редкий тип агрессивной НХЛ, связанный с пациентами, получающими терапию противоопухолевым фактором некроза альфа и аналогами пурина для лечения воспалительного заболевания кишечника [128].
7.6.2. Проявление гепатоспленической Т-клеточной лимфомы в печени
Клинические признаки включают гепатоспленомегалию, лихорадку, потерю веса, ночную потливость, панцитопению и периферический лимфоцитоз.Функциональные пробы печени повышены примерно у 50% пациентов с небольшим повышением АСТ, АЛТ или ЩФ. Уровни ЛДГ в сыворотке крови также повышены примерно у 50% пациентов, от умеренных до чрезвычайно высоких. Иммуносупрессия, особенно Т-лимфоцитов, с помощью терапии противоопухолевым фактором некроза альфа и аналогами пурина может увеличить риск этого заболевания [129].
7.7. Гемофагоцитарный синдром (ГПС)
7.7.1. Клиническая картина
HPS — это состояние, проявляющееся системными воспалительными симптомами, такими как лихорадка, гепатоспленомегалия, цитопения и гемофагоцитоз в костном мозге, селезенке и лимфатических узлах [130, 131].ГПС вызывается гиперцитокинемией, которая запускается сильно стимулированными естественными киллерами и цитотоксическими Т-клетками. Основные расстройства включают вирусные инфекции, обычно вирус Эпштейна-Барра у молодых пациентов, ревматические расстройства, синдромы иммунодефицита и агрессивные лимфомы [132]. Сообщалось, что агрессивная форма NK-клеточной лимфомы или внутрисосудистой лимфомы азиатского варианта осложняется HPS [133]. ГФС следует подозревать, если пациенты соответствуют по крайней мере пяти из следующих восьми критериев: лихорадка, спленомегалия, цитопения, гипертриглицеридемия, низкий уровень фибриногена, гемофагоцитоз при биопсии костного мозга, низкая или отсутствующая активность NK-клеток или повышенный уровень ферритина или растворимого рецептора IL2. [130].
7.7.2. Проявление HPS в печени
HPS может вызывать гепатомегалию, желтуху с холестазом, умеренное повышение уровня трансаминаз, гиперферритинемию, снижение синтетической функции печени и молниеносную печеночную недостаточность. Гепатотоксичность вызывается гемофагоцитозом синусоидов печени и воротных трактов или очаговым гепатоцеллюлярным некрозом [132].
8. Лейкемия
8.1. Острый лейкоз
8.1.1. Клиническая картина
Острые лейкозы — это новообразования, происходящие от предшественников миелоидного или лимфоидного происхождения (редко неоднозначного происхождения).Хотя ОЛЛ является наиболее распространенным злокачественным новообразованием у детей, заболеваемость увеличивается также и у пожилых людей. Заболеваемость ОМЛ увеличивается с возрастом, и ОМЛ является наиболее распространенным типом лейкозов у взрослых.
8.1.2. Проявление острого лейкоза со стороны печени
Хотя вовлечение печени при остром лейкозе обычно мягкое и бессимптомное на момент постановки диагноза [134], патологоанатомическое исследование показало инфильтрацию печени в> 95% случаев острого лимфобластного лейкоза (ОЛЛ) и до 75%. случаев острого миелоидного лейкоза (ОМЛ) [135].При ОЛЛ инфильтрация была ограничена воротными трактами, тогда как при ОМЛ инфильтрация наблюдалась как в воротных трактах, так и в синусоидах. Массивная инфильтрация печени лейкозными клетками может проявляться как фульминантная печеночная недостаточность [136]. У пациентов с острым лейкозом лекарственное поражение печени и бактериальные или грибковые инфекции также могут влиять на печень.
8.1.3. ОМЛ и гепатоспленомегалия
Пальпируемая органомегалия как проявление ОМЛ встречается редко, а значительное увеличение лимфатических узлов редко встречается у пациентов с ОМЛ.Заметная гепатоспленомегалия также встречается редко; однако, если он присутствует, у пациента скорее всего будет ОЛЛ или развитие ОМЛ в результате предшествующего миелопролиферативного расстройства (бластный кризис ХМЛ).
8.2. ОЛЛ у детей
При поступлении у детей с ОЛЛ могут быть отмечены несколько аномалий, включая дисфункцию печени, нарушения свертывания крови, гиперкальциемию, гипокальциемию, гиперкалиемию и гиперфосфатемию [137].
8.3. Предшественник B-ALL / лимфобластная лимфома (LBL) у взрослых
Предшественник B-клетки ALL связан с уменьшением количества нормальных клеток крови, вызванным замещением костного мозга опухолевыми клетками.Клинические проявления пациентов включают анемию, склонность к кровотечениям или предрасположенность к инфекциям. Часто присутствуют B-симптомы, такие как лихорадка, ночная потливость и потеря веса, но могут быть легкими. Гепатомегалия, спленомегалия или лимфаденопатия могут наблюдаться почти у половины взрослых пациентов при поступлении.
8.4. Предшественник T-ALL / LBL
Предшественник T-ALL / LBL, происходящий из Т-клеток-предшественников тимуса, обычно встречается у мужчин в возрасте примерно 20 лет. Клиническая картина включает лимфаденопатию (50%) или объемное новообразование в переднем средостении (50–75%) [138].Поражение брюшной полости встречается редко, но может быть обнаружено в основном в печени и селезенке. Более 80% пациентов имеют III или IV стадию заболевания, и почти 50% имеют B-симптомы, а уровни ЛДГ в сыворотке обычно повышены. Несмотря на то, что костный мозг при обращении часто бывает нормальным, примерно у 60% пациентов развивается инфильтрация костного мозга и последующая лейкемическая фаза, неотличимая от Т-клеточного ОЛЛ [139].
8.5. Хронический лимфоидный лейкоз (ХЛЛ)
8.5.1.Клиническая презентация
Хронический лимфолейкоз (ХЛЛ) — одно из хронических лимфопролиферативных заболеваний, характеризующихся прогрессирующим накоплением моноклональных лимфоидных клеток. Считается, что ХЛЛ идентична малой лимфоцитарной лимфоме (SLL), которая является одной из вялотекущих неходжкинских лимфом [62, 140]. ХЛЛ — наиболее распространенная лейкемия в западных странах, на которую приходится примерно 30 процентов всех лейкозов в Соединенных Штатах. Хотя ХЛЛ-лимфоциты по морфологии напоминают нормальные маленькие лимфоциты, они являются активированными клональными В-клетками на стадии между пре-В и зрелыми В-клетками.[141–143]. Лимфоциты B-CLL положительны в отношении антигенов, связанных с B-клетками (CD19, CD20, CD21 и CD23) и CD5, и экспрессируют чрезвычайно низкие уровни поверхностных мембранных иммуноглобулинов (IgM или как IgM, так и IgD).
8.5.2. Клиническая стадия ХЛЛ
Естественное течение ХЛЛ неоднородно. Системами стадирования, которые широко используются для прогнозирования прогноза пациента и определения терапевтических стратегий, являются система Раи [144] и система Бине [145].
8.5.3. Клинические особенности CLL
Наиболее частым физическим признаком является лимфаденопатия, которая присутствует у 50–90 процентов пациентов.Другой лимфоидный орган, часто увеличивающийся при ХЛЛ, — это селезенка, которая пальпируется в 25–55% случаев.
8.5.4. Печеночные проявления ХЛЛ
Пациенты с ХЛЛ часто показывают увеличение печени от легкой до умеренной степени во время первоначального диагноза в 15–25% случаев [145, 146]. Печень обычно увеличена незначительно, от 2 до 6 см ниже правого реберного края, с диапазоном тупости до перкуссии примерно 10–16 см. При пальпации печень обычно безболезненная, твердая, с гладкой поверхностью.Увеличенная печень у пациентов с ХЛЛ часто проявляется обширной лимфоцитарной инфильтрацией в портальных трактах с функциональным нарушением печени на поздних стадиях [147, 148].
8.6. Волосатоклеточный лейкоз (HCL)
8.6.1. Клиническая картина
Клиническая картина HCL включает следующее [144, 149]: (1) переполнение живота из-за спленомегалии, которое может вызвать спонтанный разрыв селезенки [150], (2) системные симптомы, такие как усталость, слабость и потеря веса. без лихорадки или ночного потоотделения, (3) склонность к кровотечениям, вызванная тяжелой тромбоцитопенией или рецидивирующими инфекциями, и (4) бессимптомная спленомегалия или цитопения, которые могут быть обнаружены случайно, и наиболее частым физическим признаком HCL является пальпируемая спленомегалия (80–90%) случаев).Массивная спленомегалия, простирающаяся более чем на 8 см ниже левого края ребра, наблюдается в 25% случаев.
8.6.2. Проявление HCL в печени
Гепатомегалия и лимфаденопатия не характерны для HCL и проявляются примерно у 20% и 10% пациентов соответственно.
8.6.3. Лабораторные данные
У большинства пациентов с HCL наблюдаются панцитопения (60–80%), анемия (85%), тромбоцитопения и нейтропения (80%). Лейкоцитоз может присутствовать в 10–20% случаев.Аномальные функциональные пробы печени и гипергаммаглобулинемия наблюдаются в 20% случаев. Клетки лейкемии часто инфильтрируют печень как в портальных трактах, так и в синусоидах, а увеличение печени наблюдается у 40% пациентов [151].
Список литературы
1. Гитлин Н. Печень и системные заболевания . Нью-Йорк, Нью-Йорк, США: Черчилль Ливингстон; 1997. [Google Scholar] 3. Сингх М.М., Покрос П.Дж. Гематологические и онкологические заболевания и печени. Клиники болезней печени .2011; 15 (1): 69–87. [PubMed] [Google Scholar]
4. Актуальность. Подход к диагностике гемолитической анемии у взрослого. 2012.
5. Cazzola M, Beguin Y. Новые инструменты для клинической оценки функции эритрона у человека. Британский гематологический журнал . 1992. 80 (3): 278–284. [PubMed] [Google Scholar] 6. Босси Д., Джардина Б. Физиология красных клеток. Молекулярные аспекты медицины . 1996. 17 (2): 117–128. [PubMed] [Google Scholar]
7. Клинические справочники по идиопатическим гемопоэтическим нарушениям.при поддержке Министерства здравоохранения, труда и социального обеспечения Японии.
8. Актуальность. Внешняя неиммунная гемолитическая анемия, вызванная системным заболеванием. 2012.
9. Якоб HS, Амсден Т. Острая гемолитическая анемия с ригидными эритроцитами при гипофосфатемии. Медицинский журнал Новой Англии . 1971. 285 (26): 1446–1450. [PubMed] [Google Scholar] 10. Шило С., Вернер Д., Хершко С. Острая гемолитическая анемия, вызванная тяжелой гипофосфатемией при диабетическом кетоацидозе. Acta Haematologica .1985. 73 (1): 55–57. [PubMed] [Google Scholar] 11. Зиве Л. Желтуха, гиперлипемия и гемолитическая анемия: ранее нераспознанный синдром, связанный с алкогольной жировой дистрофией печени и циррозом. Анналы внутренней медицины . 1958; 48 (3): 471–496. [PubMed] [Google Scholar] 12. Мелроуз У.Д., Белл П.А., Юп ДМЛ, Байки МДж. Алкогольный гемолиз при синдроме Зиева: клиническое и лабораторное исследование пяти случаев. Клиническая и лабораторная гематология . 1990. 12 (2): 159–167. [PubMed] [Google Scholar] 13.Пиччини Дж., Халдар С., Джефферсон Б. Случаи из медицинской службы Ослера в университете Джона Хопкинса. Американский медицинский журнал . 2003. 115 (9): 729–731. [PubMed] [Google Scholar] 14. Zeerleder S. Аутоиммунная гемолитическая анемия — практическое руководство для решения диагностических и терапевтических задач. Нидерландский медицинский журнал . 2011. 69 (4): 177–184. [PubMed] [Google Scholar] 15. Engelfriet CP, Van’t Veer MB, Maas N, Ouwehand WH, Beckers D, Von dem Borne Kr. A.E.G. AEG. Аутоиммунные гемолитические анемии. Клиническая иммунология и аллергия Байера . 1987. 1 (2): 251–267. [Google Scholar] 16. Шири Р.С., Киклер Т.С., Белл В., Литтл Б., Смит Б., Несс П.М. Смертельная иммунная гемолитическая анемия и печеночная недостаточность, связанные с аутоантителами IgM, реагирующими на тепло. Vox Sanguinis . 1987. 52 (3): 219–222. [PubMed] [Google Scholar] 17. Socié G, Mary JY, De Gramont A и др. Пароксизмальная ночная гемоглобинурия: отдаленное наблюдение и прогностические факторы. Ланцет . 1996. 348 (9027): 573–577.[PubMed] [Google Scholar] 18. Де Латур Р.П., Мэри Дж. Ю., Саланубат С. и др. Пароксизмальная ночная гемоглобинурия: естественное течение подкатегорий болезней. Кровь . 2008. 112 (8): 3099–3106. [PubMed] [Google Scholar] 19. Росс ВФ. Пароксизмальная ночная гемоглобинурия как молекулярное заболевание. Медицина . 1997. 76 (2): 63–93. [PubMed] [Google Scholar] 20. Hartmann RC, Jenkins DE. Тест «сахар-вода» при пароксизмальной ночной гемоглобинурии. Медицинский журнал Новой Англии .1966. 275 (3): 155–157. [PubMed] [Google Scholar] 21. Хэм TH, Дингл JH. Исследования по разрушению красных кровяных телец. II. Хроническая гемолитическая анемия с пароксизмальной ночной гемоглобинурией: некоторые иммунологические аспекты гемолитического механизма с особым упором на сывороточный комплемент. Журнал клинических исследований . 1939. 18 (6): 657–672. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Актуально. Диагностика и лечение пароксизмальной ночной гемоглобинурии. 2012.
24.Шах А. Приобретенная гемолитическая анемия. Индийский журнал медицинских наук . 2004. 58 (12): 533–536. [PubMed] [Google Scholar]
25. Актуально. Обзор клинических проявлений серповидноклеточной анемии. 2012.
26. Банерджи С., Оуэн С., Чопра С. Серповидноклеточная гепатопатия. Гепатология . 2001. 33 (5): 1021–1028. [PubMed] [Google Scholar] 27. Берри PA, Cross TJS, Thein SL, et al. Нарушение функции печени при серповидно-клеточной анемии: новая система классификации
на основе глобальной оценки. Клиническая гастроэнтерология и гепатология . 2007. 5 (12): 1469–1476. [PubMed] [Google Scholar] 28. Эберт Э.С., Нагар М., Хагшпиль К.Д. Желудочно-кишечные и печеночные осложнения серповидноклеточной анемии. Клиническая гастроэнтерология и гепатология . 2010. 8 (6): 483–489. [PubMed] [Google Scholar] 29. Джонсон С.С., Омата М., Тонг М.Дж. Поражение печени при серповидно-клеточной анемии. Медицина . 1985. 64 (5): 349–356. [PubMed] [Google Scholar] 30. Sheehy TW. Серповидно-клеточная гепатопатия. Южный медицинский журнал .1977; 70 (5): 533–538. [PubMed] [Google Scholar] 31. Броуди Дж. И., Райан В. Н., Хайдар М. А.. Изоферменты щелочной фосфатазы сыворотки при серповидно-клеточной анемии. Журнал Американской медицинской ассоциации . 1975. 232 (7): 738–741. [PubMed] [Google Scholar] 32. ДеВолт К.Р., Фридман Л.С., Вестерберг С., Мартин П., Хосейн Б., Баллас С.К. Гепатит С при серповидно-клеточной анемии. Журнал клинической гастроэнтерологии . 1994. 18 (3): 206–209. [PubMed] [Google Scholar] 33. Леонард МБ, Земель Б.С., Кавчак Д.А., Охене-Фремпонг К., Столлингс В.А.Статус цинка в плазме, рост и созревание у детей с серповидно-клеточной анемией. Педиатрический журнал . 1998. 132 (3): 467–471. [PubMed] [Google Scholar] 34. Прасад А.С., Раббани П., Варт Дж. Влияние цинка на гипераммониемию у субъектов с серповидно-клеточной анемией. Американский журнал гематологии . 1979. 7 (4): 323–327. [PubMed] [Google Scholar] 35. Гугре Н.Р., Вуд Дж. Калибровка релаксации-железа при перегрузке железом в печени: исследование основных биофизических механизмов с использованием модели Монте-Карло. Магнитный резонанс в медицине . 2011. 65 (3): 837–847. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Hankins JS, Smeltzer MP, McCarville MB, et al. Особенности накопления железа в печени у пациентов с серповидноклеточной анемией и талассемией с перегрузкой железом. Европейский гематологический журнал . 2010. 85 (1): 51–57. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Siegelman ES, Outwater E, Hanau CA, et al. Распределение железа в брюшной полости при серповидно-клеточной анемии: результаты МРТ у пациентов с переливанием и нетрансфузионной зависимостью. Журнал компьютерной томографии . 1994. 18 (1): 63–67. [PubMed] [Google Scholar] 38. Сигал Т., Селигсон У., Агай Э., Модан М. Клинические и лабораторные аспекты диссеминированного внутрисосудистого свертывания (ДВС): исследование 118 случаев. Тромбоз и гемостаз . 1978. 39 (1): 122–134. [PubMed] [Google Scholar] 39. Штейн С.Ф., Харкер Л.А. Кинетические и функциональные исследования тромбоцитов, фибриногена и плазминогена у пациентов с циррозом печени. Журнал лабораторной и клинической медицины .1982. 99 (2): 217–230. [PubMed] [Google Scholar] 40. Сервера Р., Пьетте Дж. К., Фонт Дж. И др. Антифосфолипидный синдром: клинические и иммунологические проявления и паттерны проявления заболевания в когорте из 1000 пациентов. Артрит и ревматизм . 2002. 46 (4): 1019–1027. [PubMed] [Google Scholar] 41. Ашерсон Р.А., Хамашта М.А., Орди-Рос Дж. И др. «Первичный» антифосфолипидный синдром: основные клинические и серологические признаки. Медицина . 1989. 68 (6): 366–374. [PubMed] [Google Scholar] 42.Gromnica-Ihle E, Schossler W. Антифосфолипидный синдром. Международный архив аллергии и иммунологии . 2000; 123: с. 67. [PubMed] [Google Scholar] 43. Усман I, Хамашта М. Абдоминальные проявления антифосфолипидного синдрома. Ревматология . 2007. 46 (11): 1641–1647. [PubMed] [Google Scholar] 44. Stone JH. HELLP-синдром: гемолиз, повышенные ферменты печени и низкие тромбоциты. Журнал Американской медицинской ассоциации . 1998. 280 (6): 559–562. [PubMed] [Google Scholar] 45.Сибай Б.М., Рамадан МК, Уста I, Салама М., Мерсер Б.М., Фридман С.А. Материнская заболеваемость и смертность при 442 беременностях с гемолизом, повышенными ферментами печени и низким уровнем тромбоцитов (синдром HELLP) Американский журнал акушерства и гинекологии . 1993. 169 (4): 1000–1006. [PubMed] [Google Scholar] 46. Катанзарит В.А., Стейнберг С.М., Мосли К.А., Ландерс К.Ф., Казинс Л.М., Шнайдер Дж.М. Тяжелая преэклампсия с молниеносным и резким повышением уровней аспартатаминотрансферазы и лактатдегидрогеназы: высокий риск материнской смерти. Американский журнал перинатологии . 1995. 12 (5): 310–313. [PubMed] [Google Scholar] 47. Рамос-Казальс М., Стоун Дж. Х., Сид М.К., Бош X. Криоглобулинемии. Ланцет . 2012. 379 (9813): 348–360. [PubMed] [Google Scholar] 48. Brouet JC, Clauvel JP, Danon F. Биологическое и клиническое значение криоглобулинов. Отчет о 86 случаях. Американский медицинский журнал . 1974. 57 (5): 775–788. [PubMed] [Google Scholar] 49. Росса А.Д., Тревизани Г., Бомбардиери С. Криоглобулины и криоглобулинемия: диагностические и терапевтические соображения. Клинические обзоры по аллергии и иммунологии . 1998. 16 (3): 249–264. [PubMed] [Google Scholar] 50. Инверницци Ф., Пиолтелли П., Каттанео Р. Долгосрочное последующее исследование эссенциальной криоглобулинемии. Acta Haematologica . 1979; 61 (2): 93–99. [PubMed] [Google Scholar] 51. La Civita L, Zignego AL, Monti M, Longombardo G, Pasero G, Ferri C. Смешанная криоглобулинемия как возможное предопухолевое заболевание. Артрит и ревматизм . 1995. 38 (12): 1859–1860. [PubMed] [Google Scholar] 52.Саадун Д., Селлам Дж., Гиллани-Далбин П., Кресель Р., Пьетте Дж. К., Какуб П. Повышенный риск лимфомы и смерти среди пациентов с смешанной криоглобулинемией, не связанной с вирусом гепатита С. Архив внутренней медицины . 2006. 166 (19): 2101–2108. [PubMed] [Google Scholar] 53. Пилери П., Уэмацу Й., Кампаньоли С. и др. Связывание вируса гепатита С с CD81. Наука . 1998. 282 (5390): 938–941. [PubMed] [Google Scholar] 54. Аньелло В., Чунг Р. Т., Каплан Л. М.. Роль инфекции вируса гепатита С в криоглобулинемии II типа. Медицинский журнал Новой Англии . 1992. 327 (21): 1490–1495. [PubMed] [Google Scholar] 55. Аньелло В. Этиология и патофизиология смешанной криоглобулинемии, вызванной вирусной инфекцией гепатита С. Семинары Springer по иммунопатологии . 1997. 19 (1): 111–129. [PubMed] [Google Scholar] 56. Чарльз ЭД, Грин Р.М., Марукиан С. и др. Клональная экспансия иммуноглобулина M + CD27 + B-клеток при HCV-ассоциированной смешанной криоглобулинемии. Кровь .2008. 111 (3): 1344–1356. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Knight GB, Gao L, Gragnani L, et al. Обнаружение В-клеток WA при вирусной инфекции гепатита С: потенциальный прогностический маркер криоглобулинемического васкулита и В-клеточных злокачественных новообразований. Артрит и ревматизм . 2010. 62 (7): 2152–2159. [PubMed] [Google Scholar] 58. Чарльз Э.Д., Брунетти С., Марукиан С. и др. Клональные В-клетки у пациентов со смешанной криоглобулинемией, ассоциированной с вирусом гепатита С, содержат расширенное подмножество анергических В-клеток CD21low. Кровь . 2011. 117 (20): 5425–5437. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Шотт П., Пользен Ф., Мюллер-Иссбернер А., Рамадори Г., Хартманн Х.
In vitro Реактивность криоглобулина IgM и IgG при смешанной криоглобулинемии, связанной с вирусом гепатита С. Гепатологический журнал . 1998. 28 (1): 17–26. [PubMed] [Google Scholar] 60. Бойер О., Саадун Д., Абриол Дж. И др. CD4 + CD25 + дефицит регуляторных Т-клеток у пациентов с гепатитом С-смешанным криоглобулинемическим васкулитом. Кровь . 2004. 103 (9): 3428–3430. [PubMed] [Google Scholar] 61. Монтаньино Г. Переоценка клинических проявлений смешанной криоглобулинемии. Семинары Springer по иммунопатологии . 1988. 10 (1): 1–19. [PubMed] [Google Scholar] 62. Swerdlow SH, Campo E, Harris NL, et al., Редакторы. Классификация опухолей кроветворных и лимфоидных тканей Всемирной организации здравоохранения . Лион, Франция: IARC Press; 2008. [Google Scholar] 63. Faderl S, Talpaz M, Estrov Z, O’Brien S, Kurzrock R, Kantarjian HM.Биология хронического миелолейкоза. Медицинский журнал Новой Англии . 1999. 341 (3): 164–172. [PubMed] [Google Scholar] 64. Savage DG, Szydlo RM, Goldman JM. Клинические особенности при постановке диагноза у 430 пациентов с хроническим миелоидным лейкозом, наблюдавшихся в специализированном центре в течение 16 лет. Британский гематологический журнал . 1997. 96 (1): 111–116. [PubMed] [Google Scholar] 65. Сервантес Ф., Розман С. Многофакторный анализ прогностических факторов при хроническом миелоидном лейкозе. Кровь .1982. 60 (6): 1298–1304. [PubMed] [Google Scholar] 66. Ондрейко SM, Кьельдсберг CR, Fineman RM. Монобластная трансформация при хроническом миелолейкозе: проявление массивного поражения печени. Рак . 1981. 48 (4): 957–963. [PubMed] [Google Scholar] 67. Berlin NI. Диагностика и классификация полицитемий. Семинары по гематологии . 1975. 12 (4): 339–351. [PubMed] [Google Scholar] 68. Пирсон Т.С., Мессинези М. Диагностические критерии красноватой полицитемии. Лейкемия и лимфома .1996; 22 (приложение 1): 87–93. [PubMed] [Google Scholar] 69. Michiels JJ, Juvonen E. Предложение по пересмотру диагностических критериев эссенциальной тромбоцитемии и истинной полицитемии, проведенное Исследовательской группой Thrombocythemia Vera. Семинары по тромбозам и гемостазу . 1997. 23 (4): 339–347. [PubMed] [Google Scholar] 70. Торгано Дж., Манделли С., Массаро П. и др. Гастродуоденальные поражения при истинной полицитемии: частота и роль Helicobacter pylori
. Британский гематологический журнал .2002. 117 (1): 198–202. [PubMed] [Google Scholar] 71. Валла Д., Касадеваль Н., Лакомб С. Первичное миелопролиферативное заболевание и тромбоз печеночной вены. Проспективное исследование образования эритроидных колоний in vitro у 20 пациентов с синдромом Бадда-Киари. Анналы внутренней медицины . 1985. 103 (3): 329–334. [PubMed] [Google Scholar] 72. Visani G, Finelli C, Castelli U и др. Миелофиброз с миелоидной метаплазией: клинико-гематологические параметры, предсказывающие выживаемость у 133 пациентов. Британский гематологический журнал . 1990; 75 (1): 4–9. [PubMed] [Google Scholar] 73. Сильверштейн MN. Агногенная миелоидная метаплазия . Актон, Массачусетс, США: Publishing Sciences Group; 1975. [Google Scholar] 74. Варки А., Лоттенберг Р., Гриффит Р., Рейнхард Э. Синдром идиопатического миелофиброза. Клинико-патологический обзор с акцентом на прогностические переменные, предсказывающие выживаемость. Медицина . 1983; 62 (6): 353–371. [PubMed] [Google Scholar] 75. Лиоте Ф., Йени П., Тейе-Тибо Ф. и др.Асцит, выявляющий перитонеальное и печеночное экстрамедуллярное кроветворение с пелиозом при агногенной миелоидной метаплазии: клинический случай и обзор литературы. Американский медицинский журнал . 1991. 90 (1): 111–117. [PubMed] [Google Scholar] 76. Лопес-Гильермо А., Сервантес Ф., Бругера М., Перейра А., Фелиу Е., Розман С. Дисфункция печени после спленэктомии при идиопатическом миелофиброзе: исследование с участием 10 пациентов. Acta Haematologica . 1991. 85 (4): 184–188. [PubMed] [Google Scholar] 77.Тиле Дж., Квасницка Х.М., Верден С., Занкович Р., Диль В., Фишер Р. Идиопатический первичный остео-миелофиброз: клинико-патологическое исследование с участием 208 пациентов с особым акцентом на эволюцию особенностей заболевания, дифференциацию от эссенциальной тромбоцитемии и переменные прогностического воздействия. . Лейкемия и лимфома . 1996. 22 (3-4): 303–317. [PubMed] [Google Scholar] 78. Пиво ПА, Кэмпбелл П.Дж., Грин Ар. Сравнение различных критериев диагностики первичного миелофиброза показывает ограниченную клиническую применимость для измерения сывороточной лактатдегидрогеназы. Haematologica . 2010; 95 (11): 1960–1963. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Приминьяни М., Мартинелли И., Буччарелли П. и др. Факторы риска тромбофилии при обструкции внепеченочной воротной вены. Гепатология . 2005. 41 (3): 603–608. [PubMed] [Google Scholar] 80. Валла Д., Касадеваль Н., Хьюисс М.Г. и др. Этиология тромбоза воротной вены у взрослых. Проспективная оценка первичных миелопролиферативных заболеваний. Гастроэнтерология . 1988. 94 (4): 1063–1069.[PubMed] [Google Scholar] 81. Хукстра Дж., Брессер Е.Л., Смальберг Дж. Х., Спаандер М.С., Либик Ф.В., Янссен Х.Л. Длительное наблюдение за пациентами с тромбозом воротной вены и миелопролиферативными новообразованиями. Журнал тромбоза и гемостаза . 9 (11): 2208–2214. [PubMed] [Google Scholar] 82. P’ng S, Carnley B, Baker R, Kontorinis N, Cheng W. Недиагностированное миелопролиферативное заболевание в случаях внутрибрюшного тромбоза: полезность мутации JAK2 617F. Клиническая гастроэнтерология и гепатология .2008. 6 (4): 472–475. [PubMed] [Google Scholar] 83. Qi X, Yang Z, Bai M, Shi X, Han G, Fan D. Мета-анализ: значение скрининга мутации JAK2V617F при синдроме Бадда-Киари и тромбозе системы воротной вены. Пищевая фармакология и терапия . 2011. 33 (10): 1087–1103. [PubMed] [Google Scholar] 84. Мурад С.Д., Плессье А., Эрнандес-Герра М. и др. Этиология, лечение и исход синдрома Бадда-Киари. Анналы внутренней медицины . 2009. 151 (3): 167–175.[PubMed] [Google Scholar] 85. Primignani M, Barosi G, Bergamaschi G и др. Роль мутации JAK2 в диагностике хронических миелопролиферативных нарушений при тромбозе внутренних вен. Гепатология . 2006. 44 (6): 1528–1534. [PubMed] [Google Scholar] 86. Патель Р.К., Ли Н.К., Хенеган М.А. и др. Распространенность активирующей мутации тирозинкиназы JAK2 V617F при синдроме Бадда-Киари. Гастроэнтерология . 2006. 130 (7): 2031–2038. [PubMed] [Google Scholar]
87. Актуально.Эпидемиология, патологические особенности и диагностика классической лимфомы Ходжкина. 2012.
88. Росс А., Фридман Л.С. Печень при системном заболевании. В: Bacon BR, O’Grady JG JG, Di Bisceglie AM, Lake JR, редакторы. Комплексная клиническая гепатология . 2-е издание. Филадельфия, Пенсильвания, США: Мосби Эльзевьер; 2006. с. п. 537. [Google Scholar] 89. Хабшер С.Г., Ламли М.А., Элиас Э. Синдром исчезающего желчного протока: возможный механизм внутрипеченочного холестаза при лимфоме Ходжкина. Гепатология .1993. 17 (1): 70–77. [PubMed] [Google Scholar] 90. Гулитер С., Эрдем О., Исик М., Ямак К., Улуоглу О. Холестатическая болезнь печени с дуктопенией (синдром исчезающего желчного протока) при болезни Ходжкина: отчет о случае. Тумори . 2004. 90 (5): 517–520. [PubMed] [Google Scholar] 91. Леувенбург I, Lugtenburg EPJ, Van Buuren HR, Zondervan PE, De Man RA. Тяжелая желтуха, вызванная синдромом исчезающего желчного протока, как симптом лимфомы Ходжкина, полностью обратимая после химиотерапии. Европейский журнал гастроэнтерологии и гепатологии .2008. 20 (2): 145–147. [PubMed] [Google Scholar] 92. Роуботэм Д., Вендон Дж., Уильямс Р. Острая печеночная недостаточность, вторичная по отношению к инфильтрации печени: опыт одного центра из 18 случаев. Кишечник . 1998. 42 (4): 576–580. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93. Шехаб Т.М., Камински М.С., Лок АСФ. Острая печеночная недостаточность из-за поражения печени гематологическими злокачественными новообразованиями. Болезни пищеварения и науки . 1997. 42 (7): 1400–1405. [PubMed] [Google Scholar] 94. Jaffe ES. Злокачественные лимфомы: патология поражения печени. Семинары по болезням печени . 1987. 7 (3): 257–268. [PubMed] [Google Scholar] 95. Сало Дж., Номдеду Б., Бругера М. и др. Острая печеночная недостаточность из-за неходжкинской лимфомы. Американский журнал гастроэнтерологии . 1993. 88 (5): 774–776. [PubMed] [Google Scholar] 96. Вардарели Э., Дундар Э., Аслан В., Гулбас З. Острая печеночная недостаточность из-за лимфомы Ходжкина. Медицинские принципы и практика . 2004. 13 (6): 372–374. [PubMed] [Google Scholar] 97. Dourakis SP, Tzemanakis E, Deutsch M, Kafiri G, Hadziyannis SJ.Фульминантная печеночная недостаточность как паранеопластическое проявление болезни Ходжкина. Европейский журнал гастроэнтерологии и гепатологии . 1999. 11 (9): 1055–1058. [PubMed] [Google Scholar] 98. Роуботэм Д., Вендон Дж., Уильямс Р. Острая печеночная недостаточность, вторичная по отношению к инфильтрации печени: опыт одного центра из 18 случаев. Кишечник . 1998. 42 (4): 576–580. [Бесплатная статья PMC] [PubMed] [Google Scholar] 99. Эмиль Дж. Ф., Азулай Д., Горнет Дж. М. и др. Первичные неходжкинские лимфомы печени с узловатой и диффузной инфильтрацией имеют разные прогнозы. Анналы онкологии . 2001. 12 (7): 1005–1010. [PubMed] [Google Scholar] 100. Морали Г.А., Розенманн Э., Ашкенази Дж., Мюнтер Г., Браверман Д.З. Острая печеночная недостаточность как единственное проявление рецидивирующей неходжкинской лимфомы. Европейский журнал гастроэнтерологии и гепатологии . 2001. 13 (10): 1241–1243. [PubMed] [Google Scholar] 101. Йешурун М., Иснард Ф., Гардерет Л. и др. Острая печеночная недостаточность как начальное проявление трансформации неходжкинской лимфомы низкой степени в крупноклеточную лимфому. Лейкемия и лимфома . 2001. 42 (3): 555–559. [PubMed] [Google Scholar] 102. Вульф Г.М., Петрович Л.М., Ройтер С.Е. и др. Острая печеночная недостаточность из-за лимфомы. Диагностическая проблема при рассмотрении трансплантации печени. Болезни пищеварения и науки . 1994. 39 (6): 1351–1358. [PubMed] [Google Scholar] 103. Бругера М., Микель Р. Влияние гематологических и лимфатических заболеваний на печень. В: Rodés J, Benhaumou JP, Blei AT, Reichen J, Rizzetto M, редакторы. Учебник гепатологии .3-е издание. Оксфорд, Великобритания: Блэквелл; 2007. с. п. 1662. [Google Scholar] 104. Гоффине Д.Р., Кастеллино Р.А., Ким Х. Стадия лапаротомии у неотобранных ранее нелеченных пациентов с неходжкинскими лимфомами. Рак . 1973; 32 (3): 672–681. [PubMed] [Google Scholar] 105. Рисдалл Р., Хоппе Т., Варнке Р. Лимфома неходжкина. Исследование эволюции болезни на основе 92 вскрытых случаев. Рак . 1979; 44 (2): 529–542. [PubMed] [Google Scholar] 106. Civardi G, Vallisa D, Bertè R, Lazzaro A, Moroni CF, Cavanna L.Очаговые поражения печени при неходжкинской лимфоме: исследование их распространенности, клинического значения и роли инфекции вируса гепатита С. Европейский журнал рака . 2002. 38 (18): 2382–2387. [PubMed] [Google Scholar] 107. Масуд А., Кайруз С., Худхуд К. Х., Хегази А.З., Бану А., Гупта, Северная Каролина. Первичная неходжкинская лимфома печени. Современная онкология . 2009. 16 (4): 74–77. [Бесплатная статья PMC] [PubMed] [Google Scholar] 108. Хайдер Ф.С., Смит Р., Хан С. Первичная лимфома печени, проявляющаяся как фульминантная печеночная недостаточность с гиперферритинемией: отчет о болезни. Журнал медицинских историй болезни . 2008; 2, статья № 279 [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Баумхор Д., Цанков А., Дирнхофер С., Торнилло Л., Терраччано Л. М.. Особенности инфильтрации печени при лимфопролиферативном заболевании. Гистопатология . 2008. 53 (1): 81–90. [PubMed] [Google Scholar] 110. Кэмерон А.М., Трути Дж., Труэлл Дж. И др. Фульминантная печеночная недостаточность от первичной лимфомы печени: успешное лечение ортотопической трансплантацией печени и химиотерапией. Трансплантация .2005. 80 (7): 993–996. [PubMed] [Google Scholar] 111. Кикума К., Ватанабе Дж., Оширо Ю. и др. Этиологические факторы первичной В-клеточной лимфомы печени. Вирховский архив . 2012. 460 (4): 379–387. [Бесплатная статья PMC] [PubMed] [Google Scholar] 112. Идзуми Т., Сасаки Р., Миура Ю., Окамото Х. Первичная гепатоспленочная лимфома: связь с инфекцией вируса гепатита С. Кровь . 1996. 87 (12): 5380–5381. [PubMed] [Google Scholar] 113. Йошикава М., Ямане Ю., Йонеда С. и др. Острая печеночная недостаточность из-за гепатоспленочной B-клеточной неходжкинской лимфомы у пациента, инфицированного вирусом гепатита С. Гастроэнтерологический журнал . 1998. 33 (6): 880–885. [PubMed] [Google Scholar] 114. Феррери А.Дж., Кампо Э., Сеймур Дж. Ф. и др. Внутрисосудистая лимфома: клинические проявления, естественное течение, лечебные и прогностические факторы в серии из 38 случаев, с особым акцентом на «кожный вариант» British Journal of Hematology . 2004. 127 (2): 173–183. [PubMed] [Google Scholar] 115. Шимада К., Мацуэ К., Ямамото К. и др. Ретроспективный анализ внутрисосудистой крупноклеточной В-клеточной лимфомы, получавшей химиотерапию, содержащую ритуксимаб, по данным исследовательской группы IVL в Японии. Журнал клинической онкологии . 2008. 26 (19): 3189–3195. [PubMed] [Google Scholar] 116. Чапин Дж. Э., Дэвис Л. Е., Корнфельд М., Мандлер Р. Н.. Неврологические проявления внутрисосудистого лимфоматоза. Acta Neurologica Scandinavica . 1995. 91 (6): 494–499. [PubMed] [Google Scholar] 117. Детский М.Э., Чиу Л., Шандлинг М.Р., Спроул М.Э., Урселл М.Р. На неправильном пути. Медицинский журнал Новой Англии . 2006; 355 (1): 67–74. [PubMed] [Google Scholar] 118. Мурасе Т., Ямагути М., Сузуки Р. и др.Внутрисосудистая крупноклеточная B-лимфома (IVLBCL): клинико-патологическое исследование 96 случаев с особым упором на иммунофенотипическую гетерогенность CD5. Кровь . 2007. 109 (2): 478–485. [PubMed] [Google Scholar] 119. Мурасе Т., Накамура С., Каваути К. и др. Азиатский вариант внутрисосудистой крупной B-клеточной лимфомы: клинические, патологические и цитогенетические подходы к диффузной большой B-клеточной лимфоме, связанной с гемофагоцитарным синдромом. Британский гематологический журнал . 2000. 111 (3): 826–834.[PubMed] [Google Scholar] 120. Кодзима К., Канеда К., Ясукава М. и др. Специфичность анализа клональности перестройки гена тяжелой цепи иммуноглобулина на основе полимеразной цепной реакции для выявления инфильтрата костного мозга при гемофагоцитарном синдроме, ассоциированном с В-клеточной лимфомой. Британский гематологический журнал . 2002. 119 (3): 616–621. [PubMed] [Google Scholar] 121. Наримацу Х., Моришита Й., Сайто С. и др. Полезность аспирации костного мозга для точной диагностики азиатского варианта внутрисосудистой лимфомы: четыре вскрытия. Лейкемия и лимфома . 2004. 45 (8): 1611–1616. [PubMed] [Google Scholar] 122. Шимада К., Мурасе Т., Мацуэ К. и др. Поражение центральной нервной системы при внутрисосудистой В-крупноклеточной лимфоме: ретроспективный анализ 109 пациентов. Наука о раке . 2010. 101 (6): 1480–1486. [PubMed] [Google Scholar] 123. Röglin J, Böer A. Кожные проявления внутрисосудистой лимфомы имитируют воспалительные заболевания кожи. Британский журнал дерматологии . 2007. 157 (1): 16–25. [PubMed] [Google Scholar] 124.Понзони М., Феррери А.Д.М., Кампо Э. и др. Определение, диагностика и лечение внутрисосудистой крупноклеточной В-клеточной лимфомы: предложения и перспективы международного консенсусного совещания. Журнал клинической онкологии . 2007. 25 (21): 3168–3173. [PubMed] [Google Scholar] 125. Гангули С. Острое внутримозговое кровоизлияние при внутрисосудистой лимфоме: серьезное побочное действие ритуксимаба, связанное с инфузией. Американский журнал клинической онкологии . 2007. 30 (2): 211–212. [PubMed] [Google Scholar] 126.Мартусевич-Борос М., Виатр Э., Радзиковска Э., Рошковски-Слиз К., Лангфорт Р. Легочная внутрисосудистая крупноклеточная B-лимфома как причина тяжелой гипоксемии. Журнал клинической онкологии . 2007. 25 (15): 2137–2139. [PubMed] [Google Scholar] 127. Ямада С., Ниший Р., Ока С. и др. FDG-PET — основной метод визуализации для диагностики внутрисосудистой лимфомы с началом инсульта. Архив неврологии . 2010. 67 (3): 366–367. [PubMed] [Google Scholar] 128. Рош Дж. Р., Гросс Т., Мамула П., Гриффитс А., Хьямс Дж.Т-клеточная лимфома печени и селезенки у подростков и молодых людей с болезнью Крона: поучительный рассказ? Воспалительные заболевания кишечника . 2007. 13 (8): 1024–1030. [PubMed] [Google Scholar] 129. Бейгель Ф., Юргенс М., Тиллак С. и др. Т-клеточная лимфома печени и селезенки у пациента с болезнью Крона. Nature Reviews Гастроэнтерология и гепатология . 2009. 6: 433–436. [PubMed] [Google Scholar] 130. Créput C, Galicier L, Buyse S, Azoulay E. Понимание органной дисфункции при гемофагоцитарном лимфогистиоцитозе. Медицина интенсивной терапии . 2008. 34 (7): 1177–1187. [PubMed] [Google Scholar] 131. Янка Г.Е. Гемофагоцитарные синдромы. Обзоры крови . 2007. 21: 245–253. [PubMed] [Google Scholar] 132. Де Кергенек С., Хиллер С., Молиние В. и др. Печеночные проявления гемофагоцитарного синдрома: исследование 30 случаев. Американский журнал гастроэнтерологии . 2001. 96 (3): 852–857. [PubMed] [Google Scholar] 133. Аркаини Л., Лаццарино М., Коломбо Н. и др. Лимфома маргинальной зоны селезенки: прогностическая модель для клинического использования. Кровь . 2006. 107 (12): 4643–4649. [PubMed] [Google Scholar] 134. Бругера М., Микель Р. Влияние гематологических и лимфатических заболеваний на печень. В: Rodés J, Benhaumou JP, Blei AT, Reichen J, Rizzetto M, редакторы. Учебник гепатологии . 3-е издание. Оксфорд, Великобритания: Блэквелл; 2007. с. п. 1662. [Google Scholar] 135. Thiele DL. Печеночные проявления системных заболеваний и других заболеваний печени. В: Feldman M, Friedman LS, Sleisenger MH, редакторы. Болезни желудочно-кишечного тракта и печени Sleisenger & Fordtran .7-е издание. Филадельфия, Пенсильвания, США: Elsevier Science; 2002. с. п. 1603. [Google Scholar] 136. Litten JB, Rodríguez MM, Maniaci V. Острый лимфобластный лейкоз, проявляющийся фульминантной печеночной недостаточностью. Кровь у детей и рак . 2006. 47 (6): 842–845. [PubMed] [Google Scholar] 137. Марголин JF, Steuber CP, Poplack DG. Острый лимфобластный лейкоз. В: Pizzo PA, Poplack DG, ред. Принципы и практика детской онкологии . 4-е издание. Филадельфия, Пенсильвания, США: Липпинкотт-Рэйвен; 2001 г.п. п. 489. [Google Scholar] 138. Streuli RA, Kaneko Y, Variakojis D. Лимфобластная лимфома у взрослых. Рак . 1981; 47 (10): 2510–2516. [PubMed] [Google Scholar] 139. Копелан Э.А., Макгуайр Э.А.. Биология и лечение острого лимфобластного лейкоза у взрослых. Кровь . 1995. 85 (5): 1151–1168. [PubMed] [Google Scholar] 140. Цимбериду А.М., Вен С., О’Брайен С. и др. Оценка хронического лимфолейкоза и малой лимфоцитарной лимфомы по абсолютному количеству лимфоцитов у 2126 пациентов: 20-летний опыт работы в Техасском университете М.Онкологический центр Д. Андерсона. Журнал клинической онкологии . 2007. 25 (29): 4648–4656. [PubMed] [Google Scholar] 141. Фейс Ф., Гиотто Ф., Хашимото С. и др. В-клетки хронического лимфоцитарного лейкоза экспрессируют ограниченные наборы мутированных и немутантных рецепторов антигена. Журнал клинических исследований . 1998. 102 (8): 1515–1525. [Бесплатная статья PMC] [PubMed] [Google Scholar] 142. Дамле Р.Н., Гиотто Ф., Валетто А. и др. Клетки В-клеточного хронического лимфоцитарного лейкоза выражают фенотип поверхностной мембраны активированных, испытанных антигеном В-лимфоцитов. Кровь . 2002. 99 (11): 4087–4093. [PubMed] [Google Scholar] 143. Стивенсон Ф.К., Калигарис-Каппио Ф. Хронический лимфоцитарный лейкоз: откровения от рецептора В-клеток. Кровь . 2004. 103 (12): 4389–4395. [PubMed] [Google Scholar] 144. Катовский Д. Волосато-клеточный лейкоз и пролимфоцитарный лейкоз. Клиники гематологии . 1977; 6 (1): 245–268. [PubMed] [Google Scholar] 145. Бине Дж. Л., Окуье А., Дигьеро Дж. И др. Новая прогностическая классификация хронического лимфолейкоза, полученная на основе многомерного анализа выживаемости. Рак . 1981. 48 (1): 198–206. [PubMed] [Google Scholar] 146. Рай KR, Савицкий A, Cronkite EP. Клиническая стадия хронического лимфолейкоза. Кровь . 1975. 46 (2): 219–234. [PubMed] [Google Scholar] 147. Шварц Дж. Б., Шамсуддин А. М.. Эффекты лейкозных инфильтратов в различных органах при хроническом лимфолейкозе. Патология человека . 1981. 12 (5): 432–440. [PubMed] [Google Scholar] 148. Wilputte JY, Martinet JP, Nguyen P, Damoiseaux P, Rahier J, Geubel A. Хронический лимфоцитарный лейкоз с портальной гипертензией и без поражения печени: клинический случай, подчеркивающий роль повышенного сплено-портального кровотока и «защитной» синусоидальной вазоконстрикции. Acta Gastro-Enterologica Belgica . 2003. 66 (4): 303–306. [PubMed] [Google Scholar] 149. Голомб HM, Катовский D, Golde DW. Волосатоклеточный лейкоз. Клинический обзор 71 случая. Анналы внутренней медицины . 1978. 89 (5): 677–683. [PubMed] [Google Scholar] 151. Yam LT, Janckila AJ, Chan CH, Li CY. Поражение печени при лейкемии волосатых клеток. Рак . 1983. 51 (8): 1497–1504. [PubMed] [Google Scholar] 152. Кайл Р.А., Герц М.А., Витциг Т.Э. и др. Обзор 1027 пациентов с впервые диагностированной множественной миеломой. Труды клиники Мэйо . 2003. 78 (1): 21–33. [PubMed] [Google Scholar] 153. Перес-Солер Р., Эстебан Р., Альенде Э. Участие печени во множественной миеломе. Американский журнал гематологии . 1985. 20 (1): 25–29. [PubMed] [Google Scholar] 154. Чанг Х., Бартлетт Э.С., Паттерсон Б., Чен К.И., Йи QL. Отсутствие CD56 на злокачественных плазматических клетках спинномозговой жидкости является признаком множественной миеломы с поражением центральной нервной системы. Британский гематологический журнал . 2005. 129 (4): 539–541.[PubMed] [Google Scholar]
155. Актуально. Обзор амилоидоза. 2012.
156. Бак Ф.С., Косс МН. Амилоидоз печени: морфологические различия между системными типами AL и AA. Патология человека . 1991. 22 (9): 904–907. [PubMed] [Google Scholar] 157. Ивата Т., Хошии Ю., Кавано Х. и др. Амилоидоз печени в Японии: гистологический и морфометрический анализ на основе амилоидных белков. Патология человека . 1995. 26 (10): 1148–1153. [PubMed] [Google Scholar] 158. Левин Р.А.Амилоидная болезнь печени. Корреляция клинических, функциональных и морфологических признаков у 47 пациентов. Американский медицинский журнал . 1962. 33 (3): 349–357. [PubMed] [Google Scholar] 159. Sarsik B, Sen S, Kirdok FS, Akarca US, Toz H, Yilmaz F. Амилоидоз печени: морфологический спектр гистопатологических изменений при амилоидозе AA и nonAA. Патология — исследования и практика . 2012. 208 (12): 713–718. [PubMed] [Google Scholar] 160. Ван Ю.Д., Чжао С.Ю., Инь Х.З. Первичный амилоидоз печени: небольшой обзор литературы и отчеты о пяти случаях. Анналы гепатологии . 2012; 11: 721–727. [PubMed] [Google Scholar]
COVID-19 и заболевание печени: механистические и клинические перспективы
COVID-19 Центра системных наук и инженерии (CSSE) Университета Джонса Хопкинса (JHU) https: // coronavirus.jhu.edu/map.html (2021 г.).
Берлин, Д. А., Гулик, Р. М. и Мартинес, Ф. Дж. Суровый Covid-19. N. Engl. J. Med. 383 , 2451–2460 (2020).
CAS
PubMed
Google ученый
Тай, М. З., По, К. М., Рения, Л., Макари, П. А. и Нг, Л. Ф. П. Троица COVID-19: иммунитет, воспаление и вмешательство. Nat. Rev. Immunol. 20 , 363–374 (2020).
CAS
PubMed
Google ученый
Всемирная организация здравоохранения. Клиническое ведение COVID-19: временное руководство (2020).
Williamson, E.J. et al. Факторы, связанные со смертью, связанной с COVID-19, с использованием OpenSAFELY. Природа 584 , 430–436 (2020).
CAS
Google ученый
Иоанну, Г. Н. и др. Факторы риска госпитализации, искусственной вентиляции легких или смерти среди 10131 ветеранов США с инфекцией SARS-CoV-2. JAMA Netw. Откройте 3 , e2022310 (2020).
PubMed
PubMed Central
Google ученый
Групп, р.C. et al. Дексаметазон у госпитализированных пациентов с Covid-19 — предварительное сообщение. N. Engl. J. Med. https://doi.org/10.1056/NEJMoa2021436 (2020).
Артикул
Google ученый
Виерсинга, У. Дж., Родс, А., Ченг, А. К., Пикок, С. Дж. И Прескотт, Х. С. Патофизиология, передача, диагностика и лечение коронавирусной болезни 2019 (COVID-19): обзор. JAMA 324 , 782–793 (2020).
CAS
Google ученый
Альбиллос, А., Ларио, М. и Альварес-Мон, М. Иммунная дисфункция, связанная с циррозом: отличительные особенности и клиническое значение. J. Hepatol. 61 , 1385–1396 (2014).
CAS
PubMed
Google ученый
Таппер Э. Б., Робсон С. и Малик Р. Коагулопатия при циррозе печени — роль тромбоцитов в гемостазе. J. Hepatol. 59 , 889–890 (2013).
CAS
PubMed
Google ученый
Соавторы, Г. Б. Д. С. Глобальное, региональное и национальное бремя цирроза по причинам в 195 странах и территориях, 1990–2017 гг .: систематический анализ для исследования глобального бремени болезней, 2017 г. Lancet Gastroenterol. Гепатол. 5 , 245–266 (2020).
Google ученый
Пирола, К. Дж. И Сукоян, С. Вирус SARS-CoV-2 и экспрессия рецепторов хозяина в печени: предполагаемые механизмы участия печени в COVID-19. Liver Int. 40 , 2038–2040 (2020). Профили экспрессии генов в печени человека, показывающие наличие рецепторов ACE2 на холангиоцитах и гепатоцитах .
CAS
PubMed
Google ученый
Qi, F., Qian, S., Zhang, S. & Zhang, Z. Секвенирование одноклеточной РНК 13 тканей человека позволяет идентифицировать типы клеток и рецепторы коронавирусов человека. Biochem. Биофиз. Res. Commun. 526 , 135–140 (2020).
CAS
PubMed
PubMed Central
Google ученый
Де Смет В., Ферхюльст С. и ван Грюнсвен Л. А. Анализ секвенирования РНК отдельных клеток не позволил предсказать инфицирование гепатоцитов SARS-CoV-2. J. Hepatol. 73 , 993–995 (2020).
PubMed
PubMed Central
Google ученый
Chu, H. et al. Сравнительный тропизм, кинетика репликации и профили повреждения клеток SARS-CoV-2 и SARS-CoV с последствиями для клинических проявлений, трансмиссивности и лабораторных исследований COVID-19: обсервационное исследование. Lancet Microbe 1 , e14 – e23 (2020).
CAS
PubMed
PubMed Central
Google ученый
Ma-Lauer, Y. et al. p53 подавляет репликацию коронавируса SARS и нацелен на SARS-уникальный домен и PLpro через убиквитинлигазу E3 RCHY1. Proc. Natl Acad. Sci. США 113 , E5192 – E5201 (2016).
CAS
PubMed
Google ученый
Zhao, B. et al. Резюме инфекции SARS-CoV-2 и повреждения холангиоцитов органоидами протоков печени человека. Protein Cell 11 , 771–775 (2020). Экспрессия ACE2 и TMPRSS2 на органоидах протоков печени, допускающая заражение SARS-CoV-2 .
CAS
PubMed
PubMed Central
Google ученый
Gaebler, C. et al. Эволюция иммунного иммунитета к SARS-CoV-2. Природа https://doi.org/10.1038/s41586-021-03207-w (2021 г.).
Артикул
PubMed
Google ученый
Yang, L. et al. Платформа на основе плюрипотентных стволовых клеток человека для изучения тропизма SARS-CoV-2 и моделирования вирусной инфекции в клетках и органоидах человека. Стволовые клетки клеток 27 , 125–136.e7 (2020).
CAS
PubMed
PubMed Central
Google ученый
Paizis, G. et al. Хроническое повреждение печени у крыс и людей активирует новый фермент, превращающий ангиотензин, фермент 2. Кишечник 54 , 1790–1796 (2005). Исследование в эпоху до COVID-19, демонстрирующее повышенную экспрессию печеночного ACE2 у пациентов с циррозом .
CAS
PubMed
PubMed Central
Google ученый
Fondevila, M. F. et al. Пациенты с ожирением и НАСГ имеют повышенную печеночную экспрессию критических точек входа SARS-CoV-2. J. Hepatol. 74 , 469–471 (2021).
CAS
PubMed
Google ученый
Herath, C. B. et al. Повышение уровня печеночного ангиотензин-превращающего фермента 2 (ACE2) и ангиотензин- (1-7) при экспериментальном фиброзе желчных путей. J. Hepatol. 47 , 387–395 (2007).
CAS
PubMed
PubMed Central
Google ученый
Chua, R. L. et al. Тяжесть COVID-19 коррелирует с взаимодействиями эпителия дыхательных путей с иммунными клетками, выявленными с помощью одноклеточного анализа. Nat. Biotechnol. 38 , 970–979 (2020).
CAS
PubMed
Google ученый
Ziegler, C.G.K. et al. Рецептор SARS-CoV-2 ACE2 представляет собой стимулируемый интерфероном ген в эпителиальных клетках дыхательных путей человека и обнаруживается в определенных подмножествах клеток в тканях. Ячейка 181 , 1016–1035.e19 (2020).
CAS
PubMed
PubMed Central
Google ученый
Onabajo, O.O. et al. Интерфероны и вирусы индуцируют новую усеченную изоформу ACE2, а не полноразмерный рецептор SARS-CoV-2. Nat. Genet. 52 , 1283–1293 (2020).
PubMed
Google ученый
Wei, C. et al. Рецептор В-скавенджера ЛПВП типа 1 способствует проникновению SARS-CoV-2. Nat. Метаб. 2 , 1391–1400 (2020).
CAS
PubMed
Google ученый
Grove, J. et al. Уровни экспрессии рецепторов скавенджера BI и BII модулируют инфекционность вируса гепатита С. J. Virol. 81 , 3162–3169 (2007).
CAS
PubMed
PubMed Central
Google ученый
Zuo, T. et al. Отображение фекальной вирусной активности SARS-CoV-2 в сочетании с составом кишечной микробиоты у пациентов с COVID-19. Кишечник 70 , 276–284 (2021).
CAS
PubMed
Google ученый
Lamers, M. M. et al. SARS-CoV-2 продуктивно инфицирует энтероциты кишечника человека. Наука 369 , 50–54 (2020).
CAS
PubMed
Google ученый
Qian, Q. et al. Прямое свидетельство активной репликации SARS-CoV-2 в кишечнике. Clin. Заразить. Дис. https://doi.org/10.1093/cid/ciaa925 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Sonzogni, A. et al. Гистопатология печени при тяжелой дыхательной недостаточности COVID 19 указывает на сосудистые изменения. Liver Int. 40 , 2110–2116 (2020). Гистология печени 48 пациентов, умерших от дыхательной недостаточности COVID-19, демонстрирует высокие показатели стеатоза и микротромботической болезни.SARS-CoV-2 был обнаружен в ткани печени у 68% больных .
CAS
PubMed
Google ученый
Wang, Y. et al. Инфекция печени SARS-CoV-2 напрямую способствует печеночной недостаточности у пациентов с COVID-19. J. Hepatol. 73 , 807–816 (2020).
CAS
PubMed
PubMed Central
Google ученый
Гордон Д.E. et al. Карта взаимодействия белков SARS-CoV-2 выявляет цели для перепрофилирования лекарств. Природа 583 , 459–468 (2020).
CAS
PubMed
PubMed Central
Google ученый
Nie, X. et al. Многоорганный протеомный ландшафт вскрытий COVID-19. Ячейка 184 , 775–791.e14 (2021). В этом исследовании 11 394 белка были количественно определены в образцах вскрытия из 7 органов 19 пациентов с COVID-19.Было обнаружено широко распространенное нарушение регуляции белков печени, связанное с полиорганной дисфункцией и гистологическим повреждением .
CAS
PubMed
PubMed Central
Google ученый
Guan, W. J. et al. Клиническая характеристика коронавирусной болезни 2019 в Китае. N. Engl. J. Med. 382 , 1708–1720 (2020).
CAS
Google ученый
Sultan, S. et al. Институт AGA экспресс-анализ желудочно-кишечных и печеночных проявлений COVID-19, мета-анализ международных данных и рекомендации по консультативному ведению пациентов с COVID-19. Гастроэнтерология 159 , 320–334.e27 (2020).
CAS
PubMed
PubMed Central
Google ученый
Richardson, S. et al. Представлены характеристики, сопутствующие заболевания и исходы среди 5700 пациентов, госпитализированных с COVID-19 в районе города Нью-Йорка. JAMA 323 , 2052–2059 (2020).
CAS
Статья
Google ученый
Goyal, P. et al. Клиническая характеристика Covid-19 в Нью-Йорке. N. Engl. J. Med. 382 , 2372–2374 (2020).
Google ученый
Youssef, M. et al. COVID-19 и дисфункция печени: систематический обзор и метаанализ ретроспективных исследований. J. Med. Virol. 92 , 1825–1833 (2020).
CAS
PubMed
Google ученый
Hundt, M. A., Deng, Y., Ciarleglio, M. M., Nathanson, M. H. & Lim, J. K. Аномальные тесты печени при COVID-19: ретроспективное наблюдательное когортное исследование 1827 пациентов в крупной сети больниц США. Гепатология 72 , 1169–1176 (2020).
CAS
PubMed
Google ученый
Elmunzer, B.J. et al. Пищеварительные проявления у пациентов, госпитализированных с COVID-19. Clin. Гастроэнтерол. Гепатол. https://doi.org/10.1016/j.cgh.2020.09.041 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Fu, Y. et al. Клинические особенности пациентов, инфицированных COVID-19, с повышенным уровнем биохимии печени: многоцентровое ретроспективное исследование. Гепатология https: // doi.org / 10.1002 / hep.31446 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Mao, R. et al. Проявления и прогноз поражения желудочно-кишечного тракта и печени у пациентов с COVID-19: систематический обзор и метаанализ. Ланцет Гастроэнтерол. Гепатол. 5 , 667–678 (2020).
PubMed
PubMed Central
Google ученый
Phipps, M. M. et al. Острое повреждение печени при COVID-19: распространенность и связь с клиническими исходами в большой когорте США. Гепатология 72 , 807–817 (2020). Большое ретроспективное когортное исследование в США ( n = 3,381), демонстрирующее, что острое повреждение печени является обычным и часто легким заболеванием во время COVID-19. Плохие результаты были связаны с тяжелым повреждением печени .
CAS
PubMed
Google ученый
Zhou, F. et al. Клиническое течение и факторы риска смертности взрослых пациентов с COVID-19 в Ухане, Китай: ретроспективное когортное исследование. Ланцет 395 , 1054–1062 (2020). Ретроспективное когортное исследование, проведенное в Китае, предоставив ранние данные о клиническом течении и лабораторных параметрах, включая ферменты печени, среди пациентов с COVID-19 .
CAS
PubMed
PubMed Central
Google ученый
Сингх С. и Хан А. Клинические характеристики и исходы коронавирусной болезни 2019 г. среди пациентов с ранее существовавшим заболеванием печени в США: исследование многоцентровой исследовательской сети. Гастроэнтерология 159 , 768–771.e3 (2020).
CAS
PubMed
PubMed Central
Google ученый
Xu, Z. et al. Патологические данные COVID-19, связанные с синдромом острого респираторного дистресс-синдрома. Ланцет Респир. Med. 8 , 420–422 (2020).
CAS
PubMed
PubMed Central
Google ученый
Lagana, S. M. et al. Патология печени у пациентов, умирающих от COVID-19: серия из 40 случаев, включая клинические, гистологические и вирусологические данные. Мод. Патол. 33 , 2147–2155 (2020).
CAS
PubMed
Google ученый
Джотимани Д., Венугопал Р., Абедин М. Ф., Калиамурти И. и Рела М. COVID-19 и печень. J. Hepatol. 73 , 1231–1240 (2020).
CAS
PubMed
PubMed Central
Google ученый
Bloom, P. P. et al. Биохимия печени у госпитализированных пациентов с COVID-19. Гепатология https://doi.org/10.1002/hep.31326 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Бакхольц А. П., Каплан А., Розенблатт Р. Э. и Ван Д. Клинические характеристики, диагноз и исходы у 6 пациентов с инфекцией COVID-19 и рабдомиолизом. Mayo Clin. Proc. 95 , 2557–2559 (2020).
CAS
PubMed
PubMed Central
Google ученый
Zhang, Y. et al. Коагулопатия и антифосфолипидные антитела у пациентов с Covid-19. N. Engl. J. Med. 382 , e38 (2020).
PubMed
Google ученый
Díaz, L.A. et al. Высокая распространенность стеатоза печени и тромбоза сосудов при COVID-19: систематический обзор и метаанализ данных аутопсии. World J. Gastroenterol. 26 , 7693–7706 (2020)
PubMed
PubMed Central
Google ученый
Papic, N. et al. Поражение печени во время гриппа: взгляд на пандемию гриппа 2009 г. Influenza Other Respir. Вирусы 6 , e2 – e5 (2012).
PubMed
Google ученый
Mehta, P. et al. COVID-19: рассмотрите синдромы цитокинового шторма и иммуносупрессию. Ланцет 395 , 1033–1034 (2020).
CAS
PubMed
PubMed Central
Google ученый
Da, B. L. et al. Повреждение печени у госпитализированных пациентов с COVID-19 коррелирует с гипервоспалительным ответом и повышенным уровнем IL-6. Hepatol. Commun. 5 , 177–188 (2020).
PubMed Central
Google ученый
Liu, J. et al. Продольные характеристики ответов лимфоцитов и цитокиновых профилей в периферической крови пациентов, инфицированных SARS-CoV-2. EBioMedicine 55 , 102763 (2020).
PubMed
PubMed Central
Google ученый
Diao, B. et al. Снижение и функциональное истощение Т-клеток у пациентов с коронавирусной болезнью 2019 (COVID-19). Фронт. Иммунол. 11 , 827 (2020).
CAS
PubMed
PubMed Central
Google ученый
Al-Samkari, H. et al. COVID-19 и коагуляция: кровотечение и тромботические проявления инфекции SARS-CoV-2. Кровь 136 , 489–500 (2020).
CAS
PubMed
PubMed Central
Google ученый
Klok, F.A. et al. Подтверждение высокой совокупной частоты тромботических осложнений у тяжелобольных пациентов ОИТ с COVID-19: обновленный анализ. Тромб. Res. 191 , 148–150 (2020).
CAS
PubMed
PubMed Central
Google ученый
Middeldorp, S. et al. Частота венозной тромбоэмболии у госпитализированных пациентов с COVID-19. J. Thromb. Гемост. 18 , 1995–2002 (2020).
CAS
PubMed
PubMed Central
Google ученый
Poissy, J. et al. Легочная эмболия у пациентов с COVID-19: осведомленность о повышенной распространенности. Тираж 142 , 184–186 (2020).
CAS
PubMed
PubMed Central
Google ученый
Olry, A. et al. Поражение печени, вызванное лекарственными препаратами, и инфекция COVID-19: правила остаются прежними. Drug Saf. 43 , 615–617 (2020).
CAS
PubMed
Google ученый
Cao, B. et al. Испытание применения лопинавира-ритонавира у взрослых, госпитализированных с тяжелой формой COVID-19. N. Engl. J. Med. 382 , 1787–1799 (2020).
PubMed
Google ученый
Cai, Q. et al. COVID-19: аномальные тесты функции печени. Дж.Гепатол. 73 , 566–574 (2020).
CAS
PubMed
PubMed Central
Google ученый
Muhovic, D. et al. Первый случай лекарственного поражения печени, связанного с применением тоцилизумаба у пациента с COVID-19. Liver Int. 40 , 1901–1905 (2020).
CAS
PubMed
Google ученый
Махамид, М., Мадер Р. и Сафади Р. Гепатотоксичность тоцилизумаба и анакинры при ревматоидном артрите: управленческие решения. Clin. Pharmacol. 3 , 39–43 (2011).
CAS
PubMed
PubMed Central
Google ученый
Beigel, J.H. et al. Ремдесивир для лечения Covid-19 — окончательный отчет. N. Engl. J. Med. 383 , 1813–1826 (2020).
CAS
PubMed
Google ученый
Montastruc, F., Thuriot, S. & Durrieu, G. Расстройства печени с использованием ремдесивира для лечения коронавируса 2019. Clin. Гастроэнтерол. Гепатол. 18 , 2835–2836 (2020).
CAS
PubMed
PubMed Central
Google ученый
Консорциум испытаний солидарности ВОЗ. и другие. Перепрофилированные противовирусные препараты для Covid-19 — промежуточные результаты испытаний солидарности ВОЗ. N. Engl. J. Med. 384 , 497–511 (2021).
Google ученый
Ponziani, F. R. et al. Поражение печени не связано со смертностью: это результат большой когорты пациентов с SARS-CoV-2. Алимент. Pharmacol. Ther. 52 , 1060–1068 (2020).
CAS
PubMed
Google ученый
Yip, T. C. F. et al. Повреждение печени независимо связано с неблагоприятными клиническими исходами у пациентов с COVID-19. Кишечник https://doi.org/10.1136/gutjnl-2020-321726 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Weber, S. et al. Нарушения функции печени при поступлении в больницу связаны с тяжелым течением инфекции SARS-CoV-2: проспективное когортное исследование. Кишечник https://doi.org/10.1136/gutjnl-2020-323800 (2021).
Артикул
PubMed
PubMed Central
Google ученый
Ding, Z. Y. et al. Связь аномалий печени с внутрибольничной смертностью у пациентов с COVID-19. J. Hepatol. https://doi.org/10.1016/j.jhep.2020.12.012 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Zhang, Y. et al. Нарушение функции печени у пациентов с COVID-19: ретроспективный анализ 115 случаев из единого центра в городе Ухань, Китай. Liver Int. 40 , 2095–2103 (2020).
CAS
PubMed
Google ученый
Yadav, D. K. et al. Вовлечение печени в COVID-19: систематический обзор и метаанализ. Кишечник https://doi.org/10.1136/gutjnl-2020-322072 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Lei, F. et al. Продольная связь между маркерами повреждения печени и смертностью от COVID-19 в Китае. Гепатология 72 , 389–398 (2020). Многоцентровое ретроспективное когортное исследование 5771 пациента, госпитализированного с COVID-19 в Китае, с описанием продольных моделей биохимии печени .
CAS
PubMed
Google ученый
Bangash, M. N. et al. SARS-CoV-2: печень — всего лишь свидетель тяжелого заболевания? J. Hepatol. 73 , 995–996 (2020).
CAS
PubMed
PubMed Central
Google ученый
Нур, М. Т. и Манория, П. Иммунная дисфункция при циррозе печени. J. Clin. Пер. Гепатол. 5 , 50–58 (2017).
PubMed
PubMed Central
Google ученый
Pose, E. et al. PD-L1 сверхэкспрессируется в макрофагах печени при хронических заболеваниях печени, и его блокада улучшает антибактериальную активность против инфекций. Гепатология https://doi.org/10.1002/hep.31644 (2020).
Артикул
PubMed
Google ученый
Piano, S., Brocca, A., Mareso, S. & Angeli, P. Инфекции, осложняющие цирроз печени. Liver Int. 38 (Приложение 1), 126–133 (2018).
PubMed
Google ученый
Fan, V. S. et al. Факторы риска положительного результата теста на SARS-CoV-2 в национальной системе здравоохранения США. Clin. Заразить. Дис. https://doi.org/10.1093/cid/ciaa1624 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Иоанну, Г. Н. и др. Цирроз и инфекция SARS-CoV-2 у ветеранов США: риск заражения, госпитализация, вентиляция и смертность. Гепатология https://doi.org/10.1002/hep.31649 (2020). Данные из электронных медицинских карт США показывают более низкий риск положительного результата теста на SARS-CoV-2, но более высокие показатели смертности от COVID-19 у пациентов с циррозом печени по сравнению с пациентами без .
Артикул
PubMed
PubMed Central
Google ученый
Fine, M. J. et al. Правило прогноза для выявления пациентов с внебольничной пневмонией из группы низкого риска. N. Engl. J. Med. 336 , 243–250 (1997).
CAS
PubMed
Google ученый
Schütte, A., Ciesek, S., Wedemeyer, H. & Lange, C.M. Инфекция вируса гриппа как провоцирующее событие острой или хронической печеночной недостаточности. J. Hepatol. 70 , 797–799 (2019).
PubMed
Google ученый
Eslam, M. et al. Новое определение жировой болезни печени, связанной с метаболической дисфункцией: международное экспертное консенсусное заявление. J. Hepatol. 73 , 202–209 (2020).
PubMed
PubMed Central
Google ученый
Ji, D. et al. Неалкогольные жировые заболевания печени у пациентов с COVID-19: ретроспективное исследование. J. Hepatol. 73 , 451–453 (2020).
CAS
PubMed
PubMed Central
Google ученый
Zhou, Y. J. et al. Более молодые пациенты с MAFLD подвержены повышенному риску тяжелого заболевания COVID-19: многоцентровый предварительный анализ. J. Hepatol. 73 , 719–721 (2020).
CAS
PubMed
PubMed Central
Google ученый
Roca-Fernandez, A. et al. Высокое содержание жира в печени связано с более высоким риском развития симптоматической инфекции COVID-19 — первые наблюдения британского биобанка. medRxiv https: // doi.org / 10.1101 / 2020.06.04.20122457 (2020).
Артикул
Google ученый
Lopez-Mendez, I. et al. Связь стеатоза и фиброза печени с клиническими исходами у пациентов с инфекцией SARS-CoV-2 (COVID-19). Ann. Гепатол. 20 , 100271 (2021).
PubMed
Google ученый
Marjot, T. et al. Результаты после заражения SARS-CoV-2 у пациентов с хроническим заболеванием печени: исследование в международном регистре. J. Hepatol. 74 , 567–577 (2020).
PubMed
PubMed Central
Google ученый
Marjot, T. et al. Инфекция SARS-CoV-2 у больных аутоиммунным гепатитом. J. Hepatol. https://doi.org/10.1016/j.jhep.2021.01.021 (2021 г.). Самая большая когорта пациентов с АИГ и инфекцией SARS-CoV-2 ( n = 70), показывающая эквивалентный риск смерти по сравнению с подобранными по шкале предрасположенностью пациентами с другой этиологией заболевания печени ( n = 862) и пациентов без заболеваний печени ( n = 769) .
Артикул
PubMed
PubMed Central
Google ученый
Iavarone, M. et al. Высокие показатели 30-дневной смертности у пациентов с циррозом печени и COVID-19. J. Hepatol. 73 , 1063–1071 (2020). Многоцентровое исследование в северной Италии, посвященное результатам и ведению пациентов с циррозом печени и COVID-19, включая использование тромбопрофилактики .
CAS
PubMed
PubMed Central
Google ученый
Bajaj, J. S. et al. Цирроз связан с высокой смертностью и повторной госпитализацией в течение 90 дней независимо от COVID-19: многоцентровая когорта. Liver Transpl. https://doi.org/10.1002/lt.25981 (2021 г.). Длительное наблюдение за пациентами с циррозом, пережившими острый эпизод COVID-19, показывающее эквивалентную смертность через 90 дней по сравнению с пациентами с циррозом только .
Артикул
PubMed
PubMed Central
Google ученый
Wu, T. et al. Разработка диагностических критериев и прогностической оценки острой хронической печеночной недостаточности, связанной с вирусом гепатита В. Кишечник 67 , 2181–2191 (2018).
CAS
PubMed
Google ученый
Moreau, R. et al. Острая хроническая печеночная недостаточность — это особый синдром, который развивается у пациентов с острой декомпенсацией цирроза. Гастроэнтерология 144 , 1426–1437.e9 (2013).
PubMed
Google ученый
Horwitz, L. I. et al. Динамика показателей смертности от COVID-19 с поправкой на риск. J. Hosp. Med. 16 , 90–92 (2021).
PubMed
Google ученый
Дуддемпуди, А. Т. Иммунология при алкогольной болезни печени. Clin. Liver Dis. 16 , 687–698 (2012).
PubMed
Google ученый
Yeoh, Y. K. et al. Состав кишечной микробиоты отражает тяжесть заболевания и дисфункциональные иммунные реакции у пациентов с COVID-19. Кишечник https://doi.org/10.1136/gutjnl-2020-323020 (2021 г.).
Артикул
PubMed
PubMed Central
Google ученый
Bajaj, J. S. Измененная микробиота при циррозе и ее связь с развитием инфекции. Clin. Liver Dis. 14 , 107–111 (2019).
Google ученый
Adeniji, N. et al. Социально-экономические факторы способствуют более высокому риску COVID-19 у расовых и этнических меньшинств с хроническими заболеваниями печени (ХЗП). Гастроэнтерология https://doi.org/10.1053/j.gastro.2020.11.035 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Wegermann, K. et al. Расовые и социально-экономические различия в использовании телемедицины у пациентов с заболеванием печени во время COVID-19. Dig. Дис. Sci. https://doi.org/10.1007/s10620-021-06842-5 (2021 г.).
Артикул
PubMed
PubMed Central
Google ученый
Boettler, T. et al. Влияние COVID-19 на лечение пациентов с заболеваниями печени: документ с изложением позиции EASL-ESCMID после 6 месяцев пандемии. Представитель JHEP 2 , 100169 (2020). В этой статье обсуждается влияние COVID-19 на лечение гепатологов и представлена обновленная информация о рекомендуемой практике для врачей, занимающихся лечением пациентов с заболеваниями печени .
PubMed
PubMed Central
Google ученый
Fix, O. K. et al. Рекомендации по передовой клинической практике для гепатологов и поставщиков трансплантатов печени во время пандемии COVID-19: консенсус группы экспертов AASLD. Гепатология 72 , 287–304 (2020). Руководство AASLD по ведению пациентов с заболеваниями печени и реципиентов трансплантата печени во время пандемии COVID-19 .
CAS
PubMed
Google ученый
Целевая группа APASL по Covid-19, Лау, Г. и Шарма, М. Руководство по клинической практике для гепатологов и провайдеров трансплантации печени во время пандемии COVID-19: рекомендации консенсуса экспертной группы APASL. Hepatol. Int. 14 , 415–428 (2020).
Google ученый
Angeli, P. et al. Руководство EASL по клинической практике ведения пациентов с декомпенсированным циррозом печени. J. Hepatol. 69 , 406–460 (2018).
Google ученый
Манолис А.С., Манолис Т.А., Манолис А.А., Папатеу Д. и Мелита, инфекция H. COVID-19: вирусная макро- и микрососудистая коагулопатия и тромбоэмболия / профилактическое и терапевтическое лечение. J. Cardiovasc. Pharmacol. Ther. 26 , 12–24 (2021 г.).
CAS
PubMed
Google ученый
Бикдели, Б.и другие. COVID-19 и тромботическая или тромбоэмболическая болезнь: значение для профилактики, антитромботической терапии и последующего наблюдения: современный обзор JACC. J. Am. Coll. Кардиол. 75 , 2950–2973 (2020).
CAS
PubMed
PubMed Central
Google ученый
Turco, L., de Raucourt, E., Valla, D. C. & Villa, E. Антикоагулянтная терапия у пациентов с циррозом печени. Отчеты JHEP 1 , 227–239 (2019).
PubMed
PubMed Central
Google ученый
Лоффредо, Л., Пастори, Д., Фаркомени, А. и Виоли, Ф. Эффекты антикоагулянтов у пациентов с циррозом и тромбозом воротной вены: систематический обзор и метаанализ. Гастроэнтерология 153 , 480–487.e1 (2017).
CAS
PubMed
Google ученый
Тритчлер Т.и другие. Антикоагулянтные вмешательства у госпитализированных пациентов с COVID-19: обзор объема рандомизированных контролируемых испытаний и призыв к международному сотрудничеству. J. Thromb. Гемост. 18 , 2958–2967 (2020).
CAS
PubMed
Google ученый
Lemos, A.C.B. et al. Сравнение терапевтических и профилактических антикоагулянтов при тяжелой форме COVID-19: рандомизированное клиническое исследование фазы II (HESACOVID). Тромб.Res. 196 , 359–366 (2020).
CAS
PubMed
PubMed Central
Google ученый
Ватт, К. Д. Ключи к долгосрочному уходу за реципиентом трансплантата печени. Nat. Преподобный Гастроэнтерол. Гепатол. 12 , 639–648 (2015).
PubMed
Google ученый
Benitez, C. et al. Проспективное многоцентровое клиническое исследование отмены иммуносупрессивных препаратов у стабильных взрослых реципиентов трансплантата печени. Гепатология 58 , 1824–1835 (2013).
CAS
PubMed
Google ученый
Colmenero, J. et al. Эпидемиологическая картина, частота и исходы COVID-19 у пациентов с трансплантацией печени. J. Hepatol. 74 , 148–155 (2021). Проспективное общенациональное исследование, включающее последовательную когорту пациентов с трансплантацией печени с COVID-19 в Испании. Смертность у реципиентов LT была ниже, чем у подобранной общей популяции .
CAS
PubMed
Google ученый
Ravanan, R. et al. Инфекция SARS-CoV-2 и ранняя смертность реципиентов, находящихся в списке ожидания, и реципиентов солидных органов в Англии: национальное когортное исследование. Am. J. Transplant. 20 , 3008–3018 (2020).
CAS
PubMed
Google ученый
Webb, G.J. et al. Результаты после инфицирования SARS-CoV-2 у реципиентов трансплантата печени: исследование в международном регистре. Ланцет Гастроэнтерол. Гепатол. 5 , 1008–1016 (2020). Данные международного реестра для 151 реципиента LT и 627 пациентов, не перенесших трансплантацию, демонстрируют эквивалентный риск смерти после инфекции SARS-CoV-2 в анализе с сопоставлением по шкале предрасположенности .
PubMed
PubMed Central
Google ученый
Rauber, C. et al. Распространенность SARS-CoV-2 и клинические особенности COVID-19 в немецкой когорте реципиентов печени: проспективное серологическое исследование. Пересадка. Proc. https://doi.org/10.1016/j.transproceed.2020.11.009 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Lee, B. T. et al. COVID-19 у реципиентов трансплантата печени: первый опыт из эпицентра США. Гастроэнтерология 159 , 1176–1178.e2 (2020).
CAS
PubMed
PubMed Central
Google ученый
Pereira, M. R. et al. COVID-19 у реципиентов трансплантатов твердых органов: первоначальный отчет из эпицентра США. Am. J. Transplant. 20 , 1800–1808 (2020).
CAS
PubMed
Google ученый
Матур, А. К., Шаубель, Д. Э., Гонг, К., Гайдингер, М. К. и Мерион, Р. М. Различия в частоте трансплантации печени в США по признаку пола. Am. J. Transplant. 11 , 1435–1443 (2011).
CAS
PubMed
PubMed Central
Google ученый
Sharma, P. et al. Влияние распределения на основе MELD на терминальную стадию почечной недостаточности после трансплантации печени. Am. J. Transplant. 11 , 2372–2378 (2011).
CAS
PubMed
PubMed Central
Google ученый
Либер, С. Р. и др. Влияние посттрансплантационного сахарного диабета на результаты трансплантации печени. Clin. Пересадка. 33 , e13554 (2019).
PubMed
PubMed Central
Google ученый
Everhart, J. E. et al. Изменение веса и ожирение после трансплантации печени: частота встречаемости и факторы риска. Liver Transpl. Surg. 4 , 285–296 (1998).
CAS
PubMed
Google ученый
Su, F. et al.Старение зарегистрированных на трансплантацию печени и реципиентов: тенденции и влияние на результаты в списке ожидания, исходы после трансплантации и выгода от выживаемости, связанной с трансплантацией. Гастроэнтерология 150 , 441–453.e6 (2016).
PubMed
Google ученый
Сейям М., Нойбергер Дж. М., Гансон Б. К. и Хабшер С. Г. Цирроз после ортотопической трансплантации печени при отсутствии рецидива первичного заболевания. Liver Transpl. 13 , 966–974 (2007).
PubMed
Google ученый
Rabiee, A. et al. Повреждение печени у реципиентов трансплантата печени с коронавирусной болезнью 2019 (COVID-19): многоцентровый опыт США. Гепатология https://doi.org/10.1002/hep.31574 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Clift, A. K. et al. Алгоритм прогнозирования риска для жизни (QCOVID) для определения риска госпитализации и смертности от коронавируса 19 у взрослых: национальное исследование когортного происхождения и валидации. BMJ 371 , m3731 (2020).
PubMed
PubMed Central
Google ученый
Уэбб, Дж. Дж., Мун, А. М., Барнс, Э., Барритт, А. С. Четвертый и Марджот, Т. Возраст и сопутствующие заболевания имеют решающее значение для риска смерти от COVID-19 у реципиентов трансплантата печени. J. Hepatol. https://doi.org/10.1016/j.jhep.2021.01.036 (2021 г.).
Артикул
PubMed
PubMed Central
Google ученый
Del Valle, D. M. et al. Сигнатура воспалительного цитокина предсказывает тяжесть COVID-19 и выживаемость. Nat. Med. 26 , 1636–1643 (2020).
PubMed
Google ученый
Zhang, Q. et al.Врожденные аномалии IFN-иммунитета I типа у пациентов с опасным для жизни COVID-19. Наука https://doi.org/10.1126/science.abd4570 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Bastard, P. et al. Аутоантитела к IFN типа I у пациентов с опасным для жизни COVID-19. Наука https://doi.org/10.1126/science.abd4585 (2020).
Артикул
PubMed
PubMed Central
Google ученый
RECOVERY Коллективная группа. и другие. Дексаметазон у госпитализированных пациентов с Covid-19 — предварительное сообщение. N. Engl. J. Med. https://doi.org/10.1056/NEJMoa2021436 (2020).
Артикул
Google ученый
Д’Антига, L. Коронавирусы и пациенты с ослабленным иммунитетом: факты во время третьей эпидемии. Liver Transpl. 26 , 832–834 (2020).
PubMed
Google ученый
Boettler, T. et al. Уход за пациентами с заболеваниями печени во время пандемии COVID-19: документ с изложением позиции EASL-ESCMID. Представитель JHEP 2 , 100113 (2020).
PubMed
PubMed Central
Google ученый
Polack, F. P. et al. Безопасность и эффективность вакцины Covid-19 мРНК BNT162b2. N. Engl. J. Med. 383 , 2603–2615 (2020).
CAS
PubMed
Google ученый
Voysey, M. et al. Безопасность и эффективность вакцины ChAdOx1 nCoV-19 (AZD1222) против SARS-CoV-2: промежуточный анализ четырех рандомизированных контролируемых испытаний в Бразилии, Южной Африке и Великобритании. Ланцет 397 , 99–111 (2021).
CAS
PubMed
PubMed Central
Google ученый
Баден, Л. Р. и др. Эффективность и безопасность вакцины mRNA-1273 SARS-CoV-2. N. Engl. J. Med. 384 , 403–416 (2021).
CAS
PubMed
Google ученый
Логунов Д.Ю. Безопасность и эффективность гетерологичной первичной вакцины против COVID-19 на основе векторов rAd26 и rAd5: промежуточный анализ рандомизированного контролируемого исследования фазы 3 в России. Ланцет https://doi.org/10.1016/S0140-6736(21)00234-8 (2021).
Артикул
PubMed
PubMed Central
Google ученый
Marjot, T. et al. Вакцинация против SARS-CoV-2 у пациентов с заболеванием печени: ответ на следующий большой вопрос. Ланцет Гастроэнтерол. Гепатол . (2021 г.). Сводка данных по безопасности и эффективности вакцинации против SARS-CoV-2 по результатам испытаний фазы III и обсуждение ключевых клинических и исследовательских соображений для пациентов с заболеванием печени и трансплантацией .
Lebosse, F. et al. CD8 + Т-клетки пациентов с циррозом имеют фенотип, который может способствовать иммунной дисфункции, связанной с циррозом. EBioMedicine 49 , 258–268 (2019).
PubMed
PubMed Central
Google ученый
Лиаскоу Э. и Хиршфилд Г. М. Иммунная дисфункция, связанная с циррозом: новое понимание нарушения адаптивного иммунитета. EBioMedicine 50 , 3–4 (2019).
PubMed
PubMed Central
Google ученый
Арванити, В.и другие. Инфекции у пациентов с циррозом печени увеличивают смертность в четыре раза и должны использоваться для определения прогноза. Гастроэнтерология 139 , 1246–1256 (2010).
PubMed
Google ученый
McCashland, T. M., Preheim, L. C. и Gentry, M. J. Ответ пневмококковой вакцины при циррозе и трансплантации печени. J. Infect. Дис. 181 , 757–760 (2000).
CAS
PubMed
Google ученый
Aggeletopoulou, I., Davoulou, P., Konstantakis, C., Thomopoulos, K. & Triantos, C. Ответ на вакцинацию против гепатита B у пациентов с циррозом печени. Rev. Med. Вирол . 27 , https://doi.org/10.1002/rmv.1942 (2017).
Чонг П. и Эйвери Р. К. Комплексный обзор практики иммунизации реципиентов трансплантации твердых органов и гемопоэтических стволовых клеток. Clin. Ther. 39 , 1581–1598 (2017).
CAS
PubMed
Google ученый
Fix, О. К. Консенсус группы экспертов AASLD: вакцины для предотвращения инфекции COVID-19 у пациентов с заболеваниями печени. (AASLD, 2021). Согласованные заявления AASLD о подходе к вакцинации против SARS-CoV-2 у пациентов с заболеванием печени и после трансплантации .
Таппер, Э. Б. и Асрани, С. К. Пандемия COVID-19 окажет долгосрочное влияние на качество лечения цирроза печени. J. Hepatol. 73 , 441–445 (2020).
CAS
PubMed
PubMed Central
Google ученый
Гарсия-Цао, Г., Абралдес, Дж. Г., Берзиготти, А. и Бош, Дж. Портальное гипертоническое кровотечение при циррозе: стратификация риска, диагностика и лечение: практическое руководство Американской ассоциации по исследованию 2016 г. заболеваний печени. Гепатология 65 , 310–335 (2017).
PubMed
Google ученый
Эрман, А., Вонг, В. В. Л., Фельд, Дж. Дж., Гроотендорст, П. и Кран, М. Д. Влияние на здоровье отсрочки противовирусного лечения прямого действия при хроническом гепатите С: аналитический подход к принятию решений. Liver Int. 40 , 51–59 (2020).
PubMed
Google ученый
Wu, C. Y. et al. Связь между ультразвуковым скринингом и смертностью у пациентов с гепатоцеллюлярной карциномой: общенациональное когортное исследование. Кишечник 65 , 693–701 (2016).
PubMed
Google ученый
Amaddeo, G. et al. Влияние COVID-19 на лечение гепатоцеллюлярной карциномы в зоне с высокой распространенностью. Представитель JHEP 3 , 100199 (2021). Многоцентровое ретроспективное исследование во Франции, показывающее более длительную продолжительность лечения ГЦК во время пандемии, чем в течение того же периода времени в предыдущем году .
PubMed
Google ученый
Ди Майра, Т. и Беренгер, М. COVID-19 и трансплантация печени. Nat. Преподобный Гастроэнтерол. Гепатол. 17 , 526–528 (2020).
PubMed
Google ученый
Мерола, Дж., Шильски, М. Л. и Маллиган, Д. С. Влияние COVID-19 на донорство органов, закупку органов и трансплантацию печени в США. Hepatol. Commun. 5 , 5–11 (2020).
PubMed Central
Google ученый
Ritschl, P. V. et al. Программы трансплантации твердых органов сталкиваются с отсутствием эмпирических данных о пандемии COVID-19: подход, основанный на консенсусе рекомендаций стороннего общества. Am. J. Transplant. 20 , 1826–1836 (2020).
CAS
PubMed
Google ученый
Thorburn, D. et al. Возобновление трансплантации печени на фоне пандемии COVID-19. Ланцет Гастроэнтерол. Гепатол. 6 , 12–13 (2021 г.).
PubMed
Google ученый
Всемирная организация здравоохранения. Global Hepatitis Report, 2017. https://www.who.int/hepatitis/publications/global-hepatitis-report2017/en/ (2017).
Blach, S. et al. Влияние COVID-19 на глобальные усилия по ликвидации гепатита С. J. Hepatol. 74 , 31–36 (2021).
CAS
PubMed
Google ученый
The Lancet Gastroenterology Hepatology. Ликвидация вирусного гепатита в эпоху COVID-19: проблема и возможности. Ланцет Гастроэнтерол. Гепатол. 5 , 789 (2020).
CAS
PubMed
PubMed Central
Google ученый
Serper, M. et al. Местный ответ на COVID-19 при запущенном заболевании печени: текущая модель лечения, проблемы и возможности. J. Hepatol. 73 , 708–709 (2020).
CAS
PubMed
PubMed Central
Google ученый
Verna, E.C. et al. Клинические исследования в области гепатологии в эпоху пандемии COVID-19 и в постпандемию: проблемы и потребность в инновациях. Гепатология 72 , 1819–1837 (2020).
CAS
PubMed
Google ученый
Nicola, M. et al. Социально-экономические последствия пандемии коронавируса (COVID-19): обзор. Внутр. J. Surg. 78 , 185–193 (2020).
PubMed
PubMed Central
Google ученый
Nassisi, M. et al. Влияние карантина COVID-19 на фундаментальные научные исследования в офтальмологии: опыт узкоспециализированного исследовательского центра во Франции. Глаз 34 , 1187–1188 (2020).
CAS
PubMed
PubMed Central
Google ученый
Бакалейщик. Коронавирус: кризис привел к дополнительным расходам на выпивку в супермаркетах в размере 160 миллионов фунтов стерлингов. (Бакалейщик, 2020).
Институт изучения алкоголя. Потребление алкоголя во время изоляции от COVID-19 в Великобритании ias.org https://www.ias.org.uk/wp-content/uploads/2020/06/sb28062020.pdf (2020).
Общественное здравоохранение Англии. Более широкое влияние COVID-19 на инструмент мониторинга здоровья. gov.uk https://www.gov.uk/government/publications/wider-impacts-of-covid-19-on-health-monitoring-tool (2020).
Институт изучения алкоголя. Потребление алкоголя во время пандемии COVID-19 в Великобритании — Второй брифинг IAS ias.org https://www.ias.org.uk/wp-content/uploads/2020/10/sb2
20.pdf (2020).
Да, Б. Л., Им, Г. Ю. и Скиано, Т. Д. Похмелье от COVID-19: нарастающая волна расстройства, связанного с употреблением алкоголя, и связанных с алкоголем заболеваний печени. Гепатология 72 , 1102–1108 (2020).
CAS
PubMed
Google ученый
Niedzwiedz, C. L. et al. Психическое здоровье и поведение в отношении здоровья до и во время начальной фазы изоляции от COVID-19: продольный анализ лонгитюдного исследования домашних хозяйств в Великобритании. J. Epidemiol. Общественное здравоохранение 75 , 224–231 (2021). Данные лонгитюдного опроса среди 9748 взрослых в Великобритании, показывающие увеличение регулярного употребления алкоголя и чрезмерного употребления алкоголя на ранних стадиях пандемии наряду со снижением психологического благополучия .
PubMed
Google ученый
Winstock, A. R. et al. Отчет об основных результатах GDS COVID-19 Special Edition https://www.globaldrugsurvey.com/gds-covid-19-special-edition-key-findings-report/ (2020).
Исследование «Инструментарий по алкоголю». Потребление алкоголя в Англии ucl.ac.uk https://www.ucl.ac.uk/pals/research/clinical-educational-and-health-psychology/research-groups/health-psychology-research-45 (2020 ).
Kim, J. U. et al. Влияние ограничения COVID-19 на потребление алкоголя у пациентов с ранее существовавшим расстройством, связанным с употреблением алкоголя. Ланцет Гастроэнтерол. Гепатол. 5 , 886–887 (2020).
PubMed
PubMed Central
Google ученый
Cargill, Z. et al. Поступления в больницу после коронавируса COVID-19 с тяжелыми заболеваниями печени, связанными с алкоголем: канарейка в угольной шахте? Frontline Gastroenterol. https://doi.org/10.1136/flgastro-2020-101693 (2020).
Артикул
Google ученый
Pellegrini, M. et al. Изменения веса и пищевых привычек у взрослых с ожирением в период «изоляции», вызванные чрезвычайной ситуацией, связанной с вирусом COVID-19. Питательные вещества 12 , 2016 (2020).
CAS
PubMed Central
Google ученый
dВопросы и ответы. Влияние COVID-19 на диабетическое сообщество в США https://d-qa.com/our-work/ (2020).
Махмуд, Н., Хаббард, Р.А., Каплан Д. Э. и Серпер М. Снижение госпитализаций с циррозом печени после пандемии COVID-19: национальное когортное исследование. Гастроэнтерология 159 , 1134–1136.e3 (2020).
CAS
PubMed
PubMed Central
Google ученый
Bajaj, J. S. et al. Сравнение риска смертности у пациентов с циррозом и COVID-19 по сравнению с пациентами с циррозом только и только с COVID-19: многоцентровая подобранная когорта. Кишечник 70 , 531–536 (2021).
CAS
PubMed
Google ученый
Kim, D. et al. Предикторы исходов COVID-19 у пациентов с хроническим заболеванием печени: многоцентровое исследование в США. Clin. Гастроэнтерол. Гепатол. https://doi.org/10.1016/j.cgh.2020.09.027 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Sarin, S. K. et al. Существовавшее ранее заболевание печени связано с плохим исходом у пациентов с инфекцией SARS CoV2; исследование APCOLIS (APASL COVID-19 Liver Injury Spectrum Study). Hepatol. Int. 14 , 690–700 (2020).
PubMed
Google ученый
Kates, O. S. et al. COVID-19 при трансплантации твердых органов: многоцентровое когортное исследование. Clin. Заразить. Дис. https://doi.org/10.1093/cid/ciaa1097 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Belli, L. S. et al. Защитная роль такролимуса, вредная роль возраста и сопутствующих заболеваний у реципиентов трансплантата печени с Covid-19: результаты многоцентрового европейского исследования ELITA / ELTR. Гастроэнтерология https://doi.org/10.1053/j.gastro.2020.11.045 (2020)
Статья
PubMed
PubMed Central
Google ученый
Батт, А.А., Ян, П., Чотани, Р.А., и Шейх, О.С. Смертность не увеличивается у людей, инфицированных SARS-CoV-2 и инфицированных вирусом гепатита С. Liver Int. https://doi.org/10.1111/liv.14804 (2021 г.).
Артикул
PubMed
PubMed Central
Google ученый
Tillett, R. L. et al. Геномные доказательства реинфекции SARS-CoV-2: тематическое исследование. Lancet Infect. Дис. 21 , 52–58 (2021).
CAS
PubMed
Google ученый
Qin, J. et al. Периоперационная картина заболевания COVID-19 у реципиента трансплантата печени. Гепатология 72 , 1491–1493 (2020).
CAS
PubMed
Google ученый
Long, Q. X. et al. Клинико-иммунологическая оценка бессимптомных инфекций SARS-CoV-2. Nat.Med. 26 , 1200–1204 (2020).
CAS
PubMed
Google ученый
Levitsky, J. et al. Риск иммуноопосредованной дисфункции трансплантата у реципиентов трансплантата печени с рецидивирующей инфекцией ВГС, получавших пегилированный интерферон. Гастроэнтерология 142 , 1132–1139.e1 (2012).
CAS
PubMed
Google ученый
Friend, B.D. et al. Смертельное ортотопическое отторжение трансплантата печени, вызванное ингибитором контрольной точки, у двух пациентов с рефрактерной метастатической гепатоцеллюлярной карциномой. Pediatr. Рак крови 64 , e26682 (2017).
Google ученый
Дучини А., Хендри Р. М., Ниберг, Л. М., Вернес, М. Э. и Покрос, П. Дж. Иммунный ответ на вакцину против гриппа у взрослых реципиентов трансплантата печени. Liver Transpl. 7 , 311–313 (2001).
CAS
PubMed
Google ученый
Что означает повышенный уровень печени у собаки? • MSPCA-Angell
Мара Ратнофски, DVM
angell.org/generalmedicine
617-522-7282
Печень — удивительный орган, выполняющий более 500 жизненно важных функций.Он обрабатывает всю кровь, покидающую желудочно-кишечный тракт, расщепляя токсины, превращая лекарства в формы, которые могут быть лучше использованы организмом, и вырабатывает питательные вещества. Печень накапливает энергию и железо для будущего использования организмом, помогает регулировать свертывание крови и выводит старые эритроциты из кровообращения. Печень выделяет продукты жизнедеятельности в виде желчи, вещества, которое также помогает переваривать жиры.
Ваш ветеринар может порекомендовать анализ крови, чтобы проверить показатели печени вашей собаки.Это может быть частью обычного обследования, чтобы получить более полное представление об общем состоянии здоровья вашей собаки, или ваш ветеринар может беспокоиться о функции печени вашей собаки. Плохой аппетит, рвота, вялость, обильное питье и мочеиспускание, изменение цвета глаз или кожи на желтый, судороги и скопление жидкости в брюшной полости — все это может быть признаком заболевания печени.
Ниже приводится разбивка того, что оценивает ваш ветеринар, когда он или она смотрит на «показатели печени».
1) Гепатоцеллюлярные ферменты — AST (аспартатаминотрансфераза) и ALT (аланинаминотрансфераза)
AST и ALT — это ферменты, содержащиеся в клетках печени.Когда уровень в крови повышается, это означает, что ферменты вышли из клеток печени из-за повреждения клеток. AST обнаруживается в мышечных клетках, а также в клетках печени, поэтому повышение уровня AST без аналогичного повышения уровня ALT может указывать на повреждение мышц, а не повреждение печени. Хотя повышение уровня АЛТ характерно для печени, существует множество заболеваний, не связанных с печенью, которые могут косвенно влиять на печень и вызывать повышение уровня АЛТ. Например, сердечная недостаточность и воспаление кишечника могут вызвать повышение АЛТ в 4 или 5 раз по сравнению с нормальным диапазоном.Даже тяжелое стоматологическое заболевание может вызвать повышение АЛТ. Что касается первичных проблем с печенью, прием определенных токсинов или хроническое воспаление печени (из-за инфекции, чрезмерной реакции иммунной системы, генетических нарушений и т. Д.), Как правило, приводит к наиболее значительному повышению уровня АЛТ.
2) Холестатические ферменты — ALP (щелочная фосфатаза) и GGT (γ-глутамилтранспептидаза)
ALP и GGT содержатся в клетках, выстилающих желчные протоки — тонкие трубки, которые направляют поток желчи из печени в тонкий кишечник.Если поток желчи заблокирован, эти клетки увеличивают производство ALP и GGT и высвобождают их в кровь. Причины плохого оттока желчи в печени включают узловую гиперплазию (доброкачественное заболевание у пожилых собак), обширную инфекцию, раковые опухоли и аномалии кровеносных сосудов. Однако существует несколько различных форм ЩФ у собак, и наши обычные лабораторные тесты не могут различить их. У собак младше года обычно повышенный уровень ЩФ в результате роста костей, поскольку существует форма ЩФ, ассоциированная с костью (В-ЩФ).Собаки, принимающие стероидные препараты, часто имеют повышенную ЩФ, потому что существует форма, стимулируемая присутствием стероидов (С-ЩФ). Эти повышения не указывают на дисфункцию печени. У некоторых пород собак, таких как шотландские терьеры, сибирские хаски и миниатюрные шнауцеры, также наблюдается доброкачественное повышение ЩФ. И так же, как с гепатоцеллюлярными ферментами, холестатические ферменты также увеличиваются из-за воздействия на печень не связанных с печенью заболеваний. Панкреатит, заболевание желчного пузыря, воспаление кишечника и некоторые эндокринные заболевания повышают уровень ЩФ.
Другие стандартные лабораторные результаты также могут помочь нам определить заболевание печени. Поскольку печень отвечает за выработку альбумина (белка крови) и холестерина, низкий уровень альбумина или холестерина может быть результатом тяжелого заболевания печени. Пожелтение глаз и кожи, также известное как желтуха или желтуха, может возникнуть, когда печень не удаляет эффективно разрушенные старые эритроциты из кровотока. Низкий уровень сахара в крови может возникнуть, когда больная печень не может высвобождать накопленную энергию.
Как видите, повышение показателей печени не обязательно означает серьезную проблему с печенью вашей собаки. Ваш ветеринар примет во внимание породу вашей собаки, возраст, историю болезни, а также недавние лекарства и дополнительные лабораторные результаты, чтобы определить, есть ли доброкачественное объяснение лабораторным результатам, уместен ли мониторинг показателей печени в течение нескольких месяцев или требуется дальнейшая диагностика. Дополнительная диагностика может включать рентген, УЗИ брюшной полости, дополнительные анализы крови (желчные кислоты, уровень аммиака) или биопсию печени.В любом случае печень обладает удивительной способностью к регенерации, поэтому наличие даже значительно повышенных показателей печени не обязательно означает плохой прогноз.
Обнаружена сильная связь между отклонениями от нормы печеночных тестов и плохими исходами на COVID-19
Исследователи Йельского центра печени обнаружили, что у пациентов с COVID-19 отклонения в тестах печени были намного выше, чем предполагалось в более ранних исследованиях. Они также обнаружили, что более высокие уровни ферментов печени — белков, высвобождаемых при повреждении печени — были связаны с худшими результатами для этих пациентов, включая поступление в реанимацию, искусственную вентиляцию легких и смерть.
Исследование появилось в сети 29 июля в журнале Hepatology.
Предыдущие исследования в Китае показали, что примерно у 15% пациентов с COVID-19 были аномальные тесты печени. Йельское исследование, которое ретроспективно рассматривало 1827 пациентов с COVID-19, которые были госпитализированы в систему здравоохранения Йельского университета Нью-Хейвена в период с марта по апрель, показало, что частота аномальных тестов печени была намного выше — от 41,6% до 83,4% пациентов, в зависимости от по конкретному тесту.
Всего исследователи из Йельского университета изучили пять тестов печени, изучая такие факторы, как повышение уровня аспартатаминотрансферазы (AST) и аланинтрансаминазы (ALT), которые указывают на воспаление клеток печени; повышение билирубина, что свидетельствует о нарушении функции печени; и повышенный уровень щелочной фосфатазы (ЩФ), что может указывать на воспаление желчных протоков.
Хотя исследователи не знают, почему частота аномальных тестов печени была намного выше, чем в предыдущих исследованиях из Китая, старший автор доктор Джозеф Лим, профессор медицины и директор Йельской программы по вирусным гепатитам, сказал, что другие различия в состоянии здоровья между пациентами Это можно объяснить населением Китая и США.
«Мы можем предположить, что пациенты в США могут иметь повышенный уровень других факторов риска, таких как алкогольная или неалкогольная жировая болезнь печени», — сказал он.
В США около трети людей страдают ожирением печени, а несколько миллионов человек страдают хроническим гепатитом B или C.
Доктор Майкл Натансон
Болезнь печени широко распространена среди населения США. Доктор Майкл Натансон, профессор медицины Глэдис Филлипс Крофут (заболевания пищеварительной системы), профессор клеточной биологии, директор Йельского центра печени и соавтор исследования, сказал: «В США около одной трети людей страдают ожирением печени, а несколько миллионов человек страдают хроническим гепатитом B или C.”
Поскольку исследователи из Йельского университета имели доступ к медицинским картам пациентов, они также могли просматривать свои тесты печени до того, как им был поставлен диагноз COVID-19. Примерно четверть пациентов в исследовании имели отклонения в тестах печени до госпитализации по поводу вируса. Но независимо от того, приходили ли пациенты в больницу с существующими проблемами с печенью или у них возникли они во время госпитализации, связанной с COVID-19, наблюдалась сильная связь между аномальными тестами печени и тяжестью случаев COVID-19, говорят исследователи.
По словам Натансона, вместо того, чтобы сама печень приводила к худшим результатам у пациентов с COVID-19, этот орган, скорее всего, является «сторонним наблюдателем», затронутым гипервоспалением, связанным с COVID-19, и побочными эффектами связанных с ним методов лечения.
Исследование отметило взаимосвязь между лекарствами, используемыми для лечения тяжелого COVID-19, и повреждением печени, в первую очередь препаратом тоцилизумаб.
«Мы наблюдали сильную связь между использованием лекарств от COVID-19 и аномальными тестами печени», — сказал Лим, но добавил, что они не могут с уверенностью сказать, что аномальные тесты были вызваны «лекарственным поражением печени», а не болезнь.
Ученые проводят дополнительные клинические и лабораторные исследования, чтобы лучше понять влияние COVID-19 на патологию печени. Натансон отметил, что Йельский центр печени, являясь одним из четырех центров печени, спонсируемых Национальным институтом здравоохранения, имеет уникальные возможности для продвижения этого исследования.
Дополнительные исследователи Йельского университета, вовлеченные в исследование, включают ведущего автора и резидента по внутренним болезням доктора Мелани Хундт; биостатист Яньхонг Дэн, содиректор аналитики Йельского центра аналитических наук; и Мария Чиарлеглио, доцент Йельской школы общественного здравоохранения.
.
