ПЕЧЕНЬ — Большая Медицинская Энциклопедия
ПЕЧЕНЬ [hepar (PNA, JNA, BNA)] — непарный орган, располагающийся в брюшной полости и относящийся к пищеварительной системе; является самой крупной железой в организме человека, принимает участие в процессах пищеварения, обмена веществ и кровообращения, осуществляет специфические ферментативные и экскреторные функции.
Сравнительная анатомия и эмбриология
У низших позвоночных П. появляется в виде трубчатого выроста кишки, стенка которого состоит из энтодермального эпителия. Этот слепой вырост лежит между листками брыжейки тонкой кишки. У ланцетника П. сохраняется в виде такого зачатка. У рыб такой зачаток прорастает в мезенхиму спланхноплевры, в которой ветвится. На эпителий слабо канализированных его ветвей наслаивается соединительная ткань, в которой проходят многочисленные кровеносные сосуды. Древовидная конструкция трубок и эпителиальных тяжей представляет основу развивающейся П. У круглоротых зачаток П. превращается в сложную трубчатую железу. Ее выводные протоки собирают секрет (желчь) из мелких канальцев, в к-рые открываются межклеточные щели. У наземных животных клеточная масса П. уплотняется, утрачивается ее трубчатое строение, уменьшается число печеночных пластин между синусоидами и число гепатоцитов в каждой печеночной пластине.
превращается в сложную трубчатую железу. Ее выводные протоки собирают секрет (желчь) из мелких канальцев, в к-рые открываются межклеточные щели. У наземных животных клеточная масса П. уплотняется, утрачивается ее трубчатое строение, уменьшается число печеночных пластин между синусоидами и число гепатоцитов в каждой печеночной пластине.
У человека П. закладывается на 3-й неделе эмбрионального развития. Выпячивание вентральной стенки начального отдела первичной средней кишки, который соответствует будущей двенадцатиперстной кишке, появляется у эмбрионов длиной 2,5 мм. Из энтодермальной выстилки этого выпячивания и развивается зачаток П. — печеночный дивертикул. У эмбриона длиной 5—6 мм в зачатке П. различают краниальную часть, из которой развиваются печеночные пластинки, внутрипеченочные желчные протоки и оба печеночных протока; каудальную часть, включающую пузырный отдел, из которого возникают желчный пузырь и пузырный проток, и центральную часть, из которой формируется общий желчный проток. Масса быстро размножающихся эпителиальных клеток врастает в мезенхиму вентральной брыжейки, заполняя пространство между поперечной перегородкой, пупочно-кишечным протоком и желудком. Система печеночных синусоидов, возникающая в мезенхиме вентральной брыжейки, позднее соединяется с ветвями венозных сосудов. В мезенхиме, сохраняющейся между печеночными пластинками, очень рано появляются очаги кроветворения в форме кровяных островков; они могут располагаться и в просветах синусоидов.
Масса быстро размножающихся эпителиальных клеток врастает в мезенхиму вентральной брыжейки, заполняя пространство между поперечной перегородкой, пупочно-кишечным протоком и желудком. Система печеночных синусоидов, возникающая в мезенхиме вентральной брыжейки, позднее соединяется с ветвями венозных сосудов. В мезенхиме, сохраняющейся между печеночными пластинками, очень рано появляются очаги кроветворения в форме кровяных островков; они могут располагаться и в просветах синусоидов.
На внутреннее строение зачатка П. влияют проходящие через него вены, с которыми соединяются печеночные синусоиды. Трабекулы печеночных клеток врастают в прослойки рыхлой соединительной ткани между пупочно-брыжеечными венами, из которых левые в дальнейшем редуцируются, а из правых формируется воротная вена. В пузырном отделе печеночного зачатка, сплошном вначале, затем возникает полое выбухание, из которого в дальнейшем формируются желчный пузырь Pi пузырный проток. Из листков вентральной брыжейки и мезенхимы образуются соединительнотканная капсула П.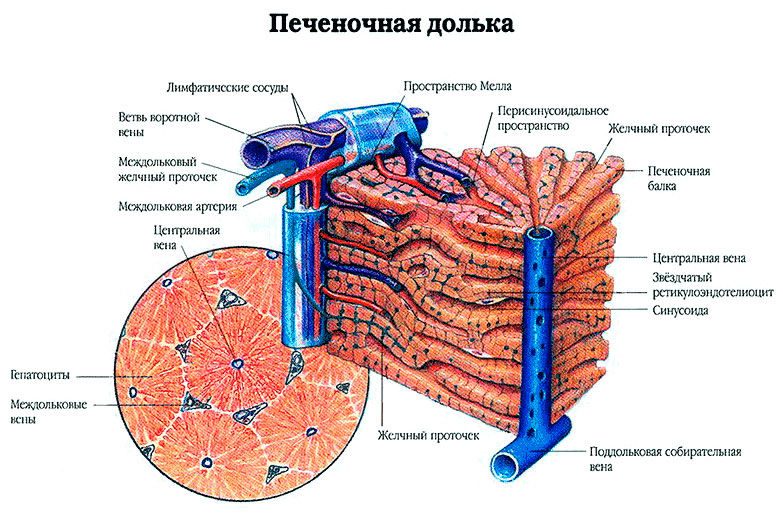 с мезотелиаль-ным слоем, междольковая соединительная ткань, а также соединительная ткань и гладкие мышцы желчных протоков. Остатки мезенхимы в развивающейся П. включаются в интерстициальную соединительную ткань, участвуют в создании стенок синусоидных кровеносных капилляров и сосудов между печеночными пластинками.
с мезотелиаль-ным слоем, междольковая соединительная ткань, а также соединительная ткань и гладкие мышцы желчных протоков. Остатки мезенхимы в развивающейся П. включаются в интерстициальную соединительную ткань, участвуют в создании стенок синусоидных кровеносных капилляров и сосудов между печеночными пластинками.
У 6-недельного зародыша П. макроскопически напоминает тутовую ягоду. К 18-й неделе внутриутробного развития обозначаются сегменты П.
Анатомия
Рис. 1. Макропрепарат печени (вид со стороны диафрагмальной поверхности): 1 — правая треугольная связка, 2 — диафрагма, 3 — венечная связка печени, 4 — левая треугольная связка, 5 — фиброзный отросток печени, 6 — левая доля печени, 7 — серповидная связка, 8 — круглая связка печени, 9 — вырезка круглой связки, 10 — нижний край печени, 11 — дно желчного пузыря, 12 — правая доля печени.
П. располагается в надчревье, занимая правое подреберье, собственно надчревную область и заходя левой долей в левое подреберье. П.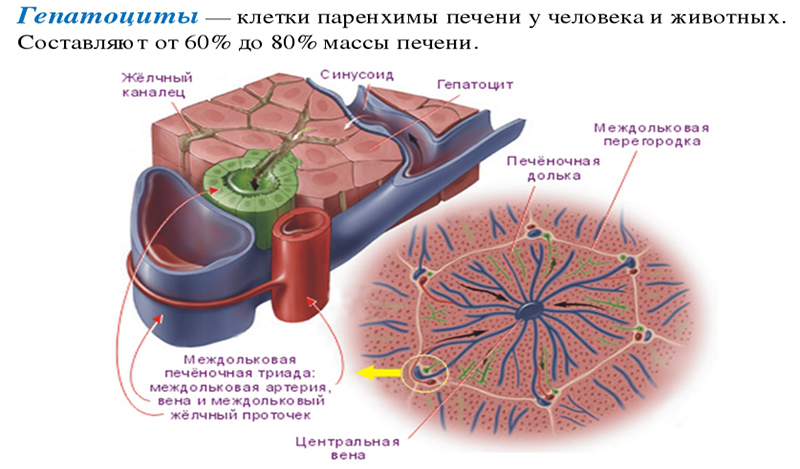 имеет неправильную куполообразную форму (рис. 1), красновато-коричневый цвет, мягкую, слегка упругую консистенцию, ее вес (масса) ок. 1500 г. Различают верхнюю поверхность П., соприкасающуюся с диафрагмой, и нижнюю, висцеральную, соприкасающуюся с органами брюшной полости. Передний (нижний) край П. острый, задний — закругленный. Сверху можно видеть деление П. на правую и левую доли, границей между которыми служит серповидная связка П.— переход брюшины с верхней поверхности П. на диафрагму. Два продольных углубления и поперечная борозда на висцеральной поверхности П. делят ее на 4 доли: правую, левую, квадратную и хвостатую. Правое продольное углубление спереди обозначается как ямка желчного пузыря, сзади обусловлено бороздой нижней полой вены. В левом продольном углублении сзади находится фиброзный тяж (венозная связка) — облитерированный венозный проток, спереди — круглая связка П., представляющая собой заросшую пупочную вену. Верхняя граница П., совпадающая с уровнем диафрагмы, идет дугообразно из правого десятого межреберья, от точки его пересечения со средней подмышечной линией, до левого пятого межреберья, до точки его пересечения с левой среднеключичной линией.
имеет неправильную куполообразную форму (рис. 1), красновато-коричневый цвет, мягкую, слегка упругую консистенцию, ее вес (масса) ок. 1500 г. Различают верхнюю поверхность П., соприкасающуюся с диафрагмой, и нижнюю, висцеральную, соприкасающуюся с органами брюшной полости. Передний (нижний) край П. острый, задний — закругленный. Сверху можно видеть деление П. на правую и левую доли, границей между которыми служит серповидная связка П.— переход брюшины с верхней поверхности П. на диафрагму. Два продольных углубления и поперечная борозда на висцеральной поверхности П. делят ее на 4 доли: правую, левую, квадратную и хвостатую. Правое продольное углубление спереди обозначается как ямка желчного пузыря, сзади обусловлено бороздой нижней полой вены. В левом продольном углублении сзади находится фиброзный тяж (венозная связка) — облитерированный венозный проток, спереди — круглая связка П., представляющая собой заросшую пупочную вену. Верхняя граница П., совпадающая с уровнем диафрагмы, идет дугообразно из правого десятого межреберья, от точки его пересечения со средней подмышечной линией, до левого пятого межреберья, до точки его пересечения с левой среднеключичной линией.
В этих точках сходятся верхняя и нижняя границы П. Нижняя граница П. справа совпадает с нижним краем реберной дуги. От места соединения IX и VIII ребер нижняя граница проходит косо влево к месту соединения хрящей левых VIII и VII ребер, пересекая срединную плоскость тела примерно на середине расстояния между пупком и мечевидным отростком грудины.
Висцеральной поверхностью П. соприкасается с некоторыми прилегающими к ней органами. К левой доле П. примыкают кардиальная часть желудка и брюшная часть пищевода.
На поверхности правой доли оставляют вдавления ободочная кишка, правые почка и надпочечник. П. почти со всех сторон покрыта брюшиной. Исключение составляет ее задневерхняя поверхность, сращенная с нижней поверхностью диафрагмы. Брюшина переходит с П. на желудок и верхнюю часть двенадцатиперстной кишки в виде малого сальника, который включает печеночно-желудочную и печеночно-дуоденальную связки. В число брюшинных связок П. включаются также печеночно-почечная и венечная связки.
В фиксации П. важную роль играет сращение ее с диафрагмой и нижней полой веной. Кроме того, удержанию П. в определенном положении способствует давление брюшного пресса и наличие связок.
П. окружена тонкой фиброзной оболочкой, состоящей из сети коллагеновых тяжей с примесью эластических волокон и отделяющей паренхиму П. от серозной оболочки. В области ворот П. фиброзная оболочка становится толще и вместе с воротной веной и собственной печеночной артерией под названием околососуди-стой фиброзной капсулы (портального тракта) входит в ворота П. Фиброзную оболочку, портальный тракт и внутрипеченочную соединительную ткань называют стромой П., которая у взрослых занимает ок. 4,3% объема органа (у детей до 6%).
Через П. во внутриутробном периоде проходит обогащенная кислородом и питательными веществами плацентарная кровь. Доставляется она по пупочной вене, которая у ворот П. вступает в воротную вену. В этом месте от нее отходит венозный проток, направляющийся в нижнюю полую вену. После рождения венозный проток превращается в венозную связку, а остаток облитерированной пупочной вены сохраняется в виде круглой связки П. С 2—3 мес. Г1. выступает из-под реберной дуги; она или вытянута в длину, или имеет выпуклую форму с неровными краями. Ребенок рождается с относительно большой П. Она весит в среднем 135 г, что составляет 4,5—5,5% от веса тела. В первые месяцы жизни относительные размеры П. уменьшаются, ее нижняя часть выступает за пределы правой реберной дуги на 1 — 2 см. К 2 годам вес П. увеличивается вдвое, к 3 годам — втрое. Сравнительно большая левая доля П. простирается в левую подреберную область и покрывает селезенку. К 7 годам границы П. соответствуют таковым у взрослого человека.К периоду полового созревания вес П. достигает в среднем 1350 г и составляет 3% от веса тела.
После рождения венозный проток превращается в венозную связку, а остаток облитерированной пупочной вены сохраняется в виде круглой связки П. С 2—3 мес. Г1. выступает из-под реберной дуги; она или вытянута в длину, или имеет выпуклую форму с неровными краями. Ребенок рождается с относительно большой П. Она весит в среднем 135 г, что составляет 4,5—5,5% от веса тела. В первые месяцы жизни относительные размеры П. уменьшаются, ее нижняя часть выступает за пределы правой реберной дуги на 1 — 2 см. К 2 годам вес П. увеличивается вдвое, к 3 годам — втрое. Сравнительно большая левая доля П. простирается в левую подреберную область и покрывает селезенку. К 7 годам границы П. соответствуют таковым у взрослого человека.К периоду полового созревания вес П. достигает в среднем 1350 г и составляет 3% от веса тела.
Рис. 1. Схематическое изображение дольки печени: 1 — сеть желчных канальцев, 2 — междольковые артерии, 3 — дольки печени, 4 — центральные вены, 5 — печеночная триада (междольковая артерия, междольковая вена, желчный междольковый проток).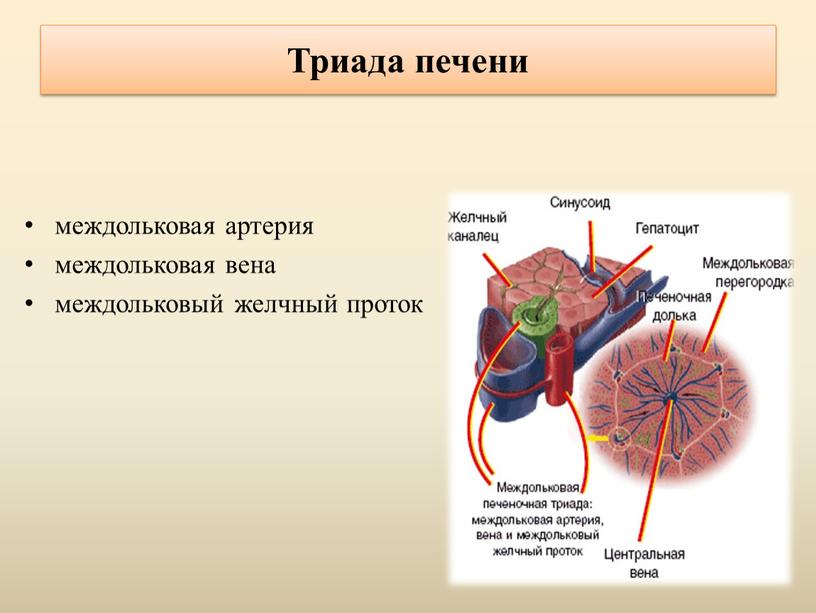
Рис. 2. Схематическое изображение сегментов печени (вид с диафрагмальной поверхности): I — передний сегмент, II — задний сегмент, III — медиальный сегмент, IV — боковой сегмент; 1 —общий желчный проток, 2 — воротная вена, 3 — собственная печеночная артерия.
Паренхима П. состоит из долек (цветн. рис. 1), клетки которых вырабатывают желчь (см.), собирающуюся в междольковые проточки. Следуя рядом с междольковы-ми кровеносными сосудами и соединяясь друг с другом, они образуют сегментарные и долевые протоки, а затем общий печеночный проток, который выходит из ворот печени (см. Желчные протоки). Внутрипеченочные желчные пути обособлены по долям. Правый печеночный проток принимает желчь из передней и задней ветвей, соответствующих одноименным сегментам правой доли. Левый печеночный проток,образующийся из слияния медиальной и латеральной ветвей, относится к двум сегментам левой доли. В соответствии с расположением желчных путей каждый из сегментов может быть разделен на верхнюю и нижнюю области. Через границы между сегментами, как правило, не переходят желчные пути и кровеносные сосуды. В хвостатой доле П. имеются отдельные правый и левый протоки.
Через границы между сегментами, как правило, не переходят желчные пути и кровеносные сосуды. В хвостатой доле П. имеются отдельные правый и левый протоки.
Рис. 2. Схема сегментарного строения печени по Куино (С. Couinaud): а — диафрагмальная поверхность печени, б — висцеральная поверхность печени; римскими цифрами обозначены номера сегментов.
Сегментом П. считают пирамидальный участок ее паренхимы, прилегающий к так наз. печеночной триаде (ветвь 2-го порядка воротной вены, сопутствующая ей ветвь собственной печеночной артерии и соответствующая ветвь печеночного протока). Передний сегмент правой доли проецируется на переднюю и верхнюю части диафрагмальной поверхности П., а задний сегмент занимает заднюю часть диафрагмальной поверхности и всю висцеральную поверхность правой доли П. Медиальный и латеральный сегменты разделяются левым продольным углублением. Квадратная и хвостатая доли П. составляют медиальный сегмент, а собственно левая доля совпадает с латеральным сегментом, (цветн. рис. 2). Число и номенклатура сегментов не полностью разработаны. Так, по схеме Куино (рис. 2) в П. выделяют 8 сегментов, в работах других исследователей — до 26.
рис. 2). Число и номенклатура сегментов не полностью разработаны. Так, по схеме Куино (рис. 2) в П. выделяют 8 сегментов, в работах других исследователей — до 26.
Кровоснабжение. П. получает кровь из воротной вены и собственной печеночной артерии, входящих в ворота П. между листками печеночно-двенадцатиперстной связки. Оба сосуда разветвляются в П. до общей капиллярной сети. Собственная печеночная артерия делится на правую и левую ветви, соответствующие долевым артериям. От них начинаются артерии сегментов: переднего и заднего — от правой долевой артерии, медиального и латерального — от левой. Они сопровождают соответствующие желчные протоки и дихотомически разделяются на ветви, из которых одна направляется в верхнюю область сегмента, другая в нижнюю. Кровоснабжение хвостатой доли обеспечивают правая и левая ветви собственной печеночной артерии. Постепенно истончаясь, артериальные ветви становятся междольковыми артериями, располагаются между дольками печени и доставляют им кровь. Капилляры, образующиеся в результате ветвления артериол, внедряются между балками долек печени и соединяются с синусоидными капиллярами портальной системы. Прямые сообщения между артериолами и венулами на периферии долек можно рассматривать как артериоловену-лярные анастомозы.
Капилляры, образующиеся в результате ветвления артериол, внедряются между балками долек печени и соединяются с синусоидными капиллярами портальной системы. Прямые сообщения между артериолами и венулами на периферии долек можно рассматривать как артериоловену-лярные анастомозы.
Воротная вена (см.) образует воротный синус, из которого берут начало правая и левая ветви и поперечная часть ствола хвостатой доли, распадающиеся на 6—10 ветвей. Существует 5—7 порядков ветвления воротной вены перед тем, как самые тонкие междольковые ветви превратятся в вокругдольковые (сеп-тальные) вены (они же прекапиллярных, или терминальные, венулы). Сеп-тальные вены, направляющиеся радиально, переходят в синусоидные капилляры, общие для артериальной и воротной системы. Капилляры открываются в центральную вену, получившую свое название от местоположения в центре дольки. Центральными венами начинается дренажная система печеночных вен. Вставочные и поддольковые собирательные вены формируют в конечном счете 3—4 главные печеночные вены. Короткие по протяжению стволы правой, средней и левой печеночных вен открываются в нижнюю полую вену непосредственно из паренхимы П. на задней ее поверхности. При их впадении в стенке вен располагаются мышечные жомы (сфинктеры).
Короткие по протяжению стволы правой, средней и левой печеночных вен открываются в нижнюю полую вену непосредственно из паренхимы П. на задней ее поверхности. При их впадении в стенке вен располагаются мышечные жомы (сфинктеры).
Лимфоотток из П. совершается по поверхностным и глубоким лимф, сосудам. Поверхностные лимф, сосуды следуют в толще капсулы П., образуя лимф, сеть с ячейками полигональной, вытянутой или неправильно-округлой формы. Многие петли ограничены лимф, сосудами, имеющими слепые выросты и расширения. Капиллярная сеть дает начало собирающим лимф, сосудам, к-рые при слиянии переходят в отводящие сосуды. Поверхностные лимф, сосуды анастомозируют с глубокими, начинающимися от вокруг-дольковых капиллярных сетей. Внутри долек лимф, капилляров нет. Междольковые лимф, коллекторы присоединяются к лимф, сплетениям, сопровождающим внутрипеченочные кровеносные сосуды и выводные желчные протоки. Здесь оформляются глубокие отводящие лимф, сосуды, направляющиеся к воротам П. или на ее заднюю поверхность к лимф, узлам задней брюшной стенки.
или на ее заднюю поверхность к лимф, узлам задней брюшной стенки.
Иннервация осуществляется симпатическими, парасимпатическими и чувствительными нервными волокнами. В нервных пучках, вступающих в П. по ходу воротной вены и собственной печеночной артерии, преобладают миелиновые волокна. Различают переднее печеночное сплетение, окружающее собственную печеночную артерию, и заднее, располагающееся рядом с воротной веной и общим желчным протоком. Эти сплетения формируются из ветвей чревного сплетения и хорд блуждающих нервов. В обоих сплетениях имеются многочисленные нервные узлы. Доказано участие в иннервации П. диафрагмальных нервов. Стенки кровеносных сосудов П. богаты адренергическими нервными волокнами. В стенках желчных протоков встречаются холинергические волокна, которых мало в стенке воротной вены. Окончания нервных волокон с плотными синаптическими везикулами обнаруживаются в среднем слое стенки сосудов вплоть до их внутренней оболочки. В области сфинктеров печеночных вен выделяются густые скопления нервных волокон. Стенка воротной вены содержит разнообразные чувствительные нервные окончания, совокупность которых позволяет выделить портальную рефлексогенную зону. Существование эфферентной иннервации печеночных клеток не доказано.
Стенка воротной вены содержит разнообразные чувствительные нервные окончания, совокупность которых позволяет выделить портальную рефлексогенную зону. Существование эфферентной иннервации печеночных клеток не доказано.
Рентгеноанатомия. На рентгенограмме П. дает интенсивную однородную тень. Контур диафрагмальной поверхности П. сливается с тенью правой половины диафрагмы. Наружный и передний контуры правой доли П. ровные, четкие.Нижний контур П. соответствует ее переднему краю — от тени позвоночника он направляется книзу и кнаружи; на нем можно заметить выемку в области ворот П. и ямку желчного пузыря. С наружным контуром правой доли П. нижний контур образует острый угол, который не превышает 60°. Левая доля П. у взрослых проецируется на тень позвоночника и поэтому видна гл. обр. в левой боковой проекции, в которой тень ее имеет форму треугольника, основанием обращенного к переднему скату диафрагмы, одной стороной — к передней брюшной стенке, а второй стороной — к передней стенке желудка. У детей левая доля П. относительно велика, и тень ее выдается влево от изображения позвоночника.
У детей левая доля П. относительно велика, и тень ее выдается влево от изображения позвоночника.
Изображение П. в плоскости, перпендикулярной к продольной оси тела, получают с помощью компьютерной томографии (см. Томография компьютерная). На компьютерных томограммах тень П. однородна, но в ней вырисовываются узкие светлые полоски крупных вен и желчных протоков; четко отображаются желчный пузырь и окружающие его прослойки жировой ткани.
Гистология
Паренхима П. построена из клеток железистого эпителия, образующих печеночные балки и пластинки, из которых состоят дольки П. На поперечном разрезе печеночная долька имеет вид шестиугольника, от сторон которого к центру тянутся печеночные балки и синусоидные капилляры. В середине шестиугольника печеночной дольки находится центральная вена. Внутридольковые кровеносные капилляры на всем протяжении выстланы эндотелием с плоскими, тонкими, пористыми клетками, к которым прилегают звездчатые ретикулоэндоте-лиоциты. Печеночные клетки, окружающие синусоиды П. , обладают большим количеством цитоплазматических микровыростов (микроворсин), увеличивающих их всасывающую и экскреторную поверхность. Клетки отстоят от поверхности эндотелия капилляров на нек-ром расстоянии, поэтому между ними образуется перисинусоидальное пространство — так наз. пространство Диссе. Пространство Диссе сообщается через поры с капиллярами и поэтому заполнено плазмой. Оно сообщается также с интерстициальным пространством Молля, откуда тканевая жидкость на периферии дольки может оттекать в междольковые корни лимф, системы.
, обладают большим количеством цитоплазматических микровыростов (микроворсин), увеличивающих их всасывающую и экскреторную поверхность. Клетки отстоят от поверхности эндотелия капилляров на нек-ром расстоянии, поэтому между ними образуется перисинусоидальное пространство — так наз. пространство Диссе. Пространство Диссе сообщается через поры с капиллярами и поэтому заполнено плазмой. Оно сообщается также с интерстициальным пространством Молля, откуда тканевая жидкость на периферии дольки может оттекать в междольковые корни лимф, системы.
Диаметр печеночных клеток составляет 18—40 мкм в зависимости от интенсивности обменных процессов и степени заполнения сосудистого русла кровью. Размеры печеночных клеток могут изменяться даже в течение суток. Их цитоплазма содержит большое число органелл, особенно митохондрий (см.). Имеется хорошо развитый гладкий и шероховатый Эндоплазматический ретикулум (см.). Пластинчатый комплекс (см. Гольджи комплекс) располагается между ядром клетки и плазмолеммой, обращенной к желчному капилляру, что объясняют его участием в регуляции желчеобразования. Хроматин в ядре распределен равномерно, кроме ДНК, в нем обнаруживают кислую и щелочную фосфатазу. Гепатоциты, располагающиеся по периферии дольки П., обладают хорошо развитым пластинчатым комплексом и менее крупными, округлыми митохондриями; они богаты гликогеном и ферментами углеводного обмена. В центральной зоне дольки П. гепатоциты более светлые, отличаются активностью белкового обмена, проявляют выраженную реакцию на щелочную фосфатазу. Помимо функциональных особенностей в печеночных клетках наблюдаются возрастные изменения. Так, процент двуядерных гепатоцитов с 1,5% у новорожденного достигает 8,3% у взрослых. В старческом возрасте в гепатоцитах откладывается пигмент липофусцин.
Хроматин в ядре распределен равномерно, кроме ДНК, в нем обнаруживают кислую и щелочную фосфатазу. Гепатоциты, располагающиеся по периферии дольки П., обладают хорошо развитым пластинчатым комплексом и менее крупными, округлыми митохондриями; они богаты гликогеном и ферментами углеводного обмена. В центральной зоне дольки П. гепатоциты более светлые, отличаются активностью белкового обмена, проявляют выраженную реакцию на щелочную фосфатазу. Помимо функциональных особенностей в печеночных клетках наблюдаются возрастные изменения. Так, процент двуядерных гепатоцитов с 1,5% у новорожденного достигает 8,3% у взрослых. В старческом возрасте в гепатоцитах откладывается пигмент липофусцин.
Печеночные пластинки разделены синусоидными капиллярами диаметром до 30 мкм и перисинусоидальны-ми пространствами Диссе. Стенка синусоидного капилляра построена из одного слоя эндотелиоцитов и не имеет базальной мембраны. Эндотелиоциты имеют уплощенную форму и многочисленные поры в цитоплазме. В цитоплазме эндотелиоцитов видны обильные мелкие митохондрии, рибосомы, хорошо представлен пластинчатый комплекс, а также много внутриклеточных включений, из которых одни постоянны, как, напр. , вакуоли, другие появляются периодически при изменении функционального состояния клетки. Большое число вакуолей облегчает трансэндотелиальный перенос молекул. Эндотелиоциты наряду со звездчатыми ретикулоэндотелиоцитами выполняют фагоцитарную функцию. В месте начала синусоида и при его впадении в центральную вену располагаются своеобразные запирательные устройства — прека-пиллярный и превенозный сфинктеры. Предполагают, что в их состав могут входить мышечные и гломусные клетки. Синусоидальные капилляры, которыми завершается портальная венозная система, встречаются с капиллярами артериального дерева П. в периферической и центральной зонах дольки П.
, вакуоли, другие появляются периодически при изменении функционального состояния клетки. Большое число вакуолей облегчает трансэндотелиальный перенос молекул. Эндотелиоциты наряду со звездчатыми ретикулоэндотелиоцитами выполняют фагоцитарную функцию. В месте начала синусоида и при его впадении в центральную вену располагаются своеобразные запирательные устройства — прека-пиллярный и превенозный сфинктеры. Предполагают, что в их состав могут входить мышечные и гломусные клетки. Синусоидальные капилляры, которыми завершается портальная венозная система, встречаются с капиллярами артериального дерева П. в периферической и центральной зонах дольки П.
Физиология
П. выполняет многообразные функции, важнейшими из которых являются гомеостатическая, метаболическая, экскреторная, барьерная и депонирующая. Осуществление этих функций и участие П. в обмене веществ возможны благодаря тесной связи П. с другими внутренними органами и кровью. Анатомическое положение, особенности строения, кровоснабжения и лимфообращения определяют многообразие функций П. Так, с особенностями внутрипеченочного кровообращения связывают различие функций периферических и центральных отделов долек П. Гепатоциты периферических отделов печеночных долек накапливают различные вещества, в т. ч. и высокоэргические соединения (см.), участвуют в детоксикации; гепатоциты центральных отделов печеночных долек осуществляют метаболизм билирубина и экскрецию в желчные капилляры ряда веществ эндо- и экзогенного происхождения.
Так, с особенностями внутрипеченочного кровообращения связывают различие функций периферических и центральных отделов долек П. Гепатоциты периферических отделов печеночных долек накапливают различные вещества, в т. ч. и высокоэргические соединения (см.), участвуют в детоксикации; гепатоциты центральных отделов печеночных долек осуществляют метаболизм билирубина и экскрецию в желчные капилляры ряда веществ эндо- и экзогенного происхождения.
Система кровообращения П. включает два приносящих кровеносных сосуда — воротную вену, через к-рую поступает 70—80% общего объема притекающей крови, и собственную печеночную артерию (20— 30% общего объема притекающей к П. крови) и один уносящий — печеночную вену. С целью выяснения роли портальной и печеночной систем в кровоснабжении П. в 1877 г. Н. В. Экк предпринял попытку выключения у собаки портального венозного кровоснабжения П. путем наложения анастомоза (фистула Эк-ка) между воротной и нижней полой веной, что привело к гибели животных вследствие отравления продуктами расщепления пищевых веществ (в первую очередь белков), поступавшими из кишечника в систему кровообращения, минуя П.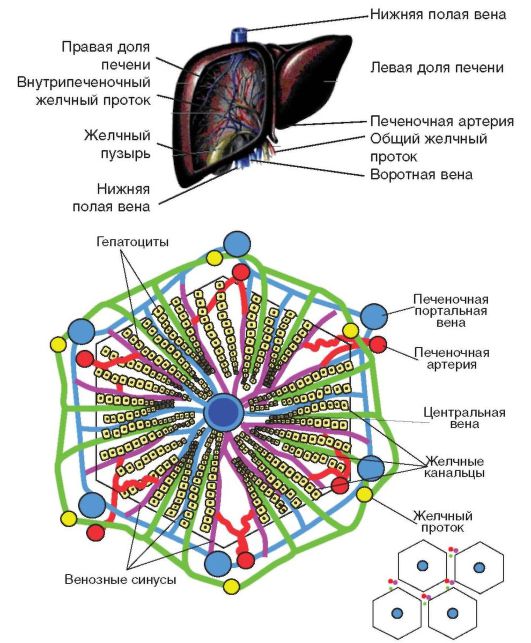 В 1893 г. И. П. Павлов, усовершенствовав технику операции и разработав специальный режим питания оперированных животных, добился их выживания в 30% случаев.
В 1893 г. И. П. Павлов, усовершенствовав технику операции и разработав специальный режим питания оперированных животных, добился их выживания в 30% случаев.
Через воротную вену в П. с кровью поступают продукты расщепления пищевых веществ, продукты гемолиза и др. Богатая кислородом кровь, поступающая через собственную печеночную артерию, вначале омывает гепатоциты периферических отделов долек П., отдавая им часть кислорода. К центральным отделам печеночных долек поступает кровь, менее насыщенная кислородом, что сказывается, напр., при действии повреждающих факторов — гепатоциты центральных отделов долек П. повреждаются сильнее периферических. В состоянии покоя, когда во внутрипеченочном кровоо6ращении участвует ок. 25% внутридольковых капилляров, через П. проходит до 30—35% минутного объема крови, что составляет 1460—1790 мл крови в 1 мин. Контакту гепатоцитов с кровью способствует медленный внутриорганный кровоток, обусловленный значительной шириной синусоидных капилляров и наличием в них и печеночных венах мышечных волокон, участвующих в регуляции скорости тока крови (см.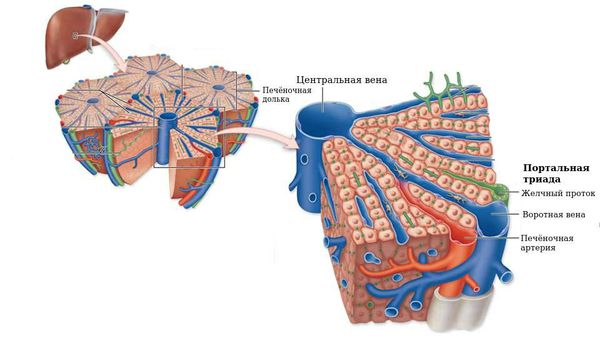 Портальное кровообращение).
Портальное кровообращение).
П. активно участвует в лимфообразовании. Установлено, что значительная часть лимфы грудного протока образуется в П. Эта лимфа содержит большое количество белка, что объясняется высокой проницаемостью печеночных капилляров для белков плазмы. Лимфообразование в П. способствует устранению застойных явлений при нарушениях кровообращения, удалению и обезвреживанию инф. агентов, уменьшению концентрации токсинов.
В П. синтезируются многие вещества и факторы белковой природы, регулирующие свертываемость крови,— компоненты протромбинового комплекса (факторы II, VII, IX, X), фибриноген, факторы свертывания V, XI, XII, XIII, а также антитромбин и антиплазмии (см. Свертывающая система крови).
П. играет важную роль в поддержании постоянства состава крови, что обеспечивается ее участием во многих обменных процессах, обусловливающих образование, накопление и выделение в кровь различных метаболитов, с одной стороны, и поглощение из крови, трансформацию и экскрецию многих веществ — с другой.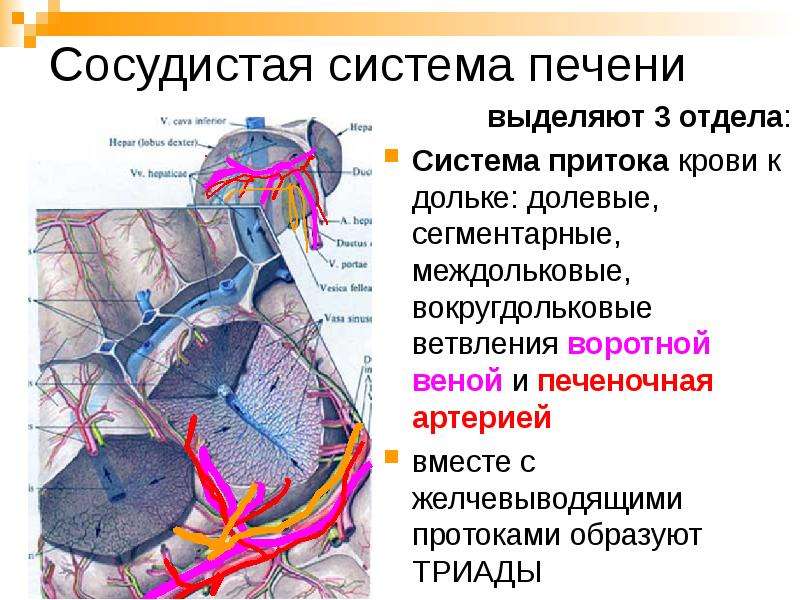 Функции П. в обмене веществ связаны с различными структурами гепатоцита. Так, в его ядре осуществляется синтез ядерных белков, в ядрышках — синтез и транскрипция РНК; в митохондриях происходит окислительное фосфорилирование, синтез белков и мочевины, окисление жирных кислот и цикл Трикарбоновых кислот; в пластинчатом комплексе осуществляются фосфорилирование гликопротеидов, гликозаминогликанов, концентрация протеина; в лизосомах образуется желчь, происходит внутриклеточное пищеварение, осуществляются защитные реакции; синтез липидов локализован в гранулярной эндоплазматической сети, здесь же и в гладкой эндоплазматической сети осуществляется превращение гормонов.
Функции П. в обмене веществ связаны с различными структурами гепатоцита. Так, в его ядре осуществляется синтез ядерных белков, в ядрышках — синтез и транскрипция РНК; в митохондриях происходит окислительное фосфорилирование, синтез белков и мочевины, окисление жирных кислот и цикл Трикарбоновых кислот; в пластинчатом комплексе осуществляются фосфорилирование гликопротеидов, гликозаминогликанов, концентрация протеина; в лизосомах образуется желчь, происходит внутриклеточное пищеварение, осуществляются защитные реакции; синтез липидов локализован в гранулярной эндоплазматической сети, здесь же и в гладкой эндоплазматической сети осуществляется превращение гормонов.
П. участвует в сложных процессах обмена белков и аминокислот (см. Азотистый обмен), в ней образуется большинство белков плазмы крови. Почти исключительно в П. происходит образование мочевины, она участвует также в переаминировании и дезаминировании аминокислот, образовании глутамина, синтезе креатина.
Существенную роль П. играет в обмене липидов. В основном в П. синтезируются триглицериды, фосфолипиды и желчные к-ты; образуется значительная часть эндогенного холестерина; происходит окисление триглицеридов, образование ацетоновых тел. П. принимает участие в образовании липопротеидов — транспортной формы триглицеридов и ряда других плохо растворимых в воде веществ. Обмен липидов тесно связан и с желчевыделительной функцией П., поскольку желчь имеет важное значение для гидролиза и всасывания жиров в кишечнике (см. Жировой обмен).
играет в обмене липидов. В основном в П. синтезируются триглицериды, фосфолипиды и желчные к-ты; образуется значительная часть эндогенного холестерина; происходит окисление триглицеридов, образование ацетоновых тел. П. принимает участие в образовании липопротеидов — транспортной формы триглицеридов и ряда других плохо растворимых в воде веществ. Обмен липидов тесно связан и с желчевыделительной функцией П., поскольку желчь имеет важное значение для гидролиза и всасывания жиров в кишечнике (см. Жировой обмен).
П. активно участвует в межуточном обмене углеводов (см. Углеводный обмен) — в ней происходит процесс гликогении (синтез гликогена) и гликогенолиз. Клетки П. содержат ферменты, включающие в метаболизм галактозу и фруктозу. В Пг образуется также сахар и гликоген из неуглеводов (гликснеогения), происходит окисление глюкозы, образование глюкуроновой к-ты, участвующей в конъюгации ряда веществ, что повышает их водораство-римость и облегчает выведение из организма.
Участие П.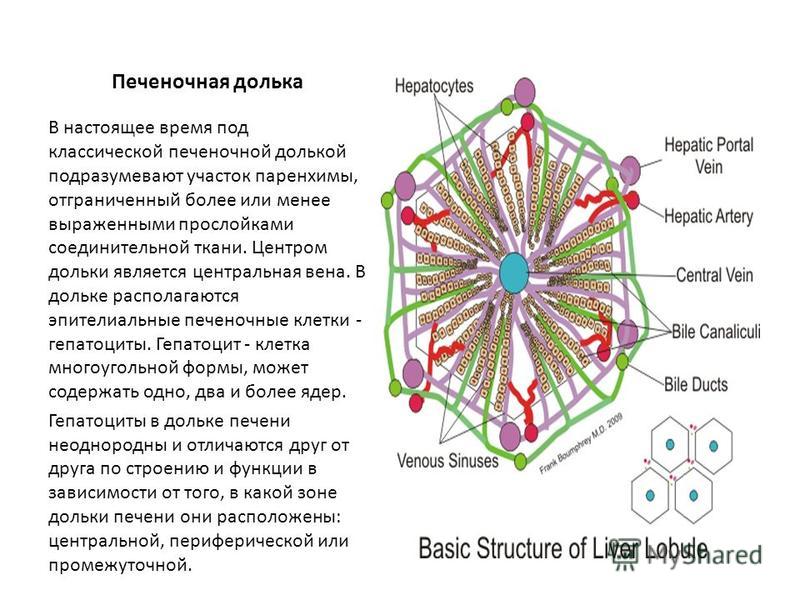 в пигментном обмене заключается в образовании билирубина, конъюгации его с глюкуроновой к-той и экскреции в желчь.
в пигментном обмене заключается в образовании билирубина, конъюгации его с глюкуроновой к-той и экскреции в желчь.
П. принимает участие в обмене биологически активных веществ — гормонов, биогенных аминов, витаминов. В ней осуществляется ферментативная инактивация стероидных гормонов (глюкокортикостерои-дов, альдостерона, андрогенов, эстрогенов), а также инактивация инсулина, глюкагона, антидиуретического гормона, гормона щитовидной железы; метаболизируются биогенные амины — серотонин, гистамин, катехоламины.
Участие П. в обмене жирорастворимых витаминов (A, D, Е, К) начинается уже при их всасывании, для которого необходимо присутствие в кишечнике желчи. П. является основным местом синтеза витамина А; здесь же образуются биологически активные формы витамина В (пиридоксальфосфат), фолиевой к-ты (тетрагидрофолиевая к-та), холина (цитидинмонофосфат холина).
Тесно связан с П. обмен микроэлементов. П. синтезирует белки, транспортирующие железо (сидерофилин) и медь (церулоплазмин), участвует в обмене марганца, молибдена, кобальта и ряда других металлов (см. Минеральный обмен). Роль П. в обмене натрия и калия сводится к тому, что она участвует в регуляции выделения калия почками, участвуя в обмене альдостерона. С регулирующим влиянием II. на активность альдостерона и антидиуретического гормона связано ее участие в водном обмене организма (см. Водносолевой обмен). В П. синтезируются альбумины, поддерживающие коллоидно-осмотическое равновесие крови.
Минеральный обмен). Роль П. в обмене натрия и калия сводится к тому, что она участвует в регуляции выделения калия почками, участвуя в обмене альдостерона. С регулирующим влиянием II. на активность альдостерона и антидиуретического гормона связано ее участие в водном обмене организма (см. Водносолевой обмен). В П. синтезируются альбумины, поддерживающие коллоидно-осмотическое равновесие крови.
Экскреторная функция П. обеспечивает выведение из организма с желчью более 40 соединений, как синтезированных непосредственно в П., так и захваченных из крови (в большинстве случаев после метаболических изменений в П.). П. способна также экскретировать вещества, связанные с крупномолекулярными белками, и не растворимые в воде. К числу веществ, экскрети-руемых П. в составе желчи, относятся холестерин, желчные к-ты, фосфолипиды, билирубин, многие белки, в т. ч. обладающие ферментативной активностью (напр., щелочная фосфатаза), мочевина, медь, спирты и др.
Процесс образования желчи начинается в гепатоците (см. Желчеобразование?), где синтезируются холестерин, желчные к-ты и фосфолипиды; здесь же происходит образование парных соединений (конъюгация) билирубина и других эндогенных и экзогенных веществ, что способствует их экскреции из гепатоцита.
Желчеобразование?), где синтезируются холестерин, желчные к-ты и фосфолипиды; здесь же происходит образование парных соединений (конъюгация) билирубина и других эндогенных и экзогенных веществ, что способствует их экскреции из гепатоцита.
Холестерин (см.), желчные кислоты (см.) и фосфолипиды (см. Фосфатиды) выделяются из гепатоцита в виде макромолекулярного комплекса или мицеллы. Образование мицеллы необходимо для растворения в воде и экскреции холестерина, поскольку достаточная растворимость его достигается только в присутствии фосфолипидов, к-рые сами по себе не растворяются в воде, но в присутствии желчных кислот обладают очень высокой растворимостью. Кроме желчных кислот, в состав мицеллы входят другие органические анионы, в частности билирубин.
Секреция гидроксихолановых к-т из гепатоцита за счет повышения осмотического давления в межклеточных пространствах вызывает приток воды. Скорость притока воды в межклеточные пространства зависит от скорости выделения желчных кислот гепатоцитами. Таким образом формируется гепатоцитарная фракция желчи. Активный транспорт желчных кислот гепатоцитами— основной, но не единственный фактор, регулирующий объем секретируемой желчи. Формирование желчи продолжается в иерилобулярных желчных канальцах и формируемых путем их слияния междольковых или внутрипеченочных желчных протоках, эпителий которых способен секретировать фракцию, независимую от желчных к-т,— жидкость, богатую электролитами (хлорид натрия, бикарбонат натрия).
Таким образом формируется гепатоцитарная фракция желчи. Активный транспорт желчных кислот гепатоцитами— основной, но не единственный фактор, регулирующий объем секретируемой желчи. Формирование желчи продолжается в иерилобулярных желчных канальцах и формируемых путем их слияния междольковых или внутрипеченочных желчных протоках, эпителий которых способен секретировать фракцию, независимую от желчных к-т,— жидкость, богатую электролитами (хлорид натрия, бикарбонат натрия).
На процесс образования желчи в гепатоците оказывает воздействие метаболизм холестерина, а следовательно, желчных кислот и фосфолипидов, т. к. синтез этих веществ взаимосвязан. Они подвержены влиянию гормонов (в частности, половых, особенно эстрогенов), зависят от состояния кишечно-печеночной циркуляции составных компонентов желчи и ряда других факторов.
Регуляция дальнейшего формирования желчи в желчных протоках и желчевыделения (см.) осуществляется жел.-киш. гормонами. Так, гастрин и секретин усиливают желчевыделение, вызывая секрецию в желчь обогащенной бикарбонатом жидкости, а глюкагон усиливает отток желчи, не меняя ее электролитного состава.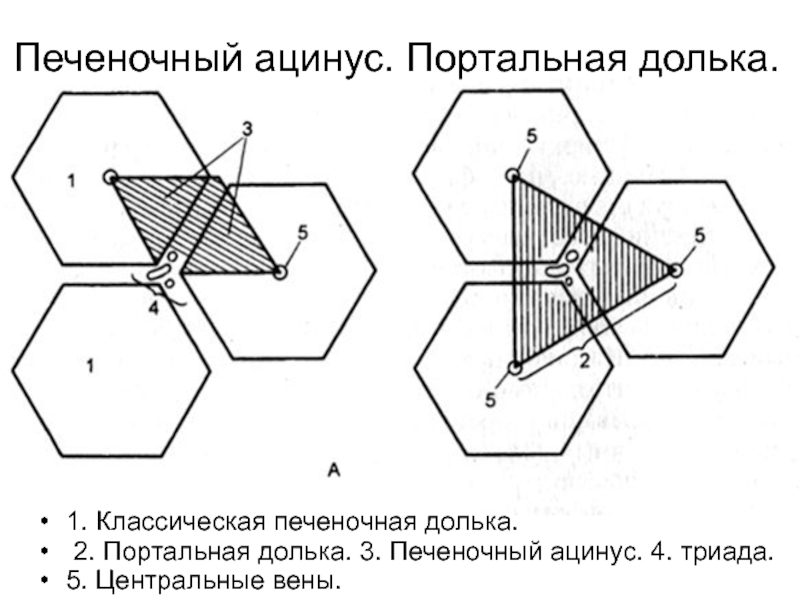 На отток желчи из желчных протоков и желчного пузыря оказывает влияние гормон холецистокинин. Большую роль в регуляции желчевыделения играет состояние нервной системы.
На отток желчи из желчных протоков и желчного пузыря оказывает влияние гормон холецистокинин. Большую роль в регуляции желчевыделения играет состояние нервной системы.
Барьерная функция П. направлена на защиту организма от изменений окружающей среды, способствует предохранению клеток П., а также других органов и тканей от действия повреждающих агентов, сохранению относительного постоянства состава, физ.-хим. и биол, свойств внутренней среды, необходимых для нормальной жизнедеятельности организма. Барьерная функция П. осуществляется особыми физиол, механизмами — барьерами, среди которых условно различают внешние и внутренние. П. как орган является внешним барьером, обезвреживая ряд чуждых организму ядовитых соединений, поступивших с пищей или образовавшихся в кишечнике. К внешним барьерам относится и ре-тикулоэндотелиальная система П., также участвующая в обезвреживании ядов и болезнетворных агентов (см. Ретикулоэндотелиальная система).
Внутренние барьеры П., регулирующие поступление из крови энергетических ресурсов и своевременный отток продуктов клеточного метаболизма, обеспечивают постоянство оптимального состава тканевой (внеклеточной) жидкости. Внутренние барьеры также препятствуют поступлению из крови чужеродных и ядовитых веществ. Они представлены гистогематическими барьерами (см. Барьерные функции), основными структурными элементами которых являются эндотелий кровеносных капилляров, базальная мембрана, основное аморфное вещество, волокна, внутриклеточные барьеры (липопротеиновые мембраны, системы каналов, эндоплазматическая сеть, аппарат Гольджи, клеточная оболочка). Внутренние барьеры активно отбирают из крови необходимые для нормальной жизнедеятельности вещества и выводят продукты их обмена, определяя функциональное состояние органа в целом, его способность противостоять вредным влияниям. Задержка перехода чужеродного вещества из крови и окружающих тканей через внутренний барьер определяет защитную функцию барьера, а создание оптимальных условий для жизнедеятельности клеточных и неклеточных элементов органа — его регуляторную функцию.
Внутренние барьеры также препятствуют поступлению из крови чужеродных и ядовитых веществ. Они представлены гистогематическими барьерами (см. Барьерные функции), основными структурными элементами которых являются эндотелий кровеносных капилляров, базальная мембрана, основное аморфное вещество, волокна, внутриклеточные барьеры (липопротеиновые мембраны, системы каналов, эндоплазматическая сеть, аппарат Гольджи, клеточная оболочка). Внутренние барьеры активно отбирают из крови необходимые для нормальной жизнедеятельности вещества и выводят продукты их обмена, определяя функциональное состояние органа в целом, его способность противостоять вредным влияниям. Задержка перехода чужеродного вещества из крови и окружающих тканей через внутренний барьер определяет защитную функцию барьера, а создание оптимальных условий для жизнедеятельности клеточных и неклеточных элементов органа — его регуляторную функцию.
Защитная функция П. заключается в обезвреживании инф. и токсических агентов. Неспецифические механизмы защиты от инфекционных агентов связаны с деятельностью звездчатых ретикулоэндотелиоцитов, макрофагов, нейтрофильных лейкоцитов, осуществляющих захват и лизис возбудителей инфекции.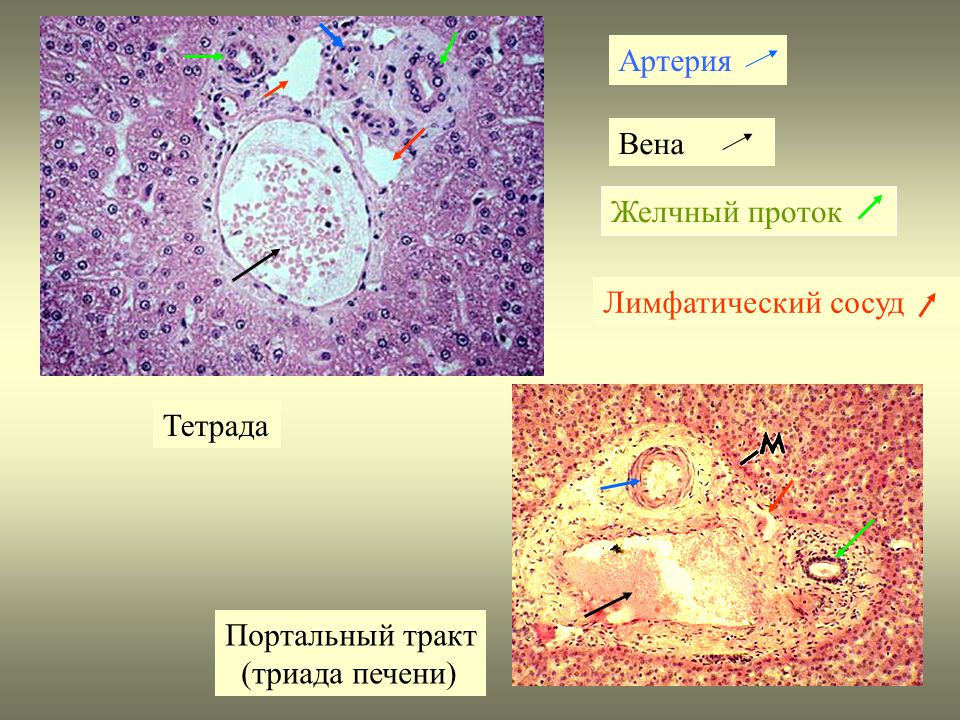 Специфические (иммунные) защитные реакции осуществляются в результате деятельности в первую очередь лимфоцитов лимф, узлов П. и синтезируемых ими антител. Защита организма от токсических агентов, поступающих извне или образовавшихся в ходе межуточного обмена, осуществляется в П. путем хим. превращения вещества, приводящего к уменьшению токсичности или повышению во-дорастворимости, облегчающему его выделение. Важнейшее значение в процессах обезвреживания токсических агентов имеют микросомальные ферменты гепатоцитов, осуществляющие окисление или восстановление токсических метаболитов и чужеродных веществ. Микросомальные метаболические превращения касаются преимущественно липидорастворимых соединений; при этом продукты ферментативных реакций имеют, как правило, большую водо-растворимость, чем исходный субстрат. В мик росомах осуществляются реакции биол, окисления — ароматическое гидроксилирование, дезаминирование, сульфоокисление. Все они требуют присутствия восстановленного НАДФ и кислорода.
Специфические (иммунные) защитные реакции осуществляются в результате деятельности в первую очередь лимфоцитов лимф, узлов П. и синтезируемых ими антител. Защита организма от токсических агентов, поступающих извне или образовавшихся в ходе межуточного обмена, осуществляется в П. путем хим. превращения вещества, приводящего к уменьшению токсичности или повышению во-дорастворимости, облегчающему его выделение. Важнейшее значение в процессах обезвреживания токсических агентов имеют микросомальные ферменты гепатоцитов, осуществляющие окисление или восстановление токсических метаболитов и чужеродных веществ. Микросомальные метаболические превращения касаются преимущественно липидорастворимых соединений; при этом продукты ферментативных реакций имеют, как правило, большую водо-растворимость, чем исходный субстрат. В мик росомах осуществляются реакции биол, окисления — ароматическое гидроксилирование, дезаминирование, сульфоокисление. Все они требуют присутствия восстановленного НАДФ и кислорода. Большое значение имеет также такой компонент электронной транспортной системы, как цитохром Р-450. Окисление токсических веществ обеспечивается и немикросомальными ферментными системами — митохондриальными (аминокс-идаза) и цитоплазматическими (алкогольдегидрогеназа и др.). Путем окисления в П. метаболизируются такие вещества, как этанол, фенобарбитал, анилин, толуол, нафталин, триптамин, гистамин и ряд других.
Большое значение имеет также такой компонент электронной транспортной системы, как цитохром Р-450. Окисление токсических веществ обеспечивается и немикросомальными ферментными системами — митохондриальными (аминокс-идаза) и цитоплазматическими (алкогольдегидрогеназа и др.). Путем окисления в П. метаболизируются такие вещества, как этанол, фенобарбитал, анилин, толуол, нафталин, триптамин, гистамин и ряд других.
Восстановительные процессы также осуществляются ферментами как микросом, так и других клето
Медицинская академия имени С.И. Георгиевского ФГАОУ ВО «КФУ им. В.И. Вернадского». Печень. Поджелудочная железа.
ПЕЧЕНЬ.
Микроскопически печень состоит из 500 000 печеночных ДОЛЕК и междольковых структур.
КЛАСССИЧЕСКАЯ печеночная ДОЛЬКА – это блок тканей шестиугольной формы. Она состоит из: а) центральной вены, б) радиально расположенных печеночных БАЛОК, в) СИНУСОИДНЫХ капилляров (между двумя балками), г) желчных капилляров (между 2-мя гепатоцитами). Печеночная БАЛКА ( или пластинка) – это группа анастамозирующих гепатоцитов толщиной в 1 клетку.
Печеночная БАЛКА ( или пластинка) – это группа анастамозирующих гепатоцитов толщиной в 1 клетку.
В печени ЧЕЛОВЕКА границы между дольками представлены ТРИАДАМИ печени. В печени СВИНЬНИ между дольками — широкие СЕПТЫ из рыхлой соединит.ткани. ТРИАДА печени сост. из: 1) междольковая артерия (веточка печеночной артерии), 2) междольковая вена (веточка воротной вены), 3) междольковый желчный проток.
ГЕПАТОЦИТ – это клетка эпителия, образующая ПАРЕХИМУ печени. Он содержат 1-2 ядра и развитую грЭПС и аЭПС. Функции: 1) Синтез (в гр.ЭПС) и секреция белков плазмы крови – альбуминов, фибриногена.2) В аЭПС осуществляются: а) синтез гликогена из глюкозы, б) распад гликогена до глюкозы и секреция глюкозы в кровь. 3) секреция в кровь липопротеиновых частиц, 4) Секреция пигмента билирубина и желчных солей в желчный капилляр, 5) Синтез (в аЭПС) малотоксичной мочевины из ядовитого аммиака.
3) секреция в кровь липопротеиновых частиц, 4) Секреция пигмента билирубина и желчных солей в желчный капилляр, 5) Синтез (в аЭПС) малотоксичной мочевины из ядовитого аммиака.
Стенка желчного капилляря не имеет собственных клеток и образована ПЛАЗМОЛЕММОЙ двух соседних гепатоцитов.
Стенка СИНУСОИДНОГО капилляра содержит 4 типа НЕПАРЕНХИМАТОЗНЫХ клеток 1) 50% — эндотелиоциты (однослойн. плоский эпител.). Функц.: трансэдотелиальный обмен. Остальные 3 типа клеток имеют ЗВЕЗДЧАТУЮ форму:
2) звездчатые макрофаги (клетки Купфера). Функц.: фагоцитоз бактерий и старых эритроц. 3) 20%-перисинусоидальные липоциты=жиронакапливающие кл.=клетки Ито.). Функц.: а) депо витаминов А и D, б) при стимуляции алкоголем секретируют много коллагена, что приводит к ЦИРРОЗУ печени. 4) pit-клетки=NK-клетки=натуральные киллеры.). Функц.: элиминация раковых клеток
4) pit-клетки=NK-клетки=натуральные киллеры.). Функц.: элиминация раковых клеток
Эмбрион. источник для гепатоцитов — ЭНТОдерма передней кишки (печеночная бухта).
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА.
Состоит из ДОЛЕК и междольковых септ (перегородок из рыхлой соединитд. тк.).
ДОЛЬКА состоит из клеток железистого ЗПИТЕЛИЯ, к-рый образует ПАРЕНХИМУ (П.).
2 вида паренхимы (П.) в дольке: 1) ЭКЗОКРИННАЯ П. (97%).
2) ЭНДОКРИННАЯ П. (3%).
1) Экзокринная П. представлена сложной альвеолярно-трубчатой экзокринной железой.
Эта железа в дольке состоит из: а) концевой отдел= панкреатический АЦИНУС, б) вставочный выводной проток, в) внутридольковый выводной проток.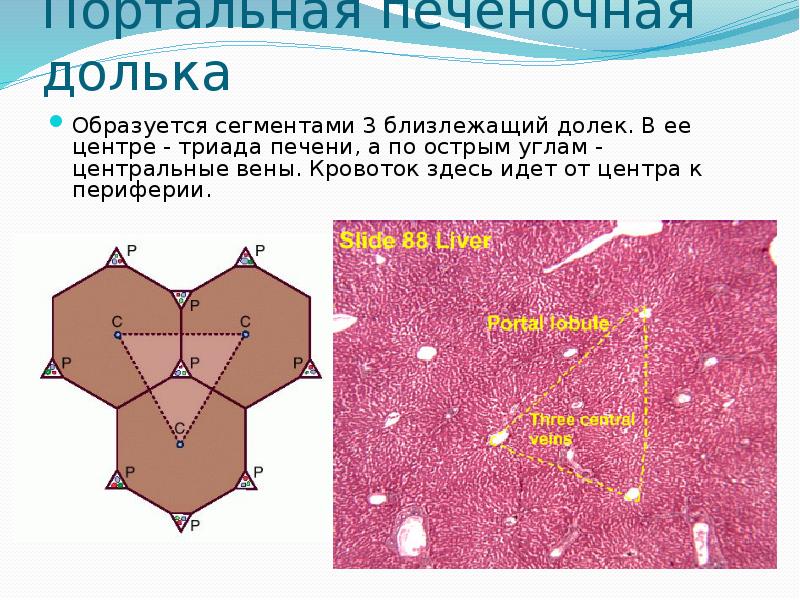
Панкреатический АЦИНУС состоит из: а) 8-12 АЦИНОЦИТОВ, или экзокринных панкреатоцитов, б) центроацинозных клеток (плоский эпит.) Ациноцит имеет пирамидную форму, в апикальной части содержит ЗИМОГЕННЫЕ секреторне гранулы. Функц.: секреция неактивних пищеварительных ФЕРМЕНТОВ (трипсиноген, липаза, амилаза).
2) Эндокринная П. представлена панкреатическими островками, или островками Лангерганса. Островок Лангерганса состоит из: а) ИНСУЛОЦИТОВ, или эндокринных панкреатоцитов, б) фенестрированных гемокапилляров, Все инсулоциты содержат секреторне ГРАНУЛЫ с гормоном.
Виды ИНСУЛОЦИТОВ в панкреатическом островке:
- 70%- В-инсулоциты. Функ.: секреция гормона ИНСУЛИН. Он ПОНИЖАЕТ уровень глюкозы в крови= ГИПОгликемическое действие.
 Тем самым препятствует развитию сахарного диабета..
Тем самым препятствует развитию сахарного диабета.. - 20% — А-инсулоциты. Функ.: секреция гормона ГЛЮКАГОН. Он ПОВЫШАЕТ уровень глюкозы крови= ГИПЕРгликемическое действие.
- 5%-D-инсулоциты. Секретируют гормон соматостатин.
- D1-инсулоциты. Секретируют гормон ВИП (вазоактивный интестинальный пептид).
- PP-инсулоциты. Секретируют гормон панкреатический полипептид.
Эмбр. источник для всех эпителиоцитов паренхимы — ЭНТОдерма передней кишки.
Составитель – доцент В.В. Бондаренко.
тканевой состав, структурно-функциональные единицы. Строение классической дольки. — Студопедия
Студопедия
Категории
Авто
Автоматизация
Архитектура
Астрономия
Аудит
Биология
Бухгалтерия
Военное дело
Генетика
География
Геология
Государство
Дом
Журналистика и СМИ
Изобретательство
Иностранные языки
Информатика
Искусство
История
Компьютеры
Кулинария
Культура
Лексикология
Литература
Логика
Маркетинг
Математика
Машиностроение
Медицина
Менеджмент
Металлы и Сварка
Механика
Музыка
Население
Образование
Охрана безопасности жизни
Охрана Труда
Педагогика
Политика
Право
Программирование
Производство
Промышленность
Психология
Радио
Регилия
Связь
Социология
Спорт
Стандартизация
Строительство
Технологии
Торговля
Туризм
Физика
Физиология
Философия
Финансы
Химия
Хозяйство
Черчение
Экология
Эконометрика
Экономика
Электроника
Юриспунденкция
Предметы
Авиадвигателестроения
Административное право
Административное право Беларусии
Алгебра
Архитектура
Безопасность жизнедеятельности
Введение в профессию «психолог»
Введение в экономику культуры
Высшая математика
Геология
Геоморфология
Гидрология и гидрометрии
Гидросистемы и гидромашины
История Украины
Культурология
Культурология
Логика
Маркетинг
Машиностроение
Медицинская психология
Менеджмент
Металлы и сварка
Методы и средства измерений
электрических величин
Мировая экономика
Начертательная геометрия
Основы экономической теории
Охрана труда
Пожарная тактика
Процессы и структуры мышления
Профессиональная психология
Психология
Психология менеджмента
Современные фундаментальные и
прикладные исследования
в приборостроении
Социальная психология
Социально-философская проблематика
Социология
Статистика
Теоретические основы информатики
Теория автоматического регулирования
Теория вероятности
Транспортное право
Туроператор
Уголовное право
Уголовный процесс
Управление современным производством
Физика
Физические явления
Философия
Холодильные установки
Экология
Экономика
История экономики
Основы экономики
Экономика предприятия
Экономическая история
Экономическая теория
Экономический анализ
Развитие экономики ЕС
Чрезвычайные ситуации
Печеночная долька, как морфофункциональная единица печени
Печеночная долька — морфофункциональная единица печени. В центре дольки находится центральная вена. Центральные вены, соединяясь между собой, в итоге впадают в печеночные вены, последние, в свою очередь, впадают в нижнюю полую вену. Долька имеет форму призмы 1-2 мм. Она состоит из радиально расположенных двойных рядов клеток (печеночных пластин, или балок). Между рядами гепатоцитов находятся внутридольковые желчные протоки, их концы, обращенные к центральной вене, замкнуты. Образовавшаяся желчь направляется к периферии долек. Между печеночными пластинами находятся синусоидные капилляры, где смешивается кровь, поступающая в печень по воротной вене и собственной печеночной артерии. По периферии печеночной дольки находятся триады: междольковые вены (до которых разветвляется воротная вена), междольковые артерии (до которых разветвляется собственная артерия печени) и междольковые желчные протоки (которые, сливаясь между собой, в итоге формируют правый и левый печеночные протоки).
Таким образом, внутри печеночной дольки желчь продвигается от центра к периферии и в дальнейшем через общий желчный проток выводится из печени. Кровь из воротной вены и собственной артерии печени, смешиваясь внутрипеченочной дольки, двигается от ее периферии к центру и выводится через центральные вены в систему нижней полой вены.
Печеночная долька отграничена от других соединительнотканной оболочкой, содержащей коллагеновые и эластиновые волокна. Общее число печеночных долек составляет около 0,5 млн. За 1 мин через печень взрослого протекает 1,2 л крови, почти 70% из которой поступает через воротную вену.
Функциональная единица включает в себя синусоид с окружающим пространством между его эндотелием и гепатоцитами (пространство Диссе), прилежащими гепатоцитами и желчным канальцем. Некоторые авторы полагают, что структуру печени следует рассматривать исходя из строения приводящих и отводящих кровеносных сосудов, их переплетения,
Для клинической оценки важным является состояние синусоидов. Они имеют три отдела: периферический, промежуточный и центральный. Промежуточный отдел составляет 90% их длины. Он, в отличие от периферического и центрального отдела, не имеет базальной мембраны. Между эндотелием синусоида и гепатоцитами имеются пространства, сообщающиеся с пери портальными пространствами; вместе с межклеточными щелями они служат началом лимфатической системы. Именно в указанных пространствах и совершается контакт различных веществ с цитоплазматической мембраной печеночной клетки.
Эндотелий синусоидов содержит поры, обеспечивающие переход в гепатоциты различных молекул. Некоторые из эндотелиальных клеток обеспечивают структуру синусоидов, а другие, например звездчатые ретикулоэндотелиоциты (клетки Купфера), обладают фагоцитарной функцией или принимают участие в обновлении и новообразовании соединительной ткани. Указанные клетки составляют 40% всех эндотелиальных клеток. При этом 48% эндотелиальных клеток выполняют структурную функцию и 12% — фибропластическую.
Периферические отделы печеночной дольки образованы мелкими гепатоцитами, они участвуют в процессе регенерации и исполняют роль пограничной пластинки, отделяя паренхиму дольки от соединительной ткани портального поля. Через пограничную пластинку в дольку проникают междольковые вены системы v. portae и артериолы печеночной артерии, выходят холангиолы, впадающие в междольковые печеночные протоки. Между гепатоцитами и соединительной тканью находятся пространства, именуемые пространствами Моля.
Портальный тракт на периферии дольки имеет вид треугольника с заключенными в нем конечными ветвями портальной вены, печеночной артерии и междольковым желчным протоком, называемыми триадой. В ее состав входят лимфатические щели с выстланным эндотелием и нервы, оплетающие кровеносные сосуды. Богатая сеть нервных волокон проникает в печеночные дольки до гепатоцитов и эндотелиальных клеток.
Соединительная ткань в виде ретикулиновых и коллагеновых волокон, а также базальных мембран синусоидов, кровеносных сосудов и желчных протоков портального тракта у детей очень нежная и лишь у пожилых людей образует грубые волокнистые скопления.
[1], [2], [3], [4], [5], [6]
Печень. Поджелудочная железа | ГИСТОЛОГИЯ, ЦИТОЛОГИЯ И ЭМБРИОЛОГИЯ
ПЕЧЕНЬ
Печень – самая крупная железа пищеварительного тракта. В ней обезвреживаются многие продукты обмена веществ, инактивируются гормоны, биогенные амины, а также ряд лекарственных препаратов. Печень участвует в защитных реакциях организма против микробов и чужеродных веществ. В ней образуется гликоген. В печени синтезируются важнейшие белки плазмы крови: фибриноген, альбумины, протромбин и др. Здесь метаболизируется железо и образуется желчь. В печени накапливаются жирорастворимые витамины – А, Д, Е, К и др. В эмбриональном периоде печень является кроветворным органом.
Развитие. Зачаток печени образуется из энтодермы в конце 3-й недели эмбриогенеза в виде мешковидного выпячивания вентральной стенки туловищной кишки (печёночная бухта), врастающего в брыжейку.
Строение. Поверхность печени покрыта соединительно-тканной капсулой. Структурно-функциональной единицей печени является печёночная долька. Паренхима клеток состоит из эпителиальных клеток – гепатоцитов.
Существует 2 представления о строении печёночных долек. Старое классическое, и более новое, высказанное в середине ХХ столетия. Согласно классическому представлению, печёночные дольки имеют форму шестигранных призм с плоским основанием и слегка выпуклой вершиной. Междольковая соединительная ткань образует строму органа. В ней проходят кровеносные сосуды и желчные протоки.
Исходя из классического представления о строении печёночных долек, кровеносную систему печени условно разделяют на три части: система притока крови к долькам, система циркуляции крови внутри них, и систему оттока крови от долек.
Система оттока представлена воротной веной и печеночной артерией. В печени они многократно разделяются на все более мелкие сосуды: долевые, сегментарные и междольковые вены и артерии, вокругдольковые вены и артерии.
Печеночные дольки состоят из анастомозирующих печеночных пластинок (балок), между которыми находятся синусоидные капилляры, радиально сходящиеся к центру дольки. Число долек в печени составляет 0,5- 1 млн. Друг от друга дольки ограничены неотчетливо (у человека) тонкими прослойками соединительной ткани, в которой располагаются печеночные триады — междольковые артерии, вены, желчный проток, а также поддольковые (собирательные) вены, лимфатические сосуды и нервные волокна.
Печеночные пластинки — анастомозирующие друг с другом пласты печеночных эпителиальных клеток (гепатоцитов), толщиной в одну клетку. На периферии дольки вливаются в терминальную пластинку, отделяющую ее от междольковой соединительной ткани. Между пластинками располагаются синусоидные капилляры.
Гепатоциты — составляют более 80% клеток печени и выполняют основную часть свойственных ей функций. Имеют многоугольную форму, одно или два ядра. Цитоплазма зернистая, воспринимает кислые или основные красители, содержит многочисленные митохондрии, лизосомы, липидные капли, частицы гликогена, хорошо развита а-ЭПС и гр-ЭПС, комплекс Гольджи.
Поверхность гепатоцитов характеризуется наличием зон с разной структурно- функциональной специализацией и участвует в образовании: 1) желчных капилляров 2) комплексов межклеточных соединений 3) участков с увеличенной поверхностью обмена между гепатоцитами и кровью — за счет многочисленных микроворсинок, обращенных в перисинусоидальное пространство.
Функциональная активность гепатоцитов проявляется в их участии в захвате, синтезе, накоплении и химическом преобразовании разнообразных веществ, которые в дальнейшем могут выделяться в кровь или желчь.
Участие в обмене углеводов: углеводы запасаются гепатоцитами в виде гликогена, который они синтезируют из глюкозы. При потребности в глюкозе она образуется путем расщепления гликогена. Таким образом, гепатоциты обеспечивают поддержание нормальной концентрации глюкозы в крови.
Участие в обмене липидов: липиды захватываются клетками печени из крови и синтезируются самими гепатоцитами, накапливаясь в липидных каплях.
Участие в обмене белков: белки плазмы синтезируются в гр-ЭПС гепатоцитов и выделяются в пространство Диссе.
Участие в пигментном обмене: пигмент билирубин образуется в макрофагах селезенки и печени в результате разрушения эритроцитов, под действием ферментов ЭПС гепатоцитов коньюгируется с глюкуронидом и выделяется в желчь.
Образование желчных солей происходит из холестерина в а-ЭПС. Желчные соли обладают свойством эмульгаторов жиров и способствуют их всасыванию в кишечнике.
Зональные особенности гепатоцитов: клетки расположенные в центральных и периферических зонах дольки, различаются размерами, развитием органелл, активностью ферментов, содержанием гликогена, липидов.
Гепатоциты периферической зоны активнее участвуют в процессе накопления питательных веществ и детоксикации вредных. Клетки центральной зоны активнее в процессах экскреции в желчь эндогенных и экзогенных соединений: они сильней повреждаются при сердечной недостаточности, при вирусном гепатите.
Терминальная (пограничная) пластинка — узкий периферический слой дольки, охватывающий снаружи печеночные пластинки и отделяющий дольку от окружающей ее соединительной ткани. Образована мелкими базофильными клетками и содержит делящиеся гепатоциты. Предполагается, что в ней находятся камбиальные элементы для гепатоцитов и клеток желчных протоков.
Продолжительность жизни гепатоцитов 200-400 суток. При снижении их общей массы (вследствие токсического повреждения) развивается быстрая пролиферативная реакция.
Синусоидные капилляры располагаются между печеночными пластинками, выстланы плоскими эндотелиоцитами, между которыми имеются мелкие поры. Между эндотелиоцитами рассеяны звездчатые макрофаги (клетки Купфера) не образующие сплошного пласта. К звездчатым макрофагам и эндотелиоцитам со стороны просвета, к синусоидам прикрепляется с помощью псевдоподий ямочные (pit- клетки).
В их цитоплазме кроме органелл присутствуют секреторные гранулы. Клетки относят к большим лимфоцитам, которые обладают естественной киллерной активностью и эндокринной функцией и могут осуществлять противоположные эффекты: уничтожать поврежденные гепатоциты при заболевании печени, а в период выздоровления стимулировать пролиферацию печеночных клеток.
Базальная мембрана на большом протяжении у внутридольковых капилляров отсутствует, за исключением их периферических и центральных отделов.
Капилляры окружены узким вокругсинусоидным пространством (пространство Диссе), в нем кроме жидкости, богатой белками, находятся микроворсинки гепатоцитов, аргирофильные волокна, а также отростки клеток, известных под названием перисинусоидальные липоциты. Они небольшого размера, располагаются между соседними гепатоцитами, постоянно содержат мелкие капли жира, имеют много рибосом. Полагают, что липоциты подобно фибробластам способны к волокнообразованию, а также к депонированию жирорастворимых витаминов. Между рядами гепатоцитов, составляющих балку, располагаются желчные капилляры или канальцы. Они не имеют собственной стенки, так как образованы соприкасающимися поверхностями гепатоцитов, на которых имеются небольшие углубления. Просвет капилляра не сообщается с межклеточной щелью благодаря тому, что мембраны соседних гепатоцитов в этом месте плотно прилегают друг к другу. Желчные капилляры слепо начинаются на центральном конце печеночной балки, на периферии ее переходят в холангиолы — короткие трубочки, просвет которых ограничен 2-3 овальными клетками. Холангиолы впадают в междольковые желчные протоки. Таким образом, желчные капилляры располагаются внутри печеночных балок, а между балками проходят кровеносные капилляры. Каждый гепатоцит, поэтому имеет 2 стороны. Одна сторона билиарная, куда клетки секретируют желчь, другая васкулярная — направлена к кровеносному капилляру, в который клетки выделяют глюкозу, мочевину, белки и другие вещества.
В последнее время появилось представление о гистофункциональных единицах печени — портальных печеночных дольках и печеночных ацинусах. Портальная печеночная долька включает сегменты трех соседних классических долек, окружающих триаду. Такая долька имеет треугольную форму, в ее центре лежит триада, а по углам вены, кровоток направлен от центра к периферии.
Печеночный ацинус образован сегментами двух рядом расположенных классических долек, имеет форму ромба. У острых углов проходят вены, а у тупого угла — триада, от которой внутрь ацинуса идут ее ветви, от этих ветвей к венам (центральным) направляются гемокапилляры.
Желчевыводящие пути — система каналов, по которым желчь из печени направляется в двенадцатиперстную кишку. Они включают внутрипеченочные и внепеченочные пути.
Внутрипеченочные — внутридольковые — желчные капилляры и желчные канальцы (короткие узкие трубочки). Междольковые желчные пути располагаются в междольковой соединительной ткани, включают холангиолы и междольковые желчные протоки, последние сопровождают ветви воротной вены и печеночной артерии в составе триады. Мелкие протоки, собирающие желчь из холангиол выстланы кубическим эпителием, сливаются в более крупные с призматическим эпителием
Желчные внепеченочные пути включают:
а) желчные долевые протоки
б) общий печеночный проток
в) пузырный проток
г) общий желчный проток
Имеют однотипное строение — их стенка состоит из трех нечетко разграниченных оболочек: 1)слизистая 2)мышечная 3)адвентициальная.
Слизистая оболочка выстлана однослойным призматическим эпителием. Собственная пластинка слизистой представлена рыхлой волокнистой соединительной тканью, содержащей концевые отделы мелких слизистых желез.
Мышечная оболочка — включает косо или циркулярно ориентированные гладкомышечные клетки.
Адвентициальная оболочка — образована рыхлой волокнистой соединительной тканью.
Стенка желчного пузыря образована тремя оболочками. Слизистая — однослойный призматический эпителий и собственный слой слизистой — рыхлая соединительная ткань. Волокнисто-мышечная оболочка. Серозная оболочка покрывает большую часть поверхности.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
Поджелудочная железа является смешанной железой. Она состоит из экзокринной и эндокринной частей.
В экзокринной части вырабатывается панкреатический сок, богатый ферментами – трипсином, липазой, амилазой и др. В эндокринной части синтезируется ряд гормонов — инсулин, глюкогон, соматостатин, ВИП, панкреатический полипептид, принимающие участие в регуляции углеводного, белкового и жирового обмена в тканях.
Развитие. Поджелудочная железа развивается из энтодермы и мезенхимы. Ее зачаток появляется в конце 3- 4 недели эмбриогенеза. На 3 месяце плодного периода зачатки дифференцируются на экзокринные и эндокринные отделы. Из мезенхимы развиваются соединительно-тканные элементы стромы, а также сосуды. Поджелудочная железа с поверхности покрыта тонкой соединительно-тканной капсулой. Ее паренхима разделена на дольки, между которыми проходят соединительно-тканные тяжи с кровеносными сосудами, нервами.
Экзокринная часть представлена панкреатическими ацинусами, вставочными и внутридольковыми протоками, а также междольковыми протоками и общим панкреатическим протоком.
Структурно-функциональной единицей экзокринной части является панкреатический ацинус. Он включает в себя секреторный отдел и вставочный проток. Ацинусы состоят из 8-12 крупных панкреоцитов, расположенных на базальной мембране и нескольких мелких протоковых центроацинозных эпителиоцитов. Экзокринные панкреоциты выполняют секреторную функцию. Они имеют форму конуса с суженой верхушкой. В них хорошо развит синтетический аппарат. В апикальной части содержатся гранулы зимогена (содержащих проферменты), она окрашивается оксифильно, базальная расширенная часть клеток окрашена базофильно, однородна. Содержимое гранул выделяется в узкий просвет ацинуса и межклеточные секреторные канальцы.
Секреторные гранулы ациноцитов содержат ферменты (трипсин, хемотрипсин, липазу, амилазу и др.), способные переварить в тонкой кишке все виды поглощаемой пищи. Большая часть ферментов секретируется в виде неактивных проферментов, приобретающих активность только в двенадцатиперстной кишке, что обеспечивает защиту клеток поджелудочной железы от самопереваривания.
Второй защитный механизм связан с одновременной секрецией клетками ингибиторов ферментов, препятствующих их преждевременной активации. Нарушение выработки панкреатических ферментов приводит к расстройству всасывания питательных веществ. Секреция ациноцитов стимулируется гормоном холецитокинином, вырабатываемым клетками тонкой кишки.
Центроацинозные клетки — мелкие, уплощенные, звездчатой формы, со светлой цитоплазмой. В ацинусе располагаются центрально, выстилая просвет не полностью, с промежутками, через которые в него поступает секрет ациноцитов. У выхода из ацинуса сливаются, образуя вставочный проток, и фактически являясь его начальным участком, вдвинутым внутрь ацинуса.
Система выводных протоков включает: 1)вставочный проток 2)внутридольковые протоки 3)междольковые протоки 4)общий выводной проток.
Вставочные протоки — узкие трубочки, выстланные плоским или кубическим эпителием.
Внутридольковые протоки выстланы кубическим эпителием.
Междольковые протоки лежат в соединительной ткани, выстланы слизистой оболочкой, состоящей из высокого призматического эпителия и собственной соединительно-тканной пластинки. В эпителии имеются бокаловидные клетки, а также эндокриноциты, вырабатывающие панкреозимин, холецистокинин.
Эндокринная часть железы представлена панкреатическими островками, имеющими овальную или округлую форму. Островки составляют 3% объема всей железы. Клетки островков — инсулиноциты, небольших размеров. В них умеренно развита гранулярная эндоплазматическая сеть, хорошо выражен аппарат Гольджи, секреторные гранулы. Эти гранулы неодинаковы в различных клетках островков.
На этом основании выделяют 5 основных видов: бета-клетки (базофильные), альфа-клетки (А), дельта-клетки (Д), Д1 клетки, РР-клетки. В — клетки (70-75%) их гранулы не растворяются в воде, но растворяются в спирте. Гранулы В-клеток состоят из гормона инсулина, который оказывает гипогликемическое действие, так как он способствует усвоению глюкозы крови клетками тканей, при недостатке инсулина количество глюкозы в тканях снижается, а содержание ее в крови резко возрастает, что приводит к сахарному диабету. А-клетки составляют примерно 20-25% . в островках они занимают периферическое положение. Гранулы А-клеток устойчивы к спирту, растворяются в воде. Они обладают оксифильными свойствами. В гранулах А-клеток обнаружен гормон глюкагон, он является антагонистом инсулина. Под его влиянием в тканях происходит расщепление гликогена до глюкозы. Таким образом, инсулин и глюкагон поддерживают постоянство сахара в крови и определяют содержание гликогена в тканях.
Д-клетки составляют 5-10%, имеют грушевидную или звездчатую форму. Д-клетки секретируют гормон соматостатин, который задерживает выделение инсулина и глюкагона, а также подавляет синтез ферментов ацинозными клетками. В небольшом числе в островках находятся Д1 клетки, содержащие мелкие аргирофильные гранулы. Эти клетки выделяют вазоактивный интестинальный полипептид (ВИП), который снижает артериальное давление, стимулирует выделение сока и гормонов поджелудочной железы.
РР-клетки (2-5%) вырабатывают панкреатический полипептид, стимулирующий выделение панкреатического и желудочного сока. Это полигональные клетки с мелкой зернистостью, локализуются по периферии островков в области головки железы. Также встречаются среди экзокринных отделов и выводных протоков.
Помимо экзокринных и эндокринных клеток, в дольках железы описан еще один тип секреторных клеток — промежуточные или ациноостровковые. Они располагаются группами вокруг островков, среди экзокринной паренхимы. Характерной особенностью промежуточных клеток является наличие в них гранул двух типов — крупных зимогенных, присущих ацинозным клеткам, и мелких, типичных для инсулярных клеток. Большая часть ациноостровковых клеток выделяет в кровь как эндокринные, так и зимогенные гранулы. По некоторым данным ациноостровковые клетки выделяют в кровь трипсиноподобные ферменты, которые из проинсулина высвобождают активный инсулин.
Васкуляризация железы осуществляется кровью, приносимой по ветвям чревной и верхней брыжеечной артерий.
Эфферентная иннервация железы осуществляется блуждающим и симпатическими нервами. В железе имеются интрамуральные вегетативные ганглии.
Возрастные изменения. В поджелудочной железе они проявляются в изменении соотношения между ее экзокринной и эндокринной частями. С возрастом уменьшается количество островков. Пролиферативная активность клеток железы крайне низкая, в физиологических условиях в ней происходит обновление клеток путем внутриклеточной регенерации.
Ротовая полость
Пищевод. Желудок
Кишечник: тонкий и толстый
48. Печень человека — МГМСУ им. А.И. Евдокимова
48. Печень человека
Гистологический препарат №48
Печень человека.
Окраска гематоксилином и эозином. Увеличение малое и большое. Найти:
- дольку печени;
- печеночную балку;
- гепатоцит;
- кровеносный синусоидальный капилляр;
- ядра звездчатых макрофагов;
- центральную вену,
- триаду печени и в ней:
- междольковую вену,
- междольковую артерию,
- междольковый желчный проток;
- поддольковые вены.
ВИДЕО I
Ситуационная задача 01-17
Ситуационная задача 01-18
Ситуационная задача 01-44 (смежная тема)
Печень относится крупным органам пищеварения. Доп. информация — см. препарат №43 Дно желудка
Дополнительный материал
- Электронная микрофотография. Желчный капиляр печени. «Атлас», 1970, стр. 322, рис. 442.
- Электронная микрофотография. Микроструктура гепатоцита. «Атлас», 1970, стр. 321, рис. 441.
- Схема ультрамикроскопического строения печени. Учебник, 1989 г., стр. 348, рис. 219.
- Схема строения долек и балок печени. Учебник, 1989 г., стр. 550 рис. 220.
Печень — самая массивная железа организма. Как любая другая железа, она состоит из паренхимы и стромы. Паренхима печени построена из клеток железистого эпителия энтодермального происхождения. Строма имеет мезенхимальное происхождение и состоит из рыхлой волокнистой неоформленной соединительной ткани. В организме печень выполняет несколько десятков функций, большинство из которых связано с её положением на пути тока крови из пищеварительного тракта в общий кровоток. Она выполняет защитную функцию против микробов и чужеродных веществ, поступающих из кишечника в кровь, обезвреживает многие вредные продукты обмена веществ, инактивирует гормоны, биогенные амины, лекарственные препараты. Печень секретирует желчь, синтезирует белки плазмы крови, образует и накапливает гликоген, участвует в обмене холестерина и витаминов и т. д. Паренхима печени с помощью более (печень свиньи) или менее (печень человека) выраженных соединительнотканных прослоек разделена на участки неправильной, часто гексагональной формы, называемые печеночными дольками. Печеночная долька является структурно-функциональной единицей органа. Необходимо отметить, что представление о структурно-функциональной единице печени млекопитающих возникло давно, но оно не было однозначным на протяжении истории изучения этого органа. Более того, оно подвергается трансформации и в настоящее время. Сейчас, наряду с классической печеночной долькой, выделяют еще портальную дольку и ацинус. Это связано с тем, что условно выделяют различные центры в одних и тех же реально существующих структурах.
Кровоснабжение печени. Чтобы понять морфологию структурно функциональной единицы печени, необходимо изучить кровоснабжение органа, так как гепатоциты печени топографически тесно связаны с кровеносными сосудами. В ворота печени входят воротная вена и печеночная артерия. В печени они многократно разделяются на все более мелкие сосуды: долевые, сегментарные, междольковые, вокругдольковые артерии и вены. На всем протяжении эти сосуды сопровождают желчные протоки, и они располагаются в соединительнотканных прослойках. Междольковая артерия и междольковая вена с междольковым желчным протоком вместе составляют так называемую триаду печени. Рядом располагаются лимфатические сосуды. От вокругдольковых вен и артерий отходят капилляры, которые направляются в печеночные дольки и на их периферии сливаются, образуя внутридольковые синусоидные сосуды (капилляры). В них течет смешанная кровь в направлении от периферии к центру дольки и собирается в центральную вену. Центральной веной начинается отток крови от дольки. Далее кровь поступает в поддольковые вены, которые формируют 3 — 4 главные печеночные вены, выходящие из органа.
Печеночная долька. В настоящее время под классической печеночной долькой подразумевают участок паренхимы, отграниченный более или менее выраженными прослойками соединительной ткани. Центром дольки является центральная вена. В дольке располагаются эпителиальные печеночные клетки — гепатоциты. Гепатоцит — клетка многоугольной формы, может содержать одно, два и более ядер. Наряду с обычными (диплоидными) ядрами, имеются и более крупные полиплоидные ядра. В цитоплазме присутствуют все органеллы общего значения, содержатся различного рода включения: гликоген, липиды, пигменты. Гепатоциты в дольке печени неоднородны и отличаются друг от друга по строению и функции в зависимости от того, в какой зоне дольки печени они расположены: центральной, периферической или промежуточной. Структурным и функциональным показателям в дольке печени свойственен суточный ритм. Гепатоциты, составляющие дольку, образуют печеночные балки или трабекулы, которые, анастомозируя друг с другом, располагаются по радиусу и сходятся к центральной вене. Между балками, состоящими самое меньшее из двух рядов печеночных клеток, проходят синусоидные кровеносные капилляры. Стенка синусоидного капилляра выстлана эндотелиоцитами, лишенными (на большем своем протяжении) базальной мембраны и содержащими поры. Между клетками эндотелия рассеяны многочисленные звездчатые макрофаги (клетки Купфера). Третий вид клеток — перисинусоидальные липоциты, имеющие небольшой размер, мелкие капли жира и треугольную форму, располагаются ближе к перисинусоидальному пространству. Перисинусоидальное пространство или вокругсинусоидальное пространство Диссе представляет собой узкую щель между стенкой капилляра и гепатоцитом. Васкулярныи полюс гепатоцита имеет короткие цитоплазматические выросты, свободно лежащие в пространстве Диссе. Внутри трабекул (балок), между рядами печеночных клеток, располагаются желчные капилляры, которые не имеют собственной стенки и представляют собой желоб, образованный стенками соседних печеночных клеток. Мембраны соседних гепатоцитов прилегают друг к другу и образуют в этом месте замечательные пластинки. Желчные капилляры характеризуются извитым ходом и образуют короткие боковые мешкообразные ответвления. В их просвете видны многочисленные короткие микроворсинки, отходящие от биллиарного полюса гепатоцитов. Желчные капилляры переходят в короткие трубочки — холангиолы, которые впадают в междольковые желчные протоки. На периферии долек в междольковой соединительной ткани располагаются триады печени: междольковые артерии мышечного типа, междольковые вены безмышечного типа и междольковые желчные протоки с однослойным кубическим эпителием.
Портальная печеночная долька. Образуется сегментами трех соседних классических печеночных долек, окружающих триаду. Она имеет треугольную форму, в ее центре лежит триада, а на периферии (по углам) центральные вены.
Печеночный ацинус образован сегментами двух расположенных рядом классических долек и имеет форму ромба. У острых углов ромба проходят центральные вены, а триада располагается на уровне середины. У ацинуса, как и у портальной дольки, нет морфологические очерченной границы, подобной соединительнотканным прослойкам, отграничивающим классические печеночные дольки.
Желчный пузырь. Образованная в печени желчь поступает через систему выводных протоков в желчный пузырь. Он имеет стенку, состоящую из трех оболочек: слизистой, мышечной и адвентициальной. Слизистая оболочка образует многочисленные складки, выстланные однослойным каемчатым призматическим эпителием, способным всасывать воду и другие вещества из желчи. Мышечная оболочка характеризуется преимущественно циркулярным направлением гладких миоцитов, а наружная — адвентициальная состоит из плотной соединительной ткани. Со стороны брюшной полости желчный пузырь покрыт серозной оболочкой с мезотелием.
Что такое триада порталов? (с иллюстрациями)
Портальная триада — это область печени, названная в честь ее треугольной формы и трех ее основных компонентов: печеночной артерии, воротной вены печени и печеночных протоков или желчных протоков. Однако этот термин можно считать неправильным, поскольку он также содержит другие структуры. Этот отдел печени на самом деле более известен под своим клиническим термином — портальная гепатит. Другие термины включают поперечную щель и портальную щель. Портальная триада служит воротами кровеносных сосудов или входом в печеночную дольку.
Нарушение работы портальной триады может вызвать повышение артериального давления в воротной вене печени.
Кровеносные сосуды, которые входят в тройку, — это печеночная артерия и печеночная воротная вена. Первую иногда называют собственно печеночной артерией или собственно печеночной артерией, чтобы отличить ее от общей печеночной артерии, которая является местом ее происхождения.Печеночная артерия, образующая триаду, отвечает за снабжение печени кислородом крови через ее левый и правый каналы. Он также отделен от гастродуоденальной артерии, которая является другой ветвью, отходящей от общей печеночной артерии, и поставляет насыщенную кислородом кровь в желудок, а также в начальный отдел тонкой кишки, называемый двенадцатиперстной кишкой.
Печеночная артерия, воротная вена печени и печеночные протоки образуют портальную триаду.
Портальная вена — другой кровеносный сосуд, образующий портальную триаду. Подобно печеночной артерии, она разделяется на левый и правый каналы при достижении печени и снабжает этот орган кровью, богатой питательными веществами. Однако воротная вена отвечает за большую часть кровоснабжения; медицинские исследователи оценивают его в 75 процентов.Кроме того, он получает кровь из желудка и тонкой кишки, а не из сердца. Портальная вена берет начало от соединения верхней брыжеечной вены и селезеночной вены на шейке поджелудочной железы и имеет общую длину около 3 дюймов (8 сантиметров) у взрослых.
Печеночные протоки выходят из печени и соединяются с кишечником для транспортировки желчи, которая используется для пищеварения.Он разделен на левый и правый протоки, каждый из которых соответствует участку печени, за дренирование которого они отвечают. Другими структурами портальной триады являются лимфатические сосуды, которые являются компонентами иммунной системы организма, и ветвь блуждающего нерва, который является одним из нервов, исходящих из головного мозга.
Неисправность портальной триады может вызвать проблемы с печенью, такие как цирроз, и, в самых крайних случаях, смерть.Распространенным заболеванием является портальная гипертензия, которая означает высокое кровяное давление в воротной вене печени. Это состояние можно лечить с помощью бета-адреноблокаторов, снижающих давление в кровотоке в вене.
Портальная вена происходит от соединения верхней брыжеечной вены и селезеночной вены на шейке поджелудочной железы.
Проявления печени при гематологических заболеваниях
Поражение печени часто наблюдается при нескольких гематологических заболеваниях, что приводит к аномальным функциональным тестам печени, аномалиям при визуализирующих исследованиях печени или клиническим симптомам, проявляющимся в печени. При гемолитической анемии желтуха и гепатоспленомегалия часто напоминают заболевания печени. При гематологических злокачественных новообразованиях злокачественные клетки часто инфильтрируют печень и могут демонстрировать аномальные результаты тестов функции печени, сопровождающиеся гепатоспленомегалией или образованием множественных узелков в печени и / или селезенке.Эти случаи могут в дальнейшем перерасти в фульминантную печеночную недостаточность.
1. Введение
Гепатологи или терапевты иногда сталкиваются с печеночными проявлениями различных гематологических нарушений в повседневной практике, включая различные отклонения в тестах функции печени или визуализирующих исследованиях печени. Некоторые гематологические нарушения также имитируют заболевания печени. Хотя обзорные статьи о гематологических нарушениях и заболеваниях печени были опубликованы ранее [1–3], мы также рассматриваем более свежие темы в этой статье.
2. Нарушения эритроцитов (эритроцитов)
2.1. Гемолитическая анемия (HA)
2.1.1. Классификация по сайту разрушения эритроцитов
При серьезном повреждении мембраны эритроцитов в кровотоке происходит немедленный лизис (внутрисосудистый гемолиз). В случаях менее серьезного повреждения клетки могут разрушаться внутри моноцитарно-макрофагальной системы в селезенке, печени, костном мозге и лимфатических узлах (внесосудистый гемолиз) [4–6].
2.1.2. Клиническая картина
Пациенты с ГК обычно обращаются со следующими признаками: быстрое начало анемии, желтуха, пигментные (билирубиновые) желчные камни в анамнезе и спленомегалия.Также может возникнуть легкая гепатомегалия [4].
2.1.3. Тесты функции печени на HA
При гемолизе уровни сывороточной лактатдегидрогеназы (ЛДГ) (особенно изоформ LDh2 и LDh3) повышаются из-за лизированных эритроцитов [4]. Уровни аспартаттрансаминазы (AST) в сыворотке также слегка повышаются при гемолизе, причем соотношение LDH / AST в большинстве случаев превышает 30 [7]. Уровень общего билирубина редко может превышать 5 мг / дл, если функция печени в норме, за исключением случаев острого гемолиза, вызванного серповидно-клеточным кризом.Дисфункция печени также может быть вызвана переливанием крови при анемии при серповидно-клеточной анемии (ВСС) и талассемии [1, 3].
2.1.4. Гемолиз при заболевании печени
Гемолиз может быть вызван либо аномалиями мембран эритроцитов (внутренними), либо факторами окружающей среды (внешними). Большинство внутренних причин являются наследственными, за исключением пароксизмальной ночной гемоглобинурии (ПНГ) или редких состояний приобретенной альфа-талассемии [4].
Внешний HA вызывается иммунными или неиммунными механизмами.Внешний неиммунный HA вызывается системными заболеваниями, включая некоторые инфекционные заболевания, а также заболевания печени или почек. Различные заболевания печени могут индуцировать HA, и двумя основными причинами внешнего HA у пациентов с заболеваниями печени являются разрушение эритроцитов в увеличенной селезенке (гиперспленизм) и приобретенные изменения в мембране красных клеток (например, клетки-мишени, акантоциты, эхиноциты и стоматоциты). Заболевания печени, особенно вызванные алкогольной интоксикацией, вызывают тяжелую гипофосфатемию [8–10], которая, предположительно, приводит к снижению уровня аденозинтрифосфата в эритроцитах, что приводит к хрупкости мембран эритроцитов и сфероидности.Эти эритроциты легко захватываются селезенкой из-за их пониженной деформируемости. Когда преобладающей причиной является чрезмерное употребление алкоголя, состояние быстро улучшается после прекращения употребления алкоголя.
Синдром Зиве — плохо изученное заболевание, характеризующееся ожирением печени / циррозом, сильной болью в верхней части живота и правом подреберье, желтухой, гиперлипидемией и НА [11–13].
2.2. Аутоиммунный HA (AIHA)
AIHA характеризуется повышенным разрушением эритроцитов за счет аутоантител с активацией комплемента или без нее.Диагностика АИГА включает сочетание клинических и лабораторных признаков гемолиза эритроцитов вместе с обнаружением аутоантител и / или отложением комплемента на эритроцитах, обнаруживаемых с помощью прямого антиглобулинового теста, также известного как прямой тест Кумбса [14]. Более чем у половины пораженных пациентов АИГА связан с основным заболеванием, включая какой-либо тип инфекционного заболевания, иммунного расстройства или лимфопролиферативного расстройства (вторичный АИГА), тогда как у других пациентов нет никаких доказательств основных заболеваний (идиопатических или первичных АИГА). [15].
2.2.1. Тесты функции печени в AIHA
Лабораторные данные AIHA не отличаются от результатов других причин гемолиза, то есть снижения уровня гаптоглобина в сыворотке, непрямой билирубинемии и повышенных уровней ЛДГ (преобладание I> II) и АСТ (в основном ЛДГ). / AST> 30). Общий билирубин в сыворотке редко превышает 5 мг / дл, часто наблюдается поликлональная гипергаммаглобулинемия.
2.2.2. Печеночная недостаточность в AIHA
Иммуноглобулин (Ig) G-антитела (редко антитела IgM) обычно реагируют с антигенами на поверхности эритроцитов при температуре тела и поэтому называются «теплыми агглютининами», тогда как антитела IgM (редко типа IgG) реагируют с антигенами. на поверхности эритроцитов ниже температуры тела и поэтому называются «холодовыми агглютининами».«Тепло реагирующие антитела IgM могут приводить к печеночной недостаточности in vivo аутоагглютинации [16]. Сообщалось о летальном случае, когда первичный АИГА проявлялся острой печеночной недостаточностью [16]. У пациента наблюдались повторяющиеся эпизоды внутрисосудистого гемолиза. Несмотря на терапию кортикостероидами, спленэктомию и многократные переливания крови, пациент в конечном итоге скончался от печеночной недостаточности.
2.3. PNH
PNH — это необычный тип приобретенного гемолиза, который встречается у взрослых среднего возраста [17, 18].У пациентов наблюдается темная моча (гемоглобинурия), обычно это утренние пробы. Было доказано, что ПНГ является приобретенным клональным генетическим заболеванием, вызываемым соматической мутацией X-сцепленного гена PIG-A в гемопоэтических стволовых клетках [19].
2.3.1. Клиническая картина
Клинические проявления ПНГ в первую очередь связаны с аномалиями кроветворной функции, ГК, состоянием гиперкоагуляции, гипоплазией или аплазией костного мозга и прогрессированием до миелодиспластического синдрома или острого лейкоза [18].
2.3.2. Диагноз ПНГ
ПНГ ранее ставился косвенно на основании чувствительности эритроцитов ПНГ к лизированию комплементом. Тест на лизис сахарозы используется в качестве скринингового теста, а диагноз подтверждается тестом на кислотный гемолиз Хэма [20–22]. Однако для диагностики было разработано обнаружение дефицита гликозилинозитолфосфолипидного белка при ПНГ с помощью проточного цитометрического анализа [23].
2.3.3. Заболевание печени, ассоциированное с ПНГ
Одним из серьезных осложнений ПНГ является развитие состояния гиперкоагуляции и образование тромбов.Тромбоз при ПНГ обычно возникает во внутричерепных, печеночных или воротных сосудах. ПНГ является одной из наиболее частых причин появления тромбоза воротной вены de novo и редкой причиной синдрома Бадда-Киари [24].
2.4. Серповидноклеточная болезнь (SCD)
SCD представляет собой аутосомно-рецессивное генетическое заболевание, возникающее в результате наследования варианта гемоглобина S (Hb S) цепи β -глобина. Наиболее тяжелая форма с гомозиготностью по Hb S (Hb SS) называется серповидноклеточной анемией (SCA).Менее тяжелые формы обладают гетерозиготностью по Hb S и C (Hb SC) или Hb β -талассемия (Hb β -thal). Эритроциты деформируются в серповидную форму (серповидную форму), подвержены гемолизу, часто образуя скопления в сосудистой сети (вазоокклюзионный криз), вызывая повреждение органов [25].
2.4.1. Печеночные проявления при SCD
Печень может быть поражена заболеванием с сосудистыми осложнениями от серповидного процесса. Более того, многократные переливания крови, необходимые для лечения, могут увеличить риск вирусного гепатита, перегрузки железом и развития пигментированных камней в желчном пузыре, что может способствовать развитию заболевания печени, называемого «серповидноклеточная гепатопатия» [26–28].Острая боль в животе и отклонения в тестах функции печени, а также желтуха могут быть вызваны острым серповидно-печеночным кризом, серповидноклеточным внутрипеченочным холестазом, холециститом и холедохолитиазом с непроходимостью общего желчного протока.
2.4.2. Функциональные пробы печени при SCD
Нарушения функциональных пробы печени часто встречаются у пациентов с SCD. Повышение непрямого билирубина, ЛДГ и АСТ без других признаков заболевания печени обнаруживается у 72% пациентов с ВКА, что связано с гемолизом и / или неэффективным эритропоэзом [29].Концентрации общего билирубина обычно <6 мг / дл, но могут удвоиться (<15 мг / л) во время серповидно-печеночного криза [30]. Уровни АЛТ в сыворотке могут более точно отражать повреждение гепатоцитов [29]. Щелочная фосфатаза (ЩФ) в сыворотке крови, преимущественно костного происхождения, обычно повышена [31].
Острое повышение сывороточной аминотрансферазы может наблюдаться при ишемии печени при вазоокклюзионном кризе, тогда как хронические нарушения функции печени обнаруживаются у 9–25% пациентов [29, 32], обычно вызванные сопутствующими заболеваниями печени, такими как хронические гепатит B или C, обструкция общего желчного протока или употребление алкоголя.
2.4.3. Гипераммониемия из-за дефицита цинка при SCD
Низкие уровни цинка в плазме наблюдаются у 44% пациентов с SCD [33], что может привести к развитию энцефалопатии из-за гипераммонемии у пациентов с циррозом и SCA, которую можно исправить введением цинка [34] .
2.4.4. Визуализирующие исследования печени при SCD
Результаты компьютерной томографии пациентов с гомозиготной SCA выявляют диффузную гепатомегалию. Селезенка обычно маленькая, атрофическая и может иметь плотные кальцификаты из-за повторного инфаркта селезенки.Двойные гетерозиготы (Hb SC и Hb S β -thal) обычно имеют спленомегалию и могут проявлять инфаркт, разрыв, кровотечение или абсцесс селезенки.
МРТ может показать снижение интенсивности сигнала в печени и поджелудочной железе [35] из-за отложений железа у пациентов с ВСС, получающих хронические переливания крови [36–39]. УЗИ брюшной полости может выявить камни в желчном пузыре или повышенную эхогенность печени и поджелудочной железы из-за отложений железа [37].
3. Нарушения коагуляции
3.1. Диссеминированная внутрисосудистая коагуляция (ДВС)
ДВС — системный процесс, вызывающий как тромбоз, так и кровотечение. Патогенез ДВС-синдрома обусловлен, прежде всего, чрезмерным образованием тромбина, что приводит к широко распространенному и системному внутрисосудистому образованию тромбов. Основными инициирующими факторами являются высвобождение или экспрессия тканевого фактора, вторичного по отношению к обширному повреждению эндотелия сосудов, или усиление экспрессии моноцитами в ответ на эндотоксин и различные цитокины. Наиболее частыми причинами ДВС-синдрома являются сепсис, травмы и разрушение тканей, рак и акушерские осложнения.
3.1.1. Диагностика ДВС-синдрома
Диагноз ДВС-синдрома предполагает наличие анамнеза и симптомов, тромбоцитопении и наличия микроангиопатических изменений в мазке крови. Диагноз подтверждается лабораторными исследованиями, которые демонстрируют доказательства как увеличения образования тромбов (например, снижение фибриногена), так и увеличения фибринолиза (например, повышение количества продуктов распада фибрина или D-димера).
3.1.2. Печеночные проявления при ДВС-синдроме
Желтуха часто встречается у пациентов с ДВС-синдромом и может быть вызвана повреждением печени и повышенным продуцированием билирубина вследствие гемолиза.Кроме того, гепатоцеллюлярное повреждение может быть вызвано сепсисом и гипотонией. Общие проявления острого ДВС-синдрома, помимо кровотечения, включают тромбоэмболию и дисфункцию почек, печени, легких и центральной нервной системы. В серии из 118 пациентов с острым ДВС-синдромом нарушение функции печени было обнаружено у 19% [38]. Тяжелое заболевание печени включает снижение синтеза факторов и ингибиторов свертывания крови [39], фибринолиз, фибриногенолиз и повышенный уровень продуктов распада фибрина.Тромбоцитопения может быть вызвана гиперспленизмом, вторичным по отношению к портальной гипертензии.
3.2. Синдром антифосфолипидных антител (APS)
Синдром антифосфолипидных антител (APS) или синдром APLA характеризуется присутствием одного из антифосфолипидных антител (aPL) в плазме и возникновением любых клинических проявлений, включая венозные или артериальные тромбозы или заболеваемость беременностью. .
3.2.1. Клиническая картина
APS возникает как первичный или вторичный из основных заболеваний, таких как системная красная волчанка (СКВ).В серии первичных или вторичных АФС, тромбоз глубоких вен (ТГВ) (32%), тромбоцитопения (22%), ретикулярная ливедо (20%), инсульт (13%), поверхностный тромбофлебит (9%), тромбоэмболия легочной артерии (9%) , потеря плода (8%), транзиторная ишемическая атака (7%) и гемолитическая анемия (7%) часто наблюдаются [40], а венозные тромбозы встречаются чаще, чем артериальные тромбозы [41, 42]. Хотя наиболее частыми участками, где возникает ТГВ, являются икры и почечные вены, также могут быть поражены печеночные, подмышечные, подключичные и сетчатые вены, синусы головного мозга и полая вена.
3.2.2. Проявление печени в APS
Поражение печени может включать тромбоз печени или воротной вены, который может привести к синдрому Бадда-Киари, веноокклюзионной болезни печени, инфаркту печени, портальной гипертензии и циррозу. [40, 43].
3.3. Синдром HELLP
Синдром HELLP определяется гемолизом с микроангиопатическим мазком крови, повышенными ферментами печени и низким количеством тромбоцитов [44]. Синдром HELLP встречается примерно у 1-2 на 1000 беременностей и у 10-20 процентов женщин с тяжелой преэклампсией / эклампсией.
3.3.1. Клиническая картина
Наиболее частыми клиническими проявлениями являются боль в животе [45], тошнота, рвота и недомогание, которые могут напоминать вирусный гепатит, особенно если уровни АСТ и ЛДГ в сыворотке заметно повышены [46]. Гипертония и протеинурия присутствуют примерно в 85 процентах случаев. Дифференциальный диагноз включает острую жировую болезнь печени при беременности (ОЖП). Продление активированного протромбиновым временем частичного тромбопластинового времени (АЧТВ), низкие концентрации глюкозы и повышенные концентрации креатинина чаще встречаются у женщин с AFLP, чем у женщин с HELLP.
3.3.2. Печеночные проявления при HELLP-синдроме
HELLP-синдром и тяжелая преэклампсия могут быть связаны с печеночными проявлениями, включая инфаркт, кровотечение и разрыв.
4. Криоглобулинемия
4.1. Определение и классификация
Осаждения в сыворотке при температуре ниже 37 ° C относятся к криоглобулину (CG). ХГ состоит из иммуноглобулина (Ig) и компонентов комплемента [47], а криоглобулинемия означает присутствие ХГ в сыворотке крови пациента.Согласно классификации Бруэ, основанной на клональности Ig [48], существует три типа ХГ. CG типа I (моноклональный Ig) обычно связан с гематологическим злокачественным новообразованием, таким как макроглобулинемия Вальденстрема или множественная миелома. CG типа II (поликлональный и моноклональный Ig) часто является вторичным по отношению к хроническим инфекциям, таким как гепатит C или инфекция вируса иммунодефицита человека. CG типа III (поликлональный Ig) часто является вторичным по отношению к системным ревматическим заболеваниям.
4.2. Клиническая картина
Клинические признаки ХГ типа I (моноклональные Ig) включают синдром повышенной вязкости, вызванный гематологическими злокачественными новообразованиями.В то время как CG типа II и III (смешанный и поликлональный Ig, соответственно) присутствуют с «триадой Мельцера» пальпируемой пурпуры, артралгии и миалгии, вызванной васкулитом в сосудах малого и среднего размера [49].
Вторичные лимфопролиферативные расстройства встречаются менее чем у 5-10 процентов пациентов с ХГ типа II через 5-10 лет после постановки диагноза [50-52]. Первичные злокачественные новообразования включают В-клеточную неходжкинскую лимфому, лимфому средней и высокой степени злокачественности и лимфому низкой степени злокачественности, такую как иммуноцитома, лимфоидные опухоли, ассоциированные со слизистой оболочкой, и центроцитарную фолликулярную лимфому.Среди пациентов с криоглобулинемией типа II, связанной с гепатитом С, частота неходжкинской лимфомы оценивается в 35 раз выше, чем в общей популяции.
4.3. Криоглобулинемия при инфекции HCV
Патогенез CG наиболее изучен при хронической инфекции HCV. Гиперактивация В-клеток может быть результатом инфицирования В-клеток ВГС через белок клеточной поверхности CD81 [53], хронической антиген-неспецифической стимуляции макромолекулярными сывороточными комплексами, содержащими ВГС, включая ВГС-IgG и ВГС-липопротеин [54, 55], или от антиген-специфический механизм HCV [56], приводящий к размножению специфических клонов B-клеток, экспрессирующих идиотип WA [57] или V (H) 1-69 [58].Частицы HCV часто обнаруживаются в комплексах CG, но развитие CG при инфекции гепатита C не обязательно требует вириона HCV или его компонентов [59].
Среди пациентов с ВГС-инфекцией количество циркулирующих регуляторных Т-клеток сравнивалось между пациентами с симптоматической и бессимптомной ХГ [60], и было обнаружено, что средние уровни регуляторных Т-клеток были значительно ниже у пациентов с симптоматической ХГС-ассоциированной ХГ. чем бессимптомные предметы.
4.4. Печеночная манифестация криоглобулинемии
Сообщалось о печеночных проявлениях в виде гепатомегалии, аномальных функциональных тестов печени или аномальной биопсии печени, причем до 90 процентов, возможно, из-за самого хронического гепатита [61].
5. Гематологические новообразования
5.1. Классификация новообразований кроветворного происхождения
Новообразования, происходящие из гемопоэтических и лимфоидных тканей, классифицируются в соответствии с их морфологическими, иммунофенотипическими, генетическими и клиническими особенностями, а также по типу происхождения клеток и стадии дифференцировки в соответствии с широко применяемой и принятой Всемирной организацией здравоохранения система классификации 2001 г., обновленная в 2008 г. [62].
Миелоидные новообразования включают хронические миелопролиферативные новообразования (MPN), MDS или острые лейкозы с миелоидными линиями.Лимфоидные новообразования делятся на острый лимфобластный лейкоз / лимфому, происходящие от предшественников В- или Т-лимфоидных клеток, или на опухоли, происходящие из зрелых Т- или В-лимфоцитов, включая плазматические клетки. Новообразования гистиоцитарных / дендритных клеток происходят из антигенпрезентирующих клеток или тканевых макрофагов. Редкие случаи не поддаются классификации по миелоидной или лимфоидной линии [62].
6. Миелоидные новообразования
Хронические MPN, также называемые миелопролиферативными расстройствами, классически включают хронический миелоидный лейкоз (CML), истинную полицитемию (PV), эссенциальную тромбоцитемию и первичный идиопатический миелофиброз.
6.1. CML
CML — это MPN, характеризующийся нарушением регуляции продукции и неконтролируемой пролиферацией зрелых и незрелых гранулоцитов с нормальной морфологией. Опухолевые клетки происходят из плюрипотентной гемопоэтической стволовой клетки, имеющей приобретенный гибридный ген BCR-ABL1 , обычно посредством транслокации между хромосомами 9 и 22, t (9; 22) (q34; q11), именуемой Филадельфийской (Ph ) хромосома. BCR-ABL1 индуцирует лейкемогенез через киназозависимые и независимые пути передачи сигналов.Естественное течение ХМЛ варьируется от хронической фазы до ускоренной фазы или взрывного кризиса, но процесс прогрессирования полностью не изучен [62].
6.1.1. Клинические симптомы и проявление ХМЛ в печени
На момент обращения у 20–50% пациентов симптомы отсутствуют. Лабораторные данные включают лейкоцитоз с незрелыми клетками гранулоцитарного ряда и базофилию, легкую анемию и тромбоцитоз. Симптомы включают усталость, недомогание, потливость и потерю веса.Боль в животе и дискомфорт могут возникать в левом подреберье (иногда относящемся к левому плечу), а также может присутствовать раннее насыщение из-за спленомегалии с периспленитом и / или инфарктом селезенки или без него. Также наблюдаются различные степени гепатомегалии. Болезненность в области нижней части грудины иногда возникает из-за разрастания костного мозга, и часто встречаются эпизоды кровотечения из-за дисфункции тромбоцитов [63, 64].
В хронической фазе примерно у 50% пациентов с ХМЛ при поступлении обнаруживается гепатомегалия от легкой до умеренной степени без нарушений функции печени [65].Однако во время бластного криза инфильтрация синусоид печени незрелыми клетками может привести к увеличению печени и повышению уровня ЩФ в сыворотке [66].
6.2. PV
PV является одним из хронических MPN, и клинические признаки включают повышенное количество эритроцитов, спленомегалию, тромбоцитоз и / или лейкоцитоз, тромботические осложнения, эритромелалгию или зуд. При физикальном обследовании спленомегалия, полнокровие лица (красный цианоз) и гепатомегалия выявляются у 70%, 67% и 40% пациентов соответственно [67].Непальпируемая спленомегалия распознается у большинства пациентов при визуализирующих исследованиях [68, 69].
Жалобы со стороны желудочно-кишечного тракта часто встречаются при ПВ, с высокой частотой эпигастрального дистресса, пептических язв и гастродуоденальных эрозий при эндоскопии верхних отделов желудка [70]. Они были связаны с изменениями кровотока в слизистой оболочке желудка из-за изменения вязкости крови и / или повышенного высвобождения гистамина из тканевых базофилов, хотя одно исследование показало высокую частоту положительной инфекции Helicobacter pylori [70].Хотя прямое поражение печени встречается редко, у некоторых пациентов может развиваться острый или хронический синдром Бадда-Киари [71].
6.3. Первичный миелофиброз (ПМФ)
Первичный миелофиброз (ПМФ) — хроническое злокачественное гематологическое заболевание, характеризующееся спленомегалией, лейкоэритробластозом, фиброзом костного мозга и экстрамедуллярным гематопоэзом.
6.3.1. Проявление PMF в печени
На момент постановки диагноза PMF гепатомегалия наблюдается у 40–70% пациентов, а спленомегалия — как минимум у 90% [72–74].Гепатоспленомегалия вызывается выраженным экстрамедуллярным гемопоэзом, который может развиться после спленэктомии, особенно в печени [75, 76]. В отчете о 10 пациентах с PMF значительное увеличение размера печени и сывороточных концентраций ALP, билирубина и / или γ -GTP было замечено у всех пациентов, у которых впоследствии развилась острая печеночная недостаточность, что привело к смерти 3 -4 недели после спленэктомии [76].
6.3.2. Аномальные функциональные тесты печени в PMF
Пациенты с PMF могут иметь неспецифические отклонения лабораторных тестов, включая повышение сывороточных концентраций ALP, LDH, мочевой кислоты, лейкоцитарной ALP и витамина B12 [77, 78].Повышение ЩФ может быть связано с поражением печени или костей, в то время как повышение ЛДГ может быть следствием неэффективного кроветворения.
6.4. MPN и тромбоз воротной вены
MPN могут быть нечастой причиной тромбоза тирозинкиназы воротной вены (V617F) неясной этиологии [79–81]. JAK2 мутация может быть обнаружена в таких случаях [82, 83].
6.5. MPN и синдром Бадда-Киари
Мутация JAK2 может быть обнаружена почти у всех пациентов с PV и примерно у 50 процентов пациентов с эссенциальной тромбоцитемией (ET) или PMF. JAK2 (V617F) мутации были описаны у 26-59 процентов пациентов с синдромом Бадда-Киари без видимых обнаружений MPN [84–87]. Эти данные предполагают наличие скрытых MPN у некоторых пациентов с так называемым «идиопатическим» синдромом Бадда-Киари.
7. Лимфоидные новообразования
7.1. Лимфома Ходжкина (HL)
HL, ранее называвшаяся болезнью Ходжкина, является первой выявленной лимфоидной опухолью, которая обычно возникает в лимфатических узлах и распространяется непрерывно через лимфатическую систему.HL гистологически характеризуется гигантскими клетками, называемыми клетками Ходжкина / Рида-Штернберга (H / RS), большинство из которых представляют собой трансформированные вирус-положительные В-клетки Эпштейна-Барра, присутствующие в реактивном клеточном фоне, состоящем из гранулоцитов, плазматических клеток и лимфоцитов.
7.1.1. Печеночные проявления HL
Об инфильтрации злокачественных клеток в печени сообщалось у 14% пациентов с HL. Гепатомегалия обнаруживается у 9% пациентов с I-II стадиями заболевания и у 45% пациентов с III-IV стадиями [88].Легкое повышение аминотрансферазы и умеренное повышение ЩФ может происходить из-за инфильтрации опухолью или обструкции внепеченочных желчных протоков [88]. Холестаз может быть вызван прямой инфильтрацией клеток лимфомы, обструкцией внепеченочных желчных путей, вирусным гепатитом, гепатотоксичностью лекарств или синдромом исчезающих желчных протоков [89–91]. Приблизительно у 3–13% пациентов с HL наблюдается желтуха [90]. Острая печеночная недостаточность может быть вызвана ишемией, вторичной по отношению к сдавлению синусоидов печени инфильтрирующими клетками лимфомы [92, 93].
7.2. Неходжкинская лимфома (НХЛ)
НХЛ классифицируется по морфологии клеток от мелкоклеточного до крупноклеточного, а в соответствии с естественной историей клинической агрессивности заболевания — на низкую, среднюю или высокую степень.
7.2.1. Печеночная манифестация NHL
Инфильтрация лимфомными клетками печени с гепатомегалией чаще встречается в NHL, чем в HL, при этом в 16–43% случаев наблюдается поражение печени [88]. Внепеченочная обструкция также чаще встречается при НХЛ, чем при HL, а инфильтрация печени чаще встречается при В-клеточных лимфомах низкой степени, чем при лимфомах высокой степени [94].Острая печеночная недостаточность может возникать при НХЛ, как видно из HL [95], что вызвано внезапной ишемией, связанной с массивной инфильтрацией синусоидов или замещением паренхимы печени злокачественными клетками [95]. Хотя вовлечение печени как в HL, так и в NHL может проявляться как острая печеночная недостаточность [96–101], трансплантации печени следует избегать [102].
Острая печеночная недостаточность, вызванная лимфомой, может быть заподозрена в случаях острого начала увеличения печени и лактоацидоза, отличных от других причин печеночной недостаточности [2, 103].
7.2.2. Тесты на аномальные функции печени в NHL
Тесты функции печени у пациентов с NHL показывают от легкого до умеренного повышения сывороточной ЩФ [88]. Повышенный уровень ЛДГ в сыворотке также часто наблюдается у пациентов с НХЛ, особенно при высокоагрессивном типе, таком как лимфома Беркитта или лимфобластная лимфома, что отражает высокую опухолевую нагрузку, обширную инфильтрацию печени и сопутствующую иммуноопосредованную ГК, что связано с плохим прогнозом. .
7.2.3. Визуализирующие исследования печени в NHL
Хотя диффузная гепатоспленомегалия обычно наблюдается у пациентов с вялотекущими лимфомами, функция печени при НХЛ обычно сохраняется.С другой стороны, дискретные образования печени чаще встречаются у высокоагрессивных подтипов [104, 105]. Однако не все очаговые поражения печени у пациентов с НХЛ связаны с лимфомой. В отчете о 414 последовательных пациентах с НХЛ только 39% очаговых поражений печени, обнаруженных в начале заболевания, были вызваны НХЛ и 58% были доброкачественными [106], тогда как 74% поражений, обнаруженных во время наблюдения, были вызваны НХЛ и 15% были из-за злокачественной опухоли, отличной от НХЛ (например, гепатоцеллюлярная карцинома, метастатическая опухоль из другого вторичного злокачественного образования).Асцит может присутствовать и может быть хилезным в случаях лимфатической обструкции.
7.3. Первичная НХЛ печени
Первичная НХЛ печени — редкое заболевание, составляющее <1% всех экстранодальных лимфом. Две трети случаев возникают у мужчин в возрасте примерно 50 лет. Симптомы включают боль в животе, лихорадку, гепатомегалию и аномальные тесты функции печени с повышением уровня ЛДГ выше, чем у АЛТ [107, 108]. Наиболее распространенным гистологическим подтипом первичной НХЛ печени является диффузная В-клеточная лимфома большого размера, составляющая 80–90% случаев.Это заболевание может проявляться узелками в печени или диффузной портальной инфильтрацией и синусоидальным распространением [109].
Острая печеночная недостаточность, вызванная первичной лимфомой печени, лечится с помощью трансплантации печени и последующей химиотерапии [110]. Хотя первичная лимфома печени встречается редко, стойкие воспалительные процессы, связанные с инфекцией ВГС или аутоиммунным заболеванием, могут играть роль в лимфомагенезе В-клеток печени [111].
7.4. Первичная гепатоспленочная NHL
Сообщалось о первичной гепатоспленочной диффузной крупноклеточной B-лимфоме, ассоциированной с ВГС [112], также может развиться острая печеночная недостаточность плода [113].Хотя этиологическая роль ВГС в лимфоме неизвестна, ВГС-положительные лимфомы, как правило, возникают в экстранодальных участках, особенно в печени, селезенке или слюнных железах, где находится ВГС и происходит хроническая инфильтрация лимфоцитов.
7,5. Внутрисосудистая диффузная крупноклеточная лимфома
Внутрисосудистая диффузная крупноклеточная лимфома или внутрисосудистая лимфома — редкое, но важное состояние у пациентов с быстро проявляющейся лихорадкой, сыпью или ишемическими, неврологическими или респираторными симптомами.При этом состоянии опухолевые клетки обычно развиваются исключительно в мелких сосудах кожи, головного мозга, печени или легких. Биопсия из этих органов необходима для гистологического диагноза.
Симптомы лихорадки, ночного потоотделения и потери веса наблюдаются у 55–85% пациентов с В-клеточной лимфомой [114, 115]. Пораженные органы различаются в зависимости от области. В западных странах чаще всего встречаются симптомы, связанные с центральной нервной системой (39%) и кожей (39%) [114, 116, 117], тогда как симптомы, связанные с костным мозгом (32%), печенью (26%), и селезенка (26%) встречаются реже.В Азии чаще встречаются симптомы, связанные с поражением костного мозга (75%), селезенки (67%) и печени (55%) [118–121], тогда как симптомы, связанные с поражением центральной нервной системы (27%) и кожи поражения (15%) встречаются реже [122]. Гемофагоцитарный синдром также описан в японской серии (азиатский вариант) [120].
Диагноз внутрисосудистой крупноклеточной лимфомы может быть установлен путем случайной биопсии кожи [123] или биопсии органов, подозреваемых в поражении; например, биопсия печени, если наблюдаются необъяснимые аномальные тесты функции печени, легкого, если присутствуют необъяснимые легочные симптомы, и мозга, если существуют необъяснимые неврологические симптомы [124–127].
7.6. Гепатоспленочная Т-клеточная лимфома
7.6.1. Клиническая презентация
Гепатоспленочная Т-клеточная лимфома — это редкий тип агрессивной НХЛ, ассоциированный с пациентами, получающими терапию противоопухолевым фактором некроза альфа и аналогами пурина для лечения воспалительного заболевания кишечника [128].
7.6.2. Печеночные проявления гепатоспленической Т-клеточной лимфомы
Клинические признаки включают гепатоспленомегалию, лихорадку, потерю веса, ночную потливость, панцитопению и периферический лимфоцитоз.Функциональные пробы печени повышены примерно у 50% пациентов с небольшим повышением АСТ, АЛТ или ЩФ. Уровни ЛДГ в сыворотке крови также повышены примерно у 50% пациентов, от умеренных до чрезвычайно высоких. Иммуносупрессия, особенно Т-лимфоцитов, с помощью терапии противоопухолевым фактором некроза альфа и аналогами пурина может увеличить риск этого заболевания [129].
7.7. Гемофагоцитарный синдром (ГПС)
7.7.1. Клиническая картина
HPS представляет собой состояние, проявляющееся системными воспалительными симптомами, такими как лихорадка, гепатоспленомегалия, цитопения и гемофагоцитоз в костном мозге, селезенке и лимфатических узлах [130, 131].HPS вызывается гиперцитокинемией, которая запускается сильно стимулированными естественными киллерами и цитотоксическими Т-клетками. Основные расстройства включают вирусные инфекции, обычно вирус Эпштейна-Барра у более молодых пациентов, ревматические расстройства, синдромы иммунодефицита и агрессивные лимфомы [132]. Сообщалось, что агрессивная форма NK-клеточной лимфомы или внутрисосудистой лимфомы азиатского варианта осложняется HPS [133]. ГПС следует подозревать, если пациенты соответствуют по крайней мере пяти из следующих восьми критериев: лихорадка, спленомегалия, цитопения, гипертриглицеридемия, низкий уровень фибриногена, гемофагоцитоз при биопсии костного мозга, низкая или отсутствующая активность NK-клеток или повышенные уровни ферритина или растворимого рецептора IL2 [130].
7.7.2. Проявление HPS в печени
HPS может вызывать гепатомегалию, желтуху с холестазом, умеренное повышение уровня трансаминаз, гиперферритинемию, снижение синтетической функции печени и молниеносную печеночную недостаточность. Гепатотоксичность вызывается гемофагоцитозом в синусоидах печени и воротных трактах или очаговым гепатоцеллюлярным некрозом [132].
8. Лейкоз
8.1. Острый лейкоз
8.1.1. Клиническая картина
Острые лейкозы — это новообразования, происходящие от предшественников миелоидного или лимфоидного происхождения (редко — неоднозначного происхождения).Хотя ОЛЛ является наиболее распространенным злокачественным новообразованием у детей, заболеваемость повышается также у пожилых людей. Заболеваемость ОМЛ увеличивается с возрастом, и ОМЛ является наиболее распространенным типом лейкозов у взрослых.
8.1.2. Проявление острого лейкоза в печени
Хотя вовлечение печени при остром лейкозе обычно мягкое и бессимптомное на момент постановки диагноза [134], патологоанатомическое исследование показало инфильтрацию печени в> 95% случаев острого лимфобластного лейкоза (ОЛЛ) и до 75%. случаев острого миелолейкоза (ОМЛ) [135].При ОЛЛ инфильтрация была ограничена воротными трактами, тогда как при ОМЛ инфильтрация наблюдалась как в воротных трактах, так и в синусоидах. Массивная инфильтрация печени лейкозными клетками может проявляться фульминантной печеночной недостаточностью [136]. У пациентов с острым лейкозом поражение печени, вызванное лекарственными средствами, а также бактериальные или грибковые инфекции могут также влиять на печень.
8.1.3. ОМЛ и гепатоспленомегалия
Пальпируемая органомегалия как проявление ОМЛ встречается редко, а значительное увеличение лимфатических узлов редко встречается у пациентов с ОМЛ.Заметная гепатоспленомегалия также встречается нечасто; однако, если он присутствует, у пациента, вероятно, есть ОЛЛ или развитие ОМЛ в результате предшествующего миелопролиферативного расстройства (бластный кризис ХМЛ).
8.2. ОЛЛ у детей
При обращении у детей с ОЛЛ могут быть отмечены несколько аномалий, включая дисфункцию печени, нарушения свертывания крови, гиперкальциемию, гипокальциемию, гиперкалиемию и гиперфосфатемию [137].
8.3. Предшественник B-ALL / лимфобластная лимфома (LBL) у взрослых
Предшественник B-лимфоцитов ALL связан с уменьшением количества нормальных клеток крови, вызванным замещением костного мозга опухолевыми клетками.Клинические проявления пациентов включают анемию, склонность к кровотечениям или предрасположенность к инфекциям. Часто присутствуют B-симптомы, такие как лихорадка, ночная потливость и потеря веса, но могут быть легкими. Гепатомегалия, спленомегалия или лимфаденопатия могут наблюдаться почти у половины взрослых пациентов.
8.4. Предшественник T-ALL / LBL
Предшественник T-ALL / LBL, происходящий из Т-клеток-предшественников тимуса, обычно встречается у мужчин в возрасте приблизительно 20 лет. Клинические проявления включают лимфаденопатию (50%) или объемное новообразование в переднем средостении (50–75%) [138].Поражение брюшной полости встречается редко, но может быть обнаружено в основном в печени и селезенке. Более 80% пациентов имеют III или IV стадию заболевания, и почти у 50% наблюдаются B-симптомы, а уровень ЛДГ в сыворотке обычно повышен. Хотя костный мозг при поступлении часто бывает нормальным, примерно у 60% пациентов развивается инфильтрация костного мозга и последующая лейкемическая фаза, неотличимая от Т-клеточного ОЛЛ [139].
8.5. Хронический лимфоидный лейкоз (ХЛЛ)
8.5.1.Клиническая презентация
Хронический лимфолейкоз (ХЛЛ) — одно из хронических лимфопролиферативных заболеваний, характеризующихся прогрессирующим накоплением моноклональных лимфоидных клеток. Считается, что ХЛЛ идентичен малой лимфоцитарной лимфоме (SLL), которая является одной из вялотекущих неходжкинских лимфом [62, 140]. ХЛЛ — наиболее распространенная лейкемия в западных странах, на которую приходится примерно 30 процентов всех лейкозов в Соединенных Штатах. Хотя ХЛЛ-лимфоциты по морфологии напоминают нормальные маленькие лимфоциты, они являются активированными клональными В-клетками на стадии между пре-В и зрелыми В-клетками.[141–143]. Лимфоциты B-CLL положительны в отношении антигенов, связанных с B-клетками (CD19, CD20, CD21 и CD23) и CD5, и экспрессируют чрезвычайно низкие уровни поверхностных мембранных иммуноглобулинов (IgM или оба IgM и IgD).
8.5.2. Клиническая стадия ХЛЛ
Естественное течение ХЛЛ неоднородно. Системами стадирования, которые широко используются для прогнозирования прогноза пациента и определения терапевтических стратегий, являются система Раи [144] и система Бине [145].
8.5.3. Клинические особенности CLL
Наиболее частым физическим признаком является лимфаденопатия, которая присутствует у 50–90 процентов пациентов.Другой лимфоидный орган, часто увеличивающийся при ХЛЛ, — это селезенка, которая пальпируется в 25–55% случаев.
8.5.4. Проявление ХЛЛ в печени
Пациенты с ХЛЛ часто показывают увеличение печени от легкой до умеренной степени во время первоначального диагноза в 15–25% случаев [145, 146]. Печень обычно увеличена незначительно, от 2 до 6 см ниже правого края ребер, с диапазоном тупости до перкуссии примерно 10–16 см. При пальпации печень обычно безболезненная, твердая, с гладкой поверхностью.Увеличенная печень у пациентов с ХЛЛ часто проявляется обширной лимфоцитарной инфильтрацией в воротных трактах с функциональным нарушением печени на поздних стадиях [147, 148].
8.6. Волосатоклеточный лейкоз (HCL)
8.6.1. Клиническая картина
Клиническая картина HCL включает следующее [144, 149]: (1) наполнение живота из-за спленомегалии, которое может вызвать спонтанный разрыв селезенки [150], (2) системные симптомы, такие как усталость, слабость и потеря веса. без лихорадки или ночного потоотделения, (3) склонность к кровотечениям, вызванная тяжелой тромбоцитопенией или рецидивирующими инфекциями, и (4) бессимптомная спленомегалия или цитопения, которые могут быть обнаружены случайно, и наиболее частым физическим признаком HCL является пальпируемая спленомегалия (80–90%) случаев).Массивная спленомегалия, простирающаяся более чем на 8 см ниже левого края ребра, наблюдается в 25% случаев.
8.6.2. Проявление HCL в печени
Гепатомегалия и лимфаденопатия при HCL не характерны и проявляются примерно у 20% и 10% пациентов соответственно.
8.6.3. Результаты лабораторных исследований
У большинства пациентов с HCL наблюдаются панцитопения (60–80%), анемия (85%), тромбоцитопения и нейтропения (80%). Лейкоцитоз может присутствовать в 10–20% случаев.Аномальные функциональные пробы печени и гипергаммаглобулинемия наблюдаются в 20% случаев. Клетки лейкемии часто инфильтрируют печень как в портальных трактах, так и в синусоидах, и увеличение печени наблюдается у 40% пациентов [151].
9. Миелома и родственные заболевания
9.1. Множественная миелома
9.1.1. Клиническая картина
Множественная миелома — это одно из новообразований плазматических клеток (т.е. терминально дифференцированных В-клеток), которое с возрастом встречается все чаще.Обычно он поражает костный мозг, вырабатывает моноклональный иммуноглобулин и может вызывать дисфункцию или повреждение различных органов. У большинства пациентов с множественной миеломой наблюдаются признаки или симптомы, связанные с инфильтрацией плазматических клеток в кость или повреждением почек из-за избытка легких цепей [152].
9.1.2. Печеночная манифестация MM
Гепатомегалия наблюдается у 15–40% пациентов и иногда может сопровождаться спленомегалией [153, 154]. В серии из 1027 клинических случаев, проведенных в клинике Мэйо в этом единственном учреждении, были обнаружены относительно редкие симптомы и признаки гепатомегалии (4%) и спленомегалии (1%).
9.2. Амилоидоз
9.2.1. Клиническая презентация
Амилоидоз относится к отложению амилоидных фибрилл во внеклеточной ткани, состоящих из низкомолекулярных субъединиц белков. Двумя основными частыми причинами системного отложения амилоида являются амилоидоз AL и AA. Амилоидоз легкой цепи иммуноглобулина (AL) (первичный амилоидоз) состоит из моноклональных легких цепей с дискразией плазматических клеток или без нее (множественная миелома и макроглобулинемия Вальденстрема).Амилоидоз АА состоит из фрагментов реактива острой фазы, называемого сывороточным амилоидом А. АА амилоидоз обычно является реактивным (вторичным) по отношению к хроническому воспалению. Симптомы амилоидоза неспецифические, включая усталость и потерю веса. Часто наблюдаются органомегалия и дисфункция пораженных органов, включая нефротический синдром, рестриктивную кардиомиопатию, периферическую невропатию, макроглоссию, пурпуру или коагулопатию [155].
9.2.2. Печеночные проявления амилоидоза
Гепатомегалия со спленомегалией или без нее наблюдается у 70 процентов пациентов.Холестатический паттерн с повышенным уровнем печеночных ферментов наблюдается примерно у 25 процентов. Поражение печени может происходить при всех типах амилоидоза, а гистологически доказанное поражение печени при системном амилоидозе обнаруживается у 17–98% пациентов [156–158]. При амилоидозе печени отложение амилоида АК обычно наблюдается в сосудах, в то время как отложения не-АК амилоида появляются смешанным образом в сосудах, синусоидальных клетках и портальной строме [159].
Первичный амилоидоз печени AL — редкое заболевание.Гепатомегалия и повышенная ЩФ присутствуют у большинства пациентов, что может быть связано с плохим прогнозом [160].
Анестезиологические особенности при гепатэктомиях под контролем сосудов печени
Предпосылки . Опасности хирургического вмешательства на печени были уменьшены благодаря развитию методов контроля сосудов печени и анестезиологического лечения. В этой статье были рассмотрены аспекты анестезии при методиках окклюзии сосудов печени. Методы . Поиск литературы в Medline с использованием терминов «анестезия», «анестезия», «печень», «гепатэктомия», «приток», «закупорка оттока», «Прингл», «гемодинамика», «воздушная эмболия», «кровопотеря». «Переливание», «ишемия-реперфузия», «прекондиционирование». Результатов . Целенаправленное анестезиологическое лечение в соответствии с применяемым методом окклюзии сосудов печени улучшает исход операции и снижает заболеваемость и смертность после операции на печени. Выводы . Методы окклюзии сосудов печени имеют общие соображения по поводу анестезии с точки зрения предоперационной оценки, мониторинга, индукции и поддержания анестезии. С другой стороны, управление гемодинамикой, профилактика воздушной эмболии сосудов, переливание крови и повреждение печени возможны, если план анестезии запланирован в соответствии с методом выполненной окклюзии сосудов печени.
1. Введение
Гепатэктомия — один из методов лечения доброкачественных и злокачественных заболеваний печени. Хотя резекция печени связана с высокими показателями смертности и заболеваемости, недавние достижения в области анестезиологического и хирургического лечения значительно снизили операционный риск. Методы сосудистого контроля во время гепатэктомии очень сложны и должны выполняться с учетом особых требований к анестезии.
Методы контроля сосудов печени можно разделить на те, которые включают закупорку притока в печень, и методы, предполагающие окклюзию притока и оттока печени.Их можно резюмировать следующим образом: (1) окклюзия притока сосудов. (A) окклюзия печеночной ножки: (a) непрерывный маневр Прингла (CPM), (b) прерывистый маневр Прингла (IPM). (B) селективная окклюзия притока. (2) ) Исключение притока и оттока сосудов (A) Полное исключение сосудов печени (THVE), (B) окклюзия притока с экстрапаренхимальным контролем основных печеночных вен: с селективным исключением сосудов печени (SHVE).
При выполнении этих методов анестезия должна учитывать гемодинамику, риски сосудистой воздушной эмболии, ишемическое реперфузионное повреждение печени, интраоперационную кровопотерю и необходимость переливания крови, факторы, которые обычно усложняют методы контроля сосудов печени.Особое внимание следует уделять предоперационной оценке и индукции анестезии, поскольку пациенты, перенесшие резекцию печени, обычно имеют плохое состояние здоровья. Тщательный подбор анестезирующих препаратов может минимизировать эффекты снижения кровотока в печени, вызванные принятой хирургической техникой.
2. Методы
Был проведен обширный поиск литературы. Наша цель состояла в том, чтобы определить особенности анестезии в методах контроля сосудов печени.Статьи были отобраны с помощью поиска литературы в Medline в соответствии со следующими критериями: (1) Все проспективные рандомизированные исследования были тщательно оценены и представлены, поскольку они являются наиболее важным источником информации о результатах хирургических и анестезиологических манипуляций. (2) Крупные. также были включены ретроспективные исследования. Упоминаются несколько историй болезни и небольшие исследования, учитывая тот факт, что они выделяют специальные анестетики как
Core Concepts — Диагностика и лечение печеночной энцефалопатии — Лечение осложнений, связанных с циррозом
Диагностика
Открытая печеночная энцефалопатия диагностируется на основании клинических данных и путем исключения других причин изменения психического статуса.[2] Наиболее частыми расстройствами, которые следует учитывать при дифференциальной диагностике явной печеночной энцефалопатии, являются побочные эффекты, связанные с приемом лекарств, тяжелые электролитные нарушения (гипонатриемия и гиперкальциемия), уремия, системная инфекция, инфекция центральной нервной системы, психические расстройства, связанные с алкоголем ( интоксикация, абстинентный синдром или синдром Вернике-Корсакова), гипогликемия, гиперкапния, бессудорожная эпилепсия и внутричерепное кровотечение или инсульт. [2,4] В рамках диагностического процесса клиницист должен классифицировать тип и тяжесть явной печеночной энцефалопатии.[2] Для большинства пациентов критерии Вест-Хейвена считаются золотым стандартом для классификации тяжести явной печеночной энцефалопатии; он классифицирует тяжесть печеночной энцефалопатии на основе клинической оценки с оценкой от 0 (отсутствие аномалий) до 4 степени (кома) (рис. 3). [9,10] Шкала комы Глазго, однако, может быть более полезной для пациентов с тяжелой энцефалопатией и заметным изменением психического статуса (рис. 4). [2] Диагноз минимальной печеночной энцефалопатии требует специального психометрического тестирования.[20,21,22]
Лабораторные испытания
У пациентов с циррозом печени и подозрением на печеночную энцефалопатию лабораторные исследования играют важную роль в выявлении провоцирующих факторов и исключении альтернативных причин измененного мышления. Обычные лабораторные исследования включают оценку функции печени и почек, электролитов, глюкозы, посевов и скрининг на лекарства. Хотя уровни аммиака в артериальной и венозной крови могут коррелировать с тяжестью печеночной энцефалопатии, образец крови следует собирать без использования жгута и доставить на льду в лабораторию для анализа в течение 20 минут, чтобы гарантировать точность результатов.[4] Кроме того, существует множество внепеченочных причин гипераммониемии, таких как желудочно-кишечное кровотечение, почечная недостаточность, гиповолемия, обширное мышечное напряжение, нарушение цикла мочевины, парентеральное питание, уросепсис и использование определенных лекарств (например, вальпроевой кислоты). Хотя пациенты с печеночной энцефалопатией имеют повышенный уровень аммиака в сыворотке, тяжесть печеночной энцефалопатии не коррелирует с уровнями аммиака в сыворотке выше определенного предела. [23,24] По всем этим причинам получение уровней аммиака в сыворотке для диагностики печеночной энцефалопатии не рекомендуется , но если тест был назначен и результат был нормальным, диагноз печеночной энцефалопатии должен потребовать повторной оценки.[2] Если у пациента диагностирована печеночная энцефалопатия, и он получает медикаментозное лечение для снижения уровня аммиака, для оценки эффективности лечения можно использовать серийный мониторинг уровня аммиака в крови. [2]
Изображения
Компьютерная томография головного мозга (КТ) имеет низкую чувствительность для выявления отека мозга на ранней стадии, но может помочь исключить другие причины измененного мышления, например, внутримозговое кровоизлияние. Магнитно-резонансная томография головного мозга (МРТ) может использоваться для диагностики отека головного мозга и других аномалий головного мозга, связанных с печеночной энцефалопатией.Двусторонняя и симметричная гиперинтенсивность бледного шара в базальных ганглиях на Т 1 -взвешенная МРТ-визуализация может быть замечена у пациентов с циррозом и печеночной энцефалопатией, но эти результаты не коррелируют со степенью печеночной энцефалопатии [25]. Считается, что это открытие связано с избыточным уровнем циркулирующего марганца. Неясно, связаны ли эти изменения МРТ конкретно с печеночной энцефалопатией или вместо этого могут быть вызваны циррозом или портосистемным шунтированием. Таким образом, МРТ не используется для диагностики или оценки печеночной энцефалопатии.Для оценки факторов, провоцирующих печеночную энцефалопатию, также можно использовать другие типы изображений, например рентгенограмму грудной клетки для оценки инфекции или визуализацию кишечника для оценки непроходимости или кишечной непроходимости.
Психометрические тесты
В отсутствие очевидных результатов физикального обследования печеночной энцефалопатии нейропсихометрические тесты могут использоваться для выявления нарушений внимания, зрительно-пространственных способностей, мелкой моторики и памяти. Эти нейропсихометрические тесты необходимы для диагностики минимальной печеночной энцефалопатии.[26] К сожалению, большинство этих тестов требуют специальных знаний, могут потребовать очень много времени для проведения и могут не быть широко доступны для использования в США, поскольку необходимы нормативные данные для местного населения. Они также неспецифичны, поскольку любая причина дисфункции мозга может привести к ненормальным результатам. С практической точки зрения, диагностика минимальной печеночной энцефалопатии важна, поскольку она часто связана с нарушением навыков вождения. [27,28] Ниже приведены некоторые из наиболее признанных и широко используемых психометрических тестов для диагностики минимальной печеночной энцефалопатии.[2,21,22,29]
- Тест критической частоты мерцания (CFF) : Тест CFF использует тестовую систему Шухфрида для оценки зрительного различения и функциональной эффективности коры головного мозга (общее возбуждение). [30,31] CFF выполняется с помощью светового диод для создания интрафовеальной стимуляции и, таким образом, оценки способности пациента обнаруживать мерцание света; Этот тест является чувствительным и воспроизводимым средством для количественной оценки тяжести минимальной печеночной энцефалопатии.[30,31] С практической точки зрения для этого теста требуется специальное оборудование, и он не подходит для лиц с красно-зеленой дальтонизмом. [2]
- Тест Струпа : Тест Струпа оценивает избирательное внимание и скорость обработки по интерференции между визуальным цветом и написанным названием цвета. EncephalApp Stroop — это приложение для смартфона, которое использует смартфон или планшет в качестве инструмента для выявления минимальной печеночной энцефалопатии путем оценки избирательного внимания и тормозных реакций.[32,33] В тесте используется «выключенное состояние» с нейтральными стимулами и «включенное состояние» с неконгруэнтными стимулами.
- Тест ингибиторного контроля (ICT) : ICT — это компьютеризированный тест, который оценивает устойчивое внимание и ухудшение рабочей памяти. [34,35] Во время ICT, которое занимает около 15 минут, субъекты видят непрерывный поток писем на компьютере экран, и им предлагается нажать кнопку, если они увидят X, за которым следует Y; в тесте используются приманки (XX или YY) для оценки способности субъекта подавлять реакцию на приманки.[34,35] Тест оценивается на основе количества правильных ответов на цели и скорости приманки. [21,36]
- Тест соединения номера Часть A и Часть B : Тест соединения номера можно быстро и легко провести в офисе или у постели больного, но эти тесты имеют ограниченную специфичность. (Рисунок 5) [37,38] Числовые тесты могут проводиться как отдельный тест или как часть теста синдрома портосистемной энцефалопатии (PSE) или оценки психометрической печеночной энцефалопатии (PHES).
- Тест на синдром портосистемной энцефалопатии (PSE) : PSE представляет собой набор из примерно 30 различных психометрических тестов для оценки различных когнитивных областей; PSE был одобрен Рабочей группой на Всемирном конгрессе гастроэнтерологов в Вене в 1998 г. в качестве золотого стандарта для диагностики минимальной печеночной энцефалопатии, но клинически этот тест был заменен более практическими тестами [9,38].
- Психометрическая оценка печеночной энцефалопатии (PHES) : PHES использует подмножество пяти тестов, взятых из теста на синдром портосистемной энцефалопатии (PSE).[38] Пять тестов состоят из: (1) теста соединения номера A, (2) теста соединения номера B, (3) теста цифрового символа, (4) теста последовательной точки и (5) теста отслеживания линии. [21, 38] Этот тест в первую очередь оценивает внимание, зрительно-пространственное восприятие, зрительно-пространственное построение, психомоторную скорость и двигательную точность. [21,22]
- Повторяемая батарея для оценки неврологического статуса (RBANS) : RBANS — это компьютеризированные психометрические тесты (например, тормозной контрольный тест) и нейрофизиологические тесты, используемые для диагностики печеночной энцефалопатии в клинических испытаниях.[26,39]
- Тест непрерывного времени реакции (CRT) : Тест индекса CRT измеряет стабильность времени моторной реакции (нажатие кнопки в ответ на слуховые стимулы) и требует простого программного и аппаратного обеспечения для управления. [40,41]
- SCAN Test : SCAN Test измеряет скорость и точность теста памяти распознавания цифр в компьютеризированном формате. [42]
Электроэнцефалография
Электроэнцефалография (ЭЭГ) позволяет оценить легкую печеночную энцефалопатию и является более объективной, чем психометрические тесты, но она также неспецифична, поскольку на нее могут влиять другие метаболические нарушения.Для этого требуются специальные инструменты, поэтому он обычно не используется в клинической практике [5].
Общее введение: достижения в хирургии печени
1. Введение
Резекция печени — это обычно выполняемая процедура при различных злокачественных и доброкачественных опухолях печени [1, 2]. Исторически резекция печени, независимо от показания, была связана с высокой заболеваемостью и смертностью [2–4]. Однако в течение последних десятилетий периоперационный исход после резекции печени улучшился благодаря более глубоким знаниям об анатомии и функции печени, совершенствованию операционных методов и достижениям в области анестезии и послеоперационного ухода [1, 3, 4].
Операция по резекции печени возможна, так как печень обладает способностью к регенерации. Хотя сомнительно, что древние греки уже ценили это уникальное качество печени, оно было впервые описано в мифе о Прометее (Προμηθεύς): он разгневал богов своим неуважением (ὕβρις) после восхождения на гору Олимп и кражи факела в чтобы дать людям огонь. Он был наказан Зевсом и прикован к скале в горах Каукас. Каждые пару дней приходил орел и съедал часть его печени.Поскольку печень каждый раз восстанавливалась, орел возвращался снова и снова, чтобы съесть печень и тем самым истязать бедного Прометея (рис. 1). Благодаря этим древним знаниям считалось возможным извлекать части печени, поскольку этот орган обладает достаточной способностью работать с меньшей частью и способен восстанавливаться.
Рис. 1.
Прометей прикованный (243 x 210 см), Питер Пауль Рубенс, ок. 1611-1618, Филадельфия, Музей искусств Филадельфии.
Кроме орла, ни один человек не решился удалить часть печени.В древний период ассирийской и вавилонской культур 2000–3000 гг. До н.э. печень играла важную роль в предсказании будущего, считывая поверхность принесенных в жертву животных [5]. Это было также распространено в этрусском обществе, где гаруспики предсказывали будущее по овечьей печени. Гиппократ (460–377 гг. До н.э.), один из отцов-основателей древней медицины, дал не только клятву с этическими правилами, которая до сих пор используется всеми врачами. Его тщательные наблюдения также привели к рекомендации разрезать и дренировать абсцессы печени ножом [5].Цельс задокументировал лечение обнаженной печени в военных ранах. Хотя он не был врачом, он описал свои наблюдения в первом веке нашей эры из Александрийской школы, возглавляемой Герофилом Халкидонским и Эрисастратом Хиосским [5]. В ту же эпоху грек Гален стал одним из врачей императора в Риме и написал отчеты о вскрытии многих видов животных, включая приматов. Он описал центральную роль печени в абсорбции и пищеварении, и его работа сохраняла большое значение в ближайшие столетия [5].В последующие столетия появилось много отчетов, описывающих лечение военных или травматических ран.
Глиссон провел обширные исследования анатомии сосудов в 1654 году (рис. 2) [6]. Прошло более двух столетий, прежде чем его работа была заново открыта и прояснена Рексом (1888) в Германии и Кантли (1897) в Англии [5, 7]. Эти вклады привели к разделению печени на левую и правую доли [5].
Рис. 2.
Фрэнсис Глиссон (1599–1677).
2. История хирургии печени
Прошло еще 17 веков, прежде чем Hildanus успешно выполнил первую частичную резекцию печени при травме [8]. Введение эфирной анестезии (1846 г.) и растущие знания об антисептике (1867 г.) сделали возможными успешные плановые операции на брюшной полости (таблица 1) [5]. Langenbuch был первым, кто успешно выполнил плановую резекцию печени в 1887 г. (рис. 3), а Wendel провел первую гемигепатэктомию в 1911 г. [8]. Принципы гемостаза и регенерации печени были определены в период 1880-1900 гг. [8].Знание принципа контроля притока и оттока печени и сосудов было одним из главных достижений. До этого в основном применялись клиновидные резекции и матрасные швы. Это понимание сокращения притока и оттока было отмечено публикацией Джеймса Хогарта Прингла из Глазго, Шотландия (рис. 4) [9]. Он описал идею цифрового контроля прикорневой связки для уменьшения кровотечения в печени. В его знаменитом отчете (1908) о кровоизлиянии в печень после травмы были включены восемь пациентов.Трое умерли до операции, один отказался от операции, и все четыре прооперированных пациента умерли; двое умерли во время операции и двое вскоре после этого [5, 9]. Однако его идея цифрового контроля сосудов воротника была более успешной в лабораторных условиях, где он прооперировал трех кроликов с лучшими результатами, что привело к его публикации. В наши дни, более века спустя, «маневр Прингла» или «щипок Прингла» по-прежнему используется во всем мире в хирургии резекции печени и преподается всем молодым хирургам для контроля кровоизлияния в печень.
| 1846 | Введение эфирной анестезии | Morton | |||
| 1863 | Бактериальное брожение вина | Пастер | |||
| 1867 | 902 | Брунс | |||
| 1880 | Обнаружение стрептококков, стафилококков и пневмококков | Пастер | |||
| 1881 | Первая успешная гастрэктомия | Первая успешная гастрэктомия | Langenbuch | ||
| 1883 | Первый анастомоз толстой кишки у человека | Бильрот и Сенн | |||
| 1884 | Поджелудочная железа иссечена по поводу рака | Бильрот | 02 | Fitz | |
| Введение стерилизации паром | Von Bergmann | ||||
| Первая плановая резекция печени по поводу аденомы | Lius | ||||
| 1887 | Первая успешная 9050 элективная резекция печени | 509 9050 9050 1887 | Успешная тампонировка колотого ранения печени | Burckhardt | |
| 1888 | Первая успешная лапаротомия при травматическом повреждении печени | Willet |
Таблица 1.
Успехи в начале хирургии [5].
Рис. 3.
Джеймс Хогарт Прингл (1863-1941).
Рис. 4.
Карл Лангенбух (1846–1901).
Операция на печени постепенно становилась все более популярной, поскольку лучшее понимание анатомических сегментов было установлено после работы Куино [10]. Классическая морфологическая (внешняя) анатомия с двумя главными долями (левой и правой) была расширена внутренней анатомией печени с несколькими независимыми функциональными сегментами (рис. 5).Каждый сегмент печени состоит из паренхимы печени с отводящей ветвью печеночной вены и портальной триады; ветвь печеночной артерии, приводящая воротная вена и выводящий желчный проток. Классическая правая доля состоит из четырех сегментов, левая доля состоит из трех сегментов, а хвостатая доля — из первого сегмента.
Зная сегментарную анатомию печени, можно выбрать безопасную плоскость пересечения для резекции без чрезмерной кровопотери и без некроза остаточной печени. Эта специфическая анатомия независимых функциональных сегментов позволила резецировать части печени без ущерба для печеночной функции остаточных сегментов.Более того, как уже описано в мифе о Прометее, печень обладает способностью к регенерации в отличие от других органов человека. Другими словами, после частичной резекции печень может восстановить свою массу и функцию. Термин «функция печени» на самом деле является собирательным термином для ряда функций, включая, среди прочего, детоксикацию аммиака, синтез мочевины, синтез и секрецию желчи, синтез белка, глюконеогенез и клиренс или детоксикацию лекарств, бактериальных токсинов и бактерий [11]. .Поскольку печень является основным детоксицирующим органом человека, адаптация ее функции имеет решающее значение для выживания. Однако восстановление требует времени. После операции на печени с уменьшением массы печеночных клеток может начаться «программа выживания» для жизненно важных функций печени [12]. Некоторые из этих функций быстро увеличиваются в остаточной печени после резекции [13]. В свете крупных резекций печени вполне вероятно, что слишком маленький функциональный остаток печени может привести к печеночной недостаточности — летальному осложнению операции на печени.
Рис. 5.
Анатомия печени с отдельными сегментами в соответствии с классификацией Куино. На этом рисунке показаны только основные венозные сосуды (воротная вена, полая вена и печеночные вены).
3. Резекционная хирургия печени
Хирургия печени и желчевыводящих путей включает широкий спектр показаний для хирургического лечения печени, от биопсии и резекции до трансплантации печени. Наиболее важными показаниями для хирургического лечения являются поражения печени: они включают широкий спектр доброкачественных и злокачественных поражений, которые могут быть как первичными (гепатоцеллюлярная карцинома), так и вторичными опухолями (т.е. метастазы). Также показанием к операции могут быть некоторые инфекционные заболевания печени (например, эхинококкоз). Необратимое нарушение функции печени, вызванное острыми или хроническими заболеваниями печени, может быть показанием к трансплантации печени. Другие доброкачественные заболевания печени, такие как симптоматические простые кисты и поликистозная болезнь печени (PCLD), также могут потребовать хирургического лечения. Другие причины хирургического вмешательства на печени могут быть после тяжелой травмы или травмы печени. Последние указания выходят за рамки данной главы.Поскольку поражения печени являются основным показанием к хирургическому вмешательству при заболеваниях печени, основное внимание будет уделяться резекционной хирургии печени.
3.1. История хирургии печени при злокачественных новообразованиях
Сообщение о первой анатомической правой гепатэктомии по поводу рака, выполненной Лортатом-Якобом в 1952 году, ознаменовало новую эру в хирургии печени [14]. Однако вначале кровопотеря и смертность были значительными. Многоцентровый анализ в 1977 г. более 600 резекций печени по разным показаниям показал, что операционная летальность составила 13%, а при больших резекциях — 20% [15].Несмотря на это, первопроходцы в хирургии печени продолжали поиски улучшения этой сложной области знаний, и постепенно смертность снизилась до 5,6% [16]. Пятилетняя выживаемость увеличилась с 20% вначале [16, 17] до 67% у отдельных пациентов [18]. Более ранние разработки в хирургии печени были отмечены значительным вкладом Starzl (США), Bismuth (Франция) и Ton That Tung (Вьетнам) [19-22]. При лучшем знании сегментарной анатомии было показано, что сегментарные резекции с сохранением паренхимы были столь же эффективны, как и классические долевые резекции, и таким образом сохранялась более функциональная остаточная печень [3, 23, 24].Кроме того, со временем были модернизированы и усовершенствованы методы анестезиологической помощи и пересечения печени [1, 3, 4, 25, 26].
За последние десятилетия в нескольких больших сериях было показано, что периоперационные результаты стали более обнадеживающими, с операционной смертностью менее 5% в центрах с большим объемом операций [3, 24, 25]. Благодаря этим улучшениям в хирургии печени, которые не только продлевают жизнь, но и являются потенциально излечивающим вариантом лечения первичного и метастатического рака [27, 28], хирургия печени стала стандартом лечения отдельных пациентов с первичными и вторичными злокачественными новообразованиями гепатобилиарной системы.Более того, с повышением безопасности резекций печени, это стало наиболее эффективным методом лечения некоторых доброкачественных заболеваний [29].
Трудно выделить один различающий фактор, который сделал возможным улучшение результатов [3]. Многие факторы способствуют постепенному улучшению результата. Наиболее важными факторами в этом отношении, вероятно, являются лучшее знание анатомии печени и, следовательно, анатомических резекций, лучший выбор пациентов, общие улучшения в оперативной и анестезиологической помощи и развитие гепатобилиарной хирургии как отдельной области специализации [3].
3.2. Техники рассечения при резекции печени
Пересечение паренхимы — наиболее сложная часть резекции печени. Из-за сложной сосудистой и желчной анатомии печени кровотечение представляет собой большой риск [30–35]. Первая резекция печени не удалась из-за кровотечения, или пациенты вскоре умерли из-за кровотечения [31]. До 1980-х годов смертность после резекции печени составляла от 10 до 20%, и кровотечение было частой причиной [30]. Более того, переливание крови в периоперационном периоде связано с более неблагоприятным исходом в долгосрочной перспективе [33].В отличие от факторов, связанных с пациентом или опухолью, хирургические методы можно изменить, чтобы предотвратить потерю крови и переливание крови.
Разделение паренхимы впервые было описано в 1958 году, когда Лин и его коллеги представили технику перелома пальца (дигитоклазия), при которой ткань печени раздавливается между пальцами хирурга [30]. Сосуды и желчные протоки обнажаются, идентифицируются и затем разделяются. Вскоре этот метод был усовершенствован за счет использования хирургических зажимов (например, зажима Келли) и назван методом раздавливания-зажима [30, 31].Разделение сосудов и желчных протоков может быть достигнуто путем наложения швов, биполярной электрокоагуляции, устройств для герметизации сосудов или сосудистых зажимов. Он часто сочетается с прерывистой закупоркой притока путем пережатия портальной триады (маневр Прингла) [31].
Впоследствии было разработано множество методов рассечения, чтобы улучшить результаты. Ультразвуковой хирургический аспиратор Cavitron (CUSA, Tyco Healthcare, Мэнсфилд, Массачусетс, США) сочетает в себе ультразвуковую энергию с аспирацией и обеспечивает более точную плоскость рассечения.Открываются сосуды и желчные протоки, которые затем могут быть разделены любым методом, выбранным хирургом [30, 31]. В недавнем исследовании пересечение паренхимы печени с использованием CUSA было связано с более высоким числом потенциально опасной воздушной эмболии, хотя пациенты не проявляли клинических симптомов [36]. Гармонический скальпель (Ethicon Endo-Surgery, Цинциннати, Огайо, США) сопоставим с CUSA, но он использует ультразвуковые ножницы и вибрацию для прорезания паренхимы. Он мгновенно коагулирует кровеносные сосуды за счет денатурации белка и в основном используется при лапароскопических процедурах из-за трудностей с использованием других инструментов для рассечения в этих условиях.Гидравлическая или водоструйная струя использует струю воды под высоким давлением для рассечения паренхимы печени и обнажения сосудов и желчных протоков, после чего их можно разделить. Как и в случае с Harmonic Scalpel, термическое повреждение меньше. При резекции печени с помощью радиочастоты электроды с радиочастотой вставляются в плоскость рассечения, и в течение одной-двух минут прикладывается радиочастотная энергия, после чего производится рассечение коагулированной печени с помощью обычного скальпеля. [30, 31].
В обзоре, включающем семь рандомизированных контролируемых испытаний с участием в общей сложности 556 пациентов, метод зажима-раздавливания был быстрее и ассоциировался с более низкими показателями кровопотери и переливаний по сравнению с CUSA, гидроструйным и радиочастотным рассекающим герметиком.Не было обнаружено значительных различий в смертности, заболеваемости, дисфункции печени, пребывании в ОИТ и продолжительности пребывания в больнице. Техника раздавливания-зажима не требует больших затрат и не требует дополнительных инструментов. Однако не все методы в исследованиях сочетались с окклюзией сосудов. Это могло привести к смещению в пользу техники зажима-раздавливания [32, 34]. Исследование CRUNSH продемонстрирует, превосходит ли сосудистое сшивание по сравнению с методом сжатия-зажима при плановой резекции печени [37].Палавесино и его коллеги разработали так называемый «метод двух хирургов», сочетающий в себе прижигание с солевым раствором и ультразвуковой диссектор. Облучение сосудов и желчных протоков и гемостаз выполняются одновременно. Ретроспективно наблюдались значительно более низкие показатели переливания крови [33].
В заключение, метод зажима-раздавливания кажется более совершенным, особенно потому, что это простой метод и не требует больших затрат. Его можно рассматривать как золотой стандарт, с которым следует сравнивать новые устройства или методы.Однако качественные рандомизированные контролируемые испытания отсутствуют. Кроме того, немаловажную роль играет опыт хирурга. Из-за этого можно сказать, что предпочтительным методом является техника зажима-раздавливания, а другие методы могут применяться или комбинироваться в зависимости от опыта и предпочтений хирурга.
3.3. Злокачественные новообразования
Печень выполняет важную функцию детоксицирующего органа благодаря анатомическому расположению в брюшной полости; большинство органов желудочно-кишечного тракта отводят венозную кровь в печень.Это делает печень частым местом метастазов различных внутрибрюшных, а иногда и внебрюшинных первичных злокачественных опухолей. Также первичный рак может возникнуть в печени. Из них наиболее частым злокачественным новообразованием является гепатоцеллюлярная карцинома. При нормальном функционировании печени резекция является методом выбора для большинства этих злокачественных поражений.
Метастазы колоректального происхождения — самые частые злокачественные новообразования в печени. Ежегодно диагностируется около миллиона новых случаев заболевания и ежегодно умирает около полумиллиона случаев, поэтому колоректальный рак является одной из наиболее частых причин смерти от рака во всем мире [38].Более чем у половины пациентов с колоректальным раком развиваются метастазы в печень [39]. Более того, до 25% этих пациентов имеют метастазы в печени одновременно с первичным диагнозом [40]. Таким образом, метастазы в толстую кишку могут рассматриваться как серьезная проблема для здоровья [39].
Единственный шанс на долгосрочное выживание у пациентов с метастазами в печень обеспечивается резекцией этих метастазов в печени, при этом 5-летняя выживаемость составляет около 30-40% [41]. Однако до недавнего времени немногие пациенты со злокачественными новообразованиями печени рассматривались для частичной резекции печени.Из-за ограниченных критериев резекции были отобраны только 10-20% пациентов со злокачественными новообразованиями. Оставшейся части пациентов была предложена паллиативная химиотерапия, в результате чего средняя выживаемость составила 6–12 месяцев [8, 42]. Из-за повышенной безопасности хирургии печени резекция печени в настоящее время также используется при других метастазах, таких как нейроэндокринные опухоли [43], саркомы [44], меланома [45-47], рак желудка [48-50] и рак груди [48]. , 51, 52].
Критерии отбора для резекции печени изначально были довольно строгими: одностороннее распределение, менее четырех метастазов, максимальный размер опухоли 5 см и свободный край опухоли 1 см.Эти критерии резекции оценивались с течением времени, и от них постепенно отказались, поскольку они оказались не так важны, как предполагалось ранее [53–55]. Даже у пожилых пациентов и групп с плохим прогнозом полная резекция опухоли приводит к хорошему долгосрочному выживанию [56-58].
В лечении злокачественных заболеваний печени за последние годы было разработано много улучшений: новые хирургические стратегии для более безопасной резекции (включая двухэтапную гепатэктомию и эмболизацию воротной вены), более эффективная химиотерапия и дополнительные методы, такие как местная абляционная терапия для увеличения возможное лечебное лечение [59-64].Сочетание этих достижений привело к значительному прогрессу и привело к тому, что большее количество пациентов, считающихся подходящими для резекции печени, составили почти 30% [62]. В последние годы сообщалось о лучшей выживаемости пациентов с первичным или метастатическим раком печени, и в настоящее время резекция печени является единственным потенциально излечивающим вариантом лечения.
3.4. Доброкачественные поражения печени
В случае злокачественного заболевания печени хирургическая резекция в настоящее время считается оправданной, несмотря на заболеваемость и смертность, которые могут достигать 42% и 6%.5% соответственно [1, 3, 65-67]. Однако в случае доброкачественного заболевания печени это решение остается более трудным. Благодаря широкому использованию методов визуализации, таких как ультразвуковое исследование, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), все чаще выявляются доброкачественные образования в печени. Однако не все доброкачественные опухоли печени требуют резекции. В первую очередь необходимо провести тщательную диагностику с помощью КТ или МРТ с контрастным усилением. Доброкачественные образования можно грубо разделить на твердые и нетвердые поражения (таблица 2).
| Солидные очаги | Симптомы | Лечение | |
| Гепатоцеллюлярная аденома | Вариабельная: от случайного ожидания 9 до сильной боли в животе (550 см) 50 см , прекратите прием пероральных контрацептивов Резекция ≥5 см для предотвращения разрыва и злокачественного перерождения | ||
| Фокальная узловая гиперплазия | В основном случайная находка | Хирургическое вмешательство, показанное редко | |
| Ангиомиолипома | В основном случайная находка Узловая регенеративная гиперплазия | В основном бессимптомная, следует рассматривать у пациентов с клиническими признаками портальной гипертензии без признаков цирроза | Нет доказанного лечения |
| Нетвердые поражения | |||
| Simp ле киста печени | Вариабельная: от случайной находки до боли в животе | Операция показана только в случае симптомов | |
| Билиарная цистаденома | Переменная: от случайной находки до боли в животе | Может быть показано хирургическое вмешательство (злокачественное перерождение) | |
| Билиарная гамартома | Нет | Хирургическое вмешательство не показано | |
| Кавернозная гемангиома | Варьируется, в зависимости от размера | Хирургическое вмешательство редко показано | |
| Эхинококкоз до эхинококкоза | Вариативное заболевание от эхинококкоза до эпизодической боли в животе | Операция, показанная для облегчения симптомов и предотвращения разрыва | |
Таблица 2.
Наиболее важные доброкачественные поражения печени, разделенные на твердые и нетвердые.
3.5. История хирургии печени при доброкачественных новообразованиях
Первый случай хирургической резекции предположительно доброкачественной опухоли печени был описан в 1886 году Антонио Лиусом в Италии [68]. Лиус был ассистентом Теодора Эшера, который иссек аденому на ножке размером с голову ребенка (15,5 см в наибольшем диаметре) из левой доли печени 67-летней женщины. Во время операции произошло неконтролируемое кровотечение, и пациент умер через несколько часов после операции.Немецкий хирург фон Лангенбух был первым, кто выполнил успешную резекцию доброкачественной твердой опухоли на ножке левой печени весом 370 грамм у 30-летней женщины, которая жаловалась на дискомфорт в животе в годы после рождения первого ребенка в 1887 году. [69]. В послеоперационном периоде произошло вторичное кровотечение из-за кровотечения из прикорневого сосуда. Это удалось при повторном обследовании, и пациент выжил. Ход симптомов и событий в последнем случае предполагает, что опухоль, скорее всего, была гепатоцеллюлярной аденомой.
В настоящее время хорошо известно, что небольшие доброкачественные образования, совместимые с диагнозом гемангиомы, фокальной узловой гиперплазии (ФНГ) или гепатоцеллюлярной аденомы (ГКА), не являются показанием для резекции печени [53]. Гепатоцеллюлярные аденомы считаются наиболее важными, хотя и редко встречающимися доброкачественными опухолями печени, которые чаще всего встречаются у женщин. Они известны своим повышенным риском кровотечения и злокачественной трансформации в гепатоцеллюлярную карциному (ГЦК), если размер превышает 5 см. Поэтому хирургическая резекция ГКА рекомендуется при более крупных поражениях [53, 54].Очаговая узловая гиперплазия и гемангиомы не считались потенциально предраковыми поражениями.
Первое сообщение о случае злокачественной трансформации ГКА было опубликовано в 1981 году Tesluk и Lawrie [70]. Пациентка была 34-летней женщиной с большой ГКА диаметром 16 см. Сначала у нее было кровотечение из опухоли, после чего ее использование оральных контрацептивов было прекращено, и опухоль впоследствии сократилась до стабильных 5 см. Три года спустя была выполнена частичная гепатэктомия, когда опухоль вернулась к своему размеру при первом проявлении.Гистологический анализ выявил хорошо дифференцированный ГЦК. Пациент скончался от сепсиса через пять недель после операции.
Фостер и Берман были первыми, кто сообщил об оценке риска злокачественной трансформации в 1994 году, поскольку они обнаружили частоту 13% в своей серии из 13 пациентов [71]. Совсем недавно систематический обзор литературы за последние 40 лет, содержащей более 1600 ГКА по всему миру, выявил 68 сообщений о злокачественной трансформации, что привело к общей частоте 4,2% среди всех случаев аденомы [72].В настоящее время идентифицировано несколько других факторов риска злокачественного потенциала ГЦА, помимо размера [73–84]. Они перечислены в таблице 3.
| Факторы риска |
| Размер опухоли ≥5 см |
| Наличие мутации, активирующей β-катенин |
| Наличие дисплазии клеток печени |
| Пациенты с болезнью накопления гликогена |
| История приема андрогенов или анаболических стероидов |
| Мужской пол |
| Ожирение / избыточный вес |
Таблица 3.
Факторы риска злокачественной трансформации гепатоцеллюлярных аденом.
3,6. Хирургическое лечение гепатоцеллюлярных аденом
Выявление нескольких факторов риска злокачественного потенциала ГКА в последние годы дает лучшие показания для хирургического лечения этих предположительно доброкачественных опухолей. Кроме того, онкомаркеры аденомы Бордо (таблица 4) внесли большой вклад в классификацию подтипов ГКА и дали более четкое представление о патологическом механизме злокачественного развития [79].Совсем недавно было показано, что методы МРТ имеют ценность для выявления предраковых ГЦА [85, 86]. Эти достижения в стратификации факторов риска вместе с подтипами опухолей перед операцией на печени могут помочь в выборе ГКА с высоким риском злокачественного развития для хирургической резекции. К сожалению, рутинное выполнение биопсии HCA еще не реализовано из-за риска ошибки выборки, кровотечения, посева опухоли по следу иглы и сложной интерпретации окрашивания β-катенина.Однако переход к более строгому процессу отбора в ближайшем будущем неизбежен и может означать значительное сокращение числа резекций печени и, следовательно, заболеваемости и даже смертности в выбранной группе преимущественно молодых пациентов.
| Тип HCA | Частота (%) | Злокачественная трансформация | Маркеры активированы |
| β-катенин + / GS + | |||
| HNF1α инактивирован | 30-50 | Редко | LFABP- |
| Воспалительный | 35 | Нет | SAA50 | Нет | Нет |
Таблица 4.
Типы HCA и их иммуногистохимические маркеры.
CRP, С-реактивный белок; GS, глутамин синтетаза; ГКА, гепатоцеллюлярная аденома; HNF1a, ядерный фактор гепатоцита 1a; LFABP, белок, связывающий жирные кислоты печени; SAA, сывороточный амилоид А; +, положительный; -, отрицательно. Таблица адаптирована с разрешения Stoot et al. 2010 [72].
Что касается лечения разрывов ГЦА, то неотложная операция связана с высокими показателями заболеваемости и смертности [73, 85]. Хотя некоторые авторы все еще предлагают это лечение [86], от максимально инвазивной терапии немедленной резекции печени постепенно отказались.Многие хирурги печени предпочитают консервативное лечение разрыва ГЦА, состоящее из немедленной реанимации с лапаротомией и марлевой тампонады [74]. Селективная эмболизация артерий при разрыве ГЦА может быть ценной альтернативой, хотя о ней редко сообщалось [55, 63, 70, 72, 87].
В заключение, резекция печени при доброкачественных опухолях в основном предназначена для ГКА с риском злокачественного развития или кровотечения. Достижения в области определения патологических подтипов, радиологической визуализации и стратификации риска привели к новым открытиям и помощи в обосновании резекции печени в более избранной популяции.
4. Достижения в хирургическом лечении доброкачественных кистозных поражений: эхинококкоз
Хирургическое лечение также может быть показано при инфекционных заболеваниях печени, таких как доброкачественные поражения, вызванные паразитарной инфекцией, называемой эхинококкозом. Эхинококкоз человека — это зооноз, вызываемый личиночными формами (метацестодами) ленточных червей Echinococcus (E.), обнаруживаемых в тонком кишечнике плотоядных животных. Два вида имеют клиническое значение — E. granulosus и E. multilocularis — вызывающие кистозный эхинококкоз (CE) и альвеолярный эхинококкоз (AE) у людей соответственно [87].Кроме того, в начале -х годов века были обнаружены так называемые неотропические виды эхинококкоза E. oligarthrus и E. vogeli , вызывающие поликистозный эхинококкоз (ПЭ). E. vogeli вызывает болезнь, аналогичную AE, а E. oligharthrus имеет более доброкачественный характер [88]. Эхинококкоз является эндемическим заболеванием во всем мире в крупных районах овцеводства, включая Африку, Средиземноморский регион Европы, Ближний Восток, Азию, Южную Америку, Австралию и Новую Зеландию [89–96].Кистозный эхинококкоз человека — одно из самых запущенных паразитарных заболеваний в мире. Во многих эндемичных регионах большинство инфицированных пациентов значительно страдают от этого заболевания, обычно из-за отсутствия возможностей лечения из-за плохой инфраструктуры и нехватки оборудования и лекарств [97, 98]. Заболеваемость эхинококком в западных индустриальных странах относительно низка [93, 94, 99]. Миграция и путешествия привели к увеличению распространенности этого заболевания в северных частях Европы и Северной Америки [96, 100].Диагноз эхинококкоза печени может быть поставлен на основе сочетания симптомов пациента, результатов визуализации печени, обнаружения антител, специфичных к эхинококку, и микроскопического или молекулярного исследования кистозной жидкости. Наиболее частым местом кистозных поражений является печень (60% пациентов), за которой следуют легкие примерно у 20% пациентов. Остальные поражения обнаруживаются по всему телу [92, 95, 99, 101, 102].
Естественное течение этой инфекции может быть чрезвычайно различным [101].Кисты печени могут спонтанно разрушаться, кальцифицироваться или даже исчезать. У этих пациентов симптомы могут отсутствовать в течение многих лет. Нередко кисты обнаруживаются при визуализации брюшной полости по другой причине. С другой стороны, кисты также могут неуклонно увеличиваться в диаметре примерно на 1-3 см в год [96, 99]. Они не имеют тенденции к инфильтративному или деструктивному росту, но давление или массовое воздействие кист может вытеснять здоровые ткани и органы. Таким образом, у большинства пациентов наблюдаются симптомы механического воздействия на другие органы или структуры, которые могут приводить к боли в правом верхнем квадранте, гепатомегалии и желтухе в зависимости от локализации и характера кист [91, 96, 99, 101].Заражение кисты может привести к сепсису и / или образованию абсцессов печени. Вызывает опасение опасное осложнение — разрыв эхинококкозной кисты печени в брюшную полость. Это может привести к серьезной анафилаксии, сепсису и / или перитонеальному распространению. Содержимое разорванной кисты может распространяться в желчные пути, приводя к холангиту или холестазу, а также к плеврам или легким, вызывая гидатидоз плевры или бронхиальный свищ, соответственно [91, 92, 102].
4.1. История хирургии печени по поводу эхинококкоза
Эхинококкоз был признан Гиппократом более двух тысячелетий назад.Было показано, что это доброкачественное заболевание действует как злокачественная болезнь, поскольку имеет тенденцию распространяться на другие органы и вызывать разрушительное заболевание, иногда даже приводящее к смерти. Серьезные последствия этого заболевания были известны в конце 1880-х годов, когда Лоретта выполнила первую левостороннюю резекцию печени по поводу эхинококоза в Болонье [8]. В последние годы многие разработки улучшили течение эхинококкоза: улучшили медицинскую терапию, улучшили хирургические процедуры и разработали минимально инвазивные методы.
С исторической точки зрения, основным вариантом лечения эхинококкоза печени был открытый хирургический доступ с боковой тампонады и несколько радикальных или более консервативных хирургических техник [96, 99]. Эта терминология в литературе может сбивать с толку. Консервативная хирургия означает использование методов сохранения тканей; эхинококковая киста эвакуируется и перициста остается на месте, а при радикальных процедурах удаляются и киста, и перициста. Наиболее распространенные консервативные методы включают простой дренаж через трубку, марсупиализацию, капитоннаж, снятие крыши, частичную цистэктомию или открытую или закрытую полную цистэктомию с или без соматопластики.Консервативные операции дают хорошие результаты в отношении кровопотери и продолжительности пребывания в стационаре [103, 104]. Напротив, содержимое кисты и вся перикистозная оболочка удаляются радикальными методами; выполняется полная перицистэктомия или резекция печени (гемигепатэктомия или лобэктомия) [90, 94, 101, 104].
При хирургических вмешательствах при эхинококковых кистах печени необходимо полное удаление паразита. Кроме того, крайне важно предотвращение разлива содержимого кисты во время операции и сохранение здоровья печени [91, 93, 96].Разливание могло привести не только к рецидиву эхинококкоза, но и к анафилактическому шоку перед введением противоглистных препаратов. Поэтому хирурги должны выполнять процедуры с акцентом на безопасное и полное обнажение кисты, безопасную декомпрессию кисты, безопасную эвакуацию содержимого кисты, стерилизацию кисты, лечение желчных осложнений и лечение оставшейся полости кисты. Методика должна быть безопасной, легко воспроизводимой и с низким уровнем осложнений, особенно в неэндемичных регионах, где количество операций невелико.В прошлом веке эхинококкоз был оперирован с высоким риском заболеваемости и рецидива, возможно, из-за разлива содержимого кисты во время операции. В 1970-х годах Саиди разработал специальный конус, который замораживали до кисты, чтобы снизить риск разлива содержимого кисты. Этот конус также упростил дезинфекцию полости кисты [105]. Недавно это старое лечение, известное также как «метод замороженной нерпы», было протестировано в неэндемичных регионах и было признано эффективным хирургическим методом лечения эхинококкоза печени [104].В этом ретроспективном исследовании 112 последовательных пациентов прошли хирургическое лечение эхинококкоза методом «замороженной печати» с 1981 по 2007 год. Частота рецидивов наблюдалась у 9 (8%) пациентов, а заболеваемость — у 20 пациентов (17,9%). Что еще более важно, в этом исследовании более 25 лет хирургического лечения «эхинококкоза» смертности не наблюдалось. Был сделан вывод, что этот хирургический метод, применявшийся в прошлом веке, по-прежнему безопасен и эффективен в новом тысячелетии. Этот метод особенно полезен в неэндемичных регионах, поскольку он обеспечивает высокую эффективность и низкие показатели заболеваемости.
Помимо «метода замороженного шва», варианты хирургического лечения могут варьироваться от консервативного (цистэктомия) до радикального (полная открытая резекция) и лапароскопических методов. Споры о лучшем хирургическом лечении все еще продолжаются: должно ли это быть консервативное хирургическое вмешательство или радикальное хирургическое вмешательство, при котором киста полностью удаляется, включая перицист, путем тотальной перицистэктомии или частичной гепатэктомии, или это должен быть открытый или лапароскопический доступ [101, 102].
4.2. Чрескожное лечение
С появлением противоглистных препаратов открылись новые возможности лечения.При использовании этого лекарства риск анафилаксии стал меньше, и были разработаны чрескожные методы лечения. Одним из таких методов лечения эхинококкоза является ПАРА: чрескожная аспирация, инъекция и повторная аспирация. В недавнем метаанализе оперативного и безоперационного лечения (PAIR) эхинококкоза печени [92], PAIR плюс химиотерапия оказалась лучше хирургической. Метаанализ показал, что PAIR ассоциировался с улучшенной эффективностью, более низкими показателями заболеваемости, смертности, рецидивов заболевания и более коротким пребыванием в больнице [92].
В заключение, основные варианты лечения кистозного эхинококкоза печени бывают тройными: медикаментозная терапия, хирургическое вмешательство и чрескожный дренаж (пункционная аспирационная инъекция и реаспирация, также известная как PAIR) или комбинация этих методов лечения [91, 92, 100]. В последней редакции IWGE ВОЗ было заявлено, что хирургическое вмешательство остается краеугольным камнем лечения эхинококкоза, поскольку оно может удалить эхинококкоз и привести к полному излечению. Однако рекомендуется тщательно оценивать хирургическое лечение по сравнению с другими менее инвазивными вариантами, такими как чрескожные вмешательства.[88]
5. Улучшения в предоперационном планировании
Важным способом улучшения результатов операции на печени является предотвращение осложнений, связанных с резекцией печени. Одним из наиболее серьезных осложнений при хирургии печени остается пострезекционная печеночная недостаточность. Это серьезное осложнение может возникнуть, если степень поражения опухоли требует обширной резекции печени (3 или более сегментов), оставляя небольшой послеоперационный остаток печени [3, 106, 107]. Из-за нарушения функции печени это может даже привести к летальному исходу.Очевидно, что ограничение резекции печени, чтобы оставить достаточный объем остатка печени для правильного функционирования печени, может предотвратить это. Однако серьезные гепатэктомии выполняются все чаще, в основном потому, что показания к резекции печени постоянно расширяются. Прежние противопоказания, такие как билобарная болезнь, количество метастазов и даже внепеченочные заболевания, постепенно отменяются, и после агрессивной индукционной химиотерапии можно ожидать нарушения функции печени.Следовательно, послеоперационный объем и функция остаточной печени стали главными определяющими факторами респектабельности [108–110]. Чтобы улучшить результат при расширенных резекциях и, таким образом, предотвратить послеоперационную печеночную недостаточность после резекции печени, надежная объемная оценка части печени, подлежащей резекции, а также будущего остаточного объема печени должна быть особенно важной частью предоперационной оценки. Безопасность резекции печени может повыситься, если оценка минимального объема остаточной печени будет получена с помощью КТ-волюметрии [106, 111].
Полезность существующего профессионального программного обеспечения для обработки изображений часто ограничивается стоимостью, отсутствием гибкости и особыми требованиями к оборудованию, такими как подключение к компьютерному сканеру. Кроме того, предполагаемая операция должна быть известна исследователю для точного прогнозирования объема остаточной печени и требует опыта хирурга печени. Таким образом, КТ-волюметрия до сих пор была междисциплинарным методом, требующим усилий преданных своему делу хирургов и радиологов и дорогостоящего программного обеспечения.Проспективный объемный КТ-анализ печени на персональном компьютере, выполняемый оперирующим хирургом у пациентов, перенесших обширную печень, значительно улучшил бы эту предоперационную оценку. ImageJ — это бесплатная программа обработки изображений на основе Java с открытым исходным кодом, разработанная Национальным институтом здравоохранения (NIH) и может использоваться для этой цели [112]. OsiriX ® — это версия Apple для анализа изображений, которая была протестирована для волюметрии печени с помощью компьютерной томографии [113]. Это также бесплатная, удобная для пользователя система программного обеспечения, которую можно использовать для виртуальных резекций печени и объемного анализа [113].
По мере того, как выполняется больше крупных резекций печени, становится все более важным проводить волюметрию печени. Недавно эти два пакета программного обеспечения для обработки изображений с открытым исходным кодом были исследованы для проспективного измерения объема остаточной печени с целью снижения риска пострезекционной печеночной недостаточности. Объемы общей печени, опухоли и образца будущей резекции у включенных пациентов были измерены до операции с помощью ImageJ и OsiriX двумя хирургами и хирургом-стажером [114]. Результаты сравнивались с фактическим весом резецированных образцов и измерениями рентгенолога с использованием профессионального программного обеспечения Aquarius iNtuition ® , подключенного к компьютерному сканеру.Был сделан вывод, что проспективный КТ-объемный анализ печени с помощью ImageJ или OsiriX® был надежным и может быть точно использован на персональном компьютере нерадиологами. ImageJ и OsiriX® дают результаты, сопоставимые с профессиональным радиологическим программным обеспечением iNtuition ® .
6. Минимально инвазивная хирургия
Чтобы свести к минимуму ущерб от лечения, в прошлом веке была введена лапароскопическая хирургия, позволяющая избежать больших разрезов при многих операциях на желудочно-кишечном тракте. После первой лапароскопической холецистэктомии в 1987 г. [115] количество показаний к этому малоинвазивному доступу увеличилось.Результат побудил хирургов разработать лапароскопическую технику для многих процедур, включая резекции печени [116]. Хотя этот тип хирургии технически более сложен и, следовательно, требует много времени [117, 118], он оказался полезным для пациентов с меньшей болью и лучшим восстановлением по сравнению с открытой операцией на печени [119-121].
6.1. История лапароскопической хирургии
Основы лапароскопической хирургии были заложены в начале двадцатого века, когда немецкий хирург Келлинг сообщил об эндоскопической визуализации брюшной полости у анестезированной собаки с помощью цистоскопа Нитце (1887) в 1902 году [122] .После внедрения эндоскопического исследования содержимого брюшной полости на модели животных, соотечественник Якобеус начал экспериментировать с лапароскопией на человеческих трупах, а также на живых людях. В 1911 г. он сообщил о 80 лапароскопических исследованиях брюшной полости [123, 124]. В последующие годы лапароскопический подход был усовершенствован за счет внедрения методов освещения, усовершенствования систем линз, использования более чем одного троакара и индукции пневмоперитонеума (Гетце и Вереш).Тогда началась эра терапевтической лапароскопии, которая позволила свести к минимуму ущерб от лечения и избежать больших разрезов при многих операциях на желудочно-кишечном тракте. Однако только в 1987 году была проведена первая лапароскопическая холецистэктомия [115].
Поначалу считалось, что операция на печени не подходит для лапароскопических методов, поскольку она может создавать риск газовой эмболии и большой кровопотери во время рассечения печени. Также скептики указали на предполагаемый риск метастазов в области троакара в разрезах кожи.Постепенно, по мере того как некоторые экспертные центры сообщали о целесообразности и безопасности, он стал более популярным.
Этот новый подход к резекции печени был внедрен в 1990-х годах. Сначала процедура использовалась только для диагностической лапароскопии и биопсии печени, позже показания были распространены на фенестрацию кист печени и анатомические резекции печени. В 1992 году Гагнер и др. сообщил о первой лапароскопической клиновидной резекции печени. Всего три года спустя Cuesta et al. первыми выполнили два случая ограниченной лапароскопической операции на печени II и IV сегмента в Нидерландах [125].Первая лапароскопическая левосторонняя бисегментэктомия печени была выполнена группой Азагры [126]. С тех пор в нескольких исследованиях сообщалось о возможности и безопасности лапароскопической резекции опухолей печени в центрах с большим опытом как гепатобилиарной, так и лапароскопической хирургии [116, 117, 127-130].
Однако после его внедрения лапароскопическая резекция печени оставалась сложной задачей из-за трудностей, связанных с безопасной мобилизацией и обнажением этого хрупкого и тяжелого органа.Поэтому вначале для лапароскопического доступа выбирались только поверхностные и периферические поражения в переднебоковых сегментах. В последнее время центры с обширным опытом лапароскопии и хирургии печени также выполнили большие лапароскопические резекции печени с удовлетворительными результатами. Важно отметить, что до настоящего времени не было обнаружено никаких доказательств нарушения онкологического клиренса при лапароскопической резекции печени [120]
6.2. Преимущества лапароскопической техники
Утверждается, что лапароскопический доступ перенес боль пациента на хирурга, поскольку последний должен был получить новые операционные навыки и более сложные методы.На самом деле лапароскопическая хирургия — это совершенно другое понятие хирургии. Обычное трехмерное поле по своей природе двумерно, и тактильная обратная связь ухудшена по сравнению с открытой операцией. Более того, требуется полная амбидекстрия, а также навыки манипулирования хрупкими конструкциями длинными инструментами при минимальной тактильной обратной связи. Кроме того, хирург становится еще более зависимым от своей команды и инструментов, так как ему потребуется опытная помощь для тракции и операторской работы, а также он должен доверять материалу даже больше, чем при открытой операции.Для пациентов наиболее важными предполагаемыми преимуществами лапароскопической процедуры являются снижение кровопотери [119, 120], уменьшение послеоперационной боли [118, 127, 131], более раннее функциональное восстановление [127, 130], более короткое послеоперационное пребывание в больнице [118, 120, 121, 127, 130-132] и улучшенные косметические аспекты [127, 130]. Сообщается, что повторные операции проходят легче из-за уменьшения спаек [127, 130-132]. Кроме того, можно избежать процедур open-close с большими разрезами, если при лапароскопии обнаружены метастазы в брюшину.
Тем не менее, до сих пор не было рандомизированных контролируемых исследований
Важнейшая функциональная анатомия печени и желчевыводящих путей для хирурга
1. Введение
То, что каждый хирург столкнется с осложнениями, несомненно. Действительно, было сказано, что если у человека нет осложнений, он не делает достаточно операций. Тем не менее, серьезных хирургических осложнений часто можно избежать, и они часто являются результатом трех трагических хирургических ошибок. Этими ошибками являются: 1) неспособность обладать достаточными знаниями нормальной анатомии и функции, 2) неспособность распознать анатомические варианты, когда они присутствуют, и 3) неспособность обратиться за помощью в случае неуверенности или неуверенности.Все эти ошибки, кроме последней, можно исправить путем изучения и усилий. Что касается последней ошибки, то большинство хирургов учатся смирению через свои неудачи и за счет своих пациентов, в то время как некоторые никогда не учатся.
Важность точного знания структуры паренхимы, кровоснабжения, лимфатического дренажа и вариантов анатомии при исходе, пожалуй, нигде более очевидна, чем в гепатобилиарной хирургии. Хотя печень исторически была областью, куда немногие храбрые люди осмеливались ступить, и еще меньше возвращались во второй раз, недавние достижения в технике анестезии и периоперационном уходе теперь позволяют проводить операции на печени с низкой заболеваемостью и смертностью как в академических, так и в общественных больницах.Тем не менее, хирургов должным образом предупреждают о том, что они должны проанализировать свои собственные навыки и знания, прежде чем рискнуть перейти в правый подреберье. В этой главе мы рассмотрим функциональную анатомию желчевыводящих путей и печени, необходимую для проведения безопасных и успешных операций на печени.
2. Печень
2.1. Поверхностная анатомия
Печень расположена в основном в правом верхнем квадранте и обычно полностью защищена нижними ребрами. Большая часть вещества печени находится на правой стороне, хотя нередко левый боковой сегмент выгибается над селезенкой.Верхняя поверхность печени прилегает к нижней поверхности диафрагмы как с правой, так и с левой стороны. При нормальном вдохе печень может подниматься до 4 -го или 5 -го межреберного промежутка справа.
Сама печень полностью покрыта перитонеальным слоем, за исключением задней поверхности, где она отражается на нижней поверхности диафрагмы, образуя правую и левую треугольные связки. Печень прикреплена к диафрагме и передней брюшной стенке тремя отдельными связочными связками, а именно серповидной, круглой, а также правой и левой треугольными связками.(Рис. 1) Серповидная связка, расположенная на передней поверхности печени, начинается от передних створок правой и левой треугольных связок и заканчивается внизу там, где круглая связка входит в пупочную щель. Желчный пузырь обычно прикрепляется к нижней поверхности правой доли и направлен к пупочной щели. В основании ямки желчного пузыря находится прикорневая поперечная щель, через которую проходят основные портальные структуры к правой доле.Дополнительные важные ориентиры на задней поверхности печени включают глубокую вертикальную бороздку, в которой расположена нижняя полая вена, и большую оголенную область (то есть без перитонеального покрытия), которая обычно контактирует с правым полушарием и правым надпочечником. Левый латеральный сегмент печени перекрывает хвостатую долю, расположенную слева от полой вены. Хвостатая доля слева ограничена трещиной, содержащей венозную связку (остаток пупочной вены).Дополнительные важные элементы левой поверхности включают желудочно-печеночный сальник, расположенный между левым боковым сегментом и желудком. Желудочно-печеночный сальник может содержать замещенные или добавочные печеночные артерии. Наконец, обычно имеется толстая фиброзная полоса, которая охватывает полую вену высоко с правой стороны и проходит кзади к поясничным позвонкам. Эта полоса, которую иногда называют связкой полой вены, должна быть разделена, чтобы обеспечить надлежащую визуализацию надпеченочной полой и правых печеночных вен.
Рисунок 1.
Поверхностная анатомия печени. (A) передняя поверхность, (B) нижняя поверхность печени. Перепечатано с разрешения Хана и Блумгари, Функциональная печеночная и радиологическая анатомия в хирургии печени и желчевыводящих путей (3-е издание), Blumgart LH, Fong Y and WH Jarnigan (Eds.) Lippincott Williams, Лондон, Великобритания (2000).
2.2. Паренхима (вещество печени)
Печень состоит из двух основных долей, большой правой доли и левой доли меньшего размера.Хотя серповидная связка часто считается разделяющей печень на правую и левую доли, истинные «анатомические» или «хирургические» правая и левая доли печени определяются ходом средней печеночной вены, которая проходит через основные ножницы. печени. Хотя в течение последнего столетия предлагались различные описания внутренней анатомии печени, сегментарная анатомия печени Куино (1957) является наиболее полезной для хирурга.
Система классификации Куино делит печень на четыре уникальных сектора в зависимости от хода трех основных печеночных вен.Каждый сектор получает кровоснабжение от отдельной воротной ножки. Внутри основной ножницы находится средняя печеночная вена, которая проходит от левой стороны надпеченочной полой вены до середины ямки желчного пузыря. Функционально основная ножница разделяет печень на отдельные правую и левую доли, которые имеют независимый портальный приток и архитектуру желчевыводящих путей. (Рисунки 2 и 3) Искусственная линия, разделяющая печень на правую и левую полушарие, известна как линия Кэнтли.Правые печеночные вены проходят внутри правой сегментарной ножницы и разделяют правую долю на правый задний и передний секторы, в то время как левые печеночные вены повторяют путь серповидной связки и разделяют левую долю на медиальный и боковой сегменты.
Рисунок 2.
Сегментарная и секторальная анатомия печени. Печень делится на три основные ножницы правой, средней и левой ветвями печеночной вены. Средняя печень проходит через главную ножницу (или линию Кантли) и разделяет печень на правую и левую доли.Правая печеночная вена делит правую печень на передний (сегменты V и VIII) и задний (сегменты VI и VII) сектора, а левая печеночная вена разделяет левую долю на медиальный (сегменты IV A и B) и боковые сегменты (сегменты II). и III). Внутрипеченочные разветвления правого и левого печеночных протоков, артерий и воротных вен (показаны) в горизонтальной плоскости печени делят печень на восемь отдельных сегментов. Хвостатая доля (сегмент I) не является ни частью, ни левой долей. Скорее, хвостатая доля принимает венозные и артериальные ветви как с правой, так и с левой стороны печени и отводится непосредственно в нижнюю полую вену.
Правая и левая доли печени далее делятся на 8 сегментов на основе распределения портальных ножниц . В воротах правая воротная вена проходит очень короткий путь (1–1,5 см), прежде чем попасть в печень. Попадая в паренхиму печени, воротная вена разделяется на правую переднюю секторную ветвь, которая изгибается вертикально во фронтальной плоскости печени, и заднюю секторную ветвь, которая следует более заднебоковым ходом. Правая воротная вена кровоснабжает передний (или переднемедиальный) и задний (или заднебоковой) секторы правой доли.Схема ветвления этих секторных воротных вен подразделяет правую печень на 4 сегмента: сегменты V (передний и нижний) и VIII (передний и верхний) образуют передний сектор, а сегменты VI (задний и нижний) и VII (задний и верхний). ) образуют задний сектор.
В отличие от правой воротной вены, левая воротная вена имеет большую внепеченочную длину (3-4 см), проходящую под нижней частью квадратной доли (сегмент 4В), окутанной оболочкой брюшины (прикорневой пластиной.Достигнув пупочной щели, левая воротная вена проходит вперед и вверх в пределах вещества печени и отдает горизонтальные ветви к квадратной доле медиально (сегменты IV A (верхний) и B (нижний)) и к левому латеральному сегменту ( сегменты III (нижний) и II (верхний)) (рис. 3).
Рис. 3.
Сегментарная анатомия печени Кюнино. (а) внешний вид in vivo; (б) внешний вид ex vivo.
Хвостатая доля (сегмент I) не входит ни в левую, ни в правую доли, хотя лежит в основном на левой стороне (рис. 4).Точнее, это самая дорсальная часть печени, расположенная за левой долей и охватывающая ретропеченочную полую вену от ворот до диафрагмы. Часть хвостатой доли, которая находится в правой печени, обычно довольно мала и расположена кзади от сегмента 4B. На рисунке 3 показано расположение хвостатой доли, которая находится между левой воротной веной и полой веной слева, а также средней печеночной веной и полой веной в правой печени. Хвостатая доля принимает кровеносные сосуды и желчные протоки как из правого, так и из левого полушария.Правая сторона хвостатой доли и хвостатый отросток получают кровоснабжение от ветвей правой или главной воротной вены, в то время как левая сторона хвостатой части получает отдельный сосуд от левой воротной вены.
Аберрантная сегментарная анатомия печени встречается редко. Наличие крошечной левой доли является наиболее частой аномалией, о которой сообщают, и важно только потому, что она может служить ограничением для выполнения расширенных правых гепатэктомий. Хотя сообщения о «дополнительных» долях печени не редкость, они не представляют собой отдельные сегменты с независимым внутрипеченочным сосудистым снабжением, а скорее представляют собой удлиненные языки нормальной ткани печени.Доля Риделя является наиболее частой из этих «дополнительных» долей, и на самом деле это протяженный кусок ткани печени, свисающий снизу с сегментов 5 и 6.
3. Печеночные вены (отток)
Три основные печеночные вены (справа , средний и левый) образуют основной тракт оттока печени, хотя всегда присутствуют дополнительные вены (5-20) разного размера как прямые коммуникации между полой веной и задней поверхностью правой доли. Уникально то, что хвостатая доля (сегмент I) дренируется главным образом через прямое сообщение с ретропеченочной полой полостью.
Печеночные вены лежат в пределах трех больших ножниц печени, разделяющих паренхиму на правый передний и задний секторы, а также правую и левую доли. (Рис. 2 и 3) Правая печеночная вена лежит в пределах правой ножницы (или сегментарной щели) и делит правую долю на задний (VI и VII сегменты) и передний (сегменты V и VIII) секторы. Средние печеночные вены лежат в пределах главной печеночной ножницы (или главной долевой щели), отделяющей правый передний сектор (сегменты V и VIII) от квадратной доли (сегмент IV).Анатомически основные ножницы разделяют печень на правую и левую доли. Левая печеночная вена лежит в пределах левой ножницы (или левой сегментарной щели) на уровне серповидной связки или справа от нее. Правая печеночная вена впадает непосредственно в надпеченочную полую вену, тогда как средняя и левая печеночные вены сливаются, образуя короткий общий ствол перед входом. Пупочная вена представляет собой дополнительное альтернативное место венозного оттока. Он располагается под серповидной связкой и в конечном итоге заканчивается в левой печеночной вене или, реже, в месте слияния средней и левой печеночных вен.
4. Аномалии печеночных вен
Хотя приведенного выше обзора должно хватить в качестве поверхностного знания анатомии печеночных вен, оно далеко не исчерпывающее. Например, обычно встречаются большие добавочные правые печеночные вены, и оценка этих структур при осевой визуализации может быть важной для планирования операции. Если присутствует большая добавочная правая печеночная вена, можно разделить все три основные печеночные вены при выполнении расширенной левой гепатэктомии. Наиболее важно то, что хирург, приступающий к резекции печени, должен хорошо знать внутреннее течение печеночных вен, поскольку опасность, которую представляет венозное кровотечение в печени, невозможно переоценить.
5. Печеночные артерии (приток)
5.1. Анатомия внепеченочной артерии
«Нормальная» анатомия печеночной артерии не является нормальной. Действительно, стандартная анатомия чревной артерии, описанная в большинстве основных анатомических трактатов, встречается только в 60% случаев. Вспомогательная печеночная артерия относится к сосуду, который снабжает кровью сегмент печени, который также получает кровоснабжение из нормальной печеночной артерии. Аберрантная печеночная артерия называется замененной печеночной артерией , поскольку она представляет собой единственное кровоснабжение определенного сегмента печени.Чтобы оценить аномальную анатомию, необходимо точное знание нормальной анатомии печеночной артерии, и этому разделу посвящен этот раздел.
Чревная артерия возникает из аорты вскоре после выхода через диафрагмальный перерыв. Сам чревный ствол обычно очень короткий и вскоре после своего возникновения разделяется на левую желудочную, селезеночную и общую печеночную артерию. (Рисунок 5). Общая печеночная артерия обычно проходит вперед на короткое расстояние в забрюшинном пространстве, где она выходит на верхнюю границу поджелудочной железы и с левой стороны общего печеночного протока.Общая печеночная артерия обеспечивает 25% кровоснабжения печени, а портальная вена — остальные 75%.
Рис. 4.
Анатомия хвостатой доли. Хвостатая доля расположена слева от нижней полой вены (I.V.C). Вверху хвостатая доля покрыта сегментами II и III, которые на этой диаграмме отражены латерально. Венозная связка, остаток пупочной вены плода, проходит через переднюю поверхность хвостатой доли и входит в левую печеночную вену.Хвостатая доля проходит по ретропеченочной полой вене от общего ствола средней и левой печеночных вен (M.H.V., L.H.V.) до воротной вены (P.V.) снизу. (Левая (L.P.V.) и правая воротная вены (R.P.V.)). Небольшие венозные притоки отводят хвостовую долю прямо в I.V.C. По своей медиальной поверхности хвостатая доля прикрепляется к правой печени хвостатым отростком.
Рис. 5.
Нормальная анатомия чревной оси. Наличие правого печеночного (R.H.), среднего печеночного (M.H.) до сегмента IV и левой печеночной (L.H.) артерии.
Отойдя от чревной оси, общая печеночная артерия поворачивается вверх и проходит сбоку и примыкает к общему желчному протоку. Гастродуоденальная артерия, кровоснабжающая проксимальный отдел двенадцатиперстной кишки и поджелудочную железу, обычно является первой ветвью общей печеночной артерии. Вскоре после этого правая желудочная артерия отрывается и продолжается в малом сальнике вдоль малого изгиба желудка. На этом этапе общая печеночная артерия называется собственно печеночной артерией.Правильная печеночная артерия идет к воротам и вскоре разделяется на правую и левую печеночные артерии. Перед бифуркацией небольшая кистозная артерия разветвляется, чтобы обеспечить кровоснабжение желчного пузыря. Проходя через печеночно-двенадцатиперстную связку, собственно печеночная артерия, общий желчный проток и воротная вена покрываются оболочкой брюшины внутри гепатодуоденальной связки. Собственная печеночная артерия разветвляется раньше, чем общий желчный проток и воротная вена. В 80% случаев правая печеночная артерия проходит кзади от общего печеночного протока до попадания в паренхиму печени.В 20% случаев правая печеночная артерия может лежать впереди общего печеночного протока. Достигнув паренхимы печени, правая печеночная артерия разветвляется на правую переднюю (сегменты V и VIII) и правую заднюю секторальную ветви (сегменты VI и VII). Задняя секторная ветвь сначала проходит горизонтально через поперечную щель корня грудной клетки (по Гунцу), обычно присутствует у основания сегмента V и прилегает к хвостатому отростку. Левая печеночная артерия проходит вертикально по направлению к пупочной щели, где от нее отходит небольшая ветвь (часто называемая средней печеночной артерией) к сегменту IV, прежде чем продолжить кровоснабжение сегментов II и III.Дополнительные мелкие ветви левой печеночной артерии снабжают хвостатую долю (сегмент I), хотя ветви хвостатой артерии могут также выходить из правой печеночной артерии. Секторальные и сегментарные желчные протоки и воротные вены повторяют ход ветвей печеночной артерии. Более подробно внутрипеченочное ветвление этих структур будет рассмотрено ниже.
Кровоснабжение общего желчного протока разнообразное и множественное. Было показано, что ветви общих печеночных, гастродуоденальных и панкреатодуоденальных артерий обеспечивают артериальное кровоснабжение на различных уровнях.
5.2. Печеночные артериальные аномалии
Вариации артериального кровоснабжения печени являются обычным явлением. Хотя печеночная артерия обычно отходит от чревной оси, полное замещение основной печеночной артерии или ее ветвей происходит с переменной частотой. Точно так же дупликация или дополнительные ветви печеночной артерии, особенно добавочная левая печеночная артерия, могут быть скорее нормой, чем аномалией. Наиболее частая аномалия печеночной артерии, включающая замененный сосуд, — это замещенная правая печеночная артерия (25%).В этой ситуации замещенная правая печеночная артерия обычно выходит из верхней брыжеечной артерии и проходит латеральнее и кзади от воротной вены внутри печеночно-двенадцатиперстной связки. (Рисунок 6). В редких случаях вся общая печеночная артерия или отдельные ее ветви могут отходить непосредственно от чревного ствола или аорты.
Рисунок 6.
Аномалии печеночной артерии. (a) Замещенная главная печеночная артерия, возникающая из верхней брыжеечной артерии (SMA), (b) Независимое происхождение правой и левой печеночной артерии от чревной оси, (c) Замещенная правая печеночная артерия, возникающая из SMA, (d) Замещенная левая печеночная артерия, отходящая от левой желудочной артерии (LGA), (e) Добавочная правая печеночная артерия, отходящая от SMA, (f) Добавочная левая печеночная артерия, отходящая от LGA.
6. Анатомия воротной вены
Портальная вена образована слиянием верхней брыжеечной вены (ВБВ) и селезеночной вены за шейкой и телом поджелудочной железы. Примерно у одной трети всех людей нижняя брыжеечная вена также может присоединяться к этому слиянию. Венозные притоки из поджелудочной железы также могут стекать непосредственно в воротную вену и обычно соответствуют артериальному кровоснабжению. Точнее, бывают передние, задние, верхние и нижние сосуды поджелудочной железы.Кроме того, левая желудочная вена и нижняя брыжеечная вена обычно впадают в селезеночную вену, но в редких случаях эти сосуды могут напрямую входить в воротную вену. Хирургическая догма гласит, что на передней поверхности воротной вены нет венозных ветвей и, по большей части, это правда — большинство вен входит в воротную вену сбоку по касательной. Однако, отдавая дань хирургической догме, реальность такова, что небольшие передние венозные ветви могут существовать, и любые манипуляции позади шейки поджелудочной железы и впереди воротной вены должны выполняться с максимальным оперативным воздействием и осторожностью.
Доступ к воротной вене обычно достигается путем идентификации верхней брыжеечной вены на нижней поверхности поджелудочной железы. В некоторых случаях необходимо сначала определить местонахождение средней колической вены внутри поперечной ободочной кишки и проследить ее ниже SMV. Длина SMV сильно варьируется и может варьироваться от нескольких миллиметров до 4 см. Во многих случаях ВМС состоит из 2–4 венозных ветвей, которые сливаются незадолго до присоединения к воротной вене, а не из одной доминирующей вены.Нижняя панкреатодуоденальная вена, которая может быть довольно выступающей, является единственной веной, которая обычно напрямую входит в SMV. Правильная идентификация этой вены необходима, чтобы избежать травм (и часто значительной кровопотери). Все другие венозные притоки поджелудочной железы входят в воротную вену, а не в SMV.
При панкреатодуоденальной резекции раннее разделение общего желчного протока (CBD) обеспечивает хороший доступ к правой боковой стороне воротной вены и способствует созданию «туннеля» над воротной веной и под ней. поджелудочная железа.После определения резектабельности поражения поджелудочной железы мы выступаем за раннее пересечение общего желчного протока. Если позже окажется, что опухоль неоперабельна, можно выполнить паллиативный обходной билиоэнтерический обходной анастомоз.
Помимо описанных выше вариантов, существуют дополнительные (но редкие) врожденные аномалии воротной вены, о которых хирургу следует знать. Двумя наиболее распространенными являются передняя воротная вена, расположенная над поджелудочной железой и двенадцатиперстной кишкой, и прямой вход воротной вены в нижнюю полую вену — врожденный «портокавальный» шунт.Невозможно переоценить важность тщательного рассечения воротной вены. Непреднамеренное повреждение или перерезание воротной вены или главного притока трудно исправить, и это остается одной из самых смертельных хирургических ошибок.
7. Анатомия внутрипеченочной артерии и воротной вены
На всем протяжении печени секторальные и сегментарные желчные протоки, печеночные артерии и ветви воротной вены соединяются. (Рис. 7). В то время как знание точной анатомии внутрипеченочных желчных протоков имеет наибольшую практическую ценность для оперирующего хирурга, дальнейшие подробности внутрипеченочной анатомии будут обсуждаться в этом разделе ниже.
8. Желчные пути
Внепеченочная анатомия желчных протоков
Внепеченочная желчная система состоит из внепеченочных частей правого и левого желчных протоков, которые соединяются, образуя единый желчный канал, проходящий через заднюю головку поджелудочной железы к входят в медиальную стенку второй части двенадцатиперстной кишки. Желчный пузырь и пузырный проток образуют дополнительную часть этой внепеченочной билиарной системы, которая обычно соединяется с конечной частью общего печеночного протока, образуя общий желчный проток.В большинстве случаев место слияния правого и левого желчных протоков находится справа от пупочной щели и кпереди от правой ветви воротной вены. Правый печеночный проток обычно короткий (<1 см) и разветвляется на правый задний секторный проток (сегменты VI / VII) и правый передний секторальный проток (сегменты V / VIII) вскоре после входа в паренхиму печени. Напротив, левый печеночный проток имеет относительно длинный внепеченочный ход (2–3 см) вдоль основания квадратной доли (сегмент IV) и входит в паренхиму печени через пупочную щель.Опускание прикорневой пластинки (то есть соединительной ткани, охватывающей левые элементы печени и капсулу Глиссона) у основания квадратной доли обеспечивает отличный доступ как к воротам желчных путей, так и к внепеченочной части левого печеночного протока. (Рисунок 8)
9. Общий желчный проток
Традиционно точка входа пузырного протока делит главный внепеченочный желчный проток на общий печеночный проток (вверху) и общий желчный проток (внизу). Общий желчный проток продолжается в нижнем положении впереди воротной вены и латеральнее общей печеночной артерии.Если печеночная артерия разветвляется рано, можно увидеть, что правая печеночная артерия проходит ниже (в 80% случаев) общего желчного протока (см. Подробности выше). На стыке 1 -й части и 2 -й части двенадцатиперстной кишки, общий желчный проток проходит за двенадцатиперстной кишкой кзади от головки поджелудочной железы, чтобы войти в медиальную стенку двенадцатиперстной кишки (2 и часть) в сфинктере Одди.
Рис. 7.
Портальные ножки. Этот вид в разрезе правой и левой воротных ножек демонстрирует ход правой и левой воротных вен, печеночных протоков и печеночных артерий, когда они входят в паренхиму печени
Рисунок 8.
Опускание прикорневой пластины и обнажение левого печеночного протока. Левый печеночный проток проходит у основания квадратной доли (сегмент 4) и покрыт прикорневой пластиной (слоем соединительной ткани, проходящим между гепатодуоденальной связкой и глиссоновой капсулой печени. Разделение этого слоя демонстрирует внепеченочную часть левый печеночный проток, выходящий из пупочной щели (числа 2, 3, 4 относятся к сегментарной анатомии печени).
10. Желчный пузырь и пузырный проток
Желчный пузырь расположен на нижней поверхности переднего нижнего сектора (сегмент V). ) правой доли печени.Хотя часто он плотно прилегает, он отделен от паренхимы печени кистозной пластинкой — слоем соединительной ткани, выходящим из капсулы Глиссона и продолжающимся прикорневой пластинкой в основании сегмента IV. В редких случаях желчный пузырь лишь слабо прикреплен к нижней поверхности печени тонко завуалированной брыжейкой и может быть подвержен завороту. Изменения в анатомии желчного пузыря встречаются редко. Эти варианты включают (а) двулопастный или двойной желчный пузырь, (б) перегородку желчного пузыря или (в) дивертикулы желчного пузыря.
Пузырный проток выходит из инфиндибулума желчного пузыря и проходит медиальнее и ниже, чтобы присоединиться к общему печеночному протоку. Пузырный проток обычно имеет диаметр 1-3 мм и может составлять от 1 мм до 6 см в длину в зависимости от его соединения с общим печеночным протоком. В слизистой оболочке пузырного протока присутствуют спиральные складки слизистой оболочки, называемые клапанами Гайстера. Патологии пузырного протока встречаются редко и включают (а) двойные пузырные протоки (очень редко), (б) аберрантные участки входа пузырных протоков и (в) аберрантное сращение пузырных протоков с общим печеночным протоком.Аберрантные точки входа в пузырный проток включают низкий вход в общий печеночный проток, ретродуоденальный или ретропанкреатический, и аномальный вход в главный правый печеночный проток или секторный проток. Аберрантное сращение пузырного протока и общего печеночного протока может принимать несколько форм, включая (а) отсутствие пузырного протока (<1%), (б) параллельное течение пузырного протока и общей печеночной артерии с общей перегородкой (20%) и (c) аномальный проход пузырного протока кзади от общего печеночного протока с входом на медиальной стенке (5%).(Рисунок 9)
Рисунок 9.
Вариации анатомии пузырного протока.
Обычно кистозная артерия представляет собой единственный сосуд, который проходит латеральнее и кзади от пузырного протока. Однако вариации анатомии кистозной артерии являются обычным явлением. (Рис. 10) Сообщалось о множественных кистозных артериях, происхождении кистозной артерии от сегментарной или долевой печеночной артерии, аберрантном течении кистозной артерии над пузырным протоком и о различных других аномалиях. Тщательное интраоперационное определение анатомии кистозной артерии важно для предотвращения ненужного кровотечения во время холецистэктомии.
Рис. 10.
Аномалии кистозной артерии. (A) Типичное течение, (B) Двойная кистозная артерия, (C) кистозная артерия, пересекающая кпереди от главного желчного протока, (D) кистозная артерия, исходящая из правой ветви печеночной артерии и пересекающая общий печеночный проток спереди, (E ) кистозная артерия, исходящая из левой ветви печеночной артерии, (F) кистозная артерия, исходящая из гастродуоденальной артерии, (G) кистозная артерия может исходить из чревной оси, (H) кистозная артерия, исходящая из замещенной правой печеночной артерии.
10. Анатомия внутрипеченочного желчного протока
Понимание анатомии внутрипеченочного протока, безусловно, важно и жизненно важно для выполнения высоких билиарных анастомозов при холангиокарциноме (опухоли Клацкина), внутрипеченочном билиоэнтеральном шунтировании и сложных резекциях долей печени, таких как резекции калитки. и трисегментэктомия слева и справа. Правая и левая доли печени дренируются отдельно через правый и левый печеночные протоки. Напротив, 1–4 протока меньшего размера из правого или левого печеночных протоков дренируют хвостатую долю.Внутри паренхимы печени внутрипеченочные билиарные радикалы параллельны основным притокам портальной триады, направленным к каждому печеночному сегменту печени. В частности, желчные протоки обычно располагаются выше ответвления дополнительной воротной вены, а печеночная артерия — ниже.
Левый печеночный проток дренирует все 3 сегмента левой печени. (Сегмент II, III и IV). В некоторых учебниках сегмент IV, квадратная доля, подразделяется на подсегменты (4A, высший, и 4B, низший).Итак, концептуально и правый, и левый печеночные протоки дренируют 4 сегмента каждый. Хотя левый печеночный проток берет начало в печени и заканчивается в общем печеночном протоке, его ‘путь легче описать в обратном порядке, поскольку внепеченочные области легко видны оперирующему хирургу. После бифуркации на правый и левый печеночные протоки левый проток направляется к пупочной щели вдоль нижней поверхности сегмента IVB выше и позади левой ветви воротной вены.Доступ к этой области можно получить, опустив прикорневую пластину (описано выше). Несколько небольших ответвлений от квадратной доли (сегмент 4) и хвостатой доли (сегмент 1) могут входить в левый проток в этом месте. Левый печеночный проток образован внутри пупочной щели протоком сегмента III (латеральный) и сегмента IVB (медиальный). По ходу пупочной щели вертикально по направлению к серповидной связке формируются ветви II сегмента (латеральный) и сегмента IVA (медиальный). Хотя для доступа к сегментарным желчным протокам для анастомозов требуется осторожное и утомительное рассечение (например,g., обход сегмента III), контроль сегментарных портальных триад ко всем областям левой доли легко достижим в пределах пупочной щели. (см. рисунок 11)
Рисунок 11.
Левая ножка воротной вены. Слияние воротных вен IV, II и III сегмента внутри пупочной щели образует левую воротную вену. Отдельный сегмент I воротной вены также входит в левую воротную вену до того, как сливается с правой воротной веной в воротах. Линии A, B, C, D демонстрируют различные линии пересечения воротной вены, которые необходимы для выполнения различных резекций печени.Линия А — это линия рассечения для завершения левой гепектекомии и хвостовой лобэктомии. Линия B — это линия рассечения для завершения левой гепатэктомии. Линия C — это линия рассечения для резекции сегмента II. Линия D — это линия рассечения для резекции сегмента III.
Правый печеночный проток выходит из печени у основания сегмента V справа от хвостатого отростка. Этот проток дренирует сегменты V, VI, VII и VIII и берет начало на стыке правого заднего (сегменты VI и VII) и переднего (сегменты V и VIII) секторных протоков.Правый задний секторный проток проходит почти горизонтально у основания сегментов V и VI, которые часто можно увидеть в поперечной щели на поверхностной поверхности печени. Сегментарные билиарные ветви от VI (нижнего) и VII (верхнего) сегментов сходятся, образуя главный правый задний секторный проток. Сегментарные ветви от V и VIII сегментов образуют правый передне-секторный проток. В то время как правый задний секторный проток следует горизонтальным курсом, правый передний секторный проток проходит почти вертикально в пределах сегмента V и принимает ответвления как из сегмента V (нижний), так и из VIII (верхнего).
Отток желчных протоков хвостатой доли менее предсказуем. Концептуально хвостатая доля состоит из трех отдельных областей — правой части, левой части и хвостатого отростка. В некоторых случаях могут присутствовать три отдельных желчных протока. Хвостатый отросток представляет собой узкую перемычку из ткани, которая соединяет хвостатую часть с правой долей (сегмент V). Более чем в 75% случаев отток хвостового канала осуществляется как в правую, так и в левую систему протоков печени, но может происходить изолированный дренаж в правый (<10%) или левый печеночный проток (~ 15%).
11. Аномальный дренаж желчных протоков
Нормальная анатомия внутри- и внепеченочных желчных протоков присутствует примерно в 75 процентах случаев. (Рисунок 12) Следует приложить все усилия, чтобы определить существующую внутрипеченочную анатомию на основе дооперационной визуализации, поскольку невыполнение этого может привести к серьезным осложнениям. Аномалии как секторальной, так и сегментарной анатомии могут существовать вместе или по отдельности. Более общий тип каждой из аномалий будет описан более подробно ниже.
Аномальная секторальная анатомия желчевыводящих путей
Хотя слияние правого и левого печеночного протока обычно происходит на воротах, тройное слияние правого заднего и переднего секторальных протоков с левым печеночным протоком может существовать до ~ 15 % случаев.(Рисунок 12) В 20% случаев один из правых секторных протоков, чаще всего передний секторный проток, может входить в общий печеночный проток дистальнее места слияния. Если эту ситуацию не распознать, она может быть очень опасной и является частой причиной травм при лапароскопической холецистэктомии. Реже (~ 5%) правый задний секторный проток (и редко правый передний секторный проток) может пересекаться, чтобы войти во внутрипеченочную часть левого печеночного протока. Неспособность оценить эту аномалию до правой или левой гепатэктомии может привести к серьезным послеоперационным проблемам.Обратите внимание, некоторые авторитетные источники считают, что эта аномалия представляет собой наиболее частые внутрипеченочные изменения желчных протоков.
Рис. 12.
Нормальная и аберрантная анатомия секторального протока. (A) Типичная анатомия протока, (B) тройное слияние, (C) Эктопический дренаж правого секторального протока в общий печеночный проток (C1, правый передний проток, дренирующий в общий печеночный проток; C2, правый задний проток, дренирующий в общий проток печени) печеночный проток), (D) внематочный дренаж правого секторального протока в систему левого печеночного протока (D1, правый задний секторный проток, дренирующий в левую систему протоков печени; D2, правый передний секторный проток, дренирующий в систему левого печеночного протока, ( E) отсутствие слияния печеночного протока, (F) отсутствие правого печеночного протока и эктопический дренаж правого заднего протока в пузырный проток.
Аномальная сегментарная билиарная анатомия
Сообщалось о большом количестве сегментарных билиарных аномалий. Большинство из них не важны для хирурга и представляют только анатомический интерес. На рисунке 13 показаны наиболее распространенные аномалии, о которых сообщалось в правой доле и медиальном сегменте левой доли.
Рис. 13.
Нормальная и аберрантная анатомия сегментарного протока. (A) вариации сегмента V, (B) вариации сегмента VI, (C) вариации сегмента VIII, (D) вариации сегмента IV.Обратите внимание, что дренаж сегментов II, III и VII не меняется.
12. Резюме
Всестороннее понимание нормальной и аберрантной анатомии — краеугольный камень хирургии. Истинность этого утверждения наиболее очевидна при выполнении сложной гепатобилиарной хирургии. Знание сегментарной анатомии печени, а также всестороннее понимание нормальной и аномальной анатомии артерий, вен и желчных протоков — это sine qua non для выполнения безопасной резекции печени.Последние достижения в периоперационном ведении пациентов с гепатобилиарными заболеваниями (подробно описаны в других разделах этой книги) позволяют хирургу выполнять все более радикальные процедуры на печени (для более тяжелых пациентов).

 Тем самым препятствует развитию сахарного диабета..
Тем самым препятствует развитию сахарного диабета..