70. Принципы лечения микозов и онихомикозов.
Лечение
микозов.Проводится
в два этапа.
1)При сухих
формах,сквамозных,гиперкератотических
отслаивают роговой слой-кератолитические
средства.Для глубокой одномоментной
отслойки – 20% салицил-молочный состав
коллодия,1 раз в день в теч.5-7 дней,после
чего под компресс на ночь 2-5% салицил.вазелин.
2)После отслойки в
теч.2-4 нед приём антимикотических средств
(экзодерил,ламизин,микроспор) 10-14 дн.
При интертригинозной
форме надо снять воспаление:
1)Наружно
примочки,ванночки с дез.средствами;антигистаминные
препараты.
2)Длительное
использование растворов,кремов,мазей
с антимикатическим эффектом.
Если процесс имеет
склонность к распространению – внутрь
антимикотики (кетоконазол,ламизил,интраконазол)
Патогенетическая
терапия:
-индукторы интерферона
-вит. А,Е,Левит в теч
А,Е,Левит в теч
3-4 нед для улучшения процесса.
-сонация всех очагов
Профилактика.Иметь
индивидуальные предметы обихода,соблюдать
правила личной гигиены.
Лечение
онихомикозов.
Так как возбудитель
поражает и само ногтевое ложе,то
1)Удаление ногтевой
пластинки.После размягчения мазями-нанесение
антимикотических средств на ногтевое
ложе+чистка 1 раз в 7 дней
2)Нанесение
мазей,кремов с чисткой ногтевого
ложа.Если терапия наружная не
помогает-антимикотики внутрь.
Первые контрольные
микроскопич.исследования проводят
через 6-8 нед-ногтей,через 12 нед-онихомикоза
стоп.
Главное в профилактике
иметь всё индивидуальное.
При излечении стоп
необходимо в теч.6-12 мес.после каждой
водной процедуры в целях профилактики
смазывать ногтевые пластинки,стопы-антимикотическими
препаратами.
71.
 Паховая эпидермофития.Этиол,пат-нез,клиника,диф.Диаг,леч
Паховая эпидермофития.Этиол,пат-нез,клиника,диф.Диаг,леч
Паховая
эпидермофития-микоз,поражающий
эпидермис,ногти.
Возбудитель-грибок
Er.
Inguinale.Заражаются
через предметы обихода при повышенной
потливости,повышенной влажности и
температуре.Болеют в основном мужчины.
Клиника.Появляются
розовые пятна диаметром до 1 см.Появляются
воспалительные явления в центре-
увеличивается до 10 см в диаметре-крупные
кольцевидные красные пятна- фестончатые
очаги. Часто поражается паховая
область,под молочными
железами,мошонка,межъягодичная складка.
Зуд.
Диаг-ка.
Клиника,микроскопия,бак.посев.
Диф.диаг-ка с
псориазом и кандидозом.
Леч. Примочки,антимикотики.
Профилактика. Все
предметы обихода должны быть индивидуальные.
72. Микроспория.Хар-ка возбудителей,эпидемиол.Классиф.
Микроспория-контагиозная
дерматофития,пораж. гладкую кожу,волосистую
гладкую кожу,волосистую
часть головы,длинные и пушковые волосы
у детей от 1 до 11 лет+молодые женщины.
Этиолог. Возбудитель
гр.рода Microsporum
и их 2 типа:зоофильный(кошачий и собачий)
и антропофильный (ржавый).Передача при
непосредственном контакте.Источник
только больной человек,чаще ребёнок.
Инкубациооный период 3-7 дней.Попав на
кожу,гриб внедряется в неё и начинает
размножаться.Довольно быстро
распространяясь на поверхности
волоса,гриб разрушает кутикулу.,между
чешуйками которой скапливаются споры.Т.о.
гриб окружает волос,формируя чехол,и
плотно заполняет луковицу.Попав в почву
с заражённым волосом или чешуйкой.гриб
сохраняет жизнеспособность 1-3
мес.Инкубационый период при зоофильной
форме 5-7 дн.
Классификация.Выделяют:
-поверхностную
микроспорию волосистой части головы
-микроспорию гладкой
кожи
70. Принципы лечения микозов и онихомикозов.
Лечение
микозов. Проводится
Проводится
в два этапа.
1)При
сухих формах,сквамозных,гиперкератотических
отслаивают роговой слой-кератолитические
средства.Для глубокой одномоментной
отслойки – 20% салицил-молочный состав
коллодия,1 раз в день в теч.5-7 дней,после
чего под компресс на ночь 2-5% салицил.вазелин.
2)После
отслойки в теч.2-4 нед приём антимикотических
средств (экзодерил,ламизин,микроспор)
10-14 дн.
При
интертригинозной форме надо снять
воспаление:
1)Наружно
примочки,ванночки с дез.средствами;антигистаминные
препараты.
2)Длительное
использование растворов,кремов,мазей
с антимикатическим эффектом.
Если
процесс имеет склонность к распространению
– внутрь антимикотики
(кетоконазол,ламизил,интраконазол)
Патогенетическая
терапия:
-индукторы
интерферона
-вит.А,Е,Левит
в теч 3-4 нед для улучшения процесса.
-сонация
всех очагов
Профилактика.Иметь
индивидуальные предметы обихода,соблюдать
правила личной гигиены.
Лечение
онихомикозов.
Так
как возбудитель поражает и само ногтевое
ложе,то
1)Удаление
ногтевой пластинки.После размягчения
мазями-нанесение антимикотических
средств на ногтевое ложе+чистка 1 раз
в 7 дней
2)Нанесение
мазей,кремов с чисткой ногтевого
ложа.Если терапия наружная не
помогает-антимикотики внутрь.
Первые
контрольные микроскопич.исследования
проводят через 6-8 нед-ногтей,через 12
нед-онихомикоза стоп.
Главное
в профилактике иметь всё индивидуальное.
При
излечении стоп необходимо в теч.6-12
мес.после каждой водной процедуры в
целях профилактики смазывать ногтевые
пластинки,стопы-антимикотическими
препаратами.
71. Паховая эпидермофития.Этиол,пат-нез,клиника,диф.
 Диаг,леч
Диаг,леч
Паховая
эпидермофития-микоз,поражающий
эпидермис,ногти.
Возбудитель-грибок
Er.
Inguinale.Заражаются
через предметы обихода при повышенной
потливости,повышенной влажности и
температуре.Болеют в основном мужчины.
Клиника.Появляются
розовые пятна диаметром до 1 см.Появляются
воспалительные явления в центре-
увеличивается до 10 см в диаметре-крупные
кольцевидные красные пятна- фестончатые
очаги. Часто поражается паховая
область,под молочными
железами,мошонка,межъягодичная складка.
Зуд.
Диаг-ка.
Клиника,микроскопия,бак.посев.
Диф.диаг-ка
с псориазом и кандидозом.
Леч.
Примочки,антимикотики.
Профилактика.
Все предметы обихода должны быть
индивидуальные.
72.Микроспория.Хар-ка возбудителей,эпидемиол.Классиф.
Микроспория-контагиозная
дерматофития,пораж.гладкую кожу,волосистую
часть головы,длинные и пушковые волосы
у детей от 1 до 11 лет+молодые женщины.
Этиолог.
Возбудитель гр.рода Microsporum
и их 2 типа:зоофильный(кошачий и собачий)
и антропофильный (ржавый).Передача при
непосредственном контакте.Источник
только больной человек,чаще ребёнок.
Инкубациооный период 3-7 дней.Попав на
кожу,гриб внедряется в неё и начинает
размножаться.Довольно быстро
распространяясь на поверхности
волоса,гриб разрушает кутикулу.,между
чешуйками которой скапливаются
споры.Т.о. гриб окружает волос,формируя
чехол,и плотно заполняет луковицу.Попав
в почву с заражённым волосом или
чешуйкой.гриб сохраняет жизнеспособность
1-3 мес.Инкубационый период при зоофильной
форме 5-7 дн.
Классификация.Выделяют:
-поверхностную
микроспорию волосистой части головы
-микроспорию
гладкой кожи
Микотические поражения ЛОР органов Текст научной статьи по специальности «Клиническая медицина»
Микотические поражения ЛОР-органов
^ А. И. Крюков, В.Я. Кунельская, Г.Б. Шадрин
И. Крюков, В.Я. Кунельская, Г.Б. Шадрин
Московский научно-практический центр оториноларингологии Департамента здравоохранения г. Москвы
Лекция для практических врачей посвящена оценке современного состояния проблемы грибковых заболеваний ЛОР-органов. Приведены особенности клинической картины, даны рекомендации по диагностике и лечению грибковых заболеваний ЛОР-органов с использованием современных противогрибковых препаратов.
Ключевые слова: микоз ЛОР-органов, диагностика, лечение.
Введение
В настоящее время проблема микотических заболеваний человека приобрела важное социальное значение в связи с существенным увеличением их частоты. Так, по данным ВОЗ, 20% населения всего мира, т.е. каждый пятый житель планеты, поражено грибковой инфекцией. Особенно настораживает микологов, инфекционистов и врачей других специальностей повышение уровня заболеваемости глубокими микозами, к которым относятся и микозы ЛОР-органов.
Особенно настораживает микологов, инфекционистов и врачей других специальностей повышение уровня заболеваемости глубокими микозами, к которым относятся и микозы ЛОР-органов.
Рост числа больных ЛОР-микозами обусловлен существенным увеличением количества факторов риска их развития, среди которых ведущие позиции занимают ятрогенные иммунодефицитные состояния вследствие массивной антибиотикотера-пии, длительного использования глюко-кортикоидных и иммуносупрессивных препаратов при онкологических заболеваниях, болезнях крови, СПИДе; а также соматическая патология, например, сахарный диабет, бронхиальная астма и др.
Тяжелые формы микозов самой различной локализации, в том числе ЛОР-микозы, возникают при загрязнениях окружающей среды, повышении радиационного
Контактная информация: Шадрин Георгий Борисович, [email protected]
фона и при воздействии других факторов, ослабляющих защитные силы организма.
Этиология
ЛОР-микозы — инфекционное заболевание, поскольку патологический процесс возникает только при патогенном воздействии гриба как возбудителя болезни. Однако болезнь развивается не у всех, кто вступает в контакт с грибами, а при определенных условиях. Это особенно относится к микозам ЛОР-органов, поскольку возбудителями этой группы заболеваний являются условно-патогенные грибы родов Candida, Aspergillus, Penicillium, Scopulariopsis, Mucor и др. Эти грибы широко распространены в природе и только при соответствующих условиях эндогенного и экзогенного порядка переходят к паразитическому образу жизни, т.е. вызывают заболевание.
Возбудителями микозов ЛОР-органов могут быть и патогенные грибы, вызывающие глубокие микозы. До последнего времени считали, что такие микозы, как кок-цидиоидоз, криптококкоз, бластомикоз, характерны только для стран с тропическим влажным климатом и могут быть широко распространены в эпидемических местностях. Но в последние годы эти заболевания привлекают всё большее внимание медиков, что обусловлено распространени-
Но в последние годы эти заболевания привлекают всё большее внимание медиков, что обусловлено распространени-
Микотические поражения ЛОР-органов
ем спорадических случаев этих тяжелейших микозов во многие страны и в том числе в различные регионы России.
Патогенез
Основными патогенетическими факторами возникновения микоза являются: адгезия (прикрепление гриба к поверхности слизистой оболочки или к коже), колонизация грибов и их инвазивный рост. При тяжелых формах ЛОР-микозов следующими этапами являются генерализация процесса, проникновение грибов в кровь с диссеминацией и возникновением вторичных очагов микоза в различных органах и тканях. Знание закономерностей развития адгезии, колонизации и инвазивного роста грибов и определяет в целом понимание патогенеза возникновения ЛОР-микоза.
Нозологическими формами грибковых заболеваний ЛОР-органов являются: ото-микоз, фарингомикоз, ларингомикоз, микоз околоносовых пазух и риномикоз.
По данным Московского научно-практического центра оториноларингологии установлено, что среди грибковых заболеваний ЛОР-органов доминирует отомикоз (50% от всех диагностированных ЛОР-микозов), реже встречаются фарингомикоз (24%), микоз носа и околоносовых пазух (14%) и ларингомикоз (12%).
Основными возбудителями грибковых заболеваний ЛОР-органов являются дрожжеподобные грибы родов Candida и Geotrichum; плесневые грибы родов Aspergillus, Penicillium, Scopulariopsis, Mucor, Cephalosporium, Alternaria и др.
Клинические проявления
Клинические проявления при микозах ЛОР-органов во многом обусловлены локализацией патологического процесса. Клиническая картина при этом разнообразна, но имеет ряд специфических признаков. Объективным клиническим признаком при всех формах микотических за-
Клиническая картина при этом разнообразна, но имеет ряд специфических признаков. Объективным клиническим признаком при всех формах микотических за-
болеваний верхних дыхательных путей и уха является наличие специфического отделяемого (корочки, налеты, густой казеоз-ный или жидкий секрет и др.), цвет, количество и консистенция которого зависят от вида гриба и фазы его развития.
Микозы ЛОР-органов, как и другие виды специфического воспаления, имеют хроническое течение, характеризующееся малозаметным началом заболевания, его постепенным развитием и значительной продолжительностью с частыми обострениями. Заболевание может возникать в любом возрасте. Для микозов ЛОР-органов специфично и то, что они всегда протекают с выраженными явлениями общей интоксикации организма.
Диагноз грибкового заболевания уха и верхних дыхательных путей, как любого инфекционного заболевания, устанавливается только на основании комплексных лабораторных микологических методов исследований.
Микологическая диагностика проводится в основном в двух направлениях:
1) микологическое исследование патологического отделяемого как нативных, так и окрашенных препаратов;
2) посевы патологического отделяемого на различные элективные питательные
Рис. 1. Аспергиллез наружного слухового прохода. Эндоскопическая картина.
Лечебное дело 3.2011
Рис. 2. Аспергиллез наружного слухового прохода. Отомикроскопия.
Рис. З. Кандидоз наружного слухового прохода. Эндоскопическая картина.
Рис. 4. Мукороз наружного слухового прохода. Эндоскопическая картина.
Рис. 5. Микоз наружного слухового прохода, вызванный Rhizomucor spp. Отомикроскопия.
5. Микоз наружного слухового прохода, вызванный Rhizomucor spp. Отомикроскопия.
среды для выделения культур грибов и их родовой и видовой идентификации.
Для уточнения диагноза в ряде случаев необходимо производить серологические, аллергологические и гистологические исследования.
В активной стадии аспергиллеза и муко-роза, т.е. когда образуется много микотических масс с воздушным мицелием, для диагностики может быть использован операционный отоларингологический микро-
скоп (отомикроскопический способ экспресс-диагностики) (рис. 1—5).
Лечение
Терапия микотических заболеваний ЛОР-органов представляет известные трудности и не всегда бывает достаточно эффективной, несмотря на применение современных эффективных противогрибковых препаратов. Это связано в первую очередь
Это связано в первую очередь
Лекции
со спецификой инфекционного процесса,
поскольку условно-патогенные грибы родов Candida, Aspergillus, Penicillium, Scopulariopsis, Mucor и др. вызывают заболевание только при определенных предрасполагающих факторах. При лечении больных микозами ЛОР-органов необходимо учитывать все возможные условия, при которых возникло данное заболевание конкретно у данного больного, с целью их возможного устранения: отмена антибактериальной или кортикостероидной терапии, проведение комплексного общеукрепляющего лечения, витаминотерапия. Необходимо выявлять и проводить лечение таких заболеваний, как сахарный диабет, заболевания крови, иммунодефицитные состояния, заболевания желудочно-кишечного тракта и др. Следует учитывать и роль аллергии в патогенезе заболевания, поскольку грибы обладают выраженными аллергенными свойствами. Следовательно, одновременно с противогрибковой следует проводить и десенсибилизирующую терапию.
Следовательно, одновременно с противогрибковой следует проводить и десенсибилизирующую терапию.
В настоящее время проблема рациональной противогрибковой терапии микозов ЛОР-органов не теряет актуальности. Большое количество препаратов-антимикоти-ков расширяет возможности лечения грибковых поражений как различных локализаций, так и по видовой принадлежности возбудителя. Необходим рациональный выбор антимикотика, оказывающего наименьшее токсическое и наибольшее терапевтическое действие. Антимикотическая лекарственная терапия должна основываться на результатах лабораторных микологических исследований чувствительности грибов (возбудителя заболевания у конкретного больного) к применяемым антимикотикам. Но часто, особенно при острых формах грибкового заболевания, выбор препарата осуществляется эмпирически, так как патогенный гриб идентифицируется не сразу и тесты могут занять длительное время.
При терапии грибковых поражений носа и околоносовых пазух предусматрива-
ются как общие, так и местные мероприятия. Чаще всего грибковым процессом поражаются верхнечелюстные пазухи. При инвазивных формах грибкового поражения верхнечелюстных пазух наиболее эффективным является сочетание медикаментозного противогрибкового и хирургического лечения. Хирургическое лечение почти всегда необходимо для элиминации аспергиллезного очага инфекции этой локализации. Оперативное лечение заключается в выполнении радикальной операции на одной или обеих верхнечелюстных пазухах в зависимости от локализации процесса. Операция производится экстрана-зально с полным удалением всех патологически измененных тканей. Ход оперативного вмешательства диктуется глубиной и распространенностью микотического процесса. В послеоперационном периоде проводятся ежедневные промывания пазухи антисептиками и антимикотиками (мира-мистин, хинозол, суспензия пимафуцина, клотримазол).
Чаще всего грибковым процессом поражаются верхнечелюстные пазухи. При инвазивных формах грибкового поражения верхнечелюстных пазух наиболее эффективным является сочетание медикаментозного противогрибкового и хирургического лечения. Хирургическое лечение почти всегда необходимо для элиминации аспергиллезного очага инфекции этой локализации. Оперативное лечение заключается в выполнении радикальной операции на одной или обеих верхнечелюстных пазухах в зависимости от локализации процесса. Операция производится экстрана-зально с полным удалением всех патологически измененных тканей. Ход оперативного вмешательства диктуется глубиной и распространенностью микотического процесса. В послеоперационном периоде проводятся ежедневные промывания пазухи антисептиками и антимикотиками (мира-мистин, хинозол, суспензия пимафуцина, клотримазол).
При острых токсических формах инвазивного аспергиллеза околоносовых пазух в обязательном порядке проводится системная антифунгальная терапия. Применяется вориконазол или липидный амфотери-цин В. Возможно применение каспофунги-на и амфотерицина В, а после стабилизации процесса — лечение итраконазолом.
Применяется вориконазол или липидный амфотери-цин В. Возможно применение каспофунги-на и амфотерицина В, а после стабилизации процесса — лечение итраконазолом.
При кандидозном поражении носа и околоносовых пазух необходимо сочетать применение системных антимикотиков с местным противогрибковым воздействием на очаг инфекции. При кандидозном заболевании наиболее эффективен флуконазол (Микофлюкан) — препарат выбора, назначается 1 раз в сутки в дозе от 50 до 200 мг. Курс терапии составляет 14—20 дней в зависимости от тяжести процесса. При неэффективности лечения стандартными дозами флуконазола назначается итраконазол (100 мг/сут) или кетоконазол (200 мг/сут) в течение месяца.
‘ 13 Лечебное дело 3.Z011
Микотические поражения ЛОР-органов
Грибковое заболевание ротоглотки, фарингомикоз, в основном вызывается дрожжеподобными грибами рода Candida, что во многом обусловливает и тактику проводимого лечения. Ограниченные остро возникающие кандидозные поражения миндалин, развившиеся в процессе антибиотико-терапии, могут быстро излечиваться после прекращения введения антибиотиков и применения местного противогрибкового лечения. Однако более распространенные поражения слизистой оболочки ротоглотки с наклонностью к хроническому течению и рецидивированию требуют длительного курсового лечения с применением средств местной и общей антимикотической терапии. Наиболее эффективным при системной терапии является флуконазол (Мико-флюкан).
Ограниченные остро возникающие кандидозные поражения миндалин, развившиеся в процессе антибиотико-терапии, могут быстро излечиваться после прекращения введения антибиотиков и применения местного противогрибкового лечения. Однако более распространенные поражения слизистой оболочки ротоглотки с наклонностью к хроническому течению и рецидивированию требуют длительного курсового лечения с применением средств местной и общей антимикотической терапии. Наиболее эффективным при системной терапии является флуконазол (Мико-флюкан).
Всем больным фарингомикозом этот препарат назначается перорально в дозе 50 мг 1 раз в сутки. Продолжительность лечения при хроническом грибковом фарингите составляет 14 дней, при хроническом грибковом тонзиллите — 20 дней. При недостаточной эффективности лечения дозировка флуконазола увеличивается до 100 мг/сут. При лечении фарингомикоза также применяются: натамицин по 100 мг 3 раза в день 10 дней; итраконазол по 100 мг 14 дней; кетоконазол по 200 мг 1 раз в день 14 дней; тербинафин (Экзифин) по 250 мг/сут 10 дней.
Помимо системного лечения рекомендуется и местное: при хроническом тонзиллите грибковой этиологии — курсы промываний лакун миндалин растворами антисептиков с противогрибковым действием; при хроническом фарингите используются антисептики и антимикотики — биопарокс, мирамистин, хинозол, бура в глицерине, клотримазол, суспензия пимафуцина в виде смазываний, полосканий, орошений, ингаляций.
Спецификой лечения грибкового поражения гортани является широкое использование ингаляционного метода для введе-
ния лекарственных препаратов в организм больного. Эффективность аэрозольного метода при воспалительных заболеваниях гортани определяется тем, что лекарственное вещество непосредственно воздействует на очаг заболевания, создается более высокая концентрация препарата в месте поражения. При таком методе введения эффективными являются, особенно при кандидозном поражении, ингаляции с водорастворимой натриевой солью нистатина, с натриевой солью леворина и с амфо-терицином В.
При ларингомикозе в обязательном порядке кроме ингаляционной проводится и системная терапия антимикотиками. При кандидозном поражении гортани назначают флуконазол (Микофлюкан) 1 раз в сутки в дозе от 100 до 200 мг в зависимости от тяжести течения заболевания. При плесневом ларингомикозе наиболее эффективными являются итраконазол и тербинафин (Экзифин). Курс терапии итраконазолом составляет 14 дней по 100 мг/сут, тербина-фином — 15 дней по 250 мг 1 раз в сутки.
При лечении отомикозов местное воздействие на микотический очаг сочетается с общей противогрибковой терапией. При системной терапии кандидозных поражений наиболее эффективными являются флуконазол (Микофлюкан) и пимафуцин, при плесневых микозах — итраконазол, тербинафин (Экзифин). Курс лечения флуконазолом составляет 10 дней по 50—100 мг/сут; пимафуцином — 10 дней по 100 мг 3 раза в сутки; итраконазолом — 14 дней по 100 мг/сут. Для местного применения при плесневых микозах наиболее эффективными являются препараты экзо-дерил, нитрофунгин, экзифин, а при кан-дидозных поражениях уха — клотримазол, тербинафин, пимафуцин.
Для местного применения при плесневых микозах наиболее эффективными являются препараты экзо-дерил, нитрофунгин, экзифин, а при кан-дидозных поражениях уха — клотримазол, тербинафин, пимафуцин.
Поскольку грибковые заболевания склонны к рецидивированию, необходимо динамическое диспансерное наблюдение за больными с грибковыми поражениями верхних дыхательных путей и уха и при
——————-Лечебное дело 3.2011
Лекции
показаниях — проведение профилактических курсов противогрибкового лечения. Анализ результатов лечения больных ЛОР-микозами с использованием указанных выше лекарственных средств позволяет сделать вывод об эффективной элиминации грибов-возбудителей заболевания, что подтверждается нормализацией клинической картины и отрицательными результатами микологических исследований.
В целом при правильном лечении микозов ЛОР-органов терапия достаточно эффективна. Неудовлетворительные результаты во многом связаны с тем, что клинические проявления при микозах еще недостаточно знакомы врачам, грибковый процесс длительно не распознается, адекватное лечение запаздывает и проводится в поздние сроки, когда заболевание уже распространилось и перешло в хроническую форму.
Рекомендуемая литература
Акулич Н.И., Лопатин А.С. Грибковое заболевание глотки // Леч. врач. 2003. № 8. С. 34—37. Аравийский Р.А., Климко Н.Н., Васильева Н.В. Диагностика микозов: пособие для врачей. СПб.: СПбМАПО, 2004. 185 с.
Веселов А.В. Вориконазол — новый этап в терапии системных микозов // Фарматека. 2006. № 16(131). С. 22-31.
Дайняк Л. Б., Кунельская В.Я. Микозы верхних дыхательных путей. М.: Медицина, 1979. 245 с.
Б., Кунельская В.Я. Микозы верхних дыхательных путей. М.: Медицина, 1979. 245 с.
Крюков А.И., Кунельская В.Я., Петровская А.Н. и др. Микоз послеоперационной полости среднего уха : метод. рек. № 2. М., 2003. 21 с.
Крюков А.И., Туровский А.Б., Димова А.Д, Шадрин Г.Б. Микозы в оториноларингологии // Consilium Medicum. 2004. Т 6. № 4. С. 56.
Кубанова А.А., Потекаев Н.С., Потекаев Н.Н. Руководство по практической микологии. М.: Деловой экспресс, 2001. 144 с.
Кунельская В.Я. Микозы в оториноларингологии. М.: Медицина, 1989. 320 с.
Кунельская В.Я., Шадрин Г.Б. Рациональные методы терапии грибковых заболеваний ЛОР-органов // Четвертая научно-практическая конференция 18—19 мая 2006 г. : тез. докл. М., 2006. С. 26-28.
Кунельская В. Я., Шадрин Г.Б., Мачулин А.И. Лечение грибковых поражений верхних дыхательных путей // Вестн. оториноларингол. 2008. № 2. С. 78-80.
Я., Шадрин Г.Б., Мачулин А.И. Лечение грибковых поражений верхних дыхательных путей // Вестн. оториноларингол. 2008. № 2. С. 78-80.
Кунельская В.Я., Шадрин Г.Б. Современные принципы лечения и профилактики отоми-коза // Пробл. мед. микологии. 2008. Т 10. № 2. С. 58.
Национальное руководство по оториноларингологии / Под ред. В.Т Пальчуна. М.: Гэо-тар-Медиа, 2008. 960 с.
Шадрин Г.Б. Опыт применения препарата Экзо-дерил при лечении отомикоза // Пробл. мед. микологии. 2007. Т. 9. № 2. С. 108.
Gonzalez G.M., Fothergill A.W., Sutton D.A. et al. In vitro activities of new and established tria-zoles against opportunistic filamentous and dimorphic fungi // Med. Mycol. 2005. V. 43. P. 281-284.
Pontes Z.B., Silva A.D., Lima Ede O. et al. Otomycosis: a retrospective study // Braz. J. Otorhinolaryngol. 2009. V. 75. № 3. P. 367-370.
Otomycosis: a retrospective study // Braz. J. Otorhinolaryngol. 2009. V. 75. № 3. P. 367-370.
Vennewald I., Klemm E. Otomycosis: diagnosis and treatment // Clin. Dermatol. 2010. V. 28. № 2. P. 202-211.
Mycotic Damage in Otorhinolaryngology A.I. Kryukov, V.Ya. Kunelskaya, and G.B. Shadrin
This practical lecture reviews current problems of mycotic disorders of otorhinolaryngology. Clinical features are presented, diagnostic and treatment guidelines are given, using contemporary antifungal medications.
Key words: mycosis of ENT-organs, diagnosis of ENT-organs, treatmnent of ENT-organs.
‘ Щ Лечебное дело 3.Z011
Осторожно МИКРОСПОРИЯ | ГАУЗ «Краевой клинический кожно-венерологический диспансер»
Определение.
Микроспория – это грибковое заболевание с поражением волос, гладкой кожи с вовлечением или без вовлечения пушковых волос, чрезвычайно редко ногтей, вызываемая грибами рода Microsporum.
Помимо медицинского названия, у данного грибкового заболевания имеется еще одно широко распространенное наименование – стригущий лишай.
Термин «стригущий лишай» является традиционным обозначением группы заболеваний кожи и волосистой части головы, при которых поражаются волосы и происходит их обламывание, вследствие чего образуются проплешины. А поскольку еще 100 лет назад врачи не умели определять возбудителей инфекций ввиду отсутствия соответствующих методик, то все заболевания классифицировались, описывались и назывались преимущественно по внешним проявлениям. Именно поэтому микроспория была названа стригущим лишаем. Однако с развитием науки и техническим прогрессом врачи смогли выявлять не только признаки заболеваний, но и выделять их возбудителей, что стало буквально прорывом. В этот период удалось установить, что заболевание, которое всегда называли стригущим лишаем, может вызываться двумя видами патогенных грибков – Trichophyton и Microsporum. И тогда разновидность стригущего лишая, вызываемую грибками рода Trichophyton, стали называть трихофитией, а Microsporum – соответственно, микроспорией. Но поскольку внешние признаки и течение трихофитии и микроспории очень похожи, то за этими двумя инфекциями осталось прежнее общее название – стригущий лишай. Таким образом, согласно современным представлениям, микроспория является грибковой инфекцией (микозом), поражающей кожу, волосы, крайне редко ногти, и одновременно считается одной из разновидностей стригущего лишая.
В этот период удалось установить, что заболевание, которое всегда называли стригущим лишаем, может вызываться двумя видами патогенных грибков – Trichophyton и Microsporum. И тогда разновидность стригущего лишая, вызываемую грибками рода Trichophyton, стали называть трихофитией, а Microsporum – соответственно, микроспорией. Но поскольку внешние признаки и течение трихофитии и микроспории очень похожи, то за этими двумя инфекциями осталось прежнее общее название – стригущий лишай. Таким образом, согласно современным представлениям, микроспория является грибковой инфекцией (микозом), поражающей кожу, волосы, крайне редко ногти, и одновременно считается одной из разновидностей стригущего лишая.
Актуальность.
В настоящее время микроспория — самый распространенный микоз у детей.
Возбудитель инфекции. Среди грибов рода Microsporum имеется около 20 видов, способных вызывать заболевание. Грибы рода Microsporum устойчивы к повреждающим факторам внешней среды, а также к различным противогрибковым препаратам, что связано с особенностями строения. У данного вида грибов выявлена ультраструктурно плотная толстая стенка, состоящая из 6 слоев, усиленная реберными выступами. Эти грибы способны сохранять жизнеспособность в волосах до 10 лет, в кожных чешуйках – до 7 лет.
У данного вида грибов выявлена ультраструктурно плотная толстая стенка, состоящая из 6 слоев, усиленная реберными выступами. Эти грибы способны сохранять жизнеспособность в волосах до 10 лет, в кожных чешуйках – до 7 лет.
Эпидемиология.
Источниками микроспории могут служить животные, люди и почва.
Основные животные, участвующие в сохранении и передаче инфекции, являются кошки, особенно котята (70-80%), реже собаки (4%).. Особенно часто болеют микроспорией кошки светлых мастей и тигрового окраса, видимо, это связанно со сниженной резистентностью к грибам у данных разновидностей кошек.
Крайне опасен контакт с бродячими кошками и собаками, которые нередко оказываются больными микроспорией.
Также заражение этим микозом возможно от больного микроспорией человека, чаще детей (3-10%), и чрезвычайно редко – от почвы (0,7%).
К редким животным, болеющим микроспорией и могущим явиться источником заражения людей, причисляют обезьян, тигров, львов, диких и домашних свиней (особенно поросят), лошадей, овец, серебристо-черных лисиц, кроликов, крыс, мышей, хомяков, морских свинок и других мелких грызунов, а также домашних птиц.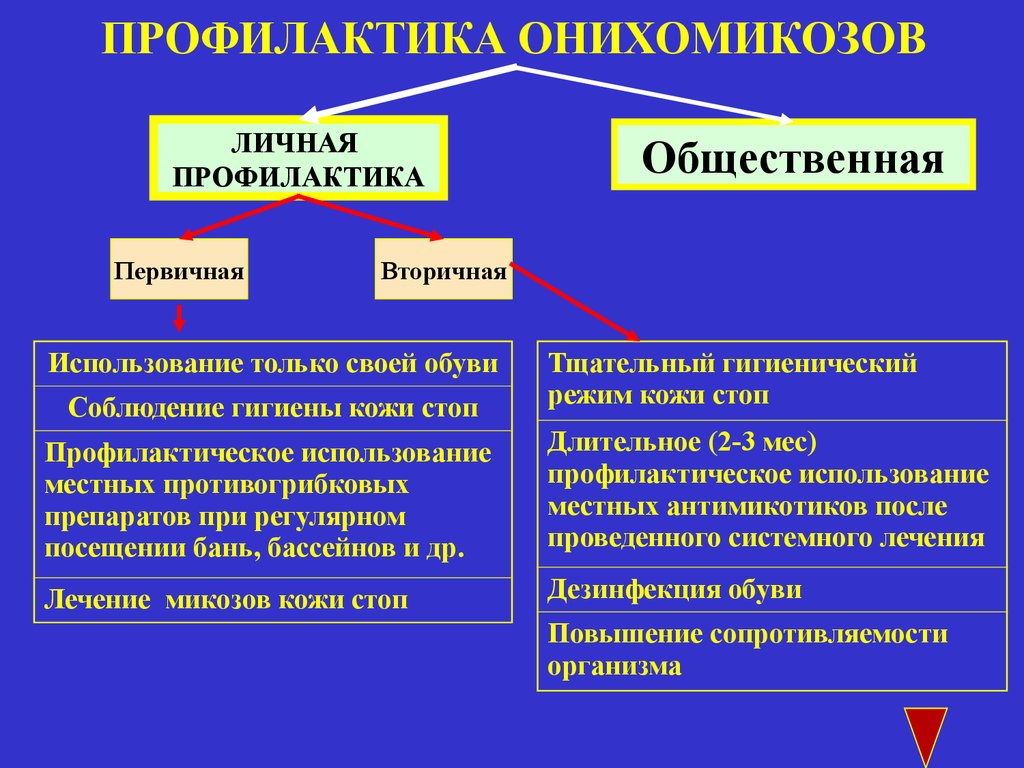
Механизм заражения
Чаще всего заражаются микроспорией непосредственно от больного животного, когда с ним играют, моют, греют под рубашкой, пускают его в постель, а также через инфицированные от него предметы окружающей среды. А поскольку чаще всего носителями микроспории являются котята, то наблюдается два сезонных пика повышения заболеваемости данной инфекцией – в середине лета и осенью, когда кошки приносят приплод. Чтобы заразиться микроспорией, достаточно погладить кошку или собаку, которые больны инфекцией или являются бессимптомными носителями.
Заражение микроспорией возможно не только при непосредственном контакте с больным животным, но также при прикосновении к предметам, на которых имеется шерсть и чешуйки кожи инфицированного животного.
Дело в том, что кошки и собаки, больные микроспорией или являющиеся носителями грибка, могут оставлять маленькие и незаметные кусочки шерсти на различных предметах обихода (мебель, ковры, кровати, диваны, кресла, одежда, обувь и т. д.), в которых содержатся споры грибка. Человек, прикасаясь к таким кусочкам шерсти, содержащим споры грибка, также заражается микроспорией.
д.), в которых содержатся споры грибка. Человек, прикасаясь к таким кусочкам шерсти, содержащим споры грибка, также заражается микроспорией.
Передача инфекции от больного человека к здоровому при непосредственных близких контактах или при использовании различных предметов, на которых находятся чешуйки кожи инфицированного лица (например, при использовании расчески, шапки, ножниц для стрижки волос, принадлежащих человеку, больному микроспорией).
В домашних условиях – предметом инфицирования может быть постельное белье, полотенце, одежда, подстилки для животных и предметы ухода за ними.
В подъездах домов и дворах инфекция может передаваться через околодверные коврики, пыль лестничных клеток, песок детских песочниц, вода луж.
Источником инфицирования новорожденных может быть детская коляска, оставленная на ночь в подъезде дома и облюбованная кошками.
В парикмахерских при ненадлежащей стерилизации, инфицироваться можно через машинки для стрижки волос, ножницы, расчески, пеньюары, бигуди, фены, кисти для мытья.
При простом попадании грибка на кожу человек не заболеет микроспорией, поскольку патогенный грибок будет уничтожен нормальной микрофлорой и иммунной системной или просто смыт в ходе выполнения гигиенических мероприятий.
Таким образом, для заболевания микроспорией необходимо не только попадание грибка на кожный покров, но и наличие неких предрасполагающих факторов, которые позволят ему внедриться в кожу и спровоцировать инфекцию. К ним относятся: 1. Травматические повреждения кожи; 2. Мацерация кожи; 3. Сниженный иммунитет 4. Невыполнение гигиенических мероприятий.
Интересные факты
Подъем заболеваемости микроспорией отмечается с июня до ноября, затем снижается до минимума к апрелю.
Микроспория чаще регистрируется в городах с многоэтажными домами, где бродячие животные контактируют с домашними. Заболеваемость среди безнадзорных животных достигает 50%.
Микроспория у детей у детей встречается гораздо чаще, чем у взрослых, что объясняется двумя основными факторами. Во-первых, дети чаще контактируют с больными животными, соответственно, у них выше риск заражения инфекцией. И во-вторых, сальные железы кожного покрова детей не вырабатывают кислот, обладающих губительным действием в отношении грибков. То есть грибок, попавший на кожу ребенка, вызовет микроспорию с гораздо большей вероятностью, чем у взрослого в аналогичной ситуации, поскольку после полового созревания железы начинают вырабатывать кислоты, губительно действующие на возбудителей микроспории. Немаловажно, что у детей менее развиты гигиенические навыки, чем у взрослых.
Во-первых, дети чаще контактируют с больными животными, соответственно, у них выше риск заражения инфекцией. И во-вторых, сальные железы кожного покрова детей не вырабатывают кислот, обладающих губительным действием в отношении грибков. То есть грибок, попавший на кожу ребенка, вызовет микроспорию с гораздо большей вероятностью, чем у взрослого в аналогичной ситуации, поскольку после полового созревания железы начинают вырабатывать кислоты, губительно действующие на возбудителей микроспории. Немаловажно, что у детей менее развиты гигиенические навыки, чем у взрослых.
Клиника
Инкубационный период составляет в большинстве случаев 1-2 недели.
При микроспории волосистой части головы появляются единичные 1 или 2 очага до 3-5 см в диаметре, правильной округло-овальной формы с четкими границами. Волосы в очагах становятся тусклыми, сероватыми, обломаны на одном уровне на высоте 4-6 мм, как бы подстрижены. При беглом взгляде очаги напоминают вид «серых пятен». Поверхность очагов бывает покрыта сероватыми чешуйками, будто слегка присыпаны мукой.
Поверхность очагов бывает покрыта сероватыми чешуйками, будто слегка присыпаны мукой.
При микроспории гладкой кожи очаги чаще всего наблюдаются на лице, шее, кистях, предплечьях, плечах, но могут быть и на туловище. Типичны округлые или овальные эритематосквамозные отечные пятна от 0,5 до 2-3 см в диаметре, окруженные непрерывным возвышающимся периферическим валиком, на котором определяются пузырьки, быстро подсыхающие корочки. Микроспория может поражать также пушковые волосы.
Диагностика микроспории.
Клинический диагноз микроспории обязательно должен быть подтвержден данными лабораторного исследования.
Принципы лечения включают:
- Изоляцию от больного животного;
- Прием системных противогрибковых препаратов внутрь
- Местно-мазевое противогрибковое лечение.
Принципы профилактики микроспории
- Основные меры профилактики микроспории у детей – обучение малыша правильному общению с животными: ребенок должен знать, что такие контакты могут быть небезопасным.
 Ребенок должен знать внешние признаки микроспории у животных , не допускать общения с больными животными. После того как ребенок погладил кошку или собаку, он должен помыть руки.
Ребенок должен знать внешние признаки микроспории у животных , не допускать общения с больными животными. После того как ребенок погладил кошку или собаку, он должен помыть руки.
- Недопустимо пользование чужими предметами — такими, как расческа, носовой платок и т.п. Нельзя надевать на себя чужую одежду.
- Нельзя разрешать пускать животных, особенно кошек и собак, в постель, греть их под рубашкой. После игры с ними следует сразу же вымыть руки теплой водой с мылом.
- Следует избегать контакта с бездомными животными, осматривать домашних животных, в том числе и тех, которые не контактируют с дикими, снижают риск заражения микроспорией.
- Осмотры детей в организованных коллективах (детские сады, пионерские лагеря) должны проводиться не реже 2 раз в год, с применением лампы Вуда
- При выявлении заболевания ребенка следует изолировать от других детей.
- По решению врача больной может быть направлен на лечение в специализированный стационар.
 Показаниями для госпитализации являются:
Показаниями для госпитализации являются:
— тяжелое течение заболевания и наличие сопутствующей патологии
— отсутствие эффекта от амбулаторного лечения;
— по эпидемиологическим показаниям: больные из организованных коллективов при отсутствии возможности изоляции их от здоровых лиц (например, при наличии микроспории у лиц, проживающих в интернатах, детских домах, общежитиях, дети из многодетных и асоциальных семей).
- Все вещи, принадлежавшие заболевшему ребенку, подлежат дезинфекции в паровоздушной камере, а при ее отсутствии – кипячению и глажению.
- В квартире, где был больной котенок, всю мебель, инвентарь, полы, ковры, подстилки для животных следует обработать дезинфицирующим средством, обладающих противогрибковым действием. После обработки вещей дезинфектантом их стирают горячей водой с мылом.
- Дети должны иметь индивидуальные постельные принадлежности, нательное белье, полотенца, расчески, заколки, бантики и т.д.
- Особенно опасен контакт с бродячими, и, зачастую, больными микроспорией, кошками и собаками.
 Иногда заразить ребенка может подаренная родителями обезьянка, хомячок, морская свинка, которые, хоть и редко, но также болеют этим микозом. Поэтому домашние питомцы должны периодически наблюдаться у ветеринара.
Иногда заразить ребенка может подаренная родителями обезьянка, хомячок, морская свинка, которые, хоть и редко, но также болеют этим микозом. Поэтому домашние питомцы должны периодически наблюдаться у ветеринара. - Домашние животные, больные микроспорией, подлежат полноценному лечению с осуществлением ветеринарного надзора за их излеченностью.
- В детских учреждениях, особенно в детских садах и яслях запрещается содержать каких-либо животных.
- Машинки для стрижки, ножницы, расчески в парикмахерских необходимо дезинфицировать после каждого клиента.
- Существенная роль в борьбе с микроспорией принадлежит санитарному просвещению. В специальных лекциях, стенгазетах, массовых печатных изданиях целесообразно рассказывать о путях заражения микроспорией, мерах профилактики, последствиях заболевания.
Современные методы лечения микоза стоп
Микоз стоп является одним из наиболее распространенных заболеваний в мире, склонен к рецидивирующему течению. Общеизвестно, что лечение микоза стоп наиболее эффективно на ранних стадиях болезни. Большое значение при этом имеет четкое соблюдение схемы применения противогрибковых средств, которая должна отвечать научным достижениям в сфере доказательной медицины. Микоз стоп, более известный как «грибок» — инфекционное заболевание с преимущественным поражением кожи подошв и межпальцевых складок. Причиной его является грибковая флора. Микоз стоп является очень контагиозным заболеванием – заражение зачастую происходит при посещении общих душевых комнат, бани, бассейнов.
Общеизвестно, что лечение микоза стоп наиболее эффективно на ранних стадиях болезни. Большое значение при этом имеет четкое соблюдение схемы применения противогрибковых средств, которая должна отвечать научным достижениям в сфере доказательной медицины. Микоз стоп, более известный как «грибок» — инфекционное заболевание с преимущественным поражением кожи подошв и межпальцевых складок. Причиной его является грибковая флора. Микоз стоп является очень контагиозным заболеванием – заражение зачастую происходит при посещении общих душевых комнат, бани, бассейнов.
Лечение микоза стоп – основные принципы современной терапии
Симптомы микоза стоп разнообразные: от сухости и шелушения кожи до глубоких поражений всех её слоев, что зависит как от вида возбудителя, так и от преморбидного фона человека.
Но вне зависимости от этих факторов, существует правило: чем раньше начать терапию микоза стоп – тем выше ее эффективность.
Лечение микоза стоп:
• Наружные противогрибковые средства: основные принципы терапии
• Мазь, крем, спрей в лечении микоза – что выбрать
• Системные противогрибковые средства: принципы применения
• Преимущества комбинированной терапии микоза стоп
Читайте нас в Telegram.
Наружные противогрибковые средства: основные принципы терапии
Противогрибковые средства существуют в формах для наружного (крем, мазь, спрей) и внутреннего (таблетки, капсулы) применения. Выбор формы препарата или же их комбинация зависит от локализации и стадии микоза стоп.
Показания к назначению наружных противогрибковых средств:
1. Локализация поражения: кожа подошвы и межпальцевых складок.
2. Анамнез заболевания не превышает 3 месяца.
3. Пациент ранее не применял других противогрибковых средств.
Классификация действующих веществ препаратов для наружного применения по их химической составляющей:
1. Азолы: клотримазол;
2. Аллиламины: тербинафин;
3. Другие: хлорнитрофенол;
Кратность нанесения противогрибкового средства: 2-3 раза в день соответственно инструкции к применению. Длительность лечения микоза в каждом случае устанавливается врачом индивидуально, но, как правило, составляет не менее 4 недель.
Мазь, крем, спрей в лечении микоза – что выбрать
При выборе формы выпуска препарата (крем, мазь, спрей) необходимо учитывать, что мазь, имея в своем составе большое количество жиров, обладает наибольшей степенью проникновения. Наносить ее нужно тонким слоем на сухие и шелушащиеся участки кожи. Основой крема же есть водопроницаемое вещество, что делает его наиболее подходящим для нанесения на мокнущие зоны, например, при дисгидротической форме микоза стоп. Что касается спрея, его использование целесообразно только на ранних стадиях развития микоза стоп, поскольку спрей не обладает глубокой проницаемостью.
Системные противогрибковые средства: принципы применения
Системные противогрибковые средства существуют в форме таблеток и капсул. При этом достижение лечебного эффекта происходит за счет всасывания действующего вещества в желудочно-кишечном тракте в общий кровоток и дальнейшего создания терапевтической концентрации во всех тканях и биологических жидкостях организма.
Показания к назначению системных противогрибковых средств:
1. Неэффективность местной монотерапии микоза стоп;
2. Продолжительность заболевания более 3 месяцев;
Классификация действующих веществ препаратов для внутреннего применения по их химической составляющей:
1. Азолы: производительные имидазола.
2. Аллиламины: тербинафин.
Невзирая на большое количество исследований, нет никаких доказательств в пользу выбора той или иной группы системных противогрибковых средств, но все же стоит учитывать некоторые их особенности:
1. Препараты группы азолов имеют фунгистатический эффект, тогда как аллиламины – фунгицидный.
2. Азолы имеют биодоступность больше, нежели аллиламины, но это гораздо чаще приводит к поражению печени.
3. Азолы существуют только в пероральных формах, тогда как аллиламины существуют в форме для наружного и системного применения.
Кратность применения препаратов – 1 раз в день, длительность лечения микоза в среднем составляет от 2 до 6 недель в зависимости от тяжести заболевания. Препарат должен приниматься в одно и то же время суток, при этом отсутствие комплаенса (пропуски, несвоевременный прием, самопроизвольное завершение лечения микоза) может привести к развитию резистентной грибковой флоры, терапия которой потребует немалых усилий.
Препарат должен приниматься в одно и то же время суток, при этом отсутствие комплаенса (пропуски, несвоевременный прием, самопроизвольное завершение лечения микоза) может привести к развитию резистентной грибковой флоры, терапия которой потребует немалых усилий.
Преимущества комбинированной терапии микоза стоп
Комбинированная схема сочетает в себе одновременное применение местных и системных противогрибковых средств. Она есть терапией выбора при сочетании микоза стоп с онихомикозом, или же при отсутствии эффекта от предыдущего лечения. Ее преимуществом является возможность применения одного действующего вещества (например, тербинафина) как перорально, так и местно. Это дает возможность использования более низких доз препаратов системного действия, нежели при пероральной монотерапии, что минимизирует побочные действия без потери эффективности. При этом лечение микоза должно продолжаться еще неделю после исчезновения всех проявлений заболевания.
Успех в лечении микоза стоп напрямую зависит от правильно подобранной схемы терапии в каждом индивидуальном случае. Необходимо всегда учитывать потенциальную угрозу развития тяжелых побочных эффектов противогрибковых средств. В то же время, несоблюдение режима приема или недостаточная доза препарата может повлечь за собой развитие резистентности. Поэтому в лечении микоза стоп важно ответственно подходить к назначению той или иной формы препарата, учитывая особенности каждого клинического случая.
Необходимо всегда учитывать потенциальную угрозу развития тяжелых побочных эффектов противогрибковых средств. В то же время, несоблюдение режима приема или недостаточная доза препарата может повлечь за собой развитие резистентности. Поэтому в лечении микоза стоп важно ответственно подходить к назначению той или иной формы препарата, учитывая особенности каждого клинического случая.
Виды и лечение микозов (стр. 3 из 8)
Руброфития крупных складок (пахово‑бедренных, подмышечных), часто распространяется далеко за их пределы, сопровождается зудом.
Диагноз руброфитии основывается на клинической картине, данных микроскопического исследования чешуек, пушковых волос, ногтей. Окончательно подтверждает диагноз культуральное исследование. Очаги руброфитии гладкой кожи дифференцируют с псориазом, красным плоским лишаем, герпетиформным дерматитом Дюринга, красной волчанкой и др.
Очаги руброфитии гладкой кожи дифференцируют с псориазом, красным плоским лишаем, герпетиформным дерматитом Дюринга, красной волчанкой и др.
Лечение микозов стоп (эпидермофитии стоп. рубромикоза) обычно состоит из 2 этапов: подготовительного и основного. Цель подготовительного этапа – удаление чешуек и роговых наслоений при сквамозно‑гиперкератотической форме и устранение островоспалительных явлений при интертригинозной и дисгидротической, особенно при их экзематизации. Для удаления чешуек и роговых наслоений в зависимости от их интенсивности используют различные кератолитические средства и методы. Более эффективна отслойка по Арисвичу: на подошвы на 2 сут под компресс наносят мазь, содержащую 12 г салициловой кислоты, 6 г молочной кислоты и 82 г вазелина. При необходимости отслойку проводят повторно. Хороший эффект дает молочно‑салициловый коллодий (молочной и салициловой кислоты по 10 г, коллодия 80 г), которым смазывают подошвы утром и вечером в течение 6–8 дней, затем на ночь под компресс наносят 5% салициловый вазелин, после чего назначают ножные мыльно‑содовые ванны и отслаивающийся эпидермис удаляют пемзой. Островоспалительные явления и экзематизацию при интертригинозном и дисгидротическом вариантах микозов стоп устраняют по принципам лечения острой экземы. Основной этап лечения микозов стон – назначение антимикотических препаратов: ламизила (крем), микозолона, клотримазола (крем, раствор), микополицида, нитрофунгина, микосептина, жидкости Кастеллани (фукорпин) и др. Лечение онихомикозов представляет трудную задачу. Ламизил (тербинафин) дает высокий уровень излечения за 6–12 нед при поражении ногтей пальцев кистей и 12–30 нед – ногтей пальцев стоп. Препарат принимают внутрь по 250 мг, местное лечение не проводится.
Островоспалительные явления и экзематизацию при интертригинозном и дисгидротическом вариантах микозов стоп устраняют по принципам лечения острой экземы. Основной этап лечения микозов стон – назначение антимикотических препаратов: ламизила (крем), микозолона, клотримазола (крем, раствор), микополицида, нитрофунгина, микосептина, жидкости Кастеллани (фукорпин) и др. Лечение онихомикозов представляет трудную задачу. Ламизил (тербинафин) дает высокий уровень излечения за 6–12 нед при поражении ногтей пальцев кистей и 12–30 нед – ногтей пальцев стоп. Препарат принимают внутрь по 250 мг, местное лечение не проводится.
Более обширным спектром (включая плесневые грибы, которые нередко включаются как микстинфекция) обладает орунгал, который назначается внутрь по 400 мг в сутки в течение 7 дней, затем через интервал в 3 нед такой цикл повторяют еще 1 (для ногтей рук) – 2 (для ногтей стоп) раза (метод пульс‑терапии). Местное лечение не требуется.
Первые контрольные микологические исследования (микроскопия и посев) производят после 6 нед лечения онихомикоза кистей и 12 нед – онихомикоза стоп. Препараты фунгистатического действия – гризеофульвин и кетоконазол (низорал) – при онихоми козах применяют в комбинации с местным лечением. Гризеофульвин в 1‑й месяц лечения назначают по 6–8 таблеток в сутки, во 2‑й – в такой же дозе через день, а затем вплоть до отрастания здоровых ногтей 2 раза в неделю. При лечении гризеофульвином возможны головные боли, головокружения, боли в области сердца, желудочно‑кишечные расстройства (тошнота, рвота, боли в области живота, частый и жидкий стул), токсидермии. Низорал (кетоконазол) принимают по 1 таблетке (200 мг) в сутки в течение 6–8 мес и более. Осложнения и побочные явления редки, в 10–14% случаев развивается транзиторное повышение печеночных ферментов без клинических проявлений нарушения функции печени; возможны гепатиты, эндокринопатия. Местное лечение онихомикоза включает удаление ногтей хирургическим путем или путем повторного наложения кератолитических пластырей, обычно уреапласта (мочевины 20 г, воды 10 мл, воска 5 г, ланолина 20 г, свинцового пластыря 45 г).
Препараты фунгистатического действия – гризеофульвин и кетоконазол (низорал) – при онихоми козах применяют в комбинации с местным лечением. Гризеофульвин в 1‑й месяц лечения назначают по 6–8 таблеток в сутки, во 2‑й – в такой же дозе через день, а затем вплоть до отрастания здоровых ногтей 2 раза в неделю. При лечении гризеофульвином возможны головные боли, головокружения, боли в области сердца, желудочно‑кишечные расстройства (тошнота, рвота, боли в области живота, частый и жидкий стул), токсидермии. Низорал (кетоконазол) принимают по 1 таблетке (200 мг) в сутки в течение 6–8 мес и более. Осложнения и побочные явления редки, в 10–14% случаев развивается транзиторное повышение печеночных ферментов без клинических проявлений нарушения функции печени; возможны гепатиты, эндокринопатия. Местное лечение онихомикоза включает удаление ногтей хирургическим путем или путем повторного наложения кератолитических пластырей, обычно уреапласта (мочевины 20 г, воды 10 мл, воска 5 г, ланолина 20 г, свинцового пластыря 45 г). Пластырь наносят на 2 сут, затем проводят «чистку» ложа с помощью лезвия безопасной бритвы. В дальнейшем обнаженное ложе обрабатывают разнообразными антимикотическими средствами (салициловой кислоты и чистого йода по 1 г, димексида 1 мл, дистиллированной воды 9 мл; салициловой кислоты и чистого йода по 1 г, димексида 3 мл, дистиллированной воды 7 мл: онихофисан и др.). После хирургического удаления в течение 1‑й недели ложе обрабатывают солкосериловой мазью с добавлением 3% кетоконазола (низорала). В амбулаторных условиях при небольшом числе пораженных ногтей можно рекомендовать ежедневное их механическое стачивание в течение длительного времени с последующим пропитыванием фунгицидными жидкостями (салициловой кислоты и чистого йода по 1 г, димексида 30 мл), лаками лоцерил, батрафен. При эпидермофитии и руброфитии складок, а также ограниченной руброфитии гладкой кожи показаны кремы ламизил, микозолон, тридерм, клотримазол, низорал и другие антимикотические средства. При генерализованных формах руброфитии и поражении пушковых волос наружное лечение следует сочетать с пероральным применением орунгала, ламизила или низорала.
Пластырь наносят на 2 сут, затем проводят «чистку» ложа с помощью лезвия безопасной бритвы. В дальнейшем обнаженное ложе обрабатывают разнообразными антимикотическими средствами (салициловой кислоты и чистого йода по 1 г, димексида 1 мл, дистиллированной воды 9 мл; салициловой кислоты и чистого йода по 1 г, димексида 3 мл, дистиллированной воды 7 мл: онихофисан и др.). После хирургического удаления в течение 1‑й недели ложе обрабатывают солкосериловой мазью с добавлением 3% кетоконазола (низорала). В амбулаторных условиях при небольшом числе пораженных ногтей можно рекомендовать ежедневное их механическое стачивание в течение длительного времени с последующим пропитыванием фунгицидными жидкостями (салициловой кислоты и чистого йода по 1 г, димексида 30 мл), лаками лоцерил, батрафен. При эпидермофитии и руброфитии складок, а также ограниченной руброфитии гладкой кожи показаны кремы ламизил, микозолон, тридерм, клотримазол, низорал и другие антимикотические средства. При генерализованных формах руброфитии и поражении пушковых волос наружное лечение следует сочетать с пероральным применением орунгала, ламизила или низорала.
Профилактика микозов стоп должна заключаться в первую очередь в дезинфекции полов в банях, душевых установках, раздевальнях при плавательных бассейнах и спортивных залах в конце каждого рабочего дня (лучше всего кипятком или 1–2% хлорной известью). Вода в плавательных бассейнах подлежит обязательному хлорированию и регулярной смене; в идеале она должна быть проточной. Деревянные решетки необходимо исключить из обихода, заменив их резиновыми ковриками, легко поддающимися дезинфекционной обработке. На предприятиях, где условия работы требуют ежедневного душа, все рабочие должны быть обеспечены индивидуальными резиновыми или пластмассовыми тапочками. Подобными тапочками необходимо пользоваться также при посещении бань и плавательных бассейнов. Очень важно строго контролировать санитарное состояние маникюрных и педикюрных кабинетов с обязательной дезинфекцией инструментов после каждого клиента, проводить регулярные осмотры работников бань, плавательных бассейнов и душевых установок для исключения заболеваемости микозами стоп. Не следует пользоваться общей обувью, носками и чулками.
Не следует пользоваться общей обувью, носками и чулками.
ПАХОВАЯ ЭПИДЕРМОФИТИЯ
Паховая эпидермофития – дерматомикоз, поражающий эпидермис, реже ногти.
Этиология и патогенез. Возбудитель – грибок Epidermophyton floccosum, в чешуйках кожи и частицах ногтей грибок выявляют в виде септированного ветвящегося короткого (2–4 мкм) мицелия и располагающихся цепочками прямоугольных артроспор. На среде Сабуро колонии имеют округлую форму, желтоватый цвет и пушистую консистенцию. Заражение происходит через предметы обихода, используемые больным (мочалки, клеенки, термометры, белье), а также при несоблюдении правил гигиены в банях, душевых, бассейнах. Развитию заболевания способствуют повышенное потоотделение, высокая температура и влажность окружающей среды, повреждение и мацерация кожи. Болеют чаще мужчины.
Клиническая картина характеризуется появлением на коже шелушащихся розовых пятен до 1 см в диаметре, постепенно разрастающихся по периферии при одновременном уменьшении (вплоть до разрешения) воспалительных явлений в центре, в связи с чем формируются крупные (до 10 см в диаметре) кольцевидные воспалительные пятна красного цвета, образующие при слиянии фестончатые очаги. Границы очагов резкие, подчеркнуты отечным ярким гиперемированным воспалительным валиком с пузырьками и мелкими пустулами на его поверхности. Наиболее часто поражаются паховые области (что отражено в названии микоза), мошонка, внутренние поверхности бедер, реже межъягодичная складка, подмышечные области, складки под молочными железами. Гораздо реже поражаются межпальцевые промежутки стоп и совсем редко – ногти. Беспокоит зуд.
Границы очагов резкие, подчеркнуты отечным ярким гиперемированным воспалительным валиком с пузырьками и мелкими пустулами на его поверхности. Наиболее часто поражаются паховые области (что отражено в названии микоза), мошонка, внутренние поверхности бедер, реже межъягодичная складка, подмышечные области, складки под молочными железами. Гораздо реже поражаются межпальцевые промежутки стоп и совсем редко – ногти. Беспокоит зуд.
Диагноз основывается на клинической картине и обнаружении возбудителя при микроскопическом исследовании чешуек кожи, ногтей. Окончательно подтверждает диагноз культуральное исследование. Дифференциальный диагноз проводят с эритразмой, рубромикозом, псориазом, кандидозом.
Лечение: в остром периоде используют примочки из 0,25% раствора нитрата серебра, 1% раствора резорцина, мази микозолон, тридерм, внутрь назначают антигистаминные препараты, после ликвидации везикуляции используют 2% йодную настойку, 3–5% серно‑дегтярную мазь, а также официнальные антимикотические наружные средства – микосептин, ламизил, клотримазол, низорал и др.
Профилактика заключается в соблюдении правил личной гигиены, борьбе с потливостью. Общественная профилактика, как при микозах стоп.
МИКРОСПОРИЯ
Микроспория – контагиозная дерматофития, поражающая гладкую кожу, волосистую часть головы, длинные и пушковые волосы.
Этиология и патогенез. Заболевание вызывается грибами рода Microsporum, имеющими мелкие споры. Этиологическая роль различных видов рода Microsporum в патологии человека и животных неоднозначна. На территории России микроспория вызывается зоофильным М. canis и более контагиозным, хотя и менее распространенным, антропофильным М. ferrugineum. Основными источниками М. canis служат кошки (особенно котята) и собаки, передача возбудителя от которых происходит обычно при непосредственном контакте; заражение возможно через предметы и вещи, загрязненные чешуйками и волосами, содержащими грибы. Источником М. ferrugineum является только больной человек, чаще ребенок. Пути передачи зоофильных и антропофильных микроспорумов от больного человека здоровому в семье, парикмахерских и детских коллективах такие же, что и возбудителей поверхностной трихофитии. Микроспория – болезнь детского возраста, встречается у детей от 4 до 11 лет, но могут болеть молодые женщины с тонкой и нежной кожей. В развитии заболевания имеют значение гиповитаминозы, иммунодефицитные состояния, несоблюдение правил личной гигиены. Инкубационный период составляет 3–7 дней.
Микроспория – болезнь детского возраста, встречается у детей от 4 до 11 лет, но могут болеть молодые женщины с тонкой и нежной кожей. В развитии заболевания имеют значение гиповитаминозы, иммунодефицитные состояния, несоблюдение правил личной гигиены. Инкубационный период составляет 3–7 дней.
Клиническая картина. При микроспории волосистой части головы формируются округлые, резко отграниченные крупные (диаметром до 2–3 см и более) очаги, поверхность которых покрыта наслоением довольно плотно сидящих отрубевидных чешуек серовато‑белого цвета на фоне слабо выраженной эритемы. Наиболее характерным ее признаком является сплошное обламывание волос в очаге примерно на высоте 3–5 мм над кожей: пораженные волосы – это отчетливо заметно даже невооруженному глазу – окружены, как муфтой, серовато‑белым надетом, состоящим, что выявляется при микроскопическом исследовании, из мелких (типа манной крупы) спор гриба, окружающих волос (эктотрикс). При микроспории волосистой части головы, вызываемой М. ferrugineum, возникают множественные очаги небольшой величины, неправильных очертаний, с нечеткими границами. Преимущественная локализация очагов поражения – краевая зона волосистой части головы с нередким распространением на гладкую кожу. Обламывание волос происходит на уровне 6–8 мм. Клинически микроспория гладкой кожи характеризуется слабовоспалительными розовыми шелушащимися пятнами диаметром 0,5–2 см с четкими границами, по мере их роста центральная часть пятен светлеет, а в периферической зоне могут быть видны немногочисленные папулезные и папуловезикулезные элементы. В дальнейшем в центре таких кольцевидных элементов может образоваться новое кольцо (двойное, тройное), высыпания растут и быстро диссеминируют по коже (особенно после мытья). Очаги поражения чаще локализуются на туловище, лице, верхних конечностях. Микотический процесс распространяется на пушковые волосы.
ferrugineum, возникают множественные очаги небольшой величины, неправильных очертаний, с нечеткими границами. Преимущественная локализация очагов поражения – краевая зона волосистой части головы с нередким распространением на гладкую кожу. Обламывание волос происходит на уровне 6–8 мм. Клинически микроспория гладкой кожи характеризуется слабовоспалительными розовыми шелушащимися пятнами диаметром 0,5–2 см с четкими границами, по мере их роста центральная часть пятен светлеет, а в периферической зоне могут быть видны немногочисленные папулезные и папуловезикулезные элементы. В дальнейшем в центре таких кольцевидных элементов может образоваться новое кольцо (двойное, тройное), высыпания растут и быстро диссеминируют по коже (особенно после мытья). Очаги поражения чаще локализуются на туловище, лице, верхних конечностях. Микотический процесс распространяется на пушковые волосы.
Ведение больных с микозами гладкой кожи, складок, кистей и стоп
Введение
Дерматофиты – грибы, поражающие ороговевающие ткани (кожу, волосы и ногти) и растущие на них, вызывая инфекцию. По происхождению дерматофиты подразделяют на три группы: трихофиты (вызывающие заболевания кожи, волос и ногтей), эпидермофиты (вызывающие заболевания кожи и ногтей) и микроспорумы (поражающие кожу и волосы). По типу заражения их разделяют на антропофильные, зоофильные и геофильные. И наконец, в зависимости от места поражения, их клинически классифицируют как микозы кожи головы, лица, бороды, туловища, ладоней, паховой области, стоп и ногтей. Другие клинические варианты включают черепитчатый лишай, псевдочерепитчатый лишай и гранулему Майокки.
По происхождению дерматофиты подразделяют на три группы: трихофиты (вызывающие заболевания кожи, волос и ногтей), эпидермофиты (вызывающие заболевания кожи и ногтей) и микроспорумы (поражающие кожу и волосы). По типу заражения их разделяют на антропофильные, зоофильные и геофильные. И наконец, в зависимости от места поражения, их клинически классифицируют как микозы кожи головы, лица, бороды, туловища, ладоней, паховой области, стоп и ногтей. Другие клинические варианты включают черепитчатый лишай, псевдочерепитчатый лишай и гранулему Майокки.
Несмотря на растущую заболеваемость дерматофитиями во всем мире, особенно в тропиках, исследованиями в этой области часто пренебрегали. В самом деле, чтобы найти руководство по лечению микозов гладкой кожи туловища и паховых складок нужно обратиться к исследованиям двадцатилетней давности (по данным Американской Академии Дерматологии), да и те в современном мире утратили актуальность. Более современные руководящие принципы лечения, опубликованные Британской Ассоциацией Дерматологии и в British Medical Journal, в основном посвящены лечению микозов кожи головы и ногтей, с редкими упоминаниями микозов кожи туловища/паха. Обновленные Кокрейновские обзоры по применению топической терапии микозов гладкой кожи туловища, паха и стоп, и некоторые другие о пероральной терапии помогли восполнить пробелы в знаниях, но хорошо организованные исследования, национальные или международные руководства, основанные на принципах доказательной медицины, рекомендации по дозировкам и продолжительности лечения системными антимикотиками при микозах кожи туловища и паховых складок все еще отсутствуют. Данный обзор нацелен на то, чтобы еще раз осветить эту важную тему, и детально рассматривает новейшие подходы к изучению патофизиологии и лечению микозов гладкой кожи, подчеркивая отсутствие ясности в некоторых аспектах терапии.
Обновленные Кокрейновские обзоры по применению топической терапии микозов гладкой кожи туловища, паха и стоп, и некоторые другие о пероральной терапии помогли восполнить пробелы в знаниях, но хорошо организованные исследования, национальные или международные руководства, основанные на принципах доказательной медицины, рекомендации по дозировкам и продолжительности лечения системными антимикотиками при микозах кожи туловища и паховых складок все еще отсутствуют. Данный обзор нацелен на то, чтобы еще раз осветить эту важную тему, и детально рассматривает новейшие подходы к изучению патофизиологии и лечению микозов гладкой кожи, подчеркивая отсутствие ясности в некоторых аспектах терапии.
Изменяющаяся эпидемиология дерматофитий
Дерматофиты – наиболее частые возбудители поверхностных грибковых инфекций во всем мире, распространенные в развивающихся странах, особенно тропических и субтропических, таких как Индия, где температура воздуха и относительная влажность высоки. Другие факторы, такие как рост урбанизации, ношение тесной обуви и обтягивающей одежды тоже увеличивают риск заболевания. За последние несколько лет исследования эпидемиологии дерматофитий в разных регионах Индии выявили тенденцию к учащению заболеваемости кожными дерматофитиями в связи с изменением спектра инфекции и выделением некоторых редких видов. Trichophytonrubrum остается самым распространенным изолятом, а микозы кожи туловища и паховой области – наиболее распространенными заболеваниями, согласно относительно масштабным исследованиям из Ченнаи и Раджастана. Впрочем, по результатам исследований из Лакхнау и Нью Дели, Trichophytonmentagrophytes и Miscrosporum audouinii являются наиболее часто встречающимися изолятами. Некоторые исследования также сообщают о выделении редких видов, таких как Microsporum gypseum, в неэндемичной части света.
Другие факторы, такие как рост урбанизации, ношение тесной обуви и обтягивающей одежды тоже увеличивают риск заболевания. За последние несколько лет исследования эпидемиологии дерматофитий в разных регионах Индии выявили тенденцию к учащению заболеваемости кожными дерматофитиями в связи с изменением спектра инфекции и выделением некоторых редких видов. Trichophytonrubrum остается самым распространенным изолятом, а микозы кожи туловища и паховой области – наиболее распространенными заболеваниями, согласно относительно масштабным исследованиям из Ченнаи и Раджастана. Впрочем, по результатам исследований из Лакхнау и Нью Дели, Trichophytonmentagrophytes и Miscrosporum audouinii являются наиболее часто встречающимися изолятами. Некоторые исследования также сообщают о выделении редких видов, таких как Microsporum gypseum, в неэндемичной части света.
Патогенез дерматофитий
Генетика дерматофитий
Не все люди одинаково предрасположены к грибковым инфекциям даже при совпадении факторов риска. Доказано существование семейной или генетической предрасположенности, которая может быть опосредована специфическими дефектами врожденного и адаптивного иммунитета. Одной из первых грибковых инфекций, генетическая склонность к которым была установлена, была Токелау, или черепитчатый лишай. Согласно Jaradat et al., пациенты с низким уровнем дефензина бета 4 предрасположены ко всем видам дерматофитий.
Доказано существование семейной или генетической предрасположенности, которая может быть опосредована специфическими дефектами врожденного и адаптивного иммунитета. Одной из первых грибковых инфекций, генетическая склонность к которым была установлена, была Токелау, или черепитчатый лишай. Согласно Jaradat et al., пациенты с низким уровнем дефензина бета 4 предрасположены ко всем видам дерматофитий.
Патогенез дерматофитий включает в себя сложные взаимодействия между организмом пациента, возбудителем заболевания и окружающей средой. Факторы которые располагают к такой инфекции – сопутствующие заболевания, такие как сахарный диабет, лимфомы, иммунокомпрометированный статус или синдром Кушинга, пожилой возраст, что может привести к тяжелой, захватывающей обширные участки кожи и трудно поддающейся лечению дерматофитии. Некоторые зоны кожи более подвержены развитию дерматофитии, например области, склонные к опрелости (складки), где обильное потоотделение, мокнутие и щелочной pH способствуют росту грибка. После попадания на кожу больного, инфекция развивается, пользуясь подходящими условиями среды, постепенно внедряется в кожу – этот процесс опосредован протеазами, сериновыми субтилиназами и фунголизином, которые вызывают расщепление кератиновой сети до олигопептидов или аминокислот и являются мощными иммуногенными стимулами. К тому же, маннаны, выделяемые T. rubrum, приводят к ингибированию лимфоцитов. Сниженное функционирование клеток Th27 приводит к уменьшению выделения интерлейкина-17 (IL-17), IL-22 (ключевого цитокина для борьбы с микозами слизистых оболочек), что в свою очередь ведет к персистированию заболевания.
После попадания на кожу больного, инфекция развивается, пользуясь подходящими условиями среды, постепенно внедряется в кожу – этот процесс опосредован протеазами, сериновыми субтилиназами и фунголизином, которые вызывают расщепление кератиновой сети до олигопептидов или аминокислот и являются мощными иммуногенными стимулами. К тому же, маннаны, выделяемые T. rubrum, приводят к ингибированию лимфоцитов. Сниженное функционирование клеток Th27 приводит к уменьшению выделения интерлейкина-17 (IL-17), IL-22 (ключевого цитокина для борьбы с микозами слизистых оболочек), что в свою очередь ведет к персистированию заболевания.
Иммунология дерматофитий
Иммунный ответ на инфекцию, вызванную дерматофитами варьируется от неспецифического механизма до гуморального и клеточного иммунного ответа. Принятое сегодня мнение заключается в том что клеточно-опосредованный механизм иммунного ответа отвечает за контроль над дерматофитиями.
Врожденный иммунный ответ
Дерматофиты содержат в клеточной стенке молекулы углеводов (бета-глюкан), которые узнаются врожденными иммунными механизмами, такими как дектин-1 и дектин-2, которые активируют толл-подобные рецепторы 2 и 4 (TLR-2 и TLR-4). Дектин-1 амплифицирует синтез фактора опухолевого некроза – фактора-альфа и IL-17, IL-6 и IL-10, каждый из которых стимулирует адаптивный иммунитет. Кератиноциты в присутствии антигенов дерматофитов, таких как трихофитин, высвобождают IL-8, сильный нейтрофильный хемоаттрактант. Новейшие исследования указывают на участие TLR-2 и TLR-4 в локализованныз и рассеянных дерматофитиях из-за T.rubrum. Сниженная экспрессия TLR-4 в нижних и верхних слоях эпидермиса у пациентов с локализованной и рассеянной дерматофитией являлась отличием больных от контрольной группы. Экспрессия TLR-2 была сохранена в эпидермисе всех трех групп.
Дектин-1 амплифицирует синтез фактора опухолевого некроза – фактора-альфа и IL-17, IL-6 и IL-10, каждый из которых стимулирует адаптивный иммунитет. Кератиноциты в присутствии антигенов дерматофитов, таких как трихофитин, высвобождают IL-8, сильный нейтрофильный хемоаттрактант. Новейшие исследования указывают на участие TLR-2 и TLR-4 в локализованныз и рассеянных дерматофитиях из-за T.rubrum. Сниженная экспрессия TLR-4 в нижних и верхних слоях эпидермиса у пациентов с локализованной и рассеянной дерматофитией являлась отличием больных от контрольной группы. Экспрессия TLR-2 была сохранена в эпидермисе всех трех групп.
Адаптивный иммунный ответ
- Гуморальный иммунитет: гуморальный иммунитет не защищает от дерматофитий. У пациентов с хронической формой дерматофитии отмечается высокий уровени IgE и IgG4, что отвечает за положительный (IgE-опосредованный) результат IH теста на трихофитон. С другой стороны, у пациентов с положительным тестом на гиперчувствительность замедленного типа отмечается пониженный уровень Ig.
 IH тест на трихофитон ассоциируют с наличием сывороточных IgE и IgG (в основном IgG4) против антигенов тихофитона, маркеров Th3 ответа. Здесь IL-4, произведенный CD4 T-клетками (Th3 клетками) индуцирует переключение изотипа антител на IgG4 и IgE.
IH тест на трихофитон ассоциируют с наличием сывороточных IgE и IgG (в основном IgG4) против антигенов тихофитона, маркеров Th3 ответа. Здесь IL-4, произведенный CD4 T-клетками (Th3 клетками) индуцирует переключение изотипа антител на IgG4 и IgE. - Клеточный иммунитет. Некоторые эксперименты показали что борьба с дерматофитией опосредована DTH. Иммунитет к патогенам возможно регулируется клетками Th2 или Th3, которые определяют дальнейший путь развития инфекции. Острый воспалительный ответ коррелирует с положительным результатом DTH теста на трихофитин и последующим излечением от заболевания, в то время как хроническая инфекция характеризуется высоким уровнем IH и низким – DTH.
Неспецифический ответ
Было установлено, что ненасыщенный трансферрин ингибирует дерматофиты, связывая их гифы. Комменсальный питироспорум способствует липолизу и увеличивает запас жирных кислот доступных для ингибирования роста грибка.
Диагноз дерматофитий
Лабораторные исследования
Для точности результатов лабораторных исследований критическое значение имеет качество и количество исследуемого материала. Соскоб должен быть взят на границе здоровой и пораженной кожи и транспортирован в предварительно стерилизованной черной диаграммной бумаге, которая предотвращает намокание материала, а следовательно и рост бактерий. Ниже приведены различные лабораторные анализы, которые могут быть проведены для подтверждения диагноза дерматофития.
1. Прямое микроскопическое исследование: Обработка образца кожи 10–20% раствором гидроксида калия (KOH) – быстрый и недорогой подручный метод, позволяющий подтвердить наличие инфекции, вызванной дерматофитами. Положительный результат на соскобе характеризуется наличием преломляющих свет, длинных, гладких, ундулирующих, ветвящихся и септированных гифальных нитей с (или без) артроконидиоспорами. Ложноотрицательный результат наблюдается в 15% случаев. Окрашивание флюоресцентными красителями (диаминостилбен) является наиболее точным методом позволяющим микроскопически определить наличие грибка в кожных чешуйках и образцах ногтей и кожи. Эти вещества связываются с хитином, основным компонентом клеточной стенки гриба.
Эти вещества связываются с хитином, основным компонентом клеточной стенки гриба.
2. Культура и чувствительность к противогрибковым препаратом:: Декстрозный агар Сабуро (SDA, 4% пептон, 1% глюкоза, агар, вода) наиболее часто используемая элективная среда для дерматофитов, на этой среде основано большинство морфологических описаний. Развитие колонии занимает 7–14 дней. Модифицированный, с добавлением гентамицина, хлорамфеникола и циклогексамида ингибирует рост грибов-сапрофитов. Селективная среда дерматофитов – альтернатива элективным средам, содержащим pH индикатор феноловый красный. Она инкубируется при комнатной температуре в течение 5–14 дней. Дерматофиты утилизируют белок, приводя к выделению избытка ионов аммония и щелочной среде, из-за чего среда меняет цвет с желтого на ярко-красный.
Определение чувствительности к антимикотикам
1. Метод микродилюции: Метод микродилюции бульона для определения чувствительности к антимикотикам был изначально разработан как модификация стандартного метода Clinical and Laboratory Standards Institute M38-A2. Конечная концентрация используемого тербинафина и итраконазола – 0.06–32.0 μг/мл, флюконазола – 0.13–64.0 μг/мл. Стандартизированный инокулюм готовится путем микроскопического подсчета микроконидий. Культура растет на скошенном SDA в течение 7 дней при температуре 35°C для получения конидий. Стерильный нормальный солевой раствор (85%) добавляется на скошенный агар, и по культуре аккуратно проводят аппликатором с ватным кончиком для отделения конидий от гиф. Суспензия переносится в стерильную колбу для центрифугирования, и объем доводят до 5 мл стерильным нормальным солевым раствором. Полученную суспензию измеряют гемацитометром и разводят на среде RPMI 1640 до необходимой концентрации. Чашки засеваются в соответствии с эталонным методом. Чашки инкубируются при температуре 35°C и визуально оцениваются на 4 день инкубации. Минимальная ингибирующая концентрация определяется по той концентрации, при которой рост организмов ингибируется на 80% по сравнению с контролем.
Конечная концентрация используемого тербинафина и итраконазола – 0.06–32.0 μг/мл, флюконазола – 0.13–64.0 μг/мл. Стандартизированный инокулюм готовится путем микроскопического подсчета микроконидий. Культура растет на скошенном SDA в течение 7 дней при температуре 35°C для получения конидий. Стерильный нормальный солевой раствор (85%) добавляется на скошенный агар, и по культуре аккуратно проводят аппликатором с ватным кончиком для отделения конидий от гиф. Суспензия переносится в стерильную колбу для центрифугирования, и объем доводят до 5 мл стерильным нормальным солевым раствором. Полученную суспензию измеряют гемацитометром и разводят на среде RPMI 1640 до необходимой концентрации. Чашки засеваются в соответствии с эталонным методом. Чашки инкубируются при температуре 35°C и визуально оцениваются на 4 день инкубации. Минимальная ингибирующая концентрация определяется по той концентрации, при которой рост организмов ингибируется на 80% по сравнению с контролем.
2. Определение минимальной фунгицидной концентрации (MFC): Для определения MFC, 100-μл аликвоты забираются из лунок, где не наблюдается роста после конца периода инкубации, и высеваются на чашки с SDA. Чашки инкубируются при температуре 30°C в течение 7 дней. MFC определяется по наименьшей концентрации лекарства, при которой не наблюдается видимого роста грибка или образования колоний
Чашки инкубируются при температуре 30°C в течение 7 дней. MFC определяется по наименьшей концентрации лекарства, при которой не наблюдается видимого роста грибка или образования колоний
· 3. Идентификация дерматофита: Заключение может быть сделано на основание колониальных свойств, микроскопической морфологии и физиологических тестов. Дерматофиты могут быть идентифицированы основываясь на морфологии их макроконидий. Лишь немного физиологических тестов позволяют удостовериться в том что перед исследователем тот или иной вид. Помимо этого, особая потребность в аминокислотах и витаминах позволяет отличить один вид Trichophyton от другого. Способность к гидролизу мочевины отличает T. mentagrophytes (уреаза+) от T. rubrum (уреаза -).
Гистопатология
Гистологическое исследование можно использовать в диагностике гранулемы Майокки, при которой KOH-тест поверхностных чешуек чаще дает отрицательный результат. При наличии, гифы могут быть заметны в роговом слое при окраске гематоксилин-эозином. Наиболее часто используемые специальные красители это краситель Шиффа и метенамин-серебро Гомори, которые помогают окрасить гифы.
При наличии, гифы могут быть заметны в роговом слое при окраске гематоксилин-эозином. Наиболее часто используемые специальные красители это краситель Шиффа и метенамин-серебро Гомори, которые помогают окрасить гифы.
Дерматоскопия
Волосы в форме запятой, слегка изогнутые, разрушенные стержни волос, штопорообразные волосы являются дерматоскопическими маркерами микозов кожи головы. Также наблюдаются сломанные и дистрофичные волосы. При микозах кожи туловища, поражение волосяного покрова туловища заметное при дерматоскопии указывает на необходимость проведения системной терапии.
Полимеразная цепная реакция и амплификация последовательностей аминокислот
Эти пробы не только помогают быстро диагностировать инфекцию на ранней стадии, дно и способствуют определению устойчивости к лекарственным препаратам, и включают в себя:
· Униплексная ПЦР для прямой детекции дерматофитов в клинических образцах: ПЦР для прямого определения наличия в образце кожи дерматофитов доступна в виде анализа PCR-ELISA, который отдельно идентифицирует множество видов дерматофитов. В пилотном исследовании, чувствительность и специфичность теста в сравнении с культурами была 80.1% и 80.6%
В пилотном исследовании, чувствительность и специфичность теста в сравнении с культурами была 80.1% и 80.6%
· Мультиплексная ПЦР для определение грибковой ДНК дерматофитов: Коммерчески доступные мультиплексные ПЦР исследования позволяют одновременно амплифицировать 21 патоген дерматомикозов с последующей детекцией ДНК путем гелевого электрофореза.
Новейшие молекулятрые методы, такие как матрично-активированная лазерная дезорпция/ионизация и массовая спектрометрия
Основаны на определении биохимических свойств продуктов протеолитического разложения, которые являются результатом жизнедеятельности грибковых инфекционных агентов или неинфекционных заболеваний. Таковые представлены продуктами протеолитического разложения собственных белков организма. Пептидные паттерны взятых образцов идентифицируются путем сравнения с известными пептидными спектрами заболеваний кожи, хранящимися в существующей базе данных. Эта процедура позволяет значительно сэкономить время, поскольку становится возможной одномоментная идентификация до 64 штаммов дерматофитов, а результат бывает доступен в течение 24 ч.
Отражающая конфокальная микроскопия
Предоставляет изображение эпидермиса и поверхностных слоев дермы in vivo на клеточном уровне и может быть использована для обнаружения кожных микозов и паразитарных инфекций. Ветвящиеся гифы грибка могут быть обнаружены в области покраснения и шелушения на коже. Преимущество пробы заключается в неинвазивности; при ретроспективном анализе метода Friedman et al. Чувствительность была оценена как 100%.
В заключение следует сказать что при клинической диагностики дерматофитий кожи стоит подтверждать диагноз микологическим исследованием. Несмотря на то что традиционные методы, такие как прямое обнаружение грибка с помощью раствора KOH предоставляют более или менее чувствительный и доступный результат, новые неинвазивные методы такие как дерматоскопия обладают значительными преимуществами, такими как простота в использовании, способность оценить поражение волосяного покрова туловища и следовательно возможность сделать выбор в пользу системной или топической терапии. Культуральные исследования и исследования чувствительности штамма к антимикотикам являются более дорогостоящими и специализированными методами, но в большинстве клинических центров стоит установить необходимое оборудование для их проведения, особенно учитывая сегодняшнюю тенденцию к учащению случаев устойчивых к терапии дерматофитий. Другие методы, такие как ПЦР и отражающая конфокальная микроскопия, по-прежнему используются главным образом в научных целях.
Культуральные исследования и исследования чувствительности штамма к антимикотикам являются более дорогостоящими и специализированными методами, но в большинстве клинических центров стоит установить необходимое оборудование для их проведения, особенно учитывая сегодняшнюю тенденцию к учащению случаев устойчивых к терапии дерматофитий. Другие методы, такие как ПЦР и отражающая конфокальная микроскопия, по-прежнему используются главным образом в научных целях.
Лечение дерматофитий кожи
Нефармакологические меры
Пациентам следует рекомендовать носить свободную одежду из хлопка или синтетических материалов, промакивающую влагу с поверхности кожи. Такими же должны быть носки. Области, наиболее предрасположенные к проникновению инфекции, должны быть полностью высушены прежде чем пациент наденет одежду. Пациентам следует избегать хождения босиком и обмена одеждой с другими людьми.
Лечение противогрибковыми препаратами
Все еще используется ряд традиционных агентов без специфической антимикробной функции, включая мазь Уитфилда и краситель Кастеллани (раствор карболового фуксина). Эффективность этих препаратов не оценивалась должным образом. таблице 1 представлена классификация часто используемых антимикотиков. Обширные поражения кожи, которые не поддаются лечению повторными курсами различных препаратов местного действия следует подвергнуть системной терапии. До сих пор не проведено сравнительного исследования комбинации системного и топического подхода и монотерапии системными противогрибковыми препаратами. Топические препараты обладают лучшей фармакокинетикой, чем их системные аналоги. Таким образом, комбинация методов должна лучше бороться с грибковой инфекцией чем только системная или только топическая терапия. Комбинировать следует препараты из разных групп для обеспечения более широкого спектра действия и предотвращения развития резистентности. Лекарства, назначаемые на более короткий промежуток времени, но в большей дозировке обеспечивают меньший риск развития резистентности по сравнению с препаратами, назначаемыми в маленькой дозировке на долгое время. Лекарственные средства с кератофильными и липофильными свойствами, при назначении в высоких дозах, имеют накопительный эффект и способствуют лучшему излечению от грибковой инфекции.
Эффективность этих препаратов не оценивалась должным образом. таблице 1 представлена классификация часто используемых антимикотиков. Обширные поражения кожи, которые не поддаются лечению повторными курсами различных препаратов местного действия следует подвергнуть системной терапии. До сих пор не проведено сравнительного исследования комбинации системного и топического подхода и монотерапии системными противогрибковыми препаратами. Топические препараты обладают лучшей фармакокинетикой, чем их системные аналоги. Таким образом, комбинация методов должна лучше бороться с грибковой инфекцией чем только системная или только топическая терапия. Комбинировать следует препараты из разных групп для обеспечения более широкого спектра действия и предотвращения развития резистентности. Лекарства, назначаемые на более короткий промежуток времени, но в большей дозировке обеспечивают меньший риск развития резистентности по сравнению с препаратами, назначаемыми в маленькой дозировке на долгое время. Лекарственные средства с кератофильными и липофильными свойствами, при назначении в высоких дозах, имеют накопительный эффект и способствуют лучшему излечению от грибковой инфекции.
Таблица 1
Классификация вариантов терапии противогрибковыми препаратами в зависимости от их структуры
Класс антимикотиков | Примеры |
Антибиотики | |
Полиены | Амфотерицин B, нистатин, натамицин |
Гетероциклический бензофуран | Гризеофульвин |
Антиметаболиты | Флуцитозин |
Азолы | |
Имидазолы | Топические – клотримазол, эконазол, миконазол, бифоназол, фентиконазол, оксиконазол, тиоконазол, сертаконазол, берконазол, люликоназол, эберконазол Системные – кетоконазол |
Триазолы | Итраконазол, флюконазол (также топический), вориконазол, позаконазол, равуконазол, прамиконазол, альбаконазол |
Аллиламины | Тербинафин, бутенафин, нафтифин |
Эхинокандины | Капсофунгин, анидулафунгин, микафунгин, аминокандин |
Производные сордарина | GR135402, GM237354 |
Антагонисты клеточной стенки | Капсофунгин, микафунгин |
Другие агенты | Толнафтат, циклопрокс, аморолфин, ундециленовая кислота, буклозамид, мазь Уитфилда, бензоиловый пероксид, пиритион цинка, сульфид селена, азелаиновая кислота, никкомицины, икофунгипен |
Новая и потенциальная терапия | Демцидин, макрокарпал С |
Показания к системной терапии при дерматофитии
- Микоз кожи головы
- Онихомикозы
- Микозы, поражающие более одной области кожи одновременно, например, микоз кожи паха и туловища, или микоз паховой области и стоп
- Микоз кожи туловища с обширными поражениями кожи.
 Впрочем, устоявшееся определение обширного поражения отсутствует
Впрочем, устоявшееся определение обширного поражения отсутствует - Микозы стоп с глубоким поражением подошвы, пяточной области или тыльной стороны стопы, с тяжелым изъязвлением
Топическая терапия антимикотиками при микозах паховой области, туловища и стоп
Рассмотрение данных об использовании существующих топических антимикотиков
Для лечения локализованных форм микозов кожи головы, паховой области, туловища, лица и стоп доступны различные топические противогрибковые препараты. Они могут также быть использованы в комбинации с оральными антимикотиками при более тяжелом течении заболевания. Большинство исследований в области лечения микозов кожи туловища и паховой области рассматривает эффективность именно топических притовогрибковых препаратов, и лишь немногие исследования посвящены терапии оральными антимикотиками. Мета-анализ Rotta et al. оценивает эффективность терапии 14 различными топическими противогрибковыми препаратами и включает в себя 65 рандомизированных контролируемых испытаний (РКИ), сравнивающих топические антимикотики друг с другом или с плацебо. Эффективность оценивается достижением излечения от грибковой инфекции и длительностью излечения. В результате исследования не было найдено значительных различий между противогрибковыми препаратами в плане достижения микологического излечения по завершении терапии. Относительно длительности излечения, бутенафин и тербинафин оказались эффективнее клотримазола. Попарное сравнение топических антимикотиков показало, что бутенафин и тербинафин обеспечивают лучшее излечение, чем клотримазол, оксиконазол и сертаконазол; тербинафин эффектикнее циклопирокса, нафтифин – оксиконазола.
Эффективность оценивается достижением излечения от грибковой инфекции и длительностью излечения. В результате исследования не было найдено значительных различий между противогрибковыми препаратами в плане достижения микологического излечения по завершении терапии. Относительно длительности излечения, бутенафин и тербинафин оказались эффективнее клотримазола. Попарное сравнение топических антимикотиков показало, что бутенафин и тербинафин обеспечивают лучшее излечение, чем клотримазол, оксиконазол и сертаконазол; тербинафин эффектикнее циклопирокса, нафтифин – оксиконазола.
Кокрейновские обзоры терапии микозов паховой области и кожи туловища топическими антимикотиками также указывают на то что индивидуальная терапия тербинафином и нафтифином эффективна и имеет мало побочных эффектов. Другие топические антимикотики, такие как азолы, тоже эффективны в плане клинического и микологического излечения. Относительно комбинированной терапии топическими стероидами и антимикотиками не существует отдельных руководств. Достаточного количества данных для точной оценки случаев повторного заболевания после курса индивидуальной или комбинированной терапии нет. Различия между разными противогрибковыми препаратами связаны в основном с меньшей дозировкой и более коротким курсом терапии одних препаратов относительно других. Топические антимикотики обычно применяются один или два раза в день в течение 2–4 недель, как показано в Таблице 2. В конце курса в большинстве случаев достигается клиническое излечение.
Достаточного количества данных для точной оценки случаев повторного заболевания после курса индивидуальной или комбинированной терапии нет. Различия между разными противогрибковыми препаратами связаны в основном с меньшей дозировкой и более коротким курсом терапии одних препаратов относительно других. Топические антимикотики обычно применяются один или два раза в день в течение 2–4 недель, как показано в Таблице 2. В конце курса в большинстве случаев достигается клиническое излечение.
Таблица 2
Обзор топических антимикотиков, используемых для лечения микозов кожи туловища, паховой области и стоп
Азол | Форма | Место | Частота применения | Длительность применения |
Имидазолы (%) | ||||
Клотримазол (1) | Крем, лосьон | T. | дважды в сут | 4-6 недель |
Эконазол (1) | Крем | T. corporis/cruris/pedis | 1 раз в сут-дважды в сут | 4-6 недель |
Миконазол (1) | Крем, лосьон | T. corporis/cruris/pedis | дважды в сут | 4-6 недель |
Оксиконазол (2) | Крем, лосьон | T. corporis/cruris/pedis | 1 раз в сут-дважды в сут | недели |
Сертаконазол (2) | Крем | T. corporis/cruris/pedis | дважды в сут | 4 недели |
Люликоназол (1) | Крем, лосьон | T. | 1 раз в сут | 2 недели |
Эберконазол (1) | Крем | T. corporis/cruris/pedis | 1 раз в сут | 2-4 недели |
триазолы (%) | ||||
Эфинаконазол (10) | Раствор | T. pedis | 1 раз в сут | До 52 недель при сопутствующем микозе паха |
аллиламины | ||||
Тербинафин | Крем, пудра | T. corporis/cruris/pedis/manum | дважды в сут | 2-4 недели |
Нафтифин 1% | Крем | T. | 1 раз в сут-дважды в сут | 2 недели после исчезновения симптомов |
Бутенафин 1% | Крем | T. corporis/cruris/pedis | 1 раз в сут-дважды в сут | 2-4 недели |
другое | ||||
Аморолфин 0.25% | Крем | T. corporis | дважды в сут | 4 недели |
Амфотерицин В (1 мг) 0.1% | Гель на основе липидов | T. corporis | дважды в сут | 2 недели |
Moriarty et al., тоже подчеркивают значение топической терапии в лечении микозов кожи туловища, паховой области и стоп. Они также перечисляют частые причины неудовлетворительных результатов терапии, а именно низкую чувствительность к препарату, повторное заражение, резистентность к препарату и заражение других инфекционным агентом. Таких пациентов следует направлять в более высокоспециализированный центр для прохождения необходимой терапии. Они также предлагают местное применение гидрокортизона на короткое время для лечения воспалений в пораженной области. Исследования показали, что применение топических стероидов повышает биодоступность топических антимикотиков, главным образом группы имидазола, вдобавок обеспечивая симптоматическое лечение ранних стадий воспаления. Несмотря на то, что этот метод приносит облегчение больным с воспаленными образованиями, его использование следует строго пресекать в таких странах, как Индия, где легкая доступность безрецептурных топических стероидов и их неправильное использование часто выливается в развитие у больных такого заболевания как tinea incognito. Стероиды могут быть полезны для купирования симптомов на начальной стадии заболевания, но длительное их использование может привести к таким осложнениям как атрофия, телеангиэктазия, особенно часто встречающаюся у больных с поражениями в области сгибов.
Они также перечисляют частые причины неудовлетворительных результатов терапии, а именно низкую чувствительность к препарату, повторное заражение, резистентность к препарату и заражение других инфекционным агентом. Таких пациентов следует направлять в более высокоспециализированный центр для прохождения необходимой терапии. Они также предлагают местное применение гидрокортизона на короткое время для лечения воспалений в пораженной области. Исследования показали, что применение топических стероидов повышает биодоступность топических антимикотиков, главным образом группы имидазола, вдобавок обеспечивая симптоматическое лечение ранних стадий воспаления. Несмотря на то, что этот метод приносит облегчение больным с воспаленными образованиями, его использование следует строго пресекать в таких странах, как Индия, где легкая доступность безрецептурных топических стероидов и их неправильное использование часто выливается в развитие у больных такого заболевания как tinea incognito. Стероиды могут быть полезны для купирования симптомов на начальной стадии заболевания, но длительное их использование может привести к таким осложнениям как атрофия, телеангиэктазия, особенно часто встречающаюся у больных с поражениями в области сгибов. Топические антимикотики с сильным противовоспалительным действием, такие как сертаконазол или люликоназол, являются лучшим вариантом терапии чем комбинации антимикотиков и стероидов.
Топические антимикотики с сильным противовоспалительным действием, такие как сертаконазол или люликоназол, являются лучшим вариантом терапии чем комбинации антимикотиков и стероидов.
Микозы стоп обычно лечатся топическим противогрибковым кремом в течение 4 недель; межпальцевые микозы требуют лечения в течение всего 1 недели. Различные топические антимикотики, эффективные в борьбе с микозами стоп, это азоны, аллиламины, бутенафин, циклопрокс, толнафтат и аморолфин, что доказано мета-исследованием, предоставившим свидетельство о большей эффективности топических противогрибковых средств в сравнении с плацебо. Мета-анализ 11 рандомизированных испытаний выявил более высокий процент излечения при терапии тербинафином и нафтифином в сравнении с азолами. Нистатин не пригоден для лечения дерматофитий. Также была доказана эффективность геля гидрохлорида нафтифина в лечении межпальцевого и мокасинового типов грибка.
Новейшие топические антимикотики
Люликоназол, азоловый антимикотик, обладает фунгицидным действием, аналогичным или более сильным чем у тербинафина, против различных видов трихофитов. Доступный в форме 1% крема, он эффективен для лечения дерматофитий при применении раз в день в течение 1–2 недель. Одобрен US Food and Drug Administration для лечения межпальцевых микозов стоп, микозов паховой области и кожи туловища, безопасен. Также была доказана эффективность пенка нитрата эконазола. Тем не менее, эти препараты более дорогостоящие, а значит могут привести к проблемам приверженности к лечению в бедных странах и способствовать выработке резистентности.
Доступный в форме 1% крема, он эффективен для лечения дерматофитий при применении раз в день в течение 1–2 недель. Одобрен US Food and Drug Administration для лечения межпальцевых микозов стоп, микозов паховой области и кожи туловища, безопасен. Также была доказана эффективность пенка нитрата эконазола. Тем не менее, эти препараты более дорогостоящие, а значит могут привести к проблемам приверженности к лечению в бедных странах и способствовать выработке резистентности.
В заключение следует сказать, что использование специальной системы переносчиков, где лекарственное средство переносится мицеллами или использование наноструктурного переносчика на основе липидов, микроэмульсий и везикулярных систем, таких как липосомы, ниосомы, трансферосомы, этосомы или везикул способствующих пенетрации является многообещающим методом так как повышает биодоступность лекарства, способствуя достижению наилучшего терапевтического результата. В последнее время, липидный гель амфотерицина B показал впечатляющие фарамакологические свойства и хорошие клинические результаты в лечении различных грибковых заболеваний кожи и слизистых, в том числе и дерматофитий, при полном отсутствии побочных эффектов. Амфотерицин B, встроенный в микроэмульсию, обеспечивает 100% уменьшение распространения поражения и обладает высокой противогрибковой активностью против T. rubrum. Одна из актуальных проблем заключается в том, может ли использование топического амфотерицина способствовать развитию резистентности, ограничивая его использование для лечения более инвазивных грибковых инфекций. Микроэмульсии гризеофульвина имеют высокий показатель излечения дерматофитий. Новая формула тербинафина, известная как раствор тербинафина, образующий пленку, образует тонкую пленку для топического применения, обладающую фунгицидным эффектом, который держится около 13 дней с момента аппликации. Также зафиксированы случаи успешного излечения микозов кожи туловища комбинацией топического изоконазола и дифлюкотолона (сильного топического стероида).
Амфотерицин B, встроенный в микроэмульсию, обеспечивает 100% уменьшение распространения поражения и обладает высокой противогрибковой активностью против T. rubrum. Одна из актуальных проблем заключается в том, может ли использование топического амфотерицина способствовать развитию резистентности, ограничивая его использование для лечения более инвазивных грибковых инфекций. Микроэмульсии гризеофульвина имеют высокий показатель излечения дерматофитий. Новая формула тербинафина, известная как раствор тербинафина, образующий пленку, образует тонкую пленку для топического применения, обладающую фунгицидным эффектом, который держится около 13 дней с момента аппликации. Также зафиксированы случаи успешного излечения микозов кожи туловища комбинацией топического изоконазола и дифлюкотолона (сильного топического стероида).
Оральная противогрибковая терапия микозов кожи туловища, паховой области и стоп
Рассмотрение данных об использовании существующих оральных антимикотиков
Системные антимикотики назначают в случае обширных поражений кожи и при отсутствии излечения в ходе топической терапии. Из множества различных системных антимикотиков наиболее часто назначаются тербинафин и итраконазол. Гризеофульвин и флюконазол также эффективны, но требуют долгого курса лечения. РКИ подтверждают эффективность системных антимикотиков. [Таблица 3]. Сравнительное испытание итраконазола 100 мг/день и ультрамикронизированного гризеофульвина 500 мг/день при лечении микозов кожи туловища или паховой области показали лучший клинический и микологический результат при лечении итраконазолом после терапии в течение 2 недель. Подобное исследование, сравнивающее тербинафин с гризеофульвином (оба по 500 мг ежедневно в течение 6 недель) для лечения микозов кожи туловища выявило показатель микологического излечения равный 87% в первой группе и 73% в последней. Двойное слепое исследование итраконазола (100 мг/день) и гризеофульвина (500 мг/день) показало большую эффективность итраконазола.
Из множества различных системных антимикотиков наиболее часто назначаются тербинафин и итраконазол. Гризеофульвин и флюконазол также эффективны, но требуют долгого курса лечения. РКИ подтверждают эффективность системных антимикотиков. [Таблица 3]. Сравнительное испытание итраконазола 100 мг/день и ультрамикронизированного гризеофульвина 500 мг/день при лечении микозов кожи туловища или паховой области показали лучший клинический и микологический результат при лечении итраконазолом после терапии в течение 2 недель. Подобное исследование, сравнивающее тербинафин с гризеофульвином (оба по 500 мг ежедневно в течение 6 недель) для лечения микозов кожи туловища выявило показатель микологического излечения равный 87% в первой группе и 73% в последней. Двойное слепое исследование итраконазола (100 мг/день) и гризеофульвина (500 мг/день) показало большую эффективность итраконазола.
Таблица 3
Рекомендованная дозировка различных системных антимикотиков при дерматофитии
Заболевание | Лекарство | Доза (перорально) | Длительность лечения |
T. | Тербинафин | 250 мг раз в день, 2-6 мг/кг/день | 2-3 недели |
Итраконазол | 200 мг/день | 1-2 недели | |
Флюконазол | 150-300 мг/неделю | 3-4 недели | |
Гризеофульвин (микроразмер) (ультрамикроразмер) | 500 мг/день (10-20 мг/кг/день) | 2-4 недели | |
300-375 мг/день (5-10 мг/кг/день) | |||
T.pedis | Тербинафин | 250 мг раз в день | 1 неделя (межпальцевой), 2 недели (мокасиновый) |
Итраконазол | 100-200 мг/день | 2-4 недели | |
Флюконазол | 150 мг/неделю | 4 недели | |
Гризеофульвин (микроразмер) (ультрамикроразмер) | 750-1000 мг/день | 4-8 недель | |
660-750 мг/день |
Топическая терапия менее эффективна чем терапия оральными антимикотиками при лечении микозов стоп; оральная терапия обычно длится 4–8 недель. В систематическом обзоре эффективности оральных антимикотиков тербинафин был найден более эффективным, чем гризеофульвин, в то время как у тербинафина и итраконазола эффективность была одинакова. В дополнение к противогрибковой терапиии, влажные повязки с жидкостью Бурова (1% ацетата алюминия или 5% субацетата алюминия), прикладываемые на 20 мин 2–3 раза в день, могут быть полезны если наблюдается образование волдырей или мацерация. Из различных вариантов микозов стоп наиболее трудно поддается лечению гиперкератотическая форма из-за образования плотных чешуек, которые приводят к неэффективности топических антимикотиков и необходимости более длительного лечения системными антимикотиками. Использование кератолитических средств и комбинации топических и системных антимикотиков было найдено наиболее действенным для достижения клинического и микологического излечения на ранних сроках и уменьшения длительности курса лечения оральными антимикотиками, что приводит к улучшению комплаенса пациента.
В систематическом обзоре эффективности оральных антимикотиков тербинафин был найден более эффективным, чем гризеофульвин, в то время как у тербинафина и итраконазола эффективность была одинакова. В дополнение к противогрибковой терапиии, влажные повязки с жидкостью Бурова (1% ацетата алюминия или 5% субацетата алюминия), прикладываемые на 20 мин 2–3 раза в день, могут быть полезны если наблюдается образование волдырей или мацерация. Из различных вариантов микозов стоп наиболее трудно поддается лечению гиперкератотическая форма из-за образования плотных чешуек, которые приводят к неэффективности топических антимикотиков и необходимости более длительного лечения системными антимикотиками. Использование кератолитических средств и комбинации топических и системных антимикотиков было найдено наиболее действенным для достижения клинического и микологического излечения на ранних сроках и уменьшения длительности курса лечения оральными антимикотиками, что приводит к улучшению комплаенса пациента. Вторичная бактериальная инфекция должна лечиться оральными антибиотиками. Другая сопутствующая терапия может включать в себя использование противогрибковой пудры для предотвращения мокнутия, а также отказ от тесной обуви.
Вторичная бактериальная инфекция должна лечиться оральными антибиотиками. Другая сопутствующая терапия может включать в себя использование противогрибковой пудры для предотвращения мокнутия, а также отказ от тесной обуви.
Новейшие оральные антимикотики
Новые публикации, посвященные использованию системных противогрибковых препаратов для лечения микозов паховой области и кожи туловища, отсутствуют. Несмотря на то, что в последние двадцать лет были найдены некоторые новые системные антимикотики, большинство из них применяют только для лечения тяжелых угрожающих жизни инвазивных системных микозов, данные об их эффективности для лечения поверхностных микозов отсутствуют. Была доказана эффективность позаконазола для лечения пациента с обширным поражением кожи и ногтей в связи с мутацией в гене CARD9.
Новая и перспективная терапия
Помимо уже упомянутых антимикотиков, экстракты некоторых растений (Китайские травы) также оказались эффективными для лечения распространенных дерматофитий. Один из них – макрокарпал C, активный ингредиент, получаемый из свежих листьев Eucalyptus globulus, обладающий противогрибковым действием в отношении T. mentagrophytes и T. rubrum. Демицидин, антимикробный пептид имеет противогрибковое действие в концентрации, в норме присутствующей в поте, что обеспечивает понимание новой цели для лечения инфекций, вызванных дерматофитами.
Один из них – макрокарпал C, активный ингредиент, получаемый из свежих листьев Eucalyptus globulus, обладающий противогрибковым действием в отношении T. mentagrophytes и T. rubrum. Демицидин, антимикробный пептид имеет противогрибковое действие в концентрации, в норме присутствующей в поте, что обеспечивает понимание новой цели для лечения инфекций, вызванных дерматофитами.
Особые случаи
Гранулема Майокки
Это глубокая дерматофития, которая вызывается тем, что долго тянущаяся поверхностная грибковая инфекция проникает в низлежащие ткани. Самый частый этиологический агент – T. rubrum. Механические повреждения кожи в результате травмы могут позволить инфекции проникнуть в сетчатый слой дермы, вызывая разрушение клеток и уменьшение показателя pH в дерме, что дает инфекции более выгодные условия для развития. Чаще всего встречается у лиц с иммунокомпрометированным статусом. Аппликация топических стероидов приводит к локальной иммуносуппрессии и развитию гранулемы Майокки. Системные антимикотики, такие как тербинафин в дозировке 250 мг/день в течение 4–6 недель, итраконазол 200 мг дважды в день в течение 1 недели/месяца или 2 месяцев успешно борются с заболеванием.[,] Также предложены схемы лечения гризеофульвином и итраконазолом (ежедневно).
Системные антимикотики, такие как тербинафин в дозировке 250 мг/день в течение 4–6 недель, итраконазол 200 мг дважды в день в течение 1 недели/месяца или 2 месяцев успешно борются с заболеванием.[,] Также предложены схемы лечения гризеофульвином и итраконазолом (ежедневно).
Черепитчатый и псевдочерепитчатый лишай
Черепитчатый лишай это хроническая поверхностная грибковая инфекция гладкой кожи, вызываемая Trichophyton concentricum. Болезнь возникает в результате близкого контакта со спорами и нитями T. Concentricum, особенно у матерей и их детей. Установлено, что генетический, природный и иммунологический факторы играют важную роль в развитии этой грибковой инфекции. Тип наследования – аутосомно-рецессивный, изредка встречаются случаи аутосомно-доминантного наследования. У большинства пациентов есть специфические антитела к T. concentricum, что свидетельствует о снижении клеточного иммунитета. Влияние рациона питания, дефицита железа и недоедания считают сопутствующими факторами. Диагноз главным образом ставится клинически и путем выделения чистой культуры. Часты случаи повторного заражения. Лечение заключается в комбинации топических и системных противогрибковых препаратов, поскольку только топическая терапия не приводит к излечению. Гризеофульвин, азолы, такие как кетоконазол и итраконазол, долгие годы использовались для лечения этого заболевания с переменным успехом. На сегодня наилучшим средством является тербинафин в дозировке 250 мг/день для взрослых. В последнее время было зарегистрировано несколько случаев возникновения образований, напоминающих черепитчатый лишай, у пациентов, злоупотребляющих топическими стероидами. Обычно вместо T. concentricum из таких образований выделяют T. mentagrophytes.
Диагноз главным образом ставится клинически и путем выделения чистой культуры. Часты случаи повторного заражения. Лечение заключается в комбинации топических и системных противогрибковых препаратов, поскольку только топическая терапия не приводит к излечению. Гризеофульвин, азолы, такие как кетоконазол и итраконазол, долгие годы использовались для лечения этого заболевания с переменным успехом. На сегодня наилучшим средством является тербинафин в дозировке 250 мг/день для взрослых. В последнее время было зарегистрировано несколько случаев возникновения образований, напоминающих черепитчатый лишай, у пациентов, злоупотребляющих топическими стероидами. Обычно вместо T. concentricum из таких образований выделяют T. mentagrophytes.
Противогрибковая терапия у иммунокомпрометированных лиц и беременных женщин
У некоторых категорий населения, таких как зараженные ВИЧ, грибковые инфекции поражают особенно обширные области кожи. Однако характерная морфология образований может отсутствовать в связи с тем, что воспаление не возникает из-за подавленного иммунитета. Некоторым пациентам с сопутствующими заболеваниями, такими как почечная или печеночная недостаточность, следует выписывать системные антимикотики с большой осторожностью. Клиренс тербинафина значительно снижен у пациентов с почечной недостаточностью. Поэтому доза должна быть скорректирована в соответствие с состоянием пациента, или же следует отдать предпочтение препарату из другой фармакологической группы. Лицам с печеночной недостаточностью не следует назначать итраконазол. При беременности тербинафин является лекарством категории В. Тем не менее, четких руководящих принципов лечения в этих случаях нет, и к каждому пациенту нужен индивидуальный подход, основанный на соотношении риска и пользы.
Некоторым пациентам с сопутствующими заболеваниями, такими как почечная или печеночная недостаточность, следует выписывать системные антимикотики с большой осторожностью. Клиренс тербинафина значительно снижен у пациентов с почечной недостаточностью. Поэтому доза должна быть скорректирована в соответствие с состоянием пациента, или же следует отдать предпочтение препарату из другой фармакологической группы. Лицам с печеночной недостаточностью не следует назначать итраконазол. При беременности тербинафин является лекарством категории В. Тем не менее, четких руководящих принципов лечения в этих случаях нет, и к каждому пациенту нужен индивидуальный подход, основанный на соотношении риска и пользы.
Хронические дерматофитии
В литературе также описан так называемый синдром T. rubrum, генерализованная хроническая персистирующая руброфития, генерализованный микоз кожи туловища или инфекция T. rubrum сухого типа. Болезнь характеризуется вовлечением в патологический процесс минимум четырех областей, таких как стопы (подошвенная), ладони (ладонная), ногти и какой-либо другой области за исключением паховой. Из пораженных областей выделяют чистую культуру T. rubrum. К хроническим дерматофитиям относят персистирующие дерматофитии с хроническим течением с эпизодами ремиссии и обострения. Хроническое течение характеризуется длительностью и рекуррентностью заболевания, хотя четкого определения у этого термина нет. Возникновение таких случаев связано со свойствами патогена, организма хозяина и фармакологическими факторами. В настоящее время отсутствуют руководящие принципы лечения хронических дерматофитий. Несмотря на это, некоторые исследования подтверждают что для микозов кожи головы не характерно развитие резистентности к антимикотикам; по микозам кожи туловища и паховой области таких данных нет. Этот факт следует также рассматривать в свете участившихся клинических случаев в Индии, когда у пациента распознавали неподдающиеся лечению кожные дерматофитии.
Из пораженных областей выделяют чистую культуру T. rubrum. К хроническим дерматофитиям относят персистирующие дерматофитии с хроническим течением с эпизодами ремиссии и обострения. Хроническое течение характеризуется длительностью и рекуррентностью заболевания, хотя четкого определения у этого термина нет. Возникновение таких случаев связано со свойствами патогена, организма хозяина и фармакологическими факторами. В настоящее время отсутствуют руководящие принципы лечения хронических дерматофитий. Несмотря на это, некоторые исследования подтверждают что для микозов кожи головы не характерно развитие резистентности к антимикотикам; по микозам кожи туловища и паховой области таких данных нет. Этот факт следует также рассматривать в свете участившихся клинических случаев в Индии, когда у пациента распознавали неподдающиеся лечению кожные дерматофитии.
Детальное рассмотрение патогенеза и методов лечения хронических/рекуррентных дерматофитий не входит в задачи данного исследования.

Заключение
Лечение кожных дерматофитий становится все сложнее, и дерматологи сталкиваются с необходимостью мыслить за рамками привычных схем лечения чтобы справиться с этой проблемой. Несмотря на наличие достаточного количества доказательств действенности топических антимикотиков в лечении локализованных форм заболевания, ощущается нехватка данных относительно частоты повторного заражения после курса монотерапии топическими антимикотиками. Среди множества опций, наиболее действенным методом лечения локализованной грибковой инфекции (микозов головы/паховой области/стоп) является аппликация топического тербинафина в течение 4 недель. Для заболеваний, поражающих более обширные области кожи, выбор не так очевиден. И тербинафин (250–500 мг/день в течение 2–6 недель) и итраконазол (100–200 мг/день в течение 2–4 недель) одинаково эффективны. Тем не менее, дозировка и длительность терапии, которые приведут к микологическому излечению и предотвратят риск повторного заражения, неясна. Данный обзор подчеркивает обширные пробелы в исследовании лечения кожных дерматофитий, которые следует восполнить для того, чтобы лучше и эффективнее лечить пациентов. Необходимо провести больше РКИ, сравнивающих различные схемы оральной противогрибковой терапии, чтобы выявить оптимальную дозировку и длительность лечения.
Данный обзор подчеркивает обширные пробелы в исследовании лечения кожных дерматофитий, которые следует восполнить для того, чтобы лучше и эффективнее лечить пациентов. Необходимо провести больше РКИ, сравнивающих различные схемы оральной противогрибковой терапии, чтобы выявить оптимальную дозировку и длительность лечения.
Микоз — обзор | Темы ScienceDirect
CANDIDA MENINGITIS
Candida sp. в настоящее время является наиболее распространенным этиологическим агентом грибковых инфекций, но редко вызывает инфекции ЦНС. Candida sp. может вызвать менингит, микроабсцессы головного мозга и инфаркт головного мозга после тромбоза или кровоизлияния в результате ангиоинвазии. У здоровых людей инфекции CNS Candida развиваются редко. Диагноз может быть трудным, потому что изоляция от крови не указывает на инфекцию ЦНС, а изоляция от спинномозговой жидкости встречается редко.Недавний иммуноферментный анализ (EIA) или тест на латекс-агглютинацию Candida , направленный на поиск маннана, антигена Candida , может оказаться полезным, если он окажется положительным в спинномозговой жидкости. Для постановки точного диагноза может потребоваться биопсия менингеального или церебрального абсцесса.
Для постановки точного диагноза может потребоваться биопсия менингеального или церебрального абсцесса.
В настоящее время индукционное лечение проводится амфотерицином B, часто с флуцитозином, за исключением Candida lusitaniae, , который устойчив к амфотерицину (см. Таблицу 3). Однако липосомальный амфотерицин B успешно вылечил пять из шести случаев менингита новорожденных Candida .Альтернативными вариантами являются флуконазол и вориконазол. Однако, если азол назначается на фоне предшествующей азольной терапии или изоляции видов, отличных от albicans , следует рассмотреть возможность лабораторного тестирования изолята на устойчивость к флуконазолу или вориконазолу.
ЦСЖ часто стерилизуется раньше, чем ткани головного мозга и оболочек, поэтому для разрешения диагноза необходимо следить за результатами нейровизуализации и ЦСЖ. Если шунты ЦСЖ присутствуют до развития менингита Candida , их следует удалить, поскольку могут присутствовать биопленки Candida , что приводит к рецидиву. В идеале шунт следует заменять после стерилизации спинномозговой жидкости. Однако, если пациент получает полную противогрибковую терапию, новые шунты заражаются редко. Продолжительность терапии не установлена, но поддерживающая терапия должна продолжаться как минимум 4 недели после исчезновения всех клинических признаков и связанных с нейровизуализационных поражений.
В идеале шунт следует заменять после стерилизации спинномозговой жидкости. Однако, если пациент получает полную противогрибковую терапию, новые шунты заражаются редко. Продолжительность терапии не установлена, но поддерживающая терапия должна продолжаться как минимум 4 недели после исчезновения всех клинических признаков и связанных с нейровизуализационных поражений.
Цели / области интересов исследования:
Грибковые публикации Книги
Рецензируемые публикации
Разделы книги / обзоры
|
Фотодинамическая терапия в лечении поверхностных микозов: доказательная оценка
Гавличкова Б., Чайка В.А., Фридрих М. Эпидемиологические тенденции микозов кожи во всем мире. Микозы 2008; 51 Дополнение 4: 2–15.
Артикул
PubMed
Google ученый
Гупта А.К., Купер Э.А. Обновление противогрибковой терапии дерматофитий. Микопатология. 2008. 166: 353–67.
Артикул
PubMed
Google ученый
Моан Дж., Пэн К. Очерк столетней истории PDT. Anticancer Res. 2003. 23: 3591–600.
PubMed
Google ученый
Hamblin MR, Hasan T. Фотодинамическая терапия: новый антимикробный подход к инфекционным заболеваниям? Photochem Photobiol Sci. 2004; 3: 436–50.
CAS
Статья
PubMed
Google ученый
Smijs TG, Bouwstra JA, Schuitmaker HJ, Talebi M, Pavel S. Новая модель кожи ex vivo для изучения восприимчивости дерматофита Trichophyton rubrum к фотодинамической обработке в различных фазах роста. J Antimicrob Chemother.2007; 59: 433–40.
CAS
Статья
PubMed
Google ученый
Доннелли РФ, Маккаррон Пенсильвания, Тунни ММ. Противогрибковая фотодинамическая терапия. Microbiol Res. 2008; 163: 1–12.
CAS
Статья
PubMed
Google ученый
Кальцавара-Пинтон П.Г., Вентурини М., Сала Р. Полный обзор фотодинамической терапии при лечении поверхностных грибковых инфекций кожи.J Photochem Photobiol B. 2005; 78: 1–6.
CAS
Статья
PubMed
Google ученый
О’Риордан К., Акилов О.Е., Хасан Т. Возможности фотодинамической терапии в лечении локализованных инфекций. Фотодиагностика Photodyn Ther. 2005; 2: 247–62.
Артикул
Google ученый
Сотириу Э., Панагиотиду Д., Иоаннидес Д. Лечение фотодинамической терапией 5-аминолевулининовой кислотой при дерматомикозе, вызванном Trichophyton rubrum : сообщение о 10 случаях.J Eur Acad Dermatol Venereol. 2009; 23: 341–2.
CAS
Статья
PubMed
Google ученый
Сотириу Э., Куссиду Т., Пацаци А., Апалла З., Иоаннидес Д. Фотодинамическое лечение дерматофитного опоясывающего лишая стопы межпальцевого типа с использованием 5-аминолевулиновой кислоты: небольшое клиническое исследование. J Eur Acad Dermatol Venereol. 2009; 23: 203–4.
CAS
Статья
PubMed
Google ученый
Кальцавара-Пинтон П.Г., Вентурини М., Капеззера Р., Сала Р., Зейн С. Фотодинамическая терапия межпальцевых микозов стоп с местным применением 5-аминолевулиновой кислоты. Фотодерматол Фотоиммунол Фотомед. 2004; 20: 144–7.
CAS
Статья
PubMed
Google ученый
Ватанабэ Д., Кавамура С., Масуда Ю., Акита Ю., Тамада Ю., Мацумото Ю. Успешное лечение онихомикоза ногтей на ногах с помощью фотодинамической терапии. Arch Dermatol.2008; 144: 19–21.
Артикул
PubMed
Google ученый
Пирачини Б.М., Реч Г., Тости А. Фотодинамическая терапия онихомикоза, вызванного Trichophyton rubrum . J Am Acad Dermatol. 2008; 59: S75–6.
Артикул
PubMed
Google ученый
Сотириу Э., Куссиду-Эремонти Т., Чайдеменос Г., Апалла З., Иоаннидес Д. Фотодинамическая терапия дистального и латерального подногтевого онихомикоза ногтей на ногах, вызванного Trichophyton rubrum : предварительные результаты одноцентрового открытого исследования.Acta Derm Venereol. 2010; 90: 216–7.
Артикул
PubMed
Google ученый
Kim YJ, Kim YC. Успешное лечение разноцветного лишайника фотодинамической терапией 5-аминолевулиновой кислотой. Arch Dermatol. 2007; 143: 1218–20.
Артикул
PubMed
Google ученый
Morton CA, McKenna KE, Rhodes LE. Рекомендации по местной фотодинамической терапии: обновленная информация.Br J Dermatol. 2008; 159: 1245–66.
CAS
Статья
PubMed
Google ученый
Maisch T. Антимикробная фотодинамическая терапия: полезно ли в будущем? Lasers Med Sci. 2007; 22: 83–91.
Артикул
PubMed
Google ученый
Smijs TG, Schuitmaker HJ. Фотодинамическая инактивация дерматофита Trichophyton rubrum . Photochem Photobiol.2003. 77: 556–60.
CAS
Статья
PubMed
Google ученый
Smijs TG, van der Haas RN, Lugtenburg J, Liu Y, de Jong RL, Schuitmaker HJ. Фотодинамическая обработка дерматофита Trichophyton rubrum и его микроконидий порфириновыми фотосенсибилизаторами. Photochem Photobiol. 2004. 80: 197–202.
CAS
Статья
PubMed
Google ученый
Smijs TG, Bouwstra JA, Talebi M, Pavel S. Исследование условий, влияющих на восприимчивость дерматофита Trichophyton rubrum к фотодинамической обработке. J Antimicrob Chemother. 2007. 60: 750–9.
CAS
Статья
PubMed
Google ученый
(PDF) Ведение микозов в повседневной практике
ДРАГО УПРАВЛЕНИЕ МИКОЗАМИ В ЕЖЕДНЕВНОЙ ПРАКТИКЕ
650 GIORNALE ITALIANO DI DERMATOLOGIA E VENEREOLOGIA Декабрь 2017 г.
23.Илкит М., Дурду М. Tinea pedis: этиология и глобальная эпидемиология
распространенной грибковой инфекции. Crit Rev Microbiol 2015; 41: 374-88.
24. Канаван Т.Н., Елевски Б.Е. Выявление признаков Tinea Pedis: ключ
к пониманию клинических переменных. J Drugs Dermatol 2015; 14 (10
Suppl): s42-7.
25. Айв Ф.А., Маркс Р. Тинея инкогнито. Br Med J 1968; 3: 149-52.
26. Fenizi G, Altobella A. Tinea incognita rosacea-like: due casi clinici.
Exper Derm 2015; 17: 53-6.
27. Hay RJ. Tinea Capitis: текущее состояние. Микопатология.
2017; 182: 87-93.
28. Хосрави А.Р., Шокри Х., Вахеди Г. Факторы в этиологии и предисловии —
Положение взрослого Tinea Capitis и обзор опубликованной литературы.
Mycopathologia 2016; 181: 371-8.
29. Тан Дж, Ран X, Ран Ю. Ультрафиолетовая дерматоскопия для диагностики
tinea capitis. J Am Acad Dermatol 2017; 76: S28-S30.
30. Difonzo EM, Faggi E, Bassi A, Campisi E, Arunachalam M, Pini G,
et al. Кожные заболевания Malassezia у человека. Г Итал Дерматол Венереол
2013; 148: 609-19.
31. Ху С.В., Бигби М. Разноцветный лишай: систематический обзор интервенций.
действий. Arch Dermatol 2010; 146: 1132.
32. Гупта А.К., Лейн Д., Паке М. Систематический обзор системного лечения —
методов лечения разноцветного лишая и рекомендации по режиму дозирования, основанные на фактических данных,
исправлений.J Cutan Med Surg 2014; 18: 79-90.
33. Фаергеманн Дж., Баран Р. Эпидемиология, клинические проявления и ди-
агноз онихомикоза. Br J Dermatol 2003; 149: 1-4.
34. Шер Р.К., Рич П., Паризер Д., Элевски Б. Эпидемиология, этиол-
ogy и патофизиология онихомикоза. Semin Cutan Med Surg
2013; 32 (2 Приложение 1): S2-4.
35. Пирачини BM. Заболевания ногтей: Практическое руководство по диагностике и лечению
. Берлин: Спрингер; 2014 г.
36. Тости А, Елевский Б.Е. Онихомикоз: практические подходы к рецидиву и рецидиву Mini-
mize. Расстройство придатков кожи 2016; 2: 83-7.
37. Difonzo EM, Scar F., Arunachalam M, Galeone M. Fluconazolo: ef-
cacia terapeutica nelle onicomicosi. Il Dermatologo 2014; 1.
38. Sobel JD. Вульвовагинальный кандидоз. Ланцет 2007; 369: 1961-71.
39. Гонсалвес Б., Феррейра С., Алвес CT, Энрикес М., Азередо Дж., Сильва С.
Вульвовагинальный кандидоз: эпидемиология, микробиология и факторы риска —
тор.Crit Rev Microbiol 2016; 42: 905-27.
40. Биккер Дж. Терапевтические принципы вульвовагинальной дерматологии. Der-
matol Clin 2010; 28: 639-48.
41. Собел Дж. Д., Каперник П. С., Зервос М., Рид Б. Д., Хутон Т., Сопер Д.,
и др. Лечение осложненного кандидозного вагинита: сравнение
однократных и последовательных доз флуконазола. Am J Obste Gynecol
2001; 298: 191-9.
42. Sobel JD. Рецидивирующий кандидозный вульвовагинит.Am J Obstet Gynecol
2016; 214: 15-21.
43. Собель Д.Д., Визенфельд Х.С., Мартенс М., Данна П., Хутон Т.М., Rom-
Пало А и др. Поддерживающая терапия флуконазолом при рецидивирующем кандидозе влагалища
. N Engl J Med 2004; 351: 876-83.
44. Graziottin A, Murina F. La sda terapeutica delle Candidosi vulvo-
vaginali ricorrenti. Минерва Гинеколь 2010; 62: 1-12.
45. Дондерс Г.Г., Беллен Г., Мендлинг В. Ведение рецидивирующего вульвовагинального кандидоза
как клинического заболевания.Ginecol Obstet Invest
2010; 70: 306-21.
46. Джентиле А. Trattamento delle Candidosi vaginali con uconazolo: tera-
pia sistemica против terapia combinata sistemica e locale. Derm Clin
2011; том XXXI: 59-61.
Ссылки
1. Mondello F. Funghi patogeni per l’uomo: generalità e prospettive;
[Интернет]. Доступно по адресу: http://www.iss.it/binary/publ/cont/08-10_
web.12064.pdf [процитировано 11 мая 2017 г.].
2. Папини М., Дифонцо Э.М., Калабро Дж., Джанни С., Калькатерра Р.
Суперцены, 2014. Linee Guida e Raccomandazioni
SIDeMaST; [Интернет]. Доступно по адресу: http://www.pacinimedicina.it/
wp-content / uploads / micosi_sidemast.pdf [цитируется 11 мая 2017 г.].
3. Пирачини BM. Fluconazolo nelle onicomicosi. UniversoMicosi.it
2012; NS: 7-8.
4. Флуконазоло. Riassunto delle Caratteristiche del Prodotto.
5.Аллен Д., Уилсон Д., Дрю Р., Perfect J. Противогрибковые средства с азолом: 35 лет лечения инвазивных грибковых инфекций
. Expert Rev Anti Infect Ther
2015; 13: 787-98.
6. Азанза Дж. Р., Гарсия-Кетглас Э., Садаба Б. Фармакология азолов.
Ред. Iberoam Micol 2007; 24: 223-7.
7. Грант С.М., Клиссолд С.П. Флуконазол. Обзор его фармакодинамических и фармакокинетических свойств и терапевтического потенциала
при поверхностных и системных микозах.Наркотики 1990; 39: 877-916.
8. Goa KL, Barradell LB. Флуконазол. Обновление его фармакодинамических и фармакокинетических свойств и терапевтического применения при основных
суперсистемных и системных микозах у пациентов с ослабленным иммунитетом.
Наркотики 1995; 50: 658-90.
9. Рамони С., Веральди С. Le Candidiasis superciali, отчет о болезни. J Health
Sci 2016, 13
10. Itraconazolo. Riassunto delle Caratteristiche del Prodotto.
11.Хардин TC, Graybill JR, Fetchick R, Woestenborghs R, Rinaldi
MG, Kuhn JG. Фармакокинетика итраконазола после перорального введения нормальным добровольцам. Антимикробные агенты Chemother
1988; 32: 1310-3.
12. Cauwenbergh G, Degreef H, Heykants J, Woestenborghs R, Van
Rooy P, Haeverans K. Фармакокинетический профиль перорально вводимого итраконазола в коже человека. J Am Acad Dermatol
1988; 18: 263-8.
13. Грант С.М., Клиссолд С.П. Итраконазол. Обзор его фармакодинамических и фармакокинетических свойств, а также терапевтическое использование при суперпрофессиональных и системных микозах. Наркотики 1989; 37: 310-44.
14. Heykants J, Van Peer A, Van de Velde V, Van Rooy P, Meuldermans
W, Lavrijsen K, et al. Клиническая фармакокинетика итраконазола:
обзор. Микозы 1989; 32 (Дополнение 1): 67-87.
15. Лим С.Г., Сойер А.М., Хадсон М., Серкомб Дж., Паундер РЭ.Абсорбция флюконазола и итраконазола
в условиях низкой внутригазовой кислотности
. Aliment Pharmacol Ther 1993; 7: 317-21.
16. Тербинана. Riassunto delle Caratteristiche del Prodotto.
17. Jensen JC. Клиническая фармакокинетика тербинана. Clin Exp Der-
матол 1989; 14: 110-3.
18. Бальфур Я.А., Фолдс Д. Тербинажне. Обзор его фармакодинамических
и фармакокинетических свойств, а также терапевтического потенциала при суперсиальных микозах
.Наркотики 1992; 43: 259-84.
19. Гавличкова Б., Чайка В.А., Фредерих М. Эпидемиологические тенденции
микозов кожи в мире. Микозы 2008; 51: 2-15.
20. Келли Б.П. Поверхностные грибковые инфекции. Pediatr Rev 2012; 33: e22-37.
21. Саху А.К., Махаджан Р. Управление tinea corporis, tinea cruris,
и tinea pedis: всесторонний обзор. Индийский дерматол онлайн
2016; 7: 77-86.
22. Гупта А.К., Чаудри М., Элевски Б. Tinea corporis, tinea cruris, tinea
nigra и piedra.Dermatol Clin 2003; 21: 395-400.
Конфликт интересов. — Авторы удостоверяют, что нет конфликта интересов с какой-либо финансовой организацией в отношении материала, обсуждаемого в рукописи.
Рукопись принята: 10 мая 2017 г. — Рукопись получена: 10 мая 2017 г.
Диагностика, профилактика и лечение грибковых инфекций
Дина Гулд Профессор прикладного здравоохранения, Школа медсестер и акушерства Святого Варфоломея, Городской университет, Лондон
Большинство грибов безвредно живут в окружающей среде, но некоторые виды могут вызывать болезни у человека-хозяина.Медсестры, работающие в первичном звене медико-санитарной помощи, обычно принимают пациентов с поверхностными грибковыми инфекциями и имеют все возможности для того, чтобы дать совет о лечении и мерах по предотвращению распространения инфекции в доме. Пациенты с ослабленной иммунной функцией, поступающие в больницу, имеют высокий риск развития серьезных инвазивных грибковых инфекций. Системные грибковые инфекции представляют собой серьезную проблему среди пациентов в критическом состоянии в условиях оказания неотложной помощи и являются причиной увеличения доли инфекций, связанных с оказанием медицинской помощи.
Стандарт сестринского дела .
25, 33, 38-47.
DOI: 10.7748 / нс2011.04.25.33.38.c8464
Переписка
Экспертная оценка
Эта статья прошла двойное слепое рецензирование.
Хотите узнать больше?
Подпишитесь на безлимитный доступ
Попробуйте доступ на 1 месяц всего за 1 фунт стерлингов и получите:
В ваш пакет подписки входит:
- Полный доступ к стандарту ухода.com и приложение «Стандарт медсестер»
- Ежемесячное цифровое издание
- Портфолио RCNi и интерактивные викторины CPD
- RCNi Learning с более чем 200 модулями, основанными на фактах
- 10 статей в месяц из любого другого журнала RCNi
Подписаться
Студент RCN? Студент стандартного медсестринского дела
Уже подписаны? Войти
Кроме того, вы можете приобрести доступ к этой статье на следующие семь дней.Купить сейчас
или
Диагностика и лечение у реципиентов трансплантата
Системные грибковые инфекции обычно возникают у серьезно больных людей с признанными факторами риска, такими как те, которые часто встречаются у реципиентов трансплантата. К сожалению, их часто диагностируют поздно, когда эффективность доступных методов лечения низка, часто менее 50%, а стоимость с точки зрения потерянных жизней, продолжительности пребывания в больнице и общих затрат больницы существенно возрастает.Применение противогрибковых препаратов, эффективность которых, по сообщениям, превышает 50%, относится к профилактическим. При профилактическом использовании эти инфекции снижаются более чем в 95% от ожидаемых случаев. Выбор профилактического средства должен основываться на простоте его введения, отсутствии побочных эффектов, сниженной вероятности потенциальных лекарственных взаимодействий и его эффективности у пациентов с установленными факторами риска и сопутствующими патологическими процессами, включая заболевания почек, печени и хронических легких. .В этой статье представлены показания к применению доступных в настоящее время противогрибковых агентов, их побочные эффекты, лекарственные взаимодействия, простота дозирования и применимость у пациентов с ранее существовавшими болезненными состояниями, и особенно у реципиентов трансплантата печени.
1. Эпидемиология
Частота и разнообразие инвазивных грибковых инфекций значительно увеличились за последние три десятилетия в результате изменений в медицинской и хирургической помощи, особенно в отделениях интенсивной терапии, которые используют инвазивные катетеры для мониторинга в сочетании с использованием более мощных иммуносупрессоров и антибиотиков [1].Текущий рост инвазивных грибковых инфекций является результатом изменений в лечении заболеваний с использованием мощных иммунодепрессантов, множественных антибиотиков, использования процедур поддержки органов, включая механическую вентиляцию легких, гемодиализ и венозную гемофильтрацию, а также чрезмерное питание родителей. Эти медицинские и процедурные достижения в сочетании с применением более агрессивных противоопухолевых методов лечения и трансплантацией лиц с уже существующими сердечно-легочными, почечными и печеночными процессами изменили частоту и подход к грибковым инфекциям.В частности, как прямой результат этих достижений и терапевтических успехов, популяция, подверженная риску грибковых инфекций, значительно увеличилась [2, 3]. В начале 1980-х годов системный кандидоз был признан важной медицинской проблемой. Смертность, связанная с кандидозом, неуклонно росла до 1988 г., когда она достигла пика со скоростью 0,6 на 100 000 населения [4]. В результате последних достижений в лечении инвазивного кандидоза смертность от кандидемии ежегодно снижалась с момента ее пика.Тем не менее, системный кандидоз остается четвертым по распространенности внутрибольничной инфекцией кровотока [3]. Хотя количество инфекций кровотока из-за C . albicans уменьшилось, из-за других видов Candida , в частности C . глабрата , С . krusei и C . парапсилоз, , увеличились [1].
В отличие от кандидоза, число инфекций и смертей в результате других грибковых патогенов, особенно видов Aspergillus , продолжало расти с конца 1980-х годов [4–9].Смертность от инвазивных инфекций аспергиллеза остается очень высокой, особенно у реципиентов трансплантата, несмотря на использование новых методов диагностики и достижения в терапии [10].
Риск системной грибковой инфекции наиболее высок у пациентов с гематологическими заболеваниями, требующими трансплантации аллогенных гемопоэтических стволовых клеток с последующей трансплантацией аутологичных трансплантатов, другими гематологическими заболеваниями, связанными с тяжелой и длительной лейкопенией, у пациентов с новообразованиями твердых органов и у лиц с трансплантированными твердыми органами [11– 20].Наличие сопутствующего хронического заболевания легких и трансплантации сердца / легких увеличивает риск инфекций, вызванных дрожжами и плесенью, особенно Aspergillus .
Конкретные грибковые и дрожжевые патогены, наблюдаемые при трансплантации гемопоэтических стволовых клеток и трансплантации твердых органов, резко различаются. В частности, на инвазивные Aspergillus и другие плесневые грибки приходится 70% грибковых / плесневых инфекций у реципиентов гемопоэтических стволовых клеток, в то время как только меньшая часть реципиентов трансплантатов твердых органов приобретает эти инфекции, если только у них нет сопутствующего хронического заболевания легких или реципиент не подвергается воздействию строительная площадка больницы или пыль, содержащая плесень [10–13, 17, 18].Незаплесневые инфекции реципиентов гемопоэтических стволовых клеток составляют 30% от общего числа грибковых / плесневых инфекций в этой популяции. Напротив, почти все инфекции у реципиентов трансплантата твердых органов вызваны грибковыми агентами, и лишь небольшая часть случаев возникает в результате Aspergillus и других плесневых грибов. В этой более поздней группе инвазивный кандидоз составляет 50% от общего числа инфекций, за которыми следуют Cryptococcus (7%), эндемический микоз (6%) и, наконец, все другие грибковые или плесневые инфекции вместе составляют 37% от общего числа. .Эти различия в характере инвазивных грибковых инфекций между трансплантатом гемопоэтических стволовых клеток и трансплантацией твердых органов, по крайней мере частично, связаны с рутинным использованием азольных агентов для профилактики в первой группе, но не во второй.
2. Различия, обусловленные типом трансплантации органов
Как и ожидалось, общая частота системных грибковых инфекций наиболее высока у тех, кто получает трансплантаты костного мозга, по сравнению с трансплантатами твердых органов. Заболеваемость варьируется в каждой группе в зависимости от типа трансплантированного костного мозга и твердого органа.У реципиентов костного мозга частота наиболее высока у тех, кто получает несоответствующие и неродственные аллогенные стволовые клетки (5,9%). У пациентов, получавших соответствующие аллогенные стволовые клетки, частота встречаемости ниже — 3,7%, а у пациентов, получающих аутологичные стволовые клетки, — самая низкая частота (0,6%). Эти уровни инфицирования отражают основные различия в химиоаблативной терапии, используемой для кондиционирования костного мозга, продолжительность переживаемой посттрансплантационной цитопении и различия в иммуносупрессии, применяемые между этими различными группами [17].
Различия в частоте и типе системных грибковых инфекций, возникающих в результате трансплантации конкретного органа, также наблюдаются у реципиентов солидных органов. У тех, кто получил трансплантаты легких, самый высокий уровень заболеваемости (7,9%), затем идут сердце (3,4%), затем печень (3,1%), почки (1,1%) и поджелудочная железа (0,7%). Те, кто получает трансплантацию легких и сердца, чаще страдают инфекциями Aspergillus , в то время как те, кто получает неторакальные твердые органы, испытывают кандидоз в качестве основного грибкового патогена [1–4, 17–19].Риск кандидоза у реципиентов солидных органов максимален сразу после трансплантации (первые 2-3 месяца после трансплантации), а затем снижается, поскольку другие грибковые патогены, включая аспергиллез, гистоплазмоз, кокцидиоидомикоз и бластомикоз, становятся более заметными, с вариациями в зависимости от географического положения получатель [2]. Ранние инфекции, вызванные кандидозом, являются результатом использования постоянных катетеров, центральных трубок, ран живота, дренажа и вторичных операций, а также использования парентерального питания и искусственной вентиляции легких [5].Поздние инфекции, которые возникают от месяцев до лет после трансплантации, являются следствием пожизненных иммуносупрессивных средств, которые эти пациенты принимают для предотвращения отторжения, и уникальных воздействий окружающей среды, которые испытывает реципиент.
3. Стоимость грибковых инфекций
Прямые затраты на грибковые инфекции значительны [19]. Глобальные издержки от кандидоза в 2,5 раза выше, чем от инфекций Aspergillus . Однако, если глобальная стоимость скорректирована с учетом числа инфицированных людей, индивидуальные затраты будут в 2-3 раза выше для тех, кто инфицирован вирусом Aspergillus , по сравнению с теми, кто страдает кандидозом [19].
4. Диагностика грибковых инфекций
Ранняя диагностика и лечение критически важны с точки зрения получения лучшего результата, определяемого как снижение заболеваемости и смертности. Диагностика инвазивных грибковых инфекций затруднена из-за отсутствия специфических признаков и симптомов до поздних стадий заболевания и трудностей, связанных с документированием диагноза с помощью современных диагностических инструментов, получением инфицированной ткани, необходимой для постановки конкретного диагноза, а в некоторых случаях определение чувствительности выделенного агента к применяемой схеме лечения [20].
5. Терапевтические определения
Высокая смертность от инвазивных хирургических инфекций в значительной степени связана с задержкой в распознавании инфекции у лиц, подверженных риску тяжелых инфекций, и трудностями в установлении раннего диагноза из-за неспецифических клинических особенностей , низкая чувствительность микроскопических методов диагностики, сложность получения инфицированной ткани для гистологических и микробиологических диагностических процедур и надлежащая интерпретация процедур визуализации [20].
Как прямое следствие этих факторов были разработаны и используются профилактические, эмпирические и превентивные методы лечения. Конкретный противогрибковый агент, выбранный для каждого из этих терапевтических подходов, варьируется в зависимости от центра и конкретных типов трансплантации. Факторы, влияющие на выбор противогрибкового средства, включают характеристики пациента, клинические обстоятельства, а также наличие или отсутствие явного сепсиса и / или гемодинамической нестабильности.
Эмпирическая терапия определяется как начало противогрибковой терапии у человека с высоким риском инвазивной грибковой инфекции и проявления симптомов и / или признаков инфекции, но без микробиологической документации инфекции.В эмпирической терапии используется противогрибковый агент широкого спектра действия в течение 3 или более дней до тех пор, пока не станет возможной деэскалация, в зависимости от конкретной выявленной инфекции, ее локализации и клинического статуса пациента.
Профилактическая терапия определяется как использование противогрибкового средства с целью предотвращения вероятности инвазивной грибковой инфекции у человека с высоким риском такой инфекции. Превентивная терапия определяется как начало противогрибковой терапии на основании результатов раннего диагностического теста.
6. Диагностические инструменты
Доступные в настоящее время диагностические инструменты для постановки диагноза инвазивной грибковой инфекции включают следующее: галактоманнан, (1,3) — β -глюкан и C . albicans обнаружение антител зародышевой трубки. У каждой из этих процедур есть свой набор проблем, ограничивающих их широкое применение.
Тест на галактоманнан — это иммуноферментный анализ, одобренный FDA и используемый в США и Европе.Анализ может обнаружить галактоманнан в крови в среднем за 5–8 дней (диапазон 1–27 дней) до появления клинических признаков и симптомов инвазивной грибковой инфекции. Это неспецифический тест, который позволяет предположить только наличие грибковой инфекции, поскольку измеряет компонент грибковых гиф. В случае положительного результата определяемый уровень варьируется в зависимости от нагрузки инфекционного агента и может использоваться для мониторинга реакции на терапию [21–24]. К сожалению, ложноположительные результаты встречаются у 5,7–14,0% взрослых и до 83% у новорожденных.Причина этих положительных результатов не совсем ясна, но использование пиперациллин-тазобактама у взрослых и перекрестная реактивность с антигенами, экспрессируемыми у видов Bifidobacterium у новорожденных, были предложены в качестве возможных причин [25, 26].
В целом, анализ галактоманнана имеет умеренную точность для диагностики инвазивной грибковой инфекции у лиц с ослабленным иммунитетом и более эффективен при гематологических злокачественных новообразованиях или процедурах трансплантации гематологических стволовых клеток, чем при процедурах трансплантации твердых органов [21–24] .Тем не менее, наличие положительного результата анализа галактоманнана с использованием жидкости бронхоавеолярного лаважа у реципиента трансплантата солидного органа с клиническими признаками бронхиальной инфекции или пневмонии является высоко диагностическим в этой популяции [26, 27].
Анализ (1,3) — β -d-глюкана был одобрен FDA, и при положительном результате в крови предполагается наличие грибковой инфекции. Он, как и тест на галактоманнан, представляет собой грибковый маркер широкого спектра действия, требующий последующих микробиологических исследований и визуализации для определения конкретной инфекции.Его полезность отражает тот факт, что глюканы являются критическим соединением клеточной стенки большинства патологических грибов, за исключением криптококка , и зигомицетов [28–33].
Основной проблемой анализа (1,3) — β -d-глюкана является его потребность в стеклянной посуде без эндотоксина и глюкана, а также наличие ложноположительного результата в результате присутствия альбумина, иммуноглобулинов, глюкансодержащие материалы, грамположительные бактерии и гемодиализ. В результате его основная польза — исключить возможность грибковой инфекции [29–33].
Антитела к C . albicans антигена зародышевой трубки были полезны при обнаружении инвазивного кандидоза из-за широкого спектра видов Candida [34, 35]. Он оказался наиболее полезным при обнаружении инфекций Candida у потребителей наркотиков, гематологического рака и у реципиентов трансплантата, а также у медицинских пациентов в отделениях интенсивной терапии [34, 35]. Его использование у реципиентов трансплантата твердых органов не оценивалось.
Использование полимеразной цепной реакции (ПЦР) для обнаружения ДНК грибов доступно в исследовательских лабораториях, но не стандартизировано и не одобрено FDA.Более беспокоит тот факт, что из-за своей чувствительности они могут быть положительными в образцах, полученных от пациентов с колонизацией, а не с инфекцией. Следовательно, диагноз инфекции, а не колонизации может фактически потребовать использования менее чувствительного теста для подтверждения.
Микробиологические культуры биологических жидкостей и тканей для обнаружения инвазивной грибковой инфекции требуют нескольких дней, а иногда и недель для идентификации конкретного грибкового патогена.При этом они очень специфичны и при необходимости могут использоваться для тестирования устойчивости к противогрибковым препаратам.
7. Доступные противогрибковые агенты (таблицы 1 и 2)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Как правило, противогрибковые агенты нацелены на компоненты клеточной стенки грибов, которые приводят к нарушению гомеостаза клеточной стенки и вызывают осмотический стресс, который приводит к лизису и гибели грибов. Полиены (амфотерицин) связываются с эргостеролом, основным стериновым компонентом клеточной мембраны грибов, что приводит к потере целостности клеточной стенки. Азолы (флуконазол, итраконазол, вориконазол и позаконазол) ингибируют ферменты, участвующие в синтезе эргостерола. Эхинокандины подавляют синтез глюкана.Глюкан — это длинноцепочечный полимер, отвечающий за стабильность клеточной стенки грибов. На его долю приходится 30–60% массы клеточной стенки у видов Candida , Aspergillus и Saccharomyces видов. Важно отметить, что клетки человека не содержат глюкан, что объясняет низкую токсичность для человека, связанную с этим классом агентов.
7.1. Полиены
Амфотерицин был основным средством для лечения инвазивных грибковых инфекций более полувека.Его эффективность основана на его способности связываться с эргостерином, основным стеролом в клеточной стенке грибов, вызывая потерю осмотической регуляции клеточной стенки и лизис инфицирующего гриба (фунгицидный). Фактором, ограничивающим его использование, является нефротоксичность, особенно прогрессирующая почечная дисфункция, связанная с гипокалиемией, почечным канальцевым ацидозом и гипокальциемией. Препараты амфотерицина на липидной основе снизили нефротоксичность по сравнению с исходным агентом, но по-прежнему имеют аналогичную картину побочных эффектов.К сожалению, эти препараты амфотерицина на основе липидов не обладают большей эффективностью и значительно дороже исходного материала.
Использование режимов гидратации с нормальным физиологическим раствором и непрерывной инфузией амфотерицина уменьшило лихорадку, озноб и приливы, связанные с его использованием, но может быть проблематичным у пациентов с трансплантатами с уже существующей дисфункцией почек и / или печени, которые часто бывают такими. перегрузка объема осложняется низким уровнем сывороточного альбумина [36].Эти же люди могут иногда испытывать острую легочную реакцию, похожую на отек легких, при приеме амфотерицина.
Амфотерицин — разрешенное противогрибковое средство для C . albicans , но имеет пониженную активность против C . глабрата , С . Крузей , С . lusitaniae и плесени. Более того, не было показано, что полиены имеют какое-либо значение для профилактики. Токсичность полиенов, особенно их нефротоксичность и их стоимость (полиены, солюбилизированные липидами), делают их менее вероятными для использования, чем другие доступные в настоящее время агенты.
7.2. Азолы
Этот класс агентов менее токсичен, чем полиены, и их можно вводить как перорально, так и внутривенно. Они действуют путем ингибирования синтеза эргостерола и с помощью других неустановленных механизмов. Их нарушение работы большого количества ферментных систем P450 ограничивает их использование у людей, которым требуются другие агенты, метаболизируемые ферментами P450, что может потребовать альтернативного режима дозирования этих других агентов (см. Таблицы 3 (a) и 3 (b)) . Превосходный профиль токсичности флуконазола, его доступность для внутривенного и перорального введения, а также низкая стоимость делают его препаратом выбора для гемодинамически стабильных пациентов с кандидемией.
| (a) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
коллоидная дисперсия2
9050 Vor2
910
57 9105 910p2 9105 9105 9105 9509 9105
9105
0
9105
0
9105
0 9105
0 9105
0 9105
0 E
0
| ||||||||||||||||||||||||||||||||||||||||||||||||
Активность вориконазола против Candida превосходит активность флуконазола на основании данных МИК, его активность против флуконазол-резистентных видов и его более широкий спектр делают его предпочтительным средством для гемодинамически нестабильных пациентов или те, кто До того, как инфекция вызвана nonalbicans Candida , Aspergillus или любой другой плесенью [37].Однако он оказывает клинически важный эффект на метаболизм агента, ингибирующего кальциневрин (иммунодепрессанты), что приводит к заметному увеличению их уровней в цельной крови, которые могут достигать токсических уровней, если доза этих иммунодепрессантов не будет заметно снижена. Более того, с использованием вориконазола были связаны две уникальные токсичности. Это развитие нарушения зрения и светочувствительности кожи. Нарушение зрения наблюдается у 45% людей, принимающих агент.Как правило, это преходящее заболевание, которое проходит при продолжении лечения. Кожная реакция светочувствительности необычна и, что важно, не предотвращается с помощью солнцезащитных лосьонов. Это полностью обратимо при отмене препарата. Использование вориконазола и позаконазола противопоказано, если сиролимус используется как часть иммуносупрессивного режима (см. Таблицу 3 (а)). Итраконазол может вызывать уникальный комплекс побочных эффектов, состоящий из гипотензии, гипокалиемии и отеков. Отрицательный инотропный эффект, вызывающий застойную сердечную недостаточность, также был идентифицирован и ограничивает его полезность у людей с ранее существовавшим заболеванием сердца [38].У итраконазола есть две другие ограничивающие проблемы, особенно у пациентов с трансплантацией гемопоэтических стволовых клеток: его потенциал для гепатотоксичности и его пониженное всасывание при использовании в сочетании с блокаторами H 2 или агентами, ингибирующими протонную помпу.
7.3. Фтороцитозин
Фторцитозин — аналог пиримидина, который подавляет синтез ДНК и белка. Его основное применение — в сочетании с другими агентами для лечения криптококковых инфекций [39–41]. Развитие быстрой лекарственной устойчивости и его токсичность (см. Таблицу 3 (b)) ограничивают его полезность при других грибковых инфекциях [41].
7.4. Эхинокандины
Эхинокандины представляют собой полусинтетические липопептиды, которые были первоначально выделены из различных грибковых агентов и впоследствии модифицированы. В частности, они представляют собой циклические гексапептиды с N-связанной ацильной боковой цепью, которая, по-видимому, необходима для их противогрибковой активности. У них разная молекулярная масса, которая составляет около 1200 дальтон. Этот класс агентов подавляет синтез глюкана, основного компонента клеточной стенки грибов, необходимого для стабильности, особенно у видов Candida и Aspergillus .Было показано, что эхинокандины усиливают фагоцитарную активность макрофагов, действие, которое также может способствовать их эффективности при устранении грибковых инфекций. Более того, они также обладают активностью против предварительно сформированных биопленок Candida и, таким образом, предотвращают прилипание видов Candida к эндотелиальным клеткам.
Фармакокинетические характеристики эхинокандинов показаны в таблице 5. Между различными агентами есть очень незначительные различия, за исключением точного механизма их метаболизма.Важно отметить, что для пациентов с почечной недостаточностью коррекции дозы не требуется. В настоящее время анидулафунгин является единственным доступным эхинокандином, который не требует корректировки дозы в случаях с умеренным заболеванием печени, определяемым как пациенты с баллами по шкале Чайлд-Пью от 7 до 9.
Поскольку эхинокандины не закрепляют ферментные системы цитохрома P450 и не взаимодействуют с P-гликопротеином, как некоторые азолы, они не влияют на уровни ингибирующих кальциневрин иммунодепрессантов и многих других лекарств, используемых для управлять другими инфекциями, гипертонией и сердечной аритмией, часто наблюдаемой у реципиентов трансплантата (таблицы 3 (а) и 3) (б)). Особый интерес для популяции трансплантатов эхинокандины обладают ограниченной теоретической активностью против Pneumocystis carinii ( P . jiroveci ) инфекции [42, 43]. Они эффективны также против видов гистоплазмоза, видов blastomyces и видов coccidioides — грибковых агентов, которые вызывают поздние инфекции в популяциях трансплантатов. Сообщалось о резистентности к эхинокандинам [44, 45]. К сожалению, доступные оценки значений MIC для эхинокандинов не позволяют четко разграничить чувствительные и устойчивые грибы [37, 45–48]. В результате эти анализы следует интерпретировать с осторожностью и в контексте. Специфические механизмы, ответственные за устойчивость к эхинокандинам, не ясны, но, по-видимому, связаны с мутациями в субъединице глюкансинтетазы [44, 49]. Были идентифицированы и другие второстепенные механизмы. Повышение уровня трансаминаз и щелочной фосфатазы в сыворотке — одно из наиболее частых лабораторных изменений, связанных с каспофунгином [50, 51]. В последнее время применение микафунгина у пациентов с заболеваниями печени ограничено (как указано в его новом вкладыше к упаковке) из-за сообщений об остром гепатите и печеночной недостаточности, возникающих при его применении [51].Использование таких препаратов, как рифампин, фенитоин, карбамезапин, эфавиренц и невирапин, вызывает снижение уровня каспофунгина и требует увеличения его дозировки на 50%. Каспофунгин снижает AUC для такролимуса на 20%, в то время как циклоспорин вызывает увеличение AUC для каспофунгина на 35%. Микафунгин увеличивает AUC сиролимуса на 21% и нифедипина на 18%. Об этих взаимодействиях с анидулафунгином не сообщалось (таблицы 3 (а) и 3) (b)). Следует отметить, что средняя оптовая стоимость 20-дневного курса каспофунгина в США составляет примерно 7-8000 долларов по сравнению с 3-4000 долларов для анидулафунгина и 2–5000 долларов для внутривенного флуконазола (в зависимости от дозы).Средняя оптовая стоимость микафунгина за тот же период составила бы 4-5000 долларов. 8. Клиническое использование имеющихся противогрибковых агентовАгенты, доступные для лечения инвазивных грибковых инфекций, представлены в таблицах 1 и 2. Механизмы действия каждого класса лекарств, показания к конкретному заболеванию для каждого лекарства, и дозы, рекомендуемые для каждого показания, указаны в Таблице 1. В Таблице 2 представлены данные относительно выбора противогрибковой терапии для каждого грибкового агента, который в настоящее время одобрен FDA.Варианты лекарств указаны как первая линия (рекомендуется), вторая линия (реже используются, но эффективны), третья линия (потенциально эффективная) и препараты с неизвестной эффективностью. В таблице 3 представлены данные об эффективности и общей смертности при лечении системных грибковых инфекций. Вориконазол в настоящее время является препаратом первой линии для лечения инфекций, вызванных Aspergillus [52, 53]. Вориконазол также является единственным средством, показанным для инфекций, вызванных видами Fusarium и Scedosporium apiospermum .Только вориконазол, флуконазол и итраконазол доступны как для перорального, так и для внутривенного введения. Эхинокандины заменили азольные агенты для лечения инвазивного кандидоза [52–54]. Основные побочные эффекты и лекарственные взаимодействия каждого противогрибкового агента представлены в таблицах 3 (a) и 3 (b). В таблице 6 перечислены противопоказания и предупреждения FDA для имеющихся противогрибковых средств.
Влияние существовавшей ранее почечной и / или печеночной дисфункции на дозирование этих доступных противогрибковых агентов показано в таблицах 6 (a ) и 6 (б).Дозу азольных агентов необходимо уменьшить по мере снижения клиренса креатинина. Эффект ранее существовавшего заболевания почек несущественен для эхинокандинов. Как уже отмечалось, существует мало данных о применении противогрибковых средств у лиц с заболеваниями печени. Единственным агентом, для которого не требуется корректировка дозы при запущенном заболевании печени, является анидулафунгин [55]. Появляются четыре новых противогрибковых агента [47]. К ним относятся изавуконазол и равуконазол, оба из которых обладают широким спектром активности, большим объемом распределения и очень длительным периодом полураспада.Альбаконазол обладает широким спектром активности против видов Candida , видов Aspergillus и видов Cryptococcus , а также имеет длительный период полувыведения. Аминокандин имеет очень длительный период полувыведения, что позволяет ему вводить внутривенно реже, чем ежедневно. Комбинированная противогрибковая терапия иногда используется при тяжелых и клинически устойчивых к лекарствам инфекциях с целью максимизировать эффективность и потенциально минимизировать токсичность [56, 57]. При выборе агентов, которые будут использоваться в комбинации, следует комбинировать только те, которые имеют разные механизмы действия.Таким образом, рекомендуется использовать агент, действующий на цитоплазматическую мембрану (полиен или азол), плюс агент, действующий на синтез ДНК или белка (фторцитозин), или активный агент клеточной стенки (эхинокандины), если будет использоваться комбинированная терапия. Однако следует отметить, что нет окончательных данных, подтверждающих использование комбинированной терапии для лечения грибковых инфекций per se , но это может быть разумно подразумевается на основании использования комбинированных методов лечения в качестве общепринятого лечения бактериальных и вирусных инфекций. .При этом, учитывая низкие показатели эффективности лечения инвазивных грибковых инфекций одним агентом в целом, комбинированная терапия может повысить эффективность лечения в трудных для лечения ситуациях. Одно исследование состоит из триазола и эхинокандина у реципиентов трансплантата твердых органов. Он показывает снижение смертности у лиц с почечной недостаточностью и инвазивным вирусом Aspergillus [56]. 9. Клиническая и экономическая значимость грибковых инфекций, особенно кандидозаВ прошлом системные грибковые инфекции считались проблемой только для пациентов с нейтропенией.Однако, помимо фактора риска нейтропении, более свежие данные предполагают, что половина всех грибковых инфекций, приобретенных в больнице, произошла у тяжелобольных хирургических пациентов. Виды Candida составляют более 80% всех нозокомиальных изолятов грибов [62–64], в отличие от видов Aspergillus и менее распространенных видов Fusarium и Rhizopus , которые составляют только 10% оставшихся нозокомиальных изолятов. Инвазивный кандидоз является наиболее часто встречающейся инвазивной грибковой инфекцией и чаще всего встречается у реципиентов с ослабленным иммунитетом после трансплантации твердых органов, получающих химиотерапию и пациентов, перенесших несколько сложных хирургических вмешательств на брюшной полости. Как указывалось ранее, вида Candida стали четвертым по распространенности изолятом нозокомиального кровотока, уступая только коагулазонегативным Staphylococcus , Staphylococcus aureus и Enterococci . Этот факт особенно важен, когда известно, что менее чем в половине случаев инвазивной кандидемии, документально подтвержденных при вскрытии, был положительный предубойный посев крови на Candida [59]. Инвазивные Candida инфекции имеют средний уровень смертности от 25 до 38%.Конкретные виды Candida , отвечающие за кандидемию в популяциях высокого риска, за последнее десятилетие изменились с C . albicans другим видам nonalbicans, причем примерно половина зарегистрированных случаев приходится на виды nonalbicans [5]. Что еще более важно, эти виды nonalbicans ( C . glabrata , C . krusei и C . parapsilosis ) имеют более высокий уровень смертности, объясняют большую продолжительность пребывания в отделениях интенсивной терапии и связаны с более высокими показателями почечной недостаточности, тромбоцитопении, злокачественных новообразований и ИВЛ.Факторы риска, признанные для кандидемии в целом, включают сложные операции на брюшной полости, повторные операции, парентеральное питание, использование антибиотиков широкого спектра действия, использование множественных сосудистых катетеров, ранее признанную колонизацию Candida , механическую вентиляцию легких и заместительную почечную терапию [58 , 59]. В проспективном клиническом исследовании, посвященном изучению факторов риска инфекций кровотока Candida у более чем 4000 хирургических пациентов, среди выявленных пациентов были ранее перенесенные операции (RR = 7.3), острая почечная недостаточность (ОР = 4,2), парентеральное питание (ОР = 3,6) и наличие трехпросветного катетера (ОР = 5,4) [58] . Другие факторы риска, выявленные в других исследованиях, включали госпитализацию в ОИТ> 4 дней, сахарный диабет, ВИЧ-инфекции, центральные инфекции, нейтропению, химиотерапию, рак (особенно гематологические раковые заболевания), использование антибиотиков широкого спектра действия, использование 3 или более антибиотиков, и ИВЛ> 2 дней. Первым ответом на подозрение на кандидемию является начало противогрибковой терапии вориконазолом или эхинокандином и удаление всех сосудистых линий.Важно понимать, что посев крови положительный в случаях инвазивной кандидемии менее чем в 50% случаев. Инвазивные инфекции Fusarium , аналогичные инфекциям Candida , выявляются при посеве крови менее чем в половине случаев. Хуже инвазивная инфекция Aspergillus редко идентифицируется при посеве крови. Первая линия терапия Candidemia остается спорной, так как исследования сообщали об аналогичных показателях эффективности с амфотерицином, флуконазол, эхинокандинами и вориконазолом [65-69].С увеличением частоты встречаемости видов nonalbicans, особенно у тяжелобольных пациентов, использование агентов широкого спектра действия, таких как вориконазол, эхинокандин или амфотерицин, может быть более целесообразным, по крайней мере, до тех пор, пока не будет идентифицирован конкретный вид Candida , чтобы избежать повышенной смертности. возникающие в случаях, когда изначально назначено неподходящее терапевтическое средство. Ограничением внутривенного вориконазола является его состав с циклодекстрином, который накапливается у людей с нарушенной функцией почек.Выявленные ранее многочисленные побочные эффекты амфотерицина ограничивают его использование. Среди эхинокандинов только анидулафунгин показал превосходство над флуконазолом [55]. Более того, его эффективность, безопасность и отсутствие метаболизма цитохрома P450 предполагают, что его следует рассматривать как вариант первой линии при инвазивной кандидозной инфекции. Независимо от выбора конкретного эхинокандина вместо флуконазола, эхинокандины рекомендуются для использования у людей, которые находятся в критическом состоянии или гемодинамически нестабильны. Кандидемия связана с повышением стоимости госпитализации, оцениваемой в 68 311 долларов США (95% ДИ 57 513–79 108 долларов США) и более продолжительной продолжительностью пребывания, оцениваемой в 23,1 дня госпитализации (95% ДИ 19,3–26,8 дней) по сравнению с установленной DRG контрольная популяция без кандидемии [70–72]. Частота инвазивных грибковых инфекций у реципиентов трансплантата твердых органов колеблется от 5 до 42% [73]. В зависимости от пересаживаемого органа, он самый низкий для реципиентов поджелудочной железы и самый высокий для реципиентов трансплантата печени. Candida вида и, в меньшей степени, Aspergillus , составляют подавляющее большинство инвазивных грибковых агентов у реципиентов трансплантата твердых органов [14]. Cryptococcus и эндемические микозы возникают поздно, обычно через год или более после трансплантации. В настоящее время в большинстве центров трансплантации печени используется противогрибковая профилактика в раннем послеоперационном периоде у отдельных реципиентов, перенесших сложные или повторяющиеся хирургические вмешательства после трансплантации [74–76].Основная проблема, связанная с применением азольной терапии у реципиентов трансплантата, заключается во взаимодействии с ингибиторами кальциневрина, что, следовательно, требует корректировки дозы того или иного агента. 10. Опыт применения противогрибковых агентов у лиц с заболеваниями печениНесмотря на наличие значительных данных относительно использования и мер предосторожности, которые следует применять с противогрибковыми агентами у лиц с прогрессирующим заболеванием почек, мало данных для пациентов с запущенным заболеванием печени (таблицы 6 (а) и 6 (б)). В еврейской больнице Барнеса анидулафунгин недавно был использован вместо предпочтительного для больниц каспофунгина при двух конкретных категориях заболеваний с клинической эффективностью [55]. Субъекты в этом отчете состояли из пациентов с нарушением функции печени (71% группы) и лиц с потенциальным лекарственным взаимодействием с каспофунгином (21% группы). Эти две группы не были взаимоисключающими, однако по 4 пациента соответствовали обоим критериям. Вместе эти две группы составили 83% тех, кто получал анидулафунгин в отчете. В своем обсуждении авторы отметили, что ни каспофунгин, ни микафунгин не изучались у пациентов с тяжелым заболеванием печени и что анидулафунгин является единственным агентом с подходящими фармакокинетическими свойствами, что делает его приемлемым агентом в популяции пациентов с заболеваниями печени. Фактически, у 5 из 35 пациентов (14,5%) в их исследовании общий уровень билирубина превышал 10 мг / дл, а у двоих общий билирубин превышал 40 мг / дл. Один из их пациентов имел уровень трансаминаз более чем в 10 раз превышающий верхний уровень нормы в то время, когда была начата терапия анидулафунгином. Грибковые инфекции после трансплантации печени, хотя нечасто повышают уровень смертности и увеличивают общую стоимость периоперационного ухода за трансплантатом [70–73]. Заболеваемость лекарственной устойчивостью C . albicans , nonalbicans Candida видов, Aspergillus и другие инвазивные плесневые грибки у реципиентов трансплантата увеличивается и ассоциируется со снижением выживаемости [77, 78]. Факторы риска грибковых инфекций после трансплантации печени хорошо известны и включают предоперационную почечную недостаточность, фульминантную печеночную недостаточность, длительную предоперационную госпитализацию, особенно в отделении интенсивной терапии, чрезмерную потребность в интраоперационном переливании крови, раннюю ретрансплантацию или осложнения, требующие возвращения в операционную, и количество повторных операций [73, 75, 77]. Несмотря на эту информацию, грибковая профилактика была предметом значительных дискуссий с точки зрения ее эффективности, стоимости, выбора агентов, режима дозирования и продолжительности терапии. В последнее время отсутствие профилактики среди реципиентов трансплантата печени из группы высокого риска было связано с 4-кратным повышением риска грибковых инфекций (<0,05) по сравнению с группой профилактического риска амфотерицином [79–81]. Проведено лишь несколько хорошо спланированных профилактических исследований у пациентов с трансплантатами печени [82–88].Одно исследование было безрезультатным, а два показали эффективность флуконазолов в предотвращении инвазивного кандидоза. В частности, одно исследование показало, что флуконазол предотвращает инфекции, вызванные C . albicans , но не C . glabrata или C . krusei инфекций. Одно сообщение об использовании итраконазола в профилактических целях после трансплантации снизило частоту грибковых инфекций с контрольного значения 24% до 4% [86]. Мета-анализ использования противогрибковой профилактики у реципиентов трансплантата печени пришел к выводу, что профилактика снижает общее количество эпизодов инфекций, а также заболеваемость, напрямую связанную с грибковой инфекцией, но не влияет на общую смертность [74]. Никакие профилактические исследования у реципиентов трансплантатов солидных органов не продемонстрировали явного положительного эффекта в предотвращении инвазивного Aspergillus , но были интерпретированы как предполагающие, что это может иметь место [75–77]. Напротив, исследования таргетной терапии после трансплантации печени продемонстрировали, что вориконазол является начальной терапией выбора для инвазивного Aspergillus . Было показано, что непрерывные инфузии амфотерицина также эффективны и в целом безопасны, но многие потенциальные эффекты амфотерицина делают вориконазол предпочтительным средством при этом показании [36, 52]. 11. Резюме(1) Грибковые инфекции, особенно кандидоз и Aspergillus , представляют собой серьезные проблемы со здоровьем у серьезно больных, таких как реципиенты трансплантата, несмотря на то, что факторы риска таких инфекций хорошо известны и предсказуемы. 2) Системные грибковые инфекции обычно диагностируются поздно, а лечение требует больших затрат с точки зрения потерянных жизней, продолжительности пребывания в больнице и общих медицинских затрат. (3) Несмотря на множество агентов, доступных в настоящее время для лечения системных грибковых инфекций, эффективность таких обработок мало.(4) Упреждающая или профилактическая терапия грибковых инфекций у отдельных пациентов с 3 или более факторами риска таких инфекций представляется разумной и может быть единственным способом предотвращения этих инфекций. Очевидно, что необходимы дальнейшие исследования для определения наилучшего агента, оптимальной дозировки и продолжительности терапии у пациентов с ослабленным иммунитетом и пациентов с трансплантатом. другие терапевтические агенты при коморбидных болезненных состояниях, затрагивающих почки, печень или оба органа, выбор противогрибкового агента для использования в конкретном случае должен основываться на (а) вероятности терапевтического эффекта, (б) признанных и ожидаемых неблагоприятных события, связанные с их использованием, (c) возможность лекарственного взаимодействия, и, наконец, простота их введения с особым вниманием к их применению у лиц с уже существующими или сопутствующими заболеваниями почек и / или печени. Противогрибковые препараты системного действия при кожных грибковых инфекциях Резюме Введение
Обычный подход к лечению кожных инфекций у иммунокомпетентных пациентов — лечение местными агентами.Однако инфекции ногтей и волос, широко распространенный дерматофитоз и хронические нечувствительные дрожжевые инфекции лучше всего лечить пероральными противогрибковыми препаратами. Когда применять системную терапию Дерматофитоз (дерматофития или стригущий лишай) волосистой части головы, кожи и ногтей
Хронические нечувствительные дрожжевые инфекции В большинстве случаев разноцветный лишай (лишай) и себорейный дерматит, наиболее легким проявлением которого является отрубевидный лишай на голове, также легко поддаются местному лечению. Поскольку возбудитель дрожжей Malassezia furfur является частью нормальной кожной флоры, во избежание рецидивов часто требуется профилактическое лечение. Основными показаниями к применению пероральных противогрибковых средств являются случаи, когда местное лечение не помогло:
Как следует подтвердить решение о лечении? Недостатки лекарственных препаратов для местного применения Существуют серьезные проблемы с соблюдением режима лечения, поскольку пациенту трудно продолжать лечение или знать, где применять крем после исчезновения воспалительных признаков.На практике большинство местных лекарств необходимо продолжать в течение некоторого времени после исчезновения симптомов и видимых признаков. Местные препараты могут быть трудными для использования в определенных областях, например на волосах и ногтях, а также в некоторых более чувствительных областях, таких как влагалище, пах или расщелина рта. Преимущества и недостатки системных препаратов К недостаткам в основном относятся потенциальные побочные эффекты. Есть также соображения стоимости, особенно с новыми противогрибковыми препаратами системного действия. Противогрибковые препараты для перорального применения Гризеофульвин Гризеофульвин обычно хорошо переносится. Побочные эффекты включают головную боль, желудочно-кишечные расстройства и, реже, крапивницу, диарею и светочувствительность. Следует избегать приема препарата при беременности и пациентам с заболеваниями печени.Гризеофульвин может снизить антикоагулянтный эффект варфарина, а одновременное применение фенобарбитона может снизить биодоступность гризеофульвина. Гризеофульвин может также взаимодействовать с алкоголем, вызывая реакцию типа дисульфирама. Поэтому у многих пациентов алкоголь будет противопоказанием к его употреблению. Кетоконазол Кетоконазол не всасывается системно после местного применения, но хорошо всасывается при пероральном приеме в кислой среде. Он плохо всасывается у пациентов с ахлоргидрией и у тех, кто принимает антациды или антагонисты рецепторов h3. Обычная доза для взрослых составляет 200-400 мг / день в зависимости от инфекции, которую лечат. У детей можно применять дозу 3 мг / кг. Продолжительность лечения также будет зависеть от характера инфекции. У пациентов, получающих лечение более 30 дней, необходимо контролировать функцию печени.Наиболее частыми побочными эффектами являются тошнота, анорексия и рвота, возникающие примерно у 20% пациентов. Может быть нарушен метаболизм стероидов надпочечников или яичек. Одновременное применение кетоконазола с терфенадином или астемизолом было связано с потенциально смертельными сердечными аритмиями. Кетоконазол также усиливает действие варфарина, пероральных гипогликемических средств и фенитоина. Флуконазол Абсорбция флуконазола не зависит от кислотных условий, а также не зависит от приема пищи. Обычные дозы для взрослых составляют от 100 до 400 мг / день, в зависимости от иммунного статуса пациента, возбудителя инфекции и реакции пациента на терапию.При большинстве кожно-слизистых заболеваний у иммунокомпетентных пациентов рекомендуемая доза для взрослых составляет 150 мг / неделю в течение 4 недель. Вагинальный кандидоз обычно поддается однократной дозе 150 мг. Флуконазол обычно хорошо переносится с небольшими побочными эффектами, такими как тошнота и рвота, возникающими у некоторых пациентов. В отличие от кетоконазола и итраконазола, флуконазол мало взаимодействует с лекарствами. Однако эффекты варфарина, пероральных гипогликемий, фенитоина и теофиллина могут усиливаться флуконазолом при приеме в дозах 200 мг / день или выше. Итраконазол Всасывание из желудочно-кишечного тракта улучшается, если препарат вводится с пищей или в кислой среде.Обычная доза для взрослых при кожных инфекциях составляет 100-200 мг / день в зависимости от инфекции, которую лечат. Итраконазол обычно хорошо переносится, у некоторых пациентов отмечаются незначительные побочные эффекты в виде тошноты, головной боли и боли в животе. Концентрации итраконазола снижаются при одновременном применении фенитоина, рифампицина, антацидов и антагонистов h3. Одновременный прием терфенадина или астемизола с итраконазолом противопоказан, а эффекты варфарина, пероральных гипогликемических средств, фенитоина и дигоксина могут усиливаться.
Тербинафин Препарат хорошо всасывается, обладает высокой липофильностью, концентрируется в дерме, эпидермисе и жировой ткани. Тербинафин метаболизируется в печени, а неактивные метаболиты выводятся с мочой.Обычная доза для взрослых составляет 250 мг / день, продолжительность лечения зависит от локализации и степени инфекции, от двух недель для межпальцевого дерматофитии стопы до 4-6 недель для широко распространенного или хронического нечувствительного дерматофитоза кожи и / или или кожи головы, до 12 недель для ногтей. Тербинафин обычно хорошо переносится, и наиболее частыми побочными эффектами являются тошнота, боль в животе и кожные аллергические реакции, но они часто бывают легкими и преходящими. Сообщалось также о нарушении вкуса и токсичности для печени. Какие препараты и когда следует использовать? Заключение Дополнительная литература Elewski BE. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Ребенок должен знать внешние признаки микроспории у животных , не допускать общения с больными животными. После того как ребенок погладил кошку или собаку, он должен помыть руки.
Ребенок должен знать внешние признаки микроспории у животных , не допускать общения с больными животными. После того как ребенок погладил кошку или собаку, он должен помыть руки. Показаниями для госпитализации являются:
Показаниями для госпитализации являются: Иногда заразить ребенка может подаренная родителями обезьянка, хомячок, морская свинка, которые, хоть и редко, но также болеют этим микозом. Поэтому домашние питомцы должны периодически наблюдаться у ветеринара.
Иногда заразить ребенка может подаренная родителями обезьянка, хомячок, морская свинка, которые, хоть и редко, но также болеют этим микозом. Поэтому домашние питомцы должны периодически наблюдаться у ветеринара. IH тест на трихофитон ассоциируют с наличием сывороточных IgE и IgG (в основном IgG4) против антигенов тихофитона, маркеров Th3 ответа. Здесь IL-4, произведенный CD4 T-клетками (Th3 клетками) индуцирует переключение изотипа антител на IgG4 и IgE.
IH тест на трихофитон ассоциируют с наличием сывороточных IgE и IgG (в основном IgG4) против антигенов тихофитона, маркеров Th3 ответа. Здесь IL-4, произведенный CD4 T-клетками (Th3 клетками) индуцирует переключение изотипа антител на IgG4 и IgE. Впрочем, устоявшееся определение обширного поражения отсутствует
Впрочем, устоявшееся определение обширного поражения отсутствует corporis/cruris/pedis
corporis/cruris/pedis corporis/cruris/pedis
corporis/cruris/pedis corporis/cruris/pedis
corporis/cruris/pedis corporis/cruris
corporis/cruris Диагностика и лечение микозов человека .Тотова, Нью-Джерси: Humana Press; 2008: 1-428.
Диагностика и лечение микозов человека .Тотова, Нью-Джерси: Humana Press; 2008: 1-428. J Med Vet Mycol 1991; 29: 419-421.
J Med Vet Mycol 1991; 29: 419-421. Med Pediatr Oncol 1995; 25: 119-122.
Med Pediatr Oncol 1995; 25: 119-122. Сохранение криптококкомы при нейровизуализации. Clin Infect Dis 2000; 31: 1303-1306.
Сохранение криптококкомы при нейровизуализации. Clin Infect Dis 2000; 31: 1303-1306. Прямое выделение Candida spp. из посевов крови на CHROMagar Candida. J Clin Microbiol 2003; 41: 2629-2632.
Прямое выделение Candida spp. из посевов крови на CHROMagar Candida. J Clin Microbiol 2003; 41: 2629-2632. J Clin Microbiol 2005; 43: 433-435.
J Clin Microbiol 2005; 43: 433-435. , Ким С.Х., Вольф С.Е., Hospenthal DR . Корреляция посева и гистопатологии при грибковой колонизации ожоговой раны и инфекции. Бернс 2007; 33: 341-346.
, Ким С.Х., Вольф С.Е., Hospenthal DR . Корреляция посева и гистопатологии при грибковой колонизации ожоговой раны и инфекции. Бернс 2007; 33: 341-346. С., Хоспенталь Д. Р.. Первичное выделение видов Candida из образцов мочи с использованием хромогенных сред. Микозы 2008; 51: 141-146.
С., Хоспенталь Д. Р.. Первичное выделение видов Candida из образцов мочи с использованием хромогенных сред. Микозы 2008; 51: 141-146. Х., Веллер П.Ф., ред. Тропические инфекционные болезни. Принципы, патогены и практика . Филадельфия: Черчилль Ливингстон; 1999: 665-671.
Х., Веллер П.Ф., ред. Тропические инфекционные болезни. Принципы, патогены и практика . Филадельфия: Черчилль Ливингстон; 1999: 665-671. В: Медицинский справочник сил специальных операций . Джексон, Вайоминг: Тетон НьюМедиа; 2001.
В: Медицинский справочник сил специальных операций . Джексон, Вайоминг: Тетон НьюМедиа; 2001. ИД: Гистоплазмоз (болезнь Дарлинга). ID: Паракокцидиоидомикоз (южноамериканский бластомикоз). В: Медицинский справочник сил специальных операций (CD-ROM). Джексон, Вайоминг: Тетон НьюМедиа; 2002.
ИД: Гистоплазмоз (болезнь Дарлинга). ID: Паракокцидиоидомикоз (южноамериканский бластомикоз). В: Медицинский справочник сил специальных операций (CD-ROM). Джексон, Вайоминг: Тетон НьюМедиа; 2002.