Прививка от пневмонии детям и взрослым в клиниках Ниармедик
Пневмонию, чаще всего, вызывает пневмококковая инфекция, которая является причиной и других недугов – менингита, отита, синусита. Это один из самых грозных возбудителей, способный привести к летальному исходу. Особенно опасно заболевание для маленьких детей, иммунитет которых еще не сформирован. Прививка – эффективное средство профилактики, которое позволяет предупредить болезнь.
В сети клиник НИАРМЕДИК для вакцинации от пневмококковой инфекции используются только проверенные клиническими испытаниями сертифицированные вакцины, соответствующие международным стандартам. Медицинский персонал тщательно соблюдает стерильность, используя только одноразовые материалы и инструменты. Прививки от пневмонии детям и взрослым проводятся только после консультации высококвалифицированных педиатров и терапевтов.
Преимущества вакцинации в НИАРМЕДИК
Тщательный медицинский осмотр перед вакцинацией
Врачи наших клиник проводят обязательное предварительное медицинское обследование ребенка. Специалисты определяют состояние здоровья малыша, выясняют реакцию на предыдущее введение вакцины, выявляют наличие хронических заболеваний, проводят лабораторные исследования крови и мочи. При необходимости рекомендуют консультации узкопрофильных врачей. Прививка от пневмонии возможна только для здорового малыша.
Специалисты определяют состояние здоровья малыша, выясняют реакцию на предыдущее введение вакцины, выявляют наличие хронических заболеваний, проводят лабораторные исследования крови и мочи. При необходимости рекомендуют консультации узкопрофильных врачей. Прививка от пневмонии возможна только для здорового малыша.
Высококачественные эффективные вакцины
Для детских прививок используются наиболее известные вакцины от пневмококковой инфекции, успешно применяемые во всем мире: Пневмо-23 (Франция), Превенар (США), Синфлорикс (бельгийский препарат, производится в России). Иммунизацию против пневмонии можно проводить совместно с плановыми прививками.
Особенности прививок от пневмонии
Микроорганизмы, вызывающие воспаление легких, обладают серотипами разной степени патогенности (порядка 100 видов). Постоянно передается человеку примерно четверть из них. В составе препаратов имеются антигены бактерий, наиболее часто встречающихся серотипов.
Наиболее известные вакцины от пневмонии
Превенар (США) – полисахаридно-белковая пневмококковая вакцина, обеспечивает невосприимчивость к 13-ти основным типам возбудителей, рекомендуется к применению у младенцев с двухмесячного возраста. Вакцина оказывает профилактическое действие и предупреждает развитие целого ряда заболеваний.
Пневмо-23 (Франция) – вакцина защищает от пневмококков 23 серотипов, разрешена детям старше двух лет. Стойкий иммунитет на 5 лет достигается уже при введении всего одной дозы.
В составе Синфлорикс (разработка бельгийских ученых) десять наиболее распространенных антигенов бактерий. Эти типы стрептококка являются причиной от 50 до 95% случаев заболеваний пневмококком у детей до 5-ти летнего возраста. Помимо стрептококка, вакцина против пневмонии формирует иммунитет к гемофильной палочке) и усиливает выработку иммунитета на введение дифтерийных и столбнячных анатоксинов.
Вакцины вводятся внутримышечно и подкожно. Иммунизацию против пневмококков можно совмещать с плановыми прививками.
Схема вакцинации
В соответствии с Национальным календарем прививок вакцинация от пневмонии проводится в 2, 4, 5 и 15 месяцев. Если до двух лет ребенку не сделали прививку, можно вакцинировать и в 5-6 лет. Это особенно важно для часто болеющих малышей.
Местом введения вакцины для детей до 2-х лет служит переднебоковая поверхность бедра. Более старшим инъекция выполняется в верхнюю треть плеча.
Вакцинация от пневмонии взрослых проводится один раз, ревакцинация при этом не требуется. Врачи НИАРМЕДИК рекомендуют взрослым из группы риска делать прививки регулярно, каждые 5 лет.
Возможные побочные реакции
Современные препараты редко дают побочные эффекты. Как правило, это покраснение и болезненность в месте укола, возможен небольшой отек. Иногда может повыситься незначительно температура, снизиться аппетит. В подавляющем большинстве случаев эти проявления быстро проходят.
Противопоказания
- Индивидуальная непереносимость препарата;
- Аллергия на компоненты вакцины;
- Повышенная температура;
- Заболевания в острой форме;
- Хронические прогрессирующие заболевания.

Три последних показания не относятся к абсолютным – вакцинация переносится на более поздний срок, когда ребенок выздоравливает или вступает в стадию ремиссии при хронических заболеваниях.
Пройдите вакцинацию в НИАРМЕДИК!
Сделайте прививку качественными вакцинами в наших клиниках. Процедура безопасна, способствует формированию иммунитета.
Не ставьте здоровье своего ребенка под угрозу! Звоните нам и записывайтесь на прием.
Когда и с какой целью требуется прививка от пневмонии детям?
На сегодняшний день по официальным данным медицины пневмония является одним из самых опасных инфекционных заболеваний, которые могут поражать детский организм. У маленького ребенка еще не совсем развит иммунитет, поэтому он уязвим для патогенных микроорганизмов, особенно при искусственном вскармливании. В такой ситуации эффективно помогает предупредить заражение прививка от воспаления легких.
Насколько вакцина необходима
Пневмококковое воспаление легких развивается при проникновении в орган бактерий пневмококков. Существует около 100 видов этой бактерии. Она может провоцировать синусит, отит, пневмонию и другие поражения. Самые большие риски инфекции и тяжелой степени заболевания установлены для грудных детей.
Существует около 100 видов этой бактерии. Она может провоцировать синусит, отит, пневмонию и другие поражения. Самые большие риски инфекции и тяжелой степени заболевания установлены для грудных детей.
В возрасте младше года обычно возбудителем пневмонии является пневмококк. Для предупреждения заражения требуется прививка от пневмонии детям, она показана каждому малышу. В обязательном порядке вакцинация детям до года проводится для следующих групп риска:
- генетическая предрасположенность к заболеванию;
- хронические патологии;
- продолжительные и частые простудные заболевания;
- недоношенные дети.
Также врачи педиатры классифицируют несколько факторов, повышающих риск заражения малыша. Это:
- постоянная слишком высокая влажность в помещении, где находится грудничок;
- низкая температура воздуха;
- родовая травма;
- плохой иммунитет.
Побочные действия прививка не вызывает. Не проводится вакцина до 2 месяцев, первая прививка показана, начиная с 3 месяцев. Изредка может отмечаться покраснение места инъекции, ухудшается сон на несколько дней, незначительно поднимается температура. Если вакцину от пневмококка сочетают с другой прививкой, то может отмечаться повышение температуры тела до 38 градусов – это нормально. Если показатели выше 39 – требуется консультация специалиста. Категорически запрещено делать прививку от пневмококка с БЦЖ.
Изредка может отмечаться покраснение места инъекции, ухудшается сон на несколько дней, незначительно поднимается температура. Если вакцину от пневмококка сочетают с другой прививкой, то может отмечаться повышение температуры тела до 38 градусов – это нормально. Если показатели выше 39 – требуется консультация специалиста. Категорически запрещено делать прививку от пневмококка с БЦЖ.
Повторная вакцинация отменяется в таких ситуациях:
- чувствительность к препарату;
- большой диаметр покраснения после прививки – более 8 см.
Вакцинацию рекомендуется проводить в следующем возрасте:
- первая прививка – в 3 месяца;
- вторая – в 4,5 месяца;
- третья – в полгода;
- ревакцинация в 1,5 года.
Возможная реакция на прививание
Когда родители подписывают согласие на проведение вакцинации, то интересуются рисками и противопоказаниями к ее реализации. Прививка проводится препаратом Превенар. Реакция будет зависеть от большого количества факторов – в особенности от возраста и склонности к гиперчувствительности. Чем младше ребенок, тем внимательнее должны быть доктора.
Чем младше ребенок, тем внимательнее должны быть доктора.
Побочные действия, как правило, отмечаются у детей в возрасте младше 1 года. У новорожденных до 28 недель органы дыхательной системы еще полноценно не сформировались, поэтому сохраняются высокие риски остановки дыхания. Значит, этот возраст прямое противопоказание к вакцинации.
Побочными действиями Превенара могут быть:
- покраснения и боль в месте укола;
- повышение температуры до 38 градусов;
- ухудшение аппетита;
- расстройство пищеварения;
- рвота;
- небольшой отек в месте введения инъекции;
- раздраженность и плаксивость малыша.
Важно! При гиперчувствительности к Превенару могут формироваться аллергические отеки.
Вакцину от пневмококка Пневмо 23 в 97,5% дети переносят хорошо и без негативных последствий. Редко отмечается небольшое уплотнение, краснота в месте укола. Через несколько дней симптомы пройдут самостоятельно.
В 5% случаев возникают местные реакции, выраженное жжение и зуд в месте введения вакцины. Эти проявления проходят спустя сутки.
К общим побочным реакциям относится незначительный подъем температуры, которую легко сбить жаропонижающими лекарствами или она нормализуется без помощи препаратов.
Необходимые действия до и после вакцинации
Перед тем, как делать прививку от пневмонии детям, требуется установить, насколько он здоров. Лучше проводить прививку тогда, когда в поликлинике день здоровых детей. Это снизит риски одновременного заражения ОРВИ от заболевших детей. Антигистаминные средства заранее назначаются только аллергикам.
Дети прививаются от воспаления легких внутримышечно. До 2 лет укол делается в переднюю часть бедра, после 2 лет – в дельтовидную мышцу на плече.
После вакцинации не следует сразу уходить домой. Лучше минимум на 20 минут остаться в больнице, чтобы предотвратить негативные реакции на укол. При гиперчувствительности сильная патологическая симптоматика развивается именно в это время. Если ребенок будет в поликлинике, врачи быстро смогут оказать первую помощь. Это случается редко, но важно учесть все риски.
Если ребенок будет в поликлинике, врачи быстро смогут оказать первую помощь. Это случается редко, но важно учесть все риски.
Уход после вакцинации
Сразу после вакцинации не рекомендуется изменять рацион. При диарее, рвоте и высокой температуре важно обеспечить постоянное питье. В первые 2 – 3 дня беспокоиться не следует, затем состояние должно нормализоваться.
Если температура превышает 38 градусов, следует дать жаропонижающее и проконсультироваться с врачом. Местного лечения прививки не требуется, поэтому не нужно мазать это место йодом, зеленкой, другими мазями, не следует приклеивать пластыри и т.п. При нормальном самочувствии малыша разрешено купать, гулять с ним.
Вакцина безопасна, является необходимым мероприятием. При отказе от прививки под угрозу ставится детское здоровье. Иногда прививка переносится, но для этого врачи указывают особые причины:
- острые инфекционные заболевания;
- обострения хронических патологий;
- подъем температуры невыясненной причины.

Список препаратов
Современная медицина выделяет две разновидности вакцин, которые применяются для защиты организма от заражения пневмококком:
- Превенар – данный препарат разрешен после возраста 2 месяца. При организации прививки важно учесть, что делать ее потребуется несколько раз до 5 лет. Почти все дозы вводятся до 2 лет, а последняя – в 5 лет. Противопоказание Превенара – это реакция гиперчувствительности на компоненты вакцины.
- Пневмо 23 – для эффективности прививки достаточно одного введения. Ее применяют для детей старше 2 лет. Допустимо провести дополнительную вакцинацию, но только через 3 года после первой.
Несмотря на прогрессивное развитие медицины, многие мамы высказывают свое негативное мнение, касающееся разнообразных прививок, также отмечается плохое восприятие новшеств. Некоторые родители слишком опасаются побочных реакций на прививки, забывая о том, что для ребенка важно становление его иммунитета, что в маленьком возрасте малыш беззащитен, а любая инфекция спровоцирует опасные и иногда необратимые осложнения. Воспаления легких – тяжелое заболевание для маленьких детей, особенно в возрасте младше 1 года. В связи с этим требуется хорошо подумать, прежде чем писать отказ от обязательных прививок. Отсутствие вакцинации может еще больше навредить малышу и вызывать множество проблем в будущей жизни.
Воспаления легких – тяжелое заболевание для маленьких детей, особенно в возрасте младше 1 года. В связи с этим требуется хорошо подумать, прежде чем писать отказ от обязательных прививок. Отсутствие вакцинации может еще больше навредить малышу и вызывать множество проблем в будущей жизни.
Прививка от пневмонии детям до года и взрослым: что важно знать?
Ежегодно миллионы людей заболевают пневмококковыми инфекциями, значительная часть из которых маленькие дети. Прививка от пневмонии позволяет снизить риск возникновения воспалительного процесса, который может быть очень опасен и даже привести в некоторых случаях к летальному исходу.
Как действует вакцина?
Иммунизация против пневмонии при помощи прививки – это решение, которое позволяет значительно обезопасить себя и своих детей от возможности развития пневмококковой инфекции. Компоненты вакцины способны губительно воздействовать на многие существующие в природе болезнетворные микроорганизмы из семейства стрептококков. Таким образом снижается риск развития следующих болезней:
Таким образом снижается риск развития следующих болезней:
- Отит,
- Менингит,
- Эндокардит,
- Пневмония,
- Артрит и другие.
Важно осознавать, что вакцинация не дает 100% защиты от перечисленных заболеваний, но в случае их возникновения, можно надеяться на их более легкое и неосложненное течение.
Виды прививок
Современная медицина располагает выбором препаратов для осуществления прививок от пневмококковой инфекции. Желательно знать, как они называются, и что собой представляют.
Препарат «Превенар»
Этот препарат все чаще используется для осуществления прививок. Он представляет собой полисахаридную вакцину с дифтерийным белком, который устойчив к 13 возбудителям пневмококковой инфекции. Считается, что именно эти 13 видов могут вызывать наиболее опасные заболевания для человеческого организма. Препарат можно применять для грудничков, начиная уже с двухмесячного возраста. Рекомендуется произвести прививку до достижения ими 5 лет. Помимо детей, Превенар может использоваться для вакцинации пожилых людей, лиц, страдающих сахарным диабетом, циррозом печени, ВИЧ и иными заболеваниями серьезного характера.
Помимо детей, Превенар может использоваться для вакцинации пожилых людей, лиц, страдающих сахарным диабетом, циррозом печени, ВИЧ и иными заболеваниями серьезного характера.
Возможные побочные явления: зуд и оттек в месте ввода укола, нарушение стула, повышенная температура тела.
Основная страна-производитель препарата – США.
Раствор для инъекций «Пневмо 23»
Данная прививка от пневмонии разрешена детям, только достигшим двух лет и старше. Она способна активно воздействовать сразу на 23 возбудителей воспаления легких. Также Пневмо 23 может быть рекомендована людям, старше 65 лет и иным лицам с повышенным риском развития пневмококковой инфекции.
Возможные побочные явления: оттек и ощущение зуда на месте укола, повышенная в течение одних суток температура тела.
Препарат уже выпускается в виде шприца с дозировкой на одного человека.
Порошок для инъекций «АКТ-Хиб»
Прививка АКТ-Хиб направлена на профилактику пневмонии, вызванной гемофильной палочкой. Для детей, не достигших 5 лет, данный вид пневмонии представляет серьезную угрозу для здоровья.
Для детей, не достигших 5 лет, данный вид пневмонии представляет серьезную угрозу для здоровья.
В отличие от предыдущих двух видов средств, данный препарат представляет собой порошок для инъекций, который запакован в отдельном флаконе. Разводят порошок непосредственно перед началом процедуры.
Возможные побочные явления: оттек и покраснение кожного покрова в месте прививки, а также могут наблюдаться повышенная температура тела, потерянный аппетит и общая слабость организма.
Принципы подготовки к вакцинации
Для того чтобы облегчить возможные побочные эффекты вакцинирования необходимо следовать правилам предварительной подготовки. Их необходимо соблюдать всем лицам, вне зависимости от возраста:
- В течение 2-3 недель до назначенной даты вакцинации стоит понаблюдать за состоянием пациента. Важно, чтобы отсутствовали любые признаки наличия вирусной или бактериальной инфекции, резкие изменения в поведении, нарушения психического состояния,
- Если у лица, которому показана прививка, имеются различного рода хронические болезни, важно предварительно убедиться в том, что они не находятся в стадии обострения.
 Для этого могут потребоваться дополнительные процедуры обследования: от анализа мочи до рентгенографии,
Для этого могут потребоваться дополнительные процедуры обследования: от анализа мочи до рентгенографии, - Если пациент подвержен аллергическим реакциям, то за 5 дней до планируемой даты посещения больницы, ему следует начать принимать антигистаминные препараты в профилактической дозировке. Для того чтобы максимально снизить риск возникновения ответной реакции организма на вводимый препарат, противоаллергические средства необходимо принимать еще в течение 2-3 дней после прививки,
- Настоятельно не рекомендуется посещать места большого скопления людей в течение 2 недель,
- Если прививка показана ребенку до 2 лет, то стоит внимательно отнестись к его режиму питания. Не следует вводить новые неизвестные для него продукты,
- В день вакцинации пациента в обязательном порядке должен осмотреть врач для подтверждения его стабильного состояния.
Игнорирование вышеперечисленных правил может привести к возникновению побочных эффектов за счет ослабленного состояния организма. Особенно опасно это для детей младшего возраста, что объясняется их еще формирующейся и не окрепшей иммунной системы. Поэтому прививаться пациент должен только в здоровом состоянии.
Особенно опасно это для детей младшего возраста, что объясняется их еще формирующейся и не окрепшей иммунной системы. Поэтому прививаться пациент должен только в здоровом состоянии.
График вакцинации
Противопневмококковая вакцинация разрешена детям до года, но при необходимости врачи могут перенести срок по медицинским показаниям. В целом рекомендованный график прививок зависит от возраста ребенка:
- В период 2-6 месяцев. Инъекция вводится 3 раза с равными интервалами в 1 месяц. Ревакцинация осуществляется в срок между 12 и 15 месяцами,
- В период 7-11 месяцев. Прививку делают два раза, интервал при этом должен составлять не менее 1 месяца. Ревакцинация необходима в 2 года,
- В период 12-23 месяцев. Прививку вводят 2 раза с интервалом 2 месяца,
- 2-5 лет. Вакцина применяется однократно.
Взрослым людям прививку осуществляют 1 раз без необходимости ревакцинации. А для детей, входящих группу риска существует индивидуальная схема ввода препарата.
Вакцина от пневмонии может сочетаться с любыми другими видами прививок. Исключение составляет только БЦЖ.
Уход после прививки
Как и любая другая прививка, пневмококковая вакцина требует соблюдение определенных правил ухода за пациентом после введения препарата. Важно:
- Наблюдать за температурой тела в течение 3-4 суток. При необходимости следует принимать жаропонижающие препараты,
- Потреблять достаточное количество жидкости. Это необходимо для того, чтобы минимизировать риск интоксикации организма,
- Для детей соблюдать привычный рацион питания. Следует отказаться от введения новых продуктов хотя бы в течение недели. В случае если ребенок грудной, матери также стоит воздержаться от продуктов, потенциально считающимися аллергенами.
Место укола у данной вакцины мочить не запрещается, поэтому водные процедуры можно принимать уже в первый день после прививки.
Противопоказания
Прививка от пневмонии взрослым и детям в некоторых случаях может быть противопоказана. Так недопустим ввод препарата в следующих случаях:
Так недопустим ввод препарата в следующих случаях:
- Любое нехарактерное реагирование организма на предыдущие пневмококковые прививки. Это могут быть отечность и уплотнения в месте укола, размером более 8 мм, а также судороги, обмороки и различного рода аллергические реакции,
- Повышенная чувствительность к компонентам вакцины, а именно дифтерийным антигенам. Об этом могут говорить отрицательная реакция на прививки АКДС, АДС,
- Детский возраст до 2 месяцев. Некоторые виды вакцин разрешены с 1,5 месяцев,
- Наличие инфекционного процесса в организме,
- Период обострения хронических заболеваний,
- Повышенная температура тела.
Прививка может быть полностью отменена для пациента. Это может быть, например, в случаях непереносимости компонентов вакцины. При таких явлениях, как обострение хронических болезней или недомогания, вакцинирование переносят на определенный период. Такое решение называется медицинским отводом.
Возможные осложнения и реакции
Прививка от пневмонии может спровоцировать определенную реакцию организма. Чаще всего этот фактор зависит от неподготовленности пациента к вакцинации, когда, например, в его организме имеется воспалительный процесс. По этой причине всех лиц, получивших прививку, обязывают в течение 30 минут не покидать пределы поликлиники, а по истечении времени показать место укола медперсоналу для того, чтобы убедиться в отсутствии прогрессирующей реакции.
Чаще всего этот фактор зависит от неподготовленности пациента к вакцинации, когда, например, в его организме имеется воспалительный процесс. По этой причине всех лиц, получивших прививку, обязывают в течение 30 минут не покидать пределы поликлиники, а по истечении времени показать место укола медперсоналу для того, чтобы убедиться в отсутствии прогрессирующей реакции.
Побочные эффекты могут начать проявляться в течение первых трех суток. Обычно они выражаются в следующих явлениях:
- Кожа на месте укола может приобрести отечность, красный оттенок, чувство зуда и жжения. Нередки случаи возникновения уплотнения на данном участке, который, как правило, рассасывается самостоятельно без применения дополнительных средств,
- Температура тела повышается и держится обычно в пределах 37-38 градусов,
- Потеря аппетита,
- Повышенная возбудимость и нарушение сна. У маленьких детей часто наблюдается сонливость,
- Ноющие боли в области костей и мышц.

Многие из перечисленных реакций проходят самостоятельно буквально в течение нескольких часов или пары дней. Но пускать процесс на самотек не стоит. В случае резкого ухудшения состояния или высокой температуры в течение более 3-4 дней, стоит немедленно обратиться к врачу.
Загрузка…
Прививка от пневмонии детям до года и взрослым: что важно знать?
Ежегодно миллионы людей заболевают пневмококковыми инфекциями, значительная часть из которых маленькие дети. Прививка от пневмонии позволяет снизить риск возникновения воспалительного процесса, который может быть очень опасен и даже привести в некоторых случаях к летальному исходу.
Как действует вакцина?
Постановка прививки
Иммунизация против пневмонии при помощи прививки – это решение, которое позволяет значительно обезопасить себя и своих детей от возможности развития пневмококковой инфекции. Компоненты вакцины способны губительно воздействовать на многие существующие в природе болезнетворные микроорганизмы из семейства стрептококков. Таким образом снижается риск развития следующих болезней:
Компоненты вакцины способны губительно воздействовать на многие существующие в природе болезнетворные микроорганизмы из семейства стрептококков. Таким образом снижается риск развития следующих болезней:
- Отит;
- Менингит;
- Эндокардит;
- Пневмония;
- Артрит и другие.
Важно осознавать, что вакцинация не дает 100% защиты от перечисленных заболеваний, но в случае их возникновения, можно надеяться на их более легкое и неосложненное течение.
Виды прививок
Современная медицина располагает выбором препаратов для осуществления прививок от пневмококковой инфекции. Желательно знать, как они называются, и что собой представляют.
Препарат «Превенар»
Препарат Превенар
Этот препарат все чаще используется для осуществления прививок. Он представляет собой полисахаридную вакцину с дифтерийным белком, который устойчив к 13 возбудителям пневмококковой инфекции. Считается, что именно эти 13 видов могут вызывать наиболее опасные заболевания для человеческого организма.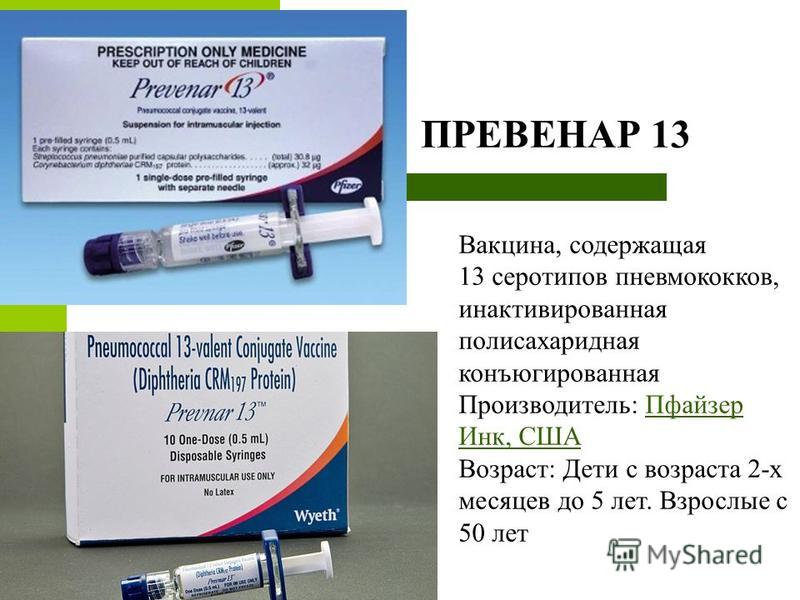 Препарат можно применять для грудничков, начиная уже с двухмесячного возраста. Рекомендуется произвести прививку до достижения ими 5 лет. Помимо детей, Превенар может использоваться для вакцинации пожилых людей, лиц, страдающих сахарным диабетом, циррозом печени, ВИЧ и иными заболеваниями серьезного характера.
Препарат можно применять для грудничков, начиная уже с двухмесячного возраста. Рекомендуется произвести прививку до достижения ими 5 лет. Помимо детей, Превенар может использоваться для вакцинации пожилых людей, лиц, страдающих сахарным диабетом, циррозом печени, ВИЧ и иными заболеваниями серьезного характера.
Возможные побочные явления: зуд и оттек в месте ввода укола, нарушение стула, повышенная температура тела.
Основная страна-производитель препарата – США.
Раствор для инъекций «Пневмо 23»
Пневмо 23
Данная прививка от пневмонии разрешена детям, только достигшим двух лет и старше. Она способна активно воздействовать сразу на 23 возбудителей воспаления легких. Также Пневмо 23 может быть рекомендована людям, старше 65 лет и иным лицам с повышенным риском развития пневмококковой инфекции.
Возможные побочные явления: оттек и ощущение зуда на месте укола, повышенная в течение одних суток температура тела.
Препарат уже выпускается в виде шприца с дозировкой на одного человека.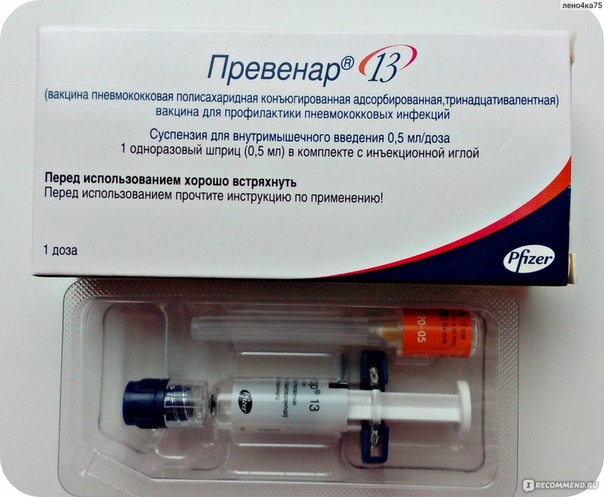
Порошок для инъекций «АКТ-Хиб»
Порошок для инъекций «АКТ-Хиб»
Прививка АКТ-Хиб направлена на профилактику пневмонии, вызванной гемофильной палочкой. Для детей, не достигших 5 лет, данный вид пневмонии представляет серьезную угрозу для здоровья.
В отличие от предыдущих двух видов средств, данный препарат представляет собой порошок для инъекций, который запакован в отдельном флаконе. Разводят порошок непосредственно перед началом процедуры.
Возможные побочные явления: оттек и покраснение кожного покрова в месте прививки, а также могут наблюдаться повышенная температура тела, потерянный аппетит и общая слабость организма.
Принципы подготовки к вакцинации
При склонности к аллергическим реакциям за несколько дней перед прививкой принимают антигистаминные препараты
Для того чтобы облегчить возможные побочные эффекты вакцинирования необходимо следовать правилам предварительной подготовки. Их необходимо соблюдать всем лицам, вне зависимости от возраста:
- В течение 2-3 недель до назначенной даты вакцинации стоит понаблюдать за состоянием пациента.
 Важно, чтобы отсутствовали любые признаки наличия вирусной или бактериальной инфекции, резкие изменения в поведении, нарушения психического состояния;
Важно, чтобы отсутствовали любые признаки наличия вирусной или бактериальной инфекции, резкие изменения в поведении, нарушения психического состояния; - Если у лица, которому показана прививка, имеются различного рода хронические болезни, важно предварительно убедиться в том, что они не находятся в стадии обострения. Для этого могут потребоваться дополнительные процедуры обследования: от анализа мочи до рентгенографии;
- Если пациент подвержен аллергическим реакциям, то за 5 дней до планируемой даты посещения больницы, ему следует начать принимать антигистаминные препараты в профилактической дозировке. Для того чтобы максимально снизить риск возникновения ответной реакции организма на вводимый препарат, противоаллергические средства необходимо принимать еще в течение 2-3 дней после прививки;
- Настоятельно не рекомендуется посещать места большого скопления людей в течение 2 недель;
- Если прививка показана ребенку до 2 лет, то стоит внимательно отнестись к его режиму питания.
 Не следует вводить новые неизвестные для него продукты;
Не следует вводить новые неизвестные для него продукты; - В день вакцинации пациента в обязательном порядке должен осмотреть врач для подтверждения его стабильного состояния.
Игнорирование вышеперечисленных правил может привести к возникновению побочных эффектов за счет ослабленного состояния организма. Особенно опасно это для детей младшего возраста, что объясняется их еще формирующейся и не окрепшей иммунной системы. Поэтому прививаться пациент должен только в здоровом состоянии.
График вакцинации
Противопневмококковая вакцинация разрешена детям до года, но при необходимости врачи могут перенести срок по медицинским показаниям. В целом рекомендованный график прививок зависит от возраста ребенка:
- В период 2-6 месяцев. Инъекция вводится 3 раза с равными интервалами в 1 месяц. Ревакцинация осуществляется в срок между 12 и 15 месяцами;
- В период 7-11 месяцев. Прививку делают два раза, интервал при этом должен составлять не менее 1 месяца.
 Ревакцинация необходима в 2 года;
Ревакцинация необходима в 2 года; - В период 12-23 месяцев. Прививку вводят 2 раза с интервалом 2 месяца;
- 2-5 лет. Вакцина применяется однократно.
Взрослым людям прививку осуществляют 1 раз без необходимости ревакцинации. А для детей, входящих группу риска существует индивидуальная схема ввода препарата.
Вакцина от пневмонии может сочетаться с любыми другими видами прививок. Исключение составляет только БЦЖ.
Уход после прививки
Как и любая другая прививка, пневмококковая вакцина требует соблюдение определенных правил ухода за пациентом после введения препарата. Важно:
- Наблюдать за температурой тела в течение 3-4 суток. При необходимости следует принимать жаропонижающие препараты;
- Потреблять достаточное количество жидкости. Это необходимо для того, чтобы минимизировать риск интоксикации организма;
- Для детей соблюдать привычный рацион питания. Следует отказаться от введения новых продуктов хотя бы в течение недели. В случае если ребенок грудной, матери также стоит воздержаться от продуктов, потенциально считающимися аллергенами.

Место укола у данной вакцины мочить не запрещается, поэтому водные процедуры можно принимать уже в первый день после прививки.
Противопоказания
Прививка от пневмонии взрослым и детям в некоторых случаях может быть противопоказана. Так недопустим ввод препарата в следующих случаях:
- Любое нехарактерное реагирование организма на предыдущие пневмококковые прививки. Это могут быть отечность и уплотнения в месте укола, размером более 8 мм, а также судороги, обмороки и различного рода аллергические реакции;
- Повышенная чувствительность к компонентам вакцины, а именно дифтерийным антигенам. Об этом могут говорить отрицательная реакция на прививки АКДС, АДС;
- Детский возраст до 2 месяцев. Некоторые виды вакцин разрешены с 1,5 месяцев;
- Наличие инфекционного процесса в организме;
- Период обострения хронических заболеваний;
- Повышенная температура тела.
Прививка может быть полностью отменена для пациента. Это может быть, например, в случаях непереносимости компонентов вакцины. При таких явлениях, как обострение хронических болезней или недомогания, вакцинирование переносят на определенный период. Такое решение называется медицинским отводом.
При таких явлениях, как обострение хронических болезней или недомогания, вакцинирование переносят на определенный период. Такое решение называется медицинским отводом.
Возможные осложнения и реакции
Прививка от пневмонии может спровоцировать определенную реакцию организма. Чаще всего этот фактор зависит от неподготовленности пациента к вакцинации, когда, например, в его организме имеется воспалительный процесс. По этой причине всех лиц, получивших прививку, обязывают в течение 30 минут не покидать пределы поликлиники, а по истечении времени показать место укола медперсоналу для того, чтобы убедиться в отсутствии прогрессирующей реакции.
Повышение температуры одна из реакций на прививку
Побочные эффекты могут начать проявляться в течение первых трех суток. Обычно они выражаются в следующих явлениях:
- Кожа на месте укола может приобрести отечность, красный оттенок, чувство зуда и жжения. Нередки случаи возникновения уплотнения на данном участке, который, как правило, рассасывается самостоятельно без применения дополнительных средств;
- Температура тела повышается и держится обычно в пределах 37-38 градусов;
- Потеря аппетита;
- Повышенная возбудимость и нарушение сна.
 У маленьких детей часто наблюдается сонливость;
У маленьких детей часто наблюдается сонливость; - Ноющие боли в области костей и мышц.
Многие из перечисленных реакций проходят самостоятельно буквально в течение нескольких часов или пары дней. Но пускать процесс на самотек не стоит. В случае резкого ухудшения состояния или высокой температуры в течение более 3-4 дней, стоит немедленно обратиться к врачу.
Прививка от пневмонии детям до года и после года: побочные эффекты, отзывы
Прививку от пневмонии детям начали делать только в новом тысячелетии. Относительная новизна, а также негативные последствия от вакцинации вызывают много дискуссий между родителями и врачами. В то же время она защищает от пневмококковых инфекций, опасных для здоровья и жизни малышей.
Схема вакцинации
В медучреждениях используют два препарата – французский «Пневмо-23» и американский «Превенар». Первый подходит для малышей старше 2 лет. Второй применяется с 2-месячного возраста. Вакцина сочетается со всеми прививками, кроме БЦЖ.
Первый подходит для малышей старше 2 лет. Второй применяется с 2-месячного возраста. Вакцина сочетается со всеми прививками, кроме БЦЖ.
Источник: Getty
Прививка от пневмонии детям делается с 2-месячного возраста.
Препарат вводится по следующей схеме:
- Младенцев младше полугода вакцинируют 3 раза с интервалом в 1-1,5 месяца. Ревакцинацию проводят в возрасте 11-15 месяцев.
- Детей в возрасте от полугода прививают 2 раза с интервалом 1-1,5 месяца. Ревакцинация после 2 лет. Точное время определяет врач.
- Малышей постарше вакцинируют 1 раз.
Хотя в возрасте до года уколов больше, педиатры советуют не затягивать с введением препарата. Неокрепший организм грудничков быстро подхватывает опасные инфекции. Их иммунной системе сложно бороться с болезнью, из-за чего происходят различные осложнения.
Побочные эффекты
Вакцины от пневмококковых инфекций в редких случаях провоцируют осложнения:
- уплотнение и покраснение места укола;
- незначительное повышение температуры тела;
- ухудшение эмоционального состояния: раздражительность, капризность, вялость;
- аллергическая реакция.

Если у ребенка непереносимость компонентов препарата, осложнения могут быть тяжелыми. Вакцина способна спровоцировать обострение хронического заболевания, спазм бронхов, крапивницу и даже анафилактический шок. Чтобы этого не произошло, младенца обследует педиатр. Только убедившись в отсутствии противопоказаний, грудничку вводят препарат.
Стоит ли прививаться?
Среди родителей есть как сторонники, так и противники вакцинации. Среди негативных отзывов преобладает мнение, что сразу после рождения в организм ребенка и так слишком часто вводятся различные препараты. Положительно настроенные родители принимают в учет, от каких осложнений спасает вакцина.
Мнение педиатров однозначно. Если нет противопоказаний, прививку нужно сделать. Она защитит от таких опасных заболеваний, как пневмония, отит, менингит, артрит, эндокардит и прочих недугов, провоцируемых пневмококковой инфекцией.
особенности, правила и сроки вакцинации
Устоявшееся мнение о том, что воспаление легких возникает от переохлаждения и простуды не является достоверным, так как эта патология легочной системы развивается на фоне прогрессирования бактерий, именуемых пневмококками. Как любую бактериальную и вирусную инфекцию, воспаление легких можно предупредить, если своевременно будет сделана прививка от пневмонии.
Как любую бактериальную и вирусную инфекцию, воспаление легких можно предупредить, если своевременно будет сделана прививка от пневмонии.
Особенно актуальной такая вакцинация считается для детей раннего возраста и пожилых пациентов из-за несовершенства иммунной защиты организма. После попадания в организм активных штаммов вакцины, начинается выработка молекул – антител, которые и призваны бороться с проникающими пневмококками.
Особенности бактериальной пневмонии
Вакцина от пневмонии, рекомендуемая детям раннего возраста и взрослым пациентам, имеет ряд показаний и несколько противопоказаний. Доктора особенно рекомендуют учитывать противопоказания к вакцинации, но не игнорировать профилактическую прививку. Воспалительная легочная патология, вызываемая бактериальными микроорганизмами, протекает на фоне характерной симптоматики:
- острое лихорадочное состояние, сопровождающееся высокой температурой, ломотой в мышцах, болью в теле;
- затрудненное дыхание с выраженным кашлевым синдромом;
- отхождение мокроты в виде слизи с «ржавым» оттенком и привкусом;
- боль в груди.

Самые тяжелые формы бактериальной пневмонии диагностируются у малышей младенческого и раннего возраста, а также у пожилых пациентов старше 65 лет. Именно этой категории особенно требуется вакцинация от воспаления легких бактериального типа. Кроме того, специалисты рекомендуют проводить своевременную вакцинацию следующим категориям:
- больным сахарным диабетом;
- пациентам, злоупотребляющим алкоголем и курением табака;
- людям с ослабленной иммунной системой;
- пацментам, имеющим в анамнезе хронические заболевания.
Особенности иммунизации
Учитывая то, что прививка от пневмонии ставится по показаниям, вакцинации, в первую очередь, подлежат:
- Дети младенческого и раннего дошкольного возраста.
- Пожилые пациенты в возрасте от 65 лет.
- Люди, страдающие хроническими заболеваниями, влияющими на нормальное функционирование иммунитета.
- Люди, имеющие хронические очаги инфекции, в том числе тубинфицированные.

Для того, чтоб профилактическое вакцинирование прошло успешно, стоит также учитывать противопоказания. Специалисты обращают внимание на то, что прививки от пневмонии противопоказаны:
- При любых острых воспалительных или инфекционных заболеваниях, диагностируемых у пациента на момент вакцинации.
- При хронически патологиях в стадии обострения.
- При имеющихся в анамнезе осложнениях и аллергических реакциях на предыдущие вакцинации.
- Женщинам в первом и втором триместре беременности.
Решение о вакцинации малышей и взрослых от пневмококковых инфекций принимает доктор. При принятии решения врач учитывает наличие или отсутствие в анамнезе любых патологий и подбирает наиболее подходящую для пациента вакцину.
Виды вакцины и сроки вакцинации
На сегодняшний день у специалистов в арсенале имеется три вида вакцины против пневмонии, каждая из которых имеет свои преимущества и доказала на деле свою действенность и эффективность.
| Вакцина | Сроки вакцинации (возраст пациента) | Количество обезвреживаемых бактерий | Преимущества |
| Превенар | 2 месяца 3 месяца 4 месяца 12 месяцев | 13 основных типов возбудителей | Обеспечивает защиту от пневмококковых агентов у малышей младенческого возраста |
| Пневмо-23 | 24 месяца 25 месяцев 30 месяцев | 23 типа возбудителей | Формирует устойчивый иммунитет от нескольких наиболее распространенных видов пневмококковых бактерий |
| АКТ-Хиб | 3 месяца 5 месяцев 6 месяцев 18 месяцев | Гемофильная палочка | Формирует защиту не только от пневмококковых бактерий, но от сепсиса, менингита, некоторых форм артрита |
Шансы заболеть воспалением легких наиболее высоки у малышей в возрасте до 2 лет, особенно в том случае, если ребенок находится на искусственном вскармливании и не получает с грудным молоком защитные антитела.
Второй группой риска по заболеваемости микробными формами воспаления легких считаются пациенты старше 60 лет. Их иммунная система с трудом справляется с микроорганизмами и бактериями, к тому физическая активность в этом возрасте снижена.
Доктора обращают внимание на то, что стопроцентной защиты от пневмококков, естественно, добиться сложно. Однако, своевременная вакцинация значительно снижает риск инфицирования, а в случае попадания пневмококков в организм, облегчает протекание заболевания и проявления симптоматики.
Принципы подготовки к вакцинации
Для того, чтоб прививка, предупреждающая пневмонию, прошла без последствий и способствовала обеспечению максимальной защиты организма от пневмококковых агентов, к ней стоит заранее правильно подготовиться. Это условие в одинаковой степени касается и малышей, и взрослых пациентов.
- За 2-3 недели до планируемой даты вакцинации стоит понаблюдать за пациентом и его общим состоянием здоровья.
 У малышей и у взрослых в момент вакцинации не должно быть признаков недомогания, вирусной инфекции, простудных симптомов.
У малышей и у взрослых в момент вакцинации не должно быть признаков недомогания, вирусной инфекции, простудных симптомов. - В течение этого периода не рекомендуется посещать места с большим скоплением людей и массовые мероприятия.
- При наличии хронических патологий в анамнезе у пациента следует обратить на них пристальное внимание и позаботиться о том, чтоб заболевание оставалось в стадии ремиссии.
- Пациентам с повышенной готовностью аллергического ответа организма за неделю до планируемой вакцинации следует начинать принимать антигистаминные препараты. Прием таких лекарственных средств желательно продолжить в течение 2-3 дней и после вакцинации.
- В день прививки пациента должен обязательно осмотреть доктор для того, чтоб удостовериться в отсутствии простудных или вирусных патологий. Родители малышей должны также помнить, что прививку делают только в день здорового ребенка, когда в поликлинике нет больных и инфицированных детей.
- За неделю до планируемой прививки малышу не следует вводить новый прикорм или давать ему незнакомые продукты.
 Это может спровоцировать угнетение иммунной системы, особенно в тех случаях, когда в организм малыша попадут незнакомые пищевые аллергены.
Это может спровоцировать угнетение иммунной системы, особенно в тех случаях, когда в организм малыша попадут незнакомые пищевые аллергены.
Эти своевременно принятые меры помогут избежать инфицирования пациента перед или непосредственно во время вакцинации. Организм сможет сосредоточить все силы на выработке необходимых антител и последующей качественной защите от пневмококков.
Правильная поэтапная подготовка к вакцинации минимизирует также риск осложнений и побочных эффектов от прививки, сглаживает протекание постпрививочного периода.
Возможные осложнения и реакция
К сожалению, введение пневмококковой вакцины, как и проведение любых других прививок, может повлечь негативную реакцию организма. Родители должны помнить, в первую очередь, что уносить малыша домой сразу после прививки не рекомендуется. Следует побыть в поликлинике последующие четверть часа и убедиться в отсутствии резкой негативной или бурно прогрессирующей аллергической реакции.
В течение 2-3 суток после введения вакцины у малышей и взрослых могут проявиться следующие побочные эффекты:
- Место укола может уплотниться, покраснеть, кожа в этом месте может «гореть».
 При надавливании на область уплотнения взрослый ощущает резкую боль, малыш реагирует громким плачем.
При надавливании на область уплотнения взрослый ощущает резкую боль, малыш реагирует громким плачем. - Температура тела может повыситься до 38 градусов и выше. Прием жаропонижающего препарата допускается в том случае, если отметка на термометре поднимается выше 38.
- В некоторых случаях у пациента не пару дней пропадает аппетит, повышается сонливость. Особенно часто такая симптоматика наблюдается у детей: малыш становится вялым, капризным, его постоянно клонит в сон.
- В редких случаях у детей, которым сделана прививка от пневмококков, может открыться рвота и выраженная диарея. Этот симптом требует срочного обращения к врачу за медицинской помощью, так как у малыша может развиться опасное состояние обезвоживания организма.
- Симптомы лихорадки: жар, озноб, ломота в мышцах и в теле.
Тяжелое постпрививочное осложнение, требующее срочного обращения к докторам, также проявляется в следующей симптоматике:
- температура продолжает расти и после приема жаропонижающих препаратов;
- наблюдаются судороги или потеря сознания у пациента;
- маленький ребенок беспокоиться, отказывается кушать и пить;
- на месте укола образовался гнойный нарыв.

Поводом для обращения к доктору служит также затяжное течение постпрививочной реакции (более 3 суток), особенно, если речь идет о детях.
Постпрививочный уход
В последующие после проведения вакцинации дни следует обратить внимание на состояние здоровья и самочувствие пациента. Специалисты обращают внимание на то, что купание после прививки от пневмококковых инфекций разрешаются с первого дня, мочить место укола также можно.
Для того, чтоб минимизировать риск возникновения патологической реакции на вакцину, следует соблюдать рекомендации по постпрививочному уходу.
- В последующие после прививки несколько дней не стоит менять привычный рацион питания и добавлять в него новые продукты или продукты с высоким риском аллергической реакции.
- Кормящим матерям также стоит внимательно следить за своим питанием, не употреблять новые продукты и аллергены.
- Стоит также обратить внимание на питьевой режим: количество потребляемой в сутки жидкости должно быть достаточным для того, чтоб нормализовать обмен веществ и снизить возможные проявления интоксикации.

- Не следует обрабатывать место укола зеленкой, йодом, спиртом или другими антисептиками.
- Температуру тела пациента после прививки следует контролировать в течение 3 суток, в случае необходимости стоит принимать жаропонижающее средство.
Доктора обращают внимание на то, что вакцинация от пневмококковых инфекций считается безопасным профилактическим мероприятием. Важно учитывать все рекомендации доктора перед прививкой и в постпрививочный период, к тому же, в большинстве случаев, патологической реакции на прививку от пневмококков не диагностируется.
вакцин для профилактики пневмонии и повышения выживаемости детей
Shabir A Madhi a , Orin S Levine b , Rana Hajjeh b , Osman D Mansoor c , Thomas Cherian d
Введение
Пневмония является наиболее частой причиной детской смертности, особенно в странах с самой высокой детской смертностью, и Детский фонд Организации Объединенных Наций (ЮНИСЕФ) и ВОЗ определили ее как главного «забытого убийцу детей». 1 Почти все (99,9%) случаи смерти детей от пневмонии происходят в развивающихся и наименее развитых странах, большинство из которых происходит в странах Африки к югу от Сахары (1 022 000 случаев в год) и Южной Азии (702 000 случаев в год). Из всех случаев смерти от пневмонии 47,7% приходится на наименее развитые страны, 1 большинство из которых имеют право на получение поддержки для покупки вакцин и разработки своих программ иммунизации через Альянс ГАВИ. 2
1 Почти все (99,9%) случаи смерти детей от пневмонии происходят в развивающихся и наименее развитых странах, большинство из которых происходит в странах Африки к югу от Сахары (1 022 000 случаев в год) и Южной Азии (702 000 случаев в год). Из всех случаев смерти от пневмонии 47,7% приходится на наименее развитые страны, 1 большинство из которых имеют право на получение поддержки для покупки вакцин и разработки своих программ иммунизации через Альянс ГАВИ. 2
Хотя различные патогены могут вызывать пневмонию по отдельности или в комбинации, имеющиеся данные, включая эффективность ведения случая, позволяют предположить, что основными причинами являются две бактерии: Haemophilus influenzae типа b (Hib) и Streptococcus pneumoniae (пневмококк). . 3 По оценкам ВОЗ, в 2000 г. на Hib и пневмококк вместе приходилось более 50% случаев смерти от пневмонии среди детей в возрасте от 1 месяца до 5 лет. 4 Доступно несколько эффективных вакцин для профилактики детской пневмонии, в том числе две вакцины, включенные в программы иммунизации во всех странах, Bordetella pertussis и вакцины против кори, а также две относительно новые вакцины, конъюгированная вакцина Hib (HibCV) и конъюгированная пневмококковая вакцина.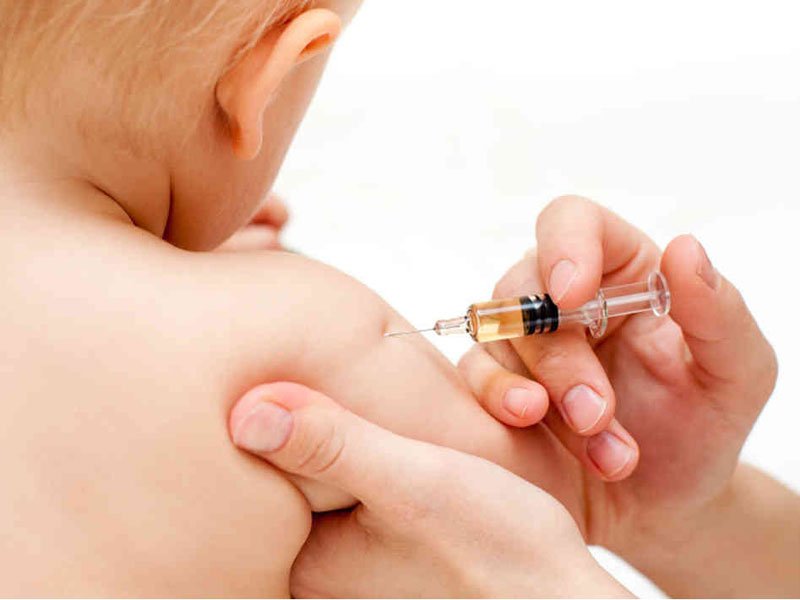 (PCV).
(PCV).
В этой статье мы стремимся контекстуализировать потенциальную роль вакцин как части пакета детских вмешательств, направленных на снижение заболеваемости и смертности от детской пневмонии. Мы резюмируем прогресс в сокращении детской смертности от пневмонии с помощью вакцины против кори и коклюша; проанализировать эффективность новых бактериальных конъюгированных вакцин против пневмонии; и обсудить потенциальные препятствия и возможные решения для обеспечения того, чтобы вакцины против пневмонии достигли групп населения с наибольшим риском смертности от пневмонии.
Стратегия поиска и критерии выбора
Мы обнаружили публикации о роли бактериальных конъюгированных вакцин против пневмонии путем поиска в PubMed. Поисковые запросы включали «пневмококковая конъюгированная вакцина», «конъюгированная вакцина Hib», «радиологическая пневмония», «бактериальная конъюгированная вакцина», «рентгенограмма», «пневмония», «ребенок», «диагноз» и «вакцина». Статьи были отобраны на основе их актуальности для оценки пневмонии у детей. Краткое изложение роли противокоревой и коклюшной вакцин против пневмонии было получено путем выявления ключевых документов.
Борьба с коклюшем и корью
За последние несколько десятилетий наблюдается значительный прогресс в снижении смертности от коклюша и кори. Эффективные инактивированные цельноклеточные коклюшные вакцины доступны с 1950-х годов и включены в большинство программ иммунизации во всем мире. Как следствие, по оценкам ВОЗ, в 2003 г. 38,3 миллиона случаев заболевания и 607 000 смертей были предотвращены с помощью вакцинации против коклюша. 5 Тем не менее, по оценкам, коклюш по-прежнему является причиной 295 000–390 000 детских смертей ежегодно, причем большинство смертей приходится на страны с низким уровнем иммунизации и высоким уровнем смертности. 6 Дальнейшие успехи могут быть достигнуты за счет увеличения охвата тремя дозами вакцины против дифтерии, столбняка и коклюша в младенчестве и введения бустерных доз вакцины, если это необходимо.
Прогресс в снижении смертности от кори был еще большим. Пневмония как осложнение после инфицирования корью встречается у 2–27% детей в исследованиях на уровне сообщества и у 16–77% госпитализированных детей. 7 Кроме того, пневмония является причиной 56–86% всех смертей, связанных с корью. 7 Патогенез может быть связан с самим вирусом или с наложенными вирусными или бактериальными инфекциями, встречающимися в 47–55% случаев. 7 Пневмококк — наиболее часто идентифицируемый организм (30–50% всех микробиологически подтвержденных тестов). 8 , 9 В 1980 году, до широкого распространения вакцинации против кори в развивающихся странах, от кори умерло более 2,5 миллиона человек. В 1999 году этот показатель снизился до 873 000 смертей. 10 В 2001 году стратегия сокращения смертности от кори была начата в 47 приоритетных странах с самым высоким бременем болезней.Эта стратегия заключалась в увеличении охвата первой плановой дозой противокоревой вакцины, предоставлении второй возможности за счет дополнительных мероприятий по иммунизации, надлежащего ведения случаев и улучшения эпиднадзора. Широкое внедрение этой стратегии, особенно в приоритетных странах Африки, привело к дальнейшему снижению на 60% расчетной смертности от кори с 873 000 в 1999 г. до 345 000 в 2005 г. 11 Более амбициозная глобальная цель снижения смертности на 90% по сравнению с 2000 годом установлен на 2010 год.
Эффективность HibCV и PCV
С 1996 г. эффективность HibCV и PCV для профилактики детской пневмонии была подтверждена в ходе восьми клинических испытаний и трех исследований «случай – контроль» и подтверждена многочисленными оценками эпиднадзора (рис. 1). 12 — 22
Рис. 1. Глобальное распределение исследований PCV и HibCV против радиологически подтвержденной пневмонии a, b
ДИ, доверительный интервал; DBRCT, двойное слепое рандомизированное контролируемое исследование; Конъюгированная вакцина против HibCV, Haemophilus influenzae типа b; PCV, пневмококковая конъюгированная вакцина; США, Соединенные Штаты Америки; VAR — сокращение, связанное с вакцинацией, на 1000 детей-лет наблюдения; VE, эффективность вакцины против пневмонии, подтвержденной радиологически, с использованием анализа по протоколу, если таковой имеется. a Во всех исследованиях по оценке PCV, а также в исследованиях HibCV в Индонезии и Бангладеш использовались рекомендации ВОЗ по интерпретации и составлению отчетов о рентгенограммах грудной клетки. 23 b В исследовании, проведенном в Колумбии, использовалась оценка алгоритма, которая включала рентгенологически подтвержденную пневмонию в качестве одного из критериев.
HibCV
Первыми исследованиями, показавшими эффективность HibCV для профилактики пневмонии, были рандомизированные контролируемые испытания в Чили и Гамбии. 12 , 13 Оба исследования показали значительную защиту от бактериемической пневмонии, вызванной Hib (80–100%), и рентгенологически подтвержденной пневмонии (около 22%). Эти исследования также показали, что частота предотвращенных случаев пневмонии с отрицательным посевом была в 5-10 раз выше, чем частота предотвращенных случаев с подтвержденным посевом, что подтверждает наблюдения о том, что большинство бактериальных пневмоний не выявляется обычными диагностическими методами и что испытания вакцин являются наиболее распространенными. надежный подход к оценке бремени бактериальной пневмонии.
Совсем недавно дополнительные клинические испытания и исследования «случай – контроль» с HibCV расширили наши знания на другие географические регионы. Рандомизированное контролируемое испытание на острове Ломбок в Индонезии помогло выявить бремя Hib-инфекции в Азии. 14 Однако это исследование показало значительное снижение риска клинической пневмонии, но не снижение риска радиологически подтвержденной пневмонии среди вакцинированных по сравнению с невакцинированными детьми. Показатели клинического менингита, которые можно предотвратить с помощью вакцины, были аналогичны показателям, наблюдаемым в Африке и других регионах высокого риска.В соответствии с другими исследованиями, бремя предотвращенной пневмонии было примерно в 10 раз больше, чем бремя предотвращенного менингита.
Исследования «случай – контроль» предоставляют дополнительные доказательства эффективности HibCV для профилактики пневмонии. 19 — 21 Недавнее исследование методом случай-контроль, проведенное в Бангладеш, показало, что вакцинация против Hib была связана с 34–44% снижением риска радиологически подтвержденной пневмонии. 21 В этом исследовании HibCV был распределен с использованием квази-рандомизированного подхода, и были внесены поправки на ключевые факторы, влияющие на факторы.Об оценках высокой эффективности вакцин против радиологически подтвержденной пневмонии также сообщалось в исследованиях случай-контроль, проведенных в Бразилии (31%) и Колумбии (47–55%). 19 , 20
Во всех исследованиях, в которых оценивалась эффективность HibCV против пневмонии, использовалась первичная серия из трех доз вакцины в младенчестве, хотя и с разным начальным возрастом и интервалами между дозами, и без дополнительной бустерной дозы вакцины, вводимой в течение второго года жизни.Лишь в некоторых более поздних исследованиях использовался стандартизированный подход к интерпретации рентгенограмм грудной клетки, что затрудняло сравнение исследований.
PCVs
PCV представляют собой еще один эффективный метод профилактики пневмонии у детей и их семей. В настоящее время доступны данные пяти рандомизированных контролируемых испытаний препаратов PCV для профилактики пневмонии у детей. 15 — 18 , 22 Сравнение исследований облегчается тем фактом, что в каждом исследовании использовалась стандартная интерпретация рентгенограмм грудной клетки. 23 Все дети в каждом исследовании получали HibCV, поэтому пропорциональное снижение радиологически подтвержденной пневмонии было в дополнение к профилактике, вызванной HibCV. В двух исследованиях в Соединенных Штатах Америки (США) использовалась семивалентная вакцина, в двух в Африке — девятивалентная вакцина, а на Филиппинах — 11-валентный состав. Исследования охватывают широкий спектр эпидемиологических условий, включая сельские районы Африки с высоким уровнем младенческой смертности, городские районы Африки с высоким уровнем распространенности ВИЧ, пригородные районы Азии с высоким уровнем использования антибиотиков, коренное американское население и типичное население американских медицинских организаций. .Эти исследования выявили снижение (на 20–37%) радиологически подтвержденной пневмонии, что подтвердило важность серотипов пневмококковой вакцины как причины пневмонии. 15 — 17 , 22 Как и HibCV, большая часть предотвратимых заболеваний не обнаруживается с помощью обычных диагностических методов. Эффективность ПКВ против бактериемической пневмонии вакцинного серотипа высока (67–87%), 15 , 16 , но сравнение с частотой подтвержденной рентгеном пневмонии или клинической пневмонии показывает, что посев в 20 раз больше -отрицательные случаи предотвращаются по сравнению с положительными случаями посева. 24
Использование определения случая, которое не является специфическим для заболевания вакцинного серотипа (например, радиологически подтвержденная пневмония, которая также может быть вызвана невакцинными пневмококками серотипа или другими патогенами), позволит более точно оценить количество предотвращенных случаев, но может недооценивать пропорциональное снижение заболеваемости пневмококковой пневмонией вакцинного типа. 25 Радиологически подтвержденная пневмония, хотя она постоянно используется в качестве критерия исхода для оценки эффективности PCV, тем не менее может различаться по своей чувствительности (76.5% в Гамбии против 58,1% в Южной Африке) в различных условиях. 17 , 24 В США через 3 года после введения ПКВ наблюдалось снижение на 39% (95% доверительный интервал, ДИ: 22–52) случаев госпитализации с пневмонией среди детей младше 2 лет. 26 Абсолютное снижение частоты клинической пневмонии было в 30 раз больше, чем снижение пневмококковой пневмонии (506 против 17 предотвращенных эпизодов на 100 000 детей лет) согласно диагнозу выписки врача, что еще раз подчеркивает трудности в диагностике пневмококковой пневмонии. даже в промышленно развитых странах, и существенный эффект вакцинации, который можно не заметить при диагностике на основе посева.Более сильное, чем ожидалось, снижение клинической пневмонии в США после введения ПКВ могло быть связано с тем, что ПКВ предотвращала осложнение наложенной пневмококковой инфекции у детей, инфицированных респираторными вирусами. Такое наложенное пневмококковое заболевание у детей с респираторными вирусными инфекциями было распространено почти у трети детей, госпитализированных с тяжелой пневмонией в эпоху предвакцинации. 27
Важная роль пневмококка у детей с вирусной пневмонией была продемонстрирована в южноафриканском исследовании эффективности вакцины, в котором дети, вакцинированные девятивалентной вакциной PCV, были на 31% (95% ДИ: 15–43) менее вероятны госпитализации по поводу пневмонии, был выявлен респираторный вирус, в том числе на 45% (95% ДИ: 14–64) вероятность госпитализации с пневмонией, связанной с вирусами гриппа A / B, ниже. 28 Вакцинация детей PCV может сыграть важную роль в снижении тяжести заболеваемости респираторно-вирусной пневмонией, а также в обеспечении готовности к будущей пандемии гриппа, поскольку пневмококковая пневмония обычно следует за гриппом. 29 В отличие от Hib-инфекции, которая поражает в основном детей в возрасте до 2 лет, пневмококковая инфекция также встречается у детей старшего возраста и взрослых. Как следствие, иммунизация детей PCV может обеспечить защиту невакцинированному населению посредством защиты стада. 30 , 31 В США этот косвенный эффект вакцинации предотвратил в два-три раза больше случаев инвазивной пневмококковой инфекции, чем благодаря прямому эффекту вакцинации маленьких детей. 32 Косвенный эффект, вероятно, является причиной 26% (95% ДИ: 4–43) сокращения госпитализаций с пневмонией среди лиц в возрасте 18–39 лет, через 3 года после внедрения семивалентной ПКВ в США. 26
Эпиднадзор за инвазивным заболеванием, подтвержденным посевом, является ценным, потому что он дает единственную возможность контролировать эффективность вакцины против конкретных серотипов и выявлять изменения в распределении серотипов, вызывающих заболевание.В США опыт борьбы с болезнями невакцинного серотипа варьировался в разных популяциях от населения в целом, где через 6 лет наблюдается рост заболеваемости невакцинного типа, но остается незначительным по сравнению со снижением заболеваемости вакцинным типом. по сравнению с коренным населением в сельской местности Аляски, у которых высокий уровень невакцинных заболеваний через 3–5 лет после вакцинации. 32 , 33 Замена серотипа при колонизации носоглотки и среднем отите наблюдалась ранее. 34 Наиболее убедительные доказательства ценности ПКВ для улучшения выживаемости детей получены в исследовании в Гамбии, в котором девятивалентная ПКВ снизила смертность от всех причин на 16% (95% ДИ: 3–28) у реципиентов вакцины: абсолютное снижение на 7,4 предотвращенных смертей на 1000 вакцинированных детей. 17
Исходя из бремени болезни и доказанной эффективности HibCV и PCV в различных условиях, ВОЗ рекомендует включить обе эти вакцины в программы плановой иммунизации. 22 , 35 Ожидается, что вместе, HibCV и PCV, если они будут применяться повсеместно, будут предотвращать не менее 1 075 000 детских смертей каждый год, преимущественно в развивающихся странах, а с защитой стада — дополнительные случаи и смерти в старших возрастных группах. 4
Вакцины против гриппа
Недавние успехи в разработке адаптированных к холоду живых аттенуированных противогриппозных вакцин, адаптированных к холоду, обладают потенциалом для снижения заболеваемости детским гриппом. 36 Эффект вакцины против гриппа был противоречивым: один метаанализ показал относительно низкую эффективность и ограниченные данные для детей в возрасте до 2 лет. 37 Более поздний анализ показал, что методологические проблемы некоторых исследований привели к недооценке эффективности вакцины против гриппа у детей. 38 Тем не менее, как и в случае субъединичных вакцин против гриппа, которые могут предотвратить 87% госпитализаций с пневмонией, связанной с гриппом, 39 эффективная вакцинация против гриппа зависит от соответствия между штаммами, включенными в вакцину, и циркулирующими штаммами во время любой эпидемии.Включение вакцинации против гриппа в качестве текущей стратегии сокращения детской пневмонии во многих развивающихся странах осложняется необходимостью мобилизовать детей для сезонной вакцинации, логистическими проблемами хранения живых аттенуированных вакцин в холодовой цепи, опасениями по поводу их реактогенности в младенцы очень раннего возраста и необходимость ежегодной ревакцинации.
ВИЧ-инфекция и вакцинация
Несмотря на то, что дети с ВИЧ составляют менее 5% детского населения, даже в странах Африки к югу от Сахары с тяжелым бременем, эти дети непропорционально сильно страдают от пневмонии (риск в девять раз выше) и подвержены пневмонии, вызванной большим разнообразием патогенов. 24 , 40 В Южной Африке на ВИЧ-инфицированных детей приходится 45% всей заболеваемости детской пневмонией и 90% смертности от пневмонии. 24 , 41 Этот высокий риск заболевания и более широкий спектр причин усложняет диагностику и лечение и повышает важность профилактики. Данные о HibCV и PCV у детей, инфицированных ВИЧ, не вызывают опасений по поводу безопасности. Однако иммунные ответы на HibCV и PCV уменьшаются количественно и качественно.Титры антител сохраняются в течение более короткого периода времени, а реакция памяти ухудшается по сравнению с детьми, не инфицированными ВИЧ. 42 — 45 Субоптимальные иммунные ответы (25–75%) также наблюдались против кори у детей с ВИЧ, не принимающих антиретровирусные препараты. 46 Что касается вакцинации в целом, обзоры данных по безопасности, иммуногенности и эффективности детских вакцин для ВИЧ-инфицированных детей недавно показали, что на реакцию на вакцины сильно влияет использование антиретровирусных препаратов. 46 Например, иммунный ответ на ПКВ у детей с ВИЧ, получающих антиретровирусную терапию, аналогичен таковому у детей, не инфицированных ВИЧ. 47
PCV и HibCV менее эффективны против инвазивных заболеваний у детей с ВИЧ, не получавших антиретровирусные препараты (65% и 54% соответственно), по сравнению с детьми без ВИЧ (83% и 90% соответственно). 16 , 48 Тем не менее, из-за повышенного в 20-40 раз риска заражения этими бактериями, ВИЧ-инфицированные дети по-прежнему обладают значительным защитным эффектом, а абсолютное бремя инвазивных заболеваний и пневмонии, предотвращаемых вакцинами, превышает детей, не инфицированных ВИЧ. 16 , 48 В этом контексте ВОЗ рекомендовала странам с высоким уровнем распространения ВИЧ сделать приоритетным включение ПКВ в свои программы иммунизации. 21
Вакцины будущего
Хотя имеющиеся в настоящее время вакцины могут предотвратить большинство случаев смерти от пневмонии у детей, необходимы дополнительные исследования, чтобы определить причину остальных случаев пневмонии и разработать вакцины против этих патогенов. Следующим агентом, который можно предотвратить с помощью вакцинации, может быть нетипируемый агент H.грипп . Новая пневмококковая конъюгированная вакцина, в которой в качестве конъюгата используется протеин-D H. influenzae , защищает от острого среднего отита, вызванного H. influenzae , 49 , и в настоящее время оценивается эффективность против пневмококковой инфекции и H. influenzae пневмонии. . Нетипируемый H. influenzae — возбудитель пневмонии в Азии. 50
Другие патогены, против которых в настоящее время разрабатываются вакцины, включают респираторно-синцитиальный вирус, 51 , который является наиболее распространенным вирусным патогеном (25–35%), выявляемым у детей с пневмонией и бронхиолитом, 52 , 53 и вирус парагриппа. тип 3. 54 Кроме того, улучшенные вакцины для защиты от туберкулеза легких также могут способствовать сдерживанию непрекращающейся эпидемии детской пневмонии. Mycobacterium tuberculosis вызывает пневмонию примерно у 8% ВИЧ-инфицированных и ВИЧ-неинфицированных детей, госпитализированных с тяжелой пневмонией в странах Африки к югу от Сахары. 55 , 56
Рентабельность
Вакцинация детей широко считается одним из наиболее экономически эффективных мер профилактики заболеваний. 57 Многочисленные исследования показывают, что плановая вакцинация в развивающихся странах вакциной HibCV, PCV, коклюшной вакциной и противокоревой вакциной отвечает критериям высокоэффективных с точки зрения затрат медицинских вмешательств по ряду правдоподобных предположений, касающихся эффективности, цены и бремени болезней. Недавний обзор пакетов вмешательств, сделанный Laxminarayan et al. 57 показывает, что программы детской иммунизации и контроля смертности от пневмонии у детей очень рентабельны. Обзор показывает умеренную экономическую эффективность вакцин, содержащих Hib.Laxminarayan et al. не сообщали о рентабельности вакцинации против вакцины против пневмококковой инфекции, но недавний анализ рентабельности вакцинации против пневмококка в странах, охваченных Альянсом ГАВИ, показал, что при цене 5 долларов США за дозу программа вакцины против пневмококка будет соответствовать требованиям ВОЗ или превышать их. порог «очень рентабельный» в 69 из 72 отвечающих критериям стран. 58 Эти результаты были консервативными в том смысле, что они не предполагали какой-либо защиты стада среди невакцинированных детей или взрослых и не предполагали никакой прямой защиты после двухлетнего возраста.5 лет, хотя имеющиеся данные позволяют предположить, что оба этих преимущества вероятны. Предыдущие исследования экономической эффективности HibCV и PCV для развивающихся стран дали аналогичные результаты. 59
Преимущества
Новые вакцины для предотвращения пневмонии могут быть доставлены с помощью существующих программ иммунизации, в рамках которых в 2006 г. была получена третья доза вакцины против дифтерии, столбняка и коклюша примерно 79% когорты новорожденных в мире (база данных ВОЗ / IVB). Хотя вакцины охватывают лишь несколько конкретных патогенов и только избранные серотипы некоторых из целевых патогенов, иммунизация имеет ряд других преимуществ, которые делают ее высокоэффективным инструментом борьбы с болезнями.Иммунизация обеспечивает прочную, долговременную защиту, требует всего нескольких контактов для обеспечения этой защиты, быстро масштабируется и способна охватить группы населения, с которыми трудно добраться с помощью лечебных медицинских услуг. Опыт внедрения вакцины против гепатита В и HibCV показал, что охват этими вакцинами может быть быстро увеличен до тех же уровней, что и третья доза вакцины против дифтерии, столбняка и коклюша. Даже когда эти вакцины не поставлялись в сочетании с вакцинами против дифтерии, столбняка и коклюша и где внедрение было поэтапным в стране, уровни охвата, близкие к показателям охвата третьей дозой вакцины против дифтерии, столбняка и коклюша, были достигнуты в большинстве стран в 3–3 раза. 5 лет.В странах, где комбинированные вакцины были внедрены в масштабах всей страны, уровень охвата немедленно повысился до третьей дозы вакцины против дифтерии, столбняка и коклюша.
Таким образом, вакцины могут быстро охватить большую часть населения и быстро снизить уровень заболеваемости. В отношении некоторых болезней защита стада может распространить пользу от вакцинации детей и на другие возрастные группы, что является преимуществом, с которым могут сравниться немногие другие вмешательства. Как для HibCV, так и для PCV использование схем с тремя дозами, вводимыми в младенчестве, является эффективным, а текущие программы в большей части Африки и в других местах не включают плановую иммунизацию на втором году жизни (т.е. «Бустерные» иммунизации), хотя для определения потребности в дополнительных дозах в этих условиях требуется тщательный мониторинг заболевания.
Варианты финансирования
На протяжении многих лет относительно высокие цены и ограниченное краткосрочное финансирование закупок препятствовали использованию новых вакцин во многих развивающихся странах. С созданием Альянса ГАВИ в 2000 году финансирование доступа к вакцинам для беднейших стран значительно улучшилось. Альянс начался с предоставления странам гарантированного финансирования на срок до 5 лет для закупки вакцин и укрепления систем иммунизации.Финансирование включало поддержку распространения вакцин против коклюша и кори, а также закупку HibCV. В 2005 году финансирование Альянса ГАВИ было продлено на 10 лет, а в последние годы его общие обязательства увеличились с примерно 750 миллионов долларов США до более 6 миллиардов долларов США. Это увеличение финансирования включает более 500 миллионов долларов США на укрепление систем здравоохранения и 1,5 миллиарда долларов США на закупку ПКВ через инновационный механизм, известный как Предварительное рыночное обязательство. Для повышения национальной ответственности и поощрения решений, основанных на фактах, Альянсу ГАВИ требуется небольшая сооплата (в настоящее время от 0 долларов США.15 и 0,30 доллара США за дозу) из стран для новых вакцин, таких как HibCV и PCV. Ранний опыт использования вакцин против HibCV и гепатита B показал, что преодоление финансовых препятствий было необходимо, но не достаточно для ускорения внедрения. Отсутствие доказательств и политики для поддержки принятия решений в странах также является серьезным препятствием. В ответ Альянс ГАВИ также предоставил решения, создав проект ускоренной разработки и внедрения пневмококковых вакцин и инициативу по Hib.Эти специализированные группы обеспечивают поддержку эпиднадзора, исследований, анализа экономической эффективности и других мероприятий, способствующих принятию более эффективных решений партнерами Альянса ГАВИ, международными агентствами и национальными правительствами. Прогресс в обеспечении доступа для стран с низким уровнем дохода через Альянс ГАВИ не сопровождался прогрессом в странах с уровнем дохода ниже среднего. В некоторых крупных странах с уровнем доходов чуть выше предела для участия в альянсе ГАВИ, таких как Египет и Филиппины, много детей живут в бедности, но не имеют национального финансирования для самостоятельного доступа к новым вакцинам.Без дополнительных усилий по обеспечению доступа для этих стран будет сложно избежать ситуации бимодального доступа к новым вакцинам, при которой самые богатые и беднейшие страны имеют доступ, а страны, находящиеся в середине, будут отставать на годы.
Дорога впереди
Существующие и новые вакцины против пневмонии являются важной частью любого пакета для борьбы с пневмонией в детстве. Действительно, каждая из рассмотренных здесь вакцин рекомендована ВОЗ для включения в национальные программы.Благодаря новому устойчивому финансированию, доступному для многих развивающихся стран, основное препятствие на пути использования новых вакцин было в значительной степени преодолено, и более широкое использование всех вакцин против пневмонии в значительной степени доступно для стран с низким уровнем доходов. Хотя впереди дорога более ровная, чем раньше, многое еще предстоит сделать. Для достижения успеха потребуется политическая воля, чтобы превратить профилактику пневмонии в приоритетную задачу, укрепление систем здравоохранения для обеспечения того, чтобы вакцины достигли всех детей, и продолжение исследований, чтобы опережать бактерии и вирусы, которые уже можно предотвратить с помощью вакцин, и разработать новые технологии для предотвращения тех, у кого нет вакцин.Также необходим расширенный эпиднадзор, который позволяет странам отслеживать действие вакцин и адаптировать свои программы для реагирования на изменения. ■
Благодарность
Мы благодарим Питера Штребеля за его рецензию на раздел рукописи, посвященный кори.
Конкурирующие интересы: Шабир Мадхи получил поддержку в виде исследовательского гранта и работал в бюро докладчиков Wyeth Vaccines and Pediatrics. Остальные авторы не заявляют о конкурирующих интересах.
Список литературы
- Пневмония: забытый убийца детей . Женева: ЮНИСЕФ / ВОЗ; 2006.
- Black RE, Morris SS, Bryce J. Где и почему ежегодно умирают 10 миллионов детей? Lancet 2003; 361: 2226-34 DOI: 10.1016 / S0140-6736 (03) 13779-8 pmid: 12842379.
- Sazawal S, черный RE. Влияние ведения случаев пневмонии на смертность новорожденных, младенцев и детей дошкольного возраста: метаанализ исследований на уровне сообщества. Lancet Infect Dis 2003; 3: 547-56 doi: 10.1016 / S1473-3099 (03) 00737-0 pmid: 12954560.
- Смертность, которую можно предотвратить с помощью вакцин, и глобальное видение и стратегия иммунизации, 2006-2015 гг. MMWR Morb Mortal Wkly Rep 2006; 55: 511-5 pmid: 166
.
- Противококлюшные вакцины — позиционный документ ВОЗ. Wkly Epidemiol Rec 2005; 80: 31-9 PMID: 15717398.
- Crowcroft NS, Stein C, Duclos P, Birmingham M. Как лучше всего оценить глобальное бремя коклюша? Lancet Infect Dis 2003; 3: 413-8 doi: 10.1016 / S1473-3099 (03) 00669-8 pmid: 12837346.
- Duke T, Mgone CS. Корь: не просто вирусная экзантема. Lancet 2003; 361: 763-73 DOI: 10.1016 / S0140-6736 (03) 12661-X pmid: 12620751.
- Morton R, Mee J. Корневая пневмония: результаты пункции легкого в 56 случаях, связанные с рентгенологическими изменениями грудной клетки и клиническими особенностями. Ann Trop Paediatr 1986; 6: 41-5 pmid: 2428292.
- Quiambao BP, Gatchalian SR, Halonen P, Lucero M, Sombrero L, Paladin FJ и др., и другие. Коинфекция часто встречается при пневмонии, связанной с корью. Pediatr Infect Dis J 1998; 17: 89-93 DOI: 10.1097 / 00006454-199802000-00002 pmid: 94.
- Прогресс в сокращении глобальной смертности от кори, 1999-2004 гг. MMWR Morb Mortal Wkly Rep 2006; 55: 247-9 pmid: 16528234.
- Wolfson LJ, Strebel PM, Gacic-Dobo M, Hoekstra EJ, McFarland JW, Hersh BS. Была ли достигнута цель снижения смертности от кори в 2005 году? Исследование моделирования естественной истории. Lancet 2007; 369: 191-200 DOI: 10.1016 / S0140-6736 (07) 60107-X pmid: 17240285.
- Mulholland K, Hilton S, Adegbola R, Usen S, Oparaugo A, Omosigho C, et al., Et al. Рандомизированное испытание конъюгированной вакцины против столбняка с белком Haemophilus influenzae типа b. Lancet 1997; 349: 1191-7 DOI: 10.1016 / S0140-6736 (96) 09267-7 pmid:
39.
- Левин О.С., Лагос Р., Муньос А., Вильяроэль Дж., Альварес А.М., Абрего П. и др. И др. Определение бремени пневмонии у детей, которую можно предотвратить вакцинацией против Haemophilus influenzae типа b. Pediatr Infect Dis J 1999; 18: 1060-4 DOI: 10.1097 / 00006454-199
0-00006 pmid: 10608624.
- Gessner BD, Sutanto A, Linehan M, Djelantik IG, Fletcher T, Gerudug IK, et al., Et al. Заболеваемость пневмонией и менингитом, предотвращаемым с помощью вакцинации Haemophilus influenzae типа b, у индонезийских детей: рандомизированное испытание вакцины с помощью вакцины. Lancet 2005; 365: 43-52 DOI: 10.1016 / S0140-6736 (04) 17664-2 pmid: 15643700.
- Хансен Дж., Блэк С., Шайнфилд Х, Чериан Т., Бенсон Дж., Файерман Б. и др., и другие. Эффективность гептавалентной пневмококковой конъюгированной вакцины у детей младше 5 лет для профилактики пневмонии: обновленный анализ с использованием стандартизированной интерпретации рентгенограмм грудной клетки Всемирной организацией здравоохранения. Pediatr Infect Dis J 2006; 25: 779-81 doi: 10.1097 / 01.inf.0000232706.35674.2f pmid: 16
3.
- Klugman KP, Madhi SA, Huebner RE, Kohberger R, Mbelle N, Pierce N. Испытание 9-валентной пневмококковой конъюгированной вакцины у детей с ВИЧ-инфекцией и без нее. N Engl J Med 2003; 349: 1341-8 DOI: 10.1056 / NEJMoa035060 pmid: 14523142.
- Cutts FT, Zaman SM, Enwere G, Jaffar S, Levine OS, Okoko JB, et al., Et al. Эффективность девятивалентной пневмококковой конъюгированной вакцины против пневмонии и инвазивного пневмококкового заболевания в Гамбии: рандомизированное двойное слепое плацебо-контролируемое исследование. Lancet 2005; 365: 1139-46 DOI: 10.1016 / S0140-6736 (05) 71876-6 pmid: 15794968.
- О’Брайен К.Л., Моултон Л.Х., Рид Р., Уэзерхольц Р., Оски Дж., Браун Л. и др., и другие. Эффективность и безопасность семивалентной конъюгированной пневмококковой вакцины у детей американских индейцев: групповое рандомизированное исследование. Lancet 2003; 362: 355-61 DOI: 10.1016 / S0140-6736 (03) 14022-6 pmid: 12
- 8.
- де Андраде А.Л., де Андраде Дж. Г., Мартелли СМ. Эффективность конъюгированной вакцины против Haemophilus influenzae b при детской пневмонии: исследование случай-контроль в Бразилии. Int J Epidemiol 2004; 33: 173-81 DOI: 10.1093 / ije / dyh025 pmid: 15075166.
- de la Hoz F, Higuera AB, Di Fabio JL, Luna M, Naranjo AG, de la Luz Valencia M и др., и другие. Эффективность вакцинации против Haemophilus influenzae типа b против бактериальной пневмонии в Колумбии. Vaccine 2004; 23: 36-42 doi: 10.1016 / j.vaccine.2004.05.017 pmid: 15519705.
- Baqui AH, El Arifeen S, Saha SK, Persson L, Zaman K, Gessner BD, et al., Et al. Эффективность конъюгированной вакцины против Haemophilus influenzae типа b для профилактики пневмонии и менингита у детей Бангладеш: исследование случай-контроль. Pediatr Infect Dis J 2007; 26: 565-71 DOI: 10.1097 / INF.0b013e31806166a0 pmid: 17596795.
- Пневмококковая конъюгированная вакцина для детской иммунизации — позиционный документ ВОЗ. 22. Wkly Epidemiol Rec 2007; 82: 93-104 pmid: 17380597.
- Чериан Т., Малхолланд Е.К., Карлин Дж. Б., Остенсен Х., Амин Р., де Кампо М. и др. И др. Стандартизированная интерпретация рентгенограмм грудной клетки у детей для диагностики пневмонии в эпидемиологических исследованиях. Bull World Health Organ 2005; 83: 353-9 pmid: 15976876.
- Мадхи С.А., Куванда Л., Катленд С., Клугман К.П.Влияние 9-валентной пневмококковой конъюгированной вакцины на бремя пневмонии для общественного здравоохранения у ВИЧ-инфицированных и неинфицированных детей. Clin Infect Dis 2005; 40: 1511-8 DOI: 10.1086 / 429828 pmid: 15844075.
- Мадхи С.А., Клугман К.П. Определение Всемирной организации здравоохранения «пневмония, подтвержденная радиологическими исследованиями» может недооценивать истинную ценность конъюгированных пневмококковых вакцин для общественного здравоохранения. Вакцина 2007; 25: 2413-9 DOI: 10.1016 / j.vaccine.2006.09.010 pmid: 17005301.
- Grijalva CG, Nuorti JP, Arbogast PG, Martin SW, Edwards KM, Griffin MR. Снижение числа госпитализаций с пневмонией после плановой иммунизации детей пневмококковой конъюгированной вакциной в США: анализ временных рядов. Lancet 2007; 369: 1179-86 DOI: 10.1016 / S0140-6736 (07) 60564-9 pmid: 17416262.
- Микелоу И.К., Олсен К., Лозано Дж., Роллинз Н.К., Даффи Л.Б., Зиглер Т. и др. И др. Эпидемиология и клиническая характеристика внебольничной пневмонии у госпитализированных детей. Педиатрия 2004; 113: 701-7 doi: 10.1542 / peds.113.4.701 pmid: 15060215.
- Мадхи С.А., Клугман К.П. Роль Streptococcus pneumoniae в вирус-ассоциированной пневмонии. Nat Med 2004; 10: 811-3 DOI: 10,1038 / нм1077 pmid: 15247911.
- Klugman KP, Madhi SA. Пневмококковые вакцины и готовность к гриппу. Наука 2007; 316: 49-50 doi: 10.1126 / science.316.5821.49c pmid: 17412937.
- Клугман КП. Эффективность пневмококковых конъюгированных вакцин и их влияние на носительство и устойчивость к противомикробным препаратам. Lancet Infect Dis 2001; 1: 85-91 DOI: 10.1016 / S1473-3099 (01) 00063-9 pmid: 11871480.
- Whitney CG, Farley MM, Hadler J, Harrison LH, Bennett NM, Lynfield R, et al., Et al. Снижение инвазивной пневмококковой инфекции после введения конъюгированной протеин-полисахаридной вакцины. N Engl J Med 2003; 348: 1737-46 DOI: 10.1056 / NEJMoa022823 pmid: 12724479.
- Прямое и косвенное влияние плановой вакцинации детей 7-валентной пневмококковой конъюгированной вакциной на частоту инвазивной пневмококковой инфекции — США, 1998-2003 гг. MMWR Morb Mortal Wkly Rep 2005; 54: 893-7 pmid: 16163262.
- Singleton RJ, Hennessy TW, Bulkow LR, Hammitt LL, Zulz T, Hurlburt DA, et al., Et al. Инвазивное пневмококковое заболевание, вызванное невакцинными серотипами, среди детей коренных народов Аляски с высоким уровнем охвата 7-валентной пневмококковой конъюгированной вакциной. JAMA 2007; 297: 1784-92 DOI: 10.1001 / jama.297.16.1784 pmid: 17456820.
- Эскола Дж., Килпи Т., Палму А., Йокинен Дж., Хаапакоски Дж., Херва Е. и др., и другие. Эффективность пневмококковой конъюгированной вакцины против острого среднего отита. N Engl J Med 2001; 344: 403-9 DOI: 10.1056 / NEJM200102083440602 pmid: 11172176.
- Документ с изложением позиции ВОЗ по конъюгированным вакцинам против Haemophilus influenzae типа b (заменяет документ с изложением позиции ВОЗ по вакцинам против Hib, ранее опубликованный в Еженедельном эпидемиологическом журнале). Wkly Epidemiol Rec 2006; 81: 445-52 pmid: 17124755.
- Piedra PA, Gaglani MJ, Kozinetz CA, Herschler GB, Fewlass C, Harvey D, et al., и другие. Трехвалентная живая аттенуированная интраназальная вакцина против гриппа, введенная во время вспышки гриппа типа A (h4N2) в 2003–2004 годах, обеспечила немедленную, прямую и непрямую защиту детей. Педиатрия 2007; 120: e553-64 doi: 10.1542 / peds.2006-2836 pmid: 17698577.
- Smith S, Demicheli V, Di Pietrantonj C, Harnden AR, Jefferson T, Matheson NJ, et al., Et al. Вакцины для профилактики гриппа у здоровых детей. Кокрановская база данных Syst Rev 2006; 1: CD004879-pmid: 16437500.
- Manzoli L, Schioppa F, Boccia A, Villari P. Эффективность вакцины против гриппа для здоровых детей: метаанализ, оценивающий потенциальные источники вариаций оценок эффективности, включая качество исследования. Pediatr Infect Dis J 2007; 26: 97-106 doi: 10.1097 / 01.inf.0000253053.01151.bd pmid: 17259870.
- Allison MA, Daley MF, Crane LA, Barrow J, Beaty BL, Allred N и др. И др. Эффективность вакцины против гриппа у здоровых детей в возрасте от 6 до 21 месяца в сезоне 2003-2004 гг. J Pediatr 2006; 149: 755-62 DOI: 10.1016 / j.jpeds.2006.06.036 pmid: 17137887.
- Грэм С.М., Гибб Д.М. Заболевания ВИЧ и респираторные инфекции у детей. Br Med Bull 2002; 61: 133-50 DOI: 10.1093 / bmb / 61.1.133 pmid: 11997303.
- Цви К.Дж., Петтифор Дж.М., Содерлунд Н. Поступления в педиатрическую больницу южноафриканской городской региональной больницы: влияние ВИЧ, 1992–1997. Ann Trop Paediatr 1999; 19: 135-42 DOI: 10.1080 / 027249399
pmid: 106.
- Гибб Д., Споулу В., Джакомелли А., Гриффитс Х., Мастерс Дж., Мисбах С. и др. И др. Ответы антител на вакцины против Haemophilus influenzae типа b и Streptococcus pneumoniae у детей с инфекцией вируса иммунодефицита человека. Pediatr Infect Dis J 1995; 14: 129-35 pmid: 7746695.
- Мадхи С.А., Куванда Л., Катленд С., Холм А., Кайхти Н., Клугман К.П. Количественный и качественный ответ антител на пневмококковую конъюгированную вакцину среди африканских детей, инфицированных вирусом иммунодефицита человека, и неинфицированных. Pediatr Infect Dis J 2005; 24: 410-6 doi: 10.1097 / 01.inf.0000160942.84169.14 pmid: 15876939.
- Гибб Д., Джакомелли А., Мастерс Дж., Спулу В., Руга Е., Гриффитс Н. и др. И др. Устойчивость антител к полисахаридной конъюгированной вакцине Haemophilus influenzae типа b у детей с вертикально приобретенной инфекцией вируса иммунодефицита человека. Pediatr Infect Dis J 1996; 15: 1097-101 DOI: 10.1097 / 00006454-199612000-00008 pmid: 8970219.
- Мадхи С.А., Куванда Л., Сааринен Л., Катленд С., Мотупи Р., Кайхти Н. и др., и другие. Иммуногенность и эффективность конъюгированной вакцины против Haemophilus influenzae типа b у ВИЧ-инфицированных и неинфицированных африканских детей. Vaccine 2005; 23: 5517-25 doi: 10.1016 / j.vaccine.2005.07.038 pmid: 16107294.
- Obaro SK, Pugatch D, Luzuriaga K. Иммуногенность и эффективность детских вакцин у ВИЧ-1-инфицированных детей. Lancet Infect Dis 2004; 4: 510-8 DOI: 10.1016 / S1473-3099 (04) 01106-5 pmid: 15288824.
- Абзуг М.Дж., Пелтон С.И., Сонг Л.Й., Фентон Т., Левин М.Дж., Нахман С.А. и др., и другие. Иммуногенность, безопасность и предикторы ответа после серии пневмококковых конъюгатов и пневмококковых полисахаридных вакцин у детей, инфицированных вирусом иммунодефицита человека, получающих высокоактивную антиретровирусную терапию. Pediatr Infect Dis J 2006; 25: 920-9 doi: 10.1097 / 01.inf.0000237830.33228.c3 pmid: 17006288.
- Мадхи С.А., Петерсен К., Хосал М., Хюбнер Р.Э., Мбелле Н., Мотупи Р. и др. И др. Снижение эффективности конъюгированной вакцины против Haemophilus influenzae типа b у детей с высокой распространенностью инфекции вируса иммунодефицита человека типа 1. Pediatr Infect Dis J 2002; 21: 315-21 DOI: 10.1097 / 00006454-200204000-00011 pmid: 12075763.
- Примула Р., Петерс П., Чробок В., Криз П., Новакова Е., Калискова Е. и др. И др. Пневмококковые капсульные полисахариды, конъюгированные с протеином D, для профилактики острого среднего отита, вызванного как Streptococcus pneumoniae, так и нетипируемым Haemophilus influenzae: рандомизированное двойное слепое исследование эффективности. Lancet 2006; 367: 740-8 DOI: 10.1016 / S0140-6736 (06) 68304-9 pmid: 16517274.
- Shann F. Haemophilus influenzae pneumonia: тип b или не тип b? Ланцет 1999; 354: 1488-90. PMID: 10551490 DOI: 10.1016 / S0140-6736 (99) 00232-910.1016 / S0140-6736 (99) 00232-9
- Райт П.Ф., Каррон Р.А., Белше Р.Б., Томпсон Дж., Кроу Дж. Э., Бойс Т.Г. и др. И др. Оценка живого, холодного пассирования, чувствительного к температуре, респираторно-синцитиального вируса-кандидата в младенчестве. J Infect Dis 2000; 182: 1331-42 DOI: 10.1086 / 315859 pmid: 11010838.
- Law BJ, Carbonell-Estrany X, Simoes EA.Обновленная информация об эпидемиологии респираторно-синцитиального вируса: взгляд из развитых стран. Respir Med 2002; 96 Приложение B; S1-7.
- Simoes EA. Респираторно-синцитиальная вирусная инфекция. Lancet 1999; 354: 847-52 pmid: 10485741.
- Belshe RB, Newman FK, Tsai TF, Karron RA, Reisinger K, Roberton D, et al., Et al. Оценка фазы 2 живой аттенуированной вакцины мутанта 45 холодного пассажа парагриппа типа 3 у здоровых детей в возрасте 6-18 месяцев. J Infect Dis 2004; 189: 462-70 DOI: 10.1086/381184 pmid: 14745704.
- Мадхи С.А., Петерсен К., Мадхи А., Хосал М., Клугман К.П. Повышенное бремя болезней и устойчивость бактерий к антибиотикам, вызывающая тяжелые внебольничные инфекции нижних дыхательных путей у детей, инфицированных вирусом иммунодефицита человека 1 типа. Clin Infect Dis 2000; 31: 170-6 DOI: 10.1086 / 313925 pmid: 10
7. - Zar HJ, Hanslo D, Tannenbaum E, Klein M, Argent A, Eley B, et al., Et al. Этиология и исход пневмонии у детей, инфицированных вирусом иммунодефицита человека, госпитализированных в Южной Африке. Acta Paediatr 2001; 90: 119-25 DOI: 10.1080 / 080352501300049163 pmid: 11236037.
- Laxminarayan R, Mills AJ, Breman JG, Measham AR, Alleyne G, Claeson M, et al., Et al. Улучшение глобального здравоохранения: ключевые идеи проекта приоритетов борьбы с болезнями. Lancet 2006; 367: 1193-208 DOI: 10.1016 / S0140-6736 (06) 68440-7 pmid: 16616562.
- Sinha A, Levine O, Knoll MD, Muhib F, Lieu TA. Экономическая эффективность пневмококковой конъюгированной вакцинации в профилактике детской смертности: международный экономический анализ. Lancet 2007; 369: 389-96 DOI: 10.1016 / S0140-6736 (07) 60195-0 pmid: 17276779.
- Миллер М.А., Макканн Л. Анализ политики использования вакцин против гепатита B, Haemophilus influenzae типа b, Streptococcus pneumoniae-конъюгата и ротавирусных вакцин в национальных календарях иммунизации. Health Econ 2000; 9: 19-35 doi: 10.1002 / (SICI) 1099-1050 (200001) 9: 13.0.CO; 2-C19 :: help-hec487> pmid: 10694757.
Филиалы
- Департамент науки и технологий / Национальный исследовательский фонд: Болезни, предупреждаемые с помощью вакцин, Университет Витватерсранда, Больница Криса Хани Барагвант, Бертшем, 2013 г., Южная Африка.
- Департамент международного здравоохранения, Школа общественного здравоохранения Bloomberg Джонса Хопкинса, Балтимор, Мэриленд, Соединенные Штаты Америки.
- Отдел здравоохранения Детского фонда Организации Объединенных Наций (ЮНИСЕФ), Нью-Йорк, штат Нью-Йорк, США.
- Департамент иммунизации, вакцин и биологических препаратов, Всемирная организация здравоохранения, Женева, Швейцария.
Резюме вакцинации против пневмококка | Кому и когда проводить вакцинацию | Провайдерам
В США доступны 2 типа пневмококковой вакцины:
- Пневмококковая конъюгированная вакцина (PCV13 или Prevnar13®)
- Пневмококковая полисахаридная вакцина (PPSV23 или Pneumovax23®)
Узнайте ниже, какие пневмококковые вакцины рекомендует CDC в зависимости от возрастной группы и состояния здоровья.
Дети до 2 лет
CDC рекомендует ЦВС-13 для всех младенцев в виде серии из 4 доз.
- Дайте 1 дозу в 2 месяца, 4 месяца, 6 месяцев и от 12 до 15 месяцев.
Дети, которые пропустили прививки или начали серию позже, все равно должны получить вакцину. Рекомендуемое количество доз и интервалы между дозами зависят от возраста ребенка на момент начала вакцинации. Дополнительные сведения см. В Графике вакцинации детей и подростков.
Дети от 2 до 4 лет без определенных заболеваний
CDC определяет неполный график как не получивший все рекомендованные соответствующие возрасту начальные серии или не получивший все соответствующий возрасту график наверстывания.
CDC рекомендует вакцинацию против ЦВС-13 детям в возрасте от 2 до 4 лет, которые не вакцинированы или получили неполную серию вакцины ЦВС-13. Дополнительные сведения см. В Графике вакцинации детей и подростков.
Дети от 2 до 5 лет с определенными заболеваниями
CDC рекомендует вакцинировать пневмококковую вакцину детям от 2 до 5 лет с определенными заболеваниями. В таблицах ниже представлена подробная информация по состоянию здоровья. Вы также можете посмотреть таблицу 11 для получения дополнительных сведений.
Для ребенка с любым из этих состояний:
- Хроническая болезнь сердца
- Хроническое заболевание легких, включая астму, при лечении высокими дозами пероральных кортикостероидов
- Сахарный диабет
- Утечка цереброспинальной жидкости
- Кохлеарный имплант (ы)
CDC рекомендует вам:
- Введите 2 дозы PCV13, если они не вакцинированы или получили неполную серию PCV13 с <3 дозами.Дайте вторую дозу по крайней мере через 8 недель после первой.
- Дайте 1 дозу PCV13, если они получили 3 дозы PCV13, но ни одна из них не была введена после 12 месяцев.
- Дайте 1 дозу PPSV23 не менее чем через 8 недель после завершения серии PCV13.
Для ребенка с любым из этих состояний:
- Серповидно-клеточная анемия или другие гемоглобинопатии
- Анатомическая или функциональная аспления
- Врожденный или приобретенный иммунодефицит
- ВИЧ-инфекция
- Хроническая почечная недостаточность или нефротический синдром
- Ятрогенная иммуносупрессия, включая лучевую терапию
- Лейкемия или лимфома
- Болезнь Ходжкина
- Множественная миелома
- Генерализованные и метастатические злокачественные новообразования
- Трансплантация твердых органов
CDC рекомендует вам:
- Введите 2 дозы PCV13, если они не вакцинированы или получили неполную серию PCV13 с <3 дозами.Дайте вторую дозу по крайней мере через 8 недель после первой.
- Дайте 1 дозу PCV13, если они получили 3 дозы PCV13, но ни одна из них не была введена после 12 месяцев.
- Введите 2 дозы PPSV23 после завершения серии PCV13. Дайте первую дозу по крайней мере через 8 недель после любой предыдущей дозы PCV13, затем введите вторую дозу PPSV23 по крайней мере через 5 лет после первой дозы PPSV23.
Дети от 6 до 18 лет с определенными заболеваниями
CDC рекомендует вакцинировать пневмококковую вакцину детям в возрасте от 6 до 18 лет с определенными заболеваниями.В таблицах ниже представлена подробная информация по состоянию здоровья. См. Эту таблицу для получения дополнительных сведений.
Для ребенка с любым из этих состояний:
- Утечка цереброспинальной жидкости
- Кохлеарный имплант (ы)
CDC рекомендует вам:
- Дайте 1 дозу PCV13, если они не получали никаких доз PCV13. Перед введением любых рекомендуемых доз PPSV23 введите PCV13.
- Дайте 1 дозу PPSV23 (если еще не вводили ранее в детстве) по крайней мере через 8 недель после PCV13.
Для ребенка с любым из этих состояний:
- Серповидно-клеточная анемия или другие гемоглобинопатии
- Анатомическая или функциональная аспления
- Врожденный или приобретенный иммунодефицит
- ВИЧ-инфекция
- Хроническая почечная недостаточность или нефротический синдром
- Ятрогенная иммуносупрессия, включая лучевую терапию
- Лейкемия или лимфома
- Болезнь Ходжкина
- Множественная миелома
- Генерализованные и метастатические злокачественные новообразования
- Трансплантация твердых органов
CDC рекомендует вам:
- Дайте 1 дозу PCV13, если они не получали никаких доз PCV13.Перед введением любых рекомендуемых доз PPSV23 введите PCV13.
- Убедитесь, что ребенок получил 2 дозы PPSV23. Первую дозу PPSV23 следует вводить как минимум через 8 недель после любой предыдущей дозы PCV13, затем вторую дозу PPSV23 следует вводить как минимум через 5 лет после первой дозы PPSV23.
Для ребенка с любым из этих состояний:
- Хроническая болезнь сердца
- Хроническое заболевание легких, включая хроническую обструктивную болезнь легких, эмфизему и астму (при лечении высокими дозами пероральных кортикостероидов)
- Сахарный диабет
- Алкоголизм
- Хроническая болезнь печени
CDC рекомендует вам:
- Дайте 1 дозу PPSV23 (если еще не вводили ранее в детстве).
Взрослые от 19 до 64 лет
CDC рекомендует вакцинацию от пневмококка взрослым от 19 до 64 лет, которые имеют определенные заболевания или курят. В таблицах ниже представлена подробная информация по состоянию здоровья и курению. См. Раздел «Сроки вакцинации против пневмококковой инфекции для взрослых» значок pdf [5 страниц] для получения дополнительных сведений.
Для всех с одним из перечисленных ниже состояний, которые ранее не получали рекомендованные пневмококковые вакцины:
- Утечка цереброспинальной жидкости
- Кохлеарный имплант (ы)
CDC рекомендует вам:
- Дайте 1 дозу PCV13 и 1 дозу PPSV23.Сначала введите PCV13, а затем дайте дозу PPSV23 как минимум через 8 недель.
Для всех с одним из перечисленных ниже состояний, которые ранее не получали рекомендованные пневмококковые вакцины:
- Серповидно-клеточная анемия или другие гемоглобинопатии
- Анатомическая или функциональная аспления
- Врожденный или приобретенный иммунодефицит
- ВИЧ-инфекция
- Хроническая почечная недостаточность или нефротический синдром
- Лейкемия или лимфома
- Болезнь Ходжкина
- Генерализованные и метастатические злокачественные новообразования
- Ятрогенная иммуносупрессия, включая лучевую терапию
- Множественная миелома
CDC рекомендует вам:
- Дайте 1 дозу PCV13 и 2 дозы PPSV23.Сначала введите PCV13, а затем введите первую дозу PPSV23 как минимум через 8 недель. Дайте вторую дозу PPSV23 по крайней мере через 5 лет после первой дозы PPSV23.
Для тех, кто курит и ранее не получал рекомендованную пневмококковую вакцину
Для всех с одним из перечисленных ниже состояний, которые ранее не получали рекомендованную пневмококковую вакцину:
- Алкоголизм
- Хроническая болезнь сердца
- Хроническая болезнь печени
- Хроническая болезнь легких, включая хроническую обструктивную болезнь легких, эмфизему и астму
- Сахарный диабет
Взрослые в возрасте 65 лет и старше без иммунодефицитных состояний, кохлеарного имплантата или утечки цереброспинальной жидкости
CDC рекомендует вакцинировать пневмококковую вакцину всем взрослым в возрасте 65 лет и старше.См. Раздел «Сроки вакцинации против пневмококковой инфекции для взрослых» значок pdf [5 страниц] для получения дополнительных сведений.
Все взрослые в возрасте 65 лет и старше должны получить 1 дозу PPSV23. Кроме того, врачи должны рассмотреть возможность обсуждения вакцинации против ЦВС-13 со своими взрослыми пациентами в возрасте 65 лет и старше, у которых нет иммунодефицитных состояний †, кохлеарного имплантата или утечки спинномозговой жидкости и которые никогда ранее не получали ЦВС-13. Когда пациенты и клиницисты принимают участие в совместном принятии клинических решений об использовании ЦВС-13, соображения могут включать в себя индивидуальный риск контакта с серотипами ЦВС-13 и риск пневмококковой инфекции для этого человека из-за основных заболеваний.
- Для взрослых в возрасте 65 лет и старше, у которых нет иммунодефицитных состояний, утечки спинномозговой жидкости или кохлеарного имплантата и которые хотят получить ТОЛЬКО PPSV23 :
- Введите 1 дозу PPSV23.
- Любой, кто получил какие-либо дозы PPSV23 до 65 лет, должен получить 1 последнюю дозу вакцины в возрасте 65 лет и старше. Эту последнюю дозу вводите как минимум через 5 лет после предыдущей дозы PPSV23.
- Для взрослых в возрасте 65 лет и старше, у которых нет иммунодефицитных состояний, утечки спинномозговой жидкости или кохлеарного имплантата и которые хотят получить PCV13 И PPSV23:
- Сначала введите 1 дозу PCV13, а затем 1 дозу PPSV23 не менее чем через год.
- Любой, кто получил какие-либо дозы PPSV23 до 65 лет, должен получить 1 последнюю дозу вакцины в возрасте 65 лет и старше. Эту последнюю дозу вводите как минимум через 5 лет после предыдущей дозы PPSV23.
- Если пациент уже получил PPSV23, введите дозу PCV13 не менее чем через 1 год после того, как он получил самую последнюю дозу
- Сначала введите 1 дозу PCV13, а затем 1 дозу PPSV23 не менее чем через год.
- Введите 1 дозу PPSV23.
Рекомендации для совместного принятия клинических решений об использовании ПКВ13 среди взрослых в возрасте 65 лет и старше
Клиницисты и пожилые люди могут учитывать следующее при принятии этого решения:
- PCV13 — безопасная и эффективная вакцина для пожилых людей.Риск заболевания типа ЦВС13 среди взрослых в возрасте ≥65 лет намного ниже, чем он был до внедрения педиатрической программы, в результате косвенных эффектов ЦВС13 (снижение носительства и передачи среди населения). Остающийся риск является функцией риска контакта каждого отдельного пациента с серотипами PCV13 и влияния основных заболеваний на риск развития пневмококковой инфекции у пациента в случае контакта.
- Следующие взрослые люди в возрасте ≥65 лет потенциально подвержены повышенному риску заражения серотипами ЦВС13 и могут получить более высокую, чем в среднем, пользу от вакцинации ЦВС13, и поставщики медицинских услуг, ухаживающие за многими пациентами в этих группах, могут рассмотреть возможность регулярного предложения ЦВС13 своим пациентам в возрасте ≥ 65 лет, ранее не получавших ПКВ13:
- Лица, проживающие в домах престарелых или других учреждениях длительного ухода
- Лица, проживающие в регионах с низким уровнем поглощения PCV13 у детей (используйте ChildVaxView Interactive! Для поиска данных о состоянии и выбранной местности)
- Люди, путешествующие в места, где нет детской программы PCV13 (используйте значок VIEW-hube на внешней стороне, чтобы увидеть, в каких странах используется PCV13)
- Заболеваемость инвазивным пневмококком типа PCV13 и пневмонией увеличивается с возрастом и выше среди лиц с хроническими заболеваниями сердца, легких или печени, диабетом или алкоголизмом, а также среди тех, кто курит сигареты или страдает более чем одним хроническим заболеванием.Хотя косвенные эффекты от использования ЦВС13 в педиатрии были задокументированы для этих групп взрослых и были сопоставимы с эффектами, наблюдаемыми среди здоровых взрослых, остаточное бремя болезней типа ЦВС13 в этих группах остается выше. Поставщики медицинских услуг / практикующие врачи, осуществляющие уход за пациентами с этими заболеваниями, могут рассмотреть возможность предложения PCV13 таким пациентам в возрасте ≥65 лет, которые ранее не получали PCV13.
Сноска
† К иммунодефицитным состояниям относятся: хроническая почечная недостаточность, нефротический синдром, иммунодефицит, ятрогенная иммуносупрессия, генерализованные злокачественные новообразования, вирус иммунодефицита человека, болезнь Ходжкина, лейкемия, лимфома, множественная миелома, трансплантация твердых органов, врожденная или приобретенная аспления, серповидно-клеточная анемия и др. гемоглобинопатии.
Взрослые в возрасте 65 лет и старше с иммунодефицитным состоянием, кохлеарным имплантатом или утечкой спинномозговой жидкости
CDC рекомендует вакцинировать пневмококковую вакцину всем взрослым в возрасте 65 лет и старше. См. Раздел «Сроки вакцинации против пневмококковой инфекции для взрослых» значок pdf [5 страниц] для получения дополнительных сведений.
Для всех с одним из перечисленных ниже состояний, которые ранее не получали рекомендованные пневмококковые вакцины:
- Утечка цереброспинальной жидкости
- Кохлеарный имплант (ы)
- Серповидно-клеточная анемия или другие гемоглобинопатии
- Анатомическая или функциональная аспления
- Врожденный или приобретенный иммунодефицит
- ВИЧ-инфекция
- Хроническая почечная недостаточность или нефротический синдром
- Лейкемия или лимфома
- Болезнь Ходжкина
- Генерализованные и метастатические злокачественные новообразования
- Ятрогенная иммуносупрессия, включая лучевую терапию)
- Трансплантация твердых органов
- Множественная миелома
CDC рекомендует вам:
- Сначала дайте 1 дозу PCV13.
- Введите 1 дозу PPSV23 по крайней мере через 8 недель после любой предыдущей дозы PCV13 и как минимум через 5 лет после любой предыдущей дозы PPSV23.
- Любой, кто получил какие-либо дозы PPSV23 до 65 лет, должен получить 1 последнюю дозу вакцины в возрасте 65 лет и старше.
Начало страницы
Атипичные патогены и проблемы внебольничной пневмонии
КРИСТОФЕР П. ТИБОДО, LCDR, MC, USN, и ЭНТОНИ Дж. ВИЕРА, LCDR, MC, USNR, Военно-морской госпиталь Джексонвилл, Джексонвилл, Флорида
Am Famician., 1 апреля 2004 г .; 69 (7): 1699-1707.
Атипичные организмы, такие как Mycoplasma pneumoniae, Chlamydia pneumoniae и Legionella pneumophila, являются причиной до 40 процентов случаев внебольничной пневмонии. Лечение антибиотиками является эмпирическим и включает лечение как типичных, так и атипичных организмов. Доксициклин, фторхинолон с повышенной активностью против Streptococcus pneumoniae или макролид подходят для амбулаторного лечения иммунокомпетентных взрослых пациентов. Госпитализированных взрослых следует лечить цефотаксимом или цефтриаксоном с макролидом или только фторхинолоном.Эти же агенты можно использовать у взрослых пациентов в отделениях интенсивной терапии, хотя монотерапия фторхинолоном не рекомендуется; вместо цефотаксима или цефтриаксона можно использовать ампициллин-сульбактам или пиперациллин-тазобактам. Амбулаторное лечение детей в возрасте от двух месяцев до пяти лет состоит из приема высоких доз амоксициллина в течение семи-десяти дней. Однократная доза цефтриаксона может применяться у младенцев, когда первая доза антибиотика может быть отсрочена или не всасывается. Детей постарше можно лечить макролидом.Госпитализированным детям следует назначать макролид плюс ингибитор бета-лактама. В случае биотеррористической атаки легочная болезнь может быть вызвана микроорганизмами, вызывающими сибирскую язву, чуму или туляремию. Внезапный острый респираторный синдром начинается с гриппоподобного заболевания, за которым через два-семь дней следует кашель, одышка и, в некоторых случаях, острый респираторный дистресс.
Внебольничная пневмония (ВП) ежегодно поражает примерно 4,5 миллиона взрослых в Соединенных Штатах.1 Около одной трети этих взрослых нуждаются в госпитализации.1 Смертность среди госпитализированных пациентов с ВП варьируется каждый год и может достигать 35 процентов.2 Хотя Streptococcus pneumoniae вызывает до 70 процентов случаев ВП, атипичные патогены являются причиной 30-40 процентов случаев3 и могут быть копатогенами в других случаях. Даже при знании некоторых общих характеристик инфекций, вызываемых атипичными микроорганизмами (Таблица 1) 4, определение конкретного патогена на основе клинических, радиологических и лабораторных данных является трудным и обычно проводится ретроспективно, если вообще проводится.
Атипичные патогены
МИКОПЛАЗМА PNEUMONIAE
Mycoplasma pneumoniae вызывает широкий спектр респираторных инфекций, включая пневмонию, трахеобронхит и инфекции верхних дыхательных путей. Только от 3 до 10 процентов людей, инфицированных M. pneumoniae, заболевают пневмонией.5 Поскольку инфекция M. pneumoniae становится все более распространенной с возрастом, особенно важно учитывать этот агент у пожилых пациентов.6
Инфекция M. pneumoniae встречается повсюду. год, но может вызывать периодические вспышки в небольших населенных пунктах.Передача происходит от человека к человеку, и инфекция распространяется медленно, чаще всего в закрытых группах населения (например, в домах, школах, предприятиях).
M. pneumoniae — патоген, чаще всего связанный с атипичной пневмонией. Начало коварное, длится от нескольких дней до недели. Обычно присутствующие конституциональные симптомы включают головную боль, усиливающуюся кашлем, недомоганием, миалгиями и болью в горле. Кашель обычно сухой, приступообразный, хуже ночью.
Клиническое течение пневмонии, вызванной M.pneumoniae обычно протекает в легкой форме и проходит самостоятельно. Уровень смертности составляет приблизительно 1,4 процента2. Однако легочные осложнения могут быть значительными и включают выпот, эмпиему, пневмоторакс и респираторный дистресс-синдром.
Просмотр / печать таблицы
ТАБЛИЦА 1
Диагностические признаки, указывающие на внебольничную пневмонию, вызванную атипичными патогенами
Диагностическая особенность Mycoplasma pneumonia Chlamydia pneumonia310100 916 Анамнез
Боль в животе
—
—
+
Путаница
–910 910 910 910 910 910 910 910 910 +
Диарея
+/–
—
+
Боль в ухе
16
/910
–
Головная боль (легкая)
+
—
—
Миалгия
910/ +
Плевритная боль
+/–
—
+
Боль в горле10 910 900 +/–
—
Физические признаки
Поражение сердца
+/–
—
—
8 12 12 +/–
—
+/–
Кровохарканье
—
—
+
Фарингит (нет16101018 910
910 21
18 910 910 21
)
—
Сыпь
+/–
—
—
Феномен Рейно
—
—
Рентгенограмма грудной клетки
Пятнистый инфильтрат
Воронкообразный или ограниченный инфильтрат
Пятнистая консолидация
2
2
2
2
2
Холодные агглютинины 900 23
+
—
—
Гипонатриемия
—
—
31010 910 0uk +/–
—
+
Микроскопическая гематурия
—
—
3 10 910 910 910
—
—
+
ТАБЛИЦА 1
Диагностические признаки, указывающие на внебольничную пневмонию, вызванную атипичными патогенами
Диагностическая пневмония Пневмония Диагностическая пневмония Виды Legionella pneumonia История
Боль в животе
—
—
+
16 — —
+
Диарея
+/–
—
+
910 910 9103 910 910 9100 Ухо +/–
—
—
Головная боль (легкая)
+
—
—
100310
+
+/–
9 0016 + Плевритная боль
+/–
—
+
Боль в горле10 910 900 +/–
—
Физические признаки
Поражение сердца
+/–
—
—
8 12 12 +/–
—
+/–
Кровохарканье
—
—
010 0103 910 Фарингит (неэкссудативный) +
+ 9 0023
—
Сыпь
+/–
—
—
—
—
Рентгенограмма грудной клетки
Пятнистый инфильтрат
Воронкообразный или ограниченный инфильтрат
9007 9002 9103 910 Результаты лабораторных анализов
Холодные агглютинины
+
—
—
Гипонатриемия
— 910 910
— 910 910
лейк оцитоз
+/–
—
+
Микроскопическая гематурия
—
— 23
— Повышение уровня трансаминаз
—
—
+
M.pneumoniae может быть связана с несколькими внелегочными проявлениями. Кожные проявления включают многоформную эритему, узловатую эритему, макулопапулезные и везикулярные высыпания и крапивницу. Неврологические нарушения включают асептический менингит, церебральную атаксию, энцефалит, синдром Гийена-Барре и поперечный миелит. Производство холодовых агглютининов может привести к гемолитической анемии, особенно при высоких титрах M. pneumoniae. Наконец, могут возникнуть такие осложнения, как миокардит, панкреатит, перикардит и полиартрит.
CHLAMYDIA PNEUMONIAE
Chlamydia pneumoniae — облигатный внутриклеточный организм, способный к стойкой латентной инфекции. Человек — единственный известный резервуар. Передача происходит в результате контакта с респираторными секретами с инкубационным периодом в несколько недель.
К 20 годам половина людей в Соединенных Штатах имеет определяемые уровни антител к C. pneumoniae.7 Антитела присутствуют у 75 процентов пожилых людей.7C. pneumoniae чаще встречается у пожилых пациентов с сопутствующими заболеваниями, чем у тех, кто в остальном здоров.8
Пациенты с инфекцией C. pneumoniae часто проявляют боль в горле, головную боль и кашель, который может сохраняться в течение нескольких месяцев, если лечение не было начато раньше. 9 Мокрота обычно скудная или отсутствует, и обычно присутствует субфебрильная температура. Рентгенограммы грудной клетки, как правило, показывают менее обширные инфильтраты, чем при других причинах пневмонии, хотя сообщалось о значительных инфильтратах.10
Большинство случаев инфекции C. pneumoniae протекают в легкой форме, но может развиться тяжелое заболевание, требующее госпитализации в отделение интенсивной терапии. .Смертность оценивается в 9 процентов, и смерть обычно связана с вторичной инфекцией и сопутствующим сопутствующим заболеванием2.
LEGIONELLA PNEUMOPHILA
Как и C. pneumoniae, виды Legionella являются внутриклеточными организмами. Legionella pneumophila является наиболее патогенным видом, и было идентифицировано несколько серотипов. Серотип 1 был связан с большинством зарегистрированных случаев пневмонии у людей, вызванной L. pneumonphila.11
Заражение происходит в результате контакта с легионеллами в окружающей среде.О передаче вируса от человека к человеку не сообщалось. Легионеллы чаще всего встречаются в пресноводных и искусственных водных системах. Патогены также можно найти во влажной почве, особенно возле ручьев и прудов. Искусственные системы для нагрева и охлаждения воды могут быть основными средами для распространения легионелл из-за таких условий, как температура от 32 ° C (89,6 ° F) до 45 ° C (113 ° F), застой воды и наличие отложений накипи и амеб.12 Конденсаторы, градирни, оборудование для респираторной терапии, душевые, водопроводные краны и водовороты были связаны со вспышками легионеллеза.13
Факторы риска развития легионеллеза включают ночевки вне дома, недавние работы по водопроводу, почечную или печеночную недостаточность, диабет, злокачественные новообразования и другие состояния, подрывающие иммунную систему. 14
Посмотреть / распечатать таблицу
ТАБЛИЦА 2
Эмпирические схемы приема антибиотиков для внебольничной пневмонии *
Амбулаторное лечение
Доксициклин (вибрамицин)
9102 910 Текин], левофлоксацин [Levaquin], моксифлоксацин [Avelox]) с повышенной активностью против Streptococcus pneumoniae
или
Макцинитромицин [азитромицин] [азитромицин] [азитромицин] [азитромицин]
Стационарное лечение
Пациент вне отделения интенсивной терапии
Цефалоспорин расширенного спектра действия (цефотаксим [Клафоран], цефтриаксон [роцефин]) плюс макролид
Только фторхинолон
Пациент в отделении интенсивной терапии
Цефотаксим или цефтриаксон плюс макролид
10 9102 Цефотаксим или цефтриаксон плюс фторхинолон
или
Бета-лактам (ампициллин-сульбам-1018, зульбактамперолактамин) 9 [унасина-цилла] [унасинабактам] 9 [унасинабактам]
или
Бета-лактам плюс фторхинолон
Прочие обстоятельства
Структурное заболевание легких, пиперацилмин, пиперациллин, пиперациллин, пиперациллин-агент [пиперациллин-пиперациллин] или цефепим [Максипим]) плюс фторхинолон (включая ципрофлоксацин в высоких дозах [Cipro])
Бета-лактамная аллергия: фторхинолон с клиндамицином или без него (Клеоцин)
8 2 2 2 9107 9107 : фторхинолон с клиндамицином, метронидазолом (Flagyl) или бета-лактамом или без него ТАБЛИЦА 2
Схемы эмпирических антибиотиков при внебольничной пневмонии *
Амбулаторное лечение
12 или
Фторхинолон (гатифлоксацин [Tequin], левофлоксацин [Levaquin], моксифлоксацин [Avelox]) с повышенной активностью против Streptococcus pneumoniae
0y 910 918 9102 9102 9102 910 910 910 910 910 910 910 918 910 [Зитромакс], кларитромицин [Биаксин], эритромицин) Стационарное лечение
Пациент не в отделении интенсивной терапии
споринспор цефтрифт расширенного спектра действия [Роцефин]) плюс макролид
или
Только фторхинолон
Пациент в отделении интенсивной терапии плюс макролид
9101 8
или
Цефотаксим или цефтриаксон плюс фторхинолон
или 103 9108 9107 9107 9107 9107
9101 9101 9101 9101 9101 9101 [Unasyn], пиперациллин-тазобактам [Zosyn]) плюс макролид или
Бета-лактам плюс фторхинолон 918 910 910 910 910 910 910 910 Другие условия
Структурное заболевание легких: антипсевдомонадный агент (пиперациллин [пипрацил], пиперациллин-тазобактам, карбапенем или цефепим [максипим]) плюс фторхинолон (в том числе ципрофлоксацин в высоких дозах [
03189
03 9307 9103 9307 9307 9102 9103 9102 9102 9102 9102])
Бета-лактамная аллергия: фторхинолон с клиндамицином или без него (Клеоцин) 900 23
Аспирационная пневмония: фторхинолон с клиндамицином, метронидазолом (Flagyl) или бета-лактамом или без него. от лихорадки до высокой температуры, измененного психического статуса и дыхательной недостаточности.15 Неспецифические симптомы могут проявляться на ранней стадии заболевания и включать головную боль, мышечные боли, анорексию и недомогание.15 Диарея и другие желудочно-кишечные симптомы присутствуют в 20-40% случаев.15 Лейкоцитоз является частым лабораторным обнаружением, и окраска мокроты по Граму часто показывает обилие воспалительных клеток без преобладания микроорганизмов.11
Среди случаев ВП с атипичными причинами, болезнь легионеров имеет наиболее тяжелое клиническое течение, и болезнь может становиться все более тяжелой, если инфекция не лечится надлежащим образом и на ранней стадии .Хотя внелегочные проявления встречаются редко, легионеллез является причиной миокардита, перикардита и эндокардита протезных клапанов, а также гломерулонефрита, панкреатита и перитонита.15 Когда ВП вызывается видами Legionella, уровень смертности составляет 14 процентов2
Терапия
Терапия пневмонии является эмпирической, потому что специфические патогены обычно не идентифицируются во время начала лечения. Несколько классов антибиотиков эффективны против атипичных патогенов.Однако, поскольку виды C. pneumoniae и Legionella являются внутриклеточными организмами, а M. pneumoniae не имеет клеточной стенки, бета-лактамы неэффективны.
Эритромицин и, в некоторых случаях, тетрациклин были традиционными препаратами для лечения пневмонии, вызванной атипичными патогенами. Есть несколько клинических испытаний (если таковые имеются), демонстрирующих эффективность эритромицина при инфекции Legionella. Однако эритромицин и тетрациклин эффективны против M. pneumoniae и, как было показано, сокращают продолжительность симптомов у C.pneumoniae.5,8
Новые макролиды, такие как азитромицин (Зитромакс) и кларитромицин (Биаксин), обладают хорошей активностью в отношении видов M. pneumoniae, C. pneumoniae и Legionella и, как правило, переносятся лучше, чем эритромицин.16–20 Доксициклин ( Vibramycin) также эффективен, 21 обычно вызывает меньше побочных эффектов со стороны желудочно-кишечного тракта и является менее дорогой альтернативой.
Фторхинолоны продемонстрировали отличную активность против M. pneumoniae, C. pneumoniae и видов Legionella.Кроме того, фторхинолоны имеют преимущество в виде дозирования один раз в день и превосходной биодоступности, независимо от того, вводятся ли они внутривенно или перорально. 22–25
Американское общество инфекционных болезней (IDSA) 26 опубликовало исчерпывающее, основанное на доказательствах руководство к применению ведение ВП у иммунокомпетентных взрослых. Рекомендации по эмпирическому лечению основаны на том, проходят ли пациенты амбулаторное или стационарное лечение (таблица 2) 26. Решение о госпитализации может приниматься в соответствии с правилом прогнозирования смертности, показанным на рисунке 1.27
Просмотреть / распечатать Рисунок
Определение риска смертности от внебольничной пневмонии
РИСУНОК 1
Правило прогноза для внебольничной пневмонии.
Информация от Файн MJ, Auble TE, Yealy DM, Hanusa BH, Weissfeld LA, Singer DE, et al. Правило прогноза для выявления пациентов с внебольничной пневмонией из группы низкого риска. N Engl J Med 1997; 336: 246–8.
Определение риска смертности при внебольничной пневмонии
РИСУНОК 1
Правило прогнозирования внебольничной пневмонии.
Информация от Файн MJ, Auble TE, Yealy DM, Hanusa BH, Weissfeld LA, Singer DE, et al. Правило прогноза для выявления пациентов с внебольничной пневмонией из группы низкого риска. N Engl J Med 1997; 336: 246–8.
Не нужно проводить посев крови перед началом амбулаторного лечения. Однако IDSA26 рекомендует проводить посев крови у госпитализированных пациентов, если это возможно, до введения антибиотиков. Этим пациентам также рекомендуется окрашивание мокроты по Граму и посев.Антибиотикотерапия должна быть начата в течение четырех часов после госпитализации.28
Проблемы с лечением
ОТКАЗ ОТ АМБУЛАТОРНОГО ВЕДЕНИЯ
Пациенты, получающие антибиотики, могут не вести амбулаторное лечение по ряду причин, таких как резистентность к антибиотикам, плохое соблюдение или непереносимость перорального приема. антибиотики, закупоривающие поражения (например, инородное тело, рак), эмпиема и неправильный диагноз26. В таблице 326,29 перечислены альтернативные диагнозы, которые могут имитировать ВП.
ПАРАПНЕВМОНИЧЕСКИЙ ЭФФУЗИЯ И ЭМПИЕМА
До 57 процентов пациентов с ВП имеют плевральный выпот на рентгенограммах грудной клетки.30 Эмпиема, определяемая как гной в плевральной полости, должна быть удалена с помощью дренажной трубки, катетера с визуализацией, торакоскопии или торакотомии.26 Даже если плевральная жидкость не содержит свободно текущего откровенного гноя, ее следует сливать, когда pH уровень ниже 7,2 или результат окрашивания по Граму положительный26. Некоторые эксперты рекомендуют дренировать любой парапневмонический выпот, размер которого на рентгенограмме бокового пролежня превышает 10 мм.30
ДЕТИ
Основанное на фактических данных руководство по ведению ВП при ВП kids, разработанная детской больницей, доступна онлайн.31 Пневмонию следует подозревать у ребенка с лихорадкой и тахипноэ. Поскольку заражение атипичным патогеном у детей в возрасте от двух месяцев до пяти лет маловероятно, рекомендуется лечение этих пациентов высокими дозами амоксициллина (от 80 до 90 мг на кг в день) в течение семи-десяти дней. Цефалоспорин или макролид рекомендуется тем, у кого аллергия на пенициллин. Макролиды рекомендуются для лечения ВП у детей старше пяти лет из-за повышенной вероятности инфицирования M.pneumoniae или C. pneumoniae у детей старшего возраста. Макролиды также покрывают S. pneumoniae.
Госпитализация должна рассматриваться для любого ребенка с ВП и необходима, если ребенку требуется кислородная или внутривенная терапия, или если соблюдение режима лечения или последующее наблюдение могут быть проблемой. Лечение макролидом и бета-лактамом (амоксициллин в высоких дозах или парентеральный цефтриаксон [роцефин]) следует рассматривать у детей с более тяжелой пневмонией. Дети, находящиеся на амбулаторном лечении, должны пройти повторное обследование в течение 24-72 часов.31
Посмотреть / распечатать таблицу
ТАБЛИЦА 3
Условия, которые могут имитировать внебольничную пневмонию
Синдром острого респираторного дистресс-синдрома
Ателектаз
Облитная пневмония
Синдром Черджа-Стросса
Коллагеновая сосудистая болезнь
Застойная сердечная недостаточность
Медикаментозное заболевание легких
03
10 03
10 Иариопатия легких Воспалительное заболевание легких
Интерстициальный пневмонит
Злокачественный плевральный выпот
Новообразование
Профессиональное заболевание 18
Легочная эмболия
Легочное кровотечение или инфаркт
Лучевой пневмонит
Саркоидоз
Саркоидоз
0 Мимическая внебольничная пневмония Синдром острого респираторного дистресс-синдрома
Ателектаз
Облитерирующий бронхиолит с организующейся пневмонией
9103 Васкулярный синдром 6
0 Стр. болезнь Застойная сердечная недостаточность
Медикаментозное заболевание легких
Идиопатический фиброз легких
Воспаление маторное заболевание легких
Интерстициальный пневмонит
Злокачественный плевральный выпот
Новообразование
Профессиональное заболевание легких 910
9102 910 910 910 910 910 Легочное кровотечение или инфаркт
Лучевой пневмонит
Саркоидоз
Гранулематоз Вегенера
У пожилых пациентов с респираторными симптомами
У пожилых пациентов с респираторными симптомами
могут быть симптомы респираторных заболеваний .Вместо этого у них может быть измененное психическое состояние или история падений.32 Пожилые пациенты также более склонны иметь серьезные сопутствующие заболевания, такие как хроническая обструктивная болезнь легких, застойная сердечная недостаточность или заболевание почек, и особенно восприимчивы к беззвучной аспирации. 32,33
Аспирационную пневмонию следует заподозрить у пациентов с состоянием, которое нарушает сознание или глотание, особенно если рентгенограмма грудной клетки показывает инфильтраты в зависимых сегментах легкого.Следует вводить антибиотики, эффективные против анаэробных организмов изо рта (Таблица 2) .26
Посмотреть / распечатать таблицу
ТАБЛИЦА 4
Критерии госпитализации пациентов с пневмонией в дома престарелых
Госпитализировать пациента, если двое или более из следующих присутствуют:
Частота дыхания> 30 вдохов в минуту или 10 вдохов выше исходного
Насыщение кислородом <90 процентов в воздухе помещения
Систолическое артериальное давление <90 мм рт. Ст. Или на 20 мм рт. Ст. Ниже исходного
Потребность в кислороде на 3 л в минуту выше исходного уровня
Неконтролируемая хроническая обструктивная болезнь легких, застойная сердечная недостаточность, или диабет
Если ранее были в сознании, не может быть разбужен
Новое или повышенное возбуждение
При наличии любого из вышеперечисленных, госпитализация также показана при отсутствии надлежащих физических и человеческих ресурсов (например,g., медперсонал, врач, кислород, аспирационное оборудование, доступ в лабораторию, внутривенные жидкости).
ТАБЛИЦА 4
Критерии госпитализации пациентов домов престарелых с пневмонией
Госпитализировать пациента, если присутствуют два или более из следующих:
Частота дыхания> 30 вдохов в минуту или 10 вдохов выше исходного
Насыщение кислородом <90 процентов в воздухе помещения
Систолическое артериальное давление <90 мм рт.ст. или на 20 мм рт.ст. ниже исходного уровня
Потребность в кислороде на 3 л в минуту больше, чем исходная
Неконтролируемая хроническая обструктивная болезнь легких, застойная сердечная недостаточность или диабет
Если ранее был в сознании, невозможно разбудить
8 12 012 Новая или усиленная агитация
При наличии любого из вышеперечисленных также указывается госпитализация, если надлежащие физические и человеческие ресурсы недоступны (например,g., медперсонал, врач, кислород, аспирационное оборудование, доступ в лабораторию, внутривенные жидкости).
ТАБЛИЦА 5
Рекомендации по лечению для жителей домов престарелых с внебольничной пневмониейПравообладатель не предоставил права на воспроизведение этого элемента на электронных носителях. Сведения об отсутствующем элементе см. В исходной печатной версии данной публикации.
Пневмония, полученная в доме престарелых, имеет высокий уровень заболеваемости и смертности (до 44 процентов).34 Это ведущее инфекционное заболевание, требующее перевода из дома престарелых в больницу.32 Рекомендации относительно того, когда следует госпитализировать, представлены в таблице 4.34. Рекомендуемые схемы лечения для пациентов в домах престарелых приведены в таблице 5.32
ИММУНОКОМПРОМИССИРОВАННЫЕ ПАЦИЕНТЫ
Рекомендации, приведенные в этой статье, предназначены для иммунокомпетентных пациентов. У пациентов с ослабленным иммунитетом может развиться пневмония от таких организмов, как Pneumocystis carinii, виды Candida и Aspergillus, а также от других условно-патогенных организмов, не рассмотренных в этой статье.
Стратегии профилактики
Несмотря на доказательства, свидетельствующие о том, что пневмококковая вакцина значительно снижает частоту возникновения пневмококковой пневмонии у лиц с иммунодефицитом, показатели иммунизации в лучшем случае невысоки.35 Вакцинация более вероятна, если ее рекомендует врач пациента или кто-то в больнице. кабинет врача.35 Хотя грипп не рассматривается в этой статье, он является важным фактором CAP; поэтому пациенты с риском ВП должны проходить ежегодную вакцинацию против гриппа.26 Кроме того, долгосрочная гигиена полости рта, по-видимому, снижает заболеваемость пневмонией среди пожилых людей, живущих в домах престарелых.36
АГЕНТЫ БИОТЕРРОРИЗМА, КОТОРЫЕ МОГУТ ВЫЗЫВАТЬ ПНЕВМОНИЮ
Некоторые организмы, которые могут использоваться в биологическом оружии, могут вызывать заболевания, проявляющиеся в виде CAP (Таблица 6) 26,37. Для врачей важно знать о потенциальной биотеррористической тактике и рисках, а также о связанных с этим потребностях здравоохранения. Информация о ответных мерах биотерроризма доступна на веб-сайте Американской академии семейных врачей (https: // www.aafp.org/btresponse.xml).
ВНЕЗАПНЫЙ ОСТРЫЙ ДЫХАТЕЛЬНЫЙ СИНДРОМ
Периодически эпидемиологическое расследование, вызванное вспышкой пневмонии, приводит к идентификации ранее нераспознанного организма26. Примером может служить внезапный острый респираторный синдром (ТОРС). SARS, который, как считается, возник в многоквартирном доме в Гонконге, вызван коронавирусом (SARS-CoV). Во время вспышки атипичной пневмонии с 2002 по 2003 год было зарегистрировано более 8000 вероятных случаев заболевания из 29 разных стран.В Соединенных Штатах было зарегистрировано 29 случаев заболевания.38
ТОРС проявляется продромальным периодом симптомов гриппоподобного заболевания (лихорадка, озноб, миалгии, головная боль, диарея), за которыми в течение двух-семи дней следует кашель, одышка и возможно, острый респираторный дистресс-синдром. 26,38 Летальность от SARS составляет около 9,6 процента38. В Соединенных Штатах не было случаев смерти, связанных с SARS.38 Информация о SARS и инструкции для путешественников доступны в Центрах болезней Веб-сайт по контролю и профилактике (http: // www.cdc.gov/sars/index.html).
Посмотреть / распечатать таблицу
ТАБЛИЦА 6
Агенты биотерроризма, которые могут вызвать пневмоноподобное заболевание
Болезнь Возбудитель Клинические особенности Дополнительные данные или диагностический ключ 00
Диагностика Продолжительность лечения Профилактика после заражения Сибирская язва
Bacillus anthracis
Лихорадка, недомогание, кашель, острый респираторный дистресс-синдром, шок
um Окраска по Граму непериферической крови, посев крови
Ципрофлоксацин (Cipro) или другой фторхинолон, доксициклин (вибрамицин) или пенициллин (если чувствительный)
60 дней
Ципрофлоксацин 60 дней, амоксициллин, амоксициллин, 60 дней
Чума
Yersinia pestis
Высокая температура, недомогание, кашель, кровянистая мокрота, шок
Кровянистая мокрота в течение 24 часов после начала
Грамотрицательные биполярные грамотрицательные бактерии и посев крови, мокроты, спинномозговой жидкости
Доксициклин или фторхинолон
10 дней
Доксициклин или фторхинолон в течение 7 дней
Tularemia
Tularemia
Tularemia 9102 910 916 Femina , прострация, кашель
Хестрадиограмма показывает очаговый инфильтрат, внутригрудную лимфаденопатию
Посев крови, мокроты, образца из глотки (высокий риск для лабораторного персонала)
Доксициклин
16 14 дней 910cline или тетрациклин на 14 дней Q Fever
Coxiella burnetii
Лихорадка, кашель, одышка, потеря веса, боль в груди
Минимально продуктивный кашель, неопределенная боль в груди или стеснение в груди
Посев крови , ПЦР, серология
Доксициклин, тетрациклин
от 5 до 7 дней
Тетрациклин или доксициклин в течение пяти дней, начиная с 8-го по 12-й день
Brucella10
910 910 Brucella10
910
Лихорадка, миалгии, кашель
Волнообразная лихорадка, костно-суставные симптомы
Культура крови, посев костного мозга, иммуноанализ, ПЦР (высокий риск для лабораторного персонала)
Доксициклин плюс рифампин (рифадин) стрептомицин
6 недель
Нет рекомендовано
ТАБЛИЦА 6
Агенты биотерроризма, которые могут вызвать пневмонию, похожую на болезнь
Болезнь Возбудитель Клинические признаки Дополнительные данные или диагностический ключ 1006 006 Диагностика
Профилактика после заражения Сибирская язва
Bacillus anthracis
Лихорадка, недомогание, кашель, острый респираторный дистресс-синдром, шок
Рентгенограмма расширенного средостения
на грудной клетке 910 кровь, посев крови Ципрофлоксацин (Cipro) или другой фторхинолон, доксициклин (вибрамицин) или пенициллин (при чувствительности)
60 дней
Ципрофлоксацин 60 дней
доксициллин 6018
0 910 910 910 910 910 910 910 910 910 910 910 910 9102 1 Чума
Yersinia pestis
Высокая температура, недомогание, кашель, кровянистая мокрота, шок
Кровянистая мокрота в течение 24 часов после начала
Грамотрицательная биполярная окраска кокрамкобактерий посев крови, мокроты, цереброспинальной жидкости
Доксициклин или фторхинолон
10 дней
Доксициклин или фторхинолон в течение 7 дней
Tularemia
Tularemia
Tularemia
910 прострация, кашель Хестрадиограмма показывает очаговый инфильтрат, внутригрудную лимфаденопатию
Посев крови, мокроты, образца из глотки (высокий риск для лабораторного персонала)
Доксициклин
14циллин 910 тетрациклин 14 дней
91 012
Q Fever
Coxiella burnetii
Лихорадка, кашель, одышка, потеря веса, боль в груди
Минимально продуктивный кашель, неопределенная боль в груди или стеснение в груди
Посев крови, ПЦР, серология
Доксициклин, тетрациклин
от 5 до 7 дней
Тетрациклин или доксициклин в течение пяти дней, начиная с 8-го дня по 12-й день
Brucelosis 10
910 910
Лихорадка, миалгии, кашель
Волнообразная лихорадка, костно-ассоциированные костно-суставные симптомы
Посев крови, посев костного мозга, иммуноанализ, ПЦР (высокий риск для лабораторного персонала)
Доксициклин плюс рифампин (Рифцинадин) или стрептомицин
6 недель
Не рекомендуется
Вакцина от пневмонии: что вы должны знать?
Цивилизации всегда были во власти болезней.Более 50 миллионов человек умерли из-за вспышки гриппа в 1918 году, а бубонная чума сократила население вдвое, где она нашла убежище.
Хоть и не так опасно, как пандемии, отправившие людей в отставку, но пневмония сделала свою долю проблем. Он живет с нами с незапамятных времен, по словам Гиппократа, это «болезнь, названная древними». Можно представить, насколько древним может быть что-то, если греческий врач 4 -го века до нашей эры называет это древним.В течение 19 -го -го века пневмония сделала туберкулез ведущей причиной смерти во всем мире, и поэтому люди того времени начали называть его «капитаном людей смерти». Должен сказать, какое классное название.
Сегодня, хотя пневмония по-прежнему поражает более 500 миллионов человек во всем мире, уничтожение в значительной степени обеспечивается вакцинами, такими как вакцины от Streptococcus pneumonia.
Пневмококковая пневмония
Причиной пневмококковой пневмонии является печально известная Streptococcus pneumonia. Из-за разрушительного воздействия. ученые выбрали этот штамм бактерий для большинства текущих программ вакцинации.
В Соединенных Штатах Америки этот клинический преступник госпитализировал почти 800 000 человек по обвинению в заболевании пневмококковой пневмонией. Иногда АТ проникает еще дальше и убивает в среднем 40 000 пациентов в Соединенных Штатах. На этом безумие этого штамма не заканчивается, поскольку он чаще всего поражает детей, подвергая их иммуногенную уязвимость многим заболеваниям.
В тяжелых случаях пневмонии, если инфекция распространяется бесконтрольно, она может вызвать тяжелые состояния, такие как:
- Бактериемия (распространение инфекции в кровотоке)
- Септицемия (распространение инфекции по организму)
В случае пневмококковой пневмонии количество случаев, которые прогрессируют до бактериемии, составляет почти 20%, что свидетельствует об инфекционном потенциале этого заболевания. Уровень смертности от пневмококковой пневмонии также выше (до пяти раз) по сравнению с уровнем смертности от пневмонии, вызванной небактериальными причинами, такими как вирусная пневмония.
Здоровый человек заражается пневмококковой инфекцией при контакте с выделениями дыхательной системы больного человека, например слюна, слизь или и то, и другое, содержащие инфекционные микроорганизмы.
Один из наиболее часто задаваемых вопросов врачей общей практики, «заразна ли пневмония?», Можно лучше понять, если мы знаем о процессе распространения пневмонии. Инфицированные люди действуют как резервуары в течение периода времени, когда у них проявляются симптомы, и многих дней после этого.Пациенты с симптомами пневмококковой инфекции переносят в носовой и ротовой полости жизнеспособные микроорганизмы, которые легко переносятся в атмосферу в виде аэрозольных капель.
Streptococcus Pneumoniae A и ассоциированные инфекции
Известно, что инфекции, вызванные возбудителями пневмококков, довольно распространены, включая вирусную пневмонию, отсюда их непостижимая распространенность. Как только инфекция диагностируется, пациенту проводится оперативный курс антимикробной терапии.Но даже эти действия оказались неэффективными для снижения уровня смертности от пневмококковой пневмонии. Это можно объяснить двумя объяснениями:
- Появление новых штаммов и вариантов бактерии.
- Развитие устойчивости бактерии к антибиотикам.
Обычно инфекции, вызываемые Streptococcus pneumoniae , не ограничиваются пневмококковой пневмонией, множество других инфекций также вызываются тем же возбудителем, а именно:
- Пневмония
- Менингит
- Бактериемия
- Средний отит (ОМ).
- Синусит
Еще одним важным фактором, позволившим этим патогенам взять верх над антибиотиками, в основном пенициллином, является развитие у них устойчивости. Этот интеллектуальный микробный процесс заставил ученых и производителей вакцин снова заняться чертежной доской, чтобы найти «развивающееся» решение этой проблемы.
Устойчивые штаммы
Первые признаки устойчивости к пенициллину были зарегистрированы в 1967 г. D. Hansman и M.M. Bullen, опубликованной в The Lancet, согласно которой штаммы пневмококков начали демонстрировать десенсибилизацию к пенициллину в виде более низкой чувствительности при введении антибиотиков.
С тех пор появилось множество штаммов пневмококков, которые не только демонстрируют разную степень устойчивости к пенициллину, но также и к нескольким классам антибиотиков, поэтому их называют новой проблемой для медицинского персонала во всем мире. Сегодня штаммы стрептококков, резистентных к пенициллину, быстро распространяются, о новых случаях сообщают из Европы, Африки и США.
Помимо пенициллина, устойчивые штаммы проявляют различные степени устойчивости среди многих других антибиотиков, а именно:
- Триметоприм-сульфаметоксазол.
- Рифампицин
- Клиндамицин
- Эритромицин
- Тетрациклин
- Хлорамфеникол и др.
Динамический характер пневмококковых штаммов был основной причиной развития лекарственной устойчивости у этого организма. Штаммы способствуют появлению устойчивых клонов, в которых гены, ассоциированные с устойчивостью, либо принимаются, либо прекращаются, что приводит к распространению генов устойчивости на другие штаммы организма.
Распространенность устойчивых штаммов
Хотя первый полностью устойчивый к пенициллину штамм был идентифицирован у взрослых, но дети более восприимчивы к нему, а также штамм с множественной лекарственной устойчивостью.
Следующие серогруппы Streptococcus pneumoniae до сих пор сохранили свойства устойчивости к пенициллину и множественной лекарственной устойчивости:
Удивительно, но все эти серотипы в основном участвуют в передаче и распространении различных пневмококковых заболеваний у детей.
Ниже приводится краткое описание различных типов прививок от пневмококка против пневмококковой пневмонии с точки зрения их плана действий и того, почему они не обладают качествами вакцины широкого спектра действия от пневмококковой пневмонии.
- Вакцины, конъюгированные с полисахаридными белками.
- Очищенные белковые вакцины.
- Комбинированные белковые вакцины.
- Стратегические вакцины, нацеленные на слизистую оболочку
Всем вышеупомянутым вакцинам не хватало средств контроля широкого спектра различных штаммов пневмонии, которых почти 23. Некоторые вакцины показали многообещающие результаты в лабораторных условиях, но отсутствуют клинические исследования с точки зрения их эффективности и долгосрочной профилактики. пневмококковых заболеваний, которые могут возникнуть у вакцинированного.
Идеальные реципиенты для пневмококковой вакцины
Хотя pneumoniae не различает, кого заражать, но, как и мы, показывает небольшую предвзятость по отношению к определенным группам. Согласно руководящим принципам прививок от пневмонии, выпущенным Национальной службой здравоохранения (NHS) Великобритании, младенцы и пожилые люди старше 65 лет должны быть вакцинированы, поскольку они очень восприимчивы. Помимо них, человеку (будь то ребенок или взрослый), который страдает длительным заболеванием, особенно в отношении сердца или почек, следует вводить пневмококковую вакцину, чтобы снизить риск надвигающейся пневмококковой инфекции в их.
Центры по контролю и профилактике заболеваний (CDC) США рекомендовали обязательную вакцинацию детей в возрасте до 2 лет, поскольку они более восприимчивы к пневмококковой инфекции. Также рекомендуется довериться практикующему врачу, с которым консультируется семья, чтобы получить наилучший медицинский совет в случае конкретного человека, который заразился пневмококковой инфекцией или подвергается риску заражения. .
Типы вакцины против пневмонии
Несмотря на то, что вакцина против пневмонии подверглась огромным исследованиям в течение определенного периода времени, на данный момент только два вакцины считаются безопасными для использования в целях вакцинации людей от возможной пневмококковой инфекции. Согласно данным, представленным NHS и CDC, для вакцинации рекомендуется использовать следующие вакцины:
Пневмококковая полисахаридная вакцина
Пневмококковая полисахаридная вакцина, также известная как PPSV23 или вакцина против пневмонии 23, использует мертвые микроорганизмы для тренировки иммунитета вакцинированного против патогена.В настоящее время эта вакцина продается с этикеткой «Пневмовакс».
PPSV23 делает вакцинированного иммунным против развивающегося менингита или бактериемии, вызванного штаммом S. pneumoniae , от которого человек был вакцинирован, кроме очевидной иммунизации против пневмонии
Поскольку эта вакцина состоит из мертвых микроорганизмов, что в отличие от старой концепции вакцинации, когда вакцина использовалась для содержания ослабленных или живых микроорганизмов, вероятность заражения человека в результате прививки минимальна, не говоря уже о заболевании.
Пневмококковая конъюгированная вакцина
Пневмококковая конъюгированная вакцина, также известная как вакцина PCV или вакцина против пневмонии 13, была разработана для обеспечения иммунитета вакцинированного против 13 различных штаммов Streptococcus pneumonia. Традиционно эта вакцина предназначалась для вакцинации младенцев и детей в возрасте до двух лет с целью тренировки их иммунной системы для предотвращения любой будущей инфекции, вызванной Streptococcus pneumonia. Согласно CDC и NHS, идеальный возраст вакцины против пневмонии для иммунизации ребенка составляет два месяца, поскольку к этому времени иммунная система полностью развита, чтобы реагировать на вакцину.
Прививка от пневмонии 13 (вакцина PCV) делает вакцинированного иммунным против развития менингита или бактериемии, вызванного штаммами S. pneumoniae . Однако основная функция вакцины против ПКВ — иммунизация против пневмонии. В 2011 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США одобрило использование этой конкретной вакцины для вакцинации людей старше 50 лет. В настоящее время эта вакцина доступна на рынке под торговой маркой Prevnar.Прививка от пневмонии Prevnar в настоящее время является частью программы вакцинации, инициированной NHS, известной как «Программа детской вакцинации», согласно которой вакцина вводится детям младше двух лет с целью предотвращения пневмонии у детей.
Как все работает
Ранее было установлено, что пневмококковая конъюгированная вакцина обеспечивает иммунитет против 13 штаммов Streptococcus pneumonia , а пневмококковая полисахаридная вакцина помогает организму выработать иммунитет против 23 штаммов этого же организма.Но возникает один вопрос; «Как эти вакцины на самом деле работают после прививки вакцинированной одной или обеими?»
И вакцина PCV, и PPV содержат возбудитель пневмококковых инфекций, то есть S. pneumonia в инактивированном или убитом состоянии. Смысл введения реального организма в целом или по частям состоит в том, чтобы укрепить иммунную систему вакцинируемого таким образом, чтобы он заранее продуцировал необходимые антитела против S. pneumonia .
Антитела — это защитные белки, вырабатываемые иммунной системой организма для борьбы с болезнетворными организмами и агентами, разрушая их или делая неспособными вызывать заболевание у человека.Если микроорганизм заражает человека, у которого в организме есть антитела против этого микроорганизма до заражения, это значительно снижает риск того, что этот человек заболеет в результате установленного заболевания.
На сегодняшний день выделено только 10 штаммов пневмококковых бактерий из почти 90 штаммов, вызывающих наиболее серьезные инфекции. Рекомендации NHS по пневмококковой вакцине предполагают, что вакцины против пневмококковой бактерии показывают свою эффективность примерно в 60% случаев.Сценарий, при котором сама вакцина вызывает заболевание, исключен из-за того, что вакцины включают мертвые, убитые или инактивированные микроорганизмы и их части.
Рекомендуемый график вакцинации
График прививок — это график, отображающий график прививок, которые либо рекомендуются, либо являются обязательными врачом. Частота применения пневмококковой вакцины варьируется в зависимости от различных доступных вакцин и региона, в котором они вводятся.Ниже приводится вакцинация и план последующих действий Национальной службы здравоохранения по вакцинации детей в возрасте до двух лет. В этом плане, составленном в соответствии с рекомендациями по пневмококковой вакцине, за первичной дозой прививки от пневмонии 13 следует последующая бустерная доза от пневмонии.
Возраст Вакцина Количество выстрелов 8 недель Вакцина против ПКВ (PCV13) 1 16 недель Вакцина против ПКВ (PCV13) 1 1 год Вакцина против ПКВ (PCV13) 1 В отличие от младенцев, схема вакцинации против пневмококковой вакцины для взрослых сравнительно проста и включает однократную прививку, достаточную для придания пожизненного иммунитета взрослым в возрасте 65 лет и старше.Прививки от пневмонии для пожилых людей не требуют последующей бустерной дозы от пневмонии. В случае взрослых, страдающих заболеванием, которое делает их иммунную систему склонной к ослаблению, рекомендуется пятилетняя вакцинация, которая достаточна для восстановления их способности бороться с пневмококковыми микроорганизмами и держать их в страхе.
Уровень успешности вакцин против пневмонии
Среди исследователей велись большие споры о том, сколько раз вакцина работает, а сколько — нет.Согласно фактам и цифрам, опубликованным CDC на их веб-сайте, вакцины против пневмококковых заболеваний работают отлично, если учитывать общую статистику, но, к сожалению, в случае отдельных пациентов они не могут предотвратить все случаи.
Согласно исследованиям дозировки пневмококковой конъюгированной вакцины (PCV13), одной дозы вакцины достаточно для предотвращения появления симптомов пневмококковых заболеваний у 8 из каждых 10 детей, которым была сделана прививка.Анализ 100 пациентов старше 65 лет, которым была сделана однократная прививка пневмококковой конъюгированной вакцины (PCV13), показывает, что 75% из них обладают защитой от всех видов пневмококковых заболеваний, а 5% защищены от заражения пневмококковой пневмонией.
Исследования, касающиеся пневмококковой полисахаридной вакцины, также известной как PPSV23, показывают, что на каждые 100 взрослых, которым была введена разовая доза пневмококковой полисахаридной вакцины, защита от пневмококковой инфекции наблюдалась у 50-85% группы.
Противопоказания к пневмококковой вакцине
Несмотря на указание CDC и NHS инициировать прививку вакцины некоторым людям, которые подвержены большему риску развития пневмококковых инфекций, оба органа упоминают некоторые противопоказания, в которых предпочтительно отложить прививку вакцины или прекратить ее. все вместе. Эти противопоказания объясняются ниже:
Беременность и после нее
Как правило, вакцинация вакциной от пневмонии во время беременности или в период грудного вскармливания не считается вредной для здоровья ребенка или матери.Обычной практикой было избегать вакцинации будущей матери или во время кормления грудью, чтобы избежать ненужной реакции, которая может нанести в равной мере вред матери или ребенку.
Врачи обычно просят матерей подождать, пока их беременность не закончится, чтобы сделать вакцинацию. В некоторых случаях, даже во время беременности, врач может порекомендовать прививку вакцины от пневмонии; учитывая обстоятельства, когда польза от вакцинации перевешивает риски возникновения реакции.
Пирексия
Наблюдать за здоровьем любого человека, подписывающегося на вакцинацию (включая детей и взрослых), является обычной практикой. В тех случаях, когда у пациентов проявляются признаки и симптомы легкой болезни, врачи обычно разрешают им сделать прививку вакциной.
В некоторых особых случаях, когда болезнь достигла серьезной стадии, когда лихорадка овладевает телом, врачи воздерживаются от прививки вакцины. В таких условиях перед прививкой вакцины рекомендуется дать спасть лихорадке.
Аллергические болезни
Аллергические реакции вызывают серьезную озабоченность, когда речь идет о здоровье вакцинированного сразу после прививки. Врачи советуют родителям сообщать о любых реакциях, которые ребенок мог испытать в прошлом при вакцинации другими вакцинами, чтобы они могли определить, вызовет ли вакцина от пневмонии реакцию или нет.
В случаях, когда у пациентов возникла анафилактическая реакция (тяжелая аллергическая реакция) сразу после прививки вакциной против пневмонии или любой другой вакциной, врачи предлагают вообще избегать вакцинации, поскольку более сильная анафилактическая реакция может привести к летальному исходу, если дело не обрабатывается должным образом.
Если после прививки возникает легкое воспаление в месте инъекции или легкая сыпь на любом другом участке кожи, то это безопасно, и пациенту не следует опасаться, поскольку это нормально при введении пневмококковой вакцины.
Можем ли мы рассчитывать на бесплатные вакцины для борьбы с пневмонией в слаборазвитых странах?
В конце 2016 года глобальная коалиция, известная как «Врачи без границ», отклонила предложение Pfizer предоставить бесплатную вакцину против пневмонии для борьбы с пневмонией в развивающихся странах.В развивающихся странах ситуация с пневмококковыми заболеваниями хуже. Во всем мире в этих странах от пневмонии умирает в общей сложности почти один миллион детей. На этой шариковой фигуре пневмококковые заболевания считаются самыми смертоносными заболеваниями детей.
На рынке доступны вакцины для вакцинации детей от пневмококковых заболеваний, производимые компаниями GlaxoSmithKline и Pfizer, но цена на эти вакцины очень высока, что делает их недоступными для всех жителей развивающихся стран.
Когда представители организации «Врачи без границ» пытались договориться о ценах на эти вакцины с компаниями-производителями, одна из них вместо этого предложила бесплатные вакцины в качестве пожертвований. После этого предложения главный операционный директор организации «Врачи без границ» отклонил это предложение, заявив, что «Предоставляя вакцину против пневмонии бесплатно, фармацевтические корпорации могут использовать это как оправдание того, почему цены остаются высокими для других, включая другие гуманитарные организации и развивающиеся страны, которые также не может позволить себе вакцину.”
Джейсон Коун, исполнительный директор коалиции, говорит, что предложение о бесплатной вакцинации — это не только краткосрочное решение надвигающейся проблемы высокой заболеваемости пневмококковой инфекцией на фоне стремительно растущих цен на вакцину, но и замедление роста цен на вакцину. усилия, предпринимаемые коалициями, такими как «Врачи без границ», с целью побудить правительство инициировать доступную программу вакцинации для всех жителей страны, подвергающихся высокому риску. Позиция «Врачей без границ» заключается в том, что фармацевтические гиганты, такие как Pfizer, должны снизить стоимость своей последней вакцинации против пневмонии до 5 долларов, чтобы сделать вакцинацию доступной для каждого ребенка на планете, которому необходимо пройти вакцинацию.
Обозреватель Anti-Vax отказывается от своих недавних взглядов
Доктор Даниэль Нейдес является главным операционным директором, а также медицинским директором в Cleveland Clinic Wellness Institute. 6 января -го года он опубликовал колонку в официальном блоге Cleveland Clinic Wellness Institute, в которой предположил, что вакцины приносят больше вреда, чем пользы. Он утверждал, что консерванты и адъюванты, входящие в состав вакцины, вызывают у потомства неврологические расстройства, такие как аутизм.Обзор колонки, опубликованной д-ром Нейдесом несколькими годами ранее, рассказывает совершенно другую историю. В обзоре он хвалит прививки от гриппа, которые он получил ранее, которые позволили ему пережить волну гриппа, которая переросла в эпидемию в 2009 году.
Представитель Кливлендского института здоровья клиники прокомментировал ситуацию, сказав, что колонка представляет собой размышления и замечания приглашенного обозревателя, а логотип клиники появляется во всех колонках, которые публикуются приглашенным обозревателем на официальном сайте. .Комментарий появился в результате негативной реакции со стороны научного и медицинского сообщества по всему миру, которые выступали за основанные на фактах сообщения в случае обвинений, которые связывают аутизм с тимеросалом.
Центры по контролю и профилактике заболеваний (CDC) признают присутствие тимеросала, глутамата натрия, формальдегида, яичного белка, антибиотиков и солей алюминия в вакцинах, разрешенных в США, но наличие всех этих добавок и консервантов оправдано одним или более функций, которые способствуют стабильности и эффективности вакцины.
Более раннее исследование, проведенное Полом А. Оффитом и Ритой К. Джуд, было опубликовано в томе 112 th Pediatrics. В ходе подробного исследования оба автора проанализировали количество добавок в вакцинах, функции добавок и токсическое количество добавок, которое должно присутствовать, чтобы оценить пагубные (негативные) эффекты у вакцинированного. Количество токсичных металлов и их солей, а также других компонентов необходимо увеличить в 1000 раз по сравнению с количеством, присутствующим в вакцинах, только тогда они станут токсичными для человека, чтобы усвоить их.
В конце концов, следует иметь в виду, что все испытания вакцин на животных и людях, которые проводились на данный момент, сделали их безвредными. Обычно наблюдаемые побочные эффекты вакцины против пневмонии носят умеренный характер и не представляют угрозы для здоровья человека, подвергающегося иммунизации от пневмонии.
Побочные реакции, которые наблюдались в некоторых случаях, представляют собой анафилактические реакции, которые, вероятно, связаны с присутствием в вакцинах желатина и яичных белков.Гиперчувствительность к любому другому компоненту вакцины до сих пор не подтверждена документально.
Вакцина, другие советы и многое другое
Пневмония — это легочная инфекция. Это не заразно, но часто вызывается инфекциями верхних дыхательных путей в носу и горле, которые могут быть заразными.
Пневмония может случиться с кем угодно и в любом возрасте. Младенцы в возрасте до 2 лет и взрослые старше 65 лет подвергаются более высокому риску. К другим факторам риска относятся:
- проживание в хосписе или учреждении
- с использованием аппарата ИВЛ
- частые госпитализации
- ослабленная иммунная система
- прогрессирующее заболевание легких, такое как ХОБЛ
- астма
- болезнь сердца
- курение сигареты
К людям с риском аспирационной пневмонии относятся те, кто:
- злоупотребляет алкоголем или рекреационными наркотиками
- имеет медицинские проблемы, влияющие на их рвотный рефлекс, такие как травма головного мозга или проблемы с глотанием
- выздоравливают после хирургических процедур, требующих анестезии
Аспирационная пневмония — это особый тип легочной инфекции, которая возникает в результате случайного вдыхания слюны, пищи, жидкости или рвоты в легкие.Это не заразно.
Прочтите, чтобы узнать больше о способах защиты от пневмонии.
Пневмония часто возникает в результате инфекции верхних дыхательных путей. Инфекции верхних дыхательных путей могут возникнуть в результате простуды или гриппа. Они вызываются микробами, такими как вирусы, грибки и бактерии. Микробы могут распространяться разными способами. К ним относятся:
- через контакт, например, рукопожатие или поцелуй
- по воздуху, чихание или кашель, не прикрывая рот или нос
- через поверхности, к которым прикасаются
- в больницах или медицинских учреждениях при контакте с медицинскими работниками поставщики или оборудование
Получение вакцины против пневмонии снижает, но не устраняет, риск заражения пневмонией.Существует два типа вакцин против пневмонии: пневмококковая конъюгированная вакцина (PCV13 или Prevnar 13) и пневмококковая полисахаридная вакцина (PPSV23 или Pneumovax23).
Пневмококковая конъюгированная вакцина защищает от 13 видов бактерий, вызывающих серьезные инфекции у детей и взрослых. ЦВС-13 является частью стандартного протокола вакцинации младенцев и проводится педиатром. Младенцам назначают серию из трех или четырех доз, начиная с 2-месячного возраста. Последняя доза назначается младенцам к 15 месяцам.
Взрослым в возрасте 65 лет и старше PCV13 вводится однократно. Ваш врач может порекомендовать ревакцинацию через 5-10 лет. Людям любого возраста, у которых есть факторы риска, такие как ослабленная иммунная система, также следует получить эту вакцину.
Пневмококковая полисахаридная вакцина — это однократная вакцина, защищающая от 23 видов бактерий. Не рекомендуется детям. PPSV23 рекомендуется взрослым старше 65 лет, которые уже получили вакцину против PCV13. Обычно это происходит примерно через год.
Люди в возрасте от 19 до 64 лет, которые курят или имеют заболевания, повышающие риск пневмонии, также должны получить эту вакцину. Людям, получившим PPSV23 в возрасте 65 лет, как правило, не требуется повторная вакцинация позже.
Предупреждения и побочные эффекты
Некоторым людям не следует делать прививку от пневмонии. В их число входят:
- человек, страдающих аллергией на вакцину или какой-либо ее ингредиент
- человека, у которого была аллергическая реакция на ЦВС7, бывшую версию вакцины против пневмонии
- беременные женщины
- люди, сильно простуженные , грипп или другое заболевание
Обе вакцины против пневмонии могут иметь некоторые побочные эффекты.К ним могут относиться:
- покраснение или припухлость в месте инъекции
- мышечные боли
- лихорадка
- озноб
Дети не должны получать вакцину от пневмонии и вакцину от гриппа одновременно. Это может увеличить риск возникновения судорог, связанных с лихорадкой.
Есть кое-что, что вы можете сделать вместо вакцины против пневмонии или в дополнение к ней. Здоровые привычки, которые помогают укрепить вашу иммунную систему, могут снизить риск заболевания пневмонией.Также может помочь хорошая гигиена. Вы можете сделать следующее:
- Избегайте курения.
- Часто мойте руки в теплой мыльной воде.
- Используйте дезинфицирующее средство для рук на спиртовой основе, если не можете мыть руки.
- По возможности избегайте контакта с больными людьми.
- Отдохни.
- Придерживайтесь здоровой диеты, включающей много фруктов, овощей, клетчатки и нежирного белка.
Хранение детей и младенцев вдали от людей, болеющих простудой или гриппом, может помочь снизить их риск.Кроме того, следите за тем, чтобы носики были чистыми и сухими, и научите ребенка чихать и кашлять в локоть, а не в руку. Это может помочь уменьшить распространение микробов среди других.
Если у вас уже есть простуда и вы обеспокоены тем, что она может перерасти в пневмонию, поговорите со своим врачом о возможных профилактических мерах. Другие советы:
- Обязательно достаточно отдыхайте, выздоравливая после простуды или другой болезни.
- Пейте много жидкости, чтобы устранить заложенность.
- Используйте увлажнитель.
- Принимайте добавки, такие как витамин С и цинк, чтобы укрепить вашу иммунную систему.
Советы по предотвращению послеоперационной пневмонии (пневмонии после операции) включают:
- упражнения для глубокого дыхания и кашля, которые вам проведет врач или медсестра. который включает антисептик, такой как хлоргексидин
- как можно дольше сидеть и ходить, как только вы сможете
Если у вас пневмония, вызванная бактериальной инфекцией, ваш врач пропишет вам антибиотики.Вам также могут потребоваться дыхательные процедуры или кислород в зависимости от ваших симптомов. Ваш врач примет решение на основе ваших симптомов.
Вам также может быть полезно принимать лекарства от кашля, если кашель мешает вам отдыхать. Однако кашель важен для того, чтобы помочь вашему организму вывести мокроту из легких.
Отдых и много жидкости помогут вам быстрее поправиться.
Пневмония — потенциально серьезное осложнение инфекции верхних дыхательных путей, распространяющееся на легкие.Это может быть вызвано различными микробами, включая вирусы и бактерии. Младенцам до 2 лет и взрослым старше 65 лет рекомендуется сделать прививку от пневмонии. Лица любого возраста, относящиеся к группе повышенного риска, также должны получить вакцину. Здоровые привычки и соблюдение правил гигиены могут снизить риск заболевания пневмонией.
Границы | Механизмы естественного иммунитета к Streptococcus pneumoniae
Введение
Streptococcus pneumoniae является основной причиной острого среднего отита, внебольничной пневмонии, бактериального сепсиса и менингита и, по оценкам, является причиной более 800 000 случаев смерти детей ежегодно (1). Штаммы S. pneumoniae , вызывающие инвазивные инфекции, окружены слоем полисахаридной капсулы, которая подавляет врожденный и адаптивный иммунный ответ на инфекцию (2). Капсула имеет различный биохимический состав и антигенную структуру между штаммами S. pneumoniae , что дает более 90 различных серотипов капсулы (3). Вакцины, специфичные для серотипа S. pneumoniae , были разработаны с использованием капсульного антигена, связанного с белком-носителем, называемых пневмококковыми конъюгированными вакцинами (PCV), и они очень эффективны против серотипов, включенных в вакцину (4–6).Тем не менее, по-прежнему сохраняется высокий уровень смертности и заболеваемости из-за инфекций, вызванных S. pneumoniae , из-за ограниченного охвата серотипом ПКВ, приводящего к серотипозаместительному заболеванию, и их высокой стоимости, ведущей к неполному использованию ПКВ при низком и среднем уровнях страны дохода. Кроме того, PCV менее эффективны для предотвращения пневмонии по сравнению с сепсисом и менингитом, несмотря на то, что пневмония вносит наибольший вклад в бремя болезни (1, 7, 8). Необходимы новые подходы для преодоления ограничений существующей PCV.Одним из способов определения новых профилактических стратегий могло бы стать определение механизмов естественного адаптивного иммунитета к S. pneumoniae , который затем можно было бы направить на повышение иммунитета против инфекции в группах высокого риска, таких как дети и пожилые люди. В этом обзоре мы обсудим доказательства естественного адаптивного иммунитета к S. pneumoniae и механизмы, с помощью которых это может быть опосредовано.
Клинические и эпидемиологические доказательства адаптивного иммунитета к S.пневмония
S. pneumoniae Колонизация носоглотки
В отличие от некоторых основных бактериальных респираторных патогенов, таких как Mycobacterium tuberculosis , S. pneumoniae также является широко распространенным комменсалом верхних дыхательных путей, особенно носоглотки, у человека. Колонизация носоглотки происходит в первые годы жизни и впоследствии неоднократно (9–11). Последовательные эпизоды колонизации различными штаммами пневмококков возникают у детей до 2 лет (9, 10), при этом точечная распространенность носоглоточного носительства оценивается в 27–65% среди младенцев.Распространенность этой колонизации снижается с возрастом до <10% во взрослой жизни (12–14) и даже ниже у пожилых людей (15). Это снижение колонизации, по-видимому, имеет многофакторный характер, одним из элементов которого может быть созревание иммунной системы с возрастом. Основной носоглоточный резервуар для распространения S. pneumoniae находится в детях, и, следовательно, вакцинация детей PCV (которая предотвращает колонизацию носоглотки) привела к значительному коллективному иммунитету против взрослых S.pneumoniae пневмония (12).
Эпидемиологические доказательства естественного приобретенного адаптивного иммунитета к S. pneumoniae
Субъекты с дефектами их адаптивного иммунного ответа более восприимчивы к инфекциям S. pneumoniae . Эти группы включают людей с генетическими или приобретенными дефектами продукции иммуноглобулинов, а также тех, у кого есть серьезные дефекты адаптивного иммунитета из-за трансплантации стволовых клеток или ВИЧ-инфекции (16–18). Кроме того, у субъектов с дефицитом классического пути активации комплемента значительно повышается частота пневмококковой септицемии, менингита и бактериальной пневмонии (19).Хотя это будет отражать ослабленный опосредованный комплементом врожденный иммунитет к S. pneumoniae (20), классический путь комплемента также жизненно важен для опосредованного антителами уничтожения S. pneumoniae (2) и, следовательно, восприимчивости субъектов с классическим путем. дефекты частично отражают ослабленный иммунитет, опосредованный антителами. Кроме того, частота инфицирования S. pneumoniae с возрастом имеет ярко выраженную U-образную кривую с самой высокой заболеваемостью у младенцев и пожилых людей (21), что свидетельствует о наличии адаптивного иммунного ответа на S.pneumoniae , которая улучшается у детей по мере взросления, а затем, возможно, ослабевает из-за старения иммунитета у пожилых. Частота сепсиса S. pneumoniae , связанного с пневмонией, также выше у младенцев, чем у взрослых, что указывает на то, что у взрослых иммунная система способна предотвратить распространение в кровь из легких. В целом эти эпидемиологические данные указывают на наличие значительного естественного адаптивного иммунитета, который помогает предотвратить инфекцию S. pneumoniae .Важно отметить, что частота инфицирования всеми серотипами падает одновременно (22), эпидемиологическое наблюдение, которое предполагает, что естественно приобретенная устойчивость к инфекциям S. pneumoniae опосредована независимыми от серотипа механизмами, а не антикапсулярными антителами.
Это свидетельство естественного приобретенного адаптивного иммунитета к S. pneumoniae приводит к вопросу о том, как он развился? Лишь небольшая часть людей подверглась воздействию S. pneumoniae во время инвазивных заболеваний, таких как сепсис и менингит, и хотя у гораздо большего числа людей будет эпизод S.pneumoniae pneumonia, это было бы с одним штаммом и капсульным серотипом. Напротив, почти все люди были подвержены воздействию S. pneumoniae через события носоглоточной колонизации несколько раз и многими различными штаммами. Следовательно, если у большинства (если не у всех) людей есть естественный серотип-независимый адаптивный иммунитет к S. pneumoniae , то это должно было произойти из-за колонизации, а не активного инфекционного заболевания.
Доказательства того, что S.pneumoniae Колонизация носоглотки — событие иммунизации
Данные, полученные во время естественного и экспериментального инфицирования человека и на мышах, теперь убедительно показали, что колонизация носоглотки S. pneumoniae действительно является иммунизирующим событием. Множественные продольные исследования сывороточных ответов антител у младенцев показывают развитие ответов антител на капсульные и белковые антигены S. pneumoniae в сыворотке и слюне после событий колонизации человека (11, 14, 23, 24).На мышиных моделях несколько авторов показали, что иммунные ответы, опосредованные антителами и Т-клетками, развиваются после события колонизации S. pneumoniae или воздействия антигенов S. pneumoniae в носоглотку (25–32). Кроме того, после успешной экспериментальной колонизации человека уже существующими антителами S. pneumoniae (33, 34) и S. pneumoniae -специфическим IL-17 крови и легких, продуцирующим CD4 + клеток памяти, увеличиваются (35). , обеспечивающие повышенный гуморальный и клеточный иммунитет.Эти данные подтверждают, что колонизация является иммунизацией, и это подтверждается данными младенцев, показывающими постепенное увеличение ответов антибелкового антигена IgG с возрастом и корреляцию между событиями колонизации и увеличением антикапсулярных антител для нескольких серотипов (11).
Механизмы естественной адаптивной иммунной защиты против S. pneumoniae Инфекция
Обсуждаемые выше данные демонстрируют, что у людей действительно развиваются естественные адаптивные иммунные ответы против S.pneumoniae в ответ на колонизацию носоглотки и что эти ответы, вероятно, будут защитными. Адаптивный ответ на колонизацию носоглотки S. pneumoniae включает приобретение антикапсулярных (14, 36, 37) и антибелковых антител (38-40), а также клеточных иммунных ответов CD4 + , направленных только на белковые антигены. (39, 41). Наблюдение за клеточными иммунными ответами CD4 + важно, поскольку ответы Th27 CD4 + являются обычным механизмом выведения патогенов на поверхности слизистых оболочек посредством быстрого рекрутирования нейтрофилов в место инфекции, улучшения функции эпителиального барьера и повышенной секреции антибактериальные пептиды (42, 43).Однако, чтобы эффективно использовать эти данные для разработки стратегий профилактики против S. pneumoniae , необходимо сделать еще один шаг и определить, какой из этих ответов действительно защищает от инфекций S. pneumoniae .
Все лицензированные пневмококковые вакцины используют полисахаридный капсульный антиген, а капсульные антитела против капсулы обладают высокой защитой от инфекции, вызванной этим серотипом (5, 44, 45). Как следствие, исторически в литературе также подчеркивалась роль антител против капсул как механизма естественного иммунитета против S.pneumoniae (46). Это подтверждается ранними данными, показывающими, что сыворотки от выживших после тяжелой болезни S. pneumoniae обеспечивали серотип-специфичную защиту при использовании в качестве пассивной терапии антителами (47–51). Однако, как упоминалось выше, эпидемиологические данные свидетельствуют о том, что естественный иммунитет имеет значительный серотип-независимый компонент. Анализ наборов данных из нескольких стран (например, США, Финляндии и Израиля) продемонстрировал снижение заболеваемости инвазивными заболеваниями с возрастом независимо от повышения уровней серотип-специфичных антител, предполагая другой механизм защиты, такой как приобретенный иммунитет к некапсулярным антигены или созревание неспецифических иммунных ответов (22).Теоретическое моделирование также показало, что только 30–60% снижения повторной колонизации обусловлено антикапсулярным иммунитетом, выработанным во время предыдущих событий колонизации (52). Данные на животных моделях показали, что антитела и, в последнее время, клеточно-опосредованные иммунные ответы, нацеленные на белок, а не на капсульные антигены, могут защитить от инфекций S. pneumoniae , обеспечивая доказательство принципа того, что эти независимые от капсульного антигена механизмы могут опосредовать приобретенный естественным образом иммунитет к S.pneumoniae у человека (25, 26, 38, 53). Какие белки доминируют в ответе антител человека на белковых антигенов S. pneumoniae , было недавно определено Краучером с использованием протеомного микрочипа, который отображает более 2000 потенциальных антигенов S. pneumoniae . Из них 208 имели значительные ответы IgG в сыворотке, полученной от 35 здоровых взрослых в США. Около половины этих антигенов были аллельными вариантами высоко вариабельных поверхностных белков PspA, PspC, ZmpA и ZmpB, экспрессируемых различными S.pneumoniae (54). Остальные белки, распознаваемые сывороткой человека, были более консервативными между штаммами и были обогащены мотивами для адгезии или деградации, метаболизма клеточной стенки или связывания растворенных веществ для транспорта. Эти результаты согласуются с предыдущим подходом к обратной вакцинологии скрининга, который идентифицировал белки, распознаваемые антителами в сыворотке крови человека, который идентифицировал белки PspC и PspA, а также PcsB и StkP (55). Имеются лишь ограниченные данные об идентификации S.pneumoniae , которые вызывают ответ клеток Th27 CD4 + , поскольку это технически сложно. Доступные данные были получены на мышах путем скрининга библиотеки экспрессии, содержащей> 96% предсказанного пневмококкового белка, и идентифицировали несколько белков (включая липопротеины-переносчики ABC), которые индуцируют ответы Th27 после воздействия целых пневмококков и очищенных белковых антигенов, с небольшим перекрытием между с антигенами белка, индуцирующего антитела (56).
В целом, данные исследований на людях и животных показывают, что колонизация индуцирует как антикапсульные, так и антибелковые ответы антител, а также, кроме того, клеточный иммунитет к белковым антигенам.Анатомия, ассоциированные иммунологические ткани и взаимодействия с растворимыми иммунными эффекторами в жидкости слизистой оболочки или в плазме различаются между общими анатомическими участками инфекции S. pneumoniae , создавая потенциальные различия в относительной эффективности различных иммунных эффекторов для контроля Инфекция S. pneumoniae между анатомическими участками. Отсюда следует обсуждение того, какие механизмы естественного адаптивного иммунитета защищают от S.pneumoniae делится на три репрезентативных очага инфекции; (i) носоглотка как участок слизистой оболочки, колонизированный S. pneumoniae ; (ii) кровь как очаг системной инвазивной инфекции; и (iii) легкие как глубокий очаг инфекции слизистой оболочки, тесно связанный с системным кровообращением, а также участок, ответственный за самое большое бремя тяжелых инфекций во всем мире. В целом, данные исследований на животных (в основном на мышах) могут четко определить защитные механизмы, но имеют более ограниченную полезность из-за потенциальных различий в иммунной функции между видами.Однако после раннего детства у всех людей было несколько эпизодов колонизации S. pneumoniae , каждый из которых будет стимулировать некоторую степень иммунного ответа, и эту фоновую ситуацию значительного предшествующего воздействия S. pneumoniae в течение многих лет трудно воспроизвести. в моделях мышей. Человеческие данные имеют прямое отношение к проблеме, но обычно возможно только предоставить потенциальные корреляции, а не прямые доказательства между конкретным иммунным эффектором и защитой от болезни.
Предотвращение последующей колонизации
Данные мыши
Играют ли антитела важную роль в контроле первичного эпизода колонизации носоглотки S. pneumoniae исследовали McCool и Weiser с использованием мышиных моделей инфекции и нокаутных штаммов мышей, влияющих на определенные аспекты опосредованного антителами иммунитета (38). Они создали мышиную модель колонизации у мышей xid , у которых наблюдается слабый ответ антител на полисахаридную капсулу.Клиренс S. pneumoniae из носоглотки был аналогичным у мышей xid по сравнению с мышами дикого типа. Эти результаты были подтверждены с использованием мышей uMT , у которых отсутствовали В-клетки и ответы антител, которые также все еще были способны устранить колонизацию носоглотки S. pneumoniae . Эти результаты демонстрируют, что ответы антител не способствуют устранению событий первичной колонизации, и были подтверждены другими исследованиями (57). Вместо этого защита от реколонизации была потеряна у мышей с дефицитом клеток CD4 + , что подчеркивает необходимость клеточного иммунитета, а не антител для защиты от реколонизации (58).Аналогичные данные были получены при интраназальном введении полисахарида клеточной стенки антигена S. pneumoniae , который ингибировал последующую колонизацию независимо от антител, но зависел от клеток CD4 + (29). Кроме того, эти авторы впервые подтвердили важную роль IL-17 в предотвращении колонизации, хотя точный механизм, с помощью которого этот цитокин обеспечивает защиту, не был определен. Вакцинация убитым неинкапсулированным S. pneumoniae также индуцировала иммунитет Th27 CD4 + , который предотвращал колонизацию носоглотки гетерологичным S.pneumoniae серотипа (27, 59).
Данные, полученные в результате этих исследований, указали на важную роль клеток CD4 + , а не антител для предотвращения второго эпизода колонизации S. pneumoniae , и это было подтверждено более подробным исследованием на мышах. Zhang et al. продемонстрировали, что устранение как начального, так и второго эпизода колонизации S. pneumoniae у взрослых мышей зависело от клеточных ответов, а не от гуморального иммунитета (58, 60).Клиренс начального эпизода колонизации включал рекрутирование моноцитов / макрофагов в просвет верхних дыхательных путей посредством TLR2-зависимого механизма, который требовал IL-17, секретирующего популяцию клеток CD4 + (57, 60). Для предотвращения второго эпизода колонизации также необходимы клетки IL-17 и CD4 + , что опосредовано быстрым привлечением нейтрофилов в носоглотку. Эти данные подтверждаются другими данными, показывающими, что клетки CD4 + и IL-17 необходимы для защиты от колонизации и опосредуют защитный эффект иммунизации цельноклеточными вакцинами против колонизации [28, 29, 31].
В целом, данные на мышах демонстрируют, что ответы Th27 на белковые антигены имеют решающее значение для контроля колонизации S. pneumoniae после предыдущего эпизода колонизации; Последующая работа идентифицировала несколько белковых антигенов, которые способны индуцировать опосредованный Th27 иммунитет, но неизвестно, являются ли эти антигены одинаковыми для разных штаммов S. pneumoniae (56). Эти данные не исключают потенциальной роли антител, индуцированных вакциной, для предотвращения колонизации после вакцинации, а вакцинация мышей белковыми антигенами вызывает защиту против S.pneumoniae (61, 62) и пассивная иммунизация антикапсулярными антителами предотвращают как колонизацию, так и передачу инфекции между однопометниками (63, 64).
Данные о человеке
Как обсуждалось выше, продольные исследования продемонстрировали, что антитела как к белковым, так и к капсульным антигенам развиваются после эпизодов колонизации S. pneumoniae . Как следствие, сыворотка взрослых содержит антитела к множеству капсульных серотипов S. pneumoniae и сотне или около того белковых антигенов (11, 54).Кроме того, различные исследования идентифицировали ответы Th27 CD4 + на S. pneumoniae в лимфоидной ткани (65, 66), бронхоальвеолярном лаваже (35) и крови (31, 35, 67). Доказательства того, какой из этих естественных иммунных механизмов может предотвратить колонизацию у людей, получить труднее. Впечатляющее снижение распространенности серотипа вакцины S. pneumoniae как носоглоточного комменсала в популяциях, вакцинированных PCV, демонстрирует, что высокие уровни антикапсулярных антител действительно предотвращают колонизацию (5–7).Недавние данные, полученные с использованием экспериментальной модели носительства пневмококка человека (EHPC) и модели на мышах, предполагают, что антикапсулярное антитело ингибирует установление колонизации серотип-специфической агглютинацией S. pneumoniae (63, 68). Неясно, достаточно ли более низких уровней антикапсулярных антител, вызванных естественной колонизацией, а не вакцинацией PCV, для предотвращения колонизации.
Наиболее важные данные об иммунных механизмах, предотвращающих колонизацию у людей, были получены с использованием модели EHPC.В этой экспериментальной модели инфицирования человека добровольцам вводят интраназально штамм серотипа 6B, что приводит к успешной носоглоточной колонизации примерно у половины субъектов (34). Предыдущая колонизация предотвратила повторное заселение тем же штаммом (34). В этой модели все набранные субъекты имели обнаруживаемые уровни IgG к антигенам S. pneumoniae до назофарингеального введения S. pneumoniae , но уровни антипневмококковых IgG не коррелировали с тем, была ли колонизация успешной или нет (34).Напротив, предыдущая модель EHPC предполагала, что антитела к поверхностному белку S. pneumoniae PspA коррелировали с предотвращением успешной колонизации, обеспечивая некоторые доказательства того, что антибелковые антитела могут предотвращать колонизацию (33). Воздействие штаммов серотипа 6B или 23F увеличивало антительный ответ на множественные белки S. pneumoniae (например, PspA, PspC, PsaA и PdB), с наибольшим увеличением у субъектов с положительным носительством (33, 34, 69). Системные антитела против капсул были обнаружены только у субъектов, у которых после заражения развилось носительство (34). S. pneumoniae -специфические IL-17, секретирующие CD4 + клеток, были обнаружены в легких до воздействия штамма 6B, но их количество увеличивалось в бронхоальвеолярной жидкости в 17 раз и в крови в 8 раз у добровольцев, у которых колонизация была успешной ( 35, 69). В целом эти данные подтверждают, что ранее существовавшие антитела и локальный клеточный иммунитет CD4 + к S. pneumoniae значительно усиливаются событиями колонизации, и что это, по-видимому, предотвращает повторную колонизацию, по крайней мере, на период в несколько месяцев.Однако данные не могут определить, какой из этих иммунных механизмов был важен для предотвращения повторной колонизации.
Профилактика S. pneumoniae Септицемия и менингит
Данные мыши
Данные
на мышах также ясно демонстрируют, что колонизация носоглотки способствует защите от инвазивных заболеваний, но в отличие от предотвращения колонизации это зависит от опосредованного антителами иммунитета, а не от клеток CD4 + . Cohen et al.показали, что предыдущий эпизод колонизации штаммом S. pneumoniae D39 обладал высокой защитой от последующей летальной инвазивной пневмонии, с основным эффектом предотвращения сепсиса (70). Мыши с обедненным CD4 + все еще были защищены от сепсиса, тогда как у мышей с дефицитом антител защиты не наблюдалось, а пассивный перенос сыворотки от колонизированных мышей иммунно-наивным мышам также защищал от септицемии S. Аналогичным образом, Bou Ghanem и др. обнаружили, что предыдущая колонизация защищала от S.pneumoniae пневмония с сепсисом, вызванным штаммом TIGR4, с наиболее сильным влиянием на колониеобразующие единицы крови (КОЕ) (71). Повторные эпизоды колонизации носоглотки у мышей с дефицитом антител не вызывали какой-либо защиты, тогда как защита сохранялась после истощения клеток CD4 + , и авторы предположили, что долгоживущие антитела, секретирующие клетки CD138 + , были ответственны за защитный эффект предшествующей колонизации. Эти данные, демонстрирующие важную роль антител, возможно, не удивительны, поскольку защита от сепсиса у мышей зависит от растворимых медиаторов, таких как комплемент и естественные и индуцированные антитела, работающие во взаимодействии с ретикулоэндотелиальной системой, особенно с селезенкой (72–74), а не CD4 + Th27 опосредованные механизмы.
Данные о человеке
На протяжении многих лет было общепринятым, что основным механизмом естественного иммунитета против инвазивного пневмококкового заболевания (ИПБ) были антикапсулярные антитела, генерируемые предыдущими эпизодами колонизации или инфекции (44, 48, 50). Однако эпидемиологические данные, о которых говорилось выше, постепенно ставили под угрозу это предположение. Совсем недавно экспериментальные данные Wilson et al. продемонстрировал, что антитело к белку, а не капсульный антиген является основным механизмом естественного иммунитета к S.pneumoniae сепсис и ИПД (75). Для этого авторы использовали внутривенный иммуноглобулин (ВВИГ), который используется для предотвращения инфекций у лиц с первичным дефицитом антител (76, 77). ВВИГ содержит объединенный IgG из плазмы примерно тысячи доноров, которые вряд ли были вакцинированы против S. pneumoniae из-за отсутствия факторов риска, и, следовательно, содержит репертуар естественных антител для популяции, от которой доноры получено.В IVIG были обнаружены антитела как к капсуле S. pneumoniae , так и к множественным белкам. Иммуноблоты против лизатов из различных штаммов пневмококков продемонстрировали высококонсервативный паттерн белковых мишеней, распознаваемых ВВИГ, включая основные поверхностные белки пневмококка, такие как холин-связывающие белки и липопротеины. Важно отметить, что опсонофагоцитоз S. pneumoniae был улучшен по сравнению с неинкапсулированными бактериями, но уменьшился, когда антикапсулярные антитела были истощены из препарата ВВИГ.ВВИГ обладал высокой защитой от септицемии S. pneumoniae на моделях мышей даже после истощения антикапсулярных антител. Эти данные демонстрируют высокий уровень естественных антител к антигенам белка S. pneumoniae в сыворотке взрослых, что способствует удалению бактерий во время сепсиса. Кроме того, пассивная вакцинация мышей сывороткой, полученной от субъектов EHPC человека, колонизированных штаммом серотипа 6B, обеспечивала защиту от штамма серотипа 2 D39 в модели пневмонии, в которой летальность обусловлена септицемией (34).Данные этих двух исследований обеспечивают прямое доказательство того, что антибелковые антитела являются важным механизмом естественного иммунитета к системной инфекции S. pneumoniae .
Профилактика S. pneumoniae Пневмония
Носоглотка представляет собой очаг инфекции слизистой оболочки, а сепсис — системный участок, тогда как наиболее частое очаг серьезной инфекции, легкие, представляет собой комбинацию этих двух. На ранних стадиях пневмонии инфекция ограничивается взаимодействиями с поверхностью слизистой оболочки, которые аналогичны тем, которые обнаруживаются в носоглотке.По мере развития инфекции происходит нарушение функции эпителиального / эндотелиального барьера и привлечение клеток к альвеолам, задействуя системные растворимые и опосредованные белыми клетками иммунные механизмы в альвеолах. Следовательно, как слизистые, так и системные механизмы адаптивного иммунитета потенциально могут играть роль в защите от пневмонии, вызванной S. pneumoniae .
Данные мыши
В нескольких исследованиях изучалась роль иммунитета, вызванного колонизацией, в защите от пневмонии на мышиных моделях.В мышиной модели бессимптомного носительства штамма D39 количество КОЕ, извлеченных из легких, было снижено по сравнению с контрольными мышами после инвазивного заражения летальной пневмонией, что позволяет предположить, что колонизация действительно улучшает местный иммунитет легких против пневмонии S. pneumoniae (26). Авторы также показали повышенные уровни IL-17A и CD4 + клеток в легких ранее колонизированных мышей, что указывает на потенциальную роль опосредованного Т-клетками иммунитета в предотвращении пневмонии.Эти данные были разработаны Wilson et al. с использованием неинвазивного штамма S. pneumoniae серотипа 19F, который вызывает только легочную инфекцию без сепсиса, чтобы можно было оценить иммунитет легких отдельно от защиты от системной инфекции (25). Предыдущая колонизация защищала от последующей пневмонии с заметным снижением КОЕ в легких. Дополнительные эксперименты продемонстрировали, что В-клетки, CD4 + и IL-17 необходимы для защиты от пневмонии S. pneumoniae , вызванной штаммом 19F.Эти результаты предполагают, что естественный защитный иммунитет к пневмонии S. pneumoniae требует комбинации как гуморального иммунитета, так и клеток Th27 CD4 + . Защита также требовала нейтрофилов, предположительно в качестве основного механизма уничтожения бактерий, и ранее колонизированные мыши, по-видимому, имели более быстрый приток нейтрофилов в легкие во время пневмонии S. pneumoniae , совместимой с улучшенным местным иммунитетом Th27 (58). После колонизации не было обнаружено никаких антикапсулярных ответов IgG.Это свидетельствует о том, что гуморальный компонент защиты от пневмонии требует вместо этого антибелковых антител, и в соответствии с предыдущими моделями колонизации мышей и людей (28, 31, 69) авторы обнаружили ответы антител на важные поверхностные белковые антигены PsaA, PhtD и PpmA. .
Две дополнительные статьи также продемонстрировали важную роль клеток Th27 CD4 + , индуцированных предшествующим воздействием S. pneumoniae , для защиты от последующих тяжелых S.pneumoniae пневмония (78, 79). В обеих этих статьях была замечена защита от пневмонии, вызванной другим капсульным серотипом, что свидетельствует о том, что она зависит от распознавания белковых антигенов. Smith et al. использовали предварительное воздействие S. pneumoniae через самоограничивающуюся инфекцию легких, а не колонизацию, и продемонстрировали, что защита была специфичной для S. pneumoniae и требовала введения живых, а не мертвых бактерий, предполагая необходимость размножения бактерий в дыхательных путях .Важно отметить, что они идентифицировали популяцию резидентных Т-клеток памяти в легких, которые опосредовали антиген-специфический иммунитет Th27 к S. pneumoniae и который был ограничен долей, ранее подвергавшейся воздействию S. pneumoniae . Еще неизвестно, достаточны ли небольшие количества бактерий, которые достигают легких из-за микроаспирации в результате «чистой» носоглоточной колонизации, для индукции этой популяции резидентных Т-клеток легочной ткани.
Данные о человеке
Повышенная частота инфекций легких у пациентов с дефицитом иммуноглобулина (16, 80), ВИЧ-инфекцией (81) или наследственными заболеваниями, влияющими на пути IL-17 [например, синдром hyperIgE (82)], действительно указывает на роль как антител, так и Th27. Клетки CD4 + для защиты от пневмонии S. pneumoniae как у людей, так и у мышей. Однако эти данные искажены наличием дополнительных иммунных эффектов для каждого состояния, причем даже дефицит иммуноглобулина приводит к функциональным нарушениям S.pneumoniae -специфические CD4 + клеток (83). Как упоминалось ранее, данные, полученные с использованием жидкости для бронхоальвеолярного лаважа, подтвердили, что в легких человека присутствуют уже существующие клетки CD4 + , которые продуцируют IL-17 (и часто TNF-альфа) при стимуляции S. pneumoniae (36). Авторы продемонстрировали, что IL-17 улучшает киллинг S. pneumoniae , опосредованный макрофагами или нейтрофилами (31), обеспечивая дополнительный механизм, с помощью которого IL-17 может способствовать иммунитету к внеклеточным бактериям.BALF также содержит антитела к белку S. pneumoniae и капсулярным антигенам (33, 34, 69). Следовательно, человеческие данные идентифицировали локальный легочный Th27 CD4 + и антитела, специфичные для S. pneumoniae , которые усиливаются носоглоточной колонизацией, что потенциально может способствовать легкому иммунитету к пневмонии, как было описано на моделях мышей. Однако дополнительная стадия определения того, какой из этих иммунных ответов на самом деле защищает от инфекции легких S. pneumoniae у человека, не является легким.
Значение данных о естественном иммунитете к S. pneumoniae
Как описано выше, исследования на мышах определили, как иммунитет, приобретенный естественным путем в результате предшествующей колонизации, может защитить от инфекций S. pneumoniae , и большая часть данных подкреплена эпидемиологическими и экспериментальными данными, полученными на людях. Эти механизмы суммированы на рисунке 1. В этом последнем разделе мы обсудим, как данные о естественной инфекции могут повлиять на стратегии вакцинации и наше понимание механизмов, лежащих в основе восприимчивости к S.pneumoniae в группах высокого риска.
Рисунок 1 . Краткое изложение того, что известно о механизмах естественного приобретенного (в отличие от индуцированного вакциной) адаптивного иммунитета к S. pneumoniae у мышей и людей в трех репрезентативных очагах инфекции: носоглотке, легких и крови. Ссылки, относящиеся к каждому утверждению, приведены ниже.
У детей события колонизации пневмококками происходят часто, и, как обсуждалось выше, это необходимо для развития иммунитета против S.пневмония . В зрелом возрасте показатели колонизации сильно снижаются (15, 36, 84), но данные модели EHPC ясно показывают, что событие колонизации по-прежнему стимулирует усиление ранее существовавших иммунных ответов (34, 35, 69). Следовательно, колонизация имеет значительные иммунные преимущества для хозяина, которые могут быть затронуты, если экология колонизации S. pneumoniae изменится. Многочисленные исследования действительно показали, что плановая вакцинация детей против вакцины против вируса гепатита C оказывает сильное воздействие на S.pneumoniae со значительно сниженной скоростью носительства серотипов, присутствующих в вакцине (5, 6). Однако параллельно наблюдалось увеличение колонизации невакцинными серотипами, которые, как сообщается, имеют более низкий потенциал инвазивного заболевания (85, 86), и это изменение экологии серотипа носительства в пользу или менее инвазивных серотипов также должно поддерживать положительные эффекты колонизации. о естественных механизмах иммунитета. Если более агрессивные превентивные стратегии уменьшат общее количество S.pneumoniae , то может наблюдаться снижение силы естественного иммунитета и потенциально парадоксальное увеличение риска инфицирования взрослых.
Данные о естественном иммунитете также должны помочь определить, почему определенные группы риска, такие как пожилые люди, пациенты с хроническими заболеваниями легких или ВИЧ-инфекция, очень восприимчивы к инфекциям S. pneumoniae . Исследования, проведенные как на мышах, так и на пациентах, выявили феномен старения иммунитета (87, 88), включая усиление исходного воспаления, которое, по-видимому, ухудшает развитие иммунитета против S.pneumoniae после колонизации (88, 89). У пожилых людей сниженная частота событий колонизации (15, 90) и сниженные уровни и активность В-клеток памяти IgM (91) также могут влиять на индуцированный колонизацией иммунитет к S. pneumoniae . Streptococcus pneumoniae -специфические ответы CD4 не регулируются ВИЧ-инфекцией (92), и они могут лежать в основе значительно повышенной восприимчивости ВИЧ-положительных субъектов к инфекциям, вызываемым S. pneumoniae .Необходимо четко определить, как возраст и сопутствующие заболевания влияют на приобретенные естественным путем адаптивные реакции, чтобы было более четкое понимание того, почему эти группы очень чувствительны к S. pneumoniae . Эффективные методы измерения силы антипротеина и клеточного иммунного ответа CD4 + на S. pneumoniae могут также значительно улучшить нашу способность измерять чувствительность к этому патогену, которая в настоящее время зависит только от измерения уровней антикапсулярных антител.
Признание того, что существует значительный элемент естественного адаптивного иммунитета к S. pneumoniae , также должно предоставить возможности для новых стратегий вакцинации для предотвращения инфекций S. pneumoniae . Во-первых, можно разработать стратегии, повышающие существующий естественный иммунитет, особенно у субъектов с высоким риском. Во-вторых, зная механизмы, необходимые для предотвращения конкретных заболеваний, таких как пневмония, они могут быть нацелены на новые вакцины, например, для индукции клеточного иммунитета, опосредованного CD4 + (в основном Th27).Более того, признание того факта, что белковые антигены у людей могут обеспечивать значительный иммунитет, должно стимулировать исследования вакцин, которые вызывают иммунные ответы на белковый антиген.
Сводка
В этом обзоре обсуждались индукция и механизмы естественного иммунного ответа на S. pneumoniae . Многочисленные доказательства, полученные в ходе экспериментов на животных и на людях, убедительно продемонстрировали, что колонизация носоглотки стимулирует значительный уровень естественного иммунитета к S.pneumoniae , который помогает предотвратить последующие события колонизации, а также системные и легочные инфекции. Механизмы, участвующие в предотвращении инфекции, зависят от анатомического участка, с акцентом на антитела во время системной инфекции и на клетки Th27 CD4 + для инфекции слизистой оболочки, причем пневмония, по-видимому, представляет собой комбинацию этих двух. В отличие от предыдущих предположений, антитела к белку, а также капсульные антигены играют важную роль. Дальнейшая работа необходима для определения того, какие белковые антигены являются наиболее важными для защитного иммунитета и существуют ли важные роли для других клеточных иммунных механизмов [e.g., Tregs, которые, как было показано, важны для врожденного иммунитета (93)], а также клетки Th27 CD4 + . В целом, эти результаты могут привести к гораздо лучшему пониманию того, почему определенные группы пациентов подвержены высокому риску заражения S. pneumoniae , и должны помочь улучшить будущие стратегии вакцинации.
Авторские взносы
ER-S, GE и JB внесли свой вклад в разработку рукописи. ER-S и JB внесли свой вклад в его критическую переработку и написали окончательную версию.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. O’Brien KL, Wolfson LJ, Watt JP, Henkle E, Deloria-Knoll M, McCall N, et al. Бремя болезней, вызываемых Streptococcus pneumoniae , у детей младше 5 лет: глобальные оценки. Ланцет. (2009) 374: 893–902.DOI: 10.1016 / S0140-6736 (09) 61204-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Hyams C, Camberlein E, Cohen JM, Bax K, Brown JS, Hyams C, et al. Капсула Streptococcus pneumoniae подавляет активность комплемента и фагоцитоз нейтрофилов с помощью множества механизмов. Infect Immun. (2010) 78: 704–15. DOI: 10.1128 / IAI.00881-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Bentley SD, Aanensen DM, Mavroidi A, Saunders D, Rabbinowitsch E, Collins M, et al.Генетический анализ капсульного биосинтетического локуса от всех 90 серотипов пневмококков. PLoS Genet. (2006) 2: e31. DOI: 10.1371 / journal.pgen.0020031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Смит П., Оберхольцер Д., Хайден-Смит С., Коорнхоф Х. Дж., Хиллеман М. Р., Смит П. и др. Защитная эффективность пневмококковых полисахаридных вакцин. JAMA. (1977) 238: 2613–6. DOI: 10.1001 / jama.1977.03280250039019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6.Уитни К.Г., Фарли М.М., Хадлер Дж., Харрисон Л.Х., Беннетт Н.М., Линфилд Р. и др. Снижение инвазивной пневмококковой инфекции после введения конъюгированной протеин-полисахаридной вакцины. N Engl J Med. (2003) 348: 1737–46. DOI: 10.1056 / NEJMoa022823
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Bonten MJ, Huijts SM, Bolkenbaas M, Webber C, Patterson S, Gault S и др. Конъюгированная полисахаридная вакцина против пневмококковой пневмонии у взрослых. N Engl J Med. (2015) 372: 1114–25. DOI: 10.1056 / NEJMoa1408544
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Хуссейн М., Мелегаро А., Пебоди Р.Г., Джордж Р., Эдмундс В.Дж., Талукдар Р. и др. Продольное домашнее исследование Streptococcus pneumoniae носоглотки в Великобритании. Epidemiol Infect. (2005) 133: 891–8. DOI: 10.1017 / S0950268805004012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Hill PC, Cheung YB, Akisanya A, Sankareh K, Lahai G, Greenwood BM, et al.Носоглоточное носительство Streptococcus pneumoniae у младенцев в Гамбии: продольное исследование. Clin Infect Dis. (2008) 46: 807–14. DOI: 10.1086 / 528688
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Тернер П., Тернер С., Грин Н., Эштон Л., Лве Э, Джанхот А. и др. Ответы сывороточных антител на колонизацию пневмококков в первые 2 года жизни: результаты продольного когортного исследования SE в Азии. Clin Microbiol Infect. (2013) 19: E551–8.DOI: 10.1111 / 1469-0691.12431
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Абдуллахи О., Карани А., Тигой С.К., Муго Д., Кунгу С., Ванджиру Е. и др. Распространенность и факторы риска пневмококковой колонизации носоглотки среди детей в районе Килифи, Кения. PLoS ONE. (2012) 7: e30787. DOI: 10.1371 / journal.pone.0030787
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Yahiaoui RY, den Heijer CDj, van Bijnen EM, Paget WJ, Pringle M, Goossens H, et al.Распространенность и устойчивость к антибиотикам комменсального Streptococcus pneumoniae в девяти европейских странах. Future Microbiol. (2016) 11: 737–44. DOI: 10.2217 / fmb-2015-0011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Голдблатт Д., Хуссейн М., Эндрюс Н., Эштон Л., Вирта С., Мелегаро А. и др. Ответы антител на носоглоточное носительство Streptococcus pneumoniae у взрослых: продольное домашнее исследование. J Infect Dis. (2005) 192: 387–93. DOI: 10.1086 / 431524
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Ридда И., Макинтайр С. Р., Линдли Р., Макинтайр П. Б., Браун М., Офтаде С. и др. Отсутствие пневмококкового носительства у госпитализированных лиц пожилого возраста. Вакцина. (2010) 28: 3902–4. DOI: 10.1016 / j.vaccine.2010.03.073
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Оксенхендлер Э., Жерар Л., Фиески К., Мальфеттс М., Муийо Г., Жоссо Р. и др.Инфекции у 252 пациентов с общим вариабельным иммунодефицитом. Clin Infect Dis. (2008) 46: 1547–54. DOI: 10.1086 / 587669
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Кумар Д., Хумар А., Плевнеши А., Сигал Д., Франке Н., Грин К. и др. Инвазивное пневмококковое заболевание у взрослых реципиентов трансплантатов гемопоэтических стволовых клеток: десятилетие проспективного популяционного наблюдения. Пересадка костного мозга. (2008) 41: 743–7. DOI: 10,1038 / sj.bmt.1705964
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Янофф Е.Н., Брейман Р.Ф., Дейли К.Л., Хоупвелл П.К., Янофф Е.Н. и др. Пневмококковая инфекция при ВИЧ-инфекции. Эпидемиологические, клинические и иммунологические перспективы. Ann Intern Med. (1992) 117: 314–24. DOI: 10.7326 / 0003-4819-117-4-314
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Jönsson G, Truedsson L, Sturfelt G, Oxelius VA, Braconier JH, Sjöholm AG, Jonsson G, et al.Наследственный дефицит C2 в Швеции: частые инвазивные инфекции, атеросклероз и ревматические заболевания. Медицина. (2005) 84: 23–34. DOI: 10.1097 / 01.md.0000152371.22747.1e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Юсте Дж., Сен А., Труэдссон Л., Йонссон Дж., Тай Л.С., Хьямс С. и др. Нарушение опсонизации с C3b и фагоцитоз Streptococcus pneumoniae в сыворотке от субъектов с дефектами классического пути комплемента. Infect Immun. (2008) 76: 3761–70. DOI: 10.1128 / IAI.00291-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Мелегаро А., Эдмундс В.Дж., Пебоди Р., Миллер Е., Джордж Р., Мелегаро А. и др. Текущее бремя пневмококковой инфекции в Англии и Уэльсе. J Infect. (2006) 52: 37–48. DOI: 10.1016 / j.jinf.2005.02.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Липсич М., Уитни К.Г., Зелл Э., Кайялайнен Т., Даган Р., Малли Р.Являются ли антикапсулярные антитела основным механизмом защиты от инвазивного пневмококкового заболевания? PLoS Med. (2005) 2: e15. DOI: 10.1371 / journal.pmed.0020015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Преваес С.М., ван Вамель В.Дж., де Фогель С.П., Винховен Р.Х., ван Гилс Э.Дж., ван Белкум А. и др. Колонизация носоглотки вызывает реакцию антител на стафилококковые и пневмококковые белки, которые не связаны со снижением риска последующего носительства. Infect Immun. (2012) 80: 2186–93. DOI: 10.1128 / IAI.00037-12
CrossRef Полный текст | Google Scholar
24. Simell B, Kilpi TM. Кайхти Х. Пневмококковое носительство и средний отит индуцируют у детей антитела к пневмококковым капсульным полисахаридам в слюне. J Infect Dis. (2002) 186: 1106–14. DOI: 10.1086 / 344235
CrossRef Полный текст | Google Scholar
25. Уилсон Р., Коэн Дж. М., Хосе Р. Дж., Де Фогель С., Баксендейл Н., Браун Дж. С., Уилсон Р. и др.Защита от инфекции легких Streptococcus pneumoniae после колонизации носоглотки требует как гуморального, так и клеточного иммунного ответа. Mucosal Immunol. (2015) 8: 627–39. DOI: 10,1038 / mi.2014.95
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Ричардс Л., Феррейра Д.М., Мияджи Э.Н., Эндрю П.В., Кадиоглу А., Ричардс Л. и др. Иммунизирующий эффект пневмококковой колонизации носоглотки; защита от будущей колонизации и смертельных инвазивных заболеваний. Иммунобиология. (2010) 215: 251–63. DOI: 10.1016 / j.imbio.2009.12.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.



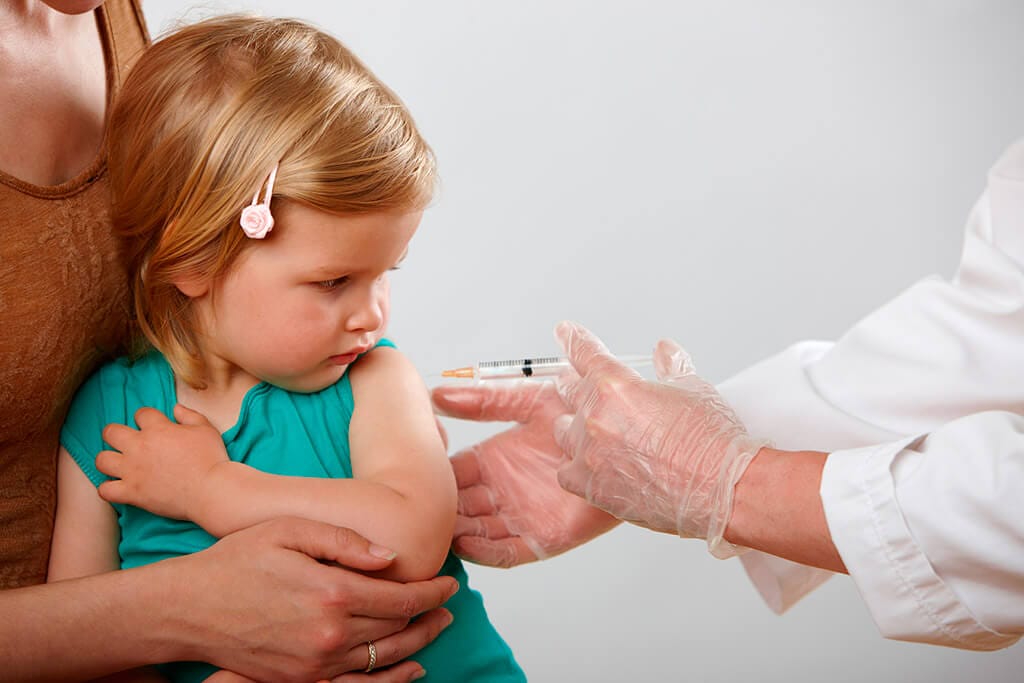 Для этого могут потребоваться дополнительные процедуры обследования: от анализа мочи до рентгенографии,
Для этого могут потребоваться дополнительные процедуры обследования: от анализа мочи до рентгенографии,
 Важно, чтобы отсутствовали любые признаки наличия вирусной или бактериальной инфекции, резкие изменения в поведении, нарушения психического состояния;
Важно, чтобы отсутствовали любые признаки наличия вирусной или бактериальной инфекции, резкие изменения в поведении, нарушения психического состояния; Не следует вводить новые неизвестные для него продукты;
Не следует вводить новые неизвестные для него продукты; Ревакцинация необходима в 2 года;
Ревакцинация необходима в 2 года;
 У маленьких детей часто наблюдается сонливость;
У маленьких детей часто наблюдается сонливость;


 У малышей и у взрослых в момент вакцинации не должно быть признаков недомогания, вирусной инфекции, простудных симптомов.
У малышей и у взрослых в момент вакцинации не должно быть признаков недомогания, вирусной инфекции, простудных симптомов. Это может спровоцировать угнетение иммунной системы, особенно в тех случаях, когда в организм малыша попадут незнакомые пищевые аллергены.
Это может спровоцировать угнетение иммунной системы, особенно в тех случаях, когда в организм малыша попадут незнакомые пищевые аллергены. При надавливании на область уплотнения взрослый ощущает резкую боль, малыш реагирует громким плачем.
При надавливании на область уплотнения взрослый ощущает резкую боль, малыш реагирует громким плачем.