Рак толстой кишки – не приговор, прогноз выживаемости после операции.
В настоящее время рак толстой кишки не является приговором. Победить болезнь и начать жить полноценной жизнью может даже тот, у кого диагноз рак толстой кишки на последней стадии. Важно своевременно выявить болезнь, распознать тревожные симптомы и начать лечение.
Толстая кишка — это конечная часть кишечника, имеющая длину примерно 2 метра. Состоит толстая кишка из таких отделов: ободочная восходящая, поперечная, нисходящая, сигмовидная, прямая кишка. Патология может возникнуть в любом отделе толстого кишечника. Ежегодно в мире диагностирую около полумиллиона новых случаев злокачественных новообразований в толстом кишечнике.
Учёные установили, что неправильное питание, образ жизни и наследственность больше всего способствуют образованию канцерогенов в кишечнике. При запорах канцерогены оказывают негативное действие на стенки кишечника. Из-за этого происходит перерождение «нормальных» клеток в раковые. Опасность рака заключается в том, что раковые клетки быстро делятся, разрастаясь в толстой кишке и соседних органах.
При запорах канцерогены оказывают негативное действие на стенки кишечника. Из-за этого происходит перерождение «нормальных» клеток в раковые. Опасность рака заключается в том, что раковые клетки быстро делятся, разрастаясь в толстой кишке и соседних органах.
Диагноз рак толстой кишки имеет многочисленные истории болезни, которые доказывают, что рак можно победить. Главное – вовремя обратиться к врачу, начать лечение и придерживаться рекомендаций, которые позволят поддерживать здоровье и долголетие.
Краткое описание и классификация стадий рака толстого кишечника
Выделяют четыре стадии рака:
1. Рак толстой кишки 1 стадия – локализуется в пределах толстого кишечника, в области слизистых и подслизистых оболочек. Размер опухоли небольшой – как узелок. При своевременном выявлении и химиотерапии прогноз максимально благоприятный, более 80 % пациентов исцеляются.
2. Рак толстой кишки 2 стадия характеризуется увеличением опухоли, но в стенку кишечника она ещё не прорастает. Несмотря на увеличение размеров опухоли при раке толстой кишки 2 стадии всё же прогноз является благоприятным для 70 % пациентов.
Несмотря на увеличение размеров опухоли при раке толстой кишки 2 стадии всё же прогноз является благоприятным для 70 % пациентов.
3. Рак толстой кишки 3 стадия, при котором выживаемость составляет 50 % из-за образования метастазов в конечной стадии. На этом этапе опухоль разрастается вглубь толстой кишки и растёт вовнутрь, закрывая просвет кишечника.
4. Рак толстой кишки 4 стадии имеет печальный прогноз – 15 % пациентов имеют шанс на выздоровление. На этом этапе опухоль имеет большие размеры, может разрастись не только в толстом кишечнике, но и затронуть ближайшие органы. Метастазы проникают в органы малого таза, печень, костную ткань, лёгкие. Шанс выжить появится только в случае проведения оперативного лечения и курса химиотерапии.
Явные и тайные симптомы рака толстой кишки
Диагностировать рак в начальной стадии очень сложно, так как опухоль не вызывает дискомфорта и не проявляется соответствующими признаками.
С ростом опухоли начинают появляться такие тревожные симптомы:
• ноющая боль в животе носящая тупой характер;
• длительный запор;
• болезненная дефекация;
• острая непроходимость кишечника;
• снижение веса;
• плохой аппетит;
• урчание в животе, метеоризм;
• субфебрильная температура;
• примеси крови и слизи в кале, нередко кровотечения;
• бледные кожные покровы;
• слабость;
• недомогание.
Рак толстой кишки описывает история болезни, которая включает несколько тревожных симптомов. Чтобы убедиться в правильности диагноза обязательно проведение обследования.
Что делать при подозрении на рак толстой кишки
Диагностика начинается с опроса и физических методов исследования – пальпации и перкуссии брюшной полости, пальцевого исследования прямой кишки. С помощью аппаратных исследований – колоноскопии и ирригоскопии, узи и томографии можно получить развёрнутую информацию о состоянии толстого кишечника, размерах и очагах новообразований. Лабораторные исследования включают в себя анализы крови, мочи, кала на копрограмму.
Методы лечения
Рак – это страшный диагноз, но его можно вылечить, избавив и очистив организм от новообразований. Вопрос методов и способов лечения, как и реабилитации, после оперативного вмешательства или курса химиотерапии зависит от того, какая степень рака у пациента.
В нашей клинике работают опытные онкологи, которые выберут наиболее эффективную схему лечения.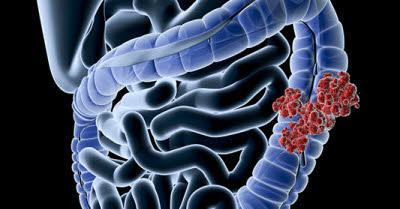
На первом и втором этапе, а также в начале третьего этапа заболевания эффективно хирургическое лечение. В этот период рак ещё не успел дать метастазы в другие органы, не успел разрастись до критических размеров. Хирург удаляет поражённые ткани толстого кишечника, а также находящиеся по соседству лимфатические узлы. При необходимости оперативное лечение сочетают с химиотерапией и лучевой терапией.
Новым направлением в лечении рака является молекулярно направленная или таргетная терапия. Эти препараты разрабатывают генные инженеры. Главный принцип действия таргетных лекарственных препаратов – узконаправленное действие на определенную функцию раковых клеток. К примеру, на деление и рост сосудов раковых клеток, выработку защитных антител в организме.
Особенности реабилитации
Восстановительный период является важным этапом в лечении рака. Организм должен восстановиться после операции и химиотерапии. В этот период важно следить за своим состоянием, чтобы не допустить рецидивов.
Важными факторами успешного лечения являются:
• соблюдение режима дня, бодрствования и сна;
• отсутствие нервных нагрузок и стрессов;
• отсутствие физических нагрузок;
• плановый приём витаминов, препаратов для поддержки иммунитета и восстановления организма после лечения;
• постоянное наблюдение у врача, сдача анализов, диагностика.
Рак толстой кишки требует изменить питание после операции. Пища должна быть богата витаминами, минералами и клетчаткой, что важно для перистальтики кишечника и формирования мягких каловых масс.
Диета при раке толстой кишки должна включать:
• свежие овощи – морковь, капусту, репу, редьку;
• фрукты – яблоки, цитрусовые;
• в ежедневном меню должно быть первое блюдо.
Те, кто перенесли рак толстой кишки, обязательно получат у доктора клинические рекомендации касательно дальнейшего наблюдения и периодичности осмотра у гастроэнтеролога и проктолога.
Бывают случаи, когда в результате операции на толстом кишечнике приходится выводить кишку наружу. Для этого хирурги формируют колостому – отверстие для вывода каловых масс в области брюшной стенки. Первое время это вызывает трудности как психологические, так и физические. Принятие такого способа жизни придёт постепенно, а наши специалисты помогут в реабилитации.
Рекомендации по организации питания в послеоперационный период
После операции перед пациентом стоит главная цель – делать всё возможное, чтобы на кишечнике быстрее зажили швы. Для этого нужно чтобы стул быть ежедневным, а каловые массы были мягкими.
Для этого важно придерживать реабилитационной программы по питанию:
1. В течение двух дней после операции нельзя кушать, так как в этот период происходит заживление послеоперационных швов;
2. Следующие четыре дня питание должно быть восьмиразовым, объём порции – не более 200 гр, температура должна быть от 35 до 40 С, консистенция блюд – желеобразная или жидкая. В меню должно быть кисель, желе, чай, кисель, чай.
В меню должно быть кисель, желе, чай, кисель, чай.
3. Следующие четыре дня кратность приёма пищи составляет шесть раз. Объём порции не более 400 гр. Консистенция блюд – жиркие и протёртые пюреобразные. Температура блюд до 40 С. В меню разрешают включать лёгкие бульоны, каши на воде, обязательно протёртые, суфле из мяса и рыбы, приготовленные на пару.
4. Последний этап длится две недели. Питание в течение дня делится на пять приёмов пищи. Пища должна быть максимально щадящей – протертой, полужидкой, тёплой. При приготовлении нужно придерживаться технологий приготовления на пару, отваривания и запекания без образования корочки. В меню добавляют отварные мясо и рыбу, паровой омлет, запечённые яблоки.
Важно употреблять достаточное количество жидкости – не менее 2,5 литра. Для того, чтобы слабительный эффект был мягким можно заменить употребление жидкости травяными чаями из корня крушины или корня ревеня.
Группа риска
Предупредить болезнь гораздо проще, чем лечить.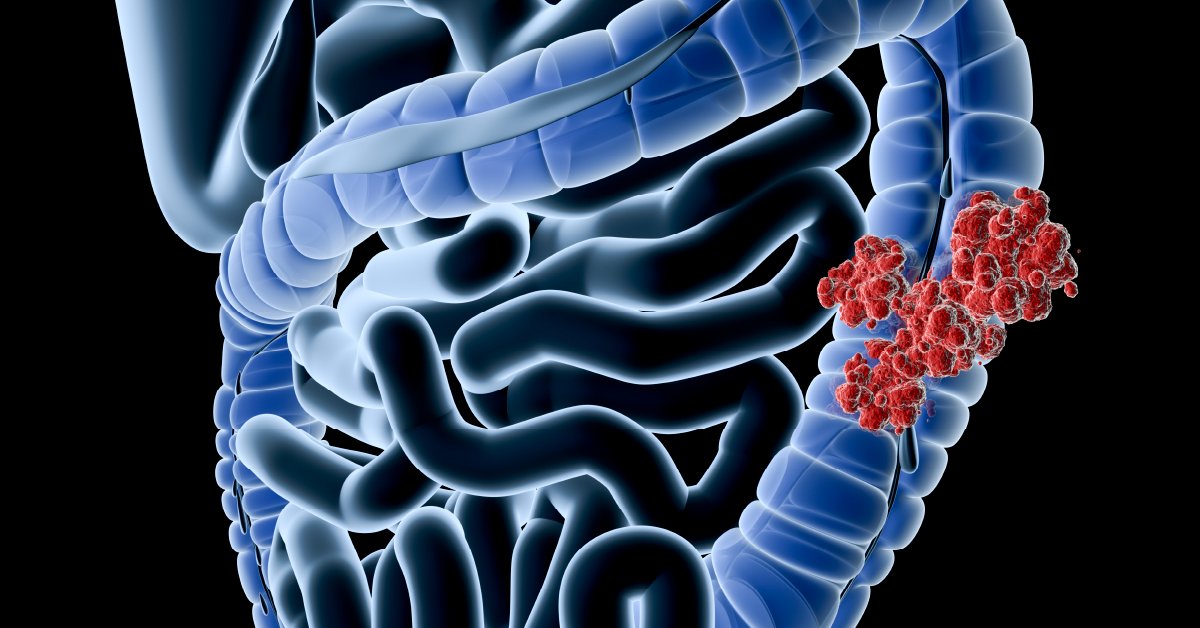
Рассмотрим наиболее весомые факторы, которые могут послужить толчком к развитию рака толстого кишечника:
1. Из медицинской практики известно, что колиты в области толстой кишки могут стать предвестниками рака.
2. Часто причиной рака могут стать полипы, которые вовремя не удалили.
3. Наследственность так же является предрасполагающим фактором для лиц, которые состоят в близком родстве с теми, у кого выявлен рак толстой кишки.
4. Чрезмерный приём белковой пищи, состоящей из мяса птицы, свинины и говядины.
5. Обильное употребление мучных изделий.
6. Рацион, скудный на клетчатку, которая содержится в овощах и фруктах.
7. Отсутствие физической активности, гиподинамия.
8. Злоупотребление алкоголем и курением.
9. Люди пожилого возраста.
Продолжительность жизни при раке толстой кишки
Рак толстой кишки имеет обнадёживающий прогноз выживаемости после операции. Так, после удаления поражённого участка толстой кишки, вероятность повторного развития раковых клеток возможна в срок – 5 лет.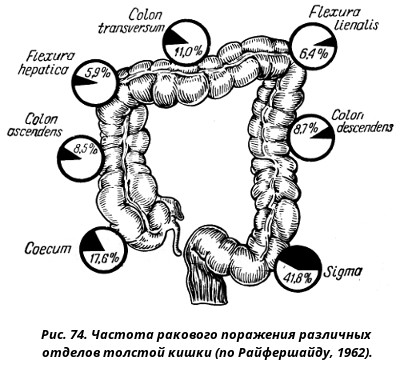 Это время является для многих шансом, который позволит сохранить жизнь, навсегда избавиться от недуга.
Это время является для многих шансом, который позволит сохранить жизнь, навсегда избавиться от недуга.
Если через 5 лет рецидива нет, значит, лечение проведено правильно, пациент и доктор справились с поставленной задачей!
Сказать сколько живут с раком толстой кишки сложно, всё зависит от того, когда у человека выявлен рак и как оперативно проведено лечение. Статистика печальна, только треть пациентов сможет исцелиться. Ясно одно, чем раньше выявят рак, тем больше шансов пролечиться и избавиться от недуга.
Где получить квалифицированную помощь
Среди множества государственных и частных клиник нужно выбрать ту, которой вы сможете доверить своё здоровье. Наша клиника – это команда профессионалов с большим опытом работы. Мы работаем по современным методикам, постоянно перенимаем опыт у зарубежных и отечественных коллег. Клиника обеспечена высокоточным оборудованием для диагностики и оперативного лечения.
Всем, у кого диагноз рак толстой кишки мы даём рекомендации по лечению, подготовке к операции, проведению химиотерапии и послеоперационному восстановительному периоду. Наши консультанты имеют большой опыт и помогут справиться с временными трудностями.
Наши консультанты имеют большой опыт и помогут справиться с временными трудностями.
Комфортные условия клиники, доброжелательный персонал и высокий профессионализм врачей помогут победить недуг и восстановить здоровье!
Роль кишечной микробиоты при иммунотерапии рака толстой кишки | Хакимова
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, JemalA. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65 (2):87-108.
2. Fearon ER. Molecular genetics of colorectal cancer. Ann Rev Pathol. 2011;6 (1):479-507.
3. Jafri SH, Mills G. Lifestyle modification in colorectal cancer patients: an integrative oncology approach. Future Oncol. 2013;9 (2):207-218.
4. Okugawa Y, Grady WM, Goel A. Epigenetic alterations in colorectal cancer: emerging biomarkers. Gastroenterology. 2015;149 (5):1204-1225.
Okugawa Y, Grady WM, Goel A. Epigenetic alterations in colorectal cancer: emerging biomarkers. Gastroenterology. 2015;149 (5):1204-1225.
5. Lasry A, Zinger A, Ben-Neriah Y. Inflammatory networks underlying colorectal cancer. Nat Immunol. 2016;17 (3):230-240.
6. O’Keefe SJ. Diet, microorganisms and their metabolites, and colon cancer. Nat Rev Gastroenterol Hepatol. 2016;13 (12):691-706.
7. Jess T, Simonsen J, Jcrgensen KT, Pedersen BV, Nielsen NM, Frisch M. Decreasing risk of colorectal cancer in patients with inflammatory bowel disease over 30 years. Gastroenterology. 2012;143 (2):375-381.
8. Jess T, Horvath-Puho E, Fallingborg J, Rasmussen HH, Jacobsen BA. Cancer risk in inflammatory bowel disease according to patient phenotype and treatment: a Danish population-based cohort study.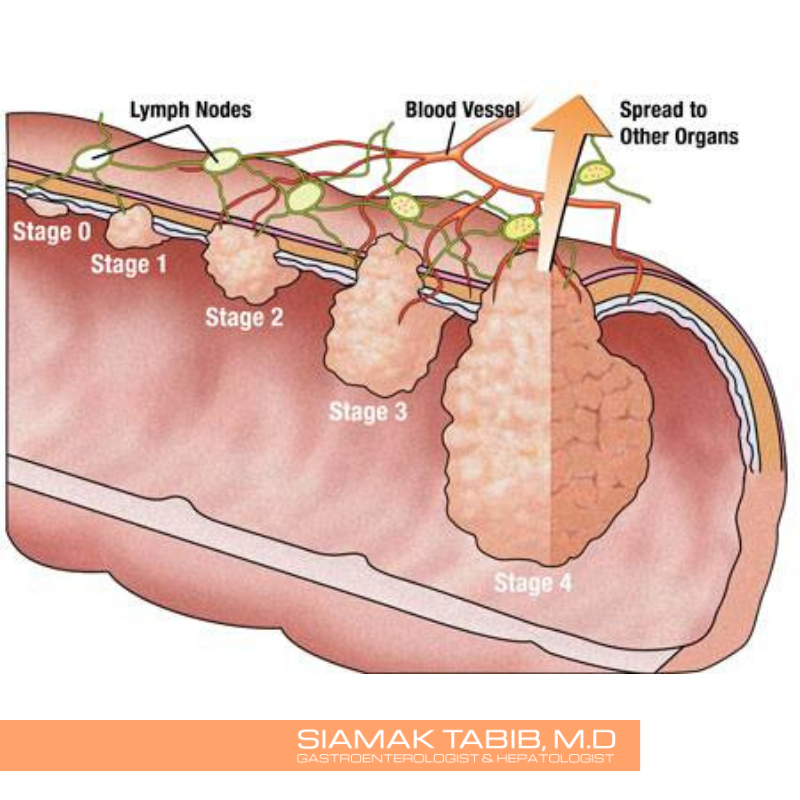 Am J Gastroenterol. 2013;108 (12):1869-1876.
Am J Gastroenterol. 2013;108 (12):1869-1876.
9. Johnson CM, Wei C, Ensor JE, et al. Meta-analyses of colorectal cancer risk factors. Cancer Causes Control. 2013;24 (6):1207-1222.
10. Farraye FA, Odze RD, Eaden J, Itzkowitz SH. AGA medical position statement on the diagnosis and management of colorectal neoplasia in inflammatory bowel disease. Gastroenterology. 2010;138 (2):738-745.
11. Lasry A, Zinger A, Ben-Neriah Y. Inflammatory networks underlying colorectal cancer. Nat Immunol. 2016;17 (3):230-240.
12. Johnson CM, Wei C, Ensor JE, et al. Meta-analyses of colorectal cancer risk factors. Cancer Causes Control. 2013;24 (6):1207-1222.
13. Kostic AD, Chun E, Meyerson M, Garrett WS. Microbes and inflammation in colorectal cancer. Cancer Immunol Res. 2013;1 (3):150-157.
Kostic AD, Chun E, Meyerson M, Garrett WS. Microbes and inflammation in colorectal cancer. Cancer Immunol Res. 2013;1 (3):150-157.
14. Bruner SD, Jobin C. Intestinal microbiota in inflammatory bowel disease and carcinogenesis: implication for therapeutics. Clin Pharmacol Ther. 2016;99 (6):585-587.
15. Ijssennagger N, van der Meer R, van Mil SWC. Sulfide as a mucus barrier-breaker in inflammatory bowel disease? Trends Mol Med. 2016; 22 (3):190-199.
16. Uronis JM, Muhlbauer M, Herfarth HH, Rubinas TC, Jones GS, Jobin C. Modulation of the intestinal microbiota alters colitis-associated colorectal cancer susceptibility. PLoS One. 2009;4 (6):e6026.
17. Li Y, Kundu P, Seow SW, et al. Gut microbiota accelerate tumor growth via c-jun and STAT3 phosphorylation in APC Min/ + mice. Carcinogenesis. 2012;33 (6):1231—1238.
Gut microbiota accelerate tumor growth via c-jun and STAT3 phosphorylation in APC Min/ + mice. Carcinogenesis. 2012;33 (6):1231—1238.
18. Васильев А.Н. Трансплантация фекальной микробиоты: возможные терапевтические подходы и вопросы правового регулирования / А.Н. Васильев, Д.В. Горячев, Е.В. Гавришина и др. // Биопрепараты. Рецензируемый научно-практический журнал. 2015. No 2 (54) С. 15-23.
19. Yu J, Feng Q, Wong SH, et al. Metagenomic analysis of faecal microbiome as a tool towards targeted non-invasive biomarkers for colorectal cancer. Gut. 2017;66 (1):70-78.
20. Crawford PA, Gordon JI. From the cover: microbial regulation of intestinal radiosensitivity. Proc Natl Acad Sci. 2005;102 (37): 13254-13259.
21. Yu T, Guo F, Yu Y, et al. Fusobacterium nucleatum promotes chemoresistance to colorectal cancer by modulating autophagy. Cell. 2017; 170 (3):548-563.
22. Vetizou M, Pitt JM, Daillere R, et al. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota. Science. 2015; 350 (6264):1079-1084.
23. Routy B, Le Chatelier E, Derosa L, et al. Gut microbiome influences efficacy of PD-1 based immunotherapy against epithelial tumors. Science. 2018;359 (6371):91-97.
24. Ahmed S, Johnson K, Ahmed O, Iqbal N. Advances in the management of colorectal cancer: from biology to treatment. Int J Colorectal Dis. 2014;29 (9):1031-1042.
25. Field K, Lipton L. Metastatic colorectal cancer-past, progress and future. World J Gastroenterol. 2007;13 (28):3806-3815.
26. Dejea CM, Wick EC, Hechenbleikner EM, et al. Microbiota organization is a distinct feature of proximal colorectal cancers. Proc Natl Acad Sci. 2014;111 (51):18321-18326.
27. Li S, Konstantinov SR, Smits R, Peppelenbosch MP. Bacterial biofilms in colorectal cancer initiation and progression. Trends Mol Med. 2017; 23 (1):18-30.
28. Sicard J-F, Le Bihan G, Vogeleer P, Jacques M, Harel J. Interactions of intestinal bacteria with components of the intestinal mucus. Front Cell Infect Microbiol. 2017 ;7:387.
29. Yu J, Feng Q, Wong SH, et al. Metagenomic analysis of faecal microbiome as a tool towards targeted non-invasive biomarkers for colorectal cancer. Gut. 2017;66 (1):70-78.
30. Nakatsu G, Li X, Zhou H, et al. Gut mucosal microbiome across stages of colorectal carcinogenesis. Nat Commun. 2015;6 (1):8727.
31. Huipeng W, Lifeng G, Chuang G, Jiaying Z, Yuankun C. The differences in colonic mucosal microbiota between normal individual and colon cancer patients by polymerase chain reaction-denaturing gradient gel electrophoresis. J Clin Gastroenterol. 2014;48 (2):138-144.
32. Warren RL, Freeman DJ, Pleasance S, et al. Co-occurrence of anaerobic bacteria in colorectal carcinomas. Microbiome. 2013;1 (1):16.
33. Wu N, Yang X, Zhang R, et al. Dysbiosis signature of fecal microbiota in colorectal cancer patients. Microb Ecol. 2013;66 (2):462-470.
34. Kahouli I, Tomaro-Duchesneau C, Prakash S. Probiotics in colorectal cancer (CRC) with emphasis on mechanisms of action and current perspectives. J Med Microbiol. 2013;62 (Pt_8):1107-1123.
35. Ito M, Kanno S, Nosho K, et al. Association of Fusobacterium nucleatum with clinical and molecular features in colorectal serrated pathway. Int J Cancer. 2015;137 (6):1258-1268.
36. Park CH, Han DS, Oh Y-H, Lee A-Reum, Lee Y-Ra, Eun CS. Role of Fusobacteria in the serrated pathway of colorectal carcinogenesis. Sci Rep. 2016;6 (1):25271.
37. Ye X, Wang R, Bhattacharya R, et al. Fusobacterium nucleatum subspecies Animalis influences proinflammatory cytokine expression and monocyte activation in human colorectal tumors. Cancer Prev Res. 2017;10 (7):398-409.
38. Nosho K, Sukawa Y, Adachi Y, et al. Association of Fusobacterium nucleatum with immunity and molecular alterations in colorectal cancer. World J Gastroenterol. 2016;22 (2):557-566.
39. de Vries NL, Swets M, Vahrmeijer AL, Hokland M, Kuppen PJ. The immunogenicity of colorectal cancer in relation to tumor development and treatment. Int J Mol Sci. 2016;17 (7):E1030.
40. Nishino M, Ramaiya NH, Hatabu H, Hodi FS. Monitoring immunecheckpoint blockade: response evaluation and biomarker development. Nat Rev Clin Oncol. 2017;14 (11):655—668.
41. Stewart CA, Metheny H, Iida N, et al. Interferon-dependent IL-10 production by Tregs limits tumor Th27 inflammation. J Clin Invest. 2013;123 (11):4859-4874.
42. Pang Y, Gara SK, Achyut BR, et al. TGF-P signaling in myeloid cells is required for tumor metastasis. Cancer Discov. 2013;3 (8):936-951.
43. Qian X, Chen H, Wu X, Hu L, Huang Q, Jin Y. Interleukin-17 acts as double-edged sword in anti-tumor immunity and tumorigenesis. Cytokine. 2017;89:34-44.
44. Pitt JM, Vetizou M, Waldschmitt N, et al. Fine-tuning cancer immunotherapy: optimizing the gut microbiome. Cancer Res. 2016; 76 (16):4602-4607.
45. West NR, Powrie F. Immunotherapy not working? Check your microbiota. Cancer Cell. 2015;28 (6):687-689.
46. Snyder A, Pamer E, Wolchok J. Immunotherapy. Could microbial therapy boost cancer immunotherapy? Science. 2015;350 (6264):1031-1032.
47. Tanaka A, Sakaguchi S. Regulatory T cells in cancer immunotherapy. Cell Res. 2017;27 (1):109-118.
48. Geis AL, Fan H, Wu X, et al. Regulatory T-cell response to entero-toxigenic Bacteroides fragilis colonization triggers IL17-dependent colon carcinogenesis. Cancer Discov. 2015;5 (10):1098-1109.
49. Viaud S, Saccheri F, Mignot G, et al. The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide. Science. 2013;342 (6161):971-976.
50. Baecher-Allan C, Viglietta V, Hafler DA. Human CD4+CD25+ regulatory T cells. Semin Immunol. 2004;16 (2):89-98.
51. Egen JG, Kuhns MS, Allison JP. CTLA-4: new insights into its biological function and use in tumor immunotherapy. Nat Immunol. 2002; 3 (7):611-618.
52. Vetizou M, Pitt JM, Daillere R, et al. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota. Science. 2015; 350 (6264):1079-1084.
53. Dubin K, Callahan MK, Ren B, et al. Intestinal microbiome analyses identify melanoma patients at risk for checkpoint-blockade-induced colitis. Nat Commun. 2016;7:10391.
54. Nishino M, Ramaiya NH, Hatabu H, Hodi FS. Monitoring immunecheckpoint blockade: response evaluation and biomarker development. Nat Rev Clin Oncol. 2017;14 (11):655-668.
55. Gopalakrishnan V, Spencer CN, Nezi L, et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science. 2018;359 (6371):97-103.
56. Sivan A, Corrales L, Hubert N, et al. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy. Science. 2015;350 (6264):1084-1089.
57. Matson V, Fessler J, Bao R, et al. The commensal microbiome is associated with anti-PD-1 efficacy in metastatic melanoma patients. Science. 2018;359 (6371):104-108.
58. Jin P, Wang K, Huang C, Nice EC. Mining the fecal proteome: from biomarkers to personalised medicine. Expert Rev Proteomics. 2017; 14 (5):445-459.
59. Ai L, Tian H, Chen Z, Chen H, Xu J, Fang JY. Systematic evaluation of supervised classifiers for fecal microbiota-based prediction of colorectal cancer. Oncotarget. 2017;8 (6):9546-9556.
60. Zhang MM, Cheng JQ, Xia L, et al. Monitoring intestinal microbiota profile: a promising method for the ultraearly detection of colorectal cancer. Med Hypotheses. 2011;76 (5):670-672.
61. Shah MS, Desantis TZ, Weinmaier T, et al. Leveraging sequencebased faecal microbial community survey data to identify a composite biomarker for colorectal cancer. Gut. 2018;67 (5):882-891.
62. Enq RR. How’s your microbiota? Let’s check your urine. Blood. 2015; 126 (14):1641-1642.
63. Ferreira RM, Pereira-Marques J, Pinto-Ribeiro I, et al. Gastric microbial community profiling reveals a dysbiotic cancer-associated microbiota. Gut. 2018;67 (2):226-236.
64. Panteli JT, Forkus BA, van Dessel N, Forbes NS. Genetically modified bacteria as a tool to detect microscopic solid tumor masses with triggered release of a recombinant biomarker. Integr Biol. 2015;7 (4):423-434.
65. Gardlik R, Fruehauf JH. Bacterial vectors and delivery systems in cancer therapy. IDrugs. 010;13(10):701-706.
ВЛИЯНИЕ НАЦИОНАЛЬНЫХ ПРОЕКТОВ В ОБЛАСТИ ОНКОЛОГИИ НА ВЫЖИВАЕМОСТЬ БОЛЬНЫХ РАКОМ ПРЯМОЙ КИШКИ: ПОПУЛЯЦИОННЫЙ АНАЛИЗ | Дубовиченко
1. GLOBOCAN 2018: estimated cancer incidence, mortality and prevalence worldwide in 2012 [accessed 03.11.2018]. Available at: http://gco.iarc.fr/today/online-analysis-pie
2. Winawer S, Classen M, Lambert R, Fried M. Colorectal cancer screening. URL: http://www.worldgastroenterology.org/assets/downloads/en/pdf/guidelines/06_colorectal_cancer_screening.pdf (ACCESSED 21.07.2018).
3. GLOBOCAN 2012: estimated cancer incidence, mortality and prevalence worldwide in 2012 [accessed 15.04.2017]. Available at: http://globocan.iarc.fr/Default.aspx
4. Murray SA, Grant E, Grant A, Kendall M. Dying from cancer in developed and developing countries: lessons from two qualitative interview studies of patients and their carers. BMJ. 2003 Feb 15;326 (7385):368.
5. Navarro M, Nicolas A, Ferrandez A, Lanas A. Colorectal cancer population screening programs worldwide in 2016: An update. World Journal of Gastroenterology. 2017;23 (20):3632–3642. DOI: 10.3748/wjg.v23.i20.3632
6. Saha AK, Smith KJ, Sue-Ling H, Sagar PM, Burke D, Finan PJ. Prognostic factors for survival after curative resection of Dukes’ B colonic cancer. Colorectal Dis. 2011 Dec;13 (12):1390–4. DOI: 10.1111/j.1463–1318.2010.02507.x
7. Laohavinij S, Maneechavakajorn J, Techatanol P. Prognostic factors for survival in colorectal cancer patients. J Med Assoc Thai. 2010 Oct;93 (10):1156–66.
8. Zhang S, Gao F, Luo J, Yang J. Prognostic factors in survival of colorectal cancer patients with synchronous liver metastasis. Colorectal Dis. 2010;12:754–761
9. Каприн А. Д., Старинский В. В., Петрова Г. В. Злокачественные новообразования в России в 2016 году (заболеваемость и смертность). М.: МНИОИ им. П. А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России. 2018. Доступно: http://www.oncology.ru/service/statistics/malignant_tumors/2016.pdf [дата обращения 28.07.2018].
10. Указ Президента РФ № 204 от 7.05.2018 г. «О национальных целях и стратегических задачах развития Российской Федерации на период до 2024 года» (Москва, Кремль, 7 мая 2018 г.). Доступно по: http://www.kremlin.ru/acts/bank/43027
11. Мерабишвили В. М. Злокачественные новообразования в Северо-Западном федеральном округе России (заболеваемость, смертность, контингенты, выживаемость больных). Экспресс-информация. Выпуск IV. Под ред. проф. А. М. Беляева. СПб., 2018, 444 с.
12. Дубовиченко Д. М., Вальков М. Ю., Карпунов А. А., Панкратьева А. Ю. Популяционная оценка динамики заболеваемости и стадийной структуры рака прямой кишки в условиях реализации мероприятий Национального проекта «Здоровье» и диспансеризации определенных групп взрослого населения в Архангельской области (итоги предварительного исследования). Исследования и практика в медицине. 2017;4 (3):23–32. DOI: 10.17709/2409–2231–2017–4-3–3
13. Allemani C, Coleman MP. Public health surveillance of cancer survival in the United States and worldwide: The contribution of the CONCORD programme. Cancer. 2017 Dec 15;123 Suppl 24:4977–4981. DOI: 10.1002/cncr.30854
14. Coleman MP. Cancer survival: global surveillance will stimulate health policy and improve equity. Lancet. 2014 Feb 8;383 (9916):564–73. DOI: 10.1016/S0140–6736 (13)62225–4
15. Allemani C, Matsuda T, Di Carlo V, Harewood R, Matz M, Nikšić M, et al. Global surveillance of trends in cancer survival 2000–14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet. 2018 Mar 17;391 (10125):1023–1075. DOI: 10.1016/S0140–6736 (17)33326–3
16. Moghimi-Dehkordi B, Safaee A, Zali MR. Comparison of colorectal and gastric cancer: survival and prognostic factors. Saudi J Gastroenterol. 2009 Jan;15 (1):18–23. DOI: 10.4103/1319–3767.43284.
17. Morris EJ, Sandin F, Lambert PC, Bray F, Klint A, Linklater K, et al. A population-based comparison of the survival of patients with colorectal cancer in England, Norway and Sweden between 1996 and 2004. Gut. 2011 Aug;60 (8):1087–93. DOI: 10.1136/gut.2010.229575.
18. Hoseini S, Moaddabshoar L, Hemati S, et al. An overview of clinical and pathological characteristics and survival rate of colorectal cancer in Iran. Ann Colorectal Res 2014;2: e17264.
19. Geiger TM, Ricciardi R. Screening Options and Recommendations for Colorectal Cancer. Clin Colon Rectal Surg. 2009 Nov;22 (4):209–17. DOI: 10.1055/s-0029–1242460
20. Doubeni CA, Weinmann S, Adams K, Kamineni A, Buist DS, Ash AS, et al Screening colonoscopy and risk of incident latestage colorectal cancer diagnosis in average-risk adults: a nested case-control study. Ann Intern Med. 2013 Mar 5;158 (5 Pt 1):312–20. DOI: 10.7326/0003–4819–158–5-201303050–00003.
21. Bretthauer M. Evidence for colorectal cancer screening. Best Pract Res Clin Gastroenterol. 2010 Aug;24 (4):417–25. DOI: 10.1016/j.bpg.2010.06.005.
22. El Zoghbi M, Cummings LC. New era of colorectal cancer screening. World J Gastrointest Endosc. 2016 Mar 10;8 (5):252–8. DOI: 10.4253/wjge.v8.i5.252
23. Levin TR, Corley DA, Jensen CD, Schonger JE, Quinn VP, Zauber AG, et al. Eff ects of Organized Colorectal Cancer Screening on Cancer Incidence and Mortality in a Large Community-Based Population. Gastroenterology. 2018 Nov;155 (5):1383–1391.e5. DOI: 10.1053/j.gastro.2018.07.017
24. Sormani MP. The Will Rogers phenomenon: the eff ect of diff erent diagnostic criteria. J Neurol Sci. 2009 Dec;287 Suppl 1: S46–9. DOI: 10.1016/S0022–510X (09)71300–0
25. Ng O, Watts E, Bull C, Morris R, Acheson A, Banerjea A. Colorectal cancer outcomes in patients aged over 85 years. Ann R Coll Surg Engl. 2016 Mar;98 (3):216–21. DOI: 10.1308/rcsann.2016.0085.
26. Millan M, Merino S, Caro A, Feliu F, Escuder J, Francesch T. Treatment of colorectal cancer in the elderly. World J Gastrointest Oncol. 2015 Oct 15;7 (10):204–20. DOI: 10.4251/wjgo.v7.i10.204.
Лечение рака толстой кишки (PDQ®) — версия для пациента
О PDQ
Запрос данных врача (PDQ) — это обширная база данных по раку Национального института рака (NCI). База данных PDQ содержит резюме последней опубликованной информации о профилактике, обнаружении, генетике, лечении, поддерживающей терапии, а также дополнительной и альтернативной медицине. Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке.Версии для пациентов написаны на понятном нетехническом языке. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке.
PDQ — это услуга NCI. NCI является частью Национальных институтов здравоохранения (NIH). NIH — это центр биомедицинских исследований при федеральном правительстве. Обзоры PDQ основаны на независимом обзоре медицинской литературы. Это не политические заявления NCI или NIH.
Цель этого обзора
В этом обзоре информации о раке PDQ содержится текущая информация о лечении рака толстой кишки.Он предназначен для информирования и помощи пациентам, семьям и лицам, осуществляющим уход. Он не дает официальных руководящих принципов или рекомендаций для принятия решений в отношении здравоохранения.
Рецензенты и обновления
Редакционные коллегии составляют сводки информации о раке PDQ и поддерживают их в актуальном состоянии. Эти советы состоят из экспертов в области лечения рака и других специальностей, связанных с раком. Резюме регулярно пересматриваются, и в них вносятся изменения при появлении новой информации. Дата в каждой сводке («Обновлено») — это дата самого последнего изменения.
Информация в этом обзоре пациентов была взята из версии для медицинских работников, которая регулярно проверяется и обновляется по мере необходимости редакционной коллегией PDQ по лечению взрослых.
Информация о клиническом испытании
Клиническое испытание — это исследование, призванное ответить на научный вопрос, например, лучше ли одно лечение, чем другое. Испытания основаны на прошлых исследованиях и на том, что было изучено в лаборатории. Каждое испытание отвечает на определенные научные вопросы, чтобы найти новые и более эффективные способы помощи больным раком.Во время клинических испытаний лечения собирается информация об эффектах нового лечения и о том, насколько хорошо оно работает. Если клинические испытания покажут, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным». Пациенты могут захотеть принять участие в клиническом исследовании. Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Клинические испытания можно найти в Интернете на сайте NCI. Для получения дополнительной информации позвоните в Информационную службу рака (CIS), контактный центр NCI, по телефону 1-800-4-CANCER (1-800-422-6237).
Разрешение на использование данного обзора
PDQ является зарегистрированным товарным знаком. Содержимое документов PDQ можно свободно использовать как текст. Его нельзя идентифицировать как сводную информацию о раке NCI PDQ, если не отображается вся сводка и не обновляется регулярно. Тем не менее, пользователю будет разрешено написать такое предложение, как «В сводке информации о раке PDQ NCI о профилактике рака груди указываются риски следующим образом: [включить выдержку из резюме]».
Лучше всего процитировать это резюме PDQ:
Редакционная коллегия PDQ® Adult Treatment.PDQ Лечение рака толстой кишки. Бетесда, Мэриленд: Национальный институт рака. Обновлено <ММ / ДД / ГГГГ>. Доступно по адресу: https://www.cancer.gov/types/colorectal/patient/colon-treatment-pdq. Дата обращения <ММ / ДД / ГГГГ>. [PMID: 26389319]
Изображения в этом обзоре используются с разрешения автора (ов), художника и / или издателя только для использования в обзорах PDQ. Если вы хотите использовать изображение из сводки PDQ и не используете всю сводку, вы должны получить разрешение от владельца. Он не может быть предоставлен Национальным институтом рака.Информацию об использовании изображений в этом обзоре, а также многих других изображений, связанных с раком, можно найти в Visuals Online. Visuals Online — это коллекция из более чем 3000 научных изображений.
Заявление об ограничении ответственности
Информация, содержащаяся в этих сводках, не должна использоваться для принятия решений о страховом возмещении. Более подробную информацию о страховом покрытии можно найти на сайте Cancer.gov на странице «Управление онкологическими услугами».
Свяжитесь с нами
Подробнее о том, как связаться с нами или получить помощь при раке.gov можно найти на нашей странице «Свяжитесь с нами для получения помощи». Вопросы также можно отправить на Cancer.gov через электронную почту веб-сайта.
Меняется ли прогноз колоректального рака в зависимости от локализации опухоли?
Gastroenterol Hepatol Bed Bench. 2011 Осень; 4 (4): 199–209.
, 1 , 2 , 3 , 3 и 4
Мохамад Асгари Джафарабади
1 Национальный центр управления общественным здравоохранением (NPMC) и Департамент статистики и эпидемиологии Школы здравоохранения и питания, Тебризский университет медицинских наук, Тебриз, Иран
Сейед Моменех Мохаммади
2 Больница Имама Хомейни, Тебризский университет медицинских наук, Тебриз, Иран
Эбрахим Хаджизаде
3 Кафедра биостатистики, Школа Медицинские науки, Университет Тарбиат Модаррес, Тегеран, Иран
Аноширван Каземнеджад
3 Кафедра биостатистики, Школа медицинских наук, Университет Тарбиат Модаррес, Тегеран, Иран
Сейед Реза Фатеми
4 Медицинский университет Шахида Бехешти Наук, Тегеран, Иран
1 Национальный центр управления общественным здравоохранением (NPMC ) и Департамент статистики и эпидемиологии Школы здоровья и питания Тебризского университета медицинских наук, Тебриз, Иран
2 Больница Имама Хомейни, Тебризский университет медицинских наук, Тебриз, Иран
3 Департамент биостатистики, Школа медицинских наук, Университет Тарбиат Модаррес, Тегеран, Иран
4 Университет медицинских наук Шахида Бехешти, Тегеран, Иран
Автор, ответственный за переписку. Перепечатка или переписка: Мохамад Асгари Джафарабади, доктор философии, Национальный центр управления общественным здравоохранением (NPMC) и Департамент статистики и эпидемиологии, Школа здоровья и питания, Тебризский университет медицинских наук, Тебриз, Иран. Эл. Почта: [email protected]
Поступила 25 июня 2011 г .; Принято 18 августа 2011 г.
Copyright © 2011 Научно-исследовательский институт гастроэнтерологии и заболеваний печени
Эта работа находится под лицензией Creative Commons Attribution-NonCommercial 3.0 Непортированная лицензия, которая позволяет пользователям читать, копировать, распространять и создавать производные работы в некоммерческих целях из материала при условии правильного цитирования автора оригинальной работы.
Эта статья цитируется в других статьях в PMC.
Abstract
Aim
Целью данного исследования было сравнение прогностических факторов рака прямой и толстой кишки.
Предпосылки
Прогноз колоректального рака (CRC) может зависеть от анатомической локализации.
Пациенты и методы
Всего в исследование были включены 1219 пациентов с диагнозом КРР согласно отчету о патологии онкологического регистра RCGLD с 1 января 2002 г. по 1 октября 2007 г. Демографические и клинико-патологические факторы были проанализированы с помощью анализа выживаемости.
Результаты
С момента постановки диагноза рак толстой кишки имел значительно лучшую выживаемость, чем рак прямой кишки (многомерный коэффициент риска (MVHR) = 0,24; 95% доверительный интервал (ДИ) = (0,074-0.77)). Другие факторы, включая семейное положение (MVHR = 1,78; 95% CI = (0,33-9,62)), индекс массы тела (BMI) (MVHR = 1,21 и 1,54; 95% CI = (0,33-4,85) и (0,44- 5.4) соответственно для групп с ИМТ <18,5 и> 30), патологической стадии (MVHR = 0,64; 95% ДИ = (0,21-1,98)) и алкогольного анамнеза (MVHR = 4,86; 95% ДИ = (67-35,14) ) существенно не различались между двумя группами пациентов, но предполагали возможное влияние на прогноз. Общая выживаемость в прямой кишке была лучше, чем в толстой кишке.
Заключение
Наши результаты подтверждают эту гипотезу о том, что прогноз CRC зависит от локализации опухоли.
Ключевые слова: Факторы прогноза, Колоректальный рак, Анализ выживаемости
Введение
Во всем мире колоректальный рак (КРР) является третьим по распространенности злокачественным новообразованием (1) и пятым и третьим по распространенности раком у мужчин и женщин в Иране. (2). Во всем мире показатели CRC растут (2–11). В Иране наблюдается резкий рост CRC, особенно у молодых пациентов (12–14 лет), и это сделало CRC важной проблемой общественного здравоохранения в нашей стране.
Факторы, которые, как известно, предрасполагают к CRC, включают возраст, пол и расу (3, 4, 15–23).Умеренное или сильное употребление алкоголя и повышенный ИМТ показали соответствие с повышенным образованием колоректальной карциномы и аденом, известных предшественников CRC (17, 24–31). Дополнительные предрасполагающие факторы включают семейный анамнез рака толстой или прямой кишки. Пациенты с воспалительным заболеванием кишечника (ВЗК), семейным аденоматозным полипозом (FAP) или наследственным неполипозным раком толстой кишки (HNPCC) (9, 32-40) также подвержены повышенному риску CRC.
Прогностические факторы для пациентов с CRC включают анатомическое расположение опухоли (5, 19, 20, 39, 41).Поэтому прогностические факторы рака прямой или толстой кишки можно рассматривать отдельно. Хотя связь локально-специфичного CRC с прогностическими факторами изучалась в ходе некоторых исследований (16, 19, 42–46), существует несколько исследований, в которых проводилось сравнение рака толстой и прямой кишки (39, 47). Это исследование было направлено на оценку и сравнение прогностических факторов рака прямой и толстой кишки с помощью одномерного и многомерного анализа выживаемости.
Пациенты и методы
Данные были получены из онкологического регистрационного центра Исследовательского центра гастроэнтерологии и заболеваний печени (RCGLD) Университета медицинских наук Шахида Бехешти, Тегеран, Иран.В онкологический регистр предоставляется информация о пациентах из десяти государственных и частных больниц, сотрудничающих с ними. Все пациенты с диагнозом CRC согласно отчету о патологии онкологического реестра соответствовали критериям участия в этом исследовании. На основе этого критерия в общей сложности 1219 пациентов (802 (65,8%) с раком толстой кишки и 392 пациента (32,2%) с раком прямой кишки. 25 пациентов (2,1%) с раком неизвестной первичной формы были исключены из анализа.
В этом продольном анализе выживаемости время последующего наблюдения определялось как дата постановки диагноза до 1 октября 2007 г. как время смерти от болезни (как точное время неудачи) или выживаемость (как время цензуры).Время начала исследования считалось 1 января 2002 года. Смерть подтверждена телефонным контактом с родственниками пациентов. Для нескольких пациентов (2,1%) не удалось получить информацию о причине смерти, и эти пациенты были исключены из анализа.
Для всей информации о пациентах демографические характеристики включали возраст на момент постановки диагноза, пол, расу, семейное положение и образование, а клинико-патологические характеристики включали ИМТ, алкогольный анамнез, FAP, HNPCC, IBD, семейный анамнез и патологическую стадию, которые были использованные в анализе были взяты из больничных карт.Патологическая стадия опухоли определялась как ранняя (включая I и II) и запущенная (включая III и IV) согласно Американскому объединенному комитету по раку (AJCC) (15). Основываясь на топографии места рака, толстая и ректальная кишка были разделены, чтобы определить места рака.
Время выживания было рассчитано в месяцах и представлено как среднее (± стандартное отклонение) время выживания. Значимые факторы (p <0,1) из одномерного анализа были кандидатами на включение в многомерный анализ.Отношение риска по конкретной причине (HR) (и его 95% ДИ) рассматривалось как величина представляющего интерес эффекта. На этом этапе значения p менее 0,05 считались значимыми. HR разницы и ее 95% доверительный интервал рассчитывались с помощью функции «lincom» программного обеспечения STATA. Предположения о пропорциональности опасности были проверены с помощью ph-теста остатков Шенфилда (48). Также был вычислен индекс C Харрелла, который определяется как мера соответствия между прогнозами и результатами, и выше (> 0.5) значения этого индекса свидетельствуют об адекватности моделирования данных (49). Данные анализировали с использованием статистического программного обеспечения STATA 10 (StataCorp, College Station, Texas 77845 USA).
Результаты
Всего было изучено 508 субъектов в течение 14407 месяцев.
Среднее время наблюдения (± SD) в месяцах для пациентов с раком прямой и толстой кишки составило 26,35 (± 25,27) и 23,88 (± 20,56) соответственно. Средний возраст на момент постановки диагноза (± SD) в месяц составил 53,56 (± 14,21) у пациентов с раком толстой кишки и 55 лет.03 (± 37,63) у больных раком прямой кишки. Всего за период исследования умерли 223 (19,7%) испытуемых. Для всех пациентов выживаемость 1, 2, 3, 4 и 5 лет составила 91,7%, 83,7%, 75,9%, 69,0% и 63,3% соответственно. Средняя продолжительность жизни (95% доверительный интервал) этих пациентов составила 111,82 (102,25 — 121,39) месяца. 124 (11,4%) больных раком прямой кишки умерли за период исследования. У этих пациентов вероятность выживаемости через 1, 2, 3, 4 и 5 лет составила 96,0%, 91,2%, 84,0%, 78,2% и 76,0% соответственно. Среднее время выживания (95% доверительный интервал) этих пациентов составляло 135.95 (126,20 — 145,70) месяцев.
На основании одномерного анализа демографических характеристик () возраст на момент постановки диагноза, пол, семейное положение и образование были значимо связаны с выживаемостью пациентов с раком толстой кишки (P <0,1), но этническая принадлежность не была значимой (p> 0,1) . Также возраст на момент постановки диагноза и пол были значимо связаны с раком прямой кишки (P <0,1), но семейное положение, образование и этническая принадлежность не были значимыми (P> 0,1).
Таблица 1
Демографические и клинико-патологические характеристики участников исследования и результаты однофакторного анализа по толстой и прямой кишке
| Характеристика | Рак толстой кишки | Рак прямой кишки | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IDR × 1000 | Значение P b | N (%) | IDR × 1000 | Значение P b | |||||||||||
| Возраст при диагностике | <45 a | 241 (30) | 6.8 | ——- | 118 (30) | 3,4 | ——- | ||||||||
| 45-65 | 373 (47) | 6,9 | 0,933 | 176 (45) | 4,1 | 0,408 | |||||||||
| > 65 | 188 (23) | 9,1 | 0,195 | 98 (25) | 5,4 | 9017 | 9017 9017 Мужской a | 472 (59) | 8.1 | ——- | 248 (63) | 4,6 | ——- | ||
| Внутренняя часть | 330 (41) | 6,2 | 0,077 | 144 (37) | 3,3 | 0,098 | |||||||||
| Семейное положение | Холост a | 32 (4) | 12,2 | ——- | 22 (6) | 6,6 | ——- | ||||||||
| В браке | 729 (96) | 7.0 | 0,058 | 344 (94) | 3,9 | 0,175 | |||||||||
| Этническая принадлежность | Фарс a | 367 (51) | 7,7 | ——- 180 (53207 | 4,4 | ——- | |||||||||
| Курд | 59 (8) | 9,3 | 0,524 | 26 (8) | 5,6 | 0,473 | 56 (8) | 7.1 | 0,824 | 23 (7) | 2,1 | 0,121 | |||
| Turk | 158 (22) | 6,1 | 0,232 | 69 (20) | 3,9 | Прочие | 79 (11) | 9,5 | 0,283 | 44 (13) | 4,6 | 0,856 | |||
| Образование | Неграмотные a | ——- | 81 (29) | 5,2 | ——- | ||||||||||
| Начальная школа | 208 (33) | 7,9 | 0,428 | 85 (30) | 4,2 | 0,459 | |||||||||
| Средняя школа | 155 (25) | 6,0 | 0,054 | 67 (24) | 3,4 | 0,198 | 9020 | 104 (17) | 7.0 | 0,256 | 50 (18) | 3,6 | 0,258 | ||
| ИМТ | 18,6 — 24,9 a | 252 (49) | 8,3 | ——— | 6,2 | ——— | |||||||||
| <18,5 | 45 (9) | 12,3 | 0,119 | 27 (10) | 8,4 | 0,285 | |||||||||
| 25-29,9 | 170 (33) | 3.7 | <0,001 | 77 (28) | 2,0 | <0,001 | |||||||||
| > 30 | 46 (9) | 6,6 | 0,431 | 21 (8) | |||||||||||
| История употребления алкоголя | никогда не использовался a | 684 (91) | 6,9 | ——— | 331 (92) | 4,1 | ——- — | ||||||||
| прошлое или текущее a | 71 (9) | 10.5 | 0,060 | 27 (8) | 2,5 | 0,208 | |||||||||
| FAP | № a | 255 (99) | 7,0 | ——— | 73 ( 97) | 2,9 | ——— | ||||||||
| Да | 3 (1) | 5,0 | 0,670 | 2 (3) | 4,7 | 0,597 | № a | 136 (83) | 8.8 | ——— | 51 (91) | 5,0 | ——— | ||
| Да | 28 (17) | 7,7 | 0,789 | 5 (9) | 1,1 | 0,138 | |||||||||
| IBD | № a | 296 (97) | 6,8 | ——— | 102 (98) | 3,2 | ——— | ||||||||
| Есть | 10 (3) | 21.5 | 0,047 | 2 (2) | 4,3 | 0,775 | |||||||||
| Семейный анамнез рака | № a | 466 (60) | 7,3 | ——— | 255 (69) | 4,3 | ——— | ||||||||
| Да | 308 (40) | 5,0 | 0,346 | 114 (31) | 5,0 | 0,490 | |||||||||
| Патологическая стадия | Ранняя a | 313 (52) | 7.6 | ——— | 118 (46) | 4,3 | ——— | ||||||||
| Продвинутый | 290 (48) | 6,4 | <0,001 | 141 (55) | 3,6 | 0,001 | |||||||||
Результаты теста на клинико-патологические факторы () показали, что для пациентов с раком толстой кишки ИМТ, алкогольный анамнез, ВЗК и патологическая стадия были значимыми (P <0,1), но другие факторы, включая FAP, HNPCC и семейный анамнез рака, не были значимыми (P> 0.1). Также результаты показали, что для пациентов с раком прямой кишки ИМТ и патологическая стадия были значительными (P <0,1), но другие клинико-патологические переменные, включая алкогольный анамнез, FAP, HNPCC, IBD, семейный анамнез рака, не были значимыми (P> 0,1). На следующем этапе значимые переменные в одномерном анализе были введены в многомерный анализ.
Тест отношения правдоподобия показал значительный вклад переменных, введенных в модель (Wald Chi Square = 64.74, df = 18 (AIC = 684,38) и P <0,001). Результаты ph-теста остатков Шенфельда показали, что все переменные, внесенные в модель, удовлетворяли предположению PH регрессии Кокса (все P> 0,05). Индекс Харрелла C для модели был равен 0,74, что свидетельствует о разумном согласии между наблюдаемым результатом и прогнозируемым моделью.
Из этих значимых факторов одномерного анализа пол и образование не могли быть включены в многомерный анализ, поскольку их присутствие вместе с другими переменными создавало проблему линейности, и они автоматически удалялись из анализа.Основываясь на результатах многофакторного анализа (), ИМТ, алкогольный анамнез, ВЗК и патологическая стадия рака были значимыми прогностическими факторами рака толстой кишки (P <0,05), но возраст на момент постановки диагноза и семейное положение не были значимыми для этого рака ( P> 0,05). Также для рака прямой кишки возраст на момент постановки диагноза, ИМТ, ВЗК и патологическая стадия рака были значимыми прогностическими факторами (P <0,05), но семейное положение и алкогольный анамнез не были существенно связаны с выживаемостью этого рака (P> 0.05).
Таблица 2
Результаты многомерной модели для значимых прогностических факторов из одномерного анализа толстой и прямой кишки
| Характеристика | Рак толстой кишки | Рак прямой кишки | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| P-значение c | HR b | 95% CI | P-value c | ||||||||||||
| Возраст при диагностике | <45 | 1 46 a | —— | —— | 1 a | —— | —— | ||||||||
| 45-65 | 0.83 | 0,43–1,57 | 0,56 | 3,44 | 1,29–9,16 | 0,01 | |||||||||
| > 65 | 1,00 | 0,45– 2,26 | 0,99 | 0,45– 2,26 | 0,99 | ||||||||||
| Семейное положение | Холост | 1 a | —— | —— | 1 a | —— | —— | ||||||||
| женат | 0.71 | 0,21–2,36 | 0,57 | 0,40 | 0,12–1,30 | 0,13 | |||||||||
| ИМТ | 18,6 — 24,9 | 1 a | 12 —— | 1 a | —— | —— | |||||||||
| <18,5 | 2,67 | 1,12-6,34 | 0,03 | 2,20 | 0,74-6,50 0,15 9020 | ||||||||||
| 25-29.9 | 0,41 | 0,20-0,83 | 0,01 | 0,26 | 0,09-0,74 | 0,01 | |||||||||
| > 30 | 0,62 | 0,19-2,05 | 0,19-2,05 | 0,50 | |||||||||||
| История алкоголя | никогда не использовался | 1 a | —— | —— | 1 a | —— | — — | ||||||||
| прошлое или текущее использование | 2.30 | 1,14-4,67 | 0,02 | 0,47 | 0,07-3,00 | 0,43 | |||||||||
| IBD | нет | 1 a | —— | 902 —— 1 a | —— | —— | |||||||||
| да | 9,97 | 2,82-35,28 | 0,00 | 8,50 | 1,31-55,32 | 0,03 | Патологическая стадия | ранняя | 1 a | —— | —— | 1 a | —— | —— | |
| продвинутый | 1.94 | 1,06-3,54 | 0,03 | 3,03 | 1,17-7,89 | 0,02 | |||||||||
Хотя при одномерном анализе не было статистически значимой разницы между раком прямой и толстой кишки (), но наблюдался некоторый существенный эффект. для ИМТ, алкогольного анамнеза, FAP, HNPCC и IBD. Также в скорректированном анализе возраст на момент постановки диагноза значительно отличался между двумя частями толстой и прямой кишки (ДИ не включал 1), но другие факторы не были значительно различны между этими двумя частями.Хотя это и не было статистически значимым, при сравнении выживаемости при раке прямой и толстой кишки были выявлены некоторые предполагаемые величины эффекта в семейном положении, ИМТ, алкогольном анамнезе и патологической стадии.
Таблица 3
Сравнение нескорректированных и скорректированных соотношений рисков между участками прямой и толстой кишки по демографическим и клиническим характеристикам
| Характеристика | Не скорректирована | Скорректирована | |||||
|---|---|---|---|---|---|---|---|
| HR a (C / R) b | 95% CI (C / R) c | HR c (C / R) c | 95% CI ( C / R) c | ||||
| Возраст на момент диагностики | |||||||
| 45-65 | .83 | .50-1.39 | .24 | .074- .77 | |||
| > 65 | .81 | .45-1.47 | .66 | .12- 3.63 | |||
| Женский) | 1,07 | 0,67-1,70 | —— | —— | |||
| Семейное положение (замужем) | ,98 | .40- 2,41 | 1,78 | . 33- 9,62 | |||
| Этническая принадлежность | |||||||
| Курды | .92 | ,37- 2,27 | —— | —— | |||
| Lor | 1,98 | ,67- 5,86 | —— | —— | |||
| Turk | ,85 | .46- 1,55 | —— | —— | |||
| Прочие | 1,17 | .59- 2,32 | —— | —— | |||
| Образование | |||||||
| Начальная школа | 1.04 | .54- 1.98 | —— | —— | |||
| Средняя школа | .95 | .46-1.99 | —— | —- — | |||
| Университет | 1,10 | ,52- 2,35 | —— | —— | |||
| ИМТ | .50- 2.28 | 1.21 | .30 -4.85 | ||||
| 25-29,9 | 1,35 | 0,66-2,77 | 1,54 | 0,44 — 5,4 | |||
| > 30 | 2,15 | ,64- 7,28 6 902 902 902,01 | |||||
| История употребления алкоголя (прошлое или текущее употребление) | 2,53 | .999-6,43 | 4,86 | ,67- 35,14 | |||
| FAP (настоящее время) | ,38 | 0,0722-6,66 —— | —— | ||||
| HNPCC (Настоящее время) | 4.23 | .47- 38,42 | —— | —— | |||
| IBD (настоящее время) | 2,30 | ,27- 22,32 | 1,17 | .12- 11,23 | |||
| Семейный анамнез рака (настоящее время) | 1,00 | 0,62–1,60 | —— | —— | |||
| Патологическая стадия (продвинутая) | 0,86 | 0,9–1,50 | 0,64 | 0,21-1,98 | |||
Кривые выживаемости для толстой и прямой кишки на основе скорректированного анализа показывают, что скорректированная выживаемость пациентов с раком толстой кишки () упала примерно на 0.3 через 100 месяцев и продолжалось до конца исследования с прямой линией, но это произошло примерно через 0,7 через 100 месяцев для рака прямой кишки. Таким образом, в целом скорректированная выживаемость пациентов с раком прямой кишки лучше, чем у пациентов с раком толстой кишки.
Скорректированная вероятность выживания при раке прямой и толстой кишки
Обсуждение
CRC представляет собой серьезную проблему для общественного здравоохранения, и его частота растет в Иране (11–14). Неоднородность CRC по анатомической локализации требует анализа показателей смертности по локализации опухоли.Это исследование было проведено на 1219 иранских пациентах с CRC, чтобы оценить влияние конкретных прогностических факторов рака толстой и прямой кишки.
В одномерном анализе пол пациента и ИМТ были существенно связаны со смертностью от рака прямой и толстой кишки. В исследовании Wei et al. (2004), не было значительной корреляции между смертностью от рака прямой и толстой кишки и возрастом пациентов (39). Meguid et al (2008) сообщили о значительной разнице в возрасте между толстой и прямой кишкой (47).В других исследованиях сообщалось, что смещение опухоли слева направо значительно увеличивается с увеличением возраста и года постановки диагноза (16, 43, 45, 50), Roncucci et al (1996) показали обратную зависимость (51). В исследованиях, сравнивающих исходы для CRC и пола пациентов, Wei et al (2004) не обнаружили различий между толстой и прямой кишкой (39). Другие исследования показали, что у мужчин чаще встречается рак дистальной и прямой кишки, а у женщин — более проксимальный рак толстой кишки (16, 21, 43, 45, 47). Дальнейшие исследования ссылались на другие факторы пациента, такие как достижения в учебе, как на факторы, связанные с локализацией опухоли и исходом, но доказательства такой связи остаются противоречивыми (16, 19, 23, 43, 44, 47, 52, 53).
ИМТ был независимым прогностическим фактором как для толстой, так и для прямой кишки с немного большей опасностью в области толстой кишки (хотя и не значимой). В соответствии с нашим исследованием, в исследовании Wei et al (2004) не было значительных различий между толстой и прямой кишкой, но они указали ИМТ как прогностический фактор только для рака толстой кишки (39). Le Marchand и др. (1992) обнаружили связь ИМТ как с проксимальным (слепая, восходящая, поперечная), так и с дистальным (нисходящая, сигмовидная и прямая) раками ободочной кишки (27, 17, 26, 29, 54, 55).
Хотя алкогольный анамнез не имел значительных различий между раком толстой и прямой кишки, существенная разница в величине эффекта наблюдалась с более сильными опасностями в области толстой кишки (одномерный (U) HR (толстая / прямая кишка) = 2,53, MVHR (толстая / прямая кишка) = 4,86)). Алкогольный анамнез был значимым для рака толстой кишки на основании однофакторного и многофакторного анализа (MVHR = 2,3), но связь не была значимой для прямой кишки. Это говорит о том, что алкогольный анамнез может быть независимым прогностическим фактором только для рака толстой кишки.Как и наши выводы, Wei et al. не наблюдали какой-либо существенной разницы между этими подсайтами (39). Кроме того, обзор 27 эпидемиологических исследований показал, что в когортных исследованиях оценки риска рака толстой кишки составляют 1,0–1,7, а для рака прямой кишки — столько же (56), но сравнения между этими двумя частями не проводились. Мета-анализ комбинированных когортных исследований и исследований случай-контроль показал умеренно повышенный риск КРР с зависимостью от дозы для увеличения потребления алкоголя (57, 58), но не выявил каких-либо различий в риске рака толстой кишки по сравнению с риском рака прямой кишки. рак (58).Высокое потребление алкоголя было связано с умеренным повышением риска КРР в нескольких недавних исследованиях, причем среди лиц с хроническим ВЗК было отмечено повышенное количество рака толстой кишки (25, 28) (24). С другой стороны, результаты некоторых других исследований показали, что алкоголь связан с опухолями дистального отдела толстой кишки и прямой кишки (17, 57, 59). Возможными причинами явно противоречивых выводов могут быть разные группы характеристик суб-участков по разным моделям воздействия, например раса и генотипы (57).
ВЗК было очень значимым как для толстой, так и для прямой кишки (HR (толстая кишка) = 9,97 и HR (прямая кишка) = 8,50), с немного более сильной ассоциацией для участка толстой кишки (HR (толстая / прямая кишка) = 2,3). CRC является наиболее частой локализацией рака при ВЗК (язвенный колит (ЯК) и болезнь Крона (БК)) (40). В популяционном исследовании было обнаружено, что риск рака толстой кишки среди пациентов с ЯК и БК примерно в 2-3 раза выше, чем в общей популяции, и что риск рака прямой кишки увеличивается в 2 раза при ЯК, но не в 2 раза. CD (32).Эффект UC или CD на рак толстой кишки или прямой кишки был подтвержден другими исследованиями (60–67). В этом исследовании мы не делали разделения между ЯК и БК, поскольку колоректальная карцинома, осложняющая ЯК, клинико-патологически очень похожа на осложняющую БК, а колоректальная карцинома, связанная с БК, имеет 5-летнюю выживаемость, аналогичную колоректальной карциноме, встречающейся при ЯК (46% против 50%) (68).
В семейном анамнезе не было ни значительных, ни предполагаемых различий между этими двумя участками прямой и прямой кишки, и он не был существенно связан с раком прямой или толстой кишки.Однако в исследовании Wei et al (2004) было продемонстрировано, что семейный анамнез CRC, по-видимому, влияет на относительный риск (ОР) рака толстой кишки (ОР = 1,94 (1,80, 2,10)) сильнее, чем ОР рака прямой кишки (1,27 (1.08, 1.50)) (39) и в своем исследовании Fuchs et al сообщили об относительном риске (ОР) 1,99 (95% доверительный интервал (ДИ): 1,50–2,63) для рака толстой кишки и относительном риске 0,86 (95% ДИ: 0,43–1,70) для рака прямой кишки среди тех, кто сообщил о семейном анамнезе рака толстой или прямой кишки (35, 38).
FAP и HNPCC существенно не различались между толстой и прямой кишкой, однако при одномерном анализе наблюдалась значительная величина эффекта; FAP представлял большую опасность при раке прямой кишки, однако HNPCC при раке толстой кишки (FAP: HR (толстая / прямая кишка) = 0,378, HNPCC: HR (толстая / прямая кишка) = 4,23). Кроме того, как FAP, так и HNPCC не были значимо связаны ни с раком толстой кишки, ни с раком прямой кишки, но в других исследованиях сообщалось, что HNPCC и FAP предрасполагают к раку толстой и прямой кишки (69). Однако в соответствии с нашими выводами, другие исследования показали, что у людей с FAP очень сильное предпочтение к развитию CRC в левой толстой кишке, в то время как у людей с HNPCC есть сильное предпочтение в развитии CRC в правой толстой кишке (36, 37, 41, 70 ).Было высказано предположение, что разные патогенетические механизмы могут объяснять такие различия (33, 39, 41). Кроме того, на основании исследования, проведенного Molaei et al. (2010) оценка распространенности HNPCC в Иране составляла 5,5% от общего числа случаев колоректального рака (70), в то время как в нашем исследовании она составляла 9%, как и в другом исследовании (71).
Разница между толстой и прямой кишкой не была значимой для патологической стадии рака при однофакторном и многомерном анализах, но пациенты с раком толстой кишки имели лучшую выживаемость, чем пациенты с раком прямой кишки, предположительно (UHR (толстая / прямая кишка) = 0.86, MVHR (ободочная / прямая кишка) = 0,639). Кроме того, патологическая стадия рака была значимо связана с выживаемостью при раке толстой и прямой кишки на основании как одномерного, так и многомерного анализов (толстая кишка: HR = 1,94, прямая кишка: HR = 3,03). Таким образом, патологическая стадия является независимым прогностическим фактором выживаемости как в толстой, так и в прямой кишке с более сильной ассоциацией со смертностью от рака прямой кишки. Результаты некоторых исследований согласуются с нашими результатами (72). Однако в исследовании Meguid et al (2008) патологическая стадия значительно различалась между правой и левой ободочной кишкой (47), но они просто сравнили частоту событий, но не выживаемость.Также они использовали большое количество наблюдений, которые обеспечили большую статистическую мощность для значительного обнаружения расхождения. С другой стороны, в отношении наших результатов ведутся переговоры (16, 41, 73).
Общая скорректированная выживаемость и выживаемость 1, 2, 3, 4 и 5 лет пациентов с раком прямой кишки были лучше, чем у пациентов с раком толстой кишки. Это показывает лучший общий и ежегодный статус пациентов с раком прямой кишки. Однако другие исследования показали обратные результаты (41, 42, 74, 75). Есть и аргументы (3, 5, 9, 76, 77).
Это исследование имеет преимущество по сравнению с другими последующими исследованиями колоректального рака; Изучая выживаемость при раке толстой и прямой кишки по прогностическим факторам, можно было обеспечить справедливое сравнение результатов между опухолями в этих двух сегментах кишечника. Однако, несмотря на споры о несогласованности данных о сайт-специфическом механизме колоректальной карциномы, все же существует, и необходимо собрать больше доказательств о конкретных характеристиках этих видов рака, чтобы определенно подтвердить зачатие.Особенно необходимо большее количество случаев для достижения более высокой статистической мощности для выявления значительных различий, которые были заявлены как предполагаемые или существенные. Это было ограничением нашего исследования. В качестве еще одного ограничения у нас не было доступа к некоторым важным данным, таким как физическая активность, диета и некоторые генетические маркеры. Неизвестная причина смерти в некоторых случаях была еще одним ограничением. Могут существовать этиологические различия между проксимальным и дистальным отделом толстой кишки (39, 41), что является нашим предложением для другого исследования.
В заключение, на основании наших выводов существуют различия между двумя участками прямой кишки. Хотя только для возраста на момент постановки диагноза была статистически значимая разница между толстой и прямой кишкой, но для других факторов, включая семейное положение, ИМТ, алкогольный анамнез и патологическую стадию, некоторые из них предполагали существенный (хотя статистически незначимый) размер эффекта расхождений. наблюдаемый. Наши результаты подтверждают эту гипотезу о том, что некоторые прогностические факторы по-разному влияют на толстую и прямую кишку.Следовательно, CRC не является единым целым, и толстую кишку и прямую кишку следует оценивать отдельно, чтобы не упустить полезную информацию, которая будет полезна для изучения молекулярного механизма, прогноза и применения лечения, разработки клинических испытаний и разработки соответствующих методов лечения и планирования. скрининговые программы.
Благодарности
Мы будем очень признательны за ценный вклад Университета Тарбиат Модарес и онкологического регистрационного центра Исследовательского центра гастроэнтерологии и заболеваний печени в это исследование.
Примечания
( Пожалуйста, цитируйте как: Асгари Джафарабади М., Мохаммади С.М., Хаджизаде Э., Каземнеджад А., Фатеми С.Р. Различается ли прогноз колоректального рака в зависимости от локализации опухоли? : 199-209).
Список литературы
1. Викхэм Р., Лассер Ю. Азбука колоректального рака. Семинары по онкологическому сестринскому делу. 2007; 23: 1–8. [Google Scholar] 2. Министерство здравоохранения и медицинского образования. 2006. Министерство здравоохранения и медицинского образования Исламской Республики Иран, офис заместителя министра здравоохранения, Центр по борьбе с болезнями, онкологический кабинет.Ежегодный национальный отчет о регистрации рака в Иране. [Google Scholar] 3. Поурхосингхоли М.А., Фагихзаде С., Гаджизаде Э., Абади А. Годы жизни, потерянные из-за рака прямой кишки в Иране. Gastroenterol Hepatol Bed Bench. 2010; 3: 187–89. [Google Scholar] 4. Chew M-H, Koh P-K, Ng K-H, Eu K-W. Повышение выживаемости в азиатской когорте молодых пациентов с колоректальным раком: анализ 523 пациентов из одного учреждения. Int J Colorectal Dis. 2009; 24: 1075–83. [PubMed] [Google Scholar] 5. Зали MR. Колоректальный рак — скрининг в Иране.Gastroenterol Hepatol Bed Bench. 2008; 1: 103–104. [Google Scholar] 6. Пейн С. Болезнь не равных возможностей — обзор колоректального рака у мужчин и женщин с учетом пола и пола: Часть I. JMHG. 2007; 4: 131–9. [Google Scholar] 7. Седерлунд С., Брандт Л., Лапидус А., Карлен П., Брострем О., Лёфберг Р. и др. Тенденции уменьшения во времени колоректального рака в большой группе пациентов с воспалительным заболеванием кишечника. Гастроэнтерология. 2009; 136: 1561–7. [PubMed] [Google Scholar] 8. Тойода Й, Накаяма Т, Ито И, Иока А, Цукума Х.Тенденции заболеваемости колоректальным раком по субпунктам в Осаке, Япония. Jpn J Clin Oncol. 2009; 39: 189–91. [PubMed] [Google Scholar] 9. Wilkes G, Hartshorn K. Рак прямой и анальной кишки. Semin Oncol Nurs. 2009. 25: 32–47. [PubMed] [Google Scholar] 10. Ганапати С., Кумар Д., Кацулас Н., Мелвилл Д., Ходжсон С., Финлейсон С. и др. Колоректальный рак у молодых: тенденции, характеристики и исходы. Int J Colorectal Dis. 2011; 26: 927–34. [PubMed] [Google Scholar] 11. Хоссейни С., Изадпанах А., Ярмохаммади Х.Эпидемиологические изменения колоректального рака в Ширазе, Иран: 1980–2000 гг. ANZ J Surg. 2004. 74: 547–49. [PubMed] [Google Scholar] 12. Ансари Р., Махдавиния М., Саджади А., Нураи М., Камангар Ф., Бишехсари Ф. и др. Заболеваемость и возрастное распределение колоректального рака в Иране: результаты популяционного онкологического регистра. Cancer Lett. 2006; 240: 143–47. [PubMed] [Google Scholar] 13. Фороутан М., Рахими Н., Табатабаифар М., Дарвиши М., Хашеми М., Хоссейнпанах Ф. и др. Клинические особенности колоректального рака в Иране: 15-летний обзор.Dig Dis. 2008; 9: 225–27. [PubMed] [Google Scholar] 14. Пахлаван П.С., Дженсен К. Краткое влияние эпидемиологических особенностей колоректального рака в Иране. Тумори. 2005. 91: 291–94. [PubMed] [Google Scholar] 15. Akhoond MR, Kazemnejad A, Hajizadeh E, Ghanbari Motlagh A. Сравнение рака толстой и прямой кишки: выживаемость и прогностические факторы. Gastroenterol Hepatol Bed Bench. 2010; 3: 177–86. [Google Scholar] 16. Ченг X, Чен В.В., Стил Б., Руис Б., Фултон Дж., Лю Л. Уровень заболеваемости и стадии заболевания колоректальным раком на отдельных участках по расе, полу и возрастной группе в Соединенных Штатах, 1992–1997 годы.Рак. 2001. 92: 2547–54. [PubMed] [Google Scholar] 17. Chyou P-H, Nomura AMY, Stemmermann GN. Проспективное исследование рака прямой и толстой кишки среди японских мужчин на Гавайях. Ann Epidemiol. 1996; 6: 276–82. [PubMed] [Google Scholar] 18. Джи Б.Т., Девеса СС, Чоу WH, Джин Ф., Гао Ю.Т. Тенденции заболеваемости колоректальным раком по подразделениям в городском Шанхае, 1972–1994 гг. Биомаркеры эпидемиологии рака Пред. 1998. 7: 661–66. [PubMed] [Google Scholar] 19. Ли М., Ли JY, Чжао А.Л., Гу Дж. Колоректальный рак или рак прямой и толстой кишки? Клинико-патологическое сравнение рака толстой и прямой кишки.Онкология. 2007. 73: 52–57. [PubMed] [Google Scholar] 20. Нельсон Р.Л., Доллеар Т., Фрилс С., Перски В. Отношение возраста, расы и пола к локализации колоректальной карциномы. Рак. 1997. 80: 193–97. [PubMed] [Google Scholar] 21. Свенссон Э., Гротмол Т., Хофф Дж., Лангмарк Ф., Норстейн Дж., Третли С. Тенденции заболеваемости колоректальным раком в Норвегии по полу и анатомическому расположению: возрастно-периодический когортный анализ. Eur J Cancer Пред. 2002; 11: 489–95. [PubMed] [Google Scholar] 22. Таджима К., Хиросе К., Накагава К., Куроиси Т., Томианага С.Городские и сельские различия в тенденции смертности от колоректального рака с особым упором на суб-сайты рака толстой кишки в Японии. Jpn J из Cancer Res. 1985. 76: 717–28. [PubMed] [Google Scholar] 23. Тавани А., Фиоретти Ф., Франчески С., Галлус С., Негри Е., Монтелла М. и др. Образование, социально-экономический статус и риск рака толстой и прямой кишки. Int J Epidemiol. 1999. 28: 380–85. [PubMed] [Google Scholar] 24. Cho E, Smith-Warner SA, Ritz J, van den Brandt PA, Colditz GA, Folsom AR, et al. Потребление алкоголя и колоректальный рак: объединенный анализ 8 когортных исследований.Ann Intern Med. 2004. 140: 603–13. [PubMed] [Google Scholar] 25. Erhardt JG, Kreichgauer HP, Meisner C, Bode JC, Bode C. Алкоголь, курение сигарет, факторы питания и риск колоректальных аденом и гиперпластических полипов. Eur J Nut. 2002; 41: 35–43. [PubMed] [Google Scholar] 26. Gerhardsson-deVerdier M, Hagman U, Steineck G, Rieger A, Norell S. Диета, масса тела и колоректальный рак: референтное исследование в Стокгольме. Int J Cancer. 1990; 46: 832–8. [PubMed] [Google Scholar] 27. ЛеМаршан Л., Уилкенс Л., Ми МП.Ожирение в молодом и среднем возрасте и риск колоректального рака у мужчин. Контроль причин рака. 1992; 3: 349–54. [PubMed] [Google Scholar] 28. Мидзуэ Т., Танака К., Цудзи И., Вакай К., Нагата К., Отани Т. и др. Риск употребления алкоголя и колоректального рака: оценка, основанная на систематическом обзоре эпидемиологических данных среди населения Японии. Jpn J Clin Oncol. 2006; 36: 582–97. [PubMed] [Google Scholar] 29. Слэттери М.Л., Эдвардс С., Куртин К., Ма К., Эдвардс Р., Голубков Р. и др. Физическая активность и колоректальный рак.Am J Epidemiol. 2003. 158: 214–24. [PubMed] [Google Scholar] 30. Thygesen LC, Wu K, Gronbaek M. Потребление алкоголя и колоректальный рак: сравнение подходов для включения повторных измерений потребления алкоголя. Эпидемиология. 2008. 19: 258–64. [PubMed] [Google Scholar] 31. У АХ, Хендерсон БЭ. Употребление алкоголя и табака: факторы риска колоректальной аденомы и рака? Natl Cancer Inst. 1995; 87: 239–40. [PubMed] [Google Scholar] 32. Bernstein CN, Blanchard JF, Kliewer E, Wajda A. Риск рака у пациентов с воспалительным заболеванием кишечника: популяционное исследование.Рак. 2001. 91: 854–62. [PubMed] [Google Scholar] 33. Bufill JA. Колоректальный рак: данные о различных генетических категориях, основанных на проксимальном или дистальном расположении опухоли. Ann Intern Med. 1990; 113: 779–88. [PubMed] [Google Scholar] 34. Antelo M, Castells A. Семейная история колоректального рака: новый предиктор выживания рака толстой кишки? ДЖАМА. 2008; 299: 2515–23. [PubMed] [Google Scholar] 35. Fuchs C, Giovannucci E, Golditz G, Hunter DJ, Speizer FE, Willett WC. Проспективное исследование семейного анамнеза и риска колоректального рака.N Engl J Med. 1994; 331: 1669–74. [PubMed] [Google Scholar] 36. Якопетта Б. Есть две стороны колоректального рака? Int J Cancer. 2002; 101: 403–8. [PubMed] [Google Scholar] 37. Линч Х., Уотсон П., Ланспа С.Дж., Маркус Дж., Смирк Т., Фитцгиббонс Р.Дж., младший и др. Естественная история колоректального рака при наследственном неполипозном колоректальном раке (синдромы Линча I и II) Dis Colon Rectum. 1988. 31: 439–44. [PubMed] [Google Scholar] 38. Махдавиния М., Бишехсари Ф., Ансари Р., Норузбейги Н., Халегинеджад А., Хормазди М. и др.Семейный анамнез колоректального рака в Иране. BMC Рак. 2005; 5: 5–112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Вэй Е.К., Джованнуччи Е., Ву К., Рознер Б., Фукс С.С., Виллетт В.К. и др. Сравнение факторов риска рака прямой и толстой кишки. Int J Cancer. 2004; 108: 433–42. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Стейнберг С.М., Баркин Ю.С., Каплан Р.С., Стаблин Д.М. Прогностические показатели опухолей толстой кишки. Рак. 1986; 57: 1866–70. [PubMed] [Google Scholar] 43. Troisi RJ, Freedman AN, Devesa SS.Заболеваемость колоректальной карциномой в США: обновленные тенденции по полу, расе, возрасту, участку и стадии, 1975-1994 гг. Рак. 1999; 85: 1670–6. [PubMed] [Google Scholar] 44. Wu X, Chen VW, Martin J, Roffers S, Groves FD, Correa CN и др. Уровни заболеваемости колоректальным раком и распределение стадий среди азиатов и жителей островов Тихого океана в Соединенных Штатах: с 1995 по 1999 год. Эпидемиологические биомаркеры рака Пред. 2004; 13: 1215–22. [PubMed] [Google Scholar] 45. Ву XC, Чен В.В., Стил Б., Руис Б., Фултон Дж., Лю Л. и др.Уровень заболеваемости и стадии заболевания колоректальным раком на субпункте по расе, полу и возрастным группам в Соединенных Штатах, 1992–1997 годы. Рак. 2001. 92: 2547–54. [PubMed] [Google Scholar] 46. Асгари-Джафарабади М., Гаджизаде Э., Каземнеджад А., Фатеми С.Р. Локальная оценка прогностических факторов выживаемости у пациентов с иранским колоректальным раком: анализ выживаемости с конкурирующими рисками. Азиатско-Тихоокеанский регион J Cancer Prev. 2009; 10: 815–21. [PubMed] [Google Scholar] 47. Meguid RA, Slidell MB, Wolfgang CL, Chang DC, Ahuja N.Есть ли разница в выживаемости между правосторонним и левосторонним раком толстой кишки? Энн Сург Онкол. 2008; 15: 2388–94. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Кляйнбаум Д.Г., Кляйн М. Второе изд. Нью-Йорк: Спрингер; 2005. Анализ выживания: самообучающийся текст. [Google Scholar] 49. Харрелл Ф.Е., Калифф Р.М., Прайор Д.Б., Ли К.Л., Розати Р.А. Оценка результатов медицинских тестов. J Am Med Assoc. 1984; 247: 2543–46. [PubMed] [Google Scholar] 50. Saltzstein SL, Behling CA. Возраст и время как факторы сдвига слева направо подсистемы колоректальной аденокарциномы: исследование 213 383 случаев из реестра рака Калифорнии.J Clin Gastroenterol. 2007; 41: 173–77. [PubMed] [Google Scholar] 51. Ронкуччи Л., Фанте Р., Лози Л., Грегорио С.Д., Микели А., Бенатти П. и др. Выживаемость при раке прямой и толстой кишки в популяционном регистре рака. Eur J Cancer. 1996; 32A: 295–302. [PubMed] [Google Scholar] 52. Чарльз Р., Томас Дж. Расовые различия в анатомическом распределении рака толстой кишки. Arch Surg. 1992; 127: 1241–5. [PubMed] [Google Scholar] 53. Egeberga R, Halkjæra J, Rottmanna N, Hansena L., Holten I. Социальное неравенство, частота и выживаемость от рака толстой и прямой кишки в популяционном исследовании в Дании, 1994–2003 гг.Eur J Cancer. 2008; 44: 1978–88. [PubMed] [Google Scholar] 54. Colditz GA, Cannuscio CC, Frazier AL. Физическая активность и снижение риска рака толстой кишки: значение для профилактики. Контроль причин рака. 1997. 8: 649–67. [PubMed] [Google Scholar] 55. Поттер Дж. Д. Колоректальный рак: молекулы и популяции. J Natl Cancer Inst. 1999; 91: 916–32. [PubMed] [Google Scholar] 56. Франчески С., Ла-Веккья С. Алкоголь и риск рака желудка и прямой кишки. Dig Dis. 1994; 12: 276–89. [PubMed] [Google Scholar] 57.Ахтер М., Курияма С., Накая Н., Симадзу Т., Омори К., Нишино Ю. и др. Употребление алкоголя связано с повышенным риском развития рака дистального отдела толстой кишки и прямой кишки у японских мужчин: когортное исследование Мияги. Eur J Cancer. 2007; 43: 383–90. [PubMed] [Google Scholar] 58. Corrao G, Bagnardi V, Zambon A, La Vecchia C. Мета-анализ потребления алкоголя и риска 15 заболеваний. Предыдущая Мед. 2004; 38: 613–9. [PubMed] [Google Scholar] 59. Джованнуччи Э, Римм Э, Ашерио А., Штампфер М., Кольдиц Дж., Уиллетт В.Алкоголь, диеты с низким содержанием метионина и фолиевой кислоты и риск рака толстой кишки у мужчин. J Natl Cancer Inst. 1995; 87: 265–73. [PubMed] [Google Scholar] 61. Экбом А, Хелмик С., Зак М., Адами Х.О. Повышенный риск рака толстой кишки при болезни Крона с поражением толстой кишки. Ланцет. 1990; 336: 357–59. [PubMed] [Google Scholar] 62. Экбом А., Хелмик С., Зак М., Адами Х.О. Экстраколонические злокачественные новообразования при воспалительном заболевании кишечника. Рак. 1991; 67: 2015–9. [PubMed] [Google Scholar] 63. Гайд С.Н., Приор П., Аллан Р.Н., Стивенс А., Джуэлл Д.П., Трулав С.К. и др.Колоректальный рак при язвенном колите: когортное исследование первичных направлений из трех центров. Кишечник. 1988; 29: 206–17. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Карлен П., Лофберг Р., Бростром О., Лейонмарк К.Э., Хеллерс Г., Перссон П.Г. Повышенный риск рака при язвенном колите: популяционное когортное исследование. Am J Gastroenterol. 1999; 94: 1047–52. [PubMed] [Google Scholar] 65. Леннард-Джонс Дж. Э., Мелвилл Д. М., Морсон BC, Ричи Дж. К., Уильямс CB. Предрак и рак при обширном язвенном колите: данные среди 401 пациента старше 22 лет.Кишечник. 1990; 31: 800–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Mellemkjaer L, Olsen JH, Frisch M, Johansen C, Gridley G, McLaughlin JK. Рак у больных язвенным колитом. Int J Cancer. 1995; 60: 330–3. [PubMed] [Google Scholar] 68. Чой П.М., Зелиг депутат. Сходство колоректального рака при болезни Крона и язвенном колите: последствия для канцерогенеза и профилактики. Кишечник. 1994; 35: 950–4. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Уотсон П., Линч ХТ. Экстраколонический рак при наследственном неполипозном колоректальном раке.Рак. 1993; 71: 677–85. [PubMed] [Google Scholar] 70. Molaei M, Mansoori BK, Ghiasi S, Khatami F, Attarian H, Zali MR. Колоректальный рак в Иране: иммуногистохимические профили четырех белков восстановления несоответствия. Int J Colorectal Dis. 2010; 25: 63–9. [PubMed] [Google Scholar] 71. Стивенсон Б.М., Финан П.Дж., Гаскойн Дж. И др. Частота семейного колоректального рака. Br J Surg. 1991; 78: 1162–6. [PubMed] [Google Scholar] 72. Холл NR, Finan PJ, Brown S, AI-Jaberi T, Tsang CS. Сравнение прогнозов при раке толстой и прямой кишки.Colorectal Dis. 2000; 2: 159–64. [PubMed] [Google Scholar] 73. Хайдингер Г., Вальдхоер Т., Хакл М., Вутук С. Выживаемость пациентов с колоректальным раком в Австрии по полу, возрасту и стадии. Wien Med Wochenschr. 2006. 156 (19-20): 549–51. [PubMed] [Google Scholar] 75. Gatta G, Faivre J, Capocaccia R, Ponz-deLeon M. Выживаемость пациентов с колоректальным раком в Европе в период 1978–1989 годов. Eur J Cancer Пред. 1998. 34: 2176–83. [PubMed] [Google Scholar] 76. Беррино Ф., Де-Анжелис Р., Россо М.С.С., Ласота МБ, Коберг Дж. В., Сантакуилани М.Выживаемость от восьми основных видов рака и всех видов рака вместе у взрослых европейцев, диагностированных в 1995–1999 годах: результаты исследования EUROCARE-4. Ланцет Онкол. 2007. 8: 773–83. [PubMed] [Google Scholar] 77. Зампиноа М.Г., Лабианка Р., Беретта Дж., Гатта Дж., Лорризо К., де-Брауд Ф. и др. Рак прямой кишки. Crit Rev Oncol Hematol. 2004. 51: 121–43. [PubMed] [Google Scholar]
фактов о раке толстой кишки | Коалиция против рака толстой кишки
Список фактов может напугать. Обдумывая приведенную здесь информацию, помните, что при своевременном обследовании
и своевременной оценке симптомов рак толстой кишки можно предотвратить, вылечить и победить!
О колоректальном раке
- Рак толстой кишки — это рак толстой кишки.Рак прямой кишки — это рак прямой кишки. Вместе они составляют колоректальный .
- Это третий наиболее часто диагностируемый рак и вторая по значимости причина смерти от рака.
- Колоректальный рак в равной степени поражает мужчин и женщин, а также людей всех рас и национальностей.
- Половина всех новых диагнозов колоректального рака приходится на людей в возрасте 66 лет и младше.
- 5-летняя относительная выживаемость при раке толстой кишки 1 и 2 стадии составляет 90%; 5-летняя выживаемость для пациентов, у которых диагностирована стадия III, составляет 71%, а стадия IV — 14%.
- Часто те, у кого диагностирован колоректальный рак, не испытывают никаких признаков или симптомов, связанных с этим заболеванием.
Семейная история
- Люди, чьи родители, братья, сестры или дети болеют колоректальным раком, имеют в 2 или 3 раза больший риск развития рака толстой кишки по сравнению с теми, у кого это заболевание не было в семейном анамнезе.
- Хотя у большинства людей с диагнозом рак толстой кишки нет семейного анамнеза болезни, тем, у кого есть семейный анамнез, следует начинать скрининг в более раннем возрасте.
- Когда родственнику поставлен диагноз в молодом возрасте или если заболевание имеет более одного родственника, риск развития колоректального рака увеличивается в три-шесть раз по сравнению с населением в целом.
Колоректальный рак у молодых людей
- В 2020 году будет диагностировано около 18 000 случаев колоректального рака у людей в возрасте до 50 лет, что эквивалентно 49 новым случаям в день.
- Возраст каждого пятого пациента с колоректальным раком составляет от 20 до 54 лет.
- Это 3-я ведущая причина смерти от рака среди молодых людей.
- Риск колоректального рака увеличивается с возрастом; 90% случаев диагностируются у лиц в возрасте 50 лет и старше.
- В то время как заболеваемость колоректальным раком снижается среди взрослых в возрасте 50 лет и старше, заболеваемость колоректальным раком увеличивается среди взрослых в возрасте до 50 лет.
- У людей, родившихся после 1990 года, в 2 раза выше риск развития рака толстой кишки и в 4 раза выше риск развития рака прямой кишки, чем у людей, родившихся в 1950 году.
- В 2020 году будет зарегистрировано 49 новых случаев колоректального рака у людей моложе 50 лет, диагностируемых в день, или 18 000 за год.
- У людей молодого возраста чаще, чем у людей старшего возраста, была диагностирована поздняя стадия рака толстой кишки или прямой кишки, поскольку они не достигли рекомендованного возраста для проведения скрининга.
Как насчет скрининга?
- По данным Американского онкологического общества, мужчины и женщины должны начинать скрининг на колоректальный рак в возрасте 45 лет.
- Доступно множество скрининговых тестов, в том числе некоторые неинвазивные и недорогие тесты, которые можно провести в уединении вашего собственного дома.
- По оценке Национального круглого стола по вопросам колоректального рака, если бы 80% подходящего населения прошли обследование в возрасте 50 лет, количество смертей, связанных с колоректальным раком, могло бы сократиться на 230 000.
- Скрининг имеет потенциал для выявления и даже предотвращения колоректального рака, поскольку полипы (предшественники рака) могут быть удалены во время скрининга с помощью колоноскопии.
- Прохождение скрининга с рекомендованной частотой увеличивает вероятность того, что при наличии колоректального рака он будет обнаружен на более ранней стадии.
- Когда колоректальный рак обнаруживается на ранних стадиях, вероятность его излечения выше, лечение менее обширное, а выздоровление происходит намного быстрее.
- Риск развития или смерти от колоректального рака можно снизить, поддерживая здоровую массу тела, регулярно занимаясь физическими упражнениями, ограничивая потребление красного и переработанного мяса, а также отказываясь от курения.
Что еще?
- За последние десять лет показатели скрининга на колоректальный рак увеличились, но показатели все еще остаются низкими, особенно среди тех, кто не имеет страховки.
- Уровень заболеваемости колоректальным раком у лиц возраста скрининга снижается в США с середины 1980-х годов из-за повышения осведомленности и скрининга.
- Колоректальный рак обычно развивается медленно в течение 10–15 лет.
- Заболеваемость раком прямой кишки в США сильно различается в зависимости от географического региона.Факторы, способствующие этому, включают региональные различия в факторах риска и доступ к скринингу и лечению.
- Расовые / этнические группы имеют более высокий уровень смертности от колоректального рака, потому что они с меньшей вероятностью будут обследованы вовремя, у них меньше доступа к скринингу и с меньшей вероятностью будет обнаружен колоректальный рак на самых ранних стадиях.
- 51% людей в возрасте от 50 до 54 лет не прошли скрининг на колоректальный рак.
- Общая стоимость лечения колоректального рака в США составляет около 14 миллиардов долларов в год.
- При своевременном обследовании и тестировании колоректальный рак является предотвратимым , излечимым и победимым .
Список литературы
Американское онкологическое общество: основные статистические данные по колоректальному раку
Пресс-релиз Американского онкологического общества: перенос бремени колоректального рака на людей более молодого возраста
Американское онкологическое общество: выживаемость при колоректальном раке
Национальные институты здравоохранения: прогноз затрат на лечение рака
Далее >> Каковы симптомы?
Информация на этих страницах предназначена только для информационных целей.Прежде чем принимать какие-либо медицинские решения, проконсультируйтесь со своим врачом.
Рак толстой кишки II стадии: лечить или не лечить?
Обновленные ссылки
Фотерингем, С., Мозоловски, Г. А., Мюррей, Э. М., и Керр, Д. Дж. (2019). Проблемы и решения в стратегиях лечения пациентов с раком толстой кишки II стадии. Гастроэнтерологический отчет , 7 (3), 151-161.
Каннаркатт, Дж., Джозеф, Дж., Курниали, П. К., Аль-Джанади, А., & Хринченко, Б. (2017). Адъювантная химиотерапия рака толстой кишки II стадии: клиническая дилемма. Журнал онкологической практики , 13 (4), 233-241.
Мейерс, Б. М., Косби, Р., Кереши, Ф., и Джонкер, Д. (2017). Адъювантная химиотерапия рака толстой кишки II и III стадии после полной резекции: систематический обзор Cancer Care Ontario. Клиническая онкология , 29 (7), 459-465.
Национальные всеобъемлющие правила сети по борьбе с раком Версия 2.Рак толстой кишки 2021 года. www.nccn.org
Исходные ссылки
Де Доссо, С., Сесса, К., и Салетти, П. (2009). Адъювантная терапия рака толстой кишки: настоящее и перспективы. Cancer Treat Rev, 35 (2), 160–166.
Gangadhar, T., & Schilsky, R.L. Молекулярные маркеры для индивидуальной адъювантной терапии рака толстой кишки. Нат Рев Клин Онкол .
Gill, S. et al. Объединенный анализ адъювантной терапии на основе фторурацила для лечения рака толстой кишки II и III стадии: кому и в какой степени? Дж.Clin. Онкол. 22, 1797-1806 (2004).
Glas, A.M., et al. Разработка и проверка надежной прогностической и прогностической подписи для пациентов с колоректальным раком (CRC). Журнал клинической онкологии , Протоколы ежегодного собрания ASCO 2009 г. Том 27, № 15S (Приложение от 20 мая), 2009 г .: 4036.
Halling, K.C., French, A.J. и С.К. McDonnell et al. , Нестабильность микросателлитов и аллельный дисбаланс 8p при колоректальном раке стадии B2 и C, J Natl Cancer Inst 91 (1999), стр.1295–1303.
Kerr, D et al. (2009). Количественный мультигенный анализ ОТ-ПЦР для прогнозирования рецидива рака толстой кишки II стадии: отбор генов в четырех крупных исследованиях и результаты независимого проспективно разработанного валидационного исследования QUASAR (аннотация 4000). J Clin Oncology , 27 (доп. 15).
Lanza, G, Matteuzzi, M and R. Gafá et al. , Аллельная потеря хромосомы 18q и прогноз при раке толстой кишки II и III стадии, Int J Cancer 79 (1998), стр.390–395.
Ле Войер, Т. Е., Сигурдсон, Э. Р., Хэнлон, А. Л., Майер, Р. Дж., Макдональд, Дж. С., Каталано, П. Дж. И др. (2003). Выживаемость рака толстой кишки связана с увеличением количества анализируемых лимфатических узлов: вторичный обзор межгруппового исследования INT-0089. Дж. Клин Онкол, 21 (15), 2912-2919.
Маршалл, Дж. Л. Оценка риска колоректального рака II стадии. Онкология (Уиллистон-Парк), 24 (1 Приложение 1), 9-13.
Макклири, Н. Дж., И Мейерхардт, Дж.A. Новые разработки в адъювантной терапии рака толстой кишки II стадии. Оценка риска у пожилого пациента. Онкология (Уиллистон-Парк), 24 (1 Приложение 1), 3-8.
Moertel, C. G., Fleming, T. R., Macdonald, J. S., Haller, D. G., Laurie, J. A., Tangen, C. M., et al. (1995). Межгрупповое исследование фторурацила и левамизола в качестве адъювантной терапии для рака толстой кишки стадии II / В2 по Дьюку. Дж. Клин Онкол, 13 (12), 2936-2943.
О’Коннелл, Дж. Б., Маггард, М. А., и Ко, К.Ю. (2004). Показатели выживаемости рака толстой кишки с новой стадией шестого издания Американского объединенного комитета по раку. J Natl Cancer Inst, 96 (19), 1420-1425.
Куах, Х. М., Чоу, Дж. Ф., Гонен, М., Шайа, Дж., Шраг, Д., Ландманн, Р. Г. и др. (2008). Идентификация пациентов с раком толстой кишки II стадии высокого риска для адъювантной терапии. Dis Colon Rectum, 51 (5), 503-507.
Ribic, C.M. et al. Статус микросателлитной нестабильности опухоли как прогностический фактор преимущества адъювантной химиотерапии на основе фторурацила при раке толстой кишки. N. Engl. J. Med. 349 , 247-257 (2003).
Salazar, R., et al. Разработка и проверка надежного высокопроизводительного теста на экспрессию генов (ColoPrint) для стратификации риска у пациентов с раком толстой кишки. Симпозиум по онкологическим заболеваниям желудочно-кишечного тракта ASCO 2010, Реферат № 295.
Sargent, D. J. et al. Подтверждение дефицита репарации ошибочного спаривания (dMMR) в качестве прогностического маркера отсутствия пользы от химиотерапии на основе 5-FU при II и III стадии рака толстой кишки (CC): объединенный молекулярный реанализ рандомизированных испытаний химиотерапии. J. Clin. Онкол. (Тезисы собраний) 29, 4008 (2008).
Шраг, Д., Рифас-Шиман, С., Сальц, Л., Бах, П. Б., и Бегг, К. Б. (2002). Использование адъювантной химиотерапии для участников программы Medicare с раком толстой кишки II стадии. J Clin Oncol, 20 (19), 3999-4005.
Vicuna, B., & Benson, A. B., 3rd. (2007). Адъювантная терапия рака толстой кишки II стадии: прогностические и прогностические маркеры. J Natl Compr Canc Netw, 5 (9), 927-936.
Вайзер, М.R., Landmann, R.G., Kattan, M. W., Gonen, M., Shia, J., Chou, J., et al. (2008). Индивидуальный прогноз рецидива рака толстой кишки с помощью номограммы. Дж. Клин Онкол, 26 (3), 380-385.
Фактическая выживаемость после резекции первичного колоректального рака: результаты проспективного многоцентрового исследования | Всемирный журнал хирургической онкологии
Глобальная обсерватория рака (GCO). https://gco.iarc.fr/. По состоянию на август 2020 г.
Dienstmann R, Mason MJ, Sinicrope FA, Phipps AI, Tejpar S, Nesbakken A, et al.Прогнозирование общей выживаемости при раке толстой кишки II и III стадии вне системы TNM: ретроспективное объединенное исследование биомаркеров. Энн Онкол. 2017; 28 (5): 1023–31. https://doi.org/10.1093/annonc/mdx052.
CAS
Статья
PubMed
PubMed Central
Google ученый
Karahalios A, English DR, Simpson JA. Изменение веса и риск колоректального рака: систематический обзор и метаанализ. Am J Epidemiol. 2015; 181 (11): 832–45.https://doi.org/10.1093/aje/kwu357.
Артикул
PubMed
Google ученый
Лауби-Секретан Б., Скоччанти С., Лумис Д., Гросс Й., Бьянкини Ф., Стрейф К. и др. Ожирение и рак — точка зрения Рабочей группы IARC. N Engl J Med. 2016; 375 (8): 794–8. https://doi.org/10.1056/NEJMsr1606602.
Артикул
PubMed
PubMed Central
Google ученый
Yuhara H, Steinmaus C, Cohen SE, Corley DA, Tei Y, Buffler PA. Является ли сахарный диабет независимым фактором риска рака толстой и прямой кишки? Am J Gastroenterol. 2011; 106 (11): 1911–21; викторина 1922 года. https://doi.org/10.1038/ajg.2011.301.
Артикул
PubMed
PubMed Central
Google ученый
Longo WE, Johnson FE. Предоперационная оценка и послеоперационное наблюдение за пациентами с раком прямой и толстой кишки.Surg Clin North Am. 2002. 82 (5): 1091–108. https://doi.org/10.1016/S0039-6109(02)00050-6.
Артикул
PubMed
Google ученый
Общество AC. Факты и цифры о раке, 2020 г. Am Cancer Soc J CA. 2020. с. 3.
Rondeau V, Schaffner E, Corbiere F, Gonzalez JR, Mathoulin-Pelissier S. Модели лечения слабости для данных о выживаемости: применение к рецидивам рака груди и повторной госпитализации при колоректальном раке.Stat Methods Med Res. 2013; 22 (3): 243–60. https://doi.org/10.1177/0962280210395521.
Артикул
PubMed
Google ученый
Lambert PC, Thompson JR, Weston CL, Dickman PW. Оценка и моделирование доли излечения в популяционном анализе выживаемости при раке. Биостатистика. 2007. 8 (3): 576–94. https://doi.org/10.1093/biostatistics/kxl030.
Артикул
PubMed
Google ученый
Primrose JN, Perera R, Gray A, Rose P, Fuller A, Corkhill A и др. Эффект от 3 до 5 лет планового последующего наблюдения CEA и CT для выявления рецидива колоректального рака: рандомизированное клиническое исследование FACS. ДЖАМА. 2014; 311 (3): 263–70. https://doi.org/10.1001/jama.2013.285718.
CAS
Статья
PubMed
Google ученый
Вилле-Йоргенсен П., Сык И., Смед К., Лаурберг С., Нильсен Д.Т., Петерсен С.Х. и др. Влияние более или менее частого последующего обследования на общую и специфическую смертность от рака прямой кишки у пациентов с колоректальным раком II или III стадии: рандомизированное клиническое исследование COLOFOL.ДЖАМА. 2018; 319 (20): 2095–103. https://doi.org/10.1001/jama.2018.5623.
Артикул
PubMed
PubMed Central
Google ученый
Голландский институт рака. Руководство по колоректальному раку. 2017.
Google ученый
Yu Y, Carey M, Pollett W., Green J, Dicks E, Parfrey P, et al. Характеристики долгосрочной выживаемости когорты пациентов с колоректальным раком и исходные переменные, связанные с исходами выживаемости с или без эффектов, изменяющихся во времени.BMC Med. 2019; 17 (1): 150. https://doi.org/10.1186/s12916-019-1379-5.
Артикул
PubMed
PubMed Central
Google ученый
Бувье А.М., Лонуа Г., Бувье В., Ролло Ф., Манфреди С., Фавр Дж. И др. Частота и характер поздних рецидивов у больных раком толстой кишки. Int J Cancer. 2015; 137 (9): 2133–8. https://doi.org/10.1002/ijc.29578.
CAS
Статья
PubMed
Google ученый
Lalmahomed ZS, Coebergh van den Braak RRJ, Oomen MHA, Arshad SP, Riegman PHJ, IJzermans JN, et al. Многоцентровый отбор образцов свежезамороженной ткани при колоректальном раке: соответствует ли качество стандартам современных исследований биомаркеров? Банк клеточной ткани. 2017; 18 (3): 425–31. https://doi.org/10.1007/s10561-017-9613-x.
CAS
Статья
PubMed
PubMed Central
Google ученый
Клоостерман В.П., Коберг ван ден Браак Р.Р.Дж., Питерс М., ван Роосмален М.Дж., Сивертс А.М., Штангл С. и др.Систематический анализ онкогенных слияний генов при первичном раке толстой кишки. Cancer Res. 2017; 77 (14): 3814–22. https://doi.org/10.1158/0008-5472.CAN-16-3563.
CAS
Статья
PubMed
Google ученый
Creasy JM, Sadot E, Koerkamp BG, Chou JF, Gonen M, Kemeny NE, et al. Фактическая 10-летняя выживаемость после резекции колоректального метастаза в печень: какие факторы препятствуют излечению? Операция. 2018; 163 (6): 1238–44. https: // doi.org / 10.1016 / j.surg.2018.01.004.
Артикул
Google ученый
van Vugt JLA, Buettner S, Levolger S, Coebergh van den Braak RRJ, Suker M, Gaspersz MP, et al. Низкая масса скелетных мышц связана с повышенными расходами в больнице у пациентов, перенесших операцию по удалению рака пищеварительного тракта. PLoS One. 2017; 12 (10): e0186547. https://doi.org/10.1371/journal.pone.0186547.
CAS
Статья
PubMed
PubMed Central
Google ученый
Othus M, Barlogie B, Leblanc ML, Crowley JJ. Модели лечения как полезный статистический инструмент для анализа выживаемости. Clin Cancer Res. 2012. 18 (14): 3731–6. https://doi.org/10.1158/1078-0432.CCR-11-2859.
Артикул
PubMed
PubMed Central
Google ученый
Йилмаз Ю.Е., Лоулесс Ю.Ф., Андрулис И.Л., Бык С.Б. Выводы из моделирования молекулярных маркеров для прогноза рака груди. J Clin Oncol. 2013. 31 (16): 2047–54.https://doi.org/10.1200/JCO.2012.46.6615.
Артикул
PubMed
Google ученый
Sy JP, Taylor JM. Оценка в модели лечения пропорциональных рисков Кокса. Биометрия. 2000. 56 (1): 227–36. https://doi.org/10.1111/j.0006-341X.2000.00227.x.
CAS
Статья
PubMed
Google ученый
Chao Cai YZ, Peng Y, Zhang J. Подбирайте полупараметрические модели для отверждения смеси.В: Пакет R для оценки полупараметрических моделей отверждения смеси PH и AFT, т. 2.0; 2012.
Google ученый
Гундерсон Л.Л., Джессап Дж. М., Сарджент Д. Д., Грин Флорида, Стюарт А. К.. Пересмотренная классификация TN для рака толстой кишки, основанная на национальных данных о выживаемости. J Clin Oncol. 2010. 28 (2): 264–71. https://doi.org/10.1200/JCO.2009.24.0952.
Артикул
PubMed
Google ученый
Бленкинсопп В.К., Стюарт-Браун С., Блесовский Л., Кирни Г., Филдинг Л.П. Гистопатологические отчеты при раке толстой кишки. J Clin Pathol. 1981; 34 (5): 509–13. https://doi.org/10.1136/jcp.34.5.509.
CAS
Статья
PubMed
PubMed Central
Google ученый
Шнайдер Н.И., Лангнер С. Прогностическая стратификация пациентов с колоректальным раком: современные перспективы. Cancer Manag Res. 2014; 6: 291–300. https://doi.org/10.2147 / CMAR.S38827.
Артикул
PubMed
PubMed Central
Google ученый
Серрано Дель Мораль А, Перес Вьехо Э, Мансанедо Ромеро I, Родригес Каравака Г., Перейра Перес Ф. Систематическая вторичная хирургия плюс HIPEC у пациентов без признаков рецидива, с высоким риском карциноматоза после резекции колоректального рака . Cir Esp. 2018; 96 (2): 96–101. https://doi.org/10.1016/j.ciresp.2017.11.006.
Артикул
PubMed
Google ученый
Элиас Д., Оноре С., Дюмон Ф., Дюкре М., Бойдж В., Малка Д. и др. Результаты систематической вторичной хирургии плюс hipec у бессимптомных пациентов с высоким риском развития колоректального перитонеального карциноматоза. Ann Surg. 2011; 254 (2): 289–93. https://doi.org/10.1097/SLA.0b013e31822638f6.
CAS
Статья
PubMed
Google ученый
Sammartino P, Sibio S, Biacchi D, Cardi M, Mingazzini P, Rosati MS, et al.Долгосрочные результаты после проактивного лечения для локорегионального контроля у пациентов с раком толстой кишки с высоким риском перитонеальных метастазов. Int J Colorectal Dis. 2014; 29 (9): 1081–9. https://doi.org/10.1007/s00384-014-1929-4.
CAS
Статья
PubMed
Google ученый
Моран Б.Дж. ПРОФИЛОЧИП: отсутствие преимуществ повторной хирургии плюс HIPEC при колоректальных перитонеальных метастазах. Ланцет Онкол. 2020; 21 (9): 1124–5. https: // doi.org / 10.1016 / S1470-2045 (20) 30338-7.
Артикул
PubMed
Google ученый
Клавер С.Э., Висселинк Д.Д., Пунт С.Я., Снаебьорнссон П., Крези Дж., Альберс А. и др. Адъювантный HIPEC у пациентов с раком толстой кишки с высоким риском перитонеальных метастазов: основной результат многоцентрового рандомизированного исследования COLOPEC. J Clin Oncol. 2019; 37: 482.
Багестани А.Р., Данешва Т., Поурхосинголи М.А., Асадзаде Х. Выживание колоректального рака при наличии конкурирующих рисков — моделирование Weibull Distribution.Азиатский Pac J Cancer Prev. 2016; 17 (3): 1193–6. https://doi.org/10.7314/APJCP.2016.17.3.1193.
Артикул
PubMed
Google ученый
Моррисон Д.С., Парр К.Л., Лам Т.Х., Уэшима Х., Ким Х.С., Джи С.Х. и др. Поведенческие и метаболические факторы риска смерти от рака толстой и прямой кишки: анализ данных Азиатско-Тихоокеанского сотрудничества когортных исследований. Азиатский Pac J Cancer Prev. 2013. 14 (2): 1083–7. https://doi.org/10.7314/APJCP.2013.14.2.1083.
Артикул
PubMed
Google ученый
Кри М., Тонита Дж., Тернер Д., Наджент З., Алви Р., Барсс Р. и др. Сравнение полученного лечения с давно существующими рекомендациями для пациентов с раком прямой кишки III стадии и II / III стадии рака прямой кишки, диагностированным в Альберте, Саскачеване и Манитобе в 2004 г. Clin Colorectal Cancer. 2009. 8 (3): 141–5. https://doi.org/10.3816/CCC.2009.n.023.
Артикул
PubMed
Google ученый
Winget M, Hossain S, Yasui Y, Scarfe A. Характеристики пациентов с аденокарциномой толстой кишки III стадии, которые не получают рекомендованного в руководстве лечения. Рак. 2010. 116 (20): 4849–56. https://doi.org/10.1002/cncr.25250.
Артикул
PubMed
Google ученый
Lemmens VE, van Halteren AH, Janssen-Heijnen ML, Vreugdenhil G, Repelaer van Driel OJ, Coebergh JW. Адъювантное лечение пожилых пациентов с раком толстой кишки III стадии на юге Нидерландов зависит от социально-экономического статуса, пола и сопутствующих заболеваний.Энн Онкол. 2005. 16 (5): 767–72. https://doi.org/10.1093/annonc/mdi159.
CAS
Статья
PubMed
Google ученый
Quipourt V, Jooste V, Cottet V, Faivre J, Bouvier AM. Одни только сопутствующие заболевания не объясняют недостаточное лечение колоректального рака у пожилых людей: французское популяционное исследование. J Am Geriatr Soc. 2011. 59 (4): 694–8. https://doi.org/10.1111/j.1532-5415.2011.03334.x.
Артикул
PubMed
Google ученый
van Erning FN, van Steenbergen LN, Lemmens V, Rutten HJT, Martijn H, van Spronsen DJ, et al. Условное выживание для длительно перенесших колоректальный рак в Нидерландах: у кого лучше? Eur J Cancer. 2014; 50 (10): 1731–9. https://doi.org/10.1016/j.ejca.2014.04.009.
Артикул
PubMed
Google ученый
Azizmohammad Looha M, Pourhoseingholi MA, Nasserinejad M, Najafimehr H, Zali MR. Применение непараметрической модели скорости излечения без использования смеси для анализа выживаемости пациентов с колоректальным раком в Иране.Эпидемиол. Здоровье. 2018; 40: e2018045. https://doi.org/10.4178/epih.e2018045.
Артикул
PubMed
PubMed Central
Google ученый
Paulson EC, Wirtalla C, Armstrong K, Mahmoud NN. Пол влияет на лечение и выживаемость в хирургии колоректального рака. Dis Colon Rectum. 2009. 52 (12): 1982–91. https://doi.org/10.1007/DCR.0b013e3181beb42a.
Артикул
PubMed
Google ученый
McArdle CS, Макмиллан, округ Колумбия, Hole DJ. Мужской пол отрицательно влияет на выживаемость после операции по поводу колоректального рака. Br J Surg. 2003. 90 (6): 711–5. https://doi.org/10.1002/bjs.4098.
CAS
Статья
PubMed
Google ученый
Majek O, Gondos A, Jansen L, Emrich K, Holleczek B, Katalinic A, et al. Половые различия в выживаемости при колоректальном раке: популяционный анализ 164 996 пациентов с колоректальным раком в Германии.PLoS One. 2013; 8 (7): e68077. https://doi.org/10.1371/journal.pone.0068077.
CAS
Статья
PubMed
PubMed Central
Google ученый
Micheli A, Ciampichini R, Oberaigner W., Ciccolallo L, de Vries E, Izarzugaza I, et al. Преимущество женщин в выживаемости от рака: анализ данных EUROCARE-4. Eur J Cancer. 2009. 45 (6): 1017–27. https://doi.org/10.1016/j.ejca.2008.11.008.
CAS
Статья
PubMed
Google ученый
van Eeghen EE, Bakker SD, van Bochove A, Loffeld RJ. Влияние возраста и коморбидности на выживаемость при колоректальном раке. J Гастроинтест Онкол. 2015; 6 (6): 605–12. https://doi.org/10.3978/j.issn.2078-6891.2015.070.
Артикул
PubMed
PubMed Central
Google ученый
Пуле М.Л., Бакли Э., Нийонсенга Т., Родер Д. Влияние коморбидности на смертность от колоректального рака в австралийской онкологической популяции. Научный представитель2019; 9 (1): 8580. https://doi.org/10.1038/s41598-019-44969-8.
CAS
Статья
PubMed
PubMed Central
Google ученый
Guinney J, Dienstmann R, Wang X, de Reynies A, Schlicker A, Soneson C, et al. Консенсусные молекулярные подтипы колоректального рака. Nat Med. 2015; 21 (11): 1350–6. https://doi.org/10.1038/nm.3967.
CAS
Статья
PubMed
PubMed Central
Google ученый
Прогноз колоректального рака в специализированной больнице Тикур Анбесса, единственном онкологическом центре в Эфиопии
Аннотация
Введение
Колоректальный рак является третьим по частоте диагностированием рака у мужчин и вторым во всем мире среди женщин.По данным ракового регистра Аддис-Абебы, он является первым среди мужчин и четвертым среди женщин в Эфиопии. Однако исследований прогностических факторов и выживаемости при колоректальном раке не проводилось. Следовательно, это исследование было направлено на оценку времени выживания и выявление прогностических факторов.
Методы
В этом ретроспективном исследовании, проведенном в учреждении, в качестве источников данных использовались обзор медицинских карт 422 пациентов с колоректальным раком и телефонное интервью. Время выживания оценивали с помощью оценщика Каплана-Мейера.Прогностические факторы были определены с использованием многомерной регрессионной модели Кокса.
Результаты
Пациенты с диагнозом рака прямой кишки имели на 76% (HR: 1,761, 95% CI: 1,173–2,644) повышенный риск смерти по сравнению с пациентами с раком толстой кишки. У пациентов с положительным лимфоузлом вероятность смерти была в 3,146 (95% ДИ: 1,626–6,078) раза по сравнению с пациентами с отрицательным узлом, а у пациентов с метастатическим раком вероятность смерти была в 4,221 раза (95% ДИ: 2,788–6,392) раза по сравнению с пациентами без метастазов. Адъювантная терапия снизила риск смерти на 36.1% (ОР: 0,639 (95% ДИ: 0,418–0,977)) по сравнению с пациентами, которым была выполнена только хирургическая резекция. Среднее время выживания составляло 39 месяцев, а общая пятилетняя выживаемость составляла 33%.
Выводы
Общая выживаемость была низкой, и большинство пациентов на момент обращения были молоды. На выживаемость пациента в значительной степени влияет запущенная стадия рака на момент обращения и задержки в назначении адъювантной терапии. Адъювантная терапия была одним из хороших прогностических факторов.
Образец цитирования: Этисса Е.К., Ассефа М., Айеле Б.Т. (2021) Прогноз колоректального рака в специализированной больнице Тикур Анбесса, единственном онкологическом центре в Эфиопии. PLoS ONE 16 (2):
e0246424.
https://doi.org/10.1371/journal.pone.0246424
Редактор: Чих-Пин Чуу, Национальные научно-исследовательские институты здравоохранения, ТАЙВАНЬ
Поступила: 11 февраля 2020 г .; Одобрена: 16 января 2021 г .; Опубликовано: 2 февраля 2021 г.
Авторские права: © 2021 Etissa et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах с вспомогательной информацией.
Финансирование: Автор (ы) не получил специального финансирования для этой работы.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Рак является ведущей причиной смерти во всем мире, превосходя показатели смертности от туберкулеза, малярии и ВИЧ / СПИДа вместе взятых, и незаметно занимает центральное место. Колоректальный рак — это рак толстой кишки. Анатомически он также известен как рак толстой кишки или рак прямой кишки, но когда оба они имеют схожие черты, их называют колоректальным раком (CRC) [1–5]. Клиническая картина CRC зависит от его размера, наличия или отсутствия метастазов и расположения опухоли.Ранний CRC часто протекает бессимптомно [6]. CRC является третьим по частоте диагностированием рака у мужчин и вторым у женщин, что делает это заболевание второй по частоте причиной смерти, связанной с раком, во всем мире и остается одним из самых серьезных раковых заболеваний-убийц в мире. Ожидается, что его бремя будет увеличиваться. Несмотря на это возрастающее бремя, в Африке КПР продолжает получать относительно низкий приоритет общественного здравоохранения из-за ограниченных ресурсов и большего числа других быстрых заболеваний [3,5,7,8].
В Эфиопии CRC является третьим по распространенности раком среди всего взрослого населения, и пациенты часто имеют запущенные стадии рака [9].Согласно данным ракового регистра Аддис-Абебы, он является первым среди мужчин и четвертым среди женщин [10]. Из 14 500 случаев смерти мужчин, связанных с раком, 11,2% были вызваны CRC, а 4,8% из 26 200 случаев смерти женщин, связанных с раком, были вызваны CRC [11]. В настоящее время CRC является наиболее распространенным раком, составляющим 13% всех злокачественных опухолей желудочно-кишечного тракта. Больше смертей от CRC (52%) происходит в менее развитых регионах мира, что отражает более низкую выживаемость в этих регионах [3,12].
Различные исследования показали, что выживаемость CRC в основном определяется возрастом на момент постановки диагноза, осложненным колоректальным раком (перфорация, непроходимость, кровотечение), местом опухоли, степенью опухоли, зрелостью опухоли, размером опухоли, поражением лимфатических узлов, отдаленными метастазами, методами лечения и осложнениями. после лечения.В некоторых литературных источниках сообщается, что пол, образовательный статус, семейный анамнез, предоперационный уровень карциноэмбрионального антигена (CEA) и лимфоваскулярная инвазия являются значимыми прогностическими факторами [13–16]. Самые высокие показатели пятилетней выживаемости (72%) были в Израиле и Северной Корее, в Северной Америке, Европе и Австралии / Новой Зеландии выживаемость колеблется от 65% до 70%, 55% в других развитых странах, 39% в развивающихся странах, включая Индия и 14% в Африке [6,17,18].
В Африке данные о выживаемости CRC скудны.В Эфиопии, насколько нам известно, не проводились исследования прогностических факторов и выживаемости при колоректальном раке. По этим причинам в этом исследовании изучались выживаемость и прогностические факторы пациентов с колоректальным раком в специализированной больнице Тикур Анбесса (TASH) в Аддис-Абебе, Эфиопия.
Материалы и методы
Было проведено ретроспективное исследование пациентов с колоректальным раком, направленных в центр лучевой терапии TASH с января 2012 года по декабрь 2016 года. TASH — единственный онкологический и онкологический справочный центр, предоставляющий услуги для большинства больных раком со всей страны [ 19].
Были изучены медицинские карты 422 пациентов с колоректальным раком, и последующие телефонные разговоры использовались для выяснения жизненного статуса пациентов. Время наблюдения — от даты первого подтвержденного диагноза до даты смерти, даты потери до наблюдения или даты последнего контакта. Цензурированными считались пациенты с неизвестным жизненным статусом или живые пациенты при последнем контакте (по телефону). Тринадцать пациентов, не соответствующих критериям включения, были исключены из исследования. Данные о социально-демографических характеристиках, генетическом факторе (семейный анамнез CRC), сопутствующих заболеваниях (ВИЧ / СПИД, сахарный диабет и гипертония) и патологических характеристиках (локализация первичной опухоли, гистопатология, степень опухоли, размер опухоли, метастазы в лимфатические узлы, отдаленные метастазы, лимфоваскулярная инвазия, периневральная инвазия и предоперационный уровень CEA и метод лечения) были извлечены из медицинских карт.
Учет размера выборки
Определение размера выборки началось с определения d (количества событий), поскольку количество наблюдаемых событий имеет значение, превышающее общее количество пациентов при анализе данных о выживаемости. Требуемое общее количество событий (Freedman 1982) было рассчитано с использованием [20]:
d =, при условии, что Δ = коэффициент опасности постоянен во времени. Для двустороннего логрангового теста (H 0 : Δ = 1 против H A : Δ ≠ 1).
Тогда необходимое общее количество пациентов можно рассчитать как. Предыдущее аналогичное исследование, проведенное в Гане, показало, что функция выживаемости (s (t)) = 0,16, поэтому мы использовали s ( t ) = 0,16. Мы также знаем, что Δ = −log ( с ( t )) = log (0,16) = 1,832.
Для получения общего размера выборки, необходимого для получения степени 90%, отношения рисков 1,832 и двустороннего уровня значимости 5%, необходимое количество событий составляет:
Z α / 2 = 1.96 для доверительной вероятности 95% и Z β = вероятность совершения ошибки типа II, чтобы получить степень 90%.
Соответственно.
Поправка на потерю 20%. .
Требуемый размер выборки составлял 172. Тем не менее, в исследование были включены все пациенты с колоректальным раком, пролеченные в TASH с 2012 по 2016 год и соответствующие критериям включения. Следовательно, выборка, использованная для этого исследования, составила 422 человека.
План анализа
Анализ проводился с использованием SPSS версии 25 и Stata версии 14.Описательный анализ проводился с использованием частоты, процентов и медианы. Время выживания оценивали по методу Каплана-Мейера. Лог-ранговый тест использовался для сравнения (общей) выживаемости двух или более групп и определения потенциальных прогностических переменных. В одномерном анализе переменные с p <0,25 были введены в многомерную регрессионную модель Кокса. Отклонение от допущения о пропорциональном риске регрессионной модели Кокса было исследовано с использованием графиков масштабированных остатков Шенфельда, глобального теста и логарифмического преобразования кривых выживаемости Каплана-Майера категориальных переменных.Прогностические факторы выживаемости при колоректальном раке были определены с использованием многофакторной регрессионной модели Кокса. Значение P менее 0,05 считалось статистически значимым.
Этическое одобрение и согласие на участие
Чтобы получить доступ к медицинской документации, письмо об этическом одобрении предлагаемого исследования было получено от комитета по этике исследований Института GAMBY Medical and Business Sciences College (GCA.A 20/2010) в специализированную больницу Тикур Анбесса. Из специализированной больницы Тикур Анбесса было получено письмо с разрешением на извлечение данных из медицинских карт.Письменное согласие получить не удалось, так как пациентов не было в учреждении. Устное информированное согласие было получено для пациента, имеющего право на телефонное интервью, засвидетельствовано двумя опытными сборщиками данных, не участвующими в исследовании, и задокументировано в письменной форме. Несовершеннолетние в исследование не включались.
Результаты
Сводка исходной информации
В этом ретроспективном исследовании были рассмотрены в общей сложности 422 пациента с колоректальным раком, пролеченных в специализированной больнице Тикур Анбесса с января 2012 года по декабрь 2016 года.Сто семьдесят пять (41,5%) пациентов умерли в период исследования, а остальные 247 (58,5%) были подвергнуты цензуре. Большинство пациентов — 262 (62,1%) — мужчины. Общий средний возраст составил 46 лет с межквартильным размахом (IQR) 23 и 185 (43,9%) были в возрастной группе 40–59 лет. 52 (12,3%) сопутствующие заболевания 28 (6,6%) пациентов были гипертоническими, 15 (3,6%) диабетиками и 7 (1,7%) были ВИЧ-положительными на момент обращения. Подробности представлены в таблице 1.
Как показано в таблице 2, двоеточие, 217 (51.4%) и прямая кишка 144 (34,1%) были наиболее частыми участками рака. Сорок пять (31,3%) пациентов с раком прямой кишки прошли адъювантную химиотерапию или лучевую терапию после операции, 31 (21,5) прошли адъювантную химиотерапию и лучевую терапию после операции и 23 (16%) не получали никакого лечения. У большинства пациентов, 333 (~ 79%), аденокарцинома БДУ, за ней следуют муцинозная аденокарцинома (12,9%) и аденокарцинома с перстневым кольцом (4,7%). У 198 (46,9%) пациентов была высокодифференцированная аденокарцинома.
У большинства пациентов диагностирована первичная опухоль Т3 (46,7%). Около четверти пациентов поступили с патологически подтвержденным поражением регионарных лимфатических узлов. В 57,1% случаев статус лимфатических узлов неизвестен, что означает, что мы не знаем стадию TNM в этой группе пациентов. Почти половина (49,3%) пациентов получали адъювантную химиотерапию или лучевую терапию после операции. Всем пациентам, прошедшим адъювантную терапию, была проведена операция.
Годовая заболеваемость и выживаемость больных колоректальным раком
Из 422 пациентов 175 (41.5%) умерли и 144 (34,1%) были живы к октябрю 2018 г., когда статус пациентов обновлялся в последний раз. Жизненное состояние остальных 103 (24,4%) было неизвестно из-за отказа отвечать на звонки и отсутствия работающих телефонов. В целом наблюдалось 822,25 человеко-года со средним сроком наблюдения 19 месяцев (IQR 28). Таким образом, уровень смертности от колоректального рака составляет 21,28% на 100 человеко-лет наблюдения.
График на рис. 1 показывает общую кривую выживаемости пациентов с колоректальным раком в TASH.График показывает, что выживаемость пациентов уменьшается с увеличением времени наблюдения. Общая выживаемость за один, три и пять лет составила 80%, 55% и 33% соответственно. Среднее время общей выживаемости составляло 39 месяцев.
В таблице 3 показаны результаты логрангового теста социально-демографических характеристик и наличия сопутствующих заболеваний у пациентов с CRC. Статистически значимых различий между группами выживания не наблюдалось (P> 0,05), хотя наличие сопутствующих заболеваний, по-видимому, снижало выживаемость пациентов.
Среднее время выживаемости, выживаемость и лог-ранговый тест для патологических и клинических переменных оценивались однофакторно.
Как показано в Таблице 4, патологические и клинические факторы, такие как место первичной опухоли, гистопатология, степень опухоли, размер опухоли, метастаз в лимфатические узлы, отдаленные метастазы и метод лечения, были значительно связаны со временем выживания пациентов (p <0,05). Пациенты с раком толстой кишки и толстой кишки выживали лучше, чем у пациентов с другим распространенным раком прямой кишки.Пациенты с плохо дифференцированной степенью опухоли имели повышенный риск смерти по сравнению с пациентами с хорошо и умеренно дифференцированной степенью опухоли. Среднее время выживания было выше (60 месяцев) среди пациентов с отрицательными лимфоузлами по сравнению с пациентами с положительным диагнозом лимфоузлов (24 месяца). Точно так же пациенты с метастатическим раком имели более низкую 5-летнюю выживаемость (2%). В зависимости от метода лечения пациенты, которые получали адъювантную химиотерапию и адъювантную лучевую терапию после операции и которые получали адъювантную химиотерапию или адъювантную лучевую терапию после операции, имели более высокое среднее время выживания (73 месяца) и (46 месяцев) соответственно.Более низкая средняя продолжительность жизни (6 месяцев) наблюдалась среди тех, кто не получал никакого лечения рака в течение периода наблюдения в TASH. Это связано с тем, что пациенты с запущенным заболеванием не подходят для химиотерапии или лучевой терапии и отказываются начать лечение. Не было получено достаточно данных для таких переменных, как уровень предоперационной CEA, лимфоваскулярная и периневральная инвазия. Следовательно, для этих переменных не проводилось исследование данных.
Результат многомерной регрессионной модели Кокса
Для определения прогностических факторов, переменные с p-значением <= 0.25 при однофакторном анализе (таблицы 3 и 4) были рассмотрены для множественной регрессионной модели Кокса. Следовательно, возраст на момент постановки диагноза (p = 0,159), коморбидность (p = 0,100), локализация первичной опухоли (p <0,01), гистопатология CRC (p = 0,011), степень опухоли (p <0,001), размер опухоли (p <0,001), метастазы в лимфатические узлы (p <0,001), отдаленные метастазы (<0,001), метод лечения (p <0,001) и пол (из-за его важности в онкологическом исследовании) были введены в окончательную модель множественной регрессии Кокса. Предположение о пропорциональном риске было проверено с использованием масштабированных остатков Шенфельда и глобального теста для модели (p = 0.0584). Нам не удалось отвергнуть нулевую гипотезу о том, что опасности пропорциональны. Масштабированные остатки Шенфельда также были нанесены на график для каждой переменной, и наклон был близок к нулю для переменных в модели, а кривые Каплана-Мейера были параллельны для каждой категории переменных в зависимости от времени. Это означает, что допущение о пропорциональном риске не было нарушено для этих данных. Результаты заключительного многомерного регрессионного анализа Кокса представлены в таблице 5. От наибольшего к наименее сильному: отдаленные метастазы (P <0.001), вовлечение лимфатических узлов (P <0,01), методы лечения (p <0,01) и место первичной опухоли (P <0,05) были значительно связаны с выживаемостью.
Пациенты с диагнозом рака прямой кишки имели повышенный риск смерти на 76% (ОР 1,761, 95% ДИ: 1,173–2,644) по сравнению с раком толстой кишки. У пациентов с положительным лимфоузлом вероятность смерти была в 3,146 (95% ДИ: 1,629–6,078) раза по сравнению с пациентами с отрицательным лимфоузлом. Риск смерти от метастатического рака составлял 4,221 (95% ДИ: 2,788–6,392) раза для неметастатических пациентов.Что касается метода лечения, риск смерти был на 36,1% меньше (ОР: 0,639 (95% ДИ: 0,418–0,977)) и на 47,9% меньше (ОР: 0,521 (95% ДИ: 0,279–0,973)) у тех пациентов, которые получали адъювантную химиотерапию. или адъювантная лучевая терапия и которые получали адъювантную химиотерапию и адъювантную лучевую терапию, соответственно, по сравнению с пациентами, которым была выполнена только хирургическая резекция (таблица 5).
Обсуждение
В этом исследовании представлены оценки продолжительности жизни и определены прогностические факторы пациентов с колоректальным раком в единственном онкологическом центре в Эфиопии за период 2012–2016 годов.Наши результаты показали, что средний возраст на момент постановки диагноза составлял 46 лет, а 52,8% диагностированных были моложе 50 лет, что показывает, что большинство пациентов с колоректальным раком в Эфиопии — молодые люди и взрослые среднего возраста, тогда как средний возраст постановки диагноза составлял 70 лет в Германии. Данные из Омана показали, что средний возраст составлял 56 лет, а большинство пациентов, 61,1%, были старше 50 лет. Аналогичным образом, в Иордании средний возраст составлял 62 года для мужчин и 58 лет для женщин. Более половины пациентов были старше 60 лет, что отличается от результата нашего исследования.Способствующим фактором может быть возрастная структура Эфиопии. Это также может быть связано с нездоровой диетой в Эфиопии (высокое потребление жиров и красного мяса), а также может иметь место отсутствие регистрации рождений, поскольку большинство пациентов из сельской местности могут не знать своего точного возраста [21–23].
Около 34% пациентов на момент обращения имели метастатический рак. Это похоже на отчет из Омана (36,8) и Кении (29,1%), но в отличие от отчетов из Германии (28,1%), Ганы (24,9%), Малайзии (24,9%).3%), в Иордании (17,2%) и Иране (6,8%) у пациентов были метастазы [13,16,21–25]. Позднее обращение может быть связано с низкой осведомленностью пациентов о признаках и симптомах колоректального рака, отсутствием программы скрининга, длительной и плохой системой направления к специалистам в Эфиопии. Это могло способствовать наблюдаемой низкой выживаемости пациентов, проходящих лечение в специализированной больнице Тикур Анбеса в Аддис-Абебе, Эфиопия.
В нашем текущем исследовании пятилетняя общая выживаемость (ОВ) составила 33%, что намного ниже, чем показатель ОВ в развитых странах.Самая высокая пятилетняя выживаемость (72%) в Израиле и Северной Корее. Выживаемость колеблется от 65% до 70% в Северной Америке, Европе и Австралии, 63% в Германии и 55% в других развитых странах [17,18,21]. Это могло быть в первую очередь связано с увеличением количества обследований на рак прямой кишки, удалением предраковых аденом, своевременным и продвинутым лечением в развитых странах. В развивающихся странах Азии пятилетняя выживаемость пациентов с CRC колебалась от 33% до 56,9% в Иране, 58,2% в Иордании, 43% и 48%.7% в Малайзии, 42% в Омане, 39% в Индии, 38,6% в Таиланде, что превышает выживаемость пациентов в Эфиопии [13–15,18,22–26]. Причиной такой разницы может быть отсутствие программ скрининга для выявления рака на ранней стадии, слаборазвитая инфраструктура онкологических медицинских учреждений в Эфиопии. Лечение также очень ограничено и недоступно, особенно для пациентов, живущих далеко от TASH, единственного онкологического и онкологического центра в стране. Общая пятилетняя выживаемость пациентов с колоректальным раком в клинической больнице в Гане (n = 221) составила 16%, что ниже общей выживаемости в этом исследовании [16].Различия в методологии, характеристиках населения и наблюдаемом количестве событий могли повлиять на эти различия в выводах.
В нашем исследовании возраст на момент постановки диагноза не был значимым прогностическим фактором, влияющим на выживаемость. Это согласуется с исследованиями, проведенными в Малайзии и Гане [16,25]. Однако это противоречило исследованиям, проведенным в Индии, Иране, Иордании и Таиланде [13,14,23,27,28]. Это могло быть связано с тем, что большинство участников исследования были молоды по сравнению с пациентами в этих исследованиях.Коморбидность также не является значимым прогностическим фактором, влияющим на выживаемость пациента. Этот вывод также согласуется с сообщениями из Ганы, Ирана и Малайзии [15,16,25].
В многофакторной модели регрессии Кокса первичная опухоль (P <0,05), поражение лимфатических узлов (P <0,01), отдаленные метастазы (P <0,001) и методы лечения (p <0,01) были значимыми прогностическими факторами для выживаемости пациентов с колоректальным раком. У пациентов с диагнозом рака прямой кишки на 76% (HR = 1,761) риск смерти был выше, чем у пациентов с раком толстой кишки.Это согласуется с сообщениями из Ирана, где рак прямой кишки имел высокий риск смерти и в значительной степени определяет прогноз [13]. В нашем исследовании это связано с неадекватностью лечения.
В этом исследовании риск смерти был значительно выше для тех пациентов, у которых был диагностирован положительный лимфатический узел (HR = 3,146), по сравнению с отрицательным лимфатическим узлом. Этот вывод согласуется с сообщениями из Ганы, Малайзии, Таиланда и Ирана [13,14,16,25]. Другой вывод этого исследования — риск смерти был в четыре раза выше (HR = 4.221) для пациентов с метастатическим раком по сравнению с пациентами с неметастатическим раком. Этот результат сопоставим с сообщениями, обнаруженными в Гане, Таиланде, Иордании, Малайзии и Иране [13,14,16,23,25]. Поражение узлов и метастатический рак на момент обращения были основными прогностическими факторами для пациентов с колоректальным раком.
Результаты этого исследования показывают, что риск смерти был значительно меньше (HR = 0,639 и 0,521) среди тех, кто получал адъювантную химиотерапию или / или адъювантную лучевую терапию, по сравнению с теми, кто получил только хирургическую резекцию.Это похоже на сообщения из Ганы, Таиланда, Ирана и Малайзии о том, что адъювантная терапия была хорошим прогностическим фактором [13,14,16,25].
Исследование проводилось в единственном онкологическом справочном центре в стране, который оказывает услуги по лечению большинства онкологических больных со всей страны. Следовательно, наши выводы могут отражать ситуацию во всей Эфиопии. Поскольку данные взяты из вторичного источника, некоторые прогностические факторы, такие как семейный анамнез, поражение лимфатических узлов, инвазия лимфатических сосудов, периневральная инвазия и предоперационный уровень CEA, отсутствовали в медицинских записях во время сбора и очистки данных.Кроме того, в наше исследование не была включена важная информация о диете и физической активности, потреблении алкоголя, истории курения, индексе массы тела и осложнениях после лечения. Другое ограничение заключается в том, что только семь пациентов с CRC умерли в учреждении с подробным отчетом о причинах смерти. Смерть остальных 168 пациентов и причины смерти были установлены путем телефонного интервью, а не из отчета о смерти, что может привести к перевыявлению смерти в результате систематической ошибки в установлении причины.
Заключение
В этом исследовании оценивается низкая общая пятилетняя выживаемость.Большинство пациентов были молодыми людьми, у которых диагностирована поздняя стадия рака. На выживаемость пациента в значительной степени влияет продвинутая стадия обращения и задержка в назначении адъювантной терапии. Первичная локализация опухоли, поражение лимфатических узлов, отдаленные метастазы и методы лечения были важными прогностическими факторами колоректального рака. Рак прямой кишки, рак прямой кишки и метастатический рак при представлении пациентов с колоректальным раком снижали выживаемость. В то же время адъювантная терапия увеличивала выживаемость.Адъювантная химиотерапия за счет улучшения доступа к химиотерапии и лучевой терапии улучшит исход.
Благодарности
Авторы хотели бы поблагодарить центр лучевой терапии TASH за предоставление разрешения на извлечение данных для этого исследования и г-на Соломона Асмэра за его поддержку на протяжении всего этого исследования и сотрудников карточной комнаты.
Список литературы
- 1.
Бутаеб А. Двойное бремя инфекционных и неинфекционных заболеваний в развивающихся странах.Труды Королевского общества тропической медицины и гигиены. 2006; 100 (3): 191–9. pmid: 16274715 - 2.
Олсен М. Рак в Африке к югу от Сахары: необходимость новых парадигм в глобальном здравоохранении. Центр изучения долгосрочного будущего имени Фредерика С. Парди, 2015 г. - 3.
Линдси А., Брей Ф., Сигел Ребекка Л., Ферлай Дж., Тьелент Лорте-Дж., Джемаль А. Глобальная статистика рака, 2012 CA CANCER J CLIN. 2015; 65 (2): 87–108. pmid: 25651787 - 4.
О колоректальном раке.Американское онкологическое общество. 2016. - 5.
Брей Ф., Ферли Дж., Сурджоматарам И., Л. Сигель Р., А. Торре Л., Джемаль А. Глобальная статистика рака 2018 г .: Глобальные оценки заболеваемости и смертности от 36 видов рака в 185 странах мира. CA CANCER J CLIN 2018; 68: 394–424. pmid: 30207593 - 6.
Американское онкологическое общество в фактах и цифрах по колоректальному раку, 2014–2016 гг. 2014. - 7.
Глобальный, региональный и национальный уровни возрастной смертности и 240 причин смерти, 1990–2013 годы: систематический анализ для исследования глобального бремени болезней 2013 года.1990–2013 Ланцет. 2015: 385. - 8.
Ирабор Д. Возникновение колоректального рака в Западной Африке: принятие неизбежного. Южноафриканский гастроэнтерологический обзор. 2017 (1): 11–6. pmid: 29962648 - 9.
Национальный план борьбы с раком Эфиопии, 2015 г. - 10.
Memirie S, Habtemariam M, Asefa M, Deressa B, Abayneh G, Tsegaye B и др. Оценка заболеваемости раком в Эфиопии в 2015 г. с использованием данных реестра населения. Журнал глобальной онкологии.2018. pmid: 30241262 - 11.
Всемирная организация здравоохранения — Профили онкологических стран. 2014. - 12.
Информационные бюллетени по раку: колоректальный рак. Международное агентство ВОЗ по изучению рака. 2016. - 13.
Заре-Бандамири М., Ханджани Н., Джахани Ю., Мохаммадианпанах М. Факторы, влияющие на выживаемость пациентов с колоректальным раком в Ширазе, Иран. Азиатско-Тихоокеанский журнал профилактики рака. 2016; 17 (1): 159–63. pmid: 26838203 - 14.
Лаохавиний С., Манечавакаджорн Дж., П. Т.Факторы прогноза выживаемости у больных колоректальным раком. J Med Assoc Thailand. 2010. 93 (10): 1156–66. pmid: 20973318 - 15.
Расули М., Моради Г., Рошани Д., Никкху Б., Гадери Э, Гайтаси Б. Факторы прогноза и выживаемость колоректального рака в провинции Курдистан, Иран: популяционное исследование (2009–2014 гг.). Медицина (Балтимор). 2017; 96 (6). - 16.
Agyemang-Yeboah F, Yorke J, Obirikorang C, Batu E, Acheampong E, Frimpong E и др. Показатели выживаемости при колоректальном раке в Гане: ретроспективное исследование на базе больниц.PLOS ONE. 2018. pmid: 30566456 - 17.
Гранадос-Ромеро Дж., Вальдеррама-Тревиньо А., Контрерас-Флорес Э., Баррера-Мера Б., Энрикес М., Уриарте-Руиз К. и др. Колоректальный рак: обзор. Международный журнал исследований в области медицинских наук. 2017; 5 (11): 4667–76. - 18.
4-е издание Global Cancer Facts & Figures. Американское онкологическое общество, Inc., Исследования по надзору. 2018. - 19.
Гебремедин А., Шимелис Д., Астер Т., Шад А., М. Л. Международная сеть по лечению и исследованиям рака.2012. - 20.
Вольноотпущенник LS. Таблицы количества пациентов, необходимых для клинических испытаний, с использованием логарифмического рангового теста. Статистика в медицине. 1982; 1 (2). - 21.
Майек О., Гондос А., Янсен Л., Эмрих К., Холлечек Б., Каталинич А. и др. Выживаемость от колоректального рака в Германии в начале 21 века. Британский журнал рака. 2012; 106: 1875–80. pmid: 22555397 - 22.
Кумар С., Берни И., Захид К., Соуза П., Белуши М., Меки Т. и др. Характеристики пациентов с колоректальным раком, лечение и выживаемость в Омане — исследование в одном центре.Азиатско-Тихоокеанский журнал профилактики рака. 2015; 16 (12): 4853–8. pmid: 26163603 - 23.
Sharkas G, Arqoub K, Khader Y, Tarawneh M, Nimri O, Al-zaghal M и др. Колоректальный рак в Иордании: выживаемость и связанные с ним факторы. Журнал онкологии 2017. pmid: 28458690 - 24.
Саиди Х., Абдихакин М., Нджихиа Б., Джумба Дж., Киари Дж., Гитхайга Дж. И др. Клинические результаты колоректального рака в Кении. Анналы африканской хирургии. 2011; 7. - 25.
Хассан М., Суан М., Сулар С., Мохаммед Н., Исмаил I, Ахмад Ф.Анализ выживаемости и прогностические факторы для пациентов с колоректальным раком в Малайзии. Азиатско-Тихоокеанский журнал профилактики рака. 2016; 17 (7): 3575–81. - 26.
Магаджи Б., Мой Ф., Рослани А., Лоу В. Показатели выживаемости и предикторы выживаемости среди пациентов с колоректальным раком в малазийской больнице третичного уровня. BMC Рак 2017; 17. - 27.
Yeole BB, Sunny L, Swaminathan R, Sankaranarayanan R, DM P. Выживаемость населения от колоректального рака в Мумбаи (Бомбей), Индия.Eur J Cancer. 2001. 37 (11): 1402–8. pmid: 11435072 - 28.
Asl M, Barfaeie F, Gohari M, Roudbary M, Khodabakhshi R. Анализ выживаемости пациентов с колоректальным раком и его прогностические факторы с использованием регрессии Кокса Razi Journal of Medical Sciences 2015; 22 (130).
Расширенная версия рака толстой кишки | ASCRS
Рак толстой кишки — распространенное злокачественное новообразование в США. Лечение пациентов с раком толстой кишки может быть сложным и может потребовать наличия команды хирургических и медицинских специалистов.В этом обзоре представлена общая информация для пациентов и их семей, включая рак толстой кишки, его факторы риска и симптомы, оценку и стадию рака, а также наиболее распространенные методы лечения. В этом обзоре содержится общая информация для пациентов и их семей о факторах риска, симптомах, оценке и стадии рака, а также о наиболее распространенных методах лечения. Поскольку лечение и прогноз рака прямой кишки часто отличаются от рака толстой кишки, рак прямой кишки рассматривается в отдельном обзоре.
ЧТО ТАКОЕ КОЛОНКА?
Ободочная и прямая кишки являются частями пищеварительной системы. Они образуют длинную мышечную трубку, называемую толстой кишкой (также называемой толстой кишкой). Ободочная кишка — это первые 4–5 футов толстой кишки, а прямая кишка — последние 6 дюймов. Частично переваренная пища попадает в толстую кишку из тонкой кишки. Ободочная кишка удаляет воду и питательные вещества из пищи, а остальное превращает в отходы (кал). Отходы проходят из толстой кишки в прямую кишку, а затем выводятся из организма через задний проход (отверстие).
ЧТО ТАКОЕ РАК толстой кишки?
Рак начинается в клетках, строительных блоках, из которых состоят ткани. Ткани составляют органы тела. Обычно клетки растут и делятся, образуя новые клетки, когда они нужны организму. Когда клетки стареют, они умирают, и их место занимают новые клетки. Иногда этот упорядоченный процесс идет не так. У пациентов с раком толстой кишки новые клетки образуются, когда они не нужны организму, а старые клетки не умирают, когда они должны.Рак, который начинается в толстой кишке, называется раком толстой кишки, а рак, который начинается в прямой кишке, называется раком прямой кишки. Рак, который начинается в любом из этих органов, также может называться колоректальным раком. Эти раковые клетки обладают способностью проникать в стенку толстой кишки или распространяться на лимфатические узлы или другие органы. Хирургическое лечение рака толстой кишки обычно направлено на удаление опухоли и лимфатических узлов рядом с опухолью. Медикаментозное лечение рака толстой кишки обычно является дополнением к хирургическому лечению.
КАК РАСПРОСТРАНЕННЫЙ РАК толстой кишки?
В 2012 году у более чем 103 000 человек в США был диагностирован рак толстой кишки, что сделало его четвертым по распространенности раком как у мужчин, так и у женщин. Около 5% американцев заболевают колоректальным раком в течение жизни. Рак толстой кишки обычно поддается профилактике, поддается лечению и часто излечивается. Тем не менее, более 50 000 американцев ежегодно умирают от колоректального рака, что делает его второй ведущей причиной смертей, связанных с раком.Хирургия — это основная форма лечения. Выживаемость пациента напрямую связана со стадией рака (насколько он запущен). Стадия рака наиболее точно определяется по отчету о патологии, полученному после хирургического удаления и биопсии раковой ткани. Чем раньше будет обнаружен и вылечен рак толстой кишки, тем лучше. Рецидив раковой ткани после операции является серьезной проблемой и часто является основной причиной смерти.
КАКОВЫ ФАКТОРЫ РИСКА РАКА толстой кишки?
Никто не знает точных причин колоректального рака.Врачи часто не могут объяснить, почему у одного человека развивается это заболевание, а у другого — нет. Однако ясно, что колоректальный рак не заразен. Никто не может заразиться этой болезнью от другого человека. Исследования показали, что люди с определенными факторами риска чаще других заболевают колоректальным раком. Фактор риска — это то, что может увеличить вероятность развития болезни.
- Возраст старше 50 лет : Колоректальный рак чаще возникает с возрастом.Более 90% людей с этим заболеванием диагностируются после 50 лет. Средний возраст постановки диагноза — 72 года.
- Диета: Исследования показывают, что диета с высоким содержанием жира (особенно животного жира) и низким содержанием кальция, фолиевой кислоты и клетчатки может повысить риск развития колоректального рака. Кроме того, некоторые исследования показывают, что люди, которые придерживаются диеты с очень низким содержанием фруктов и овощей, могут иметь более высокий риск развития колоректального рака. Однако результаты исследований диеты не всегда совпадают, и необходимы дополнительные исследования, чтобы лучше понять, как диета влияет на риск колоректального рака
- Колоректальные полипы : Полипы — это наросты на внутренней оболочке толстой или прямой кишки.Они часто встречаются у людей старше 50 лет. Большинство полипов доброкачественные (не злокачественные), но некоторые полипы могут прогрессировать до рака. Обнаружение и удаление полипов снижает риск рака прямой кишки.
- Семейный анамнез колоректального рака : Родственники первой степени родства (родители, братья, сестры или дети) человека с колоректальным раком в анамнезе несколько более склонны к развитию этого заболевания, особенно если у родственника был рак в молодой возраст. Если у нескольких близких родственников в анамнезе был колоректальный рак, риск еще выше.
- Генетические изменения : Изменения некоторых генов увеличивают риск колоректального рака.
- Наследственный неполипозный рак толстой кишки (HNPCC) является наиболее распространенным типом наследственного (генетического) колоректального рака. Однако на его долю приходится лишь небольшой процент всех случаев колоректального рака. Это вызвано изменениями в конкретном гене. У большинства людей с измененным геном HNPCC развивается рак толстой кишки, и средний возраст установления диагноза рака толстой кишки составляет 44 года.
- Семейный аденоматозный полипоз (FAP) — редкое наследственное заболевание, при котором в толстой и прямой кишке образуются сотни полипов.Это вызвано изменением определенного гена, называемого геном APC. Если FAP не лечить, это обычно приводит к колоректальному раку к 40 годам. FAP составляет менее 1 процента всех случаев колоректального рака.
- Рак в личном анамнезе : У человека, который уже болел колоректальным раком, может развиться колоректальный рак во второй раз, поэтому после прохождения лечения важно внимательно следить за своими лечащими врачами. Кроме того, женщины, у которых в анамнезе был рак яичников, матки или груди, имеют несколько более высокий риск развития колоректального рака.
- Язвенный колит или болезнь Крона : Человек, который много лет страдал от этих состояний, вызывающих воспаление толстой кишки, имеет повышенный риск развития колоректального рака.
- Курение сигарет : Человек, который курит сигареты, может иметь повышенный риск развития полипов и колоректального рака.
Если у вас колоректальный рак, вы также можете быть обеспокоены тем, что у членов вашей семьи может развиться это заболевание.Людям, которые думают, что они могут подвергаться риску, следует поговорить со своим врачом. Врач может посоветовать способы снизить риск и составить соответствующий график осмотров.
МОЖНО ЛИ ПРЕДОТВРАТИТЬ РАК толстой кишки?
Рак толстой кишки в значительной степени можно предотвратить. Самый важный шаг в предотвращении рака толстой кишки — это пройти скрининговый тест. Из-за продемонстрированного медленного роста большинства первичных поражений, лучшей выживаемости пациентов с ранними стадиями поражений, а также относительной простоты и точности скрининговых тестов, скрининг на рак толстой кишки должен быть частью рутинной помощи всем взрослым в возрасте 45 * лет и старше. .Тем, у кого есть близкие родственники с колоректальным раком, следует начать обследование раньше.
Скрининговые тесты, кроме колоноскопии, могут включать анализ стула на кровь (гемокультацию), фекальную ДНК, гибкую ректороманоскопию (более короткая область) или рентгеновский снимок (бариевая и / или воздушная клизма или специальный тип компьютерной томографии). Любой патологический скрининговый тест должен сопровождаться колоноскопией. Колоноскопия включает в себя обследование с использованием гибкого подвесного инструмента для исследования всей толстой кишки. Полипы можно идентифицировать, и их часто можно удалить во время колоноскопии.По этой причине большинство медицинских работников рекомендуют начинать с колоноскопии в качестве скринингового теста.
Есть некоторые свидетельства того, что диета с высоким содержанием клетчатки и низким содержанием жиров может помочь предотвратить колоректальный рак.
Члены семей людей с HNPCC или FAP могут пройти генетическое тестирование для проверки конкретных генетических изменений. Тем, у кого обнаруживаются отклонения в генах, медицинские работники могут предложить способы снизить риск колоректального рака или улучшить обнаружение этого заболевания.Некоторым пациентам врач может порекомендовать операцию по удалению всей или части толстой и прямой кишки до развития рака.
* В 2018 году, вслед за новыми данными о повышенном риске рака толстой кишки у лиц моложе 50 лет, Американское общество хирургии толстой и прямой кишки изменило рекомендации, чтобы рассмотреть возможность начала скрининга в возрасте 45 лет.
КАКИЕ СИМПТОМЫ РАКА ОБОЛОЧКИ?
Многие виды рака толстой кишки не вызывают никаких симптомов и выявляются при обычных скрининговых обследованиях.Наиболее частый симптом колоректального рака — изменение привычки кишечника. Многие симптомы, часто связанные с заболеванием, не связаны с раком. Другие распространенные незлокачественные проблемы со здоровьем могут вызывать те же симптомы. Однако любому, у кого есть следующие симптомы, следует обратиться к врачу для диагностики и лечения как можно раньше.
Симптомы рака толстой кишки могут включать:
- Диарея или запор
- Чувство, что ваш кишечник не опорожняется полностью
- Обнаружение крови (ярко-красной или очень темной) в стуле
- Стул уже, чем обычно
- Частые газовые боли или судороги, ощущение переполнения или вздутия живота
- Похудание по неизвестной причине
- Усталость
- Тошнота или рвота
Обычно ранний рак не вызывает боли.Важно не ждать, чтобы почувствовать боль, прежде чем обратиться к врачу.
КАК ДИАГНОСТИРУЕТСЯ РАК толстой кишки?
Если результаты скринингового теста указывают на рак или у вас есть симптомы, ваш врач должен выяснить, вызваны ли они раком или какой-либо другой причиной. Колоноскопия — самый распространенный метод диагностики рака толстой кишки, хотя другие тесты могут указывать на диагноз. Во время колоноскопии любая аномальная область (например, полип) проверяется на наличие раковых клеток. Часто аномальная ткань может быть полностью удалена во время колоноскопии.Патолог проверяет ткань на наличие раковых клеток с помощью микроскопа. В настоящее время нет надежных анализов крови для диагностики рака толстой кишки.
ЕСТЬ ЛИ РАЗНЫЕ ТИПЫ РАКА ОБОЛОЧКИ?
Да, однако, более 95% всех случаев рака прямой кишки называются аденокарциномами. Эти виды рака возникают из клеток слизистой оболочки толстой или прямой кишки. Когда врачи говорят о колоректальном раке, они почти всегда имеют в виду именно это. В центре внимания этого обзора — лечение аденокарциномы.Другие гораздо менее распространенные типы опухолей включают карциноидные опухоли, стромальные опухоли желудочно-кишечного тракта (ГИСО), лимфомы и саркомы.
КАК ОЦЕНКА И СТАДИЯ РАКА ОБОЛОЧКИ?
После постановки диагноза рака толстой кишки вашему врачу необходимо знать степень (клиническую стадию) заболевания, чтобы спланировать наилучшее лечение. Этап зависит от того, проникла ли опухоль в близлежащие ткани, распространился ли рак и, если да, то в какие части тела. Когда колоректальный рак распространяется за пределы толстой или прямой кишки, раковые клетки часто обнаруживаются в близлежащих лимфатических узлах.Если раковые клетки достигли этих узлов, они также могут распространиться на другие лимфатические узлы или другие органы. После распространения на лимфатические узлы клетки рака прямой кишки чаще всего распространяются на печень. Врачи называют это «отдаленным» или метастатическим заболеванием.
Когда рак распространяется из исходного места в другую часть тела, новая опухоль имеет тот же тип аномальных клеток и то же имя, что и исходная опухоль. Например, если колоректальный рак распространяется на печень, раковые клетки в печени на самом деле являются клетками колоректального рака.Заболевание представляет собой метастатический колоректальный рак, а не рак печени. По этой причине его лечат как рак прямой кишки, а не как рак печени.
По возможности перед лечением рака толстой кишки следует провести тщательную диагностическую оценку. Помимо сбора личного медицинского и семейного анамнеза и проведения медицинского осмотра, ваш врач может назначить следующие анализы:
- Анализы крови: Они должны включать полный подсчет клеток (для проверки на анемию), стандартные биохимические анализы крови и уровень CEA (карциноэмбрионального антигена).CEA продуцируется некоторыми видами рака толстой кишки и используется для выявления рецидива рака.
- Колоноскопия: Колоноскопия должна выполняться для оценки всей толстой и прямой кишки перед операцией, если только клиническое состояние пациента не позволяет провести колоноскопию. Колоноскопия дает полезную информацию об общем состоянии толстой кишки и позволяет провести биопсию рака и удалить полипы в других областях толстой кишки. У некоторых пациентов радиологическая процедура может использоваться в качестве альтернативного теста для оценки толстой кишки перед операцией.
- CT (компьютерная томография): рентгеновский аппарат, подключенный к компьютеру, делает серию подробных снимков областей внутри вашего тела. Компьютерная томография может показать, распространился ли рак на печень, легкие или другие органы. Другие методы визуализации, такие как сканирование МРТ (магнитно-резонансная томография) и ПЭТ (позитронно-эмиссионная томография); может быть заказан вашим врачом по конкретным показаниям.
Врачи описывают рак прямой кишки по следующим стадиям:
Стадия 0 : Рак обнаруживается только во внутренней выстилке толстой или прямой кишки.«Карцинома in situ» считается раком толстой кишки 0 стадии.
Стадия I : Опухоль проросла во внутреннюю стенку толстой или прямой кишки. Опухоль не проросла сквозь стену.
Стадия II: Опухоль проникает глубже или проникает сквозь стенку толстой или прямой кишки. Он мог проникнуть в близлежащие ткани, но раковые клетки не распространились на лимфатические узлы.
Стадия III: Рак распространился на близлежащие лимфатические узлы, но не на другие части тела.
Стадия IV: Рак распространился на другие части тела, например, на печень или легкие.
Часто окончательная стадия не завершается до тех пор, пока не будет проведена операция по удалению опухоли, когда лимфатические узлы можно будет оценить на предмет рака под микроскопом.
Достижения в колоректальном исследовании [Интернет]. Бестесда, доктор медицины: Национальный институт здоровья, c.2010 г. Рак толстой кишки; [цитируется 10 декабря 2013 г.]. Доступно по адресу: http: // www.nih.gov/science/colorectalcancer/
КАК ЛЕЧИТЬ РАК толстой кишки?
Основой лечения является хирургическое вмешательство, и выбор метода лечения зависит в основном от локализации опухоли в толстой кишке и стадии заболевания. Также может быть добавлена химиотерапия или комбинация процедур. В отличие от рака прямой кишки, лучевая терапия редко используется при раке толстой кишки, хотя она может иметь значение при лечении запущенных или рецидивирующих опухолей. Каждое лечение сопряжено с определенными рисками, которые описаны ниже.Пациент также может вообще отказаться от лечения. Однако без какого-либо лечения рак толстой кишки почти наверняка будет продолжать расти и распространяться в другие места, что может привести к полной непроходимости кишечника, перфорации кишечника и, в конечном итоге, к смерти. Когда рак толстой кишки диагностируется на поздней стадии (IV), химиотерапия может быть назначена либо как единственное лечение, либо перед операцией.
КАК ОСУЩЕСТВЛЯЕТСЯ ХИРУРГИЯ ПРИ РАКА ОБОЛОЧКИ И ЧТО ТАКОЕ ВОССТАНОВЛЕНИЕ?
Хирургическое удаление пораженного участка толстой кишки является наиболее распространенным методом лечения колоректального рака и избавляет многих пациентов от болезни без необходимости в дополнительной терапии.Существуют два основных хирургических подхода к лечению рака толстой кишки:
- Лапароскопия: Рак толстой кишки можно удалить с помощью тонкой трубки с подсветкой (лапароскопа), подключенной к видеоэкрану. На животе делают три или четыре крошечных разреза. Хирург видит внутри вашего живота с помощью лапароскопа и может использовать небольшие инструменты, чтобы освободить толстую кишку от ее прикреплений в теле. Затем опухоль и близлежащие лимфатические узлы удаляются вместе с частью здоровой толстой кишки.Хирург проверяет остальную часть кишечника и печень, чтобы увидеть, распространился ли рак. Лапароскоп также может использоваться с новыми подходами к удалению рака, такими как хирургия одного порта и роботизированная хирургия. Ваши хирурги могут обсудить плюсы и минусы этих новых технологий.
- Открытая операция : Хирург делает больший разрез на брюшной полости, чтобы удалить опухоль и часть здоровой толстой или прямой кишки. Также удаляются близлежащие лимфатические узлы. Хирург проверяет остальную часть кишечника и печень, чтобы увидеть, распространился ли рак.
Примерно в 20% операций по поводу рака толстой кишки операция не может быть безопасно выполнена с помощью лапароскопии, поэтому выполняется открытая операция или лапароскопическая операция превращается в открытую одновременно с лапароскопической операцией. Оба метода требуют общей анестезии и примерно 4-7 дней, проведенных в больнице на восстановление. Несколько крупных исследований продемонстрировали, что оба подхода приводят к одинаковым результатам в отношении рака, если они выполняются хирургами, имеющими достаточную подготовку в области колоректальной хирургии.Хирург удаляет рак толстой кишки и одинаковое количество здоровых толстых кишок и лимфатических узлов с помощью любого доступа. Есть определенные показания к выбору лапароскопии или открытого хирургического вмешательства; Ваш хирург обсудит с вами эти особенности до операции.
При удалении части толстой или прямой кишки хирург обычно может заново соединить здоровые концы кишечника. Это называется анастомозом. Однако иногда повторное подключение невозможно. В этом случае хирург прокладывает новый путь, по которому отходы покидают ваше тело.Хирург делает отверстие (стому) в стенке брюшной полости, соединяет верхний конец кишечника с кожей и закрывает другой конец. Операция по созданию стомы называется колостомией. Плоский мешок надевается на стому для сбора отходов, а специальный клей удерживает его на месте. Реже при раке толстой кишки тонкий кишечник может использоваться для создания стомы (илеостомы). У многих людей временная стома может быть восстановлена через несколько месяцев.
Время, необходимое для заживления после операции, у каждого человека разное.Первые несколько дней вам может быть некомфортно. Лекарства могут помочь контролировать вашу боль; вам должно быть достаточно удобно стоять и ходить с посторонней помощью. Перед операцией вам следует обсудить план обезболивания со своим врачом или медсестрой. После операции ваш врач может скорректировать план, если вам нужно больше боли. Обычно на какое-то время чувствуется усталость или слабость. Хирургическое вмешательство также может вызвать послеоперационный запор или диарею. Ваш хирург может дать инструкции по лечению этих состояний.Кроме того, ваша медицинская бригада будет следить за вами на предмет признаков кровотечения, инфекции или других проблем, требующих немедленного лечения.
После выписки из больницы вам следует возобновить легкую деятельность, например прогулки и личный уход. Ваш хирург может запретить вам поднимать тяжелые предметы в течение определенного времени, чтобы снизить риск развития грыжи (выпуклости под разрезом живота). Как правило, вы можете вернуться к нормальной диете, и особенно важно адекватное потребление жидкости.Перед выпиской спросите своего хирурга или медсестру о возобновлении приема ранее принимаемых лекарств в дополнение к любым новым лекарствам, которые вы, возможно, принимаете.
КАКОВЫ РИСК ОПЕРАЦИИ ПРИ РАКА ОБОЛОЧКИ?
В целом, операция по поводу рака толстой кишки очень безопасна, выживаемость в ближайший период после операции составляет более 95%. Осложнения встречаются несколько чаще, у 1 из 5 пациентов; они могут варьироваться от незначительных инфекций до состояний, требующих повторного хирургического вмешательства и длительного пребывания в больнице.Наиболее частым осложнением является инфекция раны в месте разреза, которую обычно лечат путем вскрытия самого поверхностного слоя раны, а иногда и антибиотиками. Для этого может потребоваться ежедневное закрытие раны марлей по мере заживления раны. Другие потенциальные инфекции включают внутрибрюшную инфекцию (абсцесс), инфекции мочевыводящих путей (мочевой пузырь) и пневмонию.
У некоторых пациентов в венах ног развиваются сгустки, называемые тромбозами глубоких вен (ТГВ).Ходьба вскоре после операции помогает снизить риск ТГВ, и большинство хирургов также пропишут инъекционные лекарства, которые используются для снижения риска образования тромбов.
У небольшого числа пациентов может наблюдаться тяжелое послеоперационное ректальное кровотечение из анастомоза толстой кишки. Кровотечение обычно возникает в течение двух недель после операции. Вам следует обсудить риск кровотечения со своим врачом, если вы планируете возобновить прием каких-либо предоперационных препаратов для разжижения крови. Если вы планируете дальние поездки после выписки из больницы, где получить неотложную медицинскую помощь сложно, то эти планы следует обсудить с вашим хирургом.
Иногда соединение между концами кишечника дает утечку. Эту серьезную проблему можно лечить с помощью антибиотиков, дренажа через кожу или повторной операции, которая может потребовать колостомы или илеостомии. Общее состояние вашего здоровья до операции влияет на риск других осложнений, таких как проблемы с сердцем или дыханием.
КАКАЯ ДОПОЛНИТЕЛЬНАЯ ТЕРАПИЯ НЕОБХОДИМА ПРИ РАКА ОБОЛОЧКИ ПОСЛЕ ОПЕРАЦИИ?
Пациентам, у которых рак толстой кишки обнаружен в лимфатических узлах (стадия III) или удаленных участках (стадия IV), обычно рекомендуется пройти химиотерапию после операции, если это приемлемо с медицинской точки зрения.Химиотерапия использует противоопухолевые препараты для уничтожения раковых клеток. Исследования показали, что химиотерапия улучшает долгосрочную выживаемость за счет снижения риска рецидива рака у пациентов с раком толстой кишки III стадии. Большинство пациентов с раком толстой кишки без распространения на лимфатические узлы или другие участки (стадия I или II) эффективно лечатся только хирургическим вмешательством, хотя некоторым из этих пациентов с определенными факторами риска также может помочь химиотерапия.
Противораковые препараты обычно вводятся через вену, но некоторые можно вводить перорально.В настоящее время наиболее распространенными химиотерапевтическими препаратами, назначаемыми пациентам с раком толстой кишки, являются 5-фторурацил (также называемый 5-FU) и оксалиплатин. Другие могут быть использованы в определенных ситуациях по указанию вашей медицинской бригады. Через несколько недель после операции вас могут лечить в амбулаторных условиях, в кабинете врача или дома. Лечение обычно не требует госпитализации на ночь.
Помимо уничтожения раковых клеток, химиотерапевтические препараты могут повредить нормальные клетки, которые быстро делятся.Побочные эффекты химиотерапии зависят в основном от конкретных препаратов и дозы:
- Клетки крови: Эти клетки борются с инфекциями, способствуют свертыванию крови и доставляют кислород ко всем частям вашего тела. Когда лекарства воздействуют на ваши клетки крови, у вас больше шансов получить инфекции, ушибы или кровотечение, а также вы почувствуете себя очень слабым и усталым.
- Клетки в корнях волос: Химиотерапия может вызвать выпадение волос. Ваши волосы снова отрастут, но они могут несколько отличаться по цвету и текстуре.Химиотерапия при колоректальном раке обычно не вызывает полного выпадения волос.
- Клетки, выстилающие пищеварительный тракт: Химиотерапия может вызвать плохой аппетит, тошноту и рвоту, диарею или язвы во рту и губах.
Химиотерапия колоректального рака может вызвать покраснение и болезненность кожи ладоней и ступней. Кожа может отслоиться. У некоторых пациентов также возникает онемение или покалывание в руках и ногах.Ваша медицинская бригада может посоветовать способы борьбы со многими из этих побочных эффектов. Большинство побочных эффектов обычно проходят после окончания лечения.
КАКИЕ ФАКТОРЫ ВЛИЯЮТ НА РЕЗУЛЬТАТ ПОСЛЕ ЛЕЧЕНИЯ?
Вероятный исход для пациентов с раком толстой кишки чаще всего зависит от стадии. Пациенты с раком, ограниченным слизистой оболочкой толстой кишки, имеют лучший прогноз. Это причина того, почему так важно раннее выявление с помощью таких методов обследования, как колоноскопия.Такие факторы, как перфорация или обструкция толстой кишки, или поражение других органов раком, приводят к худшему исходу. Некоторые особенности, наблюдаемые при осмотре под микроскопом после операции, также могут повлиять на исход. Ваш хирург обсудит с вами конкретные результаты во время первого послеоперационного визита.
КАКИЕ ДЕЙСТВИЯ ПОСЛЕ ЛЕЧЕНИЯ РАКА ОБОЛОЧКИ?
Последующее наблюдение после лечения рака толстой кишки очень важно. Даже после потенциально излечивающей хирургии и использования дополнительных методов лечения, таких как химиотерапия, у пациентов может развиться рецидив рака.Риск рецидива высок, если основное заболевание находится на более поздней стадии. Врачи следят за вашим выздоровлением и проверяют, нет ли рецидива рака. Обследования помогают гарантировать, что любые изменения в состоянии здоровья будут замечены и при необходимости вылечены. Обследования могут включать физический осмотр (включая цифровой ректальный осмотр), лабораторные анализы (тест CEA), колоноскопию, рентген, компьютерную томографию или другие тесты. Плановые осмотры обычно проводятся каждые 3-6 месяцев в течение нескольких лет, в то время как компьютерная томография или другие визуализационные тесты и колоноскопия выполняются через 1 год после операции.Частота последующих экзаменов зависит от результатов предыдущего экзамена.
ЗАКЛЮЧЕНИЕ
Рак толстой кишки — распространенное злокачественное новообразование, вызывающее значительное количество смертей. Тем не менее, это потенциально можно предотвратить с помощью скрининга и излечить только хирургическим вмешательством, если оно диагностировано на ранней стадии. Современная химиотерапия продолжает улучшать выживаемость пациентов на более поздних стадиях. Симптомы рака толстой кишки расплывчаты и, следовательно, требуют оценки медицинских специалистов.Для лечения рака толстой кишки часто требуется команда опытных врачей, включая колоректальных хирургов, медицинских онкологов, радиологов и патологов. Эти врачи работают с пациентом, чтобы составить наиболее безопасный и эффективный план лечения.
Что такое хирург толстой и прямой кишки?
Хирурги толстой и прямой кишки являются экспертами в хирургическом и безоперационном лечении заболеваний толстой, прямой и анальной кишки. Они прошли усовершенствованную хирургическую подготовку по лечению этих заболеваний, а также полную общую хирургическую подготовку.Сертифицированные хирурги толстой и прямой кишки проходят ординатуру по общей хирургии, хирургии толстой и прямой кишки и проходят интенсивные обследования, проводимые Американским советом по хирургии и Американским советом по хирургии толстой и прямой кишки. Они хорошо разбираются в лечении как доброкачественных, так и злокачественных заболеваний толстой и прямой кишки и заднего прохода и могут выполнять обычные скрининговые обследования и хирургически лечить состояния, если для этого есть показания.
ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ
Американское общество хирургов толстой и прямой кишки занимается обеспечением высококачественного ухода за пациентами путем развития науки, профилактики и лечения расстройств и заболеваний толстой, прямой и анальной кишки.Эти брошюры носят инклюзивный, но не предписывающий характер. Их цель — предоставить информацию о заболеваниях и процессах, а не предписывать конкретную форму лечения. Они предназначены для использования всеми практикующими врачами, медицинскими работниками и пациентами, которым нужна информация о лечении рассматриваемых состояний. Следует понимать, что эти брошюры не должны рассматриваться как включающие все надлежащие методы ухода или исключающие методы ухода, разумно направленные на получение тех же результатов.Окончательное решение относительно уместности какой-либо конкретной процедуры должен сделать врач с учетом всех обстоятельств, представленных отдельным пациентом.
ССЫЛКИ И ДОПОЛНИТЕЛЬНЫЕ ИСТОЧНИКИ ИНФОРМАЦИИ
Mutch M и Cellini C. Глава 41, «Хирургическое лечение рака толстой кишки». Глава в Beck DE, Roberts PL, Saclarides TJ, Senagore AJ, Stamos MJ, Wexner SD, Eds. Учебник ASCRS по хирургии толстой кишки и прямой кишки, 2-е издание. Спрингер, Нью-Йорк, штат Нью-Йорк; 2011 г.
Чанг Г.Дж., Кайзер А.М., Миллс С. и др. Параметры практики для лечения рака толстой кишки. Заболевания толстой и прямой кишки. 2012; 55: 831-843.
Веб-сайт Национального института рака США (по состоянию на август 2012 г.): http://www.cancer.gov/cancertopics/types/colon-and-rectal
Веб-сайт Американского общества хирургов толстой и прямой кишки, Росс Х. Рак толстой кишки: противоречия в ведении больных на стадии II. Базовые предметы.(по состоянию на август 2012 г.):
http://www.fascrs.org/physICAL/education/core_subjects/2009/colon_cancer_controversies
Веб-сайт Американского онкологического общества (по состоянию на август 2012 г.): http://www.cancer.org/Cancer/ColonandRectumCancer/index
Благодарность: ASCRS благодарит Шона С. Глазго, доктора медицины, за его помощь в разработке этой учебной брошюры.
.
