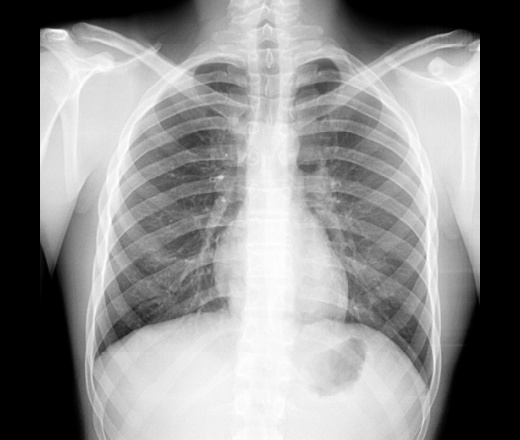
Рентген Саратов | Флюорография
Рентген в клинике «Медгард» Саратов
С приходом в медицинскую практику новых методов диагностики — УЗИ, МРТ, КТ, существует ошибочное мнение, что рентгенологические исследования потеряли свою актуальность – это не так.
Рентген был и остаётся высокоинформативной диагностической технологией, незаменимой во врачебной практике.
Рентгенография — метод лучевой диагностики, благодаря которому врач получает снимок высокого качества, практически любого органа или структуры организма. Основным преимуществом современной рентгенографии является высокое пространственное разрешение.
За счет разницы плотности между патологическими и нормальными тканями, врачи диагностируют различные болезни легких, костей и других органов. Кроме того, рентгенография отличается разумно низкой стоимостью, без дискриминации качества информативности.
Рентген исследования в клинике «Медгард»
Клиника «Медгард» оснащена инновационным рентгеновским оборудованием Clinodigit EVO, которое позволяет получить снимки самого высокого качества при минимальной лучевой нагрузке на пациента.
Конструкция аппарата обеспечивает удобный доступ к столу для позиционирования пациента. Это особенно важно при проведении специализированных исследований.
Наши специалисты, врачи-рентгенологи высшей квалификации проводят рентгенологическую (рентгеногрфию и рентгеноскопию) диагностику практически всех органов и систем органов:
- флюорография (рентген легких)
- рентгенографию и рентгеноскопию грудной клетки
- рентгенографию и рентгеноскопию ЖКТ
- рентгенографию брюшной полости и органов малого таза
- рентгенографию костей и суставов
- рентгенографию позвоночника
- рентгенографию области головы
- ирригоскопию
Полученные снимки подвергаются тщательному анализу и описанию, что поможет вашему лечащему врачу в постановке точного диагноза и назначении соответствующего лечения.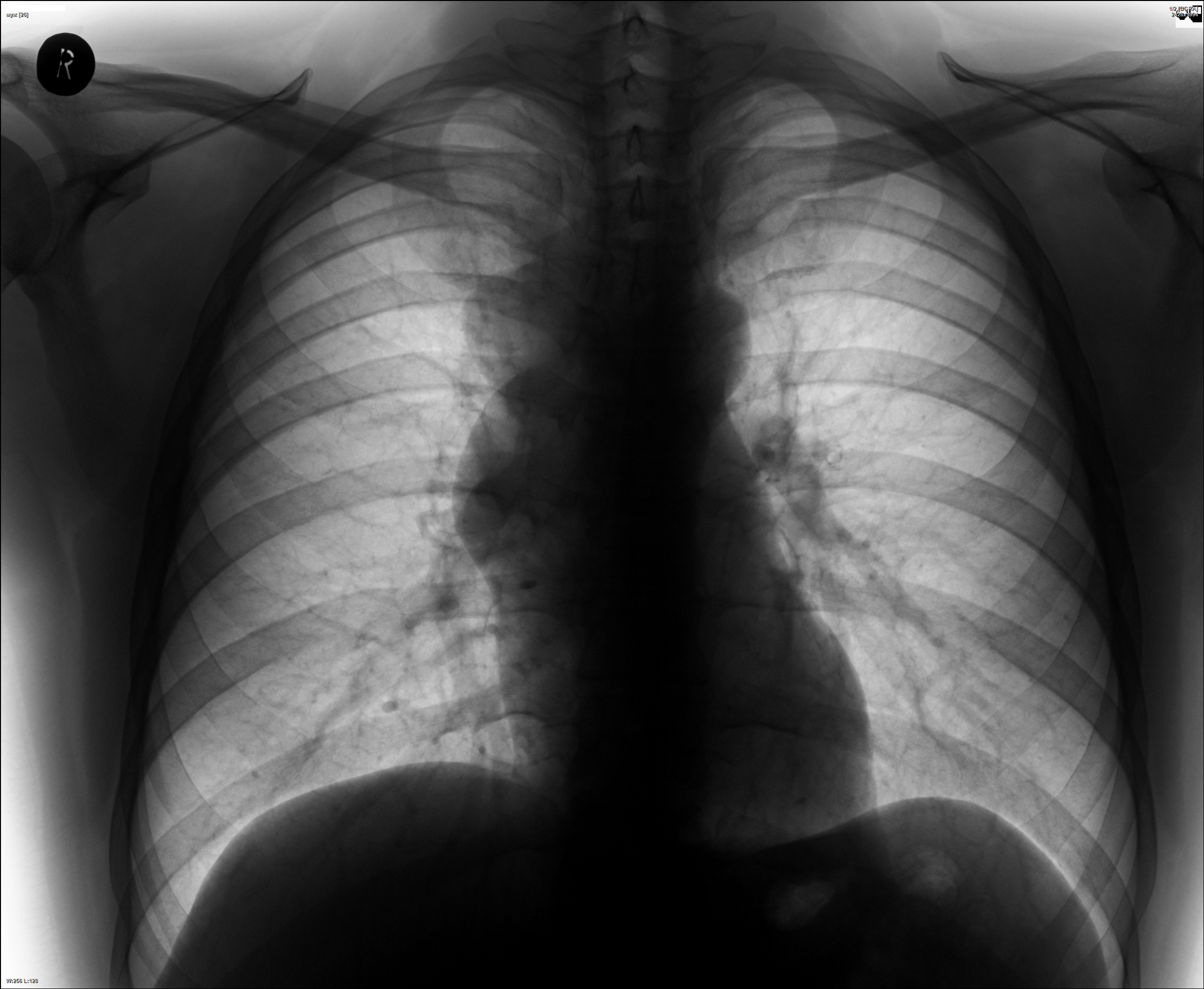
Рентген аппарат в отделении стоматологии
При отделении стоматологии клиники «Медгарде» также работает рентген аппарат Rotograph Plus Ceph — современная модификация хорошо зарекомендовавшей себя модели для получения панорамных снимков зубного ряда и всей черепной коробки. Особенности модели:
- возможность томографии височно-нижнечелюстного сустава (ВНЧС)
- возможность цефалометрии
- высокочастотная генерация рентгеновского излучения;
Rotograph Plus Ceph предназначен для одномоментной томографии челюстно-лицевой системы человека на специальную кассету 15×30 см с усиливающими экранами.
Для позиционирования пациента служит перекрестное световое центровочное устройство, моторизованная головка с цифровой индикацией на экране, система самоцентрирующихся контрольных зеркал и ряд предохранительных устройств, препятствующих возникновению нештатных ситуаций.
Аппарат позволяет получать ортопантомограммы при:
- панорамной экспозиции
- экспозиции ВНЧС с открытым и закрытым ртом на одном снимке
- цефалометрической экспозиции черепа
- экспозиции околоносовой пазухи.
Высокое качество рентгенограмм достигается за счет псевдоэллиптической системы вращения, оригинальной системы перекрестного центрирования световых лучей, использования экранов из редкоземельных элементов, усиливающих излучение в зеленой области спектра, и, самое главное, малого диаметра фокусного пятна 0,5 мм.
Система вращения позволяет получать ортогональное изображение всех зубов с оптимальной зоной фокусировки в 10 мм для резцов и 20 мм для коренных зубов.
Записаться на рентген исследование можно по телефону клиники или через сайт.
Пройти платную флюорографию в Уфе
Пройдите флюорографию у нас!
Записаться можно по телефону +7 (347) 200-81-84. Наши преимущества:
Наши преимущества:
- Качественное обследование проводится опытными специалистами на высоком уровне качества, клиника имеет лицензию и другие разрешительные документы.
- Современное оборудование. Обследование выполняется с помощью высокотехнологичных цифровых аппаратов, это позволяет добиваться высокого качества изображения.
- Флюорография проводится быстро. Не будет больших очередей, мы поможем оперативно провести медосмотры сотрудников, чтобы не отвлекать персонал от работы надолго.
- Медосмотры с флюорографией не потребуют больших расходов от предприятия.
Как записаться на обследование?
Позвоните нам и договоритесь о времени проведения процедуры. Правильно организованная профилактика позволит остановить страшную болезнь, тогда как несвоевременное выявление может привести к росту числа заболевших. Проведение обследования позволит не только сохранить здоровье сотрудников, но и легко пройти государственные проверки. Обратиться в «Инспектрум Клиник» — действительно выгодное решение, ждем вас!
О флюорографии
Эпидемиологическая ситуация по заболеваемости туберкулезом в России остается крайне напряженной: в нашей стране число заболевших на тысячу населения в 4-8 раз выше, чем во многих странах Европы (по разным оценкам). Каждый год в мире заболевает около 9 миллионов человек, и только грамотно организованная профилактика и своевременное лечение могут спасти от болезни. Одним из самых результативных методов раннего выявления туберкулеза является флюорография. Сделать снимок можно меньше чем за минуту, но это позволит выявить заболевание на самой ранней стадии и вовремя приступить к лечению.Флюорография в центре «Инспектрум Клиник» предлагается по выгодным ценам, возможно выполнение не только индивидуальных анализов, но и коллективных заявок от предприятий.
Что представляет собой этот вид обследования?
Ежегодные медосмотры, которые должны организовывать для своих работников все предприятия, обязательно включают такой вид исследования, как флюорография. Для его проведения используется флуоресцентный экран и рентгеновское излучение: оно неравномерно проходит через органы и ткани человека, в результате фотография теневого изображения позволяет увидеть состояние легких.
Для его проведения используется флуоресцентный экран и рентгеновское излучение: оно неравномерно проходит через органы и ткани человека, в результате фотография теневого изображения позволяет увидеть состояние легких.
Врач-рентгенолог по расположению пятен на флюорографическом снимке может определить начало патологического процесса и место его расположения. Если выявлен туберкулезный очаг, пациенту будет немедленно назначено лечение, а при запущенных случаях больной направляется в специальный стационар. Медосмотры с флюорографией обязательно должны проходить работники детских и медицинских учреждений, преподаватели, продавцы, а также представители иных профессий, постоянно контактирующие с людьми. Кроме того, ежегодно обследуются школьники и студенты, это позволяет предотвратить развитие туберкулеза у детей и подростков.
Хирургическое лечение
Хирургические методы — это в основном методы локального лечения, основанного преимущественно на ножевом или электрохирургическом иссечении первичного очага злокачественной опухоли. К хирургическим методам относят также замораживание опухолевой ткани, криохирургию и разрушение опухоли лазерным лучом.
Несмотря на различные виды механического и физического воздействия, все эти методы преследуют прежде всего цель непосредственного удаления или разрушения опухоли, исходя из представления, что первоначально она имеет локальный характер. Иными словами, хирургические методы наиболее эффективны при лечении начальных стадий развития опухоли.
В настоящее время опухоли почти всех локализаций могут быть подвергнуты хирургическому лечению. Широко используется хирургия рака пищевода, легкого, гортани, щитовидной железы, трахеи, молочной железы, желудка, толстой кишки, почки, мочевого пузыря, внутренних органов женской половой сферы. Кроме того, оперативное лечение является ведущим при опухолях мягких тканей и забрюшинного пространства, саркомах опорно-двигательного аппарата. Среди различных методов лечения злокачественных новообразований (оперативных, лучевых, химиотерапевтических) доля хирургических методов составляет 40-50% (без учета паллиативных и пробных операций).
При обсуждении плана лечения каждого онкологического больного, которое должно обязательно осуществляться группой специалистов-онкологов (хирург, радиолог, химиотерапевт) определяют показания к применению того метода лечения, который может оказаться наиболее эффективным в данном конкретном случае. При этом необходимо учитывать возраст больного, наличие сопутствующих заболеваний, локализацию злокачественной опухоли, степень ее распространенности, темпы роста и морфологическую структуру опухоли. Только при объективном обсуждении этих данных может быть окончательно решен вопрос о целесообразности применения хирургического метода лечения.
Противопоказания к хирургическому лечению рака
Противопоказанием к радикальному хирургическому лечению служит генерализация опухолевого процесса — развитие диссеминации и появление отдаленных метастазов, неудалимых при оперативном вмешательстве. Как правило, такая генерализация наблюдается при низкодифференцированных формах рака, протекающих биологически крайне агрессивно.
Противопоказанием к операции может явиться также общее тяжелое состояние больного, обусловленное старческим возрастом и наличием некомпенсированных сопутствующих хронических заболеваний сердца, легких, печени, почек. Однако после тщательной подготовки таких больных в стационарных условиях общее состояние и функциональные показатели могут существенно улучшиться, свидетельствуя о наступившей компенсации. В таких случаях, особенно при локализованном опухолевом процессе, следует повторно обсудить вопрос о возможности хирургического лечения.
Показания к хирургическому лечению рака
Хирургическое лечение показано и, как свидетельствует накопленный опыт, оно оказывается наиболее эффективным при наличии следующих условий:
- Локализация злокачественной опухоли в пределах части пораженного органа (доли, сегмента, сектора), когда опухоль не распространяется за покрывающую орган серозную оболочку или капсулу.
 При прорастании последних и развитии метастазов в регионарных лимфатических узлах хирургический метод также применим, однако отдаленные результаты в таких случаях значительно ухудшаются.
При прорастании последних и развитии метастазов в регионарных лимфатических узлах хирургический метод также применим, однако отдаленные результаты в таких случаях значительно ухудшаются. - Экзофитный характер опухоли, когда хорошо выражены ее границы и опухолевый узел четко ограничен от окружающей ткани. Если опухоль представляет собой инфильтрат без четких границ, то это значительно снижает возможности радикального иссечения, поскольку очень трудно определить истинное распространение опухоли по органу. В подобных случаях при гистологическом исследовании удаленного препарата по линии операционного разреза нередко обнаруживают опухолевые клетки.
- Сохранение высокой степени клеточной дифференцировки опухоли, т. е. наличие картины структурной зрелости, когда ткань опухоли по сравнению с нормальной, хотя и является менее совершенной, но все же в определенной мере сохраняет ее морфологические и функциональные признаки. Напротив, прогноз резко ухудшается при хирургическом лечении злокачественных опухолей низкой степени зрелости, с потерей клеточной дифференцировки.
- Медленные темпы прогрессирования опухоли, что определяется на основании изучения анамнестических данных, результатов диспансерного наблюдения, путем сопоставления флюорограмм и рентгенограмм, произведенных в предыдущие годы при профилактической флюорографии, оформлении на санаторно-курортное лечение, поступлении на работу и т. д. Имеется определенная зависимость между клиническим течением и морфологической характеристикой опухоли. При длительном, торпидном развитии заболевания, иногда исчисляемом многими месяцами и даже годами, существует большая вероятность относительно высокой степени зрелости злокачественной опухоли. Так, например, клиническое течение высокодифференцированных форм папиллярного рака щитовидной железы и злокачественных карциноидов кишечника может исчисляться несколькими годами, в то время как больные с низкодифференцированными формами рака щитовидной железы, желудка, кишечника, молочной железы, как правило, имеют короткий анамнез и клинически эти опухоли протекают крайне агрессивно.
 С другой стороны, клиническое течение злокачественных новообразований обусловлено степенью не только зрелости клеточных элементов опухоли, но и реактивности организма, что имеет весьма важное значение при выборе хирургического метода лечения.
С другой стороны, клиническое течение злокачественных новообразований обусловлено степенью не только зрелости клеточных элементов опухоли, но и реактивности организма, что имеет весьма важное значение при выборе хирургического метода лечения.
Обязательным условием хирургического вмешательства при злокачественных опухолях является соблюдение принципов онкологического радикализма, предусматривающих знание биологических особенностей распространения опухоли в пределах пораженного органа, возможностей перехода на соседние органы и ткани, а также четкого представления о путях метастазирования по лимфатическим коллекторам.
Ошибки при хирургических операциях
Опыт показывает, что хирурги, не обладающие специальной подготовкой для оперирования онкологических больных и не имеющие достаточных знаний о клинико-биологических закономерностях развития рака, допускают ряд серьезных ошибок, роковым образом отражающихся на дальнейшей судьбе пациента.
Довольно часто при меланоме кожи производят амбулаторное, нерадикальное, косметическое удаление опухоли, ошибочно принимаемой за «родинку», «пигментное пятно» и др. Иногда прибегают к биопсии такого образования, что является совершенно недопустимым. При раке молочной железы, мягких тканей конечностей и туловища иногда ограничиваются энуклеацией опухолевых узлов, не осуществляя при этом срочного гистологического исследования удаленной опухолевой ткани, хотя в подобных случаях оно должно выполняться обязательно.
Распространенной ошибкой при раке желудка, толстой кишки, гортани, щитовидной железы, шейки матки является выполнение операций не отвечающих в полной мере принципам онкологической хирургии. В частности, не всегда достаточно широко удаляют окружающую орган клетчатку с лимфатическими узлами. Даже в хорошо оснащенных хирургических клиниках зачастую не производят гистологического контроля с помощью срочной биопсии при резекции пораженного опухолью органа. Между тем в таких случаях при плановом гистологическом исследовании могут быть обнаружены опухолевые клетки по линии операционного разреза. Это указывает на то, что объем операции был определен неправильно и лечение оказалось нерадикальным,
Это указывает на то, что объем операции был определен неправильно и лечение оказалось нерадикальным,
Оперативное вмешательство, производимое с соблюдением онкологического радикализма, обязательно предусматривает четкое выполнение следующих принципиальных установок.
- Широкое иссечение органа или тканей, из которых исходит злокачественная опухоль. Учитывая особенности распространения опухоли, наиболее радикальным следует считать тотальное или субтотальное удаление пораженного органа, например, при раке молочной железы — полное ее удаление, при раке желудка — тотальную или субтотальную гастроэктомию, при раке легкого — пневмонэктомию. Вместе с тем наличие в ряде случаев ограниченного процесса позволяет считать возможным выполнение экономных операций, при которых удаляют только пораженную долю, сектор или сегмент органа. Например, при небольшом по размеру раке легкого может быть произведена лобэктомия, при начальном раке щитовидной железы — гемитиреоидэктомия с удалением перешейка, при ограниченном раке гортани — горизонтальная или вертикальная резекция органа. Выполнение такого рода операций, иногда в комбинации с лучевым лечением или химиотерапией, не снижает степени радикализма и вместе с тем является более выгодным в функциональном отношении.
- Удаление регионарных лимфатических узлов, являющихся зоной возможного метастазирования или уже пораженных метастазами. Такими регионарными лимфатическими коллекторами для молочной железы являются подкрыльцовые и подключичные лимфатические узлы. Отток лимфы из желудка осуществляется прежде всего в лимфатические узлы большого и малого сальника. При раке шейки и тела матки лимфогенное метастазирование на первом этапе ограничивается бассейном подвздошных и обтурационных ямок. С целью более радикального иссечения лимфатических сосудов и узлов их удаляют с окружающей жировой клетчаткой в пределах включающего их фасциального футляра.
- Удаление пораженного органа, регионарного лимфатического коллектора и при необходимости окружающих тканей производят, как правило, единым блоком, так как такой характер оперативного вмешательства повышает степень радикализма в связи с тем, что при этом не обнажается поверхность опухоли, не пересекаются лимфатические пути и, следовательно, снижается возможность обсеменения операционного поля опухолевыми клетками.
 С целью уменьшения так называемой манипуляционной диссеминации техника оперирования должна быть атравматичной, исключающей непосредственный контакт рук оперирующего хирурга и хирургического инструментария с опухолью. Все это создает условия для абластического оперирования, подобно тому, как асептика предусматривает профилактические мероприятия с целью избежать инфекционного загрязнения операционной раны.
С целью уменьшения так называемой манипуляционной диссеминации техника оперирования должна быть атравматичной, исключающей непосредственный контакт рук оперирующего хирурга и хирургического инструментария с опухолью. Все это создает условия для абластического оперирования, подобно тому, как асептика предусматривает профилактические мероприятия с целью избежать инфекционного загрязнения операционной раны.
Объем хирургического вмешательства
Однако в настоящее время хирургические операции приходится зачастую выполнять в менее благоприятных условиях, когда опухолевый процесс уже имеет значительную распространенность. В этих условиях особое значение приобретает выбор оптимального варианта объема хирургического вмешательства. На протяжении последних десятилетий велась активная дискуссия по этому вопросу. В основном обсуждались две точки зрения. Согласно первой, объем оперативного вмешательства определяли формулой: «маленькая опухоль — большая операция, большая опухоль — маленькая операция», т.е. при большом распространении опухоли бесполезно рассчитывать на радикализм, даже расширяя границы оперативного вмешательства. Операцию в таких случаях следует выполнять как паллиативную или пробную. Согласно другой точке зрения, «малая опухоль требует большой операции, а большая опухоль — еще большей».
Сторонники этой точки зрения стоят за расширение объема хирургического вмешательства даже при прорастании опухоли в соседние органы и ткани и наличии отдаленных, но удалимых метастазов. Они предлагают выполнять расширенные или комбинированные оперативные вмешательства. Серьезными аргументами в пользу таких больших по объему операций являются следующие данные. Проведенные научные исследования показали, что целому ряду больных отказывают в радикальном лечении из-за ошибочного завышения распространенности опухолевого процесса. Так, было установлено, что у 15% больных после ранее произведенных пробных торакотомий по поводу якобы неоперабельного рака легкого удалось при повторном вмешательстве выполнить радикальные операции, более чем 20% больных раком желудка также ошибочно были признаны неоперабельными во время лапаротомий. Эти больные были радикально оперированы более опытными хирургами-онкологами.
Эти больные были радикально оперированы более опытными хирургами-онкологами.
С рубцом на легких. Как жить после коронавируса
Сегодня практически никто не говорит о тех людях, которые переболели коронавирусной инфекцией и выписаны из больниц. Они уже не заразны, и о них все забывают. А ведь эти люди страдают: многим трудно дышать при нагрузках, не вернулось обоняние, у кого-то повышена температура. Большинство подавлены психологически. Корреспондент «Российской газеты» узнала, как же жить дальше тем, кто был на грани смерти.
За советами обратилась к авторитетному реабилитологу Леониду Дьякову. Он специалист кафедры медицинской реабилитации, спортивной медицины, физического воспитания с курсом медико-социальной экспертизы Ростовского государственного медицинского университета. А также член ассоциации врачей амбулаторной реабилитации и Европейской ассоциации амбулаторной реабилитации.
Успокойте и погуляйте
Леонид Леонидович, на что в первую очередь надо обратить внимание близким и родным тех, кто перенес COVID-19 в тяжелой форме?
Леонид Дьяков: Я бы обратил внимание, прежде всего, на психологические, даже философские моменты. Важно понимать, что выписавшиеся пациенты прошли через тяжелый этап в своей жизни.
Болезнь — это вынужденная остановка, которая, на мой взгляд, дается, чтобы притормозить, оглянуться, подумать о том, как ты живешь. В кризис человек переосмысливает многое, понимает, что он сделал не так и что нужно изменить в себе самом. А болезнь — это и есть кризис. Своего рода предупреждение, тревожный звонок, шанс что-то исправить, постараться поменять отношение к своему здоровью.
Близкие могут помочь пережить этот «посткризис»?
Леонид Дьяков: Мое глубокое убеждение, что родственники, близкие люди могут оказать неоценимую поддержку. Но для этого необходимо иметь полную информацию, понимать опасность состояния, которое пережил их близкий человек.
К сожалению, коронавирус может влиять на мягкую оболочку мозга. Отсюда плохое настроение, ничего не хочется делать, развивается депрессия. Происходит жесткая переоценка ценностей, человек рефлексирует.
Родным нужно понимать это и поддерживать выздоравливающего. Вообще роль близких людей очень велика на всех этапах реабилитации, которая может продолжаться довольно длительное время — от трех месяцев до года.
Что конкретно они должны делать?
Леонид Дьяков: Например, городским жителям непривычно много гулять, но для восстановления это необходимо, причем в парках или за городом. Родственники могут составить компанию, организовать двух-трехчасовую прогулку с лечебной целью. Не надо экономить на этом времени.
Подходить к таким нагрузкам нужно строго индивидуально. Для начала подойдет просто медленная ходьба. Чуть позже, когда человек окрепнет, можно освоить скандинавскую ходьбу (лучше начинать с опытным инструктором или врачом ЛФК, владеющим этой методикой). Стойкий оздоравливающий эффект дает плавание. Но это должно быть активное движение в воде. Возможно, для некоторых пациентов целесообразно будет начать с гидрокинезиотерапии (специальные комплексы упражнений в воде с инструктором).
Прислушайтесь к сердцу
Кроме психологического состояния, на что еще надо обратить внимание?
Леонид Дьяков: Коронавирус — болезнь серьезная, которая наносит вред не только органам дыхания (о поражении легких наслышаны все), но и другим системам и органам человеческого организма. Прежде всего, сердечно-сосудистой системе. Одно из самых распространенных осложнений COVID-19 — миокардит, воспаление сердечной мышцы. Оно особенно опасно тем, что может развиться не сразу, а спустя время.
Вирус внедряется в миокард?
Леонид Дьяков: Вирус поражает эндотелий, внутреннюю «выстилку» сосудов, а сосуды проходят по всему телу.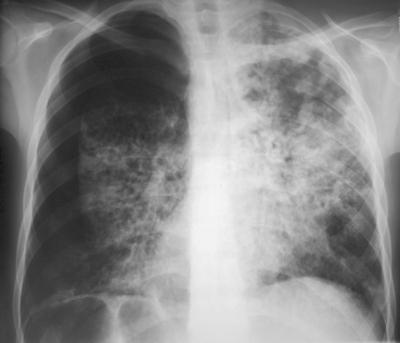 Одно из самых уязвимых мест — миокард. По этой же причине могут страдать почки. Ведь они представляют собой клубок сосудов. Если вирус поражает их, то неизбежны проблемы.
Одно из самых уязвимых мест — миокард. По этой же причине могут страдать почки. Ведь они представляют собой клубок сосудов. Если вирус поражает их, то неизбежны проблемы.
Какие симптомы должны насторожить, когда надо снова срочно бежать к врачу?
Леонид Дьяков: Необъяснимая, внезапная слабость. Нарушение работы сердца, ощущение перебоев. Повышение температуры до 37 и более градусов. Нарастающая одышка.
Даже если человек уже выписался из госпиталя, при появлении этих симптомов нужно обратиться к доктору. В идеале — к кардиологу, можно к терапевту, пульмонологу.
Если появляются отеки на лице и руках, возникает частое мочеиспускание — это признаки нарушения жидкостного обмена, также не стоит медлить с визитом к врачу.
Кстати, при миокардите тоже бывают отеки, чаще на ногах, это важный симптом развивающихся осложнений.
КТ, ЭКГ и витамины
Предположим, явных симптомов, о которых вы говорите, нет. Но чтобы быть уверенным в полном выздоровлении, нужно ли сдать контрольные анализы? Достаточно ли флюорографии раз в год или нужно КТ? Сколько времени нужно наблюдаться?
Леонид Дьяков: В течение года после выписки хорошо бы сделать три раза КТ легких. Не надо бояться дозы облучения, современные аппараты практически безвредны. Осложнения можно выявить только при компьютерной томографии. Она покажет участки легких, которые поражены. И своевременно принять меры. Также после выписки советую три раза в течение года сделать ЭКГ, общий анализ крови и анализ мочи.
Важный показатель работы дыхательной системы — функцию внешнего дыхания — можно исследовать с помощью спирометрии. Это простая манипуляция, ее проводит пульмонолог или специалисты отделений функциональной диагностики.
А дома можно использовать портативный пульсоксиметр. Миниатюрный прибор определит насыщаемость крови кислородом (сатурацию). За этим показателем следует наблюдать также в течение года, это должно войти в привычку, как, например, измерение давления с помощью тонометра.
Нужна ли специальная диета?
Леонид Дьяков: Для выздоравливающих важно полноценное питание, достаточное количество белка и жира. При тяжелом течении болезни в организме происходит существенная утрата белка.
А жир нужен для того, чтобы легкие полноценно работали, особые вещества, состоящие в том числе из жиров, препятствуют слипанию альвеол. И, конечно, витамины. Большие дозы человек получает уже во время курса лечения. Но и после выписки желательно принимать поливитамины в течение трех месяцев. Конечно, под контролем и по назначению врача.
Иммунитет — это не навсегда
Сколько длится иммунитет после того, как человек переболеет? И как узнать, что иммунитет исчерпан?
Леонид Дьяков: Стойкого иммунитета не формируется. Иммунитет понятие специфическое, человек приобретает его, но существуют многие разновидности вирусов, и они изменяются столь стремительно, что пожизненный иммунитет человек так и не приобретает. А узнать, что он исчерпан — просто: человек снова заболевает.
Люди, тяжело переболевшие COVID-19, рассказывают о поражении части легкого, иногда до 40 процентов. Восстанавливаются ли ткани? Или они замещаются соединительными и нефункциональными? Как жить, образно говоря, с половиной легкого? Чего надо остерегаться? Есть какие-то ограничения по профессиональной, спортивной деятельности?
Леонид Дьяков: На самом деле, легочная ткань хорошо компенсируется. Даже альвеолы восстанавливаются.
Природа подстраховала человека на этот случай, недаром легкие — это парный орган и человек может жить с одним легким. Конечно, для этого главное — правильное лечение и реабилитация.
Ограничения после тяжелого течения болезни могут существовать для работ, связанных с изменением атмосферного давления — на глубине, на высоте. Ограничения могут сказаться и на спортивной карьере.
Нередки случаи, когда заболевали не только люди группы риска, но полные сил здоровые люди, регулярно занимавшиеся спортом. Когда им можно возвращаться к тренировкам?
Леонид Дьяков: В первые дни после выписки должна быть совсем небольшая нагрузка, нужно поберечься. Ходить немного и постоянно следить за своим состоянием.
Начинать с обычных упражнений, но под контролем, индивидуально подобрать нагрузку. Конечно, здесь не обойтись без специалистов — реабилитолога, врача ЛФК, пульманолога, кардиолога и других.
Сколько может длиться период восстановления?
Леонид Дьяков: Реабилитация займет достаточно длительный период, особенно если пришлось прибегнуть к помощи ИВЛ. Очень хорошая старая советская система восстановления отводила на лечение обычной пневмонии три месяца, и этот период обязательно включал в себя санаторно-курортное лечение.
Это был крайне важный этап. Раньше, еще до революции, больные ездили «на воды» и дышать воздухом. Кое-где еще сохранились курортологические технологии, климатолечение. Целебен сухой морской, хвойный воздух. Это Крым, Геленджик.
Леонид Леонидович, сейчас есть какая-то программа реабилитации для людей, перенесших COVID-19?
Леонид Дьяков: Проблема коронавируса — новая. И программы такие только-только появились. Есть рекомендации различных сообществ реабилитологов. Есть рекомендации для реабилитации после внебольничных пневмоний.
В советские времена за человеком, перенесшим пневмонию, в течение трех месяцев пристально наблюдали, потом еще год контролировали. В этот период важно вовремя распознать начавшиеся осложнения, чтобы человек не стал инвалидом.
После пневмонии в легких остается рубец, как после травмы или инфаркта, так называемый фиброз. Его можно минимизировать, чтобы орган максимально эффективно функционировал. Для этого необходима программа реабилитации, причем каждому конкретному больному индивидуальная. Кому-то достаточно дыхательной гимнастики, кому-то показано электролечение, массаж, кинезиотерапия, кинезиотейпирование, бальнеологические процедуры и т. д.
Кому-то достаточно дыхательной гимнастики, кому-то показано электролечение, массаж, кинезиотерапия, кинезиотейпирование, бальнеологические процедуры и т. д.
Сейчас в нашей стране сохранилось примерно 1700 санаториев, в некоторых проводят нужные процедуры. Существует ряд технологий, которые можно применять амбулаторно на уровне поликлинической помощи.
Специальность «реабилитолог» появилась совсем недавно. Их пока очень мало. И целая проблема выстроить эту цепочку после госпитальной помощи больным. Но делать это крайне важно и как можно быстрее, чтобы последствия коронавируса не откликнулись всем нам в ближайшем будущем.
СИНДРОМ «МАТОВОГО СТЕКЛА» ПРИ ОЦЕНКЕ КТ-ИЗОБРАЖЕНИЙ ОРГАНОВ ГРУДНОЙ КЛЕТКИ В ПРАКТИКЕ КЛИНИЦИСТА: ПАТОГЕНЕЗ, ЗНАЧЕНИЕ, ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ | Карнаушкина
1. Тюрин И.Е. Компьютерная томография органов грудной полости. СПб: ЭЛБИ-СПб. 2003; 371 с.
2. Verschakelen J.A., Wever W.De. Medical Radiology. Computed Tomography of the Lung. A Pattern Approach Encyclopedia of Medical Radiology. Berlin: Springer Berlin Heidelberg New York. 2007; 196 p.
3. Collins J. CT signs and patterns of lung disease. Radiol. Clin. North. Am. 2001; 39: 1115—1135.
4. James C. Reed. Chest Radiology. Plain Film Patterns and Differential Diagnoses. Mosby; 2010; 480 p. with 548 illustrations.
5. Тюрин И.Е. Рентгенодиагностика тяжелой пневмонии и гриппа. Лучевая диагностика и терапия. 2016; 1: 13-16. DOI: 10.22328/2079-5343-2016-1-13-16
6. James C. Reed. Chest Radiology: Patterns and Differential Diagnoses. United States of America: Saunders Elsevier; 2017; 614 p.
United States of America: Saunders Elsevier; 2017; 614 p.
7. Nestor Muller C. Silva. The Teaching Files: Chest. United States of America: Saunders Elsevier; 2009.
8. Peter J. Winningham, Santiago Martínez-Jiménez, Melissa L. Rosado-de-Christenson et al. Bronchiolitis: A Practical Approach for the General Radiologist. RadioGraphics. 2017; May-June 37(3): 1-18. DOI: 10.1148/rg.2017160131.
9. Аверьянов А.В. Лесняк В.Н. Коган Е.А. Редкие заболевания легких: диагностика и лечение. М.: ООО «Издательство «Медицинское информационное агентство». 2016; 248 с.
10. Georgiadou S.P., Sipsas N.V., Marom E.M. et al. The diagnostic value of halo and reversed halo signs for invasive mold infections in compromised hosts. Clin. Infect. Dis. 2011; 52 (9): 1144-1155.
11. Тюрин И.Е. Рентгенодиагностика внебольничных пневмоний. Поликлиника. 2013; 3(1): 7-11. Tyurin I.E. Chest radiographs in patients with pneumonia. Poliklinica. 2013; 3(1): 7-11 [In Russian].
12. Ланге С., Уолш Д. Лучевая диагностика заболеваний органов грудной клетки. М.: ГЭОТАР-Медиа. 2010; 432 с.
13. Прокоп М., Галански М. Спиральная и многослойная компьютерная томография. М.: ООО «МЕДпресс-информ». 2011; 416 с.
14. The National Lung Screening Trial Research Team. N Engl J Med. 2011; 365:395-409.
Вопрос-Ответ » Государственное бюджетное учреждение здравоохранения
02. 11.2020 00:47:04
11.2020 00:47:04
Здравствуйте, Тест пот погронично отрицательно, Кт чистое, флюрография чисто, кровь чиста, УЗИ лимфоузлов чистая, ребёнок аллергик. Является ли ребёнок инфицирован туберкулезом. SOS Ульяновск, нужно независимое решение фтизиатра.
Здравствуйте! Проведение независимой экспертизы не входит в функции ГБУЗ «Пензенская областная туберкулезная больница». Обратитесь к врачу-фтизиатру по месту жительства.
28.10.2020 09:24:34
У ребенка был пол диаскин тест ,потом стояли на учете у фтизиатра бпотом два раза отриц .потом через 2 года опять ложно положит .сделаи кт легких .узи.анализ крови все спокойно .стоим на учете. теперь опять похоже положит.диаскин тест.чувствует себя хорошо .скоро будет кт легких .что это все может значить как быть дальше от препаратов отказ писали .он еще аллергик
Здравствуйте. Для решения Вашего вопроса необходима индивидуальная консультация у врача фтизиопедиатра.
27.10.2020 11:05:47
Добрый день. Прошу пояснить : для получения справки в школу при отказе проведения Диаскинтест в школе (ребенок 10 лет ) подойдут ли результаты анализа на Ат к Mycobacterium tuberculosis для предоставления фтизиатору ?
В Пензе не нашла клинику для проведения Ти- SPOT теста. Может существует ли ещё альтернативная диагностика (в семье все здоровы, у ребенка Манту 2019г. отр.) .
Альтернативой Диаскинтесту является T SPOT.
27.10.2020 10:57:46
Здравствуйте!скажите пожалуйста после перенесённого раннее туберкулеза легких(5 лет назад),т спот будет отрицательным?
Здравствуйте! На данный вопрос однозначно ответить нельзя. Все зависит от формы перенесенного заболевания, индивидуальных особенностей организма.
Все зависит от формы перенесенного заболевания, индивидуальных особенностей организма.
23.10.2020 10:08:18
Добрый день, мужу на кт в заключении написали образование в легком. Можно у вас получить консультацию и у какого врача.
Здравствуйте! Вы можете получить консультацию врача-фтизиатра в поликлинике по адресу: Н-Тамбовская,9, время работы с 8.00-18.00 кроме выходных.
19.10.2020 13:36:00
Добрый день.Нужно пройти ежегодную диспансеризацию в списке есть флюорография.Можно ли сделать T SPOT самостоятельно ( без записи к фтизиатру и без направления от него) и с результето идти к терапевту? Благодарю за ответ.
Здравствуйте! Для прохождения диспансеризации необходима флюорография органов грудной клетки, так как при ней можно заподозрить не только туберкулез, но и друзие заболевания легких. T SPOT можно сделать самостоятельно, без направления, но заменой ФГО в данном случае он не является.
09.10.2020 12:03:23
Может ли туберкулёз быть невидимым на флюорографии и рентгене? При отсутствии каких либо хронических заболеваний два отрицательных Диаскин теста с разницей во времени три с половиной месяца.Может ли при них быть активный туберкулёз?плюс ко всему этому отсутствие каких либо признаков воспаления в анализах крови и мочи.Человек поправляется. Но обнаружены пятна КТ.
Здравствуйте! Флюорографическое обследование является скрининговым методом. Диагноз «туберкулез» ставиться при комплексном обследовании у врача-фтизиатра.
04. 10.2020 07:45:15
10.2020 07:45:15
Здравствуйте, с другого региона нахожусь в Пензе. Могу ли я у вас платно сдать анализы мокроты для выявления бактерии туберкулеза на аппарате BACTEC и сдать мокроту на посев? И сколько это будет стоить? Что для этого нужно?
Здравствуйте! Платная услуга по исследованию мокроты для физических лиц не предусмотрена. Бесплатное исследование проводится по назначению врача-фтизиатра гражданам, зарегистрированным на территории Пензенской области.
02.10.2020 23:17:04
Здравствуйте. В тубдеспансере требуют флюорографию всех проживащих вместе с ребенком взрослых, муж отказывается ее делать , последнюю делал 1год и 3 месяца назад, примут ли с этой флюорографией или без нее?
Здравствуйте! Результат флюорографического обследования легких действителен 1 год.
01.10.2020 15:52:47
Гумэр Сыраевич, добрый день! Подскажите, пожалуйста, будет ли информативен Т-спот у ребенка 4 года, если накануне сделать прививку от гриппа (Совигриппом)?
Здравствуйте! Если Вы делали данный тест с целью профилактического обследования, то результаты действительны 1год. Если цель обследования иная, то кратность обследования устанавливается индивидуально.
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
Челябинские онкологи осваивают удаление опухолей легкого эндоскопическим доступом
Впервые на Южном Урале проведены две однопортовые операции по удалению части легкого эндоскопическим доступом. Операции сделаны в ходе мастер-класса по VATS-хирургии, который состоялся в Челябинском областном центре онкологии и ядерной медицины. Новая методика сокращает сроки послеоперационной реабилитации, позволяет избежать разного рода осложнений и ускоряет выздоровление больного.
Пациентками торакальных онкохирургов стали две жительницы Челябинской области, у которых ранее был обнаружен рак легкого. Одна из пациенток – жительница поселка Лазурный Красноармейского района. Женщину мучал кашель, в поселке диагноз поставить не смогли, и врач дал направление в Челябинскую областную больницу. Там на КТ обнаружили в легких маленькое пятнышко, которое было не заметно на флюорографии. У другой пациентки из Златоуста новообразование помогла выявить как раз флюорография, вовремя сделанная при диспансеризации.
«У обеих пациенток локальные (начальные) стадии. Благодаря развитию различных методов диагностики такие пациенты стали появляться чаще, раньше было гораздо больше запущенных случаев, – отметил врач-онколог торакального онкологического отделения ЧОКЦО и ЯМ Егор Печерица. – Чем раньше пациент к нам попадет, тем лучше, и это зависит от работы первичного звена в поликлинике. Есть стандарт обследования, и чем быстрее пациент выполняет этот стандарт, тем быстрее мы верифицируем диагноз и проводим хирургическое лечение».
Онкохирурги провели две лобэктомии (удаление части (доли) легкого, пораженного опухолевыми клетками) с помощью малоинвазивной методики VATS-хирургии и современного эндоскопического оборудования. Суть ее в том, что хирургическое вмешательство (видеоторакоскопическая операция) выполняется не из большого открытого доступа, а из одного разреза. Это технически удобнее для хирургов и менее травматично для пациентов.
«Однопортовая эндоскопия – это одна из разновидностей лечения рака легкого, относительно новый метод, который, впрочем, уже достаточно распространен в мире, – рассказал руководитель «Центра торакальной хирургии» ОКБ №1 (Тюмень) Дмитрий Сехниаидзе. – Делается небольшой разрез до пяти сантиметров, что дает преимущество перед другими методами – меньше травма, меньше пациент находится в больнице, меньше осложнений. Через такой доступ можно сделать весь необходимый объем операции, есть лишь один ограничивающий фактор – это размер опухоли. Считается, что все, что больше 7 см, лучше оперировать открыто».
Считается, что все, что больше 7 см, лучше оперировать открыто».
Первые сутки после операции пациентки проведут в реанимации, а затем будут переведены в обычные палаты.
Напомним, рак легкого занимает первое место в структуре общей заболеваемости злокачественными новообразованиями у мужчин и четвертое – среди всего населения. А среди причин смертности рак легкого – безусловный лидер.
Рак легких: диагностика и тесты
Если у вас есть симптомы или ваш врач подозревает, что у вас рак легких, вам необходимо пройти определенные тесты, чтобы поставить диагноз.
Эти обследования могут исключить другие состояния и выявить стадию вашего заболевания.
Ранняя диагностика важна, потому что чем раньше будет обнаружен рак легких, тем лучше ваш прогноз.
Тесты на рак легких
Для постановки диагноза рака легких вам может потребоваться пройти один или несколько из следующих тестов.
Рентген грудной клетки Рентген грудной клетки использует небольшое количество радиации, чтобы сделать снимок внутри грудной клетки. Они не считаются эффективным методом скрининга рака легких, но иногда опухоль может появиться на рентгеновском снимке, который вы получили по другой проблеме. Если врачи подозревают у вас подозрительное пятно, вам, вероятно, потребуется компьютерная томография (КТ), чтобы подтвердить диагноз.
Компьютерная томография Этот тест дает врачам более подробные изображения, чем рентген грудной клетки. КТ позволяет обнаружить очень маленькие опухоли и пятна в легких.Ваш врач также может использовать изображения компьютерной томографии, чтобы определить, распространилась ли опухоль на лимфатические узлы.
Биопсия Для этого теста врачи берут небольшой кусочек ткани и исследуют его под микроскопом. Биопсия может подтвердить, что опухоль является злокачественной, и определить, какой у вас тип рака легких. Ваш врач может взять биопсию пятна на вашем легком, лимфатических узлах или других областях, где распространился рак. Существует несколько типов биопсии при раке легких, в том числе:
Существует несколько типов биопсии при раке легких, в том числе:
- Игольная биопсия Небольшая игла вводится через кожу для сбора ткани или жидкости для анализа.Этот тип биопсии обычно выполняется с помощью компьютерной томографии, ультразвука, магнитно-резонансной томографии (МРТ) или рентгеноскопии.
- Бронхоскопия Тонкая трубка, называемая бронхоскопом, вводится через нос или рот и вводится в легкие. Маленькая камера позволяет врачам заглядывать в ваши легкие и брать иглой образец ткани. Иногда врачи проводят эту процедуру с помощью специальной технологии, которая заставляет патологические ткани загораться. Это известно как автофлуоресцентная бронхоскопия.
- Медиастиноскопия Врачи делают разрез у основания шеи и вставляют хирургические инструменты за грудную клетку, чтобы проверить наличие рака. Они также могут брать образцы из лимфатических узлов.
- Эндобронхиальное ультразвуковое исследование Эта процедура включает использование ультразвука с бронхоскопом для сбора образцов ткани.
- Торакоцентез Врачи используют полую иглу для сбора жидкости, которая образовалась между легкими и грудной стенкой. Эта жидкость проверяется на наличие раковых клеток.
- Торакоскопия Во время этой процедуры врачи делают разрез в грудной стенке и вводят устройство с камерой, чтобы заглянуть внутрь легких и удалить ткань.
Другие методы визуализации Ваш лечащий врач может провести другие сложные визуализационные тесты, такие как МРТ или позитронно-эмиссионная томография (ПЭТ), чтобы лучше рассмотреть опухоль и определить, распространился ли рак легких по всему телу. Эти тесты также могут помочь врачам определить стадию рака.Если у вас рак легких, ваш врач может захотеть сделать МРТ вашего мозга, чтобы убедиться, что рак не распространился туда, потому что сканирование ПЭТ не может смотреть на мозг.
Тесты функции легких Тест функции легких обычно включает вдох и выдох через трубку для измерения потока воздуха. Эти тесты иногда проводят после диагностики рака легких, чтобы увидеть, насколько хорошо работают ваши легкие, и определить, можете ли вы быть кандидатом на операцию.
Раннее выявление, раннее удаление: решительный шаг вперед в борьбе с раком легких | Winship Magazine
Мы вдыхаем и выдыхаем каждую минуту каждого дня.Наши легкие жизненно важны. Тем не менее, если группа клеток в чьих-то легких начинает превращаться в опухоль, этот человек обычно не может ее увидеть или почувствовать — до тех пор, пока она не станет достаточно большой, чтобы быть опасной.
Легкие заключены в ребра с небольшим количеством нервных окончаний. Таким образом, опухоль должна вырасти довольно большими, прежде чем она начнет отбирать достаточную емкость легких, чтобы вызвать дискомфорт или заставить кого-то кашлять. Даже ниже этого порога, когда опухоль становится больше, некоторые клетки с большей вероятностью отделяются и метастазируют.
Раннее обнаружение рака легких с помощью визуализации дает возможность выявить опухоль до того, как она разрастется и распространится. В 2011 году Национальное испытание по скринингу легких, в котором приняли участие более 50 000 участников, установило спасительную ценность скрининга на рак легких с помощью КТ с низкой дозой (компьютерной томографии) для людей, которые много курили в анамнезе. За последние два года и Medicare, и частное страхование начали покрывать процедуру проверки.
«Улучшение скрининга меняет результаты для пациентов с раком легких, позволяя нам точно находить эти опухоли раньше», — говорит Аллан Пикенс , торакальный хирург Winship и директор малоинвазивной торакальной хирургии и торакальной онкологии в больнице Университета Эмори в Мидтауне.«Когда мы обнаруживаем эти опухоли раньше, они обычно имеют меньший размер и не имеют возможности распространиться на другие части тела, лимфатические узлы или другие органы».
Из-за большего количества обследований врачи все чаще обнаруживают рак легких, когда они маленькие: во многих случаях менее двух сантиметров в ширину. Клинические исследования показывают, что это момент, когда можно вылечить рак только хирургическим путем. Кроме того, хирурги переходят к минимально инвазивным подходам, также известным как торакальная хирургия с помощью видео.
Бекки Хафф обращалась к рентгенологам не в первую очередь по поводу ее легких, а для проверки результатов кальцификации после маммографии. В результате при компьютерной томографии ее груди в легких были обнаружены узелки. Сейчас ей 67 лет, она бросила курить более двух десятилетий назад и задается вопросом, не повлияла ли работа в задымленном офисе на риск рака.
В течение двух лет врачи из Эмори под руководством пульмонолога Джеральда Стэтона контролировали ее легкие с помощью дополнительных компьютерных томографов каждые шесть месяцев.Затем изменение внешнего вида узелков и безрезультатная биопсия заставили ее обратиться к Пикенсу. Перед операцией был выполнен другой тип визуализации — ПЭТ-сканирование, чтобы оценить возможность распространения рака.
«Для меня это была еще одна гарантия, что они заранее точно знали, что им нужно делать», — говорит Хафф.
Пикенс удалила верхнюю долю левого легкого, сделав два небольших разреза сбоку на ее теле. Два месяца спустя с помощью аналогичной процедуры он удалил сегмент из ее правого легкого.Когда патологи исследовали удаленную ткань и образцы ее лимфатических узлов, они не обнаружили никаких признаков того, что опухоль проникла в лимфатические узлы. Это означало, что она могла отказаться от химиотерапии и лучевой терапии.
«Это пример того, как мы смогли добраться туда раньше, чем рак», — говорит Пикенс.
Безусловно, ее восстановление после операций сопровождалось некоторой болью. Ей было трудно найти удобное положение для сна, и ей нужно было пару недель принимать обезболивающее. Тем не менее, она избегала операций по вскрытию грудной клетки.
Тем не менее, она избегала операций по вскрытию грудной клетки.
«Я перенес операцию намного быстрее, чем другие люди, которых я видел», — говорит Хафф.
Примерно во время операции весной 2011 года Хафф начала брать уроки игры на фортепиано. Воспитывая пятерых детей, она всегда хотела научиться играть. Сейчас, спустя пять лет после операций и обнадеживающего ПЭТ-сканирования в этом году, она продолжает учиться игре на фортепиано и остается активной, часто гуляя по лесному участку своей семьи в округе Талбот, штат Джорджия.
Тщательная визуализация
Хотя опухоли Хафф были обнаружены до того, как были объявлены результаты Национального исследования легких, ее опыт показывает, как тщательная визуализация и минимально инвазивная хирургия меняют решения о лечении пациентов с раком легких на ранней стадии.
Требуется тщательная визуализация, поскольку подозрительные результаты КТ легких сами по себе не означают, что требуется биопсия или хирургическое вмешательство. «Обратите внимание, что вначале мы называем их узелками, а не опухолями», — говорит Уильям Ауфферманн , кардиоторакальный радиолог в Winship.«Вместо того, чтобы сразу же подавать сигнал тревоги, мы применяем многоуровневый подход, в зависимости от размера узелка и истории болезни пациента».
Некоторые узелки видны на КТ, несмотря на то, что они настолько малы, что их сложно провести точную биопсию. Радиологи описывают другие легочные узелки как имеющие вид матового стекла, и их бывает сложно диагностировать. По словам Ауфферманна, перенесенные инфекции или воспаление могут настолько изменить ткани легких, что они станут подозрительными.
Он и его коллеги использовали систему Lung-RADS, разработанную Американским колледжем радиологии в 2015 году.Согласно этим рекомендациям, только если узелок становится больше примерно восьми миллиметров при повторной визуализации, требуется ПЭТ-сканирование или биопсия. Ниже этого размера рекомендации требуют повторного сканирования через три или шесть месяцев.
Золотые маркеры на пухлых тканях
Большинство операций по поводу рака легких в настоящее время выполняется с использованием минимально инвазивных подходов — более 80 процентов в Эмори. Это дает пациенту преимущества: сокращается меньше мышц и быстрее восстанавливается. Однако обычно хирурги должны касаться узелка, чтобы найти его, и доступ к легкому через меньшие разрезы предотвращает это.
Помните, что легочная ткань обычно заполнена воздухом — что-то вроде пухлого спального мешка. Когда кому-то делают компьютерную томографию и обнаруживают узелок, значит, в нем присутствует воздух. Во время операции ткань разрушается, в результате чего узелок смещается с того места, где он был.
В Winship кардиоторакальные хирурги Manu Sancheti , Seth Force и его коллеги разработали методику использования золотых маркеров, называемых реперными, для отслеживания небольших узелков. Они опубликовали свои выводы в 2014 году в Annals of Thoracic Surgery.
Во время компьютерной томографии рентгенолог отмечает узелок, вставляя репер, который затем становится видимым во время операции с помощью рентгеноскопии. Это позволяет хирургу точно вырезать соответствующий клин легочной ткани, содержащий узелок.
«Некоторые узелки настолько малы, что их вообще трудно почувствовать», — говорит Форс. «Вместо того, чтобы тратить до 45 минут на поиски узелка во время операции, это привлекательная и точная альтернатива».
Иногда рак можно диагностировать и удалить за один день.Некоторые узелки расположены глубже, поэтому их труднее получить сначала с помощью игольной биопсии.
Образец из узелка может быть удален во время малоинвазивной операции, отправлен в лабораторию патологии, и в течение 30 минут хирург может получить ответ на вопрос: это рак?
«Мы берем небольшой кусочек легочной ткани с нормальным краем и кладем его в пакет, чтобы не пролить опухолевые клетки», — говорит Пикенс. «При необходимости пациенту в это время может быть сделана окончательная операция через небольшие разрезы.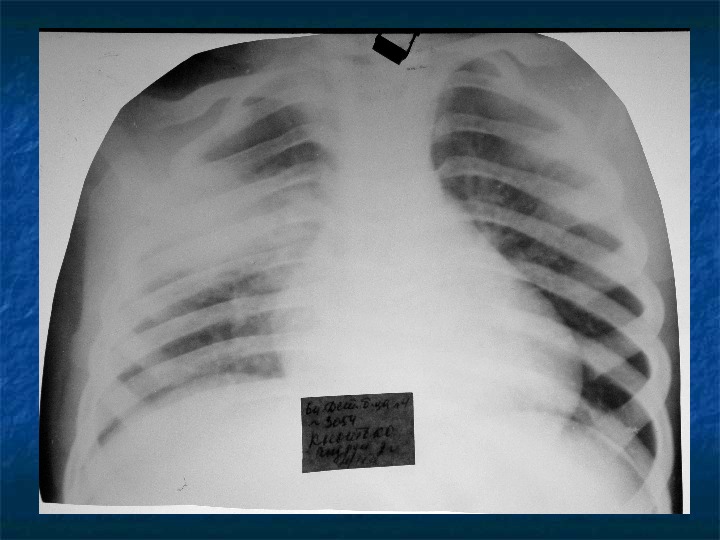 «
«
Если удаленная опухоль достаточно велика, врачи выберут курс химиотерапии, даже если не обнаружено распространения лимфатических узлов. Критическое измерение — это фактический размер опухоли после удаления, а не с помощью визуализации. Разделительная линия составляет четыре сантиметра, что установлено общенациональными исследованиями, в которых изучалась польза химиотерапии для более ранних опухолей.
Адвокат судебного процесса в Индиане Джеймс Станкевич вспоминает, как онколог Фадло Хури объяснил, что опухоль, которую Форс только что удалил из его легкого, была чуть выше этого порога.
«Мы будем действовать на всякий случай», — сказали ему.
Как и Хафф, Станкевич также пришел к своему диагнозу обходным путем — врачи в Чикаго диагностировали у него туберкулез, прежде чем он попросил сделать биопсию иглой, чтобы исключить рак. Когда результаты биопсии оказались положительными, он приехал в Уиншип по предложению родственника.
«Доктор Форс был обнадеживающим голосом в темное, пугающее время», — говорит Станкевич.
Force удалось выполнить лобэктомию через разрез под одним из сосков Станкевича.По его словам, после операции он действительно испытывал некоторую боль при движении или скручивании рук. Тем не менее, он остался доволен результатами. Недавно он закончил курс лечения цисплатином, и ему запланированы регулярные компьютерные томографии, чтобы продолжить наблюдение за его легкими.
«Десять лет назад мы бы относились к нему иначе, — говорит Форс. «Мы бы не стали давать ему химиотерапию».
Результаты исследования
В области хирургии рака легких продолжаются постоянные исследования по вопросу о том, что лучше всего — операция на открытой грудной клетке или минимально инвазивный доступ, а также об эффективности удаления всей доли легкого по сравнению с частичным удалением доли.
Хирурги Эмори Рэйчел Медбери , Феликс Фернандес и коллеги проанализировали общенациональные записи и обнаружили, что обнаружение рака в лимфатических узлах чаще встречается при открытой хирургии грудной клетки (12,8% против 10,3%) по сравнению с хирургией с использованием видео. Это говорит о том, что открытая операция может дать хирургу преимущество в проведении тщательного обследования лимфатических узлов, хотя разница была меньше для пациентов, лечившихся в академическом или исследовательском учреждении.
Фернандес, при поддержке гранта в 2014 году от Агентства по исследованиям и качеству здравоохранения, возглавляет сбор более подробной информации о результатах хирургического вмешательства при раке легких.Он и другой ведущий торакальный хирург Флориды следят за интеграцией данных, собранных Обществом торакальных хирургов (STS), которые включают клинические данные на уровне пациентов, с информацией о заболеваниях и смертности от Центров Medicare и Medicaid Services.
«Благодаря достижениям в области скрининга легких, все согласны с тем, что мы увидим больше пациентов с ранней стадией рака, которые могут быть кандидатами на хирургическое вмешательство», — говорит Фернандес. «Минимально инвазивные подходы могут многое предложить, и это также возможность определить, что приведет к лучшим долгосрочным результатам.«
Простой и безопасный метод маркировки узелков в легких под контролем КТ перед торакоскопической хирургической резекцией с использованием видео, пересмотр
Цель . Мы описываем наш опыт использования простого, безопасного и воспроизводимого метода проторакоскопической метастазэктомии для маркировки узелков в легких. Торакоскопическая резекция узелка легкого снижает дискомфорт пациента, количество осложнений, более высокий уровень ухода, пребывание в больнице и стоимость; однако небольшие глубоко расположенные узелки в легких трудно обнаружить и удалить торакоскопически. Материалы и методы . Мы описываем и анализируем успех нашей новой техники, при которой узелки выявляются на КТ с низкой дозой и маркируются метиленовым синим с помощью рентгеноскопии КТ непосредственно перед операцией. Результатов . Было отмечено 30 узелков со средним размером 8 мм (4–18 мм), расположенных на средней глубине 17 мм, распределенных по обоим легким. Краситель был обнаружен на плевральной поверхности у 97% пациентов и на узелке у 93%. Серьезных осложнений не было.Торакоскопическая резекция возможна в 90% случаев. Заключение . Это простой и безопасный метод маркировки узелков в легких для облегчения торакоскопической резекции в тех случаях, когда это может быть технически невозможно из-за расположения узелка.
1. Введение
Видеоассистированная торакальная хирургия (VATS) была внедрена в начале 1990-х годов [1, 2] и в настоящее время широко считается золотым стандартом при подозрении на резекцию злокачественных узлов легких. Этот метод может уменьшить дискомфорт пациента, осложнения, потребность в более высоком уровне ухода, пребывание в больнице и стоимость по сравнению с открытой торакотомией.В 1999 г. обзор резекции узелков легкого VATS показал, что в 54% случаев требовалось преобразование от открытой торакотомии к полной резекции. Исследование показало, что причиной большинства конверсий (46%) было нарушение локализации узелков [3]. Проблема еще больше усугубляется с небольшими глубоко расположенными узелками в легких, поскольку висцеральная плевра может не демонстрировать никаких изменений формы или цвета, что еще больше затрудняет локализацию этих узелков торакоскопически [4].
В литературе описан ряд различных методов предоперационной «маркировки» с разной степенью успеха, осложнениями, стоимостью, специализированным оборудованием и необходимыми знаниями.Мы пересматриваем простую, но безопасную технику с использованием компьютерной томографии (КТ) для маркировки с использованием инъекции метиленового синего перед метастазэктомией в легкие с помощью VATS, описанной как у взрослых, так и у детей, начиная с 1990-х годов [5, 6], но впоследствии недостаточно использованной.
2. Метод
Используя нашу технику, узелки идентифицируются на КТ с «низкой дозой» (120 кВ, модулированный ток мА и регистрация 6,0 мм) до маркировки. Металлический кожный маркер используется для помощи в локализации и планировании подходящей точки введения кожной иглы.Для безопасного разбавления метиленового синего отбирают 5 мл венозной крови пациента и асептически смешивают с метиленовым синим в соотношении 1 часть метиленового синего на 5 частей собственной крови.
Затем, под местной анестезией и в асептических условиях, узелок маркируется с помощью компьютерной рентгеноскопии. В нашем институте мы используем управляемый вручную импульсный рентгеноскопический навигатор CAREVision (Siemens Somatom) CT (120 кВ и мАс 30). Доступ к узлу осуществляется с помощью спинномозговой иглы 16 / 18G аналогично биопсии легкого (рис. 1).Достигнув узелка, смесь крови метиленового синего вводится непосредственно рядом с узелком и по ходу иглы вплоть до плевральной поверхности, когда игла втягивается, оставляя путь метиленового синего / крови (рис. 2).
Процедура проводится в радиологическом отделении непосредственно перед операцией. Попав в операционное отделение, хирург сначала просматривает переформатированные изображения коронки, а затем может определить местонахождение красителя на плевральной поверхности под прямым зрением с помощью торакоскопа, направляя доступ к паренхиматозному узлу.
Когда игла помещается немного выше или ниже узелка из-за технических трудностей, таких как приближение, затрудненное вышележащими ребрами, краситель может не примыкать непосредственно к узелку. В этом случае необходимы КТ-реконструкции и диалог с оперирующим хирургом.
3. Результаты
Мы отметили 30 узелков за 2 года. Средний возраст пациентов составлял 68 (51–81), ИМТ 25 (22–28) и средний ОФВ1 98% от прогнозируемого (82–115%). Средний размер узелков составлял 8 мм (4–18 мм), расположенных на средней глубине 17 мм (6–42 мм), распределенных по обоим легким (правое = 17 (верхнее = 5, нижнее = 12) и левое 13 (верхнее). = 8, нижний = 5)).Средний объем вводимого красителя составлял 3 мл (2–4 мл). Краситель был обнаружен на плевральной поверхности у 97% (29/30) пациентов и на узелке у 93% (28/30). Серьезных осложнений не было, но два небольших пневмоторакса не имели клинического значения, и один пациент испытывал дискомфорт; это было решено с помощью вторичной инъекции местного анестетика. Побочных эффектов на общую анестезию не наблюдалось, а торакоскопическая резекция была возможна в 90% (27/30) случаев. Один из случаев преобразован в открытую резекцию, что было связано с техническими трудностями при операции, а не с маркировкой.В двух других случаях, когда торакоскопическая резекция была невозможна, расположение узелка затрудняло обеспечение полной резекции с резекцией VATS, и это стало очевидным только во время операции.
4. Обсуждение
Описанные методы радиологической маркировки под компьютерной томографией включают маркировку проволокой [7, 8], маркировку липиодолом [9], маркировку барием [10] и комбинации маркировки проволокой и липиодолом [11]. Маркировка проводов под контролем КТ была связана с неконтролируемым пневмотораксом и смещением проволоки, а также с высокой долей незначительных побочных эффектов, таких как небольшой пневмоторакс и перифокальное кровотечение [7, 8, 11, 12].Было обнаружено, что метод, использующий вводимые под контролем КТ бариевые контрастные шарики для маркировки узелков в легких, во всех случаях вызывает локальные острые воспаления [10], и это потенциально может препятствовать хирургической резекции.
Было описано использование системы управления лечением StealthStation Treon (Medtronic; Луисвилл, Кентукки). Система управляет введением метилена в узелок легкого или рядом с ним. Результаты были успешными, серьезных осложнений не сообщалось; однако оборудование может быть дорогостоящим и требует обучения для использования [13].
Описаны хирургические методы с использованием метиленового синего, когда хирург пальпирует больше поверхностных узелков пальцем через разрез порта и отмечает пальпируемую область перед продолжением резекции VATS [14]. Методика с использованием метиленового синего под радиологическим контролем для маркировки перед микродохэктомией груди также продемонстрировала равную диагностическую точность по сравнению с маркировкой проволокой [15].
Необходимость точной локализации, особенно для более глубоких узелков в легких, важна для успеха процедуры VATS при метастазэктомии в легкие.Описанный метод является экономичным, безопасным и надежным методом маркировки узелков в легких перед резекцией. Метод не требует дорогостоящего оборудования, описанного в других исследованиях; при этом нет риска смещения проволоки. Как и в исследованиях Ленглингера и соавт. в 1994 г. [5] и McConnell et al. в 2002 г. [6] ни у одного пациента не было побочных эффектов смеси метиленового синего и аутологичной крови, и не было серьезных осложнений.
Малый пневмоторакс — частое незначительное осложнение любой процедуры, при которой игла проходит через плевру, и обычно разрешается спонтанно без дальнейшего лечения; однако все эти пациенты подверглись немедленной операции.Многократное прокалывание плевры увеличивает риск пневмоторакса, поэтому важно тщательно спланировать процедуру перед процедурой с указанием безопасного пути прохождения иглы [16]. Одним из основных факторов риска развития пневмоторакса является фоновая хроническая обструктивная болезнь легких и связанные с ней осложнения, такие как пузыри и пузыри [17]. К другим факторам риска развития пневмоторакса относятся увеличение возраста пациента, увеличение глубины поражения, увеличение времени прохождения иглы через плевру и прохождение трещины [16, 17].Также необходимо учитывать движение легких при дыхании, и могут потребоваться прерывистые задержки дыхания во время получения изображений и продвижения иглы [16]. Сообщается, что частота пневмоторакса колеблется от 9% до 54% при биопсии легочных узлов [16, 17], в среднем 20% [18], повышаясь до 39% у пациентов с фоновой эмфиземой [19]. Наша частота пневмоторакса, равная 7% при использовании этой методики, меньше, чем в вышеупомянутых 9 исследованиях, и ни одно из них не привело к каким-либо осложнениям во время последующего индукционного наркоза.Ни у одного из пациентов в этой когорте не было значительной эмфиземы, пузырей или пузырей.
Проблема, которую мы обнаружили, заключается в том, что, даже если вводится только небольшой объем, краситель может распространяться по гораздо большей площади в соседнем легком, чем просто паренхима, окружающая узелок, который нужно маркировать; таким образом, когда инъекция начинается, она должна быть медленной и постоянной, при этом игла выводится обратно на висцеральную плевральную поверхность.
Четкое общение с хирургами, выполняющими последующую метастазэктомию, имеет первостепенное значение, а реконструированные многоплоскостные КТ-изображения локализации узелка помогают при планировании процедуры.Это и обсуждение с хирургом, когда есть малейшие опасения, когда маркировка неточная, неизбежно уменьшат количество неудач и осложнений.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Ателектаз — Основы диагностической визуализации для студентов
Корпус 1
Послеоперационный ателектаз
Клинический:
История болезни — Эта 50-летняя женщина перенесла колостомию через два дня после операции.У нее был жар, кашель и утомляемость.
Симптомы — Легкий кашель.
Физический — Легкие чистые при аускультации. Отмечалось плохое вдохновение из-за дискомфорта в животе.
Лаборатория — Количество лейкоцитов у нее было слегка повышенным.
DDx:
Ателектаз
Пневмония
Рекомендация по визуализации
Рентген грудной клетки
ODIN Link Линейный ателектаз, рисунок 9.9: https://mistr.usask.ca/odin/?c seID = 20160412203825261
Рисунок 9.9. Послеоперационный ателектаз: линейный или пластинчатый ателектаз; Левая нижняя доля
Визуализация
Выводы :
В обоих нижних отделах легких были полосы линейного помутнения. Нет данных о воздушных бронхограммах. Наблюдалась легкая эвентрация правой диафрагмы. Никаких новообразований или аденопатии.
Устный перевод :
Двустороннее легкое, линейный ателектаз.
Диагноз:
Пластинчатый или ленточный ателектаз.
Обсуждение:
Определение ателектаза:
Ателектаз — это уменьшение вздутия всего или части легкого. Синоним «коллапс» часто используется как синоним ателектаза, особенно когда он тяжелый или сопровождается явным увеличением помутнения легких.
На рентгеновских снимках и компьютерной томографии наблюдается уменьшение объема, сопровождающееся повышенной непрозрачностью (рентгенограмма грудной клетки) или ослаблением (компьютерная томография) пораженной части легкого.Ателектаз часто связан с аномальным смещением трещин, бронхов, сосудов, диафрагмы, сердца или средостения. Распределение может быть субсегментным, сегментарным или долевым. Субсегментарный ателектаз часто определяют по таким дескрипторам, как линейный, дискоидный или пластинчатый.
Различные типы ателектазов:
Пассивный — Другой объект занимает пространство, обычно занимаемое легким, чаще всего плевральной жидкостью, но образования, например легкие или плевральные, могут увеличиваться и вызывать сжатие соседнего легкого.Пневмоторакс также может привести к пассивному ателектазу, так как воздух в плевральной полости вызывает частичное коллапс легкого.
Резорбтивный — Препятствие (внутрипросветное или внепросветное) препятствует нормальному проникновению и выходу воздуха. Газ в вентилируемом легком (бронхи, респираторные бронхиолы, альвеолы) ниже по потоку от препятствия резорбируется / абсорбируется. Это можно увидеть при эндобронхиальных злокачественных новообразованиях, слизистых пробках в бронхах или внешних массах, сдавливающих дыхательные пути, что приводит к обструкции бронхов.
Кроме того, невозможность полностью надуть легкие, т.е. шинирование грудной клетки из-за боли и длительного постельного режима. может привести к появлению линейных полос резорбтивного ателектаза.
Cicatrizing (/ ˈsikəˌtrīz /) — Аномальная эластичность легких препятствует полному расширению легкого. Это часто встречается после лучевой терапии легких или в результате фиброзной инфекции, такой как туберкулез.
Рентгенологические данные могут включать:
- Ателектаз — это часто непрозрачное легкое, связанное с уменьшением объема легкого, содержащего воздух.
- Ателектаз может иметь субсегментарный (линейный), сегментарный или долевой характер.
- Внешний вид уменьшенного объема легких зависит от типа ателектаза.
Корпус 2
Ателектаз после интубации
Клинический:
История болезни — Этот трехлетний мужчина поступил с тяжелой астмой и потребовал эндотрахеальной интубации.
Симптомы — Нет — интубировано, седативно и парализовано.
Физическое состояние — Нет звуков дыхания в левом полушарии или верхнем правом легком.
Лаборатория — Без взносов.
DDx:
Ателектаз
Свернуть
Пневмония
Рекомендация по визуализации
Рентген грудной клетки
ODIN Link Неуместная эндотрахеальная трубка и ателектаз, рис. 9.10: https://mistr.usask.ca/odin/?caseID=20170114165716169
Рисунок 9.10 Резорбтивный ателектаз.Эндотрахеальная трубка в правом главном бронхе. Абсолютно ателектатическое левое легкое и ателектаз правой верхней доли
Визуализация
Выводы :
Левое легкое полностью помутнено, как и правая верхняя доля. Эндотрахеальная трубка находится в правом главном бронхе довольно дистально. Обратите внимание на то, что сердечная тень не была видна в правом гемитораксе, поскольку все центральные структуры средостения смещены влево из-за полного ателектаза левого легкого.
Устный перевод :
Тотальный резорбтивный ателектаз с закупоркой бронхов, снабжающих эндотрахеальной трубкой обе доли левого легкого и правую верхнюю долю.
Диагноз:
Неправильная эндотрахеальная трубка, приводящая к резорбтивному (обструктивному) ателектазу.
Корпус 3
Плевральный выпот, пассивный ателектаз
Клинический:
История болезни — У этого 42-летнего мужчины был тяжелый панкреатит, вызванный желчными камнями.Он пожаловался на сильную одышку и боли в животе.
Симптомы — Сильная одышка с повышенной работой дыхания и беспокойством из-за одышки.
Физическое состояние — Снижение шума дыхания в обоих полушариях. Уменьшение объема обоих легких.
Лаборатория — Без взносов.
DDx:
Ателектаз
Свернуть
Пневмония
Плевральный выпот
Рекомендация по визуализации
Рентген грудной клетки
ODIN Link для массивных плевральных выпотов и ателектазов (рентген грудной клетки и УЗИ), рисунок 9.11A и B: https://mistr.usask.ca/odin/?caseID=20170407235
0
Рисунок 9.11A Пассивный ателектаз. Большой плевральный выпот
Рисунок 9.11B Пассивный ателектаз — УЗИ, большой плевральный выпот с ателектазом
Визуализация
Выводы CXR :
Объем вентилируемых легких очень уменьшен. Обнаружены большие двусторонние плевральные выпоты.
Устный перевод :
Базилярный ателектаз из-за большого двустороннего плеврального выпота.
Результаты US:
Базилярное легкое представляет собой эхогенную коллапсированную треугольную структуру. Спавшееся легкое в основном находится во взвешенном состоянии в плевральной жидкости. Спавшееся легкое окружает большая безэховая область.
Диагноз:
Пассивный ателектаз из-за большого двустороннего плеврального выпота.
Рисунок 9.9 Послеоперационный ателектаз: линейный или пластинчатый ателектаз; Левая нижняя доля выполнена доктором Брентом Бербриджем, доктором медицины, FRCPC, Университетскими консультантами по медицинской визуализации, Медицинский колледж, Университет Саскачевана, используется в соответствии с CC — BY-NC-SA 4.0 лицензия.
Рисунок 9.10 Резорбтивный ателектаз. Эндотрахеальная трубка в правом главном бронхе. Доктором Брентом Барбриджем, доктором медицинских наук, FRCPC, Медицинским консультантом по визуализации при Медицинском колледже Университета Саскачевана используется полностью ателектатическое левое легкое и ателектаз правой верхней доли под лицензией CC — BY-NC-SA 4.0.
Рисунок 9.11A Пассивный ателектаз. Массивные плевральные выпоты, проведенные доктором Брентом Бербриджем, доктором медицины, FRCPC, консультантами по медицинской визуализации при университете, Медицинским колледжем, Университет Саскачевана, используются в соответствии с CC — BY-NC-SA 4.0 лицензия.
Рис. 9.11B. Пассивный ателектаз — УЗИ большой плевры с ателектазом, проведенное доктором Брентом Бербриджем, доктором медицинских наук, FRCPC, Университетскими консультантами по медицинской визуализации, Медицинский колледж Университета Саскачевана, используется в соответствии с лицензией CC — BY-NC-SA 4.0.
Бронхоскопические методы диагностики и определения стадии рака легкого
Введение
Первая бронхоскопия была выполнена в 1887 году Густавом Киллианом из Фрайбурга, Германия [1].
В первые годы развития бронхоскопии показания к процедуре были в основном терапевтическими: удаление инородных тел и расширение стриктур от туберкулеза и дифтерии.В начале 20 века шевалье Джексон, отец Американской ассоциации бронхоэзофагологов, усовершенствовал бронхоскопические методы и разработал современные жесткие бронхоскопы [2]. Опять же, первичное показание часто было терапевтическим.
Фиброоптическая бронхоскопия (FOB) была разработана в конце 1960-х годов С. Икедой [3] и стала основным исследованием при обследовании пациентов с подозрением на рак легкого. Он используется в основном как диагностический инструмент, позволяющий определить гистологический тип опухоли.Бронхоскопия также играет важную роль в определении стадии заболевания и в расширении терапевтических возможностей. FOB удобен в выполнении, безопасен и хорошо переносится пациентом.
Требование минимальной седации делает ее приемлемой в качестве амбулаторной процедуры, поэтому при первоначальной оценке она почти полностью заменила жесткую бронхоскопию. Разработка видеобронхоскопов имеет дополнительное преимущество в том, что облегчает обучение и делает процедуру более интересной для других наблюдателей в группе бронхоскопии.
Гибкость бронхоскопа позволяет оператору обследовать большинство бронхов четвертого, а часто и до шестого порядка. Кроме того, оператор может напрямую оценить такие детали слизистой оболочки, как цвет и сосудистость. Относительные противопоказания к процедуре немногочисленны и включают: гипоксемию, резистентную к дополнительному кислороду (O 2 ), трудноизлечимый кровоточащий диатез, тяжелую легочную гипертензию, сердечно-сосудистую нестабильность и острую гиперкапнию [4].
FOB безопасен с уровнем осложнений 0.12% и смертность 0,04% [5]. Опасности кровотечения и пневмоторакса связаны с используемой процедурой биопсии и будут обсуждены позже. У всех пациентов бронхоскоп вызывает временное усиление обструкции дыхательных путей, что может привести к гиперкапнии [6]. Несоответствующая седация бензодиазепинами или опиатами увеличивает вероятность респираторных осложнений, и пациентов с высоким риском следует выявлять путем предварительного измерения газов артериальной крови [5–7]. Необходимо предоставить дополнительный O 2 , и пациенты должны находиться под постоянным наблюдением с помощью пульсоксиметрии.Для пациентов с ишемической болезнью сердца в анамнезе следует использовать кардиомониторинг и немедленно получить реанимационное оборудование.
Хотя FOB в значительной степени заменил жесткую бронхоскопию при первоначальной оценке пациента, жесткий прицел имеет преимущества в определенных ситуациях [8]. Как уже упоминалось, он может предоставить более точную информацию об эндобронхиальном расположении опухоли до резекции.
Кроме того, изменение объема позволяет оценить подвижность проксимальных дыхательных путей, обеспечивая косвенную оценку поражения узлов средостения.Обструкция дыхательных путей меньше, и поэтому жесткий эндоскоп может быть предпочтительным при обследовании пациентов с сужением трахеи, у которых гибкий эндоскоп может вызвать критическое сужение дыхательных путей. Он обеспечивает превосходное всасывание, облегчая оценку и биопсию потенциально геморрагических поражений и удаление больших опухолей [8–10]. Кроме того, многие врачи в настоящее время заново изучают эту технику, облегчающую эндобронхиальную лазерную терапию и процедуры стентирования [11].
Диагностическая ценность фибробронхоскопии
Ожидаемый результат диагностики FOB зависит от локализации и распространения опухоли.Центральные эндобронхиальные поражения дают самый высокий диагностический результат (> 90%), в то время как небольшие периферические поражения часто оказываются более неуловимыми, если не используются более сложные и трудоемкие методы. Вопрос о том, какая комбинация цитологических и гистологических процедур обеспечивает оптимальный диагностический результат, не получил окончательного ответа, но, вероятно, зависит от опыта, имеющегося в каждом отдельном центре. Обычные методы включают промывание бронхов, чистку щеткой и биопсию, но они могут быть расширены за счет использования трансбронхиальной игольной аспирации (TBNA) и бронхоальвеолярного лаважа (BAL) [12].
Более 70% карцином легких видны FOB, и, хотя результат зависит от опыта оператора, высокий уровень диагностической точности может быть достигнут путем взятия от трех до пяти образцов биопсии и комбинации чистки зубов, биопсии и промывки бронхов. можно ожидать установления диагноза в> 60% случаев [6, 7, 13, 14]. Когда опухоль видна, но имеет интрамуральное, а не эндобронхиальное распространение, диагностическая ценность падает до 55% и еще больше снижается, когда опухоль находится вне поля зрения бронхоскописта [6, 7, 12].
Основная роль БАЛ у пациентов с раком легких — это диагностика оппортунистических инфекций у пациентов, проходящих химиотерапию. Однако БАЛ может играть более важную роль в диагностике самого злокачественного новообразования. Высокая диагностическая ценность продемонстрирована при обнаружении злокачественных гематологических заболеваний легких, первичной бронхоальвеолярно-клеточной карциномы и метастатической аденокарциномы молочной железы [15–17].
Информация о роли БАЛ в диагностике первичного рака легкого остается скудной.
Исследование БАЛ у 55 пациентов с периферическим поражением легких показало диагностический результат ~ 30% без ложноположительных результатов и только один случай неправильного типирования клеток. Кроме того, в сочетании с промыванием бронхов и выделением мокроты после бронхоскопии БАЛ увеличивал выход до 56% [18]. Исследование БАЛ у 162 пациентов со злокачественными инфильтратами легких выявило улучшение чувствительности в случаях бронхоальвеолярно-клеточного рака (93%) и карциноматозного лимфангита (83%).Было обнаружено 45% неходжкинских лимфом, и иммуноцитохимия сыграла важную роль в идентификации и классификации [19].
BAL безопасен; кровотечение и пневмоторакс встречаются редко, а лихорадка и временная потеря функции легких редко бывают серьезными, и рентгеноскопия не требуется. Кроме того, диагностическая ценность высока при других заболеваниях, помимо рака, таких как туберкулез легких. Достижения в клеточной и молекулярной биологии могут дополнить технику БАЛ для повышения скорости диагностики опухолей при периферических поражениях (особенно аденокарциноме), а также могут предоставить полезный инструмент для изучения молекулярных механизмов, управляющих генезом рака легких [20–22].
Видимые эндобронхиальные поражения
Центральные опухоли могут проявляться как экзофитные образования с частичной или полной окклюзией просвета бронхов, как перибронхиальные опухоли с внешней компрессией дыхательных путей или с инфильтрацией опухоли подслизистой оболочки. Изменения при перибронхиальных опухолях или подслизистой инфильтрации часто незначительны, дыхательные пути следует тщательно исследовать на предмет характерных изменений, таких как эритема, потеря бронхиальных отметин и узловатость поверхности слизистой оболочки.Образцы центральных поражений обычно берутся с помощью комбинации промывок бронхов, чистки бронхов и эндобронхиальной биопсии. Выход эндобронхиальной биопсии является самым высоким при экзофитных поражениях, с диагностической эффективностью ~ 90% [23-25]. В этой ситуации, вероятно, будет достаточно трех-четырех биопсий. Следует попытаться получить биопсию из участков поражения, которые кажутся жизнеспособными.
При подслизистых поражениях, TBNA может быть выполнена путем введения иглы в подслизистую плоскость под косым углом, а у пациентов с перибронхиальным заболеванием и внешней компрессией игла должна быть введена через стенку бронха в поражение [26, 27].Это особенно неприятно, когда очевидно, что адекватные образцы биопсии видимого эндобронхиального заболевания не позволяют поставить диагноз. Причины этого включают наличие поверхностного некроза или наличие артефакта раздавливания (особенно часто с образцами из мелкоклеточной карциномы). В этих обстоятельствах TBNA может улучшить диагностическую ценность [28, 29].
Что касается стадии T, FOB может позволить оператору определить, что опухоль не подлежит резекции. К признакам неработоспособности относятся: паралич голосовой связки; опухоль до уровня правого трахеобронхиального перехода или в пределах 2 см от левого трахеобронхиального перехода; и определенное поражение карины или трахеи (рис.1).
фигура 1
Фиброоптическое бронхоскопическое изображение, показывающее опухоль, которая неоперабельна из-за локализации.
Поражения периферических легких
Образцы периферических поражений обычно берутся с помощью комбинации промывки бронхов, щеток, трансбронхиальной биопсии и TBNA. Диагностическая ценность бронхоскопии для периферических поражений зависит от ряда факторов, включая размер поражения, расстояние поражения от ворот и от отношения между поражением и бронхом. Эффективность бронхоскопии для поражений <3 см варьируется от 14-50% по сравнению с диагностической эффективностью 46-80%, когда поражение составляет> 3 см [30-32].Наличие признаков бронхов на КТ грудной клетки предсказывает гораздо более высокую эффективность бронхоскопии при периферических поражениях легких. В этих случаях следует использовать рентгеноскопический контроль, чтобы гарантировать правильное расположение диагностического приспособления (рис. 2).
фигура 2
Компьютерная томография грудной клетки, показывающая бронхит.
Рентгеноскопия увеличивает диагностическую ценность трансбронхиальной биопсии (TBBX) при очаговых поражениях легких, но требует много времени, опыта и не повсеместно доступна.Однако, если заболевание носит диффузный характер, например, при карциноматозном лимфангите, результаты одинаковы вне зависимости от того, используется ли рентгеноскопия или нет [33]. Действительно, Tbbx можно рассматривать как процедуру выбора при карциноматозном лимфангите. Осложнения TBBX включают пневмоторакс и кровотечение, но они обычно незначительны и редко бывают серьезными.
В ситуациях, когда биопсия бронхов не может быть получена, исследование смыва бронхов может дать полезную информацию и часто дает дополнительную информацию [34, 35].Часто разумно выполнять все виды процедур отбора проб для максимизации урожайности [12].
Несколько исследований продемонстрировали, что TBNA можно использовать для получения диагностической ткани из периферических поражений. Типичные результаты сообщают об увеличении диагностической доходности от процентных значений от середины 30 до высоких 60 [12, 36–38]. Как и в случае Tbbx, важен размер периферического поражения; хотя это характерно не для всех исследований. Оптимальные урожаи обеспечиваются за счет использования комбинации диагностических методов.TBNA может представлять собой альтернативу TBBX, когда дыхательные пути стенозированы или внешне сжаты до такой степени, что невозможно провести щипцы TBBX.
Необходимость обследования и лечения легочных узелков и новообразований все чаще встречается в грудной медицине. У пациентов с такими узелками диагностическая процедура обычно выполняется как TBBX под рентгеноскопическим контролем. Обычно выполняемая процедура, эндоскопическая трансбронхиальная биопсия, связана с низкой эффективностью при очагах поражения размером менее 3 см или с проблемами поражения, невидимыми при рентгеноскопии.Выход во многом зависит от размера и локализации аномалии [39, 40] и, как правило, от способности визуализировать поражение рентгеноскопически. Узлы, которые слишком малы для визуализации с помощью обычной рентгеноскопии во время процедуры, создают особую проблему и обычно требуют дополнительных, часто хирургических, процедур биопсии.
Если бы проблемы с диагностической эффективностью могли быть решены, гибкая бронхоскопия представляла бы очень интересную часть в обследовании и лечении поражений легких.Следовательно, необходимы новые методы навигации и локализации, независимые от визуализации с помощью рентгеноскопии, но все же зависящие от технических навыков бронхоскописта. Перспективными новыми технологиями являются электромагнитная навигация и эндобронхиальное ультразвуковое исследование.
Электромагнитная навигация
Система электромагнитной навигации — это устройство локализации, которое помогает разместить эндобронхиальные аксессуары (, например, , щипцы, щетку и иглу) в нужных областях легкого.
Система использует низкочастотные электромагнитные волны, которые излучаются электромагнитной платой, расположенной под матрасом стола для бронхоскопии. Датчик-зонд диаметром 1 мм и длиной 8 мм, установленный на конце гибкого металлического кабеля, составляет основную сборку устройства (ориентируемую направляющую). Как только зонд помещается в электромагнитное поле, его положение в плоскостях X, Y и Z, а также его ориентация (движения по крену, тангажу и рысканью) фиксируются системой электромагнитной навигации.Затем эта информация отображается на мониторе в режиме реального времени. У фиксируемой направляющей также есть дополнительная функция, которая позволяет поворачивать ее дистальную часть на 360 °. Полностью выдвижной зонд встроен в гибкий катетер (служащий расширенным рабочим каналом), который после размещения в желаемом месте создает легкий доступ для бронхоскопических принадлежностей. Компьютерное программное обеспечение и монитор позволяют бронхоскописту просматривать восстановленные трехмерные компьютерные томографические (КТ) снимки анатомии объекта в корональной, сагиттальной и аксиальной проекциях вместе с наложенной графической информацией, отображающей положение сенсорного зонда.
Есть еще несколько серьезных ограничений для этой техники. Для планирования необходима компьютерная томография по специальному протоколу (разрезы размером 1 мм и плотное наложение). Для планирования процедуры необходимо использование программного обеспечения для электромагнитной навигационной бронхоскопии (ENB). Планирование может быть выполнено даже в системе или на специальном ноутбуке перед процедурой; на планирование требуется некоторое время, до 10 минут с обученными коллегами. Продолжительность процедуры увеличивается по сравнению с традиционной диагностической бронхоскопией с рентгеноскопией; но по сравнению с техникой, которая у нас есть в настоящее время для повреждений такого размера, пункции под контролем КТ, время эквивалентно.И последнее, но не менее важное: путеводитель предназначен для одноразового использования и стоит 500–1 000 долларов США, в зависимости от рынка. Возмещение также зависит от местных систем и варьируется от 0 до 1000 долларов США. Шварц и др. . [41] провели испытание, чтобы определить практичность, точность и безопасность электромагнитной навигации в реальном времени при обнаружении искусственно созданных периферических поражений легких на модели свиней. Никаких побочных эффектов, таких как пневмоторакс или внутреннее кровотечение, не было обнаружено ни у одного животного в этом исследовании.Они пришли к выводу, что технология электромагнитного позиционирования в реальном времени в сочетании с ранее полученными снимками компьютерной томографии является точной технологией, которая может улучшить стандартную бронхоскопию, чтобы помочь в достижении периферических поражений легких и выполнении биопсии.
На основании результатов этого исследования Becker et al . [42] провели пилотное исследование на людях. Они исследовали полезность системы у 30 последовательных пациентов, поступивших для эндоскопической оценки узелков и новообразований в легких. Размер поражения в этой популяции варьировал от 12 до 106 мм, но в этом раннем исследовании специально не контролировался.Оценка была возможна у 29 пациентов, и у 20 пациентов был установлен окончательный диагноз без каких-либо осложнений, связанных с навигационным устройством.
В неконтролируемом исследовании снова Schwarz et al . [43] подтвердили, что процедура была безопасной и добавляла в среднем всего 15 минут ко времени обычной бронхоскопии. Успешные диагностические биопсии получены у 69% пациентов. Последующее исследование 60 пациентов [44], опубликованное в 2006 году, успешно достигло целевого поражения в 100% случаев.При бронхоскопии с электромагнитной навигацией диагностировано 80,3% поражений, 74% периферических поражений и 100% лимфатических узлов. 57% поражений имели размер <2 см. Результаты диагностики существенно не различались в зависимости от размера поражения. Точность ENB-навигации была доказана в исследованиях на животных и в сравнении с контрольными точками, подтвержденными рентгеноскопией, у людей [43, 44]. Тем не менее, во всех предыдущих диагностических исследованиях с использованием ENB также использовалась рентгеноскопия для проведения биопсии. Роль ENB как отдельной технологии все еще не доказана, и остаются опасения, что инструменты для биопсии могут сместить точно расположенный расширенный рабочий канал (EWC) при замене сенсорного зонда.
Эберхардт и др. . [45] исследовали эффективность ENB без рентгеноскопии при диагностике периферических поражений легких и одиночных легочных узелков. У 89 пациентов было проведено биопсия 92 периферических поражений легких. Диагностическая ценность ENB составила 67%, что не зависело от размера поражения. Средняя ошибка навигации составила 9 ± 6 мм (диапазон 1–31 мм). При анализе по распределению долей наблюдалась тенденция к более высокому результату ENB при диагностике поражений в правой средней доле (88%). Исследование пришло к выводу, что ENB можно использовать в качестве автономной бронхоскопической техники без ущерба для диагностической эффективности или увеличения риска пневмоторакса.Это может привести к значительной экономии времени и избежать радиационного облучения.
Макрис и др. . [46] подтвердили эти результаты. У 40 пациентов были достигнуты все целевые очаги поражения, кроме одного, и общая диагностическая ценность составила 62,5% (25 из 40). Кроме того, французская группа резюмировала, что бронхоскопия с электромагнитной навигацией может улучшить диагностическую ценность трансбронхиальной биопсии без дальнейшего рентгеноскопического контроля и может быть полезной для ранней диагностики рака легких, особенно у неоперабельных пациентов.
Эндобронхиальное УЗИ
На данный момент доступны две разные системы. Линейный эндобронхиальный ультразвуковой бронхоскоп (EBUS), который включает ультразвуковой датчик на его дистальном конце, использует фиксированный набор датчиков, выровненных по криволинейной схеме.
Из-за размера прицела систему можно использовать только в центральных дыхательных путях. Для периферического легкого необходимо использовать радиальную EBUS. Радиальная система EBUS состоит из механического радиального мини-зонда.
Доступны два типа мини-зонда: один с выемкой на конце для заполняемого водой баллонного катетера, другой без выемки. В частности, с насечкой ультразвуковое исследование может выполняться с использованием баллонного метода, то есть баллон надувается на дистальном конце зонда после того, как зонд вставлен в инструментальный канал.
Баллонный метод позволяет легко очертить ультразвуковые изображения даже в тех местах, где трудно удерживать испражненную воду.Ограничением является размер: с тубусом баллона должен использоваться канал диаметром ≥2,8 мм. Зонд без выемки меньше (1,7 мм) и может также использоваться в меньших прицелах.
Обычно используется частота 20 МГц, хотя также доступны пробники на 12 и 30 МГц. Для использования в периферических легочных чаще всего зонд вводится через направляющую оболочку в рабочий канал бронхоскопа. После локализации поражения (рис. 3) бронхоскоп удерживают на месте у ближайшего видимого субсегментарного киля, а мини-зонд удаляют.Через направляющую оболочку щипцы направляются к поражению. Используя направляющую оболочку, можно выполнить TBBX под управлением EBUS без потери положения узелка. Первые исследования проводились без направляющей оболочки; В настоящее время предпочтительной является методика с использованием направляющих тубусов.
Рисунок 3
Эндобронхиальное ультразвуковое исследование, показывающее поражение.
Технико-экономическое обоснование TBBX под контролем EBUS [47] без использования рентгеноскопии показало, что EBUS может служить альтернативой рентгеноскопии для визуализации при биопсии периферических поражений.В исследовании тенденция к превосходным результатам с EBUS была особенно сильной при поражениях диаметром менее 3 см. Такие же результаты показали Shirakawa et al. [48]. После технико-экономического обоснования исследователи начали изучать возможность использования EBUS в качестве дополнения к диагностике периферических поражений легких и единичных легочных узелков.
Большое проспективное исследование Paone et al . [49] сравнили традиционную бронхоскопическую трансбронхиальную биопсию с EBUS при периферических поражениях.Они обнаружили, что бронхоскопия под контролем EBUS имела чувствительность 0,83 для поражений размером более 3 см и 0,75 для поражений размером менее 3 см; По сравнению с традиционной трансбронхиальной биопсией, EBUS также показала себя многообещающим при использовании для узелков размером <3 см. Эти типы поражений часто трудно визуализировать рентгеноскопически при трансбронхиальной биопсии, а бронхоскопия в таких условиях имеет низкую диагностическую ценность.
В большинстве опубликованных исследований использовалась рентгенографическая рентгеноскопия с облучением как пациента, так и медицинского персонала.Этот результат согласуется с исследованием Herth et al . [50], включая только периферические поражения легких <30 мм и сообщая о диагностической эффективности 87% для TBBX под контролем EBUS без необходимости в радиографическом оборудовании или радиационном облучении.
Для очагов <20 мм эффективность обнаружения и патологической диагностики под контролем EBUS снизилась менее чем на 30% [51]. В отличие от этого, японские группы сообщили о диагностической эффективности 53 и 72%, соответственно, для поражений <20 мм при использовании TBBX под контролем EBUS с катетером и при рентгенографической рентгеноскопии [52, 53].Совсем недавно одна из этих японских групп выполнила TBBX под контролем EBUS с использованием виртуальной бронхоскопической навигации и выявила 67% поражений <20 мм на EBUS, в результате чего диагностическая ценность составила 44% [54].
Ограничением для этих систем является значительная кривая обучения, и методы обучения и обучения врачей все еще нуждаются в разработке. Техника в периферическом легком не такая сложная, как в центральных дыхательных путях, но всю процедуру нужно тренировать. Кроме того, в случае EBUS ситуация с возмещением расходов должна быть обсуждена с местной системой.Однако EBUS не имеет навигационной системы и требует от оператора вслепую подвигать бронхоскоп к поражению, зная о предварительных радиологических исследованиях, таких как компьютерная томография.
Биопсии с использованием ENB не всегда приводили к постановке диагноза, несмотря на точную навигацию в подавляющем большинстве случаев с точностью до 10 мм от центра мишени. Дыхательные вариации, вызывающие более крупные, чем ожидалось, ошибки навигации и смещение EWC, когда были введены инструменты для биопсии, могут объяснить этот диагностический результат ниже ожидаемого.В ENB отсутствуют средства для непосредственной визуализации поражений перед биопсией. О роли сочетания EBUS с ENB для получения преимуществ и минимизации ограничений любого метода никогда не сообщалось. Eberhardt et al. [55] провел проспективное рандомизированное контролируемое исследование, включающее три группы только с EBUS, только ENB и комбинированные EBUS / ENB, чтобы проверить эту гипотезу.
Из 120 набранных пациентов 118 имели окончательный гистологический диагноз и были включены в окончательный анализ.Диагностическая ценность комбинированной процедуры (88%) была выше, чем у эндобронхиального УЗИ (69%) или только электромагнитной навигации (59%; p = 0,02).
Группа пришла к выводу, что комбинированное эндобронхиальное ультразвуковое исследование и электромагнитная навигация улучшает диагностическую ценность гибкой бронхоскопии при периферических поражениях легких без ущерба для безопасности.
Стадирование средостения
Трансбронхиальная игла аспирации
Первое описание отбора проб средостенных лимфатических узлов через киль трахеи с помощью жесткого бронхоскопа было сделано Шиппати [56, 57], аргентинским врачом, который представил эту технику на Аргентинском совещании по бронхоэзофагологии в 1949 году.В 1978 году Ван и др. . [58] продемонстрировали, что с помощью этой техники можно также брать образцы паратрахеальных узлов. В 1979 году Охо и др. . [59] представили гибкую иглу, которую можно было использовать через бронхофиброскоп, а в 1983 году Wang et al. [60], а также Ван и Терри [61] указали на диагностическую возможность этого метода для определения стадии рака легких и разработали новые типы игл. Последующие публикации подчеркнули его полезность в диагностике эндобронхиальных и периферических поражений, а способность TBNA поставить диагноз даже при отсутствии эндобронхиального заболевания нехирургическим способом подтвердила его полезность для бронхоскопистов [62–64].
Операторы сообщили об использовании игл для цитологии 21 и 22 и гистологических игл 19 размера [65]. Для получения дополнительных образцов необходимо промыть иглу небольшим объемом физиологического раствора и собрать «промывочный раствор» для анализа. Хотя TBNA широко не используется, он, по-видимому, улучшает диагностическую ценность при взятии образцов из видимых эндобронхиальных, подслизистых и периферических поражений. Кроме того, этот метод может обнаруживать заболевание средостения, что потенциально позволяет оператору диагностировать и определить стадию опухоли легкого за одну процедуру, выполняемую под местной анестезией.
TBNA можно использовать для отбора образцов лимфатических узлов, которые расположены непосредственно рядом с трахеей и крупными бронхами. Следует проявлять осторожность при выполнении TBNA перед осмотром дистальных дыхательных путей и другими процедурами отбора проб, поскольку загрязнение слущивающимися злокачественными клетками является признанной причиной ложноположительных результатов. В исследованиях сообщается о степени чувствительности 43–83% и положительной прогностической ценности 89–100% [66–71]. Использование иглы 19-го калибра обеспечивает большую чувствительность, чем игла 22-го калибра, но комбинация образцов обеспечивает лучший выход [65, 72].Хотя прогностическая ценность положительного результата высока (часто 100%), прогностическая ценность отрицательного результата невысока и не устраняет необходимость в дальнейшем хирургическом стадировании [62–72].
Потенциальным ограничением стадирования средостения лимфатических узлов с TBNA является то, что оператор слеп. Эту технику можно комбинировать с эндобронхиальным ультразвуком с помощью мини-зондов [73, 74].
Многочисленные исследования TBNA, выполненные за последние несколько лет, подтверждают безопасность процедуры. Случаев смерти от TBNA не описано.Сообщалось о редких осложнениях: пневмоторакс [75], пневмомедиастинум [76], гемомедиастинум [77], бактериемия [78] и перикардит [79]. Ни одно из этих осложнений не повлекло за собой серьезных клинических последствий.
Одним из основных осложнений TBNA является возможное серьезное повреждение рабочего канала прицела [64]. Это чаще случается с невыдвижной иглой (которая больше не должна быть доступна на рынке), и ее можно избежать, если оператор позаботится о том, чтобы ввести и извлечь иглу из бронхоскопа с наконечником, полностью втянутым в тубус.
Эндоэзофагеальное УЗИ с тонкоигольной аспирацией
Эндо-пищеводное ультразвуковое исследование с тонкоигольной аспирацией (EUS-FNA) — относительно новый метод, впервые описанный в 1991 г. [80]. С тех пор было опубликовано несколько исследований, и было продемонстрировано, что обычно все очаги поражения, обозначенные EUS, могут быть пунктированы, и даже небольшие поражения размером до 5 мм могут быть диагностированы [81].
EUS-FNA выполняется с помощью эзофагоскопии, а игла для биопсии проходит через рабочий канал эндоскопа через стенку пищевода и направляется ультразвуковым методом к интересующему поражению в средостении.Процедура проводится под местной анестезией и седацией. Этот метод дает отличный обзор структур средостения, включая хороший доступ к параэзофагеальному пространству, аортико-легочному окну, субкаринальной области и области вокруг левого предсердия (уровни 4, 5 и 7) [82– 84], а затем преимущество EUS заключается в том, что он неинвазивен, безопасен и рентабелен [85]. Однако область перед трахеей, заполненной воздухом, не может быть визуализирована.
Процедура может быть выполнена по i.v. седация с использованием мидазолама или пропофола [82]. Эхоэндоскоп сначала вводят до уровня чревной оси и постепенно отводят вверх для получения подробных изображений средостения. Поскольку ультразвуковые волны излучаются параллельно длинной оси эндоскопа, можно визуализировать всю иглу, приближающуюся к цели в секторном звуковом поле. Импульсно-волновая допплеровская ультрасонография выполняется всякий раз, когда предполагаются сосудистые структуры на пути иглы или рядом с ней, чтобы при необходимости скорректировать целевую линию [84].Игла продвигается через стенку пищевода и направляется в целевое поражение. Центральный стилет удаляется, и к втулке иглы прикрепляется специальный шприц емкостью 10 мл для выполнения отсасывания, когда игла перемещается вперед и назад внутри массы. Всасывание медленно прекращается, и узел иглы извлекается из биопсийного канала. Для получения адекватной ткани выполняли один-два прохода иглы [86, 87].
Визуальная оценка лимфатических узлов средостения с помощью EUS дала для различных наблюдателей чувствительность 0.54–0,75, специфичность 0,71–0,98, прогностическая ценность положительного результата 0,46–0,77 и прогностическая ценность отрицательного результата 0,85–0,93, всего у> 1000 пациентов [88]. Эти исследования широко различались по количеству исследованных уровней лимфатических узлов средостения, визуальным критериям злокачественности и характеристикам популяции пациентов. По сравнению с КТ, частота выявления злокачественных лимфатических узлов выше при ЭУЗИ с меньшим количеством ложноположительных результатов [89].
EUS позволяет оценить лимфатические узлы средостения на большинстве уровней, особенно на уровнях 4 слева, 5, 7, 8 и 9, а также метастазов в левом надпочечнике.Уровни 1, 2, 3 и 4 справа не всегда поддаются оценке из-за воздействия воздуха на более крупные дыхательные пути [82, 84]. Однако при увеличении обнаружение легче [81, 88]. Свойства лимфатических узлов, указывающие на возможное злокачественное новообразование, включают гипоэхогенное ядро, острые края, округлую форму и диаметр длинной оси> 10 мм [88]. Признаками доброкачественности являются гиперэхогенная сердцевина (жир), центральная кальцификация (старая гранулематозная болезнь), нечеткие края, длинная и узкая форма и диаметр длинной оси до 1 см [89, 90].
Ложноотрицательные результаты могли быть получены из-за иногда плохого отбора образцов лимфатических узлов во время EUS-FNA (сбор образцов только из наиболее подозрительных узлов). Многие результаты были подтверждены клиническим, а не хирургическим наблюдением. Несмотря на эти недостатки, клиническое влияние EUS-FNA иллюстрируется изменением лечения НМРЛ после EUS-FNA у 66% пациентов или отменой 68 и 49% запланированных медиастиноскопий и торакотомий, соответственно.
Согласно Hunerbein et al. [86], EUS-FNA поставила неожиданный диагноз в 30% процедур. В двух исследованиях с моделями анализа решений было показано, что EUS-FNA дешевле по сравнению с медиастиноскопией для оценки всего средостения или только субкаринальных лимфатических узлов [82, 91, 92].
Barawi et al . [93] проспективно изучали частоту осложнений, связанных с EUS-FNA. В 842 процедурах EUS-FNA средостения были зарегистрированы 1 инфекция, 2 кровотечения и 1 необъяснимая преходящая гипотензия.EUS-FNA относительно противопоказан пациентам с дивертикулом Ценкера или склонностью к кровотечениям [94].
FNA при кистозном поражении средостения следует избегать или, при необходимости, предшествовать профилактическому назначению антибиотиков [95].
EBUS-TBNA
Стадия лимфатических узлов также является основным показанием для использования нового эндоскопа EBUS-TBNA. Ультразвуковой преобразователь, интегрированный в бронхоскоп с отдельным рабочим каналом, потенциально может увеличить выход TBNA, позволяя непосредственно визуализировать размещение иглы в интересующей области.Поэтому был разработан специальный бронхоскоп для ультразвуковой пункции, в который встроили выпуклый датчик на конце гибкого бронхоскопа. С помощью этого бронхоскопа теперь возможно прямое TBNA под контролем эндобронхиального ультразвукового исследования с конвексным зондом в реальном времени (бронхоскопия EBUS-TBNA).
EBUS-TBNA выполняется путем прямого контакта датчика со стенкой трахеи или бронха. Когда очаг поражения очерчен, через биопсийный канал эндоскопа вводится стальная игла 22-го размера во всю длину.Перед биопсией может быть проведено энергетическое допплеровское исследование, чтобы избежать непреднамеренного прокола сосудов. Под ультразвуковым контролем в реальном времени игла вводится в поражение (рис. 4). Всасывание производится шприцем, и игла перемещается вперед и назад внутри поражения [96].
Рисунок 4
Ультразвуковой контроль в реальном времени, используемый для введения иглы в идентифицированное поражение.
EBUS-TBNA существует уже более 5 лет. Растущее количество исследований подтверждает его полезность для оценки проходимости дыхательных путей и рекомендаций по процедурам, особенно с учетом доступности ПЭТ [97–100].
EBUS-TBNA имеет доступ ко всем станциям лимфатических узлов средостения, доступным для медиастиноскопии, а также к узлам N1. В крупнейшем испытании были представлены результаты метода у 502 пациентов [101]. 572 лимфатических узла были пунктированы, и 535 (94%) поставили диагноз. Биопсии брали со всех доступных станций лимфатических узлов (2l, 2r, 3, 4r, 4l, 7, 10r, 10l, 11r и 11l. Средний диаметр узлов ± sd составлял 1,6 ± 0,36 см, а диапазон — 0,8–3,2 см. Чувствительность составила 92%, специфичность — 100%, а прогностическая ценность положительного результата — 93%.Как и во всех других исследованиях, осложнений не было.
Датско-немецкая группа [102] дополнительно исследовала точность EBUS-TBNA в узлах отбора проб диаметром менее 1 см. Среди 100 пациентов были обнаружены и взяты образцы 119 лимфатических узлов размером 4–10 мм. Злокачественные новообразования были обнаружены у 19 пациентов, но пропущены у двух других; все диагнозы подтверждены хирургическими данными. Средний диаметр пунктированных лимфатических узлов составил 8,1 мм. Чувствительность EBUS-TBNA для выявления злокачественных новообразований составила 92.3%; специфичность была 100%; а прогностическая ценность отрицательного результата составила 96,3%. Опять же, никаких осложнений не произошло. Они подытожили, что EBUS-TBNA может отбирать даже небольшие узлы средостения, что позволяет избежать ненужного хирургического исследования у 1 из 5 пациентов, у которых нет данных КТ о заболевании средостения. У потенциально оперируемых пациентов с клинически неметастатическим НМРЛ могут быть полезны дооперационные биопсии EBUS-TBNA и определение стадии. Исследование, сравнивающее EBUS-TBNA, КТ и ПЭТ для определения стадии рака легких в лимфатических узлах, показало высокую эффективность EBUS-TBNA [103].Всего в исследование были включены 102 потенциально работоспособных пациента с доказанным (n = 96) или радиологически подозреваемым (n = 6) раком легкого. КТ, ПЭТ и EBUS-TBNA были выполнены до операции для оценки метастазов средостения и прикорневых лимфатических узлов. Чувствительность КТ, ПЭТ и EBUS-TBNA для правильной диагностики стадий средостения и прикорневых лимфатических узлов составила 76,9, 80,0 и 92,3% соответственно; специфичность составила 55,3, 70,1 и 100% соответственно; точность диагностики — 60.8, 72,5 и 98,0% соответственно. Было доказано, что EBUS-TBNA обладает высокой чувствительностью и специфичностью по сравнению с КТ или ПЭТ для определения стадии средостения у пациентов с потенциально операбельным раком легкого.
Рестэджинг средостения — еще одна область растущего интереса к стратегии лечения рака легких. В случаях рака легких на поздней стадии лимфатического узла перед хирургической резекцией можно провести индукционную химиотерапию. Медиастиноскопия считается золотым стандартом определения стадии средостения.Однако повторная медиастиноскопия может быть технически сложной и поэтому обычно не выполняется. Возможность выполнять многократные повторные биопсии с использованием EBUS-TBNA позволяет восстановить средостение после введения химиотерапии.
Группе из 124 последовательных пациентов с тканевым подтвержденным заболеванием IIIA-N2, получавших индукционную химиотерапию, была проведена рестейджинг средостения с помощью EBUS-TBNA. Чувствительность, специфичность, положительная прогностическая ценность, отрицательная прогностическая ценность и диагностическая точность EBUS-TBNA для восстановления средостения после индукционной химиотерапии составляли 76, 100, 100, 20 и 77% соответственно.EBUS – TBNA — это точный, минимально инвазивный тест для восстановления средостения у пациентов с НМРЛ. Однако из-за низкой прогностической ценности отрицательных результатов опухолевые отрицательные результаты должны быть подтверждены хирургическим стадированием [104].
EBUS-TBNA может также использоваться для диагностики внутрилегочных узлов, а также средостенных и прикорневых лимфатических узлов. Ограничением является досягаемость EBUS-TBNA, которая зависит от размера бронха. Обычно EBUS-TBNA можно ввести до лобного бронха.Опухоли легких, расположенные рядом с дыхательными путями в пределах досягаемости EBUS-TBNA, могут быть диагностированы с помощью EBUS-TBNA. Торнуи и др. . [105] сообщили, что их опыт является этим показателем. У 60 пациентов, ранее перенесших недиагностическую бронхоскопию, у 77% они смогли установить окончательный диагноз без каких-либо осложнений.
Осложнения, связанные с процедурой, аналогичны таковым при обычной TBNA, включая кровотечение из крупных сосудов, пневмомедиастинум, медиастинит, пневмоторакс, бронхоспам и ларингоспазм.Осложнений, связанных с EBUS-TBNA, не наблюдалось, и на сегодняшний день в литературе не сообщается о серьезных осложнениях. Хотя EBUS позволила бронхоскописту видеть за дыхательными путями, необходимо знать о возможных осложнениях, связанных с процедурой [106, 107].
Быстрая оценка на месте
Экспресс-оценка на месте (ROSE) сравнима с интраоперационным исследованием замороженных срезов. Этот метод требует, чтобы цитопатолог и патолог немедленно обработали и интерпретировали окрашенную влажную пленку аспирата и сообщили о результате бронхоскописту.Для всех игольных техник преимущества должны быть возобновлены. Несколько исследований показали, что ROSE снижает частоту неадекватных образцов, что является важной причиной недиагностических аспиратов TBNA [108–111].
Давенпорт [112] изучил значение ROSE в 73 аспиратах и сравнил результаты со 134 образцами, которые обычно обрабатывались. Аспираты получали из лимфатических узлов средостения и периферических узлов легких. При использовании ROSE доля аспиратов, показывающих злокачественные клетки, увеличилась с 31% до 56%.Доля неадекватных отрицательных образцов снизилась с 56% до 18%. Отрицательный аспират с ROSE имел более высокую прогностическую ценность, чем у обычно приготовленных образцов. В недавнем проспективном исследовании Diette et al . [113] оценили трансбронхиальный игольчатый аспират с ROSE в 81 из 204 случаев. Общий диагностический результат составил 81%, когда использовался ROSE, по сравнению с 50% выходом, когда образцы обрабатывались обычным способом. Многомерный анализ показал, что ROSE был независимым предиктором положительного аспирата для злокачественных клеток с отношением шансов 4.5. Среднее количество попыток иглы было немного больше с ROSE. Согласованность между предварительным диагнозом, поставленным при бронхоскопии, и окончательным диагнозом, достигнутым после последующего анализа материалов в цитопатологической лаборатории, составило 87%, что указывает на то, что оценка аспирата иглой на месте довольно точна, но не идеальна.
Хотя ROSE, кажется, улучшает диагностическую ценность TBNA, ее экономическая эффективность остается неясной. Для успешного использования ROSE необходимы услуги опытного цитопатолога.Многие патологи не одобряют ROSE из-за дополнительных затрат времени и усилий. Возмещение этих услуг сторонним плательщиком сильно различается. В настоящее время решение об использовании ROSE должно приниматься в индивидуальном порядке.
Узелков в легких — Mauna Kea Technologies
* Изображения и видео любезно предоставлены проф. Аннема и доктор Вейманс, отделение пульмонологии, Медицинский центр Амстердамского университета
1. GLOBOCAN 2018, Брей Ф., Ферли Дж., Сурджоматарам И., Сигель Р.Л., Торре Л.А., Джемал А. (2018).Глобальная статистика рака 2018: оценки GLOBOCAN заболеваемости и смертности от 36 раковых заболеваний во всем мире в 185 странах. CA Cancer J Clin. 68 (6): 394–424. https://doi.org/10.3322/caac.21492 PMID: 30207593
2. Исследовательская группа NLST. Снижение смертности от рака легких с помощью низкодозного компьютерного томографического скрининга. N Engl J Med. 2011 август; 365 (5): 395–409.
3. Хираки Т., Мимура Х., Гобара Х., Шибамото К., Иноуэ Д., Мацуи Ю. и др. Частота и факторы риска пневмоторакса и установки грудной трубки после чрескожной биопсии легкого под контролем рентгеноскопии: ретроспективный анализ процедур, проводимых в течение 9-летнего периода.Am J Roentgenol. 2010 Март; 194 (3): 809–14.
4. Гупта С., Уоллес М.Дж., Карделла Дж.Ф., Кунду С., Миллер Д.Л., Роуз С.К. и др. Рекомендации по повышению качества чрескожной игольной биопсии. J Vasc Interv Radiol JVIR. Июль 2010; 21 (7): 969–75.
5. Ост Д.Э. и другие. Возможности диагностики и осложнения бронхоскопии при поражении периферических легких. Результаты реестра AQuIRE. Am J Respir Crit Care Med, 2017.
6. Heuvelmans, A. et al. Связь между количеством узелков и вероятностью рака легких при исходном скрининге на КТ рака легких: исследование NELSON.Рак легкого, 2017.
.
7. Сандип Дж. Кхандхар, Марк Р. Боулинг, Хавьер Фландес и др. al .; Электромагнитная навигационная бронхоскопия для доступа к поражениям легких у 1000 пациентов: первые результаты проспективного многоцентрового исследования NAVIGATE Study
8. Seijo LM, de Torres JP, Lozano MD, et al. Диагностическая эффективность бронхоскопии с электромагнитной навигацией во многом зависит от наличия знака бронха на КТ: результаты проспективного исследования. Сундук 2010; 138 (6) 1316-1321
9.Сеносаин М.Ф., Массион П.П. Внутриопухолевая гетерогенность при ранней аденокарциноме легкого. Фасад Онкол. 2020; 10: 349. Опубликовано 17 марта 2020 г. doi: 10.3389 / fonc.2020.00349
10. Статистика рака: рак легких и бронхов ». Национальный институт рака, https://seer.cancer.gov/ statfacts / html / Lungb.html
.
11. Wijmans L. et al. Конфокальная лазерная эндомикроскопия с использованием иглы для диагностики и определения стадии рака легких в реальном времени, European Respiratory Journal, 2019.
12. Крамер Т., Вейманс Л., де Брюин Д.М., Бонта П.И., Аннема Дж. Т..Конфокальная лазерная эндомикроскопия (nCLE) на основе бронхоскопической иглы как инструмент обнаружения периферического рака легких в режиме реального времени. Отделение пульмонологии Медицинского центра Амстердамского университета. Презентация ERS 2020.
Системы Cellvizio® серии 100 с конфокальными мини-зондами TM являются медицинскими приборами, сертифицированными стандартами, имеют маркировку CE (CE 0459) (класс IIa — NB: G-MED) и одобрены FDA. Системы Cellvizio® серии 100 с конфокальными мини-зондами TM — это конфокальные лазерные системы с волоконно-оптическими зондами, которые предназначены для получения изображений внутренней микроструктуры тканей, включая, помимо прочего, идентификацию клеток и сосудов, их организацию или архитектуру.Пожалуйста, ознакомьтесь с этикетками и инструкциями по применению. Доступность продукта не может быть гарантирована во всех странах. За дополнительной информацией обращайтесь к местному торговому представителю. Эти утверждения и связанные с ними ссылки на конкретные клинические исследования не предназначены для представления заявлений о безопасности или эффективности для выявления или лечения какого-либо конкретного состояния или болезненного состояния. Скорее, эта информация предназначена для предоставления полезной ссылки на избранную опубликованную литературу, описывающую опыт врачей в связанных клинических применениях.Любая диагностическая оценка всегда должна производиться лечащим врачом на основе оценки всех источников клинической, эндоскопической и другой соответствующей информации. Эти заявления не были проверены, подтверждены или одобрены FDA США. AQ-Flex ™ 19 сертифицирован CE: «Конфокальные мини-зонды AQ-Flex ™ 19 ™ предназначены для получения изображений анатомических путей, то есть желудочно-кишечного тракта и дыхательных путей, доступ к которым осуществляется с помощью эндоскопа или эндоскопических принадлежностей, в том числе через эндоскопические иглы.»AQ-Flex ™ 19 одобрен FDA:« После подключения к системе Cellvizio® 100 Series, Confocal Miniprobes ™, AQ-Flex ™ 19, предназначен для получения изображений анатомических путей, то есть желудочно-кишечного тракта и дыхательных путей, доступ к которым осуществляется эндоскоп или эндоскопические аксессуары (например, аспирационные иглы, используемые во время процедур, включая иглы EUS-FNA, EBUS-TBNA и TBNA) »
Биопсия грудной клетки под визуальным контролем: методы и клинические результаты | Insights into Imaging
Viggiano RW, Swensen SJ, Rosenow EC 3rd (1992) Оценка и лечение одиночных и множественных легочных узелков.Clin Chest Med 13 (1): 83–95
CAS
PubMed
Google Scholar
Nomori H, Watanabe K, Ohtsuka T., Naruke T., Suemasu K, Uno K (2004) Оценка ПЭТ-сканирования фтордезоксиглюкозы (FDG) F-18 для легочных узелков диаметром менее 3 см, со специальной ссылкой к изображениям КТ. Рак легкого 45 (1): 19–27
Статья
PubMed
Google Scholar
Hammerschlag G, Cao J, Gumm K, Irving L, Steinfort D (2015) Распространенность случайных легочных узелков на компьютерной томографии грудной клетки у пациентов с травмами.Intern Med J 45 (6): 630–633
CAS
Статья
PubMed
Google Scholar
Момен М. Вахиди, Джозеф А. Говерт, Ранджит К. Гоудар и др. Доказательства лечения пациентов с легочными узлами: когда это рак легкого? Руководства по клинической практике ACCP (2-е издание)
Manhire A, Charig M, Clelland C, Gleeson F, Miller R, Moss H, Pointon K, Richardson C (2003) Sawicka E; BTS.Рекомендации по биопсии легких под радиологическим контролем. Грудная клетка 58 (11): 920–936
CAS
Статья
PubMed
PubMed Central
Google Scholar
Laroche C, Fairbairn I, Moss H, Pepke-Zaba J, Sharples L, Flower C, Coulden R (2000) Роль компьютерного томографического сканирования грудной клетки перед бронхоскопией в исследовании подозрения на рак легких. Thorax 55 (5): 359–363
CAS
Статья
PubMed
PubMed Central
Google Scholar
Collins CD, Breatnach E, Nath PH (1992) Чрескожная пункционная биопсия узелков легких после неудачной бронхоскопической биопсии. Eur J Radiol 15 (1): 49–53
CAS
Статья
PubMed
Google Scholar
Goldsmith SJ, Kostakoglu L (2000) Роль ядерной медицины в оценке одиночного легочного узелка. Semin Ultrasound CT MR 21 (2): 129–138
CAS
Статья
PubMed
Google Scholar
Гоулд М.К., Маклин С.К., Кушнер В.Г., Рыдзак К.Э., Оуэнс Д.К. Точность позитронно-эмиссионной томографии для диагностики легочных узелков и массовых поражений: метаанализ. JAMA 2001; 21; 285 (7): 914–24
Erasmus JJ, McAdams HP, Connolly JE (2000) Одиночные легочные узелки: часть II. Оценка неопределенного узелка. Радиография 20 (1): 59–66
CAS
Статья
PubMed
Google Scholar
Erasmus JJ, McAdams HP, Patz EF Jr, Coleman RE, Ahuja V, Goodman PC (1998) Оценка первичных карциноидных опухолей легких с использованием FDG PET.AJR Am J Roentgenol 170 (5): 1369–1373
CAS
Статья
PubMed
Google Scholar
Higashi K, Ueda Y, Seki H, Yuasa K, Oguchi M, Noguchi T., Taniguchi M, Tonami H, Okimura T., Yamamoto I (1998) ПЭТ-изображение с фтором-18-FDG в бронхиолоальвеолярном легком отрицательное. карцинома. J Nucl Med 39 (6): 1016–1020
CAS
PubMed
Google Scholar
МакМахон Х., Остин Дж. Х., Гамсу Дж., Херольд С. Дж., Джетт Дж. Р., Найдич Д. П., Патц Е. Ф. младший (2005) Свенсен С. Дж.; Общество Флейшнера.Рекомендации по ведению небольших легочных узелков, обнаруженных при компьютерной томографии: заявление Общества Флейшнера. Радиология 237 (2): 395–400
Статья
PubMed
Google Scholar
Gruden JF, Klein SJ, Webb WR (1993) Чрескожная трансторакальная игольчатая биопсия при СПИДе: анализ у 32 пациентов. Радиология 189: 567–571
CAS
Статья
PubMed
Google Scholar
Sinner WN (1984) Тонкоигольная биопсия туберкулем. Сундук 85: 836
CAS
Статья
PubMed
Google Scholar
Хоффер Ф.А., Гоу К., Флинн П.М. и др. (2001) Точность чрескожной биопсии легкого при инвазивном аспергиллезе легких. Педиатрическая радиология 31: 144–152
CAS
Статья
PubMed
Google Scholar
Nosari A, Anghilieri M, Carrafiello G, Guffanti C et al (2003) Использование чрескожной биопсии легкого для диагностики мицелиальных грибковых инфекций при гематологических злокачественных новообразованиях.Haematologica 88 (12): 1405–1409
PubMed
Google Scholar
Carrafiello G, Laganà D, Nosari AM, Guffanti C et al (2006) Использование компьютерной томографии (КТ) и тонкоигольной аспирационной биопсии (FNAB) в ранней диагностике грибковых инфекций легких. Изучение инфекций мицелиальных грибов у пациентов с гематологическим иммунодефицитом. Radiol Med 111 (1): 33–41
CAS
Статья
PubMed
Google Scholar
Raptakis T, Boura P, Tsimpoukis S, Gkiozos I, Syrigos KN (2013) Эндоскопическая и эндобронхиальная пункционная аспирация под контролем УЗИ в средостении немелкоклеточного рака легкого. Anticancer Res 33 (6): 2369–2376
CAS
PubMed
Google Scholar
Lange TJ, Kunzendorf F, Pfeifer M, Arzt M, Schulz C (2012) Эндобронхиальная трансбронхиальная пункционная аспирация под контролем УЗИ в повседневной практике — множество положительных результатов и последующих тестов.Int J Clin Pract 66 (5): 438–445
CAS
Статья
PubMed
Google Scholar
Картер Б.В., Маром Е.М., Деттербек ФК (2014) Обращение к пациенту с новообразованием в переднем средостении: руководство для клиницистов. J Thorac Oncol 9 (9 Дополнение 2): S102 – S109
Артикул
PubMed
Google Scholar
Картер Б.В., Окумура М., Деттербек Ф.К., Маром Е.М. (2014) Подход к пациенту с новообразованием в переднем средостении: руководство для радиологов.J Thorac Oncol 9 (9 Дополнение 2): S110 – S118
Артикул
PubMed
Google Scholar
Chouaid C, Dujon C, Monnet I, Madroszyk A, Le Caer H et al (2014) Возможность и клиническое влияние повторной биопсии при распространенном немелкоклеточном раке легкого: проспективное многоцентровое исследование в реальных условиях. — мировая настройка (исследование GFPC 12-01). Рак легкого 86 (2): 170–173
Статья
PubMed
Google Scholar
Patel IJ, Davidson JC et al (2012) Консенсусные рекомендации по перипроцедурному управлению статусом коагуляции и риском гемостаза при чрескожных вмешательствах под визуальным контролем. J Vasc Interv Radiol 23 (6): 727–736
Статья
PubMed
Google Scholar
Laurent F, Montaudon M, Latrabe V, Bégueret H (2003) Чрескожная биопсия при раке легких. Eur J Radiol 45 (1): 60–68
Статья
PubMed
Google Scholar
Klein JS, Zarka MA (1997) Трансторакальная пункционная биопсия: обзор. J Thorac Imaging 12 (4): 232–249
CAS
Статья
PubMed
Google Scholar
Sheth S, Harper UH, Stanley DB et al (1999) Руководство США по торакальной биопсии: ценная альтернатива КТ. Радиология 210 (3): 721–726
CAS
Статья
PubMed
Google Scholar
Winokur RS, Pua BB, Sullivan BW, Madoff DC (2013) Чрескожная биопсия легкого: техника, эффективность и осложнения.Semin Intervent Radiol. 30 (2): 121–127
Статья
PubMed
PubMed Central
Google Scholar
Anzidei M, Argirò R, Porfiri A, Boni F et al (2015) Предварительный клинический опыт использования специальной интервенционной роботизированной системы для биопсии поражений легких под контролем КТ: сравнение с традиционной ручной техникой. Eur Radiol 25 (5): 1310–1316
Статья
PubMed
Google Scholar
Romanes GJ (1981) Учебник анатомии Каннингема. Oxford University Press, Лондон
Google Scholar
Глассберг Р.М., Суссман С.К., Гликштейн М.Ф. (1990) КТ-анатомия внутренних сосудов молочной железы: важность при планировании чрескожных трансторакальных процедур. AJR 155: 397–400
CAS
Статья
PubMed
Google Scholar
Янкелевиц Д.Ф., Васкес М., Хеншке К.И. (2000) Специальные методы трансторакальной пункционной биопсии легочных узлов.Radiol Clin N Am 38: 267–279
CAS
Статья
PubMed
Google Scholar
Lang EK, Ghavami R, Schreiner VC, Archibald S, Ramirez J (2000) Аутологическое уплотнение сгустка крови для предотвращения пневмоторакса при биопсии легкого под контролем КТ. Радиология 216 (1): 93–96
CAS
Статья
PubMed
Google Scholar
Wagner JM, Hinshaw JL (2011) LubnerMG, et al. Биопсия легких под контролем КТ: пластырь плевральной кровью снижает частоту установки плевральной дренажной трубки при постбиопсийном пневмотораксе.AJR Am J Roentgenol 197 (4): 783–788
Статья
PubMed
Google Scholar
ДиБардино Д.М., Ярмус Л.Б., Семан Р.В. (2015) Трансторакальная пункционная биопсия легкого. J Thorac Dis 7 (Дополнение 4): S304 – S316
PubMed
PubMed Central
Google Scholar
Capalbo E, Peli M, Lovisatti M, Cosentino M et al (2014) Трансгрудная биопсия поражений легких: FNAB или CNB? Наш опыт и обзор литературы.Radiol Med 119 (8): 572–594
Статья
PubMed
Google Scholar
Schneider F, Smith MA, Lane MC et al (2015) Достаточность образцов биопсии стержневой иглы и тонкоигольных аспиратов для молекулярного тестирования аденокарциномы легких. Am J Clin Pathol 143 (2): 193–200 quiz 306
Статья
PubMed
Google Scholar
Layfield LJ, Coogan A, Johnston WW et al (1996) Трансторакальная тонкоигольная аспирационная биопсия.Чувствительность к методике наведения, размеру и расположению поражения. Acta Cytol 40: 687–690
CAS
Статья
PubMed
Google Scholar
Ямагами Т., Като Т., Иида С. и др. (2004) Чрескожная пункционная биопсия небольших узелков легких под ребром под рентгеноскопическим контролем компьютерной томографии с наклоном гентри. Сундук 126: 744–747
Артикул
PubMed
Google Scholar
Wang Y, Jiang F, Tan X, Tian P (2016) Чрескожная трансторакальная игольчатая биопсия под контролем КТ для парамедиастинальных и непарамедиастинальных поражений легких: диагностическая ценность и осложнения у 1484 пациентов. Лекарство 95 (31): e4460
Артикул
PubMed
PubMed Central
Google Scholar
Wu CC, Maher MM, Shepard JA (июнь 2011 г.) Осложнения чрескожной игольной биопсии грудной клетки под контролем КТ: профилактика и лечение.AJR Am J Roentgenol 196 (6): W678 – W682
Артикул
PubMed
Google Scholar
Анзидей М., Саккони Б., Фрайоли Ф, Саба Л. и др. (2015) Разработка модели прогнозирования и оценки риска связанных с процедурой осложнений у пациентов, перенесших чрескожную биопсию легких под контролем компьютерной томографии. Eur J Cardiothorac Surg 48 (1): e1 – e6
Артикул
PubMed
Google Scholar
Birchard KR (2011) Трансторакальная пункционная биопсия. Semin Intervent Radiol 28: 87–97
Статья
PubMed
PubMed Central
Google Scholar
Traill ZC, Gleeson FV (1997) Отсроченный пневмоторакс после чрескожной тонкоигольной аспирационной биопсии легких под контролем КТ. Торакс 52: 581–582
CAS
Статья
PubMed
PubMed Central
Google Scholar
Wu CC, Maher MM, Shepard JA (2011) Осложнения чрескожной игольной биопсии грудной клетки под контролем КТ: профилактика и лечение. AJR Am J Roentgenol 196: W678 – W682
Артикул
PubMed
Google Scholar
Geraghty PR, Kee ST, McFarlane G et al (2003) Трансторакальная игольная аспирационная биопсия под контролем КТ легочных узелков: размер иглы и частота пневмоторакса. Радиология 229: 475–481
Статья
PubMed
Google Scholar
CollingsCL WJL, BansonNL LRC (1999) Пневмоторакс и зависимое и независимое положение пациента после пункционной биопсии легкого. Радиология 210 (1): 59–64
Статья
Google Scholar
Heck SL, Blom P, Berstad A (2006) Точность и осложнения при игольчатой биопсии легочных масс под контролем рентгеноскопии при компьютерной томографии. Eur Radiol 16 (6): 1387–1392
Статья
PubMed
Google Scholar
Cox JE, Chiles C, McManus CM, Aquino SL, Choplin RH (1999) Трансторакальная пункционная аспирационная биопсия: переменные, которые влияют на риск пневмоторакса. Радиология 212 (1): 165–168
CAS
Статья
PubMed
Google Scholar
Казеруни Е.А., Лим Ф.Т., Михаил А., Мартинес Ф.Дж. (1996) Риск пневмоторакса при трансторакальной игольной аспирационной биопсии легкого под контролем КТ. Радиология 198 (2): 371–375
CAS
Статья
PubMed
Google Scholar
Ko JP, Shepard JO, Drucker EA et al (2001) Факторы, влияющие на частоту пневмоторакса при биопсии легкого: влияют ли время пребывания и угол плевральной пункции? Радиология 218 (2): 491–496
CAS
Статья
PubMed
Google Scholar
Khankan AA, Al-Muaikeel M (2012) Чрескожная трансторакальная биопсия под визуальным контролем при раке легкого с акцентом на методику КТ. J Infect Public Health 5 (Suppl 1): S22 – S30
Статья
PubMed
Google Scholar
YamagamiT NT, Iida S, Kato T, Nishimura T (2002) Управление пневмотораксом после чрескожной биопсии легких под контролем КТ. Chest 121 (4): 1159–1164
Артикул
Google Scholar
Генри М., Арнольд Т., Харви Дж. (2003) Рекомендации BTS по лечению спонтанного пневмоторакса. В: Рекомендации BTS по лечению заболеваний плевры. Thorax 58 (Suppl II): ii39 – ii52
Артикул
PubMed
PubMed Central
Google Scholar
Sinner WN (1976) Осложнения чрескожной трансторакальной игольной аспирационной биопсии. Acta Radiol Diagn (Stockh) 17 (6): 813–828
CAS
Статья
Google Scholar
Berquist TH, Bailey PB, Cortese DA et al (1980) Трансторакальная пункционная биопсия: точность и осложнения в зависимости от местоположения и типа поражения. Mayo Clin Proc 55: 475–481
CAS
PubMed
Google Scholar
Tai R, Dunne R, Trotman-Dickenson B, Jacobson F et al (2016) Частота и тяжесть легочного кровотечения у пациентов, перенесших чрескожную трансторакальную биопсию легкого под контролем КТ: опыт одного учреждения для 1175 случаев. Радиология 279 (1): 287–296
Статья
PubMed
Google Scholar
Милнер Л.Б., Райан К., Гулло Дж. (1979) Смертельное внутригрудное кровоизлияние после чрескожной аспирационной биопсии легкого. AJR Am J Roentgenol 132 (2): 280–281
CAS
Статья
PubMed
Google Scholar
Ханкан А., Сирхан С., Арис Ф (2015) Общие осложнения несосудистых чрескожных вмешательств на грудной клетке: диагностика и лечение. Semin Intervent Radiol 32 (2): 174–181
Статья
PubMed
PubMed Central
Google Scholar
Freund MC, Petersen J, Goder KC, Bunse T, Wiedermann F, Glodny B (2012) Системная воздушная эмболия во время чрескожной иглой биопсии легкого: частота и факторы риска. BMC Pulm Med 12: 2
Статья
PubMed
PubMed Central
Google Scholar

 При прорастании последних и развитии метастазов в регионарных лимфатических узлах хирургический метод также применим, однако отдаленные результаты в таких случаях значительно ухудшаются.
При прорастании последних и развитии метастазов в регионарных лимфатических узлах хирургический метод также применим, однако отдаленные результаты в таких случаях значительно ухудшаются. С другой стороны, клиническое течение злокачественных новообразований обусловлено степенью не только зрелости клеточных элементов опухоли, но и реактивности организма, что имеет весьма важное значение при выборе хирургического метода лечения.
С другой стороны, клиническое течение злокачественных новообразований обусловлено степенью не только зрелости клеточных элементов опухоли, но и реактивности организма, что имеет весьма важное значение при выборе хирургического метода лечения. С целью уменьшения так называемой манипуляционной диссеминации техника оперирования должна быть атравматичной, исключающей непосредственный контакт рук оперирующего хирурга и хирургического инструментария с опухолью. Все это создает условия для абластического оперирования, подобно тому, как асептика предусматривает профилактические мероприятия с целью избежать инфекционного загрязнения операционной раны.
С целью уменьшения так называемой манипуляционной диссеминации техника оперирования должна быть атравматичной, исключающей непосредственный контакт рук оперирующего хирурга и хирургического инструментария с опухолью. Все это создает условия для абластического оперирования, подобно тому, как асептика предусматривает профилактические мероприятия с целью избежать инфекционного загрязнения операционной раны.