МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: II РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
II РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
«Современные тенденции развития лекарственной терапии опухолей»
АДЪЮВАНТНОЕ ЛЕЧЕНИЕ РАКА ОБОДОЧНОЙ КИШКИ
Л.В. Манзюк, Ф.В. Доненко
Онкологический научный центр им.Н.Н. Блохина РАМН, Москва
Исследования, проведенные в последнее десятилетие, убедительно доказали важность адъювантной химиотерапии для больных раком ободочной кишки. Профилактическая лекарственная терапия, проводимая после радикальных операций, стала неотъемлемым этапом в комплексном лечении этой многочисленной группы пациентов. Эти же исследования показали, что целесообразность проведения адъювантной химиотерапии зависит от исходной стадии заболевания. Общая пятилетняя выживаемость для больных раком ободочной и прямой кишки составляет 61%, однако при локализованном процессе она выше — 92%, при наличии региональных метастазов — 63%, а при наличии отдаленных метастазов — 7% (1).
В настоящее время при раке ободочной и прямой кишки широко используется классификация Дюка или ее модификации, а так же классификация TNM, которые представлены в табл.1 (2).
Адъювантная химиотерапия стандартно назначается в стадии С по Дюку, так как высок риск развития метастазов и рецидивов, а лечение снижает этот риск и увеличивает пятилетнюю выживаемость. Считается, что больные с более низкими стадиями не имеют высокого риска развития метастазов и рецидивов, что оправдывало бы проведение профилактического лечения. Однако, значительная часть таких больных обманывают ожидания. Поэтому большое значение имеет поиск дополнительных прогностических факторов или маркеров, определяющих степень злокачественности опухоли и прогнозирующих течение болезни.
Таблица 1.
Классификации рака ободочной и прямой кишки и результаты пятилетней выживаемости в зависимости от стадии.
| TNM | Модифицированная классификация Дюка | 5-ти летняя выживаемость |
|---|---|---|
| TisNoMo T1NoMo T2NoMo | A | 90 – 100% |
| T3NoMo | B1 | 80 – 85 % |
| T4NoMo | B2 | 70 — 75 % |
| T1-4N1Mo | C1 | 50 — 65% |
| T1-4N2-3Mo | C2 | 35 — 45% |
| T1-4N0-3M1 | D | 5% |
Показано, что высокий процент анеуплоидии ДНК и клеток в S-фазе предсказывают высокую частоту рецидивов и низкую выживаемость у оперированных больных в стадии B2 по Дюку (3). Значение других маркеров, таких как уровень РЭА до операции, наличие коллоида, экспрессия онкогенов, повреждение хромосом (делеция DDC на 18q и p53 на 17q), активность тимидилатсинтетазы, экспрессия Р-гликопротеина и др. до конца не ясно и активно изучается (4,5,6,7,8). Это необходимо для идентификации групп больных с высоким риском рецидивирования, которые также нуждаются в проведении профилактического лечения.
Значение других маркеров, таких как уровень РЭА до операции, наличие коллоида, экспрессия онкогенов, повреждение хромосом (делеция DDC на 18q и p53 на 17q), активность тимидилатсинтетазы, экспрессия Р-гликопротеина и др. до конца не ясно и активно изучается (4,5,6,7,8). Это необходимо для идентификации групп больных с высоким риском рецидивирования, которые также нуждаются в проведении профилактического лечения.
Первые исследования по оценке роли адъювантной химиотерапии при II-III стадиях рака ободочной кишки проведены Gastrointestinal Tumor Study Group (GITSG) в начале 80-х годов. Профилактическая химиотерапия 5-фторурацилом, проводимая после радикальной операции, сравнивалась с чисто хирургическим лечением. Было показано, что 5-фторурацил не улучшает отдаленные результаты (9). Первое исследование, показавшие положительное влияние адъювантной химиотерапии комбинацией MOF (CCNU + 5-FU + винкристин) на безрецидивную и общую выживаемость больных раком ободочной кишки II — III стадии (B2, C1 и C2 по Дюку), проведено Wolmark N с соавторами (10).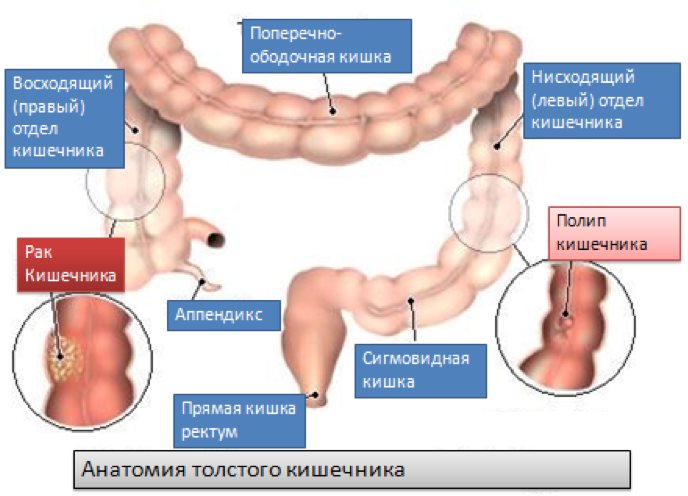
Положительное влияние профилактической химиотерапии 5-фторурацилом и левaмизолом у больных раком ободочной кишки после радикальных операций было продемонстрировано в двух исследованиях (11, 12). В первом исследовании (11) 400 пациентов раком ободочной кишки II-III стадии после радикальной операции были разделены на три группы: часть больных только наблюдалась, часть получила лечение левамизолом, часть лечилась комбинацией левамизола с 5-фторурацилом. Было показано, что профилактическое лечение левамизолом не улучшает результаты операции, а комбинация 5-фторурацила с левамизолом у больных с III стадией (стадия С по Дюку) улучшает безрецидивную и общую выживаемость. Второе исследование подтвердило результаты предыдущего: у больных с III стадией рака ободочной кишки профилактическая химиотерапия 5-фторурацилом с левaмизолом снизила риск рецидивов на 41%, а смертность на 33%(12). Таким образом, после проведенных исследований профилактическое лечение комбинацией 5-фторурацила с левамизолом у больных c III стадией (стадия С по Дюку) рака ободочной кишки было признано стандартным и рекомендовано для практического применения.
Возможный механизм синергического действия противоопухолевого препарата левамизола с 5-фторурацилом много обсуждался. Традиционно механизм действия левамизола рассматривался как иммуномодулирующий. Более поздние исследования на клеточных линиях рака ободочной кишки показали, что синергизм между двумя препаратами — результат включения 5-фторурацила в РНК, вследствие чего происходит аккумуляция НLA класса I РНК, которую левамизол делает стабильной (13).
Успешное применение комбинации 5-фторурацила с лейковорином при диссеминированном раке ободочной и прямой кишки подтолкнуло к изучению ее в качестве адъювантного лечения. В 1993 году Wolmark N. с соавторами (14) опубликовал результаты рандомизированного исследования, в котором сравнивалась комбинация MOF и комбинация 5-фторурацила с лейковорином у 1081 больного со стадией В2/С рака ободочной кишки после радикальных операций. Показано преимущество комбинации 5-фторурацила с лейковорином. Разные режимы применения 5-фторурацила с лейковорином были оценены у больных со стадией В и С рака ободочной кишки в качестве адъювантного лечения по сравнению с контрольной группой еще в трех евро-канадских исследованиях(15,16,17). В результате показано статистически достоверное снижение смертности на 22-35%, увеличение 3-летней безрецидивной выживаемости с 62 до 71%, а общей выживаемости с 78 до 83% у больных со стадией С, получавших адъювантное лечение, по сравнению с контролем.
В результате показано статистически достоверное снижение смертности на 22-35%, увеличение 3-летней безрецидивной выживаемости с 62 до 71%, а общей выживаемости с 78 до 83% у больных со стадией С, получавших адъювантное лечение, по сравнению с контролем.
До недавнего времени считалось, что профилактическое лечение комбинацией 5-фторурацила с лейковорином в течение 6 месяцев является более дешевым эквивалентом одногодичному применению 5-фторурацила с левамизолом. В 1997 году были опубликованы результаты рандомизированного исследования, включавшего 3759 больных со стадией В2/С рака ободочной кишки (18). Сравнивались четыре лечебных режима: I — 5-фторурацил с низкими дозами лейковорина, II — 5-фторурацил с высокими дозами лейковорина, III — 5-фторурацил с левамизолом, IY — 5-фторурацил с лейковорином и левамизолом. В результате установлено, что комбинация 5-фторурацила с лейковорином, применяемая 6 месяцев, не уступает по эффективности комбинации 5-фторурацила с левамизолом в течение 12 месяцев, а комбинация 5-фторурацила с лейковорином и левамизолом не имеет преимуществ перед другими режимами.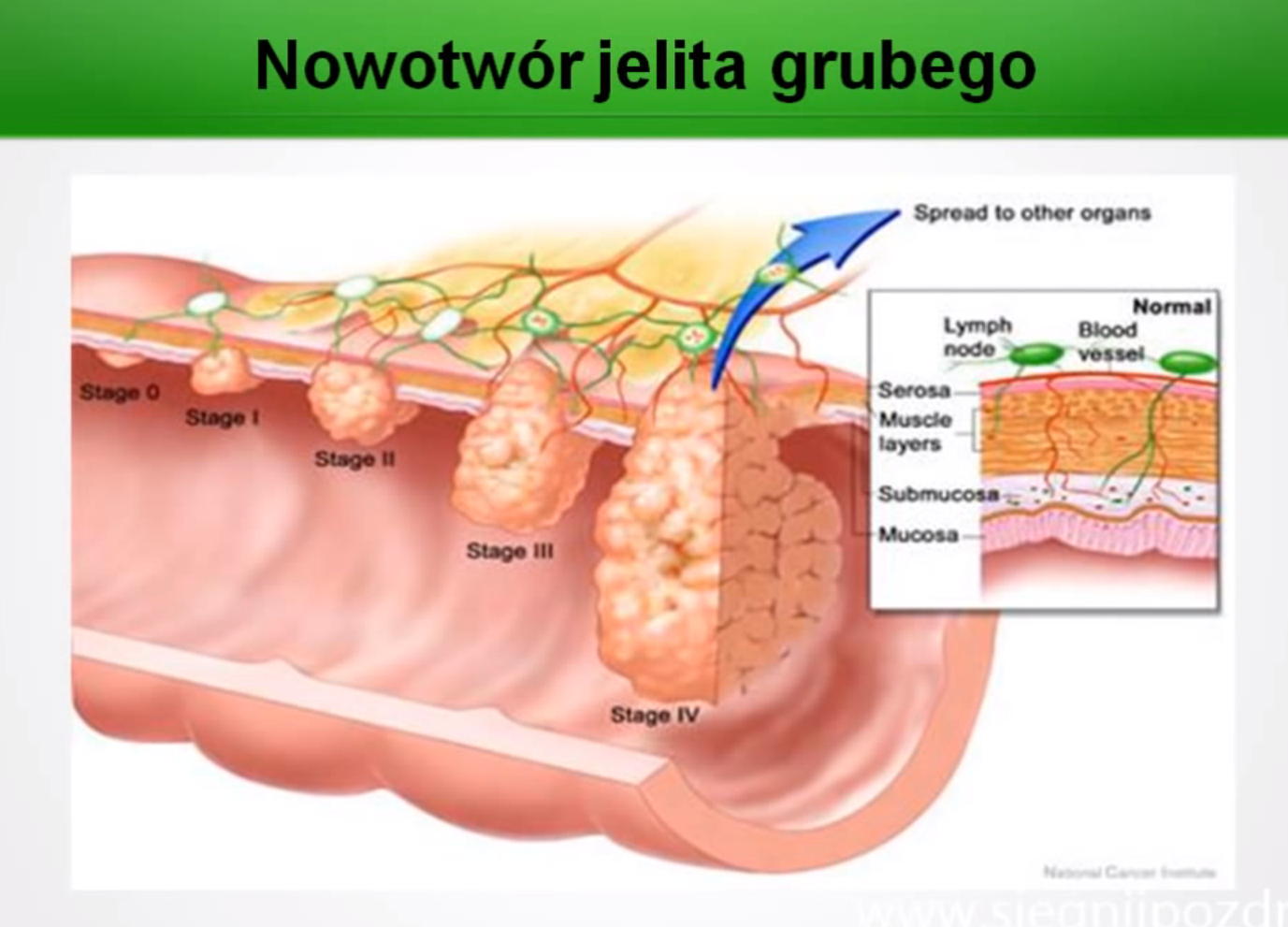
В настоящее время стандартным считается следующий режим профилактической химиотерапии при III стадии рака ободочной кишки: 5-фторурацил — 425 мг/м2 в/в 5 дней + лейковорин — 20 мг/м2 в/в 5 дней. Повторные курсы каждые 4-5 недель. Лечение в течение 6 месяцев. Основным проявлением токсичности этого режима является желудочно-кишечная (диарея).
Одним из методов адъювантной химиотерапии рака ободочной кишки является использование короткой инфузии 5-фторурацила с гепарином в печеночную вену послеоперационно у больных с высоким риском развития метастазов в печень. По данным Taylor I с соавторами (19), который провел рандомизированное исследование, включавшее 244 больных, применение этой методики снижает риск развития печеночных метастазов и улучшает выживаемость. Однако более позднее рандомизированное исследование, основанное на наблюдениях за 1158 больными, получавшими или только операцию, или дополнительно 5-фторурацил с гепарином в печеночную вену, не подтвердило результаты Taylor с соавт.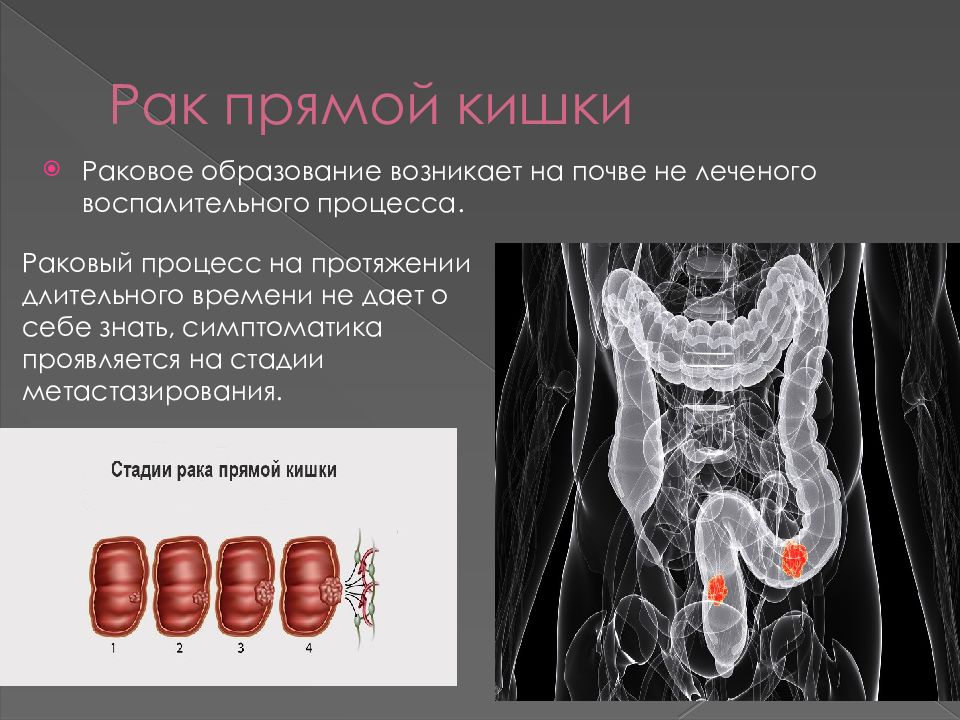 , а показано лишь увеличение безрецидивной выживаемости (20).
, а показано лишь увеличение безрецидивной выживаемости (20).
Одним из аспектов адъювантного лечения при раке ободочной кишки является периоперационная химиотерапия, хотя ее роль еще окончательно не определена. С этой целью организовано рандомизированное исследование, в котором часть больных в течение 7 дней периоперационно получает 5-фторурацил, другая часть больных этого лечения не получает. В дальнейшем всем пациентам проводится стандартное лечение комбинацией 5-фторурацила с левамизолом. Возможно, это исследование внесет ясность в вопрос о роли периоперационной профилактической химиотерапии (21).
В последние годы появились сообщения об эффективности производного фторпиримидина препарата UFT в монотерапии или в комбинации с митомицином С в качестве адъювантного лечения у больных раком ободочной и прямой кишки (22, 23). Однако роль UFT, а также его комбинации с лейковорином должна быть уточнена в последующих исследованиях.
Различия в экспрессии антигенов между опухолевыми и нормальными клетками организма позволяют расширить возможности лечения ряда онкологических заболеваний. Для клеток колоректального рака показана экспрессия нескольких антигенов: раковоэмбрионального, мутантного K-ras, карбогидратных GM2, sTn(c), TF (c), sialyl-Le A, Le Y. Это делает возможным разработку антиген-специфических способов лечения колоректального рака (28).
Для клеток колоректального рака показана экспрессия нескольких антигенов: раковоэмбрионального, мутантного K-ras, карбогидратных GM2, sTn(c), TF (c), sialyl-Le A, Le Y. Это делает возможным разработку антиген-специфических способов лечения колоректального рака (28).
Принципиально существуют два подхода к использованию антигенных различий между опухолевыми и нормальными клетками. Первый заключается в активации иммунной системы больного вакцинами, содержащими эти антигены. Второй — в пассивной иммунотерапии больного посредством введения противоопухолевых моноклональных антител.
Предклинические исследования показали эффективность обоих подходов. Так, введение мышам с опухолью толстого кишечника гуманизированных моноклональных антител huKS 1/4 -14-2, противоопухолевой антигенной детерминанте Ep CAM GA733-2 приводило практически к 80% излечению животных (24). Изготовление гуманизированных или «очеловеченных» антител стало необходимым после того, как была показана высокая эффективность их мышиных аналогов mAb 17-1A. В рандомизированных исследованиях, включавших 189 больных со стадией С рака ободочной кишки, при использовании моноклональных антител профилактически после удаления основной опухоли было показано увеличение пятилетней выживаемости на 30% и увеличение продолжительности безрецидивного периода на 27%. Однако введение чужеродного, в данном случае, мышиного, белка имеет определенные ограничения, обойти которые возможно при использовании гуманизированных антител. При клиническом изучении моноклональных антител I131-mAb Ab33 у 5 из 23 больных зарегистрирован противоопухолевый эффект (25). Разработка других антигензависимых способов лечения пока ограничена I и II фазами клинических исследований.
В рандомизированных исследованиях, включавших 189 больных со стадией С рака ободочной кишки, при использовании моноклональных антител профилактически после удаления основной опухоли было показано увеличение пятилетней выживаемости на 30% и увеличение продолжительности безрецидивного периода на 27%. Однако введение чужеродного, в данном случае, мышиного, белка имеет определенные ограничения, обойти которые возможно при использовании гуманизированных антител. При клиническом изучении моноклональных антител I131-mAb Ab33 у 5 из 23 больных зарегистрирован противоопухолевый эффект (25). Разработка других антигензависимых способов лечения пока ограничена I и II фазами клинических исследований.
Вакцинация — это другой путь использования антигенных отличий опухоли для ее лечения. В настоящее время вакцинация проводится, как правило, больным с распространенным опухолевым процессом. Это, с одной стороны, может объяснить низкий иммунный ответ организма больного на антиген, но, с другой стороны, степень выраженности иммунного ответа коррелирует с более благоприятным прогнозом течения заболевания. Показано, что наличие ответа на антиидиотипические антитела 105 AD7 (мимикрируют с колоректальным опухолевым антигеном gp 72) является хорошим прогностическим признаком, так как у больных увеличивалась продолжительность безрецидивного периода. Так, у 23 больных была изучена антиидиотипическая вакцина, содержащая в качестве антигена моноклональные мышиные антитела 3Н1 (26,27).
Показано, что наличие ответа на антиидиотипические антитела 105 AD7 (мимикрируют с колоректальным опухолевым антигеном gp 72) является хорошим прогностическим признаком, так как у больных увеличивалась продолжительность безрецидивного периода. Так, у 23 больных была изучена антиидиотипическая вакцина, содержащая в качестве антигена моноклональные мышиные антитела 3Н1 (26,27).
Проводятся более широкие исследования по возможности использования в качестве адъювантной терапии вакцин на основе раково-эмбрионального антигена. В США вакцина, созданная на основе рекомбинантного РЭА, проходит I фазу клинических испытаний, и исследователи отмечают перспективность подобных работ, так как у больных с диссеминированным процессом на фоне экспрессии эндогенного РЭА удалось получить иммунный ответ и не было зарегистрировано никаких побочных реакций. В других клинических исследованиях у больных колоректальным раком удалось зафиксировать иммунный ответ к рекомбинантному РЭА, который проявлялся в РЭА-зависимых лимфопролиферативных процессах. Рекомбинантный РЭА использовали с адъювантом гидроксиалюминием и колониестимулирующими факторами. Отсутствие побочных эффектов позволило авторам рекомендовать изучение роли этой вакцины для лечения больных с менее распространенным процессом (28).
Рекомбинантный РЭА использовали с адъювантом гидроксиалюминием и колониестимулирующими факторами. Отсутствие побочных эффектов позволило авторам рекомендовать изучение роли этой вакцины для лечения больных с менее распространенным процессом (28).
В заключение следует сказать, что согласительная конференция, проводившаяся под эгидой Национального ракового института (США) установила, что в качестве профилактического лечения при раке ободочной кишки в стадии С после радикальной операции должна использоваться комбинация 5-фторурацила с лейковорином в течение 6 месяцев или моноклональные антитела. Применение этих методов улучшает отдаленные результаты лечения больных.
Список литературы.
1. Саncer Facts. Figures-1996. Atlanta,GA: American Cancer Society; 1966: 1-33.
2. Kohne-Womper C.M., Schoffski P., Smoll H.J. Adjuvant therapy for colon adenocarcinoma: current status of clinical investigation. Am. Oncol. , 1994, v.5 (suppl.3), pp.97-104.
, 1994, v.5 (suppl.3), pp.97-104.
3. Witzig T., Loprinzi C., Goncharoff N. et al. DNA ploidy and cell kinetic measurements as predictors of recurrence and survival in stages B2 and C colorectal adenocarcinoma. Cancer; 1991, v.68,pp.879-888.
4. Cohen A.M., Minsky B.D., Schilsky R.L.: Colon cancer, in De Vita V.T., Hellman S., Rosenberg S.A. (eds.): Cancer: Principles and Practice of Oncology, Philadelphia, PA, Lippincott, 1993, pp. 929-977.
5. Moertal C.G., O`Fallon J.R., Go V.Z., et al: The preoperative carcinoembryonic antigen test in diagnosis, staging, and prognosis of colorectal cancer. Cancer,1986,v.58, pp. 603-610.
6. Jen J.,Kim M., Piantadosi S., et al., Allelic loss of chromosome 18q and prognosis in colorectal cancer N. Engl. J. Med., 1994, v. 331, pp.213-221.
7. Peters C.J., van der Wilt C.L., Groeningen C.J., et al. Thymidilate synthase inhibition after administration of fluorouracil with or without leucovorin in colon cancer patient: Implications for treatment with Fluouracil. J. Clin. Oncol.,1994, v.12,pp.2035-2042.
J. Clin. Oncol.,1994, v.12,pp.2035-2042.
8. Sinicrope F., Mart J., Brasitus et al. Relationship of P-glycoprotein and carcinoembryonic antigen expression in human colon carcinoma to local invasion, DNA ploidy and disease relapse. Cancer, 1994, v. 74., pp. 2908-2917.
9. Buyse M., Leleniuch-Jacquotte A., Chalmess t. Adjuvant therapy of colorectal cancer JAMA, 1988, v.259, pp.3571-35-78.
10. Wolmark N., Fisher B., Rockette M., et al Postoperative adjuvant chemotherapy or BCG for colon cancer. Results from NSABP Protocol C-01. J NCI, 1988, v. 80, pp.30-36.
11. Lauric J.A., Moertel C. G., Fleming T.R. et al Surgical adjuvant therapy of large-bowel carcinoma: an evaluation of levamisole and fluorouracil. J.Clin. Oncol.,1989,v.7.,pp.1447-1456.
12. Moertel C.G., Fleming T.R., MacDonald J.S. et al Fluorouracil plus levamisole as effective adjuvant therapy after resection of stage III colon carcinoma: a final report/ Ann. Intern. Med., 1995, v. 122, pp. 321-326.
Intern. Med., 1995, v. 122, pp. 321-326.
13. ElMuataz G. Et al J. Nat. Cancer Inst., 1995., v. 87, pp. 489-495.
14. Wolmark N.,., Rockette M., Fisher B et al The benefit of leucovorin-modulated fluorouracil as postoperative adjuvant therapy for primary colon cancer. J. Clin. Oncol. 1993, v. 11, pp. 1879-1887.
15. O`Connel M., Mailliard J., MacDonald J.S.t al An Intergroup trial of intensive course 5-FU and low dose leucovorin as surgical adjuvant therapy for high risk colon cancer. Proc.SCO, 1993, v. 12, p.190.
16. International multicenter pooled analysis of colon cancer Trials (IMPACT) investigators. Efficacy of adjuvant fluorouracil and folinic acid in colon cancer. Lancet, 1995, v. 345, pp. 939-944.
17. Francini G., Petrioli R., Lorenzini L/ et al Folinic acid and 5-fluorouracil as adjuvant chemotherapy in colon cancer. Gastroenterology, 1994, v. 106, pp. 899-906.
18. Haller D. G., Catalano P.G., MacDonald J.S., Mayer R.J. Fluorouracil, leucovorin and levamisole adjuvant therapy for colon cancer: for-year results of INT-DO89. Proc. ASCO, 1997, v.16, p.265a, abs. 940.
19. Taylor I., Machin D., Mullee M. Et al. A randomized controlled trial of colorectal cancer Br.J. Surg.,1985, v. 72, pp. 359-362.
20. Wolmark N.,., Rockette M., Wickerham D.L. et al Adjuvant therapy of Dukes A, B and C adenocarcinoma of the colon with portal — vein Fluorouracil hepatic infusion. J. Clin. Oncol., 1990, v. 8, pp. 1466-1475.
21. Wolmark N.,., Rockette M., Petrelli et al. Long-term results of efficacy of perioperative portal vein infusion of 5-FU for treatment of colon cancer: NSABP C-02. Proc.Am.Soc.Clin. Oncol., 1994, v.13, p.194 (abs).
22. Mitmi T., Tsuchiya S., Hiki Y. Et al. A randomized controlled study on adjuvant chemotherapy to curative resection of colorectal cancer. Proc. ASCO, 1993, v. 12, p.225, abs.690.
Proc. ASCO, 1993, v. 12, p.225, abs.690.
23. Nakazato H., Koike A., Sail S. Et al Efficacy of oral UFT as adjuvant chemotherapy to curative resection of colorectal cancer: a prospective randomized clinical trial. Proc. ASCO, 1997, v. 16, p. 279a, abs. 990.
24. Xiang R., Lode H.N., Dolman C.S. et al. Elimination of established murine colon carcinoma metastases by antibody-interleukin 2 fusion protein therapy. Cancer Res., 1997, v. 57, pp. 4948-4955.
25. Tschmelitsch J., Barendswaard E., Williams C. Et al. Enhanced antitumor activity of combination radioimmunotherapy (131I-labeled monoclonal antibody A33) with chemotherapy (fluorouracil). Cancer Res., 1997, v. 57, pp.2181-2186.
26. Chatterjee S.K., Tripathi P.K., Chakraborty M. et al. Molecular mimicry of carcinoembryonic antigen by peptides derived from the structure of an anti-idiotype antibody. Cancer Res., 1998, v. 58, pp. 1217-1224.
27. Dalgleish A. Anti-idiotype vaccines tackle colorectal cancer. The Lancet, 1996, v. 347, p.1682.
Dalgleish A. Anti-idiotype vaccines tackle colorectal cancer. The Lancet, 1996, v. 347, p.1682.
28. Sznol M., Holmund J. Antigen -specific agents in development. Seminars in oncology., 1997, v. 24, pp. 173-186.
МЕЗЕНХИМАЛЬНЫЕ ОПУХОЛИ ТОЛСТОЙ КИШКИ: ДИАГНОСТИКА, ЛЕЧЕНИЕ, ПРОГНОЗ (клинический случай и обзор литературы) | Майновская
1. Sherri L, Stewart et al. A Population-Based Study of Colorectal Cancer Histology in the United States, 1998-2001. Colorectal Cancer Histology. 2006:1128-1141. doi:10.1002/cncr.22010.
2. Devriendt S, Leman G, Vanrykel F. Primary leiomyosarcoma of the colon: a case report and review of the literature. Acta Chirurgica Belgica. 2019:1-4. doi:10.1080/00015458.2019.1589185.
3. Maron DJ. Carcinoids, GISTs, and Lymphomas of the Colon and Rectum. In: Steele S., Hull T., Hyman N., Maykel J., Read T., Whitlow C. The ASCRS Manual of Colon and Rectal Surgery. Springer, Cham. 2019.
Maron DJ. Carcinoids, GISTs, and Lymphomas of the Colon and Rectum. In: Steele S., Hull T., Hyman N., Maykel J., Read T., Whitlow C. The ASCRS Manual of Colon and Rectal Surgery. Springer, Cham. 2019.
4. Ma G, Murphy J, Martinez M. et al. Epidemiology of gastrointestinal stromal tumors in the era of histology codes: results of a population-based study. Cancer Epidemiol Biomarkers Prev. 2015;24:298-302. doi:10.1158/1055-9965.EPI-14-1002.
5. Никулин М.П., Стилиди И.С. Гастроинтестинальные стромальные опухоли (ГИСО). Эпидемиология, диагностика, современные подходы к лечению. Современная онкология. Экстра-выпуск. 2007, с. 3-50.
6. Ассоциация онкологов России, Российское общество клинической онкологии. Клинические рекомендации «Гастроинтестинальные стромальные опухоли». 2018.
2018.
7. Мазуренко Н.Н., Цыганова И.В. Молекулярно-генетические особенности и маркеры гастроинтестинальных стромальных опухолей. Успехи молекулярной онкологии. 2015; № 2, с. 29-37. doi: 10.17650/2313-805X.2015.2.2.29-40.
8. Халиков Д.Д., Ахметзянов Ф.Ш., Петров С.В. Клиникоморфологическая характеристика гастроинтестинальных стромальных опухолей. Архив патологии. 2017; № 79(4), с. 48-55. doi:10.17116/patol201779448-55.
9. Miettinen M, Furlong M, Sarlomo-Rikala M. et al. Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the rectum and anus: a clinicopathologic, immunohistochemical, and molecular genetic study of 144 cases. Am J SurgPathol. 2001;25(9):1121-1133. doi: 10.1097/00000478-200109000-00002.
10. Emile J, Brahimi S, Coindre J. et al. Frequencies of KIT and PDGFRA mutations in the MolecGIST prospective populationbased study differ from those of advanced GISTs. Med Oncol. 2012;29(3):1765-1772. doi: 10.1007/s12032-011-0074-y.
Emile J, Brahimi S, Coindre J. et al. Frequencies of KIT and PDGFRA mutations in the MolecGIST prospective populationbased study differ from those of advanced GISTs. Med Oncol. 2012;29(3):1765-1772. doi: 10.1007/s12032-011-0074-y.
11. Killian J, Miettinen M, Walker R. et al. Recurrent epimutation of SDHC in gastrointestinal stromal tumors. Sci Transl Med. 2014;24;6(268):268-277. doi: 10.1126/scitranslmed.3009961.
12. Lindberg M. Gastrointestinal stromal tumor. Diagnostic pathology. Soft tissue tumors 2nd edition. Elsevier, 2016:734-749.
13. Koliaraki V, Pallangyo CK, Greten FR. et al. Mesenchymal Cells in Colon Cancer. Gastroenterology. 2017:152(5):964-979. doi: 10.1053/j.gastro.2016.11.049.
14. Nishida T, Blay J-Y, Hirota S. et al. The standard diagnosis, treatment, and follow-up of gastrointestinal stromal tumors based on guidelines. Gastric Cancer. 2015;19(1):3-14. doi: 10.1007/s10120-015-0526-8.
Nishida T, Blay J-Y, Hirota S. et al. The standard diagnosis, treatment, and follow-up of gastrointestinal stromal tumors based on guidelines. Gastric Cancer. 2015;19(1):3-14. doi: 10.1007/s10120-015-0526-8.
15. WHO Classification of Tumors Editorial Board. Digestive system Tumours. 5th. ed. Lyon (France): International agency for Research on Cancer; 2019.
16. Lasota J, Miettinen M. Clinical significance of oncogenic KIT and PDGFRA mutations in gastrointestinal stromal tumours. Histopathology. 2008;53:245-266. doi: 10.1111/j.13652559.2008.02977.x.
17. Joensuu H, Vehtari A, Riihimaki J. et al. Risk of recurrence of gastrointestinal stromal tumour after surgery: an analysis of pooled population-based cohorts. Lancet Oncol. 2012;13:265-274. doi: 10.1016/S1470-2045(11)70299-6.
18. Miettinen M, Lasota J. Gastrointestinal Stromal Tumors. Review on Morphology, Molecular Pathology, Prognosis, and Differential Diagnosis. Arch Pathol Lab Med. 2006;130:1466-1476. doi: 10.1043/1543-2165(2006)130[1466:GSTROM]2.0.CO;2.
19. Heikki J. Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Human pathology. 2008;39:14111419. doi:10.1016/j.humpath.2008.06.025.
20. McCarter MD, Antonescu CR, Ballman KV. et al. American College of Surgeons Oncology Group (ACOSOG) Intergroup Adjuvant Gist Study Team. Microscopically positive margins for primary gastrointestinal stromal tumors: analysis of risk factors and tumor recurrence. J Am Coll Surg. 2012;215:53-59. doi:10.1016/j.jamcollsurg.2012.05.008.
21. Corless CL, Ballman KV, Antonescu CR. et al. Pathologic and molecular features correlate with long-term outcome after adjuvant therapy of resected primary GI stromal tumor: the ACOSOG Z9001 trial. J Clin Oncol. 2014;32:1563-1570. doi:10.1200/JCO.2013.51.2046.
Corless CL, Ballman KV, Antonescu CR. et al. Pathologic and molecular features correlate with long-term outcome after adjuvant therapy of resected primary GI stromal tumor: the ACOSOG Z9001 trial. J Clin Oncol. 2014;32:1563-1570. doi:10.1200/JCO.2013.51.2046.
22. He LJ, Wang BS, Chen CC. Smooth muscle tumors of the digestive tract: report of 160 cases. Br J Surg. 1988;75:184-186. doi: 10.1002/bjs.1800750233.
23. Kusminsky RE, Bailey W. Leiomyomas of the rectum and anal canal: report of 6 cases and review of the literature. Dis Colon Rectum. 1977;20:580-599. doi:10.1007/BF02586622.
24. Suzuki A, Fukuda S, Tomita S. et al. An unusual case of colonic leiomyosarcoma presenting with fever. Significant uptake of radioactivity of gallium-67 in the tumor. Gastroenterol Jpn. 1984;19:486-492. doi: 10.1007/BF02807262.
1984;19:486-492. doi: 10.1007/BF02807262.
25. Lindberg M. Gastrointestinal Smooth Muscle Neoplasms. Diagnostic pathology. Soft tissue tumors 2nd edition. Elsevier 2016:752-755.
26. Coindre JM. Grading of soft tissue sarcomas: review and update. Arch Pathol Lab Med. 2006;130(10):1448-53. doi: 10.1043/1543-2165(2006)130[1448:GOSTSR]2.0.CO;2.
27. Nuessle WR, Magill TR. Leiomyosarcoma of the transverse colon. Report of a case with discussion. Dis Colon Rectum. 1990;33:323-326. doi: 10.1007/BF02055477.
28. Vorobyov G.I., Odaryuk T.S., Shelygin Yu.A. et al. Surgical Treatment of Benign, Myomatous Rectal Tumors. Dis Colon Rectum. 1992;35(4):328-331. doi:10.1007/BF02048109.
29. Yang J. Primary leiomyosarcoma in the colon: A case report. Medicine (Baltimore).2018;97(7): e9923. doi: 10.1097/MD.0000000000009923.
Yang J. Primary leiomyosarcoma in the colon: A case report. Medicine (Baltimore).2018;97(7): e9923. doi: 10.1097/MD.0000000000009923.
30. Чеснокова Н.П., Невважай Т.А., Понукалина Е.В. и соавт. Лейкемоидные реакции: классификация, этиология, патогенез, принципиальные отличия от лейкозов. Международный журнал экспериментального образования. 2015; № 7, с. 186-188.
Рак толстой кишки | ЧУЗ «КБ «РЖД-Медицина» им. Н.А. Семашко»
Схема радикальных операций при раке ободочной кишки А-А — правосторонняя гемиколэктомия; |
Раковые заболевания сегодня, к сожалению, не редкость. Найти квалифицированного специалиста и хорошо оснащенное лечебное учреждение — это путь к успеху и выздоровлению. Пройти диагностику и лечение рака толстой кишки в ЮВАО вы можете в ДКБ. им Семашко. Онкологическое отделение нашей больницы полностью оснащено для хирургического и химиотерапевтического лечения рака, здесь выполняются высокотехноогические операции любого уровня сложности.
Найти квалифицированного специалиста и хорошо оснащенное лечебное учреждение — это путь к успеху и выздоровлению. Пройти диагностику и лечение рака толстой кишки в ЮВАО вы можете в ДКБ. им Семашко. Онкологическое отделение нашей больницы полностью оснащено для хирургического и химиотерапевтического лечения рака, здесь выполняются высокотехноогические операции любого уровня сложности.
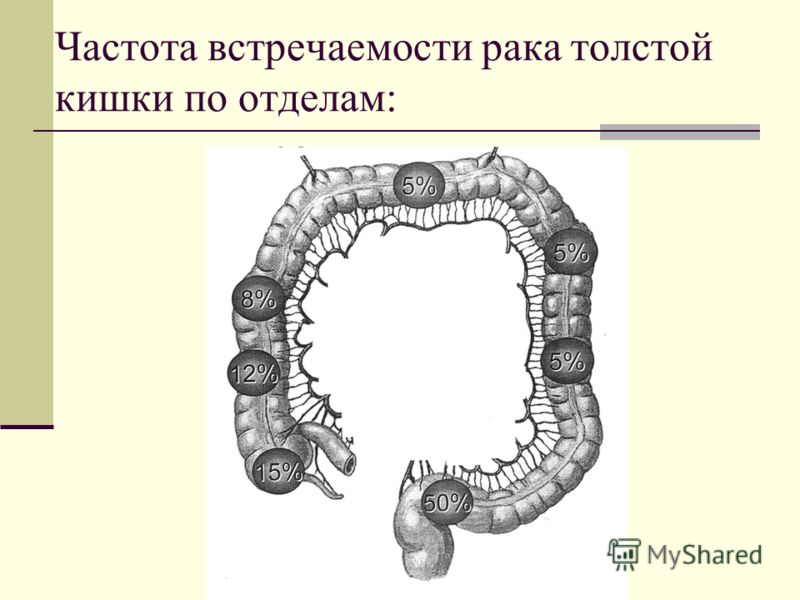
Рак ободочной кишки в структуре заболеваемости населения России злокачественными заболеваниями занимает пятое место как у женщин, так и у мужчин.
Имеются существенные различия в частоте поражения населения различных регионов опухолями толстого кишечника.
Например, в США, Бельгии, Шотландии заболеваемость в 10 раз выше, чем в странах африканского континента. Рак толстой кишки, как правило, возникает у людей старше 60 лет.
Важное значение в возникновении данной патологии имеет диета. Высокое содержание в рационе мяса, уменьшение клетчатки, увеличение животного жира ускоряет рост кишечных бактерий, вырабатывающих канцерогены.
Природные витамины А,С,Е инактивируют канцерогены, а турнепс и цветная капуста индуцируют экспрессию бензпирен гидроксилазы, способной инактивировать поглощённые канцерогены.
Отмечено резкое снижение случаев заболевания среди вегетарианцев.
Факторами риска являются наличие
- колоректального рака среди родственников первой степени родства,
- язвенный колит,
- болезнь Крона,
- диффузный семейный полипоз,
- ворсинчатые опухоли,
- иммунодефициты,
- возраст старше 60 лет.
Диагностика и лечение рака толстой кишки
Клиническая картина рака ободочной кишки довольно разнообразна, однако по совокупности симптомов можно выделить шесть наиболее характерных форм течения заболевания:
- токсикоанемическая — характеризуется развитием прогрессирующей анемии, наличием субфебрильной температуры;
- энтероколитическая — чередование запоров с появлением жидкого стула, появления чувства дискомфорта в брюшной полости;
- диспепсическая форма — тошнота, рвота, отрыжка, снижение аппетита, боли в животе;
- обтурационная — симптомы нарушения проходимости кишечника;
- опухолевая — сам больной или врач находят опухоль в брюшной полости на фоне кажущегося благополучия.

Диагноз рака ободочной кишки возможно установить на основании и по совокупности данных клинического, рентгенологического, эндоскопического и лабораторных методов исследования. Диагностику и лечение рака толстой кишки вы можете пройти в КБ им. Семашко (ЮВАО). Наша больница оснащена всем необходимым для точной диагностики и качественного лечения данного заболевания.
Пальпация опухоли правой половины ободочной кишки, как правило, выявляются в сравнительно ранней стадии. Рак левой половины толстого кишечника в этот период своего развития пальпаторно выявить удаётся реже.
Пальцевое исследование прямой кишки является необходимым при подозрении на опухоль толстого кишечника.
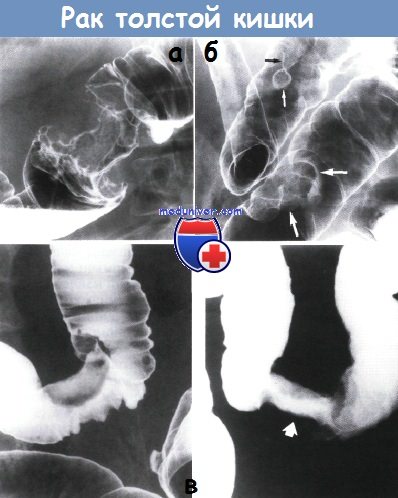
Рентгенологическое исследование даёт возможность не только диагносцировать первичную опухоль, но и позволяет выявить первичную множественность злокачественного процесса, выявить часто встречающиеся полипы. Исследование проводится с бариевой взвесью, с применением метода двойного контрастирования (барий воздух).
Ректороманоскопия позволяет в 55-60% случаев выявить опухоли в сигмовидной кишке, даёт возможность взять биопсию. Колоноскопия, выполняемая при помощи гибкой волокнистой оптики, позволяет осмотреть всю толстую кишку. Взятие биопсии в значительной степени помогает установить правильный диагноз.
УЗИ брюшной полости и малого таза позволяет оценить местную распространённость опухолевого процесса, наличие отдалённых метастазов. Лапароскопическое исследование позволяет визуально определить диссеминацию по париетальной и висцеральной брюшине, распостранение процесса в печень.
В последние годы используются новые высокоинформативные методы диагностики рака ободочной кишки. К ним относятся радиоиммунохирургия, позитронно — эмиссионная томография, определение опухолевых маркёров (раковоэмбриональный антиген).
Аденокарциномы встречаются в 78-90% всех опухолей этой локализации.
Анатомические области и части толстой кишки: аппендикс, слепая кишка, восходящий отдел, печёночный изгиб, поперечная ободочная кишка, селезёночный изгиб, нисходящий отдел, сигмовидная кишка, ректосигмоидный отдел, прямая кишка.
Группирование по четырём стадиям происходит на основе международной клинической классификации рака ободочной и прямой кишки по системе ТNM, где Т обозначает местное распространение опухоли, N — наличие метастазов в регионарных лимфоузлах, а М — отдалённые метастазы.
Регионарными лимфоузлами являются околоободочные и околопрямокишечные, а также узлы, располагающиеся вдоль подвздошной, правой, левой, средней толстокишечной, нижней брыжеечной и верхней прямокишечной, внутренней подвздошной артерий.
Наиболее частой локализацией отдалённых метастазов являются печень, забрюшинные и парааортальные лимфоузлы, лёгкие, кости скелета. Основным методом лечения рака толстой кишки является хирургический.
В зависимости от степени местного распространения опухоли и наличия регионарных метастазов должен быть выбран индивидуальный план хирургического, комбинированного или комплексного лечения. Вид оперативного лечения определяют в соответствии с локализацией опухоли. При локализации опухоли в слепой, восходящей кишке и печёночном изгибе выполняют правостороннюю гемиколэктомию, при раке поперечноободочной кишки — её резекция, при раке селезёночного угла, нисходящей и проксимального отдела сигмовидной кишки — левосторонняя гемиколэктомия, при раке сигмовидной кишки — резекция кишки с удалением клетчатки по ходу сигмовидной артерии.
Комбинированное оперативное вмешательство показано при прорастании опухоли в соседние структуры. При этом резекцию выполняют единым блоком. Эффективность лечения повышается за счёт использования комбинированного метода. Широкое применение находит лучевая терапия в плане комбинированного лечения (на I этапе перед операцией). Реже лучевая терапия используется после оперативных вмешательств — обычно в тех случаях, когда есть сомнение в радикальности выполненной операции.
При невозможности выполнить радикальную операцию производится паллиативное вмешательство типа паллиативной резекции кишки, наложение противоестественного заднего прохода, различного вида стом, а также обходных анастомозов.
Химиотерапия при раке ободочной кишки носит в большей степени паллиативный характер. При использовании препаратов 5-фторурацил и фторафур пятилетняя выживаемость составляет 12-18%. В последние годы появились другие более эффективные препараты.
Прогноз при злокачественных опухолях толстого кишечника зависит от формы роста опухоли, гистологии и степени дифференцировки опухоли, локализации процесса, пола и возраста больного.
Пятилетняя выживаемость составляет в среднем 55-60% при своевременном начале лечения опухолей ободочной кишки.
Диагностика и лечение рака толстой кишки в ЮВАО (Юго-восточном административном округе г. Москвы) осуществляется всего в нескольких клиниках, среди которых ЧУЗ «Клиническая Больница «РЖД-Медицина» им. Н.А. Семашко».
Наши специалисты окажут вам необхоимую медицинскую помощь на уровне мировых стандартов. Стоимость операции вы можете найти в разделе Цены. Получить более подробную информацию или записаться на прием вы можете по круглосуточному телефону +7 (499) 266-98-98.
Распространен и опасен: главное о колоректальном раке — Онкоцентр
Главная » Распространен и опасен: главное о колоректальном раке
Колоректальный рак — «болезнь цивилизации». Наиболее часто опухоли толстой кишки диагностируют у жителей США, Западной Европы и Австралии. Почему этому заболеванию подвержено население развитых стран? Как обезопасить себя от неприятного диагноза и что делать при первом подозрении? На наши вопросы ответил к. м. н., заведующий отделением колопроктологии Санкт-Петербургского клинического научно-практического центра специализированных видов медицинской помощи Илья Черниковский.
м. н., заведующий отделением колопроктологии Санкт-Петербургского клинического научно-практического центра специализированных видов медицинской помощи Илья Черниковский.
Какие виды колоректального рака бывают?
Колоректальный рак (КРР) включает в себя несколько видов. Первый и самый распространенный — это рак ободочной кишки (аденокарцинома толстой кишки). Вторым по частоте является рак прямой кишки (аденокарцинома прямой кишки). И третий вид — это рак анального канала, как правило он плоскоклеточный. Значительно реже встречаются другие злокачественные опухоли прямой ободочной кишки: гастроинтестинальная стромальная опухоль, нейроэндокринный рак или карциноид — более доброкачественный вариант нейроэндокринной опухоли. И совсем редко встречаются меланомы прямой кишки и анального канала.
На каком месте по заболеваемости находится колоректальный рак?
Если брать все виды рака, которые относят к КРР, то на третьем месте в мире. Но в развитых странах процент пациентов с КРР немного больше. Скорее всего, это связано с увеличенной продолжительностью жизни и особенностями питания.
Скорее всего, это связано с увеличенной продолжительностью жизни и особенностями питания.
Считается, что если в популяции употребляют больше мясных продуктов и меньше растительной пищи, то вероятность возникновения колоректального рака увеличивается.
Какие виды КРР более распространены среди женщин, а какие среди мужчин?
Достоверно известно, что любым видом КРР чаще болеют женщины. Это принято связывать с тем, что женщины живут дольше, а колоректальный рак, как и большинство других видов рака, — это болезнь пожилых людей. Раньше считалось, что рак анального канала тоже чаще встречается у женщин. В 1975 году в США на 100 тыс человек им болело меньше 1% женщин и около 0,7% мужчин. А к 2007 году этот уровень увеличился в 1,7 и 3 разасоответственно. Достоверно установлена причина этого вида рака — он вызывается вирусом папилломы человека (ВПЧ) и передается между партнерами, практикующими анальный секс. Поэтому сейчас много мужчин нетрадиционной сексуальной ориентации страдают от рака анального канала, но, конечно, в зону риска входят и женщины. Если проводить массовую вакцинацию от онкогенных штаммов ВПЧ, то сложившуюся ситуацию можно было бы улучшить. Причем это работает не только при вышеуказанном заболевании, но и для других видов плоскоклеточного рака: рака шейки матки и некоторых видов опухолей головы и шеи.
Поэтому сейчас много мужчин нетрадиционной сексуальной ориентации страдают от рака анального канала, но, конечно, в зону риска входят и женщины. Если проводить массовую вакцинацию от онкогенных штаммов ВПЧ, то сложившуюся ситуацию можно было бы улучшить. Причем это работает не только при вышеуказанном заболевании, но и для других видов плоскоклеточного рака: рака шейки матки и некоторых видов опухолей головы и шеи.
Как можно понять, что у тебя повышенный риск развития колоректального рака? С какого возраста следует начинать профилактические обследования?
Очень важно помнить, что 10% случаев КРР — это наследственные формы.
В США, где скрининг развит наиболее сильно, принято выделять группы среднего, повышенного и высокого риска.
Группа среднего риска — это большинство из нас: здоровые люди, у которых нет близких родственников, которые бы болели КРР, раком желудка, раком тела матки или раком молочной железы. У них отсутствуют наследственные синдромы и хронические воспалительные заболевания кишечника, а именно неспецифический язвенный колит или синдром раздраженной кишки.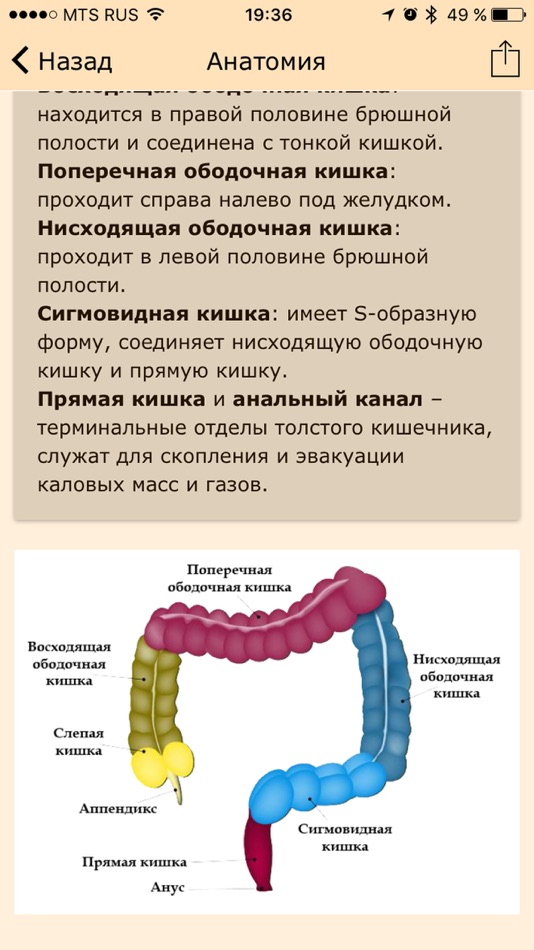 В этой группе скрининговые обследования нужно проводить с 55 лет.
В этой группе скрининговые обследования нужно проводить с 55 лет.
Группа повышенного риска — это пациенты, у которых кровные родственники (родители или бабушки\дедушки) болели указанными выше видами рака. У таких людей повышен риск возникновения злокачественного новообразования, в том числе и КРР. Представителям этой группы следует начинать обследования раньше, в США советуют это делать с 45 лет.
И, наконец, есть группа высокого риска. В нее входят пациенты с доказанными наследственными синдромами: диффузным семейным полипозом, синдромом Пейтца–Егерса или синдромом Линча. Для таких людей характерно раннее возникновение полипов в кишечнике и затем развитие из них злокачественной опухоли. Также сюда относят пациентов, более 10 лет страдающих неспецифическим язвенным колитом или болезнью Крона. Этой группе нужно начинать скрининговую программу намного раньше. Например, наличие родственников с диффузным семейным полипозом сдвигает эту границу аж к 20 годам. А при синдроме Линча у пациента в 100% случаев разовьется колоректальный рак, если он до него доживет. Если у таких людей находят опухоль кишечника, то удаляют всю толстую и прямую кишку, понимая, что рано или поздно у них разовьется рак и в оставшейся части.
Если у таких людей находят опухоль кишечника, то удаляют всю толстую и прямую кишку, понимая, что рано или поздно у них разовьется рак и в оставшейся части.
Первая стадия скрининга для всех групп риска — это иммунохимический анализ кала на скрытую кровь. Тест бывает количественный и качественный, но лучше выбирать количественный, он точнее. Если тест показывает наличие крови в кале, то тогда следует выполнить фиброколоноскопию, чтобы посмотреть все толстую и прямую кишку.
Какие программы скрининга действуют сейчас в России?
В России, к сожалению, вообще нет скрининговых программ, если мы говорим о популяционном скрининге. У нас есть только некоторые элементы. Например, в Санкт-Петербурге несколько лет назад проводилась программа по скринингу рака молочной железы. Женщин обследовали, поводили маммографию, специально оснащали кабинеты маммологов и прочее. Но такие программы должны финансироваться отдельно, а у нас все пытаются включить в программу диспансеризации, не совсем понимая, что диспансеризация и онкологический скрининг — разные вещи.
Всего в мире известны три опухолевые локализации, в отношении которых популяционный скрининг доказано эффективен: КРР, рак молочной железы и рак шейки матки. Все остальные вопросы, связанные со скринингом, например, рака легкого или рака предстательной железы, пока только изучаются, очевидных доказательств эффективности сегодня нет. А внедрение скрининговой программы по КРР в США помогло снизить смертность примерно на 10%, это жизнь 13,5 тысяч человек ежегодно.
Но что очень важно для популяционного скрининга, так это хороший охват групп населения. Если он меньше 50%, то затраты на скрининг превышают пользу. В такие программы должны вовлекаться не только онкологи, эпидемиологи и другие врачи, но также СМИ, медиаперсоны да и общество в целом. Это большая комплексная работа, которой сейчас нет в России.
Какие профилактические действия помогут снизить риск КРР?
Безусловно, первое, что можно сделать — отказаться от курения. Также нужно стараться употреблять больше клетчатки и меньше переработанного красного мяса. Если есть проблемы с функционированием кишечника (синдром раздраженной кишки, нарушения стула) — это нужно обязательно лечить. И, наконец, нужно понимать, что если вам стукнуло пятьдесят лет, то необходимо на всякий случай сдать кал на скрытую кровь и сделать колоноскопию. Любые жалобы: изменение стула, наличие крови — должны быть поводом для посещения врача. Нельзя махать рукой на такие обстоятельства, думая, что у тебя просто геморрой. Нужно обратиться к специалисту, который назначит правильное обследование и лечение. Для любого грамотного проктолога наличие крови в стуле — это повод назначить фиброколоноскопию.
Также нужно стараться употреблять больше клетчатки и меньше переработанного красного мяса. Если есть проблемы с функционированием кишечника (синдром раздраженной кишки, нарушения стула) — это нужно обязательно лечить. И, наконец, нужно понимать, что если вам стукнуло пятьдесят лет, то необходимо на всякий случай сдать кал на скрытую кровь и сделать колоноскопию. Любые жалобы: изменение стула, наличие крови — должны быть поводом для посещения врача. Нельзя махать рукой на такие обстоятельства, думая, что у тебя просто геморрой. Нужно обратиться к специалисту, который назначит правильное обследование и лечение. Для любого грамотного проктолога наличие крови в стуле — это повод назначить фиброколоноскопию.
На какие моменты нужно обратить внимание, когда тебе назначают колоноскопию?
Как и при любой другой инвазивной манипуляции, чем чаще врач ее выполняет, тем больше у него в этом опыта. Достаточно банальная истина, но нужно обращаться в учреждение с хорошим потоком пациентов. Во-вторых, нужно идти туда, где процедуру вам сделают на качественном оборудовании. И, желательно, где вам обеспечат обезболивание.
Во-вторых, нужно идти туда, где процедуру вам сделают на качественном оборудовании. И, желательно, где вам обеспечат обезболивание.
К сожалению, у нас есть проблема с отсутствием контроля качества колоноскопии. Хотя вполне объективные критерии ее выполнения существуют. К этим проблемам на западе относятся очень серьезно. Гипотетически можно делать колоноскопию всем людям, например, в городе Санкт-Петербурге. Потратить на это огромные деньги. Но если сделать ее всем и некачественно, то ценность такой процедуры теряется. Если врач пропустит 15% полипов у 15% больных, то ценность этого скрининга будет нулевая. Именно поэтому за рубежом есть четкие объективные критерии оценки качества выполненной процедуры. А у нас их пока нет.
А каковы эти критерии качества?
Самое понятное для неспециалистов — колоноскопия не должна продолжаться меньше 15 минут. Если доктор говорит, что очень быстро засунул колоноскоп, моментально осмотрел всю кишку и он молодец, то это не так.
Значит он смотрел невнимательно. А полипы бывают маленькие, например, полсантиметра-сантиметр. Если врач эти полипы пропустил, а в следующий раз человек собрался сделать колоноскопию, скажем, через 10 лет, то за это время из полипа может развиться рак.
Кстати, критерии качества хирургического вмешательства при КРР тоже важный вопрос. Ведь что такое онкологическая операция? Это операция, качество которой мы не можем определить сегодня, завтра или послезавтра. В отличии от какого-нибудь геморроя, при онкологическом заболевании у пациента, зачастую нет жалоб. Он лег на стол и чувствовал себя хорошо; встал и чувствует то же самое. Но как выполнена эта операция, мы не знаем. Мы можем это определить только через год, когда человек придет, сделает компьютерную томограмму и там действительно будет все хорошо, без признаков рецидива болезни. Но если он придет, а эти признаки будут, то поздно что-то говорить доктору. Время уже упущено.
Сегодня именно для КРР существуют вполне четкие критерии качества. Их придумали онкохирурги в развитых странах. Это, так называемая, препарат-ориентированная хирургия. На основании характеристик удаленного препарата уже через день после операции можно сказать, качественно она была выполнена или нет. Но по этим критериям в России никто не оценивает хирургов. Мы сейчас пытаемся исправить ситуацию, создаем раковый регистр. Уже охватили несколько учреждений в Питере и других городах России, которые будут участвовать в оценке качества операций. Это очень важно, поскольку качественно сделанная операция при КРР дает прибавку к выживаемости в 10%.
Их придумали онкохирурги в развитых странах. Это, так называемая, препарат-ориентированная хирургия. На основании характеристик удаленного препарата уже через день после операции можно сказать, качественно она была выполнена или нет. Но по этим критериям в России никто не оценивает хирургов. Мы сейчас пытаемся исправить ситуацию, создаем раковый регистр. Уже охватили несколько учреждений в Питере и других городах России, которые будут участвовать в оценке качества операций. Это очень важно, поскольку качественно сделанная операция при КРР дает прибавку к выживаемости в 10%.
Нужно ли выполнять биопсию при колоноскопии?
Современная колоноскопическая техника позволяет отличить обычный доброкачественный полип от чего-то более серьезного. Но нужно понимать, что любой полип больше полусантиметра должен быть удален. Маленькие можно удалять амбулаторно, прямо во время процедуры. Но вот для крупных полипов или полипов с подозрением на злокачественный рост нужно выполнить биопсию. И если он большой, но доброкачественный, то удаляют его в стационаре — обычно это занимает не больше двух дней. А если мы получаем при изучении биопсии злокачественный результат, то тогда уже нужно проходить полное обследование, определять клиническую стадию заболевания. И в зависимости от стадии уже определяется тактика лечения: начиная от эндоскопического удаления во время колоноскопии и заканчивая применением всех методов лечения.
И если он большой, но доброкачественный, то удаляют его в стационаре — обычно это занимает не больше двух дней. А если мы получаем при изучении биопсии злокачественный результат, то тогда уже нужно проходить полное обследование, определять клиническую стадию заболевания. И в зависимости от стадии уже определяется тактика лечения: начиная от эндоскопического удаления во время колоноскопии и заканчивая применением всех методов лечения.
Расскажите, пожалуйста, поподробнее про методы лечения.
В идеале мы должны находить онкологические заболевания, в частности колоректальный рак, на таких стадиях, чтобы было достаточно небольшого вмешательства. Если бы мы всем пациентам диагностировали КРР на первой стадии, то можно было бы ограничиться эндоскопическими вмешательством во время колоноскопии. И это было бы здорово. И более того, это был бы окончательный метод лечения, который приводил бы к выздоровлению у большинства больных в 99% случаев. Но, к сожалению, пока мы далеки от этого.
Есть пациенты с опухолями побольше, но все равно вполне операбельными. В этих случаях достаточно только хирургического вмешательства, которое также приведет к полному излечению большинства больных. Не потребуется больше ничего, кроме наблюдения у онколога.
Когда пациент попадает в руки онкологов уже на третьей стадии, ему требуется использование нескольких методов лечения. Принципиально в онкологии их существует три: хирургическое лечение, лекарственное (химиотерапевтическое) лечение и лучевое воздействие на опухоль. Если мы говорим про рак прямой кишки, то на третьей стадии пациент обязательно должен получить все три составляющие. Причем начинать лечение нужно, как правило, с химиолучевой терапии, а затем уже проводить хирургическое вмешательство. В этом случае мы увеличиваем безрецидивную выживаемость на 10-15%, если сравнивать с только хирургическим лечением.
Если говорить про рак ободочной кишки, то он, как правило, не подвергается лучевому воздействию. Очень сложно облучить опухоль, которая расположена в брюшной полости. Пациент дышит, двигается, кишечник перистальтирует и нецелевые органы могут попасть под лучевое воздействие. На третьей стадии этого вида КРР уже определенно используется химиотерапия, но как профилактическое лечение после хирургического вмешательства. Она позволяет увеличить выживаемость таких пациентов примерно на 5-10%, что несомненно важно.
Пациент дышит, двигается, кишечник перистальтирует и нецелевые органы могут попасть под лучевое воздействие. На третьей стадии этого вида КРР уже определенно используется химиотерапия, но как профилактическое лечение после хирургического вмешательства. Она позволяет увеличить выживаемость таких пациентов примерно на 5-10%, что несомненно важно.
Так как на третьей стадии необходимо комбинированное и комплексное лечение, этим не должен заниматься стационар общего профиля. Кроме того, очень важно чтобы решение о тактике лечения принимал консилиум в составе хирурга-онколога, химиотерапевта и радиолога. Это прописано у нас в приказе Министерства здравоохранения «Об утверждении Порядка оказания медицинской помощи населению по профилю «онкология»».
Ну и наконец, самая печальная группа больных, которые обращаются к онкологам на 4 стадии заболевания с метастазами в отдаленные органы. Чтобы совсем не наводить пессимизм, можно сказать, что за последние 20 лет удалось добиться довольно существенных прорывов в лечении таких больных.
Во-первых, оказалось, что единичные метастазы в отдаленные органы очень «покладисты» в лечении КРР. Мы знаем, что примерно в 70% случаев КРР метастазирует в печень. Во вторую очередь в легкое. Сейчас появились разные способы воздействия на метастазы в печени. Помимо обычной химиотерапии и хирургического лечения, есть еще методы малоинвазивного лечения, которые сводятся к закупорке одного или нескольких кровеносных сосудов печени эмболизатом, содержащим химиопрепарат. Кроме этого, к малоинвазивным инструментам относят методы локального воздействия на метастазы в печени: криоабляцию, микроволновую абляция и радиочастотную абляцию метастатических очагов. Все вышеперечисленное позволяет использовать, комбинировать и выбирать наиболее эффективные подходы в том или ином случае. Это позволяет боротся за таких больных довольно долго и существенно продлевать им жизнь.
Во-вторых, появились новые таргетные препараты, которые дают очень хороший эффект. На фоне этих препаратов, при выполнении операции на печени, некоторые пациенты получили существенное 30-40% повышение выживаемости. Это большой прорыв.
Это большой прорыв.
Вышесказанное еще раз доказывает, что заниматься пациентами с КРР должны в стационарах, где работают все группы специалистов. Помимо просто хирурга, который может удалить опухоль, нужны еще грамотные химиотерапевты и радиологи, специалисты по хирургическому лечению печени и т.д. Если пациент может получить все это в одном стационаре, у него появляется шанс жить гораздо дольше.
В России такие места есть. Например, в Петербурге как минимум три таких учреждения: «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)», «НМИЦ онкологии им. Н.Н. Петрова» и «Городской клинический онкологический диспансер». А в Москве можно выделить «Московскую городскую онкологическую больницу №62», «НМИЦ онкологии им. Н.Н. Блохина», «МНИОИ им. П.А. Герцена» и «Государственный Научный Центр Колопроктологии». Не нужно бояться названия. Пациенты часто думают, что если написано слово онкологический, то у них все плохо, мы там лечиться не будем.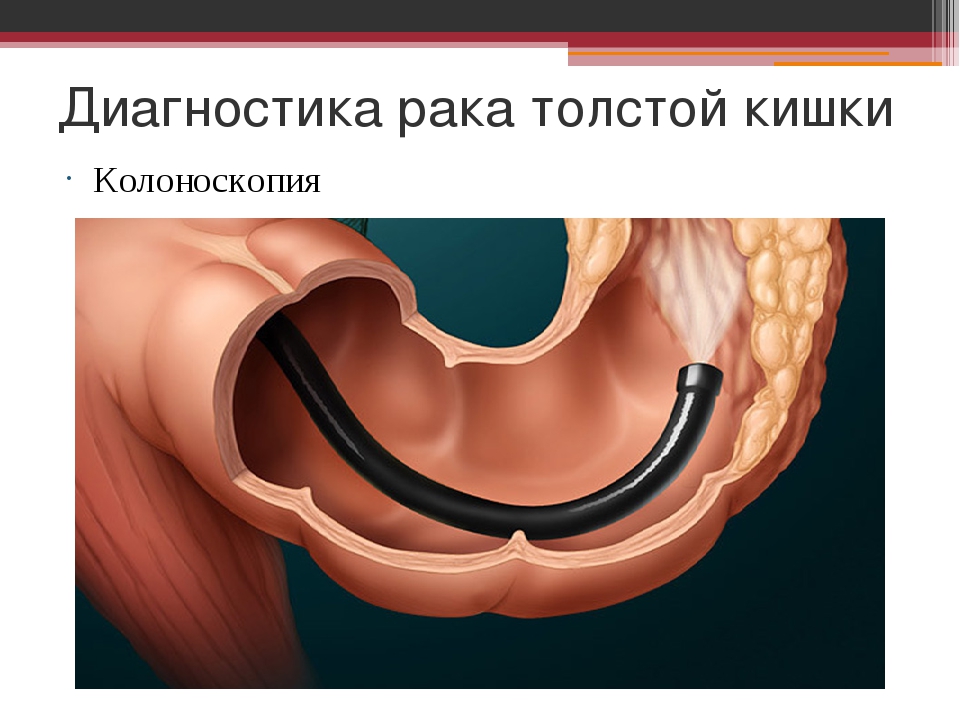 Ну нет же! Слово «онкологический» означает, что в клинике есть все необходимое для лечения этой сложной группы заболеваний.
Ну нет же! Слово «онкологический» означает, что в клинике есть все необходимое для лечения этой сложной группы заболеваний.
Расскажите еще, пожалуйста, о влиянии локализации рака на выживаемость.
Есть данные, что при расположении первичной опухоли в левой половине ободочной кишки (то есть, в нисходящей ободочной, сигмовидной и прямой кишке) выживаемость существенно выше, чем при локализации рака в правой половине (слепой или восходящей ободочной кишке). Но пока этот вопрос на стадии изучения, и уже появляются альтернативные точки зрения.
Как правило, опухоли с левой стороны ободочной кишки диагностируются раньше. Это связано с тем, что, во-первых, в левой половине ободочной кишки опухоль часто вызывает стеноз — из-за него возникают нарушения дефекации и кровь в стуле, следовательно, пациенты раньше обращаются к врачу. Во-вторых, когда выполняют колоноскопическое исследование, иногда не могут пройти колоноскопом дальше определенного места. До левой половины добраться проще, далеко не все эндоскописты доходят до слепой кишки и тщательно рассматривают правую половину.
А это пока никто не учитывал в исследованиях. Есть мнение, что это все связано не с биологией опухоли, а лишь с такими факторами. Я сейчас ссылаюсь на нашего самого известного онкогенетика, профессора Имянитова Евгения Наумовича. Он считает, что глобальных генетических различий между правой и левой половиной опухоли нет.
Какие советы вы могли бы дать пациентам?
Первое: вы не должны бояться обследований.
Второе: если у вас подтвердился диагноз КРР, обязательно обратитесь в специализированное учреждение! Часто пациент выбирает врача по советам: говорят у него «хорошие руки». Но если руководствоваться этим принципом, то мы никогда не узнаем реального качества операции, мы увидим только шов. Дальнейшая судьба пациента хирургу, как правило, неизвестна, с рецидивом приходят уже к онкологу. Поэтому важно, чтобы пациент выбирал место лечения, специализирующееся на его заболевании. Если есть отделение в городе, где оперируют пятьсот колоректальных раков в год, то нужно идти туда. А не в клинику, где это вмешательство делают двадцать раз в год, но каждый раз говорят, что с «хорошими руками».
А не в клинику, где это вмешательство делают двадцать раз в год, но каждый раз говорят, что с «хорошими руками».
В развитых странах, если отделение выполняет менее пятидесяти операций в год, связанных с КРР, то его перепрофилируют. В Санкт-Петербурге совершенный разброс в этом плане. Пациенты обращаются в разные учреждения и оперируются не в профильных центрах. И дело даже не в том, что там плохие доктора, просто это не их работа. Так же, как если я начну оперировать грыжи. Да, я умею это делать, но это не моя задача. А у нас все, кому не лень, хватаются оперировать рак.
А потом министр здравоохранения приезжает и удивляется, что в Санкт-Петербурге плохая онкологическая статистика. А это все из-за того, что в Петербурге зачастую не следуют порядку оказания помощи онкологическим больным. У нас примерно половина пациентов оперируется не в профильных учреждениях на сегодняшний день. А отвечают за результаты онкологи.
Мы боремся с этим уже давно и продолжим это делать, чтобы закрепить эту простую истину: онкологические больные должны лечиться у онкологов.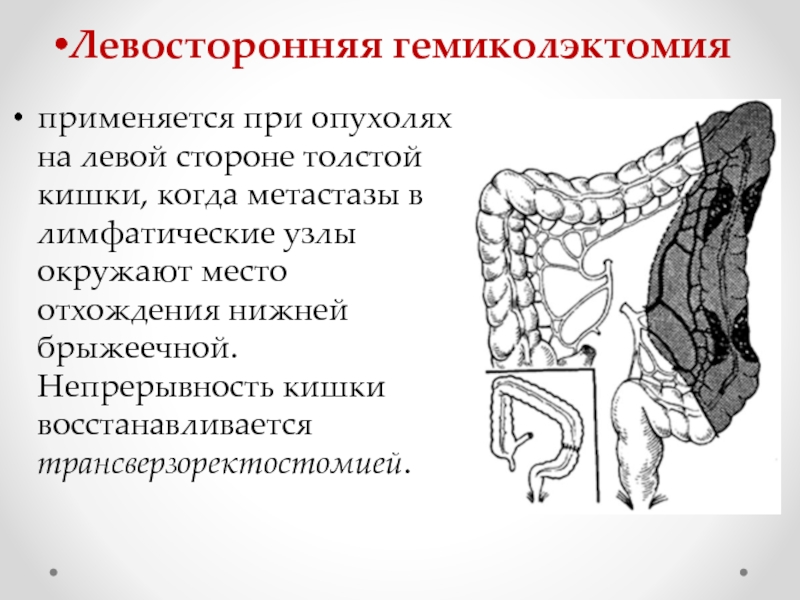 Это очень важно.
Это очень важно.
И третий пункт, люди мало что знают о своих правах. У нас в городе пациент, которому поставили диагноз рак, имеет право сделать все обследования, которые необходимы для определения тактики, бесплатно и в рамках одного учреждения. Что сегодня происходит с такими больными? Им ставят диагноз и начинают гонять: в одно место — сделать КТ, в другое — выполнить платно МРТ, а потом только берут на операцию в непрофильное учреждение. А после оказывается, что ему нужно делать химиотерапию. А еще желательно, перед тем как назначить лекарства, провести иммуногистохимическое и молекулярно-генетическое консультирование для более прецизионного лечения. И все это платно.
Такой бардак твориться сейчас в Санкт-Петербурге сплошь и рядом. Больные должны знать, что они могут прийти и получить весь объем исследований в одном месте, бесплатно, для того чтобы определиться с тактикой лечения. И не нужно бояться, что в государственном учреждении это займет много времени. На сегодняшний день, есть приказ комитета по здравоохранению, в котором говорится, что в течение десяти рабочих дней пациент должен быть обследован. Любой врач из поликлиники, если он заподозрил диагноз КРР, может направить человека к нам. Пациент спокойно позвонит по телефону и запишется на следующий день на консультацию. Это то, как нужно поступить в случае обнаружения колоректального рака, но, к сожалению, об этом мало кто знает.
Любой врач из поликлиники, если он заподозрил диагноз КРР, может направить человека к нам. Пациент спокойно позвонит по телефону и запишется на следующий день на консультацию. Это то, как нужно поступить в случае обнаружения колоректального рака, но, к сожалению, об этом мало кто знает.
Источник: Profilactica.media
Елизавета Бабицкая
Рак кишечника: как уберечь себя от страшного заболевания
В мире ежегодно регистрируется 600 000 новых случаев рака толстой кишки, в России — 40 000 новых случаев рака толстой кишки (согласно данным Государственного научного центра Колопроктологии им. А.Н. Рыжих). В целом, рак кишечника занимает третье место в стране среди всех онкологических заболеваний. Этому недугу подвержены одинаково как мужчины, так и женщины. Рак кишечника с каждым годом «молодеет», т.е. его обнаруживают у людей на самом пике жизненной активности, а не на склоне лет.
Подобно другим онкологическим заболеваниям, опасность рака кишечника кроется в том, что он долгое время протекает бессимптомно. Ваш организм давно болен, но внешне еще не дает никаких проявлений, и только на поздней стадии, наличие рака становится очевидным. Как и любая другая злокачественная опухоль, течение рака кишечника проходит очень тяжело; прогноз болезни на 3-4 стадиях крайне неблагоприятен.
Ваш организм давно болен, но внешне еще не дает никаких проявлений, и только на поздней стадии, наличие рака становится очевидным. Как и любая другая злокачественная опухоль, течение рака кишечника проходит очень тяжело; прогноз болезни на 3-4 стадиях крайне неблагоприятен.
Причины возникновения рака кишечника
- Несбалансированные питание (большое потребление тяжелой белковой пищи, недостаток в рационе растительных волокон и клетчатки; увлечение горячими жареными блюдами)
- Вредные привычки
- Воздействие агрессивных химических веществ
- Радиация
- Воспалительные заболевания кишечника (болезнь Крона, неспецифический язвенный колит, геморрой в обостренной и хронической формах и др.)
- Полипы в кишечнике
- Семейный анамнез
Международный опыт однозначно диктует требования к использованию мультидисциплинарного подхода в диагностике и лечении рака кишечника. Что это значит? Пациенту назначаются не просто процедуры каждым специалистом отдельно, а применяется командный подход, в котором важен и профессионализм врачей, и уровень оборудования клиники.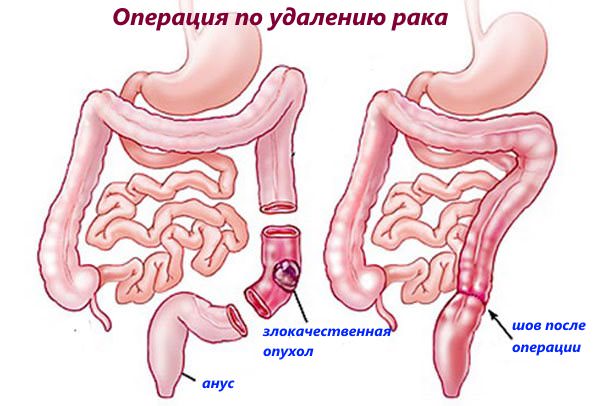
Диагностика рака кишечника
Только высококачественное оборудование позволит провести все необходимые исследования на должном уровне и показать реальную картину состояния вашего здоровья.
При раке кишечника применяют:
- специализированные тесты в лаборатории, включая исследования онкомаркеров, иммуногистохимические тесты образцов;
- проведение обследований на мощных и быстрых томографах (КР, МРТ, виртуальная колоноскопия) в том числе с введением контрастных веществ и при необходимости под седацией.
- эндоскопическое исследование кишечника. Аппарат, установленный в СМЦ, позволяет решить вопрос о биопсии в ходе самого исследования всего за несколько секунд. Это возможно благодаря специальной технологии NBI-zoom.
Лечение рака кишечника
В лечении необходим подбор индивидуальной программы. При этом составленная схема лечения (иногда со сложной комбинацией этапов хирургии, химиотерапии, лучевого лечения) должна реализовываться в тесном контакте врачей онколога, лучевого терапевта, колопроктолога. Любое изменение в самочувствии, коррекция схемы должна проводиться за пару минут при личном контакте специалистов. Тогда лечение будет быстрым, и соответственно максимально эффективным.
Любое изменение в самочувствии, коррекция схемы должна проводиться за пару минут при личном контакте специалистов. Тогда лечение будет быстрым, и соответственно максимально эффективным.
Не доводите ситуацию до страшного диагноза «рак». Запишитесь для профилактического осмотра к врачу-колопроктологу, который
- составит вам комплексную программу обследования (далеко не всем пациентам нужна именно колоноскопия, кому-то достаточно обычного осмотра, а для кого-то необходимо проведение виртуальной колоноскопии, это совсем другое исследование),
- проанализирует семейные факторы риска заболевания,
- составит личный календарь профилактических приемов и обследований, которые позволят избежать рака кишечника.
ПОМНИТЕ! Невнимательное отношение к своему организму, низкая квалификация врача, недостаточный уровень его персональной ответственности и устаревшая диагностическая база могут стоить вашей жизни!
Семейный Медицинский Центр обладает не только оборудованием самого последнего поколения, но и предлагает своим пациентам консультации настоящих профессионалов с многолетним опытом.
Вам всегда рады помочь:
симптомы и лечение — АЛТ УКраина ЛТД
Рак толстой и прямой кишки (колоректальный рак) поражает самую нижнюю часть кишечника человека. Рак толстой и прямой кишки можно назвать «тихим убийцей». Опухоль кишечника растет медленно и не вызывает никаких симптомов до тех пор, пока не достигнет большого размера. Но, к счастью, рак успешно лечится, если его вовремя диагностировать.
Скрининговые тесты и профилактические обследования являются важными инструментами профилактики и раннего выявления рака толстой и прямой кишки. Они позволяют определить не только рак, но и предраковые новообразования (аденоматозные полипы).
Ранняя диагностика спасает жизнь. Скрининговые программы успешно работают в развитых странах Европы, Японии, США, Израиле. Своевременное удаление полипов с последующим наблюдением пациента существенно снижает риск колоректального рака.
Симптомы и признаки рака прямой кишки
• Наиболее частыми симптомами рака толстой и прямой кишки являются:
• Боль в желудке (солнечном сплетении) и кишечные колики
• Изменения в характере кишечных отправлений (запор или понос)
• Кровь или слизь в кале.
• Чувство утомляемости или слабости
• Железодефицитная анемия (снижение гемоглобина в крови)
• Стул черного цвета
Диагностика рака прямой кишки
Согласно американскому и европейскому протоколу исследования на колоректальный рак, все лица, достигшие возраста 50 лет, обязаны произвести анализ кала на скрытую кровь и гастроколоноскопию.
Наиболее информативным и часто встречающимся исследованием является колоноскопия. Во время процедуры возможно увидеть опухоль или подозрительные образования и произвести биопсию материала (патогистологическое исследование ткани под микроскопом) для подтверждения или исключения наличия раковых клеток.
Согласно «Европейскому руководству по контролю качества скрининга и диагностики колоректального рака» колоноскопия проводится с использованием видеоэндоскопа и с хромоэндоскопией (хромоскопией — подкрашиванием слизистой), NBI (Narrow Band Imaging, исследованием в узкополосном спектре света), обязательной прицельной биопсией, а также в случае необходимости – с эндоскопическим ультразвуковым исследованием (эндосонографией) для определения точных размеров и структуры обнаруженного новообразования. И сследование рекомендуется проводить под седацией.
И сследование рекомендуется проводить под седацией.
Иногда опухоль может быть находкой при других исследованиях, например, компьютерной томографии, осмотре прямой кишки у проктолога, уролога, гинекологическом осмотре или ультразвуковом исследовании.
Стадии рака прямой толстой кишки
Для правильного выбора стратегии лечении следующим этапом является стадирование опухоли. Оно может быть первичным (до операции) или вторичным (послеоперационным). При стадировании определяют распространенность опухоли как местно в стенке кишки, так и системно (наличие поражения лимфатических узлов и отдаленных метастазов). Стадирование является чрезвычайно важным для прогноза заболевания, выбора объема и способа лечения.
Для стадирования используют осмотр пациента, данные биопсии, КТ, МРТ, рентгенографию, УЗИ (в зависимости от возможностей лечебного учреждения и особенностей заболевания).
Окончательное стадирование в большинстве случаев возможно только по результатам гистологического исследования удаленного на операции материала. В диагнозе обязательно должно быть указано количество исследованных лимфоузлов, потому что это важно для оценки стадии и радикальности операции.
В диагнозе обязательно должно быть указано количество исследованных лимфоузлов, потому что это важно для оценки стадии и радикальности операции.
Существуют 4 стадии рака толстой и прямой кишки. Больные с 1-3 стадиями обычно подвергаются хирургическому или комбинированному лечению (операция, химиотерапия или лучевая терапия).
Четвертую стадию рака преимущественно лечат химиотерапией, а также некоторым пациентам возможно выполнение вмешательств для циторедукции (удаление опухоли и/или метастазов).
Лечение рака толстой и прямой кишки
Основным методом лечения рака толстой кишки является хирургическая операция. На ранних стадиях опухоль может быть удалена эндоскопическим способом – эндоскопическая резекция слизистой оболочки (EMR) и эндоскопическая диссекция в подслизистом слое (ESD).
В тех случаях, когда эндоскопические оперативные методики уже не могут дать ожидаемого результата, врачи обращаются к открытым или лапароскопическим вмешательствам. Во время операции пораженную опухолью часть толстой кишки и окружающие ткани удаляют. Важным элементом операции является удаление лимфатических узлов, в которые происходит отток лимфы из зоны опухоли (лимфодиссекция).
Важным элементом операции является удаление лимфатических узлов, в которые происходит отток лимфы из зоны опухоли (лимфодиссекция).
У большинства людей концы кишки могут быть соединены вместе после удаления части, пораженной раком, и, в этом случае, пациент продолжает ходить в туалет естественным путем. Такие операции выполняют как традиционным путем, так и малоинвазивно – лапароскопически.
В некоторых случаях концы кишки нельзя соединить сразу во время операции. Это происходит, когда существует высокий риск несостоятельности (расхождения или незаживления) соединенных частей кишки, чаще при воспалении, при котором необходимо время для заживления тканей.
В этих случаях хирург пришивает конец кишки к коже стенки живота, эта операция называется колостомией (при выведении тонкой кишки – илеостомией). При этом кал отходит в специальный пластиковый мешок. Обычно колостома – это временная мера, и кишечник может быть восстановлен (его концы сшиты) через несколько недель или месяцев. У некоторых пациентов колостомия может быть постоянной.
У некоторых пациентов колостомия может быть постоянной.
Большинство пациентов с раком прямой кишки нуждаются в комбинированном лечении: хирургии, химиотерапии и лучевой терапии. Лечение выбирают соответственно стадии заболевания.
При первой стадии возможно только хирургическое лечение. При 2 и 3 стадиях обычно химиотерапию и облучение назначают до операции (неоадъювантная терапия) с дополнительной химиотерапией в послеоперационном периоде.
При четвертой стадии в основном назначают химиотерапию, которая может быть дополнена хирургической операцией. Неоадъювантная терапия способствует уменьшению опухоли, снижая риск рецидивов опухоли и улучшая возможности ее удаления.
Хирургическое лечение заключается в удалении части или всей прямой кишки, иногда с анусом. Такие операции также часто заканчивают колостомией (временной или постоянной). Операции выполняют как лапароскопически, так и открыто.
Химиотерапия
Химиотерапия – это лечение, которое назначают, чтобы остановить рост раковых клеток или замедлить его.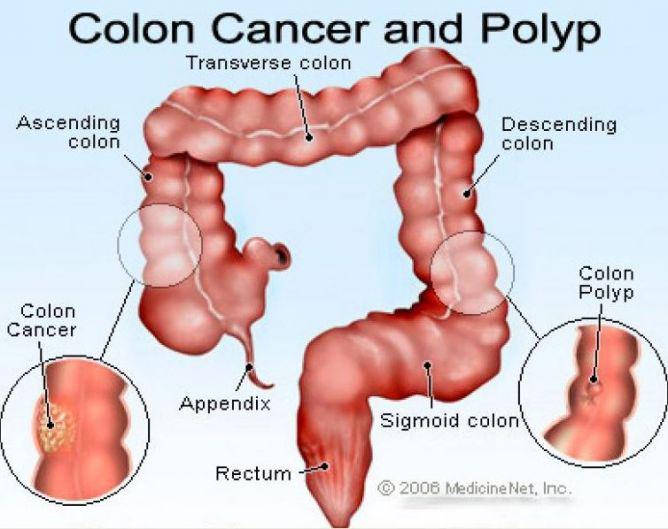 Даже при полном удалении опухоли есть риск, что в теле человека останутся клетки, и рак может возникнуть вновь (рецидив). Химиотерапия после операции может убить эти клетки и повысить возможность выживания пациента. Этот тип химиотерапии называется адъювантным. Химиотерапия может быть как внутривенной, так и таблетированной.
Даже при полном удалении опухоли есть риск, что в теле человека останутся клетки, и рак может возникнуть вновь (рецидив). Химиотерапия после операции может убить эти клетки и повысить возможность выживания пациента. Этот тип химиотерапии называется адъювантным. Химиотерапия может быть как внутривенной, так и таблетированной.
Современное поколение химиопрепаратов называется «тагретными» (целевыми) и обладает высокой эффективностью при подборе по генетическому профилю опухоли. Химиотерапия показана при 3 и 4 стадии рака, в некоторых случаях при второй стадии.
Наблюдение после операции
К сожалению, операция и химиотерапевтическое лечение не дают 100% гарантии излечения от рака. Однако ранее выявление и своевременное лечение рецидивов или прогрессирования заболевания дают пациенту шанс продлить жизнь на 5-10 лет даже с 4 стадией заболевания.
Поэтому пациенты после операций при раке толстой кишки должны находиться под наблюдением врача. Это включает осмотры, выполнение колоноскопий, КТ, рентгенологических и ультразвуковых исследований, а также контроль уровня раково-эмбрионального антигена в крови.
Помните, ранняя диагностика рака кишечника – залог успешного лечения!
Оборудование для эндоскопических исследований и малоинвазивных операций
Всем требованиям «Европейского руководства по контролю качества скрининга и диагностики колоректального рака» соответствует эндоскопическое оборудование, которое выпускает компания «OLYMPUS». Наша компания является авторизованным дистрибьютором этой компании.
Рак толстой кишки
Рак толстой кишки представляет собой злокачественную опухоль в области толстой кишки. Толстая кишка – это нижняя часть кишечника, выполняющая функцию всасывания воды и формирования каловых масс.
Заболеваемость раком толстой кишки резко возрастает с возрастом, чаще всего он выявляется после 55 лет. В большинстве случаев заболевание возникает в результате озлокачествления полипов кишечника.
Успешность лечения зависит от стадии, на которой было выявлено данное заболевание.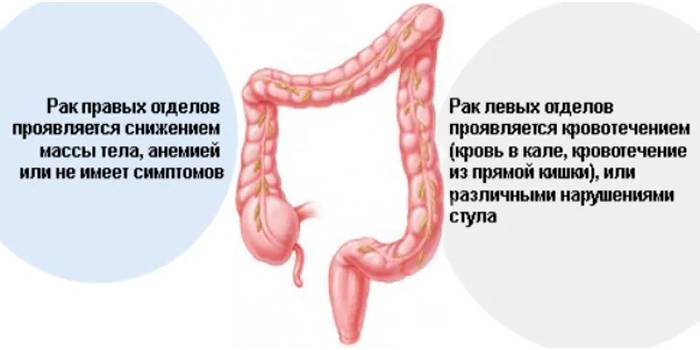
По достижении 50 лет мужчинам и женщинам рекомендуется регулярное плановое проведение исследований, направленных на выявление колоректального рака.
Синонимы русские
Колоректальный рак, рак толстого кишечника.
Синонимы английские
Colon Cancer, Colorectal Cancer.
Симптомы
- Рак толстой кишки на ранних стадиях может протекать бессимптомно за счет медленного роста опухоли. Как правило, проходит достаточно большой интервал времени, прежде чем появляются первые признаки болезни. Симптомы зависят от расположения, стадии опухоли, от наличия метастазов.
- Кровотечение из прямой кишки, кровь в стуле. Даже после единичного случая необходимо исключить рак желудочно-кишечного тракта.
- Стойкий дискомфорт в животе, боль, судороги, газы.
- Диарея или запор.
- Анемия, вызванная скрытыми кровотечениями.
- Частичная кишечная непроходимость, которая проявляется как лентообразный стул, коликообразные боли в животе.

- Опухоль, прощупываемая через брюшную стенку.
- Усталость, быстрая утомляемость.
- Потеря веса.
Общая информация о заболевании
Колоректальный рак – это образование злокачественной опухоли из клеток толстой кишки – нижней части кишечника, расположенной в брюшной полости и в полости малого таза, ее длина составляет около 1,5-2 метров. Она заканчивается прямой кишкой, а затем анальным отверстием. В толстой кишке происходит в основном всасывание воды и формирование оформленного кала из пищевой кашицы.
Рак толстой кишки предполагает перерождение здоровых клеток кишечника в измененные, раковые. Здоровые клетки, появляясь в нужном количестве, в назначенное время отмирают, уступая место новым клеткам. В отличие от здоровых, раковые клетки начинают бесконтрольно расти, не отмирая в положенное время. Скопления этих клеток образует раковую опухоль.
Раковые клетки могут распространяться в близлежащие ткани и органы организма и образовывать метастазы (метастазировать). Рак толстой кишки часто метастазирует в лимфатические узлы, печень, легкие.
Рак толстой кишки часто метастазирует в лимфатические узлы, печень, легкие.
Чаще всего рак толстой кишки развивается как перерождение аденоматозных полипов. Полипы представляют собой округлые образования, которые появляются в результате утолщения внутренней выстилки толстой кишки и выступают в ее просвет. Полипы могут быть плоскими или иметь грибовидную форму. Существует большое количество видов полипов, однако превратиться в раковую опухоль могут только аденоматозные полипы.
Также появление рака толстой кишки может быть связано с наследственной предрасположенностью к развитию заболевания, с хроническими воспалительными заболеваниями кишечника.
Стадии развития рака толстой кишки:
1. Раковая опухоль распространяется за пределы слизистой оболочки, но не прорастает через стенку толстой кишки.
2. Раковая опухоль прорастает стенку кишки, лимфатические узлы при этом не поражаются.
3. Рак поражает лимфатические узлы.
4. Раковая опухоль увеличивается. Рак распространяется на лимфатические узлы, печень, легкие.
Рак распространяется на лимфатические узлы, печень, легкие.
Кто в группе риска?
- Пожилые люди. В большинстве случаев рак толстой кишки развивается после 50 лет (90 % случаев). Риск удваивается с каждым прожитым десятилетием.
- Лица с наследственной предрасположенностью к развитию заболевания.
- Имеющие полипы толстой кишки (у 50 % наблюдается повторное появление полипов, у 5 % они перерождаются в рак).
- Лица с хроническими воспалительными заболеваниями кишечника, такими как язвенный и гранулематозный колит, болезнь Крона (у 15-30 % развивается рак толстой кишки).
- Люди с наследственным неполипозным колоректальным раком (заболевание появляется у 15-20 %).
- Лица с наследственным семейным полипозом – врождённым заболеванием, приводящим к развитию множественных полипов в толстой кишке (у 30-100 % больных развивается рак толстой кишки).
- Лица, употребляющие большое количество жиров и низкое количество клетчатки.

- Люди, ведущие сидячий образ жизни.
- Больные диабетом.
- Люди с ожирением.
- Курящие.
- Злоупотребляющие алкоголем.
- Перенесшие лечение с применением лучевой терапией.
Диагностика
Для ранней диагностики рака толстой кишки начиная с 50 лет и женщинам, и мужчинам необходимо регулярно проходить следующие исследования:
Исследование кала на скрытую кровь. Сдавать анализ необходимо ежегодно.
Колоноскопия проводится 1 раз в 10 лет. Это осмотр толстой кишки с помощью введения зонда, позволяющий выявить полипы, рак толстой кишки.
При подозрении на диагноз «рак толстой кишки» применяется исследование кала на скрытую кровь, определение уровня онкомаркеров в крови. Затем проводится пальцевое ректальное обследование, ректороманоскопия. Диагноз подтверждается биопсией. После подтверждения диагноза проводится трансректальное УЗИ, КТ и МРТ брюшной полости, рентгенография грудной клетки.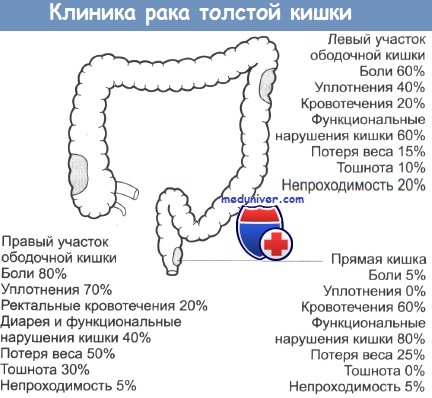
Лабораторные исследования:
- Общий анализ крови позволяет выявить анемию, которая может указывать на скрытые кровотечения и нарушения пищеварения при раке толстой кишки.
- Анализ кала на скрытую кровь. Положительный результат может указывать на внутренние кровотечения желудочно-кишечного тракта. Следует иметь в виду, что ложноположительные результаты могут быть связаны с употреблением в пищу большого количества мяса, рыбы, помидоров, с приемом препаратов железа, обезболивающих и др.
Онкомракеры:
- Раковый эмбриональный антиген (РЭА). Повышение РЭА наблюдается в 70 % случаев рака толстой кишки. Определение уровня онкомаркера позволяет диагностировать заболевание, его рецидивы.
- СА 19-9 и СА 242. Измерение уровня данных онкомаркеров в сочетании с РЭА повышает чувствительность и, следовательно, увеличивает достоверность результатов исследования.
- СА 125 и Tumor Marker 2 (TM 2). Определение уровня СА 125 и ТМ 2 также может способствовать выявлению рецидивов и оценке эффективности лечения.

Следует учитывать, что уровень данных онкомаркеров может быть повышен и при других видах рака.
Другие методы исследования:
- Пальцевое ректальное обследование. Во время проведения обследования врач изучает прямую кишку посредством введения пальца в анальное отверстие. Позволяет выявить наличие раковой опухоли прямой кишки, определить ее размер, глубину местного распространения.
- Ректороманоскопия представляет собой визуальный осмотр примерно 30 см толстой кишки с помощью ректороманоскопа – трубки с источником света. Ректороманоскопия позволяет также провести биопсию – забор клеток с подозрительного участка для их последующего изучения под микроскопом. Только биопсия позволяет достоверно определить наличие рака и его тип.
- Ирригоскопия – это рентгенологическое исследование толстой кишки с введением в неё с помощью клизмы рентгеноконтрастного препарата. Позволяет исследовать рельеф слизистой оболочки толстой кишки, выявить полипы и раковую опухоль.

- Колоноскопия предполагает осмотр толстой кишки с помощью введения зонда через прямую кишку. Позволяет выявить не только рак толстой кишки, но даже небольшие полипы, произвести биопсию всех подозрительных участков. При обнаружении полипов они удаляются.
- Трансректальное УЗИ. В ходе исследования в прямую кишку вводится небольшой зонд. Позволяет определить глубину распространения опухоли, что особенно важно на ранних стадиях заболевания.
После подтверждения диагноза проводится определение стадии рака, диагностические мероприятия, направленные на выявление метастазов.
- Компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) брюшной полости. Позволяют получить детальную информацию о размерах опухоли, вовлеченность соседних органов в опухолевый процесс, выявить метастазирование рака.
- Рентгенография грудной клетки позволяет выявить метастазирование рака в легкие.
Лечение
Стратегия лечения определяется, исходя из стадии, типа рака, состояния пациента.
Используются методы:
- На ранних стадиях заболевания проводится хирургическая операция. Удаляется раковая опухоль, часть толстой кишки, пораженной раком, близлежащие лимфатические узлы. При удалении части прямой кишки может потребоваться создание постоянной или временной колостомы – отверстия в брюшной стенке с выведением через него толстой кишки для избавления организма от каловых масс.
- Химиотерапия. При этом применяются препараты для уничтожения раковых клеток. Химиотерапия может проводиться для лечения рака и после операции, может сочетаться с лучевой терапией.
- Лучевая терапия. Предполагает использование излучения, направленного на уничтожение раковых клеток. Может быть использована до и после операции.
- Паллиативная терапия проводится, когда радикальное лечение не представляется возможным. Ее целью является облегчение состояния пациента. Для этого может использоваться лучевая терапия, химиотерапия, хирургические методы лечения.

Профилактика
- Существуют способы снижения риска развития рака толстой кишки:
- Для ранней диагностики рака толстой кишки начиная с 50 лет и женщинам, и мужчинам необходимо регулярно проходить исследование кала на скрытую кровь (ежегодно), колоноскопию (один раз в 10 лет).
- Лицам, входящим в группу риска развития заболевания, необходимо более частое проведение исследований, направленных на выявление рака толстой кишки.
- Употребление большого количества овощей, фруктов и цельных злаков поможет снизить риск развития заболевания.
- Отказ от алкоголя.
- Отказ от курения.
- Поддержание здорового веса.
- Физическая активность не менее 30 минут в течение каждого дня.
Рекомендуемые анализы
- Общий анализ крови
- Анализ кала на скрытую кровь
- Раковый эмбриональный антиген (РЭА)
- СА 125
- СА 19-9
- СА 242
- Tumor Marker 2 (TM 2) — пируваткиназа
Лечение рака толстой кишки (PDQ®) — версия для пациента
О PDQ
Запрос данных врача (PDQ) — это обширная база данных по раку Национального института рака (NCI).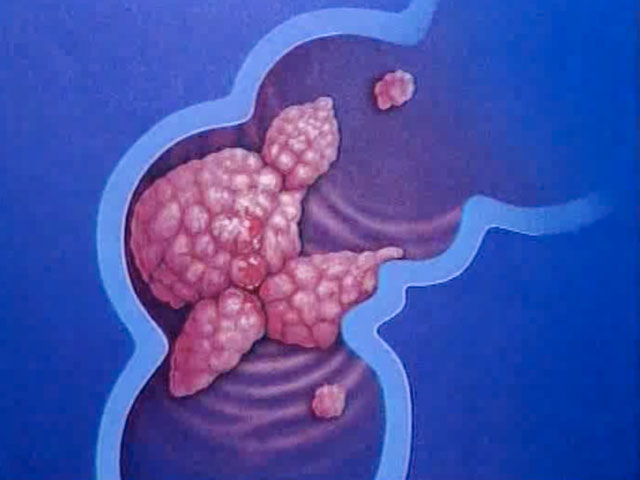 База данных PDQ содержит резюме последней опубликованной информации о профилактике, обнаружении, генетике, лечении, поддерживающей терапии, а также дополнительной и альтернативной медицине. Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке.Версии для пациентов написаны понятным, нетехническим языком. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке.
База данных PDQ содержит резюме последней опубликованной информации о профилактике, обнаружении, генетике, лечении, поддерживающей терапии, а также дополнительной и альтернативной медицине. Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке.Версии для пациентов написаны понятным, нетехническим языком. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке.
PDQ — это услуга NCI. NCI входит в состав Национальных институтов здравоохранения (NIH). NIH — это центр биомедицинских исследований при федеральном правительстве. Обзоры PDQ основаны на независимом обзоре медицинской литературы. Это не политические заявления NCI или NIH.
Цель этого обзора
В этом обзоре информации о раке PDQ содержится текущая информация о лечении рака толстой кишки.Он предназначен для информирования и помощи пациентам, семьям и лицам, осуществляющим уход.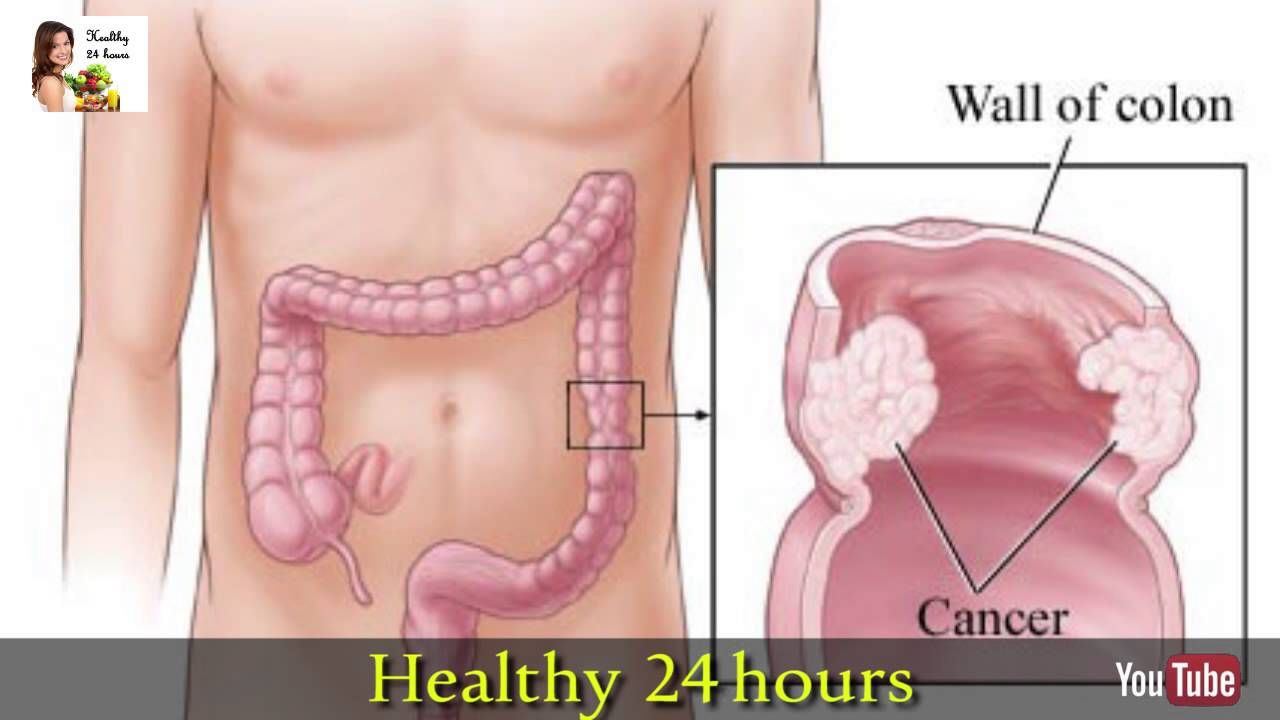 Он не дает официальных руководящих принципов или рекомендаций для принятия решений в отношении здравоохранения.
Он не дает официальных руководящих принципов или рекомендаций для принятия решений в отношении здравоохранения.
Рецензенты и обновления
Редакционные коллегии составляют сводки информации о раке PDQ и поддерживают их в актуальном состоянии. Эти советы состоят из экспертов в области лечения рака и других специальностей, связанных с раком. Резюме регулярно пересматриваются, и в них вносятся изменения при появлении новой информации. Дата в каждой сводке («Обновлено») — это дата самого последнего изменения.
Информация в этом обзоре пациентов была взята из версии для медицинских работников, которая регулярно пересматривается и обновляется по мере необходимости редакционной коллегией PDQ по лечению взрослых.
Информация о клиническом испытании
Клиническое испытание — это исследование, призванное ответить на научный вопрос, например, лучше ли одно лечение, чем другое. Испытания основаны на прошлых исследованиях и на том, что было изучено в лаборатории.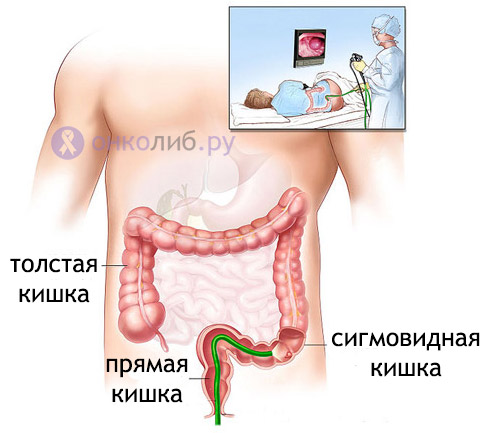 Каждое испытание отвечает на определенные научные вопросы, чтобы найти новые и лучшие способы помочь больным раком.Во время клинических испытаний лечения собирается информация об эффектах нового лечения и о том, насколько хорошо оно работает. Если клинические испытания покажут, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным». Пациенты могут захотеть принять участие в клиническом исследовании. Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Каждое испытание отвечает на определенные научные вопросы, чтобы найти новые и лучшие способы помочь больным раком.Во время клинических испытаний лечения собирается информация об эффектах нового лечения и о том, насколько хорошо оно работает. Если клинические испытания покажут, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным». Пациенты могут захотеть принять участие в клиническом исследовании. Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Клинические испытания можно найти в Интернете на сайте NCI. Для получения дополнительной информации позвоните в Информационную службу рака (CIS), контактный центр NCI, по телефону 1-800-4-CANCER (1-800-422-6237).
Разрешение на использование данного обзора
PDQ является зарегистрированным товарным знаком. Содержимое документов PDQ можно свободно использовать как текст. Его нельзя идентифицировать как сводку информации о раке NCI PDQ, если не отображается вся сводка и не обновляется регулярно.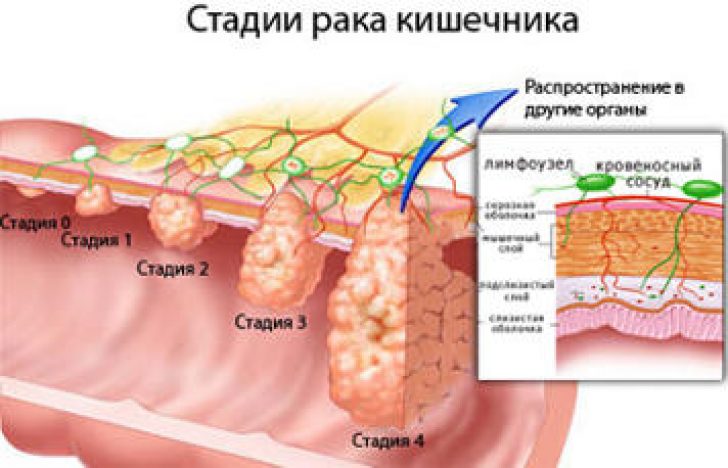 Тем не менее, пользователю будет разрешено написать такое предложение, как «В сводке информации о раке PDQ NCI о профилактике рака груди указаны риски следующим образом: [включить выдержку из резюме]».
Тем не менее, пользователю будет разрешено написать такое предложение, как «В сводке информации о раке PDQ NCI о профилактике рака груди указаны риски следующим образом: [включить выдержку из резюме]».
Лучший способ процитировать это резюме PDQ:
Редакционная коллегия PDQ® Adult Treatment.PDQ Лечение рака толстой кишки. Bethesda, MD: Национальный институт рака. Обновлено <ММ / ДД / ГГГГ>. Доступно по адресу: https://www.cancer.gov/types/colorectal/patient/colon-treatment-pdq. Дата обращения <ММ / ДД / ГГГГ>. [PMID: 26389319]
Изображения в этом обзоре используются с разрешения автора (ов), художника и / или издателя только для использования в обзорах PDQ. Если вы хотите использовать изображение из сводки PDQ и не используете все сводки, вы должны получить разрешение от владельца. Он не может быть предоставлен Национальным институтом рака.Информацию об использовании изображений в этом обзоре, а также многих других изображений, связанных с раком, можно найти в Visuals Online. Visuals Online — это коллекция из более чем 3000 научных изображений.
Visuals Online — это коллекция из более чем 3000 научных изображений.
Заявление об ограничении ответственности
Информация, содержащаяся в этих сводках, не должна использоваться для принятия решений о страховом возмещении. Более подробная информация о страховом покрытии доступна на сайте Cancer.gov на странице «Управление онкологическими услугами».
Свяжитесь с нами
Подробнее о том, как связаться с нами или получить помощь при раке.gov можно найти на нашей странице «Свяжитесь с нами для получения помощи». Вопросы также можно отправить на Cancer.gov через электронную почту веб-сайта.
Понимание стадии и степени колоректального рака
Ободочная и прямая кишки — два основных компонента толстой кишки. Стенка кишечника состоит из нескольких слоев, включая слизистую оболочку (внутреннюю оболочку), подслизистую основу, несколько слоев мышц и серозную оболочку (внешний слой). Сеть кровеносных сосудов и лимфатических узлов также питает ткани в толстой кишке и вокруг нее. Стадия колоректального рака определяется степенью распространения заболевания через эти слои толстой или прямой кишки и / или в лимфатические узлы или другие органы.
Стадия колоректального рака определяется степенью распространения заболевания через эти слои толстой или прямой кишки и / или в лимфатические узлы или другие органы.
Каждая стадия отражает то, как болезнь распространилась в или через толстую или прямую кишку или распространилась на близлежащие или отдаленные органы. Врачи также используют систему TNM для более точного определения степени определенных видов рака на каждой стадии. Так определяется система:
T (опухоль): Это описывает размер исходной опухоли.
N (узел): Указывает, присутствует ли рак в лимфатических узлах.
M (метастазы): Это относится к тому, распространился ли рак на другие части тела.
Каждому фактору присваивается номер (0-4) или буква X. При использовании этой системы определения стадии колоректального рака большее число указывает на увеличение степени тяжести. Например, оценка T1 указывает на меньшую опухоль, чем оценка T2. Буква X означает, что информация не может быть оценена.
Буква X означает, что информация не может быть оценена.
После присвоения баллов T, N и M определяется один из следующих общих этапов:
Стадия 0: На слизистой (внутренняя оболочка толстой или прямой кишки) обнаруживаются аномальные клетки или новообразования, такие как полипы. Это известно как карцинома in situ, потому что клетки ограничены местом своего происхождения, и нет никаких доказательств того, что они распространились на другие слои толстой или прямой кишки или в лимфатические узлы или метастазировали в другие органы. Клетки, обнаруженные при колоректальном раке стадии 0, могут быть злокачественными или предраковыми.
Стадия I (колоректальный рак 1 стадия): Рак прорастал в стенку кишечника, через слизистую (внутреннюю оболочку) и в подслизистую оболочку и, возможно, проник в мышцу. Нет никаких доказательств того, что рак распространился на лимфатические узлы или отдаленные органы.
Стадия II (колоректальный рак 2 стадии): Колоректальный рак 2 стадии делится на три категории:
- Стадия IIA: Рак прорастает в серозную оболочку (самый внешний слой толстой или прямой кишки), но не прорастает через нее.
 Он не достиг ближайших органов или лимфатических узлов и не распространился на отдаленные органы.
Он не достиг ближайших органов или лимфатических узлов и не распространился на отдаленные органы. - Стадия IIB: Рак разросся через все слои толстой или прямой кишки, но не распространился на лимфатические узлы или отдаленные органы.
- Стадия IIC: Рак разросся через все слои кишечника и распространился на близлежащие органы или ткани. Рак не распространился на лимфатические узлы или отдаленные органы.
Стадия III (колоректальный рак 3 стадии): Колоректальный рак стадии III делится на три категории:
- Стадия IIIA: Рак прорастал в стенку кишечника, через слизистую (внутреннюю оболочку) и в подслизистую основу и, возможно, проник в мышцу.Рак распространился на три лимфатических узла рядом с местом первичной опухоли.
- Стадия IIIB: рак прорастает в самый внешний слой толстой или прямой кишки или через них и может распространиться на близлежащие органы или ткани. Рак распространился на три лимфатических узла рядом с первичным очагом, но не распространился на отдаленные органы.

- Стадия IIIC: Рак прорастает во внешний слой толстой или прямой кишки или проходит через него и может распространиться на четыре или более лимфатических узла рядом с первичным очагом.Рак также распространился на близлежащие органы.
Стадия IV (4-я стадия колоректального рака): Стадия IV — наиболее запущенная стадия колоректального рака. Если вам поставили диагноз колоректальный рак IV стадии, это означает, что рак метастазировал в отдаленные участки, например, в печень или легкие. Рак мог прорасти или не прорасти через стенку толстой или прямой кишки, а лимфатические узлы могли быть поражены, а могли и не быть.
Колоректальный рак IV стадии подразделяется на две категории в зависимости от того, поразил ли метастаз более одного органа.Исходная опухоль может быть любого размера, и лимфатические узлы могут быть вовлечены или не быть вовлечены, но если рак распространился на один другой орган, он считается стадией IVA , тогда как более одного органа будет определено как стадия IVB .
Колоректальный рак IV стадии может быть определен по любой категории T или N, с той лишь разницей, что отнесение к M1 или M2 является более подходящим.
При обеих формах колоректального рака IV стадии опухоль может быть любого размера (T), а лимфатические узлы могут быть вовлечены или не вовлечены (N).M1a указывает на то, что рак распространился только на один орган, тогда как M1b означает, что поражено более одного органа.
Следующая тема: Как диагностируется колоректальный рак?
Исследование
пациентов с колоректальным раком (стадия IIIC) с использованием регорафениба или стандартного лечения (без лечения) после адъювантного FOLFOX — полный текст
Пациенты с раком толстой кишки стадии IIIC имеют 5-летнюю выживаемость 28%. Рак толстой кишки III стадии указывает на поражение лимфатических узлов.
Адъювант FOLFOX снижает риск рецидива колоректального рака только на 40%, поэтому почти 50% пациентов все еще умирают от этого заболевания. По оценкам, у 50% пациентов рецидив наступает в течение 18 месяцев.
По оценкам, у 50% пациентов рецидив наступает в течение 18 месяцев.
Поскольку прогноз колоректального рака зависит от стадии заболевания и поскольку метастатическое заболевание неизлечимо, была разработана концепция добавления регорафениба к адъюванту FOLFOX, чтобы дать пациентам с колоректальным раком высокого риска лучший шанс на излечение.
Предлагается лечить пациентов с толстым кишечником высокого риска (стадия IIIC [T4a, N2a, M0] или [T3-4a, N2b, M0] или [T4b, N1-N2, M0] согласно Американскому объединенному комитету по раку [AJCC ] 7-е изд.) выбранных из электронной базы данных медицинских карт iKnowMed (iKM), прошедших адъювантную процедуру FOLFOX. Это технико-экономическое обоснование предназначено для определения начальной дозы регорафениба и оценки того, что по крайней мере 75% пациентов будут способны переносить полную дозу регорафениба после приема адъюванта FOLFOX.
Пациенты будут случайным образом распределены на группы регорафениба или SOC (без лечения). Чтобы проверить наилучшую переносимость начальной дозы, первые 50 пациентов получат регорафениб и будут рандомизированы в соотношении 1: 1 либо на 120 мг внутрь (перорально), либо на 160 мг внутрь.Если доза 120 мг хорошо переносится и токсичность не является тяжелой (степень 2 или меньше) по завершении цикла 2, доза будет увеличена до 160 мг, начиная с цикла 3. Регистрация и рандомизация пациентов возобновятся после 26 числа. затем после 50-го пациента завершают 3 цикла исследуемого лечения. Совет по мониторингу безопасности данных (DSMB) соберется после того, как 26-й пациент завершит 3 цикла лечения, а второе совещание состоится после того, как 50-й пациент завершит 3 цикла.При необходимости будет запланировано третье собрание DSMB. Остальные 214 пациентов будут рандомизированы в соотношении 2: 3 в зависимости от выбранной начальной дозы по сравнению с SOC.
Чтобы проверить наилучшую переносимость начальной дозы, первые 50 пациентов получат регорафениб и будут рандомизированы в соотношении 1: 1 либо на 120 мг внутрь (перорально), либо на 160 мг внутрь.Если доза 120 мг хорошо переносится и токсичность не является тяжелой (степень 2 или меньше) по завершении цикла 2, доза будет увеличена до 160 мг, начиная с цикла 3. Регистрация и рандомизация пациентов возобновятся после 26 числа. затем после 50-го пациента завершают 3 цикла исследуемого лечения. Совет по мониторингу безопасности данных (DSMB) соберется после того, как 26-й пациент завершит 3 цикла лечения, а второе совещание состоится после того, как 50-й пациент завершит 3 цикла.При необходимости будет запланировано третье собрание DSMB. Остальные 214 пациентов будут рандомизированы в соотношении 2: 3 в зависимости от выбранной начальной дозы по сравнению с SOC.
Кроме того, оценка текстуры (пространственные вариации интенсивности пикселей) при компьютерной томографии (КТ) может помочь предсказать риск рецидива. Поэтому диски CT будут отправлены в лабораторию Imaging Endpoints Core Lab, Скоттсдейл, Аризона, где для анализа будет использоваться платформа TexRAD (программный алгоритм).
Поэтому диски CT будут отправлены в лабораторию Imaging Endpoints Core Lab, Скоттсдейл, Аризона, где для анализа будет использоваться платформа TexRAD (программный алгоритм).
Рак толстой кишки: выживаемость и прогноз
Если вам поставили диагноз «рак толстой кишки», у вас, вероятно, возникнет много вопросов.Какое вероятное течение болезни? Каковы ваши шансы на выздоровление? Термин, который ваш врач будет использовать для этого, является вашим прогнозом. Получить точные ответы сложно, потому что ситуация каждого человека уникальна. Многие факторы влияют на будущее людей с раком толстой кишки.
Показатели выживаемости при раке толстой кишки
Врачи ежегодно диагностируют рак толстой кишки у более чем 135 000 человек в США.Стадия рака толстой кишки при постановке диагноза влияет на выживаемость. Этапы варьируются от 1 (локализованный) до 4 (продвинутый). Локализованный рак толстой кишки означает, что раковые клетки находятся только в толстой кишке. Когда он диагностируется на ранней стадии, выживаемость хорошая. Около 90% людей, которым поставлен диагноз на ранних стадиях, живут не менее пяти лет.
Этапы варьируются от 1 (локализованный) до 4 (продвинутый). Локализованный рак толстой кишки означает, что раковые клетки находятся только в толстой кишке. Когда он диагностируется на ранней стадии, выживаемость хорошая. Около 90% людей, которым поставлен диагноз на ранних стадиях, живут не менее пяти лет.
По мере развития рака толстой кишки вероятность выживания снижается. Пятилетняя выживаемость составляет 71% для тех, кому поставлен диагноз, когда рак распространяется на лимфатические узлы и органы около толстой кишки.Выживаемость еще больше снижается, если рак распространяется по всему телу. Тогда около 13% людей живут пять и более лет.
Однако другие факторы могут улучшить этот показатель. Если у вас есть небольшое количество опухолей, которые распространились где-то еще в организме, и вам сделана операция по их удалению, ваша выживаемость улучшится. Имейте в виду, что эта статистика не охватывает все сценарии. Кроме того, цифры могут со временем меняться, поскольку медицинское сообщество обнаруживает более эффективные диагностические инструменты и методы лечения.
Ваш прогноз — это объяснение того, как болезнь может повлиять на вас и возможно ли вылечить ваш рак. Ваш прогноз основан на:
Стадия : это степень распространенности рака, то есть степень его распространения за пределы толстой кишки.
Оценка : Оценка показывает, насколько велика вероятность того, что рак будет расти и распространяться, и как быстро это может произойти.
Говорить о своем прогнозе означает также говорить о возможных методах лечения.Ваша медицинская бригада объяснит, насколько эффективным может быть лечение в вашем случае, в зависимости от стадии рака и вашего общего состояния здоровья.
Ваш прогноз наилучший, если рак толстой кишки диагностирован на ранней стадии, когда он находится только в толстой кишке. Вылечить рак можно несколькими способами. Это может быть хирургическое вмешательство, химиотерапия, лучевая терапия или комбинация методов лечения.
Около половины людей с раком толстой кишки переносят операцию по удалению рака. Даже при хирургическом вмешательстве и других методах лечения некоторые раковые клетки могут остаться, а позже снова отрасти.Исследования показывают, что здоровое питание и регулярные упражнения могут помочь снизить риск.
Если у вас рак на поздней стадии и степень его развития указывает на быстрое развитие и распространение, ваш прогноз может быть плохим. Может быть не так много доступных методов лечения рака. Тем не менее, химиотерапия и другие методы лечения могут помочь некоторым людям, замедляя развитие рака и предотвращая его дальнейшее распространение.
Разговор о ваших шансах на выживание и прогноз может быть пугающим.Тем не менее, это важный разговор с врачом. Обсудите, что вы можете сделать, чтобы либо вылечить свой рак, либо достичь момента, когда он находится в стадии ремиссии, что означает, что у вас нет или уменьшаются признаки рака по результатам визуализирующих исследований и других критериев. Даже если лечение не может помочь вам прожить дольше, некоторые могут контролировать ваши симптомы, чтобы вы чувствовали себя комфортно.
Даже если лечение не может помочь вам прожить дольше, некоторые могут контролировать ваши симптомы, чтобы вы чувствовали себя комфортно.
Рак толстой кишки: Аденокарцинома толстой кишки
Что такое рак толстой кишки (аденокарцинома толстой кишки)
Рак толстой кишки может относиться к типу аденокарциномы и обычно возникает из эпителия (слоя клеток), выстилающего внутреннюю часть толстой кишки.Ободочная кишка является частью толстой кишки. Толстый кишечник начинается в нижнем конце тонкой кишки (подвздошная кишка), у слепой кишки. Аппендикс отходит от слепой кишки. Начало ободочной кишки — восходящая ободочная кишка, которая становится поперечной ободочной кишкой там, где встречается с печенью (изгиб печени). Поперечная ободочная кишка проходит через верхнюю часть живота, пока не соприкасается с селезенкой (селезеночный изгиб), где она становится нисходящей ободочной кишкой. В этот момент толстая кишка спускается по брюшной полости к тазу, где она становится сигмовидной кишкой (названной потому, что она изгибается в форме буквы «S», а сигма в переводе с греческого означает «S»).Сигмовидная кишка оканчивается прямой кишкой, которая действует как мешок для хранения фекалий, прежде чем они будут выведены через задний проход. В этот момент толстая кишка спускается по брюшной полости к тазу, где она становится сигмовидной кишкой (названной потому, что она изгибается в форме буквы «S», а сигма в переводе с греческого означает «S»).Сигмовидная кишка оканчивается прямой кишкой, которая действует как мешок для хранения фекалий, прежде чем они будут выведены через задний проход. |
В целом функция толстой кишки — поглощать воду из стула. Когда подвздошная кость откладывает свое содержимое в слепую кишку, она становится чрезвычайно жидкой. Они постепенно затвердевают по мере продвижения по толстой кишке.
Статистика рака толстой кишки (аденокарцинома толстой кишки)
Рак толстой кишки встречается часто, но очень редко встречается у молодых людей.С возрастом это становится более распространенным. Наибольшему риску подвержены женщины старше 50 лет. Географически опухоль встречается по всему миру, но чаще всего встречается в регионах с низким содержанием клетчатки. К регионам мира с высоким потреблением жиров и низким потреблением клетчатки относятся Европа, США и Австралия.
К регионам мира с высоким потреблением жиров и низким потреблением клетчатки относятся Европа, США и Австралия.
Факторы риска рака толстой кишки (аденокарцинома толстой кишки)
Наследственная
В группе особо высокого риска находятся люди с наследственными заболеваниями, такими как семейный аденоматозный полипоз или наследственный неполипозный колоректальный рак.При этих состояниях рак толстой кишки может возникать даже у пациентов в возрасте от 20 до 30 лет.
Семейная история
Родственники первой степени родства пациентов с колоректальным раком имеют повышенный риск рака толстой кишки, особенно если у родственника он развивается в молодом возрасте.
Полипы толстой кишки
Некоторые типы полипов, особенно ворсинчатые аденомы, могут стать злокачественными. Пациентам, у которых ранее был полип в толстой кишке, следует регулярно проходить колоноскопию (спросите у врача, как часто).
Воспалительное заболевание кишечника
Пациенты, страдающие язвенным колитом, имеют десятикратный риск рака толстой кишки и должны проходить регулярную колоноскопию.
Диета
Диета с высоким содержанием жиров и низким содержанием клетчатки, особенно с высоким содержанием красного мяса, связана с раком толстой кишки. Люди, страдающие ожирением, также подвергаются повышенному риску.
Прогрессирование рака толстой кишки (аденокарцинома толстой кишки)
Опухоль распространяется, вторгаясь в стенку кишечника.Пройдя через мышечный слой в стенке кишечника, он попадает в лимфатические сосуды, распространяясь на местные, а затем и региональные лимфатические узлы. Иногда он распространяется через кровоток в печень, которая является наиболее частым местом метастазирования этой опухоли. Другие органы человека, которые могут быть затронуты путем распространения через кровь, — это легкие, реже кости и еще реже мозг. Если через стенку кишечника проходит много опухолевых клеток, они имеют тенденцию плавать в виде небольшого количества жидкости в брюшной полости и могут заразить покрытие кишечника (брюшину).При этом типе ракового посева в брюшной полости образуются маленькие узелки, которые раздражают ткани и вызывают образование большого количества асцита (жидкости).
Если через стенку кишечника проходит много опухолевых клеток, они имеют тенденцию плавать в виде небольшого количества жидкости в брюшной полости и могут заразить покрытие кишечника (брюшину).При этом типе ракового посева в брюшной полости образуются маленькие узелки, которые раздражают ткани и вызывают образование большого количества асцита (жидкости).
Как диагностируется рак толстой кишки (аденокарцинома толстой кишки)?
Общие исследования рака толстой кишки могут показать анемию или отклонения в тестах функции печени. Уровень альбумина в крови может быть низким. Если поражение печени тяжелое, профиль свертывания будет ненормальным с повышенным МНО (международное нормализованное отношение).
Прогноз рака толстой кишки (аденокарцинома толстой кишки)
Ранний рак толстой кишки имеет очень хороший прогноз.Если они не проникли через мышечную стенку, подавляющее большинство рака толстой кишки можно вылечить хирургическим путем. После того, как опухоль пробила мышечную стенку и перешла в региональные лимфатические узлы, более 60% пациентов будут выжить как минимум 5 лет. Если опухоль распространилась на другие органы, такие как печень или легкие, текущая 5-летняя выживаемость составляет примерно 10%.
Если опухоль распространилась на другие органы, такие как печень или легкие, текущая 5-летняя выживаемость составляет примерно 10%.
Как лечится рак толстой кишки (аденокарцинома толстой кишки)?
Лечение раннего рака толстой кишки — хирургическое.Для опухолей, которые не достигли мышечного слоя в стенке кишечника, это будет излечить более чем в 90% случаев. Операция при раке толстой кишки обычно проводится для удаления первичной опухоли для всех видов рака, кроме тех, которые распространились на отдаленные органы. В некоторых из этих случаев первичная опухоль может быть удалена, если кишечник выглядит так, как будто он закупоривается. Вам посоветуют ваш хирург, гастроэнтеролог и онколог.
Если опухоль прорвала стенку кишечника, особенно если она попала в местные лимфатические узлы, адъювантная химиотерапия увеличит шансы на успех.То же самое верно, если он распространился на региональные лимфатические узлы. Существует четкое единодушное мнение о том, что опухоли, распространившиеся на регионарные лимфатические узлы, должны получать адъювантную химиотерапию. Опухоли, которые прорвали мышечную слизистую оболочку, но не попали в регионарные лимфатические узлы, также могут получить пользу от адъювантного лечения. Это решение принимается в индивидуальном порядке совместно с вашим онкологом.
Опухоли, которые прорвали мышечную слизистую оболочку, но не попали в регионарные лимфатические узлы, также могут получить пользу от адъювантного лечения. Это решение принимается в индивидуальном порядке совместно с вашим онкологом.
Если рак толстой кишки распространился на печень, более долгосрочное паллиативное лечение может быть достигнуто путем хирургического вмешательства на первичной опухоли для предотвращения непроходимости кишечника с последующим специальным лечением метастазов.Если есть только единичные метастазы в одной стороне печени, есть довольно веский аргумент в пользу хирургического вмешательства для его удаления у пациентов, которые в остальном физически довольно здоровы. Если рак толстой кишки распространился на кость и вызывает боль, местная лучевая терапия может быть очень полезной для контроля местных симптомов. Стандартная адъювантная терапия при резекции рака толстой кишки — это 5-ФУ и фолинат кальция в течение шести месяцев. Стандартной терапией метастического рака толстой кишки является иринотекан, 5-ФУ и лейковорин. Каждый из агентов в этом режиме вводится путем внутривенной инъекции еженедельно в течение 4 недель каждые 6 недель.
Каждый из агентов в этом режиме вводится путем внутривенной инъекции еженедельно в течение 4 недель каждые 6 недель.
Улучшение симптомов — важное измерение. Конкретный мониторинг может осуществляться путем измерения СЕА в сыворотке. Если была достигнута радикальная хирургическая резекция, рекомендуется проводить ежегодные повторные проверки с помощью колоноскопии. Визуализация рака толстой кишки обычно выполняется либо с помощью ультразвука, либо с помощью компьютерной томографии для выявления рецидива в печени или лимфатических узлах. При метастатическом заболевании сывороточный CEA может быть очень полезным для оценки ответа на лечение. Можно отслеживать аномальные функциональные тесты печени и выполнять визуализацию любых метастазов в мягких тканях, например, в печени или легких.Симптомы, которые могут потребовать внимания, включают усталость от анемии, висцеральную боль от метастазов в печень и, реже, соматическую боль от метастазов в кости. При наличии метастазов в легких может наблюдаться плевральный выпот, вызывающий одышку. Выпот может потребовать дренажа.
Выпот может потребовать дренажа.
Рак толстой кишки (аденокарцинома толстой кишки) Ссылки
- Браунвальд Э., Фаучи А.С., Каспер Д.Л., и др. . Принципы внутренней медицины Харрисона (15-е издание). Нью-Йорк: McGraw-Hill Publishing; 2001 г.[Книга]
- Кумар П., Кларк М. (ред.). Клиническая медицина (5-е издание). Эдинбург: компания WB Saunders; 2002. [Книга]
- McLatchie G, Leaper DJ (ред.). Оксфордский справочник по клинической хирургии (2-е издание). Оксфорд: издательство Оксфордского университета; 2002. [Книга]
Насколько агрессивным должно быть лечение колоректального рака?
Колоректальный рак, хотя его можно предотвратить и медленно развиваться, является вторым по значимости раком в США.
Колоректальный рак — четвертый по распространенности рак у мужчин и женщин в США.Комплексный онкологический центр Розуэлл-Парк рекомендует регулярные скрининговые тесты на колоректальный рак, начиная с 50-летнего возраста. Благодаря использованию ранних процедур скрининга, таких как анализ кала на скрытую кровь и колоноскопия, опухоли могут быть обнаружены и удалены до того, как они станут злокачественными, что делает колоректальный рак одним из немногих. действительно предотвратимые виды рака.
Благодаря использованию ранних процедур скрининга, таких как анализ кала на скрытую кровь и колоноскопия, опухоли могут быть обнаружены и удалены до того, как они станут злокачественными, что делает колоректальный рак одним из немногих. действительно предотвратимые виды рака.
У мужчин и женщин среднего возраста на внутренней поверхности толстой кишки может появиться образование, известное как полип. Эти полипы обычно начинаются доброкачественными, но со временем могут стать злокачественными.Если эти поверхностные полипы обнаруживаются на ранней стадии во время обследования при колоноскопии, их, вероятно, можно удалить с помощью передовых эндоскопических методов во время колоноскопии или с помощью малоинвазивной хирургии вскоре после их обнаружения. Однако, поскольку только от 60 до 65% людей, которым следует пройти скрининг на колоректальный рак, на самом деле это делают, колоректальные опухоли часто обнаруживаются на гораздо более поздних стадиях.
Даже если опухоли обнаруживаются после того, как они становятся злокачественными, колоректальный рак все еще очень поддается лечению и медленно развивается. Пациенты могут занять некоторое время, чтобы решить, какое лечение лучше всего подходит для их ситуации, и не должны думать, что им нужно спешить с принятием решения о лечении.
Пациенты могут занять некоторое время, чтобы решить, какое лечение лучше всего подходит для их ситуации, и не должны думать, что им нужно спешить с принятием решения о лечении.
Никогда не пропустите еще один блог Обсуждения рака!
Подпишитесь на нашу ежемесячную электронную рассылку Cancer Talk.
Подписаться!
«Как только вы услышите слово« рак », я понимаю, что вы хотите, чтобы он был удален как можно быстрее», — говорит Стивен Нуркин, доктор медицинских наук, онколог-хирург в Розуэлл-парке. «Но когда опухоль обнаруживается, она, вероятно, существует уже год или больше.Мы рекомендуем встретиться со специалистами, чтобы определить стадию рака, а затем день за днем предпринимать следующие шаги. У нас есть время поработать с вами, чтобы убедиться, что все покрыто. Мы хотим убедиться, что вы достаточно здоровы, чтобы пройти операцию, и перед операцией посетили соответствующего специалиста. Затем мы хотим помочь вам решить, какая стратегия лечения лучше всего подходит для вас. При колоректальном раке обычно нет необходимости принимать немедленное решение о лечении ».
При колоректальном раке обычно нет необходимости принимать немедленное решение о лечении ».
Используя мультидисциплинарный командный подход, Нуркин и его коллеги из Розуэлл Парк рассматривают рак каждого пациента индивидуально и выбирают лучший план лечения.
При раке толстой кишки на более ранней стадии операцию по удалению опухолей можно запланировать уже через несколько недель после постановки диагноза, но при раке прямой и толстой кишки на более поздних стадиях перед операцией часто требуется другой вид лечения. «Мы можем попросить пациента пройти несколько недель химиотерапии или лучевой терапии, прежде чем мы продолжим операцию», — говорит Нуркин. «В случаях распространенного рака прямой кишки пациентам может потребоваться химиотерапия или лучевая терапия на срок до двух месяцев».
Колоректальный рак хорошо поддается лечению и не требует агрессивного плана лечения, но это не означает, что к этому заболеванию следует относиться легкомысленно.Это вторая ведущая причина смертей от рака в США
.
Людям старше 50 или с повышенным риском развития колоректального рака Roswell Park рекомендует проводить анализы кала на скрытую кровь каждые один или два года и колоноскопию один раз в 10 лет. Регулярно проходя скрининг на колоректальный рак, вы можете не только спасти себя от лечения, но и спасти свою жизнь.
Наш подход к лечению рака толстой и прямой кишки — Институт рака Дана-Фарбер
Наша специализированная команда
Пациентов, которые обращаются в Центр рака толстой и прямой кишки, принимает наша высокоспециализированная команда, в которую входят одни из лучших практикующих врачей во всех областях медицины.Достижения наших экспертов включают продвижение национальных стандартов лечения, проведение революционных исследований, руководство международными исследованиями новых лекарств и создание инновационных методов профилактики, диагностики и лечения колоректального рака.
Поскольку мы являемся узкоспециализированным лечебным центром, в котором врачи занимаются исключительно лечением этих заболеваний, мы уделяем особое внимание конкретным потребностям людей с раком прямой и толстой кишки. Сюда входят пациенты, которые находятся на всех стадиях заболевания, от предраковых поражений до злокачественных новообразований на поздних стадиях, распространившихся на печень или другие органы.Наши медсестры сертифицированы и обучены онкологическому уходу и специализируются на уходе за пациентами, которые проходят лечение рака желудочно-кишечного тракта или восстанавливаются после него.
Сюда входят пациенты, которые находятся на всех стадиях заболевания, от предраковых поражений до злокачественных новообразований на поздних стадиях, распространившихся на печень или другие органы.Наши медсестры сертифицированы и обучены онкологическому уходу и специализируются на уходе за пациентами, которые проходят лечение рака желудочно-кишечного тракта или восстанавливаются после него.
Наши врачи-ученые также специализируются на уходе за выжившими и исследовали, как образ жизни (включая
рацион питания,
кофеин и
упражнение) повторение воздействия. Результаты этих открытий включаются в планы лечения каждого пациента.
Комплексная помощь
Наша цель — сделать лечение каждого пациента оптимальным и всеобъемлющим.В рамках вашего визита в Центр мы можем порекомендовать вам встретиться с генетическим консультантом для оценки наследственных рисков колоректального (и других) рака. Пациенты с положительным результатом теста на определенные синдромы посещаются как минимум ежегодно для постоянного лечения и консультирования. Мы также предоставляем генетическое тестирование и поддержку для
Мы также предоставляем генетическое тестирование и поддержку для
члены семьи, которые могут быть предрасположены к колоректальному раку.
Если вам сделают операцию, вам поставят
Путь улучшенного восстановления после операции, который мы разработали специально для пациентов с колоректальным раком, чтобы ускорить процесс восстановления и минимизировать осложнения.Это поможет вам вернуться к нормальному функционированию раньше, чем при традиционных протоколах колоректальной хирургии.
Индивидуальный уход
Наш приоритет — относиться к каждому пациенту как к личности, заслуживающей нашего величайшего уважения, сострадания и сочувствия. Наши опекуны понимают, насколько сложной может быть диагностика колоректального рака, и мы стремимся найти самые лучшие способы удовлетворить уникальные потребности каждого пациента и его семьи.
Все больше и больше таргетных методов лечения фокусируются на специфических молекулярных изменениях в индивидуальной опухоли пациента. Дана-Фарбер / Центр рака Бригама и женщин (DF / BWCC) является лидером в
Дана-Фарбер / Центр рака Бригама и женщин (DF / BWCC) является лидером в
прецизионная медицина рака (также называемая персонализированной медициной). Вам, как пациенту, предлагают проверить опухоль на генетические мутации. Результаты этого теста позволяют вашей команде разработать для вас индивидуальные стратегии лечения, будь то стандартные методы лечения или клинические испытания, которые могут быть более эффективными в борьбе с вашей опухолью. Мы проводим клинические испытания, направленные на лечение конкретных изменений или мутаций в опухоли, включая испытания иммунотерапии.
Если у вас есть генетический синдром в дополнение к раку прямой или толстой кишки, вас будут осматривать врачи, специализирующиеся на лечении пациентов, которым требуется индивидуальное наблюдение после лечения.
Посмотреть
слайд-шоу об исследованиях, направленных на развитие целенаправленной желудочно-кишечной терапии с учетом генома (ДНК).
Программы поддержки
Мы понимаем, что лечение рака может быть сложной задачей как физически, так и эмоционально.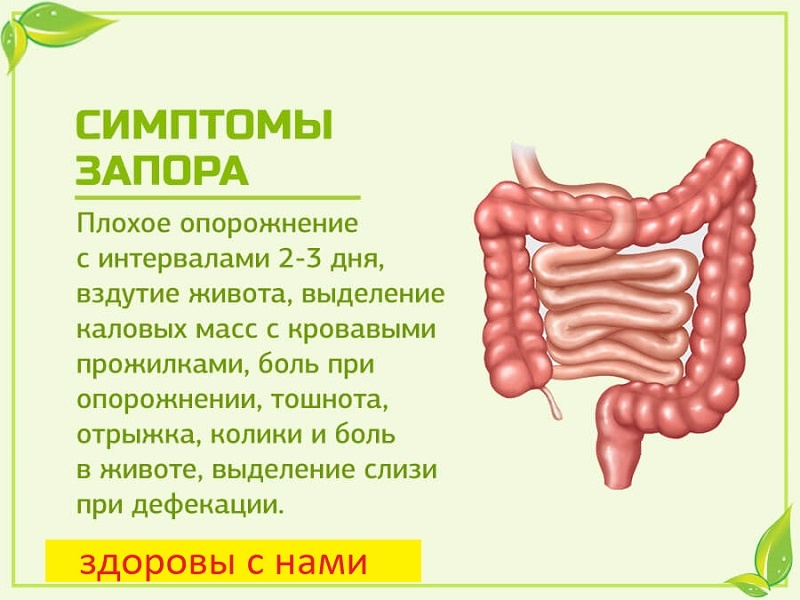 Наши пациенты и их семьи имеют доступ к нашему полному спектру услуг поддержки на протяжении всего периода лечения и восстановления.Это включает в себя
Наши пациенты и их семьи имеют доступ к нашему полному спектру услуг поддержки на протяжении всего периода лечения и восстановления.Это включает в себя
консультирование и социальная работа,
занятия и консультации,
психосоциальная поддержка,
лечение боли и симптомов (также называемое паллиативной помощью),
интегративная терапия и
группы поддержки.
Многие наши пациенты работают с
службы питания и консультанты по планированию питания с самого начала лечения. Если вам нужен
колостомия, вы можете работать со специализированными медсестрами и социальными работниками, которые научат вас, как ухаживать за колостомой и как вы можете чувствовать себя наиболее комфортно.
Инновации и исследования
В основе нашей заботы лежит специализированная исследовательская программа. Врачи-ученые в Центре рака толстой и прямой кишки находятся на переднем крае исследований рака — разрабатывают способы улучшения клинических и хирургических результатов пациентов, проводят международные клинические испытания и сотрудничают с исследователями фундаментальных наук, чтобы предлагать пациентам новейшие методы лечения.
Наши специалисты в каждой специальности являются лидерами в своих областях и регулярно публикуют свои открытия о новых методах лечения, механизмах, лежащих в основе этих заболеваний, хирургических методах, генетических открытиях, скрининге и раннем обнаружении.Они изучают все аспекты этих заболеваний, от того, как они развиваются, до роли, которую диета, кофеин и упражнения играют в здоровье выживших. Наши открытия включают:
- Аспирин может улучшить выживаемость пациентов, у которых уже был диагностирован колоректальный рак. Результаты исследования показывают, что пациенты с колоректальным раком, которые регулярно принимали аспирин после постановки диагноза, имели почти на 30 процентов меньший риск смерти от своего заболевания в течение первого десятилетия после постановки диагноза, чем не принимавшие аспирин.
- Пациенты, которые после постановки диагноза остаются физически активными, имеют более низкий риск рецидива и более высокую выживаемость.
 Наша команда опубликовала первые исследования физических упражнений и выживаемости при колоректальном раке, которые теперь были подтверждены другими группами и включены в национальные и международные руководства по уходу за выжившими после рака толстой и прямой кишки.
Наша команда опубликовала первые исследования физических упражнений и выживаемости при колоректальном раке, которые теперь были подтверждены другими группами и включены в национальные и международные руководства по уходу за выжившими после рака толстой и прямой кишки. - Пациенты с диагнозом рака толстой кишки,
Витамин D в их крови имеет лучшую выживаемость, чем те, кто испытывал дефицит этого витамина.Кроме того, у пациентов с IV стадией рака толстой кишки или прямой кишки очень низкий уровень витамина D. Исследователи планируют клиническое испытание, в котором эти пациенты будут принимать витамин D вместе со стандартной химиотерапией.
Многопрофильная помощь
Наш новаторский подход отражен в нашей отличительной совместной междисциплинарной модели оказания помощи, в которой участвуют врачи, медсестры, исследователи и наши многочисленные поставщики услуг поддержки. Специалисты в области гастроэнтерологии, эндоскопии, патологии, радиологии, колоректальной хирургии, хирургической онкологии, медицинской онкологии и радиационной онкологии регулярно встречаются, чтобы объединить планы лечения по специальностям, упростить общение с пациентами и убедиться, что каждый подход к лечению учитывается на каждом этапе.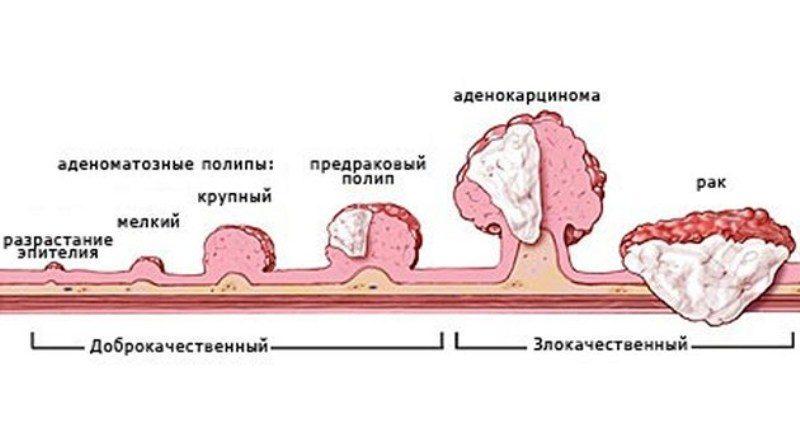
Наш опыт делает нас ресурсом
Мы делимся нашим глубоким опытом, обучая пациентов и практикующих врачей новейшим методам диагностики и лечения людей с раком прямой и толстой кишки, а также нашим открытиям в отношении способов предотвращения рецидивов. Наши специалисты регулярно выступают на образовательных конференциях для медицинского сообщества, выступают с докладами о колоректальном раке по всему миру и участвуют в советах по опухолям в различных больницах.
Кроме того, наш Центр:
- Предлагает альтернативные мнения и рекомендации коллегам по всей стране.
- Обучает будущих лидеров по всем аспектам колоректального рака.
- Функционирует как домашний центр и центр сотрудничества для исследований колоректального рака.
- Предлагает модель ухода за пациентом, построенную на основе передовых исследований.
- Работает с местными хирургами, онкологами и лучевыми терапевтами по всей Новой Англии в рамках
Partners Healthcare System.

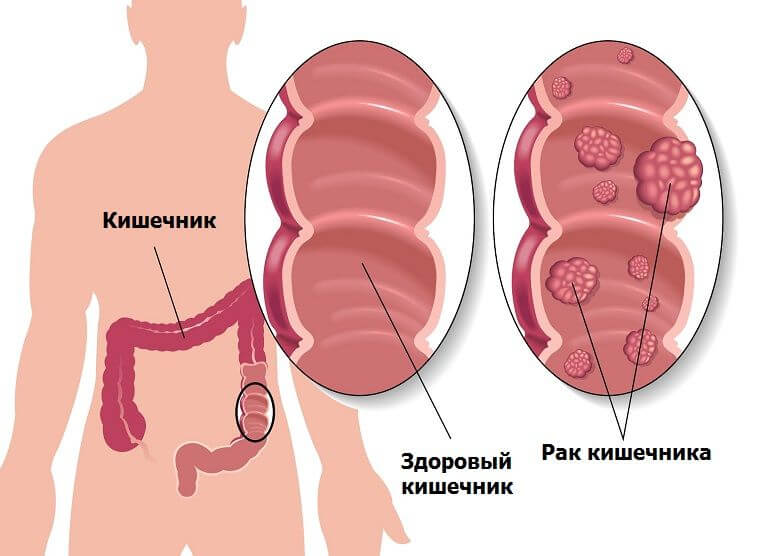




 Он не достиг ближайших органов или лимфатических узлов и не распространился на отдаленные органы.
Он не достиг ближайших органов или лимфатических узлов и не распространился на отдаленные органы.
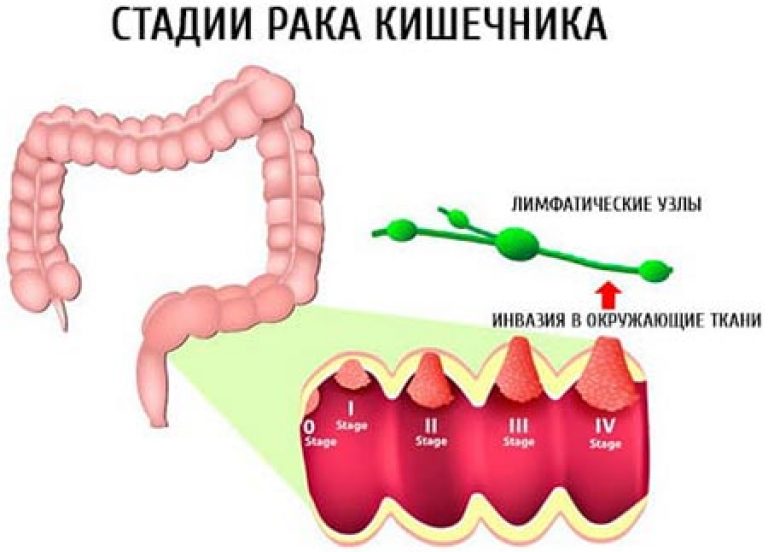 Наша команда опубликовала первые исследования физических упражнений и выживаемости при колоректальном раке, которые теперь были подтверждены другими группами и включены в национальные и международные руководства по уходу за выжившими после рака толстой и прямой кишки.
Наша команда опубликовала первые исследования физических упражнений и выживаемости при колоректальном раке, которые теперь были подтверждены другими группами и включены в национальные и международные руководства по уходу за выжившими после рака толстой и прямой кишки.