РЕЦИДИВЫ РАКА ПРЯМОЙ КИШКИ ПОСЛЕ ХИРУРГИЧЕСКОГО И КОМБИНИРОВАННОГО ЛЕЧЕНИЯ: ФАКТОРЫ РИСКА, ДИАГНОСТИКА И ЛЕЧЕНИЕ | Пу
1. Чиссов В.И., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2011 году (заболеваемость и смертность). ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России, 2013.
2. Peeters K.C., Marijnen C.A., Nagtegaal I.D. et al. The TME trial after a median follow-up of 6 years: increased local control but nosurvival benefit in irradiated patients with resectable rectal carcinoma. Ann Surg 2007;246(5):693–701.
3. Sauer R., Becker H., Hohenberger W. et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004;351(17):1731–40.
4. Ortiz H., Wibe A., Ciga M.A. et al. Impact of a multidisciplinary team trainingprogramme on rectal cancer outcomes in Spain. Colorectal Dis 2013;15(5):544–51.
Ortiz H., Wibe A., Ciga M.A. et al. Impact of a multidisciplinary team trainingprogramme on rectal cancer outcomes in Spain. Colorectal Dis 2013;15(5):544–51.
5. Martling A., Holm T., Rutqvist L.E. et al. Impact of a surgical training programme on rectal cancer outcomes in Stockholm. Br J Surg 2005;92(2):225–9.
6. Farouk R., Nelson H. and Gunderson L.L. Aggressive multimodality treatment for locally advanced irresectable rectal cancer. Br J Surg 1997; 84(6):741–9.
7. Wong C.S., Cummings B.J., Brierley J.D. et al. Treatment of locally recurrent rectal carcinoma—results and prognostic factors. Int J Radiat Oncol Biol Phys 1998;40(2):427–35.
8. Jörgren F., Johansson R., Damber L. , Lindmark G. Risk factors of rectal cancer local recurrence: population-based survey and validation of the Swedish rectal cancer registry. Colorectal Dis 2010;12(10):977–86.
, Lindmark G. Risk factors of rectal cancer local recurrence: population-based survey and validation of the Swedish rectal cancer registry. Colorectal Dis 2010;12(10):977–86.
9. Williams N.S. and Abulafi A.M. Local recurrence of colorectal cancer: the problem, mechanisms, management and adjuvant therapy. Br J Surg 1994;81(1):7–19.
10. Chen G. et al. Causes of recurrence in low rectal carcinoma after low anastomosis operation. Clin J Med Officers 2010;38(4):503–5.
11. Koca D., Binicier C., Oztop I. et al. Prognostic factors affecting recurrence and survival in patients with locally advanced rectal cancer. J BUON 2012;17(2):291–8.
12. Wu Z.Y. et al. Risk factors of local recurrence after curative resection in patients with middle and lower rectal carcinoma. Chin J Pract Surg 2008;28(2):133–5.
Chin J Pract Surg 2008;28(2):133–5.
13. Liebig C., Ayala G., Wilks J. et al. Perineural invasion is an independent predictor of outcome in colorectal cancer. J Clin Oncol 2009;27(31):5131–7.
14. Wang L.M., Kevans D., Mulcahy H. et al. Tumor budding is a strong and reproducible prognostic marker in T3N0 colorectal cancer. Am J Surg Pathol 2009;33(1):134–41.
15. NCCN Clinical Practice Guidelines in Oncology: Rectal Cancer. V. 2. 2012.URL: http://www.nccn.org (дата обращения 01.03.2012).
16. Sauer R., Liersch T., Merkel S. et al. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol 2012;30(16):1926–33.
J Clin Oncol 2012;30(16):1926–33.
17. Ceyhan G.O., Liebl F., Maak M. et al. The severity of neural invasion is a crucial prognostic factor in rectal cancer independent of neoadjuvant radiochemotherapy. Ann Surg 2010;252(5):797–804.
18. Li C.S., Wan D.S., Pan Z.Z. et al. [Multivariate prognostic analysis of patients with low and middle rectal cancer after curative resection]. Ai Zheng 2006;25(5):587–90.
19. Kim J.C., Yu C.S., Lim S.B. et al. Abdominoperineal resection and low anterior resection: comparison of long-term oncologic outcome in matched patients with lower rectal cancer. Int J Colorectal Dis 2013;28(4):493–501.
20. Wibe A., Syse A., Andersen E. et al. Oncological outcomes after total mesorectal excision for cure for cancer of the lower rectum: anterior vs. abdominoperineal resection. Dis Colon Rectum 2004;47(1):48–58.
abdominoperineal resection. Dis Colon Rectum 2004;47(1):48–58.
21. West N.P., Anderin C., Smith K.J. et al. Multicentre experience with extralevator abdominoperineal excision for low rectal cancer. Br J Surg 2010;97(4):588–99.
22. Birbeck K.F., Macklin C.P., Tiffin N.J. et al. Rates of circumferential resection margin involvement vary between surgeons and predict outcomes in rectal cancer surgery. Ann Surg 2002;235(4):449–57.
23. Guillem J.G., Paty P.B. and Cohen A.M. Surgical treatment of colorectal cancer. CA Cancer J Clin 1997;47(2):113–28.
24. Williams N.S. The rationale for preservation of the anal sphincter in patients with low rectal cancer. Br J Surg 1984;71(8):575–81.
25. Kusters M., Beets G.L., van de Velde C.J. et al. A comparison between the treatment of low rectal cancer in Japan and the Netherlands, focusing on the patterns of local recurrence. Ann Surg 2009;249(2):229–35.
26. Moriya Y., Sugihara K., Akasu T., Fujita S. Importance of extended lymphadenectomy with lateral node dissection for advanced lower rectal cancer. World J Surg 1997;21(7):728–32.
27. Georgiou P., Tan E., Gouvas N. et al. Extended lymphadenectomy versus conventional surgery for rectal cancer: a meta-analysis. Lancet Oncol 2009;10(11):1053–62.
28. Dresen R.C., Peters E.E., Rutten H.J. et al. Local recurrence in rectal cancer can be predicted by histopathological factors. Eur J Surg Oncol 2009;35(10):1071–7.
Eur J Surg Oncol 2009;35(10):1071–7.
29. Bülow S., Christensen I.J., Iversen L.H. et al. Intra-operative perforation is an important predictor of local recurrence and impaired survival after abdominoperineal resection for rectal cancer. Colorectal Dis 2011;13(11):1256–64.
30. Suzuki K., Dozois R.R., Devine R.M. et al. Curative reoperations for locally recurrent rectal cancer. Dis Colon Rectum 1996;39(7):730–6.
31. Wanebo H.J., Antoniuk P., Koness R.J. et al. Pelvic resection of recurrent rectal cancer: technical considerations and outcomes. Dis Colon Rectum 1999;42(11):1438–48.
32. Hahnloser D., Nelson H., Gunderson L.L. et al. Curative potential of multimodality therapy for locally recurrent rectal cancer. Ann Surg 2003;237(4):502–8.
Ann Surg 2003;237(4):502–8.
33. Enríquez-Navascués J.M., Borda N., Lizerazu A. et al. Patterns of local recurrence in rectal cancer after a multidisciplinary approach. World J Gastroenterol 2011;17(13):1674–84.
34. Kusters M., Marijnen C.A., van de Velde C.J. Patterns of local recurrence in rectal cancer; a study of the Dutch TME trial. Eur J Surg Oncol 2010;36(5):470–6.
35. Höcht S., Mann B., Germer C.T. et al. Pelvic sidewall involvement in recurrent rectal cancer. Int J Colorectal Dis 2004;19(2):108–13.
36. Kim T.H., Jeong S.Y., Choi D.H. et al. Lateral lymph node metastasis is a major cause of locoregional recurrence in rectal cancer treated with preoperative chemoradiotherapy and curative resection. Ann Surg Oncol 2008;15(3):729–37.
Ann Surg Oncol 2008;15(3):729–37.
37. Ефетов В.М., Ефетов С.В., Черипко О.Н. Рецидивы рака прямой кишки. Онкология 2006;8(2):176–180.
38. Gu J.Z. Clinical path of diagnosis and treatment for locally recurrent rectal cancer. Chin J Pract Surg 2011;31(4):277–80.
39. Kodeda K., Derwinger K., Gustavsson B., Nordgren S. Local recurrence of rectal cancer: a population-based cohort study of diagnosis, treatment and outcome. Colorectal Dis 2012;14(5):e230–7.
40. Heriot A.G., Byrne C.M., Lee P. et al. Extended radical resection: the choice for locally recurrent rectal cancer. Dis Colon Rectum 2008;51(3):284–91.
41. Palmer G., Martling A., Cedermark B., Holm T. A population-based study on the management and outcome in patients with locally recurrent rectal cancer. Ann Surg Oncol 2007;14(2):447–54.
Palmer G., Martling A., Cedermark B., Holm T. A population-based study on the management and outcome in patients with locally recurrent rectal cancer. Ann Surg Oncol 2007;14(2):447–54.
42. Salo J.C., Paty P.B., Guillem J. et al. Surgical salvage of recurrent rectal carcinoma after curative resection: a 10-year experience. Ann Surg Oncol 1999;6(2): 171–7.
43. Thaysen H.V., Jess P. and Laurberg S. Health-related quality of life after surgery for primary advanced rectal cancer and recurrent rectal cancer: a review. Colorectal Dis 2012;14(7):797–803.
44. Morken J.J., Baxter N.N., Madoff R.D., Finne C.O. 3rd. Endorectal ultrasound-directed biopsy: a useful technique to detect local recurrence of rectal cancer. Int J Colorectal Dis 2006;21(3):258–64.
45. Dan’ko N.A., Vazhenin A.V. and Nadvikova E.A. [Value of magnetic resonance imaging in the diagnosis of recurrent colorectal cancer]. Vestn Rentgenol Radiol 2012;3:28–33.
Dan’ko N.A., Vazhenin A.V. and Nadvikova E.A. [Value of magnetic resonance imaging in the diagnosis of recurrent colorectal cancer]. Vestn Rentgenol Radiol 2012;3:28–33.
46. Colosio A., Fornès P., Soyer P. et al. Local colorectal cancer recurrence: pelvic MRI evaluation. Abdom Imaging 2013;38(1):72–81.
47. Ho M.L., Liu J.and Narra V. Magnetic resonance imaging of rectal cancer. Clin Colon Rectal Surg 2008;21(3):178–87.
48. Abir F., Alva S., Longo W.E. et al. The postoperative surveillance of patients with colon cancer and rectal cancer. Am J Surg 2006;192(1):100–8.
49. Stückle C.A., Haegele K.F., Jendreck M. et al. [Improvements in detection of rectal cancer recurrence by multiplanar reconstruction]. Radiologe 2005;45(10): 930–4, 936.
Radiologe 2005;45(10): 930–4, 936.
50. Blomqvist L., Holm T., Göranson H. et al. MR imaging, CT and CEA scintigraphy in the diagnosis of local recurrence of rectal carcinoma. Acta Radiol 1996;37(5):779–84.
51. Pema P.J., Bennett W.F., Bova J.G., Warman P. CT vs MRI in diagnosis of recurrent rectosigmoid carcinoma. J Comput Assist Tomogr 1994;18(2):256–61.
52. Petersen H., Nielsen M.J., Høilund-Carlsen M. et al. PET/CT may change diagnosis and treatment in cancer patients. Dan Med Bull 2010;57(9):A4178.
53. Shamim S.A., Kumar R., Shandal V. et al. FDG PET/CT evaluation of treatment response in patients with recurrent colorectal cancer. Clin Nucl Med 2011;36(1):11–6.
54. Maas M., Rutten I.J., Nelemans P.J. et al. What is the most accurate whole-body imaging modality for assessment of local and distant recurrent disease in colorectal cancer? A meta-analysis : imaging for recurrent colorectal cancer. Eur J Nucl Med Mol Imaging 2011;38(8):1560–71.
Maas M., Rutten I.J., Nelemans P.J. et al. What is the most accurate whole-body imaging modality for assessment of local and distant recurrent disease in colorectal cancer? A meta-analysis : imaging for recurrent colorectal cancer. Eur J Nucl Med Mol Imaging 2011;38(8):1560–71.
55. The Association of Coloproctology of Great Britain and Ireland. Guidelines for the management of colorectal cancer, 3rd edition (2007). URL: http://www.acpgbi.org.uk (дата обращения 01.03.2012).
56. Harji D.P., Griffiths B., McArthur D.R., Sagar P.M. Surgery for recurrent rectal cancer: higher and wider? Colorectal Dis 2013;15(2):139–45.
57. Bhangu A., Ali S.M., Cunningham D. et al. Comparison of long-term survival outcome of operative vs nonoperative management of recurrent rectal cancer. Colorectal Dis 2013;15(2):156–63.
Colorectal Dis 2013;15(2):156–63.
58. Rödel C., Grabenbauer G.G., Matzel K.E. et al. Extensive surgery after high-dose preoperative chemoradiotherapy for locally advanced recurrent rectal cancer. Dis Colon Rectum 2000;43(3):312–9.
59. Vermaas M., Ferenschild F.T., Nuyttens J.J. et al., Preoperative radiotherapy improves outcome in recurrent rectal cancer. Dis Colon Rectum 2005;48(5):918–28.
60. Mohiuddin M., Marks G. and Marks J. Long-term results of reirradiation for patients with recurrent rectal carcinoma. Cancer 2002;95(5):1144–50.
61. Valentini V., Morganti A.G., Gambacorta M.A. et al. Preoperative hyperfractionated chemoradiation for locally recurrent rectal cancer in patients previously irradiated to the pelvis: A multicentric phase II study. Int J Radiat Oncol Biol Phys 2006;64(4):1129–39.
Int J Radiat Oncol Biol Phys 2006;64(4):1129–39.
62. Hu J.B., Sun X.N., Yang Q.C. et al. Three-dimensional conformal radiotherapy combined with FOLFOX4 chemotherapy for unresectable recurrent rectal cancer. World J Gastroenterol 2006;12(16):2610–4.
63. Wang J.J., Yuan H.S., Li J.N. et al. Interstitial permanent implantation of 125I seeds as salvage therapy for re-recurrent rectal carcinoma. Int J Colorectal Dis 2009 Apr;24(4):391–9.
64. Hartley J.E., Lopez R.A., Paty P.B. et al. Resection of locally recurrent colorectal cancer in the presence of distant metastases: can it be justified? Ann Surg Oncol 2003;10(3):227–33.
65. Saito N., Koda K., Takiguchi N. et al. Curative surgery for local pelvic recurrence of rectal cancer. Dig Surg 2003;20(3):192–9; discussion 200.
Dig Surg 2003;20(3):192–9; discussion 200.
66. Dozois E.J., Privitera A., Holubar S.D. et al. High sacrectomy for locally recurrent rectal cancer: Can long-term survival be achieved? J Surg Oncol 2011;103(2):105–9.
67. Nielsen M.B., Rasmussen P.C., Lindegaard J.C., Laurberg S. A 10-year experience of total pelvic exenteration for primary advanced and locally recurrent rectal cancer based on a prospective database. Colorectal Dis 2012;14(9):1076–83.
68. Moore H.G., Shoup M., Riedel E. et al. Colorectal cancer pelvic recurrences: determinants of resectability. Dis Colon Rectum 2004;47(10):1599–606.
69. Zhao J., Du C.Z., Sun Y.S., Gu J. Patterns and prognosis of locally recurrent rectal cancer following multidisciplinary treatment. World J Gastroenterol 2012;18(47):7015–20.
World J Gastroenterol 2012;18(47):7015–20.
70. Kusters M., Dresen R.C., Martijn H. Radicality of resection and survival after multimodality treatment is influenced by subsite of locally recurrent rectal cancer. Int J Radiat Oncol Biol Phys 2009;75(5):1444–9.
71. Hellinger M.D. and Santiago C.A. Reoperation for recurrent colorectal cancer. Clin Colon Rectal Surg 2006;19(4):228–36.
72. De Wever I. Pelvic exenteration: long-term oncological results in a series of 106 patients. Acta Chir Belg 2011;111(5):282–7.
73. Moriya Y. Treatment strategy for locally recurrent rectal cancer. Jpn J Clin Oncol 2006;36(3):127–31.
74. Suo J. and Xia M.J. Surgical treatment strategies for the local recurrence of rectal cancer. Chin J Pract Surg 2012;32(9):785–6, 789.
Suo J. and Xia M.J. Surgical treatment strategies for the local recurrence of rectal cancer. Chin J Pract Surg 2012;32(9):785–6, 789.
75. Jager E., Heike M., Bernhard H. et al. Weekly high-dose leucovorin versus low-dose leucovorin combined with fluorouracil in advanced colorectal cancer: results of a randomized multicenter trial. Study Group for Palliative Treatment of Metastatic Colorectal Cancer Study Protocol 1. J Clin Oncol 1996;14(8):2274–9.
Рак прямой кишки. Послеоперационная профилактика расстройств
Хирургическое лечение рака прямой кишки в начале разработки этой проблемы было связано с обеспечением безопасности оперативных вмешательств и борьбой с интраоперационными осложнениями, затем — с возрастанием радикальности операций и расширением зоны лимфодиссекции. Впервые радикальную операцию по поводу рака прямой кишки — брюшно-промежностную экстирпацию — выполнил W. Miles. Суть операции заключалась в футлярном удалении непосредственно самой прямой кишки. В отечественной хирургии приоритет в разработке и внедрении в клиническую практику передней (чрезбрюшинной) резекции прямой кишки принадлежит Б.А. Петрову, впервые выполнившему эту ССО в 1937 году.
Miles. Суть операции заключалась в футлярном удалении непосредственно самой прямой кишки. В отечественной хирургии приоритет в разработке и внедрении в клиническую практику передней (чрезбрюшинной) резекции прямой кишки принадлежит Б.А. Петрову, впервые выполнившему эту ССО в 1937 году.
Уважаемые пациенты! Обратите внимание на следующие материалы сайта:
|
Новые возможности для увеличения доли ССО появились с внедрением в хирургическую практику циркулярных сшивающих аппаратов последних моделей в сочетании с зажимом для наложения кисетного шва и монофиламентных нитей на прямых гнущихся иглах. Все это упростило выполнение предельно низких от анокутанной линии резекций прямой кишки. К этому добавились специальные исследования об особенностях внутрикишечного распространения ракового поля в дистальном направлении от видимого края опухоли. Оказалось, что достаточно отступить на 1,5 — 2 см от нижней границы пальпируемой части раковой опухоли, чтобы линия резекции пришлась по здоровой, непораженной опухолевыми клетками кишке. Стали выполняться не только низкие, но и ультранизкие резекции прямой кишки. Появились сообщения из высококвалифицированных и специализированных лечебно-научных учреждений о транссфинктерных резекциях ПК.
К этому добавились специальные исследования об особенностях внутрикишечного распространения ракового поля в дистальном направлении от видимого края опухоли. Оказалось, что достаточно отступить на 1,5 — 2 см от нижней границы пальпируемой части раковой опухоли, чтобы линия резекции пришлась по здоровой, непораженной опухолевыми клетками кишке. Стали выполняться не только низкие, но и ультранизкие резекции прямой кишки. Появились сообщения из высококвалифицированных и специализированных лечебно-научных учреждений о транссфинктерных резекциях ПК.
Профилактика послеоперационных колоректальных расстройств
при раке прямой кишки
В последние годы с целью профилактики послеоперационных колоректальных расстройств широкое распространение получили операции формирования толстокишечного резервуара при резекциях прямой кишки. Исходные позиции этого предложения очевидны — создать вместо утраченных после резекции прямой кишки накопительной и эвакуаторной функций, подобие их, за счет резервуара из толстой кишки. Работ в этом плане довольно много. Использовался при этом многолетний опыт формирования тонкокишечных резервуаров при тотальной проктоколэктомии. Со временем стало очевидным, что чисто механически замена утраченных функций прямой кишки так просто не решается и последовала оценка результатов операций с формированием толстокишечных резервуаров, сообщения об изменении методики операции и новые предложения. Термин «неоректум» стал применяться все реже и реже.
Работ в этом плане довольно много. Использовался при этом многолетний опыт формирования тонкокишечных резервуаров при тотальной проктоколэктомии. Со временем стало очевидным, что чисто механически замена утраченных функций прямой кишки так просто не решается и последовала оценка результатов операций с формированием толстокишечных резервуаров, сообщения об изменении методики операции и новые предложения. Термин «неоректум» стал применяться все реже и реже.
Первоначально резервуар стремились формировать достаточно объемным 7,5-10 см. По мере изучения функциональных результатов резекций ПК с созданием толстокишечных резервуаров становилось очевидным, что лучшие данные выявляются при резервуарах меньшего размера — 5 см. Так, Jin-Ichi Hida et all. (1996 г.) проводили рандомизированные исследования с формированием резервуаров 10 и 5 см (длина). Первая группа (10 см) — 20 чел., вторая группа (5 см) — тоже 20 чел. Оценивали результаты через 1 год. Эвакуаторная функция при резервуаре 5 см была значительно выше, чем при «неоректум» 10 см. Сфинктерная функция была одинаковой в обеих группах. Оценивая функцию по ряду параметров, авторы определенно высказываются за создание толстокишечного резервуара 5 см. Они пишут: «J-резервуар 5 см дает адекватную резервуарную функцию без компрометирующей эвакуации». Через 3 года авторы вернулись к этому вопросу и убежденно пришли к заключению, что наблюдающиеся затруднения с эвакуацией кишечного содержимого после операций определенно связаны с размером резервуара — чем он больше, тем чаше наблюдаются затруднения.
Сфинктерная функция была одинаковой в обеих группах. Оценивая функцию по ряду параметров, авторы определенно высказываются за создание толстокишечного резервуара 5 см. Они пишут: «J-резервуар 5 см дает адекватную резервуарную функцию без компрометирующей эвакуации». Через 3 года авторы вернулись к этому вопросу и убежденно пришли к заключению, что наблюдающиеся затруднения с эвакуацией кишечного содержимого после операций определенно связаны с размером резервуара — чем он больше, тем чаше наблюдаются затруднения.
Необходимость формирования толстокишечного резервуара возникает при низких резекциях прямой кишки. Правда понятие «низкая резекция» определяется по-разному и значение здесь имеет каждый сантиметр. Обычно речь идет о раке среднеампулярного отдела прямой кишки с определением нижней границы резекции. Т.С.Одарюк с соавт. (2000 г.) пишут, что это в среднем 1,5 см от аноректальной линии. Необходимость в резервуаре авторы обуславливали развитием «Синдрома низкой передней резекции» после прямых наданальных анастомозов.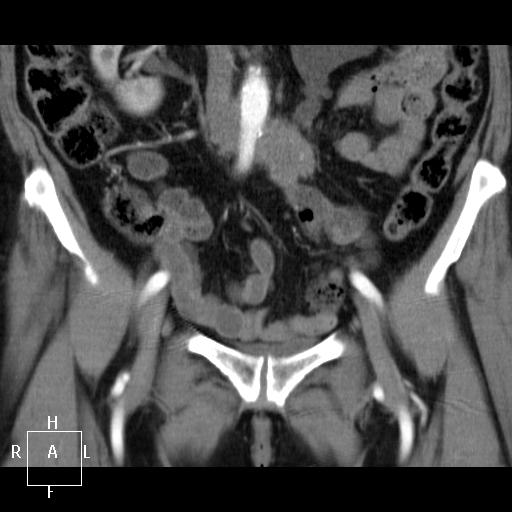
Jin-ichi Hida et all (1998 г.) приходят к заключению, что при резекции прямой кишки выше 4 см от зубчатой линии нужно выполнять прямой колоанальный анастомоз, а ниже 4 см — формировать J-резервуар.
Для оценки колоректальной функции у больных после резекций прямой кишки с формированием толстокишечного резервуара используется метод анкетирования (вопросник) и объективные исследования аноректальной функции в разные сроки после оперативного вмешательства.
Наряду с безусловно положительной оценкой резекции прямой кишки при раковом ее поражении с формированием толстокишечного резервуара, ряд авторов обращает внимание на недостатки такой операции. Справедливо замечают Г.И.Воробьев с соавт. (2000 г.), что «до настоящего времени сохраняется нестабильность и непредсказуемость функциональных результатов, особенно в отдаленные сроки после данного вмешательства (операции с резервуарами)». Так, у 15-20% больных не удается добиться нужной континенции.
В связи с выявленными негативными сторонами J-резервуаров в литературе стали обращать внимание на особенности формирования самого толстокишечного резервуара. Г.А.Покровский с соавт. (1998 г.) вместо J-образного создавали Э-образный резервуар, но число таких операций невелико — всего пять оперированных больных. G.A.Maurer et all (1999 г.) высказывают мнение, что короткий толстокишечный резервуар более физиологичен и приближается к «неоректум». В эксперименте на свинках они формировали несколько видов резервуаров и наиболее приемлемой оказалась простая конструкция с поперечной колопластикой которая создает подобие ампулы прямой кишки. Они анастомозировали ее с оставшейся частью анального канала. R.Ruppert &D.Staimmer (1999 г.), зная эти экспериментальные исследования на свинках и видя недостатки J-резервуаров, использовали колопласткиу у 31 больного. Функциональные результаты оказались заметно лучше.
Г.А.Покровский с соавт. (1998 г.) вместо J-образного создавали Э-образный резервуар, но число таких операций невелико — всего пять оперированных больных. G.A.Maurer et all (1999 г.) высказывают мнение, что короткий толстокишечный резервуар более физиологичен и приближается к «неоректум». В эксперименте на свинках они формировали несколько видов резервуаров и наиболее приемлемой оказалась простая конструкция с поперечной колопластикой которая создает подобие ампулы прямой кишки. Они анастомозировали ее с оставшейся частью анального канала. R.Ruppert &D.Staimmer (1999 г.), зная эти экспериментальные исследования на свинках и видя недостатки J-резервуаров, использовали колопласткиу у 31 больного. Функциональные результаты оказались заметно лучше.
Интересный вариант ССО предложили В.В.Яновой с соавт. при низких резекциях ПК, когда опухоль располагается не выше 3 см от зубчатой линии анального канала. Эти авторы с 1989 г. делают в низведенной кишке две продольные насечки с последующим сшиванием их поперек, что создает S-образный изгиб и увеличивает объем кишки. Функция финктерного аппарата признана хорошей и удовлетворительной у 60.5% больных: 5-летнее выживание — 69%. Опыт авторов — лечение 700 больных РПК.
Функция финктерного аппарата признана хорошей и удовлетворительной у 60.5% больных: 5-летнее выживание — 69%. Опыт авторов — лечение 700 больных РПК.
Поиск лучших вариантов формирования толстокишечных резервуаров и оценка колоанальной функции в таких случаях продолжается. Совершенствование колопластических операций в этом плане, вероятно, займет определяющее место.
Склонностью к лимфотропизму при раке прямой кишки
В связи с тем, что рак прямой кишки, согласно исследованиям, обладает склонностью к лимфотропизму, именно лимфаденэктомии в хирургическом лечении рака прямой кишки придается весьма важное значение. Лимфогенное метастазирование рака прямой кишки является одной из вероятных причин развития локорегионального рецидива после операции. Поэтому наряду с удалением первичной опухоли целью хирургического лечения является радикальное удаление зон регионарного метастазирования опухоли.
Еще W.Miles в 1908 г. были определены три основные пути лимфогенного метастазирования при раке прямой кишки — восходящий, нисходящий и латеральный, что послужило началом разработки принципов лимфодиссекции при неопластических образованиях ПК.
- Восходящее метастазирование охватывает параректальные, верхние ректальные и нижние брыжеечные лимфоузлы.
- Латеральное метастазирование затрагивает средние ректальные, запирательные, внутренние подвздошные и общие подвздошные узлы.
- Нисходящее метастазирование — паховые лимфоузлы.
Периневральная инвазия
При наличии инвазии опухоли в нервную ткань метастазы в лимфоузлах обнаруживается в 81%, а без такового — в 37%.
Первичный рак прямой кишки характеризуется тем, что опухоль остается длительное время локализованной и относительно медленно растет по сравнению с другими опухолями пищеварительного тракта. Локализованный и медленный рост характерен так же и для метастазов в лимфоузлы. Исходя из этой биологической особенности рака прямой кишки, было сделано предположение, что, увеличив объем лимфаденэктомии, можно достичь снижения количества рецидивов.
Впервые расширенная лимфаденэктомия была описана Kuru в 1942 г. Однако, результаты исследований не показали статистически значимой разницы в 5-летней выживаемости между группами больных, которым проводились стандартная и расширенная лимфаденэктомия. Вновь интерес к расширенной лимфаденэктомии появился в 80-е годы, когда Heald и соавт. предложили выполнение тотальной мезоректумэктомии, т.е. удаление совокупности тканей и органов, находящихся в пределах фасциальной оболочки прямой кишки, включающей в себя параректальную клетчатку, кровеносные и лимфатические сосуды. Используя данную методику, этим авторам удалось снизить частоту местных рецидивов до 5%, что, однако не удалось воспроизвести другим исследователям, но вновь возник интерес к расширенной лимфаденэктомии.
Вновь интерес к расширенной лимфаденэктомии появился в 80-е годы, когда Heald и соавт. предложили выполнение тотальной мезоректумэктомии, т.е. удаление совокупности тканей и органов, находящихся в пределах фасциальной оболочки прямой кишки, включающей в себя параректальную клетчатку, кровеносные и лимфатические сосуды. Используя данную методику, этим авторам удалось снизить частоту местных рецидивов до 5%, что, однако не удалось воспроизвести другим исследователям, но вновь возник интерес к расширенной лимфаденэктомии.
Takahashi T. и соавт. предложили различать несколько вариантов лимфаденэктомии: ограниченную, стандартную и расширенную. Однако такое деление не является общепризнанным.
- Ограниченной лимфаденэктомии соответствует тотальная мезоректумэктомия.
- Стандартная лимфаденэктомия — ограниченная + высокая перевязка нижней брыжеечной артерии у аорты и удаление лимфоузлов по ходу подвздошных сосудов.
- Расширенная лимфаденэктомия — стандартная + лимфодиссекция в запирательном пространстве.

По мнению японских хирургов, ограниченная лимфаденэктомия показана при ранних стадиях рака прямой кишки, стандартная — при распространенном раке верхних отделов ПК, расширенная — при распространенном раке нижних отделов ПК.
Данные о влиянии расширенной лимфаденэктомии на 5-летнюю выживаемость больных раком стадии В и С по Dukes весьма противоречивы. Необходимы дальнейшие многоцентровые исследования.
Недостатки лимфаденэктомии при раке прямой кишки
Основным недостатком лимфаденэктомии является нарушение мочевой и половой функций, которые встречаются в 30% и 80 — 100% наблюдений соответственно. Такие нарушения могут быть связаны с разными причинами, но, несомненно, они возникают при пересечении вегетативных нервов таза. Выясняя функциональные результаты ССО выполненных по поводу РПК, мы также обращали внимание на частоту мочеполовой дисфункции у этих больных. Это послужило поводом для проведения собственных исследований по выяснению особенностей строения и расположения вегетативных нервов таза.
Казалось бы очевидным, что для получения лучших функциональных результатов после низкой резекции ПК необходимо позаботиться о сохранении вегетативной иннервации органов таза, однако специальных исследований в этом плане очень мало. Вероятно, правы Yasutomi Masayuki et all. (1995 г.), которые пишут, что в предыдущие годы все внимание было сосредоточено на повышение радикальности операций. К этому нужно добавить, что не существует, а мы специально интересовались, специфических методов идентификации нервных структур (окраска, свечение и т.д.).
Проблему составляет сохранение иннервации при резекциях ПК и ряд хирургов призывают бережно относиться к нервным структурам таза. В этом отношении нужно отметить определенную настойчивость и последовательность исследований японских хирургов.
Сохранение вегетативных нервов малого таза при операциях у больных РПК реально при начальных формах ракового поражения при стадиях по Dukes А и В. Окончательно неясным и спорным является вопрос о возможности и целесообразности сохранения гипогастральных нервов при более распространенных формах опухолевого поражения ПК, не пренебрегая онкологическими интересами.
Оригинальные исследования T.Kono et all. (1998 г.), которые провели исследование на крысах по трансплантации тазовых нервов после их предварительного иссечения. Через 6 недель они уже регистрировали ритмичные сокращения мочевого пузыря у всех подопытных. Авторы делают смелый вывод, что трансплантация нервов таза успешно восстанавливает функцию мочевого пузыря и поэтому такую операцию можно рекомендовать в практику.
Yasutomi M. et all. при низких резекциях ПК у 185 больных ранними формами ракового поражения всегда стремились сохранить пучки вегетативных нервов. Дисфункция мочеиспускания после операции уменьшилась до 15% (раньше — 33%), половая потенция снизилась до 21% (раньше — 81%), 5-летняя выживаемость — 81%.
Sugihara Kenichi et all., сохраняя нервные пучки с обеих сторон при резекциях прямой кишки отметили способность к произвольному мочеиспусканию у 93,5%, а половую потенцию — у 70,4%. При ранних раках прямой кишки, замечают авторы, нервы должны сохраняться полностью, а при обнаружении метастазов опухоли в тазу — следует стремиться к сохранению нервов хотя бы с одной стороны. 5-летняя выживаемость составила при стадиях по Dukes А — 96,4%, В — 84,0%, С — 67,3%. Ishikura S. et all. (1999 г.) оперировали 50 больных низким РПК, сохраняя нервные тазовые пучки. 3-летняя выживаемость составила в среднем — 88%. При I-II стадиях — 97%, при III стадии — 73%. Авторы подчеркивают, что сохранение нервных пучков не было причиной местного рецидива раковой опухоли. Matsumoto A. et all. (1995 г.) обращают внимание на то, что рассечение пучка гипогастрального нерва с одной стороны не нарушает функцию мочевого пузыря. Sugihara K. et all. (1996 г.) при операции 214 больных с низким РПК сберегали нервы таза. У 70,4% мужчин сохранилась половая функция. 5-летняя выживаемость после таких операций составила: при стадии А — 96,4%, В — 84%, С — 67,3%.
5-летняя выживаемость составила при стадиях по Dukes А — 96,4%, В — 84,0%, С — 67,3%. Ishikura S. et all. (1999 г.) оперировали 50 больных низким РПК, сохраняя нервные тазовые пучки. 3-летняя выживаемость составила в среднем — 88%. При I-II стадиях — 97%, при III стадии — 73%. Авторы подчеркивают, что сохранение нервных пучков не было причиной местного рецидива раковой опухоли. Matsumoto A. et all. (1995 г.) обращают внимание на то, что рассечение пучка гипогастрального нерва с одной стороны не нарушает функцию мочевого пузыря. Sugihara K. et all. (1996 г.) при операции 214 больных с низким РПК сберегали нервы таза. У 70,4% мужчин сохранилась половая функция. 5-летняя выживаемость после таких операций составила: при стадии А — 96,4%, В — 84%, С — 67,3%.
Интересна работа хирургов из Нидерланд. Хирурги этой страны обратили внимание на то обстоятельство, что после операций по поводу рака на прямой кишке, возникает значительное число мочеполовых нарушений, что, безусловно, сказывается на КЖ этих пациентов.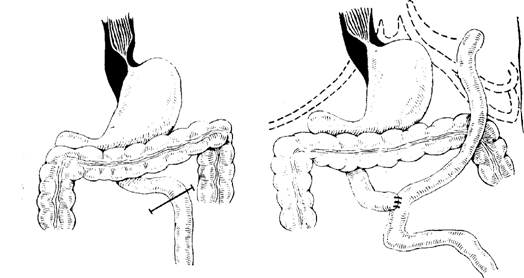 В связи с этим они пригласили японских хирургов и с их помощью оперировали 47 больных с низким раком ПК, которым сохраняли нервы таза. Мочевых расстройств не развилось ни у кого из больных. 19 из 30 мужчин были сексуально активны. Половое бессилие связано по их наблюдениям с повреждением гипогастрального сплетения. Для сохранения эякуляции необходимо сохранение верхнего гипогастрального сплетения. Авторы заключают, что операции с сохранением нервов таза должны стать хирургическим стандартом при оперативном лечении начальных форм рака прямой кишки.
В связи с этим они пригласили японских хирургов и с их помощью оперировали 47 больных с низким раком ПК, которым сохраняли нервы таза. Мочевых расстройств не развилось ни у кого из больных. 19 из 30 мужчин были сексуально активны. Половое бессилие связано по их наблюдениям с повреждением гипогастрального сплетения. Для сохранения эякуляции необходимо сохранение верхнего гипогастрального сплетения. Авторы заключают, что операции с сохранением нервов таза должны стать хирургическим стандартом при оперативном лечении начальных форм рака прямой кишки.
О возможности сохранения нервов таза при резекциях прямой кишки сообщают и отечественные авторы: Г.И.Воробьев с соавт., П.В.Царьков с соавт. А.И.Темников и Ю.П.Дугин.
Мы провели собственное исследование с целью изучить некоторые особенности и варианты расположения верхнего подчревного сплетения, подчревных нервов и их ветвей, с целью возможного сохранения их при операциях по поводу низкого рака ПК.
Материалом для исследования послужили 12 бальзамированных и 5 нефиксированных трупов людей, умерших от причин не связанных с патологией органов малого таза. Методика исследования заключалась в проведении общей и специальной антропометрии, препарирования, зарисовки, протоколирования, фотографирования, видеозаписи.
Методика исследования заключалась в проведении общей и специальной антропометрии, препарирования, зарисовки, протоколирования, фотографирования, видеозаписи.
Верхнее подчревное сплетение формируется при слиянии вегетативных нервов расположенных впереди нижней части абдоминального отдела аорты и, как правило, по своей ширине соответствует поперечным размерам аорты в области ее бифуркации. В результате проведенных исследований было выявлено в основном два варианта строения верхнего подчревного сплетения — многоветвистая и маловетвистая формы. Многоветвистая форма представлена нервным сплетением в виде широкой «пластины», имеющей треугольную или трапецивидную форму с основанием обращенным вниз, образованной большим количеством нервных волокон, формирующих густую сеть ниже бифуркации аорты. При этом сплетение располагается кзади от позадипрямокишечной клетчатки и прямокишечных сосудов. Позади верхнего подчревного сплетения располагается пристеночный листок фасции таза и левая общая подвздошная вена. Нижний край сплетения определялся четко при выделении тупфером и располагался ниже мыса крестца (по средней сагиттальной линии) на 0,4 — 2,4 см. От нижнего края сплетения, являясь продолжением его, отходят правый и левый подчревные нервы. Они располагаются на заднебоковой поверхности таза и направляются вниз, вдоль и медиальнее мочеточников и внутренней подвздошной артерии. В местах перекреста мочеточника с маточной артерией или семенным протоком, эти нервы располагаются так, что артерия матки (семенной проток) находится спереди, а мочеточник сзади от нервов. В этой зоне нервы распадаются преимущественно на три группы нервных волокон, образуя нижнее подчревное билатеральное сплетение. Эти группы нервных волокон направляются соответственно: к мочевому пузырю, к матке (семенным пузырькам, простате), к прямой кишке. К стенке кишки волокна нервов подходят в составе боковой связки прямой кишки вместе со средней прямокишечной артерией и веной, располагаясь произвольно относительно друг друга.
Нижний край сплетения определялся четко при выделении тупфером и располагался ниже мыса крестца (по средней сагиттальной линии) на 0,4 — 2,4 см. От нижнего края сплетения, являясь продолжением его, отходят правый и левый подчревные нервы. Они располагаются на заднебоковой поверхности таза и направляются вниз, вдоль и медиальнее мочеточников и внутренней подвздошной артерии. В местах перекреста мочеточника с маточной артерией или семенным протоком, эти нервы располагаются так, что артерия матки (семенной проток) находится спереди, а мочеточник сзади от нервов. В этой зоне нервы распадаются преимущественно на три группы нервных волокон, образуя нижнее подчревное билатеральное сплетение. Эти группы нервных волокон направляются соответственно: к мочевому пузырю, к матке (семенным пузырькам, простате), к прямой кишке. К стенке кишки волокна нервов подходят в составе боковой связки прямой кишки вместе со средней прямокишечной артерией и веной, располагаясь произвольно относительно друг друга.
Маловетвистая форма строения нервов характеризовалась наличием отдельных, немногочисленных, относительно толстых волокон с единичными анастомозами между ними. Волокна сплетения так же располагаются кзади от позадипрямокишечной клетчатки, верхних прямокишечных сосудов и не связаны с этими образованиями.
С учетом особенностей топографо-анатомического расположения автономных нервов таза, мы применили нерв-сберегающую технику оперирования при выполнении операций на прямой кишке по поводу рака ее различной локализации.
Показанием к операции у всех больных была аденокарцинома. Большинство новообразований соответствовало стадии Dukes B с высокой и умеренной степенью дифференцировки опухоли и локализацией ее в средне и нижнеампулярном отделах. Преобладающим типом операции была низкая передняя аппаратная резекция и брюшно-промежностная экстирпация прямой кишки. Обязательными этапами операции у всех больных были: высокая перевязка нижнебрыжеечной артерии и вены непосредственно у аорты, иссечение мезоректальной клетчатки, определение формы верхнего подчревного сплетения, выделение, взятие на «держалку» и мобилизация правого и левого подчревных нервов.
После предварительной перевязки нижних мезентериальных сосудов у аорты и пересечения сигмовидной кишки, мы считали необходимым выяснить особенности строения верхнего гипогастрального сплетения, а затем приступали к выделению правого и левого подчревных нервов, до этапа мобилизации прямой кишки. Ориентиром для определения верхнего гипогастрального сплетения является тазовый мыс, где нетрудно визуализировать его нижний край. Над поверхностью нерва тупфером сдвигали жировую ткань, брали его на “держалку” и преимущественно острым путем выделяли из параректальной клетчатки, передвигая “держалку” вниз к боковой связке прямой кишки. С помощью такого приема выделяли нерв с другой стороны. После этого подчревные нервы становились подвижными и смещаемыми в стороны на 5 — 6 см. Это обстоятельство является весьма важным, так как дает возможность производить иссечение мезоректальной клетчатки в необходимом объеме, без ущерба для онкологических принципов проведения операции. У большинства больных гипогастральные нервы никак не выделяются, а сливаются с окружающими тканями и представляются в виде тонкой и узкой “полоски”.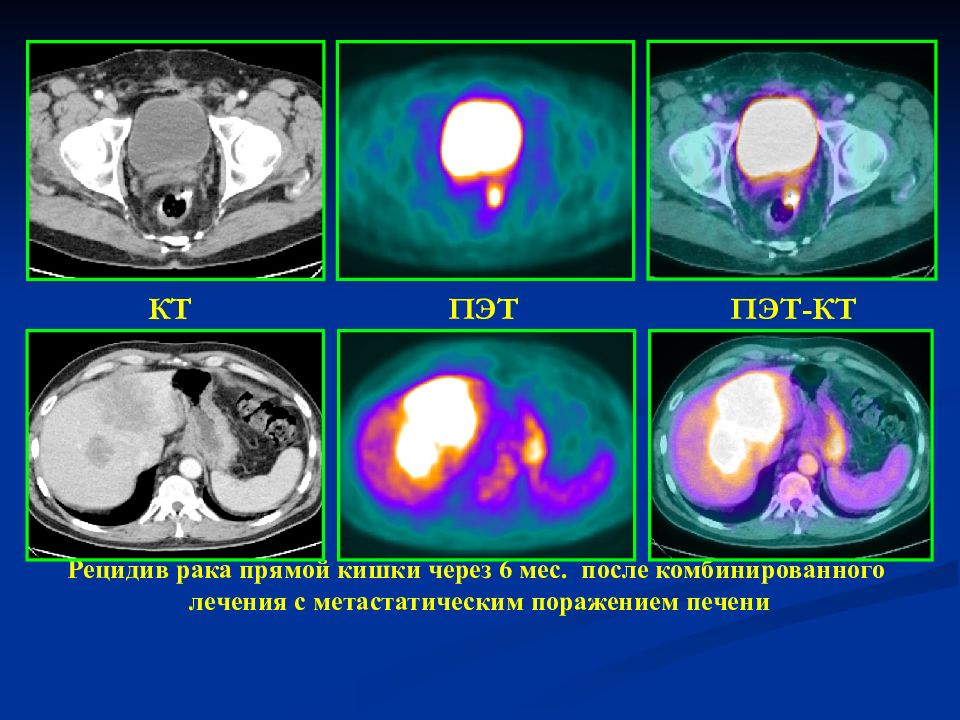 Именно у таких пациентов подчревные нервы могут быть легко повреждены при мобилизации прямой кишки или иссечения мезоректальной клетчатки. Только у трех больных подчревные нервы были представлены хорошо контурирующимися, достаточно толстыми стволами и легко визуализировались.
Именно у таких пациентов подчревные нервы могут быть легко повреждены при мобилизации прямой кишки или иссечения мезоректальной клетчатки. Только у трех больных подчревные нервы были представлены хорошо контурирующимися, достаточно толстыми стволами и легко визуализировались.
При дальнейшей мобилизации прямой кишки, мы старались выделить и визуализировать боковые связки ее (которые пересекаем на зажимах), с тем чтобы в инструмент, вместе со средними прямокишечными сосудами, попали только те веточки нижнего билатерального сплетения, которые направляются к стенке прямой кишки. Ветви идущие к другим органам малого таза, сохраняли с удалением окружающей их клетчатки. В тех случаях, когда раковая опухоль распространялась на окружающие ткани и вовлекала гипогастральный нерв с одной стороны, мы принебрегали им, соблюдая онкологические принципы оперирования и старались сохранить целостность подчревного нерва с другой стороны. Так мы оперировали трех больных.
В тех же случаях, когда опухоль распространяется на окружающие ткани с вовлечением вегетативных нервов таза с обеих сторон, ее следует удалять единым блоком совместно с нервами.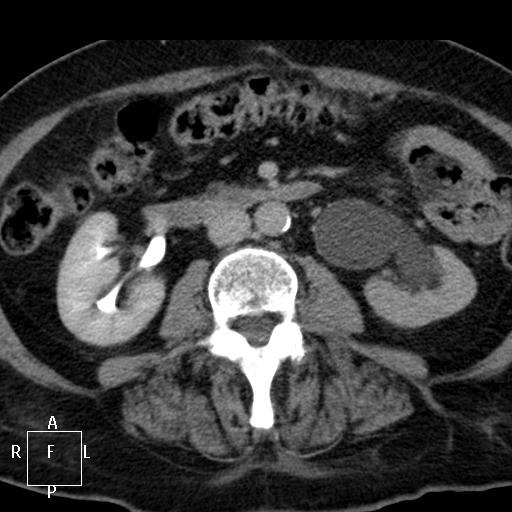
Мочевую функцию оценивали путем расспроса пациентов о характере позывов, частоте мочеиспускания и объеме выделяемой мочи, после удаления мочевого катетера, который вводили на 2 — 4 суток. У 94% больных было свободное, произвольное мочеиспускание сразу после извлечения катетера Фоллея. Пациенты не отмечали разницы в характере позывов, частоте мочеиспускания и объеме мочи, по сравнению с дооперационным периодом. У всех сексуально-активных мужчин сохранилась половая функция.
- Мы представили современное состояние проблемы, связанной с функциональными результатами после операций на прямой кишке при раковом поражении ее.
- Мы не склонны давать категорические рекомендации относительно выбора одного единственного способа лечения, для уменьшения частоты функциональных расстройств после операций на прямой кишке.
- Знание литературы этой проблемы — залог для оперирующих хирургов правильно подойти к выбору нужной тактики в каждом конкретном случае. Однако несомненно, что соблюдение онкологических принципов оперирования нужно иметь в виду прежде всего.
 Далее — всегда следует стремиться к выполнению ССО, если даже для этого придется делать интерсфинктерные резекции ПК. Несомненно, оперирующим на ПК хирургам нужно освоить методику формирования толстокишечных резервуаров и колопластику.
Далее — всегда следует стремиться к выполнению ССО, если даже для этого придется делать интерсфинктерные резекции ПК. Несомненно, оперирующим на ПК хирургам нужно освоить методику формирования толстокишечных резервуаров и колопластику. - Бережное отношение к нервам таза — еще одна забота при операциях на прямой кишке. Это реально, о чем свидетельствуют, как литературные данные, так и наши целенаправленные исследования и результаты проводившихся оперативных вмешательств.
Сложное комбинированное вмешательство (мультиорганная резекция по поводу рецидива рака ободочной кишки, устранение эхинококковой кисты в печени, холицистэктомия) проведено в НМИЦ хирургии им. А.В. Вишневского
Удаление рецидивной опухоли в брюшной полости — задача непростая. Такие опухоли обычно врастают в окружающие органы и крупные сосуды, что делает оперативное вмешательство чрезвычайно трудным или даже невозможным. Если же ситуацию сопровождает ряд других проблем, она осложняется еще больше и способна поставить в тупик и высококвалифицированных опытных специалистов.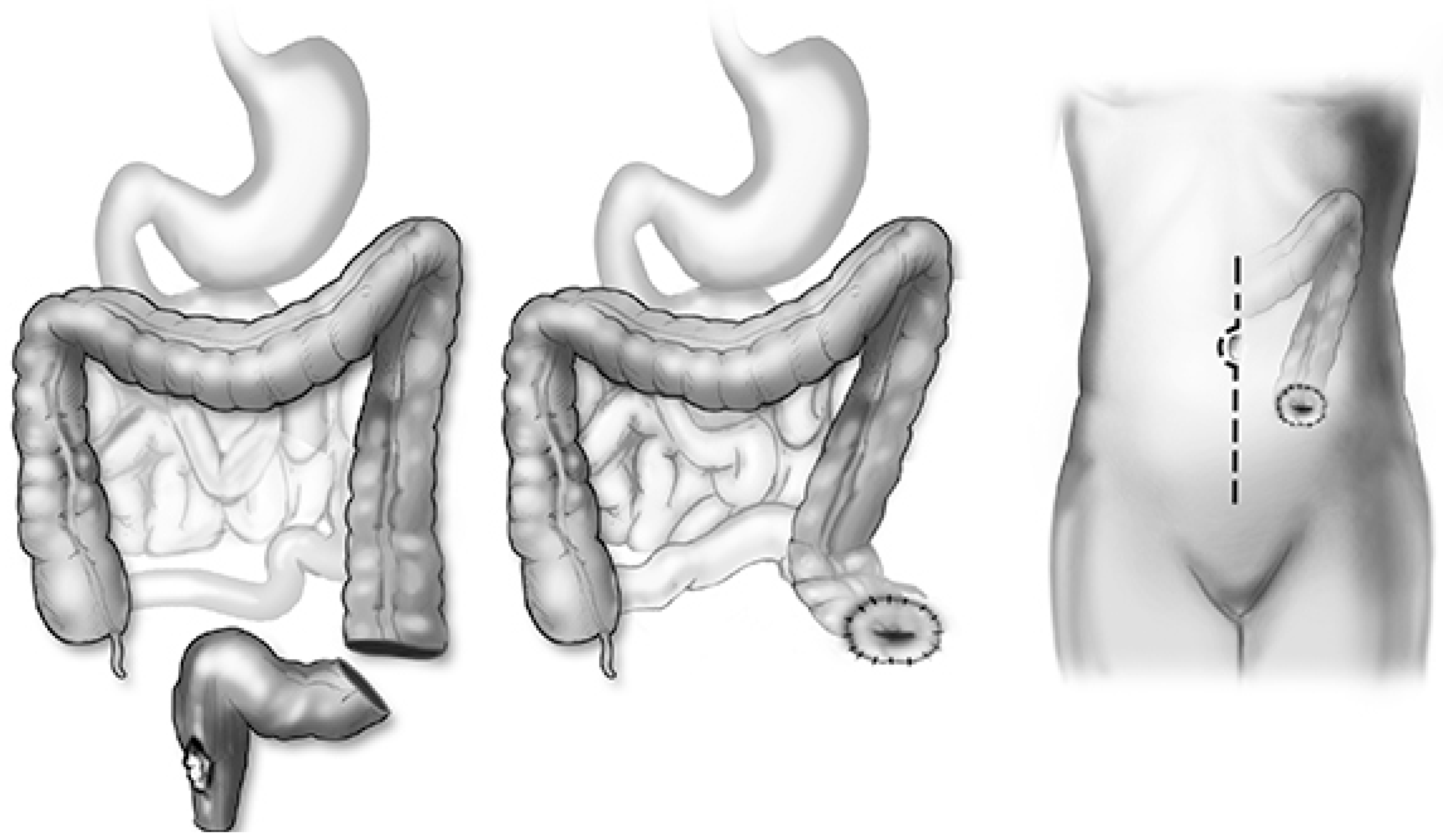
Пациент, диагноз
Пациент 35 лет. Рецидив рака ободочной кишки. Метастатическое поражение печени. Эхинококкоз печени. Желчнокаменная болезнь.
Суть вмешательства
Резекция ободочной кишки и зоны ее соустья с тонкой кишкой в сочетании с резекцией 12-перстной кишки, головки поджелудочной железы и 8-го сегмента печени, широкое удаление окружающих лимфатических узлов. Холицистэктомия. Дренирование остаточной полости эхинококковой кисты в печени.
Как развивались события
Молодой человек 35 лет, живущий в экологически благоприятной среде в сельской местности, был госпитализирован по скорой помощи для ликвидации кишечной непроходимости как угрожающего жизни состояния. В хирургическом отделении выяснилось, что кишечная непроходимость вызвана закрывающей просвет толстой кишки опухолью больших размеров, и ее экстренное удаление потребовало и удаления правой половины ободочной кишки.
Была сформирована колостома (искусственное соустье на передней брюшной стенке), затем на фоне благоприятного течения послеоперационного периода она была закрыта, и сформирован илеотрансверзоанастомоз — соединение тонкой и толстой кишки. Назначенное химиотерапевтическое лечение пациент по каким-то причинам игнорировал.
Назначенное химиотерапевтическое лечение пациент по каким-то причинам игнорировал.
Через 14 месяцев образовалась рецидивная опухоль, которая по данным исследований (КТ и др.) представлялась неудалимой. Она затрагивала не только толстую кишку в зоне выполненной операции, но прорастала в соседние органы: 12-перстную кишку, головку поджелудочной железы. Также были обнаружены метастазы в печени. Один из них имел кистозный характер и располагался в центре печени, в переплетении венозно-артериальных и портальных венозных сосудистых стволов, — это делало трудноосуществимым его удаление или другое воздействие (высокотемпературное, радиочастотное). Ситуация в целом казалась вышедшей из-под контроля.
Пациент самостоятельно обратился в одно из ведущих онкологических учреждений Москвы. Там подтвердили, что имеется не только рецидив опухоли, но и метастазы, один из которых казался подозрительным на паразитарное поражение печени. Поскольку в онкологическом учреждении не принято лечить доброкачественные и неопухолевые изменения, пациенту рекомендовали проконсультироваться в НМИЦ хирургии им. А.В. Вишневского — как в многопрофильном центре, который имеет большой опыт в лечении и онкологических, и доброкачественных поражений печени, поджелудочной железы, ободочной кишки — даже при их распространенности до такой степени, когда это затрагивает смежные органы и окружающие структуры.
А.В. Вишневского — как в многопрофильном центре, который имеет большой опыт в лечении и онкологических, и доброкачественных поражений печени, поджелудочной железы, ободочной кишки — даже при их распространенности до такой степени, когда это затрагивает смежные органы и окружающие структуры.
Как принималось решение
Обследование в НМИЦ хирургии им. А.В. Вишневского выявило наличие рецидивной опухоли, которая проросла в несколько соседних органов, двух мелких метастазов в печени и крупного кистозного образования (около 5 см) – эхинококковой кисты с угрозой разрыва.
Ситуация была чрезвычайно сложная, однако после ее всестороннего анализа и детального обсуждения специалисты Центра хирургии имени Вишневского пришли к выводу, что опухоль имеет ограниченное распространение и при расширенной операции с резекцией нескольких органов удалить ее можно. Они оценили возможности пациента перенести большое вмешательство и приняли решение удалять опухоль с последующим химиотерапевтическим лечением рака ободочной кишки и противопаразитарным лечением эхинококкоза печени.
Пациента госпитализировали и оперировали (через год и три месяца после первого хирургического вмешательства по месту жительства).
Рис. 1. Данные компьютерной томографии. Видна рецидивная опухоль округлой формы и паразитарная киста печени, располагающаяся в развилке ветвей воротной вены.
Риски и особенности ситуации
Случай непростой со всех точек зрения: рецидив злокачественной опухоли, запущенное заболевание, метастазы в печени, эхинококковая киста с угрозой разрыва (если это происходит, сколексы паразита вызывают обсеменение брюшной полости, и вскоре возникают многочисленные дочерние кисты), желчнокаменная болезнь.
Рис. 2. Данные компьютерной томографии. Видна паразитарная киста печени, располагающаяся между нижней полой веной, ее ветвями и стволом воротной вены.
Комментарий хирурга
Д.м.н. Илья Анатольевич Козлов, заведующий онкологическим отделением хирургических методов лечения и противоопухолевой лекарственной терапии:
«Почему рецидив возник так быстро — меньше, чем через год? Возможно, при первой операции опухоль не была удалена полностью. Причины, по которым этого не было сделано, могут быть разными. Одна из них — кишечная непроходимость, баллонообразно расширенные отделы ободочной и тонкой кишки — не позволили хирургам точно определить, насколько опухоль была распространена.
Причины, по которым этого не было сделано, могут быть разными. Одна из них — кишечная непроходимость, баллонообразно расширенные отделы ободочной и тонкой кишки — не позволили хирургам точно определить, насколько опухоль была распространена.
Кроме того, не стоит забывать, что пациент пренебрег рекомендациями врачей о необходимости химиотерапевтического лечения, — вероятно, в силу беспечности, свойственной молодости.
В итоге нам предстояло провести чрезвычайно сложное комбинированное вмешательство. Была выполнена резекция поперечно-ободочной кишки с зоной тонкокишечно-ободочного соединения и рецидивной опухолью, резекция 12-перстной кишки, головки поджелудочной железы, широкое удаление окружающих лимфатических узлов, а также резекция 8-го сегмента печени с дренированием остаточной полости эхинококковой кисты (наличие эхинококкоза было подтверждено во время операции при УЗИ и исследовании содержащейся в полости паразитарной кисты жидкости). Кроме того, мы «попутно» удалили желчный пузырь, потому что во время обследования у молодого человека диагностировали еще и желчнокаменную болезнь.
Рис. 3. Схема выполненной операции.
Что касается метастазов в печени, которые были обнаружены при УЗ-исследовании, то их размер не превышал 0,5 см. Кроме того, они залегали достаточно глубоко и, повторю, были такими мелкими, что попытка получить их гистологическую структуру в процессе операции могла оказаться слишком травматичной, а вмешательство и без того было большим. Для удаления же этих мелких узлов потребовалась бы обширная резекция печени или радиочастотное воздействие, то есть опять же серьезная дополнительная травма. При этом однозначно высказаться в пользу метастатического поражения все-таки было трудно. И все же в таких ситуациях мы обычно идем по пути гипердиагностики, заведомо подозревая метастатическое поражение.
В итоге — с учетом того, что после операции пациент должен был пройти химиотерапевтическое лечение — было принято решение о дальнейшем наблюдении за этими узлами.
Что дальше? Все будет зависеть не только от грамотно подобранной химиотерапии, но и от дисциплинированности и стойкости пациента.
Если узлы редуцируют, то необходимость в их хирургическом лечении отпадет. Если будут увеличиваться в размерах, но новых узлов не появится, может встать вопрос об изменении химиотерапии (вторая линия химиотерапии).
Возможно, понадобится пункционная биопсия, чтобы выбрать таргетную терапию с учетом генетических характеристик этих образований. Если они остановят свой рост, тогда, возможно, будет принято решение об их устранении путем резекции печени или аппаратного воздействия (радиочастотная аблация, криодеструкция).
Повторное хирургическое вмешательство может дать шанс стабилизировать процесс, — удаление метастазов (опять же с последующей химиотерапией) позволяет надеяться в некоторых случаях даже на излечение.
Сегодня у большого числа пациентов мы можем ждать положительного эффекта от сочетания разумной, но в то же время агрессивной хирургии и разумной, деликатной химиотерапии.
Что хотелось бы добавить? В большинстве случаев, особенно вдали от крупных хирургических или онкологических центров, у практического врача возникает желание отказать в радикальном хирургическом лечении таким пациентам в связи с распространенностью опухолевого процесса. С одной стороны, рецидивная опухоль, которая проросла в несколько органов, с другой — наличие метастазов. А здесь ситуация и вовсе необычная — на этом фоне еще и паразитарное поражение печени, не относящееся к онкологии и требующее специфического лечения. Конечно, решение таких разноплановых задач под силу только многопрофильным центрам с серьезным опытом в области хирургии и лекарственной терапии онкологических, доброкачественных и иных поражений.
Но здесь важно еще вот что. У людей, который живут понятиями 20-30-летней давности, существует мнение, что онкологический диагноз – это неизбежная гибель пациента. Но сегодня даже в самой отчаянной ситуации, когда, казалось бы, выхода нет, он может найтись совершенно неожиданным образом. Безвыходных ситуаций не так много даже в онкологии. Надо бороться, и мы не прекращаем борьбы. Однако есть определенные правила, руководства к действию, — если они продиктованы специалистами соответствующего профиля и квалификации, пациент должен их беспрекословно, неукоснительно соблюдать».
Рецидив рака | Диагностика и лечение рецидивов рака
Даже после успешно проведенного лечения злокачественных новообразований остается риск, что болезнь вернется, потому что в организме остались раковые клетки. По статистике, в ¾ случаев в течение 5 лет после лечения случаются рецидивы рака — именно поэтому врачи говорят о ремиссии, а не о выздоровлении. Наиболее опасны ранние, возникающие в течение нескольких месяцев после терапии, — они агрессивны и часто ведут к гибели пациента. Поэтому наблюдение у врача после операции и/или курса химио- и лучевой терапии является обязательным — оно позволяет своевременно заметить ухудшение ситуации и принять меры.
Затрудняет ситуацию то, что при рецидивах рака симптомы могут отличаться от тех, которые были ранее, — только в трети всех случаев обнаруживаются в той же локализации, гораздо чаще страдают соседние органы и ткани. Отличаются и сами симптомы, и их интенсивность. Поэтому необходимы регулярные осмотры, анализы крови для определения уровня РЭА и других онкомаркеров, при подозрении на возвращение проблемы — МРТ, КТ и другие исследования. Они позволяют своевременно принять меры, не давая процессу зайти слишком далеко.
Госпитализация онкологических больных. Ежедневно. Круглосуточно
Нам доверяют 9500 пациентов ежегодно.
Какие виды рака повторно выявляются чаще других
На риск возврата болезни влияет не только локализация на момент лечения — большое значение имеет то, из каких клеток развивалась опухоль, стадия, на которой проводилось лечение, степень дифференциации раковых клеток, а также образ жизни пациента.
Врачи и пациенты сталкиваются с рецидивами рака желудка, легкого, щитовидной или молочной железы, мужчины — простаты, женщины — матки и яичников и др. Общие рекомендации для всех пациентов относятся к образу жизни:
- поддерживать вес в норме или снизить его, если человек страдает от ожирения. Лишний жир снижает скорость обменных процессов, в результате чего вредные вещества дольше находятся в организме, а также оказывают другое негативное влияние;
- заниматься физкультурой — умеренные нагрузки благотворно влияют на физическое состояние и повышают тонус, оказывают положительное воздействие на эмоциональный фон и психологический настрой, которые также важны после лечения;
- отказаться от рафинированных продуктов, снизить потребление сахара и «быстрых» углеводов, увеличить количество клетчатки в рационе, чтобы нормализовать стул и ускорить вывод продуктов жизнедеятельности;
- ограничить потребление алкоголя;
- отказаться от курения, избегать повышенной инсоляции — не посещать солярии, использовать солнцезащитные средства перед выходом на яркое солнце.
Нам доверяют 9500 пациентов ежегодно
Кроме того, есть и специфические рекомендации, связанные с прооперированным органом, которые помогут при раке снизить риск рецидива после операции — в основном они касаются специфических исследований и приема необходимых препаратов.
Рецидивы рака: лечение и прогноз
При повторном выявлении злокачественных опухолей проводятся диагностические мероприятия, чтобы уточнить, они единичные или множественные, это новый первичный очаг или он развился из остатков ранее удаленного, те же ткани стали основой для новообразования или они отличаются от предыдущего случая, в каких органах расположены, объем метастазирования, если он есть и т.д.
Все это влияет на выбор лечебной тактики — если ранее применяемые методики не дали результата, их заменяют другими. Как правило, лечение проводят комплексно, сочетая хирургию, радиотерапию и химиопрепараты, также их могут дополнять иммуно-, гормонотерапия и другие вспомогательные инструменты.
При ранних рецидивах после рака прогноз менее благоприятен, чем при возвращении болезни через год или более — это говорит о более агрессивном течении недуга. Повысить свои шансы на долгую жизнь можно, изменив образ жизни: отказавшись от курения, нормализовав питание и снизив массу тела при ожирении, регулярно давая телу умеренные нагрузки.
Чтобы своевременно среагировать на ухудшение состояния, необходимо регулярно проводить обследование. Все диагностические процедуры и, при необходимости, лечение вы можете получить в Клинике НАКФФ. Телефон для записи +7(495) 023-56-96.
Рецидивы рака прямой кишки и методы их предупреждения Текст научной статьи по специальности «Клиническая медицина»
УДК 616.35-006.6-089-036.87:616-08-059:614.2
РЕЦИДИВЫ РАКА ПРЯМОЙ КИШКИ И МЕТОДЫ ИХ ПРЕДУПРЕЖДЕНИЯ
Представлен анализ историй болезни 40 пациентов с рецидивами рака прямой кишки. Оперативное лечение по поводу первичной опухоли прямой кишки в онкоучреждении (РНИОИ) получили 4 (10,0%) пациента, остальные 36 (90,0%) — в хирургических стационарах общелечебной сети. После операции 23 (57,5% ) больных из 40 были подвергнуты дополнительной терапии: химиотерапии — 16 человек, лучевой — 7. В 10 случаях рецидивы рака возникли в первые 4 — 6 месяцев наблюдения, что позволяет говорить о продолженном росте опухоли и нерадикальности проведенного хирургического вмешательства, при этом все пациенты получили лечение в стационарах общелечебной сети. Стремление к органосохраняющим операциям, определение адекватного объема хирургического вмешательства в каждом конкретном случае должны тщательно оцениваться хирургом. Проведенное исследование показало, что онкологические больные должны быть госпитализированы в профильные специализированные стационары, что определит адекватно тактику лечения и прогноз заболевания.
Ключевые слова: рецидив, рак прямой кишки, оперативное вмешательство, химиотерапия.
Проблема лечения рака прямой кишки продолжает оставаться в центре внимания отечественных и зарубежных онкологов. Во многом это обусловлено ростом заболеваемости раком данной локализации в развитых странах. В 2010 г. в России рак прямой кишки занимал 7 место в структуре онкологической заболеваемости и составил 5% [8]. При этом отдаленные результаты хирургического лечения оставляют желать лучшего, 5летняя выживаемость не превышает 50-55% [4, 7, 3, 14]. Попытки повысить радикальность расширением объема вмешательства (выполнением тотальной мезоректумэктомии и др.) позволили добиться лишь некоторого снижения частоты местных рецидивов [12, 11]. Лечение рецидивных опухолей является одной из проблем современной клинической онкологии. Понятию рецидива опухолей посвящено исследование Франка Г.А. (2006) [13], предлагающего говорить о рецидивной болезни и выделять следующие категории рецидивов: продолженный рост, возобновленный рост, новый рост, локо- регионарное распространение, прорастание соседних органов. отдаленные метастазы в лимфатические узлы и органы. Эти варианты, по мнению автора. имеют существенное значение для оценки прогноза и выбора адекватной тактики лечения. Иммуногистохимические методы, помогая в определении гистогенеза и биологических свойств опухоли, лишь в редких случаях дают возможность уточнить вариант рецидивной болезни. Что касается рака прямой кишки, то частота возникновения рецидивов достигает 45%, и наряду с отдаленными метастазами локорегионарные рецидивы являются одной из главных причин смерти больных [2, 5, 9, 1].
Ведущим методом лечения больных раком прямой кишки, определяющим ближайшие и отдаленные результаты, является хирургический. На сегодняшний день изменилась не только сама техника операций, но и стратегия, и тактика хирургического лечения — органосохраняющая и функционально-щадящая направленность является приоритетной. Скрытое течение болезни, отсутствие яркой манифестации на ранних стадиях заболевания приводят к тому, что 60-80% пациентов с опухолями толстой кишки обращаются за помощью с распространенными, запущенными процессами, а в связи с развившимися осложнениями нередко госпитализируются в хирургические отделения стационаров общего профиля [6]. Схемы лечения в таких стационарах разработаны для пациентов с экстренной хирургической патологией и не всегда учитывают особенности лечения онкобольных, в связи с наступившим осложнением преобладает синдромный подход, а опухоль рассматривается как одна из причин ургентного состояния, требующего экстренного вмешательства. Решение онкологических проблем откладывается на более поздние сроки, что неизбежно затягивает лечение и ухудшает его результаты. Кроме того, в своем стремлении к выполнению ор-ганосохраняющих операций хирурги могут нарушить грань, разделяющую радикальные и нерадикальные вмешательства. Только онколог, обладающий специальными знаниями и профессиональным опытом, может определить адекватный объем хирургического вмешательства в каждом конкретном случае, а затем дополнить его противоопухолевыми методами лечения (химиотера-
О.И. КИТ, Ю.А. ГЕВОРКЯН В.Х. АНАПАЛЯН, В.А. ДОНЦОВ В.Е. КОЛЕСНИКОВ, Д.С. ПЕТРОВ Е.М. НЕПОМНЯЩАЯ
Ростовский
нау**но-исследовател.ъский онкологический институт
e-mail: gevorkyan.ooo @ mail.ru
певтическим или лучевым) в зависимости от степени распространенности процесса, характера роста опухоли и степени ее агрессивности.
Цель работы — оценить некоторые причины возникновения рецидивов рака прямой
кишки.
Материалы и методы. Изучены истории болезни 40 больных раком прямой кишки, обратившихся в 2008- 2009 гг. в поликлинику института по поводу рецидива опухоли. Мужчин было 26 человек, женщин — 14 в возрасте от 40 до 70 лет. Изучены локализация первичной опухоли в прямой кишке, распространенность опухолевого процесса, объемы выполненных оперативных вмешательств, рассмотрены лечебные учреждения, в которых проводилось предыдущее лечение. Проанализированы сроки возникновения рецидивов рака прямой кишки и их лечение.
Результаты и обсуждение. Проанализированы историй болезни 40 больных с рецидивом рака прямой кишки. Частота локализации первичной опухоли в различных отделах прямой кишки представлена в табл. 1. Следует отметить, что рецидивы рака чаще возникали при анальном и нижнеампулярном поражении прямой кишки, что соответствует литературным данным [10].
Локализация опухоли в прямой кишке, абс. ч. ( % )
Таблица 1
Локализация опухоли Число больных (п=40)
Анальныйканал 4 (10%)
Нижнеампулярныйотдел 23 (57,5%)
Среднеампулярный отдел 4 (10%)
Верхнеампулярный отдел 6 (15%)
Ректосигмоидный отдел 3 (7,5%)
Стадии первичного злокачественного процесса представлены в табл.М0
40 13 11 4 2 8 2
(32,5%) (27,5%) (10%) (5%) (20%) (5%)
Как видно из табл. 2, все больные впервые выявлены в Т3, Т4 стадии опухолевого процесса, при этом у 24 пациентов отсутствовали метастазы в регионарные лимфатические узлы. Структура произведенных операций представлена в табл. 3.
Таблица 3
Объем выполненных оперативных вмешательств при первичном раке
прямой кишки, абс.ч. (% )
Виды операций
Количество операций Брюшно-анальная резекция Передне-верхняя резекция Операция Гартмана Брюшно-промежностная экстирпация
40 4 (10%) 9 (22,5%) 4 (10%) 23 (57,5%)
Из 40 больных с рецидивом опухоли оперативное лечение по поводу первичного рака прямой кишки в онкологическом стационаре (Ростовский НИИ онкологии ) проведено 4 (10%) пациентам, остальным 36 (90%) — в хирургических стационарах общелечебной сети. Этот факт уже сам по себе имеет большое значение в плане оценки адекватности проводенного лечения и прогноза течения заболевания.
Так, после операции по поводу рака прямой кишки лишь 23 (57,5%) пациента из 40 подвергнуты дополнительной терапии: химиотерапии — 16 человек и лучевой — 7.
При этом отмечено, что рецидивная опухоль локализовалась внутрикишечно в 14 случаях, внекишечно — у 26 пациентов.
Прослежены сроки возникновения рецидивов у больных раком прямой кишки (табл. 4).
Таблица 4
Сроки выявления рецидивов рака прямой кишки
Число рецидивов Сроки выявления рецидивов (в мес.)
0-3 4-6 7-9 10-12 13-15 16-18 19-21 22-24 25-27 28-30 77 (6, 5 лет)
40 — 10 8 8 4 5 1 1 1 1 1
В течение первого года после лечения рецидивы рака выявлены у 26 (65%) больных и у 11 (27,5%) — в течение второго года наблюдения. При этом из 26 рецидивов, зарегистрированных в первый год после лечения, в 10 (38,7%) случаях рецидивы выявлены через 4-6 месяцев после операции, что позволяет говорить о продолженном росте опухоли и нерадикальности предпринятого хирургического вмешательства. Все 10 пациентов пролечены в хирургических стационарах общелечебной сети гг. Ростова и Краснодара. Объем оперативных вмешательств у этой группы больных был следующим: двум пациентам выполнена брюшно-анальная резекция прямой кишки, четырем — резекция прямой кишки, в четырех случаях — брюшно-промежностная экстирпация прямой кишки. Послеоперационная лучевая терапия ни одному из пациентов не назначалась, адъювант-ную химиотерапию после операции получили лишь три человека.
При анализе группы больных (8 человек), у которых рецидивы выявлены через 7 — 9 месяцев после операции, брюшно-промежностная экстирпация выполнена в трех случаях, брюшно-анальная резекция прямой кишки — у одного больного, у четырех пациентов выполнена резекция прямой кишки. Адъювантную химиотерапию получили четыре человека.
При анализе группы больных с рецидивами в сроки от 10 до 12 месяцев после операции (8 человек) в одном случае была выполнена брюшно-анальная резекция, у двух больных — операция Гартмана, в остальных пяти случаях — брюшно-промежностная экстирпация. Два пациента получили в последующем лучевое лечение, один больной — химиотерапию.
Анализ полученных данных показал, что рецидивы после операции в сроки до одного года были обнаружены у 26 человек, при этом все они были прооперированы по поводу первичной опухоли прямой кишки в хирургических отделениях общелечебной сети.
Больным с рецидивами рака прямой кишки в институте произведены следующие оперативные вмешательства: эвисцерация органов малого таза — в трех случаях, экстирпация прямой кишки после резекции — шести больным и удаление рецидива после экстирпации прямой кишки — шести пациентам. Все больные получили дополнительное лечение.
Проведен анализ четырнадцати случаев, когда рецидивы возникли в сроки от 1 года до 6,5 лет (табл. 4). Из них в 4 случаях пациенты получили комплексное лечение по поводу первичного рака прямой кишки в онкологическом стационаре. У двух больных рецидивы выявлены через 14 и 17 месяцев после экстирпации прямой кишки в отделении общей онкологии, в последующем они получили лучевое лечение в СОД 40 грей и по 4 курса химиотерапии. У двух больных рецидивы возникли, соответственно, через 25 месяцев и 6,5 лет после экстирпации прямой кишки в нашем отделении. Им произведено удаление рецидива с последующим лучевым лечением в СОД 40 грей и шестью курсами химиотерапии по схеме РоНох-6. Остальные десять пациентов пролечены по поводу первичной опухоли прямой кишки в хирургических стационарах общелечебной сети: одному больному выполнена передняя резекция прямой кишки, двум — операция Гартмана, в семи случаях — брюшно-промежностная экстирпация прямой кишки. В этих наблюдениях послеоперационная лучевая терапия проведена одному больному, адъювантную химиотерапию получили четыре человека. По поводу возникших рецидивов рака прямой кишки в институте им произведены следующие оперативные вмешательства: эвисцерация органов малого таза в одном случае, экстирпация прямой кишки — двум больным, удаление рецидива после экстирпации прямой кишки — трем пациентам. Все больные получили химио-лучевое лечение.
Известно, что при выборе объема операции необходимо учитывать помимо стадии процесса форму роста опухоли, т.к. органосохраняющие операции при инфильтративных формах роста вызывают сомнения в радикальности хирургического вмешательства. Стремление к органосохра-няющим операциям , определение адекватного объема хирургического вмешательства в каждом конкретном случае должны тщательно оцениваться хирургом. Назначение комбинированного и комплексного лечения, включающего операцию с использованием противоопухолевых методов лечения ( лучевого и / или химиотерапевтического), определяется прогностическими факторами: распространенностью процесса, характером роста опухоли, гистотипом , степенью дифференци-ровки опухоли, требует специальных знаний и профессионального опыта онколога.
Таким образом, проведенный анализ свидетельствует о том, что онкологические больные на всех этапах противоопухолевого лечения должны быть госпитализированы в профильные спе- циализированные стационары, что определяет адекватность лечения и прогноз заболевания.
Литература
1. Айазбаев, Н.Б. Непосредственные результаты хирургического лечения рака прямой кишки / Н.Б. Айазбаев,Ю.В. Войновский, И.И. Новиков // УП съезд онкологов и радиологов стран СНГ, 5— 7 сентября
2012 г.-Астана, 2012.- С. 176- 177.
2. Полирадиомодификация в комбинированном лечении рака прямой кишки: обоснование, результаты, перспективы /Ю.А. Барсуков [и др.]// Материалы I съезда колопроктологов СНГ. -Ташкент, 2009.-
С.171-172.
3. Сфинктеросохраняющее лечение больных раком дистального отдела прямой кишки в условиях
комплексной терапии /Ю.А. Барсуков [и др.]// УП съезд онкологов и радиологов стран СНГ, 5-7 сентября
2012г.-Астана,2012.- С. 181.
4. Наш опыт лечения рака прямой кишки /Д.И. Демин [и др.]// Современные технологии в онкологии: Материалы У1 Всероссийского съезда онкологов.- Ростов-на-Дону: ЗАО « Книга», 2005.-Т. 1.- С.252.
5. Еропкин, П.В. Внутритазовая химиотерапия с гипертермией в лечении местнораспространенного
рака прямой кишки /П.В. Еропкин, Е.Г. Рыбаков, М.В. Алексеев // Совершенствование медицинской помощи
при онкологических заболеваниях, включая актуальные проблемы детской гематологии и онкологии. Национальная онкологическая программа: Сб. материалов науч.-практ. конф. с международным участием,
29-30 октября 2009 г.-М.:Издательский дом «Кодекс», 2009.- Т.1.- С.161.
6. Местнораспространенный рак прямой кишки — пути улучшения результатов лечения /Д.В. Еры-
гин [и др.]// Совершенствование медицинской помощи при онкологических заболеваниях, включая актуальные проблемы детской гематологии и онкологии. Национальная онкологическая программа: Сб. материалов
науч.-практ. конф. с международным участием, 29-30 октября 2009г.- М.: Издательский дом «Кодекс»,
2009.-
Т.1.- С.18-19.
7. В.М. Ефетов Рецидивы рака прямой кишки /В.М. Ефетов,С.В. Ефетов, О.Н. Черипко // Онкология.- 2006.- Т.8, № 2.- С.176-180.
8. Злокачественные новообразования в России в 2010 году ( заболеваемость и смертность ) / Под
ред. В.И. Чиссова , В.В. Старинского , Г.В. Петровой.- М.: ФГБУ «МНИОИ им. П.А.Герцена»
Минздравсоцраз-
вития России, 2012.-260с.
9. Избагамбетов, Н.А. Анализ комбинированного лечения рака прямой кишки Н.А. Избагамбетов
//Материалы У1 съезда онкологов и радиологов стран СНГ, 1-4 октября 2010г.- Душамбе,2010.- С. 187.
10. Наврузов, С.Н. Ближайшие результаты комплексного лечения нижнеампулярного рака прямой
кишки /С.Н. Наврузов,А.М. Хакимов, С.С. Худоеров // Материалы I съезда колопроктологов СНГ. —
Ташкент,
2009.- С. 126-127.
11. Лимфодиссекция в хирургическом лечении рака прямой кишки /С.Н. Наврузов [и др.]// Коло-
проктология.- 2011. -№ 3 (37) приложение.- С. 80.
12. Роль тотальной мезоректумэктомии в снижении местных рецидивов при раке среднеампулярного
отдела прямой кишки /В.А. Порханов [и др.]// Совершенствование медицинской помощи при онкологических заболеваниях, включая актуальные проблемы детской гематологии и онкологии. Национальная онкологическая программа: Сб. материалов науч.-практ. конф. с международным участием, 29-30 октября 2009г.-
М.: Издательский дом «Кодекс», 2009.- Т.2.- С.24.
13. Франк, Г.А. Рецидивы опухолей. Понятие, сущность, терминология /Г.А. Франк// Рос. онкол. ж. —
2006.- № 3.- С.50- 52.
14. Результаты выполнения мультивисцеральной резекции по поводу местно —
распространенного
рака прямой кишки /И.Б. Щепотин[и др.]// YII съездонкологовирадиологовстранСНГ, 5-7 сентября 2012г.-
Астана,2012.-С.211.
RECTAL CANCER RECURRENCES AND METHODS OF THEIR PREVENTION
O.I. KIT, YUA GEVORKYAN V.H. ANAPALYAN V.A. DONTZOV, V.E. KOLESNIKOV D.S. PETROV E.M. NEPOMNYASCHAYA
Rostov Cancer Research Institute
e-mail: gevorkyan.000 @ mail.ru
Analysis of 40 patients with colorectal cancer recurrence is pre- sented. Surgical treatment for the primary tumor at Rostov Cancer Re- search Institute were performed to 4 (10.0%) patients, the rest of pa- tients 36 (90.0%) received medical care in the surgical hospitals of gen- eral health network. After the operation, 23 (57.5%) of 40 patients underwent adjuvant therapy: chemotherapy — 16 people, radiation — 7. In 10 cases cancer recurrences occurred in the first 4 — 6 months of observation, which suggests a continuation of the growth of the tumor and non-radical surgical intervention, all patients were treated in hospitals
general health network. The desire for conserving surgery, definition of an adequate level of surgical intervention in each case must be carefully
evaluated by surgeon. The study showed that cancer patients needed to
be hospitalized to relevant specialized hospitals, which will determine the appropriate treatment and prognosis. Keywords: recurrence, rectal cancer, surgery, chemotherapy.
Что делать, если химиотерапия не помогает?
Основная причина
Основная и самая частая причина того, почему химиотерапия не помогает, — это генетические изменения в клетке. Как правило, в РФ химиотерапия назначается на основании диагноза и, в некоторых случаях, результатов нескольких генетических тестов на наличие мутаций в опухоли. Этого критически недостаточно для подбора наиболее подходящей терапии для пациента.
В Европе и США пациентам уже давно назначается расширенное молекулярно-генетическое исследование опухоли для определения наиболее эффективной и наименее токсичной терапии. Такое генетическое исследование позволяет определить, какие препараты будут работать конкретно для данного пациента.
Узнайте больше — оформите заявку на сайте, мы свяжемся с вами в ближайшее время и ответим на все интересующие вопросы.
Оформить заявку на консультацию
Когда химиотерапия не помогает?
Онкологические пациенты часто сталкиваются с проблемой, когда химиотерапия не помогает, и рак не реагирует на химиотерапию. К признакам относятся:
- продолжение роста опухоли
- появление метастазов
- возвращение прежних или появление новых симптомов основного заболевания
- другие признаки (рост маркеров, появление асцита/плеврита и др.)
В этой статье вы узнаете, почему химиотерапия не помогает, и получите эффективный способ подбора подходящей терапии. Для того, чтобы правильно построить план по поиску эффективного лечения, нужно понимать возможные причины неэффективности терапии.
Почему не помогла химиотерапия?
Резистентность или невосприимчивость опухоли к химиотерапии может возникать как на первых этапах лечения ввиду недостаточной молекулярной диагностики, так и в дальнейшем, когда опухоль изначально контролировалась теми или иными препаратами, но в дальнейшем перестала отвечать на лечение или начала расти. Резистентность опухолевых клеток — это сложный молекулярный механизм.
Есть несколько возможных причин:
- Гетерогенность опухоли: злокачественная опухоль состоит из субпопуляций клеток с различными генетическими и эпигенетическими свойствами. К сожалению, в процессе химиотерапевтического лечения не всегда удается убить все опухолевые клетки: оставшаяся клеточная популяция приобретает новые мутации, что делает опухоль нечувствительной к предыдущему лечению;
- Опухолевое микроокружение, включающее неопухолевые клетки и внеклеточные молекулы, так же может способствовать резистентности опухоли посредством сложного взаимодействия между раковыми клетками и нормальными клетками;
- Инактивация противоопухолевых препаратов. Взаимодействие между лекарственными препаратами и разными белками может изменять молекулярные характеристики препаратов: опухолевые клетки приобретают резистентность, и активность лекарственных средств снижается;
- Множественная лекарственная устойчивость – это способность раковых клеток выживать несмотря на применение различных противоопухолевых препаратов с различными механизмами действия. Например, раковые клетки способны выталкивать лекарственные средства посредством белков-транспортеров (семейство АВС-транспортеров), таких как Р-гликопротеид, который под воздействием гидролиза изменяет свои свойства и выбрасывает лекарственное вещество во внеклеточное пространство;
- Также при смене клеточной популяции может происходить смена молекулярной мишени опухолевых клеток, что способствует устойчивости в том числе к таргетным препаратам.
Как понять, какое лечение будет эффективным?
Рак — это генетическое заболевание, развивающееся из-за накопления в клетках мутаций. Ключ к эффективному лечению — поиск мутаций в опухоли. Ввосприимчивость опухоли к препаратам определяется по наличию в ней определенных мутаций. Например:
- Мутация в генах BRCA1, BRCA2 говорит об эффективности PARP-ингибиторов, фторпиримидинов при раке молочной железы. При обнаружении мутаций генов BRCA1/2 при раке яичников также возможно применение PARP-ингибитора (Олапариб) в качестве монотерапии пациенток с платиночувствительным рецидивом;
- Активирующие мутации в 7, 9, 20 экзонах гена PIK3CA обнаруживаются почти у 40% пациенток с гормон-рецептор позитивным/HER2-негативным раком молочной железы и у 10% пациенток с тройным негативным подтипом, что определяет резистентность опухоли как к гормональной терапии, так и к химиотерапии. В случае обнаружения мутаций (h2047R, E545K, E542K, N345K и h2047L), могут применяться селективные ингибиторы PI3Ka (с добавлением Фулвестранта в случае гормон-рецептор позитивного рака), что может способствовать, в том числе, преодолению гормональной резистентности болезни;
- Мутации EGFR способствуют гиперактивации тирозинкиназного пути, что создает благоприятные условия для выживания опухолевых клеток немелкоклеточного рака легкого. Однако, для таких пациентов открывается терапевтическое окно в виде применения таргетной терапии с использованием ингибиторов тирозинкиназы EGFR (Гефитиниб и Эрлотиниб). Результаты исследований свидетельствуют о значительном увеличении выживаемости без прогрессирования при использовании данной группы препаратов по сравнению лечением препаратами платины. Мутации Del19 и L858R (реже G719X, L861Q, S768I и др.) являются предикторами чувствительности к терапии ингибиторами тирозинкиназы, а возникновение мутации T790M в гене EGFR является наиболее частой причиной резистентности к проводимой таргетной терапии;
- Семейство генов RAS включает гены KRAS и NRAS. Мутации гена KRAS встречаются в основном во 2 экзоне (12, 13 кодоны) генов KRAS и NRAS, однако, так же описаны в 3 (61 кодон) и 4 экзонах (117 и 146 кодоны) служат предикторами резистентности опухоли к анти-VEGF-терапии у пациентов с колоректальным раком. Реже и, в основном, у пациенток старшей возрастной группы с заболеванием восходящей ободочной кишки, встречается мутация гена BRAF V600, ассоциированная с более агрессивным течением заболевания. Для таких пациентов необходимо добавление к стандартной терапии ингибитора BRAF-киназ Вемурафениба;
- В настоящее время, назначение иммунотерапии возможно вне зависимости от локализации и морфологического подтипа опухоли. Пациенты с высоким показателем микросателлитной нестабильности (MSI-High) или с дефицитом коррекции неспаренных оснований (dMMR/mismatch repair deficiency), пациенты с высокой мутационной нагрузкой или TMB-high (Tumor Mutation Burden), а так же пациенты с мутацией гена NTRK выигрывают от назначения иммунотерапевтических препаратов.
Для того, чтобы найти все возможные мутации, проводится расширенное молекулярно-генетическое исследование опухоли.
Если пациенту не проводилось расширенное генетическое исследование, или проводилось не в полном объеме, то заранее определить эффективность назначенного лечения нельзя.
Именно поэтому часто назначенная химиотерапия не работает.
Как найти правильное лечение?
Чтобы узнать, какая терапия подходит именно в вашем случае, необходимо проанализировать несколько сот генов опухоли на наличие мутаций. Для этого проводится комплексное генетическое исследование опухоли ONCOGENOTEST. Исследование позволит понять, какие препараты будут работать для данной опухоли, а какие будут неэффективны и даже токсичны.
Какое лечение возможно, если химиотерапия не помогла?
Исследование ONCOGENOTEST анализирует эффективность препаратов всех типов лекарственной терапии: химиотерапии, таргетной терапии и иммунотерапии. Например, эффективным может оказаться:
- Химиотерапевтическое лечение для 2-й и последующих линии терапии, подобранное на основании индивидуальной чувствительности опухоли по результатам расширенного генетического исследования опухоли
- Таргетная и иммунотерапия на при нахождении биомаркеров эффективности таких препаратов
Эффективность данного подхода показана на примере частых, в последнее время, включений в стандарты лечения подходов, ранее доступных только для персонализированной онкологии:
- Последние рекомендации по лечению распространенного рака почки, где уже на первой линии могут быть применены сочетание препаратов таргетной и иммунотерапии (Акситиниб + Пембролизумаб)
- Внедрение в лечение плохо поддающихся химиотерапии опухолей мочевого пузыря иммунотерапевтическими и таргетными препаратам (недавнее одобрение в развитых странах препарата Бельверса для отобранных генетическим тестированием групп пациентов)
- Рекомендации в развитых странах для диагностики и лечения рака поджелудочной железы — считается необходимым расширенное молекулярно-генетическое исследование уже при первичном обследовании (ASCO 2020)
Как заказать генетическое исследование опухоли?
Для того, чтобы заказать исследование ONCOGENOTEST, необходимо:
- заполнить заявку на сайте https://oncogenotest.com/form
- предоставить генетический материал опухоли
Исследование выполняется в течение 24 рабочих дней.
Что является результатом генетического исследования опухоли?
По результату исследования ONCOGENOTEST вы получаете отчет, в котором будет перечислены списки эффективных, неэффективных и токсичных препаратов, а также клинические испытания, в которых пациент может принять участие.
У меня есть вопросы, кто может ответить?
Обратитесь за бесплатной консультацией в ONCOGENOTEST
Источники
Mansoori B, Mohammadi A, Davudian S, Shirjang S, Baradaran B. The Different Mechanisms of Cancer Drug Resistance: A Brief Review. Adv Pharm Bull. 2017;7(3):339-348. doi:10.15171/apb.2017.041
Xing Ke, Lisong Shen Molecular targeted therapy of cancer: The progress and future prospect. Frontiers in Laboratory Medicine, Volume 1, Issue 2, 2017, Pages 69-75, ISSN 2542-3649, doi:10.1016/j.flm.2017.06.001
Удаление ворсинчатой опухоли прямой кишки, кишечника в Нижнем Новгороде
Доброе утро. Я проходила обследование 10.06.2021г.у докторов Серебрякова Е.Ю. и Третьяковой К.Ю. Хочу выразить огромную благодарность докторам. Евгений Юрьевич делал мне обследование ФГДС. Я очень сильно боялась данной процедуры. Но обследование было проведено на высоком уровне, с филигранной точностью, у меня было ощущение, что обследовали каждый миллиметр желудка. Далее была на приеме у гастроэнтеролога Каролины Юрьевны. Доктор очень внимательно, тщательно провела осмотр, установила картину болезни и назначила лечение. Я только 2 день принимаю назначенные лекарства, а боль из желудка ушла. Это специалисты высокого уровня!!! Низкий поклон вам в вашем благородном, нелегком труде!!!!
Елена Александровна
Всем Добрый День. В декабре месяце 20 года в ГБУЗ Республики Мордовия «Республиканская клиническая больница № 5» Поликлиника №3 в эндоскопическом отделение при проведении видеоколонскопии был обнаружен в кишечнике полип. По рекомендации лечащего врача, обратилась в Региональный центр эндоскопии Нижний Новгород по электронной почте. Ответа долго ждать не пришлось. Врач, Митраков Александр Анатольевич, прислал приглашение в Региональный центр эндоскопии. В связи, с эпид обстановкой, встречу перенесли на весенний период. В начале мая запланировали встречу и Региональный центр эндоскопии прислал полный поэтапный перечень действий для подготовки к операции. 18 мая 21 года к 8.00. часам, как было и назначено, прибыли в Региональный центр эндоскопии. Операция назначена на 9.00. часов. Приёмные покои Регионального центра изумительно чисты. Удобные и мягкие кресла для спокойного отдыха сопровождающих, звучит тихая музыка. Для сопровождающих предлагают чай, кофе, всё спокойно с уважением. Сестра — администратор Мария приглашает к приёму медицинских документов вежливо, отвечает на вопросы спокойно, успокаивает, заметив волнения. Ровно в 9.00. пригласили на операцию. Предварительная беседа с врачом — анестезиологом Дядюра Сергеем Олеговичем, Митраковым Александром Анатольевичем в лёгкой приятной форме, затем сама операция. После операции, врач предлагает отдохнуть и получить результаты, рекомендации по диете и приглашение в дальнейшем на консультацию. Всё спокойно и с большим уважением к своему посетителю. От всей души огромное спасибо доктору Митракову Александру Анатольевичу, анестезиологу Дядюра Сергею Олеговичу за высокий профессионализм и искреннее доброе внимание. Благодарю сестер Маскову И.В., Рябинчук О.А. и сестру — администратора Марию за заботу и доброе отношение. Дай Вам БОГ ЗДОРОВЬЯ, СЧАСТЬЯ и УДАЧИ в Ваших начинаниях. Благодарю Вас. Если есть у кого проблемы в этой области, РЕКОМЕНДУЮ посетить Региональный центр эндоскопии Нижний Новгород. С Уважением, Муравьева Н. Б. г. Саранск 22.05.2021г.
Нелли
Приехала в этот центр по рекомендации своего врача местной поликлиники. До этого была в двух мед. учреждениях, где четких разъяснений не получила по своему диагнозу и в сомнениях ушла без решения проблемы. В этом центре администратор по телефон подобрала удобное время приема сразу к двум специалистам (гастроентеролог и эндоскопист). Доктор Кряжов В.А. вежливо выслушал мои жалобы, вопросы и дал четкое объяснение диагноза, доктор Михайлова Я.В. дала рекомендации по диагнозу с воспалением поджелудочной железы, объяснила все результаты обследований и дала рекомендации на длительный период. Записалась на удаление полипа именно сюда. Выражаю благодарность за профессионализм и компетентность врачам и администраторам данного центра!
Мария
Посетила данную клинику по рекомендации знакомых и не пожалела. Персонал очень приветливый, придя туда, понимаешь, что все будет хорошо и обследование будет сделано на высшем уровне, и что с пациентами работает команда профессионалов! Хочу поблагодарить всех сотрудников клиники, которые провели мне комплексное обследование.
Наталья
Искала врача — женщину, чтобы с опытом работы и хорошими отзывами. Мне посоветовали знакомые Смирнову из нижегородского онкодиспансера, но там она в декрете, а работает сейчас 2 раза в неделю только в региональном центре эндоскопии. Так я попала к ним на Ямскую. Клиника в интересном стиле, какая-то восточная тема. Очень чисто, красиво, удобный диван, расслабляющая музыка, улыбчивая девушка-администратор. Саму процедуру не помню, поскольку делала во сне, поэтому помню разговор с врачами и медсёстрами, вкусный кофе после пробуждения (это невероятно кстати было) и радость от того, что я решилась и прошла обследование. Спасибо персоналу за отношение, доктору за подробный рассказ о состоянии моего кишечника, о дальнейшей тактике лечения. Оказалось всё не так страшно, как я себе напридумывала. 😀 Рекомендую клинику, всё грамотно, душевно и с большим вниманием, готовностью ответить на все вопросы и во всем помочь. Браво!
Светлана
Хочу поблагодарить Бушуева Романа Сергеевича и всех сотрудников,которые провели мне комплексное обследование под седацией. Я очень переживала,но результат меня порадовал. В дальнейшем буду проверять здоровье у вас и рекомендовать знакомым.
анна
Хочу выразить благодарность коллективу центра. Была назначена колоноскопия, очень переживала как пройдет, долго настраивалась, но по приходу в ваш центр, все страхи ушли. Спасибо эндоскописту Бушуеву Роману Сергеевичу и всей его команде квалифицированных специалистов за проведенную работу. Администраторам Марии и Анастасии за внимание и поддержку.
Раиса
Здравствуйте. Хочу выразить огромную благодарность коллективу Центра. Не в первый раз обследуюсь именно в этом Центре. Перед первым обследованием долго выбирала между различными клиниками Н.Новгорода, сейчас уверена,что мой выбор был правильным. Я очень рада,что попала в надежные руки! Послеоперационное обследование проводили врач-эндоскопист Евгений Юрьевич Серебряков, врач-анестезиолог Сергей Олегович Дядюра, медсестры Екатерина Гуськова (анестезия) и Ирина Москова (эндоскопия). Действительно, профессионалы высочайшего класса! Грамотно, уверенно и очень спокойно они проводят все манипуляции. Им хочется доверять. Современное медицинское оборудование позволяет проводить обследование на самом высоком уровне! А доктор Серебряков очень подробно и понятно разъяснит результаты, ответив на все вопросы. А ведь точное обследование — залог дальнейшего успешного лечения. Эта прекрасная команда медиков умеет создать комфортный психологический настрой пациенту, что очень важно для нас, наверное, позитивный настрой больного человека тоже способствует скорейшему выздоровлению. И спасибо огромное администратору Центра Наталье Аузяк. Она первой встречает пациентов, принимает телефонные звонки. Отзывчивая и доброжелательная, всегда поможет решить проблему! Спасибо вам всем огромное! Вы классные! Желаю всем вам доброго здоровья, личного благополучия и всего самого наилучшего! С огромным уважением,Ольга Смирнова.
Ольга Смирнова
Отзывы пишу не часто, но тут просто не могу не поделиться, вдруг кто-то тоже в постоянном поиске. Много букв)) Как же я рада, что выбрала именно этот центр, чтобы сделать комплексное обследование! (колоноскопию и гастроскопию). С самого начала очень понравилась атмосфера, интерьер, даже сайт. Приятные цвета, удобно и понятно. Для меня это важно, обострено психическое восприятие. Ведь то, что нас окружает — отражение внутреннего. Милые девушки на ресепшн, всё красиво обустроено, восточная тематика, я бы даже сказала уютно, располагает не нервничать). Люблю японскую культуру и их подход ко многим вещам. Очень впечатлило, что доктора центра проходят повышение квалификации заграницей, постоянно обучаются новому, развиваются. Перечитала на сайте все статьи))) У меня достаточно непростая ситуация со здоровьем, столько клиник за этот год перепробовала, и всё не то. Седацию делать нельзя, поэтому готовилась к обследованию в сознании, немного страшно было, конечно. Но когда увидела доктора — Кряжова Владимира Алексеевича, сразу даже полегчало)) добрый, отзывчивый, грамотный человек, огромное спасибо ему за поддержку и понимание! Сам кабинет удобный, одноразовое белье, приглушенный свет, подушечка, всё как нужно. Я задавала очень много вопросов по своей проблеме и не только, хотелось побольше узнать от опытного специалиста, раз уж такая возможность была) Поразило то, как доктор ворочал этим шлангом с кнопочками и колёсиками, будто на каком-то инструменте виртуозно играл 😀 Поскольку наркоза не было, я старалась отвлечься как могла) но на самом деле не так страшно, как казалось. Владимир Алексеевич всегда предупреждал, когда будет неприятно (на поворотах кишки). Поскольку я достаточно худенькая, чувствовалось сильнее. Но в общем процедура терпимая, когда от нее зависит твоя жизнь, здоровье…темболее когда доверяешь её проведение профессионалу своего дела и хорошему человеку! При случае несомненно буду рекомендовать, особенно родным, бабушкам и дедушкам в возрасте. С таким подходом к пациентам, как в Региональном центре эндоскопии, совсем нечего бояться. На счет цен — хоть и немного дороже, чем в некоторых других клиниках, но для меня главное, помимо достоверных результатов — это человечное отношение и то настроение, которое остаётся после приёма. Спасибо всем работникам, докторам, которые выбрали этот непростой путь! Процветания центру! От Души благодарю
Марина
Добрый день всем! Когда врач мне назначил комплексное обследование (ФГС+колоноскопия) я пришла в ужас, честно говоря было ОЧЕНЬ страшно! Две недели переживала и собиралась с мыслями. Выбрала все же процедуру под седацией в клинике Региональный центр эндоскопии, и не пожалела ни разу! Выбирая специалиста клиники ознакомилась с его высокой квалификацией, с отзывами, посмотрела видео, и решилась — Гагаев Роман Андреевич. Осталось очень довольная доктором и всем коллективом бригады врачей которые со мной работали. Все специалисты корректные, не было ни стеснения, ни боязни. Специалисты все рассказали, поддержали. Проснувшись от процедуры не было никаких неприятных ощущений, все классно! Наверное сказать спасибо, это ничего не сказать! Побольше бы таких молодых высококвалифицированных специалистов — профессионалов. Огромное спасибо вам — Роман Андреевич! Также хотелось бы сказать огромное спасибо врачам, которые со мной работали: анастезиолог — Дядюра Сергей Олегович, и анестезистка Ольга Рябинчук — все профессионалы, оказывали поддержку. Тем, кто сомневается делать или не делать такую процедуру, скажу так — обязательно сделайте!
Елена
Посетила эту клинику впервые, долго выбирала , и не пожалела о своем выборе. На ресепшен, администратор центра Мария, профессионально разъяснила порядок проведения обследования, ответила на все заданные вопросы, помогла с оформлением документов. Процедура обследования и операция (удаление полипов в кишечнике), по моему мнению, прошли идеально. Врачебный персонал Серебряков Евгений Юрьевич (эндоскопист), Дядюра Сергей Олегович (анестезиолог), медицинские сестры Маскова Ирина и Гуськова Екатерина профессионалы высокого класса. Перед проведением процедуры анестезиолог Сергей Олегович задавал вопросы, чтобы иметь полную «картинку» моего состояния. После этого, со мной беседовал Евгений Юрьевич, который внимательно выслушал меня и доходчиво объяснил, как будет проходить обследование. Очень внимательны мед.сестры, особенно хочу отметить Гуськову Катюшу. Очень благодарна Врачу(с большой буквы) Серебрякову Евгению Юрьевичу. Мы с мужем решили, что через пару месяцев он тоже пройдет комплексное обследование в вашей клинике у Врача Серебрякова Е. Ю Вот прошло уже три дня, чувствую себя превосходно! Спасибо огромное! .
наталия 68лет
Добрый день! Хочу выразить огромную благодарность Смирновой Раисат Саидовне за ее труд! За ее трепетное отношение к пациенту! За ее легкую руку, делала колоноскопию у неё уже 4 раз! Первые три раза делала в онкодиспансере без медикаментозного сна, на четвёртый решила попробовать во сне! Отличный доктор! Хорошие результаты, очень благодарна за консультацию и перед процедурой! Помогла, посоветовала лекарство для очищения кишечника! Если бы все врачи были такие, поверьте, можно было бы до многого и не доводить! А раньше узнавать о своих проблемах! Всем здоровья! Раисат Саидовна, спасибо вам от всей моей семьи!
Оксана
Моя мама сегодня проходила обследование в вашей клинике и попросила меня передать слова благодарности за чуткое отношение и поддержку. Она не «дружит» с компьютером в силу возраста, но после выхода из наркоза от рассеянности забыла всё и не смогла поблагодарить своего врача Кряжова Владимира Алексеевича и его помощников за то, что деликатно и очень доброжелательно провели процедуру. Спасибо Вам, доктор! Процветания и побольше благодарных пациентов, и конечно, крепкого здоровья всем. С уважением, Анна Михайловна
Анна
08/01/2021 делала эндоскопию у врача Киргинцевой Елены Анатольевны. врач «прибежала» на работу без 10 минут 9. буквально через 5 минут меня вызвал врач. я пришла в данную клинику т.к. у меня болел желудок, боли прошли , но я хотела выяснить по какой причине они у меня были. Елена Анатольевна провела мне процедуру. скажу так, есть врачи которые непосредственно ведут диалог с пациентом. Елена Анатольевна просто сделала свое дело и выписала мне заключение. я сама уточнила, что мне принимать , если будут боли, врач выписала Омез. далее прихожу домой. ничего не кушаю. у меня болит всё. просто сильнейшие боли в желудке, отрыжка идет, я не могу ни ходить , ни сидеть, ни лежать, так как очень сильно болел желудок. мое тело всё тряслось. со слезами на глазах я пришла в аптеку , где фармацевт ужаснулся увидев меня и услышав мою историю. фармацевт связался с другим фармацевтом и решили, что мне поможет Алмагель А. к вечеру у меня поднялась температура к 39. ночь прошла. утром я встаю. у меня до сих пор отрыжка воздухом!! хотя я ничего не кушала и подобного у меня никогда не было. температура 37,5. позвонила в клинику. со мной мой врач Елена Анатольевна не связалась. со мной связался Митраков Александр Анатольевич. после он меня принял. спасибо большое , что нашли время и меня осмотрели. также врач со мной постоянно на связи! очень благодарна Александру Анатольевичу. повторно фгдс я отказалась делать, так как у меня боли до сих пор. моё мнение это непрофессионализм врача Киргинцевой Е.А. . Вопрос , почему до сих пор у меня идет отрыжка?! я считаю, что у меня скопился воздух в желудке и он распирает стенки желудка. от этого у меня сильная боль. за такую процедуру я отдала в сумме 3.500тр. и еще помимо этого я лечусь покупаю лекарства после данной процедуры. хотя я шла в клинику, чтоб меня обследовали, мое здоровье. а получилось , что плюсом меня еще и покалечили! У меня до сих пор температура держится 37,5 , отрыжка идет (я ничего не кушаю), боли в желудке. Почему я должна отдавать такие деньги за некачественно проведенную процедуру ? Почему мой врач Елена Анатольевна не связалась со мной ? Почему у всё еще отрыжка? Александр Анатольевич со мной на связи за что я ему благодарна! .
Гончарова Ольга
Мой выбор врача и клиники оправдал все мои ожидания.Я очень долго собиралась сделать комплексное обследование,но меня пугала и подготовка к обследованию,и сама процедура,т.к. начиталась в интернете всяких»страшилок»,но на сайте всё было подробно описано и девочки администраторы несколько раз перезванивали,уточняли всё ли понятно и может есть какие вопросы.У меня подготовка прошла хорошо,никаких негативных последствий я не испытала.Доктора я выбрала, Митракова Александра Анатольевича,ознакомилась с его высокой квалификацией,с отзывами,с его научными работами,и решила пойду только к нему.Моя интуиция меня не подвела,ни в выборе клиники,ни в выборе врача,это ДОКТОР ,таких сегодня единицы. Огромное спасибо вам Александр Анатольевич!!! Приветливая администратор встретила и проводила меня к Александру Анатольевичу,который подробно расспросил меня о моих жалобах,просмотрел анализы,рассказал,как будет проходить обследование.Я очень сильно боялась,меня просто трясло от страха,он меня успокоил,заверив,что всё пройдёт хорошо,Потом со мной побеседовал,расспросил,успокоил, анестезиолог Дядюра Сергей Олегович и передал меня в руки замечательным медсёстрам Елене и Ирине,которые тоже меня очень поддержали своей чуткостью и добрым отношением ко мне,огромное им спасибо.От страха у меня подскочило давление,ввели препарат,чтобы нормализовать давление,и я очень мягко и незаметно погрузилась в сон.Всё обследование прошло хорошо.Негативных ощущений после процедуры не было,как будто я просто поспала и всё.Оказались все мои страхи напрасны, я попала в отличные профессиональные руки мед.персонала! После процедуры Александр Анатольевич мне всё рассказал и выдал заключение о проведённой диагностике. Я обязательно буду рекомендовать ваш центр всем своим друзьям и знакомым,которым потребуется такое обследование.Желаю Вам,Александр Анатольевич,и вашему центру новых достижений в вашей деятельности. С благодарностью,Галина Геннадьевна.
Галина Геннадьевна
Хочется сказать очень чуткому и внимательному врачу Бушуеву Роману Сергеевичу. Ранее была у него на обследовании в другой клинике, но поскольку теперь он работает здесь — записалась и пришла к вам. Врач уже 3 года назад увидел пусть очень маленький, но всё же не совсем хороший полип, который не увидели в районной поликлинике. Хорошо, что чувствуя неладное и сходила перепровериться, в результате Роман Сергеевич удалил всё вовремя и без последствий. В этот раз к счастью, всё хорошо, доктор искренне меня поздравил! Всем рекомендую и доктора, и клинику. Ничего не бойтесь, отношение тут как с ребёнком, никакого дискомфортно, по-доброму так, аж жить хочется. Всех благ! Теперь я спокойно и без переживаний встречу Новый год. Надеюсь у всех он будет лучше, чем этот. С наступающим!)
Татьяна В
В ноябре 2020 года я приехала на госпитализацию из Саранска, меня разместили в комфортных условиях, затем была проведена операция по удалению полипа в желудке. Хочется выразить благодарность Митракову А. А. и всему медицинскому персоналу за профессионализм, внимательное отношение к пациенту. Операция прошла успешно благодаря их мастерству. Огромное спасибо!
Екатерина Четвергова
Добрый день! Спасибо за информацию. Моя жена Татьяна Николаевна Булах выражает благодарность врачу Серебрякову Евгению Юрьевичу за проведённые исследования (гастроскопия и колоноскопия). Перед обследованием врач побеседовал с ней, а после обследования всё подробно разъяснил по результатам исследования. Ещё спасибо врачу — анестезиологу Дедюре Сергею Олеговичу, очень доброжелательный и внимательный. С уважением, семья Булах.
Анатолий Булах
Обратилась в Региональный Эндоскопический центр в октябре 2020 года по вопросу удаления полипов кишечника.Огромное спасибо всем ! Хочется выразить благодарность милейшей девушке консультанту Наталье,которая несколько раз звонила,все подробно объясняла,интересовалась самочувствием,напоила чаем.И ,конечно же,низкий поклон самому маэстро-доктору ! Кряжову Владимиру Алексеевичу!Внимательный,тактичный,все четко и подробно объяснил. Удивлена и потрясена,что встречаются у нас еще такие врачи. Успехов и процветания вашей клинике! Держитесь,Господа!(насколько это возможно,в это непростое время) Обязательно приеду весной.
Анна
В октябре 2020 года проходила комплексное обследование под седацией. Уважаемая Нина Николаевна! Благодарю Вас, как руководителя «Регионального центра эндоскопии», создавшего замечательное медицинское учреждение, в котором чувствуешь себя очень комфортно с первой минуты пребывания и до окончания обследования. Грамотно подобранный Вами персонал сделал Ваш центр одним из лучших в городе. Хочу выразить благодарность Вам за большое мастерство, высочайший профессионализм и теплую атмосферу, которая живет в Вашем центре. Желаю Вам и Вашему коллективу крепкого здоровья, энергии, огромных успехов и радости, чтобы у Вас хватило сил делать добро как можно дольше. Мое спасибо Вам, искреннее, огромное, от чистого сердца! С уважением, Лемзякова С. Ф.
Лемзякова С.Ф.
Посещаю Региональный Центр Эндоскопии уже не в первый раз,и остаются только положительные впечатления, доброжелательные и тактичные Администраторы на рецепции, и что действительно, важно грамотные и внимательные Врачи. Приём проводят в точно назначенное время. Этот медицинский центр с уверенностью можно рекомендовать своим близким и знакомым.
Елизавета
Проходила ФГДС у Серебрякова Е.Ю. в июне 2020. В клинике чистенько и уютно. Врач перед осмотром всё спросил, уточнил, что беспокоит и что было на предыдущих обследованиях. Заморозил тщательно горло (я проходила ФГДС без наркоза), всё рассказал о том как будет проходить процедура, далее проводил на саму процедуру. Так как мне есть с чем сравнивать, у меня за плечами с десяток ФГДС, могу сказать, что врач делает саму процедуру хорошо, что немаловажно, во время всей процедуры не молчит, говорит что и как делать, разговаривает с пациентом))) смотрит тщательно и аккуратно. После процедуры врач рассказал, что увидел при обследовании. Единственное, что мне осталось непонятным при выявленной атрофии почему то не взяли биопсию.
Екатерина
Хорошая клиника. Очень доброжелательный персонал. Врачи с отличной практикой, всё объясняют подробно.
Мария
22 июня был на ФГДС в данном центре. Прошло все спокойно и без болезненно. Встретили, все объяснили, проводили к доктору Серебрякову Евгению Юрьевичу, он все объяснил дословно, что и как будет проводится. После отвели к анестезиологу, поговорили с ним(к сожалению не запомнил ФИО анестезиолога). Дальше вступил в работу медперсонал, все сделали и уложили аккуратно. Потом засыпаешь и просыпаешься. Провели к месту отдыха, напоили чаем с печеньками и отправился домой. После нескольких дней был на приеме у гастроэнтеролога Михайловой Я.В. она все объяснила и разжевала на доступном мне языке. Мне все понравилось в этом центре. Огромное человеческое спасибо всем.
Александр
20 июня 2020 года проходил комплексное обследование у Кряжова Владимира Алексеевича. Врач очень приятный, впрочем как и весь коллектив. Раньше слышал об подобных процедурах не самые приятные отзывы, поэтому решил довериться только опытному коллективу Регионального Центра Эндоскопии и только под внутривенной седацией (наркозом). Прошло как в сказке. Тебя выключили — включили и все готово. И что самое главное не каких болезненных ощущений. Желаю всему коллективу здоровья и семейного благополучия.
Денис
16 мая мне удаляли очень большой полип в сигмовидной кишке..Принимал меня доктор Кряжов Владимир Алексеевич.Симпатичный ,внимательный ,обходительный молодой человек всретил меня у рицепшен. Операция прошла благополучно ,за что очень благодарна и доктору Кряжову Владимиру Алексеевичу и всем медицинским работникам ,которые вокруг меня суетились. После операции напоили чаем ,дали соответствующие рекомендации и документы,проводили до выхода. Приглашали на консультации. Хочу сказать по поводу самого центра.Красиво оформленное помещение, вежливая девушка на рецепшен поднимают настроение. Что меня удивляет,это то что все анализы,все справки и другие документы на операцию,я послала по электронной почте. Доктор познакомился с моими документами и по телефону назначил день и время операции. Когда я приехала к назначенному времени ,меня в центре уже ждали. Еще раз благодарю всех работников регионального центра эндоскопии за вашу работу и желаю всем ЗДОРОВЬЯ,ЗДОРОВЬЯ и ЗДОРОВЬЯ, С уважением Зуева Людмила Николаевна г.Кулебаки Нижегородской области
Людмила
Делал в субботу комплексное обследование у Владимира Алексеевича Кряжова.Все прошло замечательно-большое спасибо всему персоналу за такое доброжелательное отношение к своим пациентам.
Сергей
Клиника очень понравилась!!! Я делала комплексное исследование (ФГДС и колоноскопию) под седацией. Все прошло отлично! Хочу выразить огромную благодарность врачу Киргинцевой Елене Анатольевне и всем специалистам которые были возле меня. Все приветливые, мастера своего дела, профессионалы! Я очень боялась и переживала перед этой процедурой, но оказалось напрасно. Я уснула, а проснулась уже после всех манипуляций. Я буду рекомендовать данную клинику друзьям и родным, ведь здоровье всего дороже!!! Спасибо БОЛЬШОЕ всему персоналу.
Яна , 36 лет
Посетила эту клинику впервые, и ни разу не пожалела о своём выборе. Записалась на не очень приятную процедуру (как мне казалось изначально) гастроскопию и колоноскопию под медицинским наркозом, но потом моё мнение изменилось в лучшую сторону, благодаря приветливым врачам и персоналу. Всё прошло идеально, от записи на приём до фразы до свидания. Расскажу с самого начала. При входе в клинику сразу переключаешься на душевный и спокойный лад, всё очень чисто, аккуратно и по-домашнему. Приветливая и лучезарная администратор Юля сразу всё рассказала и проводила к врачу Серебрякову Евгению Юрьевичу. Доктор подробно расспросил о моих жалобах, просмотрел все имеющиеся анализы и ранее сделанные исследования, подробно рассказал, как будет проходить моя процедура. После беседы с ним, мои страхи просто исчезли. Затем я отправилась в кабинет, где меня встретили медсестра Ирина и анестезиолог Дарья, измерили давление, предоставили специальное бельё для колоноскопии. Всё прошло просто идеально. Выражаю вам всем огромную благодарность за ваш труд, отзывчивость, понимание. Однозначно буду рекомендовать эту клинику своим друзьям и знакомым. Желаю вам здоровья, а клинике процветания!
Анна
Необходимо было пройти неприятную процедуру колоноскопию, откладывала очень долго все не решалась, т к наслушалась отзывов. Обратилась в вашу клинику, и осталась Очень довольна. Атмосфера более доброжелательная — все четко, спокойно, начиная с рецепции и заканчивая проведения самой процедуры. Сама процедура прошла во сне, нервные клетки не потрачены. Врач Серебряков Евгений Юрьевич все подробно объяснил, до процедуры, и после ознакомил с результатами обследования, все очень понятным языком. Спасибо вам всем! С удовольствие порекомендую вашу клинику.
Татьяна
Хочу поделиться с вами о процедуре ФГДС (гастроскопия с седацией). Я эту процедуру делала в поликлинике (без наркоза) и это так было ужасно, что отложилось на всю жизнь. Когда мне надо было повторить ФГДС я обратилась в «Региональный центр эндоскопии». С первого шага я очутилась в доброжелательной атмосфере, меня встретила чудесная девушка на ресепшен — Ксения, а далее все как в сказке, сначала пообщалась с замечательным врачом — Серебряковым Е. Ю., он все меня расспросил, успокоил и передал меня анестезиологам Коробко А. А. и Олечке Р., они меня настроили, успокоили и замечательная медсестра Ирина сделала профессионально укол в вену, и я уснула. Затем меня разбудили. Я очень благодарна этому коллективу, который на высшем профессиональном уровне выполняют свою работу. Спасибо вам огромное. С уважением, Липатова И. А. Всем рекомендую этот центр.
Липатова И.А.
Понравилась атмосфера, внимательные администраторы, очень приятная и внимательная медсестра Ирина. Особая благодарность врачу Кряжову! Прошла ФГДС в срочном порядке, очень все аккуратно и не больно, очень внимательные врачи и медперсонал, все объяснили, настроили. Отличное новое оборудование, качественный ремонт, чай/ кофе (не пригодился даже) — приняли сразу. Не думала, что такая процедура вызовет такие положительные эмоции. А неделей раньше моя мама прошла в этой клинике колоноскопию, без седации, довольна внимательным отношением и отсутствием сильного дискомфорта! Приняли вовремя, заранее напомнив о визите! Буду советовать «Региональный центр эндоскопии» своим знакомым, все на высшем уровне, спасибо большое, вы настоящие профессионалы!
Аноним
Попала на прием к главному врачу профессору Нине Николаевне Митраковой. Врача такого уровня встречаю впервые, уже третью колоноскопию пыталась сделать и наконец получилось! Я хочу сказать одно: оборудование сейчас много где хорошее, а вот руки золотые редко встречаются. Не больно, с подробными комментариями и внимательным тактичным отношением — вот так могу рассказать про само обследование. Такого грамотного доктора встретишь нечасто (сопоставить её могу только с Абелевич). Всем рекомендую и сам центр, и особенно Митракову, теперь только к ней всех близких отправляю. Спасибо!
Елена
Я впервые посетила этот центр, записывалась на исследование. Мне очень понравилось, что, с точки зрения безопасности клиента, в период карантина там очень правильно организована работа. Клиентов кроме меня не было, когда я заходила, передо мной вышла женщина. То есть, запись ведётся так, чтобы люди не пересекались друг с другом. Все поверхности обрабатываются антисептиками. Роман Андреевич Гагаев спокойный, внимательный, тактичный человек, очень тщательно всё посмотрел. Мою проблему он правильно обозначил, хотя не обязан был меня консультировать. Результат я получила на руки, описание подробное. Я очень довольна осталась!
Наталья
Был на приёме у эндоскописта. Меня приняли даже пораньше. Врач вежливый и отзывчивый. Процедура проходила с анестезией. Врач сразу же написал описание. Видно, что врач профессионал с большой буквы, так как мне все четко и доходчиво объяснил и я остался очень доволен. А в центре все, я бы даже сказал, стерильно и на ресепшн все вежливы и все на высшем уровне!
Сергей
Хочу выразить огромную благодарность врачу Ветюгову Дмитрию Евгеньевичу за профессионально проведённые исследования (колоноскопия и гастроскопия). Мне очень повезло, что мой врач высококвалифицированный и ответственный специалист, который очень внимательно выслушал все жалобы перед обследованием и дал подробные разъяснения по результатам исследования. Огромное спасибо врачу-анестезиологу Поляковой Ольге Вячеславовне, медицинской сестре Гусевой Елене и администратору Логиновой Любови за доброе и чуткое отношение.
Коломытова В.И., 70 лет
Хочу выразить благодарность врачу-эндоскописту Гагаеву Роману Андреевичу и врачу анестезиологу Исакову Олегу Вячеславовичу за их профессионализм, оперативность в принятии решении, и внимательное, человечное отношение. В сентябре 2019 обращались с мамой в данный центр,была проведена колоноскопия (с седацией) с одновременным удалением полипов кишечника. Операция прошла безболезненно,после операции также неприятных ощущений не было. Еще раз спасибо и дальнейших вам успехов в вашей профессии!!!!
Юлия
На высшем уровне все — начиная с предоставления парковки, сама клиника — все красиво, уютно, удобно, все необходимое предоставлено. вплоть до средств ухода за обувью и дезодоранта. Ну и , собственно, медицинские услуги на высшем уровне. Очень довольна! Огромное спасибо Александру Анатольевичу и всем другим участвовавшим специалистам. Очень боялась самой процедуры (колоно и гастроскопия), но даже после обследования в теле никаких неприятных ощущений — как будто просто поспала. Ранее делала ФГДС в других местах — гортань болела пару дней потом. Про колоно даже и думать боялась. Внимательный персонал, неформальное, человеческое отношение. Пока отдыхала после процедуры уже после консультации врача — со мной побеседовала врач-диетолог, уточнила, как питаться после диеты и обследования. предложили чай и угостили личным шоколадом, что очень поддержало и морально и физически — очень есть хотелось ))). Огромное всем спасибо еще раз! Приду к вам, как и назначил врач, через годика полтора!
Светлана
Моей маме нужно было проверить верхний и нижний отделы кишечника. Записались к Смирновой Раисат Саидовне на диагностическое обследование. В первый приём было выполнено фгдс-исследование: все прошло очень легко и безболезненно. Мама не в первый раз делает Фгдс — и всегда неприятные ощущения, здесь было намного лучше. Во втрой приём было назначено колоректальное исследование. Подготовка к исследованию прошла мягко на Мовипрепе. Все, кто рассказывал про эту процедуру -говорили, что и подготовка к ней сложная: надо выпить много жидкости, а в итоге кишечник не чистый. Но подготовка и сама процедура прошли хорошо. Мама делала без анестезии, в кишечник вводился углекислый газ. В первый сутки после исследования кишечник «не раздувало». До этого делали в другом центр «на воздухе» и длительное время оставались неприятные ощущения:( После процедуры дали возможность отдохнуть и отправили домой на такси. Всем рекомендую данный центр. Персонал доброжелательный, грамотные специалисты!
Екатерина
Благодарю всех сотрудников клиники за доброжелательное отношение к своим пациентам! В клинике царит атмосфера добра и уюта. Все медицинские процессы организованы на высоком уровне! Исследования проводятся в очень комфортных для пациента условиях. Как врач хочу отметить высочайший профессионализм специалистов центра! Успехов Вам и процветания!
Екатерина
Выражаю ОГРОМНУЮ БЛАГОДАРНОСТЬ Специалистам центра и особенно Митракову Александру Анатольевичу за ОГРОМНЫЙ ПРОФЕССИОНАЛИЗМ. До обращения в «ЦЕНТР ЭНДОСКОПИИ» В течении нескольких лет пытаемся поставить правильный диагноз, прошли большое количество обследований, делали колоноскопию — результат был нулевой. По совету друзей обратились к Александру Анатольевичу, хоть и пришлось Ехать в другой город, мы из Самары, но здоровье Мамы дороже. Приятный вежливый персонал, сделали качественную анестезию, провели тщательное обследование(есть с чем сравнивать), все объяснили и рассказали. Наконец то поставили верный диагноз. Сейчас проходим лечение в своем городе. Обязательно обратимся для контрольного обследования после прохождения курса лечения. СПАСИБО!!! Всем Здоровья!
Раджабов Казбек
Уважаемый Александр Анатольевич! Огромная благодарность Вам и сотрудникам эндоскопического центра за оперативную и качественную операцию. Успехов Вам, здоровья и благополучия! Спасибо! С уважением, пациент Игорь Васильевич Г.
Игорь Васильевич
Владимир Алексеевич Кряжов — один из лучших эндоскопистов нашего города, у него очень много заслуженных наград и сертификатов. Долго изучала отзывы перед тем как решится на удаление образования в кишечнике, и не пожалела, что выбрала его. Сделал всё аккуратно, удалил опухоль, ничего потом не кровило, не болело и уже через полгода на контрольном осмотре никаких следов не осталось на этом месте. Спасибо Вам, доктор!
Никифорова Ольга
Исследование кишечника я делала под наркозом у Киргинцевой Елены Анатольевны. Как только я открыла глаза, сначала со мной поговорил анестезиолог, а потом доктор пришла в палату и в общих чертах ответила на мои вопросы. Рассказывать особо было нечего, так как выяснилось, что у меня все хорошо. А те страшилки, которыми меня пугали в другой клинике, всего навсего функциональные особенности. Нет ничего такого, что нужно удалять, просто нужно изменить отношение к питанию и образу жизни!!! И ещё понравилось отношение к себе, медработники меня успокоили, анестезиолог тоже был хороший, доктор меня проконсультировала, полностью проинформировала о процедуре. Рассказывала все с юмором, чтобы снять мое напряжение. Ей удалось меня успокоить. Главное, что после обследования, я не ощущаю последствий. Судя по полученному заключению, повторно обращаться мне не нужно. Но если возникнет необходимость — только к ней.
Оксана Мамонтова
Глотать кишку для обследования кишечника — стало приятного, конечно, но хотя бы без боли и достаточно быстро как оказалось. Делала впервые, поэтому боялась. Делала врач Раисат Саидовна. Я заснула, а потом меня разбудили, когда все закончилось. Боли никакой не было. Спасибо!
Екатерина
Лечусь который год у гастроэнтеролога и всё безуспешно, меняю одно лекарство на другое. Случайно услышал от знакомых о хорошей консультации доктора Гагаева и решил сходить. Осмотр провёл хорошо, есть с чем сравнивать (это было 4-е фгдс, пару раз горло обдирали что потом есть не мог). Также с доктором мы обсудили питание, были даны рекомендации по диете и образу жизни. Врач обладает широкими познаниями в своей области. Думаю, что я смогу его порекомендовать своим знакомым тоже, как и мне его в своё время. У гастроэнтеролога я был потом по его рекомендации и наконец лечение стало помогать, а я имею опыт обращения к другим врачам, поэтому есть с чем сравнить. Приносил с собой обследования свежие, недельной давности, также были анализы с собой. Хочу так же заметить, что времени мне было уделено в два раза больше, чем было оговорено ранее, хотя это был конец рабочего дня и клиника уже закрывалась. Резюме: оценка 5 баллов за профессионализм и отношение к пациентам!
Павел Алексеевич
Хочу выразить огромную благодарность врачу-эндоскописту Митракову Александру Анатольевичу за отличную работу, профессионализм и внимательное отношение. Очень рада, что попала в руки такого высококвалифицированного доктора! Также благодарю Клюеву А.В. и Белякову О.Б. за чуткое отношение и доброжелательность. Желаю всем здоровья, благополучия и успехов во всем! Спасибо!
Людмила
Хочу выразить благодарность прекрасному специалисту — Митракову Александру Анатольевичу, а также его помощницам за професссиональную, ответственную и квалифицированную работу! За внимание и отзывчивость, понимание и доброжелательность! Хочу пожелать Вам крепкого здоровья и огромного успеха!
Галина Васильевна
Хирургия локально рецидивирующего рака прямой кишки: советы, хитрости и подводные камни
Clin Colon Rectal Surg. 2016 июн; 29 (2): 114–122.
, MBBS, MS, FRACS, 1, 2 , MD, MBA, FRACS, 1 и, MBChB, MMedSci, FRACS 1
Сатиш К. Уорриер
1 Департамент рака Хирургия, Онкологический центр Питера МакКаллума, Восточный Мельбурн, Виктория, Австралия
2 Отделение колоректальной хирургии, Alfred Health, Мельбурн, Виктория, Австралия
Александр Г.Heriot
1 Отделение онкологической хирургии, Онкологический центр Питера МакКаллума, Восточный Мельбурн, Виктория, Австралия
Эндрю Крейг Линч
1 Отделение онкологической хирургии, Онкологический центр Питера Маккаллума, Восточный Мельбурн, Виктория, Австралия
1 Отделение онкологической хирургии, Онкологический центр Питера МакКаллума, Восточный Мельбурн, Виктория, Австралия
2 Отделение колоректальной хирургии, Альфред Хелс, Мельбурн, Виктория, Австралия
Адрес для корреспонденции Сатиш К.Warrier, MBBS, MS, Отделение онкологической хирургии FRACS, Онкологический центр Питера МакКаллума, Сент-Эндрюс-Плейс, Восточный Мельбурн, VIC 3002, Австралия, moc.oohay@10169hsitas Эта статья цитируется в других статьях в PMC.
Abstract
Рак прямой кишки может рецидивировать локально у 10% пациентов, которым выполняется радикальная резекция по поводу первичного рака. Хирургическое вмешательство считается целесообразным в лечебных учреждениях, а также в некоторых случаях с паллиативной целью. Безрецидивная выживаемость после восстановительной резекции зависит от достижения границы резекции R0.Необходимо четкое понимание прикладной хирургической анатомии, соответствующее предоперационное планирование и мультидисциплинарный подход к агрессивной резекции мягких тканей, костей и сосудов с соответствующей реконструкцией. Обсуждаются технические советы, приемы и подводные камни, которые могут помочь в лечении этих видов рака, а также обсуждается роль дополнительной импульсной лучевой терапии и интраоперационной лучевой терапии в лечении таких видов рака.
Ключевые слова: экзентерация таза, рак прямой кишки, рецидив рака, колоректальная хирургия
Предпосылки
Колоректальный рак (CRC) является третьим по распространенности раком у мужчин и вторым по частоте у женщин. 1 До одной трети CRC возникает из-за новообразований в прямой кишке, где в большинстве случаев цель лечения остается излечивающей. 1 К сожалению, от 6 до 13% таких случаев рецидив заболевания в области таза и / или промежности может стать проблемой для хирурга. 2 Исторически частота местных рецидивов (ЛР) составляла 32% после первичной лечебной резекции прямой кишки, и, возможно, наиболее известно, что контрольная группа шведского исследования рака прямой кишки имела 5-летнюю частоту ЛР 27%. 2 3 4 Распространение и популяризация тотального мезоректального иссечения (т. Е. Стандартизированной техники экстрафасциальной диссекции мезоректума с максимальным учетом эмбриологических плоскостей) и улучшение предоперационной лучевой терапии и химиотерапии снизили бремя этого заболевания. для лечащих врачей. 4 5 6 7
Почти у половины пациентов с рецидивом рака прямой кишки болезнь ограничена тазом и может считаться технически резектабельной. 2 8 В настоящее время установлено, что радикальное хирургическое вмешательство дает этим пациентам наилучшие шансы на долгосрочное выживание. 9 10 11
В этой статье рассматривается предоперационный отбор потенциально оперативных кандидатов, важность предоперационной оценки и мультидисциплинарный подход к лечению. В нем также рассматриваются технические советы и приемы, связанные с поливисцеральной резекцией на основе анатомического участка рецидива.В нем обсуждается потенциальная роль импульсной радиации и роль интраоперационной лучевой терапии (ИОЛТ) в лечении рецидивирующего рака прямой кишки.
Сроки и факторы риска местного рецидива
Большая часть ЛР возникает в течение 2 лет после первичной операции, хотя может возникнуть и позже. Хериот и его коллеги сообщили, что 43% LR были обнаружены через 48 месяцев после первичной операции, 9 , в то время как отдельное исследование Sagar и его коллег показало, что 40% LR произошли через 36 месяцев. 10
Продвинутые первичные опухоли более склонны к LR, особенно если существует угроза или вовлечение периферической резекции края (CRM), плохая дифференцировка, лимфоваскулярная инвазия, венозная или периневральная инвазия, непроходимость или перфорация опухоли. 8 Авторы также предполагают, что время LR может быть отложено, если неоадъювантная химиолучевая терапия используется до окончательной первичной резекционной операции.
Лечение рецидивирующего рака прямой кишки
Лечение рака прямой кишки является многопрофильным.Это требует специального участия нескольких команд. Цели состоят в том, чтобы улучшить качество жизни (QOL) за счет контроля симптомов, продлить выживаемость и обеспечить лечение, где это возможно, при минимизации сопутствующей заболеваемости. Важно отметить, что после мультидисциплинарной оценки многие пациенты с рецидивирующим заболеванием могут не приступить к операции, и многие факторы влияют на решение оперировать или нет.
Бремя метастатического заболевания, размер опухоли и инфильтрация соседних структур, а также состояние пациента — все это влияет на решение о продолжении обширной резекционной операции.Неоперационные стратегии лечения, такие как дистанционная лучевая терапия или паллиативная химиотерапия, не обеспечивают возможности излечения, со средней выживаемостью около 5 месяцев. 2 12 Неоперационные методы лечения могут играть роль в ведении пациентов, получающих паллиативное лечение. Формирование стомы, установка нефростомы и мочеточниковые стенты могут использоваться выборочно, особенно когда радикальное хирургическое вмешательство считается нецелесообразным.
Традиционно абсолютными противопоказаниями считались карциноматоз брюшины, высокое поражение крестца, закрытие внешних подвздошных сосудов, инвазия седалищной вырезки, двусторонняя непроходимость мочеточника с двусторонним гидронефрозом и наличие грубого отека нижних конечностей (в дополнение к неоперабельным отдаленным метастазам). к тазовой экстренной хирургии. 8 Многие из этих догм были поставлены под сомнение, поскольку экстренные центры по всему миру расширяют традиционные границы резекции.
Обширная резекция может происходить за счет функционального компромисса. Однако пациенты с прогрессирующим злокачественным новообразованием таза без резекции также могут страдать от сильной боли от костной, мышечной или нервной инвазии. 13 14 Янг и его коллеги оценили показатели качества жизни у 148 пациентов, перенесших экстренную операцию, и сравнили их с пациентами, которые не получали это лечение. 15 Исследование показало, что пациенты относительно быстро восстанавливались после операции, и через 3 месяца, по многим показателям качества жизни, кривые Каплана-Мейера времени до ухудшения, по-видимому, пересекались с пациентами из неоперационной группы, которые продолжали испытывать медленное отклонить. 15
Команда расширения: многие руки делают легкую работу
Важно создать команду расширения. Эти случаи могут быть технически сложными, и наличие бригады, которая регулярно выполняет сложные поливисцеральные резекции, может сократить время операций и уровень стресса персонала операционной и улучшить результаты.Помимо регулярных назначенных специализированных урологов, пластических хирургов, хирургов-ортопедов и потенциально сосудистых хирургов в отдельных случаях, важно, чтобы экстренный хирург (колоректальный хирург с опытом хирургии рака и тазовой эксентерации) взял на себя ведущую роль в пред- и интраоперационном решении. -изготовление. Наш подход состоит в том, чтобы в большинстве случаев иметь двух специальных хирургов-колоректальных хирургов. Мы обнаружили, что такой подход сокращает время операции и, хотя и не количественно, снижает стресс в операционной.Совместное принятие решений также может быть полезным, особенно при попытке сохранить органы (например, часть мочевого пузыря, простату или основные нервы). В дополнение к этим людям, опытные медицинские и радиационные онкологи, а также радиологи, ядерные врачи и патологи помогают участвовать в заседаниях совета по опухолям и обсуждениях с участием энтеростомических терапевтов, психологов, диетологов и медицинских сестер-специалистов по лечению рака.
Переоблучать или нет?
Многие пациенты после операции по поводу рака прямой кишки, направляемые на операцию, прошли стандартный длительный курс химиолучевой терапии (50.4Gy) ранее. Наши онкологи-радиологи определяют количество полученного излучения и показания к нему. Если период времени превышает 2 года, многие наши пациенты получат повторное облучение. Профиль безопасности и эффективности этого режима был сформулирован Ng и его коллегами. 16 Гурен и его коллеги недавно завершили систематический обзор возможности повторного облучения. 17 В исследовании участвовали 375 пациентов, повторно облученных по поводу рецидивирующего рака прямой кишки, и сообщалось об общем низком уровне острой токсичности.Авторы рекомендовали использовать гиперфракционированную химиолучевую терапию для ограничения поздней токсичности. 17
Местный рецидив — где он?
В литературе описано несколько систем классификации. Группа Мэйо описала рецидив в зависимости от локализации (крестцовый, передний, левый или правый) и в зависимости от степени фиксации. 18 Ванебо и его коллеги описали это на основе более традиционной системы метастазов опухолевых узлов, обозначив «R» для рецидива. 19 Мур и его коллеги из Мемориального онкологического центра им. Слоуна Кеттеринга описывают LR в зависимости от того, является ли рецидив осевым (включая анастомоз, промежность, периректальные мягкие ткани), передним (включая мочеполовой тракт), задним (крестец или копчик) или латеральным (костная боковина ). 20 Бойл и его коллеги описывают рецидивы как центральные, крестцовые, боковые или композитные (когда рецидив затрагивает крестец или боковую стенку). 21
В этой статье описываются отсеки согласно Мур и его коллег; Однако стоит отметить, что каждый отсек может создавать технические проблемы.Первый — это центральный отсек . Хотя рецидивы здесь теоретически проще технически, все же требуется бдительность, чтобы гарантировать выполнение резекции R0. Например, если у пациента есть центральный рецидив после стандартной нижней передней резекции, часто требуется экстралеваторная абдоминоперинеальная резекция с сопутствующей копцигэктомией, чтобы гарантировать достижение R0. Второй, передний отсек , может быть технически более подходящим, но создает уникальные проблемы.Здесь часто обращаются за урологической помощью, и следует рассмотреть возможность как половой уретрэктомии, так и комбинированного иссечения лобковой кости, чтобы повысить частоту R0 в случаях высокого риска. Задний отсек обычно костный (хотя во многих классификациях относится к структурам, расположенным позади маточно-влагалищной оси). Крестец можно удалить в положении лежа на животе или при абдоминолитотомии. В последнее время уровень диссекции расширился, и композитные резекции S1 / L5 считаются возможными; тем не менее, здесь необходимы опытные специалисты-ортопеды или нейрохирурги, чтобы избежать катастрофических последствий и повышения заболеваемости.Боковые рецидивы традиционно были наиболее сложными для выполнения резекции R0.
Программа реабилитации и периоперационный уход
Пациенты, перенесшие сложные операции на органах малого таза, подвергаются повышенному риску серьезных сердечных, респираторных, тромботических и раневых осложнений. Специальная программа реабилитации может снизить этот риск. 22 Это включает раннюю активную сердечно-легочную оценку пациентов и программы упражнений по мере необходимости. Программа включает скоординированное формирование у пациентов толерантности к физической нагрузке, чтобы уменьшить воздействие стрессовых факторов операции.Программа также помогает компенсировать потерю физической формы во время фазы неоадъювантного лечения. 22 После первичного облучения или повторного облучения многие пациенты входят в катаболическую фазу, и в интервале между повторным облучением и операцией (часто 10–12 недель) диетологи нашего отделения активно стремятся улучшить питание за счет дополнительных высококалорийных и высокобелковых добавок. напитки. Это позволяет пациентам находиться в наилучшем возможном состоянии, чтобы противостоять серьезным экзентерациям. Опытный анестезиологический менеджмент с надлежащим мониторингом жидкости, защитой зоны давления и контролем температуры дополняется программой раннего восстановления, независимо от продолжительности операции.Хериот и его коллеги сообщили о первоначальном австралийском опыте расширенной радикальной резекции по поводу локально рецидивирующего рака прямой кишки. 9 Данные включали пациентов из Онкологического центра Питера МакКаллума в Мельбурне, Королевского принца Альфреда в Сиднее и больницы Крайстчерча (Крайстчерч, Новая Зеландия), все специализированные лечебные центры. Из 160 пациентов у 61% был край резекции R0, и наблюдалась только одна периоперационная смерть. Это отражает наш постоянный опыт работы с расширенными резекциями.
Наш стандартный подход
Пациенты размещаются в модифицированном положении Ллойда – Дэвиса, при этом обе руки всегда заправлены боком, чтобы обеспечить доступ к тазу как первичному хирургу, так и ассистенту. Если предполагается сакрэктомия, то два 2-литровых мешка с физиологическим раствором помещаются под поясничную область, чтобы поднять дистальный отдел крестца. После лапаротомии по средней линии и адгезиолиза проводится оценка заболевания брюшины и метастазов в печени. Нашим предпочтительным самоудерживающимся ретрактором является Balfour-Doyen, поскольку он обеспечивает более близкий доступ к пациенту.Третья рука используется исключительно для рассечения таза. Первоначальная диссекция включает оценку петель тонкой кишки, которые могут прилегать к новообразованию. Потенциальная ловушка для хирургов состоит в том, чтобы попытаться освободить тонкую кишку напрямую от новообразования или, в качестве альтернативы, использовать резкое рассечение, чтобы освободить тонкую кишку от новообразования. Если придерживаться такой стратегии, существует значительный риск разрыва опухоли. В таких случаях петли тонкой кишки рассекают и резецируют enbloc. Это может включать резекцию нескольких отдельных петель, прикрепленных к опухоли.Авторы предлагают использовать передне-задний доступ, при котором слои прикрепленной тонкой кишки последовательно сшиваются и отделяются от опухоли до тех пор, пока тонкая кишка полностью не освободится ().
Передний и задний отдел тонкой кишки прошивают скобами для доступа к образованию.
После доставки пакета тонкой кишки рассечение начинается с полной мобилизацией левой толстой кишки для удобного доступа. Часто необходимо мобилизовать и правую кишку.Мочеточники идентифицируются с обеих сторон (мочеточниковые катетеры устанавливаются в начале лечения, если не планируется цистэктомия) и закрепляются с помощью силиконовых петель для сосудов. Экстрафасциальная плоскость (полная мезоректальная иссеченная задняя плоскость) отслеживается сзади, если не подозревается опухоль. Мобилизация правого мочеточника продолжается вниз по направлению к пузырно-мочеточниковому соединению. Если у мужчины предполагается переднее разгибание, то мочевой пузырь мобилизуют по позадилонному пространству вниз по направлению к поднимающей пластине спереди.Урологические данные можно запросить, хотя важно, чтобы колоректальный хирург диктовал плоскость рассечения и уровень уретрального отдела. В большинстве случаев уретру можно разделить, взяв дорсальный венозный комплекс из переднего доступа.
Центральные рецидивы
Степень резекции зависит от степени заболевания. Мирнезами и Сагар описали трансперинеальный доступ к изолированным рецидивам; однако в большинстве случаев это невозможно. 10 При поражении мочеполовых структур лучше всего вводить enbloc. 8
Если поражены только матка и влагалище, их можно резецировать с чистым краем. В этой части может помочь специалист-гинеколог-онколог. Цель гистерэктомии enbloc в этой ситуации — обеспечить резекцию R0. После полного уретеролиза круглую связку, широкую связку и питающие сосуды гонад можно перевязать отдельно. Используя тампон на держателе во влагалище, абдоминальный хирург может точно разрезать и открыть влагалище ниже шейки матки, а усовершенствованное биполярное или ультразвуковое устройство можно использовать для прорыва задней стенки, а также для освобождения притоков, проходящих в матку. .На этом этапе во влагалище, пока оно открыто, не будет опухоли, и можно точно определить уровень разделения прямой кишки. В случаях, когда требуется задняя вагинэктомия как часть абдоминоперинеальной резекции enbloc, предпочтительнее использовать двойной хирургический подход сверху и снизу. Пример этого показан на.
Резекция матки и задней части влагалища единым блоком с абдоминоперинеальной резекцией (APR) прямой кишки. ( a ) Интраоперационный вид созданной полости с неповрежденной передней частью влагалища.( b ) Образец после блочной резекции матки и задней части влагалища с APR.
Хотя при большинстве рецидивов малого таза вполне вероятно, что необходима абдоминоперинеальная резекция (из-за фиброза и предшествующего низкого анастомоза), это, конечно, не всегда так. У некоторых пациентов возможен реанастомоз, или проводится процедура low Hartmann, чтобы избежать болезненности раны промежности. 9
щадящие тазовые органы
щадящие расширения мочевого пузыря рассматриваются только выборочно.Энблок-семенная везикулэктомия или простатэктомия рассматриваются, если первичная опухоль прилегает к простате или минимально проникает в простату без вовлечения других мочеполовых структур. 23 Тернер и его коллеги опубликовали свой опыт проведения 10 простатэктомий enbloc по сравнению с 20 цистопростатэктомиями enbloc в Крайстчерче (Крайстчерч, Новая Зеландия). 24 Серия показала, что у одной трети пациентов была моча, и эректильная функция была серьезно нарушена.Сохраняются опасения относительно урологической функции, а также потенциального риска мочеиспускания и свищей.
Если опухоль проникает в купол мочевого пузыря или упирается в него, можно выполнить частичную цистэктомию с использованием двухслойного закрытия. Оценить степень поражения мочевого пузыря может быть сложно. Если предоперационная оценка выявляет инвазию около треугольника, можно использовать один из методов — наполнить мочевой пузырь водой, чтобы облегчить резекцию и сохранить как можно больше мочевого пузыря.В качестве альтернативы можно использовать цистотомию, чтобы обнажить устья мочеточника и, следовательно, точно определить треугольник.
У женщин центральная точка экстентерации включает матку, шейку матки или свод влагалища. При рецидивах свода влагалища мы предпочитаем следовать в мочеточниковой, а не в сосудистой плоскости и оставаться позади прямой кишки. Если требуется полная задняя вагинэктомия, то для облегчения этого выполняется полная гистерэктомия. Перед резекцией проводится тщательное обсуждение вопросов фертильности, менопаузального статуса и половой функции.
Четкая граница резекции (как микроскопическая, так и макроскопическая) остается целью из-за ее значительного влияния как на локальный, так и на отдаленный рецидив, а также на выживаемость. 9 Неудивительно, что поражение краев (R1 или выше) связано с нарушением выживаемости. Задействованные макроскопические запасы (R2) связаны с худшими результатами. Боковые рецидивы также привели к значительно худшей общей выживаемости. 9
Передние рецидивы: расширение границ
Передние рецидивы могут создавать уникальные проблемы.Иссечение может быть проведено сопровождающим урологом, участвующим в предоперационном планировании. Важно, чтобы экстренный хирург определил, где происходит рассечение передних структур. Наше отделение регулярно выполняет повторную диагностику (КТ, МРТ, ПЭТ-сканирование) при запущенных рецидивных формах рака прямой кишки после предоперационной химиолучевой (или повторной) терапии.
Центральной точкой оси переднего отдела тазового дна является уретра. 25 Передний отдел ограничен лобковым сочленением, а также верхним и нижним лонными ветвями.Местно-распространенный рак прямой кишки (а также опухоли мягких тканей мочевого пузыря, простаты, вульвы, влагалища, шейки матки) может примыкать к этому краю. По нашему опыту, существует риск положительного переднего края, особенно если рассечение уретры проводится через абдоминальный доступ. Кроме того, перевязка дорсального венозного комплекса может быть сложной задачей в области облучения, что сопряжено с риском значительной кровопотери.
Наш подход к определенным передним рецидивным опухолям заключается в доступе к уретре через промежностный доступ.Пример этого приведен в разделе с выделением правильной плоскости уретрального отдела.
( a ) Сагиттальная МРТ показывает как неправильную линию уретрального отдела (красная стрелка), так и правильную линию уретрального отдела (зеленая стрелка). ( b ) Разрез «слезинки» для перинеального доступа к отделу уретры. ( c ) Промежуточная уретрэктомия для обнажения нижних ветвей лобка.
Авторский подход заключался в операции в положении абдоминолитотомии с пациентом в крутом Тренделенбурге.Для доступа к луковично-губчатой мышце после подкожной диссекции выполняется отдельная дорсальная прорезь для удлинения кожи. Затем мышцы отрываются от надкостницы нижних лобковых ветвей. Основание полового члена зашиваем швом 0-Викрил (полиглактин). Затем визуализируют уретру с пересечением мочевого катетера. Мочевой катетер зажимается с обеих сторон, чтобы предотвратить утечку. Это обеспечивает легкий передний доступ для проведения диссекции абдоминальной бригады.
Соломон и его коллеги описывают новую и более обширную резекцию лобковой кости по поводу опухоли, поражающей нижние ветвь лобковой кости. 25 Доступ к кости такой же, как описано выше, но рассечение продолжается до мобилизованной плоскости передней стенки на верхней стороне лобка. Это позволяет полностью подвешивать брюшную стенку, половой член и мошонку. После перевязки сосудов притоков внутренней подвздошной кости можно пересечь верхнюю и нижнюю лобковые ветви от седалищной кости с помощью осциллирующей пилы.Можно выбрать либо полное иссечение композитной лобковой кости, либо частичное иссечение лобковой кости, включая нижние лобковые ветви и нижнюю половину лобкового симфиза, с сохранением верхних лобковых ветвей. 25 Эта стратегия важна при хирургическом лечении сложных передних опухолей. Важно, чтобы экстренные хирурги были знакомы с такими методами.
Резекция заднего отсека и расширенная костная резекция
В то время как многие авторы отстаивают метод сакрэктомии лежа на животе, наш подход заключается в выполнении сакрэктомии с использованием абдоминолитотомии, особенно если уровень резекции крестца не превышает S3.Это особенно полезно, когда на процедуре присутствуют два экстренного хирурга. Тщательное планирование с правильным расположением пациента имеет решающее значение для процедуры. Пациент находится в модифицированной позе Ллойда-Дэвиса, обе руки подвернуты, а промежность находится далеко за «разрывом» в операционном столе. Таз проталкивается кпереди двумя большими солевыми мешками под поясничной областью. 26 Мы считаем, что абдоминолитотомия обеспечивает больший доступ к латеральному отделу, лучший контроль над основными сосудами и обнажение пояснично-крестцового ствола в тазу с рассечением седалищного нерва в более латеральном направлении.Он также позволяет точно разместить вертикальный миокожный лоскут прямой мышцы живота (VRAM).
Операция начинается с абдоминального доступа. Соответствующая подвздошная сосудистая сеть изолируется в зависимости от предполагаемой степени резекции. Использование открытого биполярного устройства, такого как LigaSure Impact (LigaSure (Stryker), Tempe, AZ), может значительно облегчить рассечение таза.
Передний край рассечения определяется степенью поражения мягких тканей (мочевого пузыря, влагалища, простаты и уретры в тазу) и костной ткани (лобка).Когда трансабдоминальная фаза рассечения близится к завершению, промежностная фаза рассечения начинается вторым экстренным хирургом. Вокруг анального края делается эллиптическое иссечение; однако, если требуется сакрэктомия, выполняется дополнительный задний разрез, чтобы облегчить доступ к крестцу. Рассечение ишиоанальных жировых подушечек выполняется по окружности, и рассечение продолжается кзади от копчика и крестца. Большую ягодичную мышцу отделяют от крестца и продолжают рассечение кзади до позвоночника S2.Крестец полностью обнажен с отсеченными от кости связками (крестцово-копчиковая связка) и мышечными структурами.
Абдоминальный хирург будет использовать электрокоагуляцию, чтобы открыть пресакральную фасцию и мышцы (грушевидную мышцу), чтобы обнажить передний крестец. Спица Киршнера (K) вводится в крестец на уровне рассечения, обеспечивая хирургу промежности гибкий ретрактор кзади от крестца на соответствующем уровне, чтобы гарантировать, что кожа заднего отдела не будет повреждена.Остеотом увеличенной длины и молоток используются для выполнения сакрэктомии от медиального до латерального направления.
Выше уровня S3 для костной резекции предпочтительнее доступ лежа на животе. Угол крестца затрудняет сакрэктомию в положении литотомии выше этого уровня. В отдельных случаях в опытных центрах возможна расширенная резекция крестцово-тазового отдела. В этих случаях очень важны сосудистое облучение и контроль. Обнажаются нижняя аорта, полая вена, а также дистальные подвздошные артерии и вены.Техника включает лигирование ветвей внутренней подвздошной артерии дистальнее заднего отдела ветви верхней ягодичной артерии. Это сохраняет приток крови к ягодичным мышцам и мягким тканям промежности. Последовательно разделяются внутренняя подвздошная вена и несколько ее притоков.
Подвздошный канал и колостома создаются во время абдоминальной фазы операции. Выявляется уровень пояснично-крестцового рассечения и выполняется однокортикальная передняя остеотомия.Титановый винт устанавливается на уровне места остеотомии. Это позволяет выполнять точную заднюю остеотомию с помощью интраоперационной рентгеноскопии.
Вторая часть процедуры предполагает размещение пациента в положении лежа. Вдоль крестца делается задний срединный разрез, и большая ягодичная мышца освобождается от прикрепления. Крестцово-остистая и крестцово-бугристая связки разделяются для доступа к полости таза сзади. Мышцы грушевидной мышцы разделены, защищая седалищный и половой нервы.Затем выполняются ламинэктомия, перевязка дурального мешка (с нейрохирургической или ортопедической помощью) и резекция крестца. 26
Высокая резекция позвоночника может привести к нестабильности позвоночника, требующей реконструкции. Colibaseanu и его коллеги описывают использование позвоночно-тазовой стабилизации с задним тазовым спондилодезом от нижнего поясничного отдела позвоночника до оставшегося таза, поскольку более высокие резекции могут нарушить позвоночно-тазовую целостность. 27 Реконструкция выполняется с использованием двойных трансплантатов малоберцовой кости и инструментальной стабилизации от нижней поясничной области до оставшейся части таза.У 28 из 30 пациентов была резекция R0 в первоначальной серии по Колибасиану и его коллегам, без операционной смертности. 27 Ранняя послеоперационная заболеваемость была высокой (40% III / IV степени по классификации Clavien). Половина пациентов страдала хронической болью и более 20% имели симптомы невропатического мочевого пузыря. Почти половине из них потребовалась амбулаторная помощь. В целом 2- и 5-летняя выживаемость составила 86 и 46% соответственно, хотя и ограничивалась короткой средней продолжительностью наблюдения (2,7 года). 27 Серия демонстрирует, что пояснично-крестцовая резекция возможна, однако, со значительными краткосрочными осложнениями и с некоторыми функциональными нарушениями.
Рецидивы боковых стенок таза
LR может распространяться на боковые стенки таза. Такой рецидив является сложной задачей и в нашей практике является наиболее частой причиной рассмотрения интраоперационного облучения. Рецидивирующие опухоли могут распространяться на мягкие ткани боковой стенки, мочеточников, подвздошных сосудов, седалищного нерва, грушевидной мышцы и костей таза. Из-за ограничений костного таза этот тип рецидива по-прежнему имеет худший прогноз и является наиболее частым местом для положительного края. 9
Понимание анатомии в этой области имеет решающее значение, поскольку эта плоскость находится за пределами компетенции большинства колоректальных хирургов. Медиальный край наружной подвздошной вены обеспечивает доступ к медиальной стороне большой поясничной мышцы. Это, в свою очередь, является медиальной границей внутренней запирательной мышцы, которая представляет собой ключевую точку рассечения для рассечения боковой стенки таза. Перед операцией необходимо установить двусторонние мочеточниковые стенты, а мочеточник медиализовать до пузырно-мочеточникового перехода.Затем последовательно идентифицируются и лигируются внутренние подвздошные притоки. Внутреннюю запирательную оболочку можно частично удалить, если она задействована, что потенциально может принести в жертву запирательный нерв. Сохранение запирательного нерва возможно, если заболевание изолировано и цель состоит в том, чтобы очистить рецидивирующие боковые лимфатические узлы боковой стенки таза. При необходимости внутреннюю подвздошную артерию и вену можно перевязать, при необходимости взяв притоки для удаления образования боковой стенки и лимфатических узлов. Такое рассечение должно обеспечить полную визуализацию пояснично-крестцового ствола с последующим каудальным рассечением, позволяющим визуализировать и, при необходимости, рассечение грушевидной мышцы и корешков чревных нервов.
Ловушка для хирурга — отсутствие контроля над внешними и внутренними подвздошными сосудами. Мы выступаем за использование сосудистых петель и наличие сосудистых зажимов, необходимых для перевязки сосудов. Хотя большая часть диссекции выполняется резко, мы обнаружили, что арахисовый тампон и выборочное использование энергетических устройств (как передовая биполярная технология, так и ультразвуковая энергия) могут быть полезными. Опытная помощь важна. указывает на рассечение боковой стенки таза с интраоперационным облучением или без него.На рисунках также показано обнажение бедренного нерва, внутренняя резекция подвздошной кости и наружная резекция подвздошной кости с реконструкцией.
Расширение границ вбок. ( a ) Стандартная диссекция боковой стенки таза. ( b ) Боковая резекция R0 боковой стенки таза с последующей ИОЛТ. ( c ) Резекция подвздошной и большой поясничной мышцы и сохранение бедренного нерва. ( d ) Резекция внутренней подвздошной артерии. ( e ) Резекция сосудов единым блоком левой общей подвздошной артерии и вены.( f ) Реконструкция сосудов с пересечением правой бедренной артерии и левой бедренной артерии и трансплантатом подкожной вены для левой общей подвздошной вены.
Появляются сообщения из Японии, которые демонстрируют, что лапароскопический доступ к этому рассечению возможен у пациентов с низким индексом массы тела. 28 Мочеточник должен быть изолирован и медиализован до пузырно-мочеточникового перехода. Открытые наружные подвздошные сосуды позволят обнажить внутреннюю запирательную мышцу медиально.Это рассечение может продолжаться до мускулатуры леваторани. Ткань медиальнее медиальной пупочной связки должна быть рассечена для выборочного рассечения и перевязки запирательных сосудов. Соединение внутренней подвздошной артерии и вены может быть медиализовано, чтобы обнажить пояснично-крестцовый ствол ниже, и дальнейшее рассечение позволит получить доступ к передней части грушевидной мышцы. Сосуды infrapiriformis и последующие передние ветви внутренних подвздошных сосудов могут быть перевязаны последовательно.Внутренние подвздошные сосуды можно взять с помощью сосудистого степлера или наложить шовную нить нерассасывающимся монофиламентным швом. Внутренние ветви таза можно пожертвовать, а грушевидную мышцу можно частично или полностью разделить.
Группа St.Marks описала свой опыт расширенного иссечения боковой стенки таза в ходе шести резекций R0 по поводу рецидивов боковой стенки. 29 Авторы описывают две фазы диссекции: экстратазовую фазу и абдоминальную фазу.Пациента сначала кладут на живот, а рассечение продолжается до ягодичных мышц. Ягодичная мышца отражается сбоку и снизу, обнажая поясничную фасцию и крестцово-остистую связку. Это позволяет обнажить грушевидную мышцу, которая проходит через выемку и лежит над седалищным нервом. Грушевидная мышца делится на латеральном направлении, где становится сухожильной. Если опухоль распространяется на мышцу, возможно, придется пожертвовать ягодичной мышцей. Обнажается седалищная вырезка и идентифицируются седалищный нерв, верхняя и нижняя ягодичные артерии.Рассечение надкостницы и кости проводится за пределами переднего крестца по средней линии. Идентифицируются и разделяются крестец и крестцово-бугристые связки. Затем медиализуются разделенные седалищный отдел позвоночника и связка. Авторы описывают использование этого подхода к нижним и верхним ягодичным артериям с соответствующими мышцами. Седалищный нерв приносят в жертву путем инфильтрации местного анестетика и разделения его скальпелем при условии сохранения ипсилатерального бедренного нерва. Масса ткани мобилизуется, чтобы ее можно было продвинуть через седалищную выемку.После этого абдоминальная фаза начинается с того, что абдоминальный хирург приносит в жертву внутреннюю подвздошную кость на ипсилатеральной стороне. Уровень сосудистого деления зависит от того, приносится ли в жертву верхняя ягодичная артерия. 29
Интраоперационная лучевая терапия
ИОЛТ обеспечивает усиленное облучение ложа опухоли после хирургической резекции опухоли. В большинстве ретроспективных серий случаев описывается интраоперационная электронная терапия, но несколько центров могут проводить ИОЛТ с высокой мощностью дозы. 30 Преимущество этого метода заключается в том, что гибкие аппликаторы, изготовленные по индивидуальному заказу, можно использовать для точной доставки одной большой фракции излучения (обычно 5 Гр). Проникновение только на короткое расстояние, поэтому его можно использовать в случаях, когда хирургические поля близки или вовлечены. Из-за своей ограниченной доступности ИОРТ не получил широкого распространения. ИОЛТ — это дополнение, а не замена агрессивной хирургической резекции. Резекция R2 с ИОЛТ не считается приемлемой лечебной стратегией; тем не менее, там, где хирургический край резекции находится близко (обычно костная боковая стенка), ИОЛТ может предложить дополнительное лечение 5 мм.Преимуществами являются минимальная токсичность, бережное отношение к здоровым тканям и короткое время лечения (30 минут) с возможностью уменьшения рецидивов. 30 Мочеточник и нервы можно защитить с помощью свинцовых экранов ().
Систематический обзор, оценивающий преимущества ИОЛТ, продемонстрировал значительную неоднородность исследований, но улучшил 5-летний местный контроль, а также безрецидивную и общую выживаемость у пациентов, перенесших ИОРТ, без различий в заболеваемости. 31
Варианты реконструкции
Дефекты промежности, возникающие при разрастании таза, часто бывают большими.Были описаны многие методы, включая использование кожно-мышечных лоскутов на брюшной полости, ягодичных лоскутов или паховых лоскутов на ножке. Мы предпочитаем реконструкции лоскута VRAM, потому что они позволяют здоровой сосудистой ткани заполнить созданное мертвое пространство. Наш пластический хирург извлечет лоскут предпочтительно с правой стороны (если не выполнялась предварительная илеостомия или подвздошная кишка). Этот лоскут также можно использовать для воссоздания задней стенки влагалища. Мы обычно не используем профилактическую сетку, чтобы укрепить мышечный дефект, образовавшийся в результате сбора мышечной ткани.Если расширенная резекция выполняется лапароскопически, то чаще всего используют кожно-мышечный лоскут нижней ягодичной артерии. Послеоперационный уход требует частого переворачивания из стороны в сторону и регулярного наблюдения за лоскутом. Следует избегать сидения, и часто можно начинать ходить примерно через неделю после операции.
Дополнения к уходу: сексуальная функция, функция мочеиспускания и установка стомы
Размещение стомы, сексуальная функция и функция мочеиспускания — все это зависит от радикальной расширенной резекции таза, и специализированные центры должны иметь услуги для удовлетворения этих потребностей.
Стома должна располагаться на расстоянии не менее 3 см от реберного края, от гребня подвздошной кости и внутри прямой мышцы. Обследование как в положении стоя, так и в положении сидя позволит оптимально сидеть при стоме и избежать образования складок. В случае двойной стомы уростома размещается выше, чем колостома, чтобы ремни стомы не соприкасались.
Когда используется лоскут VRAM, фиксированные анатомические маркеры (например, линия соска) используются в качестве точки компаса, учитывая неопределенность окончательного положения кожи.
В нашем центре есть специализированная клиника сексуального здоровья и эректильной дисфункции. Несмотря на то, что спонтанная эрекция после передних экстензий является необычной, с соответствующей помощью (например, ингибиторами ФДЭ5 или инъекционными препаратами) эти симптомы могут улучшиться. 32
Заключение
Лечение рецидивирующего рака прямой кишки является сложной задачей. Необходим мультидисциплинарный подход с участием специалистов при раннем принятии решений, предоперационном планировании, интраоперационном вскрытии и послеоперационном уходе.Повторное облучение и интраоперационное облучение могут использоваться выборочно для улучшения результатов с приемлемой заболеваемостью. Понимание потенциальных областей, вызывающих беспокойство, с точки зрения положительной маржи и расширения традиционных плоскостей может привести к хорошим онкологическим результатам.
Ссылки
1. Рак в Австралии, обзор, 2006 AIHW cat .; 2007
2. Лопес-Костнер Ф., Фацио В. В., Виньяли А., Рыбицки Л. А., Лавери И. С. Местно-рецидивирующий рак прямой кишки: предикторы и успех спасательной операции. Dis Colon Rectum.2001. 44 (2): 173–178. [PubMed] [Google Scholar] 3. Повышение выживаемости при предоперационной лучевой терапии при резектабельном раке прямой кишки. Шведское исследование рака прямой кишки. N Engl J Med. 1997. 336 (14): 980–987. [PubMed] [Google Scholar] 4. Kapiteijn E, Marijnen C A, Colenbrander A. C. и др. Локальный рецидив у пациентов с раком прямой кишки, диагностированный в период с 1988 по 1992 год: популяционное исследование в западных Нидерландах. Eur J SurgOncol. 1998. 24 (6): 528–535. [PubMed] [Google Scholar] 5. Макфарлейн Дж. К., Райалл Р. Д., Хилд Р. Дж.Мезоректальное иссечение при раке прямой кишки. Ланцет. 1993. 341 (8843): 457–460. [PubMed] [Google Scholar] 6. Хилд Р.Дж., Муж Э.М., Райалл Р.Д. Мезоректум в хирургии рака прямой кишки — ключ к рецидиву тазовых органов? Br J Surg. 1982. 69 (10): 613–616. [PubMed] [Google Scholar] 8. Сагар П. М., Пембертон Дж. Х. Хирургическое лечение местного рецидивирующего рака прямой кишки. Br J Surg. 1996. 83 (3): 293–304. [PubMed] [Google Scholar] 9. Хериот А.Г., Бирн С.М., Ли П. и др. Расширенная радикальная резекция: выбор при локально рецидивирующем раке прямой кишки.Dis Colon Rectum. 2008. 51 (3): 284–291. [PubMed] [Google Scholar] 10. Мирнезами А. Х., Сагар П. М. Хирургия рецидивирующего рака прямой кишки: технические примечания и лечение осложнений. Tech Coloproctol. 2010. 14 (3): 209–216. [PubMed] [Google Scholar] 11. Мэдофф Р. Д. Расширенные резекции при распространенном раке прямой кишки. Br J Surg. 2006. 93 (11): 1311–1312. [PubMed] [Google Scholar] 12. Мория Ю. Стратегия лечения местно-рецидивирующего рака прямой кишки. Jpn J ClinOncol. 2006. 36 (3): 127–131. [PubMed] [Google Scholar] 13.Темпл Л. К., Бачик Дж., Саватта С. Г. и др. Разработка проверенного инструмента для оценки функции кишечника после сфинктеросохраняющей хирургии рака прямой кишки. Dis Colon Rectum. 2005. 48 (7): 1353–1365. [PubMed] [Google Scholar] 14. Остин К. К., Янг Дж. М., Соломон М. Дж. Качество жизни выживших после экзентерации таза при раке прямой кишки. Dis Colon Rectum. 2010. 53 (8): 1121–1126. [PubMed] [Google Scholar] 15. Янг Дж. М., Баджери-Паркер Т., Мася Л. М. и др. Качество жизни и другие результаты, сообщаемые пациентами после экстентерации злокачественного новообразования таза.Br J Surg. 2014. 101 (3): 277–287. [PubMed] [Google Scholar] 16. Нг М. К., Леонг Т., Хериот А. Г., Нган С. Ю. Повторное облучение один раз в день при раке прямой кишки у пациентов, которые ранее получали лучевую терапию таза. J Med Imaging Radiat Oncol. 2013. 57 (4): 512–518. [PubMed] [Google Scholar] 17. Гурен М. Г., Ундсет С., Рекстад Б. Л. и др. Повторное облучение местного рецидивирующего рака прямой кишки: систематический обзор. RadiotherOncol. 2014. 113 (2): 151–157. [PubMed] [Google Scholar] 18. Сузуки К., Дозоис Р. Р., Девайн Р. М. и др. Лечебные повторные операции при местно рецидивирующем раке прямой кишки.Dis Colon Rectum. 1996. 39 (7): 730–736. [PubMed] [Google Scholar] 19. Ванебо Х. Дж., Антонюк П., Конесс Р. Дж. И др. Резекция таза рецидивирующего рака прямой кишки: технические аспекты и результаты. Dis Colon Rectum. 1999. 42 (11): 1438–1448. [PubMed] [Google Scholar] 20. Мур Х. Г., Шуп М., Ридель Э. и др. Рецидивы колоректального рака таза: детерминанты резектабельности. Dis Colon Rectum. 2004. 47 (10): 1599–1606. [PubMed] [Google Scholar] 21. Бойл К. М., Сагар П. М., Чалмерс А. Г., Себаг-Монтефиоре Д., Кэрнс А., Эрдли И.Хирургия местно-рецидивирующего рака прямой кишки. Dis Colon Rectum. 2005. 48 (5): 929–937. [PubMed] [Google Scholar] 22. Вест М.А., Лафни Л., Литго Д. и др. Влияние предварительной реабилитации на объективно измеренную физическую форму после неоадъювантного лечения у пациентов с предоперационным раком прямой кишки: слепое интервенционное пилотное исследование. Br J Anaesth. 2015; 114 (2): 244–251. [PubMed] [Google Scholar] 23. Дэвис П. В. Р., Карне П., Белл С., Уорриер С. К. Экзентерация с сохранением мочевого пузыря при местно-распространенном раке прямой кишки. ANZ J Surg.2013; 83 (1): 26. [Google Scholar] 24. Тернер Г. А., Харрис С. А., Эглинтон Т. В. и др. Цистопростатэктомия по сравнению с одной простатэктомией при местнораспространенном или рецидивирующем раке таза. ANZ J Surg. 2016; 86 (1–2): 54–58. [PubMed] [Google Scholar] 25. Соломон М. Дж. А., Остин К. К., Мася Л., Ли П. Иссечение лобковой кости и промежностная уретрэктомия для радикального иссечения переднего отдела во время экзентерации таза. Dis Colon Rectum. 2015. 58 (11): 1114–1119. [PubMed] [Google Scholar] 26. Соломон М. Дж., Тан К. К., Бромилов Р. Г., Аль-мозани Н., Ли П. Дж.Сакрэктомия через абдоминальный доступ при экстентерации таза. Dis Colon Rectum. 2014. 57 (2): 272–277. [PubMed] [Google Scholar] 27. Колибасиану Д. Т., Дозойс Э. Дж., Матис К. Л. и др. Расширенная резекция крестцово-тазового отдела при локально рецидивирующем раке прямой кишки: может ли это быть безопасно и с хорошими онкологическими исходами? Dis Colon Rectum. 2014; 57 (1): 47–55. [PubMed] [Google Scholar] 28. Акиёси Т., Нагата Дж., Нагасаки Т. и др. Лапароскопическая спасательная латеральная тазовая лимфатическая диссекция для локально рецидивирующего рака прямой кишки.Colorectal Dis. 2015; 17 (10): O213 – O216. [PubMed] [Google Scholar] 29. Shaikh I, Aston W., Hellawell G. и др. Расширенное иссечение боковой стенки таза (ELSiE): подход к оптимизации полной резекции при местнораспространенном или рецидивирующем раке прямой кишки с поражением боковой стенки таза. Tech Coloproctol. 2014. 18 (12): 1161–1168. [PubMed] [Google Scholar] 30. Тан Дж., Хериот А.Г., Маккей Дж. И др. Проспективное исследование интраоперационной лучевой терапии местнораспространенным или рецидивирующим раком прямой кишки в одной руке.J Med Imaging Radiat Oncol. 2013. 57 (5): 617–625. [PubMed] [Google Scholar] 31. Мирнезами Р., Чанг Дж., Дас П. и др. Интраоперационная лучевая терапия при колоректальном раке: систематический обзор и метаанализ методов, отдаленные результаты и осложнения. SurgOncol. 2013. 22 (1): 22–35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Хирургия локально рецидивирующего рака прямой кишки: советы, хитрости и подводные камни
Clin Colon Rectal Surg. 2016 июн; 29 (2): 114–122.
, MBBS, MS, FRACS, 1, 2 , MD, MBA, FRACS, 1 и, МБЧБ, MMedSci, FRACS 1
Сатиш К.Warrier
1 Отделение онкологической хирургии, Онкологический центр Питера МакКаллума, Восточный Мельбурн, Виктория, Австралия
2 Отделение колоректальной хирургии, Alfred Health, Мельбурн, Виктория, Австралия
Александр Г. Хериот
1 Отделение онкологической хирургии, Онкологический центр Питера МакКаллума, Восточный Мельбурн, Виктория, Австралия
Эндрю Крейг Линч
1 Отделение онкологической хирургии, Онкологический центр Питера МакКаллума, Восточный Мельбурн, Виктория, Австралия
1 Отделение Хирургия рака, Онкологический центр Питера МакКаллума, Восточный Мельбурн, Виктория, Австралия
2 Отделение колоректальной хирургии, Alfred Health, Мельбурн, Виктория, Австралия
Адрес для корреспонденции Сатиш К.Warrier, MBBS, MS, Отделение онкологической хирургии FRACS, Онкологический центр Питера МакКаллума, Сент-Эндрюс-Плейс, Восточный Мельбурн, VIC 3002, Австралия, moc.oohay@10169hsitas Эта статья цитируется в других статьях в PMC.
Abstract
Рак прямой кишки может рецидивировать локально у 10% пациентов, которым выполняется радикальная резекция по поводу первичного рака. Хирургическое вмешательство считается целесообразным в лечебных учреждениях, а также в некоторых случаях с паллиативной целью. Безрецидивная выживаемость после восстановительной резекции зависит от достижения границы резекции R0.Необходимо четкое понимание прикладной хирургической анатомии, соответствующее предоперационное планирование и мультидисциплинарный подход к агрессивной резекции мягких тканей, костей и сосудов с соответствующей реконструкцией. Обсуждаются технические советы, приемы и подводные камни, которые могут помочь в лечении этих видов рака, а также обсуждается роль дополнительной импульсной лучевой терапии и интраоперационной лучевой терапии в лечении таких видов рака.
Ключевые слова: экзентерация таза, рак прямой кишки, рецидив рака, колоректальная хирургия
Предпосылки
Колоректальный рак (CRC) является третьим по распространенности раком у мужчин и вторым по частоте у женщин. 1 До одной трети CRC возникает из-за новообразований в прямой кишке, где в большинстве случаев цель лечения остается излечивающей. 1 К сожалению, от 6 до 13% таких случаев рецидив заболевания в области таза и / или промежности может стать проблемой для хирурга. 2 Исторически частота местных рецидивов (ЛР) составляла 32% после первичной лечебной резекции прямой кишки, и, возможно, наиболее известно, что контрольная группа шведского исследования рака прямой кишки имела 5-летнюю частоту ЛР 27%. 2 3 4 Распространение и популяризация тотального мезоректального иссечения (т. Е. Стандартизированной техники экстрафасциальной диссекции мезоректума с максимальным учетом эмбриологических плоскостей) и улучшение предоперационной лучевой терапии и химиотерапии снизили бремя этого заболевания. для лечащих врачей. 4 5 6 7
Почти у половины пациентов с рецидивом рака прямой кишки болезнь ограничена тазом и может считаться технически резектабельной. 2 8 В настоящее время установлено, что радикальное хирургическое вмешательство дает этим пациентам наилучшие шансы на долгосрочное выживание. 9 10 11
В этой статье рассматривается предоперационный отбор потенциально оперативных кандидатов, важность предоперационной оценки и мультидисциплинарный подход к лечению. В нем также рассматриваются технические советы и приемы, связанные с поливисцеральной резекцией на основе анатомического участка рецидива.В нем обсуждается потенциальная роль импульсной радиации и роль интраоперационной лучевой терапии (ИОЛТ) в лечении рецидивирующего рака прямой кишки.
Сроки и факторы риска местного рецидива
Большая часть ЛР возникает в течение 2 лет после первичной операции, хотя может возникнуть и позже. Хериот и его коллеги сообщили, что 43% LR были обнаружены через 48 месяцев после первичной операции, 9 , в то время как отдельное исследование Sagar и его коллег показало, что 40% LR произошли через 36 месяцев. 10
Продвинутые первичные опухоли более склонны к LR, особенно если существует угроза или вовлечение периферической резекции края (CRM), плохая дифференцировка, лимфоваскулярная инвазия, венозная или периневральная инвазия, непроходимость или перфорация опухоли. 8 Авторы также предполагают, что время LR может быть отложено, если неоадъювантная химиолучевая терапия используется до окончательной первичной резекционной операции.
Лечение рецидивирующего рака прямой кишки
Лечение рака прямой кишки является многопрофильным.Это требует специального участия нескольких команд. Цели состоят в том, чтобы улучшить качество жизни (QOL) за счет контроля симптомов, продлить выживаемость и обеспечить лечение, где это возможно, при минимизации сопутствующей заболеваемости. Важно отметить, что после мультидисциплинарной оценки многие пациенты с рецидивирующим заболеванием могут не приступить к операции, и многие факторы влияют на решение оперировать или нет.
Бремя метастатического заболевания, размер опухоли и инфильтрация соседних структур, а также состояние пациента — все это влияет на решение о продолжении обширной резекционной операции.Неоперационные стратегии лечения, такие как дистанционная лучевая терапия или паллиативная химиотерапия, не обеспечивают возможности излечения, со средней выживаемостью около 5 месяцев. 2 12 Неоперационные методы лечения могут играть роль в ведении пациентов, получающих паллиативное лечение. Формирование стомы, установка нефростомы и мочеточниковые стенты могут использоваться выборочно, особенно когда радикальное хирургическое вмешательство считается нецелесообразным.
Традиционно абсолютными противопоказаниями считались карциноматоз брюшины, высокое поражение крестца, закрытие внешних подвздошных сосудов, инвазия седалищной вырезки, двусторонняя непроходимость мочеточника с двусторонним гидронефрозом и наличие грубого отека нижних конечностей (в дополнение к неоперабельным отдаленным метастазам). к тазовой экстренной хирургии. 8 Многие из этих догм были поставлены под сомнение, поскольку экстренные центры по всему миру расширяют традиционные границы резекции.
Обширная резекция может происходить за счет функционального компромисса. Однако пациенты с прогрессирующим злокачественным новообразованием таза без резекции также могут страдать от сильной боли от костной, мышечной или нервной инвазии. 13 14 Янг и его коллеги оценили показатели качества жизни у 148 пациентов, перенесших экстренную операцию, и сравнили их с пациентами, которые не получали это лечение. 15 Исследование показало, что пациенты относительно быстро восстанавливались после операции, и через 3 месяца, по многим показателям качества жизни, кривые Каплана-Мейера времени до ухудшения, по-видимому, пересекались с пациентами из неоперационной группы, которые продолжали испытывать медленное отклонить. 15
Команда расширения: многие руки делают легкую работу
Важно создать команду расширения. Эти случаи могут быть технически сложными, и наличие бригады, которая регулярно выполняет сложные поливисцеральные резекции, может сократить время операций и уровень стресса персонала операционной и улучшить результаты.Помимо регулярных назначенных специализированных урологов, пластических хирургов, хирургов-ортопедов и потенциально сосудистых хирургов в отдельных случаях, важно, чтобы экстренный хирург (колоректальный хирург с опытом хирургии рака и тазовой эксентерации) взял на себя ведущую роль в пред- и интраоперационном решении. -изготовление. Наш подход состоит в том, чтобы в большинстве случаев иметь двух специальных хирургов-колоректальных хирургов. Мы обнаружили, что такой подход сокращает время операции и, хотя и не количественно, снижает стресс в операционной.Совместное принятие решений также может быть полезным, особенно при попытке сохранить органы (например, часть мочевого пузыря, простату или основные нервы). В дополнение к этим людям, опытные медицинские и радиационные онкологи, а также радиологи, ядерные врачи и патологи помогают участвовать в заседаниях совета по опухолям и обсуждениях с участием энтеростомических терапевтов, психологов, диетологов и медицинских сестер-специалистов по лечению рака.
Переоблучать или нет?
Многие пациенты после операции по поводу рака прямой кишки, направляемые на операцию, прошли стандартный длительный курс химиолучевой терапии (50.4Gy) ранее. Наши онкологи-радиологи определяют количество полученного излучения и показания к нему. Если период времени превышает 2 года, многие наши пациенты получат повторное облучение. Профиль безопасности и эффективности этого режима был сформулирован Ng и его коллегами. 16 Гурен и его коллеги недавно завершили систематический обзор возможности повторного облучения. 17 В исследовании участвовали 375 пациентов, повторно облученных по поводу рецидивирующего рака прямой кишки, и сообщалось об общем низком уровне острой токсичности.Авторы рекомендовали использовать гиперфракционированную химиолучевую терапию для ограничения поздней токсичности. 17
Местный рецидив — где он?
В литературе описано несколько систем классификации. Группа Мэйо описала рецидив в зависимости от локализации (крестцовый, передний, левый или правый) и в зависимости от степени фиксации. 18 Ванебо и его коллеги описали это на основе более традиционной системы метастазов опухолевых узлов, обозначив «R» для рецидива. 19 Мур и его коллеги из Мемориального онкологического центра им. Слоуна Кеттеринга описывают LR в зависимости от того, является ли рецидив осевым (включая анастомоз, промежность, периректальные мягкие ткани), передним (включая мочеполовой тракт), задним (крестец или копчик) или латеральным (костная боковина ). 20 Бойл и его коллеги описывают рецидивы как центральные, крестцовые, боковые или композитные (когда рецидив затрагивает крестец или боковую стенку). 21
В этой статье описываются отсеки согласно Мур и его коллег; Однако стоит отметить, что каждый отсек может создавать технические проблемы.Первый — это центральный отсек . Хотя рецидивы здесь теоретически проще технически, все же требуется бдительность, чтобы гарантировать выполнение резекции R0. Например, если у пациента есть центральный рецидив после стандартной нижней передней резекции, часто требуется экстралеваторная абдоминоперинеальная резекция с сопутствующей копцигэктомией, чтобы гарантировать достижение R0. Второй, передний отсек , может быть технически более подходящим, но создает уникальные проблемы.Здесь часто обращаются за урологической помощью, и следует рассмотреть возможность как половой уретрэктомии, так и комбинированного иссечения лобковой кости, чтобы повысить частоту R0 в случаях высокого риска. Задний отсек обычно костный (хотя во многих классификациях относится к структурам, расположенным позади маточно-влагалищной оси). Крестец можно удалить в положении лежа на животе или при абдоминолитотомии. В последнее время уровень диссекции расширился, и композитные резекции S1 / L5 считаются возможными; тем не менее, здесь необходимы опытные специалисты-ортопеды или нейрохирурги, чтобы избежать катастрофических последствий и повышения заболеваемости.Боковые рецидивы традиционно были наиболее сложными для выполнения резекции R0.
Программа реабилитации и периоперационный уход
Пациенты, перенесшие сложные операции на органах малого таза, подвергаются повышенному риску серьезных сердечных, респираторных, тромботических и раневых осложнений. Специальная программа реабилитации может снизить этот риск. 22 Это включает раннюю активную сердечно-легочную оценку пациентов и программы упражнений по мере необходимости. Программа включает скоординированное формирование у пациентов толерантности к физической нагрузке, чтобы уменьшить воздействие стрессовых факторов операции.Программа также помогает компенсировать потерю физической формы во время фазы неоадъювантного лечения. 22 После первичного облучения или повторного облучения многие пациенты входят в катаболическую фазу, и в интервале между повторным облучением и операцией (часто 10–12 недель) диетологи нашего отделения активно стремятся улучшить питание за счет дополнительных высококалорийных и высокобелковых добавок. напитки. Это позволяет пациентам находиться в наилучшем возможном состоянии, чтобы противостоять серьезным экзентерациям. Опытный анестезиологический менеджмент с надлежащим мониторингом жидкости, защитой зоны давления и контролем температуры дополняется программой раннего восстановления, независимо от продолжительности операции.Хериот и его коллеги сообщили о первоначальном австралийском опыте расширенной радикальной резекции по поводу локально рецидивирующего рака прямой кишки. 9 Данные включали пациентов из Онкологического центра Питера МакКаллума в Мельбурне, Королевского принца Альфреда в Сиднее и больницы Крайстчерча (Крайстчерч, Новая Зеландия), все специализированные лечебные центры. Из 160 пациентов у 61% был край резекции R0, и наблюдалась только одна периоперационная смерть. Это отражает наш постоянный опыт работы с расширенными резекциями.
Наш стандартный подход
Пациенты размещаются в модифицированном положении Ллойда – Дэвиса, при этом обе руки всегда заправлены боком, чтобы обеспечить доступ к тазу как первичному хирургу, так и ассистенту. Если предполагается сакрэктомия, то два 2-литровых мешка с физиологическим раствором помещаются под поясничную область, чтобы поднять дистальный отдел крестца. После лапаротомии по средней линии и адгезиолиза проводится оценка заболевания брюшины и метастазов в печени. Нашим предпочтительным самоудерживающимся ретрактором является Balfour-Doyen, поскольку он обеспечивает более близкий доступ к пациенту.Третья рука используется исключительно для рассечения таза. Первоначальная диссекция включает оценку петель тонкой кишки, которые могут прилегать к новообразованию. Потенциальная ловушка для хирургов состоит в том, чтобы попытаться освободить тонкую кишку напрямую от новообразования или, в качестве альтернативы, использовать резкое рассечение, чтобы освободить тонкую кишку от новообразования. Если придерживаться такой стратегии, существует значительный риск разрыва опухоли. В таких случаях петли тонкой кишки рассекают и резецируют enbloc. Это может включать резекцию нескольких отдельных петель, прикрепленных к опухоли.Авторы предлагают использовать передне-задний доступ, при котором слои прикрепленной тонкой кишки последовательно сшиваются и отделяются от опухоли до тех пор, пока тонкая кишка полностью не освободится ().
Передний и задний отдел тонкой кишки прошивают скобами для доступа к образованию.
После доставки пакета тонкой кишки рассечение начинается с полной мобилизацией левой толстой кишки для удобного доступа. Часто необходимо мобилизовать и правую кишку.Мочеточники идентифицируются с обеих сторон (мочеточниковые катетеры устанавливаются в начале лечения, если не планируется цистэктомия) и закрепляются с помощью силиконовых петель для сосудов. Экстрафасциальная плоскость (полная мезоректальная иссеченная задняя плоскость) отслеживается сзади, если не подозревается опухоль. Мобилизация правого мочеточника продолжается вниз по направлению к пузырно-мочеточниковому соединению. Если у мужчины предполагается переднее разгибание, то мочевой пузырь мобилизуют по позадилонному пространству вниз по направлению к поднимающей пластине спереди.Урологические данные можно запросить, хотя важно, чтобы колоректальный хирург диктовал плоскость рассечения и уровень уретрального отдела. В большинстве случаев уретру можно разделить, взяв дорсальный венозный комплекс из переднего доступа.
Центральные рецидивы
Степень резекции зависит от степени заболевания. Мирнезами и Сагар описали трансперинеальный доступ к изолированным рецидивам; однако в большинстве случаев это невозможно. 10 При поражении мочеполовых структур лучше всего вводить enbloc. 8
Если поражены только матка и влагалище, их можно резецировать с чистым краем. В этой части может помочь специалист-гинеколог-онколог. Цель гистерэктомии enbloc в этой ситуации — обеспечить резекцию R0. После полного уретеролиза круглую связку, широкую связку и питающие сосуды гонад можно перевязать отдельно. Используя тампон на держателе во влагалище, абдоминальный хирург может точно разрезать и открыть влагалище ниже шейки матки, а усовершенствованное биполярное или ультразвуковое устройство можно использовать для прорыва задней стенки, а также для освобождения притоков, проходящих в матку. .На этом этапе во влагалище, пока оно открыто, не будет опухоли, и можно точно определить уровень разделения прямой кишки. В случаях, когда требуется задняя вагинэктомия как часть абдоминоперинеальной резекции enbloc, предпочтительнее использовать двойной хирургический подход сверху и снизу. Пример этого показан на.
Резекция матки и задней части влагалища единым блоком с абдоминоперинеальной резекцией (APR) прямой кишки. ( a ) Интраоперационный вид созданной полости с неповрежденной передней частью влагалища.( b ) Образец после блочной резекции матки и задней части влагалища с APR.
Хотя при большинстве рецидивов малого таза вполне вероятно, что необходима абдоминоперинеальная резекция (из-за фиброза и предшествующего низкого анастомоза), это, конечно, не всегда так. У некоторых пациентов возможен реанастомоз, или проводится процедура low Hartmann, чтобы избежать болезненности раны промежности. 9
щадящие тазовые органы
щадящие расширения мочевого пузыря рассматриваются только выборочно.Энблок-семенная везикулэктомия или простатэктомия рассматриваются, если первичная опухоль прилегает к простате или минимально проникает в простату без вовлечения других мочеполовых структур. 23 Тернер и его коллеги опубликовали свой опыт проведения 10 простатэктомий enbloc по сравнению с 20 цистопростатэктомиями enbloc в Крайстчерче (Крайстчерч, Новая Зеландия). 24 Серия показала, что у одной трети пациентов была моча, и эректильная функция была серьезно нарушена.Сохраняются опасения относительно урологической функции, а также потенциального риска мочеиспускания и свищей.
Если опухоль проникает в купол мочевого пузыря или упирается в него, можно выполнить частичную цистэктомию с использованием двухслойного закрытия. Оценить степень поражения мочевого пузыря может быть сложно. Если предоперационная оценка выявляет инвазию около треугольника, можно использовать один из методов — наполнить мочевой пузырь водой, чтобы облегчить резекцию и сохранить как можно больше мочевого пузыря.В качестве альтернативы можно использовать цистотомию, чтобы обнажить устья мочеточника и, следовательно, точно определить треугольник.
У женщин центральная точка экстентерации включает матку, шейку матки или свод влагалища. При рецидивах свода влагалища мы предпочитаем следовать в мочеточниковой, а не в сосудистой плоскости и оставаться позади прямой кишки. Если требуется полная задняя вагинэктомия, то для облегчения этого выполняется полная гистерэктомия. Перед резекцией проводится тщательное обсуждение вопросов фертильности, менопаузального статуса и половой функции.
Четкая граница резекции (как микроскопическая, так и макроскопическая) остается целью из-за ее значительного влияния как на локальный, так и на отдаленный рецидив, а также на выживаемость. 9 Неудивительно, что поражение краев (R1 или выше) связано с нарушением выживаемости. Задействованные макроскопические запасы (R2) связаны с худшими результатами. Боковые рецидивы также привели к значительно худшей общей выживаемости. 9
Передние рецидивы: расширение границ
Передние рецидивы могут создавать уникальные проблемы.Иссечение может быть проведено сопровождающим урологом, участвующим в предоперационном планировании. Важно, чтобы экстренный хирург определил, где происходит рассечение передних структур. Наше отделение регулярно выполняет повторную диагностику (КТ, МРТ, ПЭТ-сканирование) при запущенных рецидивных формах рака прямой кишки после предоперационной химиолучевой (или повторной) терапии.
Центральной точкой оси переднего отдела тазового дна является уретра. 25 Передний отдел ограничен лобковым сочленением, а также верхним и нижним лонными ветвями.Местно-распространенный рак прямой кишки (а также опухоли мягких тканей мочевого пузыря, простаты, вульвы, влагалища, шейки матки) может примыкать к этому краю. По нашему опыту, существует риск положительного переднего края, особенно если рассечение уретры проводится через абдоминальный доступ. Кроме того, перевязка дорсального венозного комплекса может быть сложной задачей в области облучения, что сопряжено с риском значительной кровопотери.
Наш подход к определенным передним рецидивным опухолям заключается в доступе к уретре через промежностный доступ.Пример этого приведен в разделе с выделением правильной плоскости уретрального отдела.
( a ) Сагиттальная МРТ показывает как неправильную линию уретрального отдела (красная стрелка), так и правильную линию уретрального отдела (зеленая стрелка). ( b ) Разрез «слезинки» для перинеального доступа к отделу уретры. ( c ) Промежуточная уретрэктомия для обнажения нижних ветвей лобка.
Авторский подход заключался в операции в положении абдоминолитотомии с пациентом в крутом Тренделенбурге.Для доступа к луковично-губчатой мышце после подкожной диссекции выполняется отдельная дорсальная прорезь для удлинения кожи. Затем мышцы отрываются от надкостницы нижних лобковых ветвей. Основание полового члена зашиваем швом 0-Викрил (полиглактин). Затем визуализируют уретру с пересечением мочевого катетера. Мочевой катетер зажимается с обеих сторон, чтобы предотвратить утечку. Это обеспечивает легкий передний доступ для проведения диссекции абдоминальной бригады.
Соломон и его коллеги описывают новую и более обширную резекцию лобковой кости по поводу опухоли, поражающей нижние ветвь лобковой кости. 25 Доступ к кости такой же, как описано выше, но рассечение продолжается до мобилизованной плоскости передней стенки на верхней стороне лобка. Это позволяет полностью подвешивать брюшную стенку, половой член и мошонку. После перевязки сосудов притоков внутренней подвздошной кости можно пересечь верхнюю и нижнюю лобковые ветви от седалищной кости с помощью осциллирующей пилы.Можно выбрать либо полное иссечение композитной лобковой кости, либо частичное иссечение лобковой кости, включая нижние лобковые ветви и нижнюю половину лобкового симфиза, с сохранением верхних лобковых ветвей. 25 Эта стратегия важна при хирургическом лечении сложных передних опухолей. Важно, чтобы экстренные хирурги были знакомы с такими методами.
Резекция заднего отсека и расширенная костная резекция
В то время как многие авторы отстаивают метод сакрэктомии лежа на животе, наш подход заключается в выполнении сакрэктомии с использованием абдоминолитотомии, особенно если уровень резекции крестца не превышает S3.Это особенно полезно, когда на процедуре присутствуют два экстренного хирурга. Тщательное планирование с правильным расположением пациента имеет решающее значение для процедуры. Пациент находится в модифицированной позе Ллойда-Дэвиса, обе руки подвернуты, а промежность находится далеко за «разрывом» в операционном столе. Таз проталкивается кпереди двумя большими солевыми мешками под поясничной областью. 26 Мы считаем, что абдоминолитотомия обеспечивает больший доступ к латеральному отделу, лучший контроль над основными сосудами и обнажение пояснично-крестцового ствола в тазу с рассечением седалищного нерва в более латеральном направлении.Он также позволяет точно разместить вертикальный миокожный лоскут прямой мышцы живота (VRAM).
Операция начинается с абдоминального доступа. Соответствующая подвздошная сосудистая сеть изолируется в зависимости от предполагаемой степени резекции. Использование открытого биполярного устройства, такого как LigaSure Impact (LigaSure (Stryker), Tempe, AZ), может значительно облегчить рассечение таза.
Передний край рассечения определяется степенью поражения мягких тканей (мочевого пузыря, влагалища, простаты и уретры в тазу) и костной ткани (лобка).Когда трансабдоминальная фаза рассечения близится к завершению, промежностная фаза рассечения начинается вторым экстренным хирургом. Вокруг анального края делается эллиптическое иссечение; однако, если требуется сакрэктомия, выполняется дополнительный задний разрез, чтобы облегчить доступ к крестцу. Рассечение ишиоанальных жировых подушечек выполняется по окружности, и рассечение продолжается кзади от копчика и крестца. Большую ягодичную мышцу отделяют от крестца и продолжают рассечение кзади до позвоночника S2.Крестец полностью обнажен с отсеченными от кости связками (крестцово-копчиковая связка) и мышечными структурами.
Абдоминальный хирург будет использовать электрокоагуляцию, чтобы открыть пресакральную фасцию и мышцы (грушевидную мышцу), чтобы обнажить передний крестец. Спица Киршнера (K) вводится в крестец на уровне рассечения, обеспечивая хирургу промежности гибкий ретрактор кзади от крестца на соответствующем уровне, чтобы гарантировать, что кожа заднего отдела не будет повреждена.Остеотом увеличенной длины и молоток используются для выполнения сакрэктомии от медиального до латерального направления.
Выше уровня S3 для костной резекции предпочтительнее доступ лежа на животе. Угол крестца затрудняет сакрэктомию в положении литотомии выше этого уровня. В отдельных случаях в опытных центрах возможна расширенная резекция крестцово-тазового отдела. В этих случаях очень важны сосудистое облучение и контроль. Обнажаются нижняя аорта, полая вена, а также дистальные подвздошные артерии и вены.Техника включает лигирование ветвей внутренней подвздошной артерии дистальнее заднего отдела ветви верхней ягодичной артерии. Это сохраняет приток крови к ягодичным мышцам и мягким тканям промежности. Последовательно разделяются внутренняя подвздошная вена и несколько ее притоков.
Подвздошный канал и колостома создаются во время абдоминальной фазы операции. Выявляется уровень пояснично-крестцового рассечения и выполняется однокортикальная передняя остеотомия.Титановый винт устанавливается на уровне места остеотомии. Это позволяет выполнять точную заднюю остеотомию с помощью интраоперационной рентгеноскопии.
Вторая часть процедуры предполагает размещение пациента в положении лежа. Вдоль крестца делается задний срединный разрез, и большая ягодичная мышца освобождается от прикрепления. Крестцово-остистая и крестцово-бугристая связки разделяются для доступа к полости таза сзади. Мышцы грушевидной мышцы разделены, защищая седалищный и половой нервы.Затем выполняются ламинэктомия, перевязка дурального мешка (с нейрохирургической или ортопедической помощью) и резекция крестца. 26
Высокая резекция позвоночника может привести к нестабильности позвоночника, требующей реконструкции. Colibaseanu и его коллеги описывают использование позвоночно-тазовой стабилизации с задним тазовым спондилодезом от нижнего поясничного отдела позвоночника до оставшегося таза, поскольку более высокие резекции могут нарушить позвоночно-тазовую целостность. 27 Реконструкция выполняется с использованием двойных трансплантатов малоберцовой кости и инструментальной стабилизации от нижней поясничной области до оставшейся части таза.У 28 из 30 пациентов была резекция R0 в первоначальной серии по Колибасиану и его коллегам, без операционной смертности. 27 Ранняя послеоперационная заболеваемость была высокой (40% III / IV степени по классификации Clavien). Половина пациентов страдала хронической болью и более 20% имели симптомы невропатического мочевого пузыря. Почти половине из них потребовалась амбулаторная помощь. В целом 2- и 5-летняя выживаемость составила 86 и 46% соответственно, хотя и ограничивалась короткой средней продолжительностью наблюдения (2,7 года). 27 Серия демонстрирует, что пояснично-крестцовая резекция возможна, однако, со значительными краткосрочными осложнениями и с некоторыми функциональными нарушениями.
Рецидивы боковых стенок таза
LR может распространяться на боковые стенки таза. Такой рецидив является сложной задачей и в нашей практике является наиболее частой причиной рассмотрения интраоперационного облучения. Рецидивирующие опухоли могут распространяться на мягкие ткани боковой стенки, мочеточников, подвздошных сосудов, седалищного нерва, грушевидной мышцы и костей таза. Из-за ограничений костного таза этот тип рецидива по-прежнему имеет худший прогноз и является наиболее частым местом для положительного края. 9
Понимание анатомии в этой области имеет решающее значение, поскольку эта плоскость находится за пределами компетенции большинства колоректальных хирургов. Медиальный край наружной подвздошной вены обеспечивает доступ к медиальной стороне большой поясничной мышцы. Это, в свою очередь, является медиальной границей внутренней запирательной мышцы, которая представляет собой ключевую точку рассечения для рассечения боковой стенки таза. Перед операцией необходимо установить двусторонние мочеточниковые стенты, а мочеточник медиализовать до пузырно-мочеточникового перехода.Затем последовательно идентифицируются и лигируются внутренние подвздошные притоки. Внутреннюю запирательную оболочку можно частично удалить, если она задействована, что потенциально может принести в жертву запирательный нерв. Сохранение запирательного нерва возможно, если заболевание изолировано и цель состоит в том, чтобы очистить рецидивирующие боковые лимфатические узлы боковой стенки таза. При необходимости внутреннюю подвздошную артерию и вену можно перевязать, при необходимости взяв притоки для удаления образования боковой стенки и лимфатических узлов. Такое рассечение должно обеспечить полную визуализацию пояснично-крестцового ствола с последующим каудальным рассечением, позволяющим визуализировать и, при необходимости, рассечение грушевидной мышцы и корешков чревных нервов.
Ловушка для хирурга — отсутствие контроля над внешними и внутренними подвздошными сосудами. Мы выступаем за использование сосудистых петель и наличие сосудистых зажимов, необходимых для перевязки сосудов. Хотя большая часть диссекции выполняется резко, мы обнаружили, что арахисовый тампон и выборочное использование энергетических устройств (как передовая биполярная технология, так и ультразвуковая энергия) могут быть полезными. Опытная помощь важна. указывает на рассечение боковой стенки таза с интраоперационным облучением или без него.На рисунках также показано обнажение бедренного нерва, внутренняя резекция подвздошной кости и наружная резекция подвздошной кости с реконструкцией.
Расширение границ вбок. ( a ) Стандартная диссекция боковой стенки таза. ( b ) Боковая резекция R0 боковой стенки таза с последующей ИОЛТ. ( c ) Резекция подвздошной и большой поясничной мышцы и сохранение бедренного нерва. ( d ) Резекция внутренней подвздошной артерии. ( e ) Резекция сосудов единым блоком левой общей подвздошной артерии и вены.( f ) Реконструкция сосудов с пересечением правой бедренной артерии и левой бедренной артерии и трансплантатом подкожной вены для левой общей подвздошной вены.
Появляются сообщения из Японии, которые демонстрируют, что лапароскопический доступ к этому рассечению возможен у пациентов с низким индексом массы тела. 28 Мочеточник должен быть изолирован и медиализован до пузырно-мочеточникового перехода. Открытые наружные подвздошные сосуды позволят обнажить внутреннюю запирательную мышцу медиально.Это рассечение может продолжаться до мускулатуры леваторани. Ткань медиальнее медиальной пупочной связки должна быть рассечена для выборочного рассечения и перевязки запирательных сосудов. Соединение внутренней подвздошной артерии и вены может быть медиализовано, чтобы обнажить пояснично-крестцовый ствол ниже, и дальнейшее рассечение позволит получить доступ к передней части грушевидной мышцы. Сосуды infrapiriformis и последующие передние ветви внутренних подвздошных сосудов могут быть перевязаны последовательно.Внутренние подвздошные сосуды можно взять с помощью сосудистого степлера или наложить шовную нить нерассасывающимся монофиламентным швом. Внутренние ветви таза можно пожертвовать, а грушевидную мышцу можно частично или полностью разделить.
Группа St.Marks описала свой опыт расширенного иссечения боковой стенки таза в ходе шести резекций R0 по поводу рецидивов боковой стенки. 29 Авторы описывают две фазы диссекции: экстратазовую фазу и абдоминальную фазу.Пациента сначала кладут на живот, а рассечение продолжается до ягодичных мышц. Ягодичная мышца отражается сбоку и снизу, обнажая поясничную фасцию и крестцово-остистую связку. Это позволяет обнажить грушевидную мышцу, которая проходит через выемку и лежит над седалищным нервом. Грушевидная мышца делится на латеральном направлении, где становится сухожильной. Если опухоль распространяется на мышцу, возможно, придется пожертвовать ягодичной мышцей. Обнажается седалищная вырезка и идентифицируются седалищный нерв, верхняя и нижняя ягодичные артерии.Рассечение надкостницы и кости проводится за пределами переднего крестца по средней линии. Идентифицируются и разделяются крестец и крестцово-бугристые связки. Затем медиализуются разделенные седалищный отдел позвоночника и связка. Авторы описывают использование этого подхода к нижним и верхним ягодичным артериям с соответствующими мышцами. Седалищный нерв приносят в жертву путем инфильтрации местного анестетика и разделения его скальпелем при условии сохранения ипсилатерального бедренного нерва. Масса ткани мобилизуется, чтобы ее можно было продвинуть через седалищную выемку.После этого абдоминальная фаза начинается с того, что абдоминальный хирург приносит в жертву внутреннюю подвздошную кость на ипсилатеральной стороне. Уровень сосудистого деления зависит от того, приносится ли в жертву верхняя ягодичная артерия. 29
Интраоперационная лучевая терапия
ИОЛТ обеспечивает усиленное облучение ложа опухоли после хирургической резекции опухоли. В большинстве ретроспективных серий случаев описывается интраоперационная электронная терапия, но несколько центров могут проводить ИОЛТ с высокой мощностью дозы. 30 Преимущество этого метода заключается в том, что гибкие аппликаторы, изготовленные по индивидуальному заказу, можно использовать для точной доставки одной большой фракции излучения (обычно 5 Гр). Проникновение только на короткое расстояние, поэтому его можно использовать в случаях, когда хирургические поля близки или вовлечены. Из-за своей ограниченной доступности ИОРТ не получил широкого распространения. ИОЛТ — это дополнение, а не замена агрессивной хирургической резекции. Резекция R2 с ИОЛТ не считается приемлемой лечебной стратегией; тем не менее, там, где хирургический край резекции находится близко (обычно костная боковая стенка), ИОЛТ может предложить дополнительное лечение 5 мм.Преимуществами являются минимальная токсичность, бережное отношение к здоровым тканям и короткое время лечения (30 минут) с возможностью уменьшения рецидивов. 30 Мочеточник и нервы можно защитить с помощью свинцовых экранов ().
Систематический обзор, оценивающий преимущества ИОЛТ, продемонстрировал значительную неоднородность исследований, но улучшил 5-летний местный контроль, а также безрецидивную и общую выживаемость у пациентов, перенесших ИОРТ, без различий в заболеваемости. 31
Варианты реконструкции
Дефекты промежности, возникающие при разрастании таза, часто бывают большими.Были описаны многие методы, включая использование кожно-мышечных лоскутов на брюшной полости, ягодичных лоскутов или паховых лоскутов на ножке. Мы предпочитаем реконструкции лоскута VRAM, потому что они позволяют здоровой сосудистой ткани заполнить созданное мертвое пространство. Наш пластический хирург извлечет лоскут предпочтительно с правой стороны (если не выполнялась предварительная илеостомия или подвздошная кишка). Этот лоскут также можно использовать для воссоздания задней стенки влагалища. Мы обычно не используем профилактическую сетку, чтобы укрепить мышечный дефект, образовавшийся в результате сбора мышечной ткани.Если расширенная резекция выполняется лапароскопически, то чаще всего используют кожно-мышечный лоскут нижней ягодичной артерии. Послеоперационный уход требует частого переворачивания из стороны в сторону и регулярного наблюдения за лоскутом. Следует избегать сидения, и часто можно начинать ходить примерно через неделю после операции.
Дополнения к уходу: сексуальная функция, функция мочеиспускания и установка стомы
Размещение стомы, сексуальная функция и функция мочеиспускания — все это зависит от радикальной расширенной резекции таза, и специализированные центры должны иметь услуги для удовлетворения этих потребностей.
Стома должна располагаться на расстоянии не менее 3 см от реберного края, от гребня подвздошной кости и внутри прямой мышцы. Обследование как в положении стоя, так и в положении сидя позволит оптимально сидеть при стоме и избежать образования складок. В случае двойной стомы уростома размещается выше, чем колостома, чтобы ремни стомы не соприкасались.
Когда используется лоскут VRAM, фиксированные анатомические маркеры (например, линия соска) используются в качестве точки компаса, учитывая неопределенность окончательного положения кожи.
В нашем центре есть специализированная клиника сексуального здоровья и эректильной дисфункции. Несмотря на то, что спонтанная эрекция после передних экстензий является необычной, с соответствующей помощью (например, ингибиторами ФДЭ5 или инъекционными препаратами) эти симптомы могут улучшиться. 32
Заключение
Лечение рецидивирующего рака прямой кишки является сложной задачей. Необходим мультидисциплинарный подход с участием специалистов при раннем принятии решений, предоперационном планировании, интраоперационном вскрытии и послеоперационном уходе.Повторное облучение и интраоперационное облучение могут использоваться выборочно для улучшения результатов с приемлемой заболеваемостью. Понимание потенциальных областей, вызывающих беспокойство, с точки зрения положительной маржи и расширения традиционных плоскостей может привести к хорошим онкологическим результатам.
Ссылки
1. Рак в Австралии, обзор, 2006 AIHW cat .; 2007
2. Лопес-Костнер Ф., Фацио В. В., Виньяли А., Рыбицки Л. А., Лавери И. С. Местно-рецидивирующий рак прямой кишки: предикторы и успех спасательной операции. Dis Colon Rectum.2001. 44 (2): 173–178. [PubMed] [Google Scholar] 3. Повышение выживаемости при предоперационной лучевой терапии при резектабельном раке прямой кишки. Шведское исследование рака прямой кишки. N Engl J Med. 1997. 336 (14): 980–987. [PubMed] [Google Scholar] 4. Kapiteijn E, Marijnen C A, Colenbrander A. C. и др. Локальный рецидив у пациентов с раком прямой кишки, диагностированный в период с 1988 по 1992 год: популяционное исследование в западных Нидерландах. Eur J SurgOncol. 1998. 24 (6): 528–535. [PubMed] [Google Scholar] 5. Макфарлейн Дж. К., Райалл Р. Д., Хилд Р. Дж.Мезоректальное иссечение при раке прямой кишки. Ланцет. 1993. 341 (8843): 457–460. [PubMed] [Google Scholar] 6. Хилд Р.Дж., Муж Э.М., Райалл Р.Д. Мезоректум в хирургии рака прямой кишки — ключ к рецидиву тазовых органов? Br J Surg. 1982. 69 (10): 613–616. [PubMed] [Google Scholar] 8. Сагар П. М., Пембертон Дж. Х. Хирургическое лечение местного рецидивирующего рака прямой кишки. Br J Surg. 1996. 83 (3): 293–304. [PubMed] [Google Scholar] 9. Хериот А.Г., Бирн С.М., Ли П. и др. Расширенная радикальная резекция: выбор при локально рецидивирующем раке прямой кишки.Dis Colon Rectum. 2008. 51 (3): 284–291. [PubMed] [Google Scholar] 10. Мирнезами А. Х., Сагар П. М. Хирургия рецидивирующего рака прямой кишки: технические примечания и лечение осложнений. Tech Coloproctol. 2010. 14 (3): 209–216. [PubMed] [Google Scholar] 11. Мэдофф Р. Д. Расширенные резекции при распространенном раке прямой кишки. Br J Surg. 2006. 93 (11): 1311–1312. [PubMed] [Google Scholar] 12. Мория Ю. Стратегия лечения местно-рецидивирующего рака прямой кишки. Jpn J ClinOncol. 2006. 36 (3): 127–131. [PubMed] [Google Scholar] 13.Темпл Л. К., Бачик Дж., Саватта С. Г. и др. Разработка проверенного инструмента для оценки функции кишечника после сфинктеросохраняющей хирургии рака прямой кишки. Dis Colon Rectum. 2005. 48 (7): 1353–1365. [PubMed] [Google Scholar] 14. Остин К. К., Янг Дж. М., Соломон М. Дж. Качество жизни выживших после экзентерации таза при раке прямой кишки. Dis Colon Rectum. 2010. 53 (8): 1121–1126. [PubMed] [Google Scholar] 15. Янг Дж. М., Баджери-Паркер Т., Мася Л. М. и др. Качество жизни и другие результаты, сообщаемые пациентами после экстентерации злокачественного новообразования таза.Br J Surg. 2014. 101 (3): 277–287. [PubMed] [Google Scholar] 16. Нг М. К., Леонг Т., Хериот А. Г., Нган С. Ю. Повторное облучение один раз в день при раке прямой кишки у пациентов, которые ранее получали лучевую терапию таза. J Med Imaging Radiat Oncol. 2013. 57 (4): 512–518. [PubMed] [Google Scholar] 17. Гурен М. Г., Ундсет С., Рекстад Б. Л. и др. Повторное облучение местного рецидивирующего рака прямой кишки: систематический обзор. RadiotherOncol. 2014. 113 (2): 151–157. [PubMed] [Google Scholar] 18. Сузуки К., Дозоис Р. Р., Девайн Р. М. и др. Лечебные повторные операции при местно рецидивирующем раке прямой кишки.Dis Colon Rectum. 1996. 39 (7): 730–736. [PubMed] [Google Scholar] 19. Ванебо Х. Дж., Антонюк П., Конесс Р. Дж. И др. Резекция таза рецидивирующего рака прямой кишки: технические аспекты и результаты. Dis Colon Rectum. 1999. 42 (11): 1438–1448. [PubMed] [Google Scholar] 20. Мур Х. Г., Шуп М., Ридель Э. и др. Рецидивы колоректального рака таза: детерминанты резектабельности. Dis Colon Rectum. 2004. 47 (10): 1599–1606. [PubMed] [Google Scholar] 21. Бойл К. М., Сагар П. М., Чалмерс А. Г., Себаг-Монтефиоре Д., Кэрнс А., Эрдли И.Хирургия местно-рецидивирующего рака прямой кишки. Dis Colon Rectum. 2005. 48 (5): 929–937. [PubMed] [Google Scholar] 22. Вест М.А., Лафни Л., Литго Д. и др. Влияние предварительной реабилитации на объективно измеренную физическую форму после неоадъювантного лечения у пациентов с предоперационным раком прямой кишки: слепое интервенционное пилотное исследование. Br J Anaesth. 2015; 114 (2): 244–251. [PubMed] [Google Scholar] 23. Дэвис П. В. Р., Карне П., Белл С., Уорриер С. К. Экзентерация с сохранением мочевого пузыря при местно-распространенном раке прямой кишки. ANZ J Surg.2013; 83 (1): 26. [Google Scholar] 24. Тернер Г. А., Харрис С. А., Эглинтон Т. В. и др. Цистопростатэктомия по сравнению с одной простатэктомией при местнораспространенном или рецидивирующем раке таза. ANZ J Surg. 2016; 86 (1–2): 54–58. [PubMed] [Google Scholar] 25. Соломон М. Дж. А., Остин К. К., Мася Л., Ли П. Иссечение лобковой кости и промежностная уретрэктомия для радикального иссечения переднего отдела во время экзентерации таза. Dis Colon Rectum. 2015. 58 (11): 1114–1119. [PubMed] [Google Scholar] 26. Соломон М. Дж., Тан К. К., Бромилов Р. Г., Аль-мозани Н., Ли П. Дж.Сакрэктомия через абдоминальный доступ при экстентерации таза. Dis Colon Rectum. 2014. 57 (2): 272–277. [PubMed] [Google Scholar] 27. Колибасиану Д. Т., Дозойс Э. Дж., Матис К. Л. и др. Расширенная резекция крестцово-тазового отдела при локально рецидивирующем раке прямой кишки: может ли это быть безопасно и с хорошими онкологическими исходами? Dis Colon Rectum. 2014; 57 (1): 47–55. [PubMed] [Google Scholar] 28. Акиёси Т., Нагата Дж., Нагасаки Т. и др. Лапароскопическая спасательная латеральная тазовая лимфатическая диссекция для локально рецидивирующего рака прямой кишки.Colorectal Dis. 2015; 17 (10): O213 – O216. [PubMed] [Google Scholar] 29. Shaikh I, Aston W., Hellawell G. и др. Расширенное иссечение боковой стенки таза (ELSiE): подход к оптимизации полной резекции при местнораспространенном или рецидивирующем раке прямой кишки с поражением боковой стенки таза. Tech Coloproctol. 2014. 18 (12): 1161–1168. [PubMed] [Google Scholar] 30. Тан Дж., Хериот А.Г., Маккей Дж. И др. Проспективное исследование интраоперационной лучевой терапии местнораспространенным или рецидивирующим раком прямой кишки в одной руке.J Med Imaging Radiat Oncol. 2013. 57 (5): 617–625. [PubMed] [Google Scholar] 31. Мирнезами Р., Чанг Дж., Дас П. и др. Интраоперационная лучевая терапия при колоректальном раке: систематический обзор и метаанализ методов, отдаленные результаты и осложнения. SurgOncol. 2013. 22 (1): 22–35. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Лечение рака прямой кишки, этап
Лечение рака прямой кишки в основном зависит от стадии (степени) рака, но могут иметь значение и другие факторы.
Людям с раком прямой кишки, не распространившимся на отдаленные участки, обычно проводят хирургическое лечение. Лечение лучевой и химиотерапией (химиотерапией) также может проводиться до или после операции.
Лечение рака прямой кишки 0 стадии
Рак прямой кишки стадии 0 не вышел за пределы внутренней оболочки прямой кишки. Обычно все, что нужно, — это удалить или уничтожить рак. Обычно вы можете лечиться с помощью хирургического вмешательства, такого как полипэктомия (удаление полипа), местное иссечение или трансанальная резекция.В редких случаях может потребоваться более обширная операция.
Лечение рака прямой кишки I стадии
Рак прямой кишки I стадии разросся в более глубокие слои стенки прямой кишки, но не распространился за пределы прямой кишки.
Эта стадия включает раковые образования, которые были частью полипа. Если полип полностью удален во время колоноскопии без рака по краям, никакое другое лечение может не понадобиться. Если рак в полипе был высокой степени злокачественности (см. Стадии колоректального рака) или если по краям полипа были раковые клетки, вам могут посоветовать дополнительную операцию.Также может быть рекомендовано дополнительное хирургическое вмешательство, если полип нельзя удалить полностью или если его пришлось удалить по частям, что затрудняет определение наличия раковых клеток по краям (краям).
При других формах рака I стадии хирургическое вмешательство обычно является основным лечением. Некоторые небольшие раковые образования стадии I можно удалить через задний проход без разреза живота (живота) с помощью трансанальной резекции или трансанальной эндоскопической микрохирургии (ТЕМ). Для других видов рака может быть выполнена низкая передняя резекция (LAR), проктэктомия с коло-анальным анастомозом или абдоминоперинеальная резекция (APR), в зависимости от того, где именно находится рак в прямой кишке.
Обычно после этих операций дополнительное лечение не требуется, если только хирург не обнаружит, что рак находится на более поздней стадии, чем предполагалось до операции. В более поздних стадиях обычно назначается комбинация химиотерапии и лучевой терапии. Чаще всего используются 5-ФУ и капецитабин.
Если вы недостаточно здоровы, чтобы делать операцию, вас могут лечить химиотерапией с лучевой терапией.
Лечение рака прямой кишки II стадии
Многие виды рака прямой кишки II стадии прорастают через стенку прямой кишки и могут распространяться на близлежащие ткани.Они не распространились на лимфатические узлы.
Большинство людей с раком прямой кишки II стадии будут лечиться химиотерапией, лучевой терапией и хирургическим вмешательством, хотя порядок этих процедур может быть другим для некоторых людей. Например, вот общий подход к лечению этих видов рака:
- Многие люди получают как химиотерапию, так и лучевую терапию (так называемую химиолучевую терапию ) в качестве первого курса лечения. Химиотерапия, проводимая с лучевой терапией, обычно представляет собой 5-ФУ или капецитабин (Кселода).
- Обычно за этим следует хирургическое вмешательство, такое как низкая передняя резекция (LAR), проктэктомия с коло-анальным анастомозом или абдоминоперинеальная резекция (APR), в зависимости от того, где находится рак в прямой кишке. Если химиотерапия и лучевая терапия достаточно уменьшают опухоль, иногда может быть сделана трансанальная резекция вместо более инвазивной LAR или APR. Это может помочь вам избежать колостомы. Но не все врачи согласны с этим методом, потому что он не позволяет хирургу проверить близлежащие лимфатические узлы на наличие рака.
- После операции проводится дополнительная химиотерапия, обычно в течение 6 месяцев. Химиотерапия может представлять собой схему FOLFOX (оксалиплатин, 5-FU и лейковорин), 5-FU и лейковорин, CAPEOX (капецитабин плюс оксалиплатин) или только капецитабин, в зависимости от того, что лучше всего подходит для вашего здоровья.
Другой вариант — сначала пройти только химиотерапию, затем химиотерапию и лучевую терапию, а затем хирургическое вмешательство.
Людям, которым нельзя пройти курс химиотерапии и лучевой терапии, в первую очередь может быть проведена операция (например, LAR, проктэктомия с коло-анальным анастомозом или APR).За этим может последовать химиотерапия, а иногда и лучевая терапия.
Лечение рака прямой кишки III стадии
Рак прямой кишки стадии III распространился на близлежащие лимфатические узлы, но не на другие части тела.
Большинство людей с раком прямой кишки III стадии будут лечиться химиотерапией, лучевой терапией и хирургическим вмешательством, хотя порядок этих процедур может отличаться.
Чаще всего химиотерапия сначала проводится вместе с лучевой терапией (так называемая химиолучевая терапия ).Это может уменьшить размер рака, часто облегчая удаление больших опухолей. Это также снижает вероятность того, что рак вернется в таз. Облучение перед операцией также имеет тенденцию вызывать меньше проблем, чем облучение после операции.
За химиолучевой терапией следует операция по удалению рака прямой кишки и близлежащих лимфатических узлов, обычно путем низкой передней резекции (LAR), проктэктомии с колоанальным анастомозом или абдоминоперинеальной резекции (APR), в зависимости от того, где находится рак в прямой кишке.Если рак достиг близлежащих органов, может потребоваться более обширная операция, известная как экзентерация таза.
После операции проводится химиотерапия, обычно в течение примерно 6 месяцев. Наиболее распространенные схемы включают FOLFOX (оксалиплатин, 5-FU и лейковорин), 5-FU и лейковорин, CAPEOX (капецитабин плюс оксалиплатин) или только капецитабин. Ваш врач порекомендует тот, который лучше всего подходит для вашего здоровья.
Другой вариант может заключаться в том, чтобы сначала пройти только химиотерапию, затем химиотерапию и лучевую терапию, а затем хирургическое вмешательство.
Для людей, которые по какой-то причине не могут пройти курс химиотерапии и лучевой терапии, хирургическое вмешательство (например, LAR, проктэктомия с коло-анальным анастомозом или APR) может быть первым лечением. За этим может последовать химиотерапия, иногда вместе с лучевой терапией.
Лечение рака прямой кишки IV стадии
Рак прямой кишки стадии IV распространился на отдаленные органы и ткани, такие как печень или легкие. Варианты лечения рака IV стадии в некоторой степени зависят от того, насколько широко распространен рак.
Если есть шанс, что все опухоли можно удалить (например, есть только несколько опухолей в печени или легких), наиболее распространенные варианты лечения включают:
- Операция по удалению рака прямой кишки и отдаленного рака с последующей химиотерапией (и / или лучевой терапией в некоторых случаях)
- Химиотерапия с последующей операцией по удалению рака прямой кишки и отдаленного рака, обычно с последующей химиотерапией и лучевой терапией (химиолучевой терапией)
- Химиотерапия с последующей химиолучевой терапией с последующей операцией по удалению рака прямой кишки и отдаленного рака.За этим может последовать дополнительная химиотерапия.
- Химиолучевая терапия с последующей операцией по удалению рака прямой кишки и отдаленного рака. За этим может последовать химиотерапия.
Эти подходы помогут вам прожить дольше. Операция по удалению рака прямой кишки обычно представляет собой низкую переднюю резекцию (LAR), проктэктомию с коло-анальным анастомозом или абдоминоперинеальную резекцию (APR), в зависимости от того, где она расположена.
Если единственным местом распространения рака является печень, вас могут лечить химиотерапией, которая вводится прямо в артерию, ведущую к печени (инфузия печеночной артерии).Это может уменьшить раковые образования в печени лучше, чем если химиотерапия вводится в вену (IV) или перорально.
Если рак более распространен и не может быть полностью удален хирургическим путем, варианты лечения зависят от того, вызывает ли рак закупорку кишечника. Если это так, может потребоваться немедленная операция. В противном случае рак, скорее всего, будет лечить химиотерапией и / или препаратами таргетной терапии (без хирургического вмешательства). Некоторые из вариантов включают:
- FOLFOX: лейковорин, 5-FU и оксалиплатин (элоксатин)
- FOLFIRI: лейковорин, 5-FU и иринотекан (Camptosar)
- CAPEOX или CAPOX: капецитабин (Кселода) и оксалиплатин
- FOLFOXIRI: лейковорин, 5-FU, оксалиплатин и иринотекан
- Одна из вышеперечисленных комбинаций плюс лекарство, нацеленное на VEGF (бевацизумаб [Авастин], зив-афлиберцепт [Залтрап] или рамуцирумаб [Цирамза]), либо лекарство, нацеленное на EGFR (цетуксимаб [Эрбитукс] или панитумумаб [Vectibix] )
- 5-ФУ и лейковорин, с лекарственным средством таргетного действия или без него
- Капецитабин с целевым лекарственным средством или без него
- Иринотекан, с целевым лекарственным средством или без него
- Только цетуксимаб
- Панитумумаб отдельно
- Регорафениб (Стиварга) отдельно
- Трифлуридин и типирацил (Лонсурф)
Выбор лекарств или комбинаций лекарств зависит от нескольких факторов, включая предыдущее лечение, общее состояние вашего здоровья и то, насколько хорошо вы переносите лечение.
Если химиотерапия уменьшает рак, в некоторых случаях можно рассмотреть возможность хирургического вмешательства, чтобы попытаться удалить весь рак на этом этапе. После операции можно будет снова провести химиотерапию.
Если рак не уменьшается, можно попробовать другую комбинацию лекарств. Для людей с определенными изменениями генов в их раковых клетках другим вариантом после начальной химиотерапии может быть лечение иммунотерапевтическими препаратами, такими как пембролизумаб (Кейтруда) или ниволумаб (Опдиво).
При раковых заболеваниях, которые не уменьшаются при химиотерапии, и широко распространенных формах рака, вызывающих симптомы, лечение проводится для облегчения симптомов и предотвращения долгосрочных проблем, таких как кровотечение или закупорка кишечника.Процедуры могут включать одно или несколько из следующих:
- Операция по удалению рака прямой кишки
- Операция по созданию колостомы и обходу рака прямой кишки (отклоняющая колостома)
- Использование специального лазера для уничтожения рака прямой кишки
- Помещение стента (полой металлической трубки) в прямую кишку, чтобы она оставалась открытой; это не требует хирургического вмешательства
- Химиолучевая терапия
- Только химиотерапия
Если рак печени нельзя удалить хирургическим путем, потому что он слишком велик или их слишком много, возможно, удастся уничтожить их (частично или полностью) с помощью абляции или эмболизации.
Лечение рецидивирующего рака прямой кишки
Рецидив рака означает, что рак вернулся после лечения. Он может вернуться в область первоначального рака прямой кишки (локально) или в отдаленные органы, такие как легкие или печень. Если рак действительно рецидивирует, это обычно в первые 2–3 года после операции, но он может повториться и намного позже.
Местный рецидив
Если рак возвращается в таз (локально), его лечат хирургическим вмешательством по удалению рака, если это возможно.Эта операция часто бывает более обширной, чем первоначальная операция. В некоторых случаях лучевая терапия может проводиться во время операции (это называется интраоперационная лучевая терапия , ) или после нее. Химиотерапия также может быть назначена после операции. Также может быть использована лучевая терапия, если она раньше не применялась.
Отдаленный рецидив
Если рак возвращается в отдаленную часть тела, лечение будет зависеть от того, можно ли удалить его хирургическим путем.
Если рак можно удалить, делают операцию.Химиотерапия может быть назначена перед операцией (см. Список возможных вариантов лекарств в разделе «Лечение рака прямой кишки IV стадии» выше). Химиотерапию можно назначить и после операции . Когда рак распространился на печень, химиотерапия может быть проведена через печеночную артерию, ведущую в печень.
Если рак нельзя удалить хирургическим путем, можно использовать химиотерапию и / или препараты для таргетной терапии. Для людей с определенными изменениями генов в раковых клетках другим вариантом может быть лечение с помощью иммунотерапии.Используемые лекарства будут зависеть от того, какие лекарства человек получал ранее, и от его общего состояния здоровья. Если рак не уменьшается, можно попробовать другую комбинацию лекарств.
Как и в случае рака прямой кишки IV стадии, в какой-то момент можно использовать хирургическое вмешательство, лучевую терапию или другие подходы для облегчения симптомов и предотвращения долгосрочных проблем, таких как кровотечение или закупорка кишечника.
Эти виды рака часто трудно поддаются лечению, поэтому вы также можете спросить своего врача, есть ли какие-либо клинические испытания новых методов лечения, которые могут вам подойти.
Подробнее о повторении см. Общие сведения о повторении.
Приведенная здесь информация о лечении не является официальной политикой Американского онкологического общества и не предназначена для использования в качестве медицинских рекомендаций, заменяющих опыт и суждения вашей команды по лечению рака. Он предназначен для того, чтобы помочь вам и вашей семье принять информированное решение вместе с вашим врачом. У вашего врача могут быть причины предложить план лечения, отличный от этих общих вариантов лечения.Не стесняйтесь задавать ему или ей вопросы о вариантах лечения.
Стратегия лечения местно-рецидивирующего рака прямой кишки | Японский журнал клинической онкологии
Аннотация
Несмотря на радикальное хирургическое вмешательство, у 33% пациентов с раком прямой кишки разовьется локорегиональный рецидив. Ведение таких пациентов особенно сложно. Хирургия — это основа лечения пациентов с мобильным рецидивом. Однако у большинства пациентов развиваются рецидивы с поражением тазовой стенки.Сообщалось, что у этих пациентов комбинированная терапия, включая радикальное хирургическое вмешательство и интраоперационную лучевую терапию, дает 5-летнюю выживаемость до 31% и частоту местного контроля 50–71%. Наиболее важным фактором для получения длительного местного контроля и выживаемости является резекция R0. Расширенная операция, такая как абдоминально-крестцовая резекция, не пользуется популярностью из-за 5-летней выживаемости 16–31% и значительной послеоперационной заболеваемости. Повторный рецидив после операции происходит локально и в легких и остается серьезной проблемой.При хирургическом лечении местного рецидива решающее значение имеют факторы, связанные с хирургом. Следует разработать систему стадирования с использованием степени фиксации и других прогностических факторов, чтобы в каждом случае применялись соответствующие методы лечения.
ВВЕДЕНИЕ
У 4–33% пациентов, перенесших радикальное хирургическое вмешательство по поводу рака прямой кишки, развивается локорегиональный рецидив. Без лечения у этих пациентов с местно-рецидивирующим раком прямой кишки (LRRC) средняя выживаемость составляет ~ 8 месяцев.Если лечение не проводится, они страдают от серьезных симптомов, особенно от боли, и качество их жизни (КЖ) становится крайне низким (1–4). Почти половина LRRC расположена в тазу без отдаленных метастазов. Лучшее лечение LRRC в этой ситуации — полная резекция рецидивирующей опухоли.
Есть несколько различных вариантов лечения LRRC. Эти варианты зависят от характера LRRC, который может проявляться как мобильный рецидив или огромная масса, занимающая таз.
При нефиксированных рецидивных опухолях полная резекция может быть достигнута с помощью ограниченного хирургического вмешательства, такого как абдоминально-перинеальная резекция, и результаты относительно благоприятны.
Когда LRRC растет в узком тазу, он может легко проникнуть в стенку таза, проявляясь в виде фиксированной рецидивирующей опухоли (FRT). Если FRT затрагивает только передние структуры, полное расширение таза достигает адекватных границ. Однако у большинства пациентов с LRRC имеется дорсальное и / или дорсолатеральное поражение таза.Эти пациенты представляют собой особую проблему. Может потребоваться обширное хирургическое вмешательство, такое как абдоминально-крестцовая резекция. Однако несоответствующее хирургическое вмешательство у этих пациентов может вызвать распространение ятрогенного рака, что приведет к ухудшению качества жизни.
ОБЫЧНОЕ ЛЕЧЕНИЕ
У пациентов с LRRC, которые не подходят для хирургического вмешательства, химиорадация является основным доступным терапевтическим методом. Эффект лучевой терапии зависит от размера опухоли и полученной общей дозы облучения.Доза 45 Гр обеспечивает хорошее облегчение боли у 50–80% пациентов (5) с низким риском токсичности для тонкой кишки. Однако при этой дозе нельзя ожидать противоопухолевого эффекта, который может привести к полному ответу или увеличению выживаемости. Другой подход — введение дозы 50 Гр в то же поле излучения, которое используется для лечения первичного рака прямой кишки. Затем поле излучения уменьшается, чтобы охватить только место рецидива опухоли, и к этому месту доставляется общая доза 60–70 Гр.Однако не было показано, что одна только внешняя лучевая лучевая терапия (ДЛТ) приводит к значительному увеличению выживаемости.
По этой причине обычно используется комбинация лучевой терапии и химиотерапии. Обоснование комбинированной терапии включает (i) усиление цитотоксичности с помощью противоопухолевого агента и облучения, (ii) использование химиотерапии, которая обеспечивает лечение отдаленных метастазов в дополнение к местному контролю опухоли, обеспечиваемому лучевой терапией, и (iii) потенциальную возможность для снижения дозировки агентов и, следовательно, их токсичности путем комбинирования различных методов лечения без снижения общей эффективности (6,7).
ДЛТ, применяемая отдельно или в сочетании с химиотерапией, обеспечивает временное улучшение симптомов у большинства пациентов. Среднее время выживания составляет 14 месяцев, а время местного контроля — 5 месяцев. Пятилетняя выживаемость у этих пациентов обычно составляет <5% (8).
Предоперационная химиолучевая терапия используется при первичном раке прямой кишки для снижения стадии опухоли и улучшения резектабельности. Тот же подход использовался и для LRRC. Rodel et al. (9) проводили химиолучевую терапию перед операцией у 35 пациентов с LLRC с использованием 5-FU (1000 мг / м 2 / день).Они сообщили, что добились резекций без края в 17 случаях (61%). Ожидается, что другие химиотерапевтические агенты, такие как СРТ-11 и оксалиплатин, будут играть важную роль в ведении этих пациентов в будущем (10).
МУЛЬТИМОДАЛЬНОЕ ЛЕЧЕНИЕ
Отчеты некоторых западных центров показывают, что улучшенный местный контроль и выживаемость могут быть достигнуты у отдельных пациентов с помощью предоперационной химиолучевой терапии, радикальной хирургии и интраоперационной лучевой терапии (ИОЛТ) (11–22).Этот подход признает, что удовлетворительный противоопухолевый эффект не может быть достигнут только с помощью химиолучевой терапии. Добавление ИОЛТ означает, что максимально возможная доза облучения может быть доставлена рецидивной опухоли. Это может позволить провести менее обширную операцию.
Одним из преимуществ ИОЛТ является то, что он дает в три раза больший биологический эффект, чем фракционированный ДЛТ. Кроме того, ИОЛТ имеет то преимущество, что излучение точно доставляется в ложе опухоли, смещая при этом соседние нормальные структуры из поля облучения.Использование ИОЛТ позволяет снизить дозу ДЛТ и, таким образом, снижает токсичность этого метода. Исследователи клиники Мэйо сообщили о 3-летней выживаемости 39% и 5-летней выживаемости 20% у 123 пациентов с LRRC, которые лечились с помощью ИОЛТ и хирургического вмешательства (14). Mannaerts et al. (16,18) в Нидерландах использовали предоперационную дозу лучевой терапии 50,4 Гр (30 Гр у пациентов, получавших ратиотерапию) перед операцией, во время которой они выполняли ИОЛТ. Доза ИОЛТ определялась R-статусом резекции.Пациенты, перенесшие резекцию R0 (микроскопически отрицательные края), получали дозу 10 Гр, резекции R1 (микроскопически положительные поля) — дозу 15 Гр и случаи R2 (макроскопически положительные поля) — дозу 17,5 Гр. Общая 3-летняя выживаемость составила 58%. Однако пациенты, перенесшие резекцию R2, показали худший прогноз в этой серии. Wiig et al. (19) сообщили о 5-летней выживаемости 60% у пациентов, получавших дооперационное облучение и имевших резекцию R0.Это поднимает вопрос о том, действительно ли IORT требуется в случаях с предыдущей резекцией R0, особенно потому, что не все случаи R0 в этой серии получали IORT. Можно утверждать, что истинная резекция R0 не оставляет раковых клеток, которые необходимо уничтожить с помощью ИОЛТ. Однако в клинической практике, поскольку не всегда легко отличить фиброз от рецидивирующего рака, у некоторых пациентов, перенесших резекцию R0, может быть остаточное заболевание, и ИОЛТ может помочь (20,21).
Abuchaibe et al. (12) и Bussieres et al.(15) сообщили о пациентах с резекцией R2, которым проводилась ИОЛТ, но не выполнялась послеоперационная ДЛТ. Эта стратегия привела к плохому результату и предполагает, что дополнительный EBRT важен для достижения местного контроля. Облучения пациентов, которые ранее получали лучевую терапию, обычно избегают из-за опасения тяжелой поздней лучевой токсичности. Mohiuddin et al. (2,23) сообщили о 103 случаях, которые получили повторное облучение и показали приемлемую позднюю токсичность (17% с хронической тяжелой диареей, 15% с непроходимостью тонкой кишки и 4% с фистулой).
Несмотря на использование мультимодальной терапии, 5-летняя выживаемость пациентов с LRRC остается 22–31%, а частота местного контроля — 50–71% (Таблица 1). Нельзя ожидать, что ИОЛТ компенсирует резекцию R2 (13), и сама по себе связана с потенциальными осложнениями. Наиболее частыми побочными эффектами являются стеноз мочеточника и периферическая невропатия. В серии из 123 случаев, проведенных в клинике Mayo (14), частичный стеноз мочеточника как осложнение возник у 6% пациентов, при этом 10% пациентов потребовали установки мочеточникового стента.Периферическая нейропатия наблюдалась у 16–34% пациентов.
Таблица 1.
Результат после комплексной терапии
| Автор . | Год . | Кол-во дел . | Резекция (%) . | Хирургия . | 5-YSR (%) . | Повторный местный рецидив (%) . |
|---|---|---|---|---|---|---|
| Willet et al. (11) | 1991 | 30 | 27 | 38 | ||
| Magrini et al. (32) | 1996 | 16 | 100 | Расширенный | 48 (2 года) | 36 |
| Bussieres et al. (15) | 1996 | 73 | 57 | Смешанный | 31 | 29 |
| Valentini et al.(17) | 1999 | 47 | 45 | Limited | 22 | 31 |
| Wiig et al. (19) | 2000 | 107 | 41 | Limited | 30 | 50 |
| Mannaerts et al. (18) | 2001 | 33 | 64 | Смешанный | 60 (3 года) | 27 |
| Hahnloser et al. (21) | 2003 | 304 | 100 | Limited | 25 |
| Автор . | Год . | Кол-во дел . | Резекция (%) . | Хирургия . | 5-YSR (%) . | Повторный местный рецидив (%) . |
|---|---|---|---|---|---|---|
| Willet et al. (11) | 1991 | 30 | 27 | 38 | ||
| Magrini et al.(32) | 1996 | 16 | 100 | Расширенный | 48 (2 года) | 36 |
| Bussieres et al. (15) | 1996 | 73 | 57 | Смешанный | 31 | 29 |
| Valentini et al. (17) | 1999 | 47 | 45 | Limited | 22 | 31 |
| Wiig et al. (19) | 2000 | 107 | 41 | Limited | 30 | 50 |
| Mannaerts et al.(18) | 2001 | 33 | 64 | Смешанный | 60 (3 года) | 27 |
| Hahnloser et al. (21) | 2003 | 304 | 100 | Limited | 25 |
Таблица 1.
Результат после комбинированной терапии
| Автор . | Год . | Кол-во дел . | Резекция (%) . | Хирургия . | 5-YSR (%) . | Повторный местный рецидив (%) . |
|---|---|---|---|---|---|---|
| Willet et al. (11) | 1991 | 30 | 27 | 38 | ||
| Magrini et al. (32) | 1996 | 16 | 100 | Расширенный | 48 (2 года) | 36 |
| Bussieres et al.(15) | 1996 | 73 | 57 | Смешанный | 31 | 29 |
| Valentini et al. (17) | 1999 | 47 | 45 | Limited | 22 | 31 |
| Wiig et al. (19) | 2000 | 107 | 41 | Limited | 30 | 50 |
| Mannaerts et al. (18) | 2001 | 33 | 64 | Смешанный | 60 (3 года) | 27 |
| Hahnloser et al.(21) | 2003 | 304 | 100 | Limited | 25 |
| Автор . | Год . | Кол-во дел . | Резекция (%) . | Хирургия . | 5-YSR (%) . | Повторный местный рецидив (%) . |
|---|---|---|---|---|---|---|
| Willet et al. (11) | 1991 | 30 | 27 | 38 | ||
| Magrini et al. (32) | 1996 | 16 | 100 | Расширенный | 48 (2 года) | 36 |
| Bussieres et al. (15) | 1996 | 73 | 57 | Смешанный | 31 | 29 |
| Valentini et al.(17) | 1999 | 47 | 45 | Limited | 22 | 31 |
| Wiig et al. (19) | 2000 | 107 | 41 | Limited | 30 | 50 |
| Mannaerts et al. (18) | 2001 | 33 | 64 | Смешанный | 60 (3 года) | 27 |
| Hahnloser et al. (21) | 2003 | 304 | 100 | Limited | 25 |
Брахитерапия использует гамма-лучи или бета-лучи, излучаемые герметичным закрытым радиоактивным источником для проведения интерстициального облучения.В последнее время из-за опасений по поводу воздействия радиации на хирурга и изоляции пациентов все чаще используются системы удаленной постнагрузки с высокой мощностью дозы (24,25). Goes et al. (24) сообщили об использовании трубок для последующей нагрузки, вводимых во время операции после операции по уменьшению опухоли, для проведения брахитерапии у 30 ранее облученных пациентов. У этих пациентов с LRRC местный контроль был достигнут в 18 случаях (64%) со средним периодом наблюдения 36 месяцев. Преимущество брахитерапии заключается в том, что она сводит к минимуму количество излучения, которому подвергаются окружающие ткани, и, следовательно, это полезный метод для ранее облученных пациентов.Однако точное размещение зондов для постнагрузки может быть затруднено, поскольку рецидивирующее поражение окружено рубцовой тканью и находится глубоко внутри таза. Альтернативные методы точного размещения трубок включают чрескожное введение под контролем КТ, но это связано с риском повреждения тонкой кишки и образования свищей, если трубка повреждает часть тонкой кишки, лежащую в тазу. Следовательно, брахитерапия еще не стала стандартной терапией для LRRC.
КОМБИНИРОВАННЫЙ ОТДЕЛ
Очевидно, что для достижения долгосрочного местного контроля и повышения выживаемости у пациентов с LRRC необходимо выполнить резекцию R0.Это особая проблема, когда пациенты имеют FRT с дорсальным и / или дорсолатеральным поражением.
В 1981 году Ванебо представил технику абдоминально-крестцовой резекции, которую переняли другие хирурги (26–39). Расширенная хирургия FRT не стала популярной из-за того, что 5-летняя выживаемость составляет 16–31% (Таблица 2). Bozzetti et al. (34) указали на ограничения хирургического лечения, а Wiggers et al. (33) показали критическое отношение к расширенной хирургии. В 1999 году Ванебо и др.(36) проанализировали результаты расширенного хирургического вмешательства у 53 пациентов. Операционная летальность составила 8%, средняя кровопотеря — более 8000 мл, а средняя продолжительность операции — ~ 20 часов. Все пациенты ранее были облучены. Общая 5-летняя выживаемость составила 31%, а 5-летняя выживаемость без признаков заболевания — 23%. Высокая ампутация крестца была выполнена в 32 случаях (60%) по поводу рецидивов таза, распространяющихся до мыса крестца или седалищной вырезки. Во всех случаях были сохранены внутренние подвздошные сосуды и выполнена лимфодиссекция в тазу.Метастазирование в боковые лимфоузлы наблюдалось только в одном случае (1,8%), что является удивительно низкой частотой. Остается неясным, произошло ли это из-за воздействия радиации или из-за метода, использованного для поиска метастазов. Вряд ли можно утверждать, что расширенная операция приемлема как с точки зрения хирургической инвазивности, так и с точки зрения онкологических исходов, и, следовательно, эта терапия позиционируется как сложное и сложное лечение.
Таблица 2.
Результат после комбинированной резекции
| Автор . | Год . | Кол-во дел . | TPE . | PW . | РТ . | 5-YSR (%) . | Повторный местный рецидив (%) . |
|---|---|---|---|---|---|---|---|
| Hafner et al. (28) | 1991 | 21 | 11 | 1 | 20 | 38 | |
| Maetani et al.(35) | 1998 | 59 | 39 | 43 | 26 | 25 | 61 |
| Wanebo et al. (36) | 1999 | 53 | 27 | 53 | 31 | 49 | |
| Ямада и др. (38) | 2001 | 60 | 30 | 23 | 16 | ||
| Мория (39) | 2004 | 57 | 57 | 909 57 25 |
| Автор . | Год . | Кол-во дел . | TPE . | PW . | РТ . | 5-YSR (%) . | Повторный местный рецидив (%) . |
|---|---|---|---|---|---|---|---|
| Hafner et al. (28) | 1991 | 21 | 11 | 1 | 20 | 38 | |
| Maetani et al.(35) | 1998 | 59 | 39 | 43 | 26 | 25 | 61 |
| Wanebo et al. (36) | 1999 | 53 | 27 | 53 | 31 | 49 | |
| Ямада и др. (38) | 2001 | 60 | 30 | 23 | 16 | ||
| Мория (39) | 2004 | 57 | 57 | 909 57 25 |
Таблица 2.
Результат после комбинированной резекции
| Автор . | Год . | Кол-во дел . | TPE . | PW . | РТ . | 5-YSR (%) . | Повторный местный рецидив (%) . |
|---|---|---|---|---|---|---|---|
| Hafner et al.(28) | 1991 | 21 | 11 | 1 | 20 | 38 | |
| Maetani et al. (35) | 1998 | 59 | 39 | 43 | 26 | 25 | 61 |
| Wanebo et al. (36) | 1999 | 53 | 27 | 53 | 31 | 49 | |
| Ямада и др. (38) | 2001 | 60 | 30 | 23 | 16 | ||
| Мория (39) | 2004 | 57 | 57 | 909 57 25 |
| Автор . | Год . | Кол-во дел . | TPE . | PW . | РТ . | 5-YSR (%) . | Повторный местный рецидив (%) . |
|---|---|---|---|---|---|---|---|
| Hafner et al. (28) | 1991 | 21 | 11 | 1 | 20 | 38 | |
| Maetani et al.(35) | 1998 | 59 | 39 | 43 | 26 | 25 | 61 |
| Wanebo et al. (36) | 1999 | 53 | 27 | 53 | 31 | 49 | |
| Ямада и др. (38) | 2001 | 60 | 30 | 23 | 16 | ||
| Мория (39) | 2004 | 57 | 57 | 909 57 25 |
В 2004 году мы сообщили об исходе лечения тотального экзентерации таза с помощью дистальной сакрэктомии (TPES) у 57 пациентов с FRT (39).Операционная летальность составила 3,5%, медиана кровопотери и время операции — 2500 мл и 682 мин соответственно. Эти результаты отличаются от результатов, сообщенных Wanebo et al. (36). Мы проанализировали факторы, которые могут быть причиной этой разницы. Наши пациенты с первичным раком прямой кишки подвергаются полному мезоректальному иссечению или более обширной операции, тогда как в США обычно выполнялись менее обширные операции. Все пациенты Ванебо прошли предоперационную лучевую терапию, в результате которой развился фиброз таза.Однако у наших пациентов послеоперационное рубцевание после обширной первичной резекции приводит к более техническим трудностям при удалении рецидива заболевания. Кроме того, половине наших пациентов была проведена предоперационная лучевая терапия. Мы пришли к выводу, что в целом разница в результатах не связана с объемом первоначальной операции, которую перенес пациент, или с тем, была ли лучевая терапия проведена до операции. Основное различие между двумя сериями — это степень резекции крестца. В отличие от Wanebo, мы ограничили уровень крестцовой ампутации нижним краем второго крестцового позвонка или ниже, чтобы сохранить вторые крестцовые нервы.Высокая крестцовая ампутация связана с более тяжелыми осложнениями, включая затруднения с подвижностью и значительное ухудшение качества жизни. После менее обширной крестцовой ампутации пациенты достигли приемлемого качества жизни, за исключением жизни с двойной стомой и временной болью из-за резекции крестцовых нервов (39,40). Для наших пациентов выживаемость составила 61% через 3 года и 46% через 5 лет. Несмотря на эти улучшенные результаты по сравнению с серией Ванебо, местный рецидив и метастазы в легкие встречаются у более чем 90% пациентов.
Меры по предотвращению дальнейших местных рецидивов и метастазов остаются проблемой при ведении таких пациентов. Мы пришли к выводу, что хирургическое лечение, включая резекцию тазовой стенки и ИОЛТ, является оптимальным методом для улучшения показателей местного контроля у пациентов с LRRC. Новые противоопухолевые средства, такие как CPT-11, UFT, капецитабин и оксалиплатин, показали эффективность при лечении рака прямой кишки и будут играть все более важную роль у пациентов с метастатическим заболеванием.
ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ
Факторы, предсказывающие успех операции по поводу LRRC, остаются спорными.Некоторые параметры, такие как тип первичной операции, размер опухоли, наличие тяжелых симптомов и уровень СЕА в сыворотке до повторной резекции, были оценены как потенциальные прогностические индикаторы (41). Willet и Wanebo обнаружили улучшенную резектабельность у пациентов с начальной низкой передней резекцией по сравнению с первоначальной APR (11,31). Напротив, мы не обнаружили разницы ни в резектабельности, ни в выживаемости у пациентов, у которых развилась FRT (39). Среди других факторов, отрицательная резекция CEA и R0 была связана с лучшим прогнозом.Shoup et al. (42) сообщили, что сосудистая инвазия и резекция R1 / R2 являются факторами плохого прогноза. В обоих отчетах подчеркивается, что наиболее важным прогностическим фактором является то, была ли выполнена резекция R0.
Уже было показано, что при хирургическом лечении первичного рака прямой кишки решающее значение имеют факторы, связанные с хирургом, а также биологические факторы. Состояние хирургической границы и осложнения определяются исключительно техническими навыками хирурга (43). Сложные операции, такие как TPES или абдоминально-крестцовая резекция, должны проводиться только в специализированных центрах, которые обладают особым опытом в таких сложных операциях.
СТУПЕНЧАТАЯ СИСТЕМА
Не существует установленного метода определения стадии для пациентов с LRRC. Судзуки и др. (44,45) оценили степень фиксации опухоли к окружающим структурам в соответствии с хирургическими и патологическими данными и предложили свой собственный метод стадирования. Valentini et al. (17) также сообщили об аналогичной системе стадирования, основанной на компьютерной томографии. Они отметили, что степень фиксации является независимым прогностическим фактором. Wanebo et al. (36) предложили новую систему стадий для стадий TR1-2 – TR-5, которые определяются степенью инвазии.
Очень важно, чтобы для этих сложных пациентов была разработана система стадирования, чтобы обеспечить проведение соответствующей терапии.
ЗАКЛЮЧЕНИЕ
Ведение пациентов с LRRC представляет собой серьезную проблему. Потенциально существует большое количество доступных терапевтических вариантов. Хирургическое вмешательство остается оптимальным лечением местного рецидива, если оно может быть достигнуто с приемлемым качеством жизни. Роль химиотерапии и лучевой терапии еще предстоит выяснить.ИОЛТ может улучшить местный контроль заболевания у пациентов, у которых может быть достигнута резекция R0 или R1.
Список литературы
1.
Гундерсон Л.Л., Сосин Х. Зона поражения, обнаруженная при повторной операции после «лечебной операции» по поводу аденокарциномы прямой кишки.
Рак
1974
;
34
:
1278
–92.2.
McDermott FT, Hughes ES, Pihl E, Johnson WR, Price AB. Местный рецидив после потенциально лечебной резекции рака прямой кишки у 1008 пациентов.
Br J Surg
1985
;
72
:
34
–7.3.
McCall JL, Cox MR, Wattchow DA. Анализ частоты местных рецидивов рака прямой кишки только после операции.
Int J Colorectal Dis
1995
;
10
:
126
–32.4.
Pilipshen SJ, Heilweil M, Quan SH, Sternberg SS, Enker WE. Особенности рецидивов тазовых органов после окончательной резекции рака прямой кишки.
Рак
1984
;
53
:
1354
–62.5.
Пачини П., Чионини Л., Пиртоли, Пиртоли Л., Чиатто С., Туччи Е. и др. Симптоматические рецидивы рака прямой и сигмовидной кишки. Влияние лучевой терапии на качество жизни.
Dis Colon Rectum
1986
;
29
:
865
–8.6.
О’Коннелл MJ, Детский DS, Moertel CG, Holbrook MA, Schutt AJ, Rubin J, et al. Проспективная контролируемая оценка комбинированной лучевой терапии органов малого таза и экстракции метанолом остатков БЦЖ (MER) при локально неоперабельном или рецидивирующем раке прямой кишки.
Int J Radiat Oncol Biol Phys
1982
;
8
:
1115
–9.7.
О’Коннелл MJ, Мартенсон JA, Wieand HS, Macdonald JS, Haller DG, Gunderson LL, et al. Улучшение адъювантной терапии рака прямой кишки путем сочетания длительной инфузии 5-ФУ с лучевой терапией после радикальной хирургии.
N Engl J Med
1994
;
331
:
502
–7.8.
Wong CS, Cumming BJ, Brierly JD, Catton CN, McLean M, Catton P и др.Результаты лечения местно-рецидивирующей карциномы прямой кишки и факторы прогноза.
Int J Radiat Oncol Bio Phys
1998
;
40
:
427
–35.9.
Родель С., Грабенбауэр Г.Г., Мацель К., Шик С., Фиткау Р., Пападопулос Т. и др. Обширное хирургическое вмешательство после предоперационной химиолучевой терапии высокими дозами при местнораспространенном рецидивирующем раке прямой кишки.
Dis Colon Rectum
2000
;
43
:
312
–9.10.
Рич Т.А., Кириченко А.В.График приема камптотецина и время приема с облучением.
Онкология
2001
;
15
:
37
–41.11.
Willett CG, Shellito PC, Tepper JE, Eliseo R, Convery K, деревянный туалет. Интраоперационная лучевая терапия электронным пучком при рецидивирующей местнораспространенной карциноме прямой или ректосигмоидной кишки.
Рак
1991
;
67
:
1504
–8.12.
Abuchaibe O, Calvo FA, Azinovic I, Aristu J, Pardo F, Alvarez-Cienfuegos J.Интраоперационная лучевая терапия при местнораспространенном рецидивирующем колоректальном раке.
Int J Radiat Oncol Biol Phys
1993
;
26
:
859
–67,13.
Уоллес Х.Дж., Виллет К.Г., Шеллито П.С., Коэн Дж.Дж., Гувер Х.С. Интраоперационная лучевая терапия при местнораспространенном раке прямой или прямой кишки.
J Surg Oncol
1995
;
60
:
122
–7.14.
Гандерсон Л.Л., Нельсон Х., Мартенсон Дж. А., Ча С., Хэддок М., Девайн Р., Фик Дж. М. и др.Интраоперационное электронное и внешнее лучевое облучение с 5-фторурацилом или без него и максимальная хирургическая резекция ранее необлученного, местно-рецидивирующего колоректального рака.
Dis Colon Rectum
1996
;
39
:
1379
–95,15.
Bussieres E, Gilly FN, Rouanet P, Mahe MA, Roussel A, Delannes M, et al. Рецидивы рака прямой кишки: результаты мультимодального подхода с интраоперационной лучевой терапией. Французская группа интраоперационной лучевой терапии.
Int J Radiat Oncol Biol Phys
1996
;
34
:
49
–56,16.
Mannaerts GHH, Martijn H, Crommelin MA, Stultiens GNM, Dries W., Repelaer van Driel и др. Интраоперационная электронно-лучевая терапия при местно-рецидивирующем раке прямой кишки.
Int J Radiat Oncol Biol Phys
1999
;
45
:
297
–308.17.
Валентини В., Морганти А., Де Франко А., Коко С., Ратто С., Доглитто Г.Б. и др. Химиолучевая терапия с интраоперационной лучевой терапией или без нее у пациентов с местно рецидивирующей карциномой прямой кишки.
1999
;
86
:
2612
–24.18.
Mannaerts GHH, Rutten HJT, Martijn H, Groen GJ, Hanssens PEJ, Wiggers T. Абдоминально-крестцовая резекция при первичном нерезектабельном и местно-рецидивирующем раке прямой кишки.
Dis Colon Rectum
2001
;
44
:
806
–14,19.
Wiig JN, Poulsen JP, Larsen S, Braendengen M, Waehre H, Giercksky KE. Тотальная экзентерация таза с предоперационным облучением при распространенном первичном и рецидивирующем раке прямой кишки.
евро J Surg
2002
;
168
:
42
–8.20.
Hahnloser D, Haddock MG, Nelson H. Интраоперационная лучевая терапия в мультимодальном подходе к лечению колоректального рака.
Surg Oncol Clin N Am
2003
;
12
:
993
–1013.21.
Hahnloser D, Nelson H, Gunderson LL, Hassan I, Haddock MG, O’Connell MJ, et al. Лечебный потенциал комплексной терапии местно-рецидивирующего рака прямой кишки.
Ann Surg
2003
;
237
:
502
–8.22.
Mohuiddin M, Lingareddy V, Rakinic J, Marks G. Повторное облучение рака прямой кишки и хирургическая резекция после сверхвысоких доз.
Int J Radiat Oncol Biol Phys
1993
;
27
:
1159
–63,23.
Mohuiddin M, Marks G, Marks J. Долгосрочные результаты повторного облучения пациентов с рецидивирующей карциномой прямой кишки.
2002
;
95
:
1144
–50,24.
Goes RN, Беарт RW, Саймонс А.Дж., Гундерсон Л.Л., Градо Дж., Стритер О.Использование брахтерапии в лечении местно-рецидивирующего рака прямой кишки.
Dis Colon Rectum
1997
;
40
:
1177
–9.25.
Кюне Дж., Клейсли Т., Бирнацки П., Гирвигиан М., Стритер О., Корман М.Л. и др. Использование брахитерапии с высокой мощностью дозы в лечении местно-рецидивирующего рака прямой кишки
2003
;
46
:
895
–9.26.
Wanebo HJ, Марков, RC. Абдоминально-крестцовая резекция местно-рецидивирующего рака прямой кишки.
Ann Surg
1981
;
194
:
458
–71.27.
Такаги Х., Моримото Т., Хара С., Сузуки Р., Хорио С. Семь случаев экзентерации таза в сочетании с резекцией крестца по поводу местного рака прямой кишки.
J Surg Oncol
1986
;
32
:
184
–8.28.
Hafner GH, Herrera L, Petrelli NT. Характер рецидива колоректальной аденокарциномы после экзентерации таза.
Arch Surg
1991
;
126
:
1510
–13.29.
Maetani S, Nishikawa T, Iijima Y, Tobe T, Kotoura Y.Шиката Дж. И др. Обширная резекция единым блоком регионально рецидивирующей карциномы прямой кишки.
Рак
1992
;
69
:
2876
–83.30.
Temple WJ, Ketcham AS. Резекция крестца для лечения опухолей малого таза.
Am J Surg
1992
;
163
:
370
–4.31.
Wanebo HJ, Koness J, Vezeridis MP, Cohen SI, Wrobleski D. Резекция таза рецидивирующего рака прямой кишки.
Ann Surg
1994
;
220
:
586
–97.32.
Magrini S, Nelson H, Gunderson LL. Крестцово-тазовая резекция и интраоперационное электронное облучение в лечении рецидивирующего рака прямой кишки.
Dis Colon Rectum
1996
;
39
:
1
–9.33.
Wiggers T, de Vries MR, Veeze-Kuypers B. Хирургия местного рецидива рака прямой кишки.
Dis Colon Rectum
1996
;
39
:
323
–8.34.
Боццетти Ф., Бертарио Л., Россетти С., Дженнари Л., Андреола С., Баратти Д. и др.Хирургическое лечение местно-рецидивирующей карциномы прямой кишки.
Dis Colon Rectum
1997
;
40
:
1421
–4.35.
Маэтани С., Онодера Х., Нисикава Т., Моримото Х., Ида К. и др. Значение местного рецидива рака прямой кишки как местного или диссеминированного заболевания.
Brit J Surg
1998
;
85
:
521
–5.36.
Ванебо Х.Дж., Антонюк П., Конесс Дж., Леви А., Везеридис М., Коэн С.И. и др. Тазовая резекция рецидивирующего рака прямой кишки.
Dis Colon Rectum
1999
;
42
:
1438
–48,37.
Temple WJ, Saettler EB. Местно рецидивирующий рак прямой кишки: роль комплексной резекции обширных опухолей таза со стратегиями минимизации риска рецидива.
J Surg Oncol
2000
;
73
:
47
–58,38.
Ямада К., Исидзава Т., Нива К., Чуман И., Акиба С. и др. Характер инвазии в области малого таза является прогностическим при лечении местно-рецидивирующего рака прямой кишки.
Brit J Surg
2001
;
88
:
988
–93,39.
Мория Й, Акасу Т., Фудзита С., Ямамото С. Полная экзентерация таза с дистальной сакрэктомией при фиксированном рецидивирующем раке прямой кишки в тазу.
Dis Colon Rectum
2004
;
47
:
2047
–54,40.
Гурен MG, Wiig JN, Dueland S, Tveit KM, Fossa SD. Качество жизни пациентов с отводом мочи после операции по поводу местнораспространенного рака прямой кишки.
евро J Surg Oncol
2001
;
27
:
645
–51.41.
Lopez-Kostner F, Fazio VW, Vignali A, Rybicki LA, Lavery C. Местно рецидивирующий рак прямой кишки. Предсказатели и успех спасательной операции.
Dis Colon Rectum
2001
;
44
:
173
–8,42.
Shoup M, Guillem JG, Alektiar KM, Liau K, Paty PB, Cohen AM и др. Предикторы выживаемости при рецидивирующем раке прямой кишки после резекции и интраоперационной лучевой терапии.
Dis Colon Rectum
2000
;
45
:
585
–92.43.
Портер Г.А., Соскольне ЦЛ, Якимец В.В., Ньюман СК. Факторы, связанные с хирургом, и исход при раке прямой кишки.
Ann Surg
1998
;
227
:
157
–67,44.
Suzuki K, Gunderson LL, Devine RM, Weaver AL, Dozois RR, Ilstrup D и др. Интраоперационное облучение после паллиативных операций по поводу местно-рецидивирующего рака прямой кишки.
Рак
1995
;
75
:
939
–52,45.
Suzuki K, Dozois RR, Devine RM, Nelson H, Weaver AL, Gunderson LL и др.Лечебная повторная операция при местно-рецидивирующем раке прямой кишки.
Dis Colon Rectum
1996
;
39
:
730
–6.
© 2006 Фонд содействия исследованиям рака
Расширенная версия последующего наблюдения при раке толстой кишки и прямой кишки
После лечения рака прямой или толстой кишки постоянное наблюдение для выявления рецидива заболевания считается важной частью лечения пациентов с колоректальным раком.Последующее наблюдение за колоректальным раком относится к систематическому подходу к мониторингу пациентов на предмет нового или рецидивирующего рака после лечения. Большинство этих рекомендаций применимы как к раку прямой, так и прямой кишки. При необходимости отмечаются различия. Соблюдение этих рекомендаций может быть полезно для раннего выявления предраковых полипов и рецидивов рака. Однако систематическое наблюдение не является надежным и не гарантирует отсутствия нового рака толстой кишки. Информация в этой брошюре предназначена для того, чтобы помочь пациентам и их семьям понять их постоянный риск рецидива рака и помочь в организации соответствующего последующего ухода для поддержания их безракового состояния.Этот документ также может быть полезен лечащим врачам, чтобы помочь в надлежащем долгосрочном послеоперационном лечении. В конечном итоге уход за каждым пациентом должен оцениваться индивидуально. Любые вопросы или проблемы, связанные с надлежащим последующим наблюдением в индивидуальном порядке, должны рассматриваться лечащим врачом пациента, часто при консультации с колоректальным хирургом или другим специалистом.
Пациентам с раком прямой или толстой кишки в анамнезе необходима информация относительно:
- Какие пациенты нуждаются в контрольном обследовании
- Риск рецидива колоректального рака
- Типы и сроки соответствующих контрольных анализов
- Признаки и симптомы рецидива рака
- Риск развития новых полипов
- Повышенный семейный риск полипов и рака толстой кишки
В следующей информации изложены общие рекомендации по последующему наблюдению после лечения рака толстой или прямой кишки.
КАКИМ БОЛЬНЫМ НУЖНЫ ТЕСТИРОВАНИЕ?
После того, как пациенту поставили диагноз и вылечили колоректальный рак, важно понимать, что необходимо дальнейшее наблюдение. По сравнению с пациентами, у которых в анамнезе не было рака прямой или толстой кишки, пациенты с колоректальным раком в анамнезе имеют значительно повышенный риск не только рецидива рака толстой кишки, но и развития новых полипов, которые являются предшественниками колоректального рака.
У любого пациента, перенесшего радикальную операцию по поводу полипа или колоректального рака, примерно вдвое выше риск развития новых полипов.Этим пациентам необходимо сделать первую колоноскопию через 1 год после операции, контрольную колоноскопию через 3 года и последующие колоноскопии с интервалом не менее 5 лет. При обнаружении новых полипов или новообразований необходимо соответствующим образом изменить наблюдение за пациентом.
Риск рецидива колоректального рака часто определяется стадией рака. Рак стадии I имеет самый низкий риск рецидива рака, в то время как рак стадии II и III имеет более высокий риск рецидива.Рак стадии II — это рак, при котором лимфатические узлы отсутствуют, но опухоли прорастают глубже через стенку толстой или прямой кишки или проникают в другие органы, которые удаляются во время операции. Раками стадии III называют те, которые распространились на лимфатические узлы. Опухоли стадии IV распространились на органы, удаленные от толстой или прямой кишки, такие как печень, легкие или мозг (см. Рисунок ниже). Из-за индивидуальных различий в опухолях стадии IV пациенты следуют более индивидуализированному режиму последующего наблюдения.
КАК РЕЦЕНЗИРУЕТСЯ РАК толстой и прямой кишки?
Две основные модели рецидива колоректального рака — локальные и отдаленные. Под местным рецидивом понимается опухоль, рецидивирующая в той же области, что и исходная опухоль. Отдаленный рецидив (метастатическое заболевание) означает, что клетки исходного рака распространились на отдаленные органы, чаще всего в печень или легкие. Контрольные тесты направлены на выявление рецидивов заболевания по этим двум основным категориям.
Кроме того, новый колоректальный рак может развиваться на участках толстой и прямой кишки, отличных от места первоначальной опухоли. На самом деле это не рецидив, а скорее новый рак, который развивается через некоторое время после лечения исходного рака.
ПОСЛЕДУЮЩИЕ ИСПЫТАНИЯ
Соответствующее последующее тестирование является ключом к раннему выявлению и потенциально успешному лечению рецидива рака. Эти тесты были разработаны для того, чтобы попытаться выявить рецидивы до развития симптомов, чтобы вмешательство могло быть как можно более успешным.К широким категориям последующих анализов относятся рутинный анамнез и физический осмотр, анализы крови, такие как сывороточный карциноэмбриональный антиген (РЭА), колоноскопия и радиологическая визуализация.
МЕДИЦИНСКАЯ ИСТОРИЯ И ФИЗИЧЕСКОЕ ОБСЛЕДОВАНИЕ
История болезни и медицинский осмотр являются основными компонентами послеоперационного наблюдения. Хотя это важно, часто это наименее эффективный способ выявления ранних рецидивов, потому что подавляющее большинство из них не имеют никаких признаков или симптомов.Эти обследования чаще всего проводятся лечащим врачом больного раком или онкологом. Тщательный сбор анамнеза может выявить новые изменения в привычках кишечника или наличие нового кровотечения или, возможно, необъяснимую потерю веса. Любой из этих признаков или симптомов требует тщательного обследования. Соответствующие результаты физикального обследования могут включать наличие ректального кровотечения или пальпируемого образования. Аномальное увеличение лимфатических узлов может ощущаться в паховых лимфатических узлах, или, реже, во время абдоминального или ректального исследования могут ощущаться образования.
Карциноэмбриональный антиген (CEA) — это белок, который вырабатывается некоторыми раковыми клетками, включая клетки колоректального рака, и секретируется в кровоток.
Уровень
CEA в крови следует проверять примерно во время операции и примерно каждые 3 месяца после лечения в течение не менее 2 лет у пациентов с раком толстой или прямой кишки II или III стадии. После 2-летнего наблюдения уровень CEA в крови проверяется не реже одного раза в 6 месяцев в течение дополнительных трех лет.
Повышенный уровень может потребовать дополнительных обследований, таких как визуализация, компьютерная томография грудной клетки, брюшной полости и таза или ПЭТ. Визуализация может выявить источник рецидива, но иногда может дать другие случайные результаты, которые могут потребовать обследований.
СКАНИРОВАНИЕ КТ
Компьютерная томография (КТ) — это очень чувствительный рентгеновский тест, который позволяет врачам заглядывать «внутрь» тела и определять новые или рецидивирующие опухоли. Большинству пациентов с раком толстой или прямой кишки II или III стадии ежегодно проводится компьютерная томография грудной клетки, брюшной полости и таза.
КОЛОНОСКОПИЯ, СИГМОИДОСКОПИЯ И ПРОКТОСИГМОИДОСКОПИЯ
Колоноскопия и ректороманоскопия — это тесты, которые позволяют врачу исследовать всю толстую кишку или нижнюю треть толстой кишки соответственно. Гибкие камеры с подсветкой вводятся через задний проход или через колостому, чтобы врач мог увидеть внутреннюю часть кишечника, сделать снимки и биопсию, а также удалить полипы. Эта процедура обычно выполняется амбулаторно в хирургическом или эндоскопическом центре.Пациентам обычно требуется пройти процедуру очищения кишечника за 1 или 2 дня до процедуры, чтобы слизистая оболочка толстой и прямой кишки была чистой и была хорошо видна вся область.
Проктосигмоидоскопия может выполняться как гибким, так и жестким (прямым) эндоскопом. В этой процедуре область видимости продвигается только до самой нижней части толстой кишки. Он используется в тех случаях, когда исследуемой областью является только нижняя часть желудочно-кишечного тракта.
Колоноскопия и гибкая проктосигмоидоскопия являются очень безопасными процедурами и редко имеют серьезные осложнения. Двумя основными рисками, связанными с этими процедурами, являются значительное кровотечение и перфорация толстой кишки. Хотя они вызывают беспокойство, на самом деле они редки и встречаются менее чем в 1 или 2 из 1000 колоноскопий.
У некоторых пациентов колоректальный рак может быть вызван генетическими синдромами. В этих уникальных обстоятельствах рекомендации по скринингу или надзору могут быть гораздо более агрессивными.Решение относительно частоты проведения колоноскопии следует принимать после тщательной консультации с врачом и может включать последующее наблюдение у консультанта по генетике.
ДРУГИЕ ИСПЫТАНИЯ
Ультразвук прямой кишки — это тест, который иногда используется для определения глубины инвазии рака в стенку прямой кишки у пациентов с раком прямой кишки. Обычно его проводят в офисе или в процедурном центре. Это может сделать рентгенолог, колоректальный хирург или гастроэнтеролог. После очистительной клизмы обследование обычно проводится с помощью жесткого ультразвукового зонда или в сочетании с гибкой ректороманоскопией.
Позитронно-эмиссионная томография (ПЭТ) — это радиологический тест, который иногда используется для оценки возможности распространения опухоли. Для этого теста перед сканированием вводится специальная форма глюкозы (сахара) с радиоактивной меткой, и, как и при компьютерной томографии, пациента помещают в ПЭТ-сканер. Опухоли и метастазы будут поглощать глюкозу быстрее, чем другие ткани, и выглядят как яркие пятна на ПЭТ-сканировании. Этот тест малоинвазивен и очень безопасен. Количество радиации от введенной глюкозы практически безвредно, и тест обычно не включает инъекции каких-либо других красителей.Беременным или планирующим беременность пациенткам следует обсудить вопросы фертильности со своим врачом до облучения.
Магнитно-резонансная томография (МРТ) — еще один радиологический тест, используемый для создания изображения внутренней анатомии пациента. Вместо использования излучения, как это делают компьютерная томография или рентген, изображения основаны на генерации сильного магнитного поля. Изображения, полученные таким образом, могут предоставить очень специфические анатомические детали, которые могут дополнять информацию, полученную с помощью компьютерной томографии.МРТ обычно является безопасным тестом, но он может сбивать с толку некоторых пациентов, особенно тех, кто страдает клаустрофобией, потому что его помещают в относительно узкий туннельный аппарат, часто на 20–30 минут. Пациенты могут разговаривать и взаимодействовать с техниками, проводящими тест, но должны сохранять неподвижность. Пациенты с определенными металлическими имплантатами, такими как кардиостимуляторы, могут не пройти МРТ.
ЛОКАЛЬНАЯ ВТОРИЧНОСТЬ
Местный рецидив определяется как повторный рост колоректального рака на месте первоначального рака.Поскольку исходная опухоль была удалена вместе с участком толстой или прямой кишки, в котором она возникла, истинный местный рецидив во внутренней оболочке кишечника может произойти в месте повторного соединения двух частей кишечника. Эти опухоли могут быть видны внутри стенок толстой кишки при колоноскопии в виде разрастаний в месте воссоединения или рядом с ним. Они могут прорастать во внутреннюю оболочку кишечника и вызывать симптомы, связанные с кровотечением или сужением места соединения.
Если сужение является значительным, у пациентов могут развиться изменения в привычках кишечника (менее частые испражнения, более узкий стул, трудности с выталкиванием стула) или обструктивные симптомы (отсутствие испражнений, боли в животе, увеличение размера живота, рвота).О любых изменениях в поведении кишечника у пациента с предыдущей резекцией толстой или прямой кишки следует сообщать своему врачу, и, вероятно, их необходимо будет оценить с помощью колоноскопии. При ранних рецидивах опухоль может вообще не вызывать никаких симптомов и может быть обнаружена только при обычном наблюдении.
Местные рецидивы также могут возникать за пределами стенки кишечника. Эти рецидивы часто изначально протекают бессимптомно и не обнаруживаются при колоноскопии, поскольку при колоноскопии видна только внутренняя часть кишечника.Эти рецидивы обычно обнаруживаются либо с помощью контрольного рентгеновского снимка (например, компьютерной томографии), либо сигнализируются увеличением уровня CEA (см. Ниже). Когда эти внешние местные рецидивы перерастают в определенные структуры, они могут вызывать вторичные симптомы, такие как боль, или симптомы со стороны других систем органов, в которые они вторгаются. Рецидивы за пределами толстой кишки, вызывающие симптомы, часто связаны с плохим исходом.
ДИСТАНЦИОННОЕ ВОЗВРАЩЕНИЕ
Отдаленные рецидивы возникают у пациентов с отложенными метастазами (распространяются на другие органы, не находящиеся в прямом контакте с исходной опухолью, чаще всего через лимфатические узлы или кровоток).Наиболее частыми локализацией отдаленных рецидивов рака прямой и толстой кишки являются печень и легкие. Эти рецидивы часто не имеют никаких симптомов и обнаруживаются только во время планового последующего рентгеновского обследования или патологического исследования CEA, которое требует визуализации для поиска возможного источника.
ЧТО ПРОИСХОДИТ, ЕСЛИ ОБНАРУЖЕН ВТОРИЧНЫЙ?
Если во время регулярного наблюдения будет обнаружен рецидив, ваш онколог и колоректальный хирург будут работать вместе, чтобы определить, насколько он обширен.Скорее всего, будут выполнены визуальные тесты, такие как компьютерная томография или ПЭТ-сканирование, чтобы определить, было ли дополнительное отдаленное распространение. Если рецидив удален от исходной опухоли или находится более чем в одной области, обычно сначала лечат его химиотерапией. Если рецидив является локальным, его можно вылечить с помощью другой операции. Если ваш первоначальный рак был в толстой кишке (а не в прямой кишке), более вероятно, что этот местный рецидив удастся удалить.
Если местный рецидив находится в прямой кишке, это может вызвать определенные проблемы при поражении соседних структур.Попытки хирургического вмешательства по излечению могут включать необходимость удаления части крестца (копчика), частей мочевыделительной системы и влагалища. Чтобы определить, поражены ли другие органы, обычно проводится МРТ таза. Кроме того, если пациент еще не получил лучевую терапию до операции по поводу рака прямой кишки, она почти всегда показана при лечении рецидивирующего рака прямой кишки.
Приведенная ниже таблица взята с веб-сайта Американского общества клинической онкологии и представляет собой самую последнюю версию рекомендаций, основанную на самом последнем обзоре литературы по этому вопросу.
| Рекомендации по последующему уходу | Год 1 | Год 2 | Год 3 | Год 4 и 5 * |
|---|---|---|---|---|
| Визит к врачу | Каждые 3-6 месяцев | Каждые 3-6 месяцев | Каждые 3-6 месяцев | Каждые 6 месяцев |
| Тест CEA | Каждые 3 месяца | Каждые 3 месяца | Каждые 3 месяца | По определению врача |
| КТ (грудная клетка и брюшная полость) | Ежегодно по рекомендации врача | Ежегодно по рекомендации врача | Ежегодно по рекомендации врача | По определению врача |
| КТ (таз) (только рак прямой кишки) | Ежегодно по рекомендации врача | Ежегодно по рекомендации врача | Ежегодно по рекомендации врача | По определению врача |
| Колоноскопия | Однажды | В 3 года | ||
| Проктосигмоидоскопия (только рак прямой кишки) | Каждые 6 месяцев в течение 5 лет |
* Через 5 лет необходимость в будущих тестах и посещениях решается пациентом и врачом.
ЧТО ТАКОЕ ХИРУРГ ОБОЛОЧКИ И РЕКТИКИ?
Хирурги толстой и прямой кишки являются экспертами в хирургическом и безоперационном лечении заболеваний толстой, прямой и анального отверстия. Они прошли усовершенствованную хирургическую подготовку по лечению этих заболеваний, а также полную общую хирургическую подготовку. Они хорошо разбираются в лечении как доброкачественных, так и злокачественных заболеваний толстой и прямой кишки и заднего прохода, а также могут проводить обычные скрининговые обследования и хирургически лечить состояния, если для этого есть показания.
ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ
Американское общество хирургов толстой и прямой кишки занимается обеспечением высококачественного ухода за пациентами путем развития науки, профилактики и лечения расстройств и заболеваний толстой, прямой и анальной кишки. Эти брошюры носят инклюзивный, но не предписывающий характер. Их цель — предоставить информацию о заболеваниях и процессах, а не предписывать конкретную форму лечения. Они предназначены для использования всеми практикующими врачами, медицинскими работниками и пациентами, которым нужна информация о лечении рассматриваемых состояний.Следует понимать, что эти брошюры не должны рассматриваться как включающие все надлежащие методы ухода или исключающие методы ухода, разумно направленные на получение тех же результатов. Окончательное решение относительно уместности какой-либо конкретной процедуры должен сделать врач с учетом всех обстоятельств, представленных отдельным пациентом.
Цитаты
Дуйовни Н. и Хуриган Дж. Глава 48, «Колоректальный рак: наблюдение».Глава в Beck DE, Roberts PL, Saclarides TJ, Senagore AJ, Stamos MJ, Wexner SD, Eds. Учебник ASCRS по хирургии толстой кишки и прямой кишки, 2-е издание. Спрингер, Нью-Йорк, штат Нью-Йорк; 2011.
ASCRS: Параметры практики для наблюдения и последующего наблюдения за пациентами с раком прямой и толстой кишки. Dis Colon Rectum 2004; 47: 807–817.
Веб-сайт Национального института рака США (по состоянию на август 2012 г.): http://www.cancer.gov/cancertopics/types/colon-and-rectal
© 2015 Американское общество хирургов толстой и прямой кишки
Колоректальный рак, метастатический или рецидивирующий
Обзор темы
Подходит ли вам эта тема?
Эта тема о колоректальном раке, который распространился или вернулся.Если вы хотите узнать больше о колоректальном раке на ранней стадии, см. Тему Колоректальный рак.
Что такое колоректальный рак?
Колоректальный рак возникает, когда в толстой или прямой кишке растут ненормальные клетки. Эти клетки срастаются и образуют полипы. Со временем некоторые полипы могут перейти в рак. Этот рак также называется раком толстой кишки или раком прямой кишки, в зависимости от того, где находится рак.
Метастатический рак — это рак, распространившийся на другие части тела.Когда рак прямой или толстой кишки распространяется, он чаще всего распространяется на печень. Иногда он распространяется на легкие, кости или другие органы тела.
Рак толстой кишки и прямой кишки часто возвращается через месяцы или годы после лечения. Это называется рецидивирующим раком. Если исходный рак был удален до того, как он смог распространиться, шансы, что он вернется, будут ниже.
Что вызывает метастатический или рецидивирующий колоректальный рак?
Врачи не знают точной причины. Но вероятность того, что рак распространится или вернется, выше, если он находится на более поздней, более поздней стадии, когда он впервые обнаружен.
Иногда раковые клетки слишком малы, чтобы их можно было обнаружить с помощью тестов. Эти клетки могут продолжать расти и позже проявляться как метастатический рак, даже спустя годы после лечения.
Каковы симптомы?
Наиболее частыми симптомами являются:
- Изменение привычек кишечника, например учащение стула, более жидкий стул или ощущение, что кишечник не опорожняется полностью.
- Кровь в стуле или очень темный стул.
- Потеря аппетита.
- Боль в животе, особенно газы, спазмы или чувство распирания.
- Худеем без особых усилий.
- Постоянная утомляемость (утомляемость).
У некоторых людей симптомы отсутствуют.
Если ваш рак распространился, у вас могут быть другие симптомы в зависимости от того, где находится рак.
Как диагностируется метастатический или рецидивирующий колоректальный рак?
Рак толстой кишки или прямой кишки, который распространился или вернулся, диагностируется с помощью физического осмотра и нескольких тестов, включая анализы крови, рентген грудной клетки, сканирование костей, ультразвук, а также компьютерную томографию, ПЭТ или МРТ.
Диагноз обычно подтверждается биопсией. Во время этого теста ваш врач возьмет образцы тканей из любых участков, которые не выглядят нормально. Ткань будет изучена под микроскопом, чтобы увидеть, есть ли в ней рак.
Если в прошлом вы лечились от рака прямой или толстой кишки, важно проходить регулярные осмотры, чтобы как можно скорее обнаружить новый рак.
Как лечится?
Рак толстой кишки и прямой кишки, который распространился или вернулся, в некоторых случаях можно вылечить.Лечение может включать хирургическое вмешательство, лучевую терапию, химиотерапию и таргетную терапию. Рак прямой кишки можно лечить с помощью иммунотерапии. Когда рак невозможно вылечить, лечение может помочь вам почувствовать себя лучше и прожить дольше.
Узнать, что у вас рак распространился или вернулся, может быть очень сложно. Некоторым людям полезно поговорить о своих чувствах с семьей и друзьями. Вы также можете поговорить со своим врачом или с другими людьми, у которых был этот вид рака. Местное отделение Американского онкологического общества может помочь вам найти группу поддержки.
Причина
Точная причина колоректального рака неизвестна. В большинстве случаев заболевание начинается с небольших образований или полипов внутри кишечника.
Метастатический и рецидивирующий колоректальный рак возникает, когда рак распространяется или возвращается, даже спустя годы после лечения. Иногда раковые клетки слишком малы, чтобы их можно было найти и удалить. Они продолжают расти и позже вызывают проблемы.
Симптомы
Наиболее частыми симптомами являются:
- Изменение привычек кишечника, например узкий стул, частая диарея или запор.
- Кровь в стуле или стул, похожий на черный деготь.
- Потеря аппетита.
- Боль в животе, особенно газовые боли, спазмы или чувство распирания.
- Необъяснимая потеря веса.
- Постоянная утомляемость (утомляемость).
У некоторых людей какое-то время симптомы не проявляются.
Если ваш рак распространился, у вас могут быть другие симптомы в зависимости от того, где находится рак.
Что происходит
Как растет и распространяется рак
Рак — это рост аномальных клеток в организме.Эти лишние клетки срастаются и образуют массы, комки или опухоли. При колоректальном раке эти разрастания обычно начинаются с безвредных полипов в толстой кишке. Если полипы не найти и не удалить, некоторые из них могут перейти в рак.
Если позволить раку продолжать расти, со временем он проникнет и разрушит близлежащие ткани, а затем распространится дальше.
- Рак толстой кишки часто сначала распространяется на близлежащие лимфатические узлы. Оттуда он может распространиться на другие части тела, обычно в печень.Он также может распространяться на легкие, кости или другие органы тела.
- Рак прямой кишки может распространяться непосредственно на легкие, минуя печень.
Рецидив колоректального рака возникает, когда рак снова начинает расти через несколько месяцев или лет после лечения.
Выживаемость
Долгосрочный результат или прогноз колоректального рака зависит от того, насколько опухоль разрослась и распространилась. Эксперты говорят о прогнозе с точки зрения «5-летней выживаемости». Это означает процент людей, которые все еще живы через 5 лет или дольше после того, как у них был обнаружен рак.Важно помнить, что это только средние значения. У всех разные случаи. И эти цифры не обязательно показывают, что с вами будет.
5-летняя выживаемость: сноска 1
- Это 71% для людей, у которых рак распространился на близлежащие органы или лимфатические узлы. Это означает, что около 71 человека из 100 все еще живы через 5 или более лет после того, как у них был обнаружен рак.
- Это 14% для людей, у которых рак распространился дальше на другие части тела.Это означает, что около 14 из 100 человек все еще живы через 5 или более лет после того, как у них был обнаружен рак.
Эти числа взяты из отчетов, составленных с 2007 по 2013 год, до того, как стали доступны новые методы лечения. Так что реальные шансы на выживание, вероятно, будут выше этих цифр.
Что увеличивает ваш риск
Даже после успешного лечения колоректальный рак может вернуться (рецидив). Но это зависит от стадии рака до лечения.
Ваш риск рецидива или метастатического рака зависит от того, насколько агрессивен ваш рак и насколько эффективно лечение.
Когда вам следует позвонить своему врачу?
Вы можете регулярно посещать врача для проверки симптомов, но симптомы могут проявляться между посещениями. Знайте, что для вас нормально, и сразу же сообщайте своему врачу о любых изменениях. Обязательно сообщите врачу, если почувствуете даже очень небольшие изменения.
Позвоните своему врачу, если у вас есть какие-либо из этих симптомов:
- Изменение привычек кишечника, например запор или диарея
- Боль или вздутие живота
- Снижение веса, потеря аппетита или сильная усталость
- Устойчивое одышка или кашель (особенно кашель с кровью)
- Боль в костях
- Спутанность сознания или ухудшение памяти
К кому обратиться
Если вы лечились от колоректального рака, врачи, которые могут оценить любые новые симптомы, включают:
Обследования и анализы
Обследования, которые помогут вашему врачу определить, распространился ли колоректальный рак или вернулся ли он, включают:
- УЗИ брюшной полости для определения причины боли или вздутия живота.
- Колоноскопия, чтобы узнать, вернулся ли рак в кишечник.
- Анализы крови , чтобы выяснить, вернулся ли рак (CEA) или чтобы найти причину таких симптомов, как слабость, утомляемость, лихорадка, синяки или потеря веса (общий анализ крови).
- Рентген грудной клетки для определения причины таких симптомов, как постоянный кашель, кашель с кровью, боль в груди или затрудненное дыхание.
- КТ , МРТ или ПЭТ, чтобы увидеть, распространился ли колоректальный рак на грудную клетку или органы в области живота или таза.
- КТ головного мозга или МРТ для выявления таких симптомов, как спутанность сознания, паралич, онемение, проблемы со зрением, головокружение или головные боли.
- Биопсия , такая как биопсия печени или биопсия легких, чтобы выяснить, где распространились раковые клетки.
- Сканирование костей, чтобы узнать, распространились ли раковые клетки на кости.
Если обнаружен метастатический рак, вы также можете пройти генетические тесты, прежде чем ваш врач порекомендует план лечения.Эти тесты ищут изменения (мутации) генов, которые могут возникнуть при колоректальном раке. Они могут показать, какие химиотерапевтические препараты помогут.
Обзор лечения
Ваше лечение рака прямой кишки, который распространился или вернулся, может включать:
Хирургия
. Если рак вернулся в ваш кишечник или другую часть вашего тела, его можно удалить хирургическим путем. Чтобы узнать больше, см. Хирургия.Химиотерапия
.Эти лекарства убивают раковые клетки, которые распространились на другие части вашего тела. Они также могут облегчить боль, вызванную раком. Чтобы узнать больше, см. Лекарства.Лучевая терапия
. Рентген можно использовать для уменьшения колоректальных опухолей, которые могут вызывать закупорку. Они также могут уменьшить кровотечение или боль. Чтобы узнать больше, см. Другое лечение.Таргетная терапия
. В этом лечении используются лекарства, называемые моноклональными антителами, для лечения колоректального рака.Его часто назначают вместе с химиотерапией. Чтобы узнать больше, см. Лекарства.Клинические испытания
. Это исследования новых или различных способов лечения рака.
Колоректальный рак часто возвращается, даже после лечения, которое казалось успешным. Ваш рак может вернуться, даже если вы сделаете все возможное, чтобы предотвратить его. Если это произойдет, сосредоточьтесь на том, что вы и ваш врач можете сделать для лечения своих симптомов, чтобы помочь вам почувствовать себя лучше и жить дольше.
Ваше лечение будет зависеть от конкретной информации о раке, ваших предпочтений и вашего здоровья.
Некоторые случаи еще можно вылечить. Когда рак невозможно вылечить, лечение поможет вам почувствовать себя лучше и прожить дольше.
Обезболивание
Боль — одна из основных проблем людей, больных раком. Но боль при раке почти всегда можно контролировать. Есть несколько способов контролировать боль, например, с помощью сильнодействующих лекарств, таких как опиоиды. Или вы можете пройти курс лечения, уменьшающий опухоль и блокирующий нервную боль.
Паллиативная помощь
Паллиативная помощь — это вид помощи людям, страдающим серьезными заболеваниями. Это отличается от лечения вашей болезни. Его цель — улучшить качество вашей жизни — не только в вашем теле, но также в вашем разуме и духе. Вы можете получить этот уход вместе с лечением, чтобы вылечить вашу болезнь.
Поставщики паллиативной помощи помогут контролировать боль или побочные эффекты. Они могут помочь вам решить, какое лечение вы хотите или не хотите. И они могут помочь вашим близким понять, как вас поддержать.
Если вас интересует паллиативная помощь, поговорите со своим врачом.
Уход за пациентами в конце жизни
Для некоторых людей с запущенным раком наступает время, когда лечение для лечения рака больше не кажется хорошим выбором. Это может быть связано с тем, что побочные эффекты, время и стоимость лечения превышают обещание излечения или облегчения. Но вы все равно можете пройти лечение, чтобы чувствовать себя максимально комфортно в оставшееся время. Вы и ваш врач можете решить, когда вы будете готовы к лечению в хосписе.
Для получения дополнительной информации см. Разделы:
Профилактика
Не существует надежного способа предотвратить рецидив рака прямой кишки или его распространение на другие части тела.
Но есть изменения в образе жизни, которые могут помочь вам после лечения. Исследования показывают, что эти вещи могут помочь: сноска 2
Первоначальное лечение колоректального рака сопровождается регулярными посещениями врача и обследованием, чтобы помочь найти рак, если он вернется.
Домашнее лечение
Управление побочными эффектами
Во время лечения вы можете помочь справиться со своими побочными эффектами и симптомами в домашних условиях. Если ваш врач дал вам инструкции или лекарства для лечения этих проблем, обязательно используйте их.
Попробуйте домашние средства от:
- тошноты или рвоты, например имбирный чай, мятные леденцы или жевательную резинку. Обязательно пейте достаточно жидкости, чтобы не обезвоживаться.
- Обезболивающие, например безрецептурные болеутоляющие, тепловые или холодные компрессы.Поговорите со своим врачом, прежде чем использовать домашнее средство от боли. Чтобы узнать больше, см. Тему «Боль при раке».
- Диарея, например, частые глотки воды небольшими глотками и откусывания соленых крекеров.
- Запор, например, потребление большого количества воды и клетчатки в вашем рационе. Не используйте слабительное, не посоветовавшись предварительно с врачом.
Другие проблемы, которые можно решить дома, включают:
- Проблемы со сном. Если у вас проблемы со сном, постарайтесь регулярно ложиться спать, ежедневно заниматься спортом и избегать употребления кофеина в конце дня.
- Чувствую себя очень уставшим. Если вам не хватает энергии или вы легко становитесь слабым, постарайтесь больше отдыхать. Планируйте свое расписание, чтобы максимально использовать имеющуюся у вас энергию.
- Язвы во рту. Следите за тем, что вы едите и пьете. Регулярно полощите рот жидкостью для полоскания рта или жидким антацидом.
В целом, здоровые привычки, такие как сбалансированное питание, достаточное количество сна и физические упражнения, могут помочь контролировать симптомы.
Как справиться со стрессом
Рак может быть очень стрессовым.Поиск новых способов справиться со стрессом может помочь вам почувствовать себя лучше.
Например, вы можете:
- Попробовать техники для снижения стресса, такие как йога и упражнения на визуализацию.
- Расскажите о своих чувствах. Ваш центр лечения рака может предлагать консультационные услуги и группы поддержки.
- Попросите своего врача помочь вам найти другие источники поддержки и информации.
Ваше отношение к своему телу может измениться после лечения. Работа с образом своего тела может включать в себя открытый разговор с партнером о своих заботах и обсуждение своих чувств с врачом.
Обратитесь в местное отделение Американского онкологического общества, чтобы найти группу поддержки. Очень полезно поговорить с другими людьми, у которых был подобный опыт.
Рак может изменить вашу жизнь во многих отношениях. Чтобы справиться с этими изменениями, см. Раздел «Получение поддержки при раке».
Лекарства
Химиотерапия — это использование лекарств для остановки роста рака или облегчения симптомов. Иногда химиотерапия может использоваться для уменьшения опухолей в печени, чтобы их можно было удалить хирургическим путем.
Лекарства можно вводить через иглу в вену, в виде таблеток, которые можно проглотить, или в виде укола (инъекции).
Выбор лекарств
Чаще всего используются следующие лекарственные средства:
- Бевацизумаб (Авастин).
- Капецитабин (Кселода).
- Фторурацил (5-ФУ).
- Иринотекан (Камптозар).
- Леуковорин (Фусилев).
- Оксалиплатин (Элоксатин).
Цетуксимаб (Эрбитукс) и панитумумаб (Вектибикс) могут использоваться при колоректальном раке, который распространился и не улучшился во время или после лечения другими препаратами.Эти виды лекарств, называемые моноклональными антителами, могут не подействовать на некоторых людей. Поэтому перед этим лечением ваша опухолевая ткань будет проверена на наличие определенных генных изменений (мутаций).
Ваш врач может назначить лекарства от тошноты и рвоты.
Операция
Операция может использоваться для удаления рака толстой или прямой кишки. Или это может быть сделано для удаления рака, который распространился на другие органы тела. Тип выбранной операции зависит от стадии рака.
Хирургия на выбор
- Резекция кишечника. Хирург вырезает опухоль в толстой или прямой кишке, а также в соседних частях толстой или прямой кишки. Затем два здоровых конца толстой или прямой кишки снова сшивают.
- Резекция печени. Хирург удаляет рак, который распространился на печень, а также на части печени, которые находятся рядом с раком. Если рак в вашей печени слишком велик, чтобы удалить его хирургическим путем, вам могут назначить химиотерапию.Он может уменьшить опухоль, чтобы ее можно было удалить.
- Резекция легкого, надпочечника или яичника , в зависимости от того, где распространился рак, и от того, подходите ли вы для этой операции.
Если рак, вернувшийся в кишечник, имеет большой размер, возможно, придется удалить большую часть толстой или прямой кишки. Если не удается соединить концы толстой или прямой кишки, вам может потребоваться колостома. Большинству людей постоянная колостома не нужна.
Иногда операция используется не для лечения рака, а для того, чтобы сделать вашу жизнь более комфортной.Например, хирург может сделать колостому, чтобы облегчить симптомы, вызванные опухолью, блокирующей толстую кишку.
Другое лечение
Лучевая терапия
Лучевая терапия использует рентгеновские лучи для уничтожения клеток колоректального рака. Часто сочетается с хирургическим вмешательством или химиотерапией. Радиация также может использоваться для уменьшения размера рака, когда он блокирует толстую или прямую кишку.
Лучевая терапия вряд ли вылечит метастатический или рецидивирующий колоректальный рак.Но они могут облегчить боль и дискомфорт, замедлить распространение болезни и помочь вам прожить дольше.
Лечение рака, распространившегося на печень
Иногда колоректальный рак, распространившийся на печень, можно удалить хирургическим путем. Но обычно требуются другие методы лечения, например:
- Радиочастотная абляция. В опухоль вставлен небольшой провод, излучающий радиоволны. Радиоволны уничтожают рак, распространившийся на печень, не нанося вреда здоровым тканям.
- Криохирургия. Это можно сделать во время операции по поводу рака, распространившегося на печень. Жидкий азот используется для замораживания и уничтожения раковых клеток.
- Эмболизация. Это уменьшает раковые клетки, распространившиеся на печень, из-за прекращения кровоснабжения.
- Интерстициальная лучевая терапия. При этом типе лечения внутренним облучением радиоактивный материал, запечатанный в иглах, проволоках, семенах или катетерах, вводится непосредственно в опухоль или ткань тела.
- Внутриартериальная химиотерапия печени. Хирург вживляет небольшую помпу в живот, которая вводит химиотерапию прямо в опухоль. Насос можно оставлять на месте столько, сколько необходимо.
Клинические испытания
Клинические испытания — это исследования, направленные на поиск новых методов лечения. Если вам интересно, спросите своего врача, есть ли у вас испытания, в которых вы можете принять участие. Национальный институт рака или местное отделение Американского онкологического общества также могут помочь вам найти клинические испытания.
Дополнительные методы лечения
Люди иногда используют дополнительные методы лечения наряду с лечением, чтобы облегчить симптомы и побочные эффекты лечения. Некоторые из дополнительных методов лечения, которые могут быть полезны, включают:
Эти процедуры могут помочь вам почувствовать себя лучше. Они могут облегчить лечение рака. Они также могут уменьшить хроническую боль в пояснице, боли в суставах, головные боли и боль от лечения.
Перед тем, как попробовать дополнительную терапию, поговорите со своим врачом о возможной ценности и побочных эффектах.Сообщите своему врачу, если вы уже используете какие-либо подобные методы лечения. Эти методы лечения не предназначены для замены стандартного лечения. Но они могут улучшить качество вашей жизни и помочь справиться со стрессом и побочными эффектами лечения рака.
Список литературы
Цитаты
- Национальный институт рака (2017). Факты статистики рака SEER: рак толстой и прямой кишки. Национальный институт рака . https://seer.cancer.gov/statfacts/html/colorect.html. По состоянию на 10 ноября 2017 г.
- Национальная комплексная онкологическая сеть (2012 г.). Рак толстой кишки. Руководство NCCN по клинической практике в онкологии , версия 3. Доступно в Интернете: http://www.nccn.org/professionals/physician_gls/f_guidelines.asp#site.
Консультации по другим работам
- Libutti SK, et al. (2015). Рак прямой кишки.В VT DeVita Jr et al., Eds., DeVita, Hellman, and Rosenberg’s Cancer Principles and Practices of Oncology, 10th ed., Pp. 823–841. Филадельфия: Уолтерс Клувер.
- Национальный институт рака (2011). PDQ рака толстой кишки: лечение — версия для пациента. Доступно в Интернете: http://www.cancer.gov/cancertopics/pdq/treatment/colon/Patient.
- Национальный институт рака (2011 г.). PDQ рака прямой кишки: лечение — версия для специалистов в области здравоохранения. Доступно в Интернете: http: //www.cancer.gov / racetopics / pdq / treatment / rectal / HealthProfessional / allpages.
- Национальный институт рака (2012 г.). Лечение рака прямой кишки (PDQ) — версия для пациентов. Доступно в Интернете: http://www.cancer.gov/cancertopics/pdq/treatment/rectal/Patient.
Кредиты
Текущий по состоянию на:
17 декабря 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
E.Грегори Томпсон, врач-терапевт
Кэтлин Ромито, врач-семейная медицина
Адам Хусни, врач-терапевт, семейная медицина
Кеннет Барк, врач-терапевт, общая хирургия, хирургия толстой и прямой кишки
Раннее выявление рецидива колоректального рака у пациентов, перенесших хирургическое вмешательство с целью лечения: текущее состояние и проблемы
J Рак
2014; 5 (4): 262-271.
DOI: 10.7150 / jca.7988
Обзор
Патрик.Э. Янг 1,3 , Крейг М. Уомельдорф 2,3 , Эрик К. Джонсон 4 , Джастин А. Майкель 5 , Бьорн Брухер 6 , Алекс Стоядинович 6 , Ицхак Авиталь 6 , Авирам Ниссан 7 , Скотт Р. Стил 4
1. Отделение медицины, Отделение гастроэнтерологии, Национальный военный медицинский центр Уолтера Рида, Бетесда, Мэриленд, США
2. Отделение медицины, Отделение гастроэнтерологии, Военно-медицинский центр Сан-Антонио, Сан-Антонио, Техас, США
3.Медицинский факультет Университета медицинских наук в униформе, Бетесда, Мэриленд, США
4. Отделение хирургии, Армейский центр Мэдиган, Такома, Вашингтон, США
5. Отделение колоректальной хирургии, Мемориальный медицинский центр Массачусетского университета, Вустер, Массачусетс , США
6. Онкологический институт Bon Secours, Ричмонд, штат Вирджиния, США
7. Отделение хирургии, Медицинский центр Хадасса-Еврейского университета, Иерусалим, Израиль
Образец цитирования:
Молодой PE, Womeldorph CM, Johnson EK, Maykel JA, Brucher B, Stojadinovic A, Avital I, Nissan A, Steele SR.Раннее выявление рецидива колоректального рака у пациентов, перенесших хирургическое вмешательство с лечебной целью: текущее состояние и проблемы. J Cancer 2014; 5 (4): 262-271. DOI: 10.7150 / jca.7988. Доступна с
https://www.jcancer.org/v05p0262.htm
Несмотря на успехи в неоадъювантной и адъювантной терапии, внимание к правильной хирургической технике и улучшение патологической стадии как для первичных, так и для метастатических поражений, почти у половины всех пациентов с колоректальным раком разовьется рецидив заболевания.Более того, сюда входят ~ 25% пациентов с теоретически излечимыми лимфоузлами, неметастатическими стадиями I и II болезни. Учитывая ежегодную заболеваемость колоректальным раком, примерно 150 000 новых пациентов ежегодно становятся кандидатами для последующего наблюдения. В сочетании с большей популяцией, уже включенной в протокол наблюдения, это приводит к огромному количеству пациентов с риском рецидива. Поэтому крайне важно, чтобы стратегии были нацелены на обнаружение рецидива как можно раньше, чтобы можно было начать лечение, которое все еще может привести к излечению.Тем не менее, существуют разногласия относительно оптимальной стратегии надзора (высокая — интенсивность против традиционной), идеального режима тестирования и общей эффективности. Хотя преимущества могут включать более раннее выявление рецидива, улучшение психологического благополучия и более высокую общую выживаемость, это необходимо сопоставить с потенциальными недостатками, включая более инвазивные тесты, более высокую частоту повторных операций и увеличение затрат. В этом обзоре мы рассмотрим имеющиеся в настоящее время варианты и проблемы, связанные с эпиднадзором за колоректальным раком и ранним выявлением рецидивов.
Ключевые слова : колоректальный рак, колоноскопия, EUS, CEA, рецидив
Колоректальный рак ежегодно поражает почти 150 000 пациентов в США и является причиной почти 50 000 смертей. (1) У тех, кому посчастливилось быть кандидатом на операцию с лечебной целью, адекватное последующее наблюдение может выявить ранний рецидив, метахронное злокачественное новообразование и метастатическое заболевание. Несколько специализированных обществ опубликовали рекомендации относительно надлежащего последующего наблюдения за такими пациентами (, таблица 1, ).(2-7) Несмотря на то, что эти руководящие принципы согласуются по многим ключевым моментам, остаются области разногласий.
Учитывая, что ~ 30-50% пациентов, перенесших лечебную резекцию, в конечном итоге будут иметь рецидив заболевания, оптимизация стратегии наблюдения имеет первостепенное значение. (4) Однако для того, чтобы такая стратегия была значимой, необходимо выполнить несколько основных требований. Во-первых, рецидив должен быть обнаружен в бессимптомной фазе. В противном случае клиницист мог бы просто дождаться появления симптомов, вместо того чтобы предпринимать какие-либо стратегии наблюдения.Во-вторых, обнаружение рецидивирующего или метахронного заболевания должно привести к эффективному лечению и лучшему клиническому исходу, чем отсутствие наблюдения. Исторически это в первую очередь означало дополнительное оперативное вмешательство, поскольку в большинстве случаев хирургическое вмешательство было единственным вариантом лечения, а другие методы, такие как химиотерапия, зарезервированы для паллиативной помощи. Совсем недавно достижения в области минимально инвазивных методов (, т. Е. , химиоэмболизация, криотерапия, радиочастотная абляция) и высокоцелевых биологических агентов несколько изменили эту парадигму.Тем не менее, по-прежнему действует принцип, согласно которому, если пациент не желает проходить дальнейшее лечение или не может быть кандидатом на такое лечение, постоянное наблюдение неоправданно.
Одна из трудностей, с которыми врачи сталкиваются при интерпретации литературы по этой теме, — это быстрое развитие технологий. Например, первое рандомизированное клиническое испытание, сравнивающее режим интенсивного эпиднадзора со «стандартным» наблюдением, было опубликовано в 1995 году, а набор пациентов проводился в конце 1980-х годов.(8) Компьютерная томография не смогла улучшить раннее обнаружение в этом исследовании, но компьютерная томография, выполненная с помощью двухсрезового сканера 25 лет назад, отличается от того, которое выполняется сегодня на 128-срезовом аппарате. Улучшения в хирургической технике и послеоперационном ведении увеличили выживаемость оперированных по поводу рецидивов, в то время как достижения в области химиотерапии и биологических агентов позволили пациентам, у которых ранее было неоперабельное заболевание, стать операбельными. (9) Наконец, необходимо учитывать цели и предпочтения пациентов в лечении, поскольку все последующие тесты сопряжены с риском.Эти риски включают как физические (, например, перфорация, радиационное облучение), так и психические (, например, тревога, избегание фобий), которые потенциально могут отрицательно сказаться на качестве оставшейся жизни пациентов. Авторы надеются, что информация в этой статье станет отправной точкой для разговора с пациентами о текущем состоянии науки в области наблюдения за колоректальным раком и раннего выявления рецидивов.
Точное определение стадий пациентов с колоректальным раком не только помогает выбрать правильный протокол лечения, но также позволяет разделить пациентов на когорты с аналогичным прогнозом как безрецидивной, так и общей выживаемости.Тем не менее, признано, что на каждой стадии AJCC некоторые пациенты живут намного дольше своей предполагаемой 5-летней выживаемости, в то время как у других развиваются рецидивы или они умирают от того, что теоретически было излечимым заболеванием. Биология опухоли, схемы лечения и реакция опухоли каждого человека на лечение — все это играет важную роль в конечном результате. Помимо требований, перечисленных ранее, при разработке идеального протокола послеоперационного наблюдения для наблюдения за пациентами с колоректальным раком желательны определенные критерии: 1) широкая доступность; 2) высокая чувствительность к раннему выявлению рецидивов; 3) высокая специфичность, чтобы гарантировать правильную маркировку тех, у кого нет заболеваний; и 4) рентабельность.Тем не менее, успех каждого протокола зависит от сильных и слабых сторон его отдельных компонентов. Например, небольшое повышение неспецифического опухолевого маркера может иметь совершенно иное значение, чем заметное изменение на ПЭТ-сканировании в ранее ничем не примечательном тазу. С другой стороны, хотя частота раннего выявления может улучшаться с каждым 3-месячным анамнезом и физическим, лабораторным тестированием, компьютерной томографией, ПЭТ-сканированием, эндоскопическим ультразвуком (EUS) и колоноскопией, это невозможно и не рентабельно.
При оценке влияния стратегии интенсивного и стандартного эпиднадзора на исходы у пациентов с колоректальным раком после резекции было проведено не менее 8 рандомизированных контролируемых испытаний, (10-18) 7 метаанализов (19-24) и одно Кокрановское обновление ( 25) были завершены в последнее десятилетие. Несмотря на обилие данных, на которых можно основывать рекомендации, существует множество проблем. Определение того, что представляет собой интенсивное наблюдение по сравнению со стандартным, варьируется, как и индивидуальная программа. Тем не менее, хотя схемы и компоненты наблюдения в разных исследованиях различаются, результаты, как правило, предполагают улучшение раннего выявления, увеличение частоты лечебной резекции рецидива и лучшую общую выживаемость с более интенсивными протоколами.В Кокрановском обзоре (25), хотя абсолютное количество рецидивов было схожим, интенсивное наблюдение было связано с улучшением общей выживаемости через пять лет (OR = 0,73; 95% ДИ 0,59–0,91). Кроме того, несмотря на неоднородность исследований, авторы смогли определить, что время рецидива значительно сократилось на -6,75 (95% ДИ -11,06 до -2,44), что свидетельствует о более раннем обнаружении рецидива в когорте высокоинтенсивного наблюдения. . Данные об отдельных компонентах этих лечебных стратегий будут рассмотрены ниже.
Как только пациенты входят в протокол наблюдения, хотя и кажется простым, первым шагом в управлении рецидивом является точное определение его наличия. На практике это может быть намного сложнее, чем на первый взгляд. К сожалению, только ~ 10-20% всех рецидивов рака толстой кишки возникают локально-регионально после стандартного онкологического иссечения, и многие из них не видны внутриполочечно. Другие модели рецидивов включают поражение соседних брыжеечных узлов, а также новообразования, затрагивающие брюшную стенку или забрюшинное пространство.Было показано, что обструкция, перфорация и поражения Т4 независимо связаны с местным рецидивом рака толстой кишки. (26) Местный рецидив рака прямой кишки во многом зависит от стадии, метода резекции и адъювантной терапии. В зависимости от местоположения, характеристик опухоли и сопутствующих заболеваний (и желаний пациента) поражения прямой кишки могут быть удалены стандартными онкологическими методами (, т. Е. , полное мезоректальное иссечение или абдоминально-перинеальная резекция) или трансанально (местное иссечение, трансанальная эндоскопическая микрохирургия). или трансанальная малоинвазивная хирургия).После традиционного трансанального иссечения частота местных рецидивов опухолей T1 и T2 составляет ~ 10-20% и 25-50% соответственно. (27) Поражения T2 становятся все более сомнительными для успешного использования этого подхода, в основном из-за их учащения рецидивов. В большом исследовании, проведенном в Университете Миннесоты, авторы обнаружили, что частота местных рецидивов составляет 47% в поражениях T 2 . (28) Вы и ваши коллеги обследовали 765 пациентов из Национальной базы данных по раку, перенесших местное иссечение по поводу болезни AJCC стадии 1, включая 164 пациентов с поражениями T 2 .В целом частота местных рецидивов в течение пяти лет составила 22,1%, что значительно выше, чем после стандартной резекции, но меньше, чем в исследовании Университета Миннесоты. (29) Частично это, вероятно, вторично по отношению к таким факторам, как размер, дисплазия, статус края и гистологические предикторы (, то есть , лимфоваскулярная инвазия, степень дифференцировки, расстояние от анального края). Кроме того, технические факторы играют роль в частоте рецидивов, при этом наибольшие неблагоприятные факторы риска — это неадекватные границы резекции.(30-32) Прежде всего, трансанальное иссечение должно представлять собой биопсию на всю толщину с полем не менее 1 см, иначе рецидив почти гарантирован.
И наоборот, риск местного рецидива после радикальной операции по поводу ранней стадии поражения относительно низок и составляет от ~ 2 до 5%, в то время как риск отдаленного рецидива выше и составляет ~ 10-20%. (33) Другие исследования продемонстрировали более высокую общую частоту рецидивов через 5 лет, даже для ранних поражений, с выживаемостью без заболевания 77% для пациентов со стадией 1 заболевания после полного мезоректального иссечения.(34) Подобно исходам после местного удаления, биология опухоли и технические факторы, такие как правильные методы TME, адекватные поля и предотвращение разлива опухоли, играют роль. С добавлением адъювантной терапии и опытных хирургов, хорошо разбирающихся в мезоректальной резекции (35), сообщалось о частоте местных рецидивов <5% с поражениями еще более поздней стадии. (36)
Вариабельность результатов также возникает из-за других факторов, таких как использование адъювантной химио- или лучевой терапии.Протоколы используют адъювантную или неоадъювантную химиотерапию с лучевой терапией или без лучевой терапии с местным иссечением, аналогично радикальному. Фактически, наблюдается растущая тенденция к использованию адъювантной терапии с местным иссечением, как в адъювантной, так и в неоадъювантной среде, для уменьшения стадии поражения. (37, 38) Russell и соавторы сообщили о 65 пациентах, перенесших местное иссечение с последующим наблюдением или послеоперационным 5-FU и одной из двух различных доз лучевой терапии для поражений высокого риска (T 2 , T 3 , положительная лимфоваскулярная инвазия, размер> 3 см или повышенный CEA).(39) При минимальном периоде наблюдения в течение 5 лет у 11 (17%) пациентов развился рецидив заболевания, а 8 (12,3%) пациентов умерли. Предикторами рецидива заболевания были более высокая Т-стадия (23% для опухолей T 3 против 4% для поражений T 1 ) и большая окружность поражений (18% для поражений, охватывающих 21-40% окружности против 6 % с участием <20%). Marks и его коллеги сообщили о небольшом проспективном исследовании 14 пациентов с минимальным периодом наблюдения 24 месяца, которым была проведена предоперационная лучевая терапия высокой дозой 4500 сГр с последующей LE через 4-6 недель.(38) У трех (21%) пациентов развился местный рецидив, и один (7%) пациент умер от рецидива заболевания. Эта же группа впоследствии сообщила о 48 пациентах, разделенных на три группы: с T 3 или размером> 3 см (n = 15), T 1 или T 2 с поражениями, все размером <3 см (n = 18), а также пациентов с исходными поражениями Т 3 или размером> 3 см, у которых после предоперационного облучения стадия поражения снизилась до более низкой Т-стадии или менее 3 см (n = 15). (40) Хотя общий 5-летний рецидив составил 10%, у пациентов с постлучевой стадией T 3 частота местных рецидивов составляла 67% по сравнению с 11% для стадии T 0 / T 1 очагов, вызывающих ставят под сомнение его полезность в когортах высших Т-стадий.
Напротив, Perez и его коллеги исследовали когорту с дистальным раком прямой кишки, все из которых прошли неоадъювантную химиолучевую терапию с последующим радикальным иссечением. (41) После резекции 88/289 (30%) имели патологическое поражение рака прямой кишки T 2 , а у 19% этих пациентов были метастазы в лимфатические узлы, несмотря на химиолучевую терапию. Таким образом, местное иссечение у этих пациентов представляло бы неприемлемый риск местной неэффективности, и авторы пришли к выводу, что при поражениях T 2 следует проводить радикальное хирургическое вмешательство в качестве стандартного лечения.Та же группа также сообщила о небольшой группе пациентов, которые получали неоадъювантную химиотерапию с отличным ответом и последующую трансанальную эндоскопическую микрохирургию. Несмотря на то, что окончательной патологией был ypT0-2, местная неэффективность составила 15% при среднем периоде наблюдения 15 месяцев.
Радиология и рецидивирующие заболевания
Выявление рецидива анастомоза с помощью прямой визуализации может быть довольно простым делом и будет обсуждаться ниже в разделе колоноскопии. Тем не менее, при рецидивах вне просвета радиология играет важную роль как в раннем выявлении, так и в дифференциации рецидивирующего заболевания от доброкачественных результатов, таких как послеоперационные изменения.Способность радиологических тестов различать эти поражения, хотя часто это возможно в рамках всего клинического контекста, представляет свой собственный уникальный набор проблем и подчеркивает некоторые из проблем, связанных с режимом интенсивного последующего наблюдения. В то время как раннее выявление более распространено при агрессивном эпиднадзоре, поэтому ложноположительные результаты приводят к более инвазивным тестам, повышенному риску ненужной заболеваемости и более высоким затратам. Тем не менее, важно иметь реалистичные ожидания и понимать ограничения визуализационных исследований в рамках любой конкретной программы наблюдения.
КТ
КТ остается «рабочей лошадкой» для последующей визуализации колоректального рака. Как показано в Таблице 1 , каждая социальная рекомендация использует серийную КТ-визуализацию как компонент стандартизированного протокола наблюдения. Следует отметить, что ASCO ограничивает свои рекомендации по ежегодной КТ 3 годами, в то время как NCCN недавно изменил свои рекомендации с ежегодной в течение первых 3 лет на 5 лет после резекции. В целом КТ обеспечивает эффективное средство для определения наличия новых поражений (метастатических и доброкачественных) по всему телу (особенно при обнаружении новых поражений печени и груди).Однако он хуже, чем МРТ при различении послеоперационных изменений и рецидивов при использовании отдельно, особенно в области таза (КТ: чувствительность 82% и специфичность 50% с PPV 69% и NPV 67% с точностью 68%; МРТ: 91% чувствительность, 100% специфичность, положительная прогностическая ценность (PPV) 100% и отрицательная прогностическая ценность (NPV) 89% с точностью 95%.) (43) Хотя метаанализ рандомизированных исследований показывают явную пользу КТ, выполняемую в первые несколько лет после операции, а польза в последующие годы неясна.В исследовании 207 пациентов Уолтер и его коллеги недавно изучили полезность компьютерной томографии, выполненной через пять лет после радикальной резекции CRC. (44) Из 34 пациентов, у которых развились метастазы, все были обнаружены в течение 3,5 лет после резекции, и ни одного случая метастатического CRC не было отмечено через пять лет. Авторы справедливо пришли к выводу, что КТ на пятом году обучения не играет никакой роли в наблюдении за CRC.
Таблица 1
Социальные рекомендации по надзору за колоректальным раком, леченным с лечебной целью
| Общество | Год | Колоноскопия | CEA | История и физика | Визуализация | 909 909 | r909 .Если AA, повторите через 1 год. Если нет, то 3 года, то 5 лет. | q3-6 мес. X2 года, затем каждые 6 мес. X3 г. | q3-6 мес. X2 года, затем каждые 6 мес. X3 г. | CT C / A / P: каждые 1 год x5 при высоком риске рецидива * |
|---|---|---|---|---|---|
| ASCO | 2005 | Предполагается, что толстая кишка «очищена», 2–3 года. то q5, если нормально. | квартал мес. x3 года при II / III стадии | q3-6 мес. X3 года, затем каждые 6 мес. X2 г. | CT C / A: каждые 1 год x 3 года. Добавьте таз при раке прямой кишки. |
| NICE | 2011 | @ 1год. Если все в порядке, повторите через 5 лет. В противном случае интервал определяется результатами. | по крайней мере каждые 6 мес. X 3 г. | Регулярное наблюдение через 4-6 недель после операции. | CT C / A / P: не менее 2 в первые 3 года. |
| AGA | 2006 | @ 1 год. Если все в норме, повторите через 3, 5 лет. | Не адресовано | Не адресовано | Не адресовано |
| ESMO | 2012 | @ 1 год, затем каждые 5 лет. | каждые 3-6 месяцев x 3 года, затем каждые 6-12 месяцев x 2 года | каждые 3-6 месяцев x 3 года, затем каждые 6-12 месяцев x 2 года | CT C / A каждые 6-12 месяцев x 3 года, если высокий риск. Рассмотрим каждые 3-6 мес. УЗИ печени. |
| ASCRS | 2004 | @ 1 год, затем каждые 3 года. | Минимум 4 месяца x 2 года, затем каждые 6 месяцев x 2 года, затем ежегодно | Минимум 4 месяца x 2 года, затем каждые 6 месяцев x 2 года, затем ежегодно | Не следует проводить рутинную визуализацию печени; Недостаточно данных для поддержки или опровержения CXR; Рассмотрите возможность EUS при раке прямой кишки |
| NCCN: Национальная сеть онкологической помощи; yrs: годы; ASCO: Американское общество клинических онкологов; мес: месяцев НИЦЦА: Национальный институт здравоохранения и передового опыта; EUS: эндоректальное ультразвуковое исследование AGA: Американская гастроэнтерологическая ассоциация; CXR: рентген грудной клетки ESMO: Европейское общество медицинской онкологии C / A / P: грудная клетка / брюшная полость / таз ASCRS: Американское общество хирургов толстой и прямой кишки * Опухоль с лимфатической или сосудистой инвазией или плохой дифференцировкой | |||||
MRI
Магнитно-резонансная томография (МРТ) имеет более высокую чувствительность (~ 75-90%), чем КТ, для обнаружения специфических колоректальных метастазов в печень (45) и даже лучше для определения рецидива рака прямой кишки в тазовой области (чувствительность 91%) , точность 62%).(46, 47) Однако более высокая стоимость МРТ и ее ограниченная ценность при обнаружении метастазов в легких препятствуют ее рутинному использованию по сравнению с КТ для послеоперационного наблюдения. Исследование, посвященное роли магнитно-резонансной томографии (МРТ) в дополнение к стандартному наблюдению, показало, что МРТ пропустила 13% рецидивов, а 14% положительных исследований были ложноположительными. (48) Не было разницы между МРТ и обычным тестированием в отношении выявления случаев, подходящих для резекции, и авторы пришли к выводу, что МРТ не играет роли в этой ситуации.Хотя его полезность при обнаружении ранних рецидивов спорна, (48) консенсусные группы экспертов по-прежнему рекомендовали использовать МРТ вместе с клиническим обследованием и ПЭТ для определения возможности достижения отрицательных границ резекции при рецидивах рака прямой кишки таза до начала операции. (49) Кроме того, недавние инновации в методах МРТ, такие как использование движущегося стола и последовательностей T1 и STIR, продемонстрировали, что результаты выявления рецидива рака прямой кишки для всего тела аналогичны результатам ПЭТ-КТ.(50)
ПЭТ сканирование
Позитронно-эмиссионная томография с фтордезоксиглюкозой (ФДГ-ПЭТ) предоставляет информацию о метаболической активности поражения, теоретически позволяя лучше различать гиперметаболическую опухоль и послеоперационные изменения. В сочетании с визуализацией слияния с КТ (ПЭТ-КТ) это дает возможность отображать анатомические особенности, а также наложенное поглощение индикатора глюкозы. В ретроспективном исследовании, проведенном в Чешской Республике, изучалось использование ПЭТ и ПЭТ КТ для выявления рецидива рака толстой кишки.(51) В этом исследовании чувствительность, специфичность и общая точность ПЭТ / КТ с F-фтордезоксиглюкозой (ФДГ) составили 89%, 92% и 90%, правильно обнаружив 40 из 45 пациентов с рецидивирующим заболеванием. Другое исследование Кишимото показывает, что КТ / ПЭТ является чувствительным методом выявления рецидивов заболевания, но отмечает, что его высокая стоимость сделала его неэффективным по стоимости тестом для общего использования. (52) Цифровая гибридная визуализация показала уровень точности до 93% для локального рецидива рака прямой кишки, что значительно лучше, чем в любом исследовании по отдельности.(53) Кроме того, он значительно более чувствителен (94,6%), чем КТ или неулучшенная магнитно-резонансная томография (МРТ) для обнаружения метастазов в печени. (47) FDG-PET также имеет значение при исследовании пациентов с повышенными опухолевыми маркерами и отрицательными стандартными изображениями, где положительный выход опухоли составляет 38-57% и даже коррелирует с общей выживаемостью. (54, 55) Хотя стоимость остается проблемой, она может помочь снизить отрицательную скорость исследования.
В проспективных данных, сравнивающих МРТ с ПЭТ для местного рецидива рака прямой кишки (с использованием гистологической биопсии в качестве золотого стандарта), чувствительность, специфичность, положительная и отрицательная прогностическая ценность и точность составили 86.7%, 68,9%, 48,1%, 93,9% и 73,3% для МРТ с контрастным усилением и 93,3%, 68,9%, 50%, 96,9% и 75% для ПЭТ-КТ. (56) К сожалению, было всего 39 случаев, и роль раннего обнаружения была спорной. В других сравнениях сообщается об общей диагностической точности ПЭТ-КТ на уровне 91% (чувствительность 86%, специфичность 96%) и 83% для МРТ (чувствительность 72%, специфичность 93%) соответственно; хотя ПЭТ-КТ, по-видимому, лучше подходит для поражения узлов и одинакова для поражения органов. (50) В целом, хотя ПЭТ и ПЭТ-КТ, по всей видимости, не являются выгодными с точки зрения затрат для рутинного наблюдения, они стали основным методом отличия рецидива опухоли от других аномалий визуализации.
КТ-колонография
Наконец, КТ-колонография (КТ-колонография) интуитивно может показаться полезным методом наблюдения, поскольку она предоставляет информацию о внутрипросветных и внепросветных рецидивах. В США это исследование обычно проводится без внутривенного контраста, что ограничивает возможность обнаружения метастатических очагов. Однако в таких странах, как Корея, где обычно используется внутривенное введение контрастного вещества, ЦКО зарекомендовал себя как полезный инструмент эпиднадзора. (57) В исследовании 742 пациентов, перенесших лечебную хирургическую операцию, CTC обнаружил 100% метахронных опухолей, а также 11 экстраколонических рецидивов, но был только 81% чувствителен к обнаружению продвинутых аденом.Предыдущие авторы даже рекомендовали его рутинное использование в условиях послеоперационного наблюдения, чтобы позволить одновременную оценку отдаленного и локально-регионального рецидива, при этом позволяя визуализировать анастомоз. (58) Однако авторы отмечают, что воспаление и язвы в месте анастомоза могут быть ошибочно идентифицированы как рецидив. В других небольших сериях сообщается о степени точности 94% (95% ДИ; 83–99%) для выявления местного рецидива. (59, 60) Несмотря на то, что CTC зарекомендовал себя как полезный инструмент для первичного скрининга CRC, необходимы дополнительные исследования, чтобы определить, является ли CTC жизнеспособным и рентабельным вариантом надзора за CRC.
Краеугольным камнем для выявления эндолуменального местного рецидива, а также метахронного рака является прямая визуализация слизистой оболочки толстой кишки с помощью колоноскопии. Однако, хотя колоноскопия остается золотым стандартом для обнаружения и профилактики колоректального рака, это несовершенный инструмент даже в лучших руках. Частота пропусков при аденокарциноме колеблется от 1 до 3% и существенно не различается между стандартным скрининговым обследованием и обследованием, при котором обнаруживается первичный рак.(61, 62) Более того, 2-7% пациентов с колоректальным раком имеют синхронный рак толстой кишки на момент постановки диагноза. (63-66) Другие пациенты могут иметь обструкцию или перфорацию, когда очистка толстой кишки невозможна во время экстренной операции. По этим причинам большинство специализированных обществ рекомендуют повторную колоноскопию в течение года после радикальной резекции CRC и в течение 6 месяцев, если визуализация всей толстой кишки до операции была невозможна. (2-6, 67)
Как отмечалось ранее, было проведено несколько систематических обзоров, в которых стратегия интенсивного наблюдения, включая колоноскопию, сравнивалась либо со стандартной практикой, либо с минимальным последующим наблюдением.(19-25) В то время как большинство этих исследований предполагают улучшение выживаемости при интенсивном наблюдении (9-13%), испытания, на которых основаны эти мета-анализы, проводились до нынешнего мультидисциплинарного подхода к лечению онкологических больных. Таким образом, вероятно, что польза от тщательного последующего наблюдения даже более значительна, чем было показано в этих исследованиях.
Конкретно изучая влияние колоноскопии, Ван и его коллеги с тех пор провели рандомизированное исследование, в котором сравнивали интенсивное колоноскопическое наблюдение с обычным колоноскопическим наблюдением.(68) В этом исследовании 326 пациентов, перенесших лечебную резекцию CRC, интенсивная группа получала колоноскопию с 3-месячными интервалами в течение одного года, каждые 6 месяцев в течение следующих двух лет и один раз в год в дальнейшем. В обычной группе колоноскопия проводилась через 6, 30 и 60 месяцев после операции в соответствии с общественными рекомендациями. Группа интенсивного наблюдения имела улучшенную общую 5-летнюю выживаемость (77% против 73%), а также более высокий процент послеоперационных онкологических заболеваний, которые были обнаружены в бессимптомной фазе, и большее количество повторных операций с лечебной целью.Частота рецидивов анастомоза в этом исследовании составляла 6-8% через 2 года. Ретроспективное исследование в Японии, в котором анализировались пациенты за тот же период времени, показало, что частота местных рецидивов составляет всего 0,7%, что больше соответствует показателям исследований, опубликованных за последнее десятилетие, в то время как недавний метаанализ показал, что ректальный вымывание значительно снижает частоту рецидивов анастомоза при раке прямой кишки (ОР = 0,3; 95% ДИ = 0,12-0,71; P = 0,007). (69) Несколько исследователей подсчитали рентабельность колоноскопии как части стратегии интенсивного наблюдения.Хасан и его коллеги показали, что колоноскопия является рентабельной, с затратами в 40 313 долларов на год жизни. (70) Ди Кристафаро и др. . изучили экономическую эффективность (, т. е. , общая стоимость и процент рецидивов, выявленных стратегией) рекомендованного протокола мультимодального наблюдения, включая колоноскопию, КЭА, КТ грудной клетки и брюшной полости, а также физикальное обследование. Эта стратегия оказалась наиболее эффективной для пациентов со стадиями I и II, которые составляют подавляющее большинство пациентов, подвергнутых резекции с лечебной целью, с соотношением цена / эффективность 319 евро.24. (71) Очевидно, что колоноскопия играет важную роль в наблюдении за колоректальным раком, а также в исключении синхронного / метахронного заболевания. Однако маловероятно, особенно в свете небольшого процента внутрипросветных рецидивов, что изменение рекомендуемых в настоящее время интервалов колоноскопии резко повлияет на показатели раннего выявления.
Роль эндоскопического УЗИ
К сожалению, не все рецидивы проявляются на поверхности слизистой оболочки. В этих случаях полезным дополнением является эндоскопическое ультразвуковое исследование (ЭУЗИ), которое позволяет с высокой степенью детализации визуализировать все слои стенки кишечника, а также окружающие структуры.(72) Хотя ЭУЗИ широко использовалась для выявления рецидивов заболевания верхних отделов желудочно-кишечного тракта, для нижних отделов желудочно-кишечного тракта она не была столь ценной, возможно, потому, что послеоперационные изменения трудно отличить от рецидивов заболевания (73–77).
EUS был введен для оценки субэпителиальных поражений желудочно-кишечного тракта в конце 1980-х годов. В то время эти устройства были жесткими и не имели оптоволоконной визуализации, что ограничивало обследование дистальным отделом прямой кишки и прилегающими тканями. По мере развития технологий ультразвуковые датчики позволяли исследовать большие части толстой кишки даже в случаях тяжелого стеноза.Большинство ранних исследований пришли к выводу, что одного EUS недостаточно для диагностики, поскольку результаты сонографии при злокачественных рецидивах неотличимы от послеоперационных изменений, особенно в течение первых 3-6 месяцев. (78-81) Накадзима, и др. показал периферическую гипертрофию 3 -го и 4 -го слоев стенки кишечника в течение 6 месяцев после операции, когда утолщение слоя 3 -го обычно разрешалось.(81) Он предположил, что локальная гипертрофия 4 -го слоя слизистой оболочки является признаком рецидива, который 1) не будет виден при осмотре просвета; и 2) будут неотличимы от послеоперационных изменений на компьютерной томографии. Рецидив характеризовался гипоэхогенной областью в стенке слизистой оболочки или периректальном пространстве, тогда как послеоперационное рубцевание, как правило, было гиперэхогенным. Тем не менее, это не получило широкого распространения, и только EUS все еще сильно зависит от способностей пользователя, как и его использование при первичной постановке.(82)
EUS действительно имеет определенные преимущества в этой настройке, особенно при обнаружении рецидива заболевания раньше, чем при других традиционных методах визуализации. Для сравнения, визуализация поперечного сечения имеет уровень точности около 80 с для послеоперационного обнаружения рецидива. В одном из самых ранних исследований по оценке точности EUS для выявления локально рецидивирующего рака прямой кишки сравнивали его с пальцевым ректальным или сигмоидоскопическим исследованием (73). Из 85 включенных пациентов у 22 были эндосонографические доказательства рецидива, только 19 из которых были видны другими методами.Исследователи наблюдали три модели рецидива: поражение слизистой оболочки, внешне похожее на первичную опухоль, области со смешанной эхоплотностью внутри стены и области с плохим эхосигналом за пределами стены. Во всех случаях подозрения на рецидив пациенту проводилась биопсия промежности для подтверждения. Эти результаты подтверждают предыдущие исследования Hildebrandt et al. и Romano et al. демонстрирует эффективность EUS при последующем наблюдении за хирургически пролеченными пациентами с раком прямой кишки.(78, 83) Из тридцати рецидивов, отмеченных в этих исследованиях, 6 были обнаружены только с помощью EUS. Основываясь на этих ранних исследованиях, несколько исследователей добавили EUS к другим методам наблюдения в рамках своего стандартного протокола лечения рака прямой кишки. В одном из таких исследований Ramirez и его коллеги выполнили EUS в рамках своего протокола наблюдения, начиная с 3 месяцев после операции. (74) Всего было включено 66 пациентов, 13 (~ 20%) из которых имели местные рецидивы. Практически все рецидивы развились в течение 2 лет после операции.Из 13 случаев 3 были диагностированы только с помощью EUS. Интересно, что эти три случая представляли 75% случаев, в которых была возможна спасательная операция, что позволяет предположить, что EUS может обнаружить рецидив на ранней стадии. Выживаемость пациентов, перенесших спасательную операцию, составила 36 месяцев против 15 месяцев в паллиативной группе. Хотя исследованию не хватает возможности окончательно доказать это, данные свидетельствуют о том, что раннее выявление рака прямой кишки с помощью EUS может повлиять на выживаемость. Из-за этого текущая рекомендация рабочей группы нескольких обществ США предлагает EUS через 3-6 месяцев в течение первых 2 лет после резекции как разумный вариант для пациентов с лечебной резекцией по поводу рака прямой кишки.(2)
Основная ценность EUS в оценке возможного рецидива CRC сегодня заключается в его способности проводить тонкоигольную аспирацию (FNA) и тонкоигольную биопсию (FNB), что позволяет собирать образцы для гистологического и иммуногистохимического анализа. и преодоление некоторой врожденной предвзятости пользователей. Два исследования, посвященные EUS с FNA, показали, что это очень точный тест для диагностики субэпителиальных и экстрапросветных поражений толстой и прямой кишки (81, 84). В обоих исследованиях точность EUS-FNA составляла 90–95% по сравнению с точностью 82% только для визуализации (84).Эти исследования подтверждают выводы многочисленных предыдущих исследований и описаний случаев относительно точности и / или безопасности отбора проб под контролем EUS. (72, 78-88) В совокупности эти исследования включают в общей сложности 1027 пациентов и 110 случаев рецидива с зарегистрированной точностью в пределах 87-100%. Примерно в 10% случаев EUS была единственным средством диагностики. В одном из исследований EUS диагностировал 100% бессимптомных рецидивов, тогда как КТ выявила только 75% из них. (85) Все шесть субъектов имели право на лечебную операцию.Небольшое исследование Моркена предполагает, что общая выживаемость улучшается в случаях, когда рецидивы были обнаружены с помощью EUS, по сравнению с другими способами. (88) Как и в исследовании Ramirez, в 13% случаев рецидив был обнаружен только с помощью ERUS, что позволило 26 из 39 попытаться радикально удалить рецидив. Хотя эти результаты обнадеживают и существуют текущие рекомендации / протоколы по использованию EUS для наблюдения за раком прямой кишки, это не получило широкого распространения. Рандомизированные испытания EUS в этой ситуации, возможно, с усилением контраста, являются оправданными.
Ограничения в интерпретации роли визуализации
Несмотря на достижения в хирургической технике и широкую доступность неоадъювантной химиотерапии и лучевой терапии, рак прямой кишки рецидивирует локально в одной трети случаев. (89) Текущие показатели местных рецидивов рака толстой кишки ниже, чем в предыдущих отчетах, но все же имеют место и могут иметь разрушительные последствия не только для выживания, но и для качества жизни. Как уже говорилось, методы визуализации обычно используются как часть комплексной стратегии обнаружения таких рецидивов.К сожалению, в большинстве исследований эти методы использовались в сочетании с серологическими тестами и колоноскопией, поэтому прямое влияние самих рентгенографических исследований бывает трудно выявить. Йохманс и его коллеги попытались ответить на этот вопрос в исследовании, посвященном оценке вероятности обнаружения при визуализации наблюдения в Бельгии. (90) Обычная визуализация в этом случае состояла из рентгена грудной клетки и УЗИ печени каждые 6 месяцев в течение первого года и ежегодно в течение пяти лет. В то время как CEA был наиболее чувствительным маркером, обнаруживающим 63% случаев, 25% были обнаружены только с помощью визуализации, при этом половина из них подлежала хирургической резекции.Однако, как демонстрирует Таблица 1 , большинство рекомендаций ушли от рентгенографии грудной клетки и УЗИ и перешли на КТ. Следовательно, для ответа на этот вопрос необходимы дополнительные данные.
Карциноэмбриональный антиген
Карциноэмбриональный антиген (CEA) представляет собой гликопротеиновый онкофетальный антиген, который экспрессируют многие эпителиальные опухоли. (91) Хотя CEA обычно считается онкомаркером, уровни также могут быть повышены при различных незлокачественных состояниях, включая панкреатит, курение сигарет и воспалительные заболевания кишечника.Этот относительно недорогой анализ крови, впервые описанный Голдом и Фридманом в 1965 году, был частью большинства рекомендуемых стратегий наблюдения. (92) Семьдесят процентов пациентов с колоректальным раком будут иметь повышение уровня CEA при постановке диагноза, что делает его полезным маркером для лечения и наблюдения за заболеванием после операции. (93) Несмотря на это, некоторые разногласия по поводу его полезности все еще существуют. Тан, и др. выполнил количественный метаанализ 20 исследований, в которых участвовали 4285 пациентов, изучающих рабочие характеристики CEA при его использовании для выявления рецидива CRC.(94) Они обнаружили общую чувствительность 0,64 (95% ДИ 0,61–0,67) со специфичностью 0,90. Используя методы мета-регрессии, они подсчитали, что оптимальный баланс чувствительности и специфичности достигается при 2,2 нг / мл. Даже на этом уровне авторы пришли к выводу, что CEA не обладает достаточной чувствительностью и специфичностью для изолированного использования. Недавнее исследование, проведенное Ченом и его коллегами из Тайваня, показало, дает ли повышение CEA дополнительную ценность в обнаружении послеоперационного рецидива. (91) В их исследовании с участием 4841 пациента у 999 пациентов был повышенный CEA (определенный на уровне> 5 нг / мл) и рецидивы.Примерно у трех четвертей этих пациентов рецидив был обнаружен другими способами одновременно с первым повышением CEA. Авторы пришли к выводу, что для раннего выявления рецидива необходим более чувствительный тест. В клинической практике РЭА редко используется отдельно для определения рецидива. Скорее используется комбинация повышенного или повышающегося CEA в сочетании с клиническими или рентгенологическими признаками рецидива. В исследовании Metser с коллегами рецидив заболевания был обнаружен только у 65% пациентов с повышенным CEA с последующей мультидетекторной КТ (MDCT) и CT / PET в среднем в течение 18 месяцев после повышения CEA.(95) Наконец, некоторые опухоли, которые экспрессировали CEA при представлении, подвергаются дедифференцировке и перестают экспрессировать CEA при метастазировании, что делает их бесполезными в качестве инструмента наблюдения в этих случаях.
EUS и отдаленные метастазы
Имеются ограниченные данные о полезности EUS в диагностике отдаленного рецидива CRC per se . Исследования DeWitt et al. и Hunerbein и др. . смотрели на точность EUS для рецидивных или метастатических злокачественных новообразований желудочно-кишечного тракта в целом.(76, 87) В общей сложности 188 пациентов прошли EUS с FNA подозрительных поражений, включая лимфатические узлы. Размер очагов варьировал от 7 до 70 мм, они располагались как над, так и под диафрагмой. Точность составляла 92-95%. В большинстве случаев имелось клиническое, рентгенологическое или патологическое подозрение на метастатическое заболевание. Поскольку большинство этих поражений были аденокарциномами (включая несколько видов рака толстой кишки), кажется разумным экстраполировать эти результаты на колоректальный рак. Хотя EUS с FNA не играет никакой роли в первичном надзоре, он часто бывает полезен, когда подозрительные поражения обнаруживаются в других исследованиях изображений, и имеет преимущество непрерывной локализации иглы в реальном времени во время отбора образцов ткани.Однако в настоящее время для раннего выявления колоректального рака этот метод имеет ограниченное применение.
Соблюдение руководящих принципов
Многочисленные исследования выявили высокую вариабельность соблюдения опубликованных руководств как в первичных условиях (96), так и при эпиднадзоре. (96-101) Точный характер дисперсии различается среди исследуемых групп и может отражать местные / региональные факторы. Например, в исследовании, проведенном в Манитобе, 80,4% всех субъектов прошли колоноскопию в пределах рекомендованного интервала, тогда как 47% прошли визуализацию печени и только 22% прошли тестирование CEA в соответствии с рекомендациями.(97) Напротив, в исследовании, проведенном в США с использованием базы данных исследований и наблюдения за результатами лечения рака (CanCORS), менее половины всех субъектов прошли колоноскопию в течение 14 месяцев после операции. (98) В обоих исследованиях было отмечено, что более частый контакт с руководителем первичной медико-санитарной помощи был связан с соблюдением рекомендаций.
В некоторых исследованиях врачи проводили больше контрольных осмотров, чем рекомендуется. Например, норвежское исследование показало, что 37% субъектов получали визуализацию чаще, чем требуется в рекомендациях.(99) Это особенно верно для пациентов с раком прямой кишки, у которых местные рецидивы вызывают большее беспокойство. Исследование в США четырех географически различных организаций по техническому обслуживанию здравоохранения показало, что только 55% выживших после CRC прошли колоноскопию в соответствии с рекомендациями, тогда как 73% прошли не рекомендуемых тестов для поиска метастазов. (100) Более того, пациенты прошли, в среднем, вдвое большее количество медицинских осмотров, что указывает на то, что отсутствие клинического наблюдения не объясняет недостаточность колоноскопических обследований.В то время как факторы пациента, такие как беспокойство и страх по поводу длительного ожидания повторных обследований, могут влиять на эту схему чрезмерного использования, недостаток знаний врача или его вера в рекомендации также могут играть роль в расхождении с руководящими принципами. Тем не менее, в эту эпоху сдерживания затрат дополнительный акцент должен быть сделан на максимизации результатов при минимизации ненужного тестирования.
Кокрановский обзор 2008 г. по обнаружению CRC хорошо обобщает литературу по этому вопросу. В нем авторы заявляют, что, хотя интенсивное наблюдение было связано с улучшением выживаемости по всем причинам, «неясно, что составляет оптимальный режим последующего наблюдения».Различные стратегии интенсивного наблюдения сравнивали либо со стандартными методами лечения, либо просто с менее интенсивными режимами. Следующий шаг — провести испытания, сравнивающие одну интенсивную стратегию с другой. Кроме того, цель состоит не просто в обнаружении рецидива, а в способности выявить рецидив заболевания как можно раньше, чтобы облегчить вмешательство и лечение. В то время как достижения молекулярной медицины и эпигенетики могут предоставить подходящие цели, чтобы сделать это возможным в будущем, в настоящее время не существует единого теста, который был бы достаточно чувствительным и специфичным, чтобы использовать его отдельно для обнаружения рецидива CRC.
Выраженные взгляды принадлежат автору (авторам) и не отражают официальную политику Министерства армии США, Министерства военно-морского флота, Министерства обороны или правительства США.
Авторы заявили об отсутствии конкурирующих интересов.
1.
Американское онкологическое общество. Колоректальный рак в фактах и цифрах, 2011-2013 гг. Атланта:
Американское онкологическое общество. 2011 г.
2.
Рекс Д.К., Кахи СиДжей, Левин Б. и др. . Рекомендации по колоноскопическому наблюдению после резекции рака: обновленное согласованное мнение Американского онкологического общества и целевой группы США по колоректальному раку . Гастроэнтерология. 2006; 130 : 1865–1871
3.
Деш CE, Benson AB Somerfield MR. и др. . Эпиднадзор за колоректальным раком: обновление 2005 г. Практического руководства Американского общества клинической онкологии . J Clin Oncol. 2005; 23 : 8512-8519
4.
Scholl HJ, VanCutsem E, Stein A. и др. . Консенсусное руководство ESMO по ведению пациентов с раком прямой и толстой кишки. Индивидуальный подход к принятию клинических решений . Ann Oncol. 2012; 23 : 2479-2516
5.
Постон Г.Дж., Тейт Д., Оконнелл С. и др. . Диагностика и лечение колоректального рака: краткое изложение руководства NICE . BMJ. 2011; 343 : 1-4
6.
NCCN. NCCN Клинические рекомендации по онкологии: рак толстой кишки; версия 3 .
2013.
7.
Энтони Т., Симманг С., Хайман Н. и др. . Параметры практики для наблюдения и последующего наблюдения за пациентами с раком прямой и толстой кишки . Dis Colon Rectum. 2004; 47 : 807-17
8.
Макела Дж. Т., Лайтинен С. О., Кайралуома М. И.. Пятилетнее наблюдение после радикальной операции по поводу колоректального рака. Результаты проспективного рандомизированного исследования . Arch Surg. 1995; 130 : 1062-1067
9.
Schwarz RE, Berlin JD, Lenz HJ, Nordlinger B, Rubbia-Brandt L, Choti MA. Системные цитотоксические и биологические методы лечения колоректальных метастазов в печени: консенсусное заключение экспертов . Е.П.Б. (Оксфорд). 2013; 15 (2): 106-15
10.
Ольссон Б., Бреланд Ю., Экберг Х., Граффнер Х., Транберг К. Последующее наблюдение после лечебной операции по поводу колоректальной карциномы . Dis Colon Rectum. 1995; 38 : 619-626
11.
Макела Дж. Т., Сеппо О. Л., Кайралуома М. И.. Пятилетнее наблюдение после радикальной операции по поводу колоректального рака . Arch Surg. 1995; 130 : 1062-1067
12.
Кьельдсен Б.Дж., Кронборг О., Фенгер С., Йоргенсен О.Д. Проспективное рандомизированное исследование последующего наблюдения после радикальной хирургии колоректального рака . Br J Surg. 1997; 84 : 666-660
13.
Kjeldsen BJ, Thorsen H, Whalley D, Kronborg O. Влияние последующего наблюдения на качество жизни, связанное со здоровьем, после радикальной операции по поводу колоректального рака . Scan J Гастроэнтерол. 1999; 34 : 505-15
14.
Шумейкер Д., Блэк Р., Джайлз Л., Тоули Дж. Ежегодная колоноскопия, КТ печени и рентгенография грудной клетки не влияют на 5-летнюю выживаемость пациентов с колоректальным раком . Гастроэнтерол. 1998; 114 : 7-14
15.
Пьетра Н., Сарли Л., Кости Р., Оучеми К., Граттарола М., Пераккия А. Роль наблюдения в лечении местных рецидивов колоректального рака . Dis Colon Rectum. 1998; 41 : 1127-1133
16.
Secco GB, Fardelli R, Gianquinto D. и др. . Эффективность и стоимость последующего наблюдения с учетом риска у пациентов после хирургии колоректального рака: проспективное, рандомизированное и контролируемое исследование . Europ J Surg Oncol. 2002; 28 : 418-423
17.
Ватчоу Д.А., Веллер Д.П., Эстерман А. и др. . Общая практика и наблюдение за пациентами с раком толстой кишки: рандомизированное контролируемое исследование . Br J Рак. 2006; 94 : 1116-1121
18.
Родригес-Моранта Ф., Сало Дж., Аркуза А. и др. . Послеоперационное наблюдение за пациентами с колоректальным раком, перенесшими лечебную резекцию: проспективное, многоцентровое, рандомизированное, контролируемое исследование . J Clin Oncol. 2006; 24 : 386-393
19.
Bruinvels DJ, Stiggelbout AM, Kievit J. и др. . Наблюдение за пациентами с колоректальным раком. Метаанализ . Ann Surg. 1994; 219 : 174-82
20.
Розен М., Чан Л., Беарт Р. В., Вукасин П., Энтон Г. Последующее наблюдение за колоректальным раком: метаанализ . Dis Colon Rectum. 1998; 41 : 1116-26
21.Джеффри Г.М., Хикки Б.Э., Хайдер П. Стратегии наблюдения за пациентами, лечившимися от неметастатического колоректального рака . Кокрановская база данных Syst Rev. 2002; 1 : CD002200. DOI: 10.1002 / 14651858.CD002200
22.
Renehan AG, Egger M, Saunders MP, O’Dwyer ST. Влияние интенсивного наблюдения после лечебной резекции колоректального рака на выживаемость: систематический обзор и метаанализ рандомизированных исследований . BMJ. 2002; 324 : 813-6
23.Фигередо А., Рамбл Р. Б., Марун Дж. и др. . и члены группы сайта по лечению рака желудочно-кишечного тракта Программы онкологической помощи Онтарио по доказательной помощи. Последующее наблюдение за пациентами с лечебно удаленным колоректальным раком: практическое руководство . BMC Рак. 2003; 3 : 26
24.
Тяндра Дж.Дж., Чан МКИ. Последующее наблюдение после лечебной резекции колоректального рака: метаанализ . Dis Colon Rectum. 2007; 50 : 1783-1799
25.
Джеффри М., Хикки Б.Э., Хидер ПН. Стратегии наблюдения за пациентами, пролеченными по поводу неметастатического колоректального рака . Кокрановская база данных Syst Rev. 2008; 1 : Cd002200.Doi 10.1002 / 14651858.Cd002200.Pub2, 2002
26.
Cortet M, Grimault A, Cheynel N, Lepage C, Bouvier A, Faivre J. Типы рецидивов обструкции рака толстой кишки после хирургического лечения: популяционное исследование . Colorectal Dis. 2013 г. DOI: 10.1111 / codi.12268
27.
Пати ПБ, Нэш Г.М., Барон П. и др. . Отдаленные результаты местного иссечения рака прямой кишки . Ann Surg. 2002; 236 : 522-29
28.
Меллгрен А., Сиривонгс П., Ротенбергер Д.А., Мэдофф Р.Д., Гарсия-Агилар Дж. Является ли местное иссечение адекватной терапией для раннего рака прямой кишки? . Dis Colon Rectum. 2000; 43 : 1064-71
29.You YN, Baxter NN, Stewart A, Nelson H. Является ли увеличение частоты местного иссечения рака прямой кишки I стадии в Соединенных Штатах оправданным ?: общенациональное когортное исследование из Национальной базы данных рака . Ann Surg. 2007; 245 : 726-33
30.
Sengupta S, Tjandra JJ. Местное удаление рака прямой кишки: какие доказательства? . Dis Colon Rectum. 2000; 44 : 1345-61
31.
Буве М., Милас М., Джакко Г.Г., Клири К.Р., Джанян Н.А., Скиббер Дж. Предикторы рецидива после местного иссечения и послеоперационной химиолучевой терапии аденокарциномы прямой кишки . Ann Surg Oncol. 1999; 6 : 26-32
32.
Ниссан А., Стоядинович А., Шайа Дж. и др. . Предикторы рецидива у пациентов с аденокарциномой прямой кишки T2 и ранней T3, N0, леченной только хирургическим путем . J Clin Oncol. 2006; 24 : 4078-84
33.
Бонадео Ф.А., Ваккаро Калифорния, Бенати М.Л., Кинтана GM, Гарионе XE, Telenta MT. Рак прямой кишки: местный рецидив после операции без лучевой терапии . Dis Colon Rectum. 2001; 44 : 374-9
34.
Пепарини Н., Матуро А., Ди Маттео Ф.М., Меле Р., Бенедетти Ф., Ди Маттео Г. Долгосрочная выживаемость и рецидивы после тотальной нервосберегающей хирургии рака прямой кишки . Гепатогастроэнтерология. 2006; 53 : 850-3
35.
Ричардсон Д.П., Портер Г.А., Джонсон П.М. Знания хирургов влияют на взаимосвязь между объемом хирурга и результатами лечения рака прямой кишки . Ann Surg. 2013; 257 (2): 295-301
36.
Kusters M, Marijnen CA, van de Velde CJ. и др. . Типы местных рецидивов рака прямой кишки; исследование голландского исследования TME . Eur J Surg Oncol. 2010; 36 (5): 470-6
37.
Fichera A, Allaix ME. Новые данные по лечению рака прямой кишки, меняющие парадигму . J Gastrointest Surg. 2013 [Epub впереди печати]
38.Marks G, Mohiuddin MM, Masoni L, Pecchioli L. Предоперационное облучение в высоких дозах и местное иссечение на всю толщину. Новая опция для пациентов с избранными формами рака прямой кишки . Dis Colon Rectum. 1999; 33 : 735-9
39.
Рассел А.Х., Харрис Дж., Розенберг П.Дж. и др. . Консервация анального сфинктера у больных аденокарциномой дистального отдела прямой кишки: отдаленные результаты протокола группы лучевой терапии онкологии 89-02 . Int J Radiat Oncol Biol Phys. 2000; 46 : 313-22
40.
Мохиуддин М., Маркс Г., Бэннон Дж. Предоперационная лучевая терапия в высоких дозах и местное иссечение на всю толщину: новый вариант для избранных T3-дистальных опухолей прямой кишки . Int J Radiat Oncol Biol Phys. 1994; 30 (4): 845-9
41.
Перес Р.О., Хабр-Гама А., Проскуршим И. и др. . Местное иссечение рака прямой кишки ypT2 — много шума из-за чего-то . J Gastrointest Surg. 2007; 11 : 1431-8
42.
Перес РО, Хабр-Гама А, Линн ПБ. и др. . Трансанальная эндоскопическая микрохирургия остаточного рака прямой кишки (ypT0-2) после неоадъювантной химиолучевой терапии: еще одно предостережение . Dis Colon Rectum. 2013; 56 (1): 6-13
43.
Пема П.Дж., Беннетт В.Ф., Бова Дж. Г., Варман П. КТ против МРТ в диагностике рецидивирующей ректосигмоидной карциномы . J Comput Assist Tomogr. 1994; 18 (2): 256-61
44.
Уолтер С.Дж., Аль-Аллак А., Борлей Н. и др. . Контрольная компьютерная томография пятого года после потенциально излечивающей резекции колоректального рака . Хирург. 2013; 11 : 25-29
45.
Шефер О., Лангер М. Обнаружение рецидива рака прямой кишки с помощью КТ, МРТ и ПЭТ / КТ . Eur Radiol. 2007; 17 (8): 2044-54
46.Бломквист Л., Олсен Х., Хиндмарш Т., Йонссон Э., Холм Т. Местный рецидив рака прямой кишки: МРТ до и после оральных суперпарамагнитных частиц по сравнению с компьютерной томографией с контрастным усилением . Eur Radiol. 2000; 10 (9): 1383-9
47.
Бипат С., ван Леувен М.С., Comans EF. и др. . Колоректальные метастазы в печень: КТ, МРТ и ПЭТ для диагностики — метаанализ . Радиология. 2005; 237 (1): 123-131
48.Титу Л. В., Николсон А. А., Хартли Дж. Э., Брин Д. Д., Монсон-младший. Регулярное наблюдение с помощью магнитно-резонансной томографии не улучшает обнаружение резектабельных местных рецидивов колоректального рака . Ann Surg. 2006; 243 (3): 348-352
49.
Chew MH, Brown WE, Masya L, Harrison JD, Myers E, Solomon MJ. Клинические критерии, критерии МРТ и ПЭТ-КТ, используемые хирургами для определения пригодности для операции на тазовых полостях при рецидивирующем раке прямой кишки: исследование Delphi . Dis Colon Rectum. 2013; 56 (6): 717-25
50.
Шмидт Г.П., Баур-Мельник А., Хауг А. и др. . МРТ всего тела при 1,5 Тл и 3 Тл в сравнении с ФДГ-ПЭТ-КТ для выявления рецидива опухоли у пациентов с колоректальным раком . Eur Radiol. 2009; 19 (6): 1366-78
51.
Вотрубова Ю., Белохлавек О., Ярускова М. и др. . Роль ФДГ-ПЭТ / КТ в обнаружении рецидива колоректального рака . Eur J Nucl Med Mol Imaging. 2006; 33 : 779-784
52.
Кишимото Г., Мраками К., Кон С.А. и др. . Последующее наблюдение после лечебной резекции колоректального рака: влияние позитронно-эмиссионной томографии-компьютерной томографии (ПЭТ / КТ) . Rev Gastroenterol Peru. 2010; 30 (4): 328-33
53.
Фукунага Х., Секимото М., Икеда М. и др. . Объединенное изображение позитронно-эмиссионной томографии и компьютерной томографии для диагностики местного рецидива рака прямой кишки . Ann Surg Oncol. 2005; 12 (7): 561-9
54.
Джакомобоно С., Галликкио Р., Капаччионе Д. и др. . F-18 FDG PET / CT в оценке пациентов с необъяснимым повышением CEA после хирургической резекции по поводу колоректального рака . Int J Colorectal Dis. 2013 [Epub впереди печати]
55.
Пэн Нью-Джерси, Ху Ц., Кинг Т.М., Чиу Ю.Л., Ван Дж.Х., Лю Р.С. Выявление резектабельных рецидивов у пациентов с колоректальным раком с помощью 2 — [(18) f] фтор-2-дезокси-d-глюкозо-позитронно-эмиссионной томографии / компьютерной томографии . Радиофарм. 2013; 28 (6): 479-87
56.
Fiocchi F, Iotti V, Ligabue G. и др. . МРТ и ПЭТ-КТ с контрастным усилением в оценке пациентов с подозрением на местный рецидив карциномы прямой кишки . Radiol Med. 2010; 115 (6): 906-19
57.
Ким Х.Дж., Пак С.Х., Пикхардт П.Дж. и др. . КТ-колонография для комбинированного эпиднадзора за толстой и экстраколонической кишкой после лечебной резекции колоректального рака . Радиология. 2010; 257 (3): 697-704
58.
Чой Й.Дж., Пак С.Х., Ли СС. и др. . КТ-колонография для наблюдения после операции по поводу колоректального рака . AJR Am J Roentgenol. 2007; 189 (2): 283-9
59.
Флетчер Дж. Г., Джонсон С. Д., Крюгер В. Р.. и др. . КТ-колонография с контрастным усилением при рецидивирующей колоректальной карциноме: возможность одновременной оценки метастатического заболевания, местного рецидива и метахронной неоплазии при колоректальной карциноме . AJR Am J Roentgenol. 2002; 178 (2): 283-90
60.
You YT, Chang Chien CR, Wang JY. и др. . Оценка компьютерной томографической колонографии с контрастным усилением при обнаружении местного рецидивирующего колоректального рака . World J Gastroenterol. 2006; 12 (1): 123-6
61.
Ван Рейн Дж. К., Рейстма Дж. Б., Стокер Дж. и др. . Частота пропуска полипа, определенная с помощью тандемной колоноскопии: систематический обзор . Am J Gastroenterol. 2006; 101 : 343-350
62.
Ким Х.Г., Ли Ш., Чон СР. и др. . Клиническое значение первой контрольной колоноскопии после эндоскопического удаления раннего колоректального рака . Гепатогастроэнтерол. 2013; 60 (125): 1047-52
63.
Пангана Т.Дж., Ледесма Э.Дж., Миттлман А. и др. . Применение колоноскопии при исследовании синхронных колоректальных новообразований . Рак. 1984; 53 : 356-359
64.
Kronborg O, Hage E, Deichgraeber E. Оставшаяся толстая кишка после радикальной операции по поводу колоректального рака. Первые три года проспективного исследования . Dis Col Rectum. 1983; 26 : 172-76
65.
Вебер CA, Девени К.Э., Пеллегрини CA. и др. . Рутинная колоноскопия в лечении колоректального рака . AM J Surg. 1986; 152 : 87-92
66.Langevin JM, Nivatvongs S. Истинная частота синхронного рака толстой кишки. Проспективное исследование . Am J Surg. 1984; 147 : 330-333
67.
Американское онкологическое общество / Целевая группа мультиобщества США по колоректальному раку / Американский колледж радиологии (ACS / USMSTF / ACR). Скрининг и наблюдение для раннего выявления колоректального рака и аденоматозных полипов, 2008: совместное руководство Американского онкологического общества, Целевой группы США по колоректальному раку и Американского колледжа радиологии . CA Cancer J Clin. 2008; 58 (3): 130-60
68.
Ван Т., Цуй И, Хуанг В.С. и др. . Роль послеоперационного колоноскопического наблюдения после радикального хирургического вмешательства по поводу колоректального рака: проспективное рандомизированное клиническое исследование . Gastrointest Endosc. 2009; 69 : 609-15
69.
Мацуда А., Киши Т., Муссо Г. и др. . Влияние интраоперационного ректального вымывания на местный рецидив после операции по поводу рака прямой кишки: метаанализ . Ann Surg Oncol. 2013; 20 (3): 856-63
70.
Hassan C. Pickhardt PJ, Zullo A, et al. Экономическая эффективность раннего колоноскопического наблюдения после удаления рака . Dig Liv Dis. 2009; 41 : 881-885
71.
Ди Кристафаро Л., Скарпа М., Ангриман И. и др. . Анализ экономической эффективности протоколов послеоперационного наблюдения после радикальной операции по поводу колоректального рака . Acta Chir Belg. 2012; 122 : 24-32
72.
Бейнон Дж., Мортенсен Нью-Джерси, Фой Д.М. и др. . Выявление и оценка местного рецидивирующего рака прямой кишки с помощью эндосонографии прямой кишки . Dis Colon Rectum. 1989; 32 : 509-517
73.
Вудворд Т., Менке Д. Диагностика рецидивирующей карциномы прямой кишки с помощью тонкоигольной аспирации под контролем EUS . Gastrointest Endosc. 2000; 51 : 223-225
74.Рамирес Дж. М., Мортенсен Н. Дж., Такеучи Н. и др. . Эндолюминальная ультрасонография в динамическом наблюдении за пациентами с раком прямой кишки . Br J Surg. 1994; 81 : 692-694
75.
Hunerbein M, Totkas S, Moesta KT, Ulmer C, Handke T., Schlag P. Роль трансректальной биопсии под ультразвуковым контролем в послеоперационном наблюдении пациентов с раком прямой кишки . Хирургия. 2001; 129 : 164-169
76.ДеВитт Дж., Горал С., Кахи С., ЛеБлан Дж. и др. . EUS-FNA рецидивирующих послеоперационных внепросветных и метастатических злокачественных новообразований . Gastrointest Endosc. 2003; 58 : 542-548
77.
Ротондано Г., Эспозито П., Пеллеккья Л., Нови А., Романо Г. Раннее выявление локально рецидивирующего рака прямой кишки с помощью эндосонографии . Br J Радиология. 1997; 70 : 567-571
78.
Hildebrandt U, Feifel G, Schwarz HP, Scherr O. Эндоректальное УЗИ: инструментарий и клинические аспекты . Int J Colorect Dis. 1986; 1 : 203-207
79.
Konkam P, LeBlanc JK. Диагностика рецидивирующего рака прямой кишки глубоко в стенку влагалища с помощью трансвагинальной эндоскопической аспирации тонкой иглой под ультразвуковым контролем . Эндоскопия. 2008; 40 : 873-874
80.
Романо G, Esercizio L, Santangelo M, Vallone G, Santangelo ML. Влияние компьютерной томографии vs.Интраректальное ультразвуковое исследование для диагностики, резектабельности и прогноза местного рецидивирующего рака прямой кишки . Dis Colon Rectum. 1993; 36 : 261-265
81.
Накадзима С. Эффективность EUS для выявления рецидива заболевания анастомоза толстой кишки . Diagn Ther Endosc. 2001; 7 : 149-158
82.
Дьюхерст К., Розен депутат, Блейк Массачусетс. и др. . Критерии соответствия ACR стадия колоректального рака до лечения . J Am Coll Radiol. 2012; 9 (11): 775-81
83.
Романо Дж., Де Роса П., Валлоне Дж., Ротондо А., Грасси Р., Сантанджело М. Л.. Интраректальное ультразвуковое исследование и компьютерная томография в до- и послеоперационном обследовании пациентов с карциномой прямой кишки . Br J Surg. 1985; 72 : S117-119
84.
Сасаки Ю., Нива Ю., Хироока Ю. и др. . Использование эндоскопической тонкоигольной аспирации под контролем УЗИ для исследования подслизистых и внешних масс толстой и прямой кишки . Эндоскопия. 2005; 37 : 154-160
85.
Novell F, Pascual S, Viella P, Trias M. Эндоректальное ультразвуковое исследование при наблюдении за раком прямой кишки . Int J Colorect Dis. 1997; 12 : 78-81
86.
Хара К., Ямао К. и др. . Эндоскопическая ультразвуковая биопсия и тонкоигольная аспирационная биопсия под контролем эндоскопии для диагностики заболеваний нижних отделов пищеварительного тракта . Эндоскопия. 2003; 35 : 966-969
87.
Хюнербейн М., Тоткас С. и др. . Тонкоигольная биопсия под контролем EUS: минимально инвазивный доступ к метастатическому или рецидивирующему раку . Eur J Ultra. 1999; 10 : 151-157
88.
Morken JJ, Baxter NN, Madoff RD, Finne CO. Эндоректальная биопсия под контролем УЗИ: полезный метод обнаружения местного рецидива рака прямой кишки . Int J Colorectal Dis. 2006; 21 : 258-264
89.
Абулафи AM, Уильямс NS. Местный рецидив колоректального рака: проблемы, механизмы, лечение и адъювантная терапия . Br J Surg. 1994; 81 : 7-19
90.
Йохманс И., Топал Б., Д’Хур А. и др. . Результат стандартной визуализации после лечебного лечения колоректального рака . Acta Chir Belg. 2008; 108 : 88-92
91.Chen CS, Hsieh MC, Lai CC. и др. . Время подготовки повышения карциноэмбрионального антигена при послеоперационном наблюдении за колоректальным раком не повлияло на выживаемость после рецидива . Int J Colorectal Dis. , 2010 (25): 567-571
92.
Gold P, Freedman SO. Специфические карциноэмбриональные антигены пищеварительной системы человека . J Exp Med. 1965; 122 (3): 467-81
93.
Moertel CG, O’Fallon JR, Go VL. и др. . Предоперационный тест на карциноэмбриональный антиген для диагностики, определения стадии и прогноза колоректального рака . Рак. 1986; 58 : 603-610
94.
Тан Э, Гувас Н., Николлс Р.Дж. и др. . Диагностическая точность карциноэмбрионального антигена при обнаружении рецидива колоректального рака . Surg Oncol. 2009Mar; 18 (1): 15-24
95.
Метсер У, Ю Дж, Максуини С. и др. . Оценка рецидива опухоли у пациентов с колоректальным раком и повышенным уровнем карциноэмбрионального антигена: ПЭТ / КТ с ФДГ по сравнению с 64-МДКТ с контрастированием грудной клетки и брюшной полости . Am J Roentgenol. 2010; 194 : 766-771
96.
Уокер А.С., Нельсон Д.У., Фаулер Дж. Дж., Кози М. В., Куэйд С., Джонсон Е. К., Майкель Дж. А., Стил С. Р.. Оценка рекомендаций по наблюдению за колоноскопией: действительно ли мы соблюдаем рекомендации? . Am J Surg. 2013; 205 (5): 618-22
97.
Сислер Дж. Дж., Сео Б., Кац А. и др. . Соответствие рекомендациям ASCCO после лечения колоректального рака: популяционный анализ . J Oncol Pract. 2012; 8 (4): e69-e79
98.
Зальц Т, Вайнбергер М, Аянян Дж. З. и др. . Различия в использовании колоноскопии для наблюдения среди выживших после колоректального рака в США . BMC Health Serv Res. 2010; 10 : 256
99.
Сёрейде К., Трэланд Дж. Х., Стокеланд П. Дж. и др. . Соблюдение национальных рекомендаций по надзору после радикальной резекции неметастатического рака толстой и прямой кишки: опрос норвежских желудочно-кишечных хирургов . Colorect Dis. 2011; 14 : 320-324
100.
Саллум Р.Г., Хорнбрук М.С., Фишман П.А. и др. . Соблюдение рекомендаций по эпиднадзору после лечения рака молочной железы и колоректального рака с лечебной целью . Рак.


 Далее — всегда следует стремиться к выполнению ССО, если даже для этого придется делать интерсфинктерные резекции ПК. Несомненно, оперирующим на ПК хирургам нужно освоить методику формирования толстокишечных резервуаров и колопластику.
Далее — всегда следует стремиться к выполнению ССО, если даже для этого придется делать интерсфинктерные резекции ПК. Несомненно, оперирующим на ПК хирургам нужно освоить методику формирования толстокишечных резервуаров и колопластику.