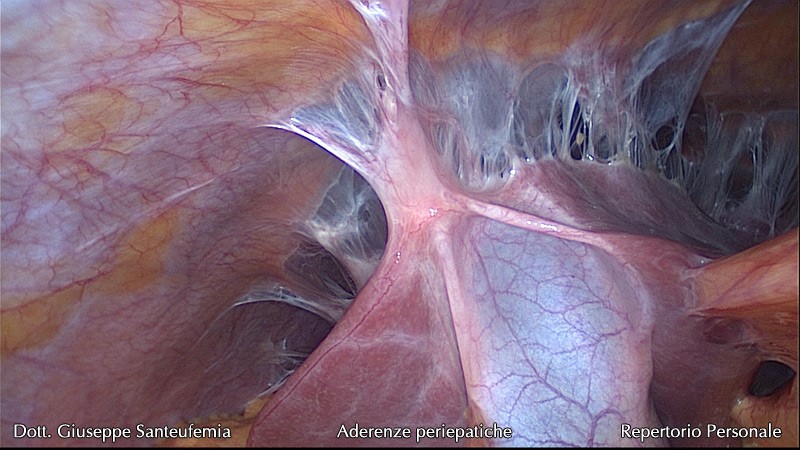
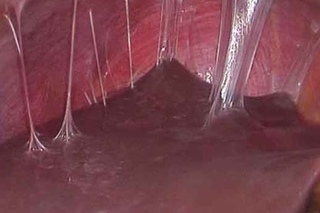
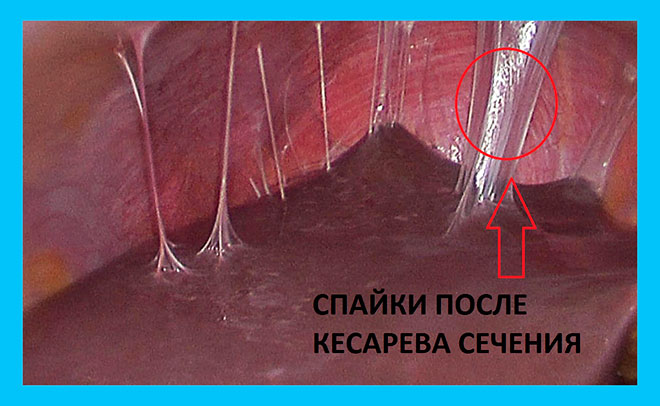
Спаечная болезнь | Компетентно о здоровье на iLive
Как развивается спаечная болезнь?
Спаечная болезнь – очень сложная патология, ее невозможно решить без чёткого понимания процессов, протекающих в брюшной полости.
По мнению современных исследователей, защитные клеточные процессы, иницирующиеся различными интраперитонеальными повреждающими моментами — оперативное вмешательство, травма, воспалительные процессы различного генеза развиваются при непосредственном участии основных «генераторов» клеток воспаления — брюшины и большого сальника. Именно они обеспечивают наибольшее значение с точки зрения филогенеза механизмы клеточной защиты.
В этом вопросе следует остановиться на производных моноцитов – перитонеальных макрофагах. Речь идет о так называемых стимулированных перитонеальных макрофагах, т.е. фагоцитах, входящих в состав воспалительного экссудата брюшной полости. В литературе показано, что в первые часы воспалительной реакции в брюшную полость выходят в основном нейтрофильные лейкоциты, а к концу первых или началу вторых суток в экссудат мигрируют монокуклеары, активирующиеся и дифференцирующиеся в перитонеальные макрофаги.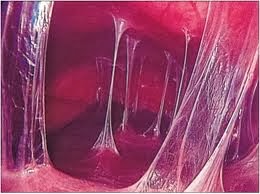 Их функции определяются способностью интенсивно поглощать различные биологические субстраты и активно участвовать в катаболизме интраперитонеального процесса. Именно поэтому состояние макрофагальных реакций в патогенезе спаечной болезни можно считать бесспорным.
Их функции определяются способностью интенсивно поглощать различные биологические субстраты и активно участвовать в катаболизме интраперитонеального процесса. Именно поэтому состояние макрофагальных реакций в патогенезе спаечной болезни можно считать бесспорным.
При изучения состояния защитных клеточных реакций у человека наиболее информативным считают метод изучения асептической воспалительной реакции (АВР) в «кожном окне».
Для осуществления этого исследования на скарифицированную поверхность исследуемого накладывают и закрепляют стерильное предметное стекло для снятия отпечатков через 6 и 24 ч, получая, таким образом, клеточный материал первой и второй фаз АВР. В последующем их окрашивают и изучают под микроскопом, оценивая своевременность смены фаз (хемотаксис), процентный клеточный состав, количественное взаимоотношение различных элементов и цитоморфологию.
Исследования, проведённые по этой методике, показали, что у здоровых людей в первой фазе АВР нейтрофилы составляют в среднем 84,5%, а макрофаги – 14% во второй фазе АВР наблюдают противоположное соотношение клеток: нейтрофилы — 16,0%, а макрофаги — 84%, эозинофилы не превышают 1,5%.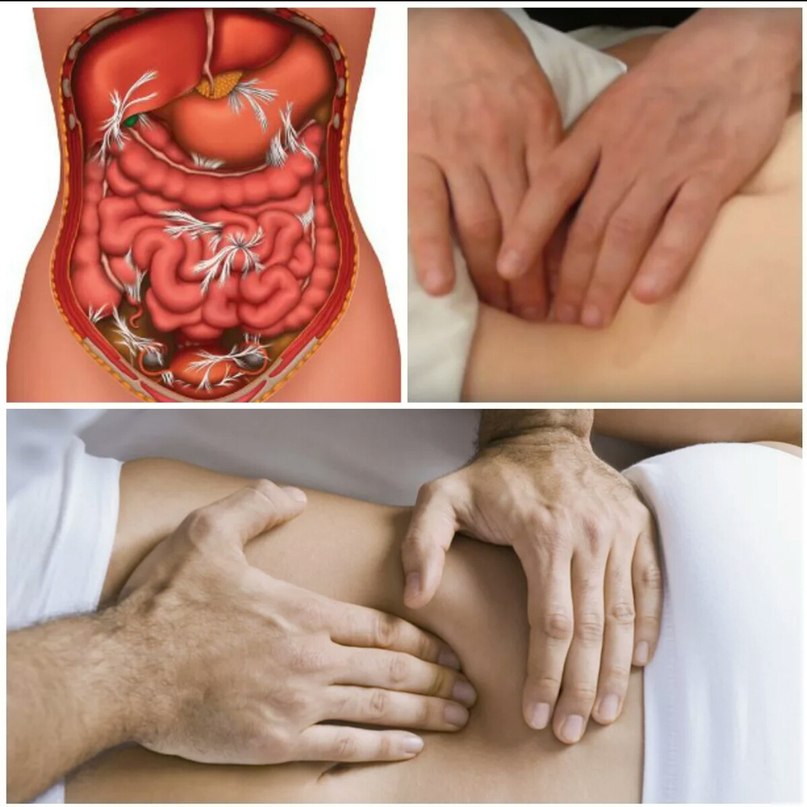
Лимфоциты не обнаруживают вообще. Всякого рода отклонения в указанной последовательности выхода и процентного соотношения клеток свидетельствует о нарушении клеточных механизмов защиты.
В последнее время появились клинические и экспериментальные исследования, в которых говорится, что спаечная болезнь – результат нарушения обмена соединительной ткани, в частности коллагена. Стабилизация цепей коллагена осуществляется при участии медьсодержащегоо фермента лизилоксидазы, катализирующего превращение лизилодезоксилизина в альдегиды. Эти альдегиды, в свою очередь, образуют поперечные ковалентные связи, формируя трёхспиральную молекулу нерастворимого зрелого коллагена. Активность лизилоксидазы прямо связана с активностью N-ацетилтрансферазы — конституционального фермента, катализирующего процесс инактивации токсических продуктов обмена веществ и привносимых извне лигандов.
Общеизвестно, что человеческая популяция по активности N-ацетилтрансферазы делится на так называемых «быстрых» и «медленных» ацетиляторов. При этом к медленным ацетиляторам относят лиц с процентом ацетилирования менее 75, к быстрым ацетиляторам — с процентом ацетилирования, превышающим 75.
При этом к медленным ацетиляторам относят лиц с процентом ацетилирования менее 75, к быстрым ацетиляторам — с процентом ацетилирования, превышающим 75.
Процесс регенерации брюшины образование коллагеновых волокон у индивидуумов с различной скоростью ацетилирования происходит по-разному.
- У медленных ацетиляторов накапливаются субстраты ацетилирования (эндогенные и экзогенные хелатные комплексы), которые связывают ионы меди, входящие в состав лизилоксидазы. Скорость синтеза кросс-связей снижается, количество формирующихся волокон невелико. Накапливающийся латерантный коллаген по принципу обратной связи активирует эндогенную коллагеназу.
- У быстрых ацетиляторов накопления субстратов ацетилирования не происходит. ионы мели не связываются, активность лизилоксидазы высокая. Происходит активный синтез и отложение коллагеновых волокон на имеющихся наложениях фибрина. На этих волокнах в свою очередь оседают фибробласты, что извращает нормальное течение регенерации брюшины и приводит к формированию спаечной болезни.

Спаечная болезнь развивается вследствие присутствия причинно-следственной связи между цитодинамическими, цитоморфологическими сдвигами нормального течения местных и общих клеточных реакций защиты при расстройствах репаративного синтеза коллагена.
Указанные осложнения в клинической практике представлены такими состояниями, как: ранняя непроходимость кишечника (РСНК), поздняя кишечная непроходимость (ПСНК) и спаечная болезнь (СБ).
Исходя из вышеизложенного, у больных, у которых есть спаечная болезнь, необходимо проводить комплексное исследование, включающее фенотипирование по скорости ацетилирования, изучение цитодинамических процессов и цитоморфологии фагоцитирующих клеток в перитонеальном экссудате (местная клеточная реакция), в «кожном окне» по Ребуку (общая клеточная реакция). Верификацию полученных данных необходимо проводить методам ультразвуковой эхографии (ультрасонографии) брюшной полости и видеолапароскопии.
Спаечная болезнь характеризуется наличием изменений в исследуемых параметрах характерные только для указанной патологии.
Цитодинамические реакции в послеоперационном периоде у этих больных имели свои особенности как в перитонеальном экссудате, так и в отпечатках «кожного окна». Так, в перитонеальном экссудате наблюдали сниженное количество макрофагальных элементов, в течении АВР — нарушение макрофагального хемотаксиса и повышенное содержание волокон фибрина в ранке «кожного окна». Средняя скорость ацетилирования у детей с РСНК была достоверно выше, чем больных с благоприятным течением послеоперационного периода, и составлял; 88,89±2.8% (р
Результаты проведённых исследований позволили прийти к следующему заключению.
Если оперативное вмешательство на органах брюшной полости выполняется у ребенка с фенотипом быстрого ацетилирования и при этом у него присутствует недостаточность макрофагальной реакции, обусловленная нарушением хемотаксической активности мононуклеарных фагоцитов, то, с одной стороны, будет происходить усиленное фибринообразование и ускоренный синтез коллагена за счёт интенсивной пролиферации фибробластов, опережающей скорость нормального катаболизма фибрина, а с другой стороны — неадекватная макрофагальная реакция, извращая кинетику воспаления, что приведёт к длительной персистенции продуктов деградации брюшины, обусловливая сенсибилизацию организма продуктами тканевого распада и формирование гиперчувствительности замедленно типа, хронического воспаления на иммунной основе с привлечением ещё больше: количества фибробластов в очаг воспаления. Таким образом, все отмеченные процессы в совокупности приведут к избыточному синтезу соединительной ткани – формированию такого состояния, как спаечная болезнь. Следует отметить, что сопутствующая патология желудочно-кишечного тракта многократно увеличит риск патологического фибринообразования.
Таким образом, все отмеченные процессы в совокупности приведут к избыточному синтезу соединительной ткани – формированию такого состояния, как спаечная болезнь. Следует отметить, что сопутствующая патология желудочно-кишечного тракта многократно увеличит риск патологического фибринообразования.
Спаечная болезнь — статьи о гинекологии
Спаечная болезнь брюшной полости
Это состояние, при внутренние органы и ткани срастаются между собой полосками соединительной ткани (фиброзными полосками, или спайками). Сращения могут представлять собой толстые тяжи, иногда с сосудами и нервами, а могут быть тонкими мембранами. Спайки нарушают подвижность органов, прежде всего кишечника, связывая их соединительнотканными “мостиками”. Они могут возникнуть между петлями тонкого и толстого кишечника, в области печени, желчного пузыря, матки и маточных труб, яичников, мочевого пузыря, брюшины.
Причины спаечной болезни
Чаще всего причиной считают операции на органах брюшной полости. Спайки возникают после 93% хирургических вмешательств. Если операция проводилась в области малого таза с вовлечением кишечника или матки с придатками, то риск возникновения спаек растет. Процесс утолщения и уплотнения спаек может продолжаться десятки лет.
Спайки возникают после 93% хирургических вмешательств. Если операция проводилась в области малого таза с вовлечением кишечника или матки с придатками, то риск возникновения спаек растет. Процесс утолщения и уплотнения спаек может продолжаться десятки лет.
Возможные причины, провоцирующие образование спаек:
- повреждение внутренних органов;
- высыхание поверхности внутренних органов во время хирургического вмешательства;
- контакт внутренних тканей с инородными объектами, такими как марля, хирургические перчатки, шовный материал, инструменты;
- кровь, поврежденные ткани или тромбы, инородные тела, не полностью удаленные при операции.
Также причиной могут стать состояния, напрямую не связанные с хирургическим вмешательством:
- разрыв аппендикса, желчного пузыря;
- лучевая терапия;
- гинекологические инфекции;
- инфекции органов брюшной полости;
- травмы.
В 4,7% случаев спайки врожденные, их формирование происходит во время закладки органов.
В редких случаях спайки могут возникнуть без видимых причин.
Код по МКБ-10
Коды заболевания в соответствии с классификацией:
- K66.0 — брюшинные спайки
- N73.6 — тазовые перитонеальные спайки у женщин
- Т99.4 — послеоперационные спайки в малом тазу
- Q43.3 — врожденные аномалии фиксации кишечника.
Симптомы спаечной болезни
Обычно спаечная болезнь протекает бессимптомно. Реже пациент жалуется на постоянные боли (синдром хронической боли) либо на дискомфорт в области живота.
Боли при спаечной болезни
Часто возникают около пупка, имеют приступообразный, спастический характер. Нередки вздутие живота, метеоризм.
У пациенток повышен риск внематочной беременности. Образование спаек непосредственно в матке может приводить к привычному невынашиванию беременности.
Также могут развиваться бесплодие у женщин или кишечная непроходимость.
Кишечная непроходимость при спаечной болезни
Состояние требует немедленной медицинской помощи, чаще всего — операции. Срочная консультация врача необходима, если у пациента, когда-либо в жизни перенесшего оперативное вмешательство или воспаление в брюшной полости, появились следующие симптомы:
Срочная консультация врача необходима, если у пациента, когда-либо в жизни перенесшего оперативное вмешательство или воспаление в брюшной полости, появились следующие симптомы:
- сильная боль схваткообразного характера в животе
- тошнота, рвота
- метеоризм, сокращения кишечника, которые сопровождаются звуками (бульканье, переливание)
- увеличение размера живота
- невозможность дефекации или невозможность выпустить газ
- запор, т.е. дефекация реже трех раз в неделю. Процесс дефекации может быть болезненным.
Диагностика спаечной болезни
К сожалению, спайки нельзя обнаружить лабораторными анализами или стандартными визуализирующими методами исследования (рентгенографией, УЗИ).
Точную диагностику спаечной болезни проводят только при визуальном осмотре брюшной полости во время лапароскопии или открытой операции на брюшной полости.
Рентген и компьютерная томография (КТ) могут помочь в выявлении кишечной непроходимости.
Лечение спаечной болезни
Если спайки не проявляются и не вызывают никаких симптомов, то лечение не нужно.
Хирургическая операция — единственный эффективный метод лечения. Показания:
- болевой синдром;
- бесплодие;
- кишечная непроходимость; при полной кишечной непроходимости операция обязательна, при частичной могут помочь консервативные методы.
Однако повторная операция значительно повышает риск образования новых спаек.
Лечение спаечной болезни народными средствами
В крупных клинических исследованиях народные методы не изучались. Таким образом эффективность их не подтверждена, но и не опровергнута.
Диета при спаечной болезни
Исследования не выявили, что питание, диета или какие-то отдельные питательные вещества играют роль в профилактике спаек. Если диагностирована частичная кишечная непроходимость, то имеет смысл увеличить употребление жидкости и есть меньше клетчатки. Подобные рекомендации по питанию лучше получить у лечащего врача.
Прогноз
Сама спаечная болезнь обычно не вызывает жалоб, протекает бессимптомно и опасности не представляет. Опасны осложнения. В настоящее время методов, позволяющих полностью удалить все спайки, не существует. Также нет идеального способа лечения, но ученые ведут исследования новых вариантов терапии.
Профилактика спаечной болезни
Заболевание сложно предотвратить полностью, но можно снизить его риск. Для этого при проведении операций стоит отдавать предпочтение малотравматичному лапароскопическому способу. Если он невозможен и требуется операция с широким разрезом на брюшной стенке, то в конце желательна установка специального разделительного материала между органами или между органами и брюшной стенкой. Этот материал похож на вощеную бумагу и полностью рассасывается в течение недели, он увлажняет поверхность органов и не дает расти соединительной ткани между органами.
Другие способы профилактики спаечной болезни кишечника и органов малого таза во время операции обязательны:
- использование перчаток, не обработанных крахмалом и тальком
- аккуратное и бережное обращение с органами
- сокращение времени операции
- тщательная остановка кровотечения
- использование увлажненных тампонов и салфеток
- адекватное применение физиологического раствора для орошения органов с целью увлажнения.

Мерами профилактики после операции считают раннюю активизацию больного (раннее вставание) и дыхательную гимнастику.
Источники
- Abdominal Adhesions
What are abdominal adhesions?, NIH — https://www.niddk.nih.gov/health-information/digestive-diseases/abdominal-adhesions - Abdominal Adhesions, Medicine Central — https://im.unboundmedicine.com/medicine/view/5-Minute-Clinical-Consult/117470/all/Abdominal_Adhesions
симптомы, лечение народными средствами, как лечить спаечную болезнь брюшной полости в домашних условиях
Спаечный процесс характеризуется образованием соединительной ткани между внутренними органами и брюшной полостью. Чаще всего болезнь возникает после хирургического вмешательства, реже – в результате воспаления. Возможна как консервативная терапия, так и домашнее лечение с разрешения специалиста. Для начала рекомендуется изучить методы лечения симптомов спаек в кишечнике народными средствами и выбрать самые подходящие.
Что такое спайки
Спаечные образования возникают в ответ на воспалительный процесс или механическое повреждение. Органы брюшной полости покрыты тонкой оболочкой, называемой брюшиной. При повреждении или воспалении оболочка утолщается, что приводит к появлению спаек – специфического сращивания, которое защищает органы от распространения воспаления. При вовремя начатой терапии поверхность спаек уменьшается.
В чем опасность
Появление образований имеет не только положительную, но и негативную сторону. Со временем разросшиеся ткани начинают мешать правильной работе внутренних органов.
У женщин болезнь может привести к бесплодию: разросшаяся соединительная ткань начинает затрагивать матку, маточные трубы и яичники, из-за чего нарушается попадание яйцеклетки в полость матки. Также распространение спаек негативно сказывается на скорости передвижения сперматозоидов по маточным трубам, что существенно снижает шансы на успешное зачатие.
Причины возникновения
Основные причины, вызывающие заболевание:
- воспаление внутренних органов: аднексит, холецистит, энтерит и пр.;
- оперативное вмешательство;
- кровоизлияние в брюшную полость;
- развитие эндометриоза;
- химическое поражение, возникающее при забросе желчи или содержимого желудка в брюшную полость (при прободной язве).
Важно! Заболевание обычно диагностируется случайно, чаще всего у женщин, жалующихся на проблемы с зачатием.
Симптомы и первые признаки
Признаки и проявления зависят от локализации болезни и чаще напоминают симптомы патологий желудочно-кишечного тракта. Спаечное поражение протекает в нескольких формах:
- латентная;
- с выраженным болевым синдромом;
- с преобладанием диспепсических нарушений;
- с кишечной непроходимостью.
Латентная форма не дает симптоматики. При возникновении формы с болевым синдромом ощущается ноющая, тупая боль в месте локализации образования. Усиление дискомфорта возникает после физических нагрузок и сразу после еды. Возможно присоединение тошноты и расстройства желудка. Локализация боли зависит от места образования соединительной ткани.
При возникновении формы с болевым синдромом ощущается ноющая, тупая боль в месте локализации образования. Усиление дискомфорта возникает после физических нагрузок и сразу после еды. Возможно присоединение тошноты и расстройства желудка. Локализация боли зависит от места образования соединительной ткани.
Читайте на сайте:
Чем опасна кишечная непроходимость у ребенка
Динамическая непроходимость и как ее лечить
Если спаечный процесс проявляется диспепсическими нарушениями, возникают такие симптомы:
- ухудшение аппетита;
- рвота, тошнота;
- изжога;
- проблемы со стулом, запоры;
- вздутие живота;
- метеоризм.
Реже отмечаются схваткообразные боли в животе.
Спаечная непроходимость кишки – опасное состояние, требующее немедленной медицинской помощи. В противном случае возможен смертельный исход. Основные признаки:
- резкие, схваткообразные боли в животе;
- рвота и тошнота;
- вздутие живота и полное отсутствие газов;
- отсутствие дефекации;
- слабость и нарастание признаков отравления.

Важно! Для лечения непроходимости требуется срочное хирургическое вмешательство.
Народные средства
Существует несколько методов народной терапии, которые могут помочь вылечить спаечное образование. Лечиться таким способом допустимо, если образовавшаяся уплотненная соединительная ткань не несет вреда для организма по месту локализации. При возникновении любых признаков ухудшения нужно незамедлительно обратиться к врачу.
Примочки и компрессы
Один из вариантов – использование повязок, компрессов или примочек. Подходящее лекарственное растение – семена льна. Горсть семян заворачивают в марлевый мешочек и опускают в кипяток на 2-3 минуты. Когда мешочек остынет, семена в виде примочки накладывают на места образования спаек. Компресс оставляют на ночь. Повторять процедуру можно ежедневно.
Массаж
Регулярный самомассаж поможет разъединить соединительную ткань между органами. Проводить его нужно ежедневно, пока не наступит облегчение. Ощущения могут быть болезненными. Делается массаж подушечками пальцев.
Проводить его нужно ежедневно, пока не наступит облегчение. Ощущения могут быть болезненными. Делается массаж подушечками пальцев.
Пример механического воздействия:
- Большим пальцем правой руки упереться в зону над пупком.
- Большим пальцем левой руки проделать то же самое, но нажимая под пупком.
- На выдохе пальцы во время надавливания перемещать навстречу друг другу.
- Задержать дыхание на несколько секунд с последующим надавливанием на зоны и выполнением массирующих движений.
Для внутреннего применения
Хорошую эффективность показывают сборы лекарственных трав, используемые для перорального употребления. Полезно принимать отвары, настойки и семена.
Отвар из смеси плодов шиповника и листьев крапивы улучшает общее самочувствие больного и ускоряет рассасывание спаек:
- Смешать 2 ст. ложки свежих ягод шиповника и 1 ст. ложку ягод брусники. Добавить несколько листьев крапивы.

- Смесь из растений залить стаканом кипятка.
- Пить ежедневно по 100 мл с утра и вечером, пока больному не станет легче.
Травяной отвар из мать-и-мачехи, донника и золототысячника можно принимать ежедневно в течение месяца:
- Смесь растений (1 ст. ложка) залить стаканом кипятка, настаивать несколько часов в термосе.
- Настой употреблять по четверти стакана за полчаса до еды 3-4 раза в сутки.
По подобному рецепту можно употреблять и моринду. Для приготовления раствора смешивают сухие листья, корни и плоды. Лекарственное растение снимает боль и нервное напряжение. Принимать его рекомендуется не более трех недель.
От болезненных спаек подходят для перорального употребления семена льна и подорожника. Семена принимать удобно, ведь их не нужно заваривать, можно есть в сухом виде. Для лечения спаек употребляют перед едой семена льна и подорожника два раза в день по 1 ч. ложке.
Читайте на сайте:
Как распознать и вылечить обтурационную непроходимость
Паралитическая кишечная непроходимость
Возможный вред и противопоказания
Народная терапия, по сравнению с консервативными методами лечения, обладает низкой степенью эффективности. Если неосторожно принимать отвары или неправильно делать массаж, от таких действий можно получить больше вреда, нежели пользы.
Возможна непереносимость каких-либо растений, что вызовет общее ухудшение состояния, расстройство желудка или аллергическую реакцию. При склонности к пищевой аллергии и наличии тяжелых хронических заболеваний фитотерапия противопоказана.
Профилактика
Часто соединительные ткани появляются после хирургического и лапароскопического лечения. Это связано с попаданием крови в брюшную полость.
Для предупреждения появления спаек рекомендовано промывание брюшной полости раствором Рингера и однократное введение раствора гепарина натрия в количестве 5000 МЕ. Также могут назначаться различные ферментные средства («Лонгидаза») либо препараты, препятствующие образованию соединительной ткани.
Также могут назначаться различные ферментные средства («Лонгидаза») либо препараты, препятствующие образованию соединительной ткани.
Заключение
Спаечный процесс может вызывать неприятные симптомы и приводить к возникновению женского бесплодия. В незапущенных ситуациях после консультации врача допустимо использование народных средств терапии, которые помогут улучшить самочувствие пациента.
Спаечная болезнь брюшной полости — причины, симптомы, диагностика, лечение
Спаечная болезнь брюшной полости редко классифицируется как самостоятельное заболевание, чаще является следствием оперативного вмешательства, которое проводилось ранее. При этом, спайки могут приводить к серьёзным нарушениям в работе органов пищеварения. Как предотвратить образование спаек и в чем их основная опасность?
Как развивается спаечная болезнь
Преимущественно этот процесс не доставляет беспокойства. В организме человека, на кишечнике, органах брюшной полости, нарастают соединительные ткани, которые блокируют кровоток в органах, нарушают их работу.
В зависимости от причины возникновения, спайки могут носить единичный или множественный характер. До определённого момента, они не доставляют серьезного дискомфорта, не причиняют боли. Но при активном нарастании, соединительные ткани могут нарушать работу органов ЖКТ, приводить к непроходимости кишечника.
Нередко этот процесс продолжается на протяжении нескольких месяцев или лет.
Причины развития спаечной болезни брюшной полости
Спайки образуются по нескольким причинам, они часто возникают как следствие оперативного вмешательства, в случае если:
- Манипуляции проводились несоответствующим образом, слишком грубая работа хирурга, низкая квалификация.
- В момент вмешательства, перчатки врача или инструменты, контактировали с тканями органа, вызвав определённые изменения в них.
- Операция носила сложный характер, в процессе ее проведения были затронуты, повреждены внутренние органы.
- Швы были наложены неправильно, с нарушениями, в результате чего и началось нарастание соединительных тканей.

Помимо оперативных вмешательств, у болезни есть и другие причины возникновения:
- воспалительные заболевания, развывшиеся после операции или до ее проведения;
- инфекционные заболевания гинекологического характера, в случае отсутствия адекватной терапии;
- проведение лучевой терапии, при лечении заболеваний онкологического характера.
Часто спайки возникают после удаления аппендицита, эта несложная операция может привести к нежелательным последствиям.
Нередко установить причину образования спаек невозможно, болезнь протекает бессимптомно, а диагностируется случайно, при проведении плановых обследований.
Спаечная болезнь с преобладанием болевого синдрома
Спазмы, неприятные ощущения в области брюшной полости, часто являются следствием образования спаек. Дискомфорт возникает при движениях, может ограничивать подвижность, часто беспокоит после еды.
В зависимости от локализации, спайки могут нарушать ток крови к органом системы пищеварения. Результатам этого считается боль, которая часто беспокоит человека.
Результатам этого считается боль, которая часто беспокоит человека.
Она может сочетаться с другой симптоматикой, усиливая дискомфорт.
Боли возникают не только по причине нарушения кровотока, но и как следствие изменения функционирования органов системы пищеварения. Из-за спаек они не могут нормально сокращаться, образования мешают.
Спаечная болезнь с преобладанием диспепсических нарушений
Это когда помимо боли появляются и другие, неприятные признаки, которые свидетельствуют о том, что спаечный процесс активно развивается. Что беспокоит человека:
- Тошнота, рвота, часто возникающая после приема пищи, причем она может носить эпизодический характер, появляться после употребления в пищу определенных продуктов.
- Нарушения стула, частые запоры, которые не связаны с образом жизни, питанием.
- Отрыжка, возникающая после приема пищи, с возможным обратным забросом содержимого желудка в пищевод и ротовую полость.
У женщин боли могут локализироваться в области органов системы репродукции, что затрудняет диагностику. При этом другие признаки также присутствуют.
При этом другие признаки также присутствуют.
Спаечная непроходимость кишечника
Непроходимость, развывшаяся по причине спаечного процесса, потенциально опасна для жизни человека.
Основные признаки кишечной непроходимости при спаечной болезни органов брюшной полости:
Тошнота и рвота: | При этом содержимое желудка, в случае развития рвоты отличается гнилостным, неприютным запахом, что свидетельствует о серьезных нарушениях в процессе пищеварения. |
Отрыжка: | Возникает после приема пищи, с обратным забросом содержимого желудка, отрыжка может переходить в рвоту. |
Вздутие. появление клиники острого живота: | Болезненность органов брюшной полости при пальпации. |
Урчание в желудке: | Которое нередко сопровождается сильными болевыми ощущениями. |
Запор: | Носящий длительный характер, решить проблему при помощи средств медикаментозного характера или путем коррекции питания – невозможно. |
Непроходимость кишечника, в независимости от причины возникновения, может привести к пагубным последствиям. Организм человека постепенно отравляется, результатом чего может стать летальный исход.
Непроходимость развивается в результате спаечного процесса, когда фиброзные ткани приводят к «слипанию» органов системы пищеварения.
Схема диагностики
Есть несколько методов, которые помогут диагностировать заболевание. Часто больные не подозревают о том, что в их организме протекают процессы, нарушающие работу органов ЖКТ.
Диагностировать болезнь при помощи проведения каких-либо анализов невозможно. Но есть другие способы, которые помогут в диагностике заболевания:
Рентгенографическое исследование с введением контрастного вещества: | Позволяет получить необходимую информацию о состоянии органов брюшной полости. |
УЗИ: | В некоторых случаях проведение ультразвукового исследования помогает диагностировать изменения, затронувшие ткани, но часто требуется назначение дополнительных процедур диагностического характера. |
КТ или МРТ органов брюшной полости: | В зависимости от состояния пациента проводить обследование будут с введением контрастного вещества или без такового. |
В качестве диагностического исследования могут назначить лапароскопию, ее проводят с целью определить степень поражения органов спаечным процессом, а также устранить спайки, убрать их. Тем самым нормализовав функцию органов ЖКТ.
Лапароскопическое и эндоскопические исследования считаются оптимальными, поскольку позволяют получить полную информацию о состоянии тканей.
Как проводят:
- через небольшие проколы в области брюшной полости вводят микроскопическую камеру;
- она передает на монитор изображение, которое изучает врач, изображение помогает в диагностике заболевания.
Проведение лапароскопии помогает не только диагностировать болезнь, но и убрать спайки, в случае их обнаружения.
Лечение
Условно терапию можно разделить на несколько этапов, она включает:
- Проведение операций, направленных на удаление спаек.

- Применение препаратов, которые способствуют рассасыванию образований из соединительной ткани.
- Проведение физиотерапевтических процедур, способствующих уменьшению спаек в размерах.
- Коррекции питания, проводится в случае, если у человека нет серьезных нарушений в работе кишечника.
Хирургическая терапия
Полостные операции проводят редко, в случае если человека беспокоит непроходимость кишечника. Полостная операция не решает проблемы, она способна спровоцировать образование новых спаек.
Но в случае, если иным способом скорректировать состояние пациента не возможно, то врачи делают следующее:
- вскрывают область брюшной полости в районе пораженного органа;
- иссекают спайки путем хирургического вмешательства, используя скальпель;
- восстанавливают работу органов системы пищеварения, закрывают брюшную полость пациента.
Щадящим считается проведение лапароскопии, не подразумевающей вскрытие брюшной полости, а значит, снижающее риск образования спаек.
Нередко спайки рассекают лазерным лучом, что помогает устранить образования и снизить потенциальные риски. Но такая операция считается дорогостоящей и проводят ее определенным пациентам, при наличии показаний.
Восстановление после операции
Проведение полостной операции подразумевает прохождение через период восстановления. Он заключается в соблюдении определенных правил, которые помогут избежать повторного образования спаек на органах брюшной полости.
Период восстановления может занять несколько недель, месяцев. В зависимости от сложности оперативного вмешательства, которое проводилось пациенту.
При лапароскопии восстановительный период, как таковой, отсутствует. Человека выписывают из стационара через несколько дней, выдав определенные рекомендации.
Чаще всего, после проведения любой операции, рекомендуется:
- Отказаться от тяжелых физических нагрузок, избегать силовых тренировок и поднятия тяжестей.
- Соблюдать диету, избегать приема в пищу продуктов, нагружающих работу органы системы пищеварения.

- Принимать определенные препараты, которые помогут избежать образования новых спаек на стенках кишечника.
Восстановление может включать массаж и проведение физиотерапевтических процедур, в том числе выполнение упражнений лечебной физкультуры. Но тут все зависит от состояния пациента и рекомендаций врача.
Препараты
Восстановление, как и лечение спаек на раннем этапе развития, проходит с проведением рассасывающей терапии. Она подразумевает прием медикаментов, которые препятствуют нарастанию соединительных тканей.
Рассасывающую терапию назначают после проведения любой операции, она помогает снизить риск образования спаек. Но эффективность такого лечения зависит от множества факторов, в том числе от восприимчивости организма к лекарственным средствам.
Препараты подирает врач, в индивидуальным порядке, средняя продолжительность курса 10-14 дней.
Физиотерапия
Препятствуют процессу нарастания соединительных тканей и физиотерапевтические процедуры. В период восстановления будут эффективны следующие манипуляции:
В период восстановления будут эффективны следующие манипуляции:
- терапия с использованием магнитов, наложение их на область брюшной полости;
- проведение электрофореза, с использованием определенных препаратов;
- прогревание, назначается курсом, по рекомендации врача, в зависимости от состояния пациента.
Уменьшить существующие риски поможет лечебная физкультура. Занятия проводят в группе или индивидуально, рекомендуя выполнять специально подобранные упражнения.
Питание
Диета считается важной частью восстановительного процесса, она назначается и в случае обнаружения спаек на кишечнике. Но при непроходимости, соблюдение правил питания не приносит желаемого результата.
Какой схемы питания стоит придерживаться в случае обнаружения спаечного процесса:
Придется отказаться от продуктов, которые стимулируют газообразование в желудке, это: | газированные напитки, бобовые, еда с высоким содержанием клетчатки. |
Под запетом пища, раздражающая слизистую желудка и кишечника: | Острые, пряные и соленые блюда, а также полуфабрикаты, богатые специями. |
Не стоит включать в рацион: | Жирные и жаренные продукты, которые тяжело перевариваются и нагружают органы системы пищеварения. |
Не рекомендуется употреблять в пищу: | Отруби, молочные продукты, напитки богатые кофеином, алкогольную продукцию. |
Еда поможет избежать проблем, снизить выраженность спазмов, в случае их наличия. Предпочтение отдается пище, которая легко усваивается, содержит все необходимые витамины и минеральные элементы.
Чтобы ускорить восстановительный процесс, поддержать организм, нужно начать прием витаминов. Можно попросить лечащего врача подобрать подходящий комплекс.
Возможные осложнения и прогноз для жизни
Если человеку была оказана помощь своевременно, то тяжелых последствий для здоровья ждать не стоит. Поэтому можно сказать, что прогноз у заболевания благоприятный.
Поэтому можно сказать, что прогноз у заболевания благоприятный.
Но, чтобы избежать рецидива образования спаек, придется:
- Регулярно проходить диагностические исследования, с целью контроля за состоянием.
- Соблюдать диету, отказаться от определенных продуктов, потенциально опасных для здоровья.
- Вести здоровый образ жизни, нормализовать физическую активность, избегать приема алкоголя.
Осложнением операции по удалению спаек может стать усугубление патологического провеса. По этой причине так важно контролировать состояние, избегать присоединения вторичной инфекции.
Профилактика
Специфических профилактических мер, способных предотвратить образование спаек, не существует. Для предотвращения развития болезни, рекомендуется:
- вести правильный образ жизни, избегать приемов вредной пищи, ограничить потребление алкоголя;
- нормализовать двигательную активность, заниматься спортом, гулять на свежем воздухе, плавать в бассейне;
- употреблять достаточное количество жидкости, избегать нервных перенапряжений.

Это общие рекомендации, которых стоит придерживаться, но есть и другие, они касаются не только пациентов, но и докторов:
- В процессе оперативного вмешательства удалять крупные сгустки крови.
- Избегать соприкосновения тканей органов с перчатками хирурга и инструментами.
В восстановительный период проводить антибактериальную терапию, чтобы исключить вероятность развития воспаления, присоединения вторичной инфекции.
Еще в рамках профилактики, врачи советуют соблюдать диету и регулярно проходить обследования диагностического характера. Делать УЗИ брюшной полости раз в 6-8 месяцев.
Профилактика зависит от причины возникновения спаек, нередко она сводиться к нормализации образа жизни. Но как таковых мер, предотвращающих развитие спаек, не существует. При соблюдении всех рекомендаций, приеме препаратов, ограничений в еде – спаечный процесс все равно может прогрессировать. По причине неверного проведения оперативного вмешательства.
Поэтому лапароскопия или использование эндоскопа также стоит считать профилактикой спаек. Ведь минимальные вмешательства, отсутствие глубоких разрезов, повреждений, помогает снизить риски. Уменьшить вероятность нарастания соединительных тканей.
Ведь минимальные вмешательства, отсутствие глубоких разрезов, повреждений, помогает снизить риски. Уменьшить вероятность нарастания соединительных тканей.
В рамках профилактики рекомендуется после операции курсом проводить физиотерапевтические процедуры, сочетая их с приемом медикаментов, соблюдением определенных правил питания.
Важно избегать инфекционных заболеваний ЖКТ и репродуктивных органов. Ведь инфекция способна усугубить состояние, привести к образование спаек и развитию других, нежелательных осложнений.
Хотя специфических мер профилактики заболеваний подобного рода не существует, соблюдение рекомендаций врача в постоперационный период поможет снизить существующие риски.
Когда в брюшной полости человека начинает развитие спаечная болезнь, важно не упустить момент. Диагностировать патологические изменения своевременно, принять меры и избежать осложнений, в виде кишечной непроходимости.
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.
Расскажите друзьям! Расскажите об этой статье своим друзьям в любимой социальной сети с помощью социальных кнопок. Спасибо!
Поделиться
Поделиться
Твит
Телеграм
Класс
Вотсап
основные методы терапии и прогноз
Содержание статьи:
Спайки – патологическое состояние, выражающееся в сращении между серозными оболочками внутренних органов брюшной полости. По большей части они представляют собой защитную реакцию на воспалительные процессы в брюшине, возникающие в результате хронических болезней и длительно заживающих механических травм, в том числе хирургических операций. Но бывают и врожденные спайки, вызванные различными аномалиями внутриутробного развития плода. Это явление встречается достаточно часто: спаечные связки диагностируются со временем у каждого десятого человека, перенесшего внутриполостную операцию в области брюшины.
Как образуются спайки в брюшной полости
Механизм образования спаек выглядит следующим образом: при возникновении в брюшной полости воспалительного процесса организм начинает формировать вокруг пораженных органов защитную оболочку из фибрина, стремясь избежать распространения воспаления. «Строительный материал» для этой цели он «добывает» из фибриногена – белка, входящего в состав крови. Это вещество обладает свойством связывать токсины, препятствуя их разрушительному действию. Отграничивая поврежденную ткань от здоровой, оно останавливает развитие воспалительного процесса, выполняя таким образом защитную функцию. Помимо травм и хронических воспалительных процессов, причиной образования спаек в области брюшины может стать:
«Строительный материал» для этой цели он «добывает» из фибриногена – белка, входящего в состав крови. Это вещество обладает свойством связывать токсины, препятствуя их разрушительному действию. Отграничивая поврежденную ткань от здоровой, оно останавливает развитие воспалительного процесса, выполняя таким образом защитную функцию. Помимо травм и хронических воспалительных процессов, причиной образования спаек в области брюшины может стать:
- Кровоизлияние в брюшную полость.
- Инфекция в брюшной полости.
- Вредное воздействие химических веществ.
- Гинекологические заболевания невоспалительного характера – эндометриоз, параметрит и другие.
Небольшие спайки, образовавшиеся в результате незначительных повреждений, рассасываются самостоятельно спустя непродолжительное время после угасания патологического процесса. Если же повреждение имело серьезный характер, в спаечной ткани, помимо фибрина, формируются прочные коллагеновые нити, укрепляющие ее. Постепенно в ней начинают образовываться нервные связи и кровеносные сосуды – она становится практически полноценной тканью, которая не может рассосаться.
Постепенно в ней начинают образовываться нервные связи и кровеносные сосуды – она становится практически полноценной тканью, которая не может рассосаться.
Разросшиеся спайки отрицательно влияют на перистальтику кишечника, препятствуя нормальному движению его петель, и могут стать причиной не только хронических запоров, но и кишечной непроходимости. Такие образования уже нельзя считать безобидными, и для их устранения приходится прибегать к специальной терапии, как консервативной, так и оперативной.
Симптоматика и диагностика
Начинать лечение спаек нужно на ранней стадии, пока они не превратились в прочные тяжи, для удаления которых понадобится хирургического рассечение. Определить наличие спаек брюшины, возникших вследствие хирургического вмешательства, можно по следующим признакам:
- Умеренные тянущие боли, локализующиеся в зоне послеоперационного рубца.
- Нарушение нормальной деятельности кишечника – запоры и поносы, вздутие и метеоризм, не имеющие объяснимых причин.

- Перистальтика кишечника, сопровождаемая звуками бульканья и урчания.
При спайках в органах малого таза боль может иррадиировать не только в низ живота, но и в тазобедренный сустав или поясничный отдел позвоночника. И обращаться с этим симптомом следует не к остеопату, а к полостному хирургу.
Симптоматика спаек имеет много общего с более серьезными заболеваниями органов брюшной полости, поэтому не стоит заниматься самодиагностикой и самолечением – лучше обратиться за помощью к специалисту-хирургу. Врач проводит опрос и внешний осмотр пациента, применяя метод пальпации (ощупывания) живота. Подтвердить или опровергнуть диагноз ему поможет специальное обследование с использованием различных высокотехнологичных методик:
- обзорной рентгенографии брюшной полости;
- гастроскопии;
- колоноскопии;
- лапароскопии;
- ультразвукового исследования брюшной полости;
- рентгеноскопии брюшины с использованием бария;
- ирригоскопии толстой кишки с использованием контрастного вещества;
- исследования с применением радиоактивных изотопов йода.

Убедившись в точности диагноза и определив локализацию, характер и размеры спаек брюшины, врач назначает курс соответствующей терапии. Она может носить как консервативный, так и оперативный характер.
Способы лечения
При незначительных образованиях применяется консервативное лечение спаечного процесса в брюшной полости. Его начинают применять с превентивной целью практически сразу после проведения хирургической операции. Лекарственная терапия в послеоперационный период включает применение фибринолитических препаратов: Фибринолизина, Урокиназы. Для рассасывания недавно образовавшихся спаек назначаются инъекции Лонгидазы, Лидазы, Плазмола. Назначение мягких слабительных средств с целью нормализации стула также помогает предотвратить образование спаек.
Выполнение комплекса специальных упражнений при спаечной болезни брюшной полости – еще один способ предотвратить обострение проблемы. В него входят упражнения на растяжку, на тренировку брюшного пресса, а также методика диафрагмального дыхания. Выполнять их можно начинать сразу после выписки из больницы, естественно, не допуская перенапряжения и дозируя нагрузку в соответствии с самочувствием и физическим состоянием.
Выполнять их можно начинать сразу после выписки из больницы, естественно, не допуская перенапряжения и дозируя нагрузку в соответствии с самочувствием и физическим состоянием.
Народные целители предлагают лечить спайки отварами и настоями трав. Заварив столовую ложку сушеного зверобоя стаканом кипятка и выдержав ее на медленном огне четверть часа, отвар нужно остудить, процедить и выпить в течение дня. Используют с этой целью и листья трехлетнего алоэ. Их нужно 3 дня подержать в холодильнике, затем измельчить, смешать со сливочным маслом и медом в пропорции 1/6/6. Столовую ложку смеси утром и вечером добавить в стакан теплого молока и выпить утром и вечером.
Важная роль в рассасывании и предотвращении образования спаек принадлежит диете. Больному нужно питаться часто и дробно, избегая острых, соленых, жирных и сладких блюд.
Против «старых» спаек консервативные методы лечения бессильны – в этом случае применяется методика малоинвазивной хирургии. Рассечение спаек в брюшной полости выполняется электроскальпелем или радиоволновым ножом, вводимым внутрь через лапароскопический разрез. Для предотвращения рецидива в брюшину вводятся специальные барьерные жидкости.
Рассечение спаек в брюшной полости выполняется электроскальпелем или радиоволновым ножом, вводимым внутрь через лапароскопический разрез. Для предотвращения рецидива в брюшину вводятся специальные барьерные жидкости.
Профилактические меры
Для профилактики образования спаек в брюшной полости необходимо своевременное лечение воспалительных процессов. Нужно вести здоровый образ жизни, активно двигаться, правильно питаться, следить за регулярностью работы кишечника.
После проведения хирургических вмешательств в курс восстановительной терапии следует включить прием фибринолитических препаратов, а также пройти физиотерапевтические процедуры, способствующие рассасыванию спаек и предотвращению образования рубцов: электрофорез, магнитотерапию.
Важно учесть, что при неоднократных полостных операциях риск образования спаек с каждой последующей операцией возрастает.
Спаечная болезнь — виды, причины, симптомы и лечение
Спаечная болезнь – термин, который употребляют для более точного обозначения состояний, в результате развития которых происходит формирование спаек в брюшной полости.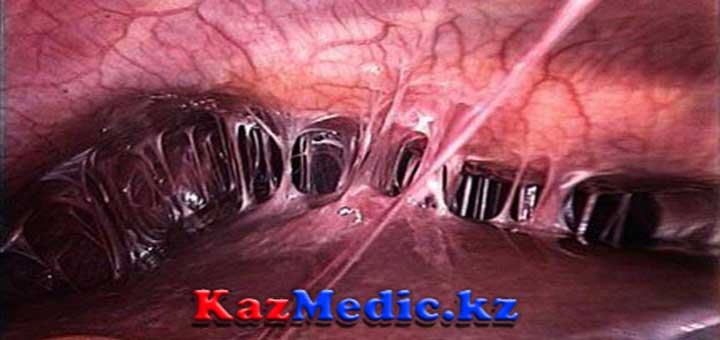 Обычно данная болезнь развивается при ряде воспалительных недугов, травматических повреждениях брюшины, а также после проведённых оперативных вмешательств.
Обычно данная болезнь развивается при ряде воспалительных недугов, травматических повреждениях брюшины, а также после проведённых оперативных вмешательств.
Онлайн консультация по заболеванию «Спаечная болезнь».
Задайте бесплатно вопрос специалистам: Хирург.
При прогрессировании воспалительных недугов в малом тазу, на поверхности брюшины формируется белый клейкий налёт, в состав которого входит фибрин. Сформированная плёнка выполняет важную функцию – она склеивает в очаге соседствующие поверхности. Таким образом, создаётся специфическое препятствие для дальнейшего распространения воспаления.
Как только воспалительный процесс в местах склеивания органов стихнет, могут начать формироваться белесые плёнки. Именно их называют спайками. Основная функция данных тяжей – не дать распространиться воспалению по всей брюшной полости.
Стоит отметить и тот факт, что наличие воспаления в брюшной полости ещё не говорит о том, что это приведёт к формированию спаек.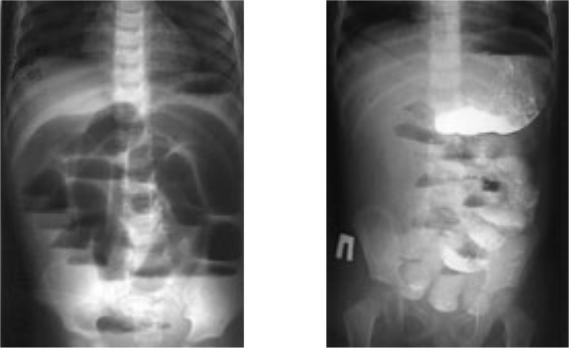 Если своевременно заняться лечением спаечной болезни, то вероятность формирования таких белесых плёнок значительно снизится.
Если своевременно заняться лечением спаечной болезни, то вероятность формирования таких белесых плёнок значительно снизится.
Причин прогрессирования недуга достаточно много, но их связывает один момент – они приводят к травматизации тканей и органов в брюшной полости. Причины формирования спаек можно разделить на 3 группы:
- травматизация брюшной полости;
- воспалительные недуги аппендикса, кишечника, придатков и яйцеводов;
- химические повреждения. К развитию спаечной болезни может привести разрыв жёлчного пузыря, прободение желудка, которое сопровождается выходом в брюшную полость желудочного сока и его содержимого. Также такое заболевание может развиться вследствие ожогов щелочами и кислотами, которые были приняты намеренно или случайно.
Довольно частой причиной прогрессирования спаечной болезни в органах малого таза является наличие хронического воспалительного процесса в органах репродуктивной системы.
Согласно МКБ-10 спайки в брюшной полости делятся на несколько видов:
- брюшные спайки;
- послеоперационные спайки в малом тазу;
- перитонеальные воспалительные спайки в малом тазу.

Спаечная болезнь
Масштабы спаечного процесса в брюшной полости могут быть различными. Могут сформироваться как отдельные тяжи, фиксирующиеся только в двух точках, а может наблюдаться распространение по всей полости. Спаечная болезнь обычно локализуется в зоне, где ранее было проведено хирургическое вмешательство.
Спаечная болезнь бывает:
- острой;
- интермиттирующей;
- хронической.
Симптомы заболевания напрямую зависят от формы патологии, которая прогрессирует у человека. Для острой формы характерно внезапное начало. Появляется выраженный болевой синдром, перистальтика кишечника усиливается, возникает рвота и повышается температура тела. Боль имеет тенденцию к усилению. Если в этот момент провести анализ крови, то в нём будет отмечаться ускорение СОЭ, а также лейкоцитоз.
При нарастании кишечной непроходимости отмечаются такие симптомы:
Для интермиттирующей формы спаечной болезни характерным является периодичность болевых приступов. Болевые ощущения различны по интенсивности. Появляются диспептические расстройства. Часто пациенты с интермиттирующей формой патологии госпитализируются во время усиления указанных симптомов.
Болевые ощущения различны по интенсивности. Появляются диспептические расстройства. Часто пациенты с интермиттирующей формой патологии госпитализируются во время усиления указанных симптомов.
Хроническая форма спаечной болезни в малом тазу или брюшной полости проявляется болезненными ощущениями в животе, постоянным чувством дискомфорта, запорами, а также приступами непроходимости кишечника, которые возникают периодически.
Заподозрить наличие спаечной болезни в малом тазу или брюшной полости можно на основании анамнеза, а также характерных симптомов. Для уточнения диагноза используются как лабораторные, так и инструментальные методики:
Диагностика спаечной болезни в малом тазу у женщин несколько отличается. В этом случае диагностикой занимается врач-гинеколог. Заподозрить наличие патологического процесса в малом тазу можно уже при проведении гинекологического осмотра, а также на основании характерных симптомов. Далее назначаются такие методы исследования:
Стоит отметить важный момент, при диагностике спаечного процесса в малом тазу, лапароскопия является наиболее информативным методом, но если есть подозрение на развитие процесса в брюшной полости, данную процедуру проводить строго запрещено.
Лечение спаечной болезни проводится как консервативными, так и хирургическими методиками. Вариант лечения выбирает врач, после проведения тщательной диагностики, оценки выраженности симптомов, получения результатов анализов.
Консервативные методики используются в том случае, если болезнь не имеет ярко выраженных симптомов. В этом случае рекомендуется диета при спаечной болезни кишечника, а также курсы фитотерапии. Неприятные симптомы недуга можно устранить при помощи народных средств лечения.
Диета при данной патологии подразумевает полный отказ от тяжёлой пищи, а также отказ от приёма продуктов, провоцирующих повышенное газообразование. Показано употреблять кисломолочные продукты, диетическое мясо, отварные или паровые овощи, нежирные бульоны.
Исключают такие продукты:
- виноград;
- мучные изделия;
- цельное молоко;
- приправы;
- бобовые;
- газированные напитки;
- кондитерские изделия.

С целью рассасывания спаек назначаются инъекционные препараты:
- спленин;
- экстракт алоэ;
- стекловидное тело;
- ферменты.
Если же симптомы патологии усиливаются и доставляют больному сильные страдания, то врач может принять решение о проведении хирургического вмешательства. Сейчас широко используются современные малоинвазивные методы оперативного вмешательства:
- лапароскопия;
- электроскопия;
- лазеротерапия;
- аквадиссекция.
Поделиться статьей:
Все ли корректно в статье с медицинской точки зрения?
Ответьте только в том случае, если у вас есть подтвержденные медицинские знания
Что это такое, симптомы, лечение
Что такое спайки брюшной полости?
Спайки брюшной полости — это полосы рубцовой ткани, которые образуются между органами брюшной полости, в основном тонкой кишкой. Спайки возникают после абдоминальной хирургии и могут привести к слипанию тканей, хотя обычно они просто перемещаются свободно.
Спайки возникают после абдоминальной хирургии и могут привести к слипанию тканей, хотя обычно они просто перемещаются свободно.
Что такое брюшная полость?
Брюшная полость — это внутренняя часть тела от груди до бедер. Он содержит:
- Пищеварительная система, включая желудок и кишечник.
- Женские репродуктивные органы.
- Почки и надпочечники.
- Печень
- Поджелудочная железа.
- Селезенка.
Что вызывает спайки в брюшной полости?
Спайки возникают после абдоминальных операций, особенно между петлями тонкой кишки.
Какие симптомы?
Большинство спаек не вызывают никаких симптомов. Однако иногда спайки брюшной полости могут вызывать перекручивание кишечника, подобно тому, как может перекручиваться садовый шланг.Это состояние может возникнуть вскоре после или даже через несколько лет после операции и может привести к полной или частичной кишечной непроходимости, также называемой непроходимостью тонкого кишечника.
При наличии препятствий пища, жидкость, воздух и отходы не могут проходить через тело. Вы можете заметить такие знаки, как:
- Сильная боль в животе.
- Вздутие живота.
- Тошнота и рвота.
Далее: Диагностика и тесты
Последний раз проверял медицинский работник Cleveland Clinic 20.10.2020.
Ссылки
Получите полезную, полезную и актуальную информацию о здоровье и благополучии
е Новости
Клиника Кливленда — некоммерческий академический медицинский центр.Реклама на нашем сайте помогает поддерживать нашу миссию. Мы не поддерживаем продукты или услуги, не принадлежащие Cleveland Clinic.
Политика
Лечение спаек брюшной полости (спаек в области живота) в Монтекатини Терме, Италия
Спаечная болезнь характеризуется образованием соединительнотканных тяжей (спаек) между брюшиной и внутренними органами.Спайки в большинстве случаев образуются после операции. Симптомы зависят от расположения спаек, заболевание может протекать бессимптомно или проявляться внезапно и остро, требуя срочной госпитализации в хирургическое отделение. Острые состояния обычно возникают из-за непроходимости кишечника, симптомами которой являются сильная боль, тошнота, рвота, жар, запор или диарея. Частые приступы рвоты вызывают обезвоживание, которое дополняется снижением артериального давления, слабостью и постоянной утомляемостью.Спаечная болезнь лечится консервативно, подавляется болевой синдром, предотвращается образование новых спаек. В экстренных случаях, при регулярных рецидивах и обострениях показано хирургическое вмешательство.
Служба поддержки клиентов
Не знаете, по каким критериям выбрать курорт или спа-отель?
Не умеете бронировать?
Позвоните нам, и наша служба поддержки поможет вам.
часто задаваемые вопросы
Починская Марина
Руководитель службы поддержки
Консультация врача
Бесплатная помощь врача санатория
Если у вас возникли трудности с выбором санатория или санаторно-курортного отеля, подходящего для лечения ваших заболеваний, воспользуйтесь бесплатной консультацией санаторно-курортного врача Елены Хорошевой.
Отправьте свой вопрос здесь
Хорошева Елена
Главный врач sanatoriums.com
Лечение спаек брюшной полости (спаек в области живота) во Франтишковых Лазнях, Чехия
Спаечная болезнь характеризуется образованием соединительнотканных тяжей (спаек) между брюшиной и внутренними органами.Спайки в большинстве случаев образуются после операции. Симптомы зависят от расположения спаек, заболевание может протекать бессимптомно или проявляться внезапно и остро, требуя срочной госпитализации в хирургическое отделение. Острые состояния обычно возникают из-за непроходимости кишечника, симптомами которой являются сильная боль, тошнота, рвота, жар, запор или диарея. Частые приступы рвоты вызывают обезвоживание, которое дополняется снижением артериального давления, слабостью и постоянной утомляемостью.Спаечная болезнь лечится консервативно, подавляется болевой синдром, предотвращается образование новых спаек. В экстренных случаях, при регулярных рецидивах и обострениях показано хирургическое вмешательство.
Лучшие спа-отели во Франтишковых Лазнях по качеству лечения
Спа Отель Киев
3 *
От 58 € за 1 день
полный пансион и лечение
9,0 /10
Спа Отель Харви
4 *
От 45 € за 1 день
полный пансион и лечение
8,2 /10
Спа-отель Dr.Адлер
3 *
От 58 € за 1 день
полный пансион и лечение
8,5 /10
Спа-отель Бельведер
3 *
От 64 € за 1 день
полный пансион и лечение
8,1 /10
Спа Отель Империал
4 *
От 82 € за 1 день
полный пансион и лечение
8,2 /10
Спа Отель Павлик-Аквафорум
4 *
От 80 € за 1 день
полный пансион и лечение
7,4 /10
Показать все спа-отели в городе Франтишковы Лазне
Служба поддержки клиентов
Не знаете, по каким критериям выбрать курорт или спа-отель?
Не умеете бронировать?
Позвоните нам, и наша служба поддержки поможет вам.
часто задаваемые вопросы
Починская Марина
Руководитель службы поддержки
Консультация врача
Бесплатная помощь врача санатория
Если у вас возникли трудности с выбором санатория или санаторно-курортного отеля, подходящего для лечения ваших заболеваний, воспользуйтесь бесплатной консультацией санаторно-курортного врача Елены Хорошевой.
Отправьте свой вопрос здесь
Хорошева Елена
Главный врач sanatoriums.com
Влияние эмодина на предотвращение послеоперационных внутрибрюшных спаек
Предпосылки .Послеоперационные внутрибрюшные спайки — серьезное осложнение после абдоминальной хирургии. Хотя для предотвращения и лечения спаек использовались различные методы, эффекты не были удовлетворительными. Эмодин, производное антрахинона природного происхождения и активный ингредиент традиционных китайских трав, проявляет различные фармакологические эффекты. В нашем исследовании мы продемонстрировали влияние лечения эмодином на предотвращение образования послеоперационных спаек. Материалы и методы .Всего 48 крыс были разделены на шесть групп. Спайки брюшной полости образовывались в результате истирания слепой кишки и ее противоположной брюшной стенки. В опытных группах крысам ежедневно вводили перорально эмодин. На седьмой день после операции крыс умерщвляли, собирали кровь и патологические образцы. Образование спаек в брюшной полости оценивали с помощью аутопсии, патологии, иммуногистохимии, вестерн-блоттинга и иммуноферментного анализа. Результатов .Спайки в брюшной полости были заметно уменьшены при лечении эмодином. По сравнению с контрольной группой отложение коллагена было уменьшено, а степень полноты мезотелиальной полноты брюшины была выше в группах, получавших эмодин. Эмодин обладал противовоспалительным действием, уменьшал окислительный стресс и способствовал движению кишечного тракта (). Заключение . Эмодин значительно уменьшал образование внутрибрюшных спаек на модели крыс.
1. Введение
Образование внутрибрюшных спаек — серьезное осложнение после абдоминальной хирургии.Риск развития внутрибрюшинных спаек после лапаротомии у пациентов составляет 90–95% [1, 2], что является одним из самых серьезных осложнений после хирургического вмешательства на желудочно-кишечном тракте. Спайки брюшины могут вызывать различные проблемы, такие как непроходимость тонкой кишки, женское бесплодие, хронические боли в животе и повышенные трудности во время повторной операции, все это сильно влияет на качество жизни и увеличивает медицинские расходы [3–5]. Стратегии лечения и профилактики спаек можно разделить на четыре категории: общие принципы, хирургические методы, химические агенты и механические барьеры [6, 7].Несмотря на то, что для предотвращения образования спаек применялось несколько методов, «золотой стандарт» лечения еще не определен, и хирургам все еще необходимо искать более эффективные методы профилактики и лечения послеоперационных спаек брюшной полости [8].
Формирование спаек в брюшной полости — сложный процесс, который включает воспаление, ангиогенез, фибринолиз, восстановление ткани брюшины и другие биохимические процессы [4, 9–11]. Когда травма или травма происходит в брюшной полости, возникает ишемия локальной области, и в течение нескольких минут активируются каскады воспалительного процесса и коагуляции.Воспалительные клетки, такие как нейтрофилы и макрофаги, и клетки восстановления тканей будут мигрировать в поврежденную область, а свернувшаяся кровь образует фибриновую сетку [12, 13]. Затем, примерно через 24 часа, мезотелий начнет расти, за ним следует пролиферация фибробластов на 3-й день и ангиогенез на 5-й день. Если брюшина восстанавливается хорошо и фибриновая сетка абсорбируется, спаечные процессы очень незначительны; в противном случае образуются спайки брюшной полости [2, 4]. Фибробласты и воспалительная система играют важную роль в механизме формирования абдоминальных спаек [2, 14, 15].Кишечные движения также играют важную роль в формировании спаек брюшной полости [16]. Раннее движение кишечника разрушает фибриновые мостики и препятствует инвазии фибробластов в адгезивные ткани. Кроме того, мобилизация способствует фибринолизу за счет увеличения движения жидкости и обмена метаболитов в брюшине [16, 17].
Эмодин (1,3,8-тригидрокси-6-метилантрахинон) является производным антрахинона природного происхождения и активным ингредиентом традиционных китайских трав, включая Rheum palmatum , Polygonum cuspidatum , Polygonum multiflorum , Aloe vera и Cassia obtusifolia .Эмодин демонстрирует множество фармакологических преимуществ в фармакологических исследованиях [18]. Согласно предыдущим исследованиям [18–21], эмодин продемонстрировал различные эффекты, включая противовирусное, антибактериальное, антиаллергическое, антиостеопоротическое, противодиабетическое, противовоспалительное и противоопухолевое действие, а также может снижать окислительный стресс. Более того, эмодин может уменьшать отложение коллагена при панкреатите и повреждениях легких и подавлять сигнальный путь TGF- β при многих раковых заболеваниях человека [20, 22].Как слабительное средство в традиционных китайских травах [23], основным действием эмодина является стимуляция кишечного движения. Поскольку воспаление, отложение коллагена, окислительный стресс и движение кишечника играют важную роль в формировании послеоперационных внутрибрюшных спаек, мы предположили, что эмодин может уменьшить образование послеоперационных спаек. В этом исследовании мы намеревались продемонстрировать, что эмодин может предотвращать послеоперационное образование спаек брюшной полости.
2. Материалы и методы
2.1. Животные и химические вещества
Всего 48 крыс линии Sprague-Dawley весом от 200 до 250 г были приобретены в Центре экспериментальных животных Сианьского университета Цзяотун. С животными обращались гуманно в соответствии с Хельсинкской декларацией. Все животные получали ad libitum коммерческую диету и имели постоянный доступ к пресной воде. Животных содержали в стандартных лабораторных условиях при температуре 22 ± 2 ° C. Этот эксперимент был проведен в лаборатории экспериментальных исследований Сианьского университета Цзяотун с согласия Комитета по этике экспериментальных животных [24].
Эмодин (PubChem CID: 10207) был приобретен у Sigma-Aldrich Co. LLC® (Сент-Луис, Миссури) и растворен в 0,5% натрий карбоксиметилцеллюлозе (0,5% CMC-Na®; Henan Qianzhi Company, Хэнань, Китай ) при разных концентрациях [25].
2.2. Дизайн исследования и хирургическая процедура
Все крысы голодали, и за день до операции удалили шерсть на их животе. Крысы были поровну разделены на шесть групп. Животных глубоко анестезировали внутрибрюшинной инъекцией 50 мг / кг барбитала натрия (Guidechem, Шанхай, Китай), а кожу живота дезинфицировали повидон-йодом перед операцией.Как описано ранее [3, 26, 27], делали вертикальный разрез по средней линии (длиной 2-3 см), за исключением животных с предшествующим образованием внутрибрюшных спаек. За исключением группы ложной операции, переднюю поверхность каждой слепой кишки соскребали мягким тампоном 40 раз, что вызывало легкое серозное кровоизлияние, приводящее к образованию поверхностных повреждений на площади примерно 1,5 см × 1,5 см. Таким же образом обрабатывали брюшную стенку крысы, противоположную поцарапанной слепой кишке. Перед закрытием брюшной полости слепую кишку помещали в исходное положение напротив раненой брюшной стенки в полном контакте друг с другом.В группе ложной операции крысы не подвергались процедуре формирования спаек брюшной полости. В группе гиалуроната натрия 2 мл геля гиалуроната медицинского назначения (Qingdao Haitao Biochemical Co. Ltd., Циндао, Китай) наносили мазком на истираемую область перед закрытием брюшной полости. Брюшную полость закрыли в два слоя с помощью узловых швов Vicryl® 3-0. После операции крысам трех экспериментальных групп перорально вводили 20 (группа с низкой дозой), 40 (группа со средней дозой) или 80 (группа с высокой дозой) мг / кг эмодина ежедневно.Группе фиктивных операций и контрольной группе перорально вводили одинаковое количество 0,5% CMC-Na один раз в день в течение одной недели.
2.3. Классификация и оценка адгезии
Через неделю после операции всех животных анестезировали, как описано ранее, и выполняли обратный U-образный разрез для оценки спаек. Образование адгезии было измерено двумя независимыми исследователями, которые не знали протокола исследования, в соответствии с методом, описанным Hoffmann et al. [28] и Лаудер и др.[29]. Схема оценки Хоффмана учитывает количество, силу и распределение спаек. Схемы Лаудера были измерены и выражены в процентах от общей площади деперитонеализированной поверхности [7] (дополнительные таблицы, доступные на сайте https://doi.org/10.1155/2017/1740317). После того, как была проведена оценка адгезии, ткани и сыворотка крови были собраны для следующих экспериментов.
2.4. Гистопатологическая оценка
Окрашивание гематоксилином и эозином использовали для оценки воспаления и состояния фибрилляции.После 24 часов фиксации адгезионные ткани поврежденной стенки слепой кишки и париетальной брюшины заливали парафином, а затем разрезали на серийные парафиновые срезы толщиной 4 мкм и мкм. Часть парафиновых срезов окрашивали гематоксилином и эозином для наблюдения за морфологией и условиями адгезии тканей. Гистопатологические оценки фиброза и воспаления проводились с помощью световой микроскопии. Окрашенные срезы оценивали два патолога из отделения патологии Первой дочерней больницы Сианьского университета Цзяотун, которые не знали об экспериментальных группах.По крайней мере, пять случайно выбранных мощных полей были проанализированы для каждого раздела, и по крайней мере четыре секции на крысу были оценены и классифицированы с использованием системы оценок, описанной в дополнительной таблице [30, 31].
2,5. Окрашивание по Массону для осаждения коллагена
Подмножество парафиновых срезов использовали для окрашивания по Массону для наблюдения за содержанием коллагена. Парафиновые срезы окрашивали с использованием набора для окрашивания Masson (Bogoo Biotechnology Co. Ltd., Шанхай, Китай) в соответствии с инструкциями производителя.Процент положительного окрашивания оценивали с помощью программного обеспечения Image-Pro Plus 5.0 (Leica Qwin Plus, Leica Microsystem Imaging Solutions Ltd., Кембридж, Великобритания). Для измерения средней толщины коллагена в адгезивных тканях были случайным образом выбраны восемь микроскопических полей.
2.6. Иммуногистохимическое окрашивание
Иммуногистохимическое окрашивание использовали для оценки отложения коллагена ( α -SMA, MMP-9), заживления мезотелиальных клеток (CK-18) и динамики желудочно-кишечного тракта (C-kit) и проводили с использованием набора стрептавидин-биотин. (Максим, Фучжоу, Китай) в соответствии с инструкциями производителя.Срезы депарафинизировали и регидратировали, инкубировали с раствором перекиси водорода 30 г / л при комнатной температуре в течение 5 минут и блокировали козьей сывороткой. Затем срезы инкубировали с мышиным антикрысиным α -актином гладких мышц ( α -SMA; разведение 1: 100, Santa Cruz Biotechnology, Даллас, Техас, США), рецептором тирозинкиназы (C-kit; 1 : Разведение 100, Abcam, Великобритания), цитокератин-18 (CK-18; разведение 1:50, Abcam, Великобритания) и антитела к матриксной металлопротеиназе-9 (MMP-9; разведение 1: 100, Abcam) при 4 ° C в течение ночи. .Затем срезы инкубировали с биотинилированным кроличьим антимышиным IgG в течение 20 минут. Инкубацию с комплексом стрептавидин-биотинпероксидаза при 37 ° C проводили в течение еще 20 минут. Срезы промывали фосфатно-солевым буфером четыре раза по 5 минут на каждую промывку. Для визуализации использовали тетрагидрохлорид диаминобензидина, а в качестве контрастного красителя — гематоксилин. Секции были обезвожены, смонтированы и герметизированы. Чтобы оценить выражение этих показателей, по крайней мере пять случайных полей адгезии с высоким увеличением были рассмотрены для каждого раздела, как описано в гистопатологической оценке.Затем окраску СК-18 использовали для оценки степени полноты мезотелиальных клеток. Скорость рассчитывалась путем деления длины окрашенных мезотелиальных клеток в адгезионной ткани на общую длину мезотелиальных клеток в выбранных полях. Система оценки α -SMA, C-kit и MMP-9 выглядит следующим образом: 0 — нет экспрессии, 1 — низкая экспрессия, 2 — умеренная экспрессия, 3 — сильная экспрессия и 4 — очень сильная экспрессия. Состояние экспрессии в адгезивной ткани рассчитывали как среднюю оценку исследуемых срезов.
2.7. Вестерн-блот
Вестерн-блот проводился в соответствии с предыдущими исследованиями [24, 32] для оценки воспаления (ЦОГ-2) и отложения коллагена ( α -SMA, MMP-9) для дальнейшего определения механизма действия эмодина (SMAD3). Буфер для лизиса белка млекопитающих (Thermo Fisher Scientific, Waltham, MA, USA) использовали для экстракции общего тканевого белка. Такие же количества белка подвергали электрофорезу в геле додецилсульфата натрия и полиакриламидного геля и затем переносили на мембраны из поливинилиденфторида (EMD Millipore, Billerica, MA, USA).Мембраны инкубировали в разбавленных первичных антителах в течение ночи и хранили при 4 ° C. Первичные антитела представляли собой антитело против COX-2 (Санта-Крус, разведение 1: 200), антитело против SMAD3 (Санта-Крус, разведение 1: 500), антитело против α -SMA (Санта-Крус, разведение 1: 200). ) и антитела против бета-актина ( β -актин) (Santa Cruz, разведение 1: 1000). Мембраны инкубировали со вторичным антителом, а затем с пероксидазой хрена (HRP; Santa Cruz). Затем для обнаружения полос была использована система усиленной хемилюминесценции (EMD Millipore).Интенсивность полос рассчитывали с использованием программного обеспечения Image-Pro Plus 5.0 (Media Cybernetics Inc., Роквилл, Мэриленд, США).
2,8. Иммуноферментный анализ (ИФА)
Интерлейкин-6 (ИЛ-6) и трансформирующий фактор роста- β 1 (TGF- β 1) (индикаторы воспаления), а также гастрин и мотилин (индикаторы желудочно-кишечного тракта). динамика) измеряли в крови, взятой через 7 дней после операции. В соответствии с протоколами производителей использовали четыре коммерческих набора ELISA (все от Meilian Biology, Шанхай, Китай) для IL-6, TGF- β 1, гастрина и мотилина.Концентрации образцов рассчитывали с использованием стандартной кривой. Уровни оцениваемых показателей выражаются в пикограммах на миллиграмм белка.
2.9. Тест хемилюминесценции для активных форм кислорода
Как сообщалось ранее [33], активные формы кислорода (ROS) были измерены в жидкости перитонеального лаважа через 7 дней после операции. Жидкости для лаважа собирали перед открытием брюшной полости. Коммерческий набор для обнаружения ROS (Sinovac Biochemical Reagents, Шанхай, Китай) использовали в соответствии с протоколом производителя.Концентрации образцов рассчитывали с использованием стандартной кривой.
2.10. Эксперимент по динамике желудочно-кишечного тракта
Для определения состояния динамики желудочно-кишечного тракта в различных группах был проведен тест на выталкивание чернил. Всем крысам вводили 2 мл чернил, состоящих из 5% углеродного порошка и 0,5% суспензии CMC-Na, через желудочный зонд за 30 минут до второй лапаротомии. После оценки состояния спаек из брюшной полости удалили всю тонкую кишку.Затем разрезали тонкий кишечник по антимезентериальной стороне. Затем мы измерили общую длину от дистального отдела желудка до илеоцекального соединения и длину от привратника до самой дальней точки, которой достиг углеродный порошок. Скорость движения кишечника рассчитывалась с использованием следующего уравнения: скорость движения кишечника (%) = длина движения углеродного порошка / общая длина тонкой кишки × 100%.
2.11. Статистический анализ
Все данные были проанализированы с помощью SPSS18.0 (Чикаго, Иллинойс, США) и представлены как средние ± стандартная ошибка среднего (SEM). Дисперсионный анализ (ANOVA) был проведен для определения значимых различий в нормально распределенных данных, а аномально распределенные данные были проанализированы с помощью теста Краскела-Уоллиса. Данные подсчета были определены с помощью точного теста Фишера. значения <0,05 считались значимыми.
3. Результаты
3.1. Общие наблюдения показывают, что лечение эмодином уменьшило спаек в брюшной полости
Ни одно животное не погибло во время операции или послеоперационного лечения; Таким образом, исследование завершили всего 48 крыс.Перед второй лапаротомией раневых инфекций и разрывов не было.
Чтобы изучить влияние эмодина на предотвращение образования спаек после операции, мы сначала оценили образование спаек, используя систему баллов, как описано ранее, когда брюшная полость была открыта через 7 дней после операции (рис. 1 (а)). Между группами наблюдались существенные различия, и лечение эмодином значительно уменьшило спаечные процессы, особенно в группе, получавшей высокие дозы эмодина () (Рисунки 1 (b) и 1 (c); и, соответственно.). Кроме того, самые высокие показатели отсутствия адгезии были обнаружены в группах фиктивной операции и высоких доз эмодина () (рис. 1 (d)). Таким образом, наши общие наблюдения показывают, что эмодин эффективно снижает образование внутрибрюшных спаек.
Эндотелий как потенциальная мишень для лечения аневризмы брюшной аорты
Ранее считалось, что аневризма брюшной аорты (ААА) ослабляет дефектные медиальные артериальные / адвентициальные слои, например, клетки гладких мышц / фибробластов. Следовательно, помимо хирургического вмешательства, лекарственные препараты, нацеленные на медиальный слой для укрепления стенки аорты, являются наиболее подходящей стратегией лечения АБА.Однако до сих пор неясно, оказывают ли такие препараты какое-либо положительное влияние на прогноз ААА, скорость роста, разрыва аневризмы или выживаемость. Примечательно, что клинические исследования показали, что ААА тесно связана с эндотелиальной дисфункцией у пожилых людей. Кроме того, животные модели эндотелиальной дисфункции и разобщения эндотелиальной синтазы оксида азота (eNOS) имели очень высокую скорость образования ААА, что указывает на критическое участие эндотелия и возможное фармакологическое решение, направленное на эндотелий, при лечении ААА.Было обнаружено, что эндотелиальные клетки запускают ремоделирование сосудистой стенки путем высвобождения протеаз или рекрутирования макрофагов вместе с другими нейтрофилами в медиальный слой. Более того, воспаление и окислительный стресс артериальной стенки были вызваны эндотелиальной дисфункцией. Интересно, что существует парадоксальная дифференциальная корреляция между диабетом и образованием аневризмы в капиллярах сетчатки и аорте. Расшифровка значимости такой разницы может объяснить текущие безуспешные приемы лечения AAA и предложить решение этой проблемы лечения.В настоящее время считается, что ААА и атеросклероз — это два отдельных, но связанных заболевания, основанных на их различных клинических паттернах, которые еще больше усложнили загадку. Следовательно, тщательное исследование взаимодействия между эндотелием и медиальным / адвентициальным слоем может дать нам лучшее понимание и новый взгляд на формирование AAA, особенно после учета важности эндотелия в развитии AAA. Более того, с помощью этого анализа можно получить информацию о новой стратегии лечения, заменяющей используемые в настоящее время, но не оптимальные методы лечения AAA.
1. Введение
По определению, аневризма — это расширение артерии до диаметра, по крайней мере, на 50% превышающего ее нормальный размер. В целом аневризмы аорты анатомически делятся на аневризмы грудной аорты (TAA) и аневризмы брюшной аорты (AAA), включая аневризмы надпочечников и инфраренальной аорты. Заболеваемость TAA каждый год колебалась от 6 на 100 000 в британском исследовании [1] до 9,1 / 16,3 (F / M) на 100 000 в Швеции и 17,39 / 21,75 (F / M) в Испании [2, 3]. Подсчитано, что три четверти всех аневризм возникают в брюшной аорте.Ежегодная частота аневризмы брюшной аорты составляет 40 случаев на 100 000 населения [4]. Болеют в шесть раз больше мужчин, чем женщин [4, 5]. У пожилых мужчин общий диаметр инфраренального отдела брюшной аорты составляет около 15–24 мм. Если диаметр превышает 30 мм, обычно более чем на два стандартных отклонения выше среднего диаметра как для мужчин, так и для женщин, это состояние принято рассматривать как АБА [6–8]. Опрос в Великобритании показал, что 1,5% населения имеют размер AAA> 30 мм [9]. Многоцентровое скрининговое исследование аневризмы в США показало, что 4.6% населения в возрасте от 65 до 74 лет имели АБА [10]. Распространенность АБА среди мужчин старше 65 лет в Швеции составила 1,8% [11]. Мета-анализ коллекции международных исследований показал, что AAA у мужчин и женщин составляет около 6% и 1,6% соответственно [12]. Предполагается, что AAA чаще встречается в клинике, чем TAA. В последние годы заболеваемость АБА имеет тенденцию к росту по мере старения населения. Более того, по сравнению с TAA, AAA имеет более высокую заболеваемость и представляет большую опасность для населения из-за более высоких темпов роста [8].
Разрыв аневризмы — наиболее серьезное последствие АБА. Часто наличие AAA неизвестно до разрыва, который быстро прогрессирует до обескровливания и смерти. Общая летальность при разрыве АБА достигает 90%; Таким образом, идеальным лечением является восстановление аневризмы до ее разрыва. Однако многие аневризмы не достигают хирургических показаний, когда они впервые обнаруживаются, но их размер будет увеличиваться с каждым годом. Диаметр кровеносного сосуда сильно коррелирует с более высоким риском разрыва.Считается, что риск разрыва АБА размером более 6 см составляет 26% [13]. Следовательно, AAA называют «тихо тикающей бомбой замедленного действия» в теле [14].
2. Анатомия брюшной аорты отличается от грудной аорты
Грудная и брюшная аорты имеют структурные различия в количестве пластинчатых единиц, которые колеблются от 55–60 единиц и 28–32 единиц соответственно [15]. Клетки из разных сегментов аорты имеют четкое различие в своем происхождении, в том числе из нервного гребня, мезенхимы и чревной мезодермы, которые соответствуют разным сегментам.Более того, предшественники клеток нервного гребня грудной аорты по-разному реагируют на различные цитокины и факторы роста, чем мезодермальные предшественники брюшной аорты [16]. Региональные различия между грудной и брюшной аортами приводят к разным клеточным ответам на одни и те же стимулы. Например, брюшная аорта подвержена атерогенезу в отличие от ее грудного аналога [17]. Более того, было продемонстрировано, что мутации в рецепторе трансформирующего фактора роста- β (TGF- β ) могут приводить к TAA, но мало влияют на брюшную аорту [18].Это может быть объяснено дифференциальной функцией воспалительных путей или TGF- β между участками сосудов. Примечательно, что медиальный слой в брюшной аорте обычно полностью бессосудистый, тогда как медиальный слой в грудной аорте содержит vasa vasorum [15]. Следовательно, медиальный слой брюшной аорты более подвержен гипоксии, чем грудная аорта. Гипоксия наблюдается в интиме и средах поражения AAA, потому что внутрипросветный тромб в сосудистых поражениях может препятствовать перфузии кислорода в просвете, что способствует гипоксии в интиме [19].Кроме того, было показано, что артериосклероз и гиперплазия интимы вызывают стеноз адвентициального vasa vasorum, который усугубляет гипоксию ткани в брюшной аорте [20].
3. Патологические механизмы AAA
Хотя дилатация аневризмы брюшной аорты вызвана различной этиологией, ведущей к сложному патогенезу, гистопатологические результаты всегда схожи; например, есть дегенерации в основном в средней части и адвентиции стенки аорты. Как правило, возникновение аневризмы аорты связано с дефектами и повреждениями стенки аорты, вызванными воспалением, окислительным стрессом, активацией матриксных металлопротеиназ (ММР) и апоптозом гладкомышечных клеток сосудов (VSMC).В частности, воспалительные клетки инфильтрируют в среду и адвентицию из-за аутоиммунной реакции с внешними антигенами, вызывая окислительный стресс и избыточную продукцию цитокинов / хемокинов и протеаз. Этот процесс приводит к разрушению эластичных волокон, разрушению коллагеновых волокон и потере VSMC (рис. 1). В результате стенка аорты ослабляется из-за уменьшения толщины и снижения механической функции. В конце концов, стенка аорты не может выдержать воздействия кровотока и расширяется с образованием ААА.
4. Генетика и AAA
Расширение брюшной аорты является результатом как экологических, так и генетических факторов. У несовершеннолетних аневризма грудной аорты, в частности, всегда является прямым следствием мутаций в ключевых генах, таких как FBN1 , COL3A1 , ACTA2 и TGFBR1 / 2 , которые вызывают структурные дефекты стенки сосудов [21]. Однако в предыдущих исследованиях было высказано предположение, что ААА — это многофакторное заболевание, в которое вовлечены многие гены и пути, такие как внеклеточный матрикс (ЕСМ), воспаление, иммунитет, окислительный стресс, передача сигналов клеток, рост клеток и выживание клеток.Среди них генетика по-прежнему играет ключевую роль в развитии и формировании AAA, поскольку риски выше у пациентов с семейным анамнезом AAA, чем без него [22]. Недавно было проведено секвенирование экзома для изучения возможных вариантов генов-кандидатов путем сравнения образцов ткани ДНК от пациентов с AAA и нормальной контрольной группы, в которых мутации в 25 генах, как было обнаружено, были связаны с образованием AAA. Однако ассоциативные исследования не могут подтвердить причинные факторы AAA, которые все еще плохо изучены [22].Среди них была идентифицирована миссенс-мутация ESRRA (эстроген-связанный рецептор альфа), регулятор фактора роста эндотелия сосудов (VEGF) [23]. Следовательно, есть генетические доказательства участия эндотелия в формировании AAA.
5. Атеросклероз и AAA
Инфраренальная брюшная аорта связана с развитием атеросклероза и по совпадению является наиболее частым местом формирования аневризмы брюшной полости. Ранее считалось, что атеросклероз является основным патологическим процессом, приводящим к образованию ААА.Это мнение было основано на выводах о том, что пациенты с AAA часто имеют сопутствующий атеросклероз [24]. Однако было высказано предположение, что образование аневризмы и атеросклероз развиваются не параллельно, а независимо друг от друга через разные патогенные механизмы [24]. Например, просвет сужается при атеросклерозе, но увеличивается при АБА; диабет провоцирует атеросклероз, но защищает от ААА; и пролиферация SMC происходит при атеросклерозе, но апоптоз SMC происходит при AAA. Таким образом, ААА и атеросклероз теперь рассматриваются как два отдельных, но связанных заболевания.Действительно, атеросклероз и ААА имеют некоторые общие факторы риска, такие как оба тесно связаны с эндотелиальной дисфункцией [24].
6. Доказательства эндотелиальной дисфункции при AAA на животных.
Обычно считается, что рецептор, вызывающий клеточный ответ на повышение напряжения в стенке аорты, продуцируемый Ang II, происходит в медиальном слое, а не в эндотелии. Напротив, специфическая для эндотелиальных клеток недостаточность рецепторов Ang II типа 1a заметно ослабляет развитие Ang II-индуцированных аневризм аорты у мышей с рецептором LDL — / — , но дефицит рецептора Ang II типа 1a в VSMC не оказывал такого влияния на развитие аневризм [25].Более того, Franck et al. продемонстрировали, что восстановление эндотелиальной выстилки является эффективной терапией для контроля динамики ААА и остановки распространения ААА [26].
Постепенно эндотелий привлек внимание исследователей AAA. Эндотелиальные клетки представляют собой однослойный плоский эпителий, выстилающий просвет сосуда, и участвуют во многих физиологических процессах для поддержания нормальной структуры и функции стенки сосуда. В стенке артерии эндотелиальные клетки секретируют различные вещества, которые влияют на функцию других клеток, включая гладкомышечные клетки, лейкоциты и так далее, чтобы инициировать серию критических атак на среду и адвентициальные слои.Патологические изменения эндотелиальных клеток или эндотелиальная дисфункция возможны раньше, чем изменения медиа и адвентиции в процессе формирования ААА.
Дефицит eNOS увеличивает атеросклероз и AAA у мышей apoE (- / -) без изменения артериального кровяного давления, массы тела, концентрации холестерина в сыворотке или распределения холестерина липопротеинов [27, 28]. Более того, у мышей с инфузией Ang II избыточная экспрессия ароЕ (- / -) или PCSK9 индуцируется гиперхолестеринемией и ААА [29].Эндотелиальная функция регулируется биодоступностью NO, продукция которой модулируется экспрессией eNOS и статусом связывания. Однако разобщение eNOS приводит к эндотелиальной дисфункции, вызывая чрезмерный окислительный стресс в эндотелиальных клетках, который вызывает вредный окислительный / нитрозативный стресс в местных клетках.
Статус связывания eNOS определяется его кофактором тетрагидробиоптерином (HB 4 ), производство которого регулируется путем синтеза de novo (ключевым ферментом является GTP-циклогидроксилаза 1 (GCh2)) и путем восстановления (ключевой фермент дигидрофолатредуктаза (DHFR)).Сообщалось, что модель мыши (hph2) с дефицитом HB 4 из-за мутации GCh2 была охарактеризована как имеющая разобщение eNOS и эндотелиальную дисфункцию, что привело к высокому риску AAA при инфузии Ang II [30]. Взаимосвязь eNOS с добавкой HB 4 или лечением фолиевой кислотой предотвращала образование ААА или снижала такой риск [30]. Более того, уровни h5B в сыворотке и аорте тесно коррелируют, при этом оба они снижаются с развитием AAA, но повышаются при лечении фолиевой кислотой у мышей hph2 или апоЕ (- / -), инфузированных Ang II, что позволяет предположить, что сывороточный h5B может использоваться в качестве биомаркера для Оценка развития и лечения AAA [31].Кроме того, Cai et al. сообщили, что животные, обладающие двойной мутацией hph2 и NOX1, NOX2, p47phox или NOX4, снизили частоту ААА и расширение брюшной аорты после инфузии Ang II из-за снижения продукции супероксида, а также улучшили биодоступность NO и h5B и восстановили активность связывания eNOS. по сравнению с мышами hph2. Эти изменения сохранили функцию DHFR в эндотелии [32].
7. Клинические доказательства участия эндотелия в AAA
Клиническое исследование продемонстрировало, что циркулирующие биомаркеры эндотелиальной дисфункции у пациентов с атеросклерозом (количество лейкоцитов, фибриноген, D-димер, тропонин T, N-концевой продольный натрийуретический пептид, и высокочувствительный С-реактивный белок) также тесно связаны с возникновением и частотой возникновения ААА [33].Эпидемиологические исследования показывают, что факторы риска ААА, такие как старение, курение, мужской пол, высокое кровяное давление, гиперлипидемия, атеросклероз и гипергомоцистеинемия, являются основными факторами, вызывающими повреждение эндотелиальных клеток, ведущее к эндотелиальной дисфункции [34–36]. Например, распространенность ААА среди курящих в четыре раза выше, чем среди некурящих, что означает, что курение пагубно сказывается на функции эндотелия и, таким образом, тесно связано со многими сердечно-сосудистыми заболеваниями [34, 37].Кроме того, недавние исследования на людях показывают, что некоторые эндотелиальные защитные препараты, такие как статины, ингибиторы ангиотензинпревращающего фермента (ИАПФ) и блокаторы рецепторов AT 1 (БРА), могут быть полезны для подавления разрыва и роста аневризмы, но эффект неясен. в некоторых более крупных когортных отчетах [38, 39]. Механизм приема лекарств также не ясен, поэтому нельзя исключать эффект регуляции функции эндотелия и увеличения оксида азота (NO).
8. Эндотелий и напряжение сдвига
Эндотелий находится в прямом контакте с кровотоком, который может создавать большое напряжение сдвига.Влияние различных режимов потока на стенки сосудов создает два вида напряжения сдвига: однонаправленное ламинарное напряжение сдвига (LSS) и колебательное напряжение сдвига (OSS). Сообщалось, что AAA возникает в областях рефлюкса, низкого напряжения сдвига стенки или нарушений кровотока, в то время как высокий LSS снижает развитие AAA [40]. Гемодинамические силы регулируют окислительный стресс и активные формы кислорода (АФК) в эндотелии. LSS подавляет супероксид, в то время как OSS увеличивает его количество из эндотелиальных клеток. Кроме того, NOX опосредует окислительный стресс в ответ на различные напряжения сдвига [41].LSS активирует NOX2, чтобы вызвать продукцию NO, в то время как OSS активирует NOX1 с несвязанным eNOS [41]. Кроме того, напряжение сдвига снижает экспрессию eNOS в эндотелиальных клетках через рецептор, названный «scavenger рецептор класса B member-1» (SR-B1) [42]. SR-B1, рецептор липопротеинов высокой плотности, участвует в регуляции эндотелиальных клеток в ответ на напряжение сдвига, что способствует образованию ААА у некоторых пациентов с атеросклерозом и в некоторых моделях животных, таких как мыши с нокаутом гена ApoE с введенным Ang II [28].
Напряжение сдвига регулирует экспрессию и активность протеаз, секретируемых эндотелиальными клетками. Обычно ЕСМ состоит из эластина, коллагена, протеогликана, гликопротеина, гликозаминогликана и так далее. ECM поддерживает равновесие между синтезом и деградацией, в то время как пациенты с AAA имеют нарушения метаболизма ECM, проявляющиеся в повреждениях эластина и коллагеновых волокон [43]. ММП и цистеиновые протеазы, такие как катепсины K, L и S, участвуют в деградации ECM [44, 45].Соответственно, экспрессия TIMP3 снижается, а активность MMP увеличивается по сравнению с состоянием OSS по сравнению с LSS [46]. Хотя некоторые исследования показывают, что TIMP неожиданно увеличивается в стенке аневризмы [47], баланс между протеазами и антипротеазами, по-видимому, способствует протеолизу [7]. Катепсин — это еще один вид семейства протеаз, который гидролизует ECM, разрушая эластичные и коллагеновые волокна, способствуя образованию AAA [45]. Наблюдается увеличение экспрессии катепсина в эндотелиальных клетках в месте поражения AAA [48, 49].Экспрессия и активность катепсинов значительно ниже при ламинарном потоке, чем при турбулентном потоке в эндотелиальных клетках [50, 51]. Гемодинамические силы косвенно опосредуют экспрессию катепсина в эндотелиальных клетках, регулируя инфильтрацию воспалительных клеток и высвобождая воспалительные факторы [51, 52].
9. Эндотелий, воспаление и окислительный стресс
Эндотелиальные клетки участвуют в воспалении стенки аорты. Напряжение сдвига и кровоток в эндотелии влияют на стенку аорты посредством ингибирования воспалительных цитокинов и молекул адгезии, секретируемых эндотелием, что дополнительно снижает воспалительную реакцию в средах и адвентиции [53].Основываясь на предыдущих исследованиях, возможно, что образование ААА запускается врожденным или аутоиммунным иммунитетом к внешним антигенам, которые могут иметь общие молекулярные мотивы с мотивами на стенке аорты [54]. Воспаление считается важным фактором возникновения и прогрессирования аневризм. Проникающие макрофаги и лейкоциты являются основными источниками протеиназ. Кроме того, проникающие иммунные клетки высвобождают цитокины, ROS и молекулы клеточной адгезии, что приводит к дальнейшему привлечению иммунных клеток, индукции апоптоза VSMC и повреждению тканей.
Доказательства показывают, что фактор транскрипции ядерный фактор-каппа B (NF- κ B) опосредует ряд генов, связанных как с воспалительными, так и с окислительными реакциями в стенке аорты [55–57]. Было обнаружено, что, когда путь NF- κ B эндотелиальных клеток был заблокирован, инфильтрация воспалительных клеток, экспрессия воспалительных факторов и реакция на окислительный стресс снижались в средах и адвентиции артерий; это привело к подавлению образования аневризмы [58].Hannawa et al. обнаружили, что селектины способствуют привлечению и инфильтрации воспалительных клеток при раннем образовании ААА [59]. Они также продемонстрировали, что рекрутирование воспалительных клеток было значительно снижено у мышей с нокаутом P-селектина, поэтому дефицит P-селектина, который экспрессируется в эндотелиальных клетках, ослабляет образование аневризмы [60].
Эндотелиальные клетки также участвуют в окислительном стрессе стенки аорты. Эндотелиальные клетки стимулируются секретируемыми веществами, повышающими уровень АФК в гладких мышцах.Возникновение окислительного стресса в эндотелиальных клетках наблюдается до изменений VSMC, а также инфильтрации воспалительных клеток. Окислительный стресс и воспаление взаимодействуют, увеличивая повреждение артериальных тканей. На участках тканей с хроническим воспалением обычно наблюдается повышенный уровень АФК. Медиаторы воспаления активируют НАДФН-оксидазу с образованием О 2 — , а НАДФН-оксидаза, как и iNOS, в свою очередь, участвует в реакции воспаления [61, 62].Продукты АФК способствуют инфильтрации воспалительных клеток и увеличивают секрецию провоспалительных цитокинов [63]. Помимо этих ролей, ROS непосредственно активирует MMPs [64], ингибируя ингибитор активатора плазминогена типа 1 (PAI-1), который является ингибитором MMP, который индуцирует апоптоз VSMC [65]. Это увеличение ROS в эндотелиальных клетках изменяет функцию VSMC и способствует окислительному стрессу, при котором циклофилин A (CypA) может действовать как промежуточная молекула [66]. CypA вызывает миграцию и пролиферацию гладкомышечных клеток, увеличивает экспрессию молекул адгезии эндотелия и опосредует хемотаксис воспалительных клеток [66].Однако после специфического нокдауна гена CypA в эндотелиальных клетках Ang II не увеличивал уровень ROS в VSMC, в которых также блокировалась секреция воспалительных цитокинов, таких как MCP-1, IL-6 и хемокин [67]. Более того, на уровни CypA в VSMC также влияют эндотелиальные клетки [66].
10. ECM и VSMC в медиа
ECM и VSMC — главные компоненты в медиа ткани. С одной стороны, VSMCs уменьшаются в количестве из-за апоптоза и некроптоза [68], а с другой стороны, VSMCs синтезируют большие количества компонентов ECM и увеличивают пролиферацию, а также миграцию в сосудистой стенке.Это одна из наиболее значимых причин ослабления ткани медиатора, которая приводит к структурным и функциональным нарушениям в апоптотических VSMC [69]. Wang et al. сообщили, что рекрутирование макрофагов вызывает гибель VSMC посредством пути, опосредованного FasL / Fas-Caspase-8-RIP1 [70]. Ингибиторы RIP1 обращают вспять потерю VSMC, предотвращают воспаление и деградацию ECM и способствуют восстановлению ткани аорты. Кроме того, VSMC необходимы не только для кратковременной регуляции артериального давления за счет изменения тонуса и диаметра сосудов, но и для долгосрочной адаптации через структурное ремоделирование путем изменения количества клеток и состава соединительной ткани [71].По мере снижения сократительных свойств увеличивается пролиферация и миграция VSMC поражений AAA в результате преобразования в синтетический фенотип. Было продемонстрировано, что ингибирование каскада mTOR ослабляет прогрессирование ААА путем сохранения или восстановления сократительного фенотипа VSMC [72].
По сравнению с неразорвавшимися аневризмами ангиогенез более очевиден во внешних двух третях средней ткани при разрыве AAA. Инфильтрация воспалительных клеток и воспалительных факторов вызывает медиальный лимфангиогенез и ангиогенез [19].Эти новообразования неполные, негерметичные и легко разрываются, что приводит к ремоделированию сосудов и ослаблению стенки аорты за счет ослабления ее структурной целостности [73, 74]. Более того, образование лимфатических микрососудов может привести к проникновению воспалительных клеток в ткань среды, а вновь образованные лимфатические микрососуды не могут полностью отводить лимфу [19]. Однако точный механизм неоваскуляризации и лимфангиогенеза при разрыве и развитии аневризмы аорты не ясен.
11. Адвентиция и AAA
И грудная аорта, и брюшная аорта представляют собой эластические артерии, которые состоят из интимы, медиального и адвентициального слоев.Изменение эластина и коллагена в стенке аорты зависит от продукции протеаз резидентными клетками сосудистой стенки (медиальные гладкомышечные клетки и адвентициальные фибробласты) и лимфомоноцитарными инфильтратными клетками, в этом процессе адвентиция играет главную роль. Примечательно, что адвентициальные фибробласты, секретирующие MCP-1, также привлекают моноциты к стенке аорты, которые затем способствуют пролиферации большего количества фибробластов для усиления воспалительного ответа. Эта амплификация представляет собой поворотный этап в развитии и формировании AAA [75].
12. Сигнальный путь и AAA
Было предложено множество механизмов образования AAA, и фундаментальные исследования помогли определить молекулярную основу и медиаторов повреждения аорты, включая ангиотензин II, лейкотриен-LT4, простагландин E2 (PGE2), интерлейкины, фактор некроза опухоли, тканевый активатор плазминогена, c-Jun N-терминальная киназа, NF- κ B, rho-киназы, остеопротегерин, химазы, индуцируемый гипоксией фактор-1 (HIF-1), метаболизм, SMAD, TGF- β и его сигнальный путь [23, 76, 77].Общий механизм все еще остается загадкой, но текущие знания об образовании AAA проиллюстрированы на рисунке 2: в присутствии некоторых отягчающих факторов, таких как гипертония, курение и старение, NOX активируются при активации RAS, что в дальнейшем вызывает разобщение eNOS за счет окисления. h5B (кофактор eNOS) или окислительный стресс / гиперпродукция супероксида. Эндотелиальная дисфункция является следствием разобщения eNOS, которое запускает серию каскадов, включая сверхэкспрессию ICAM / VCAM, чтобы усилить иммунный ответ и вызвать инфильтрацию моноцитов.Эти механизмы распространяют окислительный стресс на слои среды и адвентиции. Взятые вместе, активность ММП индуцируется, чтобы инициировать деградацию и протеолиз ECM, в то время как VSMC становится апоптотическим, чтобы еще больше ослабить сосудистую стенку. NF- κ B также активируется, и лизис коллагена не может уравновешиваться фибробластами. Более того, внутрипросветный тромбоз при гипоксии, вызванной адвентицией, вызывает неоваскуляризацию.
13. Диабет и аневризма в капиллярах сетчатки по сравнению с аортой
Аневризма капилляров сетчатки является маркером очень ранней диабетической ретинопатии (DR), при которой диабет считается очень высоким фактором риска микроаневризмы капилляров сетчатки [78].Парадоксально, но эпидемиологические данные для AAA показали отрицательную связь с диабетом [79–82], хотя существуют некоторые противоречивые данные [83, 84]. Распространенность диабета 2 типа у пациентов с АБА колебалась от 6 до 14%, в то время как при отсутствии АБА она достигала 17–36% [85]. Также было обнаружено, что скорость роста аневризм у больных сахарным диабетом в среднем ниже, чем у недиабетиков [86, 87]. Механизм пока точно не известен. Однако, несмотря на отрицательную связь, смертность от диабета с AAA выше, чем у недиабетических пациентов с AAA [85].
Перициты, покрывающие капилляры, имеют функции, аналогичные функциям гладкомышечных клеток, то есть поддерживают механическую стабильность капиллярной структуры. Микроаневризма сетчатки — это раннее патологическое изменение при диабетической ретинопатии, характеризующееся исчезновением перицитов из капилляров сетчатки. Роль эндотелия в DR не ясна. Однако недавно было обнаружено, что гипергликемия индуцирует активацию PKC, которая оказывает ингибирующее действие на экспрессию eNOS в эндотелиальных клетках, вызывая эндотелиальную дисфункцию [88].Более того, сообщалось, что гипергликемия способствует адгезии лейкоцитов к эндотелию, возможно, за счет активации активации NF- κ B, которая вызывает апоптоз эндотелиальных клеток [89, 90]. Продвинутые гликированные конечные продукты (AGE), индуцированные гипергликемией, связываются с его рецепторами в эндотелиальных клетках и перицитах, что приводит к повреждению микрососудов сетчатки, влияя на внутриклеточные функции, такие как повышенная продукция ROS, жесткость сосудов и апоптоз клеток. С одной стороны, апоптоз эндотелиальных клеток и перицитов в положении in situ, в то время как бесполезная пролиферация эндотелиальных клеток в перемещающемся положении без поддержки перицитов, оба из которых приводят к образованию микроаневризмы в сетчатке.
AAA мышей с гипергликемией продемонстрировали уменьшение инфильтрации макрофагами, эластолиза и неоваскуляризации в стенках аорты [79]. Исследования показали, что накопление AGE отрицательно коррелирует с диаметром аорты [91], а также экспрессией и активностью MMP-2 [92]. Также постулируется, что лечение диабета, такое как метформин, может оказывать защитное действие на ААА. Тем не менее, похоже, что образование микроаневризмы сетчатки отличается от аневризмы аорты при диабете.Тщательное исследование дифференциальной корреляции между диабетом и образованием аневризмы в капилляре сетчатки и в аорте может пролить свет на текущий пробел в исследованиях ААА.
14. Современные методы лечения AAA
В настоящее время хирургическое лечение расширяющихся артерий или установка стента является основной мерой, используемой для снижения риска разрыва аневризмы. Требуется ли пациенту хирургическое лечение, зависит от всесторонней оценки многих факторов, таких как диаметр аневризмы, скорость ее роста, наличие симптомов и ожидаемая продолжительность жизни.Общие клинические хирургические методы включают открытое хирургическое вмешательство и эндоваскулярное восстановление аневризмы (EVAR). При EVAR в полость брюшной аорты имплантируют трубку или стент, чтобы поддерживать стенку аорты и позволять току крови проходить через вену. Хотя по сравнению с обычным открытым хирургическим вмешательством у пациентов, которым вводили EVAR, наблюдается короткое время послеоперационного восстановления и низкая краткосрочная смертность, также нет значительных различий в долгосрочной (> 2 лет) смертности.
Пациентам с бессимптомной аневризмой диаметром <40 мм и низким риском разрыва рекомендуется лечение консервативными методами и регулярное повторное обследование.Вопрос о том, следует ли пациентам с размером аневризмы 40–54 мм подвергаться хирургическому вмешательству, до сих пор остается спорным. Некоторые исследования показали, что регулярное цветное допплеровское ультразвуковое исследование или КТА-обследование брюшной аорты для наблюдения за ростом аневризмы является эффективным и безопасным методом. Когда этим пациентам было проведено раннее хирургическое лечение, значительного улучшения показателя долгосрочной выживаемости не наблюдалось. Таким образом, показания к хирургическому вмешательству у пациентов с диаметром аневризмы <54 мм в значительной степени зависели от индивидуальных обстоятельств.Особенно рекомендуется консервативное лечение пожилым людям с тяжелыми осложнениями. Скрининг групп высокого риска, таких как пожилые люди, курильщики и люди с соответствующим семейным анамнезом, для выявления биомаркеров в крови полезен для ранней диагностики и лечения с целью снижения смертности от разрыва аневризмы [93, 94]. Важно, чтобы пациенты, у которых нет показаний к хирургическому вмешательству, все же получали лечение, чтобы ограничить рост аневризмы.
В то время как хирургическое вмешательство является единственной мерой, используемой для снижения риска разрыва аневризмы в настоящее время, неинвазивные медицинские методы лечения могут использоваться в качестве адъювантной терапии.В настоящее время изучаются различные противовоспалительные, антиоксидантные и гемодинамические модуляторы, а также ингибиторы ММП, чтобы замедлить рост аневризмы, снизить риск разрыва и улучшить прогноз, а также смертность после операции. Скорость роста аневризмы увеличивается у людей, которые курят, поэтому изменение образа жизни, направленное на отказ от курения, полезно для предотвращения возникновения АБА и задержки развития аневризмы [87].
Статины (ингибиторы 3-гидрокси-3-метилглутарил-кофермента А-редуктазы) снижают уровень продуктов АФК и обладают противовоспалительным действием, ограничивая прогрессирование ААА независимо от гиполипидемических эффектов [95, 96].Ингибиторы ренин-ангиотензин-альдостероновой системы, ИАПФ и БРА, теоретически должны замедлять артериальную дилатацию и снижать риск разрыва ААА. Хотя статины и ИАПФ хорошо переносятся, недавний метаанализ имеющихся данных показал, что эти классы препаратов или противовоспалительная терапия не влияют на прогрессирование ААА [97]. Хотя исследования на животных продемонстрировали, что блокаторы бета-рецепторов могут подавлять рост и разрыв аневризм, влияя на гемодинамику, что полезно для задержки распространения ААА [98], не было клинических доказательств положительного влияния таких стратегий на прогрессирование ААА.Напротив, были обнаружены доказательства ускорения роста у пациентов, принимавших доксициклин, ингибитор ММП [99]. Эти данные резко контрастируют с доступными доклиническими данными, которые показывают, что фармацевтическое вмешательство в аспекты системы РАС, метаболизма холестерина, сосудистого воспаления или активности протеазы эффективно снижает образование аневризмы на моделях болезней грызунов [100]. Следовательно, хотя управление риском сердечно-сосудистых заболеваний не влияет на прогрессирование АБА, важно понимать, что управление риском показано пациентам с АБА, поскольку эта группа имеет чрезвычайно высокий сердечно-сосудистый риск [6].
Фармакологический подход, эффективно ограничивающий прогрессирование ААА или риск разрыва у людей, не выявлен. Чего не хватало, так это детального понимания механизмов инициации и расширения AAA. Исследования роли и значения сосудистых эндотелиальных клеток в патогенезе и прогрессировании ААА откроют новую перспективу для открытия новой мишени для предотвращения образования ААА и задержки его прогрессирования. Статины, препараты против РАС и антиоксиданты могут оказывать некоторое влияние на восстановление эндотелиальной дисфункции, но неэффективны или специфичны для воссоединения eNOS [30, 101–105].Фолиевая кислота или другие препараты, направленные на разобщение eNOS, должны быть разработаны и испытаны в AAA для проверки их эффективности [30, 106].
15. Заключение и перспектива
AAA — это потенциально смертельное сердечно-сосудистое заболевание, которое будет становиться все более и более распространенным по мере старения населения. Патологические механизмы AAA являются результатом многих факторов, включая снижение VSMC, активацию MMP, распад ECM и инфильтрацию воспалительных клеток, но нельзя игнорировать роль эндотелиальных клеток.Признавая важность эндотелиальной дисфункции в формировании AAA, а также подтверждая эффективность фармакологической терапии при AAA, мы можем обнаружить многообещающую стратегию раннего вмешательства для пациентов с высоким риском или хирургической адъювантной терапии в дополнение к существующим хирургическим вариантам лечения. продвинутый AAA. С этой целью дифференциальная роль функции эндотелия в развитии капиллярной микроаневризмы и ААА при диабете может лежать в основе многообещающего решения ААА.
Согласие
Авторы уведомляют об отсутствии потенциально дублирующих друг друга статей при подготовке, представлении или публикации. Авторы этой рукописи все прочитали и согласны с ее содержанием. Они благодарны профессору Цзюнь Фу (отделение сердечно-сосудистой хирургии, Азиатская больница сердечно-сосудистых заболеваний в Ухане) за ценные советы при написании этой статьи.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Цзинюань Сунь и Хунпин Дэн внесли равный вклад в эту статью.
Выражение признательности
Это исследование поддержано Национальным научным фондом Китая (проект № 81170767 и № 81571376, доктору Гао) и Фондом исследований диабета Китайской медицинской ассоциации (проект № 13060906481, доктору Гао). ).
% PDF-1.4
%
175 0 объект
>
endobj
xref
175 74
0000000016 00000 н.
0000002340 00000 н.
0000002508 00000 н.
0000002544 00000 н.
0000002989 00000 н.
0000003102 00000 п.
0000003215 00000 н.
0000004112 00000 н.
0000005014 00000 н.
0000005178 00000 п.
0000005321 00000 п.
0000005957 00000 н.
0000005994 00000 н.
0000006097 00000 н.
0000007261 00000 н.
0000008431 00000 н.
0000008492 00000 п.
0000022000 00000 н.
0000023321 00000 п.
0000024486 00000 п.
0000025314 00000 п.
0000026160 00000 п.
0000026799 00000 н.
0000027268 00000 н.
0000028434 00000 п.
0000028953 00000 п.
0000029751 00000 п.
0000030503 00000 п.
0000030644 00000 п.
0000031431 00000 п.
0000032250 00000 п.
0000032550 00000 п.
0000032713 00000 п.
0000032945 00000 п.
0000033822 00000 п.
0000034550 00000 п.
0000037243 00000 п.
0000047701 00000 п.
0000050999 00000 н.
0000061362 00000 п.
0000072648 00000 п.
0000082572 00000 п.
0000087866 00000 п.
0000087926 00000 п.
0000097904 00000 п.
0000099015 00000 н.
0000099301 00000 п.
0000099355 00000 н.
0000111117 00000 н.
0000111937 00000 н.
0000111999 00000 н.
0000116805 00000 н.
0000118426 00000 н.
0000118711 00000 н.
0000118783 00000 н.
0000118982 00000 п.
0000119107 00000 н.
0000119207 00000 н.
0000119324 00000 н.
0000119438 00000 н.