Чем лечить золотистый стафилококк в носу: эффективные средства
Стафилококк – это общее название бактериальной группы, которая состоит из 27 известных медицине видов микроорганизмов, некоторые из них могут располагаться на слизистой оболочки кожного покрова человека.
В основном стафилококки не несут никакого вреда, однако, среди них медики выделяют только 3 основных видов, которые могут поспособствовать развитию заболевания.
Одним из самых опасных считается золотистый стафилококк.
Золотистый стафилококк: что это
Стафилококк является патогенной грамположительной бактерией, которая имеет круглую форму. Эту бактерию можно считать возбудителем множества заболеваний, начиная от самых легких, таких как угри, фурункулы и империго и заканчивая заболеваниями, приводящими к летальному исходу (менингиту, пневмонии, токсическому шоку и сепсису).
К основной области поражения стафилококком относятся носовые пазухи и впадины подмышек. Как ни удивительно, но главными переносчиками бактерии, являются медицинские работники.
К сожалению, золотистый стафилококк имеет удивительную живучесть. Стафилококк не погибает даже в чистом этиловом спирте.
Учитывая то, что золотистый стафилококк отлично переносит соленую среду и даже хлорид натрия ей не страшен, эта бактерия прекрасно уживается в организме, особенно если человек склонен к потливости.
Стафилококк способен вырабатывать такой фермент, как липазу, который расщепляет жир и разрушает сальную пробку, находящуюся возле волосяного мешочка на коже. Вследствие этого происходят образования фурункулы и карбункулы.
Но все же у золотистого стафилококка есть свои слабости и к одной из них можно отнести чувствительное восприятие анилиновой краски, к которым относится и бриллиантовая зелень.
Золотистый стафилококк в носу
Одно из наиболее распространенных мест на теле, где может развиться
Стафилококк относится к патогенным бактериям, которые вызывают различные заболевания
стафилококк – это слизистая носа.
Стоит заметить, что бактерия способна проявиться даже у абсолютно здорового человека. Большинство людей даже не подозревают о наличии микроорганизмов и длительное время являются просто носителями заболевания.
Бактерия «спит» до тех пор, пока иммунная система человека работает в норме, но как только организм ослабевает – это дает толчок к росту и размножению бактерии на слизистой носа. Как следствие, у человека возникают такие заболевания, как гайморит, фронтит, атрофия слизистой и хронический ринит.
Воспалительные процессы могут возникнуть не только по причине понижения общего состояния здоровья, но и из-за таких факторов, как:
резкие температурные перепады, приводящие к переохлаждению либо сильной потливости
- при вирусной этиологии
- в ситуации, когда организм плохо адаптируется к окружающей среде
- при применении капель для носа на антибактериальной основе
- при использовании капель, которые приводят к сужению сосудов
- после применения антибиотиков.
Симптомы наличия золотистого стафилококка
Как было сказано ранее, любой человек может быть носителем стафилококка, и может не подозревать о его существовании до определенного срока. Уже при первом дискомфорте необходимо обратиться к специалисту.
Причиной для посещения врача могут стать следующие симптомы:
- покраснения кожного покрова и слизистой в области носа
- высокая температура
- непроходимость носа, которая трудно вылечивается при помощи традиционных препаратов
- гнойные выделения
- интоксикация всего организма
Слизистая оболочка носа чаще всего поражается золотистым стафилококком
- при атрофии слизистой.
Важно уже при первых проявлениях недуга посетить врача и пройти полное обследование, так как золотистый стафилококк имеет свойство быстрого размножения.
Лечение противовирусными медикаментами и антибиотиками не только не принесут положительных результатов, но и способны усугубить ситуацию и способствовать размножению бактерии.
Диагностика заболевания
Уже при первых проявлениях воспаления и обращения к специалисту необходимо будет сдать ряд анализов.
В первую очередь происходит физикальное исследование, сдача анализов и сбор информации у пациента о возможном способе заражения, так как заболевание может иметь клинический характер.
Если заболевание протекает у ребенка, то врач должен осмотреть кожный покров, уточнить характер стула пациента и сопутствующие симптомы, связанные с ЖКТ.
Выявить микроорганизмы в слизистой можно при помощи бакпосева, который выделяет бактерии из питательной среды носоглотки.
Перед сдачей анализов необходимо подготовиться. В этот день не рекомендуется использование зубной пасты и различный ополаскивателей для рта, также не желательно кушать и пить перед этим (если мазок берется из полости рта).
Прежде чем сдавать анализ за 2 недели до назначенной даты стоит отказаться от использования каких-либо антибактериальных препаратов. Результаты мазка будут готовы в течение 4-7 дней после сдачи. Нормой по бакпосеву считается не больше 106 единиц бактерий.
Лечение стафилококка в носовой полости
Лечение золотистого стафилококка возможно только после полного обследования и по рекомендации специалиста.
Самолечение может привести к обратному эффекту и заболевание будет только
Назначить лечение может только врач после проведенного обследования
развиваться.
К сожалению, золотистый стафилококк активно проявляется в случае снижения иммунитета у человека и бактерия стойко переносит медикаменты содержащие пенициллин.
В первую очередь во время лечения необходимо учитывать такие нюансы:
- золотистый стафилококк стойко переносит обширный ряд антибиотиков
- регулярное использование антибиотиков способно привести к появлению уникального штампа стафилококка
- в случае неправильного лечения эффект может быть абсолютно противоположным, а инфекция может распространиться с кровью по всему организму
- в случае неполного либо неправильного лечения могут возникнуть серьезные последствия (гнойное поражение кожного покрова, кишечная интоксикация, менингит и т.
 д.).
д.).
Прежде чем приступить к использованию того или иного антибиотика нужно определить чувствительность организма на этот препарат. Для лечения чаще всего используется Диклоксациллин, Узанин, Ванкомицин и т.д.
Параллельно с антибиотиками можно использовать бриллиантовый зеленый, а также бактериофаги.
Также необходимо восстановить иммунную систему при помощи витаминных комплексов, регулярного сна и правильного питания.
Помимо методов традиционной медицины, часто используются и народные способы лечения золотистого стафилококка, но применять их рекомендуется только по согласованию с лечащим врачом и после полного обследования.
Можно использовать компрессы, в составе которых вода и уксус, горячую ванну и различные припарки.
Чтобы избавиться от гнойных выделений, необходимо применять растение окопник лекарственный. Также хорошим свойством обладает отвар из репейника, который рекомендуется закапывать в нос в течение дня. Помимо устранения инфекции народными средствами можно восстановить иммунную систему. Для этого рекомендуется употреблять настойку эхинацеи, отвар шиповника и абрикосовую мякоть.
О золотистом стафилококке больше расскажет специалист на видео:
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.
Понравилось? Лайкни и сохрани у себя на страничке!
Смотрите также:
Загрузка… Об авторе: Софья Тутовски « Предыдущая запись Следующая запись »
Наука: Наука и техника: Lenta.ru
Нос человека содержит бактерии, которые производят эффективный антибиотик. Это выяснили немецкие бактериологи из Тюбингенского университета, которые хотели определить причины, по которым в носовой полости только двух третей всех людей живет и размножается золотистый стафилококк. Результаты исследования опубликованы в журнале Nature.
Результаты исследования опубликованы в журнале Nature.
В большинстве случаев бактерии золотистого стафилококка (Staphylococcus aureus) являются безвредными, но иногда они вызывают сепсис, попадая, например, в открытую рану. S.aureus часто встречается в больницах, а один из его штаммов обладает лекарственной устойчивостью к антибиотикам пенициллинового ряда. Ежегодно от суперинфекций, вызванных стафилококком, погибает до 10 тысяч человек.
Материалы по теме
00:09 — 22 июля 2016
Адские гончие
Как человека жестоко убивают обитающие в организме пузырьки
Ученые выяснили, что человеческий нос, в котором часто поселяется S.aureus, является агрессивной средой для микроба. В нем содержатся другие виды стафилококков, в частности, S. lugdunensis, который предотвращает рост потенциально патогенной бактерии. Это ему удается благодаря производству вещества, содержащего антибиотик. Исследователям удалось синтезировать соединение, названное лугдунином, в лаборатории. Эксперименты показали, что оно предотвращает рост колоний S.aureus в чашке Петри, а при нанесении на кожу мышей избавляет грызунов от инфекции.
Принцип работы лугдунина пока остается неясным. Бактериологи отмечают, что золотистый стафилококк не развивает устойчивость к нему, даже при воздействии низких доз антибиотика в течение 30 дней.
Исследователи изучили микробные популяции в носу госпитализированных пациентов и обнаружили, что 60 человек являются носителями S.aureus, а 17 — S. lugdunensis. При этом только у одного человека эти два вида микроорганизмов присутствовали одновременно, что указывает на то, что S. lugdunensis является врагом золотистого стафилококка.
Если длительное применение лугдунина действительно не вызывает появления супербактерий, которые устойчивы к лечению, то этот препарат может предотвратить закат эры антибиотиков, прогнозируемый многими специалистами. Ученые, однако, отмечают, что следует скептически относиться к такой возможности, и в будущем резистентность к новому антибактериальному соединению все-таки может проявиться.
Стафилококк — Американская Медицинская Клиника
Стафилококки — это распространенное семейство бактерий. Так или иначе, Вы контактируете с ними ежедневно — они обитают на Вашем теле и широко распространены в природе.
При наличии определенных условий, бактерия, попадая в организм, проявляет патологическую активность и вызвать воспаление любого органа или системы. Это влечет за собой развитие опаснейших заболеваний — сепсис, пневмонию, расстройство ЦНС, общую интоксикацию организма.
Современное оборудование и большой опыт врачей Американской Медицинской Клиники позволяют эффективно диагностировать наличие в организме патогенных бактерий и бороться с их воздействием. Как распознать у себя наличие опасных микроорганизмов разберемся вместе.
Виды стафилококка
Наиболее распространены и опасны следующие виды стафилококка:
-
сапрофитный стафилококк — вызывает наименьшие поражения, заболеванию подвержены в основном женщины, у которых бактерия вызывает заболевания мочевого пузыря и почек; -
эпидермальный стафилококк — проявляет патологическую активность при ослабленном иммунитете и вызывает заражение крови или воспаление внутренней оболочки сердца; -
золотистый стафилококк — груднички и взрослые люди — все подвержены этому заболеванию вне зависимости от пола и возраста, вызывает более сотни воспалительных заболеваний любых органов.
Симптомы стафилококка
Проявление симптомов стафилококка зависит от тяжести инфекции и локализации процесса:
-
воспаление кожи и подкожной клетчатки; -
гнойное поражение костей — боли в руках и ногах, которые усиливаются при движении; -
стафилококк в горле — боли в горле, налет на миндалинах, першение, кашель, покраснение зева; -
стафилококк в носе — заложенность носа и насморк; -
воспаление органов брюшной полости — боли в животе, диарея, тошнота и рвота; -
воспаление оболочек сердца — повышенная температура, шумы в сердце, резкое похудение; -
воспаление органов дыхательной системы — кашель, одышка, общее недомогание; -
воспаление головного мозга — менингит и абсцесс головного мозга; -
воспаление органов мочеполовой системы — болезненные ощущения в спине и в паховой области при мочеиспускании.
Как Вы можете видеть, стафилококк поражает любые органы человеческого организма и при отсутствии лечения вызывает тяжелые осложнения — вплоть до летального исхода.
При первом же проявлении симптомов Вам необходимо обратиться в Американскую Медицинскую Клинику. Большой опыт наших врачей и использование современного оборудования позволяет эффективно диагностировать и лечить стафилококк. Рассмотрим подробнее, как это происходит.
Лечение стафилококка
Лечение золотистого стафилококка и любых других его видов заключается в борьбе с бактерией — возбудителем заболевания и устранение последствий ее жизнедеятельности.
Для лечения гнойников и отеков применяют хирургическое вскрытие с последующим их промыванием антибиотиками и дренированием.
В связи с нечувствительностью бактерий стафилококка к стандартным антибиотикам, применяют препараты нового поколения.
Также применяют терапию фагами — внедрение в Ваш организм специфических вирусов, которые избирательно уничтожают лишь стафилококк.
Вдобавок ко всему применяют различные средства укрепления иммунитета для самостоятельной борьбы с патогенными бактериями.
Помните, что эффективное комплексное лечение назначит только врач на основе тщательной диагностики Вашего организма. Опыт и высокая квалификация наших специалистов гарантируют Вам наиболее эффективную терапию с наименьшей степенью оперативного вмешательства. Это в короткие сроки позволит Вам вернуться к привычному образу жизни.
Смотрите также:
Золотистый стафилококк в горле — лечение
Стафилококк — это заболевание инфекционного характера, которое может поражать любые органы человека. Представляет собой микроорганизм условно-патогенной микрофлоры, который при пониженной иммунной системе и слабом организме начинает активно размножаться. Зачастую стафилококковая инфекция выявляется в носоглотке.
Наиболее опасным микроорганизмом из этой группы считается золотистый стафилококк в горле. При его развитии в носоглотке образуются высыпания с наличием гноя.
Своё название он получил из-за характерного цвета — золотистого, который можно увидеть под микроскопом. Именно данный вид инфекции считается наиболее опасным, развивается он быстро и может давать осложнения разного характера. Чаще всего инфекцию выявляют у деток, пожилых людей, потому как у них ослаблен иммунитет.
Чем опасна инфекция
Многие носители микроорганизма даже не подозревают о его наличии, поэтому не используют меры защиты для себя и окружающих. И только при появлении явных основных признаков обращаются к врачу для проведения лечения заболевания.
Основной путь заражения стафилококком — контактный. Не следует забывать и о том, что микроорганизм может передаваться воздушно-капельно. По данным ВОЗ, золотистый стафилококк возглавляет список бактерий, которыми чаще всего заражаются в медучреждениях.
Методы лечения стафилококка в носу и горле
Если вовремя обратиться к специалисту, то лечебный курс составит около недели. Если же есть гнойнички, тогда лечить инфекцию придётся около 2-3 недель.
И после лечебного курса необходимо будет принимать меры профилактики, потому что первые недели иммунитет ещё слаб, и заражение может произойти заново.
Лечение золотистого стафилококка с помощью народных средств
Народная медицина может выступать в качестве дополнительного метода лечения. Нередко это даёт положительный эффект.
Можно полоскать горло травяными отварами и настоями (ромашка, шалфей, чабрец). Эти травы снимают воспаление и снижают болевой синдром. Рекомендуется потребление шиповника, он богат витаминами, выводит токсины.
Хорошо помогает натуральный мёд, если на него нет аллергии. Нужно рассасывать по маленькой ложечке каждые 30 минут.
Чёрная смородина — это кладезь витаминов. Её можно кушать в свежем виде либо в виде варенья, запивая тёплым чаем. Обильное питьё — обязательное условие при лечении стафилококка. Можно пить чаи из малины, калины.
Её можно кушать в свежем виде либо в виде варенья, запивая тёплым чаем. Обильное питьё — обязательное условие при лечении стафилококка. Можно пить чаи из малины, калины.
Хорошо пить отвар из таких трав: барбарис, душица, череда, эвкалипт, корень солодки. Травы заливаются двумя стаканами холодной воды, смесь ставится на огонь на 10 минут. Настаивается отвар 1,5 часа, потом процеживается. В него можно положить немного мёда.
При гнойном процессе также нельзя делать компрессы и прогревания, пить тёплое молоко. Физиопроцедуры назначаются только после устранения гнойников.
Также среди народных методов лечения и профилактики золотистого стафилококка особого внимания заслуживает лечение медью или металлотерапия, известное ещё со времён Аристотеля. В своих работах древний врачеватель упоминает о лечении ушибов, язв и отёков прикладыванием медных пластин. Авиценна рекомендовал при гнойном воспалении прикладывать к поражённой области медный купорос, а восточные целители лечили переломы и болезни костей порошком красной меди, назначая его для приёма внутрь. В традициях нашего народа также есть рецепты лечения медью, которую применяли при различных заболеваниях — от ушибов, язв и нагноений до холеры.
Немаловажную роль в профилактике стафилококковой инфекции играет применение медной посуды в быту. Умывание водой из медного таза, питание из медной посуды обеспечивают постоянный приток этого металла в организм. Медь необходима для протекания многих жизненно важных биохимических процессов, синтеза коллагена, усвоения железа и синтеза гемоглобина. Кроме того, она обладает сильными антибактериальными свойствами, убивая даже метициллин-устойчивый стафилококк, не поддающийся действию антибиотиков.
Антисептический эффект меди выше, чем у серебра, поэтому в Америке, Японии и Англии из неё делают противомикробное больничное оборудование, ручки дверей, перила и другие контактные поверхности, через которые может распространяться инфекция.
Медь — это единственный металл, который встраиваясь в клетку аэробов (патогенной микрофлоры), вызывает в них процессы удушения, и они в свою очередь естественным образом умирают. При этом медь абсолютно безвредна для анаэробных организмов (лакто- и бифидо бактерий)! Это особенно важно при золотистом стафилококке, который при жизни выделяет огромное количество сильных ядов, но если его убить антибиотиками, то он выделит ещё более опасные яды, после которых человеку становится ещё хуже.
Если в вашем обиходе отсутствуют предметы из меди (настоящая медь должна иметь красноватый, а не золотистый отлив), то необходимо обеспечить её поступление в организм с пищей (или добавить в рацион БАДы).
Много меди содержится в шпинате, листьях салата, гречневой крупе, неочищенном овсе, говяжьей и свиной печени.
Суточная норма меди для взрослого человека — 2 мг, при дозировке свыше 3 мг могут проявиться симптомы интоксикации: тошнота и признаки пищевого отравления, слюнотечение и привкус металла во рту, диарея, почечная и печеночная недостаточность, нарушения нервной системы.
Отметим также, что коллоидное серебро при приёме его внутрь тоже оказывает положительный эффект на стафилококк.
Профилактика
- Нужно соблюдать гигиенические меры: мыть руки, посуду, регулярно делать в доме влажную уборку, вытирать пыль, мыть и стирать детские игрушки, проветривать квартиру.
- Если выявили стафилококковую инфекцию у одного члена семьи, надо проверить и всех остальных.
- Сдать анализы на скрытые вирусы, ведь они могут ослаблять иммунитет, что становится предпосылкой развития стафилококка (в норме иммунитет с ним справляется).
- Соблюдать усиленные меры гигиены в больничных учреждениях.
- Следить за качеством продуктов, которые вы едите.
По материалам https://mjusli.ru, https://www.ayzdorov.ru
Эффективное лечение синусита в клинике «Гиппократ»
Отделение отоларингология МЦ «Гиппократ» успешно специализируется на лечение синуситов, гайморитов, тонзилитов, лорингитов, фарингитов, ринитов и других заболеваний уха, горла и носа.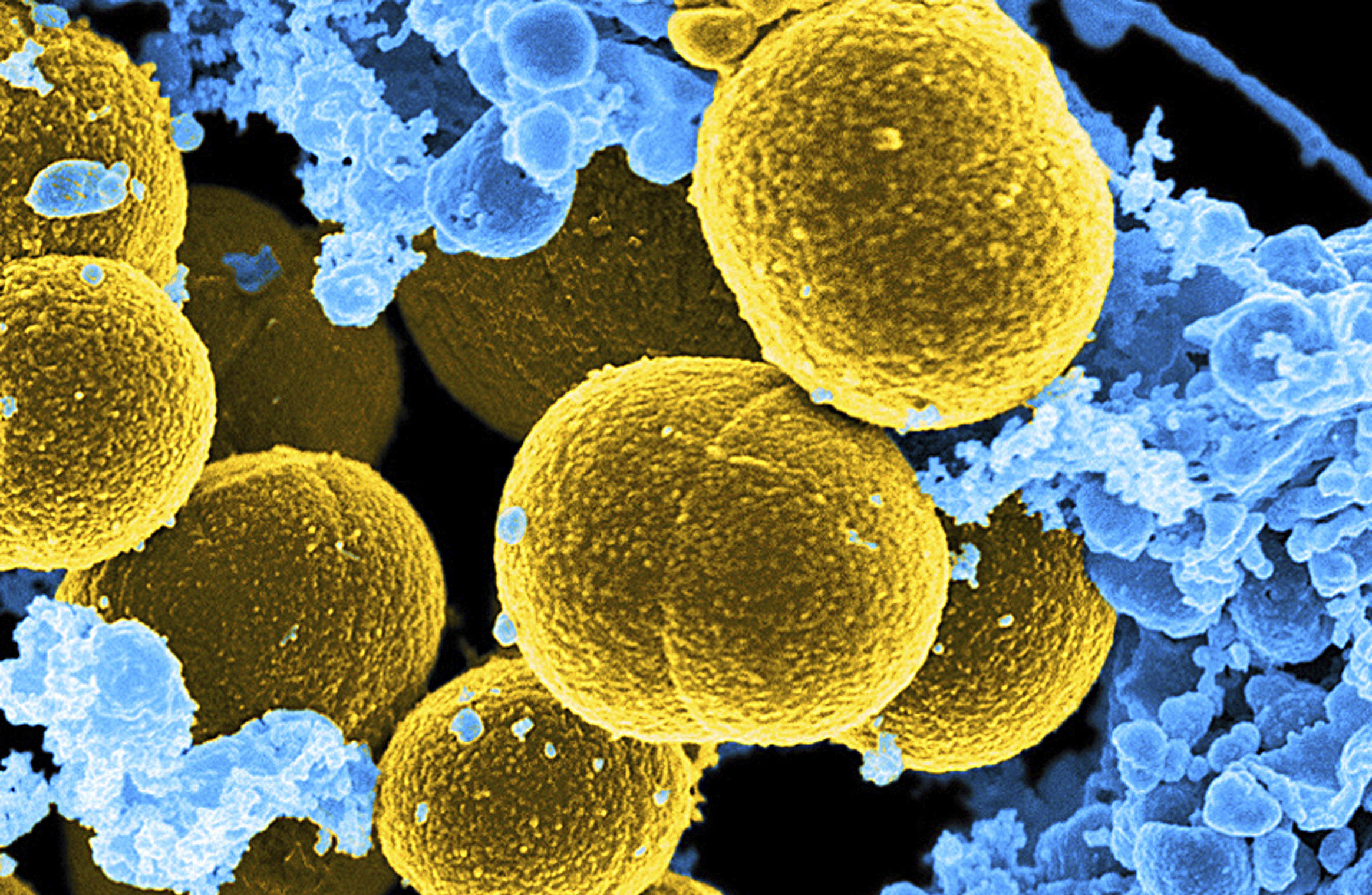
Синусит это воспаление или инфекция придаточных пазух носа и слизистой оболочки носовых ходов, сопровождающееся плотными выделениями из носа, лицевой болью или давлением, лихорадкой, и снижением обоняния. Эти пазухи выстланы слизистой оболочкой, заполнены воздухом и расположены в области лба, носа, щек и глаз.Если вы почувствовали симптомы синусита ,обратитесь в лор отделение МЦ «Гиппократ». Специалисты проведут диагностику и назначат правильное лечение.
У человека различают четыре группы придаточных пазух носа, названных в соответствии с их расположением:
- Лобная пазуха — парная пазуха, расположена в лобной кости;
- Гайморова или верхнечелюстная пазуха — наиболее крупная парная пазуха, расположенная в верхней челюсти;
- Решетчатая пазуха или решётчатый лабиринт — парная пазуха, сформированная ячейками решётчатой кости;
- Клиновидная пазуха — является основной пазухой и располагается в теле клиновидной кости.
Синусит возникает, если придаточные пазухи засоряются или закупориваются при насморке, простуде, или других инфекционных заболеваниях. Бактерии и другие микроорганизмы в таких условиях начинают размножаться очень быстро, что приводит к инфекции и воспалению околоносовой пазухи.
В зависимости длительности этих симптомов, синусит классифицируется как острый, подострый, хронический или рецидивирующий. Вирусы являются наиболее частой причиной острого синусита, но бактерии ответственны за большинство серьезных случаев.
Боль, усталость и другие симптомы синусита могут оказывать значительное влияние на качество жизни. Это состояние может вызвать эмоциональный стресс, нарушает нормальную деятельность и привычный образ жизни .При возникновении симптомов –следует обратиться к лору .
По месту локализации синусита ,после тщательной диагностики в нашем медицинском центре, отоларингологи выделяют следующие заболевания:
- Гайморит — возникает при воспалении верхнечелюстной придаточной пазухи;
- Фронтит — возникает при воспалении лобной придаточной пазухи;
- Этмоидит — возникает при воспалении ячеек решётчатой кости;
- Сфеноидит — возникает при воспалении клиновидной пазухи.

Гайморит является наиболее часто встречающимся заболеванием и придаточных пазух носа. Все методики лечения гайморита подбираются индивидуально, после консультации врача-лора.
Причины синусита и гайморита
Причины гайморит и синусита- Вирусы. Вирусы вызывают 90 — 98% случаев острого синусита. Типичный процесс, ведущий к острому синуситу или гаймориту, начинается с вирусной простуды. У большинства людей с простудой встречается воспаление пазух. Эти воспаления, как правило, краткие и слабо выражены, и лишь у очень немногих заболевших простудой развивается истинный синусит. Но в тоже время, простуда и грипп вызывает воспаление, повышение продукции секрета слизистых желез и застой в носовых раковинах, так называемый ринит, что приводит к обструкции в пазухах. Ринит всегда сопровождает синусит, поэтому синусит также называют риносинусит.
- Бактерии. Небольшой процент случаев острого синусита и, возможно, хронические синуситы, вызваны бактериями. Бактерии обычно присутствуют в носовых проходах и в горле и, как правило, безвредны. Однако на холоде или при вирусной инфекции верхних дыхательных происходит блокировка носовых проходов, нарушение естественного очищения околоносовых пазух и застой секрета внутри синусов, что дает благодатную почву для размножения болезнетворных бактерий, а так же золотистый стафилококк наиболее часто связаны с острым синуситом. Эти бактерии также другие штаммы, также связаны с хроническим синуситом. Бактериальный синусит обычно вызывает более серьезные симптомы и длится дольше, чем вирусный синусит.
- Грибки. Аллергическая реакция на плесневые грибки является причиной некоторых случаев хронического риносинусита. Аспергилл является наиболее распространенным грибком, связанным с синуситом. Грибковые инфекции также могут возникать у пациентов со здоровой иммунной системой, но они гораздо менее распространены.
Искривление носовой перегородки — Аллергия, астма, и иммунный ответ. Аллергия, астма и синуситы часто пересекаются. Сезонный аллергический ринит и другие аллергии, которые вызывают насморк, предрасполагают к развитию синусита. Многие из иммунных факторов, наблюдаемых у людей с хроническим синуситом, напоминают те, которые появляются при аллергическом рините. Астма также тесно связана с синуситом и у большинства пациентов эти заболевания протекают параллельно. Некоторые исследования показывают, что синусит может ухудшить симптомы астмы.
Аллергия, астма и синуситы часто пересекаются. Сезонный аллергический ринит и другие аллергии, которые вызывают насморк, предрасполагают к развитию синусита. Многие из иммунных факторов, наблюдаемых у людей с хроническим синуситом, напоминают те, которые появляются при аллергическом рините. Астма также тесно связана с синуситом и у большинства пациентов эти заболевания протекают параллельно. Некоторые исследования показывают, что синусит может ухудшить симптомы астмы.
- Структурные аномалии носовых проходов. Структурные аномалии в носу могут привести к застою секрета внутри синусов и тем самым увеличить риск хронических синуситов. Такие аномалии включают в себя:
— Полипы – небольшие доброкачественные образования в носовом проходе, которые создают препятствие для естественного дренажа секрета и ограничивают приток воздуха. Полипы могут возникнуть сами по себе в результате предыдущей инфекции пазух, которая вызвала разрастание носовых мембран.
— Увеличенные аденоиды могут привести к синуситу. Аденоиды — ткани, расположенные высоко на задней стенке глотки. Они состоят из лимфоидной ткани, которая призвана «ловить» и уничтожать болезнетворные микроорганизмы, попадающие в носоглотку из воздуха.
Специалисты лор отделения рекомендуют не откладывать проблемы со здоровьем и незамедлительно обратиться к врачу.
28.08.2019
Стафилококк в горле и в носу
Стафилококк в горле представляет собой наличие на слизистой этой области определенного вида бактерий, способных вызывать разнообразные гнойно-воспалительные процессы. Науке известно более 20 разновидностей этих бактерий, причем значительная их часть постоянно присутствует в микрофлоре каждого человека на слизистых оболочках, в частности горла и носа.
Многие стафилококки при этом абсолютно безвредны, и лишь три их вида способны спровоцировать развитие каких-либо заболеваний. Самой распространенной из них считается такая бактерия как золотистый стафилококк. Она не представляет никакой опасности для человека до тех пор, пока не произойдет ослабление иммунной защиты организма.
Она не представляет никакой опасности для человека до тех пор, пока не произойдет ослабление иммунной защиты организма.
Лечение стафилококковых заболеваний горла и носа напрямую зависит от симптомов, и заключается в использовании антибактериальных лекарственных препаратов, а также бактериофагов и иммуномодуляторов.
Почему возникает стафилококк в горле?
Причины возникновения стафилококковой инфекции в горле и носу
В окружающей среде живет огромное множество различных патогенных и непатогенных бактерий, часть из которых обитает на коже человека. На первых минутах жизни (сразу после рождения) кожу, пищеварительный тракт и органы дыхания ребенка заселяет различная микрофлора, в основном та, которая присутствует у матери.
Золотистый стафилококк считается самым патогенным микроорганизмом. Однако это не мешает ему обитать на человеческой коже, слизистой оболочке и в кишечнике.
Золотистый стафилококк в горло проникает из внешней среды через дыхательные пути либо из внутренних очагов инфекции при хроническом тонзиллите, хроническом синусите, хроническом бронхите и трахеите, при кариесе, зубном камне.
Пути заражения золотистым стафилококком
Заразиться данным видом инфекции возможно несколькими способами, к которым относятся:
- Контактный путь заражения, когда стафилококк попадает в горло через предметы гигиены или грязные руки.
- Воздушно-капельно, когда патологические бактерии ауреус проникает в носоглотку посредством дыхательной деятельности, с воздухом, содержащим данную бактерию. Золотистый стафилококк в подобных случаях в больших количествах выделяется больными людьми либо носителями в процессе кашля, разговора или чихания.
- Воздушно-пылевым путем, когда в носоглотке стафилококк оседает вместе с частичками пыли, которая находится в воздухе и в предметах окружающего пространства, особенно на полу, предметах мебели, одежде, где данная бактерия сохраняет свои болезнетворные свойства в период до полугода.
 Как еще возникает золотистый стафилококк в горле?
Как еще возникает золотистый стафилококк в горле? - Пищевой путь, когда данный микроорганизм проникает внутрь человеческого организма при употреблении некоторых продуктов питания. Развитию стафилококковых инфекций способствует недостаточная термообработка мясных блюд, некачественно вымытая посуда и грязные руки во время приготовления либо употребления пищи. Поэтому необходимо тщательно соблюдать правила гигиены при кормлении грудью детей, а также санировать очаги инфекции в организме, чтобы не заразить ребенка стафилококком.
- Вертикальный путь, когда стафилококковая инфекция проникает в носоглотку ребенка при заглатывании околоплодных вод, инфицированных данным возбудителем, либо при прохождении по родовым путям.
- Ятрогенный, когда стрептококки и стафилококки в горле и носу оказываются из-за несоблюдения санитарных норм при проведении разнообразных инвазивных диагностических либо лечебных манипуляций.
Аутоинфекция
Кроме этого, существует так называемая аутоинфекция, которая представляет собой переход от бессимптомного носительства возбудителя в заболевание при воздействии некоторых неблагоприятных факторов. Эти факторами могут являться:
- Ослабление функций иммунной защиты организма.
- Самостоятельно применение антибактериальных медикаментозных препаратов, следствие которого стал дисбактериоз кишечника либо слизистой носоглотки.
- Микротравмы данной области.
- Общее переохлаждение.
- Психоэмоциональное перенапряжение.
- Голодание и т. д.
Итак, способов заражения различными видами инфекций, поражающих носоглотку, немало, тем не менее избежать инфицирования возможно, если соблюдать элементарные правила, касающиеся осуществления личной гигиены и здорового образа жизни. Немаловажным аспектом здесь является иммунитет, который способен устранить любое вредоносное вторжение в организм извне, поэтому крайне важно его укреплять.
Симптомы
Стафилококк в горле можно заметить по некоторым основным симптомам, которые наиболее характерны при заболеваниях, которые он вызывает. Основными проявлениями этого является:
Основными проявлениями этого является:
- Першение и ощущение сухости в полости носоглотки.
- Болевой синдром в горле, который нарастает в процессе глотания.
- Охриплость голоса и легкий невыраженный кашель.
- Сильное повышение температуры.
Разновидности стафилококковой инфекции
Развитие стафилококка в носу и горле может происходить абсолютно бессимптомно, однако в большинстве случаев наблюдаются различные формы воспаления в верхних дыхательных путях. К ним относятся:
- Тонзиллит — воспалительный процесс, развивающийся в тканях миндалин.
- Фарингит – воспаление слизистой оболочки гортани и носа.
- Ларингит – патологический процесс, который характеризуется воспалением голосовых связок.
Каждая из вышеперечисленных форм заболевания проявляется в виде отдельного комплекса симптомов, которые имеют более выраженный характер в детском возрасте, чем во взрослом.
Стафилококковый тонзиллит
Данное заболевание протекает в виде следующих явлений:
- Выраженный красный цвет миндалин.
- Образование гнойных наслоений на миндалинах белого или желтого цвета.
- Болевой синдром. Боль может переходить в ушные ходы или шею и резко усиливается во время глотания, что может вызвать снижение аппетита.
- Выраженная лихорадка и головная боль, сильное недомогание, озноб и другие проявления интоксикации.
- Лимфоаденопатия, затрагивающая шейные лимфоузлы.
Стафилококковый фарингит
Стафилококк в горле и данное заболевание соответственно проявляется следующим образом:
- Покраснение и отечность задней стенки носоглотки.
- Наслоения на ней в виде слизистого либо гнойного налета.
- Першение в горле.
- Сухой кашель.
- Охриплость.
- Повышение температуры, слабость, явления озноба и лихорадки.
Стафилококковый ларингит
Во время развития данной патологии больные могут жаловаться на следующие симптомы:
- Боли в груди.

- Сухость слизистой в области гортани и першение.
- Потеря голоса либо выраженная охриплость.
- Повышение температуры до субфебрильных показателей, озноб, интоксикация.
Диагностика стафилококковых инфекций
Симптомы размножения в носоглотке стафилококков не считаются специфическими, поэтому невозможно поставить диагноз «стафилококковая инфекция» без специальных исследований. Из-за лечить подобные заболевания носоглотки следует только после того, как возбудитель патологии будет идентифицирован. С этой целью применяются бактериоскопические, бактериологические и серологические методы лабораторной диагностики.
Самым распространенным методом определения стафилококка у взрослых в горле является мазок. Биологический материал подвергается исследованию под микроскопом, потом осуществляется высевание на питательную среду с целью получения колонии бактерий. Если стафилококк присутствует через сутки после данного посева, появляются специфические колонии бактерий бело-желтого цвета.
При серологических исследованиях используют бактериофаги, которые подразделяются на четыре основных группы. При положительном тесте стафилококк убивает бактериофаг. Он применяется редко в силу своей неточности и низкой информативности.
Лечение стафилококка в горле
Терапевтические методы по устранению подобного патологического процесса, протекающего в области носоглотки, должны определяться исключительно специалистами, поскольку некомпетентное лечение может привести к возникновению устойчивости стафилококковой инфекции к определенным антибактериальным лекарственным препаратам.
При лечении стафилококка в горле у взрослого необходимо добиться следующих целей:
- Подавить активность возбудителя заболевания, в частности, стафилококка.
- Восстановить структурные характеристики слизистой оболочки полости носа и глотки.
- Стимулировать функционирование иммунной защиты организма.
Для подавления размножения стафилококковой инфекции используются, как правило, различные противомикробные медикаментозные средства, а именно:
- Системные антибиотики – «Кларитромицин», «Клиндамицин», «Цефотаксим», «Амоксиклав» и другие, применение которых возможно при распространении стафилококковой инфекции в другие отделы организма, а также при тяжелом ее течении.

- Противостафилококковый либо комплексные бактериофаги, которые дополняют основную антибактериальную терапию. Подобные лекарственные препараты представляют собой вирусы, которые способны поражать стафилококки. К примеру, комплексный бактериофаг содержит в себе вирусы от стафилококка, стрептококка и клебсиеллеза. В качестве монотерапии данное средство может применяться в детском возрасте. Что еще предполагает лечение стафилококка в носу и горле?
- Иммуномодуляторы, применение которых является важной частью противостафилококкового лечения. К таким медикаментам относятся: «Противостафилококковый иммуноглобулин», «ИРС-19», «Тактивин», «Рибомунал», «Полудан» и другие.
Прием всех данных лекарственных средств проводится, как правило, в течение острого периода инфекционного заболевания, а после этого – в уменьшенных дозах на протяжении двух недель после исчезновения симптомов.
Можно ли вылечить золотистый стафилококк у взрослого в горле средствами народной медицины?
Лечение народными средствами
Вылечить патологии, вызванные данным возбудителем, только при помощи народных методов невозможно. Тем не менее, они могут эффективно дополнить классическую терапию, облегчив симптомы и значительно ускорив выздоровление.
К таким средствам можно отнести:
- Абрикосы и смородину, которые содержат аскорбиновую кислоту, антиоксиданты, пектин и многие другие полезные вещества.
- Настой шиповника.
- Отвар корней лопуха либо эхинацеи. Средство применяется, как правило, для полоскания горла.
- Настой тимьяна, почек березы и листьев тысячелистника.
Местное лечение заболеваний, вызванных стафилококком
Локально бороться со стафилококковой инфекцией носоглотки помогают следующие медикаментозные средства:
- «Хлорофиллипт»;
- «Хлоргексидин»;
- «Тантум Верде»;
- «Гексорал»;
- «Мирамистин».
Таким образом, мы разобрались в том, какие заболевания в горле и носу вызывает стафилококк. Также рассмотрели медикаментозные средства и народные методы для борьбы с инфекцией. Важно понимать, что при возникновении первых симптомов болезни необходимо сразу же обращаться к врачу. Самолечение чревато последствиями.
Также рассмотрели медикаментозные средства и народные методы для борьбы с инфекцией. Важно понимать, что при возникновении первых симптомов болезни необходимо сразу же обращаться к врачу. Самолечение чревато последствиями.
границ | Антимикробное лечение Staphylococcus aureus у пациентов с муковисцидозом
Введение
Золотистый стафилококк — это повсеместный комменсальный патоген человека. Он обычно выделяется у пациентов с муковисцидозом (CF) и считается одной из основных причин рецидивирующих острых легочных инфекций и прогрессирующего снижения функции легких, которые характеризуют это наследственное опасное для жизни мультисистемное заболевание (Cogen et al., 2015). Однако истинная роль с.aureus у пациентов с МВ до конца не изучен (Hurley, 2018). Дифференциация инфекции S. aureus (т.е. присутствие S. aureus в дыхательных путях, связанное со значительными респираторными симптомами) от простой колонизации S. aureus (т.е. присутствие S. aureus в дыхательных путях без любое клиническое проявление) у пациентов с МВ часто невозможно.
В отличие от того, что было продемонстрировано для Pseudomonas aeruginosa (Lund-Palau et al., 2016), окончательно не известно, является ли предотвращение колонизации S. aureus эффективной и безопасной мерой для снижения риска ранних легочных инфекций (Smyth and Rosenfeld, 2017). Более того, хотя существует общее мнение о том, что антибиотики необходимо назначать для лечения острых инфекций S. aureus (Akil and Muhlebach, 2018), неизвестно, какой вид терапии является наиболее эффективным для снижения риска хронического S. aureus , особенно когда метициллин-устойчивый S.aureus (MRSA) являются возбудителями (Muhlebach, 2017). Наконец, когда происходит персистирование S. aureus в дыхательных путях, нет единого мнения о том, как лучше всего уничтожить S. aureus из легких (Ahmed and Mukherjee, 2018). Основная цель этого повествовательного обзора — обсудить современные знания о роли S. aureus у пациентов с МВ.
Носительство
Staphylococcus aureus у здоровых субъектов и у пациентов с МВ
S.aureus — обычное явление у здоровых людей. Колонизация происходит в первые дни жизни, так как более чем у 70% новорожденных базальные культуры положительны на этот патоген. Более того, примерно 45% младенцев постоянно колонизируются в течение первых 8 недель после рождения (Peacock et al., 2003). Носительство S. aureus снижается с возрастом, но остается значительным даже у подростков и взрослых, среди которых установлено, что 30% или более являются носителями (Kenner et al., 2003; Anwar et al., 2004; Бишофф и др., 2004; Leman et al., 2004). Частота обнаружения носительства строго зависит от метода сбора респираторного секрета. Традиционно используются только мазки из носа, но было показано, что немаргинальное число субъектов несет S. aureus в ротоглотке. Следовательно, более высокая частота носительства показана при одновременном сборе мазков из носа и глотки. Эспозито и др. (Esposito et al., 2014) изучили 497 здоровых людей в возрасте 6-17 лет и обнаружили, что 264 (53.1%) были носителями S. aureus : 129 (25,9%) ротоглоточных носителей и 195 (39,2%) носителей носа, из которых 60 (12,1%) были ротоглоточными и назальными носителями. Все эти данные свидетельствуют о том, что вероятность положительного результата мазка из носа или ротоглотки на S. aureus , точно отражающего этиологию инфекции нижних дыхательных путей, мала и что использование мазков из носа / ротоглотки для выявления S. aureus легких инфекции могут привести к неверным результатам со значительным завышением.
Однако дифференциация простых носителей от истинно инфицированных пациентов кажется еще более сложной задачей у пациентов с МВ, поскольку частота носительства у этих субъектов была выше, чем у лиц без МВ. Сравнение мазков из мазков и культур бронхоальвеолярного лаважа S. aureus , проведенное у детей с МВ <5 лет, показало, что положительная прогностическая ценность мазков составила только 64% (Rosenfeld et al., 1999). Некоторые факторы могут объяснить более высокую тенденцию пациентов с МВ достигать S.носители aureus . Младенцы с МВ имеют более раннее присутствие S. aureus в носоглотке, чем здоровые люди из контрольной группы, вероятно, потому, что у них есть дефект защиты от бактерий, которые могут способствовать колонизации дыхательных путей (Prevaes et al., 2016). Свидетельства того, что свиньи с МВ при заражении бактериальными патогенами развивают заболевание легких и обнаруживают дефектную бактериальную эрадикацию при рождении, убедительно подтверждают эту гипотезу (Stoltz et al., 2010). Более того, в отличие от других бактерий, S. aureus может очень хорошо расти при анаэробиозе, состоянии, совместимом с экосистемой МВ, где снижение мукоцилиарного транспорта, стойкая гиперсекреция слизи и увеличенная высота слизистого слоя просвета приводят к развитию значительных гипоксических состояний. в слизистых пробках (Goss, Muhlebach, 2011).Однако, в отличие от того, что происходит у здоровых субъектов, которые в большинстве случаев, хотя и являются носителями, остаются бессимптомными (Wertheim et al., 2005), у пациентов с МВ наблюдается ранняя и стойкая колонизация S. aureus , особенно при небольших вариантах колоний ( SCVs) могут быть связаны со значительно худшим респираторным исходом (Wolter et al., 2013). Более того, приобретение de novo S. aureus в возрасте 3 лет было связано с развитием большего числа бронхоэктазов и более низким FEF25–75%, прогнозируемым через 5–7 лет (Caudri et al., 2018).
Риск того, что колонизация S. aureus может привести к развитию инфекций с быстрым структурным и функциональным ухудшением нижних дыхательных путей, объясняет, почему профилактика колонизации S. aureus считается потенциальной мерой для защиты детей с МВ с первых месяцев жизни.
Профилактика
золотистого стафилококка Колонизация
Антистафилококковая профилактика антибиотиками узкого спектра действия, такими как флуклоксациллин, рекомендуется в Великобритании от диагностики в неонатальном периоде до конца третьего года жизни с возможным продлением до 6 лет (Национальный институт здравоохранения и качества ухода, 2017 г.).Эта рекомендация подтверждается результатами некоторых исследований, проведенных несколько лет назад. Было показано, что профилактика цефалексином в течение 2 лет при амбулаторном ведении пациентов с МВ, колонизированных S. aureus , была связана со значительным сокращением числа респираторных заболеваний, госпитализаций по поводу респираторных проблем и использования антибиотиков по сравнению с пациентами, получавшими плацебо ( Loening-Baucke et al., 1979). Более того, в течение 24 месяцев Weaver et al. (Weaver et al., 1994) наблюдали за группой детей с МВ, получавших с первых недель жизни непрерывный пероральный прием флуклоксациллина или эпизодические противомикробные препараты в соответствии с клиническими показаниями.Они обнаружили, что дети, которым не проводилась профилактика, имели более частый кашель и большее количество изолятов S. aureus в мокроте, чем младенцы, получавшие профилактику. Более того, дети с МВ чаще госпитализировались и оставались в больнице дольше, чем пациенты, принимавшие флуклоксациллин.
Однако более поздние исследования вызвали сомнения как в эффективности, так и в безопасности профилактики. Проблемы, связанные с профилактикой, подчеркиваются выводами Кокрановского обзора, в котором были проанализированы четыре исследования, опубликованные до сентября 2016 г. (Smyth and Rosenfeld, 2017).Профилактика началась в раннем младенчестве и продолжалась до 6 лет, не вызвала значительных побочных эффектов и снизила количество детей с одним или несколькими изолятами S. aureus в течение периода исследования. Однако постоянное введение антибиотиков не привело к какому-либо истинному клиническому преимуществу. Не было обнаружено различий между леченными и нелеченными детьми в отношении функции легких, питания, госпитализации и дополнительных курсов антибиотиков. Более того, нельзя исключать, что антибиотикопрофилактика может вызвать повышенный риск заражения P.aeruginosa приобретение. Объединение данных из четырех исследований продемонстрировало тенденцию к более низкому кумулятивному уровню изоляции P. aeruginosa в группе профилактики через 2 и 3 года и тенденцию к более высокому уровню от 4 до 6 лет.
Кроме того, предел отсутствия информации об истинной эффективности и безопасности профилактики S. aureus не был решен по результатам ряда исследований, не включенных в ранее цитируемый метаанализ. Результаты были явно противоречивыми.Введение амоксициллина-клавуланата оказалось неэффективным как при заражении S. aureus , так и при P. aeruginosa (Douglas et al., 2009). Длительное использование противостафилококковых препаратов, в основном пероральных цефалоспоринов, уменьшило колонизацию S. aureus на , но было связано с повышенным риском заражения P. aeruginosa на (Ratjen et al., 2001). Наконец, наиболее обескураживающий вывод об использовании S. aureus для профилактики сделан из результатов исследования, в котором данные, собранные в Великобритании, где была рекомендована профилактика, сравнивались с данными, собранными в США, где применялись только антибиотики. периодически по мере необходимости (Hurley et al., 2018). В общей сложности 1074 ребенка из Великобритании и 3677 детей с МВ были набраны с рождения или с момента их первого обследования и наблюдались до достижения 4-летнего возраста. Более раннее приобретение S. aureus и P. aeruginosa было зарегистрировано у детей в США, что свидетельствует о положительном эффекте профилактики. Однако, когда результаты, собранные в Великобритании, были проанализированы отдельно, было показано, что дети, получавшие флуклоксациллин, имели повышенный риск заражения P. aeruginosa (риск опасности [HR], 2.53; 95% доверительный интервал [CI], 1,71–3,74; p <0,001] и никаких преимуществ относительно приобретения S. aureus (HR 1,22; 95% ДИ 0,74–2,0; p = 0,43).
Однако, поскольку эффективность и безопасность антибиотикопрофилактики остаются спорными, Фонд муковисцидоза США не рекомендует назначать препараты против S. aureus для профилактики (Cystic Fibrosis Foundation, 2013).
Staphylococcus aureus Инфекция у больных МВ
В первое десятилетие жизни S.aureus — наиболее распространенный патоген, обнаруживаемый в дыхательных путях пациентов с МВ с респираторными симптомами. Лишь позже P. aeruginosa становится распространенным, хотя S. aureus по-прежнему играет важную роль в качестве причины обострений [Cystic Fibrosis Foundation (США), 2017]. Однако в последние годы распространенность инфекции S. aureus увеличилась, о чем свидетельствуют Razvi et al. (Razvi et al., 2009), которые проанализировали Реестр пациентов Фонда муковисцидоза США с 1995 по 2005 год и подсчитали, что в течение этого периода распространенность инфекций MSSA и MRSA прогрессивно увеличивалась (уровень инфицирования MSSA — 21.7% в 1995 г. и 33,2% в 2005 г .; Уровень инфицирования MRSA составил 0,1% в 1995 г. и 17,2% в 2005 г.).
Из-за выработки нескольких факторов вирулентности (Akil and Muhlebach, 2018) присутствие S. aureus в дыхательных путях связано со значительными изменениями в легких. Развитие соответствующей воспалительной реакции, которая более серьезна, чем воспалительная реакция на другие распространенные респираторные бактерии, и менее серьезна, чем реакция только на P. aeruginosa (Gangell et al., 2011), еще больше увеличивает повреждение структуры и функций легких. В жидкости бронхоальвеолярного лаважа детей с МВ с инфекцией S. aureus увеличивается количество клеток, а также уровни интерлейкина-8, ферментов нейтрофилов (миелопероксидаза и эластаза нейтрофилов) и маркеров окислительного стресса (Khan et al., 1995; Розенфельд и др., 2001; Бреннан и др., 2005; Слай и др., 2009). Хотя за некоторыми исключениями (Thomas et al., 1998; Miall et al., 2001; Sawicki et al., 2008), исследования показали, что повреждение легких больше, а смерть наступает чаще и раньше, когда штаммы MRSA являются причиной инфекция.Ren et al. (Ren et al., 2007) оценили объем форсированного дыхания за 1 секунду (ОФВ1) у 1834 пациентов с МВ, положительных только на S. aureus , в соответствии с присутствием MRSA или MSSA в их респираторном секрете. У всех субъектов, независимо от возраста, ОФВ1 был значительно ниже у пациентов с MRSA, чем у пациентов с MSSA ( p <0,001). Более того, вероятность госпитализации и лечения антибиотиками была значительно выше у пациентов с MRSA по сравнению с пациентами с MSSA.Однако функция легких снижается быстрее, когда инфекция MRSA сохраняется, а не в случаях обнаружения инцидента. За двухлетний период Sawicki et al. (Sawicki et al., 2008) не обнаружили изменений в прогнозируемой скорости снижения ОФВ1% у пациентов с случайным обнаружением MRSA. Напротив, Dasenbrook et al. (Dasenbrook et al., 2008), которые изучали 1732 человека в возрасте 8–21 лет с персистирующей инфекцией MRSA (≥3 культур MRSA), за которыми наблюдали в среднем 3,5 года, сообщили, что среднее снижение ОФВ1 у этих пациентов было на 43% больше. быстрее, чем у пациентов без MRSA (разница -0.62% прогнозируемых / год; 95% ДИ, от -0,70 до -0,54; р <0,001).
Влияние MRSA на смертность подчеркивается в исследовании, проведенном Dasenbrook et al. (Dasenbrook et al., 2010). Эти авторы ретроспективно проанализировали медицинские карты 19833 пациентов с МВ в возрасте от 6 до 45 лет, за которыми наблюдались в период с января 1996 года по декабрь 2006 года в США, чтобы сравнить выживаемость между пациентами с МВ с и без MRSA дыхательных путей. Смертность составила 18,3 смертей (95% ДИ, 17,5–19,1) на 1000 пациенто-лет у пациентов без MRSA и 27.7 смертей (95% ДИ, 25,3–30,4) на 1000 пациенто-лет у пациентов с MRSA. После корректировки на изменяющиеся во времени ковариаты, связанные с тяжестью заболевания, было обнаружено, что MRSA связан с более высоким риском смерти (95% ДИ, 1,11–1,45). С другой стороны, важность MRSA как причины смерти, по-видимому, подтверждается данными о том, что, когда MRSA удаляется из дыхательных путей, риск смерти возвращается к аналогичным уровням, обнаруженным у MSSA-положительных пациентов.
Все эти находки объясняют, почему уничтожение S.aureus из дыхательных путей пациентов с МВ в настоящее время считается важным для ограничения негативного развития структуры и функций легких. Однако для достижения этой цели кажется обязательным не только назначать эффективное лечение антибиотиками, но и, по возможности, вмешиваться в факторы, способствующие сохранению S. aureus и развитию хронической инфекции.
Факторы, связанные с персистенцией
Staphylococcus aureus у пациентов с МВ
Несколько факторов риска стойкости S.aureus у людей с МВ. Устойчивость MRSA была связана с получением помощи в центре CF с повышенной распространенностью MRSA, наличием недостаточности поджелудочной железы, диабетом, связанным с CF, и количеством госпитализаций в год (Akil and Muhlebach, 2018). Однако наиболее важной причиной, по-видимому, является способность патогена развивать адаптивные механизмы, которые позволяют ему противостоять давлению антибиотиков и защитным силам хозяина. Описаны трансформация в SCV, рост в анаэробных условиях, образование биопленок и развитие изолятов-персистеров.Хотя существуют различия в зависимости от субстрата, используемого для культивирования, или способности расти при CO 2 (Gomez-Gonzalez et al., 2010), SCV S. aureus обычно характеризуются мутациями в метаболических генах, которые вызывают дефицит роста. и подавленная, но не исключенная активность α-цитотоксина. Это позволяет патогену жизнеспособно сохраняться внутри клеток-хозяев. Однако, когда происходит лизис клетки-хозяина, внутриклеточный S. aureus снова становится внеклеточным и может проникать в соседнюю ткань.Это объясняет, почему SCV часто можно получить у пациентов, страдающих рецидивирующими и резистентными к терапии инфекциями. Наконец, поскольку SCV выглядят как маленькие гладкие колонии с медленным ростом на культуральной чашке, их трудно обнаружить, и их часто не замечают или неправильно идентифицируют (Kahl et al., 2016).
Однако при использовании правильных условий культивирования SCV могут быть обнаружены у определенного числа пациентов с МВ. В 34-месячном проспективном исследовании было обнаружено, что SCV могут быть идентифицированы отдельно или в сочетании с нормальным S.aureus , в одной трети случаев и у большинства пациентов эти варианты оставались в дыхательных путях в течение длительного времени, до 31 месяца (Kahl et al., 1998). Наличие SCV связано с персистирующей инфекцией, ухудшением функции легких, устойчивостью к нескольким антибиотикам и коинфекцией P. aeruginosa (Besier et al., 2007; Schneider et al., 2008; Wolter et al., 2013).
Что касается чувствительности к антибиотикам, большинство SCV являются MRSA. В недавнем исследовании (Suwantarat et al., 2018), проведенного в США с июля по декабрь 2014 г., в котором было проанализировано 483 образцов дыхательных путей с положительным результатом на S. aureus , было показано, что пациенты с SCV MRSA чаще (93%) имели стойкую инфекцию MRSA (≥4 MRSA -положительные респираторные культуры за предыдущие 18 месяцев), чем таковые с не-SCV-MRSA (39%, p <0,001). Более того, респираторная функция у пациентов с SCV MRSA была хуже, чем у пациентов с не SCV-MRSA, о чем свидетельствует статистически значимое более низкое среднее прогнозируемое значение FEV1% ( p <0.001), а использование триметоприма / сульфаметоксазола (TMP / SMX) и тетрациклинов было выше ( p <0,001 и p <0,004, соответственно). Наконец, хотя 100% SCV были чувствительны к ванкомицину и цефтаролину, большинство из них были очень чувствительны к линезолиду (86%), рифампицину (86%) и тетрациклину (86%), а также к клиндамицину, TMP / SMX, эритромицину. , а моксифлоксацин (4%) был плохим (18%, 18%, 4% и 4% соответственно). Более того, немаргинальное количество изолятов имело минимальную ингибирующую концентрацию ванкомицина (МИК) 2 мкг / дл, что находится на верхнем пределе диапазона чувствительности (Chen et al., 2014).
Возникновение SCV зависит от нескольких факторов, включая предыдущее воздействие антибиотиков и коинфекцию P. aeruginosa . Besier et al. (Besier et al., 2007) сообщили, что предыдущее лечение TMP / SMX было независимым фактором риска для выявления SCV. Аналогичные результаты были получены Schneider et al. (Schneider et al., 2008), которые показали, что носители SCV S. aureus предварительно лечились чаще и в течение более длительных периодов системными аминогликозидами ( p = 0.02) и TMP / SMX ( p = 0,001).
S. aureus / P. aeruginosa относительно часто встречается у пациентов с МВ. Несколько исследований показали, что SCV чаще обнаруживаются в случаях коинфекции, чем когда только S. aureus выявляется в респираторных секретах (Kahl et al., 1998; Besier et al., 2007; Schneider et al., 2008). Это открытие считается следствием стратегии выживания, использованной S. aureus для преодоления негативных эффектов нескольких экзопродуктов, секретируемых P.aeruginosa (Hotterbeekx et al., 2017). Исследования in vitro показали, что такие молекулы, как 4-гидрокси-2-гептилхинолин N -оксид (HQNO) (Hoffman et al., 2006) и пиоцианин (Tashiro et al., 2013), продуцируемые P. aeruginosa ингибируют систему цитохрома, препятствуя окислительному дыханию и росту S. aureus и способствуя образованию SCV (Filkins et al., 2015). Это открытие четко подчеркивает важность эффективной профилактики и лечения P.aeruginosa , чтобы снизить риск образования SCV и выявить более серьезные проблемы при лечении S. aureus . После индукции SCV происходят дальнейшие метаболические изменения в S. aureus . Эти изменения способствуют внутриклеточной персистенции S. aureus (Atalla et al., 2011) и его тенденции к образованию биопленок (Mitchell et al., 2010). Поскольку большинство препаратов, используемых для лечения бактериальных инфекций у пациентов с МВ, остаются во внеклеточном пространстве и не обладают значительной внутриклеточной бактерицидной активностью, внутриклеточные SCV не уничтожаются, и возникает хроническая инфекция.Более того, SCV остаются потенциально способными вызывать острую инфекцию, особенно когда клетки рассеиваются из биопленки, что может привести к распространению патогенов (Moormeier and Bayles, 2017; Akil and Muhlebach, 2018).
Образование биопленок дополнительно способствует сохранению инфекций и риску обострения, потому что включение бактерий в матрицу на основе полимера снижает эффективность защиты хозяина и активность антибиотиков. Антитела и макрофаги плохо проникают в структуру биопленки, а патогены, включенные в биопленки, имеют пониженную восприимчивость.Более того, они выживают при высоких концентрациях антибиотиков, хотя протестированная МИК не меняется (Waters et al., 2016).
Развитие клеток-персистеров является последним фактором, который может объяснить хроническую инфекцию S. aureus и рецидивирующие обострения у пациентов с МВ. Персистентность — это способность патогена переносить смертельные дозы антибиотиков, несмотря на отсутствие генетических изменений (Brauner et al., 2016). Персистирующие клетки представляют собой спящие или фенотипические варианты, которые обычно присутствуют в общей популяции данного бактериального патогена и могут постепенно отбираться в результате повторного лечения антибиотиками, которые уменьшают нормальные штаммы и способствуют появлению персистеров.У пациентов с МВ это ясно продемонстрировано для P. aeruginosa (Smith et al., 2006), и предполагается, что это происходит даже для S. aureus.
Лечение острого и хронического
Staphylococcus aureus Инфекция у пациентов с МВ
Пациентов с МВ с S. aureus можно разделить на четыре разные группы: с первой или ранней инфекцией S. бессимптомные или симптоматические, а также пациенты с хроническими инфекциями, которые могут протекать в стабильных клинических условиях или с обострением респираторных заболеваний.
Лечение пациентов с МВ с их первой или ранней инфекцией S. aureus без симптомов обсуждается, потому что, как сообщалось ранее, практически невозможно отличить простую колонизацию от бессимптомной инфекции. Более того, ненужное введение антибиотиков может сопровождаться рядом проблем, включая появление устойчивости к антибиотикам и колонизацию P. aeruginosa .
Напротив, рекомендуется применение антибиотиков у пациентов с симптомами, а также лечение стабильных субъектов с хронической инфекцией, хотя окончательно не установлено, может ли лечение уничтожить S.aureus и изменить клиническое течение CF. Было предпринято несколько попыток прояснить эти проблемы, но результаты не позволяют сделать однозначных выводов, поскольку большинство исследований были неконтролируемыми сериями случаев, включали очень мало пациентов и использовали разные определения эрадикации S. aureus и схем лечения. .
До первых лет 1990-х годов, когда MRSA был редкостью, попытки лечения и искоренения S. aureus в основном основывались на комбинации двух антибиотиков из набора полусинтетического лекарственного средства, устойчивого к β-лактамазе (флуклоксациллин). или диклоксациллин), рифампицин и фузидиевая кислота.Курс антибиотиков продолжительностью 2–4 недели считался эффективным для большинства пациентов. Тем, кто не ответил, был рекомендован второй курс (Döring and Hoiby, 2004). Ретроспективное исследование, проведенное в Дании с участием 191 пациента с МВ и 2 349 курсов антибиотиков с 1965 по 1979 год, показало, что S. aureus можно было полностью удалить из мокроты в 74% случаев. Второй курс антибиотиков продолжительностью 2 или 4 недели был успешным у большинства оставшихся пациентов, о чем свидетельствует сохранение инфекции в течение 6 месяцев только в 9% случаев (Szaff and Høiby, 1982).
Подход к заражению S. aureus значительно усложнился с появлением MRSA. Хотя MRSA был идентифицирован во всем мире, частота обнаружения особенно высока в Азии, на Мальте, а также в Северной и Южной Америке (Stefani et al., 2012), где распространение этого патогена быстро увеличивается. В США, например, распространенность в 2017 г. составила 25,9% по сравнению с 2% в 1999 г. [Cystic Fibrosis Foundation (US), 2017]. Рост выявления MRSA недавно был также зарегистрирован в Европе, где несколько лет назад он не превышал 3% в большинстве стран (Goss and Muhlebach, 2011).Напротив, в 2016 году Европейский центр по контролю и профилактике заболеваний сообщил, что процент MRSA среди всех изолятов S. aureus был выше 25% в 7 из 29 стран Европейского Союза или Европейской экономической зоны (Европейский центр по профилактике и контролю заболеваний, 2018 г.).
Хотя ряд пациентов с их первой или ранней культурой, положительной на MRSA, могут избавиться от патогенов без терапии, потому что они просто колонизируются, в нескольких исследованиях оценивалось влияние антибиотиков на этих субъектов.Применялись пероральные и парентеральные антибиотики, иногда связанные с ингаляционными препаратами, такими как ванкомицин (Campbell et al., 2016); в большинстве случаев отмечен определенный положительный эффект (Garske et al., 2004; Macfarlane et al., 2007; Vanderhelst et al., 2013; Kappler et al., 2016; Muhlebach et al., 2017; Dolce et al. , 2019). Несколько примеров могут проиллюстрировать, какие протоколы использовались и какие результаты были получены. Открытое проспективное исследование недавно колонизированных пациентов в возрасте 0,6–39,6 лет, проведенное в Германии с января 2002 г. по декабрь 2012 г. (Kappler et al., 2016) показали, что длительная эрадикация, оцениваемая по микробиологическому статусу на третий год после первого обнаружения, может быть получена в 84% случаев (31/37 пациентов) с трехэтапным протоколом. Первоначально пациенты получали лечение в течение 3 недель двумя внутривенными (IV) антибиотиками, выбранными в соответствии с чувствительностью к патогенам. Также применялись гигиенические мероприятия и местная терапия в течение 5 дней. За этим первым этапом лечения последовал 6-недельный период с двойной пероральной антибиотикотерапией и ингаляцией ванкомицина.Наконец, каждое новое обнаружение MRSA лечилось 6-недельной ингаляцией ванкомицина и местной терапией в течение 5 дней. В рандомизированном контролируемом исследовании, проведенном в период с апреля 2011 г. по сентябрь 2014 г. в США (Muhlebach et al., 2017) у пациентов в возрасте 4–45 лет с их первым или ранним (≤2 положительных посевов в течение 3 лет) S. aureus инфекция, эрадикация была определена как отрицательная респираторная культура MRSA через 28 дней после рандомизации, а лечение основывалось на пероральном TMP / SMX или, если у пациента был сульфаллергический, миноциклин плюс пероральный рифампин, хлоргексидин для полоскания рта в течение 2 недель, назальный мупироцин и хлоргексидин салфетки для тела в течение 5 дней и обеззараживание окружающей среды в течение 21 дня.Эрадикация наблюдалась в 82% случаев, получавших антибиотики, и в 26% случаев в контроле. На 84-й день 55% леченых субъектов и только 10% контрольной группы остались MRSA-отрицательными. В итальянском рандомизированном контролируемом исследовании, проведенном в период с июля 2013 года по апрель 2016 года (Dolce et al., 2019), значительно более длительный период отсутствия MRSA в респираторном секрете (три отрицательных посева за 6 месяцев) считался показателем искоренения. Более того, хотя использовались те же антибиотики, которые были прописаны в исследовании в США, лечение проводилось в течение более длительного периода (21 день).Причем обеззараживание кожи и поверхностей не добавлялось. У пролеченных пациентов был продемонстрирован более низкий уровень положительности MRSA, хотя различия по сравнению с контролем не достигли статистической значимости. Однако, несмотря на некоторые положительные результаты, недавний Кокрановский обзор опубликованных исследований (Lo et al., 2018) пришел к выводу, что в настоящее время недостаточно доказательств в поддержку использования схем лечения, предложенных в этих исследованиях. С другой стороны, предлагаемые протоколы не были должным образом оценены с точки зрения воздействия на функцию легких, смертность и стоимость лечения.Более того, некоторые протоколы очень сложны и требуют полного соблюдения пациентом, а в случае детей — его семьей.
Было собрано очень мало данных о влиянии лечения антибиотиками у пациентов с МВ и стойким MRSA, и имеющиеся данные, по-видимому, указывают на то, что искоренение у этих субъектов очень сложно. В недавнем исследовании, проведенном в США в 2017 г. (Dezube et al., 2018), в котором участвовали 29 субъектов в возрасте ≥18 лет с хронической инфекцией MRSA, лечение основывалось на TMP / SMX или, при непереносимости, доксициклине, в связь с рифампицином в течение 28 дней.Добавлены актуальная дезактивация и экологическая очистка. Более того, все включенные пациенты были рандомизированы для получения либо ингаляционного ванкомицина, либо небулайзерного плацебо. Результаты были неудовлетворительными, поскольку лечение в целом было малоэффективным, а ингаляционный ванкомицин не увеличивал скорость эрадикации. Только в 20% случаев в обеих группах посев мокроты был отрицательным по MRSA в конце лечения и через 3 месяца.
У пациентов с хронической инфекцией MRSA, страдающих от обострения, лечение варьировалось в зависимости от тяжести заболевания.Анонимный перекрестный опрос аккредитованных Фондом МВ в США программ помощи (Zobell et al., 2015) показал, что амбулаторное лечение в 2013 году основывалось на пероральных препаратах. TMP / SMX был наиболее часто назначаемым антибиотиком как детям (38%), так и взрослым (34%). Комбинация с рифампицином использовалась в 10% случаев. Для стационарного лечения наиболее часто назначаемыми препаратами были линезолид (как внутривенно, так и перорально) и ванкомицин внутривенно. Эти препараты считаются препаратами выбора для лечения обострений S.aureus большинством экспертов (Mandell et al., 2007; Torres et al., 2009).
Обеспокоенность относительно антибиотиков, используемых для лечения
Staphylococcus aureus Инфекции у пациентов с МВ
Использование антибиотиков у пациентов с МВ заслуживает особого внимания, потому что у этих субъектов метаболизм лекарств в печени увеличивается, как и почечный клиренс. Это состояние означает, что во многих случаях дозировка лекарства должна быть увеличена, а уровни в сыворотке крови должны контролироваться, чтобы избежать риска токсичности.Например, рекомендуется увеличить дозу β-лактамов на 20–30% и контролировать плазменные концентрации аминогликозидов (Rey et al., 1998). Более того, часто пациенты с МВ одновременно получают несколько антибиотиков для лечения S. aureus и P. aeruginosa , которые часто заражают этих субъектов одновременно. Использование нескольких методов лечения увеличивает риск нежелательных явлений, связанных с антибиотиками, и негативного взаимодействия между лекарствами. Наконец, некоторые из антибиотиков, обычно используемых у пациентов с МВ, имеют ограничения, которые необходимо учитывать для обеспечения эффективного терапевтического результата.
Один из лучших примеров в этом отношении — ванкомицин. Этот препарат плохо проникает как в легкие, так и в биопленку (Cruciani et al., 1996), что может вызвать проблемы с эрадикацией MRSA, особенно когда МИК патогена находится в верхнем диапазоне чувствительности (van Hal et al., 2012 ). Однако рекомендуемая доза ванкомицина составляет 15 мг / кг каждые 8 часов, поскольку было продемонстрировано, что у взрослых эта доза обычно обеспечивает достижение фармакокинетических параметров [соотношение 24-часовой площади под кривой зависимости концентрации от времени ( AUC) до бактериального MIC ≥400 и минимальной концентрации 15–20 мкг / мл], которые были связаны с элиминацией чувствительного MRSA (Liu et al., 2011).
Однако, хотя фармакокинетика ванкомицина у взрослых с МВ аналогична фармакокинетике здоровых взрослых (Pleasants et al., 1996), это не относится к детям. У детей с МВ фармакокинетика ванкомицина различается, и рекомендуемая дозировка не всегда обеспечивает максимальную эффективность препарата. Средняя доза 17,4 ± 4,4 мг / кг привела к средней минимальной концентрации в сыворотке всего 10,1 ± 3,8 мг / л и средней суточной AUC только 282,5 ± 816,9 мг (Stockmann et al., 2013). Этот результат означает, что у детей необходимы более высокие дозы или постоянный мониторинг концентрации лекарственного средства для проверки достижения эффективных минимальных уровней.Напротив, использование только высоких доз требует мониторинга, поскольку ванкомицин нефротоксичен и более высокие, чем рекомендуемые минимальные уровни в сыворотке крови, связаны со значительной почечной недостаточностью (Carreno et al., 2014). Связь с другими нефротоксическими препаратами, такими как аминогликозиды, дополнительно указывает на необходимость мониторинга. Чтобы снизить риск неэффективности лечения или токсичности, рекомендуется непрерывная инфузия. Детей с обострением, которые не достигли адекватных минимальных уровней, несмотря на то, что им давали 15–19 мг / кг каждые 6 часов, успешно лечили непрерывной инфузией доз от 31 до 50 мг / кг / день без каких-либо значительных побочных эффектов (Fung, 2012) .
По сравнению с ванкомицином линезолид имеет то преимущество, что его можно вводить не только внутривенно, но и перорально. Однако дозировка, необходимая для лечения инфекций MRSA у пациентов с МВ, окончательно не установлена. У взрослых введение 600 мг два раза в день считается эффективным для эрадикации MRSA с МПК ≤1 мкг / мл, но кажется необходимым добавление третьей суточной дозы, когда МПК ≥2 мкг / мл (Keel et al. , 2011). Для детей с МВ эффективная дозировка не определена.В исследовании, в котором использовалась утвержденная доза 10 мг / кг три раза в день, было обнаружено, что ни один из участников не достиг целевых значений AUC / MIC ≥83 и что у более молодых пациентов были самые низкие значения AUC / MIC (Santos et al. ., 2009). Эти результаты, по-видимому, указывают на то, что для лечения инфекций MRSA у педиатрических пациентов, особенно у детей младшего возраста, необходимы более высокие дозы, чем рекомендованные. К сожалению, это предположение противоречит доказательствам того, что более высокие дозы линезолида связаны с немаргинальными желудочно-кишечными и гематологическими побочными эффектами (Chiappini et al., 2010).
Некоторые опасения были высказаны и в отношении других препаратов, обычно используемых для лечения инфекций, вызванных S. aureus . Тетрациклины, TMP / SMX и фузидиевая кислота обычно демонстрируют низкие уровни устойчивости in vitro (Champion et al., 2014) и широко использовались в попытке искоренить MSSA и MRSA (Muhlebach et al., 2017; Dolce et al., др., 2019). Однако тетрациклины нельзя применять у детей младше 8 лет из-за риска развития побочных эффектов (Smith et al., 2001). TMP / SMX, по-видимому, имеет разные фармакокинетические характеристики у пациентов с МВ, с более коротким периодом полувыведения и увеличенным общим временем выведения из организма (Reed et al., 1984), что предполагает необходимость увеличения суточной дозировки, но доз, соответствующих получить максимальный эффект не определено. Более того, данные об эффективности TMP / SMX при обострениях MRSA отсутствуют. Среди новых антибиотиков, эффективных против MRSA, цефтаролин использовался для лечения инфекций MRSA у пациентов с МВ.При исследовании фармакокинетических характеристик цефтаролина у детей и молодых людей с МВ было обнаружено, что по сравнению со здоровыми людьми цефтаролин имел значительно более низкий период полувыведения и требовал более высоких, чем рекомендуемые дозы, для достижения концентраций в крови> 60% от нормы. МИК MRSA у всех пациентов (Le et al., 2017; Barsky et al., 2018). В некоторых исследованиях сообщается, что цефтаролин может быть эффективным при лечении инфекций MRSA у пациентов, не страдающих МВ. Средняя частота клинического излечения у 379 пациентов составила 74% (Cosimi et al., 2017). Однако опыт лечения МВ крайне ограничен (Cannavino et al., 2016), а информация о безопасности и переносимости более высоких доз отсутствует. Клиндамицин не может быть рекомендован пациентам с МВ, поскольку было показано, что у пациентов с МВ распространенность индуцибельной устойчивости к клиндамицину значительно выше, чем у пациентов без МВ (48% против 8%; p <0,01) (Moore et al. др., 2008). Наконец, хотя новые липогликопептидные препараты оритаванцин (Stewart et al., 2017) и далбаванцин (Bouza et al., 2018) эффективны in vitro против S. aureus с множественной лекарственной устойчивостью, они не лицензированы для использования у детей и не могут быть рекомендованы для лечения пациентов с МВ, поскольку в настоящее время существует мало доказательств их использования при легочной инфекции.
Выводы
Несмотря на то, что доступность и использование лекарственных средств, эффективных против S. aureus , совпало со значительным улучшением прогноза заболевания легких у пациентов с МВ, что ясно свидетельствует о важности S.aureus , как использовать старые и новые препараты для достижения максимальной эффективности, точно не определено. Самой важной проблемой остается то, что высокая частота, с которой S. aureus переносится здоровыми субъектами, препятствует дифференциации простой колонизации от инфекции. Эта проблема особенно актуальна, когда обнаружение S. aureus происходит у детей без признаков и симптомов заболевания и объясняет, почему нет единого мнения о профилактическом использовании антибиотиков.
Более того, хотя эксперты рекомендуют антибиотики пациентам с МВ с симптомами и пациентам с постоянным обнаружением S. aureus , лучший подход к лечению антибиотиками не установлен. Точно не определено, какие препараты следует выбирать для лечения инфекций MRSA. Кроме того, требуется дополнительная информация о дозировке и продолжительности приема антибиотиков. Наконец, необходимо определить лучший способ окончательной оценки эффективности антибактериальной терапии, чтобы обеспечить пациентам с МВ лечение высочайшего уровня.
Вклад авторов
SE предложила проект и написала первый черновик рукописи; GP, VM и NPa критически отредактировали текст и внесли существенный научный вклад; LP провела анализ литературы; NPr был соавтором рукописи и руководил проектом. Все авторы одобрили окончательный вариант рукописи.
Финансирование
Это исследование было поддержано грантом Фонда Касса ди Риспармио ди Перуджа (№ 3368-2018).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
Ахмед, М. И., Мукерджи, С. (2018). Лечение хронической метициллин-чувствительной Staphylococcus aureus легочной инфекции у людей с муковисцидозом. Кокрановская база данных Syst. Ред. 7, CD011581. doi: 10.1002 / 14651858.CD011581.pub3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Акил, Н., Мухлебах, М. С. (2018). Биология и лечение метициллин-устойчивого Staphylococcus aureus при муковисцидозе. Pediatr. Пульмонол. 53, S64 – S74. doi: 10.1002 / ppul.24139
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Анвар, М. С., Джаффери, Г., Рехман Бхатти, К. У., Тайиб, М., Бохари, С. Р. (2004). Staphylococcus aureus и носительство MRSA через нос в общей популяции. J. Coll. Врачи Хирург. Пак. 14, 661–664.
PubMed Аннотация | Google Scholar
Аталла, Х., Джайлз, К., Маллард, Б. (2011). Staphylococcus aureus вариантов малых колоний (SCV) и их роль в заболевании. Anim. Health Res. Ред. 12, 33–45. doi: 10.1017 / S1466252311000065
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Barsky, E. E., Pereira, L. M., Sullivan, K. J., Wong, A., McAdam, A. J., Sawicki, G. S., et al. (2018). Фармакокинетика и фармакодинамика цефтаролина у пациентов с муковисцидозом. J. Cyst. Фиброс. 17, e25 – e31. doi: 10.1016 / j.jcf.2017.10.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Besier, S., Smaczny, C., Von Mallinckrodt, C., Krahl, A., Ackermann, H., Brade, V., et al. (2007). Распространенность и клиническое значение Staphylococcus aureus малых колоний при кистозном фиброзе легких. J. Clin. Microbiol. 45, 168–172. doi: 10.1128 / JCM.01510-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bischoff, W. E., Wallis, M. L., Tucker, Reboussin, B.A., Sherertz, R.J. (2004). Staphylococcus aureus носительство через нос в студенческом сообществе: распространенность, клональные отношения и факторы риска. Заражение. Control Hosp. Эпидемиол. 25, 485–491. doi: 10.1086 / 502427
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bouza, E., Valerio, M., Soriano, A., Morata, L., Carus, E.G., Rodríguez-González, C., et al. (2018). Далбаванцин в лечении различных грамположительных инфекций: практический опыт. Внутр. J. Antimicrob. Агенты 51, 571–577. doi: 10.1016 / j.ijantimicag.2017.11.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браунер, А., Фридман, О., Гефен, О., Балабан, Н.К. (2016). Различение устойчивости, толерантности и стойкости к лечению антибиотиками. Нац. Rev. Microbiol. 14, 320–330. doi: 10.1038 / nrmicro.2016.34
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Brennan, S., Hall, G. L., Horak, F., Moeller, A., Pitrez, P.M., Franzmann, A., et al. (2005). Взаимосвязь техники вынужденных колебаний у детей дошкольного возраста с кистозным фиброзом и воспалением легких. Грудь 60, 159–163. DOI: 10.1136 / thx.2004.026419
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэмпбелл, К. Т., Маккалеб, Р., Манаско, К. Б. (2016). Новые ингаляционные противомикробные препараты для пациентов с муковисцидозом. Ann. Фармакотер. 50, 133–140. doi: 10.1177 / 1060028015621916
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cannavino, C. R., Mendes, R. E., Sader, H. S., Farrell, D.J., Critchley, I.A., Biek, D., et al. (2016). Развитие устойчивого к цефтаролину MRSA у ребенка с муковисцидозом после многократного воздействия антибиотиков. Pediatr. Заразить. Дис. J. 35, 813–815. doi: 10.1097 / INF.0000000000001171
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Caudri, D., Turkovic, L., Ng, J., de Klerk, N.H., Rosenow, T., Hall, G. L., et al. (2018). Связь между Staphylococcus aureus и последующими бронхоэктазами у детей с муковисцидозом. J. Cyst. Фиброс. 17, 462–469. doi: 10.1016 / j.jcf.2017.12.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чемпион, Э. А., Миллер, М. Б., Попович, Э. Б., Хоббс, М. М., Сайман, Л., Мухлебах, М. С. (2014). Чувствительность к противомикробным препаратам и молекулярное типирование MRSA при муковисцидозе. Pediatr. Пульмонол. 49, 230–237. doi: 10.1002 / ppul.22815
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chen, S. Y., Liao, C.H., Wang, J. L., Chiang, W. C., Lai, M. S., Chie, W. C., et al. (2014). Специфические для метода характеристики тестов на чувствительность к ванкомицину МИК для прогнозирования смертности пациентов с метициллин-резистентной бактериемией Staphylococcus aureus . J. Antimicrob. Chemother. 69, 211–218. doi: 10.1093 / jac / dkt340
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chiappini, E., Conti, C., Galli, L., de Martino, M. (2010). Клиническая эффективность и переносимость линезолида у педиатрических пациентов: систематический обзор. Clin. Ther. 32, 66–88. doi: 10.1016 / j.clinthera.2010.01.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коген, Дж., Эмерсон, Дж., Сандерс, Д. Б., Рен, К., Шехтер, М. С., Гибсон, Р. Л. и др. (2015). Факторы риска снижения функции легких у большой группы молодых пациентов с муковисцидозом. Pediatr. Пульмонол. 50, 763–770. doi: 10.1002 / ppul.23217
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cosimi, R.А., Бейк, Н., Кубяк, Д. В., Джонсон, Дж. А. (2017). Цефтаролин при тяжелых метициллинрезистентных Staphylococcus aureus инфекциях: систематический обзор. Заражение открытого форума. Дис. 4, оф084. doi: 10.1093 / ofid / ofx084
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cruciani, M., Gatti, G., Lazzarini, L., Furlan, G., Broccali, G., Malena, M., et al. (1996). Проникновение ванкомицина в ткань легких человека. J. Antimicrob. Chemother. 38, 865–869.doi: 10.1093 / jac / 38.5.865
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dasenbrook, E. C., Checkley, W., Merlo, C. A., Konstan, M. W., Lechtzin, N., Boyle, M. P. (2010). Связь между устойчивостью к метициллину дыхательных путей Staphylococcus aureus и выживаемостью при муковисцидозе. JAMA 303, 2386–2392. doi: 10.1001 / jama.2010.791
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дасенбрук, Э. К., Мерло, К.А., Динер-Вест, М., Лехцин, Н., Бойл, М. П. (2008). Стойкий метициллин-устойчивый Staphylococcus aureus и скорость снижения ОФВ1 при муковисцидозе. г. J. Respir. Крит. Care Med. 178, 814–821. doi: 10.1164 / rccm.200802-327OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dezube, R., Jennings, M. T., Rykiel, M., Diener-West, M., Boyle, M. P., Chmiel, J. F., et al. (2018). Ликвидация стойкой метициллин-резистентной инфекции Staphylococcus aureus при муковисцидозе. J. Cyst. Фиброс. 19, 357–363. doi: 10.1016 / j.jcf.2018.07.005
CrossRef Полный текст | Google Scholar
Dolce, D., Neri, S., Grisotto, L., Campana, S., Ravenni, N., Miselli, F., et al. (2019). Эрадикация метициллин-резистентного Staphylococcus aureus у пациентов с муковисцидозом: рандомизированное многоцентровое исследование. PLoS One 14, e0213497. doi: 10.1371 / journal.pone.0213497
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Деринг, Г., Хойби, Н. (2004). Раннее вмешательство и профилактика заболеваний легких при муковисцидозе: европейский консенсус. J. Cyst. Фиброс. 3, 67–91. doi: 10.1016 / j.jcf.2004.03.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дуглас, Т. А., Бреннан, С., Гард, С., Берри, Л., Гангелл, К., Стик, С. М. и др. (2009). Приобретение и искоренение P. aeruginosa у детей раннего возраста с муковисцидозом. евро. Респир. J. 33, 305–311. DOI: 10.1183 / 036.00043108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Esposito, S., Terranova, L., Zampiero, A., Ierardi, V., Rios, W. P., Pelucchi, C., et al. (2014). Глотка и нос Staphylococcus aureus Носительство здоровыми детьми. BMC Infect. Дис. 14, 723. doi: 10.1186 / s12879-014-0723-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Филкинс, Л. М., Грабер, Дж. А., Олсон, Д. Г., Долбен, Э. Л., Линд, Л. Р., Бхуджу, С., и др. (2015). Совместное культивирование Staphylococcus aureus с Pseudomonas aeruginosa приводит S. aureus к ферментативному метаболизму и снижению жизнеспособности в модели кистозного фиброза. J. Bacteriol. 197, 2252–2264. doi: 10.1128 / JB.00059-15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Fung, L. (2012). Ванкомицин непрерывной инфузии для лечения метициллин-устойчивого Staphylococcus aureus у пациентов с муковисцидозом. Ann. Фармакотер. 46, е26. doi: 10.1345 / aph.1R272
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gangell, C., Gard, S., Douglas, T., Park, J., de Klerk, N., Keil, T., et al. (2011). Воспалительные реакции на отдельные микроорганизмы в легких у детей с муковисцидозом. Clin. Заразить. Дис. 53, 425–432. doi: 10.1093 / cid / cir399
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гарске, Л. А., Кидд, Т.J., Gan, R., Bunting, J.P., Franks, C.A., Coulter, C., et al. (2004). Рифампицин и фузидат натрия снижают частоту выделения устойчивых к метициллину Staphylococcus aureus (MRSA) у взрослых с муковисцидозом и хронической инфекцией MRSA. J. Hosp. Заразить. 56, 208–214. doi: 10.1016 / j.jhin.2003.12.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gomez-Gonzalez, C., Acosta, J., Villa, J., Barrado, L., Sanz, F., Orellana, M.A., и другие. (2010). Клиническая и молекулярная характеристика инфекций, вызванных CO 2 -зависимых малых колоний вариантов Staphylococcus aureus . J. Clin. Microbiol. 48, 2878–2884. doi: 10.1128 / JCM.00520-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hoffman, L. R., Déziel, E., D’Argenio, D. A., Lépine, F., Emerson, J., McNamara, S., et al. (2006). Селекция на вариантов Staphylococcus aureus с малыми колониями из-за роста в присутствии Pseudomonas aeruginosa . Proc. Natl. Акад. Sci. США 103, 19890–19895. doi: 10.1073 / pnas.0606756104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hotterbeekx, A., Kumar-Singh, S., Goossens, H., Malhotra-Kumar, S. (2017). In vivo и In vitro взаимодействия между Pseudomonas aeruginosa и Staphylococcus spp. Фронт. Клетка. Заразить. Microbiol. 7, 106. doi: 10.3389 / fcimb.2017.00106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hurley, M.Н., Фогарти, А., Маккивер, Т. М., Госс, К. Х., Розенфельд, М., Смит, А. Р. (2018). Выявление респираторных бактерий и профилактика антистафилококковыми антибиотиками у детей раннего возраста с муковисцидозом. Ann. Являюсь. Грудной. Soc. 15, 42–48. doi: 10.1513 / AnnalsATS.201705-376OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каль, Б. К., Беккер, К., Лёффлер, Б. (2016). Клиническое значение и патогенез вариантов малых колоний стафилококков при хронических инфекциях. Clin. Microbiol. Ред. 29, 401–427. doi: 10.1128 / CMR.00069-15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kahl, B., Herrmann, M., Everding, A. S., Koch, H. G., Becker, K., Harms, E., et al. (1998). Персистирующая инфекция штаммами вариантов небольших колоний Staphylococcus aureus у пациентов с кистозным фиброзом. J. Infect. Дис. 177, 1023–1029. doi: 10.1086 / 515238
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Капплер, М., Nagel, F., Feilcke, M., Kröner, C., Pawlita, I., Naehrig, S., et al. (2016). Ликвидация метициллин-резистентного Staphylococcus aureus , впервые обнаруженного при муковисцидозе: одноцентровое обсервационное исследование. Pediatr. Пульмонол. 51, 1010–1019. doi: 10.1002 / ppul.23519
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кил, Р. А., Шафтлейн, А., Клофт, К., Поуп, Дж. С., Кнауфт, Р. Ф., Мухлебах, М., и др. (2011). Фармакокинетика линезолида для внутривенного и перорального введения у взрослых с муковисцидозом. Антимикробный. Агенты Chemother. 55, 3393–3398. doi: 10.1128 / AAC.01797-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kenner, J., O’Connor, T., Piantanida, N., Fishbain, J., Eberly, B., Viscount, H., et al. (2003). Показатели носительства метициллин-резистентных и метициллин-чувствительных Staphylococcus aureus в амбулаторных условиях. Заражение. Control Hosp. Эпидемиол. 24, 439–444. doi: 10.1086 / 502229
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан, Т.Z., Wagener, J. S., Bost, T. T., Martinez, J., Accurso, F. J., Riches, D. W. (1995). Раннее легочное воспаление у младенцев с кистозным фиброзом. г. J. Respir. Крит. Care Med. 151, 1075–1082. doi: 10.1164 / ajrccm / 151.4.1075
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Le, J., Bradley, J. S., Hingtgen, S., Skochko, S., Black, N., Jones, R. N., et al. (2017). Фармакокинетика однократного приема цефтаролина фозамила у детей с муковисцидозом. Pediatr.Пульмонол. 52, 1424–1434. doi: 10.1002 / ppul.23827
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Leman, R., Alvarado-Ramy, F., Pocock, S., Barg, N., Kellum, M., McAllister, S., et al. (2004). Назальное носительство метициллин-резистентного Staphylococcus aureus в популяции американских индейцев. Заражение. Control Hosp. Эпидемиол. 25, 121–125. doi: 10.1086 / 502361
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю, К., Байер, А., Косгроув, С. Е., Даум, Р. С., Фридкин, С. К., Горвиц, Р. Дж. И др. (2011). Руководство по клинической практике Американского общества инфекционистов по лечению метициллин-резистентных инфекций Staphylococcus у взрослых и детей: краткое содержание. Clin. Заразить. Дис. 52, 285–292. doi: 10.1093 / cid / cir034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ло, Д. К., Мухлебах, М. С., Смит, А. Р. (2018). Вмешательства по искоренению метициллин-устойчивого Staphylococcus aureus (MRSA) у людей с муковисцидозом. Кокрановская база данных Syst. Ред. 7, CD009650. doi: 10.1002 / 14651858.CD009650.pub4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Loening-Baucke, V. A., Mischler, E., Myers, M. G. (1979). Плацебо-контролируемое исследование терапии цефалексином при амбулаторном ведении пациентов с муковисцидозом. J. Pediatr. 95, 630–637. doi: 10.1016 / S0022-3476 (79) 80785-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lund-Palau, H., Тернбулл А. Р., Буш А., Бардин Э., Кэмерон Л., Сорен О. и др. (2016). Pseudomonas aeruginosa Инфекция при муковисцидозе: патофизиологические механизмы и терапевтические подходы. Эксперт Ред. Респир. Med. 10, 685–697. DOI: 10.1080 / 17476348.2016.1177460
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Macfarlane, M., Leavy, A., McCaughan, J., Fair, R., Reid, A.J. (2007). Успешная деколонизация метициллин-устойчивого Staphylococcus aureus у педиатрических пациентов с муковисцидозом (CF) с использованием трехэтапного протокола. J. Hosp. Заразить. 65, 231–236. doi: 10.1016 / j.jhin.2006.10.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mandell, L.A., Wunderink, R.G., Anzueto, A., Bartlett, J.G., Campbell, G.D., Dean, N.C., et al. (2007). Общество инфекционных болезней Америки / Американское торакальное общество Консенсусное руководство по ведению внебольничной пневмонии у взрослых. Clin. Заразить. Дис. 44 Дополн. 2, S27 – S72. doi: 10.1086 / 511159
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Miall, L.С., МакГинли, Н. Т., Браунли, К. Г., Конвей, С. П. (2001). Метициллин-резистентная инфекция Staphylococcus aureus (MRSA) при кистозном фиброзе. Arch. Дис. Ребенок. 84, 160–162. doi: 10.1136 / adc.84.2.160
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mitchell, G., Séguin, D. L., Asselin, A. E., Déziel, E., Cantin, A. M., Frost, E. H., et al. (2010). Staphylococcus aureus сигма B-зависимое появление вариантов малых колоний и образование биопленок после воздействия Pseudomonas aeruginosa 4-гидрокси-2-гептилхинолин-N-оксид. BMC Microbiol. 10, 33. doi: 10.1186 / 1471-2180-10-33
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мур, З. С., Джеррис, Р. К., Хилински, Дж. А. (2008). Высокая распространенность индуцибельной устойчивости к клиндамицину среди изолятов Staphylococcus aureus от пациентов с муковисцидозом. J. Cyst. Фиброс. 7, 206–209. doi: 10.1016 / j.jcf.2007.07.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Muhlebach, M.С. (2017). Метициллин-устойчивый Staphylococcus aureus при муковисцидозе: как с этим бороться? Curr. Opin. Pulm. Med. 23, 544–550. doi: 10.1097 / MCP.0000000000000422
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Muhlebach, M. S., Beckett, V., Popowitch, E., Miller, M. B., Baines, A., Mayer-Hamblett, N., et al. (2017). Микробиологическая эффективность раннего лечения MRSA при муковисцидозе в рандомизированном контролируемом исследовании. Грудь 72, 318–326.doi: 10.1136 / thoraxjnl-2016-208949
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Peacock, S.J., Justice, A., Griffiths, A., de Silva, G.D., Kantzanou, M. N., Crook, D., et al. (2003). Детерминанты приобретения и носительства Staphylococcus aureus в младенчестве. J. Clin. Microbiol. 41, 5718–5725. doi: 10.1128 / JCM.41.12.5718-5725.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pleasants, R.A., Michalets, E.Л., Уильямс, Д. М., Самуэльсон, В. М., Рем, Дж. Р., Ноулз, М. Р. (1996). Фармакокинетика ванкомицина у взрослых пациентов с муковисцидозом. Антимикробный. Агенты Chemother. 40, 186–190. doi: 10.1128 / AAC.40.1.186
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Prevaes, S. M., de Winter-de Groot, K. M., Janssens, H. M., de Steenhuijsen Piters, W. A., Tramper-Stranders, G.A., Wyllie, A. L., et al. (2016). Развитие микробиоты носоглотки у младенцев с муковисцидозом. г. J. Respir. Крит. Care Med. 193, 504–515. doi: 10.1164 / rccm.201509-1759OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ratjen, F., Comes, G., Paul, K., Posselt, H.G., Wagner, T.O., Harms, K. (2001). Влияние продолжительной антистафилококковой терапии на частоту приобретения P. aeruginosa у пациентов с муковисцидозом. Pediatr. Пульмонол. 31, 13–16. doi: 10.1002 / 1099-0496 (200101) 31: 1 <13 :: AID-PPUL1001> 3.0.CO; 2-N
PubMed Реферат | CrossRef Полный текст | Google Scholar
Разви, С., Куиттелл, Л., Сьюэлл, А., Куинтон, Х., Маршалл, Б., Сайман, Л. (2009). Респираторная микробиология пациентов с муковисцидозом в США, 1995–2005 гг. Chest 136, 1554–1560. DOI: 10.1378 / Chess.09-0132
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рид, М. Д., Стерн, Р. К., Бертино, Дж. С., младший, Майерс, К. М., Ямасита, Т. С., Блумер, Дж. Л. (1984). Дозирование последствий быстрой элиминации триметоприм-сульфаметоксазола у пациентов с муковисцидозом. J. Pediatr. 104, 303–307. doi: 10.1016 / S0022-3476 (84) 81019-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ren, C. L., Morgan, W. J., Konstan, M. W., Schechter, M. S., Wagener, J. S., Fisher, K. A., et al. (2007). Наличие метициллин-резистентного Staphylococcus aureus в респираторных культурах от пациентов с муковисцидозом связано с более низкой функцией легких. Pediatr. Пульмонол. 42, 513–518. doi: 10.1002 / ppul.20604
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Розенфельд, М., Эмерсон, Дж., Аккурсо, Ф., Армстронг, Д., Кастиль, Р., Гримвуд, К., и др. (1999). Диагностическая точность посевов ротоглотки у младенцев и детей раннего возраста с муковисцидозом. Pediatr. Пульмонол. 28, 321–328. DOI: 10.1002 / (SICI) 1099-0496 (199911) 28: 5 <321 :: AID-PPUL3> 3.0.CO; 2-V
PubMed Реферат | CrossRef Полный текст | Google Scholar
Rosenfeld, M., Gibson, R.L., McNamara, S., Emerson, J., Burns, J.L., Castile, R., et al. (2001). Ранняя легочная инфекция, воспаление и клинические исходы у младенцев с кистозным фиброзом. Pediatr. Пульмонол. 32, 356–366. doi: 10.1002 / ppul.1144
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Santos, R. P., Prestidge, C. B., Brown, M. E., Urbancyzk, B., Murphey, D. K., Salvatore, C. M., et al. (2009). Фармакокинетика и фармакодинамика линезолида у детей с муковисцидозом. Pediatr. Пульмонол. 44, 148–154. doi: 10.1002 / ppul.20966
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Савицкий, Г.S., Rasouliyan, L., Pasta, D. J., Regelmann, W. E., Wagener, J. S., Waltz, D. A., et al. (2008). Влияние инцидента обнаружения метициллин-устойчивого Staphylococcus aureus на легочную функцию при муковисцидозе. Pediatr. Пульмонол. 43, 1117–1123. doi: 10.1002 / ppul.20914
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schneider, M., Mühlemann, K., Droz, S., Couzinet, S., Casaulta, C., Zimmerli, S. (2008). Клинические характеристики, связанные с выделением небольших вариантов колоний Staphylococcus aureus и Pseudomonas aeruginosa из респираторных секретов пациентов с кистозным фиброзом. J. Clin. Microbiol. 46, 1832–1834. doi: 10.1128 / JCM.00361-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sly, P. D., Brennan, S., Gangell, C., de Klerk, N., Murray, C., Mott, L., et al. (2009). Заболевание легких при диагностике у младенцев с кистозным фиброзом, обнаруженным при обследовании новорожденных. г. J. Respir. Крит. Care Med. 180, 146–152. doi: 10.1164 / rccm.200901-0069OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Smith, E.Э., Бакли Д. Г., Ву З., Саэнфиммачак К., Хоффман Л. Р., Д’Аргенио Д. А. и др. (2006). Генетическая адаптация Pseudomonas aeruginosa к дыхательным путям пациентов с муковисцидозом. Proc. Natl. Акад. Sci. США 103, 8487–8492. doi: 10.1073 / pnas.0602138103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смит, М. В., Ункель, Дж. Х., Фентон, С. Дж. (2001). Применение тетрациклинов в педиатрической практике. J. Pediatr. Pharmacol. Ther. 6, 66–71.
Google Scholar
Стефани, С., Чанг, Д. Р., Линдси, Дж. А., Фридрих, А. В., Кернс, А. М., Вест, Х. и др. (2012). Метициллин-устойчивый Staphylococcus aureus (MRSA): глобальная эпидемиология и гармонизация методов типирования. Внутр. J. Antimicrob. Агенты 39, 273–282. doi: 10.1016 / j.ijantimicag.2011.09.030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стюарт, К. Л., Тернер, М. С., Френс, Дж. Дж., Снайдер, К. Б., Смит, Дж. Р. (2017). Практический опыт терапии оритаванцином при инвазивных грамположительных инфекциях. Заражение. Дис. Ther. 6, 277–289. doi: 10.1007 / s40121-017-0156-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Stockmann, C., Sherwin, C. M., Zobell, J. T., Lubsch, L., Young, D. C., Olson, J., et al. (2013). Популяционная фармакокинетика интермиттирующего ванкомицина у детей с муковисцидозом. Фармакотерапия 33, 1288–1296.doi: 10.1002 / phar.1320
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Штольц, Д. А., Мейерхольц, Д. К., Пеццуло, А. А., Рамачандран, С., Роган, М. П., Дэвис, Г. Дж. И др. (2010). У свиней с муковисцидозом развивается заболевание легких, и при рождении наблюдается дефектная бактериальная эрадикация. Sci. Пер. Med. 2, 29–31. doi: 10.1126 / scitranslmed.3000928
CrossRef Полный текст | Google Scholar
Suwantarat, N., Rubin, M., Bryan, L., Tekle, T., Boyle, M.П., Кэрролл, К. С. и др. (2018). Частота вариантов малых колоний и чувствительность к противомикробным препаратам метициллин-устойчивого Staphylococcus aureus у пациентов с муковисцидозом. Диагн. Microbiol. Заразить. Дис. 90, 296–299. doi: 10.1016 / j.diagmicrobio.2017.11.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Szaff, M., Høiby, N. (1982). Лечение антибиотиками инфекции Staphylococcus aureus при муковисцидозе. Acta Paediatr.Сканд. 71, 821–826. doi: 10.1111 / j.1651-2227.1982.tb09526.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Tashiro, Y., Yawata, Y., Toyofuku, M., Uchiyama, H., Nomura, N. (2013). Межвидовое взаимодействие между Pseudomonas aeruginosa и другими микроорганизмами. Microbes Environ. 28, 13–24. doi: 10.1264 / jsme2.ME12167
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Thomas, S. R., Gyi, K. M., Gaya, H., Ходсон, М. Э. (1998). Метициллин-устойчивый Staphylococcus aureus : воздействие в национальном центре кистозного фиброза. J. Hosp. Заразить. 40, 203–209. DOI: 10.1016 / S0195-6701 (98)
-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Torres, A., Ewig, S., Lode, H., Carlet, J. (2009). Европейская рабочая группа HAP. Определение, лечение и профилактика внутрибольничной пневмонии: европейская перспектива. Intensive Care Med. 35, 9–29. DOI: 10.1007 / s00134-008-1336-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
van Hal, S. J., Lodise, T. P., Paterson, D. L. (2012). Клиническое значение минимальной ингибирующей концентрации ванкомицина при инфекциях Staphylococcus aureus : систематический обзор и метаанализ. Clin. Заразить. Дис. 54, 755–777. DOI: 10.1093 / cid / cir935
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vanderhelst, E., De Wachter, E., Виллекенс, Дж., Пиерард, Д., Винкен, В., Малфрут, А. (2013). Ликвидация хронической метициллин-резистентной Staphylococcus aureus инфекции у пациентов с муковисцидозом. Наблюдательное проспективное когортное исследование 11 пациентов. J. Cyst. Фиброс. 12, 662–666. doi: 10.1016 / j.jcf.2013.04.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Waters, E.M., Rowe, S.E., O’Gara, J.P., Conlon, B.P. (2016). Конвергенция персистера Staphylococcus aureus и исследование биопленок: можно ли определить биопленки как сообщества прикрепленных клеток-персистеров? PLoS Pathog. 12, e1006012. doi: 10.1371 / journal.ppat.1006012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Weaver, L. T., Green, M. R., Nicholson, K., Mills, J., Heeley, M. E., Kuzemko, J. A., et al. (1994). Прогноз при муковисцидозе, получающем непрерывный прием флуклоксациллина с неонатального периода. Arch. Дис. Ребенок. 70, 84–89. doi: 10.1136 / adc.70.2.84
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wertheim, H. F., Melles, D.К., Вос, М. К., ван Лиувен, В., ван Белкум, А., Вербру, Х. А. и др. (2005). Роль носительства в инфекциях Staphylococcus aureus . Ланцетная инфекция. Дис. 5, 751–762. doi: 10.1016 / S1473-3099 (05) 70295-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wolter, D. J., Emerson, J. C., McNamara, S., Buccat, A. M., Qin, X., Cochrane, E., et al. (2013). Staphylococcus aureus вариантов с малыми колониями независимо связаны с более тяжелым заболеванием легких у детей с кистозным фиброзом. Clin. Заразить. Дис. 57, 384–391. doi: 10.1093 / cid / cit270
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zobell, J. T., Epps, K. L., Young, D. C., Montague, M., Olson, J., Ampofo, K., et al. (2015). Использование антибиотиков для лечения метициллин-резистентной инфекции Staphylococcus aureus при муковисцидозе. Pediatr. Пульмонол. 50, 552–559. doi: 10.1002 / ppul.23132
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Деколонизация MRSA
Введение
- Деколонизация — это процесс искоренения или уменьшения бессимптомного носительства MRSA.
- Ноздри являются основным местом колонизации. Другие места колонизации включают носоглотку, кожу (особенно кожные складки), промежность, подмышечные впадины и желудочно-кишечный тракт.
- Деколонизацию следует начинать только после того, как инфекция исчезнет.
- Когда человек болен MRSA, загрязнение окружающей среды и одежды может происходить из-за удаления чешуек с кожи и прикосновения к поверхностям загрязненной кожей или руками.
Показания
Решение рекомендовать деколонизацию должно следовать за оценкой человека (и его близких контактов), которая включает его готовность и способность соблюдать режим.
Деколонизация обычно рекомендуется, когда отдельные лица или их домашние контакты:
- имеют рецидивирующие MRSA или стафилококковые инфекции
- подвержены повышенному риску заражения из-за других существующих заболеваний
- — медицинские работники или лица, осуществляющие уход
или - , когда есть продолжающиеся инфекции MRSA, возникающие в четко определенной, тесно связанной когорте, например, в общежитии, детском саду или спортивном клубе.
Если в домохозяйстве, несмотря на лечение, продолжаются инфекции, следует рассмотреть возможность деколонизации всех членов домохозяйства, даже если у некоторых членов нет активной инфекции. Все члены семьи должны начать деколонизацию в один и тот же день.
Деколонизация не всегда бывает успешной с первой попытки, и, возможно, ее придется повторить.
Схема лечения деколонизацией
Гель для душа
Ежедневно в течение 5 дней. Используйте 1 процент триклозана (500 мл) или 4 процента хлоргексидина глюконата (500 мл).Оба продукта продаются в аптеках без рецепта. Ориентировочная стоимость для пациента от 16 до 24 долларов. Хлоргексидина глюконат противопоказан людям с перфорированной барабанной перепонкой.
Мазь назальная
Дважды в день в течение 5 дней — используйте мупироцин 2% (трубка бактробана 3 г). Требуется рецепт, и ориентировочная стоимость частных рецептов составляет до 26 долларов. Этот продукт включен в Программу фармацевтических льгот (PBS) только для аборигенов или жителей островов Торресова пролива с целью лечения колонизации носа с помощью S.aureus.
Протезы
Пациентам с зубными протезами следует замочить их на ночь в чистящем средстве для зубных протезов, например Steradent или Polident.
Пациенты с известным горлом
Полощите горло два раза в день жидкостью для полоскания рта на основе 0,2% хлоргексидина, например, Savacol или Rivacol, которые продаются в аптеке без рецепта.
Скрининг на очистку после деколонизации
- Скрининг после деколонизации для определения клиренса обычно не рекомендуется.Однако его можно проводить, когда результаты скрининга считаются полезными для лечения MRSA, например, когда:
- человек подвержены повышенному риску заражения из-за других существующих заболеваний
- есть постоянные инфекции, происходящие в домохозяйствах или четко определенной, тесно связанной когорте, такой как общежитие, спортивный клуб или детский сад
- человек запрашивают информацию о своем исходе
- запрашиваются Министерством здравоохранения.
Деколонизация и очистка
- Если показан скрининг клиренса, возьмите мазки (предварительно смочите сухие участки стерильной водой или физиологическим раствором) из ноздрей, горла и любых ран или поражений кожи на 1-й и 12-й неделе после деколонизации.
Факторы, способствующие провалу деколонизации
- Деколонизация менее вероятно будет успешной, если у человека есть носительство в горле, хронические или открытые раны или постоянные устройства для постоянного пребывания на месте.
- Существует вероятность отказа и / или повторной колонизации при несоблюдении требований личной гигиены и экологической чистоты.
- Деколонизацию не следует начинать у людей с чесоткой или активными эксфолиативными кожными заболеваниями, такими как экзема или псориаз, поскольку она может потерпеть неудачу, а процедуры для кожи могут усугубить их состояние.
- Любое отшелушивающее состояние кожи следует лечить в первую очередь после консультации с дерматологом.
Важная информация
- Может потребоваться назначение определенных антибиотиков в рамках режима деколонизации для людей с рецидивирующими инфекциями после двух последовательных процедур деколонизации.
Это следует делать после консультации с врачом-инфекционистом или клиническим микробиологом. - Устойчивость к мупироцину связана с широким распространением и длительным использованием, и его использование первоначально должно быть ограничено двумя последовательными процедурами деколонизации.
- Если используется рифампицин, он всегда будет рекомендован в сочетании с другими антибиотиками (никогда в качестве единственного агента).
Рифампицин является антимикробным препаратом, требующим официального подтверждения, и лечение MRSA не является одним из показаний для его использования в PBS. - Деколонизирующее лечение новорожденных (<2 месяцев) не следует начинать в сообществе, если это специально не рекомендовано врачом-инфекционистом или клиническим микробиологом.
Деколонизирующее лечение MRSA — информационный бюллетень для поставщика медицинских услуг (PDF, 137 КБ)
Деколонизирующая обработка MRSA — информационный бюллетень для потребителей (PDF 1.4MB)
Последний раз просмотрено: 17-01-2019
Staph может скрываться глубоко в носу, результаты исследования | Центр новостей
Shutterstock.com
Новое исследование показывает, что бактерии стафилококка могут скрываться глубоко внутри носа.
Ученые из Медицинской школы Стэнфордского университета обнаружили, что ранее не замеченные участки глубоко внутри носа могут быть резервуарами для золотистого стафилококка , основной бактериальной причины заболевания.
Результаты их исследования были опубликованы 11 декабря в журнале Cell Host & Microbe .
Исследователи из Стэнфорда далее обнаружили обратную зависимость между присутствием S.aureus на этих участках и другого вида бактерий, Corynebacterium pseudodiphtheriticum , что позволяет предположить, что два организма конкурируют друг с другом и что C. pseudodiphtheriticum — или какой-то молекулярный продукт, который он выделяет — может оказаться полезным в борьбе с S. aureus инфекций.
«Около одной трети всех людей являются постоянными носителями S. aureus , другая треть — случайными носителями, а оставшаяся треть, похоже, не несет S.aureus », — сказал Дэвид Релман, доктор медицины, профессор Томаса К. и Джоан М. Мериган и профессор медицины, микробиологии и иммунологии. Релман, который также является руководителем отдела инфекционных заболеваний в системе здравоохранения Пало-Альто по делам ветеранов, был старшим автором исследования. Ведущим автором был Милин Ян, доктор философии, аспирант лаборатории Релмана на момент проведения экспериментов.
«Давно известно, что нос является основным резервуаром S. aureus », — сказал Релман.Жук также изобилует кожей, особенно в подмышечных впадинах и паху. Однако в подавляющем большинстве случаев это мало или не причиняет никакого вреда. (Если это приносит пользу, то никто еще не понял, что это такое, добавил Релман.)
Но если кожа повреждена, например, раной, медицинским разрезом или размещением катетера, S. aureus может попасть в кровоток и вызвать серьезные и даже опасные для жизни проблемы, такие как сепсис, пневмония или инфекция сердца. клапаны.Около половины всех штаммов S. aureus устойчивы к семейству антибиотиков, включая метициллин. В 2011 году только в США произошло более 80 000 тяжелых метициллин-устойчивых инфекций S. aureus , а также более 11 000 связанных смертей, а также гораздо большее количество менее тяжелых инфекций.
«Не все, кто носит S. aureus , заболевают», — сказал Релман. «Когда они гуляют по улице и в остальном здоровы, пытается избавить их от S.aureus не нужны, а иногда и бесполезны. Но как только носитель попадает в больницу с основным заболеванием, с ослабленной иммунной системой или с высокой вероятностью прохождения процедур, проникающих через кожу, носительство S. aureus становится серьезной проблемой ».
Существуют строгие и несколько утомительные схемы уничтожения S. aureus , обитающего на коже или в носу людей, но обычно это вопрос недель или месяцев, прежде чем бактерии снова заселят тех, кто чувствителен.Новое исследование предлагает возможную причину этого.
Ученые набрали 12 здоровых субъектов и доставили их в Стэнфордскую клинику ушей, носа и горла, которой руководит соавтор исследования Питер Хван, доктор медицины, профессор отоларингологии. Используя специальные инструменты, позволяющие направлять крошечные мазки в определенные места внутри носа, они взяли образцы из трех конкретных областей. Первым местом — и, безусловно, наиболее хорошо изученным, поскольку оно гораздо более доступным, — был передний нерв, относительно сухой участок ткани, похожий на кожу, расположенный около ноздри.Вторым был средний проход — более теплая, влажная, продуцирующая слизь складка, обнаруженная примерно на полпути вверх по носовой полости. И третьим было клиновидно-этмоидальное углубление, расположенное глубоко внутри полости около крыши носа и, как и средний проход, теплое, влажное и слизистое.
Дэвид Релман
Исследователи обнаружили, что наличие или отсутствие S. aureus на одном носовом участке обычно коррелирует с его присутствием или отсутствием на двух других. Подразумевается: если передняя ноздря человека является переносчиком бактерий, вероятно, и верхние области слизистой оболочки тоже.Возможно, именно поэтому попытки изгнать S. aureus так часто оказывались недолговечными. Сосредоточение усилий в основном на бактериях в переднем отделе носа, как это делают современные процедуры деколонизации, оставляет нетронутыми более глубокие резервуары.
Команда
Релмана усвоила еще три вещи. Во-первых, относительная численность S. aureus была обратно пропорциональна относительной численности другого вида бактерий, C. pseudodiphtheriticum . Когда один присутствовал на высоких уровнях, другой присутствовал на низких уровнях или отсутствовал.Один из соавторов исследования, Сундж Памп, доктор философии, научный сотрудник лаборатории Релмана, поместил два вида бактерий на чашку с агаром для дальнейшего изучения этой взаимосвязи и обнаружил, что C. pseudodiphtheriticum сильно блокирует рост S. .aureus .
Исследователи подозревают, что что-то C. pseudodiphtheticum продуцирует и секретирует — возможно, белок или, возможно, небольшую молекулу — что является причиной отказа S. aureus ’к развитию.По словам Пэмпа, если такое вещество будет идентифицировано, оно может дать ключ к разработке новых соединений для предотвращения или лечения инфекций, вызванных S. aureus .
Во-вторых, микробные сообщества у тех пациентов, которые являются носителями S. aureus , отличались другими способами от таковых у пациентов, которые этого не делают. Это может означать, что S. aureus изменяет свою среду, делая его более или менее благоприятным для различных других микробов. Или это может означать, что различные микробные сообщества более или менее благоприятны для колонизации S.aureus . В последнем случае можно будет предсказать, основываясь на их резидентных носовых микробах, какие пациенты с наибольшей вероятностью будут подвержены высокому риску заражения S. и следить за ними и относиться к ним соответственно. Те пациенты, у которых обнаружен более низкий риск, могут быть избавлены от таких процедур.
В-третьих, в среднем проходе и клиновидно-этмоидальном углублении — двух более глубоких и влажных слизистых оболочках носа — микробные сообщества были похожи друг на друга, но сильно отличались от сообщества, населяющего более доступный и лучше изученный внешний участок, передний Нарис.Это говорит о том, что обычные в настоящее время методы отбора проб из носовой полости для исследования микробов могут давать искаженные результаты.
Другими соавторами исследования были аспирант Джулия Фукуяма; резидент-отоларинголог До-Ён, доктор медицины; и профессор статистики Сьюзан Холмс, доктор философии. Исследование финансировалось Пионером Национального Института Здоровья (грант DP1OD000964), Благотворительным фондом Дорис Дьюк и Фондом Томаса К. и Джоан М. Мериган.
Информация о Департаменте микробиологии и иммунологии и Департаменте медицины Стэнфорда, которые также поддержали эту работу, доступна по адресу http: // microimmuno.stanford.edu и http://medicine.stanford.edu соответственно.
Воздействие сигаретного дыма перенаправляет Staphylococcus aureus на профиль вирулентности, связанный с персистирующей инфекцией.
Как табачный дым вызывает заболевание: биология и поведенческие основы заболевания, связанного с курением: отчет главного хирурга Атланты, Джорджия. Министерство здравоохранения и социальных служб США , Центры по контролю и профилактике заболеваний , Национальный центр профилактики хронических заболеваний и укрепления здоровья , Управление по курению и здоровью (2010).
Проктор Р. Н. История открытия связи между сигаретой и раком легких: доказательные традиции, корпоративное отрицание, глобальные потери. Tob Control 21 , 87–91, https://doi.org/10.1136/tobaccocontrol-2011-050338 (2012).
Артикул
PubMed
Google Scholar
Амброз, Дж. А. и Баруа, Р. С. Патофизиология курения сигарет и сердечно-сосудистых заболеваний: обновленная информация. J Am Coll Cardiol 43 , 1731–1737, https://doi.org/10.1016/j.jacc.2003.12.047 (2004).
CAS
Статья
PubMed
Google Scholar
Zuo, L. et al. . Взаимосвязанная роль курения сигарет, окислительного стресса и иммунного ответа при ХОБЛ и соответствующих лечениях. Am J Physiol Lung Cell Mol Physiol 307 , L205–218, https://doi.org/10.1152/ajplung.00330.2013 (2014).
ADS
CAS
Статья
PubMed
Google Scholar
Багайткар, Дж., Демут, Д. Р. и Скотт, Д. А. Употребление табака увеличивает восприимчивость к бактериальной инфекции. Tob Induc Dis 4 , 12, https://doi.org/10.1186/1617-9625-4-12 (2008).
Артикул
PubMed
PubMed Central
Google Scholar
Гармендиа, Дж., Morey, P. & Bengoechea, J. A. Влияние воздействия сигаретного дыма на взаимодействия хозяина и бактериальных патогенов. Eur Respir J 39 , 467–477, https://doi.org/10.1183/036.00061911 (2012).
CAS
Статья
PubMed
Google Scholar
Нуорти, Дж. П. и др. . Курение сигарет и инвазивное пневмококковое заболевание. Группа активного наблюдения за ядром бактерий. N Engl J Med 342 , 681–689, https: // doi.org / 10.1056 / NEJM200003093421002 (2000).
CAS
Статья
PubMed
Google Scholar
Мутепе, Н. Д. и др. . Влияние конденсата сигаретного дыма на образование пневмококковой биопленки и пневмолизина. Eur Respir J 41 , 392–395, https://doi.org/10.1183/036.00213211 (2013).
CAS
Статья
PubMed
Google Scholar
Тонетти, М. С. Курение сигарет и заболевания пародонта: этиология и лечение заболеваний. Ann Periodontol 3 , 88–101, https://doi.org/10.1902/annals.1998.3.1.88 (1998).
CAS
Статья
PubMed
Google Scholar
Цезарь Нето, Дж. Б., Роза, Э. Ф., Паннути, К. М. и Ромито, Г. А. Курение и ткани пародонта: обзор. Braz Oral Res 26 (Приложение 1), 25–31 (2012).
Артикул
Google Scholar
Обейд П. и Берси П. Влияние курения на здоровье пародонта: обзор. Adv Ther 17 , 230–237 (2000).
CAS
Статья
Google Scholar
Бергстром Дж. Табакокурение и поддесневой зубной камень. J Clin Periodontol 32 , 81–88, https://doi.org/10.1111 / j.1600-051X.2004.00638.x (2005).
Артикул
PubMed
Google Scholar
Хатчерсон, Дж. А., Скотт, Д. А. и Багайткар, Дж. Царапины на поверхности — индуцированные табаком бактериальные биопленки. Tob Induc Dis 13 , 1, https://doi.org/10.1186/s12971-014-0026-3 (2015).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Аркави, Л. и Беновиц, Н. Л. Курение сигарет и инфекция. Arch Intern Med 164 , 2206–2216, https://doi.org/10.1001/archinte.164.20.2206 (2004).
Артикул
PubMed
Google Scholar
Домагала-Кулавик Дж. Влияние сигаретного дыма на легкие и системный иммунитет. J Physiol Pharmacol 59 (Дополнение 6), 19–34 (2008).
PubMed
Google Scholar
Стампфли, М. Р. и Андерсон, Г. П. Как сигаретный дым искажает иммунные реакции, способствуя развитию инфекции, заболеваний легких и рака. Nat Rev Immunol 9 , 377–384, https://doi.org/10.1038/nri2530 (2009).
CAS
Статья
PubMed
Google Scholar
Стрингер, К. А., Тобиас, М., О’Нил, Х. К. и Франклин, С. С. Подавление каспазо-подобной активности экстрактом сигаретного дыма нарушает фагоцитоз нейтрофилов человека. Am J Physiol Lung Cell Mol Physiol 292 , L1572–1579, https://doi.org/10.1152/ajplung.00325.2006 (2007).
CAS
Статья
PubMed
Google Scholar
Corberand, J. et al. . Влияние табакокурения на функции полиморфно-ядерных лейкоцитов. Infect Immun 23 , 577–581 (1979).
CAS
PubMed
PubMed Central
Google Scholar
Рассел Р.Э. и др. . Альвеолярный макрофаг-опосредованный эластолиз: роль матриксных металлопротеиназ, цистеиновых и сериновых протеаз. Am J Physiol Lung Cell Mol Physiol 283 , L867–873, https://doi.org/10.1152/ajplung.00020.2002 (2002).
CAS
Статья
PubMed
Google Scholar
Лаан М., Бозиновски С. и Андерсон Г. П. Сигаретный дым подавляет индуцированное липополисахаридом производство воспалительных цитокинов путем подавления активации протеина-активатора-1 в эпителиальных клетках бронхов. J Immunol 173 , 4164–4170 (2004).
CAS
Статья
Google Scholar
Краситель, Дж. А. и Адлер, К. Б. Воздействие сигаретного дыма на эпителиальные клетки дыхательных путей. Грудь 49 , 825–834 (1994).
CAS
Статья
Google Scholar
Пикок, С. Дж., Де Сильва, И. и Лоуи, Ф.D. Что определяет носительство золотистого стафилококка через нос? Trends Microbiol 9 , 605–610 (2001).
CAS
Статья
Google Scholar
ван Белкум, А. и др. . Реклассификация типов носительства Staphylococcus aureus. J Infect Dis 199 , 1820–1826, https://doi.org/10.1086/599119 (2009).
Артикул
PubMed
Google Scholar
Гордон Р. Дж. И Лоуи Ф. Д. Патогенез метициллин-резистентной инфекции Staphylococcus aureus. Clin Infect Dis 46 (Приложение 5), S350–359, https://doi.org/10.1086/533591 (2008).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Чемберс, Х. Ф. и Делео, Ф. Р. Волны устойчивости: золотистый стафилококк в эпоху антибиотиков. Nat Rev Microbiol 7 , 629–641, https: // doi.org / 10.1038 / nrmicro2200 (2009).
CAS
Статья
PubMed
PubMed Central
Google Scholar
ДеЛео, Ф. Р., Отто, М., Крейсвирт, Б. Н. и Чемберс, Х. Ф. Связанный с сообществом метициллин-устойчивый золотистый стафилококк. Lancet 375 , 1557–1568, https://doi.org/10.1016/S0140-6736(09)61999-1 (2010).
Артикул
PubMed
PubMed Central
Google Scholar
Кулькарни, Р. и др. . Сигаретный дым увеличивает образование биопленки Staphylococcus aureus из-за окислительного стресса. Infect Immun 80 , 3804–3811, https://doi.org/10.1128/IAI.00689-12 (2012).
CAS
Статья
PubMed
PubMed Central
Google Scholar
McEachern, E. K. et al. . Анализ влияния сигаретного дыма на фенотипы вирулентности стафилококков. Infect Immun 83 , 2443–2452, https://doi.org/10.1128/IAI.00303-15 (2015).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Кулькарни, Р. и др. . Золотистый стафилококк, устойчивый к метициллину, подвергающийся воздействию экстракта сигаретного дыма, регулирует функцию лейкоцитов для сохранения легочной ткани. Am J Respir Cell Mol Biol 55 , 586–601, https://doi.org/10.1165 / rcmb.2015-0397OC (2016).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Grundmann, H. et al. . Географическое распространение Staphylococcus aureus, вызывающего инвазивные инфекции, в Европе: молекулярно-эпидемиологический анализ. PLoS Med 7 , e1000215, https://doi.org/10.1371/journal.pmed.1000215 (2010).
Артикул
PubMed
PubMed Central
Google Scholar
Лю, Ю. и др. . Молекулярные доказательства распространения двух основных метициллин-устойчивых клонов Staphylococcus aureus с уникальным географическим распределением в китайских больницах. Противомикробные агенты Chemother 53 , 512–518, https://doi.org/10.1128/AAC.00804-08 (2009).
CAS
Статья
PubMed
Google Scholar
Теновер, Ф. К. и Геринг, Р. В. Метициллин-резистентный штамм золотистого стафилококка USA300: происхождение и эпидемиология. J Antimicrob Chemother 64 , 441–446, https://doi.org/10.1093/jac/dkp241 (2009).
CAS
Статья
PubMed
Google Scholar
Laabei, M. et al. . Эволюционные компромиссы лежат в основе многогранной вирулентности Staphylococcus aureus. PLoS Biol 13 , e1002229, https://doi.org/10.1371/journal.pbio.1002229 (2015).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Лаабей, М. и др. . Прогнозирование вирулентности MRSA по его геномной последовательности. Genome Res 24 , 839–849, https://doi.org/10.1101/gr.165415.113 (2014).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Recker, M. et al. . Клональные различия в смертности, связанной с бактериемией Staphylococcus aureus. Nat Microbiol 2 , 1381–1388, https: // doi.org / 10.1038 / s41564-017-0001-x (2017).
CAS
Статья
PubMed
Google Scholar
Melles, D. C. et al. . Совместная колонизация носоглотки Staphylococcus aureus и Streptococcus pneumoniae у детей не зависит от бактериального генотипа. Microbiology 153 , 686–692, https://doi.org/10.1099/mic.0.2006/002279-0 (2007).
CAS
Статья
PubMed
Google Scholar
Богерт, Д. и др. . Колонизация Streptococcus pneumoniae и Staphylococcus aureus у здоровых детей. Lancet 363 , 1871–1872, https://doi.org/10.1016/S0140-6736(04)16357-5 (2004).
CAS
Статья
PubMed
Google Scholar
Wang, J. T. et al. . Распространенность и факторы риска колонизации устойчивым к метициллину Staphylococcus aureus среди взрослых в местных сообществах на Тайване. J Clin Microbiol 47 , 2957–2963, https://doi.org/10.1128/JCM.00853-09 (2009).
Артикул
PubMed
PubMed Central
Google Scholar
Olsen, K. et al. . Носительство золотистого стафилококка через нос связано с уровнем 25-гидроксивитамина D в сыворотке крови, полом и статусом курения. Тромсё стафилококк и исследование кожи. Eur J Clin Microbiol Infect Dis 31 , 465–473, https: // doi.org / 10.1007 / s10096-011-1331-x (2012).
CAS
Статья
PubMed
Google Scholar
Пейнтер, К. Л. и др. . Staphylococcus aureus приспосабливается к окислительному стрессу, производя устойчивые к h3O2 варианты небольших колоний посредством SOS-ответа. Infect Immun 83 , 1830–1844, https://doi.org/10.1128/IAI.03016-14 (2015).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Хосино, Ю. и др. . Цитотоксическое действие экстракта сигаретного дыма на клеточную линию альвеолярного типа II. Am J Physiol Lung Cell Mol Physiol 281 , L509–516 (2001).
CAS
Статья
Google Scholar
Ziebuhr, W. et al. . Обнаружение кластера генов межклеточной адгезии (ica) и фазовых вариаций в штаммах культуры крови Staphylococcus epidermidis и изолятах слизистой оболочки. Infect Immun 65 , 890–896 (1997).
CAS
PubMed
PubMed Central
Google Scholar
Laabei, M., Jamieson, W. D., Massey, R.C. & Jenkins, A. T. Взаимодействие золотистого стафилококка с фосфолипидными везикулами — новый метод точного определения активности регулятора вспомогательного гена (agr). PLoS One 9 , e87270, https://doi.org/10.1371/journal.pone.0087270 (2014).
ADS
CAS
Статья
PubMed
PubMed Central
Google Scholar
Рудкин, Дж. К. и др. . Оксациллин изменяет профиль экспрессии токсинов у ассоциированного с сообществом метициллин-устойчивого золотистого стафилококка. Противомикробные агенты Chemother 58 , 1100–1107, https://doi.org/10.1128/AAC.01618-13 (2014).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Эдвардс, А. М. Переключение фенотипа является естественным следствием репликации Staphylococcus aureus. J Bacteriol 194 , 5404–5412, https://doi.org/10.1128/JB.00948-12 (2012).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Проктор, Р. А. и др. . Варианты небольших колоний: патогенная форма бактерий, способствующая хроническим и рецидивирующим инфекциям. Nat Rev Microbiol 4 , 295–305, https: // doi.org / 10.1038 / nrmicro1384 (2006).
CAS
Статья
PubMed
Google Scholar
Lunter, G. & Goodson, M. Stampy: статистический алгоритм для чувствительного и быстрого картирования считываний последовательностей Illumina. Genome Res 21 , 936–939, https://doi.org/10.1101/gr.111120.110 (2011).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Iqbal, Z., Caccamo, M., Turner, I., Flicek, P. & McVean, G. De novo Сборка и генотипирование вариантов с использованием цветных графов де Брейна. Nat Genet 44 , 226–232, https://doi.org/10.1038/ng.1028 (2012).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Янг, Б.С. и др. . Эволюционная динамика Staphylococcus aureus во время перехода от носительства к заболеванию. Proc Natl Acad Sci USA 109 , 4550–4555, https://doi.org/10.1073/pnas.1113219109 (2012).
ADS
Статья
PubMed
Google Scholar
Valavanidis, A., Vlachogianni, T. & Fiotakis, K. Табачный дым: участие активных форм кислорода и стабильных свободных радикалов в механизмах окислительного повреждения, канцерогенеза и синергетических эффектов с другими вдыхаемыми частицами. Int J Environ Res Public Health 6 , 445–462, https: // doi.org / 10.3390 / ijerph6020445 (2009).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Cosgrove, K. et al. . Каталаза (KatA) и алкилгидропероксидредуктаза (AhpC) играют компенсаторную роль в устойчивости к пероксидному стрессу и необходимы для выживания, устойчивости и колонизации носа у Staphylococcus aureus. J Bacteriol 189 , 1025–1035, https://doi.org/10.1128/JB.01524-06 (2007).
CAS
Статья
PubMed
Google Scholar
Кристиан С.А. и др. . D-аланилирование тейхоевых кислот способствует устойчивости к антимикробным пептидам стрептококков группы А, выживанию нейтрофилов и инвазии эпителиальных клеток. J Bacteriol 187 , 6719–6725, https://doi.org/10.1128/JB.187.19.6719-6725.2005 (2005).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Fang, F. C. Противомикробные действия активных форм кислорода. MBio 2 , https://doi.org/10.1128/mBio.00141-11 (2011).
Новик Р. П. Аутоиндукция и передача сигналов в регуляции вирулентности стафилококков. Mol Microbiol 48 , 1429–1449 (2003).
CAS
Статья
Google Scholar
Фей, П. Д. и др. . Генетический ресурс для быстрого и всестороннего фенотипического скрининга несущественных генов Staphylococcus aureus. MBio 4 , e00537–00512, https://doi.org/10.1128/mBio.00537-12 (2013).
CAS
Статья
PubMed
PubMed Central
Google Scholar
McCourt, J., O’Halloran, DP, McCarthy, H., O’Gara, JP & Geoghegan, JA. Фибронектин-связывающие белки необходимы для образования биопленок ассоциированным с сообществом штаммом Staphylococcus aureus, устойчивым к метициллину. LAC. FEMS Microbiol Lett 353 , 157–164, https: // doi.орг / 10.1111 / 1574-6968.12424 (2014).
CAS
Статья
PubMed
Google Scholar
Mazmanian, S. K., Ton-That, H. & Schneewind, O. Катализируемое сортазой закрепление поверхностных белков на клеточной стенке Staphylococcus aureus. Mol Microbiol 40 , 1049–1057 (2001).
CAS
Статья
Google Scholar
Vandenesch, F., Лина, Г. и Генри, Т. Гемолизины золотистого стафилококка, двухкомпонентные лейкоцидины и цитолитические пептиды: избыточный арсенал факторов вирулентности, повреждающих мембраны? Front Cell Infect Microbiol 2 , 12, https://doi.org/10.3389/fcimb.2012.00012 (2012).
Артикул
PubMed
PubMed Central
Google Scholar
Garzoni, C. & Kelley, W. L. Staphylococcus aureus: новые доказательства внутриклеточной персистенции. Trends Microbiol 17 , 59–65, https://doi.org/10.1016/j.tim.2008.11.005 (2009).
CAS
Статья
PubMed
Google Scholar
Wesson, C.A. et al. . Глобальные регуляторы Staphylococcus aureus Agr и Sar влияют на интернализацию и индукцию апоптоза. Infect Immun 66 , 5238–5243 (1998).
CAS
PubMed
PubMed Central
Google Scholar
Вестергаард, М., Пауландер, В. и Ингмер, Х. Активация SOS-ответа увеличивает частоту небольших вариантов колоний. BMC Res Notes 8 , 749, https://doi.org/10.1186/s13104-015-1735-2 (2015).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Bui, L. M., Hoffmann, P., Turnidge, J. D., Zilm, P. S. & Kidd, S. P. Продолжительный рост клинического штамма Staphylococcus aureus приводит к отбору стабильного типа клеток с вариантами малых колоний. Infect Immun 83 , 470–481, https://doi.org/10.1128/IAI.02702-14 (2015).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Каль, Б. К., Беккер, К. и Лоффлер, Б. Клиническая значимость и патогенез вариантов малых колоний стафилококка при стойких инфекциях. Clin Microbiol Rev 29 , 401–427, https://doi.org/10.1128/CMR.00069-15 (2016).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Брук, И. и Хаусфельд, Дж. Н. Микробиология острого и хронического гайморита у курильщиков и некурящих. Ann Otol Rhinol Laryngol 120 , 707–712, https://doi.org/10.1177/000348941112001103 (2011).
Артикул
PubMed
Google Scholar
Рамакришнан, В.Р. и Франк, Д. Н. Влияние курения сигарет на микробиом среднего прохода при хроническом риносинусите. Int Forum Allergy Rhinol 5 , 981–989, https://doi.org/10.1002/alr.21626 (2015).
Артикул
PubMed
Google Scholar
Andersen, P. S. et al. . Факторы риска колонизации носа золотистым стафилококком у датских близнецов среднего и пожилого возраста. Eur J Clin Microbiol Infect Dis 32 , 1321–1326, https: // doi.org / 10.1007 / s10096-013-1882-0 (2013).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Чен, К. Дж. и др. . Факторы, связанные с носовой колонизацией метициллин-резистентного золотистого стафилококка среди здоровых детей на Тайване. J Clin Microbiol 49 , 131–137, https://doi.org/10.1128/JCM.01774-10 (2011).
CAS
Статья
PubMed
Google Scholar
ван ден Аккер, Э. Л. и др. . Носительство золотистого стафилококка через нос связано с полиморфизмом генов рецепторов глюкокортикоидов. J Infect Dis 194 , 814–818, https://doi.org/10.1086/506367 (2006).
Артикул
PubMed
Google Scholar
Ваннер, С. и др. . Стеновые тейхоевые кислоты опосредуют повышенную вирулентность золотистого стафилококка. Nat Microbiol 2 , 16257, https: // doi.org / 10.1038 / nmicrobiol.2016.257 (2017).
CAS
Статья
PubMed
Google Scholar
Painter, K. L., Krishna, A., Wigneshweraraj, S. & Edwards, A. M. Какую роль играет система регулятора дополнительных генов, воспринимающая кворум, во время бактериемии Staphylococcus aureus? Trends Microbiol 22 , 676–685, https://doi.org/10.1016/j.tim.2014.09.002 (2014).
CAS
Статья
PubMed
Google Scholar
Отто, токсины M. Staphylococcus aureus. Curr Opin Microbiol 17 , 32–37, https://doi.org/10.1016/j.mib.2013.11.004 (2014).
CAS
Статья
PubMed
Google Scholar
Sun, F. et al. . Agr, чувствительный к кворуму, опосредует реакцию бактериального окисления посредством внутримолекулярного дисульфидного окислительно-восстановительного переключателя в регуляторе ответа AgrA. Proc Natl Acad Sci USA 109 , 9095–9100, https: // doi.org / 10.1073 / pnas.1200603109 (2012).
ADS
Статья
PubMed
Google Scholar
Роуз, Х. Р. и др. . Цитотоксическая вирулентность предсказывает смертность при нозокомиальной пневмонии, вызванной метициллинорезистентным золотистым стафилококком. J Infect Dis 211 , 1862–1874, https://doi.org/10.1093/infdis/jiu554 (2015).
CAS
Статья
PubMed
Google Scholar
Смельцер, М.С. Патогенез золотистого стафилококка: важность снижения цитотоксичности. Trends Microbiol 24 , 681–682, https://doi.org/10.1016/j.tim.2016.07.003 (2016).
CAS
Статья
PubMed
Google Scholar
Морикава, К. и др. . Адаптация вне стрессовой реакции: динамика клеточной структуры и популяционная гетерогенность Staphylococcus aureus. Microbes Environ 25 , 75–82 (2010).
Артикул
Google Scholar
Лехнер, С., Льюис, К. и Бертрам, Р. Золотистый стафилококк, устойчивый к бактерицидным антибиотикам. J Mol Microbiol Biotechnol 22 , 235–244, https://doi.org/10.1159/000342449 (2012).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Shee, C., Gibson, J.Л. и Розенберг, С. М. Два механизма создают горячие точки мутаций на разрывах ДНК в Escherichia coli. Cell Rep 2 , 714–721, https://doi.org/10.1016/j.celrep.2012.08.033 (2012).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ishida, M. et al. . Отказ от курения обращает вспять двухцепочечные разрывы ДНК в мононуклеарных клетках человека. PLoS One 9 , e103993, https: // doi.org / 10.1371 / journal.pone.0103993 (2014).
ADS
Статья
PubMed
PubMed Central
Google Scholar
Clement, S. et al. . Доказательства наличия внутриклеточного резервуара в слизистой оболочке носа у пациентов с рецидивирующим риносинуситом, вызванным Staphylococcus aureus. J Infect Dis 192 , 1023–1028, https://doi.org/10.1086/432735 (2005).
Артикул
PubMed
Google Scholar
Тан, Н. К. и др. . Варианты малых колоний и переключение фенотипа внутриклеточного Staphylococcus aureus при хроническом риносинусите. Allergy 69 , 1364–1371, https://doi.org/10.1111/all.12457 (2014).
Артикул
PubMed
Google Scholar
Chua, K. Y. et al. . Доминирующий австралийский внебольничный клон Staphylococcus aureus ST93-IV [2B], приобретенный внебольным сообществом, является высоко вирулентным и генетически отличным. PLoS One 6 , e25887, https://doi.org/10.1371/journal.pone.0025887 (2011).
ADS
CAS
Статья
PubMed
PubMed Central
Google Scholar
Баба Т. и др. . Геном и детерминанты вирулентности внебольничного MRSA с высокой вирулентностью. Ланцет 359 , 1819–1827 (2002).
CAS
Статья
Google Scholar
Холден, М. Т. и др. . Геномный портрет возникновения, эволюции и глобального распространения пандемии метициллин-устойчивого золотистого стафилококка. Genome Res 23 , 653–664, https://doi.org/10.1101/gr.147710.112 (2013).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Holden, M. T. et al. . Последовательность генома недавно появившегося, высокотрансмиссивного, устойчивого к множеству антибиотиков и антисептиков варианта метициллин-устойчивого Staphylococcus aureus, тип последовательности 239 (TW). J Bacteriol 192 , 888–892, https://doi.org/10.1128/JB.01255-09 (2010).
CAS
Статья
PubMed
Google Scholar
Holden, M. T. et al. . Полные геномы двух клинических штаммов Staphylococcus aureus: доказательства быстрой эволюции вирулентности и устойчивости к лекарствам. Proc Natl Acad Sci USA 101 , 9786–9791, https://doi.org/10.1073/pnas.0402521101 (2004).
ADS
CAS
Статья
PubMed
Google Scholar
O’Neill, A. J. Staphylococcus aureus Sh2000 и 8325-4: сравнительные последовательности генома ключевых лабораторных штаммов в исследованиях стафилококков. Lett Appl Microbiol 51 , 358–361, https://doi.org/10.1111/j.1472-765X.2010.02885.x (2010).
CAS
Статья
PubMed
Google Scholar
Duthie, E. S. & Lorenz, L. L. Стафилококковая коагулаза; механизм действия и антигенность. J Gen Microbiol 6 , 95–107, https://doi.org/10.1099/00221287-6-1-2-95 (1952).
CAS
Статья
PubMed
Google Scholar
Grundling, A. & Schneewind, O. Сшитый пептидогликан опосредует связывание лизостафина с оболочкой клеточной стенки Staphylococcus aureus. J Bacteriol 188 , 2463–2472, https: // doi.org / 10.1128 / JB.188.7.2463-2472.2006 (2006).
CAS
Статья
PubMed
PubMed Central
Google Scholar
На пути к терапии на основе моноклональных антител для профилактики и лечения инфекций, вызванных Staphylococcus aureus | Журнал инфекционных болезней
(См. Отчет Breif Чена и др. На стр. 884–8.)
Staphylococcus aureus — важный патоген для человека и основная причина бактериальных инфекций во всем мире. S. aureus вызывает широкий спектр заболеваний, от обычных инфекций кожи и мягких тканей (SSTI) до тяжелой опасной для жизни бактериемии. Действительно, S. aureus является одной из наиболее частых причин бактериемии [1] и наиболее частой причиной инфекционного эндокардита в промышленно развитых странах [2]. Кроме того, S. aureus является преобладающей причиной костно-суставных инфекций и SSTIs [3]. Болезнь, вызванная S. aureus , тесно связана с существованием в качестве комменсала человека, и этот организм может вызывать ятрогенные инфекции у людей с предрасполагающими факторами риска, такими как постоянное использование устройств и хирургическое вмешательство.На эпидемиологию болезни S. aureus влияет способность патогена быстро развивать устойчивость к антибиотикам. Например, устойчивый к метициллину S. aureus (MRSA) появился почти 70 лет назад и остается серьезной проблемой в больницах во всем мире [4]. Помимо выдающейся роли в лечении заболеваний, связанных с оказанием медицинской помощи, S. aureus является основным источником внебольничной инфекции у лиц без явных факторов риска. Например, появление и быстрое распространение штамма CA-MRSA USA300 способствовало значительному росту SSTI, что почти утроило количество обращений в отделения неотложной помощи в США в период с 1993 по 2005 гг. [5].Совсем недавно общенациональный эпиднадзор за инфекциями MRSA в медицинских центрах показал, что USA300 является преобладающим типом штамма как в общинах, так и в медицинских учреждениях США, во всех регионах и во всех местах инфицирования [6]. Вклад S. aureus в общее бремя устойчивости к противомикробным препаратам является значительным, и у патогена развились механизмы устойчивости практически ко всем клинически полезным агентам. Проблема усугубляется ограниченным количеством микробицидных агентов, находящихся на стадии разработки фармацевтических препаратов.Учитывая способность S. aureus быстро развивать антибактериальную резистентность, существует острая необходимость в альтернативных методах лечения для профилактики и лечения стафилококковой инфекции, таких как вакцины. В настоящее время не существует лицензированной вакцины S. aureus , несмотря на многочисленные попытки протестировать как активную, так и пассивную иммунизацию, большинство из которых не соответствовало предварительным конечным точкам. Есть несколько потенциальных причин, по которым стратегии вакцинации не увенчались успехом.Традиционные подходы, направленные на усиление опсонофагоцитоза, предполагают высокую эффективность фагоцитоза S. aureus нейтрофилами здоровых людей [7]. Кроме того, штаммы CA-MRSA, такие как USA300, демонстрируют повышенную внутриклеточную выживаемость и быстро лизируют полиморфно-ядерные лейкоциты человека после поглощения [7]. Несмотря на то, что на сегодняшний день безуспешно, продолжаются попытки разработать поливалентные вакцины, в том числе направленные против факторов вирулентности и токсинов [8].Остается задача разработать вакцину против микроба, который, вероятно, развился вместе с людьми с древних времен.
Хотя S. aureus известен как условно-патогенный микроорганизм, он также является комменсальным организмом человека. Например, Gorwitz и др. Сообщили, что примерно 28% здоровых людей в США бессимптомно колонизируются S. aureus в передних носовых ходах [9], включая колонизацию MRSA у 1,5% опрошенных людей. Совсем недавно Альбрехт и др. (Члены той же исследовательской группы) идентифицировали S.aureus у 38,8% лиц, обращающихся в отделения неотложной помощи в США по поводу чего-то другого, кроме инфекции, и это включало колонизацию MRSA у 9,5% этих лиц [10]. В этих исследованиях также сравнивали колонизацию S. aureus у лиц, обращающихся в отделение неотложной помощи по поводу кожных абсцессов, с контрольными субъектами (находящимися в отделении неотложной помощи по поводу чего-то другого, кроме инфекции), и они расширили скрининг на колонизацию, включив в него горло, пах и желудочно-кишечный тракт (прямая кишка) [10].Одно примечательное открытие, о котором сообщили Альбрехт и др., Заключается в том, что пах, а не нос, чаще был положительным для колонизации USA300 (метициллин-чувствительный S. aureus [MSSA] или MRSA), тогда как нос чаще всего был колонизирован для всех других клонов. из S. aureus . Более того, люди с инфекциями S. aureus с MRSA обычно колонизировались в нескольких участках тела, тогда как люди с инфекциями MSSA часто колонизировались в одном месте.
Колонизация не вызывает проблем для здоровых людей; однако это связано с инфекцией у людей с факторами риска инфицирования и / или сопутствующих заболеваний.В историческом исследовании, опубликованном в 2001 году, фон Эйфф и его коллеги сообщили, что бактериемия S. aureus связана с носовой колонизацией, то есть микроорганизмы, выделенные из крови, были идентичны микроорганизмам, выделенным из носа, у 82–85% пациентов [ 11]. В соответствии с этими выводами, Альбрехт и др. Обнаружили, что S. aureus , выделенные из кожных абсцессов, чаще всего (примерно в 88% случаев) были идентичны по молекулярному типированию таковым из участков колонизированных тел [10]. Работа нескольких исследовательских групп показала, что колонизация MRSA является фактором риска последующей инфекции MRSA [12, 13] (обзор Wertheim et al [14]).Смысл этих исследований в совокупности заключается в том, что колонизация S. aureus (также называемая носительством) является основным фактором, определяющим последующую инфекцию. Поскольку носительство S. aureus связано с инфекцией у восприимчивых людей, а глобальное бремя MRSA относительно велико, некоторые медицинские учреждения проверили, эффективна ли деколонизация S. aureus в носу для предотвращения инфекций [15 ]. Результаты имели различный успех, но эту вариабельность можно частично отнести к колонизации на других участках, кроме носа.Деколонизация носа обычно достигается путем местного применения мази с антибиотиком (мупироцином) в передние носовые ходы [16]. Хотя этот подход может хорошо работать для уменьшения нагрузки S. aureus в носу, он не снижает бактериальную нагрузку на других участках, колонизированных S. aureus , включая пах и желудочно-кишечный тракт. Более подробные протоколы деколонизации устраняют носительство S. aureus со всех участков тела, но включают купание с хлоргексидиновым мылом в течение нескольких дней и прием пероральных антибиотиков [17].Профилактическая или терапевтическая вакцина может быть разработана для содействия полной деколонизации (всего тела) S. aureus . Такая вакцина могла бы стать большим достижением в профилактике инфекций S. aureus у лиц из группы риска и была бы более практичной для использования в клинике.
В этом выпуске журнала Journal of Infectious Diseases Чен и др. Показывают, что нацеливание на S. aureus белка A (SpA) с помощью моноклональных антител (Mab) значительно снижает S.aureus колонизация носоглотки и кишечного тракта мыши [18]. Уменьшение колонизации S. aureus после лечения анти-SpA Mab сопровождалось повышением уровня сывороточных антител, специфичных к нескольким молекулам S. aureus , которые, как известно, способствуют прилипанию к тканям хозяина. Эти исследования расширяют интригующую линию исследований этой исследовательской группы способности SpA действовать как иммуномодулятор.
Ранее авторы сообщали, что мыши, иммунизированные мутантным белком SpA, неспособным связывать Fc-область антитела, продуцируют SpA-нейтрализующие антитела [19].Животные, иммунизированные мутантным, но не диким типом SpA, были защищены от инфекции S. aureus . Эти данные побудили авторов предложить модель, согласно которой SpA дикого типа ингибирует выработку антител, которые в противном случае защищали бы от инфекции S. aureus . Помня эту идею, группа создала мышиные моноклональные антитела, в том числе одно, названное hMab 3f6, которое представляет собой IgG2a, который ингибирует способность SpA блокировать образование антител, специфичных для S.aureus [20]. Примечательно, что hMAb 3f6 защищает мышей от летальной бактериемии и подчеркивает идею о том, что SpA является потенциальной мишенью для лечения.
В своей текущей работе Чен и др. Создали более стабильное рекомбинантное моноклональное антитело (rMab 363) путем клонирования и экспрессии Mab 363 в клетках HEK293 F [18]. rMab 363, экспрессируемый клетками HEK293 F, и hMab 363, экспрессируемый клетками гибридомы мыши, обладали сопоставимой способностью нейтрализовать SpA, способствовать бактерицидной активности в крови и уменьшать S.aureus на модели инфекции у мышей. Затем авторы продемонстрировали, что внутрибрюшинное введение rMab 363 предотвращает колонизацию глотки мыши штаммом S. aureus WU1 (штамм, который, как известно, постоянно колонизирует носоглотку и желудочно-кишечный тракт мышей) или способствует деколонизации в течение нескольких дней после введения. В частности, имело место сопутствующее увеличение количества антител, специфичных для молекул вирулентности S. aureus , включая те, которые, как известно, участвуют в адгезии и колонизации клеток-хозяев.
Подход против SpA Mab может решить две важные проблемы, связанные с носительством S. aureus . Во-первых, возможность деколонизации целевых популяций без использования антибиотиков станет крупным прорывом в профилактике S. aureus . Кроме того, многие предыдущие подходы к вакцине S. aureus были направлены частично на стимулирование опсонофагоцитоза, тогда как вакцина Chen et al. Обеспечивает адаптивный иммунитет против S. aureus [18]. Следовательно, вторым важным преимуществом подхода к анти-SpA Mab является развитие защитного иммунитета против S.aureus . Еще предстоит определить, приводят ли результаты на животных моделях к аналогичным результатам у людей, но исследования Чена и др. Являются важным шагом вперед в наших усилиях по разработке вакцины S. aureus .
Банкноты
Финансовая поддержка. Эта работа была поддержана Программой внутренних исследований Национального института аллергии и инфекционных заболеваний Национальных институтов здравоохранения.
Возможный конфликт интересов. Оба автора: о конфликте интересов не сообщалось. Оба автора подали форму ICMJE для раскрытия информации о потенциальных конфликтах интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Список литературы
1.
Набер
СК
.
Staphylococcus aureus Бактериемия: эпидемиология, патофизиология и стратегии лечения
.
Clin Infect Dis
2009
;
48
(
Дополнение 4
):
S231
—
7
.2.
Fowler
VG
Jr,
Miro
JM
,
Hoen
B
и др. ;
Исследователи ICE
.
Staphylococcus aureus Эндокардит: следствие медицинского прогресса
.
JAMA
2005
;
293
:
3012
—
21
. 3.
Тонг
SY
,
Davis
JS
,
Eichenberger
E
,
Holland
TL
,
Fowler
VG
Jr.
Staphylococcus aureus Инфекции: эпидемиология, патофизиология, клинические проявления и лечение
.
Clin Microbiol Ред.
2015
;
28
:
603
—
61
.4.
Lee
AS
,
de Lencastre
H
,
Garau
J
и др.
Метициллин-устойчивый Staphylococcus aureus
.
Nat Rev Dis Primers
2018
;
4
:
18033
.5.
Pallin
DJ
,
Egan
DJ
,
Pelletier
AJ
,
Espinola
JA
,
Hooper
DC
,
Camargo
CA
Увеличено
США Посещение отделений неотложной помощи при инфекциях кожи и мягких тканей и изменении выбора антибиотиков во время появления метициллин-резистентных Staphylococcus aureus
, ассоциированных с сообществами.
Ann Emerg Med
2008
;
51
:
291
—
8
.6.
Diekema
DJ
,
Richter
SS
,
Heilmann
KP
и др.
Продолжается появление USA300 метициллин-устойчивого Staphylococcus aureus в Соединенных Штатах: результаты общенационального эпиднадзора
.
Инфекционный контроль Hosp Epidemiol
2014
;
35
:
285
—
92
.7.
Voyich
JM
,
Braughton
KR
,
Sturdevant
DE
и др.
Анализ механизмов, используемых Staphylococcus aureus для предотвращения разрушения нейтрофилами человека
.
J Immunol
2005
;
175
:
3907
—
19
,8.
Fowler
VG
Jr,
Proctor
RA
.
Где стоит вакцина Staphylococcus aureus
?
Clin Microbiol Infect
2014
;
20
(
Доп. 5
):
66
—
75
.9.
Gorwitz
RJ
,
Kruszon-Moran
D
,
McAllister
SK
и др.
Изменение распространенности колонизации носа Staphylococcus aureus в США, 2001–2004 гг.
.
J Infect Dis
2008
;
197
:
1226
—
34
.10.
Альбрехт
VS
,
Лимбаго
BM
,
Моран
GJ
и др.;
EMERGEncy ID NET Study Group
.
Staphylococcus aureus колонизация и тип штамма на различных участках тела пациентов с закрытым абсцессом и неинфицированными контрольными группами в отделениях неотложной помощи США
.
J Clin Microbiol
2015
;
53
:
3478
—
84
.11.
von Eiff
C
,
Becker
K
,
Machka
K
,
Stammer
H
,
Peters
G
.
Носовое носительство как источник бактериемии Staphylococcus aureus . Исследовательская группа
.
N Engl J Med
2001
;
344
:
11
—
6
.12.
Дэвис
KA
,
Стюарт
JJ
,
Крауч
HK
,
Florez
CE
,
Hospenthal
DR
.
Метициллин-устойчивый Staphylococcus aureus (MRSA) колонизация ноздрей при поступлении в больницу и его влияние на последующую инфекцию MRSA
.
Clin Infect Dis
2004
;
39
:
776
—
82
,13.
Seybold
U
,
Schubert
S
,
Bogner
JR
,
Hogardt
M
.
Staphylococcus aureus Инфекция после носовой колонизации: подход к быстрой стратификации риска в университетской системе здравоохранения
.
J Hosp Infect
2011
;
79
:
297
—
301
.14.
Wertheim
HF
,
Melles
DC
,
Vos
MC
и др.
Роль носительства в Staphylococcus aureus инфекциях
.
Lancet Infect Dis
2005
;
5
:
751
—
62
.15.
Simor
AE
.
Стафилококковая деколонизация: эффективная стратегия профилактики инфекции
?
Lancet Infect Dis
2011
;
11
:
952
—
62
.16.
Perl
TM
,
Cullen
JJ
,
Wenzel
RP
и др. ;
Группа исследования мупироцина и риска развития золотистого стафилококка
.
Мупироцин для интраназального введения в послеоперационный период Staphylococcus aureus Инфекции
.
N Engl J Med
2002
;
346
:
1871
—
7
,17.
Buehlmann
M
,
Frei
R
,
Fenner
L
,
Dangel
M
,
Fluckiger
U
,
Widmer
AF
.
Высокоэффективная схема деколонизации метициллин-резистентных Staphylococcus aureus носителей
.
Инфекционный контроль Hosp Epidemiol
2008
;
29
:
510
—
6
0,18.
Chen
X
,
Sun
Y
,
Missiakis
D
,
Schneewind
O
.
Staphylococcus aureus деколонизация мышей моноклональным антителом, нейтрализующим белком А
.
J Infect Dis
2018
.19.
Ким
HK
,
Cheng
AG
,
Kim
HY
,
Missiakas
DM
,
Schneewind
O
.
Нетоксигенная вакцина на основе протеина А против метициллин-резистентных инфекций Staphylococcus aureus у мышей
.
J Exp Med
2010
;
207
:
1863
—
70
.20.
Kim
HK
,
Emolo
C
,
DeDent
AC
,
Falugi
F
,
Missiakas
DM
,
Schneewind
O
.
Моноклональные антитела, специфичные к белку А, и профилактика болезни Staphylococcus aureus у мышей
.
Infect Immun
2012
;
80
:
3460
—
70
.
Опубликовано издательством Oxford University Press для Общества инфекционистов Америки, 2018 г.
Эта работа написана (а) государственным служащим (ами) США и находится в открытом доступе в США.
Носительство в носоглотке, виды спа и профили чувствительности к антибиотикам Staphylococcus aureus от здоровых детей в возрасте до 5 лет в Восточной Уганде | BMC Infectious Diseases
Wertheim HF, Melles DC, Vos MC, van Leeuwen W, van Belkum A, Verbrugh HA, Nouwen JL. Роль носительства в инфекциях, вызванных Staphylococcus aureus. Lancet Infect Dis. 2005. 5 (12): 751–62.
PubMed
Статья
Google Scholar
де Бенито С., Алоу Л., Бесерро-де-Бенгоа-Вальехо Р., Лоса-Иглесиас, ME, Гомес-Лус М.Л., Колладо Л., Севильяно Д. Распространенность Staphylococcus spp. носовая колонизация среди врачей ортопедической медицины и связанные факторы риска в Испании.Антимикробная защита от инфекций. 2018; 7: 24.
PubMed
PubMed Central
Статья
Google Scholar
Кейтс А.Е., Тапалия Д., Смит Т.С., Чорази М.Л. Распространенность и молекулярная характеристика Staphylococcus aureus в образцах стула человека. Антимикробная защита от инфекций. 2018; 7: 42.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Lucia Preocuescu L, Streinu-Cercel O. Распространенность носового носительства S aureus у детей. Микробы. 2013. 3 (2): 49–51.
PubMed
PubMed Central
Статья
Google Scholar
Williams PCM, Isaacs D, Berkley JA. Устойчивость к противомикробным препаратам среди детей в Африке к югу от Сахары. Lancet Infect Dis. 2018; 18 (2): e33–44.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Абдулгадер СМАА. Носоглоточное носительство с Staphylococcus aureus у здоровых детей в течение первого года жизни — исследование здоровья детей Дракенштейна: докторская диссертация, Кейптаунский университет; 2016.
Bebell LM, Ayebare A, Boum Y 2nd, Siedner MJ, Bazira J, Schiff SJ, Metlay JP, Bangsberg DR, Ttendo S, Firth PG. Распространенность и корреляты носительства MRSA и MSSA в региональной специализированной больнице Уганды. J Antimicrob Chemother. 2017; 72 (3): 888–92.
CAS
PubMed
Google Scholar
Катите Д.П., Намаззи С., Оки М, Окенг А, Балуку Х, Мусиси Н.Л., Катабази Ф.А., Йолоба М.Л., Сссентонго Р., Наджука ФК. Высокая распространенность метициллин-резистентного золотистого стафилококка в хирургических отделениях больницы Мулаго в Кампале, Уганда. BMC Res Notes. 2011; 4: 326.
PubMed
PubMed Central
Статья
Google Scholar
Сени Дж., Бванга Ф., Наджука К.Ф., Макоборе П., Оки М., Мшана С.Е., Киденья Б.Р., Джолоба М.Л., Катите Д.П.Молекулярная характеристика Staphylococcus aureus у пациентов с инфекциями в области хирургического вмешательства в больнице Мулаго в Кампале, Уганда. PLOS ONE. 2013; 8 (6): e66153.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Rutebemberwa E, Mpeka B, Pariyo G, Peterson S, Mworozi E, Bwanga F, Källander K. Высокая распространенность устойчивости к антибиотикам в изолятах носоглоточных бактерий от здоровых детей в сельской местности Уганды: перекрестное исследование.Ups J Med Sci. 2015; 120 (4): 249–56.
PubMed
PubMed Central
Статья
Google Scholar
Wardlaw T., Salama P, Johansson EW, Mason E. Пневмония: главный убийца детей. Ланцет. 2006. 368 (9541): 1048–50.
PubMed
Статья
PubMed Central
Google Scholar
Калянго Дж. Н., Альфвен Т., Петерсон С., Мугеньи К., Карамаги К., Рутебемберва Э.Комплексное ведение пациентов с малярией и пневмонией на уровне общины повышает эффективность оперативного и надлежащего лечения симптомов пневмонии у детей в возрасте до пяти лет в восточной части Уганды. Малар Дж. 2013; 12: 340.
PubMed
PubMed Central
Статья
Google Scholar
Катите Д.П., Кимани С.Н., Катабази Ф.А., Окенг А., Оки М.С., Нантеза А., Йолоба М.Л., Наджука ФК. Идентификация золотистого стафилококка: ДНКаза и солевой агар с маннитолом повышают эффективность теста на коагулазу в пробирке.Анн Клин Микробиол Антимикроб. 2010; 9: 23.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Кэрролл К.С., Борек А.П., Бургер С., Гланц Б., Бхалли Х., Хенчак С., Флейхарт, округ Колумбия. Оценка автоматической микробиологической системы BD Phoenix для идентификации и тестирования чувствительности к антимикробным препаратам стафилококков и энтерококков. J Clin Microbiol. 2006. 44 (6): 2072–7.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Лабораторные процедуры: панели BD Phoenix ™ PMIC / ID BPPP, панели BD Phoenix ™ PID [http://www.bd.com/]. Доступ 2011.
Катите Д.П., Кабуго У, Балуку Х, Ньякарахука Л., Кьобе С., Оки М., Наджука К.Ф., Джолоба М.Л. Распространенность и паттерны чувствительности к антимикробным препаратам бактерий молочников и коров с клиническим маститом в Кампале, Уганда и ее окрестностях. PLoS One. 2013; 8 (5): e63413.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Хармсен Д., Клаус Х., Витте В., Ротгангер Дж., Турнвальд Д., Фогель У. Типирование метициллин-устойчивого золотистого стафилококка в условиях университетской больницы с использованием нового программного обеспечения для определения повторения спа-процедур и управления базами данных. J Clin Microbiol. 2003. 41 (12): 5442–8.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Азимве ББ, Балдан Р., Тровато А., Чирилло Д.М. Распространенность и молекулярные характеристики Staphylococcus aureus, включая штаммы, устойчивые к метициллину, выделенные из бестарного молока и сырых молочных продуктов в пастбищных общинах на юго-западе Уганды.BMC Infect Dis. 2017; 17 (1): 422.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Азимве ББ, Балдан Р., Тровато А., Чирилло Д.М. Молекулярная эпидемиология Panton-valentine. Лейкоцидин-положительные изоляты устойчивых к метициллину стафилококков, устойчивых к метициллину, в пастбищных сообществах сельских районов на юго-западе Уганды. BMC Infect Dis. 2017; 17:24.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Boye K, Bartels MD, Andersen IS, Moller JA, Westh H. Новая мультиплексная ПЦР для легкого скрининга на метициллин-устойчивый золотистый стафилококк SCCmec типов I-V. Clin Microbiol Infect. 2007. 13 (7): 725–7.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Tenover FC, Arbeit RD, Goering RV, Mickelsen PA, Murray BE, Persing DH, Swaminathan B. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериального штамма.J Clin Microbiol. 1995; 33 (9): 2233.
CAS
PubMed
PubMed Central
Google Scholar
Хеннесси Р.С., Майлз Р.А. Золотистый стафилококк типа 80 и инфекции человека в Уганде. Br Med J. 1958; 2 (5101): 893–5.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Херрманн М., Абдулла С., Алаби А., Алонсо П., Фридрих А. В., Фур Г., Герман А., Керн В. В., Кремснер П. Г., Мандомандо I и др.Стафилококковая инфекция в Африке: еще одно забытое «тропическое» заболевание. Future Microbiol. 2013. 8 (1): 17–26.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Джейкоб С.К., Мур С.К., Банура П., Пинкертон Р., Мейя Д., Опенди П., Рейнольдс С.Дж., Кения-Мугиша Н., Майянджа-Кицца Н., Шельд В.М. и др. Тяжелый сепсис в двух больницах Уганды: проспективное обсервационное исследование лечения и исходов в популяции, преимущественно инфицированной ВИЧ-1.PLoS One. 2009; 4 (11): e7782.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Mugalu J, Nakakeeto MK, Kiguli S, Kaddu-Mulindwa DH. Этиология, факторы риска и непосредственный исход бактериологически подтвержденной неонатальной сепсиса в больнице Мулаго, Уганда. Afr Health Sci. 2006. 6 (2): 120–6.
CAS
PubMed
PubMed Central
Google Scholar
Оджулонг Дж., Мвамбу Т., Джолоба М., Бванга Ф., Кадду-Мулиндва Д. Относительная распространенность метициллин-резистентного золотистого стафилококка и структура его восприимчивости в больнице мулаго, Кампала, Уганда. Tanzan J Health Res. 2009. 11 (3): 149–53.
CAS
PubMed
Статья
Google Scholar
Шаумбург Ф., Алаби А.С., Петерс Г., Беккер К. Новая эпидемиология инфекции Staphylococcus aureus в Африке. Clin Microbiol Infect.2014. 20 (7): 589–96.
CAS
PubMed
Статья
Google Scholar
Сени Дж., Наджука К.Ф., Катите Д.П., Макоборе П., Джолоба М.Л., Каджумбула Х., Капеса А., Бванга Ф. Устойчивость к противомикробным препаратам у госпитализированных хирургических пациентов: незаметно возникающая проблема общественного здравоохранения в Уганде. BMC Res Notes. 2013; 6: 298.
PubMed
PubMed Central
Статья
Google Scholar
Ангузу Дж. Р., Олила Д. Паттерны лекарственной чувствительности бактериальных изолятов из септических послеоперационных ран в региональной специализированной больнице в Уганде. Afr Health Sci. 2007. 7 (3): 148–54.
CAS
PubMed
PubMed Central
Google Scholar
Кизито М., Мворози Е., Ндугва С., Сержант Г.Р. Бактериемия при гомозиготной серповидно-клеточной анемии в Африке: оправдана ли профилактика пневмококка? Arch Dis Child. 2007. 92 (1): 21–3.
CAS
PubMed
Статья
Google Scholar
Bachou H, Tylleskar T, Kaddu-Mulindwa DH, Tumwine JK. Бактериемия среди детей с тяжелой недостаточностью питания, инфицированных и не инфицированных вирусом иммунодефицита человека-1, в Кампале, Уганда. BMC Infect Dis. 2006; 6: 160.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Falagas ME, Karageorgopoulos DE, Leptidis J, Korbila IP. MRSA в Африке: заполнение глобальной карты устойчивости к противомикробным препаратам. PLoS One.2013; 8 (7): e68024.
PubMed
PubMed Central
Статья
Google Scholar
Дэвид М.З., Даум Р.С. Связанный с сообществом метициллин-устойчивый золотистый стафилококк: эпидемиология и клинические последствия возникающей эпидемии. Clin Microbiol Rev.2010; 23 (3): 616–87.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Кюнерт М.Дж., Крушон-Моран Д., Хилл Х.А., Маккуиллан Дж., Макаллистер С.К., Фосхейм Г., Макдугал Л.К., Чайтрам Дж., Дженсен Б., Фридкин С.К.Распространенность колонизации носа Staphylococcus aureus в США, 2001–2002 гг. J Infect Dis. 2006. 193 (2): 172–9.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Tigabu A, Tiruneh M, Mekonnen F. Частота носительства, антимикробная чувствительность и связанные факторы Staphylococcus aureus с особым акцентом на MRSA среди городских и сельских детей начальной школы в Гондэре, Северо-Западная Эфиопия: сравнительный кросс -Секционное исследование.Adv Prev Med. 2018; 2018: 9364757.
PubMed
PubMed Central
Статья
Google Scholar
Aiken AM, Mutuku IM, Sabat AJ, Akkerboom V, Mwangi J, Scott JAG, Morpeth SC, Friedrich AW, Grundmann H. Носительство Staphylococcus aureus в больнице уровня 5 Thika, Кения: поперечное исследование . Антимикробная защита от инфекций. 2014; 3:22.
PubMed
PubMed Central
Статья
Google Scholar
Gnanamani A, Hariharan P, Paul-Satyaseela M. Staphylococcus aureus: обзор бактериологии, клинических заболеваний, эпидемиологии, устойчивости к антибиотикам и терапевтического подхода. Передний золотистый стафилококк. 2017: 4–28. Шимаа Энани и Лаура Э. Кротти Александр, IntechOpen, https://doi.org/10.5772/67338. Доступно по адресу: https://www.intechopen.com/books/frontiers-in-i-staphylococcus-aureus-i-/staphylococcus-aureus-overview-of-bacteriology-clinical-diseases-epidemiology-antibiotic-resistance-.
Google Scholar
Kong EF, Johnson JK, Jabra-Rizk MA. Связанный с сообществом устойчивый к метициллину Staphylococcus aureus: враг среди нас. PLoS Pathog. 2016; 12 (10): e1005837.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Mpairwe Y, Wamala S. Устойчивость к антибиотикам в Уганде: анализ ситуации и рекомендации. Кампала: Национальная академия наук Уганды; 2015.
Google Scholar
Шитту АО, Каба М., Абдулгадер С.М., Аджао Й.О., Абиола М.О., Олатимехин АО. Мупироцин-резистентный золотистый стафилококк в Африке: систематический обзор и метаанализ. Антимикробная защита от инфекций. 2018; 7 (1): 101.
PubMed
PubMed Central
Статья
Google Scholar
Musser JM, Kapur V. Клональный анализ метициллин-устойчивых штаммов Staphylococcus aureus из межконтинентальных источников: ассоциация гена mec с дивергентными филогенетическими линиями подразумевает распространение путем горизонтального переноса и рекомбинации.J Clin Microbiol. 1992. 30 (8): 2058–63.
CAS
PubMed
PubMed Central
Google Scholar
Eibach D, Nagel M, Hogan B, Azuure C, Krumkamp R, Dekker D, Gajdiss M, Brunke M, Sarpong N, Owusu-Dabo E, et al. Носовое носительство Staphylococcus aureus среди детей в регионе Ашанти в Гане. PLoS One. 2017; 12 (1): — e0170320.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Мореми Н., Мшана С.Е., Камугиша Е., Катараихья Дж., Таппе Д., Фогель У., Лямуя Е.Ф., Клаус Х. Преобладание метициллин-резистентного золотистого стафилококка-ST88 и нового ST1797, вызывающих раневую инфекцию и абсцессы. J Infect Dev Ctries. 2012; 6 (08): 620–5.
PubMed
Статья
PubMed Central
Google Scholar
Асадоллахи П., Фарахани Н.Н., Мирзайи М., Хорамруз С.С., ван Белкум А., Асадоллахи К., Дадаши М., Дарбан-Сарохалил Д.Распределение наиболее распространенных типов спа среди клинических изолятов устойчивых и чувствительных к метициллину Staphylococcus aureus во всем мире: обзор. Front Microbiol. 2018; 9: 163.
PubMed
PubMed Central
Статья
Google Scholar
Donkor ES, Jamrozy D, Mills RO, Dankwah T, Amoo PK, Egyir B, Badoe EV, Twasam J, Bentley SD. Исследование по контролю над геномной инфекцией Staphylococcus aureus в двух больницах Ганы.Устойчивость к заражению лекарствами. 2018; 11: 1757–65.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Рао К., Шанг В., Ху Х, Рао X. Staphylococcus aureus ST121: глобально распространенный гипервирулентный клон. J Med Microbiol. 2015; 64 (12): 1462–73.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Mohammadi S, Sekawi Z, Monjezi A, Maleki M-H, Soroush S, Sadeghifard N, Pakzad I, Azizi-Jalilian F, Emaneini M, Asadollahi K, et al.Появление SCCmec типа III с различными профилями устойчивости к противомикробным препаратам и СПА-типами среди метициллин-резистентного золотистого стафилококка, изолированного от медицинских и внебольничных инфекций на западе Ирана. Int J Infect Dis. 2014; 25: 152–8.
CAS
PubMed
Статья
PubMed Central
Google Scholar
Neela V, Ghasemzadeh Moghaddam H, van Belkum A, Horst-Kreft D, Mariana NS, Ghaznavi Rad E. IIIA в Малайзии.Eur J Clin Microbiol Infect Dis. 2009; 29 (1): 115.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Хан С., Сунг К., Ирам С., Наваз М., Сюй Дж., Мараса Б. Черновые последовательности генома двух метициллин-устойчивых клинических изолятов Staphylococcus aureus. Объявление о геноме. 2016; 4 (1): e01396–15.
PubMed
PubMed Central
Статья
Google Scholar
Мараса Б.С., Хан С., Ирам С., Сунг К., Сюй Дж. Проект последовательности генома метициллин-устойчивого клинического изолята 51S золотистого стафилококка (тип последовательности 291). Объявление о геноме. 2015; 3 (5): e01050–15.
PubMed
PubMed Central
Статья
Google Scholar
Зейдл К., Леймер Н., Палейрос Маркес М., Фуррер А., Хольцманн-Бюргель А., Сенн Г., Збинден Р., Цинкернагель А.С. Клональность и чувствительность к противомикробным препаратам метициллин-устойчивого золотистого стафилококка в университетской больнице Цюриха, Швейцария, с 2012 по 2014 год.Анн Клин Микробиол Антимикроб. 2015; 14 (1): 14.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Tong SYC, Schaumburg F, Ellington MJ, Corander J, Pichon B, Leendertz F, Bentley SD, Parkhill J, Holt DC, Peters G, et al. Новые виды стафилококков, которые являются частью комплекса, связанного со Staphylococcus aureus: непигментированный Staphylococcus argenteus sp. ноя и связанный с нечеловеческими приматами Staphylococcus schweitzeri sp.ноя Int J Syst Evol Microbiol. 2015; 65 (Pt 1): 15–22.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Посев из носоглотки | UF Health, University of Florida Health
Определение
Посев из носоглотки — это тест, который исследует образец секрета из верхней части глотки, за носом, для выявления организмов, которые могут вызывать заболевания.
Альтернативные названия
Культура — носоглотка; Мазок на респираторные вирусы; Тампон для каретки стафилококка
Как проводится тест
Перед началом исследования вас попросят кашлять, а затем наклонить голову назад.Стерильный тампон с ватным наконечником осторожно вводят через ноздрю в носоглотку. Это часть глотки, которая покрывает нёбо. Тампон быстро вращается и удаляется. Образец отправляется в лабораторию. Там ее помещают в специальную посуду (культуру). Затем за ним наблюдают, чтобы увидеть, растут ли бактерии или другие болезнетворные организмы.
Как подготовиться к экзамену
Никакой специальной подготовки не требуется.
Как будут себя чувствовать во время теста
У вас может возникнуть легкий дискомфорт, или возникнет рвота.
Почему проводится тест
Тест определяет вирусы и бактерии, вызывающие симптомы со стороны верхних дыхательных путей. К ним относятся:
- Bordetella pertussis , бактерии, вызывающие коклюш
- Neisseria meningitidis , бактерии, вызывающие менингококковый менингит
- Staphylococcus aureus , бактерии, вызывающие инфекцию, устойчивую к стафилококку , Metochyloc870,
- aureus
- Вирусные инфекции, такие как вирус гриппа или респираторно-синцитиальный вирус
Культура может использоваться для определения того, какой антибиотик подходит для лечения инфекции, вызванной бактериями.
Нормальные результаты
Присутствие микроорганизмов, обычно обнаруживаемых в носоглотке, является нормальным.
Что означают аномальные результаты
Присутствие любого болезнетворного вируса, бактерий или грибков означает, что эти организмы могут вызывать вашу инфекцию.
Иногда такие организмы, как Staphylococcus aureus , могут присутствовать, не вызывая заболевания. Этот тест может помочь идентифицировать резистентные штаммы этого микроорганизма (метициллин-резистентный Staphylococcus aureus или MRSA), чтобы при необходимости можно было изолировать людей.
Риски
В этом тесте нет рисков.
Изображения
Ссылки
Chernecky CC, Berger BJ. Культура, распорядок. В: Chernecky CC, Berger BJ, ред. Лабораторные исследования и диагностические процедуры . 6-е изд. Сент-Луис, Миссури: Эльзевьер Сондерс; 2013: 409-411.

 д.).
д.).
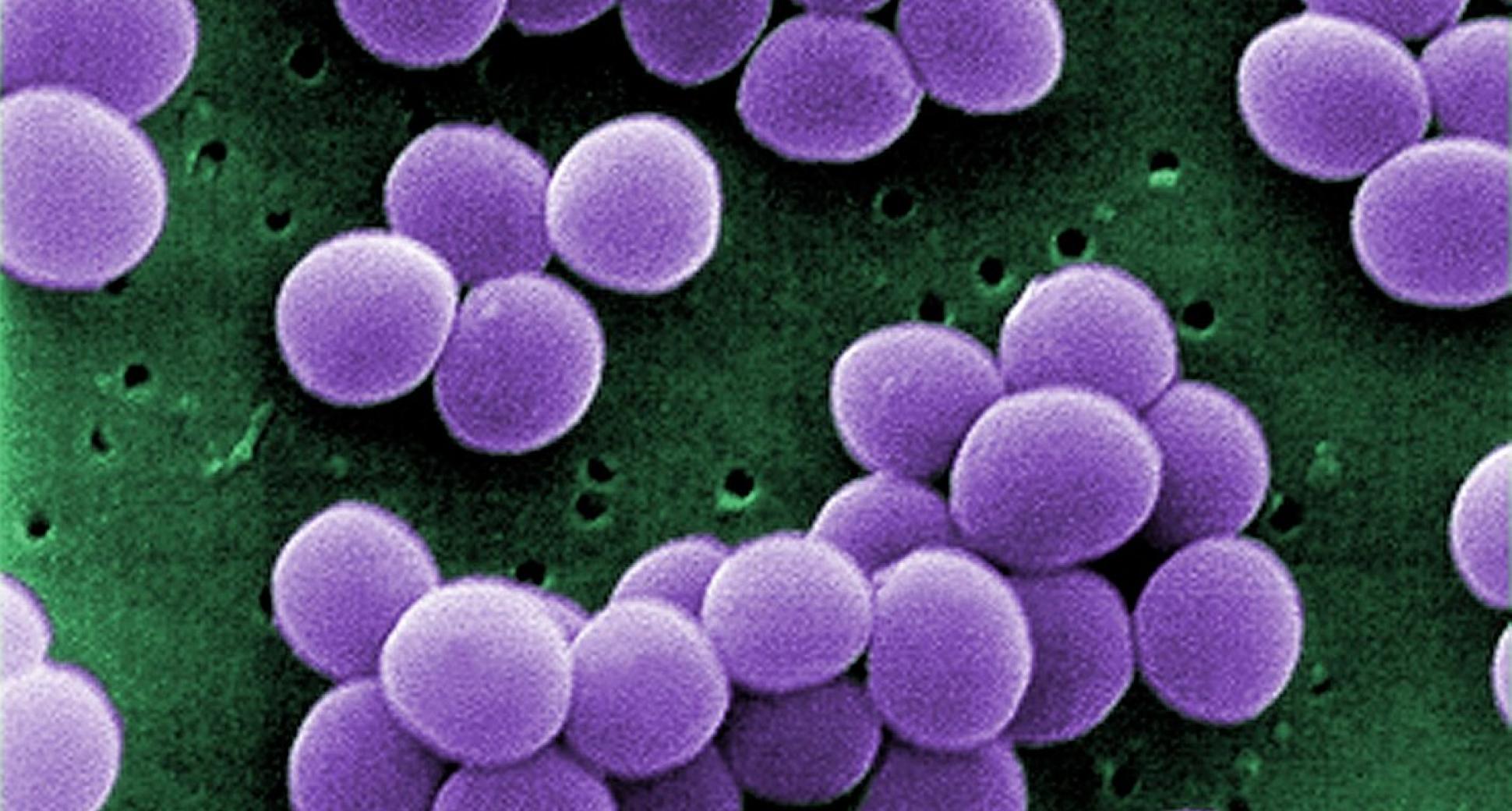
 Как еще возникает золотистый стафилококк в горле?
Как еще возникает золотистый стафилококк в горле?
