Дисбактериоз — симптомы, лечение — Медицинский центр
Что такое дисбактериоз?
Кишечник человека населен различными видами бактерий. Есть «хорошие» бактерии, которые помогают усваивать различные полезные вещества из съеденной пищи, поддерживают иммунитет, защищают от аллергии, снижают вероятность некоторых онкологических заболеваний и предотвращают заселение кишечника «плохими» бактериями.
В случае, если под влиянием каких-либо факторов снижается количество «хороших» бактерий, кишечник заселяют бактерии «плохие». Это состояние — нарушение состава и свойств микрофлоры — называется ДИСБАКТЕРИОЗОМ.
Таким образом, дисбактериоз — это не болезнь, а состояние, вызванное определенными факторами, вызывающими нарушение микрофлоры кишечника.
К этим факторам относятся: изменение состава употребляемой пищи и воды, пищевое отравление, применение антибиотиков и других лекарств, заболевания желудочно-кишечного тракта. Значит, для избавления от дисбактериоза необходимо избавиться в первую очередь от причин.
Симптомы дисбактериоза могут быть от простого урчания в животе (при легкой степени) до запоров или диареи, болей в животе, тошнота, рвота, неприятный запах изо рта, наличие непереваренной пищи в кале, в тяжелых случаях присоединяется быстрая утомляемость, сонливость или бессонница.
При легкой степени симптомы могут прекратиться при устранении причины. Более тяжелые формы могут приводить к воспалению стенки кишечника, нарушению всасывания пищи, появлению анемии и авитаминоза. Эта стадия требует тщательного обследования и назначения медикаментозного лечения. Причем лечить следует в первую очередь основное заболевание, служащее причиной дисбактериоза. Необходимо так же восстановить нарушенную микрофлору.
Основными методами лечения дисбактериоза служат:
Диета. Правильное питание, особенно при начальных стадиях, может полностью устранить проблему. Рацион должен быть максимально сбалансирован, в нем обязательно присутствие лакто- и бифидобактерий, клетчатки, пектина и ограничение тяжелой, жирной, острой пищи.
Из медицинских препаратов используются пребиотики и пробиотики.
Пребиотики не всасываются в кишечнике, а являются питательной средой для полезной микрофлоры.
Пробиотики — это препараты, состоящие из специальных форм лакто и бифидобактерий. Они нужны для заселения кишечника полезной микрофлорой. Их эффективность не всегда доказана, так не всегда можно определить, каких именно микроорганизмов и в каком количестве не хватает.
При тяжелых формах применяются фармакологические препараты- антибиотики и бактериофаги, подавляющие рост и развитие патогенной микрофлоры.
Как вспомогательные, могут применяться и препараты, стимулирующие иммунную систему, спазмолитики, антиаллергические средства.
Хороший эффект для избавления от патогенной микрофлоры дает гидроколонотерапия.
В любом случае, поставить правильный диагноз и назначить лечение может только врач.
В медицинском центре «На Восточной» Вас ждет высококвалифицированный врач-гастроэнтеролог, который поможет справиться с проблемой, назначить необходимое обследование и лечение.
Гастроэнтерология » МедАрт, г.Томск
Что такое дисбактериоз?
Дисбактериоз – состояние, при котором происходит нарушение количественного состава или нормального микробного состава кишечника.
У каждого здорового человека в кишечнике находятся бактерии, способствующие перевариванию пищи и выполняющие ряд других полезных функций. В случае ослабления иммунной системы происходят нарушения и в микрофлоре кишечника. Представители нормальной микрофлоры (молочнокислые и кишечные палочки, бифидобактерии и др.) сокращаются в количестве, а количество микроорганизмов (стафилококк, синегнойная палочка, кандида и т.д.) увеличивается.
Чем опасен Дисбактериоз?
При дисбактериозе страдает не только полостное (в просвете кишки), но и пристеночное (на стенках кишечника) пищеварение. При воспалении слизистой оболочки ухудшается восстановление ее клеток, что ведет к прогрессирующей атрофии слизистой, снижению адсорбционной способности клеток и нарушению пристеночного пищеварения. Это приводит к накоплению в просвете кишки не до конца расщепленных продуктов, что проявляется поносом, урчанием в кишечнике, вздутием живота. Параллельно с этим развивается дисфункция толстой кишки. Помимо местного и общего воздействия продуктов бактериального обмена и вредных веществ (токсинов), утрачивается способность микробов переводить пищеварительные ферменты, поступающие из верхних отделов кишечника, в неактивную форму, и они в больших количествах выделяются вместе с фекалиями. Из-за дисбактериоза ухудшается синтез основных бактериальных витаминов и их усвоение в кишечнике, нарушается обмен веществ. Дисбактериоз приводит к появлению аллергенных факторов, которые способны затянуть течение воспалительных заболеваний пищеварительного тракта.
Это приводит к накоплению в просвете кишки не до конца расщепленных продуктов, что проявляется поносом, урчанием в кишечнике, вздутием живота. Параллельно с этим развивается дисфункция толстой кишки. Помимо местного и общего воздействия продуктов бактериального обмена и вредных веществ (токсинов), утрачивается способность микробов переводить пищеварительные ферменты, поступающие из верхних отделов кишечника, в неактивную форму, и они в больших количествах выделяются вместе с фекалиями. Из-за дисбактериоза ухудшается синтез основных бактериальных витаминов и их усвоение в кишечнике, нарушается обмен веществ. Дисбактериоз приводит к появлению аллергенных факторов, которые способны затянуть течение воспалительных заболеваний пищеварительного тракта.
Дисбактериоз служит фоном для развития многих заболеваний. А сочетанный дисбактериоз не только способствует многим патологическим процессам, но может иметь и собственные клинические проявления.
В итоге резко ослабевают физиологические, в частности защитные, функции кишечника. Частые простуды, аллергии, гинекологические расстройства, кожные высыпания и, разумеется, желудочно-кишечные расстройства — вот перспективы запущенного дисбактериоза. Дисбактериоз кишечника может приводить к дисбактериозу мочеполового тракта, зева. Нарушение баланса кишечной микрофлоры служит толчком к развитию острых и обострению хронических заболеваний.
Причины дисбактериоза:
-длительный прием антибиотиков;
-наличие различных хронических и функциональных заболеваний органов и систем. Особенно это касается органов ЖКТ;
-злоупотребление алкоголем;
-нерациональное питание;
-состояние серьезного иммунодефицита. Они возникают при СПИДе, некоторых видах рака, химиотерапии;
-наличие в кишечнике паразитов или болезнетворных микробов (дизентерия, сальмонеллез, вирусные заболевания). Они выделяют вещества, которые также убивают полезных микробов;
-постоянное пребывание в состоянии стресса и неблагоприятная экология.
Основные симптомы дисбактериоза.
Симптомы дисбактериоза являются неспецифичными. Это могут быть: отрыжка, тошнота, изжога. Иногда при этом появляются неприятный запах изо рта, неприятный привкус во рту, может даже держаться субфебрильная температура. У некоторых людей возникают аллергические реакции на безобидные продукты.
Обычно пациенты при дисбактериозе кишечника также жалуются на чувство дискомфорта в животе и повышенное газообразование. Их начинают беспокоить различные нарушения стула: поносы, запоры или неустойчивый стул. Некоторые люди отмечают боли в животе.
Нужно знать, что дисбактериоз всегда приводит к усугублению течения различных хронических заболеваний пищеварительного тракта. По этой причине крайне важно вовремя диагностировать и начать лечить дисбактериоз.
При появлении этих симптомов необходимо обратиться к ГАСТРОЭНТЕРОЛОГУ. Для диагностики данного состояния применяют:
-эндоскопическое исследование;
-посев кала на флору (анализ кала на дисбактериоз).
Лечение дисбактериоза заключается в:
-соблюдение диеты;
-приеме бактериальных препаратов для восстановления кишечной флоры;
-применение спазмолитиков, препаратов осмотического действия и пробиотиков;
-нормализации моторики кишечника.
Профилактика дисбактериоза.
Чтобы дисбактериоз не появился, необходимо проводить его профилактику. Первичная профилактика дисбактериоза является достаточно непростым делом. Ведь для этого нужно улучшить экологию, питание, избавиться от стрессов и негативного воздействия разнообразных факторов внешней и внутренней среды.
Вторичная профилактика подразумевает рациональное применение антибиотиков и других медикаментов, которые могут нарушить эубиоз. Необходимо вовремя и правильно лечить болезни органов пищеварения, которые могут нарушить микробиоценоз.
Большое внимание нужно уделять рациональному режиму питания. Пища должна иметь сбалансированный состав.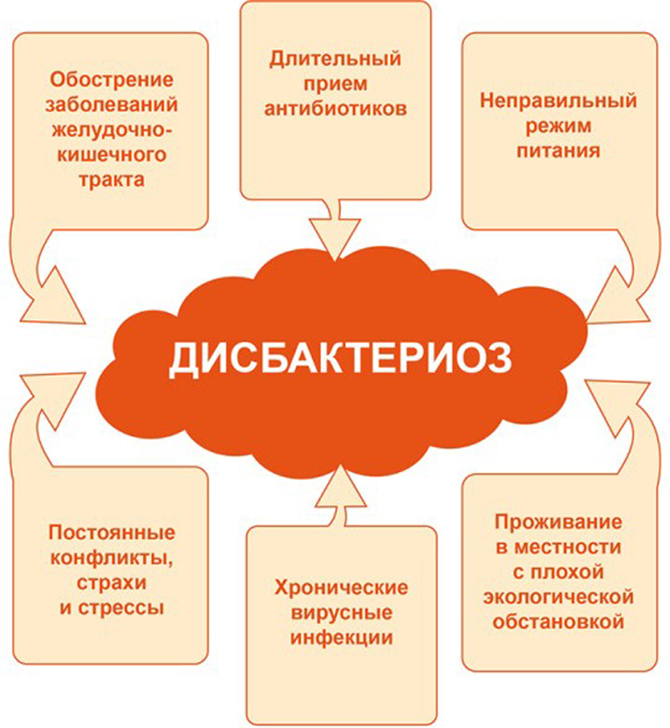
Если приходится принимать антибиотики, то одновременно следует использовать специальные препараты, которые способствуют поддержанию роста и развития нормальной микрофлоры кишечника.
Дисбактериоз – это гражданская война внутренней микрофлоры кишечника
|
Характерный симптом дисбактериоза – вздутие живота. Фото Depositphotos/PhotoXPress.ru |
Термин «дисбактериоз» сегодня на слуху. Существует ошибочное мнение, что это – самостоятельное заболевание. Однако в новой международной классификации болезней дисбактериоз кишечника не значится. Не используется он в качестве медицинского диагноза и в нашей стране. То есть дисбактериоз кишечника не является самостоятельным недугом. Под ним понимается синдром (совокупность симптомов), обусловленный, например, нерациональным питанием или различными недугами, связанными с расстройством нормальной деятельности кишечника. При этом зачастую происходит количественное и качественное нарушение обитающей в нем микрофлоры. Между прочим, масса всех проживающих в кишечнике одного человека микроорганизмов (а их около 500 видов) может составлять более 2 кг.
Среди микроорганизмов, входящих в нормальную микрофлору, есть как полезные, так и вредные бактерии. К первым относятся, например, бифидобактерии и лактобактерии, ко вторым – стафилококки и стрептококки. Полезные микроорганизмы всегда входят в состав нормальной микрофлоры, их еще называют обязательными. Они участвуют в процессе пищеварения, способствуют усвоению витаминов, регулируют водно-солевой обмен, стимулируют иммунитет, обладают антиаллергическим действием, помогают выводить из организма различные токсины. Словом, их значение трудно переоценить.
Что касается вредных (болезнетворных) бактерий, то они считаются необязательными и непостоянными представителями нормальной микрофлоры. Вредные бактерии попадают в кишечник, например, с недостаточно обработанной в термическом отношении пищей. Примечательно, что эти микроорганизмы до поры до времени мирно сосуществуют с полезными бактериями, не вызывая проблем у здорового человека.
Вредные бактерии попадают в кишечник, например, с недостаточно обработанной в термическом отношении пищей. Примечательно, что эти микроорганизмы до поры до времени мирно сосуществуют с полезными бактериями, не вызывая проблем у здорового человека.
Однако данное равновесие неустойчивое. Стоит ему под влиянием какого-либо негативного фактора нарушиться, как болезнетворные микроорганизмы начинают активно размножаться, вызывая расстройство нормальной микрофлоры кишечника и способствуя возникновению дисбактериоза.
Распространенной причиной его появления является нерациональное питание, например преобладание в рационе белков и жиров животного происхождения и недостаток свежих овощей, фруктов, кисломолочных продуктов. Другая причина – длительный и бесконтрольный прием антибактериальных и некоторых других лекарств и, как следствие, ослабление иммунитета. А это, в свою очередь, приводит к развитию дисбактериоза. Размножение патогенной флоры происходит также при различных желудочно-кишечных заболеваниях, инфекциях и ряде других недугов.
Один из признаков нарушения микрофлоры – нарушение стула, обусловленное повышенным образованием желчных кислот и усилением перистальтики кишечника. В других случаях (чаще у пожилых людей) дисбактериоз, наоборот, проявляется запором. Еще один характерный симптом – вздутие живота, вызванное усиленным образованием газов в толстой кишке. Кроме того, при дисбактериозе снижается аппетит, бывают тошнота, отрыжка. У больного наблюдаются также нарушение обмена веществ, расстройство сна, повышенная утомляемость, сухость кожи.
Теперь о лечении. Медикаментозная терапия направлена на устранение причины, вызвавшей недуг, и восстановление нормальной микрофлоры кишечника. С этой целью применяются лекарства, стимулирующие размножение полезных бактерий, а также содержащие живые микроорганизмы (лактобактерии и бифидобактерии). Для уничтожения патогенных микроорганизмов назначают антибактериальные препараты, а при выраженном нарушении процесса пищеварения – ферменты. Активно используются также фитотерапевтические рекомендации.
Активно используются также фитотерапевтические рекомендации.
Важную роль в восстановлении нормальной микрофлоры играет диета. Из пищевого рациона следует исключить острую и жирную пищу, копчености, продукты, усиливающие бродильные процессы в кишечнике, – сладости, квашеную капусту, газированные напитки. Не следует также употреблять бобовые (фасоль, горох), свежий хлеб, алкоголь. В меню могут присутствовать блюда из нежирного мяса (вареного или тушеного), каши (рисовая, гречневая, овсяная), зелень (петрушка, укроп) и молочнокислые продукты (кефир, простокваша).
Дисбактериоз кишечника — симптомы и лечение
Дисбактериоз кишечника – это заболевание, которое характеризуется нарушением соотношения и состава населяющих кишечник микроорганизмов.
Без соответствующего лечения данное заболевание может привести к серьёзным нарушениям в работе желудочно-кишечного тракта.
Причины появления дисбактериоза
Существует многоженство факторов, способных изменить нормальную микрофлору кишечника. Но чаще всего своим появление дисбактериоза связано с:
- Прием некоторых лекарственных средств: антибиотиков, слабительных, гормональных, психотропных и т.д.;
- Неправильное питание и злоупотребление алкоголем;
- Инфекционные заболевания;
- Хронические заболевания желудочно-кишечного тракта;
- Продолжительное психоэмоциональное перенапряжение;
- Аллергические заболевания
- Иммунодифициты.
Основные симптомы дисбактериоза
Симптомы дисбактериоза бывают идентичны симптомам других гастроэнтерологических заболеваний. При дисбактериозе могут беспокоить:
- Изменения стула: поносы, запоры или неустойчивый стул;
- Дискомфорт в животе, вздутие;
- Повышенное газообразование;
- Резкий запах стула;
- Тошнота;
- Боли в животе без четкой локализации;
- Аллергические реакции;
- Утомляемость, слабость.

Диагностика и лечение дисбактериоза
В первую очередь, для постановки диагноза необходимо провести анализ кала. Также врач может назначить: гастроскопию, ректороманоскопию, ирригоскопию, колоноскопию.
Лечение дисбактериоза кишечника проводится в комплексе и подразумевает: восстановление нормальной микрофлоры кишечника, улучшение пищеварения, восстановление моторики кишечника. Лекарственная терапия подразумевает прием антибактериальных препаратов и бактериальных, регуляторов пищеварения.
Лечение дисбактериоза у взрослых и детей
К какому специалисту следует обратиться, если у вас обнаружились симптомы Дисбактериоза?
Профилактика дисбактериоза
Профилактика дисбактериоза заключается в решении ряда проблем:
- Организация рационального питания;
- Контроль применяемых лекарственных препаратов;
- Улучшение экологической обстановки;
- Своевременное лечение заболеваний желудочно-кишечного тракта.
Лечение гастроэнтерологических заболеваний – одно из приоритетных направлений работы клиники «Семейная».
Запись на прием к врачу гастроэнтерологу
Обязательно пройдите консультацию квалифицированного специалиста в области гастроэнтерологии в клинике «Семейная».
Чтобы уточнить цены на прием врача гастроэнтеролога или другие вопросы пройдите по ссылке ниже
Дисбактериоз кишечника — Гастроэнтерология — Многофункциональный лечебно-диагностический центр для всей семьи ЗДОРОВЬЕ ПЛЮС в Пятигорске
О дисбактериозе кишечника в последнее время часто говорят с экранов телевизоров, убеждая нас в том, что данное заболевание требует принятия немедленных мер. Но в действительности, согласно заключению Всемирной организации здравоохранения, дисбактериоз кишечника не является заболеванием. Это синдром, который возникает из-за нарушения баланса микроорганизмов в кишечнике.
В кишечнике каждого человека имеются как полезные, так и патогенные микроорганизмы. Если организм здоров, то «перевес» на стороне полезной микрофлоры. Если же баланс нарушается, то патогенная микрофлора начинает «перевешивать». Так и возникает дисбактериоз.
Следует отметить, что каких-то конкретных симптомов, которые бы указывали на наличие данного синдрома, у дисбактериоза кишечника нет. При нарушении микрофлоры кишечника у человека могут возникать поносы, запоры, тошнота, метеоризм, изжога, отрыжка. Во рту при наличии данного синдрома у многих пациентов появляется неприятный привкус, а иногда и неприятный запах.
Нарушение микрофлоры кишечника провоцирует возникновение аллергических реакций на, казалось бы, безобидные продукты. У пациента может незначительно повышаться температура. Если дисбактериоз появился у человека в возрасте, то он может также сопровождаться запорами.
Нарушение микрофлоры кишечника приводит к нарушению ее основных функций, из-за чего у человека может развиться полигиповитаминоз. В результате у пациента не только нарушается кишечная моторика, но и наблюдаются явления, которые, на первый взгляд, совершенно не связаны с деятельностью кишечника, например, головные боли или дистрофия миокарда. Страдает периферическая нервная система, человек находится в подавленном состоянии, он становится раздражительным. Полигиповитаминоз, появившийся на фоне дисбактериоза, приводит к возникновению стоматита, дерматита, к усилению слюноотделения.
Диагностирование дисбактериоза кишечника является комплексным. Пациенту предстоит сдать лабораторные анализы, в том числе на посев мочи, желчи и кала. Проводится также копрологическое исследование кала, с помощью которого может быть обнаружена йодофильная микрофлора в комплексе со значительным объемом переваренной клетчатки и крахмала. При наличии данных составляющих можно говорить о том, что у пациента действительно имеется дисбактериоз кишечника.
Также осуществляется обследование метаболитов, при котором определяется наличие в микрофлоре летучих жирных кислот, которые выделяются микробами в процессе своей жизнедеятельности и развития. Этот метод очень простой и быстрый, ведь результат будет готов уже через несколько часов. Особо ценен он также тем, что значительно дешевле бактериологического метода.
Этот метод очень простой и быстрый, ведь результат будет готов уже через несколько часов. Особо ценен он также тем, что значительно дешевле бактериологического метода.
Лечение дисбактериоза должно быть комплексным и включать следующие меры:
- назначение диеты, ведение здорового образа жизни;
- устранение избыточного роста патогенной микрофлоры в кишечнике;
- обеспечение размножения полезной для организма микрофлоры;
- разработка мер по повышению иммунитета, чтобы обеспечить нормальную микрофлору кишечника
При выявлении любых из перечисленных симптомов следует обратиться к врачу-гастроэнтерологу
Записаться на прием Вы можете по телефону 8 (928) 337-60-60.
лечение и диагностика дисбактериоза кишечника
Дисбактериоз – заболевание, при котором наблюдается патологическое изменение состава нормальной флоры кишечника, когда количество полезных бактерий снижается, а патогенных – возрастает. Вследствие этого процесса нарушается работа кишечника.
Заболевание проявляется хорошо выраженными симптомами, которые доставляют немало дискомфорта:
- диарея, метеоризм, вздутие живота и урчание в кишечнике,
- могут возникать аллергические реакции на некоторые продукты,
- боль в животе,
- тошнота и рвота,
- жидкий стул нехарактерного цвета,
- снижение аппетита, потеря массы тела,
- снижение иммунитета, развитие грибковых заболеваний.
Симптомы не проявляются одновременно и резко, а степень их выраженности зависит от стадии болезни. При появлении признаков заболевания необходима срочная консультация гастроэнтеролога.
Если врач подтвердит диагноз, лечение дисбактериоза должно быть начато незамедлительно. Больным показана терапия лекарственными средствами по нескольким направлениям: для устранения причины заболевания, снятия острых симптомов и восстановления нормальной флоры кишечника и нормализации работы органа.
Лечение дисбактериоза кишечника неразрывно связано с соблюдением диеты. Питание больного должно быть сбалансированным, обогащенным витаминами и микроэлементами. Также нужно следить за потребляемым количеством жидкости: часто при дисбактериозе организм страдает от обезвоживания.
Дисбактериоз у взрослых может быть вызван приемом антибиотиков, неправильным питанием, другими заболеваниями печени и желудочно-кишечного тракта (гастрит, панкреатит), а также чрезмерным употреблением алкоголя.
Особого внимания требует дисбактериоз у детей, лечение которого крайне изматывает маленьких пациентов. Заболевание может быть вызвано самыми разными причинами: не вовремя введенный прикорм, частая смена детского рациона, раннее отлучение от груди.
Если вы ищете клинику в Минске, где могут правильно диагностировать и назначить корректное лечение дисбактериоза, Проктологический центр «МедКлиник» рад предложить вам свои услуги. У нас работают высококвалифицированные специалисты, имеющие колоссальный опыт лечения заболеваний желудочно-кишечного тракта.
Дисбактериоз кишечника у детей и пути его коррекции | Коваленко А.А., Жихарева Н.С.
В желудочно–кишечном тракте (ЖКТ) здоровых лиц насчитывается более 500 видов различных микроорганизмов, большую часть из которых составляют представители так называемой облигатной микрофлоры (бифидобактерии, лактобактерии, непатогенная кишечная палочка и др.). На 92–95% микрофлора кишечника состоит из облигатных анаэробов. Состав кишечной микрофлоры достаточно индивидуален и формируется в первые дни жизни ребенка. Важнейшим фактором формирования нормальной микрофлоры является естественное вскармливание, так как женское молоко содержит ряд веществ, которые способствуют заселению кишечника определенными видами микроорганизмов в определенных количествах. Даже незначительное неблагополучие в первые дни жизни ребенка, особенно патологические состояния ЖКТ, способны вызвать тяжелые, трудно корректируемые в дальнейшем нарушения биоценоза кишечника. Особый ущерб микрофлоре кишечника в этот период может нанести нерациональная антибиотикотерапия.
Особый ущерб микрофлоре кишечника в этот период может нанести нерациональная антибиотикотерапия.
С физиологической точки зрения важно присутствие в кишечнике бифидобактерий, анаэробных палочек, составляющих 85–98% от всей нормальной толстокишечной микрофлоры (109–1011 микробных тел в 1 г содержимого), которые являются важнейшим фактором колонизационной резистентности, в частности, благодаря выработке молочной кислоты, лизоцима, спиртов и ряда других бактерицидных веществ, стимуляции иммунной системы ЖКТ. Бифидобактерии способствуют утилизации пищевых ингредиентов, синтезируют витамины К, С, некоторые витамины группы В, способствуют всасыванию витамина Д, железа, кальция. Лактобактерии (107–108 микробных тел в 1 г содержимого толстой кишки) способствуют процессам восстановления слизистой оболочки кишки, противостоят заселению патогенных микроорганизмов. Непатогенные разновидности кишечной палочки, составляющие примерно 0,01% от общего количества микробов в толстой кишке (107–108 микробных тел в 1 г содержимого), также необходимы для нормального течения пищеварительных процессов, вырабатывают витамин К, а также колицины, тормозящие рост патогенной микрофлоры.
Нарушение микробного равновесия в кишечнике именуется дисбактериозом или (в более широком значении) дисбиозом кишечника. Основными причинами дисбактериоза кишечника являются различные заболевания ЖКТ, особенно связанные с синдромом мальабсорбции (СМ), нерациональное питание ребенка (особенно в первые месяцы жизни), антибиотикотерапия (особенно в первые дни жизни). В ряде случаев он может быть связан с особенностями иммунной системы кишечника. При этом обычно он имеет упорное, трудно поддающееся терапии течение. При таком дисбактериозе в обычных условиях установить причину, как правило, не удается. Дисбактериоз кишечника является синдромом, всегда вторичным состоянием, и развивается при любом неблагополучии в ЖКТ. В свою очередь, дисбактериоз кишечника существенно меняет состав внутренней среды кишки, что нарушает пищеварительные процессы, оказывает повреждающее действие на кишечную стенку и усугубляет уже имеющуюся мальабсорбцию. Таким образом, через дисбактериоз кишечника замыкается патогенетический порочный круг, разорвать который необходимо как для успешного лечения основного заболевания, так и для ликвидации его последствий.
Таким образом, через дисбактериоз кишечника замыкается патогенетический порочный круг, разорвать который необходимо как для успешного лечения основного заболевания, так и для ликвидации его последствий.
Согласно классификации дисбактериоза кишечника по И.Б. Куваевой, К.С. Ладодо (1991) можно выделить четыре его степени.
Первая степень – латентная фаза дисбиоэа проявляется только в снижении на 1–2 порядка количества защитной микрофлоры – бифидобактерий, лактобацилл, а также полноценных кишечных палочек до 80% от общего количества. Остальные показатели соответствуют физиологической норме (эубиозу). Как правило, начальная фаза не вызывает дисфункций кишечника и возникает как реакция организма практически здорового человека на воздействие неблагоприятных факторов, таких как, например, нарушение режима питания и др. В этой фазе возможно вегетирование в кишечнике незначительного количества отдельных представителей условно–патогенной флоры.
Вторая степень – пусковая фаза более серьезных нарушений характеризуется выраженным дефицитом бифидобактерий на фоне нормального или сниженного количества лактобацилл или сниженной их кислотообразующей активности, дисбалансом в количестве и качестве кишечных палочек, среди которых нарастает доля лактозонегативных или цитрат–ассимилирующих вариантов. При этом на фоне дефицита защитных компонентов кишечного микробиоценоза происходит размножение либо плазмокоагулирующих стафилококков, либо протеев, либо грибов рода Кандида.
Вегетирование в кишечнике протеев или плазмокоагулирующих стафилококков в этой фазе развития дисбактериоза чаще транзиторное, чем постоянное. Функциональные расстройства пищеварения выражены неотчетливо – спорадически жидкий стул зеленоватого цвета с резким запахом, со сдвигом рН в щелочную сторону, иногда, напротив, задержки стула, может отмечаться тошнота.
Третья степень – фаза агрессии аэробной флоры характеризуется отчетливым нарастанием содержания агрессивных микроорганизмов; при этом размножаются до десятков миллионов в ассоциации золотистые стафилококки и протеи, гемолитические знтерококки; среди кишечных палочек на среде Эндо преобладают колонии не темно–красного цвета с металлическим блеском, а розовье, бледно–розовые, сиреневатые или темно–красные слизистые, что отражает замещение полноценных эшерихий бактерияии родов Klebsiella, Enterobacter, Citrobacter и др. Эта фаза дисбактериоза, как правило, проявляется дисфункциями кишечника с расстройствами моторики, секреции ферментов и всасывания.
Эта фаза дисбактериоза, как правило, проявляется дисфункциями кишечника с расстройствами моторики, секреции ферментов и всасывания.
Четвертая степень – фаза ассоциативного дисбиоза характеризуется глубоким разбалансированием кишечного микробиоценоза с изменением количественных соотношений основных групп микроорганизмов, изменением их биологических свойств, накоплением токсических метаболитов. Характерно вегетирование энтеропатогенных серотипов E.coli, сальмонелл, шигелл и других возбудителей острых кишечных инфекций. Возможно раэмножение клостридий. Эта фаза дисбиоза характеризуется функциональными растройствами пищеварительной системы и нарушениями общего нутритивного статуса, дефицитом массы тела, бледностью кожных покровов, снижением аппетита, частым стулом с примесью слизи, зелени, иногда крови, с резким гнилостньм или кислым запахом.
Дисбактериоз кишечника всегда вторичен. Дисбактериоз возникает как следствие изменения внутренней среды кишки и/или прямого воздействия на кишечную микрофлору. Причинами могут быть любые заболевания органов пищеварения, т.к. при этом всегда изменяется внутренняя среда кишки, что неизбежно отражается на ее экосистеме. Нередкими причинами являются антибиотикотерапия (рациональная и, тем более, нерациональная), функциональные нарушения моторики, диетические особенности и, видимо, встречающиеся чаще, чем диагностируются, иммунодефицитные состояния. Сам же дисбактериоз может приводить к повреждению кишечного эпителия, нарушению процессов переваривания и всасывания, усугубляя уже имеющиеся нарушения в ЖКТ.
Точная диагностика дисбактериоза достаточно затруднительна. Наиболее достоверным является исследовании микрофлоры в биоптате тощей кишки, полученном в ходе эндоскопического исследования, однако этот метод в силу технических сложностей не может быть повседневным. В результате наиболее распространенным методом является определение состава фекальной микрофлоры, отражающей микробный состав лишь дистальных отделов кишечника.
Так как дисбактериоз кишечника не является болезнью, то правильнее говорить не о его лечении, а о коррекции микрофлоры кишечника. Поскольку дисбактериоз всегда вторичен – усилия необходимо направить на выявление причины дисбактериоза, т.е. основного заболевания, и лечение этого заболевания. Нередко этого оказывается вполне достаточным.
Поскольку дисбактериоз всегда вторичен – усилия необходимо направить на выявление причины дисбактериоза, т.е. основного заболевания, и лечение этого заболевания. Нередко этого оказывается вполне достаточным.
В коррекции дисбактериоза можно выделить несколько подходов. Первое – применение живых микроорганизмов (фармакологические препараты или пищевые добавки), оказывающих положительное влияние на микробный баланс кишечника, которые именуются пробиотиками. Пробиотический эффект доказан для следующих микроорганизмов и, соответственно, содержащих их препаратов: Lactobacillus acidophilus, Lactobacillus GG, Lactobacillus fermentum, Strepto(Entero)coccus faecium SF68, S. termophilus, B. bifidum, Saccharomyces boulardii.
Второе направление – создание в кишечнике условий, благоприятствующих нормальной микрофлоре, но неблагоприятных для нежелательных микроорганизмов. С этой целью назначаются пребиотики – частично или полностью неперевариваемые компоненты пищи, которые избирательно стимулируют рост и/или метаболизм одной или нескольких групп микроорганизмов, обитающих в толстой кишке, обеспечивая нормальный состав кишечного микробиоценоза. К пребиотикам относятся дисахариды, олигосахариды, пищевые волокна. Принцип действия всех пребиотиков примерно одинаков: пребиотики не расщепляются ферментативными системами желудочно–кишечного тракта, но утилизируются микрофлорой толстой кишки, что способствует росту бифидум– и лактобактерий, изменяет рН среды в толстой кишке, а синтезирующиеся короткоцепочечные жирные кислоты оказывают трофическое действие на колоноциты. Пребиотическим эффектом обладает лактулоза, синтетический дисахарид, состоящий из фруктозы и галактозы. Лактулоза эффективно восстанавливает кишечный биоценоз, обладая за счет этого в более высоких дозах слабительным действием. Более длинные молекулы олигосахаридов входят в состав грудного молока (галактоолигосахариды) и ряда продуктов растительного происхождения (фруктоолигосахариды) и являются физиологическими регуляторами кишечного биоценоза и моторики. Олигосахариды женского молока являются важнейшими и уникальными (т.к. присутствуют только в женском молоке) факторами формирования кишечной микрофлоры в первые месяцы жизни ребенка, в связи с чем обоснована необходимость их введения в состав смесей для искусственного вскармливания.
Под термином «пищевые волокна» в настоящее время понимают достаточно гетерогенную группу полисахаридов, в основном растительного происхождения, наиболее известными из которых являются целлюлоза и гемицеллюлоза. В то же время к пищевым волокнам относятся инулин, хитин, хитозан, пектины, камеди, слизии, лигнин. Некоторые авторы относят к ним также аминосахара грибов и ракообразных и даже неперевариваемые белки. И все же «классические» пищевые волокна это – крупномолекулярные полимеры глюкозы, содержащиеся в растениях и составляющие основу их клеточных стенок.
Рафинизация значительно снижает долю пищевых волокон в пище. Содержание волокон в неочищенных злаковых, орехах, бобовых выше, чем в очищенных. Современные технологические процессы, применяемые в пищевой промышленности, оставлют чрезвычайно мало пищевых волокон в конечном продукте.
Целлюлоза представляет собой неразветвленный полимер глюкозы, образованный 1–4 связями между мономерами. Молекула состоит из десятков тысяч мономеров, и целлюлоза различных растений может различаться по длине цепи и несколько различаться по химическим и физическим свойствам. Гемицеллюлоза является полимером глюкозы, арабинозы, глюкуроновой кислоты и ее метилового эфира. Также как и целлюлоза, разные варианты гемицеллюлозы неднородны по своими физико–химическим свойствам. Инулин является полимером фруктозы и содержится в большом количестве в топинамбуре, корнях цикория и артишоках. Камеди являются разветвленными полимерами глюкуроновой и галактуроновой кислот, к которым присоединены остатки арабинозы, маннозы, ксилозы, а также соли магния и кальция. Слизи представляют собой разветвленные сульфатированные арабиноксиланы. Пектины представляют собой полимеры галактуроновой и гиалуроновой кислот. Пектиновые вещества входят в состав клеточных стенок и межуточного вещества высших растений. Лигнин является полимерным остатком древесины после ее перколяционного гидролиза, который проводится с целью выделения целлюлозы и гемицеллюлозы. Альгинаты – соли альгиновых кислот, в большом количестве содержащихся в бурых водорослях, молекула которых представлена полимером полиуроновых кислот.
Содержание пищевых волокон в различных продуктах различно. В средних количествах (1–1,9 г/100 г продукта) они содержатся в моркови, сладком перце, петрушке (как в корне, так и зелени), редьке, репе, тыкве, дыне, черносливе, апельсине, лимоне, бруснике, фасоле, гречневой и перловой крупе, «Геркулесе», ржаном хлебе. Более высокое их содержание (2–3 г/100 г продукта) в чесноке, клюкве, красной и черной смородине, черноплодной рябине, ежевике, овсяной крупе, хлебе из белково–отрубной муки. Наконец, в наибольших количествах (более 3 г/100 г продукта) пищевые волокна содержатся в укропе, кураге, клубнике, малине, чае (4,5 г/100 г), овсяной муке (7,7 г/100 г), пшеничных отрубях (8,2 г/100 г), сушеном шиповнике (10 г/100 г), жареном кофе в зернах (12,8 г/100 г), овсяных отрубях (14 г/100 г). Примером рафинированного продукта может послужить растворимый кофе, в котором в отличие от исходного продукта пищевых волокон не содержится вообще.
Пищевые волокна обладают многочисленными физиологическими эффектами, что определяет их значение для нормального функционирования организма.
Пищевые волокна удерживают воду, влияя тем самым на осмотическое давление в просвете желудочно–кишечного тракта, электролитный состав кишечного содержимого и массу фекалий, увеличивая их объем и вес. Растворимые пищевые волокна, формируя гелеобразованные структуры, препятствуют рефлюксам, в т.ч. гастроэзофагеальному, способствуют опорожнению желудка и увеличивают скорость пассажа кишечного содержимогов. Перечисленные эффекты в целом направлены на стимуляцию моторики желудочно–кишечного тракта.
Пищевые волокна обладают высокой адсорбционной способностью. Этим объясняется их детоксицирующее действие. Кроме того, они адсорбируют желчные кислоты и уменьшают их всасывание, регулируя, с одной стороны, объем пула желчных кислот в организме и, с другой стороны, оказывают гипохолестринемический эффект.
Большое значение имеют также катионообменные свойства кислых полисахаридов и антиоксидантный эффект лигнина.
Пищевые волокна являются важными регуляторами состава кишечной микрофлоры. Переваривание пищевых волокон, поступающих в кишечник, реализуется микрофлорой толстой кишки, которая получает энергетический и пластический материал. С другой стороны, короткоцепочечные жирные кислоты, образующиеся в результате активности микрофлоры, необходимы для нормального функционирования эпителия толстой кишки. Нормальный состав микрофлоры и нормальное функционирование колоноцитов обеспечивают физиологические процессы в толстой кишке и ее нормальную моторику.
Точная суточная потребность пищевых волокон для человека не установлена. Предполагается, что взрослый человек должен за сутки съедать 20–35 г пищевых волокон, в то время как в среднем европеец потребляет около 13 г пищевых волокон в сутки.
Отсутствие пищевых волокон в диете может приводить к ряду патологических состояний. Наиболее очевидна связь недостатка пищевых волокон в питании с развитием запоров. С дефицитом пищевых волокон в пище связывают развитие ряда заболеваний и состояний, как рак толстой кишки, синдром раздраженного кишечника, запоры, желчно–каменная болезнь, сахарный диабет, ожирение, атеросклероз, ишемическая болезнь сердца, варикозное расширение и тромбоз вен нижних конечностей и др., однако фактически в большинстве случаев эта связь остается недоказанной.
Таким образом, пищевые волокна не являются лишь «балластными веществами», как трактовалось их значение ранее, и должны присутствовать в рационе как взрослого человека, так и ребенка.
К третьей группе средств для коррекции состава кишечной микрофлоры относятся сами метаболиты, продуцируемые микроорганизмами, нормальными обитателями кишечника человека.
Одним из современных препаратов, используемых для коррекции дисбиозов кишечника, является Аципол (Россия).
Штаммы лактобактерий, входящие в Аципол, выделены от здоровых людей разного возраста. Эти штаммы обладают высокой биохимической активностью, не требовательны к составу питательных сред и условиям выращивания. Антагонистическая активность лактобактерий по отношению к шигеллам Зоне, Флекснера, протеи, сальмонеллам, стафилококкам высокая; гибель тест–организмов in vitro наступает через 24–48 ч в 96–100%. Обладая высокой антагонистической активностью, ацидофильные лактобациллы устойчивы к неблагоприятным условиям желудочно–кишечного тракта (ЖКТ). Эти свойства лактобацилл свидетельствуют об их хорошей переносимости (адаптогенности) в условиях ЖКТ, помогают им хорошо выживать и оказывать благотворное влияние на микрофлору кишечника.
Второй биологический компонент Аципола – биомасса живых кефирных грибков. В сухом веществе биомассы кефирных грибков содержится 40% углеводов в том числе 30 % полисахарида, состоящего из глюкозы и галактозы, до 2% органических кислот, 30–40% белка, содержащего все незаменимые аминокислоты с повышенным количеством валина и треонина.
Проведенные клинические испытания Аципола позволяют рекомендовать применение препарата в широкой практике для лечения у детей:
– больных острыми кишечными инфекциями установленной (шигеллез, сальмонеллез, эшерихиоз, ротавирусная инфекция) и неустановленной этиологии;
– при инфекциях, вызванных условнопатогенными микроорганизмами;
– при кишечных расстройствах и дисфункциях желудочно–кишечного тракта, сопровождающихся дисбактериозом кишечника;
– у новорожденных, в том числе недоношенных, маловесных детей, с глубокой врожденной патологией, у которых в первую очередь наблюдается дефицит лакто– и бифидофлоры;
– для восстановления нормальной микрофлоры и снижения объема проводимой антибактериальной терапии при рецидивирующем течении пневмоцистоза.
С 2007 г. Аципол выпускается в новой лекарственной форме – «Аципол, капсулы».
Капсулы – дозированная лекарственная форма, состоящая из лекарственного средства, заключенного в твердую желатиновую капсулу цилиндрической формы с полусферическими концами. Содержимое капсулы – сухая биомасса светло–кремового цвета с кисломолочным запахом и вкусом. Одна капсула (одна доза) содержит живых ацидофильных лактобацилл не менее 107 и полисахарида кефирных грибков (0,4±0,1) мг.
Преимущества препарата «Аципол, капсулы» перед лекарственной формой «Аципол, таблетки»:
1. Использование жесткой разъемной формы и возможность высвобождения из нее содержимого позволяет растворять препарат перед применением без предварительного измельчения.
2. При прохождении капсул через верхний отдел желудочно–кишечного тракта не происходит осаждение части аципола на стенках глотки и пищевода, что увеличивает дозу аципола, доставляемого в толстый и тонкий отделы кишечника.
3. Лучшая защищенность лактобактерий от нежелательного воздействия кислоты желудочного сока повышает биодоступность препарата (до 95%).
4. Сухая измельченная биомасса заключенная в желатиновые капсулы без предварительного прессования (в отличие от таблеток) позволяет сохранить высокую специфическую активность высушенной биомассы и снизить объем биологически активного материала в одной дозе.
5. Упаковка капсул в пластиковые банки по 20–30 штук не требует специального инструмента для вскрытия флакона и исключает возможность случаев попадания микросколов стекла в препарат.
6. Использование полимерной банки с крышками, имеющими специальный вкладыш из селикогеля, позволяет сохранить препарат без изменения влажности на протяжении всего срока годности.
Таким образом, в современных условиях врач располагает широким арсеналом средств для коррекции состава кишечной микрофлоры, однако в реальной практике эта задача остается достаточно сложной. Исходя из концепции дисбактериоза кишечника как вторичного состояния, первоочередной задачей остается поиск вызвавшей его причины и ее устранение, в сочетании с назначением препаратов представленных трех групп или их комбинации в зависимости от индивидуальных особенностей течения патологического процесса у конкретного пациента.
Литература
1. Петухов В.А., Стернина Л.А., Травкин А.Е. Нарушение функций печени и дисбиоз при липидном дистресс–синдроме Савельева: Современный взгляд на проблему // Consilium medicum. – 2004. – Т. 6, №6. – С. 406–412.
2. Урсова Н.И. Особенности формирования хронической патологии у детей в экологически неблагоприятных условиях (факторы риска, лечение и реабилитация). Автореф. Дисс. докт. мед. наук. – М., 2001. – 38с.
3. Урсова Н.И. Римарчук Г.В. Щеплягина Л.А. Савицкая К.И. Современные методы коррекции дисбиоза кишечника у детей. Учебное пособие. – М.: МОНИКИ, 2000
4. Урсова Н.И., Римарчук Г.В., Савицкая К.И. К проблеме дисбиоза кишечника у детей. /Детская гастроэнтерология и проблемы педиатрии. Вчера, сегодня, завтра. – Н.–Новгород, 1999. – С. 131–133.
.
Что такое дисбактериоз кишечника? Причины, симптомы и исцеление от корня
Хронические проблемы с пищеварением, такие как вздутие живота, боль, запор или диарея, могут сигнализировать о множестве разных вещей, но в основе проблемы часто лежит дисбактериоз кишечника. Если вы хотите разобраться в своих проблемах со здоровьем пищеварительной системы, прочтите все, что вам нужно знать о дисбалансе здоровья кишечника и о том, почему это так часто.
Что такое дисбактериоз кишечника?
«В вашем кишечнике обитает более 100 триллионов бактерий — и это МНОГО, — говорит Сара Стейнберг, доктор медицинских наук, врач в Parsley Health в Нью-Йорке.Вместе бактерии и другие микробы в кишечнике составляют микробиом кишечника, и в последние годы мы много узнали о том, как работает этот микробиом и как он влияет на аспекты нашего здоровья, включая не только пищеварение, но и нашу иммунную систему. , воспалительная реакция и даже психическое здоровье. «За последние 10 лет сфера науки о микробиоме действительно пережила бурный рост», — объясняет доктор Стейнберг.
«Дисбиоз» — это термин, используемый для описания дезадаптации или дисбаланса внутри тела, а «дисбактериоз кишечника» возникает, когда имеется дисбаланс в количестве и разнообразии микрофлоры кишечника.Это может повлиять на ваше здоровье по-разному; на самом деле, как писали авторы исследования 2018 года: «Исследования на животных моделях и на людях показали, что стойкий дисбаланс микробного сообщества кишечника, называемый дисбактериозом, связан с воспалительными заболеваниями кишечника (ВЗК), синдромом раздраженного кишечника (СРК), диабетом. , ожирение, рак, сердечно-сосудистые заболевания и заболевания центральной нервной системы ».
Как видите, здоровье кишечника играет важную роль в нашем долгосрочном здоровье и способности бороться с болезнями.
Что вызывает дисбактериоз кишечника?
Как д-р.Стейнберг объясняет: «Кажется, что каждый день мы узнаем что-то новое о факторах, которые способствуют дисбалансу бактерий в кишечнике». По ее словам, некоторые из основных факторов, которые настраивают людей на дисбактериоз кишечника:
1. Лекарства
Сюда входят антибиотики, кислотоснижающие препараты, безрецептурные обезболивающие, стероиды и оральные противозачаточные таблетки. Все эти лекарства «вызывают незаметное оскорбление кишечной флоры, которое может привести к дисбактериозу», — объясняет доктор Стейнберг.Многовариантный метанализ 2020 года в Nature Communications показал, что 18 широко используемых категорий лекарств сильно влияют на состав микробиома кишечника, причем наибольшее влияние оказывают ингибиторы протонной помпы (ИПП), слабительные и антибиотики. Каждый препарат оказывает немного разное действие, вызывая такие вещи, как увеличение популяции определенных вредных бактерий и увеличение производства жирных кислот. Эти типы изменений связаны с несколькими состояниями здоровья.
2. Диета
По словам доктораСтейнберг, «американская диета, как правило, содержит больше плохих жиров и меньше овощей, что может негативно повлиять на нашу кишечную флору». Почему? Потому что овощи содержат много грубых кормов и клетчатки, которые способствуют росту полезных бактерий. Стандартная американская диета также содержит много углеводов, которые могут позволить плохим бактериям разрастаться и вытеснить хорошие. К сожалению, это может вызвать у вас желание больше сахара, заставить вас есть больше сахара и, возможно, даже развить проблемы с сахаром в крови, такие как преддиабет или диабет.
3. Стресс
Если вам нужна еще одна причина, почему стресс является самой токсичной вещью в вашей жизни, мы все больше и больше узнаем о том, как стресс негативно влияет на микробиом кишечника. Исследование животных, проведенное в 2011 году в журнале Brain, Behavior, and Immunity , показало, что социальные стрессоры приводят к менее разнообразным бактериальным сообществам в кишечнике и большему количеству потенциально вредных бактерий. Авторы исследования 2018 года также писали, что «все больше признается, что стресс модулирует структуру и активность сообщества кишечной микробиоты и может быть одним из причинных факторов дисбактериоза.”
К сожалению, употребление лекарств, диета с большим количеством обработанных пищевых продуктов и стрессовый образ жизни — все это чрезвычайно распространено для большинства людей, что означает, что многие из нас подвергаются более высокому риску развития дисбаланса микробиома кишечника и борьбы с его последствиями. могу иметь.
Симптомы дисбактериоза кишечника
Некоторые из признаков того, что нездоровый уровень стресса, лекарства и неправильное питание повлияли на микробиом кишечника, очевидны; другие, не так много. «Для большинства людей симптомы дисбактериоза очень очевидны и включают такие вещи, как диарея, запор, вздутие живота, отрыжка и боль в животе», — говорит доктор.Стейнберг. Но это не единственные симптомы, на которые следует обращать внимание. По словам Стейнберга, дисбаланс микробиома также может быть фактором, способствующим возникновению более сложных проблем, таких как тяга к сахару и тяга к углеводам. Есть также люди с дисбактериозом, у которых вообще нет симптомов пищеварения. «Вместо этого дисбактериоз может быть основной причиной таких проблем, как сыпь, розацеа и повторяющиеся крапивницы», — объясняет она.
При отсутствии лечения дисбактериоз может способствовать развитию всех видов болезней, включая тревогу и депрессию, волчанку, рассеянный склероз, повышенную кишечную проницаемость и диабет — и это лишь некоторые из них.Так что, хотя дисбактериоз — не повод для паники, вам следует заняться этим. «Если его не лечить, он может стать основной причиной множества различных заболеваний», — говорит доктор Стейнберг. И многие из этих заболеваний также требуют приема лекарств и вызывают стресс, что усугубляет дисбактериоз. «Это становится вопросом несбалансированной кишечной флоры, способствующей распространению факторов риска, которые ее вызвали», — продолжает она. Вот почему так важно начать лечение дисбактериоза кишечника на ранней стадии и поддерживать здоровье кишечника.
Исцеление от дисбактериоза кишечника
Parsley Health использует целостный, индивидуальный подход к лечению дисбактериоза.Как правило, это означает создание плана лечения, адаптированного к индивидуальному пациенту с учетом его симптомов и образа жизни. Но, по словам доктора Стейнберга, когда дело доходит до дисбактериоза, многие из этих планов лечения имеют следующие общие черты:
1. Уменьшение сахара и углеводов
«Одна вещь, которая всегда была очень ясной, — это то, что транспорт глюкозы — это огромный медиатор дисбактериоза », — говорит д-р Стейнберг. Другими словами, количество потребляемого сахара оказывает огромное негативное влияние на кишечную флору.Хорошая новость заключается в том, что, изменив кишечную флору на более здоровый баланс, ваша тяга к сахару уменьшится, потому что ваш кишечник начнет отдавать предпочтение более здоровым бактериям, чем нездоровым, поедающим сахар.
2. Увеличение потребления клетчатки
Клетчатка — еще одна важная часть головоломки здорового кишечника. Это потому, что клетчатка является источником пребиотиков, которые, по сути, являются пищей, которую любят есть здоровые кишечные бактерии. По словам доктора Стейнберга, когда дело доходит до потребления клетчатки, цель — разнообразие.«Мы часто застреваем в тупике в том, что мы едим. Когда мы подходим к исцелению кишечника, мы хотим создать разнообразную экосистему », — говорит она. Она рекомендует есть разнообразные овощи, которые обеспечивают все виды грубых кормов. «Порошок инулина также является отличной пребиотической добавкой, которую можно добавить в свой распорядок дня, чтобы накормить полезные кишечные бактерии», — продолжает она.
3. Серьезно относитесь к снятию стресса
Если вы хотите вылечить дисбактериоз кишечника, очень важно контролировать стресс.«Я очень верю в медитацию и занимаюсь йогой более 25 лет, — говорит доктор Стейнберг. Тем не менее, любое упражнение на осознанность поможет. «Каждый человек должен найти свою точку доступа», — продолжает она. «Некоторым людям нужно утомлять себя потными уроками йоги; другим нравится делать упражнения на равновесие ». Ключ в том, чтобы выбраться из головы и войти в тело. «Все эти упражнения переносят всю активность вашего мозга из лобной доли (часть мозга, которая регулирует принятие решений, суждение и память) в мозжечок (часть мозга, которая регулирует движение мышц)», — говорит ДокторСтейнберг.
4. Улучшение качества сна
И последнее, но не менее важное: сон является важной частью лечения дисбактериоза кишечника. Поначалу это может показаться странным. Какое отношение имеет сон к бактериям в кишечнике? Что ж, исследования показывают, что бактерии сна и кишечника на самом деле неразрывно связаны. Например, авторы исследования 2019 года пришли к выводу, что общее разнообразие микробиома положительно коррелировало с повышенной эффективностью сна и общим временем сна и отрицательно коррелировало с бодрствованием после наступления сна.Это означает, что разнообразный микробиом был связан с большим количеством сна, лучшим сном и меньшим количеством пробуждений посреди ночи (ура!). Чтобы улучшить сон без лекарств, доктор Стейнберг рекомендует утром первым делом получить солнечный свет и свежий воздух: «Я очень верю в то, что солнечный свет может сбросить циркадный ритм», — говорит она.
В конце концов, здоровый кишечник действительно является секретом хорошего общего здоровья. Хорошая новость заключается в том, что даже если вы в настоящее время имеете дело с дисбактериозом кишечника, внесение нескольких целенаправленных изменений в образ жизни может помочь вам вернуть свой кишечник — и остальную часть тела — в норму.
Факты о дисбактериозе кишечника и о том, как его вылечить
Вы разделяете свое тело с триллионами микроскопических организмов. Когда они не ладят, это называется «дисбактериозом», и это имеет косвенные последствия для вашего здоровья.
Дисбиоз — это современная проблема, которая возникла, когда ученые обнаружили поразительное разнообразие микробов, обитающих в человеческом теле и внутри него. По большей части эти одноклеточные организмы безвредны (некоторые даже хороши) и живут в симбиозе с вами, хозяином.
Но микробы — чувствительные маленькие существа, и их гармоничные сообщества легко вывести из равновесия. Это позволяет менее дружелюбным насекомым брать на себя ответственность и делать то, что им лучше всего подходит — а это не всегда то, что нужно вашему организму. Это упрощенное определение дисбактериоза .
В этой статье вы познакомитесь с причинами дисбактериоза, его симптомами, тестированием и лечением. Вы обнаружите, что дисбактериоз — удивительно распространенная проблема, и почему исследователи до сих пор не уверены в том, что первично: дисбактериоз или болезнь.
☝️ ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ ☝Эта статья предназначена только для информационных целей. Он не предназначен для использования в качестве замены профессиональных медицинских рекомендаций, диагностики или лечения.
Содержание
Что такое дисбактериоз?
Дисбиоз определяется как негативные изменения в микробных сообществах вашего тела, которые связаны с проблемами со здоровьем и заболеваниями. Выделяют два основных типа дисбактериоза: бактериальный и грибковый.Однако дисбактериоз не является заболеванием.
Дисбиоз — это универсальный термин, потому что не существует «идеального» микробиома. Каждый человек уникален, а это значит, что каждый микробиом тоже уникален. Однако исследователи выявили некоторые общие признаки дисбактериоза, которые связаны с количеством одних микробов по сравнению с другими:
- чрезмерный рост некоторых бактерий или дрожжей
- Отсутствие или недостаток полезных бактерий
- Низкое разнообразие видов в микробиоме
Грибковый дисбактериоз
В организме также обитает небольшое количество дрожжей, которые по большей части безвредны.Тем не менее грибковый рост — частая причина инфекций уха, микобактериоза, молочницы и вагинальных инфекций, многие из которых вызываются дрожжами Candida и плесенью Aspergillus.
☝️ СОВЕТ ☝️ Значение дисбактериоза происходит от древнегреческого: dys- (плохой или больной) и biosis (образ жизни).
Что такое дисбактериоз кишечника?
Самая известная микробная экосистема — это микробиом кишечника. Расположенный в толстой кишке, он содержит триллионы бактериальных клеток, которые работают с кишечником, чтобы поддерживать его здоровье.Также там есть дрожжи, грибы и археи.
В здоровом и сбалансированном микробиоме содержится достаточно нужных бактерий для производства важных питательных веществ, которые поддерживают здоровье слизистой оболочки кишечника и защищают от вторжений, которые могут вызвать дисбактериоз, захватив экосистему.
Разнообразие — это ключевой показатель для измерения дисбактериоза кишечного микробиома. В здоровом микробиоме присутствует более 1000 различных видов бактерий. Они контролируют чужеродные бактерии и потенциально инфекционные микробы, чтобы они не могли размножаться и вызывать болезни.
Что вызывает дисбактериоз кишечника?
Иллюстрация сделана на основе обзора о дисбактериозе, проведенного ДеГруттола А.К. и другие.
В вашей повседневной жизни есть множество факторов, которые могут повлиять на дисбактериоз толстой кишки и здоровье микробиома, самым большим из которых являются антибиотики. Даже всего один курс антибиотиков может вызвать дисбактериоз, который длится месяцами. Многократный прием антибиотиков может даже навсегда нарушить микробиом кишечника.
Другие факторы, связанные с дисбактериозом кишечника, включают вашу диету и образ жизни.Вечеринки каждый вечер и питание за счет фаст-фуда и сладких напитков не принесут пользы вашему кишечнику, а вот употребление большого количества цельных продуктов, фруктов и овощей и регулярные физические упражнения принесут пользу.
Практически невозможно определить, является ли дисбактериоз частью проблемы или просто следствием болезни. Исследователи полагают, что это, вероятно, порочный круг, в котором микробиом кишечника и организм создают условия для болезни.
Действительно, болезнь (и даже прием лекарств) может повлиять на микробиом, вызывая дисбактериоз, который затем подпитывает болезнь.Точно так же считается, что дисбактериоз может вызывать проблемы с обменом веществ в организме, которые в дальнейшем повышают восприимчивость человека к болезням.
Симптомы дисбактериоза
Симптомы дисбактериоза кишечника очень расплывчаты и совпадают со многими распространенными проблемами со здоровьем, включая синдром раздраженного кишечника, воспалительное заболевание кишечника и целиакию. Исследования также показывают, что дисбактериоз является фактором риска развития этих состояний.
Общие симптомы дисбактериоза кишечника:
- метеоризм
- вздутие живота
- Боль в животе
- понос
- запор
Просто помните, что если у вас есть симптомы дисбактериоза кишечника, вам всегда следует обращаться к врачу для диагностики, чтобы убедиться, что у вас нет серьезных проблем со здоровьем.
Тесты на дисбактериоз
Дисбактериоз — это слово, используемое для описания функционального состояния. Это не диагноз, потому что оно не считается состоянием здоровья.
Если вы хотите проверить наличие дисбактериоза кишечника, вы можете пройти тест на микробиом кишечника, например, тест на микробиом Атласа. Их не называют тестами на дисбактериоз кишечника, потому что они анализируют многие особенности кишечной микробиоты, а не только дисбактериоз.
Вы можете заказать тест на микробиом Атлас онлайн прямо сейчас и получить набор для сбора, который будет доставлен к вам домой.Все, что вам нужно сделать, это собрать небольшой образец стула и вернуть его. Ваш образец анализируется в лаборатории, чтобы определить бактерии в кишечнике и их влияние на ваше здоровье.
| Отчет | Что вы узнаете |
|---|---|
| Разнообразие микробиома | Узнайте, насколько разнообразен микробиом вашего кишечника и является ли дисбактериоз проблемой. |
| Полезные бактерии | Узнайте о полезных бактериях в кишечнике и о том, достаточно ли у вас их для защиты от дисбактериоза. |
| Уровни бутирата | Узнайте, производят ли ваши бактерии достаточно бутирата, чтобы поддерживать здоровье кишечника. |
| Метаболизм пищевых волокон | Выясните, насколько хорошо кишечные микробы расщепляют различные пищевые волокна. |
| Защита от болезней | Узнайте, как кишечные микробы защищают вас от 5 болезней, связанных с дисбактериозом. |
| Синтез витаминов | Узнайте, производят ли ваши микробы достаточно витаминов B и K, чтобы прокормить сообщество. | Диета при дисбактериозе | Открывайте для себя индивидуальные списки продуктов каждую неделю, чтобы восстановить микробиом кишечника и бороться с дисбактериозом. |
Хотя универсального определения дисбактериоза не существует, существует достаточно доказательств, чтобы знать, как выглядит сбалансированный микробиом. Вот почему тесты на микробиом кишечника — хороший вариант, если вас беспокоит дисбактериоз.
Разнообразие тестов на дисбактериоз
Микробиомные тесты — лучший способ проверить разнообразие вашего микробиома — основной индикатор здоровья — который показывает, здоровы и сбалансированы ли ваши кишечные бактерии, или есть ли избыток одних бактерий и недостаток других.
Когда в кишечнике недостаточно полезных и пробиотических бактерий, вы более подвержены дисбактериозу. Вот почему микробиомный тест Atlas также проверяет количество пробиотических бактерий, таких как Lactobacillus и Bifidobacteria , а также других полезных бактерий в кишечнике.
Питательный тест на дисбактериоз
Тесты, такие как микробиомный тест Атласа, могут оценить уровень бутирата (критически важной короткоцепочечной жирной кислоты), вырабатываемой вашими бактериями для поддержания здоровья кишечника.Кишечные микробы также производят витамины, которые питают другие бактерии, и вы можете увидеть, как здесь живет ваш микробиом.
Статус защиты от болезней
Дисбактериоз часто наблюдается при серьезных заболеваниях, и наш тест на микробиом может оценить, насколько микробиом вашего кишечника похож или отличается от пяти распространенных заболеваний:
- Болезнь Крона
- Язвенный колит
- Ожирение
- Болезнь сердца
- Сахарный диабет II типа
Лечение дисбактериоза кишечника
Лечение дисбактериоза следует подбирать индивидуально для каждого человека с учетом результатов теста на микробиом кишечника.Протокол дисбактериоза кишечника может включать комбинацию диетических изменений, пробиотических добавок и изменений образа жизни для создания оптимальных условий для процветания полезных бактерий.
Получите еженедельные индивидуальные рекомендации по питанию для борьбы с дисбактериозом
Не существует лекарства, которое могло бы лечить симптомы дисбактериоза кишечника, и лечение обычно разрабатывается для каждого конкретного случая. При умеренном дисбалансе микробиома, выявленном с помощью теста микробиома Атласа, ваши еженедельные рекомендации по питанию — это диета для лечения дисбактериоза.
Кормя свой микробиом пребиотическими продуктами, вы подпитываете полезные бактерии в кишечнике, чтобы они могли процветать и восстанавливать баланс в экосистеме. Пребиотики — это просто причудливое слово для обозначения растительной пищи, потому что полезные кишечные бактерии питаются пищевыми волокнами и питательными веществами для растений.
Дневник питания Atlas Biomed для здоровья микробиома
Эта индивидуальная диета от дисбактериоза — естественное средство от дисбактериоза, не требующее никаких добавок или лекарств. Все, что вам нужно сделать, это следовать своим еженедельным рекомендациям по питанию и записывать свой прогресс в приложении Atlas Health.
В этом приложении есть встроенная функция подсчета очков, позволяющая оценивать ваши блюда на основе того, насколько они благоприятны для микробиома, чтобы помочь вам придерживаться диеты при дисбактериозе кишечника. Кроме того, вы можете получить бесплатную консультацию диетолога и попросить совета у профессионала.
Отслеживайте состояние своего микробиома с течением времени с помощью нашей тестовой подписки
. С помощью нашей подписки вы даже можете отслеживать, насколько эффективна ваша диета для лечения дисбактериоза кишечника. Проходите тест на микробиом Atlas каждые три месяца, чтобы увидеть, как меняется ваш микробиом и как он реагирует на улучшения в выборе продуктов питания.
Другие виды дисбактериоза
Дисбактериоз поражает не только толстую кишку. Это может повлиять на любую часть тела, которая имеет свою особую экосистему микробов, потому что бактерии повсюду от вашего рта до ваших мочевых путей.
Дисбактериоз кожи
Только ваша кожа имеет несколько нишевых микробиомов, зависящих от местной окружающей среды. Например, микробы, которым нравится жирная кожа вашего носа, скорее всего, не будут получать столько удовольствия от ваших потных подмышек.
Действительно, некоторые исследования показали, что перхоть и себорейный дерматит (зудящая сыпь с шелушащимися чешуйками) связаны с грибковым и бактериальным дисбиозом. Атопический дерматит, более известный как экзема, также связан с дисбактериозом микробиома кожи.
Дисбактериоз полости рта
Дисбактериоз полости рта — еще одна распространенная проблема, которая может иметь серьезные последствия. Гингивит и пародонтит (две стадии заболевания десен) связаны с дисбактериозом ротовой полости, вызываемым бактерией Porphyromonas gingivalis .
Чрезмерный рост P. gingivalis означает, что эти микробы могут путешествовать с вашей слюной в пищеварительный тракт, где они могут активировать вашу иммунную систему, вызывая хроническое воспаление и дисбактериоз микробиома кишечника.
Чрезмерный бактериальный рост в тонком кишечнике (SIBO)
Ваш кишечник состоит из двух частей. Тонкий кишечник извлекает большую часть энергии и питательных веществ из пищи, в то время как толстый кишечник поглощает воду, электролиты и некоторые другие питательные вещества и избавляется от продуктов жизнедеятельности.
СИБР — это тип дисбактериоза, при котором избыточный бактериальный рост приводит к избыточной выработке метана или водорода. Эти газы влияют на клетки слизистой оболочки кишечника, вызывая вздутие живота, боли в животе, газообразование, диарею и иногда запор.
Кандидозный дисбактериоз
Candida — это обычно безвредные дрожжи, которые иногда бесконтрольно вырастают и захватывают местный микробиом с неприятными побочными эффектами. Чрезмерный рост Candida — это форма дисбактериоза, известная как кандидоз.
Дрожжи Candida могут вызывать молочницу — грибковый дисбактериоз ротовой полости — с неприятными симптомами, такими как болезненность, белые или желтые пятна, которые кровоточат при соскабливании, неприятный привкус во рту, сухость и трещины на краях рта.
Другой распространенный тип грибкового дисбактериоза Candida поражает только женщин: дрожжевые инфекции. В вагинальном микробиоме преобладают бактерии Lactobacillus , которые поддерживают кислотность окружающей среды для отпугивания патогенов. Когда эта экосистема нарушена (например, антибиотиками), дрожжи кандиды могут взять верх и вызвать вагинальную инфекцию.
☝️ ФАКТ ☝️ Микробиомные тесты не могут показать вам, есть ли у вас грибковый рост, дисбактериоз кожи или паразитарная инфекция.
Дисбактериоз и СРК — Канадский фонд здоровья пищеварительной системы
Дисбактериоз и СРК: небольшой урок истории
Вы знаете, что это просто еще один день в чудесном мире здоровья кишечника, когда мы бросаем вам еще одно сумасшедшее слово и соединяем его с аббревиатурой! Дисбактериоз и СРК? Что это такое и почему мы об этом говорим? Ну, это начинается с нашего микробиома, и ответы не черно-белые.
Доказательства человеческого микробиома были впервые обнаружены австрийским педиатром по имени Теодор Эшерих. Он фактически обнаружил тип бактерий (позже названный Escherichia coli ) в кишечнике как здоровых детей, так и детей, страдающих диарейными заболеваниями (возможно, СРК-Д?). После этого первоначального открытия того, что казалось безобидными бактериями, другие ученые начали описывать другие микроорганизмы, которые, казалось, существовали во многих других областях человеческого тела и на нем.Например; кожа, нос, рот, желудочно-кишечный тракт и т. д. Со временем в первом десятилетии двадцать первого века была разработана концепция того, что мы теперь знаем как «человеческий микробиом».
Благодаря этому раннему открытию мы узнали, что большая часть вашего микробиома располагается в вашем пищеварительном тракте, особенно в кишечнике. Мы называем это кишечной микробиотой, которая содержит десятки триллионов микроорганизмов. Хотя у каждого из нас есть уникальная микробиота кишечника, она всегда выполняет одни и те же физиологические функции, оказывая непосредственное влияние на наше здоровье.Некоторые из функций:
- Помогает организму переваривать определенные продукты, которые желудок и тонкий кишечник не могут переваривать
- Производство некоторых витаминов (B и K).
- Играет важную роль в иммунной системе, выполняя барьерный эффект.
Здоровая и сбалансированная кишечная микробиота является ключом к правильному пищеварению
Итак, что такое Дисбактериоз и какое отношение он имеет к СРК?
Итак, мы прошли долгий путь с тех пор, как Теодор Эшерих впервые открыл кишечную палочку, но мы все еще многого не знаем о микробиоте кишечника.Что мы действительно знаем, так это то, что люди со здоровой кишечной микробиотой, кажется, наполнены счастливыми сообществами микробов, которые работают вместе, чтобы поддерживать ваше здоровье, как физическое, так и психическое. Когда одна из этих счастливых маленьких колоний выходит из равновесия, это может привести к так называемому дисбактериозу . Это просто причудливый способ сказать, что все микробы, живущие в вашем кишечнике, не в порядке.
Так вот, в большинстве случаев, если произойдет небольшой дисбаланс, вы, возможно, будете страдать от чего-то столь же незначительного, как расстройство желудка.Однако, если беспокойство между вашими микробными сообществами перерастает из небольшого спора по соседству в полномасштабную войну в вашем кишечнике, будьте осторожны. Вы можете столкнуться с риском развития гораздо более серьезных осложнений со здоровьем. Недавние исследования связали дисбактериоз с расстройствами кишечника, такими как синдром раздраженного кишечника (СРК), и даже хроническими заболеваниями кишечника, такими как болезнь Крона и язвенный колит. Также было высказано предположение, что, хотя дисбактериоз может быть причиной этих расстройств, он также может ухудшить симптомы.В этой области предстоит еще много исследований.
Так что же вызывает дисбактериоз?
Как всегда, когда дело касается кишечника, нет ничего универсального, поэтому ответ на этот вопрос сложен и у всех может сработать по-разному.
Например, многие эксперты предполагают, что диета с высоким содержанием пребиотиков может предотвратить дисбактериоз, однако это было бы сложным изменением образа жизни для многих людей с СРК, если бы они придерживались краткосрочной диеты с FODMAP. Причина этого в том, что многие продукты с высоким содержанием FODMAP являются диетическими пребиотиками.
Однако есть несколько типичных причин дисбактериоза, за которыми следует внимательно следить:
Антибиотики
Если вы регулярно принимаете обычные антибиотики или едите много мяса, выращенного с помощью антибиотиков, вы подвержены риску дисбактериоза. Некоторые антибиотики могут серьезно нарушить баланс вашего микробиома. Вот почему следует избегать злоупотребления антибиотиками.
Диета с высоким содержанием простых сахаров / углеводов
Мы пришли к выводу, что вы действительно то, что вы едите! Диета сильно влияет на состав и функции кишечной микробиоты, потенциально способствуя появлению симптомов СРК.Например, потребление искусственных подсластителей может привести к нарушению регуляции кишечной микробиоты.
Диета с высоким содержанием белка
Хотя диета с высоким содержанием белка может быть полезна для кратковременной потери веса и полезна для некоторых аспектов метаболического здоровья, она может быть не идеальной в долгосрочной перспективе из-за своего воздействия на микробиоту кишечника . Исследователи обнаружили, что высокое потребление белка увеличивает ферментацию в толстом кишечнике, вызывая образование определенных токсичных бактериальных метаболитов, связанных с такими заболеваниями, как колоректальный рак.
Попробуйте поэкспериментировать с более сбалансированной диетой. Чтобы получить простое руководство о том, как составить более сбалансированное питание, ознакомьтесь с Руководством по питанию Канады.
Стресс, как физический, так и психический
Было замечено, что длительный стресс у человека фактически подавляет его способность производить нечто, называемое иммуноглобулином A. Иммуноглобулин A на самом деле играет очень важную роль. Это помогает бороться (как вы уже догадались) с плохими микробами, также известными как патогены. Это означает, что пока вы находитесь в состоянии стресса, ваша естественная защита от кишечных плохих парней падает, и в вашем микробиоме вырывается ад.Эти патогены вытесняют хорошие микробы и начинают враждебный захват. Это одна из причин, почему стресс является огромным триггером для людей с СРК, о чем мы расскажем в этой статье.
Злоупотребление алкоголем
Известно, что чрезмерное употребление алкоголя (употребление двух или более алкогольных напитков в день) является серьезным нарушителем микробного сообщества, живущего в нашем кишечнике. Может увеличить долю вредных бактерий, снизить уровень полезных бактерий; а также может спровоцировать чрезмерный рост микроорганизмов, что связано с заболеванием печени.Поскольку это может нарушить баланс бактерий в кишечнике, употребляйте меньше алкоголя или вообще избегайте его.
Инфекции желудочно-кишечного тракта
Дисбактериоз также может вызывать так называемый постинфекционный СРК. Большинство людей, страдающих кишечными инфекциями (например, кишечной палочкой), быстро выздоравливают. Однако, к сожалению, некоторые этого не делают. Поскольку микробиота кишечника делает то, что делает лучше всего (защищает вас от вреда!), Она может проиграть битву с особенно серьезной инфекцией. Это может привести к дисбактериозу и впоследствии вызвать СРК у некоторых людей.
Итак, дисбактериоз вызывает СРК?
Краткий ответ — наверное. Было показано, что дисбоз связан с несколькими заболеваниями и состояниями, одним из которых является СРК. В настоящее время ученые работают над тем, чтобы точно выяснить, КАК микробиота может влиять на симптомы СРК. Самое интересное во всем этом заключается в том, что недавно были получены очень многообещающие доказательства того, что да, и у мужчин, и у женщин с СРК есть микробиомы, которые существуют в состоянии дисбактериоза.Это захватывающе, потому что это действует как отправная точка. Способ начать углубляться в науку и найти причину, а в один прекрасный день, возможно, даже лекарство.
Проблема в том, что ученым еще предстоит точно определить, где и как их микробиомы перешли от дисбактериоза к СРК. Какие штаммы микробов вымерли, вызывая СРК? Были ли введены новые штаммы патогенов? Если да, то сколько? А какой? Атакует ли злонамеренный штамм и уничтожает другие штаммы? Или диета человека заставляла голодать колонии микробов? Это был стресс? Или это была комбинация всего этого?
Хотя детали все еще неясны, данные свидетельствуют о том, что у людей, живущих с СРК, в кишечнике действительно менее разнообразное и нестабильное сообщество бактерий, чем у людей, не страдающих этим заболеванием.
Однако будущее выглядит светлым. С каждым днем мы узнаем все больше и больше о микробиоме! А пока позаботьтесь о своем!
Список литературы
Хаврелак, Дж. А., и Майерс, С. П. (2004, июнь). Причины дисбактериоза кишечника: обзор. Получено с https://www.ncbi.nlm.nih.gov/pubmed/15253677/
.
Кеннеди П. Дж., Крайан Дж. Ф., Динан Т. Г. и Кларк Г. (2014, 21 октября). Синдром раздраженного кишечника: расстройство оси микробиом-кишечник-мозг? Получено с https: // www.ncbi.nlm.nih.gov/pmc/articles/PMC4202342/
Тамболи, К. П., Нейт, К., Десремо, П., и Коломбель, Дж. Ф. (2004, январь). Дисбактериоз при воспалительном заболевании кишечника. Получено с https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1773911/
.
Влияние кишечного микробиома на неинфекционные заболевания и поведение: основные результаты проекта Mynewgut Андреу Прадос-Хизер Галипо — https://www.gutmicrobiotaforhealth.com/en/the-gut-microbiomes-influence-on-non-communicable- Основные-выводы-исследования-болезни-и-поведение-mynewgut-project /
Интервью с Берндом Шнаблем: «Хронический алкоголь изменяет кишечную микробиоту и может привести к избыточному бактериальному росту» Хизер Галипо — редакционная группа GMFH — https: // www.gutmicrobiotaforhealth.com/en/interview-bernd-schnabl-chronical-alcohol-alters-gut-microbiota-can-lead-bacterial-overgrowth/
Дисбактериоз кишечника и СРК — Monash Fodmap
Дисбактериоз — это нарушение баланса типов кишечных бактерий, присутствующих в организме, особенно в кишечнике.
Этот дисбаланс может означать 3 вещи (Petersen C, 2014)
- Утрата полезных микробных организмов в нашем кишечнике
- Расширение потенциально вредных микроорганизмов
- Утрата микробного разнообразия
Это не взаимно эксклюзивные и могут происходить одновременно.
Дисбактериоз может быть вызван различными внешними факторами, такими как изменение диеты, прием лекарств (особенно антибиотиков) или патогенов (бактерии или вирусы, которые могут вызывать заболевание). (Родино-Жанейро, 2018 г.) Например, один метаанализ показал, что приступ гастроэнтерита увеличивает риск развития СРК (в следующие 3–18 месяцев) в семь раз.
Итак, как это связано с IBS?
Исследования показали снижение численности (общего числа) и разнообразия (разнообразия) бактерий среди людей с СРК.(Principi N, 2018) Предполагается, что это может способствовать: (Petersen C, 2014)
- Повышенной проницаемости нашего кишечника и, возможно, нарушению всасывания питательных веществ и снижению защиты от патогенов.
- Измененная перистальтика кишечника, которая относится к тому, как наш кишечник движется и перемещает отходы через него.
- Повышенная чувствительность; по мере снижения болевого порога боль усиливается из-за избытка газа и воды в кишечнике
- Иммунные изменения
- Изменения в оси головного мозга кишечника
Эти изменения могут усугубить симптомы кишечника, такие как вздутие живота, избыток газов, боль в животе и измененные привычки кишечника.
Что ты умеешь?
В настоящее время не существует убедительных доказательств правильного метода диагностики или лечения дисбактериоза. Большинство людей думают, что логическим ответом на дисбактериоз кишечника являются пробиотики, обеспечивающие ваш организм большим количеством полезных бактерий, которые помогают снова сбалансировать кишечник. Но хотя имеющиеся у нас данные о лечении пробиотиками многообещающие, на данном этапе мы еще не знаем достаточно, чтобы дать четкие ответы.
А пока…
- После постановки диагноза СРК попробуйте диету с низким содержанием FODMAP, чтобы сначала уменьшить симптомы.Начни здесь.
- Ешьте продукты, богатые пребиотиками — не придерживайтесь шага 1 диеты FODMAP слишком долго, начните возвращать продукты, как только симптомы исчезнут. Вы также можете включить эти пребиотики с низким содержанием FODMAP в свой ежедневный рацион, даже на начальном этапе ограничения.
- Рассмотрите пробиотические добавки; Прочтите наши мысли о них здесь.
Ссылки
Петерсен С., Раунд Дж. Определение дисбактериоза и его влияния на иммунитет и болезнь хозяина.Клеточная микробиология 2014, 16 (7): 1024-1033. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4143175/pdf/cmi0016-1024.pdf
Родино-Жанейро, Б.К., Викарио М., Алонсо-Котонер С., Паскуа-Гарсия Р., Сантос Дж. Обзор микробиоты и синдрома раздраженного кишечника: будущее терапии. Достижения в терапии 2018, 35: 289-310. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5859043/pdf/12325_2018_Article_673.pdf
Principi N, Cozzali R, Farinelli E, Brusaferro A, Esposito S. Дисбиоз кишечника и синдром раздраженного кишечника: потенциальная роль пробиотиков.Журнал инфекции 2018, 76, 111-120. https://www.sciencedirect.com/science/article/pii/S0163445317304127
Границы | NLR и воспалительные заболевания, связанные с дисбактериозом кишечника: движущие силы или препятствия?
Введение
Здоровый кишечник человека заселен несколькими микроорганизмами, включая грибы, вирусы и бактерии, принадлежащие к разным семействам (1). Исследования микробиома кишечника показывают большое количество бактерий из семейств Bacteroidaceae, Prevotellaceae, Rikenellaceae и Ruminococcaceae в толстой кишке (2).С другой стороны, тонкий кишечник в основном заселен бактериями из семейств Lactobacillaceae и Enterobacteriaceae (3). В последние годы секвенирующий анализ гена 16S рРНК выявил связь между микробиотой кишечника и воспалительными заболеваниями (4). Изменения в составе кишечной микробиоты, процесс, называемый дисбиозом, играют ключевую роль в патогенезе воспалительных заболеваний, таких как ревматоидный артрит (5), атеросклероз (6), язвенный колит, болезнь Крона (7) и сахарный диабет. типа 1 и 2 (8, 9).Соответственно, модуляция микробиоты кишечника пребиотиками и пробиотиками в качестве профилактических или терапевтических стратегий смягчения патогенеза воспалительных заболеваний изучается все чаще (10).
Рецепторы врожденного иммунитета, также называемые рецепторами распознавания образов (PRR), экспрессируются несколькими клетками и участвуют в распознавании микробных продуктов или эндогенных собственных молекул. PRR являются ключевыми компонентами патогенеза воспалительных и аутоиммунных заболеваний (11, 12).Толл-подобные рецепторы (TLR) и NOD-подобные рецепторы (NLR) относятся к основным семействам, составляющим суперсемейство PRR (13). В процессе дисбактериоза увеличенное количество патобионтных бактерий модулирует экспрессию и активацию TLR, что приводит к провоспалительной реакции в кишечнике и вне кишечника (14, 15). С другой стороны, NLR имеют либо положительные, либо вредные эффекты, которые зависят от антимикробных факторов и провоспалительного цитокинового профиля после активации микробиоты кишечника.В этом мини-обзоре подчеркивается различная роль NLR в метаболических и воспалительных заболеваниях, связанных с дисбактериозом кишечника.
Дисбактериоз кишечника при воспалительных заболеваниях
Микробиота кишечника в гомеостазе напрямую связана со здоровьем хозяина. Кишечная микробиота влияет на метаболизм хозяина (16), иммунную систему (17, 18), микробицидные механизмы кишечника (19) и поддерживает кишечный барьер (20). Многие исследования показывают, что факторы окружающей среды, такие как использование антибиотиков (21, 22), диета (23) и стресс (24), могут изменить микробиоту кишечника, увеличивая количество патобионтических бактерий за счет комменсальных бактерий, процесс, известный как дисбиоз ( 25).Дисбактериоз кишечника способствует развитию ряда аутоиммунных, воспалительных и метаболических заболеваний, таких как ревматоидный артрит (РА), воспалительные заболевания кишечника (ВЗК) и сахарный диабет (26, 27). Однако во многих случаях, например, при ВЗК, еще не известно, является ли дисбактериоз причиной или следствием заболевания (28, 29). Точная роль микробиоты кишечника в патогенезе РА также полностью не изучена. Однако у мышей без микробов (GF) наблюдается задержка развития RA по сравнению с контрольной группой (30).На ранних стадиях РА было зарегистрировано уменьшение количества некоторых комменсальных бактерий, таких как бактерии, принадлежащие к роду Bifidobacteria и Bacteroides , и увеличение количества Escherichia coli и Proteus mirabilis (31, 32) . Кроме того, у пациентов с РА наблюдается повышение уровня Prevotella copri , а также IgA и IgG против P. copri , что позволяет предположить, что эти бактерии могут вносить вклад в патогенез РА (33).
Воспалительные заболевания кишечника, такие как болезнь Крона (БК) и язвенный колит (ЯК), поражают около 3 миллионов человек в Европе и США, причем высокая и ускоренная заболеваемость наблюдается в развивающихся странах (34, 35).Хотя этиология все еще не ясна, генетическая предрасположенность и факторы окружающей среды, такие как диета и использование антибиотиков, являются триггерами этих заболеваний, которые в основном характеризуются хроническим воспалением кишечника (34, 36). Кроме того, нарушение эпителиального барьера и дисбактериоз кишечника широко сообщается у пациентов и в экспериментальных моделях желудочно-кишечных инфекций (37, 38), включая пациентов с ВЗК (39, 40). Метагеномный анализ 16S рРНК показал, что микробиота, присутствующая в кале мышей с ЯК, сильно отличается от микробиоты в кале здоровых мышей, главным образом увеличением видов филума Verrucomicrobia и уменьшением Tenericutes у мышей с колитом, что коррелирует с с более высоким показателем заболевания (41, 42).Увеличение количества энтеробактерий наблюдается в образцах кала пациентов с CD (43). Численность Escherichia и Shigella также увеличивается в этом состоянии по сравнению со здоровыми людьми. Кроме того, сообщалось о снижении количества родов Roseburia, Coprococcus и Ruminococcus , которые являются важными продуцентами бутирата (44, 45). Анализ биопсии толстой кишки у пациентов с ВЗК также показывает снижение Firmicutes и увеличение Bacteroidetes (46), а у пациентов с ВЗК наблюдается повышенное производство биопленок штаммов Enterococcus по сравнению со штаммами из контрольной группы (47).
Несбалансированная микробиота кишечника и изменения барьерной функции кишечника также тесно связаны с патогенезом сахарного диабета (СД) (48). СД включает группу метаболических заболеваний, характеризующихся в основном хронической гипергликемией, возникающей в результате нарушения секреции и / или функциональности инсулина (49). При диабете 1 типа (T1D), также называемом аутоиммунным диабетом, присутствуют аутоантитела, и аутореактивные лимфоциты опосредуют разрушение β-клеток поджелудочной железы, что приводит к полному дефициту инсулина (50).Влияние микробиоты на развитие T1D было продемонстрировано на мышах с дефицитом Myd88 и диабетом без ожирения (NOD), выращенных в условиях, свободных от патогенов (SPF) или микробов (GF). Принимая во внимание, что мыши SPF NOD.Myd88 — / — защищены от T1D, у мышей в условиях GF развивается T1D, показывая, что защитные эффекты Myd88 зависят от присутствия микробиоты кишечника (51). В этом контексте многие исследования показали различия в составе микробиоты между диабетиками и недиабетическими пациентами, предполагая, что эти изменения связаны с развитием и тяжестью СД1 (52, 53).Исследования бактериального протеома показывают высокое обогащение белками Clostridium и Bacteroides у детей с СД1, тогда как контрольная группа демонстрирует большее обогащение белками Bifidobacterium (54). Кроме того, снижение количества видов, продуцирующих лактат и бутират, таких как B. adolescentis , связано с аутоиммунитетом T1D (55).
В моделях диабета 2 типа (T2D) дисбиоз кишечника усугубляет воспалительный процесс, увеличивает проницаемость кишечника, а также изменяет метаболизм короткоцепочечных жирных кислот, которые важны для инсулинорезистентности (56), в дополнение к ускорению развития ожирение, ретинопатия и нефропатия (57).У пациентов с сахарным диабетом 2 типа чрезмерное потребление углеводов и белков связано с дисбалансом микробиоты кишечника, с увеличением рода Clostridium и уменьшением Bifidobacterium spp. и Lactobacillus , помимо непереносимости глюкозы (58). Более того, в экспериментальных моделях СД2 введение бактерий рода Bifidobacterium улучшает толерантность к глюкозе и придает защитную роль в развитии СД2 (59, 60).Точно так же введение Bacteroides acidifaciens снижает инсулинорезистентность и даже предотвращает ожирение (61).
Рецепторы врожденного иммунитета, такие как NLR, играют решающую роль в защите кишечного барьера от различных микроорганизмов из окружающей среды. Эти рецепторы также модулируют микробный состав кишечника, что связано с развитием воспалительных заболеваний (62).
Защитная роль NLR в гомеостазе кишечной микробиоты и ВЗК
Компоненты врожденной иммунной системы являются первым барьером против инфекций и распознают гибель клеток, вызывая быстрый иммунный ответ за счет распознавания патоген-ассоциированного молекулярного паттерна (PAMP) и ассоциированного с повреждением молекулярного паттерна (DAMP) соответственно (63).NLR являются частью множества рецепторов врожденного иммунитета, расположенных во внутриклеточной среде, и инициируют воспалительные процессы. NOD1 и NOD2, центральные члены NLR, в основном распознают бактериальный пептидогликан и, таким образом, индуцируют транскрипцию генов NF-kB и митоген-активируемых протеинкиназ (MAPK), активируя экспрессию провоспалительных факторов различными клетками (13).
Рецептор NOD1 обнаруживает гамма-D-глутамил-мезо-диаминопимелиновую кислоту (γ iE-DAP), пептид, обнаруживаемый в основном в грамотрицательных бактериях, но также и в группах грамположительных бактерий, таких как Listeria spp.и Bacillus spp (64–66). В отсутствие NOD1 происходит размножение некоторых кишечных бактерий, таких как Clostridiales , Bacteroides spp., Сегментированные нитчатые бактерии (SFB) и Enterobacteriaceae. Рецептор NOD2 обнаруживает мурамилдипептид (MDP), присутствующий в бактериальном пептидогликане, и является наиболее важным рецептором в контроле гомеостаза кишечника (67). Этот рецептор контролирует комменсальную микробиоту и устранение патогенных бактерий в криптах кишечника, сводя к минимуму риск воспаления кишечника и колоректального рака (68–70).Интересно, что экспрессия NOD2 зависит от присутствия кишечных комменсальных бактерий, что указывает на положительную обратную связь. Дефицит NOD2 нарушает это гомеостатическое взаимодействие, что приводит к дисбактериозу кишечника и повышенной восприимчивости к ВЗК (69).
Другие NLR также играют важную роль в гомеостазе кишечника. Активация семейства NOD-подобных рецепторов — пиринового домена, содержащего 6 (NLRP6), посредством олигомеризации и сборки белков с комплексом инфламмасом — активирует каспазу-1 и приводит к синтезу IL-1β и IL-18 в кишечном эпителии (71 ).Дефицит NLRP6 в эпителиальных клетках толстой кишки мышей снижает уровень IL-18, способствует дисбактериозу кишечника и увеличивает риск колита (72, 73). IL-18, секретируемый эпителиальными клетками, стимулирует барьерную функцию и регенерацию эпителиальных клеток (73). Кроме того, сама комменсальная микробиота активирует инфламмасому NLRP6, что приводит к выработке слизи бокаловидными клетками и антимикробными пептидами, поддерживая здоровый состав кишечной микробиоты (74).
NLRP3, другой тип NLR, высоко экспрессируется в моноцитарной линии (75) и способствует большей продукции IL-1β по сравнению с IL-18, что приводит к изменениям в составе кишечной микробиоты (76).В нормальных условиях у мышей с дефицитом NLRP3 наблюдается дисбиоз кишечника, связанный с чрезмерным ростом Prevotellaceae и Bacteroidetes (77), тогда как соотношение между Firmicutes и Bacterioidetes уменьшается (78). В отличие от других NLR, NLRP12 обладает противовоспалительным действием, ингибируя канонический и неканонический NF-κB; снижение выработки воспалительных цитокинов, хемокинов и канцерогенных факторов (79–82) и контроль инфекции грамотрицательными бактериями (83). Дефицит NLRP12 на модели колита, индуцированного декстран-сульфатом натрия (DSS), способствует воспалению толстой кишки, снижает разнообразие кишечной микробиоты и увеличивает количество колитогенных бактерий, таких как семейство Erysipelotrichaceae, что свидетельствует о защитной роли NLRP12 при ВЗК (84).
Расходящиеся роли NLR и AIM2 в развитии T1D
В последние несколько лет несколько линий доказательств продемонстрировали, что члены семейства NLR участвуют в патогенезе T1D. Недавно мы сообщили, что мыши, лишенные NOD2, но не NOD1, устойчивы к индуцированному стрептозотоцином (STZ) T1D и неспособны вызывать иммунный ответ Th2 и Th27 в лимфатических узлах поджелудочной железы (PLN) и поджелудочной железе. Интересно, что у мышей с диабетом наблюдаются изменения в составе микробиоты кишечника, и это связано с транслокацией микробиоты кишечника в PLN (рис. 1).Когда эти мыши подвергаются лечению антибиотиками широкого спектра действия до инъекций STZ, у них не развиваются признаки СД1, такие как гипергликемия. Кроме того, введение лиганда NOD2, MDP, способствует развитию STZ-индуцированного T1D у мышей дикого типа (WT), которым вводили антибиотики и инъецировали STZ. Наши результаты демонстрируют, что распознавание микробиоты кишечника NOD2 в PLN запускает провоспалительный ответ, который индуцирует патогенный иммунный ответ клеток Th2 и Th27, тем самым внося вклад в патогенез STZ-индуцированного T1D (Таблица 1) (85).
Рисунок 1 . Экспрессия и дифференциальные функции NLR в развитии диабета 1 типа. Повышенная экспрессия AIM2 была обнаружена в слизистой оболочке кишечника мышей с преддиабетическим состоянием, и его активация вызывает высвобождение IL-18, что, в свою очередь, способствует продукции RegIIIγ. Этот механизм ослабляет дисбактериоз кишечника, укрепляет барьер кишечника и ослабляет ответ лимфоцитов Th2 и Tc1 против продуцирующих инсулин β-клеток, что в конечном итоге защищает от T1D. С другой стороны, NOD2 распознает перемещенный мурамилдипептид (MDP) из дисбиотической микробиоты и способствует активации лимфоцитов Th2 и Th27 при T1D.Наконец, у мышей с диабетом наблюдалась повышающая регуляция экспрессии NLRP3 в PLN, которая активируется в макрофагах путем распознавания митохондриальной ДНК (мДНК), приводит к продукции IL-1β и стимулирует образование патогенных лимфоцитов Th27 и Th2, что приводит к началу T1D.
Таблица 1 . Резюме экспериментальных исследований роли NLR в T1D.
STZ-инъецированные мыши WT демонстрируют увеличение различных групп бактерий в кишечной микробиоте, таких как семейство Bacteroidaceae и род Bacteroides , которые были связаны с повышенной восприимчивостью к T1D у людей (91, 92).Эти результаты повторяют то, что было обнаружено у пациентов с сахарным диабетом 1 типа, при этом тип Bacteroidetes, семейство Bacteroidaceae и род Bacteroides чаще встречаются у детей с положительной реакцией на антитела, чем у сверстников с отрицательной реакцией на антитела (55). Другое важное наблюдение, обнаруженное среди пациентов с диабетом 1 типа, — снижение разнообразия микробиоты, связанное с уменьшением относительной численности Bifidobacterium, Roseburia, Faecalibacterium и Lachnospira (91).Эти данные показывают, что дисбактериоз кишечника, наблюдаемый у пациентов с диабетом 1 типа, может действовать как триггер окружающей среды в развитии заболевания, и что стратегии, нацеленные на блокировку передачи сигналов NOD2, появляются в качестве потенциальных методов лечения СД1. Аналогичные результаты были получены на модели спонтанных мышей T1D. У мышей NOD.NOD2 — / — без совместного проживания наблюдается снижение частоты СД1 и снижение CD4 + IFN-γ + / CD8 + IFN-γ + (Th2 / Tc1) и CD4 + IL-17 + / CD8 + IL-17 + (Th27 / Tc17) T-клетки в PLN, что указывает на то, что активация NOD2 регулирует развитие T1D, изменяя состав микробиоты кишечника и модулируя адаптивный иммунный ответ ( 86).
Другие исследования также показали, что NLRP3 необходим для патогенеза СД1. Дефицит NLRP3 у мышей NOD защищает от T1D, подавляя экспрессию хемокинов и хемокиновых рецепторов, участвующих в миграции иммунных клеток к островкам поджелудочной железы. Дефицит NLRP3 у мышей NOD снижает экспрессию CCR5 и CXRC3 на Т-клетках, а также экспрессию генов CCL5 и CXCL10 в ткани поджелудочной железы, и эти процессы происходят зависимым от IRF1 образом (87). Кроме того, наша исследовательская группа продемонстрировала, что активация инфламмасомы NLRP3 митохондриальной ДНК (мДНК) способствует высвобождению IL-1β макрофагами, способствуя генерации патогенных клеток Th27 / Th2 в PLN и чувствительности к T1D в модели STZ-индуцированного T1D (рис. , Таблица 1) (88).Соответственно, ассоциативное исследование в северо-восточной части Бразилии выявило два однонуклеотидных полиморфизма (SNP) в NLRP3, rs10754558 и rs358294199, которые связаны с T1D у людей, предполагая, что вариации в NLRP3 могут быть предрасполагающим генетическим фактором развитие аутоиммунного СД1 (89).
Другой рецептор врожденного иммунитета, который приводит к сборке инфламмасом при его активации, — это датчик ДНК, отсутствующий в меланоме 2 (AIM2) (93, 94). Активация AIM2 участвует в аутоиммунных и воспалительных заболеваниях (95).В модели STZ T1D AIM2 высоко экспрессируется в подвздошной кишке на ранних стадиях заболевания. Интересно, что мыши с инъекцией AIM2 — / — STZ демонстрируют повышенную частоту T1D, повышенную кишечную проницаемость и бактериальную транслокацию в PLN, что приводит к провоспалительному ответу, опосредованному клетками Th2 и Tc1. Когда микробиота кишечника истощается коктейлем антибиотиков широкого спектра действия перед инъекциями STZ, повышенная чувствительность к T1D, наблюдаемая у мышей AIM2 — / — , исчезает (Таблица 1).Эффекты, индуцированные активацией AIM2 in vivo , опосредуются высвобождением IL-18, что способствует регенерации продукции III гамма (RegIIIγ) островкового происхождения, таким образом смягчая изменения микробиоты кишечника и усиливая барьерную функцию кишечника. Вместе наши данные показывают, что активация AIM2 ограничивает дисбактериоз кишечной микробиоты, кишечную проницаемость и транслокацию в PLN, уменьшая провоспалительный ответ и обеспечивая защиту от T1D (90).
Роль NLR в ожирении, СД2 и сопутствующих заболеваниях
Дисбактериоз кишечника может приводить к повышенной проницаемости кишечного барьера, что приводит к системному воспалению низкой степени и метаболическим нарушениям, таким как ожирение, сахарный диабет 2 типа и ишемический инсульт (96, 97).Рецепторы врожденного иммунитета играют роль в системном воспалении, вызванном ожирением. У мышей, получавших диету с высоким содержанием жиров (HFD), наблюдается усиление воспаления толстой кишки и эндотоксемии из-за повышенной кишечной проницаемости слизистой оболочки толстой кишки (98). Кроме того, наблюдается усиление передачи сигналов TLR4 в толстой кишке и активация NF-κB (98). Однако самки мышей, лишенные TLR4, демонстрируют более высокий риск развития ожирения, но также обладают большей защитой от инсулинорезистентности, возможно, из-за отсутствия передачи сигналов TLR4 в органах, важных для метаболического гомеостаза (99).Кроме того, другие исследования показали, что дисбактериоз кишечника способствует состоянию метаболической эндотоксемии при ожирении, что приводит к накоплению ЛПС в крови, мета воспламенению и инсулинорезистентности через путь CD14 / TLR4 (100–102).
T2D — это хроническое метаболическое воспалительное состояние и самый распространенный тип диабета у взрослых во всем мире (103). Это заболевание инициируется обострением дисфункции поджелудочной железы, когда выработка инсулина β-клетками поджелудочной железы не успевает за увеличением периферической инсулинорезистентности (104, 105).Системное воспаление слабой степени сопровождает диабет с высокими уровнями в сыворотке крови C-реактивного белка (CRP), фактора некроза опухоли (TNF-α), хемопривлекающего моноциты белка-1 (MCP-1) и IL-1β (106, 107 ). Кроме того, ожирение, старение и другие состояния, способствующие хроническому воспалению слабой степени, связаны с повышенным риском развития СД2 (108–110). Системно высокие сывороточные концентрации IL-6, IL-1β и TNF-α увеличивают инсулинорезистентность и вызывают эндотелиальную дисфункцию, стимулируя сосудистую систему к развитию заболеваний, связанных с диабетом, включая системную артериальную гипертензию (111).Между тем, повышение уровня IL-1β, IL-6 и IL-8 в поджелудочной железе снижает экспрессию гена инсулина в β-клетках поджелудочной железы, что способствует повышению инсулинорезистентности (112).
Точный баланс между активацией врожденных рецепторов NOD1 и NOD2 имеет решающее значение для поддержания периферической резистентности к инсулину. Прямая активация рецепторов NOD1 посредством внутрибрюшинного введения лиганда NOD1 у мышей WT приводит к увеличению периферической инсулинорезистентности в течение 6 часов (113). В этом же исследовании активация NOD1 вызывала небольшое увеличение циркулирующих провоспалительных цитокинов.Кроме того, более высокие концентрации медиаторов воспаления наблюдаются в культурах фибробластов 3T3-L1, дифференцированных в адипоциты и подвергнутых воздействию лигандов NOD1 в течение 18 часов (113). Воспаление периферических тканей, особенно жировой ткани (114), является отличительной чертой СД2 и напрямую способствует его патогенезу через дисфункцию жировой ткани и последующие осложнения энергетического гомеостаза и промежуточного метаболизма (115). В этом контексте мыши NOD1 / NOD2 с двойным нокаутом защищены от периферической инсулинорезистентности и периферического воспаления, наблюдаемых в модели T2D, вызванной ожирением (HFD) (113).
NOD2 — это рецептор врожденного иммунитета, который распознает пептидогликан в клеточной стенке бактерий и, следовательно, представляет собой важное звено между микробиотой кишечника и иммунитетом (116). Следовательно, профиль активации NOD2 может быть важным при метаболических заболеваниях с ответвлениями иммунной системы и, следовательно, может представлять собой связь между микробиотой кишечника и этими заболеваниями. Дефицит NOD2 у мышей способствует большему перемещению бактерий из кишечника (116). В модели HFD мыши с дефицитом NOD2 проявляют большую периферическую резистентность к инсулину, воспаление висцеральной жировой ткани и более высокое содержание бактериальной ДНК в печени (117).HFD увеличивает соотношение Firmicutes к Bacteriodetes, а у мышей NOD2 — / — , подвергнутых HFD, обнаруживается дисбактериоз, представленный увеличением количества бактерий Helicobacter () и семейства Peptococcaceae и уменьшением количества бактерий рода Clostridium по сравнению с Мыши WT, получавшие HFD (117). Трансплантация фекалий от мышей с ожирением мышам с худым GF увеличивает общую массу тела и массу жировой ткани. В качестве альтернативы трансплантация фекалий от тощих мышей мышам GF с ожирением снижает массу жировой ткани (118).В этой последней экспериментальной установке наблюдается увеличение количества типов Bacteriodetes в кишечнике, что связано с производством метаболитов микробиоты с модулирующими свойствами хозяина, в частности: SCFAs (118). Интересно, что адекватное потребление пищевых волокон способствует секреции SCFAs кишечной микробиотой. Кроме того, активация рецептора GPR43 у мышей с помощью SCFAs в макрофагах M2 жировой ткани приводит к повышенной метаболической активности и способствует поддержанию и гомеостазу здоровой жировой ткани, улучшая метаболическое здоровье (119).
Заключительные замечания
Различные категории NLR модулируют вызванные дисбиозом кишечника внекишечные и кишечные воспалительные заболевания. Эффекты NLR разнообразны и могут быть как защитными, так и вредными, в зависимости от иммунологического контекста. В кишечнике NLR регулируют состав и транслокацию кишечной микробиоты, влияя на секрецию слизи и продукцию антимикробных пептидов, тем самым играя ключевую роль в защите от воспалительных заболеваний кишечника, таких как язвенный колит и болезнь Крона.Альтернативно, NLR также активируются микробными PAMP (кишечная микробиота) или эндогенными DAMP (компонентами мертвых или умирающих клеток), которые действуют как отрицательные или положительные регуляторы врожденного и адаптивного иммунного ответа и способствуют восприимчивости или устойчивости к метаболическим заболеваниям, таким как как ожирение, диабет 1, 2 типа и их сопутствующие заболевания. Таким образом, фармакологическая модуляция этих рецепторов может представлять новые терапевтические стратегии для этих воспалительных и метаболических заболеваний.
Авторские взносы
JE-O, JL, ÍP, JG и GM в равной степени внесли свой вклад в написание рукописи. JS и RT оказали научную помощь и критически пересмотрели ее. DC координировал и рецензировал рукопись. Все авторы одобрили подачу и публикацию.
Финансирование
Это исследование было поддержано грантами Исследовательского фонда Сан-Паулу (FAPESP) (номера процессов: 2012 / 10395-0; 2018 / 14815-0).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
5. Чжан X, Чжан Д., Цзя Х., Фэн К., Ван Д., Лян Д. и др. Микробиомы полости рта и кишечника нарушаются при ревматоидном артрите и частично нормализуются после лечения. Nat Med. (2015) 21: 895–905. DOI: 10,1038 / нм.3914
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Карлссон Ф. Х., Фак Ф., Нукау И., Тремароли В., Фагерберг Б., Петранович Д. и др. Симптоматический атеросклероз связан с измененным метагеномом кишечника. Nat Commun. (2012) 3: 1245. DOI: 10.1038 / ncomms2266
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Tamboli CP, Neut C, Desreumaux P, Colombel JF. Дисбактериоз при воспалительном заболевании кишечника. Gut. (2004) 53: 1–4. DOI: 10.1136 / gut.53.1.1
CrossRef Полный текст | Google Scholar
8. Тай Н, Вонг Ф.С., Вэнь Л. Роль кишечной микробиоты в развитии сахарного диабета 1-го, 2-го типа и ожирения. Rev Endocr Metab Disord. (2015) 16: 55–65. DOI: 10.1007 / s11154-015-9309-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Ли Х, Ватанабе К., Кимура И. Дисбиоз кишечной микробиоты стимулирует и подразумевает новые терапевтические стратегии для лечения сахарного диабета и связанных с ним метаболических заболеваний. Front Immunol. (2017) 8: 1882. DOI: 10.3389 / fimmu.2017.01882
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Frosali S, Pagliari D, Gambassi G, Landolfi R, Pandolfi F, Cianci R.Как сложное взаимодействие между толл-подобными рецепторами, микробиотой и кишечным иммунитетом может влиять на патологию желудочно-кишечного тракта. J Immunol Res. (2015) 2015: 489821. DOI: 10.1155 / 2015/489821
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Роуленд И., Гибсон Дж., Хейнкен А., Скотт К., Суонн Дж., Тиле И. и др. Функции кишечной микробиоты: метаболизм питательных веществ и других компонентов пищи. Eur J Nutr. (2018) 57: 1–24. DOI: 10.1007 / s00394-017-1445-8
CrossRef Полный текст | Google Scholar
18.Лазар В., Диту Л.М., Пиркалабиру Г.Г., Георге И., Курутиу С., Холбан А.М. и др. Аспекты взаимодействия микробиоты кишечника и иммунной системы при инфекционных заболеваниях, иммунопатологии и раке. Front Immunol. (2018) 9: 1–1830. DOI: 10.3389 / fimmu.2018.01830
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Зарринпар А., Шаикс А., Сюй З.З., Чанг М.В., Мароц, Калифорния, Сагательян А. и др. Вызванное антибиотиками истощение микробиома изменяет метаболический гомеостаз, влияя на передачу сигналов в кишечнике и метаболизм в толстой кишке. Nat Commun. (2018) 9: 2872. DOI: 10.1038 / s41467-018-05336-9
PubMed Аннотация | CrossRef Полный текст
22. Kim HJ, Lee SH, Hong SJ. Вызванный антибиотиками дисбиоз кишечной микробиоты усугубляет атопический дерматит у мышей из-за измененных короткоцепочечных жирных кислот. Allergy Asthma Immunol Res. (2020) 12: 137–48. DOI: 10.4168 / aair.2020.12.1.137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Alou MT, Lagier J, Raoult D.Влияние диеты на микробиоту кишечника и дисбактериоз, связанный с нарушением питания. Hum Microbiome J. (2016) 1: 3–11. DOI: 10.1016 / j.humic.2016.09.001
CrossRef Полный текст | Google Scholar
24. Карл Дж. П., Хэтч А. М., Арчидиаконо С. М., Пирс С. К., Пантоха-Фелисиано И. Г., Доэрти Л. А. и др. Влияние психологических, экологических и физических стрессоров на микробиоту кишечника. Front Microbiol. (2018) 9: 2013. DOI: 10.3389 / fmicb.2018.02013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29.Бутто Л.Ф., Халлер Д. Дисбиоз при воспалении кишечника: причина или следствие. Int J Med Microbiol. (2016) 306: 302–9. DOI: 10.1016 / j.ijmm.2016.02.010
CrossRef Полный текст | Google Scholar
31. Ваахтовуо Дж., Мунукка Э., Коркеамаки М., Лууккайнен Р., Тойванен П. Фекальная микробиота при раннем ревматоидном артрите. J Rheumatol. (2008) 35: 1500–5.
Google Scholar
32. Ньюкирк М.М., Збар А., Барон М., Манжес АР. Отчетливые паттерны бактериальной колонизации подтипов Escherichia coli связаны со статусом ревматоидного фактора при раннем воспалительном артрите. Ревматология. (2010) 49: 1311–6. DOI: 10.1093 / ревматология / keq088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Пианта А., Арвикар С., Стрле К., Дроуин Е.Е., Ван К., Костелло С.Е. и др. Доказательства иммунной значимости кишечного микроба prevotella copri у пациентов с ревматоидным артритом. Arthritis Rheumatol. (2017) 69: 964–75. DOI: 10.1002 / art.40003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34.Ni J, Wu GD, Albenberg L, Tomov VT. Микробиота кишечника и ВЗК: причинная связь или корреляция? Nat Publ Gr. (2017) 14: 573–84. DOI: 10.1038 / nrgastro.2017.88
CrossRef Полный текст | Google Scholar
35. Соавторы G 2017 IBD. Глобальное, региональное и национальное бремя воспалительных заболеваний кишечника в 195 странах и территориях, 1990–2017 гг .: систематический анализ для исследования глобального бремени болезней, 2017 г. Lancet Gastroenterol Hepatol. (2020) 5: 17–30.DOI: 10.1016 / S2468-1253 (19) 30333-4
CrossRef Полный текст | Google Scholar
36. Маттос БРР, Гарсия М.П.Г., Ногейра Дж.Б., Пайатто Л.Н., Альбукерке К.Г., Соуза К.Л. и др. Воспалительное заболевание кишечника: обзор иммунных механизмов и биологических методов лечения. Медиаторы воспаления. (2015) 2015: 493012. DOI: 10.1155 / 2015/493012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Битти Дж. К., Акиерман С. В., Мотта Дж. П., Муиз С., Воркентин М. Л., Харрисон Дж. Дж. И др.Giardia duodenalis вызывает патогенный дисбиоз биопленок кишечной микробиоты человека. Int J Parasitol. (2017) 47: 311–26. DOI: 10.1016 / j.ijpara.2016.11.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Yu LCH, Shih YA, Wu LL, Lin YD, Kuo W.T., Peng WH, et al. Кишечный дисбактериоз способствует развитию устойчивых к антибиотикам бактериальных инфекций: системного распространения устойчивых и комменсальных бактерий через эпителиальный трансцитоз. Am J Physiol Gastrointest Liver Physiol. (2014) 307: G824–35. DOI: 10.1152 / ajpgi.00070.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Пророк-Хамон М., Фрисвелл М.К., Алсвид А., Робертс К.Л., Сонг Ф., Фланаган П.К. и др. Связанные со слизистой оболочкой толстой кишки диффузно адгезивные afaC + Escherichia coli , экспрессирующие lpfA и pks, увеличиваются при воспалительном заболевании кишечника и раке толстой кишки. Gut. (2014) 63: 761–70. DOI: 10.1136 / gutjnl-2013-304739
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41.Саманта А.К., Торок В.А., Перси Нью-Джерси, Абимослех С.М., Ховарт Г.С. Микробный дактилоскопический анализ позволяет выявить уникальные бактериальные сообщества в фекальной микробиоте крыс с экспериментально вызванным колитом. J Microbiol. (2012) 50: 218–25. DOI: 10.1007 / s12275-012-1362-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Нагалингам Н.А., Као Дж.Й., Янг В.Б. Микробная экология кишечника мышей, связанная с развитием колита, индуцированного декстран-сульфатом натрия. Воспаление кишечника. (2011) 17: 917–26. DOI: 10.1002 / ibd.21462
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Сексик П., Риготтье-Гойс Л., Грамет Г., Сутрен М., Почарт П., Марто П. и др. Изменения доминирующих фекальных бактериальных групп у пациентов с болезнью Крона толстой кишки. Gut. (2003) 52: 237–42. DOI: 10.1136 / gut.52.2.237
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Чен Л., Ван В., Чжоу Р., Нг С.К., Ли Дж., Хуанг М. и др.Характеристики фекальной и слизистой микробиоты у китайских пациентов с воспалительным заболеванием кишечника. Медицина. (2014) 93: e51. DOI: 10.1097 / MD.0000000000000051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Ковальска-Дуплага К., Госевски Т., Капуста П., Срока-Олексяк А., Ведрихович А., Печарковский С. и др. Различия в микробиоме кишечника здоровых детей и пациентов с впервые диагностированной болезнью Крона. Sci Rep. (2019) 9: 18880. DOI: 10.1038 / s41598-019-55290-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Уокер А. В., Сандерсон Дж. Д., Черчер С., Паркс Г. С., Хадспит Б. Н., Реймент Н. и др. Высокопроизводительный анализ библиотеки клонов микробиоты, связанной со слизистой оболочкой, выявляет дисбактериоз и различия между воспаленными и невоспаленными участками кишечника при воспалительном заболевании кишечника. BMC Microbiol. (2011) 11: 7. DOI: 10.1186 / 1471-2180-11-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47.Golinska E, Tomusiak A, Gosiewski T, Wiecek G, Machul A, Mikolajczyk D, et al. Факторы вирулентности штаммов энтерококков , выделенных от пациентов с воспалительным заболеванием кишечника. World J Gastroenterol. (2013) 19: 3562–72. DOI: 10.3748 / wjg.v19.i23.3562
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Лу Дж., Ма К.Л., Руань XZ. Дисбиоз микробиоты кишечника способствует развитию сахарного диабета. Инфекционные микробы Dis. (2019) 1: 43–8.DOI: 10.1097 / IM9.0000000000000011
CrossRef Полный текст | Google Scholar
51. Вен Л., Лей Р. Е., Волчков П. Ю., Странджес П. Б., Аванесян Л., Стоунбрейкер А. С. и др. Врожденный иммунитет и микробиота кишечника в развитии диабета 1 типа. Природа. (2008) 455: 1109–13. DOI: 10.1038 / nature07336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Джамшиди П., Хасанзаде С., Тахвилдари А., Фарси Й., Арбаби М., Мота Дж. Ф. и др. Есть ли какая-либо связь между микробиотой кишечника и диабетом 1 типа? Систематический обзор. Gut Pathog. (2019) 11:49. DOI: 10.1186 / s13099-019-0332-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Пинто Е., Ансельмо М., Калха М., Боттрилл А., Дуарте И., Эндрю П. У. и др. Кишечный протеом детей с диабетом и контрольной группы обогащен различными микробными белками и белками хозяина. Микробиология. (2017) 163: 161–74. DOI: 10.1099 / mic.0.000412
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55.де Гоффау М.С., Луопаярви К., Книп М., Илонен Дж., Руохтула Т., Харконен Т. и др. Состав фекальной микробиоты у детей с бета-клеточным аутоиммунитетом и без него различается. Диабет. (2013) 62: 1238–44. DOI: 10.2337 / db12-0526
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Сиркана А., Фрамарин Л., Леоне Н., Беррутти М., Кастеллино Ф., Паренте Р. и др. Изменение микробиоты кишечника при диабете 2 типа: просто совпадение? Curr Diab Rep. (2018) 18:98.DOI: 10.1007 / s11892-018-1057-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Фернандес Р., Виана С.Д., Нунес С., Рейс Ф. Диабетический дисбактериоз кишечной микробиоты как воспаление и состояние иммунного старения, которое способствует прогрессированию ретинопатии и нефропатии. Biochim Biophys Acta Mol Basis Dis. (2019) 1865: 1876–97. DOI: 10.1016 / j.bbadis.2018.09.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Ямагути Ю., Адачи К., Сугияма Т., Симозато А., Эби М., Огасавара Н. и др.Связь кишечной микробиоты с метаболическими маркерами и диетическими привычками у пациентов с сахарным диабетом 2 типа. Пищеварение. (2016) 94: 66–72. DOI: 10.1159 / 000447690
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Ле ТКС, Хосака Т., Нгуен Т.Т., Кассу А., Данг Т.О., Тран HB и др. Виды Bifidobacterium снижают уровень глюкозы в сыворотке, увеличивают экспрессию сигнальных белков инсулина и улучшают профиль адипокина у мышей с диабетом. Biomed Res. (2015) 36: 63–70.DOI: 10.2220 / биомедры.36.63
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Кикучи К., Бен Отман М., Сакамото К. Стерилизованные бифидобактерии подавляли накопление жира и уровень глюкозы в крови. Biochem Biophys Res Commun. (2018) 501: 1041–7. DOI: 10.1016 / j.bbrc.2018.05.105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Ян Дж.Й., Ли Ю.С., Ким Й., Ли Ш., Рю С., Фукуда С. и др. Комменсал кишечника Bacteroides acidifaciens предотвращает ожирение и улучшает чувствительность к инсулину у мышей. Mucosal Immunol. (2017) 10: 104–16. DOI: 10,1038 / mi.2016.42
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Даолин Т., Руи К., Койн С.Б., Зе Х.Дж., Лотце М.Т. PAMP и DAMP: сигнальные 0, которые стимулируют аутофагию и иммунитет. Immunol Rev. (2012) 249: 158–75. DOI: 10.1111 / j.1600-065X.2012.01146.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Жирардин С.Е., Травассос Л.Х., Эрве М., Блано Д., Бонека И.Г., Филпотт Д.Д. и др.Требования к молекулам пептидогликана, позволяющие обнаруживать их с помощью Nod1 и Nod2. J Biol Chem. (2003) 278: 41702–8. DOI: 10.1074 / jbc.M307198200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Girardin SE, Boneca IG, Carneiro LAM, Antignac A, Jéhanno M, Viala J, et al. Nod1 обнаруживает уникальный муропептид из грамотрицательного бактериального пептидогликана. Наука. (2003) 300: 1584–7. DOI: 10.1126 / science.1084677
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66.Чамайлард М., Хашимото М., Хори Й., Масумото Дж., Цю С., Сааб Л. и др. Существенная роль NOD1 в распознавании хозяином бактериального пептидогликана, содержащего диаминопимелиновую кислоту. Nat Immunol. (2003) 4: 702–7. DOI: 10.1038 / ni945
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Инохара Н., Огура Ю., Фонтальба А., Гутьеррес О., Понс Ф., Креспо Дж. И др. Распознавание хозяином бактериального мурамилдипептида, опосредованного NOD2: последствия для болезни Крона. J Biol Chem. (2003) 278: 5509–12. DOI: 10.1074 / jbc.C200673200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Рехман А., Сина С., Гаврилова О., Хеслер Р., Отт С., Бейнс Дж. Ф. и др. Nod2 необходим для временного развития кишечных микробных сообществ. Gut. (2011) 60: 1354–62. DOI: 10.1136 / gut.2010.216259
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Петницки-Оквейя Т., Хрнцир Т., Лю Ю.Дж., Бисвас А., Худкович Т., Тласкалова-Хогенова Х. и др.Nod2 необходим для регуляции комменсальной микробиоты в кишечнике. Proc Natl Acad Sci USA. (2009) 106: 15813–8. DOI: 10.1073 / pnas.0
2106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Кутюрье-Майяр А., Секер Т., Рехман А., Норманд С., Де Арканджелис А., Хеслер Р. и др. NOD2-опосредованный дисбиоз предрасполагает мышей к трансмиссивному колиту и колоректальному раку. J Clin Invest. (2013) 123: 700–11. DOI: 10.1172 / JCI62236
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72.Леви М., Таисс К.А., Зееви Д., Дохналова Л., Зильберман-Шапира Г., Махди Дж. А. и др. Метаболиты, модулируемые микробиотой, формируют микроокружение кишечника, регулируя передачу сигналов воспаления NLRP6. Ячейка. (2015) 163: 1428–43. DOI: 10.1016 / j.cell.2015.10.048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Элинав Э., Стровиг Т., Кау А.Л., Энао-Мехиа Дж., Тайс, Калифорния, Бут CJ и др. Инфламмасома NLRP6 регулирует микробную экологию толстой кишки и риск колита. Ячейка. (2011) 145: 745–57. DOI: 10.1016 / j.cell.2011.04.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Wlodarska M, Thaiss CA, Nowarski R, Henao-Mejia J, Zhang JP, Brown EM, et al. Инфламмасома NLRP6 управляет интерфейсом кишечника хозяин-микроб, регулируя секрецию слизи бокаловидными клетками. Ячейка. (2014) 156: 1045–59. DOI: 10.1016 / j.cell.2014.01.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75.Awad F, Assrawi E, Jumeau C, Georgin-Lavialle S, Cobret L, Duquesnoy P и др. Влияние поляризации человеческих моноцитов и макрофагов на экспрессию NLR и активацию инфламмасомы NLRP3. PLoS ONE. (2017) 12: e0175336. DOI: 10.1371 / journal.pone.0175336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Яо Х, Чжан Ц., Син И, Сюэ Г, Чжан Ц., Пан Ф и др. Ремоделирование кишечной микробиоты гиперактивным NLRP3 побуждает регуляторные Т-клетки поддерживать гомеостаз. Nat Commun. (2017) 8: 1–17. DOI: 10.1038 / s41467-017-01917-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Хенао-Мейя Дж., Элинав Э., Джин С., Хао Л., Мехал В.З., Строиг Т. и др. Инфламмасомный дисбиоз регулирует прогрессирование НАЖБП и ожирения. Природа. (2012) 482: 179–85. DOI: 10.1038 / nature10809
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Уильямс К.Л., Лич Дж. Д., Дункан Дж. А., Рид В., Раллабанди П., Мур С. и др.Белок CATERPILLER Monarch-1 является антагонистом toll-подобных рецепторов, фактора некроза опухоли α- и провоспалительных сигналов, индуцированных Mycobacterium tuberculosis. J Biol Chem. (2005) 280: 39914–24. DOI: 10.1074 / jbc.M502820200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Lich JD, Williams KL, Moore CB, Arthur JC, Davis BK, Taxman DJ и др. Передний край: monarch-1 подавляет неканоническую активацию NF-κB и p52-зависимую экспрессию хемокинов в моноцитах. J Immunol. (2007) 178: 1256–60. DOI: 10.4049 / jimmunol.178.3.1256
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Аллен И.К., Уилсон Дж. Э., Шнайдер М., Лич Дж. Д., Робертс Р. А., Артур Дж. К. и др. NLRP12 подавляет воспаление толстой кишки и онкогенез за счет негативной регуляции неканонической передачи сигналов NF-κB. Иммунитет. (2012) 36: 742–54. DOI: 10.1016 / j.immuni.2012.03.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82.Заки М.Х., Фогель П., Малиредди Р.КС., Боди-Малапель М., Ананд П.К., Бертин Дж. И др. NOD-подобный рецептор NLRP12 ослабляет воспаление толстой кишки и онкогенез. Cancer Cell. (2011) 20: 649–60. DOI: 10.1016 / j.ccr.2011.10.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Владимер Г.И., Венг Д., Пакетт SWM, Ваная С.К., Ратинам ВАК, Ауне М.Х. и др. Инфламмасома NLRP12 распознает yersinia pestis. Иммунитет. (2012) 37: 96–107. DOI: 10.1016 / j.иммунитет.2012.07.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Chen L, Wilson JE, Koenigsknecht MJ, Chou WC, Montgomery SA, Truax AD, et al. NLRP12 ослабляет воспаление толстой кишки, поддерживая микробное разнообразие толстой кишки и способствуя защитному росту комменсальных бактерий. Nat Immunol. (2017) 18: 541–51. DOI: 10.1038 / ni.3690
CrossRef Полный текст | Google Scholar
85. Коста FRC, Francozo MCS, de Oliveira GG, Ignacio A, Castoldi A, Zamboni DS, et al.Транслокация кишечной микробиоты в лимфатические узлы поджелудочной железы запускает активацию NOD2 и способствует возникновению T1D. J Exp Med. (2016) 213: 1223–39. DOI: 10.1084 / jem.20150744
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Ли YY, Пирсон JA, Chao C, Peng J, Zhang X, Zhou Z и др. Нуклеотид-связывающий домен олигомеризации, содержащий белок 2 (Nod2), модулирует восприимчивость к TIDM микробиотой кишечника. J Аутоиммун. (2017) 82: 85–95. DOI: 10.1016 / j.jaut.2017.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Ху Ц., Дин Х, Ли Й, Пирсон Дж. А., Чжан Х, Флавелл Р. А. и др. Дефицит NLRP3 защищает от диабета 1 типа за счет регуляции хемотаксиса островков поджелудочной железы. Proc Natl Acad Sci USA. (2015) 112: 11318–23. DOI: 10.1073 / pnas.1513509112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Карлос Д., Коста, Франция, Перейра, Калифорния, Роча, Ф.А., Яочите, JNU, Oliveira GG, et al.Митохондриальная ДНК активирует инфламмасому NLRP3 и предрасполагает к диабету 1 типа на мышиной модели. Front Immunol. (2017) 8: 164. DOI: 10.3389 / fimmu.2017.00164
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Pontillo A, Brandao L, Guimaraes R, Segat L, Araujo J, Crovella S. Два SNP в гене NLRP3 вовлечены в предрасположенность к диабету 1 типа и целиакии в педиатрической популяции из северо-восточной Бразилии. Аутоиммунитет. (2010) 43: 583–9.DOI: 10.3109 / 08916930
0432
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90. Лейте Дж. А., Пессенда Дж., Герра-Гомес ИК, де Сантана АКМ, Андре Перейра С., Рибейро Кампос Коста Ф и др. ДНК-сенсор AIM2 защищает от индуцированного стрептозотоцином диабета 1 типа, регулируя гомеостаз кишечника через путь IL-18. Ячейки. (2020) 9: 959. DOI: 10.3390 / Cell
59
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91.Murri M, Leiva I., Gomez-Zumaquero JM, Tinahones FJ, Cardona F, Soriguer F и др. Микробиота кишечника у детей с диабетом 1 типа отличается от таковой у здоровых детей: исследование случай-контроль. BMC Med. (2013) 11:46. DOI: 10.1186 / 1741-7015-11-46
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Паттерсон Е., Маркес Т.М., О’Салливан О., Фицджеральд П., Фицджеральд Г.Ф., Коттер П.Д. и др. Стрептозотоцин-индуцированный диабет типа 1 у крыс Sprague-Dawley связан с измененным составом кишечной микробиоты и уменьшением разнообразия. Микробиология. (2015) 161: 182–93. DOI: 10.1099 / mic.0.082610-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Хорнунг В., Аблассер А., Шаррел-Деннис М., Бауэрнфейнд Ф., Хорват Г., Кэффри Д. Р. и др. AIM2 распознает цитозольную дцДНК и формирует воспаление, активирующее каспазу-1, с ASC. Природа. (2009) 458: 514–8. DOI: 10.1038 / nature07725
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Ратинам ВАК, Цзян Цзинь, Ваггонер С.Н., Шарма С., Коул Л. Е., Ваггонер Л. и др.Инфламмасома AIM2 необходима для защиты хозяина от цитозольных бактерий и ДНК-вирусов. Nat Immunol. (2010) 11: 395–402. DOI: 10.1038 / ni.1864
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Ман С.М., Карки Р., Каннеганти Т-Д. Инфламмасома AIM2 при инфекции, раке и аутоиммунитете: роль в распознавании ДНК, воспалении и врожденном иммунитете. Eur J Immunol. (2016) 46: 269–80. DOI: 10.1002 / eji.201545839
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96.Ямасиро К., Танака Р., Урабе Т., Уэно Ю., Ямаширо Ю., Номото К. и др. Дисбактериоз кишечника связан с метаболизмом и системным воспалением у пациентов с ишемическим инсультом. PLoS ONE. (2017) 12: e0171521. DOI: 10.1371 / journal.pone.0171521
CrossRef Полный текст | Google Scholar
97. Pasini E, Corsetti G, Assanelli D, Testa C, Romano C, Dioguardi FS, et al. Влияние хронических упражнений на микробиоту кишечника и кишечный барьер у человека с диабетом 2 типа. Minerva Med. (2019) 110: 3–11. DOI: 10.23736 / S0026-4806.18.05589-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Ким К.А., Гу В, Ли И.А., Джон Э.Х., Ким Д.Х. Микробиота кишечника, вызванная диетой с высоким содержанием жиров, усугубляет воспаление и ожирение у мышей через сигнальный путь TLR4. PLoS ONE. (2012) 7: e47713. DOI: 10.1371 / journal.pone.0047713
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Ши Х., Кокоева М.В., Иноуэ К., Цамели И., Инь Х., Флиер Дж. С..TLR4 связывает врожденный иммунитет и резистентность к инсулину, вызванную жирными кислотами. J Clin Invest. (2006) 116: 3015–25. DOI: 10.1172 / JCI28898
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Кани П.Д., Амар Дж., Иглесиас М.А., Погги М., Кнауф С., Бастелика Д. и др. Метаболическая эндотоксемия вызывает ожирение и инсулинорезистентность. Диабет. (2007) 56: 1761–72. DOI: 10.2337 / db06-1491
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101.Поджи М., Бастелика Д., Гуаль П., Иглесиас М.А., Гремо Т., Кнауф С. и др. Мыши C3H / HeJ, несущие мутацию toll-подобного рецептора 4, защищены от развития инсулинорезистентности в белой жировой ткани в ответ на диету с высоким содержанием жиров. Diabetologia. (2007) 50: 1267–76. DOI: 10.1007 / s00125-007-0654-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Луч Э., Кузен Б., Гариду Л., Серино М., Вагет А., Барро С. и др. Метаболическая эндотоксемия напрямую увеличивает пролиферацию предшественников адипоцитов в начале метаболических заболеваний через CD14-зависимый механизм. Mol Metab. (2013) 2: 281–91. DOI: 10.1016 / j.molmet.2013.06.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Пайпер М.С., Саад Р.Дж. Сахарный диабет и Cclon. Curr Treat Options Gastroenterol. (2017) 15: 460–74. DOI: 10.1007 / s11938-017-0151-1
CrossRef Полный текст | Google Scholar
104. Аларкон К., Боланд Б. Б., Учизоно Ю., Мур П. С., Петерсон Б., Раджан С. и др. Адаптивная пластичность β-клеток поджелудочной железы при ожирении увеличивает выработку инсулина, но отрицательно влияет на секреторную функцию. Диабет. (2016) 65: 438–50. DOI: 10.2337 / db15-0792
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Рандерия С.Н., Томсон Г.Дж., Нелл Т.А., Робертс Т., Преториус Э. Воспалительные цитокины при сахарном диабете 2 типа как способствующие гиперкоагуляции и аномальное образование тромбов. Cardiovasc Diabetol. (2019) 18:72. DOI: 10.1186 / s12933-019-0870-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107.Hotamisligil GS, Arner P, Caro JF, Atkinson RL, Spiegelman BM. Повышенная экспрессия фактора некроза опухоли-α в жировой ткани при ожирении и инсулинорезистентности человека. J Clin Invest. (1995) 95: 2409–15. DOI: 10.1172 / JCI117936
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Ян С.Т., Цзя Дж.Х., Лв XF, Шао Ю.Х., Инь С.Н., Чжан XG и др. Гликемический контроль и комплексный контроль метаболических факторов риска у пожилых людей с диабетом 2 типа. Exp Gerontol. (2019) 127: 110713. DOI: 10.1016 / j.exger.2019.110713
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Маскаринек Г., Садакане А., Сугияма Х., Бреннер А., Тацукава Ю., Грант Е. Диабет 2 типа, ожирение и риск рака груди среди японских женщин из когорты выживших после атомной бомбы. Cancer Epidemiol. (2019) 60: 179–84. DOI: 10.1016 / j.canep.2019.04.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. Ли С., Лейси М.Э., Янкович М., Корреа А., Ву WC.Связь между фенотипами ожирения и инсулинорезистентностью и риском диабета 2 типа у афроамериканцев: исследование сердца Джексона. J Clin Transl Endocrinol. (2020) 19: 100210. DOI: 10.1016 / j.jcte.2019.100210
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112. Hotamisligil GkS, Peraldi P, Budavari A, Ellis R, White MF, Spiegelman BM. IRS-1-опосредованное ингибирование активности тирозинкиназы рецептора инсулина при резистентности к инсулину, индуцированной TNF-альфа и ожирением. Наука. (1996) 271: 665–70. DOI: 10.1126 / science.271.5249.665
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Schertzer JD, Tamrakar AK, Magalhães JG, Pereira S, Bilan PJ, Fullerton MD, et al. Активаторы NOD1 связывают врожденный иммунитет с инсулинорезистентностью. Диабет. (2011) 60: 2206–15. DOI: 10.2337 / db11-0004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Rakotoarivelo V, Lacraz G, Mayhue M, Brown C, Rottembourg D, Fradette J, et al.Профили воспалительных цитокинов во висцеральной и подкожной жировой ткани у пациентов с ожирением, перенесших бариатрическую операцию, показывают отсутствие корреляции с ожирением или диабетом. EBioMedicine. (2018) 30: 237–47. DOI: 10.1016 / j.ebiom.2018.03.004
CrossRef Полный текст | Google Scholar
116. de Souza PR, Guimarães FR, Sales-Campos H, Bonfá G, Nardini V, Chica JEL, et al. Отсутствие рецептора NOD2 предрасполагает к воспалению кишечника из-за нарушения регуляции иммунного ответа у хозяев, которые не могут контролировать дисбактериоз кишечника. Иммунобиология. (2018) 223: 577–85. DOI: 10.1016 / j.imbio.2018.07.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Дену Е., Лольмед К., Гариду Л., Поми С., Чабо С., Лау Т.С. и др. Нарушение восприятия пептидогликана NOD 2 способствует воспалению, дисбактериозу и инсулинорезистентности, вызванному диетой. EMBO Mol Med. (2015) 7: 259–74. DOI: 10.15252 / emmm.201404169
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118.Muegge BD, Kuczynski J, Knights D, Clemente JC, González A, Fontana L, et al. Диета способствует сближению функций микробиома кишечника в филогенезе млекопитающих и в организме человека. Наука. (2011) 332: 970–4. DOI: 10.1126 / science.1198719
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Накадзима А., Накатани А., Хасегава С., Ирие Дж., Одзава К., Цудзимото Г. и др. Рецептор короткоцепочечных жирных кислот GPR43 регулирует воспалительные сигналы в макрофагах М2-типа жировой ткани. PLoS ONE. (2017) 12: e0179696. DOI: 10.1371 / journal.pone.0179696
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кишечные микробы и заболевания пищеварительной системы у собак
Ян С. Суходольски, MedVet, DrVetMed, PhD, AGAF, DACVM
Texas A&M University
Микробиота кишечника состоит из вирусов, бактерий, грибов и простейших. В прошлом для описания этой сложной экосистемы использовалось слово микрофлора , но более подходящим термином является микробиота (от — bios , «живые организмы»).Микробиом — это коллективный геном всех этих микробов. На сегодняшний день большинство исследований сосредоточено на бактериальной микробиоте, которая, по оценкам, составляет подавляющее большинство кишечной микробиоты.
По оценкам, в кишечнике присутствует 100 триллионов микробных клеток, что в 10 раз превышает количество клеток млекопитающих во всем организме. В совокупности количество микробных генов превышает количество генов хозяина примерно в 10 раз.
Эта сложная экосистема кишечных бактерий оказывает огромное влияние на здоровье хозяина.Взаимодействия между бактериями и хозяином опосредуются через прямой контакт между микробами и иммунной системой и через различные метаболиты микробиоты. Физиологический микробиом модулирует иммунную систему, защищает от энтеропатогенов и обеспечивает питательные свойства хозяина.
И наоборот, изменения сложных взаимоотношений между кишечными бактериями и клетками-хозяевами влияют на иммунные ответы и метаболический статус хозяина и могут привести к заболеванию (, рис. 1, ).Недавние исследования описали дисбактериоз кишечника (т.е. изменения в составе и / или разнообразии кишечной микробиоты) при различных острых и хронических желудочно-кишечных (ЖКТ) расстройствах. 1 Кроме того, первоначальные данные на моделях человека и животных связывают хронический дисбактериоз, например, вызванный воздействием антибиотиков, с внекишечными расстройствами, такими как диабет и ожирение. 2,3 Эти данные подчеркивают важность кишечной микробиоты и дисбактериоза в регуляции метаболизма хозяина, причем эффекты выходят далеко за пределы желудочно-кишечного тракта.
Паттерны дисбактериоза и метаболические признаки, наблюдаемые при острых и хронических заболеваниях желудочно-кишечного тракта и метаболическом синдроме, только начинают описываться. Признаки дисбактериоза и метаболические изменения оцениваются на предмет их диагностического и терапевтического потенциала. В этой статье представлен обзор бактерий в кишечнике собак и роль дисбактериоза в этиологии заболеваний желудочно-кишечного тракта.
Рис. 1. Взаимодействие между кишечной микробиотой, иммунной системой и метаболизмом хозяина.(A) В здоровом кишечнике существует правильное пространственное расположение между очень многочисленной микробиотой просвета, эпителием и иммунными клетками (дендритными клетками, лимфоцитами, макрофагами, нейтрофилами), которые присутствуют в небольшом количестве. Микробиота обеспечивает иммуномодулирующие стимулы для иммунной системы, метаболизирует и сбраживает сложные углеводы в полезные короткоцепочечные жирные кислоты (SCFA). Эти SCFA обеспечивают энергией эндотелиальные клетки, обладают противовоспалительным действием и регулируют перистальтику кишечника.Нормальная микробиота также превращает первичные желчные кислоты во вторичные желчные кислоты, которые также обладают противовоспалительным действием, индуцируют глюкагоноподобный пептид 1 (который, в свою очередь, увеличивает инсулин) и уменьшают, например, споруляцию Clostridium difficile. (B) В болезненном состоянии, независимо от первопричины, снижение выработки антимикробных пептидов и слизи приводит к увеличению кишечной проницаемости и транслокации бактерий. Врожденные иммунные рецепторы, такие как Toll-подобные рецепторы на макрофагах и других иммунных клетках, распознают определенные патоген-ассоциированные молекулярные паттерны из-за дисбактериоза (например, липополисахариды в стенках бактериальных клеток) и запускают воспалительные реакции.Макрофаги фагоцитируют микробы, вызывая также иммунные реакции, которые могут привести к окислительному стрессу. Окислительный стресс, в свою очередь, может вызвать дисбактериоз кишечника.
РЕДКАЯ ПОРОДА
У каждой собаки есть уникальное микробное сообщество с отчетливыми различиями в пропорциях этих бактериальных групп. Тем не менее, содержание бактериальных генов сохраняется у разных людей, что позволяет предположить, что функциональные аспекты микробиома у разных животных схожи. Индивидуальные различия между видами микробов могут вызывать индивидуальные реакции на разные диеты, источники клетчатки и пробиотики.
МИКРОБИОТА КИШЕЧНИКА В ЗДОРОВЬЕ
Идентификация и компоненты
До недавнего времени идентификация кишечных бактерий почти всегда осуществлялась с использованием традиционных бактериальных культур. Культура фекалий может быть полезна для обнаружения специфических энтеропатогенов, таких как Salmonella или Campylobacter jejuni , поскольку этот подход позволяет проводить испытания клинических образцов на чувствительность к антибиотикам, но подавляющее большинство кишечных бактерий являются анаэробами и не поддаются обнаружению с помощью стандартные методы выращивания.Таким образом, рутинный бактериальный посев не позволяет детально охарактеризовать сложные кишечные бактериальные сообщества (, рис. 2, ). В настоящее время для характеристики кишечной микробиоты используется ряд молекулярных методов. 4
Традиционные бактериальные культуры, а также молекулярные подходы выявили различия в типах и количестве бактерий в желудочно-кишечном тракте. Количество бактерий в двенадцатиперстной кишке здоровых собак колеблется от 10 2 до 10 9 колониеобразующих единиц (КОЕ) / г. 5 В толстой кишке находятся гораздо более высокие значения, до 10 11 КОЕ / г. 6
Молекулярные инструменты позволили идентифицировать ранее не культивируемые и, следовательно, неизвестные бактерии. В то время как в двенадцатиперстной кишке обитает смесь аэробных и факультативных анаэробных бактерий, толстая кишка почти исключительно колонизирована строгими анаэробами. 7 Бактериальные группы Clostridiaceae, Bacteroidaceae, Prevotellaceae и Fusobacteriaceae преобладают в толстом кишечнике ( Рисунок 2 ).Следует отметить, что у каждой собаки есть уникальное микробное сообщество с отчетливыми различиями в пропорциях этих бактериальных групп. Тем не менее, содержание бактериальных генов сохраняется у разных людей, что позволяет предположить, что функциональные аспекты микробиомов у разных животных схожи. 8 Тем не менее, индивидуальные различия между видами микробов могут вызывать индивидуальные реакции на разные диеты, источники клетчатки и пробиотики.
Желудочно-кишечный тракт также является домом для разнообразной популяции вирусов и грибов.Одно исследование описало до 40 видов грибов в образцах фекалий собак; большинство из них были различными Candida spp. 9 На основании этих результатов ожидается, что грибковые организмы будут обнаружены в обычных мазках фекалий. Их точный вклад в здоровье и болезнь остается неясным, поскольку при сравнении здоровых собак с собаками с острой диареей не сообщалось о каких-либо существенных различиях в типах грибов.
Рисунок 2. Преобладающие таксоны бактерий в образцах кала здоровых собак.Каждая полоса соответствует одной здоровой собаке. Обратите внимание, что представленные семейства бактерий широко варьируются, преобладают анаэробные бактерии, и соотношение этих бактериальных групп различается у каждой здоровой собаки. Обычная бактериальная культура пропускает эти анаэробные бактерии. Мазки кала, которые оценивают соотношение грамположительных и грамотрицательных бактерий, также бесполезны для оценки дисбактериоза, поскольку каждая собака имеет уникальное соотношение этих групп.
Роли
Сбалансированный микробиом имеет решающее значение для поддержания здоровья хозяина.Нормальная микробиота выполняет следующие функции:
- Модулирует иммунную систему
- Контролирует проникновение энтеропатогенов
- Обеспечивает хозяина питательными веществами путем метаболизма и ферментации различных пищевых компонентов
Кишечные бактерии также способствуют развитию физиологии кишечника. Это было продемонстрировано в исследованиях на выращенных без микробов мышах, у которых обнаружена измененная архитектура эпителия (например, уменьшенное количество лимфоидных фолликулов) по сравнению с мышами, подвергшимися воздействию бактерий при рождении.
Постоянные перекрестные помехи между кишечной микробиотой и иммунными клетками хозяина опосредуются комбинацией метаболитов микробного происхождения (например, короткоцепочечных жирных кислот [SCFA], индола, вторичных желчных кислот), а также молекул на поверхности бактерий, которые активируют рецепторы врожденной иммунной системы хозяина (например, Toll-подобные рецепторы, дендритные клетки).
Комменсальные бактерии, которые предотвращают вторжение в слизистую оболочку транзиторных патогенов за счет конкуренции за питательные вещества и места адгезии эпителия, являются важной частью кишечного барьера.Кроме того, они создают физиологически ограничивающую среду для нерезидентных видов бактерий за счет секреции антимикробных соединений и модуляции pH в просвете.
Основные группы бактерий в кишечнике — это строгие или факультативные анаэробы. Преобладающие семейства бактерий в толстом кишечнике (, рис. 2, ) ферментируют пищевые углеводы (например, крахмал, целлюлозу, пектин, инулин), что приводит к образованию SCFA (например, ацетата, пропионата, бутирата) и других метаболитов.SCFA являются важным источником энергии и факторов роста для эпителиальных клеток кишечника и оказывают модулирующее влияние на перистальтику кишечника. Кроме того, SCFA обладают иммуномодулирующими свойствами. Например, бутират индуцирует иммунорегуляторные Т-клетки, а ацетат благотворно модулирует кишечную проницаемость.
Новая область исследований направлена на лучшее описание биологических функций дополнительных метаболитов бактериального происхождения, которые недавно были признаны регуляторами здоровья хозяина, таких как индол и вторичные желчные кислоты.Например, диетический триптофан метаболизируется бактериями в индол, который, как было показано, снижает экспрессию интерлейкина-8, усиливает барьерную функцию кишечника и улучшает энтеропатию, вызванную приемом нестероидных противовоспалительных препаратов у мышей. 10 Некоторые виды бактерий в толстой кишке превращают первичные желчные кислоты во вторичные желчные кислоты (например, литохолевую и дезоксихолевую кислоты). Следовательно, вторичные желчные кислоты присутствуют в толстой кишке в гораздо более высоких концентрациях, чем первичные желчные кислоты.Такая высокая концентрация вторичных желчных кислот в толстой кишке полезна, поскольку эти кислоты являются важным регулятором гомеостаза хозяина за счет активации различных рецепторов по всему телу. Например, специфический для желчных кислот мембранный рецептор TGR5 экспрессируется в желчном пузыре, в эпителии желчных протоков, на моноцитах и макрофагах, а также в клетках мышц, почек, поджелудочной железы и кишечника. Активация этих рецепторов, к которым вторичные желчные кислоты имеют самое высокое сродство, подавляет экспрессию провоспалительных цитокинов и модулирует метаболизм инсулина и глюкозы за счет активации глюкагоноподобного пептида 1. 11
Вторичные желчные кислоты также подавляют прорастание спор Clostridium difficile , тогда как увеличение количества первичных желчных кислот (эффект дисбактериоза) способствует прорастанию спор бактерий. Дисбактериоз кишечника приводит к снижению видов бактерий, превращающих желчные кислоты, и, следовательно, связан с дисметаболизмом желчных кислот (снижение вторичных и увеличение первичных желчных кислот) и потенциально системными эффектами на метаболизм хозяина. 12,13 Кроме того, аномальное увеличение первичных желчных кислот может вызвать секреторную диарею.
ДИСБИОЗ
Дисбактериоз кишечника определяется как различия в соотношении бактериальных групп по сравнению с таковыми у здоровых собак и часто сопровождается сокращением видового разнообразия. Сообщалось о дисбактериозе кишечника при различных острых и хронических расстройствах желудочно-кишечного тракта, но он также может быть вызван применением антибиотиков широкого спектра действия. 1
Значение микробиоты кишечника в регуляции иммунитета и метаболизма хозяина ( Рис. 1 ) означает, что дисбиотический микробиом может иметь негативные последствия для хозяина.Однако степень клинических признаков у разных людей разная. Например, введение метронидазола здоровым собакам вызывало серьезные изменения в микробиоте кишечника с уменьшением количества комменсальных анаэробных бактерий и одновременным увеличением количества Escherichia coli ; эти изменения сопровождались обширными изменениями метаболических путей в просвете кишечника (например, усилением окислительного стресса, снижением вторичных желчных кислот). 14 У девяти из 16 собак на фоне приема антибиотиков развился жидкий стул, но у остальных собак не было никаких клинических признаков, несмотря на аналогичные микробные и биохимические изменения.Это говорит о том, что клинические признаки зависят от взаимодействия множества микробных факторов и факторов хозяина, некоторые из которых (например, лежащая в основе генетическая предрасположенность хозяина, пищевые и экологические триггеры) еще предстоит выяснить. Тем не менее, дисбактериоз, вызванный антибиотиками, является примером того, как изменения микробного состава и метаболизма могут повлиять на здоровье хозяина, поскольку вызванный антибиотиками дисбиоз в раннем детстве или повторная пульс-терапия признаны фактором риска развития аллергии, ожирения и воспалительных процессов. заболевание кишечника у человека. 3,15
Новые эпидемиологические данные о людях и наше развивающееся понимание иммуномодулирующих и метаболических свойств кишечной микробиоты предполагают, что правильная диагностика и коррекция дисбактериоза будут важными целями при различных заболеваниях. Дисбиотический микробиом может причинить вред через несколько механизмов (, вставка 1, ), которые, вероятно, действуют одновременно. Диарея может быть вызвана бактериальными энтеротоксинами, которые стимулируют секрецию слизистой оболочки. Еще одним недавно признанным механизмом диареи у людей является мальабсорбция желчных кислот из-за неспособности дисбиотической микробиоты преобразовывать первичные желчные кислоты во вторичные. 13 Первоначальные исследования показывают, что такой механизм также может встречаться у собак, и требует дальнейшего изучения. 12,16
КОРОБКА 1
Последствия дисбактериоза
- Избыточное производство и перемещение бактериальных токсинов
- Воспалительная стимуляция иммунной системы
- Снижение противовоспалительных метаболитов (например, SCFA, индолов, вторичных желчных кислот)
- Изменения ферментов щеточной каймы
- Повреждение рецепторов слизистой оболочки
- Конкуренция за питательные вещества (например, витамин B12)
- Повышенная кишечная проницаемость
Оценка дисбактериоза
Из-за важности комменсальной микробиоты для поддержания гомеостаза важно диагностировать дисбактериоз.Как уже отмечалось, бактериальный посев кала не может охарактеризовать многие анаэробы в желудочно-кишечном тракте. По оценкам, только очень небольшой процент кишечных бактерий можно культивировать с помощью стандартных лабораторных методов. Лучший способ полностью охарактеризовать микробиоту — это платформы высокопроизводительного секвенирования, которые могут обеспечить обзор пропорций всех бактериальных групп в образце; однако стоимость и длительные сроки выполнения ограничивают использование этого метода для исследовательских исследований. Использование анализов полимеразной цепной реакции (ПЦР) для нацеливания на определенные бактериальные таксоны, которые постоянно изменяются у собак с хроническими энтеропатиями (ХЭ), может обеспечить более быстрые результаты. 1
Результаты этих множественных ПЦР-анализов можно объединить и выразить в виде математического соотношения, индекса дисбактериоза (DI; , рис. 3, ). Отрицательный DI (<0) указывает на нормальную микробиоту, тогда как положительный DI (> 0) указывает на дисбактериоз, связанный с CE. 17 Затем DI можно использовать для мониторинга реакции микробиоты на терапию CE. Первоначальные долгосрочные последующие исследования на собаках с CE показывают, что микробиому требуется несколько месяцев для нормализации, даже если собаки реагируют в течение нескольких недель снижением показателей клинической активности. 18
Недавнее небольшое исследование, в котором оценивали 3 собак с CE, использовало DI для мониторинга микробных изменений фекалий в ответ на трансплантацию фекальных микробов. 19 Все 3 собаки первоначально показали немедленное снижение DI, но через 3 недели дисбактериоз вернулся у 1 собаки (увеличение DI выше 2), при этом клинические признаки не улучшились. У оставшихся 2 собак наблюдалось частичное улучшение клинических признаков, и их DI оставался ниже 0 в течение большей части 8-недельного периода наблюдения.Этот первоначальный небольшой набор данных предполагает возможность мониторинга микробиоты с течением времени у пациентов с КЭ и после трансплантации фекальных микробов, но необходимы дополнительные исследования для определения точности и клинической применимости анализа микробиоты.
Анализ образцов кала дает информацию только об изменениях микробиоты просвета. Использование флуоресцентной гибридизации in-situ (FISH) образцов кишечной биопсии позволяет визуализировать, переместились ли бактерии в эпителий слизистой оболочки, как это наблюдается у собак с гранулематозным колитом. 20 Положительный результат указывает на необходимость антимикробной терапии для удаления перемещенных бактерий. FISH требует специального анализа и доступен только в нескольких справочных лабораториях.
Хотя оценка микробиоты кала полезна для распознавания дисбактериоза в толстом кишечнике, образцы кала, вероятно, не точно отражают ситуацию в тонком кишечнике. Хотя образцы фекалий многих собак с заболеванием тонкого кишечника показывают дисбактериоз, у подгруппы собак может быть дисбактериоз исключительно тонкого кишечника.Измерения сывороточных концентраций кобаламина и фолиевой кислоты остаются наиболее полезными маркерами дисбактериоза тонкого кишечника. У собак с дисбактериозом тонкого кишечника может быть снижено содержание кобаламина в сыворотке крови и может повыситься концентрация фолиевой кислоты в сыворотке; изменение обоих параметров очень указывает на состояние.
Недавние исследования оценили связь между дисбиозом и изменениями в различных биохимических путях (например, аномальный метаболизм желчных кислот, аминокислот и триптофана), которые влияют на иммунную систему и метаболизм хозяина. 18,21 Многие новые метаболические биомаркеры, такие как концентрации фекальных желчных кислот, исследуются для лучшей оценки этиологии и лечения заболеваний ЖКТ, и вскоре они могут стать полезными в повседневной практике.
Рис. 3. Индекс дисбактериоза (DI) повышен у собак с хроническими энтеропатиями (CE). DI — это математическое соотношение, которое суммирует численность различных бактериальных групп (например, E coli, Faecalibacterium, Blautia, Fusobacterium) в одно число.DI ниже 0 указывает на нормальную микробиоту, а DI выше 0 указывает на дисбактериоз в толстой кишке. Анализ DI коммерчески доступен в желудочно-кишечной лаборатории Техасского университета A&M.
Рекомендации по коррекции дисбактериоза
Микробиота играет важную роль в метаболизме организма. Недавние метаболомические исследования четко связали дисбактериоз с различными заболеваниями желудочно-кишечного тракта и за его пределами. Однако требуется дополнительная работа, чтобы определить, как модулировать микробиом для наилучшего терапевтического успеха и предсказать ответ на конкретную терапию.
Диета и противомикробная терапия
Дисбактериоз присутствует у многих собак с CE и может быть причиной диареи у некоторых пациентов, но дисбактериоз также может быть следствием воспаления желудочно-кишечного тракта у других пациентов. Вероятен градиент различных паттернов заболевания у разных пациентов, причем иммунная система хозяина и микробиом вносят свой вклад в разной степени. Следовательно, наличие дисбактериоза не означает немедленной необходимости в антимикробной терапии, поскольку собаки с чувствительной к диете CE также могут иметь дисбактериоз.Некоторые животные с диареей благоприятно реагируют на противомикробные препараты, но антибиотики могут вызывать диарею у других. Длительное введение антибиотиков может вызывать паттерны дисбактериоза, которые могут стать фактором риска различных метаболических заболеваний, например, из-за индукции дисметаболизма желчных кислот. 3 В настоящее время лучшим терапевтическим подходом к лечению хронических заболеваний желудочно-кишечного тракта остается эмпирический подход с последовательным протоколом испытаний пищевых продуктов, противовоспалительных и / или противомикробных препаратов.
Пробиотики и пребиотики
Поскольку микробиота участвует в патофизиологии хронического желудочно-кишечного заболевания, может оказаться целесообразным добавление пробиотической и пребиотической терапии.Пробиотики — это живые микроорганизмы, которые при введении в достаточном количестве приносят пользу здоровью хозяина. В нескольких исследованиях оценивалась польза пробиотиков при острых и хронических заболеваниях желудочно-кишечного тракта. Данные свидетельствуют о том, что пробиотики оказывают лишь незначительное влияние на кишечную микробиоту, но их положительный эффект у собак с воспалительным заболеванием кишечника может быть частично связан с иммунной стимуляцией и / или усилением функции кишечного барьера. 22 Кроме того, похоже, что введение более высоких доз и нескольких штаммов приводит к более высокой вероятности того, что пробиотические бактерии смогут колонизировать кишечник.
Пребиотики — это ферментируемые и неферментируемые волокна, которые после достижения толстой кишки метаболизируются кишечными бактериями с образованием SCFA и других метаболитов, которые могут иметь иммуномодулирующее действие. Большинство коммерческих диет для кишечника содержат пребиотики.
Трансплантация фекальных микробов
Трансплантация фекальных микробов вызвала большой интерес. Хотя это очень успешный терапевтический подход у людей с рецидивирующим заболеванием C difficile , его использование при КЭ у собак требует дальнейшего изучения, поскольку патофизиология этих заболеваний различается.Неофициальные данные и мелкомасштабные исследования предполагают, что трансплантация фекальных микробов может быть многообещающей у подгруппы собак с CE, 19 , но в настоящее время правильный отбор пациентов является чисто эмпирическим и требуются дополнительные исследования.
Ян С. Суходольски, MedVet, DrVetMed, PhD, AGAF, DACVM, получил степень ветеринара в Университете ветеринарной медицины в Вене, Австрия, и докторскую степень по ветеринарной микробиологии в Техасском университете A&M. Он сертифицирован по иммунологии Американским колледжем ветеринарных микробиологов (ACVM) и в настоящее время является адъюнкт-профессором и заместителем директора по исследованиям в Лаборатории желудочно-кишечного тракта Техасского A&M.Его исследования сосредоточены на тестировании функций желудочно-кишечного тракта и микробной экологии кишечника, с акцентом на пробиотические и диетические вмешательства в качестве терапевтического применения у животных с воспалительными заболеваниями кишечника, ожирением и сахарным диабетом.
Ссылки
- Honneffer JB, Minamoto Y, Suchodolski JS. Изменения микробиоты при остром и хроническом воспалении желудочно-кишечного тракта у кошек и собак. World J Gastroenterol 2014; 20: 16489-16497.
- Саари А., Вирта Л.Дж., Санкилампи У. и др.Воздействие антибиотиков в младенчестве и риск ожирения в первые 24 месяца жизни. Педиатрия 2015; 135: 617-626.
- Vrieze A, Out C, Fuentes S, et al. Влияние перорального ванкомицина на микробиоту кишечника, метаболизм желчных кислот и чувствительность к инсулину. Дж. Hepatol 2014; 60: 824-831.
- Suchodolski JS. Диагностика и интерпретация дисбактериоза кишечника у собак и кошек. Vet J 2016; DOI: 10.1016 / j.tvjl.2016.04.011
- Немецкий AJ, Day MJ, Ruaux CG и др.Сравнение прямых и непрямых тестов на избыточный бактериальный рост в тонком кишечнике и антибиотикочувствительную диарею у собак. J Vet Intern Med 2003; 17: 33-43.
- Mentula S, Harmoinen J, Heikkilä M и др. Сравнение культивируемых микробиот тонкого кишечника и фекалий у гончих. Appl Environ Microbiol 2005; 71: 4169-4175.
- Suchodolski JS, Camacho J, Steiner JM. Анализ бактериального разнообразия в двенадцатиперстной кишке, тощей кишке, подвздошной и толстой кишке собак с помощью сравнительного анализа гена 16S рРНК. FEMS Microbiology Ecology 2008; 66: 567-578.
- Guard BC, Suchodolski JS. Симпозиум по видам лошадей — микробиология и метагеномика кишечника собак: от филогении к функции. J Anim Sci 2016; 94: 2247-2261.
- Фостер М.Л., Дауд С.Е., Стивенсон С. и др. Характеристика грибкового микробиома (микобиома) в образцах фекалий собак. Vet Med Int 2013; 2013: 658373.
- Whitfield-Cargile CM, Cohen ND, Chapkin RS, et al. Полученный из микробиоты метаболит индол уменьшает воспаление и повреждение слизистой оболочки на мышиной модели энтеропатии, связанной с НПВП. Кишечные микробы 2016; 7: 246-261.
- Павлидис П., Пауэлл Н., Винсент Р.П. и др. Систематический обзор: желчные кислоты и воспаление кишечника — агрессоры просвета или регуляторы защиты слизистой оболочки? Aliment Pharmacol Ther 2015; 42: 802-817.
- Honneffer J, Guard B, Steiner JM, et al. Mo1805 Ненаправленная метаболомика выявляет нарушение метаболических путей желчных кислот, холестерина и триптофана у собак с идиопатическим воспалительным заболеванием кишечника. Гастроэнтерология 2015; 148: S-715 (аннотация).
- Duboc H, Rajca S, Rainteau D и др. Соединение дисбактериоза, дисметаболизма желчных кислот и воспаления кишечника с воспалительными заболеваниями кишечника. Кишечник 2013; 62: 531-539.
- Suchodolski JS, Olson E, Honneffer J, et al. Влияние диеты с гидролизованным белком и метронидазола на фекальный микробиом и метаболом у здоровых собак. J Vet Intern Med 2016; 30: 1455 (аннотация).
- Cox LM, Blaser MJ. Антибиотики в молодости и ожирении. Нат Рев эндокринол 2015; 11: 182-190.
- Kent AC, Cross G, Taylor DR, et al. Измерение сывороточного 7альфа-гидрокси-4-холестен-3-она как маркера мальабсорбции желчных кислот у собак с хронической диареей: пилотное исследование. Vet Rec Open 2016; 3: e000163.
- Alshawaqfeh M, Guard M, Minamoto Y, et al. Индекс дисбактериоза для оценки микробных изменений в образцах кала собак с хронической энтеропатией. J Vet Intern Med 2016; 30: 1536 (аннотация).
- Minamoto Y, Otoni CC, Steelman SM, et al. Изменение фекальной микробиоты и профилей метаболитов в сыворотке крови у собак с идиопатическим воспалительным заболеванием кишечника. Кишечные микробы 2015; 6: 33-47.
- Гербек З. Оценка терапевтического потенциала восстановления гомеостаза желудочно-кишечного тракта с помощью трансплантации фекальной микробиоты у собак. Магистерская работа: Университет Любляны, Словения, 2016.
- Симпсон К.В., Доган Б., Ришнив М. и др. Прилипшая и инвазивная инфекция Escherichia coli связана с гранулематозным колитом у собак-боксеров. Infect Immun 2006; 74: 4778-4792.
- Guard BC, Barr JW, Reddivari L, et al.Характеристика микробного дисбактериоза и метаболических изменений у собак с острой диареей. PLoS ONE 2015; 10: e0127259.
- Росси Г., Пенго Г., Калдин М. и др. Сравнение микробиологических, гистологических и иммуномодулирующих параметров в ответ на лечение комбинированной терапией преднизоном и метронидазолом или пробиотическими штаммами VSL # 3 у собак с идиопатическим воспалительным заболеванием кишечника. Plos ONE 2014; 9: e94699.
питательных веществ | Бесплатный полнотекстовый | Дисбиоз кишечной микробиоты, вызванный диетой, и его влияние на иммунитет и заболевания
Влияние диеты на состав микробиоты было продемонстрировано во время начальной фазы колонизации: младенцы, вскармливаемые грудью, имеют более высокие уровни Bifidobacteria spp.в то время как у младенцев, вскармливаемых смесью, более высокий уровень Bacteroides spp., а также повышенный уровень Clostridium coccoides и Lactobacillus spp. [44]. Предполагалось, что после послеродового периода микробиота будет относительно стабильной на протяжении всей жизни. Однако несколько недавних исследований показали, что диетические факторы изменяют микробное сообщество, что приводит к биологическим изменениям в организме хозяина (таблица 1). Фактически, состав микробиоты кишечника сильно коррелирует с диетой, что продемонстрировано исследованием, оценивающим относительный вклад генетики и диеты хозяина в формирование микробиоты кишечника и модулирование фенотипов метаболического синдрома у мышей.У мышей, получавших диету с высоким содержанием жиров, наблюдается много ключевых изменений популяции кишечника, таких как отсутствие защитных барьеров кишечника Bifidobacteria spp. В целом, диетические изменения могут объяснить 57% общих структурных вариаций микробиоты кишечника, тогда как генетические изменения составляют не более 12% [45]. Это указывает на то, что диета играет доминирующую роль в формировании микробиоты кишечника, а изменение ключевых групп населения может превратить здоровую микробиоту кишечника в организм, вызывающий заболевание. Например, «западная» диета с высоким содержанием сахара и жира вызывает дисбактериоз, который влияет как на метаболизм желудочно-кишечного тракта хозяина, так и на иммунный гомеостаз [46].Это было смоделировано в модели гуманизированных мышей, где фекальная микробиота взрослого человека была трансплантирована мышам GF. Мышей кормили диетой с низким содержанием жиров, богатой полисахаридами растений, и при переходе на «западную» диету состав микробиоты перешел на чрезмерный рост Firmicutes, включая Clostridium innocuum, Eubacterium dolichum, Catenibacterium mitsuokai и Enterococcus spp., А также Enterococcus spp., А также значительное сокращение нескольких видов Bacteroides spp. [18]. У мышей диета с пониженным содержанием углеводов приводит к обогащению популяций бактерий типа Bacteroidetes [47], а диета с ограничением калорийности предотвращает рост Clostridium coccoides, Lactobacillus spp.и Bifidobacteria spp., которые являются основными продуцентами бутирата, необходимыми для гомеостаза колоноцитов [48]. Диеты, богатые сложными углеводами, содержат меньше патогенных видов, таких как Mycobacterium avium подвидов paratuberculosis и Enterobacteriaceae [49], чем диеты с более высоким содержанием жира или белка [48,50,51,52]. Сложные углеводы также повышают уровень полезных бифидобактерий. такие как B. longum подвидов longum, B. breve и B. thetaiotaomicron [53]. С другой стороны, рафинированный сахар способствует чрезмерному росту условно-патогенных бактерий, таких как C.difficile [54] и C. perfringens за счет увеличения выхода желчи [55]. Вегетарианство изменяет кишечную микробиоту у людей, потому что большое количество клетчатки приводит к увеличению производства короткоцепочечных жирных кислот микробами, что снижает рН кишечника. Это предотвращает рост потенциально патогенных бактерий, таких как кишечная палочка и другие представители Enterobacteriaceae [56]. Интересно, что было обнаружено, что европейские дети имеют микробиоту, обедненную Bacteroidetes и обогащенную Enterobacteriaceae, по сравнению с африканскими детьми, проживающими в сельской местности, что авторы объясняют низким потреблением пищевых волокон европейцами [57].Хотя это еще не продемонстрировано на людях, было высказано предположение, что материнский рацион может влиять на микробиоту потомства. Диета с высоким содержанием жиров (44% сгущенного молока и 8% кукурузного масла), которую скармливали крысам и передавали их грудным детенышам с грудным молоком, вызвала специфические микробные изменения в отпечатках микробиоты их щенков, такие как увеличение популяции Lactobacillus spp. и Enterococcus spp. и истощенные Bacteroides spp. и Prevotella spp. [58]. Другие исследования, проведенные на мышах, показали, что диета с высоким содержанием жиров, богатая сафлоровым маслом, полиненасыщенной жирной кислотой омега-6 (ПНЖК), снижает количество Bacteroidetes, одновременно обогащая популяции Firmicutes, Actinobacteria и Proteobacteria [59,60].Авторы показали, что потребление сафлорового масла стимулировало рост δ-протеобактерий за счет усиления бактериальных генов, отвечающих за хемотаксис и развитие жгутиков, давая им конкурентное преимущество перед другими группами бактерий, колонизирующими ЖКТ [61]. Однако другое исследование показало, что диета, богатая насыщенными (молочными) жирами, а не сафлоровым маслом, вызвала рост δ-протеобактерий, в частности Bilophila wadsworthia, в слепой кишке [62]. Эти противоречивые наблюдения могут быть результатом исследуемой области желудочно-кишечного тракта, поскольку слепая кишка и толстая кишка различаются как по микробной среде обитания, так и по функциям.Таким образом, нельзя сделать вывод о преимуществах сафлорового масла над молочным жиром только на основании этих двух исследований. Микробные изменения в желудочно-кишечном тракте оказывают глубокое влияние на воспалительные и метаболические реакции организма. Например, богатая белком диета увеличивает активность бактериальных ферментов, таких как β-глюкуронидаза, азоредуктаза и нитроредуктаза, которые продуцируют токсичные метаболиты, вызывающие воспалительные реакции [63]. Из-за сложного баланса, который существует внутри микробиоты, изменения в одной группе или виде могут не только напрямую влиять на хозяина, но также могут разрушить все микробное сообщество.Например, представители филы Firmicutes, Actinobacteria, Verrucomicrobium и Bacteroidetes могут разлагать сложные углеводы, не всасываемые хозяином [64], а также могут подавлять рост условно-патогенных микроорганизмов, таких как Clostridium spp. и представители Enterobacteriaceae, такие как E. coli [65,66]. Дисбиоз также может изменять метаболическую активность других членов микробиоты кишечника [67].

