Хронический гепатит дельта: современное состояние проблемы и перспективы лечения. Клиническая фармакология и терапия
В 1977 г. М. Rizzetto и соавт. описали новый антиген, случайно обнаруженный методом прямой иммунофлюоресценции в ядрах гепатоцитов HBsAg (+) больных. Антитела к названному впоследствии «дельта-антигеном» белку определялись в ткани печени больных активным хроническим гепатитом/циррозом печени и отсутствовали при остром гепатите В и неактивном носительстве HBsAg [1]. В дальнейшем было установлено, что этот белок является структурным компонентом нового вируса, получившего название вируса гепатита D (HDV).
Хроническая HDV-инфекция представляет собой одно из самых тяжелых и быстропрогрессирующих заболеваний печени с высоким риском развития цирроза печени и гепатоцеллюлярной карциномы. Несмотря на большое количество исследований, посвященных этой инфекции, ряд вопросов, в первую очередь патогенез, особенности естественного течения и эффективные методы лечения HDV-инфекции, остаются от крытыми.
Строение и свойство вируса
HDV представляет собой сферическую частицу диаметром от 28 до 39 мм, покрытую поверхностным антигеном HBV (рис. 1), внутри которой находится нуклеокапсид диаметром 19 нм, содержащий РНК вируса [2]. Нуклеокапсид состоит из 60 молекул дельта-антигена, который представлен двумя формами: длинной [L] (214 аминокислот), размером 27 кДа, и короткой [S] (195 аминокислот), размером 24 кДа. Длинный антиген образуется путем присоединения дополнительных 19-20 аминокислот на уровне нуклеотида 1012 малого антигена [3]. Ген, кодирующий HDAg, был успешно клонирован с помощью обратной транскриптазы и полимеразной цепной реакции [4]. HDV-S антиген необходим для репликации вируса, в то время как HDV-L антиген, наоборот, обладает способностью подавлять репликацию, но играет ключевую роль в механизмах сборки и секреции вирусной частицы.
Рис. 1. Строение HDV
Геном РНК вируса представлен комплементарной одноцепочечной циркулярной нитью длиной в 1679 нуклеотидных оснований и является наименьшим из РНК-вирусов, поражающих человека. В геноме HDV имеется 6 открытых рамок считывания, из которых только одна рамка, участвующая в транскрипции, находится на позитивной стороне нити генома HDV RNA [5]. Ме ха низм репликации РНК вируса в своем роде уникальный и происходит путем так называемого симметричного двойного повторяющегося цикла (рис. 2). В процессе репликации в клетке присутствуют три формы вирусной РНК: геномная РНК (отрицательной полярности), антигеномная РНК (положительной полярности) и информационная РНК, наименьшая по размеру (примерно 900 нуклеотидов), которая содержит открытую рамку считывания для синтеза антигенов вируса. Репликация HDV автономна от HBV, но, будучи вирусом-сателлитом, HDV использует HBsAg для сборки вириона, секреции из гепатоцита и инфицирования других гепатоцитов.
В геноме HDV имеется 6 открытых рамок считывания, из которых только одна рамка, участвующая в транскрипции, находится на позитивной стороне нити генома HDV RNA [5]. Ме ха низм репликации РНК вируса в своем роде уникальный и происходит путем так называемого симметричного двойного повторяющегося цикла (рис. 2). В процессе репликации в клетке присутствуют три формы вирусной РНК: геномная РНК (отрицательной полярности), антигеномная РНК (положительной полярности) и информационная РНК, наименьшая по размеру (примерно 900 нуклеотидов), которая содержит открытую рамку считывания для синтеза антигенов вируса. Репликация HDV автономна от HBV, но, будучи вирусом-сателлитом, HDV использует HBsAg для сборки вириона, секреции из гепатоцита и инфицирования других гепатоцитов.
Рис. 2. Репликация HDV. 1 и 5 – синтез иРНК, кодирующих HDV-S и HDV-Lантигены вируса; 2 и 4 – синтез антигеномной РНК на основе геномной РНК и обратно; 3 – синтез HDV-S антигена, который способствует репликации вируса; 6 – синтез HDV-L антигена, который подавляет репликацию вируса и способствует сборке и секреции вируса.
Одним из важных направлений исследований генома HDV является изучение его стабильности. Эти исследования позволили выявить изменения состава РНК вируса в течение болезни у одного и того же пациента, которые могут быть одной из причин спонтанной реактивации хронического гепатита дельта. В исследовании китайских ученых было установлено, что более выраженные мутации обнаруживались при тяжелых обострениях [6]. Подобные исследования, возможно, помогут в будущем пролить свет на закономерности спонтанной реактивации HDV и своевременно реагировать на них, предотвращая реактивацию инфекции.
Эпидемиология
HDV распространен повсеместно. Считается, что около 5% больных хроническим гепатитом В инфицированы HDV (15-20 млн) [7]. Несмотря на одинаковые механизмы инфицирования и статус HDV как сателлитного вируса, реализующего свой потенциал только в присутствии HBsAg, зоны наибольшего распространения дельта-инфекции не повторяют в точности таковые HBV-инфекции. HDV высоко эндемичен в странах Средиземноморья, на Ближнем Востоке, в Центральной Африке, Центральной Азии и в северных частях Южной Америки. В США, Канаде и в странах Северной Европы (Дании, Швеции, Норвегии) значительное распространение HDV-инфекции отмечено в группах повышенного риска, в первую очередь у наркоманов. В настоящее время в мире выделяют регионы с низкой (0-5%), умеренной (6-20%), высокой (21-59%) и очень высокой (более 60%) частотой обнаружения маркеров HDV у лиц, инфицированных HBV (рис. 3).
В США, Канаде и в странах Северной Европы (Дании, Швеции, Норвегии) значительное распространение HDV-инфекции отмечено в группах повышенного риска, в первую очередь у наркоманов. В настоящее время в мире выделяют регионы с низкой (0-5%), умеренной (6-20%), высокой (21-59%) и очень высокой (более 60%) частотой обнаружения маркеров HDV у лиц, инфицированных HBV (рис. 3).
Рис. 3. Распространение HDV в мире [8]
Больные с гемофилией и другими состояниями, нуждающиеся в регулярных трансфузиях, составляли основную группу инфицированных в 80-х годах, однако со временем их доля постепенно уменьшается, что, по-видимому, связано с введением массовой вакцинации населения против HBV и рутинного скрининга продуктов крови на HBsAg.
За последние два десятилетия прошлого века отмечено значительное снижение распространенности HDV-инфекции, в первую очередь в странах Западной Европы, Юго-Восточной Азии и Турции. По данным итальянского многоцентрового исследования, распространенность HDV среди носителей HBsAg в 1997 г. равнялась 8,3% (69 из 834), что значительно ниже показателей 1992 и 1987 гг. (14% и 23%, соответственно). В период с 1987 г. по 1997 г. распространенность гепатита дельта в Италии снижалась на 1,5% ежегодно, в связи с чем авторы пришли к выводу, что в течение ближайших нескольких лет удастся установить полный контроль над распространением вируса гепатита дельта в итальянской популяции [9]. Аналогичную картину демонстрировали наблюдения и из других европейских стран, что позволило в конце 90-х годов рассматривать гепатит дельта как исчезающее заболевание, но в новых эпидемиологических исследованиях отмечено изменение ситуации в течение последнего десятилетия. В Италии частота обнаружения маркеров HDV среди носителей HBsAg после длительного периода снижения (с 24,6% в 1978–1981 гг. до 8,3% в 1997 г.) в настоящее время остается достаточно высокой – 8,1% в 2007 г. [10]. В Германии, где в 90-е годы наблюдалось снижение распространенности гепатита дельта с 18,6% до 6,8%, с 1999 г. она сохраняется на стабильно высоком уровне (8-14%) [11].
равнялась 8,3% (69 из 834), что значительно ниже показателей 1992 и 1987 гг. (14% и 23%, соответственно). В период с 1987 г. по 1997 г. распространенность гепатита дельта в Италии снижалась на 1,5% ежегодно, в связи с чем авторы пришли к выводу, что в течение ближайших нескольких лет удастся установить полный контроль над распространением вируса гепатита дельта в итальянской популяции [9]. Аналогичную картину демонстрировали наблюдения и из других европейских стран, что позволило в конце 90-х годов рассматривать гепатит дельта как исчезающее заболевание, но в новых эпидемиологических исследованиях отмечено изменение ситуации в течение последнего десятилетия. В Италии частота обнаружения маркеров HDV среди носителей HBsAg после длительного периода снижения (с 24,6% в 1978–1981 гг. до 8,3% в 1997 г.) в настоящее время остается достаточно высокой – 8,1% в 2007 г. [10]. В Германии, где в 90-е годы наблюдалось снижение распространенности гепатита дельта с 18,6% до 6,8%, с 1999 г. она сохраняется на стабильно высоком уровне (8-14%) [11].
Причиной вновь возросшей распространенности HDV-инфекции, скорее всего, является миграция населения из неблагополучных и эндемичных по гепатиту дельта регионов, что подтверждается высоким уровнем носительства HDV среди некоренного населения. К примеру, распространенность HDV-инфекции в Швей царии составляет 5,9%, а среди мигрантов достигает 38,0% [12].
Одной из причин сохраняющейся распространенности HDV-инфекции наряду с миграцией населения можно назвать снижение настороженности врачей. При проверке лабораторий муниципальных клиник Лондона выяснилось, что в течение последних нескольких лет рутинное тестирование носителей HBsAg на маркеры HDV проводилось не во всех случаях [13]. Аналогичные данные были получены в Чехии, Италии, Франции и Германии [14,15]. В исследовании, проведенном в клинике им. Е.М.Тареева, у 16 (31%) из 64 больных диагноз «хронический гепатит D» был впервые установлен спустя длительное время (до 10 лет), хотя эти больные наблюдались в других лечебных учреждениях с диагнозом хронического гепатита В; при этом им ни разу не проводили исследование сыворотки на маркеры дельтаинфекции [16].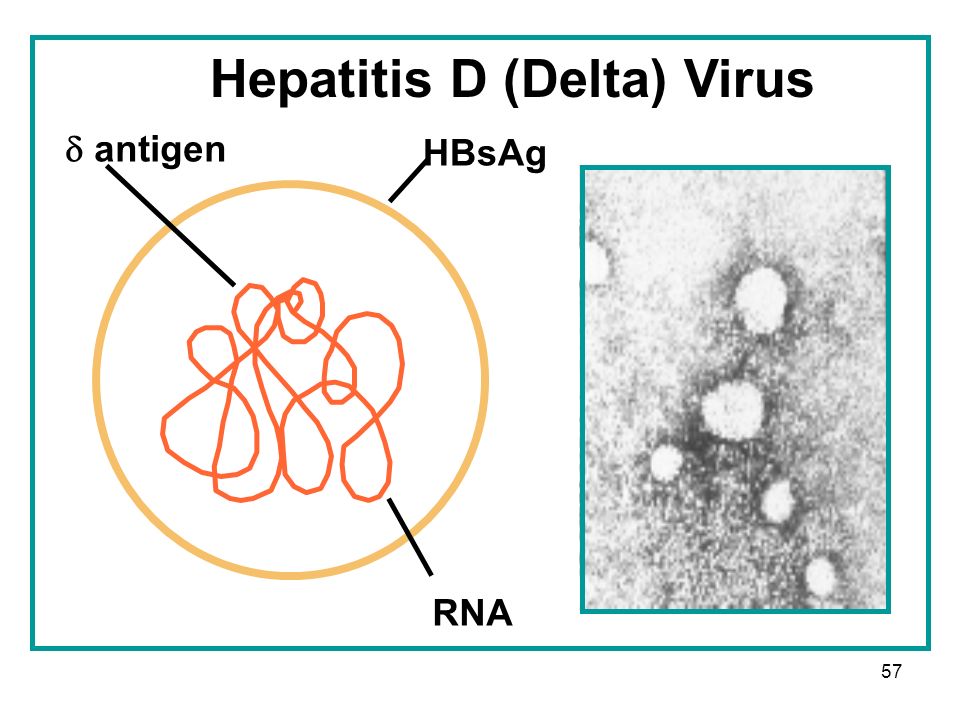 Это еще раз подчеркивает необходимость обязательного тестирования всех больных с HBsAg на HDV, особенно при высокой активности воспаления и наличии цирроза печени.
Это еще раз подчеркивает необходимость обязательного тестирования всех больных с HBsAg на HDV, особенно при высокой активности воспаления и наличии цирроза печени.
В России оценка частоты выявления маркеров HDV среди носителей HBsAg проводилась в нескольких регионах. В европейской части России антитела к HDV определялись у 1,3-5,5% HBsAg (+) лиц [17]. Энде мич ным по HDV-инфекции регионом признана Рес пуб лика Саха (Якутия), где доля хронического гепатита дельта в этиологической структуре хронических вирусных гепатитов составила 24,5%, в отдельных районах доля больных с антителами к HDV среди HBsAg (+) лиц достигала 31% [18,19]. Существенный уровень носительства HDV-инфекции был отмечен также в Рес пуб лике Тыва [20]. Необычно высокий уровень распространенности HDV-инфекции регистрировался в Астраханской области, где среди 151 больного с хроническим заболеванием печени у 66,9% был обнаружен HBsAg, а у 74,5% из них определялись маркеры HDV. В то же время среди пациентов с острым гепатитом В частота выявления антител к HDV составила только около 10% [21]. В исследовании, проведенном в клинике им. Е.М. Таре ева в Москве, за период с 2002 г. по 2014 г. маркеры активной дельта-инфекции (антиHDV-IgM и/или HDV RNA) были выявлены у 118 (21,7%) из 543 больных с HBsAg [22]. Обращает на себя внимание вспышка HDV-инфекции в конце 90-х годов в Самар ской области, где частота обнаружения HDV у HBsAg (+) лиц достигала 39%, что, вероятно, объясняется большим числом наркоманов в эпидемиологической выборке [23].
В исследовании, проведенном в клинике им. Е.М. Таре ева в Москве, за период с 2002 г. по 2014 г. маркеры активной дельта-инфекции (антиHDV-IgM и/или HDV RNA) были выявлены у 118 (21,7%) из 543 больных с HBsAg [22]. Обращает на себя внимание вспышка HDV-инфекции в конце 90-х годов в Самар ской области, где частота обнаружения HDV у HBsAg (+) лиц достигала 39%, что, вероятно, объясняется большим числом наркоманов в эпидемиологической выборке [23].
Очень высокий уровень инфицированности HDV отмечен во Вьетнаме, Гренландии, Индии, Иране, Мавритании, Монголии, Нигерии, Пакистане, Таджи ки стане, Тунисе [23-33].
Пути передачи HDV аналогичны таковым HBV: преимущественно парентеральный, реже половой и перинатальный. У обследованных нами 118 пациентов с хроническим гепатитом D, факторы риска инфицирования HDV распределились следующим образом: оперативные вмешательства (включая стоматологические) – 51%, гемотрансфузии – 20%, наркомания – 18%, возможный внутрисемейный путь передачи – 17%. У 10% больных путь передачи инфекции установить не удалось [22]. Контагиозная активность HDV значительно ниже по сравнению с HBV, поэтому половой, перинатальный и бытовой пути передачи не столь очевидны, хотя в эндемичных по HDV регионах они могут играть более важную роль [34]. По данным итальянского исследования, члены семьи больного с HDV-инфекцией имели 12,9-кратный риск инфицирования вирусом по сравнению с таковым в общей популяции [35].
У 10% больных путь передачи инфекции установить не удалось [22]. Контагиозная активность HDV значительно ниже по сравнению с HBV, поэтому половой, перинатальный и бытовой пути передачи не столь очевидны, хотя в эндемичных по HDV регионах они могут играть более важную роль [34]. По данным итальянского исследования, члены семьи больного с HDV-инфекцией имели 12,9-кратный риск инфицирования вирусом по сравнению с таковым в общей популяции [35].
В настоящее время выделяют 8 различных генотипов HDV в зависимости от нуклеотидной последовательности и географической распространенности, хотя последний фактор частично утратил свое значение в силу миграции населения. Различные генотипы HDV отличаются друг от друга не более чем на 30 нуклеотидов по длине генома, но различия в нуклеотидной последовательности могут доходить до 30% [36].
Первый генотип наиболее распространен и встречается повсеместно, особенно в странах Средиземно мор ского региона, Африке, Европе и Северной Америке. Хронический гепатит, вызванный вирусом 1-го генотипа, характеризуется вариабельным течением (от мягких до быстропрогрессирующих форм). В исследовании, проведенном в клинике им. Е.М.Таре ева, у всех обследованных больных с HDV-инфекцией был выявлен 1-й генотип, преимущественно подтип 1b (в 85% случаев) [16]. Данный подтип наиболее близок к последовательностям молдавских и болгарских изолятов HDV [37]. Второй и 4-й генотипы встречаются преимущественно на Дальнем Востоке, в том числе в России [38], характеризуются, как правило, мягким, медленно прогрессирующим (по сравнению с 1-м генотипом), редко – тяжелым (прежде всего 4-й генотип) течением заболевания. Третий генотип встречается в северной части Южной Америки (Колумбия, Вене су эла, Перу, Эквадор), а гепатит, вызванный вирусом этого генотипа, имеет наиболее тяжелое, часто фульминантное течение заболевания с быстрым исходом в цирроз печени. Другие генотипы были идентифицированы относительно недавно в Африке и недостаточно изу чены.
Хронический гепатит, вызванный вирусом 1-го генотипа, характеризуется вариабельным течением (от мягких до быстропрогрессирующих форм). В исследовании, проведенном в клинике им. Е.М.Таре ева, у всех обследованных больных с HDV-инфекцией был выявлен 1-й генотип, преимущественно подтип 1b (в 85% случаев) [16]. Данный подтип наиболее близок к последовательностям молдавских и болгарских изолятов HDV [37]. Второй и 4-й генотипы встречаются преимущественно на Дальнем Востоке, в том числе в России [38], характеризуются, как правило, мягким, медленно прогрессирующим (по сравнению с 1-м генотипом), редко – тяжелым (прежде всего 4-й генотип) течением заболевания. Третий генотип встречается в северной части Южной Америки (Колумбия, Вене су эла, Перу, Эквадор), а гепатит, вызванный вирусом этого генотипа, имеет наиболее тяжелое, часто фульминантное течение заболевания с быстрым исходом в цирроз печени. Другие генотипы были идентифицированы относительно недавно в Африке и недостаточно изу чены.
Патогенез
В настоящее время не существует единой точки зрения на патогенез HDV-инфекции, обсуждается как иммуноопосредованное [39-41], так и прямое цитопатическое действие вируса на печень [42].
Показано, что периферические мононуклеарные клетки пациентов с неактивным хроническим гепатитом D (стабильно нормальный уровень АЛТ и отсутствие анти-HDV IgM) демонстрировали специфичную в отношении HDAg пролиферацию in vitro [43]. Отсут ствие аналогичных проявлений у сопоставимых пациентов с активным печеночным процессом, видимо, отражает то, что в данном случае именно клеточный иммунный ответ позволял контролировать течение HDV-инфекции.
HDV ингибирует не только систему эндогенных ИФН-a, активирующихся в ответ на вирус [47], но и блокирует сигнальные пути JAK-STAT, необходимые для индукции противовирусного ответа [48]. Данное свойство HDV может быть одной из причин низкой эффективности противовирусной терапии ИФН-α.
Первые данные о возможном цитопатическом эф фекте HDV были получены в ходе наблюдения за вспышками тяжелых случаев вирусного гепатита дельта в бассейне реки Амазонка, которые были обусловлены третьим генотипом HDV [49]. При этом в ткани печени определялись выраженный мелкокапельный стеатоз и эозинофильный некроз на фоне умеренных лобулярных изменений. Подобные гистологические проявления наблюдались также при фульминантном гепатите дельта у жителей регионов Экваториальной Африки [50].
При этом в ткани печени определялись выраженный мелкокапельный стеатоз и эозинофильный некроз на фоне умеренных лобулярных изменений. Подобные гистологические проявления наблюдались также при фульминантном гепатите дельта у жителей регионов Экваториальной Африки [50].
Открытым остается вопрос о защитной роли антител к HDV, которые выявляют у всех больных, имевших контакт с вирусом, но не ассоциируются с развитием иммунитета. Повторное инфицирование шимпанзе, перенесших острый гепатит дельта, тем же вирусом, сопровождалась менее выраженной виремией, чем при первом инфицировании [51]. Это позволяет предполагать, по крайней мере, частичную защитную функцию вирус-специфичных антител, ограничивающую репликацию вируса.
Диагностика
Для диагностики HDV-инфекции определяют антитела к вирусу и RNA HDV в сыворотке крови. Антитела к HDV (анти-HDV) суммарные выявляют более чем в 90% случаев в течение 3–8 нед после инфицирования. При острой цикличной HDV-инфекции титр антиHDV IgM, как правило, невысокий, и они исчезают из крови в течение нескольких месяцев. При хронической HDV-инфекции (как правило, при суперинфекции) титр очень высокий и сохраняется на протяжении длительного времени. Анти-HDV IgG выявляют как при острой (в сочетании с преходящими анти-HDV IgM), так и при хронической (в сочетании со стойко персистирующими анти-HDV IgM) HDV-инфекции.
При хронической HDV-инфекции (как правило, при суперинфекции) титр очень высокий и сохраняется на протяжении длительного времени. Анти-HDV IgG выявляют как при острой (в сочетании с преходящими анти-HDV IgM), так и при хронической (в сочетании со стойко персистирующими анти-HDV IgM) HDV-инфекции.
В настоящее время основным маркером репликативной активности HDV считают обнаружение RNA HDV в сыворотке крови методом ПЦР. С началом применения ПЦР для определения RNA HDV в крови роль анти-HDV IgM значительно снизилась. Однако, с учетом вариабельности генома HDV и отсутствия стандартизации тест-систем тестирование анти-HDV IgM может быть оправдано при подозрении на ложно-отрицательный результат ПЦР.
Рутинное количественное определение RNA HDV в настоящее время нецелесообразно, так как отсутствуют данные о корреляции уровня виремии и выраженности печеночного процесса [52]. Таким образом, единственной целью количественного определения RNA HDV представляется контроль эффективности противовирусной терапии [53].
Естественное течение и прогноз гепатита дельта
Острый гепатит дельта. Выделяют два варианта острого гепатита дельта, существенно отличающихся по течению и исходам: коинфекция и суперинфекция. При коинфекции оба вируса (HDV и HBV) попадают в организм одновременно, при этом наблюдаются, как правило, две волны активности гепатита (возможно, с желтушным компонентом): первая обусловлена HBV, вторая (через 2–4 нед) – HDV. Инкубационный период при коинфекции составляет в среднем от 3 до 7 нед [7].
При коинфекции в подавляющем большинстве случаев (более 95%) заболевание имеет циклическое течение и заканчивается спонтанным выздоровлением и элиминацией как маркеров HBV (HBsAg, DNA HBV), так и HDV (анти-HDV IgM, RNA HDV). При этом течение острого гепатита D обычно клинически и гистологически неотличимо от острого гепатита В (в ряде случаев описаны две волны обострения заболевания или желтухи). Менее чем в 5% случаев возможно развитие хронического гепатита D, а также фульминантной печеночной недостаточности [23,29,54,55].
При суперинфекции HDV попадает в организм человека с хронической HBV-инфекцией. Более чем в 90% случаев отмечается развитие хронического гепатита D [57]. У шимпанзе гистологические изменения в печени при суперинфекции HDV были значительно более выраженными, чем при коинфекции HDV или суперинфекции носителей HBV вирусом гепатита С [58]. Менее чем в 10% случаев суперинфекция HDV может разрешиться самостоя тельно с сохранением или даже элиминацией HBV (клиренсом HBsAg) [59]. При суперинфекции HDV значительно чаще развивается фульминантная печеночная недостаточность [57,60]. При отсутствии данных о существующем гепатите В суперинфекция HDV может быть ошибочно диагностирована как острый гепатит В [61].
Хронический гепатит дельта. В настоящее время выделяют 3 фазы течения HDV-инфекции в зависимости от вирусологического профиля: острая фаза с выраженной репликацией HDV, высокой активностью АЛТ и супрессией HBV; хроническая фаза, характеризующаяся уменьшением активности HDV, реактивацией HBV и умеренным повышением активности АЛТ; третья фаза с развитием цирроза печени и гепатоцеллюлярной карциномы в результате репликации одного из вирусов или ремиссии в исходе значительного уменьшения активности обоих вирусов [62]. Стадийность течения может быть прослежена у большинства больных хроническим гепатитом D. Однако, как показали клинические исследования, течение заболевания может отличаться в зависимости от популяции и генотипа HDV [63].
Стадийность течения может быть прослежена у большинства больных хроническим гепатитом D. Однако, как показали клинические исследования, течение заболевания может отличаться в зависимости от популяции и генотипа HDV [63].
Имеющиеся данные о естественном течении хронического гепатита D, прогнозе и риске развития цирроза печени и его осложнений противоречивы. На наш взгляд, подобные значительные расхождения могут быть объяснены следующими причинами:
1. В большей части опубликованных наблюдений отсутствует четкое разделение пациентов на группы с отдельным анализом каждой из них. Это приводит к тому, что статистическая обработка и анализ проводятся в выборках больных, находящихся на разных стадиях заболевания, – от хронического гепатита до декомпенсированного цирроза печени.
2. Наблюдения последнего десятилетия позволили отметить изменение «характера» заболевания, в том числе за счет уменьшения числа новых случаев острого гепатита. Все чаще наблюдается преобладание вялотекущих стабильных форм заболевания и реже встречаются агрессивные формы хронического гепатита, которые в течение короткого времени приводят к развитию цирроза печени и его осложнений. Именно они определяли грозный облик болезни в конце прошлого века.
Именно они определяли грозный облик болезни в конце прошлого века.
В итальянском многоцентровом исследовании авторы сравнили две группы больных, наблюдавшихся в 1977-1986 гг. (n=122) и 1987-1996 гг. (n=162) [64]. Агрессивное течение хронического гепатита D в первой декаде отмечалось значительно чаще (65%), чем во второй (17%). Аналогичные результаты были получены в ряде других итальянских работ [65,66]. По данным испанского исследования, доля больных с острым гепатитом D агрессивного течения в 1983-1995 гг. значительно превышала таковую в 1996-2008 гг. [67]. Двадцатилетняя выживаемость больных хроническим гепатитом D в одном исследовании составляла 86% [65].
Риск развития цирроза печени в итальянском исследовании у больных, инфицированных HDV 1-го генотипа (77% мужчин, средний возраст 30 лет, цирроз печени у 35%), составлял около 4% в год, что значительно выше, чем при моноинфекции вирусами гепатита В или С [65]. В этом же исследовании частота спонтанной сероконверсии HBsAg равнялась 0,25% в год и была выше у больных с длительной ремиссией заболевания и стабильно нормальной активностью АЛТ. Сероконверсия HBsAg, тем не менее, не гарантировала отсутствие осложнений. У 2 из 22 пациентов с сероконверсией отмечено развитие гепатоцеллюлярной карциномы. Последнее, вероятно, отражает длительность печеночного процесса и сопряженных с этим нарушений в геноме гепатоцитов.
Сероконверсия HBsAg, тем не менее, не гарантировала отсутствие осложнений. У 2 из 22 пациентов с сероконверсией отмечено развитие гепатоцеллюлярной карциномы. Последнее, вероятно, отражает длительность печеночного процесса и сопряженных с этим нарушений в геноме гепатоцитов.
У значительной части больных хроническим гепатитом D в момент установления диагноза выявляют стадию цирроза печени. Это, по-видимому, отражает более тяжелое течение заболевания по сравнению с таковым при моноинфекции вирусами гепатита В и С. Так, доля больных с циррозом печени среди пациентов с хронической HDV-инфекцией в крупных исследованиях составляла от 27% до 82% [13,16,42,65,67].
Декомпенсация и развитие печеночной недостаточности остаются главными причинами смертности при хронической HDV-инфекции. В многоцентровом ретроспективном исследовании у 200 больных с компенсированным (класс А по шкале Чайлд-Пью) циррозом печени в исходе HBV- и HDV-инфекции из нескольких клиник Западной Европы развитие печеночной недостаточности и гепатоцеллюлярной карциномы в течение 80 мес было отмечено у 31% и 13% больных гепатитом D, соответственно [68]. Риск декомпенсации, развития гепатоцеллюлярной карциномы и печеночной смерти при HDV-инфекции превышал таковой в сопоставимой группе больных с HBV-инфекцией в 2,2, 3,2 и 2,0 раза, соответственно. Риск декомпенсации был выше у больных пожилого возраста, а также пациентов с гипоальбуминемией и гипергаммаглобулинемией.
Риск декомпенсации, развития гепатоцеллюлярной карциномы и печеночной смерти при HDV-инфекции превышал таковой в сопоставимой группе больных с HBV-инфекцией в 2,2, 3,2 и 2,0 раза, соответственно. Риск декомпенсации был выше у больных пожилого возраста, а также пациентов с гипоальбуминемией и гипергаммаглобулинемией.
В другом крупном исследовании именно развитие печеночной недостаточности, а не гепатоцеллюлярной карциномы определяло выживаемость HDV-инфицированных больных с компенсированным циррозом печени (n=166) [69]. 1, 2 и 5-летняя выживаемость составила 94,3%, 82,5% и 51,5%, соответственно.
В нашем исследовании в течение в среднем 4,1 года (от 1 до 9 лет) умерли 24 из 118 больных хроническим гепатитом D (у 66% имелся цирроз печени). Причины смерти включали печеночную кому (у 12), гепатоцеллюлярную карциному (у 9), кровотечения из варикознорасширенных вен пищевода (у 2) [22].
Данные об онкогенном потенциале HDV противоречивы. В некоторых ранних работах [70,71] не было выявлено достоверного увеличения риска развития гепатоцеллюлярной карциномы при HDV-инфекции по сравнению с таковым при HBV-инфекции. Однако многие авторы склонны объяснять этот факт тем, что больные с HDV-инфекцией часто умирают от прогрессирующей печеночной недостаточности и других осложнений цирроза печени, не доживая до гепатоцеллюлярной карциномы [7]. В исследовании, проведенном в Греции, было показано, что у больных хроническим гепатитом D, которые не погибли от печеночной недостаточности, риск развития гепатоцеллюлярной карциномы в течение 12 лет составил почти 42% [72]. При длительном наблюдении (в среднем 7 лет) больных вызванным HDV циррозом печени в итальянской популяции развитие гепатоцеллюлярной карциномы было отмечено в 25% случаев, риск опухолевой трансформации составлял 2,8% в год [65]. Аналогичные данные приводятся в исследовании из Германии (n=67, длительность наблюдения 7 лет), по данным которого ежегодный риск развития гепатоцеллюлярной карциномы у больных с циррозом печени, вызванным HDV, составил 2,7% [73].
Однако многие авторы склонны объяснять этот факт тем, что больные с HDV-инфекцией часто умирают от прогрессирующей печеночной недостаточности и других осложнений цирроза печени, не доживая до гепатоцеллюлярной карциномы [7]. В исследовании, проведенном в Греции, было показано, что у больных хроническим гепатитом D, которые не погибли от печеночной недостаточности, риск развития гепатоцеллюлярной карциномы в течение 12 лет составил почти 42% [72]. При длительном наблюдении (в среднем 7 лет) больных вызванным HDV циррозом печени в итальянской популяции развитие гепатоцеллюлярной карциномы было отмечено в 25% случаев, риск опухолевой трансформации составлял 2,8% в год [65]. Аналогичные данные приводятся в исследовании из Германии (n=67, длительность наблюдения 7 лет), по данным которого ежегодный риск развития гепатоцеллюлярной карциномы у больных с циррозом печени, вызванным HDV, составил 2,7% [73].
Клинические проявления
Печеночные и внепеченочные проявления хронического гепатита D существенно не отличаются от таковых при заболевании печени, обусловленном вирусом гепатита В [16,42,74,75]. При хроническом гепатите D, как правило, отмечается более высокая активность печеночного процесса по сравнению с таковой при хроническом гепатите В. Обращают на себя внимание значительно более высокая гипергаммаглобулинемия, преимущественно за счет IgG, наличие ревматоидного фактора и криоглобулинов в сыворотке крови при хроническом гепатите D, которые отражают, по-видимому, выраженность аутоиммунных нарушений. HDV, как правило, подавляет активность HBV (лишь у 10-20% больных определяется DNA HBV в сыворотке крови). При этом не было выявлено более высокой активности хронического гепатита D у больных с сохранением виремии HBV [7].
При хроническом гепатите D, как правило, отмечается более высокая активность печеночного процесса по сравнению с таковой при хроническом гепатите В. Обращают на себя внимание значительно более высокая гипергаммаглобулинемия, преимущественно за счет IgG, наличие ревматоидного фактора и криоглобулинов в сыворотке крови при хроническом гепатите D, которые отражают, по-видимому, выраженность аутоиммунных нарушений. HDV, как правило, подавляет активность HBV (лишь у 10-20% больных определяется DNA HBV в сыворотке крови). При этом не было выявлено более высокой активности хронического гепатита D у больных с сохранением виремии HBV [7].
Лечение
Уникальный механизм репликации HDV, отсутствие собственных полимераз и высокий патогенный потенциал делают вирус трудной мишенью для противовирусной терапии. В течение последних трех десятилетий были предприняты неоднократные попытки использования различных препаратов для лечения хронического гепатита D, однако только некоторые из них сохраняют актуальность в настоящее время.
Рекомбинантный интерферонa. Первые попытки противовирусной терапии хронического гепатита дельта относятся к середине 80-х годов [76]. В 10 рандомизированных клинических исследованиях, в которых изучался рекомбинантный ИФН-a, устойчивый вирусологический ответ (УВО) был отмечен всего у 17,4% больных [77]. Гистологическое улучшение и нормализация активности АЛТ в результате лечения ИФНa были достигнуты у 27,2% и 34,8% пациентов, соответственно, однако через 6 месяцев после завершения терапии активность АЛТ оставалась в пределах нормы только у 11,9% больных. В двух клинических исследованиях, в которых сравнивали эффективность высоких и низких доз ИФН-a (9 или 3 млн МЕ 3 раза в нед), был показан отчетливый дозозависимый эффект препарата – УВО был достигнут в 23,3% и 10,0% случаев, соответственно.
В итальянском исследовании 90 больных (72% из них с циррозом печени) получали рекомбинантный ИФН-a в дозе 6-9 млн МЕ [65]. У 72% больных проведен один курс лечения (продолжительностью в среднем 17 месяцев, у 24% – два курса, у 4% – три курса. УВО был достигнут и сохранялся в течение 36 месяцев наблюдения у 25 (27,8%) больных, в том числе у 15 (60%) – на стадии хронического гепатита.
УВО был достигнут и сохранялся в течение 36 месяцев наблюдения у 25 (27,8%) больных, в том числе у 15 (60%) – на стадии хронического гепатита.
В долгосрочном исследовании американских ученых у пациентов, получавших рекомбинантный ИФН-a в дозе 9 млн МЕ в течение 48 недель, биохимический ответ, достигнутый к концу терапии у половины больных, сохранялся в течение всех 14 лет наблюдения. Особого внимания заслуживает тот факт, что у пациентов со стабильно нормальным уровнем АЛТ и клиренсом анти-HDV IgM и повторно гистологически верифицированным активным циррозом печени (после завершения лечения и через год) в ходе долгосрочного наблюдения было обнаружено полное разрешение фиброза печени [78]. В другом длительном исследовании клиренса HDV и HBV и полного разрешения гистологически верифицированного цирроза печени удалось добиться у пациента, получавшего рекомбинантный ИФН-a в дозе 5 млн МЕ ежедневно в течение 12 лет [79]. Еще в одном наблюдении отмечена элиминация вирусов гепатита В и D при длительном лечении в течение 12 лет малыми дозами интерферона a-2b [80].
Нуклеоз(т)идные аналоги. Важное значение HBsAg для процесса сборки HDV, риск ускоренного прогрессирования фиброза при активной репликации HBV у больных хроническим гепатитом D, а также недостаточная эффективность рекомбинантного ИФН-a оправдывали попытки применения нуклеоз(т)идных аналогов. Однако использование фамцикловира [81], ламивудина [79], рибавирина [82], клевудина [63] и адефовира [83] не позволяло подавить репликацию HDV. На основании этих наблюдений сформировалось мнение, что нуклеоз(т)идные аналоги не эффективны против HDV, а их применение оправдано лишь при наличии активной репликации HBV у больных хроническим гепатитом дельта. Однако следует отметить, что все вышеперечисленные исследования ограничивались наблюдением в течение двух лет, хотя доказано, что нуклеоз(т)идные аналоги при длительном применении способны снижать уровень cccDNA и HBsAg, что лишает HDV субстрата для экспрессии и таким образом может опосредованно ингибировать репликацию вируса. Наглядно продемонстрировать этот механизм позволило наблюдение 16 больных с хроническим гепатитом D и коинфекцией ВИЧ, которым проводилась высокоактивная антиретровирусная терапия (ламивудин в сочетании с тенофовиром и/или эмтрицитабином) в течение 6 лет [84]. У 3 (18,8%) больных были достигнуты авиремия RNA HDV и нормализация уровня АЛТ, у остальных 13 (81,2%) – снижение виремии и активности АЛТ. Успех длительного применения тенофовира в лечении хронического гепатита D вызвал закономерный интерес, и в июне 2009 г. был начато многоцентровое европейское исследование HIDIT II, предполагавшее применение пегилированного ИФН a-2а в комбинации с плацебо или тенофовиром в течение 96 недель у больных хроническим гепатитом D и последующее наблюдение в течение 6 лет. Таким образом, в настоящее время точкой приложения современных мощных нуклеотидных аналогов в лечении хронического гепатита D можно считать случаи c активной репликацией HBV, а эффективность длительного лечения с целью ингибирования cccDNA HBV требует дальнейших исследований с большим количеством больных.
У 3 (18,8%) больных были достигнуты авиремия RNA HDV и нормализация уровня АЛТ, у остальных 13 (81,2%) – снижение виремии и активности АЛТ. Успех длительного применения тенофовира в лечении хронического гепатита D вызвал закономерный интерес, и в июне 2009 г. был начато многоцентровое европейское исследование HIDIT II, предполагавшее применение пегилированного ИФН a-2а в комбинации с плацебо или тенофовиром в течение 96 недель у больных хроническим гепатитом D и последующее наблюдение в течение 6 лет. Таким образом, в настоящее время точкой приложения современных мощных нуклеотидных аналогов в лечении хронического гепатита D можно считать случаи c активной репликацией HBV, а эффективность длительного лечения с целью ингибирования cccDNA HBV требует дальнейших исследований с большим количеством больных.
Пегилированный интерферонa-α. В настоящее время пегилированный ИФН-a является препаратом выбора в лечении хронического гепатита D, что обосновывается результатами трех клинических исследований, проведенных во Франции, Германии и Италии [82,85,86].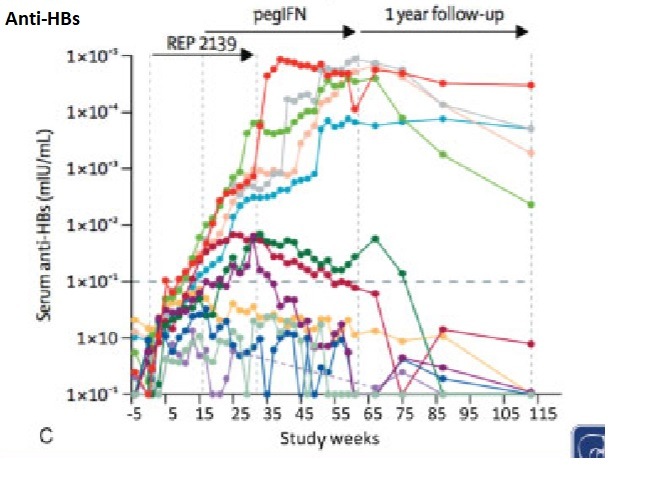 УВО (авиремия HDV RNA через 24 недели после завершения терапии) был достигнут в среднем у четверти из 64 больных хроническим гепатитом D, получавших пегилированный ИНФ a-2b в дозе 1,5 мкг/кг в течение 48-72 недель. Во французской выборке (14 больных) только авиремия HDV на 24-й неделе терапии была признана достоверным предиктором УВО (р=0,021) [85].
УВО (авиремия HDV RNA через 24 недели после завершения терапии) был достигнут в среднем у четверти из 64 больных хроническим гепатитом D, получавших пегилированный ИНФ a-2b в дозе 1,5 мкг/кг в течение 48-72 недель. Во французской выборке (14 больных) только авиремия HDV на 24-й неделе терапии была признана достоверным предиктором УВО (р=0,021) [85].
Альтернативные методы лечения. Среди наиболее перспективных альтернативных методов лечения можно выделить ингибитор пренилирования (фарнесилтрансферазы и геранилгеранилтрансферазы) лонафарниб, preS-производный ингибитор входа HBV мирклюдекс-B и полимеры нуклеиновых кислот REP-2139, которые блокируют синтез и секрецию HBsAg. Механизм действия ингибиторов пренилирования заключается в ингибировании присоединения белков фарнесила или геранилгеранила к цистеиновому остатку на С-конце молекулы HDV-L-антигена, что препятствует связи нуклеокапсида HDV с HBsAg, тем самым блокируя сборку полноценного вируса гепатита дельта [87]. Эффективные модели ингибирования пренилирования были продемонстрированы как in vitro [88], так и in vivo на мышах. В этих исследованиях авиремии HDV удавалось достичь уже через 7 дней терапии ингибитором фарнесилтрансферазы [89]. В исследованиях II фазы была установлена эффективность лонафарниба в сочетании с ритонавиром и пегилированным интерфероном-a [90, 91]. В исследовании LOWR-HDV-4 15 больных хроническим гепатитом D получали лонафарниб в дозе 50-75-100 мг в сочетании с ритонавиром 100 мг/сут. К концу лечения уровень RNA HDV снизился в среднем на 1,52 log10 МЕ/мл, а нормализация АЛТ отмечена в 53% случаев [90].
В этих исследованиях авиремии HDV удавалось достичь уже через 7 дней терапии ингибитором фарнесилтрансферазы [89]. В исследованиях II фазы была установлена эффективность лонафарниба в сочетании с ритонавиром и пегилированным интерфероном-a [90, 91]. В исследовании LOWR-HDV-4 15 больных хроническим гепатитом D получали лонафарниб в дозе 50-75-100 мг в сочетании с ритонавиром 100 мг/сут. К концу лечения уровень RNA HDV снизился в среднем на 1,52 log10 МЕ/мл, а нормализация АЛТ отмечена в 53% случаев [90].
Пилотные исследования показали более выраженное подавление репликативной активности HDV при лечении мирклюдексом-B в сочетании с пегилированным ИФН a-2а [92] или тенофовиром [93].
Наиболее впечатляющие результаты получены при лечении полимером нуклеиновых кислот REP-2139 (внутривенно в дозе 500 и 250 мг 1 раз в нед в течение 30 нед) в сочетании с пегилированным ИФН a-2а. У 7 (58%) и 9 (75%) из 12 больных (без цирроза печени) через год после окончания лечения сохранялись авиремия (RNA HDV
<15 МЕ/мл) и нормализация активности АЛТ, соответственно [94]. У 5 (42%) боль ных наблюдалась сероконверсия HBsAg. Необ хо ди мо отметить, что эффективность и безопасность REP-2119 у больных циррозом печени еще предстоит оценить.
У 5 (42%) боль ных наблюдалась сероконверсия HBsAg. Необ хо ди мо отметить, что эффективность и безопасность REP-2119 у больных циррозом печени еще предстоит оценить.
В последние годы также обсуждается применение при хроническом гепатите D пегилированного интерферона-l, который, как показали исследования, отличается от пегилированного ИФН-a меньшей частотой нежелательных явлений (прежде всего, гриппоподобных реакций и цитопении) [95].
Все эти препараты планируется оценить в клинических исследованиях III фазы.
Трансплантация печени
В первых наблюдениях трансплантации печени при гепатите дельта, опубликованных с 1987 г., отмечали высокий риск реактивации HDV, несмотря на комбинированную профилактику с применением иммуноглобулина человека и вакцины против HBV [96]. В последующем стало очевидно, что риск реинфекции после трансплантации печени при HDV-инфекции ниже, чем при моноинфекции вирусами гепатита В и С [97]. Немаловажно также, что в отличие от моноинфекции HBV, частота реинфекции HDV после трансплантации печени оставалась стабильно низкой на протяжении длительного времени – 15,3% в течение 14 лет наблюдения [98].
Немаловажно также, что в отличие от моноинфекции HBV, частота реинфекции HDV после трансплантации печени оставалась стабильно низкой на протяжении длительного времени – 15,3% в течение 14 лет наблюдения [98].
Длительное время обсуждалась возможность «латентного» течения HDV-инфекции у больных после трансплантации печени при отсутствии маркеров HBV-инфекции. Следует отметить, что большинство исследований, выявивших данный феномен, относились к 1990-м годам, когда тест-системы не позволяли определять минимальные титры вируса. К тому же, по данным Smedile и соавт., вирион HDV, выделенный у больных с виремией после трансплантации печени, был покрыт поверхностным антигеном HBV и содержал в себе полноценный геном HDV, являясь идентичным дотрансплантационному образцу, тем самым исключая возможность репликации вируса при отсутствии HBV [99]. Наличие HDAg в гепатоцитах больных после трансплантации печени при отсутствии признаков репликации HBV, скорее всего, следует объяснять отсроченной элиминацией вирусов, даже на фоне лечения иммуноглобулином человека против HBV [100].
Комбинированная профилактика реинфекции с применением человеческого иммуноглобулина против вируса гепатита В и нуклеоз(т)идного аналога в настоящее время считается оптимальным и общепринятым методом. Монопрофилактика как ламивудином, так и иммуноглобулином человека ассоциировалась с высоким риском реинфекции HBV [101,102]. Таким образом, комбинированная профилактика реинфекции HBV после трансплантации печени позволила достичь сразу несколько целей:
- одновременное воздействие на различные регионы генома HBV: preS/S через иммуноглобулин человека и ген полимеразы через нуклеоз(т)идные аналоги;
- высокая эффективность;
- относительно низкая себестоимость терапии за счет экономии иммуноглобулина человека.
Что такое гепатит дельта? | Здоровая жизнь | Здоровье
В России разработали инновационный препарат для лечения гепатита дельта, известного также как вирус гепатита D. Как сообщили медики, в результате клинических испытаний, в которых принимали участие более 250 человек, им удалось добиться снижения вирусной нагрузки, нормализации биохимических показателей печени и восстановления нормальной структуры этого органа.
По данным Всемирной организации здравоохранения, вирусом гепатита D инфицированы около 20 млн человек. Больше всего зараженных в ряде стран Африки и Азии, на Ближнем Востоке. В России, по данным врачей, много инфицированных гепатитом дельта в Тыве и Якутии. АиФ.ru узнал у врача гастроэнтеролога-гепатолога Сергея Вялова, что вызывает заболевание, какие сегодня существуют схемы лечения и насколько они эффективны.
Что вызывает гепатит D и чем он опасен?
Инфицирование гепатитом D (HDV) возможно лишь при наличии в организме человека вируса гепатита В. По данным ВОЗ на 2019 год, примерно 5% пациентов с хронической инфекцией гепатита B инфицированы гепатитом D — то есть около 15-20 миллионов человек. Пациенты с такой коинфекцией предрасположены к более быстрому развитию цирроза и рака печени. Как сообщается на официальном сайте организации, инфицирование HDV происходит одновременно с HBV или в виде суперинфекции по отношению к последнему. Передача вируса чаще всего происходит перинатальным путем от матери ребенку, а также при контакте с кровью или другими биологическими жидкостями.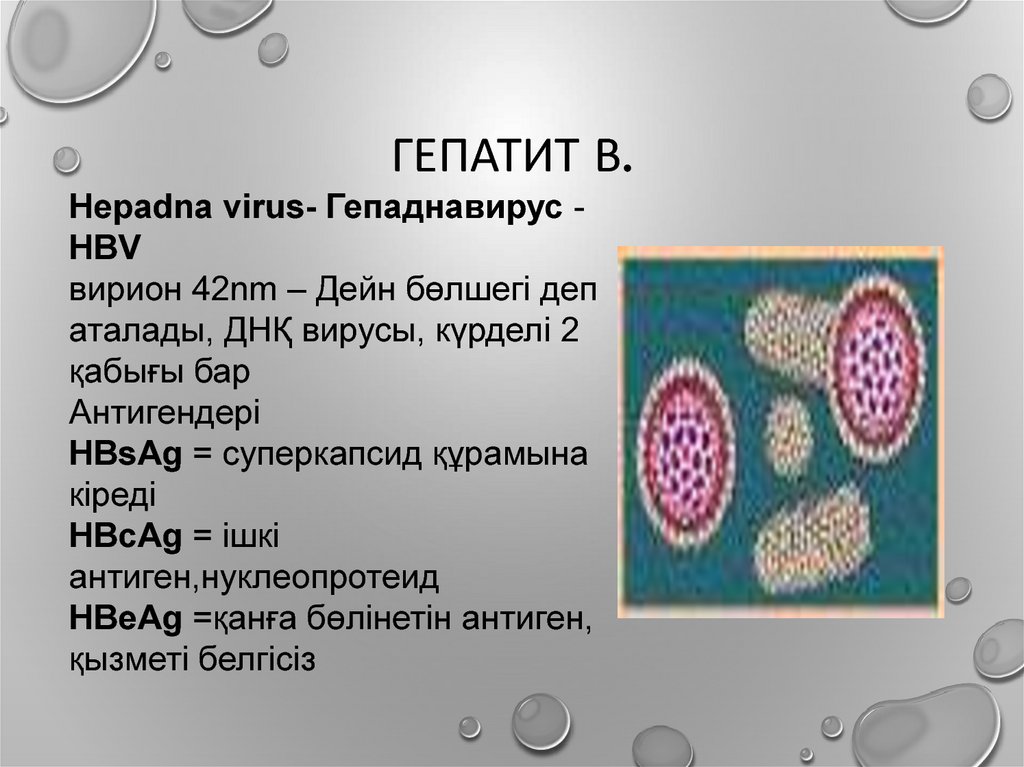
«Гепатит D сам по себе опасности не представляет, потому что он не может повреждать печень без гепатита В. То есть, если они вдвоем соединяются, тогда беда. А если гепатит D сам по себе, то он ничего плохого не делает, у него просто нет „материальной базы“, чтобы что-то повредить. Проблема заключается в том, что, если у человека есть гепатит В, то ему, по идее, надо на постоянной основе принимать противовирусную терапию, которая уменьшает количество вируса В в крови и тогда человеку D особо и не страшен. Потому что D — это как бы дополнительная „опция“, которая усиливает гепатит B. Заразиться им можно через кровь и биологические жидкости», — поясняет врач гастроэнтеролог-гепатолог Сергей Вялов.
Какие существуют схемы лечения гепатита дельта?
По словам Сергея Вялова, пациенту назначается специальная противовирусная терапия. Если выявить заболевание на ранней стадии, то оно хорошо поддается лечению.
«Основная проблема в том, что наш человек терпит до последнего», — говорит Вялов. Эксперт обращает внимание, что, так как печень нервных окончаний не имеет, она не болит, пока не дойдет до цирроза или до фиброза. А на этой стадии болезнь уже лечится плохо. «А если человек периодически сдает анализы на гепатит В, хотя бы раз в пять лет, то его, в любом случае, выявят на ранней стадии. На ранней стадии прекрасно все лечится», — поясняет Вялов. Также врач напоминает, что от гепатита В есть прививка. «Если человек сделал эту прививку, то он никогда гепатит В бы не получит, и, соответственно, гепатит D тоже», — говорит он.
По словам эксперта, у врачей нет необходимости лечить непосредственно гепатит дельта, поскольку он зависит от гепатита В. Таким образом, в первую очередь терапия должна быть направлена на лечение гепатита В. «Есть противовирусные препараты, они прекрасно работают, обеспечивают снижение количества вируса практически до нуля или до полного исчезновения, тут уже индивидуальные особенности», — объясняет Вялов.
Смотрите также:
этиология, эпидемиология, особенности течения и исходы uMEDp
В мире насчитывается около 400 млн лиц с хронической инфекцией, вызванной вирусом гепатита В (Hepatitis B virus, HBV). Из них от 15 до 25 млн имеют признаки инфицирования вирусом гепатита D (Hepatitis D virus, HDV). Данный вирус считается вирусом – спутником HBV и для своей репликации и сборки использует ферменты и белки (HBsAg) HBV. Он несколько похож на вироиды растений, но выделен в отдельное семейство и отдельный вид гепатотропных вирусов. HDV характеризуется эндемичностью распространения: его обнаруживают преимущественно в Южной Европе, определенных регионах Азии, Африки и Латинской Америки. В России эндемичность по HDV установлена в отношении Астраханской области и ряда районов восточнее Урала. Вирус вызывает коинфекцию и суперинфекцию, которые протекают как острый гепатит либо первично хронические формы с высокой активностью, быстрым развитием цирроза печени с тяжелым прогрессирующим течением и повышенной частотой развития гепатом. Показано значение генетического фактора (антигены HLA) в развитии той или иной формы дельта-инфекции. В последние годы наблюдается тенденция не только к снижению встречаемости вируса в эндемичных регионах и смягчению тяжести течения гепатита и цирроза печени дельта-вирусной этиологии (патоморфоз), но и к повышению частоты выявления HDV в зонах усиленной миграции населения.
Введение
Вирус гепатита D (Hepatitis D virus, HDV) был открыт в 1977 г. М. Rizzetto и коллегами при исследовании биоптатов печени, полученных от больных хронической инфекцией, вызванной вирусом гепатита В (Hepatitis B virus, HBV), c наиболее выраженными повреждениями печени. Иммунофлуоресцентный анализ гепатоцитов показал наличие специфического антигена – дельта-антигена (HDAg). Одновременно в сыворотках крови данных пациентов были обнаружены специфические антитела к этому антигену (HDAb) [1–3].
Позднее было продемонстрировано, что инфекция HBV, ассоциированная с HDAg (HBV/HDV), не развивается у шимпанзе, у которых в крови ранее выявлялись титры антител к поверхностному антигену HBV (HBsАg). При этом отмечалось быстрое повышение и персистирование HDAg у шимпанзе, хронически инфицированных HBV. Было высказано предположение, что HDAg – новый маркер трансмиссивного патогена, вариант вируса гепатита B либо новый вирус, которому необходим HBV в качестве «помощника». При изучении сывороток M. Rizzetto и соавт. обнаружили наличие антител HDAb у больных из Италии и всего мира, что позволило говорить о широкой распространенности HDV [2–5]. Впоследствии было установлено, что помимо ассоциации нового антигена с HBsAg он объединен с небольшой РНК, являющейся возможным генетическим материалом подобных вирусов. Это также указывало на независимость данного генетического материала от генома HBV [6].
Таким образом, геном HDV оказался самым мелким из всех известных вирусов РНК, содержащих около 1682 пар нуклеотидов, и напоминал вирусы растений. В 1986 г. HDV был назван первым вирусом животных с идентифицированной циркулярной РНК, что свидетельствовало о его происхождении от растительных вирусов. По размеру и вторичной структуре он схож с растительными аироидами и вирусоидами [7, 8].
Еще одной необычной особенностью РНК HDV стала открытая в 1989 г. способность к саморасщеплению (из-за присутствия фермента рибозима) на геномную и антигеномную последовательность РНК, представляющую собой цепочку из 85 нуклеотидов, которые самостоятельно расщепляются и связываются воедино. Рибозимы также встречаются в вироидах растений, хотя и имеют иную структуру, чем вирус дельта [9, 10].
Лишь в 1993 г. были опубликованы результаты важнейшего исследования T.B. Fu и J. Taylor [11], позволившие расширить знания о роли HBV и гепатоцитов в репликации HDV. Транскрипция геномной и антигеномной вирусной РНК осуществляется при участии РНК-полимеразы двух гепатоцитов. Предполагалось, что особая форма вирусной РНК может распознаваться РНК-полимеразой-2 как стандартная двухцепочечная ДНК. Конечный итог репликации – преобразование геномной и антигеномной РНК, катализированной рибозимом, с разъединением продукта транскрипции (геномная – антигеномная РНК) в форму циркулярной РНК вируса HDV [11–14].
Таким образом, HDV – дефектный РНК-вирус, требующий HBsAg от HBV для сборки вириона, его высвобождения и передачи. Вирус представляет собой частицу размером 36 нм с внутренним рибонуклеопротеиновым комплексом примерно 20 нм в диаметре, состоящим из РНК-содержащего генома, объединенного со структурным белком – HDAg, окруженным оболочечным гликопротеином HBsAg. В инфицированных клетках формирование рибонуклеопротеида не зависит от HBV, однако без покрытия HBsAg он не может выходить из клетки и инфицировать другие гепатоциты. Следовательно, HDV является вирусом – спутником HBV и может инфицировать лиц, которые либо одновременно получают HBV (коинфекция), либо уже являются носителями HBsAg (суперинфекция). Важный момент: при наличии антител к HBsAg (иммунные к HBV-инфекции) пациенты невосприимчивы к HDV [15–17].
Классификация
Международным комитетом по таксономии вирусов (International Committee on Taxonomy of Viruses, ICTV) HDV признан новым видом вирусов позвоночных, единственным представителем которого является семейство Deltaviridae, а видом – Deltavirus. Хотя HDV имеет простое строение и по способу репликации похож на фитопатогены, вироиды и вирусоиды, он существенно отличается от других вирусов и считается особым видом. HDV обычно классифицируется как сателлитный вирус, или спутник HBV: основной биологический принцип его функционирования заключается в том, что HDV не способен к инфекции в отсутствие HBV [12, 18, 19].
Строение вируса
На поверхности HDV имеется сферическое липопротеиновое покрытие, содержащее HBsAg [20]. Внутри вириона находится рибонуклеопротеин, состоящий из вирусного генома и HDAg. Вирусный геном состоит из одноцепочечной циркулярной РНК (ssRNA) молекулярной массой около 1,7 кДа с отрицательной полярностью. Из-за большого количества гуанина и цитозина около 74% нуклеотидов в этой молекуле комплементарны сами по себе, могут образовывать особую вторичную структуру и объединяться с HDAg [21, 22].
HDAg – единственный белок, кодируемый HDV. Этот фосфопротеин может находиться в двух особых формах: короткой – HDAg-S и длинной – HDAg-L молекулярной массой 24 кДа (195 аминокислот) и 27 кДа (214 аминокислот) соответственно.
Как показали результаты исследований, HDAg-S способствует репликации РНК, тогда как HDAg-L обеспечивает образование покрытия HDV RNA и сборку вириона [23–27].
Во время цикла репликации антигеномная РНК подвергается посттранскрипционной модификации, а ген, кодирующий HDAg-S, модифицируется ферментом аденозин-дезаминазой (ADAR1), белком хозяина (гепатоцит), меняющим аденин на инозин, непрямым образом меняющим стоп-кодон УАГ на УГГ (триптофан), известный под названием «сайт Янтарь/W», что дает начало гену, кодирующему HDAg-L с дополнительными 19 аминокислотами [29–31].
Различия между двумя формами HDAg – 19 дополнительных аминокислот в С-терминальном регионе HDAg-L. Обе изоформы HDAg совместно имеют многочисленные функциональные домены, включая RNA-связывающий домен (RBD), ядерный локализационный сигнал (NLS), спирально свернутый домен (ССD), и С-терминальную часть последовательности, богатой пролином и глицином. 19 дополнительных аминокислот протеина HDAg-L являются сигнальной последовательностью для сборки вируса (VAS), который является высоко вариабельным и имеет специфическую последовательность для каждого генотипа. Будучи ключевым в сборке вирусной частицы, он служит связующим звеном при взаимодействии HBsAg и мембраны. HDAg подвергается нескольким посттранскрипционным модификациям, таким как фосфорилирование, ацетилирование и метилирование, а в случае с HDAg-L – изопренилирование. Метилирование Арг13, ацетилирование Лиз72 и фосфорилирование Сер177 и Сер123 связаны с внутриклеточной локализацией HDAg и репликацией РНК. Большая часть из этих изменений важны для участия HDAg-S в репликации HDV РНК, которая происходит путем прямой стимуляции продолжения транскрипции через замену транскрипционного фактора супрессии транскрипции, связанного с РНК-полимеразой-2 [32–42].
Репликация генома полностью управляется РНК, то есть весь синтез новой РНК осуществляется с использованием непосредственно РНК HDV как матрицы, без промежуточного образования матричной ДНК для репликации. В гепатоцитах HDV синтезирует комплементарную РНК, получившую название антигеномной, на основе генома исходной РНК вируса. Геном и антигеном содержат один рибозимный домен по 85 нуклеотидов, способный к саморасщеплению и самосвязыванию. Это необходимо для репликации вирусной РНК [43–46].
HDV использует способ репликации, называемый двойным скользящим кругом, что очень напоминает репликацию вироидов, вирусоидов и вироидоподобных сателлитных РНК [47].Главной особенностью этого типа репликации является использование циркулярной цепи РНК в качестве исходной матрицы, которая транскрибируется РНК-зависимой РНК-полимеразой хозяина или вируса-помощника. Заслуживает внимания тот факт, что HDV – единственный человеческий патоген, который использует фермент хозяина [48–50].
Вместе с тем в случае с вирусом HDV, где клеткой хозяина является гепатоцит, вследствие отсутствия РНК-зависимой РНК-полимеразы в эукариотических клетках данный вирус «вводит в заблуждение» и использует собственную РНК-полимеразу гепатоцита. Далее новая цепь РНК подвергается рибозим-каталитическому расщеплению и в конце концов связывается с ферментами клетки хозяина [51].
Исследования последних десятилетий расширили понимание репликации HBV, что позволяет предположить участие аналогичных механизмов в развитии начальных этапов инфицирования гепатоцитов [52, 53].
В начале поверхностные белки – производные оболочки вируса HBV связываются с гепарансульфат-протеогликанами (HSPG). Эта связь, несмотря на низкую аффинность, важна при инфекционном процессе, так как помогает адгезии вириона к клеточному рецептору, Na+-таурохолат ко-транспортному полипептиду (NTCP). Лишь после первого шага – связи с NTCP возникает высокоаффинная связь, запускающая процесс проникновения вирусной частицы за счет эндоцитоза внутрь клетки. После проникновения в клетку рибонуклеопротеид HDV высвобождается в цитоплазму и переносится, транслоцируется при участии HDAg в клеточное ядро через сайт с ядерной локализацией (NLS). Переносится рибонуклеопротеид транспортными белками клетки – импортинами [54–59].
В ядре, особенно в нуклеоплазме, геномная РНК транскрибируется РНК-полимеразой-2 в немодифицированную м-РНК, которая в свою очередь мигрирует в цитоплазму, где транслируется в HDAg-S (требующий для репликации РНК HDV). В ядре, точнее в нуклеосоме, геномная РНК траскрибируется с помощью РНК-полимеразы-1 в комплементарную РНК-матрицу, называемую антигеномной РНК. В нуклеоплазме антигеномная РНК транскрибируется РНК-полимеразой-2 в новую геномную РНК [41, 60].
Позднее часть антигеномной РНК, чтобы стать матрицей для редактированной геномной РНК, подвергается редактированию через ADAR1. Так редактируется м-РНК и далее становится источником HDAg-L.
Согласно данным исследований, ошибки, возникающие в процессе работы полимераз и катализируемых ADAR1 редактирование Янтарь/W, а также рекомбинации РНК, способствуют генетической гетерогенности HDV. Причем ряд исследований показал, что рекомбинации не являются чем-то редким [61–63].
В исследовании B.T. Sy и соавт. показано, что происходит в геноме HDV при рекомбинации в положении nt908, локализованной ниже рибозимной активности (Rz), до полиаденилирования и формирования полиадениловой сигнальной последовательности. Эта рекомбинация может способствовать вариабельности генотипов HDV [64].
Две изоформы HDAg посылаются в ядро, где они связываются с новой нередактированной геномной РНК, образуя новый рибонуклеопротеин, который переносится в цитоплазму. Таким образом, РНК-HDV может реплицироваться в гепатоцитах и образовывать РНК-HDV без помощи HBV [17]. Вместе с тем HBV необходим для активной HDV-инфекции: при сборке вириона HDAg-L будет взаимодействовать с HBsAg в эндоплазматической сети с образованием инфекционной вирусной частицы, где после высвобождения новых вирусных частиц через комплекс Гольджи эти частицы начнут инфицировать другие клетки [64, 65].
Генотипы и эпидемиология
По оценкам исследователей, в мире насчитывается 400 млн хронических носителей HBV, из которых у 15–20 млн имеются серологические свидетельства наличия HDV [63, 66].
Разнообразие генетики вирусов связано с географическим происхождением изолятов. Выявлено и классифицировано восемь генотипов, которые идентифицированы, – с HDV-1 до HDV-8 [67–70].
Традиционно к регионам с высокой эндемичностью HDV относят Центральную и Северную Африку, бассейн Амазонки, Восточную Европу и Средиземноморье, Средний Восток и части Азии [69]. HDV-1 распространен повсеместно [75] и выявлен в США, Европе и на Среднем Востоке, а также в России, Африке, Азии и Бразилии [24, 71–76].
HDV-2, ранее известный как генотип IIa, обнаруживается в Японии, на Тайване и в России [77–79]. HDV-3 был изолирован в Амазонском регионе (Перу, Колумбия, Эквадор, Бразилия) [80–83]. Этот генотип относится к наиболее агрессивным среди всех генотипов HDV и характеризуется развитием острых гепатитов, нередко с фульминантным течением [72, 82]. HDV-4 (ранее генотип IIb) выявляется на Тайване и в Японии [84]. Генотипы HDV-5, HDV-6, HDV-7 и HDV-8 в основном обнаруживаются в Африке [67].
В странах СНГ и Прибалтике встречаемость HDV у хронических носителей HВsAg низкая (большая часть Европейской части России, Украина, Белоруссия). Молдавия считается гиперэндемичной по HDV. Маркеры HDV широко распространены в Средней Азии, Казахстане, Азербайджане (15–17%), а также в ряде регионов Сибири [85–94].
При проведении исследований в Астраханской области нами было установлено, что у носителей HBsAg частота обнаружения HDAb составляет 2,7%. При этом среди лиц с острым HВV-гепатитом HDAb обнаруживается почти в 10% случаев. За период 1990–2010 гг. сывороточные маркеры HDV (HDAb) были исследованы у 266 пациентов с хроническим гепатитом (ХГ) и циррозом печени (ЦП). При этом со временем наблюдалась отчетливая тенденция к снижению частоты выявления HDAb в Астраханском регионе. Так, за 1990–2000 гг. HDAb выявлен у 50,3% больных ХГ и ЦП, а за 2001–2010 гг. – лишь у 25%. Причем у четверти всех лиц с наличием сывороточных маркеров HDV при проведении иммуноферментного анализа HBsAg не обнаружен. Этот факт указывает на необходимость определения маркеров HDV даже в отсутствие признаков HBV-инфекции. Кроме того, доказана связь между частотой ХГ D и ЦП D и алкогольным фактором. Как уже отмечалось, после 2000 г. маркеры HDV, согласно полученным данным, стали встречаться при ХГ и ЦП более чем вдвое реже, чем в предшествовавшем периоде наблюдения (25 0,05), а при ЦП – с 89 до 44% (р
Течение гепатита D
Клинический исход острого HDV зависит от типа инфекции. В то время как коинфекция HBV/HDV хронизируется лишь в 2% случаев, суперинфекция HDV переходит в хроническую форму примерно в 90% случаев. Начиная с самых ранних исследований HDV рассматривают как высокопатогенный вирус, вызывающий более тяжелую форму ХГ вирусной этиологии во всех возрастных группах. ЦП развивается примерно в 70–80% случаев в течение десяти лет после дебюта HDV. При этом имеются сообщения о благоприятном клиническом течении заболевания, сопровождающемся минимальным повреждением печени [89, 96–98].
Отсутствие длительных проспективных исследований естественного течения заболевания затрудняет определение долгосрочных последствий ХГ D, таких как развитие ЦП, декомпенсация функционального состояния печени и развитие гепатоцеллюлярной карциномы (ГЦК). Таким образом, большая часть данных получена в ретроспективных исследованиях, предоставляющих общую картину естественного течения гепатита D. Однажды возникнув, ЦП может стать стабильной болезнью в течение десятилетия, хотя позднее в ходе прогрессирования заболевания значительная часть больных умирает от печеночной декомпенсации или ГЦК, независимо от проведения трансплантации печени. Ежегодная частота развития печеночной декомпенсации при ЦП D варьируется от 2,6 до 3,6%, а ГЦК – от 2,6 до 2,8% [99–102].
В течение двух последних десятилетий зарегистрировано значительное снижение частоты HDV-инфекции в развитых странах, особенно в Южной Европе, вследствие всеобщей вакцинации против HBV и улучшения социально-экономических условий. Резкое изменение в эпидемиологии привело к значительному уменьшению новых случаев гепатита D в Европе с преобладанием лиц с декомпенсированным ЦП либо неактивной, не прогрессирующей болезнью. В настоящее время новые и высокоактивные формы гепатита D определяются в Европе лишь у мигрантов из областей с распространенной эндемичной HDV-инфекцией или внутривенных наркоманов [103].
Дельта-инфекция характеризуется определенной генетической гетерогенностью. Ее клинические особенности, варианты течения, предрасположенность и резистентность к данной патологии могут быть связаны с антигенами главного комплекса гистосовместимости человека – HLA. Так, согласно данным наших исследований, у русских пациентов с дельта-вирусными ХГ и ЦП чаще встречаются антигены HLA-B8, B35, редко – HLA-B18. При этом у пациентов с аналогичными заболеваниями печени, вызванными только вирусом HBV, наблюдается повышенная частота прежде всего HLA-B18, в меньшей степени HLA-B35. У казахских пациентов отмечается ассоциация дельта-инфекции с антигенами HLA-B35 и B40, а также с гаплотипами A2/B35 и A1/B35 [89, 104–106].
Вирус гепатита D и ГЦК
Гепатоцеллюлярная карцинома является важной медико-социальной проблемой и остается второй по частоте причиной смерти от рака в мире. С ГЦК связаны более чем 90% случаев первичного рака печени. ГЦК ассоциируется с особенно плохим прогнозом, возникновением 700 000 новых случаев в год и ежегодной смертностью до 600 000 [107, 108].
Все виды вирусных гепатитов склонны к хронизации и являются этиологическим фактором более чем 80% случаев ГЦК. Подсчитано, что в настоящее время примерно 170 млн хронических носителей HCV, 350 млн носителей HBV и 15–20 млн носителей HDV составляют общее число инфицированных вирусными гепатитами в мире [109].
Некоторые механизмы развития ГЦК и ее прогрессирования доказаны при наличии вирусной гепатотропной инфекции. Они включают антивирусный противовоспалительный ответ, иммунную «зачистку» инфицированных клеток и последующую регенерацию гепатоцитов, которые приводят к генетическим и эпигенетическим изменениям, предрасполагающим к развитию ГЦК [74, 110–112].
Эксперты IARC разделили ряд инфекционных агентов на группы по частоте развития рака: группа 1 – высокая частота канцерогенеза у человека; группа 2А – возможный эффект канцерогенеза; группа 2В – низкий канцерогенный эффект; группа 3 – недостаточная доказанность канцерогенеза.
HBV и HCV отнесены IARC к группе 1. HDV уже несколько лет причисляют к группе 3, так как доказательств роли HDV как фактора, способствующего развитию ГЦК при HBV, недостаточно. Однако имеются данные, что риск ГЦК выше при наличии суперинфекции вирусом HDV на фоне инфекции HBV [113–115].
Повышенная частота ЦП, ассоциированная с повышенным развитием печеночного воспаления, у хронических носителей HDV представляет непрямой фактор риска в отношении ГЦК. Тем не менее дальнейшее повышение онкогенности вследствие собственно HDV-инфекции не доказано [116, 117].
В ряде исследований в отличие от моноинфекции HBV коинфекция HBV/HDV повышала риск ГЦК, приводя к трехкратному росту частоты ГЦК и двукратному росту смертности [100, 118]. Между тем ретроспективный анализ 962 больных с HBV, из которых 82 имели коинфекцию HDV, показал одинаковые уровни ГЦК в обеих группах. Таким образом, подобные взаимодействия носят противоречивый характер, и роль HDV в индукции и развитии ГЦК подлежит дальнейшему изучению [119].
R. Romeo и соавт. показали, что высокая скорость репликации HDV у нецирротических больных ассоциируется с ускорением прогрессирования цирроза и развитием ГЦК (при мультивариантном анализе относительный риск 1,42; 95%-ный доверительный интервал 1,04–1,95; p = 0,03). Роль HDV-виремии как предиктора неблагоприятного исхода у больных ЦП менее существенна [120].
Таким образом, HDV остается потенциальным фактором риска тяжелого течения заболевания печени и развития ГЦК, но в отличие от HВV и HСV, при которых высокая частота канцерогенеза считается доказанным фактом, установление подобной закономерности для HDV требует дальнейших исследований.
Заключение
HDV обладает уникальными особенностями строения и жизненного цикла, является «помощником» вируса гепатита В. Он крайне неравномерно распространен в мире, причем площадь эндемичных зон сравнительно невелика.
Дельта-инфекцию принято подразделять на ко- и суперинфекцию с развитием тяжелых форм острого и хронического гепатита, нередко с быстро прогрессирующим течением заболевания и развитием осложнений.
Распространение вакцинации против гепатита B значительно снизило частоту HDV к 2000–2010 гг., однако резкое усиление миграции из эндемичных регионов и распространение внутривенных наркотиков вновь сделали проблему HDV актуальной в развитых странах.
Результаты абсолютного большинства исследований указывают на высокую частоту развития ЦП как исхода заболевания с быстрым развитием декомпенсации печени. В отношении гепатомы данные противоречивы: имеется информация о высокой частоте развития ГЦК при дельта-вирусной инфекции и незначительном вкладе HDV в канцерогенез. В мире вновь возрастает интерес к дельта-инфекции в силу тяжести заболевания и нерешенных проблем, в частности связанных с лечением.
Продолжение следует
Вирус гепатита D, антитела класса IgM (Hepatitis delta virus, IgM antibodies; anti-HDV IgM )
Исследуемый материал
Сыворотка крови
Метод определения
Иммуноанализ.
Маркёр острой инфекции.
Вирус гепатита D (HDV) – неполноценный РНК-содержащий вирусный агент, который в своем жизненном цикле зависит от вируса гепатита В, используя его белок (HBsAg) для собственной оболочки. Поэтому гепатит D может развиваться только у тех лиц, которые также инфицированы вирусом гепатита B (HBsAg-положительных). Пути передачи этого вируса от человека к человеку аналогичны передаче вируса гепатита B – через кровь, продукты крови; возможна передача инфекции при половых контактах. Распространенность данной инфекции достаточно широкая, ориентировочная встречаемость HDV у носителей HBsAg – порядка 5%.
Различают коинфекцию (одновременное возникновение у человека вирусного гепатита В и инфицирование HDV) и суперинфекцию (когда инфицирование вирусом гепатита D произошло на фоне уже имеющейся инфекции вирусом гепатита B). Острая коинфекция HBV-HDV в подавляющем большинстве случаев (до 90%) имеет благоприятный исход, заканчивается спонтанным избавлением от вируса, но она может вызвать и очень тяжелый острый гепатит с риском фульминантного течения болезни. Частота хронизации гепатита В при коинфекции не повышается, но хронический гепатит в случае коинфекции сопряжен с высоким риском развития тяжелого поражения печени.
Суперинфекция HDV (на фоне уже имеющегося хронического гепатита В) протекает клинически более тяжело, чем коинфекция. Спонтанное избавление от вируса наблюдается лишь у 15% пациентов. Присоединение HDV ухудшает течение хронического гепатита B, повышает вероятность развития фульминантной патологии печени.
Исследование антител класса IgM позволяет отличить острую инфекцию HDV от хронической. Как и при изолированной инфекции HBV, при HBV-HDV коинфекции HBsAg появляется в среднем через 2 месяца после инфицирования, после чего можно выявить маркёры репликации HDV (см. тест №325 – HDV РНК) и преходящее появление анти-HDV антител (антитела класса IgM — в течение 3-4 месяцев).
Одновременное с anti-HDV IgM выявление анти-HBcore IgM (маркёра острого гепатита В, см. тест №76) с большой долей вероятности позволяет отличить коинфекцию HBV-HDV от суперинфекции. У больных с суперинфекцией анти-HBcore IgM антитела не выявляются или присутствуют в очень низком титре.
Литература
- Wedemeyer, H.&Manns, M.P. Epidemiology, pathogenesis and management of hepatitis D: update and challenges ahead Nat. Rev. Gastroenterol. Hepatol. 2010, 7, 31–40.
- К.П. Майер. Гепатит и последствия гепатита. М. Гэотар Медицина, 1999. 412 с.
Гепатит D стал излечим – аналитический портал ПОЛИТ.РУ
Ежегодно от гепатита B умирают около 780 тысяч человек, сообщает Всемирная организация здравоохранения. Эта форма вируса может эволюционировать в «суперинфекцию», когда на него «наслаивается» дефектный гепатит D. Вовремя принятая вакцина излечивает от гепатита B в 90% случаев, но специальных лекарств от суперинфекции на рынке пока не существует. Решение должно появиться в 2017 году: российская компания «Гепатера» выпустит на фармацевтический рынок препарат, способный противостоять гепатиту B и D.
Гепатит D является наименее распространенной, но наиболее тяжелой формой вирусного гепатита. Было подсчитано, что около 15 миллионов людей с гепатитом В инфицированы гепатитом D. Оба они распространяются через биологические жидкости человека и ведут себя крайне агрессивно, приводя к циррозу и раку печени у 70% больных. Такая форма вируса сравнительно редко встречается в России и более распространена в странах Африки, расположенных к югу от Сахары, и в странах Восточной Азии, где хронически инфицированы гепатитом B и D до 10% взрослого населения.
Хотя рынок терапии хронического гепатита В с каждым годом растет, радикальных методов лечения не появляется, а существующие препараты остаются дорогостоящими. Гепатит D сегодня излечим лишь у небольшого количества пациентов, для которых эффективными оказывается курс интерферонов (ряда белков, выделяемых клетками организма в ответ на вторжение вируса). Надежду больным дает отечественный стартап.
Биотехнологическая компания «Гепатера» была основана в России в партнерстве с немецкой компанией MYR специально для разработки и выведения на рынок препаратов для лечения заболеваний печени. Мирклюдекс – первый их проект. Он направлен на лечение хронических вирусных гепатитов В и D.
«Мирклюдекс – липопептид, составленный из 47 аминокислот, который специфически блокирует рецептор, важный для проникновения вирусов гепатитов В и D в клетки печени, – объясняет управляющий партнер компании «Максвелл Биотех» Дмитрий Попов. – Такой механизм действия предотвращает поражение здоровых клеток и останавливает распространение инфекционного процесса». При хроническом гепатите B «Мирклюдекс» может быть компонентом комбинированной терапии для полного излечения пациентов. Его формула также эффективна при суперинфекции (B и D). «Препаратов с аналогичным механизмом действия для терапии вирусных гепатитов в настоящее время на мировом и российском рынке нет, – добавил Дмитрий Попов. – Это единственное лекарство, уже находящееся на стадии клинических исследований и продемонстрировавшее клинический эффект у пациентов с гепатитом D, для которых не существует других терапевтических возможностей».
Для того, чтобы зарегистрировать препарат, необходимо определить оптимальную дозировку и получить статистически достоверные данные на большой выборке пациентов. Противовирусная молекула была протестирована в двух крупнейших европейских научных центрах — университете Хайдельберга (Германия) и институте INSERM (Франция). «Гепатере» принадлежат права на исследование «Мирклюдекс» на территории РФ и стран СНГ и поэтому компания тестировала препарат в научно-исследовательских центрах России на 48 пациентах с хроническим гепатитом B, а также на 24 пациентах с хроническим гепатитом B и D. Препарат принимали как в отдельности, так и в комбинации с интерфероном. В обоих случаях он показал хорошую переносимость и благоприятный профиль безопасности. В 2014 году завершилась вторая фаза клинических исследований препарата для гепатита B, где проверялась его эффективность и безопасность.
На вопрос, возможно ли благодаря «Мирклюдекс» полное излечение пациентов с гепатитом D, Дмитрий Попов ответил, что это пока не доказано, поскольку нужно проследить изменения при длительном лечении. Но шансы высоки: «исследования продолжаются, и эффект от применения препарата при гепатите D мы наблюдали даже у пациентов с начавшимся фиброзом и компенсированным циррозом печени», – говорит он.
Препарат будет выпускаться в форме лиофилизата для приготовления раствора для инъекций. При таком способе вещества мягко высушиваются, а препарат замораживается и помещается в вакуумную камеру, где завершается его изготовление. Сейчас препарат производится на международной площадке, но «Гепатера» планирует перенести производство готовой лекарственной формы в РФ. Цена на «Мирклюдекс» будет устанавливаться на уровне препаратов, которыми в настоящее время лечат гепатит B. Кроме того, производители попытаются включить лекарство в список ЖНВЛП (Жизненно необходимых и важнейших лекарственных средств – перечень, утверждаемый Правительством РФ для регулирования цен) и в государственные закупки.
Для того, чтобы начать создание продукта, в декабре 2011 года «Гепатера» стала резидентом Биомедицинского кластера Сколково. На ранних этапах в разработку инвестировали российский венчурный фонд «Максвелл Биотех» и немецкий Hi Tech Grunderfond. Проект также получает поддержку от Департамента развития фармацевтической и медицинской промышленности Минпромторга РФ в рамках государственной программы «Фарма 2020». Поскольку проект находится на клинической стадии, основу команды составляют менеджеры и специалисты с международным опытом работы в фармацевтическом бизнесе и индустрии клинических исследований.
В настоящее время компания ведет подготовку к третьей фазе клинических исследований по гепатиту B и ко второй фазе клинических исследований по гепатиту D. Для второго исследования «Гепатера» запросила грант у Фонда «Сколково». «Сейчас мы рассматриваем заявку компании на грант для завершения второй фазы клинических испытаний при гепатите D, в том числе при комбинированном применении «Мирклюдекса» и стандартной терапии, – говорит директор по медицинским программам «Сколково» Гелена Лифшиц. – Думаю, прием заявки на грант – дело ближайшей недели. Надеемся, что в этом году компания выйдет на Грантовый комитет и получит наше финансирование».
Сотрудники «Гепатеры» уверены, что «Мирклюдекс» станет международным стандартом терапии пациентов с гепатитом D и войдет в режим излечивающей терапии гепатита В. То же говорит о препарате и Гелена Лифшиц — она называет его «потенциальным блокбастером на международном рынке» и утверждает, что другие стартапы в кластере, занимающиеся похожими исследованиями, пока сильно отстают от «Гепатеры».
Регистрация препарата планируется на 2017 год: компания рассматривает разные варианты коммерциализации своих прав.2 ME5/ML. и фи…
Добрый день! В 2018 обратилась к гастроэнтэрологу с жалобой на стул (запор). После обследования: ФГДС (биопсия из антрального отдела. Заключение — поверхностный гастрит. Дуодено-гастральный рефлюкс. Поверхностный дуоденит), УЗИ (перегиб желчного пузыря). Врач прописала Урсосан (1 мес), тримедат (1 мес). Все прошло. В 2019 стала ощущать дискомфорт справа в районе печени. Врач назначил (УЗИ, ФГДС, ОАК). ФГДС: биопат пищевода — материал, взятый из пищеводно-желудочного соединения, мелкие фрагменты оболочки пищевода, представленные утолщенным многослойным плоским эпителием без подлежащих тканей, с воспалительной инфильтрацией, полнокровием; и фрагменты поверхностных отделов слизистой оболочки желудка с очаговой гиперплазией желез, воспалительной инфильтрацией. Диагноз по МКБ — К20 — Эзофагит.
Биопат желудка: хронический поверхностный антральный гастрит низкой степени активности, полнокровие, отек стромы, Hp-.
УЗИ: уз-признаков структурной патологии не выявлено.
ОАК: HGB ( концентрация гемоглобина) понижена — 117 Г/л
Биохимия: глюкоза понижена (3,65), холестерин высокой плотности (2,13).
Инфекции: поверхностный антиген вируса гепатита В, HBsAg — не обнаружен
Суммарные антитела к антигенам гепатита С, anti-HCV-total — не обнаружены
Антиген ВИЧ р24 и антитела к ВИЧ 1 и 2 типов (HIV Ag/Ab Combo) — не обнаружены.
По результатам прописал Одестон (14 дней), Урсосан (мес), Ребагит (10 дн) + стол №5. Анализы Ферретин, Железо крови, ВитД, Вит В12. Через месяц Дискомфорт в правом подреберье все равно время от времени ощущала (но не постоянно). Врач еще раз прописал этиже препараты (мес) + Аквадетрим (2 месеца), а также консультацию гематолога (показатели анализов низкие: B12 — 213, Ферритин — 11,4, Вит Д общий 25-ОН — 28,10)).
Гематолог попросил сдать ОАК, биохимию повторно.
Железо — 5,4.
Есть еще низкие показатели, но врач сказал, что на это не стоит обращать внимание: цветной показатель — 0.836
сегментоядерные нейтрофилы понижены — 44.9
лимфоциты повышены — 39.9
Прописала — мальтофер или феррум-лек по 100мг по 1 таб. 3 раза в сутки 1 месяц, далее 1 таблетка два раза в сутки — 3 месяца.
В настоящий момент дискомфорт бескопоит. Таблетки, прописанные в последний раз не принимала. Скажите, этот дискомфорт может означать проблемы какие-либо, или я зря беспокоюсь? Все таки уже не в первый раз обращаюсь к гастроэнтэрологу.
P.S: не знаю нужно ли это, но я делала вапоризацию шейки матки (дисплазия шейки матки 1 ст) 10.10.2019
Самый агрессивный гепатит, приводящий к циррозу печени, теперь излечим — Российская газета
Сейчас, когда все сосредоточены на новом коронавирусе, как-то не на слуху другие инфекции. А ведь их никто не отменял, и заражаются ими десятки, сотни тысяч людей ежегодно.
В международный день борьбы с гепатитами эксперты предупредили: заболеваемость особо опасным гепатитом С растет, а с гепатитом В ситуация улучшается благодаря вакцинации. Еще одна хорошая новость: самый агрессивный гепатит Д, который приводит к циррозу печени всего за несколько лет после заражения, теперь излечим.
— Каждый год в России больных хроническим гепатитом С становится больше на 45-50 тысяч человек — это те, кто оказывается под наблюдением врачей, — сообщил главный внештатный инфекционист минздрава России Владимир Чуланов. — Заболеваемость гепатитом В снизилась до 0,6 случая на 100 тысяч населения — это уже уровень благополучных европейских стран. Это произошло исключительно благодаря широкой вакцинации: всего в России от гепатита В привито уже более 100 миллионов человек.
Самый редкий, но и самый агрессивный — гепатит Д, который сопутствует гепатиту В. Это такая особенность этого вируса — сам он проникнуть в организм не может, но легко «присоединяется» к проводнику, которым и выступает вирус гепатита В.
«По гепатиту Д мы обычно даем самый неблагоприятный прогноз. У него быстрая прогрессия, и из тех, кому впервые ставится этот диагноз, 60-70 процентов уже имеют цирроз печени», — пояснил главный инфекционист.
Беда в том, что все гепатиты только иногда протекают в острой форме, чаще они атакуют незаметно — печень не болит, а другие возможные симптомы человек списывает на усталость, простуду, другие незначимые причины.
Вот признаки поражения вирусами гепатита В, С, Д:
— усталость;
— плохой аппетит, тошнота;
— субфебрильная температура;
— боль в суставах;
— темный цвет мочи;
— пожелтение кожи и глазных яблок.
Сегодня единственным способом гарантированно предотвратить заражение гепатитом Д остается вакцинация от гепатита B. От гепатита С вакцины пока нет. Но зато в отличие от гепатита В (от него лекарства нет) гепатит С, а теперь и Д стали излечимы. Несколько лет назад был создан эффективный противовирусный препарат, который воздействует на вирус С. Причем не приостанавливает его разрушительное действие (как, например, в случае терапии ВИЧ — она пожизненная), а действительно полностью уничтожает. Произошел прорыв и в лечении гепатита Д: новый препарат, как говорят специалисты, эффективен даже на стадии уже начавшегося цирроза печени. Изначально разработанная в Германии лекарственная молекула была доведена до статуса лекарства в России. И с мая 2020 года наш препарат стал доступен для лечения в стационарах.
Если гепатит А — типичная инфекция «грязных рук», то вирусы В, С, Д передаются через кровь и ее компоненты. Заразиться можно грязной иглой при уколе, при переливании крови, а также занимаясь незащищенным сексом с инфицированным.
Главная защита — ограничить контакты с биологическими жидкостями: использовать одноразовые шприцы для уколов и одноразовые мединструменты. Убедиться, что маникюр-педикюр вам выполняют продезинфицированными по всем правилам ножницами, щипчиками и пилками (а лучше вовсе отказаться от обрезного маникюра). И конечно, быть уверенным в своем партнере.
Гепатит D Вопросы и ответы для общественности
Что такое гепатит D?
Гепатит D — это инфекция печени, вызываемая вирусом гепатита D. Только люди, инфицированные вирусом гепатита B, могут заразиться гепатитом D. Они могут заразиться обоими вирусами одновременно (так называемая «коинфекция») или заразиться гепатитом D после первого заражения вирусом гепатита B (известная как «суперинфекция»). . Гепатит D может вызвать тяжелые симптомы и серьезное заболевание, которое может привести к пожизненному повреждению печени и даже смерти.
Что такое коинфекция гепатита B / гепатита D?
Люди, инфицированные одновременно гепатитом B и D одновременно, считаются инфицированными одновременно. Коинфекция гепатитом B и гепатитом D может вызвать серьезные краткосрочные проблемы со здоровьем и даже печеночную недостаточность, но обычно не приводит к пожизненному заболеванию.
Что такое суперинфекция гепатита D?
Суперинфекция возникает, когда люди заражаются гепатитом D после первого заражения вирусом гепатита B.Этот тип инфекции с большей вероятностью приведет к длительному заболеванию, включая быстрое развитие фиброза печени, печеночную недостаточность и даже смерть.
Насколько распространен гепатит D в Соединенных Штатах?
Гепатит D считается необычным в США. Однако количество людей с гепатитом D неизвестно, потому что эта инфекция не отслеживается ни отделами здравоохранения, ни CDC.
Где чаще всего встречается гепатит D?
Гепатит D наиболее распространен в Восточной Европе, Южной Европе, Средиземноморском регионе, на Ближнем Востоке, в Западной и Центральной Африке, Восточной Азии и в бассейне Амазонки в Южной Америке.
Как распространяется гепатит D?
Вы можете заразиться гепатитом D только после контакта с кровью или биологическими жидкостями человека, инфицированного вирусом гепатита D. Это может произойти через
- секс с инфицированным человеком
- совместное использование игл, шприцев или любого другого оборудования, используемого для приготовления или инъекции наркотиков
- рождение от инфицированной матери (хотя это бывает редко)
- Попадание крови из открытых язв инфицированного человека
- Укол иглы или соприкосновение с острыми инструментами
- обмен личными вещами (например,g., бритвы и зубные щетки), которые могли контактировать с кровью инфицированного человека.
Могу ли я заразиться гепатитом D, кроме контакта с кровью и биологическими жидкостями инфицированного человека?
Нет. Вирус гепатита D не передается через пищу или воду, при совместном использовании столовых приборов, при кормлении грудью, объятиях, поцелуях, держании за руки, кашле или чихании.
Кто подвержен риску заражения гепатитом D?
Люди с риском гепатита D также подвержены риску гепатита B.Вы можете подвергаться повышенному риску, если вам
лет.
- инфицированы вирусом гепатита B
- Потребитель инъекционных наркотиков
- половой партнер человека, инфицированного вирусом гепатита B и / или вирусом гепатита D
- коинфицированы ВИЧ и вирусом гепатита B
- Мужчина, имеющий секс с мужчинами
Подвержен ли я риску заражения гепатитом D, если я был вакцинирован против гепатита B?
Нет. Люди, которые получают вакцину против гепатита В, также защищены от гепатита D.
У кого больше шансов иметь долгосрочные проблемы со здоровьем, такие как прогрессирующее повреждение печени, после инфицирования вирусом гепатита D?
Люди, заразившиеся гепатитом D после заражения вирусом гепатита В («суперинфекция»), имеют гораздо больше шансов получить повреждение печени и даже смерть в результате своей инфекции, чем те, кто заразится обеими инфекциями одновременно («Коинфекция»).
Каковы признаки и симптомы гепатита D?
Люди с гепатитом D могут иметь более серьезные симптомы, чем те, кто инфицирован только гепатитом В.Признаки и симптомы гепатита D обычно появляются через 3–7 недель после заражения вирусом гепатита D. В их числе:
- Лихорадка
- Усталость
- Потеря аппетита
- Тошнота
- Рвота
- Боль в животе
- Темная моча
- Табурет глиняный
- Боль в суставах
- Желтуха
Отличаются ли симптомы коинфекции от симптомов суперинфекции?
Да.Люди, которые заражаются обоими вирусами одновременно, («коинфекция») могут иметь различные наборы симптомов в течение двух отдельных периодов времени. Это происходит потому, что симптомы гепатита B могут проявляться в другое время, чем симптомы гепатита D. Люди, которые заболевают гепатитом D после того, как впервые были инфицированы вирусом гепатита B («суперинфекция»), обычно испытывают быстрые и тяжелые симптомы. Этот тип инфекции может привести к серьезным долгосрочным последствиям для здоровья, таким как заболевание печени и смерть.
Как узнать, инфицирован ли я вирусом гепатита D?
Если вы испытываете симптомы гепатита D, обратитесь к своему врачу. Анализ крови необходим для выявления заражения вирусом, вызывающим гепатит D.
Как лечится гепатит D?
Лекарство, отпускаемое по рецепту, под названием интерферон, может помочь некоторым пациентам, и в настоящее время изучаются новые методы лечения. Людям с терминальной стадией заболевания печени в результате гепатита D может потребоваться пересадка печени.
Как предотвратить гепатит D?
Чтобы предотвратить гепатит D, вы можете сделать прививку от гепатита B. Хотя вакцины против гепатита D нет, вакцинация против гепатита B также защищает вас от гепатита D.
Гепатит D: симптомы, диагностика и лечение
Что такое гепатит D?
Гепатит D — это инфекция печени, которую можно получить, если у вас гепатит B. Он может вызвать серьезные симптомы, которые могут привести к пожизненному повреждению печени и даже смерти.Иногда его называют дельта-вирусом гепатита (HDV) или дельта-гепатитом.
Хотя HDV не распространен в США, это самая тяжелая форма гепатита. Со временем это может привести к раку печени или печеночной недостаточности. Хотя лечение HDV может быть проблемой, врачи надеются, что в ближайшее время появятся более эффективные методы лечения.
Симптомы гепатита D
Признаки HDV могут включать:
Если у вас уже есть гепатит B, HDV может ухудшить ваши симптомы.
Причины гепатита D
Вы можете заразиться HDV, если вступите в контакт с кровью или другими биологическими жидкостями больного им человека.Тем не менее, он может заразить вас, только если у вас гепатит B. HDV нуждается в штамме гепатита «B», чтобы выжить.
Это может произойти двумя способами:
- Коинфекция: вы можете заразиться HBV и HDV одновременно
- Суперинфекция: вы можете сначала заболеть гепатитом B, а затем заболеть HDV. Это наиболее распространенный способ заразиться гепатитом D.
Факторы риска
Ваши шансы заразиться гепатитом D повышаются, если вы:
- У вас гепатит B
- Инъекционные наркотики
- Занимаетесь сексом с кем-то, у кого гепатит B или D
- Имеете ВИЧ и гепатит B
- Мужчина, имеющий половые контакты с другими мужчинами
Передача гепатита D
Вы можете заразиться гепатитом D только после контакта с кровью или другими жидкостями организма человека, у которого он есть.Это может произойти, если вы:
- Занимаетесь сексом с кем-то, у кого есть вирус
- Делитесь иглами, используемыми для инъекций наркотиков
- Коснитесь открытых ран человека, у которого есть вирус
- Возьмите иглу, которая контактировала с инфицированным человек
- Делитесь личными вещами, такими как бритвы или зубные щетки, которые могли коснуться крови инфицированного человека
Это редко, но матери также могут заразить своих детей HDV во время родов.
Диагноз гепатита D
Врач задаст вопросы о ваших симптомах и образе жизни, а затем проведет обследование.Они проверит вашу кровь на разные типы гепатита. Если он у вас есть, ваш врач проведет дополнительные анализы крови и визуализирующие исследования, чтобы проверить вашу печень на наличие признаков повреждения.
Лечение гепатита D
Если у вас HDV, возможно, вам потребуется обратиться к врачу, работающему с заболеваниями пищеварительного тракта, в том числе печени, например, к гастроэнтерологу. Врачи, называемые гепатологами, специализируются еще больше и лечат только заболевания печени.
Лекарства от HDV пока нет. Пока врачи не предложат лучшие варианты, чаще всего назначают пегилированный интерферон альфа (пег-IFNa).
Peg-IFNa подходит не всем. Он также может вызывать множество побочных эффектов, таких как недостаток энергии, потеря веса, симптомы гриппа и проблемы с психическим здоровьем, такие как депрессия.
Врачи не знают, как долго должно длиться лечение от HDV. Возможно, вам потребуется принимать пег-IFNa в течение года. Если анализ крови по-прежнему показывает определенное количество вируса в вашем организме, ваш врач может посоветовать вам оставаться на PEG-IFNa еще до 1 года.
Насколько хорошо работает лечение?
Ваш ответ на лечение HDV будет зависеть от того, как вы заболели этим вирусом.
Peg-IFNa часто помогает избавиться от HDV у большинства людей с коинфекцией. Если у вас суперинфекция, вероятность исчезновения вируса снижается. Возможно, вам придется научиться управлять HDV и HBV на протяжении всей жизни.
Испытываются и другие виды лечения HDV. К ним относятся лекарства, которые атакуют вирус или предотвращают его прикрепление к клеткам гепатита В, которые необходимы им для выживания.
Если у вас запущенное заболевание печени, ваш врач порекомендует пересадку печени.
Профилактика гепатита D
Никакая вакцина не может предотвратить HDV. Лучший способ избежать этого — снизить риск заражения гепатитом B. Поговорите со своим врачом о вакцинации против HBV. Избегайте контакта с кровью или другими биологическими жидкостями человека, больного гепатитом.
Не пользуйтесь общими иглами, если вы употребляете инъекционные наркотики.
- Если у вас уже есть гепатит B, вы можете снизить риск HDV. Это означает:
- Храните личные вещи, такие как зубная щетка и бритва, отдельно друг от друга.
- Наденьте перчатки, если вам нужно прикоснуться к чужой открытой ране или болячке.
Если у вас HDV, делайте каждый день здоровый выбор, чтобы защитить свою печень от дальнейшего повреждения. Избегайте алкоголя и поговорите со своим врачом о том, как правильно питаться. Вам также следует позаботиться о том, чтобы не заразить других. Сообщайте своему врачу и стоматологу свой диагноз перед каждым визитом. Также небезопасно для окружающих сдавать ткани, органы, кровь, сперму или другие биологические жидкости.
Гепатит D — NORD (Национальная организация по редким заболеваниям)
Выявление и диагностика HDV основывается на лабораторных исследованиях образцов крови.Рекомендации Американской ассоциации по изучению заболеваний печени (AASLD) предлагают тестирование на HDV с тестом на общие антитела у пациентов с хроническим HBV, которые относятся к группе высокого риска. Одним из элементов высокого риска является местоположение, включая людей, родившихся в регионах с высокой распространенностью вирусных гепатитов, таких как Западная Африка, Африканский Рог, Центральная и Северная Азия, Монголия, Пакистан, Япония, Тайвань, Кирибати, Науру, Ближний Восток. , Восточно-Средиземноморские регионы, Турция, бассейн Амазонки и Гренландия.Другими лицами высокого риска являются лица, употребляющие инъекционные наркотики, мужчины, имеющие половые контакты с мужчинами, люди с ВИЧ или коинфекцией гепатита С, лица с риском заболеваний, передающихся половым путем, и пациенты с повышенным уровнем ферментов печени, несмотря на низкий уровень ДНК ВГВ. Фонд гепатита B рекомендует проводить тестирование на HDV у всех пациентов с HBsAg +, поскольку тестирование на основе риска оказалось неудачным, и отсутствуют рецензируемые ссылки, подтверждающие, что тестирование на основе риска поможет в элиминации вирусного гепатита.
Клинические испытания и обследование
Первоначальная оценка HDV включает лабораторное тестирование образцов крови на общий иммуноглобулин G (IgG) и антитела IgM к HDV.Если обнаруживаются общие антитела к HDV (включая IgG), следует провести количественное тестирование с помощью полимеразной цепной реакции (ПЦР). Тест ПЦР ищет свидетельства активной инфекции HDV, в частности РНК HDV, которая обеспечивает свидетельство наличия активной репликации HDV.
Учитывая, что все пациенты с HDV будут иметь хроническую инфекцию HBV, уже должна была быть проведена комплексная оценка HBV. Это включает качественное тестирование на e-антиген гепатита B (HBeAg), e-антитело к гепатиту B (anti-HBe) и количественную ПЦР ДНК HBV, а также количественное тестирование на поверхностный антиген гепатита B, если таковое имеется.Все люди также должны пройти обследование на иммунитет к вирусу гепатита А с помощью теста, который выявляет общие антитела к вирусу гепатита А (включая антитела IgG). В случае отрицательного результата следует провести соответствующую вакцинацию. Все пациенты также должны пройти тестирование на вирус гепатита С и ВИЧ.
Чтобы отследить прогрессирование заболевания, все люди, оцениваемые на инфекцию HDV, также должны проходить обычное тестирование для установления исходного уровня и измерения относительно этого исходного уровня с течением времени. Необходима оценка ферментов печени, включая аспартатаминотрансферазу, аланинаминотрансферазу и щелочную фосфатазу.Также следует провести функциональные пробы печени, включая билирубин (прямой билирубин), альбумин и протромбиновое время (ПВ) / международное нормализованное отношение (МНО). Подсчет тромбоцитов следует включать в качестве косвенной оценки портальной гипертензии, поскольку это показатель цирроза печени. Также необходимо провести оценку рубцевания печени (фиброза печени). Это может быть сделано несколькими способами: с использованием показателей прогнозирования фиброза на основе неинвазивных серологических исследований (таких как оценка фиброза-4 {FIB-4}), с использованием индекса отношения аспартатаминотрансферазы к тромбоцитам (APRI), с использованием запатентованной тесты (такие как Fibrosure) или тесты на усиленный фиброз печени.Оценка фиброза печени на основе неинвазивной визуализации также может быть выполнена с помощью таких опций, как транзиторная эластография Fibroscan, эластография сдвиговой волной на основе ультразвука или магнитно-резонансная эластография. Учитывая доступность нескольких неинвазивных вариантов оценки фиброза печени, биопсия печени менее часто используется для определения стадии фиброза печени, но все же может быть полезна, когда диагноз не ясен, или для оценки других заболеваний печени, которые также могут присутствовать. , такие как неалкогольный стеатогепатит (НАСГ) и алкогольная болезнь печени (AALD).
Гепатит D | Кливлендская клиника
Вирусология
Вирусология
Талал Адхами, Мэриленд
Уильям Д. Кэри, Мэриленд
Гепатит D или дельта-вирус (HDV) — это дефектный одноцепочечный РНК-вирус, требующий присутствия вируса гепатита B (HBV) для его экспрессии и репликации. HDV представляет собой сферическую частицу размером от 35 до 37 нм, покрытую липопротеиновой оболочкой, полученной из HBsAg. HDV-РНК состоит из 1680 нуклеотидов, и репликация ограничена гепатоцитами. Считается, что это самый маленький геном РНК среди вирусов животных.
Распространенность
Распространенность
HDV имеет мировое распространение. Это эндемический вид в развивающихся странах, с высокой распространенностью в Южной Америке. Инфекция HDV встречается только у пациентов с HBV-инфекцией и, как и гепатит B, передается парентерально. Во всем мире около 5% носителей HBV являются анти-HDV-положительными. Дельта-гепатит остается распространенной проблемой среди потребителей инъекционных наркотиков.
Патофизиология
Патофизиология
Пациенты могут быть инфицированы HDV одновременно с заражением вирусом гепатита B (острая коинфекция) или могут заразиться вирусом после заражения гепатитом B (суперинфекция).До сих пор неясно, является ли вирус непосредственно цитотоксическим или является ли иммунный ответ ответственным за патологию. Иммунный ответ может быть преобладающим медиатором при хроническом заболевании, тогда как прямая вирусная цитотоксичность может преобладать при острой инфекции. Некровоспалительная активность выражена, но гистологические признаки неспецифичны для хронической инфекции HDV.
Признаки и симптомы
Признаки и симптомы
Симптомы инфекции HDV неспецифичны, и у большинства пациентов заболевание протекает субклинически.Большинство пациентов, инфицированных HDV и HBV, одновременно избавляются от дельта-вируса, тогда как у 70–90% суперинфицированных развивается хроническая дельта-инфекция. Суперинфекция вызывает более тяжелое острое заболевание, чем только ВГВ, и несет более высокий риск фульминантной печеночной недостаточности, которая встречается в 5-20% случаев.
Диагностика
Диагностика
Диагноз дельта-гепатита следует рассматривать только при наличии положительной инфекции HBV. Обычно это находит положительный результат в сыворотке крови на HBsAg или HBV DNA, или на то и другое вместе.Диагноз можно поставить путем измерения антител к дельта-антигену с помощью ELISA. Однако он может быть положительным после удаления вируса, особенно в случае коинфекции HBV-HDV. Антитела IgM повышаются при поражении печени, а не только при остром заболевании; они, по-видимому, исчезают, когда гепатит проходит. Наличие антигена HDV в сыворотке подтверждает диагноз, как и РНК HDV, которая доступна только в условиях исследования. Антитела к HDV (IgG) могут проявляться в высоких титрах при хронической инфекции HDV, тогда как более низкие титры могут быть обнаружены после разрешения вируса.
Уход
Лечение
Дельта-гепатит можно предотвратить путем вакцинации против гепатита В. В настоящее время не существует эффективной вакцины для предотвращения дельта-гепатита у хронических носителей гепатита В. Дельта-гепатит можно лечить высокими дозами интерферона до 9 миллионов ЕД три раза в неделю в течение 1 года. Хотя до 70% пациентов выводят вирус и нормализуют уровни ферментов печени, почти у всех пациентов в какой-то момент после терапии наблюдается рецидив. Ортотопическая трансплантация печени рекомендуется пациентам в декомпенсированной фазе.Интересно, что пациенты с HDV, которым была проведена трансплантация печени, имеют более высокие шансы на выживание трансплантата, чем те, кто получил трансплантат только от гепатита B. Это явление может быть результатом ингибирующего действия HDV на репликацию HBV. Этим пациентам вводят иммуноглобулин против гепатита В.
Итоги
Результатов
Коинфекция HDV и HBV может привести к тяжелому фульминантному гепатиту и печеночной недостаточности или может сохраняться как хроническая инфекция, приводя к циррозу или гепатоцеллюлярной карциноме.Хроническая инфекция может сохраняться в неактивной фазе, а у некоторых пациентов наступает полная ремиссия. Вероятность прогрессирования цирроза выше у пациентов с дельта-гепатитом, чем у пациентов, инфицированных только гепатитом B, как и риск гепатоцеллюлярной карциномы. Пациенты с коинфекцией вируса иммунодефицита человека или гепатита С имеют худший исход.
Резюме
Сводка
- Гепатит D или дельта-вирус (HDV) — это дефектный одноцепочечный РНК-вирус, требующий присутствия вируса гепатита B (HBV) для его экспрессии и репликации.HDV имеет мировое распространение. Это эндемический вид в развивающемся мире.
- HDV-инфекция ограничивается пациентами с HBV-инфекцией и, как и гепатит B, передается парентерально.
- Инфекция HDV вызывает более тяжелое острое заболевание, чем только HBV, и несет более высокий риск фульминантной печеночной недостаточности, которая встречается в 5-20% случаев.
- Вероятность прогрессирования цирроза выше у пациентов с дельта-гепатитом, чем у пациентов с гепатитом B, как и риск гепатоцеллюлярной карциномы.
- Дельта-гепатит можно предотвратить путем вакцинации против гепатита B.
Рекомендуемое чтение
Рекомендуемая литература
- Польский LB, Gallagher M, Fields HA, Hadler SC. Дельта-гепатит: молекулярная биология и клинико-эпидемиологические особенности. Clin Microbiol Rev.1993, 6: 211-229.
- Chu CM, Yeh CT, Liaw YF. Вирусная суперинфекция у ранее неизвестных хронических носителей вируса гепатита B с наложенным острым фульминантным гепатитом в сравнении с нефульминантным.J Clin Microbiol. 1999, 37: 235-237.
- Huo TI, Wu JC, Lai CR, et al: Сравнение клинико-патологических особенностей гепатоцеллюлярной карциномы, связанной с вирусом гепатита B, с суперинфекцией вируса гепатита D или без нее. J Hepatol. 1996, 25: 439-444.
- Mendez L, Reddy KR, Di Prima RA, et al: Фульминантная печеночная недостаточность из-за острого гепатита B и дельта-коинфекции: вероятная передача через кровь, связанная с подпружиненным устройством для укола пальца. Am J Gastroenterol. 1991, 86: 895-897.
молекулярной биологии и клинико-эпидемиологических особенностей.
Clin Microbiol Rev.1993 июл; 6 (3): 211–229.
Отделение гепатита, Центры по контролю и профилактике заболеваний, Атланта, Джорджия 30333.
Эта статья цитируется в других статьях в PMC.
Abstract
Вирус гепатита дельта, открытый в 1977 году, требует помощи вируса гепатита В для репликации в гепатоцитах и является важной причиной острых, молниеносных и хронических заболеваний печени во многих регионах мира.Из-за вспомогательной функции вируса гепатита дельта инфицирование им происходит либо как коинфекция с гепатитом B, либо как суперинфекция носителя поверхностного антигена гепатита B. Хотя механизмы передачи аналогичны механизмам передачи вируса гепатита B, модели передачи дельта-вируса широко варьируются во всем мире. В регионах мира, в которых инфицирование вирусом гепатита дельта не является эндемическим, болезнь ограничивается группами с высоким риском заражения гепатитом B и носителями гепатита B с высоким риском.Из-за склонности этой вирусной инфекции вызывать молниеносные, а также хронические заболевания печени, дальнейшее проникновение вируса гепатита дельта в районы мира, где хроническая инфекция гепатита B является эндемической, будет иметь серьезные последствия. Профилактика зависит от широкого использования вакцины против гепатита В. Этот обзор посвящен молекулярной биологии, а также клиническим и эпидемиологическим особенностям этой важной вирусной инфекции.
Полный текст
Полный текст доступен в виде отсканированной копии оригинальной печатной версии.Получите копию для печати (файл PDF) полной статьи (4,2 МБ) или щелкните изображение страницы ниже, чтобы просмотреть страницу за страницей. Ссылки на PubMed также доступны для Избранные ссылки .
Избранные ссылки
Эти ссылки находятся в PubMed. Это может быть не полный список ссылок из этой статьи.
- Abbatte EA, Fox E, Said-Salah, Constantine NT, Wassef HH. Этнические различия в распространенности возбудителя гепатита дельта в Джибути.Trans R Soc Trop Med Hyg. 1989, январь-февраль; 83 (1): 107–108. [PubMed] [Google Scholar]
- Ацети А., Папаро Б.С., Селестино Д., Пенника А., Каферро М., Грилли А., Себастиани А., Мохамуд О. М., Абдирахман М., Байл К. Сероэпидемиология инфекции вируса гепатита дельта в Сомали. Trans R Soc Trop Med Hyg. Май-июнь 1989 г .; 83 (3): 399–400. [PubMed] [Google Scholar]
- Alter MJ, Margolis HS. Возникновение гепатита В как заболевания, передающегося половым путем. Med Clin North Am. 1990 ноя; 74 (6): 1529–1541. [PubMed] [Google Scholar]
- Амазиго Ю.О., Чим А.Инфекция вирусом гепатита дельта в восточной Нигерии: предварительное исследование. Trans R Soc Trop Med Hyg. 1988. 82 (6): 907–907. [PubMed] [Google Scholar]
- Арагона М., Маканьо С., Каредда Ф, Кривелли О., Лаварини С., Маран Е., Фарси П., Перселл Р. Х., Риццетто М. Серологический ответ на вирус гепатита дельта при гепатите D. Ланцет. 1987, 28 февраля; 1 (8531): 478–480. [PubMed] [Google Scholar]
- Арико С., Арагона М., Риццетто М., Каредда Ф., Занетти А., Маринуччи Дж., Диана С., Фарси П., Арноне М., Капорасо Н. и др.Клиническое значение антител к вирусу гепатита дельта у бессимптомных носителей HBsAg. Ланцет. 17 августа 1985 г .; 2 (8451): 356–358. [PubMed] [Google Scholar]
- Арригони А., Понцетто А., Актис Дж., Бонино Ф. Левамизол и хронический дельта-гепатит. Ann Intern Med. 1983 июн; 98 (6): 1024–1024. [PubMed] [Google Scholar]
- Байи Д., Дерво А., Слуга Д., Паркет П.Дж. Распространенность инфекций вируса гепатита B, дельта-агента и вируса иммунодефицита человека у наркоманов. Biomed Pharmacother.1989. 43 (6): 431–437. [PubMed] [Google Scholar]
- Bass BL, Weintraub H. Раскручивающая активность, которая ковалентно модифицирует свой субстрат двухцепочечной РНК. Клетка. 23 декабря 1988 г .; 55 (6): 1089–1098. [PubMed] [Google Scholar]
- Bensabath G, Hadler SC, Soares MC, Fields H, Dias LB, Popper H, Maynard JE. Инфекция вируса гепатита дельта и гепатит Лабреа. Распространенность и роль молниеносного гепатита в бассейне Амазонки. ДЖАМА. 24 июля 1987 г .; 258 (4): 479–483. [PubMed] [Google Scholar]
- Бергманн К.Ф., Герин Дж.Л.Антигены вируса гепатита дельта в печени и сыворотке крови человека и животных. J Infect Dis. Октябрь 1986 г .; 154 (4): 702–706. [PubMed] [Google Scholar]
- Bezeaud A, Rosenswajg M, Guillin MC. Оценка пяти тестов маркеров вируса гепатита дельта для обнаружения антигена и антител. J Clin Microbiol. 1989 декабрь; 27 (12): 2880–2880. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Бонино Ф, Капорасо Н., Дентико П., Маринуччи Дж., Валери Л., Кракси А., Асьоне А., Раймондо Дж., Пиччинино Ф, Рокка Дж. И др.Знакомая кластеризация и распространение инфекции вируса гепатита дельта. J Hepatol. 1985. 1 (3): 221–226. [PubMed] [Google Scholar]
- Бонино Ф., Херманн К.Х., Риццетто М., Герлих У. Вирус гепатита дельта: белковый состав дельта-антигена и его оболочки, полученной из вируса гепатита В. J Virol. 1986 июнь; 58 (3): 945–950. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Бонино Ф, Хойер Б., Ши Дж. У., Риццетто М., Перселл Р. Х., Герин Дж. Л.. Возбудитель дельта-гепатита: структурные и антигенные свойства дельта-ассоциированной частицы.Infect Immun. 1984 Март; 43 (3): 1000–1005. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Bonino F, Negro F, Baldi M, Brunetto MR, Chiaberge E, Capalbo M, Maran E, Lavarini C, Rocca N, Rocca G. Естественная история хронической дельты гепатит. Prog Clin Biol Res. 1987. 234: 145–152. [PubMed] [Google Scholar]
- Branch AD, Benenfeld BJ, Baroudy BM, Wells FV, Gerin JL, Robertson HD. Структурный элемент РНК, чувствительный к ультрафиолету, в вироидоподобном домене вируса гепатита дельта. Наука.1989, 3 февраля; 243 (4891): 649–652. [PubMed] [Google Scholar]
- Branch AD, Robertson HD. Цикл репликации вироидов и других малых инфекционных РНК. Наука. 1984, 3 февраля; 223 (4635): 450–455. [PubMed] [Google Scholar]
- Buitrago B, Popper H, Hadler SC, Thung SN, Gerber MA, Purcell RH, Maynard JE. Специфические гистологические признаки гепатита Санта-Марта: тяжелая форма инфекции, вызванной дельта-вирусом гепатита, в северной части Южной Америки. Гепатология. 1986 ноябрь-декабрь; 6 (6): 1285–1291. [PubMed] [Google Scholar]
- Бути М., Аменгуал М.Дж., Эстебан Р., Пухоль А., Харди Р., Альенде Х., Роже М., Казакуберта Д.М., Гуардия Дж., Родригес Д.Л.Серологический профиль тканевых аутоантител при остром и хроническом дельта-гепатите. J Hepatol. 1989 ноябрь; 9 (3): 345–350. [PubMed] [Google Scholar]
- Бути М., Эстебан Р., Эстебан Дж. И., Альенде Х., Джарди Р., Гуардия Дж. Анти-HD IgM как маркер хронической дельта-инфекции. J Hepatol. 1987 февраль; 4 (1): 62–65. [PubMed] [Google Scholar]
- Бути М., Эстебан Р., Джарди Р., Альенде Х., Базельга Дж. М., Гуардия Дж. Эпидемиология дельта-инфекции в Испании. J Med Virol. 1988 ноябрь; 26 (3): 327–332. [PubMed] [Google Scholar]
- Бути М., Эстебан Р., Харди Р., Эстебан Дж. И., Гуардия Дж.Серологический диагноз острого дельта-гепатита. J Med Virol. 1986, январь, 18 (1): 81–85. [PubMed] [Google Scholar]
- Бути М., Эстебан Р., Роггендорф М., Фернандес Дж., Джарди Р., Рашофер Р., Альенде Х., Дженеска Дж., Эстебан Дж., Гуардия Дж. РНК вируса гепатита D при острой дельта-инфекции: серологический профиль и корреляция с другими маркерами вирусной инфекции гепатита D. Гепатология. 1988 сентябрь-октябрь; 8 (5): 1125–1129. [PubMed] [Google Scholar]
- Канезе М.Г., Риццетто М., Арико С., Кривелли О., Занетти А.Р., Маккиорлатти Е., Понцетто А., Леоне Л., Молло Ф, Верме Г.Ультраструктурное и иммуногистохимическое исследование дельта-антигена, связанного с вирусом гепатита В. J Pathol. 1979, август; 128 (4): 169–175. [PubMed] [Google Scholar]
- Caredda F, Antinori S, Pastecchia C, Coppin P, Palla M, Ponzetto A, Rizzetto M, Moroni M. Частота инфицирования вирусом гепатита дельта при остром HBsAg-отрицательном гепатите. J Infect Dis. 1989 Май; 159 (5): 977–979. [PubMed] [Google Scholar]
- Caredda F, Antinori S, Re T., Pastecchia C, Moroni M. Течение и прогноз острого гепатита HDV.Prog Clin Biol Res. 1987. 234: 267–276. [PubMed] [Google Scholar]
- Caredda F, Rossi E, d’Arminio Monforte A, Farci P, Lavarini C. Вспышка дельта-агента среди группы наркоманов и их близких людей. J Infect Dis. 1984 Февраль; 149 (2): 286–287. [PubMed] [Google Scholar]
- Caredda F, Rossi E, d’Arminio Monforte A, Zampini L, Re T, Meroni B, Moroni M. Коинфекция, связанная с вирусом гепатита B, и суперинфекция с дельта-агентом: неразличимое заболевание с различным исходом .J Infect Dis. 1985 Май; 151 (5): 925–928. [PubMed] [Google Scholar]
- Cargnel A, Davoli C, Vigano P, Caccia MR, Zanetti AR, Tovey G, Ellis DS, Zuckerman AJ. Паралич седьмого черепного нерва с миокимией при острой коинфекции гепатитом В и дельта-вирусами. J Med Virol. 1988 июн; 25 (2): 245–247. [PubMed] [Google Scholar]
- Кейси Дж. Л., Бергманн К. Ф., Браун Т. Л., Герин Дж. Л.. Структурные требования для редактирования РНК в вирусе гепатита дельта: доказательства механизма редактирования уридина в цитидин.Proc Natl Acad Sci U S. A. 1992, 1 августа; 89 (15): 7149–7153. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кастро А., Педрейра Дж., Санчес П. Гепатит дельта-инфекции на северо-западе Испании. Ланцет. 25 марта 1989 г .; 1 (8639): 665–665. [PubMed] [Google Scholar]
- Чех TR, Bass BL. Биологический катализ РНК. Анну Рев Биохим. 1986; 55: 599–629. [PubMed] [Google Scholar]
- Чанг Флорида, Чен П.Дж., Ту С.Дж., Ван СиДжей, Чен Д.С. Большая форма дельта-антигена гепатита имеет решающее значение для сборки вируса гепатита дельта.Proc Natl Acad Sci U S. A. 1991, 1 октября; 88 (19): 8490–8494. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Chang MF, Baker SC, Soe LH, Kamahora T., Keck JG, Makino S, Govindarajan S, Lai MM. Дельта-антиген гепатита человека представляет собой ядерный фосфопротеин с РНК-связывающей активностью. J Virol. Июль 1988 г .; 62 (7): 2403–2410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Чао М., Шей С.Ю., Тейлор Дж. Роль двух форм антигена вируса гепатита дельта: доказательства механизма самоограничивающейся репликации генома.J Virol. Октябрь 1990; 64 (10): 5066–5069. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Chao YC, Chang MF, Gust I, Lai MM. Консервация последовательности и дивергенция РНК вируса гепатита дельта. Вирусология. Октябрь 1990; 178 (2): 384–392. [PubMed] [Google Scholar]
- Чао Ю.К., Ли К.М., Тан Х.С., Говиндараджан С., Лай М.М. Молекулярное клонирование и характеристика изолята вируса гепатита дельта из Тайваня. Гепатология. 1991 Февраль; 13 (2): 345–352. [PubMed] [Google Scholar]
- Chen CJ, Hwang SJ, Fan KY, Chang SA, Chang YH, Wang SR, Liu W.T., Liaw YF, Chai CY, Chang R и др.Сероэпидемиология Т-лимфотропных вирусов человека и вирусов гепатита среди проституток на Тайване. J Infect Dis. 1988 сентябрь; 158 (3): 633–635. [PubMed] [Google Scholar]
- Chen DS, Lai MY, Chen PJ, Sheu JC, Yang PM, Sung JL. Инфекция вирусом гепатита D в гиперэндемичной зоне хронической вирусной инфекции гепатита B: опыт Тайваня. Prog Clin Biol Res. 1991; 364: 75–80. [PubMed] [Google Scholar]
- Chen DS, Lai MY, Sung JL. Инфекция дельта-агентом у пациентов с хроническими заболеваниями печени и гепатоцеллюлярной карциномой — нечастая находка на Тайване.Гепатология. 1984 Май-июнь; 4 (3): 502–503. [PubMed] [Google Scholar]
- Чен П.Дж., Калпана Дж., Голдберг Дж., Мейсон В., Вернер Б., Герин Дж., Тейлор Дж. Структура и репликация генома вируса гепатита дельта. Proc Natl Acad Sci U S. A. 1986, ноябрь; 83 (22): 8774–8778. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Chen PJ, Chen DS, Chen CR, Chen YY, Chen HM, Lai MY, Sung JL. Дельта-инфекция у бессимптомных носителей поверхностного антигена гепатита В: низкая распространенность дельта-активности и эффективное подавление репликации вируса гепатита В.Гепатология. 1988 сентябрь-октябрь; 8 (5): 1121–1124. [PubMed] [Google Scholar]
- Чин К.П., Говиндараджан С., Редекер АГ. Постоянный клиренс HBsAg при хронической вирусной инфекции гепатита В после острой дельта-суперинфекции. Dig Dis Sci. Июль 1988 г .; 33 (7): 851–856. [PubMed] [Google Scholar]
- Chu CM, Liaw YF, Pao CC, Huang MJ. Этиология острого гепатита накладывается на ранее неизвестных бессимптомных носителей HBsAg. Гепатология. Март 1989 г .; 9 (3): 452–456. [PubMed] [Google Scholar]
- Чанг, округ Колумбия, Ко Ю.С., Чен СиДжей, Чен Э.Р., Ву С.К., Ву П.С.Сероэпидемиология инфекций вируса гепатита B, вируса гепатита D и вируса иммунодефицита человека среди лиц, злоупотребляющих парентеральными наркотиками на юге Тайваня. J Med Virol. 1989 августа; 28 (4): 215–218. [PubMed] [Google Scholar]
- Чунг Д.К., Ко Ю.С., Чен СиДжей, Ву С.К., Чен Э.Р., Ляу Ю.Ф., Хван С.Дж. Сероэпидемиологические исследования инфицирования вирусами гепатита B и D среди пяти этнических групп на юге Тайваня. J Med Virol. 1988 декабрь; 26 (4): 411–418. [PubMed] [Google Scholar]
- Коломбо М., Камбьери Р., Руми М.Г., Рончи Дж., Дель Нинно Э, Де Франчис Р.Длительная дельта-суперинфекция у носителей поверхностного антигена гепатита В и ее связь с течением хронического гепатита. Гастроэнтерология. 1983 август; 85 (2): 235–239. [PubMed] [Google Scholar]
- Craxì A, Raimondo G, Longo G, Giannuoli G, De Pasquale R, Caltagirone M, Patti S, Squadrito G, Pagliaro L. Инфекция агентом Delta при остром гепатите и хронических носителях HBsAg с и без заболевание печени. Кишечник. 1984 Ноябрь; 25 (11): 1288–1290. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Crivelli O, Rizzetto M, Lavarini C, Smedile A, Gerin JL.Иммуноферментный анализ для обнаружения антител к дельта-антигену, ассоциированному с поверхностным антигеном гепатита В. J Clin Microbiol. 1981, август; 14 (2): 173–177. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Crovari P, Santolini M, Bandettini R, Bonanni P, Branca P, Coppola RC. Эпидемиология инфекций HBV и HDV в сельской местности Центральноафриканской Республики. Prog Clin Biol Res. 1991; 364: 69–73. [PubMed] [Google Scholar]
- Де Кок К.М., Говиндараджан С., Чин К.П., Редекер АГ. Дельта-гепатит в районе Лос-Анджелеса: сообщение о 126 случаях.Ann Intern Med. Июль 1986 г .; 105 (1): 108–114. [PubMed] [Google Scholar]
- Декок К.М., Джонс Б., Говиндараджан С., Редекер АГ. Распространенность инфекции вирусом гепатита дельта (дельта). Сероэпидемиологическое исследование. West J Med. Март 1988 г., 148 (3): 307–309. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- de Lalla F, Rizzardini G, Rinaldi E, Santoro D, Zeli PL, Verga G. Инфекции ВИЧ, HBV, дельта-агента и Treponema pallidum в двух сельских районах Африки. Trans R Soc Trop Med Hyg. 1990, январь-февраль; 84 (1): 144–147.[PubMed] [Google Scholar]
- Деннистон К. Дж., Хойер Б. Х., Смедиле А., Уэллс Ф. В., Нельсон Дж., Герин Дж. Л.. Клонированный фрагмент генома РНК вируса гепатита дельта: последовательность и диагностическое применение. Наука. 1986 16 мая; 232 (4752): 873–875. [PubMed] [Google Scholar]
- дель Ольмо Дж. А., Льовет Ф., Родриго Дж. М., Молина Дж., Апариси Л., Серра М. А., Вассель А., Бикскерт М. А.. Распространенность заболеваний печени и инфицирования гепатитом B, дельта-вирусом и вирусом иммунодефицита человека в двух испанских пенитенциарных учреждениях.Med Microbiol Immunol. 1990. 179 (1): 43–48. [PubMed] [Google Scholar]
- Димитракакис М., Кроу С., Густ И. Распространенность инфекции дельты в западной части Тихого океана. J Med Virol. 1986 Апрель; 18 (4): 335–339. [PubMed] [Google Scholar]
- Димитракакис М., Уоттерс М.Дж., Вуттон А., Густ I. Обнаружение антител IgM к дельта-антигену после коинфекции и суперинфекции дельта-вирусом. J Med Virol. 1986 декабрь; 20 (4): 305–311. [PubMed] [Google Scholar]
- Душейко Г.М., Бринк Б.А., Конради Д.Д., Маримуту Т., Шер Р.Распространенность вируса гепатита B, дельта и вируса иммунодефицита человека в южной части Африки: крупное обследование населения. Am J Epidemiol. 1989 Янв; 129 (1): 138–145. [PubMed] [Google Scholar]
- эль-Хазми М.А., Рамиа С. Частоты маркеров гепатита B, дельта и вируса иммунодефицита человека у саудовских пациентов с талассемией и серповидно-клеточной анемией, подвергнутых многократной трансфекции. J Trop Med Hyg. 1989 февраль; 92 (1): 1–5. [PubMed] [Google Scholar]
- Фарси П., Герин Дж. Л., Арагона М., Линдси И., Кривелли О., Балестриери А., Смедиле А., Томас Х. С., Риццетто М.Диагностическое и прогностическое значение антител IgM к вирусу гепатита дельта. ДЖАМА. 1986, 21 марта; 255 (11): 1443–1446. [PubMed] [Google Scholar]
- Фарси П., Смедиле А, Лаварини С., Пиантино П., Кривелли О., Капорасо Н., Тоти М., Бонино Ф., Риццетто М. Гепатит дельты у неявных носителей поверхностного антигена гепатита В. Заболевание, имитирующее прогрессирующий до хронического острого гепатита В Гастроэнтерология. 1983 сентябрь; 85 (3): 669–673. [PubMed] [Google Scholar]
- Фаттович Г., Боскаро С., Новента Ф, Порнаро Э., Стенико Д., Альберти А., Руол А., Реальди Г.Влияние инфекции вирусом гепатита дельта на прогрессирование цирроза при хроническом гепатите типа B. J. Infect Dis. 1987 Май; 155 (5): 931–935. [PubMed] [Google Scholar]
- Фэй Огайо. Гепатит B в Латинской Америке: эпидемиологические модели и стратегия искоренения. Латиноамериканская региональная исследовательская группа. Вакцина. Март 1990; 8 (Дополнение): S100 – S139. [PubMed] [Google Scholar]
- Филдс Х.А., Говиндараджан С., Марголис Х.С., Шабл С.Д., Эберт Дж. У., Мейнард Дж. Э. Экспериментальная передача дельта-вируса шимпанзе, хроническому носителю гепатита В, с развитием стойкого дельта-носительства.Am J Pathol. 1986 Февраль; 122 (2): 308–314. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Fonseca JC, Simonetti SR, Schatzmayr HG, Castejón MJ, Cesário AL, Simonetti JP. Распространенность инфекции вирусом гепатита дельта (HDV) среди носителей поверхностного антигена гепатита В в штате Амазонас, Бразилия. Trans R Soc Trop Med Hyg. 1988. 82 (3): 469–471. [PubMed] [Google Scholar]
- Forster AC, Symons RH. Саморасщепление плюс и минус РНК вируса и структурная модель активных сайтов.Клетка. 1987 24 апреля; 49 (2): 211–220. [PubMed] [Google Scholar]
- Forster AC, Symons RH. Саморасщепление вирусоидной РНК осуществляется предлагаемым 55-нуклеотидным активным сайтом. Клетка. 3 июля 1987 г., 50 (1): 9–16. [PubMed] [Google Scholar]
- Гленн Дж. С., Тейлор Дж. М., Уайт Дж. М.. Синтезированная in vitro РНК вируса гепатита дельта инициирует репликацию генома в культивируемых клетках. J Virol. 1990 июн; 64 (6): 3104–3107. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Glenn JS, White JM. транс-доминантное ингибирование репликации генома вируса гепатита дельта человека.J Virol. 1991 Май; 65 (5): 2357–2361. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гоудсмит Дж., Ван дер Ваальс Ф., Понцетто А., Форцани Б., Доббелаар С. Инфекции дельта-агентом, ассоциированным с вирусом гепатита В, в изолированном западноафриканском сообществе. J Trop Med Hyg. 1984 декабрь; 87 (6): 257–262. [PubMed] [Google Scholar]
- Говиндараджан С., Чин К.П., Редекер А.Г., Петерс Р.Л. Фульминантный вирусный гепатит B: роль дельта-агента. Гастроэнтерология. 1984 июн; 86 (6): 1417–1420. [PubMed] [Google Scholar]
- Говиндараджан С., Де Кок К.М., Редекер АГ.Естественное течение дельта-суперинфекции у пациентов с хроническим гепатитом В: гистопатологическое исследование с множественными биопсиями печени. Гепатология. 1986 июль-август; 6 (4): 640–644. [PubMed] [Google Scholar]
- Говиндараджан С., Филдс Х.А., Хамфри С.Д., Марголис Х.С. Патологические и ультраструктурные изменения острого и хронического дельта-гепатита у экспериментально инфицированного шимпанзе. Am J Pathol. 1986 Февраль; 122 (2): 315–322. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Govindarajan S, Hevia FJ, Peters RL.Распространенность дельта-антигена / антитела при гепатоцеллюлярной карциноме, ассоциированной с B-вирусом. Рак. 1984, 15 апреля; 53 (8): 1692–1694. [PubMed] [Google Scholar]
- Говиндараджан С., Канель Г.К., Петерс Р.Л. Распространенность дельта-антител среди пациентов, инфицированных хроническим вирусом гепатита В, в районе Лос-Анджелеса: его корреляция с диагнозом биопсии печени. Гастроэнтерология. Июль 1983 г.; 85 (1): 160–162. [PubMed] [Google Scholar]
- Говиндараджан С., Лим Б., Петерс Р.Л. Иммуногистохимическая локализация дельта-антигена, связанного с вирусом гепатита В, в биоптатах печени, содержащихся в аралдите.Гистопатология. 1984, январь; 8 (1): 63–67. [PubMed] [Google Scholar]
- Говиндараджан С., Смедиле А, Де Кок К.М., Валинлак Б., Редекер АГ, Герин Дж.Л. Изучение реактивации хронической дельта-инфекции гепатита. J Hepatol. 1989 сентябрь; 9 (2): 204–208. [PubMed] [Google Scholar]
- Гованс Э. Дж., Баруди Б. М., Негр Ф., Понцетто А., Перселл Р. Х., Герин Дж. Л.. Доказательства репликации РНК вируса гепатита дельта в ядрах гепатоцитов после заражения in vivo. Вирусология. 1988 ноябрь; 167 (1): 274–278. [PubMed] [Google Scholar]
- Гринфилд С., Фарси П., Осидиана В., Макферсон С. Н., Ромиг Т., Зейле Е., Френч М., Джонсон Б., Тукей П., Ванкья Б. М. и др.Инфекция вирусом гепатита дельта в Кении. Его географическое и племенное распространение. Am J Epidemiol. Март 1986 г., 123 (3): 416–423. [PubMed] [Google Scholar]
- Hadler SC, Alcala de Monzon M, Bensabath G, Martinez Duran M, Schatz G, Fields HA. Эпидемиология заражения вирусом гепатита дельта в менее развитых странах. Prog Clin Biol Res. 1991; 364: 21–31. [PubMed] [Google Scholar]
- Хадлер С.К., Алькала де Монсон М., Риверо Д., Перес М., Брачо А., Филдс Х. Эпидемиология и долгосрочные последствия заражения вирусом гепатита дельта у индейцев юкпа в Венесуэле.Am J Epidemiol. 1992 15 декабря; 136 (12): 1507–1516. [PubMed] [Google Scholar]
- Hadler SC, De Monzon M, Ponzetto A, Anzola E, Rivero D, Mondolfi A, Bracho A, Francis DP, Gerber MA, Thung S, et al. Дельта-вирусная инфекция и тяжелый гепатит. Эпидемия у индейцев юкпа в Венесуэле. Ann Intern Med. 1984 Март; 100 (3): 339–344. [PubMed] [Google Scholar]
- Hadziyannis SJ, Sherman M, Lieberman HM, Shafritz DA. Активность заболевания печени и репликация вируса гепатита В у носителей хронического дельта-антиген-положительного вируса гепатита В.Гепатология. 1985 июль-август; 5 (4): 544–547. [PubMed] [Google Scholar]
- Hansson BG, Moestrup T, Widell A, Nordenfelt E. Инфекция дельта-агентом в Швеции: внедрение нового возбудителя гепатита. J Infect Dis. Октябрь 1982 г., 146 (4): 472–478. [PubMed] [Google Scholar]
- He LF, Ford E, Purcell RH, London WT, Phillips J, Gerin JL. Размер возбудителя гепатита дельта. J Med Virol. 1989, январь; 27 (1): 31–33. [PubMed] [Google Scholar]
- Хеерманн К.Х., Гольдманн У., Шварц У., Зайффарт Т., Баумгартен Х., Герлих У.Большие поверхностные белки вируса гепатита В, содержащие последовательность pre-s. J Virol. 1984 ноя; 52 (2): 396–402. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hershow RC, Chomel BB, Graham DR, Schyve PM, Mandel EJ, Kane MA, Fields HA, Hadler SC. Инфекция вируса гепатита D в учреждениях штата Иллинойс для лиц с ограниченными возможностями развития. Эпидемиология и клинические проявления. Ann Intern Med. 1989 15 мая; 110 (10): 779–785. [PubMed] [Google Scholar]
- Herskowitz I. Функциональная инактивация генов доминантно-негативными мутациями.Природа. 1987, 17 сентября; 329 (6136): 219–222. [PubMed] [Google Scholar]
- Honda Y, Kondo J, Maeda T, Yoshiyama Y, Yamada E, Shimizu YK, Shikata T., Ono Y. Выделение и очистка микротрубочковых агрегатов, не связанных с гепатитом A и B. белок. J Gen Virol. Сентябрь 1990; 71 (Pt 9): 1999–2004. [PubMed] [Google Scholar]
- Хофнэгл Дж., Маллен К., Петерс М., Авиган М., Парк Й., Вагонер Дж., Герин Дж., Хойер Б., Смедайл А. Лечение хронического дельта-гепатита рекомбинантным человеческим альфа-интерфероном.Prog Clin Biol Res. 1987. 234: 291–298. [PubMed] [Google Scholar]
- Хсу Х.М., Ван Й.Ф., Ло Ш., Сунь Х.С., Ип К.К., Чен Дж.С., Чуанг СН, Чен Д.С. Инфекция вирусом гепатита D среди лиц, злоупотребляющих наркотиками внутривенно, на Тайване: анализ факторов риска и функциональные тесты печени. J Med Virol. 1990 июн; 31 (2): 76–81. [PubMed] [Google Scholar]
- Hsu HY, Chang MH, Chen DS, Lee CY. Инфекция вирусом гепатита D у детей с острой или хронической инфекцией вируса гепатита В на Тайване. J Pediatr. Июнь 1988 г .; 112 (6): 888–892.[PubMed] [Google Scholar]
- Хатчинс С.Дж., Ратьен П.Д., Форстер А.С., Саймонс Р.Х. Саморасщепление транскриптов плюс и минус РНК вироида солнечных пятен авокадо. Nucleic Acids Res. 1986, 12 мая; 14 (9): 3627–3640. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Имазеки Ф., Омата М., Охто М. Гетерогенность и скорость эволюции последовательностей РНК дельта-вируса. J Virol. 1990 ноя; 64 (11): 5594–5599. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кью М.С., Душейко Г.М., Хадзияннис С.Дж., Паттерсон А.Играет ли дельта-инфекция роль в патогенезе гепатоцеллюлярной карциномы, связанной с вирусом гепатита В? Br Med J (Clin Res Ed), 1984, 9 июня; 288 (6432): 1727–1727. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Хуроо М.С., Заргар С.А., Махаджан Р., Джавид Дж., Лал Р. Эпидемия гепатита D в предгорьях Гималаев на юге Кашмира. J Hepatol. 1988 Октябрь; 7 (2): 151–156. [PubMed] [Google Scholar]
- Kos A, Dijkema R, Arnberg AC, van der Meide PH, Schellekens H. Вирус гепатита дельта (дельта) обладает кольцевой РНК.Природа. 1986, 9 октября; 323 (6088): 558–560. [PubMed] [Google Scholar]
- Кос Т., Молин А., ван Дорн Л.Дж., ван Белкум А., Дуббелд М., Шеллекенс Х. Последовательность кДНК вируса гепатита дельта от остро инфицированного HBV шимпанзе: сохранение последовательности у экспериментальных животных. J Med Virol. 1991, август; 34 (4): 268–279. [PubMed] [Google Scholar]
- Крик М.Дж., Де Ярлэ Д.К., Трепо С.Л., Новик Д.М., Абдул-Куадер А., Рагхунат Дж. Распространенность дельта-маркеров гепатита у лиц, злоупотребляющих парентеральными наркотиками, со СПИДом и без него.J Infect Dis. 1990, август; 162 (2): 538–541. [PubMed] [Google Scholar]
- Krogsgaard K, Kryger P, Aldershvile J, Andersson P, Sørensen T.I, Nielsen JO. Дельта-инфекция и подавление репликации вируса гепатита В у хронических носителей HBsAg. Гепатология. 1987, январь-февраль; 7 (1): 42–45. [PubMed] [Google Scholar]
- Krogsgaard K, Mathiesen LR, Aldershvile J, Kryger P, Andersson P, Hansson BG, Nielsen JO, Ranek L. Дельта-инфекция и репликация вируса гепатита B у датских пациентов с молниеносным гепатитом B.Scand J Infect Dis. 1988. 20 (2): 127–133. [PubMed] [Google Scholar]
- Куо М.Ю., Чао М., Тейлор Дж. Инициирование репликации генома дельта-вируса гепатита человека из клонированной ДНК: роль дельта-антигена. J Virol. 1989 Май; 63 (5): 1945–1950. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Куо М.Ю., Голдберг Дж., Коутс Л., Мейсон В., Герин Дж., Тейлор Дж. Молекулярное клонирование РНК вируса гепатита дельта из инфицированной печени сурка: последовательность, структура и Приложения. J Virol. 1988 июнь; 62 (6): 1855–1861.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kuo MY, Sharmeen L, Dinter-Gottlieb G, Taylor J. Характеристика последовательностей саморасщепляющейся РНК в геноме и антигеноме вируса гепатита дельта человека. J Virol. 1988 декабрь; 62 (12): 4439–4444. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lange WR, Cone EJ, Snyder FR. Связь вируса гепатита дельта и вируса гепатита В у лиц, злоупотребляющих парентеральными наркотиками. 1971–1972 и 1986–1987 гг. Arch Intern Med. 1990 Февраль; 150 (2): 365–368.[PubMed] [Google Scholar]
- Леттау Л.А., Альфред Х.Дж., Глю Р.Х., Филдс Х.А., Альтер М.Дж., Мейер Р., Хадлер С.К., Мейнард Дж. Э. Внутрибольничная передача дельта-гепатита. Ann Intern Med. 1986 Май; 104 (5): 631–635. [PubMed] [Google Scholar]
- Леттау Л.А., Маккарти Дж. Г., Смит М. Х., Хадлер С. К., Морс Л. Дж., Укена Т., Бессет Р., Гурвиц А., Ирвин В. Г., Филдс Н. А. и др. Вспышка тяжелого гепатита, вызванного дельта-вирусами и вирусами гепатита B, у лиц, злоупотребляющих парентеральными наркотиками, и их контактов. N Engl J Med. 1987, 12 ноября; 317 (20): 1256–1262.[PubMed] [Google Scholar]
- Лиав Ю.Ф., Чиу К.В., Чу К.М., Шин И.С., Хуанг М.Дж. Гетеросексуальная передача вируса гепатита дельта среди населения в районе, эндемичном по инфекции вируса гепатита B: проспективное исследование. J Infect Dis. 1990 ноя; 162 (5): 1170–1172. [PubMed] [Google Scholar]
- Линь Х. Х., Ляу Й.Ф., Чен Т.Дж., Чу С.М., Хуанг М.Дж. Естественное течение пациентов с хроническим гепатитом B после суперинфекции вирусом острого гепатита дельта. Печень. 1989 июн; 9 (3): 129–134. [PubMed] [Google Scholar]
- Лин Дж. Х., Чанг М. Ф., Бейкер С. К., Говиндараджан С., Лай М. М..Характеристика антигена дельта гепатита: специфическое связывание с РНК вируса гепатита дельта. J Virol. 1990 сентябрь; 64 (9): 4051-4058. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lin SM, Ryu SJ, Liaw YF. Синдром Гийена-Барре, связанный с острой суперинфекцией вирусом дельта-гепатита. J Med Virol. Июль 1989 г .; 28 (3): 144–145. [PubMed] [Google Scholar]
- Ljunggren KE, Patarroyo ME, Engle R, Purcell RH, Gerin JL. Вирусный гепатит в Колумбии: исследование «гепатита Сьерра-Невада-де-Санта-Марта».Гепатология. Март-апрель 1985 г .; 5 (2): 299–304. [PubMed] [Google Scholar]
- Luo GX, Chao M, Hsieh SY, Sureau C, Nishikura K, Taylor J. Специфический переход оснований происходит при репликации РНК вируса гепатита дельта. J Virol. 1990 Март; 64 (3): 1021–1027. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Macagno S, Smedile A, Caredda F, Ottobrelli A, Rizzetto M. Мономерные (7S) иммуноглобулины M антитела к вирусу гепатита дельта при гепатите D. Гастроэнтерология. 1990 июн; 98 (6): 1582–1586. [PubMed] [Google Scholar]
- Macnaughton TB, Gowans EJ, Reinboth B, Jilbert AR, Burrell CJ.Стабильная экспрессия антигена вируса гепатита дельта в линии эукариотических клеток. J Gen Virol. 1990 июнь; 71 (Pt 6): 1339–1345. [PubMed] [Google Scholar]
- Макино С., Чанг М.Ф., Шие С.К., Камахора Т., Ванье Д.М., Говиндараджан С., Лай М.М. Молекулярное клонирование и секвенирование РНК вируса гепатита дельта (дельта). Природа. 1987, 24 сентября; 329 (6137): 343–346. [PubMed] [Google Scholar]
- Mandelli C, Cesana M, Ferroni P, Lorini GP, Aimo GP, Tagger A, Bianchi PA, Conte D. Инфекции HBV, HDV и ВИЧ у 242 наркозависимых: двухлетнее наблюдение .Eur J Epidemiol. 1988 сентябрь; 4 (3): 318–321. [PubMed] [Google Scholar]
- Мейнард Дж. Э., Хадлер С. К., Филдс, штат Джорджия. Дельта-гепатит в Америке: обзор. Prog Clin Biol Res. 1987. 234: 493–505. [PubMed] [Google Scholar]
- McCruden EA, Follett EA. Инфекции вируса гепатита дельта у лиц, злоупотребляющих наркотиками внутривенно, с гепатитом В на западе Шотландии. J Med Virol. Сентябрь 1989 г., 29 (1): 59–62. [PubMed] [Google Scholar]
- Меле А, Франко Э., Каприлли Ф., Джентили Дж., Стази М.А., Заратти Л., Капитанио Б., Кресчимбени Э., Корона Р., Пана А. и др.Инфекция вирусом гепатита B и дельта среди гетеросексуалов, гомосексуалистов и бисексуалов. Eur J Epidemiol. 1988 декабрь; 4 (4): 488–491. [PubMed] [Google Scholar]
- Мийч А.М., Барнс Р., Кроу С.М., Димитракакис М., Лукас ЧР. Вспышка гепатита B и D у мясников. Scand J Infect Dis. 1987. 19 (2): 179–184. [PubMed] [Google Scholar]
- Миллер Р.Х. Сравнительная молекулярная биология вирусов гепатита. Semin Liver Dis. 1991 Май; 11 (2): 113–120. [PubMed] [Google Scholar]
- Митамура К.Эпидемиология инфекции HDV в Японии. Prog Clin Biol Res. 1991; 364: 81–87. [PubMed] [Google Scholar]
- Моэструп Т., Ханссон Б.Г., Уайделл А., Норденфельт Э. Клинические аспекты дельта-инфекции. Br Med J (Clin Res Ed) 1983, 8 января; 286 (6359): 87–90. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Моранте А.Л., де ла Крус Ф., де Лопе С.Р., Эчеваррия С., Родригес Г.М., Понс-Ромеро Ф. Репликация вируса гепатита B при коинфекции гепатита B и D. Печень. 1989 Апрель; 9 (2): 65–70. [PubMed] [Google Scholar]
- Нат Н, Мушахвар И.К., Фанг CT, Бербериан Х., Додд Р.Й.Антитела к дельта-антигену у бессимптомных доноров крови, реагирующих на поверхностный антиген гепатита B, в США и их связь с другими маркерами вируса гепатита B. Am J Epidemiol. 1985 август; 122 (2): 218–225. [PubMed] [Google Scholar]
- Negro F, Baldi M, Bonino F, Rocca G, Demartini A, Passarino G, Maran E, Lavarini C, Rizzetto M, Verme G. Хронический гепатит HDV (вирус гепатита дельта). Внутрипеченочная экспрессия дельта-антигена, гистологическая активность и исход заболевания печени.J Hepatol. 1988 Февраль; 6 (1): 8–14. [PubMed] [Google Scholar]
- Negro F, Bergmann KF, Baroudy BM, Satterfield WC, Popper H, Purcell RH, Gerin JL. Инфекция вируса хронического гепатита D (HDV) у шимпанзе-носителей вируса гепатита B, экспериментально суперинфицированных HDV. J Infect Dis. Июль 1988 г .; 158 (1): 151–159. [PubMed] [Google Scholar]
- Negro F, Shapiro M, Satterfield WC, Gerin JL, Purcell RH. Повторное появление репликации вируса гепатита D (HDV) у шимпанзе, носителей вируса хронического гепатита B, повторно зараженных HDV.J Infect Dis. 1989 Октябрь; 160 (4): 567–571. [PubMed] [Google Scholar]
- Новик Д.М., Фарси П., Кроксон Т.С., Тейлор МБ, Шнебаум К.В., Лай М.Э., Бах Н., Сени Р.Т., Гелб А.М., Крик М.Дж. Антитела к вирусу гепатита D и вирусу иммунодефицита человека у лиц, злоупотребляющих парентеральными наркотиками, которые имеют положительный поверхностный антиген гепатита B. J Infect Dis. 1988 Октябрь; 158 (4): 795–803. [PubMed] [Google Scholar]
- Оттобрелли А., Марцано А., Смедиле А., Реккья С., Салиццони М., Корню С., Лами М. Е., Отте Дж. Б., Де Хемптинн Б., Губель А. и др.Паттерны повторного заражения вирусом гепатита дельта и заболевания при трансплантации печени. Гастроэнтерология. 1991 декабрь; 101 (6): 1649–1655. [PubMed] [Google Scholar]
- Поль К., Баруди Б.М., Бергманн К.Ф., Кот П.Дж., Перселл Р.Х., Хофнэгл Дж., Герин Дж.Л. Человеческое моноклональное антитело, распознающее вирусные полипептиды и продукты трансляции in vitro генома вируса гепатита D. J Infect Dis. Октябрь 1987 г., 156 (4): 622–629. [PubMed] [Google Scholar]
- Pol S, Dubois F, Roingeard P, Zignego L, Housset C, Brechot C, Goudeau A, Berthelot P.Инфекция вируса гепатита дельта у мужчин-гомосексуалистов, положительных по HBsAg во Франции. Гепатология. 1989 сентябрь; 10 (3): 342–345. [PubMed] [Google Scholar]
- Понцетто А., Кот П.Дж., Поппер Х., Хойер Б.Х., Лондон В.Т., Форд ЕС, Бонино Ф., Перселл Р.Х., Герин Дж.Л. Передача дельта-агента, ассоциированного с вирусом гепатита B, восточному сурку. Proc Natl Acad Sci U S. A. 1984, апрель; 81 (7): 2208–2212. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Понцетто А., Форцани Б., Смедиле А., Хеле С., Аванзини Л., Новара Р., Канезе М.Г.Острая и хроническая дельта-инфекция у сурка. Prog Clin Biol Res. 1987. 234: 37–46. [PubMed] [Google Scholar]
- Понцетто А., Хойер Б. Х., Поппер Х, Энгл Р., Перселл Р. Х., Герин Дж. Л.. Титрование инфекционности вируса гепатита D у шимпанзе. J Infect Dis. 1987 Янв; 155 (1): 72–78. [PubMed] [Google Scholar]
- Поппер Х., Тунг С.Н., Гербер М.А., Хадлер С.К., де Монзон М., Понцетто А., Анзола Э., Ривера Д., Мондольфи А., Брачо А. и др. Гистологические исследования тяжелой инфекции дельта-агентом у венесуэльских индейцев.Гепатология. Ноябрь-декабрь 1983 г.; 3 (6): 906–912. [PubMed] [Google Scholar]
- Поррес Дж. К., Карреньо В., Бартоломе Дж., Морено А., Галиана Ф, Кирога Дж. Лечение хронической дельта-инфекции рекомбинантным человеческим интерфероном альфа 2c в высоких дозах. J Hepatol. 1989 ноябрь; 9 (3): 338–344. [PubMed] [Google Scholar]
- Проди Г.А., Бакос Дж. Т., Бузаян Дж. М., Шнайдер И. Р., Брюнинг Г. Автолитический процессинг димерной сателлитной РНК вируса растений. Наука. 1986, 28 марта; 231 (4745): 1577–1580. [PubMed] [Google Scholar]
- Перселл Р. Х., Герин Дж. Л., Риццетто М., Понцетто А., Бонино Ф., Лондон, Вашингтон.Экспериментальная передача дельта-агента шимпанзе. Prog Clin Biol Res. 1983; 143: 79–89. [PubMed] [Google Scholar]
- Рамирес А.М., Ли С.П., Вудфилд Д.Г. Инфекция, вызванная вирусом гепатита дельта: недавно завезенная болезнь в Новой Зеландии. N Z Med J. 1987, 22 апреля; 100 (822): 235–237. [PubMed] [Google Scholar]
- Рапицетта М., Хайлу К., Понцетто А., Хеле С., Мораче Дж., Бекура Д., Бизанти Л., Конти С., Паскини П., Риццетто М. и др. Заражение вирусом гепатита дельты в Эфиопии. Eur J Epidemiol.1988 июн; 4 (2): 185–188. [PubMed] [Google Scholar]
- Rector WG, Jr, Govindarajan S, Penley KA, Judson FN. Дельта-гепатит в Денвере. West J Med. Июль 1988 г., 149 (1): 40–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rezvan H, Forouzandeh B, Taroyan S, Fadaiee S, Azordegan F. Исследование инфекции дельта-вирусом и ее клинического воздействия в Иране. Инфекция. 1990, январь-февраль; 18 (1): 26–28. [PubMed] [Google Scholar]
- Rizzetto M, Canese MG, Aricò S, Crivelli O, Trepo C, Bonino F, Verme G.Иммунофлуоресцентное обнаружение новой системы антиген-антитело (дельта / анти-дельта), связанной с вирусом гепатита В, в печени и в сыворотке носителей HBsAg. Кишечник. 1977 декабрь; 18 (12): 997–1003. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rizzetto M, Canese MG, Gerin JL, London WT, Sly DL, Purcell RH. Передача дельта-антигена, ассоциированного с вирусом гепатита В, шимпанзе. J Infect Dis. 1980 Май; 141 (5): 590–602. [PubMed] [Google Scholar]
- Риццетто М., Ши Дж. У., Гоке Д. Д., Перселл Р. Х., Верме Дж., Герин Дж. Л..Частота и значение антител к дельта-антигену при инфицировании вирусом гепатита В. Ланцет. 1979, 10 ноября; 2 (8150): 986–990. [PubMed] [Google Scholar]
- Риццетто М., Понцетто А., Форцани И. Вирус гепатита дельта как глобальная проблема здравоохранения. Вакцина. Март 1990; 8 (Дополнение): S10 – S23. [PubMed] [Google Scholar]
- Риццетто М., Понцетто А., Форцани И. Эпидемиология вируса гепатита дельта: обзор. Prog Clin Biol Res. 1991; 364: 1–20. [PubMed] [Google Scholar]
- Риццетто М., Перселл Р.Х., Герин Дж.Л.Эпидемиология HBV-ассоциированного дельта-агента: географическое распределение анти-дельта-агента и распространенность среди носителей HBsAg, подвергшихся политрансфузии. Ланцет. 1980, 7 июня; 1 (8180): 1215–1218. [PubMed] [Google Scholar]
- Риццетто М., Ши Дж. У., Герин Дж. Л.. Дельта-антиген, ассоциированный с вирусом гепатита В: выделение из печени, разработка твердофазных радиоиммуноанализов на дельта-антиген и анти-дельта и частичная характеристика дельта-антигена. J Immunol. Июль 1980; 125 (1): 318–324. [PubMed] [Google Scholar]
- Rizzetto M, Verme G, Recchia S, Bonino F, Farci P, Aricò S, Calzia R, Picciotto A, Colombo M, Popper H.Хронический гепатит у носителей поверхностного антигена гепатита В с внутрипеченочной экспрессией дельта-антигена. Активное и прогрессирующее заболевание, не поддающееся лечению иммунодепрессантами. Ann Intern Med. 1983 апр; 98 (4): 437–441. [PubMed] [Google Scholar]
- Rosina F, Pintus C, Meschievitz C, Rizzetto M. Рандомизированное контролируемое исследование 12-месячного курса рекомбинантного человеческого интерферона-альфа при хроническом дельта-гепатите (тип D): многоцентровое итальянское исследование . Гепатология. 1991 июн; 13 (6): 1052–1056.[PubMed] [Google Scholar]
- Розина Ф, Риццетто М. Лечение хронического гепатита типа D (дельта) альфа-интерфероном. Semin Liver Dis. 1989 ноябрь; 9 (4): 264–266. [PubMed] [Google Scholar]
- Rosina F, Saracco G, Lattore V, Quartarone V, Rizzetto M, Verme G, Trinchero P, Sansalvadore F, Smedile A. Рекомбинантный интерферон альфа-2 в лечении хронического вируса гепатита (HDV) ) гепатит. Prog Clin Biol Res. 1987. 234: 299–303. [PubMed] [Google Scholar]
- Розина Ф., Саракко Дж., Риццетто М.Риск заражения вирусом гепатита дельта после переливания крови. Многоцентровое исследование. N Engl J Med. 6 июня 1985 г .; 312 (23): 1488–1491. [PubMed] [Google Scholar]
- Ryu WS, Bayer M, Taylor J. Сборка частиц вируса гепатита дельта. J Virol. 1992 апр; 66 (4): 2310–2315. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sagnelli E, Felaco FM, Filippini P, Pasquale G, Peinetti P, Buonagurio E, Aprea L, Pulella C, Piccinino F, Giusti G. Влияние инфекции HDV на клинические , биохимические и гистологические проявления HBsAg-положительного хронического гепатита.Печень. 1989 август; 9 (4): 229–234. [PubMed] [Google Scholar]
- Салдана Дж. А., Томас Х. С., Монхардино, JP. Клонирование и секвенирование РНК вируса гепатита дельта, выделенной из сыворотки крови человека. J Gen Virol. Июль 1990; 71 (Pt 7): 1603–1606. [PubMed] [Google Scholar]
- Saracco G, Macagno S, Rosina F, Rizzetto M. Серологические маркеры молниеносного гепатита у лиц, положительных на поверхностный антиген гепатита B. Всемирное эпидемиологическое и клиническое исследование. Ann Intern Med. Март 1988 г .; 108 (3): 380–383. [PubMed] [Google Scholar]
- Saracco G, Rosina F, Brunetto MR, Amoroso P, Caredda F, Farci P, Piantino P, Bonino F, Rizzetto M.Быстро прогрессирующий HBsAg-позитивный гепатит в Италии. Роль инфекции вируса гепатита дельта. J Hepatol. 1987 декабрь; 5 (3): 274–281. [PubMed] [Google Scholar]
- Скотт Д.А., Буранс Дж. П., аль-Узейб HD, Арункумар Б.К., аль-Фадил М., Нигад Ю.Р., аль-Хадад А., Эльазид Р.Р., Хайамс К.С., Вуди Дж. Сероэпидемиологическое исследование вирусных гепатитов в Йеменской Арабской Республике. Trans R Soc Trop Med Hyg. Март-апрель 1990 г.; 84 (2): 288–291. [PubMed] [Google Scholar]
- Шармин Л., Куо М.Ю., Динтер-Готтлиб Г., Тейлор Дж.Антигеномная РНК вируса гепатита дельта человека может подвергаться самоотщеплению. J Virol. 1988 август; 62 (8): 2674–2679. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шармин Л., Куо М.Ю., Тейлор Дж. Самолигирующиеся последовательности РНК в антигеноме дельта-вируса гепатита человека. J Virol. 1989 Март; 63 (3): 1428–1430. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Shattock AG, Morgan BM. Чувствительный иммуноферментный анализ для обнаружения дельта-антигена и анти-дельта с использованием сыворотки в качестве источника дельта-антигена.J Med Virol. 1984. 13 (1): 73–82. [PubMed] [Google Scholar]
- Шатток А.Г., Моррис М., Кинан К., Фаган С. Серология дельта-гепатита и определение IgM анти-HD с помощью EIA с использованием дельта-антигена, полученного из сыворотки крови. J Virol Methods. Март 1989 г., 23 (3): 233–240. [PubMed] [Google Scholar]
- Shattock AG, Morris MC. Оценка коммерческих иммуноферментных анализов для обнаружения антигена гепатита дельта и вируса гепатита дельта (HDV) и антител иммуноглобулина M против HDV. J Clin Microbiol.1991 сентябрь; 29 (9): 1873–1876. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Shimizu YK, Oomura M, Abe K, Uno M, Yamada E, Ono Y, Shikata T. Производство антител, связанных с гепатитом не A и не B, в линия лимфобластоидных клеток шимпанзе, созданная путем трансформации in vitro вирусом Эпштейна-Барра. Proc Natl Acad Sci U S. A. 1985, апрель; 82 (7): 2138–2142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Shimizu YK, Purcell RH, Gerin JL, Feinstone SM, Ono Y, Shikata T. Связь между гепатитом, не относящимся к A, не B, и дельта-гепатитом: исследования с моноклональными антителами.Prog Clin Biol Res. 1987. 234: 51–60. [PubMed] [Google Scholar]
- Sjogren MH, Colichon A. Гепатит B и инфекция дельта-гепатита в Перу. Prog Clin Biol Res. 1991; 364: 97–104. [PubMed] [Google Scholar]
- Смедиле А., Бергманн К.Ф., Баруди Б.М., Уэллс Ф.В., Перселл Р.Х., Бонино Ф., Риццетто М., Герин Дж.Л. Анализ Рибозондом на РНК HDV: чувствительный метод обнаружения генома HDV в клинических образцах сыворотки. J Med Virol. 1990 Янв; 30 (1): 20–24. [PubMed] [Google Scholar]
- Smedile A, Dentico P, Zanetti A, Sagnelli E, Nordenfelt E, Actis GC, Rizzetto M.Инфекция дельта-агентом у хронических носителей HBsAg. Гастроэнтерология. 1981 декабрь; 81 (6): 992–997. [PubMed] [Google Scholar]
- Smedile A, Lavarini C, Crivelli O, Raimondo G, Fassone M, Rizzetto M. Выявление с помощью радиоиммуноанализа антител IgM к HBV-ассоциированному дельта (дельта) антигену: «клиническое значение при дельта-инфекции. J Med Virol. 1982; 9 (2): 131–138. [PubMed] [Google Scholar]
- Smedile A, Lavarini C, Farci P, Aricò S, Marinucci G, Dentico P, Giuliani G, Cargnel A, Del Vecchio Бланко С, Риццетто М.Эпидемиологические закономерности инфицирования дельта-агентом, ассоциированным с вирусом гепатита В, в Италии. Am J Epidemiol. 1983 февраль; 117 (2): 223–229. [PubMed] [Google Scholar]
- Смедиле А, Риццетто М., Деннистон К., Бонино Ф., Уэллс Ф., Верме Дж., Консоло Ф, Хойер Б., Перселл Р. Х., Герин Дж. Л.. Гепатит типа D: клиническое значение РНК вируса гепатита D в сыворотке крови, обнаруженное с помощью анализа на основе гибридизации. Гепатология. 1986 ноябрь-декабрь; 6 (6): 1297–1302. [PubMed] [Google Scholar]
- Смедиле А, Фарси П., Верме Дж., Каредда Ф, Карнел А, Капорасо Н., Дентико П., Трепо С., Ополон П., Гимсон А. и др.Влияние дельта-инфекции на тяжесть гепатита В. Ланцет. 30 октября 1982 г .; 2 (8305): 945–947. [PubMed] [Google Scholar]
- Solomon RE, Kaslow RA, Phair JP, Lyter D, Visscher B., Lyman D, VanRaden MT, Gerin J. Вирус иммунодефицита человека и вирус гепатита дельта у гомосексуальных мужчин. Исследование четырех когорт. Ann Intern Med. 1988, январь; 108 (1): 51–54. [PubMed] [Google Scholar]
- Субиран Дж., Ле Бра М., Марини П., Секу Х. Высокий уровень HBsAg и анти-дельта-носительство среди бессимптомных африканцев, живущих в кампусе Университета Ниамея, Нигер.Trans R Soc Trop Med Hyg. 1987. 81 (6): 998–1000. [PubMed] [Google Scholar]
- Stöcklin E, Gudat F, Krey G, Dürmüller U, Gasser M, Schmid M, Stalder G, Bianchi L. delta Antigen in hepatitis B: иммуногистология замороженных и парафиновых биопсий печени и взаимосвязь к инфекции HBV. Гепатология. 1981, май-июнь; 1 (3): 238–242. [PubMed] [Google Scholar]
- Strauss E, Gayotto LC, da Silva LC, Alves VA, Carrilho F, Chamone DA, da Silva EF, Porta G, Granato C, Trepo C. Неожиданно низкая распространенность дельта-антител на востоке Регион Амазонки и Сан-Паулу: данные о региональных различиях в эпидемиологии вируса дельта-гепатита в Бразилии.Trans R Soc Trop Med Hyg. 1987. 81 (1): 73–74. [PubMed] [Google Scholar]
- Tai DI, Liaw YF. Инфекция, вызванная вирусом гепатита дельта, на юге Тайваня. Scand J Infect Dis. 1989. 21 (1): 29–31. [PubMed] [Google Scholar]
- Такахаши К., Китамура Н., Шибуи Т., Камидзоно М., Мацуи Р., Йошияма И., Маеда Т., Кондо Дж., Хонда И., Ямада Е. и др. Клонирование, секвенирование и экспрессия в Escherichia coli кДНК не-А, не-В-ассоциированного с гепатитом белка агрегатов микротрубочек. J Gen Virol. 1990 сентябрь; 71 (Pt 9): 2005–2011.[PubMed] [Google Scholar]
- Тассопулос NC, Roumeliotou-Karayannis A, Papaevangelou GJ. Острый дельта-гепатит и носительство антигена гепатита В. Ann Intern Med. 1986 ноя; 105 (5): 804–805. [PubMed] [Google Scholar]
- Tassopoulos NC, Koutelou MG, Macagno S, Zorbas P, Rizzetto M. Диагностическое значение антител IgM к вирусу гепатита дельта при молниеносном гепатите B. J Med Virol. 1990 Март; 30 (3): 174–177. [PubMed] [Google Scholar]
- Тейлор Дж. М.. Структура и репликация вируса гепатита дельта.Annu Rev Microbiol. 1992. 46: 253–276. [PubMed] [Google Scholar]
- Thomas HC, Farci P, Shein R, Karayiannis P, Smedile A, Caruso L, Gerin J. Ингибирование репликации вируса гепатита дельта (HDV) лимфобластоидным человеческим альфа-интерфероном. Prog Clin Biol Res. 1987. 234: 277–290. [PubMed] [Google Scholar]
- Тиббс CJ. Дельта-гепатит в Кирибати: Тихоокеанский регион. J Med Virol. 1989 Октябрь; 29 (2): 130–132. [PubMed] [Google Scholar]
- Торрес Дж. Р., Мондольфи А. Затяжная вспышка тяжелого гепатита дельты: опыт изолированной индейской популяции в бассейне Верхнего Ориноко.Rev Infect Dis. 1991, январь-февраль; 13 (1): 52–55. [PubMed] [Google Scholar]
- Тукан А.Ю., Абу-эль-Руб О.А., Абу-Лабан С.А., Таравне М.С., Камаль М.Ф., Хадлер С.К., Кравчинский К., Марголис Х.С., Мейнард Дж. Э. Эпидемиология и клинические исходы инфекции вируса гепатита D (дельта) в Иордании. Гепатология. 1987 ноябрь-декабрь; 7 (6): 1340–1345. [PubMed] [Google Scholar]
- Цай Дж. Ф., Марголис Х. С., Филдс Х.А., Чанг В.Й., Цай Дж. Х. Суперинфекция вирусом гепатита дельта среди пациентов с хроническим гепатитом В на юге Тайваня.Scand J Infect Dis. 1990. 22 (4): 403–405. [PubMed] [Google Scholar]
- Turner GC, Panton N, Vandervelde EM. Дельта-инфекция и злоупотребление наркотиками в Мерсисайде. J Infect. Сентябрь 1989 г .; 19 (2): 113–118. [PubMed] [Google Scholar]
- Вязов С.О., Хлопова И.Н., Месянжинов В.В. Мономерный (7S) и полимерный (19S) анти-дельта IgM при острых и хронических дельта-инфекциях. Viral Immunol. 1989. 2 (2): 61–67. [PubMed] [Google Scholar]
- Wagner RW, Smith JE, Cooperman BS, Nishikura K. Активность по раскручиванию двухцепочечной РНК вносит структурные изменения посредством превращения аденозина в инозин в клетках млекопитающих и яйцах Xenopus.Proc Natl Acad Sci U S. A. 1989 Apr; 86 (8): 2647–2651. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Wang KS, Choo QL, Weiner AJ, Ou JH, Najarian RC, Thayer RM, Mullenbach GT, Denniston KJ, Gerin JL, Houghton M. Структура, последовательность и экспрессия геном вируса гепатита дельта (дельта). Природа. 1986, 9 октября; 323 (6088): 508–514. [PubMed] [Google Scholar]
- Weiner AJ, Choo QL, Wang KS, Govindarajan S, Redeker AG, Gerin JL, Houghton M. Одна антигеномная открытая рамка считывания вируса гепатита дельта кодирует эпитоп (ы) обоих гепатитов. полипептиды дельта-антигена p24 дельта и p27 дельта.J Virol. 1988 Февраль; 62 (2): 594–599. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Weisfuse IB, Hadler SC, Fields HA, Alter MJ, O’Malley PM, Judson FN, Ostrow DG, Altman NL. Дельта-гепатит у гомосексуальных мужчин в США. Гепатология. 1989 июн; 9 (6): 872–874. [PubMed] [Google Scholar]
- Веллер И.В., Караяннис П., Лок А.С., Монтано Л., Бамбер М., Томас Х.С., Шерлок С. Значение инфекции дельта-агентом в хронической вирусной инфекции гепатита В: исследование на британских носителях. Кишечник.1983 ноябрь; 24 (11): 1061–1063. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Wu HN, Lai MM. Обратимое расщепление и лигирование РНК вируса гепатита дельта. Наука. 3 февраля 1989 г .; 243 (4891): 652–654. [PubMed] [Google Scholar]
- Wu JC, Chen PJ, Kuo MY, Lee SD, Chen DS, Ting LP. Производство вируса гепатита дельта и подавление вспомогательного вируса гепатита В в клеточной линии гепатомы человека. J Virol. 1991 Март; 65 (3): 1099–1104. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Wu JC, Lee SD, Govindarajan S, Kung TW, Tsai YT, Lo KJ, Ting LP.Корреляция сывороточной дельта-РНК с клиническим течением суперинфекции вирусом острого гепатита дельта в Тайване: продольное исследование. J Infect Dis. 1990 июн; 161 (6): 1116–1120. [PubMed] [Google Scholar]
- Ся Ю.П., Чанг М.Ф., Вэй Д., Говиндараджан С., Лай М.М. Неоднородность дельта-антигена гепатита. Вирусология. 1990 сентябрь; 178 (1): 331–336. [PubMed] [Google Scholar]
- Занетти А.Р., Феррони П., Мальяно Е.М., Пировано П., Лаварини С., Массаро А.Л., Гавинелли Р., Фабрис С., Риццетто М. Перинатальная передача вируса гепатита В и дельты, ассоциированной с HBV агент от матери к потомству в северной Италии.J Med Virol. 1982. 9 (2): 139–148. [PubMed] [Google Scholar]
- Заули Д., Фускони М., Креспи С., Бьянки Ф. Б., Кракси А., Пизи Е. Тесная связь между антителами базального клеточного слоя и хронической дельта-инфекцией, связанной с вирусом гепатита В. Гепатология. 1984 ноябрь-декабрь; 4 (6): 1103–1106. [PubMed] [Google Scholar]
- Zheng H, Fu TB, Lazinski D, Taylor J. Редактирование геномной РНК вируса гепатита дельта человека. J Virol. 1992 август; 66 (8): 4693–4697. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Zignego AL, Deny P, Feray C, Ponzetto A, Gentilini P, Tiollais P, Bréchot C.Амплификация последовательностей РНК вируса гепатита дельта с помощью полимеразной цепной реакции: инструмент для обнаружения и клонирования вирусов. Зонды Mol Cell. 1990 Февраль; 4 (1): 43–51. [PubMed] [Google Scholar]
Статьи из обзоров клинической микробиологии предоставлены Американским обществом микробиологов (ASM)
Влияние инфекции вирусом гепатита дельта на заболеваемость и смертность при компенсированном циррозе печени типа B
Вирус гепатита дельта (HDV) является дефектным патогеном, которому для инфицирования необходимы вспомогательные функции вируса гепатита B (HBV).1 Он отвечает за острый или хронический гепатит. Острый дельта-гепатит может возникать либо при одновременной коинфекции HDV и HBV, либо в результате суперинфекции HDV у человека, уже хронически инфицированного HBV. Хроническая инфекция HDV чаще всего развивается после острой дельта-суперинфекции.
В многочисленных клинических исследованиях сообщалось, что пациенты с хронической инфекцией HDV часто демонстрируют тяжелый хронический гепатит или цирроз при первичной биопсии печени.3-5 Поперечные исследования показали, что пациенты с положительным хроническим гепатитом и инфекцией HDV имеют более тяжелое заболевание печени, чем у пациентов с только инфекцией HBV.6 Более того, продольные исследования показали, что инфекция HDV у пациентов с хроническим гепатитом B связана с более быстрым прогрессированием цирроза, чем у носителей HBsAg с хроническим гепатитом, и отсутствуют доказательства инфекции HDV.7 В целом эти данные показывают, что инфекция HDV имеет тенденцию влиять на неблагоприятный клинический исход хронического гепатита B. Однако в настоящее время недостаточно данных, чтобы прояснить, влияет ли HDV на клиническое течение компенсированного цирроза, связанного с HBV, и увеличивает ли риск гепатоцеллюлярной карциномы (HCC).Целью этого исследования было изучить влияние инфекции HDV на прогноз компенсированного цирроза типа B в когорте из 200 западноевропейских пациентов, не получавших лечения в течение среднего периода 6,6 лет. Заболеваемость, а именно частоту осложнений цирроза и заболеваемость ГЦК, и смертность сравнивали у пациентов с положительным и отрицательным анти-HDV.
Материалы и методы
ПАЦИЕНТЫ
Исследование основано на анализе данных, полученных в результате длительного исследования компенсированного цирроза печени, вызванного HBV, в котором участвовали девять специализированных университетских больниц в Европе, участвовавших в Совместных действиях по борьбе с вирусным гепатитом под названием Eurohep.Подробности общего дизайна этого исследования были описаны ранее. Вкратце, в настоящем исследовании оценивались все пациенты, отвечающие следующим критериям: ( a ) HBsAg-позитивность; ( b ) гистологический диагноз цирроза печени по международным критериям9; ( c ) отсутствие в анамнезе или клинических свидетельств осложнений цирроза, то есть асцита, кровотечения из варикозно расширенных вен, энцефалопатии или желтухи; ( d ) при постановке диагноза нет признаков ГЦК; ( e ) информация о сывороточном антигене е гепатита В (HBeAg) и антителах к HDV (анти-HDV) при представлении; ( f ) наблюдение в приемном центре в течение как минимум шести месяцев; ( г ) без противовирусного или стероидного лечения во время наблюдения.Эти критерии отбора привели к формированию когорты пациентов класса А. Чайлд-Пью. Пациенты с аутоиммунным или метаболическим заболеванием печени исключались по анамнезу, серологическим показателям и гистологии.
Время начала анализа заболеваемости и выживаемости было временем диагностики HBsAg-положительного компенсированного цирроза. Срок наблюдения рассчитывался от даты поступления до смерти, трансплантации печени или последнего наблюдения. Все пациенты обследовались не реже одного раза в год или чаще, в зависимости от их клинического состояния.Смерть классифицировалась как вызванная печеночной недостаточностью, если происходило ( a ) прогрессирующее нарушение функции печени, или ( b ) она наступала в течение 40 дней после кровотечения из варикозно расширенных вен, независимо от тяжести, или как вызванная ГЦК. Диагноз ГЦК был основан на результатах биопсии печени или уровней α-фетопротеина более 400 мкг / л плюс совместимое ультразвуковое исследование печени. Декомпенсация определялась как минимум как один эпизод асцита, желтухи, печеночной энцефалопатии или желудочно-кишечного кровотечения из варикозно расширенных вен.
СЕРОЛОГИЧЕСКОЕ ТЕСТИРОВАНИЕ
Вирусологические данные были получены при просмотре карт пациентов или ретроспективно с использованием сохраненных образцов сыворотки. Инфекция HDV была диагностирована на основании анти-HDV в сыворотке крови и дельта-антигена гепатита в печени. HBsAg, HBeAg, антитела к HBeAg (анти-HBe), анти-HDV и антитела к ВИЧ (анти-ВИЧ) были протестированы с помощью коммерчески доступных радиоиммуноанализов или иммуноферментных анализов (ELISA). ДНК HBV в сыворотке измеряли путем точечной гибридизации или анализа гибридизации в растворе.Сывороточные антитела к вирусу гепатита С были протестированы с помощью ELISA второго поколения. Дельта-антиген гепатита в печени тестировали путем прямой иммунофлуоресценции с использованием сыворотки против HDV, конъюгированной с флуоресцеинизотиоцианатом, на замороженных нефиксированных срезах печени или путем окрашивания иммунопероксидазой с использованием коммерчески доступных поликлональных анти-HDV на материале, залитом парафином.
СТАТИСТИЧЕСКИЙ АНАЛИЗ
Статистический анализ был выполнен с помощью теста χ 2 и теста дисперсионного анализа для сравнения различий между пропорциями и медианами соответственно.Кумулятивная вероятность появления ГЦК, возникновения декомпенсации и выживаемости рассчитывалась по методу Каплана-Мейера.10 Поскольку меньшая часть пациентов с циррозом печени была анти-HDV / HBeAg-положительной, этот анализ основан на данных, собранных в три группы циррозов: HDV-положительный / HBeAg-отрицательный, анти-HDV-отрицательный / HBeAg-отрицательный и анти-HDV отрицательный / HBeAg-положительный. Пациенты, умершие от состояний, не связанных с заболеванием печени, перенесшие трансплантацию печени и пациенты, которые были потеряны для последующего наблюдения, подвергались цензуре в момент смерти, во время трансплантации или во время исключения из этого анализа.10 Кривые сравнивались с использованием логарифмического рангового теста.11 Прогностические факторы для ГЦК, декомпенсации и выживаемости были определены с помощью регрессионного анализа Кокса, 12
13 как одномерные, так и многомерные, с обратным исключением незначимых переменных. Потенциальные прогностические факторы, оцениваемые в отношении заболеваемости и смертности, включали следующие клинические, биохимические и вирусологические переменные, измеренные при регистрации: пол, возраст, log 10 (концентрация билирубина), уровни альбумина, гамма-глобулинов и тромбоцитов, HBeAg и анти- Статус HDV.Пол (мужской = 1, женский = 0), анти-HDV (положительный = 1, отрицательный = 0) и HBeAg (положительный = 1, отрицательный = 0) были введены как дихотомические переменные. Чтобы проанализировать влияние статуса HDV на клинические конечные точки, модель Кокса включала на всех стадиях, независимо от того, значимы они или нет, индикатор статуса HDV (анти-HDV положительный = 1, отрицательный = 0), и в модели была получена Значение p для члена HDV напрямую показывает значимость статуса HDV с поправкой на влияние всех других включенных прогностических переменных.Поскольку анализ требует, чтобы все пациенты были представлены полным набором переменных, и, чтобы не уменьшать количество пациентов, отсутствующие данные были заменены нейтральными оценками14. Скорректированные относительные риски (HDV-положительный / HDV-отрицательный) (с 95 % доверительных интервалов) для ГЦК, декомпенсации и выживаемости оценивали по коэффициенту регрессии (и SE) для статуса HDV в моделях, включая переменные, влияние которых необходимо было скорректировать14. Скорректированные кривые для вероятности ГЦК или частоту декомпенсации и выживаемость оценивали с помощью регрессионных моделей, как описано ранее.14 Использовалось статистическое программное обеспечение BMDP. Во всех анализах значение p менее 0,05 считалось статистически значимым.
Результаты
БАЗОВЫЕ ХАРАКТЕРИСТИКИ В СООТВЕТСТВИИ СО СТАТУСОМ ANTI-HDV / HBeAG
Мы обследовали 200 белых пациентов с HBsAg-положительным компенсированным циррозом, которые соответствовали критериям включения. В этой серии представлены все нелеченные белые пациенты, включенные в предыдущее исследование8 по оценке выживаемости с компенсированным циррозом типа B, за исключением 17 пациентов восточного или черного происхождения, 36 пациентов с антителами к вирусу гепатита C и / или положительными анти-ВИЧ и 113, которые получали противовирусные препараты (n = 87) или стероидное (n = 26) лечение.
На момент включения 39 (20%) пациентов были анти-HDV-положительными, включая два HBeAg-положительных случая, и 161 пациент был анти-HDV-отрицательным, включая 45 HBeAg-положительных пациентов с циррозом печени.
В таблице 1 дается сравнение основных клинических и серологических характеристик пациентов в зависимости от статуса HDV и HBeAg на момент обращения. Средний возраст был ниже у пациентов с положительной реакцией на HDV, в то время как существенных различий по полу отмечено не было. Оценка вероятного источника инфекции показала более высокую долю семейных контактов и наркоманов среди пациентов с циррозом, связанным с HDV.Пациенты с положительной реакцией на HDV имели более высокие концентрации γ-глобулина и немного более низкие уровни тромбоцитов. При только что испытании у меньшей доли пациентов с циррозом, положительных по отношению к HDV / HBeAg, обнаруживалась ДНК HBV, чем у пациентов с отрицательными анти-HDV / HBeAg (7% против 30% соответственно).
Таблица 1
Исходные характеристики 200 пациентов с циррозом типа B (ребенок A) в соответствии со статусом вируса гепатита дельта (HDV) и е-антигена гепатита B (HBeAg)
КЛИНИЧЕСКИЙ РЕЗУЛЬТАТ В СООТВЕТСТВИИ СО СТАТУСОМ ANTI-HDV / HBeAG
200 пациентов наблюдались в течение среднего периода 80 (диапазон 6–198) месяцев.Продолжительность наблюдения была сопоставимой для пациентов с положительной и отрицательной реакцией на HDV (p = 0,2), как и показатели выбывания (p = 0,2) (таблица 2).
Таблица 2
Клинические исходы 200 пациентов с циррозом типа B (ребенок A) в соответствии со статусом вируса гепатита дельта (HDV) и е-антигена гепатита B (HBeAg)
Развитие HCC
Как показано в таблице 2, во время наблюдения ГЦК развился у пяти (13%) положительных по HDV / HBeAg-негативных, 19 (16%) анти-HDV-негативных / HBeAg-негативных и трех (7%) анти-HDV-негативных. / HBeAg-положительные пациенты с циррозом печени типа B; средний возраст пациентов на момент постановки диагноза ГЦК составлял 54 (диапазон 51–63), 62 (диапазон 40–76) и 64 (52–78) лет для трех групп цирроза печени соответственно.Средний интервал между моментом включения в исследование и постановкой диагноза ГЦК составлял 75 (диапазон 17–128) месяцев для пациентов, положительных по анти-HDV / HBeAg, и 48 месяцев (от 7 до 181) для пациентов с отрицательным результатом к HDV / HBeAg. отрицательные пациенты и 40 (диапазон 7–44) месяцев для анти-HDV / HBeAg-положительных пациентов с циррозом печени. Не скорректированная пятилетняя кумулятивная частота ГЦК составила 6, 10 и 9% для положительных по анти-HDV / HBeAg-отрицательных, анти-HDV-отрицательных / HBeAg-отрицательных и анти-HDV-отрицательных / HBeAg-положительных циррозов соответственно (рис. 1, вверху).
фигура 1
Кумулятивная вероятность появления гепатоцеллюлярной карциномы (ГЦК) у пациентов с компенсированным циррозом типа B (ребенок A) в зависимости от статуса антигепатит-дельта-вируса (HDV) и е-антигена гепатита B (HBeAg). Частота появления через пять лет составила 6, 10 и 9% для положительных по HDV / HBeAg-негативных (жирная линия), анти-HDV-негативных / HBeAg-негативных (тонкая линия) и анти-HDV-негативных / HBeAg-позитивных (пунктирная линия). пациенты соответственно (p = 0,33, тест логарифмического ранга) (вверху). Расчетная пятилетняя вероятность, скорректированная на все потенциальные прогностические переменные с помощью модели Кокса, составила 13, 4 и 2% для пациентов с положительными анти-HDV / отрицательными HBeAg, отрицательными анти-HDV / отрицательными HBeAg и отрицательными анти-HDV / положительными HBeAg соответственно ( Нижний).
Факторы, коррелирующие с ГЦК
Среди клинических и биохимических характеристик, изученных с помощью одномерного анализа, пожилой возраст, более низкий уровень тромбоцитов и более высокая концентрация билирубина были значительно связаны с более высоким риском ГЦК (таблица 3).
Таблица 3
Одномерный анализ Кокса для выявления случаев гепатоцеллюлярной карциномы (ГЦК), проявления декомпенсации и выживаемости у 200 пациентов с циррозом типа B (ребенок A)
В множественном регрессионном анализе Кокса более пожилой возраст (p <0.0001) и анти-HDV-положительность (p = 0,05) были независимо и достоверно связаны с более высоким риском ГЦК (таблица 4).
Таблица 4
регрессионные модели Кокса, включающие только значимые переменные (и статус HDV) для прогнозирования возникновения гепатоцеллюлярной карциномы (ГЦК), появления декомпенсации и выживаемости
Как показано в таблице 5, суперинфекция HDV значительно увеличивала риск ГЦК в 3,2 раза (полностью скорректированный относительный риск).
Таблица 5
Влияние статуса вируса гепатита дельта (HDV) на возникновение гепатоцеллюлярной карциномы (ГЦК), появление декомпенсации и выживаемость
Расчетный полностью скорректированный пятилетний риск возникновения ГЦК (с использованием медианных значений переменных на исходном уровне в модели Кокса) составлял 13, 4 и 2% для положительных по анти-HDV / HBeAg-отрицательных, анти-HDV-отрицательных / HBeAg-отрицательных, и анти-HDV-отрицательные / HBeAg-положительные циррозы соответственно (рис. 1, внизу).
Развитие декомпенсации
Из 173 пациентов, у которых не было опухоли, 12 (37%) анти-HDV-положительные / HBeAg-отрицательные, 20 (21%) анти-HDV-отрицательные / HBeAg-отрицательные и 11 (26%) анти-HDV-отрицательные / HBeAg-положительные циррозы развился хотя бы один эпизод декомпенсации (таблица 2). Не скорректированная пятилетняя вероятность декомпенсации составила 22, 16 и 19% в трех подгруппах цирроза печени соответственно (рис. 2, вверху).
фигура 2
Кумулятивная вероятность развития декомпенсации у пациентов с компенсированным циррозом печени типа B (ребенок A) в отношении статуса антигепатит-дельта-вируса (HDV) и е-антигена гепатита B (HBeAg).В анализ был включен 171 пациент без опухолей. Пятилетняя вероятность декомпенсации составляла 22, 16 и 19% для положительных анти-HDV / HBeAg-отрицательных (жирная линия), анти-HDV-отрицательных / HBeAg-отрицательных (тонкая линия) и анти-HDV-отрицательных / HBeAg-положительных (пунктирная линия). ) пациентов (p = 0,38, тест логарифмического ранга) (вверху). Расчетная пятилетняя вероятность, скорректированная на все потенциальные прогностические переменные с помощью модели Кокса, составила 18, 8 и 14% для пациентов с положительными анти-HDV / HBeAg-отрицательными, анти-HDV-отрицательными / HBeAg-отрицательными и анти-HDV-отрицательными / HBeAg-положительными пациентами соответственно ( Нижний).
Факторы, коррелирующие с декомпенсацией
Согласно однофакторному анализу, следующие переменные были достоверно связаны с более высоким риском декомпенсации: пожилой возраст, более низкая концентрация альбумина, более высокая концентрация γ-глобулина и более низкие уровни тромбоцитов (таблица 3).
В многофакторном анализе более низкая концентрация альбумина (p = 0,0001) и более высокая концентрация γ-глобулина (p <0,0001) независимо друг от друга показали значительную связь с более высоким риском декомпенсации (таблица 4).
Суперинфекция
HDV увеличивала риск декомпенсации, хотя и незначительно, в 2,2 раза (полностью скорректированный относительный риск) (таблица 5).
Расчетная полностью скорректированная пятилетняя вероятность декомпенсации (с использованием медианных значений переменных на исходном уровне в модели Кокса) составляла 18, 8 и 14% для положительных по HDV / HBeAg-негативных, анти-HDV-негативных / HBeAg-негативных и пациенты, отрицательные по анти-HDV / положительные по HBeAg, соответственно (рис. 2, внизу).
Выживание
В ходе последующего наблюдения смерть, связанная с печенью, произошла у шести (16%) анти-HDV-положительных / HBeAg-отрицательных пациентов, 23 (20%) анти-HDV-отрицательных / HBeAg-отрицательных и девяти (20%) анти-HDV-отрицательных / HBeAg-положительных пациентов. циррозы (таблица 2).Декомпенсированный цирроз печени, потребовавший трансплантации печени, имел место у четырех, двух и двух других пациентов в трех подгруппах цирроза соответственно. Не скорректированная пятилетняя вероятность выживания составляла 92, 89 и 83 у пациентов с циррозом печени с положительным анти-HDV / HBeAg-отрицательным, анти-HDV-отрицательным / HBeAg-отрицательным и отрицательным к HDV / положительным HBeAg циррозом соответственно (рис. 3, вверху).
Рисунок 3
Кумулятивная вероятность выживания пациентов с компенсированным циррозом типа B (ребенок A) в зависимости от статуса антигепатита дельта-вируса (HDV) и е-антигена гепатита B (HBeAg).Вероятность пятилетней выживаемости составляла 92, 89 и 83% для положительных по HDV / HBeAg-негативных (жирная линия), анти-HDV-негативных / HBeAg-негативных (тонкая линия) и анти-HDV-негативных / HBeAg-позитивных (пунктирная линия). пациенты (p = 0,61, логарифмический ранговый тест) (вверху). Расчетная пятилетняя вероятность выживания, скорректированная с учетом всех потенциальных прогностических переменных с помощью модели Кокса, составила 90, 95 и 93% для пациентов с положительным анти-HDV / отрицательным HBeAg, отрицательным к HDV / отрицательным HBeAg и отрицательным к HDV / положительным HBeAg пациентами соответственно. (Нижний).
Факторы, влияющие на выживаемость
Согласно однофакторному анализу, пожилой возраст, более низкая концентрация альбумина и более высокая концентрация γ-глобулина были значимо связаны с уменьшением выживаемости (таблица 3).
В многофакторном анализе пожилой возраст (p <0,0001), более низкая концентрация альбумина (p = 0,0027) и более высокая концентрация γ-глобулина (p = 0,026) независимо показали связь с уменьшением выживаемости (таблица 4).
Как показано в таблице 5, суперинфекция HDV увеличивала смертность, хотя и незначительно, в 2 раза (полностью скорректированный относительный риск).
Расчетная полностью скорректированная пятилетняя выживаемость (с использованием медианных значений переменных на исходном уровне в модели Кокса) составила 90, 95 и 93% для положительных по HDV / HBeAg-негативных, анти-HDV-негативных / HBeAg-негативных и анти- HDV-отрицательные / HBeAg-положительные циррозы печени соответственно (рис. 3, внизу).
Обсуждение
Основные результаты нашего исследования касаются клинического проявления инфекции HDV у западноевропейских пациентов с компенсированным циррозом (ребенок A) при их первом обращении в специализированные центры и влияния инфекции HDV на заболеваемость и смертность при циррозе типа B.
20% -ная распространенность анти-HDV у 200 HBsAg-положительных циррозов близко соответствует данным предыдущих европейских исследований хронических носителей HBsAg15.
16 Наши результаты показывают, что инфекция HDV в определенной степени изменяет клинические и серологические проявления HBsAg-положительного цирроза. Фактически, наличие анти-HDV в сыворотке выявило подгруппу пациентов с циррозом печени, которые были моложе и имели более высокие сывороточные уровни γ-глобулинов и несколько более низкие уровни тромбоцитов по сравнению с анти-HDV-отрицательными циррозами.Кроме того, характерными особенностями этих анти-HDV-положительных пациентов были высокая распространенность анти-HBe в сыворотке и низкая скорость активной репликации HBV, на что указывает обнаружение сывороточного HBeAg и / или ДНК HBV в небольшой части примерно 10% пациентов прошли тестирование. Эти результаты согласуются с тем фактом, что HDV подавляет синтез генома HBV, и сывороточная ДНК HBV часто остается неопределяемой традиционными методами как на острой, так и на хронической стадии суперинфекции HDV.17
18 Интересно отметить, что эти результаты согласуются с предыдущими наблюдениями, полученными в проспективных исследованиях пациентов с HBsAg-положительным хроническим гепатитом, о том, что инфекция HDV поражает в основном молодых анти-HBe-положительных пациентов и связана с более быстрым прогрессированием цирроза.7
19 Сообщалось, что примерно в 15% случаев хронического дельта-гепатита заболевание быстро прогрессирует, причем цирроз печени развивается в течение двух лет после начала, 19 и наши данные показывают, что пациенты с наложенной дельта-инфекцией могут прогрессировать до цирроза примерно 15 лет раньше, чем пациенты с HBV-инфекцией (средний возраст на момент постановки диагноза цирроза 34 против 48 лет у пациентов с положительным и отрицательным анти-HDV, соответственно).
Анализ потенциальных факторов риска инфекции HDV в нашей исследуемой популяции подтверждает, что наркоманы, принимающие парентеральные наркотики, подвергаются наибольшему риску и играют важную роль в распространении дельта-агента в западном мире.Инфекция HDV также была связана с домашним контактом с носителем, положительным по HBsAg, что согласуется с предыдущими наблюдениями о том, что внутрисемейный контакт может способствовать распространению инфекции, особенно в районах южной Европы, где дельта-агент является эндемичным15.
16
Данных о клиническом течении компенсированного цирроза, связанного с дельта-инфекцией, немного. Предыдущие продольные исследования исходов дельта-цирроза включали только небольшое количество пациентов с циррозом и / или не делали различия между компенсированным и декомпенсированным циррозом.3
20 Кроме того, в настоящее время вопрос заключается в том, влияет ли HDV на клиническое течение компенсированного цирроза, связанного с HBV, и увеличивает ли риск ГЦК.
Влияние инфекции HDV на клиническое течение компенсированного цирроза типа B (ребенок A) было проанализировано в нашей когорте из 200 нелеченных пациентов, наблюдаемых в течение среднего периода 6,6 лет; заболеваемость и смертность оценивали у дельта-положительных / HBeAg-отрицательных циррозов и сравнивали с двумя группами дельта-отрицательных пациентов, а именно 116 HBeAg-отрицательными и 45 HBeAg-положительными.Не скорректированный анализ Каплана-Мейера совокупной частоты ГЦК и декомпенсации, а также вероятности выживания не выявил значимых различий между тремя подгруппами пациентов (рис. 1, 2 и 3 вверху). Кроме того, согласно однофакторному прогностическому анализу Кокса, статус HDV не является значимым предиктором клинического исхода и имеет отрицательный коэффициент регрессии B для HCC и выживаемости (таблица 5), то есть имеет тенденцию быть связан с более низким риском опухоли печени. и более длительная выживаемость — но эти данные частично объясняются более молодым возрастом пациентов с положительной реакцией на HDV.Поскольку возраст является очень мощной прогностической переменной для ГЦК и выживаемости (таблица 4), его включение оказывает выраженный эффект в многомерный анализ, где статус HDV имеет положительный коэффициент регрессии B, то есть более высокий риск возникновения ГЦК и худшая выживаемость, если анти-HDV положительный — и становится значимым для возникновения опухоли печени (таблица 5). Эти данные показывают, что одномерный анализ может вводить в заблуждение и что эффект HDV необходимо скорректировать в многомерном анализе. Было обнаружено, что помимо возраста, уровни альбумина и гамма-глобулина являются независимыми предикторами клинического исхода в многофакторном анализе.В текущем исследовании альбумин является сильной прогностической переменной для декомпенсации и выживаемости. Только у меньшинства (17%) наших пациентов с циррозом ребенка А уровень альбумина в сыворотке крови был ниже 35 г / л, что дополнительно указывает на то, что альбумин является чувствительным маркером печеночной недостаточности при циррозе. Считается, что гипергаммаглобулинемия при циррозе является следствием хронического воздействия экзогенного антигена, абсорбируемого в основном из кишечника, в результате нарушения системной фагоцитарной активности ретикулоэндотелиальной ткани печени, связанной с внутрипеченочным шунтированием крови.21 год
22 Кроме того, недавние данные показывают, что высокие уровни антител к эндотоксинам способствуют гипергаммаглобулинемии у пациентов с циррозом, вероятно, в результате хронического воздействия эндотоксина. кровообращение в цирротической печени.
Прогноз при циррозе печени широко варьируется в зависимости от характеристик пациента. Как показано в таблице 5, похоже, что для всех трех оцененных конечных точек (ГЦК, декомпенсация и выживаемость) скорректированный эффект HDV имеет тенденцию быть вредным (положительный коэффициент регрессии B) и что оцененный риск возникновения ГЦК или декомпенсации и для более короткая выживаемость увеличивается в 2 или более раз, хотя это важно только для ГЦК.Соответственно, после поправки на клинические и серологические различия на исходном уровне оценочная пятилетняя вероятность возникновения ГЦК, декомпенсации была самой высокой, а выживаемость была самой низкой у пациентов, положительных по анти-HDV (рис. 1, 2 и 3, внизу).
Вероятность выживания (около 90% через пять лет), наблюдаемая при нашем дельта-циррозе печени, была выше, чем (71%), о которой ранее сообщалось через пять лет в голландском исследовании.20 Этот результат может быть объяснен различиями в характеристиках пациентов при поступлении, поскольку исследование из Нидерландов также включало пациентов на поздней стадии цирроза печени (дети B и C).В нашем исследовании мы проанализировали только пациентов с подтвержденным биопсией компенсированным циррозом, но нет данных о том, сколько потенциальных циррозов было исключено, потому что у них не было биопсии печени или потому что у них уже были клинические доказательства запущенного цирроза, и возможно, что могла быть ошибка отбора для исключения дельта-положительных или дельта-отрицательных пациентов с более тяжелым заболеванием печени
В заключение, наиболее важной характеристикой хронического дельта-гепатита, по-видимому, является его склонность к быстрому прогрессированию до цирроза, и наше продольное исследование, проведенное у пациентов с компенсированным циррозом печени типа B, показывает, что сопутствующая инфекция HDV связана с трехкратным повышением риска ГЦК и с двукратным повышением риска смертности, что подтверждает плохой прогноз в этой подгруппе пациентов.
Благодарности
Помимо авторов, членами Европейских согласованных действий по вирусному гепатиту (Eurohep) являются: Пьеро Алмазио, Каттедра ди Клиника Медика R, Университет Палермо, Палермо, Италия; Мигель Карнейро де Моура, Служба медицины II, Медицинская школа Лиссабона, Лиссабон, Португалия; Франсуаза Дегос, Федерация гепатогастроэнтерологии и INSERM U24, больница Божон, Париж, Франция; Стефанос Хадзиянис, Академический медицинский отдел, Общая больница Гиппократион, Афины, Греция; Ким Крогсгаард, Институт профилактической медицины, Kommunehospitalet, Копенгаген, Дания; Карлос Керо, гепатогастроэнтерология, Университетская больница Эразма в Дейкзигте, Роттердам, Нидерланды; Хосе Санчес-Тапиас, Отделение печени, Больничная клиника, Университет Барселоны, Барселона, Испания; Антонио Солинас, Istituto di Patologia Speciale Medica, Университет Сассари, Сассари, Италия.
Вирус гепатита Дельта — обзор
Способы передачи HDV аналогичны таковым для HBV. Инфекция HDV наиболее распространена среди лиц, злоупотребляющих инъекционными наркотиками, больных гемофилией и получателей многократных переливаний крови и относительно редко среди мужчин, практикующих секс с мужчинами. Перинатальное приобретение HDV встречается редко. Молекулярными и серологическими маркерами инфекции HDV являются сывороточная РНК HDV, сывороточный и печеночный HDAg, сывороточный анти-HD IgM и сывороточный анти-HD IgG. Методы иммунофлуоресценции, иммунопероксидазы и ELISA были использованы для локализации HDAg в сыворотке и ткани печени.В то время как сывороточные тесты на анти-HD IgG коммерчески доступны в Соединенных Штатах, тесты на РНК HDV и анти-HD IgM доступны только в исследовательских и справочных лабораториях. Антитела IgG к HDV обнаруживаются с помощью наборов RIA или EIA. В наборах EIA используется конкурентный формат анализа с немечеными анти-дельта-антителами из сыворотки пациента, конкурирующими с постоянным количеством человеческого анти-дельта-меченного IgG за ограниченное количество сайтов связывания HDAg. Таким образом, доля меченых анти-HD, связанных с твердой фазой, обратно пропорциональна концентрации анти-дельта в исследуемом образце.Анти-HD IgM проводится аналогично тесту на анти-HAV IgM, описанному в разделе HAV. При острой коинфекции HBV и HDV в сыворотке появляются следующие последовательные маркеры: HBsAg, РНК HDV, HDAg, анти-HD IgM и анти-HD IgG. Оба антитела обычно имеют низкую концентрацию и непродолжительный срок действия. У суперинфицированных пациентов сохраняется стойкость HBs- и HD-антигенемии и РНК HDV в сыворотке и печени инфицированных людей. Как правило, анти-HD IgM недолговечен, тогда как анти-HD IgG присутствует в более высоком титре.На рисунках 11 и 12 показаны типичные серологические курсы при коинфекции HBV-HDV и суперинфекции. Считается, что уровень анти-HD IgM повышается в ответ на HDV-индуцированное повреждение и, таким образом, представляет собой действительный суррогатный маркер повреждения печени, который иммунопатологически связан с HDV-инфекцией. Таким образом, помимо диагностической информации, сывороточный IgM к HD является лучшим предиктором приближающегося разрешения хронической болезни HDV, спонтанной или вызванной интерфероном. Несмотря на отсутствие вакцины, специфичной для HDV, наиболее полезным инструментом для предотвращения коинфекции HBV-HDV является иммунизация вакциной против гепатита B, поскольку репликация HDV зависит от HBV.
