Антибиотикоассоциированная диарея | BIOCODEX BMI PRO
Повреждая кишечную микрофлору, антибиотики могут вызывать диарею разной степени тяжести.
Антибиотики, особенно широкого спектра действия, уничтожают не только патогенные бактерии. При пероральном приеме (а также иногда и при парентеральном) они также повреждают кишечную микробиоту, иногда уменьшая количество некоторых комменсальных штаммов. Свободные ниши становятся доступны для колонизации другими бактериями1, и восстановление баланса микробиоты может занять несколько недель.
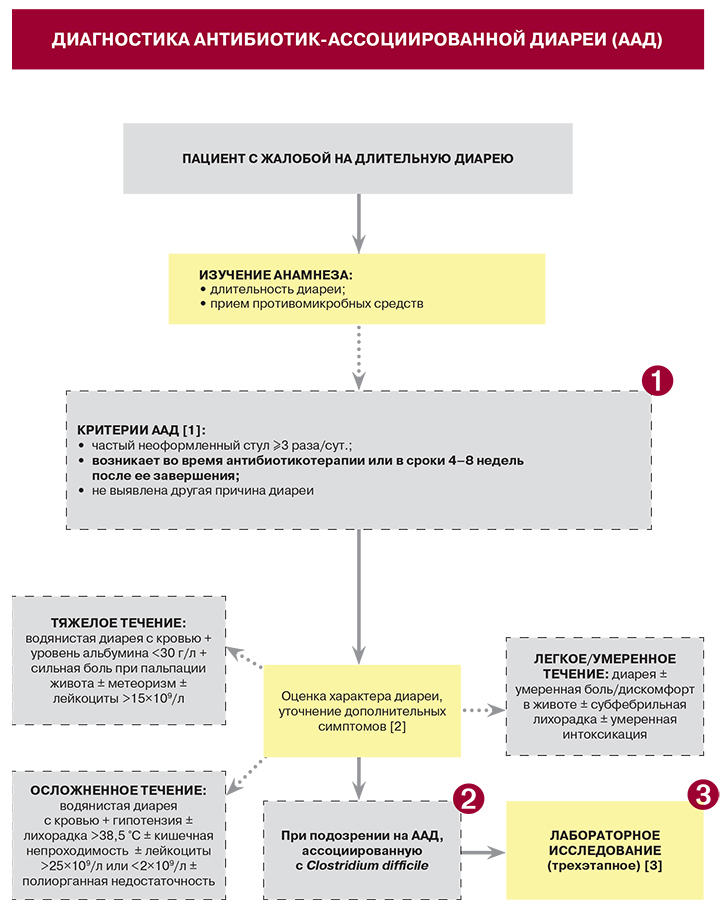
Множество причин развития антибиотик-ассоциированной диареи (ААД)
Вызванные антибиотиками нарушения кишечной микрофлоры могут привести к диарее или даже колиту. Здесь работают два механизма: сниженная способность ферментации определенных сахаров, называемых FODMAP, вызывающих осмотическую диарею (избыточное количество жидкости в тонком кишечнике) и уничтожение определенных комменсальных бактерий, что делает возможной колонизацию кишечника такими патогенными бактериями, как Clostridium difficile (основная причина нозокомиальной диареи2) или Klebsiella oxytoca3.
Разная тяжесть заболевания
Инфекция, вызванная Klebsiella oxytoca, разрешается самостоятельно после прекращения приема антибиотиков, однако другие инфекции могут вызывать намного больше проблем. В частности, некоторые штаммы C. difficile помимо того, что вызывают частые рецидивы заболевания, начинают вырабатывать устойчивость к большинству антибиотиков2 и могут вызвать тяжелый колит с летальным исходом.
Лечение
В схеме лечения всех форм диареи для борьбы с обезвоживанием всегда рекомендуется диета с низким содержанием FODMAP (молоко, сухофрукты и т. д.), и тем не менее, все чаще и чаще специалисты обращаются к проблеме восстановления равновесия микробиоты. Пробиотики, такие как Saccharomyces boulardii, показали свою эффективность в лечении и профилактике ААД4, 5. Также была установлена значимая роль Saccharomyces boulardii в профилактике рецидивов инфекции, вызванной Clostridium difficile, впрочем как и роль трансплантации фекальной микробиоты7. Однако, проблемы и риски, связанные с такой трансплантацией, ограничивают возможности применения этой терапии только наиболее тяжелыми инфекциями.
Однако, проблемы и риски, связанные с такой трансплантацией, ограничивают возможности применения этой терапии только наиболее тяжелыми инфекциями.
Источники:
1- Sheetal R. Modi, James J. Collins, and David A. Relman. Antibiotics and the gut microbiota. Review series : gut microbiome. The Journal of Clinical Investigation. J Clin Invest. 2014;124(10):4212–4218. doi:10.1172/JCI72333.
2- Leffler DA, Lamont JT. Clostridium difficile infection. N Engl J Med 2015 ; 372 : 1539-48. http://www.gsida.org/wp-content/uploads/2014/09/Clostridium-difficile-Infection.pdf
3- Beaugerie L, Metz M, Barbut F, et al. ; Infectious Colitis Study Group. Klebsiella oxytoca as an agent of antibiotic-associated hemorrhagic colitis. Clin Gastroenterol Hepatol 2003 ; 1 :370-6. http://loyce2008.free.fr/Microbiologie/diarrh%E9es%20infectieuses/Hogenauer,%20Ko%20as%20e%20causative%20organism%20of%20antibiotic%20associated%20hemorrhagic%20colitis%20NEJM.pdf.pdf
4- Hempel S, Newberry SJ, Maher AR, et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA 2012 ; 307 : 1959-69. https://ods.od.nih.gov/pubs/ebrp.probiotics_for_the_prevention_and_treatment_of_antibiotic-associated_diarrhea.pdf
5- Shan LS, Hou P, Wang ZJ, et al. Prevention and treatment of diarrhoea with Saccharomyces boulardii in children with acute lower respiratory tract infections. Benef Microbes 2013 ; 4 : 329-34.
6- McFarland LV, Surawicz CM, Greenberg RN, et al. A randomized placebo-controlled trial of Saccharomyces boulardii in combination with standard antibiotics for Clostridium difficile disease. JAMA 1994 ; 271 : 1913-8.
7- Li YT, Cai HF, Wang ZH, Xu J, Fang JY. Systematic review with meta-analysis: long-term outcomes of faecal microbiota transplantation for Clostridium difficile infection. Aliment Pharmacol Ther. 2016;43:445–57. doi: 10.1111/apt.13492. https://www.ncbi.nlm.nih.gov/pubmed/26662643
РОЛЬ ПРОБИОТИКОВ В ПРОФИЛАКТИКЕ И ЛЕЧЕНИИ АНТИБИОТИКОАССОЦИИРОВАННОЙ ДИАРЕИ У ДЕТЕЙ | Сурков
1. Запруднов А. М., Мазанкова Л. Н. Микробная флора кишечника и пробиотики. Москва: Педиатрия. 1999. 48 с.
2. Сурков А. Н. Тактика лечения острых кишечных инфекций у детей. Вопросы современной педиатрии. 2011; 10 (6): 141–47.
3. Микробиота пищеварительного тракта. Под ред. А. И. Хавкина. Москва: Фонд социальной педиатрии. 2006. 416 с.
4. Хавкин А. И. Нарушения микроэкологии кишечника. Принципы коррекции. Методические рекомендации. Москва. 2004. 40 с.
5. Кучумова С. Ю., Полуэктова Е. А., Шептулин А. А., Ивашкин В. Т. Физиологическое значение кишечной микробиоты. Consilium medicum. Гастроэнтерология. 2011; 2: 75–8.
Кучумова С. Ю., Полуэктова Е. А., Шептулин А. А., Ивашкин В. Т. Физиологическое значение кишечной микробиоты. Consilium medicum. Гастроэнтерология. 2011; 2: 75–8.
6. Урсова Н. И. Нарушения микробиоты и дисфункции билиарного тракта у детей. Под ред. проф. Г. В. Римарчук. Москва. 2005. 218 с.
7. Минушкин О. Н., Ардатская М. Д., Зверков И. В., Чичерин И. Ю. Дисбактериоз кишечника (понятие, диагностика, принципы лечебной коррекции). Современные возможности пребиотической терапии. Москва. 2010. 50 с.
8. Damrongmanee A., Ukarapol N. Incidence of antibiotic-associated diarrhea in a pediatric ambulatory care setting. J Med Asso Thai. 2007; 90: 513–7.
9. Авдеева Т. Г., Рябухин Ю. В. , Парменова Л. П., Крутикова Н. Ю., Жлобницкая Л. А. Детская гастроэнтерология: руководство. Москва: ГЭОТАР-Медиа. 2011. 192 с.
, Парменова Л. П., Крутикова Н. Ю., Жлобницкая Л. А. Детская гастроэнтерология: руководство. Москва: ГЭОТАР-Медиа. 2011. 192 с.
10. Урсова Н. И., Римарчук Г. В., Щеплягина Л. А., Савицкая К. И. Современные методы коррекции дисбиоза кишечника у детей. Учебное пособие. Москва: МОНИКИ. 2000. 48 с.
11. Alam S., Mushtaq M. Antibiotic associated diarrhea in children. Indian Pediatrics. 2009; 46: 491–96.
12. Mitchell D. K., Van R. D., Mason E. H., Norris D. M., Pickering L. K. Prospective study of toxigenic Clostridium difficile in children given amoxicillin/clavulanate for otitis media. Pediatr Infect Dis J. 1996; 15: 514–9.
13. Vanderhoof J. A., Whitney D. B., Antonson D. L., Hanner T. L., Lupo J. V., Young R. J. Lactobacillus GG in the prevention of antibiotic-associated diarrhea in children. J Pediatr. 1999; 135: 564–8.
L., Lupo J. V., Young R. J. Lactobacillus GG in the prevention of antibiotic-associated diarrhea in children. J Pediatr. 1999; 135: 564–8.
14. Arvola T., Laiho K., Torkkeli S., Mykkanen H., Salminen S., Maunula L. et al. Prophylactic Lactobacillus GG reduces antibiotic-associated diarrhea in children with respiratory infections: a randomized study. Pediatrics. 1999; 104: e 64.
15. Jirapinyo P., Densupsoontorn N., Thamonsiri N., Wongarn R. Prevention of antibiotic-associated diarrhea in infants by probiotics. J Med Assoc Thai. 2002; 85 (Suppl. 2): S739–42.
16. Turke D., Bernet J. P., Marx J., Kemph H., Giard P., Welbaum O., Lacombe A., Rembert F., Toursel F., Bernasconi P., Gottrand F., McFarland L. V., Bloch K. Incidence and risk factors of oral antibiotic-associated diarrhea in an outpatient pediatric population. J Pediatr Gastroenterol Nutr. 2003; 37: 22–6.
J Pediatr Gastroenterol Nutr. 2003; 37: 22–6.
17. La Rosa M., Bottaro G., Gulino N., Gambuzza F., Di Forti F., Ini G. et al. Prevention of antibioticassociated diarrhea with Lactobacillus sporogens and fructo-oligosaccharides in children: a multicentric double-blind vs. placebo study. Minerva Pediatr. 2003; 55: 447–52.
18. Seki H., Shiohara M., Matsumura T., Miyagawa N., Tanaka M., Komiyama A. et al. Prevention of antibiotic-associated diarrhea in children by Clostridium butyricum MIYAIRI. Pediatr Int. 2003; 45: 86–90.
19. Kotowska M., Albrecht P., Szajewska H. Saccaromyces boulardii in the prevention of antibiotic-associated diarrhea in children: a randomized double-blind placebo controlled trial. Aliment Pharmacol Ther. 2005; 21: 583–90.
20. Ruszczynski M., Radzikowski A., Szajewska H. Clinical trial: effectiveness of Lactobacillus rhamnosus (strains E/N, Oxy and Pen) in the prevention of antibiotic-associated diarrhoea in children. Alimentary Pharmacol Therap. 2008; 28: 154–61.
Ruszczynski M., Radzikowski A., Szajewska H. Clinical trial: effectiveness of Lactobacillus rhamnosus (strains E/N, Oxy and Pen) in the prevention of antibiotic-associated diarrhoea in children. Alimentary Pharmacol Therap. 2008; 28: 154–61.
21. Kramer M. S., Hutchinson T. A., Naimark L., Contardi R., Flegel K. M., Leduc D. G. Antibiotic-associated gastrointestinal symptoms in general pediatric outpatients. Pediatrics. 1985; 76: 365–70.
22. Детская гастроэнтерология: руководство для врачей. Под ред. проф. Н. П. Шабалова. Москва: МЕДпресс-информ. 2011. 736 с.
23. McFarland L. V. Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease. Am J Gastroenterol. 2006; 101 (4): 812–22.
24. Pinto L.J.F., Alcides A.P.P., Ferreira E. O., Avelar K.E.S., Sabra A., Domingues R.M.C. P. et al. Incidence and importance of Clostridium difficile in paediatric diarrhoea in Brazil. J Med Microbiol. 2003; 52: 1095–9.
25. Benson L., Song X., Campos J., Singh N. Changing epidemiology of Clostridium difficile-associated disease in children. Infect Control Hosp Epidemiol. 2007; 28: 1233–5.
26. Gogate A., De A., Nanivadekar R., Mathur M., Saraswathi K., Jog A. et al. Diagnostic role of stool culture and toxin detection in antibiotic associated diarrhea due to Clostridium difficile in children. Indian J Med Res. 2005; 122: 518–24.
27. Болезни кишечника у детей. Под общей редакцией А. М. Запруднова. Москва: Анахарсис. 2009. 280 с.
М. Запруднова. Москва: Анахарсис. 2009. 280 с.
28. Ардатская М. Д., Дубинин А. В., Минушкин О. Н. Дисбактериоз кишечника: современные аспекты изучения проблемы, принципы диагностики и лечения. Терапевтический архив. 2001; 2: 67–72.
29. Максимов В. А., Далидович К. К., Чернышев А. Л., Мельников В. Л. Диагностические тесты при заболеваниях органов пищеварения. Пенза: Информационно-издательский ПГУ. 2005. 228 с.
30. Римарчук Г. В., Щеплягина Л. А., Круглова И. В., Тюрина Т. К. Нарушение микробиоты кишечника у детей (клиническое значение, диагностика, факторы риска, новые технологии в лечении). Лекция для врачей. Москва. 2009. 32 с.
31. Казначеева Л. Ф., Ишкова Н. С., Казначеев К. С., Молокеев А. В. Методы коррекции дисбиотических нарушений кишечника у детей. Под ред. Л. Ф. Казначеевой. Новосибирск. 2006. 48 с.
С., Молокеев А. В. Методы коррекции дисбиотических нарушений кишечника у детей. Под ред. Л. Ф. Казначеевой. Новосибирск. 2006. 48 с.
32. Kale-Pradhan P. B., Jassal H. K., Wilhelm S. M. Role of Lactobacillus in the prevention of antibiotic-associated diarrhea: a meta-analysis. Pharmacotherapy. 2010; 30 (2): 119–26.
33. Bergogne-Bеrеzin E. Treatment and prevention of antibiotic associated diarrhea. Int J Antimicrob Agents. 2000; 16 (4): 521–6.
34. Doron S. I., Hibberd P. L., Gorbach S. L. Probiotics for prevention of antibiotic-associated diarrhea. J Clin Gastroenterol. 2008; 42 (Suppl. 2): S58–63.
35. Szajewska H., Ruszczynski M., Radzikowski A. Probiotics in the prevention of antibiotic-associated diarrhea in children: a meta-analysis of randomized controlled trials.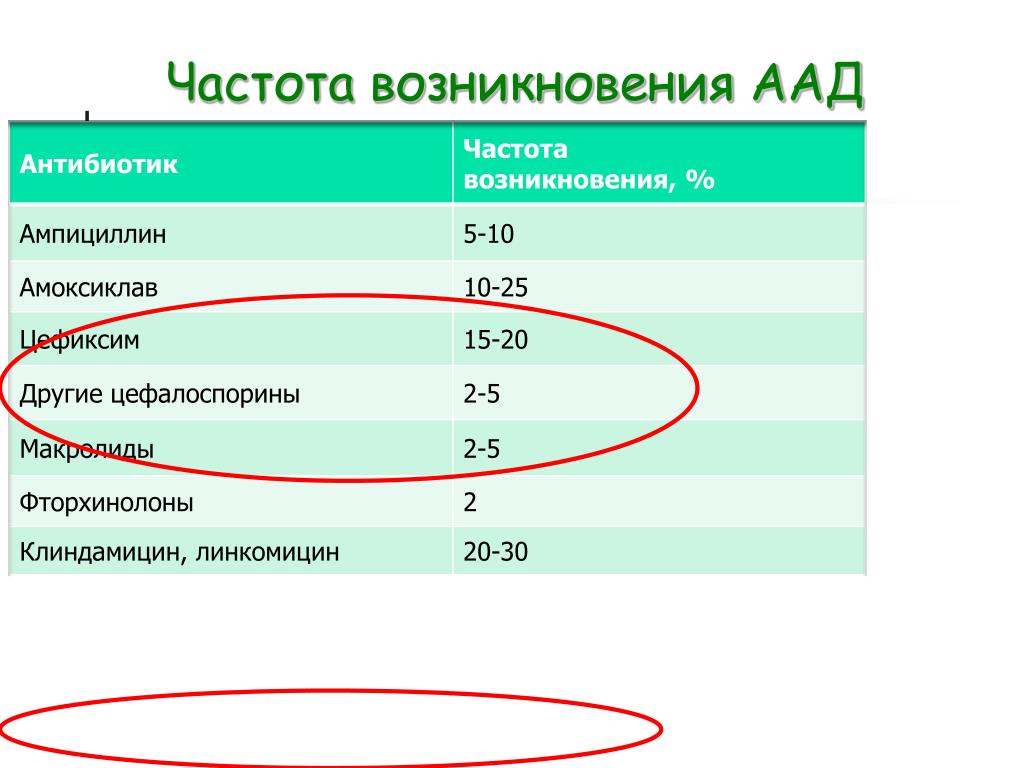 J Pediatr. 2006; 149 (3): 367–72.
J Pediatr. 2006; 149 (3): 367–72.
36. Шендеров Б. А. Медицинская микробная экология и функциональное питание. Москва: ГРАНТЪ. 1998. Т. 1. 288 с.
37. Бельмер С. В., Гасилина Т. В., Хавкин А. И., Эйберман А. С. Функциональные нарушения органов пищеварения у детей. Рекомендации и комментарии. Москва. 2006. 44 с.
38. Татьянина О. Ф. Современные антибактериальные препараты: новые возможности в профилактике дисбиотических наруше-ний. Вопросы современной педиатрии. 2011; 10 (6): 77–82.
39. Сурков А. Н. Возможности пробиотической терапии в комплексном лечении антибиотикоассоциированной диареи у детей. Вопросы современной педиатрии. 2011; 10 (2): 132–6.
40. Сурков А. Н. Возможности коррекции и профилактики нарушений микробиоценоза кишечника у часто болеющих детей. Вопросы современной педиатрии. 2013; 12 (2): 59–65.
Сурков А. Н. Возможности коррекции и профилактики нарушений микробиоценоза кишечника у часто болеющих детей. Вопросы современной педиатрии. 2013; 12 (2): 59–65.
41. Урсова Н. И. Антибиотикоассоциированная диарея: выбор пробиотика с позиций медицины, основанной на доказательствах. Трудный пациент. 2013; 11 (2–3): 22–8.
42. Ли И. А., Сильвестрова С. Ю., Дроздов В. Н. Пробиотик РиоФлора Баланс Нео и антихеликобактерная терапия — повышение эффективности лечения за счет снижения нежелательных явлений. Медицинский совет. 2013; 10: 100–3.
43. Самсонов А. А., Плотникова Е. Ю. Антибиотики: друзья или враги, как найти консенсус? Взгляд гастроэнтеролога на антибиотикоассоциированную диарею. Трудный пациент. 2012; 10 (6): 16–24.
Антибиотикоассоциированная диарея, обусловленная Clostridium difficile
Bogun, L. V. (2006) Antibiotikoassociirovannaya diareya [Antibiotic-associated diarrhea]. Klinicheskaya antibiotikoterapiya, 3, 40–43. [in Russian].
V. (2006) Antibiotikoassociirovannaya diareya [Antibiotic-associated diarrhea]. Klinicheskaya antibiotikoterapiya, 3, 40–43. [in Russian].
Korneyeva, O. N., & Ivashkin, V. T (2007) Antibiotikoassociirovannyj kolit: patomorfologiya, klinika, lechenie [Antibiotic-associated colitis: pathomorphology, clinical presentation, treatment]. Rossijskij zhurnal gastroe’nterologii, gepatologii, koloproktologii, 3, 65–70. [in Russian].
Malov, V. A. (2002) Antibiotikoassociirovannye diarei [Antibiotic-associated diarrhea]. Klinicheskaya mikrobiologiya i antimikrobnaya khimioterapiya, 4(1), 185–197. [in Russian].
Shul’pekova, Yu. O. (2007) Antibiotikoassociirovannaya diareya [Antibiotic-associated diarrhea]. Russkij medicinskij zhurnal, 6, 467–473. [in Russian].
Malov, V. A. (2000) Antibiotiko-associirovannye porazheniya kishechnika [Antibiotic-associated intestinal lesions]. Vrach, 10, 16–19. [in Russian].
Anastasij, N. A., & Dudar’ D. N. (2011) Antibiotikoassociirovannaya diareya: problemy diagnostiki [Antibiotic-associated diarrhea: diagnostic problems]. Klinichna imunolohiia, 2(41), 56–58. [in Russian].
Shifrin, O. S., & Androsova, L. N. (2003) Antibiotikoassociirovannaya diareya: novye vozmozhnosti lecheniya i profilaktiki [Antibiotic-associated diarrhea: new opportunities for treatment and prevention]. Rossijskij zhurnal gastroe’nterologii, gepatologii i koloproktologii, 5, 82–86. [in Russian].
Petruk, M. N., & Neshitov, S. P. (2009) Psevdomembranoznyiy kolit [Pseudomembranous colitis]. Khirurgiya. Zhurnal im. N.I. Pirogova, 4, 55–60. [in Russian].
Kopcha, V. S. (2007) Antybiotykoasotsiiovanyi dysbakterioz kyshechnyku: zahalna kharakterystyka ta mozhlyvosti suchasnoho konservatyvnoho likuvannia [Antibiotic-associated intestinal dysbiosis: general characteristics and possibilities of modern conservative treatment]. Infektsiini khvoroby, 3, 87–96. [in Ukrainian].
Infektsiini khvoroby, 3, 87–96. [in Ukrainian].
Bahrii, M. M. (2012) Psevdomembranoznyi kolit: kliniko-morfolohichnyi analiz fatal’noho vypadku [Pseudomembranous colitis: clinical and morphological analysis of the fatal case]. Arkhiv klinichnoi medytsyny, 2(18), 95–99. [in Ukrainian].
Tumak, I. M (2010) Diareia i psevdomembranoznyi kolit, zumovleni Clostridium difficile [Diarrhea and pseudomembranous colitis are due Clostridium difficile]. Medytsyna svitu, 6, 52–60. [in Ukrainian].
Hall, I. (1935). Intestinal flora in newborn infants with a description of a new pathogenic anaerobe. Bacillus difficilis. Am J Dis Child. 49, 390–393. doi: 10.1001/archpedi.1935.01970020105010.
Lessa, F., Mu, Y., Bamberg, W., Beldavs, Z., Dumyati, G., & Dunn, J. et al. (2015). Burden of Clostridium difficile Infection in the United States. New England Journal Of Medicine, 372(9), 825–834. doi: 10.1056/NEJMoa1408913.
Lofgren, E., Cole, S., Weber, D., Anderson, D., & Moehring, R. (2014). Hospital-Acquired Clostridium difficile Infections. Epidemiology, 25(4), 570–575. doi: 10.1097/EDE.0000000000000119.
Rupnik, M. (2007). Is Clostridium difficile-associated infection a potentially zoonotic and foodborne disease? Clinical Microbiology And Infection, 13(5), 457–459. doi: 10.1111/j.1469-0691.2007.01687.x
Jangi, S., & Lamont, J. (2010). Asymptomatic Colonization by Clostridium difficile in Infants: Implications for Disease in Later Life. Journal of Pediatric Gastroenterology and Nutrition, 51(1), 2–7. doi: 10.1097/MPG.0b013e3181d29767.
Viscidi, R., Laughon, B., Yolken, R., Bo-Linn, P., Moench, T., Ryder, R., & Bartlett, J. (1983). Serum Antibody Response to Toxins A and B of Clostridium difficile. Journal Of Infectious Diseases, 148(1), 93–100. doi: 10.1093/infdis/148.1.93.
Rousseau, C. , Poilane, I., De Pontual, L., Maherault, A., Le Monnier, A., & Collignon, A. (2012). Clostridium difficile Carriage in Healthy Infants in the Community: A Potential Reservoir for Pathogenic Strains. Clinical Infectious Diseases, 55(9), 1209–1215. doi: 10.1093/cid/cis637.
, Poilane, I., De Pontual, L., Maherault, A., Le Monnier, A., & Collignon, A. (2012). Clostridium difficile Carriage in Healthy Infants in the Community: A Potential Reservoir for Pathogenic Strains. Clinical Infectious Diseases, 55(9), 1209–1215. doi: 10.1093/cid/cis637.
Eglow, R., Pothoulakis, C., Itzkowitz, S., Israel, E., O’Keane, C., Gong, D., et al. (1992). Diminished Clostridium difficile toxin A sensitivity in newborn rabbit ileum is associated with decreased toxin A receptor. Journal of Clinical Investigation, 90(3), 822–829. doi: 10.1172/JCI115957.
O’Connor, J., Johnson, S., & Gerding, D. (2009). Clostridium difficile Infection Caused by the Epidemic BI/NAP1/027 Strain. Gastroenterology, 136(6), 1913–1924. doi: 10.1053/j.gastro.2009.02.073.
McDonald, L., Killgore, G., Thompson, A., Owens, R., Kazakova, S., Sambol, S., et al. (2005). An Epidemic, Toxin Gene–Variant Strain of Clostridium difficile. New England Journal of Medicine, 353(23), 2433–2441.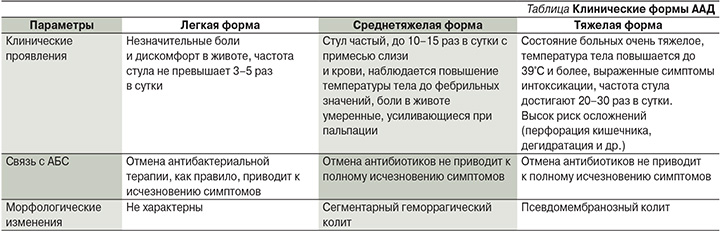 doi: 10.1056/NEJMoa051590.
doi: 10.1056/NEJMoa051590.
Akerlund, T., Persson, I., Unemo, M., Noren, T., Svenungsson, B., Wullt, M., & Burman, L. (2008). Increased Sporulation Rate of Epidemic Clostridium difficile Type 027/NAP1. Journal of Clinical Microbiology, 46(4), 1530–1533. doi: 10.1128/JCM.01964-07.
Loo, V., Poirier, L., Miller, M., Oughton, M., Libman, M., Michaud, S., et al. (2005). A Predominantly Clonal Multi-Institutional Outbreak of Clostridium difficile – Associated Diarrhea with High Morbidity and Mortality. New England Journal of Medicine, 353(23), 2442–2449. doi: 10.1056/NEJMoa051639.
Warny, M., Pepin, J., Fang, A., Killgore, G., Thompson, A., & Brazier, J. et al. (2005). Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. The Lancet, 366(9491), 1079–1084. doi: 10.1016/S0140-6736(05)67420-X.
McFarland, L., Elmer, G. W., & Surawicz, C. M. (2002). Breaking the cycle: treatment strategies for 163 cases of recurrent Clostridium difficile disease. The American Journal of Gastroenterology, 97(7), 1769–1775. doi: 10.1111/j.1572-0241.2002.05839.x.
W., & Surawicz, C. M. (2002). Breaking the cycle: treatment strategies for 163 cases of recurrent Clostridium difficile disease. The American Journal of Gastroenterology, 97(7), 1769–1775. doi: 10.1111/j.1572-0241.2002.05839.x.
Ghose, C., Kalsy, A., Sheikh, A., Rollenhagen, J., John, M., Young, J. et al. (2007). Transcutaneous Immunization with Clostridium difficile Toxoid A Induces Systemic and Mucosal Immune Responses and Toxin A-Neutralizing Antibodies in Mice. Infection And Immunity, 75(6), 2826–2832. doi: 10.1128/IAI.00127-07.
Chitnis, A. S., Holzbauer, S. M., Belflower, R. M., Winston, L. G., Bamberg, W. M., Lyons, C., et al. (2013). Epidemiology of community-associated Clostridium difficile infection, 2009 through 2011. JAMA Intern Med, 173(14), 1359–1367. doi: 10.1001/jamainternmed.2013.7056.
Антибиотикоассоциированные диареи: современный взгляд на проблему
В связи с широким применением в клинической практике антимикробных препаратов на современном этапе все большее внимание уделяется рациональным подходам к назначению антибактериальной терапии (АБТ).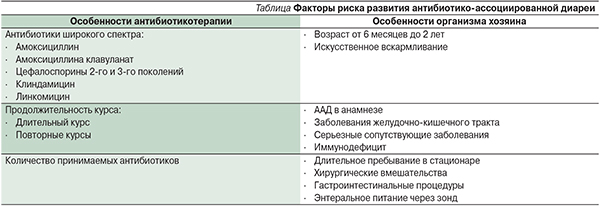 Сегодня можно говорить не просто о нежелательных реакциях и побочных эффектах АБТ, а о глобальных тенденциях, требующих незамедлительного решения. Одной из актуальных проблем медицины является развитие у пациентов на фоне применения антимикробных средств антибиотикоассоциированных диарей (ААД).
Сегодня можно говорить не просто о нежелательных реакциях и побочных эффектах АБТ, а о глобальных тенденциях, требующих незамедлительного решения. Одной из актуальных проблем медицины является развитие у пациентов на фоне применения антимикробных средств антибиотикоассоциированных диарей (ААД).
По данным различных авторов, частота развития ААД у госпитализированных пациентов в зависимости от профиля заболевания, используемых препаратов и действия предрасполагающих факторов может варьировать от 3 до 29%. Спорадические или групповые случаи ААД регистрируются в хирургических, терапевтических, урологических, гериатрических и других стационарах. Интересны данные Biocodex Laboratories, согласно которым среди 16 200 пациентов, принимавших антибиотики, развитие диареи на фоне приема антимикробных препаратов и в последующие 3 месяца после их отмены отметили 9% опрошенных моложе 15 лет и 15% старше 15 лет. Несмотря на то, что у детей диарея развивалась реже, чем у взрослых, наиболее уязвимыми были новорожденные и дети до 5 лет, среди них ААД зарегистрирована в 24% наблюдений. Как показал опрос, 61% больных самостоятельно установили связь между приемом АБ и возникновением диареи, но только 27% из них обратились по данному поводу за медицинской помощью.
Как показал опрос, 61% больных самостоятельно установили связь между приемом АБ и возникновением диареи, но только 27% из них обратились по данному поводу за медицинской помощью.
ААД могут протекать в различной форме – от нетяжелой самокупирующейся диареи до псевдомембранозного и фульминантного колита. По современным представлениям, при АБТ подавляется рост не только патогенных микроорганизмов, но и нормальной микрофлоры кишечника. В кишечнике здорового человека находится свыше 500 видов микробов, общее количество которых составляет 1014, что на порядок выше общего числа клеточного состава человеческого организма. Количество бактерий увеличивается в направлении от желудка к толстой кишке, достигая в ободочной кишке более 1 трлн/мл микробных тел.
К важнейшим физиологическим функциям кишечной микрофлоры относятся: морфокинетическая (трофическая) – продукты метаболизма микробов служат источником питания эпителиоцитов и стимулируют моторику кишечника; защитная – обеспечение колонизационной резистентности, формирование биопленки, предотвращающей адгезию чужеродных микробов, продуцирование лизоцима, органических и свободных желчных кислот, конкуренция за рецепторы и пищевые субстраты, увеличение скорости обновления клеток; пищеварительная – участие в метаболизме клетчатки и неусвоенных нутриентов, синтетическая функция – синтез холестерина, витаминов и других биологически активных веществ, иммуногенная – стимуляция синтеза иммуноглобулинов и иммунокомпетентных клеток; участие в патогенезе целого ряда патологических состояний и заболеваний (канцерогенез, ожирение, гиперхолестеринемия, артериальная гипертензия, аллергия, артриты, оксалатурия и мочекаменная болезнь, болезнь Альцгеймера и др.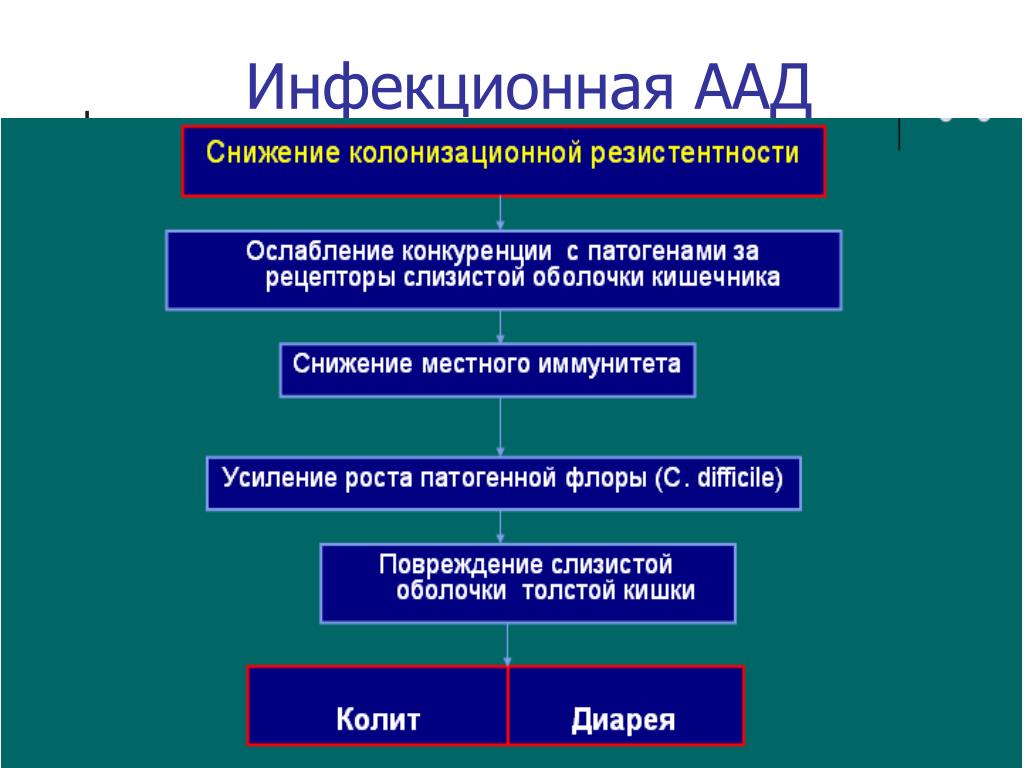 ).
).
На фоне угнетения нормальной микрофлоры кишечника происходит размножение сапрофитных микроорганизмов, которые приобретают патогенные свойства и высокую устойчивость к лекарственным препаратам. Как один из наиболее важных этиологических факторов развития ААД на сегодняшний день рассматривается облигатный грамположительный спорообразующий анаэроб Clostridium difficile. Так, согласно многочисленным данным, C. difficile ответственна за развитие 10-30% случаев ААД, 50-75% антибиотикоассоциированных колитов и фактически всех случаев псевдомембранозного колита (ПМК). Хотя роль других возбудителей изучена недостаточно, имеющиеся наблюдения свидетельствуют, что ААД могут быть обусловлены и другими микроорганизмами, такими как Salmonella spp., Clostridium perfringens тип А, Staphylococcus aureus и, возможно, грибами рода Candida.
Однако в большинстве случаев ААД следует рассматривать как полиэтиологичный синдром, не связанный с определенным инфекционным агентом и обусловленный неспецифическими изменениями нормальной микрофлоры кишечника. Подробный анализ изменений концентраций маркеров микроорганизмов (специфических жирных кислот) показывает увеличение концентрации лактобацилл, бифидобактерий, энтерококков, Eubacterium, Bacillus cereus, C. рroрionicum и т.д. Общая колонизация кишечника при ААД возрастает в 2-5 раз.
Подробный анализ изменений концентраций маркеров микроорганизмов (специфических жирных кислот) показывает увеличение концентрации лактобацилл, бифидобактерий, энтерококков, Eubacterium, Bacillus cereus, C. рroрionicum и т.д. Общая колонизация кишечника при ААД возрастает в 2-5 раз.
Существует ряд неинфекционных причин развития диареи на фоне приема антибиотиков. Так, например, эритромицин действует на мотилиновые рецепторы, клавулановая кислота и ее метаболиты стимулируют моторику тонкой кишки, пенициллины могут вызывать сегментарный колит, тетрациклины – оказывать непосредственное токсическое действие на слизистую оболочку желудочно-кишечного тракта. В результате снижения количества анаэробов в кишечнике на фоне АБТ нарушается метаболизм углеводов, что, в свою очередь, может привести к осмотической диарее.
ААД особенно часто вызывают линкомицин, клиндамицин, ампициллин, пенициллин, цефалоспорин, тетрациклин, эритромицин. Единодушно мнение специалистов о том, что способ введения АБ не играет особой роли. Так, при пероральном приеме АБ, помимо влияния на кишечную микрофлору, происходит местное воздействие на слизистую оболочку тонкой кишки; при парентеральном – АБ воздействуют на микробиоценоз кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишки. У большинства больных симптомы ААД появляются во время лечения, в 30% случаев – спустя 1-10 дней после его прекращения.
Заболевание протекает обычно без повышения температуры тела, лейкоцитоза, не сопровождается воспалительными изменениями слизистой оболочки толстой кишки. Для прекращения диареи зачастую достаточно отмены АБ или снижения его дозы, потребность в лечении возникает редко. Имеются сообщения о целесообразности лечения ААД большими дозами пробиотиков.
Современные требования к пробиотикам следующие: натуральное происхождение, устойчивость к действию кислоты желудочного сока и желчи, адгезия компонентов со стенками кишечника, способность активно колонизировать кишечник, антагонизм к патогенным бактериям, достоверно подтвержденный клинический эффект, безопасность.
Пациентам группы риска (дети до 5 лет, лица старших возрастных групп, пациенты, страдающие тяжелой соматической патологией, а также больные с различными хроническими заболеваниями желудочно-кишечного тракта) рекомендовано для предупреждения развития ААД применение бактериальных препаратов с первого дня антибиотикотерапии.
Патогенетические механизмы и подходы к лечению ААД, обусловленной Clostridium difficile, и острого осложнения антибактериальной терапии – псевдомембранозного колита – имеют свои особенности.
Частота носительства данного микроорганизма среди взрослого населения составляет 2-3%. Обязательное условие для формирования носительства у людей – нарушение состава нормальной эндогенной микрофлоры толстой кишки. В многочисленных клинико-экспериментальных исследованиях продемонстрировано, что нормальная эндогенная микрофлора способна эффективно ингибировать колонизацию кишечника C. difficile. Риск инфицирования возрастает при госпитализации больных и прямо пропорционален длительности пребывания в стационаре. Через 1-2 недели после госпитализации высеваемость C. difficile регистрируется у 13% больных, через 4 недели и более – у 50%. В среднем, 20-30% пациентов становятся носителями C. difficile в период госпитализации, а у 1/3 из них развивается ААД. Факторами, повышающими риск развития ААД у госпитализированных пациентов, являются возраст и тяжелые сопутствующие заболевания (ожоговая болезнь, уремия, лейкозы и др.). Достоверно установлено, что у людей старше 60 лет частота обнаружения C. difficile в испражнениях в десятки раз превышает аналогичный показатель у лиц молодого возраста, хотя причины данного явления пока недостаточно изучены.
При применении клиндамицина, ампициллина и цефалоспоринов частота носительства C. difficile возрастает до 15-40%. Спектр клинических проявлений варьирует от бессимптомного носительства до легкой ААД и тяжелого ПМК.
Развитие манифестных форм болезни связывают с выработкой бактериями токсинов А и В. ААД вызывают только токсигенные штаммы C. difficile. Большинство штаммов, выделяемых от пациентов с симптомами ААД, продуцируют оба токсина (до 75%), хотя в литературе имеются указания на то, что могут быть выделены штаммы, продуцирующие только один токсин.
Токсины являются крупными белковыми экзотоксинами с молекулярной массой 308 кД (токсин А – энтеротоксин) и 269 кД (токсин В – цитотоксин). Токсин А in vivo связывается со специфическими рецепторами, содержащими галактоза-b-1,4-N-ацетилглюкозамин, который входит в состав полисахаридных антигенов, обнаруживаемых на эпителиальных клетках кишечника человека. Рецепторы токсина В пока остаются неидентифицированными. Общее в действии этих токсинов – цитопатический эффект, который они реализуют через инактивацию Rho-протеинов, относящихся к семейству малых гуанозинтрифосфат(GTP)-связывающих белков. Эти протеины регулируют функции актина, цитоскелета клеток и процесс трансдукции клеточных сигналов.
Обусловленная токсинами дисрегуляция Rho-протеинов приводит к разрушению цитоскелета, округлению клеток, ретракции и апоптозу. Оба токсина, действуя синергично, вызывают развитие воспалительной реакции в слизистой оболочке толстой кишки (посредством активации выработки и секреции моноцитами цитокинов) с секрецией богатого белком экссудата, содержащего нейтрофилы, моноциты и слущенные энтероциты. Кроме того, токсин А стимулирует секрецию жидкости в просвет кишечника.
Основной симптом ААД и ПМК – обильная водянистая диарея, к которой присоединяются схваткообразные боли в брюшной полости, стихающие после акта дефекации. При развитии ПМК водянистая диарея сменяется диареей воспалительного характера с примесью крови и лейкоцитов в каловых массах, сопровождающейся фебрильной лихорадкой и лейкоцитозом. Далее возникает экссудативная энтеропатия с потерей белка через кишечник, что приводит к развитию гипоальбуминемии, отеков.
Лейкопения редко регистрируется у больных с ПМК, она является предиктором фульминантного течения, осложненного бактериемией. Приблизительно у 50% таких больных после диареи наблюдаются отсутствие испражнений, признаки кишечной непроходимости, появление симптомов «острого живота», одновременное поражение тонкой и толстой кишки.
К осложнениям ПМК относят электролитные нарушения, дегидратацию, токсический мегаколон и перфорацию толстой кишки. Без лечения летальность в таких случаях достигает 15-30%.
Диагноз ПМК подтверждается бактериологическими исследованиями, обнаружением при эндоскопии на слизистой оболочке толстой кишки бляшковидных, лентовидных и сплошных мембран, мягких, спаянных со слизистой оболочкой. Диаметр мембран – 2-8 мм, они кремового цвета, состоят из фибрина, некротизированных эпителиальных клеток и лейкоцитов. Наиболее изменены дистальные отделы ободочной и прямой кишки, без изъязвлений. При гистологическом исследовании определяется субэпителиальный отек с круглоклеточной инфильтрацией собственной пластинки, капиллярные стазы с выходом эритроцитов за пределы сосудов. На стадии образования псевдомембран под поверхностным слоем слизистой оболочки возникают экссудативные инфильтраты, местами оголяется слизистая оболочка с тенденцией к распространению на большие сегменты кишки в поздних стадиях болезни.
Лечение ПМК включает обязательную отмену АБ, прием которого спровоцировал развитие болезни, восстановление водно-электролитного баланса. Основными этиотропными препаратами, применяемыми при инфекции, вызванной C. difficile, являются метронидазол и ванкомицин, сопоставимые по клинической эффективности. Однако начинать лечение следует с метронидазола, так как ванкомицин может способствовать селекции резистентности к нему у энтерококков. Обязательное условие специфической этиотропной терапии – пероральный прием препарата, позволяющий поддерживать максимальную его концентрацию в просвете кишечника. При недостаточной эффективности антибактериальной терапии при ПМК рекомендуется внутривенное введение человеческого иммуноглобулина.
Ни одна из апробированных схем этиотропной терапии не гарантирует полной санации кишечника от спор C. difficile, поэтому остается угроза возникновения рецидива. У 20% больных ПМК имеет рецидивирующее течение, у 2-5% отмечают множественные рецидивы, причем после первого рецидива риск повторного возрастает до 68%. Факторами риска также являются: пожилой возраст, перенесенные операции на органах брюшной полости, хроническая почечная недостаточность, женский пол, развитие болезни в весенний период. К сожалению, сегодня для больных с множественными рецидивами инфекции C. difficile не существует достаточно надежных и эффективных схем лечения. В целях профилактики применяют пульс-терапию ванкомицином, комбинированную АБТ (ванкомицин + рифампицин), холестирамин, внутривенное введение иммуноглобулина. Перспективны рекомендации по применению больших доз пробиотиков, однако их прием также не гарантирует предотвращения рецидивов.
Таким образом, внимание врачей различного профиля должно быть направлено в первую очередь на соблюдение принципов рационального применения АБТ. С целью профилактики ААД и ПМК назначение АБ следует осуществлять только по строгим показаниям. Необходимо своевременно прекращать их использование при достижении клинического эффекта и немедленно отменять препарат при появлении диареи или симптомов ПМК.
Литература
1. Ерохин И.А., Шляпников С.А. и соавт. Псевдомембранозный колит и «кишечный сепсис» – следствие дисбактериоза, вызванного антибиотиками. Вестник хирургии им. И.И. Грекова, 1997, т. 156, №2, с. 108-111.
2. Парфенов И.А., Ручкина И.Н., Осипов Г.А. Антибиотикоассоциированная диарея и псевдомембранозный колит. Consilium-medicum, приложение, 2002.
3. McFarland L.V. Diarrhea acquired in the hospital. Gastroenterol Clin North Am 1993; 22:563-77.
4. George W.L., Rolfe R.D., Finegold S.M. Clostridium difficile and its cytotoxin in feces of patients with antimicrobial agent-associated diarrhea and miscellaneous conditions. J Clin Microbiol 1982; 15:1049-53.
5. Benoit R., Dorval D., Loulergue J., et al. Post-antibiotic diarrheas: role of Klebsiella oxytoca. Gastroenterol Clin Biol 1992; 16:860-4.
6. Hogenauer C., Hammer H., Krejs G. Mechanisms and management of antibiotico-associated diarrhea. Clin Inf Dis 1998; 27:702-10.
7. Holmberg S.D., Oslterholm M.T., Senger K.A. Drag-resistant Salmonella from animal fed antimicrobials. N Engl J Med 1984; 311:617-22.
8. McDonald M., Ward P., Harvey K. Antibiotic-associated diarrhoea and methicillin-resistant Staphylococcus aureus. Med J Aust 1982; 1:462-4.
9. Reinke C.M. ASHP therapeutic position statement on the preferential use of metronidazole for the treatment of Clostridium difficile-associated disease. Am J Health-Syst Pharm 1998; 55:1407-11.
10. Taylor M., Ajayi F., Almond M. Enterocolitis caused by methicillin-resistant Staphylococcus aureus. Lancet 1993; 342:804.
11. Prescott R.J., Harris M., Banejee S.S. Funginal infections of the small and large intestine. J Clin Pathol 1992; 45:806-11.
12. Hogenauer C., Hammer H.F., Krejs G.J., Reisinger E.C. Mechanisms and management of antibiotic-associated diarrhea. Clin Infect Dis 1998; 27:702-10.
13. Depitre C., Delmee M., Avesani V., et al. Serogroup F strains Clostridium difficile of produce toxin B but not toxin A. J Med Mecrobiol 1993; 3:434-41.
14. Hippenstiel S., Kratz T., Krull M., et al. Rho protein inhibition blocks protein kinase C translocation and activation. Biochem Biophys Res Commun 1998; 245:830-4.
15. Knoop F.C., Owens M., Crocker I.C. Clostridium difficile: Clinical disease and diagnosis. Clin Microbiol Rev 1993; 6:251-65.
16. Manabe Y.C., Vinetz J.M., MooreR.D., et al. Clostridium difficile colitis: An efficient clinical approach to diagnosis. Ann Intern Med 1995; 123:835-40.
17. Byl B., Jacobs F., Struelens M.J., Thys J.P. Extraintestinal infections Clostridium difficile. Clin Infect Dis 1995; 20:160-2.
18. Do A.N., Fridkin S.K., Yechouron A., et al. Risk factors for early recurrent Clostridium difficile-associated diarrhea. Clin Infect Dis 1998; 26:954-9.
19. Bergstein J.M., Kramer A., Wittman D.H., et al. Pseudomembranous colitis: How useful is endoscopy? Surg Endosc 1990; 4:217-9.
20. Fekety R. Guidelines for the diagnosis and management of Clostridium difficile-associated diarrhea and colitis. American College of Gastroenterology. Practice Parameters Committee. Am J Gastroenterol 1997; 92:739-50.
21. Teasley D.G., Gerding D.N., Olson M.M., et al. Prospective randomised trial of metronidazole versus vancomycin for Clostridium difficile-associated diarrhoea and colitis. Lancet 1983; 2:1043-6.
22. MacLaren R., Morton T.H., Kuhl D.A. Effective management of Clostridium difficile colitis. Hosp Pharm 1997; 32:1126-32.
23. Elmer G.W., McFarland L.V., Surawicz C.M., Danko L., Greenberg R.N. Behaviour of Saccharomyces boulardii in recurrent Clostridium difficile disease patients. Aliment Pharmacol Ther 1999; 13(12):1663-8.
СТАТТІ ЗА ТЕМОЮ
28.07.2021
Урологія та андрологія
Профілактика інфекційних ускладнень при проведенні біопсії передміхурової залози та інших урологічних втручаннях
У 2021 році експерти ЄАУ оновили рекомендації стосовно вибору методики й профілактики ускладнень при проведенні біопсії передміхурової залози (ПЗ). Дані нового метааналізу показали суттєве зменшення інфекційних ускладнень при біопсії ПЗ трансперинеальним доступом порівняно із трансректальним. Відповідно до результатів 7 рандомізованих клінічних досліджень за участю 1786 чоловіків, найбільш ефективною профілактикою інфекційних ускладнень при цьому втручанні є попередня обробка прямої кишки розчином повідон-йоду (рівень доказовості 1а). …
28.07.2021
Інфекційні захворювання
Урологія та андрологія
Принципи вибору антибіотиків для лікування інфекцій сечовивідних шляхів
Інфекції сечовивідних шляхів є надзвичайно поширеною проблемою в усьому світі. Через широке застосування антибактеріальних препаратів для їх лікування збудники інфекцій стають резистентними до більшості лікарських засобів. Вирішенням цієї глобальної проблеми має бути застосування тих антибіотиків, до яких резистентність збудників є мінімальною. У статті представлено принципи вибору найбільш ефективних антибактеріальних засобів для лікування інфекцій сечовивідних шляхів….
Острая диарея, ассоциированная с Clostridium difficile
Содержание номера
Т.А. Соломенцева,
ГУ «Институт терапии имени Л.Т. Малой АМН Украины», г. Харьков
Диарейный синдром, особенно острая диарея, которая не проходит самостоятельно, является труднокурируемой патологией, требующей скорой помощи пациенту, так как влечет за собой нарушение электролитного баланса и трофологическую недостаточность. При острой диарее быстро развивается значительно выраженная дегидратация организма. Иногда она приобретает катастрофическое значение и может угрожать жизни пациента. Возникновение острой диареи требует проведения неотложных мероприятий для правильной постановки диагноза и назначения адекватной терапии.
В зависимости от причины возникновения диареи и ведущего механизма развития необходим дифференцированный подход к лечению. Поэтому важным этапом является установление причины острой диареи для назначения своевременного и успешного лечения, от которого зависит прогноз больного.
Диарея (понос) — это учащение дефекаций и одновременно изменение консистенции кала (кал становится жидким и кашицеобразным). Диагностическим критерием диареи является повышение содержания жидкости в фекалиях с 60–75 до 85–90% или увеличение их массы более 200 г в сутки. Острой диарея считается, если ее продолжительность не превышает 2–3 недель, хронической — если жидкий стул продолжается более 3 недель [1].
Причинами развития острой диареи чаще всего являются прием лекарственных препаратов, инфекционные возбудители или их токсины, воспалительные или ишемические заболевания кишечника, воспаление в органах малого таза.
Инфекционная диарея является наиболее угрожающей для жизни пациента и наиболее сложной для выбора тактики лечения. Часто этиологический фактор поноса, обусловленного инфекционными агентами, установить не удается. Очень важным в этой связи является выделение из спектра инфекционной диареи колита, обусловленного инфекцией Clostridium difficile (С. difficile), так как данная патология требует особого подхода к тактике ведения пациентов. Предполагать наличие С. difficile как этиологического фактора диареи необходимо у любого больного, прошедшего курс антибиотикотерапии в течение предшествующих 4–8 недель. Симптомы могут возникать в первые дни приема антибиотиков и до 2 месяцев после прекращения лечения.
Антибиотикоассоциированный колит — воспалительное заболевание толстой кишки, ассоциированное с антибиотикотерапией, чаще всего вызванное инфекцией С. difficile и варьирующее от кратковременной диареи до тяжелого псевдомембранозного колита с образованием фибринозных бляшек на слизистой оболочке толстой кишки. Иногда используется также неофициальное название — С. difficile-колит.
Актуальность проблемы антибиотикоассоциированных диарей связана с неконтролируемым применением антибиотиков, что обусловливает усиление побочных эффектов антибиотикотерапии. Частым осложнением антибиотикотерапии является диарея, которая регистрируется в 3–25% от всех случаев применения антибиотиков. Виновником острой диареи у половины пациентов, принимающих антибиотики или другие антибактериальные агенты, является С. difficile.
Инфекция С. difficile — наиболее частая причина госпитальной диареи. В лечебных учреждениях и домах престарелых С. difficile выделяется у 30% больных с бессимптомным течением заболевания и в настоящее время признана основной причиной госпитальной диареи. При внутрибольничных вспышках наблюдается наиболее тяжелое течение данной инфекции [1]. Распространенность антибиотикоассоциированной диареи у амбулаторных больных также высока и cоставляет 22 случая на 100 тысяч населения [3].
Фактором риска развития колита, обусловленного С. difficile, служит прием антибиотиков и некоторых других лекарственных средств, обладающих антибактериальными свойствами. Прием практически любого антибиотика может быть связан с риском возникновения антибиотикоассоциированной диареи, но чаще всего тяжелое воспаление в кишечнике вызывают антибиотики широкого спектра действия. К наиболее опасным в этом отношении относятся клиндамицин, цефалоспорины (цефазолин, цефалексин и др.), производные пенициллина, клавулановая кислота. Клиндамицин — один из антибиотиков, который вызывает классические нарушения в кишечнике, характерные для псевдомембранозного колита. Совместное применение антибиотиков и лекарственных препаратов с антихолинергическими эффектами увеличивает риск развития псевдомембранозного колита в несколько раз. Препараты данной группы замедляют кишечный транзит и увеличивают время контакта бактерий со слизистой оболочкой кишки, задерживают токсины, усиливают эффекты антибиотиков широкого спектра действия.
Лица старше 60 лет более подвержены этому заболеванию. Пациенты, имеющие сопутствующую патологию, особенно сахарный диабет, аутоиммунные заболевания, цирроз печени, также попадают в группу риска развития псевдомембранозного колита. У больных, получающих иммуносупрессивную терапию, рост С. difficile наблюдается в 2 раза чаще, чем в общей популяции. К другим факторам риска относят последствия оперативного вмешательства и инвазивные процедуры на органах брюшной полости. Следует отметить, что сам факт госпитализации в стационар увеличивает риск развития псевдомембранозного колита.
В некоторых опубликованных источниках имеются единичные сведения о том, что длительный прием ингибиторов протонной помпы может усиливать размножение C. difficile в кишечнике и провоцировать развитие псевдомембранозного колита [2]. На сегодняшний день этот вопрос остается недостаточно изученным. Для более убедительного подтверждения данного предположения необходимо проведение широкомасштабных клинических исследований. Данные недавно проведенного многоцентрового контролируемого исследования показали, что ингибиторы протонной помпы не являются факторами риска развития псевдомембранозного колита. [4]
Реакция микрофлоры кишки на прием антибиотиков связана с нарушением нормального функционирования кишечной микробиоты. Под воздействием антибиотиков широкого спектра действия уменьшается количество анаэробов нормальной кишечной микрофлоры, нарушаются переваривание и всасывание углеводов и клетчатки, что обусловливает возникновение осмотической диареи. Неабсорбированные углеводы в просвете кишки создают избыточное осмотическое давление, способствуя повышенной секреции воды в просвет кишечника. Нарушение нормальной бактериальной флоры кишечника вызывает снижение синтеза короткоцепочечных жирных кислот и также приводит к нарушению адсорбции воды и электролитов, что усиливает диарейный синдром.
Важным механизмом развития диареи при приеме антибиотиков является снижение защитной функции кишки за счет снижения колонизационной резистентности, способности нормальной кишечной микрофлоры эффективно подавлять рост и размножение патогенных микроорганизмов. В результате этого снижаются местный иммунитет, синтез иммуноглобулина А, лизоцима. В условиях снижения конкуренции за жизненное пространство и питательные вещества появляется возможность для гораздо более бурного роста патогенных бактерий, в частности С. difficile [3]. С. difficile — это грамположительный спорообразующий анаэроб, являющийся представителем условно-патогенной кишечной микрофлоры. Повреждающее воздействие на кишечную стенку наносится посредством выработки токсинов А и В, которые действуют синергически и потенцируют друг друга. [3].
Спектр заболеваний, связанных с размножением в толстой кишке С. difficile, варьирует от легкой диареи до тяжелых форм псевдомембранозного колита, который при нераспознанных случаях может осложняться токсическим мегаколоном и перфорацией толстой кишки. Необходимо помнить, что симптомы заболевания могут возникать как в первые дни приема антибиотиков, так и в течение 2 месяцев после прекращения лечения.
Псевдомембранозный колит характеризуется поносом до 7–10 раз в сутки, в тяжелых случаях — до 15–20 раз в сутки, абдоминальной болью и лихорадкой. Обычно понос не сопровождается выделением крови, хотя кровь может появляться, если больной принимает антикоагулянты или антитромбоцитарные препараты либо имеет сопутствующее заболевание кишечника, например геморрой. Боль в животе почти всегда присутствует, носит схваткообразный характер и может быть достаточно интенсивной. Иногда наблюдаются перитонеальные симптомы, положительный симптом раздражения брюшины при пальпации живота. В легких случаях температура тела субфебрильная, однако у некоторых пациентов может повышаться до 38–40°С. Конституциональные симптомы типа лихорадки, дегидратации, потери аппетита также выражены в развернутой фазе заболевания. Общая астенизация очень характерна для пациентов с колитом, ассоциированным с патологическим ростом С. difficile. Фактически один из основных способов заподозрить псевдомембранозный колит у лиц с диарей, вызванной антибиотиками, — это правильная оценка астенического состояния. Пациенты часто выглядят обессиленными, сонливыми и вообще нездоровыми, имеют «больной» внешний вид. Однако подобная клиническая картина может наблюдаться при любой острой инфекционной диарее, тяжелых формах воспалительных заболеваний кишечника. Отсутствие четких типичных клинических симптомов может затруднить диагностику и отсрочить начало этиотропной терапии.
Диагностика псевдомембранозного колита строится на классических принципах. Для постановки правильного диагноза существенно важны данные анамнеза заболевания. Тщательный сбор анамнеза является ключом к выбору дальнейшей тактики обследования и лечения пациентов с острой диареей. В большинстве случаев пациент, заболевший псевдомембранозным колитом, недавно принимал антибиотики. Любое применение пациентом антибактериальных средств в течение последних месяцев должно привлечь внимание врача. Болезнь может развиться уже после одного или двух месяцев использования антибиотиков. Хотя есть некоторая зависимость между дозой и продолжительностью приема антибиотика и вероятностью развития псевдомембранозного колита, заболевание может возникнуть даже после однократного приема антибиотика. Профилактическое назначение антибиотика перед оперативным вмешательством у пациентов с хирургической патологией также может быть причиной развития пседомембранозного колита в послеоперационный период.
Тщательный осмотр больного и правильная интерпретация клинических симптомов позволяют предположить наличие у пациента псевдомембранозного колита.
Результаты лабораторных исследований могут лишь незначительно дополнить информацию, полученную при сборе анамнеза и объективном осмотре. При оценке результатов лабораторных исследований в крови выявляют анемию, лейкоцитоз со сдвигом формулы крови влево, увеличение скорости оседания эритроцитов (СОЭ), низкий сывороточный альбумин. Лейкоцитоз иногда может достигать высоких значений. Копрологическое исследование показывает наличие лейкоцитоза, обильной йодофильной микрофлоры, иногда — небольшого количества эритроцитов.
Стандартом диагностики служит исследование кала на наличие токсинов А и В С. difficile методом иммуноферментного анализа, результаты которого можно получить в течение нескольких часов, а чувствительность и специфичность метода приближаются к 100%. В редких случаях определить наличие токсинов не удается; это связано с тем, что часть штаммов C. difficile вырабатывает другие токсины. В стандартные панели для диагностики входит исследование только двух токсинов — А и B.
В таких случаях диагностика должна базироваться на данных колоноскопии и микробиологического исследования кала.
Диагностика заболевания при помощи получения культуры стула ограничивается временными интервалами, а также микробиологическими особенностями С. difficile. Выделить культуру из фекалий пациента и получить рост колоний С. difficile удается приблизительно в 20% случаев антибиотикоассоциированной диареи. Поэтому иммуноферментный метод диагностики является более информативным.
Колоноскопия и сигмоскопия используются для проведения дифференциальной диагностики с воспалительными заболевания толстой кишки, опухолями. Чаще воспалительные изменения при псевдомембранозном колите локализуются преимущественно в дистальных отделах ободочной кишки, в некоторых случаях могут поражаться и правые отделы толстого кишечника. При эндоскопическом исследовании при колите, ассоциированном с С. difficile, определяется выраженный отек, гиперемия слизистой оболочки, контактная кровоточивость. Характерными являются патологические образования на стенках ободочной или прямой кишки, в виде желтых фибринозных пленок (псевдомембран) на слизистой оболочке. До появления результатов иммуноферментного и бактериологического исследований стула диагноз устанавливается на основании характерной картины эндоскопии.
Осложнениями псевдомембранозного колита являются электролитные нарушения, дегидратация, снижение артериального давления, перфорация толстой кишки. Угрожающее жизни осложнение — развитие токсического мегаколона. Дилатация кишки более 6 см и рефрактерное течение проводимой терапии являются показанием к срочной тотальной колэктомии.
Выбор лечения во многом зависит от тяжести состояния пациента, сопутствующей патологии, наличия осложнений. Препаратами этиотропной терапии являются метранидазол и ванкомицин.
Обычно при легких и среднетяжелых формах колита лечение начинают с метронидазола, который назначается перорально по 250 мг 4 раза в сутки в течение 7–10 дней. В качестве альтернативного препарата может применяться ванкомицин перорально по 125 мг 4 раза в сутки в течение 10 дней. При тяжелых формах псевдомембранозного колита, угрозе развития осложнений дозы антибиотиков повышаются. Так, метранидазол назначается по 500 мг внутривенно каждые 6 часов, доза ванкомицина также может быть увеличена до 2 г в сутки, разделенная на четыре приема внутрь. Внутривенное введение ванкомицина неэффективно, так как при таком способе не достигается необходимая концентрация препарата в полости толстой кишки. При необходимости можно вводить препарат через назогастральный зонд.
Ванкомицин для лечения данной патологии является препаратом резерва. Ограничение применения ванкомицина связано с его высокой стоимостью и высоким риском развития устойчивого к нему энтерококка. Поэтому круг назначения ванкомицина ограничивается группой пациентов, нечувствительных к метронидазолу, или с известной непереносимостью препарата. Также ванкомицин назначается в качестве терапии первой линии беременным женщинам, лицам, употребляющим алкоголь во время лечения, пациентам с рецидивом псевдомембранозного колита после курса метронидазола.
Применение пробиотиков в качестве этиотропного лечебного средства не привело к желаемым результатам. Рандомизированное контролируемое исследование, в котором применялся пробиотический напиток, содержащий Lactobacillus casei, L. bulgaricus и Streptococcus thermophilus, показало невысокую эффективность данной терапии по сравнению с традиционными методами лечения [6].
Более удовлетворительные результаты были получены при использовании грибов Saccharomyces boulardii для лечения 124 пациентов с рецидивом псевдомембранозного колита [5].
В качестве альтернативы традиционного лечения была предложена фекальная бактериотерапия — процедура, связанная со введением бактериальной флоры, полученной от здорового донора, в толстую кишку больного. Данный метод лечения основан на ликвидации бактериального дисбаланса, который наблюдается у пациентов с рецидивированием инфекции С. difficile. Высокая вероятность успеха — почти 95% — делает ее эффективным методом резервной терапии для антибиотикоустойчивых и рецидивирующих форм C. difficile-инфекции.
Сопутствующая терапия может включать холестирамин, сорбенты, способные связывать токсины С. difficile.
Регидратационная терапия показана всем пациентам с наличием электролитных нарушений.
Несмотря на проводимую терапию, нерешенной проблемой антибиотикоассоциированной диареи является рецидив инфекции С. difficile. Она становится причиной рецидивирующей диареи у 12–20% пациентов. Причиной рецидива может быть как сохранение в споровой форме первичного штамма, так и повторное заражение другим штаммом. Рецидивы возникают обычно через 28 недель после окончания специфической терапии, направленной на уничтожение С. difficile.
Острая диарея, вызванная ростом С. difficile, является достаточно распространенным заболеванием, которое отягощает течение основного заболевания, особенно у лиц с наличием сочетанной патологии. Поэтому дифференцированное назначения антибиотиков по строгим показаниям позволит уменьшить риск развития С. difficile и будет способствовать профилактике возникновения антибиотикоассоциированной диареи.
Литература
1. Парфенов А.И. Энтерология. – М.: Триада Х, 2002. – 724 с.
2. Dial S., Delaney C., Schneider V., Suissa S. Proton pump inhibitor use and risk of community-acquired Clostridium difficile-associated disease defined by prescription for oral vancomycin therapy // CMAJ. – 2006. – Vol. 175 (7). – P. 745–748.
3. Pepin J., Saheb N., Coulombe M. et al. Emergence of fluoroquinolones as the predominant risk factor for Clostridium difficile associated diarrhea: a cohort study during an epidemic in Quebec // Clin. Infect. Dis. – 2005. – Vol. 41. – P. 1254–1260.
4. Lowe D.O., Mamdani M.M., Kopp A. et al. Proton pump inhibitors and hospitalization for Clostridium difficile-associated disease: a population-based study // Clin. Infect. Dis. – 2006. – Vol. 43 (10). – P. 1272–1276.
5. McFarland L.V., Surawicz C.M., Greenberg R.N. et al. A randomized placebo-controlled trial of Saccharomyces boulardii in combination with standard antibiotics for Clostridium difficile disease // JAMA. – 1994. – Vol. 271 (24). – P. 1913–1918.
6. Hickson M., D’Souza A.L., Muthu N. et al. Use of probiotic Lactobacillus preparation to prevent diarrhoea associated with antibiotics: randomized double blind placebo controlled trial // BMJ. – 2007. – Vol. 335 (7610). – P. 80.
Антибиотик-ассоциированная диарея и эрадикация Helicobacter pylori: пути профилактики uMEDp
Антибиотик-ассоциированная диарея (ААД) является одним из частых осложнений антибактериальной терапии. В 10–30% случаев ААД обусловлена Clostridium difficile, в 80–90% – другими микроорганизмами. C. difficile вызывает псевдомебранозный колит. В отсутствие своевременной диагностики и патогенетической терапии заболевание приводит к развитию жизнеугрожающих осложнений. Для предупреждения ААД необходимо оптимизировать применение антибактериальных препаратов и разработать схемы профилактики. В статье описана роль пробиотических препаратов как для профилактики, так и для повышения эффективности терапии на примере лечения инфекции Нelicobacter рylori.
Широкое использование антибактериальных средств привело к увеличению числа побочных эффектов. К наиболее распространенным нежелательным явлениям относятся желудочно-кишечные расстройства, такие как тошнота и диарея, обусловленные негативным влиянием антибиотиков на слизистую оболочку кишечника и кишечную микробиоту. Антибиотик-ассоциированная диарея (AAД) возникает, когда антибиотик нарушает экологию кишечной микробиоты, изменяя разнообразие и количество бактерий в кишечнике. Такие изменения могут повлиять на способность резидентной микробиоты противостоять инвазии патогенных микроорганизмов или разрастанию видов условно патогенных микроорганизмов, которые эндогенно присутствуют в микробиоте [1, 2].
AAД диагностируется при возникновении трех или более эпизодов неоформленного стула в течение двух или более последовательных дней на фоне приема антибактериальных препаратов или на протяжении восьми недель по его окончании [3].
Заболеваемость ААД среди детей составляет 5–30% [4], среди взрослых – 5–70% [5, 6] и зависит от конкретного типа антибиотика, состояния здоровья пациентов и воздействия патогенных факторов.
К антибиотикам, наиболее часто вызывающим AAД, относятся цефалоспорины, клиндамицин, пенициллины широкого спектра действия и фторхинолоны, такие как ципрофлоксацин и левофлоксацин. В 8–26% случаев ААД развивается при использовании клиндамицина или линкомицина, до 9% – при лечении пенициллинами, в основном амоксициллином и ампициллином [7].
AAД может возникнуть через несколько часов после приема антибиотика или спустя несколько месяцев после его прекращения [8].
AAД может быть инфекционной природы (патоген-специфической) и неинфекционной (идиопатической).
10–33% всех случаев ААД связано с Clostridium difficile [9, 10]. В 80–90% ААД вызывают другие бактериальные патогены, включая C. perfringens, Staphylococcus aureus и Klebsiella oxytoca [11]. Например, грамположительный спорообразующий анаэроб C. perfringens может вызывать многочисленные заболевания, включая пищевые отравления, газовую гангрену, некротические энтериты, синдром внезапной смерти и энтеротоксемию [12].
У большинства пациентов инфекция C. difficile вызывает заболевание легкой и умеренной степени, но в ряде случаев могут развиться тяжелые формы, такие как псевдомембранозный колит, или даже осложненные токсическим мегаколоном [13]. Подобное состояние достаточно редкое (
За последнее десятилетие уровень заболеваемости C. difficile резко возрос во всем мире как по частоте, так и по степени тяжести. В дополнение к антибиотикотерапии широкого спектра выявлено множество других потенциальных факторов риска инфекции C. difficile (пожилой возраст, женский пол, сопутствующие заболевания, госпитализация, длительное пребывание в стационаре, иммуносупрессивная терапия и применение ингибиторов протонной помпы) [11].
Патогенез ААД обусловлен нарушением нормальной микрофлоры, что приводит к чрезмерному росту патогенных микроорганизмов, продуцирующих цитотоксины и энтеротоксины [15]. Бактериальные токсины снижают активность мембранных пищеварительных ферментов в тонкой кишке, что приводит к нарушению переваривания. Колонизация тонкой кишки условно патогенной флорой способствует деконъюгации желчных кислот и нарушает метаболизм углеводов. Макролидные антибиотики, прежде всего эритромицин, стимулируют синтез мотилина, усиливающий перистальтическую активность. Токсины C. difficile вызывают воспалительный ответ за счет рекрутирования нейтрофилов и мастоцитов, выделяющих цитокины. Как следствие – образование псевдомембран. Данные механизмы приводят к развитию диарейного синдрома, нарушению целостности кишечного эпителия и воспалению [16, 17].
В настоящее время принята следующая классификация: ААД без признаков колита, антибиотик-ассоциированный колит и псевдомембранозный колит, вызванный C. difficile. В свою очередь колит, вызванный C. difficile, подразделяют на диарею без колита, колит без псевдомембран, псевдомембранозный и фульминантный колит [18].
Антибиотик-ассоциированные состояния должны быть заподозрены у любого пациента с диареей, получавшего антибиотики в предшествующие два месяца. Важным компонентом диагностики и дифференциальной диагностики является тщательная оценка особенностей клинической картины заболевания.
С целью диагностики колитов, связанных с C. difficile, используют лабораторные методы исследования, направленные на выявление продуктов жизнедеятельности бактерий в образцах кала. Согласно международным рекомендациям, предпочтительны двух- и трехступенчатые алгоритмы. В качестве скрининга рекомендован иммуноферментный анализ на выявление токсинов C. difficile А и В (чувствительность метода – 75–95%), а также глутаматдегидрогеназы. Этот метод используется реже, однако его чувствительность превышает 90%. Кроме того, используется высокочувствительный метод полимеразной цепной реакции [3].
Эндоскопическое исследование с оценкой гистологического материала считается достоверным методом диагностики псевдомембранозного колита при наличии типичных изменений в толстой кишке.
Основной принцип лечения идиопатической ААД заключается в отмене антибактериальных препаратов. При необходимости назначают антидиарейные средства, а также средства для коррекции дегидратации, пробиотики, способствующие восстановлению нормальной микрофлоры кишечника. Основными препаратами для лечения инфекции C. difficile являются метронидазол и ванкомицин с различными режимами введения. Пероральный прием позволяет поддержать максимальную концентрацию в просвете кишки.
С учетом актуальности проблемы продолжается поиск новых эффективных препаратов. В литературе описано применение фидаксомицина и тигециклина, биологических препаратов и др. [19].
Иногда наблюдаются рецидивы заболевания, связанные с прорастанием спор C. difficile в вегетативные формы после прекращения антибактериальной терапии. Используемые для лечения антибактериальные средства эффективны только в отношении вегетативных форм. По данным литературы, рецидив встречается в 15–25% случаев в течение двух месяцев после первоначального эпизода [20].
Для уменьшения вероятности развития рецидива предлагается использовать метод постепенной отмены ванкомицина со снижением его суточной дозы в зависимости от стартовой или пульс-терапию ванкомицином в дозе от 125–500 мг через день либо через два дня (каждые вторые-третьи сутки) в течение трех-четырех недель.
Как показал ретроспективный анализ разных режимов, наилучшие результаты по предупреждению повторных рецидивов связаны с режимом пульс-терапии ванкомицином (частота рецидивов – 14%). Несколько ниже результаты лечения с постепенным снижением дозы ванкомицина (31%). При стандартном режиме лечения частота рецидивов достигает 54% [8].
Для лечения рецидивирующей формы инфекции C. difficile предлагается трансплантация фекальной микробиоты. Впервые это было описано B. Eisman в 1958 г. при лечении псевдомембранозного энтероколита. Первое рандомизированное исследование, результаты которого были опубликованы в 2013 г., продемонстрировало эффективность инфузии донорского кала в двенадцатиперстную кишку через назодуоденальную трубку у пациентов с рецидивирующей инфекцией C. difficile. Согласно полученным результатам, в отношении лечения рецидивирующей инфекции C. difficile трансплантация донорского кала значительно эффективнее, чем использование ванкомицина [21]. Механизм, объясняющий высокую эффективность трансплантации фекальной микробиоты, является многофакторным и не до конца изучен [22, 23].
Прогноз при антибиотикотерапии зависит от степени тяжести C. difficile-ассоциированных диареи/колита, характера течения, наличия осложнений. При легком и среднетяжелом течении прогноз благоприятный. В отсутствие серьезных осложнений, таких как перфорация кишки, кишечная непроходимость, токсический мегаколон, практически все пациенты отвечают на проводимую терапию.
Наиболее частой причиной ААД в практике гастроэнтеролога является лечение Helicobacter pylori-ассоциированных заболеваний. Стандартная тройная терапия, включающая в себя кларитромицин, амоксициллин или метронидазол, а также ингибитор протонной помпы, в течение 14 дней остается золотым стандартом в лечении инфекции H. pylori [24]. Несмотря на первоначальные успехи семидневной стандартной тройной терапии, в период с 2009 по 2014 г. отмечалось постоянное снижение уровня эрадикации H. pylori как у взрослых, так и у детей – с 75 до 55% [25]. Основными причинами снижения эффективности терапии стали возрастающая резистентность к антибиотикам и плохое соблюдение режима лечения вследствие развития побочных эффектов (тошнота, рвота и диарея, вызванные антибиотиками) [26]. Развитие побочных эффектов вынуждает пациентов прерывать курс антибактериальной терапии, что приводит к неэффективности лечения и развитию резистентности H. pylori к антибиотикам.
Эрадикационная терапия обычно переносится хорошо. Тем не менее все компоненты тройной эрадикационной терапии H. pylori являются потенциальными факторами риска развития инфекции C. difficile. Однако о тяжелых побочных эффектах, таких как псевдомембранозный колит, после эрадикационной терапии сообщалось крайне редко [13].
Таким образом, при назначении схем лечения инфекции Н. рylori врач сталкивается с рядом проблем. Ключом к их решению является разработка профилактических мер. В связи с этим предлагается использовать пробиотические добавки как для профилактики ААД, так и для повышения эффективности лечения. Применение пробиотиков способно повысить переносимость лекарственных средств и приверженность пациентов лечению.
В последние годы активно рассматривают вопросы профилактики ААД пробиотическими препаратами. Назначение пробиотиков в комплексной терапии ААД многие авторы считают вполне оправданным, поскольку эти агенты способствуют восстановлению нормальной кишечной флоры и тем самым препятствуют прогрессированию клостридиальной инфекции [27, 28]. Пробиотики в отсутствие антибиотиков рекомендуют использовать в легких случаях ААД, протекающей без признаков колита. При умеренной и тяжелой форме ААД, в том числе вызванной клостридией, пробиотики рассматривают в качестве дополнения к стандартной терапии C. difficile-ассоциированной диареи [29]. Эксперты консенсуса Маастрихт V отметили положительный эффект отдельных пробиотиков в снижении частоты и выраженности побочных эффектов во время проведения эрадикационной терапии. При этом снижение частоты ААД на фоне приема пробиотиков способствует повышению приверженности пациентов
лечению [24].
Пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина [30].
Основное преимущество пробиотиков заключается в том, что они способствуют поддержанию сбалансированной микробиоты и, следовательно, создают благоприятную среду для кишечника. Кроме того, пробиотики поддерживают здоровье пищеварительного тракта и иммунной системы [31].
Положительное влияние пробиотиков на здоровье кишечника при различных состояниях (антибиотик-ассоциированная и инфекционная диарея, синдром раздраженного кишечника, некротический энтероколит и т.д.) оценивали в ряде рандомизированных контролируемых клинических исследований [32]. Пробиотики противодействуют болезнетворным микроорганизмам, конкурируя с патогенами за питательные вещества и места адгезии на слизистой оболочке желудочно-кишечного тракта (ЖКТ) в процессе конкурентного связывания. Пробиотики также могут снижать патогенность за счет вмешательства в передачу сигналов между бактериями путем деградации молекул. Кроме того, прямой антагонизм может возникнуть в результате производства бактериоцинов или метаболитов, обладающих антимикробной активностью в отношении патогенных микроорганизмов. Наконец, пробиотики способны модулировать и стимулировать местные и системные иммунные реакции [33].
Наиболее изучены Lactobacillus, Bifidobacterium и Saccharomyces. Показано, что некоторые виды Lactobacillus модифицируют иммунный ответ, уменьшая уровни провоспалительных цитокинов, стимулируют секрецию муцина, подавляют рост патогенных бактерий и ингибируют адгезию H. рylori к эпителию желудка. L. salivarius уменьшает секрецию интерлейкина (ИЛ) 8 эпителиальными клетками желудка, L. acidophilus инактивирует пути воспаления Smad7 и NFB, а L. bulgaricus ингибирует активацию сигнального пути TLR4 и продукцию ИЛ-8. L. acidophilus содержит аутолизин, белковое соединение и антибактериальное вещество, которое высвобождается после лизиса клеток. L. reuteri продуцирует реутерин, который подавляет рост бактерий, а также ингибирует бактериальную адгезию и колонизацию путем связывания спиральной бактерии с гликолипидными белковыми рецепторами [34, 35].
Состав микробиоты различается у детей и взрослых в разные периоды жизни. Межиндивидуальные различия обнаружены в микробном составе на уровне рода и вида. Например, установлено, что микробиота фекалий детей бактериологически менее сложная. В то же время с пожилым возрастом ассоциируются уменьшение бифидобактерий и увеличение разнообразия видов бактероидов. Предполагается, что изменения в микробном составе кишечника с возрастом могут изменять метаболическую способность микробиоты кишечника, что очень важно для возникновения заболеваний [36].
Появляется все больше доказательств того, что лактобациллы и бифидобактерии, населяющие ЖКТ, развивают антимикробную активность, которая участвует в защите хозяина.
Эффективность пробиотиков может зависеть от вида, дозы и заболевания, а продолжительность терапии – от клинических показаний. Отмечено, что дозировка 5 млрд колониеобразующих единиц или более в день значительно эффективнее более низкой дозировки [37].
Систематический обзор и метаанализ 31 рандомизированного контролируемого исследования с участием 8672 пациентов продемонстрировали, что пробиотики эффективны в профилактике ААД и снижают риск клостридиальной инфекции на 60% [38].
Каждый пробиотический штамм имеет уникальный механизм действия, который может быть более или менее эффективным в качестве профилактики ААД. Пробиотик L. rhamnosus GG эффективно предотвращает диарею, связанную с антибиотиками, у детей и взрослых и снижает риск развития AAД у пациентов, получавших антибиотики, с 22,4 до 12,3% [5].
Кокрейновский обзор пробиотиков для профилактики ААД у детей (23 исследования, 3938 участников) показал, что в группе пробиотиков по сравнению с группой контроля реже наблюдалась диарея, вызванная антибиотиками. Обзор показал эффективность L. rhamnosus или S. boulardii в количестве от 5 до 40 млрд колониеобразующих единиц в день. Побочные эффекты отмечались редко [39].
Данные об эффективности пробиотиков в качестве дополнения к антибиотикотерапии для улучшения эрадикации H. pylori противоречивы. Метаанализ девяти РКИ с участием 1163 детей и взрослых показал, что использование пробиотиков, содержащих лактобациллы, в качестве дополнения к антибиотикам увеличивает эффективность эрадикации H. pylori по сравнению с группой контроля [40]. Однако, согласно метаанализу 21 рандомизированного клинического исследования с участием 3452 взрослых пациентов, пробиотики в качестве дополнения к антибиотикам не улучшают эрадикацию инфекции H. pylori (отношение шансов 1,44; 95%-ный доверительный интервал 0,87–2,39) по сравнению с плацебо [41]. Тем не менее при добавлении пробиотиков в схемы эрадикации значительно снижается количество побочных эффектов, включая тошноту, рвоту, боль в эпигастральной области и диарею [27, 34].
Наряду с пробиотиками пребиотики также благотворно влияют на микробный состав ЖКТ, избирательно стимулируя рост и активность одной или ограниченного числа бактерий в толстой кишке [42].
В настоящее время все большую популярность приобретают мультиштаммовые и мультивидовые пробиотики. Перспективность их использования для профилактики и лечения ААД, а также возможность применения в схемах лечения инфекции H. pylori изучается. Эффективность терапии может зависеть от типа штамма и количества штаммов в пробиотике, дозы, продолжительности лечения и т.д.
Разработанный компанией Protexin мультипробиотик Bio-Kult (Великобритания), зарегистрированный в России под названием БАК-СЕТ, применялся во многих исследованиях компании, в основном у детей с заболеваниями ЖКТ, атопическим дерматитом и пищевой аллергией. С учетом возрастных особенностей состава кишечной микробиоты пробиотический комплекс выпускают в двух сбалансированных формах – БАК-СЕТ Беби и БАК-СЕТ Форте. БАК-СЕТ Беби содержит семь штаммов микроорганизмов – L. casei, L. rhamnosus, L. acidophilus, B. breve, B. infantis, B. longum, S. thermophilus, а также наиболее оптимальный для пищеварения детей раннего возраста пребиотик (фруктоолигосахариды из инулина), усиливающий действие пробиотических бактерий. Разрешен к применению у детей с рождения. В состав БАК-СЕТ Форте входит 14 видов живых пробиотических бактерий в высоких концентрациях – L. casei, L. plantarum, L. rhamnosus, B. bifidum, B. breve, B. longum, L. acidophilus, L. lactis, S. thermophilus, B. infantis, L. bulgaricus, L. helveticus, L. salivarius, L. fermentum, что позволяет им достигать толстой кишки без потери активности и жизнеспособности.
У пациентов гастроэнтерологического профиля мультипробиотик БАК-СЕТ исследовался компанией Protexin при синдроме раздраженного кишечника с диареей, ААД, возникшей на фоне эрадикации H. рylori, а также при метаболическом синдроме и ожирении.
В исследовании препарата БАК-СЕТ, проведенном под руководством доктора Э. Харпера, 66 детям в возрасте от трех до 14 лет назначали эрадикационную терапию H. pylori. Добавление мультипробиотика к тройной терапии существенно повысило эффективность эрадикации – до 90% (в группе без пробиотика – 70%) (p = 0,04). Кроме того, в группе пациентов, не получавших мультипробиотик, возникли нежелательные явления (тошнота и рвота – 27%, диарея – 24%). На фоне терапии с включением мультиштаммового пробиотика нежелательные явления возникли лишь в 6% случаев [43].
Новая концепция пробиотиков – мультипробиотики. Их мультивидовой состав обеспечивает микробное разнообразие, повышая биологическую активность за счет синергии разных видов бактерий.
Таким образом, развитие ААД ограничивает возможности антибактериальной терапии, в том числе для эрадикации Н. pylori, при проведении которой используются высокие суточные дозы двух антибиотиков в течение 14 дней. Это послужило толчком к интенсивному проведению исследований преимуществ использования разных пробиотиков в качестве дополнительного компонента в схемах эрадикационной терапии. Опубликованные данные гетерогенны и во многом определяются свойствами штаммов пробиотиков. Результаты большинства исследований демонстрируют преимущества этой стратегии, прежде всего для снижения частоты и выраженности нежелательных явлений антибактериальной терапии. В качестве одного из перспективных рассматривается мультипробиотический препарат БАК-СЕТ, доказательная база эффективности которого расширится в ходе дальнейших исследований.
Как антибиотики влияют на микрофлору кишечника
Оглавление
Антибиотики спасли огромное количество человеческих жизней по всему миру, они необходимы для лечения и профилактики широкого спектра опасных бактериальных инфекций. Однако микрофлора после антибиотиков подвержена их влиянию, что говорит о сопряжении этих препаратов с рядом негативных для человека последствий [1-5].
Реакция микрофлоры
Применение антибиотиков может вызвать дисбактериоз, то есть нарушение нормального состава и функций кишечной микрофлоры. Антибиотики широкого спектра действия, эффективные по отношению к множеству различных бактерий, могут поражать до 30% бактерий, в норме заселяющих желудочно-кишечный тракт [1].
Даже недельный курс антибиотиков приводит к тому, что на восстановление микрофлоры после антибиотиков может потребоваться от 6 месяцев до 2 лет после окончания их приёма [2].
Сложные соединения, которые содержатся в антибиотике, действуют на возбудителя бактериальной инфекции, разрушая клеточную стенку, повреждая ядро. Вирусные заболевания антибиотиками не лечат — у вируса, в отличие от микроба, есть только РНК и ДНК.
Влияние антибиотикотерапии
Измененная под действием антибиотиков микрофлора не может выполнять свои жизненно важные функции, такие как пищеварительная, синтетическая и др. [3] Последствия нарушения этих функций затрагивают весь организм. К дисбиозопосредованным состояниям относят:
- диабет
- ожирение
- бронхиальную астму
При нарушении баланса микрофлоры повышается риск развития инфекционных заболеваний [1].
Но самыми частыми нежелательными реакциями на фоне применения антибиотиков, являются нарушения со стороны желудочно-кишечного тракта. У пациентов отмечается раздражённый кишечник, тошнота, рвота, боли в животе, диарея [4]. Именно диарея является наиболее частым из негативных последствий приема антибиотиков, для неё существует специальный термин – «антибиотикоассоциированная диарея» [5].
Антибиотики являются причиной каждого 4-го случая диареи, вызванной приемом лекарственных средств [4].
Антибиотикоассоциированная диарея – это не связанная с другими причинами диарея, определяемая как 3 и более эпизодов неоформленного стула в течение минимум 2 дней подряд, резвившаяся на фоне применения антибиотиков [4].
С чего начинать лечение кишечника
Для профилактики и терапии ААД рекомендуется поддержание и восстановление баланса микрофлоры при помощи специальных препаратов [4].
Существуют препараты, которые оказывают влияние на функции кишечной микрофлоры — метабиотики. Они содержат аналоги продуктов метаболизма кишечных бактерий, которые практически в полном составе могут достигать цели. Один из метабиотиков — препарат нового поколения Актофлор-С.
Его действие направлено на стимуляцию роста собственной полезной микрофлоры кишечника и её физиологической активности, тем самым препарат способствует предотвращению побочных эффектов приема антибиотиков и может назначаться с первого дня их применения [6]. Актофлор-с легко принимать а его компоненты не создают дополнительной микробной нагрузки на микрофлору.
Список литературы:
1. Francino M. P. Antibiotics and the human gut microbiome: dysbioses and accumulation of resistances //Frontiers in microbiology. – 2016. – Т. 6. – С. 1543
2. Jernberg, C. et al. Long-term ecological impacts of antibiotic administration on the human intestinal microbiota / C. Jernberg et al. // The ISME journal. — 2007. — Vol. 1, № 1. — P. 56-66.
3. Guarner F, Malagelada J-R. Gut flora in health and disease. Lancet, 2003, 361: 512-9. doi:10.1016/S0140-6736(03)12489-0.
4. Захаренко С. М., Андреева И. В., Стецюк О. У. Нежелательные лекарственные реакции со стороны ЖКТ и антибиотикоассоциированная диарея при применении антибиотиков в амбулаторной практике: профилактика и лечение //Клиническая микробиология и антимикробная химиотерапия. – 2019. – Т. 21. – №. 3.
5. McFarland, L. V. (2009). Evidence-based review of probiotics for antibiotic-associated diarrhea and Clostridium difficile infections. Anaerobe, 15(6), 274–280.
6. Согласно инструкции по применению препарата Актофлор-С.
Диарея, связанная с антибиотиками — Симптомы и причины
Обзор
Диарея, связанная с антибиотиками, означает отхождение жидкого водянистого стула три или более раз в день после приема лекарств, используемых для лечения бактериальных инфекций (антибиотиков).
Чаще всего диарея, связанная с приемом антибиотиков, протекает в легкой форме и не требует лечения. Диарея обычно проходит в течение нескольких дней после прекращения приема антибиотика. Более серьезная диарея, связанная с приемом антибиотиков, может потребовать прекращения приема антибиотиков или замены их.
Симптомы
У большинства людей диарея, связанная с приемом антибиотиков, вызывает легкие признаки и симптомы, например:
- Табуреты свободные
- Более частые испражнения
Диарея, связанная с антибиотиками, может начаться примерно через неделю после начала приема антибиотика. Однако иногда диарея и другие симптомы появляются только через несколько дней или даже недель после окончания лечения антибиотиками.
Инфекция, вызванная Clostridium difficile
C. difficile — это бактерия, продуцирующая токсины, которая может вызывать более серьезную диарею, связанную с антибиотиками. Инфекция C. difficile не только вызывает жидкий стул и учащение испражнений, но и вызывает:
- Боль и спазмы внизу живота
- Субфебрильная температура
- Тошнота
- Потеря аппетита
Когда обращаться к врачу
Немедленно позвоните своему врачу, если у вас есть серьезные признаки и симптомы диареи, связанной с приемом антибиотиков.Эти признаки и симптомы являются общими для ряда состояний, поэтому ваш врач может порекомендовать тесты для определения причины.
Причины
Почему возникает диарея, связанная с приемом антибиотиков, до конца не изучено. Обычно считается, что он развивается, когда антибактериальные препараты (антибиотики) нарушают баланс хороших и вредных бактерий в желудочно-кишечном тракте.
Антибиотики, которые с наибольшей вероятностью вызывают диарею
Почти все антибиотики могут вызывать диарею, связанную с антибиотиками.Чаще всего используются следующие антибиотики:
- Цефалоспорины, такие как цефдинир и цефподоксим
- Пенициллины, такие как амоксициллин и ампициллин
Инфекция C. difficile
Когда антибиотики нарушают баланс бактерий в пищеварительной системе, бактерии C. difficile могут быстро выйти из-под контроля. Бактерии C. difficile создают токсины, которые поражают слизистую оболочку кишечника. Антибиотики, наиболее часто связанные с инфекцией C. difficile, включают фторхинолоны, цефалоспорины, пенициллины и клиндамицин.
Факторы риска
Диарея, связанная с антибиотиками, может возникнуть у любого, кто принимает антибиотики. Но у вас с большей вероятностью разовьется диарея, связанная с приемом антибиотиков, если вы:
- Переносил диарею, вызванную приемом антибиотиков, в прошлом
- Длительный прием антибиотиков
- Принимаете более одного антибиотика
Осложнения
Одним из наиболее частых осложнений любого типа диареи является чрезмерная потеря жидкости и электролитов (обезвоживание).Сильное обезвоживание может быть опасным для жизни. Признаки и симптомы включают очень сухость во рту, сильную жажду, слабое мочеиспускание или его отсутствие и слабость.
Профилактика
Чтобы предотвратить диарею, вызванную приемом антибиотиков, попробуйте:
- Принимайте антибиотики только при необходимости. Не принимайте антибиотики, если врач не считает их необходимыми. Антибиотики могут лечить бактериальные инфекции, но не помогают при вирусных инфекциях, таких как простуда и грипп.
- Попросите опекунов вымыть руки. Если вы госпитализированы, попросите всех вымыть руки или использовать дезинфицирующее средство для рук на спиртовой основе, прежде чем прикасаться к вам.
- Сообщите своему врачу, если у вас раньше была диарея, связанная с приемом антибиотиков. Одноразовая диарея, связанная с антибиотиками, увеличивает вероятность того, что антибиотики снова вызовут ту же реакцию. Ваш врач может подобрать для вас другой антибиотик.
Практическое руководство по пробиотикам в случае диареи, связанной с антибиотиками, в Нидерландах | BMC Gastroenterology
Кини К.М., Юрист-Даутш С, Арриета М-С, Финли ББ. Влияние антибиотиков на микробиоту человека и последующее заболевание. Анну. Rev. Microbiol. 2014; 68: 217–35.
Артикул
PubMed
CAS
Google Scholar
Франсино МП. Антибиотики и микробиом кишечника человека: дисбиоз и накопление резистентности. Фронт. Microbiol. 2016; 6: 1–11.
Артикул
Google Scholar
Саркер П., Мили А., Мамун А., Джалал С., Бергман П., Ракиб Р. и др. Ципрофлоксацин влияет на клетки-хозяева, подавляя экспрессию эндогенных антимикробных пептидов кателицидинов и бета-дефенсина-3 в эпителии толстой кишки. Антибиотики. 2014; 3: 353–74.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Кросвелл А., Амир Э., Теггац П., Барман М., Зальцман Н.Х. Длительное воздействие антибиотиков на микробную экологию кишечника и восприимчивость к кишечной инфекции Salmonella .Заразить. Иммун. 2009; 77: 2741–53.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Jernberg C, Löfmark S, Edlund C, Jansson JK. Долгосрочное экологическое воздействие приема антибиотиков на микробиоту кишечника человека. ISME J. 2007; 1: 56–66.
Артикул
PubMed
CAS
Google Scholar
Терк Д., Бернет Дж. П., Маркс Дж., Кемпф Х., Гиард П., Вальбаум О. и др.Заболеваемость и факторы риска диареи, связанной с пероральными антибиотиками, в амбулаторной педиатрической популяции. J. Pediatr. Гастроэнтерол. Nutr. 2003; 37: 22–6.
Артикул
PubMed
CAS
Google Scholar
Wiström J, Norrby SR, Myhre EB, Eriksson S, Granström G, Lagergren L, et al. Частота диареи, связанной с антибиотиками, у 2462 госпитализированных пациентов, лечившихся антибиотиками: проспективное исследование. J. Antimicrob. Chemother.2001; 47: 43–50.
Артикул
PubMed
Google Scholar
Крамер М.С., Хатчинсон Т.А., Наймарк Л., Контарди Р., Флегель К.М., Ледук Д.Г. Желудочно-кишечные симптомы, связанные с приемом антибиотиков, у педиатрических больных общего профиля. Педиатрия. 1985; 76: 365–70.
PubMed
CAS
Google Scholar
Kuyvenhoven MM, van Balen FAM, Verheij TJM. Амбулаторные рецепты антибиотиков с 1992 по 2001 год в Нидерландах.J. Antimicrob. Chemother. 2003. 52: 675–8.
Артикул
PubMed
CAS
Google Scholar
GIP / ZorgInstituut Nederland [Интернет]. 2016 г. Доступно по адресу: https://www.gipdatabank.nl/databank. По состоянию на февраль 2017 г.
Совместная консультация экспертов ФАО / ВОЗ. Полезные и питательные свойства пробиотиков в продуктах питания, включая сухое молоко с живыми молочнокислыми бактериями. 2001.
Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B и др.Документ о консенсусе экспертов: консенсусное заявление международной научной ассоциации пробиотиков и пребиотиков относительно области применения и надлежащего использования термина пробиотик. Nat. Преподобный Гастроэнтерол. Гепатол. 2014; 11: 506–14.
Артикул
PubMed
Google Scholar
Ричи М.Л. Романюк Т.Н. Мета-анализ эффективности пробиотиков при желудочно-кишечных заболеваниях. PLoS One. 2012; 7: e34938
Lee YK, Puong KY, Ouwehand AC, Salminen S.Вытеснение бактериальных патогенов со слизи и поверхности клеток Caco-2 лактобациллами. J. Med. Microbiol. 2003; 52: 925–30.
Артикул
PubMed
Google Scholar
Фон Оссовски И., Реунанен Дж., Сатокари Р., Вестерлунд С., Канкайнен М., Хухтинен Х. и др. Адгезионные свойства слизистой оболочки пробиотических субъединиц пилина Lactobacillus rhamnosus GG SpaCBA и SpaFED. Прил. Environ. Microbiol. 2010. 76: 2049–57.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Collado MC, González A, González R, Hernández M, Ferrús MA, Sanz Y. Антимикробные пептиды входят в число антагонистических метаболитов, продуцируемых Bifidobacterium против Helicobacter pylori . Int. J. Antimicrob. Агенты. 2005; 25: 385–91.
Артикул
PubMed
CAS
Google Scholar
Чу В., Лу Ф., Чжу В., Канг С. Выделение и характеристика новых потенциальных пробиотических бактерий на основе системы определения кворума.J. Appl. Microbiol. 2011; 110: 202–8.
Артикул
PubMed
CAS
Google Scholar
Cotter PD, Hill C, Ross PR, Paul D, Cotter CH, Bacteriocins RPR. выработка врожденного иммунитета к еде. Nat. Rev. Microbiol. 2005; 3: 777–88.
Артикул
PubMed
CAS
Google Scholar
Servin AL. Антагонистическая активность лактобацилл и бифидобактерий против микробных патогенов.FEMS Microbiol. Ред. 2004; 28: 405–40.
Артикул
PubMed
CAS
Google Scholar
Ашраф Р., Шах Н.П. Стимуляция иммунной системы пробиотическими микроорганизмами. Крит. Rev. Food Sci. Nutr. 2014; 54: 938–56.
Артикул
PubMed
CAS
Google Scholar
Хемпель С., Ньюберри С., Руэлаз А., Ван З., Майлз Дж. Н. В., Сутторп М. Дж. И др. Безопасность пробиотиков, используемых для снижения риска и предотвращения или лечения заболеваний.Evid Rep Technol Assess. 2011; 200: 1-645.
Снидман ДР. Безопасность пробиотиков. Clin. Заразить. Дис. 2008; 46: S104–11.
Артикул
PubMed
Google Scholar
Stadlbauer V. Иммуносупрессия и пробиотики: эффективны и безопасны ли они? Бенеф. Микробы. 2015; 6: 823–8.
Артикул
PubMed
CAS
Google Scholar
Дидари Т., Солки С., Мозаффари С., Никфар С., Абдоллахи М.Систематический обзор безопасности пробиотиков. Мнение эксперта. Drug Saf. 2014; 13: 227–39.
Артикул
PubMed
Google Scholar
Шарма П., Томар С.К., Госвами П., Сангван В., Сингх Р. Устойчивость к антибиотикам среди коммерчески доступных пробиотиков. Food Res. Int. 2014; 57: 176–95.
Артикул
CAS
Google Scholar
Wong A, Ngu DY, Dan LA, Ooi A, Lim RL.Выявление устойчивости к антибиотикам в пробиотиках БАД. Нутр Дж. 2015; 14: 95.
Авадхани А., Майли Х. Пробиотики для профилактики антибиотико-ассоциированной диареи и Clostridium difficile -ассоциированного заболевания у госпитализированных взрослых — метаанализ. Варенье. Акад. Медсестра Прак. 2011; 23: 269–74.
Артикул
PubMed
Google Scholar
Butler CC, Duncan D, Hood K. Предотвращает ли регулярный прием пробиотиков с антибиотиками диарею, связанную с антибиотиками? BMJ.2012; 344: e682.
Артикул
PubMed
Google Scholar
Cremonini F, Di Caro S, Nista EC, Bartolozzi F, Capelli G, Gasbarrini G, et al. Мета-анализ: влияние введения пробиотиков на диарею, ассоциированную с антибиотиками. Алимент. Pharmacol. Ther. 2002; 16: 1461–7.
Артикул
PubMed
CAS
Google Scholar
Dendukuri N, Costa V, McGregor M, Brophy JM.Пробиотическая терапия для профилактики и лечения диареи, ассоциированной с Clostridium difficile, : систематический обзор. Может. Med. Доц. J. 2005; 173: 167–70.
Артикул
Google Scholar
D’Souza AL, Rajkumar C, Cooke J, Bulpitt CJ. Пробиотики в профилактике диареи, связанной с антибиотиками: метаанализ. BMJ. 2002; 324: 1–6.
Google Scholar
Гольденберг Дж., Литвин Л., Стюрих Дж., Паркин П., Махант С., Джонстон Б. Пробиотики для профилактики детской диареи, связанной с антибиотиками. Кокрановская база данных Syst. Ред. 2015; (12): CD004827.
Голденберг Дж., Ма С., Сакстон Дж., Мартцен М., Вандвик П., Торлунд К. и др. Пробиотики для профилактики Clostridium difficile — ассоциированной диареи у взрослых и детей. Кокрановская база данных Syst. Ред.2013; (12): CD006095.
Хаврелак Дж. А., Уиттен Д. Л., Майерс СПИ. Lactobacillus rhamnosus GG, эффективный в предотвращении возникновения диареи, связанной с антибиотиками: систематический обзор. Пищеварение. 2005; 72: 51–6.
Артикул
PubMed
Google Scholar
Hempel S, Newberry SJ, Maher AR, Wang Z, Miles JNV, Shanman R, et al. Пробиотики для профилактики и лечения диареи, связанной с антибиотиками. Clin. Угол. 2012; 307: 1959–69.
CAS
Google Scholar
Johnston BC, Supina AL, Vohra S. Пробиотики для педиатрической диареи, связанной с антибиотиками: метаанализ рандомизированных плацебо-контролируемых исследований. Может. Med. Доц. J. 2006; 175: 377–83.
Артикул
Google Scholar
Джонстон Б., Гольденберг Дж., Вандвик П., Сан X, Гуйатт Г. Пробиотики для профилактики детской диареи, связанной с антибиотиками (Кокрановский обзор). Cochrane Libr. 2011; (11): CD004827.
Джонстон до н.э., Ма С.С., Гольденберг Дж. З., Торлунд К., Вандвик П.О., Леб М. и др. Пробиотики для профилактики Clostridium difficile -ассоциированной диареи. Ann Intern Med. 2012; 157: 878–88.
Kale-Pradhan PB, Jassal HK, Wilhelm SM. Роль Lactobacillus в профилактике диареи, связанной с антибиотиками: метаанализ. Фармакотерапия. 2010; 30: 119–26.
Артикул
PubMed
Google Scholar
McFarland LV. Пробиотики для первичной и вторичной профилактики инфекций C. difficile : метаанализ и систематический обзор. Антибиотики. 2015; 4: 160–78.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
McFarland LV. Мета-анализ пробиотиков для профилактики диареи, ассоциированной с антибиотиками, и лечения болезни, вызванной Clostridium difficile . Являюсь. J. Gastroenterol.2006; 101: 812–22.
Артикул
PubMed
Google Scholar
McFarland LV. Систематический обзор и метаанализ Saccharomyces boulardii у взрослых пациентов. Мир J. Gastroenterol. 2010. 16: 2202–22.
Артикул
PubMed
PubMed Central
Google Scholar
Pattani R, Palda VA, Hwang SW, Shah PS. Пробиотики для профилактики антибиотико-ассоциированной диареи и инфекции Clostridium difficile среди госпитализированных пациентов: систематический обзор и метаанализ.Open Med. 2013; 7: e56.
PubMed
PubMed Central
Google Scholar
Pillai A, Nelson RL. Пробиотики для лечения колита, ассоциированного с Clostridium difficile , у взрослых. Кокрановская база данных Syst. Ред. 2008 г .; (1): CD004611.
Szajewska H, Мета-анализ MJ. Непатогенные дрожжи Saccharomyces boulardii в профилактике диареи, связанной с антибиотиками. Алимент. Pharmacol.Ther. 2005; 22: 365–72.
Артикул
PubMed
CAS
Google Scholar
Szajewska H, Kołodziej M. Систематический обзор с метаанализом: Lactobacillus rhamnosus GG в профилактике антибиотико-ассоциированной диареи у детей и взрослых. Алимент. Pharmacol. Ther. 2015; 42: 1149–57.
Артикул
PubMed
CAS
Google Scholar
Szajewska H, Kołodziej M. Систематический обзор с метаанализом: Saccharomyces boulardii в профилактике диареи, связанной с антибиотиками. Алимент. Pharmacol. Ther. 2015; 42: 793–801.
Артикул
PubMed
CAS
Google Scholar
Szajewska H, Ruszczyński M, Radzikowski A. Пробиотики в профилактике антибиотико-ассоциированной диареи у детей: метаанализ рандомизированных контролируемых исследований.J. Pediatr. 2006; 149: 367–72.
Артикул
PubMed
Google Scholar
Тунг Дж. М., Долович Л. Р., Ли Ч. Профилактика инфекции Clostridium difficile с помощью Saccharomyces boulardii : систематический обзор. Может. J. Gastroenterol. 2009; 23: 817–21.
Артикул
PubMed
PubMed Central
Google Scholar
Urbańska M, Gieruszczak-Białek D, Szajewska H.Систематический обзор с метаанализом: Lactobacillus reuteri DSM 17938 для диарейных заболеваний у детей. Алимент. Pharmacol. Ther. 2016; 43: 1025–34.
Артикул
PubMed
Google Scholar
Videlock EJ, Cremonini F. Мета-анализ: пробиотики при диарее, связанной с антибиотиками. Алимент. Pharmacol. Ther. 2012; 35: 1355–69.
Артикул
PubMed
CAS
Google Scholar
Цзоу Дж., Донг Дж., Мета-анализ YX. Lactobacillus , содержащий четверную терапию, по сравнению со стандартной тройной терапией первой линии для эрадикации Helicobacter pylori . Helicobacter. 2009. 14: 449–59.
Артикул
Google Scholar
Szajewska H, Canani RB, Guarino A, Hojsak I, Indrio F, Kolacek S, et al. Пробиотики для профилактики диареи, связанной с приемом антибиотиков. J. Pediatr. Гастроэнтерол.Nutr. 2016; 62: 495–506.
Артикул
PubMed
CAS
Google Scholar
Суурмонд Р., ван Ри Х., Хак Т. Введение, сравнение и проверка Meta-Essentials: бесплатный и простой инструмент для мета-анализа. Res. Synth. Методы. 2017; 8: 537–53.
Артикул
PubMed
PubMed Central
Google Scholar
Арвола Т., Лайхо К., Торккели С., Микка Х.Дети с респираторными инфекциями: рандомизированное исследование. 1999; 104
Beausoleil M, Fortier N, Guénette S, L’Ecuyer A, Savoie M, Franco M, et al. Эффект ферментированного молока, сочетающего Lactobacillus acidophilus CL1285 и Lactobacillus casei в профилактике антибиотико-ассоциированной диареи: рандомизированное двойное слепое плацебо-контролируемое исследование. Может. J. Gastroenterol. 2007; 21: 732–6.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Cimperman L, Bayless G, Best K, Diligente A, Mordarski B, Oster M и др. Рандомизированное двойное слепое плацебо-контролируемое пилотное исследование Lactobacillus reuteri ATCC 55730 для профилактики диареи, связанной с антибиотиками, у госпитализированных взрослых. J. Clin. Гастроэнтерол. 2011; 45: 785–9.
Артикул
PubMed
Google Scholar
Correa NB, Peret Filho LA, Penna FJ, Lima FM, Nicoli JR. Рандомизированное контролируемое исследование формулы Bifidobacterium lactis и Streptococcus thermophilus для профилактики диареи, связанной с приемом антибиотиков, у младенцев.J. Clin. Гастроэнтерол. 2005; 39: 385–9.
Артикул
PubMed
Google Scholar
Фокс М.Дж., Ахуджа К.Д.К., Робертсон И.К., Болл М.Дж., Эри Р.Д. Может ли йогурт с пробиотиками предотвратить диарею у детей, принимающих антибиотики? Двойное слепое рандомизированное плацебо-контролируемое исследование. BMJ Open. 2015; 5: e006474.
Артикул
PubMed
PubMed Central
Google Scholar
Гао XW, Mubasher M, Fang CY, Reifer C, Miller LE.Дозозависимая эффективность патентованной пробиотической формулы Lactobacillus acidophilus CL1285 и Lactobacillus casei LBC80R для лечения антибиотико-ассоциированной диареи и Clostridium difficile -ассоциированной профилактики диареи у взрослых пациентов. Являюсь. J. Gastroenterol. Издательская группа «Природа». 2010; 105: 1636–41.
Артикул
PubMed
Google Scholar
Георгиева М., Панчева Р., Рашева Н., Ушева Н., Иванова Л., Колева К.Использование пробиотика Lactobacillus reuteri DSM 17938 для профилактики антибиотико-ассоциированных инфекций у госпитализированных болгарских детей: рандомизированное контролируемое исследование. J. IMAB — Annu. Продолжение. 2015; 21: 895–900.
Артикул
Google Scholar
Hickson M, D’Souza AL, Muthu N, Rogers TR, Want S, Rajkumar C, et al. Использование препарата пробиотика Lactobacillus для предотвращения диареи, связанной с антибиотиками: рандомизированное двойное слепое плацебо-контролируемое исследование.BMJ. 2007; 335: 80.
Артикул
PubMed
PubMed Central
Google Scholar
Конинг С.Дж., Джонкерс Д., Смидт Х., Ромбоутс Ф., Пеннингс Х.Дж., Воутерс Э. и др. Влияние многовидового пробиотика на состав фекальной микробиоты и привычки кишечника у пациентов с хронической обструктивной болезнью легких, получающих антибиотики. Br J Nutr. 2009; 103: 1452-60.
Koning CJM, Jonkers DMAE, Stobberingh EE, Mulder L, Rombouts FM, Stockbrügger RW.Влияние многовидового пробиотика на кишечную микробиоту и дефекацию у здоровых добровольцев, принимающих антибиотик амоксициллин. Являюсь. J. Gastroenterol. 2008. 103: 178–89.
Артикул
PubMed
CAS
Google Scholar
Котовска М., Альбрехт П., Шаевска Х. Saccharomyces boulardii в профилактике антибиотико-ассоциированной диареи у детей: рандомизированное двойное слепое плацебо-контролируемое исследование.Алимент. Pharmacol. Ther. 2005; 21: 583–90.
Артикул
PubMed
CAS
Google Scholar
Льюис С.Дж., Поттс Л., Барри Р.Э. Отсутствие терапевтического эффекта Saccharomyces boulardii в профилактике диареи, связанной с антибиотиками, у пожилых пациентов. J. Infect. 1998; 36: 171–4.
Артикул
PubMed
CAS
Google Scholar
Lönnermark E, Friman V, Lappas G, Sandberg T, Berggren A, Adlerberth I.Прием Lactobacillus plantarum уменьшает некоторые желудочно-кишечные симптомы во время лечения антибиотиками. J. Clin. Гастроэнтерол. 2010; 44: 106–12.
Артикул
PubMed
Google Scholar
McFarland L, Surawicz C. Профилактика диареи, связанной с лактамом, с помощью Saccharomyces boulardii по сравнению с плацебо. Am J Gastroenterol. 1995; 90: 439–48.
PubMed
CAS
Google Scholar
Myllyluoma E, Veijola L, Ahlroos T, Tynkkynen S, Kankuri E, Vapaatalo H, et al. Добавление пробиотиков улучшает переносимость эрадикационной терапии Helicobacter pylori — плацебо-контролируемое двойное слепое рандомизированное пилотное исследование. Алимент. Pharmacol. Ther. 2005; 21: 1263–72.
Артикул
PubMed
CAS
Google Scholar
Pozzoni P, Riva A, Bellatorre A, Amigoni M, Redaelli E, Ronchetti A, et al. Saccharomyces boulardii для профилактики диареи, связанной с антибиотиками, у взрослых госпитализированных пациентов: одноцентровое рандомизированное двойное слепое плацебо-контролируемое исследование.Являюсь. J. Gastroenterol. 2012; 107: 922–31.
Артикул
PubMed
Google Scholar
Ruszczyński M, Radzikowski A, Szajewska H. Клиническое испытание: эффективность Lactobacillus rhamnosus (штаммы E / N, Oxy и Pen) в профилактике антибиотико-ассоциированной диареи у детей. Алимент. Pharmacol. Ther. 2008. 28: 154–61.
Артикул
PubMed
Google Scholar
Safdar N, Barigala R, Said A, McKinley L. Возможность и переносимость пробиотиков для профилактики антибиотико-связанной диареи у госпитализированных ветеранов вооруженных сил США. J. Clin. Pharm. Ther. 2008; 33: 663–8.
Артикул
PubMed
CAS
Google Scholar
Sampalis J, Psaradellis E, Rampakakis E. Эффективность BIO K + CL1285 в сокращении антибиотико-ассоциированной диареи — двойное слепое рандомизированное многоцентровое исследование с плацебо-контролем.Arch. Med. Sci. 2010; 6: 56–64.
Google Scholar
Сон Х. Дж., Ким Дж. Й, Юнг С. А., Ким С. Е., Пак Х. С., Чон Й и др. Влияние пробиотика Lactobacillus (Lacidofil® cap) на профилактику антибиотико-ассоциированной диареи: проспективное рандомизированное двойное слепое многоцентровое исследование. J. Korean Med. Sci. 2010; 25: 1784–91.
Артикул
PubMed
PubMed Central
Google Scholar
Surawicz CM, Elmer GW, Speelman P, McFarland L.V, Chinn J, Belle VAN. Профилактика антибиотико-ассоциированной диареи, вызванной Sacchromyces boulardii: проспективное исследование. 1989; 96: 981-88.
Szajewska H, Albrecht P, Topczewska-cabanek A. Рандомизированное, двойное слепое, плацебо-контролируемое испытание: влияние добавок Lactobacillus GG на уровень эрадикации Helicobacter pylori и побочные эффекты во время лечения у детей. J Pediatr Gastroenterol Nutr.2009: 431–436.
Szymański H, Armańska M, Kowalska-Duplaga K, Szajewska H. Bifidobacterium longum PL03, Lactobacillus rhamnosus KL53A и Lactobacillus rhamnosus KL53A и Lactobacillus в профилактике антибиотиков PLar0114 в составе антибиотиков PLar0114 Lactobacillus Lactobacillus у детей рандомизированное контролируемое пилотное исследование. Пищеварение. 2008; 78: 13–7.
Артикул
PubMed
Google Scholar
Танканов Р.М., Росс М.Б., Эртель И.Дж., Дикинсон Д.Г., Маккормик Л.С., Гарфинкель Дж.Ф.Двойное слепое плацебо-контролируемое исследование эффективности Lactinex в профилактике диареи, вызванной амоксициллином. Dicp. 1990; 24: 382–4.
Артикул
PubMed
CAS
Google Scholar
Вандерхоф Дж. А., Уитни Д. Б., Антонсон Д. Л., Ханнер Т. Л., Лупо СП, Янг Р.Дж. Lactobacillus GG в профилактике антибиотико-ассоциированной диареи у детей. J. Pediatr. 1999; 135: 564–8.
Артикул
PubMed
CAS
Google Scholar
Wenus C, Goll R, Loken EB, Biong AS, Halvorsen DS, Florholmen J. Профилактика диареи, связанной с антибиотиками, с помощью ферментированного пробиотического молочного напитка. Евро. J. Clin. Nutr. 2008; 62: 299–301.
Артикул
PubMed
CAS
Google Scholar
Аллен С.Дж., Уэрхэм К., Ван Д., Брэдли С., Хатчингс Н., Харрис В. и др. Лактобациллы и бифидобактерии в профилактике антибиотико-ассоциированной диареи и Clostridium difficile диареи у пожилых стационарных пациентов (PLACIDE): рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование.Ланцет. 2013; 382: 1249–57.
Артикул
PubMed
Google Scholar
Чаттерджи С., Кар П., Дас Т., Рэй С., Гангули С., Раджендиран С. и др. Рандомизированное плацебо-контролируемое двойное слепое многоцентровое исследование эффективности и безопасности Lactobacillus acidophilus LA-5 и Bifidobacterium BB-12 для профилактики диареи, связанной с антибиотиками. J. Assoc. Врачи Индии. 2013; 61: 708–12.
PubMed
Google Scholar
Эванс М., Салевски Р.П., Кристман М.С., Жирар С.А., Томпкинс Т.А. Эффективность Lactobacillus helveticus и Lactobacillus rhamnosus для лечения антибиотико-ассоциированной диареи у здоровых взрослых: рандомизированное двойное слепое плацебо-контролируемое исследование. Br. J. Nutr. 2016; 116: 94–103.
Артикул
PubMed
CAS
Google Scholar
Ouwehand AC, DongLian C, Weijian X, Stewart M, Ni J, Stewart T. и др.Пробиотики уменьшают симптомы употребления антибиотиков в условиях больницы: рандомизированное исследование зависимости реакции от дозы. Вакцина. 2014; 32: 458–63.
Артикул
PubMed
Google Scholar
Patel J, Curry WJ, Graybill MA, Bernard S, Mcdermott AS, Karpa K. Рандомизированное исследование пробиотиков в первичной медико-санитарной помощи. J. Pharm. Лечить. Серв. Res. 2014; 5: 187–90.
Артикул
Google Scholar
Селинджер С.П., Белл А., Кэрнс А., Локетт М., Себастьян С., Хаслам Н. Пробиотик VSL # 3 предотвращает диарею, связанную с антибиотиками, в двойном слепом рандомизированном плацебо-контролируемом клиническом исследовании. J. Hosp. Заразить. 2013; 84: 159–65.
Артикул
PubMed
CAS
Google Scholar
Douillard FP, Kant R, Ritari J, Paulin L, Palva A, De Vos WM. Сравнительный анализ генома штаммов Lactobacillus casei , выделенных из продуктов Actimel и Yakult, выявил заметное сходство и указывает на общее происхождение.Microb. Biotechnol. 2013; 6: 576–87.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Horvath A, Dziechciarz P, Szajewska H. Мета-анализ: Lactobacillus rhamnosus GG для функциональных желудочно-кишечных расстройств, связанных с абдоминальной болью, в детском возрасте. Алимент. Pharmacol. Ther. 2011; 33: 1302–10.
Артикул
PubMed
CAS
Google Scholar
Sybesma W, Molenaar D, Van IJcken W, Venema K, Korta R. Нестабильность генома Lactobacillus rhamnosus GG. Прил. Environ. Microbiol. 2013; 79: 2233–2239.
Шен Н.Т., Мо А., Тманова Л.Л., Пино А., Анси К., Кроуфорд К.В. и др. Своевременное использование пробиотиков у госпитализированных взрослых предотвращает инфекцию Clostridium difficile : систематический обзор с мета-регрессионным анализом. Гастроэнтерология. Elsevier, Inc., 2017; 152: 1889–1900. e9.
Артикул
PubMed
Google Scholar
Hayes SR, Vargas AJ. Пробиотики для профилактики детской диареи, связанной с приемом антибиотиков. Explor. J. Sci. Лечить. 2016; 12: 463–6.
Google Scholar
Ouwehand AC. Обзор реакции на дозу пробиотиков в исследованиях на людях. Бенеф. Микробы. 2016: 1–10.
Эдвардс-Ингрэм Л., Гитшем П., Бертон Н., Уорхерст Дж., Кларк И., Хойл Д. и др. Генотипическая и физиологическая характеристика Saccharomyces boulardii , пробиотического штамма Saccharomyces cerevisiae .Прил. Environ. Microbiol. 2007. 73: 2458–67.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Лечение диареи, связанной с антибиотиками | Gastro Health
Антибиотики широко используются для профилактики и лечения инфекционных заболеваний. Хотя антибиотики безопасны для большинства людей, было доказано, что распространенным побочным эффектом лечения является диарея. Симптомы могут варьироваться от легкого дискомфорта в животе, водянистой диареи до тяжелого колита и даже смерти.Конечно, лекарство убивает вредные бактерии, вызывающие заболевание, но оно также уничтожает хорошие бактерии, которые удерживают наш кишечник в рабочем состоянии. Диарея определяется Всемирной организацией здравоохранения (ВОЗ, 2008) как испражнение трех или более жидкого или жидкого стула в день или более часто, чем обычно для человека.
По данным нескольких исследований, диарея возникает у 5–39% пациентов, получающих антибиотики, в зависимости от населения и типа антибиотика.Этот нежелательный симптом может быть прямым следствием изменения моторики желудочно-кишечного тракта (изменения сокращения или движения кишечника) или нарушения нормальной бактериальной флоры кишечного тракта. Однако основной причиной диареи, связанной с приемом антибиотиков, является инфекция бактериями Clostridium difficile.
Clostridium difficile, часто называемая C. difficile, представляет собой бактерию, представляющую значительную опасность для здоровья населения. Известно, что она вызывает симптомы, вплоть до опасного для жизни воспаления толстой кишки.Заболевание, вызванное C. difficile, обычно возникает после приема антибиотиков и становится более частым, тяжелым и трудным для лечения. В Соединенных Штатах он вызывает больше смертей, чем все другие кишечные инфекции вместе взятые. Предполагается, что ежегодно происходит до 3 миллионов случаев заражения. Если эти статистические данные верны, это сделает инфекцию C. difficile наиболее частой бактериальной причиной диареи в Соединенных Штатах.
Помимо использования антибиотиков, факторы риска C.difficile включают пожилой возраст, предшествующую госпитализацию, лечение химиотерапией, проживание в доме престарелых и использование ингибитора протонной помпы (лекарства, используемые для подавления кислотности желудочного сока). Пациенты, страдающие воспалительным заболеванием кишечника, как язвенным колитом, так и болезнью Крона, также особенно уязвимы к инфекции C. difficile, и врачи рекомендуют проверять их стул всякий раз, когда болезнь обостряется со значительной диареей.
Clostridium difficile — это бактерия, которая может существовать в споровой или вегетативной формах (спора — это микроорганизм в состоянии покоя или покоя).За пределами толстой кишки человека он выживает в форме спор, устойчивых к нагреванию, кислоте желудочного сока и антибиотикам. Пациенты с инфекцией C. difficile выделяют споры в стуле, что приводит к загрязнению их кожи, одежды, постельного белья и близлежащих поверхностей окружающей среды. Передается в основном фекально-оральным путем после временного заражения рук медработников. Как только споры попадают в толстую кишку, они превращаются в свою полностью функциональную и агрессивную вегетативную форму, производя токсины, которые повреждают и воспаляют слизистую оболочку толстой кишки, что приводит к колиту.
Лечение диареи, связанной с антибиотиками, состоит из нескольких этапов:
- Прекращение приема антибиотика, вызывающего проблему, является важным первым шагом.
- Введение пробиотиков, которые представляют собой живые микроорганизмы (в большинстве случаев бактерии), похожие на полезные микроорганизмы, обнаруживаемые в желудочно-кишечном тракте человека. При введении в адекватных количествах они приносят пользу здоровью хозяина в профилактике и лечении диареи, связанной с антибиотиками.
- Если у пациента есть образец кала, который дал положительный результат на C. difficile, следует начать надлежащее лечение антибиотиками и пациенту не рекомендуется использовать противодиарейные препараты (Ломотил, Имодиум и т. Д.), Поскольку их применение может ухудшить течение болезни .
- Наконец, пациентам рекомендуется пить большое количество жидкости через рот, чтобы предотвратить обезвоживание.
Инфекция C. difficile рецидивирует у 25% пациентов даже после начального успешного лечения, что требует еще одного курса лечения антибиотиками.Из-за этой высокой частоты рецидивов иммунологические подходы к профилактике и лечению рецидивов находятся в стадии разработки и включают использование иммуноглобулинов, анти-C. difficile и активная иммунизация вакцинами. Использование трансплантата фекалий также показало высокий уровень успеха в клинических испытаниях.
Цитируя аксиому Бенджамина Франклина о том, что «унция профилактики стоит фунта лечения», следующие рекомендации помогут предотвратить диарею, связанную с антибиотиками:
- Не требуйте и не принимайте антибиотики, если врач говорит, что они вам не нужны.
- Мойте руки часто и тщательно.
- Надевайте перчатки, когда находитесь рядом с пациентом, инфицированным C. difficile.
Диарея после приема антибиотиков | Everyday Health
Защитите себя
Некоторые пациенты обнаруживают, что они могут принимать определенные антибиотики, и диарея не будет проблемой, но прием других лекарств может вызвать диарею, говорит Паркман. Если у вас понос из-за приема антибиотиков, особенно если симптомы не исчезают или ухудшаются, обратитесь к врачу.Если вам необходимо продолжить лечение антибиотиками, ваш врач может переключить вас на другой препарат, у которого не будет этого побочного эффекта.
Если вы принимаете антибиотик, подумайте об изменении своего рациона на несколько дней, чтобы избегать продуктов, которые обычно вызывают диарею, таких как молочные продукты, жирные продукты, острая пища и продукты с высоким содержанием клетчатки, такие как цельнозерновой хлеб, крупы и т. Д. и фасоль. Вам также следует пить воду и отказываться от кофеина и алкоголя. Если у вас тяжелые симптомы диареи, связанной с антибиотиками, ваш врач может порекомендовать постельный режим, внутривенные жидкости для замены электролитов — натрия, калия и хлорида — и другой антибиотик для лечения вредных кишечных бактерий, вызывающих диарею.
Пробиотики могут облегчить диарею
Пробиотики — это дружественные бактерии или дрожжи, которые помогают вашей пищеварительной системе функционировать должным образом. Растущее количество исследований показывает, что пробиотики могут помочь защитить от диареи, связанной с антибиотиками. В частности, некоторые люди обнаружили, что пробиотик Lactobacillus acidophilus , содержащийся в некоторых марках йогурта, помогает уменьшить вызванную антибиотиками диарею у взрослых. Пробиотики также содержатся в мисо и других ферментированных продуктах.
Пробиотики естественным образом присутствуют в некоторых продуктах питания, добавляются к другим или могут приниматься в виде концентрированных добавок. «Существуют сотни пробиотиков», — говорит Паркман. «Каждый немного отличается. Возможно, вам придется поэкспериментировать, чтобы определить, какой из них работает для вас ».
Добавки с пробиотиками продаются в аптеках, продуктовых магазинах и магазинах здорового питания в жидкой, порошковой и капсульной формах. Иногда их хранят в холодильных камерах, потому что они нуждаются в защите от тепла.Вам следует поговорить со своим врачом, прежде чем принимать пробиотики, чтобы убедиться, что они безопасны для использования с другими вашими планами лечения.
Предписание для осторожности
Чтобы избежать диареи, связанной с антибиотиками, лучше всего принимать антибиотики только тогда, когда ваш лечащий врач считает, что они абсолютно необходимы. Антибиотики не борются с вирусными инфекциями, такими как простуда и грипп; они эффективны только против бактериальных инфекций.
Корректировка диеты может помочь вам избежать или облегчить симптомы диареи, пока вы не закончите прием антибиотиков.Пейте воду, чтобы избежать обезвоживания и восполнить потерю жидкости из-за диареи. Самое главное, если ваши симптомы ухудшаются или не проходят после приема лекарств, поговорите со своим врачом.
Диарея, связанная с антибиотиками // Middlesex Health
Обзор
Диарея, связанная с антибиотиками, — это жидкий водянистый стул три или более раз в день после приема лекарств, используемых для лечения бактериальных инфекций (антибиотиков).
Чаще всего диарея, связанная с приемом антибиотиков, протекает в легкой форме и не требует лечения.Диарея обычно проходит в течение нескольких дней после прекращения приема антибиотика. Более серьезная диарея, связанная с приемом антибиотиков, может потребовать прекращения приема антибиотиков или замены их.
Симптомы
У большинства людей диарея, связанная с приемом антибиотиков, вызывает легкие признаки и симптомы, например:
- Табуреты свободные
- Более частые испражнения
Диарея, связанная с антибиотиками, может начаться примерно через неделю после начала приема антибиотика.Однако иногда диарея и другие симптомы появляются только через несколько дней или даже недель после окончания лечения антибиотиками.
Инфекция Clostridium difficile
C. difficile — бактерия, продуцирующая токсины, которая может вызывать более серьезную диарею, связанную с антибиотиками. Инфекция C. difficile не только вызывает жидкий стул и учащение испражнений, но и вызывает:
- Боль и спазмы внизу живота
- Субфебрильная температура
- Тошнота
- Потеря аппетита
Когда обращаться к врачу
Немедленно позвоните своему врачу, если у вас есть серьезные признаки и симптомы диареи, связанной с приемом антибиотиков.Эти признаки и симптомы являются общими для ряда состояний, поэтому ваш врач может порекомендовать тесты для определения причины.
Причины
Почему возникает диарея, связанная с приемом антибиотиков, до конца не изучено. Обычно считается, что он развивается, когда антибактериальные препараты (антибиотики) нарушают баланс хороших и вредных бактерий в желудочно-кишечном тракте.
Антибиотики, которые с наибольшей вероятностью вызывают диарею
Почти все антибиотики могут вызывать диарею, связанную с антибиотиками.Чаще всего используются следующие антибиотики:
- Цефалоспорины, такие как цефдинир и цефподоксим
- Пенициллины, такие как амоксициллин и ампициллин
Инфекция C. difficile
Когда антибиотики нарушают баланс бактерий в пищеварительной системе, бактерии C. difficile могут быстро выйти из-под контроля. Бактерии C. difficile создают токсины, которые поражают слизистую оболочку кишечника. Антибиотики, наиболее часто связанные с инфекцией C. difficile, включают фторхинолоны, цефалоспорины, пенициллины и клиндамицин.
Факторы риска
Диарея, связанная с антибиотиками, может возникнуть у любого, кто принимает антибиотики. Но у вас с большей вероятностью разовьется диарея, связанная с приемом антибиотиков, если вы:
- Переносил диарею, вызванную приемом антибиотиков, в прошлом
- Длительный прием антибиотиков
- Принимаете более одного антибиотика
Осложнения
Одним из наиболее частых осложнений любого типа диареи является чрезмерная потеря жидкости и электролитов (обезвоживание).Сильное обезвоживание может быть опасным для жизни. Признаки и симптомы включают очень сухость во рту, сильную жажду, слабое мочеиспускание или его отсутствие и слабость.
Профилактика
Чтобы предотвратить диарею, вызванную приемом антибиотиков, попробуйте:
- Принимайте антибиотики только при необходимости. Не принимайте антибиотики, если врач не считает их необходимыми. Антибиотики могут лечить бактериальные инфекции, но не помогают при вирусных инфекциях, таких как простуда и грипп.
- Попросите опекунов вымыть руки. Если вы госпитализированы, попросите всех вымыть руки или использовать дезинфицирующее средство для рук на спиртовой основе, прежде чем прикасаться к вам.
- Сообщите своему врачу, если у вас раньше была диарея, связанная с приемом антибиотиков. Одноразовая диарея, связанная с антибиотиками, увеличивает вероятность того, что антибиотики снова вызовут ту же реакцию. Ваш врач может подобрать для вас другой антибиотик.
Диагностика
Чтобы диагностировать диарею, связанную с антибиотиками, ваш врач, вероятно, спросит вас об истории вашего здоровья, в том числе о том, проходили ли вы недавнее лечение антибиотиками.Если ваш врач подозревает, что у вас инфекция C. difficile, образец вашего стула может быть проверен на наличие бактерий.
Лечение
Лечение диареи, связанной с приемом антибиотиков, зависит от тяжести ваших признаков и симптомов.
Лечение легкой диареи, связанной с антибиотиками
Если у вас легкая диарея, ваши симптомы, вероятно, исчезнут в течение нескольких дней после окончания лечения антибиотиками. В некоторых случаях врач может посоветовать вам прекратить терапию антибиотиками до тех пор, пока диарея не пройдет.
Лечение для борьбы с вредными бактериями при инфекции C. difficile
Если у вас разовьется инфекция, вызванная C. difficile, ваш врач, скорее всего, прекратит прием любого антибиотика, который вы в настоящее время принимаете, и может назначить антибиотики, специально предназначенные для уничтожения бактерий, вызывающих ваши антибиотико-ассоциированные понос. Вас также попросят прекратить прием препаратов, снижающих кислотность желудка. У людей с этим типом инфекции симптомы диареи могут вернуться и потребовать повторного лечения.
Образ жизни и домашние средства
Чтобы справиться с диареей:
Пейте достаточно жидкости. Чтобы предотвратить небольшую потерю жидкости при диарее, пейте больше воды. При более тяжелой потере пейте жидкости, содержащие воду, сахар и соль. Попробуйте бульон или фруктовый сок с низким содержанием сахара. Избегайте напитков с высоким содержанием сахара, алкоголя или кофеина, таких как кофе, чай и кола, которые могут ухудшить ваши симптомы.
Для младенцев и детей, страдающих диареей, спросите своего врача об использовании раствора для пероральной регидратации, такого как Pedialyte, для восполнения жидкости и электролитов.
- Избегайте определенных продуктов. Во время диареи рекомендуется избегать жирной и острой пищи. Обычно вы можете вернуться к нормальной диете вскоре после исчезновения симптомов.
- Спросите о противодиарейных препаратах. В некоторых случаях легкой диареи, связанной с антибиотиками, ваш врач может порекомендовать противодиарейные препараты, такие как лоперамид (Имодиум A-D). Но посоветуйтесь со своим врачом, прежде чем принимать противодиарейные лекарства, потому что они могут повлиять на способность вашего организма выводить токсины и привести к серьезным осложнениям.
Люди могут обратиться к пробиотикам, содержащимся в таких продуктах, как йогурт, в надежде, что они смогут восстановить баланс полезных бактерий в пищеварительном тракте. Но нет единого мнения о том, могут ли безрецептурные пробиотики помочь уменьшить симптомы диареи, связанной с антибиотиками. Однако прием пробиотиков не причиняет вреда, если только у вас не ослаблена иммунная система.
Запись на прием
Запишитесь на прием к врачу, который назначил антибиотик.Вот некоторая информация, которая поможет вам подготовиться к встрече.
Что вы можете сделать
Составьте список:
- Ваши симптомы, включая любые, которые могут показаться не связанными с причиной, по которой вы записались на прием.
- Ключевая личная информация, , включая любые серьезные стрессы или недавние изменения в жизни, в том числе если вы недавно находились в больнице или доме престарелых.
- Лекарства, витамины или добавки , которые вы принимаете, включая дозы.Если вы недавно принимали антибиотик, укажите его название, дозировку и время прекращения приема.
- Вопросы, которые следует задать своему врачу.
В случае диареи, связанной с приемом антибиотиков, некоторые основные вопросы, которые следует задать своему врачу, включают:
- Какие тесты мне нужны?
- Мое состояние вероятно временное или хроническое?
- Как лучше всего действовать?
- Какие альтернативы основному подходу вы предлагаете?
- Есть ли ограничения, которым я должен следовать?
- Есть продукты и напитки, которых мне следует избегать?
Не стесняйтесь задавать другие вопросы.
Чего ожидать от врача
Ваш врач, скорее всего, задаст вам ряд вопросов. Если вы будете готовы ответить на них, у вас будет больше времени, чтобы обсудить другие вопросы, которые вы хотите затронуть. Ваш врач может спросить:
- Когда у вас появились симптомы?
- Можете ли вы описать свой стул? Как часто они бывают?
- Были ли у вас в анамнезе проблемы с кишечником, такие как язвенный колит, болезнь Крона или другие воспалительные заболевания кишечника?
- Были ли вы в последнее время рядом с кем-нибудь, кто болел диареей?
Что вы можете сделать тем временем
Продолжайте принимать антибиотики в соответствии с указаниями врача.
Чтобы справиться с диареей до приема на прием, вы можете:
- Пейте больше воды и других жидкостей, чтобы восполнить потерю жидкости из-за диареи
- Ешьте мягкую пищу и избегайте острой или жирной пищи, которая может усугубить диарею
© 1998-2021 Фонд медицинского образования и исследований Мэйо (MFMER). Все права защищены. Условия использования
Лечение и профилактика антибиотико-ассоциированной диареи
Abstract
Легкие или тяжелые эпизоды антибиотико-ассоциированной диареи (ААД) являются частыми побочными эффектами антибактериальной терапии.Частота возникновения ААД зависит от антибиотика и колеблется от 5 до 25%. Основной формой кишечных расстройств является псевдомембранозный колит, связанный с Clostridium difficile , который встречается у 10–20% всех ААД. В большинстве случаев прекращение приема ААД или замена стимулирующего антибиотика другим препаратом с более низким риском ААД может быть эффективным. В более тяжелых случаях, связанных с C. difficile , лечение диареи требует лечения антибиотиками, гликопептидами (ванкомицином) или метронидазолом.Другой подход к лечению или профилактике AAD основан на использовании непатогенных живых организмов, способных восстановить равновесие кишечной экосистемы. Некоторые микроорганизмы использовались для лечения или профилактики AAD, такие как отобранные штаммы Lactobacillus acidophilus , L. bulgaricus , Bifidobacterium longum и Enterococcus faecium . Был использован другой биотерапевтический агент, непатогенные дрожжи, Saccharomyces boulardii .На животных моделях колита C. difficile , инициированного клиндамицином, у животных, получавших S. boulardii (в конце терапии ванкомицином), наблюдалось значительное снижение колониеобразующих единиц C. difficile и продукции токсина B. В нескольких клинических рандомизированных исследованиях (по сравнению с плацебо) S. boulardii продемонстрировал свою эффективность за счет значительного снижения частоты возникновения колита C. difficile и предотвращения патогенных эффектов токсинов A и B C.difficile . Было показано, что это безопасное и эффективное лечение рецидивов колита C. difficile . Хороший ответ наблюдался у детей с ААД, которых лечили только S. boulardii . В отделениях интенсивной терапии профилактика AAD по-прежнему основана на ограничении чрезмерного использования антибиотиков, и распространение C. difficile или других агентов AAD следует предотвращать с помощью улучшенных мер гигиены (отдельные комнаты, отдельные ванные комнаты для пациентов, использование перчаток и мытье рук для персонала) .Кроме того, растущее использование биотерапевтических агентов, таких как S. boulardii , должно позволить предотвратить основной побочный эффект антибиотиков, то есть ААД, у пациентов из группы риска.
Ключевые слова
Диарея, связанная с антибиотиками
Кишечная экосистема
Биотерапевтические агенты
Saccharomyces boulardii
Рекомендуемые статьи Цитирующие статьи (0)
Полный текст
Copyright © 2000 Elsevier International Society Science of Chem.Все права защищены.
Рекомендуемые статьи
Ссылки на статьи
Острая диарея у взрослых — американский семейный врач
1. Guerrant RL,
Ван Гилдер Т,
Штайнер Т.С.,
и другие.;
Общество инфекционных болезней Америки.
Практические рекомендации по ведению инфекционной диареи. Клиническая инфекция .
2001; 32 (3): 331–351 ….
2. Косек М,
Берн C,
Геррант Р.Л.Глобальное бремя диарейных заболеваний, согласно оценкам исследований, опубликованных между 1992 и 2000 годами. Bull World Health Organ .
2003. 81 (3): 197–204.
3. Скаллан Э.,
Хоэкстра Р.М.,
Ангуло Ф.Дж.,
и другие.
Заболевание пищевого происхождения, приобретенное в США. Emerg Infect Dis .
2011; 17 (1): 7–15.
4. Скаллан Э.,
Гриффин П.М.,
Ангуло Ф.Дж.,
Tauxe RV,
Hoekstra RM.
Заболевание пищевого происхождения, приобретенное в Соединенных Штатах — неуточненные агенты. Emerg Infect Dis .
2011; 17 (1): 16–22.
5. DuPont HL.
Диарейные заболевания в развивающихся странах. Инфекция Dis Clin North Am .
1995. 9 (2): 313–324.
6. Хедберг CW,
Макдональд К.Л.,
Остерхольм MT.
Изменение эпидемиологии болезней пищевого происхождения: перспектива Миннесоты. Клиническая инфекция .
1994. 18 (5): 671–680.
7. Аранда-Мишель Дж.,
Джаннелла РА.
Острая диарея: практический обзор. Am J Med .
1999. 106 (6): 670–676.
8. Тургеон ДК,
Fritsche TR.
Лабораторные подходы к инфекционной диарее. Гастроэнтерол Clin North Am .
2001. 30 (3): 693–707.
9. Джонс Т.Ф.,
Буленс СН,
Геттнер С,
и другие.
Использование наборов для сбора стула, доставляемых пациентам, может улучшить подтверждение этиологии вспышек болезней пищевого происхождения. Клиническая инфекция .
2004. 39 (10): 1454–1459.
10. Центры по контролю и профилактике заболеваний.
Предварительные данные FoodNet о заболеваемости патогенами, обычно передаваемыми через пищу — 10 штатов, 2009 г. MMWR Morb Mortal Wkly Rep .
2010. 59 (14): 418–422.
11. DuPont HL.
Рекомендации по острой инфекционной диарее у взрослых. Комитет параметров практики Американского колледжа гастроэнтерологии. Ам Дж. Гастроэнтерол .
1997. 92 (11): 1962–1975.
12.Хоф Х.
История и эпидемиология листериоза. FEMS Immunol Med Microbiol .
2003. 35 (3): 199–202.
13. Джанакираман В.
Листериоз при беременности: диагностика, лечение и профилактика. Рев Акушер Гинеколь .
2008. 1 (4): 179–185.
14. Тильман Н.М.,
Геррант Р.Л.
Клиническая практика. Острая инфекционная диарея. N Engl J Med .
2004. 350 (1): 38–47.
15. Ильницкий А.
Клиническая оценка и лечение острой инфекционной диареи у взрослых. Гастроэнтерол Clin North Am .
2001. 30 (3): 599–609.
16. Фартинг М,
Салам М.А.,
Линдберг Г,
и другие.;
Всемирная гастроэнтерологическая организация.
Острая диарея у взрослых и детей: глобальная перспектива. Дж Клин Гастроэнтерол .
2013; 47 (1): 12–20.
17. Геррант Р.Л.,
Щиты ДС,
Торсон С.М.,
Шорлинг Дж. Б.,
Gröschel DH.
Оценка и диагностика острой инфекционной диареи. Am J Med .
1985; 78 (6B): 91–98.
18. Джилл CJ,
Лау Дж,
Горбач С.Л.,
Hamer DH.
Диагностическая точность анализов кала на воспалительный бактериальный гастроэнтерит в развитых и бедных ресурсами странах. Клиническая инфекция .
2003. 37 (3): 365–375.
19. Чен СС,
Чанг CJ,
Лин Т.Ю.,
Лай МВт,
Чао ХК,
Kong MS.
Полезность фекального лактоферрина в прогнозировании и мониторинге клинической тяжести инфекционной диареи. Мир Дж. Гастроэнтерол .
2011. 17 (37): 4218–4224.
20. Чой SW,
Парк CH,
Сильва ТМ,
Заенкер Э.И.,
Геррант Р.Л.
Посев или не посев: скрининг фекального лактоферрина на воспалительную бактериальную диарею. Дж. Клин Микробиол .
1996. 34 (4): 928–932.
21. Хаякава Т,
Джин CX,
Ко СБ,
Китагава М,
Исигуро Х.
Лактоферрин при желудочно-кишечных заболеваниях. Медицинский работник .2009. 48 (15): 1251–1254.
22. Геррант Р.Л.,
Ванке Калифорния,
Барретт LJ,
Schwartzman JD.
Экономичный и действенный подход к диагностике и лечению острой инфекционной диареи. Бюлл Н Й Акад Мед .
1987. 63 (6): 484–499.
23. Гангароса РЭ,
Стекло РИ,
Лью Дж. Ф.,
Скучный JR.
Госпитализации по поводу гастроэнтерита в США, 1985 г .: особое бремя болезни среди пожилых людей. Am J Epidemiol .
1992. 135 (3): 281–290.
24. Талан Д,
Моран Г.Дж.,
Ньюдоу М,
и другие.;
EMERGEncy ID NET Study Group.
Этиология кровавой диареи у пациентов, поступающих в отделения неотложной помощи США: распространенность Escherichia coli O157: H7 и других энтеропатогенов. Клиническая инфекция .
2001. 32 (4): 573–580.
25. Bauer TM,
Лалвани А,
Ференбах Я,
и другие.Разработка и проверка руководств по культивированию стула на энтеропатогенные бактерии, отличные от Clostridium difficile, у госпитализированных взрослых. ДЖАМА .
2001. 285 (3): 313–319.
26. Манацатхит С,
Dupont HL,
Фартинг М,
и другие.;
Рабочая группа Программного комитета Всемирного гастроэнтерологического конгресса в Бангкоке, 2002 г.
Руководство по ведению острой диареи у взрослых. Дж Гастроэнтерол Гепатол .2002; 17 (доп.): S54 – S71.
27. Ронер П.,
Питте Д.,
Пепи Б,
Нидже-Кинге Т,
Окенталер Р.
Этиологические агенты инфекционной диареи: значение для запросов на микробную культуру. Дж. Клин Микробиол .
1997. 35 (6): 1427–1432.
28. Центры по контролю и профилактике заболеваний.
Жизненно важные признаки: предотвращение инфекций, вызванных Clostridium difficile. MMWR Morb Mortal Wkly Rep .
2012. 61 (9): 157–162.
29. Сигель Д.Л.,
Эдельштейн PH,
Начамкин И.
Несоответствующее обследование на диарейные заболевания в больнице. ДЖАМА .
1990. 263 (7): 979–982.
30. Шэнь Б,
Хан К,
Икенберри СО,
и другие.;
Комитет по стандартам практики ASGE.
Роль эндоскопии в ведении пациентов с диареей. Гастроинтест Эндоск .
2010. 71 (6): 887–892.
31. Bellaiche G,
Ле Пеннек депутат,
Slama JL,
и другие.Значение ректосигмоидоскопии и бактериологического посева биоптатов толстой кишки в этиологической диагностике острой диареи у взрослых. Проспективное исследование 65 пациентов [на французском языке]. Ann Gastroenterol Hepatol (Париж) .
1996; 32 (1): 11–17.
32. Хан С,
Ким И,
Гарнер П.
Раствор для пероральной регидратации с пониженной осмолярностью для лечения обезвоживания из-за диареи у детей: систематический обзор. BMJ .
2001. 323 (7304): 81–85.
33. Алам NH,
Юнус М,
Фарук А.С.,
и другие.
Симптоматическая гипонатриемия во время лечения дегидратирующей диарейной болезни пероральным регидратационным раствором пониженной осмолярности. ДЖАМА .
2006. 296 (5): 567–573.
34. Дагган С,
Нурко С.
«Питание кишечника»: научная основа для продолжения энтерального питания во время острой диареи. Дж. Педиатр .
1997. 131 (6): 801–808.
35. Гадевар С,
Фазано А.Современные концепции оценки, диагностики и лечения острой инфекционной диареи. Curr Opin Pharmacol .
2005. 5 (6): 559–565.
36. Де Брюн Г.
Диарея у взрослых (острая). Ам Фам Врач .
2008. 78 (4): 503–504.
37. Тейлор Д. Н.,
Санчес JL,
Кэндлер W,
Торнтон С,
Маккуин С,
Эчеверрия П.
Лечение диареи путешественников: ципрофлоксацин плюс лоперамид по сравнению с одним ципрофлоксацином.Плацебо-контролируемое рандомизированное исследование. Энн Интерн Мед. .
1991. 114 (9): 731–734.
38. Риддл М.С.,
Арнольд С,
Tribble DR.
Влияние дополнительного лоперамида в комбинации с антибиотиками на результаты лечения диареи путешественников: систематический обзор и метаанализ. Клиническая инфекция .
2008. 47 (8): 1007–1014.
39. Hanauer SB,
DuPont HL,
Купер КМ,
Лаудадио К.
Рандомизированное двойное слепое плацебо-контролируемое клиническое испытание лоперамида плюс симетикон в сравнении с одним лоперамидом и одним симетиконом при лечении острой диареи с дискомфортом в животе, связанным с газами. Curr Med Res Opin .
2007. 23 (5): 1033–1043.
40. DuPont HL,
Хорник РБ.
Побочный эффект терапии ломотилом при шигеллезе. ДЖАМА .
1973; 226 (13): 1525–1528.
41. Мэтисон А.Дж.,
Благородный С.
Рацекадотрил. Наркотики .
2000. 59 (4): 829–835.
42. De Bruyn G,
Хан С,
Борвик А.
Лечение антибиотиками диареи путешественников. Кокрановская база данных Syst Rev .2000; (3): CD002242.
43. Wong CS,
Елачич С,
Хабиб Р.Л.,
Уоткинс С.Л.,
Tarr PI.
Риск гемолитико-уремического синдрома после лечения антибиотиками инфекций, вызванных Escherichia coli O157: H7. N Engl J Med .
2000; 342 (26): 1930–1936.
44. Casburn-Jones AC,
Фартинг MJ.
Лечение инфекционной диареи. Кишка .
2004. 53 (2): 296–305.
45. McMahan ZH,
DuPont HL.Обзорная статья: история лечения острой инфекционной диареи — от плохо сфокусированного эмпиризма до инфузионной терапии и современной фармакотерапии. Алимент Фармакол Тер .
2007. 25 (7): 759–769.
46. Аллен С.Дж.,
Мартинес Э.Г.,
Грегорио Г.В.,
Данс Л.Ф.
Пробиотики для лечения острой инфекционной диареи. Кокрановская база данных Syst Rev .
2010; (11): CD003048.
47. Bhutta ZA,
Птица СМ,
Черный RE,
и другие.Терапевтические эффекты перорального цинка при острой и стойкой диарее у детей в развивающихся странах: объединенный анализ рандомизированных контролируемых исследований. Ам Дж. Клин Нутр .
2000. 72 (6): 1516–1522.
48. Всемирная организация здравоохранения. Лечение диареи. Пособие для врачей и других старших медицинских работников. 2005. http://whqlibdoc.who.int/publications/2005/9241593180.pdf. По состоянию на 1 октября 2013 г.
49. Ejemot RI,
Эхири Дж. Э.,
Меремикву М.М.,
Critchley JA.Мытье рук для предотвращения диареи. Кокрановская база данных Syst Rev .

 pdf.pdf
pdf.pdf 13492. https://www.ncbi.nlm.nih.gov/pubmed/26662643
13492. https://www.ncbi.nlm.nih.gov/pubmed/26662643