что это такое, причины возникновения, диагностика и лечение
Гепатоспленомегалия – это одновременное увеличение в размерах печени и селезенки, имеющих общую иннервацию и путь, через который происходит отток венозной крови и лимфатической жидкости. Врачи в своей практической деятельности такой диагноз, как гепатоспленомегалия, не ставят, потому что увеличение размеров селезенки и печени является только проявлением основной патологии.
Именно поэтому целесообразно использовать термин «синдром гепатоспленомегалии», который включает в себя большое количество патоморфологических и клинических признаков.
Причины возникновения
Синдром гепатоспленомегалии развивается при большом количестве заболеваний. Само по себе увеличение селезенки и печени не является опасным, но именно это зачастую начинает беспокоить пациента. При гепатоспленомегалии причины ее возникновения должны быть выяснены как можно раньше. Это влияет на эффективность лечения. Все причины условно делятся на шесть групп:
Все причины условно делятся на шесть групп:
- болезни, которые вызваны попаданием в организм паразитов: бруцеллез, малярия, лейшманиоз и т. д.;
- хронические инфекционные заболевания: мононуклеоз, сифилис;
- заболевания печени, которые приводят к изменениям в системе кровообращения воротной зоны: гепатиты, цирроз;
- болезни, которые вызывают возникновение хронической сердечной недостаточности: ишемическая болезнь, различные пороки сердца, гипертония;
- заболевания крови: лейкоз, гемолитическая анемия, лимфогранулематоз;
- болезни, которые возникают вследствие нарушения обмена веществ: гемохроматоз, амилоидоз.
Симптомы и диагностика
При гепатоспленомегалии симптомы увеличения печени очень часто сочетаются с признаками, которые сопровождают патологический процесс. К ним относят:
- чувство тяжести и распирания, возникающее в области левого и правого подреберья;
- болезненные ощущения в области печени;
- желтушность кожы;
- частые носовые кровотечения и наличие обширных гематом, возникающих при незначительных воздействиях;
- наличие образования в виде опухоли в области правого подреберья, которое при дыхании начинает смещаться;
- увеличение размеров живота в результате возникновения асцита.

Чтобы диагностировать гепатоспленомегалию, проводят пальпацию брюшной стенки. Как правило, новообразование прощупывается в правом подреберье, смещаясь во время дыхания. Это заболевание можно выявить и визуально.
После осмотра пациенту необходимо сдать биохимический и общий анализ крови, лабораторная диагностика которой способствует выявлению сдвигов в показателях анализа и исключению инфицированности вирусами гепатита и многими другими возбудителями инфекций. Большое значение такой анализ крови и миелограмма имеет для больных, у которых гепатоспленомегалия вызвана гематологическими заболеваниями.
Исследование при помощи УЗИ считается простым и безопасным методом, которое позволяет увидеть полную картину заболевания, определить, насколько сильно выражена гепатоспленомегалия и поражены ли другие внутренние органы.
Инструментальный метод сначала проводят при помощи эхоскопии, а после этого назначают компьютерную томографию. Она необходима, если патологический процесс имеет неясную этиологию. С помощью такого исследования получают рентгеновские снимки пораженной области, что позволяет наиболее точно оценить состояние внутренних органов.
Она необходима, если патологический процесс имеет неясную этиологию. С помощью такого исследования получают рентгеновские снимки пораженной области, что позволяет наиболее точно оценить состояние внутренних органов.
Чтобы определить истинные размеры селезенки и печени, проводят ангиографию. При этом используется рентгеноконтрастное вещество, позволяющее улучшить визуализацию сосудов селезенки и печени. Антиография также помогает уточнить характер поражения (диффузный или очаговый) и определить степень нарушения кровотока по воротной вене.
В некоторых случаях установить характер патологического процесса при помощи неинвазивных методов диагностики совершенно невозможно, поэтому проводят чрескожную пункционную биопсию печени и селезенки. С помощью нее появляется возможность получить образцы ткани пораженных органов. Проводится процедура специальной тонкой иглой, осуществляемой под местным обезболиванием. Гистологическое исследование, проводимое в последующем, способствует установлению точного диагноза и помогает определить дальнейшую тактику ведения больного.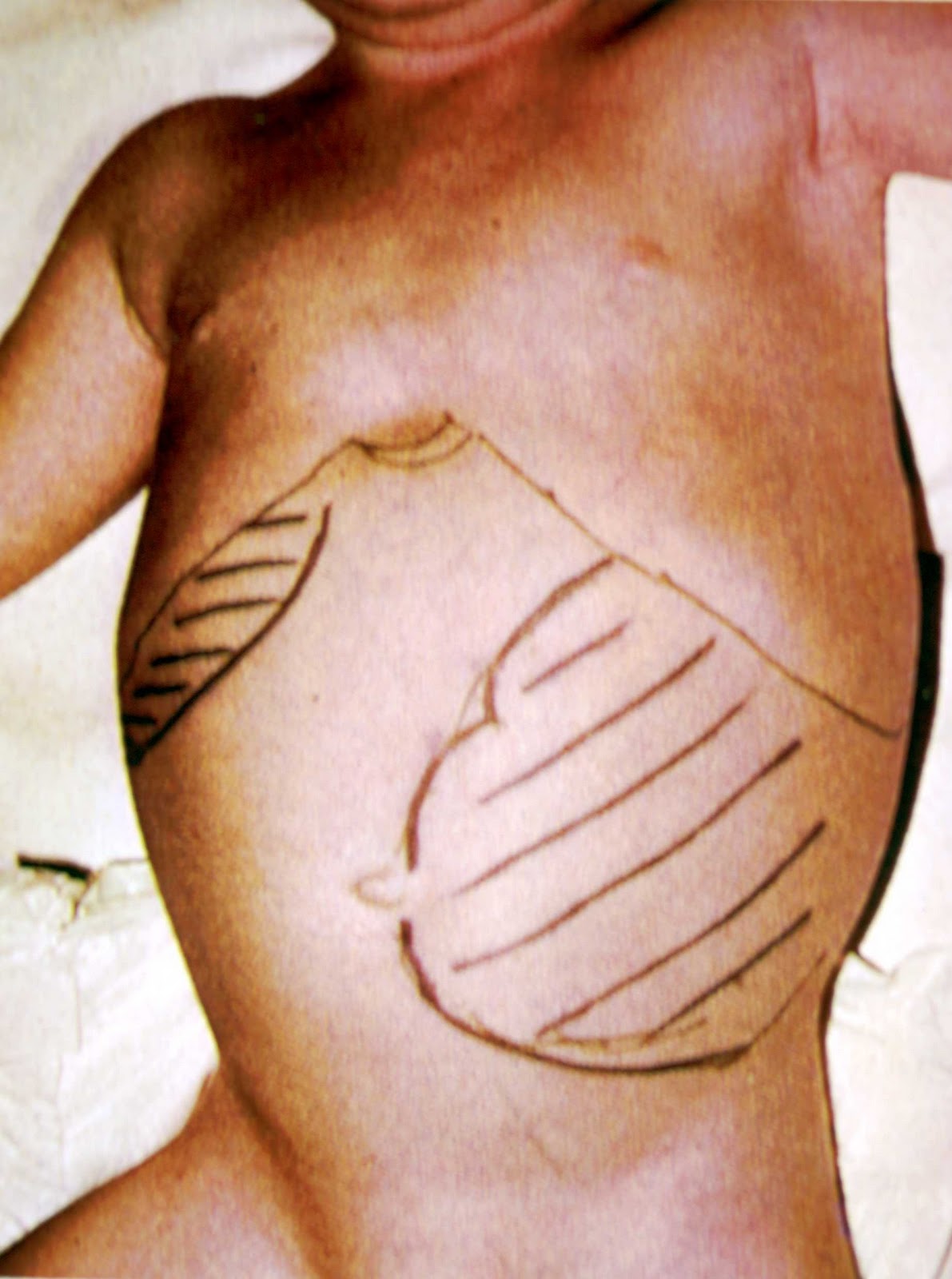
Пункция костного мозга и лимфатических узлов необходима для уточнения диагноза, если возникает подозрение на наличие у больного гематологической патологии.
Лечение
Перед тем как начать лечение, обязательно нужно выяснить причину возникновения гепатоспленомегалии. Помощь, которую необходимо оказать больному с этим заболеванием, должна быть комплексной.
- Медикаментозное лечение.
Медикаментозная терапия используется для лечения заболевания, которое вызвало увеличение органов. В основном применяют холеспазмолитические препараты (дибазол, нош-па, платифиллин, папаверин и т. д.). Из желчегонных средств используют только холецистокинетики (холосас, сорбит, ксилит и 10 или 20% раствор сернокислой магнезии). Однако такие препараты используются только тогда, когда полностью исчезнет внутрипеченочный холестаз.
- Дезинтоксикационная терапия.
Такое лечение способствует очищению крови от токсинов. В основном назначают гемодез, реополиглюкин и 5 – 10% раствор глюкозы, вводимой внутривенно, в сочетании с кокарбоксилазой и 5% раствором аскорбиновой кислоты.
В основном назначают гемодез, реополиглюкин и 5 – 10% раствор глюкозы, вводимой внутривенно, в сочетании с кокарбоксилазой и 5% раствором аскорбиновой кислоты.
- Гормональная терапия.
Способствует снятию воспаления. Чаще всего используют преднизолон (1 – 3 мг на 1 кг массы тела больного).
- Базальная терапия.
Такое лечение способствует повышению иммунитета. Применяют противовирусные и иммуномодулирующие препараты (индинавир, криксиван, интерферон, роферон А, ретровир, ацикловир, аденинарабизон, ингибитор протеаз, саквинавир, виферон, азитимидин, ламивудин, зовиракс).
- Применение витаминных комплексов.
Такое лечение лишним не будет. Кроме этого, назначают препараты, которые обновляют клетки печени.
Диета
На печень, желудок и селезенку пагубно влияет жирная пища, красители, консерванты и канцерогены, которые содержатся в разных продуктах. Чтобы внутренние органы смогли преодолеть свою болезнь, необходимо во время лечения придерживаться строгой диеты. Рацион должен включать нежирную и свежую пищу: диетические супы, обезжиренный творог, каши без сливочного масла.
Рацион должен включать нежирную и свежую пищу: диетические супы, обезжиренный творог, каши без сливочного масла.
Также вместо сока, чая или кофе рекомендуется употреблять простую минеральную воду, кисели и домашние компоты. Категорически противопоказаны пирожные, торты и другие жирные десерты.
Заключение
Причин возникновения гепатоспленомегалии очень много. Если возникает подозрение на это заболевание, то рекомендуется как можно быстрее обратиться к таким врачам, как гастроэнтеролог, инфекционист, терапевт и гематолог. Важно правильно диагностировать это заболевание и грамотно подобрать способ его лечения.
симптомы, причины, лечение, профилактика, осложнения
Патологический синдром может возникать не только у взрослых, но и у детей. Причины, отчего может быть гепатоспленомегалия у малышей, различны, но в основном это имеющиеся заболевания внутренних органов.
- Рост печени и селезёнки может возникать из-за заболеваний органов, которые связаны с нарушением работы кровеносной системы.
 К таким заболеваниям относится цирроз, гепатит, а также нарушение кровоснабжения печени.
К таким заболеваниям относится цирроз, гепатит, а также нарушение кровоснабжения печени. - Возникновение хронической инфекции в детском организме: малярия или инфекционный мононуклеоз.
- Заболевания кроветворной системы: лейкоз, а также гемолитическая анемия.
- Сердечнососудистые заболевания: пороки сердца, в том числе и врождённые, ишемические болезни и гипертония.
- Нарушения процессов обмена веществ.
- Наследственность. Очень часто в семье, где кто-либо из родственников страдал от этого синдрома и сопутствующих заболеваний, высок риск возникновения патологии у ребёнка.
Иногда из-за имеющегося заболевания внутренних органов и систем сначала начинает расти селезёнка, а после этого замечается увеличение печени, или наоборот. Развитию гепатоспленомегалии способствует множество причин и факторов.
- Определить развитие синдрома не всегда можно на ранней стадии.
 Заболевание может не проявлять себя некоторое время.
Заболевание может не проявлять себя некоторое время. - В некоторых случаях ребёнок жалуется на чувство тяжести в подреберье. Это объясняется увеличением печени и селезёнки.
- На этапе активного развития синдрома увеличение органов можно заметить визуально. Опухоль появляется как в одном подреберье, так и одновременно в двух.
- Если ребёнок делает глубокий вдох, опухоль может сместиться в другую сторону, а также ощущается ноющая боль.
- Гепатоспленомегалия может сопровождать нарушение кровообращения и желтуху. В брюшном отделе скапливается излишняя жидкость, что может проявляться визуально.
Диагностика гепатоспленомегалии у ребёнка
Диагностировать синдром врач сможет при первичном осмотре и пальпации ребёнка. Но для точного диагноза необходимо пройти некоторые обследования и сдать анализы. Диагностика необходима для выяснения точной причины возникновения гепатоспленомегалии. От этого будет зависеть метод лечения больного ребёнка.
- Ребёнок должен пройти УЗИ брюшной полости или магнитно-резонансную томографию.
- Ребёнок должен сдать развёрнутый анализ крови.
- Для определения характера патологического синдрома назначается эхоскопия.
- В некоторых случаях врач направляет малыша на радиозотопное исследование.
- Может быть использован метод пункции лимфатических узлов и костного мозга. Также может потребоваться биопсия печени или селезёнки, в зависимости от их увеличенного размера.
При своевременной диагностике и соответствующем лечении, есть вероятность полного устранения синдрома. При отсутствии лечения заболеваний печени и селезёнки, гепатоспленомегалия может вызвать серьёзные осложнения и последствия. В организме ребёнка начинают происходить необратимые процессы во внутренних органах. Синдром не является смертельным, но требует немедленной диагностики и лечения основных заболеваний.
Что можете сделать вы
Необходимое лечение при патологическом синдроме назначает врач. Родители должны придерживаться всех врачебных рекомендаций. Также необходимо облегчить состояние ребёнка.
Родители должны придерживаться всех врачебных рекомендаций. Также необходимо облегчить состояние ребёнка.
Для скорейшего выздоровления, необходимо исключить из детского рациона многие вредные продукты и добавить полезную пищу:
o Жирную и жареную пищу ребёнку с болезнями печени и селезёнки нельзя;
o Консерванты, искусственные добавки, канцерогены и красители. Продукты с содержанием этих вредных веществ следует полностью убрать из меню ребёнка;
o Также нельзя чипсы, сухарики, молочную продукцию длительного хранения, колбасы и магазинные консервы;
o Ограничить употребление сладких кондитерских изделий и магазинной выпечки;
o В рационе должны присутствовать свежие овощи и фрукты, молочные продукты, нежирное мясо, каши;
o Чай и кофе надо заменить на домашние компоты, соки, кисели и негазированную минеральную воду.
Что делает врач
После установленного диагноза врач сможет назначить лечение. Полностью вылечить гепатоспленомегалию не всегда удаётся, но можно облегчить симптомы недуга и состояние больных органов. В некоторые периоды скачков роста синдром пропадает самостоятельно без лечения. К этим периодам относится возраст ребёнка от 5 до 6 лет, а также от 10 до 11 и от 14 до 15. Лечение гепатоспленомегалии необходимо для устранения основного заболевания внутренних органов. После того как печень и селезёнка начнут полноценно работать, признаки гепатоспленомегалии исчезнут. Для устранения причины синдрома применяются разные методы лечения:
В некоторые периоды скачков роста синдром пропадает самостоятельно без лечения. К этим периодам относится возраст ребёнка от 5 до 6 лет, а также от 10 до 11 и от 14 до 15. Лечение гепатоспленомегалии необходимо для устранения основного заболевания внутренних органов. После того как печень и селезёнка начнут полноценно работать, признаки гепатоспленомегалии исчезнут. Для устранения причины синдрома применяются разные методы лечения:
- Назначается приём желчегонных средств и холеспазмолитиков;
- Применяются гормональные средства;
- Терапия по устранению признаков интоксикации организма: применяются инъекции с раствором глюкозы, аскорбиновой кислоты и гемодеза;
- Использование противовирусных, антибактериальных препаратов, а также возможное использование иммунодепрессантов;
- Употребление лекарственных средств, помогающих в обновлении клеток печени;
- Повышение иммунитета с помощью витаминных и минеральных комплексов.

- При проблемах с работой кишечника, рекомендуется принимать лекарственные средства, помогающие в пищеварении. Это необходимо для предотвращения побочных явлений после приёма некоторых медикаментов.
Предотвратить возникновение синдрома можно при постоянном контроле за здоровьем ребёнка. При возникновении признаков и симптомов заболеваний печени, селезёнки и других заболеваний внутренних органов, необходимо своевременно обращаться к врачу. Большое значение имеет питание ребёнка. В качестве профилактики гепатоспленомегалии, рацион малыша должен состоять из натуральных и полезных продуктов
Вооружайтесь знаниями и читайте полезную информативную статью о заболевании гепатоспленомегалия у детей. Ведь быть родителями – значит, изучать всё то, что поможет сохранять градус здоровья в семье на отметке «36,6».
Узнайте, что может вызвать недуг , как его своевременно распознать. Найдите информацию о том, каковы признаки, по которым можно определить недомогание. И какие анализы помогут выявить болезнь и поставить верный диагноз.
И какие анализы помогут выявить болезнь и поставить верный диагноз.
В статье вы прочтёте всё о методах лечения такого заболевания, как гепатоспленомегалия у детей. Уточните, какой должна быть эффективная первая помощь. Чем лечить: выбрать лекарственные препараты или народные методы?
Также вы узнаете, чем может быть опасно несвоевременное лечение недуга гепатоспленомегалия у детей, и почему так важно избежать последствий. Всё о том, как предупредить гепатоспленомегалия у детей и не допустить осложнений.
А заботливые родители найдут на страницах сервиса полную информацию о симптомах заболевания гепатоспленомегалия у детей. Чем отличаются признаки болезни у детей в 1,2 и 3 года от проявлений недуга у деток в 4, 5, 6 и 7 лет? Как лучше лечить заболевание гепатоспленомегалия у детей?
Берегите здоровье близких и будьте в тонусе!
Медицина и Здоровье » Диагностика и симптоматика » Гепатоспленомегалия при заболеваниях крови и ретикуло-гистиоцитарной системы
За исключением некоторых анемий, гепатоспленомегалия является сопутствующим симптомом в развитии лейкозов, ретикулезов и некоторых других заболеваний крови.
При острых формах лейкозного процесса гепатоспленомегалия бывает менее выраженной, чем при хронических (рис. 247). Увеличение размеров селезенки и печени происходит одновременно с развитием лейкоза и появлением других симптомов, как, например, прогрессирующая анемия, слабость, проявления геморрагии, септическая температура, генерализированная лимфадения. Нередко, однако, отдельные симптомы оказываются единственным проявлением болезни (моносимптоматические формы). На более поздних стадиях лейкоза обнаруживаются и некротические процессы, главным образом в полости рта, наблюдающиеся в большинстве случаев при панцитопении. Панцитопению легко можно исключить, если исследовать периферическую кровь и костный мозг. В большинстве случаев лейкоза обнаруживается гиперлейкоцитоз, а иногда и лейкопения, но отмечается также hiatus leucaemicus, что при панцитопении не наблюдается, а в костном мозге нормальные клетки почти исчезают и замещаются молодыми недифференцированными лейкоцитарными клетками, чаще всего в 85—90% лимфоидного типа (ALL), и реже — миело моноцитоидного типа (AML) с дольчатым ядром и базофильной протоплазмой (рис. 248).
248).
Хронические лейкозы в детском возрасте редкие, и поскольку их можно наблюдать, обычно это бывают миелозы, при которых количество лейкоцитов нарастает до 200 000—300 000 причем большую часть их составляют миелоциты, промиелоциты и молодые клетки (рис. 249). В таких случаях селезенка постепенно увеличивается, достигая при далеко зашедшем развитии заболевания огромных размеров (рис. 250). Она бывает твердой и при ощупывании болезненной вследствие частого периспленита. В меньшей мере увеличивается и печень. Анемия, геморрагические проявления и увеличение лимфатических узлов бывают менее выраженными и возникают в более поздний срок.
Рис. 247. Гепатоспленомегалия при остром лейкозе у ребенка, страдающего болезнью Down.
Рис. 248. Характерная миелограмма ребенка, больного острым лейкозом.
Рис. 249. Промиелоциты и миелоциты в периферической крови при хроническом лейкозе.
Рис. 250. Гепатоспленомегалия у ребенка 4-х лет, больного хроническим миелозом до и после лечения Myleran.
Хронический лимфаденозу детей почти не встречается.
При эритролейкемиях поражаются одновременно миело- и эритропоэз. Их клиническая картина бывает сходной с картиной при миелозе. Гепатоспленомегалия выражена хорошо. Однако в пунктате костного мозга, кроме незрелых клеток миелопоэза, обнаруживается и множество эритробластов, в отличие от чистых миелоз, при которых эритробластный ряд бывает угнетенным.
Болезнь di Gugiiemo, которая имеет сходную характеристику с выраженной гепатоспленомегалией, в детском возрасте не встречается.
При Полицитемии (болезнь Vaquez) в начальном периоде заболевания обнаруживается незначительная спленомегалия, но постепенно размеры селезенки увеличиваются. В дальнейшем увеличивается и печень. Характерным симптомом этого заболевания является особый синюшный цвет, особенно хорошо выступающий на лице и конечностях. Конъюнктивы оказываются сильно покрасневшими. Нередко отмечается и гипертензия, а в далеко зашедших случаях сердечная недостаточность. Существенным для целей диагностики является установление увеличения количества эритроцитов и гемоглобина выше нормы. В костном мозге обнаруживается гиперплазия как эритро-, так и грануло- и тромбопоэза. В детском возрасте полицитемия — редкая.
Существенным для целей диагностики является установление увеличения количества эритроцитов и гемоглобина выше нормы. В костном мозге обнаруживается гиперплазия как эритро-, так и грануло- и тромбопоэза. В детском возрасте полицитемия — редкая.
Тромбопения, тромбастения и другие тромбопатии — как эссенциальные, так и приобретенные — могут в своем течении сопровождаться умеренным увеличением селезенки и печени (см. «Геморрагический диатез»).
Гепатоспленомегалия вместе с генерализированной лимфаденией обнаруживается при гистиоцитозе X, в частности при злокачественной форме — остром ретикулезе (болезнь Letterer—Siwe). При этом заболевании отмечаются геморрагические явления на коже, прогрессирующая анемия, септическая температура, деструктивные очаги в плоских и трубчатых костях.
При диагностике заболевания имеют значение исследования костного мозга и биопсия пораженных лимфатических узлов, а также и то обстоятельство, что встречается в грудном возрасте
Острый ретикулез нужно дифференцировать от хронической формы гистиоцитоза X — болезни Hand—Schuller—Christian, при которой помимо прочих симптомов обнаруживается увеличение печени, а в некоторых случаях и селезенки. Гепатомегалия наблюдается, в особенности, когда болезнь возникает в раннем возрасте. Однако решающими для диагноза оказываются дефекты костей, выявляемые на черепе при рентгенографии, как и наличие экзофтальма и признаков несахарного диабета. При наличии множества дефектов костей череп напоминает географическую карту (рис. 251). Дефекты можно установить и в костях таза. На коже тела и на волосистой части головы появляется мелкое высыпание желто-коричневатого или красноватого цвета, покрытое струпиками. Нередко развивается и петехиальная сыпь. Диагноз ставится на основании гиперхолестеринемии и обнаружения характерных псевдоксантомных клеток пенистого типа в пунктате опухолевидных образований (рис. 252) или лимфатических узлов.
Гепатомегалия наблюдается, в особенности, когда болезнь возникает в раннем возрасте. Однако решающими для диагноза оказываются дефекты костей, выявляемые на черепе при рентгенографии, как и наличие экзофтальма и признаков несахарного диабета. При наличии множества дефектов костей череп напоминает географическую карту (рис. 251). Дефекты можно установить и в костях таза. На коже тела и на волосистой части головы появляется мелкое высыпание желто-коричневатого или красноватого цвета, покрытое струпиками. Нередко развивается и петехиальная сыпь. Диагноз ставится на основании гиперхолестеринемии и обнаружения характерных псевдоксантомных клеток пенистого типа в пунктате опухолевидных образований (рис. 252) или лимфатических узлов.
Рис. 251. Дефекты костей черепа с гранулемными участками у ребенка, страдающего болезнь Hand—Schuller—Christian.
Рис. 252. Псевдоксантомные клетки в пунктате гранулемного участка при болезни Hand—Schuller—Christian
Сюда можно отнести и болезнь Bril1—Sуmmers (см.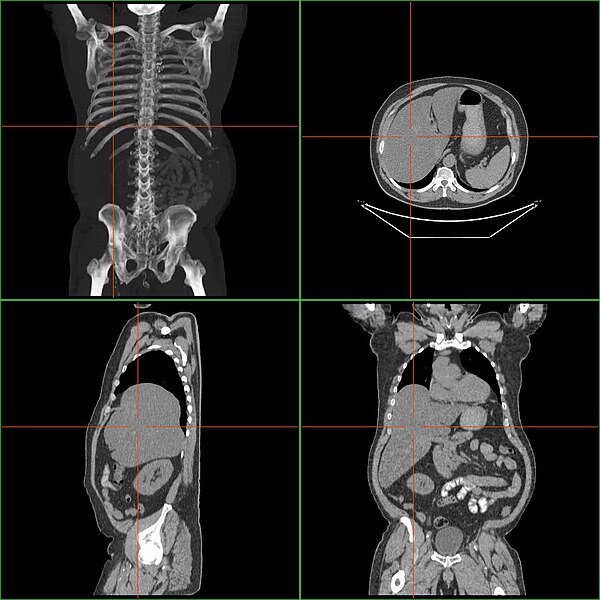 стр. 199), при которой наряду с другими симптомами, определяющими заболевание, отмечается и умеренная спленогепатомегалия. В некоторых случаях увеличенной бывает только селезенка.
стр. 199), при которой наряду с другими симптомами, определяющими заболевание, отмечается и умеренная спленогепатомегалия. В некоторых случаях увеличенной бывает только селезенка.
загрузка…
Медицина и Здоровье » Диагностика и симптоматика » Гепатоспленомегалия при опухолях
Причиной увеличения размеров печени и селезенки могут оказаться некоторые первичные опухоли, в особенности опухоли ретикулоэндотелиальной системы, лимфатических узлов и крови. Значительное число опухолей метастазирует в печень.
При лимфогранулеме селезенка всегда бывает увеличенной и весьма твердой, приобретая в некоторых случаях огромные размеры, и может быть единственным признаком заболевания (при спленомегальной форме). Обычно происходит и умеренное увеличение печени.
При лимфосаркоме селезенка не увеличивается, если не подверглась первичному поражению.
При ретотельсаркоме печень и селезенка оказываются умеренно увеличенными наряду со значительным увеличением размеров лимфатических узлов (шейных, медиастинальных, ретроперитонеальных и аксиллярных). Клиническая картина напоминает лимфосаркому, от которой отличается только тем, что в некоторых случаях рентгенологически выявляется дефект костей. Температура обычно бывает повышенной, отмечается и наличие лейкоцитоза (не больше 20000). При ретотельсаркоме костного мозга обнаруживается нарастание ретикулярного ряда, а иногда и миелоидная реакция.
Клиническая картина напоминает лимфосаркому, от которой отличается только тем, что в некоторых случаях рентгенологически выявляется дефект костей. Температура обычно бывает повышенной, отмечается и наличие лейкоцитоза (не больше 20000). При ретотельсаркоме костного мозга обнаруживается нарастание ретикулярного ряда, а иногда и миелоидная реакция.
При саркоме Ewing, хотя и редко, можно наблюдать слабую реакцию со стороны селезенки и печени. Заболевание представляет злокачественное разрастание ретикулярных клеток костного мозга, преимущественно длинных трубчатых костей. В дальнейшем поражаются плоские кости и лимфатические узлы. Для диагноза заболевания имеют значение рентгеновское изображение (разрежение структуры кости, истончение компактного вещества и наслоение костного вещества в виде листьев лука) и «исследование пунктата костного мозга, при котором открывается разрастание молодых ретикулярных клеток. Постановке диагноза, в некоторых случаях, способствует очень хорошее, но временное воздействие рентгенотерапии.
При множественной миеломе (болезнь Рустицкого—Kahler) тоже можно установить, но не обязательно, умеренную гепатоспленомегалию, при том, главным образом в далеко зашедших случаях. Миелома представляет опухолевидное разрастание плазматических ретикулярных клеток костного мозга. Поражение селезенки и печени является чаще всего результатом метастазов в них. При постановке диагноза, кроме поражений костей, в первую очередь плоских костей (резкие кругловатые просветления), обнаруживаемых рентгенологическим способом, в некоторых случаях важная роль принадлежит спонтанным переломам и некоторым лабораторным исследованиям — гиперпротеинемия за счет глобулинов (преимущественно фракции а, Р, у), выделение блока Вепсе—Jones с мочой, гиперкальциемия и гиперфосфатемия и т. д. Диагноз ставится на основании исследования костного мозга, в котором выявляется множество клеток плазматического типа — большие, с темно-синей вакуолизированной протоплазмой и просветлением около эксцентрически расположенного ядра. Оно бывает больших размеров и в некоторых случаях содержит несколько нуклеол. Встречаются и клетки с несколькими ядрами.
Оно бывает больших размеров и в некоторых случаях содержит несколько нуклеол. Встречаются и клетки с несколькими ядрами.
При сходной клинической картине, но бурно, главным образом у грудных детей, развивается х л о р о м а. Реакция со стороны селезенки и печени бывает слабой. Для диагноза имеют значение поражения плоских костей (черепа, в частности-глазниц) опухолями, в результате чего возникает экзофтальм с гематомой вокруг глаз в виде оправы для очков, находка костного мозга, нередко с характером острого лейкоза, и выведение при пункции опухолевой ткани, окрашенной в зеленый цвет находящимся в ней зеленым красящим веществом — протопорфирином.
Метастазирование опухолей в селезенку бывает исключительно редким и сравнительно частым в печень. Такую опухоль представляет меланосаркома, чаще всего при дегенерации nevus pigmentosus или при первичной опухоли сосудистой оболочки глаза. Диагностическое значение имеет выведение меланина с мочой. Частые и ранние метастазы в печень обнаруживаются при симпатогониоме; исходящей в большинстве случаев из надпочечника или из симпатической ткани средостения. Селезенка тоже может увеличиться (рис. 257). Как при хлороме, так и при симпатогониоме наблюдается метастазирование в плоские кости, в частности, в глазницы с ргоtrusio bulbi (рис. 258) и гематомами в виде оправы для очков. По другим симптомам симпатогониома напоминает лейкемии, с которыми ее нередко смешивают. Для диагноза важное значение имеет выявление абдоминальной опухоли или смещения почки, обнаруженного посредством пиелографии или пневморенографии. В костномозговом веществе обнаруживаются группы опухолевых клеток.
Селезенка тоже может увеличиться (рис. 257). Как при хлороме, так и при симпатогониоме наблюдается метастазирование в плоские кости, в частности, в глазницы с ргоtrusio bulbi (рис. 258) и гематомами в виде оправы для очков. По другим симптомам симпатогониома напоминает лейкемии, с которыми ее нередко смешивают. Для диагноза важное значение имеет выявление абдоминальной опухоли или смещения почки, обнаруженного посредством пиелографии или пневморенографии. В костномозговом веществе обнаруживаются группы опухолевых клеток.
Рис. 257. Гепатоспленомегалия, экзофтальм и подкожные узловидные метастазы при симпатогониоме
Рис. 258. Левосторонний экзофтальм после метастаза в глазницу при симпатобластоме — в начале и после обратного развития болезни.
загрузка…
PPT — Подход к ребенку с гепатоспленомегалией Презентация PowerPoint
Подход к ребенку с гепатоспленомегалией Доктор Пушпа Радж Шарма Профессор медицинского института здоровья детей
История болезни • Восемь месяцев, мужчина, из Рупандехи . • Лихорадка с кашлем и затрудненным дыханием в течение одной недели, более сильная в течение одного дня. • Прогрессирующее вздутие живота в течение 4 месяцев. • Повторная пневмония с 3 месяцев жизни
• Лихорадка с кашлем и затрудненным дыханием в течение одной недели, более сильная в течение одного дня. • Прогрессирующее вздутие живота в течение 4 месяцев. • Повторная пневмония с 3 месяцев жизни
Продолжение анамнеза. • Перинатальный период без осложнений. • Исключительно грудное вскармливание в течение 3 месяцев. • Повторное лечение антибиотиками с четырехмесячного возраста от кашля и лихорадки. • Набирает вес. • Единственный ребенок родителя. • Другие анамнезы, включая развитие, нормальны.
Осмотр • Вес: 5 кг; Длина: 64 см; OFC: 39,5 см • Апирексиальный; R / R: 66 / мин; P / R: 150 / мин. • Отсутствие бледности; нет лимфаденопатии; нет сыпи; нет катаракты; нет специфического запаха тела. • Наличие втягивания грудной клетки; двусторонние крепы.• Нормальные сердечные тоны. • Печень и селезенка на 5 и 8 см ниже реберного края соответственно; не тендер; гладкий; плавный; фирма. нет асцита; • Другая система нормальная
Исследования • Hb: 12,2 г / дл; TLC / DLC: нормальный; СОЭ: 20 мм / час. периферическая пленка / тромбоциты: в норме. • Уровень сахара в крови: 79 мг / дл, холестерин в сыворотке: 90 мг / дл; Функция печени: нормальная • Альдегидная проба: отрицательная. • Стул / моча: нормальные • ВИЧ: -веще; ФАКЕЛ: -ve; • УЗИ брюшной полости: нет асцита, гепатоспленомегалии, структурных аномалий
периферическая пленка / тромбоциты: в норме. • Уровень сахара в крови: 79 мг / дл, холестерин в сыворотке: 90 мг / дл; Функция печени: нормальная • Альдегидная проба: отрицательная. • Стул / моча: нормальные • ВИЧ: -веще; ФАКЕЛ: -ve; • УЗИ брюшной полости: нет асцита, гепатоспленомегалии, структурных аномалий
Гепатоспленомегалия: причины • Инфекционный: • Вирусный: гепатотрофные (A, B, C, D, E) и другие вирусы (герпес, цитомегал-Барстейн, Эбштейн. , ветряная оспа, ВИЧ, краснуха, адено, энтеро, арбо.) • Протозойные: малярия, калазар, амеба, токсоплазма • Бактериальные: сепсис; туберкулез, бруцеллез, сифилис, • Гельминты: эхинококкоз, мигрирующая висцеральная личинка • Грибок: гистоплазмоз
Гепатоспленомегалия: причины • Гемопоэтические: • Гемолитические: гемолитическая болезнь новорожденных; • Анемия • Метаболические: • Неймана-Пика, ганглиозидоз, Гоше, фукозидоз, Вольмана, накопление гликогена, сиалиодоз, галактосиалиодоз, α-маннозидоз.
Гепатоспленомегалия: причины • Злокачественные новообразования: • Лейкемия, гистиоцитарные синдромы, миелопролиферативные синдромы, лимфомы, • Иммунологические: • Хроническая гранулематозная, наследственная нейтрофилия, синдром Оммена.• Врожденный: • Врожденный фиброз печени • Застойный: • Обструкция печеночной вены, констриктивный перикардит
Этот пациент • Инфекционная причина, которая может иметь поражение легких, печени и селезенки: • Сепсис / другая бактериальная инфекция маловероятна: нормальный анализ крови, нормальные иммунологические отчеты на ВИЧ, TORCH, сифилис. • Вирусные инфекции маловероятны: тест функции печени нормальный, клинических признаков врожденных инфекций, таких как: • Неонатальная желтуха, ретинит, микроцефалия, гидроцефалия, внутричерепные инфекции, остеохондрит, сыпь, нормальный вес и рост для возраста, отсутствуют.
Этот пациент • Протозойно маловероятно: • Отрицательный отчет крови (анемия, желтуха, панцитопения), большая гепатоспленомегалия. • Гематологически маловероятно: • Отсутствие анемии, желтухи и наличие сильной спленомегалии. • Маловероятные злокачественные новообразования: • Нормальный отчет крови, отсутствие лимфаденопатии
• Гематологически маловероятно: • Отсутствие анемии, желтухи и наличие сильной спленомегалии. • Маловероятные злокачественные новообразования: • Нормальный отчет крови, отсутствие лимфаденопатии
Этот пациент • Иммунологически маловероятно: • Нормальная функция печени, отсутствие гиперэозинофилии и диареи • Маловероятно с точки зрения развития: • Отсутствие признаков портальной гипертензии • Застойная болезнь маловероятна: • Отсутствие признаков сердечной недостаточности, отсутствие асцита.
Этот пациент: метаболические заболевания, вызывающие гепатоспленомегалию • Инфантильный ганглиодоз GM1 (тип 1) • Гепатоспленомегалия при рождении, отек, кожные высыпания, задержка развития, судороги • Гоше: • Особенности поражения костного мозга, скелетных осложнений • Макроглоссия, нейродегенеративные особенности • Болезнь Вольмана: • Отсутствие нормального развития, стеаторея, непрекращающаяся рвота
Метаболические заболевания, вызывающие гепатоспленомегалию • Накопление гликогена Тип IV: • Нарушение развития, кардиомиопатия, миопатия: миопатия, миопатия волосы, низкий рост, скованность в суставах. • Сиалидоз и галактодиалидоз: • Неонатальный сепсис, множественный дизостоз, судороги, вишнево-красные пятна, умственная отсталость. • а-маннодидоз: • задержка психомоторного развития, множественный дистоз,
• Сиалидоз и галактодиалидоз: • Неонатальный сепсис, множественный дизостоз, судороги, вишнево-красные пятна, умственная отсталость. • а-маннодидоз: • задержка психомоторного развития, множественный дистоз,
гепатоспленомегалия недир? не демектир? hakkında bilgi, hepatosplenomegaly terim, kelime anlamı
гепатоспленомегалия: n. Hem karaciğer hem dalağın büyük oluşu.
холерофобия: n. Марази колера коркусу.
кольпорфофия: n. 1.Vagina’daki yırtık kenarlarının karşılıklı birleştirilerek dikilmesi; 2.Вагина ön veya arka duvarından üçgen şeklinde parça çıkarılarak kesik kenarların tekrar dikilmesi.
эндокраниум: n. 1. Кафатасинин ич юзейи; 2. Dura mater.
безволокнистый: n. Лисиз.
фолиевая кислота: н. Витамин B комплексин дахил олан бир мадде.
гемапофиз: n. kaburga kıkırdağı, hemapofiz.
гематопексин: n. Kanın pıhtılamasına sebep olan herhangi bir madde.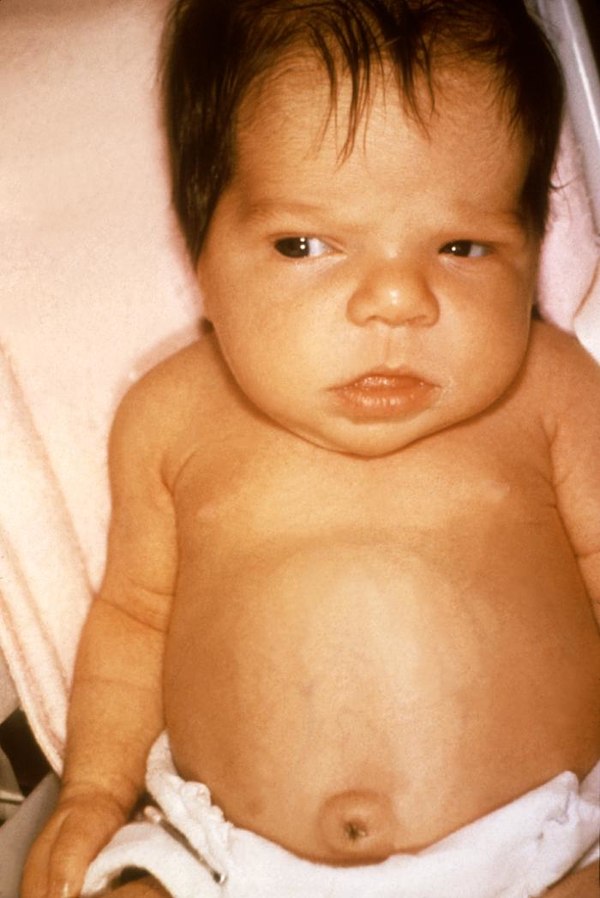
кариостаз: n. Hücre çekirdeinin istirahat hali, hücre çekirdeğinin karyokinetik bölünmeler arasındaki istirahat devresi.
лептоменинкс: n. (мн. лептоменинги). Лептоменинкс, beyin zarları (Piamater ve araknoid).
затылочно-таламический: a. Artkafa lobu ve talamusa ait.
овуляция: n. 1. Олгун кадынларда ее ай Грааф фоликюлунден юмуртанин атылмаси, овюласион; 2. Yumurtalıkta yumurtacıkların oluşumu.
параксиальный: a. Vücut eksenine yakın olan.
патокринные: a. İç salgı bezine ait bozuklukla ilgili, endokrin bozukluğa ait.
патофобия: n.Marazi hastalık korkusu, patofobi.
proteo: прив. Protein anlamına önek.
резорцин: н. биохим. Reçineden alınıp boya veya ilaç imalinde kullanılan billuri bir madde (C6H0O2).
сетка: n. (табл. Ретикула). 1. Ağcık, ağ, retikül; 2. Geviş getiren hayvanların ikinci mide bölümü.
ринополип: n. Бурун полипи.
сциллипикрин: n. биохим. Adasoanından elde edilen bir müdrir.
биохим. Adasoanından elde edilen bir müdrir.
сенсибилизация: n.1. Vücutta antijen niteliğindeki madde (bakteri, ilaç, yabancı protein, çiçek tozu v.s ‘) ye karşı, ikinci defa girişinde şiddetli reaksiyona sebep olacak şekilde duyarlımessya, vekilde duyarlımessya; 2. Uyarıya karşı hassas hale gelme ve getirilme, canlının veya canlı dokunun belli bir uyarıya karşı, eskisine oranla daha duyarlı hale gelişi, uyarıya tepkinin daha kuvvetli oluşu.
Границы | Подход к оценке стойкой гиперэозинофилии у педиатрических пациентов
Введение
Эозинофилы — это окончательно дифференцированные гранулоциты, играющие важную роль в врожденной иммунной функции, ремоделировании и восстановлении тканей, а также в патогенезе заболеваний (1).Уровень эозинофилов в периферическом кровообращении строго регулируется, при этом эозинофилы составляют лишь небольшую часть (обычно <5–6%) популяции циркулирующих лейкоцитов. Хотя обычно эозинофилы оцениваются в периферической крови, это в первую очередь клетки, обитающие в тканях (2).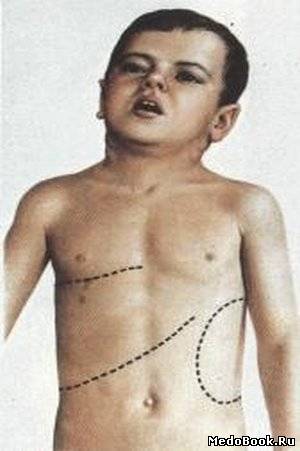 В нормальных гомеостатических условиях подавляющее большинство эозинофилов покидают кровообращение и мигрируют в определенные ткани, где они могут находиться в течение нескольких недель. Желудочно-кишечный тракт служит крупнейшим тканевым резервуаром для эозинофилов, где эти клетки обычно присутствуют в ткани слизистой оболочки от желудка до толстой кишки (3, 4).Эозинофилия, обозначаемая повышенным абсолютным количеством эозинофилов (AEC) в крови, может быть вызвана рядом важных болезненных состояний у детей и отражает баланс между производством эозинофилов в костном мозге, перемещением из костного мозга в ткани и эозинофилом. апоптоз. Преходящая эозинофилия относительно часто наблюдается в педиатрической популяции и, как правило, клинически незначима. Однако пациенты с хронической (стойкой) эозинофилией могут иметь широкий спектр клинических последствий, начиная от относительно доброкачественных заболеваний и заканчивая болезненными состояниями, связанными со значительной дисфункцией органов-мишеней и потенциально опасными для жизни последствиями.
В нормальных гомеостатических условиях подавляющее большинство эозинофилов покидают кровообращение и мигрируют в определенные ткани, где они могут находиться в течение нескольких недель. Желудочно-кишечный тракт служит крупнейшим тканевым резервуаром для эозинофилов, где эти клетки обычно присутствуют в ткани слизистой оболочки от желудка до толстой кишки (3, 4).Эозинофилия, обозначаемая повышенным абсолютным количеством эозинофилов (AEC) в крови, может быть вызвана рядом важных болезненных состояний у детей и отражает баланс между производством эозинофилов в костном мозге, перемещением из костного мозга в ткани и эозинофилом. апоптоз. Преходящая эозинофилия относительно часто наблюдается в педиатрической популяции и, как правило, клинически незначима. Однако пациенты с хронической (стойкой) эозинофилией могут иметь широкий спектр клинических последствий, начиная от относительно доброкачественных заболеваний и заканчивая болезненными состояниями, связанными со значительной дисфункцией органов-мишеней и потенциально опасными для жизни последствиями. Определение основной патологии, способствующей распространению эозинофилии, является важным первым шагом в ведении педиатрической гиперэозинофилии (ПЭ) для разработки соответствующей стратегии лечения. В этом обзоре мы обсудим дифференциальный диагноз HE у детей, сосредоточив внимание на этиологии, которая более распространена в педиатрической популяции, и на эпидемиологических различиях между детьми и взрослыми. Кроме того, мы представим направленный подход к диагностической оценке педиатрической HE, выделив некоторые важные красные флажки, которые должны побудить медицинских работников проводить более интенсивную оценку.
Определение основной патологии, способствующей распространению эозинофилии, является важным первым шагом в ведении педиатрической гиперэозинофилии (ПЭ) для разработки соответствующей стратегии лечения. В этом обзоре мы обсудим дифференциальный диагноз HE у детей, сосредоточив внимание на этиологии, которая более распространена в педиатрической популяции, и на эпидемиологических различиях между детьми и взрослыми. Кроме того, мы представим направленный подход к диагностической оценке педиатрической HE, выделив некоторые важные красные флажки, которые должны побудить медицинских работников проводить более интенсивную оценку.
Терминология
AEC представляет частоту циркулирующих эозинофилов в периферической крови (в клетках на микролитр [клеток / мкл]). Уровни эозинофилов в периферической крови варьируются в зависимости от возраста, при этом верхние пороговые значения выше у младенцев и детей ясельного возраста по сравнению с подростками и взрослыми (5–7). Однако для большинства детей старше 2 лет значение AEC> 700 клеток / мкл считается ненормально повышенным. По степени тяжести эозинофилия условно классифицируется на легкую (AEC от верхнего предела нормы до 1500 клеток / мкл), среднюю (AEC 1500–5000 клеток / мкл) и тяжелую (AEC> 5000 клеток / мкл) (4, 8) .Эозинофилия может быть преходящей, эпизодической или стойкой (хронической). Термин HE был зарезервирован для пациентов с устойчивой эозинофилией крови от умеренной до тяжелой, определяемой как AEC крови ≥1 500 клеток / мкл, полученная как минимум в 2 отдельных случаях (интервал ≥1 месяц), или выраженная эозинофилия ткани (4). Тканевый HE можно определить как процент эозинофилов, который превышает 20% от всех ядерных клеток в костном мозге или инфильтрацию ткани, которая считается обширной патологом (4). В ситуациях, когда эозинофилы непосредственно не наблюдаются в ткани, гистологические доказательства внеклеточного отложения белков гранул, происходящих из эозинофилов (например,основной основной белок, пероксидаза эозинофилов или нейротоксин, происходящий от эозинофилов) в ткани также можно использовать в качестве суррогатных маркеров тканевой эозинофилии (9).
По степени тяжести эозинофилия условно классифицируется на легкую (AEC от верхнего предела нормы до 1500 клеток / мкл), среднюю (AEC 1500–5000 клеток / мкл) и тяжелую (AEC> 5000 клеток / мкл) (4, 8) .Эозинофилия может быть преходящей, эпизодической или стойкой (хронической). Термин HE был зарезервирован для пациентов с устойчивой эозинофилией крови от умеренной до тяжелой, определяемой как AEC крови ≥1 500 клеток / мкл, полученная как минимум в 2 отдельных случаях (интервал ≥1 месяц), или выраженная эозинофилия ткани (4). Тканевый HE можно определить как процент эозинофилов, который превышает 20% от всех ядерных клеток в костном мозге или инфильтрацию ткани, которая считается обширной патологом (4). В ситуациях, когда эозинофилы непосредственно не наблюдаются в ткани, гистологические доказательства внеклеточного отложения белков гранул, происходящих из эозинофилов (например,основной основной белок, пероксидаза эозинофилов или нейротоксин, происходящий от эозинофилов) в ткани также можно использовать в качестве суррогатных маркеров тканевой эозинофилии (9). Наконец, термин гиперэозинофильный синдром (ГЭК) является обобщающим термином, описывающим гетерогенную группу расстройств, которые характеризуются HE и свидетельствуют о повреждении или дисфункции органов-мишеней, непосредственно связанных с эозинофилией тканей (10). С практической точки зрения по-прежнему важно признать клинически, что проявления эозинофилии со стороны органов-мишеней могут не проявляться при первом обнаружении HE, а у некоторых людей признаки органной дисфункции появляются спустя годы после первоначального проявления HE (11).
Наконец, термин гиперэозинофильный синдром (ГЭК) является обобщающим термином, описывающим гетерогенную группу расстройств, которые характеризуются HE и свидетельствуют о повреждении или дисфункции органов-мишеней, непосредственно связанных с эозинофилией тканей (10). С практической точки зрения по-прежнему важно признать клинически, что проявления эозинофилии со стороны органов-мишеней могут не проявляться при первом обнаружении HE, а у некоторых людей признаки органной дисфункции появляются спустя годы после первоначального проявления HE (11).
Причины гиперэозинофилии у детей
Основной дифференциальный диагноз ПЭ у детей аналогичен таковому у взрослых, за некоторыми заметными исключениями. Педиатрическая ПЭ может быть связана с множеством основных этиологий, которые можно прагматично разделить на две основные категории (первичная и вторичная ПЭ) на основе лежащих в основе механизмов, управляющих экспансией эозинофилов (рис. 1.)
Рисунок 1 . Дифференциальный диагноз гиперэозинофилии (ГЭ) у детей.Педиатрическая ПЭ может быть разделена на две основные категории (первичная и вторичная) на основе механизмов, лежащих в основе экспансии эозинофилов. Первичная HE возникает в результате аномалий миелоидных и стволовых клеток, которые способствуют размножению клона эозинофилов. Вторичный HE возникает в результате разнообразной группы болезненных состояний, которые стимулируют рост популяции эозинофилов за счет увеличения выработки эозинофилопоэтических цитокинов (IL-3, IL-5 и GM-CSF). АБЛА, аллергический бронхолегочный аспергиллез; ВИЧ, вирус иммунодефицита человека; НПВП, нестероидные противовоспалительные препараты; ПЛАТЬЕ, лекарственная реакция с эозинофилией и системными симптомами; EoE, эозинофильный эзофагит; ЭГИД, эозинофильное заболевание желудочно-кишечного тракта; ВЗК, воспалительное заболевание кишечника; STAT3, преобразователь сигнала и активатор транскрипции 3, DOCK8, выделитель цитокинеза 8; LRBA, липополисахарид-чувствительный-бежевый-подобный якорь; WAS — синдром Вискотта-Олдрича; IPEX, иммунная дисрегуляция, полиэндокринопатия, энтеропатия, Х-сцепленный синдром; АЛПС, аутоиммунный лимфопролиферативный синдром; ЭГПА, эозинофильный гранулематоз с полиангиитом; СКВ, системная красная волчанка, РТПХ, трансплантат против.болезнь хозяина.
Дифференциальный диагноз гиперэозинофилии (ГЭ) у детей.Педиатрическая ПЭ может быть разделена на две основные категории (первичная и вторичная) на основе механизмов, лежащих в основе экспансии эозинофилов. Первичная HE возникает в результате аномалий миелоидных и стволовых клеток, которые способствуют размножению клона эозинофилов. Вторичный HE возникает в результате разнообразной группы болезненных состояний, которые стимулируют рост популяции эозинофилов за счет увеличения выработки эозинофилопоэтических цитокинов (IL-3, IL-5 и GM-CSF). АБЛА, аллергический бронхолегочный аспергиллез; ВИЧ, вирус иммунодефицита человека; НПВП, нестероидные противовоспалительные препараты; ПЛАТЬЕ, лекарственная реакция с эозинофилией и системными симптомами; EoE, эозинофильный эзофагит; ЭГИД, эозинофильное заболевание желудочно-кишечного тракта; ВЗК, воспалительное заболевание кишечника; STAT3, преобразователь сигнала и активатор транскрипции 3, DOCK8, выделитель цитокинеза 8; LRBA, липополисахарид-чувствительный-бежевый-подобный якорь; WAS — синдром Вискотта-Олдрича; IPEX, иммунная дисрегуляция, полиэндокринопатия, энтеропатия, Х-сцепленный синдром; АЛПС, аутоиммунный лимфопролиферативный синдром; ЭГПА, эозинофильный гранулематоз с полиангиитом; СКВ, системная красная волчанка, РТПХ, трансплантат против.болезнь хозяина.
Первичный (клональный) HE
Первичная HE возникает в результате аномалий в компартменте костного мозга, которые способствуют распространению клона эозинофилов. В этих расстройствах эозинофилы представляют собой преобладающий тип клеток или одну из нескольких линий пролиферирующих клеток. Основные причины HE включают миелоидные новообразования и новообразования стволовых клеток, которые вместе сгруппированы в категорию миелопролиферативных HE / HES (M-HE или M-HES) (10). Эта группа расстройств включает как окончательные, так и предполагаемые эозинофильные миелопролиферативные новообразования, включая гематопоэтические новообразования с эозинофилией, возникающие в результате слияния генов или мутаций, приводящих к конститутивной активации онкогенных рецепторов тирозинкиназ, таких как PDGFRA, PDGFRB, лейстукеемия, лейстукемия, лейкоземия FGFR1. клеточный лейкоз, миелодиспластические синдромы и системный мастоцитоз.Первичные причины ПЭ составляют меньшинство случаев ПЭ у детей (12, 13).
Вторичный (реактивный) HE
Вторичный (или реактивный) HE возникает в результате болезненных состояний, которые стимулируют поликлональную экспансию эозинофилов, обычно за счет увеличения продукции цитокинов, таких как IL-3, IL-5 и GM-CSF, которые способствуют увеличению продукции и выживаемости эозинофилов (14) . Большинство случаев педиатрической ПЭ имеют вторичную этиологию.
Инфекция
Нормальные иммунологические реакции на определенные инфекционные патогены остаются одной из наиболее частых причин вторичной ПЭ у детей во всем мире.В частности, инвазивные гельминтозные инфекции (стронгилоидоз, шистосомоз, анкилостомоз, филяриоз, аскаридоз, токсокароз и трихинеллез) могут вызывать выраженную эозинофилию на ранних этапах инфицирования, когда личинки мигрируют через ткани (15). Некоторые паразиты являются эндемичными во всем мире, и их следует учитывать у всех детей с эозинофилией, независимо от их путешествий или истории контакта. Например, Strongyloides stercoralis эндемичен в районах с жарким влажным климатом (включая юго-восток США) и может напрямую проникать через кожу при контакте с почвой или водой, загрязненной фекалиями человека (15).У этого паразита может быть долгий латентный период в годы между первоначальным воздействием и развитием симптомов, поэтому инфекцию можно легко пропустить, если врач не будет регулярно проверять эту инфекцию (16). Toxocara canis и cati (этиологические причины висцеральной мигрирующей личинки) также являются эндемичными во всем мире и могут попадать в организм с почвой или продуктами питания, загрязненными фекалиями собак или кошек (15). Токсокароз непропорционально поражает педиатрическое население, особенно детей раннего возраста из-за их антисанитарных привычек при приеме пищи (15, 17, 18).Этого паразита следует учитывать у любого маленького ребенка с HE, особенно если у ребенка в анамнезе pica, поскольку эти дети подвергаются повышенному риску проглатывания зараженной почвы (17, 18). Негельминтные инфекции также могут вызывать ПЭ у детей. Заражение чесоточным клещом следует рассматривать у детей с сопутствующей кожной зудящей сыпью (19). Грибковая этиология, включая аллергический бронхолегочный аспергиллез (АБЛА), который может наблюдаться у детей с хроническими заболеваниями легких (астма, муковисцидоз), и диссеминированные инфекции кокцидиоидомикоза и гистоплазмоза, могут вызывать ПЭ (20–23).Наконец, ВИЧ — редкая причина HE в педиатрической популяции, и его следует учитывать у пациентов с необъяснимой HE и факторами риска (24–26). Примечательно, что протозойные паразиты, которые часто поражают педиатрическую популяцию ( Giardia, Cryptosporidium, Entamoeba ), как правило, не продуцируют периферическую HE (3, 15).
Иммунные заболевания
Атопическая болезнь (экзема, аллергический ринит, астма) является частой причиной эозинофилии от легкой до умеренной в педиатрической популяции, и меньшинство этих пациентов может соответствовать критериям HE.Однако наличие тяжелой стойкой эозинофилии (т.е. эозинофилов> 5000 / мкл) маловероятно вторично по отношению к атопии и требует дополнительной оценки по поводу другой этиологии. Важно отметить, что несколько синдромов иммунодефицита (дефицит преобразователя сигнала и активатора транскрипции 3 [STAT3], дефицит выделителя цитокинеза 8 [DOCK8], дефицит липополисахарид-зависимого бежевого якоря [LRBA], синдром Вискотта-Олдрича [WAS] и нарушение иммунной регуляции, полиэндокринопатия, энтеропатия, Х-сцепленный [IPEX] синдром) в детстве с атопией, повышенным уровнем IgE и эозинофилией периферической крови (27).Следовательно, у любого педиатрического пациента с HE и атопией должен быть получен тщательный инфекционный анамнез (с акцентом на частоту и этиологию инфекций). Другие иммунодефициты, которые могут проявляться при HE в педиатрической популяции, включают аутоиммунный лимфопролиферативный синдром (ALPS) и синдром Оменна, связанный с тяжелым комбинированным иммунодефицитом (27).
Гиперчувствительность к лекарствам
Реакции гиперчувствительности к лекарствам также являются частой причиной ПЭ у детей. Антибиотики (особенно пенициллины, цефалоспорины и ванкомицин), НПВП и противоэпилептические препараты обычно считаются причинами эозинофилии, но почти любое лекарство, отпускаемое по рецепту или без рецепта, лечебное средство на травах или пищевая добавка может быть триггером (16, 28, 29).Временная взаимосвязь между началом приема препарата и развитием эозинофилии помогает идентифицировать лекарственную реакцию, хотя латентный период между воздействием препарата и эозинофилией может варьироваться от дней до месяцев. Примечательно, что лекарственная реакция с эозинофилией и системными симптомами (DRESS) является потенциально опасной для жизни реакцией системной гиперчувствительности, связанной с периферической ПЭ, которая обычно проявляется после латентного периода в 2-8 недель между воздействием препарата и клиническими проявлениями (лихорадка, недомогание, лимфаденопатия, повышенные ферменты печени и болезненная кожная сыпь, которая может прогрессировать до эксфолиативного дерматита) (30).
Заболевания желудочно-кишечного тракта
Эозинофильный эзофагит (EoE) также является частой причиной HE в детской возрастной группе. Этот диагноз часто можно упустить, если не собрать соответствующий анамнез. Первичные симптомы EoE меняются с возрастом: у более молодых пациентов возникают трудности с кормлением, частая рвота, отказ от пищи / избирательное питание и нарушение нормального развития (31). По мере того, как эти дети становятся старше, жалобы на боли в животе и дисфагию усиливаются, и у подростков могут развиваться пищевые пробки.Другие первичные желудочно-кишечные эозинофильные расстройства (эозинофильные желудочно-кишечные заболевания) также могут вызывать HE у детей, хотя эти расстройства встречаются реже, чем EoE. Кроме того, воспалительное заболевание кишечника может быть связано с периферической эозинофилией.
Новообразования
Лимфоцитарный вариант HE / HES (L-HE или L-HES) — это категория заболеваний, характеризующихся наличием клональной или аберрантной популяции лимфоцитов, продуцирующих цитокины, которые способствуют выработке эозинофилов и их выживанию (10).В эту категорию входят лимфоидные новообразования, некоторые из которых чаще встречаются у детей (например, пре-В-клеточный острый лимфобластный лейкоз [ОЛЛ]). ОЛЛ может проявляться ПЭ у детей, в некоторых случаях за несколько месяцев до выявления основного злокачественного новообразования (32, 33). В этих ситуациях эозинофилы не являются частью неопластического клона и представляют собой вторичный ответ на злокачественное новообразование.
Аутоиммунные заболевания
Менее распространенная этиология вторичной ПЭ у детей включает ревматологические заболевания.Примечательно, что эозинофильный гранулематоз с полиангиитом (EGPA, ранее называвшийся синдромом Чурга-Стросса) представляет собой потенциально опасный для жизни васкулит, редко встречающийся в педиатрической популяции, и обычно ассоциируется с умеренной или тяжелой эозинофилией периферической крови, аллергическим ринитом и астмой. Наиболее часто поражаются легкие и кожа, хотя это заболевание может поражать практически любую систему органов, включая сердечно-сосудистую, желудочно-кишечную, почечную и центральную нервную систему (34).Другие аутоиммунные заболевания, связанные с HE у детей, включают системную красную волчанку, дерматомиозит и воспалительный артрит.
Другое
Надпочечниковая недостаточность связана с эозинофилией, возможно, из-за потери эндогенных глюкокортикоидов. Другие вторичные причины HE, которые следует учитывать в определенных клинических ситуациях, включают болезнь «трансплантат против хозяина» после трансплантации гемопоэтических стволовых клеток, отторжение трансплантата твердых органов и серповидно-клеточную анемию.
Эпидемиология
Общая распространенность HE в педиатрической популяции остается неизвестной, поскольку популяционных исследований не проводилось. Несколько ретроспективных когортных исследований были сосредоточены на характеристике HE среди взрослого населения (12, 35). Однако в педиатрической литературе мало данных по этому вопросу, которые в основном состоят из сообщений об отдельных случаях и небольшого числа серий случаев (36–38). Следовательно, существует очень мало данных о клинической картине, лежащей в основе этиологии и прогнозах HE в педиатрической популяции, а также о том, как она может отличаться от взрослой популяции.Недавно Willams et al . опубликовали самый крупный ретроспективный когортный анализ, в котором сравнивали детей и взрослых с ПЭ. В исследовании участвовал 291 пациент (37 детей, 254 взрослых), которые обратились в Национальные институты здравоохранения для оценки необъяснимой HE в период с 1994 по 2012 годы (12). Наиболее частым диагнозом в обеих когортах пациентов был идиопатический ГЭК (46% детей и 47% взрослых). Вторичная причина HE была выявлена только у 14% детей по сравнению с 10% взрослых, причем наиболее распространенной этиологией в обеих популяциях была гельминтная инфекция.Примечательно, что все гельминтозы в педиатрической когорте были видов Toxocara по сравнению с отсутствием во взрослой когорте, что свидетельствует о том, что повышенное подозрение на инфекцию Toxocara у детей с HE оправдано. Первичный иммунодефицит чаще отмечался в педиатрических когортах по сравнению с взрослыми, хотя количество случаев все еще было ограниченным (2/37 случаев в педиатрической когорте против 1/254 случаев в когорте взрослых). У пациентов, которые соответствовали критериям ГЭК, заметные различия в исходных характеристиках в педиатрической популяции включали преобладание мужчин, более высокие медианные пиковые уровни AEC и более высокие медианные уровни витамина B12 в сыворотке.Нарушения перестройки клональных Т-клеточных рецепторов были чрезмерно представлены среди взрослого населения. Клинические проявления были относительно схожими между двумя когортами, за исключением повышенного поражения желудочно-кишечного тракта у детей и учащенного поражения легких у взрослых. Хотя средний пик AEC был почти вдвое выше в педиатрической когорте, смертность была низкой и аналогичной таковой во взрослой когорте. Учитывая, что это исследование было составлено из одноцентрового специализированного специализированного центра (NIH), в исследуемой популяции, вероятно, будет существовать систематическая ошибка направления, что, таким образом, может не полностью отражать истинную эпидемиологию педиатрической HE в общей популяции.Сяохун и др. . завершили ретроспективный анализ этиологии HE у 88 детей, госпитализированных в Детскую больницу Медицинской школы Университета Чжэцзян в Китае в период с 2009 по 2015 гг. (13). Наиболее частая выявленная этиология была инфекционной (наиболее часто встречались паразитарные инфекции), за ней следовали аллергия и EGID. Иммунодефицит, гематологические новообразования и EGPA также были отмечены в исследуемой группе. Ограниченное количество опубликованных данных об эпидемиологии и прогнозе ПЭ у детей не позволяет сделать окончательные выводы; следовательно, остается очевидная необходимость завершения дополнительных исследований в этой области.
Клиническая оценка
Определение основного механизма распространения эозинофилии у ребенка — важный первый шаг в лечении педиатрической ПЭ, поскольку эффективная терапия зависит от знания того, нацелено ли нацеливание на сами эозинофилы или на вторичное состояние, которое стимулирует выработку эозинофилов. Учитывая широкую дифференциацию для педиатрической ПЭ, необходим систематический диагностический подход.
В целом степень эозинофилии редко бывает полезной для выявления основной причины эозинофилии, за исключением крайних значений спектра AEC (например,стойкая легкая эозинофилия [500–1 500 Eos / мкл] более вероятна при атопическом заболевании; тяжелая эозинофилия [≥100 000 Eos / мкл] с большей вероятностью вызвана миелоидным новообразованием) (16, 39). Хотя большое внимание уделяется классификации пациентов на основе уровней AEC в крови, дисфункция органа в конечном итоге вызвана инфильтрацией активированных эозинофилов в ткань, что не всегда отражается сопутствующим увеличением AEC (16, 21). Напротив, у пациентов с заметно повышенным уровнем эозинофилов периферической крови клинические симптомы могут быть незначительными или отсутствовать (40).Следовательно, наиболее важным шагом в первоначальной оценке ребенка с ПЭ является оценка наличия и степени симптомов заболевания, включая признаки поражения тканей / органов. Срочность оценки зависит от остроты симптомов заболевания, типа пораженной ткани / органа и степени дисфункции органа.
История
Все дети с HE должны пройти тщательный анамнез для устранения симптомов, указывающих на возможное поражение органов, предшествующий медицинский анамнез, воздействия (диета, путешествия, лекарства) и предшествующий подсчет эозинофилов.Симптомы, которые могут указывать на поражение конкретной системы органов, включают лихорадку, потерю веса, усталость, кожную сыпь, заложенность носа, свистящее дыхание, кашель, одышку, боль в груди, дисфагию, рвоту, потерю аппетита, боль в животе, диарею и артралгии / миалгии. Анамнез болезни, такой как рецидивирующие инфекции, атопия, воспалительное заболевание кишечника, предшествующее злокачественное новообразование или нарушение нормального развития, также может быть важным при рассмотрении дифференциального диагноза. Диетический анамнез должен включать риск употребления сырого или недоваренного мяса, особенно мяса дичи, которое может увеличить риск трихинеллеза.Проглатывание фруктов, овощей или почвы (например, ребенка с pica), возможно, загрязненной фекалиями собак или кошек, может быть фактором риска развития токсокароза. Путешествие в эндемичные по паразитам районы также может указывать на риск другой паразитарной этиологии. Однако, как отмечалось выше, отсутствие поездок или специфические факторы риска не обязательно устраняют паразитарную инфекцию, поскольку некоторые гельминты являются эндемичными во всем мире и могут иметь длительные латентные периоды (например, Strongyloides ). Воздействие лекарств также важно оценивать, особенно у тех детей, которые регулярно принимают лекарства и, следовательно, имеют постоянное воздействие.Наконец, часто бывает полезно просмотреть предыдущие данные AEC, если таковые имеются. Хроническая ПЭ при отсутствии симптомов обнадеживает и предполагает, что обследование может быть выполнено менее срочно, если в остальном ребенок здоров. При анализе тенденций AEC важно помнить, что несколько факторов могут временно снижать количество эозинофилов (например, стероиды, бактериальные или вирусные инфекции), вызывая появление нарастающей и угасающей эозинофилии.
Диагностическое тестирование
Все дети, соответствующие диагностическим критериям HE (i.например, AEC в крови ≥1,500 клеток / мкл по крайней мере в 2 отдельных случаях [интервал ≥1 месяц] или выраженная тканевая эозинофилия) или эозинофилия от умеренной до тяжелой с симптомами болезни должны пройти первоначальную диагностическую оценку, чтобы попытаться определить основную этиологию (Фигура 2). При каждом посещении следует проводить тщательный медицинский осмотр, обращая внимание на лихорадку, заложенность носа, аномальные или пониженные звуки легких, кожную сыпь, болезненность в животе, гепатоспленомегалию, лимфаденопатию или покраснение / отек суставов.Лабораторная оценка должна включать полный анализ крови с дифференцировкой для оценки аномалий в других линиях клеток крови. Мазок периферической крови должен быть рассмотрен для оценки бластов лейкоцитов или других дискразий крови, которые могут указывать на первичное гематологическое нарушение. При обнаружении бластов показана ЛДГ, мочевая кислота и консультация гематолога / онколога. Обследование костного мозга (аспирация и биопсия) следует рассматривать у любого ребенка, первоначальная оценка которого не демонстрирует четкой вторичной этиологии, и остается возможной первичная гематологическая причина эозинофилии.Кроме того, исследование костного мозга подходит для любого остро больного ребенка с поражением конкретных органов и без четкого основного диагноза, детям с количеством эозинофилов> 100000 эозинофилов / мкл или детям с аномальными признаками в мазке периферической крови (незрелая или диспластическая белая кровь. клетки, тромбоцитопения или необъяснимая анемия). Химический анализ сыворотки, креатинин и анализ мочи должны быть завершены для оценки доказательств поражения почек или мочевого пузыря.


 К таким заболеваниям относится цирроз, гепатит, а также нарушение кровоснабжения печени.
К таким заболеваниям относится цирроз, гепатит, а также нарушение кровоснабжения печени.  Заболевание может не проявлять себя некоторое время.
Заболевание может не проявлять себя некоторое время. 